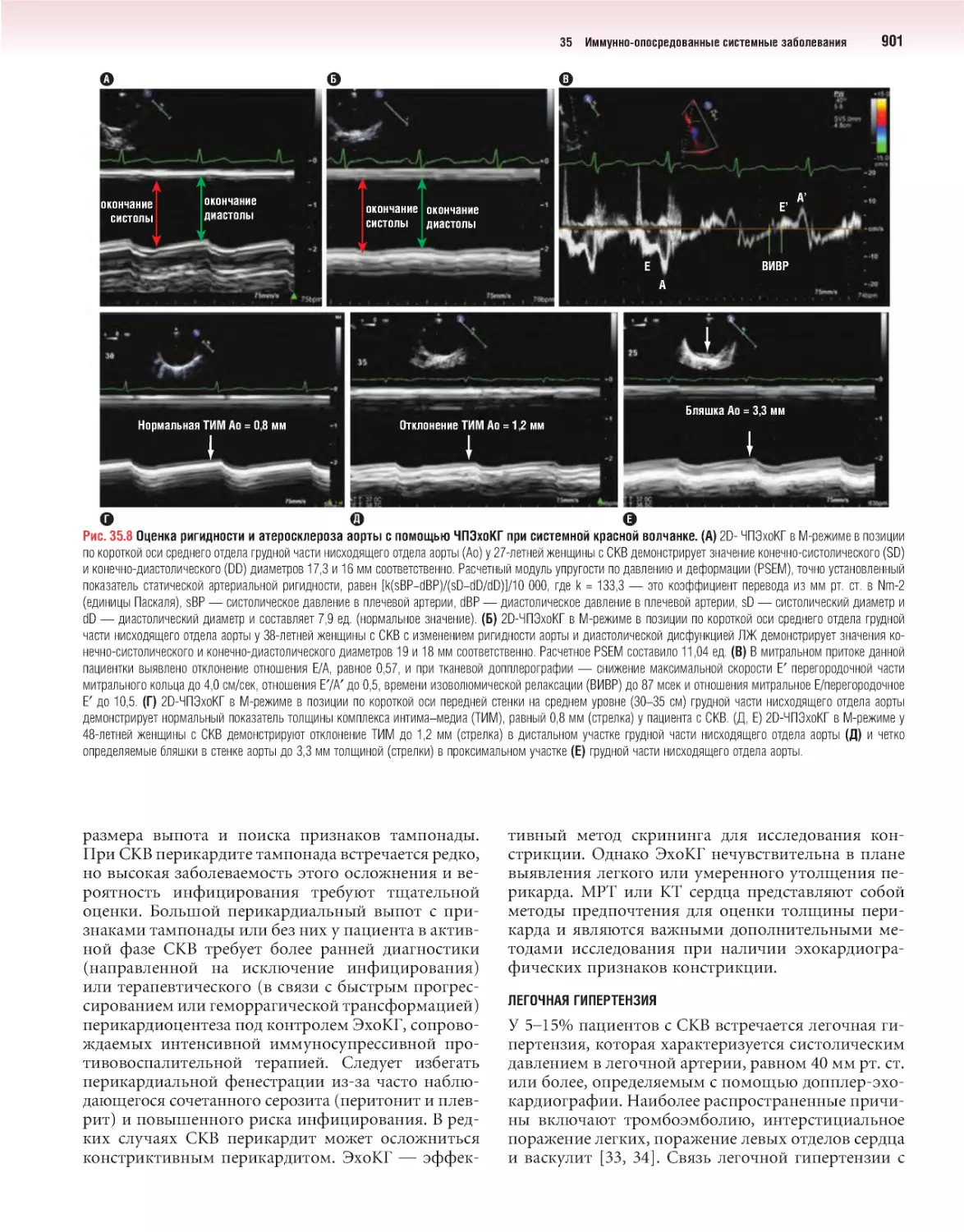
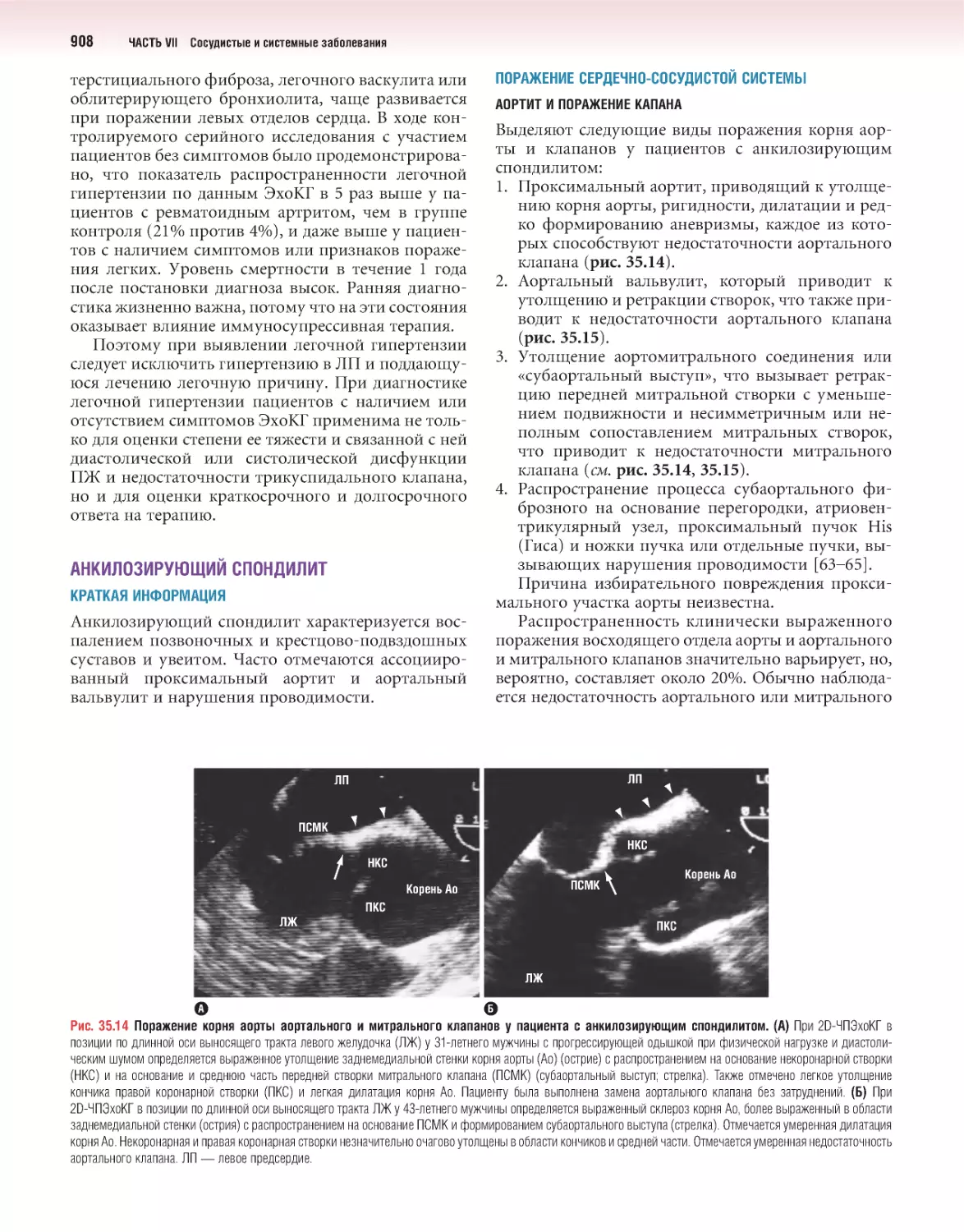
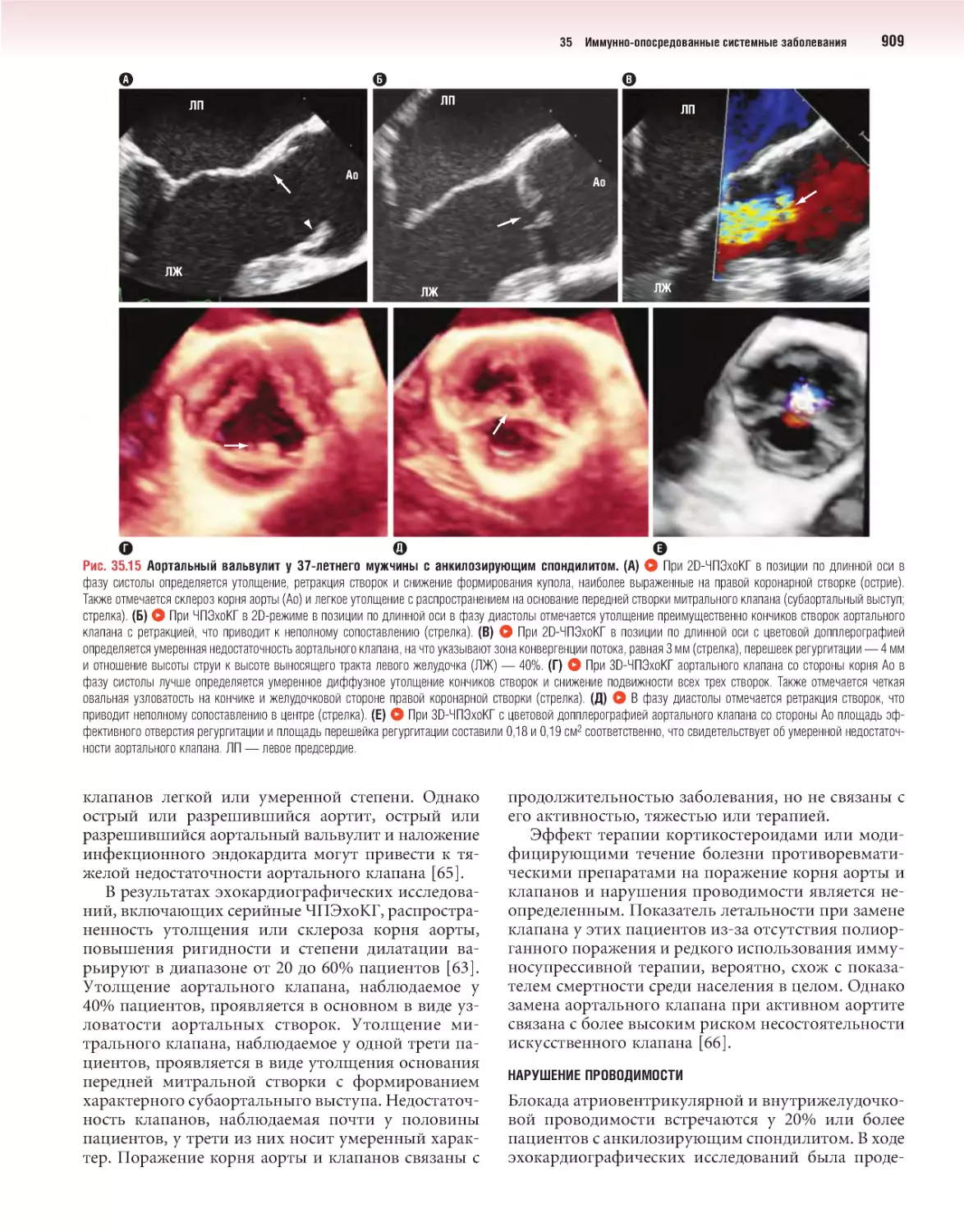
Author: Отто К.М.
Tags: патология сердечно-сосудистой системы сердечно-сосудистые заболевания внутренние болезни медицина кардиология
ISBN: 978-5-98657-064-8
Year: 2019
Text
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
П
Р
А
К
Т
И
Ч
Е
С
К
О
Е
Р
У
К
О
В
О
Д
С
Т
В
О
Отто
Новое издание широко известного практического руководства по клинической
эхокардиографии подготовлено экспертами в области интерпретации
эхокардиографических изображений и данных допплерографии.
• В каждой главе описана определенная патология, приведены
ее эхокардиографические изображения с правильной интерпретацией,
графики и рисунки, раскрывающие патофизиологию, а также рекомендации
по лечению.
• Представлены новые методы диагностики и лечения структурных патологий
сердца, включая транскатетерные методы. В конце каждой главы приведена
таблица сводных данных по получению и интерпретации эхокардиограмм.
• Подчеркивается особая роль эхокардиографии в принятии клинических решений
и прогнозировании клинических исходов.
• Информация, изложенная в книге, будет полезной для всех специалистов,
область профессионального интереса которых — сердечно-сосудистая система,
а не только для тех, кто занимается ее визуализацией.
• Это руководство также будет интересно кардиологам, анестезиологам
и другим специалистам, использующим эхокардиографию в клинической
практике, включая радиологов, интервенционных кардиологов, электрофизиологов,
врачей неотложной медицины и терапевтов, которым приходится лечить пациентов
с сердечно-сосудистыми заболеваниями.
• Много нужной информации найдут в этой книге ординаторы, старший и младший
медицинский персонал, желающие расширить свои знания по эхокардиографии.
• Для научных сотрудников в руководстве содержится подробная информация
о современных методах эхокардиографии.
Катерина Отто
Catherine Otto
К
Л
И
Н
И
Ч
Е
С
К
А
Я
Э
Х
О
К
А
Р
Д
И
О
Г
Р
А
Ф
И
Я
Otto
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
Катерина Отто
Catherine Otto
Данное издание представляет собой перевод c английского
оригинального издания The Practice of Clinical Echocardio-
graphy. Перевод опубликован по контракту с издательством
Elsevier Inc.
www.logobook.ru
Перевод
пятого издания
Перевод пятого издания
Otto Mechanical_rus.indd 1
31.10.2018 14:29:51
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
TITYL-new.indd i
03.04.2019 11:36:43
THE PRACTICE
OF CLINICAL
ECHOCARDIOGRAPHY
Fifth Edition
Catherine M. Otto, MD
J. Ward Kennedy–Hamilton Endowed Chair in Cardiology
Professor of Medicine
University of Washington School of Medicine
Director, Heart Valve Disease Clinic
Associate Director, Echocardiography Laboratory
University of Washington Medical Center
Seattle, Washington
TITYL-new.indd ii
03.04.2019 11:36:44
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
Москва
Логосфера
2019
Катерина Отто
Профессор кардиологии кафедры Дж. Уорда Кеннеди–
Гамильтона, профессор медицинского факультета
Вашингтонского университета, директор Клиники
заболеваний клапанов сердца, заместитель директора
эхокардиографической лаборатории медицинского
центра Вашингтонского университета,
Сиэтл, штат Вашингтон
Перевод пятого издания
Под общей редакцией
САНДРИКОВА ВАЛЕРИЯ АЛЕКСАНДРОВИЧА,
академика РАН, доктора медицинских наук, профессора
TITYL-new.indd iii
03.04.2019 11:36:45
УДК 616.12-008.3 -073.96
ББК 54.101
О-874
Данное издание представляет собой перевод с английского
оригинального издания The Practice of Clinical Echocardiography, 5th edition,
автор Catherine M. Otto. Перевод опубликован по контракту с издательством Elsevier Inc.
Научное редактирование перевода
(полная информация на с. xix)
Галагудза М.М. (главы 43–49), Домницкая Т.М . (главы 11–14), Зеленикин М.М. (научный консультант),
Кулагина Т.Ю . (главы 25–30), Никифоров В.С. (главы 7–10), Сандриков В.А. (главы 1–6, 15–24, 31–42)
Перевод с английского
Балакирева О.С., Барсумян А.К ., Блатун А.В., Гордеев О.Л ., Домницкая Т.М ., Кирилюк В.Э.,
Климов В.А ., Климченко Е.М., Комиссаров К.С., Лисневская Е.Е., Мусатова А.А .,
Назаренко Н.В., Никенина Е.В., Сугак А.Б ., Сухов В.К.
Отто, К.М.
Клиническая эхокардиография: практическое руководство / К.М. Отто;
пер. с англ.; под общ. ред. В.А . Сандрикова; под ред. М .М . Галагудзы,
Т.М. Домницкой, М.М. Зеленикина, Т.Ю. Кулагиной, В.С. Никифорова,
В.А. Сандрикова. — М.: Логосфера, 2019. — 1 32 0 с. : ил. : 21,6 см. — ISBN
978-5-98657-064-8 .
Новое издание широко известного практического руководства по клинической
эхокардиографии подготовлено экспертами в области интерпретации эхокардиогра-
фических изображений и данных допплерографии. В ка ждой главе описана опреде-
ленная патология, приведены ее эхокардиографические изображения с правильной
интерпретацией, графики и рисунки, раскрывающие патофизиологию, а также реко-
мендации по лечению. Представлены новые методы диагностики и лечения структур-
ных патологий сердца, включая транскатетерные методы. В конце каждой главы
приведена таблица сводных данных по получению и интерпретации эхокардиограмм.
Подчеркивается особая роль эхокардиографии в принятии клинических решений и
прогнозировании клинических исходов. Издание дополняют видеоизображения (эхо-
кардиограммы в режиме реального времени и иллюстрации из книги с закадровыми
комментариями).
Информация, изложенная в книге, будет полезной для всех специалистов, область
профессионального интереса которых — сердечно-сосудистая система, а не только
для тех, кто занимается ее визуализацией. Это руководство также будет интересно
кардиологам, анестезиологам, врачам функциональной диагностики и другим специа-
листам, использующим эхокардиографию в клинической практике, включая радио-
логов, интервенционных кардиологов, электрофизиологов, врачей неотложной меди-
цины и терапевтов, которым приходится лечить пациентов с сердечно-сосудистыми
заболеваниями. Много нужной информации найдут в этой книге ординаторы, стар-
ший и младший медицинский персонал, желающие расширить свои знания по эхо-
кардиографии. Для научных сотрудников в руководстве содержится подробная ин-
формация о современных методах эхокардиографии.
УДК 616.12 -008 .3 -073 .96
ББК 54.101
О-874
© Elsevier Inc., 2017.
Daniel H. Drake и David A. Sidebotham оставляют за собой
авторские права на оригинальные иллюстрации и видеоизображе-
ния в главе 19 «Чреспищеводная эхокардиография при рекон-
структивном хирургическом лечении митральной регургитации».
© ООО «Логосфера», перевод, оформление русского издания, 2019
ISBN 978-5 -98657-064-8 (рус.)
ISBN 978-0 -323-40125-8 (англ.)
Предупреждение. Данная область медицины характеризуется
постоянным увеличением знаний и изменениями в клиниче-
ской практике благодаря новым исследованиям и опыту лече-
ния болезней сердца. В результате изменяются методы исследо-
вания и тактика лечения некоторых заболеваний. Практикую-
щие врачи всегда должны полагаться на собственный опыт и
знания при использовании любой информации, методов и
экспериментальных данных, описанных в данном издании.
Врач должен помнить о своей профессиональной ответственно-
сти и безопасности пациентов, а также о юридических послед-
ствиях неадекватного лечения. Читателю рекомендуется обра-
щаться к самой последней информации о лекарственных пре-
паратах и фармацевтических продуктах, указанных в издании,
либо изучать инструкцию по применению, предоставляемую
производителем, для контроля рекомендуемой дозы, способа и
продолжительности терапии, а также оценки противопоказа-
ний. Вся ответственность за назначение и коррекцию дозы ле-
жит на практикующем враче, который должен индивидуально
подходить к лечению каждого пациента, опираясь на собствен-
ный опыт и знания. Издательство, авторы и редакторы не несут
никакой юридической ответственности за любые повреждения
и/или ущерб, нанесенный пациентам в результате использова-
ния любых методов, рекомендаций или предложений, которые
содержатся в данной книге.
Все права защищены. Эта книга и все материалы, содержа-
щиеся в ней, защищены авторскими правами издателя (кроме
моментов, которые указаны отдельно). Никакая часть данного
издания не может быть воспроизведена или передана в ка-
кой-либо форме любыми электронными или механическими
средствами, включая фотокопирование, запись или любую си-
стему хранения и извлечения информации, без письменного
разрешения издателя. Подробную информацию о том, как по-
лучить разрешение, а также дополнительную информацию
можно найти на нашем веб-сайте: www.elsevier.com/permissions.
TITYL-new.indd iv
03.04.2019 11:36:45
v
СОДЕРЖАНИЕ
Предисловие ................................................................................... vii
Благодарности ................................................................................ ix
В создании книги принимали участие ...................................... xi
От редакции русского издания ............................................... xvii
Научные редакторы перевода ................................................. xix
Список сокращений ..................................................................... xxi
Передовые методы эхокардиографии
Редактор Catherine M. Otto
1 Диагностическое отделение эхокардиографии 3
RORY B. WEINER , PAMELA S. DOUGLAS
2 Трехмерная эхокардиография 21
WENDY TSANG, ROBERTO M. LANG
3 Диагностическая чреспищеводная эхокардиография 45
ROSARIO V. FREEMAN
4 Интраоперационная эхокардиография 71
MICHAEL T. HALL, DONALD C. OXORN
5 Внутрисердечная эхокардиография 97
FRANK E. SILVESTRY
6 Ультразвуковое исследование сердца 111
PATRICIA A. PELLIKKA, MICHAEL W. CULLEN, HIROSHI SEKIGUCHI
Левый желудочек
Редактор Rosario V. Freeman
7 Количественная оценка массы, объема, геометрии
и систолической функции левого желудочка 131
GERARD P. AURIGEMMA
8 Скорость движения миокарда, деформация, скорость
деформации, синхронность сокращений и скручивание 157
OTTO A. SMISETH, THOR EDVARDSEN, HANS TORP
9 Диастолическая функция левого желудочка 181
THEODORE P. ABRAHAM, SUSAN A. MAYER
10 Обработка цифрового изображения и его
автоматизированный анализ при эхокардиографии 205
JOHAN G. BOSCH
Ишемическая болезнь сердца
Редактор Rosario V. Freeman
11 Оценка пациентов с острой болью в груди
в отделении реанимации и интенсивной терапии 227
KIRSTEN E. FLEISCHMANN, SARAH G. WEEKS
12 Эхокардиография в отделении неотложной кардиологии
при остром инфаркте миокарда 247
IVOR L. GERBER, ELYSE FOSTER
13 Стресс-эхокардиография при ишемии
коронарных артерий 271
FLORIAN RADER, ROBERT J. SIEGEL
14 Стресс-эхокардиография без физической нагрузки
для диагностики ишемической болезни сердца 301
VICTORIA DELGADO, JEROEN J. BAX
Пороки клапанов сердца
Редактор Judy Hung
15 Аортальный стеноз 327
NIKOLAUS JANDER, JAN MINNERS
16 Транскатетерная имплантация аортального клапана 361
DAVID MESSIKAZEITOUN, MARINA URENA
17 Аортальная регургитация 381
APTUR EVANGELISTA, LAURA GALIAN GAY
18 Митральная регургитация 407
JUDY HUNG, FRANCESCA NESTA DELLING, ROMAIN CAPOULADE
19 Чреспищеводная эхокардиография во время
реконструкции клапана при митральной регургитации 433
DANIEL H. DRAKE , KAREN G. ZIMMERMAN, DAVID A. SIDEBOTHAM
20 Транскатетерная пластика митрального клапана 469
ERNESTO E. SALCEDO, ROBERT A. QUAIFE, MICHAEL S. KIM,
JOHN D. CARROLL
21 Митральный стеноз 493
BERNARD IUNG, ALEC VAHANIAN
22 Инфекционный эндокардит 523
ZAINAB SAMAD, ANDREW WANG
23 Гемодинамика протезированных клапанов сердца 547
AJIT P. YOGANATHAN, VRISHANK RAGHAV
24 Диагностика и количественная оценка дисфункции
протезированных клапанов сердца 575
HAÏFA MAHJOUB, ABDELLAZIZ DAHOU, JEAN G. DUMESNIL,
PHILIPPE PIBAROT
Кардиомиопатия и заболевания
перикарда
Редактор James N. Kirkpatrick
25 Дилатационная кардиомиопатия 609
RICHARD K. CHENG, SOFIA CAROLINA MASRI
26 Гипертрофическая кардиомиопатия 639
ANNA WOO
27 Рестриктивная кардиомиопатия 675
TASNEEM Z. NAQVI, CHRISTOPHER P. APPLETON
28 Заболевания перикарда 705
TERRENCE D. WELCH
ЧАСТЬ
I
ЧАСТЬ
II
ЧАСТЬ
III
ЧАСТЬ
IV
ЧАСТЬ
V
TITYL-new.indd v
03.04.2019 11:36:45
vi
Содержание
29 Трансплантация сердца 733
AUDREY H. WU, THEODORE J. KOLIAS
30 Эхокардиография при механической поддержке
кровообращения 757
JAMES N. KIRKPATRICK
Правые отделы сердца
Редактор James N. Kirkpatrick
31 Эхокардиографическое исследование
правого желудочка 787
ANJALI VAIDYA, JAMES N. KIRKPATRICK
32 Легочная гипертензия 807
DAVID S. CELERMAJER, DAVID PLAYFORD
33 Патология клапанов правых отделов сердца
у взрослых 831
CHARLES J. BRUCE, HEIDI M . CONNOLLY
Сосудистые и системные заболевания
Редактор Jason Linefsky
34 Травма и расслоение аорты 863
ANN F. BOLGER
35 Иммунно-опосредованные системные заболевания 885
CARLOS A. ROLDAN
36 Эхокардиография при метаболических и пищевых
нарушениях 929
JASON LINEFSKY
37 Эхокардиография у спортсменов 953
DAVID PRIOR, MARIA BROSNAN
38 Наследственные заболевания соединительной ткани 979
ANDREW CHENG, MARK LEWIN , AARON OLSON
39 Признаки старения, определяемые
при эхокардиографии 1003
MICHAEL A. CHEN
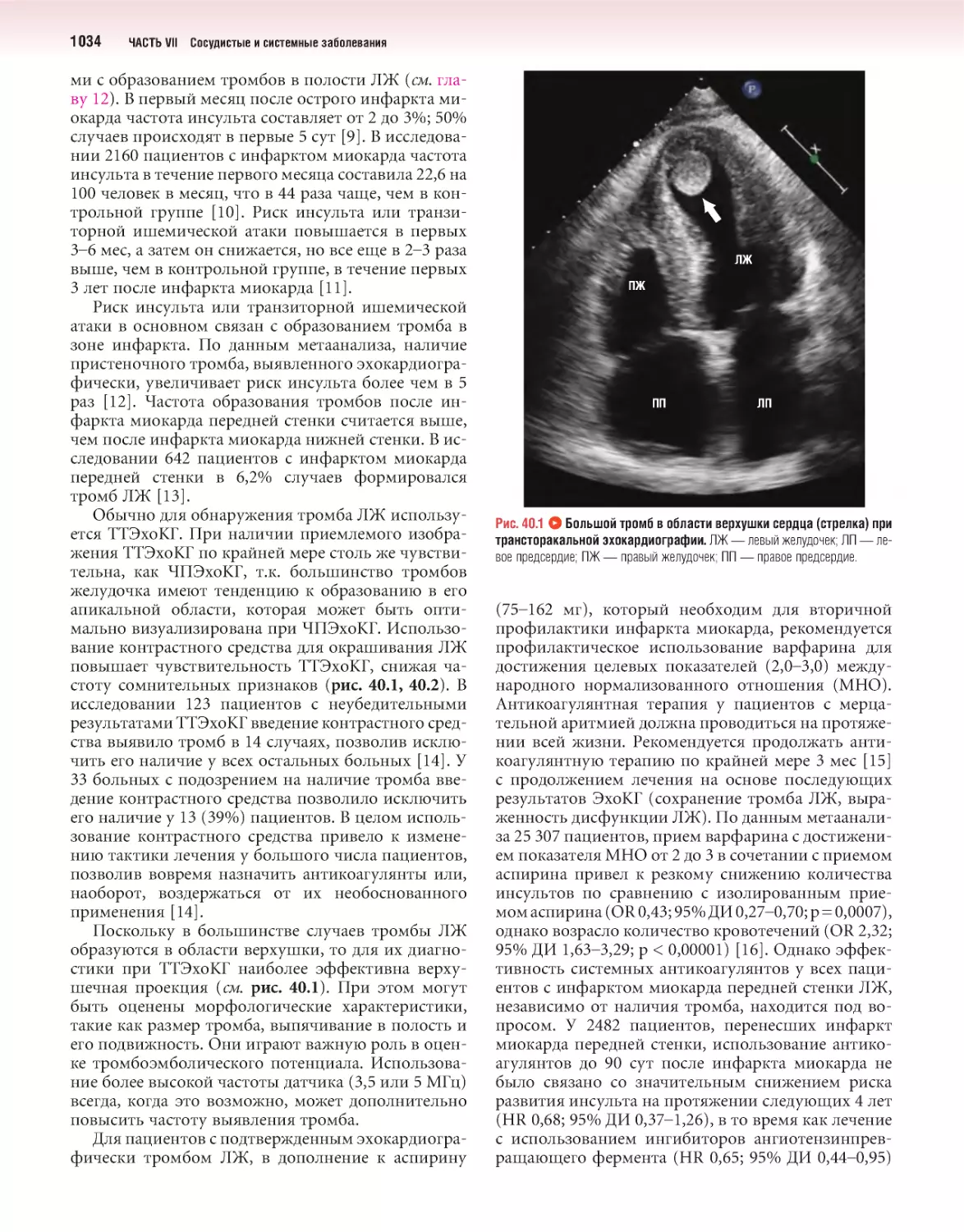
40 Эмболия сосудов большого круга кровообращения 1031
MARCO R. DI TULLIO
41 Фибрилляция и трепетание предсердий 1059
NAZEM AKOUM, JORDAN M. PRUTKIN
42 Опухоли сердца 1079
CHARLES J. BRUCE
Врожденные пороки сердца у взрослых
Редактор Karen Stout
43 Заболевания сердца во время беременности 1109
CANDICE K. SILVERSIDES, SAMUEL C. SIU
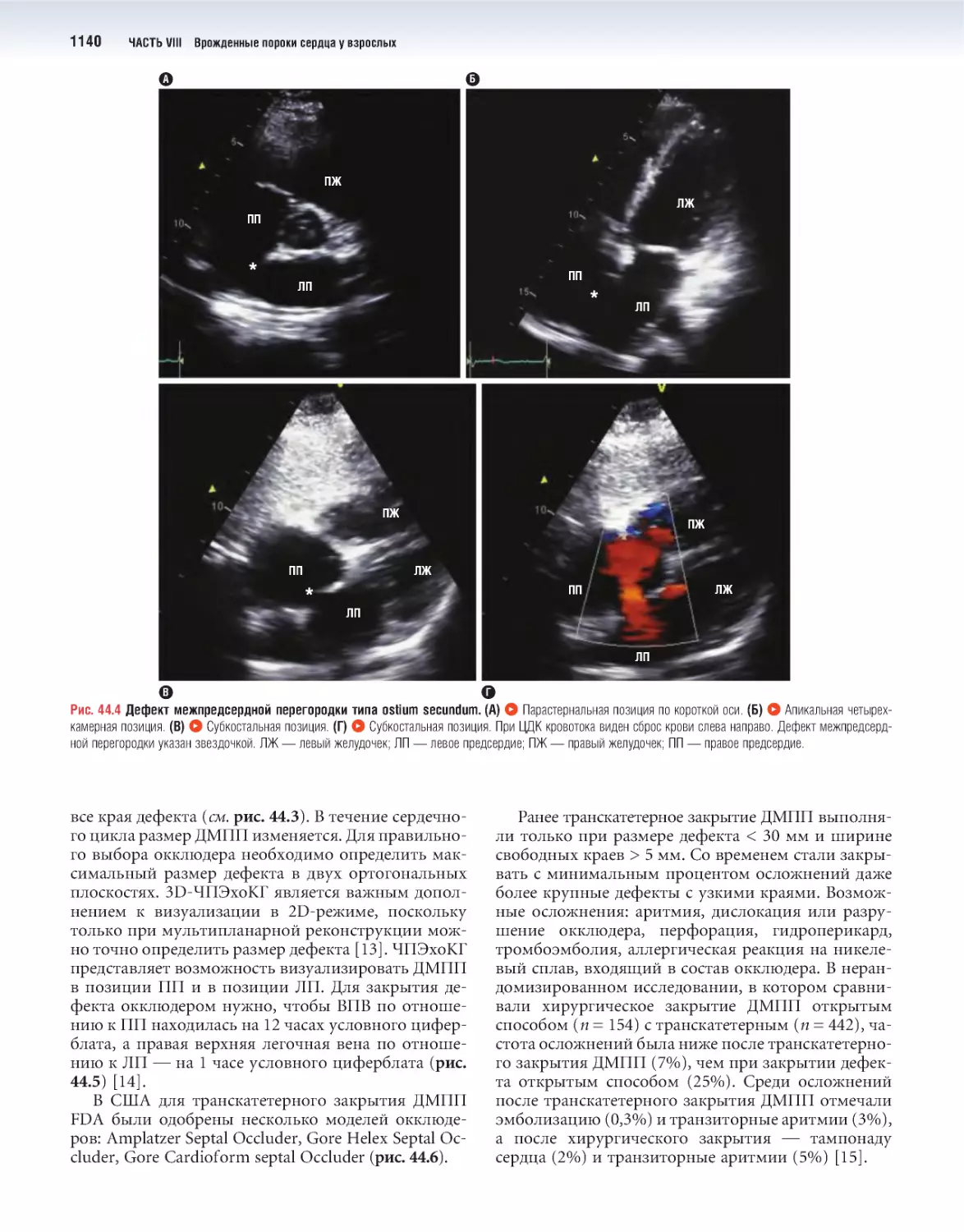
44 Врожденные внутрисердечные шунты 1133
JEANNETTE LIN, JAMIL A. ABOULHOSN
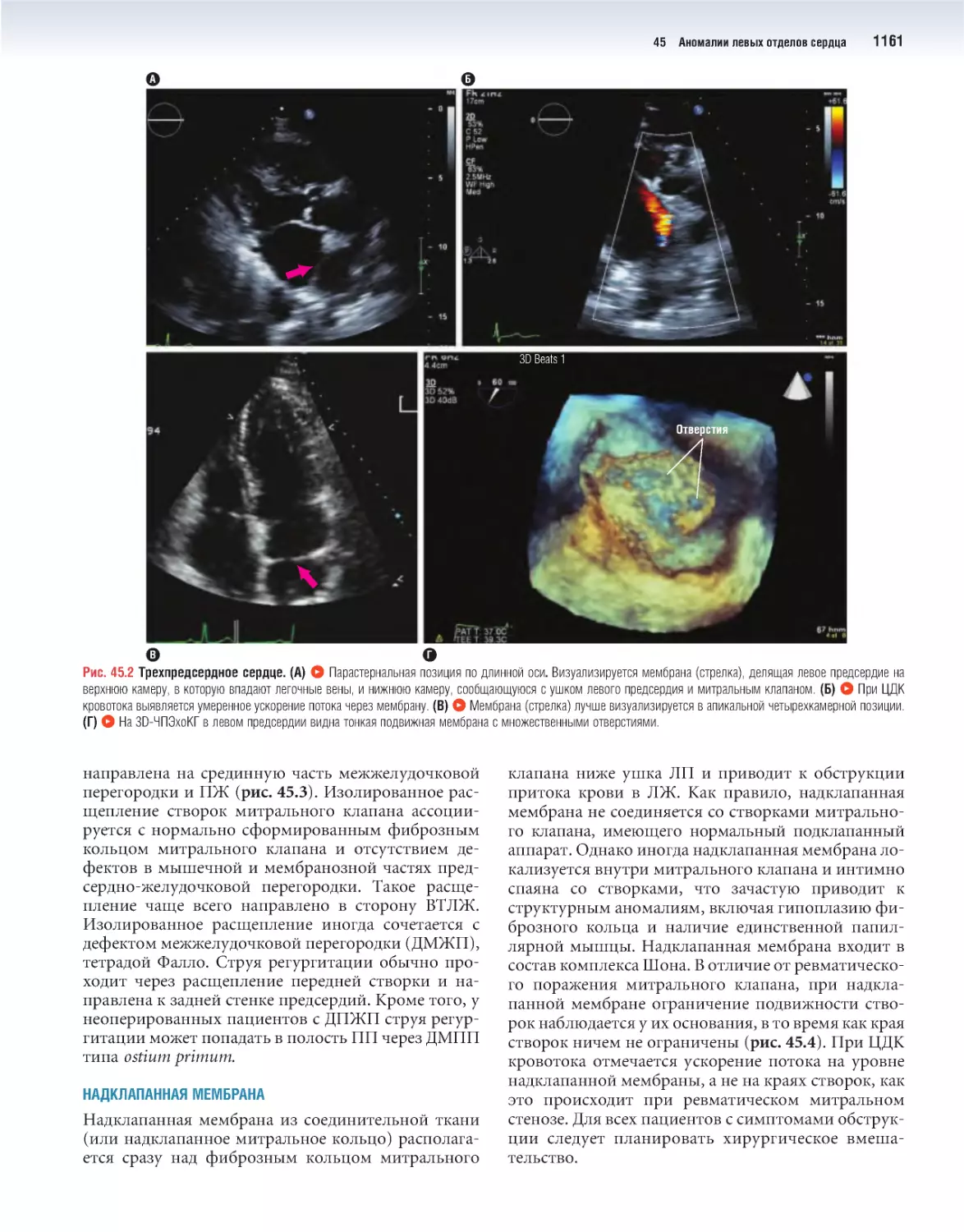
45 Аномалии левых отделов сердца 1159
AMI B. BHATT , DOREEN DEFARIA YEH
46 Аномалии правых отделов сердца 1181
YULI Y. KIM
47 Пороки конотрункуса 1209
ANNE MARIE VALENTE, STEPHEN P. SANDERS
48 Транспозиция магистральных сосудов 1225
JASON F. DEEN, ERIC V. KRIEGER
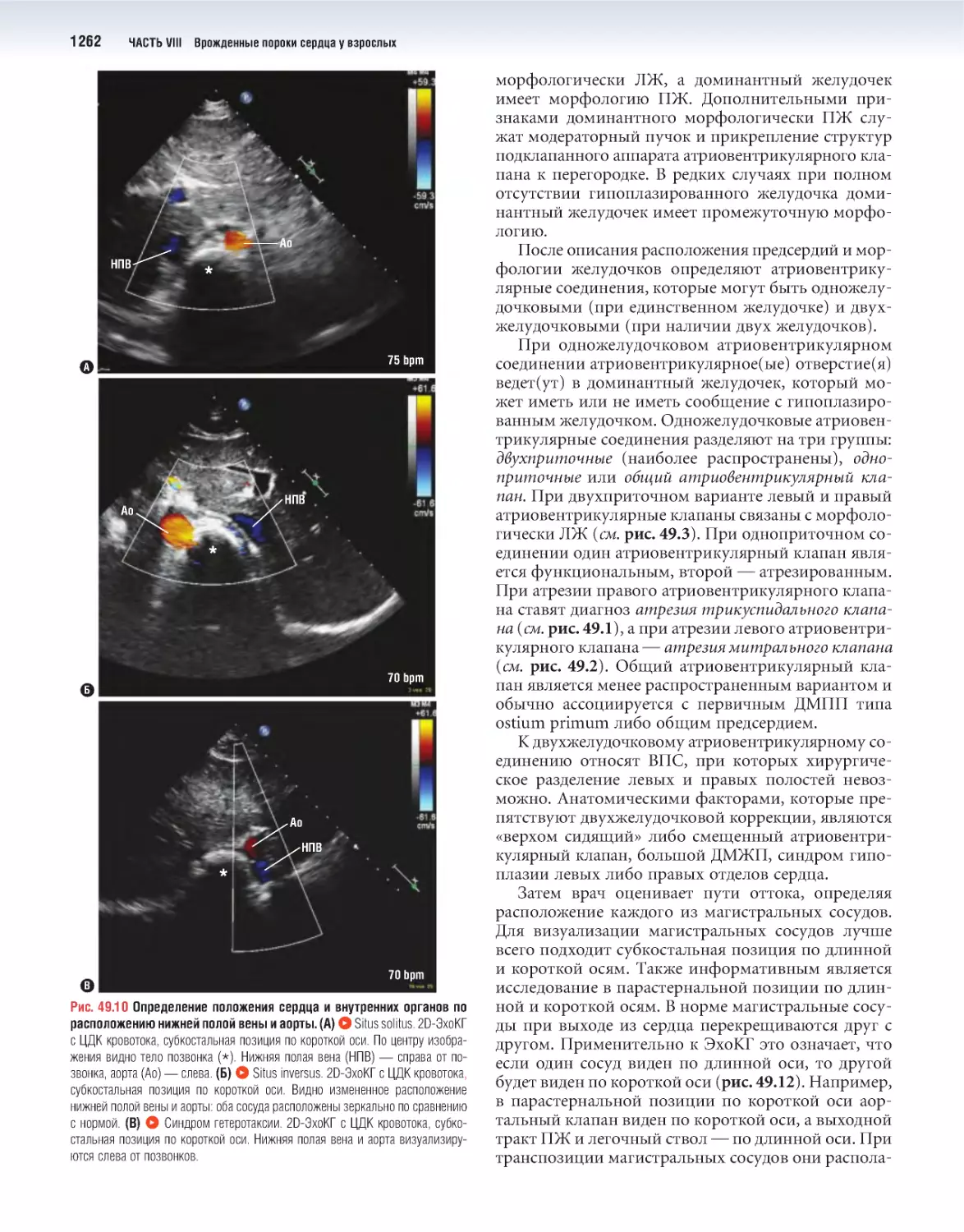
49 Единственный желудочек сердца 1247
LUKE J. BURCHILL, RACHEL M. WALD, LUC MERTENS\
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 1275
ЧАСТЬ
VI
ЧАСТЬ
VII
ЧАСТЬ
VIII
TITYL-new.indd vi
03.04.2019 11:36:45
vii
Цель данного практического руководства — расска-
зать о диагностической ценности эхокардиографии
в клинической практике и роли специалистов по
лучевой диагностике в лечении пациентов с сердеч-
но-сосудистыми заболеваниями. Информация, из-
ложенная в книге, будет полезной для всех специа-
листов, область профессионального интереса кото-
рых — сердечно-сосудистая система, а не только для
тех, кто занимается ее визуализацией. Это руковод-
ство также будет интересно кардиологам, анестези-
ологам и другим специалистам, использующим
эхокардиографию в клинической практике, вклю-
чая радиологов, интервенционных кардиологов,
электрофизиологов, врачей неотложной медицины
и терапевтов, которым приходится лечить пациен-
тов с сердечно-сосудистыми заболеваниями. Много
нужной информации найдут в этой книге ордина-
торы, старший и младший медицинский персонал,
желающие расширить свои знания по эхокардио-
графии. Для научных сотрудников в руководстве
содержится подробная информация о современных
методах эхокардиографии.
Эхокардиография — ключевой метод диагности-
ки сердечно-сосудистых заболеваний. Данный ме-
тод визуализации был интегрирован в клиническую
практику давно. Сначала это было простое описа-
ние получаемых изображений, а в настоящее время
эхокардиографические данные используют для по-
становки диагноза и назначения лечения. Нередко
для принятия клинических решений достаточно
только эхокардиографических данных. Если для
диагностики нужна дополнительная информация,
эхокардиография позволяет определить, какие дру-
гие методы визуализации следует использовать. По
сути, эхокардиография стала специализированным
видом кардиологической консультации.
Качественная интерпретация эхокардиограмм и
данных допплерографии необходима врачу с целью
принятия клинических решений, например относи-
тельно интервенционного вмешательства (транска-
тетерной имплантации аортального клапана), кон-
сервативного или оперативного лечения эндокарди-
та и расслоения аорты, определения оптимального
времени вмешательства у пациентов с хронической
болезнью сердца (регургитацией, стенозом), про-
гноза и исхода заболевания, а также состояний, при
которых нужен периодический контроль (врожден-
ные пороки сердца и состояния после операции).
Эхокардиография также необходима при выборе
оптимальной тактики ведения пациента, например
при отборе для имплантации внутрисердечного
дефибриллятора, и во время транскатетерных вме-
шательств.
В настоящее время клиническая эхокардиогра-
фия «вышла» за пределы диагностического отделе-
ния. Эхокардиограф стали использовать в отделе-
ниях интенсивной терапии, неотложной помощи,
интервенционных вмешательств, во время электро-
физиологических процедур и в операционной. Ап-
параты становятся все более удобными для исполь-
зования и менее дорогими, и вполне вероятно, что
клиническое применение данного метода визуали-
зации будет расширяться.
Каждая глава книги написана экспертом в кон-
кретной области. В основе руководства лежит пятое
издание «Учебника клинической эхокардиографии»
(Textbook of Clinical Echocardiography), написанное
К.M. Отто (Elsevier, Philadelphia, 2013). Однако в
учебнике большое внимание уделяется основным
принципам визуализации, а в практическом руко-
водстве — роли эхокардиографии при принятии
клинических решений. Акцент сделан на принци-
пах оптимального сбора данных и количественного
подхода к анализу данных с учетом потенциальных
технических ограничений метода и результатов
новых исследований. Чтобы подчеркнуть роль эхо-
кардиографии в клинической практике, проанали-
зированы преимущества и ограничения альтерна-
тивных методов диагностики. Полноту изложения
материала обеспечивают таблицы, рисунки, эхокар-
диографические и допплеровские изображения, а
также результаты современных исследований.
Пятое издание практического руководства было
реструктурировано по частям. В первых 6 главах
рассказывается о передовых принципах эхокардио-
графии. Главы, посвященные левому желудочку и
ишемической болезни сердца, отредактированы Ro-
sario Freeman, главы о пороках клапанов сердца —
Judy Hung, главы о кардиомиопатиях, заболеваниях
перикарда и правых отделов сердца — James Kirk-
patrick, главы о сосудистых и системных заболева-
ниях — Jason Linefsky. Часть, посвященная врожден-
ным порокам сердца у взрослых, в настоящее время
содержит 7 глав под редакцией Karen Stout. Этот
материал должен помочь начинающим врачам до-
стичь необходимой компетентности в эхокардио-
ПРЕДИСЛОВИЕ
TITYL-new.indd vii
03.04.2019 11:36:45
viii
Предисловие
графической оценке сложных пациентов. В табли-
цах содержатся информация о результатах исследо-
ваний, рекомендации по лечению и корреляции
клинико-эхокардиографических данных с техниче-
скими ограничениями методов визуализации о по-
лучении данных. В конце каждой главы приведена
сводная информация, которая резюмирует практи-
ческий подход к получению и интерпретации дан-
ных.
Авторы надеются, что руководство предоставит
читателю всю необходимую информацию и допол-
нит его клинический опыт. Но стоит отметить, что
компетентность в получении и интерпретации эхо-
кардиографических данных зависит от соответству-
ющего образования и обучения, которые указаны в
требованиях к аккредитации врачей, специалистов
и рекомендованы профессиональными сообщества-
ми, включая American Society of Echocardiography,
American College of Cardiology и American Heart As-
sociation.
Данное руководство включает информацию, ак-
туальную на момент его издания, поэтому мы реко-
мендуем читателю для получения самой свежей
информации обратиться к новым публикациям.
Читателям, которые заинтересованы в углубле-
нии знаний в области эхокардиографии, рекомен-
дуем обратиться к третьему изданию «Обзор руко-
водства по эхокардиографии» (Echocardiography Re-
view Guide), подготовленному Becky Schwaegler,
Rosario Freeman и мной, а также к «Серии практиче-
ской эхокардиографии по Отто» (Otto Practical
Echocardiography Series) издательства Elsevier. Эта
серия состоит из четырех книг: «Интраоперацион-
ная эхокардиография» (под редакцией Don Oxorn),
«Эхокардиография при сердечной недостаточно-
сти» (под редакцией Susan Wiegers и Martin St John
Sutton), «Эхокардиография при врожденных поро-
ках сердца» (под редакцией Mark Lewin и Karen
Stout), «Передовые подходы в эхокардиографии»
(под редакцией Linda Gillam и моей). Все книги до-
ступны в электронном виде и онлайн в Expert
Consult.
Катерина Отто
TITYL-new.indd viii
03.04.2019 11:36:45
ix
БЛАГОДАРНОСТИ
Я благодарна всем людям, которые помогали мне в
работе над данной книгой. Признательна авторам
глав, которые смогли научно, продуманно и скру-
пулёзно, в доступной форме представить информа-
цию о клинической эхокардиографии, а также ре-
дакторам частей Rosario Freeman, Judy Hung, James
Kirkpatrick, Jason Linefsky и Karen Stout за помощь
в редактировании этой книги.
Хотелось бы поблагодарить персонал каждого
учреждения за подготовку рукописи и обеспечение
постоянной связи. Слов благодарности заслужива-
ют и исследователи, которые внесли ценный вклад
в понимание многих заболеваний. Выражаю особую
признательность специалистам в области ультра-
звуковой диагностики, которые помогли нам про-
иллюстрировать руководство. Искренняя благодар-
ность художнику Joe Chovan за его потрясающие
иллюстрации. Кроме того, большая признатель-
ность Delores Meloni, Joanie Milnes, Clay Broeker и
всей редакционной и производственной команде
издательства Elsevier.
Наконец, я благодарна коллегам из отделения
кардиологии Вашингтонского университета и моей
семье за поддержку при работе над книгой.
Катерина Отто
TITYL-new.indd ix
03.04.2019 11:36:45
TITYL-new.indd x
03.04.2019 11:36:45
xi
В СОЗДАНИИ КНИГИ
ПРИНИМАЛИ УЧАСТИЕ
Jamil A. Aboulhosn, MD
Associate Professor of Medicine and Pediatrics
Division of Cardiology
University of California, Los Angeles School of Medicine
Director, Ahmanson/UCLA Adult Congenital Heart Disease Center
Ronald Reagan Medical Center at UCLA
Los Angeles, California
Theodore P. Abraham, MD
Professor of Medicine and Radiology and Radiologic Science
Division of Cardiology
Johns Hopkins University School of Medicine
Medical Director, Echocardiography
The Johns Hopkins Hospital
Baltimore, Maryland
Nazem Akoum, MD, MS
Associate Professor of Medicine
Director, Atrial Fibrillation Program
Division of Cardiology
University of Washington
Seattle, Washington
Christopher P. Appleton, MD
Professor of Medicine
Division of Cardiovascular Diseases
Mayo Clinic Arizona
Phoenix, Arizona
Gerard P. Aurigemma, MD
Professor of Medicine and Radiology
University of Massachusetts Medical School
Director, Noninvasive Cardiology
UMass Memorial Medical Center
Worcester, Massachusetts
Jeroen J. Bax, MD, PhD
Professor of Cardiology
Department of Cardiology
University of Leiden
Director of Noninvasive Imaging
Leiden University Medical Center
Leiden, The Netherlands
Ami B. Bhatt, MD
Assistant Professor
Harvard Medical School
Director Adult Congenital Heart Disease Program
Massachusetts General Hospital
Boston, Massachusetts
Ann F. Bolger, MD
William Watt Kerr Professor of Medicine
Department of Medicine, Division of Cardiology
University of California, San Francisco School of Medicine
Director, Echocardiography
Zuckerberg San Francisco General Hospital and Trauma Center
San Francisco, California
Johan G. Bosch, PhD
Associate Professor
Thoraxcenter Biomedical Engineering
Erasmus MC
Rotterdam, The Netherlands
Maria Brosnan, MBBS, PhD
Cardiologist
St. Vincent’s Hospital, Melbourne
Baker IDI, Melbourne
Melbourne, Australia
Charles J. Bruce, MBChB
Professor of Medicine
College of Medicine
Cardiovascular Diseases
Mayo Clinic
Jacksonville, Florida
Luke J. Burchill, MBBS, PhD
Assistant Professor
Adult Congenital Heart Disease, Division of Cardiology
Knight Cardiovascular Institute, Oregon Health Science University
Portland, Oregon
Romain Capoulade, PhD
Postdoctoral Fellow
Division of Cardiology
Harvard Medical School
Massachusetts General Hospital
Boston, Massachusetts
John D. Carroll, MD
Professor of Medicine
Division of Cardiology
University of Colorado, Denver
Director, Interventional Cardiology
Medical Director, Cardiac and Vascular Center
University of Colorado Hospital
Anschutz Medical Campus
Aurora, Colorado
David S. Celermajer, MBBS, PhD, DSc
Scandrett Professor of Cardiology
Sydney Medical School
University of Sydney
Director, Echocardiography Services and Director, Pulmonary
Hypertension Services
Royal Prince Alfred Hospital
Sydney, New South Wales, Australia
Michael A. Chen, MD, PhD
Associate Professor of Medicine
Division of Cardiology
University of Washington School of Medicine
Medical Director, Cardiology Clinic
Harborview Medical Center
Seattle, Washington
TITYL-new.indd xi
03.04.2019 11:36:45
xii
В создании книги принимали участие
Andrew Cheng, MD
Acting Assistant Professor
Division of Cardiology
University of Washington
VA Puget Sound Health Care System
Seattle, Washington
Richard K. Cheng, MD, MS
Assistant Professor of Medicine
Division of Cardiology
University of Washington Medical Center
Seattle, Washington
Heidi M. Connolly, MD
Professor of Medicine
Division of Cardiovascular Diseases
Mayo Clinic
Rochester, Minnesota
Michael W. Cullen, MD
Assistant Professor of Medicine
Mayo Clinic College of Medicine
Senior Associate Consultant
Department of Cardiovascular Diseases
Mayo Clinic
Rochester, Minnesota
Abdellaziz Dahou, MD, MSc
Postdoctoral Fellow
Faculty of Medicine
Laval University
Quebec Heart and Lung Institute
Quebec City, Quebec, Canada
Jason F. Deen, MD
Assistant Professor of Pediatrics
Adjunct Assistant Professor of Medicine
Division of Cardiology
Seattle Children’s Hospital
University of Washington Medical Center
Seattle, Washington
Victoria Delgado, MD, PhD
Assistant Professor
University of Leiden
Cardiologist
Department of Cardiology
Leiden University Medical Center
Leiden, The Netherlands
Francesca Nesta Delling, MD
Assistant Professor of Medicine
Department of Medicine, Division of Cardiology
University of California, San Francisco
San Francisco, California
Marco R. Di Tullio, MD
Professor of Medicine at CUMC
Department of Medicine, Division of Cardiology
Columbia University
Associate Director, Adult Cardiovascular Ultrasound Laboratories
Columbia University Medical Center
New York, New York
Pamela S. Douglas, MD
Ursula Geller Professor of Research in Cardiovascular Disease
Medicine (Cardiology)
Duke University School of Medicine
Durham, North Carolina
Daniel H. Drake, MD
Surgeon
Department of Surgery
Munson Medical Center
Director, Cardiothoracic Research
Webber Heart Center, Munson Healthcare
Traverse City, Michigan
Director, Mitral Initiative
Michigan Society of Thoracic and Cardiovascular Surgeons
Ann Arbor, Michigan
Jean G. Dumesnil, MD
Emeritus Professor of Medicine
Laval University
Quebec City, Quebec, Canada
Thor Edvardsen, MD, PhD
Professor Faculty of Medicine
University of Oslo
Head of Department
Department of Cardiology
Oslo University Hospital, Rikshospitalet
Oslo, Norway
Artur Evangelista, MD, PhD
Head of Cardiac Imaging Department
Division of Cardiology
Hospital Universitari Vall d’Hebron
Barcelona, Spain
Kirsten E. Fleischmann, MD, MPH
Professor of Clinical Medicine
Division of Cardiology, Department of Medicine
University of California, San Francisco
Medical Director, Cardiac Stress Laboratory
UCSF Medical Center
San Francisco, California
Elyse Foster, MD
Professor Emeritus of Clinical Medicine
Division of Cardiology
University of California, San Francisco
San Francisco, California
Rosario V. Freeman, MD, MS
Professor of Medicine
Division of Cardiology
Director, Cardiology Fellowship Programs
University of Washington
Seattle, Washington
Laura Galian Gay, MD
Cardiac Imaging Cardiologist
Division of Cardiology
Hospital Universitari Vall d’Hebron
Barcelona, Spain
Ivor L. Gerber, MBChB, MD
Director of Adult Echocardiography
Department of Cardiology
Green Lane Cardiovascular Service
Auckland City Hospital
Auckland, New Zealand
Michael T. Hall, MD
Acting Assistant Professor
Department of Anesthesiology
University of Washington
Seattle, Washington
TITYL-new.indd xii
03.04.2019 11:36:45
xiii
В создании книги принимали участие
Judy Hung, MD
Associate Professor of Medicine
Department of Medicine, Division of Cardiology
Harvard Medical School
Massachusetts General Hospital
Boston, Massachusetts
Bernard Iung, MD
Professor of Cardiology
Department of Cardiology
Bichat Hospital, APHP
DHU FIRE
Paris Diderot University
Paris, France
Nikolaus Jander, MD
Head of Department
Department of Echocardiography
Clinic for Cardiology and Angiology II
University Heart Center Freiburg/Bad Krozingen
Bad Krozingen, Germany
Michael S. Kim, MD
Medical Director
Structural Heart and Valve Disease Program
Cardiovascular Institute of North Colorado
Greeley, Colorado
Yuli Y. Kim, MD
Associate Professor of Medicine
Division of Cardiology
Perelman School of Medicine at the University of Pennsylvania
Medical Director, Philadelphia Adult Congenital Heart Center
Hospital of the University of Pennsylvania and The Children’s
Hospital of Philadelphia
Philadelphia, Pennsylvania
James N. Kirkpatrick, MD
Associate Professor of Medicine
Division of Cardiology, Department of Medicine
University of Washington
Director of Echocardiography
University of Washington Medical Center
Seattle, Washington
Theodore J. Kolias, MD
Associate Professor of Medicine
Division of Cardiovascular Medicine, Department
of Internal Medicine
University of Michigan Medical School
Director, Adult Echocardiography Laboratory
University of Michigan Health System
Ann Arbor, Michigan
Eric V. Krieger, MD
Assistant Professor of Medicine
Division of Cardiology
Associate Director, Adult Congenital Heart Service
University of Washington School of Medicine
Seattle, Washington
Roberto M. Lang, MD
Professor of Medicine
Director, Noninvasive Imaging Laboratories
University of Chicago
Chicago, Illinois
Mark Lewin, MD
Professor and Chief
Division of Pediatric Cardiology
University of Washington School of Medicine
Heart Center Co-Director
Seattle Children’s Hospital
Seattle, Washington
Jeannette Lin, MD
Assistant Clinical Professor of Medicine
Division of Cardiology
University of California, Los Angeles School of Medicine
Faculty, Ahmanson/UCLA Adult Congenital Heart Disease Center
Ronald Reagan Medical Center at UCLA
Los Angeles, California
Jason Linefsky, MD, MS
Assistant Professor of Medicine
Department of Medicine
Emory University
Decatur, Georgia
Hai#fa Mahjoub, MD, PhD
Postdoctoral Fellow
Faculty of Medicine
Laval University
Quebec Heart and Lung Institute
Quebec City, Quebec, Canada
Sofia Carolina Masri, MD
Assistant Professor
Cardiology Division
University of Washington
Seattle, Washington
Susan A. Mayer, MD
Assistant Professor of Medicine
Division of Cardiology
Associate Director, Echo Education
Director, Advanced Echo Fellowship
Director, Echocardiography Lab, Johns Hopkins Bayview
Johns Hopkins School of Medicine
Baltimore, Maryland
Luc Mertens, MD, PhD
Professor of Pediatrics University of Toronto
Director, Echocardiography Lab
SickKids Hospital
Toronto, Ontario, Canada
David Messika-Zetoun, MD, PhD
Professor of Cardiology
University Paris Diderot and Bichat Hospital
Paris, France
Jan Minners, MD, PhD
Professor of Medicine
Department of Cadiology and Angiology II
University of Freiburg
University Heart Center Freiburg/Bad Krozingen
Bad Krozingen, Germany
Tasneem Z. Naqvi, MD, MMM
Professor of Medicine
Department of Cardiology
Mayo Clinic College of Medicine
Director, Echocardiography and Echocardiography Fellowship
Mayo Clinic
Scottsdale, Arizona
TITYL-new.indd xiii
03.04.2019 11:36:45
xiv
В создании книги принимали участие
Aaron Olson, MD
Associate Professor of Pediatrics
Division of Pediatric Cardiology
University of Washington
Seattle Children’s Hospital
Seattle, Washington
Donald C. Oxorn, MD
Professor of Anesthesia
Adjunct Professor of Medicine
University of Washington
Seattle, Washington
Patricia A. Pellikka, MD
Professor of Medicine
Mayo Clinic College of Medicine
Chair
Division of Cardiovascular Ultrasound
Consultant
Cardiovascular Diseases and Internal Medicine
Mayo Clinic
Rochester, Minnesota
Philippe Pibarot, DVM, PhD
Professor of Medicine
Faculty of Medicine
Laval University
Canada Research Chair in Valvular Heart Disease
Quebec Heart and Lung Institute
Quebec City, Quebec, Canada
David Playford, MBBS, PhD
Professor of Cardiology
Faculty of Medicine
University of Notre Dame
Fremantle, Western Australia, Australia
Professor of Cardiology
Mount Hospital
Perth, Western Australia, Australia
David Prior, MBBS, BMedSc, PhD
Deputy Director of Cardiology
Department of Cardiology
St Vincent’s Hospital, Melbourne
Associate Professor
St Vincent’s Department of Medicine
University of Melbourne
Fitzroy, Victoria, Australia
Jordan M. Prutkin, MD, MHS
Associate Professor of Medicine
Division of Cardiology
University of Washington
Medical Director, Electrophysiology Laboratory
University of Washington Medical Center
Seattle, Washington
Robert A. Quaife, MD
Professor of Medicine
Division of Cardiology
University of Colorado, Denver
Director, Interventional Cardiology
Director, Advanced Cardiac Imaging
University of Colorado Hospital
Anschutz Medical Campus
Aurora, Colorado
Florian Rader, MD, MSc
Co-Director
Clinic for Hypertrophic Cardiomyopathy
and Aortopathies
Heart Institute
Cedars-Sinai Medical Center
Los Angeles, California
Vrishank Raghav, PhD
Postdoctoral Fellow
Wallace H. Coulter School of Biomedical Engineering
Georgia Institute of Technology
Atlanta, Georgia
Carlos A. Roldan, MD
Professor of Medicine
Department of Medicine, Division of Cardiology
University of New Mexico School of Medicine
Director, Echocardiography Laboratory
New Mexico Veterans Affairs Health Care System
Albuquerque, New Mexico
Ernersto E. Salcedo, MD
Professor of Medicine
Division of Cardiology
University of Colorado Denver
Director of Echocardiography
University of Colorado Hospital
Anschutz Medical Campus
Aurora, Colorado
Zainab Samad, MBBS, MHS
Associate Professor of Medicine
Cardiology/Medicine
Duke University
Durham, North Carolina
Stephen P. Sanders, MD
Professor of Pediatrics, Part-Time
Harvard Medical School
Director, Cardiac Registry
Departments of Cardiology, Pathology, and Cardiac Surgery
Boston Children’s Hospital
Boston, Massachusetts
Hiroshi Sekiguchi, MD
Assistant Professor of Medicine
College of Medicine, Division of Pulmonary
and Critical Care Medicine
Consultant
Mayo Clinic
Rochester, Minnesota
David A. Sidebotham, MBChB
Anesthesiologist and Intensivist
Departments of Cardiothoracic Anaesthesia and
the Cardiovascular Intensive Care Unit
Auckland City Hospital
Auckland, New Zealand
Robert J. Siegel, MD
Professor of Medicine
Director, Cardiac Noninvasive Laboratory
Medical Director, Clinic for Hypertrophic
Cardiomyopathy and Aortopathies
Cedars-Sinai Medical Center
Los Angeles, California
TITYL-new.indd xiv
03.04.2019 11:36:45
xv
В создании книги принимали участие
Candice K. Silversides, MS, MD
Associate Professor of Medicine
Division of Cardiology
University of Toronto
Head, Obstetric Medicine
Research Director, Toronto Congenital Cardiac Centre for Adults
Mount Sinai and Toronto General Hospital
Toronto, Ontario, Canada
Frank E. Silvestry, MD
Associate Professor of Medicine
Cardiovascular Division, Department of Medicine
Perelman School of Medicine at the University of Pennsylvania
Director, Cardiovascular Disease Fellowship
Hospital of the University of Pennsylvania
Philadelphia, Pennsylvania
Samuel C. Siu, MD, SM, MBA
Professor of Medicine
Western University
London, Ontario, Canada
Otto A. Smiseth, MD, PhD
Professor and Division Head
Cardiovascular and Pulmonary Diseases
Oslo University Hospital
Oslo, Norway
Karen Stout, MD
Professor of Medicine
Adjunct Professor of Pediatrics
Director, Adult Congenital Heart Disease Fellowship
University of Washington School of Medicine
Director, Adult Congenital Heart Disease Program
University of Washington Medical Center
and Seattle Children’s Hospital
Seattle, Washington
Hans Torp, DrTech
Professor
Circulation and Medical Imaging
Norwegian University of Science and Technology
Trondheim, Norway
Wendy Tsang, MD, SM
Assistant Professor of Medicine
Division of Cardiology
University of Toronto
Toronto General Hospital
University Health Network
Toronto, Ontario, Canada
Marina Urena, MD, PhD
Interventional Cardiologist
Department of Cardiology
Paris VII University
Bichat Hospital
Paris, France
Alec Vahanian, MD
Professor of Cardiology
Paris Diderot University
Head of Cardiology
Bichat Hospital, APHP
Paris, France
Anjali Vaidya, MD
Assistant Professor of Medicine
Associate Director, Pulmonary Hypertension, Right Heart Failure,
and Pulmonary Thromboendarterectomy Program
Advanced Heart Failure and Cardiac Transplant
Temple University Hospital
Philadelphia, Pennsylvania
Anne Marie Valente, MD
Associate Professor
Pediatrics and Internal Medicine
Harvard Medical School
Outpatient Director, Boston Adult Congenital Heart Disease and
Pulmonary Hypertension Program
Boston Children’s Hospital
Brigham and Women’s Hospital
Boston, Massachusetts
Rachel M. Wald, MD
Associate Professor
Pediatrics, Medicine, Medical Imaging, and Obstetrics/Gynecology
University of Toronto
University Health Network, SickKids Hospital,
Mount Sinai Hospital
Toronto, Ontario, Canada
Andrew Wang, MD
Professor of Medicine Division of Cardiovascular Medicine
Duke University
Director, Cardiovascular Disease Fellowship
Duke University Medical Center
Durham, North Carolina
Sarah G. Weeks, MD
Associate Professor
Department of Cardiac Sciences
Libin Cardiovascular Institute of Alberta
Site Director, Echocardiography Foothills Medicine Centre
University of Calgary
Calgary, Alberta, Canada
Rory B. Weiner, MD
Assistant Professor of Medicine
Harvard Medical School
Cardiology Division
Massachusetts General Hospital
Boston, Massachusetts
Terrence D. Welch, MD
Assistant Professor of Medicine
Section of Cardiology, Department of Internal Medicine
Geisel School of Medicine at Dartmouth
Dartmouth-Hitchcock Medical Center
Hanover and Lebanon, New Hampshire
Anna Woo, MD, SM
Associate Professor
University of Toronto
Director, Echocardiography Laboratory
University Health Network
Toronto, Ontario, Canada
Audrey H. Wu, MD, MPH
Clinical Associate Professor
Department of Internal Medicine, Division of Cardiovascular
Medicine
University of Michigan Health System
University of Michigan Medical Center
Ann Arbor, Michigan
TITYL-new.indd xv
03.04.2019 11:36:45
xvi
В создании книги принимали участие
Doreen DeFaria Yeh, MD
Assistant Professor of Medicine
Division of Cardiology
Harvard Medical School
Associate Director, Adult Congenital Heart Disease Program
Co-Director, Cardiovascular Disease and Pregnancy Program
Massachusetts General Hospital
Boston, Massachusetts
Ajit P. Yoganathan, BS, PhD
Wallace H. Coulter Distinguished Faculty Chair in Biomedical
Engineering and Regents Professor
Wallace H. Coulter School of Biomedical Engineering
Georgia Institute of Technology
Atlanta, Georgia
Karen G. Zimmerman, BS
Editor-in-Chief
CASE: Cardiovascular Imaging Case Reports
American Society of Echocardiography
Morrisville, North Carolina
Advanced Imaging Specialist
Webber Heart Center
Munson Healthcare
Traverse City, Michigan
TITYL-new.indd xvi
03.04.2019 11:36:45
xvii
ОТ РЕДАКЦИИ
РУССКОГО ИЗДАНИЯ
В настоящее время эхокардиография занимает ве-
дущее место среди методов исследования в кардио-
логии, кардиохирургии и аритмологии. Этот метод
визуализации незаменим в повседневной практике
и помогает врачу своевременно диагностировать
патологию миокарда, клапанного аппарата и других
структур сердца и сосудов.
Разработка и внедрение новых ультразвуковых
систем дали возможность визуализировать сердце
и коронарные сосуды с применением контрастных
средств и построением трехмерных изображений,
а также оценивать функцию миокарда с учетом его
перфузии.
Книга, которую вы держите в руках, представля-
ет собой перевод с английского популярного за ру-
бежом руководства по клинической эхокардиогра-
фии, подготовленного ведущими специалистами в
области эхокардиографии и гемодинамики.
Это руководство предоставляет читателю уни-
кальную возможность узнать, как применять эхо-
кардиографию в клинической практике и добиться
максимальной эффективности в диагностике, т.е .
что и как оценивать в зависимости от патологии и
как избежать ошибок интерпретации. В книге опи-
саны многочисленные методы, способы и приемы,
а также новые подходы к диагностике, без которых
невозможно адекватно лечить больных.
Следует отметить, что в данном практическом
руководстве полнота и четкость изложения сочета-
ются с богатейшим иллюстративным материалом.
Особенно высокую ценность для специалистов
имеют уникальные эхокардиограммы пациентов с
самой разнообразной патологией, что делает руко-
водство незаменимым в научном и практическом
плане.
Мы надеемся, что знакомство с этой интересной
книгой будет полезно специалистам в области эхо-
кардиографии, кардиологии, а также начинающим
врачам, которые выбрали данную специализацию.
В.А . Сандриков,
академик РАН, профессор,
доктор медицинских наук
TITYL-new.indd xvii
03.04.2019 11:36:45
TITYL-new.indd xviii
03.04.2019 11:36:45
xix
НАУЧНЫЕ РЕДАКТОРЫ ПЕРЕВОДА
ГАЛАГУДЗА Михаил Михайлович
Член-корреспондент РАН, доктор медицинских наук,
директор Института экспериментальной медицины ФГБУ
«Национальный медицинский исследовательский центр
им. В .А. Алмазова» Минздрава России
ДОМНИЦКАЯ Татьяна Михайловна
Доктор медицинских наук, профессор, профессор кафедры
функциональной и лучевой диагностики факультета
повышения квалификации медицинских работников
Российского университета дружбы народов
ЗЕЛЕНИКИН Михаил Михайлович
Доктор медицинских наук, профессор, заведующий
отделением хирургии детей раннего возраста с
врожденными пороками сердца ФГБУ «Национальный
медицинский исследовательский центр сердечно-сосудистой
хирургии им. А.Н. Бакулева» Минздрава России
КУЛАГИНА Татьяна Юрьевна
Доктор медицинских наук, заведующая лабораторией
электрофизиологии и нагрузочных тестов отдела
клинической физиологии, инструментальной и лучевой
диагностики ФГБНУ «Российский научный центр хирургии
им. академика Б.В . Петровского», доцент кафедры
функциональной и ультразвуковой диагностики Института
профессионального образования ФГАОУ ВО «Первый
Московский государственный медицинский университет
им. И .М . Сеченова» Минздрава России (Сеченовский
Университет)
НИКИФОРОВ Виктор Сергеевич
Доктор медицинских наук, профессор, профессор
кафедры функциональной диагностики ФГБОУ ВО
«Северо-Западный государственный медицинский
университет им. И.И. Мечникова» Минздрава России
САНДРИКОВ Валерий Александрович
Академик РАН, доктор медицинских наук, профессор,
заведующий отделом клинической физиологии,
инструментальной и лучевой диагностики ФГБНУ
«Российский научный центр хирургии им. академика
Б.В. Петровского», заведующий кафедрой функциональной
и ультразвуковой диагностики Института
профессионального образования ФГАОУ ВО «Первый
Московский государственный медицинский университет
им. И .М . Сеченова» Минздрава России (Сеченовский
Университет)
TITYL-new.indd xix
03.04.2019 11:36:45
TITYL-new.indd xx
03.04.2019 11:36:45
xxi
СПИСОК СОКРАЩЕНИЙ
2D
двухмерный
3D
трехмерный
A
скорость кровотока в позднюю диастолу
a′
скорость смещения фиброзного кольца в
позднюю диастолу
AATS
American Association of Thoracic Surgery
ACC
American College of Cardiology
ACCF
American College of Cardiology Foundation
AHA
American Heart Association
ARDMS
American Registry of Diagnostic Medical
Sonographers
ASA
American Society of Anesthesiologists
ASE
American Society of Echocardiography
ASIC
интегральные схемы специального
назначения
AUC
Appropriate Use Criteria
BACH
Boston Adult Congenital Heart
CARPREG Cardiac Disease in Pregnancy
CCI
Cardiovascular Credentialing International
CDISC
Clinical Data Interchange Standards
Consortium
COCATS Core Cardiology Training Symposium
CSA
площадь поперечного сечения
CTEPH
хроническая тромбоэмболическая
легочная гипертензия
CW
непрерывно-волновая допплерография
dP
градиент давления
dP/dt
изменение общего давления во времени
DT, замедление времени
DT
время замедления
E
скорость кровотока через митральный
клапан в раннюю диастолу
e′
скорость смещения фиброзного кольца
в раннюю диастолу
EACTS
European Association for CardioThoracic
Surgery
EAE
European Association of Echocardiography
EOA
площадь эффективного отверстия
EROA
площадь эффективного отверстия
регургитации
ESC
European Society of Cardiology
FDA
U.S. Food and Drug Administration
HFSA
Heart Failure Society of America
HR
коэффициент риска
IAC
Intersocietal Accreditation Commission
ISHLT
International Society of Heart and Lung
Transplantation
IVCT
время изоволюмического сокращения
IVRT
время изоволюмического расслабления
MeRGE
Meta-Analysis Research Group in
Echocardiography
MET
метаболический эквивалент
NBE
National Board of Echocardiography
NT-proBNP предшественник мозгового
натрийуретического пептида
NYHA
New York Heart Association
OR
отношение шансов
PHT
время полуспада давления
PISA
площадь проксимальной зоны струи
регургитации
PLAX
парастернальная позиция по длинной
оси
PROMISE Prospective Multicenter Imaging Study for
Evaluation of Chest Pai
PW
импульсно-волновая допплерография
Qp
легочный кровоток
Qs
системный кровоток
ROPAC
Registry On Pregnancy and Cardiac Disease
RR
относительный риск
RVo l
объем регургитации
s′
скорость смещения фиброзного кольца
в систолу
SAM-
синдром
систолическое движение передней
створки
SCA
Society of Cardiovascular Anesthesiologists
SD
стандартное отклонение
SR
скорость деформации
STE
эхокардиография с анализом движения
пятен
T1/2
время полуспада давления
TAPSE
систолическое смещение фиброзного
кольца трикуспидального кольца
TSPV
Toronto Stentless Porcine Valve
VO2max
максимальное потребление кислорода
VP
скорость распространения кровотока
VTI
интеграл скорости кровотока
WMSI
индекс нарушения локальной
сократимости миокарда
ZAHARA Zwangerschap bij vrouwen met een
Aangeboren HARtAfwijking
В АЛФАВИТНОМ ПОРЯДКЕ АНГЛИЙСКОГО ЯЗЫКА
TITYL-new.indd xxi
03.04.2019 11:36:45
xxii
Список сокращений
АВ
атриовентрикулярный
АГ
артериальная гипертензия
АД
артериальное давление
АК
аортальный клапан
АКПЖ аритмогенная кардиомиопатия правого
желудочка
Ао
аорта
АПФ
ангиотензинпревращающий фермент
АР
аортальная регургитация
АС
аортальный стеноз
БиУВК устройство вспомогательного
кровообращения с поддержкой левого
желудочка и правого желудочка
БЛНП
блокада левой ножки пучка Гиса
БМК
баллонная митральная комиссуротомия
ВАБК
внутриаортальная баллонная
контрпульсация
ВВ
время выброса
ВВЛЖ
время выброса из левого желудочка
ВДН
время диастолического наполнения
ВИ
время изгнания
ВИВР
время изоволюмического расслабления
ВИВС
время изоволюмического сокращения
ВИЛЖ
время изгнания из левого желудочка
ВИЧ
вирус иммунодефицита человека
ВОЗ
Всемирная организация здравоохранения
ВПВ
верхняя полая вена
ВПГД
время полуспада градиента давления
ВПС
врожденные пороки сердца
ВРЛЖ
внутренний размер левого желудочка
ВСУЗИ внутрисосудистое ультразвуковое
исследование
ВСЭ
внутрисердечная эхокардиография
ВТЛЖ
выходной тракт левого желудочка
ВТПЖ
выходной тракт правого желудочка
ВУ
время ускорения
ГКМП
гипертрофическая кардиомиопатия
ГЛЖ
гипертрофия левого желудочка
ГПД
глобальная продольная деформация
ГПЖ
гипертрофия правого желудочка
ГР
гормон роста
ГЧЖ
глубокое чресжелудочное
ДАД
диастолическое артериальное давление
ДАК
двухстворчатый аортальный клапан
ДДЛА
диастолическое давление в легочной
артерии
ДЗЛК
давление заклинивания в легочных
капиллярах
ДИ
доверительный интервал
ДКМП
дилатационная кардиомиопатия
ДЛА
давление в легочной артерии
ДМЖП дефект межжелудочковой перегородки
ДМПП дефект межпредсердной перегородки
ДОСЛЖ двойное отхождение магистральных
сосудов от левого желудочка
ДОСПЖ двойное отхождение магистральных
сосудов от правого желудочка
ДПЖП дефект предсердно-желудочковой
перегородки
ДПП
давление в правом предсердии
ДСЭ
добутаминовая стресс-эхокардиография
ЖКТ
желудочно-кишечный тракт
ЖТ
желудочковая тахикардия
ЖЭ
желудочковая экстрасистолия
ИБС
ишемическая болезнь сердца
ИВ
импульсно-волновая допплерография
ИВСУ
имплантированное внутрисердечное
устройство
ИДС
индекс допплеровской скорости
ИК
искусственное кровообращение
ИКДО
конечно-диастолический объем,
индексированный к площади поверхности
тела
ИКСО
конечно-систолический объем,
индексированный к площади поверхности
тела
ИКЭхоКГ интракардиальная эхокардиография
ИМ
инфаркт миокарда
ИМТ
индекс массы тела
индекс
Tei
индекс производительности миокарда
ИПМ
индекс производительности миокарда
ИПЭ
индекс потери энергии
ИСК
интеграл скорости кровотока
ИФР
инсулиноподобный фактор роста
ИЭ
инфекционный эндокардит
КАГ
коронарная ангиография
КГЛЖ
концентрическая гипертрофия ЛЖ
КДД
конечно-диастолическое давление
КДО
конечно-диастолический объем
КДР
конечно-диастолический размер
КИ
кардиальный индекс
КЛА
клапан легочной артерии
КМР
кардиоваскулярная магнитно-резонансная
визуализация
КР
коэффициент риска
КС
коронарный синус
КСО
конечно-систолический объем
В АЛФАВИТНОМ ПОРЯДКЕ РУССКОГО ЯЗЫКА
TITYL-new.indd xxii
03.04.2019 11:36:45
xxiii
Список сокращений
КСР
конечно-систолический размер
КТ
компьютерная томография
КТА
компьютерная томографическая
ангиография
КТМС
корригированная транспозиция
магистральных сосудов
КЦИ
критерии целесообразного использования
КШ
коронарное шунтирование
ЛА
легочная артерия
ЛАГ
легочная артериальная гипертензия
ЛАД
легочное артериальное давление
ЛБВ
левая безымянная вена
ЛВ
легочная вена
ЛГ
легочная гипертензия
ЛЖ
левый желудочек
ЛЖУВК левожелудочковое устройство
вспомогательного кровообращения
ЛКА
левая коронарная артерия
ЛЛА
левая легочная артерия
ЛНЛВ
левая нижняя легочная вена
ЛОА
левая огибающая артерия
ЛП
левое предсердие
ЛПНА
левая передняя нисходящая артерия
ЛР
легочная регургитация (регургитация на
легочном клапане)
ЛС
легочный ствол
ЛС
легочный стеноз
ЛСС
легочное сосудистое сопротивление
МЖП
межжелудочковая перегородка
МК
митральный клапан
МКТ
мультиспиральная компьютерная
томография
МН
митральная недостаточность
МНО
международное нормализированное
отношение
МНУП мозговой натрийуретический пептид
МОК
Международный олимпийский комитет
МПК
механическая поддержка кровообращения
МПП
межпредсердная перегородка
МПР
мультипланарная реконструкция
МПС
мочеполовая система
МР
митральная регургитация
МРА
магнитно-резонансная ангиография
МРИ
магнитно-резонансное исследование
МРТ
магнитно-резонансная томография
МС
митральный стеноз
МСКТ
мультиспиральная компьютерная
томография
НАК
недостаточность аортального клапана
НАо
нисходящий отдел аорты
НВД
непрерывно-волновая допплерография
НЖТ
наджелудочковая тахикардия
НПВ
нижняя полая вена
ОАК
область аортального клапана
ОАП
открытый артериальный проток
ОАС
общий артериальный ствол
ОИТР
отделение интенсивной терапии и
реанимации
ОКС
острый коронарный синдром
ООО
открытое овальное окно
ОПСС
общее периферическое сосудистое
сопротивление
ОТП
ортотопическая трансплантация печени
ОТС
относительная толщина стенки
ОФЭКТ однофотонная эмиссионная компьютерная
томография
ОЦК
объем циркулирующей крови
ПАК
площадь аортального клапана
ПАФС
первичный антифосфолипидный синдром
ПВ
печеночная вена
ПВКГ
правый верхний край грудины
(без сокращения)
ПВЛВ
правые верхние легочные вены
ПДО
парастернальная позиция по длинной оси
ПЖ
правый желудочек
ПЖУВК правожелудочковое устройство
вспомогательного кровообращения
ПКА
правая коронарная артерия
ПКС
правая коронарная створка
ПЛА
правая легочная артерия
ПМК
пролапс митрального клапана
ПМС
передняя митральная створка
ПНА
передняя нисходящая артерия
ПОР
площадь отверстия регургитации
ПП
правое предсердие
ППА
правая подключичная артерия
ППС
площадь поперечного сечения
ППТ
площадь поверхности тела
ППЦ
положительная прогностическая ценность
ПСМК
передняя створка митрального клапана
ПТГ
паратиреоидный гормон
ПЭТ
позитронно-эмиссионная томография
РЛС
резистентность легочных сосудов
САД
систолическое артериальное давление
САК
склероз аортального клапана
СВ
сердечный выброс
СГД
средний градиент давления
СГЛОС синдром гипоплазии левых отделов сердца
СД
сахарный диабет
СДЛА
систолическое давление в легочной
артерии
СДПЖ систолическое давление в правом
желудочке
СКВ
системная красная волчанка
СКФ
скорость клубочковой фильтрации
СЛА
стеноз легочной артерии
TITYL-new.indd xxiii
03.04.2019 11:36:45
xxiv
Список сокращений
СЛД
синдром Лойеса–Дитца
СМ
синдром Марфана
СН
сердечная недостаточность
СНсФВ
сердечная недостаточность с сохранной
фракцией выброса
СО
стандартное отклонение
СОЭ
скорость оседания эритроцитов
СРБ
C-реактивный белок
СРТ
сердечная ресинхронизирующая терапия
ССЗ
сердечно-сосудистое заболевание
ССТК
систолическое смещение фиброзного
кольца трикуспидального клапана
СТР
скорость трикуспидальной регургитации
СТС
синотубулярное соединение
СЭД
стресс-эхокардиография с добутамином
СЭПТК систолическая экскурсия плоскости
трикуспидального кольца
ТАДЛВ тотальный аномальный дренаж легочных
вен
ТВПШ
трансяремный внутрипеченочный
портосистемный шунт
ТДЭхоКГ тканевая допплерография
ТЗС
толщина задней стенки
ТИА
транзиторная ишемическая атака
ТИАК
транскатетерная имплантация аортального
клапана
ТК
трикуспидальный клапан
ТМС
транспозиция магистральных сосудов
ТР
трикуспидальная регургитация
ТС
трикуспидальный стеноз
ТТГ
тиреотропный гормон
ТТЭхоКГ трансторакальная эхокардиография
ТФ
тетрада Фалло
УВК
устройство вспомогательного
кровообращения
УЗИ
ультразвуковое исследование
УЛП
ушко левого предсердия
УО
ударный объем
ФВ
фракция выброса
ФВЛЖ фракция выброса левого желудочка
ФВПЖ фракция выброса ПЖ
ФК
функциональный класс
ФП
фибрилляция предсердий
ФЭД
фиброэластический дефицит
ХОБЛ
хроническая обструктивная болезнь легких
ХСН
хроническая сердечная недостаточность
ЦДК
цветовое допплеровское картирование
ЧАДЛВ частичный аномальный дренаж легочных
вен
ЧКВ
чрескожное коронарное вмешательство
ЧПЭхоКГ чреспищеводная эхокардиография
ЧСС
частота сердечных сокращений
ЭКГ
электрокардиограмма
ЭКМО
экстракорпоральная мембранная
оксигенация
ЭКС
электрокардиостимулятор
ЭЛКТ
электронно-лучевая компьютерная
томография
ЭМБ
эндомиокардиальная биопсия
ЭПБ
энтеропатия с потерей белка
ЭФ
электрофизиологическое исследование
ЭхоКГ
эхокардиография
TITYL-new.indd xxiv
03.04.2019 11:36:46
xxv
Список сокращений
Символ
Греческое
название Использование
α
альфа
Частота
γ
гамма
Вязкость
Δ
дельта
Разница, градиент
θ
тета
Угол
λ
лямбда
Длина волны
μ
мю
Микро-
π
пи
Математическая константа (≈ 3,14)
ρ
ро
Плотность тканей
σ
сигма
Напряжение стенки
τ
тау
Константа времени расслабления
желудочков
Переменная
Единица Определение
Амплитуда
дБ
Децибелы — логарифмическая шкала, описывающая амплитуду звуковой волны
Угол
градус
Градус = (π/180)rad
Площадь
см2
Квадратные сантиметры. Двухмерное измерение (например, конечно-систолическая
площадь) или другие значения (например, площадь клапана)
Частота (f)
Гц
Герц (циклов в секунду)
кГц
Килогерц = 1000 Гц
MГц
Мегагерц = 1 000 000 Гц
Длина
см
Сантиметр (1/100 м)
мм
Миллиметр (1/1000 м или 1/10 см)
Масса
г
Грамм, например: масса ЛЖ
Давление
мм рт. ст. Миллиметр ртутного столба, 1 мм рт. ст . = 1333,2 дин/см2, где дин — сила в см ⋅г ⋅сек
–2
Сопротивление
дин·c⋅см
– 5 Измерение сосудистого сопротивления
Время
сек
Секунды
мсек
Миллисекунды (1/1000 сек)
мксек
Микросекунды
Интенсивность
ультразвука
Вт/см2
Ватт (Вт) = джоуль на секунду, а джоуль = м2
·к г ⋅сек
–2
мВт/см2
Скорость (v)
м/сек
Метров в секунду
см/сек
Сантиметров в секунду
Интеграл скорости
кровотока
см
Интеграл кривой скорости допплера (см/сек) в единицу времени (сек), в см
Объем
см3
Кубический сантиметр
мл
Миллилитр, 1 мл = 1 см3
л
Литр = 1000 мл
Объемная скорость
кровотока (Q)
л/мин
Объемная скорость кровотока на клапане или сердечный выброс
л/мин = литров в минуту
мл/сек = миллилитров в секунду
мл/сек
Напряжение стенки дин/см2 Единицы меридионального либо периферического напряжения стенки
кдин/см2 Килодин на см2
кПа
Килопаскаль, где 1 кПа = 10 кдин/см2
Единицы измерения
TITYL-new.indd xxv
03.04.2019 11:36:46
TITYL-new.indd xxvi
03.04.2019 11:36:46
ЧАСТЬ
ЧАСТЬ
Передовые методы
эхокардиографии
I
ch01.indd 1
03.04.2019 11:36:18
ch01.indd 2
03.04.2019 11:36:19
3
1
Диагностическое отделение
эхокардиографии
RORY B. WEINER, MD • PAMELA S. DOUGLAS, MD
Качество оказания медицинской
помощи
Структура диагностического
отделения и процесс визуализации
Структура диагностического отделения
Процесс визуализации
Повышение качества исследования
Критерии целесообразного
использования эхокардиографии
и отбор пациентов
Воспроизводимость данных
и вариабельность интерпретации
результатов
Проведение эхокардиографических
исследований вне диагностического
отделения
Качество медицинской помощи
в эпоху реформирования системы
здравоохранения
Эхокардиография (ЭхоКГ) играет главную роль в
диагностике и лечении сердечно-сосудистых заболе-
ваний. С появлением в 1970-х гг. двухмерной ЭхоКГ
(2D-ЭхоКГ) и внедрением в 1980-х гг . допплеровско-
го метода исследования спектр диагностируемых с
помощью ЭхоКГ заболеваний сердца значительно
увеличился. Последующее развитие ЭхоКГ и появ-
ление новых технологий подтверждает ведущую
роль данного метода визуализации при лечении па-
циентов с диагностированными или подозреваемы-
ми сердечно-сосудистыми заболеваниями. Исследо-
вание сердца долгое время было приоритетным [1],
однако в последнее время все больший акцент дела-
ется на визуализации всей сердечно-сосудистой си-
стемы [2].
ЭхоКГ — широко используемый метод ви-
зуализации [3], но существуют проблемы, связан-
ные с применением данного метода [4, 5]. Измене-
ния в системе здравоохранения увеличивают требо-
вания к качеству диагностики, выдвигая на первый
план точность измерений при использовании ЭхоКГ
в клинике [6].
КАЧЕСТВО ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
Качество оказания медицинской помощи определя-
ют как «степень, с которой сфера здравоохранения
и относящиеся к ней службы медицинской помощи
повышают вероятность достижения желаемого ре-
зультата относительно здоровья отдельных лиц и
групп населения при оказании медицинской помо-
щи в соответствии с существующими профессио-
нальными знаниями» [7]. Кроме этого, медицин-
ская помощь должна быть безопасной, своевремен-
ной, квалифицированной, ориентированной на
пациента, беспристрастной и эффективной [8]. В
медицине наступила эпоха, когда все большее вни-
мание уделяется денежной составляющей, опреде-
ляемой как достигнутый результат лечения на каж-
дый потраченный доллар («количество объема ус-
луг пропорционально потраченным средствам») [9,
10]. Некоторые профессиональные организации [1,
2, 11–13] выступили с инициативой установить ми-
нимальные стандарты ЭхоКГ и уровень качества, к
которому должны стремиться все диагностические
отделения, использующие данный метод исследова-
ния. Для обеспечения качественной медицинской
помощи создана система непрерывного повышения
качества (Continuous quality improvement, CQI), ко-
торая затрагивает деятельность как врачей и специ-
алистов по ультразвуковой диагностике, так и дру-
гих специалистов в области здравоохранения. Ос-
новой для достижения этой цели может стать
использование цикла «планирование — действие —
изучение — корректировка», который называют
циклом Деминга [14].
СТРУКТУРА ДИАГНОСТИЧЕСКОГО ОТДЕЛЕНИЯ
И ПРОЦЕСС ВИЗУАЛИЗАЦИИ
Первым шагом для достижения качества ЭхоКГ яв-
ляется определение тех показателей медицинской
помощи, которые позволят измерить качество и
выявить области, нуждающиеся в улучшении. Раз-
работанная для ЭхоКГ система показателей меди-
цинской помощи включает структуру диагностиче-
ch01.indd 3
03.04.2019 11:36:19
4
ЧАСТЬ I Передовые методы эхокардиографии
ского отделения и процесс визуализации (рис. 1 .1)
[2, 11].
СТРУКТУРА ДИАГНОСТИЧЕСКОГО ОТДЕЛЕНИЯ
Структура диагностического отделения состоит из
четырех компонентов: отделение ЭхоКГ, оборудова-
ние, специалист по ультразвуковой диагностике и
врач (табл. 1 .1). Для каждого из компонентов опре-
делены свои стандарты [11]. Рекомендуется полу-
чать аккредитацию в Intersocietal Accreditation Com-
mission (IAC) как для существующих диагностиче-
ских отделений, так и для новых. Срок подачи заявок
на аккредитацию не должен превышать 2 года с мо-
мента начала работы диагностического отделения.
Аккредитация IAC — ресурсоемкий процесс [15].
Стандарты IAC организации используют в качестве
руководства для достижения высоких показателей
качества. Согласно стандартам IAC, необходим ана-
лиз клинических случаев и показателей эффектив-
ности, к которым относят корректность заключе-
ний, своевременность исследования, сопоставление
результатов ЭхоКГ с результатами других методов
визуализации (рис. 1 .2), расхождения в способах
проведения исследования между врачами.
Аккредитация IAC крайне важна, но ее недоста-
точно для обеспечения необходимого качества ра-
боты диагностического отделения, вероятно, нужен
отдельный комитет для решения этого вопроса. Ак-
кредитация помогает выявить показатели, которые
ниже базового уровня, однако минимальные стан-
дарты не отражают качество оказания медицинской
помощи, оказываемой врачами большинству паци-
ентов. Недавно IAC начала исследования для повы-
шения ценности аккредитации [15].
Существуют определенные требования к обору-
дованию для ЭхоКГ. Ультразвуковые системы долж-
ны позволять проводить исследования в M-режиме
и 2D-режиме, а также с помощью спектральной (им-
пульсно-волновой и непрерывно-волновой) доп-
плерографии, цветового допплеровского картирова-
ния кровотока и тканевой допплерографии. Также
должна быть возможность визуализации в 3D-режи-
ме и регистрации деформации миокарда. Для хране-
ния цифровых данных существуют специальные
стандарты (информация должна храниться в тече-
ние регламентированного законом времени) [11].
Качество работы диагностического отделения за-
висит от сотрудничества персонала, особенно врача
со специалистом по ультразвуковой диагностике и
другими специалистами. Знания каждого специали-
ста должны соответствовать минимальным стан-
дартам образования, каждый сотрудник в течение
2 лет с момента начала работы должен пройти спе-
циализацию и получить аттестат. Для регистрации
в качестве специалиста по ЭхоКГ в США необходи-
мо обратиться в American Registry of Diagnostic Me-
dical Sonographers либо Cardiovascular Credentialing
International.
Все врачи, кто самостоятельно выполняет эхо-
кардиографические исследования и интерпретирует
их результаты, должны иметь как минимум II сте-
пень подготовки в области трансторакальной эхо-
кардиографии (ТТЭхоКГ) (табл. 1 .2) соответствен-
но регламенту по кардиологическому профилю
COCATS IV (Core Cardiology Training Symposium) в
области ЭхоКГ, который определяет критерии ком-
петентности [16, 17]. II степень подготовки подраз-
умевает наличие достаточного опыта для точной и
самостоятельной интерпретации эхокардиограмм,
но желательно получить аттестат в National Board of
Echocardiography (NBE) и сертификат. У каждого
отделения ЭхоКГ должен быть руководитель — спе-
циалист по ультразвуковой диагностике с III степе-
нью подготовки. III степень подготовки свидетель-
ствует о том, что врач обладает знаниями по управ-
лению отделением ЭхоКГ, улучшению качества его
работы, может внедрять новые технологии, владеет
специальными методами визуализации (интраопе-
рационной ЭхоКГ, визуализацией в 3D-режиме) и
Процесс визуализации
Структура диагностического отделения
Отбор пациентов и выбор
метода исследования
Получение
изображений
Интерпретация
изображений
Передача результатов
и применение в лечебном процессе
Улучшение
результатов лечения
Рис. 1.1 Элементы оценки качества услуг, оказываемых диагностическим отделением. Процесс визуализации — это последовательный путь из не-
скольких этапов: отбор пациентов и выбор метода исследования, получение изображений, интерпретация изображений, передача результатов и применение в ле-
чебном процессе. Цель — достижение качественной визуализации для улучшения результатов лечения.
ch01.indd 4
03.04.2019 11:36:19
5
1 Диагностическое отделение эхокардиографии
Компонент
Требования
Отделение
эхокардиографии
Аккредитация IAC (аккредитацию проводят ка ждые 3 года)
Достаточное количество вспомогательного персонала (помощь в составлении расписания)
Инвентарь для стерилизации и дезинфекции зондов для ЧПЭхоКГ, чистящие средства для датчиков
ТТЭхоКГ и обработки кроватей для пациентов, доступность раковин для мытья инвентаря
Оборудование
Ультразвуковые системы для исследования в М-режиме, 2D-режиме, а также с помощью спектральной
допплерографии, цветового допплеровского картирования кровотока и тканевой допплерографии
Отра жение на экране монитора названия учреждения, фамилии пациента, даты и времени
исследования
Возможность калибровки глубины и скорости потока и отображение других физиологических
параметров
Программное обеспечение для стресс-ЭхоКГ с отображением на экране монитора четырех изображе-
ний одновременно
Датчики для ТТЭхоКГ с обеспечением низко- и высокочастотной визуализации, а также датчик Pedoff
Ультразвуковая система с возможностью настройки гармоник для оптимизации контрастного усиления
Возможность построения трехмерных изображений
Датчики для ЧПЭхоКГ
Возможность хранения цифровых данных
Контрастные средства для внутривенного введения
Специальные кровати для пациентов, в том числе откидные, для визуализации из апикального доступа
Оборудование для экстренной и неотложной медицинской помощи (кислород, набор для реанимации
и т.д.)
Соблюдение рекомендаций производителей по своевременному профилактическому обслуживанию
ультразвуковых систем
Специалист
по ультразвуковой
диагностике
Аттестация всех врачей, выполняющих эхокардиографические исследования,
в первые 2 года работы диагностического отделения
Аккредитацию можно получить через ARDMS либо через CCI
Выполнение требований региона, включая подтверждение лицензии
Врач
Минимум II степень подготовки по ТТЭхоКГ для всех врачей, кто самостоятельно интерпретирует
результаты исследований. Ежегодная оценка компетентности
Врачи со II степенью подготовки должны совершенствовать знания и повышать опыт
Специальная аттестация и сертификация после сдачи экзамена NBE
Руководитель отделения должен иметь III степень подготовки
Надлежащий контроль диагностических исследований, определяемый программами Medicare
и Medicaid: общий контроль (все учреждение), прямой контроль (врачи отделения), личный
контроль (врач на рабочем месте)
ARDMS — American Registry of Diagnostic Medical Sonographers; CCI — Cardiovascular Credentialing International; IAC — Intersocietal Accred-
itation Commission; NBE — National Board of Echocardiography; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспище-
водная эхокардиография.
[Picard MH, Adams D, Bierig SM, et al. American Society of Echocardiography recommendations for quality echocardiography laboratory opera-
tions, J Am Soc Echocardiogr 24:1–10, 2011.]
ТАБЛИЦА 1.1 Структура диагностического отделения и ее компоненты
интерпретации результатов исследования деформа-
ции миокарда, а также способен обеспечить тесное
взаимодействие с другими специалистами в неот-
ложных ситуациях. В каждом отделении должен
быть налажен четкий механизм оповещения специ-
алиста по ультразвуковой диагностике о поступле-
нии пациента, которому нужно провести ЭхоКГ по
экстренным показаниям. Некоторые исследователи
для улучшения работы отделения ЭхоКГ предложи-
ли выделять для просмотра мультимодальных изо-
бражений отдельные комнаты. В отделениях, на ба-
зе которых проходят подготовку будущие специа-
листы по ЭхоКГ, должны придерживаться
установленных принципов и требований к учебно-
му процессу для выполнения стажерами основного
учебного плана [17].
ПРОЦЕСС ВИЗУАЛИЗАЦИИ
Процесс визуализации можно разделить на 4 основ-
ных этапа: отбор пациентов и выбор метода иссле-
дования, получение изображений, интерпретация
изображений, передача результатов и применение в
лечебном процессе (табл. 1 .3; см. рис. 1 .1) [2].
Отбор пациентов для ЭхоКГ имеет большое зна-
чение для обеспечения оказания качественной ме-
дицинской помощи и предотвращает необоснован-
ное, недостаточное либо неправильное применение
этого метода визуализации. Для оптимизации отбо-
ра пациентов American College of Cardiology Foun-
dation (ACCF) и другие специализированные орга-
низации сформулировали критерии целесообразно-
го использования (КЦИ) (Appropriate Use Criteria,
AUC) эхокардиографии [18]. Однако важно, чтобы
ch01.indd 5
03.04.2019 11:36:19
6
ЧАСТЬ I Передовые методы эхокардиографии
ТТЭхоКГ: ФВЛЖ
Сопоставление
ФВЛЖ:
МРТ сердца
ФВЛЖ: нагрузочное
радионуклидное исследование
Обсуждение несоответствий на совещаниях
и обучение персонала на курсах повышения квалификации
А
ЧПЭхоКГ: регургитация на клапане
Сопоставление
Оценка механизма
регургитации
во время операции
ТТЭхоКГ:
степень регургитации
Обсуждение несоответствий на совещаниях
и обучение персонала на курсах повышения квалификации
Б
Стресс-ЭхоКГ:
нарушение сократимости миокарда
Сопоставление
ИБС: коронарная
ангиография
ИБС: КТА сердца
Обсуждение несоответствий на совещаниях
и обучение персонала на курсах повышения квалификации
В
Рис. 1 .2 Корреляция данных эхокардиографии с данными других ме-
тодов визуализации сердца. Согласно требованиям IAC, результаты эхо-
кардиографических исследований должны коррелировать с результатами дру-
гих методов визуализации либо с находками во время операции и аутопсии
(часть контроля качества). Такой анализ следует проводить ежеквартально
(4 раза в год). Необходимо выявлять несоответствия, делать выводы и на их
основании повышать эффективность работы. На рисунке приведены некото-
рые примеры сравнения эхокардиографических данных с данными других ме-
тодов визуализации. (А) Фракцию выброса левого желудочка (ФВЛЖ) при
трансторакальной эхокардиографии (ТТЭхоКГ) можно сопоставить с фракцией
выброса левого желудочка, полученной при визуализации перфузии миокарда
во время нагрузочного радионуклидного исследования и/или при магнитно-ре-
зонансной томографии (МРТ) сердца. (Б) Данные о регургитации, полученные
при чреспищеводной эхокардиографии (ЧПЭхоКГ), можно сопоставить с дан-
ными ТТЭхоКГ. Степень регургитации при ЧПЭхоКГ коррелирует с оценкой ее
во время кардиохирургического вмешательства. (В) Нарушение сократимости
миокарда при стресс-ЭхоКГ можно сопоставить с данными компьютерной то-
мографической ангиографии (КТА) либо коронарной ангиографии при ишеми-
ческой болезни сердца (ИБС) с обструкцией коронарных артерий.
ch01.indd 6
03.04.2019 11:36:19
7
1 Диагностическое отделение эхокардиографии
специалисты по ультразвуковой диагностике и дру-
гие специалисты понимали суть КЦИ. Оптимиза-
ция осуществляется путем обучения врачей и сни-
жения количества необоснованных направлений на
исследование.
Получение качественной ЭхоКГ зависит от ряда
факторов. Некоторые из них неизменны (напри-
мер, состояние здоровья пациента, его телосложе-
ние), другие варьируют (например, оборудование,
аккредитация) и гарантируют решение любых тех-
нических задач, стоящих перед диагностическим
отделением. Внедрение новых технологий, в част-
ности использование контрастных средств, сводит к
минимуму количество неинформативных ЭхоКГ
при оценке структур сердца [19]. Контрастные сред-
ства используют при плохой визуализации границ
эндокарда, особенно при оценке размеров и объема
полостей сердца, фракции выброса, а также локаль-
ной сократимости миокарда. Плохая визуализация
границ эндокарда подразумевает невозможность
достоверно различить два или более смежных сег-
мента в любой из трех апикальных позиций [19].
Контрастные средства также следует использовать
при диагностике и оценке гипертрофической кар-
диомиопатии, некомпактном миокарде левого же-
лудочка (ЛЖ), для усиления слабого допплеровско-
го сигнала либо при подозрении на тромбоз ЛЖ.
При проведении стресс-ЭхоКГ использование кон-
трастных средств оправдано, если на изображении
не удается определить эндокард и оценить сократи-
мость миокарда ЛЖ в области коронарных артерий
в состоянии покоя или быстро получить качествен-
ные изображения во время максимальной нагрузки.
Для получения полной и точной диагностиче-
ской информации следует придерживаться мини-
мальных критериев протокола ТТЭхоКГ, чреспи-
щеводной эхокардиографии (ЧПЭхоКГ) и стресс-
ЭхоКГ. Позиции и режимы, включенные в протокол
полного исследования с помощью ТТЭхоКГ, под-
робно описаны в табл. 1 .4 . Протокол полного иссле-
дования должен учитывать конкретные заболева-
ния. Например, при клапанном аортальном стенозе
максимальный градиент давления следует измерять
в нескольких позициях с использованием доппле-
ровского датчика Pedoff. Ограниченные возможно-
сти ТТЭхоКГ соответствуют диагностическим зада-
чам в том случае, если пациент проходит обследо-
вание через равные интервалы времени.
Полную ЧПЭхоКГ проводят по определенному
протоколу [20]. Изображения структур сердца мож-
но получить с помощью ЧПЭхоКГ из разных досту-
пов и позиций (см. главу 3). Позиции и последова-
тельность исследования могут меняться в зависи-
мости от клинической ситуации.
Стресс-ЭхоКГ следует проводить только при воз-
можности одновременной регистрации электрокар-
диограммы. Ультразвуковая система должна иметь
функцию отображения на экране монитора четы-
рех изображений одновременно. При оценке общей
функции ЛЖ должна быть возможность получения
исходных изображений и изображений при макси-
мальной нагрузке. При отсутствии данных о поло-
стях и клапанах сердца перед стресс-ЭхоКГ следует
провести полное исследование.
Стресс-ЭхоКГ с физической нагрузкой проводят
в парастернальной позиции по длинной оси (мож-
но заменить на апикальную), парастернальной по
короткой оси (можно заменить на субкостальную),
апикальных четырехкамерной и двухкамерной по-
зициях. Визуализацию нужно провести в течение
60 сек после завершения теста на тредмиле при мак-
симальной нагрузке либо регистрировать в момент
максимальной нагрузки при велоэргометрии в по-
ложении лежа. Для проведения стресс-ЭхоКГ с фар-
макологической нагрузкой следует придерживаться
протокола, который устанавливает минимальную и
максимальную дозы, периодичность введения ве-
щества. При стресс-тестах в доступе должны быть
оборудование и лекарства для реанимации на слу-
чай экстренной ситуации.
Самым важным фактором качественной диагно-
стики является интерпретация изображений. Раз-
Степень
подготовки
Длительность
подготовки
(месяцы)
Общая
длительность
подготовки
(месяцы)
Минимальное
количество
проведенных
ТТЭхоКГ
Минимальное
количество
интерпретированных
ТТЭхоКГ
Проведение ЧПЭхоКГ
I
3
3
75
150
Не компетентен
II
3
6
150
300
25 введений датчика
в пищевод, 50 полных
ЧПЭхоКГ (рекомендовано
100)
III
3
9
300
750
25 введений датчика
в пищевод, 50 полных
ЧПЭхоКГ (рекомендовано
100)
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 1.2 Требования к специалистам для проведения эхокардиографии
ch01.indd 7
03.04.2019 11:36:19
8
ЧАСТЬ I Передовые методы эхокардиографии
Этап
Требования
Отбор пациентов
и выбор метода
исследования
Использование КЦИ для мониторинга целесообразных и нецелесообразных
эхокардиографических исследований
Ежегодное доведение до всего персонала обновлений КЦИ
Разработка способов сокращения количества нецелесообразных эхокардиографических исследований
(в том числе обучение врачей, которые редко используют данный диагностический метод)
Перед проведением ЧПЭхоКГ врач обязан ознакомиться с анамнезом заболевания и с учетом
данных анамнеза и возможных рисков выбрать метод диагностики
Проведение стресс-ЭхоКГ под контролем опытного врача, который ознакомлен с анамнезом
заболевания пациента и знает обо всех возможных рисках
Проведение выборочного аудита целесообразности диагностического исследования
Контроль своевременности диагностических исследований и времени ожидания обследования
стационарными и амбулаторными пациентами
Использование протоколов для оценки правильности назначения исследований
Получение
изображений
Контроль знаний признаков заболеваний, техники выполнения исследований и получения
качественных изображений
Ежегодное обучение врачей
Аккредитация отделения ЭхоКГ для возможности выполнения полного протокола исследований
Ведение работы по снижению количества нецелесообразных и малоинформативных исследований
(например, при использовании контрастного средства). Даже при целесообразном использовании
контрастного средства < 5% ТТЭхоКГ были малоинформативными относительно функции
ЛЖ и > 10% стресс-ЭхоКГ — малоинформативными относительно оценки локальной функции ЛЖ
Достаточное время для проведения исследования (например, 45–60 мин для ТТЭхоКГ; позиции,
режимы, структуры сердца и измерения при ТТЭхоКГ приведены в табл. 1.4, 1.5)
Полное обследование либо обследование только интересующей структуры с помощью ЧПЭхоКГ
Регистрация роста и массы тела пациента для коррекции показателей согласно индексам
Регистрация давления и частоты сердечных сокращений на момент исследования
Количество сердечных циклов от 1 до 2 без нарушения ритма
Четкий сигнал ЭКГ во всех отведениях
Запись четкого сигнала, в том числе скорости кровотока
Запись измерений только в случае полной уверенности в их точности и воспроизводимости
При наличии регургитации выполнить цветовое допплеровское картирование кровотока
как минимум в двух позициях
При клапанном стенозе измерить максимальный градиент давления во всех возможных позициях
(в т.ч . используя датчик Pedoff)
При возможности провести полное диагностическое исследование. Если ЭхоКГ была выполнена
совсем недавно, допускается исследование лишь интересующих структур
Интерпретация
изображений
Время, потраченное на интерпретацию, зависит от сложности исследования, используемого
оборудования и опыта врача
При интерпретации следует: (1) выделить общие положения; (2) обобщить полученные данные;
(3) сопоставить полученные данные с целью исследования; (4) сопоставить полученные данные
с данными предыдущих исследований, акцентируя внимание на изменениях
Интерпретация стресс-ЭхоКГ включает оценку общей и локальной функций ЛЖ в покое
и при нагрузке. Может понадобиться и оценка гемодинамики в покое и при нагрузке
Основные элементы заключения: фамилия, имя, отчество пациента (полностью), номер медицинской
карточки, дата рождения, пол, рост, масса тела, фамилия врача, показания к проведению исследова-
ния, место проведения исследования, идентификационный номер ультразвуковой системы, описание
качества исследования, фамилия врача, который интерпретировал результаты, дата/время проведения
исследования и интерпретации, дата/время заключения, результаты эхокардиографии и вывод
о выявленных аномалиях и сопоставлении с предыдущими исследованиями (при их наличии)
Заключения всех эхокардиографических исследований должны иметь единый формат, язык и отобра-
жать ключевые измерения и характеристики структур сердца. Заключение должно включать качестве-
ную оценку всех структур, перечисленных в табл. 1 .4. При затруднении визуализации какой-либо
структуры это необходимо отразить в заключении. Обязательно помечать и комментировать атипич-
ную анатомию и функциональное состояние сердца
В журнале отметить дату, время и фамилию врача, который вносил правку электронной версии заклю-
чения (необходимо сохранять версию до правки и сопоставлять ее с последующими изменениями)
Результаты рутинных исследований должен интерпретировать опытный врач в течение первых суток
после исследования (не позднее 48 часов)
Статистические данные должен интерпретировать опытный врач
ТАБЛИЦА 1.3 Этапы процесса визуализации
ch01.indd 8
03.04.2019 11:36:20
9
1 Диагностическое отделение эхокардиографии
Каждое отделение ЭхоКГ должно иметь собствен-
ное представление о критических значениях показа-
телей и обеспечивать своевременное обращение па-
циентов к врачу. Для этого ACCF, American Heart
Association (AHA), ASE, Clinical Data Interchange
Standards Consortium (CDISC) создали консорциум
по стандартизации обмена клиническими данными
и разработали специальные термины и обозначения
для ТТЭхоКГ.
Основная цель отделения ЭхоКГ — помочь в
принятии решения о тактике лечения и выявить
прогностические признаки клинического исхода.
Хотя отделения ЭхоКГ не несут прямой ответствен-
ности за изменение лечения на основании данных
ЭхоКГ, однако их заключения представляют собой
ценный для клиники источник информации. Спе-
циалисты, проводящие ЭхоКГ, должны разрабаты-
вать критерии и расширять свои знания о том, ка-
кие данные имеют ценность для принятия диагно-
стического и клинического решения. В целом
отмечается положительная тенденция во взаимоот-
ношениях между врачами и взаимодействии между
диагностическими отделениями [24, 25]. В дальней-
шем планируется разработать методы оценки вли-
яния данных ЭхоКГ на принятие клинических ре-
шений, достоверности стратификации рисков, что
дополнит оценку качества.
Другая задача — сопоставление и сравнение ре-
зультатов ЭхоКГ с результатами других методов ви-
зуализации сердца. Примером решения этой задачи
служит многоцентровое проспективное исследова-
ние PROMISE (Prospective Multicenter Imaging Study
for Evaluation of Chest Pai). В данном исследовании
всех пациентов с впервые появившимися симпто-
мами ишемической болезни сердца разделили на
две группы. Пациентам из первой группы проводи-
ли анатомическое исследование (компьютерную то-
мографию коронарных артерий), а пациентам из
второй группы — функциональное исследование
(включая стресс-ЭхоКГ) [26]. За 2 года наблюдений
у пациентов из первой группы клинические исходы
не улучшились и не было отмечено снижения за-
трат на медицинскую помощь. Это исследование —
прекрасный пример рандомизированного исследо-
личные отделения могут иметь разные мнения по
поводу одной и той же патологии в зависимости от
того, как специалист интерпретировал результаты
обследования. В конечном итоге полную ответ-
ственность за интерпретацию несет врач, который
ставит подпись под протоколом исследования. Пол-
ная визуализация при ТТЭхоКГ должна включать
оценку всех структур сердца, их размеров и функ-
ций (табл. 1 .5). При некачественном изображении
либо невозможности оценить структуру следует от-
метить это в протоколе исследования. American So-
ciety of Echocardiography (ASE) были подробно опи-
саны все измерения, которые необходимо провести
во время исследования [21]. Главная проблема ин-
терпретации заключается в ее субъективности, т.е .
каждый врач оценивает изображение на основе сво-
их знаний и опыта, поэтому для улучшения каче-
ства диагностики необходимы объективизм и вос-
производимость полученных данных. Следует регу-
лярно совершенствовать протоколы исследований
и поддерживать стандарт, рекомендованный ASE
[11] и необходимый для аккредитации IAC [15]. Не-
давно опубликованные рекомендации включают
подходы, которые можно адаптировать под отделе-
ние любого размера и которые не нуждаются в ста-
тистическом анализе [22].
Передача результатов исследования — еще один
важный компонент качества ЭхоКГ. Заключения и
протоколы исследований должны легко и однознач-
но интерпретироваться всеми врачами. Для этого
необходимо следовать стандартам отчетности. Все
эхокардиографические заключения должны соот-
ветствовать образцу и включать описание структур
сердца, их размеров и функций. Также должна при-
сутствовать информация об отделении, его руко-
водстве, демографические данные пациента, исто-
рия болезни и факторы риска, полный протокол ис-
следования. Информация должна быть клинически
значимой, полной, ясной, сопоставимой и воспро-
изводимой [23]. Протокол исследования не должен
быть чрезмерно длинным или очень кратким. Для
контроля качества рекомендуется разработать кри-
терии оценки и отслеживать неполные заключения,
что важно для получения аккредитации IAC [15].
Этап
Требования
Передача результа-
тов и применение
в лечебном
процессе
Всю критическую информацию (расслоение аорты, тампонада сердца, новообразование, тромбоз, веге-
тации, выра женная дисфункция желудочков, регургитация либо клапанный стеноз) следует незамед-
лительно передать лечащему врачу, регистрируя дату и время предоставления критической информа-
ции. Следует акцентировать внимание врачей на том, что эхокардиографические данные действитель-
но помогают в принятии клинических решений
КЦИ — критерии целесообразного использования; ЛЖ — левый желудочек; стресс-ЭхоКГ — стресс-эхокардиография; ТТЭхоКГ — транс-
торакальная эхокардиография; УЗИ — ультразвуковое исследование; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭКГ — электро-
кардиография; ЭхоКГ — эхокардиография.
[Picard MH, Adams D, Bierig SM, et al. American Society of Echocardiography recommendations for quality echocardiography laboratory opera-
tions, J Am Soc Echocardiogr 24:1–10, 2011.]
ТАБЛИЦА 1.3
окончание
Этапы процесса визуализации
ch01.indd 9
03.04.2019 11:36:20
10
ЧАСТЬ I Передовые методы эхокардиографии
Парастернальная позиция по длинной оси
Измерение размеров ЛЖ, ЛП, диаметра аорты (2D-режим)
ЛЖ, отношение размера ЛП к диаметру аорты (ЭхоКГ в М-режиме)
Поток на клапанах (ЦДК кровотока)
Поток через приточный отдел ПЖ (ЦДК кровотока и спектральная допплерография)
Парастернальная позиция по короткой оси
На уровне АК (ЦДК кровотока через АК, клапан легочной артерии, ТК)
ЛЖ на уровне МК (2D-режим)
ЛЖ на уровне папиллярных мышц (2D-режим)
ЛЖ на уровне верхушки (2D-режим)
Апикальная четырехкамерная позиция
Четыре полости (максимальный размер ЛЖ по длинной оси) (2D-режим)
Поток через клапаны и оценка МР и ТР (ЦДК кровотока)
Поток через МК и ТК (импульсно-волновая допплерография)
Поток по легочным венам (импульсно-волновая допплерография)
Смещение септальной и латеральной частей фиброзного кольца МК (тканевая допплерография)
Деформация и скорость деформации (опционально)
Поток через МК и ТК (непрерывно-волновая допплерография)
Поток через МК (ЦДК кровотока в М-режиме) (опционально)
Межпредсердная перегородка (ЦДК кровотока)
Апикальная пятикамерная позиция
ВТЛЖ и АК (2D-режим)
Поток в ВТЛЖ (ЦДК кровотока)
Поток в ВТЛЖ (импульсно-волновая допплерография)
Поток через АК (непрерывно-волновая допплерография)
Апикальная двухкамерная позиция
МК (2D-режим)
Поток через МК (ЦДК кровотока)
Апикальная трехкамерная позиция по длинной оси
АК, МК, ВТЛЖ (2D-режим)
Поток через АК и МК (ЦДК кровотока)
Поток в ВТЛЖ (импульсно-волновая допплерография)
АК (непрерывно-волновая допплерография)
Субкостальная позиция*
4 полости, межпредсердная перегородка (2D-режим)
4 полости для оценки шунта на уровне предсердий (ЦДК кровотока)
Диаметр НПВ и коллабирование на вдохе (2D-режим)
Поток в печеночных венах (ЦДК кровотока и импульсно-волновая допплерография)
Брюшная часть нисходящего отдела аорты (2D-режим, ЦДК кровотока либо спектральная допплерография в случае АР)
Супрастернальная позиция
Дуга аорты по длинной оси (2D-режим)
Нисходящий отдел аорты (импульсно-волновая допплерография в случае АР)
Другие позиции при специфических заболеваниях
Правая парастернальная позиция при стенозе АК (непрерывно-волновая допплерография)
Правая парастернальная позиция при патологии восходящего отдела аорты (2D-режим)
Апикальная четырехкамерная позиция (введение контрастного средства в покое с пробой Вальсальвы для обнаружения
внутрисердечного либо внутрилегочного шунта)
* Субкостальная позиция по короткой оси дополняет парастернальную позицию по короткой оси.
АК — аортальный клапан; АР — аортальная регургитация; ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; ЛП —
левое предсердие; МК — митральный клапан; МР — митральная регургитация; НПВ — нижняя полая вена; ПЖ — правый желудочек;
ТК — трикуспидальный клапан; ТР — трикуспидальная регургитация; ЦДК — цветовое допплеровское картирование; ЭхоКГ — эхокар-
диография.
[Picard MH, Adams D, Bierig SM, et al. American Society of Echocardiography recommendations for quality echocardiography laboratory opera-
tions, J Am Soc Echocardiogr 24:1–10, 2011.]
ТАБЛИЦА 1.4 Рекомендуемые позиции и режимы при трансторакальной эхокардиографии
с использованием допплерографии
ch01.indd 10
03.04.2019 11:36:20
11
1 Диагностическое отделение эхокардиографии
вания клинических исходов, который может стать
основой для развития ЭхоКГ и кардиохирургии в
целом.
ПОВЫШЕНИЕ КАЧЕСТВА ИССЛЕДОВАНИЯ
Необходимость в повышении качества ЭхоКГ по-
явилась к 1990-м гг. [1]. Однако на фоне интенсив-
ного роста расходов США на здравоохранение, в
том числе на визуализацию сердца с помощью
ЭхоКГ, качество ЭхоКГ стало важным фактором со-
кращения затрат. Для реализации новых способов
повышения качества были разработаны КЦИ для
ЭхоКГ.
КРИТЕРИИ ЦЕЛЕСООБРАЗНОГО ИСПОЛЬЗОВАНИЯ
ЭХОКАРДИОГРАФИИ И ОТБОР ПАЦИЕНТОВ
КЦИ для ЭхоКГ были разработаны из-за обеспоко-
енности по поводу роста количества неинвазивных
Структуры сердца
ЛЖ
ЛП
ПП
ПЖ
Аортальный клапан
Митральный клапан
Трикуспидальный клапан
Клапан легочной артерии
Перикард
Аорта
Легочный ствол и его ветви
Нижняя полая вена
Легочные вены
Межпредсердная перегородка
Межжелудочковая перегородка
Количественная оценка
Внутренний размер ЛЖ в конце диастолы
Внутренний размер ЛЖ в конце систолы
Толщина задней стенки ЛЖ
Толщина межжелудочковой перегородки
Переднезадний размер ЛП
Корень аорты
Восходящий отдел аорты
Скорость кровотока и градиент давления на клапанах
Объем ЛЖ
Объем ЛП
Фракция выброса ЛЖ
Размеры ПЖ
Систолическая функция ПЖ
Систолическое давление в ПЖ
Локальная функция ЛЖ (анализ всех сегментов)
Диастолическая функция ЛЖ
* Включая цветовую и спектральную допплерографию.
ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый
желудочек; ПП — правое предсердие.
[Picard MH, Adams D, Bierig SM, et al. American Society of Echocardi-
ography recommendations for quality echocardiography laboratory
operations, J Am Soc Echocardiogr 24:1–10, 2011.]
ТАБЛИЦА 1.5
Оценка структур сердца, их размеров
и функций при полной трансторакальной
эхокардиографии*
методов визуализации сердца и расходов програм-
мы Medicare (федеральная программа оказания ме-
дицинской помощи престарелым в США) в период
с 1995 по 2006 г. American College of Cardiology (ACC)
опубликовал первый документ о КЦИ в 2005 г. [18].
Для ТТЭхоКГ и ЧПЭхоКГ КЦИ были опубликова-
ны в 2007 г. [5], а для стресс-ЭхоКГ — в 2008 г. [27].
В 2011 г. были опубликованы пересмотренные и об-
новленные КЦИ для взрослых пациентов при про-
ведении ТТЭхоКГ, ЧПЭхоКГ и стресс-ЭхоКГ [28], а
в 2014 г. — для педиатрического звена диагностики
[29]. В последний вариант КЦИ для взрослых вклю-
чены данные клинических исследований и рекомен-
дации после публикации первых КЦИ. Кроме того,
были пересмотрены некоторые разделы. Со време-
нем изменилась терминология, которую использу-
ют для описания трех категорий клинических пока-
заний [30]. Сначала клинические показания были
разделены на соответствующие, неопределенные и
несоответствующие. В пересмотренном варианте
КЦИ категории названы иначе: целесообразное ис-
пользование (appropriate use), сомительное использо-
вание (uncertain use) и нецелесообразное использова-
ние (inappropriate use). В настоящее время все при-
знают, что для конкретного пациента редко подходит
только одна категория.
Одними из первых задач КЦИ были оценка ка-
чества ЭхоКГ и определение соответствия. В 2007 г.
изучали КЦИ для ТТЭхоКГ в различных больницах,
включая клиники при университетах [31–33], го-
спитали ветеранов [34] и общественные больницы
[35, 36]. Было выявлено, что от 10 до 15% ТТЭхоКГ
не имеют КЦИ. Отмечено, что на качество ЭхоКГ
влияет место ее проведения: большинство нецеле-
сообразных исследований были выполнены в амбу-
латорных условиях, а не в стационарах. Это было
учтено при пересмотре КЦИ в 2011 г.
После выхода КЦИ в 2011 г. и анализа работы
клиник при университетах было отмечено, что в но-
вых КЦИ устранены практически все пробелы для
большинства ТТЭхоКГ [37, 38]. Еще один вывод за-
ключался в том, что при улучшении классификации
ТТЭхоКГ в рамках КЦИ 2011 г. нецелесообразных
исследований было не так много, как ожидалось
[38]. Следует отметить, что ЧПЭхоКГ характеризу-
ется более высокими показателями соответствия
[37, 39], что обусловлено инвазивностью процеду-
ры и необходимостью получения письменного ин-
формированного согласия на нее. Более низкие по-
казатели соответствия отмечены при стресс-ЭхоКГ
[40], что характерно для всех стресс-тестов [41].
В ходе анализа работы диагностических отделе-
ний было выявлено, что некоторые исследования
относятся к категории нецелесообразных и варьи-
руют в зависимости от места проведения (амбула-
торные условия либо стационар) (табл. 1.6). В ам-
булаторных условиях ТТЭхоКГ выполняли при
диспансерных профилактических исследованиях
ch01.indd 11
03.04.2019 11:36:20
12
ЧАСТЬ I Передовые методы эхокардиографии
пациентов с сердечно-сосудистыми заболеваниями
в анамнезе без изменения клинического статуса [37,
38]. Такие осмотры, которые проводили через опре-
деленные интервалы времени (например, каждые 3
года в случае легкой регургитации или клапанном
стенозе без изменения клинического статуса), клас-
сифицируют как нецелесообразные.
Для уменьшения количества нецелесообразных
ТТЭхоКГ разрабатывают новые программы обуче-
ния использованию КЦИ. Одно из первых таких ис-
следований было проведено на базе клиники при
университете [42]. Врачам выдали карманные реко-
мендации по использованию КЦИ и читали лекции.
В течение двух месяцев можно было общаться с ко-
ординаторами программы по электронной почте. В
итоге это привело к значительному сокращению ко-
личества нецелесообразных ТТЭхоКГ. Однако ис-
следование было нерандомизированным, и его про-
водили только в стационаре. В следующем иссле-
довании попытались устранить это ограничение,
внедрив образовательную программу по КЦИ в ам-
булаторную кардиологическую практику [43]. Ис-
следование было ограничено только количеством
врачей, принимавших участие в обучении, т.к. все
они имели специализацию по кардиологии. Благо-
даря этому доля нецелесообразных ТТЭхоКГ, по
сравнению с таковыми в контрольной группе, стала
значительно ниже (34% vs 13%, р < 0,001), а доля це-
лесообразных ТТЭхоКГ — значительно выше (58%
vs 81%, p < 0,001). Можно сделать вывод, что при
должном обучении врачей применению КЦИ каче-
ство эхокардиографических исследований повыша-
ется.
Однако, несмотря на обнадеживающие результа-
ты внедрения образовательных программ, следует
отметить, что попытки использования КЦИ для
других методов визуализации, например однофо-
тонной эмиссионной компьютерной томографии
(ОФЭКТ), успехом не увенчались (табл. 1 .7) [44].
Анализ проведения стресс-ЭхоКГ также показал,
что образовательные программы по КЦИ не смогли
снизить частоту нецелесообразных стресс-ЭхоКГ
[45]. Важно отметить: на успех внедрения образова-
тельных программ по КЦИ для ТТЭхоКГ повлияло
наличие обратной связи по электронной почте с ко-
ординаторами, в то время как при ОФЭКТ и стресс-
ЭхоКГ данное условие отсутствовало. Таким обра-
зом, обратная связь может быть эффективным ме-
тодом изменения качества работы [46]. Важность
обратной связи в образовательных программах по
КЦИ подтверждена результатами исследования про-
ведения ТТЭхоКГ и ОФЭКТ в нескольких больни-
цах, в которых занимаются диагностикой и лечени-
ем сердечно-сосудистых заболеваний [47].
Стационар
Транзиторная лихорадка без признаков бактериемии
и без новых шумов сердца
Транзиторная бактериемия, вызванная патогеном, не харак-
терным для инфекционного эндокардита, и/или с доказан-
ным источником инфекции вне сосудистого русла
Легкое головокружение или предобморочное состояние
без других симптомов заболевания сердца
Подозрение на эмболию легочной артерии
Амбулаторные условия
Регулярное наблюдение (< 3 лет) течения умеренного
клапанного стеноза без изменения клинического статуса
Регулярный контроль при установленном диагнозе «дилата-
ция восходящего отдела аорты» либо «расслоение аорты»
без изменения клинического статуса (полученные данные
на тактику лечения не влияют)
Периодический контроль артериальной гипертензии без
симптомов и признаков гипертензивной кардиомиопатии
Оценка функции левого желудочка при нормальных
данных эхокардиографии без изменения клинического
статуса
Периодический контроль функции желудочков без симпто-
мов и признаков заболеваний сердца
ТАБЛИЦА 1.6
Нецелесообразное использование
трансторакальной эхокардиографии
в стационаре и в амбулаторных условиях
Первый автор, год
Метод
исследования
Рандомизированное
исследование
Снижение количества
нецелесообразных
исследований
Частота нецелесообразных
исследований до и после
обучения
Обратная
связь
Bhatia, 2013 [42]
ТТЭхоКГ
Нет
Да
13% vs 5%
Да
Bhatia, 2014 [43]
ТТЭхоКГ
Да
Да
13% vs 34%*
Да
Willens, 2013 [45]
Стресс-ЭхоКГ Нет
Нет
31,5% vs 32,4%
Нет
Johnson, 2014 [47]
ТТЭхоКГ
Нет
Да
18,5% vs 6,9%
Да
ОФЭКТ
Нет
Да
20,5% vs 11,1%
Да
Gibbons, 2011 [44]
ОФЭКТ
Нет
Нет
14,4% vs 11,7%
Нет
Chinnaiyan, 2012 [48] КТА
Нет
Да
14,6% vs 5,8%
Да
* Процент нецелесообразных исследований в изучаемой группе в сравнении с контрольной группой.
КТА — компьютерная томографическая ангиография; ОФЭКТ — однофотонная эмиссионная компьютерная томография; стресс-ЭхоКГ —
стресс-эхокардиография; ТТЭхоКГ — трансторакальная эхокардиография.
ТАБЛИЦА 1.7 Применение критериев целесообразного использования для разных методов визуализации
ch01.indd 12
03.04.2019 11:36:20
13
1 Диагностическое отделение эхокардиографии
Еще одним фактором увеличения эффективно-
сти образовательных программ по КЦИ, способ-
ствующих повышению качества ЭхоКГ, является
риск потери финансирования. Проводя образова-
тельные лекции и разъясняя специалистам риск по-
тери финансирования при отсутствии улучшения
применения метода визуализации, удалось снизить
на 60% количество нецелесообразных исследований
с помощью компьютерной томографической анги-
ографии (КТА) [48]. Таким образом, наиболее эф-
фективными признаны методы обучения, основан-
ные на принципах КЦИ, использующие обратную
связь и учитывающие возможность снижения за-
трат. Согласно данным литературы, улучшить при-
менение стресс-тестов (ОФЭКТ или стресс-ЭхоКГ)
сложнее, чем ТТЭхоКГ или КТА [49].
Остается нерешенным вопрос об использовании
КЦИ с целью улучшения отбора пациентов для эхо-
кардиографических исследований. При оценке КТА
установлено, что через 6 месяцев после внедрения
КЦИ отмечается сокращение затрат [48]. Однако
при анализе работы отделения ЭхоКГ в стационаре
после окончания программы [50] затраты снова
оказались на прежнем уровне [42], а в амбулатор-
ном звене так и не появилась отчетность [43]. Еще
одна проблема заключается в том, что образова-
тельные программы по КЦИ ориентированы на
врачей, работающих в клиниках при университетах.
Необходимо введение образовательных программ
по КЦИ с участием врачей из различных медицин-
ских учреждений [51].
Недавнее исследование показало, что отмечается
тенденция к сокращению времени эхокардиогра-
фических исследований [52]. В 2008 г. United States
General Accounting Office сообщило, что расходы
Medicare на визуализацию сердца за период с 2000
по 2006 г. возросли в 2 раза. Однако Medicare Pay-
ment Advisory Commission опубликовала отчет, в
котором отмечено, что ежегодный рост количества
ЭхоКГ на одного человека по программе Medicare в
период с 2005 по 2009 г. составил всего 2,6%, а в пе-
риод с 2009 по 2010 г. произошло снижение на 0,8%
[53]. Эксперты не смогли объяснить, с чем это свя-
зано, но предположили влияние нескольких факто-
ров. Возможно, сыграл свою роль в улучшении от-
бора пациентов выход пересмотренных КЦИ для
ЭхоКГ. В течение этого периода одновременно шли
и другие образовательные программы, в том числе
«Выбирай с умом» American Board of Internal Medi-
cine’s [54]. Также следует отметить, что оплата кар-
диологам за неинвазивные диагностические мани-
пуляции снизилась с 2006 к 2010 г. на 33% , т.е . из-
менилась прежняя тенденция ее роста.
Начиная с первого выхода КЦИ для ЭхоКГ в
2007 г., происходил непрерывный процесс улучше-
ния качества диагностики. От пассивного анализа
практической деятельности перешли к активным
действиям путем внедрения образовательных про-
грамм и введению обратной связи с клиниками. Как
показал метаанализ, с момента выхода КЦИ показа-
тели соответствия ТТЭхоКГ возросли, однако по
ЧПЭхоКГ и стресс-ЭхоКГ они остались без измене-
ний [49]. Это может быть обусловлено тем, что
стресс-ЭхоКГ и ЧПЭхоКГ назначают лишь в необ-
ходимых случаях, благодаря чему отмечается мень-
шее количество нецелесообразных исследований.
Необходимо отметить, что при отборе пациен-
тов для исследований врач должен опираться на
свое клиническое мышление и не должен всецело
доверять КЦИ. Также остается открытым вопрос о
межэкспертном документировании всех изменений
при использовании КЦИ в визуализации сердечно-
сосудистой системы [55] и стандартизации класси-
фикации под все диагностические манипуляции.
Кроме того, следует изучить клинический эффект
всех необоснованных диагностических исследова-
ний, поскольку данные по этому вопросу противо-
речивые [35, 56]. В настоящее время целесообразное
назначение ЭхоКГ является обязательным требова-
нием для получения аккредитации IAC, поэтому ве-
дется разработка автоматизированных инструмен-
тов для облегчения этого процесса [57]. Так или
иначе, включение КЦИ в клиническую практику
рассматривают как улучшение качества оказания
медицинской помощи пациенту и инструмент на-
значения лишь целесообразных исследований (рис.
1.3).
Улучшение качества
исследований
Пациент, направленный
на эхокардиографию
Повышение
уровня образования
Нецелесообразное
исследование
Применение КЦИ
Принятие решения с использованием
автоматизированной классификации
Выполнение
эхокардиографии
Принятие клинического
решения о тактике лечения
позволяет улучшить
результаты
Надлежащее/
скорее надлежащее
Клинический опыт
расходится с КЦИ
Выполнение
эхокардиографии
?
Рис. 1.3 Отбор пациентов для эхокардиографических исследований.
Применение критериев целесообразного использования (КЦИ) для улучшения
отбора пациентов и снижения количества нецелесообразных исследований.
Влияние критериев целесообразного использования на клинические исходы
еще следует изучить.
ch01.indd 13
03.04.2019 11:36:20
14
ЧАСТЬ I Передовые методы эхокардиографии
ляют тактику лечения, показания к имплантации
кардиостимулятора [60], контролируют кардиоток-
сический эффект химиотерапии [61]. ФВЛЖ отли-
чается вариабельностью даже если соблюдаются ре-
комендуемые требования к ее количественной оцен-
ке [21]. Важной частью исследования систолической
функции является также визуальная оценка ФВ, до-
полняющая количественные данные качественны-
ми. В одном исследовании, проведенном на базе
клиники при университете, было доказано, что вве-
дение новых образовательных программ по визу-
альной интерпретации ЭхоКГ снизило вариабель-
ность оценки ФВ [62]. Оценка ФВ с помощью ЭхоКГ
и изучение данных магнитно-резонансной томогра-
фии (МРТ) сердца позволяют увеличить точность
измерения ФВ [63]. Данные методы визуализации
используют при лечении клапанных пороков серд-
ца и оценке степени трикуспидальной регургита-
ции [64] и аортальной регургитации [65]. После об-
учения улучшилось качество оценки систолической
функции ПЖ [66] и диастолической функции ЛЖ
[67], в том числе и в обычных клиниках (не на базе
университета).
Проведены комплексные мероприятия по улуч-
шению качества исследований, направленные на
Первый автор,
год
Параметры
Количество
пациентов (n)
Изменение показателей
до и после тестирования
Влияние на повышение
качества исследований
Johri, 2011 [62]
ФВЛЖ
25
ФВ±14%vsФВ±8%
Анализ клинических
наблюдений
Thavendiranathan,
2013 [63]
ФВЛЖ
31
ФВ ± 0,120 vs ФВ ± 0,097 Анализ клинических наблюде-
ний, сопоставление данных
с МРТ сердца
Grant, 2014 [64] Трикуспидальная
регургитация
16
K=0,55vsK=0,80
Анализ клинических
наблюдений
Dahiya, 2012 [65] Аортальная регургитация
17
K=0,5vsK=0,7
Разработка стратегии
Ling, 2011 [66]
Размеры и функция ПЖ
15
K=0,4vsK=0,77
(размеры ПЖ)
K=0,43vsK=0,66
(функция ПЖ)
Использование количествен-
ных показателей
Johnson, 2011
[67]
Диастолическая функция
ЛЖ (степень дисфункции)
Не указано
44% vs 76%
Обучение, изменение прото-
кола сбора данных, эксперт-
ная оценка и анализ клиниче-
ских наблюдений
Daubert, 2014
[22]
КДО ЛЖ
ФВЛЖ
Митральная регургитация
Аортальная регургитация
Диаметр ВТЛЖ
Градиент давления
на аортальном клапане
Площадь аортального
клапана
15
Допустимая воспроиз-
водимость для всех
параметров*
Анализ клинических наблюде-
ний, переобучение и новое
тестирование
* Допустимую воспроизводимость оценивали по уровню доверительной вероятности. Определяется показателем > 80% сравнений резуль-
татов разных специалистов по ультразвуковой диагностике.
K — статистический параметр; ВТЛЖ — выходной тракт левого желудочка; КДО — конечно -диастолический объем; ЛЖ — левый желу-
дочек; МРТ — магнитно-резонансная томография; ПЖ — правый желудочек; ФВ — фракция выброса; ФВЛЖ — фракция выброса ле-
вого желудочка.
ТАБЛИЦА 1.8 Литература, оценивающая воспроизводимость данных и вариабельность интерпретации результатов
ВОСПРОИЗВОДИМОСТЬ ДАННЫХ И ВАРИАБЕЛЬНОСТЬ
ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ
Интерпретация ЭхоКГ является одним из важней-
ших компонентов качества оказания медицинской
помощи. Данный диагностический метод влияет
как на изменение тактики лекарственной терапии,
так и на показания и сроки выполнения хирургиче-
ского вмешательства (например, при патологии
клапанов сердца) [58]. Учитывая это, необходимо
обеспечить последовательную и достоверную ин-
терпретацию результатов ЭхоКГ. ASE рекомендует
ежегодно анализировать данный критерий по не-
скольким параметрам [11], а для получения аккре-
дитации IAC нужна рутинная оценка ошибок ин-
терпретации [15].
Воспроизводимость данных и вариабельность ин-
терпретации результатов привлекли внимание как
факторы повышения качества оказания медицин-
ской помощи. По данной тематике стали выпускать
специализированную литературу (табл. 1 .8). В на-
стоящее время достигнут консенсус относительно
подхода к оценке воспроизводимости данных ЭхоКГ
[59], однако еще нужно разработать рекомендации.
Одним из самых важных показателей является
фракция выброса (ФВ) ЛЖ. На основе его опреде-
ch01.indd 14
03.04.2019 11:36:20
15
1 Диагностическое отделение эхокардиографии
внедрение статистической оценки воспроизводимо-
сти в клиническую практику [22]. После анализа
статистических показателей был определен наибо-
лее подходящий аналитический подход к оценке ва-
риабельности результатов — по уровню довери-
тельной вероятности [68]. Уровень доверительной
вероятности — это вероятность того, что разница
между двумя показателями одного и того же пара-
метра ЭхоКГ находится в пределах заданной прием-
лемой величины. Метод аналитического подхода
позволяет согласовывать приемлемые различия в
результатах эхокардиографических исследований
[69]. После внедрения данного метода в клиниче-
скую практику с целью улучшения воспроизводи-
мости данных [22] все врачи показали приемлемый
уровень различий результатов при оценке ФВ, ми-
тральной регургитации и градиента давления на
аортальном клапане. Приемлемая воспроизводи-
мость данных конечно-диастолического объема ЛЖ
и аортальной регургитации была достигнута боль-
шинством врачей, однако при оценке диаметра вы-
ходного тракта левого желудочка ни один из клини-
цистов не показал должной воспроизводимости
данных. Через год был проведен новый анализ тех
же показателей в этих же клиниках и оказалось, что
воспроизводимость данных поддерживается на
должном уровне. Это стало возможным благодаря
непрерывному обучению врачей (тесты, проверки,
переподготовка). В настоящее время каждое отделе-
ние ЭхоКГ разрабатывает собственную программу
по улучшению качества исследований, поскольку
консенсуса по данному вопросу пока нет (рис. 1 .4).
При улучшении качества визуализации встал во-
прос об оценке точности интерпретации на основе
Определение задач
эхокардиографического исследования
Выбор метода
эхокардиографического исследования
Переподготовка
Неприемлемая
воспроизводимость данных
Интерпретация результатов
Анализ воспроизводимости
данных
Приемлемая
воспроизводимость данных
Рис. 1.4 Алгоритм непрерывного улучшения качества интерпретаций
эхокардиограмм. Если необходимая воспроизводимость данных не достига-
ется, следует направить персонал на переподготовку с последующим повтор-
ным тестированием до достижения приемлемых результатов.
анализа результатов лечения. Оценивать результа-
ты лечения следует при визуализации сердечно-со-
судистой системы [26, 70]. В одном исследовании
изучали с помощью современных методов оценки
качества ЭхоКГ показатель выживаемости пациен-
тов [71]. У 63 000 пациентов, которым выполнили
ТТЭхоКГ в одном академическом медицинском уч-
реждении, оценивали связь между ФВЛЖ и показа-
телем смертности. Предпосылкой была четко уста-
новленная связь между ФВ и летальными исходами
[72]. Эту связь исследовали, изучая качество интер-
претации результатов ЭхоКГ каждым врачом и вли-
яние различных факторов (например, степени под-
готовки, опыта, квалификации).
Влияние степени подготовки врача на точность
оценки ФВ определяли, сравнивая графики прогно-
зирования смертности в течение одного года. Было
установлено, что врачи с сертификатом NBE имеют
значительно больший процент точного прогноза в
сравнении с теми, у которых сертификата нет. Эк-
замен NBE был разработан с целью предоставления
возможности практикующим врачам подтвердить
свою компетентность [73]. Таким образом, серти-
фикат NBE представляет собой ценный параметр
качества работы врача. Дальнейшие исследования
связи качества интерпретации и результатов ЭхоКГ
с результатами лечения могут быть проведены для
многих эхокардиографических параметров.
Еще одним важным компонентом качества эхо-
кардиографических исследований является итого-
вое заключение. С помощью стандартизированной
электронной системы отчетности было изучено вли-
яние диагностики инфекционного эндокардита при
ЭхоКГ на профилактическое лечение антибиотика-
ми [24]. В данном исследовании (проведенном до
пересмотра рекомендаций по антибиотикопрофи-
лактике в 2007 г.) было показано, что ранняя диа-
гностика инфекционного эндокардита с помощью
ЭхоКГ улучшала результаты лечения, проводимого
в соответствии с рекомендациями AHA. Однако
итоговое заключение ЭхоКГ улучшает результаты
лечения пациентов только в том случае, если ин-
формация верно интерпретирована лечащим вра-
чом. В связи с этим необходимо постоянно контро-
лировать качество заключений. Для каждого диа-
гностического исследования были разработаны
протоколы визуализации сердечно-сосудистой си-
стемы, что помогло улучшить качество оказания
медицинской помощи [23]. В одном исследовании
был изучен многолетний опыт улучшения качества
исследований в клинике при университете. В ней
была разработана система проверок в режиме реаль-
ного времени заключений ТТЭхоКГ на предмет оши-
бок и несоответствий [74]. Большинство заключе-
ний (83%) имели в среднем 0,7 ± 0,9 ошибок и
1,7 ± 1,6% несоответствий. Установили, что при со-
кращении времени исследования количество оши-
бок увеличивается. Высокий процент несоответ-
ch01.indd 15
03.04.2019 11:36:20
16
ЧАСТЬ I Передовые методы эхокардиографии
ствий диктует необходимость внедрения автомати-
зированных компьютерных систем для проверок
заключений. Однако не стоит забывать об улучше-
нии качества проведения исследования самими вра-
чами. В одном исследовании выявили, что при на-
личии в клинике системы структурированной от-
четности точность исследований, зависящая от
врача, снижается [75]. Кроме этого, в условиях жест-
ких временны
́
х рамок и критериев можно упустить
индивидуальные особенности пациента. Следова-
тельно, автоматизированные компьютерные систе-
мы не должны стать препятствием к улучшению ка-
чества оказания медицинской помощи.
ПРОВЕДЕНИЕ ЭХОКАРДИОГРАФИЧЕСКИХ
ИССЛЕДОВАНИЙ ВНЕ ДИАГНОСТИЧЕСКОГО
ОТДЕЛЕНИЯ
Большинство эхокардиографических исследований
кардиологи проводят в диагностическом отделении,
однако в последние годы постоянно растет количе-
ство исследований, выполняемых вне диагностиче-
ского отделения (табл. 1 .9). В связи с этим возникла
необходимость разработки стандартов для повы-
шения качества исследований и их применения в
кардиохирургии.
ЭхоКГ вне диагностического отделения исполь-
зуют для контроля во время открытой операции и
малоинвазивного вмешательства на сердце и сразу
после них для оценки результатов. Интраопераци-
онная ЧПЭхоКГ — одно из наиболее распростра-
ненных применений ЭхоКГ кардиохирургами в со-
трудничестве с анестезиологами (см. главу 4). Для
стандартизации интраоперационной ЧПЭхоКГ ASE
и Society of Cardiovascular Anesthesiologists разрабо-
тали общие рекомендации [76]. Основные требова-
ния направлены на непрерывное обучение врачей
проведению таких исследований [77]. В настоящее
время существует два обучающих курса. На первом
курсе анестезиологи получают опыт, проводя как
минимум 150 интраоперационных ЧПЭхоКГ под
контролем опытного кардиолога, причем 50 из этих
исследований обучаемый должен выполнить само-
стоятельно. На втором курсе необходимо в течение
4 лет после подачи заявки на получение сертифика-
та выполнить и интерпретировать не менее 150 ин-
траоперационных ЧПЭхоКГ. Кроме этого, за дан-
ный период нужно получить по меньшей мере 40
аккредитаций, связанных с ЧПЭхоКГ. Для получе-
ния сертификата необходимо иметь действующую
медицинскую лицензию и сертификат по анестези-
ологии, пройти один из курсов обучения и сдать
экзамен на национальном уровне.
При постоянном совершенствовании рентгенэн-
доваскулярных методов лечения, а именно транска-
тетерной имплантации аортального клапана (ТИАК)
и митрального клапана, одновременно растет и роль
интраоперационной ЧПЭхоКГ (см. главу 16) [78]. В
настоящее время это исследование имеет собствен-
ный код — 93355. Проведение ЧПЭхоКГ во время
рентгенэндоваскулярного вмешательства заключа-
ется в получении изображений в режиме реального
времени, оформлении документации и интерпрета-
ции полученных результатов. Также разработаны
рекомендации для дооперационных и интраопера-
ционных исследований при ТИАК баллонами вы-
сокого давления [79]. В рекомендациях указаны осо-
бенности проведения ЧПЭхоКГ, оценки морфоло-
гии анатомических структур, позиционирования
имплантируемого клапана и оценки послеопераци-
онных осложнений.
К осложнениям вмешательства относят смеще-
ние протезированного клапана, аортальную регур-
гитацию и митральную регургитацию в результате
повреждения подклапанного аппарата доставочной
системой при имплантации, нарушение сократимо-
сти миокарда ЛЖ из-за окклюзии устьев коронар-
ных артерий, тампонаду сердца, расслоение аорты
либо разрыв корня аорты, дефект межжелудочко-
вой перегородки.
Доказано, что после ТИАК прогностическую зна-
чимость имеет парапротезная фистула, ввиду чего
был разработан комплексный подход для унифика-
ции оценки данного осложнения [80]. Появляется
все больше рекомендаций по проведению ЧПЭхоКГ
во время рентгенэндоваскулярных вмешательств
Мониторинг и измерения во время хирургических
операций и инвазивных исследований
Интраоперационная ЧПЭхоКГ при кардиохирургии,
редко — других оперативных вмешательствах
Интраоперационная ЧПЭхоКГ в отделении катетеризации
сердца
Транскатетерная имплантация аортального клапана
Устранение митральной регургитации с помощью системы
MitraClip
Закрытие дефекта межпредсердной перегородки/открытого
овального окна
Закрытие парапротезной фистулы
Закрытие дефекта межжелудочковой перегородки
Интраоперационная ТТЭхоКГ в отделении катетеризации
сердца
Алкогольная аблация перегородки при обструктивной
гипертрофической кардиомиопатии
Интраоперационная ЧПЭхоКГ при электрофизиологиче-
ских вмешательствах по поводу аритмии
Закрытие ушка левого предсердия
Фокусное ультразвуковое исследование сердца
Отделения экстренной и скорой помощи
Отделения реанимации и интенсивной терапии
Дополнение к физикальному осмотру госпитализирован-
ных пациентов
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чрес-
пищеводная эхокардиография.
ТАБЛИЦА 1.9
Проведение эхокардиографических
исследований вне диагностического
отделения
ch01.indd 16
03.04.2019 11:36:20
17
1 Диагностическое отделение эхокардиографии
на митральном клапане [81]. Интраоперационную
ЭхоКГ также используют при закрытии ушка ЛП
[82].
Возрастает роль эхокардиографических исследо-
ваний в отделениях экстренной хирургии, реанима-
ции и интенсивной терапии и приемных отделени-
ях как компонент неотложной помощи. ASE разра-
ботало подробные клинические рекомендации по
использованию портативной системы для фокусно-
го ультразвукового исследования (УЗИ) сердца [83].
Фокусное УЗИ сердца — это целенаправленное
исследование сердечно-сосудистой системы в каче-
стве дополнения к физикальному осмотру или об-
следованию у постели больного для поиска специ-
фических признаков заболеваний (см. главу 6).
Фокусное УЗИ сердца отличается от ТТЭхоКГ
тем, что при фокусном УЗИ сердца ищут один или
несколько конкретных признаков, используя полу-
ченные ранее изображения и заключения. В настоя-
щее время кода для фокусного УЗИ сердца нет, од-
нако он есть для ЭхоКГ, проводимой с помощью
портативной системы с ограниченными функция-
ми, — 93308. Фокусное УЗИ сердца отличается от
ТТЭхоКГ также тем, что используют один датчик,
который позволяет провести лишь линейные изме-
рения, а изображения для последующего их про-
смотра система не сохраняет. В клинике с помощью
фокусного УЗИ сердца можно оценить лишь неко-
торые структуры сердца и их функции (размеры и
систолическую функцию ЛЖ, размеры ЛП, систо-
лическую функцию ПЖ, диаметр нижней полой ве-
ны), исключить наличие тампонады сердца и пери-
кардиальной жидкости, а также заподозрить мор-
фологические или функциональные нарушения и
направить пациента на комплексное эхокардиогра-
фическое исследование.
Часто этот метод визуализации используют при
неотложных состояниях для быстрой оценки и сор-
тировки пациентов, а также у постели больного при
внезапном изменении его клинического состояния.
Фокусное УЗИ сердца можно использовать при ин-
фузионной терапии в отделениях реанимации и ин-
тенсивной терапии для контроля объема (ориен-
тир — нижняя полая вена).
Фокусное УЗИ сердца может выполнить и интер-
претировать любой врач, получивший соответству-
ющий сертификат. В настоящее время фокусное
УЗИ сердца проводят терапевты, хирурги и ордина-
торы при обследовании госпитализированных па-
циентов. Этот метод позволяет: (1) визуализировать
сердце больного; (2) дополнить физикальный ос-
мотр (пальпация, перкуссия, стетоскоп); (3) прове-
сти диагностику в экстренных ситуациях, когда
стандартная ЭхоКГ недоступна, нецелесообразна
либо исследование связано с потерей времени. Еди-
ного стандарта обучения врачей (продолжитель-
ность, количество самостоятельных исследований
и т.д.) нет. Для рутинного использования фокусно-
го УЗИ сердца нужно изучить влияние этого метода
визуализации на результаты лечения и затраты, что
поможет разработать рекомендации по улучшению
и контролю качества. Однако следует помнить, что
при фокусном УЗИ сердца существует риск ложно-
отрицательных результатов, что может привести к
задержке начала необходимого лечения.
КАЧЕСТВО МЕДИЦИНСКОЙ ПОМОЩИ В ЭПОХУ
РЕФОРМИРОВАНИЯ СИСТЕМЫ ЗДРАВООХРАНЕНИЯ
В настоящее время на повышение качество оказа-
ния медицинской помощи диагностическим отде-
лением влияют несколько факторов: доступность,
экономическая эффективность и наличие лидер-
ских качеств у руководителя (рис. 1 .5) [6]. Термин
доступность имеет множество значений, примени-
тельно к ЭхоКГ он означает своевременность, целе-
сообразность и эффективность проведения ЭхоКГ.
Крайне важно контролировать доступность диагно-
стических исследований не только в амбулаторных
условиях, но и ночью, в выходные дни, а также в от-
делениях скорой помощи, реанимации и интенсив-
ной терапии и во время операций. К доступности
также относят внедрение в клиническую практику
новых технологий. Примерами являются 3D-ЭхоКГ
[84] и оценка деформации миокарда с помощью
спекл-трекинг ЭхоКГ (см. главы 2, 8) [85]. Фокусное
УЗИ сердца [86] представляет собой дополнитель-
ный метод, позволяющий проводить исследования
вне диагностического отделения. Для активного
внедрения данного метода рекомендуется проведе-
ние надлежащей подготовки и аттестации.
Доступность
Расширение географии доступности
Уровень обслуживания
Удовлетворенность пациентов
Информационные технологии в здравоохранении
Доступность архива изображений
К
а
ч
е
с
т
в
о
Экономическая эффективность
Минимизация расходов
Интеграция новых экономических моделей
Активное изменение подхода
к исследованиям
Наличие лидерских качеств у руководителя
Управленческие навыки
Стратегическое планирование
Сотрудничество
Рис. 1.5 Факторы, влияющие на качество оказания медицинской по-
мощи диагностическим отделением в эпоху реформирования систе-
мы здравоохранения. Для улучшения качества оказания медицинской по-
мощи нужны три взаимосвязанных компонента, а именно: доступность, эконо-
мическая эффективность и наличие лидерских качеств у руководителя.
ch01.indd 17
03.04.2019 11:36:20
18
ЧАСТЬ I Передовые методы эхокардиографии
Компонент
медицинской помощи
Цель
Рекомендации
Структура отделения
Соответствие стандартам
квалификации персонала
и оборудования
Получение аккредитации IAC
Поощрение обучения и сертификации врачей
Поддержка в получении сертификата по эхокардиографии
Обеспечение отделения соответствующим оборудованием
Отбор пациентов
Снижение количества
нецелесообразных ЭхоКГ
Применение КЦИ для всех методов эхокардиографических
исследований
Обучение персонала и внедрение КЦИ в клиническую практику
Внедрение методов по снижению количества нецелесообразных
ЭхоКГ (обучение врачей, поддержка в принятии решений)
Получение изображений Качество изображений,
достаточное для диагностики
Безвредность для здоровья
пациента
Разработка и следование протоколам получения изображений
Использование контрастного средства для снижения количества
неинформативных ЭхоКГ
Следование протоколам стресс-ЭхоКГ с физической нагрузкой
или фармакологической нагрузкой
Интерпретация
изображений
Воспроизводимость
Точность
Взаимодействие между лечащим врачом и тем, кто интерпрети-
рует результаты исследования
Выделение достаточного времени для интерпретации
Проведение всех измерений, оценка всех структур для полной
интерпретации
Синтез и анализ всех результатов для диагностики аномалий
сердца
Сравнение новых результатов с результатами предыдущих
исследований
Передача результатов
исследования
Четкость
Полнота
Своевременность
Разработка и отслеживание критериев своевременности
Соблюдение стандартов полноты заключений
Использование ключевых элементов для структурирования
отчетов
Внесение демографической информации в заключение
Документирование взаимодействия между врачами
Улучшение качества
оказания медицинской
помощи и результатов
лечения
Удовлетворенность пациента
Влияние результатов на качество
оказания медицинской помощи
Заболеваемость
Летальность
Допустимое время ожидания
исследования
Стандартизация методов определения корреляции
Разработка методов использования результатов исследований
при принятии решений
Оценка удовлетворенности пациента обследованием
Разработка методов отслеживания времени ожидания исследо-
ваний в стационаре и в амбулаторных условиях
IAC — Intersocietal Accreditation Commission; КЦИ — критерии целесообразного использования; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Действия, направленные на повышение качества эхокардиографических исследований
Экономическая эффективность играет огромную
роль в здравоохранении. Отделения должны мини-
мизировать финансовые затраты без ущерба для ка-
чества оказания медицинской помощи. Этого мож-
но добиться, постоянно совершенствуя технику ис-
следований для получения эхокардиографических
изображений надлежащего качества. Для решения
проблем постоянно развивающейся системы здра-
воохранения и для достижения нужного качества
оказания медицинской помощи руководители от-
делений должны быть лидерами в коллективе и об-
ладать особыми знаниями и навыками, включая
финансовую грамотность. Без стратегического пла-
нирования и обеспечения командного взаимодей-
ствия невозможно достичь должного качества ока-
зания медицинской помощи.
ch01.indd 18
03.04.2019 11:36:20
19
1 Диагностическое отделение эхокардиографии
ЛИТЕРАТУРА
1. American Society of Echocardiography: Rec-
ommendations for continuous quality im-
provement in echocardiography, J Am Soc
Echocardiogr 8:S1–S28, 1995.
2. Douglas P, Iskandrian AE, Krumholz HM, et
al. Achieving quality in cardiovascular imag-
ing: proceedings from the American College
of Cardiology-Duke University Medical Cen-
ter Think Tank on Quality in Cardiovascular
Imaging, J Am Coll Cardiol 48:2141–2151,
2006.
3. Pearlman AS, Ryan T, Picard MH, et al.
Evolving trends in the use of echocardiogra-
phy: a study of Medicare beneficiaries, J Am
Coll Cardiol 49:2283–2291, 2007.
4. Welch HG, Hayes KJ, Frost C. Repeat testing
among Medicare beneficiaries, Arch Intern
Med 172:1745–1751, 2012.
5. Douglas PS, Khandheria B, Stainback RF, et
al. ACCF/ASE/ACEP/ASNC/SCAI/SCCT /
SCMR 2007 appropriateness criteria for
transthoracic and transesophageal echocar-
diography, J Am Coll Cardiol 50:187–204,
2007.
6. Douglas PS, Picard MH. Healthcare reform
for imagers: finding a way forward now,
JACC Cardiovasc Imaging 6:385–391, 2013.
7. Lohr KN, Schroeder SA. A strategy for qual-
ity assurance in Medicare, N Engl J Med
322:707–712, 1990.
8. National Academy of Sciences: Crossing the
quality chasm: a new health system for the
21st century. http://iom.nationalacademies.
org/Reports/2001/Crossing-the-Quality-
Chasm-A-New-Health-System-for-the-21st-
Century.aspx. Accessed July 14, 2015.
9. VanLare JM, Conway PH. Value-based pur-
chasing — national programs to move from
volume to value, N Engl J Med 367:292–295,
2012.
10. Porter ME. What is value in health care? N Engl
J Med 363:2477–2481, 2010.
11. Picard MH, Adams D, Bierig SM, et al. Amer-
ican Society of Echocardiography recom-
mendations for quality echocardiography
laboratory operations, J Am Soc Echocardiogr
24:1–10, 2011.
12. Popescu BA, Andrade MJ, Badano LP, et al.
European Association of Echocardiography
recommendations for training, competence,
and quality improvement in echocardiogra-
phy, Eur J Echocardiogr 10:893–905, 2009.
13. Popescu BA, Stefanidis A, Nihoyannopou-
los P, et al. Updated standards and processes
for accreditation of echocardiographic labo-
ratories from The European Association of
Cardiovascular Imaging, Eur Heart J Cardio-
vasc Imaging 15:717–727, 2014.
14. The Deming Institute: The PDSA cycle.
https://www.deming.org/theman/theories/
pdsacycle. Accessed July 22, 2015.
15. Intersocietal Accreditation Commission:
About the IAC. http://www.intersocietal.org/
echo/. Accessed July 14, 2015.
16. Quinones MA, Douglas PS, Foster E, et al.
American College of Cardiology/American
Heart Association clinical competence state-
ment on echocardiography: a report of the
American College of Cardiology/American
Heart Association/American College of Phy-
sicians — American Society of Internal Med-
icine Task Force on Clinical Competence, Cir-
culation 107:1068–1089, 2003.
17. Ryan T, Berlacher K, Lindner JR, et al. CO-
CATS 4 Task Force 5: training in echocardiog-
raphy: endorsed by the American Society of
Echocardiography, J Am Soc Echocardiogr
28:615–627, 2015.
18. Patel MR, Spertus JA, Brindis RG, et al. AC-
CF proposed method for evaluating the ap-
propriateness of cardiovascular imaging, J Am
Coll Cardiol 46:1606–1613, 2005.
19. Mulvagh SL, Rakowski H, Vannan MA, et al.
American Society of Echocardiography Con-
sensus Statement on the Clinical Applications
of Ultrasonic Contrast Agents in Echocar-
diography, J Am Soc Echocardiogr 21:1179–
1201, 2008.
20. Hahn RT, Abraham T, Adams MS, et al.
Guidelines for performing a comprehensive
transesophageal echocardiographic examina-
tion: recommendations from the American
Society of Echocardiography and the Society
of Cardiovascular Anesthesiologists, J Am Soc
Echocardiogr 26:921–964, 2013.
21. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
22. Daubert MA, Yow E, Barnhart HX, et al.
Quality improvement implementation: im-
proving reproducibility in the echocardiogra-
phy laboratory, J Am Soc Echocardiogr 28:959–
968, 2015.
23. Douglas PS, Hendel RC, Cummings JE, et al.
ACCF/ACR/AHA/ASE/ASNC /HRS/NASCI/
RSNA/SAIP/SCAI/SCCT/SCMR 2008 Health
Policy Statement on Structured Reporting in
Cardiovascular Imaging, J Am Coll Cardiol
53:76–90, 2009.
24. Sanders GP, Yeon SB, Grunes J, et al. Impact
of a specific echocardiographic report com-
ment regarding endocarditis prophylaxis on
compliance with American Heart Association
recommendations, Circulation 106:300–303,
2002.
25. Heidenreich PA, Gholami P, Sahay A, et al.
Clinical reminders attached to echocardiogra-
phy reports of patients with reduced left ven-
tricular ejection fraction increase use of beta-
blockers: a randomized trial, Circulation
115:2829–2834, 2007.
26. Douglas PS, Hoffmann U, Patel MR, et al.
Outcomes of anatomical versus functional
testing for coronary artery disease, N Engl J
Med 372:1291–1300, 2015.
27. Douglas PS, Khandheria B, Stainback RF, et al.
ACCF/ASE/ACEP/AHA/ ASNC/SCAI/SCCT/
SCMR 2008 appropriateness criteria for stress
echocardiography, J Am Coll Cardiol 51:1127–
1147, 2008.
28. Douglas PS, Garcia MJ, Haines DE, et al. AC-
CF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SC-
CM/SCCT/SCMR 2011 Appropriate Use Cri-
teria for echocardiography, J Am Coll Cardiol
57:1126–1166, 2011.
29. Campbell RM, Douglas PS, Eidem BW, et al.
ACC/AAP/AHA/ASE/HRS/SCAI/SCCT/SC-
MR/SOPE 2014 Appropriate Use Criteria for
initial transthoracic echocardiography in out-
patient pediatric cardiology, J Am Coll Cardi-
ol 64:2039–2060, 2014.
30. Hendel RC, Patel MR, Allen JM, et al. Appro-
priate use of cardiovascular technology: 2013
ACCF appropriate use criteria methodology
update: a report of the American College of
Cardiology Foundation appropriate use crite-
ria task force, J Am Coll Cardiol 61:1305–
1317, 2013.
31. Ward RP, Mansour IN, Lemieux N, et al. Pro-
spective evaluation of the clinical application
of the American College of Cardiology Foun-
dation/American Society of Echocardiogra-
phy Appropriateness Criteria for transthorac-
ic echocardiography, JACC Cardiovasc Imag-
ing 1:663–671, 2008.
32. Martin NM, Picard MH. Use and appropri-
ateness of transthoracic echocardiography in
an academic medical center: a pilot observa-
tional study, J Am Soc Echocardiogr 22:48–52,
2009.
33. Kirkpatrick JN, Ky B, Rahmouni HW, et al.
Application of appropriateness criteria in
outpatient transthoracic echocardiography,
J Am Soc Echocardiogr 22:53–59, 2009.
34. Willens HJ, Go
́
mez-Marin O, Heldman A, et
al. Adherence to appropriateness criteria for
transthoracic echocardiography: comparisons
between a regional department of Veterans
Affairs health care system and academic prac-
tice and between physicians and mid-level
providers, J Am Soc Echocardiogr 22:793–799,
2009.
35. Ward RP, Krauss D, Mansour IN, et al. Com-
parison of the clinical application of the
American College of Cardiology Foundation/
American Society of Echocardiography Ap-
propriateness Criteria for outpatient trans-
thoracic echocardiography in academic and
community practice settings, J Am Soc Echo-
cardiogr 22:1375–1381, 2009.
36. Rao G, Sajnani N, Kusnetzky LL, et al. Ap-
propriate use of transthoracic echocardiogra-
phy, Am J Cardiol 105:1640–1642, 2010.
37. Mansour IN, Razi RR, Bhave NM, et al. Com-
parison of the updated 2011 Appropriate Use
Criteria for echocardiography to the original
criteria for transthoracic, transesophageal,
and stress echocardiography, J Am Soc Echo-
cardiogr 25:1153–1161, 2012.
38. Bhatia RS, Carne DM, Picard MH, et al. Com-
parison of the 2007 and 2011 Appropriate
Use Criteria for transthoracic echocardiogra-
phy in various clinical settings, J Am Soc Echo-
cardiogr 25:1162–1169, 2012.
39. Bhatia RS, Carne DM, Picard MH, et al. Com-
parison of the 2007 and 2011 Appropriate
Use Criteria for transesophageal echocardiog-
raphy, J Am Soc Echocardiogr 25:1170–1175,
2012.
40. Bhatia RS, Kumar V, Picard MH, et al. Com-
parison of the 2008 and 2011 Appropriate
Use Criteria for stress echocardiography, J Am
Soc Echocardiogr 26:339–343, 2013.
41. Doukky R, Hayes K, Frogge N, et al. Impact
of appropriate use on the prognostic value of
single-photon emission computed tomogra-
phy myocardial perfusion imaging, Circula-
tion 128:1634–1643, 2013.
42. Bhatia RS, Milford CE, Picard MH, et al. An
educational intervention reduces the rate of
inappropriate echocardiograms on an inpa-
tient medical service, JACC Cardiovasc Imag-
ing 6:545–555, 2013.
43. Bhatia RS, Dudzinski DM, Malhotra R, et al.
Educational intervention to reduce outpatient
inappropriate echocardiograms: a random-
ized control trial, JACC Cardiovasc Imaging
7:857–866, 2014.
44. Gibbons RJ, Askew JW, Hodge D, et al. Ap-
propriate use criteria for stress single-photon
emission computed tomography sestamibi
studies: a quality improvement project, Circu-
lation 123:499–503, 2011.
45. Willens HJ, Nelson K, Hendel RC, et al. Ap-
propriate use criteria for stress echocardiogra-
ch01.indd 19
03.04.2019 11:36:20
20
ЧАСТЬ I Передовые методы эхокардиографии
phy: impact of updated criteria on appropri-
ateness ratings, correlation with pre-authoriza-
tion guidelines, and effect of temporal trends
and an educational initiative on utilization,
JACC Cardiovasc Imaging 6:297–309, 2013.
46. Martin AR, Wolf MA, Thibodeau LA, et al.
A trial of two strategies to modify the test-or-
dering behavior of medical residents, N Engl
J Med 303:1330–1336, 1980.
47. Johnson TV, Rose GA, Fenner DJ, Rozario
NL. Improving appropriate use of echocar-
diography and single-photon emission com-
puted tomographic myocardial perfusion im-
aging: a continuous quality improvement ini-
tiative, J Am Soc Echocardiogr 27:749–757,
2014.
48. Chinnaiyan KM, Peyser P, Goraya T, et al.
Impact of a continuous quality improvement
initiative on appropriate use of coronary
computed tomography angiography. Results
from a multicenter, statewide registry, the
Advanced Cardiovascular Imaging Consor-
tium, J Am Coll Cardiol 60:1185–1191, 2012.
49. Fonseca R, Negishi K, Otahal P, et al. Tempo-
ral changes in appropriateness of cardiac im-
aging, J Am Coll Cardiol 65:763–773, 2015.
50. Bhatia RS, Dudzinski DM, Milford CE, et al.
Educational intervention to reduce inappro-
priate transthoracic echocardiograms: the
need for sustained intervention, Echocardiog-
raphy 31:916–923, 2014.
51. Bhatia RS, Ivers N, Yin CX, et al. Design and
methods of the Echowisely (will inappropri-
ate scenarios for echocardiography lessen sig-
nificantly) study: an investigator-blinded
randomized controlled trial of education and
feedback intervention to reduce inappropri-
ate echocardiograms, Am Heart J 170:202–
209, 2015.
52. Wiener DH. Achieving high-value cardiac
imaging: challenges and opportunities, J Am
Soc Echocardiogr 27:1–7, 2014.
53. Medicare Payment Advisory Commission:
2012 report to Congress on Medicare payment
policy, Washington, DC, 2012, Medicare Pay-
ment Advisory Commission.
54. Choosing wisely: an initiative of the ABIM
Foundation. http://www.choosingwisely.org/.
Accessed June 21, 2016.
55. Ye S, Rabbani LE, Kelly CR, et al. Can physi-
cians identify inappropriate nuclear stress
tests? An examination of inter-rater reliability
for the 2009 appropriate use criteria for ra-
dionuclide imaging, Circ Cardiovasc Qual
Outcomes 8:23–29, 2015.
56. Matulevicius SA, Rohatgi A, Das SR, et al. Ap-
propriate use and clinical impact of transtho-
racic echocardiography, JAMA Intern Med
173:1600–1607, 2013.
57. Bhave NM, Mansour IN, Veronesi F, et al. Use
of a web-based application of the American
College of Cardiology Foundation/American
Society of Echocardiography Appropriate-
ness Use Criteria for Transthoracic Echocar-
diography: a pilot study, J Am Soc Echocar-
diogr 24:271–276, 2011.
58. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
63:e57–e185, 2014.
59. Crowley AL, Yow E, Barnhart HX, et al. Crit-
ical review of current approaches for echo-
cardiographic reproducibility and reliability
assessment in clinical research, J Am Soc Echo-
cardiogr 28:B64, 2015.
60. Epstein AE, DiMarco JP, Ellenbogen KA, et al.
2012 ACCF/AHA/HRS focused update incor-
porated into the ACCF/AHA/HRS 2008
guidelines for device-based therapy of cardi-
ac rhythm abnormalities: a report of the
American College of Cardiology Foundation/
American Heart Association Task Force on
Practice Guidelines and the Heart Rhythm
Society, J Am Coll Cardiol 61:e6–e75, 2013.
61. Plana JC, Galderisi M, Barac A, et al. Expert
consensus for multimodality imaging evalua-
tion of adult patients during and after cancer
therapy: a report from the American Society
of Echocardiography and the European Asso-
ciation of Cardiovascular Imaging, J Am Soc
Echocardiogr 27:911–939, 2014.
62. Johri AM, Picard MH, Newell J, et al. Can a
teaching intervention reduce interobserver
variability in LVEF assessment: a quality con-
trol exercise in the echocardiography lab,
JACC Cardiovasc Imaging 4:821–829, 2011.
63. Thavendiranathan P, Popovic
́
ZB, Flamm SD,
et al. Improved interobserver variability and
accuracy of echocardiographic visual left
ventricular ejection fraction assessment
through a self-directed learning program us-
ing cardiac magnetic resonance images, J Am
Soc Echocardiogr 26:1267–1273, 2013.
64. Grant AD, Thavendiranathan P, Rodriguez
LL, et al. Development of a consensus algo-
rithm to improve interobserver agreement
and accuracy in the determination of tricus-
pid regurgitation severity, J Am Soc Echocar-
diogr 27:277–284, 2014.
65. Dahiya A, Bolen M, Grimm RA, et al. Devel-
opment of a consensus document to improve
multireader concordance and accuracy of
aortic regurgitation severity grading by echo-
cardiography versus cardiac magnetic reso-
nance imaging, Am J Cardiol 110:709–714,
2012.
66. Ling LF, Obuchowski NA, Rodriguez L, et al.
Accuracy and interobserver concordance of
echocardiographic assessment of right ven-
tricular size and systolic function: a quality
control exercise, J Am Soc Echocardiogr
25:709–713, 2012.
67. Johnson TV, Symanski JD, Patel SR, et al. Im-
provement in the assessment of diastolic
function in a clinical echocardiography labo-
ratory following implementation of a quality
improvement initiative, J Am Soc Echocardiogr
24:1169–1179, 2011.
68. Barnhart HX, Yow E, Crowley AL, et al.
Choice of agreement indices for assessing and
improving measurement reproducibility in a
core laboratory setting, Stat Methods Med Res
28:959–968, 2015.
69. Thavendiranathan P, Grant AD, Negishi T, et
al. Reproducibility of echocardiographic
techniques for sequential assessment of left
ventricular ejection fraction and volumes: ap-
plication to patients undergoing cancer che-
motherapy, J Am Coll Cardiol 61:77–84, 2013.
70. Douglas PS, Taylor A, Bild D, et al. Outcomes
research in cardiovascular imaging: report of
a workshop sponsored by the National Heart,
Lung, and Blood Institute, J Am Soc Echocar-
diogr 22:766–773, 2009.
71. Heidenreich PA, Maddox TM, Nath J. Mea-
suring the quality of echocardiography using
the predictive value of the left ventricular
ejection fraction, J Am Soc Echocardiogr 26:
237–242, 2013.
72. Devereux RB, Roman MJ, Palmieri V, et al.
Prognostic implications of ejection fraction
from linear echocardiographic dimensions:
the Strong Heart Study, Am Heart J 146:527–
534, 2003.
73. Weyman AE, Butler A, Subhiyah R, et al.
Concept, development, administration, and
analysis of a certifying examination in echo-
cardiography for physicians, J Am Soc Echo-
cardiogr 14:158–168, 2001.
74. Spencer KT, Arling B, Sevenster M, et al. Iden-
tifying errors and inconsistencies in real time
while using facilitated echocardiographic re-
porting, J Am Soc Echocardiogr 28:88–92, 2015.
75. Johnson AJ, Chen MY, Swan JS, et al. Cohort
study of structured reporting compared with
conventional dictation, Radiology 253:74–80,
2009.
76. Reeves ST, Finley AC, Skubas NJ, et al. Basic
perioperative transesophageal echocardiogra-
phy examination: a consensus statement of the
American Society of Echocardiography and
the Society of Cardiovascular Anesthesiolo-
gists, J Am Soc Echocardiogr 26:443–456, 2013.
77. Cahalan MK, Stewart W, Pearlman A, et al.
American Society of Echocardiography and
Society of Cardiovascular Anesthesiologists
task force guidelines for training in perioper-
ative echocardiography, J Am Soc Echocar-
diogr 15:647–652, 2002.
78. Zamorano JL, Badano LP, Bruce C, et al. EAE/
ASE recommendations for the use of echo-
cardiography in new transcatheter interven-
tions for valvular heart disease, J Am Soc
Echocardiogr 24:937–965, 2011.
79. Hahn RT, Little SH, Monaghan MJ, et al. Rec-
ommendations for comprehensive intrapro-
cedural echocardiographic imaging during
TAVR, JACC Cardiovasc Imaging 8:261–287,
2015.
80. Pibarot P, Hahn RT, Weissman NJ, et al. As-
sessment of paravalvular regurgitation fol-
lowing TAVR: a proposal of unifying grading
scheme, JACC Cardiovasc Imaging 8:340–360,
2015.
81. Cavalcante JL, Rodriguez LL, Kapdia S, et al.
Role of echocardiography in percutaneous
mitral valve interventions, JACC Cardiovasc
Imaging 5:733–746, 2012.
82. Wunderlich NC, Beigel R, Swaans MJ, et al.
Percutaneous interventions for left atrial ap-
pendage exclusion: options, assessment, and
imaging using 2D and 3D echocardiography,
JACC Cardiovasc Imaging 8:472–488, 2015.
83. Spencer KT, Kimura BJ, Korcarz CE, et al. Fo-
cused cardiac ultrasound: recommendations
from the American Society of Echocardio-
graphy, J Am Soc Echocardiogr 26:567–581,
2013.
84. Lang RM, Badano LP, Tsang W, et al. EAE/
ASE recommendations for image acquisition
and display using three-dimensional echocar-
diography, J Am Soc Echocardiogr 25:3–46,
2012.
85. Mor-Avi V, Lang RM, Badano LP, et al. Cur-
rent and evolving echocardiographic tech-
niques for the quantitative evaluation of car-
diac mechanics: ASE/EAE consensus state-
ment on methodology and indications
endorsed by the Japanese Society of Echocar-
diography, J Am Soc Echocardiogr 24:277–313,
2011.
86. Via G, Hussain A, Wells M, et al. Internation-
al evidence-based recommendations for fo-
cused cardiac ultrasound, J Am Soc Echocar-
diogr 27, 2014. 683.e1–e683.
ch01.indd 20
03.04.2019 11:36:20
21
2 Трехмерная эхокардиография
WENDY TSANG, MD, SM • ROBERTO M. LANG, MD
Функция ультразвуковой системы
визуализации
Разрешающая способность
Пространственная разрешающая
способность
Временная разрешающая способность
Соотношение между пространственным
и временным разрешениями
Получение объемных данных
Оптимизация двухмерных изображений
Режимы получения данных
Цветовое допплеровское картирование
кровотока
Трудности получения изображений
с помощью трехмерной
эхокардиографии
Оптимизация трехмерных
изображений
Усиление
Яркость
Сглаживание
Колоризация
Вывод трехмерных изображений
на экран монитора
Обрезка объемных данных
Отображение объемных данных
Анализ трехмерных изображений
Многопланарная реконструкция
Моделирование
Цветовая допплерография
Протоколы получения и анализа
трехмерных изображений
Левый желудочек
Правый желудочек
Левое предсердие
Митральный клапан
Аортальный клапан
Трикуспидальный клапан
Трехмерная цветовая допплерография
Трехмерная (Three-Dimension mode) эхокардиогра-
фия (3D-ЭхоКГ) — одно из самых важных современ-
ных нововведений в области ультразвукового иссле-
дования сердечно-сосудистой системы. С 1980-х гг.,
когда для объемной визуализации использовали ав-
тономную трехмерную реконструкцию на основе се-
рийных двухмерных (Two-Dimension mode, Bimodal)
эхокардиограмм (2D-ЭхоКГ), данный метод претер-
пел сильные изменения [1].
Достижения в области компьютерных техноло-
гий в начале 1990-х гг . позволили быстро получать
наборы объемных данных во время задержки дыха-
ния без автономной трехмерной реконструкции,
т.е . объемная визуализация происходит в режиме
реального времени. Дальнейшее развитие техноло-
гий позволило выполнять объемную визуализацию
в режиме реального времени с более высокими про-
странственным и временны
́
м разрешениями [2].
Благодаря последующим достижениям в области
электроники, миниатюризации и технологии соеди-
нительных кабелей была разработана трехмерная
чреспищеводная эхокардиография (3D-ЧПЭхоКГ).
Кроме того, появились датчики для трансторакаль-
ной эхокардиографии (ТТЭхоКГ) с возможностью
получения двухмерных и трехмерных изображений,
что улучшило диагностику в клинической практи-
ке. Для получения максимальной информации с по-
мощью 3D-ЭхоКГ нужно доскональное понимание
основных технических принципов и использование
системного подхода. Несмотря на различия в техни-
ческих характеристиках ультразвуковых систем, вы-
пускаемых разными производителями, основные
технические принципы остаются неизменными. В
этой главе особое внимание уделено получению
данных, выводу трехмерных изображений на экран
монитора и анализу структур сердца с помощью
3D-ЭхоКГ, а также ограничениям данного метода
визуализации.
ФУНКЦИЯ УЛЬТРАЗВУКОВОЙ СИСТЕМЫ
ВИЗУАЛИЗАЦИИ
Чтобы понять, как оптимизировать получение изо-
бражений с помощью 3D-ЭхоКГ, необходимо разо-
браться в отличиях визуализации в 3D-режиме от
визуализации в 2D-режиме. Для получения изобра-
жения преобразователь ультразвукового датчика пе-
редает высокочастотный звуковой сигнал. При по-
падании его на акустическую границу (например,
на границу между тканями) часть звуковых волн
отражается и возвращается обратно к датчику (эхо-
сигнал). Затем на основе расчетов с использованием
скорости звуковой волны, проходящей в тканях, и
времени, необходимого для возврата высокочастот-
ного звукового сигнала, формируется изображение,
содержащее информацию о расстояниях и интен-
сивности сигналов, передаваемых от датчика к гра-
нице между тканями. Пьезоэлектрический элемент
(кристалл) преобразователя датчика передает уль-
тразвуковые сигналы и принимает эхо-сигналы, ко-
ch02.indd 21
03.04.2019 11:38:00
22
ЧАСТЬ I Передовые методы эхокардиографии
торые поступают в ультразвуковую систему и пре-
образуются в электрические сигналы.
Одноэлементный преобразователь датчика мо-
жет получать и формировать изображения только в
одном пространственном измерении и одном вре-
менно
́
м измерении. Так формируется одномерное
изображение в M-режиме, на котором отображают-
ся только структуры, находящиеся на линии скани-
рования.
Двухмерное изображение получают с помощью
линейных ультразвуковых датчиков для конвергент-
ного сканирования, в которых в один ряд располо-
жены от 48 до 128 пьезоэлектрических элементов,
каждый из которых функционирует отдельно (рис.
2.1). Следует отметить, что двухмерные изображе-
ния могут быть получены с помощью механических
датчиков, содержащих быстро двигающийся моно-
кристалл.
Каждый пьезоэлектрический элемент активиру-
ется в определенной последовательности с задерж-
кой, совпадающей по фазе со временем иниции-
рования передачи (рис. 2 .2). Волны, генерируемые
каждым пьезоэлектрическим элементом, влияют
конструктивно и деструктивно на генерацию общей
ультразвуковой волны в направлении, называемом
радиальной линией сканирования. Поскольку в ли-
нейном ультразвуковом датчике для конвергентно-
го сканирования пьезоэлектрические элементы рас-
полагаются только в один ряд, преобразователь дат-
чика может фокусировать и регулировать фронт
ультразвуковой волны только в двух направлениях
(рис. 2 .3А): по оси Х (axial/depth, в продольном на-
правлении) и по оси Y (azimuthal, в горизонталь-
ном, или боковом, направлении). При формирова-
нии двухмерного изображения разрешение по оси
Х ограничено конструкцией пьезоэлектрических
элементов и определяет ширину среза.
При работе ультразвуковой системы в режиме
передачи сигнала (формирование ультразвукового
луча) и его получения (суммирование данных) ге-
нерируются линии сканирования.
Формирование ультразвукового луча, или про-
странственная фильтрация, — это метод обработки
сигналов с помощью ряда пьезоэлектрических эле-
ментов для направленной или пространственной
избирательности передачи и приема сигнала. Время
задержки перед активацией каждого пьезоэлектри-
ческого элемента и интенсивность посылаемого сиг-
нала позволяют фокусировать и регулировать пере-
даваемый ультразвуковой сигнал.
Для формирования ультразвукового луча необ-
ходимы высоковольтные излучатели, малошумя-
щие приемники, аналого-цифровые преобразовате-
ли для цифровой задержки сигналов и регуляторы
задержки. При визуализации в 2D-режиме форми-
рование ультразвукового луча происходит не в пре-
образователе датчика, а в ультразвуковой системе, а
при визуализации в 3D-режиме процессы фокуси-
ровки и регулировки ультразвукового луча разделе-
ны между преобразователем датчика и ультразвуко-
вой системой (рис. 2 .4).
Суммирование данных — это объединение уль-
тразвуковых сигналов от каждого пьезоэлектриче-
ского элемента для генерации линий сканирования.
В 3D-датчике все пьезоэлектрические элементы
имеют матричную структуру (2D-массив). Первые
3D-датчики были с разреженными матрицами, т.к .
не все пьезоэлектрические элементы были электри-
чески активными одновременно. Эти датчики по-
зволяли получать трехмерные изображения, кото-
рые можно было сразу визуализировать, но из-за
активации по типу разреженного массива управле-
ние ультразвуковым лучом было неточным, и часто
наблюдались эффекты дифракции, например диф-
ракционный максимум решетки.
Современные полностью дискретные матричные
3D-датчики имеют преобразователи, в которых все
пьезоэлектрические элементы одновременно элек-
трически активны. Эти 3D-датчики состоят из 2000–
3000 пьезоэлектрических элементов с рабочей ча-
стотой 2–4 МГц для ТТЭхоКГ и 2–7 МГц для чреспи-
щеводной эхокардиографии (ЧПЭхоКГ) [3]. Фазовая
активация пьезоэлектрических элементов в матри-
це позволяет 3D-датчикам генерировать радиаль-
ную линию сканирования, которая распространяет-
ся по оси Х (axial/depth, в продольном направлении)
и может регулироваться по оси Y (azimuthal, в гори-
зонтальном, или боковом, направлении) и по оси Z
(elavation, в меридиональном направлении), созда-
вая пирамидальную систему координат (см. рис.
2.3Б).
Как уже говорилось, в 2D-датчике все компонен-
ты, необходимые для формирования ультразвуко-
вого луча, расположены в ультразвуковой системе.
Для сохранения этой конфигурации в полностью
Рис. 2 .1 Пьезоэлектрические элементы преобразователя датчика.
(А) В одноэлементных преобразователях есть один активный пьезоэлектриче-
ский элемент для передачи и приема ультразвуковых сигналов. (Б) Ультразву-
ковые датчики для конвергентного сканирования состоят из 48–128 электри-
чески активных пьезоэлектрических элементов (красный цвет), расположенных
в один ряд, которые при скоординированной последовательной активизации
создают сфокусированный в определенном направлении фронт ультразвуко-
вой волны. (В) Преобразователи датчиков с разреженной матрицей состоят из
приблизительно 2000–3000 пьезоэлектрических элементов, но не все из них
электрически активны. (Г) В полностью дискретном матричном преобразова-
теле датчика электрически активны все пьезоэлектрические элементы.
А
Б
В
Г
ch02.indd 22
03.04.2019 11:38:01
23
2 Трехмерная эхокардиография
Рис. 2.3 2D-датчик и 3D-датчик. (А) Регулировка и фокусировка ультразву-
ковых лучей, формируемых 2D-датчиком, может осуществляться только в двух
направлениях: по оси Х и по оси Y. (Б) 3D-датчик генерирует радиальную ли-
нию сканирования (по оси X), которую можно регулировать по двум направле-
ниям: по оси Y и по оси Z. При этом создается пирамидальная система коор-
динат.
Z
X
X
Y
Y
А
Б
Рис. 2 .2 Формирование, передача и прием ультразвукового луча. (А) При передаче ультразвукового сигнала время активации каждого пьезоэлектриче-
ского элемента в матрице преобразователя датчика различно по фазе. Задержка ультразвуковых сигналов позволяет сформировать сфокусированный ультразву-
ковой луч. (Б) При приеме ультразвукового сигнала различными пьезоэлектрическими элементами задержка эхо-сигналов позволяет их выравнять, а затем сфо-
кусировать и когерентно суммировать. Σ — суммирование.
А
Б
Время задержки
ультразвуковой системы
T1
T2
T3
T4
T1
∑
T2
T3
T4
Матрица
преобразователя
датчика
Суммированные
радиочастотные
данные
Выравнивание
ультразвуковых сигналов
Время задержки
ультразвуковой системы
Фокусирование
ультразвуковых сигналов
Матрица
преобразователя датчика
Рис. 2 .4 Формирование ультразвукового луча в полностью дискрет-
ном матричном датчике с использованием каскадного подхода. При
визуализации в 3D-режиме процессы фокусировки и регулировки ультразву-
кового луча разделены между преобразователем датчика и ультразвуковой си-
стемой. В преобразователе датчика, состоящем из 3000 пьезоэлектрических
элементов, соединения и детальная аналоговая задержка в интегральной схе-
ме специального назначения контролируют передачу и прием сигналов с по-
мощью подразделов матрицы, называемых зонами корректировки (пунктир-
ный овал), для аналогового формирования микроимпульсов и точного управ-
ления. Сигналы суммируются, что снижает количество каналов с 3000 до
128–256 в коаксиальном кабеле датчика, связывающем его с ультразвуковой
системой. Грубое формирование ультразвукового луча с использованием циф-
ровой задержки выполняется в ультразвуковой системе. Σ — суммирование.
Суммированные
радиочастотные
данные
Σ
Задержка
Σ
Σ
Σ
Σ
Σ
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Задержка
Ультразвуковая
система
Преобразователь
датчика
дискретном матричном 3D-датчике, содержащем 3000
пьезоэлектрических элементов, нужны 3000 кана-
лов, кабель мощностью 4 кВт, что не практично [4].
Таким образом, основная проблема при разработке
полностью дискретных матричных датчиков была в
необходимости снижения энергопотребления и диа-
метра кабеля датчика при сохранении электриче-
ских соединений для каждого пьезоэлектрического
элемента, что могло бы гарантировать независи-
ch02.indd 23
03.04.2019 11:38:01
24
ЧАСТЬ I Передовые методы эхокардиографии
мость передачи и приема сигнала каждым пьезо-
электрическим элементом. Это было достигнуто
путем размещения в преобразователе датчика ми-
ниатюризованных интегральных схем специально-
го назначения (application-specific integrated circuit,
ASIC). В первом полностью дискретном матричном
датчике было 24–26 ASIC, соединенных с приблизи-
тельно 3000 пьезоэлектрическими элементами, что
позволило сохранить независимую активность этих
элементов при довольно небольшом диаметре кабе-
ля датчика. Последующая миниатюризация позво-
лила разместить в современных трансторакальных
и чреспищеводных датчиках единственную ASIC.
Размещение ASIC в преобразователе привело к
разделению процесса формирования ультразвуко-
вого луча на два этапа (см. рис. 2 .4): (1) формирова-
ние ультразвукового луча ASIC в преобразователе,
на что нужно < 1 Вт мощности; (2) грубое форми-
рование ультразвукового луча в ультразвуковой си-
стеме с передачей по обычному кабелю. При фор-
мировании ультразвукового луча ASIC больше не
нужно соединение каждого пьезоэлектрического
элемента с ультразвуковой системой. 3000 -каналь-
ные ASIC внутри преобразователя обеспечивают
тонкое регулирование, задерживая сигналы в ASIC
и суммируя сигналы в подразделах матрицы, назы-
ваемых зонами корректировки. Это позволило умень-
шить количество каналов, соединяющих преобра-
зователь датчика с ультразвуковой системой, с 3000
до 128–256. Грубое формирование ультразвукового
луча осуществляется в ультразвуковой системе.
Однако при размещении ASIC в преобразователе
датчика генерируется значительная тепловая энер-
гия. Решить эту проблему можно двумя способами:
(1) активным охлаждением, когда тепловая энергия
активно транспортируется по кабелю датчика; (2) пас-
сивным охлаждением, когда образование тепловой
энергии снижается за счет использования для про-
изводства пьезоэлектрических элементов монокри-
сталлического материала с характеристиками одно-
родных полупроводниковых доменов и пьезоэлек-
трическими свойствами. Данный новый материал
улучшил преобразование электрической энергии в
передаваемые ультразвуковые сигналы, а получен-
ные ультразвуковые сигналы — в электрическую
энергию. Повышение эффективности преобразова-
ния позволило не только сократить производство
тепловой энергии, но и увеличить ширину объема,
глубину объема (глубину проникновения ультра-
звукового луча, или расстояния, которое импульс
должен пройти вперед и назад) и разрешение, улуч-
шить качество изображения, уменьшить количе-
ство артефактов, снизить энергопотребление и по-
высить чувствительность допплерографии. Даль-
нейшее усовершенствование технологий обеспечило
подавление артефактов от боковых лепестков уль-
тразвукового луча, а также реализацию возможно-
стей ультразвука при визуализации в оттенках серо-
го и контрастного изображения. Матричные датчи-
ки стали значительно меньше, а качество
изображения — выше. Появилась возможность с
помощью одного датчика получать как двухмер-
ные, так и трехмерные изображения.
РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Между пространственной и временно
́
й разрешаю-
щими способностями 3D-ЭхоКГ связь обратно про-
порциональная. Оптимизация изображения по про-
странственному разрешению негативно сказывает-
ся на временно
́
м разрешении, и наоборот. Изучим
факторы, влияющие на эти два параметра.
ПРОСТРАНСТВЕННАЯ РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Пространственная разрешающая способность си-
стемы формирования изображения характеризует-
ся функцией размытости точки, которая может вли-
ять на качество трехмерного изображения. Функция
размытости точки — это функция, определяющая
изображение идеальной точки, построенное опти-
ческой системой. Воспроизведение одного пикселя
идеального изображения (вводная точка) будет от-
личаться от воспроизведения одного пикселя реаль-
ного изображения. Степень нечеткости (размыто-
сти) любого точечного объекта зависит от исполь-
зуемых параметров.
Каждая точка в объемных данных расположена в
системе трех координат: (1) ось Х; (2) ось Y; (3) ось Z
(см. рис. 2 .3Б). Пространственное разрешение вдоль
каждой оси будет разным в зависимости от рассто-
яния между линиями сканирования.
Матричные 3D-датчики генерируют линии ска-
нирования, которые распространяются радиально
по оси Х (в продольном направлении) и могут ре-
гулироваться в двух направлениях: по оси Y (гори-
зонтальном, или боковом) и по оси Z (меридио-
нальном). Объекты в пределах радиальной линии
сканирования визуализируются более четко, тогда
как объекты в пределах линии сканирования в дру-
гих направлениях (т.е. в меридиональном и гори-
зонтальном) расположены дальше друг от друга. В
целом изображения в плоскости Y–Z имеют самое
низкое разрешение, поскольку в этой плоскости ли-
нии сканирования наиболее удалены друг от друга.
Как правило, пространственное разрешение вдоль
оси Х аналогично пространственному разрешению
при сканировании в 2D-режиме, которое составляет
1/2 длины волны. В двух других плоскостях про-
странственное разрешение в 2–3 раза хуже. Про-
странственное разрешение в современных системах
визуализации в 3D-режиме составляет 0,5 мм для
координат по оси Х, 2,5 мм для координат по оси Y
и 3 мм для координат по оси Z. Таким образом, наи-
лучшие изображения получаются в продольном на-
правлении, наихудшие — в меридиональном на-
правлении (рис. 2 .5).
ch02.indd 24
03.04.2019 11:38:01
25
2 Трехмерная эхокардиография
На практике это проявляется получением при
ТТЭхоКГ наихудших трехмерных изображений из
апикального доступа, когда структуры сердца ото-
бражаются преимущественно с помощью коорди-
нат по осям Y и Z. И наоборот, более качественные
трехмерные изображения получаются из парастер-
нального доступа, при котором структуры сердца
отображаются с помощью координат по осям Х и Y.
По этой причине митральный клапан (МК) при
ЧПЭхоКГ визуализируется с более высоким разре-
шением, чем аортальный клапан (АК).
ВРЕМЕННАЯ РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Основным ограничением визуализации в 3D-режиме
и ЭхоКГ в целом является постоянная скорость зву-
ка в миокарде и крови (1540 м/сек). В связи с этим
максимальное количество импульсов, которые мо-
гут передаваться в секунду без помех, получается
путем деления скорости звука в миокарде и крови
на глубину объема. Максимальное количество им-
пульсов ограничивает количество наборов объем-
ных данных в секунду, которые могут быть отобра-
жены с учетом желаемого размера пирамиды и про-
странственного разрешения.
Таким образом, при визуализации в 3D-режиме
существует обратная зависимость между объемной
скоростью (временно
́
е разрешение, или частота сме-
ны кадров), размером пирамиды и количеством ли-
ний сканирования (пространственное разрешение).
Производителям удалось преодолеть ограниче-
ния фиксированной скорости звука, разработав сле-
дующие режимы: (1) «сшивание» частичных объем-
ных данных; (2) синхронизация с электрокардио-
графией (ЭКГ); (3) масштабирование в режиме
реального времени (изменение области сканирова-
X
A
Y
B
Z
Рис. 2.5 Связь между плоскостью объекта и направлением ультра-
звукового луча. При 3D-ЭхоКГ пространственное разрешение изображения
определяется направлением ультразвукового луча относительно исследуемого
объекта. Если объект расположен перпендикулярно ультразвуковому лучу
(объект А), то наилучшее пространственное разрешение будет по оси Х. Напро-
тив, если объект расположен параллельно ультразвуковому лучу (объект B), то
лучшее разрешение будет по оси Y.
ния); (4) одновременное формирование ультразву-
ковых лучей (позволяет получать полноразмерное
пирамидальное изображение); (5) интерполяция
изображения или его секторов; (6) переупорядочи-
вание кадров; (7) виртуальный массив; (8) мульти-
линейная передача импульсов; (9) увеличение ча-
стоты повторения ультразвуковых импульсов.
Синхронизация с ЭКГ и масштабирование в ре-
жиме реального времени являются режимами, ко-
торые оператор может корректировать. Другие ре-
жимы либо встроены в ультразвуковую систему,
либо доступны при работе с программным обеспе-
чением после получения изображений. Перечис-
ленные режимы будут рассмотрены в следующих
разделах, кроме масштабирования в режиме реаль-
ного времени, который является параметром разме-
ра пирамиды и обсуждается в разделе «Получение
данных с помощью трехмерной эхокардиографии».
ПОЛУЧЕНИЕ ДАННЫХ ВО ВРЕМЯ СЕРДЕЧНЫХ СОКРАЩЕНИЙ
В настоящее время существует два разных способа
получения объемных данных: (1) во время одного
сердечного сокращения; (2) во время нескольких
сердечных сокращений (от 2 до 6 сердечных ци-
клов) (рис. 2 .6).
Визуализация в 3D-режиме во время одного сер-
дечного сокращения представляет собой получение
нескольких наборов объемных данных в секунду.
Этот способ преодолевает ограничения, связанные
с нарушениями сердечного ритма или дыхательны-
ми движениями, но имеет плохие временно
́
еипро-
странственное разрешения (табл. 2 .1).
При визуализации в 3D-режиме во время не-
скольких сердечных сокращений изображения име-
ют более высокое временно
́
е разрешение. Это до-
стигается за счет получения нескольких частичных
объемных данных, которые впоследствии «сшива-
ются» для создания полного набора объемных дан-
ных. Таким образом, при увеличении объемной
скорости полный набор объемных данных может
сохраняться путем получения и «сшивания» ча-
стичных объемных данных. Этот способ применим
на практике только в том случае, если частичные
объемные данные получены из одной и той же по-
зиции датчика.
При визуализации во время нескольких сердеч-
ных сокращений возникают артефакты из-за неточ-
ного совмещения частичных объемных данных, об-
условленного движением пациента или датчика, сме-
щением сердца при его сокращении и акте дыхания,
а также изменения длительности сердечного цикла.
ОДНОВРЕМЕННОЕ ФОРМИРОВАНИЕ УЛЬТРАЗВУКОВЫХ ЛУЧЕЙ
Это режим, при котором ультразвуковая система
одновременно передает один широкий ультразву-
ковой луч и принимает несколько узких ультразву-
ковых лучей (рис. 2 .7). В зависимости от количества
принимаемых ультразвуковых лучей объемная ско-
ch02.indd 25
03.04.2019 11:38:01
26
ЧАСТЬ I Передовые методы эхокардиографии
рость увеличивается. Такая одновременная обработ-
ка полученных данных позволяет выбрать несколь-
ко линий сканирования в течение времени, которое
обычный сканер использует для создания одной ли-
нии сканирования. Это достигается тем, что каждый
формируемый ультразвуковой луч фокусируется
в немного другом направлении, что приводит к бо-
лее широкому ультразвуковому облучению. Одна-
ко поскольку принимаемые ультразвуковые лучи
все дальше ориентированы от центра переданного
ультразвукового луча, то их мощность и разреше-
ние снижаются.
Увеличение временно
́
го разрешения за счет уве-
личения количества принимаемых ультразвуковых
лучей приводит к увеличению размера, стоимости
и энергопотребления электронного устройства, фор-
мирующего передаваемый широкий ультразвуко-
вой луч. При более широком передаваемом ультра-
звуковом луче снижаются отношение сигнал/поме-
ха и контрастность.
ИНТЕРПОЛЯЦИЯ СЕКТОРОВ ИЗОБРАЖЕНИЯ
Интерполяция — это оценка неизвестных точек с
использованием известных данных. При визуализа-
ции в 3D-режиме интерполяция осуществляется
для любых секторов изображения или отдельных
кадров. Интерполяция секторов изображения вну-
три матрицы происходит по приципу шахматной
доски (рис. 2 .8). Во время первого сердечного цикла
Одно сердечное
сокращение
Несколько сердечных
сокращений
Артефакты Отсутствуют
Есть артефакты, обуслов-
ленные движением паци-
ента или датчика либо
нарушением сердечного
ритма
Временно
́
е
разреше-
ние
Низкое
Высокое
ТАБЛИЦА 2.1
Преимущества и недостатки
получения данных во время одного
и нескольких сердечных сокращений
Рис. 2 .7 Одновременное формирование ультразвуковых лучей. (А) При каждом переданном ультразвуковом импульсе одновременно принимается 64 лу-
ча. Увеличение количества принимаемых лучей увеличивает временно
́
е разрешение, но приводит к увеличению размера, стоимости и энергопотребления элек-
тронного устройства, формирующего передаваемый широкий луч. При передаваемом широком луче снижаются отношение сигнал/помеха и контрастность. (Б) Са-
мая высокая амплитуда передаваемого широкого луча — в его центре (красный цвет), а самая низкая — на периферии (синий цвет), т .е. энергетические сигна-
лы от принимаемых лучей, расположенных на отдалении от центра луча, более низкие.
А
Б
Рис. 2 .6 Получение данных во время одного или нескольких сердечных сокращений. (А) Получение данных во время одного сердечного сокращения —
это получение нескольких наборов объемных данных в секунду. (Б) Получение данных во время нескольких сердечных сокращений заключается в получении не-
скольких частичных объемных данных при синхронизации с ЭКГ, которые затем «сшиваются» для формирования полного набора объемных данных. (В) Пример
артефакта (стрелка) при «сшивании» частичных объемных данных.
Объем 1
Объем 2
Время (секунды)
Объем 3
Артефакт при «сшивании»
А
Б
В
ch02.indd 26
03.04.2019 11:38:01
27
2 Трехмерная эхокардиография
Рис. 2 .8 Интерполяция секторов изображений. (А) Первый сердечный цикл. Сканируются синие секторы, оценка красных секторов проводится по окружаю-
щим синим секторам. Желтые секторы — интерполированные. (Б) Второй сердечный цикл. Сканируются красные секторы. Каждый желтый сектор сопоставля-
ется и сравнивается с соответствующим красным сектором первого сердечного цикла. Если красный сектор по значению равен желтому сектору, то происходит
замена желтого сектора на красный сектор.
??
?
?
?
?
?
?
А
Б
сканируются активные пьезоэлектрические элемен-
ты, а неактивные интерполируются. Во втором сер-
дечном цикле первоначально неактивные пьезоэ-
лектрические элементы становятся активными и
сканируются. Результаты сравниваются с интерпо-
лированными данными. Если данные, полученные
от первоначально неактивных пьезоэлектрических
элементов, улучшают трехмерное изображение, то
используются эти данные. В противном случае ис-
пользуются интерполированные данные.
Уменьшение количества активных пьезоэлектри-
ческих элементов приводит к более быстрой обра-
ботке данных, что позволяет получать больше объ-
емных данных за определенный промежуток време-
ни, тем самым увеличивая временно
́
е разрешение.
Интерполяция может быть использована для по-
строения промежуточных объемов из смежных объ-
емов.
ПЕРЕУПОРЯДОЧИВАНИЕ КАДРОВ
При переупорядочивании кадров используется ал-
горитм с высокой частотой смены кадров, который
переупорядочивает объемные данные периодиче-
ски движущейся структуры сердца, полученные в
течение нескольких сердечных циклов [5]. Все объ-
емные данные формируются в разные периоды вре-
мени без синхронизации с ЭКГ, что сокращает вре-
мя их получения до десятых долей секунды и при-
водит к установлению высокой объемной скорости,
которая выше скорости, генерируемой ультразвуко-
вой системой в течение одного сердечного цикла.
Следует отметить, что при переупорядочивании
кадров интерполяцию не применяют. Алгоритм с
высокой частотой смены кадров функционирует
путем идентификации временно
́
й последователь-
ности объемных данных по обе стороны от R-волны
на ЭКГ и чередования этих объемных данных при
когерентной упорядоченности относительно R-волны.
Путем переупорядочивания кадров, близких к ком-
плексу QRS, устраняется вариабельность времен-
но
́
го интервала между сердечными сокращениями,
что увеличивает частоту смены кадров (т.е . объем-
ную скорость) от 10 до 540 кадров в секунду.
К недостаткам режима переупорядочивания кад-
ров относят длительность обработки каждой после-
довательности объемных данных (20 мин), низкую
вариабельность ритма сердца или его структур в
пределах комплексов QRS и другие факторы, влия-
ющие на временну
́
ю когерентность. Преимущество
режима переупорядочивания кадров заключается в
том, что его можно использовать при стандартной
ультразвуковой системе и стандартном компьютере
для визуализации в 3D-режиме.
Кроме того, этот режим можно использовать для
улучшения качества изображения. При 3D-ЭхоКГ
различные частичные объемные данные получают
в разное время в зависимости от того, каким обра-
зом отправляется, считывается и записывается ин-
формация в декартовом формате. Поскольку кадры
получаются не одновременно, возможно незначи-
тельное нарушение последовательности элементов
объемного изображения, или субкомпонентов. Ре-
шением данной проблемы может стать переупоря-
дочивание этих субкомпонентов вместо получения
целого кадра.
ВИРТУАЛЬНЫЙ МАССИВ
Современные ультразвуковые системы для визуа-
лизации в 3D-режиме в основном основаны на ап-
паратной фокусировке ультразвуковых лучей, ко-
торая устанавливает предел объемной скорости —
несколько десятков объемных данных в секунду.
В то же время высокоскоростная визуализация в
3D-режиме позволяет получать тысячи объемных
данных в секунду за счет передачи небольшого ко-
личества расфокусированных ультразвуковых волн,
облучающих всю изучаемую структуру. В этом слу-
чае во время приема ультразвуковых сигналов вы-
полняется динамическая фокусировка, а во время
передачи происходит когерентное суммирование уль-
ch02.indd 27
03.04.2019 11:38:02
28
ЧАСТЬ I Передовые методы эхокардиографии
тразвуковых сигналов, полученных из каждой пе-
редачи, что позволяет восстановить динамический
фокус без ущерба для объемной скорости за счет ис-
пользования виртуального массива, расположенно-
го за истинным источником излучения (датчиком)
[6], для искусственного формирования всего объе-
ма изображения (рис. 2 .9). Для каждого отдельного
виртуального источника вычисляются задержки и
определяется субапертура.
При расположении виртуальных источников да-
леко за истинным источником излучения (датчи-
ком) субапертура больше, что приводит к увеличе-
нию излучаемой энергии и уменьшению области
сканирования. При расположении виртуальных ис-
точников вблизи истинного источника излучения
(датчика) субапертура уменьшается, а кривизна из-
лучаемого сигнала увеличивается. Это приводит к
облучению ультразвуковыми лучами большей об-
ласти сканирования и, соответственно, снижению
энергии распространения. При расположении вир-
туальных источников за датчиком на бесконечном
удалении получаются наклонные плоские волны.
Однако, несмотря на то что этот режим обеспе-
чивает высокую объемную скорость, существуют
ограничения по соотношению между контрастно-
стью, разрешением, объемной скоростью и обла-
стью сканирования. Кроме того, использование рас-
фокусированных ультразвуковых волн может ухуд-
шать качество изображения вследствие широкого
распространения передаваемой энергии в горизон-
тальном направлении, артефактов от боковых ле-
пестков ультразвукового луча и артефактов в ре-
зультате движения, а также из-за невозможности ге-
нерации вторых гармоник. Тем не менее этот режим
в перспективе позволит выполнять картирование
кровотока и движения тканей во всей области ска-
нирования в 3D-режиме.
МУЛЬТИЛИНЕЙНАЯ ПЕРЕДАЧА ИМПУЛЬСОВ
Мультилинейная передача импульсов — это режим,
при котором одновременно передается несколько
ультразвуковых импульсов, сфокусированных по
различным направлениям [7]. Увеличение количе-
ства кадров соответствует количеству ультразвуко-
вых лучей. При традиционной мультилинейной пе-
редаче импульсов нередко наблюдаются артефакты
из-за перекрестных помех, которые возникают в ре-
зультате взаимодействия ультразвуковых полей при
передаче и приеме сигнала. Это можно устранить
путем одновременной передачи ультразвуковых сиг-
налов вдоль поперечной диагонали преобразовате-
ля датчика.
УВЕЛИЧЕНИЕ ЧАСТОТЫ ПОВТОРЕНИЯ
УЛЬТРАЗВУКОВЫХ ИМПУЛЬСОВ
Данный режим повышает объемную скорость при
цветовой допплерографии за счет объединения не-
скольких узких ультразвуковых лучей. В этом режи-
ме ультразвуковые импульсы передаются с частотой
в 3 раза выше частоты, необходимой для возвраще-
ния эхо-сигнала с самого глубокого уровня. Напри-
мер, при передаче двух импульсов эхо-сигнал от
первого импульса будет возвращаться с самого глу-
бокого уровня, а эхо-сигнал от второго импульса —
с промежуточной глубины. В этом случае невозмож-
но определить, возникает эхо-сигнал на самом глу-
боком уровне или на промежуточной глубине.
Режим увеличения частоты повторения ультразву-
ковых импульсов увеличивает предел Найквиста и
сокращает время исследования. Было продемон-
стрировано, что точность данного режима при ко-
личественной оценке аортальной регургитации пре-
вышает точность магнитно-резонансной томогра-
фии (МРТ) сердца [8].
Рис. 2.9 Виртуальный массив. (А) Виртуальный массив располагается за истинным источником излучения (датчиком) и используется для искусственного фор-
мирования всего объема изображения. (Б) Для каждого отдельного виртуального источника вычисляются задержки и определяется субапертура. (В) При неболь-
шом расстоянии между виртуальным источником и истинным источником излучения (датчиком) субапертура меньше, а кривизна излучаемой формы волны боль-
ше, при этом в связи с низкой энергией распространения ультразвуковых волн область сканирования становится более широкой.
Виртуальный
массив
Элемент
субапертуры
Виртуальный
источник
Виртуальные
источники
Пьезоэлектрическая
матрица
Пьезоэлектрическая
матрица
Задержки
Пьезоэлектрическая
матрица
Сложные
сферические
ультразвуковые
волны
А
Б
В
ch02.indd 28
03.04.2019 11:38:02
29
2 Трехмерная эхокардиография
СООТНОШЕНИЕ МЕЖДУ ПРОСТРАНСТВЕННЫМ
И ВРЕМЕННЫМ РАЗРЕШЕНИЯМИ
Объемная скорость (временно
́
е разрешение, или ча-
стота смены кадров), размер пирамиды (количество
одновременно принимаемых ультразвуковых лу-
чей, ширина объема, глубина объема) и разрешение
в боковом направлении (пространственное разре-
шение, или плотность линий сканирования) связа-
ны между собой (рис. 2 .10). Объемная скорость
определяется следующим уравнением:
Объемная скорость =
Таким образом, объемную скорость можно уве-
личить за счет уменьшения глубины объема, шири-
ны объема или количества одновременно принима-
емых ультразвуковых лучей (т.е. уменьшив размер
1540
Количество одновременно
принимаемых ультразвуковых
лучей × 2(Ширина объема/Разрешение
в боковом направлении)2 × Глубина объема
пирамиды). Однако изменение количества одновре-
менно принимаемых ультразвуковых лучей изменя-
ет отношение сигнал/помеха, что влияет на качество
изображения, а изменение разрешения в боковом на-
правлении влияет на контрастность изображения.
ПОЛУЧЕНИЕ ОБЪЕМНЫХ ДАННЫХ
При получении данных с помощью 3D-ЭхоКГ мож-
но выделить четыре основных этапа (рис. 2.11). Во-
первых, необходимо оптимизировать двухмерное
изображение. Во-вторых, в зависимости от оцени-
ваемой структуры нужно определить режим полу-
чения данных (многопланарный или пирамидаль-
ный) и размер пирамиды. Обратите внимание, что
выбор режима получения данных влияет на воз-
можность получения трехмерных цветных доппле-
ровских изображений. Затем необходимо принять
решение относительно оптимизации объемной ско-
рости (одно или несколько сердечных сокращений,
плотность линий сканирования и т.д.). В-третьих, в
зависимости от изучаемой структуры объемные
Рис. 2 .10 Связь между временны
́
м и пространственным разрешениями. (А) Объемная скорость (временно
́
е разрешение), размер пирамиды (ширина объ-
ема, глубина объема и количество одновременно принимаемых ультразвуковых лучей), разрешение в боковом направлении (пространственное разрешение, или
плотность линий сканирования) тесно взаимосвязаны, т.е . изменение одного из этих параметров влечет за собой изменение всех остальных. (Б) При увеличении
размера пирамиды сохранить объемную скорость можно, снизив разрешение в боковом направлении за счет снижения плотности линий сканирования. (В) При
увеличении разрешения в боковом направлении сохранить объемную скорость позволяет уменьшение размера пирамиды. (Г) Наконец, при увеличении объемной
скорости размер пирамиды может быть сохранен за счет уменьшения разрешения в боковом направлении.
Разрешение в боковом
направлении
Объемная
скорость
Размер
пирамиды
Разрешение в боковом
направлении
Объемная
скорость
Размер
пирамиды
Разрешение в боковом
направлении
Объемная
скорость
Размер
пирамиды
Разрешение в боковом
направлении
Объемная
скорость
Размер
пирамиды
А
Б
В
Г
ch02.indd 29
03.04.2019 11:38:02
30
ЧАСТЬ I Передовые методы эхокардиографии
данные могут быть обрезаны, а изображение опти-
мизировано. Наконец, определяют оптимальный
метод отображения объемных данных, а при необ-
ходимости выполняют анализ объемных данных.
ОПТИМИЗАЦИЯ ДВУХМЕРНЫХ ИЗОБРАЖЕНИЙ
Перед получением объемных данных следует опти-
мизировать качество двухмерного изображения.
Акустическая тень и другие помехи на двухмерном
изображении останутся в объемных данных, что
приведет к потере качества трехмерного изображе-
ния. Оптимизация двухмерного изображения мо-
жет быть достигнута путем минимизации движе-
ний пациента и датчика в сочетании с настройкой
локального и общего коэффициентов усиления.
Крайне важно при настройке получения объемных
данных, перпендикулярных исходной плоскости изо-
бражения, проводить визуализацию в многопла-
нарном режиме. Использование этого режима по-
зволяет убедиться, что в объемные данные включе-
на вся изучаемая структура.
1. ОПТИМИЗАЦИЯ ДВУХМЕРНОГО ИЗОБРАЖЕНИЯ (2D image optimization)
2. РЕЖИМЫ ПОЛУЧЕНИЯ ДАННЫХ (Acquisition modes)
3. ОБРЕЗКА И НАСТРОЙКА ПАРАМЕТРОВ РЕНДЕРИНГА (Gropping and rendering)
4. ОТОБРАЖЕНИЕ И АНАЛИЗ (Image display and analysis)
Цветное или нецветное
изображение
Режимы и размер объема (Mode and volume size)
Многопланарный или пирамидальный (Multiplane or pyramidal)
Обрезка (Gropping)
Отображение (Image display)
Анализ (Analysis)
Параметры рендеринга (Rendering thresholds)
Усиление (Gain)
Яркость (Brightness)
Сглаживание (Smoothing)
Объемная скорость (Volume rate)
Масштабирование
(Zoom)
Узкий сектор
(Narrow sector)
Широкий сектор
(Wide sector)
Одно сердечное
сокращение
(Single beat)
Несколько сердечных
сокращений
(Multibeat)
Color
No color
Автокадрирование
(Auto)
Рамочная
(Box)
Плоскостная
(Plane)
Двухплоскостная
(2-plane)
Объемный рендеринг
(Volume rendering)
Поверхностная
визуализация (Surface)
Двухмерные томографические
срезы (Tomographic slices)
МПР
(MPR)
Моделирование
(Modeling)
Рис. 2 .11 Этапы получения объемных данных: (1) оптимизация двухмерного изображения; (2) принятие решений относительно режима получения данных
и размера пирамиды, объемной скорости, а также необходимости получения цветного допплеровского изображения; (3) обрезка и настройка параметров ренде-
ринга для оптимизации трехмерного изображения; (4) отображение и анализ объемных данных. На двух видеоизображениях показано влияние параметров рен-
деринга при получении объемных данных митрального клапана с помощью ТТЭхоКГ. A При слишком высокой яркости происходит потеря глубины объема, как
при очень ярком освещении объекта. A Напротив, слишком низкая яркость приводит к тому, что структура затемняется, как будто помещается в тень. МПР —
многопланарная реконструкция.
ch02.indd 30
03.04.2019 11:38:02
31
2 Трехмерная эхокардиография
РЕЖИМЫ ПОЛУЧЕНИЯ ДАННЫХ
МНОГОПЛАНАРНЫЙ РЕЖИМ
Визуализация в многопланарном режиме (Multipla-
ne mode) позволяет отображать 2–3 плоскости в
2D-режиме и при цветовом допплеровском карти-
ровании (ЦДК) кровотока. Одно изображение это
обычно вид определенной структуры в исходной
плоскости, в то время как другое(ие) изображение(я)
представляет собой вид в плоскости, повернутой
под любым углом относительно исходной (рис. 2.12,
табл. 2 .2). Визуализация в многопланарном режиме
также применима к плоскости Z–X.
ПИРАМИДАЛЬНЫЙ РЕЖИМ
Как уже было сказано, размер пирамиды влияет на
пространственное и временно
́
е разрешения. В идеа-
ле лучше использовать пирамиду наименьшего раз-
мера, которая фиксирует нужную информацию.
Изначально получение объемных данных в пира-
мидальном режиме (Pyramidal mode) было ограни-
чено тремя относительно фиксированными разме-
рами пирамиды, но в настоящее время эти и другие
параметры доступны в ультразвуковой системе толь-
ко в качестве отправных точек для дальнейшей на-
стройки размера пирамиды (рис. 2 .13, табл. 2 .3).
Обратите внимание, что все размеры могут быть
получены во время одного или нескольких сердеч-
ных сокращений.
Режим «Масштабирование»
В режиме «Масштабирование» (Zoom) пирамида,
как правило, имеет наименьший размер, позволяю-
щий захватить небольшую изучаемую структуру
(≈ 30×30°). Этот режим используют для ее сфокуси-
рованного изображения благодаря увеличению вре-
менно
́
го и пространственного разрешений за счет
уменьшения исследуемой области как по оси Y, так
Рис. 2 .12 Двухмерное изображение в многопланарном режиме позволяет одновременно отображать две или три плоскости. Одно изображение,
как правило, — вид в исходной плоскости (А), в то время как другое(ие) изображение(я) представляет собой вид в плоскости под любым углом относительно
исходной плоскости (Б). На (А) кажется, что окклюдер, который закрывает дефект межпредсердной перегородки, расположен нормально, однако на (Б) в попе-
речной плоскости видно, что он размещен неоптимально.
Период
Цель
До получения данных Обеспечение включения изучаемой структуры сердца в объемные данные
После получения
данных
Подтверждение включения изучаемой структуры в объемные данные
Оценка артефакта при «сшивании» после захвата изображения во время нескольких сердечных циклов
Анализ
Точные измерения в поперечных плоскостях в 2D-режиме (бипланарный метод Симпсона для расчета
фракции выброса левого желудочка и т.д .) на основе объемных данных
Отображение изучаемой структуры в двух поперечных плоскостях в 2D-режиме
Точное определение локализации патологических изменений митрального/аортального клапана
в поперечных плоскостях в 2D-режиме
Измерение площади стенозированного отверстия, площади отверстия регургитации и ширины vena
contracta
Интервенционные
вмешательства
Определение места пункции межпредсердной перегородки
Оценка размещения окклюдеров для закрытия дефекта межпредсердной перегородки/открытого
овального окна
Оценка размещения системы MitraClip
Оценка околоклапанной регургитации после транскатетерного протезирования аортального клапана
ТАБЛИЦА 2.2 Использование многопланарного режима
А
Б
ch02.indd 31
03.04.2019 11:38:02
32
ЧАСТЬ I Передовые методы эхокардиографии
Масштабирование
(Zoom)
Узкий сектор
(Narrow sector)
Широкий сектор
(Wide sector)
Рис. 2 .13 Размер пирамиды. Размер пирамиды варьирует от очень неболь-
шого (режим «Масштабирование») до максимального (режим «Широкий сек-
тор»). Режим «Масштабирование» идеально подходит для захвата трехмерно-
го изображения клапанов, режим «Узкий сектор» применим при чрескожных
вмешательствах, а режим «Широкий сектор» используют для получения изо-
бражений больших структур, например левого желудочка.
Режим
Структура сердца/
вмешательство
Преимущества
Недостатки
Масштабирование Клапан
Межпредсердная
перегородка
Межжелудочковая
перегородка
Увеличение временно
́
го
разрешения
Снижение пространственного разрешения
при чрезмерном увеличении исследуемой
области
Потеря ориентации при последующем анализе
трехмерного изображения
Узкий сектор
Интервенционное
вмешательство
Визуализация интересующей
области и прилежащих анато-
мических структур
Недостаточный размер для покрытия всей
структуры
Широкий сектор
Левый желудочек
Правый желудочек
Сердце целиком
Комплексная визуализация
крупных структур сердца
и прилежащих анатомических
структур
Низкая объемная скорость
ТАБЛИЦА 2.3 Выбор пирамидального режима
и по оси Z. При чрезмерном увеличении исследуе-
мой области в этом режиме пространственное раз-
решение снижается.
Режим «Узкий сектор»
Режим «Узкий сектор» (Narrow sector) также называ-
ют «птичьим глазом». При этом режиме размер пи-
рамиды, как правило, составляет от 30–50° до 60–
90°. Такой размер пирамиды обычно недостаточен
для визуализации изучаемой структуры целиком в
любой плоскости. Тем не менее превосходное про-
странственное разрешение позволяет хорошо визуа-
лизировать комбинированные патологические изме-
нения, сохраняя при этом оптимальное временно
́
е
разрешение. Поскольку при этом режиме визуали-
зируются как исследуемая структура, так и окружа-
ющие ее области, он идеально подходит для приме-
нения во время чрескожного вмешательства.
Режим «Широкий сектор»
Режим «Широкий сектор» (Wide sector) также назы-
вают полным объемом или развернутым режимом.
При данном режиме размер пирамиды самый боль-
шой, поэтому его применяют для визуализации круп-
ных структур, например левого желудочка (ЛЖ)
или правого желудочка (ПЖ). Объемные данные,
полученные в режиме «Широкий сектор», возмож-
но обрезать или многопланарно рассечь, чтобы уда-
лить объемные данные прилежащих к изучаемой
структуре тканей для идентификации или выделе-
ния компонентов клапанных структур либо для ви-
зуализации в 2D-режиме (срезы в поперечных пло-
скостях по осям X и Y и ортогональных плоскостях)
и автономного анализа с помощью программного
обеспечения.
ЦВЕТОВОЕ ДОППЛЕРОВСКОЕ КАРТИРОВАНИЕ КРОВОТОКА
Ранее трехмерное изображение при ЦДК кровотока
можно было получить после «сшивания» 7–14 ча-
стичных объемных данных, полученных во время
нескольких сердечных сокращений. Максимальный
размер пирамиды составлял 40×40° с частотой сме-
ны кадров 15–25 Гц (в зависимости от выбранной
плотности линий сканирования).
В настоящее время для получения трехмерного
изображения при ЦДК кровотока используют от
0 до 6 отдельных синхронизируемых объемных
данных. Существенная разница между объемными
скоростями при ЦДК кровотока и визуализации в
3D-режиме в шкале оттенков серого с идентичными
параметрами зависит от производителя ультразву-
ковой системы. Обычно при получении изображе-
ний с помощью трехмерного ЦДК кровотока отме-
чается снижение объемной скорости. В настоящее
время усовершенствованные технологии трехмер-
ного ЦДК кровотока позволяют получать изобра-
ch02.indd 32
03.04.2019 11:38:03
33
2 Трехмерная эхокардиография
Однако исследование в плоскостях, перпендикуляр-
ных исходной плоскости сканирования, облегчает
идентификацию артефактов при синхронизации с
ЭКГ. Артефакты при синхронизации с ЭКГ можно
свести к минимуму, если перед захватом изображе-
ния провести исследование в плоскостях, перпенди-
кулярных исходной плоскости сканирования, опти-
мизируя при этом ЭКГ за счет уменьшения движе-
ний пациента и датчика, чтобы четко определялась
R-волна.
ОПТИМИЗАЦИЯ ТРЕХМЕРНЫХ ИЗОБРАЖЕНИЙ
После принятия решений относительно размера пи-
рамиды и объемной скорости основное внимание
следует уделить оптимизации трехмерного изобра-
жения. Цель оптимизации — коррекция объемных
данных с одновременным устранением артефактов.
Оптимизацию можно выполнять до или после по-
лучения объемных данных. Доступные настройки
зависят от производителя ультразвуковой системы,
однако во всех ультразвуковых системах есть основ-
ные настройки, которые можно корректировать:
усиление, яркость, сглаживание (табл. 2 .5), колори-
зация и сжатие. На практике при использовании со-
временных ультразвуковых систем чаще всего нуж-
на коррекция усиления.
УСИЛЕНИЕ
С помощью усиления возможно изменить электри-
ческий сигнал, генерируемый при получении эхо-
сигнала. Низкое усиление может привести к потере
эхо-сигнала, в результате в объемные данные не по-
падет необходимая информация об анатомических
структурах (рис. 2 .14). При повышенном усилении
уменьшается разрешение и наблюдается потеря
перспективы или глубины объема. Усиление может
быть скорректировано с помощью настроек общего
коэффициента усиления и компенсации усиления
по глубине. Компенсация усиления по глубине из-
меняет чувствительность на произвольной глубине,
тем самым позволяя компенсировать неравномер-
ную потерю сигнала. Общий коэффициент усиле-
ния можно отрегулировать как до захвата изобра-
жения с объемными скоростями, сопоставимыми с
объемными скоростями визуализации в 3D-режиме
в шкале оттенков серого. Однако это может быть со-
пряжено с некоторым снижением пространственно-
го разрешения.
ТРУДНОСТИ ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЙ
С ПОМОЩЬЮ ТРЕХМЕРНОЙ ЭХОКАРДИОГРАФИИ
ВРЕМЕННОЕ И ПРОСТРАНСТВЕННОЕ РАЗРЕШЕНИЯ
При визуализации в 3D-режиме основная задача за-
ключается в достижении оптимального соотноше-
ния временно
́
го и пространственного разрешений
(табл. 2 .4; см. рис. 2 .10). Как обсуждалось ранее,
улучшение пространственного разрешения может
быть достигнуто за счет увеличения плотности ли-
ний сканирования. Однако при этом возрастает вре-
мя получения и обработки объемных данных, что
ограничивает общую объемную скорость. Умень-
шение размера пирамиды позволяет увеличить объ-
емную скорость с сохранением пространственного
разрешения. Объемная скорость также может быть
увеличена за счет синхронизации с ЭКГ (получение
данных во время нескольких сердечных сокраще-
ний). Чтобы исключить артефакты при синхрони-
зации с ЭКГ, производители ультразвуковых систем
разработали технологии, которые позволяют полу-
чать объемные данные в режиме «Широкий сектор»
с высокими пространственным и временны
́
м разре-
шениями во время одного сердечного сокращения.
СИНХРОНИЗАЦИЯ С ЭЛЕКТРОКАРДИОГРАММОЙ
И ЗАДЕРЖКА ДЫХАНИЯ
У пациентов с аритмией или затруднением дыхания
сложно получить объемные данные, синхронизиро-
ванные с ЭКГ, из-за артефактов, возникающих при
«сшивании» (см. рис. 2 .6). Артефакты при синхро-
низации с ЭКГ лучше всего идентифицировать в
многопланарном режиме (отображаются плоскости,
перпендикулярные исходной плоскости). Как пра-
вило, субкомпоненты получают в планарных пло-
скостях, параллельных исходной плоскости. Визуа-
лизация в исходной плоскости не позволяет иден-
тифицировать артефакты при синхронизации с ЭКГ.
ТАБЛИЦА 2.4 Выбор временного и пространственного разрешений в зависимости от изучаемой структуры
Структура
Требования
Задача
Возможные решения
Левые и правые отделы
сердца
Высокое времен-
но
́
е разрешение,
большой размер
пирамиды
Захват изображения
в истинные конечно-
диастолический
и конечно-систоличе-
ский периоды
Получение объемных данных во время нескольких
сердечных сокращений
Использование режимов с высокой объемной скоро-
стью (одновременное формирование ультразвуко-
вых лучей, виртуальный массив и т.д.)
Уменьшение плотности линий сканирования
Мелкие высокомобиль-
ные структуры сердца
(например, клапаны,
вегетации)
Высокие про-
странственное
и временно
́
е
разрешения
Визуализация мелких
высокомобильных
структур
Уменьшение размера пирамиды
Использование режимов с высокой объемной скоро-
стью (получение объемных данных во время
нескольких сердечных сокращений и т.д .)
Увеличение плотности линий сканирования
ch02.indd 33
03.04.2019 11:38:03
34
ЧАСТЬ I Передовые методы эхокардиографии
жения, так и после, тогда как коррекция компенса-
ции усиления по глубине осуществляется только до
захвата изображения.
В идеале следует настроить усиление в среднем
диапазоне (50 единиц) и оптимизировать для обе-
спечения максимальной вариабельности при усиле-
нии и сжатии в ходе последующей обработки. Для
этого рекомендуется слегка завысить яркость изо-
бражения с помощью дифференциальной регули-
ровки усиления, а не за счет усиления мощности.
Как и при визуализации в 2D-режиме, при получе-
нии трехмерного изображения большое значение
имеет оптимизация разрешения по осям Y и X.
ЯРКОСТЬ
Если яркость слишком высока, изучаемая структура
сердца высветляется с потерей глубины объема.
При слишком низкой яркости структура выглядит
темной, в результате трехмерное изображение ста-
новится малоинформативным.
СГЛАЖИВАНИЕ
В случае сглаживания изменяется четкость тексту-
ры структур сердца. При повышении сглаживания
пропадают многие неровности текстуры, т.е. поверх-
ность структур выглядит более гладкой (рис. 2 .15).
Напротив, при снижении сглаживания становятся
лучше видны неровности структур. При настройке
сглаживания нужна точная регулировка. Если трех-
мерное изображение слишком сглажено, возможно
появление артефактов, пропуск мелких деталей ис-
следуемой структуры и небольших непостоянных
неровностей. При чрезмерном снижении сглажива-
ния возможна гипердиагностика нарушений.
КОЛОРИЗАЦИЯ
Для улучшения визуализации структур возможно
изменение цвета полученного изображения. Обыч-
но по умолчанию используется тонирование сепией
(цвет сухих осенних листьев), но некоторые специ-
алисты для цветного допплеровского изображения
предпочитают шкалу оттенков серого.
Параметр
Повышение
Снижение
Усиление
Уменьшение
разрешения
Потеря перспективы/
глубины объема
Потеря
эхо-сигнала
Яркость
Слишком светлое
изображение,
потеря глубины
объема
Слишком темное
изображение
Сглаживание Потеря текстуры/
деталей исследуе-
мой структуры
Гипердиагностика
нарушений
ТАБЛИЦА 2.5 Основные настройки оптимизации
трехмерного изображения
Рис. 2 .14 Усиление. Низкое усиление при 3D-ЭхоКГ приводит к потере эхо-сигнала, тогда как при повышенном усилении снижается разрешение и затемняется
изучаемая структура. Приведены серийные изображения аортального клапана (А–В) A A A и митрального клапана (Г–Е). Отмечается выпадение изображе-
ния кончиков створок (A) и створок (Г) вследствие низкого усиления. На (Б, Д) — нормальное изображение клапанов. Вследствие повышенного усиления кончи-
ки створок аортального клапана на (В) затемнены, а створки митрального клапана на (Е) визуализируются неполностью.
Коэффициент усиления снижен
Коэффициент усиления повышен
А
Б
В
Г
Д
Е
ch02.indd 34
03.04.2019 11:38:03
35
2 Трехмерная эхокардиография
ВЫВОД ТРЕХМЕРНЫХ ИЗОБРАЖЕНИЙ
НА ЭКРАН МОНИТОРА
ОБРЕЗКА ОБЪЕМНЫХ ДАННЫХ
Обрезка — один из самых важных инструментов,
используемых при визуализации в 3D-режиме, ко-
торый играет важную роль при отображении изуча-
емой структуры, находящейся в объемных данных.
После обрезки исследователь может оценить анато-
мию исследуемой структуры сердца и ее взаимоот-
ношения с окружающими структурами. Обрезку
можно выполнять до получения объемных данных
или после. Обрезка до получения объемных данных
позволяет улучшить временно
́
е и пространственное
разрешения и сразу получить обрезанное изображе-
ние без необходимости в последующей обработке.
При выполнении обрезки после получения объем-
ных данных пространственное и временно
́
е разре-
шения будут ниже, а объемные данные больше, но
сохраняется возможность восстановить обрезанные
объемные данные.
Как правило, обрезку выполняют после получе-
ния объемных данных, что позволяет при исполь-
зовании пирамидального режима, например «Мас-
штабирование», обрабатывать меньшие объемные
данные, представляющие интерес. Однако частой
ошибкой при обрезке является получение объем-
ных данных, слишком обрезанных вокруг исследу-
емой структуры. Это приводит к потере перспекти-
вы, а также невозможности визуализировать связи
с окружающими структурами, что затрудняет ори-
ентацию при последующем анализе трехмерных
изображений специалистом, не имеющим полной
информации.
Выбор варианта обрезки определятся тем, какая
нужна перспектива, которая, в свою очередь, зави-
сит от исследуемой структуры. Перспектива трех-
мерного изображения — это область, которая непо-
средственно связана с изучаемой структурой. На-
пример, для визуализации МК необходимо обрезать
объемные данные таким образом, чтобы удалить
верхушку сердца и половину предсердия. При этом
МК можно визуализировать как с позиции хирурга
(«вид сверху»), так и со стороны левого предсердия
(ЛП) или верхушки ЛЖ («вид снизу»). Для визуа-
лизации межпредсердной перегородки необходимо
обрезать свободные стенки обоих предсердий. Это
позволяет визуализировать правопредсердную сто-
рону межпредсердной перегородки со стороны пра-
вого предсердия (ПП) и левопредсердную сторону
межпредсердной перегородки со стороны ЛП. Та-
ким образом, одним из главных преимуществ визуа-
лизации в 3D-режиме является то, что специалист
не ограничен использованием только стандарных
позиций.
Для обрезки могут быть использованы различ-
ные способы: автокадрирование, рамочная обрезка,
плоскостная обрезка и двухплоскостная обрезка
(рис. 2 .16, табл. 2 .6). Эти способы в разных ультра-
звуковых системах могут иметь различные назва-
ния.
АВТОКАДРИРОВАНИЕ
Автокадрирование — самый быстрый способ об-
резки. При автокадрировании происходит автома-
тическое отсечение объемных данных с установкой
средней точки в центре пирамиды, а плоскости об-
резки идут параллельно исходной плоскости. Этот
способ применяют для подтверждения того, что по-
лученные объемные данные целиком охватывают
изучаемую структуру, когда обрезку выполняют по-
сле получения объемных данных.
РАМОЧНАЯ ОБРЕЗКА
Рамочная обрезка позволяет отсекать объемные дан-
ные по осям X, Y или Z с расположением центра
Рис. 2 .15 Сглаживание. (А, Б) Уменьшение сглаживания позволяет наилучшим образом оценить детали окклюдера для закрытия дефекта межпредсердной пе-
регородки. Однако при значительном уменьшении сглаживания возможна гипердиагностика нарушений. A На видео после уменьшения сглаживания определя-
ется более неровная поверхность структуры сердца. (В) Увеличение сглаживания снижает текстурность окклюдера. A На видео показаны слишком сглаженные
объемные данные, полученные при ТТЭхоКГ митрального клапана (потеря текстурности). При чрезмерном сглаживании высок риск появления артефакта и про-
пуска мелких деталей исследуемой структуры.
А
Б
В
ch02.indd 35
03.04.2019 11:38:03
36
ЧАСТЬ I Передовые методы эхокардиографии
Рис. 2.16 Способы обрезки. (А) Полученные объемные данные. (Б) При автокадрировании происходит автоматическое отсечение объемных данных с установ-
кой средней точки в центре пирамиды, а плоскости обрезки идут параллельно исходной плоскости. В данном случае исходная информация была получена в апи-
кальной четырехкамерной позиции. (В) A При рамочной обрезке объемные данные отсекаются по осям X, Y или Z (в данном случае по красной и зеленой осям).
(Г) A Плоскостная обрезка позволяет отсечь объемные данные под любым углом. В данном примере вне осей X, Y или Z находятся верхние части правого и ле-
вого желудочков. (Д) A Двухплоскостная обрезка уменьшает количество этапов, необходимых для обрезки исследуемого объекта с двух сторон. При двухпло-
скостной обрезке отсекаются структуры, расположенные вне образовавшегося прямоугольника. В данном примере в качестве объекта исследования выбран ми-
тральный клапан.
плоскостей X–Y, Y–Z или X–Z в центре пирамиды.
Этот способ обрезки идеально подходит в том слу-
чае, когда изучаемая структура выровнена по осям
X, Y и Z. Если изучаемая структура лежит вне лю-
бой оси, это затрудняет достоверное определение
изучаемой структуры без удаления основных струк-
тур.
ПЛОСКОСТНАЯ ОБРЕЗКА
Плоскостная обрезка позволяет выполнять обрезку
под любым углом, поскольку плоскость обрезки не
ограничена позиционированием изучаемой струк-
туры относительно осей X, Y и Z. Данный способ
следует использовать для обрезки объемных дан-
ных при необычном расположении изучаемой струк-
Способ
Функциональное назначение
Применение
Автокадрирование
Обрезка с установкой средней точки
в центре пирамиды
Проверка качества трехмерного изображения
Отображение структур, расположенных в центре
пирамиды
Рамочная обрезка
Обрезка по осям X, Y или Z с расположе-
нием центра плоскостей X–Y, Y–Z или
X–Z в центре пирамиды
Отображение структур, расположенных в объемных
данных по осям X, Y или Z
Плоскостная обрезка
Произвольная обрезка
Отображение структур, расположенных в объемных
данных вне осей X, Y или Z
Удаление артефактов
Двухплоскостная
обрезка
Обрезка с двух сторон от изучаемого
объекта
Для быстрой визуализации
Для специалистов с малым опытом обрезки
ТАБЛИЦА 2.6 Способы обрезки
А
Б
Г
Д
В
ch02.indd 36
03.04.2019 11:38:04
37
2 Трехмерная эхокардиография
туры или в случае необходимости удаления несим-
метричных артефактов.
ДВУХПЛОСКОСТНАЯ ОБРЕЗКА
Двухплоскостная обрезка (iCrop, или двухточечное
кадрирование) сокращает количество этапов, необ-
ходимых для обрезки изучаемого объекта в двух
плоскостях. Специалист выбирает две точки по обе
стороны изучаемого объекта. В образовавшемся пря-
моугольнике содержится изучаемая структура, а за
пределами прямоугольника находятся объемные дан-
ные, которые будут отсечены. Этот способ удобен
для быстрой визуализации небольших структур, на-
пример клапанов сердца.
ОТОБРАЖЕНИЕ ОБЪЕМНЫХ ДАННЫХ
Для отображения объемных данных используют:
(1) объемный рендеринг; (2) поверхностный ренде-
ринг; (3) двухмерные томографические срезы (рис.
2.17). Выбор метода визуализации обычно опреде-
ляется клиническим применением.
ОБЪЕМНЫЙ РЕНДЕРИНГ
Объемный рендеринг (3D-рендеринг) — это метод,
который сохраняет все объемные данные структуры
при ее отображении в плоскости. Как правило, дан-
ный метод весьма реалистично отображает изучае-
мую структуру. Объемный рендеринг осуществля-
ется с помощью различных алгоритмов. Сначала
алгоритм «проводит» световые лучи через выбран-
ные воксели (элементы объема). Затем выполняет-
ся анализ всех вокселей вдоль каждого светового лу-
ча для получения воксельного градиента интенсив-
ности, который потом объединяется с различными
уровнями контрастности, затемнения и осветления.
Это позволяет представить отдельно плотные струк-
туры (т.е . ткани) и светопроницаемые структуры
(т.е. кровь). Для отображения глубины объема и
текстур структур сердца используют различные ме-
тоды затемения (дистанционное затемнение, гради-
ентное полутоновое кодирование и текстурное за-
темнение).
Объемный рендеринг идеально подходит для ото-
бражения информации о сложных пространствен-
ных взаимоотношениях структур сердца, особенно
при оценке клапанов и прилежащих анатомических
структур или имплантированных устройств. В за-
висимости от полученных объемных данных может
понадобиться их обрезка перед отображением. При
необходимости специалист может выполнить об-
резку и поворот объемных данных вручную. Объ-
емные данные могут быть сегментированы и разде-
лены на части в электронном виде. В некоторых
ультразвуковых системах есть настройки для авто-
кадрирования объемных данных и правильного
ориентирования АК или МК. В других ультразвуко-
вых системах можно разрезать объемные данные
для отображения в двух-, трех- или четырехкамер-
ной позиции.
ПОВЕРХНОСТНЫЙ РЕНДЕРИНГ
Поверхностный рендеринг — это метод, который
показывает поверхности структур или органов в ви-
де сплошного либо проволочного каркаса. При ис-
пользовании данного метода сначала необходимо
выделить изучаемую структуру путем сегментации
объемных данных. Как правило, для отслеживания
границы эндокарда, т.е . контура изучаемой струк-
туры сердца, на срезах в поперечных плоскостях ис-
пользуют программы с ручным, полуавтоматизи-
рованным или полностью автоматизированным ал-
горитмом. Затем контуры исследуемой структуры
объединяются для создания объемной формы, ко-
торая визуализируется в виде сплошного или про-
волочного каркаса. Для создания трехмерных изо-
бражений из выборки объемных данных осущест-
вляют реконструкцию проволочного каркаса в виде
клеток (ячеек).
Рис. 2.17 Отображение объемных данных. (А) Объемный рендеринг левого желудочка. (Б) Поверхностный рендеринг левого желудочка (в виде проволочно-
го каркаса). (В) Двухмерные томографические срезы левого желудочка по короткой оси на основе объемных данных.
А
Б
В
ch02.indd 37
03.04.2019 11:38:04
38
ЧАСТЬ I Передовые методы эхокардиографии
Метод поверхностного рендеринга имеет два пре-
имущества. Во-первых, обеспечивает стереоскопи-
ческий вид, позволяющий оценить форму сердца и
его подвижность во время сердечного цикла (т.е . из-
менение объема полостей сердца). Это облегчает
визуальную оценку формы и структур ЛЖ и ПЖ.
Во-вторых, поскольку изучаемая структура сегмен-
тирована, то получаемая информация может быть
представлена количественно. При моделировании
смещения створок МК с помощью кодированных
цветовых параметрических карт можно визуально
оценить не только анатомию клапана, но и степень
смещения и провести необходимые измерения для
принятия клинических решений (рис. 2 .18) [9, 10].
У поверхностного рендеринга есть одно ограниче-
ние — он зачастую не предоставляет подробной ин-
формации о структуре тканей сердца.
ДВУХМЕРНЫЕ ТОМОГРАФИЧЕСКИЕ СРЕЗЫ
Объемные данные можно нарезать или обрезать для
получения одновременных двухмерных изображе-
ний одной и той же трехмерной структуры. Этот ре-
жим называют iSlice, или мультисрезовый. При его
использовании трехмерное изображение, получен-
ное из любого доступа, может быть представлено в
виде двухмерного изображения в стандартной или
модифицированной позиции. Это экономит время
и снижает потребность в получении нескольких
двухмерных изображений из нескольких доступов.
Кроме того, при использовании 2D-датчика получе-
ние двухмерных изображений в модифицирован-
ных позициях может быть затруднительным либо
невозможным.
Доступные томографические срезы: срез в про-
извольной плоскости, одновременные срезы в орто-
гональных плоскостях или под любым углом и па-
раллельные срезы.
Срез в произвольной плоскости позволяет специа-
листу ориентировать ее в любом направлении для
оптимальной визуализации интересующих струк-
тур сердца. Одновременные срезы в ортогональных
плоскостях включают изображения в двух или трех
плоскостях (фронтальной, сагиттальной и попереч-
ной). Одновременные срезы в ортогональных пло-
скостях обеспечивают серийную визуализацию од-
ного и того же сегмента в течение одного сердечно-
Рис. 2.18 Моделирование митрального клапана. Моделирование смещения створок митрального клапана в левое предсердие выше уровня фиброзного коль-
ца с помощью кодированных цветовых параметрических карт. (А, Б) Если клапан не изменен и смещения створок нет, модель имеет синий цвет. (В) При наличии
пролапса или молотящей створки расстояние от плоскости фиброзного кольца митрального клапана до створки, смещенной в левое предсердие, обозначается
разным цветом: от желтого (легкий пролапс) до красного (тяжелый пролапс). В данном случае показан пролапс сегмента P3. (Г) В этой модели пролапс створки
(образование так называемого тента) оценивается в профиль. Ао — аорта; Р — задняя створка митрального клапана.
Р
Ао
Р
А
Б
В
Г
ch02.indd 38
03.04.2019 11:38:05
39
2 Трехмерная эхокардиография
го цикла, что используют для оценки функции
желудочков и сократимости миокарда во время
стресс-ЭхоКГ. Наконец, можно получить несколько
равномерно распределенных параллельных срезов.
После оптимизации изображения в поперечной
плоскости двухмерные томографические срезы по-
зволяют более точно измерить полости сердца, кла-
паны и дефекты перегородки, а также оценить мор-
фологию и функцию различных структур.
АНАЛИЗ ТРЕХМЕРНЫХ ИЗОБРАЖЕНИЙ
Анализ 3D-ЭхоКГ зависит не только от исследуемой
структуры сердца (например, желудочка или клапа-
на), но и от задачи исследования (определение па-
томорфологии или количественной оценки). Для
анализа используют: (1) многопланарную рекон-
струкцию (МПР); (2) моделирование; (3) цветовую
допплерографию.
МНОГОПЛАНАРНАЯ РЕКОНСТРУКЦИЯ
МПР создает двухмерные изображения из данных
3D-ЭхоКГ. При МПР три плоскости располагаются
в любом направлении под углом относительно друг
друга и исследуемой структуры (как правило, две
плоскости ортогональны друг другу, а третья — па-
раллельна изучаемой структуре). В параллельной
плоскости можно измерить эффективное отверстие
регургитации, стенозированные отверстия и размер
дефектов межпредсердной и межжелудочковой пе-
регородок.
МОДЕЛИРОВАНИЕ
Моделирование заключается в использовании изо-
бражения, созданного при поверхностном ренде-
ринге, для получения количественной информа-
ции. Для моделирования обычно применяют про-
граммы с ручным, полуавтоматизированным или
полностью автоматизированным алгоритмом от-
слеживания контура изучаемой структуры. Из по-
лученных контуров формируется объемная модель,
с помощью которой выполняют нужные измере-
ния. В настоящее время созданы программы для
анализа ЛЖ, ПЖ, ЛП, корня аорты, МК и АК.
ЦВЕТОВАЯ ДОППЛЕРОГРАФИЯ
Данные цветовой допплерографии можно проана-
лизировать с помощью МПР или методом опреде-
ления объема. Для этого выбирают интересующую
область и измеряют скорость кровотока через нее.
По разнице кровотока между клапанами возможно
определить объем регургитации. Другим методом
оценки регургитации является метод PISA (proximal
isovelocity surface area), или метод конвергенции по-
тока. С помощью этого метода рассчитывают объ-
ем регургитации, измерив радиус проксимальной
зоны струи регургитации.
ПРОТОКОЛЫ ПОЛУЧЕНИЯ И АНАЛИЗА
ТРЕХМЕРНЫХ ИЗОБРАЖЕНИЙ
Появление 3D-ЭхоКГ дало возможность визуализи-
ровать МК в стандартной позиции и более точно из-
мерить объем ЛЖ. В настоящее время с помощью
3D-ЭхоКГ осуществляют оценку: (1) анатомии натив-
ного клапана и протезированного клапана; (2) сте-
пени клапанного стеноза и объема регургитации;
(3) объема полостей сердца. Кроме этого, 3D-ЭхоКГ
используют до, во время и после чрескожного вме-
шательства на сердце (табл. 2 .7) [11, 12]. Далее об-
суждаются конкретные протоколы 3D-ЭхоКГ и ко-
личественной оценки, рекомендованные American
Society of Echocardiography (ASE) [11, 12].
ЛЕВЫЙ ЖЕЛУДОЧЕК
В клинической практике большое значение имеет
оценка размеров и функции ЛЖ. Было продемон-
стрировано, что данные, полученные при 3D-ЭхоКГ,
были более точными и воспроизводимыми, чем
данные, полученные при 2D-ЭхоКГ, что обусловле-
но отсутствием геометрических ограничений [13].
ПОЛУЧЕНИЕ ДАННЫХ
Для определения максимальной объемной скорости
необходимо использовать пирамиду наименьшего
размера, включающую ЛЖ целиком. Для захвата
всего ЛЖ в объемные данные необходима визуали-
зация в многопланарном режиме. Для достижения
частоты смены кадров, превышающей 15 Гц, могут
понадобиться режимы с высокой объемной скоро-
стью, например получение данных во время не-
скольких сердечных сокращений. Низкая частота
смены кадров позволяет точно определить конец
систолы для исключения завышения конечно-си-
столического объема и снижения показателя фрак-
ции выброса.
ОТОБРАЖЕНИЕ
ЛЖ может быть отображен с помощью: (1) серий-
ных двухмерных томографических срезов по ко-
роткой оси (для визуализации всех стенок); (2) сре-
зов в ортогональных плоскостях (для визуализации
в 2D-режиме в двух-, трех- и четырехкамерной по-
зициях); (3) поверхностного рендеринга (для коли-
чественного анализа систолической функции на ос-
нове объемной модели); (4) объемного рендеринга
(для выявления в ЛЖ тромбов, новообразований и
дефектов перегородки).
АНАЛИЗ
Объем ЛЖ рассчитывают с помощью бипланарно-
го метода Симпсона под контролем 3D-ЭхоКГ или
путем прямой количественной оценки объема с ис-
пользованием полуавтоматизированных или пол-
ностью автоматизированных алгоритмов анализа
ЛЖ. Для выделения контура в качестве ориентиров
ch02.indd 39
03.04.2019 11:38:05
40
ЧАСТЬ I Передовые методы эхокардиографии
используются фиброзное кольцо МК и верхушка
ЛЖ. К другим важным анатомическим структурам
относятся трабекулы и папиллярные мышцы ЛЖ,
которые также должны быть включены в расчет
объема ЛЖ. Для представления ЛЖ в виде 17-сег-
ментной модели используются фиброзное кольцо
МК, папиллярные мышцы, апикальная часть поло-
сти ЛЖ и передняя и задняя точки прикрепления
перегородки к ПЖ. В настоящее время в большин-
стве программ локальный объем ЛЖ определяется
как пространство между границей эндокарда и цен-
тральной линией, проведенной через полость ЛЖ.
Определение объема может быть затруднено, если
виртуальные ориентиры смещаются в результате
изменения массы ЛЖ и ремоделирования после ин-
фаркта миокарда, что приводит к недооценке изме-
нений локального объема.
После создания 17-сегментной модели можно
оценить сократимость миокарда ЛЖ и его объем.
На основании данных 3D-ЭхоКГ также можно опре-
делить деформацию, форму и массу ЛЖ. Количе-
ственный анализ деформации миокарда с помощью
спекл-трекинг (speckle tracking) ЭхоКГ на основа-
нии данных 3D-ЭхоКГ позволяет отслеживать пят-
на (спеклы) вдоль осей X, Y и Z, в отличие от визу-
ализации в 2D-режиме, когда пятна могут лежать в
плоскости изображения и выходить за ее пределы.
Оценка формы ЛЖ при визуализации в 3D-режиме
позволяет лучше определить глобальное и локаль-
ное ремоделирование ЛЖ и оценить полость ЛЖ
целиком. При визуализации в 2D-режиме оценка
формы ЛЖ проводится с помощью индекса сфе-
ричности, который не учитывает локальные нару-
шения. Для определения массы ЛЖ нужна точная
идентификация границы не только эндокарда, но и
эпикарда. Обычно массу ЛЖ определяют с помо-
щью бипланарного метода Симпсона под контро-
лем 3D-ЭхоКГ или анализа объемных данных. Для
измерения дефектов межжелудочковой перегород-
ки следует использовать МПР.
ОГРАНИЧЕНИЯ
Использование больших объемных данных при ис-
следовании увеличенного сердца приводит к сниже-
нию объемной скорости. Получение данных во вре-
мя нескольких сердечных сокращений позволяет
устранить эту проблему, однако возникает вероят-
ность появления артефакта при «сшивании». Кроме
того, у пациентов с нарушениями сердечного ритма
и у пациентов, не способных задержать дыхание, ре-
зультаты могут быть недостоверны.
ПРАВЫЙ ЖЕЛУДОЧЕК
Оценка размеров и функции ПЖ при визуализации
в 2D-режиме осложняется тем, что форма ПЖ на-
поминает полумесяц. Была продемонстрирована
высокая точность и воспроизводимость значений
объема ПЖ, полученных при 3D-ЭхоКГ, по сравне-
нию со значениями, полученными с помощью ви-
зуализации в 2D-режиме, что связано с отсутствием
геометрических ограничений [14]. Некоторые про-
изводители выпускают ультразвуковые системы с
программным обеспечением для полуавтоматиче-
ской количественной оценки ПЖ.
Структура/вмешательство Показания
Исследуемые параметры Перспективы применения
Левый желудочек
Определение объема
Оценка формы
Оценка диссинхронии
Определение массы
Правый желудочек
Определение объема
Левое предсердие
Оценка формы
Определение объема
Правое предсердие
Определение объема
Межпредсердная/межжелу-
дочковая перегородка
Локализация дефекта
Измерение дефекта
Митральный клапан
Локализация поражения нативных
анатомических структур
Площадь стеноза при ревматизме
Анатомия протезированного
клапана
Околоклапанная регургитация
Количественная оценка
регургитации
Корень аорты
Измерение корня
Количественная оценка
регургитации
Количественная оценка стеноза
аортального клапана
Анатомия аортального клапана
Трикуспидальный клапан
Механизм регургитации
Чрескожное вмешательство Контроль процедуры
* Рекомендации American Society of Echocardiography по эхокардиографии (2013).
ТАБЛИЦА 2.7 Клинические показания к трехмерной эхокардиографии*
ch02.indd 40
03.04.2019 11:38:05
41
2 Трехмерная эхокардиография
ПОЛУЧЕНИЕ ДАННЫХ
Для определения максимальной объемной скорости
необходимо использовать пирамиду наименьшего
размера, включающую ПЖ целиком. Для захвата
всего ПЖ в объемные данные необходима визуали-
зация в многопланарном режиме. Обычно исходная
плоскость представляет собой изображение в моди-
цифированной позиции ПЖ, а в ортогональной
плоскости визуализируются приточный и отточ-
ный отделы ПЖ.
ОТОБРАЖЕНИЕ
ПЖ может быть отображен с помощью: (1) серий-
ных двухмерных томографических срезов по корот-
кой оси (для визуализации всех стенок); (2) поверх-
ностного рендеринга (для количественного анализа
систолической функции на основе объемной мо-
дели); (3) объемного рендеринга (для определения
в ПЖ электродов кардиостимулятора, выявления
тромбов, новообразований и дефектов перегородки).
АНАЛИЗ
В некоторых ультразвуковых системах доступен по-
луавтоматизированный или полностью автомати-
зированный алгоритм для анализа ПЖ. В качестве
ориентиров используют фиброзные кольца трику-
спидального клапана (ТК), АК и клапана легочной
артерии, а также свободную стенку ПЖ. После со-
здания объемной модели определяют объем ПЖ.
ОГРАНИЧЕНИЯ
Как и при оценке ЛЖ, использование больших объ-
емных данных при исследовании увеличенного серд-
ца приводит к снижению объемной скорости.
ЛЕВОЕ ПРЕДСЕРДИЕ
Объем ЛП — прогностический фактор долгосроч-
ного клинического исхода [15]. Из-за геометриче-
ских ограничений при визуализации в 2D-режиме
объем ЛП часто определяется неточно. Определе-
ние объема ЛП с помощью 3D-ЭхоКГ от этих допу-
щений не зависит.
ПОЛУЧЕНИЕ ДАННЫХ
Для определения максимальной объемной скорости
необходимо использовать пирамиду наименьшего
размера, включающую ЛП целиком. Для захвата
всего ЛП в объемные данные необходима визуали-
зация в многопланарном режиме. При исследова-
нии ЛП, как правило, можно достичь высоких объ-
емных скоростей в связи с меньшим общим разме-
ром ЛП.
ОТОБРАЖЕНИЕ
ЛП может быть отображен с помощью: (1) поверх-
ностного рендеринга (для количественного анализа
систолической функции на основе объемной моде-
ли); (2) объемного рендеринга (для определения в ЛП
электродов кардиостимулятора, выявления тром-
бов, новообразований и дефектов перегородки).
АНАЛИЗ
Полуавтоматизированный алгоритм для анализа ЛП
в современных ультразвуковых системах недосту-
пен. В некоторых лабораториях для анализа ЛП ис-
пользовали программы для ЛЖ, однако допуще-
ния, встроенные в программу для ЛЖ, при анализе
ЛП могут спровоцировать ошибки. К стандартным
ориентирам, используемым в этих программах, от-
носится фиброзное кольцо МК. После создания
объемной модели определяется объем ЛП. Для точ-
ного измерения дефектов межпредсердной перего-
родки следует использовать МПР.
ОГРАНИЧЕНИЯ
Есть множество подтверждений прогностической
значимости определения объема ЛП при визуали-
зации в 2D-режиме, однако такой информации от-
носительно определения объема ЛП с помощью
3D-ЭхоКГ нет.
МИТРАЛЬНЫЙ КЛАПАН
Визуализация МК с помощью 3D-ЭхоКГ позволяет
четко идентифицировать патологию клапана [16], в
отличие от визуализации в 2D-режиме, при которой
для определения патологических изменений нужно
проводить расчеты в уме. Однако по-прежнему оцен-
ку МК лучше всего проводить с помощью ЧПЭхоКГ
в 3D-режиме.
ПОЛУЧЕНИЕ ДАННЫХ
Как правило, для получения объемных данных МК
используют позицию, перпендикулярную ультра-
звуковому лучу. Следует выбрать пирамиду наи-
меньшего размера, полностью включающую фи-
брозное кольцо МК и все его створки. Для этого не-
обходима визуализация в многопланарном режиме.
Кроме этого, для правильной ориентации МК в объ-
емные данные должен быть включен АК. Во время
вмешательств на МК, например транскатетерной
пластики методом «край в край» с помощью систе-
мы MitraClip, при определении места пункции пере-
городки следует сканировать в двух плоскостях, а
для визуализации клапана и катетера на одном и
том же изображении при размещении клипсы мож-
но использовать поверхностный рендеринг объем-
ных данных, полученных в режиме «Узкий сектор».
Поверхностный рендеринг также применяют при
транскатетерных околоклапанных вмешательствах.
ОТОБРАЖЕНИЕ
МК может быть отображен с помощью: (1) поверх-
ностного рендеринга (для количественной оценки
на основе объемной модели); (2) объемного ренде-
ch02.indd 41
03.04.2019 11:38:05
42
ЧАСТЬ I Передовые методы эхокардиографии
ринга (для демонстрации анатомии клапана и окру-
жающих структур во время вмешательства). При
визуализации МК должен быть правильно ориенти-
рован, а АК — находиться на 12 часах условного ци-
ферблата независимо от того, происходит ли ото-
бражение со стороны ЛП или ЛЖ.
АНАЛИЗ
МК оценивают в основном по объемным изображе-
ниям. Для планиметрии отверстия МК используют
МПР. Количественную оценку дегенеративных по-
ражений клапана осуществляют в основном при на-
учных исследованиях, хотя во всех ультразвуковых
системах есть полуавтоматизированный или пол-
ностью автоматизированный алгоритм для анализа
МК. После создания модели можно оценить смеще-
ние створок МК и другие нарушения, а также про-
вести необходимые измерения.
ОГРАНИЧЕНИЯ
Часто у пациентов с пороком МК наблюдается фи-
брилляция предсердий, что служит ограничением
при получении объемных данных во время несколь-
ких сердечных сокращений. Для решения этой про-
блемы разработаны режимы с высокой объемной
скоростью, не зависящие от синхронизации с ЭКГ.
АОРТАЛЬНЫЙ КЛАПАН
Визуализация АК и корня аорты приобрела боль-
шое значение с внедрением в практику транскате-
терного протезирования АК. Для определения раз-
меров фиброзного кольца АК и самого клапана обыч-
но используют компьютерную томографию сердца,
но у некоторых пациентов данный метод визуали-
зации использовать нельзя, поэтому потребность в
оценке АК с помощью ЭхоКГ сохраняется. Кроме
того, ЭхоКГ играет важную роль при оценке состо-
яния пациента после вмешательства.
ПОЛУЧЕНИЕ ДАННЫХ
Изображения АК могут быть получены с помощью
ЧПЭхоКГ из среднего отдела пищевода в позиции
АК по длинной оси (от 120 до 140°) или ТТЭхоКГ в
парастернальной позиции по длинной оси или апи-
кальной пятикамерной позиции. Для подтвержде-
ния включения всего фиброзного кольца АК в объ-
емные данные необходима визуализация в много-
планарном режиме. Обычно используют пирамиду
небольшого или наименьшего размера. При визуа-
лизации АК в 3D-режиме могут возникнуть затруд-
нения при захвате тонких некальцифицированных
подвижных створок вследствие параллельной ори-
ентации ультразвукового луча и АК.
ОТОБРАЖЕНИЕ
АК может быть отображен с помощью: (1) поверх-
ностного рендеринга (для количественной оценки
на основе объемной модели); (2) объемного ренде-
ринга (для демонстрации анатомии клапана и окру-
жающих структур во время вмешательства). АК дол-
жен быть ориентирован так, чтобы некоронарная
створка находилась на 6 часах условного цифербла-
та независимо от того, происходит отображение со
стороны аорты или выходного тракта ЛЖ.
АНАЛИЗ
Качественную оценку АК в основном проводят по
объемным изображениям, для планиметрии исполь-
зуют МПР. В некоторых ультразвуковых системах
есть полуавтоматизированный или полностью ав-
томатизированный алгоритм анализа АК. Основ-
ным показателем является размер фиброзного коль-
ца клапана, клиническую ценность других показа-
телей, измеряемых в 3D-режиме, еще изучают.
ОГРАНИЧЕНИЯ
Как уже говорилось, проблемой является выпаде-
ние изображения тонкой подвижной створки. При
ЧПЭхоКГ улучшение визуализации в 3D-режиме и
захвата изображения может быть достигнуто при
визуализации из трансгастрального доступа благо-
даря перпендикулярному расположению клапана
относительно ультразвукового луча.
ТРИКУСПИДАЛЬНЫЙ КЛАПАН
3D-ЭхоКГ применяют для оценки анатомии ТК и
механизма регургитации [17, 18].
ПОЛУЧЕНИЕ ДАННЫХ
Получить изображения ТК при ТТЭхоКГ можно в
апикальной четырехкамерной позиции. Для под-
тверждения включения всего фиброзного кольца
ТК в объемные данные необходима визуализация в
многопланарном режиме. Обычно используют пи-
рамиду небольшого или наименьшего размера.
ОТОБРАЖЕНИЕ
Для демонстрации анатомии ТК используют объем-
ный рендеринг. ТК должен быть ориентирован так,
чтобы септальная створка находилась на 6 часах ус-
ловного циферблата независимо от того, происхо-
дит отображение со стороны ПП или ПЖ.
АНАЛИЗ
Патологические изменения ТК оценивают в основ-
ном по объемному изображению. В настоящее вре-
мя нет программного обеспечения для анализа ТК.
ОГРАНИЧЕНИЯ
Примерно у 20% пациентов изображения ТК при
2D-ТТЭхоКГ из апикального доступа малоинфор-
мативны из-за плохого качества, что отражается на
качестве изображений в 3D-режиме. В такой ситуа-
ции можно использовать парастернальный доступ.
ch02.indd 42
03.04.2019 11:38:05
43
2 Трехмерная эхокардиография
ТРЕХМЕРНАЯ ЦВЕТОВАЯ ДОППЛЕРОГРАФИЯ
ПОЛУЧЕНИЕ ДАННЫХ
Как и при стандартной визуализации в 2D-режиме,
трехмерная цветовая допплерография совмещает
информацию о кровотоке с морфологией, но имеет
те же ограничения. Получение данных с помощью
трехмерной цветовой допплерографии возможно
во время одного или нескольких сердечных сокра-
щений. Получить данные можно как при ТТЭхоКГ,
так и при ЧПЭхоКГ, но последний метод в настоя-
щее время обеспечивает значительно лучшее каче-
ство изображений.
ОТОБРАЖЕНИЕ
Данные цветовой допплерографии могут быть ото-
бражены с помощью объемного рендеринга и МПР.
Клиническое значение имеет понимание исследова-
телем ориентации кровотока. Для облегчения этого
рекомендуется отображать данные трехмерной цве-
товой допплерографии по меньшей мере в двух
плоскостях, положение которых известно. Также ре-
комендуется отображать данные трехмерной цве-
товой допплерографии вместе со специфическими
анатомическими данными, используя стандартные
позиции.
АНАЛИЗ
При анализе данных трехмерной цветовой доппле-
рографии изучают: (1) проксимальную зону струи
регургитации; (2) межжелудочковую и межпред-
сердную перегородки для исключения дефектов.
Анализ данных цветовой допплерографии может
быть выполнен с помощью МПР струи регургита-
ции и метода определения объема. Обрезку объем-
ных данных трехмерной цветовой допплерографии
проводят теми же способами, что и обрезку данных
спектральной допплерографии. Для МПР струи ре-
гургитации объемные данные трехмерной цветовой
допплерографии рекомендуется обрезать так, что-
бы получить два изображения струи регургитации
по длинной оси: одно — с наибольшей шириной
струи, другое — с наименьшей шириной струи. Не-
обходимо также изображение струи регургитации
по короткой оси на уровне vena contracta, которую
можно измерить.
ОГРАНИЧЕНИЯ
Ограничения при трехмерной цветовой допплеро-
графии обусловлены плохими пространственным
и временны
́
м разрешениями, улучшение которых
ожидают по мере развития трехмерных технологий.
Структура сердца ЧПЭхоКГ
ТТЭхоКГ
Пирамидальный
режим
Ориентация
изображения
при объемном
рендеринге
Анализ
Левый желудочек Доступ из среднего
отдела пищевода
(0/90/120°)
Апикальная четырех-
камерная позиция
Широкий сектор Позиция по корот-
кой оси или четы-
рехкамерная
позиция
МПР,
специальные
программы
для анализа
Правый
желудочек
Доступ из среднего
отдела пищевода
(0/45°)
Модифицированная
позиция ПЖ/апи-
кальная четырехка-
мерная позиция
Широкий сектор Позиция по корот-
кой оси или четы-
рехкамерная
позиция
МПР,
специальные
программы
для анализа
Левое предсердие
–
Модифицированная
апикальная четырех-
камерная позиция
Модифицированная
позиция ЛП
Масштабирование При отображении
со стороны ЛП
правая верхняя
легочная вена
должна быть
на 1 часе условного
циферблата
При отображении
со стороны ПП
верхняя полая вена
должна быть
на 11 часах услов-
ного циферблата
МПР, видоиз-
мененные
программы
для анализа
Правое
предсердие
Доступ из среднего
отдела пищевода
(0–10/90°)
Модифицированная
позиция ПЖ/апи-
кальная четырехка-
мерная позиция
Масштабирование Позиция по корот-
кой оси или четы-
рехкамерная
позиция
МПР
СВОДНАЯ ИНФОРМАЦИЯ
Получение данных, вывод изображения на экран монитора и анализ
ch02.indd 43
03.04.2019 11:38:05
44
ЧАСТЬ I Передовые методы эхокардиографии
Структура сердца ЧПЭхоКГ
ТТЭхоКГ
Пирамидальный
режим
Ориентация
изображения
при объемном
рендеринге
Анализ
Межпредсердная
перегородка
Доступ из среднего
отдела пищевода
(0/45/90/120°)
–
Масштабирование Позиция по корот-
кой оси или четы-
рехкамерная
позиция
МПР
Аортальный
клапан
Доступ из среднего
отдела пищевода
(60° или 120°)
Парастернальная
позиция по длинной
или короткой оси
либо апикальная
трех- или пятика -
мерная позиция
Масштабирование Правая коронарная
створка должна
быть на 6 часах
условного
циферблата
МПР,
специальные
программы
для анализа
Митральный
клапан
Доступ из среднего
отдела пищевода
(≈0/45–60/90/120°)
Апикальная четырех-
камерная позиция
или парастернальная
позиция по длинной
оси
Масштабирование Аортальный клапан
должен быть
на 12 часах услов-
ного циферблата
МПР,
специальные
программы
для анализа
Трикуспидальный
клапан
Доступ из среднего
отдела пищевода
(0–30°)
Трансгастральный
доступ (40°)
Модифицированная
позиция ПЖ/апи-
кальная четырехка-
мерная позиция
Масштабирование Септальная створка
должна быть
на 6 часах услов-
ного циферблата
МПР
Клапан легочной
артерии
Доступ из верхнего
отдела пищевода
(90°)
Доступ из среднего
отдела пищевода
(120°)
Парастернальная
позиция отточного
отдела ПЖ
Масштабирование Передняя створка
должна быть
на 12 часах услов-
ного циферблата
МПР
ЛП — левое предсердие; МПР — многопланарная реконструкция; ПЖ — правый желудочек; ПП — правое предсердие; ТТЭхоКГ — транс-
торакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Получение данных, вывод изображения на экран монитора и анализ
ЛИТЕРАТУРА
1. Matsumoto M, Inoue M, Tamura S, et al.
Three-dimensional echocardiography for
spatial visualization and volume calculation
of cardiac structures, J Clin Ultrasound 9:157–
165, 1981.
2. Sugeng L, Weinert L, Thiele K, Lang RM. Re-
al-time three-dimensional echocardiography
using a novel matrix array transducer, Echo-
cardiography 20:623–635, 2003.
3. Salgo IS. Three-dimensional echocardiograph-
ic technology, Cardiol Clin 25:231–239, 2007.
4. Badano LP. The clinical benefits of adding a
third dimension to assess the left ventricle
with echocardiography, Scientif ica (Cairo)
2014:897431, 2014.
5. Perrin DP, Vasilyev NV, Marx GR, del Nido
PJ. Temporal enhancement of 3D echocar-
diography by frame reordering, JACC Cardio-
vasc Imaging 5:300–304, 2012.
6. Provost J, Papadacci C, Arango JE, et al. 3D
ultrafast ultrasound imaging in vivo, Phys
Med Biol 59:L1–L13, 2014.
7. Denarie B, Bjastad T, Torp H. Multi-line
transmission in 3-D with reduced crosstalk
artifacts: a proof of concept study, IEEE
Trans Ultrason Ferroelectr Freq Control
60:1708–1718, 2013.
8. Skaug TR, Amundsen BH, Hergum T, et al.
Quantification of aortic regurgitation using
high-pulse repetition frequency three-dimen-
sional colour Doppler, Eur Heart J Cardiovasc
Imaging 15:615–622, 2014.
9. Chandra S, Salgo IS, Sugeng L, et al. Charac-
terization of degenerative mitral valve disease
using morphologic analysis of real-time
three-dimensional echocardiographic images:
objective insight into complexity and plan-
ning of mitral valve repair, Circ Cardiovasc
Imaging 4:24–32, 2011.
10. Tsang W, Weinert L, Sugeng L, et al. The val-
ue of three-dimensional echocardiography
derived mitral valve parametric maps and the
role of experience in the diagnosis of pathol-
ogy, J Am Soc Echocardiogr 24:860–867, 2011.
11. Lang RM, Badano LP, Tsang W, et al. EAE/
ASE Recommendations for Image Acquisi-
tion and Display Using Three-Dimensional
Echocardiography, J Am Soc Echocardiogr
25:3–46, 2012.
12. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European association of
cardiovascular imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
13. Mor-Avi V, Jenkins C, Kuhl HP, et al. Real-
time 3-dimensional echocardiographic quan-
tification of left ventricular volumes: multi-
center study for validation with magnetic res-
onance imaging and investigation of sources
of error, JACC Cardiovasc Imaging 1:413–423,
2008.
14. Sugeng L, Mor-Avi V, Weinert L, et al. Mul-
timodality comparison of quantitative volu-
metric analysis of the right ventricle, JACC
Cardiovasc Imaging 3:10–18, 2010.
15. Tsang TS, Abhayaratna WP, Barnes ME, et al.
Prediction of cardiovascular outcomes with
left atrial size: is volume superior to area or di-
ameter? J Am Coll Cardiol 47:1018–1023, 2006.
16. Tsang W, Lang RM. Three-dimensional echo-
cardiography is essential for intraoperative
assessment of mitral regurgitation, Circula-
tion 128:643–652, 2013. discussion 652.
17. Addetia K, Maffessanti F, Mediratta A, et al.
Impact of implantable transvenous device
lead location on severity of tricuspid regurgi-
tation, J Am Soc Echocardiogr 27:1164–1175,
2014.
18. Mediratta A, Addetia K, Yamat M, et al. 3D
echocardiographic location of implantable
device leads and mechanism of associated tri-
cuspid regurgitation, JACC Cardiovasc Imag-
ing 7:337–347, 2014.
ch02.indd 44
03.04.2019 11:38:05
45
3 Диагностическая чреспищеводная
эхокардиография
ROSARIO V. FREEMAN, MD, MS
Чреспищеводная эхокардиография
Показания
Обучение медицинского персонала
Подготовка пациента и его седация
Интубация пищевода
Перемещение зонда и стандартные
позиции при визуализации
Обработка данных и выведение
изображения на экран монитора
Изображения, получаемые
при чреспищеводной
эхокардиографии
Левый и правый желудочки
Предсердия и ушко левого предсердия
Аорта и аортальный клапан
Митральный клапан
Клапан легочной артерии
и трикуспидальный клапан
Трехмерная эхокардиография
Применение чреспищеводной
эхокардиографии в клинической
практике
Фибрилляция предсердий
и определение источника эмболии
Оценка нативных и протезированных
клапанов
Инфекционный эндокардит
Острый аортальный синдром
Взрослые пациенты с врожденным
пороком сердца
Использование чреспищеводной
эхокардиографии во время
оперативного вмешательства
и в отделении интенсивной терапии
Последовательность оценки структур
сердца с помощью чреспищеводной
эхокардиографии
Чреспищеводная эхокардиография (ЧПЭхоКГ) яв-
ляется основным методом визуализации, который
широко используют. Он помогает в решении не-
скольких клинических задач, включая диагностику,
интраоперационную оценку, а также мониторинг
сердца в режиме реального времени.
В отличие от трансторакальной эхокардиографии
(ТТЭхоКГ), размещение датчика в пищеводе при
ЧПЭхоКГ улучшает визуализацию задних структур
сердца, обеспечивая лучшую акустическую доступ-
ность (без промежуточных структур) по сравнению
с ТТЭхоКГ. ЧПЭхоКГ используют, когда получен-
ные при ТТЭхоКГ изображения недостаточно ин-
формативны и для тщательной визуализации про-
тезированных клапанов. Улучшение технологии об-
работки изображений, визуализация в 3D-режиме,
мобильность ультразвуковых систем повысили до-
ступность применения ЧПЭхоКГ в различных кли-
нических условиях, включая отделения эхокардио-
графии (ЭхоКГ), ангиографии, реанимации и ин-
тенсивной терапии и операционное отделение.
В данной главе представлены показания к прове-
дению ЧПЭхоКГ, описание получения двухмерных
и трехмерных изображений и применения ЧПЭхоКГ
в комплексной диагностике. В других главах данно-
го руководства содержится дополнительная инфор-
мация о принципах регистрации трехмерных изо-
бражений (см. главу 2), оценке нативных и протези-
рованных клапанов, проведении ЭхоКГ во время
хирургических манипуляций (см. главы 4, 16, 19,
20), диагностике эмболии и ее источника в сердце,
тактике ведения при фибрилляции предсердий (см.
главы 40, 41), а также диагностике инфекционного
эндокардита (ИЭ) (см. главу 22).
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
ПОКАЗАНИЯ
Информация, полученная при ЧПЭхоКГ, дополня-
ет результаты стандартной ТТЭхоКГ. ЧПЭхоКГ ча-
ще всего используют при недостаточной информа-
тивности ТТЭхоКГ либо когда нужно получить изо-
бражение за пределами возможностей ТТЭхоКГ.
Перед проведением ЧПЭхоКГ крайне важно со-
брать полный анамнез пациента и оценить его фи-
зическое состояние. Для получения оптимальной
диагностической информации следует знать преи-
мущества и недостатки всех методов визуализации
сердца. Относительными противопоказаниями к
ЧПЭхоКГ служат диагнозы, при которых возможны
ограничения по введению зонда с датчиком или по-
вышен риск травмирования пациента, например в
случае варикозных вен пищевода, тяжелого гемор-
рагического диатеза, наличия в анамнезе указаний
ch03.indd 45
03.04.2019 11:38:29
46
ЧАСТЬ I Передовые методы эхокардиографии
на операцию на желудочно-кишечном тракте, огра-
ниченной подвижности шеи, опухоли шеи. К абсо-
лютным противопоказаниям к ЧПЭхоКГ относят
перфорацию органов, активное кровотечение из
верхних отделов желудочно-кишечного тракта, ди-
вертикул пищевода. При стратификации риска в
отношении возможных осложнений может помочь
предварительная консультация гастроэнтеролога.
Комплексное диагностическое исследование с по-
мощью ЧПЭхоКГ включает визуализацию в 2D- и
3D-режимах, цветовую и спектральную допплеро-
графию. Позиционирование кончика зонда с датчи-
ком в пищеводе позади сердца позволяет улучшить
визуализацию левого предсердия (ЛП) и его ушка,
легочных вен, митрального клапана (МК), грудной
части нисходящего отдела аорты. При ЧПЭхоКГ аку-
стическая доступность лучше из-за отсутствия на
пути ультразвукового луча промежуточных струк-
тур (ребер и легких), что позволяет получить более
детальное изображение.
В недавно опубликованных критериях целесооб-
разного использования для ЭхоКГ приведены кли-
нические ситуации, в которых ЧПЭхоКГ является
оптимальным методом визуализации (табл. 3 .1) [1],
но решение о проведении ЧПЭхоКГ следует прини-
мать с учетом клинических данных.
ОБУЧЕНИЕ МЕДИЦИНСКОГО ПЕРСОНАЛА
Врачи, которые будут проводить ЧПЭхоКГ, должны
пройти соответствующую клиническую подготовку
и аттестацию в рамках своей специальности. Снача-
ла необходимо завершить обучение по проведению
ТТЭхоКГ, а затем обучаться проведению ЧПЭхоКГ.
Минимальные требования для допуска к ЧПЭхоКГ,
взятые из American College of Cardiology’s Core Car-
diology Training Symposium (COCATS 4 Task Force 5:
Training in Echocardiography), включают интерпрета-
цию 300 ТТЭхоКГ и выполнение не менее 50 ЧПЭхоКГ
под контролем преподавателя и 25 самостоятельных
введений зонда в пищевод [2]. Эти требования со-
гласуются с принципами о компетентности, в кото-
рых признана необходимость изучения широкого
спектра диагнозов сердечно-сосудистых заболева-
ний и понимания кардиохирургических и ангиогра-
фических вмешательств врачами, которые прово-
дят интраоперационную ЧПЭхоКГ [2–5].
National Board of Echocardiography (NBE) прово-
дит квалификационный экзамен с сертификацией
по проведению ЧПЭхоКГ для кардиологов (диагно-
стическая ЭхоКГ) и для анестезиологов (углублен-
ная базовая интраоперационная ЭхоКГ), а также по-
вторную сертификацию для последующей оценки
[6]. Клиническая компетентность врачей, проводя-
щих ЧПЭхоКГ, должна быть подтверждена соответ-
ствующими техническими навыками (табл. 3 .2) [7].
Специалист по ультразвуковой диагностике должен
уметь настраивать любую ультразвуковую систему.
На каждом рабочем месте должен быть отлажен
процесс непрерывного улучшения качества диагно-
стики [8].
Целесообразно
При высокой вероятности неинформативной ТТЭхоКГ из-за анатомических и физиологических особенностей пациента или
плохой визуализации определенных структур
Для оценки в динамике и сравнения результатов с прошлой ЧПЭхоКГ, особенно в случае необходимости изменения терапии
Во время транскатетерных вмешательств на сердце (исключая коронарные), включая установку окклюдеров, радиочастотную
аблацию, транскатетерное протезирование клапанов
При подозрении на острый аортальный синдром, например расслоение либо разрыв аорты
Для оценки анатомии и функции клапана при планировании оперативного вмешательства
Для диагностики инфекционного эндокардита при умеренной или высокой степени подозрения
Для поиска источника эмболии со стороны сердечно-сосудистой системы при доказанном отсутствии очага вне сердца
Для принятия решения об антикоагулянтной терапии, кардиоверсии, радиочастотной аблации
Сомнительно
Для поиска источника эмболии со стороны сердечно-сосудистой системы при установленном очаге вне сердца
Нецелесообразно
Рутинное использование ЧПЭхоКГ, когда с помощью ТТЭхоКГ можно получить все необходимые диагностические данные
Для оценки в динамике и сравнения результатов с предшествующей ЧПЭхоКГ при отсутствии необходимости изменения
терапии
Для рутинной оценки легочных вен после их разобщения у бессимптомных пациентов
Для диагностики инфекционного эндокардита с низкой степенью подозрения
Для поиска источника эмболии со стороны сердечно-сосудистой системы при доказанном очаге внутри сердца в ситуации,
когда данные ЧПЭхоКГ не изменят терапии
Для оценки сердца после решения об антикоагулянтной терапии и отсутствии необходимости проведения кардиоверсии
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/ SCCT/SCMR 2011 appropriate use criteria for echocar-
diography. J Am Soc Echocardiogr 24:229–267, 2011.]
ТАБЛИЦА 3.1 Показания к проведению чреспищеводной эхокардиографии в качестве диагностического исследования
ch03.indd 46
03.04.2019 11:38:29
47
3 Диагностическая чреспищеводная эхокардиография
Особенности дыхательных путей: указание в анамнезе
на проблемы с дыхательными путями, обструктивное
апноэ во время сна, небольшое раскрытие рта, аномалии
прикуса
Пожилые пациенты: повышенная чувствительность
к седативным препаратам, более высокая частота
взаимодействия этих препаратов с другими
лекарственными средствами
Хроническая сердечная недостаточность: тяжелая
систолическая дисфункция левого желудочка,
критический аортальный стеноз
Хроническая патология легких: зависимость от кислорода,
тяжелая легочная гипертензия, легочное сердце
Неврологические и нервно-мышечные расстройства,
нарушающие дыхание или глотание; неспособность
пациента выполнять команды врача
Проведение процедуры не натощак
ТАБЛИЦА 3.3
Клинические особенности, которые
ассоциируются с высоким риском
нарушения дыхания во время седации
Осложнение
Частота (%)
Летальный исход
< 0,01–0,02
Перфорация пищевода
< 0,01
Массивное кровотечение
< 0,01
Небольшое кровотечение
0,01–0,2
Бронхоспазм
0,07
Аритмия
0,06–0,3
Повреждение зубов
0,1
Дисфагия
1,8
Дисфония
12
Повреждение губ
13
[Hilberath JN, Oakes DA, Shernan SK, et al. Safety of transesophageal
echocardiography. J Am Soc Echocardiogr 23:111–1127, 2010.]
ТАБЛИЦА 3.4 Риск осложнений при чреспищеводной
эхокардиографии
Безопасное и эффективное проведение седации
Проведение полной ЧПЭхоКГ, используя все возможные
доступы
Безопасное позиционирование зонда в пищеводе
и желудке, знание всех позиций и умение использовать
допплерографию
Корректная работа с ультразвуковой системой, включая
знание элементов управления, влияющих на качество
изображения
Умение распознавать на ЧПЭхоКГ аномалии структуры
и функций сердца, отличать артефакты и норму
от патологии
Проведение качественного и количественного анализа
эхокардиографических данных
Умение описывать эхокардиографические признаки патоло-
гии и осложнения в протоколе исследования
ЧПЭхоКГ — чреспищеводная эхокардиография.
[Quinones MA, Douglas PS, Foster E, et al. ACC/AHA clinical compe-
tence statement on echocardiography: a report of the ACC/AHA/ACP/
ASIM Task Force on clinical competence. J Am Soc Echocardiogr
16:379–402, 2003.]
ТАБЛИЦА 3.2
Необходимые технические навыки
для проведения чреспищеводной
эхокардиографии
ПОДГОТОВКА ПАЦИЕНТА И ЕГО СЕДАЦИЯ
В общепринятых стандартах по мониторингу во
время умеренной седации пациента указано на не-
обходимость участия дополнительного персонала,
включая квалифицированных медсестер и анесте-
зистов. Сбор анамнеза должен включать информа-
цию о возможных симптомах и лекарствах, которые
принимает пациент, а также основные лаборатор-
ные данные и показания к ЧПЭхоКГ. Перед проце-
дурой оценивают риск седации с учетом стандартов
учреждения. Пациентам с высоким риском наруше-
ния дыхания во время седации может понадобиться
анестезия для облегчения проведения исследования
(табл. 3 .3) [9]. Профилактика ИЭ не показана, т.к.
ЧПЭхоКГ не ассоциируется со значительным ри-
ском бактериемии [10]. Для снижения риска аспи-
рации во время обезболивания в день процедуры
рекомендуется воздержаться от приема пищи за
6 час до ЧПЭхоКГ, а при необходимости приема ле-
карств рекомендуется сделать два небольших глотка
воды [11].
Перед ЧПЭхоКГ необходимо получить письмен-
ное информированное согласие пациента и разъяс-
нить ему возможные риски и осложнения. В целом
риск при ЧПЭхоКГ низкий: в 1–2% случаев отмеча-
ется дисфагия, а более серьезные осложнения, на-
пример аритмии, травмы пищевода, ротоглоточные
кровотечения наблюдаются менее чем в 1% случаев
(табл. 3 .4) [12–17]. С пациентом должен быть со-
провождающий, т.к. управлять машиной после се-
дации запрещено.
Для введения во время процедуры лекарствен-
ных препаратов и контрастных средств обеспечива-
ют внутривенный доступ. Пациенту надевают ман-
жету для автоматического периодического (с интер-
валом 3–5 мин) измерения артериального давления.
Для мониторинга состояния пациента во время се-
дации и пробуждения непрерывно регистрируют
электрокардиограмму (ЭКГ), проводят пульсокси-
метрию, а в некоторых случаях капнографию (мо-
ниторинг уровня углекислого газа в выдыхаемой
пациентом воздушной смеси). Доступ к реанимаци-
онному оборудованию должен быть постоянным.
Для местной анестезии используют лидокаин в ви-
де спрея либо раствора для полоскания рта. Доста-
точно добиться местной анестезии задней части язы-
ка, нёба, миндалин и глотки, что уменьшит рвот-
ный рефлекс и позволит снизить дозу седативного
препарата для комфортного проведения ЧПЭхоКГ.
Для седации используют внутривенные бензодиазе-
пины, например мидазолам. Одновременное при-
менение опиоидных средств, например фентанила,
дает синергический эффект. Доза должна быть ми-
ch03.indd 47
03.04.2019 11:38:29
48
ЧАСТЬ I Передовые методы эхокардиографии
нимальной для предотвращения потери сознания
либо нестабильности гемодинамики, особенно у по-
жилых и худых пациентов. Под рукой всегда должны
быть антагонисты седативных средств, например
налоксон (для опиоидных препаратов) или флумазе-
нил (для бензодиазепиновых препаратов).
ИНТУБАЦИЯ ПИЩЕВОДА
Перед интубацией пищевода пациента нужно пред-
упредить, что он во время размещения зонда может
испытать легкий дискомфорт в пищеводе или брюш-
ной полости, также возможно появление рвотного
рефлекса (эти симптомы, как правило, временные).
Перед ЧПЭхоКГ следует удалить зубные протезы
(при наличии), а разместить загубник перед седаци-
ей, т.к. после нее это может быть сложно сделать.
Зонд с датчиком перед введением следует подклю-
чить к ультразвуковой системе и проверить, что
сигнал от датчика отображается на экране монито-
ра. Зонд следует поддерживать в разблокированном
центральном положении, иначе он становится ме-
нее гибким, что может увеличить дискомфорт у па-
циента во время процедуры.
Пациент должен находиться в положении лежа
на левом боку для снижения риска аспирации во
время ЧПЭхоКГ. После достижения эффекта седа-
ции на датчик наносят специальный гель и начина-
ют продвигать зонд через загубник. Касание датчи-
ком корня языка позволяет уменьшить рефлектор-
ный спазм гортани, и пациент приспосабливается к
этому ощущению. По возможности врачу лучше ком-
ментировать каждый свой шаг. По мере продвиже-
ния зонда пациента просят совершить акт глотания,
что позволяет направить зонд с датчиком в пище-
вод. Поддержание центрального положения зонда
снижает его боковое отклонение к грушевидной ям-
ке (рис. 3 .1). В случае необходимости врач заводит
Рис. 3 .1 Неправильное положение зонда при чреспищеводной эхокардиографии. (A, Б) Сложности при введении зонда могут возникнуть из-за попа-
дания его в одну из грушевидных ямок. (В) При чрезмерном сгибании кончика зонда с датчиком можно повредить слизистую оболочку ротоглотки [Hilberath JN,
Oakes DA, Shernan SK, et al. Safety of transesophageal echocardiography. J Am Soc Echocardiogr 23:1115–1127, 2010].
Мягкое нёбо/язычок
Твердое нёбо
Верхняя губа
Зонд
Носоглотка
Язычок
Ротоглотка
Гортаноглотка
Глотка
Пищевод
Грушевидная ямка
Загубник
Язык
Я
з
ы
к
Трахея
Гортань
Миндалины
Язык
Зонд в левой грушевидной ямке
Язычок
Ротоглотка
Глотка
Пищевод
Гортаноглотка
Трахея
Гортань
Зонд
Зубы/десны
Загубник
З
о
н
д
А
Б
В
ch03.indd 48
03.04.2019 11:38:29
49
3 Диагностическая чреспищеводная эхокардиография
свой палец за загубник и давит на основание языка
вниз, чтобы открыть задний отдел ротоглотки для
прохождения зонда. Пищевод находится позади тра-
хеи, поэтому пациент должен слегка сгибать голову,
а врач — направлять зонд с датчиком в противопо-
ложную сторону, чтобы уменьшить риск интуба-
ции трахеи. Признаки интубации трахеи: боль, рез-
кое появление стойкого кашля, трудности с продви-
жением зонда на расстояние > 20–30 см и низкое
качество изображения.
Во время ЧПЭхоКГ интубированные пациенты с
эндотрахеальной трубкой обычно лежат на спине
для защиты дыхательных путей. При наличии ро-
тогастральных или назогастральных трубок их сле-
дует удалить, т.к. через них ультразвуковой луч
проникает плохо, что снижает качество изображе-
ний (назогастральные трубки небольшого диаме-
тра, например трубки для питания Добхоффа, не
ухудшают качество изображений). Пациенту, кото-
рый не получает миорелаксанты, нужно сместить
эндотрахеальную трубку в уголок рта, чтобы разме-
стить загубник. При продвижении зонд должен ид-
ти позади эндотрахеальной трубки при одновре-
менном выдвижении нижней челюсти пациента
кпереди. В трудных ситуациях может понадобиться
ларингоскопия с прямой визуализацией заднего от-
дела ротоглотки.
ПЕРЕМЕЩЕНИЕ ЗОНДА И СТАНДАРТНЫЕ ПОЗИЦИИ
ПРИ ВИЗУАЛИЗАЦИИ
В качестве руководства к проведению стандартной
ЧПЭхоКГ в предыдущих рекомендациях American
Society of Echocardiography (ASE) и Society of Cardio-
vascular Anesthesiologists (SCA) приведено 20 интра-
операционных изображений в стандартных пози-
циях [18]. В новые рекомендации была включена
дополнительная оценка полостей и клапанов серд-
ца, теперь стандартных позиций 28 (табл. 3 .5) [19].
Врач должен иметь опыт в позиционировании дат-
чика в нужном положении и уметь оптимизировать
изображение (рис. 3 .2).
Стандартные доступы ЧПЭхоКГ: из верхнего от-
дела пищевода, из среднего отдела пищевода и транс-
гастральный. Из каждого доступа визуализируются
различные структуры сердца.
В стандартной ультразвуковой системе управля-
емые датчики позволяют манипулировать ими для
настройки и изменения плоскости изображения.
Отмечается вариабельность качества изображения
даже при оптимальной акустической доступности
после размещения зонда в пищеводе из-за различий
в телосложении пациентов и расположения пище-
вода относительно сердца. Кроме этого, положение
зонда всегда ограничено положением пищевода,
что может затруднять визуализацию.
Продвижение и оттягивание зонда позволяет пе-
реместить его кончик с датчиком в пищеводе и же-
лудке в различные позиции. Глубину размещения
датчика регулируют относительно загубника, ори-
ентируясь на сантиметровые маркеры по всей дли-
не зонда. Вращение зонда в пищеводе по часовой
стрелке приводит к повороту кончика зонда с дат-
чиком к правой стороне пациента, вращение про-
тив часовой стрелки — к левой стороне. Поскольку
между кончиком зонда с датчиком и элементами
управления нет связующих компонентов, то следу-
ет одновременно вращать зонд и нужную рукоятку
зонда, чтобы снизить риск повреждения пищевода.
Вращение зонда отличается от сгибания кончика
зонда с датчиком вправо или влево, которое осущест-
вляют с помощью малой рукоятки зонда. С помо-
щью большой рукоятки сгибают кончик зонда с
датчиком кпереди (антерофлексия) и кзади (ре-
трофлексия). Кнопки управления на рукоятке зонда
позволяют изменять угол поворота датчика от 0° до
180° (см. рис. 3 .2).
ОБРАБОТКА ДАННЫХ И ВЫВЕДЕНИЕ
ИЗОБРАЖЕНИЯ НА ЭКРАН МОНИТОРА
Согласно общим представлениям, датчик и ближ-
нее к нему поле отображаются на экране монитора
вверху. При заднем расположении зонда относи-
тельно сердца передние структуры отображаются в
дальнем поле. При вращении зонда до угла 0° в ле-
вой части изображения визуализируются правые
отделы сердца, в правой части — левые. Матричные
преобразователи позволяют получить серию трех-
мерных изображений.
Массив объемных данных позволяет выбирать и
одновременно выводить на экран монитора два изо-
бражения из разных положений датчика. Как пра-
вило, второе изображение смещено на 90° относи-
тельно первого изображения (можно регулировать
во время процедуры) (рис. 3 .3).
При диагностической ЧПЭхоКГ ориентируются
на состояние пациента и данные первичного иссле-
дования, поскольку процедуру придется прервать в
случае дискомфорта пациента, нестабильности его
гемодинамики либо нарушений дыхания во время
седации.
Цель ЧПЭхоКГ — получить исчерпывающие дан-
ные. Рекомендуется начинать исследование с пози-
ционирования датчика в нижнем и среднем отделах
пищевода, т.к. размещение зонда в верхнем отделе
пищевода не очень удобно, а введение зонда в же-
лудок может вызвать легкий дискомфорт в области
живота либо тошноту. Часто приходится использо-
вать дополнительные позиции для получения более
информативных изображений и тщательной оцен-
ки функции сердца и его анатомии.
Для оптимизации визуализации на протяжении
всего исследования следует корректировать глубину
изображения, в частности уменьшать, изучая МК, и
увеличивать при оценке левого желудочка (ЛЖ).
ch03.indd 49
03.04.2019 11:38:30
50
ЧАСТЬ I Передовые методы эхокардиографии
Длинные оси правого желудочка (ПЖ) и ЛЖ
должны быть относительно параллельны друг дру-
гу и располагаться вертикально в секторе сканиро-
вания с двумя предсердиями в ближнем поле. Дан-
ная позиция позволяет оценить нижнесептальные и
боковые сегменты ЛЖ [20]. Могут возникнуть про-
блемы с визуализацией верхушки ЛЖ из-за анато-
мических ограничений пищевода, в связи с чем ко-
нечно-диастолический объем и конечно-систоличе-
ский объем желудочка не всегда удается измерить
точно. В пятикамерной позиции из среднего отдела
пищевода {позиция 1} при сгибании кончика зонда
с датчиком кпереди визуализируются выходной
ИЗОБРАЖЕНИЯ, ПОЛУЧАЕМЫЕ
ПРИ ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
ЛЕВЫЙ И ПРАВЫЙ ЖЕЛУДОЧКИ
Визуализировать желудочки лучше всего из средне-
го отдела пищевода и из желудка (табл. 3 .6). Стан-
дартная четырехкамерная позиция из среднего от-
дела пищевода {позиция 2} обеспечивает превос-
ходную оценку систолической функции ЛЖ и его
размеров. Для этого зонд продвигают на глубину
около 30 см с поворотом датчика до 0° и сгибанием
кончика зонда с датчиком кзади и влево к верхушке
ЛЖ (рис. 3 .4А).
Позиция
Угол±≈10°
Доступ из среднего отдела пищевода
{позиция 1} пятикамерная
0°
{позиция 2} четырехкамерная
10°
{позиция 3} комиссуральная (митральный клапан)
60°
{позиция 4} двухкамерная
90°
{позиция 5} левый желудочек по длинной оси
130°
{позиция 6} аортальный клапан по длинной оси
130°
{позиция 7} правые легочные вены
10°
{позиция 8} аортальный клапан по короткой оси
40°
{позиция 9} приточный и отточный отделы правого желудочка
70°
{позиция 10} бикавальная с трикуспидальным клапаном
70°
{позиция 11} бикавальная
100°
{позиция 12} ушко левого предсердия
90°
{позиция 13} нисходящий отдел аорты по короткой оси
0°
{позиция 14} нисходящий отдел аорты по длинной оси
90°
Доступ из верхнего отдела пищевода
{позиция 15} восходящий отдел аорты по длинной оси
100°
{позиция 16} восходящий отдел аорты по короткой оси
30°
{позиция 17} легочные вены
90°
{позиция 18} дуга аорты по длинной оси
0°
{позиция 19} дуга аорты по короткой оси
90°
Трансгастральный доступ
{позиция 20} базальный отдел левого желудочка по короткой оси
0°
{позиция 21} средний отдел левого желудочка по короткой оси (папиллярные мышцы)
0°
{позиция 22} верхушка левого желудочка по короткой оси
0°
{позиция 23} базальный отдел правого желудочка
0°
{позиция 24} приточный и отточный отделы правого желудочка
0°
{позиция 25} двухкамерная
90°
{позиция 26} левый желудочек по длинной оси
120°
{позиция 27} приточный отдел правого желудочка
90°
{позиция 28} глубокий: левый желудочек по длинной оси
0°
ТАБЛИЦА 3.5 Стандартные позиции чреспищеводной эхокардиографии
ch03.indd 50
03.04.2019 11:38:30
51
3 Диагностическая чреспищеводная эхокардиография
Вращение
по часовой
стрелке
Оттягивание Продвижение
Передняя
сторона
Правая
сторона
Задняя
сторона
Сгибание
кпереди
Сгибание
кзади
Сгибание
вправо
Сгибание
влево
Левая
сторона
Поворот
вперед
Поворот
назад
Доступ из верхнего отдела пищевода
Доступ из среднего отдела пищевода
Глубокий трансгастральный доступ
90°
180°
0°
Трансгастральный доступ
Вращение
против часовой
стрелки
А
Б
Рис. 3 .2 Манипуляции зондом (A) и его позиции в пищеводе (Б). С помощью кнопки на рукоятке зонда управляют углом поворота датчика. Элементы
управления на зонде позволяют манипулировать кончиком зонда с датчиком: большая рукоятка — сгибание кпереди или кзади, малая рукоятка — сгибание впра-
во или влево [Hahn RT, Abraham T, Adams MS, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from
the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 26:921–964, 2013].
Рис. 3 .3 A Ушко левого предсердия в двух плоскостях. Одновременно
на экран монитора выведены два изображения из разных положений датчика.
Второе изображение повернуто на 90° относительно первого.
тракт левого желудочка (ВТЛЖ) и аортальный кла-
пан (АК) (см. рис. 3 .4Б). Для полной визуализации
верхушки ЛЖ и более точного вычисления объемов
ЛЖ и фракции выброса зачастую необходимо трех-
мерное изображение. Как и при ТТЭхоКГ, количе-
ственное определение размеров и функции ПЖ при
ЧПЭхоКГ затруднительно из-за сложной геометрии
желудочка.
Для получения изображения в двухкамерной по-
зиции {позиция 4} датчик позиционируют в сред-
нем отделе пищевода, получают изображение в че-
тырехкамерной позиции и поворачивают датчик на
90°. При повороте датчика примерно до 60° будет
виден МК с комиссурами — комиссуральная пози-
ция из среднего отдела пищевода {позиция 3} (см.
рис. 3 .4В). Аналогично ТТЭхоКГ при ЧПЭхоКГ в
двухкамерной позиции из среднего отдела пищево-
да {позиция 4} ПЖ не отображается, а визуализиру-
ются лишь передняя и нижняя стенки ЛЖ (см. рис.
3.4Г) [20]. При дальнейшем повороте датчика до
120° с небольшим сгибанием кончика кпереди по-
лучается позиция ЛЖ по длинной оси из среднего
отдела пищевода {позиция 5}, в которой визуализи-
руются переднесептальные и нижнебоковые сег-
менты, ВТЛЖ и АК (рис. 3 .5A) [20].
Позиции из трансгастрального доступа идеаль-
ны для оценки систолической функции обоих же-
лудочков (см. табл. 3 .6), что достигается за счет про-
движения зонда в нейтральном положении через га-
строэзофагеальный сфинктер. Затем кончик зонда
с датчиком сгибают кпереди для получения изобра-
жения ЛЖ по короткой оси. В данном случае изо-
бражение «перевернуто» относительно стандартной
позиции по короткой оси при ТТЭхоКГ: нижняя
стенка расположена в ближнем поле, а передняя —
в дальнем поле.
Положение датчика в верхнем отделе желудка
позволяет получить изображение базального отдела
ЛЖ по короткой оси из трансгастрального доступа
{позиция 20} и МК с передней створкой на экране
монитора слева (рис. 3 .6A). При незначительном
продвижении зонда в позиции среднего отдела ЛЖ
по короткой оси из трансгастрального доступа {по-
зиция 21} в дальнем поле визуализируется передне-
латеральная папиллярная мышца (см. рис. 3 .6В).
ch03.indd 51
03.04.2019 11:38:30
52
ЧАСТЬ I Передовые методы эхокардиографии
Вращение зонда по часовой стрелке смещает дат-
чик к правой стороне пациента, и визуализируется
базальный отдел ПЖ из трансгастрального доступа
{позиция 23}, а небольшое продвижение зонда по-
зволяет визуализировать приточный и отточный
отделы ПЖ из трансгастрального доступа {позиция
24}. Продвижение зонда в дистальный отдел желуд-
ка позволяет получить изображение четырех поло-
стей сердца. В позиции ЛЖ по длинной оси из глу-
бокого трансгастрального доступа {позиция 28}
верхушка ЛЖ видна в ближнем поле, а ВТЛЖ и
проксимальный участок восходящего отдела аор-
ты — в дальнем поле (см. рис. 3 .6Г) с систолическим
потоком, направленным от датчика.
Аналогично визуализации из среднего отдела
пищевода к двухкамерной позиции из трансга-
стрального доступа {позиция 25} переходят, пово-
рачивая датчик до 90°, а для визуализации ЛЖ по
длинной оси из трансгастрального доступа {пози-
ция 26} — поворачивая датчик до 120°. Вращение
зонда по часовой стрелке позволяет визуализиро-
вать приточный отдел ПЖ из трансгастрального до-
ступа {позиция 27} и оценить функцию трикуспи-
дального клапана (ТК) (см. рис. 3.6Б).
Структура
Позиция*
Угол Положение зонда
Полости сердца
Левый желудочек
{позиция 2}
10°
Сгибание кончика зонда с датчиком кзади и влево
{позиция 4}
90°
{позиция 5}
130°
{позиция 21}
0°
Сгибание кончика зонда с датчиком кпереди
{позиция 25}
90°
{позиция 28}
0°
3D-ЭхоКГ
Весь желудочек в области визуализации
Левое предсердие
{позиция 2}
10°
Уменьшение глубины
{позиция 4}
90°
{позиция 5}
130°
Ушко левого предсердия
{позиция 12}
90°
Изображение в двух плоскостях
Легочные вены
{позиция 17}
90°
Сгибание кончика зонда с датчиком вправо для визуализации
правых легочных вен
{позиция 7}
10°
Сгибание кончика зонда с датчиком влево для визуализации
левых легочных вен
Правый желудочек
{позиция 2}
10°
Сгибание кончика зонда с датчиком вправо
{позиция 9}
70°
{позиция 24}
0°
Сгибание кончика зонда с датчиком вправо
{позиция 27}
90°
Правое предсердие
{позиция 2}
10°
Уменьшение глубины
{позиция 27}
90°
Межпредсердная перегородка
{позиция 11}
100°
Сгибание кончика зонда с датчиком вправо
3D-ЭхоКГ
Уменьшение глубины
Магистральные сосуды
Восходящий отдел аорты
{позиция 6}
130°
Сгибание кончика зонда с датчиком вправо
{позиция 15}
100°
{позиция 16}
30°
Нисходящий отдел аорты
{позиция 13}
0°
{позиция 14}
90°
{позиция 18}
0°
{позиция 19}
90°
Легочный ствол
{позиция 9}
70°
Сгибание кончика зонда с датчиком вправо
{позиция 19}
90°
* Описание позиций см. табл. 3.5.
3D-ЭхоКГ — трехмерная эхокардиография.
ТАБЛИЦА 3.6 Стандартные позиции чреспищеводной эхокардиографии для визуализации полостей сердца
и магистральных сосудов
ch03.indd 52
03.04.2019 11:38:30
53
3 Диагностическая чреспищеводная эхокардиография
А
Б
Г
В
ЛЖ
А2
Комиссуры
ЛЖ
ЛЖ
ЛЖ
ПЖ
ПЖ
ПП
ЛП
АК
ВТЛЖ
УЛП
КС
Рис. 3.4 Вид левого желудочка, доступ из среднего отдела пищевода. (A) A Четырехкамерная позиция {позиция 2}. В ближнем поле видны правое
предсердие (ПП) и левое предсердие (ЛП), в дальнем поле — левый желудочек (ЛЖ) и правый желудочек (ПЖ). (Б) A Пятикамерная позиция {позиция 1}, кон-
чик зонда с датчиком согнут кпереди. Видны выходной тракт левого желудочка (ВТЛЖ) и аортальный клапан (АК). (В) A Комиссуральная позиция {позиция 3}.
Виден сегмент A2 передней створки митрального клапана с обеими комиссурами. (Г) A Двухкамерная позиция {позиция 4}. Ушко левого предсердия (УЛП) —
справа, коронарный синус (КС) — слева.
ПРЕДСЕРДИЯ И УШКО ЛЕВОГО ПРЕДСЕРДИЯ
Оба предсердия хорошо визуализируются в четы-
рехкамерной позиции из среднего отдела пищевода.
В месте примыкания пищевода к ЛП также отчетли-
во видны легочные вены, ушко ЛП и МК. Однако в
некоторых случаях для точной оценки предсердий
нужно вращать зонд против часовой стрелки в пло-
скости изображения. Ушко ЛП лучше всего визуа-
лизировать в положении датчика в среднем отделе
пищевода {позиция 12} под углом приблизительно
90° и сгибанием кпереди. Одновременная оценка
ушка ЛП в двух плоскостях (см. рис. 3 .3) позволяет
исключить тромбы у пациентов с трепетанием или
фибрилляцией предсердий и перед кардиоверсией.
В бикавальной позиции {позиция 11} можно по-
лучить изображение двух полых вен. Для этого сле-
дует расположить датчик в среднем отделе пищево-
да под углом приблизительно 100° и вращать зонд
по часовой стрелке к правой стороне тела пациента.
В данном положении межпредсердная перегородка
и ЛП находятся в ближнем поле (см. рис. 3 .5B).
Верхняя полая вена впадает в полость правого пред-
сердия (ПП) прямо под перегородкой. Данная пози-
ция позволяет получить качественное трехмерное
изображение для оценки овальной ямки (при ее де-
фекте) либо межпредсердной перегородки. Враще-
ние зонда по часовой стрелке позволяет перейти в
позицию легочных вен из верхнего отдела пищево-
да {позиция 17} и визуализировать правую верх-
нюю легочную вену, которая впадает в ЛП (рис.
3.7Б). Для визуализации ТК ниже перегородки не-
обходимо перейти в бикавальную позицию с ТК из
среднего отдела пищевода {позиция 10}, изменив
угол поворота датчика примерно до 70°.
При визуализации ушка ЛП из среднего отдела
пищевода {позиция 12} под углом 90° можно уви-
деть левую верхнюю легочную вену. Для этого зонд
оттягивают и вращают против часовой стрелки.
Оценить левую верхнюю легочную вену обычно не
сложно в позиции легочных вен из верхнего отдела
пищевода {позиция 17} (см. рис. 3 .7А), но для визу-
ализации левой нижней легочной вены необходимо
совершить с зондом дополнительные манипуля-
ции. При затруднении визуализации под углом 90°
необходимо повернуть датчик до 0°. Правые легоч-
ные вены видны в соответствующей позиции из
среднего отдела пищевода {позиция 7} при враще-
нии зонда по часовой стрелке до 0°.
ch03.indd 53
03.04.2019 11:38:30
54
ЧАСТЬ I Передовые методы эхокардиографии
А
Б
Г
В
ПБ
ПП
ВПВ
НПВ
ЛП
ЛЖ
Ао
ПЖ
ПЖ
Ао
ПСМК
ВТЛЖ
Ао
АК
Рис. 3.5 Левый желудочек по длинной оси, проксимальный участок аорты и полые вены. (A) A Доступ из среднего отдела пищевода, позиция лево-
го желудочка (ЛЖ) по длинной оси {позиция 5}. В дальнем поле видны ЛЖ, аортальный клапан (АК) и часть правого желудочка (ПЖ). (Б) A Доступ из средне-
го отдела пищевода, позиция аортального клапана по длинной оси {позиция 6}. Передняя створка митрального клапана (ПСМК) прилегает к задней части АК.
Данное изображение получается при уменьшении глубины сканирования из позиции левого желудочка по длинной оси с небольшим вращением зонда для пози-
ционирования АК ближе к центру изображения. (В) A Доступ из среднего отдела пищевода, бикавальная позиция {позиция 11}. В ближнем поле визуализиру-
ются левое предсердие (ЛП) и межпредсердная перегородка. Верхняя полая вена (ВПВ) располагается справа. К этой вене прилегает пограничная борозда (ПБ).
(Г) A Доступ из верхнего отдела пищевода, позиция восходящего отдела аорты (Ао) по длинной оси {позиция 15}. ВТЛЖ — выходной тракт левого желудочка;
НПВ — нижняя полая вена; ПП — правое предсердие.
АОРТА И АОРТАЛЬНЫЙ КЛАПАН
Визуализировать АК по короткой оси {позиция 8}
можно, позиционируя датчик в среднем отделе пи-
щевода и сгибая кончик зонда с датчиком кпереди
под углом ≈ 40° (рис. 3.8А, табл. 3 .7). Крайне важно,
чтобы визуализация была не под углом, тогда будут
видны прикрепление межпредсердной перегородки
по центру некоронарной створки и правая коронар-
ная створка, прилежащая к ПЖ. При незначитель-
ном продвижении зонда и повороте датчика до ≈ 70°
видны приточный и отточный отделы ПЖ {пози-
ция 9}, ТК — слева, клапан легочной артерии —
справа в дальнем поле (см. рис. 3 .8Б). Оттягивание
зонда назад со смещением плоскости изображения
чуть выше АК позволяет визуализировать устья ко-
ронарных артерий в синусах Вальсальвы.
Поворот датчика по длинной оси до 120° позво-
ляет визуализировать ВТЛЖ и проксимальный уча-
сток восходящего отдела аорты в позиции АК по
длинной оси из среднего отдела пищевода {пози-
ция 6} (см. рис. 3 .5Б). При визуализации АК по ко-
роткой и длинной осям необходимо использовать
ЦДК кровотока. Как правило, гемодинамическая
оценка клапана при ЧПЭхоКГ менее точна в срав-
нении с ТТЭхоКГ из-за проблем с направлением
ультразвукового луча параллельно отточному отде-
лу ЛЖ и длинной оси АК. Однако оценка анатомии
и визуализация клапана с помощью ЧПЭхоКГ очень
точна. Использование трехмерной чреспищевод-
ной эхокардиографии (3D-ЧПЭхоКГ) бывает очень
полезно при оценке кальцификации АК, степени
стеноза и максимального раскрытия створок. При
визуализации в стандартных позициях аорты кла-
пан и правая коронарная створка отражаются на
экране монитора внизу.
На ЧПЭхоКГ хорошо виден проксимальный уча-
сток восходящего отдела аорты. Лучшая визуализа-
ция восходящего отдела аорты по длинной оси до-
стигается при позиционировании датчика в сред-
нем отделе пищевода, когда отображаются ВТЛЖ и
АК (см. табл. 3 .6). При вращении зонда по часовой
стрелке и незначительном его подтягивании визуа-
ch03.indd 54
03.04.2019 11:38:31
55
3 Диагностическая чреспищеводная эхокардиография
Рис. 3 .7 Легочные вены, доступ из верхнего отдела пищевода. (A) A Позиция легочных вен {позиция 17}. Левая верхняя легочная вена (ЛВЛВ) приле-
гает к ушку левого предсердия (УЛП). Иногда эти структуры лучше визуализируются при снижении угла поворота датчика от 90° до 51°. (Б) A Позиция легоч-
ных вен {позиция 17}. Правая верхняя легочная вена (ПВЛВ) прилегает к межпредсердной перегородке (МПП).
Рис. 3 .6 Визуализация из трансгастрального доступа. (A) A Позиция базального отдела левого желудочка (ЛЖ) по короткой оси {позиция 20}. Передняя
створка митрального клапана (ПСМК) визуализируется слева, задняя створка митрального клапана (ЗСМК) — справа. (Б) A Позиция приточного отдела право-
го желудочка (ПЖ) {позиция 27}. Правый желудочек визуализируется слева, правое предсердие — справа. (В) A Позиция среднего отдела левого желудочка
по короткой оси {позиция 21}. Нижняя стенка и заднемедиальная папиллярная мышца (змПМ) визуализируются в ближнем поле, передняя стенка и переднела-
теральная папиллярная мышца (плПМ) — в дальнем. (Г) A Глубокий трансгастральный доступ, позиция левого желудочка по длинной оси {позиция 28} (визу-
ализация левого желудочка в двух плоскостях). Левый желудочек виден в ближнем поле, аортальный клапан — в дальнем. На правом изображении — левый
желудочек в ортогональной плоскости. Ао — аорта; ЛП — левое предсердие; ТК — трикуспидальный клапан.
А
Б
Г
В
плПМ
змПМ
ПЖ
ПЖ
ПСМК
ЗСМК
ЛЖ
ЛП
Ао
ТК
А
Б
УЛП
ЛВЛВ
ПВЛВ
МПП
ch03.indd 55
03.04.2019 11:38:31
56
ЧАСТЬ I Передовые методы эхокардиографии
лизируется восходящий отдел аорты по длинной
оси из верхнего отдела пищевода {позиция 15} (см.
рис. 3 .5Г), а при повороте датчика до 10° — по ко-
роткой оси из верхнего отдела пищевода {пози-
ция 16}. Данные позиции используют для исключе-
ния расслоения или аневризмы проксимального
участка восходящего отдела аорты, однако наличие
атеросклеротических бляшек либо кальцификации
может ухудшить визуализацию аорты. Диаметр
аорты следует измерять в конце диастолы в не-
скольких местах (как правило, на уровне синусов,
синотубулярного соединения и среднего участка
восходящего отдела аорты). При оттягивании зонда
ультразвуковой луч проходит через воздушную
среду в трахее, которая располагается между пище-
А
Б
ПП
МПП
НКС
ЛКС
ПКС
ПЖ
МПП
ТК
АК
КЛА
Рис. 3.8 Аортальный клапан по короткой оси и выходной тракт пра-
вого желудочка, доступ из среднего отдела пищевода. (A) A Позиция
аортального клапана (АК) по короткой оси {позиция 8}. Некоронарная створка
(НКС) разделяется надвое межпредсердной перегородкой (МПП), правая ко-
ронарная створка (ПКС) прилежит к правому желудочку (ПЖ). (Б) A Позиция
приточного и отточного отделов правого желудочка {позиция 9}. Клапан легоч-
ной артерии (КЛА) виден в дальнем поле справа. ЛКС — левая коронарная
створка; ПП — правое предсердие; ТК — трикуспидальный клапан.
водом и аортой, что затрудняет визуализацию дис-
тального участка восходящего отдела аорты. Для
оценки данного участка следует использовать МРТ
либо КТ с контрастированием.
Анатомически пищевод расположен между серд-
цем и нисходящим отделом аорты. Вращение зонда
позволяет визуализировать грудную часть нисходя-
щего отдела аорты и проксимальный участок брюш-
ной части нисходящего отдела аорты. При оценке
расслоения аорты, атеромы и подозрении на периа-
ортальную гематому используют две позиции из
среднего отдела пищевода: нисходящий отдел аор-
ты по короткой оси {позиция 13} и нисходящий от-
дел аорты по длинной оси {позиция 14} (рис. 3 .9).
При оттягивании зонда к дистальному участку дуги
аорты, точной настройке датчика и регулировке его
угла визуализируются дуга аорты по длинной оси
из верхнего отдела пищевода {позиция 18} и устье
левой подключичной артерии (на изображении
справа).
МИТРАЛЬНЫЙ КЛАПАН
Благодаря близкому расположению ЛП и пищевода
возможна детальная оценка анатомии и функции
МК. Полную оценку МК проводят в различных по-
зициях датчика (см. табл. 3 .7). МК имеет продолго-
ватую седлообразную форму с линией смыкания
передней и задней створок вдоль продольной оси
клапана, причем длина прикрепления передней
створки к фиброзному кольцу меньше, чем у задней
створки. АК лежит кпереди передней створки МК, а
ушко ЛП — сбоку от него. Каждую створку МК ус-
ловно делят на три сегмента. Латеральные сегменты
обозначают цифрой 1, центральные — цифрой 2, а
медиальные — цифрой 3. Перед цифрой ставят ли-
бо букву «А», соответствующую передней створке
(anterior), либо букву «P», соответствующую задней
створке (posterior) (рис. 3 .10) [19]. Сегменты задней
створки анатомически более различимы, т.к. разде-
лены расщелинами.
Анатомическая ориентация створок МК имеет
решающее значение при планировании хирургиче-
ской коррекции. В пятикамерной позиции из сред-
него отдела пищевода {позиция 1} (см. рис. 3 .4Б) АК
и ВТЛЖ расположены ниже МК. При визуализации
ВТЛЖ и АК в пятикамерной позиции из среднего
отдела пищевода {позиция 1} и в модифицирован-
ной трехкамерной позиции плоскость изображения
проходит через центр МК и слева будет визуализи-
роваться сегмент А2, а справа — сегмент Р2 (см. рис.
3.10).
В комиссуральной позиции из среднего отдела
пищевода {позиция 3} (см. рис. 3 .4B) видны задне-
медиальная комиссура (сегменты А3 и Р3) и перед-
нелатеральная комиссура (сегменты А1 и Р1) МК. В
позиции АК по длинной оси из среднего отдела пи-
щевода {позиция 6} МК визуализируется вместе с
ch03.indd 56
03.04.2019 11:38:32
57
3 Диагностическая чреспищеводная эхокардиография
Структура
Позиция*
Угол Положение зонда
Митральный клапан
{позиция 2}
10°
{позиция 3}
60°
{позиция 5}
130°
{позиция 20}
0°
Кончик зонда с датчиком согнут кпереди
3D-ЭхоКГ
Сгибание кончика зонда с датчиком к аортальному клапану
(увеличенное изображение на экране монитора вверху)
Аортальный клапан
{позиция 1}
0°
Кончик зонда с датчиком согнут кпереди
{позиция 6}
130°
{позиция 8}
40°
Кончик зонда с датчиком согнут кпереди
{позиция 26}
120°
3D-ЭхоКГ
Сгибание кончика зонда с датчиком к правой створке аортального
клапана (увеличенное изображение на экране монитора внизу)
Трикуспидальный клапан
{позиция 2}
10°
{позиция 9}
70°
{позиция 10}
70°
{позиция 23}
0°
{позиция 27}
90°
3D-ЭхоКГ
Увеличенное изображение
Клапан легочной артерии {позиция 9}
70°
* Описание позиций см. табл. 3 .5 .
3D-ЭхоКГ — трехмерная эхокардиография.
ТАБЛИЦА 3.7 Стандартные позиции чреспищеводной эхокардиографии для визуализации клапанов сердца
сегментами А2 и Р2 (см. рис. 3 .5Б), однако в данном
случае сегмент А2 отображается справа.
Трехмерная эхокардиография (3D-ЭхоКГ) по-
зволяет детально визуализировать анатомию ство-
рок и подклапанного аппарата МК [21]. Согласно
стандартным протоколам, МК лучше всего визуа-
лизируется со стороны предсердий, при этом АК
виден на экране монитора вверху, а нижняя створ-
ка МК — внизу. При вращении изображения меди-
альная сторона МК смещается на экране монитора
вправо. При визуализации МК с его нижней по-
верхности медиальная сторона будет располагаться
на экране монитора слева.
КЛАПАН ЛЕГОЧНОЙ АРТЕРИИ
И ТРИКУСПИДАЛЬНЫЙ КЛАПАН
ТК располагается в передней части сердца, поэтому
при ЧПЭхоКГ визуализируется в дальнем поле, что
затрудняет детальную оценку его анатомии. Визуа-
А
Б
Рис. 3 .9 A Нисходящий отдел аорты, доступ из среднего отдела пищевода. (A) Позиция нисходящего отдела аорты по короткой оси {позиция 13}.
В этой позиции сечение аорты практически круглое. (Б) Позиция нисходящего отдела аорты по длинной оси {позиция 14}.
ch03.indd 57
03.04.2019 11:38:33
58
ЧАСТЬ I Передовые методы эхокардиографии
0°
A3
A2
A1
P1
P2
P3
45°
90°
135°
УЛП
Ао
Расщелина
задней створки
Р2—А2
Трехкамерная
позиция
Р3—А3,А2,А1
Двухкамерная
позиция
Р3—А3,А2,А1 —Р1
Комиссуральная
позиция
А3,А2 —Р2,Р1
Четырехкамерная
позиция
Рис. 3.10 Анатомия митрального клапана. Условное деление митрального клапана на сегменты. Изменяя угол поворота датчика, можно получить изображе-
ние разных сегментов. Точность изображения сегментов зависит от анатомии сердца и позиции датчика. А — передняя створка; P — задняя створка; Ao — аор-
та; УЛП — ушко левого предсердия [Hahn RT, Abraham T, Adams MS, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination:
recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 26:921–964, 2013].
лизация всех трех створок клапана (передней, зад-
ней и септальной) одновременно затруднена. Для
оценки анатомии и подвижности створок ТК полез-
но использовать 3D-ЭхоКГ, особенно оценивая воз-
действие электродов кардиостимулятора на створки
клапана.
Передняя и септальная створки обычно видны в
четырехкамерной позиции из среднего отдела пи-
щевода {позиция 2} (см. рис. 3.4). Изменение угла
поворота датчика до 60° с небольшим вращением
зонда по часовой стрелке позволяет визуализиро-
вать приточный и отточный отделы ПЖ из средне-
го отдела пищевода {позиция 9} (см. рис. 3 .8). ТК
имеет относительно большую поверхность, поэто-
му при стандартном исследовании не всегда визуа-
лизируется вся линия коаптации створок. Вслед-
ствие этого для визуализации струи регургитации
необходимо проводить ЦДК кровотока в несколь-
ких плоскостях при различной ориентации зонда.
ТК хорошо визуализируется из трансгастрального
доступа в позиции приточного отдела ПЖ (угол по-
ворота датчика 90°, вращение зонда по часовой
стрелке) {позиция 27} (см. рис. 3.6). В данной пози-
ции задняя створка клапана находится в ближнем
поле.
ТК и клапан легочной артерии лежат ортого-
нально относительно восходящего отдела аорты и
АК. В позиции приточного и отточного отделов ПЖ
из среднего отдела пищевода {позиция 9} на экране
монитора видны АК по короткой оси в дальнем по-
ле и клапан легочной артерии по длинной оси спра-
ва (см. рис. 3 .8Б). Как и ТК, клапан легочной арте-
рии располагается в сердце кпереди, поэтому обыч-
но хорошо визуализируется при ТТЭхоКГ, а оценка
с помощью ЧПЭхоКГ и допплерографии затрудне-
на. Клапан легочной артерии при ЧПЭхоКГ лучше
всего визуализировать из верхнего отдела пищевода
в позиции дуги аорты по короткой оси {позиция 19}.
ch03.indd 58
03.04.2019 11:38:33
59
3 Диагностическая чреспищеводная эхокардиография
Для этого зонд размещают в верхнем отделе пище-
вода и поворачивают датчик с 0° до 90° относитель-
но длинной оси дуги аорты, чтобы визуализировать
дугу аорты по короткой оси.
ТРЕХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
Достижения в создании матричных преобразовате-
лей и компьютерной обработке позволяют созда-
вать высококачественные трехмерные изображения
[22]. На трехмерном изображении утрачивается
временно
́
е и графическое разрешение двухмерного
изображения, однако улучшается оценка простран-
ственных связей между структурами сердца (рис.
3.11). При использовании 3D-ЭхоКГ получают объ-
емные данные в режиме реального времени в тече-
ние одного сердечного цикла, однако из-за ограни-
чений в их обработке изображение обычно усечен-
ное. В связи с этим для более четких изображений,
особенно при визуализации ЛЖ, нужно получить
объемные данные в течение нескольких сердечных
циклов и объединить их. Относительным ограниче-
нием данного метода является появление артефак-
тов из-за аритмии либо движения пациента во вре-
мя исследования.
При ЧПЭхоКГ трехмерные изображения можно
получить в любой момент. Для 3D-ЭхоКГ нужно
значительное время, знания по управлению объем-
ными данными и оптимизации изображения. Учи-
тывая большой объем получаемой при 3D-ЭхоКГ
информации, рекомендуется использовать этот ме-
тод визуализации только для решения конкретных
клинических задач. В настоящее время American So-
ciety of Echocardiography рекомендует использовать
3D-ЭхоКГ для оценки объема и фракции выброса
ЛЖ (рис. 3 .12), а также степени стеноза МК после
транскатетерной пластики. Отмечается все более
широкое использование 3D-ЧПЭхоКГ, особенно при
принятии клинических решений (рис. 3 .13) [19, 23].
Оценка функции ЛЖ с помощью двухмерной
чреспищеводной эхокардиографии (2D-ЧПЭхоКГ)
ограничена из-за проблем с визуализацией верхуш-
ки ЛЖ. 3D-ЭхоКГ позволяет визуализировать весь
Рис. 3 .11 Митральный клапан после протезирования и пластики. (A) A На 2D-ЧПЭхоКГ видна несостоятельность (стрелка) протезированного митраль-
ного клапана (МК). (Б) A Качественная визуализация в 3D-режиме двух парапротезных фистул (стрелки) (тот же пациент, что на А). (В, Г) A A Интраопера-
ционную ЧПЭхоКГ в 2D-режиме (В) и 3D-режиме (Г) используют для точного позиционирования баллона во время пластики митрального клапана (другой паци-
ент). АК — аортальный клапан; ЛЖ — левый желудочек; ЛП — левое предсердие.
А
Б
Г
В
Баллон
ЛП
ЛЖ
МК
ЛП
АК
МК
ch03.indd 59
03.04.2019 11:38:34
60
ЧАСТЬ I Передовые методы эхокардиографии
Рис. 3 .12 A Оценка функции левого желудочка с помощью трехмер-
ной эхокардиографии. Конечно-диастолический объем 137 мл, конечно-си-
столический объем 103 мл, ударный объем 35 мл, фракция выброса 25%.
Электрод
ПЖ
УВК
Рис. 3 .13 A Устройство вспомогательного кровообращения для ле-
вого желудочка. Визуализация устройства вспомогательного кровообраще-
ния (УВК) в 3D-режиме позволяет оценить движение перегородки относитель-
но приточной канюли у пациента с подозрением на ее обструкцию. В правом
желудочке (ПЖ) также виден электрод кардиостимулятора.
ЛЖ, количественно определить его объем и функ-
цию с помощью автоматизированного алгоритма
определения границ эндокарда. При получении
объемных данных необходимо контролировать глу-
бину сигнала, чтобы в изображение был включен
весь желудочек. 3D-ЭхоКГ не имеет геометрических
ограничений, а основана на оценке границ эндокар-
да, что обеспечивает более достоверное определение
конечно-диастолического объема и конечно-систо-
лического объема, которые сопоставимы с общей
фракцией выброса. Количественная оценка разме-
ров и функции ПЖ в 3D-режиме сложна. В настоя-
щее время нет опубликованных протоколов ЧПЭ-
хоКГ для измерения полости ПЖ.
Для качественной оценки ПЖ при 3D-ЧПЭхоКГ
зонд вращают по часовой стрелке к правой стороне
пациента для получения изображения в четырехка-
мерной позиции из среднего отдела пищевода {пози-
ция 2} (см. рис. 3 .4А) с ПЖ в центре, что обеспечива-
ет получение необходимого объема данных [24].
Отмечена значительная роль 3D-ЭхоКГ в оценке
анатомии и функции МК. Трехмерное изображение
позволяет увидеть все поверхности его створок, что
помогает в оценке анатомии и механизма дисфунк-
ции клапана. У пациентов со стенозом МК трехмер-
ное изображение позволяет спланировать баллон-
ную вальвулопластику, включая определение места
размещения баллона и степени разъединения сра-
щенных створок по комиссурам, а также послеопе-
рационную оценку функции клапана для определе-
ния остаточной регургитации (см. рис. 3.11).
Дооперационная 3D-ЭхоКГ позволяет оценить
анатомию МК для планирования операции, а интра-
операционное исследование увеличивает эффектив-
ность вмешательства [25]. При транскатетерной пла-
стике митрального клапана методом «край в край» с
помощью системы MitraClip 3D-ЭхоКГ используют
для визуализации межпредсердной перегородки
при выборе оптимального места ее пункции и по-
зиционирования катетера при размещении клипсы
(см. главу 20) [26–29].
Высокая эффективность 3D-ЭхоКГ отмечена при
использовании ее при катетеризации сердца. Во
время закрытия дефектов межпредсердной или
межжелудочковой перегородки 3D-ЭхоКГ позволя-
ет измерить дефект, определить его положение от-
носительно других структур сердца, визуализиро-
вать обе стороны перегородки для оптимизации
размещения окклюдера во время его позициониро-
вания, а также оценить результат вмешательства
[30]. Транскатетерное протезирование АК также
выполняют под контролем 3D-ЭхоКГ для визуали-
зации ВТЛЖ (рис. 3.14). Стандартная 2D-ЧПЭхоКГ
в большинстве случаев позволяет визуализировать
ВТЛЖ по короткой оси, а на трехмерном изображе-
нии виден выходной тракт по короткой и длинной
осям в поперечном сечении. Благодаря этому воз-
можно подобрать правильный размер протеза кла-
пана и, соответственно, минимизировать риск око-
локлапанной регургитации после вмешательства
(см. главу 16) [31–33]. Транскатетерная эмболиза-
ция ушка ЛП — еще разрабатываемый метод про-
филактики эмболии сердца. 3D-ЭхоКГ используют
для оценки анатомии ушка перед процедурой и во
время нее при размещении и позиционировании
специального устройства [34].
ПРИМЕНЕНИЕ ЧРЕСПИЩЕВОДНОЙ
ЭХОКАРДИОГРАФИИ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ И ОПРЕДЕЛЕНИЕ
ИСТОЧНИКА ЭМБОЛИИ
У пациентов с нарушением мозгового кровообра-
щения ЧПЭхоКГ помогает обнаружить внутрисосу-
дистый источник эмболии, приведшей к инсульту,
ch03.indd 60
03.04.2019 11:38:35
61
3 Диагностическая чреспищеводная эхокардиография
в отсутствие внесердечного очага и выбрать такти-
ку лечения, например антикоагулянтную терапию
после диагностики тромбоза [35]. ЧПЭхоКГ также
используют для исключения тромбов у пациентов,
которым планируют проведение кардиоверсии (см.
главы 40, 41; см. табл. 3 .1) [36]. Потенциальными
внутри- и внесердечными источниками эмболов
могут быть тромбы, вегетации, опухоли и атеро-
склеротические бляшки. Кроме того, риск эмболии
повышается при наличии протезированного клапа-
на и низкой скорости кровотока, что наблюдается
при фибрилляции предсердий и застое крови в уш-
ке ЛП (рис. 3 .15). Тромб в ушке ЛП ассоциируется
с фибрилляцией предсердий и является наиболее
Рис. 3.14 Трехмерное изображение выходного тракта левого желудочка. Визуализация выходного тракта левого желудочка позволяет подобрать опти-
мальный размер протеза аортального клапана (малая ось — D1 , большая ось — D3).
Рис. 3.15 A Тромб в ушке левого предсердия. (А) В дистальной трети ушка левого предсердия (УЛП) виден тромб. Наличие перикардиальной жидкости
обеспечивает контрастную визуализацию границ ушка, что облегчает диагностику тромба. (Б) Импульсно-волновая допплерография. Скорость кровотока в ушке
снижена (максимальная скорость кровотока около 20 см/сек). На электрокардиограмме регистрируется фибрилляция предсердий.
Перикардиальная
жидкость
УЛП
А
Б
ch03.indd 61
03.04.2019 11:38:35
62
ЧАСТЬ I Передовые методы эхокардиографии
частой причиной эмболии сердца. Оценка ЛП и его
ушка при ТТЭхоКГ затруднена из-за относительно
заднего анатомического положения структуры уш-
ка. ЧПЭхоКГ обладает высокой чувствительностью
к исключению тромбоза ЛП и его ушка и других
причин эмболии сердца, а специфичность метода
> 93% [35, 36].
Анатомия ушка ЛП вариабельна по форме, глу-
бине и размерам у каждого человека, поэтому важ-
но оценивать ушко ЛП из нескольких позиций [37].
Сокращение ушка во время сердечного цикла, а так-
же наличие гребенчатых мышц и трабекуляций
препятствуют диагностике тромбов. Оценить ско-
рость кровотока и определить застой крови в ушке
помогает спектральная допплерография. При ско-
рости < 0,20 м/сек риск образования тромбов повы-
шается (см. рис. 3 .15). Спонтанное контрастирова-
ние при ЭхоКГ является признаком низкой скоро-
сти потока и часто наблюдается при тромбозе.
В некоторых случаях гребенчатые мышцы между
ушком и левой верхней легочной веной ухудшают
акустическую доступность. Если результаты неод-
нозначны, проводят пробу с пузырьковым контра-
стированием, при которой тромб (если он есть) бу-
дет определяться как дефект наполнения.
Для снижения риска инсульта пациентам с сим-
птомной фибрилляцией предсердий длительностью
> 48 час, которым необходимо провести кардиовер-
сию, рекомендуется прием варфарина по крайней
мере в течение 3 нед до процедуры (рекомендации
класса I) [36]. Для уменьшения периода приема ан-
тикоагулянтов рекомендуется провести ЧПЭхоКГ
для исключения тромба в ушке ЛП при условии, что
на момент исследования уже достигнут терапевти-
ческий уровень антикоагуляции. После кардиовер-
сии прием варфарина следует продолжать не менее
4 нед (рекомендации класса II) [36].
Новым методом предотвращения формирования
тромбов в ушке ЛП у пациентов с фибрилляцией
предсердий является транскатетерная эмболизация
ушка. Во время вмешательства используют ЧПЭхоКГ
как в 2D-режиме, так и в 3D-режиме для правиль-
ного позиционирования специального устройства и
оценки эффективности вмешательства [27, 34, 38].
Источником эмболов, которые могут стать при-
чиной инсульта, могут быть и правые отделы серд-
ца при наличии открытого овального окна. Откры-
тое овальное окно можно визуализировать с помо-
щью 2D-ЧПЭхоКГ в нескольких позициях, а также
в 3D-режиме и при ЦДК кровотока. Кроме этого,
можно провести пробу с пузырьковым контрасти-
рованием, при которой пузырьки проходят по верх-
ней полой вене в ПП, а затем в ЛП через открытое
овальное окно [39]. Во время пробы перегородку
лучше всего визуализировать из среднего отдела
пищевода в бикавальной позиции {позиция 11} (см.
рис. 3.5В). Также следует учитывать, что временное
увеличение давления в ПП, например при пробе
Вальсальвы, может увеличить длительность пробы
из-за наличия градиента давления между предсер-
диями (рис. 3.16).
Потенциальными источниками эмболов при ин-
сульте выступают атеросклеротические бляшки в
восходящем отделе аорты и ее дуге. Бляшка может
изъязвляться, кальцифицироваться либо может
сформироваться тромб. Наивысший риск представ-
ляют большие бляшки и подвижные компоненты
атеромы.
ОЦЕНКА НАТИВНЫХ И ПРОТЕЗИРОВАННЫХ КЛАПАНОВ
ЭхоКГ используют для оценки анатомии и функции
клапанов. Оценивать гемодинамику на клапанах, ее
влияние на легкие и функцию сердца лучше с по-
мощью ТТЭхоКГ из-за возможности размещения
датчика в разных позициях и доступности доппле-
рографии. Однако ЧПЭхоКГ визуализирует клапа-
ны сердца лучше благодаря высокому качеству изо-
бражения и позволяет провести планиметрию для
исключения стеноза. ЧПЭхоКГ помогает при транс-
катетерном вмешательстве: при имплантации про-
теза АК либо баллонной вальвулопластике МК.
Оценка степени регургитации — сложная задача,
для решения которой нужна интеграция многих ка-
чественных и количественных переменных [40].
ЦДК кровотока помогает оценить направление по-
токов и степень регургитации. Следует отметить,
что хотя данные допплерографии и коррелируют с
тяжестью регургитации, ее степень может быть пе-
реоценена из-за таких технических факторов, как
высокая цветопередача и низкий предел Найквиста,
либо недооценена из-за эксцентрического направ-
Рис. 3.16 A Проба с пузырьковым контрастированием. Доступ из сред-
него отдела пищевода, бикавальная позиция {позиция 11}. Раствор попадает
в левое предсердие по верхней полой вене. После пробы Вальсальвы некото-
рое количество пузырьков (справа), которые прошли через открытое овальное
окно, визуализируются в левом предсердии чуть выше межпредсердной пере-
городки.
ch03.indd 62
03.04.2019 11:38:36
63
3 Диагностическая чреспищеводная эхокардиография
ления струи регургитации (в стенку принимающей
полости). Ширина самого узкого участка струи ре-
гургитации (vena contracta), оцененная полуколиче-
ственным методом, соответствует размеру отвер-
стия клапана и коррелирует со степенью регургита-
ции. Во время спектральной допплерографии при
значительной регургитации в принимающей поло-
сти выявляют ретроградный поток (рис. 3 .17).
В случае сомнительных полуколичественных и
качественных показателей рекомендуется количе-
ственно оценить эффективную площадь отверстия
регургитации (effective regurgitant orifice area, EROA)
и объем регургитации. Расчет площади прокси-
мальной зоны струи регургитации (proximal isove-
locity surface area, PISA) основан на принципе не-
прерывности и конвергенции потока. По мере того
как поток равномерно ускоряется по направлению
к отверстию, происходит образование «полусфер».
После измерения радиуса самой четкой полусферы
с соответствующим пределом Найквиста можно
рассчитать EROA, объем и степень регургитации
(рис. 3 .18, 3.19).
Есть данные о применении 3D-ЭхоКГ для коли-
чественной оценки vena contracta, EROA и PISA, од-
нако для использования этих параметров в клини-
ческой практике необходимо провести дополнитель-
ные исследования их достоверности (см. главу 18)
[26, 41, 42].
Ретроградный
поток
Ретроградный
поток
А
Б
Рис. 3 .17 Ретроградный поток при регургитации. (А) Оценка с помощью спектральной допплерографии правой верхней легочной вены у пациента с тяже-
лой митральной регургитацией. Виден ретроградный поток во время систолы (судя по ЭКГ). (Б) У пациента с тяжелой аортальной регургитацией виден ретроград-
ный поток в грудной части нисходящего отдела аорты во время диастолы.
Рис. 3 .18 Тяжелая митральная регургитация. (А) A 3D-ЭхоКГ. Видно пролабирование центральной части сегмента Р3 митрального клапана. Струя регур-
гитации имеет эксцентрический характер и направлена кпереди. (Б) A Предел Найквиста 38,5 см/сек, радиус проксимальной зоны струи регургитации равен
1,03 см. АК — аортальный клапан; ПСМК — передняя створка митрального клапана.
ПСМК
АК
Сегмент Р3
Б
А
ch03.indd 63
03.04.2019 11:38:36
64
ЧАСТЬ I Передовые методы эхокардиографии
ТТЭхоКГ является предпочтительным методом
первичной диагностики в случае подозрения на дис-
функцию или тромбоз протезированного клапана,
поскольку процедура неинвазивна и позволяет оце-
нить функцию клапана, давление в легочной арте-
рии, размеры и функцию желудочков. При мало-
информативном изображении следует использовать
ЧПЭхоКГ (рекомендации класса I) (см. главу 24) [43,
44].
Особенно трудно при ТТЭхоКГ оценить регурги-
тацию, выявить вегетации или тромбоз протезиро-
ванного МК из-за наложения акустической тени
(рис. 3 .20). Тромбоз клапана подозревают у пациен-
тов с механическим протезом при субтерапевтиче-
ской дозе антикоагулянтов, доказанной дисфункции
клапана либо инсульте из-за эмболии. При выявле-
нии тромба следует рассмотреть проведение тром-
болитической терапии и выполнить ЧПЭхоКГ для
оценки размера тромба и степени его увеличения
[45]. Размер тромба является предиктором ослож-
нений после тромболитической терапии (размер
< 0,8 см2 ассоциируется с более низким риском ин-
сульта) [43]. После тромболизиса необходимо про-
вести повторную ЭхоКГ (ТТЭхоКГ, при необходи-
мости ЧПЭхоКГ) для оценки гемодинамики на кла-
пане и наличия остаточных тромбов [35].
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Модифицированные критерии Дьюка включают ос-
новные и второстепенные критерии при диагности-
ке ИЭ. К основным относят положительную гемо-
культуру либо наличие достоверных данных о во-
влечении в воспалительный процесс эндокарда
(появление регургитации, вегетаций, абсцесса либо
частичное прорезывание швов на протезированном
клапане) [46, 47]. При оценке пациентов с подозре-
нием на ИЭ информация, полученная с помощью
ТТЭхоКГ и ЧПЭхоКГ, является дополнительной (см.
главу 22).
ТТЭхоКГ — первичный диагностический метод
визуализации, т.к. в большинстве случаев данных
этого исследования достаточно для диагностики ИЭ.
Однако ТТЭхоКГ имеет ряд недостатков, включая
невозможность визуализации вегетаций малого раз-
мера (< 3 мм), адекватной визуализации парапро-
тезных фистул и осложнений ИЭ, например абсцес-
са, деструкции створок, больших вегетаций (> 1 см),
Рис. 3 .19 Непрерывно-волновая допплерография при тяжелой ми-
тральной регургитации. При непрерывно-волновой допплерографии опре-
деляется митральная регургитация. Оптимальной позицией для ее регистрации
является трансгастральная позиция по длинной оси (98°). Максимальная ско-
рость (Vmax) струи регургитации равна 634 см/сек, интеграл скорости кровото-
ка (VTI) 208 см. Эффективная площадь отверстия регургитации (EROA), с уче-
том данных на рис. 3 .18, равна 0,4 см2 (2πr2 × Предел Найквиста/Vmax =
2π × 1,032 × 38,5/634 = 0,4 см2), что соответствует тяжелой регургитации. Объ-
ем регургитации около 84 мл (EROA × VTI = 0 ,4 см2 × 208 см = 83 ,2 см3).
А
Б
Рис. 3 .20 Околоклапанный абсцесс. (А) A ТТЭхоКГ в парастернальной позиции по длинной оси у пациента с лейкоцитозом. Акустическая тень от механиче-
ского протеза аортального клапана мешает оценить заднюю часть фиброзного кольца. Стрелка указывает на абсцесс. (Б) A ЧПЭхоКГ, доступ из среднего отде-
ла пищевода, позиция левого желудочка по длинной оси {позиция 5}. Определяется атипичное утолщение тканей, прилежащих к протезированному клапану, с
очагом усиления эхо-сигнала в центре, что указывает на абсцесс (стрелка).
ch03.indd 64
03.04.2019 11:38:37
65
3 Диагностическая чреспищеводная эхокардиография
которые повышают риск эмболии и инсульта (рис.
3.21). Чувствительность ТТЭхоКГ относительно ИЭ
при поражении нативного клапана составляет 70–
90% и ≈ 50% при поражении протезированного кла-
пана либо образовании абсцесса. Чувствительность
ЧПЭхоКГ относительно вегетаций и абсцесса зна-
чительно выше — > 90%. В связи с этим ЧПЭхоКГ
является оптимальным методом визуализации при
комплексной оценке ИЭ [43, 47, 48].
В современных клинических рекомендациях ука-
зано, что ЧПЭхоКГ следует проводить всем пациен-
там с клиническими признаками ИЭ либо при по-
дозрении на него, когда ТТЭхоКГ неинформативна;
пациентам с протезированным клапаном или с вну-
трисердечными электродами (имплантированного
кардиовертера-дефибриллятора или кардиостиму-
лятора) и при подозрении на такие специфические
осложнения, как абсцесс и повреждение клапанов
(рекомендации класса I) [43, 48].
Ложноположительные результаты ЧПЭхоКГ при
ИЭ возможны у пациентов с кальцификацией ство-
рок и их склеротическими изменениями, при нали-
чии инородных тел (пришивное кольцо протеза кла-
пана и швы), доброкачественных поражениях, на-
пример при отростке Ламбла. Ложноотрицательные
результаты возможны в случае проведения ЧПЭхоКГ
на ранней стадии заболевания, когда еще нет ослож-
нения. При отсутствии характерных признаков ИЭ
на ЧПЭхоКГ, но высоком клиническом риске ИЭ, в
частности у пациентов с персистирующей лихорад-
кой, необходимо еще раз оценить клиническое со-
стояние больного для выявления прогрессирования
заболевания (шумы при аускультации, признаки
системной эмболии) и провести повторную ЭхоКГ
(рекомендации класса I) [43, 48]. ЧПЭхоКГ следует
проводить и пациентам, инфицированным виру-
лентными микроорганизмами, например стафило-
кокками, грибами, т.к. они ассоциируются со значи-
тельной заболеваемостью, более высокой частотой
параваскулярных абсцессов и системной эмболии, а
также с повышенной летальностью.
Поскольку материал протеза имеет высокую от-
ражающую способность, возможно появление аку-
стической тени в дальнем поле, что может затруд-
нить визуализацию дистальных структур сердца (см.
рис. 3 .20А). Кроме этого, при ИЭ протезированного
клапана отмечается тенденция к появлению очагов
инфекции в виде абсцессов, а не вегетаций, которые
чаще наблюдаются на нативном клапане.
При диагностике ИЭ ЧПЭхоКГ имеет более вы-
сокую чувствительность, чем ТТЭхоКГ. В проспек-
тивном исследовании 114 пациентов с подозрением
на ИЭ всем выполняли ТТЭхоКГ и ЧПЭхоКГ. При
ЧПЭхоКГ ИЭ диагностировали у 11% пациентов с
нативным клапаном и у 34% — с протезированным
клапаном (положительная прогностическая значи-
мость 90%) [49]. Учитывая сложность диагностики
ИЭ протезированного клапана с помощью ТТЭхоКГ,
рекомендуется проводить ЧПЭхоКГ всем пациен-
там с протезированным клапаном и с подозрением
на ИЭ (рекомендации класса I), а также пациентам
с устойчивой лихорадкой даже в отсутствие бакте-
риемии (рекомендации класса IIа) [43, 48].
ОСТРЫЙ АОРТАЛЬНЫЙ СИНДРОМ
ЧПЭхоКГ позволяет получить изображения с высо-
ким разрешением восходящего и нисходящего от-
делов аорты и дуги аорты. Зачастую плохо видна
лишь небольшая часть дистального участка восхо-
дящего отдела аорты из-за прохождения ультразву-
ковых лучей через трахею, расположенную между
пищеводом и аортой. ЧПЭхоКГ обладает высокой
чувствительностью и специфичностью при диагно-
стике острого аортального синдрома, оценке регур-
гитации, повреждений коронарных артерий, дис-
функции ЛЖ и выявлении перикардиальной жид-
кости.
При остром расслоении аорты причиной аор-
тальной регургитации может быть нарушение ко-
аптации створок из-за дилатации аорты, пролапс
створок из-за распространения расслоения на фоне
существующей патологии, например двухстворча-
того АК [50].
У пациентов с подозрением на острое расслоение
восходящего отдела аорты (тип А) ЧПЭхоКГ высту-
пает методом первого выбора, поскольку позволяет
оценить степень расслоения аорты, наличие ослож-
нений и склонность к прогрессированию, а визуа-
лизация с помощью ТТЭхоКГ ограничена (рис. 3 .22)
(см. главу 34) [1, 51, 52]. При выявлении во время
ЧПЭхоКГ острого расслоения аорты следует исклю-
чить артефакты, которые могут имитировать отсло-
енный лоскут [51, 53].
Рис. 3.21 A Инфекционный эндокардит. Доступ из среднего отдела пи-
щевода, позиция левого желудочка по длинной оси {позиция 5}. Видны боль-
шие вегетации на задней створке митрального клапана и большой очаг эхо-
усиления в области вегетаций (абсцесс).
ch03.indd 65
03.04.2019 11:38:38
66
ЧАСТЬ I Передовые методы эхокардиографии
При остром расслоении аорты также используют
КТ или МРТ, которая обеспечивает послойную ви-
зуализацию всей аорты. КТ или МРТ зачастую вы-
полняют перед ЧПЭхоКГ либо совместно с ней. Од-
нако по сравнению с томографией ЧПЭхоКГ имеет
ряд преимуществ: ее можно провести у постели не-
транспортабельного больного с нестабильной гемо-
динамикой; не нужно вводить йодированное кон-
трастное средство; отсутствует воздействие ионизи-
рующего излучения [51]. При выявлении с помощью
ЧПЭхоКГ отслоенного лоскута следует оценить всю
площадь в нескольких позициях. В определении на-
чала и окончания участка расслоения, а также в
определении ложного и истинного просветов помо-
гает ЦДК кровотока (рис. 3 .23). При транскатетер-
ной или хирургической коррекции расслоения аор-
ты ЧПЭхоКГ помогает оценить качество выполнен-
ного вмешательства (например, позиционирование
стента) и описать осложнения (при их наличии).
Интрамуральная гематома (участок расслоения аор-
ты из-за кровоизлияния в медию) на ЭхоКГ опреде-
ляется в виде локализированного серповидного
участка повышенной эхогенности вдоль края стен-
ки аорты. Размеры этой гематомы могут увеличи-
ваться вплоть до расслоения либо разрыва. В насто-
ящее время при расслоении аорты 3D-ЭхоКГ еще не
используют, но этот режим, вероятно, улучшит ка-
чество изображения и клиническую диагностику
[54].
Травматический разрыв аорты (чаще всего в об-
ласти ее перешейка) в большинстве случаев закан-
чивается фатально. ЧПЭхоКГ помогает быстрой ди-
агностике разрыва аорты у выживших после этого
пациентов [51, 52, 55]. На ЭхоКГ видны расслоение
стенки аорты (чаще всего в проксимальном участке
нисходящего отдела аорты в области устья левой
подключичной артерии) и отслойка интимы в про-
свете аорты. Рядом с разрывом стенки аорты визу-
ализируется периаортальная гематома (псевдоанев-
ризма), а в просвете дистального участка аорты от-
сутствует ламинарный поток.
ВЗРОСЛЫЕ ПАЦИЕНТЫ С ВРОЖДЕННЫМ
ПОРОКОМ СЕРДЦА
У пациентов с врожденным пороком сердца (ВПС)
ЧПЭхоКГ помогает оценить анатомические струк-
туры и гемодинамику при хирургическом вмеша-
тельстве, а также определить источник эмболии и
эндокардит, что крайне затруднительно при ТТЭхоКГ
[1, 56, 57]. ЧПЭхоКГ не является методом первого
выбора, сначала врач должен провести ТТЭхоКГ и
сравнить ее результаты с предыдущими диагности-
ческими заключениями. Для анализа сложной ана-
томии сердца рекомендуется провести МРТ сердца.
У пациентов с высоким риском (например, с ци-
анотическим ВПС без лечения, тяжелой легочной
гипертензией, зависимостью от кислорода, дисфунк-
цией желудочков) рекомендуется провести ЧПЭхоКГ
с анестезиологическим пособием для поддержания
гемодинамики и проходимости дыхательных путей.
Наиболее частым показанием к ЧПЭхоКГ при
ВПС является оценка внутрисердечных шунтов,
особенно при наличии дефекта межпредсердной пе-
регородки (рис. 3 .24А), т.к. ТТЭхоКГ не обеспечива-
ет достаточную визуализацию из-за анатомическо-
го расположения предсердий. 3D-ЭхоКГ (см. рис.
3.24Б) позволяет определить размер и анатомию де-
фекта межпредсердной перегородки, а также оце-
нить возможности закрытия дефекта транскате-
терным либо открытым способом [24]. Другие вну-
трисердечные шунты, например дефект венозного
синуса, аномальный дренаж легочных вен, также хо-
рошо визуализируются с помощью ЧПЭхоКГ [58].
А
Б
Рис. 3 .22 Расслоение грудной части нисходящего отдела аорты. (А) A
Доступ из среднего отдела пищевода, позиция нисходящего отдела аорты по
короткой оси {позиция 13}. Видно расслоение аорты слева. (Б) A Доступ из
среднего отдела пищевода, позиция нисходящего отдела аорты по длинной
оси {позиция 14}. Изображение расслоения аорты в ортогональной плоскости.
При ЦДК кровотока визуализируется сообщение между истинным и ложным
просветами.
ch03.indd 66
03.04.2019 11:38:38
67
3 Диагностическая чреспищеводная эхокардиография
и парадоксальное систолическое движение перед-
ней створки МК. В настоящее время ЧПЭхоКГ во
время и после операции проводят анестезиологи
[60, 61]. В отделении интенсивной терапии ЭхоКГ
используют для оценки количественных параме-
тров функции желудочков, клапанов и диастоличе-
ской функции (с помощью допплерографии). Край-
не важно провести точные измерения, поскольку
врач принимает решение о дальнейшем лечении на
их основании [18, 62].
ЧПЭхоКГ в отделении реанимации и интенсив-
ной терапии следует проводить только при отсут-
ствии возможности неинвазивной визуализации
[1]. ЧПЭхоКГ полезна при обследовании пациентов
с необъяснимой гипотензией [63], неясным внутри-
Расслоение
Ао
ПЖ
А
Б
Рис. 3.23 Расслоение восходящего отдела аорты. ТТЭхоКГ в парастернальной позиции по длинной оси пациента с внезапно возникшей болью в области
сердца и спины. (А) Плохая визуализация среднего и дистального участков восходящего отдела аорты. (Б) A При ЧПЭхоКГ визуализируются расслоение аорты
и ложный просвет спереди и сзади истинного просвета дистальнее синотубулярного соединения. ПЖ — правый желудочек.
ИСПОЛЬЗОВАНИЕ ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
ВО ВРЕМЯ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА
И В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
Интраоперационная ЧПЭхоКГ необходима, чтобы
предупредить нежелательное нарушение гемодина-
мики у пациентов с тяжелой болезнью сердца, на-
пример хронической сердечной недостаточностью
(см. главу 4) [59]. В дополнение к стандартному ди-
агностическому протоколу ЧПЭхоКГ позволяет во
время операции контролировать функцию желу-
дочков, гемодинамику, застой крови, эмболию ле-
гочной артерии и ишемию миокарда. Есть сообще-
ния, что при трансплантации интраоперационная
ЧПЭхоКГ позволяет диагностировать острую дис-
функцию ПЖ, наличие тромбов в полостях сердца
ДМПП
ДМПП
А
Б
Рис. 3 .24 Дефект межпредсердной перегородки. (А) A 2D-ЧПЭхоКГ. Визуализируется дефект межпредсердной перегородки (ДМПП). (Б) A 3D-ЭхоКГ
того же пациента. Отлично визуализируется место локализации дефекта относительно других структур сердца.
ch03.indd 67
03.04.2019 11:38:38
68
ЧАСТЬ I Передовые методы эхокардиографии
сосудистым объемом крови, осложнением после ин-
фаркта миокарда, например разрывом папилляр-
ных мышц и дефектом межжелудочковой перего-
родки [62]. У пациентов с необъяснимой гипоксе-
мией ЧПЭхоКГ позволяет выявить открытое оваль-
ное окно с парадоксальным сбросом крови справа
налево.
ПОСЛЕДОВАТЕЛЬНОСТЬ ОЦЕНКИ СТРУКТУР
СЕРДЦА С ПОМОЩЬЮ ЧРЕСПИЩЕВОДНОЙ
ЭХОКАРДИОГРАФИИ
Последовательное отображение структур во время
ЧПЭхоКГ обеспечивает всестороннюю оценку ана-
томии сердца и его функции. В первую очередь сле-
дует оценивать ту структуру, из-за которой было
назначено исследование. Протоколы проведения
ЧПЭхоКГ у каждой клиники свои, но ключевые мо-
менты во всех протоколах одинаковы. Исследова-
ние начинают из среднего отдела пищевода. Снача-
ла оценивают желудочки, включая трехмерную ре-
конструкцию ЛЖ, затем предсердия и ушко ЛП.
После этого детально изучают в различных позици-
ях клапаны сердца с визуализацией в 3D-режиме их
анатомии и функции. При выявлении стеноза и ре-
гургитации необходимо их количественно оценить.
В бикавальной позиции можно изучить межпред-
сердную перегородку и легочные вены. После этого
зонд продвигают в желудок для дальнейшего иссле-
дования. В конце исследования визуализируют нис-
ходящий отдел аорты. Если при ЧПЭхоКГ выявле-
ны какие-либо пороки, их необходимо оценить в
нескольких позициях. ЧПЭхоКГ — полуинвазивная
процедура, которая имеет лучшую акустическую
доступность по сравнению с ТТЭхоКГ. Нередко
ЧПЭхоКГ проводят, когда ТТЭхоКГ неинформа-
тивна. Лучшее качество изображений, наличие
3D-режима и мобильность ультразвуковых систем
увеличивают доступность ЧПЭхоКГ в клинике.
Структура
Комментарии
Доступ из среднего отдела пищевода
Левый желудочек
Настройка глубины для оценки размера и функции ЛЖ. Угол 0–130°. 3D-режим для измере-
ния объема ЛЖ и ФВЛЖ
Правый желудочек
Для оценки размера и функции ПЖ зонд продвигают глубже. Угол 0–70°
Левое предсердие
Для оценки митрального клапана глубину уменьшают. Угол 0–90°. Кончик зонда с датчиком
сгибают в сторону предсердия
Ушко левого предсердия
Изображение в двух плоскостях. Необходимо найти положение для уменьшения артефактов
от края гребня между левой верхней легочной веной и ушком ЛП. Импульсно-волновая
допплерография для оценки скорости потока при фибрилляции предсердий
Правое предсердие
Уменьшение глубины ниже митрального клапана. Угол 0–90°. Зонд с датчиком сгибают в
сторону предсердия
Митральный клапан
Визуализация в 2D-режиме и цветовая допплерография в разных позициях. Угол 0–130°.
Количественная оценка регургитации, vena contracta, EROA, PISA (при регургитации выше
умеренной). Количественная оценка градиента давления в приточном отделе при стенозе
митрального клапана. 3D-ЭхоКГ митрального клапана со сгибанием кончика зонда с дат-
чиком к аортальному клапану
Аортальный клапан
Визуализация в 2D-режиме и цветовая допплерография. Угол 0–130°. Измерение ширины
vena contracta при регургитации выше умеренной. 3D-ЭхоКГ аортального клапана со сгиба-
нием кончика зонда с датчиком к правой коронарной створке
Трикуспидальный клапан
Визуализация в 2D-режиме и цветовая допплерография в разных позициях. Угол 0–70°
Клапан легочной артерии
Визуализация в 2D-режиме и цветовая допплерография. Угол 40–70°
Полость перикарда
Сгибание кончика зонда с датчиком вокруг сердца. Угол 0°
Межпредсердная перегородка
и полые вены
Визуализация в 2D-режиме и цветовая допплерография с низким пределом Найквиста.
Угол 100°. 3D-ЭхоКГ и проба с пузырьковым контрастированием при наличии внутрисер-
дечного шунта
Нисходящий отдел аорты
Две позиции, угол 0–90°. Импульсно-волновая допплерография при наличии аортальной
регургитации для поиска ретроградного потока. Визуализация атеросклеротических
бляшек
СВОДНАЯ ИНФОРМАЦИЯ
Полная чреспищеводная эхокардиография и последовательность ее проведения
ch03.indd 68
03.04.2019 11:38:39
69
3 Диагностическая чреспищеводная эхокардиография
ЛИТЕРАТУРА
1. Douglas PS, Garcia M, Haines DE, et al. AC-
CF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SC-
CM/ SCCT/SCMR 2011 appropriate use cri-
teria for echocardiography, J Am Soc Echocar-
diogr 24:229–267, 2011.
2. Ryan T, Berlacher K, Lindner JR, et al. CO-
CATS 4 task force 5: training in echocardiog-
raphy, J Am Coll Cardiol 65:1786–1799, 2015.
3. Cahalan MK, Stewart W, Pearlman A, et al.
American Society of Echocardiography and
Society of Cardiovascular Anesthesiologists
task force guidelines for training in perioper-
ative echocardiography, J Am Soc Echocar-
diogr 15:647–652, 2002.
4. Mathew JP, Glas K, Troianos CA, et al. ASE/
SCA recommendations and guidelines for
continuous quality improvement in perioper-
ative echocardiography, J Am Soc Echocar-
diogr 19:1303–1313, 2006.
5. Reeves ST, Finley A, Skubas NJ, et al. Basic
perioperative transesophageal echocardiogra-
phy examination: a consensus statement of the
American Society of Echocardiography and
the Society of Cardiovascular Anesthesiolo-
gists, J Am Soc Echocardiogr 26:443–456, 2013.
6. The National Board of Echocardiography.
http://www.echoboards.org. Accessed April
11, 2016.
7. Quinones MA, Douglas P, Foster E, et al.
ACC/AHA clinical competence statement on
echocardiography: a report of the ACC/AHA/
ACP/ASIM Task Force on clinical compe-
tence, J Am Soc Echocardiogr 16:379–402,
2003.
8. Picard MH, Adams D, Bierig SM, et al. Amer-
ican Society of Echocardiography recom-
mendations for quality echocardiography
laboratory operations, J Am Soc Echocardiogr
24:1–10, 2011.
9. Gross JB, Bailey P, Connis RT, et al. Practice
guidelines for sedation and analgesia by the-
siologists, Anesthesiology 96:1004–1017, 2002.
10. Wilson W, Taubert K, Gewitz M, et al. Pre-
vention of infective endocarditis: guidelines
from the American Heart Association: a guide-
line from the American Heart Association
Rheumatic Fever, Endocarditis, and Kawasaki
Disease Committee, Council on Cardiovascu-
lar Disease in the Young, and the Council on
Clinical Cardiology, Council on Cardiovascu-
lar Surgery and Anesthesia, and the Quality
of Care and Outcomes Research Interdisci-
plinary Working Group, Circulation 116:
1736–1842, 2007.
11. Apfelbaum JL, Caplan R, Connis RT, et al.
Practice guidelines for preoperative fasting
and the use of pharmacologic agents to reduce
the risk of pulmonary aspiration: application
to healthy patients undergoing elective proce-
dures. American Society of Anesthesiologists
Committee on Standards and Practice Param-
eters, Anesthesiology 114:495–511, 2011.
12. Chan KL, Cohen G, Sochowski RA, Baird
MG: Complications of transesophageal echo-
cardiography in ambulatory adult patients:
analysis of 1500 consecutive examinations,
J Am Soc Echocardiogr 4:577–582, 1991.
13. Daniel WG, Erbel R, Kasper W, et al. Safety
of transesophageal echocardiography. A mul-
ticenter survey of 10,419 examinations, Cir-
culation 83:817–821, 1991.
14. Hilberath JN, Oakes D, Shernan SK, et al.
Safety of transesophageal echocardiography,
J Am Soc Echocardiogr 23:1115–1127, 2010.
15. Kallmeyer IJ, Collard C, Fox JA, et al. The safe-
ty of intraoperative transesophageal echocar-
diography: a case series of 7200 cardiac surgi-
cal patients, Anesth Analg 92:1126–1130, 2001.
16. Min JK, Spencer K, Furling KT, et al. Clinical
features of complications from transesopha-
geal echocardiography: a single-center case
series of 10,000 consecutive examinations,
J Am Soc Echocardiogr 18:925–929, 2005.
17. Piercy M, McNichol L, Dinh DT, et al. Major
complications related to the use of transesoph-
ageal echocardiography in cardiac surgery,
J Cardiothorac Vasc Anesth 23:62–65, 2009.
18. Shanewise JS, Cheung A, Aronson S, et al.
ASE/SCA guidelines for performing a com-
prehensive intraoperative multiplane transe-
sophageal echocardiography examination:
recommendations of the American Society
for Echocardiography Council for Intraoper-
ative Echocardioraphy and the Society of
Cardiovascular Anesthesiologists Task Force
for Certification in Perioperative Transe-
sophageal Echocardiography, J Am Soc Echo-
cardiogr 12:884–900, 1999.
19. Hahn RT, Abraham T, Adams MS, et al.
Guidelines for performing a comprehensive
transesophageal echocardiographic examina-
tion: recommendations from the American
Society of Echocardiography and the Society
of Cardiovascular Anesthesiologists, J Am Soc
Echocardiogr 26:921–964, 2013.
20. Lang RM, Badano L, Mor-AviV, et al. Recom-
mendations for cardiac chamber quantifica-
tion by echocardiography in adults: an update
from the ASE and EACI, J Am Soc Echocar-
diogr 28:1–39, 2015.
21. Chandra S, Salgo I, Sugeng L, et al. Character-
ization of degenerative mitral valve disease
using morphologic analysis of real-time
three-dimensional echocardiographic images:
objective insight into complexity and plan-
ning of mitral valve repair, Circ Cardiovasc
Imaging 4:24–32, 2011.
22. Sugeng L, Weinert L, Thiele K, Lang RM: Re-
al-time three-dimensional echocardiography
using a novel matrix array transducer, Echo-
cardiography 20:623–635, 2003.
23. Zamorano JL, Badano L, Bruce C, et al. EAE/
ASE recommendations for the use of echo-
cardiography in new transcatheter interven-
tions for valvular heart disease, J Am Soc
Echocardiogr 24:937–965, 2011.
24. Lang RM, Badano L, Tsang W, et al. EAE/ASE
recommendations for image acquisition and
display using three-dimensional echocardiog-
raphy, J Am Soc Echocardiogr 25:3–46, 2012.
25. Wei J, Hsiung M, Tsai SK, et al. The routine use
of live three-dimensional transesophageal
echocardiography in mitral valve surgery: clin-
ical experience, Eur J Echocardiogr 11:14–21,
2010.
26. Lang RM, Adams D: 3D echocardiographic
quantification in functional mitral regurgita-
tion, JACC Cardiovasc Imaging 5:346–347,
2012.
27. Ho SY, McCarthy K, Faletra FF: Anatomy of
the left atrium for interventional echocardiog-
raphy, Eur J Echocardiogr 12:i11–15, 2011.
Структура
Комментарии
Доступ из верхнего отдела пищевода
Восходящий отдел аорты
Угол 30–100°. Измерение синусов, синотубулярного соединения, восходящего отдела аорты
при дилатации аорты
Легочные вены
Визуализация в 2D-режиме и цветовая допплерография. Угол 0–100° для правых и левых
легочных вен. Импульсно-волновая допплерография при тяжелой митральной регургита-
ции для оценки ретроградного потока
Трансгастральный доступ
Желудочки
Оценка размеров и функции желудочков. Угол 0–120°. Кончик зонда с датчиком поворачи-
вают вправо для визуализации ПЖ и трикуспидального клапана. Цветовая допплерогра-
фия при наличии митральной регургитации
Выходной тракт ЛЖ
Глубокая позиция: зонд продвигают вглубь. Цветовая допплерография при необходимости
EROA — эффективная площадь отверстия регургитации; PISA — площадь проксимальная зоны струи регургитации; ЛЖ — левый желу-
дочек; ЛП — левое предсердие; ПЖ — правый желудочек; ФВЛЖ — фракция выброса левого желудочка.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Полная чреспищеводная эхокардиография и последовательность ее проведения
ch03.indd 69
03.04.2019 11:38:39
70
ЧАСТЬ I Передовые методы эхокардиографии
28. McCarthy KP, Ring L, Rana BS: Anatomy of
the mitral valve: understanding the mitral
valve complex in mitral regurgitation, Eur J
Echocardiogr 11:i3–9, 2010.
29. Omran AS, Woo A, David TE, et al. Intraop-
erative transesophageal echocardiography ac-
curately predicts mitral valve anatomy and
suitability for repair, J Am Soc Echocardiogr
15:950–957, 2002.
30. Mullen MJ, Dias B, Walker F, et al. Intracar-
diac echocardiography guided device closure
of atrial septal defects, J Am Coll Cardiol
41:285–292, 2003.
31. Kasel AM, Cassese S, Bleiziffer S, et al. Stan-
dardized imaging for aortic annular sizing:
implications for transcatheter valve selection,
JACC Cardiovasc Imaging 6:249–262, 2013.
32. Bloomfield GS, Gilliam L, Hahn RT, et al. A
practical guide to multimodality imaging of
transcatheter aortic valve replacement, JACC
Cardiovasc Imaging 5:441–455, 2012.
33. Gripari P, Ewe SH, Fusini L, et al. Intraopera-
tive 2D and 3D transoesophageal echocardio-
graphic predictors of aortic regurgitation af-
ter transcatheter aortic valve implantation,
Heart 98:1229–1236, 2012.
34. Wunderlich NC, Beigel R, Swaans MJ, et al.
Percutaneous interventions for left atrial ap-
pendage exclusion. options, assessment, and
imaging using 2D and 3D echocardiography,
J Am Coll Cardiol Img 8:472–488, 2015.
35. Saric M, Armour A, Arnaout MS, et al. Guide-
lines for the use of echocardiography in the
evaluation of a cardiac source of embolism,
J Am Soc Echocardiogr 29:1–42, 2016.
36. January CT, Wann L, Alpert JS, et al. AHA/
ACC/HRS guideline for the management of
patients with atrial fibrillation: executive
summary. A report of the American College
of Cardiology/American Heart Association
Task Force on Practice Guidelines and the
Heart Rhythm Society, J Am Coll Cardiol
64:2246–2280, 2014.
37. Donal E, Yamada H, Leclercq C, Herpin D:
The left atrial appendage, a small, blind-end-
ed structure: a review of its echocardiograph-
ic evaluation and its clinical role, Chest
128:1853–1862, 2005.
38. Qamruddin S, Shinbane J, Shriki J, Naqvi TZ:
Left atrial appendage: structure, function,
imaging modalities and therapeutic options,
Expert Rev Cardiovasc Ther 8:65–75, 2010.
39. Marriott K, Manins V, Forshaw A, et al. De-
tection of right-to-left atrial communication
using agitated saline contrast imaging: experi-
ence with 1162 patients and recommenda-
tions for echocardiography, J Am Soc Echo-
cardiogr 26:96–102, 2013.
40. Quinones MA, Otto C, Stoddard M, et al.
Recommendations for quantification of
Doppler echocardiography: a report from the
Doppler Quantification Task Force of the
Nomenclature and Standards Committee of
the American Society of Echocardiography,
J Am Soc Echocardiogr 15:167–184, 2002.
41. Maragiannis D, Little SH: Quantification of
mitral valve regurgitation: new solutions pro-
vided by 3D echocardiography, Curr Cardiol
Rep 15:384, 2013.
42. Thavendiranathan P, Liu S, Datta S, et al.
Quantification of chronic functional mitral
regurgitation by automated 3-D peak and in-
tegrated proximal isovelocity surface area and
stroke volume techniques using real-time 3-D
volume color Doppler echocardiography:
in vitro and clinical validation, Circ Cardio-
vasc Imaging 6:125–133, 2013.
43. Nishimura RA, Otto C, Bonow RO, et al.
AHA/ACC guideline for the management of
patients with valvular heart disease. A report
of the American College of Cardiology/
American Heart Association Task Force on
Practice Guidelines, J Am Coll Cardiol 63:e57–
185, 2014.
44. Zoghbi WA, Chambers J, Dumesnil JG, et al.
Recommendations for evaluation of pros-
thetic valves with echocardiography and
Doppler ultrasound: a report from the Amer-
ican Society of Echocardiography’s Guide-
lines and Standards Committee and the Task
Force on Prosthetic Valves, J Am Soc Echocar-
diogr 22:975–1014, 2009.
45. Barbetseas J, Nagueh S, Pitsavos C, et al. Dif-
ferentiating thrombus from pannus forma-
tion in obstructed mechanical prosthetic
valves: an evaluation of clinical, transthoracic
and transesophageal echocardiographic pa-
rameters, J Am Coll Cardiol 32:1410–1417,
1998.
46. Li JS, Sexton D, Mick N, et al. Proposed mod-
ifications to the Duke criteria for the diagno-
sis of infective endocarditis, Clin Infect Dis
30:633, 2000.
47. Baddour LM, Wilson W, Bayer AS, et al. Infec-
tive endocarditis in adults: diagnosis, antimi-
crobial therapy, and management of compli-
cations: a scientific statement for healthcare
professionals from the American Heart Asso-
ciation, Circulation 132:1435–1486, 2015.
48. Habib G, Lancellotti P, Antunes MJ, et al.
2015 ESC Guidelines for the management of
infective endocarditis: the Task Force for the
Management of Infective Endocarditis of the
European Society of Cardiology (ESC). En-
dorsed by: European Association for Cardio-
Thoracic Surgery (EACTS), the European As-
sociation of Nuclear Medicine (EANM), Eur
Heart J 36:3075–3128, 2015.
49. Roe MT, Abramson M, Li J, et al. Clinical in-
formation determines the impact of trans-
esophageal echocardiography on the diagno-
sis of infective endocarditis by the Duke cri-
teria, Am Heart J 139:945, 2000.
50. Movsowitz HD, Levine R, Hilgenberg AD, Is-
selbacher EM: Transesophageal echocardio-
graphic description of the mechanisms of
aortic regurgitation in acute type A aortic dis-
section: implications for aortic valve repair,
J Am Coll Cardiol 36:884–890, 2000.
51. Goldstein SA, Evangelista A, Abbara S, et al.
Multimodality imaging of diseases of the tho-
racic aorta in adults: from the American So-
ciety of Echocardiography and the European
Association of Cardiovascular Imaging: en-
dorsed by the Society of Cardiovascular
Computed Tomography and Society for Car-
diovascular Magnetic Resonance, J Am Soc
Echocardiogr 28:119, 2015.
52. Hiratzka LF, Bakris G, Beckman JA, et al. AC-
CF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/
STS/SVM guidelines for the diagnosis and
management of patients with thoracic aortic
disease, J Am Coll Cardiol 55:e27–129, 2010.
53. Vignon P, Spencer K, Rambaud G, et al. Dif-
ferential transesophageal echocardiographic
diagnosis between linear artifacts and intralu-
minal flap of aortic dissection or disruption,
Chest 119:1778–1790, 2001.
54. Evangelista AA, Aguilar R, Cuella H, et al.
Usefulness of real-time three-dimensional
transoesophageal echocardiography in the as-
sessment of chronic aortic dissection, Eur J
Echocardiogr 12:272–277, 2011.
55. Cinnella G, Dambrosio M, Brienza N, et al.
Transesophageal echocardiography for diag-
nosis of traumatic aortic injury: an appraisal
of the evidence, J Trauma 57:1246–1255,
2004.
56. Ayres NA, Miller-Hance W, Fyfe DA, et al.
Indications and guidelines for performance
of transesophageal echocardiography in the
patient with pediatric acquired or congenital
heart disease, J Am Soc Echocardiogr 18:91–98,
2005.
57. Miller-Hance WC, Silverman N: Transesoph-
ageal echocardiography (TEE) in congenital
heart disease with focus on the adult, Cardiol
Clin 18:861–892, 2000.
58. Baker GH, Shirali G, Ringewald JM, et al.
Usefulness of live three-dimensional trans-
esophageal echocardiography in a congenital
heart disease center, Am J Cardiol 103:1025–
1028, 2009.
59. Porter TR, Shillcutt S, Adams MS, et al.
Guidelines for the use of echocardiography as
a monitor for therapeutic intervention in
adults: a report from the American Society of
Echocardiography, J Am Soc Echocardiogr 28:
40–56, 2015.
60. Wax DB, Torres A, Scher C, Leibowitz AB:
Transesophageal echocardiography utiliza-
tion in high-volume liver transplant centers in
the United States, J Cardiothor Vasc Anesth 22:
811–813, 2008.
61. Sullivan B, Puskas F, Fernandez-Bustamante
A: Transesophageal echocardiography in noi-
ac thoracic surgery, Anesthesiology Clin 30:
657–659, 2012.
62. Thys DM, Abel M, Brooker RF, et al. Practice
guidelines for perioperative transesophageal
echocardiography: an updated report by the
American Society of Anesthesiologists and
the Society of Cardiovascular Anesthesio-
logists task force on transesophageal echo-
cardiography, Anesthesiology 112:1084–1096,
2010.
63. Heidenreich PA, Stainback R, Redberg RF, et
al. Transesophageal echocardiography pre-
dicts mortality in critically ill patients with
unexplained hypotension, J Am Coll Cardiol
26:152–158, 1995.
ch03.indd 70
03.04.2019 11:38:39
71
4 Интраоперационная
эхокардиография
MICHAEL T. HALL, MD • DONALD C. OXORN, MD
Интраоперационная оценка
функции желудочков
Диастолическая функция
левого желудочка
Конечно-диастолический объем
и конечно-систолический объем
левого желудочка
Глобальная систолическая функция
Локальная сократимость миокарда
Интраоперационная оценка функции
сердца в конкретных клинических
ситуациях
Отключение искусственного
кровообращения
Коронарное шунтирование
без искусственного кровообращения
Имплантация внутрисосудистых устройств
Трансплантация
Альтернативная техника
Эпикардиальная и эпиаортальная
эхокардиография
Послеоперационные результаты
и экономическая эффективность
В этой главе описано использование чреспищевод-
ной эхокардиографии (ЧПЭхоКГ) во время различ-
ных вмешательств, а также влияние результатов ин-
траоперационной ЧПЭхоКГ на качество хирургиче-
ского лечения в целом. Интраоперационная оценка
функции клапанов, размеров полостей и маги-
стральных сосудов описана в других главах книги.
Проведение ЧПЭхоКГ в условиях операционной не
всегда позволяет получить качественные изображе-
ния. Для устранения внешних помех следует умень-
шать освещение в операционной во время исследо-
вания. Необходимо получить максимально точные
данные до хирургического разреза. При исполь-
зовании электрокоагулятора исследование следует
проводить в определенный момент вмешательства,
что позволит исключить влияние электроприбора
на качество изображения. При введении зонда с дат-
чиком для ЧПЭхоКГ пациенту, который находится
под общей анестезией и не может сказать о непри-
ятных ощущениях, следует соблюдать особую осто-
рожность.
ИНТРАОПЕРАЦИОННАЯ ОЦЕНКА
ФУНКЦИИ ЖЕЛУДОЧКОВ
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Нарушение диастолической функции левого желу-
дочка (ЛЖ) особенно выражено после завершения
искусственного кровообращения. По степени сниже-
ния диастолической функции можно прогнозиро-
вать увеличение осложнений со стороны миокарда
[1–4]. Помимо стандартных методов оценки притока
крови через митральный клапан и скорости возврата
ее по легочным венам используют новые методы для
более глубокого изучения проблем с ЛЖ.
Предложено использовать показатель расслабле-
ния ЛЖ, определяемый при тканевой допплерогра-
фии митрального клапана, который в меньшей сте-
пени подвержен искажению при изменении нагруз-
ки и функции желудочков, в отличие от параметров
стандартной допплерографии [5]. С расслаблением
ЛЖ напрямую связана скорость e′ (скорость смеще-
ния фиброзного кольца митрального клапана в ран-
нюю диастолу), поэтому ее используют для оценки
расслабления ЛЖ. Отношение скорости Е (скорости
митрального кровотока в раннюю диастолу) к ско-
рости e′ (Е/е′) более точно определяет давление на-
полнения ЛЖ. Это было подтверждено при транс-
торакальной эхокардиографии (ТТЭхоКГ), в том
числе в условиях отделения интенсивной терапии и
реанимации. Однако целесообразность использова-
ния данного параметра при ЧПЭхоКГ у пациентов
после операции на сердце не была подтверждена ис-
следованиями. Kumar и соавт. измеряли давление
наполнения с помощью катетера, установленного в
легочной артерии, и показали, что с помощью тка-
невой допплерографии митрального клапана нель-
зя точно определить давление наполнения ЛЖ [6].
На отношение E/e′ помимо давления в левом пред-
сердии (ЛП) влияет много факторов [7], что огра-
ничивает практическое применение данного пара-
метра.
ch04.indd 71
03.04.2019 11:39:01
72
ЧАСТЬ I Передовые методы эхокардиографии
Еще одним показателем диастолической функции
выступает скорость кровотока, определяемая при цве-
товой допплерографии в М-режиме. Скорость кро-
вотока меньше зависит от нагрузки, чем показатели
диастолической функции при оценке с помощью
импульсно-волновой допплерографии. Djaiani и со-
авт. [8] показали, что у пациентов, перенесших опе-
рацию коронарного шунтирования, скорость кро-
вотока < 50 см/сек указывает на нарушение диасто-
лической функции. Однако отсутствие доказанной
достоверности оценки диастолической дисфункции
с помощью этих методов ограничивает их приме-
нение при интраоперационном исследовании в кар-
диохирургии [6, 9].
КОНЕЧНО-ДИАСТОЛИЧЕСКИЙ ОБЪЕМ
И КОНЕЧНО-СИСТОЛИЧЕСКИЙ ОБЪЕМ
ЛЕВОГО ЖЕЛУДОЧКА
American Society of Echocardiography (ASE) опубли-
ковало рекомендации по количественной оценке
параметров с помощью ТТЭхоКГ и ЧПЭхоКГ. Па-
раметры этих методов визуализации сопоставимы
[10, 11]. Некоторые авторы исследовали взаимосвязь
между объемом сердца и конечно-диастолическим
объемом (КДО) либо конечно-систолическим объ-
емом (КСО), который измеряли из трансгастраль-
ного доступа в позиции среднего отдела левого же-
лудочка на уровне папиллярных мышц.
Cheung и соавт. [12] изучали влияние гиповоле-
мии на гемодинамику и индекс преднагрузки ЛЖ у
пациентов, которым провели коронарное шунтиро-
вание. Пациенты с регургитацией, нарушением сер-
дечного ритма и сердечной недостаточностью из ис-
следования были исключены. У всех пациентов от-
мечено линейное снижение показателей КДО, КСО,
давления заклинивания легочной артерии при сни-
жении объема циркулирующей крови на 0–15%. У
пациентов с нарушенной функцией ЛЖ показате-
ли, полученные при ЧПЭхоКГ, имели линейную на-
правленность. Исследователи отмечают, что оценка
объема желудочков у пациентов с асимметричной
дисфункцией желудочков может быть затруднена
из-за того, что области гипокинезии и акинезии не-
возможно визуализировать в 2D-режиме.
Следует учитывать, что невысокий показатель
КДО либо КСО не всегда свидетельствует о сниже-
нии внутрисосудистого объема. Небольшой объем
ЛЖ может быть связан с ограничением его напол-
нения, например в случае болезни перикарда, сни-
женной функции правых отделов сердца (рис. 4 .1)
из-за инфаркта миокарда правого желудочка (ПЖ),
наличия эмбола в легочной артерии. Другими при-
чинами небольшого объема ЛЖ могут быть пере-
распределение крови в грудной клетке и увеличение
инотропной функции миокарда.
Общепринятым методом измерения объема же-
лудочка является бипланарный метод Симпсона.
Исследования, в которых объем измеряли с помо-
щью двухмерной чреспищеводной эхокардиогра-
фии (2D-ЧПЭхоКГ) и двухмерной трансторакаль-
ной эхокардиографии (2D-ТТЭхоКГ) различными
датчиками, показали отсутствие различий между эти-
ми методами [13]. Полезным методом оценки объ-
ема ЛЖ является трехмерная трансторакальная эхо-
кардиография (3D-ТТЭхоКГ).
Опубликованы диапазоны нормальных значений
объема ЛЖ [14, 15]. Хотя значения в 3D-режиме не-
много занижены по сравнению с данными при маг-
нитно-резонансной томографии (МРТ) сердца [16],
получаемые значения ближе к данным МРТ сердца
и клиническая ценность их выше, чем значений, по-
лученных в 2D-режиме, что доказывает надежность
метода [17].
Значительно увеличилось использование в опе-
рационной 3D-ЧПЭхоКГ в режиме реального време-
ни, особенно при оценке митрального клапана. Ис-
пользование ЧПЭхоКГ для оценки объема ЛЖ изу-
чено не так подробно, как использование ТТЭхоКГ.
Meris и соавт. сравнили объемы желудочков и фрак-
цию выброса (ФВ), измеренные во время операции
с помощью 2D-ЧПЭхоКГ и 3D-ЧПЭхоКГ [18].
Двухмерные изображения получали, используя
автоматизированный алгоритм определения гра-
ниц эндокарда с последующей трассировкой вруч-
ную в двухкамерной и четырехкамерной позициях.
Трехмерные изображения из полного набора объ-
емных данных анализировали с помощью про-
граммного обеспечения Philips QLAB 3D-Advanced
Quantification (Philips Medical Systems, Andover, MA)
[19]. Результаты исследования приведены в табл.
4.1 .
Показатели ФВ при 2D-ЧПЭхоКГ и 3D-ЧПЭхоКГ
были одинаковы. Показатели объемов желудочков
были выше в группе 3D-ЧПЭхоКГ, разница показа-
телей была статистически значимой, но это не при-
вело к различной классификации ЛЖ как нормаль-
ный, умеренно расширенный и чрезмерно расши-
ренный. Продолжительность получения данных в
обеих группах была приблизительно одинаковой,
но анализ данных занял больше времени в группе
3D-ЧПЭхоКГ, причем этот метод визуализации ис-
пользовали только у пациентов без нарушения сер-
дечного ритма.
Оценка преднагрузки в операционной с помо-
щью ЧПЭхоКГ в режиме реального времени в боль-
шинстве случаев является полуколичественной, ос-
нованной на визуальных данных КДО и КСО при
допплерографии. Для количественной оценки объ-
емов желудочков используют 2D-ЧПЭхоКГ, по-
скольку применение 3D-ЧПЭхоКГ ограничено тех-
ническими проблемами и длительным временем
анализа полученных данных. При исследовании не-
обходимо учитывать наличие правожелудочковой
недостаточности, вазодилатации и использование
инотропных препаратов.
ch04.indd 72
03.04.2019 11:39:01
73
4 Интраоперационная эхокардиография
Г
В
А
Б
Диастола
Диастола
Систола
Систола
Рис. 4 .1 Уменьшение конечно-систолического объема левого желудочка. ЧПЭхоКГ двух пациентов, у которых наблюдается уменьшение конечно-диасто-
лического объема левого желудочка. (А, Б) A Видно уменьшение правого и левого желудочков (стрелка), что характерно для гиповолемии либо периферической
дилатации. (В, Г) A ЧПЭхоКГ пациента со вторичной легочной гипертензией из-за кистозного фиброза. Конечно-систолический объем левого желудочка чрез-
вычайно мал (стрелка), но вследствие правожелудочковой недостаточности.
ГЛОБАЛЬНАЯ СИСТОЛИЧЕСКАЯ ФУНКЦИЯ
СЕРДЕЧНЫЙ ВЫБРОС
Для постоянного мониторинга сердечного выброса
во время операции можно использовать ЧПЭхоКГ
и допплерографию. Данный метод основан на урав-
нении непрерывности потока, с помощью которого
рассчитывают ударный объем, который равен пло-
щади поперечного сечения сосуда в сердечно-сосу-
дистой системе, умноженной на интеграл скорости
кровотока (VTI) в данном сосуде. После умножения
ударного объема на частоту сердечных сокращений
получают сердечный выброс. Однако для использо-
вания данного уравнения нужно учитывать следу-
ющее: (1) оно может быть применимо только к ана-
лизируемой анатомической области; (2) профиль
кривой скорости потока через клапан не должен
иметь артефактов [20, 21]; (3) изображения должны
быть получены последовательно на одном уровне
сосуда.
ВЫХОДНОЙ ТРАКТ ЛЕВОГО ЖЕЛУДОЧКА
Применение допплерографии при оценке ЛЖ было
тщательно изучено в группе пациентов перед опе-
рацией с искусственным кровообращением и после
нее [22]. Аортальный клапан и выходной тракт ле-
вого желудочка (ВТЛЖ) видны из трансгастрально-
го доступа (угол 0–140°) с поворотом датчика влево
и низкой частотой смены кадров (рис. 4 .2).
Позиционирование датчика в желудке позволяет
одновременно проводить импульсно-волновую доп-
плерографию кровотока в ВТЛЖ и измерять его
диаметр из трансгастрального доступа или из средне-
го отдела пищевода в позиции ЛЖ по длинной оси.
Расчет площади ВТЛЖ и сердечного выброса про-
водят по стандартной формуле (см. рис. 4 .2). Уль-
тразвуковой луч должен быть направлен точно в
ВТЛЖ для исключения появления артефактов из-за
ускорения потока рядом с аортальным клапаном.
При наличии стеноза достоверность получаемых
данных уменьшается.
ch04.indd 73
03.04.2019 11:39:01
74
ЧАСТЬ I Передовые методы эхокардиографии
Рис. 4 .2 Измерение выходного тракта левого желудочка. ЧПЭхоКГ позволяет одновременно получать изображение выходного тракта левого желудочка
(ВТЛЖ) и восходящего отдела аорты. (А) ЧПЭхоКГ, трансгастральный доступ, позиция левого желудочка (ЛЖ) по длинной оси. (Б) ЧПЭхоКГ из глубокого транс-
гастрального доступа. (В) Интеграл скорости кровотока (VTI) в выходном тракте левого желудочка равен 17 см. (Г) Доступ из среднего отдела пищевода, пози-
ция левого желудочка по длинной оси. Измерение диаметра выходного тракта левого желудочка (2 см) и вычисление площади выходного тракта левого желудоч-
ка (SВТЛЖ = r2 = 3 ,14 × 1 см2 = 3 ,14 см2) и ударного объема (УО = 3 ,14 см2 × 17 см = 63 см3, или 63 мл). Vmax — максимальная скорость; ΔP — градиент давле-
ния; ΔPmax — максимальный градиент давления; АК — аортальный клапан; ПЖ — правый желудочек.
А
Б
Г
В
Vmax 81 см/сек
ΔPmax 3 мм рт. ст.
Средний ΔP 1 мм рт. ст.
VTI 17 см
АК
ЛЖ
ЛЖ
ПЖ
Диаметр ВТЛЖ 2 см
АК
Показатель
3D-ЧПЭхоКГ
2D-ЧПЭхоКГ
p
Медиана (99% ДИ)
Фракция выброса (%)
55±14
55±14
0,227
− 0,4 (−1,2–0,3)
ИКДО (мл/м2)
54±21
51±21
< 0,001
3,3 (2,5–4,2)
ИКСО (мл/м2)
26±18
24±17
< 0,001
1,4 (1,0–2,0)
ИКДО (мл/м2)*
Систолическая функция
Нормальная (62%)
47±16
43±15
< 0,001
3,2 (2,3–4,4)
Небольшое нарушение (16%) 53 ± 14
51±12
0,794
3,6 (–3,8–5,8)
Умеренное нарушение (14%) 71 ± 23
67±23
0,001
3,3 (1,6–6,2)
Тяжелое нарушение (8%)
89±23
85±24
0,023
3,9 (0,7–6,9)
Объем желудочка
Нормальный (86%)
48±12
45±12
< 0,001
3,5 (2,4–4,2)
Увеличенный (14%)
101±19
96±17
0,002
3,2 (1,2–5,6)
* В подгруппах пациентов (в скобках указан процент всей популяции, представленной в ка ждой подгруппе).
ДИ — доверительный интервал; ИКДО — индексированный конечно-диастолический объем; ИКСО — индексированный конечно-систо-
лический объем; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Meris A, Santambrogio L, Casso G: Intraoperative three-dimensional versus two-dimensional echocardiography for left ventricular assessment. Anesth
Analg 118:711–720, 2014.]
ТАБЛИЦА 4.1 Индексированные конечно-систолический объем и конечно-диастолический объем
и систолическая функция, полученные при чреспищеводной эхокардиографии (n = 152)
ch04.indd 74
03.04.2019 11:39:03
75
4 Интраоперационная эхокардиография
Lodato и соавт. [23] оценивали площадь ВТЛЖ с
помощью 2D-ТТЭхоКГ, 3D-ТТЭхоКГ и цветовой
допплерографии, измеряли ударный объем и срав-
нивали полученные результаты с данными термо-
дилюции. Эти методы коррелируют друг с другом,
однако при 3D-ТТЭхоКГ отмечено меньшее количе-
ство ошибок. Это авторы связывали с тем, что в
3D-режиме меньше геометрических ограничений.
Аналогичный результат при ТТЭхоКГ был получен
Shahgaldi и соавт. [24], которые обнаружили, что
измерение ударного объема ЛЖ планиметрическим
методом (рис. 4 .3) позволяет получить более точ-
ные данные, чем при традиционных исследовани-
ях в 2D-режиме и бипланарном методе Симпсона.
«Золотым стандартом» авторы считают исследова-
ние с помощью 3D-ТТЭхоКГ, однако лучшим мето-
дом диагностики и оценки объема ЛЖ является
МРТ сердца.
Montealegre-Gallegos и соавт. сравнили показате-
ли сердечного выброса, полученные с помощью 2D-
и 3D-ЧПЭхоКГ [25]. Авторы исходили из того, что
эллипсоидная форма ВТЛЖ может приводить к диа-
гностической ошибке [26], поэтому заменили пла-
ниметрический метод оценки площади ВТЛЖ на
метод реконструкции при 3D-ЧПЭхоКГ. Получен-
ные в 2D- и 3D-режиме данные коррелировали друг
с другом, однако при 2D-режиме корреляция была
в среднем на 10% меньше. Таким образом, исследо-
вание с помощью 2D-ЧПЭхоКГ не может служить
«золотым стандартом» оценки сердечного выброса.
ЛЕГОЧНЫЙ СТВОЛ
В положении датчика под углом 0° и сгибании зон-
да кзади на экране монитора отображаются легоч-
ный ствол и клапан легочной артерии у основания
сердца. В исследовании, проведенном Gorcsan и со-
Рис. 4 .3 Планиметрический метод измерения выходного тракта левого желудочка. Площадь выходного тракта левого желудочка (ВТЛЖ) можно изме-
рить с помощью 3D-ЧПЭхоКГ и при мультипланарной реконструкции. На ортогональном срезе (красные линии) можно выполнить трассировку площади выходно-
го тракта левого желудочка. ЛКА — левая коронарная артерия.
ЛКА
Площадь ВТЛЖ 4,2 см2
ch04.indd 75
03.04.2019 11:39:03
76
ЧАСТЬ I Передовые методы эхокардиографии
щего отдела аорты, следует скорректировать сгиба-
ние зонда и угол поворота датчика (см. рис. 4 .2).
Кроме этого, следует усреднить значения некото-
рых параметров. Это особенно важно при обследо-
вании пациентов с нарушениями сердечного ритма.
С практической точки зрения измерение сердечного
выброса с помощью допплерографии проводят при
невозможности ввести катетер в легочную артерию
либо при тяжелой трикуспидальной регургитации,
когда результаты термодилюции неточные. При од-
новременной визуализации правых и левых отде-
лов сердца можно рассчитать объем сброса крови
через внутрисердечный шунт. Однако для использо-
вания этого метода у пациентов с различными па-
тологиями сердечно-сосудистой системы необходи-
мы дальнейшие исследования. 3D-ЧПЭхоКГ более
эффективный метод, поскольку позволяет обойти
геометрические ограничения, присущие измерени-
ям в 2D-режиме, но «золотым стандартом» остают-
ся исследования с помощью термодилюции и МРТ
сердца. Ограничение использования 3D-ЧПЭхоКГ
для оценки сердечного выброса в операционной об-
условлено влиянием многих внешних факторов, ко-
торые приводят к появлению артефактов, например
нарушения сердечного ритма, работающий электро-
коагулятор и т.д.
ФРАКЦИЯ ВЫБРОСА И УДАРНЫЙ ОБЪЕМ
ФВ зависит от нагрузки и, следовательно, не явля-
ется прямым показателем сократимости миокарда
(хотя часто считают, что ФВ — отражение сократи-
тельной способности желудочков). При интраопе-
рационной ЧПЭхоКГ фракцию изменения площа-
ди, определяемую из трансгастрального доступа в
позиции среднего отдела ЛЖ по короткой оси (па-
пиллярные мышцы), часто приравнивают к ФВ, од-
нако оценка объема асимметричной полости сердца
в момент измерения ее площади имеет очевидные
ограничения. Royse и соавт. [29] показали, что фрак-
ция изменения площади с коррекцией на постна-
грузку тесно взаимосвязана с преднагрузкой, кото-
рая является относительно независимым показате-
лем сократимости. Показано, что отношение dP/dt
больше зависит от нагрузки и поэтому менее на-
дежно. Отобранные пациенты имели очень разную
общую функцию желудочков. Как упоминалось ра-
нее, наиболее распространенным и общепринятым
методом измерения ударного объема является би-
планарный метод Симпсона (рис. 4 .5).
ФВ во время операции по-прежнему чаще оце-
нивают визуально или по фракции изменения пло-
щади в одной позиции. Есть опасения, что в этом
случае у пациентов с областями гипокинезии фрак-
ция изменения площади будет недооценена.
По техническим ограничениям, упомянутым ра-
нее, 3D-ЧПЭхоКГ в режиме реального времени для
определения ФВ и объемов желудочка во время опе-
рации обычно не используют.
ЛС
Дуга
аорты
Левая
подключичная
артерия
Безымянная
вена
ВТПЖ
КЛА
Рис. 4 .4 Визуализация легочного ствола. Доступ из верхнего отдела пи-
щевода. Видны легочный ствол (ЛС), клапан легочной артерии (КЛА), левая
подключичная артерия и безымянная вена. В данной позиции можно исполь-
зовать допплерографию. ВТПЖ — выходной тракт правого желудочка.
авт. [27], для измерения диаметра использовали как
импульсно-волновую, так и непрерывно-волновую
допплерографию кровотока в легочном стволе дис-
тальнее клапана. Во всех исследованиях отмечалась
сильная корреляция с данными термодилюции с не-
большой вариабельностью. Альтернативной пози-
цией является позиция под углом от 60 до 90° и про-
хождение ультразвукового луча через дугу аорты
(рис. 4 .4).
ВЫХОДНОЙ ТРАКТ ПРАВОГО ЖЕЛУДОЧКА
Из трансгастрального доступа и при сгибании зон-
да вправо под углом от 0 до 120° отображается вы-
ходной тракт правого желудочка. Для оптимальной
визуализации следует снизить частоту смены ка-
дров. Maslow и соавт. [28] выявили сильную корре-
ляцию между показателями сердечного выброса
при импульсно-волновой допплерографии и при
термодилюции. Из исследования были исключены
пациенты с легочной гипертензией, значительной
трикуспидальной регургитацией и нарушениями
сердечного ритма. Большое количество (16%) двух-
мерных изображений было малоинформативно.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Для оценки сердечного выброса в ходе операции
наиболее воспроизводим был метод определения
площади ВТЛЖ и VTIВТЛЖ. Чтобы обеспечить хоро-
шую визуализацию аортального клапана и восходя-
ch04.indd 76
03.04.2019 11:39:04
77
4 Интраоперационная эхокардиография
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ
Тканевую допплерографию используют для изме-
рения скорости смещения латеральной части фи-
брозного кольца митрального клапана во время си-
столы в качестве показателя систолической функ-
ции, которая коррелирует с ФВ [30, 31]. Однако на
скорость и направление смещения могут влиять
различные атипичные движения миокарда (враще-
ние, смещение, подтягивание), поэтому необходи-
мо направить ультразвуковой луч параллельно сме-
щению фиброзного кольца. У хирургических паци-
ентов фиброзное кольцо часто кальцифицировано,
что также ограничивает применение данного мето-
да диагностики [32].
Чтобы решить эту проблему, было проведено не-
сколько исследований визуализации деформации и
скорости деформации миокарда для оценки функ-
ции ЛЖ (см. главу 8) [33–36]. Скорость деформации
миокарда — это локальная скорость, которую оцени-
вают по градиенту скорости, полученной при ткане-
вой допплерографии. К сожалению, необходимость
направления ультразвукового луча параллельно ис-
следуемым структурам сердца ограничивает исполь-
зование тканевой допплерографии в ходе операции
для анализа деформации миокарда [37].
СПЕКЛТРЕКИНГ ЭХОКАРДИОГРАФИЯ
Спекл-трекинг ЭхоКГ (рис. 4 .6) представляет собой
исследование, которое не зависит от угла ультразву-
А
Б
КДО 176 мл
КСО 143 мл
ФВ 19%
УО33мл
Диастола
Систола
Рис. 4 .5 Расчет фракции выброса с помощью 2D-ЧПЭхоКГ и 3D-ЧПЭхоКГ. (А) Измерение площади во время систолы (слева) и во время диастолы (спра-
ва) в четырехкамерной позиции (вверху) и двухкамерной позиции (внизу) бипланарным методом Симпсона для расчета объемов левого желудочка. Можно рас-
считать ударный объем (УО), фракцию выброса (ФВ), сердечный выброс. (Б) A С помощью 3D-ЧПЭхоКГ рассчитывают фракцию выброса у пациента с кардио-
миопатией. КДО — конечно-диастолический объем; КСО — конечно-систолический объем.
кового луча. Спекл-трекинг ЭхоКГ используют для
измерения деформации миокарда и скорости де-
формации [34]. Спекл-трекинг ЭхоКГ позволяет ко-
личественно оценить глобальную продольную де-
формацию миокарда, функцию ЛЖ и нарушения
сократимости миокарда [38]. Нарушение деформа-
ции связывают с увеличением смертности в течение
30 сут и более высоким процентом необходимости
реанимационных мероприятий [39]. Получив вы-
сококачественные изображения в 2D-режиме и при-
менив акустические маркеры для отслеживания об-
ластей миокарда (пятен, или спеклов) в течение
определенного времени, можно рассчитать дефор-
мацию миокарда и скорость деформации.
За последнее время несколько исследователей из-
учили целесообразность оценки деформации с по-
мощью тканевой допплерографии [40] и спекл-
трекинг ЭхоКГ [41]. Kukucka и соавт. обнаружили,
что при использовании спекл-трекинг ЭхоКГ в кар-
диохирургии достоверность заключений при оцен-
ке продольной и радиальной деформации прием-
лема, а сократимость миокарда лучше всего корре-
лирует с радиальной деформацией. Эти данные
следует использовать с поправкой на условия рабо-
ты в операционной, когда решение часто необходи-
мо принять за несколько секунд. При ненадлежа-
щем определении зоны интереса возможны ошиб-
ки [42].
Деформация соответствует ориентации волокон
миокарда (продольных, радиальных и циркуляр-
ch04.indd 77
03.04.2019 11:39:04
78
ЧАСТЬ I Передовые методы эхокардиографии
ных), и на нее различные заболевания влияют по-
разному [43]. Оценка с помощью ЧПЭхоКГ гло-
бальной деформации миокарда более надежна, чем
локальной [37]. Измерения следует проводить в ав-
тономном режиме. Хотя анализ деформации мио-
карда в ходе операции — весьма перспективный ме-
тод оценки глобальной и локальной систолической
функции, необходимо провести дополнительные
исследования применения данного метода в карди-
охирургии.
ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
При операциях с использованием искусственного
кровообращения крайне важно оценить функцию
ПЖ. Часто наблюдается вторичная дисфункция
ПЖ из-за недостаточной кардиоплегии [44], разви-
тия или ухудшения левожелудочковой недостаточ-
ности с нарастанием легочной гипертензии, увели-
чения трикуспидальной регургитации, воздушной
эмболии правой коронарной артерии после коро-
нарного шунтирования (рис. 4 .7, 4.8). Подход к диа-
гностике при ТТЭхоКГ такой же, что и при ЧПЭхоКГ,
однако из-за треугольной формы ПЖ бывает труд-
но количественно оценить его глобальную функ-
цию с помощью ЧПЭхоКГ. В автономном режиме
(во время коронарного шунтирования) используют
модифицированный бипланарный метод Симпсо-
на [45].
А
Б
Диастола
Систола
Диастола
Систола
VTI
VTI
Рис. 4 .6 Оценка функции левого желудочка. Оценка функции левого желудочка до и после искусственного кровообращения. (А) Определение циркулярной
деформации (слева) A, конечно-диастолического объема и конечно-систолического объема (в центре) A и интеграла скорости кровотока (VTI) выходного трак-
та левого желудочка у пациента, которому предстоит протезирование митрального клапана. (Б) A A Те же параметры после длительного искусственного кро-
вообращения и продолжительного пережатия аорты. Отмечается снижение всех трех параметров. После реанимационных мероприятий параметры вернулись к
исходным значениям.
ch04.indd 78
03.04.2019 11:39:05
79
4 Интраоперационная эхокардиография
А
Б
В
Г
ЛП
ЛП
ПКС
ПКС
ЛКС
Верх
НКС
Низ
ПКС
Рис. 4 .7 Воздушная эмболия правой коронарной артерии. (A) A В полостях левого желудочка и левого предсердия (ЛП) видно много пузырьков воздуха
после пережатия аорты. A При визуализации по короткой оси (Б) и длинной оси (В) аортального клапана видны пузырьки воздуха около правой коронарной
створки (ПКС). (Г) Поскольку пациент лежит на спине, ПКС находится вверху, поэтому пузырьки скапливаются возле устья правой коронарной артерии в синусе
Вальсальвы и могут эмболизировать артерию. ЛКС — левая коронарная створка; НКС — некоронарная створка.
А
Б
Нижняя стенка
Нижняя стенка
Рис. 4 .8 A Снижение функции правого желудочка после воздушной эмболии. Трансгастральный доступ, позиция левого желудочка по короткой оси (А)
и по длинной оси (Б). После воздушной эмболии правой коронарной артерии наблюдается нарушение сократимости миокарда нижней стенки (стрелки). Ослож-
нение следует визуализировать в режиме реального времени.
Скорость смещения фиброзного кольца трикус-
пидального клапана измеряют с помощью тканевой
допплерографии для количественной оценки функ-
ции ПЖ с допустимыми отклонениями от нормы
< 1,5 см. Более высокие отклонения связаны с не-
благоприятным прогнозом при различных сердеч-
но-сосудистых заболеваниях [46].
Во время кардиохирургических вмешательств для
лучшей визуализации латеральной части фиброз-
ного кольца трикуспидального клапана (рис. 4.9)
используют модифицированную позицию из транс-
гастрального доступа [46]. Позиционирование дат-
чика в желудке облегчает направление ультразву-
кового луча параллельно смещению фиброзного
кольца. Результаты тканевой допплерографии кор-
релируют с данными МРТ сердца при оценке сме-
щения латеральной части фиброзного кольца три-
куспидального клапана.
Результаты оценки деформации стенки ПЖ с по-
мощью спекл-трекинг ЭхоКГ хорошо коррелируют
с данными о функции ПЖ, полученными при МРТ
сердца [47]. Есть сообщения о применении спекл-
трекинг ЭхоКГ в операционной [48]. Ее данные хо-
рошо коррелируют с другими показателями, напри-
мер систолического смещения фиброзного кольца
трикуспидального клапана и фракции изменения
площади. В настоящее время отсутствуют показате-
ли нормы, однако известно, что низкая скорость де-
формации является предиктором неблагоприятных
сердечно-сосудистых событий [49].
3D-ЭхоКГ является более точным и воспроизво-
димым методом оценки функции ПЖ по сравне-
ch04.indd 79
03.04.2019 11:39:06
80
ЧАСТЬ I Передовые методы эхокардиографии
А
Б
TAPSE 1,6 см
ЛП
ПП
ПЖ
ЛЖ
IVC s′
e′
a′
Рис. 4 .9 Оценка функции правого желудочка. (А) A Из глубокого трансгастрального доступа в четырехкамерной позиции со сгибанием датчика кпереди
визуализируется латеральная часть фиброзного кольца трикуспидального клапана (стрелка). В данной позиции в М-режиме было измерено систолическое сме-
щение (двунаправленные стрелки) фиброзного кольца трикуспидального клапана (TAPSE), которое равно 1,6 см, что свидетельствует о нормальной функции пра-
вого желудочка (ПЖ). Данная позиция хорошо подходит для тканевой допплерографии, т.к . ультразвуковой луч направлен параллельно фиброзному кольцу.
(Б) Скорость s′ 9,65 см/сек свидетельствует о нормальной функции правого желудочка. a′ — скорость смещения фиброзного кольца трикуспидального клапана
в позднюю диастолу; e′ — скорость смещения фиброзного кольца трикуспидального клапана в раннюю диастолу; s′ — скорость смещения фиброзного кольца
трикуспидального клапана во время систолы; IVC — изоволюмическое сокращение; ЛЖ — левый желудочек; ЛП — левое предсердие; ПП — правое предсер-
дие.
нию с МРТ сердца и радионуклидной вентрикуло-
графией [49]. Для измерения объема ПЖ и оценки
его функции можно использовать полуавтоматизи-
рованный алгоритм определения границ эндокарда.
Функцию ПЖ во время операции лучше всего оце-
нивать с помощью ЧПЭхоКГ визуально из трансга-
стрального доступа и из среднего отдела пищевода
в четырехкамерной позиции [49].
ЛОКАЛЬНАЯ СОКРАТИМОСТЬ МИОКАРДА
Наличие связи между интраоперационной ишеми-
ей миокарда и патологией сердца [50] обусловило
необходимость активного поиска точных методов
выявления ишемии миокарда во время операции
(рис. 4 .10). Доказано, что нарушение локальной со-
кратимости миокарда, выявленное при ЧПЭхоКГ
во время операции, является чувствительным пока-
зателем ишемии и позволяет выявить патологию
до появления изменений на электрокардиограмме
(ЭКГ), катетеризации легочной артерии или до на-
рушений гемодинамики [51]. Есть несколько крите-
риев, по которым судят о преимуществах метода
визуализации: точность, воспроизводимость, стои-
мость, необходимость соответствующего опыта у
оператора и прогностическое значение данных. Не-
большое количество противопоказаний к ЧПЭхоКГ
означает, что ее можно проводить большинству па-
циентов под общей анестезией. Как правило, полу-
чить изображение из трансгастрального доступа в
позиции среднего отдела ЛЖ по короткой оси (па-
пиллярные мышцы) легко, в этой позиции хорошо
видны области миокарда, которые кровоснабжают
основные коронарные артерии. Во время операции
также осуществляется мониторинг сердечного рит-
ма и автоматический анализ динамики сегмента ST.
Опубликованы данные о последствиях наруше-
ний локальной сократимости миокарда для кардио-
хирургии и общей хирургии.
London и соавт. [52] исследовали 156 пациентов,
которым были выполнены некардиохирургические
операции и которые подверглись высокому риску
развития заболеваний коронарных артерий. При
выявлении клинических и эхокардиографических
нарушений или нарушений гемодинамики этот факт
тщательно протоколировали и проводили анализ.
Обнаруженных нарушений локальной сократимо-
сти миокарда было мало, а количество несоответ-
ствий с результатами ЭхоКГ было большим.
Послеоперационных сердечно-сосудистых ос-
ложнений также было немного, что ограничивало
рутинное применение ЧПЭхоКГ у пациентов после
некардиохирургических вмешательств. Leung и со-
авт. [53] обследовали пациентов, которым под кон-
тролем ЭКГ и ЧПЭхоКГ выполнили коронарное
шунтирование. У этих пациентов ишемия миокар-
да редко наблюдалась перед операцией, но после
операции частота осложнений, выявленных при
ЧПЭхоКГ, была выше, чем выявленных при ЭКГ.
ch04.indd 80
03.04.2019 11:39:07
81
4 Интраоперационная эхокардиография
30
20
10
Ишемия миокарда
Эффекты лекарств (например, дигиталиса)
Инфаркт миокарда
Нарушения проводящей системы
Эффекты вегетативной нервной системы
Гипертрофия левого желудочка
Артефакты измерения
Ишемия миокарда
Митральная регургитация
Увеличение давления после нагрузки
Снижение растяжимости легких
Окклюзия
Ишемия миокарда
Острая гиповолемия
Острые изменения после нагрузки
Предсуществующее заболевание миокарда
«Оглушенный» миокард
Электрокардиография
Катетеризация легочной артерии
Чреспищеводная эхокардиография
В настоящее время считают, что часто наруше-
ния локальной сократимости миокарда — результат
ишемии, но также они могут быть вызваны гипово-
лемией и «оглушенным» миокардом после искус-
ственного кровообращения. Нарушения движения
межжелудочковой перегородки наблюдаются после
искусственного кровообращения с перегрузкой пра-
вых отделов сердца и блокадой ножек пучка Гиса.
Нарушения локальной сократимости миокарда, об-
условленные перераспределением потока крови в
коронарной артерии, чаще всего являются резуль-
татом ишемии.
Comunale и соавт. [54] отметили плохую корре-
ляцию результатов ЧПЭхоКГ и ЭКГ. Исследователи
объяснили это тем, что отсутствуют стандартные
определения значительных нарушений локальной
сократимости миокарда и ишемических изменений
сегмента ST. Корреляция данных ЭКГ и ЧПЭхоКГ
остается спорной.
Самый чувствительный метод диагностики ише-
мии миокарда во время операции — ЧПЭхоКГ, по-
этому ее используют многие практикующие врачи
в качестве передовой технологии в этой области.
Однако всегда следует учитывать недостатки данно-
го метода (см. ранее). Повысить точность диагно-
стики должны визуализация в дополнительных то-
мографических плоскостях и новые методы визуа-
лизации (например, тканевая допплерография и
спекл-трекинг ЭхоКГ с визуализацией деформации
миокарда, 3D-ЧПЭхоКГ в режиме реального време-
ни). Метод оценки локальной продольной дефор-
мации миокарда весьма перспективен относитель-
но выявления ишемии миокарда [55], но необходи-
мо провести более тщательные исследования до
внедрения этого метода в рутинную клиническую
практику. Поскольку нарушения локальной сокра-
тимости миокарда предшествуют патологическим
изменениям на ЭКГ [56], ЧПЭхоКГ можно исполь-
зовать с целью мониторинга во время операции и
оценки ее результатов.
ИНТРАОПЕРАЦИОННАЯ ОЦЕНКА ФУНКЦИИ СЕРДЦА
В КОНКРЕТНЫХ КЛИНИЧЕСКИХ СИТУАЦИЯХ
Широкое применение ЧПЭхоКГ улучшило лечение
сердечно-легочной недостаточности, поскольку по-
зволило лучше понять изменения, происходящие
при операции, особенно в случае использования но-
вых методов реваскуляризации коронарных арте-
рий. ЧПЭхоКГ также может помочь практикующим
Рис. 4 .10 Методы выявления и причины ишемии миокарда во время операции [Fleisher LA: Real-time intraoperative monitoring of myocardial ischemia in
noncardiac surgery. Anesthesiology 92:1183-1188, 2000].
ch04.indd 81
03.04.2019 11:39:07
82
ЧАСТЬ I Передовые методы эхокардиографии
врачам при имплантации вне- и внутрисердечных
устройств. Использование ЧПЭхоКГ для монито-
ринга функции сердца во время некардиохирурги-
ческого вмешательства — наиболее оптимальный
метод диагностики в случае внезапного и необъяс-
нимого нарушения гемодинамики.
ОТКЛЮЧЕНИЕ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Во время отключения искусственного кровообра-
щения ЧПЭхоКГ помогает анестезиологу принять
решение о фармакологической и нефармакологиче-
ской терапии, а также объеме реанимационных ме-
роприятий.
ВОЗДУХ ВНУТРИ СЕРДЦА
После открытых операций на сердце, когда левые
полости сердца сообщались с атмосферным возду-
хом, внутри сердца может остаться воздух, который
будет визуализироваться в виде характерных свет-
лых пятен при ЧПЭхоКГ из трансгастрального до-
ступа в четырехкамерной позиции и в позиции ЛЖ
по длинной оси. Воздух часто поступает в левое
предсердие из легочных вен либо находится в под-
клапанном аппарате митрального клапана (см. рис.
4.7), поэтому крайне важно провести тщательную
деаэрацию через аорту либо верхушку ЛЖ. Кроме
этого, рекомендуется с помощью ЧПЭхоКГ иссле-
довать устье правой коронарной артерии для ис-
ключения эмболии, которая может привести к дис-
функции желудочков (см. рис. 4 .8).
СЕРДЕЧНЫЙ ВЫБРОС
Выделяют несколько причин низкого сердечного вы-
броса после искусственного кровообращения: ин-
фаркт [57], эмболия коронарных артерий, наруше-
ние метаболизма, гиповолемия, обструкция ВТЛЖ,
недостаточная кардиоплегия. При нестабильности
гемодинамики во время и после кардиохирургиче-
ских операций роль ЧПЭхоКГ крайне важна. В двух
исследованиях изучали корректность определения
показаний к проведению интраоперационной ЧПЭ-
хоКГ (табл. 4 .2) [58, 59]. Публикаций о сравнении
ЧПЭхоКГ с другими методами диагностики нет, но
крайне трудно представить более высокую скорость
получения данных, чем при ЧПЭхоКГ. Обнаружено,
что индекс локальной сократимости миокарда, по-
лученный при ЧПЭхоКГ перед операцией, является
предиктором необходимости инотропной поддерж-
ки после искусственного кровообращения [60].
КОРОНАРНОЕ ШУНТИРОВАНИЕ
БЕЗ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Одним из трудных вопросов в кардиохирургии яв-
ляется вопрос об эффективности реваскуляризации
коронарных артерий без искусственного кровооб-
ращения. Основная критика сводится к тому, что
частичная реваскуляризация приводит к необходи-
мости повторных операций, а также невозможно-
сти выполнить одновременную коррекцию сопут-
ствующих пороков сердца (например, митральной
регургитации). Согласно исследованию Shroyer [61]
Клинические признаки
Показания (количество пациентов)
Общее количество
пациентов
Нестабильность
гемодинамики
Планирование
хирургического
вмешательства
Травма Гипоксемия
Выраженная дисфункция ЛЖ ± наруше-
ние локальной сократимости миокарда
15
2
–
–
17
Расслоение аорты ± аортальная
регургитация
1
13
–
–
14
Значительная митральная регургитация 4
2
–
–
6
Внутрисердечные/межсосудистые шунты 1
1
–
2
4
Гипердинамическая функция ЛЖ
2
–
1
–
3
Тяжелая дисфункция ПЖ
2
–
1
–
3
Внесердечные тромбы
2
–
–
–
2
Значительная аортальная регургитация
2
–
–
–
2
Значительная трикуспидальная
регургитация
1
–
––
1
Тампонада сердца
1
–
–
–
1
Без признаков
5
1
4
3
13
ЛЖ — левый желудочек; ПЖ — правый желудочек.
[Brandt RR, Oh JK, Abel MD, et al. Role of emergency intraoperative transesophageal echocardiography. J Am Soc Echocardiogr 11:972–977, 1998.]
ТАБЛИЦА 4.2 Показания к проведению интраоперационной чреспищеводной эхокардиографии
ch04.indd 82
03.04.2019 11:39:07
83
4 Интраоперационная эхокардиография
Рис. 4 .11 Визуализация при внутриаортальной баллонной контрпульсации. Баллон находится в грудной части нисходящего отдела аорты. Левая подклю-
чичная артерия визуализируется перед баллоном, который не перекрывает отверстие сосуда.
85
88
Баллон для внутриаортальной контрпульсации
Дуга
аорты
Левая
подключичная
артерия
Баллон
Грудная часть
нисходящего отдела аорты
(период наблюдения 1 год), худшие результаты хи-
рургического вмешательства были в случае неис-
пользования искусственного кровообращения, хотя
в некоторых ситуациях это имело положительный
эффект [62], например у пациентов с атероматозом
аорты [63]. Этот опыт, а также обучение кардиохи-
рургов проведению операций без искусственного
кровообращения были подвергнуты критике. Дис-
куссия по данному вопросу продолжается [63].
Нестабильность гемодинамики может возник-
нуть как вследствие ишемии, так и вследствие нару-
шений сердечно-сосудистой системы из-за исполь-
зования устройств для стабилизации сердца при на-
ложении анастомозов с коронарными артериями
[64]. При операции количество сегментов миокар-
да, доступных для оценки, снижается, но ЧПЭхоКГ
позволяет адекватно оценить нарушения локальной
сократимости миокарда у большинства пациентов
[65] и принять решение о стратегии реваскуляриза-
ции [66]. Есть предположение, что заполнение по-
лости перикарда за сердцем физиологическим рас-
твором повышает качество изображений ЧПЭхоКГ
из трансгастрального доступа [67].
ИМПЛАНТАЦИЯ ВНУТРИСОСУДИСТЫХ УСТРОЙСТВ
ЧПЭхоКГ используют при имплантации различных
внутрисосудистых устройств.
КАТЕТЕРИЗАЦИЯ ЛЕГОЧНОЙ АРТЕРИИ
Дисфункция правых отделов сердца, трикуспидаль-
ная регургитация и фибрилляция предсердий за-
трудняют проведение катетера в легочную артерию.
Использование ЧПЭхоКГ во время операции облег-
чает прохождение катетера через трикуспидальный
клапан и позволяет оценить глубину размещения
катетера в легочной артерии. Это особенно важно в
случаях, когда легочная артерия может быть пересе-
чена, например при трансплантации легких.
ВНУТРИАОРТАЛЬНАЯ БАЛЛОННАЯ КОНТРПУЛЬСАЦИЯ
Баллон для внутриаортальной баллонной контр-
пульсации (ВАБК) лучше всего визуализируется при
ЧПЭхоКГ из среднего отдела пищевода в позиции
нисходящего отдела аорты по длинной оси (рис.
4.11).
Правильное позиционирование катетера — око-
ло нижней границы дуги аорты [68]. Как только на-
чинает визуализироваться конец баллона, необхо-
димо отметить положение метки зонда около угла
рта пациента. Затем зонд медленно вытягивают до
тех пор, пока не начнет визуализироваться устье ле-
вой подключичной артерии, и вновь отмечают по-
ложение метки зонда. Расстояние между баллоном
и устьем левой подключичной артерии должно
быть около 5 см.
ch04.indd 83
03.04.2019 11:39:07
84
ЧАСТЬ I Передовые методы эхокардиографии
УСТРОЙСТВА ВСПОМОГАТЕЛЬНОГО КРОВООБРАЩЕНИЯ
ДЛЯ ЛЕВОГО ЖЕЛУДОЧКА
Устройство вспомогательного кровообращения (УВК)
для ЛЖ отводит кровь из его полости, в результате
давление в ЛП становится ниже давления в правом
предсердии (ПП) (см. главу 30).
Крайне важно определить, есть ли открытое оваль-
ное окно, т.к. через него сброс крови справа налево
будет происходить постоянно. При выявлении в ле-
вых отделах сердца тромбов их следует устранить
до имплантации УВК. Установленный механиче-
ский протез аортального клапана необходимо заме-
нить на биологический, чтобы свести к минимуму
риск тромбоза и эмболии. Стеноз митрального кла-
пана может ограничивать приток крови к УВК.
Обычно в двух- и четырехкамерной позициях при-
точная канюля УВК видна в полости желудочка, а ее
конец — в области верхушки сердца. Необходимо
исключить перекрытие просвета приточной каню-
ли стенками сердца (рис. 4.12). Отточная канюля
УВК располагается в восходящем отделе аорты (рис.
4.13), поэтому крайне важно исключить аорталь-
ную регургитацию, которая может привести к пере-
грузке объемом ЛЖ при направлении кровотока в
аорту и уменьшению кровотока в большом круге
кровообращения из-за рециркуляции в насосе УВК.
При низком внутрисосудистом объеме либо крити-
чески сниженной функции ПЖ может появиться
эффект всасывания, когда стенки ЛЖ втягиваются
в полость и блокируют приток к канюле (рис. 4 .14).
Коррекция такого нарушения заключается в сниже-
нии скорости потока, которую обеспечивает насос,
отведении крови от ЛЖ, увеличении внутрисосуди-
стого объема и поддержании функции ПЖ. В слу-
чае неисправности УВК для ЛЖ может понадобить-
ся повторная операция. Для поиска причины неис-
правности (наличие тромбов внутри сердца либо
проблемы с канюлями) следует использовать ЧПЭ-
хоКГ [69].
В настоящее время созданы УВК для ЛЖ, кото-
рые можно имплантировать транскатетерным пу-
тем (Impella RP, Abiomed, Danvers, MA). Эти УВК
проводят ретроградно через аортальный клапан и
используют в качестве временной поддержки в слу-
чае сердечной недостаточности («мост к восстанов-
лению») при решении вопроса о трансплантации
либо об имплантации устройства для долгосрочной
поддержки. Также УВК имплантируют во время не-
которых процедур, связанных с высоким риском,
например при транскатетерных вмешательствах на
коронарных артериях, аблации желудочковых тахи-
кардий. Проведение ЭхоКГ в момент установки
УВК позволяет правильно позиционировать его в
полости ЛЖ, а также оценить возможные наруше-
ния работы устройства, которые могут привести к
А
Б
В
Рис. 4 .12 Визуализация приточной канюли устройства вспомогательного кровообращения для левого желудочка. Приточная канюля (белые стрел-
ки) свободно стоит в области верхушки и не упирается в межжелудочковую перегородку (красные стрелки). (А, Б) A Доступ из среднего отдела пищевода, че-
тырехкамерная позиция и позиция по длинной оси. (В) A 3D-ЧПЭхоКГ с визуализацией полости левого желудочка. В отверстии приточной канюли нет препят-
ствий кровотоку.
Отточная канюля
ВАо
АК
ЛП
Рис. 4 .13 Визуализация отточной канюли устройства вспомогатель-
ного кровообращения для левого желудочка. Отточная канюля находит-
ся в восходящем отделе аорты (ВАо). АК — аортальный клапан; ЛП — левое
предсердие.
ch04.indd 84
03.04.2019 11:39:08
85
4 Интраоперационная эхокардиография
из них необходима механическая поддержка ПЖ.
Наиболее часто используют УВК с центральной ка-
нюляцией, например Impella (Impella RP Abiomed,
Danvers, MA).
ТОТАЛЬНАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
При развитии терминальной стадии сердечной не-
достаточности, обусловленной право- и левожелу-
дочковой недостаточностью, используют УВК для
обоих желудочков, УВК для ЛП с улучшением рабо-
ты ПЖ и уменьшением легочного сосудистого со-
А
Б
Рис. 4.14 A Гипотензия после имплантации устройства вспомогательного кровообращения для левого желудочка. Эффект всасывания проявля-
ется гипотонией. Доступ из среднего отдела пищевода, четырехкамерная позиция. (А) Полость левого желудочка (белая стрелка) критически мала, а межжелу-
дочковая перегородка и стенки препятствуют потоку крови через канюлю в устройство (красная стрелка). (Б) Турбулентный поток у отверстия канюли (стрелка).
А
Б
Отточная
часть
Насос
Канюля
Приточная
часть
Проводник
+.....+ 5,31 см
Рис. 4.15 Имплантация устройства вспомогательного кровообращения Impella. (А) Кровь идет из левого желудочка (приточная часть канюли) и посту-
пает в аорту (отточная часть канюли). (Б) Доступ из среднего отдела пищевода, позиция по длинной оси левого желудочка. Видны отточная часть канюли (стрел-
ка) над аортальным клапаном и само устройство длиной 5,31 см в полости левого желудочка.
дисфункции митрального клапана. Оценку аор-
тального клапана лучше всего проводить по длин-
ной оси, а митрального клапана — под разными
углами для исключения осложнений (рис. 4 .15).
УСТРОЙСТВА ВСПОМОГАТЕЛЬНОГО КРОВООБРАЩЕНИЯ
ДЛЯ ПРАВОГО ЖЕЛУДОЧКА
При имплантации УВК для ПЖ крайне нежелатель-
но затрагивать трикуспидальный клапан. Дисфунк-
ция ПЖ после установки УВК для ЛЖ отмечается у
40% пациентов, но только небольшому количеству
ch04.indd 85
03.04.2019 11:39:08
86
ЧАСТЬ I Передовые методы эхокардиографии
А
Б
Систола
ЛП
Диастола
МК
АК
Рис. 4 .16 Искусственное сердце. При имплантации искусственного сердца желудочки с атриовентрикулярными клапанами вырезают, а предсердия соединяют
с искусственным сердцем. (А) A При ЧПЭхоКГ наблюдается адекватная функция протезированного митрального клапана (МК) со струей регургитации (стрелка)
во время систолы. (Б) Внешний вид левой стороны искусственного сердца перед трансплантацией. АК — аортальный клапан; ЛП — левое предсердие.
А
Б
В
НПВ
ВПВ
ТК
ПЖ
ПП
Рис. 4 .17 Вено-венозная экстракорпоральная мембранная оксигенация. (A) Двухпросветную канюлю Avalon (Maquet, Rastatt, Germany) для вено-веноз-
ной экстракорпоральной мембраной оксигенации проводят через верхнюю полую вену в нижнюю. Катетер введен по внутренней яремной вене и продвинут вглубь
для облегчения забора венозной крови из нижней полой вены (НПВ) и верхней полой вены (ВПВ). Отверстие в канюле расположено напротив трикуспидального
клапана (ТК) (черная стрелка). Оксигенированная кровь проходит назад через канюлю и возвращается на уровне трикуспидального клапана (красная стрелка).
(Б) A Трансгастральный доступ, позиция правого желудочка (ПЖ) по длинной оси. Визуализируется также правое предсердие (ПП). Венозная кровь идет из по-
лых вен (желтые стрелки), а оксигенированная кровь проходит назад через канюлю и возвращается на уровне трикуспидального клапана (красная стрелка). (В) A
Цветовая допплерография. Виден поток крови из канюли к трикуспидальному клапану (стрелка) [A — Souilamas R, Souilamas J, Alkhamees K, et al. Extra corporal
membrane oxygenation in general thoracic surgery: a new single veno-venous cannulation. J Cardiothorac Surg 6:52–54 , 2011].
противления, а также имплантируют искусственное
сердце. Эхокардиографическая визуализация ис-
кусственного сердца ограничена из-за его механиче-
ских клапанов и плохого прохождения ультразвуко-
вого луча через механические части устройства. В
большинстве случаев у пациентов оставляют соб-
ственные предсердия. Часто наблюдается тампона-
да сердца. Применение ТТЭхоКГ имеет ограниче-
ния, поэтому для исключения нарушений наполне-
ния предсердий из-за скопившейся крови в
перикарде нередко используют ЧПЭхоКГ (рис.
4.16).
ВЕНОВЕНОЗНАЯ ЭКСТРАКОРПОРАЛЬНАЯ
МЕМБРАННАЯ ОКСИГЕНАЦИЯ
У пациентов с дыхательной недостаточностью, не-
восприимчивой к терапии и не контролируемой с
помощью искусственной вентиляции легких, но с
сохранной функцией сердца для поддержания
функции легких можно использовать вено-веноз-
ную экстракорпоральную мембранную оксигена-
цию. Для этого двухпросветную канюлю вводят в
ПП по внутренней яремной вене. Венозная кровь
попадает в оксигенатор, где происходит насыщение
крови кислородом и удаление углекислого газа. За-
тем кровь поступает обратно в ПП. Для размещения
одного просвета канюли напротив трикуспидально-
го клапана используют ЧПЭхоКГ, чтобы убедиться,
что оксигенированная кровь попадает в ПЖ (рис.
4.17).
КАНЮЛЯЦИЯ КОРОНАРНОГО СИНУСА
Коронарный синус канюлируют вслепую через про-
кол ПП для ретроградной кардиоплегии при мало-
ch04.indd 86
03.04.2019 11:39:10
87
4 Интраоперационная эхокардиография
гут возникнуть проблемы, связанные с длительно-
стью ишемии органа. При подозрении на обструк-
цию визуализируют все имеющиеся анастомозы.
ТРАНСПЛАНТАЦИЯ ЛЕГКИХ
Во время трансплантации легких ЧПЭхоКГ исполь-
зуют для оценки сосудистых анастомозов. Обычно
хорошо визуализируются анастомозы легочных вен.
Об отсутствии значительной обструкции свидетель-
ствует скорость кровотока < 1 м/сек [70, 71]. Ана-
стомоз правой легочной артерии (реже левой) оце-
нивают из верхнего отдела пищевода в позиции
восходящего отдела аорты по короткой оси, однако
эта область сложна для визуализации.
Возможна обструкция выходного тракта правого
желудочка после возобновления перфузии транс-
плантированных легких в случае исходной гипер-
трофии ПЖ.
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
При реперфузии трансплантированной печени мо-
жет произойти значительная эмболизация правых
отделов сердца с нарушением гемодинамики. Для
диагностики и принятия решения о тактике лечения
используют ЧПЭхоКГ.
АЛЬТЕРНАТИВНАЯ ТЕХНИКА
ЭПИКАРДИАЛЬНАЯ И ЭПИАОРТАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Если есть противопоказания к проведению ЧПЭхоКГ
либо оптимальная визуализация невозможна, кар-
диохирург может получить стандартные эхокардио-
графические изображения во время операции, уста-
новив на сердце высокочастотный ультразвуковой
датчик в стерильном чехле [72]. Аналогично можно
исследовать восходящий отдел аорты для выявле-
ния атероматоза аорты перед ее пережатием [73].
0°
121°
А
Б
Канюля
ПП
ПП
КС
КС
ЛП
Рис. 4 .18 Позиционирование канюли в коронарном синусе. Коронарный синус (КС) визуализируется из нижнего отдела пищевода (А) либо из среднего от-
дела пищевода в бикавальной позиции (Б). На (А) видно, что катетер введен в правое предсердие (ПП) и заходит в устье коронарного синуса. ЛП — левое пред-
сердие.
ПП
НПВ
ЛП
ВПВ
Рис. 4 .19 Позиционирование канюли в бедренной вене. Канюля (стрел-
ка) с множеством отверстий введена по бедренной вене в правое предсердие
(ПП) через нижнюю полую вену (НПВ). ВПВ — верхняя полая вена; ЛП — ле-
вое предсердие.
инвазивном хирургическом вмешательстве. Иногда
для контроля проводят ЧПЭхоКГ (рис. 4 .18).
КАНЮЛЯЦИЯ БЕДРЕННОЙ ВЕНЫ
Иногда забор венозной крови при искусственном
кровообращении выполняют через бедренную вену
с введением канюли в ПП и затем в верхнюю полую
вену (рис. 4 .19).
ТРАНСПЛАНТАЦИЯ
ТРАНСПЛАНТАЦИЯ СЕРДЦА
ЧПЭхоКГ используют для оценки состояния сердца
донора перед забором и после отключения реципи-
ента от искусственного кровообращения, когда мо-
ch04.indd 87
03.04.2019 11:39:12
88
ЧАСТЬ I Передовые методы эхокардиографии
и установили, что интраоперационная ЧПЭхоКГ у
52 пациентов (10%) выявила особенности, которые
повлияли на тактику хирургического лечения 21 па-
циента (3,4%) (табл. 4 .4). Часто это было не диагно-
стированное ранее открытое овальное окно. После
операции у 15 пациентов было обнаружено 19 осо-
бенностей, и 10 пациентам понадобилось повторное
хирургическое вмешательство (см. табл. 4 .4).
При ретроспективном анализе 2343 кардиохи-
рургических пациентов после вмешательства Forrest
и соавт. [78] установили, что результаты интраопе-
рационной ЧПЭхоКГ изменили тактику хирургиче-
ского лечения в 4,5% случаев. При анализе пациен-
тов после коронарного шунтирования изменение
тактики произошло в 6,7% случаев у пациентов с
высоким риском и в 2,8% случаев у пациентов с
низким риском. В обоих исследованиях также оце-
нивали, приводит ли дополнительное эхокардио-
ПОСЛЕОПЕРАЦИОННЫЕ РЕЗУЛЬТАТЫ
И ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
В табл. 4 .3 приведены рекомендации American Soci-
ety of Anesthesiologists, Society of Cardiovascular An-
esthesiologists по использованию ЧПЭхоКГ в усло-
виях операционной [74] и European Association of
Echocardiography по использованию ЧПЭхоКГ в об-
щей хирургии и кардиохирургии [75]. В рекоменда-
циях [76] также перечислены противопоказания к
проведению ЧПЭхоКГ и требования к знаниям вра-
чей. Во всех случаях преимущества ЧПЭхоКГ следу-
ет оценивать с учетом осложнений после этого ис-
следования, которые составляют около 0,2% [74].
Всегда следует рассматривать альтернативные мето-
ды диагностики.
Qaddoura и соавт. исследовали 474 пациента, ко-
торым проводили коронарное шунтирование [77],
Клиническая ситуация
Рекомендации ASA/SCA [53]
Рекомендации EAE [54]
Кардиохирургическое вмешатель-
ство (не коронарное шунтирова-
ние) и хирургическое вмешатель-
ство на грудной части нисходя-
щего отдела аорты
Следует проводить всем взрослым
пациентам, которые не имеют
противопоказаний к ЧПЭхоКГ
Необходимо проводить взрослым пациентам
до кардиохирургического вмешательства
либо до операции на грудной части нисхо-
дящего отдела аорты под общей анестезией,
а также при пластике клапанов
Коронарное шунтирование
Следует проводить перед КШ для уточ-
нения или подтверждения диагноза,
поиска новой патологии, для коррек-
тировки анестезиологического пособия
и плана оперативного вмешательства
на основе полученных данных
Транскатетерное внутрисердечное
вмешательство
Рекомендовано
Некардиохирургическое
вмешательство
Следует проводить, если характер запла-
нированной операции или диагности-
рованная либо подозреваемая сер-
дечно-сосудистая патология может
привести к серьезному осложнению
(нарушению гемодинамики, невроло-
гическим расстройствам)
Следует проводить при наличии
необъяснимого и жизнеугрожающего
нарушения гемодинамики, которое
не купируется лекарственными
средствами
Проводят пациентам, которым предстоит
перенести обширную операцию: нейрохи-
рургическое вмешательство (высокий риск
венозной тромбоэмболии), трансплантацию
печени и/или легких, вмешательство
на сосудах, включая травму
Проводят пациентам, которые перенесли
обширное оперативное (некардиохирурги-
ческое) вмешательство и у которых есть
серьезное либо жизнеугрожающее наруше-
ние гемодинамики
Можно провести при обширных некардиохи-
рургических вмешательствах пациентам
с высоким риском сердечно-сосудистых
заболеваний, включая тяжелую клапанную
патологию, ишемическую болезнь сердца
и сердечную недостаточность
Интенсивная терапия
Следует проводить пациентам в крити-
ческом состоянии, когда необходимая
диагностическая информация
не может быть получена с помощью
ТТЭхоКГ либо другими методами
Проводят пациентам в критическом состоя-
нии с серьезными или жизнеугрожающими
нарушениями гемодинамики, которые
не купируются лекарственными средствами,
а также при подозрении на сердечно-сосу-
дистое заболевание
ASA — American Society of Anesthesiologists; EAE — European Association of Echocardiography; SCA — Society of Cardiovascular Anesthesiolo-
gists; КШ — коронарное шунтирование; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиогра-
фия.
ТАБЛИЦА 4.3 Рекомендации по проведению чреспищеводной эхокардиографии взрослым пациентам
ch04.indd 88
03.04.2019 11:39:12
89
4 Интраоперационная эхокардиография
графическое обследование к улучшению результа-
тов лечения.
В исследованиях, проведенных в Австралии [79],
Европе [51, 80], Канаде [81] и Индии [82], было от-
мечено, что использование ЧПЭхоКГ при планиро-
вании хирургического вмешательства (например,
коронарного шунтирования) привело к улучшению
результатов. Также оценивали влияние данных ин-
траоперационной ЧПЭхоКГ на успешность лечения.
Результаты исследований обобщены в табл. 4 .5 .
Bergquist и соавт. [83, 84] сравнили результаты
интраоперационной ЧПЭхоКГ в режиме реального
времени, которую выполнили 5 анестезиологов, с
результатами исследований, которые провели 2 дру-
гих врача, по следующим показателям: наполнение
ЛЖ, ФВ и локальная сократимость миокарда. В 75%
случаев разброс показателей ФВ и наполнения ЛЖ
был не более 10%. Точность оценки локальной со-
кратимости миокарда была вариабельна, но резуль-
таты были лучше у анестезиологов с высоким уров-
нем подготовки. В исследовании также установили,
что интраоперационная ЧПЭхоКГ сыграла наиболее
важную роль в 17% случаев. Отсутствуют исследо-
вания, которые подтверждают, что оценка с помо-
щью ЧПЭхоКГ всегда правильная и многие вмеша-
тельства не были бы проведены при использовании
только традиционных методов диагностики.
Mathew и соавт. [85] показали, что уровень под-
готовки анестезиологов сопоставим с уровнем под-
готовки врачей, для которых ЧПЭхоКГ является ос-
новным видом деятельности.
Была рассчитана экономическая эффективность
использования ЧПЭхоКГ при хирургическом лече-
нии врожденных пороков сердца [86], плановой кар-
диоверсии [87] и определении длительности лече-
ния антибиотиками в случае инфекционного эндо-
кардита [88]. Данные об использовании ЧПЭхоКГ
при коронарном шунтировании отсутствуют.
Fanshawe и соавт. [89] выявили значительную
экономическую эффективность при рутинном ис-
Особенности,
обнаруженные
перед искусственным
кровообращением
(n=52)
n
Влияние результатов
на хирургическую
тактику (n = 21)
n
Особенности,
обнаруженные
после искусственного
кровообращения
(n=15)
n
Влияние результатов
на хирургическую
тактику (n = 10)
n
ООО
22
Закрытие ООО
7
Значительная МР
3
Пластика МК
2
ПМКсМР
3
Не влияет
–
Нарушение функции
сердца
3
Оценка проходимости
шунтов
3
Значительная МР (5),
ТР (4), АР (3)
12
Пластика МК (2),
ТК (2), АК (1)
5
Снижение ФВЛЖ
6
Ревизия шунтов
5
Патология аорталь-
ного клапана (уме-
ренный стеноз)
2
Ревизия АК
2
Новые нарушения
локальной сократи-
мости миокарда
7
Установка баллона
для ВАБК
5
Подклапанный стеноз
аортального клапана
1
Миоэктомия
1
Новые нарушения
локальной сократи-
мости миокарда
и снижение функции
ПЖ или ЛЖ
2
Улучшение систоличе-
ской функции ЛЖ
4
Отмена ВАБК
4
Динамическая
обструкция
1
Лекарственная терапия –
Атерома аорты
5
Коронарное
шунтирование
без искусственного
кровообращения
2
Снижение функции
ПЖиЛЖ
2
Не влияет
–
Нарушение локальной
сократимости
миокарда
1
Не влияет
–
АК — аортальный клапан; АР — аортальная регургитация; ВАБК — внутриаортальная баллонная контрпульсация; ЛЖ — левый желудо-
чек; МК — митральный клапан; МР — митральная регургитация; ООО — открытое овальное окно; ПЖ — правый желудочек; ПМК —
пролапс митрального клапана; ТК — трикуспидальный клапан; ТР — трикуспидальная регургитация; ФВЛЖ — фракция выброса лево-
го желудочка.
[Qaddoura FE, Abel MD, Mecklenburg KL, et al. Role of intraoperative transesophageal echocardiography in patients having coronary artery bypass
graft surgery. Ann Thorac Surg 78:1586–1590, 2004.]
ТАБЛИЦА 4.4 Особенности, обнаруженные при интраоперационной чреспищеводной эхокардиографии во время
коронарного шунтирования, и влияние ее результатов на тактику хирургического лечения
ch04.indd 89
03.04.2019 11:39:13
90
ЧАСТЬ I Передовые методы эхокардиографии
Первый автор,
год исследования
Популяция/количество
вмешательств
Операция
Изменение тактики лечения, n/%
Отдаленные
результаты
Bergquist, 1996 [83, 84] n = 75/584
РКА
98/17% общего количества всех
вмешательств
Нет
Savage, 1997 [96]
n = 82 (с высоким
риском)
РКА
Изменение тактики хирургического
лечения: 27/33% общего количества
всех пациентов
Коррекция гемодинамики: 42/51%
общего количества всех пациентов
Соответствуют
первичным
данным
Sutton, 1998 [79]
n=120
РКА
16/13% общего количества всех
пациентов
Нет
Kolev, 1998 [51]
n = 224/2232
К, НК
560/25% общего количества всех
вмешательств
Нет
Couture, 2000 [81]
n=851
К
125/15% общего количества всех
пациентов
Нет
Mishra, 1998 [82]
n=5016
К
1146/23% общего количества всех
пациентов
Нет
Click, 2000 [75]
n=3245
К
441/14% общего количества всех
пациентов (перед искусственным
кровообращением)
121/4% общего количества всех
пациентов (после искусственного
кровообращения)
Нет
Qaddoura, 2004 [77]
n=474
РКА
21/4% общего количества всех
пациентов (перед искусственным
кровообращением)
19/4% общего количества всех
пациентов (после искусственного
кровообращения)
Нет
Forrest, 2002 [78]
n = 1785,
из них
РКА
62/3,5% общего количества всех
пациентов
Нет
низкий риск n = 821
2,8%
умеренный риск n = 696
2,9%
высокий риск n = 268
6,7%
К — кардиохирургические операции (коронарные и некоронарные); НК — некардиохирургические операции; РКА — реваскуляризация
коронарных артерий.
ТАБЛИЦА 4.5 Результаты исследований, в которых изменили тактику лечения кардиохирургических пациентов
после интраоперационной чреспищеводной эхокардиографии
пользовании ЧПЭхоКГ у кардиохирургических па-
циентов, но не при проведении коронарного шун-
тирования. В ряде случаев на основании результа-
тов интраоперационной ЧПЭхоКГ операцию либо
отменяли, либо рекомендовали другое вмешатель-
ство, однако привело ли изменение тактики лечения
к положительным результатам, установлено не бы-
ло. В большинстве случаев все сводилось к закры-
тию ранее не выявленного открытого овального ок-
на. Результаты обобщены и приведены в табл. 4 .6 .
Eltzschig и соавт. [90] провели крупномасштабное
(12 566 пациентов) ретроспективное исследование
влияния ЧПЭхоКГ на принятие решений в кардио-
хирургии. В период с 1990 по 2004 г. частота прове-
дения интраоперационной ЧПЭхоКГ неуклонно рос-
ла. Большинство вмешательств были скорректиро-
вано с учетом результатов ЧПЭхоКГ, проведенной
как до, так и после искусственного кровообращения
(табл. 4 .7). Как отмечено в сопроводительной пуб-
ликации [91], изменения тактики терапевтического
лечения, различия в показателях заболеваемости и
смертности неубедительны, однако полученные
данные могут послужить отличной основой для но-
вого рандомизированного контролируемого иссле-
дования с целью изучения преимуществ интраопе-
рационной ЧПЭхоКГ.
Влияние оценки функции желудочков при не-
кардиохирургических вмешательствах не было глу-
боко изучено. Hofer и соавт. [92] провели проспек-
тивное исследование пациентов с высоким риском
ишемии миокарда, которым выполняли сложные
некардиохирургические вмешательства. Во многих
ch04.indd 90
03.04.2019 11:39:13
91
4 Интраоперационная эхокардиография
Запланированная операция
Выполненная операция
Особенности
Количество пациентов
КШ
КШ + протезирование ТК
ТР (4+)
1
Протезирование МК
Пластика МК
Пролапс сегмента P2
1
КШ
КШ + протезирование МК
МР (4+)
1
КШ + протезирование МК
КШ
МР (1+)
1
Протезирование МК
—
МР (1+)
2
Примечание. Ожидаемые ежегодные затраты (в US$) на ЧПЭхоКГ для 4 операционных: общая стоимость = $193 800, в которую входят за-
траты на ультразвуковое устройство — $100 000; обслуживание — $25 000; замена/ремонт датчиков — $64 000; чистка — $1200; хране-
ние/видео — $3600.
* Исключая пациентов с открытым овальным окном.
КШ — коронарное шунтирование; МК — митральный клапан; МР — митральная регургитация; ТК — трикуспидальный клапан; ТР —
трикуспидальная регургитация; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Fanshawe M, Ellis C, Habib S, et al. A retrospective analysis of the costs and benefits related to alterations in cardiac surgery from routine intraop-
erative transesophageal echocardiography. Anesth Analg 95:824–827, 2002.]
ТАБЛИЦА 4.6 Ретроспективный анализ рутинного использования чреспищеводной эхокардиографии в кардиохирургии*
Вид хирургического вмешательства
Перед искусственным
кровообращением (%)
После искусственного
кровообращения (%)
Все пациенты (n = 12 566)
7
2,2
КШ (n = 3835)
5,4
1,5
Только клапан (n = 3840)
6,3
3,3
КШ + клапан (n = 2944)
12,3
2,2
КШ — коронарное шунтирование; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Eltzschig HK, Rosenberger P, Loffler M, et al. Impact of intraoperative transesophageal echocardiography on surgical decisions in 12,566 patients
undergoing cardiac surgery. Ann Thorac Surg 85: 845–853, 2008.]
ТАБЛИЦА 4.7 Влияние результатов интраоперационной чреспищеводной эхокардиографии
на решение о виде хирургического вмешательства
Дооперационный диагноз Всего, n
Новая терапия либо изменение терапии
Вазодилататоры, n (%)
Вазопрессоры, n (%)
Жидкость, n (%)
ИБС
61
36 (59)
28 (46)
11 (18)
ИБС + клапан
13
7 (54)
5 (39)
5 (39)
Клапан
11
4 (36)
3 (27)
2 (18)
Нарушение локальной
сократимости миокарда
28
26 (93)*
20 (71)*
9 (32)
ФВ<40%
15
8 (53)
6 (40)
1 (7)
Левожелудочковая
недостаточность
10
8 (80)*
3 (30)
1 (10)
Легочная артериальная
гипертензия
11
8 (73)*
8 (73)*
4 (36)
Правожелудочковая
недостаточность
10
7 (70)*
5 (50)
2 (20)
Всего
99
54 (55)
43 (43)
24 (24)
* p<0,05.
ИБС — ишемическая болезнь сердца; ФВ — фракция выброса; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Hofer CK, Zollinger A, Rak M, et al. Therapeutic impact of intra-operative transesophageal echocardiography during noncardiac surgery. Anaesthe-
sia 59:3–9, 2004.]
ТАБЛИЦА 4.8 Дооперационный диагноз и изменение тактики лечения после интраоперационной
чреспищеводной эхокардиографии
ch04.indd 91
03.04.2019 11:39:13
92
ЧАСТЬ I Передовые методы эхокардиографии
Параметр/объект/
вмешательство
Основные позиции
и методы оценки
Дополнительный метод
Комментарии
Диастолическая
функция
Визуализация из среднего отдела
пищевода в четырехкамерной
позиции с помощью импуль-
сно-волновой допплерографии
(предпочтительно)
Визуализация митрального
клапана с помощью ткане-
вой допплерографии
для расчета отношения E/e′
Визуализация легочных вен
с помощью импульсно-
волновой допплерографии
Объем ЛЖ
Визуализация из среднего отдела
пищевода по короткой
и длинной осям в конце
систолы и диастолы с исполь-
зованием бипланарного метода
Симпсона
Сердечный выброс
Визуализация из среднего отдела
пищевода по длинной оси ЛЖ
для расчета площади ВТЛЖ
по его диаметру
Оценка площади ЛЖ
в 3D-режиме, мультипла-
нарная реконструкция
ВТЛЖ и планиметрия
площади ВТЛЖ
Измерять ВТЛЖ следует во время
систолы
Фракция выброса
Визуализация из трансгастраль-
ного доступа в позиции сред-
него отдела ЛЖ по короткой
оси (папиллярные мышцы)
для расчета фракции изменения
площади ЛЖ во время систолы
и во время диастолы. Данный
метод имеет ограничения
Аналогичные расчеты
с помощью бипланарного
метода Симпсона
Визуализация митрального
клапана из среднего отдела пище-
вода в четырехкамерной позиции
для расчета объема ЛЖ
с помощью записи во время
нескольких сердечных циклов
Для расчета объема следует
использовать программное
обеспечение для 3D-режима
Другие параметры
сократительной
функции
Визуальная оценка утолщения
миокарда и эндокарда в различ-
ных сегментах желудочков
Визуализация митрального
клапана из среднего отдела
пищевода в четырехкамер-
ной позиции с помощью
тканевой допплерографии
Измерение скорости смещения
фиброзного кольца трикуспи-
дального клапана во время
систолы (s′)
Деформация
Визуализация из среднего отдела
пищевода и трансгастрального
доступа в позиции среднего
отдела ЛЖ по короткой оси
(папиллярные мышцы)
для измерения деформации
с помощью спекл-трекинг
ЭхоКГ
Крайне важно определить изучае-
мую анатомическую область
СВОДНАЯ ИНФОРМАЦИЯ
Основные задачи интраоперационной эхокардиографии
случаях после ЧПЭхоКГ в терапевтическое лечение
были внесены изменения (табл. 4 .8). В других ис-
следованиях также приведены данные об измене-
нии тактики лечения после проведения ЧПЭхоКГ
во время некардиохирургического вмешательства
[93, 94], однако данные об экономической эффек-
тивности не представлены. Авторы отмечают, что
трудно провести рандомизированное контролируе-
мое клиническое исследование по оценке влияния
интраоперационной ЧПЭхоКГ на терапию.
Хотя в настоящее время отсутствуют данные об
улучшении результатов лечения после интраопера-
ционной ЧПЭхоКГ, она стала важным инструмен-
том для оценки функции желудочков и клапанов во
время кардиохирургического вмешательства, при им-
плантации УВК и трансплантации органов. Следует
подчеркнуть, что решающее значение для правиль-
ной интерпретации данных имеют надлежащая
подготовка врачей и обеспечение высокого качества
исследований.
ch04.indd 92
03.04.2019 11:39:13
93
4 Интраоперационная эхокардиография
Параметр/объект/
вмешательство
Основные позиции
и методы оценки
Дополнительный метод
Комментарии
Функция ПЖ
Визуализация из трансгастраль-
ного доступа для измерения
TAPSE в М-режиме
Визуализация латеральной
части фиброзного кольца
трикуспидального клапана
и измерение скорости s′
с помощью тканевой
допплерографии
Ультразвуковой луч направляют
параллельно латеральной части
фиброзного кольца трикуспи-
дального клапана
Локальная
сократимость
миокарда
Визуальная оценка толщины
эндокарда и миокарда
Оценка деформации
с помощью спекл-трекинг
ЭхоКГ
Применение 3D-режима
Положение баллона
для ВАБК
Визуализация баллона для ВАБК
в нисходящем отделе аорты
Визуализация баллона
(может помочь вре
́
менная
приостановка его работы)
Визуализация левой подключич-
ной артерии. Оценка расстояния
между баллоном и устьем левой
подключичной артерии
Положение приточной
канюли УВК для ЛЖ
Визуализация из среднего отдела
пищевода в четырехкамерной
и двухкамерной позициях ЛЖ
Оценка положения кончика
канюли относительно
стенок желудочка
Применение цветовой допплеро-
графии для измерения скорости
кровотока. Для визуализации
канюли можно использовать
3D-режим
Положение отточной
канюли УВК для ЛЖ
Визуализация из среднего
отдела пищевода в позиции
по длинной оси
Измерение скорости крово-
тока с помощью цветовой
допплерографии
Визуализация канюли в восходя-
щем отделе аорты
УВК Impella
Визуализация из среднего
отдела пищевода в позиции
по длинной оси для оценки
расположения устройства
в полости ЛЖ
Исключение патологии
аортального клапана
Оценка функции митрального
клапана
Искусственное сердце Визуализация из среднего отдела
пищевода в четырехкамерной
позиции атриовентрикулярных
клапанов
Визуализация аортального
клапана и клапана легочной
артерии из среднего отдела
пищевода в позиции по
длинной оси
Поиск центральных струй потока.
Всегда следует исключать тампо-
наду сердца
Вено-венозная ЭКМО Визуализация из трансгастраль-
ного доступа в бикавальной
позиции по длинной оси
правых отделов сердца, полых
вен и трикуспидального
клапана
Визуализация с помощью
цветовой допплерографии
потока из устройства
в полость ПЖ через трику-
спидальный клапан
Канюляция
коронарного синуса
Визуализация из среднего отдела
пищевода в четырехкамерной
позиции со сгибанием зонда
кзади
Визуализация в бикавальной
позиции двух полых вен
с поворотом датчика
медиально
Канюляция бедренной
вены
Визуализация в бикавальной
позиции
Визуализация двух полых вен
Трансплантация сердца
и легких
Визуализация анастомозов
Использование допплерографии
при возможности
Эпикардиальная/эпиаортальная
эхокардиография
Проводит хирург, используя сте-
рильный датчик. Убедитесь, что
датчик закреплен надежно и не
контаминируется
TAPSE — систолическое смещение фиброзного кольца трикуспидального клапана; ВАБК — внутриаортальная баллонная контрпульса-
ция; ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; ПЖ — правый желудочек; УВК — устройство для вспомога-
тельного кровообращения; ЭКМО — экстракорпоральная мембранная оксигенация; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Основные задачи интраоперационной эхокардиографии
ch04.indd 93
03.04.2019 11:39:13
94
ЧАСТЬ I Передовые методы эхокардиографии
ЛИТЕРАТУРА
1. Denault AY, Couture P, Buithieu J, et al. Left
and right ventricular diastolic dysfunction as
predictors of difficult separation from car-
diopulmonary bypass, Can J Anaesth 53:1020–
1029, 2006.
2. Pauliks LB, Undar A, Clark JB, Myers JL: Seg-
mental differences of impaired diastolic re-
laxation following cardiopulmonary bypass
surgery in children: a tissue Doppler study,
Artif Organs 33:904–908, 2009.
3. Tsang MW, Davidoff R, Korach A, et al. Di-
astolic dysfunction after coronary artery by-
pass grafting — the effect of glucose-insu-
lin-potassium infusion, J Card Surg 22:185–
191, 2007.
4. Swenson JD, Bull D, Stringham J: Subjective
assessment of left ventricular preload using
transesophageal echocardiography: correspon-
ding pulmonary artery occlusion pressures,
J Cardiothorac Vasc Anesth 15:580–583, 2001.
5. Ho CY, Solomon SD: A clinician’s guide to
tissue Doppler imaging, Circulation 113:e396–
e398, 2006.
6. Kumar K, Nepomuceno RG, Chelvanathan A,
et al. The role of tissue Doppler imaging in
predicting left ventricular filling pressures in
patients undergoing cardiac surgery: an intra-
operative study, Echocardiography 30:271–
278, 2013.
7. Masutani S, Little WC, Hasegawa H, et al. Re-
strictive left ventricular filling pattern does
not result from increased left atrial pressure
alone, Circulation 117:1550–1554, 2008.
8. Djaiani GN, McCreath BJ, Ti LK, et al. Mitral
flow propagation velocity identifies patients
with abnormal diastolic function during cor-
onary artery bypass graft surgery, Anesth An-
alg 95:524–530, 2002.
9. McIlroy DR, Lin E, Durkin C: Intraoperative
transesophageal echocardiography: a critical
appraisal of its current role in the assessment
of diastolic dysfunction, J Cardiothorac Vasc
Anesth 29:1033–1043, 2015.
10. Lang RM, Bierig M, Devereux RB, et al. Rec-
ommendations for chamber quantification: a
report from the American Society of Echocar-
diography’s Guidelines and Standards Com-
mittee and the Chamber Quantification Writ-
ing Group, developed in conjunction with the
European Association of Echocardiography, a
branch of the European Society of Cardiolo-
gy, J Am Soc Echocardiogr 18:1440–1463, 2005.
11. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, Eur Heart J Cardio-
vasc Imaging 16:233–270, 2015.
12. Cheung AT, Savino JS, Weiss SJ, et al. Echo-
cardiographic and hemodynamic indexes of
left ventricular preload in patients with nor-
mal and abnormal ventricular function, An-
esthesiology 81:376–387, 1994.
13. Colombo PC, Municino A, Brofferio A, et al.
Cross-sectional multiplane transesophageal
echocardiographic measurements: compari-
son with standard transthoracic values ob-
tained in the same setting, Echocardiography
19:383–390, 2002.
14. Shiota T: Clinical Application of 3-Dimen-
sional Echocardiography in the USA, Circ J
79:2287–2298, 2015.
15. Chahal NS, Lim TK, Jain P, et al. Popula-
tion-based reference values for 3D echocar-
diographic LV volumes and ejection fraction,
JACC Cardiovasc Imaging 5:1191–1197, 2012.
16. Ruddox V, Edvardsen T, Baekkevar M, Ot-
terstad JE: Measurements of left ventricular
volumes and ejection fraction with three-di-
mensional echocardiography: feasibility and
agreement compared to two-dimensional echo-
cardiography, Int J Cardiovasc Imaging 30:
1325–1330, 2014.
17. Muraru D, Badano LP, Peluso D, et al. Com-
prehensive analysis of left ventricular geom-
etry and function by three-dimensional echo-
cardiography in healthy adults, J Am Soc
Echocardiogr 26:618–628, 2013.
18. Meris A, Santambrogio L, Casso G, et al. Intra-
operative three-dimensional versus two-dimen-
sional echocardiography for left ventricular as-
sessment, Anesth Analg 118:711–720, 2014.
19. Corsi C, Lang RM, Veronesi F, et al. Volumet-
ric quantification of global and regional left
ventricular function from real-time three-di-
mensional echocardiographic images, Circu-
lation 112:1161–1170, 2005.
20. Samstad SO, Torp HG, Linker DT, et al. Cross
sectional early mitral flow velocity profiles
from colour Doppler, Br Heart J 62:177–184,
1989.
21. Savino JS, Troianos CA, Aukburg S, et al.
Measurement of pulmonary blood flow with
transesophageal two-dimensional and Dop-
pler echocardiography, Anesthesiology 75:
445–451, 1991.
22. Parra V, Fita G, Rovira I, et al. Transoesoph-
ageal echocardiography accurately detects
cardiac output variation: a prospective com-
parison with thermodilution in cardiac sur-
gery, Eur J Anaesthesiol 25:135–143, 2008.
23. Lodato JA, Weinert L, Baumann R, et al. Use
of 3-dimensional color Doppler echocardiog-
raphy to measure stroke volume in human
beings: comparison with thermodilution, J Am
Soc Echocardiogr 20:103–112, 2007.
24. Shahgaldi K, Manouras A, Brodin LA, Winter
R: Direct measurement of left ventricular
outflow tract area using three-dimensional
echocardiography in biplane mode improves
accuracy of stroke volume assessment, Echo-
cardiography 27:1078–1085, 2010.
25. Montealegre-Gallegos M, Mahmood F, Owais
K, et al. Cardiac output calculation and
three-dimensional echocardiography, J Car-
diothorac Vasc Anesth 28:547–550, 2014.
26. Silva CD, Pedro F, Deister L, et al. Two-di-
mensional color Doppler echocardiography
for left ventricular stroke volume assessment:
a comparison study with three-dimensional
echocardiography, Echocardiography 29:766–
772, 2012.
27. Gorcsan JD, Diana P, Ball BA, Hattler BG: In-
traoperative determination of cardiac output
by transesophageal continuous wave Dop-
pler, Am Heart J 123:171–176, 1992.
28. Maslow A, Comunale ME, Haering JM, Wat-
kins J: Pulsed wave Doppler measurement of
cardiac output from the right ventricular out-
flow tract, Anesth Analg 83:466–471, 1996.
29. Royse CF, Connelly KA, MacLaren G, Royse
AG: Evaluation of echocardiography indices
of systolic function: a comparative study us-
ing pressure-volume loops in patients under-
going coronary artery bypass surgery, Anaes-
thesia 62:109–116, 2007.
30. Galiuto L, Ignone G, DeMaria AN: Contrac-
tion and relaxation velocities of the normal
left ventricle using pulsed-wave tissue Dop-
pler echocardiography, Am J Cardiol 81:609–
614, 1998.
31. Adel W, Roushdy AM, Nabil M: Mitral annu-
lar plane systolic excursion-derived ejection
fraction: a simple and valid tool in adult
males with left ventricular systolic dysfunc-
tion, Echocardiography 33:179–184, 2015.
32. Tousignant C: CON: Intraoperative Doppler
tissue imaging is a valuable addition to cardi-
ac anesthesiologists’ armamentarium, Anesth
Analg 108:41–47, 2009.
33. Simmons LA, Weidemann F, Sutherland GR,
et al. Doppler tissue velocity, strain, and strain
rate imaging with transesophageal echocardi-
ography in the operating room: a feasibility
study, J Am Soc Echocardiogr 15:768–776,
2002.
34. Maclaren G, Kluger R, Prior D, et al. Tissue
Doppler, strain, and strain rate echocardiog-
raphy: principles and potential perioperative
applications, J Cardiothorac Vasc Anesth 20:
583–593, 2006.
35. Mondillo S, Galderisi M, Mele D, et al. Speck-
le-tracking echocardiography: a new tech-
nique for assessing myocardial function, J Ul-
trasound Med 30:71–83, 2011.
36. Gorcsan 3rd J: Tanaka H: Echocardiographic
assessment of myocardial strain, J Am Coll
Cardiol 58:1401–1413, 2011.
37. MacLaren G, Kluger R, Connelly KA, Royse
CF: Comparative feasibility of myocardial ve-
locity and strain measurements using 2 dif-
ferent methods with transesophageal echo-
cardiography during cardiac surgery, J Car-
diothorac Vasc Anesth 25:216–220, 2011.
38. Brown J, Jenkins C, Marwick TH: Use of myo-
cardial strain to assess global left ventricular
function: a comparison with cardiac magnetic
resonance and 3-dimensional echocardiogra-
phy, Am Heart J 157:102, 2009. e1-e5.
39. Saito M, Negishi K, Eskandari M, et al. Asso-
ciation of left ventricular strain with 30-day
mortality and readmission in patients with
heart failure, J Am Soc Echocardiogr 28:652–
666, 2015.
40. Lee CH, Yang MM, Ho AC, et al. Evaluation
of the longitudinal contraction of the ventri-
cle septum in patients undergoing off-pump
coronary artery bypass graft surgery by strain
rate imaging, Acta Anaesthesiol Taiwan 44:11–
18, 2006.
41. Kukucka M, Nasseri B, Tscherkaschin A, et al.
The feasibility of speckle tracking for intra-
operative assessment of regional myocardial
function by transesophageal echocardiogra-
phy, J Cardiothorac Vasc Anesth 23:462–467,
2009.
42. Negishi K, Negishi T, Kurosawa K, et al. Prac-
tical guidance in echocardiographic assess-
ment of global longitudinal strain, JACC Car-
diovasc Imaging 8:489–492, 2015.
43. Hung CL, Verma A, Uno H, et al. Longitudi-
nal and circumferential strain rate, left ven-
tricular remodeling, and prognosis after myo-
cardial infarction, J Am Coll Cardiol 56:1812–
1822, 2010.
44. Winkelmann J, Aronson S, Young CJ, et al.
Retrograde-delivered cardioplegia is not dis-
tributed equally to the right ventricular free
wall and septum, J Cardiothorac Vasc Anesth
9:135–139, 1995.
45. Samad BA, Alam M, Jensen-Urstad K: Prog-
nostic impact of right ventricular involve-
ment as assessed by tricuspid annular motion
in patients with acute myocardial infarction,
Am J Cardiol 90:778–781, 2002.
46. David JS, Tousignant CP, Bowry R: Tricuspid
annular velocity in patients undergoing car-
diac operation using transesophageal echo-
ch04.indd 94
03.04.2019 11:39:13
95
4 Интраоперационная эхокардиография
cardiography, J Am Soc Echocardiogr 19:329–
334, 2006.
47. Patel KM, Sherwani SS, Baudo AM, et al. Echo
rounds: the use of transesophageal echocardi-
ography for confirmation of appropriate Im-
pella 5.0 device placement, Anesthes Analg
114: 82–85, 2012.
48. Tousignant C, Desmet M, Bowry R, et al.
Speckle tracking for the intraoperative assess-
ment of right ventricular function: a feasibil-
ity study, J Cardiothorac Vasc Anesth 24: 275–
279, 2010.
49. Kossaify A: Echocardiographic assessment of
the right ventricle, from the conventional ap-
proach to speckle tracking and three-dimen-
sional imaging, and insights into the “right
way” to explore the forgotten chamber, Clin
Med Insights Cardiol 9:65–75, 2015.
50. Swaminathan M, Morris RW, De Meyts DD,
et al. Deterioration of regional wall motion
immediately after coronary artery bypass
graft surgery is associated with long-term ma-
jor adverse cardiac events, Anesthesiology 107:
739–745, 2007.
51. Kolev N, Brase R, Swanevelder J, et al. The in-
fluence of transoesophageal echocardiogra-
phy on intra-operative decision making. A
European multicentre study. European
Perioperative TOE Research Group, Anaes-
thesia 53:767–773, 1998.
52. London MJ, Tubau JF, Wong MG, et al. The
“natural history” of segmental wall motion
abnormalities in patients undergoing noncar-
diac surgery. SPI. Research Group, Anesthesi-
ology 73:644–655, 1990.
53. Leung JM, O’Kelly B, Browner WS, et al.
Prognostic importance of postbypass region-
al wall-motion abnormalities in patients un-
dergoing coronary artery bypass graft sur-
gery. SPI Research Group, Anesthesiology
71:16–25, 1989.
54. Comunale MEHP, Body SC, Ley C, et al. The
concordance of intraoperative left ventricular
wall-motion abnormalities and electrocardio-
graphic S-T segment changes: association
with outcome after coronary revasculariza-
tion. Multicenter Study of Perioperative Isch-
emia (McSPI) Research Group, Anesthesiology
88:945–954, 1998.
55. Billehaug Norum I, Ruddox V, Edvardsen T:
Otterstad JE: Diagnostic accuracy of left ven-
tricular longitudinal function by speckle
tracking echocardiography to predict signifi-
cant coronary artery stenosis. A systematic
review, BMC Med Imaging 15:25, 2015.
56. Hauser AM, Gangadharan V, Ramos RG, et al.
Sequence of mechanical, electrocardiographic
and clinical effects of repeated coronary artery
occlusion in human beings: echocardiographic
observations during coronary angioplasty, J
Am Coll Cardiol 5:193–197, 1985.
57. Nakajima H, Ikari Y, Kigawa I, et al. Rapid
diagnosis and management of intraoperative
myocardial infarction during valvular sur-
gery: using intraoperative transesophageal
echocardiography followed by emergency
coronary artery bypass grafting without cor-
onary angiography, Echocardiography 22:834–
838, 2005.
58. Brandt RR, Oh JK, Abel MD, et al. Role
of emergency intraoperative transesophageal
echocardiography, J Am Soc Echocardiogr 11:
972–977, 1998.
59. Chan KL: Transesophageal echocardiography
for assessing cause of hypotension after car-
diac surgery, Am J Cardiol 62:1142–1143,
1988.
60. McKinlay KH, Schinderle DB, Swaminathan
M, et al. Predictors of inotrope use during
separation from cardiopulmonary bypass,
J Cardiothorac Vasc Anesth 18:404–408, 2004.
61. Shroyer AL, Grover FL, Hattler B, et al. On-
pump versus off-pump coronary-artery by-
pass surgery, N Engl J Med 361:1827–1837,
2009.
62. Peterson ED: Innovation and comparative-ef-
fectiveness research in cardiac surgery, N Engl
J Med 361:1897–1899, 2009.
63. Mishra M, Malhotra R, Karlekar A, et al. Pro-
pensity case-matched analysis of off-pump
versus on-pump coronary artery bypass
grafting in patients with atheromatous aorta,
Ann Thorac Surg 82:608–614, 2006.
64. Kapoor PM, Chowdhury U, Mandal B, et al.
Trans-esophageal echocardiography in off-
pump coronary artery bypass grafting, Ann
Card Anaesth 12:167, 2009.
65. Wang J, Filipovic M, Rudzitis A, et al. Trans-
esophageal echocardiography for monitoring
segmental wall motion during off-pump cor-
onary artery bypass surgery, Anesth Analg
99:965–973, 2004.
66. Gurbuz AT, Hecht ML, Arslan AH: Intraop-
erative transesophageal echocardiography
modifies strategy in off-pump coronary ar-
tery bypass grafting, Ann Thorac Surg
83:1035–1040, 2007.
67. Kim SH, Yeo JS, Yoon TG, et al. Placing a sa-
line bag underneath the displaced heart en-
hances transgastric transesophageal echocar-
diographic imaging during off-pump coro-
nary artery bypass surgery, Anesth Analg
109:1038–1040, 2009.
68. Shanewise JS, Cheung AT, Aronson S, et al.
ASE/SCA guidelines for performing a com-
prehensive intraoperative multiplane transe-
sophageal echocardiography examination:
recommendations of the American Society of
Echocardiography Council for Intraoperative
Echocardiography and the Society of Cardio-
vascular Anesthesiologists Task Force for
Certification in Perioperative Transesopha-
geal Echocardiography, J Am Soc Echocardiogr
12:884–900, 1999.
69. Chumnanvej S, Wood MJ, MacGillivray TE,
Melo MF: Perioperative echocardiographic
examination for ventricular assist device im-
plantation, Anesth Analg 105:583–601, 2007.
70. Huang YC, Cheng YJ, Lin YH, et al. Graft
failure caused by pulmonary venous obstruc-
tion diagnosed by intraoperative transesoph-
ageal echocardiography during lung trans-
plantation, Anesth Analg 91:558–560, 2000.
71. Michel-Cherqui M, Brusset A, Liu N, et al. In-
traoperative transesophageal echocardio-
graphic assessment of vascular anastomoses
in lung transplantation. A report on 18 cases,
Chest 111:1229–1235, 1997.
72. Reeves ST, Glas KE, Eltzschig H, et al. Guide-
lines for performing a comprehensive epi-
cardial echocardiography examination: rec-
ommendations of the American Society of
Echocardiography and the Society of Car-
diovascular Anesthesiologists, J Am Soc Echo-
cardiogr 20:427–437, 2007.
73. Glas KE, Swaminathan M, Reeves ST, et al.
Guidelines for the performance of a compre-
hensive intraoperative epiaortic ultrasono-
graphic examination: recommendations of
the American Society of Echocardiography
and the Society of Cardiovascular Anesthesi-
ologists; endorsed by the Society of Thoracic
Surgeons, J Am Soc Echocardiogr 20:1227–
1235, 2007.
74. Kallmeyer IJ, Collard CD, Fox JA, et al. The
safety of intraoperative transesophageal echo-
cardiography: a case series of 7200 cardiac
surgical patients, Anesth Analg 92: 1126–1130,
2001.
75. Click RL, Abel MD, Schaff HV: Intraoperative
transesophageal echocardiography: 5-year
prospective review of impact on surgical man-
agement, Mayo Clin Proc 75:241–247, 2000.
76. Practice guidelines for perioperative transe-
sophageal echocardiography: An updated re-
port by the American Society of Anesthesiol-
ogists and the Society of Cardiovascular An-
esthesiologists Task Force on Transesophageal
Echocardiography, Anesthesiology 112:1084–
1096, 2010.
77. Qaddoura FE, Abel MD, Mecklenburg KL, et
al. Role of intraoperative transesophageal
echocardiography in patients having coro-
nary artery bypass graft surgery, Ann Thorac
Surg 78:1586–1590, 2004.
78. Forrest AP, Lovelock ND, Hu JM, Fletcher SN:
The impact of intraoperative transoesophageal
echocardiography on an unselected cardiac
surgical population: a review of 2343 cases,
Anaesth Intensive Care 30:734–741, 2002.
79. Sutton DC, Kluger R: Intraoperative tran-
soesophageal echocardiography: impact on
adult cardiac surgery, Anaesth Intensive Care
26:287–293, 1998.
80. Mahdy S, Brien BO, Buggy D, Griffin M: The
impact of intraoperative transoesophageal
echocardiography on decision-making during
cardiac surgery, Middle East J Anesthesiol
20:199–206, 2009.
81. Couture P, Denault AY, McKenty S, et al. Im-
pact of routine use of intraoperative transe-
sophageal echocardiography during cardiac
surgery, Can J Anaesth 47:20–26, 2000.
82. Mishra M, Chauhan R, Sharma KKHP, et al.
Real-time intraoperative transesophageal echo-
cardiography — how useful? Experience of
5,016 cases, J Cardiothorac Vasc Anesth 12:
625–632, 1998.
83. Bergquist BD, Leung JM, Bellows WH: Trans-
esophageal echocardiography in myocardial
revascularization: I. Accuracy of intraopera-
tive real-time interpretation, Anesth Analg
82:1132–1138, 1996.
84. Bergquist BD, Bellows WH, Leung JM: Trans-
esophageal echocardiography in myocardial
revascularization: II. Influence on intraoper-
ative decision making, Anesth Analg 82:1139–
1145, 1996.
85. Mathew JP, Fontes ML, Garwood S, et al.
Transesophageal echocardiography inter-
pretation: a comparative analysis between
cardiac anesthesiologists and primary echo-
cardiographers, Anesth Analg 94:302–309,
2002.
86. Bettex DA, Pretre R, Jenni R, Schmid ER:
Cost-effectiveness of routine intraoperative
transesophageal echocardiography in pediat-
ric cardiac surgery: a 10-year experience,
Anesth Analg 100:1271–1275, 2005.
87. Seto TB, Taira DA, Tsevat J, Manning WJ:
Cost-effectiveness of transesophageal echo-
cardiographic-guided cardioversion: a deci-
sion analytic model for patients admitted to
the hospital with atrial fibrillation, J Am Coll
Cardiol 29:122–130, 1997.
88. Rosen AB, Fowler Jr. VG, Corey GR, et al.
Cost-effectiveness of transesophageal echo-
cardiography to determine the duration of
therapy for intravascular catheter-associated
Staphylococcus aureus bacteremia [see com-
ments], Ann Intern Med 130:810–820, 1999.
ch04.indd 95
03.04.2019 11:39:13
96
ЧАСТЬ I Передовые методы эхокардиографии
89. Fanshawe M, Ellis C, Habib S, et al. A retro-
spective analysis of the costs and benefits re-
lated to alterations in cardiac surgery from
routine intraoperative transesophageal echo-
cardiography, Anesth Analg 95:824–827, 2002.
90. Eltzschig HK, Rosenberger P, Loffler M, et al.
Impact of intraoperative transesophageal
echocardiography on surgical decisions in
12,566 patients undergoing cardiac surgery,
Ann Thorac Surg 85:845–852, 2008.
91. Greilich PE: Invited commentary, Ann Thorac
Surg 85:852–853, 2008.
92. Hofer CK, Zollinger A, Rak M, et al. Thera-
peutic impact of intra-operative transoesoph-
ageal echocardiography during noncardiac
surgery, Anaesthesia 59:3–9, 2004.
93. Schulmeyer MC, Santelices E, Vega R, Schmied
S: Impact of intraoperative transesophageal
echocardiography during noncardiac surgery,
J Cardiothorac Vasc Anesth 20: 768–771, 2006.
94. Canty DJ, Royse CF: Audit of anaesthe-
tist-performed echocardiography on periop-
erative management decisions for non-cardi-
ac surgery, Br J Anaesth 103:352–358, 2009.
95. Memtsoudis SG, Rosenberger P, Loffler M, et
al. The usefulness of transesophageal echo-
cardiography during intraoperative cardiac
arrest in noncardiac surgery, Anesth Analg
102:1653–1657, 2006.
96. Savage RM, Lytle BW, Aronson S, et al. In-
traoperative echocardiography is indicated
in high-risk coronary artery bypass grafting,
Ann Thorac Surg 64:368–373, 1997.
ch04.indd 96
03.04.2019 11:39:13
97
5 Внутрисердечная эхокардиография
FRANK E. SILVESTRY, MD
Основные принципы
Системы для внутрисердечной
эхокардиографии
Преимущества внутрисердечной
эхокардиографии
Ограничения внутрисердечной
эхокардиографии
Трехмерная внутрисердечная
эхокардиография
Последовательность визуализации
и стандартные позиции
Рутинная внутрисердечная
эхокардиография
Закрытие дефекта межпредсердной
перегородки
Пункция перегородки
Транскатетерная баллонная
вальвулопластика
митрального клапана
Электрофизиологические
процедуры
Оценка осложнений
Заключение
Внутрисердечная эхокардиография (ВСЭхоКГ) —
это инвазивный метод визуализации сердца с помо-
щью маленького ультразвукового датчика, который
помещают внутрь сердца либо сосудов. Как прави-
ло, ВСЭхоКГ проводят во время транскатетерных
вмешательств [1–3]. ВСЭхоКГ выполняет специа-
лист по ультразвуковой диагностике, рентген-эндо-
васкулярный хирург, кардиохирург или электрофи-
зиолог.
ВСЭхоКГ является альтернативным транстора-
кальной эхокардиографии (ТТЭхоКГ) и чреспище-
водной эхокардиографии (ЧПЭхоКГ) методом ви-
зуализации при многих транскатетерных вмеша-
тельствах (табл. 5.1) [4–18].
ОСНОВНЫЕ ПРИНЦИПЫ
СИСТЕМЫ ДЛЯ ВНУТРИСЕРДЕЧНОЙ ЭХОКАРДИОГРАФИИ
На рынке представлены системы для ВСЭхоКГ с од-
норазовыми катетерами размером от 8 до 10 Fr. Ка-
тетер имеет ультразвуковой механический датчик
с одноэлементным преобразователем (радиальный
катетерный датчик для ВСЭхоКГ) для получения
двухмерных изображений или полнофункциональ-
ный ультразвуковой датчик с фазированной решет-
кой, который используют при 2D-ЭхоКГ, 3D-ЭхоКГ
и допплерографии.
В одноэлементном преобразователе датчика пье-
зоэлектрический элемент вращается с высокой ско-
ростью перпендикулярно плоскости катетера, что
позволяет получать изображения в радиальных ли-
бо томографических плоскостях на 360°. Данный
тип датчика обеспечивает глубину проникновения
ультразвукового луча до 6 см и высокое разрешение
изображения при визуализации только близлежа-
щих объектов, т.е. при позиционировании радиаль-
ного катетерного датчика для ВСЭхоКГ в правые от-
делы сердца визуализировать левые отделы невоз-
можно. Кроме этого, радиальным катетерным
датчиком невозможно управлять вручную, его по-
зиционируют с помощью специального проводни-
ка. Датчик с одноэлементным преобразователем не
позволяет проводить допплерографию, а для полу-
чения трехмерных изображений необходимо иметь
несколько двухмерных изображений для последую-
щей автономной реконструкции [19].
Полнофункциональным датчиком с фазирован-
ной решеткой можно управлять вручную с помо-
щью манипуляционной рукоятки. Она позволяет
поворачивать датчик для получения изображений,
очень похожих на изображения при ЧПЭхоКГ. Фа-
зированная решетка обеспечивает возможность про-
ведения исследования в 2D-режиме и допплерогра-
фии со значительно большей глубиной проникно-
вения ультразвукового луча (15 см), чем при
использовании радиального катетерного датчика. В
настоящее время созданы датчики с фазированной
решеткой с возможностью проведения 3D-ВСЭхоКГ
в режиме реального времени [20, 21].
Сейчас существует пять систем для ВСЭхоКГ. В
одних системах есть магнитные датчики с фазиро-
ванной решеткой для виртуального трехмерного
анатомического картирования во время аблации. В
других системах ультразвуковые датчики позволя-
ют получать трехмерные изображения анатомиче-
ских структур в режиме реального времени. Есть не-
сколько публикаций о положительном опыте при-
менения датчиков данного типа [21, 22]. Наиболее
часто используют катетеры размером от 8 до 10 Fr
и различной длиной.
ch05.indd 97
03.04.2019 11:39:34
98
ЧАСТЬ I Передовые методы эхокардиографии
ПРЕИМУЩЕСТВА ВНУТРИСЕРДЕЧНОЙ ЭХОКАРДИОГРАФИИ
Роль ВСЭхоКГ заключается в визуализации вну-
тренних структур сердца и сосудов во время транс-
катетерных вмешательств. ВСЭхоКГ обеспечивает
превосходное пространственное и временно
́
е разре-
шение изображений этих структур и устройств, ко-
торые находятся вблизи датчика. При оперативных
вмешательствах ВСЭхоКГ можно использовать для
минимизации либо полного исключения радиаци-
онного облучения при рентгеноскопии [1, 2, 4, 23].
Кроме этого, при ВСЭхоКГ пациенту достаточно
минимальной седации, отсутствует риск травмати-
зации пищевода либо перегрева зонда (что возмож-
но при длительном проведении ЧПЭхоКГ), а неко-
торые структуры, например нижняя часть межпред-
сердной перегородки, визуализируются лучше, чем
при ЧПЭхоКГ [2]. ВСЭхоКГ позволяет выявить ано-
малии, которые были упущены либо не распознаны
при ЧПЭхоКГ и ТТЭхоКГ, например множествен-
ные дефекты межпредсердной перегородки, дефек-
ты межпредсердной перегородки без нижнего края,
аномальный дренаж легочных вен [24].
ОГРАНИЧЕНИЯ ВНУТРИСЕРДЕЧНОЙ ЭХОКАРДИОГРАФИИ
Радиальные катетерные датчики для ВСЭхоКГ име-
ют ограниченную глубину проникновения ультра-
звукового луча, что может затруднить обзор уда-
ленных анатомических структур. Кроме того, с по-
мощью радиального катетерного датчика нельзя
провести допплерографию. Оба этих ограничения
отсутствуют у катетерных датчиков с фазирован-
ной решеткой. Поскольку при ВСЭхоКГ катетер
вводят в полость сердца или сосуда, потенциальны-
ми осложнениями могут быть те, которые происхо-
дят при пункции вены, например тромбоз сосуда,
образование тромбов вокруг датчика, эмболия ле-
гочной артерии, тампонада сердца, кровотечение
вследствие повреждения стенки желудочка или со-
суда и образование гематомы, забрюшинное крово-
течение, инфекции, аритмия из-за механического
раздражения эндокарда. Стоимость катетеров для
ВСЭхоКГ варьирует от 800 до 3500 долларов США в
зависимости от системы. Катетеры для ВСЭхоКГ од-
норазовые и предназначены только для катетериза-
ции правых отделов сердца.
ТРЕХМЕРНАЯ ВНУТРИСЕРДЕЧНАЯ ЭХОКАРДИОГРАФИЯ
До недавнего времени 3D-ВСЭхоКГ проводили пу-
тем механического смещения радиального катетер-
ного датчика либо катетерного датчика с фазиро-
ванной решеткой во время нескольких сердечных
циклов, затем информацию обрабатывали с помо-
щью программного обеспечения для получения
трехмерного изображения [19]. Другой подход —
использование электромагнитных полей датчика.
Программное обеспечение позволяет создать вир-
туальную трехмерную анатомическую карту пред-
сердия и желудочка [2, 19, 25–30]. Эти данные могут
быть объединены с результатами трехмерной ком-
пьютерной томографии либо магнитно-резонанс-
ной томографии для улучшения визуализации ана-
томических структур. Недавно стал доступен дат-
чик Siemens Volume для 3D-ВСЭхоКГ, позволяющий
получать трехмерные изображения в режиме реаль-
ного времени в ходе транскатетерных процедур [21,
31]. Датчик пока имеет относительно небольшие
возможности для 3D-ВСЭхоКГ и низкую частоту
кадров, что ограничивает его применение [21].
Самую высокую точность и четкость визуализа-
ции обеспечивает 3D-ЧПЭхоКГ, которую применя-
ют при транскатетерной пластике митрального кла-
пана методом «край в край» с помощью системы
MitraClip. Роль 3D-ВСЭхоКГ несомненно возрастет
после улучшения ее технических характеристик.
ПОСЛЕДОВАТЕЛЬНОСТЬ ВИЗУАЛИЗАЦИИ
И СТАНДАРТНЫЕ ПОЗИЦИИ
В данном разделе описано, как получать изображе-
ния с помощью катетера AcuNav (Siemens, Mountain
View, CA) с датчиком с фазированной решеткой.
Этот датчик позволяет провести допплерографию и
визуализацию в 2D- и 3D-режиме. Катетер разрабо-
тан для вмешательств на межпредсердной перего-
родке (закрытие дефекта, пункция), направления
системы для баллонной вальвулопластики митраль-
ного клапана и проведения электрофизиологиче-
Основная роль
Вспомогательная роль
Перспективная роль
Закрытие внутрисердечных шунтов
(ДМПП, ООО)
Электрофизиологические процедуры
(изоляция легочных вен, устьев полой
вены и трикуспидального клапана,
аблация при желудочковой тахикардии)
Пункция межпредсердной перегородки
Баллонная вальвулопластика митраль-
ного клапана
Транскатетерная имплантация аорталь-
ного клапана
Закрытие внутрисердечных шунтов
(ДМЖП, ОАП)
Транскатетерная пластика митрального
клапана методом «край в край»
с помощью системы MitraClip
Алкогольная аблация перегородки при
гипертрофической кардиомиопатии
Транскатетерная пластика митрального
клапана методом «край в край»
с помощью системы MitraClip
Закрытие ушка левого предсердия
Закрытие парапротезной фистулы
Оценка тромбоза ушка левого
предсердия
ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки; ОАП — открытый артериальный про-
ток; ООО — открытое овальное окно.
ТАБЛИЦА 5.1 Клиническое использование внутрисердечной эхокардиографии
ch05.indd 98
03.04.2019 11:39:34
99
5 Внутрисердечная эхокардиография
ских процедур. При данных вмешательствах можно
использовать и другие датчики с фазированной ре-
шеткой, но возможности их могут быть ограничен-
ными.
Катетер AcuNav с датчиком с фазированной ре-
шеткой доступен в размерах 8 и 10 Fr и является са-
мым используемым катетером для ВСЭхоКГ при
оперативных вмешательствах и электрофизиологи-
ческих процедурах. С помощью этого датчика мож-
но проводить линейные и допплеровские измере-
ния, т.к. он обладает полноцветной допплеровской
технологией формирования изображений.
Катетер AcuNav V — единственный катетер для
3D-ВСЭхоКГ. Он имеет размер 10 Fr и датчик с ма-
тричным преобразователем, который обеспечивает
получение объемных данных в режиме реального
времени под углом сканирования от 22 до 90°. Та-
кой небольшой объем сектора — основное ограни-
чение этого датчика во время вмешательств при бо-
лезнях сердца [2, 18, 21].
Катетер для ВСЭхоКГ чаще всего вводят в правую
либо левую бедренную вену через специальную си-
стему для сосудистого доступа и продвигают в ней-
тральном (не согнутом) положении по нижней по-
лой вене в правое предсердие (ПП) под контролем
рентгеноскопии. Ее используют исключительно для
безопасного позиционирования катетера в нижней
полой вене и в ПП. Описаны ситуации, когда кате-
тер для ВСЭхоКГ с датчиком с фазированной ре-
шеткой позиционировали в аорте или в других со-
судах, хотя эти катетеры предназначены только для
правых отделов сердца [2, 32, 33].
После позиционирования катетера в ПП в ней-
тральном положении катетерный датчик поворачи-
вают по часовой стрелке, манипулируя рукояткой с
небольшим шагом от 10 до 15° для точной визуали-
зации структур сердца (данная манипуляция анало-
гична вращению зонда вдоль его оси при ЧПЭхоКГ
для направления ультразвукового луча в интересу-
ющие анатомические области). Ультразвуковой луч
остается неподвижным, т.е . не может менять свое
направление, как при ЧПЭхоКГ. Катетер можно со-
гнуть в четырех направлениях — кпереди, кзади,
влево и вправо. Предусмотрена возможность его
блокировки в нужном положении, при этом катетер
можно перемещать. Сгибание катетера кпереди и
кзади позволяет катетерному датчику приближать-
ся либо отдаляться от анатомических структур. Сги-
бание катетера кзади позволяет датчику «смотреть»
вверх, а сгибание кпереди обеспечивает направле-
ние «взора» вниз.
Вращение катетерного датчика по оси до 15–30°
является «домашней позицией» (нейтральной), т.е .
отправной точкой любого исследования с помощью
ВСЭхоКГ. В этой позиции возможна визуализация
ПП, трикуспидального клапана, правого желудочка
(ПЖ), аортального клапана по короткой оси и боль-
ших аневризм межпредсердной перегородки (рис.
5.1). При отсутствии уверенности в правильном по-
зиционировании катетерного датчика рекомендует-
ся вернуть его в «домашнюю позицию».
Выходной тракт правого желудочка (ВТПЖ) и кла-
пан легочной артерии визуализируются в нейтраль-
ном положении катетера с вращением катетерного
датчика по оси до 30–40° (позиция ВТПЖ) (рис.
5.2). При дальнейшем вращении до 45° (позиция
выходного тракта левого желудочка) визуализиру-
ются левый желудочек (ЛЖ) по косой длинной оси
и аортальный клапан по длинной оси. Данную по-
зицию часто используют при допплерографии аор-
тального клапана (рис. 5 .3), оценке перимембраноз-
ных дефектов межжелудочковой перегородки и во
время транскатетерной имплантации аортального
клапана [5, 22, 31, 34].
А
Б
ПЖ
ПП
АК
АМПП
АК
ПЖ
ПП
Рис. 5 .1 Внутрисердечная эхокардиография, «домашняя позиция». (A) A 2D-ВСЭхоКГ правого предсердия (ПП), правого желудочка (ПЖ) и аортального
клапана (АК) (катетер на среднем уровне правого предсердия в нейтральном положении). (Б) A 2D-ВСЭхоКГ правого предсердия, правого желудочка и аорталь-
ного клапана («домашняя позиция»). Обратите внимание на аневризму межпредсердной перегородки (АМПП), которая пролабирует в полость правого предсердия.
ch05.indd 99
03.04.2019 11:39:34
100
ЧАСТЬ I Передовые методы эхокардиографии
В позиции ВТЛЖ катетер продвигают дальше и
поворачивают катетерный датчик по часовой стрел-
ке до 60–70° для визуализации ушка левого предсер-
дия (ЛП) (позиция ушка ЛП либо позиция меж-
предсердной перегородки) (рис. 5 .4). В этой пози-
ции визуализируются нижний край межпредсердной
перегородки, ЛП, ушко ЛП, митральный клапан и
ЛЖ. Также возможно проведение допплерографии
митрального клапана, что имеет большое значение
при баллонной вальвулопластике митрального кла-
пана. Практически всегда в этой позиции визуали-
зируется ушко ЛП, что позволяет исключить его
тромбоз. Визуализация ушка ЛП для исключения
его тромбоза (рис. 5 .5) и других смежных с легоч-
ным стволом (ЛС) структур, например открытого
ПЖ
ПП
АМПП
АК
КЛА
ПП
Ао
ЛЖ
ЛЖ
ПП
ЛП
УЛП
Рис. 5.2 A Внутрисердечная эхокардиография, позиция выходного
тракта правого желудочка. 2D -ВСЭхоКГ правого предсердия (ПП), правого
желудочка (ПЖ), клапана легочной артерии (КЛА) и аортального клапана (АК).
Обратите внимание на аневризму межпредсердной перегородки (АМПП), кото-
рая пролабирует в полость правого предсердия.
Рис. 5.3 A Внутрисердечная эхокардиография, позиция выходного
тракта левого желудочка. 2D -ВСЭхоКГ правого предсердия (ПП), левого
желудочка (ЛЖ), аортального клапана и аорты (Ао).
Рис. 5 .4 A Внутрисердечная эхокардиография, позиция ушка левого
предсердия. 2D -ВСЭхоКГ правого предсердия (ПП), левого предсердия (ЛП),
левого желудочка (ЛЖ) и ушка левого предсердия (УЛП).
артериального протока (ОАП), возможна и в пози-
ции ЛС [2, 32, 35–37]. Однако, по данным некоторых
источников, использование ВСЭхоКГ для исключе-
ния тромбоза ушка ЛП остается дискуссионным
[38–42].
Для пункции межпредсердной перегородки либо
при других вмешательствах на ней следует визуали-
зировать ЛП (и его ушко), а также нижний край
межпредсердной перегородки, медленно поворачи-
вая катетерный датчик по часовой стрелке до 70–80°.
Поворот катетерного датчика до 90–100° (позиция
левых легочных вен) позволяет оценить левые верх-
нюю и нижнюю легочные вены по длинной оси
(рис. 5 .6). В нижней части изображения видны ве-
ны, а вверху — межпредсердная перегородка. Дан-
ную позицию используют для позиционирования
катетера для ВСЭхоКГ [2, 23, 43]. Затем катетер сги-
бают кзади и направо для визуализации в позиции
межпредсердной перегородки по длинной оси (рис.
5.7). Эту позицию используют для закрытия откры-
того овального окна либо для пункции перегород-
ки. Вращение катетерного датчика по часовой стрел-
ке по направлению к трикуспидальному клапану
приводит к визуализации в позиции межпредсерд-
ной перегородки по короткой оси (рис. 5 .8), что ана-
логично визуализации при ЧПЭхоКГ.
РУТИННАЯ ВНУТРИСЕРДЕЧНАЯ
ЭХОКАРДИОГРАФИЯ
ЗАКРЫТИЕ ДЕФЕКТА МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Наиболее распространенное показание к проведе-
нию ВСЭхоКГ — транскатетерное закрытие дефекта
межпредсердной перегородки либо открытого оваль-
ного окна [6, 44, 45]. Обычно для закрытия открыто-
го овального окна используют окклюдер Amplatzer,
для закрытия дефектов межпредсердной перегород-
ch05.indd 100
03.04.2019 11:39:34
101
5 Внутрисердечная эхокардиография
А
БВ
УЛП
ЛП
МПП
ЛС
ЛС
УЛП
УЛП
Ао
Рис. 5 .5 Визуализация спонтанного контрастирования и тромба в ушке левого предсердия с помощью внутрисердечной эхокардиографии.
(A) A Спонтанное контрастирование (белая стрелка) в ушке левого предсердия (УЛП). Обратите внимание, что ориентация L–R отличается от типичной (красная
стрелка). (Б, В) A A Тромб в ушке левого предсердия (белая стрелка), позиция легочного ствола (ЛС). Обратите внимание, что ориентация L–R отличается от
типичной (красная стрелка). Ао — аорта; ЛП — левое предсердие; МПП — межпредсердная перегородка.
ки — Occluder (AGA Medical Corp., Plymouth, MN,
сейчас — St. Jude, St. Paul, MN) и Gore Helex (WL Go-
re & Associates, Newark, DE). Эти окклюдеры одобре-
ны Food and Drug Administration (FDA).
Окклюдер Amplatzer представляет собой два само-
раскрывающихся диска из нитинола с полиэфир-
ной вставкой, которые соединены между собой в
центре. Окклюдер вводят с помощью доставочной
системы и размещают в дефекте межпредсердной
перегородки (рис. 5 .9). Первый диск раскрывают в
полости ЛП, а затем прижимают к перегородке.
Диск в ПП открывают аналогичным образом. Затем
проверяют стабильность окклюдера относительно
перегородки путем тракции его вперед-назад. После
этого доставочную систему отсоединяют от диска в
ЛП
ЛВЛВ
ЛНЛВ
Рис. 5 .6 A Внутрисердечная эхокардиография, позиция левых легоч-
ных вен. 2D -ВСЭхоКГ левого предсердия (ЛП), левой верхней легочной вены
(ЛВЛВ) и левой нижней легочной вены (ЛНЛВ). Датчик расположен около меж-
предсердной перегородки.
ПП. При цветовом допплеровском картировании
кровотока можно видеть поток между предсердия-
ми на уровне окклюдера до тех пор, пока каналы в
нем и он сам не эндотелизируются.
В окклюдере Gore Helex мембрана из вспененно-
го политетрафторэтилена натянута в проволочной
рамке из нитинола (см. рис. 5 .9). Диски устанавли-
вают с помощью доставочной системы в той же по-
следовательности: сначала в ЛП, затем в ПП. Важно,
что окклюдеры Amplatzer и Gore Helex можно из-
влечь с помощью доставочной системы даже после
их полного раскрытия.
Перед закрытием дефекта межпредсердной пере-
городки ВСЭхоКГ позволяет исключить аномаль-
ный дренаж легочных вен, количественно оценить
размер, расположение и количество дефектов. Для
этого последовательно оценивают 6 краев дефекта,
ПП
ЛП
Рис. 5 .7 Внутрисердечная эхокардиография, позиция межпредсерд-
ной перегородки по длинной оси. 2D -ВСЭхоКГ межпредсердной перего-
родки (стрелка, вторичная перегородка) по длинной оси. ЛП — левое пред-
сердие; ПП — правое предсердие.
ch05.indd 101
03.04.2019 11:39:35
102
ЧАСТЬ I Передовые методы эхокардиографии
ПП
ЛП
Ао
Рис. 5 .8 A Дефект межпредсердной перегородки типа ostium secun-
dum. При 2D-ВСЭхоКГ в позиции межпредсердной перегородки по короткой
оси визуализируются дефект межпредсердной перегородки типа ostium
secundum (стрелка) и сброс крови слева направо при цветовой допплерогра-
фии. Ао — аорта; ЛП — левое предсердие; ПП — правое предсердие.
ДМПП
Доставочная система
ПП
ЛП
Перегородка
Зафиксированный окклюдер
Рис. 5 .9 Дефекты межпредсердной перегородки. Позиционирование окклюдера для за-
крытия дефекта межпредсердной перегородки (ДМПП). ЛП — левое предсердие; ПП — пра-
вое предсердие. Стрелки указывают на правый и левый диски окклюдера.
к которым будет крепиться окклюдер: верхний,
нижний, задний, аортальный, атриовентрикуляр-
ный и правой верхней легочной вены. После разду-
тия баллона и измерения его «талии» (которая соот-
ветствует размеру дефекта) не должен визуализиро-
ваться сброс крови. Далее под контролем ВСЭхоКГ
вводят катетер и доставочную систему, раскрывают
диски в ЛП и ПП, оценивают положение и стабиль-
ность окклюдера, наличие сброса крови и возмож-
ных осложнений [46–48]. В табл. 5 .2 приведены ре-
комендации American Society of Echocardiography
(ASE) по оценке дефектов межпредсердной перего-
родки и открытого овального окна [46]. В частно-
сти, тщательно оценивают окружающие ткани и
края дефекта, которые играют ключевую роль в воз-
можном транскатетерном его закрытии. Обычно
для адекватной имплантации и стабилизации ок-
клюдера края дефекта должны иметь размер 4–5 мм.
Недостаточное количество тканей либо их излишек
могут привести к дислокации окклюдера [46, 49–
54]. Есть многочисленные публикации об успеш-
ch05.indd 102
03.04.2019 11:39:36
103
5 Внутрисердечная эхокардиография
ном закрытии дефекта у пациентов с недостаточной
длиной одного края, однако дефицит ткани у не-
скольких краев дефекта является показанием к про-
ведению открытого оперативного вмешательства.
При закрытии дефектов межпредсердной пере-
городки визуализацию с помощью ВСЭхоКГ начи-
нают в «домашней позиции». Затем катетер сгибают
и поворачивают катетерный датчик до 90–100° по
часовой стрелке, и визуализируется перегородка по
длинной оси. Из данной позиции катетерный дат-
Критерии
Характеристика
Тип дефекта
Открытое овальное окно, дефект типа ostium primum, дефект типа ostium secundum, другой
межпредсердный шунт (дефект венозного синуса, дефект крыши коронарного синуса,
частичный аномальный дренаж легочных вен)
Сброс крови (допплерография) Слева направо, справа налево, двунаправленный
Аневризма межпредсердной
перегородки
Наличие/отсутствие
Сопутствующие аномалии
Сеть Хиари, евстахиева заслонка
Размер дефекта
Максимальный и минимальный размеры (рекомендуется измерять с помощью 3D-ЭхоКГ),
площадь, при прекращении потока (при использовании баллона для закрытия дефекта)
Локализация дефекта
Высокий дефект типа ostium secundum, дефект венозного синуса ВПВ либо НПВ и др.
Оценка краев дефекта
Верхнего, нижнего, заднего, аортального, атриовентрикулярного и правой верхней
легочной вены
Форма дефекта
Круглая, овальная, асимметричная
Фенестрации
Наличие множественных фенестраций
Динамика дефекта
Изменение площади, максимального и минимального размеров в конце систолы и диастолы
3D-ЭхоКГ — трехмерная эхокардиография; ВПВ — верхняя полая вена; НПВ — нижняя полая вена.
[Silvestry FE, Cohen MS, Armsby LB, et al. Guidelines for the echocardiographic assessment of atrial septal defect and patent foramen ovale: from
the American Society of Echocardiography and Society for Cardiac Angiography and Interventions. J Am Soc Echocardiogr 28:910–958, 2015.]
ТАБЛИЦА 5.2 Алгоритм рутинной оценки дефектов межпредсердной перегородки и открытого овального окна
Позиция
Уровень
Сгибание катетера
Визуализируемые структуры
Кпереди/кзади Вправо/влево
«Домашняя позиция»
Средняя часть ПП Нейтральное
положение
Нейтральное
положение
ПП, трикуспидальный клапан, ПЖ,
ПВЛВ, ВТПЖ, нижняя часть МПП
Позиция межпредсердной
перегородки
Средняя часть ПП Кзади
Вправо
Нижняя и верхняя части МПП, первичная
и вторичная перегородки, взаимоотно-
шение с митральным клапаном
Позиция межпредсердной
перегородки по длинной
оси или бикавальная
позиция
Верхняя часть ПП Кзади
Вправо
МПП, первичная и вторичная перего-
родки, ВПВ
Позиция межпредсердной
перегородки по корот-
кой оси
Средняя часть ПП,
со вращением
датчика по
часовой стрелке
по направлению
к трикуспидаль-
ному клапану
Кзади
Влево
Аортальный клапан, МПП, ДМПП
в переднезадней проекции, нижняя
и атриовентрикулярная часть МПП
АК — аортальный клапан; ВПВ — верхняя полая вена; ВТПЖ — выходной тракт правого желудочка; ДМПП — дефект межпредсердной
перегородки; МПП — межпредсердная перегородка; ПВЛВ — правая верхняя легочная вена; ПЖ — правый желудочек; ПП — правое
предсердие.
ТАБЛИЦА 5.3 Оценка межпредсердной перегородки с помощью внутрисердечной эхокардиографии
чик можно повернуть по часовой стрелке для полу-
чения изображения перегородки по короткой оси.
Эта позиция идеальна для транскатетерного закры-
тия дефекта (табл. 5 .3). Для визуализации верхнего
края перегородки катетер медленно продвигают в
сторону верхней полой вены, а затем оттягивают
вниз для визуализации нижней части перегородки.
Установку окклюдера контролируют, выполняя
цветовую допплерографию или пробу с пузырько-
вым контрастированием (рис. 5 .10).
ch05.indd 103
03.04.2019 11:39:37
104
ЧАСТЬ I Передовые методы эхокардиографии
А
Б
В
Г
ЛП
ЛП
ЛП
ПП
ПП
ПП
ПП
ПП
ПП
ЛП
ЛП
ЛП
ВПВ
ВПВ
ВПВ
НАо
Рис. 5 .10 Закрытие дефекта межпредсердной перегородки под контролем внутрисердечной эхокардиографии. (A) A Визуализация дефекта меж-
предсердной перегородки типа ostium secundum (стрелка) перед вмешательством. (Б) Введение проводника в левую верхнюю легочную вену. (В) Позициониро-
вание доставочной системы в левом предсердии (ЛП). (Г) Оценка размеров дефекта с помощью баллона и цветовой допплерографии и без нее. Стрелка указы-
вает на небольшой поток между баллоном и краем дефекта. ВПВ — верхняя полая вена; НАо — нисходящий отдел аорты; ПП — правое предсердие.
ПУНКЦИЯ ПЕРЕГОРОДКИ
Пункцию перегородки выполняют в случае необхо-
димости получения доступа к ЛП (например, для
измерения давления в нем либо для проведения
аблации, закрытия ушка ЛП, восстановления и бал-
лонной вальвулопластики митрального клапана).
Самое безопасное место для пункции — в средней
части перегородки в области овальной ямки и ниже
аортального клапана. При большой толщине пере-
городки пункцию рекомендуется прекратить. Сле-
дует избегать повреждения окружающих структур:
перикарда, аорты, ЛС. ВСЭхоКГ помогает избежать
и снизить риск осложнений, а также обеспечить
надлежащее положение катетера [23, 43, 55–59].
Пункцию обычно проводят в позиции ЛП по
длинной оси (вращение по часовой стрелке на 90–
100°) и позиции ЛП по короткой оси. Доставочную
систему Mullin с иглой Brockenbrough внутри вво-
дят в ПП, подводят к перегородке и упираются в
нее. Потом выдвигают иглу до тех пор, пока ее ко-
нец не пройдет через овальную ямку (рис. 5 .11,
5.12). Нужно внимательно следить за тем, чтобы
траектория доставочной системы не была направле-
на на аорту, ЛС и заднюю стенку сердца (рис. 5 .13).
Игла должна пройти через межпредсердную перего-
родку на среднем ее уровне (рис. 5 .14). При направ-
лении иглы кзади можно случайно повредить зад-
нюю стенку предсердия, что приведет к кровотече-
нию. При направлении иглы кпереди высок риск
повреждения аорты. Пункцию выполняют только
после подтверждения в нескольких позициях пра-
вильного направления иглы. Игла, проникнув через
межпредсердную перегородку, оказывается в поло-
сти ЛП. Для подтверждения этого выполняют про-
ch05.indd 104
03.04.2019 11:39:37
105
5 Внутрисердечная эхокардиография
А
Б
В
ЛП
ЛП
ЛП
ПП
ПП
ПП
Рис. 5 .11 Закрытие дефекта межпредсердной перегородки под контролем с помощью внутрисердечной эхокардиографии. (A) A Раскрытие дис-
ка в левом предсердии (ЛП) и позиционирование к межпредсердной перегородке. (Б, В) A Раскрыты оба диска по обе стороны перегородки. ПП — правое пред-
сердие.
ЛП
ЛП
Ао
Ао
ПП
ПП
А
Б
Рис. 5 .12 A Визуализация установки окклюдера. 2D -ВСЭхоКГ (А) и
3D-ВСЭхоКГ (Б) по короткой оси сердца с проводником, который находится в
открытом овальном окне (стрелки). Ао — аорта; ЛП — левое предсердие;
ПП — правое предсердие.
А
Б
АК
АК
Ао
Ао
ПП
ПП
Окклюдер
Окклюдер
Рис. 5 .13 A Расположение окклюдера для закрытия дефекта меж-
предсердной перегородки и аорты. Расположение окклюдера для закры-
тия дефекта межпредсердной перегородки и аорты (Ао) на изображениях в
2D-режиме (А) и 3D-режиме (Б). АК
—
аортальный клапан; ПП — правое
предсердие.
бу с пузырьковым контрастированием, и в полости
ЛП визуализируются микроскопические пузырьки.
ВСЭхоКГ также используют для подтверждения
правильного позиционирования иглы при повтор-
ной пункции, если она необходима.
При использовании дилататора для расширения
отверстия в перегородке также применяют ВСЭхоКГ
с целью минимизации риска полного разрыва. По-
сле удаления доставочной системы и катетеров оце-
нивают с помощью ВСЭхоКГ размер созданного де-
фекта и принимают решение о необходимости его
закрытия, если произошел полный разрыв.
ТРАНСКАТЕТЕРНАЯ БАЛЛОННАЯ ВАЛЬВУЛОПЛАСТИКА
МИТРАЛЬНОГО КЛАПАНА
ВСЭхоКГ используют на каждом этапе баллонной
вальвулопластики митрального клапана (см. ранее)
для контроля позиционирования доставочной си-
стемы и баллона, мониторинга во время инфузии,
а также оценки остаточной регургитации после вме-
шательства [2, 11, 13, 60–62].
Процедуру начинают с установки катетера в ПП.
Затем катетерный датчик поворачивают до 60–70°
вдоль длинной оси перегородки. Часто катетер сги-
бают кпереди для направления ультразвукового лу-
ча на митральный клапан. Для измерения скорости
потока через митральный клапан, интеграла скоро-
сти кровотока (velocity-time integral, VTI), макси-
мального и среднего градиентов давления, времени
полуспада давления используют спектральную доп-
плерографию. Митральную регургитацию оценива-
ют с помощью цветовой допплерографии (рис.
5.15). В дополнительных позициях можно визуали-
зировать ЛЖ, митральный клапан и ЛП, продвигая
ch05.indd 105
03.04.2019 11:39:39
106
ЧАСТЬ I Передовые методы эхокардиографии
А
Б
ПСМК
ЛП
ЛЖ
А
Б
ЛП
ЛП
ПП
ПП
Ао
Ао
Рис. 5 .14 Пункция перегородки под контролем с помощью внутрисер-
дечной эхокардиографии. 2D -ВСЭхоКГ перегородки по короткой оси A (А)
и длинной оси A (Б) во время пункции. Стрелка на (А) указывает на кончик
иглы до ее прохождения в полость левого предсердия (ЛП), стрелка на (Б)
указывает на кончик иглы в полости левого предсердия. Ао — аорта; ПП —
правое предсердие.
Рис. 5 .15 A Внутрисердечная эхокардиография стеноза митрально-
го клапана. 2D -ВСЭхоКГ правого предсердия, левого предсердия (ЛП), лево-
го желудочка (ЛЖ) и стенозированного митрального клапана во время диасто-
лы. (А, Б) Позиция по длинной оси левого желудочка. Стрелка на (Б) указы-
вает направление потока через митральный клапан. В этой позиции с помощью
спектральной допплерографии можно измерить скорость потока и время по-
луспада давления. ПСМК — передняя створка митрального клапана.
пана, вошел в полость желудочка и не запутался в
подклапанном аппарате до раздутия. После разду-
тия баллон оттягивают назад в ЛП и проводят спек-
тральную допплерографию для расчета площади
отверстия митрального клапана и оценки степени
митральной регургитации (рис. 5 .17). После удале-
ния доставочной системы катетер возвращают в по-
зицию межпредсердной перегородки по длинной
оси для оценки дефекта с помощью цветовой доп-
плерографии (рис. 5 .18). После каждого этапа про-
цедуры тщательно оценивают в позициях ПП и ПЖ
наличие перикардиальной жидкости.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ПРОЦЕДУРЫ
ВСЭхоКГ используют при аблации в случае фи-
брилляции предсердий на каждом из этапов проце-
дуры [4, 11, 23, 43]. ВСЭхоКГ обеспечивает четкую
визуализацию овальной ямки при ее пункции, окру-
жающих структур и пузырьков в полости ЛП при
пробе с пузырьковым контрастированием, как опи-
сано ранее. ВСЭхоКГ существенно облегчает визуа-
лизацию легочных вен, особенно при введении ка-
тетера в их устья, непрерывном мониторинге при
аблации, а также позволяет оценить функцию серд-
ца в режиме реального времени и исключить ослож-
нения.
ВСЭхоКГ используют при определении местопо-
ложения устройства для закрытия ушка ЛП (правда,
ЧПЭхоКГ остается предпочтительным методом во
многих клиниках). Катетеры для ВСЭхоКГ, разме-
щенные в ПЖ, используют для оценки диссинхро-
нии и проведения ресинхронизирующей терапии,
определения влияния электростимуляции на серд-
це. ВСЭхоКГ также позволяет точно позициониро-
вать электроды кардиостимулятора в ПП.
катетер в полость ПЖ и сгибая вправо. Эти позиции
можно использовать для оценки митральной регур-
гитации, подклапанного стеноза (рис. 5.16) и каль-
цификации створок митрального клапана.
После углубленного обследования по стандарт-
ному протоколу выполняют пункцию межпред-
сердной перегородки под контролем ВСЭхоКГ (см.
ранее). После создания дефекта в перегородке в по-
лость ЛП вводят доставочную систему. Катетер по-
зиционируют в ЛП и поворачивают катетерный
датчик до 60–70° для визуализации предсердной пе-
регородки и оценки митрального клапана и ЛЖ (см.
рис. 5.12).
Далее под контролем ВСЭхоКГ позиционируют
баллон, следя за тем, чтобы он пересек границу кла-
ch05.indd 106
03.04.2019 11:39:39
107
5 Внутрисердечная эхокардиография
А
Б
ПП
ПП
ЛП
ЛП
Б
А
ЛП
МК
ЛП
ЛЖ
ПСМК
ЛЖ
Рис. 5 .16 Внутрисердечная эхокардиография. (A) A 2D-ВСЭхоКГ лево-
го предсердия (ЛП), левого желудочка (ЛЖ) и митрального клапана (МК) со
стороны правого желудочка. Обратите внимание на отсутствие перикардиаль-
ной жидкости (стрелка). (Б) Визуализация стенозированного митрального кла-
пана. Стрелка указывает направление потока. ПСМК — передняя створка ми-
трального клапана.
Рис. 5 .18 Внутрисердечная эхокардиография остаточного шунтирова-
ния после пункции межпредсердной перегородки. Сброс крови слева на-
право через дефект межпредсердной перегородки (стрелка) после ее пункции.
Визуализация в 2D-режиме A (A) и 3D-режиме A (Б), позиция межпред-
сердной перегородки по длинной оси. ЛП — левое предсердие; ПП — правое
предсердие.
ОЦЕНКА ОСЛОЖНЕНИЙ
Врач, проводящий ВСЭхоКГ, должен иметь опреде-
ленный опыт по выявлению и оценке осложнений
как во время вмешательства, так и после него. Осо-
бое внимание следует уделять выявлению тромбов
на катетерах и устройствах, перфорации сердца, ар-
терий или вен, перикардиальной жидкости. Для ви-
зуализации перикардиальной жидкости следует
установить катетерный датчик в «домашнюю пози-
цию» для визуализации свободной стенки ПЖ и
ВТЛЖ и нижней стенки ЛЖ. Для проведения доп-
плерографии и оценки потока через трикуспидаль-
ный клапан катетерный датчик устанавливают в
«домашнюю позицию», а для оценки митрального
клапана — на нижнем уровне межпредсердной пе-
регородки. ВСЭхоКГ позволяет снизить риск серьез-
Рис. 5.17 A Внутрисердечная эхокардиография тяжелой митральной
регургитации. (А) Тяжелая митральная регургитация после баллонной валь-
вулопластики митрального клапана. (Б) 2D-ВСЭхоКГ створки митрального кла-
пана (стрелка), с которой ассоциируется развитие митральной регургитации.
ЛП — левое предсердие; ПП — правое предсердие.
ПП
ПП
ЛП
ЛП
А
Б
ch05.indd 107
03.04.2019 11:39:40
108
ЧАСТЬ I Передовые методы эхокардиографии
ных осложнений за счет раннего распознания и
принятия своевременных мер по их устранению.
ЗАКЛЮЧЕНИЕ
ВСЭхоКГ проводят при транскатетерных вмешатель-
ствах в целях минимизации осложнений после ле-
чения структурных заболеваний сердца и аритмий.
Чаще всего используют катетерные датчики с фази-
рованной решеткой, поскольку они позволяют по-
лучать изображения, сопоставимые с информатив-
ностью ЧПЭхоКГ. Исследование может проводить
рентген-эндоваскулярный хирург или электрофизио-
Вмешательство
Позиция
Основные задачи
Осложнения
Закрытие ДМПП
либо открытого
овального окна
«Домашняя позиция»
Межпредсердная перего-
родка по длинной оси
Межпредсердная перего-
родка по короткой оси
Измерение размера дефекта (оценка
из разных позиций)
Диагностика сопутствующих аномалий
Оценка краев дефекта
Определение размера баллона
при допплерографии
Оценка стабильности окклюдера (тракция
вперед-назад)
Определение остаточного шунтирования
Перикардиальная жидкость
Тромбоз
Нестабильность окклюдера
Неверный выбор окклюдера
по размеру
Смещение окклюдера
Пункция межпред-
сердной
перегородки
Межпредсердная перего-
родка по длинной оси
Межпредсердная перего-
родка по короткой оси
Контроль проведения катетера и контакта
с первичной перегородкой в области
овального окна
Исключение повреждения аорты, перикарда
Перикардиальная жидкость
Перфорация аорты
Разрыв перегородки
Тромбоз
Баллонная вальвуло-
пластика митраль-
ного клапана
Межпредсердная перего-
родка по длинной оси
Межпредсердная перего-
родка по короткой оси
Визуализация со стороны
правого желудочка
Контроль пункции межпредсердной
перегородки
Оценка стеноза митрального клапана
Оценка степени митральной регургитации
Оценка митрального потока после раздува-
ния баллона
Перикардиальная жидкость
Разрыв створок
Тяжелая митральная
регургитация
Тромбоз
Аблация
при фибрилляции
предсердий
Межпредсердная перего-
родка по длинной оси
Межпредсердная перего-
родка по короткой оси
Позиция легочных вен
Ушко левого предсердия
Контроль пункции межпредсердной
перегородки
Мониторинг положения катетера
Контроль процедуры
Мониторинг образования тромбов
Перикардиальная жидкость
либо гемоперикард
Осложнения после пункции
межпредсердной
перегородки
Разрыв перегородки
Тромбоз
ДМПП — дефект межпредсердной перегородки.
СВОДНАЯ ИНФОРМАЦИЯ
Вмешательства, которые проводят под контролем внутрисердечной эхокардиографии
ЛИТЕРАТУРА
1. Silvestry FE, Kerber RE, Brook MM, et al. Echo-
cardiography-guided interventions, J Am Soc
Echocardiogr 22:213–231, 2009. quiz 316–317.
2. Bartel T, Mu
ller S, Biviano A, Hahn RT. Why
is intracardiac echocardiography helpful? Ben-
efits, costs, and how to learn, Eur Heart J 1(35):
69–76, 2014.
3. Asrress KN, Mitchell ARJ. Intracardiac echo-
cardiography, Heart 95:327–331, 2009.
4. Ali S, George LK, Das P, Koshy SKG. Intracar-
diac echocardiography: clinical utility and ap-
plication, Echocardiography 28:582–590, 2011.
5. Bartel T, Bonaros N, Mu
ller L, et al. Intracar-
diac echocardiography: a new guiding tool for
transcatheter aortic valve replacement, J Am
Soc Echocardiogr 24:966–975, 2011.
6. Medford BA, Taggart NW, Cabalka AK, et al.
Intracardiac echocardiography during atrial
septal defect and patent foramen ovale device
closure in pediatric and adolescent patients,
J Am Soc Echocardiogr 27:984–990, 2014.
7. George JC, Varghese V, Mogtader A. Intracar-
diac echocardiography: evolving use in inter-
ventional cardiology, J Ultrasound Med 33:
387–395, 2014.
8. Awad SM, Cao Q-L, Hijazi ZM. Intracardiac
echocardiography for the guidance of percu-
taneous procedures, Curr Cardiol Rep 11:210–
215, 2009.
9. Barker PCA. Intracardiac echocardiography
in congenital heart disease, J Cardiovasc Transl
Res 2:19–23, 2009.
10. Poommipanit P, Tobis J. Intracardiac echo-
cardiography (ICE) — guided biopsy of a
right atrial mass, J Invasive Cardiol 23:E99–
E101, 2011.
11. Hijazi ZM, Shivkumar K, Sahn DJ. Intracar-
diac echocardiography during interventional
and electrophysiological cardiac catheteriza-
tion, Circulation 119:587–596, 2009.
12. Zanchetta M, Onorato E, Rigatelli G, et al. In-
tracardiac echocardiography-guided trans-
catheter closure of secundum atrial septal de-
fect: a new efficient device selection method,
J Am Coll Cardiol 42:1677–1682, 2003.
13. Salem MI, Makaryus AN, Kort S, et al. Intra-
cardiac echocardiography using the AcuNav
ultrasound catheter during percutaneous bal-
loon mitral valvuloplasty, J Am Soc Echocar-
diogr 15:1533–1537, 2002.
14. Newton JD, Mitchell ARJ, Wilson N, Ormer-
od OJ. Intracardiac echocardiography for
лог. В настоящее время рекомендуется использо-
вать стандартные протоколы ВСЭхоКГ, разработан-
ные для всех хирургических вмешательств. Когда
катетерный датчик для ВСЭхоКГ будет способен
создавать трехмерные изображения, качество кото-
рых будет сопоставимо с качеством изображений
при 3D-ЧПЭхоКГ в режиме реального времени, тог-
да ВСЭхоКГ может стать предпочтительным мето-
дом визуализации при более сложных интервенци-
онных вмешательствах, например транскатетерной
пластике митрального клапана при митральной ре-
гургитации, транскатетерной имплантации аор-
тального клапана и закрытии ушка ЛП.
ch05.indd 108
03.04.2019 11:39:41
109
5 Внутрисердечная эхокардиография
patent foramen ovale closure: justification of
routine use, JACC Cardiovasc Interv 2:369,
2009. author reply 369–370.
15. Bartel T, Mu
ller S. Intraprocedural guidance:
which imaging technique ranks highest and
which one is complementary for closing para-
valvular leaks? Cardiovasc Diagn Ther 4:277–
278, 2014.
16. Saji M, Rossi AM, Ailawadi G, et al. Adjunc-
tive intracardiac echocardiography imaging
from the left ventricle to guide percutaneous
mitral valve repair with the MitraClip in pa-
tients with failed prior surgical rings, Catheter
Cardiovasc Interv, Jun 23, 2015.
17. Henning A, Mueller II , Mueller K, et al. Per-
cutaneous edge-to-edge mitral valve repair
escorted by left atrial intracardiac echocar-
diography (ICE), Circulation 11(130):e173–
e174, 2014.
18. Hahn R. Recent advances in echocardiogra-
phy for valvular heart disease, F1000Res.
F1000 Faculty Rev 4:914, 2015.
19. Kautzner J, Peichl P. 3D and 4D echo — ap-
plications in EP laboratory procedures, J In-
terv Card Electrophysiol 22:139–144, 2008.
20. Lee W, Griffin W, Wildes D, et al. A 10-Fr
ultrasound catheter with integrated micro-
motor for 4-D intracardiac echocardiogra-
phy, IEEE Trans Ultrason Ferroelectr Freq
Control 58:1478–1491, 2011.
21. Silvestry FE, Kadakia MB, Willhide J, Her-
rmann HC. Initial experience with a novel re-
al-time three-dimensional intracardiac ultra-
sound system to guide percutaneous cardiac
structural interventions: a phase 1 feasibility
study of volume intracardiac echocardiogra-
phy in the assessment of patients with struc-
tural heart disease undergoing percutaneous
transcatheter therapy, J Am Soc Echocardiogr
27:978–983, 2014.
22. Dhoble A., Nakamura M., Makar M., et al. 3D
intracardiac echocardiography during TAVR
without endotracheal intubation, JACC Car-
diovasc Imaging 9:1014–1015
23. Bulava A, Hanis J, Eisenberger M. Catheter
ablation of atrial fibrillation using zero-fluo-
roscopy technique: a randomized trial, Pacing
Clin Electrophysiol 38:797–806, 2015.
24. Bruce CJ, Friedman PA. Intracardiac echocar-
diography, Eur J Echocardiogr 2:234–244, 2001.
25. Kean AC, Gelehrter SK, Shetty I, et al. Expe-
rience with CartoSound for arrhythmia abla-
tion in pediatric and congenital heart disease
patients, J Interv Card Electrophysiol 29:139–
145, 2010.
26. Saliba W, Thomas J. Intracardiac echocar-
diography during catheter ablation of atrial
fibrillation, Europace 10(Suppl 3):iii42–iii47,
2008. Nov.
27. Biermann J, Bode C, Asbach S. Intracardiac
echocardiography during catheter-based ab-
lation of atrial fibrillation, Cardiol Res Pract
21, 2012. 921746921748.
28. Schwartzman D, Zhong H. On the use of Car-
toSound for left atrial navigation, J Cardio-
vasc Electrophysiol 21:656–664, 2010.
29. Rausch P, Manfai B, Varady E, Simor T. Ra-
diofrequency catheter ablation of left ven-
tricular outflow tract tachycardia with the as-
sistance of the CartoSound system, Europace
11:1248–1249, 2009.
30. Forleo GB, Pappalardo A, Avella A, et al. Real-
time integration of intracardiac echocardiog-
raphy and 3D electroanatomical mapping to
guide catheter ablation of isthmus-dependent
atrial flutter in a patient with complete situs
inversus and interruption of the inferior vena
cava with azygos continuation, J Interv Card
Electrophysiol 30:273–277, 2011.
31. Kadakia MB, Silvestry FE, Herrmann HC. In-
tracardiac echocardiography guided trans-
catheter aortic valve replacement, Catheter
Cardiovasc Interv 85:497–501, 2014.
32. Bartel T, Gliech V, Mu
ller S. Device closure
of patent ductus arteriosus: optimal guidance
by transaortic phased-array imaging, Eur J
Echocardiogr 12:E9, 2011.
33. Akkaya E, Vuruskan E, Zorlu A, et al. Aortic
intracardiac echocardiography-guided septal
puncture during mitral valvuloplasty, Eur
Heart J Cardiovasc Imaging 15:70–76, 2014.
34. Bartel T, Edris A, Velik-Salchner C, Mu
ller S.
Intracardiac echocardiography for guidance
of transcatheter aortic valve implantation un-
der monitored sedation: a solution to a dilem-
ma? Eur Heart J Cardiovasc Imaging 17:1–8,
2016.
35. Teramachi Y, Suda K, Yoshimoto H, et al.
Transpulmonary echocardiography to guide
stent implantation into coarctation of the
aorta, Echocardiography 32:872–874, 2015.
36. Kudo Y, Suda K, Yoshimoto H, et al. Trans-
pulmonary echocardiography as a guide for
device closure of patent ductus arteriosus,
Catheter Cardiovasc Interv 86:264–270, 2015.
37. Mitsopoulos G, Hanna RF, Brejt SZ, et al.
Retrieval of a dislodged catheter using com-
bined fluoroscopy and intracardiac echocar-
diography, Case Rep Radiol 6:610362–610364,
2015.
38. Saksena S, Sra J, Jordaens L, et al. A prospec-
tive comparison of cardiac imaging using in-
tracardiac echocardiography with trans-
esophageal echocardiography in patients with
atrial fibrillation: the intracardiac echocar-
diography guided cardioversion helps inter-
ventional procedures study, Circ Arrhythm
Electrophysiol 3:571–577, 2010.
39. Hutchinson MD, Jacobson JT, Michele JJ, et
al. A comparison of intracardiac and trans-
esophageal echocardiography to detect left
atrial appendage thrombus in a swine model,
J Interv Card Electrophysiol 27:3–7, 2010.
40. Anter E, Silverstein J, Tschabrunn CM, et al.
Comparison of intracardiac echocardiogra-
phy and transesophageal echocardiography
for imaging of the right and left atrial ap-
pendages, Heart Rhythm 11:1890–1897, 2014.
41. Ren J-F, Marchlinski FE, Supple GE, et al. In-
tracardiac echocardiographic diagnosis of
thrombus formation in the left atrial append-
age: a complementary role to transesophageal
echocardiography, Echocardiography 30:72–
80, 2013.
42. Ternacle J, Lellouche N, Deux J-F, et al. Left
atrial appendage closure monitoring without
sedation: a pilot study using intracardiac
echocardiography through the oesophageal
route, EuroIntervention 11:936–941, 2015.
43. Filgueiras-Rama D, de Torres-Alba F, Castre-
jo
́
n-Castrejo
́
n S, et al. Utility of intracardiac
echocardiography for catheter ablation of
complex cardiac arrhythmias in a medium-
volume training center, Echocardiography 32:
660–670, 2015.
44. Koenig PR, Abdulla R-I, Cao Q-L, Hijazi ZM.
Use of intracardiac echocardiography to
guide catheter closure of atrial communica-
tions, Echocardiography 20:781–787, 2003.
45. Kim SS, Hijazi ZM, Lang RM, Knight BP. The
use of intracardiac echocardiography and
other intracardiac imaging tools to guide non-
coronary cardiac interventions, J Am Coll
Cardiol 53:2117–2128, 2009.
46. Silvestry FE, Cohen MS, Armsby LB, et al.
Guidelines for the echocardiographic assess-
ment of atrial septal defect and patent fora-
men ovale: from the American Society of
Echocardiography and Society for Cardiac
Angiography and Interventions, J Am Soc
Echocardiogr 28:910–958, 2015.
47. Chessa M, Carminati M, Butera G, et al. Early
and late complications associated with trans-
catheter occlusion of secundum atrial septal
defect, J Am Coll Cardiol 39:1061–1065, 2002.
48. Yared K, Baggish AL, Solis J, et al. Echocar-
diographic assessment of percutaneous pat-
ent foramen ovale and atrial septal defect clo-
sure complications, Circ Cardiovasc Imaging
2:141–149, 2009.
49. El-Said HG, Moore JW. Erosion by the Am-
platzer septal occluder: experienced operator
opinions at odds with manufacturer recom-
mendations? Cathet Cardiovasc Intervent 73:
925–930, 2009.
50. Amin Z, Hijazi ZM, Bass JL, et al. Erosion of
Amplatzer septal occluder device after closure
of secundum atrial septal defects: review of
registry of complications and recommenda-
tions to minimize future risk, Catheter Car-
diovasc Interv 63:496–502, 2004.
51. Kamouh A, Osman MN, Rosenthal N, Blitz
A. Erosion of an Amplatzer septal occluder
device into the aortic root, Ann Thorac Surg
91:1608–1610, 2011.
52. Diab K, Kenny D, Hijazi ZM. Erosions, ero-
sions, and erosions! Device closure of atrial
septal defects: how safe is safe? Catheter Car-
diovasc Interv 80:168–174, 2012.
53. Lo
́
pez-Ferna
́
ndez T, Go
́
mez de Diego JJ,
Monedero MC, et al. Aortic wall erosion after
percutaneous closure of atrial septal defect, J
Am Soc Echocardiogr 24(227):e5–e8, 2011.
54. Amin Z. Echocardiographic predictors of car-
diac erosion after Amplatzer septal occluder
placement, Catheter Cardiovasc Interv 83:84–
92, 2014.
55. Fassini G, Russo Dello A, Conti S, Tondo C.
An alternative transseptal intracardiac echo-
cardiography strategy to guide left atrial ap-
pendage closure: the first described case,
J Cardiovasc Electrophysiol 25:1269–1271, 2014.
56. Saji M, Ragosta M, Dent J, Lim DS. Use of in-
tracardiac echocardiography to guide percu-
taneous transluminal mitral commissuroto-
my: a 20-patient case series, Catheter Cardio-
vasc Interv, May 6, 2015.
57. Johnson SB, Seward JB, Packer DL. Phased-
array intracardiac echocardiography for guid-
ing transseptal catheter placement: utility and
learning curve, Pacing Clin Electrophysiol 25:
402–407, 2002.
58. Thompson AJ, Hagler DJ, Taggart NW. Trans-
septal puncture to facilitate device closure of
“ long-tunnel” patent foramen ovale, Catheter
Cardiovasc Interv 85:1053–1057, 2015.
59. Lin D, Callans DJ. Use of intracardiac echo-
cardiography during atrial fibrillation abla-
tion to avoid complications, Future Cardiol
11:683–687, 2015.
60. Wunderlich NC, Beigel R, Siegel RJ. Manage-
ment of mitral stenosis using 2D and 3D
echo-Doppler imaging, JACC Cardiovasc Im-
aging 6:1191–1205, 2013.
61. Lee M-S, Naqvi TZ. A practical guide to the
use of echocardiography in assisting structur-
al heart disease interventions, Cardiol Clin
31:441–454, 2013.
62. Yu W-C. Intracardiac echocardiography-as-
sisted transseptal puncture, J Chin Med Assoc
73:509–510, 2010.
ch05.indd 109
03.04.2019 11:39:41
ch05.indd 110
03.04.2019 11:39:42
111
6 Ультразвуковое
исследование сердца
PATRICIA A. PELLIKKA, MD • MICHAEL W. CULLEN, MD • HIROSHI SEKIGUCHI, MD
Появление портативных ультразвуковых систем для
исследования сердца позволило проводить ультра-
звуковое исследование (УЗИ) у постели больного.
Ручные ультразвуковые системы стали применять
еще много лет назад [1], однако технологический
прогресс улучшил качество изображения, умень-
шил размер оборудования, облегчил эксплуатацию
и снизил его стоимость, что сделало УЗИ более до-
ступным. Возможность проведения эхокардиогра-
фии (ЭхоКГ) у постели больного сделала этот метод
визуализации привлекательным в качестве допол-
нения к клинической оценке состояния пациента.
УЗИ имеет особую диагностическую ценность, т.к.
дает представление о структуре сердца, его функции
и гемодинамике. Врач, оценивая изображения в ре-
жиме реального времени (без обработки), получает
моментальную информацию.
Во время УЗИ пациент не подвергается воздей-
ствию радиации или каких-либо других физиче-
ских факторов. Однако в настоящее время качество
и точность получаемой информации напрямую за-
висят от навыков и знаний врача, который прово-
дит исследование.
УЗИ сердца у постели больного, которое иногда
называют фокусным УЗИ сердца [2], отличается от
ЭхоКГ, проводимой с помощью стационарной уль-
тразвуковой системы. При ЭхоКГ возможна более
развернутая оценка сердца, но для этого нужны глу-
бокие знания, сертификация и отдельное отделение
в больнице [3]. В США ЭхоКГ проводят одни спе-
циалисты, а интерпретацию полученных изображе-
ний осуществляют другие. Большинство исследо-
ваний проводят в специализированном отделении,
лишь некоторое количество выполняют у постели
больного. Наиболее широко ЭхоКГ используют кар-
диологи, УЗИ сердца могут проводить и другие спе-
циалисты. В некоторых учебных программах пред-
усмотрены занятия по проведению и интерпрета-
ции УЗИ сердца и отдельные — по проведению и
интерпретации УЗИ других органов.
УЗИ сердца может быть продолжением физи-
кального осмотра пациента. Оно позволяет выявить
причины нарушений гемодинамики, оценить коли-
чество перикардиальной жидкости, а также заме-
нить ЭхоКГ при ее недоступности. В отличие от
ЭхоКГ, УЗИ сердца у постели больного следует про-
водить только при четких клинических показаниях.
В данной главе описаны технология, клиниче-
ские и практические аспекты УЗИ сердца. Эта ин-
формация представлена в виде руководства для чи-
тателей, которые стремятся улучшить свои знания
в области УЗИ сердца, и для тех врачей, которые
только планируют начать использование данного
метода в своей клинической практике для диагно-
стики и оценки сердечной недостаточности.
ТЕХНОЛОГИИ
Совершенствование технологий привело к разра-
ботке портативных (laptop), ручных (handheld) и
карманных (pocket-sized) ультразвуковых систем.
Любую из них можно использовать для УЗИ сердца
Технологии
Медицинские работники
Тренинг
Визуализация
Клиническое применение
Дополнение к физикальному осмотру
Измерение и оценка структур сердца
Показания к срочному ультразвуковому
исследованию сердца
Ответ организма пациента
на инфузионную терапию
Недифференцированная гипотензия
Острая дыхательная недостаточность
Использование ультразвука
при различных манипуляциях
Обучение
Применение технологии
в труднодоступных районах
Влияние данных эхокардиографии
на результаты лечения
Обеспечение качества
и интеграция в практику
Перспективы
Заключение
ch06.indd 111
03.04.2019 11:40:03
112
ЧАСТЬ I Передовые методы эхокардиографии
наряду со стационарными ультразвуковыми сис-
темами. В табл. 6 .1 приведено сравнение характе-
ристик современных стационарных, портативных,
ручных и карманных ультразвуковых систем. На
рис. 6 .1 представлены типичные модели ультразву-
ковых систем, доступные в настоящее время.
Стоимость и характеристики всех систем широ-
ко варьируют, но все системы мобильны и могут ис-
пользоваться для УЗИ сердца у постели больного.
Современные портативные ультразвуковые систе-
мы имеют большинство стандартных режимов, до-
ступных в стационарных ультразвуковых системах,
включая визуализацию в 2D-режиме, цветовую, им-
пульсно-волновую и непрерывно-волновую доппле-
рографию. Ручные и карманные ультразвуковые си-
стемы имеют ограниченные возможности. В одном
исследовании приведены данные, что портативные
ультразвуковые системы сопоставимы по качеству
изображения и точности диагностики со стационар-
ными ультразвуковыми системами [4].
Карманные ультразвуковые системы позволяют
получать двухмерные изображения с цветовой доп-
плерографией или без нее, если использовать дат-
чики с фазированной решеткой. Такая ультразвуко-
вая система легко помещается в карман, и врач мо-
жет использовать ее во время физикального осмотра.
Карманные ультразвуковые системы относительно
недороги и приравниваются к инструментам физи-
кального осмотра наряду со стетоскопом.
Однако диагностические возможности карман-
ных ультразвуковых систем (в отличие от возмож-
ностей стационарных ультразвуковых систем) край-
не малы из-за своих технологических особенностей,
а именно меньшей области обзора, низкого разре-
шения и упрощенной технологии датчиков (рис. 6 .2).
Карманные ультразвуковые системы не имеют на-
строек по улучшению качества изображения, на-
пример изменения частоты кадров, усиления, мас-
штабирования, а также возможности проведения
допплерографии. Врачи должны знать все эти огра-
ничения и учитывать возможные риски неправиль-
ной диагностики.
Исследование показало, что расхождение данных
было в 27% случаев при обследовании пациентов с
Характеристика
Современные стационарные
ультразвуковые системы
Портативные ультразвуковые
системы
Ручные и карманные
ультразвуковые системы
Источник
питания
Электроэнергия
Электроэнергия
либо аккумуляторы
Аккумуляторы (зарядка через
1–2 часа использования)
Хранение данных Несколько полных исследований
Несколько полных
исследований
Ограниченный объем данных
Передача данных DICOM для передачи и хранения
данных в PACS либо других систе-
мах и базах данных
DICOM для передачи и хране-
ния данных в PACS либо
других системах и базах
данных
Несовместимы с DICOM,
но данные можно перенести
в компьютер либо систему
«облачного» хранения
Методы
и режимы
3D, 2D, импульсно-волновая и непре-
рывно-волновая допплерография,
цветовая допплерография, бипла-
нарный метод, стресс-ЭхоКГ,
оценка деформации миокарда
2D, импульсно-волновая
и непрерывно-волновая
допплерография, цветовая
допплерография, стресс-
ЭхоКГ, оценка деформации
(доступна в большинстве
систем)
2D, ограниченная цветовая
допплерография либо без нее
Получение
изображений
Режим «Масштабирование», регули-
ровка фокуса, шкала оттенков
серого, высокая частота кадров,
динамический диапазон с задавае-
мой шириной сектора, особые
настройки при затруднении
визуализации
Множество режимов, как
у современных стационарных
ультразвуковых систем
Небольшое количество режимов,
низкая частота кадров
Просмотр
изображений
Большой монитор с высоким
разрешением
Средний монитор
Маленький монитор с низким
разрешением
Количественная
оценка структур
сердца
3D, 2D, импульсно-волновая
и непрерывно-волновая, цветовая
допплерография, оценка деформа-
ции с различной степенью
автоматизации
2D, импульсно-волновая
и непрерывно-волновая,
цветовая допплерография,
оценка деформации
(доступна в некоторых
системах)
2D, линейное измерение
DICOM — цифровая визуализация и коммуникация данных в медицине; PACS — системы хранения и обмена изображениями..
ТАБЛИЦА 6.1 Сравнение особенностей современных стационарных, портативных, ручных и карманных
ультразвуковых систем
ch06.indd 112
03.04.2019 11:40:03
113
6 Ультразвуковое исследование сердца
А
Б
Г
В
Рис. 6 .1 Доступные ультразвуковые системы для проведения эхокар-
диографии у постели больного. (A) Современная стационарная ультразву-
ковая система, которую можно использовать у постели больного, но ее боль-
шие габариты усложняют перемещение. (Б) Ультразвуковая система, имеющая
многие функции стационарной ультразвуковой системы, но с большей мобиль-
ностью. (В) Портативная ультразвуковая система. (Г) Карманная ультразвуко-
вая система.
помощью стационарной и карманной ультразвуко-
вых систем [5]. Большинство расхождений отмеча-
лось при оценке нарушений локальной сократимо-
сти миокарда и поражении клапанов (рис. 6 .3) [5].
Это указывает на то, что карманные ультразвуковые
системы не следует использовать в качестве един-
ственного инструмента диагностики, особенно если
клинические данные противоречат данным эхокар-
диографического исследования. Однако исследова-
ния с помощью карманной ультразвуковой системы
довольно точны, если их проводит опытный врач в
экстренной ситуации с целью полуколичественной
или качественной оценки нарушений систоличе-
ской функции левого желудочка (ЛЖ), дилатации
ЛЖ и наличия перикардиальной жидкости [5, 6].
МЕДИЦИНСКИЕ РАБОТНИКИ
В настоящее время УЗИ сердца могут проводить
разные медицинские работники (табл. 6 .2) [7]. Кар-
диологи (взрослые и детские), анестезиологи, врачи
скорой помощи, которые прошли углубленную
подготовку по ЭхоКГ, отмечают, что использование
карманных ультразвуковых систем полезно для бы-
строго принятия решения у постели больного. Вра-
чи, которые специализируются в неотложной по-
мощи, медицине критических состояний, кардиохи-
рургии, терапии внутренних болезней, а также
практиканты и стажеры с небольшим опытом отме-
чают пользу карманных ультразвуковых систем.
Обучение УЗИ (в том числе сердца) введено в учеб-
ные программы некоторых медицинских школ для
улучшения понимания анатомии и физиологии
сердца, расширения возможностей физикального
осмотра и повышения точности диагностики у по-
стели больного [8]. В недавно проведенных иссле-
дованиях отмечается [9, 10], что УЗИ сердца у по-
стели больного проводят все большее количество
кардиологов [11].
ТРЕНИНГ
Точность интерпретации результатов ЭхоКГ зави-
сит от опыта врача, который проводит исследова-
ние [6, 12–14]. Неверное толкование данных умень-
шает ценность метода, поэтому важно, чтобы врачи
прошли соответствующую подготовку. Большин-
ство медицинских профессиональных сообществ
выпустили собственные рекомендации по обуче-
нию УЗИ сердца (табл. 6 .3), в том числе American
Society of Echocardiography, American College of Emer-
gency Physicians, American College of Chest Physicians,
Canadian Cardiovascular Society/Canadian Society of
Echocardiography, European Association of Echocardi-
ography и World Interactive Network Focused on Criti-
cal UltraSound (WINFOCUS) [2, 9, 10, 15–19].
Требования к обучению УЗИ сердца более вари-
абельны, чем к обучению комплексной ЭхоКГ [15],
что обусловлено ограниченной практикой и более
простой техникой проведения исследования. В ре-
комендациях Canadian Cardiovascular Society/Cana-
dian Society of Echocardiography 2010 г. предложено,
что стажер должен обучаться ЭхоКГ минимум 4 не-
дели, а во время тренинга в рамках курса кардиоло-
гии выполнить 40 самостоятельных трансторакаль-
ных исследований и интерпретировать 90 протоко-
лов. Это позволит квалифицировать врача для
выполнения УЗИ сердца, т.к. он будет владеть на-
выками диагностики в конкретных клинических си-
туациях [18]. Однако такое обучение не приравни-
ch06.indd 113
03.04.2019 11:40:03
114
ЧАСТЬ I Передовые методы эхокардиографии
Рис. 6 .2 Качество изображений карманной ультразвуковой системы и стационарной ультразвуковой системы. Сравнение изображений, получен-
ных в парастернальной позиции по длинной оси с помощью карманной ультразвуковой системы (А) и стационарной ультразвуковой системы (Б). Качество изо-
бражений выше у стационарной ультразвуковой системы, что позволяет лучше визуализировать левый желудочек, восходящий отдел аорты, а также структуры,
которые могут быть связаны с болью в груди у данного пациента [Cullen MW, Blauwet LA, Vatury OM, et al. Diagnostic capability of comprehensive handheld vs trans-
thoracic echocardiography. Mayo Clin Proc 89:790–798, 2014].
Плевральные/
перикардиальные/
абдоминальные
находки (13%)
Врожденные
особенности
(5%)
Ново-
образования
(5%)
Дилатация
аорты (18%)
Поражение клапанов (18%)
Оценка размеров
и функции
правого
желудочка (8%)
Локальная
сократимость
миокарда
(24%)
Оценка размеров
и функции левого
желудочка (9%)
Рис. 6 .3 Отличие данных, полученных с помощью карманной и стацио-
нарной ультразвуковых систем. Обследовано 190 пациентов, расхождение
результатов было в 62 случаях у 51 (27%) пациента. Исследование проводили
опытные кардиологи, а интерпретацию выполняли специалисты с третьим
уровнем подготовки в области ЭхоКГ (процент несогласованности указан на
диаграмме) [Cullen MW, Blauwet LA, Vatury OM, et al. Diagnostic capability of
comprehensive handheld vs transthoracic echocardiography. Mayo Clin Proc
89:790–798, 2014].
вается к обучению кардиолога, поскольку в реко-
мендациях Royal College of Physicians and Surgeons
of Canada и Core Cardiology Training Symposium
(COCATS) [15] указано, чтобы врачи имели второй
уровень подготовки, а именно провели 150 трансто-
ракальных исследований и интерпретировали 300
протоколов. Данные рекомендации относятся и к
обучению медицинских работников, которые будут
проводить УЗИ сердца. Обучение и опыт очень
важны. Исследования показали, что вариабельность
диагностики опытными и неопытными врачами
весьма высока [6].
УЗИ сердца добавлено в учебную программу
анестезиологов, врачей, специализирующихся в не-
отложной помощи. Было принято решение, что об-
учение должно включать визуализацию и интер-
претацию под наблюдением более опытного врача.
Также подготовка включает изучение возможных
клинических ситуаций, связанных с конкретными
диагнозами, с которыми врач будет сталкиваться на
практике [2, 9, 10]. Однако рекомендации и мини-
мальные требования к обучению варьируют. Кар-
диологические общества выставляют наиболее ши-
рокие требования [2, 15, 18, 19]. В рекомендациях
American College of Emergency Physicians описаны
требования к обучению УЗИ сердца как во время
стажировки, так и после нее [16]. В них указано, что
все врачи должны получить основные теорети-
ческие и практические знания по ультразвуковой
диагностике в критических ситуациях, а также про-
слушать однодневный курс по основам физики уль-
тразвука. В конце обучения врач должен пройти
стажировку по экстренному УЗИ, включая семина-
ры, в течение как минимум двух недель (не менее
80 час). Для сдачи экзамена необходимо провести не
менее 150 исследований в экстренных условиях.
Созданы экспресс-курсы по обучению экстренному
УЗИ врачей на руководящих должностях, которым
не нужны теоретические знания в этой области.
Также изданы рекомендации, основанные на прак-
тическом опыте, для врачей скорой помощи, кото-
А
Б
ch06.indd 114
03.04.2019 11:40:04
115
6 Ультразвуковое исследование сердца
Медицинский
работник
Объем исследования
Положительные
моменты
Ограничения
Кардиолог
Диагностика и количественная оценка заболе-
ваний сердца
Большой опыт и знания
передовых технологий,
включая 3D-режим
и визуализацию
деформации миокарда
Наиболее затратный
подход; возможны огра-
ничения в экстренных
случаях
Врач-реаниматолог Оценка инфузионной терапии и систолической
функции, выявление причин гипотонии
и нестабильности гемодинамики
Высокая скорость про-
ведения исследования
Недостаточный опыт диа-
гностики сложных
пороков сердца и количе-
ственной оценки
Анестезиолог
Интраоперационное исследование
Умение проводить чрес-
пищеводную ЭхоКГ
во время операции
Недостаточный опыт коли-
чественной оценки
Врач скорой
помощи
Оценка при травмах грудной клетки
и при наличии гипотонии
Быстрая оценка и выяв-
ление некардиогенных
причин гипотонии
Недостаточный уровень
подготовки
Медработники, ока-
зывающие первич-
ную медицинскую
помощь
Скрининг спортсменов, оценка при одышке
Дополнение к физи-
кальному осмотру
Ограниченный опыт диа-
гностики болезней сердца
Средний медицин-
ский персонал
Распознание специфических состояний: гипер-
трофии и систолической дисфункции левого
желудочка [7], ревматического заболевания
[98], сердечной недостаточности [42]
Экономически выгод-
ный подход
Могут быть не распознаны
многие патологии сердца
ЭхоКГ — эхокардиография.
ТАБЛИЦА 6.2 Медицинские работники, которые могут проводить ультразвуковое исследование сердца
Профессиональное сообщество
Описание
American Society of Echocardiography [2] Экспертное заключение по требованиям к оборудованию, объему практических
занятий и теоретическому обучению УЗИ сердца
American Society of Echocardiography
и American College of Emergency
Physicians [9]
Совместные рекомендации по использованию портативной ультразвуковой системы
для УЗИ сердца в условиях экстренных ситуаций
American College of Cardiology
и American Society of Echocardiography
[15]
Совместные рекомендации по обучению, включая описание этапов и количество
экзаменов. Рекомендуется обучение использованию портативной ультразвуковой
системы в качестве дополнения к физикальному осмотру
American College of Emergency Physicians
[16]
Учебные пособия по использованию портативной ультразвуковой системы
в экстренных ситуациях, включая фокусное УЗИ при травме и УЗИ сердца
American College of Chest Physicians
and La Socitete de Reanimation de
Langue Francaise [17]
Рекомендации для реаниматологов по ультразвуковой диагностике, включая общий
курс (торакальная, сосудистая, абдоминальная диагностика) и ЭхоКГ (базовый
курс и продвинутый модуль)
Canadian Cardiovascular Society
и Canadian Society of Echocardiography
[18]
Определены минимальные требования к объему каждого уровня обучения
ЭхоКГ взрослых пациентов
European Association of Echocardiography
[19]
Обучение врачей всех специализаций, кроме кардиологов, которые полностью
владеют ЭхоКГ, использованию карманных ультразвуковых систем.
Специфические показания к использованию карманных ультразвуковых систем
World Interactive Network Focused
on Critical UltraSound (WINFOCUS)
[10]
Результаты международных исследований в области диагностики с помощью УЗИ
сердца, а также рекомендации по клиническому применению портативных ультра-
звуковых систем для проведения УЗИ сердца
УЗИ — ультразвуковое исследование; ЭхоКГ — эхокардиография.
ТАБЛИЦА 6.3 Рекомендации профессиональных сообществ по использованию портативных ультразвуковых систем
ch06.indd 115
03.04.2019 11:40:04
116
ЧАСТЬ I Передовые методы эхокардиографии
рые не прошли обучение во время стажировки [16].
Кроме того, анестезиологическая программа вклю-
чает обучение чреспищеводной ЭхоКГ.
Программы обучения УЗИ сердца разнообразны
по содержанию, но большинство из них включают
и УЗИ грудной клетки, брюшной полости и сосудов
[20]. American College of Chest Physicians предлагает
серию трехдневных теоретических и практических
online-курсов с экзаменом. После завершения обу-
чения врач может получить сертификат с подтверж-
дением умения проводить УЗИ сердца. American
College of Chest Physicians описывает все техниче-
ские и теоретические требования к компетентности,
однако не указывает требуемое количество выпол-
ненных процедур [17].
Для определения критериев, позволяющих оце-
нить степень овладения знаниями специалистом по
ультразвуковой диагностике, следует провести не-
обходимые исследования [10] по поиску объектив-
ных требований к компетентности врача, который
проводит УЗИ [2]. Большинство исследований бы-
ло сосредоточено на том, смогут ли обучающиеся
распознать систолическую дисфункцию ЛЖ либо
расширение нижней полой вены. Требования к ком-
петентности довольно широки, т.к. подразумевают
участие специалистов в разных областях. Возмож-
но, в дальнейшем новая симуляционная техника
позволит улучшить оценку компетентности [21].
Некоторые специалисты, включая студентов ме-
дицинских университетов и практикантов, могут
проводить УЗИ сердца в качестве дополнения к фи-
зикальному осмотру либо при решении конкрет-
ных клинических задач. В рамках учебной програм-
мы, которая включала теоретическую, практиче-
скую и клиническую основы, студенты смогли
получить навыки проведения исследования, тем са-
мым повысив точность клинической диагностики
по сравнению с классическим сбором анамнеза, фи-
зикальным осмотром и оценкой электрокардио-
граммы [22]. Это способствовало улучшению оцен-
ки и распознанию тяжелой систолической дисфунк-
ции ЛЖ.
В другом исследовании практиканты терапевти-
ческого профиля прошли краткий тренинг по вы-
явлению сниженной систолической функции ЛЖ,
обусловленной нарушением сократимости миокар-
да либо утолщением стенок, касания створок ми-
трального клапана перегородки (расстояние от пи-
ка E до перегородки > 1 см при ЭхоКГ в М-режиме).
Практиканты во время физикального осмотра ис-
пользовали для выявления систолической дисфунк-
ции ЛЖ портативные ультразвуковые системы [23].
Врачи-практиканты использовали для обучения си-
муляционную технику, которая имитировала рас-
ширение левого предсердия (ЛП), в рамках одноча-
совой программы тренинга, что позволило повы-
сить точность распознавания расширения ЛП
> 50 мм [24].
Обучение также прошли терапевты (20 час тео-
рии и 40 самостоятельно проведенных исследова-
ний) [25]. При диагностике поражения клапанов ис-
пользовали портативные ультразвуковые системы и
довольно часто были упущены дисфункция право-
го желудочка (ПЖ) и ЛЖ и нарушения локальной
сократимости миокарда (чувствительность 40–57%
по сравнению с чувствительностью стационарной
ультразвуковой системы).
Итак, рекомендации по обучению УЗИ сердца
существенно различаются. Зачастую курс обучения
очень короткий. Врачи после небольшой подготов-
ки могут использовать УЗИ сердца при физикаль-
ном осмотре у постели больного, но результаты ме-
нее точные по сравнению с результатами комплекс-
ной оценки с помощью трансторакальной ЭхоКГ,
для которой сроки обучения более длительные.
ВИЗУАЛИЗАЦИЯ
Оптимизация изображений необходима для пра-
вильной идентификации и интерпретации резуль-
татов. Во время ЭхоКГ, выполняемой с помощью
стационарной ультразвуковой системы, использу-
ют 2D-режим, 3D-режим, импульсно-волновую, не-
прерывно-волновую и цветовую допплерографию.
При УЗИ сердца режимов меньше. Менее опытные
специалисты, как правило, могут выводить изобра-
жения по длинной и короткой оси ЛЖ в парастер-
нальной, апикальной четырехкамерной и субко-
стальной позициях.
На рис. 6 .4 показаны изображения, которые по-
лучены из стандартных позиций. Данные позиции,
как правило, полностью соответствуют всем требо-
ваниям к УЗИ сердца. Однако для визуализации в
апикальной позиции зачастую необходим более
мощный датчик с глубоким проникновением уль-
тразвукового луча, что невозможно при использо-
вании карманных и ручных ультразвуковых систем.
Без учета врачом этого технического аспекта воз-
можны ошибочные выводы. Опытные специалисты
легко интерпретируют изображения, получаемые
при цветовой допплерографии с помощью ручных
ультразвуковых систем, но недостаточно опытный
врач плохо воспринимает эти изображения, что сни-
жает точность оценки [26].
Важным преимуществом стационарных ультра-
звуковых систем является возможность сохранения
изображений, карманные ультразвуковые системы
обычно не имеют такой возможности. В связи с этим
врачи не могут использовать стандартные протоко-
лы и сохранять изображения. Кроме того, изобра-
жения, получаемые с помощью карманных ультра-
звуковых систем, не отображают всю исследуемую
анатомическую область, а файлы часто несовмести-
мы со стационарными ультразвуковыми системами.
В связи с этим специалист, использующий карман-
ную ультразвуковую систему, должен документи-
ch06.indd 116
03.04.2019 11:40:04
117
6 Ультразвуковое исследование сердца
ровать интерпретацию изображений во время фи-
зикального осмотра. Кардиолог обычно интерпре-
тирует изображения в режиме реального времени и
устно сообщает о полученных результатах до офи-
циального заключения. Независимо от того, сохра-
няются изображения или нет, результаты иссле-
дований должны быть задокументированы в виде
стандартного заключения. В будущем по мере раз-
вития и совершенствования портативных и карман-
ных ультразвуковых систем появится возможность
записи изображений и их хранения, что значитель-
но облегчит контроль и позволит сравнивать полу-
чаемые данные с предыдущими.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
УЗИ сердца у постели больного проводят в различ-
ных обстоятельствах. Наиболее часто им дополня-
ют физикальный осмотр для повышения точности
оценки внутрисосудистого объема, выявления си-
столической дисфункции ЛЖ и причины шумов
сердца, т.е . того, что трудно оценить при физикаль-
ном осмотре. Также УЗИ сердца помогает в визуа-
лизации конкретных структур сердца при невоз-
можности проведения ЭхоКГ с помощью стацио-
нарной ультразвуковой системы, в экстренных
ситуациях, во время обучения и в полевых услови-
ях. Данный метод предложено использовать для
© Mayo Clinic
© Mayo Clinic
© Mayo Clinic
© Mayo Clinic
© Mayo Clinic
А
Б
В
Г
Д
Е
Рис. 6.4 Изображения, полученные с помощью карманной ультразвуковой системы у постели больного. (A) A Парастернальная позиция по длин-
ной оси. (Б) A Парастернальная позиция по короткой оси. (В) A Апикальная четырехкамерная позиция. (Г) A Апикальная позиция по длинной оси. (Д) A
Апикальная двухкамерная позиция. В данном примере изображение субоптимальное, т.к . не визуализируется эндокард передней стенки. Визуализация в апикаль-
ных двухкамерной позиции и позиции по длинной оси может быть сложной для неопытного врача. (Е) A Субкостальная позиция.
ch06.indd 117
03.04.2019 11:40:04
118
ЧАСТЬ I Передовые методы эхокардиографии
скрининга (проведение коротких обследований и
определение показаний к проведению ЭхоКГ с по-
мощью стационарной ультразвуковой системы).
УЗИ сердца в качестве скринингового метода иссле-
дования у постели больного предоставляет больше
информации, чем эхокардиография (ЭКГ), и может
снизить количество эхокардиографических иссле-
дований. Однако необходимы дальнейшие исследо-
вания точности и экономической эффективности
этого метода [27, 28].
ДОПОЛНЕНИЕ К ФИЗИКАЛЬНОМУ ОСМОТРУ
Обычно при оценке заболевания сердца стандарт-
ного физикального осмотра недостаточно [29]. Мно-
гочисленные исследования показали, что УЗИ серд-
ца с помощью портативной ультразвуковой систе-
мы предоставляет более точную информацию, чем
физикальный осмотр [26, 30, 31]. Даже кардиологи
не всегда точно определяют причину шума в сердце
[32]. УЗИ сердца у постели больного с использова-
нием 2D-режима и цветовой допплерографии по-
вышает точность физикального осмотра и опреде-
ления причины шума [33]. Однако для прогноза и
выбора тактики лечения крайне важно количествен-
но оценить степень стеноза либо регургитации [34].
Для количественной оценки нужна интеграция не-
скольких параметров, полученных в 2D-режиме ли-
бо 3D-режиме и при цветовой допплерографии, что
невозможно без применения комплексных эхокар-
диографических систем [35, 36]. Кроме того, при
УЗИ сердца с помощью портативной ультразвуко-
вой системы тяжесть стеноза нередко недооценива-
ют даже опытные кардиологи [33]. Таким образом,
УЗИ у постели больного полезно использовать в ка-
честве дополнения к физикальному осмотру при
поиске причины шума в сердце, но не следует пола-
гаться на результаты только этого метода исследо-
вания при оценке тяжести заболеваний клапанов.
Для прогнозирования исхода и принятия реше-
ния о тактике лечения крайне важно проводить
клиническую оценку систолической дисфункции
ЛЖ, однако оценка может быть неточной, даже ес-
ли были выполнены ЭКГ и рентгенография органов
грудной клетки [37]. УЗИ сердца у постели больно-
го облегчает раннее распознание нарушения систо-
лической функции ЛЖ [37]. С помощью портатив-
ных ультразвуковых систем обследовали пациентов
с подозрением на дисфункцию ЛЖ и сердечно-со -
судистую недостаточность. Результаты были сопо-
ставимы с результатами трансторакальной ЭхоКГ,
полученными с помощью стационарной ультразву-
ковой системы с использованием бипланарного ме-
тода Симпсона, в 91% случаев у пациентов с фрак-
цией выброса левого желудочка (ФВЛЖ) < 40%, а
также с показателем мозгового натрийуретического
пептида в плазме крови, который используют при
скрининге дисфункции ЛЖ [38]. В рекомендациях
указано, что функция ЛЖ должна быть определена
количественно, а не визуально [39], однако количе-
ственная оценка в портативных ультразвуковых си-
стемах недоступна. Кроме того, распознать наруше-
ние локальной сократимости миокарда с помощью
УЗИ сердца может только врач с большим опытом
проведения ЭхоКГ. УЗИ сердца у постели больного
можно использовать для определения систоличе-
ской дисфункции ЛЖ у пациентов с соответствую-
щими симптомами. Если обнаружены отклонения,
необходимо провести ЭхоКГ с помощью стационар-
ной ультразвуковой системы для количественной
оценки.
Внутрисосудистый объем можно точно оценить
путем визуализации нижней полой вены [40, 41]. У
пациентов с хронической сердечной недостаточно-
стью, которым выполняли катетеризацию сердца,
оценка нижней полой вены с помощью портатив-
ной ультразвуковой системы коррелировала с дав-
лением заклинивания легочной артерии. Макси-
мальный диаметр нижней полой вены, равный
2,0 см, и ее спадение на 45% свидетельствуют о дав-
лении заклинивания легочной артерии 15 мм рт. ст.
и выше [41]. Однако в некоторых случаях оценка
нижней полой вены затруднена, а также зависит от
опыта и уровня подготовки врача и технических
возможностей ультразвуковой системы [40–42].
Спортсмены проходят физикальный осмотр, как
правило, до участия в спортивных соревнованиях.
Скрининг с помощью ЭхоКГ и ЭКГ остается спор-
ным. Исследования показали, что ЭхоКГ может
быть методом скрининга у спортсменов [43], одна-
ко нужны дополнительные исследования целесо-
образности рутинного скрининга спортсменов с по-
мощью ЭКГ и ЭхоКГ [44].
ИЗМЕРЕНИЕ И ОЦЕНКА СТРУКТУР СЕРДЦА
Установлено, что УЗИ сердца у постели больного
позволяет выявить увеличение ЛЖ, систолическую
дисфункцию ЛЖ, гипертрофию ЛЖ, увеличение
ПЖ, систолическую дисфункцию ПЖ, расширение
ЛП [24], увеличение правого предсердия (ПП), на-
личие перикардиальной жидкости и определить диа-
метр нижней полой вены (табл. 6 .4) [2, 41, 45]. Чув-
ствительность и специфичность УЗИ сердца варьи-
руют от 74 до 97% и от 94 до 99% соответственно
при выявлении систолической дисфункции ЛЖ [4,
6,8,12–19],от71до94%иот97до100%привыяв-
лении расширения ЛЖ [13, 16–20], от 89 до 91% и
от 96 до 99% при перикардиальной жидкости [4, 5,
12, 13, 16–20].
Хорошая корреляция отмечается между данны-
ми портативной и стационарной ультразвуковых
систем при оценке размеров ЛЖ (рис. 6 .5) и толщи-
ны стенки [5, 6, 33, 46, 47], т.е . данные, полученные
с помощью портативной ультразвуковой системы,
можно использовать для определения массы и ги-
ch06.indd 118
03.04.2019 11:40:06
119
6 Ультразвуковое исследование сердца
пертрофии ЛЖ [6]. Данные о диаметре проксималь-
ного участка аорты, полученные опытным специа-
листом с помощью стационарной и портативной
ультразвуковых систем, хорошо коррелируют [5].
Расширение ЛП наблюдается при многих заболе-
ваниях сердца. В качестве эталона используют ре-
зультаты ЭхоКГ, полученные с помощью стацио-
нарной ультразвуковой системы. УЗИ сердца об-
наруживает умеренное и тяжелое расширение ЛП
(чувствительность 74%, специфичность 69%) [48].
В рекомендациях отмечено, что точную количе-
ственную оценку размеров ЛП для определения его
Нарушение/параметр Описание
Особенности
Расширение корня
аорты
Линейное измерение в парастерналь-
ной позиции по длинной оси [2, 5,
22]
Роль ультразвука в выявлении нарушений не установлена
Расширение ЛЖ
Линейное измерение в парастерналь-
ной позиции по длинной оси [5]
Рекомендуется измерение в 3D-режиме, а не линейное
измерение
Систолическая дис-
функция ЛЖ
Визуальная оценка с применением
бинарной классификации (< 45%
или ≥ 45%) и УЗИ сердца [5, 22]
Рекомендуется объемное измерение в двух проекциях
либо в 3D-режиме. УЗИ сердца не обеспечивает адекватной
детальной оценки локальной сократимости миокарда
Гипертрофия ЛЖ
Индекс массы миокарда рассчитывают
после линейных измерений
Неопытным врачам может быть сложно провести диффе-
ренциальную диагностику с гипертрофической кардиомио-
патией и амилоидозом
Расширение ЛП
Линейное измерение ЛП [24]
Рекомендуется измерение объемов. Расширение ЛП является
маркером некоторых заболеваний, однако для более глубо-
кой оценки рекомендуется комплексная ЭхоКГ
Расширение ПЖ
Субъективная оценка [45]
Рекомендуется проведение измерений
Систолическая дис-
функция ПЖ
Субъективная оценка [45]
Рекомендуется проведение измерений
Перикардиальная
жидкость
Средний либо большой объем
Свернувшуюся перикардиальную жидкость бывает сложно
отличить от эпикардиального жира. Локализованную жид-
кость небольшого объема определить сложно, особенно
после кардиохирургического вмешательства. При тампо-
наде сердца нужна комплексная ЭхоКГ
Диаметр нижней
полой вены
Линейное измерение и оценка
диаметра на вдохе [40, 41]
Возможна несогласованность между врачами-диагностами
из-за ограничений портативных ультразвуковых систем
ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; УЗИ — ультразвуковое исследование; ЭхоКГ — эхокардио-
графия.
ТАБЛИЦА 6.4 Оценка нарушений сердечно-сосудистой системы с помощью ультразвукового исследования сердца
Рис. 6 .5 Корреляция данных, полученных с помощью карманной и стационарной ультразвуковых систем. Хорошая корреляция отмечается при про-
ведении исследований опытными врачами, которые целенаправленно оценивают структуры в соответствии с клинической задачей, например размеры и систоли-
ческую функцию левого желудочка (ЛЖ). (А) По оси Y — показатели фракции выброса (ФВ), полученные с помощью карманной ультразвуковой системы, по
оси Х — показатели фракции выброса, полученные при ЭхоКГ с помощью стационарной ультразвуковой системы. (Б) По оси Y — показатели диастолического
размера левого желудочка, полученные с помощью карманной ультразвуковой системы, по оси Х — показатели диастолического размера левого желудочка, по-
лученные при ЭхоКГ с помощью стационарной ультразвуковой системы [Prinz C, Voigt J. Diagnostic accuracy of a hand-held ultrasound scanner in routine patients re-
ferred for echocardiography. J Am Soc Echocardiogr 24:111–116, 2011].
ФВ, стационарная ультразвуковая система (%)
Ф
В
,
к
а
р
м
а
н
н
а
я
у
л
ь
т
р
а
з
в
у
к
о
в
а
я
с
и
с
т
е
м
а
(
%
)
Р
а
з
м
е
р
Л
Ж
,
к
а
р
м
а
н
н
а
я
у
л
ь
т
р
а
з
в
у
к
о
в
а
я
с
и
с
т
е
м
а
(
м
м
)
Размер ЛЖ, стационарная ультразвуковая система (мм)
100
80
60
40
20
0
0
20
40
60
r=0,91
p<0,01
80 100
80
60
40
20
0
0
20
40
60
r=0,99
p<0,01
80
А
Б
ch06.indd 119
03.04.2019 11:40:06
120
ЧАСТЬ I Передовые методы эхокардиографии
объема обеспечивает комплексная ЭхоКГ [49]. Точ-
ная оценка размеров ЛП имеет важное клиническое
значение, т.к . объем ЛП может предсказать исход
сердечно-сосудистой патологии [50, 51].
Расширение ПЖ и его систолическая функция
были оценены с помощью портативной ультразву-
ковой системы, а затем эти данные сравнили с дан-
ными стационарной ультразвуковой системы [45].
Отмечается значительная вариабельность получен-
ных результатов. В настоящее время во всех реко-
мендациях указано, что количественную оценку
размеров ПЖ и его систолической функции следует
проводить только с помощью стационарной уль-
тразвуковой системы [52].
Количественная оценка размеров и функции по-
лостей сердца зачастую предпочтительнее, но каче-
ственная оценка у постели больного во многих слу-
чаях может быть достаточной и экономически вы-
годной. Необходимы дальнейшее изучение данной
проблемы и выбор наиболее подходящего исследо-
вания для качественной и количественной оценки.
ПОКАЗАНИЯ К СРОЧНОМУ УЛЬТРАЗВУКОВОМУ
ИССЛЕДОВАНИЮ СЕРДЦА
УЗИ сердца у постели больного с нестабильной ге-
модинамикой проводят в случаях, когда ЭхоКГ не-
доступна. Это помогает врачу определить тип шока
(обструктивный, кардиогенный, гиповолемический,
перераспределительный) как причину нестабиль-
ности гемодинамики [53].
ОБСТРУКТИВНЫЙ ШОК
УЗИ сердца при обструктивном шоке используют
для выявления обструкции выходного тракта лево-
го желудочка (ВТЛЖ) [53]. Чувствительность различ-
ных симптомов (например, парадоксальный пульс,
тахикардия, повышение венозного давления в ярем-
ных венах, гипотония, уменьшение громкости сер-
дечных тонов) при выявлении тампонады сердца
невелика [54], тогда как УЗИ сердца может значи-
тельно помочь в диагностике и выборе тактики ле-
чения.
С помощью УЗИ сердца у постели больного мож-
но легко выявить перикардиальную жидкость, ко-
торая является причиной сердечной недостаточности
[55]. Если есть сомнения, следует провести ЭхоКГ с
допплерографией с помощью стационарной ультра-
звуковой системы для выявления отклонений гемо-
динамики в печеночных венах в течение дыхатель-
ного цикла. Выявление перикардиальной жидко-
сти — одна из целей фокусного УЗИ при травме,
которое выполняют хирурги и врачи, специализи-
рующиеся в неотложной помощи и оказании меди-
цинской помощи пациентам с травмами [56].
Гипердинамическое кровообращение отмечается
примерно у 20% пациентов при ранней манифеста-
ции сепсиса [57]. Гипердинамическое кровообраще-
ние в сочетании с относительной гиповолемией мо-
жет привести к обструктивному шоку из-за внутри-
желудочковой обструкции даже при нормальной
анатомии сердца. Кроме этого, к обструкции ВТЛЖ
может привести гипердинамическое сокращение
желудочков.
Обструкция ВТЛЖ может сочетаться с гипертро-
фией ЛЖ, синдромом апикального баллонирова-
ния и острым инфарктом миокарда [58]. Синдром
апикального баллонирования может имитировать
острый коронарный синдром, при котором об-
струкция ВТЛЖ встречается в 25% случаев [59, 60].
Одним из наиболее частых диагнозов у пациен-
тов с нестабильной гемодинамикой является тром-
боэмболия легочной артерии, однако чувствитель-
ность и специфичность ультразвукового метода
при диагностике этого заболевания не определены
[61]. Расширение либо дисфункция правых отделов
сердца наблюдается как у пациентов с тромбоэмбо-
лией, так и без нее [61]. УЗИ сердца не следует ис-
пользовать в качестве единственного метода диа-
гностики тромбоэмболии легочной артерии в от-
сутствие визуализируемого тромба в нижней полой
вене (НПВ) либо правых отделах сердца.
КАРДИОГЕННЫЙ ШОК
Размеры и функции желудочков можно оценить с
помощью количественных, полуколичественных и
качественных методов. Поскольку УЗИ сердца при
сердечной недостаточности используют в качестве
быстрого вспомогательного инструмента в допол-
нение к физикальному осмотру, то зачастую прово-
дят качественную либо полуколичественную оцен-
ку [53]. Наиболее распространенными параметрами
оценки систолической функции в условиях отделе-
ния реанимации и интенсивной терапии являются
фракция выброса, фракция изменения площади и
ударный объем [53]. Отмечено, что визуальная оцен-
ка фракции выброса реаниматологами, которые
прошли курс обучения УЗИ, имеет высокую точ-
ность [62]. Глобальная оценка функции желудочков
является фундаментальным критерием для раннего
выявления кардиогенного шока. Наряду с этим
важна точная оценка локальной сократимости мио-
карда. Точность оценки и распознания нарушений
сократимости миокарда зависит как от технических
возможностей ультразвуковой системы, так и от
подготовки врача, проводящего исследование [63],
поэтому для окончательной оценки рекомендуется
комплексная ЭхоКГ. При диагностике кардиогенно-
го шока также важна оценка клапанов. Первой и
главной задачей является выявление жизнеугрожа-
ющего состояния клапанов сердца, аортальной ре-
гургитации и тяжелой митральной регургитации
[53]. После исключения угрожающей жизни пато-
логии подклапанного аппарата и регургитации сле-
дует выявить тяжелые нарушения гемодинамики,
обусловленные аортальным стенозом, митральным
ch06.indd 120
03.04.2019 11:40:06
121
6 Ультразвуковое исследование сердца
стенозом, выраженной хронической митральной
регургитацией и трикуспидальной регургитацией
[53]. При этих патологиях нужно незамедлительное
лечение.
ГИПОВОЛЕМИЧЕСКИЙ И ПЕРЕРАСПРЕДЕЛИТЕЛЬНЫЙ ШОК
Гиповолемический и перераспределительный шок
обычно наблюдают у пациентов в критическом со-
стоянии. Раннее распознавание и начало лечения
(инфузия жидкости в сочетании с введением ино-
тропных препаратов) имеют первостепенное значе-
ние. УЗИ сердца у постели больного позволяет оце-
нить внутрисосудистый объем жидкости и выявить
сопутствующую септическую кардиомиопатию.
ОТВЕТ ОРГАНИЗМА ПАЦИЕНТА
НА ИНФУЗИОННУЮ ТЕРАПИЮ
Для оценки ответа на инфузионную терапию ис-
пользуют два параметра: диаметр НПВ и интеграл
скорости кровотока в ВТЛЖ (VTIВТЛЖ). Во время
измерения диаметра НПВ следует учитывать его из-
менения во время акта дыхания (рис. 6 .6). Установ-
лено, что изменение VTIВТЛЖ во время акта дыха-
ния, пассивного поднятия ног прогнозирует ответ-
ную реакцию организма пациента на инфузионную
терапию [64–69].
Для оценки диаметра (D) НПВ во время дыхания
используют различные формулы [70–73]:
(Dmax – Dmin)/Dmin (порог 18%),
(Dmax – Dmin)/Dmean (порог 12 либо 16%),
(Dmax – Dmin)/Dmax (порог 40%).
У пациентов на механической вентиляции лег-
ких с помощью метаанализа было установлено, что
измерения диаметра НПВ имели чувствительность
81% и специфичность 87% для прогнозирования
ответа организма на инфузию жидкости [74]. Диа-
гностическая точность оценки НПВ во время акта
дыхания у пациентов на спонтанном дыхании сни-
жена [74, 75].
НЕДИФФЕРЕНЦИРОВАННАЯ ГИПОТЕНЗИЯ
УЗИ сердца часто используют вместе с УЗИ брюш-
ной полости у постели тяжелобольных пациентов с
гипотензией без установленной причины. В одном
исследовании были приведены рекомендации для
отделений неотложной помощи по проведению ком-
плексного УЗИ сердца и брюшной полости пациен-
там с недифференцированной гипотензией [76]. В
протокол была включена оценка сердца, перитоне-
альной и плевральной полостей, НПВ, аорты, что
помогает принять решение о тактике лечения [76].
В рандомизированном контролируемом исследова-
нии пациенты были разделены на две группы. В
первой группе пациентам сразу было выполнено
УЗИ, во второй группе УЗИ было отсрочено [77].
При диагностике использовали следующие пози-
ции: субкостальную, парастернальную по длинной
оси, апикальную четырехкамерную. Цели визуали-
зации: НПВ, печеночно-почечный канал, таз, брюш-
ная часть нисходящего отдела аорты. Было установ-
лено, что фокусное УЗИ снижает количество диа-
гностических ошибок и позволяет более точно
поставить окончательный диагноз [77]. В исследо-
вании оценивали результаты обследования с по-
правкой на квалификацию врача, результаты лече-
ния не учитывали. Дальнейшие исследования сле-
дует направить на изучение влияния УЗИ сердца на
клинический исход, заболеваемость, продолжитель-
ность нахождения пациента в стационаре и эконо-
мическую эффективность.
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
УЗИ сердца часто используют с УЗИ грудной клет-
ки и УЗИ сосудов для определения причин острой
дыхательной недостаточности [53]. Исследование
показало, что комплексное УЗИ сердца и грудной
клетки у пациентов с дыхательной недостаточно-
стью позволяет более быстро принять правильное
клиническое решение, сокращает время распозна-
ния кардиогенного отека легких, снижает объем на-
значаемой инфузионной терапии [78]. Еще одно ис-
следование (в рамках отделения неотложной помо-
щи) показало, что целенаправленное использование
УЗИ сердца на ранней стадии диагностики помогло
в 14% случаев выявить острые и опасные для жиз-
ни состояния у пациентов с симптомами дыхатель-
ной недостаточности, которым без УЗИ диагноз не
был бы поставлен [79]. Исследование пациентов с
острой гипоксемической дыхательной недостаточ-
ностью в отделении реанимации и интенсивной те-
A
B
21
2,12 cm
3,06 cm
Рис. 6 .6 Оценка нижней полой вены у постели больного. Изображение
нижней полой вены получено с помощью портативной ультразвуковой систе-
мы. В левой части изображения отражен максимальный диаметр (Dmax), рав-
ный 3,06 см, справа — минимальный диаметр (Dmin), равный 2,12 см. Индекс
спадения нижней полой вены рассчитывают как разность между Dmax и Dmin,
деленную на Dmean (среднее значение Dmax и Dmin).
ch06.indd 121
03.04.2019 11:40:06
122
ЧАСТЬ I Передовые методы эхокардиографии
рапии показало, что комплексное УЗИ сердца и груд-
ной клетки позволяет провести дифференциальную
диагностику между кардиогенным отеком легких и
острым респираторным дистресс-синдромом с вы-
сокой точностью [80]. Ранее врачи неотложной по-
мощи полагались лишь на результаты физикально-
го осмотра и клинические данные, однако сейчас
УЗИ сердца играет важную роль в определении
причин острой дыхательной недостаточности.
ИСПОЛЬЗОВАНИЕ УЛЬТРАЗВУКА
ПРИ РАЗЛИЧНЫХ МАНИПУЛЯЦИЯХ
В табл. 6 .5 [81–86] перечислены основные манипу-
ляции, во время которых проводили УЗИ и ЭхоКГ.
Перикардиоцентез выполняли под контролем с по-
мощью стационарной ультразвуковой системы. В
экстренных ситуациях можно использовать порта-
тивную ультразвуковую систему. Более высокий
процент успешности и минимальное количество
осложнений отмечаются в тех случаях, когда мани-
пуляцию выполняет специально обученный персо-
нал и в соответствии со стандартным протоколом
[87]. Установку центрального венозного катетера
под контролем УЗИ считают стандартом. В большин-
стве случаев катетер позиционируют во внутренней
яремной вене, реже — в подключичной (подмы-
шечной) вене или в бедренной вене. Исследования
показали, что УЗИ в режиме реального времени
ускоряет проведение процедуры, уменьшает коли-
чество ложных пункций и механических ослож-
нений по сравнению со стандартным методом без
визуализации [83, 84, 88, 89]. Аналогично УЗИ при
канюляции лучевой артерии повышает процент
успешной пункции с первой попытки по сравне-
нию с пальпаторным методом [86, 90].
ОБУЧЕНИЕ
Студенты, которые прошли курс обучения УЗИ сер-
дечно-сосудистой системы, отметили, что у них
улучшилось понимание анатомии и физиологии и
повысилось качество физикального осмотра [8, 91,
92]. Есть сообщение об обучении УЗИ в труднодо-
ступных районах мира с помощью телекоммуника-
ций [93].
ПРИМЕНЕНИЕ ТЕХНОЛОГИИ
В ТРУДНОДОСТУПНЫХ РАЙОНАХ
УЗИ сердца у постели больного использовали при
оценке состояния пациентов из малообеспеченных
групп населения. В одном бедном районе США про-
вели обследование пациентов с помощью порта-
тивной ультразвуковой системы и в 12,4% случаев
выявили сердечно-сосудистую патологию [25]. В
отдаленных районах Индии пациентов опрашивали
устно и узнавали клинический статус, а при подо-
зрении на сердечно-сосудистое заболевание прово-
дили УЗИ с помощью портативной ультразвуковой
системы. Для расшифровки и интерпретации ре-
зультатов использовали «облачные» компьютерные
технологии. Серьезные нарушения сердечно-сосу-
Первый автор,
год
Манипуляция
Метод визуализации Пациенты
Результаты
Tsang, 2002
[81]
Перикардиоцентез
ЭхоКГ
977, выполнено 1127
перикардиоцентезов
с 1979 по 2000 г.
Общее количество осложнений
4,7%, серьезные осложнения
1,2%
El Haddad,
2015 [82]
Перикардиоцентез
ЭхоКГ
212 с онкологией
Успешность 99%, средняя
выживаемость после про-
цедуры 145 дней (пациент
с раком легких — 95 дней)
Karakitsos,
2006 [83]
Канюляция внутренней
яремной вены (цен-
тральный венозный
катетер)
УЗИ сосудов
900 в критическом состо-
янии, рандомизиро-
ваны по методу
диагностики
Большой процент успешности
и меньший процент
осложнений
Fragou, 2011
[84]
Канюляция подключич-
ной вены (централь-
ный венозный
катетер)
УЗИ сосудов
401 в критическом состо-
янии, рандомизиро-
ваны по методу
диагностики
Большой процент успешности
и меньший процент
осложнений
Prabhu, 2010
[85]
Канюляция бедренной
вены (диализный
катетер)
УЗИ сосудов
110 в критическом состо-
янии, рандомизиро-
ваны по методу
диагностики
Большой процент успешности
и меньший процент
осложнений
Shiver, 2006
[86]
Канюляция лучевой
артерии (артериаль-
ный катетер)
УЗИ сосудов
30 в критическом состоя-
нии, рандомизированы
по методу диагностики
Меньшее время на проведение
процедуры и более высокая
частота успешности
УЗИ — ультразвуковое исследование; ЭхоКГ — эхокардиография.
ТАБЛИЦА 6.5 Исследования использования портативной ультразвуковой системы во время манипуляций
ch06.indd 122
03.04.2019 11:40:06
123
6 Ультразвуковое исследование сердца
дистой системы были выявлены у 17% исследуе-
мых, незначительные — у 20% [94].
Похожее исследование было проведено в Гонду-
расе с использованием карманных ультразвуковых
систем и дистанционной интерпретацией результа-
тов [95]. Карманные ультразвуковые системы пока-
зали свою значимость при обследовании пациентов
с ревматическими заболеваниями сердца, когда ис-
следование проводили два врача либо специально
обученные медсестры [96–98]. Портативные уль-
тразвуковые системы применяли в случаях скорой
и неотложной помощи на Международной косми-
ческой станции.
ВЛИЯНИЕ ДАННЫХ ЭХОКАРДИОГРАФИИ
НА РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
В нескольких исследованиях изучали влияние дан-
ных ЭхоКГ на качество оказания медицинской по-
мощи и клинический исход. В табл. 6 .6 [48, 99–101]
перечислены основные публикации о влиянии про-
ведения ЭхоКГ на результаты лечения. Исследова-
ния, в которых оценивали влияние ЭхоКГ с помо-
щью портативных ультразвуковых систем на кли-
нический исход, были сфокусированы на конкретных
параметрах. Например, при обследовании 75 паци-
ентов с декомпенсированной острой сердечной не-
достаточностью больший диаметр НПВ (как при
поступлении, так и при выписке) ассоциировался с
более высокой вероятностью госпитализации в те-
чение 30 дней [100]. Кроме этого, при обследовании
пациентов с одним либо несколькими факторами
риска сердечной недостаточности ценность данных
УЗИ сердца была выше ценности показателя уров-
ня N-терминального мозгового натрийуретическо-
го пептида В-типа при прогнозировании госпита-
лизации, осложнений и летальных исходов [99]. В
рандомизированном исследовании 453 пациентов,
которых обследовали с помощью стандартной уль-
тразвуковой системы [48], УЗИ сердца не повлияло
на общую продолжительность госпитализации. На-
против, во многих исследованиях было показано,
что именно УЗИ сердца у пациентов с сепсисом из-
менило дальнейшую тактику лечения.
Первый автор,
год
Популяция пациентов
Обследование
Результаты
Lipczyn
́
ska, 2011
[99]
175 амбулаторных пациен-
тов общего профиля с сер-
дечной недостаточностью
и факторами риска (ише-
мическая болезнь сердца,
гипертония или сахарный
диабет)
Сбор анамнеза, физикаль-
ный осмотр, определение
уровня натрийуретиче-
ского пептида, ЭхоКГ
с помощью карманной
ультразвуковой системы
Аномалии, обнаруженные при ЭхоКГ: наруше-
ние функции левого желудочка и увеличение
левого желудочка (независимые предикторы
осложнений в дальнейшем)
Lucas, 2011 [48] 453 стационарных пациента Рандомизированы по спе-
циалистам, проводящим
исследование (окончив-
шие 27-часовой курс
ЭхоКГ с помощью кар-
манной ультразвуковой
системы и специалисты
в данной области)
В целом у пациентов, которым проводили
ЭхоКГ с помощью портативной ультразвуко-
вой системы, продолжительность пребывания
в клинике не сократилась. Однако в группе
пациентов с признаками сердечной недоста-
точности после проведения ЭхоКГ
с помощью портативной ультразвуковой
системы продолжительность госпитализации
снизилась
Goonewardena,
2008 [100]
75 пациентов с декомпенси-
рованной острой сердечной
недостаточностью
Все пациенты обследованы
по стандартному прото-
колу с определением
уровня натрийуретиче-
ского пептида, а также
с помощью ручной уль-
тразвуковой системы,
предназначенной для
использования в экстрен-
ных ситуациях
Больший диаметр нижней полой вены перед
выпиской выступал независимым предикто-
ром повторной госпитализации через 30 дней
Kanji, 2014 [101] 220 пациентов с вазопрес-
сорзависимым шоком
ЭхоКГ проводили
с помощью карманной
ультразвуковой системы,
в группе сравнения —
также с помощью стацио-
нарной ультразвуковой
системы
Пациенты, которым проводили ЭхоКГ
с помощью карманной ультразвуковой
системы, получали меньше внутривенных
инфузий и имели более высокую 28-дневную
выживаемость с меньшим пора жением почек
по сравнению с пациентами, которым прово-
дили ЭхоКГ с помощью стационарной уль-
тразвуковой системы
ЭхоКГ — эхокардиография.
ТАБЛИЦА 6.6 Исследования влияния проведения эхокардиографии у постели больного на клинические результаты лечения
ch06.indd 123
03.04.2019 11:40:06
124
ЧАСТЬ I Передовые методы эхокардиографии
Воспроизводимость изображений
Взаимодействие с аккредитованным диагностическим
отделением
Регулярный аудит
Местные образовательные курсы
Сотрудничество между отделениями
Межведомственная поддержка процесса обеспечения
качества
Стандартизированное обучение специалистов
Выполнение исследований под контролем независимых
экспертов
ТАБЛИЦА 6.7 Обеспечение качества исследования
у постели больного
Недавнее исследование пациентов в состоянии
септического шока показало, что лечение сепсиса на-
ряду с терапией сердечной недостаточности связано
с более высокой выживаемостью, меньшим количе-
ством вводимой жидкости и увеличенным исполь-
зованием инотропных препаратов в отличие от те-
рапии в соответствии со стандартными протокола-
ми [101]. В этом исследовании благодаря УЗИ сердца
врачи смогли идентифицировать пациентов, чув-
ствительных к введению жидкости, что предотвра-
тило ненужную инфузию у пациентов с гипотензи-
ей, организм которых не реагирует на введение жид-
кости [101]. Все эти результаты доказывают пользу
применения УЗИ сердца при принятии решений в
конкретных клинических ситуациях. Таким обра-
зом, ЭхоКГ имеет наибольший потенциал положи-
тельного влияния на исход лечения.
ОБЕСПЕЧЕНИЕ КАЧЕСТВА
И ИНТЕГРАЦИЯ В ПРАКТИКУ
Поскольку важные решения основаны на резуль-
татах УЗИ, необходимо, чтобы информация была
точной. Каждое медицинское учреждение должно
обеспечивать получение адекватных изображений и
обучение персонала точной интерпретации резуль-
татов. Для этого необходимо предпринять несколь-
ко шагов. Во-первых, все изображения и их интер-
претация должны быть воспроизводимыми. Во-
вторых, УЗИ сердца при сердечной недостаточности
следует проводить в тесном сотрудничестве с аккре-
дитованным отделением ЭхоКГ. Сюда относят регу-
лярные проверки изображений, а также протоколы
исследований. Аудит включает оценку корреляции
с другими методами визуализации, а именно с чрес-
пищеводной ЭхоКГ и трансторакальной ЭхоКГ,
магнитно-резонансной томографией сердца, ком-
пьютерной томографией, радионуклидным иссле-
дованием и коронарной ангиографией (при их до-
ступности). Практикующие врачи-диагносты долж-
ны уметь интерпретировать результаты с учетом
противоречащих данных других исследований, осо-
бенно пациентов в критическом состоянии. Распоз-
нать систолическую дисфункцию нетрудно, но об-
наружить нарушение локальной сократимости мио-
карда может лишь опытный кардиолог.
Выявить умеренный и большой объем перикар-
диальной жидкости несложно, но признаки тампо-
нады сердца могут присутствовать и при меньшем
количестве жидкости, а локальный небольшой объ-
ем перикардиальной жидкости бывает трудно оце-
нить, особенно в случае недостаточной четкости изо-
бражения.
Руководство медицинских учреждений должно
знать обо всех ограничениях карманных ультразву-
ковых систем. Следует проводить местные образо-
вательные курсы и сертификацию, чтобы гаранти-
ровать глубокие знания своих специалистов. Кроме
этого, контроль качества включает проведение кон-
ференций, посвященных практике использования
УЗИ. В табл. 6 .7 перечислены шаги, которые учреж-
дения могут предпринять для обеспечения качества
исследования у постели больного.
ПЕРСПЕКТИВЫ
В профессиональном сообществе должна быть уста-
новлена и внедрена стандартизация обучения УЗИ
сердца. Необходимо достичь согласованности за-
ключений, подготовленных различными исследо-
вателями, с поправкой на оборудование и диагноз.
Следует определить с точки зрения оказания меди-
цинской помощи оптимальные возможности УЗИ,
в том числе допплерографии, необходимые разме-
ры и разрешающую способность ультразвуковых
систем, требования к качеству изображений, а так-
же экономическую эффективность данного метода
диагностики. Для этого нужно провести сравнитель-
ные исследования диагностики с помощью стацио-
нарной и портативной ультразвуковых систем [102],
чтобы лучше изучить, как их использование влияет
на процесс лечения. Наконец, необходимы клини-
ческие испытания роли и влияния УЗИ на результа-
ты лечения.
ЗАКЛЮЧЕНИЕ
Появление относительно недорогих ультразвуко-
вых систем с простым интерфейсом, рост количе-
ства учебных программ по проведению УЗИ сердца,
широкое признание ценности этого метода и ис-
пользования его результатов в клинике способство-
вали внедрению данной технологии в клиническую
практику. УЗИ сердца у постели больного все чаще
проводят в качестве дополнения к физикальному
осмотру для ответа на конкретные клинические во-
просы. Данный метод полезен при лечении пациен-
тов в критическом состоянии, когда стационарная
ультразвуковая система недоступна. Однако УЗИ
сердца при количественной оценке не заменяет ком-
плексную ЭхоКГ. Дальнейшие исследования долж-
ны определить роль УЗИ сердца в клинической прак-
тике и влияние на результаты лечения.
ch06.indd 124
03.04.2019 11:40:06
125
6 Ультразвуковое исследование сердца
Клиническая ситуация
Изображение
Обучение
Применение
У постели больного
Приемное отделение
Отделение неотложной
помощи
Отделение реанимации
и интенсивной терапии
Вмешательство
Машина скорой помощи
Труднодоступные районы
Цель — зона интереса
Субкостальная позиция
позволяет быстро
оценить наличие пери-
кардиальной жидко-
сти, диаметр нижней
полой вены, систоли-
ческую функцию
левого желудочка, осо-
бенно у пациентов
с гипотензией
Теоретическая и прак-
тическая подготовка,
включая изучение
всех возможных кли-
нических ситуаций
Дополнение к физикальному осмотру
для быстрой оценки структур сердца
Оценка гемодинамики в отсутствие ста-
ционарной ультразвуковой системы
Оценка гипотензии и реакции организма
пациента на инфузионную терапию
Оценка острой дыхательной
недостаточности
Проведение вмешательств под контролем
Обучение специалистов с небольшим
опытом
СВОДНАЯ ИНФОРМАЦИЯ
Ультразвуковое исследование сердца
ЛИТЕРАТУРА
1. Roelandt J, Wladimiroff JW, Baars AM. Ul-
trasonic real time imaging with a hand-held-
scanner. Part II — initial clinical experience,
Ultrasound Med Biol 4:93–97, 1978.
2. Spencer K, Kimura B, Korcarz C, et al. Fo-
cused cardiac ultrasound: recommendations
from the American Society of Echocardiogra-
phy, J Am Soc Echocardiogr 26:567–581, 2013.
3. Picard MH, Adams D, Bierig SM, et al. Amer-
ican society of echocardiography recommen-
dations for quality echocardiography labora-
tory operations, J Am Soc Echocardiogr 24:1–
10, 2011.
4. Perk G, Molisse T, Remolina A, et al. Laptop-
sized echocardiography machine versus full-
sized top-of-the-line machine: a comparative
study, J Am Soc Echocardiogr 20:281–284, 2007.
5. Cullen MW, Blauwet LA, Vatury OM, et al.
Diagnostic capability of comprehensive
handheld vs transthoracic echocardiography,
Mayo Clin Proc 89:790–798, 2014.
6. Liebo MJ, Israel RL, Lillie EO, et al. Is pocket
mobile echocardiography the next-genera-
tion stethoscope? A cross-sectional compari-
son of rapidly acquired images with standard
transthoracic echocardiography, Ann Intern
Med 155:33–38, 2011.
7. Kirkpatrick JN, Belka V, Furlong K, et al. Ef-
fectiveness of echocardiographic imaging by
nurses to identify left ventricular systolic dys-
function in high-risk patients, Am J Cardiol
95:1271–1272, 2005.
8. Rao S, van Holsbeeck L, Musial JL, et al. A pi-
lot study of comprehensive ultrasound edu-
cation at the Wayne State University School
of Medicine: a pioneer year review, J Ultra-
sound Med 27:745–749, 2008.
9. Labovitz AJ, Noble VE, Bierig M, et al. Fo-
cused cardiac ultrasound in the emergent set-
ting: a consensus statement of the American
Society of Echocardiography and American
College of Emergency Physicians, J Am Soc
Echocardiog 23:1225–1230, 2010.
10. Via G, Hussain A, Wells M, et al. Internation-
al evidence-based recommendations for fo-
cused cardiac ultrasound, J Am Soc Echocar-
diogr 27:683.e1–683.e33, 2014.
11. Stewart WJ, Douglas PS, Sagar K, et al. Echo-
cardiography in emergency medicine: a poli-
cy statement by the American Society of
Echocardiography and the American College
of Cardiology. The Task Force on Echocar-
diography in Emergency Medicine of the
American Society of Echocardiography and
the Echocardiography TPEC Committees of
the American College of Cardiology, J Am Soc
Echocardiogr 12:82–84, 1999.
12. Prinz C, Dohrmann J, van Buuren F, et al.
The importance of training in echocardiog-
raphy: a validation study using pocket echo-
cardiography, J Cardiovasc Med 13:700–707,
2012.
13. Michalski B, Kasprzak JD, Szymczyk E, Lip-
iec P. Diagnostic utility and clinical useful-
ness of the pocket echocardiographic device,
Echocardiography 29:1–6, 2012.
14. Martin LD, Howell EE, Ziegelstein RC, et al.
Hospitalist performance of cardiac hand-car -
ried ultrasound after focused training, Am J
Med 120:1000–1004, 2007.
15. Ryan T, Berlacher K, Lindner JR, et al. CO-
CATS 4 task force 5: training in echocardiog-
raphy, J Am Coll Cardiol 65:1786–1799, 2015.
16. American College of Emergency Physicians:
Emergency ultrasound guidelines—policy
statement, Ann Emerg Med 53:550–570, 2009.
17. Mayo PH, Beaulieu Y, Doelken P, et al. Amer-
ican college of chest physicians/la socie
́
te
́
de
re
́
animation de langue francaise statement on
competence in critical care ultrasonography,
Chest 135:1050–1060, 2009.
18. Burwash IG, Basmadjian A, Bewick D, et al.
2010 Canadian Cardiovascular Society/Cana-
dian Society of Echocardiography guidelines
for training and maintenance of competency
in adult echocardiography, Can J Cardiol
27:862–864, 2011.
19. Sicari R, Galderisi M, Voigt JU, et al. The use
of pocket-size imaging devices: a position
statement of the European Association of
Echocardiography, Eur J Echocardiogr 12:85–
87, 2011.
20. Eisen LA, Leung S, Gallagher AE, Kvetan V.
Barriers to ultrasound training in critical care
medicine fellowships: a survey of program di-
rectors, Crit Care Med 38:1978–1983, 2010.
21. Sheehan FH, Otto CM, Freeman RV. Echo
simulator with novel training and competen-
cy testing tools, Stud Health Technol Inform
184:397–403, 2013.
22. Panoulas VF, Daigeler AL, Malaweera AS, et
al. Pocket-size hand-held cardiac ultrasound
as an adjunct to clinical examination in the
hands of medical students and junior doctors,
Eur Heart J Cardiovasc Imaging 14:323–330,
2013.
23. Kimura BJ, Amundson SA, Willis CL, et al.
Usefulness of a hand-held ultrasound device
for bedside examination of left ventricular
function, Am J Cardiol 90:1038–1039, 2002.
24. Kimura BJ, Fowler SJ, Fergus TS, et al. Detec-
tion of left atrial enlargement using hand-car -
ried ultrasound devices to screen for cardiac
abnormalities, Am J Med 118:912–916, 2005.
25. Kirkpatrick JN, Davis A, Decara JM, et al.
Hand-carried cardiac ultrasound as a tool to
screen for important cardiovascular disease in
an underserved minority health care clinic,
J Am Soc Echocardiogr 17:399–403, 2004.
26. Martin LD, Howell EE, Ziegelstein RC, et al.
Hand-carried ultrasound performed by hos-
pitalists: does it improve the cardiac physical
examination? Am J Med 122:35–41, 2009.
27. Kitada R, Fukuda S, Watanabe H, et al. Diag-
nostic accuracy and cost-effectiveness of a
pocket-sized transthoracic echocardiographic
imaging device, Clin Cardiol 36:603–610,
2013.
28. Cardim N, Golfin C, Ferreira D, et al. Useful-
ness of a new miniaturized echocardiograph-
ic system in outpatient cardiology consulta-
tions as an extension of physical examination,
J Am Soc Echocardiogr 24:117–124, 2011.
29. Mangione S, Nieman LZ. Cardiac ausculatory
skills of internal medicine and family practice
trainees, JAMA 278:717–722, 1997.
30. Kobal SL, Trento L, Baharami S, et al. Com-
parison of effectiveness of hand-carried ultra-
sound to bedside cardiovascular physical ex-
amination, Am J Cardiol 96:1002–1006, 2005.
31. Spencer KT, Anderson AS, Bhargava A, et al.
Physician-performed point-of-care echocar-
diography using a laptop platform compared
with physical examination in the cardiovas-
cular patient, J Am Coll Cardiol 37:2013–2018,
2001.
32. Attenhofer Jost CH, Turina J, Mayer K, et al.
Echocardiography in the evaluation of systol-
ic murmurs of unknown cause, Am J Med
108:614–620, 2000.
33. Prinz C, Voigt J. Diagnostic accuracy of a
hand-held ultrasound scanner in routine pa-
tients referred for echocardiography, J Am
Soc Echocardiogr 24:111–116, 2011.
34. Nishimura R, Otto C, Bonow R, et al. 2014
AHA/ACC guideline for the management of
patients with valvular heart disease: a report of
the American College of Cardiology/American
Heart Association task force on practice guide-
lines, J Am Coll Cardiol 3:e57–e185, 2015.
35. Baumgartner H, Hung J, Bermejo J, et al.
Echocardiographic assessment of valve steno-
sis: EAE/ASE recommendations for clinical
ch06.indd 125
03.04.2019 11:40:06
126
ЧАСТЬ I Передовые методы эхокардиографии
practice, J Am Soc Echocardiogr 22:1–23, 2009.
quiz 101-102 .
36. Zoghbi W, Enriquez-Sarano M, Foster E, et
al. American Society of Echocardiography.
Recommendations for evaluation of the se-
verity of native valvular regurgitation with
two-dimensional and doppler echocardiogra-
phy, J Am Soc Echocardiogr 16:777–802, 2003.
37. Razi R, Estrada JR, Doll J, Spencer KT. Bed-
side hand-carried ultrasound by internal
medicine residents versus traditional clinical
assessment for the identification of systolic
dysfunction in patients admitted with de-
compensated heart failure, J Am Soc Echocar-
diogr 24:1319–1324, 2011.
38. Vourvouri EC, Schinkel AF, Roelandt JR, et
al. Screening for left ventricular dysfunction
using a hand-carried cardiac ultrasound de-
vice, Eur J Heart Fail 5:767–774, 2003.
39. Lang R, Bierig M, Devereux R, et al. Recom-
mendations for chamber quantification: a re-
port from the American Society of Echocar-
diography’s Guidelines and Standards Com-
mittee and the Chamber Quantification
Writing Group, developed in conjunction
with the European Association of Echocar-
diography, a branch of the European Society
of Cardiology, J Am Soc Echocardiogr 18:1440–
1463, 2005.
40. Brennan JM, Blair JE, Goonewardena S, et al.
A comparison by medicine residents of phys-
ical examination versus hand-carried ultra-
sound for estimation of right atrial pressure,
Am J Cardiol 99:1614–1616, 2007.
41. Blair J, Brennan JM, Goonewardena S, et al.
Usefulness of hand-carried ultrasound to
predict elevated left ventricular filling pres-
sure, Am J Cardiol 103:246–247, 2009.
42. Gundersen GH, Norekval TM, Haug HH, et
al. Adding point of care ultrasound to assess
volume status in heart failure patients in a
nurse-led outpatient clinic. A randomised
study, Heart 102:29–34, 2015.
43. Yim ES, Gillis EF, Ojala K, et al. Focused
transthoracic echocardiography by sports
medicine physicians: measurements relevant
to hypertrophic cardiomyopathy, J Ultra-
sound Med 32:333–338, 2013.
44. Maron BJ, Friedman RA, Kligfield P, et al. As-
sessment of the 12-lead electrocardiogram as
a screening test for detection of cardiovascu-
lar disease in healthy general populations of
young people (12–25 years of age): a scientif-
ic statement from the American Heart Asso-
ciation and the American College of Cardiol-
ogy, JACC 64:1479–1514, 2014.
45. Rugolotto M, Hu BS, Liang DH, Schnittger I.
Rapid assessment of cardiac anatomy and
function with a new hand-carried ultrasound
device (optigo): a comparison with standard
echocardiography, Eur J Echocardiogr 2:262–
269, 2001.
46. Senior R, Galasko G, Hickman M, et al. Com-
munity screening for left ventricular hyper-
trophy in patients with hypertension using
hand-held echocardiography, J Am Soc Echo-
cardiogr 17:56–61, 2004.
47. Vourvouri EC, Poldermans D, Schinkel AF, et
al. Left ventricular hypertrophy screening us-
ing a hand-held ultrasound device, European
Heart Journal 23:1516–1521, 2002.
48. Lucas BP, Candotti C, Margeta B, et al. Hand-
carried echocardiography by hospitalists: a
randomized trial, Am J Med 124:766–774,
2011.
49. Tsang TS, Abhayaratna WP, Barnes ME, et al.
Prediction of cardiovascular outcomes with
left atrial size: is volume superior to area or
diameter? J Am Coll Cardiol 47:1018–1023,
2006.
50. Tsang TS, Barnes ME, Bailey KR, et al. Left
atrial volume: important risk marker of inci-
dent atrial fibrillation in 1655 older men and
women, Mayo Clin Proc 76:467–475, 2001.
51. Moller JE, Hillis GS, Oh JK, et al. Left atrial
volume: a powerful predictor of survival af-
ter acute myocardial infarction, Circulation
107:2207–2212, 2003.
52. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015. e14.
53. Sekiguchi H. Tools of the trade: point-of-care
ultrasonography as a stethoscope, Semin
Respir Care 37:68–87, 2016.
54. Roy CL, Minor MA, Brookhart MA,
Choudhry NK. Does this patient with a peri-
cardial effusion have cardiac tamponade? JA-
MA 297:1810–1818, 2007.
55. Biais M, Carrie C, Delaunay F, et al. Evalua-
tion of a new pocket echoscopic device for
focused cardiac ultrasonograophy in an
emergency setting, Crit Care 16:R82, 2012.
56. Williams SR, Perera P, Gharahbaghian L. The
FAST and e-FAST in 2013: trauma ultraso-
nography: overview, practical techniques,
controversies, and new frontiers, Crit Care
Clin 30:119–150, 2014. vi.
57. Jones AE, Craddock PA, Tayal VS, Kline JA.
Diagnostic accuracy of left ventricular func-
tion for identifying sepsis among emergency
department patients with nontraumatic
symptomatic undifferentiated hypotension,
Shock 24:513–517, 2005.
58. Haley JH, Sinak LJ, Tajik AJ, et al. Dynamic
left ventricular outflow tract obstruction in
acute coronary syndromes: an important
cause of new systolic murmur and cardiogen-
ic shock, Mayo Clin Proc 74:901–906, 1999.
59. Bybee KA, Kara T, Prasad A, et al. Systematic
review: transient left ventricular apical bal-
looning: a syndrome that mimics ST-segment
elevation myocardial infarction, Ann Intern
Med 141:858–865, 2004.
60. El Mahmoud R, Mansencal N, Pilliere R, et al.
Prevalence and characteristics of left ventric-
ular outflow tract obstruction in tako-tsubo
syndrome, Am Heart J 156:543–548, 2008.
61. Vieillard-Baron A. Assessment of right ven-
tricular function, Curr Opin Crit Care 15:254–
260, 2009.
62. Melamed R, Sprenkle MD, Ulstad VK, et al.
Assessment of left ventricular function by in-
tensivists using hand-held echocardiography,
Chest 135:1416–1420, 2009.
63. Mirabel M, Celermajer D, Beraud AS, et al.
Pocket-sized focused cardiac ultrasound:
strengths and limitations, Arch Cardiovasc Dis
108:197–205, 2015.
64. Preau S, Saulnier F, Dewavrin F, et al. Passive
leg raising is predictive of fluid responsive-
ness in spontaneously breathing patients with
severe sepsis or acute pancreatitis, Crit Care
Med 38:819–825, 2010.
65. Maizel J, Airapetian N, Lorne E, et al. Diag-
nosis of central hypovolemia by using passive
leg raising, Intensive Care Med 33:1133–1138,
2007.
66. Lamia B, Ochagavia A, Monnet X, et al. Echo-
cardiographic prediction of volume respon-
siveness in critically ill patients with sponta-
neously breathing activity, Intensive Care Med
33:1125–1132, 2007.
67. Biais M, Vidil L, Sarrabay P, et al. Changes in
stroke volume induced by passive leg raising
in spontaneously breathing patients: compar-
ison between echocardiography and vigileo/
flotrac device, Crit Care 13:R195, 2009.
68. Thiel SW, Kollef MH, Isakow W. Non-inva-
sive stroke volume measurement and passive
leg raising predict volume responsiveness in
medical icu patients: an observational cohort
study, Crit Care 13:R111, 2009.
69. Mandeville JC, Colebourn CL. Can transtho-
racic echocardiography be used to predict flu-
id responsiveness in the critically ill patient?
A systematic review, Crit Care Res Pract
513480:2012, 2012.
70. Barbier C, Loubieres Y, Schmit C, et al. Re-
spiratory changes in inferior vena cava diam-
eter are helpful in predicting fluid responsive-
ness in ventilated septic patients, Intensive
Care Med 30:1740–1746, 2004.
71. Feissel M, Michard F, Faller JP, Teboul JL. The
respiratory variation in inferior vena cava di-
ameter as a guide to fluid therapy, Intensive
Care Med 30:1834–1837, 2004.
72. Machare-Delgado E, Decaro M, Marik PE. In-
ferior vena cava variation compared to pulse
contour analysis as predictors of fluid re-
sponsiveness: a prospective cohort study, J In-
tensive Care Med 26:116–124, 2011.
73. Muller L, Bobbia X, Toumi M, et al. AzuRea
group. Respiratory variations of inferior vena
cava diameter to predict fluid responsiveness
in spontaneously breathing patients with
acute circulatory failure: need for a cautious
use, Crit Care 16(5):R188, 2012.
74. Zhang Z, Xu X, Ye S, Xu L. Ultrasonographic
measurement of the respiratory variation in
the inferior vena cava diameter is predictive
of fluid responsiveness in critically ill pa-
tients: systematic review and meta-analysis,
Ultrasound Med Biol 40:845–853, 2014.
75. Corl K, Napoli AM, Gardiner F. Bedside so-
nographic measurement of the inferior vena
cava caval index is a poor predictor of fluid
responsiveness in emergency department pa-
tients, Emerg Med Australas 24:534–539,
2012.
76. Atkinson PR, McAuley DJ, Kendall RJ, et al.
Abdominal and cardiac evaluation with so-
nography in shock (aces): an approach by
emergency physicians for the use of ultra-
sound in patients with undifferentiated hy-
potension, Emerg Med J 26:87–91, 2009.
77. Jones AE, Tayal VS, Sullivan DM, Kline JA.
Randomized, controlled trial of immediate
versus delayed goal-directed ultrasound to
identify the cause of nontraumatic hypoten-
sion in emergency department patients, Crit
Care Med 32:1703–1708, 2004.
78. Wang XT, Liu DW, Zhang HM, Chai WZ. In-
tegrated cardiopulmonary sonography: a use-
ful tool for assessment of acute pulmonary
edema in the intensive care unit, J Ultrasound
Med 33:1231–1239, 2014.
79. Laursen CB, Sloth E, Lambrechtsen J, et al.
Focused sonography of the heart, lungs, and
deep veins identifies missed life-threatening
conditions in admitted patients with acute re-
spiratory symptoms, Chest 144:1868–1875,
2013.
80. Sekiguchi H, Schenck LA, Horie R, et al. Crit-
ical care ultrasonography differentiates ards,
pulmonary edema, and other causes in the
early course of acute hypoxemic respiratory
failure, Chest 148:912–918, 2015.
ch06.indd 126
03.04.2019 11:40:06
127
6 Ультразвуковое исследование сердца
81. Tsang TSM, Enriquez-Sarano M, Freeman
WK, et al. Consecutive 1127 therapeutic echo-
cardiographically guided pericardiocenteses:
clinical profile, practice patterns, and out-
comes spanning 21 years, Mayo Clin Proc
77:429–436, 2002.
82. El Haddad D, Iliescu C, Yusuf SW, et al. Out-
comes of cancer patients undergoing percuta-
neous pericardiocentesis for pericardial effu-
sion, J Am Coll Cardiol 66:1119–1128, 2015.
83. Karakitsos D, Labropoulos N, De Groot E, et
al. Real-time ultrasound-guided catheterisa-
tion of the internal jugular vein: a prospective
comparison with the landmark technique in
critical care patients, Crit Care 10:R162, 2006.
84. Fragou M, Gravvanis A, Dimitriou V, et al. Re-
al-time ultrasound-guided subclavian vein
cannulation versus the landmark method in
critical care patients: a prospective randomized
study, Crit Care Med 39:1607–1612, 2011.
85. Prabhu MV, Juneja D, Gopal PB, et al. Ultra-
sound-guided femoral dialysis access place-
ment: a single-center randomized trial, Clin J
Am Soc Nephrol 5:235–239, 2010.
86. Shiver S, Blaivas M, Lyon M. A prospective
comparison of ultrasound-guided and blind-
ly placed radial arterial catheters, Acad Emerg
Med 13:1275–1279, 2006.
87. Tsang T, Freeman W, Sinak L, Seward J.
Echocardiographically guided pericardicente-
sis: evolution and state-of-the-art technique,
Mayo Clin Proc 73:647–652, 1998.
88. Hind D, Calvert N, McWilliams R, et al. Ul-
trasonic locating devices for central venous
cannulation: meta-analysis, BMJ 327:361,
2003.
89. Hilty WM, Hudson PA, Levitt MA, Hall JB.
Real-time ultrasound-guided femoral vein
catheterization during cardiopulmonary re-
suscitation, Ann Emerg Med 29:331–336,
1997. discussion 337.
90. Shiloh AL, Savel RH, Paulin LM, Eisen LA.
Ultrasound-guided catheterization of the ra-
dial artery: a systematic review and meta-
analysis of randomized controlled trials,
Chest 139:524–529, 2011.
91. Hammoudi N, Arangalage D, Boubrit L, et al.
Ultrasound-based teaching of cardiac anato-
my and physiology to undergraduate medical
students, Arch Cardiovasc Dis 106:487–491,
2013.
92. Decara JM, Kirkpatrick JN, Spencer KT, et al.
Use of hand-carried ultrasound devices to
augment the accuracy of medical student
bedside cardiac diagnoses, J Am Soc Echocar-
diogr 18:257–263, 2005.
93. Bansal M, Singh S, Maheshwari P, et al. Value
of interactive scanning for improving the
outcome of new-learners in transcontinental
tele-echocardiography (vision-in-tele-echo)
study, J Am Soc Echocardiogr 28:75–87, 2015.
94. Singh S, Bansal M, Maheshwari P, et al. Amer-
ican Society of Echocardiography: remote
echocardiography with web-based assessments
for referrals at a distance (ase-reward) study, J
Am Soc Echocardiogr 26:221–233, 2013.
95. Choi BG, Mukherjee M, Dala P, et al. Inter-
pretation of remotely downloaded pocket-
size cardiac ultrasound images on a web-en -
abled smartphone: validation against work-
station evaluation, J Am Soc Echocardiogr 24:
1325–1330, 2011.
96. Beaton A, Aliku T, Okello E, et al. The utility
of handheld echocardiography for early diag-
nosis of rheumatic heart disease, J Am Soc
Echocardiogr 27:42–49, 2014.
97. Lu JC, Sable C, Ensing GJ, et al. Simplified
rheumatic heart disease screening criteria for
handheld echocardiography, J Am Soc Echo-
cardiogr 28:463–469, 2015.
98. Ploutz M, Lu JC, Scheel J, et al. Handheld
echocardiographic screening for rheumatic
heart disease by non-experts, Heart 102:35–
39, 2015.
99. Lipczyn
́
ska M, Szymanski P, Klisiewicz A,
Hoffman P. Hand-carried echocardiography
in heart failure and heart failure risk popula-
tion: a community based prospective study,
J Am Soc Echocardiogr 24:125–131, 2011.
100. Goonewardena SN, Gemignani A, Ronan A,
et al. Comparison of hand-carried ultrasound
assessment of the inferior vena cava and n-
terminal pro-brain natriuretic peptide for
predicting readmission after hospitalization
for acute decompensated heart failure, JACC
Cardiovasc Imaging 1:595–601, 2008.
101. Kanji HD, McCallum J, Sirounis D, et al. Lim-
ited echocardiography-guided therapy in
subacute shock is associated with change in
management and improved outcomes, J Crit
Care 29:700–705, 2014.
102. Kaul S, Miller J, Grayburn P, et al. A suggest-
ed roadmap for cardiovascular ultrasound re-
search for the future, J Am Soc Echocardiogr
24:455–464, 2011.
ch06.indd 127
03.04.2019 11:40:06
ch06.indd 128
03.04.2019 11:40:06
Левый
желудочек
part num
part title
ЧАСТЬ II
ch07.indd 129
03.04.2019 11:40:26
ch07.indd 130
03.04.2019 11:40:27
131
7 Количественная оценка массы,
объема, геометрии и систолической
функции левого желудочка
GERARD P. AURIGEMMA, MD
Определения и теоретические
аспекты
Оценка массы, объема и геометрии
левого желудочка
Эхокардиография в М-режиме
Двухмерная эхокардиография
Оценка систолической функции
левого желудочка
Фракция выброса
Фракция укорочения и ее производные
Отношение напряжение/укорочение
Анализ отношения давление/объем
Ограничения
Количественная оценка массы, размеров, геометрии
и систолической функции левого желудочка (ЛЖ)
важна для правильной диагностики и ведения паци-
ентов с любой болезнью сердца [1]. Например, у па-
циентов с ишемической болезнью сердца (ИБС)
определение функции ЛЖ прогностически более
информативно, чем знание о количестве поражен-
ных сосудов. Даже когда поражены лишь 1–2 сосу-
да, низкая фракция выброса (ФВ) больше ассоции-
руется с риском смерти, чем нормальная ФВ у паци-
ентов с 3–4 пораженными сосудами [2]. Увеличение
систолического и диастолического объемов ЛЖ так-
же связано с неблагоприятным прогнозом. Пациен-
тов после инфаркта миокарда с низкой ФВ для оцен-
ки риска можно классифицировать по конечно-си-
столическому объему (КСО) ЛЖ [3]. К примеру, в
исследовании Heart and Soul (проспективном иссле-
довании исходов у 1024 пациентов с ИБС) КСО был
более надежным предиктором госпитализации по
поводу сердечной недостаточности, чем ФВ или ко-
нечно-диастолический объем (КДО) (рис. 7 .1) [4].
Информация о размерах и геометрии ЛЖ также
имеет важное терапевтическое значение в свете по-
ложительных результатов лечения ингибиторами
ангиотензин-превращающего фермента на постин-
фарктное ремоделирование и прогноз у пациентов
со сниженной ФВ [5].
У пациентов с кардиомиопатией любой этиоло-
гии при ФВ < 35% [1, 6, 7] смертность остается вы-
сокой даже при лечении. Сниженная ФВ характерна
для больных идиопатической дилатационной кар-
диомиопатией и является результатом комбинации
повышенной постнагрузки и сниженной сократи-
мости. В этом случае такие показатели геометрии
ЛЖ, как относительная толщина стенки (ОТС) или
отношение масса/объем, дают прогностическую ин-
формацию, не зависящую от ФВ. Кроме того, важно
выявлять пациентов с симптомами сердечной недо-
статочности, имеющих нормальную ФВ (рис. 7 .2)
[8, 9].
Определение объема, массы и функции ЛЖ не-
обходимо для выбора оптимального срока опера-
ции для пациентов с гипертрофией, вызванной пе-
регрузкой объемом вследствие хронической тяже-
лой митральной или аортальной регургитации.
Можно отметить, что прогностическая ценность
КДО и КСО, ФВ, отношения КДО к массе, отноше-
ния систолического напряжения к укорочению и от-
ношения конечно-систолического давления к объ-
ему (P/V) была проверена в различных клинических
исследованиях. КСО и ФВ, по-видимому, являются
наиболее информативными прогностическими па-
раметрами [9]. Самым важным фактором, опреде-
ляющим выживание после операции, является си-
столическая функция ЛЖ.
При гипертрофии ЛЖ с перегрузкой давлением
вследствие аортального стеноза оценка систоличе-
ской функции, возможно, менее важна, чем оценка
нарушений, связанных с регургитацией. Выражен-
ное снижение ФВ может свидетельствовать о повы-
шенном хирургическом риске, тем не менее у паци-
ентов с низкой ФВ (от 20 до 25%) возможно суще-
ch07.indd 131
03.04.2019 11:40:27
132
ЧАСТЬ II Левый желудочек
0
0
10
20
30
40
50
60
Г
о
с
п
и
т
а
л
и
з
а
ц
и
я
в
с
в
я
з
и
с
с
е
р
д
е
ч
н
о
й
н
е
д
о
с
т
а
т
о
ч
н
о
с
т
ь
ю
(
%
)
Индекс КСО (мл/м2)
20
40
60
80
100
<22
23–32
33–42
Фракция выброса (%)
43–52
>52
n=1560
n=1530
n=1489
n=1520
n=1500
С
р
е
д
н
е
г
о
д
о
в
а
я
з
а
б
о
л
е
в
а
е
м
о
с
т
ь
(
%
)
0
5
10
15
20
Смерть, не связанная с ССЗ
Внезапная смерть
Смерть от СН
Фатальный ИМ
Инсульт
Смерть из-за других ССЗ
ственное клиническое улучшение после протезирования
аортального клапана [9]. У таких больных причиной
низкой ФВ может быть чрезмерная систолическая на-
грузка. Это явление называют неадекватной гипертро-
фией или чрезмерной постнагрузкой. Неадекватная ги-
пертрофия (на которую указывает высокая ОТС)
определяет группу пациентов с высоким периопера-
ционным риском [10]. У них нормальная или даже по-
вышенная ФВ может не оказать благоприятного вли-
яния на исход. Следовательно, при аортальном сте-
нозе показатели геометрии ЛЖ (в частности, ОТС)
прогностически более информативны, чем ФВ, и
могут предоставить новые данные об аортальном
стенозе с низким градиентом давления при нор-
мальной ФВ [11].
Хорошо известно, что увеличение массы ЛЖ
является предвестником не только сердечно-сосу-
дистого заболевания, но и смертности как от сер-
дечно-сосудистого, так и от других заболеваний,
даже когда возраст, артериальное давление и дру-
гие факторы риска учтены [12–15]. Некоторые ис-
следователи показали, что прогностическая инфор-
мативность геометрии ЛЖ возрастает пропорцио-
нально степени гипертрофии ЛЖ [16–19]. Например,
в некоторых исследованиях увеличение отношения
толщины стенки ЛЖ к размеру его полости позво-
лило идентифицировать пациентов с высоким ри-
ском сердечно-сосудистых заболеваний и смертно-
сти (рис. 7 .3) [18, 19].
Таким образом, показатели объема, массы, гео-
метрии и функции ЛЖ имеют прогностическое зна-
чение. Многие из этих параметров можно опреде-
лить при рутинной эхокардиографии (ЭхоКГ):
ЭхоКГ в М-режиме, двухмерной ЭхоКГ (2D-ЭхоКГ)
и с помощью допплерографии. В этой главе обсуж-
дается оценка геометрии, размеров, напряжения и
систолической функции ЛЖ главным образом с по-
мощью ЭхоКГ в М-режиме и 2D-ЭхоКГ. Трехмер-
ная ЭхоКГ (3D-ЭхоКГ), магнитно-резонансная то-
мография (МРТ) сердца и ультразвуковая визуали-
зация деформации миокарда постепенно занимают
свое место в оценке размеров и функции ЛЖ. Ин-
формация о 3D-ЭхоКГ и МРТ в этой главе приво-
дится в качестве референсных значений, полноцен-
ный обзор 3D-ЭхоКГ и визуализации деформации
миокарда см. в главах 2, 8. Принципы и методы ди-
агностики обсуждаются с акцентом на клиническое
применение у пациентов с гипертрофией ЛЖ и пе-
регрузкой его давлением и объемом.
ОПРЕДЕЛЕНИЯ И ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
Систолический выброс ЛЖ — комплексный про-
цесс, заключающийся в согласованном сокращении
мышечных волокон субэндокардиального, среднего
и субэпикардиального слоев. Волокна этих слоев в
комплексе имеют спиралевидное направление. Во-
локна среднего слоя ориентированы циркулярно (по
Рис. 7 .1 Связь между индексом конечно-систолического объема и ис-
ходом. Сглаженная диаграмма рассеивания пациентов, госпитализированных
с сердечной недостаточностью, а затем наблюдавшихся в течение 5,5 года, по-
казывает связь между индексом конечно-систолического объема (КСО) и ис-
ходом сердечной недостаточности в популяции. Обратите внимание, что даже
умеренное увеличение индекса КСО до > 25 мл/м2 сопровождается резким
увеличением событий, связанных с сердечной недостаточностью [McManus
DD, Shah SJ, Fabi MR, et al. Prognostic value of left ventricular end-systolic vol-
ume index as a predictor of heart failure hospitalization in stable coronary artery
disease: data from the Heart and Soul Study. J Am Soc Echocardiogr 22:190–197,
2009].
Рис. 7 .2 Прогноз у пациентов с сердечной недостаточностью в зави-
симости от фракции выброса. Данные о фракции выброса (ФВ) у пациен-
тов с сердечной недостаточностью (СН) из исследования CHARM (Candesartan
in Heart Failure: Assessment of Reduction in Mortality and Morbidity), в которое
были включены 7599 пациентов с широким спектром симптомов сердечной не-
достаточности. Среднее значение ФВЛЖ у пациентов составило 38,8% ±
14,9%. Эти данные показывают, что ФВ — сильный предиктор сердечно-со -
судистых событий у пациентов с сердечной недостаточностью и различной
функцией левого желудочка. ИМ — инфаркт миокарда; ССЗ — сердечно-со-
судистое заболевание [Solomon SD, Anavekar N, Skali H, et al. Influence of ejec-
tion fraction on cardiovascular outcomes in a broad spectrum of heart failure pa-
tients. Circulation 112:3738–3744, 2005].
ch07.indd 132
03.04.2019 11:40:27
133
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
Нормальная геометрия левого желудочка
Концентрическое ремоделирование (p = 0,45)
Недилатационная эксцентрическая ГЛЖ (p = 0,23)
Дилатационная эксцентрическая ГЛЖ (p = 0,008)
Недилатационная концентрическая ГЛЖ (p = 0,006)
Дилатационная концентрическая ГЛЖ (p = 0,003)
С
о
в
о
к
у
п
н
ы
й
р
и
с
к
0,0
0,2
0,4
0,6
0,8
1,0
1,2
60
90
180
150
120
Длительность наблюдения (месяцы)
30
0
Утолщение стенки
Ударный
объем
Сократительная
способность
Геометрия
Преднагрузка
Постнагрузка
Укорочение
продольных волокон
Укорочение
циркулярных волокон
Рис. 7.3 Связь массы и геометрии левого желудочка с исходом. Данные 8848 пациентов с гипертензией из исследования Campania Salute Network (53 ±
12 лет, 56% мужчин), которые не имели сердечно-сосудистых заболеваний и поражений клапанов сердца. Фракция выброса у всех составляла 50% и более. Ком-
бинированными конечными точками были смерть от сердечно-сосудистого заболевания, фатальный инфаркт миокарда, нефатальный инфаркт миокарда, инсульт.
График показывает, что дилатационная эксцентрическая гипертрофия левого желудочка (ГЛЖ), недилатационная концентрическая гипертрофия левого желудоч-
ка и дилатационная концентрическая гипертрофия левого желудочка ассоциируются с более высоким сердечно-сосудистым риском, который в основном зависит
от индекса массы левого желудочка [De Simone G, Izzo R, Aurigemma GP, et al. Cardiovascular risk in relation to a new classification of hypertensive left ventricular geo-
metric abnormalities. J Hypertens 33:745–754; discussion 754, 2015].
Рис. 7 .4 Связь между строением волокон миокарда, их сокращением
и ударным объемом нормального левого желудочка. Циркулярно ори-
ентированные и продольно ориентированные волокна миокарда обеспечивают
систолическое утолщение стенки левого желудочка и изменение его объема.
Их функция зависит от преднагрузки, постнагрузки, сократительной способно-
сти и геометрии левого желудочка. Сравнительно небольшое сокращение про-
дольно и циркулярно ориентированных волокон (10–15%) приводит к измене-
нию объема на 60% во время каждой систолы [Aurigemma GP, Gaasch WH, Vil -
legas B, Meyer TE. Noninvasive assessment of left ventricular mass, chamber
volume, and contractile function. Curr Probl Cardiol 20:374, 1995].
окружности). Сокращение этих волокон в основ-
ном способствует укорочению желудочка по корот-
кой оси (уменьшению его поперечного размера),
что играет основную роль в создании ударного объ-
ема (УО) (рис. 7 .4). Продольно ориентированные
волокна субэндокардиального и субэпикардиаль-
ного слоев способствуют сокращению желудочка по
длинной оси и вносят свой вклад в создание УО. По-
мимо сокращения по короткой и длинной осям во
время систолы верхушка ЛЖ вращается против ча-
совой стрелки, а его основание — по часовой стрел-
ке (если смотреть со стороны верхушки) [20, 21].
Такое скручивание ЛЖ и укорочение волокон вли-
яет на сократительную способность миокарда. В со-
ответствии с укорочением и скручиванием утолще-
ние стенки ЛЖ способствует изменению объема его
полости и созданию УО. На укорочение и утолще-
ние влияют преднагрузка, постнагрузка, сократи-
мость и геометрия ЛЖ [22].
Насосная функция ЛЖ обеспечивает ткани орга-
низма оксигенированной кровью. Таким образом, в
качестве параметра оценки насосной функции ЛЖ
можно использовать УО (табл. 7 .1). Поскольку си-
столическое давление в ЛЖ и УО обратно пропор-
циональны, для изучения функции желудочка целе-
сообразно использовать индекс производительно-
сти желудочка. Систолическая работа заключается в
укорочении волокон, что создает давление в желу-
дочке. Функцию желудочка определяют, оценивая
производительность желудочка по отношению к
длине волокна в конце диастолы, или связанным с
ней параметром. Таким образом, функцию желу-
дочка отражает кривая зависимости систолической
ch07.indd 133
03.04.2019 11:40:27
134
ЧАСТЬ II Левый желудочек
σm
σc
работы от конечно-диастолического давления, ко-
нечно-диастолического размера (КДР), КДО или на-
пряжения стенки. Увеличение КДО способствует уве-
личению систолической работы (т.е. производитель-
ности) по механизму Франка–Старлинга. Увеличение
сократимости миокарда также может приводить к
увеличению систолической работы, но в этом случае
производительность увеличивается преимуществен-
но в результате изменения инотропного состояния,
а не за счет изменения длины волокон в конце диа-
столы. Другими словами, сократимость является
основным свойством миокарда и отражает интен-
сивность его активного состояния. Использовать
термин «сократимость» (или «контрактильность»)
следует только в ситуациях, когда изменения произ-
водительности или ФВ не обусловлены изменением
преднагрузки или постнагрузки.
Сократительная функция — это более широкое
понятие, используемое при описании изменений
производительности или функции, на которые вли-
яют инотропное состояние, длина волокон или на-
грузка. Таким образом, изменение сократительной
функции миокарда лучше всего отражает ФВ. Этот
термин часто используют как синоним систоличе-
ской функции. Чтобы полностью описать ЛЖ, необ-
ходимо упомянуть несколько дополнительных па-
раметров, которые характеризуют его механические
свойства [22].
Напряжение — это отношение силы к единице
площади поперечного сечения (cross-sectional area,
CSA) материала. Этот технический термин исполь-
зуют для сравнения нагрузок на разные по размеру
элементы материала. Общая нагрузка менее важна,
чем нагрузка на каждый элемент материала. Если
одна и та же нагрузка воздействует на меньшее ко-
личество материала, значит напряжение в этом ма-
териале выше. В сферической модели ЛЖ напряже-
ние стенки (σ) прямо пропорционально трансму-
ральному давлению (P) и радиусу полости (R) ЛЖ
и обратно пропорционально толщине стенки (Th):
σ = PR/2Th.
Однако геометрия ЛЖ гораздо сложнее, поэтому
напряжение стенки состоит из нескольких компо-
нентов. Из них при анализе механики ЛЖ обычно
используют меридиональное и циркулярное напря-
жения (рис. 7 .5). Вектор меридионального напряже-
ния ориентирован в продольном направлении (от
верхушки ЛЖ к его основанию) и представляет со-
бой компонент устойчивости миокарда к нагрузке
при укорочении ЛЖ по длинной оси. Вектор цир-
кулярного напряжения направлен по касательной к
окружности и перпендикулярно длинной оси. Этот
компонент напряжения отражает сопротивление
миокарда к нагрузке при укорочении ЛЖ по корот-
Рис. 7 .5 Векторы напряжения в нормальном левом желудочке. Левый
желудочек имеет вид усеченного эллипсоида. Меридиональное напряжение
(σm) — это сила, действующая вдоль длинной оси левого желудочка. Мери-
диональное напряжение противодействует сокращению волокон по длинной
оси. Циркулярное напряжение (σc) — сила, действующая в экваториальном
направлении. Циркулярное напряжение противодействует сокращению цирку-
лярных волокон среднего слоя стенки. Область, ограниченная красными лини-
ями, — левый желудочек во время систолы, область, ограниченная синими
линиями, — левый желудочек во время диастолы [Aurigemma GP, Gaasch WH,
Villegas B, Meyer TE. Noninvasive assessment of left ventricular mass, chamber
volume, and contractile function. Curr Probl Cardiol 20:375, 1995].
Параметр
Описание
Клинический метод оценки
Влияние
Насосная функция
Функция, обеспечивающая
поступление оксигенированной
крови тканям
Ударный объем
Систолическая работа
Зависит от нагрузки
Влияют инотропные состояния
Желудочковая
функция
Производительность желудочка,
зависящая от длины волокон в
конце диастолы
Нет
Зависит от нагрузки
Влияют инотропные состояния
Сократимость
миокарда
Основное свойство миокарда,
отражающее его активное
состояние
Нет
Не зависит от нагрузки
Сократительная
способность
Показатель производительности
желудочка
Нет
Зависит от нагрузки
Влияют инотропные состояния
ТАБЛИЦА 7.1 Показатели функции левого желудочка
ch07.indd 134
03.04.2019 11:40:27
135
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
кой оси. Меридиональное напряжение (σm) можно
вычислить по формуле:
σm = P × ВРЛЖ/4 × Th(1 + ВРЛЖ/Th),
где Р — давление (мм рт. ст.); Th — толщина стен-
ки; ВРЛЖ — внутренний размер левого желудочка
[23]. Для расчета параметра напряжения размер по-
лости ЛЖ по длинной оси не нужен.
Циркулярное напряжение (σc) вычисляют по сле-
дующей формуле:
σc = P×a2[1+(b2/r2)]/(b2–a2),
где Р — конечно-систолическое давление (мм рт. ст.);
a — радиус эндокардиального (внутреннего) слоя;
b — радиус эпикардиального (внешнего) слоя; r —
радиус среднего слоя [24].
Существуют и другие способы расчета цирку-
лярного напряжения с учетом измерений по корот-
кой и длинной осям [24].
Формула для расчета меридионального напряже-
ния с использованием данных 2D-ЭхоКГ [25]:
σm = 1,33P × Am/Ac × 103 (кдин/см2),
где Ac — площадь полости ЛЖ (внутренняя, по эн-
докарду); Am = At − Ac, где At — общая площадь ЛЖ
по короткой оси (внешняя, по эпикарду). Дина =
1 г × см/сек2.
Результаты, полученные при 2D-ЭхоКГ и ЭхоКГ
в M-режиме, могут несколько различаться даже у
здоровых людей (более высокие значения σm — в
М-режиме). При сферическом желудочке σm, рас-
считанная любым способом, имеет тенденцию к за-
вышению постнагрузки [26].
Для определения напряжения стенки необходи-
мо знать давление в ЛЖ. Зачастую невозможно по-
лучить значения только инвазивным методом или
в комплексе с ЭхоКГ. Существует три неинвазив-
ных метода регистрации параметров для определе-
ния систолического давления в ЛЖ. Определение
диастолического давления в ЛЖ (и, соответственно,
диастолического напряжения) неинвазивным мето-
дом не может быть достоверным. Хотя эти методы
допускают отсутствие градиента давления в выход-
ном тракте левого желудочка (ВТЛЖ), при первом,
самом простом, методе предполагается, что конеч-
но-систолическое давление в ЛЖ приблизительно
равно максимальному систолическому артериаль-
ному давлению [22]. Таким образом, для измерения
конечно-систолического давления в ЛЖ можно ис-
пользовать метод Короткова с манжетой для изме-
рения систолического артериального давления. При
втором методе сопоставляют пульс, зарегистриро-
ванный методом Короткова при измерении систо-
лического и диастолического давлений, с расчетом
артериального давления по дикротической волне.
Третий метод подразумевает замену среднего арте-
риального давления, полученного методом Корот-
кова, на конечно-систолическое давление [27].
Параметры напряжения стенки имеют соответ-
ствующие стандартизованные величины, что по-
зволяет сравнивать механические свойства различ-
ных сердец. Конечно-систолическое напряжение
стенки, рассчитанное по конечно-систолическому
давлению (или рассмотренными ранее альтерна-
тивными методами), и конечно-систолический раз-
мер (КСР) считают показателем постнагрузки ЛЖ,
в то время как конечно-диастолическое напряжение
стенки, рассчитанное по конечно-диастолическому
давлению и КДР, — показателем преднагрузки ЛЖ.
Преднагрузка — это сила, необходимая для рас-
тяжения миофибрилл, находящихся в покое. О
преднагрузке обычно судят по конечно-диастоличе-
скому давлению, КДР или КДО ЛЖ. Для более точ-
ной оценки преднагрузки эту силу следует норма-
лизовать к единице CSA миокарда и ассоциировать
с конечно-диастолическим напряжением стенки.
Преднагрузка ЛЖ аналогична преднагрузке изоли-
рованного миокарда в миографе. Силе, действую-
щей при растяжении миокарда, противодействует
его упругость. Таким образом, степень растяжения
волокон миокарда зависит от взаимодействия меж-
ду силой растяжения миокарда и его упругостью
[28]. Преднагрузка влияет на начальную длину во-
локна и, следовательно, на систолическую функцию
ЛЖ. Влияние преднагрузки происходит постоян-
но — от сокращения к сокращению. Связь началь-
ного состояния волокон миокарда с силой их сокра-
щения называют законом Старлинга или механиз-
мом Франка–Старлинга.
Резерв преднагрузки желудочка зависит от ис-
ходных гемодинамических условий и жесткости
миокарда. У здоровых людей в вертикальном поло-
жении резерв преднагрузки больше, чем в положе-
нии лежа. Разница в резерве преднагрузки обуслов-
лена разностью между исходными значениями КДО,
которая в вертикальном положении человека ниже,
чем в положении лежа, из-за различий в венозном
возврате. Это необходимо учитывать при интерпре-
тации исследований с физической нагрузкой. КДО
нормального ЛЖ при физической нагрузке в верти-
кальном положении обычно возрастает, но во вре-
мя нагрузки в положении лежа такого может не
происходить (табл. 7 .2).
Вместе с тем способность к активации механиз-
ма Франка–Старлинга может быть ограничена в
случае гипертрофии желудочков с нарушением по-
датливости [22]. Таким образом, у пациентов с аор-
тальным стенозом или гипертонической болезнью
прирост КДО ЛЖ во время физической нагрузки
может быть мал или отсутствовать, следовательно,
ФВ не может увеличиваться адекватно [29–31]. Та-
кое ограничение резерва преднагрузки происходит
в результате резкого увеличения соотношения диа-
столических давления и объема, когда значительное
увеличение давления вызывает лишь незначитель-
ное изменение объема. Этот механизм может ле-
ch07.indd 135
03.04.2019 11:40:27
136
ЧАСТЬ II Левый желудочек
жать в основе функции ЛЖ больного в критиче-
ском состоянии.
Несмотря на низкую ФВ, во многих случаях ди-
латированное сердце (особенно при компенсиро-
ванной митральной или аортальной регургитации)
создает нормальный или увеличенный УО (см. табл.
7.2). В этом случае свой вклад вносит механизм
Франка–Старлинга, однако увеличение УО в пер-
вую очередь связано с увеличением КДО. Другими
словами, большая полость ЛЖ не всегда свидетель-
ствует об использованном резерве преднагрузки.
Часто сердце сохраняет способность использовать
резерв преднагрузки для увеличения УО, однако в
терминальной стадии сердечной недостаточности
резерв преднагрузки может быть исчерпан.
Постнагрузка — это сила, развиваемая миокар-
дом ЛЖ после сокращения. Из закона Лапласа сле-
дует, что постнагрузка (систолическое напряжение
стенки желудочка) прямо пропорциональна систо-
лическому артериальному давлению и размеру ЛЖ
и обратно пропорциональна толщине стенки. Пост-
нагрузка со временем изменяется, поэтому ее следу-
ет рассчитывать в момент открытия аортального
клапана, в конце выброса (в конце систолы) или в
любой момент в течение систолы. Хотя на постна-
грузку могут влиять систолическое давление в ЛЖ
и общее периферическое сосудистое сопротивле-
ние, эти параметры не следует рассматривать в ка-
честве эквивалента постнагрузки [32, 33]. Анало-
гично сопротивление на уровне аортального клапа-
на влияет на систолическое давление и напряжение,
но также не является эквивалентом постнагрузки
[34].
При аортальном стенозе систолическое давление
в ЛЖ может превышать 250 мм рт. ст., при соответ-
ствующем увеличении толщины стенки ЛЖ сила,
производимая каждой единицей миокарда, может
приближаться к норме (т.е. постнагрузка не изме-
нится) [22]. Однако резкое повышение систоличе-
ского давления или увеличение полости может при-
вести к увеличению постнагрузки [35]. Ввиду об-
ратной пропорциональности нагрузки и сокращения
резкое увеличение постнагрузки обычно приводит
к уменьшению сокращения, и наоборот.
Как уже упоминалось ранее, сократимость мио-
карда определяет его производительность независи-
мо от условий нагрузки. Сократимость легче изу-
чать и оценивать в изолированном миокарде, когда
условия нагрузки остаются неизменными. Напри-
мер, если длина миокарда в состоянии покоя остает-
ся постоянной, добавление дигиталиса или норадре-
налина в изолированный мышечный препарат при-
водит к увеличению степени и скорости нарастания
силы и сокращения. Такая высокая производитель-
ность при постоянных условиях нагрузки отражает
усиленный инотропный эффект (т.е. увеличение
сократимости). При многих сердечных заболевани-
ях нарушение насосной функции ЛЖ может быть
вызвано нарушением условий нагрузки, снижением
сократимости либо тем и другим, поэтому могут
возникать трудности при установлении точной
причины ухудшения сократимости миокарда. В
Покой
Нагрузка
КДО
(мл)
КСО
(мл)
ФВ (%) УО (мл)
СВ
(л/мин)
КДО
(мл)
КСО
(мл)
ФВ (%) УО (мл)
СВ
(л/мин) ΔСВ (%)
Норма
80
29
65
51
3,6
72
14
76
58
7,0
194
ГЛЖ
72
22
75
54
3,8
70
14
80
56
6,7
176
АР
189
87
54
102
7,0
232
116
45
116
14,0
200
МР
111
35
69
81
5,7
104
30
71
85
10,2
178
ДКМП
160
112
30
48
3,4
150
100
33
50
6,0
176
* В таблице отражена взаимосвязь между размером ЛЖ и СВ в покое и при нагрузке у гипотетического пациента с ППТ 1,7 м2, выполня-
ющего нагрузку на тредмиле (норма, ГЛЖ, ДКМП) и в полулежащем положении на велоэргометре (МР и АР). ЧСС в покое 70 уд/мин,
при максимальной нагрузке — 120 уд/мин. В дальнейшем исходили из того, что: (1) пациенты с АР и МР находятся в хронической ком-
пенсированной фазе с ремоделированием ЛЖ (чтобы отличить их от пациентов с выраженными острыми поражениями клапанов, при
которых дилатация полости пока не происходит); (2) УО — это весь УО ЛЖ, включая объем регургитации. КДО оценивали бипланар-
ным методом Симпсона, а УО вычисляли как сумму КДО и ФВ. Таким образом, при ДКМП УО в покое может быть в пределах нормы
и меньше ее в случае выраженной гипертрофии, т.к . утолщение стенок может происходить за счет уменьшения объема полости ЛЖ. СВ
при ДКМП в покое, наоборот, сохраняется в нормальном диапазоне за счет расширения полости, что компенсирует потерю сократитель-
ной способности, вызванную патофизиологической природой данного состояния. Во время нагрузки ГЛЖ и ДКМП не сильно влияют
на СВ, его увеличение обусловлено главным образом увеличением частоты сердечных сокращений. Общий СВ увеличивается при уве-
личении степени АР и МР, но увеличение СВ может быть небольшим, т.к. при нагрузке увеличивается и объем регургитации.
ΔСВ — изменения сердечного выброса при нагрузке (%); АР — аортальная регургитация; ГЛЖ — гипертрофия левого желудочка; ДКМП —
дилатационная кардиомиопатия; КДО — конечно -диастолический объем; КСО — конечно-систолический объем; МР — митральная ре-
гургитация; СВ — сердечный выброс; УО — ударный объем; ФВ — фракция выброса.
[Lancellotti P, Magne J. Stress echocardiography in valvular heart disease. Circ Cardiovasc Imaging 6:840–849, 2013.]
ТАБЛИЦА 7.2 Показатели параметров левого желудочка в покое и при нагрузке в норме и при патологии*
ch07.indd 136
03.04.2019 11:40:27
137
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
связи с этим существует значительный интерес к
разработке чувствительного индекса сократимо-
сти, не зависящего от изменений условий нагрузки
[36, 37]. К сожалению, полностью не зависимого от
нагрузки показателя базального уровня сократимо-
сти нет (см. табл. 7 .1) [22]. Можно продемонстриро-
вать нарушения сократимости, связанные с острыми
гемодинамическими изменениями, но определение
базального уровня сократимости у пациентов с
хронической патологией сердца пока еще невоз-
можно.
ОЦЕНКА МАССЫ, ОБЪЕМА
И ГЕОМЕТРИИ ЛЕВОГО ЖЕЛУДОЧКА
Ремоделирование ЛЖ при клапанной болезни серд-
ца, сердечной недостаточности и гипертонической
болезни характеризуется изменениями массы и гео-
метрии ЛЖ. Геометрию ЛЖ описывают следующие
параметры: ОТС, отношение размеров по короткой
и длинной осям и отношение масса/объем. Эти пара-
метры легко оценить с помощью ЭхоКГ в M-режиме
и 2D-ЭхоКГ (рис. 7.6, 7.7). Определение изменений
геометрии ЛЖ помогает в стратификации риска раз-
личных заболеваний и более полном описании ре-
моделирования ЛЖ, вызванного протезированием
клапана. Например, у пациентов с идиопатической
дилатационной кардиомиопатией более низкая вы-
живаемость связана с большим размером ЛЖ по ко-
роткой оси и увеличенным отношением размеров по
короткой и длинной осям (т.е. более сферической
геометрией ЛЖ) [38, 39].
ЭХОКАРДИОГРАФИЯ В М-РЕЖИМЕ
МАССА
Несмотря на то что с помощью компьютерной то-
мографии и МРТ возможна более точная количе-
ственная оценка, ЭхоКГ остается наиболее исполь-
зуемым методом оценки массы и геометрии ЛЖ.
Этот вопрос был рассмотрен рабочей группой по
количественной оценке полостей сердца American
Society of Echocardiography (ASE) [40]. ЭхоКГ в
М-режиме — общедоступный метод, а точность
расчета массы ЛЖ подтверждается значительным
количеством данных [41, 42]. Количественная оцен-
ка массы ЛЖ основывается на том, что желудочек
условно рассматривают в виде вытянутого эллипсо-
ида с отношением размеров по длинной и короткой
осям 2 : 1 [43, 44]. С практической точки зрения рас-
чет массы ЛЖ имеет наибольшую точность, когда
желудочек имеет нормальную форму, т.е . отноше-
ние размеров по длинной и короткой осям близко к
2 : 1. Предполагается, что размер по короткой оси
получен в области без нарушений сократимости
миокарда, т.е . при ИБС с нарушением локальной
сократимости и при перегрузке правого желудочка
(ПЖ) не следует ориентироваться на отношение
размеров по длинной и короткой осям. Массу и объ-
ем миокарда рассчитывают, используя размер по
короткой оси ЛЖ, измеренный из парастернально-
го доступа. Под контролем ЭхоКГ в 2D-режиме
ультразвуковой луч необходимо направить так,
чтобы он был перпендикулярен межжелудочковой
перегородке и задней стенке на уровне чуть ниже
кончиков створок митрального клапана. Размер по-
лости измеряют в парастернальной позиции по
длинной оси [45]. Этот подход при правильной
ориентации ультразвукового луча относительно па-
пиллярных мышц позволяет максимально точно
измерить размер полости ЛЖ. Массу ЛЖ рассчиты-
вают, измерив толщину межжелудочковой перего-
родки, толщину задней стенки и КДР ЛЖ, по фор-
муле куба [40, 45]:
Масса миокарда ЛЖ = 0,8 × [1,04 × (ТМЖПд +
ВРЛЖд + ТЗСд)3 – ВРЛЖд
3]+0,6г,
где ТМЖПд — толщина межжелудочковой перего-
родки во время диастолы; ВРЛЖд — внутренний
размер ЛЖ во время диастолы; ТЗСд — толщина
задней стенки во время диастолы; 1,04 — плотность
миокарда.
Результаты такого расчета имеют морфологиче-
ское подтверждение.
Измерения проводят с помощью современных
стандартных методик ASE [40, 45]. Как показали
Devereux и соавт. [44], масса миокарда ЛЖ, рассчи-
танная по методике ASE, превышает истинную ана-
томическую массу миокарда ЛЖ на 20%, поэтому
нужно использовать поправочный коэффициент
0,8. В табл. 7 .2 представлены нормальные значения
массы миокарда ЛЖ и относительной толщины
задней стенки во время диастолы при ЭхоКГ в
М-режиме. Особое внимание следует уделять ори-
ентации ультразвукового луча (рис. 7 .8) [45]. В табл.
7.3 представлены значения массы ЛЖ и индекса
массы ЛЖ в зависимости от пола, с индексацией и
без индексации. Было проведено несколько иссле-
дований, определяющих, нужны ли разные рефе-
ренсные значения индекса массы ЛЖ для различ-
ных популяциий (табл. 7 .4).
ОБЪЕМ
Объем (V) ЛЖ можно рассчитать по формуле, из-
мерив при ЭхоКГ в М-режиме внутренний размер
ЛЖ (ВРЛЖ) по короткой оси во время диастолы:
V = ВРЛЖ3.
Teichholz и соавт. [46] вывели более точную фор-
мулу, чтобы уменьшить завышение объема при из-
мерении большого сердца:
Vд = [7/(2,4 + ВРЛЖд)] × ВРЛЖд
3,
где Vд — объем левого желудочка во время диасто-
лы; ВРЛЖд — внутренний размер левого желудоч-
ка во время диастолы.
ch07.indd 137
03.04.2019 11:40:27
138
ЧАСТЬ II Левый желудочек
Норма
Масса
N
NN
N
↑
↑
↑↑
↑↑
↑↑↑
↑
↑
↑↑
↑↑
↑
↑
↑↑
N
NV
N
N
N
N–↓
N–↓
N–↓↓
N–↓↓
N–↓↓
↑↑
↑↑↑
N–↓↓
↓
N–↓
↑↑
↓
N
N
N
–
Объем
ОТС
М/О
Средний слой
Систолическое
напряжение
Систолическое
укорочение
Эндокардиальный
слой
Концентрическое
ремоделирование
(гипертензия)
Концентрическая
гипертрофия
(гипертензия/аортальный
стеноз)
Гипертрофическая
кардиомиопатия
Эксцентрическая
гипертрофия
(аортальная/митральная
регургитация)
Дилатационная
кардиомиопатия
М
Ж
П
В
Р
Л
Ж
Т
З
С
А
Б
Рис. 7 .6 Типы ремоделирования левого желудочка. На схеме представлена патология сердца, классифицированная с учетом массы (М) миокарда, объема
(О), относительной толщины стенки (ОТС), отношения масса/объем (М/О) левого желудочка, систолического напряжения и систолического укорочения левого же-
лудочка. N — норма; стрелка вверх — увеличение параметра; стрелка вниз — снижение параметра [Aurigemma GP, Gaasch WH, Villegas B, Meyer TE. Noninvasive
assessment of left ventricular mass, chamber volume, and contractile function. Curr Probl Cardiol 20:385, 1995].
Рис. 7 .7 Рекомендации American Society of Echocardiography по количественной оценке полостей сердца. (А) Эхокардиография в М-режиме.
(Б) Двухмерная эхокардиография. ВРЛЖ — внутренний размер левого желудочка; МЖП — межжелудочковая перегородка; ТЗС — толщина задней стенки [Lang,
RM, Badano LP, Mo-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiog-
raphy and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39 .e14, 2015].
ch07.indd 138
03.04.2019 11:40:27
139
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
А
Б
Г
В
Рис. 7 .8 Влияние субоптимального направления ультразвукового луча при оценке массы левого желудочка в М-режиме. (А) При тангенциальном
изображении ЛЖ по длинной оси может произойти переоценка размера ЛЖ. (Б) Цифровая обработка двухмерного изображения позволяет ретроспективно соз-
дать необходимый угол в М-режиме. (В) При тангенциальном изображении по короткой оси также может произойти переоценка размера ЛЖ. (Г) Решить эту про-
блему можно ретроспективно в М-режиме. Помните, что различие в 1 мм при оценке размера ЛЖ приведет к различию в 5 г при оценке массы [Marwick TH, Gil-
lebert TC, Aurigemma G, et al. Recommendations on the use of echocardiography in adult hypertension: A report from the European Association of Cardiovascular Imaging
(EACVI) and the American Society of Echocardiography (ASE). Eur Heart J Cardiovasc Imaging 16:577–605, 2015].
Линейный метод
Женщины
Мужчины
Норма
Изменения
Норма
Изменения
Легкие
Умеренные Тяжелые
Легкие
Умеренные Тяжелые
Масса ЛЖ (г)
67–162
163–186 187–210
≥ 211
88–224
225–258 259–292
≥ 293
Отношение масса ЛЖ/ППТ
(г/м2)
43–95
96–108
190–121
≥ 122
49–115
116–131 132 –148
≥ 149
Отношение масса ЛЖ/рост
(г/м)
41–99
100–115 116–128
≥ 129
52–126
127–144 145 –162
≥ 163
Отношение масса ЛЖ/рост2,7
(г/м2,7)
18–44
45–51
52–58
≥59
20–48
49–55
56–63
≥64
Относительная толщина
стенки (см)
0,22–0,42 0,43–0,47 0,48–0,52
≥ 0,53
0,24–0,42 0,43–0,46 0,47–0,51
≥ 0,52
Толщина перегородки (см) 0,6–0,9
1,0–1,2
1,3–1,5
≥ 1,6
0,6–1,0
1,1–1,3
1,4–1,6
≥ 1,7
Толщина задней стенки
(см)
0,6–0,9
1,0–1,2
1,3–1,5
≥ 1,6
0,6–1,0
1,1–1,3
1,4–1,6
≥ 1,7
* Показатели с индексированием и без индексирования к ППТ, росту и росту2,7
, полу.
ЛЖ — левый желудочек; ППТ — площадь поверхности тела.
[Lang, RM, Badano LP, Mo-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39.e14, 2015.]
ТАБЛИЦА 7.3 Значения толщины задней стенки левого желудочка, относительной толщины стенки
и массы левого желудочка*
ch07.indd 139
03.04.2019 11:40:28
140
ЧАСТЬ II Левый желудочек
Поскольку у ЭхоКГ существуют геометрические
ограничения, то 2D- и 3D-режимы предпочтитель-
нее, т.е. использование в клинической практике
М-режима для вычисления объема ЛЖ нежелатель-
но [40]. Однако эти формулы полезны для быстрой
оценки объема ЛЖ в нормальном сердце и интер-
претации данных более ранних исследований, в ко-
торых применяли М-режим.
ОТНОСИТЕЛЬНАЯ ТОЛЩИНА СТЕНКИ
Расчеты массы и объема ЛЖ в M-режиме основаны
на измерении ЛЖ по короткой оси из парастерналь-
ного доступа. Это же измерение используют для
описания геометрии ЛЖ. Хотя масса ЛЖ является
важным прогностическим фактором последующих
кардиальных событий при гипертонической болез-
ни, геометрия и параметры гипертрофии ЛЖ также
проливают свет на патофизиологию гипертониче-
ской гипертрофии [47] и могут давать прогностиче-
скую информацию [16, 17]. Наиболее часто исполь-
зуемый параметр гипертрофии — ОТС [17], кото-
рую рассчитывают по формуле:
ОТС=2×ТЗС/ВРЛЖ,
где ТЗС — толщина задней стенки; ВРЛЖ — вну-
тренний размер левого желудочка.
При гипертрофии и ремоделировании ОТС обыч-
но измеряют во время диастолы. ОТС также можно
вычислить по формуле:
ОТС = h/R,
где h — толщина стенки, R — радиус полости. В
нормальном или компенсированном желудочке
ОТС возрастает прямо пропорционально увеличе-
нию систолического давления. Верхним пределом
нормы ОТС считают 0,42 [40].
У пациентов с артериальной гипертензией без
терапии массу ЛЖ и ОТС можно использовать для
подразделения популяции на 4 основные категории
(рис. 7 .9; табл. 7 .5):
1. Концентрическая гипертрофия (увеличены ин-
декс массы ЛЖ и ОТС).
2. Эксцентрическая гипертрофия (увеличен индекс
массы ЛЖ, нормальная ОТС).
3. Концентрическое ремоделирование (нормальный
индекс массы ЛЖ, патологически высокая ОТС).
4. Нормальные масса ЛЖ и ОТС.
В популяции пациентов с артериальной гипер-
тензией без лечения большинство имели нормаль-
Концентрическая
гипертрофия
Концентрическое
ремоделирование
Н
о
р
м
а
Норма
Дилатация ЛЖ
Индекс объема ЛЖ (мл/м2)
И
н
д
е
к
с
м
а
с
с
ы
Л
Ж
(
г
/
м
2
)
Г
Л
Ж
Нормальный ЛЖ
Смешанная
гипертрофия
Дилатационная
гипертрофия
Физиологическая
гипертрофия
Эксцентрическое
ремоделирование
Эксцентрическая
гипертрофия
ОТС = 0,42
ОТС = 0,32
Рис. 7 .9 Взаимосвязь индексов объема и массы левого желудочка при физиологическом и патологических состояниях. Пациенты подразделены
в зависимости от индексов массы и объема левого желудочка (ЛЖ). Пациенты, индекс массы миокарда левого желудочка которых располагается выше средней
горизонтальной линии, имеют гипертрофию левого желудочка (ГЛЖ). Пациенты, индекс объема ЛЖ которых располагается справа от средней вертикальной ли-
нии, имеют дилатацию левого желудочка. Серый овал — это здоровые пациенты (слева от средней вертикальной линии и ниже горизонтальной линии) и паци-
енты с физиологической гипертрофией, у которых дилатация и гипертрофия могут быть связаны с занятиями спортом. Данная схема помогает определить про-
гноз при гипертензии и других патологических состояниях, как, например, на рис. 7 .3 и 7.6 . ОТС — относительная толщина стенки [Gaasch WH, Zile MR. Left ven-
tricular structural remodeling in health and disease: with special emphasis on volume, mass, and geometry. J Am Coll Cardiol 58:1733–1740, 2011].
Метод визуализации
Женщины Мужчины
Трехмерная эхокардиография
Европейская популяция
74±13г/м2 77±10г/м2
Японская популяция
56±11г/м2 64±12г/м2
Магнитно-резонансная
томография
67±11г/м2 85±15г/м2
[European Association of Cardiovascular Imaging (EACVI) and the
American Society of Echocardiography (ASE). Eur Heart J Cardiovasc
Imaging 16:577–605, 2015; MRI data from Natori S, Lai S, J. Finn P,
et al. Cardiovascular function in multi-ethnic study of atherosclerosis:
normal values by age, sex, and ethnicity. Am J Roentengol 186:S357–
S365, 2006.]
ТАБЛИЦА 7.4 Референсные значения индекса
массы ЛЖ для разных популяций
ch07.indd 140
03.04.2019 11:40:29
141
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
ные массу ЛЖ и ОТС, концентрическая гипертро-
фия наблюдалась реже всего [17].
Для усовершенствования этой оригинальной си-
стемы несколько групп исследователей [18, 19, 48,
49] использовали МРТ и ЭхоКГ и добавляли геоме-
трические подтипы. Эти исследователи разделили
концентрическую гипертрофию и эксцентрическую
гипертрофию на две подгруппы каждую, в итоге об-
разовалось четыре разных геометрических подтипа.
Они также исследовали клиническую значимость
массы и геометрических подтипов и установили,
что у пациентов с концентрической гипертрофией
наблюдается относительно высокая частота заболе-
ваний с неблагоприятными сердечно-сосудистыми
и не сердечно-сосудистыми событиями по сравне-
нию с пациентами с эксцентрической гипертрофи-
ей. Кроме того, концентрическое ремоделирование,
даже без гипертрофии, по-видимому, связано с не-
благоприятными исходами [18, 19, 48, 49]. Таким
образом, при гипертонической болезни риск сер-
дечно-сосудистых и других событий увеличивается
после оценки геометрии и массы ЛЖ. Как уже гово-
рилось, у пациентов с гипертензией при концентри-
ческой гипертрофии исходы хуже, чем при эксцен-
трической гипертрофии.
Информация о физиологическом ремоделиро-
вании ЛЖ основана на ОТС [18, 19, 48, 49]. Есть со-
общения о сильной взаимосвязи ожирения и кон-
центрической гипертрофии ЛЖ, что позволяет
опровергнуть утверждение, что при ожирении ги-
пертрофия исключительно эксцентрическая [47,
50].
Иногда массы ЛЖ больше, чем нужно для под-
держания давления. Так, значительно увеличенная
ОТС, которая встречается при гипертрофической
кардиомиопатии, гипертонической гипертрофиче-
ской кардиомиопатии пожилого возраста [41], не-
часто при гипертонической болезни и иногда при
аортальном стенозе [42], указывает на чрезмерную
или неадекватную гипертрофию ЛЖ. По нашему
опыту, при аортальном стенозе ОТС обычно < 0,8,
но когда ОТС > 0,8, это скорее свидетельствует о не-
адекватной гипертрофии.
Gaasch и Zile [42] предложили подразделять па-
циентов по массе ЛЖ, объему ЛЖ (см. рис. 7 .9) и
ОТС или отношению масса/объем. Используя этот
подход, при увеличении массы ЛЖ и ОТС (> 0,42)
нерасширенный ЛЖ можно охарактеризовать как
имеющий нормальную морфологию, концентриче-
ское ремоделирование или концентрическую гипер-
трофию. Расширенный ЛЖ без гипертрофии опи-
сывают как желудочек с эксцентрическим ремоде-
лированием, если ОТС < 0,32. Расширенный ЛЖ с
гипертрофией описывают как желудочек с эксцен-
трической гипертрофией (ОТС < 0,32), со смешан-
ной гипертрофией (ОТС > 0,42) или с физиологи-
ческой гипертрофией (ОТС 0,32–0,42). Эти катего-
рии четко различаются по функции и прогнозу (см.
рис. 7 .3, 7.6, 7.9). Форма, нагрузка и функция вза-
имосвязаны. У декомпенсированного сердца от-
мечаются низкая ОТС, высокая постнагрузка и
нарушение функции, и пока непонятно, какое от-
клонение является основным. Возможно, сначала
расширяется желудочек, увеличивая тем самым
постнагрузку и уменьшая насосную функцию, или
сначала нарушается сократимость миокарда, что
приводит к дилатации, а затем к увеличению пост-
нагрузки. Исследования с участием людей не дают
достаточной информации из-за продолжительно-
го течения болезни и других отягощающих факто-
ров, а эксперименты на животных показывают,
что все три фактора могут действовать совместно
[43].
ДВУХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
2D-ЭхоКГ позволяет получать изображения с пре-
восходной пространственной ориентацией, и ЛЖ
можно исследовать в режиме реального времени на
разных уровнях. Во многих клиниках 2D-ЭхоКГ —
основной неинвазивный метод количественной
оценки объема ЛЖ и глобальной и локальной си-
столической функции (рис. 7 .10). Для определения
массы и объема ЛЖ с помощью 2D-ЭхоКГ необхо-
димы высокое качество изображения и использова-
ние стандартных позиций по длинной и короткой
осям ЛЖ, а иногда — контрастное усиление види-
мых границ. Для вычисления объема используют
геометрические модели, приближенные к форме
ЛЖ, — вытянутый эллипс, полуэллипс и другие,
представляющие собой комбинацию геометриче-
ских форм. Подробный их обзор можно найти в
других источниках [40]. В этой главе описаны мето-
ды, наиболее подходящие для клинического ис-
пользования.
Геометрия ЛЖ
Масса ЛЖ
ОТС
Норма
≤ 115 г/м2 (мужчины),
≤ 95 г/м2 (женщины)
< 0,42
Концентрическая
гипертрофия
> 115 г/м2 (мужчины),
> 95 г/м2 (женщины)
> 0,42
Эксцентрическая
гипертрофия
> 115 г/м2 (мужчины),
> 95 г/м2 (женщины)
< 0,42
Концентрическое
ремоделирование
≤ 115 г/м2 (мужчины),
≤ 95 г/м2 (женщины)
0,42
* Измерения проводили в 2D-режиме и М-режиме.
ЛЖ — левый желудочек; ОТС — относительная толщина стенки.
[Lang, RM, Badano LP, Mo-Avi V, et al. Recommendations for cardiac
chamber quantification by echocardiography in adults: an update from
the American Society of Echocardiography and the European Associ-
ation of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39.e14,
2015.]
ТАБЛИЦА 7.5
Ремоделирование левого желудочка,
определяемое по геометрии, массе
и относительной толщине стенки*
ch07.indd 141
03.04.2019 11:40:29
142
ЧАСТЬ II Левый желудочек
КДО
КСО
А
Б
Г
В
Рис. 7 .10 Преимущества и недостатки оценки объема левого желудочка в 2D- и 3D-режиме. (А, В) Апикальная трехкамерная позиция. (Б, Г) Апикаль-
ная двухкамерная позиция. КДО — конечно-диастолический объем; КСО — конечно-систолический объем [Lang, RM, Badano LP, Mo-Avi V, et al. Recommenda-
tions for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardio-
vascular Imaging. J Am Soc Echocardiogr 28:1–39 .e14, 2015].
МАССА
Теоретически оценка массы ЛЖ в 2D-режиме пре-
восходит оценку при ЭхоКГ в М-режиме. Среднюю
толщину стенки можно рассчитать с помощью пла-
ниметрии ЛЖ по короткой оси, что помогает избе-
жать ограничений при измерении с помощью
ЭхоКГ в М-режиме.
Для расчета массы ЛЖ при 2D-ЭхоКГ можно ис-
пользовать метод площадь–длина, рассматриваю-
щий ЛЖ как усеченный эллипсоид. Объем рассчи-
тывают для внешней и внутренней «оболочек» (пло-
щадь полости ЛЖ и общая площадь ЛЖ с миокардом
соответственно):
V=5/6A×L,
где A — планиметрическая площадь ЛЖ по корот-
кой оси на уровне верхнего края папиллярной мыш-
цы; L — длина ЛЖ, полученная в апикальной четы-
рехкамерной позиции. Измерения проводят в конце
диастолы.
Так определяют общий объем ЛЖ и объем поло-
сти ЛЖ (внутренний объем ЛЖ). Объем миокарда
представляет собой разницу между внутренней и
внешней «оболочками» [40]. Для вычисления массы
миокарда объем миокарда умножают на его плот-
ность (1,04 г/мл). Достоверность результатов была
подтверждена сравнением массы ЛЖ, определен-
ной при ЭхоКГ, и анатомической массы ЛЖ у 21 па-
циента, которым была выполнена 2D-ЭхоКГ неза-
долго до смерти [51]. Была получена высокая кор-
реляция анатомических и эхокардиографических
значений массы ЛЖ (r = 0,93, стандартное отклоне-
ние = 31 г). Однако значение массы ЛЖ при
2D-ЭхоКГ обычно меньше значений, полученных
при МРТ [40, 45].
Для количественного определения объема ЛЖ с
помощью 2D-ЭхоКГ предложены различные геоме-
трические методы. Бипланарный метод Симпсона
предпочтительнее, когда форма желудочка измене-
на, например в случае апикальной аневризмы. Би-
планарный метод Симпсона основан на том, что
объем какого-либо объекта можно вычислить как
сумму объемов отдельных «срезов» объекта (см.
рис. 7 .10). Точность измерения напрямую зависит
от количества «срезов»:
n
i
i=1
V= AT
∑
ch07.indd 142
03.04.2019 11:40:29
143
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
где V — общий объем (полости или миокарда); A —
планиметрическая площадь; T — толщина среза.
Лучше всего вычислять объем ЛЖ в двух орто-
гональных апикальных позициях, совпадающих с
его длинной осью [40]. Изображения в апикальных
четырех- и двухкамерных позициях в конце диасто-
лы должны быть такими, чтобы длина ЛЖ была
максимальной. Метод площадь–длина для расчета
объема ЛЖ является альтернативой бипланарному
методу Симпсона.
В табл. 7 .6 приведены нормальные значения раз-
меров и объемов ЛЖ при 2D-ЭхоКГ, 3D-ЭхоКГ и
МРТ сердца (обратите внимание, что объемы при
МРТ больше объемов при ЭхоКГ). В рекомендаци-
ях по количественной оценке полостей сердца опи-
сана важная и, скорее всего, недооцененная взаи-
мосвязь между возрастом и объемом ЛЖ (рис. 7 .11)
[40].
ГЕОМЕТРИЯ
По сравнению с ЭхоКГ в M-режиме 2D-ЭхоКГ име-
ет лучшую пространственную ориентацию, т.е . изо-
бражение ЛЖ может быть получено на различных
уровнях в режиме реального времени. Соответ-
ственно, 2D-ЭхоКГ можно использовать для коли-
чественной оценки массы и объема ЛЖ при нару-
шении его формы, и, поскольку возможно измере-
ние длины ЛЖ, этот метод обеспечивает более
полную характеристику геометрии ЛЖ. 2D-ЭхоКГ
позволяет рассчитать отношение размеров по ко-
роткой и длинной осям и отношение масса/объем
[52]. У пациентов с нормальной массой и функци-
ей ЛЖ отношение размеров по короткой и длинной
осям варьирует от 0,45 до 0,62 [52–54]. У пациентов
с гипертонической болезнью и нормальной ФВЛЖ,
не получающих терапию, это отношение находится
в диапазоне от 0,52 ± 0,04 (у пациентов с концен-
трическим ремоделированием) до 0,63 ± 0,03 (у па-
циентов с эксцентрической гипертрофией). Отно-
шение размеров по короткой и длинной осям также
предоставляет информацию о компенсации желу-
дочка при клапанном пороке сердца. Как при дила-
тационной кардиомиопатии желудочек становится
более сферическим, так и при недостаточно ком-
пенсированном аортальном стенозе и аортальной
регургитации (с низкой ФВ), как правило, отмеча-
ется тенденция к увеличению отношения размеров
по короткой и длинной осям [54]. Увеличение этого
отношения, в свою очередь, меняет взаимодействие
меридионального и циркулярного напряжений, а
изменение распределения постнагрузки может по-
влиять на общую сократительную способность [54].
Отношение масса/объем у здоровых мужчин и
женщин при 2D-ЭхоКГ составляет ≈ 0,8 [53]. Тради-
ционно считают, что отношение масса/объем при-
близительно одинаково во всех отделах ЛЖ: от ба-
зального до апикального. Исследование методом
сверхбыстрой компьютерной томографии (позво-
ляет выполнять около 8 томографических срезов
через ЛЖ) показало, что в норме отношение масса/
объем уменьшалось в среднем от 0,8 (в базальном
отделе) до 0,25 (в апикальном отделе), что соответ-
ствует данным 2D-ЭхоКГ. Масса ЛЖ превышает
объем ЛЖ в каждом последующем срезе [55].
Важно подчеркнуть, что 2D-ЭхоКГ имеет огра-
ничения, затрудняющие ее рутинное использова-
ние в клинической практике для количественной
оценки [42]. При ЭхоКГ в М-режиме генерируется
Параметр
Мужчины
Женщины
Линейные размеры при 2D-ЭхоКГ*
ВРЛЖд
50±4
45±4
ВРЛЖс
32±4
28±3
Объем ЛЖ при 2D-ЭхоКГ*
(бипланарный метод Симпсона)
КДО ЛЖ (мл)
106±22
76±15
КСО ЛЖ (мл)
41±10
28±7
Индексированные объемы ЛЖ при 2D-ЭхоКГ*
ИКДО ЛЖ
54±10
45±8
ИКСО ЛЖ
21±5
16±4
Индексированные объемы ЛЖ при 3D-ЭхоКГ*
ИКДО ЛЖ
66±10
58±8
ИКСО ЛЖ
29±6
23±5
Объем ЛЖ при МРТ сердца†
КДО ЛЖ (мл)
142±34
109±23
КСО ЛЖ (мл)
47±19
31±10
Индексированные объемы ЛЖ при МРТ сердца†
ИКДО ЛЖ (мл/м2)
74±15
65±11
ИКСО ЛЖ (мл/м2)
49±10
46±8
КИ ЛЖ (л/мин/м2)
2,9 ± 0,6
2,9 ± 0,6
* Lang, RM, Badano LP, Mo-Avi V, et al. Recommendations for cardiac
chamber quantification by echocardiography in adults: an update from
the American Society of Echocardiography and the European Associ-
ation of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39.e14,
2015.
† Natori S, Lai S, J. Finn P, et al: Cardiovascular function in multi-eth-
nic study of atherosclerosis: normal values by age, sex, and ethnicity.
Am J Roentengol 186:S357–S365, 2006.
ВРЛЖд — внутренний размер левого желудочка во время диасто-
лы; ВРЛЖс — внутренний размер левого желудочка во время си-
столы; ИКДО — конечно -диастолический объем, индексирован-
ный к площади поверхности тела; ИКСО — конечно -систоличе -
ский объем, индексированный к площади поверхности тела;
КДО — конечно-диастолический объем; КИ — кардиальный ин-
декс; КСО — конечно -систолический объем; ЛЖ — левый желу-
дочек; МРТ — магнитно -резонансная томография; ЭхоКГ — эхо -
кардиография.
ТАБЛИЦА 7.6
Нормальные значения размеров
и объемов левого желудочка
при эхокардиографии и магнитно-
резонансной томографии сердца
ch07.indd 143
03.04.2019 11:40:29
144
ЧАСТЬ II Левый желудочек
до 1000 импульсов в секунду, в то время как часто-
та ипульсов в 2D-режиме на порядок меньше: от 30
до 60 кадр/сек (при оптимальных условиях). Каче-
ство изображения значительно ухудшается при ис-
пользовании стоп-кадра, что затрудняет визуализа-
цию эндокарда. Артефакты ближнего поля и плохое
латеральное разрешение усложняют определение
границ эндокарда по всему периметру желудочка.
Апикальные позиции часто не дают качественного
изображения, необходимого для ручной трассиров-
ки, что затрудняет расчеты. Может понадобиться
внутривенное введение контрастного средства, что
повысит точность определения объема ЛЖ. Таким
образом, при 2D-ЭхоКГ КСО и КДО нередко недо-
оцениваются. 3D-ЭхоКГ (см. главу 2) — наиболее
точный метод определения объема, массы и ФВЛЖ
главным образом потому, что отсутствуют геоме-
трические ограничения при получении изображе-
ния по направлению оси [40, 56, 57].
Апикальная четырехкамерная позиция
Бипланарный метод Симпсона
Мужчины
Возраст (лет)
20
0
20
40
60
80
100
0
20
40
80
60
100
0
20
40
80
60
100
0
20
40
60
80
100
И
К
Д
О
Л
Ж
(
м
л
/
м
2
)
К
Д
О
Л
Ж
(
м
л
/
м
2
)
И
К
Д
О
Л
Ж
(
м
л
/
м
2
)
К
Д
О
Л
Ж
(
м
л
/
м
2
)
40
60
80
20
40
60
80
Возраст (лет)
20
40
60
80
Возраст (лет)
20
40
60
80
Возраст (лет)
Женщины
Мужчины
Женщины
Рис. 7.11 Взаимосвязь между возрастом и объемом левого желудочка, определенным в апикальной четырехкамерной позиции и с помощью
бипланарного метода Симпсона. ИКДО — конечно-диастолический объем, индексированный к площади поверхности тела; ЛЖ — левый желудочек [Lang,
RM, Badano LP, Mo-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiog-
raphy and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39 .e14, 2015].
ДОППЛЕРОГРАФИЯ
Для оценки УО и сердечного выброса (СВ) ЭхоКГ
можно комбинировать с допплерографией [58, 59] и
определять интеграл линейной скорости (velocity-time
integral, VTI) кровотока. Привлекательность этого ме-
тода заключается в том, что в отличие от измерений в
M-режиме и 2D-режиме VTI не имеет геометрических
ограничений, связанных с изменением формы сердца.
Для определения УО определяют VTI кровотока
в ВТЛЖ (рис. 7 .12). Чтобы получить спектр скоро-
стей кровотока в ВТЛЖ, используют апикальную
позицию, а контрольный объем позиционируют на
уровне фиброзного кольца аортального клапана.
VTI можно определить и в других позициях, напри-
мер позиции легочного ствола или приточного от-
дела ЛЖ, но наибольшая точность получается при
измерениях в проекции проксимального участка
восходящего отдела аорты. Диаметр аорты в попе-
речном сечении измеряют приблизительно на том
ch07.indd 144
03.04.2019 11:40:29
145
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
же уровне в парастернальной позиции по длинной
оси, когда проводят импульсно-волновую или не-
прерывно-волновую допплерографию. УО равен
произведению VTI на CSA фиброзного кольца аор-
тального клапана, которое условно считают кругом:
УО=CSA×VTI,аCSA=π(D/2)2,
где CSA — площадь поперечного сечения; D — диа-
метр фиброзного кольца аортального клапана;
VTI — интеграл скорости кровотока.
Показатели УО и СВ, полученные с помощью VTI,
хорошо коррелируют с результатами одновремен-
ного определения СВ при термодилюции у пациен-
тов без регургитации в левых отделах сердца [58,
59]. VTI во многом зависит от точности измерения
диаметра фиброзного кольца аортального клапана,
поскольку при расчете CSA диаметр фиброзного
кольца возводят в квадрат. Кроме того, важно, что-
бы ультразвуковой луч был параллелен потоку. VTI
используют при отсутствии значительной патоло-
гии аортального и митрального клапанов.
Оценка функции ЛЖ с помощью допплерогра-
фии зависит от скорости внутрисердечного крово-
тока и не зависит от измерений желудочка, следова-
тельно, геометрические ограничения и погрешно-
сти исключены. Полученная информация включает
показатели УО, СВ и максимальной скорости аор-
тального потока, каждый из которых, являясь пара-
метром фазы изгнания, зависит от постнагрузки.
Другой допплеровский метод оценки систоличе-
ской функции — измерение с помощью непрерыв-
но-волновой допплерографии скорости увеличения
давления в ЛЖ (dP/dt), которую оценивают по по-
току митральной регургитации [60].
ОЦЕНКА СИСТОЛИЧЕСКОЙ ФУНКЦИИ
ЛЕВОГО ЖЕЛУДОЧКА
Основными факторами, которые влияют на сокра-
тимость и функцию ЛЖ, являются преднагрузка,
постнагрузка, сократительная (или инотропная) спо-
собность миокарда и частота сердечных сокраще-
ний. Также большое значение имеет неравномер-
ность сокращений. На УО влияют изменения меха-
нической функции, которые происходят при ИБС и
при электрокардиостимуляторе. Только при син-
хронности сокращения, стабильности сердечного
ритма и постоянных условиях нагрузки изменения
производительности миокарда указывают на изме-
нения его сократительной способности.
Из таких традиционных представлений о пред-
нагрузке, постнагрузке и сократительной способно-
сти миокарда обычно исходят при оценке быстрого
ответа организма пациента на изменение гемодина-
мики.
Изолированное увеличение преднагрузки приво-
дит к усилению работы сердца по механизму Фран-
ка–Старлинга, тогда как изолированное увеличение
постнагрузки приводит к снижению УО (или ФВ) в
соответствии с обратным соотношением силы и со-
кращения. К сожалению, невозможно изолированно
изменить пред- или постнагрузку, особенно у паци-
ентов с хронической болезнью сердца. Например,
нитраты рассматривают в качестве вазодилататоров
А
Б
Рис. 7.12 Расчет сердечного выброса по интегралу линейной скорости. (А) Диаметр ВТЛЖ измеряют в позиции по длинной оси. На рисунке в форме
цилиндра показан объем крови, выбрасываемый с каждым сокращением. (Б) VTI определяют с помощью импульсно-волновой допплерографии в апикальной по-
зиции при расположении ультразвукового луча параллельно потоку крови. VTI при планиметрии равен 18,5 см, диаметр ВТЛЖ — 24 мм (радиус 12 мм). Площадь
поперечного сечения ВТЛЖ равна произведению квадрата радиуса фиброзного кольца аортального клапана и π. Ударный объем (произведение площади попе-
речного сечения ВТЛЖ и VTI) равен 84 мл за один сердечный цикл. Следовательно, при ЧСС = 53 уд/мин сердечный выброс будет равен 4,5 л/мин.
ch07.indd 145
03.04.2019 11:40:29
146
ЧАСТЬ II Левый желудочек
и средств, первично влияющих на преднагрузку и
приводящих к снижению объема ЛЖ и артериаль-
ного давления с уменьшением постнагрузки. Более
того, артериальный вазодилататор также уменьша-
ет размер (и соответственно преднагрузку), увели-
чивая УО. Таким образом, преднагрузка и постна-
грузка тесно взаимосвязаны и предположение о воз-
можности изолированного их изменения у больных
с хронической патологией сердца является явным
упрощением.
После большинства интервенционных вмеша-
тельств возможно острое изменение пред- или пост-
нагрузки (в зависимости от площади поражения
миокарда) [61], что еще больше усложняет оценку
глобальной систолической функции. Острые изме-
нения преднагрузки приводят к изменению рабо-
ты сердца согласно закону Франка–Старлинга, от-
ношение сила/сокращение определяется длиной
волокон миокарда. Важность данного феномена
при хронических болезнях сердца или его дилата-
ции не изучена.
Обычно острые изменения функции ЛЖ или его
сократительной способности определить несложно,
сложнее установить механизм или механизмы, от-
ветственные за эти изменения. Хронические изме-
нения объема ЛЖ, его массы и геометрии интерпре-
тировать еще сложнее, т.к. эти изменения обычно
выходят за рамки традиционной взаимосвязи пред-
нагрузки, постнагрузки и сократимости. Действи-
тельно, нет приемлемого показателя сократимости
миокарда, который можно было бы использовать у
пациентов с хронической болезнью сердца. Недопу-
стимо при оценке растяжимости волокон использо-
вать конечно-диастолическое давление в ЛЖ или
абсолютное значение КДО для работы сердца с хро-
нической патологией. В связи с этим оценку сокра-
тительной способности и различий между компен-
сированным и декомпенсированным желудочками
часто проводят эмпирически с анализом, основан-
ным на физиологических принципах.
ФРАКЦИЯ ВЫБРОСА
ФВ является наиболее широко используемым пара-
метром систолической функции ЛЖ. ФВ определя-
ют как отношение разности объемов ЛЖ (т.е. УО)
к исходному объему (т.е. КДО):
ФВ = (КДО – КСО)/КДО,
где КДО — конечно-диастолический объем; КСО —
конечно-систолический объем. Данные параметры
можно оценить с помощью ЭхоКГ в М-режиме и
2D-ЭхоКГ.
ФВ представляет собой изменение объема, соот-
ветствующим образом нормализованного. ФВ мож-
но использовать как показатель функции, не зави-
симый от роста пациента или размеров желудочка.
В норме ФВ > 50% КДО. ФВ, полученная при
2D-ЭхоКГ, в среднем составляет 61–65% [40]. У па-
циентов с ИБС или идиопатической кардиомиопа-
тией ФВ = 40–50% не соответствует норме, но обыч-
но это имеет небольшое клиническое значение [7].
Однако у пациентов с митральной регургитацией
такие значения ФВ указывают на значительное сни-
жение сократительной функции [9, 32].
ГЕМОДИНАМИЧЕСКИЕ ДЕТЕРМИНАНТЫ ФРАКЦИИ ВЫБРОСА
Известно, что острые изменения нагрузки на ЛЖ
оказывают выраженное влияние на ФВ. Так, резкое
увеличение преднагрузки или уменьшение постна-
грузки приводит к более высокой ФВ. И наоборот,
острое уменьшение преднагрузки или увеличение
постнагрузки ведет к снижению ФВ. В таких усло-
виях трудно оценивать нарушения сократительной
функции. Однако если изменение нагрузки приво-
дит к изменению ФВ, не соответствующему ожидае
мому, вероятно, одновременно изменилась и сокра-
тимость (т.е. инотропный статус). Например, уве-
личение ФВ при увеличенной постнагрузке — это
результат увеличенной сократимости, т.к. увеличе-
ние постнагрузки в норме приводит к снижению
ФВ. Несмотря на чувствительность ФВ к нагрузке,
этот параметр дает полезную информацию даже во
время острых гемодинамических нарушений. Та-
ким образом, резерв преднагрузки имеет большое
значение.
У пациентов с хронической болезнью сердца ФВ
является важным показателем сократительной спо-
собности, особенно учитывая чувствительность ФВ
к увеличению постнагрузки. По мере прогрессиро-
вания дисфункции ЛЖ и дилатации постнагрузка
по закону Лапласа увеличивается, а ФВ снижается.
Выявление снижения ФВ может быть полезно
при диагностике дисфункции ЛЖ на ранних стади-
ях заболевания, но снижение ФВ не позволяет уста-
новить механизм или механизмы дисфункции. В
связи с этим у пациентов с хронической болезнью
сердца показатели ФВ следует интерпретировать с
учетом величины и сроков текущих изменений в
условиях нагрузки, которые происходят во время
прогрессирования заболевания. Например, на ран-
ней стадии аортальной регургитации преднагрузка
и постнагрузка ЛЖ обычно возрастают. Эти изме-
нения влияют на ФВ разнонаправленно, поэтому
ФВ остается в пределах нормы.
По мере ремоделирования желудочка и развития
эксцентрической гипертрофии постнагрузка и
преднагрузка нормализируются, несмотря на уве-
личение ЛЖ. Если сократимость миокарда не изме-
няется, ФВ остается нормальной. При увеличении
гемодинамической нагрузки (или развитии сокра-
тительной дисфункции) постнагрузка увеличивает-
ся, а ФВ снижается. Таким образом, даже небольшое
снижение ФВ может быть ранним маркером дис-
функции ЛЖ.
При декомпенсированном аортальном стенозе
систолическое давление в ЛЖ, согласно закону Ла-
ch07.indd 146
03.04.2019 11:40:30
147
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
пласа, возрастает пропорционально увеличению на-
пряжения стенки ЛЖ. При прогрессирующем увели-
чении напряжения ФВ снижается.
Corabello и соавт. [62] показали, что у пациентов
с критическим аортальным стенозом, хронической
сердечной недостаточностью и сниженной ФВ вслед-
ствие высокого напряжения стенки ЛЖ («дисбаланс
постнагрузки») систолическая функция после про-
тезирования клапана может улучшиться на фоне
снижения постнагрузки (рис. 7 .13) [62, 32]. И на-
оборот, у пациентов с непропорциональным сни-
жением ФВ относительно повышения напряжения
стенки в дополнение к чрезмерной постнагрузке
развиваются кардиомиопатические изменения. У
таких пациентов функциональные показатели по-
сле протезирования клапанов обычно не улучша-
ются [62, 63]. Этих больных можно выявить по низ-
кому трансаортальному градиенту давления (обыч-
но < 30 мм рт. ст.) в сочетании с тяжелым стенозом
аортального клапана [62].
В клинических условиях постановка правильно-
го диагноза может быть затруднена. Ввиду того что
уравнение Горлина зависит от кровотока, бывает
сложно дифференцировать пациентов с первичной
дисфункцией ЛЖ, сопутствующим аортальным
стенозом и кальцификацией от пациентов, у кото-
рых дисфункция ЛЖ была следствием тяжелого
аортального стеноза (см. главу 15). Для решения
этой проблемы и оценки прогноза все чаще прово-
дят стресс-ЭхоКГ с добутамином [64].
ФРАКЦИЯ УКОРОЧЕНИЯ И ЕЕ ПРОИЗВОДНЫЕ
Фракция укорочения (ФУ) — это изменение разме-
ра ЛЖ по короткой оси (в процентах). ФУ — широ-
ко используемый параметр систолической произво-
дительности миокарда. ФУ определяют по данным
ЭхоКГ в М-режиме. Это измерение особенно полез-
но, т.к. величину УО в основном определяет укоро-
чение циркулярных волокон миокарда ЛЖ. В связи
с этим ФУ соответствует ФВ. При отсутствии нару-
шений локальной сократимости миокарда эти два
показателя тесно коррелируют, хотя абсолютные
значения ФУ заметно меньше соответствующей ФВ.
Фракцию укорочения на уровне эндокарда (ФУэндо)
рассчитывают следующим образом:
ФУэндо = 100 × (ВРЛЖд – ВРЛЖс)/(ВРЛЖд).
где ВРЛЖд — внутренний размер левого желудочка
во время диастолы; ВРЛЖс — внутренний размер
левого желудочка во время систолы.
Нормальные значения ФУэндо — > 25% [22]. Как
и ФВ, ФУэндо зависит от факторов, влияющих на со-
кратительную функцию, поэтому показатель следу-
ет интерпретировать с учетом нагрузки: увеличение
преднагрузки и уменьшение постнагрузки увеличи-
вают ФУ.
Производное ФУ — скорость укорочения цирку-
лярных волокон (Vcf). Этот параметр отражает сред-
нюю скорость укорочения ЛЖ по короткой оси. Па-
раметр вычисляют при ЭхоКГ в М-режиме:
Vcf = ФУэндо/ET,
где ET — время выброса, которое включает продол-
жительность открытия аортального клапана и пе-
риод аортального кровотока (определяют при им-
пульсно-волновой или непрерывно-волновой доп-
плерографии) или которое определяется на основе
записей пульсации каротидных артерий. Единица
измерения Vcf — окружность в секунду (окр/сек).
Нижняя граница нормы — 1,1 окр/сек. Ввиду того
что Vcf —параметр скорости, а не укорочения, он
более чувствителен в отношении сократимости, чем
ФУэндо, и может быть ранним маркером нарушений
при хронической патологии.
ЭхоКГ в М-режиме также можно использовать
для оценки фракции укорочения циркулярных во-
локон среднего слоя стенки (ФУсс). ФУсс вычисляют,
используя модифицированную двухоболочечную
цилиндрическую модель [65]. Этот метод подразу-
0,5
0,4
0,3
0,2
0,1
100
200
300
400
500
600
Конечно-систолическое напряжение
Ф
р
а
к
ц
и
я
в
ы
б
р
о
с
а
Несоответствие постнагрузки
Сниженная сократимость
Рис. 7 .13 Взаимосвязь фракции выброса и конечно-систолического
напряжения у пациентов с критическим аортальным стенозом и хро-
нической сердечной недостаточностью. У всех пациентов отсутствовала
клинически значимая ишемическая болезнь сердца. Пациенты, показатели ко-
торых распределены вблизи линии регрессии (красные точки), имеют дис-
функцию левого желудочка, связанную с увеличением напряжения стенки ле-
вого желудочка (постнагрузки). У данных больных после протезирования аор-
тального клапана наблюдалось восстановление функции левого желудочка. И
наоборот, у 4 пациентов, показатели которых были ниже линии регрессии (си-
ние точки), отмечалось снижение фракции выброса, что является предиктором
снижения постнагрузки и значительного снижения сократимости миокарда. У
данных больных после протезирования аортального клапана признаков вос-
становления функции левого желудочка не обнаружено [Carabello BA, Green
LH, Grossman W, et al. Hemodynamic determination of prognosis of aortic valve
replacement in critical aortic stenosis and advanced congestive heart failure, Circu-
lation 62:42, 1980. In Aurigemma GP, Gaasch WH, Villegas B, Meyer TE: Noninva-
sive assessment of left ventricular mass, chamber volume, and contractile function.
Curr Probl Cardiol 20:374, 1995].
ch07.indd 147
03.04.2019 11:40:30
148
ЧАСТЬ II Левый желудочек
мевает постоянную массу ЛЖ в течение сердечного
цикла и не исходит из ограничения, что ФУ волокон
внешнего и внутреннего слоев стенки равны. Наи-
более важно, что ФУсс, в отличие от ФУэндо, не зави-
сит от геометрии ЛЖ, следовательно, ФУсс можно
использовать при оценке гипертрофированного
сердца с увеличенной ОТС (рис. 7 .14).
Нормальный ЛЖ
Диастола
ВРЛЖд 5,0 см
ТСд
0,9 см
Систола
ВРЛЖс 3,2 см
ТСс
1,4 см
Масса ЛЖ 158 г
ОТСд
0,36
ФУэндо 36%
ФУср
21%
ФУэндо 40%
ФУср
18%
ТСд
ВРЛЖд
ВРЛЖс
ТСс
Средний
слой стенки
Концентрическая ГЛЖ
Диастола
ВРЛЖд 4,8 см
ТСд
1,3 см
Систола
ВРЛЖс 2,9 см
ТСс
1,9 см
Масса ЛЖ 245 г
ОТСд
0,54
ТСд
ВРЛЖд
ВРЛЖс
ТСс
Средний
слой стенки
А
Б
Рис. 7 .14 Взаимосвязь укорочения и гипертрофии левого желудочка.
(А) Укорочение левого желудочка (ЛЖ) в норме. (Б) Укорочение левого желу-
дочка при концентрической гипертрофии левого желудочка (ГЛЖ). Оба рисун-
ка иллюстрируют систолическую функцию с учетом параметров укорочения
волокон среднего слоя стенки. Во время диастолы измеряют внутренний раз-
мер левого желудочка (ВРЛЖд), толщину стенок (ТСд), относительную толщи-
ну стенок (ОТСд) и определяют массу миокарда левого желудочка. Во время
систолы измеряют внутренний размер левого желудочка (ВРЛЖс) и толщину
стенок (ТСс). Систолическое укорочение — это уменьшение левого желудочка
в период от диастолы к систоле, выраженное в процентах. Фракция укороче-
ния на уровне эндокарда (ФУэндо) — это сокращение эндокардиальной поверх-
ности в процентах (внутренний круг), фракция укорочения волокон среднего
слоя стенки (ФУсс) — это сокращение волокон среднего слоя стенки в процен-
тах. При концентрической гипертрофии левого желудочка (увеличение ОТСд и
массы миокарда ЛЖ) отмечается увеличение ФУэндо и уменьшение ФУсс по
сравнению с нормой вследствие неоднородности систолического утолщения.
Волокна внутреннего (субэндокардиального) слоя миокарда в большей степе-
ни способствуют систолическому утолщению миокарда по сравнению с волок-
нами внешнего (эпикардиального) слоя. Этот эффект при концентрической ги-
пертрофии ЛЖ увеличивается.
Нормальная систолическая функция предполага-
ет смещение фиброзного кольца митрального кла-
пана по направлению к относительно неподвижной
верхушке. Таким образом, ЛЖ во время систолы уко-
рачивается по длинной оси. Оценить такое укороче-
ние можно в М-режиме и 2D-режиме [66]. Точно та-
кой принцип применяют для расчета продольной
деформации (см. главу 8). Некоторые исследователи
использовали смещение фиброзного кольца ми-
трального клапана и укорочение ЛЖ по длинной
оси в качестве показателей систолической функции
желудочка. Keren и LeJemtel [67] показали, что си-
столическое смещение фиброзного кольца митраль-
ного клапана по направлению к верхушке в целом
совпадает с систолическим компонентом венозного
легочного кровотока. Систолическое смещение фи-
брозного кольца митрального клапана заметно сни-
жено у пациентов с дилатационной кардиомиопа-
тией. Jones и Gibson [66] показали, что в норме сме-
щение фиброзного кольца митрального клапана к
верхушке предшествует укорочению циркулярных
волокон, что ведет к более сферической форме ЛЖ
в раннюю систолу [66]. Эти исследователи также
показали, что смещение фиброзного кольца ми-
трального клапана было снижено у пациентов по-
сле протезирования этого клапана [68]. У пациен-
тов с «компенсированной» гипертонической болез-
нью, т.е . с гипертрофией ЛЖ и нормальной ФВ,
укорочение ЛЖ по длинной оси снижено по срав-
нению с пациентами контрольной группы [68].
Аналогичные данные получены при исследовании
деформации с использованием МРТ, которые также
показали, что продольная скорость и продольная
деформация снижены, особенно при выраженной
гипертрофии [69, 67].
В последние годы для исследования систоличе-
ской и диастолической функций ЛЖ используют и
другие ультразвуковые методы. Время выброса и
время расслабления можно использовать для расче-
та индекса Tei (рис. 7.15) [70]. Для оценки систоли-
ческого движения миокарда используют тканевую
допплерографию, которая представляет собой мо-
дификацию импульсно-волновой допплерографии.
С ее помощью можно измерить скорость движения
миокарда и смещения фиброзного кольца митраль-
ного клапана, а не только общую амплитуду его
движения. Скорость смещения фиброзного кольца
митрального клапана во время диастолы также ис-
пользуют для оценки диастолической функции ЛЖ
(см. главу 9).
ОТНОШЕНИЕ НАПРЯЖЕНИЕ/УКОРОЧЕНИЕ
На основании большого экспериментального и кли-
нического опыта отношение напряжение/укороче-
ние миокарда используют при оценке сократитель-
ной способности и функции ЛЖ. Наиболее важное
преимущество оценки функции с использованием
ch07.indd 148
03.04.2019 11:40:31
149
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
отношения напряжение/укорочение состоит в от-
сутствии зависимости его от постнагрузки. К сожа-
лению, очень сложно или даже невозможно изме-
рить длину волокон миокарда в конце диастолы
(степень удлинения волокна в состоянии покоя).
Показатели конечно-диастолического давления, КДО
и напряжения стенки ЛЖ не могут обеспечить изме-
рение длины волокон. В связи с этим длиной волок-
на, как правило, пренебрегают и вместо отношения
сила/длина/скорость используют более простые —
сила/скорость или напряжение/укорочение.
Систолическое напряжение (силу миокарда на
единицу CSA) и укорочение (изменение длины или
объема) нормализуют соответствующим образом,
что позволяет с большой точностью сравнить рабо-
ту сердец разных размеров [71]. Таким образом, по
отношению напряжение/укорочение можно опре-
делить сократительную способность при гипертро-
фии вследствие перегрузки давлением или объе-
мом, а также при дилатационной и гипертрофиче-
ской кардиомиопатиях (см. рис. 7 .13).
Основным ограничением при анализе отноше-
ния напряжение/укорочение является предположе-
ние, что на него различия в длине волокон в покое
существенно не влияют. Однако необходимо разли-
чать состояния при острых нарушениях и стабиль-
ной хронической патологии. Безусловно, во время
острых или краткосрочных нарушений гемодина-
мики изменяется длина волокон с адекватным ис-
пользованием резерва конечно-диастолического дав-
ления, но при хронических состояниях (например,
при компенсированной хронической перегрузке объ-
a
b
ET
Поток из ЛЖ
Митральный
кровоток
ЭКГ
IVCT
IVRT
IVCT + IVRT
ET
=
Tei
a–b
b
, или
Рис. 7 .15 Индекс Tei. Индекс Tei рассчитывают как сумму времени изоволю-
мического сокращения (IVCT) и времени изоволюмического расслабления
(IVRT), деленную на время выброса (ET). ЛЖ
—
левый желудочек; ЭКГ —
электрокардиограмма [Tei C. New non-invasive index for combined systolic and
diastolic ventricular function. J Cardiol 26:135–136, 1995].
емом) этого может не происходить [72]. После острой
или подострой фазы, когда завершился процесс ком-
пенсаторного ремоделирования и изменились объ-
ем и масса ЛЖ, длина волокон в конце диастолы
может существенно не отличаться от нормы [72].
При перегрузке давлением или при концентриче-
ской гипертрофии длина саркомера в конце диа-
столы может быть даже меньше нормы [73, 74]. У
пациентов с таким сердцем использование резерва
конечно-диастолического давления ограничивает,
по-видимому, ригидность миокарда. Из этого сле-
дует, что предположения о постоянном изменении
длины волокон миокарда являются необоснован-
ными.
АНАЛИЗ ОТНОШЕНИЯ НАПРЯЖЕНИЕ/УКОРОЧЕНИЕ
ВОЛОКОН СРЕДНЕГО СЛОЯ СТЕНКИ
Анализ отношения напряжение/укорочение воло-
кон среднего слоя стенки может быть более важ-
ным, чем анализ отношения напряжение/укоро-
чение волокон эндокарда, особенно при сравнении
сократительной способности сердец с различной ге-
ометрией ЛЖ. Определение отношения напряже-
ние/укорочение волокон среднего слоя стенки имеет
целый ряд преимуществ.
Во-первых, векторы напряжения и укорочения
волокон среднего слоя стенки ориентированы в од-
ном и том же направлении, т.к. в среднем слое стен-
ки ЛЖ преобладают циркулярные волокна [22]. Во-
вторых, величина укорочения волокон среднего
слоя стенки соответствует экспериментальным дан-
ным, которые указывают, что волокна в этом слое
укорачиваются на ≈ 15–20%. Циркулярное напряже-
ние среднего слоя стенки варьирует от 9 ± 2% (у со-
бак в состоянии анестезии со вскрытой грудной
клеткой [75]) до 30 ± 7% (у людей в сознании под
контролем МРТ [76]). Мы считаем, что в экспери-
ментальных работах напряжение недооценено, а
при использовании МРТ весьма вероятна переоцен-
ка укорочения волокон. Полученные результаты
указывают на то, что укорочение циркулярных во-
локон эндокарда превышает укорочение циркуляр-
ных волокон среднего слоя стенки. Мы полагаем,
что для оценки сократительной способности мио-
карда следует использовать отношение напряже-
ние/укорочение волокон среднего слоя стенки, а не
показатель укорочения циркулярных волокон эндо-
карда, который может искажаться при изменении
геометрии желудочка.
У пациентов с гипертрофией при перегрузке дав-
лением, обусловленной аортальным стенозом, от-
ношение напряжение/укорочение волокон эндокар-
да находится в пределах нормы, поэтому и функция
ЛЖ в норме. Однако приблизительно у 30% паци-
ентов отношение напряжение/укорочение волокон
среднего слоя стенки ЛЖ является патологическим,
что указывает на скрытое снижение функции мио-
карда у данной категории больных [69].
ch07.indd 149
03.04.2019 11:40:31
150
ЧАСТЬ II Левый желудочек
АНАЛИЗ ОТНОШЕНИЯ ДАВЛЕНИЕ/ОБЪЕМ
Графическое изображение зависимости давления в
ЛЖ (P) от объема ЛЖ (V) в течение всего сердечно-
го цикла позволяет получить петли P–V. Высота
петли определяется систолическим давлением, ши-
рина — УО. Таким образом, площадь внутри петли
соответствует величине ударной работы. Согласно
определению, петли включают КДО и КСО и вос-
производят параметры УО и ФВ. Нижняя часть пет-
ли P–V (т.е . диастолическая кривая) отображает ди-
астолический желудочковый комплайнс. Петля Р–V
может дать простое, но в то же время полное опи-
сание насосной функции желудочка [77]. Такие пет-
ли можно зарегистрировать при использовании
различных методов определения объема и давления
[78–80]. Расчет объема ЛЖ в режиме on-line и авто-
матическое определение границ эндокарда при каж-
дом сокращении можно объединить с измерением
давления в ЛЖ для получения петель Р–V в режиме
реального времени, что полезно как в клинической
практике, так и при проведении научных исследо-
ваний [80, 81].
Измеряя объем ЛЖ и/или артериальное давле-
ние, можно получить множество координат макси-
мального отношения давление/объем или отноше-
ния давление/размер (в конце времени выброса).
Эти координаты демонстрируют почти прямую ли-
нейную зависимость. Наклон кривой отношения
давление/объем (Emax) при наполнении относитель-
но нечувствителен к резким изменениям нагрузки.
Отношение смещается вверх и влево при положи-
тельном инотропном влиянии. Если функция желу-
дочка снижена, отношение смещается вниз и впра-
во. Таким образом, в первом случае наклон кривой
отношения увеличивается, а во втором — уменьша-
ется. Конечно-систолический индекс сократимости
чувствителен к острым изменениям сократимости,
но его надежность у пациентов с хронической бо-
лезнью сердца уменьшается, особенно при его ди-
латации. При большом размере желудочка петля
P–V в конце систолы может быть смещена вниз и
вправо (сниженный Emax) в отсутствие нарушений
сократимости. В связи с этим Еmax должна быть нор-
мализована к размеру сердца [82, 83]. С учетом это-
го конечно-систолические отношения напряжение/
объем и напряжение/размер не должны быть основ-
ными критериями при диагностике хронической
сократительной дисфункции. Разумеется, исполь-
зовать эти параметры нецелесообразно для оценки
базальной сократимости сердца в норме и при па-
тологии. Петли P–V и отношение напряжение/раз-
мер дают важную диагностическую информацию
(с немногими исключениями), т.е . позволяют вы-
явить желудочек со сниженной функцией, по срав-
нению с простым измерением КСО или КСР.
На рис. 7 .16 приведен пример использования пе-
тель P–V . Этот пример иллюстрирует влияние про-
тезирования митрального клапана на размеры и
функцию ЛЖ при компенсированной и декомпен-
сированной хронической митральной регургита-
ции. При компенсированной митральной регурги-
тации полость сердца увеличена, но КСР составляет
Норма
До операции
После операции
Н
а
п
р
я
ж
е
н
и
е
с
т
е
н
к
и
Л
Ж
(
д
и
н
/
с
м
2
·
1
0
3
)
Размер ЛЖ (см)
Размер ЛЖ (см)
300
200
100
0
300
200
100
0
34567
34567
А
Б
Рис. 7.16 Ответ левого желудочка на протезирование митрального клапана при компенсированной и декомпенсированной митральной регур-
гитации. (А) Петля «напряжение–размер» левого желудочка (ЛЖ) до операции отражает компенсированную функцию левого желудочка: конечно-диастоличе-
ский размер составляет 6,5 см, конечно-систолический размер равен 4,2 см, систолическое напряжение увеличено минимально, фракция укорочения в пределах
нормы (35%). После протезирования митрального клапана конечно-диастолический размер и систолическое напряжение нормализовались, но фракция укороче-
ния оставалась сниженной (29%). (Б) Петля «напряжение–размер» до операции отражает декомпенсированный желудочек: конечно-диастолический размер и ко-
нечно-систолический размер значительно увеличены (7,3 и 5,4 см соответственно), фракция укорочения снижена (26%). В данном случае после протезирования
митрального клапана расширение левого желудочка сохраняется и продолжается снижение фракции укорочения [Aurigemma GP, Gaasch WH, Villegas B, Meyer TE:
Noninvasive assessment of left ventricular mass, chamber volume, and contractile function. Curr Probl Cardiol 20:421, 1995].
ch07.indd 150
03.04.2019 11:40:31
151
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
всего 4,2 см, систолическое напряжение увеличено
минимально, ФУ находится в пределах нормы
(35%). После протезирования клапана петля «на-
пряжение–размер» возвращается к значениям, близ-
ким к норме. При декомпенсированной митраль-
ной регургитации значения КДО и КСО значитель-
но увеличены, а ФУ снижена (26%). В этом случае
после протезирования митрального клапана ЛЖ
остается расширенным и происходит дальнейшее
снижение ФУ. Аналогичные данные получены у па-
циентов с аортальной регургитацией (см. главу 17)
[84].
ОГРАНИЧЕНИЯ
Стоит кратко повторить некоторые практические
ограничения оценки структуры и функции ЛЖ с
помощью ЭхоКГ. Для количественной оценки мас-
сы и объема нужно качественное изображение с чет-
кой визуализацией эндокарда. Однако нередко та-
кое изображение получить невозможно. Для коли-
чественной оценки с использованием М-режима и
2D-режима необходимо, чтобы форма желудочка не
была значительно изменена. Кроме этого, при коли-
чественной оценке в М-режиме следует уделять
большое внимание направлению ультразвукового
луча. Каждый 1 мм погрешности в оценке размеров
ЛЖ приводит к искажению значения массы ЛЖ на
8 г [85], а при измерении толщины стенки ЛЖ — на
15 г. Опыт использования 3D-ЭхоКГ [85] поднима-
ет серьезный вопрос о том, является ли направление
ультразвукового луча в обычной практике действи-
тельно ортогональным относительно длинной оси
ЛЖ. Ответ на этот вопрос поможет ответить на дру-
гой вопрос: почему у некоторых пациентов серий-
ная ЭхоКГ в М-режиме неспособна выявить изме-
нения массы ЛЖ в среднем на 20–40 г после анти-
гипертензивной терапии [86, 87].
2D-ЭхоКГ имеет свои ограничения, включая низ-
кую частоту кадров (что усложняет точный хроно-
метраж патологических изменений), артефакты в
ближнем поле и плохое латеральное разрешение.
Апикальный доступ часто не позволяет получить
качественное изображение эндокарда, необходи-
мое для ручной трассировки контура ЛЖ. Непра-
вильное определение длинной оси ЛЖ приводит к
тому, что объем ЛЖ оказывается меньше объема,
полученного при контрастной вентрикулографии,
3D-ЭхоКГ и МРТ. Однако, несмотря на эти суще-
ственные ограничения, количественные ультразву-
ковые методы нашли широкое применение в кли-
нической практике и при проведении научных ис-
следований.
Значение
Метод
и референсные
значения
Методика
Преимущества
Ограничения
Оценка размеров и массы
Маркер поврежде-
ния органов
при гипертензии
Надежный преди-
ктор исхода гипер-
тензии в популя-
ционных
исследованиях
Показатель пере-
грузки давлением
при аортальном
стенозе
ЭхоКГ
в М-режиме
(референсные
значения
см. на рис. 7.7
и в табл. 7.3,
7.4)
Для получения внутренних
линейных размеров
используют парастерналь-
ную позицию по длинной
оси. Следует направить
ультразвуковой луч пер-
пендикулярно длинной оси
ЛЖ и измерять на уровне
краев створок митрального
клапана
Электронные калиперы
ставят на границах, между
которыми располагается
миокард, а также между
внутренним краем задней
стенки и перикардом (см.
рис. 7.7)
Валидирован
при аутопсии
Широко используют
в эпидемиологических
исследованиях
Предоставляет инфор-
мацию о результатах
лечения
Высокая частота кадров
(1000 кадр/сек)
Метод нечувствителен
к изменениям формы,
обусловленным инфар-
ктом миокарда
и ремоделированием
Геометрическое ограниче-
ние: длинная ось отно-
сится к короткой как 2 : 1
Вариабельность
при повторных исследо-
ваниях делает метод
непригодным для выявле-
ния малых изменений
массы ЛЖ у одного
и того же пациента
СВОДНАЯ ИНФОРМАЦИЯ
Оценка размеров, массы, объема и функции левого желудочка
ch07.indd 151
03.04.2019 11:40:31
152
ЧАСТЬ II Левый желудочек
Значение
Метод
и референсные
значения
Методика
Преимущества
Ограничения
3D-ЭхоКГ
(см. табл. 7.3)
См. главу 2
Позволяет оценить ЛЖ
целиком
Позиции можно подо-
брать так, чтобы избе-
жать усечения
изображения
Низкая вариабельность
Валидирован при МРТ
Относительно низкая
частота кадров при коли-
чественном анализе
Возможно недостаточное
качество изображения
при мультипланарной
реконструкции
Относительно новая техно-
логия, широко
не распространена
МРТ сердца
(референсные
значения см.
в табл. 7.3)
Измерения массы ЛЖ
анатомически под-
тверждены в экспери-
ментах на животных
Низкая вариабельность
делает метод привле-
кательным для оценки
результатов вмеша-
тельств при клиниче-
ских испытаниях
Длительность исследования
и необходимость
задержки дыхания делают
его доступным лишь ста-
бильным пациентам
Длительность вычислений
Нельзя использовать
у пациентов с водителем
ритма и определенными
инородными телами
Ограниченная доступность
по сравнению с УЗИ
сердца
Оценка объема
Объем ЛЖ является
ключевым показа-
телем его размера
и предиктором
исхода при ИБС,
поражениях кла-
панов и сердечной
недостаточности
2D-ЭхоКГ
(референсные
значения
см. на рис. 7.10
и в табл. 7.6)
Объем обычно измеряют
с помощью бипланарного
метода Симпсона в апи-
кальных двух- и четырехка-
мерной позициях в конце
систолы и диастолы
(согласно рекомендациям
ASE). Для оценки размера
ЛЖ между двумя концами
фиброзного кольца
митрального клапана про-
водят линию и ее среднюю
часть соединяют с эндокар-
диальной поверхностью
верхушки
Наиболее широко при-
меняемый метод
оценки объема ЛЖ
В отличие от М-режима
можно оценить
большую часть ЛЖ
или весь ЛЖ
Хорошо известен
и относительно прост
Можно применять
после введения кон-
трастного средства
для усиления визуали-
зации границ
Можно применять
в случае ремоделиро-
вания желудочка
(после инфаркта или
в других ситуациях)
Для трассировки границ
изображение должно
быть остановлено, что
приводит к существенной
потере качества
визуализации
Искажение изображения
верхушки происходит
очень часто, что приво-
дит к недооценке объема
по сравнению с МРТ
или ангиографией
3D-ЭхоКГ:
49–66 мл/м2
(мужчины),
46–58 мл/м2
(женщины)
Позволяет оценить ЛЖ
целиком
Позиции можно подо-
брать так, чтобы избе-
жать усечения
изображения
Низкая вариабельность
Валидирован при МРТ
Относительно низкая
частота кадров при коли-
чественном анализе
Возможно недостаточное
качество изображения
при мультипланарной
реконструкции
Относительно новый
метод; доступность
по сравнению с 2D-ЭхоКГ
ограничена
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Оценка размеров, массы, объема и функции левого желудочка
ch07.indd 152
03.04.2019 11:40:31
153
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
Значение
Метод
и референсные
значения
Методика
Преимущества
Ограничения
МРТ сердца
(референсные
значения
см. в табл. 7 .6)
Позволяет оценить весь
объем ЛЖ
Возможно оценить как
общий «ангиографиче-
ский» объем ЛЖ (сре-
зовая планиметрия),
так и ударные объемы
ЛЖ и ПЖ (фазово-
контрастное
изображение)
Наиболее точный
и доступный метод
оценки объема
Длительность исследования
и необходимость
задержки дыхания делают
его доступным лишь ста-
бильным пациентам
Длительность вычислений
Нельзя использовать
у пациентов с водителем
ритма и определенными
инородными телами
Ограниченная доступность
по сравнению с УЗИ
сердца
Оценка функции
Фракция укороче-
ния волокон
эндокарда
ЭхоКГ
в М-режиме:
25–43%
(мужчины),
27–45%
(женщины)
Простота
Воспроизводимость
измерений
в М-режиме
Параметр зависит
от нагрузки
Метод нечувствителен
к изменениям формы,
обусловленным инфар-
ктом миокарда
и ремоделированием
Фракция укороче-
ния волокон сред-
него слоя стенки
ЭхоКГ
в М-режиме:
14–22%
(мужчины),
15–23%
(женщины)
Учитывает геометрию
ЛЖ
Лучший параметр
функции ЛЖ по срав-
нению с фракцией
укорочения при кон-
центрическом
ремоделировании
Прогнозирование
исходов
Параметр зависит
от нагрузки
Метод нечувствителен
к изменениям формы,
обусловленным инфар-
ктом миокарда
и ремоделированием
Параметр рассчитать
трудно, поэтому
в клинике его широко
не применяют
Ударный объем
Определение
VTI при доп-
плерографии
в 2D-режиме
Простота
Относительная
воспроизводимость
Метод наиболее полезен
при наблюдении
в динамике
Параметр зависит
от нагрузки
У пациентов с нарушени-
ями ритма изменяется
с каждым сокращением
Измерить диаметр выход-
ного тракта ЛЖ может
быть трудно, особенно
при гипертрофии базаль-
ных сегментов
перегородки
Фракция выброса
2D-ЭхоКГ:
62%±5%
(мужчины),
64%±5%
(женщины)
Наиболее широко
используемый пара-
метр систолической
функции
Не нужно индексиро-
вать к площади
поверхности тела
Можно сравнивать
показатели у взрослых
разного возраста
и телосложения
Зависит от пред-
и постнагрузки
Может быть в норме
и даже выше ее у пациен-
тов с маленьким сердцем
и малым ударным
объемом
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Оценка размеров, массы, объема и функции левого желудочка
ch07.indd 153
03.04.2019 11:40:31
154
ЧАСТЬ II Левый желудочек
Значение
Метод
и референсные
значения
Методика
Преимущества
Ограничения
3D-ЭхоКГ:
57–62%
(мужчины)
61–65%
(женщины)
Относительно низкая
частота кадров при коли-
чественном анализе
Возможно недостаточное
качество изображения
при мультипланарной
реконструкции
Относительно новый
метод, широко
не распространен
МРТ сердца:
67,2% ± 7,2%
(мужчины),
71,8% ± 5,6%
(женщины)
Длительность исследования
и необходимость
задержки дыхания делают
его доступным лишь
стабильным пациентам
Длительность вычисления
Нельзя использовать
у пациентов с водителем
ритма и определенными
инородными телами
Ограниченная доступность
по сравнению с УЗИ
сердца
ASE — American Society of Echocardiography; VTI — интеграл скорости кровотока; ИБС — ишемическая болезнь сердца; ЛЖ — левый
желудочек; МРТ — магнитно -резонансная томография; ПЖ — правый желудочек; УЗИ — ультразвуковое исследование; ЭхоКГ — эхо -
кардиография.
[Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s
Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of
Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr 18:1440–1463, 2005.]
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Оценка размеров, массы, объема и функции левого желудочка
ЛИТЕРАТУРА
1. Gaasch WH. Diagnosis and treatment of
heart failure based on LV systolic or diastolic
dysfunction, JAMA 271:1276–1280, 1994.
2. Mock MB, Rindqvist I, Fisher LD, et al. Sur-
vival of medically treated patients in the cor-
onary artery surgery (CASS) registry, Circu-
lation 66:562–567, 1982.
3. White HD, Norris RM, Brown MA, et al. Left
ventricular end systolic volume as the major
determinant of survival after recovery from
myocardial infarction, Circulation 76:44–51,
1987.
4. McManus DD, Shah SJ, Fabi MR, et al. Prog-
nostic value of left ventricular end-systolic
volume index as a predictor of heart failure
hospitalization in stable coronary artery dis-
ease: data from the Heart and Soul Study, J
Am Soc Echocardiogr 22:190–197, 2009.
5. Pfeffer MA, Braunwald E, Moye LA, et al. Ef-
fect of captopril on mortality and morbidity
in patients with left ventricular dysfunction
after myocardial infarction: results of the sur-
vival and ventricular enlargement trial, N
Engl J Med 327:669–677, 1992.
6. The SOLVD Investigators. Effect of enalapril
on survival in patients with reduced left ven-
tricular ejection fractions and congestive
heart failure, N Engl J Med 325:293–302,
1991.
7. Solomon SD, Anavekar N, Skali H, et al. In-
fluence of ejection fraction on cardiovascular
outcomes in a broad spectrum of heart fail-
ure patients, Circulation 112:3738–3744,
2005.
8. Aurigemma GP, Gottdiener JS, Shemanski L,
et al. Predictive value of systolic and diastolic
function for incident congestive heart failure
in the elderly: the Cardiovascular Health
Study, J Am Coll Cardiol 37:1042–1048, 2001.
9. Nishimura RA, Otto CM, Bonow RO, et al.
AHA/ACC Guideline for the Management of
Patients with Valvular Heart Disease: a report
of the American College of Cardiology/
American Heart Association Task Force on
Practice Guidelines, Circulation 129:e521–
643, 2014.
10. Orsinelli DA, Aurigemma GP, Battista S, et al.
Left ventricular hypertrophy and mortality
after aortic valve replacement for aortic ste-
nosis: a high risk subgroup identified by pre-
operative relative wall thickness, J Am Coll
Cardiol 22:1679–1683, 1993.
11. Hachicha Z, Dumesnil JG, Bogaty P, et al.
Paradoxical low-flow, low-gradient severe
aortic stenosis despite preserved ejection frac-
tion is associated with higher afterload and
reduced survival, Circulation 115:2856–2864,
2007.
12. Koren MJ, Devereux RB, Casale PN, et al. Re-
lation of left ventricular mass and geometry
to morbidity and mortality in uncomplicated
essential hypertension, Ann Intern Med
114:345–352, 1991.
13. Levy D, Garrison RJ, Savage D, et al. Prognos-
tic implications of echocardiographically de-
termined left ventricular mass in the Fram-
ingham Heart Study, N Engl J Med 322:1561–
1566, 1990.
14. Devereux RB, Dahlof B, Gerdts E, et al. Re-
gression of hypertensive left ventricular hy-
pertrophy by losartan compared with ateno-
lol: the Losartan Intervention for Endpoint
Reduction in Hypertension (LIFE) trial, Cir-
culation 110:1456–1462, 2004.
15. Verdecchia P, Schillaci G, Borgioni C, et al.
Adverse prognostic significance of concentric
remodeling of the left ventricle in hyperten-
sive patients with normal left ventricular
mass, J Am Coll Cardiol 25:871–878, 1995.
16. Devereux R. Left ventricular geometry,
pathophysiology and prognosis, J Am Coll
Cardiol 25:885–887, 1995.
ch07.indd 154
03.04.2019 11:40:31
155
7 Количественная оценка массы, объема, геометрии и систолической функции левого желудочка
17. Ganau A, Devereux RB, Roman MJ, et al. Pat-
terns of left ventricular hypertrophy and geo-
metric remodeling in essential hypertension,
J Am Coll Cardiol 19:550–558, 1992.
18. De Simone G, Izzo R, Aurigemma GP, et al.
Cardiovascular risk in relation to a new clas-
sification of hypertensive left ventricular geo-
metric abnormalities, J Hypertens 33:745–754,
2015. discussion 754.
19. Bang CN, Gerdts E, Aurigemma GP, et al.
Four-group classification of left ventricular
hypertrophy based on ventricular concentric-
ity and dilatation identifies a low-risk subset
of eccentric hypertrophy in hypertensive pa-
tients, Circ Cardiovasc Imaging 7:422–429,
2014.
20. Bogaert J, Rademakers FE. Regional nonuni-
formity of normal adult human left ventricle,
Am J Physiol Heart Circ Physiol 280:H610–
620, 2001.
21. Notomi Y, Setser RM, Shiota T, et al. Assess-
ment of left ventricular torsional deforma-
tion by Doppler tissue imaging: validation
study with tagged magnetic resonance imag-
ing, Circulation 111:141–147, 2005.
22. Aurigemma GP, Zile MR, Gaasch WH. Con-
tractile behavior of the left ventricle in dia-
stolic heart failure: with emphasis on region-
al systolic function, Circulation 113:296–304,
2006.
23. St. John Sutton M, Plappert T, Hirshfeld
JW, et al. Assessment of left ventricular me-
chanics in patients with asymptomatic aor-
tic regurgitation: a two-dimensional echo-
cardiographic study, Circulation 69:259–
270, 1984.
24. Gaasch WH, Zile MR, Hoshino PK, et al.
Stress-shortening relations and myocardial
blood flow in compensated and failing canine
hearts with pressure overload hypertrophy,
Circulation 79:872–883, 1989.
25. Mirsky I. Review of the various theories for
evaluation of left ventricular wall stress. In
Mirsky I, Chiston DN, Sandler H, editors:
Cardiac mechanics: physiological, chemical,
and mathematical considerations, New York,
1974, Wiley.
26. Douglas PS, Reichek N, Plappert T, et al.
Comparison of echocardiographic methods
for assessment of left ventricular shortening
and wall stress, J Am Coll Cardiol 9:945–951,
1987.
27. Rozich JD, Carabello BA, Usher BW, et al.
Mitral valve replacement with and without
chordal preservation in patients with chronic
mitral regurgitation, Circulation 86:1718–
1726, 1992.
28. Gaasch WH, Battle WE, Oboler AD, et al. Left
ventricular stress and compliance in man:
with special reference to normalized ventric-
ular function curves, Circulation 45:746–762,
1972.
29. Clyne CA, Arrighi JA, Maron BJ, et al. Sys-
temic and LV responses to exercise stress in
asymptomatic patients with valvular aortic
stenosis, Am J Cardiol 68:1469–1476, 1991.
30. Cuocolo A, Sax F, Brush J, et al. Left ventric-
ular hypertrophy and impaired diastolic fill-
ing in essential hypertension, Circulation
81:978–986, 1990.
31. Kitzman D, Higginbotham M, Cobb F, et al.
Exercise intolerance in patients with heart
failure and preserved LV systolic function, J
Am Coll Cardiol 7:1065–1072, 1991.
32. Ross Jr. J. Afterload mismatch in aortic and
mitral valve disease: implications for surgical
therapy, J Am Coll Cardiol 5:811–826, 1985.
33. Grossman W, Jones D, McLaurin LP. Wall
stress and patterns of hypertrophy in the hu-
man left ventricle, J Clin Invest 56:56–64,
1975.
34. Pouleur H, Covell JW, Ross Jr. J. Effects of
alterations in aortic input impedance on the
force-velocity-length relationship in the in-
tact canine heart, Circ Res 45:126–135, 1979.
35. Goldfine H, Aurigemma GP, Zile MR, Gaasch
WH. Left ventricular length-force-shortening
relations before and after surgical correction
of chronic mitral regurgitation, J Am Coll
Cardiol 31:180–185, 1998.
36. Carabello BA, Spann JF. The uses and limita-
tions of end-systolic indices of left ventricu-
lar function, Circulation 69:1058–1064, 1984.
37. Sagawa K. The end-systolic pressure-volume
relationship of the ventricle: definitions,
modifications, and clinical use, Circulation
61:1223–1227, 1981.
38. Douglas PS, Morrow R, Ioli A, et al. Left ven-
tricular shape, afterload and survival in idio-
pathic dilated cardiomyopathy, J Am Coll
Cardiol 13:311–315, 1989.
39. Gaasch WH, Zile MR. Left ventricular struc-
tural remodeling in health and disease: with
special emphasis on volume, mass, and geom-
etry, J Am Coll Cardiol 58:1733–1740, 2011.
40. Lang RM, Badano LP, Mo-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39.e14, 2015.
41. Topol E, Traill T, Fortuin N. Hypertensive
hypertrophic cardiomyopathy of the elderly,
N Engl J Med 312:277–283, 1985.
42. Gaasch WH, Zile MR. Left ventricular struc-
tural remodeling in health and disease: with
special emphasis on volume, mass, and geom-
etry, J Am Coll Cardiol 58:1733–1740, 2011.
43. Litwin SE, Katz SE, Weinberg EO, et al. Serial
echocardiographic-Doppler assessment of
left ventricular geometry and function in rats
with pressure-overload hypertrophy. Chronic
angiotensin converting enzyme inhibition at-
tenuates the transition to heart failure, Circu-
lation 91:2642–2649, 1995.
44. Devereux RB, Alonso D, Lutas E, et al. Echo-
cardiographic assessment of left ventricular
hypertrophy: comparison to necropsy find-
ings, Am J Cardiol 57:450–458, 1986.
45. Marwick TH, Gillebert TC, Aurigemma G, et
al. Recommendations on the use of echocar-
diography in adult hypertension: a report
from the European Association of Cardiovas-
cular Imaging (EACVI) and the American So-
ciety of Echocardiography (ASE), Eur Heart J
Cardiovasc Imaging 16:577–605, 2015.
46. Teichholz LE, Kreulen T, Herman MV, et al.
Problems in echocardiographic volume deter-
minations: echocardiographic-angiographic
correlations in the presence or absence of
asynergy, Am J Cardiol 37:7–12, 1976.
47. Turkbey EB, McClelland RL, Kronmal RA, et
al. The impact of obesity on the left ventricle:
the Multi-Ethnic Study of Atherosclerosis
(MESA), JACC Cardiovasc Imaging 3:266–
274, 2010.
48. Khouri MG, Peshock RM, Ayers CR, et al. A
4-tiered classification of left ventricular hy-
pertrophy based on left ventricular geometry:
the Dallas heart study, Circ Cardiovasc Imag-
ing 3:164–171, 2010.
49. Chinali M, Aurigemma GP. Refining patterns
of left ventricular hypertrophy using cardiac
MRI: “brother, can you spare a paradigm?”,
Circ Cardiovasc Imaging 3:129–131, 2010.
50. Aurigemma GP, de Simone G, Fitzgibbons
TP, et al. Cardiac remodeling in obesity, Circ
Cardiovasc Imaging 6:142–152, 2013.
51. Reichek NR, Helak J, Plappert T, et al. Ana-
tomic validation of left ventricular mass from
clinical two-dimensional echocardiography:
initial results, Circulation 67:348–352, 1983.
52. St. John Sutton MG, Plappert T, Crosby L, et
al. Effects of reduced left ventricular mass on
chamber architecture, load, and function: a
study of anorexia nervosa, Circulation
72:991–1000, 1985.
53. Byrd BF, Wahr D, Wang YS, et al. Left ven-
tricular mass and volume/mass ratio deter-
mined by two-dimensional echocardiography
in normal adults, J Am Coll Cardiol 6:1021–
1025, 1985.
54. Douglas PS, Reichek N, Hackney K, et al.
Contribution of afterload, hypertrophy, and
geometry to left ventricular ejection fraction
in aortic valve stenosis, pure aortic regurgita-
tion and idiopathic dilated cardiomyopathy,
Am J Cardiol 59:1398–1404, 1987.
55. Feiring A, Rumberger J, Reiter S, et al. Deter-
mination of left ventricular mass in dogs with
rapid-acquisition cardiac computed tomo-
graphic scanning, Circulation 72:1355–1364,
1985.
56. Mor-Avi V, Lang RM, Badano LP, et al. Cur-
rent and evolving echocardiographic tech-
niques for the quantitative evaluation of car-
diac mechanics: ASE/EAE consensus state-
ment on methodology and indications
endorsed by the Japanese Society of Echocar-
diography, Eur J Echocardiogr 12:167–205,
2011.
57. Dorosz JL, Lezotte DC, Weitzenkamp DA, et
al. Performance of 3-dimensional echocar-
diography in measuring left ventricular vol-
umes and ejection fraction: a systematic re-
view and meta-analysis, J Am Coll Cardiol
59:1799–1808, 2012.
58. Gardin JM, Tomasso CL, Talano JV. Evalua-
tion of dilated cardiomyopathy by pulsed
Doppler echocardiography, Am Heart J
106:1057–1065, 1983.
59. Lewis JF, Kuo LC, Nelson JG, et al. Pulsed
Doppler echocardiographic determination of
stroke volume and cardiac output: clinical
validation of two new methods using the api-
cal window, Circulation 70:425–431, 1984.
60. Bargiggia GS, Bertucci C, Recusani F, et al. A
new method for estimating left ventricular
dP/dt by continuous wave Doppler-echocar-
diography: validation studies at cardiac cath-
eterization, Circulation 80:1287–1292, 1989.
61. Allen DG, Kentish JC. The cellular basis of the
length tension relation in cardiac muscle, J
Mol Cell Cardiol 17:821–828, 1985.
62. Carabello BA, Green LH, Grossman W, et al.
Hemodynamic determination of prognosis
of aortic valve replacement in critical aortic
stenosis and advanced congestive heart fail-
ure, Circulation 62:42, 1980.
63. Sutton M, Plappert T, Spiegel A, et al. Early
postoperative changes in left ventricular
chamber size, architecture, and function in
aortic stenosis and aortic regurgitation and
their relation to intraoperative changes in af-
terload: a prospective two-dimensional echo-
cardiographic study, Circulation 76:77–89,
1987.
64. DeFilippi CR, Willett DL, Brickner ME, et al.
Usefulness of dobutamine echocardiography
in distinguishing severe from nonsevere val-
ch07.indd 155
03.04.2019 11:40:31
156
ЧАСТЬ II Левый желудочек
vular aortic stenosis in patients with de-
pressed left ventricular function and low
transvalvular gradients, Am J Cardiol 75:191–
194, 1995.
65. Aurigemma GP, Silver KH, Fox MA, et al. De-
pressed midwall and long axis shortening in
hypertensive left ventricular hypertrophy
with normal ejection fraction, J Am Coll Car-
diol 26:195–202, 1995.
66. Jones CR, Gibson D. Functional importance
of the long axis dynamics of the human left
ventricle, Br Heart J 65:215–220, 1990.
67. Keren G, LeJemtel T. Mitral annulus motion:
Relation to pulmonary venous and transmi-
tral flows in normal subjects and in patients
with dilated cardiomyopathy, Circulation
78:621–629, 1988.
68. Palmon L, Reichek N, Yeon S, et al. Intramu-
ral myocardial shortening in hypertensive left
ventricular hypertrophy with normal pump
function, Circulation 89:122–131, 1994.
69. Narayanan A, Aurigemma GP, Chinali M, et
al. Cardiac mechanics in mild hypertensive
heart disease: a speckle-strain imaging study,
Circ Cardiovasc Imaging 2:382–390, 2009.
70. Tei C. New non-invasive index for combined
systolic and diastolic ventricular function, J
Cardiol 26:135–136, 1995.
71. Mirsky I, Pasternac A, Ellison RC. General in-
dex for the assessment of cardiac function,
Am J Cardiol 30:483–491, 1972.
72. Ross Jr. J, Sonnenblick EH, Taylor RR, et al.
Diastolic geometry and sarcomere lengths in
the chronically dilated canine left ventricle,
Circ Res 28:49–56, 1971.
73. Sonnenblick EH. Correlation of myocardial
ultrastructure and function, Circulation
38:29–44, 1968.
74. Laks MM, Morady F, Swan HJC. Canine right
and left ventricular cell and sarcomere lengths
after banding the pulmonary artery, Circ Res
24:705–710, 1969.
75. Villareall FJ, Lew WYW, Waldman LK, et al.
Transmural myocardial deformation in the
ischemic canine left ventricle, Circ Res
68:368–381, 1991.
76. Clark NR, Reichek N, Bergey P, et al. Circum-
ferential myocardial shortening in the normal
human left ventricle. Assessment by MRI us-
ing spatial modulation of magnetization, Cir-
culation 84:67–74, 1991.
77. Sagawa K, Maughan L, Suga H, Sunagawa K.
Cardiac contractility and the pressure-volume
relationship, New York, 1988, Oxford Univer-
sity Press.
78. McKay RG, Aroesty JM, Heller GV, et al. Left
ventricular pressure-volume diagrams and
endsystolic pressure-volume relations in hu-
man beings, J Am Coll Cardiol 3:301–312,
1984.
79. Magorien DJ, Shaffer P, Bush CA, et al. Assess-
ment of left ventricular pressure-volume rela-
tions using gated radionuclide angiography,
echocardiography and micromanometer pres-
sure recordings, Circulation 67:844–852, 1983.
80. Gorcsan III J, Gasior TA, Mandarino WA. As-
sessment of the immediate effects of cardio-
pulmonary bypass on left ventricular perfor-
mance by on-line pressure-area relations, Cir-
culation 89:180–190, 1994.
81. Gorcsan III J, Denault A, Gasior TA, et al.
Rapid estimation of LV contractility from end
systolic relations by echocardiographic auto-
mated border detection and femoral artery
pressure, Anesthesiology 81:553–562, 1994.
82. Sagawa K. The ventricular pressure-volume
diagram revisited, Circ Res 43:677–680, 1978.
83. Berko B, Gaasch WH, Tanigawa N, et al. Dis-
parity between ejection and end systolic in-
dexes of left ventricular contractility in mitral
regurgitation, Circulation 75:1310–1319,
1987.
84. Gaasch WH, Carroll JD, Levine HJ, et al.
Chronic aortic regurgitation: prognostic val-
ue of left ventricular end-systolic dimension
and end-diastolic radius/thickness ratio, J Am
Coll Cardiol 1:775–782, 1983.
85. King DL. Three-dimensional echocardiogra-
phy: use of additional spatial data for measur-
ing left ventricular mass, Mayo Clin Proc
69:293–295, 1994.
86. Gottdiener JS, Livengood SV, Meyer PS, et al.
Should echocardiography be performed to
assess the effects of antihypertensive therapy?
Test-retest reliability of echocardiography for
measurement of left ventricular mass and
function, J Am Coll Cardiol 25:424–430, 1995.
87. Dahloff B, Pennert K, Hanson L. Reversal of
left ventricular hypertrophy in hypertensive
patients: a meta-analysis of 109 treatment
studies, Am J Hypertens 5:95–110, 1992.
ch07.indd 156
03.04.2019 11:40:31
157
8 Скорость движения миокарда,
деформация, скорость деформации,
синхронность сокращений
и скручивание
OTTO A. SMISETH, MD, PHD • THOR EDVARDSEN, MD, PHD • HANS TORP, DRTECH
Визуализация скорости движения
миокарда и смещения фиброзного
кольца
Скорость при цветовой допплерографии
Скорость при импульсно-волновой
допплерографии
Визуализация смещения
Визуализация деформации
Основные положения
Деформация и скорость деформации
при тканевой допплерографии
Физические основы спекл-трекинг
эхокардиографии
Деформация и скорость деформации
при спекл-трекинг эхокардиографии
Вращение и скручивание левого
желудочка
Ограничения визуализации
деформации и скорости деформации
Угловая зависимость
Неоптимальное отслеживание
Помехоподавление и пространственная
и временная разрешающая
способность
Перемещение контрольного объема
Реверберация
Зависимость от нагрузки
Ограничения вращения и скручивания
левого желудочка
Градиент трансмуральной деформации
Вариабельность нормальных показателей
деформации у различных
производителей оборудования
Нормальная физиология
левого желудочка
Систолическая скорость
Диастолическая скорость
Ишемия миокарда
Синхронность сокращений миокарда
Механизмы внутрижелудочковой
диссинхронии левого желудочка
Влияние блокады левой ножки пучка Гиса
на функцию левого желудочка
Диссинхрония и риск развития
желудочковых аритмий
Визуализация деформации
при субклинической дисфункции
левого желудочка
Функция правого желудочка
В повседневной клинической практике функцию
левого желудочка (ЛЖ) обычно оценивают с помо-
щью двухмерной (2D) эхокардиографии (ЭхоКГ) и
ЭхоКГ в M-режиме. Наиболее широко используе-
мым параметром глобальной функции ЛЖ являет-
ся фракция выброса (ФВ), а локальную функцию
определяют визуально оценивая сократимость ми-
окарда. В качестве более объективных методов ко-
личественной оценки локальной и глобальной си-
столической и диастолической функций ЛЖ было
предложено использовать тканевую допплерогра-
фию и спекл-трекинг ЭхоКГ.
В этой главе объясняются технические принци-
пы тканевой допплерографии и спекл-трекинг
ЭхоКГ, физиологическое значение различных пара-
метров, рассмотрено применение тканевой доппле-
рографии и спекл-трекинг ЭхоКГ в клинике, а так-
же синхронность сокращений желудочков.
ВИЗУАЛИЗАЦИЯ СКОРОСТИ ДВИЖЕНИЯ
МИОКАРДА И СМЕЩЕНИЯ ФИБРОЗНОГО КОЛЬЦА
Визуализация скорости движения миокарда и сме-
щения фиброзных колец атриовентрикулярных
клапанов предоставляет важную информацию о си-
столической и диастолической функции ЛЖ. Мак-
симальная скорость укорочения и систолическое
смещение фиброзных колец атриовентрикулярных
клапанов являются маркерами сократительной
функции, а скорость смещения фиброзного кольца
митрального клапана в раннюю диастолу является
важным параметром диастолической функции.
СКОРОСТЬ ПРИ ЦВЕТОВОЙ ДОППЛЕРОГРАФИИ
Визуализация скорости движения миокарда была
впервые проведена в начале 1990-х гг. [1, 2]. Разгра-
ничение скорости движения миокарда и скорости
ch08.indd 157
03.04.2019 11:40:51
158
ЧАСТЬ II Левый желудочек
Скорость
Кровь
Миокард
А
м
п
л
и
т
у
д
а
Б
А
Рис. 8 .1 Скорость движения миокарда и скорость кровотока. Принцип разграничения скорости движения миокарда и скорости кровотока. (А) График ил-
люстрирует разницу в скорости и амплитуде эхо-сигналов от миокарда и крови. Миокард движется гораздо медленнее, чем кровь, поэтому допплеровские часто-
ты ниже, однако амплитуда эхо-сигналов от миокарда намного выше, чем от крови. (Б) Допплерография выходного тракта левого желудочка отображает как ско-
рость движения миокарда, так и скорость кровотока. Красная стрелка указывает на высокоинтенсивные низкоскоростные эхо-сигналы от миокарда, белая стрел-
ка — на низкоинтенсивные высокоскоростные эхо-сигналы от крови.
Рис. 8 .2 Скорость движения миокарда в норме. Скорость движения межжелудочковой перегородки при тканевой допплерографии. a′ — скорость смеще-
ния фиброзного кольца митрального клапана в позднюю диастолу; e′ — скорость смещения фиброзного кольца митрального клапана в раннюю диастолу; IVC —
изоволюмическое сокращение; IVR — изоволюмическое расслабление; s′ — скорость смещения фиброзного кольца митрального клапана во время систолы.
кровотока возможно за счет разности амплитуд
эхо-сигналов и допплеровских частот (рис. 8.1).
Как и при цветовом допплеровском картирова-
нии, при тканевой допплерографии применяют ре-
жим автокоррекции для расчета и отображения в
2D-режиме распределения скоростей движения ми-
окарда с цветовым кодированием вдоль нескольких
ультразвуковых линий сканирования. Как показано
на рис. 8 .2, скорость движения миокарда регистри-
руется в режиме реального времени в виде цветных
кривых, соответствующих меткам на двухмерном
изображении в шкале оттенков серого. Частота ка-
дров при цветовой допплерографии в 2D-режиме
обычно составляет от 80 до 200 кадр/сек (в зависи-
мости от ширины сектора), что выше, чем при изо-
бражениях в шкале оттенков серого. Скорость дви-
жения миокарда автоматически преобразовывается
в числовые значения, которые можно сохранить для
последующего анализа [3]. Скорость движения ми-
окарда в направлении датчика обозначается крас-
ным цветом, а от датчика — синим цветом. На рис.
8.3 показаны результаты тканевой допплерографии
здорового человека и пациента с острым инфар-
ктом миокарда.
ch08.indd 158
03.04.2019 11:40:51
159
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
Высокая частота кадров при тканевой допплеро-
графии позволяет определять ускорение движения
миокарда, а исследование смещения фиброзных ко-
лец митрального и трикуспидального клапанов по-
казывает, что ускорение изоволюмического сокра-
щения может служить показателем глобальной со-
кратимости миокарда [4], но не отражает локальную
дисфункцию миокарда, которая наблюдается при
ишемии миокарда [5]. В настоящее время ускоре-
ние изоволюмического сокращения рассматривают
в качестве инструмента для научных исследований
и не используют в клинике в качестве показателя со-
кратимости миокарда.
Оценить функцию ЛЖ можно с помощью тка-
невой допплерографии в парастернальной позиции
по короткой оси, но в этой позиции визуализирует-
ся очень ограниченное количество сегментов (рис.
8.4), поэтому для оценки функции ЛЖ при ткане-
вой допплерографии предпочтительнее использо-
вать апикальную позицию.
СКОРОСТЬ ПРИ ИМПУЛЬСНО-ВОЛНОВОЙ ДОППЛЕРОГРАФИИ
Другой подход оценке функции ЛЖ — использова-
ние тканевой допплерографии с импульсно-волно-
вой допплерографией. Этот подход в основном
применяют для измерения скорости смещения фи-
брозных колец митрального и трикуспидального
клапанов (рис. 8 .5). Спектр скоростей показывает
распределение скоростей в контрольном объеме и
позволяет легко определять скорость движения ми-
окарда даже при наличии помех. Важно знать о
спектральном расширении (т.е. расширении записи
скорости), которое может спровоцировать серьез-
ную переоценку в зависимости от настроек коэф-
фициента усиления (см. рис. 8 .5Б). При цветовой
тканевой допплерографии используют средние ско-
рости (см. рис. 8 .5A). Спектральное расширение не
влияет на среднюю скорость, но может спровоциро-
вать ее недооценку из-за локальных помех. Это оз-
начает, что скорости, измеренные с помощью двух-
мерной цветовой допплерографии, ниже скоростей,
полученных при импульсно-волновой допплеро-
графии (есть сообщения о разнице до 25%) [6]. Что-
бы свести переоценку при спектральной тканевой
допплерографии к минимуму, рекомендуется на-
строить коэффициент усиления как можно ниже. В
примере, приведенном на рис. 8 .5Б, настройка ко-
эффициента усиления при втором сердечном со-
кращении близка к оптимальной.
Максимальная скорость смещения фиброзного
кольца митрального клапана в раннюю диастолу
(e′), полученная при импульсно-волновой доппле-
рографии, применима в рутинной клинической
практике в качестве показателя расслабления мио-
карда и восстанавливающей силы [7, 8]. Важно от-
метить, что у взрослых скорость e′ с возрастом
уменьшается, поэтому, применяя этот показатель
диастолической функции ЛЖ в клинической прак-
тике, следует ориентироваться на соответствующие
возрасту значения нормы.
ВИЗУАЛИЗАЦИЯ СМЕЩЕНИЯ
Интеграция по времени скоростей, полученных из
конкретной области, позволяет получить кривые
смещения (см. рис. 8 .3). В позиции по длинной оси
скорость движения миокарда и смещение постепен-
но возрастают от верхушки к основанию ЛЖ и мо-
гут быть в режиме реального времени отображены
в виде цветных полос, а в автономном режиме —
измерены по кривым смещения. Систолическое
смещение фиброзного кольца митрального клапана
зависит от ударного объема, но зависимость незна-
С
к
о
р
о
с
т
ь
д
в
и
ж
е
н
и
я
С
м
е
щ
е
н
и
е
С
к
о
р
о
с
т
ь
д
е
ф
о
р
м
а
ц
и
и
Д
е
ф
о
р
м
а
ц
и
я
Рис. 8.3 Тканевая допплерография здорового человека и пациента с
острым инфарктом нижней стенки левого желудочка. Обратите внима-
ние на разные шкалы. При тканевой допплерографии информацию получают
на трех уровнях боковой стенки левого желудочка в апикальной четырехкамер-
ной позиции (слева, здоровый человек) и на трех уровнях нижней стенки ле-
вого желудочка в апикальной двухкамерной позиции (справа, пациент с острым
инфарктом миокарда). При ишемически измененном миокарде обычно наблю-
дается характерное снижение систолической скорости движения миокарда и
смещения фиброзного кольца (правые верхние изображения), а также сниже-
ние систолической скорости деформации и уменьшение деформации (правые
нижние изображения).
ch08.indd 159
03.04.2019 11:40:52
160
ЧАСТЬ II Левый желудочек
А
Б
В
Рис. 8 .4 Визуализация деформации в позиции по короткой оси. (А) Скорость деформации миокарда заднего сегмента ЛЖ в парастернальной позиции по
короткой оси. (Б) Циркулярная деформация у здорового человека. (В) Радиальная деформация у того же здорового человека. a′ — скорость смещения фиброз-
ного кольца митрального клапана в позднюю диастолу; e′ — скорость смещения фиброзного кольца митрального клапана в раннюю диастолу; s′ — скорость
смещения фиброзного кольца митрального клапана во время систолы.
С
к
о
р
о
с
т
ь
(
м
/
с
е
к
)
0,1
0
Время (сек)
–0,1
А
Б
Рис. 8 .5 Тканевая допплерография с импульсно-волновой допплерографией. (А) Допплерография септальной части фиброзного кольца митрального
клапана. Наложение кривой — средняя скорость при цветовой тканевой допплерографии. (Б) Влияние регулировки коэффициента усиления при спектральной
тканевой допплерографии. Показаны три разные настройки коэффициента усиления (увеличение слева направо) и различные максимальные скорости [Manouras
A, Shahgaldi K, Winter R, et al. Comparison between colour-coded and spectral tissue Doppler measurements of systolic and diastolic myocardial velocities: effect of tem-
poral filtering and offline gain setting. Eur J Echocardiogr 10:406–413, 2009].
чительная из-за непостоянности сокращения по ко-
роткой оси.
ВИЗУАЛИЗАЦИЯ ДЕФОРМАЦИИ
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Деформация — это изменение формы. Деформация
миокарда представляет собой показатель для коли-
чественной оценки функции миокарда. Деформа-
цию миокарда также можно использовать для оцен-
ки диастолической функции, но это пока не реко-
мендуется для рутинной практики [7].
Количественную оценку функции миокарда на
основании его деформации и скорости деформации
проводили с давних пор. Первым клиническим ме-
тодом, с помощью которого начали измерять де-
формацию миокарда, стала магнитно-резонансная
томография с мечением тканей радиоактивными
изотопами, но сложность и стоимость этого иссле-
дования ограничили его применение. В настоящее
время для исследования скорости деформации ми-
окарда у постели больного используют тканевую
допплерографию и спекл-трекинг ЭхоКГ [9–12].
В ЭхоКГ термином «деформация» обозначают
локальное сокращение, утолщение и растяжение
миокарда. Этот термин заимствован из области ме-
ханики сплошных сред. Его используют при описа-
нии общей трехмерной деформации элементарного
объема в течение короткого промежутка времени.
Тензор деформации имеет 6 показателей: три отра-
жают укорочение по трем ортогональным осям (X,
Y, Z), другие три (показатели удельной деформа-
ции) отражают наклон в плоскостях X–Y, X–Z и
Y–Z. Разделив миокард на несколько элементарных
объемов, для каждого из них одним тензором де-
формации можно детально описать деформацию в
каждый момент сердечного цикла.
Однако такое описание слишком детализовано
для практического использования. Для ЭхоКГ до-
статочно информации о средней деформации сег-
мента миокарда. Удобнее использовать систему ко-
ординат по трем осям сердца — продольной, цир-
ch08.indd 160
03.04.2019 11:40:52
161
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
ΔL
L
L0
L(t )–L0
ε(t)
L0
=
кулярной и радиальной, а также измерять укорочение
и растяжение в трех направлениях в течение сердеч-
ного цикла с учетом размера на момент комплекса
QRS.
Деформацию ε(t) в одном направлении опреде-
ляют как отношение между изменением длины сег-
мента L в одном направлении в любое время t сер-
дечного цикла, т.е . L(t), и начальной длиной этого
сегмента (L0):
(8.1)
Эту деформацию называют деформацией Лагран-
жа. Для вычисления деформации надо измерить
расстояние между двумя точками в миокарде после
движения при сокращении и при расслаблении. На
рис. 8 .6 схематично показан расчет деформации Ла-
гранжа. Деформации в виде удлинения и утолще-
ния принято присваивать положительные значения
в процентах, а деформации в виде укорочения и ис-
тончения — отрицательные значения в процентах.
Это означает, что систолическое укорочение и ис-
тончение приводит к отрицательной деформации, а
систолическое утолщение и удлинение приводит к
положительной деформации.
При оценке систолической функции ЛЖ дефор-
мацию можно определить как максимальную систо-
лическую деформацию (положительную или отри-
цательную), как максимальную конечно-систоличе-
скую деформацию (во время закрытия аортального
клапана) или как максимальную деформацию, не
зависимую от времени (во время систолы или ран-
ней диастолы). При оценке глобальной деформа-
ции на основании данных нескольких сегментов
лучше использовать показатель конечно-систоли-
ческой деформации, поскольку именно он опреде-
ляет ударный объем.
Наклон кривой деформации, т.е . скорость дефор-
мации миокарда, также предоставляет важную ин-
0
0
L(t) L
ε(t) =
L
формацию. Особый интерес представляет макси-
мальный наклон кривой во время систолы, а также
в раннюю и позднюю диастолу.
Скорость деформации (strain rate, SR) сегмента
L(t) можно рассчитать следующим образом:
(8.2)
где v2(t) – v1(t) — разность скоростей между конеч-
ными точками сегмента L(t), L0 — начальная длина
сегмента L.
Определение скорости деформации похоже на
определение градиента скорости движения миокар-
да (скорость деформации Эйлера):
(8.3)
Единственное различие заключается в знамена-
теле. В уравнении 8.2 разность скоростей сравнива-
ют с начальной длиной сегмента, тогда как для рас-
чета градиента скорости движения миокарда ис-
пользуют длину сегмента в тот же момент времени,
когда измеряют скорости конечных точек сегмента.
Градиент скорости движения миокарда был впер-
вые получен с помощью тканевой допплерографии
в М-режиме путем измерения скорости утолщения
стенки [13]. Позднее определение градиента скоро-
сти движения миокарда было объединено с ткане-
вой допплерографией в 2D-режиме для визуализа-
ции скорости продольной деформации миокарда из
апикального доступа [11].
Деформацию также можно рассчитать, интегри-
руя SR по времени в конце диастолы (t = 0) до лю-
бого момента (t) в сердечном цикле:
(8.4)
где
Деформацию εN обычно называют натуральной
(natural) деформацией, т.к. она определяется нату-
ральной логарифмической функцией ln. В ЭхоКГ
предпочтительнее использовать скорость деформа-
ции Эйлера, чем скорость деформации Лагранжа,
поскольку проще вычислить прямую простран-
ственную производную от скорости деформации
миокарда (без необходимости отслеживания конеч-
ных точек сегмента во время сердечного цикла). Для
определения деформации предпочтительнее при-
менять метод расчета деформации Лагранжа, по-
скольку она может быть непосредственно интер-
претирована как укорочение или удлинение, в отли-
чие от натуральной деформации, для которой
необходим расчет по уравнению 8.4 .
ДЕФОРМАЦИЯ И СКОРОСТЬ ДЕФОРМАЦИИ
ПРИ ТКАНЕВОЙ ДОППЛЕРОГРАФИИ
При тканевой допплерографии скорости вдоль уль-
тразвукового луча измеряют одновременно в не-
21
L(t)
0
v (t) v(t)
SR=
L
21
v (t) v(t)
SR(t) =
L(t)
t
N
ε (t) = SR(τ)dτ = ln(1 + ε(t))
N
ε(t) = exp(ε (t)) 1
Рис. 8.6 Расчет деформации миокарда. Деформация Лагранжа равна
ΔL/L0, где L — текущая длина, ΔL — изменение длины, равное L(t) – L0, L0 —
исходная длина. L(t) — длина сегмента в данный момент времени.
ch08.indd 161
03.04.2019 11:40:53
162
ЧАСТЬ II Левый желудочек
скольких пространственных точках. Выбрав два зна-
чения скорости (v1 и v2) вдоль ультразвукового лу-
ча с расстоянием L для каждого кадра тканевой
допплерографии можно по уравнению 8.3 рассчи-
тать скорость деформации Эйлера SR(t) (или гради-
ент скорости движения миокарда). Улучшить точ-
ность расчета можно, используя нескольких смеж-
ных пространственных точек, за которыми следует
линейная регрессия.
На основании этой концепции Heimdal и соавт.
[11] предложили визуализацию скорости деформа-
ции в режиме реального времени с использованием
допплеровских скоростей движения миокарда. Ин-
теграция градиента скорости движения миокарда
по времени позволяет оценить натуральную дефор-
мацию (εN) по уравнению 8.4 . Путем математиче-
ского преобразования из натуральной деформации
можно получить деформацию Лагранжа (ε).
Для точного определения деформации необхо-
димо следить за движением материальных точек
(неподвижных частиц) в пределах миокарда на про-
тяжении определенного времени и регистрировать
это движение. При тканевой допплерографии это
невозможно, вследствие чего возможна небольшая
погрешность, особенно в базальных сегментах, где
движение миокарда относительно ультразвукового
луча наиболее выражено.
Использование градиента скорости движения
миокарда как показателя функции миокарда обосно-
вано тем, что разность между скоростями движения
миокарда в двух соседних сегментах указывает ли-
бо на сжатие, либо на растяжение ткани, а градиент
скорости движения миокарда равен скорости дефор-
мации.
После исследования систолической функции ЛЖ
по его длинной оси на основании скорости дефор-
мации определяют локальную скорость укороче-
ния, а на основании деформации оценивают ло-
кальную фракцию укорочения.
Скорость деформации по короткой оси ЛЖ опре-
деляет систолическую скорость утолщения. Во вре-
мя диастолы по скорости деформации определяют
скорость растяжения и истончения миокарда. Де-
формация безразмерна, а скорость деформации из-
меряют в единицах в секунду.
В принципе, SR не зависит от общего движения
сердца и движения, вызванного сокращением смеж-
ных сегментов. В этом заключается отличие SR от
скорости деформации сегмента миокарда, которая
является результатом движения, вызванного сокра-
щением этого сегмента, движения, обусловленного
подтягиванием других сегментов и перемещением
сердца [12, 14]. Эффект подтягивания объясняет,
почему продольные скорости движения миокарда
ЛЖ, измеренные в апикальной позиции, постепен-
но увеличиваются от верхушки к основанию, тогда
как деформация миокарда и скорость деформации
миокарда более постоянны.
ФИЗИЧЕСКИЕ ОСНОВЫ СПЕКЛ-ТРЕКИНГ
ЭХОКАРДИОГРАФИИ
С помощью спекл-трекинг ЭхоКГ измеряют локаль-
ное смещение миокарда. Спекл-трекинг ЭхоКГ так-
же можно использовать для количественной оценки
функции миокарда на основании скорости дефор-
мации и деформации миокарда, а также для оценки
вращения и скручивания ЛЖ. Спеклы создаются в
результате интерференции ультразвуковых лучей в
миокарде, и на изображениях в шкале оттенков се-
рого в 2D-режиме появляется характерная пятни-
стая структура (спеклы) (рис. 8 .7). Спеклы возника-
ют в результате усиления и ослабления интерфе-
ренции ультразвуковых лучей, отражающиеся от
структур, которые меньше длины ультразвуковой
волны. Случайные помехи отфильтровываются
компьютерной программой, и получаются неболь-
шие сегменты миокарда с временно стабильными и
специфическими спеклами [15]. Эти сегменты (или
«ядра») служат акустическими маркерами, которые
можно отследить в плоскости изображения от кадра
к кадру с помощью алгоритма сопоставления бло-
ков. На рис. 8 .8 приведены записи здорового серд-
ца. Также можно рассчитать векторы скорости дви-
жения миокарда, которые при отображении накла-
дываются на динамические изображения в шкале
оттенков серого (см. рис. 8 .8) [16].
Рис. 8 .7 Спекл-трекинг эхокардиография. Спекл-трекинг ЭхоКГ в четы-
рехкамерной позиции позволяет измерить деформацию путем отслеживания
спеклов на изображениях в шкале оттенков серого. Часть перегородки (крас-
ная рамка) увеличена. A На видеоизображении в режиме реального времени
сердца здорового человека отчетливо видны различные спеклы. Во второй ча-
сти демонстрируется применение программного обеспечения для наложения
спекла ограниченной части основания перегородки. Программа четко отслежи-
вает спеклы на протяжении всего сердечного цикла. В последней части пока-
зано, как программа отслеживает продольную деформацию в четырехкамер-
ной позиции (предоставлено Dr. Thomas Helle-Valle).
ch08.indd 162
03.04.2019 11:40:53
163
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
ДЕФОРМАЦИЯ И СКОРОСТЬ ДЕФОРМАЦИИ
ПРИ СПЕКЛ-ТРЕКИНГ ЭХОКАРДИОГРАФИИ
В отличие от тканевой допплерографии, при кото-
рый деформация измеряется на основе скоростей
движения миокарда от неподвижной точки в про-
странстве относительно датчика, при спекл-трекинг
ЭхоКГ одномоментно измеряется расстояние между
двумя спеклами, т.е. спекл-трекинг ЭхоКГ позволя-
ет измерить деформацию на одном и том же изо-
бражении, но в разных направлениях. Возможность
измерять деформацию с помощью спекл-трекинг
ЭхоКГ была установлена в ходе исследований, в ко-
торых в качестве эталонных методов использовали
ультразвуковую микрометрию и магнитно-резо-
нансную томографию [9]. Скорость деформации
при спекл-трекинг ЭхоКГ рассчитывают как вре-
менну
́
ю производную кривой деформации с после-
дующим преобразованием по уравнению 8.4 для
получения скорости деформации Эйлера.
При использовании спекл-трекинг ЭхоКГ важно
оптимизировать качество изображения в шкале от-
тенков серого с сохранением фокуса на промежу-
точной глубине и провести корректировку глубины
и ширины сектора, включая небольшую изучаемую
область. Оценка деформации с помощью двухмер-
ной спекл-трекинг ЭхоКГ — полуавтоматический
метод, при котором нужно быстро выбрать вруч-
ную несколько точек вдоль границы эндокарда. За-
тем выбранную область следует скорректировать
таким образом, чтобы в анализ была включена
бо
́
льшая часть толщины стенки без перикарда. Ес-
ли автоматическое слежение не соответствует визу-
альной оценке сократимости миокарда, необходимо
вручную отрегулировать изучаемую область. Конец
систолы определяют в апикальной позиции по
длинной оси по закрытию аортального клапана, эту
позицию всегда следует анализировать в первую
очередь.
С помощью спекл-трекинг ЭхоКГ в 2D-режиме
возможно оценить деформацию многих сегментов
ЛЖ у большинства пациентов. Показатель дефор-
мации рассчитывают для каждого сегмента (сегмен-
тарная деформация) и для каждой области кровос-
набжения (территориальная деформация). Также
определяют глобальную деформацию (среднее значе-
ние сегментарных деформаций) [10]. Лучше всего
удается оценить продольную и циркулярную де-
формации, радиальную деформацию оценить слож-
нее [17]. Одной из причин более низкой возможно-
сти оценки радиальной деформации является то,
что в этом направлении меньше спеклов.
На рис. 8.3 показана сегментарная и глобальная
деформация миокарда здорового сердца и сердца
при инфаркте миокарда. Нормальные значения гло-
бальной продольной деформации миокарда у здо-
рового сердца составляют 18–25% [10, 18], но диа-
пазон этих значений зависит от производителя обо-
рудования и программного обеспечения. Например,
в ходе недавнего исследования было продемонстри-
ровано, что значения глобальной продольной де-
формации у различных производителей относи-
тельно схожи (рис. 8 .9) [19], но значения сегментар-
ной деформации ЛЖ у здорового человека имеют
бо
́
льшую вариабельность.
С помощью спекл-трекинг ЭхоКГ также можно
измерить деформацию миокарда правого желудоч-
ка (ПЖ), но из-за его тонкой стенки качество сигна-
ла часто субоптимально.
Однако при спекл-трекинг ЭхоКГ в 2D-режиме
невозможно отслеживать движение, выходящее за
пределы плоскости сканирования. Отслеживать
движение спеклов в сканируемом объеме независи-
мо от направления позволяет спекл-трекинг ЭхоКГ
в 3D-режиме (рис. 8 .10). Одно из ограничений ме-
тода — зависимость от качества изображения, что
влияет на возможность определить границу эндо-
А
Б
В
Г
Рис. 8.8 Визуализация деформации с помощью двух различных компьютерных программ. (А, Б) Мгновенные векторы скорости миокарда можно рас-
считать в апикальной позиции по короткой оси и отобразить на динамических изображениях. На (А) показаны радиальные векторы скорости движения миокарда
здорового человека (синхронные), на (Б) — пациента с блокадой левой ножки пучка Гиса (асинхронные). (В, Г) Спекл-трекинг ЭхоКГ по длинной оси показывает
деформацию миокарда. На (В) — характерная деформация ЛЖ в норме. На (Г) — цвет кривой деформации соответствует сегментам ЛЖ, выделенным цветом
на (В) [А, Б — Vannan MA, Pedrizzetti G, Li P, et al. Effect of cardiac resynchronization therapy on longitudinal and circumferential left ventricular mechanics by velocity
vector imaging: description and initial clinical application of a novel method using high-frame rate B-mode echocardiographic images. Echocardiography 22:826–830 , 2005].
ch08.indd 163
03.04.2019 11:40:53
164
ЧАСТЬ II Левый желудочек
Esaote
Hitachi-A.
–18 ,0
(3,4)
–2 0,2
(3,6)
–21 ,0
(3,9)
–18 ,8
(3,6)
–1 8,2
(3,6)
–20 ,0
(3,6)
–1 8,5
(3,2)
–1 8,5
(3,1)
–2 1,5
(4,0)
–1 9,4
(3,3)
Esaote
GE
GE
Philips
Philips
Samsung
Г
П
Д
(
%
)
Samsung
Siemens
Siemens
Toshiba
Toshiba
Epsilon
Epsilon
Tomtec
Tomtec Среднее
значение
–30
–25
–20
–15
–10
–5
0
Рис. 8 .9 Вариабельность показателя глобальной продольной деформации у различных производителей оборудования. Приведены средние зна-
чения (± SD) глобальной продольной деформации (ГПД) каждого производителя. Исследование проводили с участием лиц с нормальной и незначительно нару-
шенной функцией ЛЖ. Как видно из графика, у большинства производителей наблюдалась разница (p < 0,00), фиолетовая точка — достоверное различие
(р < 0,05) [Farsalinos KE, Daraban AM, Unlu S, et al. Head-to-head comparison of global longitudinal strain measurements among nine different vendors: the EACVI/ASE
intervendor comparison study. J Am Soc Echocardiogr 28:1171–1181, 2015].
карда. Кроме того, к ограничениям спекл-трекинг
ЭхоКГ в 3D-режиме относятся случайные помехи и
относительно низкое временно
́
е и пространствен-
ное разрешения. В настоящее время технологии ви-
зуализации деформации с помощью спекл-трекинг
ЭхоКГ в 3D-режиме быстро развиваются, и ожида-
ется, что она станет более важным методом.
ВРАЩЕНИЕ И СКРУЧИВАНИЕ ЛЕВОГО ЖЕЛУДОЧКА
Скручивание ЛЖ — это вращение во время сердеч-
ного цикла верхушки ЛЖ вокруг его длинной оси
относительно основания ЛЖ, которое может быть
измерено с помощью спекл-трекинг ЭхоКГ [20, 21].
Во время систолы верхушка вращается против ча-
совой стрелки, а основание — по часовой стрелке
(рис. 8 .11). Вращение выражают в градусах (°). Раз-
ность между вращением верхушки и вращением ос-
нования называют углом скручивания. Поворот —
это градиент угла вращения, выраженный в граду-
сах на сантиметр (°/см) (см. рис. 8.11).
ОГРАНИЧЕНИЯ ВИЗУАЛИЗАЦИИ ДЕФОРМАЦИИ
И СКОРОСТИ ДЕФОРМАЦИИ
УГЛОВАЯ ЗАВИСИМОСТЬ
Деформация и скорость деформации миокарда,
определяемые с помощью тканевой допплерогра-
фии, зависят от угла сканирования, поскольку они
регистрируются только в направлении ультразву-
кового луча. Из-за сложного движения миокарда
коррекция угла сканирования невозможна, поэтому
крайне важно, чтобы ультразвуковой луч был на-
правлен параллельно стенке ЛЖ при визуализации
по длинной оси и перпендикулярно стенке ЛЖ —
при визуализации по короткой оси. При визуализа-
ции по длинной оси скорость не следует проводить
измерения вблизи верхушки, поскольку ее закруг-
ление создает затруднения.
Хотя спекл-трекинг ЭхоКГ отслеживает спеклы
независимо от угла сканирования, измерения зави-
сят от него, поскольку радиальная деформация име-
ет противоположное направление относительно
продольной и циркулярной деформаций. Если пло-
скость изображения пересекает стенку желудочка
под углом, расположенным в промежуточном поло-
жении между длинной осью и короткой осью, то ис-
тинная деформация будет недооценена. Для оценки
истинной циркулярной и радиальной деформаций
нужно получить изображение полости ЛЖ в стан-
дартной позиции по короткой оси.
НЕОПТИМАЛЬНОЕ ОТСЛЕЖИВАНИЕ
Если результаты оценки деформации кажутся не-
физиологическими, следует проанализировать ка-
чество сигнала и исключить неоптимальное отсле-
живание. Глобальная деформация может быть недо-
ch08.indd 164
03.04.2019 11:40:54
165
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
оценена при неоптимальном отслеживании, т.е . когда
недостаточно учтены все значения сегментарной де-
формации. Это особенно важно в случае локально-
го поражения миокарда, когда наблюдается нерав-
номерная деформация.
ПОМЕХОПОДАВЛЕНИЕ И ПРОСТРАНСТВЕННАЯ
И ВРЕМЕННАЯ РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Данные тканевой допплерографии и спекл-трекинг
ЭхоКГ часто довольно зашумлены, поэтому для из-
влечения информации нужно временно
́
еипро-
странственное усреднение. При тканевой допплеро-
графии сглаживание выполняют путем усреднения
значений соседних сегментов, а при спекл-трекинг
ЭхоКГ — методом сплайн, который позволяет точ-
но подобрать исходные данные и предотвращает
слишком резкие колебания. Однако сглаживание
методом сплайн может значительно повлиять на со-
седние сегменты и снизить различия сегментарной
деформации.
Измерение скорости деформации значительно
затрудняется случайными помехами. При тканевой
допплерографии помехи влияют на определение
разницы между скоростями, поскольку ошибка
представляет собой сумму ошибок двух скоростей.
Отношение сигнал/помеха при определении дефор-
мации и скорости деформации с помощью ткане-
вой допплерографии можно улучшить, увеличив
пространственное смещение (длину деформации)
точек скорости, что увеличит разность скоростей,
но уменьшит пространственное разрешение. Про-
блему со случайными помехами также можно ре-
шить путем временно
́
го усреднения в течение одно-
го сердечного цикла и усреднения в течение не-
скольких сердечных циклов. Однако эти методы
снижения помех представляют собой компромисс
Рис. 8.10 Определение деформации миокарда здорового человека. Программа вычисляет значения деформации в позициях по короткой и длинной осям.
Значения сегментарной деформации представлены на концентрической диаграмме (в центре). КДО — конечно-диастолический объем; КСО — конечно-систоли-
ческий объем; ФВ — фракция выброса (предоставлено Dr. Thomas Muri Stokke).
ch08.indd 165
03.04.2019 11:40:54
166
ЧАСТЬ II Левый желудочек
между оптимальным отношением сигнал/помеха и
требованиями к высокому пространственному и вре-
менно
́
му разрешениям. Пространственное смеще-
ние для определения продольной деформации и
скорости деформации обычно составляет от 5 до
12 мм. Диапазон деформации для измерения транс-
муральной радиальной деформации ограничен тол-
щиной стенки и поступательным движением. Исхо-
дя из опыта, длина деформации должна быть уста-
новлена примерно на 1/2 толщины стенки во время
систолы [22].
Визуализация скорости деформации имеет отно-
сительно низкое разрешение в поперечном направ-
лении, что ограничивает возможности измерения в
позиции по длинной оси отдельно субэндокарди-
ального и субэпикардиального слоев стенки. Кроме
того, при расположении контрольного объема на
внутреннем или внешнем слое стенки ЛЖ сигнал
может частично включать скорость кровотока или
скорость движения перикарда соответственно.
К счастью, измерение деформации с помощью
тканевой допплерографии имеет меньше проблем,
связанных с помехами, чем измерение скорости де-
формации, поскольку снижаются случайные поме-
хи в сигнале скорости деформации. Однако сигнал
деформации может значительно отклоняться в те-
чение сердечного цикла.
Рекомендуемая частота кадров при спекл-трекинг
ЭхоКГ составляет от 40 до 80 кадр/сек. При слиш-
ком низкой частоте кадров спеклы могут выходить
за пределы области исследования в последователь-
ных кадрах.
Не рекомендуется использовать слишком высо-
кую частоту кадров, поскольку она обычно достига-
ется за счет уменьшения количества ультразвуко-
вых лучей в каждом кадре, что снижает качество
изображения. Однако при тахикардии для предот-
вращения недостаточности выборки может понадо-
биться частота кадров, превышающая 80 кадр/сек.
Относительно низкое временно
́
е разрешение спекл-
трекинг ЭхоКГ служит ограничением, в частности
при оценке максимальных скоростей и скоростей
деформации, поскольку для точного измерения
этих параметров может понадобиться более высо-
кая частота кадров.
ПЕРЕМЕЩЕНИЕ КОНТРОЛЬНОГО ОБЪЕМА
При тканевой допплерографии измеряют скорость
в пределах фиксированной в пространстве области,
но не в пределах определенной части миокарда.
Вследствие движения сердца разница между ними
может быть значительной. Это ограничение ткане-
вой допплерографии частично можно компенсиро-
вать с помощью алгоритмов слежения, которые не-
Вращение основания
16,0
123
4
8,0
0,0
0
200 400 600 800 1000 1200 1400 1600
Вращение верхушки
Скручивание ЛЖ
Д
е
ф
о
р
м
а
ц
и
я
Левый фиброзный
треугольник
Косые волокна
внешнего слоя
Продольные волокна
внутреннего слоя
Сухожильные хорды
митрального клапана
Папиллярная
мышца
Фиброзное завихрение
верхушки
Циркулярные
волокна среднего
слоя стенки
Аорта
Левое атриовентрикулярное
отверстие
Фазы
Время (мсек)
А
Б
Рис. 8 .11 Ориентация волокон и скручивание левого желудочка. (А) Ориентация волокон левого желудочка. Субэндокардиальные волокна ориентирова-
ны продольно, волокна среднего слоя миокарда — циркулярно. Субэпикардиальные волокна ориентированы под углом около 60° относительно направления во-
локон среднего слоя. (Б) Скручивание левого желудочка сердца здорового человека рассчитано с помощью спекл-трекинг ЭхоКГ на основании показателей вра-
щения верхушки и основания. Разница между их вращением позволяет оценить угол скручивания. Во время изоволюмического сокращения (фаза 1) верхушка
вращается по часовой стрелке, а основание — против часовой стрелки. Во время выброса (фаза 2) направление вращения меняется на противоположное: вер-
хушка — против часовой стрелки, основание — по часовой стрелке. Раскручивание левого желудочка происходит преимущественно во время изоволюмическо-
го расслабления (фаза 3) и раннего диастолического наполнения (фаза 4). A A На видеоизображениях показано скручивание ЛЖ здорового человека, если
смотреть со стороны верхушки, и пациента с блокадой левой ножки пучка Гиса — с типичным паттерном колебания [A — http://biomed.brown.edu/Courses/
BI108/2006-108websites/group05ventrestoration/Website/cardiac_geo metry.htm; Б — Sengupta PP, Tajik AJ, Chandrasekaran K, Khandheria BK. Twist mechanics of the
left ventricle: principles and application. JACC Cardiovasc Imaging 1:366–376, 2008].
ch08.indd 166
03.04.2019 11:40:55
167
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
прерывно или пошагово перемещают контрольный
объем во время сердечного цикла.
РЕВЕРБЕРАЦИЯ
Реверберация — это эхо-сигналы, возникающие в
результате многократного отражения ультразвуко-
вых волн внутри тела. При ТТЭхоКГ реверберация
часто обусловлена относительно неподвижными сло-
ями тканей, расположенными близко к поверхно-
сти тела. На изображениях в шкале оттенков серого
появляются ложные эхо-сигналы или снижается
контрастность. Во время цветовой тканевой доп-
плерографии реверберация при оценке средней ско-
рости будет создавать смещение к нулевой скоро-
сти. Величина смещения зависит от интенсивности
реверберации относительно сигнала скорости тка-
ни. Однако сигнал скорости ткани редко затрагива-
ется, поэтому на цветном изображении обнаружить
реверберацию трудно. При визуализации скорости
деформации небольшое локальное изменение ско-
рости ткани приведет к большим изменениям гра-
диента скорости движения миокарда и, следова-
тельно, скорости деформации.
Единственный способ избежать артефактов ре-
верберации — сканировать из наилучшего акусти-
ческого доступа. При анализе скорости деформации
важно распознавать артефакты реверберации и из-
бегать измерений в затронутых ими областях. Ана-
томический M-режим может быть эффективным
способом выявления крупных артефактов ревербе-
рации, опытный специалист может распознать их
как нефизиологические цветовые структуры. При
реверберации высокого уровня во время спекл-
трекинг ЭхоКГ возможна существенная недооценка
деформации. Кроме того, на качество изображения
при спекл-трекинг ЭхоКГ влияет любой артефакт,
похожий на спекл, чего не следует допускать.
ЗАВИСИМОСТЬ ОТ НАГРУЗКИ
Подобно общей ФВ, все локальные показатели фа-
зы выброса зависят от нагрузки [12, 23].
ОГРАНИЧЕНИЯ ВРАЩЕНИЯ И СКРУЧИВАНИЯ
ЛЕВОГО ЖЕЛУДОЧКА
Поскольку вращение постепенно увеличивается по
направлению к верхушке, важно включить в анализ
ее дистальную часть. Для оптимальной визуализа-
ции в поперечной плоскости должна быть только
незначительная часть ПЖ. Существенным ограни-
чением является перемещение основания ЛЖ пер-
пендикулярно плоскости изображения из-за про-
дольного движения. Поскольку при 2D-ЭхоКГ не-
возможно точно измерить расстояние между двумя
плоскостями, это затрудняет измерение вращения.
Предполагается, что некоторые из этих ограниче-
ний удастся устранить с помощью спекл-трекинг
ЭхоКГ в 3D-режиме [24].
ГРАДИЕНТ ТРАНСМУРАЛЬНОЙ ДЕФОРМАЦИИ
В здоровом сердце деформация более выражена в
субэндокардиальном слое, чем в субэпикардиаль-
ном. Это в большей степени относится к радиаль-
ной и циркулярной деформации и представляет со-
бой лишь геометрический эффект, который не сви-
детельствует о наличии разницы в сократимости
внутреннего и внешнего слоев стенки [25].
ВАРИАБЕЛЬНОСТЬ НОРМАЛЬНЫХ ПОКАЗАТЕЛЕЙ
ДЕФОРМАЦИИ У РАЗЛИЧНЫХ ПРОИЗВОДИТЕЛЕЙ
ОБОРУДОВАНИЯ
Из-за разных методов отслеживания спеклов и про-
цессов обработки информации существуют разли-
чия в показателях деформации у разных произво-
дителей (см. рис. 8 .9) [19]. Это важно учитывать при
использовании нормальных показателей деформа-
ции. Кроме того, следует помнить, что после обнов-
ления программного обеспечения возможны изме-
нения показателей деформации.
НОРМАЛЬНАЯ ФИЗИОЛОГИЯ
ЛЕВОГО ЖЕЛУДОЧКА
Ударный объем представляет собой результат со-
кращения продольных и циркулярных волокон мио-
карда и скручивания ЛЖ, вследствие чего его стен-
ки утолщаются и, следовательно, уменьшается объ-
ем полости ЛЖ [18, 26–28]. У здоровых людей
смещение основания ЛЖ во время систолы состав-
ляет приблизительно 12–15 мм [26, 28], тогда как
верхушка ЛЖ перемещается всего на несколько
миллиметров, т.е. сохраняет относительную непод-
вижность. Во время ранней диастолы и наполнения
предсердия происходит растяжение миокарда.
Скручивание обусловлено спиральным строени-
ем волокон миокарда: волокна субэндокардиально-
го слоя расположены в правовращающейся спира-
ли, волокна субэпикардиального слоя — в левовра-
щающейся спирали (см. рис. 8 .11) [21, 29, 30].
Благодаря такому строению сокращение волокон
субэпикардиального и субэндокардиального слоев
приводит к скручиванию в противоположных на-
правлениях (против часовой стрелки и по часовой
стрелке соответственно). Из-за большого рычага и,
следовательно, большего крутящего момента в су-
бэпикардиальном слое здорового сердца верхушка
во время систолы вращается против часовой стрел-
ки. Однако в ранней систоле во время изоволюми-
ческого сокращения вследствие первоначальной ак-
тивации волокон субэндокардиального слоя проис-
ходит кратковременное небольшое вращение по
часовой стрелке, за которым во время выброса сле-
дует вращение против часовой стрелки, достигаю-
щее максимума к концу систолы [31]. Вращение
верхушки вносит наибольший вклад в скручивание
ЛЖ (см. рис. 8.11) [29]. На рис. 8 .11 также показано,
ch08.indd 167
03.04.2019 11:40:55
168
ЧАСТЬ II Левый желудочек
что в здоровом сердце раскручивание завершается
в основном во время изоволюмического расслабле-
ния, тогда как у пациентов с диастолической дис-
функцией существенное раскручивание происхо-
дит после начала наполнения через митральный
клапан.
Скручивание ЛЖ обеспечивает равномерное рас-
пределение напряжения волокон во всей стенке же-
лудочка, что способствует эффективному систоличе-
скому сокращению. Скручивающее движение также
способствует диастолическому наполнению за счет
внезапного высвобождения потенциальной энер-
гии эластической силы, что приводит к быстрому
раскручиванию и засасыванию крови из предсердия
[31–33].
С уменьшением скручивания во время систолы,
а также со снижением скорости и задержкой раскру-
чивания ассоциируется ряд заболеваний (табл. 8 .1).
Однако в случае гипертрофии ЛЖ и нормальной
ФВЛЖ (например, при аортальном стенозе) и у па-
циентов с гипертрофической кардиомиопатией мо-
жет наблюдаться повышение скорости скручивания
во время систолы [34, 35], обусловленное, вероятно,
увеличением длины волокон субэпикардиального
слоя в результате утолщения стенки ЛЖ и, следова-
тельно, увеличения крутящего момента. В гипер-
трофированном желудочке задержка раскручива-
ния во время диастолы — одна из причин диасто-
лической дисфункции [36]. Задержка раскручивания
может быть признаком физиологической гипертро-
фии у профессиональных спортсменов и патологи-
ческой гипертрофии при кардиомиопатии.
Скручивание ЛЖ чувствительно к изменениям
как локальной, так и глобальной функции ЛЖ [34,
37–45], поэтому скручивание ЛЖ используют для
количественной оценки систолической и диастоли-
ческой функции ЛЖ. Оценка скручивания ЛЖ с по-
мощью спекл-трекинг ЭхоКГ — новый метод, но
его еще не применяют в практике рутинно [7].
СИСТОЛИЧЕСКАЯ СКОРОСТЬ
Во время изоволюмического сокращения ЛЖ на-
блюдается кратковременная положительная ско-
рость, вызванная сокращение перед закрытием ми-
трального клапана. Изоволюмическое сокращение
вытесняет кровь митральный клапан и временно
блокируется после его закрытия (см. рис. 8.2) [46].
Иногда в конце изоволюмического сокращения
наблюдается небольшая отрицательная скорость,
которая может отражать небольшую нормальную
асинхронию электромеханической активации.
Максимальная систолическая скорость смещения
фиброзного кольца митрального клапана в раннюю
диастолу (s′) является показателем локальной систо-
лической функции [46–48]. Скорость движения мио-
карда достигает пика во время ранней фазы выбро-
са, а затем постепенно снижается. В некоторых слу-
чаях во время выброса может наблюдаться второй,
но меньший подъем скорости. Продольные скоро-
сти более воспроизводимы, чем радиальные, поэто-
му для оценки функции ЛЖ рекомендуется исполь-
зовать продольные скорости. В табл. 8 .2 приведены
нормальные значения скорости s′, оцениваемые с
помощью тканевой допплерографии.
ДИАСТОЛИЧЕСКАЯ СКОРОСТЬ
Во время изоволюмического расслабления ЛЖ на-
блюдается отрицательная скорость, которая начи-
нается ближе к концу систолы и временно прерыва-
ется закрытием аортального клапана [46], отражая
растяжение миокарда (см. рис. 8 .2). Этот процесс
аналогичен процессу при изоволюмическом сокра-
щении и объясняется небольшим увеличением объ-
ема ЛЖ из-за выпячивания в ЛЖ створок аорталь-
ного клапана при его закрытии.
В конце изоволюмического расслабления обыч-
но отмечается небольшая положительная скорость
в результате небольшое постсистолического сокра-
Заболевания сердца
Скорость скручивания Скорость раскручивания в раннюю диастолу (Er)
Систолическая сердечная недостаточность
↓↓
Диастолическая сердечная недостаточность
Nили↑
Nили↓
Аортальный стеноз
Nили↑↓
Митральная регургитация
↓↓
Трансмуральный инфаркт миокарда
↓↓
Субэндокардиальная ишемия
N
Nили↓
Дилатационная кардиомиопатия
↓↓
Гипертрофическая кардиомиопатия
Nили↑↓
Рестриктивная кардиомиопатия
Nили↑
N
Констриктивный перикардит
↓↓
ТАБЛИЦА 8.1 Скорости скручивания и раскручивания левого желудочка при различных заболеваниях сердца
ch08.indd 168
03.04.2019 11:40:55
169
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
щения [49], что, вероятно, отражает нормальную
внутрижелудочковую асинхронию расслабления
[50]. В случае поражения желудочка, например при
ишемии миокарда, может отмечаться выраженное
постсистолическое сокращение, а постсистоличе-
ская скорость может распространяться на фазу диа-
столического наполнения. Однако постсистоличе-
ская скорость и деформация у здоровых людей име-
ют малую амплитуду и наблюдаются до открытия
митрального клапана [49].
При обследовании пациентов с подозрением на
диастолическую дисфункцию важную роль играет
оценка скорости смещения фиброзного кольца ми-
трального клапана с помощью тканевой допплеро-
графии. Измерения выполняют из апикального до-
ступа. Возможно оценить скорости смещения сеп-
тальной, латеральной, передней и нижней частей
фиброзного кольца митрального клапана. Чаще все-
го используют апикальную четырехкамерную пози-
цию и измеряют скорости смещения септальной и
латеральной частей (либо определяют среднее зна-
чение скоростей смещения септальной и латераль-
ной частей). Известны две основные скорости дви-
жения миокарда — скорость e′ (скорость смещения
фиброзного кольца митрального клапана в раннюю
диастолу) и скорость a′ (скорость смещения фи-
брозного кольца митрального клапана в позднюю
диастолу) (см. рис. 8 .2). Во время медленного ран-
него наполнения волну e′ часто сопровождает про-
тивоположно направленная волна с низкой ампли-
тудой (e′′), которая отражает изменение, связанное
с перераспределением крови внутри полости ЛЖ
[48]. Диастолические скорости от основания к вер-
хушке, подобно систолическим скоростям, посте-
пенно снижаются.
Диапазон нормальных значений диастолической
скорости смещения фиброзного кольца митрально-
го клапана при тканевой допплерографии представ-
лен в табл. 8 .3 . Скорости, измеренные при цветовой
допплерографии в 2D-режиме, ниже, чем измерен-
ные с помощью импульсно-волновой допплерогра-
фии. Это необходимо учитывать при интерпрета-
ции скорости e′ в клиническом контексте. У взрос-
лых скорость e′ с возрастом снижается, поэтому при
использовании этого показателя диастолической
функции ЛЖ в клинической практике следует ори-
ентироваться на значения нормы, соответствующие
возрасту [7].
Величина скорости e′ тесно связана с активным
расслаблением миокарда, о чем свидетельствует ее
Параметр
От20до40лет
От40до60лет
>60лет
p
rP
Среднее
значение ± SD 95% ДИ
Среднее
значение ± SD 95% ДИ
Среднее
значение ± SD 95% ДИ
Скорость s′
септальной части
(см/сек)
8,6 ± 1,3
6,0–12,0 7,9 ± 1,4
5,9–11,0 7,5 ± 1,3
5,0–10,0 < 0,001
–0,30; < 0,001
Скорость s′
латеральной
части (см/сек)
10,7 ± 2,3
6,1–16,0 9,4 ± 2,2
5,0–14,0 8,5 ± 2,5
4,0–15,0 < 0,001
–0,37; < 0,001
Среднее значение
скоростей s′
септальной и
латеральной
частей (см/сек)
9,6 ± 1,6
7,0–13,0 8,7 ± 1,5
6,0–12,0 8,1 ± 1,6
5,5–12,5 < 0,001
–0,39; < 0,001
Скорость s′
нижней части
(см/сек)
9,3 ± 1,5
7,0–12,0 8,8 ± 1,5
6,0–12,0 8,2 ± 1,5
5,0–12,0 < 0,001
–0,26; < 0,001
Скорость s′
передней части
(см/сек)
10,0 ± 2,1
6,6–13,4 8,6 ± 2,0
5,0–13,0 7,6 ± 2,1
4,0–12,0 < 0,001
–0,45; < 0,001
Скорость s′ задней
части (см/сек)
10,2 ± 1,8
7,0–14,0 9,2 ± 1,9
6,0–13,2 8,8 ± 2,7
5,6–18,6 < 0,001
–0,27; < 0,001
Среднее значение
скорости s′
(см/сек)
9,7 ± 1,7
7,2–12,9 8,7 ± 1,4
6,2–11,9 8,1 ± 1,6
5,7–12,7 < 0,001
–0,41; < 0,001
* В исследовании приняли участие 449 человек — 198 мужчин и 251 женщин. Средний возраст 45,8 + 13,7 лет.
р — различия между возрастными группами (двухфакторный дисперсионный анализ); rP — корреляция по возрасту для обоих полов
(корреляционный тест Пирсона); s′ — скорость смещения фиброзного кольца митрального клапана во время систолы; SD — стандарт-
ное отклонение; ДИ — доверительный интервал; .
ТАБЛИЦА 8.2 Нормальные значения систолической скорости смещения фиброзного кольца митрального клапана
у здоровых людей в зависимости от возраста*
ch08.indd 169
03.04.2019 11:40:55
170
ЧАСТЬ II Левый желудочек
корреляция с постоянным по времени изоволюми-
ческим расслаблением ЛЖ [51–54]. Кроме того, ско-
рость e′ определяется восстанавливающей силой,
которая представляет собой высвобождение энер-
гии, сохраняющейся в миокарде при сокращении
желудочка до объема, который меньше его объема
в состоянии покоя (рис. 8.12) [55]. Во время ранней
диастолы восстанавливающая сила возвращает дли-
ну волокон к их длине в покое. Восстанавливающая
сила увеличивается постепенно при уменьшении
конечно-систолического объема и зависит от сокра-
тимости миокарда ЛЖ. Это отражает тесную взаи-
мосвязь между систолическим сокращением и диа-
столическим растяжением и свидетельствует о том,
что скорость e′ определяется как систолической, так
и диастолической функцией. Однако при сердечной
недостаточности, когда увеличивается конечно-си-
столический объем ЛЖ, восстанавливающая сила
значительно ослаблена, и систолическая функция
оказывает меньшее влияние на скорость e′. Ско-
рость e′ также определяется ранней диастолической
нагрузкой растяжения ЛЖ, которая представляет
собой трансмуральное давление в ЛЖ в начале на-
полнения [55].
Параметры
От20до40лет
От40до60лет
≥60лет
р
Среднее
значение ± СО 95% ДИ
Среднее
значение ± SD 95% ДИ
Среднее
значение ± SD 95% ДИ
Импульсно-волновая допплерография
Скорость E (см/сек)
0,82 ± 0,16
053–1,22
0,75 ± 0,17
0,46–1,13 0,70 ± 0,16
0,39–1,03 < 0,001
Скорость A (см/сек)
0,50 ± 0,13
0,30–0,87 0,62 ± 0,15
0,37–0,97 0,74 ± 0,16
0,40–1,04 < 0,001
Время замедления
скорости E (мсек)
178,2 ± 43,1
105,2–269,0 187,6 ± 45,5
114,6–288,1 208,9 ± 62,7
114,0–
385,9
< 0,001
Отношение E/A
1,71 ± 0,52
0,89–3,18 1,24 ± 0,39
0,71–2,27 0,98 ± 0,29
0,53–1,80 < 0,001
Тканевая допплерография
Скорость e′ септальной
части (см/сек)
12,1 ± 2,5
8,0–17,0
9,8 ± 2,6
5,0–16,0
7,6 ± 2,3
3,0–13,0
< 0,001
Скорость a′ септальной
части (см/сек)
8,5 ± 1,7
5,3–12,0
9,8 ± 2,0
6,9–14,0
10,5 ± 1,7
7,0–14,0
< 0,001
Скорость e′
латеральной части
(см/сек)
16,4 ± 3,4
10,0–23,0 12,5 ± 3,0
6,0–18,0
9,6 ± 2,8
4,0–17,0
< 0,001
Скорость a′
латеральной части
(см/сек)
8,2 ± 2,2
5,0–13,0
9,4 ± 2,6
5,0–15,0
10,6 ± 2,9
6,0–17,0
< 0,001
Среднее значение
скорости e′
септальной и
латеральной частей
14,3 ± 2,7
9,1–19,5
11,1 ± 2,5
6,0–16,0
8,6 ± 2,3
3,5–15,0
< 0,001
Отношение E/e′
Отношение E/e′
септальной части
6,9 ± 1,6
4,4–10,6
8,1 ± 2,3
4,3–13,2
9,7 ± 2,8
5,0–16,9
< 0,001
Отношение E/e′
латеральной части
5,1 ± 1,3
3,1–8,5
6,3 ± 2,2
3,7–12,0
7,8 ± 2,2
4,2–12,8
< 0,001
Среднее значение
отношения E/e′
септальной и
латеральной частей
5,8 ± 1,3
3,6–9,1
7,0 ± 2,1
4,2–11,5
8,5 ± 2,2
4,6–13,5
< 0,001
* В исследовании приняли участие 449 человек — 198 мужчин и 251 женщина. Средний возраст 45,8 + 13,7 года.
р — различия между возрастными группами (двухфакторный дисперсионный анализ); SD — стандартное отклонение; ДИ — доверитель-
ный интервал.
[Caballero L, Kou S, Dulgheru R, et al. Echocardiographic reference ranges for normal cardiac Doppler data: results from the NORRE Study. Eur
Heart J Cardiovasc Imaging 16:1031–1041, 2015.]
ТАБЛИЦА 8.3 Нормальные значения скорости смещения фиброзного кольца митрального клапана
во время диастолы у здоровых людей в зависимости от возраста*
ch08.indd 170
03.04.2019 11:40:55
171
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
Таким образом, тремя главными факторами, опре-
деляющими скорость e′, являются скорость рассла-
бления, восстанавливающая сила и раннее диасто-
лическое давление. Кроме этого, на скорость e′ мо-
жет влиять ригидность ЛЖ во время диастолы.
Диастолическая функция также может быть оце-
нена по диастолической скорости деформации с ис-
пользованием тканевой допплерографии или спекл-
трекинг ЭхоКГ, но прежде, чем рекомендовать ме-
тод спекл-трекинг ЭхоКГ к применению в клинике,
нужна его дополнительная валидация. В настоящее
время в ходе стандартной клинической оценки рас-
слабления ЛЖ и его ранней диастолической функ-
ции рекомендуется использовать скорости смеще-
ния фиброзного кольца митрального клапана, по-
лученные с помощью тканевой допплерографии и
импульсно-волновой допплерографии [7, 56].
ИШЕМИЯ МИОКАРДА
Причиной ишемии миокарда может быть уменьше-
ние коронарного кровотока (например, при остром
коронарном синдроме) либо увеличение потребно-
сти миокарда в кислороде (например, во время
стресса у пациентов со стенозом коронарной арте-
рии). В любом случае ишемия приводит к сниже-
нию локальной функции миокарда, которая варьи-
рует от уменьшения систолического укорочения
(гипокинезии) до систолического удлинения (дис-
кинезии) (рис. 8 .13, 8.14). Кроме того, ишемия ми-
окарда приводит к постсистолическому сокраще-
нию, т.е . сегментарному сокращению после оконча-
ния выброса из ЛЖ. Сниженное систолическое
сокращение, систолическое расширение и постси-
столическое сокращение представляют собой три
признака ишемической дисфункции, их можно ко-
личественно определить при визуализации дефор-
мации миокарда и скорости деформации [11, 12, 47,
57–60].
Наиболее выраженными характеристиками лег-
кой и умеренной ишемии миокарда являются сни-
жение максимальной скорости выброса и увеличе-
ние постсистолической скорости (см. рис. 8 .3). В ос-
новном положительная скорость изоволюмического
сокращения уменьшается, а при более выраженной
ишемии скорость изоволюмического сокращения
становится отрицательной [61]. Дискинезия связана
с увеличением постсистолической скорости вслед-
ствие постсистолического сокращения, поэтому на
типичной записи скорости движения дискинетич-
ного миокарда есть большой отрицательный скачок
при изоволюмическом сокращении и высокая по-
ложительная скорость при изоволюмическом рас-
слаблении с практически нулевой скоростью во вре-
мя выброса [23].
Скорость деформации и деформацию миокарда
при постсистолическом укорочении (см. рис. 8 .14)
можно использовать в качестве маркера острой и
стресс-индуцированной ишемии миокарда [3, 60–
62]. Механизм постсистолического укорочения мо-
жет быть обусловлен задержкой активного сокра-
щения, пассивной отдачей дискинетичного миокар-
да или комбинацией задержки активного сокращения
и пассивной отдачи [5, 63]. Когда постсистолическое
укорочение происходит в полностью пассивном
или некротически измененном миокарде, механизм
укорочения соответствует действию растянутой
упругой пружины, которая возращается в исходное
состояние после устранения растягивающей силы.
При умеренной ишемии миокарда постсистоличе-
Актин
Ca2+
Ca2+
М
и
о
з
и
н
Тропонин
ЛЖ
Ао
ЛП
Lmin
L0
А
Б
В
Рис. 8 .12 Факторы, влияющие на скорость e′. (A) Скорость расслабления левого желудочка (ЛЖ) зависит от снижения силы активных волокон миокарда.
(Б) Восстанавливающую силу можно проиллюстрировать следующим образом. Если упругую нерастянутую пружину (длина L0) сжать (длина Lmin), то возникает
сила, которая возвратит пружину к длине L0 после устранения сжимающего фактора. Аналогичным образом после сокращения левого желудочка до объема, ко-
торый меньше его объема в покое, желудочек растягивается при расслаблении миокарда в раннюю диастолу. (В) Нагрузка растяжения левого желудочка — это
давление в левом предсердии (ЛП) при открытии митрального клапана. Это давление выталкивает кровь в левый желудочек, тем самым приводя к его расшире-
нию. Ао — аорта [Smiseth OA, Remme E, Opdahl A, et al. Heart failure with normal left ventricular ejection fraction: basic principles and clinical diagnostics. In Bartunek
J, Vanderheyden M, eds: Translational approach to heart failure, Springer, 2013].
ch08.indd 171
03.04.2019 11:40:55
172
ЧАСТЬ II Левый желудочек
Рис. 8 .13 Концентрическая диаграмма сегментарной деформации при остром инфаркте миокарда. Спекл-трекинг ЭхоКГ у пациента с окклюзией пра-
вой коронарной артерии, у которого развился острый инфаркт миокарда. На рисунке приведены кривые деформации сегментов ЛЖ, кровоснабжаемых правой
коронарной артерией, типичные для острой ишемии с ранним систолическим растяжением, уменьшением систолической деформации и постсистолическим со-
кращением.
Сниженное систолическое
укорочение
Систолическое удлинение
Постсистолическое
укорочение
П
р
о
д
о
л
ь
н
а
я
д
е
ф
о
р
м
а
ц
и
я
(
%
)
ЭКГ
Время (мсек)
0
200
400
600
800
0
5
–5
–10
–15
–20
А
Б
В
Рис. 8 .14 Острый инфаркт миокарда. (А) Продольная деформация, визуализируемая с помощью спекл-трекинг ЭхоКГ в двухкамерной позиции, у пациента с
острым инфарктом миокарда через день после чрескожного коронарного шунтирования окклюзированной левой передней нисходящей артерии (ЛПНА). (Б) Маг-
нитно-резонансная томография сердца с контрастированием продемонстрировала рубец миокарда — белая область в верхушке и передней стенке. (В) Кривые
деформации показывают характерные признаки ишемической дисфункции: удлинение на протяжении всей систолы в сегменте с трансмуральным инфарктом и
различная степень дисфункции в других сегментах. Желтая кривая показывает нормальное сокращение в неизмененном сегменте. AVC — закрытие аортального
клапана; ED — конец диастолы [Smiseth OA, Torp H, Opdahl A, Haugaa KH, Urheim S., et al. Myocardial strain imaging: how useful is it in clinical decision making? Eur
Heart J 37:1196–1207, 2016].
ch08.indd 172
03.04.2019 11:40:55
173
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
ское укорочение обусловлено задержкой активного
сокращения [63]. Поскольку постсистолическое
укорочение может происходить при активном со-
кращении и в некротически измененном миокарде,
оно не является специфическим маркером жизне-
способности тканей. Однако постсистолическое
укорочение, определяемое на современном этапе по
постсистолической скорости либо постсистоличе-
ской деформации, является маркером ишемии. Сле-
дует также помнить, что постсистолическое укоро-
чение может происходить при нормальной скоро-
сти движения миокарда ЛЖ, хотя в этом случае
клиническое значение постсистолического укороче-
ния меньше, чем при ишемии миокарда [50, 64].
В этом разделе были рассмотрены в основном
показатели продольных измерений при тканевой
допплерографии в позиции по длинной оси, наибо-
лее полная визуализация левого желудочка ЛЖ воз-
можна из апикального доступа. При ишемии мож-
но наблюдать схожие показатели радиальных изме-
рений в позиции по короткой оси, но в этой позиции
существуют ограничения относительно передне-
септального и заднего сегментов ЛЖ. Некоторые
авторы использовали показатель радиальных изме-
рений в качестве градиента скорости движения ми-
окарда вместо скорости деформации [13, 47]. Это
допустимый подход, но он не получил широкого
клинического применения.
СИНХРОННОСТЬ СОКРАЩЕНИЙ МИОКАРДА
В норме активация ЛЖ быстро передается посред-
ством проводящей системы сердца, что приводит к
синхронному его сокращению. Однако у пациентов
с тяжелой сердечной недостаточностью часто на-
блюдается внутрижелудочковая или межжелудоч-
ковая задержка проведения, в результате возникает
межжелудочковая или внутрижелудочковая меха-
ническая диссинхрония, которая приводит к неэф-
фективной функции желудочка. Кроме того, у па-
циентов с сердечной недостаточностью может на-
блюдаться увеличение атриовентрикулярного ин-
тервала и, следовательно, атриовентрикулярная
диссинхрония. Из трех типов сердечной диссинхро-
нии внутрижелудочковая диссинхрония ЛЖ пред-
ставляет собой основной фактор, ассоциированный
с сердечной недостаточностью.
МЕХАНИЗМЫ ВНУТРИЖЕЛУДОЧКОВОЙ ДИССИНХРОНИИ
ЛЕВОГО ЖЕЛУДОЧКА
Сложная клиническая задача — отличить диссинхро-
нию, обусловленную задержкой электрической про-
водимости (электрическую диссинхронию) от дис-
синхронии, обусловленной нагрузкой или ишемией
(первичной механической диссинхронии). Тем не
менее отличить эти состояния необходимо, посколь-
ку электростимуляцию обоих желудочков можно
проводить только при лечении электрической дис-
синхронии. В настоящее время определение шири-
ны комплекса QRS на электрокардиограмме (ЭКГ)
является единственным методом диагностики элек-
трической диссинхронии. Блокада левой ножки пуч-
ка Гиса (БЛНПГ) определяется структурой комплек-
са QRS, что позволяет спрогнозировать эффектив-
ность сердечной ресинхронизирующей терапии.
ВЛИЯНИЕ БЛОКАДЫ ЛЕВОЙ НОЖКИ ПУЧКА ГИСА
НА ФУНКЦИЮ ЛЕВОГО ЖЕЛУДОЧКА
Наиболее характерным эхокардиографическим при-
знаком БЛНПГ является аномально быстрое систо-
лическое движение межжелудочковой перегородки
[65]: движение влево в фазу предизгнания, за кото-
рым следует парадоксальное движение вправо. Та-
кое движение при ЭхоКГ в М-режиме называют
septal beaking [66], при тканевой допплерографии —
septal f lash (рис. 8.15) [67]. Другой эхокардиографи-
ческий признак БЛНПГ — колебательное движение
верхушки, которое возникает вследствие дисбалан-
са сил при сокращениях сегментов ЛЖ, активируе-
мых в различное время [68].
В норме во время выброса свободная стенка и пе-
регородка ЛЖ непрерывно сокращаются. Однако у
пациентов с БЛНПГ сокращение рано активирован-
ной перегородки происходит до сокращения поздно
активированной свободной стенки.
В систолическом сокращении перегородки выде-
ляют две фазы — предизгнания и середины изгна-
ния, после чего следуют две фазы систолического рас-
тяжения — раннее и позднее (рис. 8 .16) [69]. Укоро-
чение в фазе предизгнания и повторное удлинение
соответствуют septal beaking или septal flash. Резуль-
татом аномального движения является заметное
уменьшение по сравнению с нормой конечного со-
кращения перегородки, измеренное во время за-
крытия аортального клапана. Внутрижелудочковая
диссинхрония приводит к снижению вклада перего-
родки в ударный объем ЛЖ и значительной потере
работы миокарда [69–71]. Снижение вклада перего-
родки частично компенсируется увеличением со-
кращения поздно активированной свободной стен-
ки, которая при раннем сокращении перегородки
предварительно растягивается [72].
Septal beaking при БЛПНГ обусловлено актив-
ным сокращением перегородки, которое не наблю-
дается в поздно активированной боковой стенке ЛЖ
[73]. Раннее систолическое растяжение перегородки
можно объяснить сильным сокращением перерас-
тянутой и поздно активированной боковой стенки
ЛЖ, что приводит к увеличению градиента транс-
септального давления и, соответственно, смещению
перегородки вправо. Позднее систолическое растя-
жение перегородки, вероятно, отражает то, что рас-
слабление рано активированных септальных сег-
ментов начинается раньше, чем поздно активиро-
ванных сегментов боковой стенки [74].
ch08.indd 173
03.04.2019 11:40:56
174
ЧАСТЬ II Левый желудочек
До СРТ
После СРТ
Septal flash
А
Б
Рис. 8.15 Блокада левой ножки пучка Гиса. (А) ЭхоКГ в M-режиме пациента с блокадой левой ножки пучка Гиса. Видно характерное аномально быстрое пе-
ремещение перегородки влево в фазе предизгнания, за которым следует парадоксальное движение вправо (septal beaking, стрелка) (предоставлено Ola Gjesdal).
(Б) Тканевая допплерография пациента с блокадой левой ножки пучка Гиса до и после сердечной ресинхронизирующей терапии (СРТ). До СРТ отмечается ран-
нее и быстрое утолщение перегородки (синий цвет) и истончение (красный цвет) в фазе предизгнания (septal flash). После СРТ septal flash отсутствует [Parsai C,
Bijnens B, Sutherland GR, et al. Toward understanding response to cardiac resynchronization therapy: left ventricular dyssynchrony is only one of multiple mechanisms. Eur
Heart J 30:940–949, 2009].
ДИССИНХРОНИЯ И РИСК РАЗВИТИЯ
ЖЕЛУДОЧКОВЫХ АРИТМИЙ
Основными причинами диссинхронии ЛЖ, т.е . не-
одновременного максимального сокращения мио-
карда, могут быть нарушение проводимости в во-
локнах Гиса–Пуркинье, электромеханической связи
и чисто механические причины (неравномерность
напряжения стенки вследствие измененной конфи-
гурации, различия локальной сократимости мио-
карда и задержка внутримышечной проводимости
из-за фиброза и рубцевания). Кроме того, с диссин-
хронией ассоциируется неравномерность электри-
ческой проводимости, например у пациентов с син-
дромом удлиненного интервала QT [75, 76].
Предположили, что диссинхрония при синдроме
удлиненного интервала QT обусловлена дисперсией
продолжительности потенциала действия, поэтому
такую диссинхронию назвали механической диспер-
сией. Было обнаружено, что диссинхрония является
предиктором риска развития желудочковых аритмий
у пациентов с синдромом удлиненного интервала
QT [75, 76] и некоторыми заболеваниями, включая
ишемическую болезнь сердца. Кроме того, механи-
ческая дисперсия, по-видимому, служит маркером
–15
–10
–5
0
5
Время (сек)
Время (сек)
ЗМК ОАК
ЗАК ОМК
Боковая
стенка
Систола
Перегородка
–15
–10
–5
0
5
ЗМК ОАК
ЗАК ОМК
Перегородка
Боковая
стенка
Систола
А
Б
Рис. 8 .16 Функция перегородки и боковой стенки ЛЖ при сердечной ресинхронизирующей терапии. Записи систолической деформации перегородки
и боковой стенки у пациента с блокадой левой ножки пучка Гиса (БЛНПГ) до сердечной ресинхронизирующей терапии (СРТ) (А) и после нее (Б). До СРТ наблю-
дается заметное сокращение перегородки в фазе предизгнания и в середине изгнания. За каждым сокращением следует растяжение, что приводит как к ранне-
му, так и позднему систолическому растяжению. До СРТ в боковой стенке наблюдается растяжение в фазе предизгнания. После СРТ нарушения отсутствуют. По-
сле СРТ растяжение перегородки происходит в фазу предизгнания, что указывает на незначительную диссинхронию. ЗАК — закрытие аортального клапана;
ЗМК — закрытие митрального клапана; ОАК — открытие аортального клапана; ОМК — открытие митрального клапана. A На видеоизображении — типичное
аномальное движение перегородки и колебание верхушки у пациента с БЛНПГ [De Boeck BW, Teske AJ, Meine M, et al. Early systolic septal lengthening [rebound
stretch] reflects the functional substrate to cardiac resynchronization therapy and predicts volumetric and neurohormonal response. Eur J Heart Fail 11:863–871, 2009].
ch08.indd 174
03.04.2019 11:40:56
175
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
развития желудочковых аритмий и внезапной смер-
ти независимо от ФВ, а также в некоторых субкли-
нических состояниях при нормальных значениях
ФВ и глобальной продольной деформации [75, 77].
Клиническое значение диссинхронии в качестве
маркера риска еще предстоит определить.
На рис. 8 .17 показано измерение механической
дисперсии как стандартного отклонения по време-
ни от начала зубца Q на ЭКГ до максимального со-
кращения миокарда в 16 сегментах ЛЖ у здорового
человека и у двух пациентов с желудочковыми арит-
миями. В сердце здорового человека наблюдаются
схожее время максимальной деформации всех сег-
ментов, а у больных — заметная вариабельность
времени максимальной деформации сегментов. Для
описания диссинхронии в сердце с ненарушенной
проводимостью волокон Гиса–Пуркинье использу-
ют разные термины: «дискоординация», «несогласо-
ванность», «механическая дисперсия» и другие.
ВИЗУАЛИЗАЦИЯ ДЕФОРМАЦИИ ПРИ СУБКЛИНИЧЕСКОЙ
ДИСФУНКЦИИ ЛЕВОГО ЖЕЛУДОЧКА
Определение глобальной продольной деформации
представляет собой очень перспективный способ
идентификации пациентов с легкой и субклиниче-
ской систолической дисфункцией, которая не со-
провождается снижением ФВ. У пациентов с кла-
панными пороками сердца деформация миокарда,
по-видимому, более чувствительный параметр, чем
ФВ, и позволяет диагностировать дисфункцию до
снижения ФВ [78]. При сердечной недостаточности
с сохранной ФВ может наблюдаться уменьшение
глобальной продольной деформации, что служит
признаком снижения систолической функции [79].
Кроме того, у пациентов, подвергающихся химио-
терапии, снижение деформации миокарда предше-
ствует значительным изменениям ФВЛЖ. Для ран-
него выявления субклинической дисфункции ЛЖ
рекомендуется оценивать глобальную продольную
деформацию с помощью спекл-трекинг ЭхоКГ [80,
81]. Следует отметить, что значение этих изменений
в прогнозировании клинического исхода после хи-
миотерапии еще предстоит определить. Визуализа-
цию деформации также можно использовать для
определения субклинической дисфункции ЛЖ при
отдельных видах кардиомиопатии, например ги-
пертрофической кардиомиопатии. Также было по-
казано, что глобальная продольная деформация яв-
ляется предиктором летального исхода среди паци-
ентов, перенесших инфаркт миокарда, и пациентов
с установленной или подозреваемой левожелудоч-
ковой недостаточностью [82].
ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
ПЖ имеет сложное анатомическое строение. В нем
выделяют два отдела: приточный и отточный, раз-
деленные наджелудочковым гребнем.
Затруднения при оценке функции ПЖ и измере-
нии ФВ обусловлены сложной формой и характе-
ром движения миокарда ПЖ и проблемой при опре-
делении границ эндокарда тонкой свободной стен-
ки ПЖ. Другим важным фактором, усложняющим
оценку функции ПЖ, является вариабельность ус-
ловий нагрузки. В повседневной практике функцию
ПЖ обычно оценивают качественно с помощью
2D-ЭхоКГ.
Систолическое сокращение боковой стенки ПЖ
приводит к его продольному укорочению прибли-
зительно на 27%. При этом основание ПЖ опуска-
ется к верхушке [83, 84], а апикальная часть относи-
тельно неподвижна. В результате сокращение цир-
кулярных волокон миокарда происходит сжатие
А
Б
В
Рис. 8 .17 Механическая дисперсия. (А) Кривые деформации миокарда левого желудочка у здорового человека (визуализация в апикальной четырехкамер-
ной позиции). (Б) Деформация миокарда левого желудочка у пациента после перенесенного инфаркта миокарда. Причиной смерти стала фибрилляции желудоч-
ков. (В) Кривые деформации миокарда левого желудочка у пациента с аритмогенной кардиомиопатией правого желудочка с эпизодами желудочковой тахикар-
дии. Стрелки на А, Б и В указывают на время максимальной отрицательной деформации. A На видеоизображении демонстрируется деформация правого желу-
дочка у здорового человека и более низкие значения деформации перегородки по сравнению с боковой стенкой правого желудочка.
ch08.indd 175
03.04.2019 11:40:56
176
ЧАСТЬ II Левый желудочек
желудочка. Межжелудочковая перегородка способ-
ствует функции ПЖ так же, как и функции ЛЖ, но
вклад ПЖ в здоровом сердце и при патологии мо-
жет быть различным. В качестве показателя функ-
ции ПЖ обычно используют фракцию изменения
площади [85], которую расчитывают в четырехка-
мерной позиции. Систолическое смещение фиброз-
ного кольца трикуспидального клапана (tricuspid an-
nular plane systolic excursion, TAPSE) — широко ис-
пользуемый показатель функции ПЖ, который
измеряют с помощью ЭхоКГ в M-режиме. В норме
TAPSE > 2,0 см [85]. Была продемонстрирована кор-
реляция TAPSE с ФВПЖ, измеренной при радиону-
клидной ангиографии [86–88]. Подобный показа-
тель можно получить, измеряя TAPSE с помощью
тканевой допплерографии.
Метод визуализации Параметр
Позиция
Применение
Интерпретация
Систолическая функция ЛЖ
Тканевая и
импульсно-волновая
допплерография
Максимальная скорость
смещения фиброзного
кольца митрального
клапана во время
систолы (s′)
Апикальная
четырехкамерная
При невозможности
оценить
глобальную
продольную
деформацию
Снижение скорости s′ указывает
на систолическую дисфункцию
Спекл-трекинг ЭхоКГ Глобальная продольная
деформация
Три стандартные
апикальные
При стандартном
исследовании
Снижение глобальной
продольной деформации
указывает на систолическую
дисфункцию
Сегментарная
деформация ЛЖ
Стандартные
В основном для
исследований
Трудно интерпретировать в
связи с отсутствием четко
установленных значений
нормы
Скорость сегментарной
или глобальной
продольной
деформации
Апикальные
Только для
исследований
Снижение максимальной
систолической скорости
деформации указывает на
систолическую дисфункцию
Максимальное
скручивание
во время систолы
По короткой оси
на уровне
основания и
верхушки
Только для
исследований
Метод не
стандартизирован
Уменьшение скручивания
указывает на систолическую
дисфункцию
Диастолическая функция ЛЖ
Тканевая и
импульсно-волновая
допплерография
Скорость смещения
фиброзного кольца
митрального клапана
в раннюю диастолу
(e′)
Апикальная
четырехкамерная
Стандартный метод
оценки
Снижение скорости e′ указывает
на нарушение расслабления;
используют нормативные
значения в зависимости
от возраста
Спекл-трекинг ЭхоКГ Скорость продольной
или радиальной
деформации
Апикальные
Только для
исследований
Снижение ранней
диастолической скорости
деформации указывает на
диастолическую дисфункцию
Максимальная скорость
и продолжительность
раскручивания
По короткой оси
на уровне
верхушки и
основания
Только для
исследований
Метод не
стандартизирован
Уменьшение максимальной
скорости и задержка
раскручивания указывают на
диастолическую дисфункцию
СВОДНАЯ ИНФОРМАЦИЯ
Клиническое применение визуализации деформации миокарда и скорости деформации
Глобальную деформацию ПЖ определяют в апи-
кальной четырехкамерной позиции как среднюю
максимальную систолическую деформацию трех
сегментов боковой стенки ПЖ [89]. Септальные сег-
менты характеризуются меньшей деформацией по
сравнению с деформацией свободной боковой стен-
ки, что может затруднить интерпретацию результа-
тов [84]. Снижение глобальной деформации ПЖ
является прогностическим маркером неблагоприят-
ного исхода при аритмогенной кардиомиопатии ПЖ,
легочной артериальной гипертензии и врожденных
пороках сердца [84, 89–94]. Анализ сегментарной и
глобальной деформации ЛЖ был успешно внедрен
во многих эхокардиографических отделениях, од-
нако внедрение анализа деформации ПЖ происхо-
дит медленнее.
ch08.indd 176
03.04.2019 11:40:57
177
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
Метод визуализации Параметр
Позиция
Применение
Интерпретация
Синхрония
Спекл-трекинг ЭхоКГ Продольная
деформация
Апикальные
При отборе
кандидатов
на СРТ
Отсутствие доказанного
дополнительного значения
при прогнозировании ответа
на СРТ
Радиальная деформация По короткой оси
В качестве
навигации
при размещении
электродов СРТ
Сегмент с поздним сокращением
свидетельствует о поздней
активации миокарда
Механическая дисперсия Апикальные
Только для
исследований
Вариабельность по времени
максимальной деформации
является предиктором
развития желудочковых
аритмий
Ишемия
Спекл-трекинг ЭхоКГ Продольная или
радиальная
деформация
Апикальные или
по короткой оси
Дополнение к
другим методам
при оценке острой
ишемии и
стресс-ЭхоКГ
Предпочтительнее
оценивать
продольную
деформацию
Систолическое удлинение,
уменьшение систолического
укорочения и постсистоли-
ческое укорочение являются
признаками ишемии (по
короткой оси — изменение
утолщения)
Тканевая и
импульсно-волновая
допплерография
Максимальная скорость
s′
Апикальные или
по короткой оси
При невозможности
оценить
деформацию
Снижение скорости s′ в
ишемизированных сегментах
Систолическая функция ПЖ
Тканевая и
импульсно-волновая
допплерография
Максимальная скорость
смещения фиброзного
кольца
трикуспидального
клапана во время
систолы (s′)
Апикальная
четырехкамерная
Дополнение к
другим методам
Снижение скорости s′ указывает
на дисфункцию ПЖ
Спекл-трекинг ЭхоКГ Сегментарная
деформация
свободной стенки ПЖ
Апикальная
четырехкамерная
Только для
исследований
Снижение систолической
деформации указывает
на дисфункцию ПЖ
Функция ЛП
Спекл-трекинг ЭхоКГ Глобальная деформация
ЛП от начала
комплекса QRS
до максимальной
деформации
Апикальные
позиции
Только для
исследований
Снижение максимальной
деформации ЛП является
признаком повышения в нем
давления
ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; СРТ — сердечная ресинхронизирующая терапия; ЭхоКГ —
эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Клиническое применение визуализации деформации миокарда и скорости деформации
ch08.indd 177
03.04.2019 11:40:57
178
ЧАСТЬ II Левый желудочек
ЛИТЕРАТУРА
1. McDicken WN, Sutherland GR, Moran CM,
Gordon LN: Colour Doppler velocity imaging
of the myocardium, Ultrasound Med Biol
18:651–654, 1992.
2. Sutherland GR, Stewart MJ, Groundstroem
KW, et al. Color Doppler myocardial imag-
ing: a new technique for the assessment of
myocardial function, J Am Soc Echocardiogr
7:441–458, 1994.
3. Edvardsen T, Aakhus S, Endresen K, et al.
Acute regional myocardial ischemia identi-
fied by 2-dimensional multiregion tissue
Doppler imaging technique, J Am Soc Echo-
cardiogr 13:986–994, 2000.
4. Vogel M, Schmidt MR, Kristiansen SB, et al.
Validation of myocardial acceleration during
isovolumic contraction as a novel noninvasive
index of right ventricular contractility: com-
parison with ventricular pressure-volume re-
lations in an animal model, Circulation
105:1693–1699, 2002.
5. Lyseggen E, Rabben SI, Skulstad H, et al.
Myocardial acceleration during isovolumic
contraction: relationship to contractility, Cir-
culation 111:1362–1369, 2005.
6. Stoylen A, Heimdal A, Bjornstad K, et al.
Strain rate imaging by ultrasonography in the
diagnosis of coronary artery disease, J Am Soc
Echocardiogr 13:1053–1064, 2000.
7. Nagueh SF, Smiseth OA, Appleton CP, et al.
Recommendations for the evaluation of left
ventricular diastolic function by echocardiog-
raphy: an update from the American Society
of Echocardiography and the European Asso-
ciation of Cardiovascular Imaging, J Am Soc
Echocardiogr 29(4):277–314, 2016.
8. Opdahl A, Remme EW, Helle-Valle T, et al.
Myocardial relaxation, restoring forces, and
early-diastolic load are independent determi-
nants of left ventricular untwisting rate, Cir-
culation 126:1441–1451, 2012.
9. Amundsen BH, Helle-Valle T, Edvardsen T,
et al. Noninvasive myocardial strain measure-
ment by speckle tracking echocardiography:
validation against sonomicrometry and
tagged magnetic resonance imaging, J Am Coll
Cardiol 47:789–793, 2006.
10. Gjesdal O, Hopp E, Vartdal T, et al. Global
longitudinal strain measured by two-dimen-
sional speckle tracking echocardiography is
closely related to myocardial infarct size in
chronic ischaemic heart disease, Clin Sci
(Lond) 113:287–296, 2007.
11. Heimdal A, Stoylen A, Torp H, Skjaerpe T:
Real-time strain rate imaging of the left ven-
tricle by ultrasound, J Am Soc Echocardiogr
11:1013–1019, 1998.
12. Urheim S, Edvardsen T, Torp H, et al. Myo-
cardial strain by Doppler echocardiography.
Validation of a new method to quantify re-
gional myocardial function, Circulation
102:1158–1164, 2000.
13. Derumeaux G, Ovize M, Loufoua J, et al. As-
sessment of nonuniformity of transmural
myocardial velocities by color-coded tissue
Doppler imaging: characterization of normal,
ischemic, and stunned myocardium, Circula-
tion 101:1390–1395, 2000.
14. Uematsu M, Nakatani S, Yamagishi M, et al.
Usefulness of myocardial velocity gradient
derived from two-dimensional tissue Doppler
imaging as an indicator of regional myocar-
dial contraction independent of translational
motion assessed in atrial septal defect, Am J
Cardiol 79(2):237–241, 1997.
15. Leitman M, Lysyansky P, Sidenko S, et al.
Two-dimensional strain-a novel software for
real-time quantitative echocardiographic as-
sessment of myocardial function, J Am Soc
Echocardiogr 17:1021–1029, 2004.
16. Kim DH, Kim HK, Kim MK, et al. Velocity
vector imaging in the measurement of left
ventricular twist mechanics: head-to-head
one way comparison between speckle track-
ing echocardiography and velocity vector im-
aging, J Am Soc Echocardiogr 22:1344–1352,
2009.
17. Gjesdal O, Helle-Valle T, Hopp E, et al. Non-
invasive separation of large, medium, and
small myocardial infarcts in survivors of re-
perfused ST-elevation myocardial infarction:
a comprehensive tissue Doppler and speckle-
tracking echocardiography study, Circ Car-
diovasc Imaging 1:189–196, 2008.
18. Marwick TH, Leano RL, Brown J, et al. Myo-
cardial strain measurement with 2-dimen-
sional speckle-tracking echocardiography:
definition of normal range, JACC Cardiovasc
Imaging 2:80–84, 2009.
19. Farsalinos KE, Daraban AM, Unlu S, et al.
Head-to-head comparison of global longitu-
dinal strain measurements among nine dif-
ferent vendors: the EACVI/ASE inter-vendor
comparison study, J Am Soc Echocardiogr
28:1171–1181, 2015.
20. Helle-Valle T, Crosby J, Edvardsen T, et al. New
noninvasive method for assessment of left ven-
tricular rotation: speckle tracking echocardiog-
raphy, Circulation 112:3149–3156, 2005.
21. Notomi Y, Lysyansky P, Setser RM, et al. Mea-
surement of ventricular torsion by two-di-
mensional ultrasound speckle tracking imag-
ing, J Am Coll Cardiol 45:2034–2041, 2005.
22. Matre K, Fannelop T, Dahle GO, et al. Radial
strain gradient across the normal myocardial
wall in open-chest pigs measured with Dop-
pler strain rate imaging, J Am Soc Echocardiogr
18:1066–1073, 2005.
23. Skulstad H, Urheim S, Edvardsen T, et al.
Grading of myocardial dysfunction by tissue
Doppler echocardiography: a comparison be-
tween velocity, displacement, and strain im-
aging in acute ischemia, J Am Coll Cardiol
47:1672–1682, 2006.
24. Lilli A, Baratto MT, Del Meglio J, et al. Left
ventricular rotation and twist assessed by
four-dimensional speckle tracking echocar-
diography in healthy subjects and pathologi-
cal remodeling: a single center experience,
Echocardiography 30:171–179, 2013.
25. Smiseth OA, Torp H, Opdahl A, et al. Myo-
cardial strain imaging: how useful is it in clin-
ical decision making? Eur Heart J 37(15):1196–
1207, 2016.
26. Alam M, Hoglund C, Thorstrand C: Longitu-
dinal systolic shortening of the left ventricle:
an echocardiographic study in subjects with
and without preserved global function, Clin
Physiol 12:443–452, 1992.
27. Becker M, Hoffmann R, Kuhl HP, et al. Anal-
ysis of myocardial deformation based on ul-
trasonic pixel tracking to determine transmu-
rality in chronic myocardial infarction, Eur
Heart J 27:2560–2566, 2006.
28. Pai RG, Bodenheimer MM, Pai SM, et al. Use-
fulness of systolic excursion of the mitral an-
ulus as an index of left ventricular systolic
function, Am J Cardiol 67:222–224, 1991.
29. Sengupta PP, Tajik AJ, Chandrasekaran K,
Khandheria BK: Twist mechanics of the left
ventricle: principles and application, JACC
Cardiovasc Imaging 1:366–376, 2008.
30. Wu MT, Tseng WY, Su MY, et al. Diffusion
tensor magnetic resonance imaging mapping
the fiber architecture remodeling in human
myocardium after infarction: correlation
with viability and wall motion, Circulation
114:1036–1045, 2006.
31. Gibbons Kroeker CA, Ter Keurs HE, Knudt-
son ML, et al. An optical device to measure
the dynamics of apex rotation of the left ven-
tricle, Am J Physiol 265:H1444–1449, 1993.
32. Rademakers FE, Buchalter MB, Rogers WJ, et
al. Dissociation between left ventricular un-
twisting and filling. Accentuation by cate-
cholamines, Circulation 85:1572–1581, 1992.
33. Wang J, Khoury DS, Yue Y, et al. Left ven-
tricular untwisting rate by speckle tracking
echocardiography, Circulation 116: 2580–
2586, 2007.
34. Stuber M, Scheidegger MB, Fischer SE, et al.
Alterations in the local myocardial motion
pattern in patients suffering from pressure
overload due to aortic stenosis, Circulation
100:361–368, 1999.
35. van Dalen BM, Kauer F, Soliman OI, et al. In-
fluence of the pattern of hypertrophy on left
ventricular twist in hypertrophic cardiomy-
opathy, Heart 95:657–661, 2009.
36. Nagel E, Stuber M, Burkhard B, et al. Cardiac
rotation and relaxation in patients with aortic
valve stenosis, Eur Heart J 21:582–589, 2000.
37. Buchalter MB, Rademakers FE, Weiss JL, et
al. Rotational deformation of the canine left
ventricle measured by magnetic resonance
tagging: effects of catecholamines, ischaemia,
and pacing, Cardiovasc Res 28:629–635, 1994.
38. DeAnda Jr. A, Komeda M, Nikolic SD, et al.
Left ventricular function, twist, and recoil af-
ter mitral valve replacement, Circulation 92(9
Suppl):II458–466, 1995.
39. Fuchs E, Muller MF, Oswald H, et al. Cardiac
rotation and relaxation in patients with
chronic heart failure, Eur J Heart Fail 6:715–
722, 2004.
40. Hansen DE, Daughters 2nd GT, Alderman
EL, et al. Effect of volume loading, pressure
loading, and inotropic stimulation on left
ventricular torsion in humans, Circulation
83:1315–1326, 1991.
41. Kroeker CA, Tyberg JV, Beyar R: Effects of
ischemia on left ventricular apex rotation. An
experimental study in anesthetized dogs, Cir-
culation 92:3539–3548, 1995.
42. Maier SE, Fischer SE, McKinnon GC, et al.
Evaluation of left ventricular segmental wall
motion in hypertrophic cardiomyopathy with
myocardial tagging, Circulation 86:1919–
1928, 1992.
43. Sandstede JJ, Johnson T, Harre K, et al. Cardi-
ac systolic rotation and contraction before and
after valve replacement for aortic stenosis: a
myocardial tagging study using MR imaging,
AJR Am J Roentgenol 178:953–958, 2002.
44. Tibayan FA, Rodriguez F, Langer F, et al. Al-
terations in left ventricular torsion and dia-
stolic recoil after myocardial infarction with
and without chronic ischemic mitral regurgi-
tation, Circulation 110(11 Suppl 1), 2004.
II109–114.
45. Yun KL, Niczyporuk MA, Daughters 2nd GT,
et al. Alterations in left ventricular diastolic
twist mechanics during acute human cardiac
allograft rejection, Circulation 83:962–973,
1991.
46. Remme EW, Lyseggen E, Helle-Valle T, et al.
Mechanisms of preejection and postejection
velocity spikes in left ventricular myocardi-
um: interaction between wall deformation
ch08.indd 178
03.04.2019 11:40:57
179
8 Скорость движения миокарда, деформация, скорость деформации, синхронность сокращений и скручивание
and valve events, Circulation 118:373–380,
2008.
47. Derumeaux G, Ovize M, Loufoua J, et al.
Doppler tissue imaging quantitates regional
wall motion during myocardial ischemia and
reperfusion, Circulation 97(19):1970–1977,
May 19, 1998.
48. Isaaz K, Munoz del Romeral L, Lee E, Schiller
NB: Quantitation of the motion of the cardi-
ac base in normal subjects by Doppler echo-
cardiography, J Am Soc Echocardiogr 6:166–
176, 1993.
49. Voigt JU, Lindenmeier G, Exner B, et al. Inci-
dence and characteristics of segmental post-
systolic longitudinal shortening in normal,
acutely ischemic, and scarred myocardium, J
Am Soc Echocardiogr 16:415–423, 2003.
50. Sengupta PP, Khandheria BK, Korinek J, et al.
Apex-to-base dispersion in regional timing of
left ventricular shortening and lengthening, J
Am Coll Cardiol 47:163–172, 2006.
51. Firstenberg MS, Greenberg NL, Main ML, et
al. Determinants of diastolic myocardial tis-
sue Doppler velocities: influences of relax-
ation and preload, J Appl Physiol 90:299–307,
2001.
52. Nagueh SF, Middleton KJ, Kopelen HA, et al.
Doppler tissue imaging: a noninvasive tech-
nique for evaluation of left ventricular relax-
ation and estimation of filling pressures, J Am
Coll Cardiol 30:1527–1533, 1997.
53. Ommen SR, Nishimura RA, Appleton CP, et
al. Clinical utility of Doppler echocardiogra-
phy and tissue Doppler imaging in the estima-
tion of left ventricular filling pressures: a com-
parative simultaneous Doppler-catheterization
study, Circulation 102:1788–1794, 2000.
54. Sohn DW, Chai IH, Lee DJ, et al. Assessment
of mitral annulus velocity by Doppler tissue
imaging in the evaluation of left ventricular
diastolic function, J Am Coll Cardiol 30:474–
480, 1997.
55. Opdahl A, Remme EW, Helle-Valle T, et al.
Determinants of left ventricular early-dia-
stolic lengthening velocity: independent con-
tributions from left ventricular relaxation, re-
storing forces, and lengthening load, Circula-
tion 119:2578–2586, 2009.
56. Nagueh SF, Bhatt R, Vivo RP, et al. Echocar-
diographic evaluation of hemodynamics in
patients with decompensated systolic heart
failure, Circ Cardiovasc Imaging 4:220–227,
2011.
57. Edvardsen T, Skulstad H, Aakhus S, et al. Re-
gional myocardial systolic function during
acute myocardial ischemia assessed by strain
Doppler echocardiography, J Am Coll Cardiol
37:726–730, 2001.
58. Gorcsan 3rd J, Strum DP, Mandarino WA,
Pinsky MR: Color-coded tissue Doppler as-
sessment of the effects of acute ischemia on
regional left ventricular function: compari-
son with sonomicrometry, J Am Soc Echocar-
diogr 14:335–342, 2001.
59. Madler CF, Payne N, Wilkenshoff U, et al.
Non-invasive diagnosis of coronary artery
disease by quantitative stress echocardiogra-
phy: optimal diagnostic models using off-line
tissue Doppler in the MYDISE study, Eur
Heart J 24:1584–1594, 2003.
60. Voigt JU, Exner B, Schmiedehausen K, et al.
Strain-rate imaging during dobutamine stress
echocardiography provides objective evidence
of inducible ischemia, Circulation 107:2120–
2126, 2003.
61. Edvardsen T, Urheim S, Skulstad H, et al.
Quantification of left ventricular systolic
function by tissue Doppler echocardiogra-
phy: added value of measuring pre- and
postejection velocities in ischemic myocardi-
um, Circulation 105:2071–2077, 2002.
62. Kukulski T, Jamal F, Herbots L, et al. Identifi-
cation of acutely ischemic myocardium using
ultrasonic strain measurements. A clinical
study in patients undergoing coronary angio-
plasty, J Am Coll Cardiol 41:810–819, 2003.
63. Skulstad H, Edvardsen T, Urheim S, et al.
Postsystolic shortening in ischemic myocar-
dium: active contraction or passive recoil?
Circulation 106:718–724, 2002.
64. Pislaru C, Anagnostopoulos PC, Seward JB, et
al. Higher myocardial strain rates during iso-
volumic relaxation phase than during ejection
characterize acutely ischemic myocardium, J
Am Coll Cardiol 40:1487–1494, 2002.
65. McDonald IG: Echocardiographic demon-
stration of abnormal motion of the interven-
tricular septum in left bundle branch block,
Circulation 48:272–280, 1973.
66. Dillon JC, Chang S, Feigenbaum H: Echocar-
diographic manifestations of left bundle
branch block, Circulation 49:876–880, 1974.
67. Parsai C, Bijnens B, Sutherland GR, et al. To-
ward understanding response to cardiac re-
synchronization therapy: left ventricular dys-
synchrony is only one of multiple mecha-
nisms, Eur Heart J 30:940–949, 2009.
68. Szulik M, Tillekaerts M, Vangeel V, et al. As-
sessment of apical rocking: a new, integrative
approach for selection of candidates for car-
diac resynchronization therapy, J Am Soc
Echocardiogr 11:863–869, 2010.
69. Gjesdal O, Remme EW, Opdahl A, et al.
Mechanisms of abnormal systolic motion of
the interventricular septum during left bun-
dle-branch block, Cir Cardiovasc Imaging
4:264–273, 2011.
70. Prinzen FW, Vernooy K, De Boeck BW, Del-
haas T: Mechano-energetics of the asynchro-
nous and resynchronized heart, Heart Fail
Rev 16:215–224, 2011.
71. Russell K, Eriksen M, Aaberge L, et al. Assess-
ment of wasted myocardial work: a novel
method to quantify energy loss due to unco-
ordinated left ventricular contractions, Am J
Physiol Heart Circ Physiol 305:H996–1003,
2013.
72. Prinzen FW, Hunter WC, Wyman BT,
McVeigh ER: Mapping of regional myocardi-
al strain and work during ventricular pacing:
experimental study using magnetic resonance
imaging tagging, J Am Coll Cardiol 33:1735–
1742, 1999.
73. Gjesdal O, Remme EW, Opdahl A, et al.
Mechanisms of abnormal systolic motion of
the interventricular septum during left bun-
dle-branch block, Circ Cardiovasc Imaging
4(3):264–273, 2011.
74. Little WC, Reeves RC, Arciniegas J, et al.
Mechanism of abnormal interventricular sep-
tal motion during delayed left ventricular ac-
tivation, Circulation 65:1486–1491, 1982.
75. Haugaa KH, Amlie JP, Berge KE, et al. Trans-
mural differences in myocardial contraction
in long-QT syndrome: mechanical conse-
quences of ion channel dysfunction, Circula-
tion 122:1355–1363, 2010.
76. Haugaa KH, Edvardsen T, Leren TP, et al.
Left ventricular mechanical dispersion by tis-
sue Doppler imaging: a novel approach for
identifying high-risk individuals with long
QT syndrome, Eur Heart J 30:330–337, 2009.
77. Haugaa KH, Smedsrud MK, Steen T, et al.
Mechanical dispersion assessed by myocardi-
al strain in patients after myocardial infarc-
tion for risk prediction of ventricular ar-
rhythmia, JACC Cardiovasc Imaging 3:247–
256, 2010.
78. Witkowski TG, Thomas JD, Debonnaire PJ,
et al. Global longitudinal strain predicts left
ventricular dysfunction after mitral valve re-
pair, Eur Heart J Cardiovasc Imaging 14:69–
76, 2013.
79. Kraigher-Krainer E, Shah AM, Gupta DK, et
al. Impaired systolic function by strain imag-
ing in heart failure with preserved ejection
fraction, J Am Coll Cardiol 63:447–456, 2014.
80. Plana JC, Galderisi M, Barac A, et al. Expert
consensus for multimodality imaging evalua-
tion of adult patients during and after cancer
therapy: a report from the American Society
of Echocardiography and the European Asso-
ciation of Cardiovascular Imaging, Eur Heart
J Cardiovasc Imaging 15:1063–1093, 2014.
81. Ersboll M, Valeur N, Mogensen UM, et al.
Prediction of all-cause mortality and heart
failure admissions from global left ventricu-
lar longitudinal strain in patients with acute
myocardial infarction and preserved left ven-
tricular ejection fraction, J Am Coll Cardiol
61:2365–2373, 2013.
82. Stanton T, Leano R, Marwick TH: Prediction
of all-cause mortality from global longitudi-
nal speckle strain: comparison with ejection
fraction and wall motion scoring, Circ Car-
diovasc Imaging 2:356–364, 2009.
83. Fine NM, Chen L, Bastiansen PM, et al. Ref-
erence values for right ventricular strain in
patients without cardiopulmonary disease: a
prospective evaluation and meta-analysis,
Echocardiography 32:787–796, 2015.
84. Forsha D, Risum N, Kropf PA, et al. Right
ventricular mechanics using a novel compre-
hensive three-view echocardiographic strain
analysis in a normal population, J Am Soc
Echocardiogr 27:413–422, 2014.
85. Lopez-Candales A, Rajagopalan N, Saxena N,
et al. Right ventricular systolic function is not
the sole determinant of tricuspid annular mo-
tion, Am J Cardiol 98:973–977, 2006.
86. Badano LP, Ginghina C, Easaw J, et al. Right
ventricle in pulmonary arterial hypertension:
haemodynamics, structural changes, imaging,
and proposal of a study protocol aimed to as-
sess remodelling and treatment effects, J Am
Soc Echocardiogr 11:27–37, 2010.
87. Kaul S, Tei C, Hopkins JM, Shah PM: Assess-
ment of right ventricular function using two-
dimensional echocardiography, Am Heart J
107:526–531, 1984.
88. Meluzin J, Spinarova L, Bakala J, et al. Pulsed
Doppler tissue imaging of the velocity of tri-
cuspid annular systolic motion; a new, rapid,
and non-invasive method of evaluating right
ventricular systolic function, Eur Heart J
22:340–348, 2001.
89. Sarvari SI, Haugaa KH, Anfinsen OG, et al.
Right ventricular mechanical dispersion is re-
lated to malignant arrhythmias: a study of pa-
tients with arrhythmogenic right ventricular
cardiomyopathy and subclinical right ventric-
ular dysfunction, Eur Heart J 32:1089–1096,
2011.
90. Chowdhury SM, Hijazi ZM, Fahey JT, et al.
Speckle-tracking echocardiographic measures
of right ventricular function correlate with
improvement in exercise function after per-
cutaneous pulmonary valve implantation, J
Am Soc Echocardiogr 28:1036–1044, 2015.
91. Kannan A, Poongkunran C, Jayaraj M, Ja-
nardhanan R: Role of strain imaging in right
ch08.indd 179
03.04.2019 11:40:57
180
ЧАСТЬ II Левый желудочек
heart disease: a comprehensive review, J Clin
Med Res 6:309–313, 2014.
92. La Gerche A, Claessen G, Dymarkowski S,
et al. Exercise-induced right ventricular
dysfunction is associated with ventricular
arrhythmias in endurance athletes, Eur
Heart J 36:1998–2010, 2015.
93. Vitarelli A, Mangieri E, Terzano C, et al.
Three-dimensional echocardiography and
2D-3D speckle-tracking imaging in chronic
pulmonary hypertension: diagnostic accuracy
in detecting hemodynamic signs of right ven-
tricular (RV) failure, J Am Heart Assoc 4:
e001584, 2015.
94. Zahid W, Bergestuen D, Haugaa KH, et al.
Myocardial function by two-dimensional
speckle tracking echocardiography and ac-
tivin A may predict mortality in patients with
carcinoid intestinal disease, Cardiology 132:
81–90, 2015.
ch08.indd 180
03.04.2019 11:40:57
181
9 Диастолическая функция
левого желудочка
THEODORE P. ABRAHAM, MD • USAN A. MAYER, MD
Основные принципы
Физиология диастолической функции
Влияние старения организма
на диастолическую функцию
Эхокардиографическая оценка
диастолической функции
Митральный кровоток
Легочный венозный кровоток
Цветовая допплерография в М-режиме
Тканевая допплерография
Оценка давления наполнения
левого желудочка
Оценка диастолической функции
в определенных условиях
Синусовая тахикардия
Фибрилляция предсердий
Митральная регургитация
Дополнительные
эхокардиографические признаки
диастолической дисфункции
Увеличение левого предсердия
и нарушение его функции
Легочная гипертензия
Клиническая оценка
диастолической функции
Определение степени диастолической
функции левого желудочка
Определение давления наполнения
левого желудочка
Новые технологии для оценки
диастолической функции
Диастолическая
стресс-эхокардиография
Деформация
Скручивание и вращение
левого желудочка
Влияние старения организма
на развитие диастолической
дисфункции и сердечной
недостаточности
ОСНОВНЫЕ ПРИНЦИПЫ
За последние 20–30 лет кардиологи все чаще при-
знают важность фазы диастолы сердечного цикла.
Клиническое значение нарушения диастолической
функции левого желудочка (ЛЖ) лучше всего ил-
люстрирует выявление и лечение сердечной недо-
статочности (СН) с сохранной фракцией выброса
(ФВ), которая в настоящее время составляет 40–50%
всех случаев СН. Несколько исследований на сегод-
няшний день демонстрируют, что заболеваемость и
смертность среди пациентов с СН с сохранной ФВ
такие же или даже выше, чем у пациентов с СН со
сниженной ФВ. Сообщается, что смертность от СН
с сохранной ФВ составляет от 10 до 30%, причем
приблизительно 70% пациентов умерли в результа-
те внезапной сердечной смерти или прогрессирова-
ния СН [1–4].
Несмотря на то что клинический диагноз в слу-
чае сохранной ФВ ставят при наличии симптомов
СН, диастолическую дисфункцию ЛЖ обычно вы-
являют с помощью различных методов визуализа-
ции, наиболее часто при эхокардиографии (ЭхоКГ).
Традиционные и новые, более совершенные эхо-
кардиографические методы помогают прояснить
вопросы, касающиеся диастолической функции ЛЖ,
и являются предпочтительными методами визуали-
зации при оценке пациентов с СН с сохранной ФВ.
ФИЗИОЛОГИЯ ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
Термин «диастола» (diastole) образован от греческих
слов dia и stellein, которые вместе (diastellein) озна-
чают разделение или распространение. Согласно
традиционной физиологии сердца, сердечный цикл
состоит из фазы систолы (выброс крови) и фазы ди-
астолы (наполнение ЛЖ). Однако последние иссле-
дования показали, что эти две фазы скорее взаимо-
связаны, чем разобщены.
Такое же разное отношение к термину «функ-
ция», т.к. фаза диастолы в основном связана с пас-
сивным наполнением ЛЖ.
Диастолическая функция — это способность ЛЖ
к адекватному наполнению для обеспечения соот-
ветствующего ударного объема без превышения
определенных пределов давления. При отсутствии
митрального стеноза диастолическое давление в
ЛЖ равно диастолическому давлению в левом пред-
сердии (ЛП) и давлению заклинивания легочной
артерии (ДЗЛА), потому что эти структуры соеди-
нены непосредственно. Диастолическая дисфунк-
ция, приводящая к повышению давления в ЛП и в
ch09.indd 181
03.04.2019 11:46:08
182
ЧАСТЬ II Левый желудочек
Изоволюмическое
расслабление
Снижение
изоволюмического
давления
ОАК
ЗАК
ЗМК
Медленное
наполнение
Наполнение в результате
сокращения предсердия
Систола
Диастола
Объем
ЛЖ
ЛП
ЛЖ
Аорта
Ауксотоническое
расслабление
ОМК Быстрое
наполнение
результате к повышению ДЗЛА, влечет за собой за-
стой крови в легких и одышку [5].
Фазы систолы и диастолы традиционно разде-
ляют по определенным движениям анатомических
структур. Физиологически диастола начинается при
закрытии аортального клапана и начале расслабле-
ния ЛЖ (рис. 9 .1) [6]. Диастола включает 4 подфа-
зы: изоволюмическое расслабление, раннее быстрое
наполнение желудочка (пик Е), диастазис (медлен-
ное наполнение) и позднее диастолическое напол-
нение желудочка при сокращении ЛП (пик А) [7].
После закрытия аортального клапана происходит
изоволюмическое расслабление и быстрое падение
давления в ЛЖ без измененений его объема. Во
время изоволюмического расслабления фиброзное
кольцо митрального клапана смещается от верхуш-
ки. Способность ЛЖ к наполнению и расслаблению
зависит от скорости смещения фиброзного кольца
митрального клапана и степени дилатации ЛЖ [8].
Поскольку давление в ЛЖ опускается ниже дав-
ления в ЛП, митральный клапан открывается, что
означает окончание изоволюмического расслабле-
ния и начало ауксотонического расслабления. Аук-
сотоническое расслабление состоит из 3 подфаз:
раннего быстрого наполнения ЛЖ, диастазиса и со-
кращения ЛП. Раннее быстрое наполнение ЛЖ про-
исходит в результате наличия градиента давлений в
ЛП и ЛЖ. Скорость кровотока зависит от различ-
ных параметров, включая эластичность ЛЖ, давле-
ние в его полости и степень его расслабления. Кровь
поступает в ЛЖ, но медленнее с ростом давления в
ЛЖ. Когда в середине диастолы давление в ЛП и
ЛЖ уравнивается, наступает диастазис, при кото-
ром поток через митральный клапан отсутствует
или минимален. Дальнейшее наполнение происхо-
дит только при снижении эластичности ЛЖ или
очень высоком давлении в ЛП. Длительность диа-
стазиса зависит от частоты сердечных сокращений
(ЧСС): наибольшая длительность отмечается при
брадикардии и резко сокращается, вплоть до его от-
сутствия, при высокой частоте ритма. В конце диа-
столы ЛП сокращается, давление в нем повышается
и происходит выброс остаточной крови из ЛП в
ЛЖ, что означает конец диастолы. Когда давление в
ЛЖ становится выше давления в ЛП, митральный
клапан закрывается.
Измерение давления в ЛЖ, ЛП и аорте, а также
оценка объема ЛЖ помогают наиболее точно оха-
рактеризовать диастолическую функцию. ЭхоКГ
позволяет измерять объемы полостей, но давление
в них оценивает только непрямым способом. Тем не
менее ЭхоКГ является лучшим неинвазивным мето-
дом визуализации для оценки диастолической фун-
кции.
В норме у здоровых лиц максимальное наполне-
ние ЛЖ происходит в раннюю диастолу. Раннее бы-
строе наполнение ЛЖ на кривой скорости митраль-
ного кровотока отражает волна Е. Увеличение дли-
тельности волны Е отражает изменение времени,
необходимого для уравновешивания давления в ЛП
и ЛЖ. В последнюю очередь в конце диастолы по-
является волна А, которая отражает сокращение
ЛП, обеспечивающее приблизительно 20% напол-
нения ЛЖ. Амплитуда волны Е значительно выше,
чем амплитуда волны А, соответственно, отноше-
ние Е/А > 1. Во время наполнения ЛЖ ЛП наполня-
ется кровью из легочных вен. В норме легочный ве-
нозный кровоток бывает трех- или четырехфаз-
ным, причем во время систолы поток выше, чем во
время диастолы, что сменяется кратковременным
ретроградным потоком при сокращении предсер-
дия. У молодых ЛЖ наполняется кровью настолько
эффективно, что преобладает диастолический по-
ток [9].
ВЛИЯНИЕ СТАРЕНИЯ ОРГАНИЗМА
НА ДИАСТОЛИЧЕСКУЮ ФУНКЦИЮ
В исследованиях здоровых лиц значительные изме-
нения диастолической функции отмечались с уве-
личением возраста, что особенно важно с учетом
преобладания СН у пожилых пациентов [10–13].
Рис. 9 .1 Изменение давления в левом желудочке и его объема во вре-
мя сердечного цикла. Фаза систолы — это время от закрытия митрального
клапана (ЗМК) до закрытия аортального клапана (ЗАК). Фаза диастолы — это
время изоволюмического расслабления от ЗАК до открытия митрального кла-
пана (ОМК), когда давление в левом желудочке (ЛЖ) снижается без измене-
ния его объема и ауксотонического расслабления (от ЗАК до ОМК, когда объ-
ем ЛЖ увеличивается с изменением в нем давления). Ауксотоническое рас-
слабление имеет три подфазы: (1) раннее быстрое наполнение ЛЖ, которое
происходит в результате появления градиента давлений между левым пред-
сердием (ЛП) и ЛЖ; (2) диастазис с относительно одинаковыми давлениями
в ЛП и ЛЖ, в результате чего поток крови через митральный клапан (МК) ми-
нимальный или отсутствует; (3) сокращение предсердия, в результате чего про-
исходит наполнение ЛЖ. ОАК — открытие аортального клапана [Bonnema DD,
Baicu C, Zile MR. Pathophysiology of diastolic heart failure: relaxation and stiffness.
В Klein AL, Garcia MJ, editors. Diastology: clinical approach to diastolic heart fail-
ure, Philadelphia, 2008, Saunders].
ch09.indd 182
03.04.2019 11:46:08
183
9 Диастолическая функция левого желудочка
При проведении многомерного анализа по данным
допплерографии возраст был одним из факторов,
определяющих наполнение ЛЖ [11]. Наблюдалось
снижение максимальной скорости волны Е при уве-
личении максимальной скорости волны А и, со-
ответственно, уменьшение отношения Е/А. Вклад
предсердия в наполнение ЛЖ увеличивался почти в
2 раза: 37% (у пациентов старшего возраста) vs 19%
(у молодых пациентов) [11]. С увеличением возрас-
та (с 70 лет и старше) отмечалось небольшое про-
грессирующее ухудшение диастолического напол-
нения: 87% здоровых лиц имели отношение E/A < 1
[13]. Время замедления волны Е и период изоволю-
мического расслабления (IVRT) были удлинены. По
кровотоку в легочных венах отмечено повышение
максимальной скорости диастолического потока и
максимальной скорости ретроградного потока, а
также доли (в %) кровотока во время систолы во
время снижения максимальной скорости диастоли-
ческого потока. Утолщение задней стенки и относи-
тельное утолщение всех стенок были больше с уве-
личением возраста, но по данным многомерного
анализа не оказывали значительного влияния на ди-
астолическое наполнение [12].
Тканевая допплерография фиброзного кольца
митрального клапана позволяет измерить смеще-
ния фиброзного кольца митрального клапана в ран-
нюю диастолу (скорость e′) и в позднюю диастолу
(скорость a′) вслед за сокращением предсердия.
Значения скоростей e′ и a′, а также отношение E/e′
во многом зависят от возраста. Скорость e′ снижа-
ется с увеличением возраста, в то время как ско-
рость a′ и отношение E/e′ повышаются [5, 14, 15]. В
табл. 9 .1 приведены изменения параметров доппле-
рографии в зависимости от возраста и пола, в табл.
9.2 — значения скоростей, полученных с помощью
тканевой допплерографии [5, 16].
ЭХОКАРДИОГРАФИЧЕСКАЯ ОЦЕНКА
ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
Гемодинамику во время диастолы лучше всего оце-
нивать неинвазивно с помощью ЭхоКГ. Оценка ди-
астолической функции — это существенный ком-
понент эхокардиографического исследования, по-
становки диагноза, лечения и прогнозирования
выживаемости пациентов с СН и одышкой. Исто-
рически допплерография обеспечила первичную
диагностику этой патологии. Недавно цветовую
допплерографию в M-режиме и тканевую доппле-
рографию стали активно использовать для оценки
диастолической функции. Допплеровскую ЭхоКГ
используют для определения степени диастоли-
ческой дисфункции по шкале от 4 до 5 первичных
степеней (рис. 9 .2) [17]. В табл. 9 .3 указаны самые
распространенные значения и переменные, отража-
ющие соответствующую степень диастолической
дисфункции [17].
МИТРАЛЬНЫЙ КРОВОТОК
Митральный кровоток лучше всего исследовать в
четырехкамерной позиции. Для точной оценки ми-
трального кровотока с помощью импульсно-волно-
вой допплерографии нужно позиционирование
контрольного объема параллельно потоку при цве-
товой допплерографии. Контрольный объем разме-
ром 1–2 мм размещают в области свободных краев
створок митрального клапана с углом сканирования
< 30°. Установки фильтра оптимизируются по ниж-
нему уровню, позволяющему получить адекватное
допплеровское изображение.
Тип митрального кровотока зависит от условий
преднагрузки и степени диастолической дисфунк-
ции (рис. 9 .3) [8]. При нарушении расслабления
(диастолическая дисфункция I степени) отмечается
снижение максимальной скорости митрального
кровотока в раннюю диастолу (Е) и увеличение ско-
рости митрального кровотока в позднюю диастолу
(А), а также более длительное IVRT и время замед-
ления. Отношение E/A < 1, время замедления обыч-
но > 240 мсек, а IVRT > 90 мсек. Псевдонормальный
митральный кровоток (диастолическая дисфункция
II степени) характеризуется более выраженным на-
рушением во время диастолы, но все показатели на-
ходятся в пределах нормы. С увеличением ригидно-
сти ЛЖ наполнение ЛП снижается, что приводит к
повышению давления в ЛП и более раннему бы-
строму наполнению. По мере повышения давления
в ЛП происходит укорочение IVRT, повышается
скорость митрального кровотока (пик Е) и умень-
шается скорость потока во время систолы предсер-
дий (пик A). Отношение E/A находится в диапазоне
от 1 до 1,5, время замедления — 150–200 мсек, а
IVRT < 90 мсек.
Ключевой признак псевдонормального митраль-
ного кровотока — поток из легочных вен при высо-
ком (≥ 35 см/сек) ретроградном потоке из предсер-
дия, что предполагает снижение эластичности. Ми-
тральный кровоток со средней диастолической
скоростью > 0,2 м/сек (волна L) ассоциируется с по-
вышением давления наполнения ЛЖ, низкой ЧСС
и задержкой расслабления миокарда (рис. 9 .4) [18].
Регистрация волны L может помочь идентифици-
ровать пациентов с выраженной диастолической
дисфункцией, большинство из которых имеют
псевдонормальный митральный кровоток [18]. У
пациентов с гипертрофией ЛЖ (ГЛЖ), наличием
волны L и псевдонормальным митральным крово-
током в дальнейшем развивается СН [19].
В ходе допплеровского исследования можно про-
вести пробу Вальсальвы, чтобы отличить нормаль-
ный митральный кровоток от патологического.
При пробе Вальсальвы преднагрузка на ЛЖ увели-
чивается [20–22] и скорость волны E должна сни-
жаться как минимум на 10%, чтобы иметь диагно-
стическое значение [20]. Снижение отношения E/A
ch09.indd 183
03.04.2019 11:46:09
184
ЧАСТЬ II Левый желудочек
< 1 у пациентов с исходным значением E/A > 1 по-
могает идентифицировать пациентов с псевдонор-
мальным митральным кровотоком (рис. 9 .5) [20].
Рестриктивный тип наполнения (диастоличес-
кая дисфунккция III степени) характеризуется повы-
шением максимальной скорости E, снижением ско-
рости А (отношение E/A > 1,5), укорочением време-
ни замедления (< 150 мсек) и нормальным или
сниженным IVRT (< 70 мсек). Однако у здоровых
лиц молодого возраста высокая максимальная ско-
рость Е и время замедления < 150 мсек могут на-
блюдаться при чрезмерном расслаблении ЛЖ и эла-
стичном возврате, поэтому необходима оценка по
иным допплеровским и эхокардиографическим по-
казателям [23]. Рестриктивный тип наполнения мо-
жет наблюдаться на поздних стадиях заболевания и
характеризуется повышенным ранним наполнени-
ем и сниженным наполнением во время диастолы.
Проба Вальсальвы помогает определить, является
состояние обратимым или нет. Если изменения об-
ратимы, то рестриктивный тип наполнения стано-
вится псевдонормальным. Если реакции на пробу
Вальсальвы нет, то митральный кровоток является
необратимо рестриктивным (диастолическая дис-
функция IV степени). Рестриктивный тип наполне-
ния связан с очень высоким давлением наполнения,
СН и неблагоприятным прогнозом. Пациенты с ре-
стриктивным типом наполнения имеют более вы-
раженную дисфункцию ЛЖ и правого желудочка
(ПЖ), их геометрическое увеличение, увеличение
Скорость
E, см/сек
Скорость
А, см/сек E/A
DT, мсек
IVRT,
мсек
SPulm,
см/сек
DPulm,
см/сек SPulm/DPulm
VmaxВТЛЖ,
м/сек
VTIВТЛЖ,
см
Женщины
Исследовано,
n (%)
657 (99) 657 (99) 657 (99) 657 (99) 653 (98) 646 (98) 637 (96) 635 (96)
654 (99) 654 (99)
Возраст
<40лет
(n = 208)
80±16 48±15
1,85±0,76 212±55 85±16 58±12 55±11 1,09±0,31 1,01±0,17 20,8±3,5
Возраст
40–60 лет
(n = 336)
74±15 59±15
1,32±0,40 220±66 95±20 59±12 48±12 1,29±0,35 1,02±0,16 21,6±3,4
Возраст
>60лет
(n = 119)
69±16 75±18
0,96±0,32 244±79 105±23 62±12 43±11 1,51±0,39 1,01±0,17 21,7±3,7
Все возраста
(n = 663)
75±16 58±18
1,42±0,62 218±66 93±21 59±12 49±12 1,26±0,37 1,01±0,16 21,4±3,5
Мужчины
Исследовано,
n (%)
599 (99) 599 (99) 599 (99) 599 (99) 597 (99) 583 (97) 583 (97) 578 (96)
591 (98) 591 (98)
Возраст
<40лет
(n = 126)
75±15 44±14
1,86±0,64 217±65 91±17 52±11 55±12 0,99±0,29 0,99±0,17 20,0±3,3
Возраст
40–60 лет
(n = 327)
64±15 52±14
1,30±0,42 232±81 100±21 55±11 47±11 1,22±0,31 0,99±0,18 20,4±3,6
Возраст
>60лет
(n = 150)
61±14 65±18
0,99±0,34 269±97 118±29 62±13 43±11 1,50±0,40 0,96±0,18 20,3±3,7
Все возраста
(n = 603)
66±15 54±17
1,34±0,54 238±85 103±24 56±12 48±12 1,23±0,37 0,98±0,18 20,3±3,6
* Данные приведены в виде среднего значения ± SD допплеровских скоростей потока 1266 здоровых лиц различного возраста и пола, ес-
ли не указано иное. Выявлены существенные различия во всех параметрах обоих полов (p ≤ 0,002, кроме показателей ВТЛЖ). У женщин
более высокие скорости при допплерографии, чем у мужчин, за исключением отношения систола/диастола в легочных венах (макси-
мальная скорость в ВТЛЖ и скорость легочного кровотока во время диастолы, p < 0,05; остальное, p < 0,001).
DPulm — максимальная скорость легочного кровотока в фазу диастолы; DT — время замедления; IVRT — время изоволюмического рас-
слабления; SPulm — максимальная скорость легочного кровотока в фазу систолы; Vmax — максимальная скорость; VTI — интеграл скоро-
сти кровотока; ВТЛЖ — выходной тракт левого желудочка.
[Dalen H, Thorstensen A, Vatten LJ, et al. Reference values and distribution of conventional echocardiographic Doppler measures and longitudinal
tissue Doppler velocities in a population free from cardiovascular disease. Circ Cardiovasc Imaging 3:614–622, 2010.]
ТАБЛИЦА 9.1 Референсные параметры митрального кровотока, измеренного с помощью допплерографии*
ch09.indd 184
03.04.2019 11:46:09
185
9 Диастолическая функция левого желудочка
Популяция
Значения нормы
Скорость e′ (см/сек) Отношение E/e′
Женщины
Возраст < 40 лет 10,0–19,2
3,0–8,2
Возраст 40–59 лет 6,5–16,1
3,2–10,4
Возраст ≥ 60 лет
1,8–14,6
3,1–14,3
Все возраста
5,4–18,2
2,5–10,9
Мужчины
Возраст < 40 лет 8,7–19,5
2,5–8,5
Возраст 40–59 лет 6,1–15,3
3,0–9,4
Возраст ≥ 60 лет
4,4–12,0
3,1–12,3
Все возраста
4,8–16,8
2,4–10,4
* Данные приведены в виде среднего значения ± 2 SD допплеров-
ских скоростей потока 1266 здоровых лиц случайной выборки.
Представлены средние значения по всем четырем стенкам ЛЖ.
Показатели скорости e′ совпадают с усредненным значением ско-
рости e′ септальной части фиброзного кольца и скорости e′ ла-
теральной части фиброзного кольца.
[Dalen H, Thorstensen A, Vatten LJ, et al. Reference values and distri-
bution of conventional echocardiographic Dopller measures and lon-
gitudinal tissue Doppler velocities in a population free from cardiovas-
cular disease. Circ Cardiovasc Imaging; 3:614–622, 2010; Flachskampf
FA, Sørensen TB, Solomon SD, et al. Cardiac imaging to evaluate left
ventricular diastolic function. JACC Cardiovasc Imaging 8:1071–1093,
2015.]
ТАБЛИЦА 9.2 Нормальные референсные значения
скорости e′ и отношения E/e′*
ЛП и митральную регургитацию, что ассоциирует-
ся с неблагоприятным прогнозом — необходимо-
стью трансплантации сердца или летальным исхо-
дом [24]. С увеличением степени диастолической
дисфункции, сопровождающейся нарушениями
расслабления, ухудшается прогноз относительно
развития СН и летального исхода [25–28]. На ско-
рость митрального кровотока влияют давление в
ЛП, выраженность расслабления миокарда, ско-
рость активного заполнения кровью, согласован-
ность работы предсердия и желудочка и волюмиче-
ский статус [29–31], поэтому для оценки диастоли-
ческой функции необходимы дополнительные
исследования.
ЛЕГОЧНЫЙ ВЕНОЗНЫЙ КРОВОТОК
Изображение легочного венозного кровотока при
импульсно-волновой допплерографии обычно по-
лучают в апикальной четырехкамерной позиции,
размещая контрольный объем на 1–2 см в просвет
правой верхней легочной вены под контролем цве-
товой допплерографии. Нормальный легочный ве-
нозный кровоток составляют немного более выра-
женная систолическая волна, диастолическая волна
и небольшая волна ретроградного потока при со-
кращении предсердия [32]. Отношение скорости
систолического потока к скорости диастолического
потока > 1 [33]. По мере увеличения давления на-
полнения ЛЖ систолический поток ослабевает, ско-
рость диастолического потока становится более вы-
раженной, а скорость ретроградного потока при со-
кращении предсердия растет. Но у многих молодых
здоровых людей систолический поток имеет сгла-
женную форму, если эффективно активное напол-
нение ЛЖ из легочных вен и снижена скорость ре-
троградного потока при сокращении предсердия.
Тяжелая митральная регургитация также может за-
медлить систолический поток и повысить скорость
диастолического потока. Повышенное конечно-ди-
астолическое давление в ЛЖ может быть выявлено
в случае регистрации скорости ретроградного пото-
ка > 30 см/сек при сокращении предсердия и увели-
чении интервала между этим ретроградным пото-
ком и волной A митрального кровотоком (Ar–A)
более чем на 35 мсек (рис. 9 .6) [34, 35].
ЦВЕТОВАЯ ДОППЛЕРОГРАФИЯ В М-РЕЖИМЕ
Цветовую допплерографию в М-режиме лучше
проводить в апикальной четырехкамерной пози-
ции, разместив курсор в центре митрального крово-
тока и выравнивая курсор со струей потока на вы-
дохе. Для лучшего наложения цветов следует пред-
варительно настроить максимальный центральный
поток до синего цвета. Информацию получают с
момента первого предела Найквиста одной из ство-
рок митрального клапана внутрь полости ЛЖ при-
близительно на 4 см [36].
У пациентов с синусовым ритмом наблюдаются
две цветовые волны. Первая волна отражает раннее
наполнение ЛЖ (в направлении верхушки) из ЛП,
вторая — поток после сокращения предсердия. Ско-
рость потока, проходящего через ЛЖ (Vp), можно
оценить, измерив угол наклона кривой раннего на-
полнения (пик E) (рис. 9 .7). Ускорение потока на-
блюдается при быстром расслаблении желудочка, а
наиболее низкая Vp — при задержке расслабления.
Vp < 50 см/сек означает, что диастолическая функ-
ция не нарушена. Vp можно использовать для оцен-
ки давления наполнения ЛЖ, а отношение E/Vp
> 1,5 свидетельствует о повышении ДЗЛА выше
12 мм рт. ст. (чувствительность 79%, специфич-
ность 89%, положительная прогностическая цен-
ность 93%, отрицательная прогностическая цен-
ность 70%) [37].
Измерение Vp может помочь в случае сомни-
тельных результатов оценки диастолической функ-
ции, но как дополнительная характеристика из-за
некоторых ограничений. У пациентов с сохранной
ФВ на отношение E/Vp следует ориентироваться с
осторожностью. Это отношение у пациентов с со-
хранной ФВ может быть нормальным, несмотря на
повышенное давление наполнения ЛЖ, особенно
при неизмененном объеме ЛЖ [30]. Оценить Vp у
ch09.indd 185
03.04.2019 11:46:09
186
ЧАСТЬ II Левый желудочек
S
s′
a′
e′
Vp
D
Поток
в легочных
венах
Митральный
кровоток
Тканевая
допплерография
Цветовая
допплерография
в одномерном
М-режиме
Нормальная диастолическая функция
Степень I
Легкая
диастолическая
дисфункция
(нарушение
расслабления)
Степень II
Умеренная
диастолическая
дисфункция
(псевдонормальный
тип наполнения)
Степень III
Тяжелая
диастолическая
дисфункция
(обратимый
рестриктивный
тип наполнения)
Степень IV
Тяжелая
диастолическая
дисфункция
(необратимый
рестриктивный
тип наполнения)
Ardur
Adur
A
E
Молодые
Взрослые
Ar
Расслабление ЛЖ
Норма
Нарушение
Нарушение
Нарушение
Нарушение
Эластичность ЛЖ
Норма
Норма или ↓
↓↓
↓↓↓
↓↓↓↓
Давление в предсердии
Норма
Норма
↑↑
↑↑↑
↑↑↑↑
Рис. 9 .2 Сравнение параметров допплерографии при нормальной диастолической функции и по степеням диастолической дисфункции. A — ско-
рость митрального кровотока в позднюю диастолу; a′ — скорость смещения фиброзного кольца митрального клапана в позднюю диастолу; Adur — длительность
предсердного митрального кровотока; Ar — скорость ретроградного потока в легочных венах при сокращении предсердия; Ardur — длительность максимальной
скорости митрального кровотока при сокращении предсердия; D — поток по легочным венам во время диастолы; E — скорость митрального кровотока в ран-
нюю диастолу; e′ — скорость смещения фиброзного кольца митрального клапана в раннюю диастолу; S — поток по легочным венам во время систолы; s′ —
скорость смещения фиброзного кольца митрального клапана во время систолы; Vp — распространение скорости при цветовой допплерографии в М-режиме;
ЛЖ — левый желудочек [Garcia MJ, Thomas JD, Klein AL. New Doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol 32:865–875,
1998].
пациентов с гипертрофической или рестриктивной
кардиомиопатией может быть сложно из-за выра-
женного внутриполостного кровотока, который
возникает до фазы раннего наполнения ЛЖ, что
указывает на очень высокую Vp [33]. Цветовую доп-
плерографию в M-режиме не следует использовать
у пациентов с протезированным митральным кла-
паном и митральным стенозом. На величину Vp
также влияет уровень преднагрузки [34].
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ
С помощью импульсно-волновой тканевой доппле-
рографии измеряют максимальную скорость про-
дольного сокращения миокарда. Тканевую доппле-
рографию фиброзного кольца митрального клапана
проводят в апикальной четырехкамерной позиции
с размещением контрольного объема в области пе-
регородки (скорость e′ септальной части фиброзно-
го кольца митрального клапана) и боковой стенки
(скорость e′ латеральной части фиброзного кольца
митрального клапана) при задержке дыхания, что-
бы избежать артефактов. Допплеровский сигнал оп-
тимизируется путем выключения фильтров движе-
ния миокарда и уменьшения допплеровского усиле-
ния. Основные исследуемые показатели: скорость
смещения фиброзного кольца митрального клапана
в раннюю диастолу (e′), скорость смещения фи-
брозного кольца митрального клапана в позднюю
диастолу (a′) и скорость смещения фиброзного
кольца митрального клапана во время систолы (s′)
(рис. 9 .8). Скорость e′ — относительно независи-
мый от нагрузки показатель расслабления ЛЖ в
раннюю диастолу, определяемый после зубца T на
электрокардиограмме [38–40]. По мере увеличения
времени расслабления скорость e′ определяется по-
сле пика E скорости митрального кровотока [23].
ch09.indd 186
03.04.2019 11:46:09
187
9 Диастолическая функция левого желудочка
Параметры
Норма
Дисфункция
Легкая (I степень) Умеренная (II степень)
Тяжелая (III степень)*
Физиология
↓ Расслабление
↓ Расслабление и ↑ КДД ЛЖ ↓ Эластичность и ↑↑ КДД ЛЖ
Отношение E/A
1−2
< 0,8
0,8–2,0
≥ 2,0
ΔE/A при пробе Вальсальвы
< 0,5
≥ 0,5
≥ 0,5
DT (мсек)
150−200
> 200
150−200
< 150
Скорость e′ (см/сек)
≥10
<8
<8
<5
Отношение E/e′≤
8
≤89
−14
≥15
IVRT (мсек)
50−100
≥ 100
60–100
≤60
S/D легочных вен
≅1
S>D
S<D
S<<D
PVA (м/сек)
< 0,35
< 0,35†
≥ 0,35
≥ 0,35
Ardur − Adur (мсек)
<20
< 20†
≥30
≥30
Скорость распространения
диастолического потока
(см/сек)
>55
>45
<45
<45
Объем ЛП
< 34 мл/м2 Незначительно
увеличен
Умеренно увеличен
Значительно увеличен
* Еще одна степень необратимо тяжелой дисфункции характеризуется отсутствием снижения скорости E в фазу напряжения при пробе
Вальсальвы.
† Длительность и скорость в легочных венах могут быть увеличены, если давление наполнения повышено.
Adur — длительность максимальной скорости A митрального кровотока; Ardur — длительность волны A ретроградного потока в легочных
венах при сокращении предсердия; DT — время замедления; E/A — отношение ранней скорости к поздней скорости митрального пото-
ка; IVRT — время изоволюмического расслабления; PVA — скорость ретроградной волны A в легочных венах; S/D — отношение скоро-
сти систолического потока к скорости диастолического потока; КДД — конечно -диастолическое давление; ЛЖ — левый желудочек; ЛП —
левое предсердие.
[Nagueh et al. American Society of Echocardiography Guidelines, J Am Soc Echocardiogr, 2009. Canadian Consensus Guidelines; Rakowki H, et al. J
Am Soc Echocardiogr 9:736–760, 1996; Yamada H, et al. J Am Soc Echocardiogr 15:1238–1244, 2002; Redfield MM. JAMA 289:194–202, 2003; Lester
SJ, et al. J Am Coll Cardiol 51:679–689, 2008; Otto CM. Ventricular diastolic filling and function. В Otto CM, editor: Textbook of clinical echocardi-
ography, ed 5, Philadelphia, 2013, Saunders.]
ТАБЛИЦА 9.3 Классификация диастолической дисфункции
Скорость a′ представляет собой максимальную ско-
рость сокращения предсердия и определяется после
зубца a на электрокардиограмме. Показано, что ве-
личина максимальной скорости a′ коррелирует с
максимальной скоростью A митрального кровото-
ка, функцией предсердия и силой предсердного вы-
броса. Нормальные значения для скорости e′ сеп-
тальной части фиброзного кольца (у здоровых лю-
дей) — более 10 см/сек, а здоровых людей в зрелом
возрасте — > 8 см/сек. Для скорости e′ латеральной
части фиброзного кольца нормальные значения —
12 см/сек и более [33]. Скорость e′ латеральной ча-
сти фиброзного кольца в норме выше скорости e′
септальной части из-за взаимосвязи ПЖ с перего-
родкой. Однако у пациентов с констриктивным пе-
рикардитом перегородочная скорость e′ сохранена
или повышена, и скорость e′ септальной части
обычно выше скорости e′ латеральной части [41–
48]. Это состояние известно под названием annulus
reversus и гипотетически является вторичным вслед-
ствие ограничения движения из-за утолщенного и
рубцовоизмененного перикарда, прилежащего к ла-
теральной части фиброзного кольца. В большом ис-
следовании Welch и соавт. [43] септальная скорость
e′, равная 9 см/сек или более, была характерным
признаком констриктивного перикардита и оказа-
лась выше, чем ожидалось, у пациентов, имеющих
симптомы СН и повышенное давление наполнения.
Тканевая допплерография септальной части фи-
брозного кольца митрального клапана также помо-
гает отличить у пациентов с СН рестриктивную
кардиомиопатию от констриктивного перикардита
[41, 42, 44]. Пороговое значение 8 см/сек или более
свидетельствует о констриктивном перикардите (чув-
ствительность 89% и выше, специфичность 96% и
выше) [42]. По мере развития у пациента диастоли-
ческой дисфункции скорость e′ снижается, что по-
могает определить, есть ли характерное для ми-
трального кровотока нарушение, т.е . скорость e′ —
один из наиболее важных параметров, по которому
можно определить, является ли митральный крово-
ток нормальным или псевдонормальным в сравне-
нии с показателями митрального потока или дан-
ных допплерограммы легочных вен [6]. Помимо
этого, у пациентов с диастолической дисфункцией
отношение e′/a′ обычно меньше 1.
ch09.indd 187
03.04.2019 11:46:09
188
ЧАСТЬ II Левый желудочек
ОЦЕНКА ДАВЛЕНИЯ НАПОЛНЕНИЯ ЛЕВОГО ЖЕЛУДОЧКА
При диастолической дисфункции максимальная
скорость E повышается, а скорость e′ соответствен-
но снижается. Отношение E/e′ коррелирует с конеч-
но-диастолическим давлением в ЛЖ и ДЗЛА [38,
45]. Среднее ДЗЛА выше 12 мм рт. ст. или конечно-
диастолическое давление в ЛЖ выше 16 мм рт. ст.,
Согласно рекомендациям по оценке диастоличе-
ской функции ЛЖ American Society of Echocardiog-
raphy (ASE), целесообразно измерение скорости e′
как септальной, так и латеральной части фиброзно-
го кольца митрального клапана и усреднение значе-
ний, чтобы учесть нарушения локальной сократи-
мости миокарда. Отношение E/e′ используют для
оценки давления наполнения ЛЖ [34].
Рис. 9 .3 Типы митрального кровотока и медиальные скорости смещения фиброзного кольца митрального клапана от нормы до диастоличе-
ской дисфункции. (А–Г) Типы митрального кровотока. (Д–З) Скорости смещения фиброзного кольца митрального клапана при тканевой допплерографии, со -
ответствующие типам митрального кровотока. Нормальная диастолическая функция представлена на (А) и (Д); нарушение расслабления (диастолическая дис-
функция I степени) — на (Б) и (Е); псевдонормальный митральный кровоток (диастолическая дисфункция II степени) — на (В) и (Ж), рестриктивный тип напол-
нения (диастолическая дисфункция II степени) — на (Г) и (З).
Н
о
р
м
а
Н
а
р
у
ш
е
н
и
е
р
а
с
с
л
а
б
л
е
н
и
я
П
с
е
в
д
о
н
о
р
м
а
л
ь
н
ы
й
т
р
а
н
с
м
и
т
р
а
л
ь
н
ы
й
п
о
т
о
к
Р
е
с
т
р
и
к
т
и
в
н
ы
й
т
р
а
н
с
м
и
т
р
а
л
ь
н
ы
й
п
о
т
о
к
А
В
Д
Е
Ж
З
Б
Г
ch09.indd 188
03.04.2019 11:46:09
189
9 Диастолическая функция левого желудочка
Волна L
↓ Преднагрузки
Норма
Нарушение
расслабления
Псевдонормальный
митральный
кровоток
Рестриктивный
митральный
кровоток
Тяжелый
рестриктивный
митральный
кровоток
среднем давлении в ЛЖ во время диастолы выше
15 мм рт. ст. У всех пациентов с отношением E/e′
> 15 было повышенное среднее давление в ЛЖ во
время диастолы. Корреляция между отношением
E/e′ и средним давлением в ЛЖ во время диастолы
была лучше у пациентов с нарушенной систоличе-
ской функцией (ФВЛЖ < 50%) по сравнению с те-
ми, у кого систолическая функция была сохранна.
При значениях отношения E/e′ между 8 и 15 наблю-
дался значительный разброс в величинах среднего
давления в ЛЖ во время диастолы, что делало этот
интервал неопределенным для диагностики. Таким
образом отношение E/e′ следует интерпретировать
с учетом систолической функции ЛЖ, размеров ЛП
и других параметров допплерографии.
По данным нескольких исследований, на ско-
рость e′ влияют степень расслабления ЛЖ, систо-
лическая функция ЛЖ, преднагрузка и минималь-
ное давление в ЛЖ [38, 40, 45, 46]. Преднагрузка но-
минально влияет на скорость e′ при нарушении
расслабления, но у пациентов с нормальным рас-
слаблением преднагрузка повышает скорость e′. У
здоровых лиц отношение E/e′ не позволяет досто-
верно оценить давление наполнения ЛЖ [45]. При
исследовании пациентов с сохранной систоличе-
ской функцией ЛЖ, но необъяснимой одышкой,
направленных на катетеризацию правых отделов
сердца, отношение E/e′ не позволило ни идентифи-
цировать пациентов с повышенным ДЗЛА, ни точ-
но его определить [47].
При исследовании пациентов с острой деком-
пенсированной СН со снижением систолической
функции, которым одновременно проводили кате-
теризацию правых отделов сердца и допплерэхо-
кардиографию, было выявлено, что с помощью
ЭхоКГ можно достоверно оценить гемодинамику,
как это указано в рекомендациях American Society
of Echocardiography и European Association of Echo-
cardiography [48]. Рекомендации были очень точны
в идентификации пациентов с повышенным ДЗЛА
(чувствительность 98%, специфичность 91%) [48].
Рис. 9 .4 Митральный поток с волной L. Волна L (в середине систолы) сви-
детельствует о выраженной диастолической дисфункции и часто наблюдается
при псевдонормальном типе наполнения.
Рис. 9 .5 Динамические изменения митрального кровотока при изменении диастолической функции (в отличие от динамических изменений, ко-
торые зависят от преднагрузки). Однонаправленные стрелки указывают на изменения митрального кровотока, не зависящие от преднагрузки. Двунаправлен-
ные стрелки указывают на динамические изменения митрального кровотока при снижении преднагрузки. При пробе Вальсальвы псевдонормальный митральный
кровоток переходит в нарушение расслабления с отношением E/A < 1, а обратимый рестриктивный — в псевдонормальный; тяжелый рестриктивный тип напол-
нения остается неизменным. Снижение скорости e′ на 10% или более считается адекватным ответом организма на пробу Вальсальвы [Hurrell DG, Nishimura RA,
Ilstrup DM, et al. Utility in assessment of left ventricular filling pressure by Doppler echocardiography: a simultaneous catheterization and Doppler echocardiographic study.
J Am Coll Cardiol 30:459–467, 1997].
что согласуется с повышенным давлением наполне-
ния ЛЖ [46]. Во время одновременных катетери-
зации правых отделов сердца и тканевой доппле-
рографии Nagueh и соавт. обнаружили, что отно-
шение E/e′ тесно связано с ДЗЛА, а не со скоростью
E митрального кровотока [38]. Отношение E/e′ > 10
соответствует среднему ДЗЛА > 15 мм рт. ст. (чув-
ствительность 97% и специфичность 78%). ДЗЛА
можно определить, используя отношение E/e′ в
уравнении регрессии: Среднее ДЗЛА = 1,91 +
(1,24 E/e′) [38].
В исследовании Ommen и соавт. 100 пациентам,
направленным на катетеризацию левых отделов
сердца, одновременно измеряли среднее давление в
ЛЖ во время диастолы и проводили допплерэхо-
кардиографию [45]. Во всех случаях оценки систо-
лической функции ЛЖ отношение E/e′ коррелиро-
вало со средним давлением в ЛЖ во время диасто-
лы лучше, чем все остальные допплеровские
показатели для измерения систолической функции
ЛЖ. Отношение E/e′ < 8 свидетельствовало о нор-
мальном среднем давлении ЛЖ во время диастолы,
а отношение E/e′ > 15 — о повышенном среднем
давлении в ЛЖ во время диастолы. Септальное
отношение E/e′ имело специфичность 86% при
ch09.indd 189
03.04.2019 11:46:10
190
ЧАСТЬ II Левый желудочек
Септальная e′ = 17,8 см/сек
s′
a′
e′
Е/септальная e′ = 5,8
SD
AR
Рис. 9 .6 Допплерография легочных вен. Отношение S/D < 1 и повышен-
ная скорость потока в предсердии (> 30 см/сек) ассоциируется с повышенным
конечно-диастолическим давлением в ЛЖ. AR — скорость ретроградного по-
тока в предсердии при сокращении предсердия; D — скорость диастолическо-
го потока; S — скорость систолического потока.
А
Б
Рис. 9 .7 Цветовая допплерография в М-режиме. (А) Нормальная ско-
рость потока (> 55 см/сек) (белая линия). Угол наклона кривой измеряют по
первому зубцу от кончиков створок митрального клапана приблизительно на
4 см в полость ЛЖ. (Б) Аномальная скорость потока (< 45 см/сек) (белая ли-
ния). Поток, регистрируемый в конце диастолы, представляет собой поток по-
сле сокращения предсердия.
Рис. 9.8 Измерение скоростей смещения фиброзного кольца ми-
трального клапана с помощью тканевой допплерографии. Скорости,
измеренные с помощью импульсно-волновой тканевой допплерографии сеп-
тальной части фиброзного кольца митрального клапана здорового молодого
мужчины: e′ — скорость смещения фиброзного кольца митрального клапана
в раннюю диастолу, a′ — скорость смещения фиброзного кольца митраль-
ного клапана в позднюю диастолу; s′ — скорость смещения фиброзного-
кольца митрального клапана во время систолы. Нормальная скорость e′
> 10 см/сек септальной части фиброзного кольца митрального клапана у здо-
ровых подростков и молодых людей и больше 8 см/сек у взрослых.
Небольшое количество пациентов подверглось по-
вторным катетеризации правых отделов сердца и
ЭхоКГ, при этом с помощью ЭхоКГ удалось опре-
делить изменения среднего ДЗЛА в дополнение к
определению систолического давления в легочной
артерии (ЛА) и среднего давления в правом пред-
сердии (ПП) при лечении СН. По типу митрально-
го кровотока можно предсказать значение ДЗЛА
приблизительно в 82% случаев. Однако у остальных
пациентов было нужно провести дополнительные
допплеровские измерения для оценки среднего
ДЗЛА. Из 79 пациентов, участвовавших в исследо-
вании, в 3 случаях допплерография не помогла
определить среднее ДЗЛА. В этом исследовании от-
ношение E/e′ также не коррелировало со ДЗЛА в
случае блокады левой ножки пучка Гиса или нали-
чия бивентрикулярного водителя ритма.
При кальцификации фиброзного кольца ми-
трального клапана, пороке митрального клапана,
протезированном митральном клапане, гипертро-
фической кардиомиопатии и констриктивном пе-
рикардите отношение E/e′ использовать не следует,
т.к. оно будет не очень точным [41, 42, 46, 49]. Низ-
кая септальная скорость e′ может наблюдаться при
желудочковых водителях ритма, блокаде левой
ножки пучка Гиса, некардиогенной легочной гипер-
тензии и инфаркте перегородки. В таких случаях
скорость e′ следует измерять в базальной части бо-
ковой стенки [5, 50]. При большом дилатированном
ЛЖ может быть сложно измерить скорость e′ лате-
ch09.indd 190
03.04.2019 11:46:10
191
9 Диастолическая функция левого желудочка
ральной части фиброзного кольца, вместо нее луч-
ше использовать скорость e′ септальной части.
Отношение E/e′ > 15 является прогностическим
признаком СН и риска смерти [51, 52]. Повышен-
ное E/e′ — это предиктор выживаемости пациентов
с острым инфарктом миокарда, независимый от ве-
личины ФВ [53].
ОЦЕНКА ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
В ОПРЕДЕЛЕННЫХ УСЛОВИЯХ
На характер диастолического потока могут влиять
различные физиологические условия, включая на-
грузку, ЧСС и сердечный ритм.
СИНУСОВАЯ ТАХИКАРДИЯ
Тахикардия приводит к повышению пика А в сере-
дине фазы митрального кровотока, сокращению
времени диастолического наполнения и выравнива-
нию пиков А и Е. Nagueh и соавт. оценивали диа-
столическую функцию у пациентов с синусовой
тахикардией, которых направили на катетеризацию
правых отделов сердца [54]. Пациенты были разде-
лены на несколько групп: группа A — митральный
кровоток с одинаковыми скоростями E и A; группа
B — скорость E меньше скорости A; группа C — ско-
рость E выше скорости A. У пациентов, имевших
скорость E меньше скорости A, наблюдалась тен-
денция к нормальному ДЗЛА, в отличие от групп A
и C. Установлено, что отношение E/e′ у пациентов
с синусовой тахикардией точно определяло значе-
ние ДЗЛА (r = 0,91).
ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
Оценка диастолической функции может быть за-
труднена при нарушениях сердечного ритма, на-
пример фибрилляции предсердий (ФП), при кото-
рой высокий сердечный ритм и вариабельность со-
кращений могут снижать точность оценки. Обычно
отмечается увеличение ЛП и замедление скорости
кровотока в легочной вене во время систолы, не-
смотря на нормальное давление в ЛП [55]. У паци-
ентов с изолированной ФП скорость e′ меньше по
сравнению с контрольной группой из здоровых лиц
[56]. Скорость смещения фиброзного кольца ми-
трального клапана можно использовать после ус-
реднения показателя за несколько сердечных ци-
клов. В одном исследовании пациентов с ФП значе-
ния скорости e′ усредняли по более чем 12 сердеч-
ным циклам. Отношение E/e′, равное 11 и выше,
коррелировало с повышенным давлением наполне-
ния ЛЖ (≥ 15 мм рт. ст.) (чувствительность 75%,
специфичность 93%) [57]. Если использовали 3 сер-
дечных цикла, чувствительность была 83%, специ-
фичность — 87%. Время замедления также может
помочь в оценке давления наполнения ЛЖ, особен-
но у пациентов со сниженной систолической функ-
цией ЛЖ [55]. При рестриктивных физиологиче-
ских изменениях, в частности времени замедления
130 мсек или менее, прогноз у пациентов с ФП не-
благоприятный по сравнению с теми, у кого нор-
мальный синусовый ритм [33]. Отношение E/e′ мо-
жет прогнозировать выживаемость пациентов с не-
клапанной ФП [58]. Среди пациентов с отношением
E/e′ > 5 чаще отмечаются смерть по различным
причинам, сердечная смерть и хроническая СН [59].
МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
На митральный кровоток и легочный венозный
кровоток также может влиять значительная ми-
тральная регургитация (МР). Пациенты с тяжелой
МР имеют высокую скорость E и сниженную ско-
рость A. Систолическое сглаживание отмечается
при допплерографии легочных вен в случае значи-
тельной МР, а при тяжелой МР может наблюдаться
ретроградный поток во время систолы. Отношение
E/e′ можно использовать для оценки давления на-
полнения ЛЖ и прогнозирования исходов у паци-
ентов со сниженной систолической функцией ЛЖ,
но не при нормальной систолической функции [46,
60]. У пациентов с нормальной систолической
функцией и значительной МР оценку следует про-
водить по иным допплеровским параметрам, на-
пример по длительности ретроградного потока из
легочной вены в предсердие и времени задержки
между скоростью E и скоростью e′ [60]. К тому же
систолическое давление в ПЖ может наблюдаться в
результате повышения давления наполнения ЛЖ
или при тяжелой МР.
ДОПОЛНИТЕЛЬНЫЕ ЭХОКАРДИОГРАФИЧЕСКИЕ
ПРИЗНАКИ ДИАСТОЛИЧЕСКОЙ ДИСФУНКЦИИ
УВЕЛИЧЕНИЕ ЛЕВОГО ПРЕДСЕРДИЯ
И НАРУШЕНИЕ ЕГО ФУНКЦИИ
ЛП выполняет три важные механические функции
(рис. 9 .9) [61, 62]: (1) служит резервуаром, получа-
ющим кровь из легочных вен, с повышением дав-
ления во время систолы и изоволюмического рас-
слабления; (2) в раннюю диастолу ЛЖ служит кана-
лом, пассивно передающим кровь из ЛП в ЛЖ по
градиенту давления [61]; (3) сокращение ЛП в кон-
це диастолы усиливает ударный объем ЛЖ пример-
но на 20% [61].
Размер ЛП — ценный параметр при оценке диа-
столической дисфункции: при умеренной или тяже-
лой диастолической дисфункции ЛП обычно уме-
ренно дилатировано, чего не отмечается при легкой
диастолической дисфункции [8, 62]. Размеры ЛП
также служат важными параметрами при прогнози-
ровании исхода. Увеличение ЛП является предикто-
ром ФП, инсульта, транзиторной ишемической ата-
ки, хронической СН, инфаркта миокарда и сердеч-
ной смерти [61, 62]. Оценка объема ЛП может
ch09.indd 191
03.04.2019 11:46:11
192
ЧАСТЬ II Левый желудочек
80
40
0
2
60
мл
см/сек
см/сек
ЭКГ
30
100
10
–10
0
–2
см/сек
S1
SRS
SRE
максимум
Пассивно
Активно
SRA
SRA
a
c
v
E
s′
e′
a′
A
Резервуар
Канал
Насосная
функция
Скорость потока в легочных венах
Деформация ЛП
Скорость деформации ЛП
Объем ЛП
Пред-А
минимум
Давление в ЛП
Скорость митрального кровотока
Скорость смещения фиброзного кольца МК
PVa
S2
εs
εE
εA
D
%
S-1
0
Рис. 9 .9 Оценка функции левого предсердия в течение сердечного цикла с помощью эхокардиографии. Левое предсердие (ЛП) служит резервуаром
для ретроградного потока из легочных вен во время систолы и его функция наилучшим образом оценивается измерением с помощью тканевой допплерографии
скорости s′ фиброзного кольца митрального клапана и скорости S с помощью допплерографии легочных вен. ЛП также является каналом для ретроградного по-
тока из легочных вен, и его функция определяется скоростью E, отношением E/A митрального кровотока и скоростью e′ фиброзного кольца митрального клапа-
на. Насосная функция осуществляется при сокращении предсердия и определяется скоростью A, отношением E/A митрального кровотока и скоростью a′ фиброз-
ного кольца митрального клапана. Деформация и скорость деформации ЛП также можно использовать для оценки функции ЛП. Участки кривой: красный цвет —
резервуар; фиолетовый цвет — канал; желтый цвет — насосная функция. A и a — поздняя диастола; a′ — сокращение предсердия; D — диастола желудочков;
ε — деформация; E и e′ — ранняя диастола; PV — скорость потока в легочных венах; s′ — систола желудочков; SRA — скорость деформации в позднюю диа-
столу; SRE — скорость деформации в раннюю диастолу; SRS — скорость деформации в диастолу желудочков; МК — митральный клапан; ПЖ — правый желу-
дочек; ЭКГ — электрокардиограмма [Hoit BD: Left atrial size and function: role in prognosis. J Am Coll Cardiol 63:493–505, 2014].
помочь повысить точность отношения E/e′ при
определении давления наполнения ЛЖ у пациентов
с нормальной ФВЛЖ, особенно у тех, у кого значе-
ние отношения E/e′ находится в диапазоне неопре-
деленных величин [63]. В последнее время мини-
мальный объем ЛП в конце диастолы, связанный с
максимальной эластичностью ЛП, может рассма-
триваться более сильным предиктором сердечно-
сосудистых событий, чем объем ЛП в конце систо-
лы [62].
Важно помнить, что увеличение ЛП может быть
связано не только с диастолической дисфункцией,
но и с другими патологиями, например предсерд-
ной аритмией, пороком митрального клапана,
врожденным заболеванием сердца или состоянием,
сопровождающимся высоким сердечным выбросом
(анемия или изменения сердца у спортсменов) [61].
Увеличение ЛП следует интерпретировать в контек-
сте анамнеза пациента и других эхокардиографиче-
ских данных.
Размеры ЛП лучше всего оценивать как объем,
индексированный к площади поверхности тела с по-
мощью бипланарного метода дисков при 2D-ЭхоКГ,
которая учитывает половые различия (рис. 9 .10) [64].
Для расчета объема контур ЛП обводят в конце си-
столы в апикальных четырех- и двухкамерной пози-
циях, в которых ЛП визуализируется максимально,
за исключением легочных вен и ушка ЛП. Верхний
предел для индексированного объема ЛП (как для
мужчин, так и для женщин) составляет 34 мл/м2
ch09.indd 192
03.04.2019 11:46:11
193
9 Диастолическая функция левого желудочка
(табл. 9.4) [64]. По мере прогрессирования дилата-
ции ЛП в ответ на снижение эластичности ЛЖ дав-
ление в ЛП повышается, чтобы поддержать адекват-
ное наполнение ЛЖ, что приводит к дальнейшему
увеличению ЛП, снижению его сократимости, уко-
рочению и ухудшению функции. Сниженная позд-
няя диастолическая деформация ЛП и скорость де-
формации по данным тканевой допплерографии и
спекл-трекинг ЭхоКГ отмечаются у пациентов с ди-
астолической СН, причем у них эти показатели ни-
же, чем у пациентов с бессимптомной диастоличе-
ской дисфункцией [65]. Оценку деформации и ско-
рости деформации ЛП рутинно выполняют нечасто,
изучение этого вопроса продолжается.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
У пациентов с выраженной диастолической дис-
функцией без признаков заболеваний легких, пато-
логии аортального или митрального клапана часто
регистрируется повышенное давление в легочной
артерии (ЛА). Систолическое давление в ЛА опре-
деляется по максимальной скорости струи трику-
спидальной регургитации с помощью непрерывно-
волновой допплерографии совместно с оценкой
давления в ПП. У пациентов с нормальной функци-
ей ЛЖ систолическое давление в ЛА хорошо корре-
лирует с ДЗЛА [66] и повышается в случае прогрес-
сирования диастолической дисфункции [67]. Со-
гласно рекомендациям по диастолической функции
ЛЖ American Society of Echocardiography (ASE) це-
лесообразно учитывать повышение систолического
давления в ЛА > 35 мм рт. ст. дополнительно к от-
ношению E/e′ при оценке давления в ЛП у пациен-
тов с сохранной или сниженной функцией ЛЖ [34].
КЛИНИЧЕСКАЯ ОЦЕНКА
ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
Оценку диастолической функции сердца начинают
с полноценной трансторакальной эхокардиографии
(ТТЭхоКГ) и интеграции всех результатов исследо-
вания.
ОПРЕДЕЛЕНИЕ СТЕПЕНИ ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
ЛЕВОГО ЖЕЛУДОЧКА
Оценка степени диастолической функции начина-
ют с оценки скорости e′ септальной части фиброз-
ного кольца, скорости e′ латеральной части фи-
брозного кольца и индекса объема ЛП (рис. 9 .11)
[34]. Если скорость e′ септальной части ≥ 8, ско-
А
Б
Рис. 9.10 Определение объема левого предсердия. Объем левого предсердия (ЛП) рассчитывают, измерив площадь и длину в апикальной четырехкамер-
ной позиции (А) и двухкамерной позиции (Б). Объем ЛП определяют в конце систолы непосредственно перед открытием митрального клапана, затем результат
индексируют к площади поверхности тела. Длину ЛП нужно сравнивать в обеих позициях, в которых ЛП визуализируют максимально.
Пациенты
Объем ЛП/ППТ (мл/м2)
Норма
Легкое нарушение
Умеренное нарушение
Тяжелое нарушение
Мужчины
16–34
34–41
42–48
>48
Женщины
16–34
34–41
42–48
>48
ППТ — площадь поверхности тела; ЛП — левое предсердие.
[Lang RM, Badano, LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39, 2015.]
ТАБЛИЦА 9.4 Нормальные и пороговые величины объема левого предсердия, индексированного
к площади поверхности тела
ch09.indd 193
03.04.2019 11:46:11
194
ЧАСТЬ II Левый желудочек
рость e′ латеральной части ≥ 10, а индекс объема ЛП
< 34 мл/м2 (норма), диастолическая функция не на-
рушена. Если увеличен индекс объема ЛП, это сле-
дует расценивать как норму, сердце спортсмена или
констриктивный перикардит. Если скорость e′ сеп-
тальной части < 8, скорость e′ латеральной ча-
сти < 10, а индекс объема ЛП > 34 мл/м2, это расце-
нивают как диастолическую дисфункцию и опреде-
ляют ее степень и давление наполнения ЛЖ.
Следует помнить, что существуют технические и
связанные с пациентом ограничения, т.е . не у каж-
дого пациента при допплерографии выявляются все
признаки. Дополнительными признаками диасто-
лической дисфункции являются ГЛЖ, кардиомио-
патия, легочная гипертензия при отсутствии порока
митрального или аортального клапана, наслед-
ственное заболевание легких, пожилой возраст (70
лет или старше), нарушения локальной сократимо-
сти миокарда и сниженная скорость e′. Диастоличе-
ская дисфункция также часто наблюдается у паци-
ентов с гипертензией в анамнезе, тучных, страдаю-
щих сахарным диабетом, ишемической болезнью
сердца, гипертрофической кардиомиопатией и ре-
стриктивной кардиомиопатией.
ОПРЕДЕЛЕНИЕ ДАВЛЕНИЯ НАПОЛНЕНИЯ
ЛЕВОГО ЖЕЛУДОЧКА
Оценка давления наполнения ЛЖ важна при веде-
нии пациентов и определении прогноза. Оценку
давления наполнения ЛЖ следует проводить ру-
тинно у всех пациентов, особенно с СН и наруше-
нием дыхания. У пациентов с сохранной ФВЛЖ
давление наполнения ЛЖ в норме, если отношение
E/e′ < 8. При отношении скорости E к скорости e′
септальной части ≥ 15, отношении скорости E к ско-
рости e′ латеральной части ≥ 12 или среднем отно-
шении E/e′ ≥ 13 давление наполнения ЛЖ повыше-
но. При значениях отношения E/e′ в диапазоне от 9
до 14 необходимо учесть дополнительные эхокар-
диографические и допплерографические параме-
тры: объем ЛП, систолическое давление в ПП, IVRT,
интервал Ar–A и тип митрального кровотока при
пробе Вальсальвы (рис. 9 .12) [34].
У пациентов со сниженной ФВЛЖ определение
давления наполнения начинают с оценки митраль-
ного кровотока (рис. 9 .13) [34]. Если E/A < 1, давле-
ние наполнения ЛЖ в норме. У пациентов с E/A > 0,8,
но < 2 давление в ЛП нормальное или повышенное.
У этих пациентов следует определять отношение
E/e′. При псевдонормальном или рестриктивном ти-
пе наполнения давление наполнения ЛЖ повышено.
Дополнительные показатели допплерэхокардиогра-
фии могут понадобиться для полной оценки диасто-
лической функции. Точность, чувствительность и
специфичность этих параметров представлены в
табл. 9 .5 [48].
НОВЫЕ ТЕХНОЛОГИИ ДЛЯ ОЦЕНКИ
ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
ДИАСТОЛИЧЕСКАЯ СТРЕСС-ЭХОКАРДИОГРАФИЯ
Диастолическая стресс-ЭхоКГ с физической нагруз-
кой (тест на тредмиле или горизонтальном велоэр-
гометре) у пациентов с одышкой помогает оценить
Септальная e′
Латеральная e′
Объем ЛП
Септальная e′ ≥ 8
Латеральная e′ ≥ 10
ЛП < 34 мл/м2
Нормальная
функция
Септальная e′ ≥ 8
Латеральная e′ ≥ 10
ЛП ≥ 34 мл/м2
Нормальная
функция,
сердце спортсмена,
констрикция
I степень
II степень
III степень
Септальная e′ < 8
Латеральная e′ < 10
ЛП ≥ 34 мл/м2
E/A < 0,8
DT > 200 мсек
Среднее E/e′ ≤ 8
Ardur – Adur < 0 мсек
Проба Вальсальвы ΔE/A < 0,5
E/A < 0,8–1,5
DT > 160–200 мсек
Среднее E/e′ ≤ 9 –12
Ardur – Addur ≥ 30 мсек
Проба Вальсальвы ΔE/A ≥ 0,5
E/A≥2
DT < 160 мсек
Среднее E/e′ ≥ 13
Ardur – Adur ≥ 30 мсек
Проба Вальсальвы ΔE/A ≥ 0,5
Рис. 9 .11 Алгоритм определения степени диастолической дисфункции. Adur — длительность предсердного митрального кровотока; Ardur — длительность
ретроградного потока из предсердия в легочные вены; Av — среднее; DT — время замедления; E — скорость митрального кровотока в раннюю диастолу; e′ —
скорость смещения фиброзного кольца митрального клапана в раннюю диастолу; ЛП — левое предсердие [Nagueh SF, Appleton CP, Gillebert TC, et al. Recommen-
dations for the evaluation of left ventricular diastolic function by echocardiography. J Am Soc Echocardiogr 22:107–133, 2009].
ch09.indd 194
03.04.2019 11:46:11
195
9 Диастолическая функция левого желудочка
E/e′
E/e′ = 9–14
Нормальное
давление в ЛП
Нормальное
давление в ЛП
↑ Давление
вЛП
↑ Давление
вЛП
Септальное E/e′ ≥ 15
или
латеральное E/e′ ≥ 12
или
среднее E/e′ ≥ 13
Объем ЛП < 34 мл/м2
Ardur – Adur < 0 мсек
Проба Вальсальвы ΔE/A < 0,5
PASP<30ммрт.ст.
IVRT/TE–e′ > 2
Объем ЛП ≥ 34 мл/м2
Ardur – Adur ≥ 30 мсек
Проба Вальсальвы ΔE/A ≥ 0,5
PASP>35ммрт.ст.
IVRT/TE–e′ > 2
E/e′ ≤ 8 (септальное,
латеральное или среднее)
Рис. 9.12 Алгоритм оценки давления наполнения левого желудочка у пациентов с нормальной фракцией выброса левого желудочка. Оценку на-
чинают с определения отношения E/e′. D
—
скорость в легочных венах во время диастолы; E — скорость наполнения ЛЖ в раннюю диастолу; e′ — скорость
смещения фиброзного кольца митрального клапана в раннюю диастолу; IVRT — время изоволюмического расслабления; PASP — систолическое давление в ле-
гочных венах; TE–e′
—
временной интервал, получаемый при вычитании времени от комплекса QRS на ЭКГ до начала скорости E из общего временного интерва-
ла от комплекса QRS до начала скорости e′; ЛП — левое предсердие [Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventric-
ular diastolic function by echocardiography. J Am Soc Echocardiogr 22:107–133, 2009].
E/A митрального
кровотока
E/A>1,но<2
илиE/A<1иЕ>50см/сек
Нормальное
давление в ЛП
Нормальное
давление в ЛП
↑ Давление
вЛП
↑ Давление
вЛП
E/средняя e′ > 15
E/Vp ≥ 2,5
S/D>1
Ardur – Adur ≥ 30 мсек
Проба Вальсальвы ΔE/A ≥ 0,5
СДЛА>35ммрт.ст.
IVRT/TE–e′ > 2
E/средняя e′ < 8
E/Vp < 1,4
S/D>1
Ardur – Adur < 0 мсек
Проба Вальсальвы ΔE/A < 0,5
СДЛА<30ммрт.ст.
IVRT/TE–e′ > 2
E/A<1иЕ≤50см/сек
E/A≥2,DT<150мсек
Рис. 9.13 Алгоритм оценки давления наполнения левого желудочка у пациентов со сниженной фракцией выброса левого желудочка. A — ско-
рость митрального кровотока в позднюю диастолу; Adur — длительность предсердного митрального кровотока; Ardur — длительность ретроградного потока из
предсердия в легочные вены; Av — среднее; D — диастолическая скорость кровотока в легочных венах; e′ — скорость смещения фиброзного кольца митраль-
ного клапана в раннюю диастолу; E/Vp — отношение максимальной скорости E к скорости распространения потока; IVRT — время изоволюмического расслабле-
ния; Lat — латеральное; S — систолическая скорость кровотока в легочных венах; ЛП — левое предсердие; СДЛА — систолическое давление в легочных ве-
нах [Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. J Am Soc Echocardiogr
22:107–133, 2009].
диастолическую функцию в покое и при нагрузке
(рис. 9.14) [68]. В предыдущих исследованиях до
42% пациентов с изолированной одышкой, направ-
ленные на стресс-ЭхоКГ, имели признаки индуци-
рованной ишемии, а одышка представляла собой
эквивалент стенокардии [69, 70]. Большинство па-
циентов с одышкой при физической нагрузке, веро-
ятно, имеют диастолическую дисфункцию, которая
ассоциируется с повышением сердечно-сосудистых
событий и смертности [69, 70]. Увеличение отноше-
ния E/e′ при физической нагрузке также является
независимым предиктором сердечно-сосудистых
ch09.indd 195
03.04.2019 11:46:11
196
ЧАСТЬ II Левый желудочек
Параметр
Чувствительность (%)
Специфичность (%)
Площадь под кривой (95% ДИ)
E/A митрального кровотока > 1,37 82
82
0,87 (0,79–0,96)
IVRT < 72 мсек
89
81
0,86 (0,73–0,99)
E/Vp ≥ 2,5
89
83
0,9 (0,81–0,99)
Среднее E/e′ > 15
89
91
0,92 (0,85–1)
PASP > 35 мм рт. ст. по данным
допплерографии
85
92
0,89 (0,92–1)
Индекс объема ЛП > 34 мл/м2
91
33
0,67 (0,52–0,83)
IVRT — время изоволюмического расслабления; PASP — систолическое давление в легочной артерии; ДИ — доверительный интервал.
[Nagueh SF, Bhatt R, Rey PV, et al. Echocardiographic evaluation of hemodynamics in patients with decompensated systolic heart failure. Circ Car-
diovasc Imaging 4:220–227, 2011.]
ТАБЛИЦА 9.5 Выявление пациентов с острой декомпенсированной сердечной недостаточностью, систолической
дисфункцией и давлением заклинивания легочной артерии более 15 мм рт. ст.
событий, который дополняет индуцируемую ише-
мию (рис. 9 .15) [71].
Пациенты могут иметь нормальную диастоличе-
скую функцию в покое, но при нагрузке ЛЖ не мо-
жет улучшить диастолическое наполнение, что при-
водит к снижению ударного объема. Нормальный
диастолический ответ организма здоровых моло-
дых людей и лиц среднего возраста на нагрузку —
увеличение скоростей E и A митрального кровотока
и скорости смещения фиброзного кольца митраль-
ного клапана, что приводит к нормализации отно-
шения E/e′ [72, 73]. У здоровых молодых людей по
E
E
e′
e′
E/e′ = 5,3
E/e′ = 15
А
Б
В
Г
Рис. 9 .14 Допплерограммы митрального кровотока и смещения фи-
брозного кольца митрального клапана при стресс-эхокардиографии.
Пациент 79 лет с гипертензией, ишемической болезнью сердца и операцией
коронарного шунтирования в анамнезе направлен для оценки одышки, возни-
кающей при физической нагрузке. Проведен тест с физической нагрузкой в
течение примерно 7 мин по протоколу Брюса. Исследование остановлено при
появлении нарушений дыхания и усталости. Артериальное давление подня-
лось с 168/86 мм рт. ст. исходно до 180/110 мм рт. ст. на пике нагрузки. При-
знаков ишемии при эхокардиографии выявлено не было. (А, В) Исходно ми-
тральный кровоток демонстрировал нарушение расслабления (А), отношение
E/e′ = 5 ,3 (В). (Б, Г) На пике нагрузки митральный кровоток был псевдонор-
мальным (Б), отношение E/e′ = 15 (Г). Это свидетельствует об ухудшении диа-
столической функции при нагрузке и повышении давления наполнения ЛЖ.
1,0
0,9
0,8
0,7
0,6
0,5
0
500
1000
Время наблюдения (дни)
С
е
р
д
е
ч
н
а
я
с
м
е
р
т
ь
и
л
и
г
о
с
п
и
т
а
л
и
з
а
ц
и
я
1500
n=493
Log rank χ2 = 11,79, р = 0,008
n=216
n=94
n=9
Нормальное E/e′ без ишемии
Повышенное E/e′ без ишемии
Нормальное E/e′ с ишемией
Повышенное E/e′ с ишемией
Рис. 9 .15 Кривые выживаемости по Kaplan–Meier. Пациенты (n = 522)
сгруппированы в соответствии с нормальным или повышенным отношением
E/e′ и наличию или отсутствию ишемии при стресс-ЭхоКГ. Количество пациен-
тов с риском отмечено на оси Х. Пациенты с изолированной ишемией или ише-
мией с повышенным отношением E/e′ имели худшие исходы (p = 0 ,003 для
обеих групп). Разницы в исходах среди пациентов с изолированной ишемией
или изолированным повышением E/e′ не отмечено (p = 0 ,46) [Holland DJ,
Prasad SB, Marwick TH. Prognostic implications of left ventricular filling pressure
with exercise. Circ Cardiovasc Imaging 3:149–156, 2010].
ch09.indd 196
03.04.2019 11:46:12
197
9 Диастолическая функция левого желудочка
сравнению с лицами среднего возраста отмечается
более энергичное расслабление, которое проявляет-
ся повышением скорости E и скорости e′ раннего
наполнения со значительным ростом отношения
E/e′ на пике нагрузки (табл. 9 .6) [73, 74]. У здоровых
лиц сердечный выброс может увеличиваться без
значительных изменений давления наполнения ЛЖ
благодаря повышению скорости расслабления мио-
карда и усиленному раннему диастолическому на-
полнению [74, 75].
В исследование Ha и соавт. [68] были включены
53 пациента с сохранной систолической функцией
ЛЖ (ФВЛЖ > 50%) и без признаков ИБС по данным
катетеризации сердца и стресс-теста или инфаркта
миокарда в анамнезе. Нормальное отношение E/e′
было у 56% пациентов исходно, у 36% отмечалось
увеличение отношения E/e′ на пике нагрузки, что
указывало на повышение давления наполнения ЛЖ
(см. рис. 9.2) [68]. Значимое снижение продолжи-
тельности физической нагрузки было отмечено при
повышении отношения E/e′ при нагрузке. Ско-
рость пикового потока трикуспидальной регургита-
ции при нагрузке значительно возрастает у паци-
ентов с исходно повышенным отношением E/e′.
Более того, повышенное отношение E/e′ по резуль-
татам стресс-ЭхоКГ на горизонтальном велоэргоме-
тре хорошо коррелировало с повышенным конеч-
но-диастолическим давлением в ЛЖ по данным ка-
тетеризации сердца [76, 77]. Отношение E/e′ > 13
имело чувствительность 73% и специфичность 96%
при определении повышенного среднего диастоли-
ческого давления в ЛЖ во время нагрузки [76]. В ис-
следовании Borlaug и соавт. [77] систолическое дав-
ление в ПП, равное 45 мм рт. ст. или выше, имело
чувствительность 96% и специфичность 95% при
выявлении пациентов с СН с сохранной ФВ. Повы-
шенная ригидность ЛЖ, нарушенное расслабление,
а также диссинхрония ЛЖ способствуют повыше-
нию давления наполнения ЛЖ [78, 79]. При исполь-
зовании новых методов визуализации пациентов с
СН с сохранной ФВ наблюдались изменения сис-
толической и диастолической функций, включая
снижение деформации миокарда во время систолы,
ротацию ЛЖ, задержку его раскручивания и напол-
нения со сниженным обратным смещением фи-
брозного кольца митрального клапана, которые
вместе могут способствовать повышению конечно-
диастолического давления в ЛЖ и одышке [80].
Диастолическая стресс-ЭхоКГ может быть цен-
ным методом диагностики СН с сохранной ФВ и
определения прогноза у пациентов с необъяснимой
одышкой, минимальной диастолической дисфунк-
цией и исходно нормальным давлением наполне-
ния ЛЖ. Митральный кровоток и скорость смеще-
ния фиброзного кольца митрального клапана мож-
но измерить после получения изображения для
оценки сократимости миокарда, поскольку измене-
ния диастолической функции могут сохраняться в
течение нескольких минут после пика нагрузки
[81].
ДЕФОРМАЦИЯ
Нарушения сократимости во время систолы легко
выявляются при визуальной оценке локальной со-
кратимости миокарда. Однако доступные в настоя-
щее время методы не позволяют аналогичным об-
разом оценивать локальную диастолическую функ-
цию. Измерение локальной деформации и скорости
деформации позволяет оценить диастолическую
механику на уровне сегментов [82]. Кривые скоро-
сти деформации имеют ранние и поздние диастоли-
ческие пики, схожие с максимальными скоростями
митрального кровотока (рис. 9 .16).
Определенная связь была отмечена между сег-
ментарным расслаблением и глобальной диастоли-
ческой дисфункцией. Говоря обобщенно, при от-
сутствии глобальной диастолической дисфункции
может существовать широкий спектр нарушений
сегментарного расслабления. Глобальная диастоли-
ческая дисфункция, выявляемая с помощью стан-
дартных методов допплерографии, ассоциируется с
определенными вариантами нарушения механики
сегментарного расслабления. Глобальная диастоли-
ческая дисфункция, выявляемая с помощью стан-
дартных допплерографических методик, ассоци-
ируется с определенными вариантами нарушения
механики регионарного расслабления; приблизи-
тельно 12–18 сегментов поражены и имеют изме-
Параметр
Здоровые люди среднего возраста
Здоровые люди молодого возраста
В покое
После нагрузки
В покое
После нагрузки
Скорость E митрального кровотока
(см/сек)
73±19
90±25
81±14
132±15
Средняя скорость e′ (см/сек)
12±4
15±5
14,3 ± 2,5
20,3 ± 2,7
Отношение E/e′
6,7 ± 2,2
6,6 ± 2,5
6,7 ± 1,4
7,1 ± 1,1
* Данные представлены как среднее ± SD.
[Oh JK, Kane GC. Diastolic stress echocardiography: the time has come for its integration into clinical practice. J Am Soc Echocardiogr 27:1060–1063,
2014.]
ТАБЛИЦА 9.6 Нормальные показатели эхокардиографических параметров во время диастолы в покое и после нагрузки*
ch09.indd 197
03.04.2019 11:46:12
198
ЧАСТЬ II Левый желудочек
ненное отношение ранней диастолической дефор-
мации к поздней [82]. Ухудшение диастолической
функции также ассоциируется с увеличением коли-
чества измененных сегментов [82]. Количество сег-
ментов с аномальной диастолической функцией
тесно связано с возрастом и гипертензией [82]. При
идентификации пациентов с риском глобальной
диастолической дисфункции могут быть информа-
тивными деформация и скорость деформации.
Расслабление — энергетически зависимый про-
цесс, для которого необходим гидролиз АТФ. При
локальной ишемии отсутствие АТФ может приве-
сти к снижению темпов расслабления и позднему
началу расслабления. Эту концепцию можно ис-
пользовать при изучении диастолической механики
для выявления ишемии в покое и при нагрузке [83].
При стресс-ЭхоКГ с добутамином отмечалась за-
держка начала механического локального рассла-
бления в ишемизированных сегментах по сравне-
нию с неишемизированными [84].
Скорость диастолической деформации в покое и
время начала локального расслабления достоверно
предсказывали наличие стеноза, выявляемого при
ангиографии [85]. Поскольку диастолическая меха-
ника более чувствительна к локальной ишемии, ве-
роятно, что нарушения диастолической механики
могут наблюдаться дольше, чем нарушения систо-
лической механики. Эту гипотезу дополнительно
оценили при пробе с физической нагрузкой. Ише-
мия, индуцируемая физической нагрузкой, прояв-
лялась систолическими и диастолическими нару-
шениями на пике нагрузки. Систолические наруше-
ния купировались в течение 90 сек после завершения
нагрузки, локальные диастолические нарушения
сохранялись от 5 до 10 мин (рис. 9 .17) [85]. Включе-
ние оценки диастолической механики при нагрузке
в клинический стресс-тест поможет раннему выяв-
лению нарушений и даст возможность зарегистри-
ровать индуцируемую ишемию без получения изо-
бражений в течение нескольких секунд после завер-
шения нагрузки.
В исследовании PARAMOUNT (Prospective Com-
parison of ARNI with ARB on Management of Heart
Failure with Preserved Ejection Fraction Trial) оцени-
вали систолическую деформацию миокарда с помо-
щью спекл-трекинг ЭхоКГ у пациентов с гипертен-
зией и сохранной ФВЛЖ [86]. В этом исследовании
пациенты с СН с сохранной ФВ имели значительно
более низкие значения продольной деформации и
циркулярной деформации, чем в контрольной
группе, причем продольная деформация была нару-
шена больше, чем циркулярная [86]. Нарушение
продольной деформации было выявлено более чем
у 50% пациентов неевропейской расы с СН с со-
хранной ФВ, у которых в анамнезе были указания
на госпитализацию по поводу СН из-за ишемии,
низкую ФВЛЖ, а также более высокие уровни
N-терминального пропептида мозгового натрийу-
ретического пептида (NT-proBNP), но не скорости
e′ или отношения E/e′ [86]. Анализ деформации мо-
жет оказаться важным для выявления пациентов с
систолической дисфункцией и сохранной ФВЛЖ и
оценки прогноза [86, 87].
СКРУЧИВАНИЕ И ВРАЩЕНИЕ ЛЕВОГО ЖЕЛУДОЧКА
Одна из новых областей применения 2D-режима и
3D-режима — анализ деформации миокарда с по-
мощью спекл-трекинг ЭхоКГ.
Спекл-трекинг ЭхоКГ — метод неинвазивной
оценки механики миокарда по отслеживанию дви-
жения спеклов в различных плоскостях, включая
скручивающее (twisting), раскручивающее (untwi-
sting) и вращательное (torsion) движения. При оцен-
2,0
SRE
SRE
SRA
SRA
1,0
–1,0
–2,0
С
к
о
р
о
с
т
ь
д
е
ф
о
р
м
а
ц
и
и
(
с
е
к
–
1
)
Время (сек)
ЭКГ
1
0
0,5
1
1,5
0
0,5
1
1,5
1,5
2
3
2,5
1
1,5
2
3
2,5
3,5
0
А
Б
Рис. 9 .16 Скорость деформации. Результаты определения скорости деформации. (А) Нормальная диастолическая скорость при отношении SRE/SRA >
1. (Б) Нарушения локальной сократимости в диастолу при отношении SRE/SRA < 1. SRA — скорость деформации в позднюю диастолу; SRE — скорость дефор-
мации в раннюю диастолу.
ch09.indd 198
03.04.2019 11:46:12
199
9 Диастолическая функция левого желудочка
ке раскручивания ЛЖ с помощью спекл-трекинг
ЭхоКГ можно оценить диастолическую функцию
ЛЖ.
В сердце есть эндокардиальные волокна, ориен-
тированные по правовращательной спирали, мио-
кардиальные волокна, ориентированные цирку-
лярно, и субэпикардиальные волокна, ориенти-
рованные по левовращательной спирали. Такая
ориентация волокон приводит к скручивающему и
выжимающему кровь движению ЛЖ, когда его вер-
хушка вращается относительно основания против
часовой стрелки вокруг длинной оси [88].
Вращение (torsia) и скручивание (twist) не являют-
ся взаимозаменяемыми терминами. Вращение —
это скручивание, нормализованное к продольной
оси ЛЖ. Во время систолы вращение против часо-
вой стрелки усиливает выброс, ближе к концу си-
столы происходит быстрое обратное вращение, т.е .
раскручивание. Считается, что обратное вращение
способствует активному диастолическому наполне-
нию и усиливает наполнение желудочков в раннюю
диастолу.
Скручивание и скорость скручивания ЛЖ — это
вращение и скорость вращения верхушки ЛЖ от-
носительно его основания. Чтобы измерить скру-
чивание ЛЖ с помощью спекл-трекинг ЭхоКГ в
2D-режиме, необходимо получить изображения
ЛЖ по короткой оси на уровне основания сердца и
верхушки [89]. Также необходима информация о
митральном кровотоке и потоке из ЛЖ, чтобы опре-
делить временные периоды открытия и закрытия
аортального клапана и открытия митрального. Су-
ществующие алгоритмы устанавливают центроид и
рассчитывают временну
́
ю область вращения ЛЖ и
профили скорости вращения ЛЖ. Роль скручива-
ния ЛЖ в выявлении диастолической дисфункции
остается спорной. В небольших исследованиях у па-
циентов с ГЛЖ и сохранной ФВ ЛЖ раннее диасто-
лическое раскручивание и скорость раскручивания
были более низкие и замедленные. В остальных ис-
следованиях разницы между пациентами с ГЛЖ и
контрольной группой из здоровых лиц не отмеча-
ли. Это может быть связано с тем, что при сниже-
нии продольной деформации увеличение скручива-
ния может быть компенсаторным механизмом для
поддержания общей ФВЛЖ. Однако в исследовани-
ях пациентов с СН отмечают более низкую скорость
раскручивания, а задержка апикально-базального
поворота может быть маркером диссинхронии.
Ретроспективное контролируемое исследование
200 пациентов с гипертензией, СН с сохранной ФВ
и систолической СН и контрольной группы из здо-
ровых лиц показало, что скручивание ЛЖ, оце-
ниваемое с помощью спекл-трекинг ЭхоКГ в 3D-
режиме, коррелирует с уровнем мозгового натрий-
уретического пептида и комбинированной конечной
точкой (сердечно-сосудистая смерть и госпитализа-
ция) [90]. Значения глобального скручивания ЛЖ у
здоровых лиц и у пациентов с гипертензией, СН с
сохранной ФВ и систолической СН составили 9,49,
9,77, 8,32 и 4,56° соответственно.
При проведении множественного регрессионно-
го анализа Кокса скручивание ЛЖ ассоциировалось
с комбинированной конечной точкой (сердечно-со-
(%)
433 мсек
300 мсек
400 мсек
383 мсек
506 мсек 717 мсек
500 мсек
35,5
34,6
51,6
35,1
4,5
7,1
8,6
28,9
29,5
28,3
26,2
8,5
ЭКГ
ЭКГ
ЭКГ
% утолщения стенки [%]
% утолщения стенки [%]
% утолщения стенки [%]
622 мсек 1000 мсек
35,5
31,0
26,5
22,0
17,5
13,0
8,5
4,0
–0,5
(%)
(%)
51,0
44,7
38,4
32,1
25,8
19,5
13,2
6,8
0,5
35,3
30,6
25,9
21,1
16,4
11,7
7,0
2,3
–2,4
ЗАК 1/3 длительности фазы диастолы
ЗАК 1/3 длительности фазы диастолы
ЗАК 1/3 длительности фазы диастолы
мсек
мсек
мсек
200
200
200
400
400
400
600
600
800
А
Б
В
Рис. 9 .17 Диастолическая деформация при стресс-тесте. Кривые деформации средних отделов переднесептальной стенки (оранжевый цвет) и средних от-
делов нижнебоковой стенки (фиолетовый цвет). Отношение максимальной систолической деформации (черная стрелка) к диастолической деформации в 1/3 дли-
тельности фазы диастолы (синяя стрелка) является нормальным с исходно нормальной систолической деформацией (А). Снижение отношения со сниженной си-
столической деформацией происходило сразу после нагрузки (Б), это отношение оставалось сниженным в течение 5 мин после прекращения стресс-теста, даже
если систолическая деформация была нормальной (В). ЗАК — закрытие аортального клапана; ЭКГ — электрокардиограмма [Ishii K, Imai M, Suyama T, et al. Ex-
ercise-induced postischemic left ventricular delayed relaxation or diastolic stunning: is it a reliable marker in detecting coronary artery disease? J Am Coll Cardiol 53:698–
705, 2009].
ch09.indd 199
03.04.2019 11:46:12
200
ЧАСТЬ II Левый желудочек
судистая смерть и госпитализация) (ОР 1,15; 95%
ДИ 1,02–1,29). В связи с этим скручивание ЛЖ мо-
жет быть полезным прогностическим маркером у
пациентов с СН, хотя необходимо провести больше
исследований, чтобы выяснить его роль в выборе
терапевтического лечения.
ВЛИЯНИЕ СТАРЕНИЯ ОРГАНИЗМА
НА РАЗВИТИЕ ДИАСТОЛИЧЕСКОЙ ДИСФУНКЦИИ
И СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Старение является доминирующим фактором ри-
ска развития сердечно-сосудистых заболеваний
[91]. Частота этих заболеваний с возрастом возрас-
тает постепенно: более 70% — среди американцев в
возрасте от 60 до 70 лет, более 80% — в возрасте 80
лет и старше [91]. Старение — это патофизиологи-
ческий процесс, ведущий к ухудшению структур-
ных и функциональных свойств сердца. В результа-
те старения сердца возникают (причем независимо
от кардиологических факторов риска) ГЛЖ, диасто-
лическая дисфункция, СН, снижение толерантно-
сти к физической нагрузке и ФП [91–94]. Медленно
прогрессирующие дегенеративные изменения серд-
ца при старении вносят свой вклад в повышение за-
болеваемости и смертности с возрастом, т.к. сердце
становится более восприимчивым к нагрузкам [92].
В патогенезе старения сердца участвует множе-
ство молекулярных механизмов [91]. К развитию
гипертрофии сердца приводят повреждения сиг-
нальных путей питания и роста, особенно регуля-
торного белка mTOR и инсулиноподобного факто-
ра роста 1 [91]. Верифицированное избыточное ко-
личество окисленных продуктов митохондриальной
реакции повреждает митохондриальную дезокси-
рибонуклеиновую кислоту (ДНК), а редокс-чув-
ствительные митохондриальные белки повреждают
клеточные макромолекулы и вмешиваются в сиг-
нальные и энергетические процессы в кардиомио-
цитах [91]. Диспропорциональное отложение вне-
клеточного матрикса и деградация матриксных ме-
таллопротеиназ являются причинами фиброза и
повышения ригидности миокарда и, следовательно,
развития диастолической дисфункции. Еще один
механизм старения сердца — нарушение кальцие-
вого гомеостаза на молекулярном уровне. Наруше-
ние диссоциации кальция из комплекса актин–ми -
озин, секвестрация кальция саркоплазматическим
ретикулумом или удаление кальция из миоцита пу-
тем натриево-кальциевого обмена могут влиять на
расслабление миокарда и, потенциально, на дли-
тельность фазы диастолы [95]. Активация нейро-
гормональной передачи сигналов с помощью ре-
нин-ангиотензин-альдостероновой системы также
влияет на старение сердца. Было показано, что ин-
фузия ангиотензина II животным нарушала у них
расслабление миокарда, индуцировала гипертро-
фию кардиомиоцитов и усиливала фиброз миокар-
да [1]. Постоянная стимуляция бета-адренергиче-
ской системы повышает ЧСС, артериальное давле-
ние, сократимость миокарда, напряжение стенок и
метаболические процессы, что может быть нежела-
тельно долгосрочным [91]. Другие потенциальные
механизмы старения включают дисрегуляцию ми-
крорибонуклеиновой кислоты (микроРНК) и ста-
рение кардиальной клетки-предшественника. Ми-
кроРНК может влиять на связанное с возрастом ре-
моделирование внеклеточного матрикса в сердце.
Кардиальные стволовые клетки и клетки-предше-
ственники в некоторой степени могут регенериро-
вать и в сердце взрослого человека, но в пожилом
возрасте этот процесс прекращается [91].
Понимание молекулярных механизмов старения
поможет в разработке вмешательств с целью пре-
кращения или уменьшения старения сердца, а соот-
ветственно снижения частоты диастолической дис-
функции и СН.
БЛАГОДАРНОСТЬ
Авторы выражают признательность Chintan Desai,
MD, за помощь в написании этой главы, Susan Phil-
lip, RDCS, Kenn Ridley, RDCS, Kenn Ridley и группе
специалистов по ультразвуковой диагностике из
эхокардиографической лаборатории больницы
Johns Hopkins — за предоставленные изображения,
а Juan Carlos Plana, Milind Desai и Alan Klein — за
возможность публикации ключевых иллюстраций
из предыдущего издания.
ch09.indd 200
03.04.2019 11:46:13
201
9 Диастолическая функция левого желудочка
Параметр
Получение изображения
Показатели
Клиническая интерпретация
Митральный
кровоток
Апикальная четырехкамерная позиция
Использование цветовой допплерогра-
фии для оптимального позициониро-
вания контрольного объема размером
1–3 мм в области краев створок
Получение максимальной допплеров-
ской скорости с помощью импуль-
сно-волновой допплерографии
Скорость развертки 100 см/сек
Скорость развертки можно уменьшить
до 25–50 мм/сек, чтобы оценить дыха-
тельные колебания
Фильтр движения миокарда снижают
так, чтобы скорости находились
на базовом уровне
Получение изображения потока
в конце выдоха при спокойном
дыхании
Для оценки IVRT ось сканирования
при непрерывно-волновой или
импульсно-волновой допплерогра-
фии размещают в выходном тракте
ЛЖ, чтобы визуализировать оконча-
ние аортального выброса и начало
митрального потока
Максимальная
скорость E*
Максимальная
скорость A*
Время замедления*
E/A*
IVRT
Adur
Норма:
E/A = 1–2, время замедления
150–240 мсек
Нарушение расслабления (диасто-
лическая дисфункция I степени):
E/A < 1, время замедления
≥ 240 мсек
Псевдонормальный митральный
кровоток (диастолическая дис-
функция II степени):
E/A = 1–1,5, время замедления
150–200 мсек
Проба Вальсальвы для отличия
нормального митрального крово-
тока от псевдонормального
E/A < 1 при исходном отношении
E/A > 1 свидетельствует о псевдо-
нормальном митральном
кровотоке
Волна L помогает идентифициро-
вать псевдонормальный митраль-
ный кровоток
Обратимо рестриктивный тип
наполнения (диастолическая дис-
функция III степени):
E/A > 1,5, время замедления
< 150 мсек
Необратимо рестриктивный тип
наполнения (диастолическая дис-
функция IV степени):
E/A > 1,5, время замедления
< 150 мсек
Отсутствие изменений митрального
кровотока при пробе Вальсальвы
IVRT 70–90 мсек (нормальное)
Тканевая
допплерография
Апикальная четырехкамерная позиция
При импульсно-волновой допплеро-
графии контрольный объем разме-
щают в септальной и латеральной
частях фиброзного кольца митраль-
ного клапана на 1 см от места прикре-
пления створок митрального клапана
Допплеровское сканирование выпол-
няют параллельно продольному сме-
щению фиброзного кольца митраль-
ного клапана
Контрольный объем 5–10 мм
Скорость развертки 50–100 мм/сек
Усиление и миокардиальные фильтры
снижают для получения оптималь-
ных допплеровских сигналов
Шкалу допплеровских скоростей уста-
навливают на уровне 20 см/сек на
всех исходных уровнях и на более
низкий уровень при наличии невысо-
ких допплеровских скоростей
Получение изображения в конце
выдоха в течение 3 усредненных сер-
дечных циклов
Максимальная скорость
e′*
Максимальная скорость
a′*
Максимальная скорость s′
E/e′*
e′/a′
Скорость e′ септальной части
фиброзного кольца < 8 см/сек
и скорость e′ латеральной части
фиброзного кольца < 8,5 см/сек
коррелируют с нарушением
расслабления
Как правило, у пациентов с диасто-
лической дисфункцией отноше-
ние e′/a′ < 1
Оценка давления наполнения ЛЖ:
отношение E/e′ < 8 (нормальное);
отношение E/e′ > 15
(повышенное)
Отношение E/e′ не является точным
показателем у здоровых лиц с
нормальной систолической функ-
цией ЛЖ
СВОДНАЯ ИНФОРМАЦИЯ
Оценка диастолической функции
ch09.indd 201
03.04.2019 11:46:13
202
ЧАСТЬ II Левый желудочек
Параметр
Получение изображения
Показатели
Клиническая интерпретация
Допплерография
легочных вен
Апикальная четырехкамерная позиция.
Обычно исследуют верхнюю правую
легочную вену
При импульсно-волновой допплеро-
графии контрольный объем размером
3–4 мм позиционируют внутрь вены
на 1–2 см
Фильтры настраивают на 200 Гц
Скорость развертки 50–100 мм/сек
Оценка изображения в конце выдоха
в течение 3 усредненных сердечных
циклов
Максимальная скорость S
Максимальная скорость D
S/D
Максимальная скорость
Ar
Adur
У здоровых взрослых S/D > 1
При повышении давления наполне-
нияЛЖS/D<1
У молодых лиц в возрасте < 40 лет
может быть S/D < 1 вследствие
повышенного активного
наполнения
Ar ≥ 35 см/сек свидетельствует
о повышенном конечно-диастоли-
ческом давлении в ЛЖ
Adur – Ar > 30 мсек свидетельствует
о повышенном конечно-диастоли-
ческом давлении в ЛЖ
Цветовая доппле-
рография
в М-режиме
Апикальная четырехкамерная позиция
Курсор параллелен митральному
кровотоку
Оптимизация глубины сканирования
для визуализации фиброзного кольца
митрального клапана и полости ЛЖ
(4 см)
Скорость наложения спектров
0,5–0,7 м/сек
Скорость развертки 100–200 мм/сек
Получение изображения на высоте
выдоха
Скорость Vp
Vp ≥ 50 см/сек (нормальная) (
При задержке расслабления, угол
наклона становится более
пологим, а Vp < 50 см/сек
Vp наиболее точно определяется
при дилатированном ЛЖ с дис-
функцией ЛЖ
Объем ЛП
Апикальные четырехкамерная и двух-
камерная позиции
Оптимизация измерения ЛП
Определяется в конце систолы, когда
размеры ЛП наибольшие, обычно за
один кадр до открытия митрального
клапана
Исключить устья легочных вен, ушко
ЛП, зону под фиброзным кольцом
митрального клапана
Длина ЛП в четырех- и двухкамерной
позициях должна быть одинаковой
Использование техники площадь–
длина или бипланарного метода
дисков
Объем ЛП, индексирован-
ный к площади поверх-
ности тела*
Верхний предел нормы для индек-
сированного объема ЛП для
мужчин и женщин — 34 мл/м2
Незначительное нарушение:
35–41 мл/м2
Умеренное нарушение: 42–48 мл/м2
Выра женное нарушение: > 48 мл/м2
Систолическое
давление в ПЖ
Непрерывно-волновая допплерография
трикуспидальной регургитации
Несколько позиций для визуализации
трикуспидальной регургитации,
чтобы получить максимальную ско-
рость при допплерографии
Измерение давления в ПП путем
оценки диаметра НПВ и ее спадения
на вдохе
НПВ измеряют на высоте выдоха
непосредственно проксимально
относительно печеночной вены
Отношение систоличе-
ского давления в ПЖ к
систолическому давле-
нию в легочной
артерии*
При отсутствии болезней легких
систолическое давление в легоч-
ной артерии > 35 мм рт. ст. свиде-
тельствует о наличии диастоличе-
ской дисфункции
Если диаметр НПВ ≤ 2,1 см и спаде-
ние > 50%, давление в ПП состав-
ляет 3 мм рт. ст.
Если НПВ < 2,1 см и спадение
< 50%, давление в ПП составляет
8ммртст.
Если НПВ > 2,1 см и спадение
> 50%, давление в ПП составляет
8ммрт.ст.
Если НПВ > 2,1 см и спадение
< 50%, давление в ПП составляет
15 мм рт. ст.
* Ключевые параметры.
IVRT — время изоволюмического расслабления; ЛЖ — левый желудочек; ЛП — левое предсердие; НПВ — нижняя полая вена; ПЖ —
правый желудочек; ПП — правое предсердие.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Оценка диастолической функции
ch09.indd 202
03.04.2019 11:46:13
203
9 Диастолическая функция левого желудочка
ЛИТЕРАТУРА
1. Ferrari R, Bo
hm M, Cleland JG, et al. Heart
failure with preserved ejection fraction: un-
certainties and dilemmas, Eur J Heart Fail
17:665–671, 2015.
2. Bhatia RS, Tu JV, Lee DS, et al. Outcome of
heart failure with preserved ejection fraction
in a population-based study, N Engl J Med
355:260–269, 2006.
3. Burkhoff D. Mortality in heart failure with
preserved ejection fraction: an unacceptably
high rate, Eur Heart J 33:1718–1720, 2012.
4. Meta-Analysis Global Group in Chronic
Heart Failure (MAGGIC). The survival of pa-
tients with heart failure with preserved or re-
duced left ventricular ejection fraction: an in-
dividual patient data meta-analysis, Eur Heart
J 33:1750–1757, 2012.
5. Flachskampf FA, Biering-Sorensen T, Solo-
mon SD, et al. Cardiac imaging to evaluate
left ventricular diastolic function, JACC Car-
diovasc Imaging 8:1071–1093, 2015.
6. Bonnema D, Baicu C, Zile M. Pathophysiol-
ogy of diastolic heart failure: relaxation and
stiffness. In Klein A, Garcia M, editors: Di-
astology: clinical approach to diastolic heart
failure, Philadelphia, 2008, Saunders.
7. Little WC, Downes TR. Clinical evaluation of
left ventricular diastolic performance, Prog
Cardiovasc Dis 32:273–290, 1990.
8. Oh JK, Park SJ, Nagueh SF. Established and
novel clinical applications of diastolic func-
tion assessment by echocardiography, Circ
Cardiovasc Imaging 4:444–455, 2011.
9. Cohen GI, Pietrolungo JF, Thomas JD, Klein
AL. A practical guide to assessment of ven-
tricular diastolic function using Doppler
echocardiography, J Am Coll Cardiol 27:1753–
1760, 1996.
10. Klein AL, Burstow DJ, Tajik AJ, et al. Effects
of age on left ventricular dimensions and fill-
ing dynamics in 117 normal persons, Mayo
Clin Proc 69:212–224, 1994.
11. Pearson AC, Gudipati CV, Labovitz AJ. Ef-
fects of aging on left ventricular structure and
function, Am Heart J 121(3 Pt 1):871–875,
1991.
12. Benjamin EJ, Levy D, Anderson KM, et al.
Determinants of Doppler indexes of left ven-
tricular diastolic function in normal subjects
(the Framingham Heart Study), Am J Cardiol
70:508–515, 1992.
13. Sagie A, Benjamin EJ, Galderisi M, et al. Ref-
erence values for Doppler indexes of left ven-
tricular diastolic filling in the elderly, J Am
Soc Echocardiogr 6:570–576, 1993.
14. Tighe DA, Vinch CS, Hill JC, et al. Influence
of age on assessment of diastolic function by
Doppler tissue imaging, Am J Cardiol 91:254–
257, 2003.
15. Munagala VK, Jacobsen SJ, Mahoney DW, et
al. Association of newer diastolic function pa-
rameters with age in healthy subjects: a pop-
ulation-based study, J Am Soc Echocardiogr
16:1049–1056, 2003.
16. Dalen H, Thorstensen A, Vatten LJ, et al. Ref-
erence values and distribution of convention-
al echocardiographic Doppler measures and
longitudinal tissue Doppler velocities in a
population free from cardiovascular disease,
Circ Cardiovasc Imaging 3:614–622, 2010.
17. Yingchonchareon T, Wuttichaipradit C, Klein
AL. Echo Doppler parameters of diastolic
function. In Lange RM, Goldstein SA, Kro-
nzon I, et al. ASE’s comprehensive echocardiog-
raphy, ed 2, Philadelphia, 2016, Saunders.
18. Ha JW, Oh JK, Redfield MM, et al. Triphasic
mitral inflow velocity with middiastolic fill-
ing: clinical implications and associated echo-
cardiographic findings, J Am Soc Echocardiogr
17:428–431, 2004.
19. Lam CS, Han L, Ha JW, et al. The mitral L
wave: a marker of pseudonormal filling and
predictor of heart failure in patients with left
ventricular hypertrophy, J Am Soc Echocar-
diogr 18:336–341, 2005.
20. Dumesnil JG, Gaudreault G, Honos GN,
Kingma JG. Use of Valsalva maneuver to un-
mask left ventricular diastolic function ab-
normalities by Doppler echocardiography in
patients with coronary artery disease or sys-
temic hypertension, Am J Cardiol 68:515–519,
1991.
21. Hurrell DG, Nishimura RA, Ilstrup DM, Ap-
pleton CP. Utility of preload alteration in as-
sessment of left ventricular filling pressure by
Doppler echocardiography: a simultaneous
catheterization and Doppler echocardio-
graphic study, J Am Coll Cardiol 30:459–467,
1997.
22. Nishimura RA, Tajik AJ. The Valsalva maneu-
ver-3 centuries later, Mayo Clin Proc 79:577–
578, 2004.
23. Rossvoll O, Hatle LK. Pulmonary venous
flow velocities recorded by transthoracic
Doppler ultrasound: relation to left ventricu-
lar diastolic pressures, J Am Coll Cardiol
21:1687–1696, 1993.
24. Pinamonti B, Di Lenarda A, Sinagra G, Cam-
erini F. Restrictive left ventricular filling pat-
tern in dilated cardiomyopathy assessed by
Doppler echocardiography: clinical, echocar-
diographic and hemodynamic correlations
and prognostic implications. Heart Muscle
Disease Study Group, J Am Coll Cardiol
22:808–815, 1993.
25. Redfield MM, Jacobsen SJ, Burnett JC, et al.
Burden of systolic and diastolic ventricular
dysfunction in the community: appreciating
the scope of the heart failure epidemic, JAMA
289:194–202, 2003.
26. Gottdiener JS, Arnold AM, Aurigemma GP,
et al. Predictors of congestive heart failure in
the elderly: the Cardiovascular Health Study,
J Am Coll Cardiol 35:1628–1637, 2000.
27. AlJaroudi W, Alraies C, Halley C, et al. Impact
of progression of diastolic dysfunction on
mortality in patients with normal ejection
fraction, Circulation 125:782–788, 2012.
28. Kane GC, Karon BL, Mahoney DW, et al. Pro-
gression of left ventricular diastolic dysfunc-
tion and risk of heart failure, JAMA 306:856–
863, 2011.
29. Choong CY, Herrmann HC, Weyman AE, Fi-
fer MA. Preload dependence of Doppler-de-
rived indexes of left ventricular diastolic
function in humans, J Am Coll Cardiol
10:800–808, 1987.
30. Kuo LC, Quinones MA, Rokey R, et al. Quan-
tification of atrial contribution to left ven-
tricular filling by pulsed Doppler echocar-
diography and the effect of age in normal and
diseased hearts, Am J Cardiol 59:1174–1178,
1987.
31. Nishimura RA, Tajik AJ. Evaluation of dia-
stolic filling of left ventricle in health and dis-
ease: Doppler echocardiography is the clini-
cian’s Rosetta Stone, J Am Coll Cardiol 30:8–
18, 1997.
32. Klein AL, Tajik AJ. Doppler assessment of
pulmonary venous flow in healthy subjects
and in patients with heart disease, J Am Soc
Echocardiogr 4:379–392, 1991.
33. Grodecki PV, Klein AL. Pitfalls in the echo-
Doppler assessment of diastolic dysfunction,
Echocardiography 10:213–234, 1993.
34. Nagueh SF, Appleton CP, Gillebert TC, et al.
Recommendations for the evaluation of left
ventricular diastolic function by echocardiog-
raphy, J Am Soc Echocardiogr 22:107–133,
2009.
35. Appleton CP, Galloway JM, Gonzalez MS, et
al. Estimation of left ventricular filling pres-
sures using two-dimensional and Doppler
echocardiography in adult patients with car-
diac disease. Additional value of analyzing
left atrial size, left atrial ejection fraction and
the difference in duration of pulmonary ve-
nous and mitral flow velocity at atrial con-
traction, J Am Coll Cardiol 22:1972–1982,
1993.
36. Garcia MJ, Ares MA, Asher C, et al. An index
of early left ventricular filling that combined
with pulsed Doppler peak E velocity may es-
timate capillary wedge pressure, J Am Coll
Cardiol 29:448–454, 1997.
37. Firstenberg MS, Levine BD, Garcia MJ, et al.
Relationship of echocardiographic indices to
pulmonary capillary wedge pressures in
healthy volunteers, J Am Coll Cardiol 36:1664–
1669, 2000.
38. Nagueh SF, Middleton KJ, Kopelen HA, et al.
Doppler tissue imaging: a noninvasive tech-
nique for evaluation of left ventricular relax-
ation and estimation of filling pressures, J Am
Coll Cardiol 30:1527–1533, 1997.
39. Nagueh SF, Middleton KJ, Kopelen HA, et al.
Doppler tissue imaging: a noninvasive tech-
nique for evaluation of left ventricular relax-
ation and estimation of filling pressures, J Am
Coll Cardiol 30:1527–1533, 1997.
40. Sohn DW, Chai IH, Lee DJ, et al. Assessment
of mitral annulus velocity by Doppler tissue
imaging in the evaluation of left ventricular
diastolic function, J Am Coll Cardiol 30:474–
480, 1997.
41. Ha JW, Oh JK, Ling LH, et al. Annulus para-
doxus: transmitral flow velocity to mitral an-
nular velocity ratio is inversely proportional
to pulmonary capillary wedge pressure in pa-
tients with constrictive pericarditis, Circula-
tion 104:976–978, 2001.
42. Reuss CS, Wilansky SM, Lester SJ, et al. Us-
ing mitral ‘annulus reversus’ to diagnose con-
strictive pericarditis, Eur J Echocardiogr
10:372–375, 2009.
43. Welch TD, Ling LH, Espinosa RE, et al. Echo-
cardiographic diagnosis of constrictive peri-
carditis: Mayo Clinic criteria, Circ Cardiovasc
Imaging 7:526–534, 2014.
44. Rajagopalan N, Garcia MJ, Rodriguez L, et al.
Comparison of new Doppler echocardio-
graphic methods to differentiate constrictive
pericardial heart disease and restrictive car-
diomyopathy, Am J Cardiol 87:86–94, 2001.
45. Ommen SR, Nishimura RA, Appleton CP, et
al. Clinical utility of Doppler echocardiogra-
phy and tissue Doppler imaging in the estima-
tion of left ventricular filling pressures: a
comparative simultaneous Doppler-catheter-
ization study, Circulation 102:1788–1794,
2000.
46. Paulus WJ, Tscho
pe C, Sanderson JE, et al.
How to diagnose diastolic heart failure: a con-
sensus statement on the diagnosis of heart
failure with normal left ventricular ejection
fraction by the Heart Failure and Echocar-
diography Associations of the European So-
ciety of Cardiology, Eur Heart J 28:2539–
2550, 2007.
ch09.indd 203
03.04.2019 11:46:13
204
ЧАСТЬ II Левый желудочек
47. Santos M, Rivero J, McCullough SD, et al. E/e’
ratio in patients with unexplained dyspnea:
lack of accuracy in estimating left ventricular
filling pressure, Circ Heart Fail 8:749–756,
2015.
48. Nagueh SF, Bhatt R, Vivo RP, et al. Echocar-
diographic evaluation of hemodynamics in
patients with decompensated systolic heart
failure, Circ Cardiovasc Imaging 4:220–227,
2011.
49. Geske JB, Sorajja P, Nishimura RA, Ommen
SR. Evaluation of left ventricular filling pres-
sures by Doppler echocardiography in pa-
tients with hypertrophic cardiomyopathy:
correlation with direct left atrial pressure
measurement at cardiac catheterization, Cir-
culation 116:2702–2708, 2007.
50. Ruan Q, Nagueh SF. Clinical application
of tissue Doppler imaging in patients with
idiopathic pulmonary hypertension, Chest
131:395–401, 2007.
51. Wang M, Yip GW, Wang AY, et al. Peak ear-
ly diastolic mitral annulus velocity by tissue
Doppler imaging adds independent and in-
cremental prognostic value, J Am Coll Cardiol
41:820–826, 2003.
52. Dokainish H, Zoghbi WA, Lakkis NM, et al.
Incremental predictive power of B-type natri-
uretic peptide and tissue Doppler echocar-
diography in the prognosis of patients with
congestive heart failure, J Am Coll Cardiol
45:1223–1226, 2005.
53. Hillis GS, Moller JE, Pellikka PA, et al. Non-
invasive estimation of left ventricular filling
pressure by E/e’ is a powerful predictor of
survival after acute myocardial infarction, J
Am Coll Cardiol 43:360–367, 2004.
54. Nagueh SF, Mikati I, Kopelen HA, et al. Dop-
pler estimation of left ventricular filling pres-
sure in sinus tachycardia. A new application
of tissue Doppler imaging, Circulation
98:1644–1650, 1998.
55. Nagueh SF, Kopelen HA, Quinones MA. As-
sessment of left ventricular filling pressures
by Doppler in the presence of atrial fibrilla-
tion, Circulation 94:2138–2145, 1996.
56. Thamilarason M, Grimm RA, Rodriguez LL,
et al. Left ventricular diastolic dysfunction in
lone atrial fibrillation determined by Doppler
tissue imaging of mitral annular motion, Am
J Cardiol 86:1026–1029, 2000.
57. Sohn DW, Song JM, Zo JH, et al. Mitral an-
nulus velocity in the evaluation of left ven-
tricular diastolic function in atrial fibrillation,
J Am Soc Echocardiogr 12:927–931, 1999.
58. Hurrell DG, Oh JK, Mahoney DW, et al. Short
deceleration time of mitral inflow E velocity:
prognostic implication with atrial fibrillation
versus sinus rhythm, J Am Soc Echocardiogr
11:450–457, 1998.
59. Okura H, Takada Y, Kubo T, et al. Tissue
Doppler-derived index of left ventricular fill-
ing pressure, E/E’, predicts survival of pa-
tients with non-valvular atrial fibrillation,
Heart 92:1248–1252, 2006.
60. Diwan A, McCulloch M, Lawrie GM, et al.
Doppler estimation of left ventricular filling
pressures in patients with mitral valve disease,
Circulation 111:3281–3289, 2005.
61. Abhayaratna WP, Seward JB, Appleton CP, et
al. Left atrial size: physiologic determinants
and clinical applications, J Am Coll Cardiol
47:2357–2363, 2006.
62. Hoit BD. Left atrial size and function: role in
prognosis, J Am Coll Cardiol 63:493–505, 2014.
63. Dokainish H, Nguyen JS, Segupta R, et al. Do
additional echocardiographic variables in-
crease the accuracy of E/e’ for predicting left
ventricular filling pressure in normal ejection
fraction? An echocardiographic and invasive
hemodynamic study, J Am Soc Echocardiogr
23:156–161, 2010.
64. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39.e14, 2015.
65. Blume GG, Mcleod CJ, Barnes ME, et al. Left
atrial function: physiology, assessment, and
clinical implications, Eur J Echocardiogr
12:421–430, 2011.
66. Bouchard JL, Aurigemma GP, Hill JC, et al.
Usefulness of the pulmonary arterial systolic
pressure to predict pulmonary arterial wedge
pressure in patients with normal left ventric-
ular systolic function, Am J Cardiol 101:1673–
1676, 2008.
67. Neuman Y, Kotliroff A, Bental T, et al. Pul-
monary artery pressure and diastolic dys-
function in normal left ventricular systolic
function, Int J Cardiol 127:174–178, 2008.
68. Ha JW, Oh JK, Pellikka PA, et al. Diastolic
stress echocardiography: a novel noninvasive
diagnostic test for diastolic dysfunction us-
ing supine bicycle exercise Doppler echocar-
diography, J Am Soc Echocardiogr 18:63–68,
2005.
69. Bergeron S, Ommen SR, Bailey KR, et al. Ex-
ercise echocardiographic findings and out-
come of patients referred for evaluation of
dyspnea, J Am Coll Cardiol 43:2242–2246,
2004.
70. Argulian E, Halpern DG, Agarwal V, et al.
Predictors of ischemia in patients referred for
evaluation of exertional dyspnea: a stress
echocardiography study, J Am Soc Echocar-
diogr 26:72–76, 2013.
71. Holland DJ, Prasad SB, Marwick TH. Prog-
nostic implications of left ventricular filling
pressure with exercise, Circ Cardiovasc Imag-
ing 3:149–156, 2010.
72. Ha JW, Lulic F, Bailey KR, et al. Effects of
treadmill exercise on mitral inflow and annu-
lar velocities in healthy adults, Am J Cardiol
91:114–115, 2003.
73. Burgess MI, Jenkins C, Sharman JE, Marwick
TH. Diastolic stress echocardiography: hemo-
dynamic validation and clinical significance
of estimation of ventricular filling pressure
with exercise, J Am Coll Cardiol 47:1891–
1900, 2006.
74. Studer Bruengger AA, Kaufmann BA, Buser
M, et al. Diastolic stress echocardiography in
the young: a study in nonathletic and endur-
ance-trained healthy subjects, J Am Soc Echo-
cardiogr 27:1053–1059, 2014.
75. Oh JK, Kane GC. Diastolic stress echocardiog-
raphy: the time has come for its integration
into clinical practice, J Am Soc Echocardiogr
27:1060–1063, 2014.
76. Talreja DR, Nishimura RA, Oh JK. Estimation
of left ventricular filling pressure with exercise
by Doppler echocardiography in patients with
normal systolic function: a simultaneous echo-
cardiographic-cardiac catheterization study, J
Am Soc Echocardiogr 20:477–479, 2007.
77. Borlaug BA, Nishimura RA, Sorajja P, et al.
Exercise hemodynamics enhance diagnosis of
early heart failure with preserved ejection
fraction, Circ Heart Fail 3:588–595, 2010.
78. Ruan Q, Nagueh SF. Clinical application of
tissue Doppler imaging in patients with
idiopathic pulmonary hypertension, Chest
131:395–401, 2007.
79. Zile MR, Baicu CF, Gaasch WH. Diastolic
heart failure—abnormalities in active relax-
ation and passive stiffness of the left ventri-
cle, N Engl J Med 350:1953–1959, 2004.
80. Tan YT, Wenzelburger F, Lee E, et al. The
pathophysiology of heart failure with normal
ejection fraction: exercise echocardiography
reveals complex abnormalities of both systol-
ic and diastolic ventricular function involving
torsion, untwist, and longitudinal motion, J
Am Coll Cardiol 54:36–46, 2009.
81. Ha JW, Choi EY, Choi D, et al. Time course
of recovery of left ventricular filling pressure
after exercise in healthy subjects, Circ J
72:186–188, 2008.
82. Takemoto Y, Pellikka PA, Wang J, et al. Anal-
ysis of the interaction between segmental re-
laxation patterns and global diastolic function
by strain echocardiography, J Am Soc Echo-
cardiogr 18:901–906, 2005.
83. Liang HY, Cauduro S, Pellikka P, et al. Use-
fulness of two-dimensional speckle strain for
evaluation of left ventricular diastolic defor-
mation in patients with coronary artery dis-
ease, Am J Cardiol 98:1581–1586, 2006.
84. Abraham TP, Belohlavek M, Thomson HL, et
al. Time to onset of regional relaxation: fea-
sibility, variability and utility of a novel index
of regional myocardial function by strain rate
imaging, J Am Coll Cardiol 39:1531–1537,
2002.
85. Ishii K, Imai M, Suyama T, et al. Exercise-in-
duced post-ischemic left ventricular delayed
relaxation or diastolic stunning: is it a reliable
marker in detecting coronary artery disease?
J Am Coll Cardiol 53:698–705, 2009.
86. Kraigher-Krainer E, Shah AM, Gupta DK, et al.
Impaired systolic function by strain imaging in
heart failure with preserved ejection fraction, J
Am Coll Cardiol 63:447–456, 2014.
87. Shah AM, Claggett B, Sweitzer NK, et al.
Prognostic importance of impaired systolic
function in heart failure with preserved ejec-
tion fraction and the impact of spironolac-
tone, Circulation 132:402–414, 2015.
88. Sengupta PP, Tajik AJ, Chandrasekaran K,
Khandheria BK. Twist mechanics of the left
ventricle: principles and application, JACC
Cardiovasc Imaging 1:366–376, 2008.
89. Takeuchi M, Otsuji Y, Lang RM. Evaluation
of left ventricular function using left ventric-
ular twist and torsion parameters, Curr Car-
diol Rep 11:225–230, 2009.
90. Chang SN, Lai YH, Yen CH, et al. Cardiac me-
chanics and ventricular twist by three-dimen-
sional strain analysis in relation to B-type na-
triuretic peptide as a clinical prognosticator
for heart failure patients, PLoS One 9:e115260,
2014.
91. Chiao YA, Rabinovitch PS. The aging heart,
Cold Spring Harb Perspect Med 5:a025148,
2015.
92. Wu JXS, Kalionis B, Wan W, Sun T. The role
of oxidative stress and inflammation in car-
diovascular aging, BioMed Res Int 2014:1–13,
2014.
93. Phillip JM, Aifuwa I, Walston J, Wirtz D. The
mechanobiology of aging, Annu Rev Biomed
Eng 17:113–141, 2015.
94. Borlaug BA. The pathophysiology of heart
failure with preserved ejection fraction, Nat
Rev Cardiol 11:507–515, 2014.
95. Borlaug BA, Kass DA. Mechanisms of diastol-
ic dysfunction in heart failure, Trends Cardio-
vasc Med 16:273–279, 2006.
ch09.indd 204
03.04.2019 11:46:13
205
Определение и необходимость
обработки цифрового изображения
Сжатие, хранение и передача
цифрового изображения
Цифровые изображения
Хранение и передача изображения
Сжатие изображения
Обработка цифрового
изображения
Улучшение изображения
Интерпретация изображения
Автоматизированное определение
границ при эхокардиографии
Проблемы и подводные камни
Практические аспекты
Методы автоматизированного
определения границ
Методы, управляемые
функциональностью
Метод, основанный на оценке структуры
Методы, основанные на анализе
объекта: геометрическое
моделирование
Методы, основанные на геометрических
моделях и сопоставлении с образцом
Трехмерное активное определение
поверхности
Методы, основанные на популяционной
модели: активные модели внешнего
вида
Автоматизированное определение
расположения структур
Сравнение методов
автоматизированного определения
границ
Перспективы
10 Обработка цифрового изображения
и его автоматизированный анализ
при эхокардиографии
JOHAN G. BOSCH, PHD
Сегодня функция обработки цифрового изображе-
ния есть в любой ультразвуковой системе или авто-
номной системе анализа. Ультразвуковые системы
стали полностью компьютеризированными. Сохра-
нение и обработка цифрового изображения как для
улучшения его качества, так и для его анализа, ста-
ли стандартными функциями. В настоящее время
доступны несколько систем автоматизированного
анализа изображений, получаемых при двухмерной
(2D) и трехмерной (3D) эхокардиографии (ЭхоКГ),
быстро появляются новые методы автоматизирован-
ного анализа.
Автоматизированный подход включает автома-
тизированное определение локализации структуры,
автоматизированное определение границы (АОГ),
спекл-трекинг, классификацию тканей/функций и
компьютерную диагностику. Автоматизированный
подход обеспечивает кардиолога и специалиста по
ультразвуковой диагностике объективными и коли-
чественными методами диагностики, необходимы-
ми в научных исследованиях и клинической прак-
тике. Тем не менее, ультразвуковое изображение
трудно интерпретировать как человеку, так и ком-
пьютеру. В этой главе приведен обзор методов, до-
ступных клиницистам, описаны возможности и
ограничения методов, а также приведены некото-
рые практические рекомендации по выбору мето-
дов с акцентом на АОГ.
ОПРЕДЕЛЕНИЕ И НЕОБХОДИМОСТЬ ОБРАБОТКИ
ЦИФРОВОГО ИЗОБРАЖЕНИЯ
Обработка цифрового изображения — это измене-
ние и анализ изображения с помощью компьютера.
Усиление изображения используют с целью улучше-
ния его качества для визуальной интерпретации
или последующего автоматизированного анализа.
Методы усиления изображений разнообразны: от
изменения контрастности до применения специаль-
ных фильтров. Анализ изображения обычно включа-
ет получение количественных данных. Анализ изо-
бражения часто заключается в автоматизированном
определении локализации и границ интересующих
структур или отслеживании их движения. Основ-
ной интерес при ЭхоКГ представляет миокард лево-
го желудочка (ЛЖ). Определение границ эндокарда
ЛЖ позволяет количественно определить площадь
полости ЛЖ, его форму, объем и т.д. В сочетании с
ch10.indd 205
03.04.2019 11:46:36
206
ЧАСТЬ II Левый желудочек
определением границ это позволяет рассчитать утол-
щение стенки ЛЖ и обнаружить объемные образо-
вания. Запись движения тканей или их границ во
время сердечного цикла позволяет рассчитать ло-
кальное смещение стенки, скорость, относительное
укорочение и т.д . Подобный анализ можно прове-
сти с правым желудочком (ПЖ), предсердиями и
клапанами.
В клинической практике количественная оценка
до сих пор не очень распространена, по-прежнему
ведущую роль играют визуальная оценка параме-
тров (например, фракции выброса) и полуколиче-
ственная оценка (например, оценка локальной со-
кратимости миокарда при стресс-ЭхоКГ). Визуаль-
ную оценку можно выполнить быстро, и некоторые
врачи достигают замечательной точности. Однако в
целом визуальная оценка субъективна, поэтому
обеспечивает неточными, невоспроизводимыми и
трудными для учета данными [1]. Визуальную оцен-
ку параметров, которые можно определить количе-
ственно, не следует проводить при наличии хоро-
шего количественного метода, за исключением ори-
ентировочных классификаций. Количественный
анализ рекомендуется в тех случаях, когда проводят
повторяющиеся интерпретации, исследуют незна-
чительные изменения, опыт врача в интерпретации
ограничен, а также когда проводят научные иссле-
дования. American Society of Echocardiography (ASE)
и European Association of Cardiovascular Imaging
(EACVI) рекомендуют применять количественные
методы [2, 3].
Классический метод выделения границ — руч-
ной. Это можно сделать на любой ультразвуковой
системе или в автономной системе анализа с помо-
щью мыши или трекбола. Однако известно, что
этот метод имеет высокую межисследовательскую и
внутриисследовательскую вариабельность. Он за-
тратен по времени и требует от оператора опреде-
ленных усилий, мастерства и сноровки. Выделять
границы вручную особенно трудно при больших
объемах изображений, например при анализе не-
скольких полных сердечных циклов, множества
изображений в поперечном сечении, на нескольких
этапах исследования (как при стресс-ЭхоКГ) либо
при анализе сотен кадров в 2D-режиме для получе-
ния трехмерного изображения полного сердечного
цикла. АОГ может решить эту проблему. Кроме то-
го, АОГ позволит проводить мониторинг параме-
тров в режиме реального времени.
Автоматизированный анализ может помочь в
исследованиях, зависящих в настоящий момент от
визуальной оценки сократимости миокарда (напри-
мер, стресс-ЭхоКГ). Серьезными ограничениями
являются отсутствие возможности количественной
оценки, большая межисследовательская, внутриис-
следовательская и межорганизационная вариабель-
ность результатов [4]. 3D-ЭхоКГ в режиме реально-
го времени для оценки объема и количественной
оценки локальной сократимости миокарда также
значительно зависит от автоматизированного ана-
лиза.
СЖАТИЕ, ХРАНЕНИЕ И ПЕРЕДАЧА
ЦИФРОВОГО ИЗОБРАЖЕНИЯ
ЦИФРОВЫЕ ИЗОБРАЖЕНИЯ
В любой современной ультразвуковой системе изо-
бражение создается в цифровом виде. Физические
процессы при получении цифровых ультразвуко-
вых изображений в этой главе рассматриваться не
будут. Читатель может прочитать о них во многих
руководствах [5, 6, 7].
Цифровые изображения состоят из пикселов
(элементов изображения), в которых яркость или
цвет описаны числовым значением. Уровень ярко-
сти (интенсивность) представлен значением шкалы
оттенков серого. Видеозапись — это последователь-
ность отдельных изображений обычно с частотой
кадров от 20 до 200 в секунду. Цифровое представ-
ление информации позволяет сохранить и обрабо-
тать изображения на компьютере. Современные
ультразвуковые системы имеют функции хранения
и передачи как изображений, так и видеозаписей.
Цифровое изображение конвертируется в аналого-
вый видеосигнал только при показе на видеомони-
торе и записи на видеомагнитофоне. Для аналити-
ческих целей использовать аналоговый видеосигнал
или запись на видеомагнитофон не рекомендуется.
Технически возможна оцифровка аналогового ви-
деосигнала с помощью устройств видеозахвата, но
это приводит к потере информации и ухудшению
качества изображения (уменьшению пространствен-
ного разрешения, частоты кадров, интенсивности и
точности). Исчезнут разделение изображений, гра-
фики и цветовые наложения, калибровка и инфор-
мация о пациенте.
ХРАНЕНИЕ И ПЕРЕДАЧА ИЗОБРАЖЕНИЯ
ЦИФРОВОЕ ИЗОБРАЖЕНИЕ И КОММУНИКАЦИИ В МЕДИЦИНЕ
Методом выбора для хранения и передачи цифро-
вого изображения является стандарт DICOM (Digital
Imaging and Communications in Medicine) [8]. Это
общепринятый международный стандарт для полу-
чения изображений в медицине, в том числе ультра-
звуковых. Стандарт DICOM (текущая версия: 2015)
постоянно расширяется и совершенствуется для
поддержки новых методов визуализации в медици-
не. Как следует из названия, DICOM — это стандарт
передачи информации, а не формат файла. DICOM
определяет, как ультразвуковая система, сервер ар-
хивирования изображений, системы коммуника-
ции и принтеры связаны между собой для передачи,
хранения, восстановления, обнаружения или печа-
ти изображения и сопутствующей информации о
пациенте. Стандарт DICOM очень сложный, полное
ch10.indd 206
03.04.2019 11:46:36
207
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
его описание составляет несколько тысяч страниц
[8]. Имейте в виду, что даже если на устройстве есть
пометка «Совместимо с DICOM», это не означает,
что оно будет работать с любым другим устрой-
ством DICOM, поскольку стандарт DICOM включа-
ет множество возможностей и методов изображе-
ния. В заявлении о соответствии DICOM указано,
какие предоставляются возможности, для каких ме-
тодов и как они поддерживаются. Чтобы проверить
совместимость устройства, необходимо сравнить
соответствующие установки, а это непростая зада-
ча. Взаимодействие между производителями уль-
тразвуковой техники ограничено, поскольку мно-
гие важные параметры производители считают
коммерческой тайной.
УНИВЕРСАЛЬНЫЕ ФОРМАТЫ
Часто для использования изображений в отчетах,
презентациях или статьях применяют универсаль-
ные форматы файлов — BMP, TIF, GIF и JPEG. Для
видеофильмов популярными форматами являются
AVI, MPEG и QuickTime. Эти форматы обычно ли-
шены возможности сохранения дополнительной
информации о пациенте, а качество изображения
может значительно пострадать из-за сжатия с поте-
рей данных (см. далее), поэтому перечисленные
форматы файлов не следует использовать для со-
хранения первичного изображения или архивиро-
вания.
СЖАТИЕ ИЗОБРАЖЕНИЯ
Для уменьшения объема хранения данных можно
использовать сжатие изображения. Методы сжатия
без потери данных (кодирование длин серий (RLE),
JPEG без потери данных) могут уменьшать размер
файла в соотношении 2 к 5, а после распаковки фай-
ла будет восстановлена точная копия исходного
изображения. Сжатие с потерей данных позволяет
уменьшить размер файла до соотношения 20 к 100.
Однако это возможно только за счет удаления ин-
формации, к которой глаз человека наименее чув-
ствителен, что приводит к необратимому ухудше-
нию изображения. Такие изображения могут быть
визуально приемлемы (при формате JPEG с соотно-
шением 20 к 100 ухудшение изображения незначи-
мо для диагностики [9]) и намного лучше по срав-
нению с потерей качества при хранении на видео-
кассете. Тем не менее на обработку и анализ
цифрового изображения могут влиять артефакты
сжатия. Сжатие с выраженной потерей данных не
рекомендуется для архивирования или если предпо-
лагается последующая обработка изображения. Ме-
тоды сжатия с потерей данных: JPEG с потерей дан-
ных, фрактальное и вейвлет-сжатие, MPEG. В насто-
ящий момент стандарт DICOM [8] поддерживает
сжатие RLE, JPEG (без потери данных и с потерей
данных), JPEG2000 и MPEG2.
ОБРАБОТКА ЦИФРОВОГО ИЗОБРАЖЕНИЯ
Обработка цифрового изображения в медицине —
развивающееся направление [10, 11]. Написаны не-
сколько хороших руководств по обработке цифро-
вых изображений в медицине, где особое внимание
уделяется ультразвуковым изображениям [12, 13].
УЛУЧШЕНИЕ ИЗОБРАЖЕНИЯ
Усиление деталей изображения для улучшения ка-
чества изображения можно использовать при визу-
альной оценке и предварительной обработке перед
анализом. Методы усиления деталей изображения,
применяемые почти во всех ультразвуковых систе-
мах и программах для анализа, схожи с таковыми в
компьютерных программах для обработки изобра-
жений. Самые простые операции — операции с та-
блицами поиска. Это действия, которые изменяют
уровень яркости (или цвета, или прозрачности)
каждого пиксела без учета яркости пикселов, грани-
чащих с ним. Исходную яркость пиксела использу-
ют, чтобы посмотреть новое значение в таблице
преобразований. Операции с таблицами поиска
включают управление уровнем яркости и псевдоокра-
шивание. При визуализации в 3D-режиме эти опе-
рации являются основными инструментами для
контроля внешнего вида объемных изображений с
точки зрения яркости, прозрачности и выделения
поверхности.
Управление уровнем яркости включает все одно-
значные изменения уровня яркости изображения на
входе до уровня яркости изображения на выходе
(как линейные, так и нелинейные). Примеры —
цифровая коррекция контрастности и яркости, ин-
версия изображения и коррекция гаммы.
Фильтрация — это операции с изображением,
которые рассматриваеют пикселы вместе с их окру-
жением и направлены на пространственные или
временные аспекты изображения. При фильтрации
возможны сглаживание изображения (редукция шу-
ма) и увеличение резкости изображения (усиление
краев). Сглаживание, или низкочастотную фильтра-
цию (например, однородную, по Гауссу), использу-
ют во многих методах АОГ (см. далее), чтобы сни-
зить зернистость и получить более или менее гомо-
генные области.
Расширение высокочастотной границы или филь-
тры обнаружения (например, Собеля, Лапласа) ча-
сто используют для обнаружения кандидатных то-
чек. Необходимо отметить, что большинство мето-
дов сглаживания слегка изменяют позицию краев и
плохо дифференцируют шум и слабый сигнал. Вы-
сокочастотная фильтрация очень чувствительна к
шуму. Фильтрация не может улучшить ультразву-
ковое изображение без одновременного удаления
ценной информации. Фильтры сглаживания и уси-
ления резкости при трехмерных исследованиях мо-
гут быть доступны в режиме реального времени, но
ch10.indd 207
03.04.2019 11:46:36
208
ЧАСТЬ II Левый желудочек
пользователи должны учитывать перечисленные
ограничения при использовании фильтрации.
ИНТЕРПРЕТАЦИЯ ИЗОБРАЖЕНИЯ
Интерпретация изображений в медицине — чрез-
вычайно сложная задача, которую очень трудно
полностью доверить компьютеру. Для людей зре-
ние — естественный процесс, который выполняется
мгновенно и автоматически. Однако зрительная
функция у человека непростой физический процесс.
Об этом свидетельствуют различные оптические ил-
люзии. В интерпретации изображения можно выде-
лить несколько уровней (рис. 10.1). Хорошей анало-
гией является понимание написанного текста или
речи (табл. 10.1). Для интерпретации написанного
текста необходимо знать алфавит, орфографию, сло-
варный состав, синтаксис и семантику, а в итоге —
тему текста, замысел автора и «украшения» текста
(юмор, сарказм и метафоры). Последнее не отно-
сится напрямую к речи, а относится к той области
жизни, про которую написан текст. Интерпрета-
ция — это непростой процесс объединения букв в
слова, слов в предложения, а предложений — в свя-
занный текст. Текст может иметь определенные не-
совершенства, например неправильное написание и
двусмысленность, а у читателя могут отсутствовать
знания в данной области. Таким образом, чтобы до-
стичь однозначной интерпретации, необходимы
взаимодействие и обратная связь между всеми уров-
нями, а иногда даже интуиция.
ИНТЕРПРЕТАЦИЯ ИЗОБРАЖЕНИЙ СЕРДЦА
Интерпретация изображений сердца имеет сходную
иерархию уровней. В основании условной пирами-
ды интерпретации изображений лежит необрабо-
танная информация об изображении (пикселы).
Выше находятся свойства изображения: яркость,
текстура и градиенты; структуры: области (группы
соседних пикселов со сходными свойствами) и края
(линии резких изменений между областями); объек-
ты: структуры сердца (участок миокарда или створ-
ка клапана); зона интереса (например поперечное
сечение по короткой оси). На вершине условной пи-
рамиды интерпретации изображений находится ин-
терпретация, например диагноз «аномальная со-
кратимость миокарда». Чтобы правильно интер-
претировать изображения нужны экспертные
знания о трехмерной анатомии структур сердца, их
динамическом поведении, патологии и вариантах
нормы, а также об особенностях применяемых ме-
тодов визуализации (отсутствие данных, неодно-
значная информация, шум и артефакты).
Очевидно, что на каждом уровне необходимы
разные знания, чтобы достоверно интерпретиро-
вать изображения. Самые низкие уровни связаны со
свойствами изображения, на высоких уровнях сле-
дует учитывать анатомические модели сердца, фи-
зиологию, врожденные и приобретенные патологии
и др. В системах АОГ заложена ограниченная ин-
формация о высоких уровнях, т.е .:
1. Используются упрощенные представления об
объекте. Например, ЛЖ считается темным, округ-
лым объектом в середине изображения, контур
эндокарда — выпуклым, сам эндокард — самой
выраженной границей на изображении, а стенка
сердца не двигается более чем x пикселов за кадр.
Такие представления являются чрезмерно обоб-
щенными и верны только в некоторой степени.
5. Интерпретация
4. Вид сердца
3. Структуры сердца
2. Области, края
1. Яркость, текстура, градиенты
0. Пикселы
Норма
Рис. 10.1 Уровни интерпретации изображений. Интерпретацию изображения можно представить в виде пирамиды с разными уровнями, начиная от значе-
ний пикселей, используемых для получения изображения, до последнего уровня — интерпретации.
ch10.indd 208
03.04.2019 11:46:36
209
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
2. Используются некоторые стандартные позиции
(например, только по короткой оси на уровне се-
редины папиллярных мышц), определенные ха-
рактеристики качества изображения (отсутствие
выпадения сигнала, низкий шум) и анатомиче-
ского строения (например, отсутствие врожден-
ных дефектов), а также параметры настройки
(шкала, усиление, частота).
3. Необходимо участие специалиста для обработки
информации высокого уровня путем инициали-
зации, регулировки или корректировки системы.
ПРАВИЛА СТАБИЛЬНОГО АВТОМАТИЗИРОВАННОГО
ОПРЕДЕЛЕНИЯ ГРАНИЦ
Никакая компьютерная система не может работать
без команд пользователя. В идеале должно быть
только одно взаимодействие: в том случае, если пра-
вильными могут быть несколько интерпретаций, то
окончательное решение принимает пользователь,
поскольку компьютер не обладает всеми знаниями
врача. Компьютерные системы с малым количе-
ством знаний и моделей высокого уровня рассчита-
ны на участие пользователя в исправлении ошибок
и неточностей, что сильно раздражает большинство
пользователей. С учетом этих ограничений можно
сформулировать несколько критериев качественно-
го и достоверного метода АОГ.
1. Метод должен генерировать «корректные» кон-
туры. Желательно, чтобы систему можно было
адаптировать к представлениям опытного поль-
зователя о правильных контурах.
2. Контуры должны быть воспроизводимы. Это ка-
жется очевидным, но почти во всех ультразвуко-
вых системах необходимо участие пользователя
(выбор параметров, указание стартовой точки
или области, коррекция), что приводит к вариа-
бельности результатов, хотя она меньше, чем
при ручной трассировке.
3. Метод должен быть удобен для пользователя, т.е .
пользователь не должен исправлять «нелепые»
ошибки или проводить повторяющиеся дей-
ствия. Задачей пользователя должно быть при-
нятие экспертного решения высокого уровня.
Из этих критериев следует:
•
метод не должен генерировать физически или
анатомически невозможные решения, мало-
вероятные решения должны быть отмечены.
Метод должен предлагать альтернативные ре-
шения в случае необходимости.
•
метод не должен отвергать контуры, создан-
ные пользователем (за исключением исправ-
ления незначительных недостатков).
•
метод должен позволять пользователю вы-
полнять интеллектуальный контроль и кор-
рекцию (например, коррекцию всего набора
изображений).
АВТОМАТИЗИРОВАННОЕ ОПРЕДЕЛЕНИЕ
ГРАНИЦ ПРИ ЭХОКАРДИОГРАФИИ
ПРОБЛЕМЫ И ПОДВОДНЫЕ КАМНИ
Интерпретация ультразвукового изображения —
трудная задача. Неопытным пользователям она
кажется сложнее интерпретации КТ и МРТ. Уль-
тразвуковое исследование обладает некоторыми
специфическими свойствами, усложняющими ав-
томатизированный анализ.
1. Интенсивность пиксела не отражает физические
свойства визуализируемой ткани в отличие от
закона Ламберта–Бера для рентгенографии или
единицы Хаунсфилда для КТ. При ультразвуко-
вом исследовании изображение формируется за
счет отражения и рассеивания ультразвуковой
волны, что, в конечном итоге, приводит к фор-
мированию узоров интерференции (пятнистых
структур) и отражению на границах тканей или
неоднородностей. Часто различные ткани можно
различить лишь по их текстуре или по ее пове-
дению в течение времени, а не по различной ин-
тенсивности.
2. Ультразвуковое изображение очень анизотропно
и зависит от расположения датчика. Интенсив-
Уровень Общие
Речь
Изображение сердца
Сопутствующие операции
0
Необработанная
информация
Образцы
Пиксел
Генерация изображения
1
Свойства
Амплитуда,
частота
Интенсивность,
текстура, градиенты
Подготовка обработки, фильтрация,
последующая экстракция
2
Структуры
Фонемы
Области, края
Соединение, слияние, соответствие, группировка
3
Объекты
Слова
Структуры сердца
Расслабление модели, определение границ,
классификация
4
Наборы объектов
Предложения
Вид сердца
Моделирование, взаимосвязи внутри объекта
5
Интерпретация
Значение
Интерпретация и
диагностика
Интерпретация высокого уровня, экспертные
системы, правила
ТАБЛИЦА 10.1 Иерархия уровней абстракции
ch10.indd 209
03.04.2019 11:46:36
210
ЧАСТЬ II Левый желудочек
ность отражения эхо-сигнала, латеральная и ра-
диальная функции рассеивания точки и отно-
шение сигнал/шум сильно зависят от глубины и
угла ультразвукового луча, а также от контроли-
руемых пользователем настроек компенсации
увеличения времени.
3. Артефакты изображения обусловлены боковы-
ми лепестками, реверберацией, помехами и абер-
рацией. Многие артефакты особенно заметны
при высоком коэффициенте усиления, который
часто используют у пациентов с ожирением или
пожилых людей.
4. Часть анатомических структур не визуализиру-
ется вследствие выпадения сигнала (структуры,
располагающиеся параллельно ультразвуковому
лучу), затенения (структуры, располагающиеся
позади акустически плотных объектов, костей
или легких), ограничения секторов сканирования
и акустической доступности. Часть информации
на неподвижной картинке обычно пропадает, но
человеческий глаз может компенсировать это
при изучении последовательных изображений.
Временна
́
я последовательность структуры и зер-
нистости, дополняя отсутствующие фрагменты,
позволяет отличить шумы, артефакты и струк-
туры и разрешить спорные моменты.
5. В отдельных случаях (особенно при визуализа-
ции в 3D-режиме) артефакты могут появляться
из-за ограничений временно
́
го разрешения в
процессе сканирования. При последовательном
линейном сканировании информация о различ-
ных отрезках комбинируется на одном изобра-
жении. В случае быстро перемещающихся струк-
тур это может приводить к пространственному
искажению, т.е. могут появляться острые перехо-
ды между «старыми» и более «новыми» частями
изображения. Это особенно заметно при трех-
мерном исследовании в режиме реального вре-
мени, когда информация о сокращениях сердца
соединяется для получения цельного изображе-
ния структуры (например, ЛЖ).
6. При исследовании в 2D-режиме точное про-
странственное расположение плоскости в попе-
речном сечении обычно неизвестно. Это отлича-
ет двухмерный метод визуализации от трехмер-
ных методов (3D-ЭхоКГ, МРТ или КТ), при
которых расположение известно, причем эту ин-
формацию часто используют при позициониро-
вании модели для распознавания. При исследо-
вании сердца в 2D-режиме выбор плоскости по-
перечного сечения зависит от навыков и точности
специалиста по ультразвуковой диагностике, а
также от акустической доступности. Кроме оши-
бок в измерении объемов, это может приводить
к проблемам распознавания, если метод опреде-
ления границ зависит от предположений формы
и наличия или отсутствия других структур, та-
ких как клапаны или папиллярные мышцы.
ПРАКТИЧЕСКИЕ АСПЕКТЫ
Практические аспекты адекватного определения
границ перечислены в конце главы в таблице «Свод-
ная информация».
ПОЛУЧЕНИЕ КАЧЕСТВЕННОГО ИЗОБРАЖЕНИЯ
Для автоматизированного анализа необходимо оп-
тимальное качество изображения. Для АОГ это ус-
ловие более критично, чем для трассировки вруч-
ную или визуального анализа. Если граница не
определяется, остается один вариант — интеллекту-
альное предположение, или интерполяция. Специ-
алист по ультразвуковой диагностике должен при-
ложить все усилия, чтобы оптимизировать качество
изображения, стандартизировать параметры систе-
мы и устранить вариабельность настроек и попе-
речного сечения.
Вид и глубину подбирают так, чтобы исследуе-
мый объект находился в фокусе, хорошо помещал-
ся и занимал бо
́
льшую часть сектора сканирования.
Акустическая сила, общие настройки и настройки
времени подбирают таким образом, чтобы эндо-
кард выглядел наиболее четко и единообразно. По-
скольку неподвижное изображение интерпретиро-
вать сложнее, чем движущиеся последовательно ка-
дры, отдельные изображения могут иметь качество
хуже, чем можно было предположить по видеоизо-
бражению.
Для анализа полного сердечного цикла и пра-
вильного выбора изображений в конце диастолы и
систолы для анализа соотношения параметров ре-
комендуется частота не менее 25 кадров в секунду.
Для большинства методов оценки движения тканей
и спекл-трекинга рекомендуется частота > 50 кадров
в секунду, т.к. данные методы зависят от локальной
взаимосвязи последовательных кадров, которая бы-
стро исчезает при снижении частоты кадров.
ОПРЕДЕЛЕНИЕ ГРАНИЦ И СОПОСТАВИМОСТЬ
Перед ручным или автоматизированным определе-
нием границ необходимо задать соответствующие
параметры. Они могут зависеть от того, какие вы-
числения будут потом проводить на основе этих
данных. Трабекулы, папиллярные мышцы и клапа-
ны при определенных вычислениях (объем ЛЖ, ло-
кальная сократимость миокарда, масса ЛЖ) могут
быть включены или исключены из исследования.
Многие вопросы требуют стандартизации: исполь-
зовать переднюю, промежуточную или заднюю гра-
ницу, что делать при нарушении ракурса и т.д . [2,
3]. Если возможно, нужно выполнить внутрииссле-
довательские и межисследовательские сравнения,
чтобы попытаться достичь консенсуса между иссле-
дователями до начала большого исследования. В не-
которых случаях это следует включить и в протокол
исследования, чтобы оценить внутриисследова-
тельскую и межисследовательскую вариабельность
ch10.indd 210
03.04.2019 11:46:36
211
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
при выборе позиций, настроек ультразвуковой си-
стемы и других факторов.
ВЫБОР МЕТОДА ОПРЕДЕЛЕНИЯ ГРАНИЦ
При использовании АОГ целесообразно тщательно
проверить его спецификацию и соответствие целям
исследования, а также ознакомиться с ограничени-
ями метода. Большинство методов имеют четкие
ограничения или предназначены для определенной
цели: получение изображения (М-режим, 2D-режим,
3D-режим, контрастность и т.д.); вид, плоскость; ис-
следуемый объект (например, ЛЖ, ПЖ, предсер-
дия); тип границы (кровь/ткань, эпикард); анализ
одного изображения, изображения в конце диасто-
лы или систолы, изображения одного или несколь-
ких сердечных циклов; марка и тип ультразвуковой
системы, определение on-line или off-line; возмож-
ность коррекции границ пользователем; зависи-
мость от параметров настройки системы, качества
изображения и типичных артефактов (шумы и вы-
падение изображений); необходимый объем взаи-
модействия с пользователем. Если для целей иссле-
дования отсутствует подходящий автоматизиро-
ванный метод, единственной альтернативой
остается определение границ вручную.
МЕТОДЫ АВТОМАТИЗИРОВАННОГО
ОПРЕДЕЛЕНИЯ ГРАНИЦ
Методы автоматизированного анализа изображе-
ния разрабатывают с момента изобретения ЭхоКГ.
Описаны сотни методов, большинство из которых
имеют значение лишь для науки [14–16]. Мы огра-
ничимся обсуждением основных методов и воздер-
живаемся от каких-либо сравнений опубликован-
ных результатов, т.к. до недавнего времени [17] не
существовало стандартных тестовых данных для
этой цели, как и стандартных тестовых критериев.
Границы обычно сравнивали с границами после
ручной трассировки одним или несколькими экс-
пертами, а показатели, например площади и объе-
ма, сравнивали с показателями, полученными в ре-
зультате других методов исследования (КТ или
МРТ). Большинство результатов разных исследова-
ний трудно сравнивать между собой. Кроме того,
хорошие результаты при малом количестве наблю-
дений не могут быть доказательством достоинства
метода. Устойчивость метода к ошибкам можно
оценить только на больших выборках.
Методы перечислены в табл. 10.2. Большинство
методов нацелено на левое предсердие, но многие
из них можно применять для других структур и по-
лостей [3, 16].
МЕТОДЫ, УПРАВЛЯЕМЫЕ ФУНКЦИОНАЛЬНОСТЬЮ
Этот класс методов АОГ зависит главным образом
от значений интенсивности изображения и его ба-
зовых характеристик (уровни 0 и 1 условной пира-
миды интерпретации изображений) без строгих
ограничений относительно формы границ и других
параметров. Эти методы обычно полезны при опре-
делении границ неправильной формы или образо-
ваний неопределенной формы (например, опухо-
лей) и менее эффективны при выявлении объектов
с четко определенной формой при неполном изо-
бражении (например, сегментация изображения
ЛЖ при ЭхоКГ). К этому классу можно отнести ме-
тоды определения порога, кластеризации, увеличе-
ния области и настройки уровня. При методе опре-
деления порога используется фиксированный уро-
вень интенсивности для отличия таких разных
тканей, как кровь и миокард.
Один из самых ранних методов автоматизиро-
ванного анализа — акустическая количественная
оценка [18]. Она основана на определении порога
интегрированного обратного рассеивания радиоча-
стотного сигнала для отличия крови и тканей. При
методе кластеризации пикселы со схожими свой-
ствами подразделяются на группы (например, кровь
или миокард) на основе статистических распределе-
ний, в частности распределения Гаусса [19] или Рэ-
лея [20]. Большинство методов кластеризации ис-
пользуют интенсивность пикселов, но также могут
оценивать края или фазы изображения [21]. В клас-
сическом методе увеличения области [22] объект
сегментируется путем многократного добавления
аналогичных пикселов, расположенных по сосед-
ству, и/или удаления отличающихся пикселов. Под-
ходы к настройке уровня [23, 24] связаны с методом
увеличения области, но математически похожи на
деформируемые модели (см. далее). Граница кос-
венно описывается эволюционным уравнением, и
распознанные объекты могут иметь любую форму
и топологию.
Как уже говорилось, все эти методы практически
не ограничивают форму определяемой области, что
делает их уязвимыми для артефактов, типичных
для ультразвуковых исследований, — выпадение
сигнала или шум. В связи с этим данные методы ча-
сто интегрируют с точными моделями для обработ-
ки таких артефактов [25, 26].
МЕТОД, ОСНОВАННЫЙ НА ОЦЕНКЕ СТРУКТУРЫ
Пример метода, основанного на оценке структуры,
можно найти среди различных двухмерных и трех-
мерных методов тканевого трекинга. Тканевой тре-
кинг заключается в отслеживании движения опре-
деленных структур путем нахождения соответствий
на последовательных изображениях. Большинство
методов тканевого трекинга основано на простых
боковых измерениях сходства определенных обла-
стей (например, нормализированная перекрестная
корреляция, или сумма абсолютных разностей).
Альтернативный метод — оптический поток, кото-
ch10.indd 211
03.04.2019 11:46:36
212
ЧАСТЬ II Левый желудочек
Уровень
Базовые методики настройки
Дополнительные методики настройки
1. Предварительная
обработка
Сильное сглаживание шума/
редукция спеклов
Контрастное натяжение,
выравнивание гистограммы
Установление порога интегрированного обратного рассеивания
(AQ) [18]
Подавление спеклов: анизотропная диффузия [79], адаптивная
фильтрация [40], морфологические фильтры, вейвлет-
преобразование [80], фильтры на основе преобразования
Фурье
2. Определение
края или
области
Определение глобального или
локального порога [40]
Простые определители края [44]
Временная непрерывность
Усовершенствованные определители края: по Marr–Hildreth; по
Canny
Сопоставление формы или границ [46, 60]
Определение области: увеличение области [22], кластеризация
на основе распределения Гаусса [19] или Рэлея [20]; пирамида
решений; нейронные сети; случайные поля Маркова,
множества уровней [23, 24, 80]
Трекинг: оптического потока [27–29], сходства блоков [31–38,
39]
Регистрация [30], прогноз временных рядов на основе фильтра
Калмана [45, 55–58, 67]
3. Геометрический
объект или
модель
Косвенные: радиальный поиск
подходящих точек, интерполяция/
соединение, сглаживание/
фильтрация формы [40]
Динамическая программная оптимизация [46]
«Змейки», «шары», «активные контуры», «деформируемые
модели» [26, 41, 42, 44]
Активные модели формы (active shape model, ASM) [60]
4. Анатомическая
структура или
модели
изображения
Отсутствуют или косвенные:
жестко запрограммированные
модели, позиционируемые вручную
Определяемая оператором
первоначальная форма/область
интереса
Позиционирование модели/методики обнаружения ориентиров:
сумма рядов/колонок, соответствие шаблону; преобразование
Хафа [81]
Составные геометрические модели формы (2D, 2D + t, 3D, 3D +
t): модели распределения точек [60], мультиобъектные
(статистические) [61, 69–72]
5. Интерпретация,
знания высокого
уровня
Отсутствуют
Интерпретация пользователем:
коррекция границ и т.д .
Адаптация моделей к изображению и пользователю [46, 67]
Использование моделей, полученных в наблюдениях:
собственные варианты внешнего вида (активные модели
внешнего вида) [59–68]
Обучение по всем проанализированным случаям: предельное
пространство, сеть вероятностного усиления [71, 73–75]
Машинное обучение [76], генерация множества гипотез,
понимание патологии, автоматизированная классификация
[78]
Сбор данных на основе анализа, автоматизированные
помощники визуализации [56–58]
2D — двухмерный; 3D — трехмерный; t — время.
ТАБЛИЦА 10.2 Автоматизированные методы определения границ на различных уровнях абстракции
рый ранее уже предлагали использовать для двух-
мерной оценки структуры [27]. С недавнего време-
ни к этому методу вернулся интерес [28, 29]. Кроме
того, обнаружение ткани может быть сформулиро-
вано как проблема деформации, к которой может
быть применено совмещение изображений [30]. В
целом такие методы тканевого трекинга могут обе-
спечить информацией о движении в виде смещения
набора точек (обычно вдоль выбранной пользова-
телем линии) или расчета полностью двухмерного
поля вектора смещения.
В последнее время было разработано несколько
трехмерных методов тканевого трекинга [31–35].
При расчете интеграла времени также можно вычис-
лить общую относительную деформацию во всех
направлениях. Спекл-трекинг в 2D- или 3D-режиме
позволяет преодолеть основное ограничение ткане-
вой допплерографии [36]. Тканевая допплерогра-
фия позволяет провести прямое физическое (доп-
плеровское) измерение скорости с высоким времен-
ны
́
м разрешением, но обеспечивает оценку движения
только в одном измерении (направлении ультразву-
кового луча). Примером метода, основанного на
оценке структуры, является метод двухмерного тка-
невого трекинга, описанный Lysyansky, Friedman и
соавт. [37, 38]. Этот метод лежит в основе программ-
ного обеспечения для двухмерной спекл-трекинг
ЭхоКГ в системе анализа EchoPAC (GE-Vingmed
Medical Systems, Horten, Norway) (рис. 10.2).
Специалист свободно обводит приблизитель-
ный внутрисердечный контур в одном изображе-
нии сердечного цикла. Полоса за пределами этого
контура является областью интереса. В пределах
этой области анализируется структура пятна, а пят-
ch10.indd 212
03.04.2019 11:46:37
213
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
Новое расположение
Старое расположение
X
dX
0
Y
dY
Двухмерный вектор скорости:
(VX,VY)=(dX,dY)· FR
А
Б
В
Г
Рис. 10.2 Двухмерная визуализация деформации. (А) В области, ограниченной неточной границей эндокарда (красные точки), идентифицируются естествен-
ные акустические маркеры миокарда (зеленые точки). (Б) Увеличенное изображение акустических маркеров на (А). Зеленые точки — центр каждого маркера
(стрелка). (В) Акустические маркеры отслеживаются автоматически от изображения к изображению. (Г) Смещение акустических маркеров характеризуется двух-
мерными векторами скорости. FR — частота кадров [Leitman M, Lysyansky P, Sidenko S, et al. Two-dimensional strain — a novel software for real-time quantitative
echocardiographic assessment of myocardial function. J Am Soc Echocardiogr 17:1021–1029, 2004].
на высокой интенсивности идентифицируются как
естественные цели (см. рис. 10.2A, Б). Эти цели от-
слеживаются по последовательным кадрам бло-
ковым соответствием с суммой критерия подобия
абсолютных разностей (см. рис. 10.2В) [36, 38]. Из
получившегося поля скорости рассчитываются ло-
кальное смещение и деформация (рис. 10.3).
Доступны похожие методы спекл-трекинга дру-
гих производителей. Предпосылкой успешного ис-
пользования методов является высокая частота кад-
ров и хорошее качество изображения. В частности,
для оценки деформации в 3D-режиме доступна
программа Toshiba 3D Wall Motion Tracking при ис-
пользовании системы Toshiba’s Artida 3D [39]. В ос-
нове ее работы лежит полуавтоматический метод
сегментации эндокарда ЛЖ и эпикарда с последую-
щим сравнением трехмерных блоков для определе-
ния движения миокарда в течение цикла и создания
кривых деформации сегментов в течение сердечно-
го цикла (рис. 10.4).
Радиальная деформация (%)
Передне-
септальный
Передний
43,3
ST
69,0
Frame = 17
21,7
%
–21,7
–43,3
–65,0
0
300
600
900
0,0
Боковой
Нижне-
септальный
Нижний
Задний
Время (мсек)
Рис. 10.3 Кривые время–деформация. Пример изображения сердца здорового человека (позиция по короткой оси на уровне середины желудочка). Радиаль-
ную деформацию рассчитывают с помощью спекл-трекинга из множества окружающих точек во время сердечного цикла. Эти данные усредняются до шести кри-
вых время–деформация для представления стандартных сегментов. Обратите внимание, что время до максимальной деформации у здорового человека возни-
кает синхронно в течение очень узкого временного промежутка [Suffoletto MS, Dohi K, Cannesson M, et al. Novel speckle-tracking radial strain from routine black-and-
white echocardiographic images to quantify dyssynchrony and predict response to cardiac resynchronization therapy. Circulation 113:960–968 , 2006].
ch10.indd 213
03.04.2019 11:46:37
214
ЧАСТЬ II Левый желудочек
Рис. 10.4 Трехмерный трекинг сократимости миокарда. Циркулярные кривые время–деформация для 16 сегментов левого желудочка и трехмерное пред-
ставление формы в конце систолы по результатам трехмерного трекинга [Seo Y, Ishizu T, Enomoto Y, et al. Validation of 3-dimensional speckle tracking imaging to
quantify regional myocardial deformation. Circ Cardiovasc Imaging 2:451–459, 2009].
МЕТОДЫ, ОСНОВАННЫЕ НА АНАЛИЗЕ ОБЪЕКТА:
ГЕОМЕТРИЧЕСКОЕ МОДЕЛИРОВАНИЕ
Несколько популярных методов АОГ основаны на
деформируемых геометрических моделях. Эти ме-
тоды также называют «активные контуры», «змей-
ки», «баллоны». Граница представлена как геоме-
трический объект — в виде кривой линии или по-
верхности, разделяющей кровь и ткань. Этот объект
подчиняется геометрическим ограничениям: он
должен иметь определенную форму, граница долж-
на быть гладкой и т.д. Для обнаружения модель
инициализируется на каком-либо участке изобра-
жения и многократно деформируется для наилуч-
шего соответствия визуальным данным. В основ-
ном это включает сведение к минимуму некоторых
энергетических условий, связанных с величиной де-
формации, приложенной к модели (внутренняя
энергия), и качеством приспособления к данным
изображения (внешняя энергия). Последнее может
быть представлено, например, прочностью края на
границе или контрастом между внешней и внутрен-
ней областями. Методы этого класса, основанные на
анализе объекта, могут существенно различаться в
зависимости от особенностей изображения, модели
формы или движения, ограничений формы, страте-
гии инициализации и оптимизации.
Эти методы применяют в основном на уровнях
1 и 2 условной пирамиды интерпретации изображе-
ний, используя геометрическую модель (уровень 2),
что обусловлено особенностями изображения (уро-
вень 1). Методы особенно полезны, если у пациента
ожидается большое количество изменений границ,
например при наличии врожденных дефектов [40].
Тем не менее достичь баланса может быть трудно:
важно предотвратить совершенно неправдоподоб-
ные интерпретации, оставаясь в пределах нормаль-
ных и патологических форм.
Дополнительным преимуществом данных мето-
дов является их гибкость и быстрота [16, 17, 26]. Ва-
рианты некоторых методов используют в опреде-
ленных коммерческих системах [41–45].
МЕТОДЫ, ОСНОВАННЫЕ НА ГЕОМЕТРИЧЕСКИХ
МОДЕЛЯХ И СОПОСТАВЛЕНИИ С ОБРАЗЦОМ
Ранний четырехмерный полуавтоматический метод
сегментации, основанный на геометрической моде-
ли [46], был разработан в нашей лаборатории путем
сопоставления изображений и динамического про-
граммирования. Метод позволяет провести сегмен-
тацию при очень ограниченном взаимодействии с
пользователем. Метод основан на более ранней си-
стеме Echo-CMS для анализа двухмерных изображе-
ний, которую применяли в исследованиях модели
сократимости миокарда при ресинхронизирующей
терапии путем бивентрикулярной стимуляции [47]
и количественной оценке локальной сократимости
миокарда при анализе его жизнеспособности,
стресс-ЭхоКГ [48] и ремоделировании ЛЖ.
Каждое трехмерное изображение в четырехмер-
ной последовательности представлено в виде ци-
линдрического набора двухмерных изображений в
позиции по длинной оси. Сначала в двух- и четы-
ch10.indd 214
03.04.2019 11:46:38
215
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
рехкамерной позициях вручную проводят трасси-
ровку границы (рис. 10.5). После пространственно-
временной интерполяции получают четырехмер-
ную геометрическую модель.
Четырехмерный паттерн интенсивности созда-
ется с помощью пространственно-временной ин-
терполяции паттернов интенсивности изображе-
ний, близко расположенных к очерченной вручную
границе. Этот четырехмерный паттерн интенсив-
ности края является описанием границ, определен-
ным пользователем. Затем паттерны интенсивно-
сти, близкие к интерполируемой четырехмерной ге-
ометрической модели, сопоставляются с краевыми
структурами. Оптимальные соединительные грани-
цы определяются с помощью динамического про-
граммирования. После определения всех границ
(см. рис. 10.5Г) специалист может их откорректиро-
вать вручную.
Все модели последовательно обновляются в со-
ответствии с изменениями, которые интерполиру-
ются и экстраполируются с последующим пере-
смотром всех границ, которые не были введены
вручную. Выявленные границы будут напоминать
границы, определенные врачом, поэтому данный
метод подходит для различных протоколов опре-
деления границ, не ограничиваясь изменениями
интенсивности, включая изображения с контраст-
ным усилением.
Этот метод крайне ценен для исследовательских
целей, поскольку позволяет проводить эффектив-
ную плавную четырехмерную коррекцию при ма-
лом участии специалиста.
4C, 2C
ED, ES
Фаза
ED
ES
4C
2C
И
з
о
б
р
а
ж
е
н
и
я
А
Б
В
Г
Д
Рис. 10.5 Четырехмерный полуавтоматический метод определения границ. Этот метод основан на геометрических моделях и сопоставлении с образцом.
(А) Метод инициализируется ручной трассировкой границ в четырехкамерной (4С) и двухкамерной (2С) позициях в конце диастолы (ЕD) и в конце систолы (ES).
После пространственно-временной интерполяции получают геометрическую модель (Б) и форму края (В). (Г) Они подбираются к другим изображениям в попе-
речном сечении и фазам сердечного цикла путем динамического программирования. (Д) Одна из трехмерных границ эндокарда определяется автоматически на
протяжении всего сердечного цикла [Van Stralen M, Bosch JG, Voormolen MM, et al. Left ventricular volume estimation in cardiac 3D ultrasound: a semiautomatic bor-
der detection approach. Acad Radiol 12:1241–1249, 2005].
ch10.indd 215
03.04.2019 11:46:38
216
ЧАСТЬ II Левый желудочек
Сходные методы доступны и для двухмерного
анализа, например метод Axius Velocity Vector Imag-
ing [49, 50], разработанный Siemens Medical Solutions
(Malvern, Pa.) . Этот метод основан на исследовании
Pedrizzetti и Tonti [51]. Сначала специалист вручную
обозначает границы, затем ее точки отслеживаются
в течение одного или нескольких сердечных циклов.
Путем перекрестной корреляции проводится согла-
сование с шаблонами вдоль линии, перпендикуляр-
ной к исходной границе. Для каждой точки опре-
деляется одномерный путь во временном направ-
лении путем поиска максимального подобия в
соседних участках на последовательных изображе-
ниях. Также отслеживается движение всех точек по
касательной вдоль границы. Комбинация смеще-
ний перпендикулярно и по касательной создает
двухмерный вектор скорости в каждой точке (рис.
10.6А). Из полученных границ рассчитываются
объемы и скорость, аналогичная таковой при ткане-
вой допплерографии, деформация и коэффициент
деформации (см. рис. 10.6Б, В). Этот метод не ис-
пользует спекл-трекинг или радиочастотную ин-
формацию, поэтому исследование можно прово-
дить в 2D-режиме on-line и off-line, применяя раз-
ные датчики. Первые клинические испытания
показали обнадеживающие результаты, особенно
при ресинхронизирующей терапии сердца [49, 50].
ТРЕХМЕРНОЕ АКТИВНОЕ ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТИ
В настоящее время существует несколько практи-
ческих методов сегментации четырехмерного (трех-
мерное изображение + время) ультразвукового изо-
бражения. Полуавтоматические методы анализа,
например четырехмерный метод сегментации ЛЖ
(TomTec Imaging Systems GmbH, Unterschleissheim,
Germany), используют все чаще. Они показывают
лучшие результаты по сравнению с МРТ [41, 42, 52].
Сначала вручную проводят трассировку границы в
трех позициях (четырехкамерной, позиции с вра-
щением на 60 и 120°) в конце диастолы и систолы.
Затем применяют трехмерную пространственно-вре-
менну
́
ю деформируемую модель [53, 54], которая
гарантирует, что поверхность ровная во времени и
пространстве. Для определения границ ПЖ про-
грамма TomTec 4D RV-Function по существу ис-
пользует тот же подход, но сначала проводят трас-
сировку границ в двух перпендикулярных позици-
ях по длинной оси (рис. 10.7) [43].
Другим примером является четырехмерный по-
луавтоматический метод определения границ с по-
А
Б
В
Рис. 10.6 Визуализация вектора скорости. (А) Стрелки на ЭхоКГ показывают направление движения границы. (Б, В) Скорость движения всех точек границы
как функция времени представлена в виде цветной карты тканевой допплерографии (предоставлено Siemens Medical Solutions, Malvern, Pa).
ch10.indd 216
03.04.2019 11:46:41
217
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
мощью аналитической программы Philips QLAB.
Этот метод основан на методе активного определе-
ния поверхности, описанном Gе
́
rard и соавт. [44].
Деформируемая поверхность описывается как двух-
сторонняя сетка. Для каждой вершины сетки вну-
треннюю энергию определяют по гладкости локаль-
ной поверхности, а внешнюю энергию — по гра-
диенту с соседним изображением в сочетании с
интенсивностью изображения.
Трехмерная сетка инициализируется в трехмер-
ное изображение в конце диастолы и систолы с по-
мощью указания вручную пяти маркеров для ми-
трального клапана и верхушки в двух- и четырехка-
мерной позициях в поперечном сечении. Стандартная
трехмерная форма ЛЖ вписывается соответственно
расставленным точкам для определения начального
меша, и начинается активная оптимизация поверх-
ности от грубой к точной форме. Сначала проводят-
ся преобразования твердого тела и аффинные пре-
образования, затем — локальная деформация меша
и его доработка. После определения поверхностей в
конце диастолы и систолы преобразование может
быть распространено на весь сердечный цикл. Для
оставшихся фаз сердечного цикла начальный меш
создается путем распространения конечно-диасто-
лической и конечно-систолической форм с исполь-
зованием четырехмерной статистической модели
движения сердца. Активная оптимизация поверх-
ности проводится отдельно для каждого трехмерно-
го изображения (рис. 10.8). Формы можно легко ре-
дактировать вручную путем перемещения трехмер-
ного меша. Из трехмерных форм был получен
широкий диапазон аналитических параметров от-
носительно глобальных и локальных объемов и ин-
декса локальной сократимости миокарда. Этот ме-
тод быстрый и вполне надежный. Он был успешно
валидизирован [44, 52].
Метод является инструментом для трехмерного
анализа объема эндокарда. Благодаря простран-
ственно-временным ограничениям гладкости, соз-
данные поверхности и кривые всегда относительно
округлые и сглаженные. Однако возможны трудно-
сти при ручной коррекции, т.к. это нарушает хоро-
шую временну
́
ю непрерывность формы и кривых.
А
Б
В
Г
Рис. 10.7 Функция правого желудочка. Полуавтоматический метод сегментации правого желудочка при 4D-ЭхоКГ. (А, Б, В) Три ЭхоКГ (ортогональные срезы
в поперечном сечении) демонстрируют границу эндокарда правого желудочка (зеленый цвет). (Г) Трехмерное изображение сегментации просвета правого желу-
дочка (предоставлено Tomtec Imaging Systems, Unterschleissheim, Germany).
ch10.indd 217
03.04.2019 11:46:41
218
ЧАСТЬ II Левый желудочек
Такая коррекция не распространяется на времен-
ную последовательность.
Не так давно компания General Electrics предста-
вила программу 4D AutoLVQ для ультразвуковой
системы CE Vingmed EchoPAC [45, 55] — метод ак-
тивного определения поверхности, который исполь-
зует 18 размещенных вручную точек (фиброзное
кольцо митрального клапана и верхушку сердца в
трех апикальных позициях в конце диастолы и си-
столы) (рис. 10.9).
Orderud и соавт. [35] объединили трехмерную
деформируемую модель с очень эффективной схе-
мой обновления фильтра Кальмана, что обеспечи-
вает быструю конвергенцию модели к полученным
данным и возможность провести в последующем
автоматическую сегментацию трехмерных изобра-
жений и количественную оценку в режиме реально-
го времени, а также выделить оптимальную пози-
цию [56, 57] или обратную связь с настройками си-
стемы визуализации [58]. Такой подход лежит в
основе автоматической программы 4D AutoLVQ
компании General Electrics.
МЕТОДЫ, ОСНОВАННЫЕ НА ПОПУЛЯЦИОННОЙ МОДЕЛИ:
АКТИВНЫЕ МОДЕЛИ ВНЕШНЕГО ВИДА
Другие методы базируются на данных экспертных
исследований, на основании которых применяют
технологию машинного обучения (см. далее) или
строят детальные статистические модели вероятных
форм и вариантов изображения. Последние называ-
ют активными моделями внешнего вида (active
appearance models, AAM). Эти методы первоначаль-
но развивали Cootes и Taylor [59] в качестве допол-
нения к методу активной модели формы (active
shape model, ASM) для определения черт лица и ана-
лиза изображений в медицине [60, 61]. Использова-
ние активных моделей внешнего вида при МРТ [62],
2D- и 3D-ЭхоКГ [62–65] дало многообещающие ре-
зультаты. Эти методы выводят типичную форму и
ЭхоКГ из большого количества изображений с гра-
ницами, обведенными экспертами. При анализе
главных компонентов по модели распределения
точки выделяют усредненную форму (рис. 10.10А)
и основные ее варианты (собственные варианты).
Путем изменения всех примеров к усредненной
форме могут быть определены среднее изображе-
ние и основные его варианты. При использовании
другого анализа главных компонентов форма, ее ва-
риации и интенсивность одновременно моделиру-
ются в активную модель внешнего вида (см. рис.
10.10Б–Г). Такая модель внешнего вида может ис-
кусственно генерировать «вероятные» эхокардио-
графические изображения. Изменяя модель по ее
собственным вариантам путем минимизации гра-
Рис. 10.8 Трехмерный полуавтоматический метод определения границы активной поверхности (Philips QLAB 3DQ Advanced) (предоставлено Philips
Medical Systems Ultrasound, Andover, Mass).
ch10.indd 218
03.04.2019 11:46:42
219
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
Рис. 10.9 Определение поверхности левого желудочка. Границы определяют вручную по положению фиброзного кольца митрального клапана и верхушки
сердца в стандартных апикальных позициях. Определяется полная поверхность в четырехмерном измерении. Трехмерный объем в конце систолы показан на кри-
вой время–объем с использованием программы 4D AutoLVQ (ультразвуковая система GE Vingmed EchoPAC) [Reant P, Barbot L, Montaudon M, et al. Robustness of
a new three-dimensional echocardiographic algorithm for left ventricular volume and ejection fraction quantification: experts vs. novices. Eur J Echocardiogr 12:895–903 ,
2011].
диентной разницы между искусственным и реаль-
ным изображением, можно найти искомую струк-
туру (см. рис. 10.10Д). Эти действия можно быстро
выполнить автоматически и с достоверными ре-
зультатами [65, 66].
Данный метод имеет значимые преимущества:
(1) моделирует как усредненную форму органа, так
и все варианты в популяции; (2) моделирует орган
целиком, в том числе типичные артефакты; (3) фик-
сирует экспертное описание правильного определе-
А
Б
В
Г
Д
Рис. 10.10 Трехмерная сегментация активной модели внешнего вида. (А) Модель из 901 точки (усредненная форма). (Б–Г) Первый способ изменения
внешнего вида и формы: отрицательное отклонение (Б), среднее (В), положительное отклонение (Г). Для каждого приведены три ортогональных среза в попе-
речном сечении и 3D-рендеринг. (Д) Пример сегментации на новых данных: три ортогональных среза в поперечном сечении и 3D-рендеринг определяемой фор-
мы с ошибкой распознавания (расстояние от границ, определенных экспертами, в мм), отмеченной цветом [Stralen M, van, Haak A, Leung KYE, et al. Full-cycle left
ventricular segmentation and tracking in 3d echocardiography using active appearance models. Proc IEEE Int Ultrasonics Symp 10.1109/ULTSYM.2015.0389 , 2015].
ch10.indd 219
03.04.2019 11:46:42
220
ЧАСТЬ II Левый желудочек
ния границы; (4) позволяет моделировать сложные
формы (например, эндокард ЛЖ + эпикард ЛЖ,
ПЖ, клапаны); (5) отсутствуют ограничения по гра-
ницам ткань/кровь; (6) легко настраивается на раз-
личные типы изображений. Ограничения этого ме-
тода — зависимость от исходных данных, выбран-
ных примеров и качества экспертных границ.
Подобный подход использует программа Auto
EF (Axius Auto Ejection Fraction) фирмы Siemens
Medical Solutions (Malvern, Pa.) для автоматического
осевого определения фракции выброса (рис. 10.11).
Программа основана на исследовании Comaniciu и
соавт. [67, 68] и позволяет автоматически опреде-
лять границы эндокарда в апикальных четырех- и
двухкамерных позициях поперечного сечения, в ос-
нове которого лежат популяционные статистиче-
ские модели формы эндокарда и изображения в
конце диастолы и систолы. После ориентировочно-
го определения положения желудочка модель внеш-
него вида накладывается на изображение и обозна-
чает границу эндокарда для кадров с предполагае-
мым концом диастолы и систолы. Используя
слияние надежной информации, границу отслежи-
вают по всей последовательности из обоих кадров,
соединяя движение, определяемое по изображени-
ям с помощью метода оптического потока, с дина-
мической моделью. Модель формы, основанная на
анализе главных компонентов, строго адаптирована
к конкретному пациенту, оценка движения и их из-
меняющаяся достоверность сочетаются с ожидае-
мой динамикой формы с использованием трекинга
на основе фильтрации Кальмана. Из найденных
контуров рассчитываются конечно-диастолический
и конечно-систолический объемы, фракция выбро-
са и строится кривая объема всего цикла. Перво-
начальная клиническая оценка показывает много-
обещающие результаты. Нужно заметить, что в
настоящий момент в нескольких методах вводят
комплексные модели формы, которые включают
множественные полости [61, 69–72].
АВТОМАТИЗИРОВАННОЕ ОПРЕДЕЛЕНИЕ
РАСПОЛОЖЕНИЯ СТРУКТУР
Для машинного обучения, например классифика-
торов, также используют базы данных, включаю-
щие примеры, проанализированные экспертами,
[71, 73–75]. Такие классификаторы подходят для ав-
томатизированного определения расположения на
изображении некоторых структур, генерации кан-
дидатных точек для сегментации и диагностики по
сходству изображений. Принцип очень похож на
автоматическое определение лица в цифровых ка-
мерах. В этих методах используют комбинации
простых классификаторов, опираясь на большое
количество основных структурных особенностей
изображения, сформированных из выбранных об-
ластей. В процессе обучения классификатор для за-
данной структуры создается путем тестирования
большого количества случайных комбинаций про-
стых классификаторов. Во все эти комбинации за-
гружаются большое количество примеров данной
структуры (как позитивных, так и негативных) и ее
особенности. Во время каждой обучающей итера-
ции лучшие комбинации сохраняют, исправляют,
смешивают или перегруппировывают, чтобы до-
биться более точного результата. Подобным обра-
зом создают сводные классификаторы, которые со-
ответствуют сигнатуре простых признаков, позво-
ляющих надежно идентифицировать искомую
структуру (рис. 10.12).
Хотя на процесс обучения нужно затратить мно-
го времени, само определение структуры может
быть очень быстрым. Многие методы этой группы,
например «вероятностное усиление» (probabilistic
boosting), «случайный лес» (random forest) и т.д.,
стали более распространенными [73–76] и успешно
зарекомендовали себя в решении ряда задач [17].
СРАВНЕНИЕ МЕТОДОВ АВТОМАТИЗИРОВАННОГО
ОПРЕДЕЛЕНИЯ ГРАНИЦ
До недавнего времени достоверность методов АОГ
чаще всего определяли, сравнивая с границами, об-
веденными вручную или полученными у тех же па-
циентов с помощью других методов исследования
(МРТ, КТ). Поскольку сбор и анализ подобной ин-
Рис. 10.11 Автоматическое определение границ фракции выброса.
Данная программа Axius Auto EF выделяет предположительные точки границы
в виде эллипса с достоверностью 95%, соответствующие локальной неточно-
сти измерения [Comaniciu D, Zhou XS, Krishnan S. Robust real-time tracking of
myocardial border: an information fusion approach. IEEE Trans Med Imaging
23:849–860 , 2004].
ch10.indd 220
03.04.2019 11:46:43
221
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
формации — очень трудоемкий процесс, это было
сделано на относительно небольших выборках дан-
ных. Сравнить точность разных методов АОГ было
непросто, т.к. их проверяли с помощью различных
данных и об их качестве и применимости ко всей
популяции информации было мало. Опубликовано
несколько прямых сравнений методов АОГ на оди-
наковых данных [53].
Чтобы лучше оценить эффективность различ-
ных методов АОГ, было организовано соревнова-
ние команд исследователей «Великий вызов». В
этом соревновании изучали эффективность алго-
ритмов сегментации по определению поверхности
эндокарда при 3D-ЭхоКГ [17, 77]. Была составлена
база четырехмерных изображений ЛЖ 45 пациен-
тов с различными заболеваниями, находившихся на
лечении в трех медицинских центрах. Изображения
были получены на разных ультразвуковых систе-
мах, потом сопоставлены и вручную проанализиро-
ваны тремя экспертами. 30% этих изображений с
очерченными вручную границами были предостав-
лены командам исследователей в качестве обучаю-
щих для оптимизации методов и достижения наи-
более точных результатов. В публикации с оконча-
тельными результатами [17] отмечено, что высокие
баллы получили геометрические модели и методы
машинного обучения, но разница между методами
была небольшой. Данные, использовавшиеся в со-
ревновании, доступны для проверки новых или мо-
дифицированных методов АОГ [77].
ПЕРСПЕКТИВЫ
В последние годы несколько технических разрабо-
ток оказали важное положительное влияние на
практическое применение АОГ, а сами методы АОГ
существенно улучшились. Стали доступны некото-
рые полезные инструменты для АОГ [32, 38, 49, 41,
43–45, 68], а в ближайшем будущем ожидаются
дальнейшие усовершенствования этих методов.
Цифровые изображения имеют значительно
лучшее качество, а изменения в интерфейсе обеспе-
чили выраженное подавление помех, высокую ча-
стоту кадров и другие улучшения. Трехмерное изо-
бражение в режиме реального времени сделало уль-
тразвуковое исследование настоящим объемным
методом визуализации, а также значительно уско-
рило развитие автоматизированного анализа. Это-
му способствовали увеличение мощности компью-
теров и появление новых алгоритмов. Дальнейшее
повышение качества изображения также улучшит
АОГ.
Все эти нововведения помогут вывести автома-
тизированный анализ ЭхоКГ на новый интеллекту-
альный уровень. Надежные методы машинного об-
учения и подходы к классификации [71, 73–75] смо-
гут предложить решения для автоматизированного
определения расположения структур и позволят за-
менить ручную инициализацию сегментации. Бо-
лее реалистичные модели, например статистические
модели формы или внешнего вида объекта [59–63,
65–67], позволят максимально учесть вариабель-
ность изображений и типичные артефакты, тем са-
мым обеспечив реалистичную сегментацию и клас-
сификацию [78]. Моделирование трехмерной ана-
томии позволит урегулировать вариабельность
ультразвуковых позиций, а интеграция тканевого
трекинга и сегментации поможет улучшить эти ме-
тоды [33]. Комбинация тканевого трекинга в режи-
ме реального времени, сегментации и классифика-
ции предоставляет большие возможности для пря-
мой количественной оценки и обратной связи на
основе изображений по положению датчика, а так-
же оптимизации изображения. В этой области уже
ведутся серьезные исследования [56–58, 69], кото-
Рис. 10.12 Автоматическое определение и оценка расположения левого предсердия. Три примера автоматического определения расположения и оцен-
ки левого предсердия в апикальной двухкамерной позиции с помощью классификатора вероятностного усиления. Красный блок — истинное положение левого
предсердия; зеленый блок — автоматическое определение с помощью классификатора вероятностного усиления [Zhang J, Zhou SK, McMillan L, Comaniciu D. Joint
real-time object detection and pose estimation using probabilistic boosting network. In Proceedings of the IEEE Conference on Computer Vision and Pattern Recognition,
Minneapolis, Minn., June 2007].
ch10.indd 221
03.04.2019 11:46:44
222
ЧАСТЬ II Левый желудочек
рые особенно важны для ручных и карманных уль-
тразвуковых систем, ориентированных на врачей с
небольшим опытом интерпретации ЭхоКГ.
«Автоматизированные помощники визуализа-
ции» позволяют найти стандартные двухмерные
позиции в трехмерном изображении и получить
информацию о фазе сердечного цикла [58] или су-
дить о корректности позиции в режиме реального
времени [57], что расширяет область применения
портативных ультразвуковых систем.
Все это в итоге должно привести к созданию ин-
теллектуального автоматизированного помощника
визуализации для специалистов ультразвуковой ди-
агностики.
Аспект
Ключевые моменты
Комментарии/ограничения
Определение цели
исследования
Исходя из задач исследования, следует определить
нужные количественные параметры (например, объем
левого желудочка, степень митральной регургитации)
Не все нужные параметры можно будет
измерить автоматически. Надо
определить, какие параметры можно
измерить на изображении
автоматически, а какие вручную
Выберите ультразвуковую систему и инструмент,
поддерживающие нужный автоматический метод/
метод автоматизированного анализа
Прочитайте инструкцию к ультразвуковой
системе, проведите тесты
Выбор метода
Оцените применимость метода для запланированного
анализа
Применим ли этот метод для нужных
позиций и структур, которые следует
анализировать? Возможна ли ручная
коррекция?
Уточните возможности оценки в режиме реального
времени, on-line или off-line, количество желательных
межисследовательских и внутриисследовательских
повторов
Определяет практические усилия для
исследования и затраты времени
Определите наличие погрешностей и сравните с
гипотезой исследования
От погрешности зависит надежность
исследования и необходимый объем
выборки пациентов
Определение границы
Определите, включать или нет папиллярные мышцы,
клапаны, трабекулы
Выясните, как исправить или
компенсировать нежелательные границы
Определите критерии исключения, связанные с
анализом
Определите, в каких случаях анализ будет
неприменим/невозможен (качество
изображения, патология, артефакты)
Качество изображений/
исследований
Оптимизируйте качество изображения в зависимости
от цели исследования (например, разделение границ
кровь/ткань для автоматизированных методов
определения границ, достаточная частота кадров для
трекинга)
Оптимальное качество изображений
является самым важным условием для
достоверного автоматизированного
определения границ. Установите
минимально допустимое качество
изображения как критерий включения
Стандартизируйте протокол получения данных:
позиции и области интереса, количество и время
записи, частота кадров, мощность, усиление/
динамический диапазон, временная регулировка
усиления и др.
Стандартизация крайне важна —
большинство методов чувствительны ко
всем этим параметрам
Проверьте качество изображения: сжатие, потеря
данных, артефакты, шум и т.д.
Могут быть причиной исключения из
исследования
Проверьте наличие заболеваний или состояний,
которые могут повлиять на анализ: гипертрофия,
дилатация, внутрисердечные образования,
врожденные пороки, имплантаты, катетеры и т.д.
Могут быть причиной исключения из
исследования
СВОДНАЯ ИНФОРМАЦИЯ
Практические аспекты автоматизированного определения границ
ch10.indd 222
03.04.2019 11:46:44
223
10 Обработка цифрового изображения и его автоматизированный анализ при эхокардиографии
ЛИТЕРАТУРА
1. Foster E, Cahalan MK: The search for intelli-
gent quantitation in echocardiography: “eye-
ball,” “trackball” and beyond, J Am Coll Car-
diol 22:848–850, 1993.
2. Lang RM, Bierig M, Devereux RB, et al.: Rec-
ommendations for chamber quantification: a
report from the American Society of Echo-
cardiography’s Guidelines and Standards
Committee and the Chamber Quantification
Writing Group, developed in conjunction
with the European Association of Echocar-
diography, a branch of the European Society
of Cardiology, J Am Soc Echocardiogr
18:1440–1463, 2005.
3. Lang RM, Badano LP, Mor-Avi V, et al.: Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
4. Hoffman R, Lethen H, Marwick TH, et al.:
Analysis of interinstitutional observer agree-
ment in interpretation of dobutamine stress
echocardiograms, J Am Coll Cardiol 27:330–
336, 1996.
5. Feigenbaum H, Armstrong WF, Ryan T:
Physics and instrumentation. In Feigen-
baum’s echocardiographyPhiladelphia, 2009,
Lippincott Williams & Wilkins.
6. Szabo T: Diagnostic ultrasound imaging: in-
side out, , ed 2, Burlington, Mass, 2013, Else-
vier Academic Press.
7. Cobbold RSC: Foundations of biomedical ul-
trasound, New York, 2007, Oxford Universi-
ty Press.
8. DICOM Standards Committee: Digital Imag-
ing and Communications in Medicine (DI-
COM), 2015 ed, Rosslyn, Va, 2015, National
Electrical Manufacturers Association.
9. Karson TH, Chandra S, Morehead AJ, et al.:
JPEG compression of digital echocardio-
graphic images: impact on image quality, J
Am Soc Echocardiogr 8:306–318, 1995.
10. Gonzalez RC, Woods RE: Digital image pro-
cessing, , ed 3, Englewood Cliffs, N.J, 2008,
Prentice-Hall.
11. Sonka M, Hlavac V, Boyle R: Image process-
ing, analysis and machine vision, , ed 4, Pa-
cific Grove, Calif., 2015, Thomson Engineer-
ing.
12. Bankman I: Handbook of medical image pro-
cessing and analysis, , ed 2, Burlington, Mass,
2008, Academic Press.
13. Sonka M, Fitzpatrick JM: Handbook of med-
ical imaging, vol. 2. Medical image processing
and analysis, Bellingham, Wash, 2000, SPIE—
The International Society for Optical Engi-
neering.
14. Noble JA, Boukerroui D: Ultrasound image
segmentation: a survey, IEEE Trans Med Im-
aging 25:987–1010, 2006.
15. Leung KYE, Bosch JG: Automated border de-
tection in three-dimensional echocardiogra-
phy: principles and promises, Eur J Echocar-
diogr 11:97–108, 2010.
16. Pedrosa J, Barbosa D, Almeida N, et al.: Car-
diac chamber volumetric assessment using 3d
ultrasound—a review, Curr Pharm Design
22:105–121, 2015.
17. Bernard O, Bosch JG, Heyde B, et al.: Stan-
dardized evaluation system for left ventricu-
lar segmentation algorithms in 3D echocar-
diography, IEEE Trans Med Imag 35(4):967–
977, 2016.
18. Perez JE, Waggoner AD, Barzilai B, et al.: On-
line assessment of ventricular function by au-
tomatic boundary detection and ultrasonic
backscatter imaging, J Am Coll Cardiol
19:313–320, 1992.
19. Papademetris X, Sinusas AJ, Dione DP, Dun-
can JS: Estimation of 3D left ventricular de-
formation from echocardiography, Med Im-
age Anal 5:17–28, 2001.
20. Sarti A, Corsi C, Mazzini E, Lamberti C: Max-
imum likelihood segmentation of ultrasound
images with Rayleigh distribution, IEEE
Trans Ultrason Ferroelectr Freq Control
52:947–960, 2005.
21. Boukerroui D, Basset O, Baskurt A, Gimenez
G: A multiparametric and multiresolution
segmentation algorithm of 3-D ultrasonic da-
ta, IEEE Trans Ultrason Ferroelectr Freq Con-
trol 48:64–77, 2001.
22. Verlande M, Flachskampf FA, Schneider W,
et al.: 3D reconstruction of the beating left
ventricle and mitral valve based on multipla-
nar TEE. In Proceedings, Computers in Car-
diology, Los Alamitos, Calif, 1991, IEEE
Computer Society Press.
23. Lin N, Yu W, Duncan JS: Combinative multi-
scale level set framework for echocardio-
graphic image segmentation, Med Image Anal
7:529–537, 2003.
24. Corsi C, Saracino G, Sarti A, Lamberti C: Left
ventricular volume estimation for real-time
three-dimensional echocardiography, IEEE
Trans Med Imaging 21:1202–1208, 2002.
25. Sanchez-Ortiz GI, Wright GJT, Clarke N, et
al.: Automated 3-D echocardiography analy-
sis compared with manual delineations and
SPECT MUGA, IEEE Trans Med Imaging
21:1069–1076, 2002.
26. Barbosa D, Dietenbeck T, Schaerer J, et al.: B-
spline explicit active surfaces: an efficient
framework for real-time 3D region-based
segmentation, IEEE Trans Image Proc 21:241–
251, 2012.
27. Meunier J: Tissue motion assessment from
3D echographic speckle tracking, Phys Med
Biol 43:1241–1254, 1998.
28. Su
hling M, Arigovindan M, Jansen C, et al.:
Myocardial motion analysis from B-mode
echocardiograms, IEEE Trans Image Process-
ing 14:525–536, 2005.
29. Leung KYE, Danilouchkine MG, Van Stralen
M, et al.: Tracking left ventricular borders in
3D echocardiographic sequences using mo-
tion-guided optical flow, Proc SPIE Med Im-
aging 7259:72590W, 2009.
30. Elen A, Choi HF, Loekx D, et al.: Three-di-
mensional cardiac strain estimation using
spatio-temporal elastic registration of ultra-
sound images: a feasibility study, IEEE Trans
Med Imaging 27:1580–1591, 2008.
31. Kawagishi T: Speckle tracking for assessment
of cardiac motion and dyssynchrony, Echo-
cardiography 25:1167–1171, 2008.
32. Perez de Isla L, Balcones DV, Fernandez-Gol-
fin C, et al.: Three-dimensional-wall motion
tracking: a new and faster tool for myocardi-
al strain assessment: comparison with two-di-
mensional-wall motion tracking, J Am Soc
Echocardiogr 22:325–330, 2009.
33. Nillesen MM, Lopata RGP, de Boode W, et
al.: 3D cardiac segmentation using temporal
correlation of radiofrequency ultrasound da-
ta, Proc Med Image Comput Assist In-
terv(1)927–934, 2009.
34. Duncan JS, Yan P, Zhu Y, et al.: LV strain es-
timation from 4D echocardiography, Proc IS-
BI696–699, 2007.
35. Orderud F, Kiss G, Langeland S, et al.: Com-
bining edge detection with speckle-tracking
for cardiac strain assessment in 3D echocar-
diography, Proc IEEE Ultrasonics
Symp1959–1962, 2008.
36. Suffoletto MS, Dohi K, Cannesson M, et al.:
Novel speckle-tracking radial strain from
routine black-and-white echocardiographic
images to quantify dyssynchrony and predict
response to cardiac resynchronization thera-
py, Circulation 113:960–968, 2006.
37. Behar V, Adam D, Lysyansky P, Friedman Z:
The combined effect of nonlinear filtration
and window size on the accuracy of tissue dis-
placement estimation using detected echo sig-
nals, Ultrasonics 41:743–753, 2004.
38. Leitman M, Lysyansky P, Sidenko S, et al.:
Two-dimensional strain—a novel software
for real-time quantitative echocardiographic
assessment of myocardial function, J Am Soc
Echocardiogr 17:1021–1029, 2004.
39. Seo Y, Ishizu T, Enomoto Y, et al.: Validation
of 3-dimensional speckle tracking imaging to
quantify regional myocardial deformation,
Circ Cardiovasc Imaging 2:451–459, 2009.
40. Nillesen MM, Lopata RGP, Gerrits IH, et al.:
Segmentation of the heart muscle in 3-D pe-
diatric echocardiographic images, Ultrasound
Med Biol 33:1453–1462, 2007.
41. Ku
hl HP, Schreckenberg M, Rulands D, et al.:
High-resolution transthoracic
real-time
three-dimensional echocardiography. Quan-
titation of cardiac volumes and function us-
ing semi-automatic border detection and
comparison with cardiac magnetic resonance
imaging, J Am Coll Cardiol 43:2083–2090,
2004.
42. Nikitin NP, Constantin C, Loh PH, et al.: New
generation 3-dimensional echocardiography
for left ventricular volumetric and functional
measurements: comparison with cardiac
magnetic resonance, Eur J Echocardiogr
7:365–372, 2006.
43. Gopal AS, Chukwu EO, Iwuchukwu CJ, et al.:
Normal values of right ventricular size and
function by real-time 3-dimensional echocar-
diography: comparison with cardiac magnet-
ic resonance imaging, J Am Soc Echocardiogr
20:445–455, 2007.
44. Ge
́
rard O, Billon AC, Rouet JM, et al.: Effi-
cient model-based quantification of left ven-
tricular function in 3-D echocardiography,
IEEE Trans Med Imaging 21:1059–1068,
2002.
45. Hansegard J, Urheim S, Lunde K, et al.: Semi-
automated quantification of left ventricular
volumes and ejection fraction by real-time
three-dimensional echocardiography, Car-
diovasc Ultrasound 7:18, 2009.
46. Van Stralen M, Bosch JG, Voormolen MM, et
al.: Left ventricular volume estimation in car-
diac 3D ultrasound: a semi-automatic border
detection approach, Acad Radiol 12:1241–
1249, 2005.
47. Breithardt OA, Stellbrink C, Kramer AP, et
al.: Echocardiographic quantification of left
ventricular asynchrony predicts an acute he-
modynamic benefit of cardiac resynchroni-
zation therapy, J Am Coll Cardiol 40:536–
545, 2002.
48. Cain P, Short L, Baglin T, et al.: Development
of a fully quantitative approach to the inter-
pretation of stress echocardiography using
radial and longitudinal myocardial velocities,
J Am Soc Echocardiogr 15:759–767, 2002.
49. Vannan MA, Pedrizzetti G, Li P, et al.: Effect
of cardiac resynchronization therapy on lon-
ch10.indd 223
03.04.2019 11:46:44
224
ЧАСТЬ II Левый желудочек
gitudinal and circumferential left ventricular
mechanics by velocity vector imaging: de-
scription and initial clinical application of a
novel method using high-frame rate B-mode
echocardiographic images, Echocardiography
22:826–830, 2005.
50. Cannesson M, Tanabe M, Suffoletto MS, et
al.: Velocity vector imaging to quantify ven-
tricular dyssynchrony and predict response to
cardiac resynchronization therapy, Am J Car-
diol 98:949–953, 2006.
51. Pedrizzetti G, Tonti G: Method of tracking
position and velocity of objects’ borders in
two or three dimensional digital images, par-
ticularly in echographic images, U.S. Patent,
April 2005. 2005/0074153.
52. Jenkins C, Chan J, Hanekom L, Marwick TH:
Accuracy and feasibility of online 3-dimen-
sional echocardiography for measurement of
left ventricular parameters, J Am Soc Echo-
cardiogr 19:1119–1128, 2006.
53. Soliman OI, Krenning BJ, Geleijnse ML, et al.:
Quantification of left ventricular volumes
and function in patients with cardiomyopa-
thies by real-time three-dimensional echocar-
diography: a head-to-head comparison be-
tween two different semiautomated endocar-
dial border detection algorithms, J Am Soc
Echocardiogr 20:1042–1049, 2007.
54. Chukwu EO, Barasch E, Mihalatos DG, et al.:
Relative importance of errors in left ventric-
ular quantitation by two-dimensional echo-
cardiography: insights from three-dimen-
sional echocardiography and cardiac magnet-
ic resonance imaging, J Am Soc Echocardiogr
21:990–997, 2008.
55. Reant P, Barbot L, Montaudon M, et al.: Ro-
bustness of a new three-dimensional echocar-
diographic algorithm for left ventricular vol-
ume and ejection fraction quantification: ex-
perts vs. novices, Eur J Echocardiogr
12:895–903, 2011.
56. Orderud F, Torp H, Rabben SI: Automatic
alignment of standard views in 3D echocar-
diograms using real-time tracking, Proc SPIE
Med Imaging 7265(72650D):1–12, 2009.
57. Snare SR, Aase SA, Mjolstad OC, et al.: Auto-
matic real-time view detection, Proc IEEE Ul-
trasonics Symp2304–2307, 2009.
58. Aase SA, Snare SR, Dalen H, et al.: Echocar-
diography without electrocardiogram, Eur J
Echocardiogr 12:3–10, 2011.
59. Cootes TF, Taylor CJ: Statistical models of ap-
pearance for medical image analysis and com-
puter vision, Proc SPIE medical imaging
2001, image processing, vol. 4322. Belling-
ham, WA, 2001, SPIE.
60. Cootes TF, Hill A, Taylor CJ, Haslam J: Use
of active shape models for locating structures
in medical images, Image Vision Computing
12:355, 1994.
61. Haak A, Vegas-Sanchez-Ferrero G, Mulder
HW, et al.: Segmentation of multiple heart
cavities in 3-D transesophageal ultrasound
images, IEEE Trans UFFC 62:1179–1189,
2015.
62. Mitchell SC, Bosch JG, Lelieveldt BPF, et al.:
3-D active appearance models: segmentation
of cardiac MR and ultrasound images, IEEE
Trans Med Imaging 21:1167–1178, 2002.
63. Bosch JG, Mitchell SC, Lelieveldt BPF, et al.:
Automatic segmentation of echocardiograph-
ic sequences by active appearance motion
models, IEEE Trans Med Imaging 21:1374–
1383, 2002.
64. Leung KYE, van Stralen M, Voormolen MM,
et al.: Improving 3D active appearance model
segmentation of the left ventricle with Jaco-
bian tuning, Proc SPIE Med Imaging
6914:69143B, 2008.
65. Stralen M van, Haak A, Leung KYE, et al.:
Full-cycle left ventricular segmentation and
tracking in 3D echocardiography using active
appearance models, Proc IEEE Int Ultrasonics
Symp0389, 2015. 2015 10.1109/ULT-
SYM.2015.
66. Leung KYE, van Stralen M, van Burken G, et
al.: Automatic active appearance model seg-
mentation of 3D echocardiograms, Proc IEEE
Int Symp Biomed Imaging320–323, 2010.
67. Comaniciu D, Zhou XS, Krishnan S: Robust
real-time tracking of myocardial border: an
information fusion approach, IEEE Trans
Med Imaging 23:849–860, 2004.
68. Georgescu B, Zhou XS, Comaniciu D, Rao B:
Real-time multi-model tracking of myocardi-
um in echocardiography using robust infor-
mation fusion. Medical image computing and
computer-assisted intervention—MICCAI
2004, Lect Notes Compute Sci 3216:777–785,
2004.
69. Schneider R: HeartModelA.I . Removing the
complexity of Live 3D Quantification. . Phil-
ips whitepaper http://www.usa .philips.com/
b-dam/b2bhc/us/feature-details/ai-
us/452299111691_heartmodel_whitepaper_
lr.pdf, 2015.
70. Wang Y, Georgescu B, Houle H, Comaniciu
D: Volumetric myocardial mechanics from
3D+T ultrasound data with multi-model
tracking, Proc STACOM/CESC 2010:184–
193, 2010.
71. Weber FM, Stehle T, Waechter-Stehle I, et al.:
Analysis of mitral valve motion in 4D trans-
esophageal echocardiography for transcathe-
ter aortic valve implantation. Proc STACOM
2014, LNCS 8896:168–176, 2015.
72. Ionasec RI, Voigt I, Georgescu B, et al.: Pa-
tient-specific modeling and quantification of
the aortic and mitral valves from 4-D cardiac
CT and TEE, IEEE Trans Medical Imaging
29:1636–1651, 2010.
73. Georgescu B, Zhou XS, Comaniciu D, Gupta
A: Database-guided segmentation of ana-
tomical structures with complex appearance,
Proc Comput Vis Pattern Recogn 2:429–436,
2005.
74. Lu X, Georgescu B, Zheng Y, et al.: Autompr:
Automatic detection of standard planes in 3D
echocardiography, Proc Int Symp Biomed
Imaging1279–1282, 2008.
75. Zhang J, Zhou SK, McMillan L, Comaniciu D:
Joint real-time object detection and pose esti-
mation using probabilistic boosting network.
In Proceedings of the IEEE Conference on
Computer Vision and Pattern Recognition,
June 2007. (Minneapolis, Minn.
76. Keraudren K, Oktay O, Shi W, et al.: Endo-
cardial 3D ultrasound segmentation using au-
tocontext random forests. In Proc MICCAI
Challenge Echocardiographic Three-dimen-
sional Ultrasound Segmentation (CETUS),
Midas Journal, 2014, pp 41–48. http://hdl.
handle.net/10380/3484.
77. CETUS challenge evaluation platform: http://
www.creatis.insa-lyon.fr/EvaluationPlat-
form/CETUS/.
78. Bosch JG, Nijland F, Mitchell SC, et al.: Com-
puter-aided diagnosis via model-based shape
analysis: automated classification of wall mo-
tion abnormalities in echocardiograms, Acad
Radiol 12:358–367, 2005.
79. Montagnat J, Sermesant M, Delingette H, et
al.: Anisotropic filtering for model-based
segmentation of 4D cylindrical echocardio-
graphic images, Pattern Recogn Lett 24:815–
828, 2003.
80. Angelini ED, Homma S, Pearson G, et al.:
Segmentation of real-time three-dimensional
ultrasound for quantification of ventricular
function: a clinical study on right and left
ventricles, Ultrasound Med Biol 31:1143–
1158, 2005.
81. Stralen M van, Leung KYE, Voormolen MM,
et al.: Time continuous detection of the left
ventricular long axis and the mitral valve
plane in 3-D echocardiography, Ultrasound
Med Biol 34:196–207, 2008.
ch10.indd 224
03.04.2019 11:46:44
Ишемическая
болезнь сердца
ЧАСТЬ
ЧАСТЬ III
ch11.indd 225
03.04.2019 11:52:28
ch11.indd 226
03.04.2019 11:52:28
227
11
Общие данные и основные
положения
Физиология острой ишемии
и эхокардиография
Технические аспекты
эхокардиографии в отделении
реанимации и интенсивной терапии
Получение изображений
Клиническое применение
Сортировка пациентов с острой болью
в груди
Оценка деформации миокарда
Стресс-эхокардиография
Применение контрастного средства
Оценка необходимости срочной
коронарной ангиографии
Стратификация риска и долгосрочные
прогнозы
Эхокардиографическая диагностика
в отделении реанимации и интенсивной
терапии
Диагностические алгоритмы
и протоколы эхокардиографии
при боли в груди
Клинико-экономическая эффективность
Оценка неишемических причин
боли в груди
Расслоение аорты
Эмболия легочной артерии
Перикардит
Аортальный стеноз
Ограничения
Оценка ишемии
Качество изображения
Укомплектованность кадрами
Заключение
Оценка пациентов с острой болью
в груди в отделении реанимации
и интенсивной терапии
KIRSTEN E. FLEISCHMANN, MD, MPH • SARAH G. WEEKS, MD
ОБЩИЕ ДАННЫЕ И ОСНОВНЫЕ ПОЛОЖЕНИЯ
Боль в груди является одной из наиболее распро-
страненных причин поступления в отделение реа-
нимации и интенсивной терапии (ОИТР), не свя-
занных с травмой. В 2007 и 2008 гг. было зареги-
стрировано 5,5 млн поступлений в ОИТР с болью в
груди, что составило 9% всех поступлений [1]. За-
дачей лечащего врача является определить, кому из
пациентов с болью в груди, нужна неотложная ме-
дицинская помощь. Значительная часть госпитали-
заций связана с патологией коронарных артерий.
13% пациентов с болью в груди имеют острый ко-
ронарный синдром.
Острый коронарный синдром может проявлять-
ся атипичными симптомами, недостаточными для
диагностики изменениями на электрокардиограм-
ме (ЭКГ) или повышением уровней кардиальных
биомаркеров. Время — крайне важный фактор, ког-
да речь идет о кардиологических больных [2]. Па-
циентов без точного диагноза часто направляют на
дальнейшее обследование сердца, что приводит к
значительным затратам. Ранняя терапия поврежде-
ний миокарда и других болезней сердца улучшает
показатели заболеваемости и смертности. Досто-
верный и своевременно поставленный диагноз ва-
жен не только для больного, точная диагностика со-
кращает время и затраты на госпитализацию.
В ОИТР эхокардиографию (ЭхоКГ) чаще всего
используют в качестве дополнительного метода ди-
агностики ишемической болезни сердца (ИБС),
включая инфаркт миокарда (ИМ). ИМ — это ги-
бель клеток миокарда из-за продолжительной ише-
мии. Существует 5 типов ИМ, но в ОИТР для выбо-
ра тактики лечения особое значение имеет тип I
(первичный тромбоз коронарных артерий) и тип II
(вторичный тромбоз коронарных артерий, на фоне
возросших потребностей миокарда в кислороде)
(табл. 11 .1) [3].
Первоначальное клиническое обследование с це-
лью обнаружения признаков повреждения миокар-
да обычно включает ЭКГ, рентгенографию грудной
клетки и определение уровней кардиальных био-
маркеров (например, тропонина). К сожалению, на
начальном этапе ИМ некоторые из этих показате-
лей могут быть в норме, несмотря на наличие по-
вреждения. Кроме этого, данные этих стандартных
исследований могут отличаться от нормы даже в от-
сутствие кардиоспецифического заболевания.
ch11.indd 227
03.04.2019 11:52:28
228
ЧАСТЬ III Ишемическая болезнь сердца
Учитывая серьезные последствия пропуска по-
вреждения миокарда и трудности в быстрой его ди-
агностике, следует провести дополнительное обсле-
дование пациентов с болью в груди (табл. 11 .2),
одышкой или гипотонией, который может помочь
в диагностике и сортировке пациентов. ЭхоКГ так-
же может помочь при лечении в некоторых чрезвы-
чайных ситуациях, например при тампонаде сердца
или брадикардии, когда нужно временно устано-
вить кардиостимулятор. В этой главе основное вни-
мание уделяется современному применению ЭхоКГ
для ранней диагностики острого коронарного син-
дрома и других причин боли в груди (табл. 11 .3).
ФИЗИОЛОГИЯ ОСТРОЙ ИШЕМИИ
И ЭХОКАРДИОГРАФИЯ
Острая ишемия связана с рядом биохимических и
физиологических изменений в миокарде [4]. Ише-
мический каскад начинается с биохимических изме-
нений, приводящих к нарушению диастолической
и систолической функций и деформации миокарда.
Эти изменения обычно предшествуют клиниче-
ским симптомам, на ЭКГ или повышению уровней
кардиальных биомаркеров [5]. Возможность с по-
мощью ЭхоКГ обнаруживать ишемию миокарда у
пациентов с болью в груди без четкого диагноза
«острый коронарный синдром» до появления сим-
птомов путем оценки глобальной и локальной
функций повысила ценность этого метода исследо-
вания.
Хотя коронарный кровоток в условиях повыше-
ния или снижения давления в широком диапазоне
поддерживается на постоянном уровне благодаря
ауторегуляции, при подозрении на коронарную не-
достаточность также может быть полезна контраст-
ная ЭхоКГ для оценки перфузии миокарда. Только
после окклюзии коронарного сосуда на 85% крово-
Тип
Название
Описание
Тип I
Спонтанный инфаркт
миокарда
Инфаркт миокарда, связанный с разрывом атеросклеротической бляшки, изъязвлением,
образованием трещин, эрозий или расслоением с формированием тромба в просвете
одной или нескольких коронарных артериях, что приводит к уменьшению кровоснабже-
ния миокарда или дистальному тромбозу с последующим некрозом миоцитов. У паци-
ента может быть предшествующая тяжелая ИБС, иногда необструктивная
Тип II
Вторичный инфаркт
миокарда на фоне
дисбаланса между
поступлением кис-
лорода и потребле-
нием его миокардом
Вклад в дисбаланс вносит повреждение миокарда с некрозом, дисфункция эндотелия,
спазм коронарной артерии, эмболия коронарных артерий, тахиаритмия и брадиаритмия,
анемия, дыхательная недостаточность, гипотония и гипертония с ГЛЖ или без нее
Тип III
Инфаркт миокарда,
приведший к сер-
дечной смерти, когда
значения кардиаль-
ных биомаркеров
были недоступны
Сердечная смерть на фоне симптомов, указывающих на ишемию миокарда, и предполага-
емых новых ишемических изменений на ЭКГ или новой БЛНПГ, наступившая до забора
крови для анализов, до того как уровень кардиальных биомаркеров мог подняться или
когда кардиальные биомаркеры не были взяты (в редких случаях)
Тип IVa Инфаркт миокарда,
связанный с ЧКВ
Определяют по повышению уровня сердечного тропонина > 5 × 99-й процентиль ВПИ
у пациентов с нормальными исходными значениями (≤ 99-го процентиля ВПИ) или уве-
личением сердечного тропонина > 20%, если базовые значения повышены и стабильны
или падают. Кроме того, существуют либо (1) симптомы, указывающие на ишемию мио-
карда; (2) новые ишемические изменения на ЭКГ либо новая БЛНПГ; (3) нарушение про-
ходимости основной коронарной артерии или ее боковой ветви при коронарной ангио-
графии, либо постоянный медленный поток или его отсутствие, либо эмболия; (4) визу-
альное подтверждение новой потери жизнеспособного миокарда или нового нарушения
локальной сократимости миокарда
Тип IVb Инфаркт миокарда,
связанный с тромбо-
зом стента
Обнаруживают при коронарной ангиографии или аутопсии после ишемии миокарда и
повышении либо снижении уровней кардиальных биомаркеров, по меньшей мере, с
одним значением выше 99-го процентиля ВПИ
Тип V
Инфаркт миокарда,
связанный с КШ
Определяют по повышению уровней кардиальных биомаркеров > 10 × 99-й процентиля
ВПИ у пациентов с нормальными исходными значениями сердечного тропонина (≤ 99-го
процентиля ВПИ). Кроме того, существует либо (1) новые патологические зубцы Q или
новая БЛНП; (2) ангиографически подтвержденный новый шунт или новая окклюзия
нативной коронарной артерии; (3) визуальное подтверждение новой потери жизнеспо-
собного миокарда или нового нарушения локальной сократимости миокарда
БЛНПГ — блокада левой ножки пучка Гиса; ВПИ — верхний предел измерения; ГЛЖ — гипертрофия левого желудочка; ИБС — ишеми-
ческая болезнь сердца; КШ — коронарное шунтирование; ЧКВ — чрескожное коронарное вмешательство; ЭКГ — электрокардиограмма.
[Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. Circulation 126:2020-2035, 2012.]
ТАБЛИЦА 11.1 Типы инфаркта миокарда
ch11.indd 228
03.04.2019 11:52:28
229
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
Предполагаемые
причины боли в груди
Альтернативные ЭхоКГ
методы исследования
Расслоение аорты
ЧПЭхоКГ, КТА, МРА,
аортография
Ишемическая болезнь
сердца
КТА, нагрузочное радионуклид-
ное исследование с визуализа-
цией перфузии миокарда, кате-
теризация левых отделов
сердца
Перикардит/миокардит
МРТ сердца
Эмболия легочной
артерии
Вентиляционно-перфузионное
сканирование, КТА, ангиогра-
фия легких
КТА — компьютерная томографическая ангиография; МРА — маг -
нитно-резонансная ангиография; МРТ — магнитно -резонансная
томография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 11.2
Исследование пациентов с болью
в груди в отделении интенсивной
терапии и реанимации
1. Симптомы или состояния, потенциально связанные с
предполагаемыми кардиальными причинами, включая
боль в груди, одышку, сердцебиение, транзиторная ише-
мическая атака, инсульт, периферическую эмболию, но
не ограниченные только ими
2. Предварительные обследования для выявления сер-
дечно-сосудистых заболеваний или структурной патоло-
гии, включая рентгенографию грудной клетки, исходные
изображения стресс-ЭхоКГ, ЭКГ или уровни кардиаль-
ных биомаркеров, но не ограниченные только ими
3. Частые желудочковые экстрасистолы или желудочковые
экстрасистолы, связанные с нагрузкой
4. Фибрилляция предсердий (устойчивая или неустойчи-
вая), наджелудочковая тахикардия или желудочковая
тахикардия
5. Клинические симптомы или признаки, связанные с кар-
диальным диагнозом (головокружение, предобморочное
или обморочное состояние)
6. Обморок, когда нет других симптомов или признаков
сердечно-сосудистого заболевания
7. Гипотония или гемодинамическая нестабильность нео-
пределенной или предположительно кардиальной
этиологии
8. Острая боль в груди при подозрении на ИМ с неинфор-
мативной ЭКГ (исходная ЭхоКГ может быть выполнена
во время боли)
9. Оценка пациента без боли в груди, но с другими сим-
птомами, соответствующими ишемии, или уровнями
кардиальных биомаркеров, указывающими на развива-
ющийся ИМ
10. Дыхательная недостаточность или гипоксемия неясной
этиологии
11. Установленная острая эмболия легочной артерии
12. Тяжелый децелерационный синдром или травмы
грудной клетки с повреждением клапана сердца, пери-
кардиальной жидкостью с вероятным либо предполагае-
мым повреждением сердца
13. Первоначальная оценка предполагаемого инфекцион-
ного эндокардита при положительной гемокультуре или
недавно возникшем шуме сердца
ИМ — инфаркт миокарда; ЭКГ — электрокардиография.
[Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HF-
SA/HRS/SCAI/SCCM/SCCT/SCMR 2011 Appropriate Use Criteria for
Echocardiography. J Am Soc Echocardiogr 24:229–267, 2011.]
ТАБЛИЦА 11.3
Критерии целесообразного
использования трансторакальной
эхокардиографии в отделении
интенсивной терапии и реанимации
ток становится ниже порогового значения нормы
[6]. Контрастная ЭхоКГ позволяет оценить перфу-
зию миокарда и, таким образом, неинвазивно выя-
вить тяжелые стенотические поражения русла коро-
нарных артерий.
ТЕХНИЧЕСКИЕ АСПЕКТЫ ЭХОКАРДИОГРАФИИ
В ОТДЕЛЕНИИ РЕАНИМАЦИИ И ИНТЕНСИВНОЙ
ТЕРАПИИ
ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЙ
Обстановка в ОИТР часто достаточно сложная для
проведения ЭхоКГ, чем в условиях диагностическо-
го отделения. Исследование пациентов с болью в
груди с помощью трансторакальной эхокардиогра-
фии (ТТЭхоКГ) должно быть нацелено на оценку
функций обоих желудочков, нарушений локальной
сократимости миокарда (отсутствие нормальной
толщины стенки, особенно в зоне кровоснабжения)
и деформации миокарда. Также можно использо-
вать контрастную ЭхоКГ, если она доступна и кли-
нически обоснована. Исследование должно помочь
определить неишемические причины боли в гру-
ди — боль, связанную с аортальным стенозом, ги-
пертрофической кардиомиопатией, перикардиаль-
ной жидкостью и расслоением аорты. Чувствитель-
ность ТТЭхоКГ относительно расслоения аорты
ограничена, т.е. даже при отрицательном результате
ТТЭхоКГ нельзя с полной уверенностью исключить
эту патологию.
Стандартными позициями ТТЭхоКГ в 2D-режи-
ме для оценки толщины стенки являются парастер-
нальные позиции по длинной и короткой осям и
апикальные четырехкамерные, трехкамерные и двух-
камерные позиции (рис. 11 .1). Если не удается до-
стичь адекватного качества изображения в пара-
стернальной или апикальной позиции, можно вос-
пользоваться субкостальной позицией. Во внеосе-
вых или боковых позициях (модифицированных)
сложно интерпретировать нарушения локальной
сократимости миокарда, и вероятность ошибок уве-
личивается. Изображения следует анализировать в
соответствии с рекомендациями American Society of
Echocardiography (рис. 11 .2) [7].
Применение контрастных средств при ЭхоКГ по-
лезно для определения границ эндокарда и анализа
сократимости миокарда. Контрастные средства для
ЭхоКГ содержат микропузырьки, которые проходят
по малому кругу кровообращения, что приводит к
ch11.indd 229
03.04.2019 11:52:28
230
ЧАСТЬ III Ишемическая болезнь сердца
пациентов с острой болью в груди и получили адек-
ватные изображения в 81% случаев [9]. Последую-
щее исследование пациентов, которым было техни-
чески сложно провести ЭхоКГ, показало, что после
введения контрастного средства процент визуализа-
ции сегментов миокарда увеличился с 68 до 99%,
что повлияло на ведение пациентов [10].
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
СОРТИРОВКА ПАЦИЕНТОВ С ОСТРОЙ БОЛЬЮ В ГРУДИ
Как только кровоснабжение миокарда падает ниже
критического уровня, быстро развиваются наруше-
ния локальной сократимости миокарда, индуциро-
ванные ишемией. Поскольку нарушения локальной
сократимости миокарда предшествуют симптомам,
пациентам с признаками острого коронарного син-
дрома без диагностически значимых изменений на
ЭКГ или уровней кардиальных биомаркеров, про-
водили ТТЭхоКГ (табл. 11 .4). Однако диагностиче-
ская точность исследования широко варьировала,
вероятно, вследствие влияния таких факторов, как:
(1) время появления симптомов; (2) площадь ин-
фаркта; (3) технические ограничения. Исследование
в ОИТР пациентов с симптомами острого коронар-
ного синдрома показало, что ТТЭхоКГ имеет отри-
цательную прогностическую значимость 97%, а по-
ложительная прогностическая значимость только
24% [11]. Нормальная систолическая функция в по-
кое обнадеживает, но этого недостаточно, чтобы ис-
ключить диагноз «острый коронарный синдром»
(см. табл. 11 .1). Оценка толщины стенки с помо-
щью ТТЭхоКГ у пациентов с подозрением на острый
коронарный синдром целесообразна, но при пер-
вичном обследовании не информативна (см. табл.
11.3) [12].
ОЦЕНКА ДЕФОРМАЦИИ МИОКАРДА
Исследования показали, что ЭхоКГ при оценке де-
формации миокарда ЛЖ более чувствительный ме-
тод, чем стандартная ТТЭхоКГ при диагностике
ишемии миокарда. Это было проверено в условиях
ОИТР при оценке пациентов с острой болью в гру-
ди с сомнительным диагнозом «острый коронар-
ный синдром» [13]. По сравнению с оценкой нару-
шений локальной сократимости миокарда оценка
локальной продольной деформации имела более
высокую чувствительность и аналогичную диагно-
стическую точность. Локальная продольная дефор-
мация миокарда имела более высокую прогности-
ческую значимость относительно кардиальных со-
бытий в течениеодного месяца (рис. 11 .4). Dahslett
и соавт. обнаружили, что максимальная глобальная
продольная деформация превосходит обычные эхо-
кардиографические параметры при диагностике па-
циентов со стенозом и без значительного стеноза
коронарных артерий (AUC 0,87, чувствительность
ПСепт
ПСепт
НБ
НСепт
НСепт
НБ
Н
Н
П
П
Б
Б
А
Б
Г
В
Рис. 11 .1 Трансторакальная эхокардиография для оценки сократимо-
сти миокарда левого желудочка. Стандартные позиции для оценки сокра-
тимости миокарда: (А) A парастернальная позиция по длинной оси, визуали-
зируются базальный переднесептальный (ПСепт) и базальный нижнебоковой
(НБ) сегменты; (Б) A парастернальная позиция по короткой оси на уровне па-
пиллярных мышц, визуализируются нижнесептальный (НСепт), переднесеп-
тальный, передний (П), боковой (Б), нижнебоковой (НБ) и нижний (Н) сегмен-
ты; (В) A апикальная четырехкамерная позиция, визуализируются нижнесеп-
тальный и боковой сегменты; (Г) апикальная двухкамерная позиция, визуали-
зируются нижний и передний сегменты.
контрастированию левого желудочка (ЛЖ) и луч-
шей визуализации границ эндокарда (рис. 11 .3).
Для обследования пациентов в экстремальных
условиях очень важно, чтобы специалист по уль-
тразвуковой диагностике или ЭхоКГ был хорошо
обучен и имел большой опыт. Специалист должен
получать необходимую информацию самым эф-
фективным способом (в правильном положении
пациента, нужным датчиком и при оптимальных
настройках системы). Настройки зависят от особен-
ностей пациента, например у пациентов с ожирени-
ем нужны низкочастотные изображения. Использо-
вание второй гармоники увеличивает отношение
сигнал/шум, что обеспечивает более четкое изобра-
жение. В случае применения контрастных средств
для определения границ эндокарда следует изме-
нить настройки, особенно механический индекс [8].
Развитие технологий значительно сократило ко-
личество малоинформативных ЭхоКГ. В раннем ис-
следовании Horowitz и соавт. проводили ЭхоКГ у
ch11.indd 230
03.04.2019 11:52:28
231
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
Двухкамерная позиция
Четырехкамерная позиция
Позиция по длинной оси
Двухкамерная позиция
Четырехкамерная позиция
Позиция по длинной оси
17
14
16
9
12
36
17
15
13
10
7
4
1
17
16
13
11
8
5
2
Передние
П
е
р
е
д
н
е
с
е
п
т
а
л
ь
н
ы
е
П
е
р
е
д
н
е
б
о
к
о
в
ы
е
1 Базальный передний
2 Базальный переднесептальный
3 Базальный нижнесептальный
4 Базальный нижний
5 Базальный нижнебоковой
6 Базальный переднебоковой
7 Медиальный передний
8 Медиальный переднесептальный
9 Медиальный нижнесептальный
10 Медиальный нижний
11 Медиальный нижнебоковой
12 Медиальный переднебоковой
13 Апикальный передний
14 Апикальный септальный
15 Апикальный нижний
16 Апикальный боковой
17 Истинная верхушка
Н
и
ж
н
е
б
о
к
о
в
ы
е
Н
и
ж
н
е
с
е
п
т
а
л
ь
н
ы
е
Нижние
Рис. 11.2 Изображения сегментов левого желудочка при визуализации в апикальных позициях: четырехкамерной, двухкамерной и позиции по длин-
ной оси ЛЖ. Вверху — ЭхоКГ, внизу — сегменты ЛЖ в каждой позиции [Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification
by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr
28:1–39 , 2015].
ch11.indd 231
03.04.2019 11:52:29
232
ЧАСТЬ III Ишемическая болезнь сердца
птомов). Данные клинических наблюдений и ре-
зультаты катетеризации сердца свидетельствуют,
что стресс-ЭхоКГ с добутамином имеет чувстви-
тельность 89,5%, специфичность 88,9% и отрица-
тельную прогностическую значимость 98,5%.
Bholasingh и соавт. оценили прогностическую
значимость стресс-ЭхоКГ с добутамином у 377 па-
циентов с болью в груди и отрицательными карди-
альными маркерами [17]. За последующие 6 меся-
цев кардиальные события произошли у 30% паци-
ентов с положительным результатом стресс-ЭхоКГ
с добутамином и у 4% пациентов с отрицательным
результатом стресс-ЭхоКГ с добутамином (OR 10,7,
p < 0,0001).
Стресс-МРТ сердца является относительно но-
вым методом визуализации. В одном центре срав-
нили стресс-ЭхоКГ и стресс-МРТ сердца при оценке
в условиях ОИТР пациентов с умеренной болью в
груди и установили, что эти методы имеют схожие
специфичность, точность, а также положительную
и отрицательную прогностическую значимость для
диагностики значимой ИБС [18].
ПРИМЕНЕНИЕ КОНТРАСТНОГО СРЕДСТВА
Точная интерпретация стресс-ЭхоКГ зависит от ка-
чества визуализации границы эндокарда всех 16 сег-
ментов сердца. Крайне важно оптимизировать ме-
тод визуализации для повышения его чувствитель-
ности, т.е . использовать контрастное средство, когда
2 или более сегментов сердца визуализируются пло-
хо [19]. Контрастная ЭхоКГ позволяет оценить
утолщение стенки и перфузию миокарда. Перфу-
зию миокарда можно быстро оценить у постели
больного в режиме реального времени, введя вну-
тривенно контрастное средство с микропузырька-
ми. Инертные микропузырьки попадают с кровью
Рис. 11 .3 Контрастное усиление. (А) Апикальная четырехкамерная позиция. Эндокард визуализируется недостаточно, что ограничивает оценку локальной со-
кратимости миокарда. (Б) Благодаря контрастному усилению локальную функцию ЛЖ можно оценить более достоверно.
А
Б
93%, специфичность 78%) [14]. Была продемон-
стрирована высокая обоснованность диагноза, но
3% сегментов не анализировали (рис. 11 .5). У паци-
ентов с острым коронарным синдромом без подъ-
ема сегмента ST специфическая для слоя эндокарда
деформация также может помочь в определении
пациентов со значительным стенозом коронарных
артерий (рис. 11 .6) [15]. Несмотря на эти много-
обещающие результаты, исследование деформации
миокарда невозможно проводить регулярно из-за
ограничений по времени, техническим возможно-
стям и опыту исследователя.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
Стресс-ЭхоКГ с физической или фармакологиче-
ской нагрузкой для оценки ишемии безопасна и эф-
фективна при выявлении нарушений локальной со-
кратимости миокарда и диагностики стенозирую-
щего атеросклероза коронарных артерий, если
соблюдаются стандартные показания и противопо-
казания к исследованию. Для физической нагрузки
используют стандартный протокол тредмил-теста
(т.е . Bruce) или горизонтальную велоэргометрию
(подробнее о стресс-ЭхоКГ при диагностике ИБС
см. главу 13). В данном разделе основное внимание
уделяется использованию стресс-ЭхоКГ для оценки
боли в груди в условиях ОИТР.
Также изучали использование стресс-ЭхоКГ с до-
бутамином для оценки боли в груди в условиях
ОИТР [16]. Пациентам с нормальной ЭКГ и кар-
диальными маркерами проводили 2D-ЭхоКГ в по-
кое. Если в покое изображения были нормальными,
стресс-ЭхоКГ с добутамином по протоколу прово-
дили опытная медсестра и специалист по УЗИ. Тест
был завершен в среднем через 5,4 час с момента по-
ступления в клинику (6,5 ± 17,5 часа от начала сим-
ch11.indd 232
03.04.2019 11:52:29
233
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
Первый автор,
год
Количество
пациентов
Характеристики пациентов
Результаты
Peels, 1990 [10a]
43
Острая боль в груди, неинформатив-
ная ЭКГ и отсутствие ИБС в
анамнезе
Чувствительность 88% и специфичность
78% для диагностики ишемии по сравнению с
ангиографией
Sabia, 1991 [10b] 171
Кардиальные симптомы
Систолическая дисфункция ЛЖ прогнозирует как
краткосрочные, так и долгосрочные кардиальные
события
Fleischmann, 1994
[27]
513
Боль в груди
Умеренная дисфункция ЛЖ и выраженная регурги-
тация независимо прогнозируют выживаемость
Trippi, 1997 [16] 163
Боль в груди, нормальные уровни
кардиальных биомаркеров и неин-
формативная ЭКГ
Стресс-ЭхоКГ с добутамином имеет отрицательную
прогностическую значимость 98,5% при ишемии
коронарных артерий
Bholasingh, 2003
[17]
377
Боль в груди, нормальные уровни
кардиальных биомаркеров и неин-
формативная ЭКГ
Стресс-ЭхоКГ с добутамином — независимый пре-
диктор кардиальных событий
Kang, 2005 [10c] 114
Боль в груди в состоянии покоя
Дефект перфузии миокарда при контрастной ЭхоКГ
связан с OR 21 при диагностике острого ИМ
Tong, 2005 [10d] 957
Боль в груди и неинформативная
ЭКГ
Контрастная ЭхоКГ обеспечивает краткосрочной и
долгосрочной прогностической информацией до
определения уровней кардиальных биомаркеров
Rinkevich, 2005
[10e]
1017
Боль в груди без подъема сегмента
ST
Утолщение стенки и перфузия миокарда являются
предикторами кардиальных событий
Wei, 2010 [10f]
720
Боль в груди без подъема сегмента
ST
Нарушения локальной сократимости миокарда ±
патологическая перфузия — независимые преди-
кторы нефатального ИМ и сердечной смерти
Gaibazzi, 2013 [21] 718
Наблюдение в течение 16 месяцев
пациентов после контрастной
стресс-ЭхоКГ с дипиридамолом для
оценки имеющейся или предпола-
гаемой ИБС
Контрастная стресс-ЭхоКГ обеспечивала лучший
прогноз, независимо от использования резерва
коронарного кровотока или перфузии миокарда
по сравнению с оценкой локальной сократимости
миокарда
Dahlslett, 2014
[14]
64
Острый коронарный синдром без
подъема сегмента ST и без диагно-
стированной ИБС
Максимальная глобальная продольная деформация
превосходила стандартные параметры у пациентов
со значимым стенозом коронарных артерий
Innocenti, 2014
[26]
626
Внезапно возникшая боль в груди у
пациентов ОИТР
Наличие обширной зоны асинергии на пике
нагрузки при стресс-ЭхоКГ было связано с небла-
гоприятным прогнозом (RR 9,8)
Lee, 2015 [13]
104
Боль в груди без установленной ИБС Сравнительная оценка деформации и локальной
сократимости миокарда эффективна при диагно-
стике ИБС (чувствительность 92%, специфичность
77%) и прогнозирования событий в будущем
ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда; ЛЖ — левый желудочек; ОИТР — отделение интенсивной терапии и ре-
анимации; ЭКГ — электрокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 11.4 Клинические исследования применения эхокардиографии при оценке боли в груди
в зоны с адекватной перфузией, а в зонах гипопер-
фузии микропузырьков нет, в результате в зонах с
нормальной перфузией интенсивность ультразву-
кового сигнала увеличивается быстрее по сравне-
нию с сигналом от зон гипоперфузии. Разрушение
пузырьков происходит под воздействием высоко-
интенсивных импульсов (механический индекс 1,0),
синхронизированных с конечно-систолической фа-
зой, а визуализация происходит при механическом
индексе около 0,5 (рис. 11 .7).
Korosoglou и соавт. изучали в ОИТР перфузию
миокарда в режиме реального времени у пациентов
с впервые возникшей болью в груди [20]. Контраст-
ная ЭхоКГ для оценки перфузии миокарда была вы-
полнена в рамках предварительного обследования
100 последовательно поступившим пациентам.
Этот метод визуализации позволил определить па-
циентов с вероятным диагнозом «острый коронар-
ный синдром», у которых уровень тропонина был в
норме. Перфузионная ЭхоКГ миокарда смогла ис-
ch11.indd 233
03.04.2019 11:52:29
234
ЧАСТЬ III Ишемическая болезнь сердца
40
20
0
20
40
60
80
100
0
100
80
60
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
(
%
)
100% Специфичность
Глобальная деформация, AUC 0,87
Локальная деформация, AUC 0,83
WNMSI, AUC 0,74
Фракция выброса, AUC 0,68
Шкала GRACE, AUC 0,68
0
25
50
75
100
0
25
50
75
100
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
(
%
)
100
75
50
25
0
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
(
%
)
100
75
50
25
0
100% Специфичность
100% Специфичность
Фракция выброса ЛЖ
Вероятность предварительного диагноза
Глобальная деформация
Локальная деформация
Нарушения локальной сократимости миокарда
А
Б
Рис. 11.4 Рабочие характеристические кривые для фракции выброса левого желудочка, вероятности предварительного диагноза, глобальной
и локальной продольной деформаций, а также нарушений локальной сократимости миокарда. (А) Диагноз «ишемическая болезнь сердца» (ИБС) у
тех, кому проводили коронарную ангиографию. (Б) Динамический контроль кардиальных событий в течение одного месяца [Lee M, Chang SA, Cho EJ, et al. Role
of strain values using automated function imaging on transthoracic echocardiography for the assessment of acute chest pain in emergency department. Int J Cardiovasc Im-
aging 31:547–556, 2015].
Рис. 11 .5 Рабочие характеристические кривые для глобальной и ло-
кальной продольной деформации, исключая значимый стеноз коро-
нарных артерий, у пациентов с подозрением на острый коронарный
синдром. AUC — площадь под кривой [Dahslett T, Karlsen S, Grenne B, et al.
Early assessment of strain echocardiography can accurately exclude significant
coronary artery stenosis in suspected non–ST-segment elevation acute coronary
syndrome. J Am Soc Echocardiogr 27:512–519, 2014].
ключить острый коронарный синдром у двух паци-
ентов с повышенным уровнем кардиальных био-
маркеров (окончательным диагнозом стал миопе-
рикардит).
Прогностическую значимость исследования пер-
фузии миокарда оценивали с помощью стресс-
ЭхоКГ с дипиридамолом у пациентов с установлен-
ной или предполагаемой ИБС. В течение 16 месяцев
после стресс-ЭхоКГ наблюдали 718 пациентов. У
18% пациентов нарушения локальной сократимо-
сти миокарда были обратимыми, у 27% пациентов
был обратимый дефект перфузии миокарда. При
нормальной перфузии миокарда при стресс-тесте
годовой показатель заболеваемости составил 1,2%
по сравнению с общей частотой кардиальных собы-
тий 6%. Исследование перфузии миокарда в допол-
нение к оценке нарушений локальной сократимо-
сти миокарда улучшало прогноз кардиальных со-
бытий (рис. 11 .8) [21].
ОЦЕНКА НЕОБХОДИМОСТИ СРОЧНОЙ
КОРОНАРНОЙ АНГИОГРАФИИ
Коронарную ангиографию по-прежнему считают
«золотым стандартом» диагностики ИБС, развива-
ющейся вследствие обструкции эпикардиальных
артерий. Пациентов с неинформативной ЭКГ и вы-
сокой вероятностью предварительного диагноза
«ишемическая болезнь сердца» часто немедленно
направляют на ангиографию и чрескожную коро-
нарную ангиопластику. Ангиография позволяет
быстро поставить диагноз, однако не может дать
информацию о функциональном состоянии сердца
при стенозе. Функциональное состояние можно
оценить с помощью катетеризации, используя кате-
теры с датчиками давления, но это занимает много
времени. Данные ЭхоКГ могут помочь в принятии
решения о необходимости срочной коронарной ан-
гиографии. При нормальной глобальной и локаль-
ной функции возможен более консервативный под-
ход с последующей стресс-ЭхоКГ для исключения
выраженного стеноза коронарных артерий. И на-
оборот, при обнаружении нового нарушения ло-
кальной сократимости миокарда следует ускорить
проведение коронарной ангиографии.
В оценке перфузии и принятии решения о вре-
мени проведения коронарной ангиографии и чре-
скожной коронарной ангиопластики также может
быть полезна контрастная ЭхоКГ. Для коронарной
ангиографии наличия перфузии тканей не нужно. В
нескольких исследованиях определяли пользу кон-
трастной ЭхоКГ для оценки микрососудистой ре-
перфузии после острого ИМ. Greaves и соавт. [22]
ch11.indd 234
03.04.2019 11:52:29
235
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
А
Б
А
Б
Рис. 11 .6 Визуализация деформации с помощью спекл-трекинг ЭхоКГ. (А) A Двухкамерная позиция. Видна акинезия передней стенки и верхушки, что
соответствует ишемии или инфаркту миокарда. (Б) A Позиция по длинной оси ЛЖ. Видна гипокинезия переднесептальных сегментов.
ch11.indd 235
03.04.2019 11:52:30
236
ЧАСТЬ III Ишемическая болезнь сердца
проводили контрастную ЭхоКГ 15 пациентам после
первичного чрескожного коронарного вмешатель-
ства при остром ИМ. Анализ показал, что перфузи-
руемые гипокинетичные или акинетичные сегмен-
ты в 50 раз чаще восстанавливают свою функцию,
чем неперфузируемые. Результаты контрастной
ЭхоКГ были предиктором устранения нарушений
локальной сократимости (чувствительность 88%,
специфичность 74% и положительная и отрица-
тельная прогностическая значимость 83 и 81% соот-
ветственно). Ценность контрастной ЭхоКГ пре-
взошла другие известные методики, такие как тром-
болизис при остром ИМ, степень миокардиального
свечения контрастного средства, а также процент
резолюции сегмента ST.
Показана жизнеспособность миокарда после ос-
трого ИМ у 99% пациентов, определенная с помо-
щью контрастной ЭхоКГ и однофотонной эмисси-
онной компьютерной томографии (ОФЭКТ). Уста-
новлено, что только определяемая с помощью
контрастной ЭхоКГ жизнеспособность является не-
зависимым многомерным прогностическим факто-
ром заболеваемости и смертности [23].
СТРАТИФИКАЦИЯ РИСКА И ДОЛГОСРОЧНЫЕ ПРОГНОЗЫ
В 2015 г. было опубликовано первое рандомизиро-
ванное исследование результатов функциональных
и анатомических обследований, проведенных паци-
ентам с симптомами, указывающими на ИБС (сред-
няя вероятность предварительного осмотра ≈53%).
0
2
4
6
8
10
12
14
16
18
20
%
2
1
3
4
5
6
7
8
9
10
11
1 Общая популяция
2 Нормальная СМ
3 Патологическая СМ
4 Нормальные СМ и РКК
5 Патологические СМ и РКК
6 Нормальный РКК
7 Патологический РКК
8 Нормальная ПМ
9 Патологическая ПМ
10 Изолированный ДПМ
11 Патологическая СМ или РКК < 2 и ДПМ
Рис. 11 .8 Сравнение прогноза кардиальных событий по сократимости миокарда, резерву коронарного кровотока и перфузии миокарда. ДПМ —
дефект перфузии миокарда; ПМ — перфузия миокарда; РКК — резерв коронарного кровотока; СМ — сократимость миокарда [Gaibazzi N, Rigo F, Lorenzoni V,
et al. Comparative prediction of cardiac events by wall motion, wall motion plus coronary flow reserve, or myocardial perfusion analysis. JACC Cardiovasc Imaging 6:1–12 ,
2013].
Рис. 11 .7 A Контрастная эхокардиография миокарда. (А) Апикальная позиция по длинной оси ЛЖ. (Б) Контрастирование полости ЛЖ в конце диастолы
и конце систолы демонстрирует акинезию нижнебокового сегмента. (В) Нарушение перфузии нижнебокового сегмента, соответствующее нарушению сократимо-
сти миокарда (предоставлено Sharon Mulvagh MD, Mayo Clinic Rochester).
А
Б
В
ch11.indd 236
03.04.2019 11:52:30
237
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
Пациентов в случайном порядке направляли на
компьютерную томографическую ангиографию
(КТА), нагрузочную ЭКГ, нагрузочное радиону-
клидное исследование или стандартную стресс-
ЭхоКГ. В среднем за 25 месяцев стратегия КТА в ка-
честве стартового метода привела к более высокой
лучевой нагрузке и повышению частоты катетери-
заций по сравнению с функциональными пробами,
а также не улучшила клинические результаты (рис.
11.9) [24].
Farkouh и соавт. исследовали долгосрочные ис-
ходы сердечно-сосудистых заболеваний среди па-
циентов с болью в груди, находящихся в ОИТР [25].
Используя критерии, предложенные Agency for
Health Care Policy and Research, эти исследователи
смогли разделить долгосрочный риск неблагопри-
ятных событий для пациентов с высоким риском
(11,5%), средним риском (6,2%) и низким риском
(2,5%). Исследования, оценивающие долгосрочную
прогностическую значимость стресс-ЭхоКГ у паци-
ентов с болью в груди, находящихся в ОИТР, пока-
зали, что возросший пик индекса нарушения ло-
кальной сократимости миокарда независимо ассо-
циировался с неблагоприятными событиями (рис.
11.10) [26].
В ряде исследований была продемонстрирована
возрастающая ценность ЭхоКГ, помимо клиниче-
ской оценки и ЭКГ, в прогнозировании клиниче-
ского исхода пациентов с острой болью в груди [27,
28]. В проспективном исследовании пациентов, по-
ступивших в большое городское ОИТР, Fleischmann
и соавт. [27] определили эхокардиографические
прогностические факторы серьезных осложнений
(рецидивирующая значительная ишемия миокарда,
сердечная недостаточность и аритмия) для пациен-
тов с болью в груди. Допплерографию выполняли
в среднем через 21 час после оценки функции обо-
их желудочков, локальной функции и функции
клапанного аппарата. При однофакторном анализе
прогностическими факторами осложнений были
функция ЛЖ (OR 2,9), функция правого желудочка
(ПЖ) (OR 2,7), конечно-диастолический размер ЛЖ
(OR 1,6), конечно-систолический размер ЛЖ (OR
1,4) и индекс локальной сократимости миокарда
(OR 3,0). Индекс локальной сократимости миокар-
да был прогностическим фактором осложнений, не-
зависимым от клинических и электрокардиографи-
ческих переменных.
За последующий период наблюдения (около 3
лет) независимыми прогностическими факторами
выживаемости были умеренная или тяжелая дис-
функция ЛЖ и более умеренная митральная регур-
гитация. Эти показатели имели у пациентов с острой
болью в груди более высокую прогностическую зна-
чимость по сравнению с клиническими данными и
результатами ЭКГ (рис. 11 .11, 11.12).
Было показано, что с помощью стресс-ЭхоКГ с
добутамином возможно спрогнозировать карди-
альные события у пациентов с установленной или
предполагаемой ИБС [29]. Наблюдение в течение 52
0
0
6
12
18
24
Месяцы с момента рандомизации
30
36
42
10
20
30
40
50
60
70
80
90
100
0
0
6
12
24
18
30
36
42
Анатомическое
обследование
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Анатомическое обследование vs функциональное обследование
HR 1,04 (95% ДИ 0,83–1,29)
p=0,75
П
а
ц
и
е
н
т
ы
с
с
е
р
д
е
ч
н
о
-
с
о
с
у
д
и
с
т
ы
м
с
о
б
ы
т
и
е
м
(
%
)
Анатомическое обследование 4996
4703
4362
3551
2652
1705
902
269
5007
4536
4115
3331
2388
1518
832
258
Функциональное обследование
Количество пациентов в группе риска
Функциональное
обследование
Рис. 11 .9 Сравнение результатов анатомических и функциональных обследований, проведенных для диагностики ишемической болезни серд-
ца. Показатели сердечно-сосудистых событий у 10 003 пациентов с симптомами, рандомизированных для стартового анатомического обследования (компьютер-
ной томографической ангиографии) и для функционального обследования (например, стресс-ЭхоКГ, нагрузочное радионуклидное исследование), показали, что
анатомическое обследование не имело преимуществ перед функциональным при средней продолжительности наблюдения в 2 года. ДИ — доверительный ин-
тервал [Douglas PS, Hoffman U, Patel MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. NEJM 372:1291–1300, 2015].
ch11.indd 237
03.04.2019 11:52:31
238
ЧАСТЬ III Ишемическая болезнь сердца
0
80
85
90
95
100
500
1000
1500
Нормальная стресс-ЭхоКГ
Патологическая стресс-ЭхоКГ
Длительность наблюдения (дни)
В
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
с
о
б
ы
т
и
й
(
%
)
p < 0,0001
2000
1,0
0,8
0,6
0,4
0,2
400
200
0
1000
800
Длительность наблюдения (дни)
600
1200 1400 1800
К
о
э
ф
ф
и
ц
и
е
н
т
в
ы
ж
и
в
а
е
м
о
с
т
и
Нет ДЛЖ
Легкая ДЛЖ
Умеренная ДЛЖ
Тяжелая ДЛЖ
Рис. 11 .10 Прогностическая значимость стресс-эхокардиографии. Кри-
вые выживаемости Kaplan–Meier демонстрируют высокую отрицательную про-
гностическую значимость стресс-ЭхоКГ у пациентов со спонтанной болью в
груди, направленных в ОИТР [Innocenti F, Cerabona P, Donnini C, et al. Long-term
prognostic value of stress echocardiography in patients presenting to the ED with
spontaneous chest pain. Am J Emerg Med 32:731–736, 2014].
Рис. 11 .11 Кривые выживаемости Kaplan–Meier пациентов с болью в
груди, стратифицированных по дисфункции левого желудочка. ДЛЖ —
дисфункция левого желудочка [Fleischmann KE, Lee RT, Come PC, et al. Impact
of valvular regurgitation and ventricular dysfunction on long term survival in patients
with chest pain. Am J Cardiol 80:1266–1272, 1997. From Excerpta Medica Inc].
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
400
200
0
1000
800
600
1200 1400 1800
К
о
э
ф
ф
и
ц
и
е
н
т
в
ы
ж
и
в
а
е
м
о
с
т
и
Длительность наблюдения (дни)
Нет МР
Легкая МР
Умеренная МР
Тяжелая МР
ональные возможности (важный прогностический
фактор). Стресс-ЭхоКГ с физической нагрузкой
сравнивали со стресс-ЭхоКГ с фармакологической
нагрузкой при диагностике ИБС. Точность диагно-
стики стресс-ЭхоКГ с физической нагрузкой и стресс-
ЭхоКГ с добутамином была одинаковой (87%), что
выше, чем стресс-ЭхоКГ с дипиридамолом (78%)
[31].
За последние 20 лет применение методов визуа-
лизации при стресс-тестах заметно увеличилось,
что привело к разработке критериев целесообразно-
го использования. Исследования показали, что доля
неадекватных реакций на стресс-тест составляет
приблизительно 13%, однако только в 2% случаев
боль в груди при вероятном остром коронарном
синдроме была неадекватной [32].
ЭХОКАРДИОГРАФИЧЕСКАЯ ДИАГНОСТИКА
В ОТДЕЛЕНИИ РЕАНИМАЦИИ И ИНТЕНСИВНОЙ ТЕРАПИИ
Фокусное УЗИ сердца для быстрой оценки пациен-
та с проникающим ранением грудной клетки стали
врачи-реаниматологи в начале 1990-х гг . [33]. С то-
го времени перечень показаний и области примене-
ния ультразвука расширились. American Society of
Echocardiography и American College of Emergency
Physicians опубликовали в 2010 г. консенсусный до-
кумент [34]. Фокусное УЗИ сердца пациентов в кри-
тическом состоянии предназначено для ответа на
определенные клинические вопросы. В первую оче-
редь оценивают наличие перикардиальной жидко-
сти, относительные размеры полостей, глобальную
сократительную функцию миокарда и степень обез-
воживания пациента. Проведение ЭхоКГ с помо-
щью стационарной ультразвуковой системы реко-
мендуют пациенту, у которого клинические призна-
ки и данные фокусного УЗИ сердца противоречивы.
Современные показания к фокусному УЗИ: травма
Рис. 11.12 Кривые выживаемости Kaplan–Meier пациентов с болью в
груди, стратифицированных по степени митральной регургитации (4+).
МР — митральная регургитация [Fleischmann KE, Lee RT, Come PC, et al. Impact
of valvular regurgitation and ventricular dysfunction on long-term survival in patients
with chest pain. Am J Cardiol 80:1266–1272, 1997. From Excerpta Medica Inc].
месяцев 860 пациентов показало, что независимые
прогностические факторы кардиальных событий
являются предикторами хронической сердечной не-
достаточности (HR 2,51), количества патологиче-
ских сегментов на пике стресс-теста (HR 1,23) и па-
тологического конечно-систолического объема ЛЖ
при стресс-тесте (HR 1,98). Неинвазивную диагно-
стику ИБС у женщин всегда считали более сложной,
чем у мужчин. Если противопоказаний нет, стресс-
ЭхоКГ с добутамином может быть подходящим
стресс-тестом для женщин, не способных к физиче-
ской нагрузке, учитывая более высокую специфич-
ность этого метода диагностики [30].
Физическая нагрузка по сравнению с фармаколо-
гической нагрузкой более точно оценивает функци-
ch11.indd 238
03.04.2019 11:52:31
239
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
В Италии было проведено исследование с уча-
стием 6723 пациентов со средним риском, болью в
груди и неинформативной ЭКГ, которые находи-
лись в ОИТР [4, 41]. В большинстве случаев пожи-
лым пациентам и пациентам с несколькими факто-
рами риска или неинформативной ЭКГ проводили
ОФЭКТ, более молодым пациентам и пациентам с
одним фактором риска или без него и нормальны-
ми ЭКГ проводили тредмил-тест, а тем, кто был не
в состоянии выполнять физическую нагрузку либо
имел сомнительные или неинформативные резуль-
таты тредмил-теста либо ОФЭКТ, проводили стресс-
ЭхоКГ с добутамином. Несмотря на сложность ин-
терпретации результатов таких разных диагности-
ческих методов, этот протокол позволил провести
раннюю диагностику ИБС у 22% пациентов с болью
в груди и ранней выпиской в 78% случаев.
Из последующего исследования 500 пациентов с
недавно возникшей болью в груди, но без харак-
терных изменений для ишемического ИМ или яв-
ных признаков ИБС после 6-часового клинического
обследования, включавшего определение уровней
тропонина, были исключены пациенты, неспособ-
ные к физической нагрузке или у которых была
блокада левой ножки пучка Гиса или плохая акусти-
ческая доступность. Пациентам проводили стресс-
ЭхоКГ с физической нагрузкой и сцинтиграфию с
метоксиизобутилизонитрилом (МИБИ) в течение
24 часов, а пациентам с аномальным уровнем тро-
понина в любое время или положительными стресс-
тестами была рекомендована ангиография. Конеч-
ными точками исследования были стеноз > 50%,
выявленный с помощью катетеризации сердца, ли-
бо сердечно-сосудистые события через 6 месяцев.
Стресс-ЭхоКГ с физической нагрузкой была поло-
жительной в 20% случаев, сцинтиграфия с МИБИ
была положительной в 24% случаев. У 14 пациентов
с отрицательной стресс-ЭхоКГ с физической на-
грузкой была в конечном итоге диагностирована
ИБС, в отличие от 13 пациентов с отрицательным
результатом сцинтиграфии с МИБИ. В этом иссле-
довании чувствительность стресс-ЭхоКГ с физиче-
ской нагрузкой и чувствительность сцинтиграфии
с МИБИ в окончательной диагностике ИБС были
сравнимы (85% vs 86%), тогда как специфичность
стресс-ЭхоКГ с физической нагрузкой была не-
сколько выше (95% vs 90%), что привело к более вы-
сокому коэффициенту вероятности для положи-
тельной стресс-ЭхоКГ с физической нагрузкой [42].
В 2010 г. Parato и соавт. опубликовали исследова-
ние 403 пациентов с болью в груди, нормальной
ЭКГ и сердечным тропонином, которых направили
к кардиологу [43]. Им провели серию ЭхоКГ в по-
кое, ЭКГ и определили уровни кардиальных био-
маркеров. У 49 пациентов был диагностирован
острый коронарный синдром, из них у 33% он был
обусловлен нарушениями локальной сократимости
миокарда, выявленными при ЭхоКГ. Самый корот-
сердца, остановка сердца, гипотония или шок,
одышка и боль в груди. Следует отметить, что
одышка и боль в груди являются показаниями клас-
са I к проведению комплексной ЭхоКГ, если диагноз
не был уточнен. American College of Emergency
Physicians опубликовала рекомендации по подго-
товке к неотложной ультразвуковой диагностике
[35]. Врачи, выполняющие фокусное УЗИ сердца,
должны постоянно совершенствовать свои знания,
архивировать изображения и составлять отчеты.
Информации о применении ультразвука у постели
больного в целях неотложной диагностики мало.
Рандомизированное исследование проведения ран-
него УЗИ и позднего УЗИ в ОИТР при гипотензии
привело к немногочисленным конкурентоспособ-
ным диагностическим причинам, однако клиниче-
ские исходы не оценивали [36].
ДИАГНОСТИЧЕСКИЕ АЛГОРИТМЫ И ПРОТОКОЛЫ
ЭХОКАРДИОГРАФИИ ПРИ БОЛИ В ГРУДИ
Протоколы ЭхоКГ, адаптированные для оценки па-
циентов с острой болью в груди, стали широко ис-
пользовать и для пациентов с низким риском [37].
Хотя данные свидетельствуют о кратковременном
риске таких клинически значимых неблагоприят-
ных событий, как угрожающая жизни аритмия, ИМ
с подъемом сегмента ST у лежачих больных, оста-
новка дыхания или кровообращения, а также о низ-
кой смертности среди пациентов с отрицательными
результатами тестов кардиальных биомаркеров, не
относящихся к жизненно важным признакам, и ре-
зультатами ЭКГ без признаков ишемии, были раз-
работаны клинические алгоритмы с использова-
нием различных дополнительных стратегий тести-
рования и оценены их клинические исходы [38].
Например, Gibler и соавт. разработали «Сердечно-
реанимационную программу» для диагностики и
лечения пациентов с болью в груди в высокоспе-
циализированных городских ОИТР [39]. Было за-
регистрировано > 1000 пациентов с симптомами,
указывающими на острый коронарный синдром.
Пациентов с установленной ИБС, инфарктом мио-
карда, острым подъемом сегмента ST, гемодинами-
чески нестабильных или с клиническими проявле-
ниями, характерными для нестабильной стенокар-
дии, немедленно направляли в ОИТР. Там всем
пациентам по истечении 9-часового периода на-
чального наблюдения проводили 2D-ЭхоКГ и дава-
ли поэтапную физическую нагрузку. Результаты
определяли дальнейшую тактику ведения пациента.
Подавляющее большинство пациентов были выпи-
саны из ОИТР (82,1%) и только 15% были в даль-
нейшем обследованы. У 34% госпитализированных
пациентов симптоматика была связана с сердцем.
Также было установлено, что у пациентов с низким
риском стресс-ЭхоКГ можно безопасно проводить
по истечении 6-часового периода наблюдения [40].
ch11.indd 239
03.04.2019 11:52:31
241
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
обычно подтверждают с помощью альтернативных
методов визуализации. Однако ЭхоКГ может быть
полезна для диагностики дилатации ПЖ, систоли-
ческой дисфункции ПЖ, уплощения межжелудоч-
ковой перегородки, трикуспидальной регургитации
и оценки систолического давления в легочной арте-
рии, что указывает на повышенное давление в лег-
ких. К сожалению, отсутствие этих признаков не ис-
ключает тромбоэмболию легочной артерии, но са-
ми признаки не являются специфическими. Таким
образом, ЭхоКГ, как правило, не рекомендуется для
обследования пациентов с нормальным давлением
и подозрением на эмболию легочной артерии [53,
54]. Однако у гемодинамически нестабильных па-
циентов в критическом состоянии может быть по-
лезна ТТЭхоКГ. Пациенты в состоянии гипотензии
или шока с явными признаками перегрузки давле-
нием ПЖ подлежат неотложной реперфузионной
терапии, если немедленная КТА недоступна (рис.
11.14) [55].
ПЕРИКАРДИТ
Перикардит (воспаление перикардиальной сумки) —
один из дифференциальных диагнозов, которые
рассматривают у пациентов с болью в груди, нахо-
дящихся в ОИТР. Боль в груди, ассоциированная с
перикардитом, будь то вирусный перикардит или
перикардит при системном заболевании, отличает-
ся от боли при ИБС, но в некоторых случаях ее
трудно отличить. Чтобы поставить диагноз «пери-
кардит», должны быть как минимум 2 признака из
следующих: типичная боль в груди (резкая, плев-
ритная, позиционная), перикардиальный шум, ха-
рактерные изменения на ЭКГ и появление или уве-
личение объема перикардиальной жидкости.
У пациентов с болью в груди при неясном диа-
гнозе может оказаться полезной ТТЭхоКГ. Кроме
симптомов острого коронарного синдрома, в диа-
гностике перикардита может помочь выявление пе-
рикардиальной жидкости без нарушений локаль-
ной сократимости миокарда. Провести ЭхоКГ реко-
Пациент с болью в груди
Кардиальные биомаркеры, ЭКГ
Расслоение типа А
(стэнфордский)
Открытая операция
после оценки
первичного риска
Без осложнений
С осложнениями
Легочная эмболия
Расслоение аорты
Острый коронарный
синдром
Расслоение типа В
(стэнфордский)
• Разрыв аорты
• Внутриорганная ишемия
• Продолжающаяся боль
и гипертензия,
несмотря на адекватную
лекарственную терапию
• Раннее расширение
ложного просвета
• Большой единый вход
Срочное КТ
Тройное исключение
при КТ при средней
вероятности ИБС
Отрицательный результат
первоначального исследования,
но высокая клиническая
настороженность → ТТЭхоКГ
Эндоваскулярная терапия
Лекарственная терапия
Рис. 11.13 Алгоритм ведения пациента с острым расслоением аорты. ИБС — ишемическая болезнь сердца; КТ — компьютерная томография; ТТЭхоКГ —
трансторакальная эхокардиография; ЭКГ — электрокардиография [Nienaber CA, Clough RE. Management of acute aortic dissection. Lancet 385:800–811, 2015].
ch11.indd 241
03.04.2019 11:52:31
242
ЧАСТЬ III Ишемическая болезнь сердца
Рис. 11 .14 Эхокардиографические признаки вторичной эмболии легочной артерии. (А) A ТТЭхоКГ пациента, поступившего в ОИТР с болью в груди и
признаками вторичной эмболии легочной артерии. Обратите внимание на расширенный правый желудочек (ПЖ). (Б) A Парастернальная позиция по короткой
оси. Расширение правого желудочка с уплощением перегородки свидетельствует о повышенном давлении в правых отделах. (В) Непрерывно-волновая доппле-
рография трикуспидальной регургитации, соответствующей тяжелой легочной гипертензии. ЛЖ — левый желудочек; ПП — правое предсердие.
ПЖ
ПП
ПЖ
3,6 м/сек
75 мм/сек
ЛЖ
ЛЖ
А
Б
В
мендуется пациентам с установленным диагнозом
«перикардит» для оценки объема перикардиальной
жидкости, если есть какие-либо клинические при-
знаки высокого риска, например тахикардия или
гипотония. ТТЭхоКГ и пункция полости перикарда
показаны пациентам с тампонадой сердца [56].
Около 15% пациентов с перикардитом имеют по-
ражения миокарда. Это чаще всего молодые мужчи-
ны (возраст < 40 лет), имеющие нарушения сердеч-
ного ритма, повышение сегмента ST на ЭКГ и не-
давнюю лихорадку в анамнезе [57].
АОРТАЛЬНЫЙ СТЕНОЗ
Скрининговое обследование для выявления аорталь-
ного стеноза включает визуализацию в 2D-режиме
с целью определения кальцификации и ограниче-
ния подвижности створок клапана, а также измере-
ние трансклапанных градиентов давления с помо-
щью допплерографии (см. главу 15). Признаки об-
структивной гипертрофической кардиомиопатии:
гипертрофия (асимметричная), парадоксальное си-
столическое движение передней створки митраль-
ного клапана и динамический градиент давления в
ВТЛЖ при допплерографии (см. главу 26).
ОГРАНИЧЕНИЯ
ОЦЕНКА ИШЕМИИ
Эхокардиографическая оценка пациентов с подозре-
нием на острый коронарный синдром имеет не-
сколько ограничений. Поскольку между эпизодами
ишемии миокарда толщина стенки ЛЖ может быть
нормальной, нормальная систолическая функция
ЛЖ у пациента не исключает ишемию миокарда как
причину симптомов. Кроме того, небольшие обла-
сти ишемизированного миокарда, особенно в суб-
эндокардиальном слое, могут не вызывать значи-
мых нарушений сократимости миокарда, что приво-
дит к ложноотрицательным результатам. Улучшает
стратификацию рисков у таких пациентов исполь-
зование контрастной ЭхоКГ для оценки перфузии
миокарда. Решение о дополнительном обследова-
нии должно быть принято после исключения ИМ.
Наличие предшествующей дисфункции ЛЖ за-
трудняет оценку новых нарушений локальной со-
кратимости миокарда и может снизить специфич-
ность данного метода.
КАЧЕСТВО ИЗОБРАЖЕНИЯ
Для обнаружения нарушений локальной сократи-
мости миокарда необходима адекватная визуализа-
ция границ эндокарда, что может быть затруднено
у пациентов с патологическим ожирением, дефор-
мацией и травмой грудной клетки и после недавно
перенесенного торакального хирургического вме-
шательства. Использование второй гармоники и
контрастного средства может улучшить визуализа-
цию границ эндокарда.
УКОМПЛЕКТОВАННОСТЬ КАДРАМИ
Наличие всегда готовых к работе квалифицирован-
ных специалистов по УЗИ и ЭхоКГ имеют большое
значение для своевременной оценки пациентов с бо-
лью в груди в условиях ОИТР. Специалисты, как
правило, доступны в рабочее время в большинстве
больниц. Однако для многих медицинских центров
экономически нецелесообразно иметь свой персо-
нал, но обращение к специалистам по УЗИ и ЭхоКГ,
находящихся за пределами лечебного учреждения,
неизбежно связано с задержками в лечении пациен-
тов. Более широкое внедрение цифровых телеси-
стем, позволяющих специалисту передать цифровые
ch11.indd 242
03.04.2019 11:52:31
243
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
ЭхоКГ по сети за пределы больницы для немедлен-
ной оценки, могут обеспечить адекватную интерпре-
тацию ЭхоКГ. Например, изображения стресс-ЭхоКГ
с добутамином во время систолы были оцифрованы
в четырехэкранный восьмикадровый киноформат
(разрешение 320 × 240 пикселей) и переданы на ин-
терпретацию в формате «без потерь», предшествую-
щем стандарту DICOM [58–60]. С того времени про-
изошли различные технические усовершенствова-
ния, включая более высокую емкость памяти, более
быстрые микропроцессоры и сетевые соединения
посредством Интернета или специализированных
локальных сетей. Конечно, при передаче информа-
ции, касающейся пациента, необходимо обеспечить
ее конфиденциальность.
ЗАКЛЮЧЕНИЕ
ТТЭхоКГ в условиях ОИТР может дать полезную
информацию для диагностики и сортировки паци-
ентов с острой болью в груди. В зависимости от си-
туации можно оценить глобальную и локальную
функции миокарда, клапанный аппарат и наличие
перикардиальной жидкости с помощью стресс-ЭхоКГ,
контрастной ЭхоКГ и ЧПЭхоКГ. Это не только по-
могает сортировать пациентов с подозрением на
острый коронарный синдром, но и предоставляет
информацию о краткосрочном и долгосрочном
прогнозах. Новые технологии оценки деформации
миокарда с помощью ЭхоКГ могут улучшить диа-
гностику у постели больного.
Диагноз
Методы визуализации
Параметры особого интереса
Ишемическая болезнь
сердца
2D-ТТЭхоКГ с допплерографией
Стресс-ЭхоКГ с физической нагрузкой
или с добутамином у некоторых
пациентов
Контрастная ЭхоКГ, перфузия
миокарда*
Деформация миокарда*
Глобальная систолическая функция ЛЖ
Фракция выброса ЛЖ
Нарушения локальной сократимости миокарда
Расслоение аорты
2D-ТТЭхоКГ с допплерографией†
ЧПЭхоКГ
Контрастная ЭхоКГ
Независимо подвижная линейная структура внутри аорты,
соответствующая отслоившейся интиме
Аортальная регургитация по данным цветовой
допплерографии
Перикардиальная жидкость
Эмболия легочной
артерии
2D-ТТЭхоКГ с допплерографией
Размеры ПЖ
Систолическая функция ПЖ
Нарушения сократимости миокарда (обычно гипокинезия
свободной стенки с сохранной сократимостью апикаль-
ных и базальных сегментов)
Давление в легочной артерии
Эхогенное образование в НПВ или правых отделах сердца,
похожее на мигрирующий тромб
Перикардит
2D-ТТЭхоКГ с допплерографией
Перикардиальная жидкость
Утолщение перикарда
Спайки
Коллабирование правых отделов сердца во время диастолы
Чрезмерная дыхательно-фазовая вариабельность скоростей
трансклапанных потоков при допплерографии
Полнокровие НПВ и отсутствие спадения при дыхательном
акте
Аортальный стеноз
2D-ТТЭхоКГ с допплерографией
Утолщение, кальцификация и снижение подвижности
створок аортального клапана
Скорость трансаортального потока > 4 м/сек при допплеро-
графии или площадь аортального клапана < 1,0 см2 свиде-
тельствуют о тяжелом аортальном стенозе
Гипертрофия ЛЖ
* Рутинно не проводят из-за ограничений по времени, технических возможностей и опыта исследователя.
† ТТЭхоКГ имеет ограниченную чувствительность для диагностики данной патологии и обычно недостаточна для ее исключения, если со-
храняются клинические подозрения.
ЛА — легочная артерия; ЛЖ — левый желудочек; НПВ — нижняя полая вена; ПЖ — правый желудочек; ТТЭхокКГ — трансторакальная
эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиография в оценке острой боли в груди в отделении интенсивной терапии и реанимации
ch11.indd 243
03.04.2019 11:52:32
244
ЧАСТЬ III Ишемическая болезнь сердца
ЛИТЕРАТУРА
1. Bhuiya FA, Pitts SR, McCaig LF. Emergency
department visits for chest pain and abdomi-
nal pain: United States, 1999-2008; National
Hospital Ambulatory Medical Care Survey:
1999-2008, NCHS Data Brief 43:4, 2010.
2. Pines JM, Pollack Jr. CV, Diercks DB, et al.
The association between emergency depart-
ment crowding and adverse cardiovascular
outcomes in patients with chest pain, Acad
Emerg Med 16:617–625, 2009.
3. Thygesen K, Alpert JS, White HD, et al. Uni-
versal definition of myocardial infarction, J
Am Coll Cardiol 50:2173–2195, 2007.
4. Tennant R, Wiggers CJ. The effect of coro-
nary artery occlusion on myocardial contrac-
tion, Am J Physio 112:351–361, 1935.
5. Hauser AM, Gangadharan V, Ramos RG, et
al. Sequence of mechanical, electrocardio-
graphic and clinical effects of repeated coro-
nary artery occlusion in human beings: echo-
cardiographic observations during coronary
angioplasty, J Am Coll Cardiol 5:193–197,
1985.
6. Gould KL, Lipscomb K. Effects on coronary
stenoses on coronary flow reserve and resis-
tance, Am J Cardiol 34:48–55, 1974.
7. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
8. Porter TR, Abdelmoneim A, Belcik JT, et al.
Guidelines for the cardiac sonographer in the
performance of contrast echocardiography: a
focused update from the American Society of
Echocardiography, J Am Soc Echocardiogr
27:797–810, 2014.
9. Horowitz RS, Morganroth J, Parrotto C, et al.
Immediate diagnosis of acute myocardial in-
farction by two-dimensional echocardiogra-
phy, Circulation 65:323–329, 1982.
10. Kurt M, Shaikh KA, Peterson L, et al. Impact
of contrast echocardiography on evaluation
of ventricular function and clinical manage-
ment in a large prospective cohort, J Am Coll
Cardiol 53:802–810, 2009.
10a. Peels CH, Visser CA, Kupper AJ, et al. Useful-
ness of two-dimensional echocardiography
for immediate detection of myocardial isch-
emia in the emergency room, Am J Cardiol
65:687–691, 1990.
10b. Sabia P, Abbott RD, Afrookteh A, et al. Im-
portance of two-dimensional echocardio-
graphic assessment of left ventricular sys-
tolic function in patients presenting to the
emergency room with cardiac-related symp-
toms, Circulation 84:1615–1624, 1991.
10c. Kang DH, Kang SJ, Song JM, et al. Efficacy of
myocardial contrast echocardiography in the
diagnosis and risk stratification of acute cor-
onary syndrome, Am J Cardiol 96:1498–1502,
2005.
10d. Tong KL, Kaul S, Wang XQ, et al. Myocardial
contrast echocardiography versus thromboly-
sis in myocardial infarction score in patients
presenting to the emergency department with
chest pain and a nondiagnostic electrocardio-
gram, J Am Coll Cardiol 46:920–927, 2005.
10e. Rinkevich D, Kaul S, Wang XQ, et al. Re-
gional left ventricular perfusion and function
in patients presenting to the emergency de-
partment with chest pain and no ST elevation,
Eur Heart J 26:1606–1611, 2005.
10f. Wei K, Peters D, Belcik T, et al. A predictive
instrument using contrast echocardiography
in patients presenting to the emergency de-
partment with chest pain and without ST seg-
ment elevation,, J Am Soc Echocardiogr
23:636–642, 2010.
11. Hickman M, Swinburn JM, Senior R. Wall
thickening assessment with tissue harmonic
echocardiography results in improved risk
stratification for patients with non-ST-seg-
ment elevation acute chest pain, Eur J Echo-
cardiogr 5:142–148, 2004.
12. Douglas PS, Garcia MJ, Haines DE, et al.
ACCF/ASE/AHA/ASNC/HFSA/HRC/SCAI/
SCCM/SCCT/SCMR appropriate use criteria
for echocardiography, J Am Soc Echocardiogr
24:229–267, 2011.
13. Lee M, Chang SA, Cho EJ, et al. Role of strain
values using automated function imaging on
transthoracic echocardiography for the as-
sessment of acute chest pain in emergency
department, Int J Cardiovasc Imaging 31:547–
556, 2015.
14. Dahslett T, Karlsen S, Grenne B, et al. Early
assessment of strain echocardiography can
accurately exclude significant coronary artery
stenosis in suspected non-ST-segment eleva-
tion acute coronary syndrome, J Am Soc
Echocardiogr 27:512–519, 2014.
15. Savari SI, Haugaa KH, Zahid W, et al. Layer-
specific quantification of myocardial defor-
mation by strain echocardiography may re-
veal significant coronary artery disease in
patients with non-ST-segment elevation acute
coronary syndrome, JACC Cardiovasc Imag-
ing 6:535–544, 2013.
16. Trippi JA, Lee KS, Kopp G, et al. Dobutamine
stress tele-echocardiography for evaluation
of emergency department patients with chest
pain, J Am Coll Cardiol 30:627–632, 1997.
17. Bholasingh R, Cornel JH, Kamp O, et al.
Prognostic value of predischarge dobutamine
stress echocardiography in chest pain patients
with a negative cardiac troponin T, J Am Coll
Cardiol 41:596–602, 2003.
18. Heitner JF, Klem I, Rasheed D, et al. Stress
cardiac MR imaging compared with stress
echocardiography in the early evaluation of
patients who present to the emergency de-
partment with intermediate-risk chest pain,
Radiology 271:56–64, 2014.
19. Pellikka PA, Nagueh SF, Elhendy AA, et al.
American Society of Echocardiography rec-
ommendations for performance, interpreta-
tion and application of stress echocardiogra-
phy, J Am Soc Echocardiogr 20:1021–1041,
2007.
20. Korosoglou G, Labadze N, Hansen A. Useful-
ness of real-time myocardial perfusion imag-
ing in the evaluation of patients with first
time chest pain, Am J Cardiol 94:1225–1231,
2004.
21. Gaibazzi N, Rigo F, Lorenzoni V, et al. Com-
parative prediction of cardiac events by wall
motion, wall motion plus coronary flow re-
serve, or myocardial perfusion analysis, JACC
Cardiovasc Imaging 6:1–12, 2013.
22. Greaves K, Dixon SR, Fejka M, et al. Myocar-
dial contrast echocardiography is superior to
other known modalities for assessing myocar-
dial reperfusion after acute myocardial in-
farction, Heart 89:139–144, 2003.
23. Dwivedi G, Janardhanan R, Hayat SA, et al.
Comparison between myocardial contrast
echocardiography and 99mTechnetium sesta-
mibi single photon emission computed to-
mography determined myocardial viability in
predicting hard cardiac events following
acute myocardial infarction, Am J Cardiol
104:1184–1188, 2009.
24. Douglas PS, Hoffman U, Patel MR, et al. Out-
comes of anatomical versus functional testing
for coronary artery disease, NEJM 372:1291–
1300, 2015.
25. Farkouh M, Aneja A, Reeder G, et al. Clinical
risk stratification in the emergency depart-
ment predicts long-term cardiovascular out-
comes in a population-based cohort present-
ing with acute chest pain: primary results of
the Olmsted County Chest Pain Study, Medi-
cine 88:307–313, 2009.
26. Innocenti F, Cerabona P, Donnini C, et al.
Long-term prognostic value of stress echocar-
diography in patients presenting to the ED
with spontaneous chest pain, Am J Emerg Med
32:731–736, 2014.
27. Fleischmann KE, Lee TH, Come PC, et al.
Echocardiographic predictors of complica-
tions in patients with chest pain, Am J Car-
diol 79:292–298, 1997.
28. Kontos MC, Arrowood JA, Paulsen WH, et al.
Early echocardiography can predict cardiac
events in emergency department patients
with chest pain, Ann Emerg Med 31:550–557,
1998.
29. Chuah SC, Pellikka PA, Roger VL, et al. Role
of dobutamine stress echocardiography in
predicting outcome in 860 patients with
known or suspected coronary artery disease,
Circulation 97:1474–1480, 1998.
30. Geleijnse ML, Krenning BJ, Soliman OI, et al.
Dobutamine stress echocardiography for the
detection of coronary artery disease in wom-
en, Am J Cardiol 99:714–717, 2007.
31. Dagianti A, Penco M, Agati L, et al. Stress
echocardiography: comparison of exercise,
dipyridamole, and dobutamine in detecting
and predicting the extent of coronary artery
disease, J Am Coll Cardiol 26:18–25, 1995.
32. Gertz ZM, O’Donnell W, Raina A, et al. Ap-
plication of appropriate use criteria to cardiac
stress testing in the hospital setting: limita-
tions of the criteria and areas for improved
practice, Clin Cardiol 38:8–12, 2015.
33. Plummer D, Brunette D, Asinger R, et al.
Emergency department echocardiography
improved outcome in penetrating cardiac in-
jury, Ann Emerg Med 21:709–712, 1992.
34. Labovitz A, Noble V, Bierig M, et al. Focused
cardiac ultrasound in the emergent setting: a
consensus statement of the American Society
of Echocardiography and American College
of Emergency Physicians, J Am Soc Echocar-
diogr 23:1225–1230, 2010.
35. American College of Emergency Physicians.
Use of ultrasound imaging by emergency
physicians. Policy 400121, Ann Emerg Med
38:469–470, 2001.
36. Jones AE, Tayal VS, Sullivan DM, et al. Ran-
domized, controlled trial of immediate versus
delayed goal-directed ultrasound to identify
the cause of nontraumatic hypotension in
emergency department patients, Crit Care
Med 32:1703–1708, 2004.
37. Amsterdam EA, Kirk JD, Bluemke DA, et al.
Testing of low-risk patients presenting to the
emergency department with chest pain, Cir-
culation 122:1756–1776, 2010.
38. Weinstock MB, Weingart S, Orth F, et al. Risk
for clinically relevant adverse cardiac events
in patients with chest pain at hospital admis-
sion, JAMA Intern Med 175:1207–1212, 2015.
ch11.indd 244
03.04.2019 11:52:32
245
11 Оценка пациентов с острой болью в груди в отделении реанимации и интенсивной терапии
39. Gibler WB, Runyon JP, Levy RC, et al. A
rapid diagnostic and treatment center for pa-
tients with chest pain in the emergency de-
partment, Ann Emerg Med 25:1–8, 1995.
40. Lewis WR, Amsterdam EA, Turnipseed S, et
al. Immediate exercise testing of low risk pa-
tients with known coronary artery disease
presenting to the emergency department with
chest pain, J Am Coll Cardiol 33:1843–1847,
1999.
41. Conti A, Paladini B, Magazzini S, et al. Chest
pain unit management of patients at low and
not low-risk for coronary artery disease in the
emergency department. A 5-year experience
in the Florence area, Eur J Emerg Med 9:31–36,
2002.
42. Conti A, Sammicheli L, Gallini C, et al. As-
sessment of patients with low-risk chest pain
in the emergency department: head-to-head
comparison of exercise stress echocardiogra-
phy and exercise myocardial SPECT, Am
Heart J 149:894–901, 2005.
43. Parato V, Mehta A, Delfino D, et al. Resting
echocardiography for the early detection of
acute coronary syndrome in chest pain unit
patients, Echocardiography 27:597–602, 2010.
44. Aldous S, Richards AM, Cullen L, et al. The
incremental value of stress testing in patients
with acute chest pain beyond serial cardiac
troponin testing, Emerg Med J 33(5):319–324,
2016.
45. Hess EP, Knoedler MA, Shah ND, et al. The
chest pain choice decision aid: a randomized
trial, Circ Cardiovasc Qual Outcomes 5:251–
259, 2012.
46. Kuntz KM, Fleischmann KE, Hunink MG, et
al. Cost-effectiveness of diagnostic strategies
for patients with chest pain, Ann Intern Med
130:709–718, 1999.
47. Wyrick J, Kalvaitis S, McConnell J, et al. Cost-
efficiency of myocardial contrast echocar-
diography in patient presenting to the emer-
gency department with chest pain of suspect-
ed cardiac origin and a non-diagnostic
electrocardiogram, Am J Cardiol 102:649–652,
2008.
48. Genders TS, Petersen SE, Pugliese F. The op-
timal imaging strategy for patients with stable
chest pain: a cost-effectiveness analysis, Ann
Intern Med 162:474–484, 2015.
49. Olsson C, Thelin S, Stahle E, et al. Thoracic
aortic aneurysm and dissection: increasing
prevalence and improved outcomes reported
in a nationwide population-based study of
more than 14,000 cases from 1987 to 2002,
Circulation 114:2611–2618, 2006.
50. Shiga T, Wajima Z, Apfel CC, et al. Diagnos-
tic accuracy of transesophageal echocardiog-
raphy, helical computed tomography, and
magnetic resonance imaging for suspected
thoracic aortic dissection: systematic review
and meta-analysis, Arch Intern Med 166:1350–
1356, 2006.
51. Shah BN, Ahmadvazir S, Pabla JS, et al. The
role of urgent transthoracic echocardiogra-
phy in the evaluation of patients presenting
with acute chest pain, Eur J Emerg Med
19:277–283, 2012.
52. Nienaber CA, Clough RE. Management of
acute aortic dissection, Lancet 385:800–811,
2015.
53. Konstantinides SV. 2014 ESC guidelines on
the diagnosis and management of pulmo-
nary embolism, Eur Heart J 35:3145–3146,
2014.
54. Konstantinides SV, Torbicki A, Agnelli G, et
al. 2014 ECS Guidelines on the diagnosis and
management of acute pulmonary embolism,
Eur Heart J 35:3033–3069, 2014.
55. Kucher N, Luder CM, Dornhofer T, et al.
Novel management strategy for patients with
suspected pulmonary embolism, Eur Heart J
24:366–376, 2003.
56. Lange RA, Hills LD. Acute pericarditis, NEJM
351:2195–2202, 2004.
57. Imazio M, Cecchi E, Demichelis B, et al. Myo-
pericarditis versus viral or idiopathic acute
pericarditis, Heart 94:498–501, 2008.
58. Trippi JA, Lee KS. Dobutamine stress tele-
echocardiography as a clinical service in the
emergency department to evaluate patients
with chest pain, Echocardiography 16:179–
185, 1999.
59. Trippi JA, Kopp G, Lee KS, et al. The feasibil-
ity of dobutamine stress echocardiography in
the emergency department with telemedicine
interpretation, J Am Soc Echocardiogr 9:113–
118, 1996.
60. Trippi JA, Lee KS, Kopp G, et al. Emergency
echocardiography telemedicine: an efficient
method to provide 24-hour consultative
echocardiography, J Am Coll Cardiol 27:1748–
1752, 1996.
ch11.indd 245
03.04.2019 11:52:32
ch11.indd 246
03.04.2019 11:52:32
247
Диагностика острого
инфаркта миокарда
Диагностическая роль
эхокардиографии
Определение локализации
инфаркта миокарда
Инфаркт правого желудочка
Диагностика осложнений
острого инфаркта миокарда
Гемодинамическая оценка
инфаркта миокарда с помощью
допплерографии
Перикардиальная жидкость
после инфаркта миокарда
Острая митральная регургитация
Разрыв межжелудочковой перегородки
Разрыв свободной стенки
левого желудочка
Псевдоаневризма
Расширение зоны инфаркта миокарда
и образование истинной аневризмы
Тромбоз левого желудочка
Стратификация риска после
острого инфаркта миокарда
Систолическая функция
левого желудочка
Балльная оценка локальной
сократимости миокарда
Диастолическая функция
левого желудочка
Объем левого предсердия
Ремоделирование левого желудочка
Стресс-эхокардиография
Резерв коронарного кровотока
Митральная регургитация
12 Эхокардиография в отделении
неотложной кардиологии
при остром инфаркте миокарда
IVOR L. GERBER, MD, MBCHB • ELYSE FOSTER, MD
Эхокардиография (ЭхоКГ) идеально подходит для
визуализации сердца в отделении неотложной кар-
диологии, поскольку имеет существенные преиму-
щества по сравнению с другими методами визуали-
зации: портативность, относительно низкую стои-
мость, много анатомических, гемодинамических и
функциональных параметров, которые можно бы-
стро оценить непосредственно у постели больного.
Трансторакальную эхокардиографию (ТТЭхоКГ) ру-
тинно используют в отделении неотложной кардио-
логии (табл. 12.1). С дальнейшим технологическим
прогрессом ТТЭхоКГ продолжает играть важную
роль в диагностике и стратификации риска у паци-
ентов отделения неотложной кардиологии [1].
Для пациента с уже диагностированным инфар-
ктом миокарда (ИМ) ранняя эхокардиографическая
оценка с рутинной оценкой систолической функ-
ции левого желудочка (ЛЖ), локальной сократимо-
сти миокарда ЛЖ, диастолической функции ЛЖ,
функции правого желудочка (ПЖ) и митральной
регургитации оказывает существенную помощь в
лечении острого ИМ. Введение контрастного сред-
ства в левые отделы сердца для контрастирования
ЛЖ уменьшает субъективность результатов и пре-
восходит рутинные методы определения фракции
выброса (ФВ) ЛЖ и локальной сократимости мио-
карда ЛЖ.
Поскольку при ишемическом каскаде наруше-
ния перфузии предшествуют нарушениям сократи-
мости миокарда ЛЖ, контрастная ЭхоКГ имеет бо-
лее высокую чувствительность при диагностике
ишемической болезни сердца (ИБС) [2]. Контраст-
ная ЭхоКГ также играет существенную роль в оцен-
ке жизнеспособности миокарда [3]. Метод количе-
ственной оценки деформации миокарда является
значительным шагом вперед: уменьшает субъек-
тивность результатов при оценке нарушений ло-
кальной сократимости миокарда [4] и помогает ис-
ключить критический стеноз коронарных артерий у
пациентов с подозрением на острый коронарный
синдром без подъема сегмента ST, когда результаты
ЭКГ однозначны, а показатели кардиальных биомар-
керов находятся в пределах нормы [5].
Трехмерная ЭхоКГ (3D-ЭхоКГ) в режиме реаль-
ного времени позволяет быстро и полуавтоматиче-
ски измерять объем и ФВЛЖ, а также автоматически
обнаруживать нарушения локальной сократимости
миокарда [6] и его перфузии [7].
Миниатюризация портативных ультразвуковых
систем обеспечила их широкое использование до-
ch12.indd 247
03.04.2019 11:52:47
248
ЧАСТЬ III Ишемическая болезнь сердца
Показание
КЦИ
Баллы*
Гипотензия или нестабильная гемодинамика
Гипотензия или нестабильная гемодинамика неопределенной или предполагаемой сердечной этиологии A
9
Оценка степени дегидратации пациента в критическом состоянии
U
5
Ишемия/инфаркт миокарда
Острая боль в груди при подозрении на инфаркт миокарда и при неинформативной ЭКГ,
ТТЭхоКГ в покое может быть выполнена во время боли
A9
Оценка пациента без боли в груди, но с другими признаками ишемии или показателями
кардиальных биомаркеров, указывающих на продолжающуюся ишемию миокарда
A8
Предполагаемое осложнение ишемии/инфаркта миокарда: острая митральная регургитация, разрыв
межжелудочковой перегородки, разрыв свободной стенки левого желудочка, тампонада сердца, шок,
распространение поражения на правый желудочек, сердечная недостаточность или тромб и др.
A9
Оценка функции желудочков после острого коронарного синдрома
Первоначальная оценка функции желудочков после острого коронарного синдрома
A
9
Повторная оценка функции желудочков в период восстановления после острого коронарного синдрома
для назначения терапии
A9
* КЦИ оценивают в баллах от 1 до 9.
A — целесообразное использование; U — сомнительное использование; КЦИ — критерии целесообразного использования; ТТЭхоКГ —
трансторакальная эхокардиография; ЭКГ — электрокардиография.
[Douglas PS, Garsia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNG/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for echocar-
diography. J Am Soc Echocardiogr. 24:229–267, 2011.]
ТАБЛИЦА 12.1 Критерии целесообразного использования трансторакальной эхокардиографии
для оценки сердечно-сосудистой системы в отделении неотложной кардиологии
полнительно к физикальному осмотру. В несколь-
ких исследованиях была показана польза таких си-
стем [8], но их возможности пока еще несопостави-
мы с возможностями стационарных ультразвуковых
систем. Необходимо убедиться, что специалисты,
выполняющие исследования с помощью портатив-
ной ультразвуковой системы, имеют соответствую-
щую подготовку.
В раннем периоде после ИМ пациентам может
быть выполнена (при осторожной седации и тща-
тельном контроле) чреспищеводная эхокардиогра-
фия (ЧПЭхоКГ). Если есть беспокойство по поводу
гемодинамической функции сердца или дыхатель-
ной системы, нужно перед ЧПЭхоКГ рассмотреть
необходимость проведения анестезиологом интуба-
ции и искусственной вентиляции легких. Причины
гемодинамической нестабильности, например на-
рушение насосной функции сердца, разрыв мио-
карда, часто можно выявить с помощью ТТЭхоКГ у
постели больного.
Однако проведение ТТЭхоКГ может быть огра-
ничено искусственной вентиляцией легких, недав-
ней кардиохирургической операцией и невозмож-
ностью адекватного позиционирования пациента. В
таких случаях может помочь ЧПЭхоКГ. В отделе-
нии неотложной кардиологии ЧПЭхоКГ также про-
водят для оценки состояния аорты и аортального
клапана у пациентов с подозрением на острое рас-
слоение аорты (особенно в случае нарушения функ-
ции почек, которое ограничивает использование
компьютерной томографии (КТ) с контрастным
усилением) и диагностики тромба в ушке левого
предсердия (ЛП) перед проведением кардиоверсии.
Двухмерную ЧПЭхоКГ (2D-ЧПЭхоКГ) и трех-
мерную ЧПЭхоКГ (3D-ЧПЭхоКГ) обычно исполь-
зуют во время транскатетерных вмешательств, на-
пример закрытия разрыва межжелудочковой пере-
городки (МЖП) после ИМ.
ДИАГНОСТИКА ОСТРОГО ИНФАРКТА МИОКАРДА
ДИАГНОСТИЧЕСКАЯ РОЛЬ ЭХОКАРДИОГРАФИИ
Точность эхокардиографической диагностики ИМ
зависит от возможности с помощью данного мето-
да обнаружить нарушения локальной сократимости
миокарда ЛЖ в соответствующем сегменте. Тяжесть
нарушений локальной сократимости миокарда за-
висит от объема трансмурального поражения мио-
карда, а размер поражения зависит от распределения
коронарного кровотока и коллатерального крово-
снабжения. Для определения степени нарушения
локальной сократимости миокарда чаще всего ис-
пользуют шкалу, приведенную в табл. 12 .2 [9].
Необходимо исключить другие причины локаль-
ной дисфункции ЛЖ (табл. 12 .3). Одной из наибо-
лее распространенных патологий, клинически по-
хожих на ИМ, является кардиомиопатия такоцубо
(синдром шарообразного расширения ЛЖ). ТТЭхоКГ
ch12.indd 248
03.04.2019 11:52:47
249
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
является бесценным методом диагностики кардио-
миопатии такоцубо с характерными признаками
некоронарного поражения ЛЖ и ранним улучше-
нием его функции, что похоже скорее на «оглушен-
ный» миокард, чем на ИМ [10]. При классической
кардиомиопатии такоцубо наблюдаются гипокине-
зия или акинезия медиальных и апикальных сег-
ментов ЛЖ и гиперкинезия базальных сегментов
ЛЖ (рис. 12 .1).
Описаны и другие формы этой патологии: сред-
нежелудочковая [11] и базальная [12]. 256 пациен-
там с данным заболеванием была выполнена маг-
нитно-резонансная томография (МРТ) сердца. В 82%
случаев выявлена апикальная форма кардиомиопа-
тии такоцубо, в 17% — среднежелудочковая и в
1% — базальная. У 34% пациентов в патологиче-
ский процесс был вовлечен ПЖ [13]. Такую патоло-
гию называют бивентрикулярной кардиомиопати-
ей такоцубо, она является независимым предикто-
ром неблагоприятного исхода [14]. Изолированное
поражение ПЖ встречается редко [15]. У 30% паци-
Баллы
Сократимость миокарда
Движение эндокарда
Утолщение стенки*
1
Норма
Норма*
Норма (> 30%)
2
Гипокинезия
Уменьшенное*
Уменьшение (< 30%)
3
Акинезия
Отсутствует*
Отсутствует
4
Дискинезия
Кнаружи*
Истончение
5
При аневризме
Деформация во время диастолы
Отсутствует
* Во время систолы.
[Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28(1):1–39.e14, 2015.]
ТАБЛИЦА 12.2 Шкала оценки сократимости миокарда
Патология/фактор
Комментарий
Блокада ветвей левой ножки пучка Гиса
На ЭКГ могут быть признаки, аналогичные признакам острого ИМ
Синдром Вольфа–Паркинсона–Уайта
Может имитировать нижний или задний ИМ
Электрокардиостимулятор
Может быть причиной нарушения сократимости межжелудочковой перего-
родки или апикальных сегментов в зависимости от места фиксации электрода
кардиостимулятора к ПЖ
Кардиохирургические операции в анамнезе Сократимость межжелудочковой перегородки может быть снижена
Перегрузка объемом ПЖ
Утолщение межжелудочковой перегородки снижено во время диастолы
Перегрузка давлением ПЖ
Утолщение межжелудочковой перегородки снижено во время систолы
Констриктивный перикардит
Диастолическое дрожание межжелудочковой перегородки
Кардиомиопатия такоцубо
Классическая: акинезия с расширением полости ЛЖ в области медиальных
и апикальных сегментов, гиперкинезия базальных сегментов ЛЖ
Миокардит
Может приводить к глобальной или локальной систолической дисфункции ЛЖ
Дилатационная кардиомиопатия
Характерна глобальная систолическая дисфункция ЛЖ, но могут быть наруше-
ния локальной сократимости миокарда и изменения толщины стенки
ИМ — инфаркт миокарда; ЛЖ — левый желудочек; ПЖ — правый желудочек; ЭКГ — электрокардиограмма.
ТАБЛИЦА 12.3 Нарушения локальной сократимости миокарда, не связанные с патологией коронарных артерий
ентов возникают ранние осложнения, например об-
струкция оттока из ЛЖ, острая митральная регур-
гитация, сердечная недостаточность, кардиогенный
шок и аритмия [16].
Результаты динамического наблюдения отмеча-
ют улучшение функции ЛЖ в большинстве случаев
в течение нескольких недель или месяцев, развитие
в течение 4 лет рецидивов в 11,4% случаев и анало-
гичную выживаемость для сопоставимых по возра-
сту и полу групп населения [17].
ОПРЕДЕЛЕНИЕ ЛОКАЛИЗАЦИИ ИНФАРКТА МИОКАРДА
В попытке установить стандарты сегментации ЛЖ
для всех методов визуализации, включая ЭхоКГ, ра-
дионуклидное исследование с визуализацией перфу-
зии миокарда, МРТ и КТ сердца, была предложена
17-сегментная модель ЛЖ [18]. Эта модель включа-
ет истинную верхушку, т.е . сегмент, расположен-
ный за пределами полости ЛЖ и визуализируемый
часто только при контрастной ЭхоКГ и исследова-
нии перфузии миокарда с контрастным усилением.
ch12.indd 249
03.04.2019 11:52:48
250
ЧАСТЬ III Ишемическая болезнь сердца
ПЖ
ЛЖ
ПЖ
ЛЖ
А
Б
Рис. 12 .1 A Кардиомиопатия такоцубо. ТТЭхоКГ, апикальная четырехкамерная позиция. Видны классические признаки кардиомиопатии такоцубо: гипокине-
зия или акинезия медиальных и апикальных сегментов левого желудочка (ЛЖ) и гиперкинезия базальных сегментов левого желудочка в конце диастолы (A) и в
конце систолы (Б). ПЖ — правый желудочек.
При рутинных исследованиях с помощью ЭхоКГ
можно использовать 16-сегментную модель (без ис-
тинной верхушки). Сегменты ЛЖ и их типичное
кровоснабжение коронарными артериями изобра-
жены на рис. 12 .2 . В целом отмечается тенденция к
более апикальной локализации ИМ в бассейне ле-
вой передней нисходящей артерии (ЛПНА) и к бо-
лее базальной локализации ИМ в бассейне правой
коронарной артерии (ПКА) и левой огибающей ар-
терии (ЛОА). Необходимо отметить, что степень
нарушения локальной сократимости миокарда за-
висит от анатомии русла коронарных артерий у
конкретного пациента. Кроме того, наличие колла-
тералей и предшествующая реваскуляризация из-
меняют локализацию ишемии и ИМ относительно
коронарного кровоснабжения.
Непосредственно визуализировать устья и прок-
симальные участки левой коронарной артерии (ЛКА),
ПКА и ЛПНА у взрослых можно с помощью ТТЭхоКГ
(рис. 12 .3), что целесообразно для исключения ано-
мального отхождения коронарных артерий, особен-
но у молодых пациентов. ТТЭхоКГ с допплерогра-
фией может быть полезна для оценки коронарного
кровотока и имеет высокую точность для исключе-
ния ангиографически и функционально значимого
стеноза ЛКА [19]. Otsuka и соавт. [20] показали, что
выявление с помощью ТТЭхоКГ с допплерографи-
ей ретроградного кровотока в дистальном участке
ПКА и ее нижнесептальных ветвях свидетельствует
об окклюзии ПКА (чувствительность 100% и спе-
цифичность 98%).
ИНФАРКТ ПРАВОГО ЖЕЛУДОЧКА
Хотя инфаркт ПЖ был впервые описан в 1930-х гг.,
клинической реальностью его признали лишь в
1970-х гг ., когда распознали гемодинамические по-
следствия. Инфаркт ПЖ наблюдается в 50% случа-
ев нижнего ИМ, но нарушения гемодинамики на-
блюдаются менее чем у 50% пациентов [21]. ПЖ
кровоснабжается преимущественно ветвями арте-
рии острого края, окклюзия ПКА проксимальнее
места отхождения этих ветвей приводит к ишеми-
ческой дисфункции ПЖ. Если окклюзия возникает
дистальнее ветвей коронарных сосудов правого
предсердия (ПП), повышенная сократимость мио-
карда ПП улучшает функцию ПЖ и сердечный вы-
брос. И наоборот, более проксимальная окклюзия
ухудшает сократимость миокарда ПП и снижает на-
полнение ПЖ и его функцию, что приводит к более
тяжелым нарушениям гемодинамики. Намного ре-
же инфаркт ПЖ развивается в сочетании с острым
переднесептальным ИМ, когда ветви коронарных
сосудов отходят от ЛПНА [22]. Кроме того, перед-
няя часть верхушки ПЖ может кровоснабжаться
ЛПНА, «оборачивающейся» вокруг верхушки серд-
ца. Изолированный инфаркт ПЖ отмечался менее
чем в 3% аутопсий умерших вследствие ИМ [22].
Клиническое значение инфаркта ПЖ заключается в
существенно более высокой частоте нарушений ге-
модинамики, аритмий и внутрибольничной леталь-
ности по сравнению с клиническим значением ИМ,
поражающим только ЛЖ [23].
ЭхоКГ играет жизненно важную роль для паци-
ентов с предполагаемым инфарктом ПЖ (табл. 12 .4)
[24]. Во многих случаях нарушения сократимости
нижней стенки ЛЖ могут быть выражены относи-
тельно слабо с сохранной ФВЛЖ. В исследовании
60 пациентов с первым острым нижним ИМ макси-
мальная систолическая скорость смещения фиброз-
ного кольца трикуспидального клапана < 12 см/сек
имела для диагностики инфаркта ПЖ чувствитель-
ность 81%, специфичность 82% и отрицательную
прогностическую значимость 92% [25]. Оценка си-
столической функции ПЖ является комплексной.
Измерения такого эхокардиографического параме-
тра, как фракция изменения площади ПЖ, и метод
«глазного яблока» (“eye-ball method”) имеют различ-
ные результаты у разных исследователей. Систоли-
ческое смещение фиброзного кольца трикуспидаль-
ного клапана 14 мм и менее является полезным объ-
ективным критерием дисфункции ПЖ. Систоличе-
ское смещение фиброзного кольца трикуспидаль-
ch12.indd 250
03.04.2019 11:52:48
251
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
Рис. 12.2 Типичное кровоснабжение сегментов миокарда левого желудочка. ЛОА — левая огибающая артерия; ЛПНА — левая передняя нисходящая
артерия; ПКА — правая коронарная артерия [Lang RM, Badano LP, Mor-AviV, et al: Recommendations for cardiac chamber quantification by echocardiography in adults:
an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28[1]:1–39 .e14, 2015].
Четырехкамерная позиция
Двухкамерная позиция
Позиция по длинной оси
IV
V
VI
III
II
I
Четырехкамерная позиция
Срез на уровне
базальных сегментов
Срез на уровне
медиальных сегментов
Срез на уровне
апикальных сегментов
Двухкамерная позиция
Позиция по длинной оси
I
I
II
II
IV
IV
III
III
VI
VI
V
V
ПКА или ЛОА
ЛПНА или ЛОА
ПКА или ЛПНА
ПКА
ЛПНА
ЛОА
17
17
17
14
16
9
12
36
15
10
4
7
1
16
13
11
8
2
5
2
1
6
5
4
3
8
7
12
16
13
15
14
11
10
9
1 Базальный передний
2 Базальный переднесептальный
3 Базальный нижнесептальный
4 Базальный нижний
5 Базальный нижнебоковой
6 Базальный переднебоковой
7 Медиальный передний
8 Медиальный переднесептальный
9 Медиальный нижнесептальный
10 Медиальный нижний
11 Медиальный нижнебоковой
12 Медиальный переднебоковой
13 Апикальный передний
14 Апикальный септальный
15 Апикальный нижний
16 Апикальный боковой
17 Истинная верхушка
13
Срез на уровне
базальных сегментов
Срез на уровне
медиальных сегментов
Срез на уровне
апикальных сегментов
Парастернальная позиция по короткой оси
Апикальный доступ
Парастернальная позиция по короткой оси
Апикальный доступ
Сегменты
ch12.indd 251
03.04.2019 11:52:49
252
ЧАСТЬ III Ишемическая болезнь сердца
Корень аорты
Корень аорты
А
Б
ного клапана следует оценивать у пациентов с по-
дозрением на инфаркт ПЖ [26].
Недавно было показано, что глобальная про-
дольная деформация ПЖ является технически лег-
ким для измерения параметром функции ПЖ и об-
ладает большими чувствительностью и специфич-
ностью, чем фракция изменения площади ПЖ и
систолическое смещение фиброзного кольца трику-
спидального клапана, для прогнозирования тяже-
лых неблагоприятных сердечно-сосудистых собы-
тий после инфаркта ПЖ. Снижение податливости
ПЖ можно обнаружить по увеличенной скорости A
при регистрации кровотока в печеночной вене и по
Рис. 12.3 Устья и проксимальные участки основных коронарных артерий. ТТЭхоКГ, высокая парастернальная позиция по короткой оси. (А) Устье левой
коронарной артерии и проксимальный участок левой передней нисходящей артерии (стрелка). (Б) Устье и проксимальный участок правой коронарной артерии
(стрелка).
Первичный признак
Дилатация правого желудочка
Нарушения локальной сократимости свободной стенки
правого желудочка
Уменьшение систолического смещения фиброзного кольца
трикуспидального клапана
Максимальная систолическая скорость смещения фиброз-
ного кольца трикуспидального клапана < 12 см/сек
Снижение глобальной продольной деформации правого
желудочка
Уменьшение фракции изменения площади правого
желудочка
Вторичный признак
Парадоксальное движение межжелудочковой перегородки
Трикуспидальная регургитация
Отрыв папиллярной мышцы трикуспидального клапана
Время полуспада давления струи регургитации на клапане
легочной артерии < 150 мсек
Дилатация нижней полой вены
Выбухание межпредсердной перегородки справа налево
Сброс крови справа налево через открытое овальное окно
ТАБЛИЦА 12.4 Эхокардиографические признаки
инфаркта миокарда правого желудочка
короткому времени полуспада давления при скоро-
сти струи регургитации на клапане легочной арте-
рии (≤ 150 мсек) [27]. К характерным эхокардиогра-
фическим признакам правожелудочковой недоста-
точности с высоким давлением в ПП относятся
выбухание межпредсердной перегородки в сторону
ЛП и дилатация нижней полой вены без спадения
во время вдоха. Данные показатели функции ПЖ
коррелируют с клиническим статусом пациента и
прогнозом [28]. При обширном инфаркте ПЖ в со-
четании с повышенным давлением в ПП может на-
блюдаться тяжелая гипоксемия в результате сброса
крови справа налево через открытое овальное окно.
В большинстве случаев инфаркта ПЖ функция
этого желудочка возвращается почти к норме в те-
чение 3–12 мес [29]. Поскольку при острой ишеми-
ческой дисфункции ПЖ в нем все же преобладает
жизнеспособный миокард, который может спон-
танно восстановиться или благоприятно реагиро-
вать на реперфузию даже в позднем периоде после
начала окклюзии, считают, что термин инфаркт
правого желудочка является неточным, вместо него
следует использовать термин ишемическая дисфунк-
ция правого желудочка [30]. Однако нужно признать,
что инфаркт ПЖ связан с относительно высокой
внутрибольничной летальностью, а восстановление
функции ПЖ с улучшением клинического течения
и выживаемости ускоряет ранняя реперфузия [31].
ДИАГНОСТИКА ОСЛОЖНЕНИЙ
ОСТРОГО ИНФАРКТА МИОКАРДА
Прогноз ИМ заметно улучшился с появлением вме-
шательств, обеспечивающих раннее восстановление
кровотока в коронарных артериях, — сначала тром-
болизиса, затем первичного чрескожного коронар-
ного вмешательства. В случае острой нестабильно-
сти гемодинамики критически важно исключить у
ch12.indd 252
03.04.2019 11:52:50
253
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
пациента разрыв миокарда (который можно устра-
нить хирургически или чрескожно), прежде чем
прийти к заключению, что в основе кардиогенного
шока лежит недостаточность насосной функции
сердца (табл. 12 .5).
В большинстве случаев ТТЭхоКГ (при необходи-
мости в сочетании с ЧПЭхоКГ) достаточно для ис-
ключения отрыва папиллярной мышцы, разрыва
свободной стенки и МЖП. В табл. 12 .6 приведено
сравнение частоты механических осложнений остро-
го ИМ до эпохи реперфузии и в эпоху реперфузии.
ГЕМОДИНАМИЧЕСКАЯ ОЦЕНКА ИНФАРКТА МИОКАРДА
С ПОМОЩЬЮ ДОППЛЕРОГРАФИИ
С помощью тщательно проведенной ТТЭхоКГ мож-
но оценить гемодинамику после перенесенного ИМ.
Простым методом оценки сердечного выброса яв-
ляется определение интеграла скорости аортально-
го кровотока с помощью импульсно-волновой доп-
плерографии. Было показано, что у пациентов с
острым ИМ диастолическую функцию ЛЖ можно
точнее оценить по давлению заклинивания легоч-
ной артерии, чем инвазивным методом, и спрогно-
Гемодинамическое осложнение
Гиповолемия
Инфаркт правого желудочка
Снижение глобальной сократимости левого желудочка
Механическое осложнение
Отрыв папиллярной мышцы с выра женной митральной
регургитацией
Разрыв межжелудочковой перегородки
Разрыв свободной стенки желудочка и тампонада сердца
Другое осложнение
Аневризма левого желудочка
Муральный тромб
Перикардиальная жидкость
ТАБЛИЦА 12.5 Эхокардиография при осложнениях
инфаркта миокарда
зировать исход заболевания. При остром ИМ повы-
шенное систолическое давление в легочной артерии
ассоциируется с увеличением смертности [32]. Из-
мерение систолического давления в легочной арте-
рии с помощью допплерографии по струе трику-
спидальной регургитации хорошо обосновано, а
диаметр и спадение нижней полой вены во время
вдоха можно использовать для оценки давления в
ПП у пациента со спонтанным дыханием.
ПЕРИКАРДИАЛЬНАЯ ЖИДКОСТЬ
ПОСЛЕ ИНФАРКТА МИОКАРДА
ТТЭхоКГ — чувствительный метод определения пе-
рикардиальной жидкости после ИМ, но ТТЭхоКГ
менее чувствительна, по сравнению с МРТ сердца,
при диагностике перикардита без перикардиальной
жидкости. Перикардит часто наблюдается после ИМ
и может быть причиной боли в груди [33].
В исследовании 908 пациентов из 25 клиник Фран-
ции [34] перикардиальная жидкость после ИМ была
выявлена в 6,6% случаев (по данным ТТЭхоКГ при
поступлении и выписке). В большинстве случаев
объем жидкости был небольшим и гемодинамиче-
ски незначимым. Обычно перикардиальная жид-
кость появляется в первые 5 сут после инфаркта (но
может появиться и в течение первых 3 нед) и в не-
большом объеме. Большое количество перикарди-
альной жидкости, расположенной циркулярно, на-
блюдается редко. Спонтанное разрешение обычно
происходит медленно — в течение 6–18 мес.
Наиболее распространенной причиной появле-
ния в умеренном или большом количестве перикар-
диальной жидкости в ранний постинфарктный пе-
риод является разрыв миокарда, а также образова-
ние в этой полости тромба (рис. 12 .4).
Дифференциальная диагностика в острой ситуа-
ции должна включать расслоение аорты и перимио-
кардит. Перикардиальная жидкость может образо-
ваться после стентирования коронарных артерий с
разрывом сосуда, имплантации временного кардио-
стимулятора и перфорации ПЖ, биопсии сердца
или транссептальной пункции в ходе интервенци-
Осложнение инфаркта миокарда
До эпохи реперфузии (%)
В эпоху реперфузии (%)
Перикардиальная жидкость
25
6,6
Тромб в левом желудочке (передний инфаркт миокарда)
35–40
5,5
Митральная регургитация
53
28
Расширение зоны инфаркта
30
4
Разрыв межжелудочковой перегородки
1–3
0,6
Разрыв свободной стенки желудочка
2
0,8
[Guereta P, Khalifeb K, Jobicc Y, et al. Echocardiographic assessment of the incidence of mechanical complications during the early phase of myo-
cardial infarction in the reperfusion era: a French multicenter prospective registry. Arch Cardiovasc Dis 101:41–47, 2008.]
ТАБЛИЦА 12.6 Сравнение частоты механических осложнений после острого инфаркта миокарда
до эпохи реперфузии и в эпоху реперфузии
ch12.indd 253
03.04.2019 11:52:52
254
ЧАСТЬ III Ишемическая болезнь сердца
ПП
ПЖ
ЛЖ
ЛП
ПЖ
ЛЖ
ЛП
ПЖ
ЛЖ
А
Б
В
Рис. 12 .4 Геморрагическая перикардиальная жидкость. (A) A ТТЭхоКГ, субкостальная позиция. Визуализируются геморрагическая перикардиальная жид-
кость и тромб (стрелка), приводящий к компрессии правого желудочка (ПЖ). (Б) A ТТЭхоКГ, парастернальная позиция по длинной оси левого желудочка (ЛЖ).
Тромб в полости перикарда (стрелка). (В) Обратите внимание на расширение нижней полой вены (стрелка) из-за повышения давления в правом предсердии.
ЛП — левое предсердие.
Рис. 12.5 A Тромб в полости перикарда за правым предсердием. Боль-
шой тромб (стрелка) за правым предсердием (ПП) приводит к его компрессии.
ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
онного вмешательства. Тромб в полости перикарда
за ПП (рис. 12 .5) может стать причиной компрессии
ПП, не связанной с перикардиальной жидкостью.
Тромбоз всегда следует предполагать у нестабиль-
ного пациента после инвазивных кардиальных вме-
шательств и на раннем этапе после кардиохирурги-
ческой операции.
ОСТРАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Выраженная острая митральная регургитация при
ИМ обычно является результатом некроза и отрыва
папиллярной мышцы. Это опасное для жизни ос-
ложнение, при котором нужно немедленное хирур-
гическое вмешательство. К митральной регургита-
ции также может привести неполное смыкание
створок митрального клапана вследствие ремодели-
рования ЛЖ и нарушения структуры желудочка.
Двухмерная ЭхоКГ (2D-ЭхоКГ) способна выявить
аномалии подклапанного аппарата, включая пато-
логическую подвижность створок и отрыв папил-
лярных мышц. При наличии эксцентрической струи
митральной регургитации и относительно нормаль-
ных размерах ЛП следует предположить отрыв па-
пиллярных мышц даже при нечеткой визуализа-
ции. Чаще всего используют цветовую допплеро-
графию, но для точной оценки степени митральной
регургитации ее следует оценить и другими метода-
ми допплерографии. У пациентов с отеком легких
при неожиданном выявлении небольшого инфар-
кта, гипердинамики ЛЖ или увеличенной скорости
раннего наполнения ЛЖ необходимо провести тща-
тельный поиск митральной регургитации, даже ес-
ли ее не выявила цветовая допплерография.
По данным литературы, отрыв папиллярной
мышцы (в основном заднемедиальной) в 15 случа-
ях из 17 наблюдался у пациентов с нижним ИМ [35].
Более высокая частота поражения заднемедиальной
папиллярной мышцы обусловлена ее кровоснабже-
нием только одной коронарной артерией (задней
нисходящей), тогда как переднелательную папил-
лярную мышцу кровоснабжают две коронарные ар-
терии — ЛПНА и ЛОА (рис. 12 .6). Сухожильные
хорды к обеим створкам отходят от каждой папил-
лярной мышцы, поэтому в случае полного отрыва
папиллярной мышцы поражаются обе створки кла-
пана. В менее тяжелых случаях наблюдается отрыв
только одной головки папиллярной мышцы. К эхо-
кардиографическим признакам отрыва папилляр-
ной мышцы относятся пролапс одной или обеих
створок, патологическая подвижность (флотация)
створки и свободной части папиллярной мышцы.
Иногда при отрыве папиллярной мышцы часть ее
может оставаться прикрепленной к сухожильным
хордам, и наблюдается ее хаотичное движение. При
отрыве только одной головки папиллярной мышцы
возможно терапевтическое лечение. В случае отры-
ва папиллярной мышцы вместе с ее основанием ос-
ложнение будет фатальным без экстренной хирур-
гической коррекции.
РАЗРЫВ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Разрыв МЖП происходит только при трансмураль-
ном инфаркте и обусловлен кровоизлиянием в зоне
ch12.indd 254
03.04.2019 11:52:52
255
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
некроза. К независимым факторам риска разрыва
МЖП относят первый инфаркт, преклонный воз-
раст (старше 65 лет), артериальную гипертензию,
женский пол и хроническую почечную патологию
[36]. Кроме того, более высокая частота данного ос-
ложнения отмечается у пациентов без стенокардии
в анамнезе и с инфарктом в зоне кровоснабжения
одной артерии. Таким образом, разрыв МЖП более
вероятен после внезапной окклюзии единственной
артерии, кровоснабжающей область МЖП с малым
количеством коллатералей. В отличие от отрыва па-
пиллярной мышцы, разрыв МЖП происходит со
схожей частотой среди пациентов с передним ИМ
(бассейн ЛПНА) и нижним ИМ (бассейн ПКА), но
с меньшей частотой — при боковом ИМ (бассейн
ЛОА).
Разрыв МЖП в дотромболитическую эру встре-
чался в 1–2% всех случаев острого ИМ и в 5% слу-
чаев фатального ИМ [37]. Внедрение в практику
первичного чрескожного коронарного вмешатель-
ства снизило частоту разрыва МЖП до 0,2–0,5%. В
период между 1990 и 2007 гг. частота разрыва МЖП
вследствие острого ИМ среди 408 пациентов остава-
лась практически такой же (0,25–0,31%), а смерт-
ность была высокой. Общая летальность в больни-
це, через 30 сут и через 1 год составляла 50, 54 и 65%
соответственно [36]. Максимальная частота разры-
ва МЖП наблюдалась в первые 24 часа после лече-
ния.
ЭхоКГ у постели больного является очень чув-
ствительным и специфичным методом диагности-
ки разрыва МЖП. Простой разрыв МЖП представ-
ляет собой прямое сообщение между ЛЖ и ПЖ, при
этом входное и выходное отверстия находятся на
одном горизонтальном уровне. Сложный разрыв
МЖП имеет входное и выходное отверстия на раз-
ных уровнях МЖП с расслоением миокарда и кро-
воизлиянием. Расслаивающая гематома на эхокар-
диограмме имеет вид прозрачного интрамиокарди-
ального дефекта.
Разрыв МЖП может быть множественным и со-
четаться с разрывом свободной стенки ЛЖ или от-
рывом папиллярной мышцы. Расширение зоны ин-
фаркта легко диагностируется с помощью ЭхоКГ и
обычно наблюдается перед разрывом МЖП. Разрыв
МЖП вследствие окклюзии ПКА обычно происхо-
дит в базальном нижнем отделе МЖП (рис. 12 .7), а
после острого переднего ИМ — чаще всего в апи-
кальном отделе МЖП (рис. 12 .8). При клиническом
подозрении на разрыв МЖП для определения лока-
лизации дефекта сначала выполняют цветовую доп-
плерографию, а затем — 2D-ЭхоКГ. При этом не-
редко нужно использовать модифицированные по-
зиции. Ширина потока крови через разрыв МЖП
при цветовой допплерографии коррелирует с раз-
мером дефекта, измеренным во время операции.
Максимальный градиент давления на разрыве
МЖП, измеренный с помощью непрерывно-волно-
вой допплерографии, позволяет оценить систоли-
ческое давление в ПЖ. Такое измерение следует
проводить с осторожностью у пациентов со слож-
ными дефектами, имеющими непрямые ходы через
миокард. Признаками повышенного давления в
ПЖ являются дилатация ПЖ, сниженная систоли-
ческая функция ПЖ и парадоксальное движение
МЖП. Признаки повышенного давления в ПП —
дилатация ПП, выгибание межпредсердной перего-
родки в сторону ЛП в течение сердечного цикла и
увеличение диаметра нижней полой вены.
При разрыве МЖП очень высокий уровень
смертности. ЭхоКГ способна обеспечить стратифи-
кацию риска у таких пациентов. Сложные разрывы
МЖП и вовлечение ПЖ являются факторами, опре-
деляющими неблагоприятные исходы [38]. Разрыв
заднего сегмента МЖП после нижнего ИМ ассоци-
ируется с более высокой смертностью из-за разви-
тия дисфункции ПЖ. Кроме того, разрывы задне-
септальных сегментов обычно более сложные, и
при них нередко поражаются удаленные участки
миокарда. Разрывы переднесептальных сегментов,
ЛЖ
ЛП
Передняя стенка
Нижняя стенка
змПМ
ЛЖ
ЛП
Передняя стенка
Нижняя стенка
плПМ
А
Б
Рис. 12 .6 Отрыв папиллярной мышцы. ЧПЭхоКГ. (А) Отрыв заднемедиальной папиллярной мышцы (змПМ) (стрелка), который встречается чаще, т.к . ее кро-
воснабжает одна коронарная артерия. (Б) Отрыв переднелатеральной папиллярной мышцы (плПМ) (стрелка), который встречается реже, т .к. ее кровоснабжают
две коронарные артерии. ЛЖ — левый желудочек; ЛП — левое предсердие.
ch12.indd 255
03.04.2019 11:52:54
256
ЧАСТЬ III Ишемическая болезнь сердца
наоборот, чаще являются простыми с очаговым по-
ражением миокарда.
Крупнейшее исследование пациентов с разрывом
МЖП после ИМ (n = 2876), информация о которых
была взята из базы данных Society of Thoracic Sur-
geons, показало операционную летальность 54%, ес-
ли операция была проведена после ИМ в течение
7 сут, и 18%, если прошло более 7 сут [39], что, ско-
рее всего, связано с критериями отбора пациентов
для операции в более поздние сроки. Обычно это
гемодинамически стабильные пациенты, имеющие
небольшой и менее сложный разрыв МЖП. Влия-
ние одновременного проведения коронарного шун-
тирования на выживаемость пациента до конца не
определена [40]. Без хирургического вмешательства
процент выживаемости пациентов очень низок (5–
10%) [41], но если пациент гемодинамически стаби-
лен или его удается стабилизировать медикаментоз-
но, хирургическое вмешательство можно отложить
[42]. У некоторых пациентов консервативный под-
ход может быть эффективным с хорошим средне-
срочным исходом. Sivadasan и соавт. описали 7 из 27
пациентов с разрывом МЖП в постинфарктном пе-
риоде, которых не оперировали и наблюдали в сред-
нем около 3 лет [38]. У всех 7 пациентов было одно-
сосудистое поражение, разрыв МЖП был неболь-
шим (в среднем 9,8 мм), отмечались минимальный
сброс крови слева направо и сохранная функция
ПЖ. Описаны спонтанные закрытия тромбом не-
больших разрывов МЖП в постинфарктном перио-
де [43].
В определенных ситуациях можно рассмотреть
транскатетерное вмешательство для закрытия де-
фекта МЖП, включая остаточный дефект после хи-
рургической коррекции разрыва МЖП, что наблю-
дается приблизительно в 25% случаев [44]. Транска-
тетерное вмешательство позволяет стабилизировать
состояние пациентов с высоким риском и отсро-
ЛЖ
ЛП
Перикардиальная
жидкость
А
Б
Рис. 12 .8 Разрыв межжелудочковой перегородки после переднего инфаркта миокарда. (A) ТТЭхоКГ, субкостальная позиция. Визуализируется дефект
межжелудочковой перегородки (стрелка) вследствие ее разрыва в апикальном отделе. (Б) При цветовой допплерографии виден сброс крови слева направо че-
рез дефект межжелудочковой перегородки (стрелка). Обратите внимание на небольшое количество перикардиальной жидкости, расположенной циркулярно.
ЛЖ — левый желудочек; ЛП — левое предсердие.
ПЖ
ЛЖ
ЛП
ПЖ
ЛЖ
А
Б
В
Рис. 12.7 Разрыв межжелудочковой перегородки после нижнего инфаркта миокарда. (A) ТТЭхоКГ, модифицированная апикальная четырехкамерная
позиция. Виден большой дефект межжелудочковой перегородки вследствие ее разрыва у пациента с обширным нижним инфарктом миокарда. Область дефек-
та — это большой неправильной формы участок отсутствия эхо-сигналов (стрелка). (Б) ТТЭхоКГ, парастернальная позиция по короткой оси сердца. Измерение
дефекта межжелудочковой перегородки (стрелка). (В) ТТЭхоКГ, парастернальная позиция по короткой оси сердца с цветовой допплерографией. Обратите внима-
ние на увеличенный правый желудочек (ПЖ) на (Б) и (В), что обусловлено нижним инфарктом миокарда с перегрузкой объемом и давлением. ЛЖ — левый же-
лудочек; ЛП — левое предсердие.
ch12.indd 256
03.04.2019 11:52:55
257
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
чить хирургическое лечение [45]. За это время про-
исходит фиброз миокарда МЖП, который облегча-
ет коррекцию разрыва. К потенциальным кандида-
там на первичное транскатетерное вмешательство
для закрытия дефекта МЖП относят пациентов с
простым разрывом размером < 15 мм либо в остром
периоде, когда риск при хирургическом вмешатель-
стве слишком высок, либо в подостром или хрони-
ческом периоде с летальностью, сопоставимой с ле-
тальностью при хирургическом методе лечения [46].
Для транскатетерного закрытия сложного разры-
ва МЖП используют два окклюдера [47]. В публи-
кации о применении окклюдеров для транскатетер-
ного закрытия разрывов МЖП в постинфарктном
периоде у 53 пациентов указано на высокую эффек-
тивость такого лечения. Внутрибольничная леталь-
ность была высокая, но пациенты, которые дожива-
ли до выписки, имели относительно хороший
прогноз в долгосрочном периоде [48].
Процедуру обычно выполняют под общей ане-
стезией и под контролем с помощью рентгеноско-
пии и ЧПЭхоКГ (рис. 12 .9) [49]. Подходящей аль-
тернативой может быть внутрисердечная ЭхоКГ.
Для закрытия апикальных дефектов у пациентов,
находящихся в сознании под седацией, предпочти-
тельнее использовать ТТЭхоКГ. ЧПЭхоКГ при за-
крытии дефекта МЖП нужна для оценки анатомии
дефекта из нескольких доступов (обычно использу-
ют доступ из верхнего и среднего отделов пищево-
да и трансгастральный доступ), включая измерение
дефекта, определение его локализации и близости к
митральному, трикуспидальному и аортальному кла-
панам (при нижнем дефекте МЖП). Интраопераци-
онная ЧПЭхоКГ также помогает при манипуляциях
с катетером и во время позиционирования и развер-
тывания окклюдера. Оценка с помощью цветовой
допплерографии — важная часть вмешательства,
особенно для выявления небольших дефектов, под-
тверждения сброса крови слева направо через де-
фект и для того, чтобы отличить остаточный дефект
от сброса крови из катетера.
Определение точного размера дефекта имеет ре-
шающее значение для успешности вмешательства.
С помощью 2D- или 3D-ЧПЭхоКГ выполняют ка-
либровку дефекта и подбирают окклюдер размером
на 50% больше, чем размер дефекта, чтобы снизить
частоту эмболизации окклюдера и появления оста-
точных шунтов. ЧПЭхоКГ также необходима для
выявления осложнений, в частности миграции ок-
клюдера, защемления катетера в митральном или
ЛЖ
ЛЖ
ПЖ
ПЖ
ДМЖП
Окклюдер
Б
А
Рис. 12 .9 Закрытие окклюдером разрыва межжелудочковой перегородки в постинфарктном периоде. (A) Левая вентрикулография перед закрыти-
ем разрыва межжелудочковой перегородки. Видны сброс крови слева направо (слева) и окклюдер Amplatzer (справа, черная стрелка) перед высвобождением из
доставочного устройства (белая стрелка). (Б) ЧПЭхоКГ, угол 0°. Дефект межжелудочковой перегородки (ДМЖП) в ее медиально-нижней части (слева). Окклю-
дер Amplatzer установлен в медиально-нижней части межжелудочковой перегородки (справа). ЛЖ
—
левый желудочек; ПЖ — правый желудочек [Ahmed A,
Ruygrok P, Wilson N, et al. Percutaneous closure of postmyocardial infarction ventricular septal defects: a single centre Experience. Heart Lung Circ 17:119–123, 2008].
ch12.indd 257
03.04.2019 11:52:58
258
ЧАСТЬ III Ишемическая болезнь сердца
трикуспидальном клапане, появления остаточных
шунтов, аортальной регургитации в результате
ятрогенного поражения аортального клапана.
РАЗРЫВ СВОБОДНОЙ СТЕНКИ ЛЕВОГО ЖЕЛУДОЧКА
При остром ИМ с подъемом сегмента ST разрыв
свободной стенки ЛЖ является второй по частоте
механической причиной летального исхода (пер-
вая — кардиогенный шок вследствие недостаточно-
сти насосной функции). Разрыв свободной стенки
ЛЖ обычно фатален [50]. Данное осложнение на-
блюдается чаще всего у пациентов с трансмураль-
ным ИМ, поражающим медиально-боковую стен-
ку, при окклюзии ЛОА (рис. 12 .10) или ЛПНА [51].
Ранняя успешная реперфузия снижает риск разры-
ва [52].
Разрыв свободной стенки желудочка клинически
проявляется обычно как острое событие, быстро
приводящее к смерти. Однако в некоторых случаях
возможно подострое или хроническое течение, если
небольшой разрыв временно закрывается фибри-
нозными перикардиальными спайками или тром-
бом. При правильной диагностике в подострой фа-
зе и своевременном хирургическом лечении шансы
на выживание у пациента хорошие [53].
Эхокардиографическим критерием риска разры-
ва является расширение зоны инфаркта со значи-
тельным утончением стенки желудочка в этой зоне.
После неосложненного трансмурального ИМ часто
присутствует немного перикардиальной жидкости,
но увеличение ее объема и наличие тромба в поло-
сти перикарда значительно повышают риск разры-
ва миокарда. Отсутствие перикардиальной жидко-
сти фактически исключает разрыв миокарда.
При ЭхоКГ тромб в полости перикарда выглядит
как плотная масса. Тромб может быть подвижным,
флотирующим в полости перикарда, или непод-
вижным, фиксированным к стенке сердца [53]. Не-
посредственно визуализировать разрыв свободной
стенки желудочка с помощью ТТЭхоКГ удается не-
часто. Если есть сомнения, введение контрастного
средства в левые отделы сердца поможет четко ви-
зуализировать разрыв [54].
По данным литературы, смертность в случае раз-
рыва свободной стенки желудочка без экстренного
хирургического вмешательства очень высока, хотя
в недавних исследованиях есть сообщения о 50%
выживаемости пациентов, которым выполняли пе-
рикардиоцентез и проводили лекарственную тера-
пию [55]. Внутрибольничная летальность пациен-
тов, подвергшихся хирургической коррекции, со-
ставляет 40%.
Выжившие и выписанные из больницы пациен-
ты имеют хороший долгосрочный прогноз [50]. Та-
ким образом, ранняя диагностика осложнения с по-
мощью ЭхоКГ и быстрое хирургическое или чрес-
кожное дренирование обязательны для пациентов с
разрывом свободной стенки ЛЖ в постинфарктном
периоде.
ПСЕВДОАНЕВРИЗМА
Псевдоаневризма — это ограниченный разрыв сво-
бодной стенки ЛЖ. Обычно псевдоаневризма явля-
ется осложнением острого ИМ, но может также на-
блюдаться после хирургического вмешательства на
сердце, травмы грудной клетки и эндокардита.
Псевдоаневризму ЛЖ нередко диагностируют слу-
чайно. По данным клиники Mayo, у 25 из 52 паци-
ентов с псевдоаневризмой ЛЖ она была случайной
находкой [56]. Чаще всего псевдоаневризма локали-
зуется в нижнем или нижнебоковом сегментах, что
связано с окклюзией ПКА или ЛОА.
Важно отличать псевдоаневризму, имеющую вы-
сокую вероятность спонтанного разрыва, от истин-
ной аневризмы, которая разрывается редко. Стенки
псевдоаневризмы образованы эпикардом, париеталь-
ным перикардом и организованным тромбом, обра-
зовавшимся вследствие кровоизлияния в полость
перикарда после разрыва миокарда. Напротив, стен-
ка истинной аневризмы состоит из плотной фи-
брозной ткани с большим пределом прочности.
Характерным эхокардиографическим призна-
ком псевдоаневризмы является наличие узкого со-
устья. Отношение диаметра этого соустья к макси-
мальному размеру аневризмы < 0,5 по сравнению с
более широким «входом» в тело истинной аневриз-
мы. Однако данный критерий не всегда надежен и
имеет чувствительность 60% в дифференциальной
диагностике псевдоаневризмы и истинной аневриз-
мы [56]. Это особенно справедливо для псевдоанев-
ризмы в области основания сердца, возникающей
чаще всего после нижнего ИМ. При спектральной и
цветовой допплерографии визуализируется харак-
ПЖ
ЛЖ
ЛП
ПП
Рис. 12 .10 A A Разрыв свободной стенки левого желудочка. Апикаль-
ная четырехкамерная позиция. Видны разрыв миокарда в области медиально-
боковой стенки левого желудочка (ЛЖ) (стрелка) и небольшой объем перикар-
диальной жидкости. ЛП
—
левое предсердие; ПЖ — правый желудочек;
ПП — правое предсердие.
ch12.indd 258
03.04.2019 11:52:58
259
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
терный поток крови через соустье псевдоаневризмы
в полость перикарда и из нее, а также патологиче-
ский кровоток в псевдоаневризме.
Хирургическая коррекция является предпочти-
тельным методом лечения, хотя консервативная те-
рапия у некоторых пациентов с высоким риском
может не ассоциироваться с повышенным риском
разрыва миокарда [57]. Чрескожное закрытие псев-
доаневризмы (рис. 12 .11) следует проводить только
тщательно отобранным пациентам и под контро-
лем ЧПЭхоКГ.
РАСШИРЕНИЕ ЗОНЫ ИНФАРКТА МИОКАРДА
И ОБРАЗОВАНИЕ ИСТИННОЙ АНЕВРИЗМЫ
Расширение зоны инфаркта может приводить к
острому ремоделированию ЛЖ с увеличением цир-
кулярной площади инфаркта в результате растяже-
ния и истончения миокарда. Этот процесс, как пра-
вило, происходит спустя 24–72 час после острого
трансмурального ИМ. Расширение зоны инфаркта
возможно в любой области ЛЖ, но чаще всего это
происходит в передневерхушечном сегменте. К эхо-
кардиографическим признакам расширения зоны
инфаркта относится аневризматическое выпячива-
ние миокарда с локальным уменьшением толщины
стенки. Тонкая некротизированная стенка имеет
плохую растяжимость, и ее истончение предшеству-
ет таким осложнениям, как разрыв МЖП, разрыв
свободной стенки желудочка или отрыв папилляр-
ной мышцы.
В отсутствие разрыва расширение зоны инфар-
кта в конечном итоге приводит к формированию
истинной аневризмы и образованию рубца на всю
толщину стенки, что наблюдается только при транс-
муральном ИМ. Истинная аневризма — это дефор-
мированный истонченный пораженный инфарктом
сегмент. Истинная аневризма проявляется аномаль-
ным движением (дискинезией) во время диастолы
и во время систолы и патологическим контуром во
время диастолы. В отличие от этого сегмент мио-
карда с дискинезией без аневризмы деформируется
во время систолы, выходя за пределы нормального
контура миокарда. Стенка истинной аневризмы
представлена тонкой рубцовой тканью (< 7 мм) и
обладает усиленной эхогенностью из-за повышен-
ного содержания коллагена. Стенка истинной анев-
ризмы со временем может кальцифицироваться.
Большинство истинных аневризм располагается в
области верхушки и передней стенки ЛЖ, реже — в
области нижней стенки (рис. 12 .12). Аневризмы бо-
ковой стенки наблюдаются очень редко. По данным
литературы, до эры реперфузии частота образова-
ния аневризмы после острого ИМ была вариабель-
ной (в среднем около 30%) [58]. Исследование 205
пациентов с острым ИМ показало существенное
уменьшение частоты образования аневризмы у па-
циентов, получающих тромболитическую терапию,
при наличии проходимой инфаркт-связанной арте-
рии по сравнению с пациентами, также получаю-
щими тромболитическую терапию, но при стенозе
инфаркт-связанной артерии [58]. Также есть сооб-
щения о сходном снижении частоты образования
аневризмы ЛЖ после первичного чрескожного ко-
ронарного вмешательства.
Серийные 2D-ЭхоКГ показывают, что аневриз-
матическая дилатация обычно появляется уже через
5 сут после ИМ. Через 3 мес после ИМ новые анев-
ризмы маловероятны. Спонтанный разрыв острой
аневризмы происходит редко, а поздний разрыв —
практически никогда. Размеры аневризмы могут
варьировать. Очень маленькие аневризмы бывает
трудно визуализировать при ЭхоКГ. Диагностика
апикальной аневризмы зависит от опыта специали-
ста по ультразвуковой диагностике. Рутинное ис-
ЛЖ
ЛП
ЛЖ
ЛП
Б
А
Рис. 12.11 Псевдоаневризма левого желудочка. (A) ТТЭхоКГ, апикальная четырехкамерная позиция. Визуализируется большая псевдоаневризма (белая
стрелка) в медиальном отделе нижнебоковой стенки левого желудочка (ЛЖ). Красная стрелка указывает на место разрыва свободной стенки ЛЖ. (Б) ТТЭхоКГ
после транскатетерного закрытия дефекта. Установлен окклюдер Amplatzer (белая стрелка). Красная стрелка указывает на катетер. ЛП — левое предсердие.
ch12.indd 259
03.04.2019 11:52:58
260
ЧАСТЬ III Ишемическая болезнь сердца
пользование высокочастотных датчиков с коротким
фокусным расстоянием улучшает разрешение в
ближнем поле, что помогает при обследовании вер-
хушки ЛЖ. Введение контрастного средства в левые
отделы сердца также может помочь в выявлении не-
больших аневризм в области верхушки.
Диагностика аневризм ЛЖ с помощью ЭхоКГ
имеет большое клиническое значение по следующим
причинам. Во-первых, раннее образование аневриз-
мы негативно влияет на раннюю (внутрибольнич-
ную) и позднюю (через 1 год) смертность и ассоци-
ируется с увеличением частоты сердечной недоста-
точности. Во-вторых, внутри аневризмы обычно
есть тромбы, что приводит к системной эмболии.
В-третьих, аневризма может вызвать жизнеугрожа-
ющую желудочковую аритмию. Пациентам с сер-
дечной недостаточностью или желудочковой арит-
мией рекомендуется аневризмэктомия, а ЭхоКГ
играет важную роль в отборе пациентов. При реше-
нии вопроса об аневризмэктомии важно убедиться,
что базальные сегменты ЛЖ имеют нормальную
функцию. При фракции укорочения базальных сег-
ментов > 18% или ФВ базальных сегментов > 40%
больше вероятность удовлетворительного резуль-
тата.
ТРОМБОЗ ЛЕВОГО ЖЕЛУДОЧКА
Тромбы в ЛЖ образуются на эндокардиальной по-
верхности акинетичных, нежизнеспособных сег-
ментов. Чаще всего тромбы образуются через 3 сут
после острого ИМ, однако они в обширных зонах
акинезии могут появиться уже через несколько ча-
сов, а в области верхушки — через несколько не-
дель. В недавнем исследовании 100 последовательно
поступивших в стационар пациентов с острым ИМ
с подъемом сегмента ST (исключая пациентов с кар-
диогенным шоком) тромб в ЛЖ после стентирова-
ния ЛПНА был обнаружен через 2–12 час после по-
явления симптомов при ТТЭхоКГ у 13 пациентов и
при МРТ сердца — у 2 пациентов (при ТТЭхоКГ не
визуализировался).
Всем пациентам выполняли ЭхоКГ после ИМ в
течение первых 3 сут, через 4,5 ± 1,1 сут и через
3 мес [59]. Все пациенты получали аспирин в дозе
75 мг/сут и клопидогрел в дозе 75 мг/сут, 50% паци-
ентов — ингибитор гликопротеина IIb/IIIa. 20% па-
циентов провели перед стентированием тромболи-
зис. Из 15 пациентов (15%) с тромбами в ЛЖ 10 ди-
агноз был поставлен в течение 1-й нед, 4 — между
1-йи4-йнед,1 —между4-йи12-йнед.
Большое ретроспективное исследование 1059 па-
циентов, перенесших острый ИМ (без ограничения
острого переднего ИМ), которым выполняли пер-
вичное стентирование и проводили перед выпиской
эхокардиографическую оценку тромба в ЛЖ (при
необходимости с введением контрастного средства)
показало, что тромб в ЛЖ был выявлен у 4% паци-
ентов, акинезия в области верхушки была у всех па-
циентов, а ФВЛЖ была значительно ниже, чем в
группе пациентов без тромба в ЛЖ [60]. Если тромб
в ЛЖ не визуализируется у пациента с высоким ри-
ском развития тромбоза, следует провести кон-
трастную ЭхоКГ или МРТ сердца с гадолинием [61].
Муральный тромб при ЭхоКГ выглядит как до-
полнительная масса, отличающаяся от эндокарда и
выступающая в полость ЛЖ (рис. 12 .13). В идеаль-
ных условиях поверхность тромба можно четко от-
личить от подлежащего эндокарда. Тромб можно
визуализировать в двух плоскостях. Характеристи-
ки ткани острого тромба обычно аналогичны тако-
вым миокарда. Хронический тромб может иметь
усиленную эхогенность, слоистость и участки каль-
цификации. Тромб может быть фиксированным
(прикрепляться к стенке широким основанием) или
иметь ножку (узкий участок прикрепления к стен-
ке). Иногда тромб имеет кистозный вид с относи-
тельной эхонегативной зоной в центре. Ложнопо-
ложительная диагностика при ЭхоКГ обычно обу-
словлена ложными хордами в области верхушки
ЛЖ, утолщенными трабекулами, связанными с ги-
пертрофией ЛЖ, или артефактами в ближнем поле
(обычно появляются при использовании низкоча-
ЛЖ
ЛП
ЛЖ
ЛП
ЛП
ЛЖ
А
Б
В
Рис. 12 .12 Истинная аневризма левого желудочка. (A, Б) ТТЭхоКГ, апикальная четырехкамерная позиция. Видна большая аневризма в апикальном отделе
левого желудочка (ЛЖ) в конце систолы (A) и в конце диастолы (Б). (В) ТТЭхоКГ, парастернальная позиция по длинной оси левого желудочка. Видна большая
аневризма базального отдела нижней стенки (стрелка). Обратите внимание на широкий «вход» в аневризму, что с большей вероятностью свидетельствует об ис-
тинной аневризме левого желудочка, а не псевдоаневризме. ЛП — левое предсердие.
ch12.indd 260
03.04.2019 11:52:59
261
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
стотных датчиков). Помочь отличить истинный
тромб могут высокочастотные датчики с коротким
фокусным расстоянием. Контрастное средство, вве-
денное в левые отделы сердца, способно очертить
контуры тромба, создавая дефект наполнения, и тем
самым повысить вероятность обнаружения тромба
(рис. 12 .14).
Частым тяжелым осложнением мурального тром-
ба является системная эмболия, особенно инсульт.
Самая высокая вероятность эмболии существует в
первые 2 нед после острого ИМ, в последующие
6 нед риск снижается, поскольку происходит эндо-
телизация тромба и, соответственно, уменьшается
его эмболический потенциал. При множественном
анализе характеристик тромба его подвижность тес-
нее всего связана с эмболическими событиями (по-
ложительная прогностическая значимость 85%), а
при сочетании подвижности тромба с его выпячи-
ванием в полость ЛЖ частота системной эмболии
доходила до 40%. У каждого пациента, получающе-
го антикоагулянтную терапию, морфология тромба
может измениться [62], т.е. необходимо наблюдать
пациентов с тромбами в ЛЖ в динамике с помощью
ЭхоКГ.
СТРАТИФИКАЦИЯ РИСКА ПОСЛЕ
ОСТРОГО ИНФАРКТА МИОКАРДА
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
ФВЛЖ является важным эхокардиографическим
критерием глобальной систолической функции ЛЖ
и предиктором клинического исхода острого ИМ
(табл. 12 .7). Однако ФВЛЖ может быть нормальной
при обширном повреждении миокарда (например,
при нижнем ИМ) за счет локальной гиперкинезии
неповрежденных сегментов [63]. Кроме того, ФВЛЖ
зависит от нагрузки и не отражает истинную сокра-
тимость миокарда ЛЖ. Было показано, что опреде-
ления других показателей систолической функции
ЛЖ позволяют лучше спрогнозировать клиниче-
ский исход после ИМ. В раннем исследовании 605
пациентов с острым ИМ White и соавт. [64] устано-
вили, что конечно-систолический объем ЛЖ пре-
восходит по точности прогноза выживаемости
ФВЛЖ у пациентов со значением этого показателя
ФВЛЖ < 50%. Глобальная продольная деформация
миокарда ЛЖ хорошо коррелирует с размером ИМ
и, как было показано, имеет более высокую диагно-
стическую ценность, чем ФВЛЖ, при оценке разме-
ра ИМ с помощью однофотонной эмиссионной
компьютерной томографии (ОФЭКТ) [65].
БАЛЛЬНАЯ ОЦЕНКА ЛОКАЛЬНОЙ
СОКРАТИМОСТИ МИОКАРДА
Полуколичественная оценка локальной систоличе-
ской функции с использованием индекса локальной
сократимости миокарда представляет собой альтер-
А
Б
В
Рис. 12 .13 Тромб в левом желудочке. (A) Острый тромбоз в области вер-
хушки левого желудочка. Обратите внимание на гомогенную структуру тромба
(стрелка) без признаков кальцификации. (Б) Тромб (стрелка), выступающий в
просвет полости левого желудочка, ассоциируется с повышенным риском си-
стемной эмболии. (В) Иногда тромб (стрелка) в левом желудочке имеет кистоз-
ный вид.
ch12.indd 261
03.04.2019 11:53:00
262
ЧАСТЬ III Ишемическая болезнь сердца
Эхокардиографический параметр
Комментарий
Фракция выброса ЛЖ
Сильный предиктор клинического исхода острого ИМ. Однако ФВЛЖ может быть
нормальной при обширном пора жении миокарда благодаря компенсаторной
локальной гиперкинезии неповрежденных сегментов
Конечно-систолический объем ЛЖ
Более достоверный прогностический показатель выживаемости, чем ФВЛЖ,
у пациентов с ФВЛЖ < 50%
Глобальная продольная деформация ЛЖ Хорошо коррелирует с размером ИМ, поэтому имеет более высокую диагностиче-
скую ценность, чем ФВЛЖ, для определения размера ИМ
Индекс локальной сократимости
миокарда ЛЖ
Высокий индекс локальной сократимости миокарда при остром ИМ коррелирует
с более высокой частотой внутрибольничных осложнений, включая злокачествен-
ную аритмию, недостаточность насосной функции, разрыв миокарда и летальный
исход
Диастолическая функция ЛЖ
Параметры диастолической функции ЛЖ являются сильными и независимыми
предикторами клинического исхода после ИМ (см. табл. 12.8)
Индекс объема ЛП
Индекс объема ЛП является независимым предиктором летального исхода
после ИМ
Митральная регургитация
Степень ишемической митральной регургитации при остром ИМ имеет
выраженную обратно пропорциональную связь с выживаемостью
Резерв коронарного кровотока
Неинвазивная оценка резерва коронарного кровотока, особенно ЛПНА, обеспечи-
вает прогностической информацией на ранней стадии после острого ИМ
Стресс-ЭхоКГ
Стресс-ЭхоКГ с физической нагрузкой позволяет выявлять индуцируемую ишемию
миокарда. Стресс-ЭхоКГ с добутамином проводят для выявления индуцируемой
ишемии и оценки жизнеспособности миокарда
Контрастная ЭхоКГ миокарда
Точная оценка реперфузии на микрососудистом уровне для выявления дисфункции
ЛЖ, оценка восстановления функции ЛЖ после острого ИМ
Механическая дисперсия
Предиктор желудочковой аритмии, не зависящий от ФВЛЖ
Скручивание ЛЖ
Пик субэпикардиального скручивания отражает трансмуральное поражение
при инфаркте и не зависит от ремоделирования ЛЖ после ИМ
ИМ — инфаркт миокарда; ЛЖ — левый желудочек; ЛП — левое предсердие; ЛПНА — левая передняя нисходящая артерия; ФВЛЖ —
фракция выброса левого желудочка; ЭхоКГ — эхокардиография.
ТАБЛИЦА 12.7 Стратификация риска после острого инфаркта миокарда
ЛЖ
А
Б
Рис. 12 .14 Тромб в левом желудочке при контрастной эхокардиографии. (A) Апикальная четырехкамерная позиция. Видно неспецифическое усиление
эхосигналов в апикальной части межжелудочковой перегородки (стрелка). (Б) При использовании контрастного средства четче определяется тромб (стрелка) в
виде дефекта наполнения. ЛЖ — левый желудочек.
нативу ФВЛЖ при исследовании систолической
функции ЛЖ [66]. Каждому хорошо визуализируе-
мому сегменту миокарда присваивали балл по шка-
ле от 1 до 5 (см. табл. 12 .2) (для оценки сократимо-
сти сегмента необходимо оценить бо
́
льшую часть
его эндокарда и исследовать утолщение стенки и
движение эндокарда). Для оценки общей сократи-
мости миокарда балл каждого сегмента суммирова-
ли и общую сумму делили на количество обследо-
ванных сегментов. В нескольких исследованиях бы-
ch12.indd 262
03.04.2019 11:53:00
263
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
ло показано, что более высокий индекс локальной
сократимости миокарда в первые 12–24 час после
поступления в клинику ассоциируется с большей
частотой внутрибольничных осложнений, включая
злокачественную аритмию, недостаточность насо-
сной функции сердца, разрыв миокарда и леталь-
ный исход [67, 68].
Нарушения сократимости миокарда вне зоны
инфаркта могут наблюдаться в раннем периоде ИМ
или появляться в постинфарктном периоде при
развитии стенокардии, служа маркером вновь воз-
никшей ишемии. Эхокардиографические признаки
асинергии в непораженной зоне в момент клиниче-
ских проявлений или после них являются четким
показателем многососудистого поражения. Наруше-
ние сократимости миокарда в двух (или даже трех)
бассейнах коронарных артерий может быть резуль-
татом: (1) предшествующего инфаркта; (2) повы-
шенной потребности в кислороде миокарда непора-
женного сегмента вследствие увеличенного напря-
жения стенки желудочка при недостаточном его
кровоснабжении; (3) прекращения коллатерального
кровоснабжения в результате окклюзии еще одной
коронарной артерии.
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
В раннюю фазу острого ИМ диагностическую ин-
формацию для оценки диастолической функции ЛЖ
позволяет получить допплерография (табл. 12 .8)
[69–75]. Отношение скорости митрального крово-
тока в раннюю диастолу (E) к скорости митрально-
го кровотока в позднюю диастолу (A) и укорочение
времени замедления раннего митрального кровото-
ка — одни из самых ранних показателей диастоли-
ческой функции ЛЖ и сильные предикторы клини-
ческого исхода. Это было подтверждено в современ-
ных исследованиях [76].
В исследовании 125 последовательно поступив-
ших в клинику пациентов с острым ИМ Moller и
соавт. [73] установили, что псевдонормальный или
рестриктивный тип наполнения был связан с про-
грессирующим расширением ЛЖ и выступал пре-
диктором смерти от сердечно-сосудистых заболева-
ний. В частности, выживаемость в течение 1 года па-
циентов с нормальным митральным кровотоком
составляла 100%, при замедленном расслаблении —
89%, при псевдонормальном митральном кровото-
ке — 50%, при рестриктивном — 35%.
Самым большим из опубликованных на сегод-
няшний день исследований проведения допплеро-
графии при остром ИМ является MeRGE (Meta-
Analysis Research Group in Echocardiography) [70].
Это исследование показало, что рестриктивный тип
наполнения наблюдается примерно у 20% пациен-
тов с острым ИМ и ассоциируется с почти трехкрат-
ным увеличением смертности. Такой митральный
кровоток не зависит от возраста пациента, размеров
ЛЖ, ФВЛЖ и класса по Killip. При исследовании 250
пациентов с острым ИМ отношение E/e′ > 15 про-
гнозировало увеличение общей смертности лучше,
чем ФВЛЖ, возраст и рестриктивный тип наполнения
[74]. Аналогичные результаты были получены при
исследовании 301 пациента, которым была выполне-
на ЭхоКГ через 2 нед после первичного ИМ с подъ-
емом сегмента ST [77]. Ценность серийных ЭхоКГ
после ИМ подтверждается тем фактом, что пациен-
ты с персистирующей аномалией или ухудшением
наполнения ЛЖ по сравнению с пациентами с улуч-
шенным или нормальным наполнением имели по-
вышенный риск смерти от сердечно-сосудистого за-
болевания и повторной госпитализации из-за сер-
дечной недостаточности [75]. Было показано, что
наряду с предоставлением прогностической инфор-
мации отношение E/e′, определяемое через 1 мес по-
сле острого ИМ с подъемом сегмента ST, является
лучшим эхокардиографическим предиктором ухуд-
шения функции ЛЖ [78].
ОБЪЕМ ЛЕВОГО ПРЕДСЕРДИЯ
В отличие от допплерографических показателей ди-
астолической функции ЛЖ, объем ЛП является бо-
лее стабильным параметром, объединяющим эф-
фекты повышенного давления наполнения сердца
вследствие предсуществующего состояния сердеч-
но-сосудистой системы и острой патологии. Beinart
и соавт. [79] показали, что индекс объема ЛП, рас-
считанный в первые 48 час после острого ИМ, явля-
ется независимым и более сильным предиктором
летального исхода в течение 5 лет, чем объем ЛЖ и
степень митральной регургитации. Moller и соавт.
[80] также показали, что индекс объема ЛП — силь-
ный предиктор летального исхода и независимый
прогностический показатель после клинических
проявлений, систолической функции ЛЖ и доппле-
рографических показателей диастолической функ-
ции. Кроме того, максимальная систолическая де-
формация ЛП при остром ИМ коррелирует с уров-
нем мозгового натрийуретического пептида и
уменьшается с ухудшением систолической и диа-
столической функций ЛЖ [81].
РЕМОДЕЛИРОВАНИЕ ЛЕВОГО ЖЕЛУДОЧКА
После трансмурального ИМ происходят изменения
структуры и функции ЛЖ, которые обычно назы-
вают ремоделированием ЛЖ [82]. В раннюю фазу ре-
моделирования изменения ограничены зоной ин-
фаркта, а во время поздней фазы происходят из-
менения всего миокарда. Этот процесс может
продолжаться в течение многих месяцев. К основ-
ным факторам, определяющим величину и продол-
жительность ремоделирования ЛЖ, относятся раз-
мер и локализация инфаркта, проходимость ин-
фаркт-связанной артерии и период времени до
восстановления в ней кровотока, нейрогормональ-
ная активация и способность внеклеточного ма-
ch12.indd 263
03.04.2019 11:53:00
264
ЧАСТЬ III Ишемическая болезнь сердца
трикса к формированию стабильного зрелого кол-
лагенового рубца. Главное клиническое значение
ремоделирования заключается в расширении желу-
дочка со снижением сократимости миокарда, что
приводит к повышению частоты сердечной недо-
статочности, аритмии и летального исхода. Кроме
этого, ремоделирование может привести к митраль-
ной регургитации в результате апикального или бо-
кового смещения папиллярных мышц, что связано
с увеличением риска сердечной недостаточности и
смертности. ЭхоКГ играет важную роль в прогнози-
ровании ремоделирования ЛЖ и восстановлении
его функции.
При чрескожном коронарном вмешательстве
удается, как правило, восстановить проходимость
инфаркт-связанной артерии, но перфузия миокар-
да может отсутствовать, что связано с неблагопри-
ятным исходом. Во многих исследованиях было
продемонстрировано, что введение контрастного
средства позволяет точно оценить реперфузию мио-
карда на микрососудистом уровне и спрогнозиро-
вать функцию ЛЖ после ИМ [83] и восстановление
функции после острого ИМ [84].
Скручивание ЛЖ — точный показатель систоли-
ческой функции ЛЖ. Было показано, что макси-
мальное субэпикардиальное скручивание четко от-
ражает трансмуральное поражение миокарда при
инфаркте и независимо связано с ремоделировани-
ем ЛЖ после ИМ [85]. Деформация ЛЖ и скорость
деформации после острого ИМ, оцененные количе-
ственно с помощью тканевой допплерографии или
спекл-трекинг ЭхоКГ, отражают объем нежизнеспо-
собного миокарда и помогают отличить трансму-
ральный ИМ от нетрансмурального [86]. Существу-
Исследование/первый
автор, год
Количество
пациентов
Комментарий
MeRGE, 2008 [70]
3396
Рестриктивный тип наполнения — независимый предиктор летального исхода
после острого ИМ независимо от ФВЛЖ, индекса конечно-систолического
объема ЛЖ и класса по Killip
Kruszewski, 2010 [69]
400
Отношение максимальной скорости митрального кровотока в раннюю диастолу
(E) к скорости смещения фиброзного кольца митрального клапана в раннюю
диастолу (e′) > 15, измеренных в 1-е сут острого ИМ, ассоциируется с повыше-
нием риска неблагоприятных событий в течение 1 года после ИМ и среднесроч-
ной смертности
Whalley, 2006 [72]
3855
Смертность среди пациентов с острым ИМ и рестриктивным типом наполнения
в 4 раза выше, чем среди пациентов с нерестриктивным типом наполнения
Moller, 2003 [71]
110
Пациенты с персистирующей патологией или ухудшением наполнения ЛЖ,
по сравнению с пациентами с улучшенным или нормальным наполнением ЛЖ,
имеют повышенный риск смерти от сердечно-сосудистого заболевания
и повторной госпитализации из-за сердечной недостаточности
Moller, 2000 [73]
125
Рестриктивный тип наполнения и псевдонормальный митральный кровоток
являются независимыми предикторами летального исхода
Hillis, 2004 [74]
250
Отношение максимальной скорости митрального кровотока в раннюю диастолу
(E) к скорости смещения фиброзного кольца митрального клапана в раннюю
диастолу (e′) > 15 — самый сильный независимый предиктор выживаемости
Moller, 2001 [75]
67
Отношение максимальной скорости митрального кровотока в раннюю диастолу
(E) к скорости распространения потока в ЛЖ ≥ 1,5, измеренных с помощью
цветовой допплерографии в М-режиме, является значимым предиктором
смерти от сердечно-сосудистого заболевания и повторной госпитализации
из-за сердечной недостаточности
Fontes-Carvalho, 2015 [78] 225
Отношение E/e′ — лучший эхокардиографический предиктор снижения функции
через 1 мес после острого ИМ
Dokainish, 2014 [76]
528
Рестриктивный тип наполнения является сильным и независимым предиктором
тяжелых неблагоприятных сердечно-сосудистых событий после ИМ с подъемом
сегмента ST и широкой вариабельностью показателей ФВЛЖ
Iwahashi, 2012 [77]
301
Отношение максимальной скорости митрального кровотока в раннюю диастолу
(E) к скорости смещения фиброзного кольца митрального клапана в раннюю
диастолу (e′), т.е. отношение E/e′, > 15, измеренных через 2 нед после ИМ с
подъемом сегмента ST, является самым сильным предиктором сердечной
смерти и повторной госпитализации из-за сердечной недостаточности
ИМ — инфаркт миокарда; ЛЖ — левый желудочек; ФВЛЖ — фракция выброса левого желудочка.
ТАБЛИЦА 12.8 Роль параметров диастолической функции в прогнозировании клинического исхода
после инфаркта миокарда
ch12.indd 264
03.04.2019 11:53:00
265
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
ет тесная корреляция между глобальной и локаль-
ной продольной деформацией и степенью снижения
микроциркуляции после ИМ. Для оценки резерва
коронарного кровотока после недавнего ИМ лучше
определять глобальную и локальную продольную
деформацию, чем проводить обычные эхокардио-
графические измерения [87]. Показатели деформа-
ции ЛЖ являются независимыми предикторами
сердечной недостаточности или летального исхода
и могут предоставить дополнительную прогности-
ческую информацию во время наблюдения паци-
ента после острого ИМ [88]. Было показано, что
именно циркулярная деформация, а не продольная,
является предиктором последующего позднего ре-
моделирования, т.к . сохранная функция циркуляр-
ных волокон может стать ограничением увеличения
желудочка после ИМ [89].
Исследования с использованием цветовой ткане-
вой допплерографии и анализ с помощью спекл-
трекинг ЭхоКГ радиальной деформации для оценки
диссинхронии ЛЖ после острого ИМ показали, что
наличие диссинхронии ЛЖ в исходном состоянии
достоверно коррелировало со степенью дилатации
ЛЖ через 6 мес наблюдения [90]. Диссинхрония ЛЖ
также была независимо связана с развитием желу-
дочковой тахикардии после ИМ [91]. В настоящее
время ФВЛЖ < 35% является показанием к имплан-
тации кардиального дефибриллятора в качестве пер-
вичной профилактики внезапной смерти.
В исследовании деформации ЛЖ у 569 пациен-
тов через 40 сут после острого ИМ (с подъемом или
без подъема сегмента ST) было обнаружено рассеи-
вание механической энергии, связанное с неодно-
родностью сокращения желудочков. Рассеивание
механической энергии является предиктором желу-
дочковой аритмии независимо от ФВЛЖ [92]. Ис-
следователи предположили, что измерение механи-
ческого напряжения и глобальной продольной де-
формации может улучшить отбор пациентов после
ИМ для имплантации кардиального дефибриллято-
ра, особенно у пациентов с ФВЛЖ > 35%, которые
не соответствуют текущим показаниям к импланта-
ции кардиального дефибриллятора [92].
СТРЕСС-ЭХОКАРДИОГРАФИЯ
Стресс-ЭхоКГ играет важную роль в оценке жизне-
способности миокарда и индуцируемой ишемии в
постинфарктном периоде. Для выявления остаточ-
ной ишемии можно использовать стресс-ЭхоКГ на
фоне инфузии высокой дозы добутамина или стресс-
ЭхоКГ с физической нагрузкой. Стресс-ЭхоКГ с до-
бутамином имеет более высокую прогностическую
значимость по сравнению со стресс-ЭхоКГ с физи-
ческой нагрузкой. Нормальная стресс-ЭхоКГ предо-
ставляет полезную прогностическую информацию
у пациентов после ИМ с сохранной ФВ, при этом
выживаемость в течение 5 лет, по данным литера-
туры, составляет 94%. Есть сообщения о 95% выжи-
ваемости в течение 1 года после острого ИМ паци-
ентов с отрицательным результатом стресс-ЭхоКГ
по сравнению с 85% и 75% выживаемостью пациен-
тов с ишемией при стресс-ЭхоКГ с высокой и низ-
кой дозами добутамина соответственно.
Низкая доза добутамина при стресс-ЭхоКГ гемо-
динамику существенно не изменяет, но может улуч-
шить функцию жизнеспособного миокарда. Улуч-
шение сократимости миокарда на фоне низкой до-
зы добутамина (сократительный резерв) указывает
на наличие жизнеспособного, но оглушенного ми-
окарда, функция которого в дальнейшем самостоя-
тельно восстанавливается, что ассоциируется с бла-
гоприятным исходом.
Высокую дозу добутамина при стресс-ЭхоКГ мож-
но использовать для выявления остаточной ишемии.
Следует проявлять осторожность в течение 1-й нед
после трансмурального ИМ, поскольку есть сооб-
щения о случаях разрыва миокарда во время инфу-
зии высокой дозы добутамина. Врач должен внима-
тельно контролировать проведение стресс-теста по-
сле острого коронарного синдрома при значительном
ухудшении функции желудочка и тяжелом заболе-
вании коронарных артерий, которые не были рева-
скуляризированы, т.к. высок риск развития аритмии.
РЕЗЕРВ КОРОНАРНОГО КРОВОТОКА
Резерв коронарного кровотока — это соотношение
между диастолической скоростью кровотока при
гиперемии (после внутривенного введения адено-
зина) и диастолической скоростью кровотока в по-
кое. Неинвазивная оценка резерва коронарного кро-
вотока, особенно в ЛПНА, обеспечивает прогности-
ческой информацией о пациентах со стабильной ИБС
и о пациентах в раннем периоде острого ИМ [93]. В
исследовании 329 пациентов с установленной или
предполагаемой ИБС и отрицательным результа-
том стресс-ЭхоКГ резерв коронарного кровотока
1,92 и ниже являлся лучшим предиктором сердеч-
но-сосудистых событий в будущем (чувствитель-
ность 77%, специфичность 85%). Оптимальное по-
роговое значение резерва коронарного кровотока
для прогнозирования жизнеспособности миокарда
составляло 1,5 через 24 час после коронарного стен-
тирования по поводу переднего ИМ с чувствитель-
ностью 94% и специфичностью 91% [94].
В другом исследовании 15 пациентов с первич-
ным острым передним ИМ после лечения с помо-
щью чрескожного коронарного вмешательства вре-
мя замедления скорости диастолического кровотока
в ЛПНА < 190 мсек всегда свидетельствовало о не-
жизнеспособном миокарде [95].
МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Митральная регургитация — распространенная па-
тология среди пациентов с острым ИМ. Частота ми-
ch12.indd 265
03.04.2019 11:53:00
266
ЧАСТЬ III Ишемическая болезнь сердца
тральной регургитации при наличии сердечной не-
достаточности увеличивается в 2 раза. Митральная
регургитация при остром ИМ, возможно, уже воз-
никла до него в результате структурной патологии
створки клапана (например, ее пролапса). Такую
митральную регургитацию следует отличать от ре-
гургитации, возникшей в результате ишемии при
ИМ, например после отрыва папиллярной мышцы
(см. ранее) .
Ишемическая митральная регургитация — это
клапанная недостаточность, обусловленная ишеми-
ей или ИМ в отсутствие первичной патологии
створки или сухожильных хорд. Степень митраль-
ной регургитации варьирует от легкой до тяжелой
[96]. Дисфункция папиллярной мышцы возникает
в результате рубцовых изменений в ней и прилежа-
щем участке миокарда, что приводит к провисанию
передней или задней створки, нарушению коаптации
створок и митральной регургитации. К нарушению
смыкания створок митрального клапана и появле-
нию митральной регургитации также может приве-
сти ремоделирование ЛЖ после трансмурального
ИМ. При ремоделировании происходит смещение
стенки ЛЖ в сторону верхушки или задней стенки,
поддерживающей папиллярную мышцу, и смеще-
ние самой папиллярной мышцы.
Кроме того, к развитию митральной регургита-
ции приводит дилатация фиброзного кольца ми-
трального клапана. Важно понимать, что в зависи-
мости от локализации инфаркта и степени ремоде-
лирования одна из створок митрального клапана
(чаще задняя) может вовлекаться в процесс в боль-
шей степени, чем другая, поэтому струя регургита-
ции становится эксцентрической, что часто является
причиной недооценки степени митральной регурги-
тации. Наличие ишемической митральной регурги-
тации при остром ИМ, даже умеренно выраженной,
ассоциируется с неблагоприятным исходом, при
этом снижение выживаемости напрямую зависит от
степени митральной регургитации [97, 98].
Пациентам с тяжелой ишемической митральной
регургитацией, которым необходима хирургическая
реваскуляризация миокарда, обычно также выпол-
няют коррекцию митрального клапана. Вопрос о
лечении умеренной ишемической митральной ре-
гургитации остается спорным [99, 100].
Эхокардиографические данные
Позиции и необходимые измерения
Диагностика инфаркта миокарда
Локализация ишемии/
инфаркта миокарда
Нарушение локальной сократимости миокарда
ЛЖ (гипокинезия или акинезия) отражает
зону кровоснабжения коронарной артерии
Необходимо исследование во всех позициях
Избегайте укорочения длины ЛЖ при визуализа-
ции в апикальной позиции
Инфаркт ПЖ
Дилатация, гипокинезия или акинезия ПЖ
Глобальная или локальная гипокинезия
или акинезия
Может присутствовать тяжелая трикуспидаль-
ная регургитация
Стандартные позиции
Следует измерить систолическое смещение
фиброзного кольца трикуспидального клапана
и скорость s′ при тканевой допплерографии
Фракция изменения площади, деформация
Осложнения инфаркта миокарда
Перикардиальная
жидкость
Как правило, небольшой объем
При большом объеме и/или геморрагической
перикардиальной жидкости следует предпо-
ложить разрыв миокарда или расслоение
аорты
Стандартные позиции
Субкостальная позиция для оценки нижней полой
вены
Ишемическая митраль-
ная регургитация
Подтягивание задней створки митрального
клапана. Апикальное натяжение створок
митрального клапана при дилатации ЛЖ
и/или нарушении его систолической
функции
Отрыв папиллярной мышцы с флотирующим
фрагментом папиллярной мышцы, прикреп-
ленным к молотящей створке
Митральная регургитация может быть
тяжелой во время эпизода ишемии
Стандартные позиции ТТЭхоКГ, включая
3D-режим для оценки анатомии митрального
клапана
Количественная оценка степени митральной
регургитации с помощью ТТЭхоКГ
Для определения причин митральной регургита-
ции можно провести ЧПЭхоКГ, включая
3D-режим
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиография в отделении неотложной кардиологии
ch12.indd 266
03.04.2019 11:53:00
267
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
Эхокардиографические данные
Позиции и необходимые измерения
Разрыв межжелудочко-
вой перегородки
Разрыв межжелудочковой перегородки
в области акинезии
Разрыв нижней части межжелудочковой пере-
городки, как правило, сопровождается дила-
тацией ПЖ и нарушением его функции
При необходимости используйте модифициро-
ванные позиции, т.к . небольшой разрыв межже-
лудочковой перегородки визуализировать
трудно
ЦДК кровотока для определения локализации
разрыва межжелудочковой перегородки
ЦДК кровотока и непрерывно-волновая доппле-
рография для выявления сброса крови слева
направо
Разрыв свободной стенки
и тампонада сердца
Разрыв обычно ассоциируется с большим
количеством геморрагической перикардиаль-
ной жидкости, тромбом в полости перикарда
и тампонадой сердца. Разрыв фатален, если
спонтанно не закрылся фибринозными пери-
кардиальными спайками
Место разрыва не всегда удается визуализировать
в 2D-режиме или 3D-режиме
ЦДК кровотока для обнаружения сообщения
между ЛЖ и перикардом
Псевдоаневризма ЛЖ
Резкий переход от нормального миокарда к
патологическому. Узкое соустье (отношение
диаметра соустья к размеру аневризмы < 0,5)
Локализуется чаще всего у основания
нижней или медиально-боковой стенки ЛЖ
Может быть покрыта тромбом
Часто ассоциируется с перикардиальной
жидкостью
Для уточнения диагноза проводят ЧПЭхоКГ
Аневризма ЛЖ
Яркий, истонченный сегмент ЛЖ с дискине-
зией и патологическим контуром во время
диастолы
Наиболее распространенная локализация —
апикальные и базальные сегменты нижней
стенки ЛЖ, аневризма боковой стенки встре-
чается редко
Могут присутствовать тромбы, особенно
в области верхушки ЛЖ
ТТЭхоКГ в апикальной позиции для визуализа-
ции аневризмы в области верхушки ЛЖ
Избегайте укорочения длины ЛЖ при визуализа-
ции в апикальной позиции
Парастернальная позиция по короткой оси
для визуализации от основания до верхушки
ЛЖ
При ЧПЭхоКГ аневризму в области верхушки ЛЖ
можно не обнаружить
Тромбоз ЛЖ
Эхогенная масса, структура которой отлича-
ется от миокарда, часто выступает в просвет
полости ЛЖ
Прилежит к сегменту(ам) с акинезией, как
правило, в области верхушки ЛЖ
Может быть один или несколько тромбов
Необходимы высокочастотный датчик, режим
«Масштабирование», регулировка усиления
и других настроек ультразвуковой системы
Избегайте укорочения длины ЛЖ
при визуализации
Можно дополнительно провести контрастную
ЭхоКГ
Стратификация риска после инфаркта миокарда
Систолическая
дисфункция ЛЖ
Локализация и размер зоны с нарушением
локальной сократимости миокарда соответ-
ствует размеру инфаркта
Все показатели систолической функции ЛЖ
определяют клинический исход
Оценка ФВЛЖ, конечно-систолического объема,
глобальной продольной деформации и локаль-
ной сократимости миокарда
При возможности измерить объем ЛЖ и ФВЛЖ
в 3D-режиме
Диастолическая
дисфункция ЛЖ
Псевдонормальный митральный кровоток
и рестриктивный тип наполнения ассоции-
руются с неблагоприятным исходом
Импульсно-волновая допплерография для иссле-
дования митрального кровотока, кровотока
в легочных венах
Тканевая допплерография
Индекс объема ЛП
Независимый прогностический показатель
Измеряют при рутинных исследованиях
ЛЖ — левый желудочек; ПЖ — правый желудочек; ТТЭхоКГ — трансторакальная эхокардиография; ФВЛЖ — фракция выброса левого
желудочка; ЦДК — цветовое допплеровское картирование; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Эхокардиография в отделении неотложной кардиологии
ch12.indd 267
03.04.2019 11:53:01
268
ЧАСТЬ III Ишемическая болезнь сердца
ЛИТЕРАТУРА
1. Marwick TH. The future of echocardiogra-
phy, Eur J Echocardiogr 10:594–601, 2009.
2. Lepper W, Belcik T, Wei K, et al. Myocardial
contrast echocardiography, Circulation 109:
3132–3135, 2004.
3. Khumri TM, Nayar S, Idupulapati M, et al.
Usefulness of myocardial contrast echocar-
diography in predicting late mortality in pa-
tients with anterior acute myocardial infarc-
tion, Am J Cardiol 98:1150–1155, 2006.
4. Pellerin D, Sharma R, Elliott P, et al. Tissue
Doppler, strain, and strain rate echocardiog-
raphy for the assessment of left and right sys-
tolic ventricular function, Heart 89(Suppl
3):iii9–iii17, 2003.
5. Dahlsett T, Karlsen S, Grenne B, et al. Early
assessment of strain echocardiography can
accurately exclude significant coronary artery
stenosis in non-ST-segment elevation acute
coronary syndrome, J Am Soc Echocardiogr
27:51209, 2014.
6. Corsi C, Lang RM, Veronesi F, et al. Volumet-
ric quantification of global and regional left
ventricular function from real-time three-di-
mensional echocardiographic images, Circu-
lation 112:1161–1170, 2005.
7. Toledo E, Lang RM, Collins KA, et al. Imag-
ing and quantification of myocardial perfu-
sion using real-time three-dimensional echo-
cardiography, J Am Coll Cardiol 47:146–154,
2006.
8. Gianstefani S, Catibog N, Whittaker A, et al.
Pocket-size imaging device: effectiveness for
ward-based transthoracic studies, Eur Heart J
Cardiovasc Imaging 14:1132–1139, 2013.
9. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28(1):1–39.e14, 2015.
10. Prasad A, Lerman A, Rihal C. Apical balloon-
ing syndrome (Tako-Tsubo or stress cardio-
myopathy): a mimic of acute myocardial in-
farction, Am Heart J 155:408–417, 2008.
11. Siddiqui M, Desiderio M, Ricculli N, et al.
Stress related cardiomyopathy with midven-
tricular ballooning: a rare variant, Case Rep
Med 2015, 2015. 154678.
12. Mehta N, Aurigemma G, Rafeq Z, et al. Re-
verse takotsubo cardiomyopathy after an ep-
isode of serotonin syndrome, Tex Heart Inst J
38:568–572, 2011.
13. Eitel I, von Knobelsdorff-Brenkenhoff F,
Bernhardt P, et al. Clinical characteristics and
cardiovascular magnetic resonance findings
in stress (Takotsubo) cardiomyopathy, JAMA
306:277–286, 2011.
14. Daoko J, Rajachandran M, Savarese R, et al.
Biventricular takotsubo cardiomyopathy.
Case study and review of the literature, Tex
Heart Inst J 40:305–311, 2013.
15. Chandorkar A, Codolosa N, Lippmann M, et
al. Recurrent right ventricular takotsubo car-
diomyopathy in a patient with recurrent as-
piration, Echocardiography 31:E240–E242,
2014.
16. Citro R, Piscione F, Parodi G, et al. Role of
echocardiography in takotsubo cardiomyop-
athy, Heart Failure Clin 9:153–166, 2013.
17. Elesber A, Prasad A, Lennon R, et al. Four-
year recurrence rate and prognosis of the api-
cal ballooning syndrome, J Am Coll Cardiol
50:448–452, 2007.
18. Lang RM, Badano L, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
19. Holte E, Vegsundvag J, Hegbom K, et al.
Transthoracic Doppler echocardiography
for detection of stenosis in the left coro-
nary artery by use of poststenotic coronary
flow profiles: a comparison with quantita-
tive coronary angiography and coronary
flow reserve, J Am Soc Echocardiogr 26:77–
85, 2013.
20. Otsuka R, Watanabe H, Hirata K, et al. A nov-
el technique to detect total occlusion in the
right coronary artery using retrograde flow
by transthoracic Doppler echocardiography,
J Am Soc Echocardiogr 18:704–709, 2005.
21. Goldstein JA. Pathophysiology and manage-
ment of right heart ischemia, J Am Coll Car-
diol 40:841–853, 2002.
22. Tahirkheli NK, Edwards WD, Nishimura RA,
et al. Right ventricular infarction associated
with anteroseptal myocardial infarction: a
clinicopathologic study of nine cases, Cardio-
vasc Pathol 9:175–179, 2000.
23. Hamon M, Agostini D, Le Page O, et al. Prog-
nostic impact of right ventricular involve-
ment in patients with acute myocardial in-
farction: meta-analysis, Crit Care Med 36:
2023–2033, 2008.
24. Kozakova M, Palombo C, Distante A. Right
ventricular infarction: the role of echocardiog-
raphy, Echocardiography 18:701–707, 2001.
25. Ozdemir K, Altunkeser BB, Icli A, et al. New pa-
rameters in identification of right ventricular
myocardial infarction and proximal right coro-
nary artery lesion, Chest 124:219–226, 2003.
26. Park S, Park J, Lee H, et al. Impaired RV glob-
al longitudinal strain is associated with poor
long-term clinical outcomes in patients with
acute inferior STEMI, J Am Coll Cardiol Ima-
ging 8:161–169, 2015.
27. Cohen A, Logeart D, Costagliola D, et al. Use-
fulness of pulmonary regurgitation Doppler
tracings in predicting in-hospital and long-
term outcome in patients with inferior wall
acute myocardial infarction, Am J Cardiol
81:276–281, 1998.
28. Ketikoglou DG, Karvounis HI, Papadopoulos
CE, et al. Echocardiographic evaluation of
spontaneous recovery of right ventricular sys-
tolic and diastolic function in patients with
acute right ventricular infarction associated
with posterior wall left ventricular infarction,
Am J Cardiol 93:911–913, 2004.
29. Hoogslag G, Haeck M, Velders M, et al. Deter-
minants of right ventricular remodeling fol-
lowing ST-segment elevation myocardial in-
farction, Am J Cardiol 114:1490–1496, 2014.
30. Goldstein JA. Right versus left ventricular
shock: a tale of two ventricles, J Am Coll Car-
diol 41:1280–1282, 2003.
31. Kakouros N, Cokkinos D. Right ventricular
myocardial infarction: pathophysiology, di-
agnosis, and management, Postgrad Med J
86:719–728, 2010.
32. Moller JE, Hillis GS, Oh JK, et al. Prognostic
importance of secondary pulmonary hyper-
tension after acute myocardial infarction, Am
J Cardiol 96:199–203, 2005.
33. Doulaptsis C, Goetschalckx K, Masci P, et al.
Assessment of early post-infarction pericar-
dial injury by CMR, JACC Cardiovasc Imaging
6:411–413, 2013.
34. Guereta P, Khalifeb K, Jobicc Y, et al. Echo-
cardiographic assessment of the incidence of
mechanical complications during the early
phase of myocardial infarction in the reper-
fusion era: a French multicenter prospective
registry, Arch Cardiovasc Dis 101:41–47, 2008.
35. Nishimura RA, Schaff HV, Shub C, et al. Pap-
illary muscle rupture complicating acute
myocardial infarction: analysis of 17 patients,
Am J Cardiol 51:373–377, 1983.
36. Vargaras-Barron J, Molina-Carrion M, Rome-
ro-Cardenas A, et al. Risk factors, angio-
graphic patterns, and outcomes in patients
with acute ventricular septal rupture during
myocardial infarction, Am J Cardiol 95:1153–
1158, 2005.
37. Moreyra A, Huang M, Wilson A, et al. Trends
in incidence and mortality rates of ventricu-
lar septal rupture during acute myocardial in-
farction, Am J Cardiol 106:1095–1100, 2010.
38. Sivadasan Pillai H, Tharakan J, Titus T, et al.
Ventricular septal rupture following myocar-
dial infarction. Long-term survival of patients
who did not undergo surgery. Single-centre
experience, Acta Cardiol 60:403–407, 2005.
39. Arnaoutakis G, Zhao Y, George T, et al. Sur-
gical repair of ventricular septal defect after
myocardial infarction: outcomes from the so-
ciety of thoracic surgeons national database,
Ann Thorac Surg 94:436–444, 2012.
40. Pang P, Sin Y, Lim C, et al. Outcome and sur-
vival analysis of surgical repair of post-in-
farction ventricular septal rupture, J Cardio-
thorac Surg 8:44, 2013.
41. Crenshaw B, Granger C, Birnbaum Y, et al.
GUSTO-1 (Global Utilization of Streptoki-
nase and TPA for Occluded Coronary Arter-
ies0 Trial Investigators. Risk factors, angio-
graphic patterns, and outcomes in patients
with ventricular septal defect complicating
acute myocardial infarction, Circulation
101:27–32, 2000.
42. Papalexopoulou N, Young C, Attia R. What is
the best timing of surgery in patients with
post-infarct ventricular septal rupture? Inter-
act Cardiovasc Thorac Surg 16:193–197, 2013.
43. Mittal C, Aslam N, Mohan B, et al. Spontane-
ous closure of post-myocardial infarction
ventricular septal rupture, Tex Heart Inst J
38:596–597, 2011.
44. Baldasare M, Polyakov M, Laub G, et al. Per-
cutaneous repair of post-myocardial infarc-
tion ventricular septal defect: current ap-
proaches and future perspectives, Tex Heart
Inst J 41:613–619, 2014.
45. Maltais S, Ibrahim R, Basmadijan A, et al.
Postinfarction ventricular septal defects: to-
wards a new treatment algorithm? Ann Tho-
rac Surg 87:687–692, 2009.
46 Attia R, Blauth C: Which patients might be
suitable for a septal occluder device closure of
postinfarction ventricular septal rupture rath-
er than immediate surgery? Interact Cardio-
vasc Thorac Surg 11:626–629, 2010.
47. Capasso F, Caruso A, Valva G, et al. Device
closure of ‘complex’ postinfarction ventricu-
lar septal defect, J Cardiovasc Med 16(Suppl
1):S15–S17, 2015.
48. Calvert P, Cockburn J, Wynne D, et al. Per-
cutaneous closure of postinfarction ventricu-
lar septal defect. In-hospital outcomes and
long-term follow-up of UK experience, Cir-
culation 129:2395–2402, 2014.
49. Kronzon I, Ruize C, Perk G. Guidance of post
myocardial infarction ventricular septal de-
fect and pseudoaneurysm closure, Curr Car-
diol Rep 16:456, 2014.
ch12.indd 268
03.04.2019 11:53:01
269
12 Эхокардиография в отделении неотложной кардиологии при остром инфаркте миокарда
50. Haddadin S, Milano A, Faggian G, et al. Sur-
gical treatment of postinfarction left ventric-
ular free wall rupture, J Card Surg 24:624–
631, 2009.
51. Lopez-Sendon J, Gurfinkel E, Lopez de Sa E,
et al. Factors related to heart rupture in acute
coronary syndromes in the Global Registry of
Acute Coronary Events, Eur Heart J 31:1449–
1456, 2010.
52. Bueno H, Martinez-Selles M, Perez-David E,
et al. Effect of thrombolytic therapy on the
risk of cardiac rupture and mortality in older
patients with first acute myocardial infarc-
tion, Eur Heart J 26:1705–1711, 2005.
53. Purcaro A, Costantini C, Ciampani N, et al.
Diagnostic criteria and management of sub-
acute ventricular free wall rupture complicat-
ing acute myocardial infarction, Am J Cardiol
80:397–405, 1997.
54. Wilkenshoff UM, Ale Abaei A, Kuersten B, et
al. Contrast echocardiography for detection
of incomplete rupture of the left ventricle af-
ter acute myocardial infarction, Z Kardiol
93:624–629, 2004.
55. Figueras J, Cortadellas J, Evangelista A, et al.
Medical management of selected patients
with left ventricular free wall rupture during
acute myocardial infarction, J Am Coll Cardi-
ol 29:512–518, 1997.
56. Yeo TC, Malouf JF, Oh JK, et al. Clinical pro-
file and outcome in 52 patients with cardiac
pseudoaneurysm, Ann Intern Med 128:299–
305, 1998.
57. Tuan J, Kaivani F, Fewins H. Left ventricular
pseudoaneurysm, Eur J Echocardiogr 9:107–
109, 2008.
58. Tikiz H, Balbay Y, Atak R, et al. The effect of
thrombolytic therapy on left ventricular an-
eurysm formation in acute myocardial in-
farction: relationship to successful reperfu-
sion and vessel patency, Clin Cardiol 24:656–
662, 2001.
59. Solheim S, Seljeflot I, Lunde K, et al. Frequen-
cy of left ventricular thrombus in patients
with anterior wall acute myocardial infarc-
tion treated with percutaneous coronary in-
tervention and dual antiplatelet therapy, Am
J Cardiol 106:1197–1200, 2010.
60. Giansteffani S, Douiri A, Delithanasis I, et al.
Incidence and predictors of early left ventric-
ular thrombus after ST-elevation myocardial
infarction in the contemporary era of prima-
ry percutaneous coronary intervention, Am J
Cardiol 113:1111–1116, 2014.
61. Roifman I, Connelly K, Wright G, et al. Echo-
cardiography vs. cardiac magnetic resonance
imaging for the diagnosis of left ventricular
thrombus: a systematic review, Can J Cardiol
31:785–791, 2015.
62. Domenicucci S, Chiarella F, Bellotti P, et al.
Long-term prospective assessment of left
ventricular thrombus in anterior wall acute
myocardial infarction and implications for a
rational approach to embolic risk, Am J Car-
diol 839:519–524, 1999.
63. Mollema S, Nucifora G, Bax J. Prognostic val-
ue of echocardiography after acute myocar-
dial infarction, Heart 95:1732–1745, 2009.
64. White HD, Norris RM, Brown MA, et al. Left
ventricular end-systolic volume as the major
determinant of survival after recovery from
myocardial infarction, Circulation 76:44–51,
1987.
65. Wang Q, Huang D, Zhang L, et al. Assessment
of myocardial infarct size by three-dimen-
sional and two-dimensional speckle tracking
echocardiography: A comparative study to
single photon emission computed tomogra-
phy, Echocardiography 32:1539–1542, 2015.
66. Baron T, Flachskampf F, Johansson K, et al.
Usefulness of traditional echocardiographic
parameters in assessment of left ventricular
function in patients with normal ejection
fraction after acute myocardial infarction: re-
sults from a large consecutive cohort, Eur
Heart J Cardiovasc Imaging 17:413–420, 2016.
67. Carluccio E, Tommasi S, Bentivoglio M, et al.
Usefulness of the severity and extent of wall
motion abnormalities as prognostic markers
of an adverse outcome after a first myocar-
dial infarction treated with thrombolytic
therapy, Am J Cardiol 85:411–415, 2000.
68. Moller JE, Hillis GS, Oh JK, et al. Wall motion
score index and ejection fraction for risk
stratification after acute myocardial infarc-
tion, Am Heart J 151:419–425, 2006.
69. Kruszewski K, Scott A, Barclay J, et al. Non-
invasive assessment of left ventricular filling
pressure after acute myocardial infarction: a
prospective study of the relative prognostic
utility of clinical assessment, echocardiogra-
phy, and B-type natriuretic peptide, Am
Heart J 159:47–54, 2010.
70. Meta-Analysis Research Group in Echocar-
diography (MeRGE) AMI Collaborators. In-
dependent prognostic importance of a re-
strictive left ventricular filling pattern after
myocardial infarction, Circulation 117:2591–
2598, 2008.
71. Moller J, Poulsen S, Sondergaard E, et al. Im-
pact of early changes in left ventricular filling
pattern on long-term outcome after acute
myocardial infarction, Int J Cardiol 89:207–
215, 2003.
72. Whalley G, Gamble G, Doughty R. Restrictive
diastolic filling predicts death after acute
myocardial infarction: systematic review and
meta-analysis of prospective studies, Heart
92:1588–1594, 2006.
73. Moller JE, Sondergaard E, Poulsen SH.
Pseudonormal and restrictive filling patterns
predict left ventricular dilation and cardiac
death after a first myocardial infarction: a se-
rial color M-mode Doppler echocardiographic
study, J Am Coll Cardiol 36:1841–1846, 2000.
74. Hillis G, Moller J, Pellika P, et al. Noninvasive
estimation of left ventricular filling pressure
by E/e′ is a powerful predictor of survival af-
ter acute myocardial infarction, J Am Coll
Cardiol 43:360–367, 2004.
75. Moller JE, Sondergaard E, Poulsen SH. Color
M-mode and pulsed wave tissue Doppler
echocardiography: powerful predictors of
cardiac events after first myocardial infarc-
tion, J Am Soc Echocardiogr 14:757–763, 2001.
76. Dokainish H, Rajaram M, Prabhakaran D, et
al. Incremental value of left ventricular sys-
tolic and diastolic function to determine out-
come in patients with acute St-segment eleva-
tion myocardial infarction: The echocardio-
graphic substudy of the OASIS-6 trial,
Echocardiography 31:569–578, 2014.
77. Iwahashieptal N, Kimura K, Kosuge M, et al.
E/e′ two weeks after onset is a powerful pre-
dictor of cardiac death and heart failure in pa-
tients with a first-time ST elevation acute
myocardial infarction, J Am Soc Echocardiogr
25:1290–1298, 2012.
78. Fontes-Carvalho R, Sampaio F, Teixeira M, et
al. Left ventricular diastolic dysfunction and
E/E′ ratio as the strongest echocardiographic
predictors of reduced exercise capacity after
acute myocardial infarction, Clin Cardiol
38:222–229, 2015.
79. Beinart R, Bovko V, Schwamm E, et al. Long-
term prognostic significance of left atrial vol-
ume in acute myocardial infarction, J Am Coll
Cardiol 44:327–334, 2004.
80. Moller JE, Hillis GS, Oh JK, et al. Left atrial
volume: a powerful predictor of survival af-
ter acute myocardial infarction, Circulation
107:2207–2212, 2003.
81. Facchini E, Degiovanni A, Marino P. Left atri-
um function in patients with coronary artery
disease, Curr Opin Cardiol 29:423–429, 2014.
82. Giannuzzi P, Temporelli P, Bosimi E, et al.
Heterogeneity of left ventricular remodeling
after acute myocardial infarction: results of
the Gruppo Italiano per lo Studio della So-
pravvivenza nell’Infarto Miocardico-3 Echo
Substudy, Am Heart J 141:131–138, 2001.
83. Balcells E, Powers ER, Lepper W, et al. Detec-
tion of myocardial viability by contrast echo-
cardiography in acute infarction predicts re-
covery of resting function and contractile re-
serve, J Am Coll Cardiol 41:827–833, 2003.
84. Jeetley P, Swinburn J, Hickman M, et al. Myo-
cardial contrast echocardiography predicts
left ventricular remodelling after acute myo-
cardial infarction, J Am Soc Echocardiogr
17:1030–1036, 2004.
85. Abate E, Hoogslag G, Leong D, et al. Associa-
tion between multilayer left ventricular rota-
tional mechanics and the development of left
ventricular remodelling after acute myocar-
dial infarction, J Am Soc Echocardiogr 27:239–
248, 2014.
86. Vartdal T, Brunvand H, Pettersen E, et al. Ear-
ly prediction of infarct size by strain Doppler
echocardiography after coronary reperfu-
sion, J Am Coll Cardiol 49:1715–1721, 2007.
87. Logstrup B, Hofsten D, Christophersen T, et
al. Correlation between left ventricular global
and regional longitudinal systolic strain and
impaired microcirculation in patients with
acute myocardial infarction, Echocardiogra-
phy 29:1181–1190, 2012.
88. Ersboll M, Valeur N, Andersen M, et al. Early
echocardiographic deformation analysis for the
prediction of sudden cardiac death and life-
threatening arrhythmias after myocardial in-
farction, J Am Coll Cardiol Img 6:851–860, 2013.
89. Hung C, Verma A, Uno H, et al. Longitudinal
and circumferential strain rate, left ventricu-
lar remodeling, and prognosis after myocar-
dial infarction, J Am Coll Cardiol 56:1812–
1822, 2010.
90. Mollema S, Liem S, Suffoletto M, et al. Left
ventricular dyssynchrony immediately after
acute myocardial infarction predicts left ven-
tricular remodelling, J Am Coll Cardiol
50:1532–1540, 2007.
91. Leong D, Hoogslag G, Piers S, et al. The rela-
tionship between time from myocardial in-
farction, left ventricular dyssynchrony, and
the risk for ventricular arrhythmia: speckle-
tracking echocardiographic analysis, J Am Soc
Echocardiogr 28:470–477, 2015.
92. Haugaa K, Grenne B, Eek C, et al. Strain echo-
cardiography improves risk prediction of ven-
tricular arrhythmias after myocardial infarc-
tion, J Am Coll Cardiol Img 6:841–850, 2013.
93. Pizzuto F, Voci P, Mariano E, et al. Assess-
ment of flow velocity reserve by transthorac-
ic Doppler echocardiography and venous ad-
enosine infusion before and after left anteri-
or descending coronary artery stenting, J Am
Coll Cardiol 38:155–162, 2001.
94. Rigo F, Cortigiani L, Pasanisi E, et al. The ad-
ditional prognostic value of coronary flow re-
serve on left anterior descending artery in pa-
ch12.indd 269
03.04.2019 11:53:01
270
ЧАСТЬ III Ишемическая болезнь сердца
tients with negative stress echo by wall mo-
tion criteria. A Transthoracic Vasodilator
Stress Echocardiography Study, Am Heart
J 151: 124–130, 2006.
95. Saraste A, Koskenvuo J, Saraste M, et al. Coro-
nary artery flow velocity profile measured by
transthoracic Doppler echocardiography pre-
dicts myocardial viability after acute myocar-
dial infarction, Heart 93:456–457, 2007.
96. Marwick T, Lancellotti P, Pierard L. Isch-
aemic mitral regurgitation: mechanisms and
diagnosis, Heart 95:1711–1718, 2009.
97. Levine RA, Schwammenthal E. Ischemic mi-
tral regurgitation on the threshold of a solu-
tion: from paradoxes to unifying concepts,
Circulation 112:745–758, 2005.
98. Feinberg MS, Schwammenthal E, Shlizerman
L, et al. Prognostic significance of mild mitral
regurgitation by color Doppler echocardiog-
raphy in acute myocardial infarction, Am J
Cardiol 86:903–907, 2000.
99. Smith P, Puskas J, AScheim D, et al. Surgical
treatment of moderate ischemic mitral regur-
gitation, N Engl J Med 371:2178–2188, 2014.
100. Chan K, Punjabi P, Flather M, et al. Coronary
artery bypass surgery with or without mitral
valve annuloplasty in moderate functional
ischemic mitral regurgitation. Final results of
the randomized ischemic mitral regurgitation
(RIME) trial, Circulation 126:2502–2510,
2012.
ch12.indd 270
03.04.2019 11:53:01
271
Стресс-эхокардиография (стресс-ЭхоКГ) — это на-
грузочное исследование с помощью эхокардиогра-
фии (ЭхоКГ) и одновременной электрокардиогра-
фией (ЭКГ). Этот метод стал одним из стартовых
при выявлении пациентов с ишемической болез-
нью сердца (ИБС). Новаторское исследование Ten-
nant и Wiggers, проведенное в 1935 г. [1], показало,
что окклюзия коронарного русла снижает сократи-
мость миокарда. Результаты этого исследования ста-
ли теоретической основой стресс-тестов. В 1970-х гг.
эксперименты на собаках с окклюзией коронарных
артерий, проведенные несколькими учеными [2–4],
показали, что нарушения локальной сократимости
миокарда можно обнаружить с помощью ультра-
звуковой визуализации. Результаты этих экспери-
ментальных исследований привели к развитию кли-
нической стресс-ЭхоКГ. Первые стресс-ЭхоКГ для
выявления нарушений локальной сократимости
миокарда левого желудочка (ЛЖ) проводили с по-
мощью ЭхоКГ в М-режиме. Было обнаружено, что
нарушения сократимости возникали на раннем эта-
пе ишемического каскада, причем при ишемии на-
рушения локальной сократимости миокарда были
более чувствительны и специфичны, чем клиниче-
ские симптомы или изменения на ЭКГ. С появлени-
ем двухмерной ЭхоКГ (2D-ЭхоКГ) стресс-ЭхоКГ
стала более эффективной.
Впервые нарушения локальной сократимости,
вызванные ишемией, выявили в 1979 г. у пациента
во время горизонтальной велоэргометрии [5]. Раз-
витие цифровых технологий в 1980-х гг . позволило
сравнить сократимость миокарда ЛЖ в покое и во
время максимальной нагрузки или сразу после нее.
Появление цифровых изображений способствовало
развитию стресс-ЭхоКГ. Возможность непосредст-
венного сравнения сократимости сегментов мио-
карда ЛЖ до нагрузки, во время нее или сразу после
нее повысила чувствительность и специфичность
стресс-ЭхоКГ. В дальнейшем появление гармоник
визуализации улучшило разрешение изображения
и определение границы эндокарда ЛЖ, а соответ-
ственно, оценку нарушений локальной сократимо-
сти миокарда.
Применение при ЭхоКГ контрастных средств
также улучшает распознавание границ эндокарда и
оценку нарушений локальной сократимости мио-
карда, особенно в случае малоинформативной
ЭхоКГ. Стресс-ЭхоКГ — важный и безопасный диа-
гностический метод. Стресс-эхокардиография с
фармакологической нагрузкой подробно описана в
главе 14.
Стресс-ЭхоКГ с физической нагрузкой, добута-
мином и вазодилататорами в соответствующих до-
зах одинаково эффективны для индуцирования
13 Стресс-эхокардиография
при ишемии коронарных артерий
FLORIAN RADER, MD, MSC • ROBERT J. SIEGEL, MD
Физиологические
и патофизиологические принципы
Ишемический каскад
Детерминанты потребности миокарда
в кислороде и поступления кислорода
в миокард
Показания и противопоказания
к стресс-эхокардиографии
Показания
Противопоказания
Клинико-экономическая эффективность
Протоколы стресс-эхокардиографии
Общие рекомендации
Оборудование и персонал
Подготовка пациента
Стресс-тесты с физической нагрузкой
Протоколы стресс-тестов с физической
нагрузкой
Стресс-эхокардиография с физической
нагрузкой при лекарственной терапии
Оценка результатов
стресс-эхокардиографии
Результаты стресс-эхокардиографии
Точность стресс-эхокардиографии
с физической нагрузкой
Чувствительность, специфичность
и прогностическая значимость
Перспективы
Оценка деформации миокарда
Трехмерная эхокардиография
ch13.indd 271
03.04.2019 11:53:18
272
ЧАСТЬ III Ишемическая болезнь сердца
нарушение электролитного баланса в миоцитах.
Эти изменения в клетках выявить в клинике невоз-
можно. Следующий этап — развитие диастоличе-
ской дисфункции. Несмотря на то что в клиниче-
ской практике регулярную оценку не проводят, есть
достаточно доказательств того, что изменения диа-
столической функции во время стресс-ЭхоКГ име-
ют прогностическую значимость для выявления
ишемии миокарда [7]. В случае длительной ишемии
становится очевидной систолическая дисфункция.
Начало очаговой или глобальной гипокинезии, аки-
незии или дискинезии миокарда — основной эхо-
кардиографический признак стресс-индуцирован-
ной ишемии миокарда. Признаки ишемии миокар-
да на ЭКГ появляются после выявления нарушений
сократимости миокарда, иногда даже в период вос-
становления после прекращения физической на-
грузки [8].
Однако симптомная стенокардия — последний
и, вероятно, наименее надежный признак ишемии
миокарда из-за субъективности восприятия и из-
менчивости симптомов. Из-за диастолической или
систолической дисфункции повышение давления в
ЛЖ, вызванное стрессом, часто приводит к появле-
нию во время стресс-теста симптомов сдавления в
груди и одышке, которые трудно отличить от сим-
птомов типичной стенокардии. Принимая во вни-
мание неблагоприятные последствия ишемическо-
го каскада, желательно как можно раньше выявить
ишемию миокарда, чтобы уменьшить ишемиче-
скую нагрузку и риск осложнений во время стресс-
теста. Хотя в настоящее время руководства [9, 10]
рекомендуют выполнять пациентам с информатив-
ной стандартной нагрузочной ЭКГ в качестве стар-
тового метода диагностики стабильной ИБС, во
многих случаях ЭхоКГ дает дополнительную важ-
ную информацию о структурах сердца и локализа-
ции ишемии миокарда, а также повышает чувстви-
тельность и специфичность метода (особенно у
женщин) [11–13].
ДЕТЕРМИНАНТЫ ПОТРЕБНОСТИ МИОКАРДА
В КИСЛОРОДЕ И ПОСТУПЛЕНИЯ КИСЛОРОДА
Основными детерминантами потребности миокар-
да в кислороде являются (1) напряжение стенки ЛЖ;
(2) частота сердечных сокращений (ЧСС); (3) систо-
лическое артериальное давление (САД). Напряже-
ние стенки ЛЖ зависит от толщины миокарда, раз-
меров желудочка и давления в ЛЖ [14, 15]. Приме-
рами изменения всех трех детерминант служат
гипертрофия ЛЖ и гипертрофия правого желудоч-
ка (ПЖ), эксцентрическое ремоделирование ЛЖ, а
также перегрузка давлением ЛЖ при артериальной
гипертензии или аортальном стенозе. Во время
стресс-теста произведение ЧСС и САД называют
внешней работой сердца (или двойным произведени-
ем), которая увеличивается при максимальном по-
треблении кислорода миокардом. Другие детерми-
Рис. 13.1 Ишемический каскад. ЭКГ — электрокардиограмма.
1. Дисбаланс между потреблением и поступлением кислорода
2. Нарушения клеточных метаболических процессов
3. Диастолическая дисфункция
4. Систолическая дисфункция
5. Ишемические изменения на ЭКГ
6. Симптомы стенокардии
Продолжительность ишемии коронарных артерий
нарушений локальной сократимости миокарда на
фоне критического стеноза коронарной артерии.
Однако стресс-ЭхоКГ с физической нагрузкой яв-
ляется предпочтительным методом, поскольку пре-
доставляет информацию о функциональных воз-
можностях пациента, толерантности к физической
нагрузке, реакции ЧСС на нее и выявляет индуци-
рованную артериальную гипертензию. Это допол-
нительная прогностическая информация, помимо
той, что получают при фармакологической нагруз-
ке или электростимуляции предсердий.
Метод стресс-ЭхоКГ и показанию к ней совер-
шенствуются благодаря улучшению качества изо-
бражения и технических возможностей ультразву-
кового исследования. Исторически нагрузочное ра-
дионуклидное исследование перфузии миокарда
была важным диагностическим методом, однако со-
всем недавно компьютерная томография (КТ) серд-
ца показала себя эффективным методом оценки
ИБС, а недавние и обоснованные опасения по пово-
ду облучения привели к возобновлению интереса к
стресс-ЭхоКГ [6].
ФИЗИОЛОГИЧЕСКИЕ
И ПАТОФИЗИОЛОГИЧЕСКИЕ ПРИНЦИПЫ
ИШЕМИЧЕСКИЙ КАСКАД
Основная задача стресс-ЭхоКГ — выявление дисба-
ланса между потребностью миокарда в кислороде и
его доставкой, т.е. ишемии миокарда. Стенокардия
является основным кардиальным симптомом ише-
мии миокарда и последним этапом в каскаде кле-
точных и макроскопических реакций на дисбаланс
между потреблением и поступлением кислорода.
Ишемический каскад представляет собой после-
довательность процессов, которые происходят по-
сле начала ишемии миокарда (рис. 13.1). Дисбаланс
между потреблением и поступлением кислорода
влечет за собой нарушение клеточных метаболиче-
ских процессов, в частности накопление лактата и
ch13.indd 272
03.04.2019 11:53:18
273
13 Стресс-эхокардиография при ишемии коронарных артерий
нанты потребности в кислороде — сократимость
[16], поступление кальция (т.е . активность Ca2+-
АТФазы) и связь возбудимости с сократимостью
[17, 18] — изучены недостаточно.
Ишемию миокарда также может вызывать: (1) сни-
жение поступления кислорода (например, при ане-
мии); (2) уменьшение эпикардиального или мик-
рососудистого коронарного кровотока из-за по-
стоянного стеноза (атеросклеротическая бляшка);
(3) аномальный эпикардиальный или микрососу-
дистый коронарный кровоток из-за динамической
обструкции, вызванной нарушением механизма ва-
зодилатации (дисфункция эндотелия, дисфункция
гладких мышц, не зависящая от эндотелия) или ва-
зоспазмом; (4) наружное сдавление интрамураль-
ных коронарных артерий из-за миокардиального
мостика или увеличения внеклеточного матрикса
при инфильтративной или гипертрофической кар-
диомиопатии; (5) снижение микрососудистого су-
бэндокардиального коронарного кровотока в слу-
чае перегрузки давлением желудочков (например,
артериальная гипертензия, аортальный стеноз, ле-
гочная гипертензия, эмболия легочной артерии);
(6) сокращение фазы диастолы (тахикардия) (пер-
фузия большинства коронарных артерий происхо-
дит во время диастолы).
Во время стресс-ЭхоКГ потребность миокарда в
кислороде возрастает максимально из-за физиче-
ской нагрузки, адренергической стимуляции добу-
тамином или внутрисердечной или внесердечной
(чреспищеводной) электростимуляции. Цель этих
стресс-тестов — увеличить внешнюю работу мио-
карда за счет увеличения ЧСС, чтобы выявить ИБС,
которая не проявляется в состоянии покоя. С помо-
щью стресс-тестов можно обнаружить стеноз коро-
нарной артерии при уменьшении просвета артерии
менее чем на 50% (75% поперечного сечения стено-
за). Однако на положительный результат стресс-
ЭхоКГ влияют все факторы, влияющие на поддер-
жание и распределение коронарного кровотока.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
К СТРЕСС-ЭХОКАРДИОГРАФИИ
Наиболее распространенными и эффективными
видами физической нагрузки при стресс-ЭхоКГ яв-
ляются нагрузка на тредмиле (беговой дорожке) и
нагрузка на вертикальном или горизонтальном ве-
лоэргометре. Если пациент не способен выполнять
физическую нагрузку, то используют фармакологи-
ческую или стимуляционную нагрузку. Ограниче-
ния обычно связаны с качеством изображения.
Ограничение по времени для визуализации после
физической нагрузки имеет стресс-тест на тредми-
ле, но не горизонтальная велоэргометрия. Горизон-
тальная велоэргометрия позволяет получать изо-
бражения во время максимальных нагрузок и когда
пациент устает. После отдыха он возобновляет на-
грузку, и можно получить дополнительные изобра-
жения.
ПОКАЗАНИЯ
Показания к стресс-ЭхоКГ: признаки ишемии мио-
карда, боль в груди в отсутствие острого коронар-
ного синдрома (ОКС) или инфаркта миокарда
(ИМ), недавно перенесенный ОКС (без проведения
коронарной ангиографии), стабильная ИБС или
изменение клинического статуса, подозрение на
ИБС перед некардиологическим вмешательством
(табл. 13.1). В европейских руководствах по стресс-
ЭхоКГ перечислены следующие показания: диагно-
стика ИБС, стратификация риска и локализации
ишемии у пациентов с установленной ИБС, оценка
связанной с физической нагрузкой одышки, оценка
некоторых пациентов перед некардиохирургиче-
ским вмешательством. Как правило, наличие неин-
формативной ЭКГ, например при блокаде левой
ножки пучка Гиса (БЛНПГ), усиливает показание к
стресс-ЭхоКГ (рис. 13.2).
Критерии целесообразного
использования
стресс-ЭхоКГ были определены в руководстве
American College of Cardiology/American Heart
Association (ACC/AHA) 2011 г. (табл. 13.2) [19]. Це-
лесообразность использования стресс-ЭхоКГ в раз-
ных клинических ситуациях оценивают в баллах от
1 до 9. Средний показатель от 7 до 9 баллов эксперт-
ная комиссия считает достаточным основанием для
стресс-ЭхоКГ. Стресс-ЭхоКГ проводят пациентам с
низкой или средней претестовой вероятностью ИБС,
Преимущества
Можно применять как физическую нагрузку,
так и фармакологическую нагрузку
Оценка структуры сердца
Оценка глобальной функции левого и правого желудочков
Оценка локальной сократимости миокарда по сегментам
в покое и при нагрузке для определения локализации
ишемии коронарных артерий
Прогнозирование кардиальных событий в будущем
Ограничения
Качество изображения зависит от особенностей пациента,
его положения, оборудования и опыта специалиста
Ограниченное время для получения изображений при
нагрузке на тредмиле
Невозможность достичь ишемического порога нагрузки
с помощью велоэргометрии
Перспективы
Оценка деформации миокарда (тканевая допплерография,
спекл-трекинг ЭхоКГ)
Трехмерная стресс-ЭхоКГ
ЭхоКГ — эхокардиография.
ТАБЛИЦА 13.1
Преимущества, ограничения
и перспективы применения
стресс-эхокардиографии
ch13.indd 273
03.04.2019 11:53:18
274
ЧАСТЬ III Ишемическая болезнь сердца
которые способны к физической нагрузке, но имеют
неинформативную ЭКГ, а также пациентам с высо-
кой претестовой вероятностью ИБС. Средний или
высокий риск по шкале Дьюка также считают пока-
занием к стресс-ЭхоКГ. Кроме того, в руководстве
2011 г. [19] стресс-ЭхоКГ рекомендуют пациентам с
симптомами, независимо от того, является ли ЭКГ
информативной. Стресс-ЭхоКГ проводят пациен-
там с возможным ОКС без ишемических изменений
на ЭКГ или БЛНПГ и нормальным или минимально
повышенным уровнем тропонина. Но некоторые
клиницисты считают нецелесообразным проводить
стресс-ЭхоКГ с физической нагрузкой пациентам с
повышенным уровнем тропонина. Более того, было
установлено (хотя это спорно), что стресс-ЭхоКГ
можно проводить пациентам без боли в груди, но с
впервые выявленной хронической сердечной недо-
статочностью или дисфункцией ЛЖ. Также считают
целесообразным проводить стресс-ЭхоКГ некото-
рым пациентам для дооперационной оценки.
В руководстве 2011 г. приведены некоторые про-
тиворечивые рекомендации, в частности выполне-
ние стресс-ЭхоКГ пациентам со стойкой или желу-
дочковой тахикардией, индуцированной физиче-
ской нагрузкой, или частыми преждевременными
желудочковыми комплексами. Пациентов со сред-
ним баллом от 1 до 3 не считают имеющими доста-
точные основания для проведения стресс-ЭхоКГ
(см. табл. 13.2). Это пациенты с низкой претестовой
вероятностью ИБС, явным ОКС с повышенным
уровнем тропонина, а также у кого стресс-ЭхоКГ с
нагрузкой может иметь неприемлемую степень лож-
ноположительного или ложноотрицательного ре-
зультата. Сомнительные показания к стресс-ЭхоКГ
(средний балл от 4 до 6) в данной главе не приведе-
ны, но описаны в руководстве 2011 г. [19].
ПРИМЕНЕНИЕ СТРЕССЭХОКАРДИОГРАФИИ С ФИЗИЧЕСКОЙ
НАГРУЗКОЙ ДЛЯ ОЦЕНКИ ПРЕДОПЕРАЦИОННОГО РИСКА
НЕКАРДИОЛОГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Предоперационный риск повышен у пациентов с
установленным заболеванием периферических арте-
рий, ИБС, сахарным диабетом или хронической сер-
дечной недостаточностью, особенно при низкой
функциональных возможностях пациента. Таким
пациентам следует провести стресс-ЭхоКГ до некар-
диологического вмешательства. В табл. 13.3 перечис-
лены показатели очень низкого и высокого риска в
дополнение к бесспорным факторам, повышающим
риск. У таких пациентов стресс-ЭхоКГ является про-
веренным методом предоперационной оценки риска
[19]. Стресс-тесты с физической нагрузкой дают по-
лезную информацию о функциональных возмож-
ностях пациента, резерве сердечного ритма и его вос-
становлении, что прогностически важно. Однако
многие пациенты не способны к физической нагруз-
Рис. 13.2 Алгоритм определения целесообразности проведения стресс-эхокардиографии для выявления ишемической болезни сердца и оцен-
ки риска. ОКС — острый коронарный синдром; ЭКГ — электрокардиограмма [Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SC-
CM/SCCT/SCMR 2011 appropriate use criteria for echocardiography. a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, Amer-
ican Society of Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic
Resonance American College of Chest Physicians. J Am Soc Echocardiogr 24:229–267, 2011].
Ишемический эквивалент
Острый
Возможный
Определенный
Да
Нет
Низкая
Средняя или
высокая
Хронический
ОКС
Претестовая вероятность
Целесообразно
Информативная
ЭКГ, пациент способен
выполнять физическую
нагрузку
Нецелесообразно
Нецелесообразно
Целесообразно
ch13.indd 274
03.04.2019 11:53:18
275
13 Стресс-эхокардиография при ишемии коронарных артерий
Показания
Баллы по шкале
целесообразного
использования (1–9)
ОБОСНОВАННЫЕ (средний балл 7–9)
Выявление ИБС/оценка риска: клинические симптомы или ишемический эквивалент (неострый)
Претестовая вероятность ИБС
Низкая
Неинформативная ЭКГ или пациент не способен к физической нагрузке
7
Средняя
Информативная ЭКГ и пациент способен к физической нагрузке
7
Неинформативная ЭКГ или пациент не способен к физической нагрузке
9
Высокая
Независимо от интерпретации ЭКГ и способности пациента к физической нагрузке
7
Выявление ИБС/оценка риска: острая боль в груди
Возможный ОКС
ЭКГ: нет ишемических изменений, или есть БЛНПГ, или есть искусственный водитель
желудочкового ритма
Низкий риск по шкале TIMI
Тропонин: отрицательный
7
ЭКГ: нет ишемических изменений, или есть БЛНПГ, или есть искусственный водитель
желудочкового ритма
Низкий риск по шкале TIMI
Уровень тропонина: пограничный, сомнительный, минимально повышен
7
ЭКГ: нет ишемических изменений, или есть БЛНПГ, или есть искусственный водитель
желудочкового ритма
Высокий риск по шкале TIMI
Тропонин: отрицательный
7
ЭКГ: нет ишемических изменений, или есть БЛНПГ, или есть искусственный водитель
желудочкового ритма
Высокий риск по шкале TIMI
Уровень тропонина: пограничный, сомнительный, минимально повышен
7
Выявление ИБС/оценка риска: без клинических симптомов (без ишемического эквивалента)
у пациентов с определенными коморбидными состояниями
Впервые возникшая СН или систолическая дисфункция ЛЖ, нет предварительной оценки ИБС
и коронарной ангиографии
7
Стойкая ЖТ, частые ЖЭС, индуцированная нагрузкой ЖТ или нестойкая ЖТ
7
Синкопе со средним или высоким общим риском ИБС
7
Уровень тропонина: повышен без симптомов или дополнительных признаков ОКС
7
После предварительного обследования
Кальцификация коронарных артерий с индексом Agatston > 400 у бессимптомных пациентов
7
Незначительный стеноз коронарной артерии при инвазивной или неинвазивной коронарной
ангиографии
8
Средний риск по индексу нагрузочной ЭКГ на тредмиле (например, индекс Дьюка)
7
Высокий риск по индексу нагрузочной ЭКГ на тредмиле (например, индекс Дьюка)
7
Новые симптомы или усугубление имеющихся симптомов
7
Сомнительный, пограничный или противоречивый стресс-тест, когда стенотический процесс
при ИБС остается под вопросом
8
Оценка риска
1 или несколько клинических факторов риска
Низкие или неизвестные функциональные возможности (< 4 MET) до операции на сосудах
7
ТАБЛИЦА 13.2 Обоснованные и необоснованные показания к стресс-эхокардиографии
ch13.indd 275
03.04.2019 11:53:18
276
ЧАСТЬ III Ишемическая болезнь сердца
Показания
Баллы по шкале
целесообразного
использования (1–9)
Через 3 мес после ОКС/ИМ с подъемом сегмента ST
Гемодинамически стабильные пациенты, без рецидивов боли в груди или отсутствие признаков СН
Оценка стресс-индуцированной ишемии
Нет предварительной коронарной ангиографии, поскольку событие инициальное
7
Через 3 мес после ОКС/НС/ИМ без подъема сегмента ST
Гемодинамически стабильные пациенты, без рецидивов боли в груди или отсутствие признаков СН
Оценка стресс-индуцированной ишемии
Нет предварительной коронарной ангиографии, поскольку событие инициальное
8
После реваскуляризации (ЧКВ или КШ) с симптомами
Ишемический эквивалент
8
После реваскуляризации (ЧКВ или КШ) без симптомов
Частичная реваскуляризация
Возможна дополнительная реваскуляризация
7
Применение контрастного средства при ТТЭхоКГ/ЧПЭхоКГ или стресс-ЭхоКГ
Избирательное применение контрастного средства
2 или более смежных сегментов ЛЖ не визуализируются без контрастирования
8
НЕОБОСНОВАННЫЕ (средний балл 1–3)
Выявление ИБС/оценка риска: клинические симптомы или ишемический эквивалент (неострый)
Низкая претестовая вероятность ИБС
Информативная ЭКГ и пациент способен к физической нагрузке
3
Выявление ИБС/оценка риска: клинические симптомы или ишемический эквивалент, острая
боль в груди
Определенный ОКС
1
Выявление ИБС/оценка риска: без клинических симптомов (без ишемического эквивалента)
Низкий общий риск ИБС
1
Средний общий риск ИБС с информативной ЭКГ
2
Нечастые ЖЭС
3
Синкопе с низким общим риском ИБС
3
После предварительного обследования: без клинических симптомов, предшествующие
доказательства субклинического течения болезни
Кальцификация коронарных артерий с индексом Agatston < 100 у бессимптомных пациентов
2
Низкий общий риск ИБС с последней стресс-ЭхоКГ < 2 лет назад
1
Низкий общий риск ИБС с последней стресс-ЭхоКГ ≥ 2 лет назад
2
Средний или высокий общий риск ИБС с последней стресс-ЭхоКГ < 2 лет назад
2
После предварительного обследования: без клинических симптомов или стабильные симптомы,
без предварительной реваскуляризации
Отсутствие симптомов или стабильные симптомы ИБС, подтвержденной с помощью коронарной
ангиографии или предварительной патологической стресс-ЭхоКГ < 2 лет назад
3
Низкий риск по индексу нагрузочной ЭКГ на тредмиле (например, индекс Дьюка)
1
Периоперационная оценка риска
Некардиологические вмешательства низкого риска без активного сердечного заболевания
1
Некардиологические вмешательства среднего риска без активных сердечных заболеваний
Средние или хорошие функциональные возможности (≥ 4 MET)
3
Нет клинических факторов риска
2
ТАБЛИЦА 13.2
продолжение Обоснованные и необоснованные показания к стресс-эхокардиографии
ch13.indd 276
03.04.2019 11:53:18
277
13 Стресс-эхокардиография при ишемии коронарных артерий
Показания
Баллы по шкале
целесообразного
использования (1–9)
Отсутствие симптомов < 1 года после стандартной катетеризации, неинвазивный тест или
предшествующей реваскуляризации
1
Сосудистые вмешательства без активных сердечных заболеваний
Средние или хорошие функциональные возможности (4 MET)
3
Отсутствие клинических факторов риска
2
Отсутствие симптомов < 1 года после стандартной катетеризации, неинвазивного теста или
предшествующей реваскуляризации
2
Оценка риска
Через 3 мес после ОКС
Первичное ЧКВ с полной реваскуляризацией, нет симптомов рецидива
2
Гемодинамически нестабильные пациенты, признаки кардиогенного шока или механические
осложнения
1
Бессимптомные пациенты после ЧКВ или КШ с адекватной реваскуляризацией перед выпиской
1
До начала кардиореабилитации (отдельное показание)
3
После реваскуляризации (ЧКВ или КШ) без симптомов
<5летпослеКШ
2
< 2 лет после ЧКВ
2
До начала кардиореабилитации (отдельное показание)
3
TIMI — тромболизис при инфаркте миокарда; БЛНПГ — блокада левой ножки пучка Гиса; ЖТ — желудочковая тахикардия; ЖЭС — _
желудочковые экстрасистолы; ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда; КШ — коронарное шунтирование; ЛЖ —
левый желудочек; MET — метаболический эквивалент; НС — нестабильная стенокардия; ОКС — острый коронарный синдром; СН —
сердечная недостаточность; ТТЭхоКГ — трансторакальная эхокардиография; ЧКВ — чрескожное коронарное вмешательство;
ЧПЭхоКГ — чреспищеводная эхокардиография; ЭКГ — электрокардиограмма.
[Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for echocar-
diography. a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiogra-
phy, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, Society for
Cardiovascular Magnetic Resonance American College of Chest Physicians. J Am Soc Echocardiogr 24:229–267, 2011.]
ТАБЛИЦА 13.2
окончание
Обоснованные и необоснованные показания к стресс-эхокардиографии
ке, поэтому широко используют фармакологические
нагрузки. Было показано, что стресс-ЭхоКГ с добу-
тамином столь же чувствительна, что и нагрузочная
сцинтиграфия с визуализацией перфузии миокарда,
но и более специфична и более точно прогнозирует
кардиальные события [20–22].
ПРОТИВОПОКАЗАНИЯ
Противопоказаний или побочных эффектов стресс-
ЭхоКГ с физической нагрузкой нет, кроме тех, ко-
торые связаны с самой физической нагрузкой. Аб-
солютными противопоказаниями к стресс-ЭхоКГ с
физической нагрузкой являются острый ИМ, неста-
бильная стенокардия, тяжелая аритмия, острая эм-
болия легочной артерии, расслоение аорты, актив-
ный миокардит или перикардит, декомпенсирован-
ная сердечная недостаточность или клинически
выраженный тяжелый аортальный стеноз. Другие
противопоказания: установленный стеноз левой ко-
ронарной артерии, тяжелая системная гипертензия,
тяжелая легочная гипертензия и неспособность па-
циента адекватно выполнять физическую нагрузку.
Также есть относительные противопоказания: ги-
пертрофическая кардиомиопатия или бессимптом-
ный критический аортальный стеноз, которые лег-
ко диагностировать с помощью стандартной ЭхоКГ
(это защищает пациентов с данными патологиями
от неадекватной нагрузки).
Кроме того, препятствовать точной диагностике
нарушений локальной сократимости миокарда мо-
гут нетяжелая аритмия и плохая акустическая до-
ступность, которая не компенсируется с помощью
контрастной ЭхоКГ. Следовательно, они также яв-
ляются относительными противопоказаниями к
стресс-ЭхоКГ. В табл. 13.2 перечислены необосно-
ванные показания к стресс-ЭхоКГ.
ch13.indd 277
03.04.2019 11:53:18
278
ЧАСТЬ III Ишемическая болезнь сердца
ПРОТОКОЛЫ СТРЕСС-ЭХОКАРДИОГРАФИИ
ОБЩИЕ РЕКОМЕНДАЦИИ
Целью стресс-ЭхоКГ является достижение физиче-
ской нагрузки, достаточной для увеличения потреб-
ности миокарда в кислороде до такого уровня, при
котором стеноз коронарной артерии может быть
выявлен с оптимальной чувствительностью и специ-
фичностью при сохранении высокого уровня безо-
пасности. Физическая нагрузка, при которой ИБС
можно подтвердить или исключить с высокой сте-
пенью достоверности, у пациентов может быть раз-
ной, но обычно составляет 85% ожидаемой макси-
мальной ЧСС, соответствующей возрасту. В зави-
симости от клинической ситуации могут быть и
другие задачи стресс-ЭхоКГ с физической нагруз-
кой — определение двойного произведения (состав-
ляющего не менее 20 000) или появление симп-
томов.
Для безопасности и своевременного выявления
признаков ишемии миокарда или декомпенсации
сердца необходимы постоянный контроль сердеч-
ного ритма, артериального давления, симптомного
статуса с помощью ЭКГ в 12 отведениях и пульсок-
Очень низкий риск ИМ
(кардиальные события < 1% в год)* Факторы, повышающие риск†
Высокий риск (RR > четырехкратного
низкого риска)£
Нормальный результат стресс-ЭхоКГ
с физической нагрузкой:
> 7 MET (у мужчин)
> 5 MET (у женщин)
Преклонный возраст
Мужской пол
Сахарный диабет
Высокая претестовая вероятность ИБС
Одышка или СН в анамнезе
Инфаркт миокарда в анамнезе
Низкая физическая активность
Неспособность к физической нагрузке
Нагрузочная ЭКГ с признаками ишемии
НЛС в покое
Гипертрофия ЛЖ
Стресс-ЭхоКГ с признаками ишемии
Снижение исходной ФВ
Неизмененный или повышенный КСО
при нагрузке§
Неизмененная или увеличенная ФВ
при нагрузке§
Повышение локальной сократимости
миокарда при нагрузке
Обширные НЛС в покое (4–5 сегментов
ЛЖ)
Исходная ФВ < 40%
Обширная ишемия (4–5 сегментов ЛЖ)
Многососудистая ишемия
НЛС в покое и отдаленная ишемия
Низкий ишемический порог
Ишемические НЛС, нет изменений ФВ
или снижение ФВ при нагрузке§
* Высокая претестовая вероятность ИБС, низкие функциональные возможности или низкая величина двойного произведения, преклон-
ный возраст, стенокардия при нагрузке, гипертрофия ЛЖ, ИМ, ХСН в анамнезе и антиишемическая терапия являются факторами, по-
вышающими риск у пациентов с нормальными результатами стресс-ЭхоКГ.
† Степень увеличения риска вариабельна.
£ Пороговые значения для групп высокого риска являются приблизительными значениями, полученными из доступных источников. Ис-
следования показали, что по сократимости миокарда, повышенной в покое и при минимальной и максимальной нагрузке, можно выяв-
лять пациентов с высоким риском, особенно со сниженной глобальной функцией ЛЖ, однако пороговые значения, используемые для
этого, вариабельны (например, максимальные значения физической нагрузки варьируют от 1,4 до более 1,7).
§ Для тредмил и стресс-ЭхоКГ с добутамином.
ИМ — инфаркт миокарда; КСО — конечно-систолический объем; ЛЖ — левый желудочек; MET — метаболический эквивалент; НЛС —
нарушения локальной сократимости; СН — сердечная недостаточность; ФВ — фракция выброса; ЭКГ — электрокардиография.
[Pellikka PA, Nagueh SF, Elhendy AA, et al. American Society of Echocardiography: American Society of Echocardiography recommendations for
performance, interpretation, and application of stress echocardiography. J Am Soc Echocardiogr 20:1021–1041, 2007.]
ТАБЛИЦА 13.3 Показатели риска при стресс-эхокардиографии
КЛИНИКО-ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
Экономическая эффективность стресс-ЭхоКГ с фи-
зической нагрузкой связана с претестовой вероят-
ностью ИБС. В табл. 13.2 перечислены критерии це-
лесообразного использования стресс-ЭхоКГ [19].
При очень низкой или очень высокой претестовой
вероятности ИБС значимость стресс-теста ограни-
чена. Наибольшая ценность стресс-ЭхоКГ отмеча-
ется у пациентов с промежуточной вероятностью
ИБС (20–80%). Однако при оценке затрат не только
на стресс-ЭхоКГ с физической нагрузкой, но и на
последующие обследования ввиду неоднозначных
результатов, добавление методов визуализации к
стресс-тестам является экономически эффектив-
ным, особенно если нагрузочная ЭКГ имеет высо-
кую вероятность быть неинформативной. Стресс-
ЭхоКГ имеет более высокую специфичность, чем
методы визуализации с более высоким коэффици-
ентом ложноположительных результатов. Это дела-
ет стресс-ЭхоКГ экономически выгодным методом
диагностики. Кроме того, радионуклидное исследо-
вание перфузии миокарда более чем в 2 раза затрат-
нее, чем стресс-ЭхоКГ [23].
ch13.indd 278
03.04.2019 11:53:18
279
13 Стресс-эхокардиография при ишемии коронарных артерий
Метод
Преимущества
Недостатки
Стресс-ЭхоКГ
Портативный, недорогой, возможны как физиче-
ская, так и фармакологическая нагрузки; отсут-
ствие радиоактивного облучения; одновременное
получение информации о структурах сердца
Перспективное направление — перфузионная
ЭхоКГ
Интерпретация зависит от опыта и знаний
оператора
На качество визуализации влияют особенности
телосложения пациента, плохая акустическая
доступность (можно улучшить при правиль-
ном использовании контрастного средства)
Компьютерная томогра-
фическая ангиография
Высокая диагностическая точность (особенно чув-
ствительность и отрицательная прогностическая
значимость; раннее выявление стенотического
поражения при ИБС (кальцификации коронар-
ных артерий, некальцифицированных атероскле-
ротических бляшек)
Перспективное направление — визуализация пер-
фузии миокарда с помощью КТ позволит оцени-
вать анатомию и функции
На точность влияют выраженная кальцифика-
ция коронарных артерий, облучение, приме-
нение йодсодержащих контрастных средств,
анатомия; не может прогнозировать функци-
ональное значение существенного стенотиче-
ского поражения (улучшится в будущем при
визуализации перфузии миокарда
с помощью КТ)
Визуализация перфузии
миокарда с помощью
ОФЭКТ
Физическая и фармакологическая нагрузка, оценка
перфузии и функции ЛЖ при синхронизации
с ЭКГ
Надежная проверка данных
Меньшая зависимость от опыта и знаний операто-
ра по сравнению со стресс-ЭхоКГ
Облучение
Артефакты затухания в мягких тканях
Визуализация перфузии
миокарда с помощью
ПЭТ
Диагностическая точность лучше таковой ОФЭКТ
Абсолютная количественная оценка кровотока
Тщательная коррекция затухания
Облучение и высокая стоимость
В основном используют при фармакологиче-
ской нагрузке
Стресс-МРТ сердца
Нет облучения; нет артефактов затухания
в мягких тканях
Одновременное получение информации о струк-
турах сердца
Высокая стоимость, большая длительность
Противопоказана пациентам с электрокардио-
стимуляторами, клаустрофобией, тяжелой
почечной недостаточностью
Магнитно-резонансная
коронарная ангиогра-
фия
Нет облучения
Нет артефактов затухания в мягких тканях
Низкое пространственное разрешение по срав-
нению с компьютерной томографической
ангиографией
Нагрузочная ЭКГ
Нет облучения, недорогая
Дополнительная прогностическая значимость
(индекс Дьюка)
Низкая диагностическая точность
Пациент должен быть способен выполнять
нагрузку
Неинформативна при отклонениях на исход-
ной ЭКГ (например, БЛНПГ, значительная
депрессия сегмента ST в покое)
БЛНПГ — блокада левой ножки пучка Гиса; ИБС — ишемическая болезнь сердца; КТ — компьютерная томография; ЛЖ — левый желу-
дочек; МРТ — магнитно -резонансная томография; ОФЭКТ — однофотонная эмиссионная компьютерная томография; ПЭТ — позитрон-
но-эмиссионная томография; ЭКГ — электрокардиограмма.
[Dowsley T, Al-Mallah M, Ananthasubramaniam K, et al. The role of noninvasive imaging in coronary artery disease detection, prognosis, and clin-
ical decision making. Can J Cardiol 29:285–296, 2013.]
ТАБЛИЦА 13.4 Преимущества и недостатки методов визуализации сердца
симетрии. Эти показатели оценивают до нагрузки
(исходно), во время нагрузки и после нее (во время
восстановительного периода). Оценка ЭКГ, жиз-
ненно важных показателей и симптомов при всех
стресс-тестах одинакова, но время визуализации при
стресс-ЭхоКГ отличается, что делает одни методы
предпочтительнее других. В табл. 13.4 перечислены
преимущества и недостатки методов визуализации
сердца, а в табл. 13.5 — преимущества и недостатки
стресс-тестов на велоэргометре и тредмиле [24].
ОБОРУДОВАНИЕ И ПЕРСОНАЛ
В кабинетах стресс-ЭхоКГ необходимы стандартное
оборудование (в зависимости от вида стресс-теста)
и персонал для обеспечения максимальной безопас-
ности пациента и эффективности теста (рис. 13.3):
моторизованный тредмил или велоэргометр; ку-
шетка для ЭхоКГ с боковым наклоном и вырезом с
левой стороны для оптимальной визуализации из
апикального доступа; оборудование, которое может
интегрировать нагрузку, ЭКГ и показатели жизнен-
но важных функций для мониторинга и отчетно-
сти, настроенное таким образом, чтобы сотрудники
могли осуществлять контроль в любой момент.
При проведении стресс-теста на тредмиле кушетка
для ЭхоКГ должна находиться в непосредственной
близости от беговой дорожки, чтобы пациент мог
быстро перемещаться для оперативного получения
ch13.indd 279
03.04.2019 11:53:18
280
ЧАСТЬ III Ишемическая болезнь сердца
изображений после максимальной нагрузки (в тече-
ние нескольких секунд после ее прекращения). В ка-
бинете также должны быть каталка с дефибрилля-
тором и лекарства, используемые во время стресс-
теста, а также для купирования реакций и побочных
эффектов препаратов при фармакологической на-
грузке. В каждом кабинете в условиях стационара
должна быть система экстренного оповещения о не-
обходимости реанимационных мероприятий. Сле-
дует ли врачу самому контролировать проведение
стресс-тестов — вопрос спорный, все зависит от ве-
домственных рекомендаций [25], однако врач дол-
жен быть доступен в любой момент при возникно-
вении осложнений во время стресс-теста.
ПОДГОТОВКА ПАЦИЕНТА
Рекомендации не совсем точны в отношении дли-
тельности периода, но в течение нескольких часов
перед стресс-ЭхоКГ пациенты не должны что-либо
принимать на тот случай, если стресс-тест спрово-
цирует сердечно-сосудистое осложнение. При за-
полнении истории болезни следует получить ин-
формацию о наличии аллергических реакций на
лекарственные препараты, которые обычно исполь-
зуют при стресс-тесте, а также провести краткий
физикальный осмотр. Необходимо сверить лич-
ность пациента и показания к стресс-ЭхоКГ. После
получения письменного информированного согла-
сия пациенту надевают манжету тонометра и зажим
для оксиметрии. Датчики ЭКГ следует размещать
после соответствующей подготовки кожи и как
можно ближе к стандартным точкам, чтобы датчи-
ки не мешали визуализации при ЭхоКГ. Некоторым
пациентам с высоким риском рекомендуется уста-
навливать внутривенный катетер даже при физиче-
Преимущества велоэргометрии
Преимущества тредмила
Легче контролировать артериальное давление и проводить
пульсоксиметрию
Меньше артефактов на ЭКГ
Непрерывная и/или периодическая визуализация
Возможность удерживать целевую ЧСС в течение длительного
времени для комплексной эхокардиографической оценки
(диастология, функция клапанов и т.д.)
Стандартный вид физической нагрузки в США
Большее количество пациентов достигает целевой ЧСС
Более достоверная информация о продолжительности
физической нагрузки, рабочей нагрузке, восстановлении
сердечного ритма
Недостатки велоэргометрии
Недостатки тредмила
Некоторые пациенты не знакомы с тренировками на
велосипеде
Меньшее количество пациентов достигает целевой ЧСС
Менее точная информация о продолжительности физической
нагрузки и прогнозе
Более высокий риск застоя крови в легких
(при горизонтальной велоэргометрии)
Периодическая визуализация
Задержка по времени между максимальной нагрузкой
и получением изображения
Ограниченное время для получения изображений
Больший риск падения и травмы
Сложнее контролировать артериальное давление и проводить
пульсоксиметрию
Больше артефактов на ЭКГ
ЭКГ — электрокардиограмма.
ТАБЛИЦА 13.5 Преимущества и недостатки велоэргометрии и тредмила
А
Б
В
Рис. 13.3 Оборудование кабинета стресс-эхокардиографии. (A) Типич-
ное расположение (слева направо): прибор для нагрузочной ЭКГ, монитор для
контроля жизненно важных функций, кушетка со встроенным горизонтальным
велоэргометром, эхокардиограф и инфузомат для внутривенного введения ле-
карств. (Б) Моторизованный тредмил. (В) Каталка с дефибриллятором.
ch13.indd 280
03.04.2019 11:53:18
281
13 Стресс-эхокардиография при ишемии коронарных артерий
ской нагрузке, чтобы в случае необходимости бы-
стро ввести лекарства по жизненным показаниям.
Интерпретация изображений стандартной ЭхоКГ (с
оценкой функций сердца и клапанов и объективно-
го статуса) так же важна, как и оценка стандартной
ЭКГ и определение показателей жизненных функ-
ций.
СТРЕСС-ТЕСТЫ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
В США наиболее распространенным стресс-тестом
с физической нагрузкой является стресс-тест на
тредмиле, главным образом потому, что это при-
вычная форма физической нагрузки для большин-
ства пациентов. Тредмил используют при нагрузоч-
ной ЭКГ, радионуклидном исследовании с физи-
ческой нагрузкой и стресс-ЭхоКГ. Тредмил имеет
преимущества при достижении максимальной на-
грузки (например, увеличение скорости и угла на-
клона), т.е . на тредмиле вероятность достижения
целевой ЧСС выше. Однако метод имеет и значи-
тельные недостатки, особенно при стресс-ЭхоКГ
(табл. 13.5).
Горизонтальная и, в меньшей степени, верти-
кальная велоэргометрия позволяет во время нагруз-
ки осуществлять непрерывный или периодический
контроль с помощью ЭхоКГ. Кроме того, во время
ножной велоэргометрии движение верхней части
тела сводится к минимуму, что уменьшает артефак-
ты на ЭКГ и значительно облегчает оценку артери-
ального давления с помощью осциллометрических,
а не мануальных методов. Ручная велоэргометрия
часто не обеспечивает достаточную нагрузку для до-
стижения конечных точек. В идеале в кабинете
стресс-ЭхоКГ должны быть доступны как тредмил,
так и велоэргометр, чтобы можно было учесть воз-
можности и ограничения пациента. Например, па-
циенты с неустойчивой походкой могут выполнять
максимальную нагрузку с помощью горизонталь-
ного велоэргометра, а пациенты с легочной гипер-
тензией или ортопноэ — вертикального (см. табл.
13.5).
ПРОТОКОЛЫ СТРЕСС-ТЕСТОВ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
Согласно протоколам стресс-тест начинают с ми-
нимальной рабочей нагрузки и увеличивают ее в
соответствии с предполагаемыми функциональ-
ными возможностями пациента. В идеале пациент
должен достичь максимальной нагрузки через
6–12 мин. Если максимальной нагрузки достигают
слишком быстро, возникают дыхательные, а не
кардиальные ограничения. Если нагрузка увеличи-
вать слишком долго, то на длительность выполня-
емого упражнения могут влиять скелетно-мышеч-
ные, а не кардиальные ограничения. Если целевая
ЧСС не достигнута, к любому виду нагрузки мож-
но добавить кистевой жим или внутривенное вве-
дение атропина.
ПРОТОКОЛЫ СТРЕССТЕСТА НА ТРЕДМИЛЕ
Наиболее часто используемым протоколом при
стресс-тесте на тредмиле с последовательными эта-
пами длительностью 3 мин (рис. 13.4) является про-
токол Bruce. Модифицированный протокол Bruce
используют для менее активных пациентов. Он
включает два дополнительных этапа с более низкой
интенсивностью нагрузки в начале теста, за которы-
ми следует обычный протокол Bruce. Протокол
Naughton с этапами, длительностью 2 мин, подхо-
дит для неактивных пациентов. Протоколы Balke и
Cornell содержат более короткие этапы и имеют
больше точек для измерений. Протокол Costill пред-
назначен для высококвалифицированных специа-
листов (обычно используют для проведения сердеч-
но-легочных нагрузок) [26].
ПРОТОКОЛЫ ВЕЛОЭРГОМЕТРИИ
Протоколы стресс-теста на тредмиле обычно содер-
жат этапы, длительностью 1–2 мин, с увеличением
рабочей нагрузки на 15–25 ватт на каждом этапе, по-
ка не будут достигнуты конечные точки. В нашей
лаборатории примерно 20% пациентов, которым
проводят горизонтальную велоэргометрию, не до-
стигают целевой ЧСС (≥ 85% ожидаемой макси-
мальной ЧСС). Мы обнаружили, что 80% пациен-
тов с неинформативной горизонтальной велоэрго-
метрией достигли диагностического результата при
целевой ЧСС после введения 0,5–2,0 мг атропина,
при этом не было никаких серьезных побочных эф-
фектов. Мы считаем, что использование атропина
для увеличения ЧСС или двойного произведения во
время стресс-ЭхоКГ с горизонтальной велоэргоме-
трией безопасно и позволяет выявить ишемию при
максимальной нагрузке и оценить гемодинамику
при субмаксимальной физической нагрузке у паци-
ентов с хронотропной некомпетентностью[27].
КИСТЕВОЙ ЖИМ
Изолированная нагрузка на кисть во время стресс-
ЭхоКГ не позволяет достичь целевой ЧСС (по воз-
расту), но может быть полезным дополнением к ве-
лоэргометрии и фармакологической нагрузке.
СТРЕСС-ЭХОКАРДИОГРАФИЯ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
ПРИ ЛЕКАРСТВЕННОЙ ТЕРАПИИ
Антиишемическая терапия снижает чувствитель-
ность стресс-ЭхоКГ, поскольку уменьшает потреб-
ность миокарда в кислороде. Таким образом, поло-
жительный результат стресс-ЭхоКГ у пациента,
принимающего лекарства, указывает на то, что у
данного пациента повышенный риск ишемических
сердечно-сосудистых событий. Однако способность
антиишемической терапии предотвращать ишеми-
ческую реакцию на стресс-тест является эффектив-
ным способом оценки адекватности консервативно-
го лечения. Стресс-ЭхоКГ с физической нагрузкой
ch13.indd 281
03.04.2019 11:53:19
282
ЧАСТЬ III Ишемическая болезнь сердца
у пациентов с установленной ИБС, получающих ан-
тиишемические препараты, полезна для оценки
адекватности лечения. Однако если целью стресс-
ЭхоКГ является выявление ИБС, антиишемическую
терапию следует отменить за 24–48 час до начала те-
ста. [23].
ОЦЕНКА РЕЗУЛЬТАТОВ СТРЕСС-ЭХОКАРДИОГРАФИИ
СИМПТОМЫ, СТЕНОКАРДИЯ
И СУБЪЕКТИВНОЕ ВОСПРИЯТИЕ НАГРУЗКИ
Симптомы обычно появляются на последнем этапе
ишемического каскада, но они не обязательно будут
признаками ишемии. Одышка, усталость, давящая
боль в груди, головокружение или обморок могут
быть признаками ишемии, но чаще всего связаны с
ограниченными функциональными возможностя-
ми, повышенным давлением в левом предсердии
(ЛП) (например, из-за диастолической дисфунк-
ции, гипертонической реакции), заболеваниями лег-
ких, динамической обструкцией (особенно во время
стресс-ЭхоКГ с добутамином или при обструктив-
ной гипертрофической кардиомиопатии) или обе-
звоживанием. Не существует стандартизованного
метода оценки этих симптомов, но пациенты долж-
ны быть проинструктированы и сообщать меди-
цинскому персоналу о любых признаках перена-
пряжения. Для описания степени боли в груди по-
лезно использовать шкалу от 0 до 10 и отслеживать
изменения во время стресс-теста и после него. Наи-
более часто для субъективной оценки нагрузки ис-
пользуют шкалу Borg из 15 или 10 баллов [28].
ЧАСТОТА СЕРДЕЧНЫХ СОКРАЩЕНИЙ
Основная цель стресс-ЭхоКГ — достижение опреде-
ленной физической нагрузки. Наиболее важный по-
казателем — ЧСС. Желательно достичь целевой
ЧСС, составляющей 85% соответствующей возра-
сту максимальной ЧСС. Такая целевая ЧСС являет-
ся обоснованным пороговым значением при про-
гнозировании кардиальных событий [29]. Причи-
нами безуспешности достижения целевой ЧСС
могут быть хронотропная некомпетентность, тера-
пия при АВ-блокаде и субмаксимальная нагрузка.
Было показано, что добавление к протоколу стресс-
теста кистевого жима или инъекции атропина явля-
ется эффективным способом увеличения ЧСС во
время физической нагрузки и позволяет пациентам
достичь целевой ЧСС. Свидетельствует ли исходная
хронотропная некомпетентность о худшем прогно-
зе для пациентов, которым при стресс-ЭхоКГ вво-
дят атропин (даже если стресс-тест неишемиче-
Рис. 13.4 Соотношение нагрузки и функционального класса в обычных протоколах стресс-тестов с физической нагрузкой. Приведены протокол
Bruce, модифицированный протокол Bruce и протокол Naughton для тредмила. MET — метаболический эквивалент [Fletcher GF, Balady GJ, Amsterdam EA, et al.
Exercise standards for testing and training: a statement for healthcare professionals from the American Heart Association. Circulation 104:1694–1740, 2001].
56,0
52,5
49,0
45,5
42,0
38,5
35,0
31,5
28,0
24,5
17,5
21,0
14,0
10,5
7,0
3,5
1500
1Ватт=6,1
кпм/мин
6,0
5,5
5,0
22
20
18
6,0
5,5
5,0
22
20
18
4,2 16 4,2 16
2,5 12 2,5 12
1,7 5
1,7 0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
миль/час
1
0
2
0
2
3,5
2
7,0
2 10,5
2 14,0
2 17,5
1,7 10 1,7 10
3,4 14 3,4 14
Bruce
модифи-
цированный,
этапы по 3 мин
Bruce,
этапы
по3мин
Для пациента
с массой тела
70 кг
1350
1200
1050
900
750
600
450
300
150
16
15
14
13
12
11
10
9
8
7
5
6
4
3
2
1
З
д
о
р
о
в
ы
й
,
в
с
о
о
т
в
е
т
с
т
в
и
и
с
в
о
з
р
а
с
т
о
м
и
а
к
т
и
в
н
о
с
т
ь
ю
З
д
о
р
о
в
ы
й
,
м
а
л
о
п
о
д
в
и
ж
н
ы
й
Велоэргометр
Тредмил
Расход O2
(мл/кг/мин)
Норма и I
Функциональный
класс
Клинический
статус
MET
MET
Naughton,
этапы
по2мин
II
С
о
г
р
а
н
и
ч
е
н
и
я
м
и
С
с
и
м
п
т
о
м
а
м
и
III
IV
Подъем
(%)
Подъем
(%)
Подъем
(%) миль/час
миль/час
ch13.indd 282
03.04.2019 11:53:19
283
13 Стресс-эхокардиография при ишемии коронарных артерий
ский), еще предстоит изучить. Однако есть сообще-
ния, что введение атропина не только увеличивает
количество пациентов, достигших целевой ЧСС, но
и повышает частоту выявления ишемии [30].
При нормальном результате стресс-ЭхоКГ с суб-
максимальной нагрузкой нужно дополнительное
обследование, если пациент находится в группе вы-
сокого риска: выполнено коронарное шунтиро-
вание; ИМ в анамнезе; нарушения локальной со-
кратимости миокарда в покое; функциональные
возможности во время стресс-теста были ограни-
ченными (< 7 MET у мужчин, < 5 MET у женщин);
выраженное повышение артериального давления;
патологические изменения на ЭКГ; боль в груди во
время стресс-теста. Пациентам из группы низкого
риска с высокой физической активностью дальней-
шее обследование может не понадобиться [31].
ВОССТАНОВЛЕНИЕ ЧАСТОТЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ
Нормальным восстановлением ЧСС при нагрузоч-
ной ЭКГ считают снижение ЧСС на ≥ 12 уд/мин
(восстановительный период происходит после фи-
зической нагрузки). При стресс-ЭхоКГ с физиче-
ской нагрузкой периода восстановления нет, нор-
мальным считают снижение ЧСС на ≥ 18 уд/мин за
первую минуту. У пациентов, не достигших поро-
гового предела ЧСС, риск смерти удваивается даже
после поправки на другие стресс-зависимые сердеч-
но-сосудистые факторы риска (HR 2,13; 95% ДИ,
1,63–2,78; p < 0,001) [29, 32].
АРТЕРИАЛЬНОЕ ДАВЛЕНИЕ
Артериальное давление во время стресс-теста зна-
чительно повышается. Это второй определяющий
фактор внешней работы сердца во время стресс-
теста. Часто во время теста определяют двойное
произведение — произведение ЧСС и артериально-
го давления. Определение артериального давления
во время стресс-теста не только помогает спрогно-
зировать риск, но и оценить адекватность контроля
гипертонической болезни у пациентов, получаю-
щих антигипертензивные препараты [33, 34]. Нор-
мальным систолическим артериальным давлением
при максимальных нагрузках считают ≤ 190 мм рт.
ст. для женщин и ≤ 210 мм рт. ст. для мужчин [35].
Есть сообщения, что гипертензия, вызванная физи-
ческой нагрузкой, увеличивает вероятность сердеч-
но-сосудистого события в 3,6 раза, а впервые воз-
никшая гипертензия в покое — в 2,4 раза [36]. Но
превалирующее значение гипертензии, индуциро-
ванной физической нагрузкой, над гипертензией в
покое остается сомнительным [37]. Назначение па-
циенту антигипертензивных препаратов на основа-
нии гипертензии, вызванной физической нагруз-
кой, не может быть рекомендацией, но им показан
строгий мониторинг артериального давления в кли-
нике и в повседневной жизни (в идеале — амбула-
торный контроль давления).
ФУНКЦИОНАЛЬНЫЕ ВОЗМОЖНОСТИ
Функциональные возможности — это предел физи-
ческой нагрузки, определяемый максимальным по-
треблением кислорода (VO2max), при котором че-
ловек может выполнять аэробные нагрузки. Мате-
матически VO2max является результатом сердечного
выброса и артериовенозной разницы (–VO2) по кис-
лороду при физическом истощении. Считается, что
VO 2max ограничен сердечным выбросом. Если
VO2max непосредственно не измеряют (как это де-
лают при сердечно-легочных стресс-тестах), объем
выполненной физической нагрузки (т.е. функцио-
нальные возможности) обычно выражают в мета-
болических эквивалентах (МЕТ), при этом 1 МЕТ
равен расходу энергии в состоянии покоя (≈ 3,5 мл
O2 × кг–1 × мин–1). Считают, что пациенты, которые
при стресс-тесте достигают < 5 МЕТ, 5–8 МЕТ, 9–11
МЕТ и ≥ 12 МЕТ, имеют низкие, умеренные, хоро-
шие и отличные функциональные возможности со-
ответственно (см. рис. 13.4) [26]. Продолжитель-
ность физической нагрузки имеет прогностическую
значимость: продолжительность менее 6 мин пред-
полагает повышенный риск смерти.
ИЗМЕНЕНИЯ НА ЭЛЕКТРОКАРДИОГРАММЕ
Основным показателем ишемии миокарда во время
или после стресс-теста является отклонение сегмен-
та ST. Об ишемии миокарда могут свидетельство-
вать как депрессия, так и элевация сегмента ST (рис.
13.5). Рекомендуемые руководствами пороговые из-
менения на ЭКГ во время стресс-теста (измеренные
через 80 мсек после точки J): косовосходящая де-
прессия сегмента ST ≥ 1,5 мм, горизонтальная или
косонисходящая депрессия сегмента ST минимум
на 1 мм. Кроме того, информацию об аритмии, вы-
званной физической нагрузкой (аритмия иногда
может быть результатом ишемии миокарда), дает
ЭКГ в 12 отведениях во время стресс-ЭхоКГ или
контроль ЧСС (например, у пациентов с фибрилля-
цией предсердий) [23].
ВИЗУАЛИЗАЦИЯ С ПОМОЩЬЮ ЭХОКАРДИОГРАФИИ
Протоколы ЭхоКГ различаются в зависимости от
вида нагрузки. Например, при стресс-тесте на тред-
миле ЭхоКГ выполняют до нагрузки и сразу после
нее (с небольшой задержкой для перехода с тред-
мила на кушетку). При стресс-ЭхоКГ с горизонталь-
ной велоэргометрией или горизонтальной левосто-
ронней стресс-ЭхоКГ с добутамином допускается
периодическая или непрерывная визуализация. Для
обнаружения нарушений локальной сократимости
миокарда, вызванных стресс-тестом, в начале физи-
ческой нагрузки или во время и после нее осущест-
вляют визуализацию в парастернальной позиции
по короткой оси и в апикальных четырехкамерной,
двухкамерной и трехкамерной позициях по длин-
ной оси. Если на исходных изображениях выявля-
ch13.indd 283
03.04.2019 11:53:19
284
ЧАСТЬ III Ишемическая болезнь сердца
А
Б
Г
В
Рис. 13.6 Неишемические причины боли в груди, диагностированные на исходной эхокардиограмме. (А) A Парастернальная позиция по короткой
оси. Тяжелый стеноз аортального клапана. (Б) A Парастернальная позиция по длинной оси. Гипертрофическая кардиомиопатия (стрелка). (В) A Парастерналь-
ная позиция по длинной оси восходящего отдела аорты. Отслойка интимы при расслоении аорты (стрелка). (Г) A Пациент с подострой эмболией легочной арте-
рии, дилатация и дисфункция правого желудочка с относительно сохранным сокращением верхушки во время систолы (стрелка), т.е. симптом МакКоннела. При
исследовании пациент находится в положении лежа на спине.
V3
–1,05
0,13
V4
–1,85
–0,66
V1
1,20
0,09
V4
–1,25
1,45
А
Б
В
Г
Рис. 13.5 Патологические изменения сегмента ST, указывающие на ишемию миокарда. На ишемию миокарда указывают: горизонтальная депрессия
сегмента ST ≥ 1,5 мм (А); косонисходящая депрессия сегмента ST ≥ 1,5 мм (Б); элевация сегмента ST с амплитудой ≥ 1 мм (В). (Г) Косовосходящая депрессия
сегмента ST < 1,5 мм не соответствует критериям ишемии.
ются некоронарогенные причины боли в груди
(рис. 13.6), возможна отмена стресс-теста или про-
ведение дополнительных диагностических исследо-
ваний. Также могут быть выявлены исходные нару-
шения локальной сократимости миокарда, которые
(если они не были известны ранее) могут стать по-
казанием к инвазивной диагностике ИБС. В некото-
рых лабораториях используют парастернальную
позицию по длинной оси, но мы предпочитаем апи-
кальную трехкамерную позицию (позволяет более
быстро и полно визуализировать апикальные сег-
менты) и визуализацию с применением контраст-
ного средства. Исходные нарушения локальной со-
кратимости миокарда и патологическое утолщение
ch13.indd 284
03.04.2019 11:53:19
285
13 Стресс-эхокардиография при ишемии коронарных артерий
миокарда должны быть отмечены для сравнения с
изображениями при нагрузке. Если границу эндо-
карда визуализировать трудно (особенно при пло-
хой визуализации двух и более сегментов), следует
провести контрастную ЭхоКГ (при отсутствии у па-
циента противопоказаний). Программное обеспе-
чение позволяет сравнивать изображения и выяв-
лять различия в сокращении миокарда во время си-
столы. Нормальной реакцией организма является
гипердинамическая функция ЛЖ и нормальное
утолщение миокарда, а гипокинезия, акинезия, дис-
кинезия или аневризматическое сокращение мио-
карда ЛЖ может быть признаком субэндокардиаль-
ной или трансмуральной ишемии. Стандартом для
стресс-ЭхоКГ, что связано с индивидуальной и меж-
ведомственной экспертной вариабельностью, явля-
ется субъективная оценка сократимости миокарда и
утолщения стенок ЛЖ. У опытных специалистов
межэкспертная вариабельность была очень хоро-
шей [23]. Нарушения локальной сократимости мио-
карда выявляют в соответствии со стандартизован-
ной 17-сегментной моделью (рис. 13.7).
Определение локализации нарушений сократи-
мости миокарда позволяет установить, являются ли
Рис. 13.7 17-сегментная модель для описания нарушений локальной сократимости миокарда. Срез на уровне базальных сегментов — в позиции по
короткой оси на уровне кончиков створок митрального клапана, срез на уровне медиальных сегментов — в позиции по короткой оси на уровне папиллярных
мышц, а срез на уровне апикальных сегментов — в позиции по короткой оси за пределами папиллярных мышц. В настоящее время рекомендуется 17-сегмент-
ная модель (см. рис. 12 .2А) [Cerqueira MD, Weissman NJ, Dilsizian V, et al. American Heart Association Writing Group on Myocardial Segmentation and Registration for
Cardiac Imaging: Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac
Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation 105:539–542, 2002].
Медиальные сегменты
7
8
9
10
11
12
Апикальные сегменты
13
14
15
16
Истинная верхушка
Вертикальная двухкамерная
позиция по длинной оси
17
Истинная верхушка
Горизонтальная четырехкамерная
позиция по длинной оси
17
Базальные сегменты
1
2
3
4
5
6
1 Базальный передний
2 Базальный переднесептальный
3 Базальный нижнесептальный
4 Базальный нижний
5 Базальный нижнебоковой
6 Базальный переднебоковой
7 Медиальный передний
8 Медиальный переднесептальный
9 Медиальный нижнесептальный
10 Медиальный нижний
11 Медиальный нижнебоковой
12 Медиальный переднебоковой
13 Апикальный передний
14 Апикальный септальный
15 Апикальный нижний
16 Апикальный боковой
ch13.indd 285
03.04.2019 11:53:20
286
ЧАСТЬ III Ишемическая болезнь сердца
коронарные артерии и их ветви, кровоснабжающие
передний и переднесептальный сегменты (левая пе-
редняя нисходящая артерия), нижний и нижнебо-
ковой сегменты (правая или левая огибающая арте-
рия), причиной ишемии миокарда [38].
Ишемию миокарда можно оценить количествен-
но с помощью показателей локальной сократимо-
сти миокарда, которые следует сравнивать с основ-
ными контрольными показателями. Другие количе-
ственные методы, например оценка деформации
миокарда, не стали стандартными из-за ограниче-
ний, описанных в конце этой главы. Большое зна-
чение имеет не только оценка утолщения миокарда
во время систолы, но и оценка внутренних разме-
ров ЛЖ (или ПЖ) на пике нагрузки. Транзиторная
ишемическая дилатация может быть признаком тя-
желого поражения проксимального русла коронар-
ных артерий (трех сосудов) при ИБС или сбаланси-
рованной ишемии и является важным прогностиче-
ским признаком исхода (табл. 13.6; рис. 13.8 –13.12)
[39]. Для врача, интерпретирующего ЭхоКГ, важно
знать причины ложноотрицательных и ложнопо-
ложительных результатов при стресс-ЭхоКГ (табл.
13.7) [40].
Разделение на группы
Количество
исследований
Всего
пациентов
Чувствительность
(%)
Специфичность
(%)
Прогностическая
значимость (%)
Метаанализ стандартной
нагрузочной ЭКГ
147
24 047
68
77
73
Исключая пациентов с ИМ
41
11 691
67
72
69
Погрешность исследования
2
> 1000
50
90
69
Метаанализ шкал стресс-тестов
24
11 788
–
–
80
Стратификация вероятности
по шкалам стресс-тестов
1
2000
95
90
92
Сцинтиграфия с таллием
59
6038
85
85
85
ОФЭКТ без ИМ
27
2136
86
62
74
Стресс-ЭхоКГ с физической
нагрузкой
58
5000
84
75
80
Исключая пациентов с ИМ
24
2109
87
84
85
Стресс-тесты без физической
нагрузки
Персантин таллия
11
< 1000
85
91
87
Стресс-ЭхоКГ с добутамином
5
< 1000
88
84
86
Кардиокимография
1
617
71
88
79
Электронно-лучевая компьютерная
томография
5
2373
90
45
61
ИМ — инфаркт миокарда; ОФЭКТ — однофотонная эмиссионная компьютерная томография; ЭКГ — электрокардиография; ЭхоКГ —
эхокардиография.
[Ashley EA, Myers J, Froelicher V. Exercise testing in clinical medicine. Lancet 356:1592–1597, 2000.]
ТАБЛИЦА 13.6 Сравнение стресс-тестов и методов визуализации, применяемых в диагностике
ишемической болезни сердца
ИНДЕКС ДЬЮКА ПРИ СТРЕССТЕСТЕ НА ТРЕДМИЛЕ
Для оценки результатов стресс-ЭхоКГ используют
интеграцию функциональных возможностей паци-
ента, стенокардии напряжения и ишемических из-
менений на ЭКГ. Индекс Дьюка является самым по-
пулярным и наиболее достоверным индексом [41],
который дает полезную информацию в сочетании
со стресс-ЭхоКГ [42]. Индекс Дьюка рассчитывают:
Время нагрузки – (5 × Отклонение сегмента ST) –
(4 × Индекс стенокардии).
Наличие стенокардии оценивают в баллах: нет
(0), стенокардия появилась (1 балл) и стенокардия
стала причиной прекращения нагрузки (2 балла).
Индекс Дьюка варьирует от –25 до +15. Чем больше
отрицательное значение, тем выше риск [41]. Хотя
индекс Дьюка полезен, важно учитывать каждый
компонент индекса индивидуально.
ДРУГИЕ ВАЖНЫЕ РЕЗУЛЬТАТЫ СТРЕССЭХОКАРДИОГРАФИИ
С помощью стресс-ЭхоКГ с физической нагрузкой
можно оценить диастолическую функцию, напри-
мер для определения причины одышки при физи-
ческой нагрузке [43]. В нескольких исследованиях
ch13.indd 286
03.04.2019 11:53:20
287
13 Стресс-эхокардиография при ишемии коронарных артерий
была описана связь между толерантностью к физи-
ческой нагрузке и диастолической функцией [44–
46]. Holland и соавт. показали, что диастолическая
функция напряжения имеет независимую прогно-
стическую значимость (помимо обнаруженной
ишемии) [47].
Это также полезно при оценке того, связана ли
вызванная физической нагрузкой одышка с диасто-
лической дисфункцией, а также имеет ли она сер-
дечное или легочное происхождение (рис. 13.13).
Обычно скорость E и скорость e′ при нагрузке по-
вышаются из-за увеличения сердечного выброса и
систолической функции. При индуцированной фи-
зической нагрузкой диастолической дисфункции
отношение E/e′ будет, скорее всего, увеличиваться,
не останется постоянным. У некоторых пациентов
оценка митрального кровотока может быть ограни-
чена слиянием раннего митрального потока и пото-
ка, связанного с сокращением предсердий (волны E
и A). Высокая скорость развертки обычно помогает
разделить волны E и A. Для диагностики важны си-
столическая функция ПЖ (как признак ранней
ишемии ПЖ либо показатель риска аритмии [48])
и систолическое давление в легочной артерии [49,
50]. Определение давления в легких во время физи-
ческой нагрузки важно для диагностики одышки
напряжения, диастолической дисфункции, первич-
ной легочной гипертензии и клапанных пороков
Baseline
exercise
0:00
71 bpm
I
0,20 mm
0,04 mV/s
0,45
–0 ,69
–2 ,45
1,43
–2 ,35
0,94
–2 ,35
0,46
–2 ,45
0,61
0,25
–0 ,79
–0 ,35
–0 ,28
0,05
0,01
0,35
–0 ,76
–2 ,45
1,09
–2,30
0,80
–0,50
–0,41
0,20
–0 ,26
–1 ,75
0,19
–1 ,30
0,42
–0 ,20
–0 ,24
1,25
–1 ,05
1,25
–0,52
0,30
–0,09
0,30
0,03
–1 ,25
1,45
–1 ,45
0,70
–0 ,10
–0 ,19
–0 ,25
–0 ,26
–1 ,95
0,62
–1 ,75
0,47
0,30
–0 ,46
0,20
0,07
1,20
–0,62
1,20
–0 ,30
–0,55
–0,35
0,50
0,25
0,45
0,19
–0,45
–0,52
0,85
0,09
0,45
–0 ,24
–0 ,70
0,21
–1 ,05
0,13
0,55
0,23
0,05
0,03
–0 ,05
0,32
0,00
–0,46
–0,05
–0,01
0,25
–0 ,04
0,75
0,01
0,90
–0 ,17
0,55
0,13
I
I
I
V1
V1
V1
V1
II
III
aVR
aVL
aVF
aVF
aVF
aVF
aVL
aVL
aVL
aVR
aVR
aVR
III
III
III
II
II
II
V2
V3
V4
V5
V6
V6
V6
V6
V5
V5
V5
V4
V4
V4
V3
V3
V3
V2
V2
V2
Baseline
exercise
0:00
71 bpm
Max. st
exercise
9:29
157 bpm
Max. st
exercise
9:29
157 bpm
Peak
exercise
9:38
160 bpm
Peak
exercise
9:38
160 bpm
Test end
recovery
13:51
82 bpm
Test end
recovery
13:51
82 bpm
Рис. 13.8 Ишемическая реакция на стресс-тест с физической нагрузкой. (А) A ЭхоКГ до нагрузки. (Б) A ЭхоКГ на пике нагрузки. Гипокинезия ниж-
него и нижнебокового сегментов, индуцированная нагрузкой (стрелки). (В) Распространенная депрессия сегмента ST на ЭКГ (стрелки). (Г) Последующая коро-
нарная ангиография продемонстрировала критический очаговый стеноз правой коронарной артерии (стрелка).
А
Б
Г
В
ch13.indd 287
03.04.2019 11:53:20
288
ЧАСТЬ III Ишемическая болезнь сердца
сердца [49, 50]. Также полезно оценивать кальци-
фикацию корня аорты, аортального клапана и фи-
брозного кольца митрального клапана, поскольку
она связана с большим риском ИБС [51].
РЕЗУЛЬТАТЫ СТРЕСС-ЭХОКАРДИОГРАФИИ
Абсолютные показания к прекращению стресс-
ЭхоКГ: боль в груди, значительные изменения сег-
мента ST помимо исходных (косовосходящая де-
прессия сегмента ST ≥ 1,5 мм и горизонтальная или
косонисходящая депрессия сегмента ST ≥ 2 мм, см.
рис. 13.5), новые нарушения локальной сократимо-
сти миокарда (табл. 13.8). Другие показатели для
ИБС не специфичны и относятся к значительному
увеличению риска, связанному с продолжением
стресс-теста у пациента с тяжелой одышкой, сниже-
нием насыщения миокарда кислородом или сниже-
нием систолического давления из-за длительной
желудочковой тахикардии, гипоперфузии или тя-
желой легочной гипертензии. В таких ситуациях
риск превышает пользу. Относительные противо-
показания не столь серьезные, как абсолютные, но
являются достаточным аргументом для прекраще-
ния теста. В нашей лаборатории мы используем их
в качестве индикаторов для прекращения стресс-
теста и проведения другого диагностического ис-
следования с целью выявления ишемии, если еще
нужна диагностика стресс-индуцированной ише-
мии.
ТОЧНОСТЬ СТРЕСС-ЭХОКАРДИОГРАФИИ
С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
Точность стресс-ЭхоКГ с физической нагрузкой на-
ходится в диапазоне от 69 до 91%, чувствитель-
ность — от 71 до 94% (см. табл. 13.6). Чувствитель-
ность в выявлении однососудистого поражения при
ИБС несколько ниже — 70–85%. Специфичность
стресс-ЭхоКГ варьирует от 41 до 100%. Такой ши-
рокий диапазон обусловлен разными факторами:
различиями лабораторий, характеристиками обсле-
дуемых пациентов (например, с плохой акустиче-
ской доступностью из-за ожирения, хронической
Рис. 13.9 Ишемическая реакция на стресс-тест с физической нагрузкой. (А, Б) ЭхоКГ до нагрузки (слева) и на пике нагрузки (справа). Гипокинезия пе-
реднесептального, переднего и бокового сегментов (стрелки). (В) Распространенная депрессия сегмента ST и элевация сегмента ST на ЭКГ в отведении aVR (стрел-
ки). (Г) Последующая коронарная ангиография продемонстрировала критический очаговый стеноз левой передней нисходящей артерии (стрелка).
До нагрузки
На пике нагрузки
На пике нагрузки
I
II
III
aVR
aVL
aVF
V1
V2
V3
V4
V5
V6
До нагрузки
Г
В
А
Б
ch13.indd 288
03.04.2019 11:53:21
289
13 Стресс-эхокардиография при ишемии коронарных артерий
обструктивной болезни легких, предшествующей
операции, деформации грудной клетки), опыта и
знаний специалистов по УЗИ и ЭхоКГ, качества ап-
паратуры.
Факторами, влияющими на чувствительность,
являются низкое качество изображения, задержка
в постобработке, низкая претестовая вероятность
ИБС, неспособность пациента достичь целевой ЧСС
или двойного произведения, отсутствие критиче-
ского стеноза коронарной артерии, однососудистое
поражение коронарного русла, сбалансированная
ишемия при многососудистых поражениях и изме-
нения боковой стенки. Специфичность может быть
снижена из-за отсутствия сократительного резерва
вследствие патологии клапанов сердца и кардио-
миопатии, нарушений локальной сократимости и
феномена привязки сегментов миокарда. Замед-
ление межжелудочковой проводимости, эктопиче-
ский ритм и гипертензивная реакция на нагрузку
также снижают специфичность метода.
Рис. 13.10 Ишемическая реакция на стресс-тест с физической нагрузкой. (А, В) ЭхоКГ до нагрузки. (Б, Г) ЭхоКГ на пике нагрузки. Гипокинезия нижне-
го и нижнебокового сегментов (стрелки). (Д) Распространенная депрессия сегмента ST на ЭКГ (стрелки). (Е) Последующая коронарная ангиография продемон-
стрировала тенденцию к коронарному вазоспазму без существенного стеноза коронарной артерии (стрелка).
V6
V3
V2
Исходная
1 Mets
8 Mets
81 bpm
155 bpm
160/80
ST @ 10mm/mV
80ms postJ
ST @ 10mm/mV
60ms postJ
Lead
ST
slope
Exercise 3
6:42
Exercise 1
00:00
0,1 mm
–0,3 mV/s
0,5
–0 ,5
0,5
–1 ,0
0,5
–0 ,8
–0 ,1
–0 ,5
–0 ,2
–0 ,4
0,1
–0 ,2
0,5
–0 ,2
0,2
–1,1
0,2
–1,0
–0 ,9
0,9
3,1
–1 ,4
–0 ,6
0,0
–2,9
1,8
0,0
1,2
–2,8
1,4
–2,5
0,1
–1 ,7
0,9
–5 ,3
1,0
1,7
0,2
–4 ,3
0,5
–4 ,8
0,9
0,7
0,0
0,0
–0,7
Максимальная депрессия сегмента ST
V1
V5
V4
V6
V3
V2
V1
V5
V4
aVF
aVL
aVR
aVF
aVL
aVR
III
II
I
III
II
I
А
Б
В
Г
Д
Е
ch13.indd 289
03.04.2019 11:53:22
290
ЧАСТЬ III Ишемическая болезнь сердца
Стресс-ЭхоКГ более точна при выявлении мно-
гососудистых поражений коронарного русла, чем
однососудистых, но иногда ограничена сбалансиро-
ванной ишемией, как и другие методы визуализа-
ции, которые выявляют ИБС по сократимости или
перфузии миокарда. Показано, что стресс-ЭхоКГ
имеет чувствительность 75% при выявлении стено-
за левой передней нисходящей артерии, 33% — сте-
ноза огибающей артерии, 78% — при поражении
правой коронарной артерии и 65% — при оценке
всех коронарных сосудов. Результаты стресс-ЭхоКГ
сопоставимы с результатами однофотонной эмис-
сионной компьютерной томографией (ОФЭКТ), за
исключением поражения огибающей артерии, в от-
ношении которой стресс-ЭхоКГ менее чувствитель-
на (рис. 13.14) [52]. Стресс-ЭхоКГ имеет большую
чувствительность в выявлении пациентов с боль-
шей степенью ишемии миокарда и поражении не-
скольких коронарных артерий. Кроме того, стресс-
ЭхоКГ с горизонтальной велоэргометрией превос-
ходит стресс-ЭхоКГ с нагрузкой на тредмиле при
определении степени ишемии миокарда по количе-
ству пораженных сегментов, однако диагностика
тяжести нарушений локальной сократимости мио-
карда у обоих методов сходна [53].
ЧУВСТВИТЕЛЬНОСТЬ, СПЕЦИФИЧНОСТЬ
И ПРОГНОСТИЧЕСКАЯ ЗНАЧИМОСТЬ
Ashley и соавт. [54] провели метаанализ и обобщили
данные о чувствительности и специфичности стресс-
ЭхоКГ и других методов. У пациентов без предше-
ствующего ИМ чувствительность, специфичность и
прогностическая значимость стресс-ЭхоКГ состави-
ли 87, 84 и 85% соответственно, по сравнению с чув-
ствительностью 86%, специфичностью 62% и про-
гностической значимостью 74% ОФЭКТ. Не исклю-
чая предшествующего ИМ, сцинтиграфия с таллием
имела чувствительность, специфичность и прогно-
стическую значимость 85, 85 и 85% соответственно,
тогда как у стресс-ЭхоКГ они составили 84, 75 и 80%
соответственно. Итак, чувствительность, специфич-
ность и прогностическая значимость стресс-ЭхоКГ и
нагрузочной сцинтиграфии с визуализацией перфу-
Рис. 13.11 Ишемическая реакция на стресс-тест с физической нагрузкой. (А, В) A ЭхоКГ до нагрузки. (Б, Г) A ЭхоКГ на пике нагрузки. Акинезия апи-
кальных переднего и нижнего сегментов (стрелки). (Д) Распространенная депрессия сегмента ST и элевация сегмента ST на ЭКГ в отведении aVR (стрелки). (Е)
Последующая коронарная ангиография продемонстрировала критический стеноз левой передней нисходящей артерии (стрелка).
Baseline
exercise
0:00
61 bpm
106/68 mmHg
V1
0,15
0,16
V1
1,20
0,09
V1
1,20
0,09
V1
1,20
–0,07
V2
0,20
–0,07
V2
1,15
0,07
V2
1,15
0,07
V2
0,15
–0,14
V3
0,35
0,12
V4
0,30
0,12
V5
0,20
0,10
V6
0,15
–0,01
V6
–1 ,25
–0 ,41
V6
–1 ,25
–0 ,41
V6
0,10
0,10
V5
–1 ,95
–0 ,66
V5
–1 ,95
–0 ,66
V5
0,15
–0,11
V4
–1 ,85
–0 ,66
V4
–1 ,85
–0 ,66
V4
0,15
–0,13
V3
–1 ,90
0,39
V3
–1 ,90
–0 ,39
V3
0,15
–0,20
Max. st
exercise
6:57
117 bpm
Peak
exercise
6:57
117 bpm
Test end
recovery
11:02
117 bpm
А
Б
Д
Г
В
Е
ch13.indd 290
03.04.2019 11:53:23
291
13 Стресс-эхокардиография при ишемии коронарных артерий
зии миокарда сопоставимы. Однако вполне возмож-
но, что существуют различия между отдельными
эхокардиографическими и радиологическими лабо-
раториями.
В исчерпывающем обзоре Dowsley и соавт. срав-
нили стресс-ЭхоКГ с КТ сердца, позитронно-эмис-
сионной томографией (ПЭТ), нагрузочной магнит-
но-резонансной томографии (МРТ) сердца с визуа-
лизацией сократимости миокарда, нагрузочной МРТ
сердца с визуализацией перфузии миокарда, а также
с ОФЭКТ и нагрузочной ЭКГ. Наибольшая чувстви-
тельность (> 90%) была у КТ сердца, ПЭТ и нагру-
зочной МРТ сердца с визуализацией перфузии ми-
окарда. Чувствительность стресс-ЭхоКГ, нагрузоч-
ной МРТ сердца с визуализацией сократимости
миокарда и ОФЭКТ была схожей (от 79 до 85%).
Хотя специфичность стресс-ЭхоКГ была самой
высокой из всех изученных методов (87%), общие
особенности других методов визуализации были
схожи (от 82 до 86%). Как и следовало ожидать, чув-
ствительность и специфичность нагрузочной ЭКГ
были самыми низкими — 68 и 77% соответственно.
Таким образом, за исключением нагрузочной
ЭКГ, все рассмотренные методы визуализации име-
ют близкие чувствительность, специфичность и
прогностическую значимость.
Metz [55] сравнил прогностическую значимость
нормальной нагрузочной сцинтиграфии с визуали-
зацией перфузии миокарда (с таллием и/или сеста-
миби) с прогностической значимостью нормальной
стресс-ЭхоКГ. Прогноз после любого из этих мето-
дов визуализации был превосходным. Отрицатель-
ная прогностическая значимость каждого из тестов
была одинаково высокой. Отрицательная прогно-
стическая значимость при перфузии миокарда для
ИМ и сердечной смерти через 36 мес составляла
Рис. 13.12 Ишемическая реакция при контрастной стресс-эхокардиографии с физической нагрузкой. (А, В) A A ЭхоКГ до нагрузки. Пациент с аки-
незией базального верхушечного сегмента (стрелки). (Б, Г) A A ЭхоКГ на пике нагрузки. Обширная гипокинезия в области верхушки и бокового сегмента, ин-
дуцированная физической нагрузкой (стрелки), и транзиторная ишемическая дилатация ЛЖ. Последующая коронарная ангиография (не показана) продемонстри-
ровала выраженное поражение коронарного русла (трех сосудов) при ишемической болезни сердца.
А
Б
Г
В
ch13.indd 291
03.04.2019 11:53:24
292
ЧАСТЬ III Ишемическая болезнь сердца
98,8% (ДИ от 98,5 до 99,0%). Последующие данные
для стресс-ЭхоКГ были через 33 мес, а отрицатель-
ная прогностическая значимость была одинаково
высокой — 98,4% (ДИ от 97,9 до 98,9%). Средние го-
довые показатели составили около 0,5% и у мужчин
и женщин были равны. Для повторных событий,
например нестабильной стенокардии или реваску-
ляризации, доля была около 1% и также была сход-
ной для методов визуализации. Учитывая высокую
и сопоставимую отрицательную прогностическую
значимость любого из методов визуализации на
протяжении почти 3 лет, они оказались клинически
очень полезными.
БЛНПГ на ЭКГ ассоциируется с повышенным
риском развития ИБС и смерти. На фоне БЛНПГ на-
грузочная ЭКГ неинформативна, а визуализация
перфузии миокарда имеет сниженную специфич-
ность. Bouzas-Mosquera и соавт. [56] изучили про-
гностическую значимость стресс-ЭхоКГ при нали-
чии БЛНПГ. Из 8050 пациентов, которым проводи-
ли стресс-ЭхоКГ, БЛНПГ была у 618 (7,7%). Ишемию
определяли как новое или прогрессирующее нару-
шение локальной сократимости при напряжении,
за исключением септальных сегментов. В качестве
критерия ишемии использовали нарастающее утол-
щение перегородки. Средняя продолжительность
наблюдения составила 4,6 года. Пациенты, у кото-
рых развилась ишемия (n = 177), имели более высо-
кую летальность в течение 5 лет по сравнению с па-
циентами с отрицательным результатом теста
(24,6% vs 12,6%, p = 0,001) и почти в 2 раза больше
Рис. 13.13 Стресс-эхокардиография с физической нагрузкой при ди-
астолической дисфункции. Допплеровские параметры при ЭхоКГ до физи-
ческой нагрузки и после ограниченной симптомами стресс-ЭхоКГ. (А) Пациент
с нормальной диастолической функцией: одинаковое увеличение скоростей E
и e′ с практически неизменным отношением E/e′. (Б) Пациент с нормальной и
псевдонормальной диастолической функцией, а также выраженным увеличе-
нием скоростей E и e′ и отношением E/e′, свидетельствующими о диастоличе-
ской дисфункции, индуцированной физической нагрузкой.
E/e′ 8
E/e′ 7
E/e′ 11
E/e′ 21
E50
E60
E80
E 150
e′ 6e
′9
e′ 7e
′7
Покой
Нагрузка
А
Б
Ложноположительный
результат
Ложноотрицательный
результат
Изолированное нарушение
сократимости базального
нижнего сегмента
Субмаксимальная
физическая нагрузка
Блокада ножки пучка Гиса
Лечение антиишемическими
препаратами
Желудочковая стимуляция
Стеноз коронарной артерии
< 50%
Предшествующая операция
на открытом сердце
Плохая визуализация
границ эндокарда
Значительная гипертензия
во время стресс-теста
Различный ракурс
изображений до и после
стресс-теста
Погрешности интерпретации
(например, высокая
претестовая вероятность)
Сбалансированная ишемия
Кардиомиопатия (особенно
гипертрофическая
кардиомиопатия)
Гипертрофия левого
желудочка
Различный ракурс
изображений до и после
стресс-теста
[Marwick TH. Stress echocardiography, Heart 89:113–118, 2003.]
ТАБЛИЦА 13.7
Причины ложноположительных
и ложноотрицательных результатов
стресс-эхокардиографии
ch13.indd 292
03.04.2019 11:53:25
293
13 Стресс-эхокардиография при ишемии коронарных артерий
серьезных неблагоприятных кардиальных событий
(18,1% vs 9,7%, p = 0,003) (рис. 13.15) [56]. В этом же
исследовании пациенты с нормальной ЭхоКГ и па-
тологической при физической нагрузке (определяли
по аномалии в покое из-за нарушения сократимости
миокарда, возникшего при нагрузке) имели значи-
тельно больше сердечных неблагоприятных карди-
альных событий. Многомерный анализ показал, что
появление новых нарушений локальной сократи-
мости миокарда было основным независимым про-
гностическим фактором смерти (HR 2,42; 95% ДИ
1,30–8,82; p = 0,013) (табл. 13.9) [56]. Исследователи
также обнаружили, что у пациентов с БЛНПГ стресс-
ЭхоКГ превосходила клинический анализ, ЭхоКГ в
покое и нагрузочную ЭКГ без ЭхоКГ.
Дополнительные признаки высокого риска —
стресс-индуцированные нарушения локальной со-
кратимости миокарда во многих сегментах, особен-
но при исходных и вызванных стресс-тестом нару-
шениях. Кроме того, с высоким риском связаны
ишемия в области левой передней нисходящей ар-
терии, стресс-индуцированные нарушения локаль-
ной сократимости миокарда в нескольких сегмен-
тах, низкий порог ишемии, отсутствие увеличения
фракции выброса в ответ на физическую нагрузку,
отсутствие уменьшения конечно-систолического
объема ЛЖ и исходная гипертрофия ЛЖ. Пациен-
ты с нарушением локальной сократимости миокар-
да в покое и без стресс-индуцированной ишемии
имеют промежуточный риск [23].
В табл. 13.4 перечислены преимущества и недо-
статки современных методов стресс-визуализации
сердца [24]. Дополнение визуализации к стресс-
тесту помимо одной нагрузочной ЭКГ значительно
повышает чувствительность и специфичность, а
выявление нарушений локальной сократимости с
помощью стресс-ЭхоКГ более специфично, чем вы-
явление дефектов перфузии миокарда при радиону-
клидном исследовании (табл. 13.10) [57].
Выбор подходящего для пациента теста зависит
от качества эхокардиографического изображения, а
также от экспертной оценки локальной сократи-
мости в сердечно-сосудистых центрах с помощью
стресс-ЭхоКГ, радионуклидного исследования, КТ
или МРТ сердца. К факторам, которые также следу-
ет учитывать, относятся затраты и лучевая нагрузка
(каждый из них свидетельствует в пользу стресс-
ЭхоКГ).
Рис. 13.14 Сравнение чувствительности стресс-эхокардиографии и
однофотонной эмиссионной томографии однососудистого поражения
разных коронарных артерий. Чувствительность стресс-ЭхоКГ и однофотон-
ной эмиссионной томографии (ОФЭКТ) сопоставимы, за исключением обнару-
жения однососудистого поражения — левой огибающей артерии (ЛОА).
ЛПНА — левая передняя нисходящая артерия; нд — недостоверно; ПКА —
правая коронарная артерия; ЭхоКГ — эхокардиография [O’Keefe JH, Barnhart
CS, Bateman TM. Comparison of stress echocardiography and stress myocardial
perfusion scintigraphy for diagnosing coronary artery disease and assessing its se-
verity. Am J Cardiol 75:25D–34D, 1995].
0
ЛПНА
3
8
4
/
4
8
2
2
5
1
/
3
4
7
4
1
5
/
4
8
0
1
0
5
0
/
1
3
2
8
ЛОА
ПКА
Чувствительность
Все сосуды
20
40
60
80
100
80%
p=нд
p < 0,00001
p=нд
p=нд
75%
72%
83%
78%
79%
65%
33%
ОФЭКТ
Стресс-ЭхоКГ
%
Абсолютные показания
Умеренный или тяжелый приступ стенокардии
Выра женная одышка
Снижение насыщения O2 < 90% или снижение≥ 10%
от исходного уровня
Снижение систолического артериального давления
≥10ммрт.ст.
Явные признаки гипоперфузии
Стойкая желудочковая тахикардия
Элевация сегмента ST ≥ 1 мм (не в отведениях V1 или aVR)
Множественные нарушения локальной сократимости мио-
карда или глобальная гипокинезия левого желудочка
Тяжелая легочная гипертензия (ДЛА ≥ 60 мм рт. ст.)
Относительные показания
Снижение систолического артериального давления
от исходного уровня, но без ишемии
Горизонтальная или косонисходящая депрессия
сегмента ST ≥ 2 мм
Наджелудочковая тахикардия, предсердно-желудочковая
блокада, брадиаритмия, нестойкая желудочковая
тахикардия
Систолическое артериальное давление ≥ 250 мм рт. ст. или
диастолическое артериальное давление ≥ 150 мм рт. ст.
Блокада ножки пучка Гиса или нарушение внутрижелудоч-
ковой проводимости, которые нельзя отличить от желу-
дочковой тахикардии
Стандартные показания
Достижение целевой ЧСС или двойного произведения
Утомление
Одышка
Неспособность пациента продолжать физическую нагрузку
ДЛА — давление в легочной артерии; ЧСС — частота сердечных
сокращений.
ТАБЛИЦА 13.8
Абсолютные, относительные
и стандартные показания
к прекращению стресс-эхокардиографии
ch13.indd 293
03.04.2019 11:53:25
294
ЧАСТЬ III Ишемическая болезнь сердца
ПЕРСПЕКТИВЫ
ОЦЕНКА ДЕФОРМАЦИИ МИОКАРДА
Интерпретация стресс-индуцированных наруше-
ний локальной сократимости миокарда является
высококачественным подходом, и, хотя чувстви-
тельность и специфичность стандартной стресс-
ЭхоКГ с физической нагрузкой также превосходны,
количественный подход может оказаться более
предпочтительным для уменьшения вариабельно-
сти межэкспертной оценки. Деформацию миокарда
измеряют либо при тканевой допплерографии, ли-
бо с помощью спекл-трекинг ЭхоКГ. Одно из ос-
новных преимуществ спекл-трекинга ЭхоКГ — это
оценка глобальной деформации (функции миокар-
да), полезная при продольном наблюдении пациен-
та с патологией клапанов или онкологической пато-
логией сердца. При стресс-ЭхоКГ обычно выявляют
локальную дисфункцию миокарда. Argyle и соавт.
[58] установили, что деформация миокарда сначала
Рис. 13.15 Кривые выживаемости Kaplan–Meier, показывающие выживаемость в течение 5 лет без серьезных неблагоприятных кардиальных
событий и уровни выживаемости пациентов с различными реакциями при стресс-эхокардиографии с физической нагрузкой. (А) Кривые выжи-
ваемости без серьезных неблагоприятных кардиальных событий (major adverse cardiac events, MACE) пациентов с ишемической и неишемической реакцией при
стресс-ЭхоКГ с физической нагрузкой. (Б) Кривые выживаемости без серьезных неблагоприятных кардиальных событий пациентов с нормальной и любой пато-
логической реакцией при стресс-ЭхоКГ с физической нагрузкой. (В) Кривые выживаемости пациентов с ишемическими и неишемическими реакциями при стресс-
ЭхоКГ с физической нагрузкой. (Г) Кривые выживаемости пациентов с нормальной и любой патологической реакцией при стресс-ЭхоКГ с физической нагрузкой
[Bouzas-Mosquera EG, Corsi C, Zamorano J, et al. Improved semiautomated quantification of left ventricular volumes and ejection fraction using 3-dimensional echocar-
diography with a full matrix-array transducer: comparison with magnetic resonance imaging. J Am Soc Echocardiogr 18:779–788, 2005].
Патологическая реакция 334
Нормальная реакция
100
80
60
40
В
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
M
A
C
E
(
%
)
20
0
p < 0,001
01234
Время (годы)
567891
0
Патологическая реакция
Нормальная реакция
275
203
142
90
61
25
197
141
81
40
15
100
80
60
40
В
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
M
A
C
E
(
%
)
20
0
01234
Время (годы)
Ишемия
Ишемия 177
p = 0,003
Нет ишемии
Нет ишемии 432
314
226
137
84
36
86
57
34
17
4
567891
0
p < 0,001
Ишемия
Нет ишемии
100
80
60
40
В
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
20
0
01234
Время (годы)
Ишемия 177
Нет ишемии 432
327
239
151
92
38
123
86
53
25
8
567891
0
100
80
60
40
В
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
20
0
p < 0,001
Патологическая реакция
Нормальная реакция
Патологическая реакция 334
Нормальная реакция 275
206
148
Время (годы)
95
65
27
244
177
109
52
19
01234567891
0
Количество пациентов в группе риска
Количество пациентов в группе риска
Количество пациентов в группе риска
Количество пациентов в группе риска
А
Б
Г
В
ch13.indd 294
03.04.2019 11:53:25
295
13 Стресс-эхокардиография при ишемии коронарных артерий
увеличивается одновременно с увеличением ЧСС,
затем выравнивается и даже может уменьшиться
из-за вызванного тахикардией снижения наполне-
ния ЛЖ и уменьшения ударного объема. С увели-
чением ЧСС линейно возрастает скорость дефор-
мации миокарда (т.е . изменение деформации во
времени), следовательно, ее можно успешно ис-
пользовать во время стресс-ЭхоКГ в качестве пока-
зателя функции миокарда. Есть сообщение, что на-
рушения постсистолической деформации миокарда
(т.е. деформации после закрытия аортального кла-
пана) являются еще одной детерминантной ише-
мии миокарда [59]. Для диагностики ИБС деформа-
цию миокарда оценивали во время стресс-теста с
физической нагрузкой (рис. 13.16) [60] и стресс-
теста с добутамином [61–63]. Есть предварительные
данные, что стресс-тест с добутамином может быть
полезен для оценки жизнеспособности миокарда
после ИМ [64]. Однако основными ограничениями
этого метода являются: (1) оценка апикальных сег-
ментов (в частности с помощью тканевой доппле-
рографии) [61]; (2) зависимость от качества изо-
бражения (особенно при спекл-трекинг ЭхоКГ);
(3) различия углов сканирования при тканевой доп-
плерографии (влияет на измерения деформации);
(4) необходимость определения зоны интереса
вручную; (5) ручное подтверждение трекинга, вы-
полненного с помощью программного обеспечения
автоматически; (6) дополнительное время для по-
стобработки и интерпретации. Кроме того, большая
часть информации по измерению деформации при
стресс-ЭхоКГ получена из немногочисленных ис-
следований с участием людей и экспериментов на
животных, а дополнительная ценность за предела-
ми визуальной оценки нарушений локальной со-
кратимости миокарда не была достаточно убеди-
тельно продемонстрирована [64]. По причине этих
ограничений в современных руководствах не реко-
мендуется рутинная оценка деформации миокарда
во время стресс-ЭхоКГ. Однако появление новых
технологий и улучшение алгоритмов трекинга мо-
гут возродить интерес к исследованию деформации
миокарда для диагностики ИБС.
ТРЕХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
3D-ЭхоКГ в режиме реального времени позволяет
быстро получать полнообъемные изображения во
время стресс-теста. Ряд объемных данных можно
использовать для создания стеков изображений по
короткой оси на любом уровне ЛЖ (рис. 13.17). Ос-
новные преимущества этого метода:(1) неограни-
ченное количество томографических изображений,
что позволяет отображать любой сегмент желудоч-
ка в нескольких плоскостях; (2) возможность выби-
рать предварительные и заключительные объемные
данные для наилучшего соответствия сегментам
миокарда, что позволяет сравнивать нарушения ло-
кальной сократимости миокарда до и после нагруз-
Фактор
HR 95%ДИ p
Мужской пол
1,97 1,29–3,02 0,002
Возраст (по годам)
1,05 1,02–1,07 < 0,001
Фибрилляция предсердий
2,24 1,27–3,97 0,006
WMSI* в покое
3,12 2,02–4,80 < 0,001
MET
0,88 0,82–0,94 < 0,001
ΔWMSI
2,42 1,21–4,82 0,012
* WMSI оставался независимым прогностическим фактором смерт-
ности и основных кардиальных событий после клинических фак-
торов, данных исходной ЭхоКГ и результатов тредмила.
MET — метаболический эквивалент; ΔWMSI — изменение индекса
сократимости миокарда; WMSI — индекс сократимости миокар-
да; ДИ — доверительный интервал.
[Bouzas-Mosquera A, Peteiro J, Alvarez-Garcia N, et al. Prognostic value
of exercise echocardiography in patients with left bundle branch block,
JACC Cardiovasc Imaging 2:251–259, 2009.]
ТАБЛИЦА 13.9
Прогностические факторы
общей смертности пациентов
с блокадой левой ножки пучка Гиса
(n = 609), которым выполняли
стресс-эхокардиографию
с физической нагрузкой
Метод
визуализации
Чувствительность
(%)
Специфичность
(%)
Компьютерная
томографическая
ангиография
98
82
Стресс-ЭхоКГ
79
87
Позитронно-
эмиссионная
томография
92
85
Стресс-МРТ
сократимости
миокарда
83
86
Стресс-МРТ
перфузии
миокарда
91
81
Однофотонная
эмиссионная
компьютерная
томография
85
85
Нагрузочная-ЭКГ
68
77
МРТ — магнитно -резонансная томография; ЭКГ — электрокарди-
ограмма; ЭхоКГ — эхокардиография.
[Dowsley T, Al-Mallah M, Ananthasubramaniam K, et al. The role of
noninvasive imaging in coronary artery disease detection, prognosis,
and clinical decision making. Can J Cardiol 29:285–296, 2013.]
ТАБЛИЦА 13.10
Сравнение чувствительности
и специфичности различных методов
визуализации при диагностике
ишемической болезни сердца
ch13.indd 295
03.04.2019 11:53:26
296
ЧАСТЬ III Ишемическая болезнь сердца
Рис. 13.16 Двухмерная спекл-трекинг эхокардиография и кривые поперечной деформации при окклюзии и реперфузии коронарной артерии.
Двухмерная спекл-трекинг ЭхоКГ в апикальной позиции по длинной оси (А, Б, В) и кривые поперечной деформации (Г, Д, Е) медиального переднесептального
сегмента (AS, оранжевая кривая), апикального переднего сегмента (АА, зеленая кривая) и медиального нижнебокового сегмента (IL, фиолетовая кривая) у 65-лет-
него мужчины с 90% стенозом сегмента 6, кровоснабжаемого левой передней нисходящей артерией, в начале обследования и через 20 и 50 сек после окклюзии
коронарной артерии. Деформация миокарда обозначена желтым цветом (интенсивность цвета соответствует степени деформации). Через 20 сек после окклюзии
коронарной артерии продолжительностью в 1/3 диастолы деформация высокой степени (Б, стрелка) появилась в сегментах риска из-за задержки расслабления.
Через 50 сек степень деформации тех же сегментов в конце систолы стала низкой (В, стрелка), указывая на вызванную ишемией систолическую дисфункцию. Во
время окклюзии коронарной артерии максимальная деформация была значительно снижена и задерживалась в сегментах риска, индекс диастолической дефор-
мации также был существенно снижен. ЗАК — закрытие аортального клапана [Ishii K, Suyama T, Imai M, et al. Abnormal regional left ventricular systolic and diastol-
ic function in patients with coronary artery disease undergoing percutaneous coronary intervention: clinical significance of post-ischemic diastolic stunning, J Am Coll Car-
diol 54:1589–1597, 2009].
А
Б
В
Г
Д
Е
20 сек
ЗАК (1/3 диастолы)
ЗАК (1/3 диастолы)
ЗАК (1/3 диастолы)
1/3 диастолы
1/3 диастолы
Конец систолы
50 сек
Исходные данные
ки; (3) быстрый захват изображений, что теорети-
чески может предотвращать формирование пост-
нагрузочного изображения при субмаксимальной
ЧСС; (4) уменьшает проблему апикального досту-
па; (5) снижает ответственность оператора за полу-
чение оптимального изображения; (6) обеспечивает
возможность более точных измерений объема ЛЖ
и фракции выброса; (7) снижает межэкспертную ва-
риабельность измерений [65, 66]. Основным преи-
муществом 3D-ЭхоКГ при нагрузочных тестах яв-
ляется возможность быстро получать полноценную
информацию о нарушениях локальной сократимо-
сти миокарда всего ЛЖ. Исследования Peteiro и
соавт. [67] и Jenkins и соавт. [68] проведения трех-
мерной стресс-ЭхоКГ с нагрузкой на тредмиле по-
казали, что 3D-ЭхоКГ обладает лучшей чувстви-
тельностью и специфичностью для выявления ИБС
(подтверждена коронарной ангиографией) по срав-
нению с двухмерной стресс-ЭхоКГ.
Недостатки 3D-ЭхоКГ: (1) длительная постобра-
ботка изображений; (2) более крупный шаг датчика,
что иногда затрудняет получение оптимальных
изображений; (3) длительность обучения специали-
стов; (4) меньше временно
́
е и пространственное
разрешения по сравнению с 2D-ЭхоКГ. Однако мы
полагаем, что значение визуализации в 3D-режиме
во время стресс-теста будет возрастать по мере усо-
вершенствования оборудования и программного
обеспечения для обработки изображений.
Итак, стресс-ЭхоКГ с физической нагрузкой яв-
ляется безопасным методом диагностики ИБС с от-
личными чувствительностью и специфичностью.
ch13.indd 296
03.04.2019 11:53:26
297
13 Стресс-эхокардиография при ишемии коронарных артерий
А
Б
В
Рис. 13.17 Трехмерная эхокардиография. Получение полнообъемного трехмерного изображения для создания стеков изображений по короткой оси (А, Б) с
целью оценки нарушений локальной сократимости миокарда, объемов и фракции выброса ЛЖ (В).
Этап
Технические детали
Результаты
Интерпретация
Исходная
ЭхоКГ
Оценка функции ЛЖ и ПЖ и сократимости
миокарда:
• Парастернальная позиция по длинной оси
• Парастернальная позиция по короткой оси
• Парастернальная позиция приточного отдела ПЖ
• Апикальная четырехкамерная позиция
• Апикальная двухкамерная позиция
• Апикальная позиция по длинной оси (может
заменять парастернальную позицию по длинной
оси)
Исходные нарушения
локальной сократимости
Переоценка
целесообразности
стресс-ЭхоКГ
в качестве
диагностического
метода
Оценка диастолической функции в покое (скорость
E при импульсно-волновой допплерографии,
скорость e′ при тканевой допплерографии
с высокой скоростью развертки)
Нормальная
диастолическая функция,
диастолическая
дисфункция I–III степени
Использовать в качестве
эталона для сравнения
с данными при
физической нагрузке
Оценка функции клапанов
Тяжелый аортальный
стеноз
Остановить тест, если
целью является оценка
функциональных
возможностей
пациента без
симптомов
Оценка систолического давления в легочной
артерии:
• Максимальная скорость струи трикуспидальной
регургитации
• Диаметр НПВ, коллабирование НПВ на вдохе
Тяжелая легочная
гипертензия
(≥ 60 мм рт. ст.)
Переоценка
целесообразности
стресс-ЭхоКГ
СВОДНАЯ ИНФОРМАЦИЯ
Стресс-эхокардиография при различных видах физической нагрузки
ch13.indd 297
03.04.2019 11:53:27
298
ЧАСТЬ III Ишемическая болезнь сердца
Этап
Технические детали
Результаты
Интерпретация
Физическая
нагрузка
Тредмил
Вертикальная велоэргометрия
Горизонтальная велоэргометрия
Дополнительные вмешательства:
• Кистевой жим
• Атропин 0,4 до максимальных 2,0 мг
Функциональные
возможности (ватт, MET,
шкала субъективного
восприятия нагрузки
Borg)
< 5 MET: низкие
5–8 MET: умеренные
9–11 MET: хорошие
≥ 12 MET: высокие
Достигнутая внешняя
рабочая нагрузка (ватт,
MET, процент
прогнозируемой ЧСС–
давление или двойное
произведение)
≥ 85% ожидаемой ЧСС,
соответствующей
возрасту, считают
подходящей рабочей
нагрузкой
Оценка ишемии Тредмил: сразу после нагрузки
Вертикальная/горизонтальная велоэргометрия: во
время каждого этапа нагрузки плюс при
максимальной нагрузке
ЭКГ
Непрерывный мониторинг ЭКГ
Аритмия
Возможный признак
ишемии или
диастолической
дисфункции,
вызванной нагрузкой
ЭКГ в 12 отведениях на каждом этапе нагрузки
Отклонение сегмента ST
(80 мсек после точки J):
• Косовосходящая
депрессия сегмента ST
≥1,5мм
• Горизонтальная или
косонисходящая
депрессия сегмента ST
≥1мм
• Элевация сегмента ST
Ишемия
ЭхоКГ
Оценка функции ЛЖ и ПЖ и локальной
сократимости миокарда:
• Парастернальная позиция по длинной оси
• Парастернальная позиция по короткой оси
Гипердинамическая
Локальная гипокинезия
Локальная акинезия
Норма
Субэндокардиальная
ишемия
Трансмуральная
ишемия
• Апикальная четырехкамерная позиция
• Апикальная двухкамерная позиция
• Апикальная позиция по длинной оси (может
заменять парастернальную позицию по длинной
оси)
Глобальная гипокинезия
или транзиторная
дилатация ЛЖ
Многососудистое
поражение
(т.е. сбалансированная
ишемия)
На усмотрение:
• Парастернальная позиция приточного отдела ПЖ
Гипокинезия или
дилатация
Ишемия ПЖ, вызванная
физической нагрузкой,
легочная гипертензия
• Оценка диастолической функции при нагрузке
(скорость E при импульсно-волновой
допплерографии, скорость e′ при тканевой
допплерографии с высокой скоростью развертки)
Одновременное
увеличение E и e′
Увеличение E > e′
Норма
Диастолическая
дисфункция,
вызванная физической
нагрузкой
Восстановление
ЧСС
При стресс-ЭхоКГ восстановительного периода нет
(по сравнению с нагрузочной ЭКГ)
≥ 18 уд/мин в течение
первой минуты
< 18 уд/мин в течение
первой минуты
Норма
Повышенный сердечно-
сосудистый риск
MET — метаболический эквивалент; ЛЖ — левый желудочек; НПВ — нижняя полая вена; ПЖ — правый желудочек; ЧСС — частота сер-
дечных сокращений; ЭКГ — электрокардиограмма; ЭхоКГ — электрокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Стресс-эхокардиография при различных видах физической нагрузки
ch13.indd 298
03.04.2019 11:53:28
299
13 Стресс-эхокардиография при ишемии коронарных артерий
ЛИТЕРАТУРА
1. Armstrong WF. Acute myocardial ischemia:
from Tennant and Wiggers to contrast echo-
cardiography, J Am Coll Cardiol 7:393–394,
1986.
2. Theroux P, Franklin D, Ross Jr. J, Kemper
WS. Regional myocardial function during
acute coronary artery occlusion and its
modification by pharmacologic agents in the
dog, Circ Res 35:896–908, 1974.
3. Theroux P, Ross Jr. J, Franklin D, et al. Re-
gional myocardial function in the conscious
dog during acute coronary occlusion and re-
sponses to morphine, propranolol, nitroglyc-
erin, and lidocaine, Circulation 53:302–314,
1976.
4. Kerber RE, Marcus ML, Ehrhardt J, et al. Cor-
relation between echocardiographically dem-
onstrated segmental dyskinesis and regional
myocardial perfusion, Circulation 52:1097–
1104, 1975.
5. Wann LS, Faris JV, Childress RH, et al. Exer-
cise cross-sectional echocardiography in isch-
emic heart disease, Circulation 60:1300–1308,
1979.
6. Fazel R, Shaw LJ. Radiation exposure from
radionuclide myocardial perfusion imaging:
concerns and solutions, J Nucl Cardiol
18:562–565, 2011.
7. Holland DJ, Prasad SB, Marwick TH. Prog-
nostic implications of left ventricular filling
pressure with exercise, Circ Cardiovasc Imag-
ing 3:149–156, 2010.
8. Michaelides AP, Fourlas CA, Giannopoulos
N, et al. Significance of QRS duration chang-
es in the evaluation of ST-segment depression
presenting exclusively during the postexercise
recovery period, Ann Noninvasive Electrocar-
diol 11:241–246, 2006.
9. Fihn SD, Gardin JM, Abrams J, et al. Ameri-
can College of Cardiology Foundation: 2012
ACCF/AHA/ACP/AATS/PCNA/SCAI/STS
guideline for the diagnosis and management
of patients with stable ischemic heart disease:
executive summary: a report of the American
College of Cardiology Foundation/American
Heart Association task force on practice
guidelines, and the American College of Phy-
sicians, American Association for Thoracic
Surgery, Preventive Cardiovascular Nurses
Association, Society for Cardiovascular Angi-
ography and Interventions, and Society of
Thoracic Surgeons, Circulation 126:3097–
3137, 2012.
10. Qaseem A, Fihn SD, Williams S, et al. Clinical
Guidelines Committee of the American Col-
lege of Physicians. Diagnosis of stable isch-
emic heart disease: summary of a clinical
practice guideline from the American College
of Physicians/American College of Cardiol-
ogy Foundation/American Heart Associa-
tion/American Association for Thoracic Sur-
gery/Preventive Cardiovascular Nurses Asso-
ciation/Society of Thoracic Surgeons, Ann
Intern Med 157:729–734, 2012.
11. Morise AP, Diamond GA. Comparison of the
sensitivity and specificity of exercise electro-
cardiography in biased and unbiased popula-
tions of men and women, Am Heart J
130:741–747, 1995.
12. Morise AP, Diamond GA, Detrano R, Bobbio
M. Incremental value of exercise electrocardi-
ography and thallium-201 testing in men and
women for the presence and extent of coro-
nary artery disease, Am Heart J 130:267–276,
1995.
13. Banerjee A, Newman DR, Van den Bruel A,
Heneghan C. Diagnostic accuracy of exercise
stress testing for coronary artery disease: a
systematic review and meta-analysis of pro-
spective studies, Int J Clin Pract 66:477–492,
2012.
14. Sarnoff SJ, Braunwald E, Welch Jr. GH, et al.
Hemodynamic determinants of oxygen con-
sumption of the heart with special reference
to the tension-time index, Am J Physiol
192:148–156, 1958.
15. Graham Jr. TP, Covell JW, Sonnenblick EH,
et al. Control of myocardial oxygen con-
sumption: relative influence of contractile
state and tension development, J Clin Invest
47:375–385, 1968.
16. Schwid HA, Buffington CW, Strum DP.
Computer simulation of the hemodynamic
determinants of myocardial oxygen supply
and demand, J Cardiothorac Anesth 4:5–18,
1990.
17. Suga H, Yamada O, Goto Y, Igarashi Y. Oxy-
gen consumption and pressure-volume area
of abnormal contractions in canine heart, Am
J Physiol 246:H154–160, 1984.
18. Suga H, Yamada O, Goto Y, et al. Constant
mechanical efficiency of contractile machin-
ery of canine left ventricle under different
loading and inotropic conditions, Jpn J
Physiol 34:679–698, 1984.
19. American College of Cardiology Foundation
Appropriate Use Criteria Task Force, Ameri-
can Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, Society for Cardiovascular Magnetic
Resonance, American College of Chest Physi-
cians Douglas PS, Garcia MJ, Haines DE, et al.
ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/
SCCM/SCCT/SCMR 2011 appropriate use
criteria for echocardiography. a report of the
American College of Cardiology Foundation
Appropriate Use Criteria Task Force, Ameri-
can Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, Society for Cardiovascular Magnetic
Resonance American College of Chest Physi-
cians, J Am Soc Echocardiogr 24:229–267,
2011.
20. Shaw LJ, Eagle KA, Gersh BJ, Miller DD.
Meta-analysis of intravenous dipyridamole-
thallium-201 imaging (1985 to 1994) and
dobutamine echocardiography (1991 to
1994) for risk stratification before vascular
surgery, J Am Coll Cardiol 27:787–798, 1996.
21. Poldermans D, Arnese M, Fioretti PM, et al.
Sustained prognostic value of dobutamine
stress echocardiography for late cardiac
events after major noncardiac vascular sur-
gery, Circulation 95:53–58, 1997.
22. Beattie WS, Abdelnaem E, Wijeysundera DN,
Buckley DN. A meta-analytic comparison of
preoperative stress echocardiography and
nuclear scintigraphy imaging, Anesth Analg
102:8–16, 2006.
23. Pellikka PA, Nagueh SF, Elhendy AA, et al.
American Society of Echocardiography:
American Society of Echocardiography rec-
ommendations for performance, interpreta-
tion, and application of stress echocardiogra-
phy, J Am Soc Echocardiogr 20:1021–1041,
2007.
24. Dowsley T, Al-Mallah M, Ananthasubrama-
niam K, et al. The role of noninvasive imaging
in coronary artery disease detection, progno-
sis, and clinical decision making, Can J Car-
diol 29:285–296, 2013.
25. Kane GC, Hepinstall MJ, Kidd GM, et al.
Safety of stress echocardiography supervised
by registered nurses: results of a 2-year audit
of 15,404 patients, J Am Soc Echocardiogr
21:337–341, 2008.
26. Fletcher GF, Balady GJ, Amsterdam EA, et al.
Exercise standards for testing and training: a
statement for healthcare professionals from
the American Heart Association, Circulation
104:1694–1740, 2001.
27. Nalawadi SS, Tolstrup K, Cuk O, et al. Atro-
pine as an adjunct to supine bicycle stress
echocardiography: an alternative strategy to
achieve target heart rate or rate pressure prod-
uct, Eur Heart J Cardiovasc Imaging 13:612–
616, 2012.
28. Borg GA. Psychophysical bases of perceived
exertion, Med Sci Sports Exerc 14:377–381,
1982.
29. Lauer MS, Francis GS, Okin PM, et al. Im-
paired chronotropic response to exercise
stress testing as a predictor of mortality, JA-
MA 281:524–529, 1999.
30. Manganelli F, Spadafora M, Varrella P, et al.
Addition of atropine to submaximal exercise
stress testing in patients evaluated for sus-
pected ischaemia with SPECT imaging: a
randomized, placebo-controlled trial, Eur J
Nucl Med Mol Imaging 38:245–251, 2011.
31. Makani H, Bangalore S, Halpern D, et al.
Cardiac outcomes with submaximal normal
stress echocardiography: a meta-analysis, J
Am Coll Cardiol 60:1393–1401, 2012.
32. Nishime EO, Cole CR, Blackstone EH, et al.
Heart rate recovery and treadmill exercise
score as predictors of mortality in patients
referred for exercise ECG, JAMA 284:1392–
1398, 2000.
33. Singh JP, Larson MG, Manolio TA, et al.
Blood pressure response during treadmill
testing as a risk factor for new-onset hyper-
tension. The Framingham heart study, Circu-
lation 99:1831–1836, 1999.
34. Lauer MS, Pashkow FJ, Harvey SA, et al. An-
giographic and prognostic implications of an
exaggerated exercise systolic blood pressure
response and rest systolic blood pressure in
adults undergoing evaluation for suspected
coronary artery disease, J Am Coll Cardiol
26:1630–1636, 1995.
35. Lauer MS, Levy D, Anderson KM, Plehn JF.
Is there a relationship between exercise sys-
tolic blood pressure response and left ven-
tricular mass? The Framingham Heart Study,
Ann Intern Med 116:203–210, 1992.
36. Allison TG, Cordeiro MA, Miller TD, et al.
Prognostic significance of exercise-induced
systemic hypertension in healthy subjects,
Am J Cardiol 83:371–375, 1999.
37. Fagard R, Staessen J, Thijs L, Amery A. Prog-
nostic significance of exercise versus resting
blood pressure in hypertensive men, Hyper-
tension 17:574–578, 1991.
38. Cerqueira MD, Weissman NJ, Dilsizian V, et
al. American Heart Association Writing
Group on Myocardial Segmentation and Reg-
istration for Cardiac Imaging: Standardized
myocardial segmentation and nomenclature
ch13.indd 299
03.04.2019 11:53:28
300 ЧАСТЬ III Ишемическая болезнь сердца
for tomographic imaging of the heart. A state-
ment for healthcare professionals from the
Cardiac Imaging Committee of the Council
on Clinical Cardiology of the American Heart
Association, Circulation 105:539–542, 2002.
39. Turakhia MP, McManus DD, Whooley MA,
Schiller NB. Increase in end-systolic volume
after exercise independently predicts mortal-
ity in patients with coronary heart disease:
data from the Heart and Soul Study, Eur
Heart J 30:2478–2484, 2009.
40. Marwick TH. Stress echocardiography, Heart
89:113–118, 2003.
41. Mark DB, Shaw L, Harrell Jr. FE, et al. Prog-
nostic value of a treadmill exercise score in
outpatients with suspected coronary artery
disease, N Engl J Med 325:849–853, 1991.
42. Marwick TH, Case C, Vasey C, et al. Predic-
tion of mortality by exercise echocardiogra-
phy: a strategy for combination with the
Duke treadmill score, Circulation 103:2566–
2571, 2001.
43. Kane GC, Oh JK. Diastolic stress test for the
evaluation of exertional dyspnea, Curr Car-
diol Rep 14:359–365, 2012.
44. Grewal J, McCully RB, Kane GC, et al. Left
ventricular function and exercise capacity,
JAMA 301:286–294, 2009.
45. Otto ME, Pereira MM, Beck AL, Milani M.
Correlation between diastolic function and
maximal exercise capacity on exercise test,
Arq Bras Cardiol 96:107–113, 2011.
46. Ha JW, Lulic F, Bailey KR, et al. Effects of
treadmill exercise on mitral inflow and an-
nular velocities in healthy adults, Am J Car-
diol 91:114–115, 2003.
47. Holland DJ, Prasad SB, Marwick TH. Prog-
nostic implications of left ventricular filling
pressure with exercise, Circ Cardiovasc Imag-
ing 3:149–156, 2010.
48. La Gerche A, Claessen G, Dymarkowski S, et
al. Exercise-induced right ventricular dys-
function is associated with ventricular ar-
rhythmias in endurance athletes, Eur Heart J
36:1998–2010, 2015.
49. Ha JW, Choi D, Park S, et al. Determinants
of exercise-induced pulmonary hypertension
in patients with normal left ventricular ejec-
tion fraction, Heart 95:490–494, 2009.
50. Shim CY, Kim SA, Choi D, et al. Clinical
outcomes of exercise-induced pulmonary
hypertension in subjects with preserved left
ventricular ejection fraction: implication of
an increase in left ventricular filling pres-
sure during exercise, Heart 97:1417–1424,
2011.
51. Jeon DS, Atar S, Brasch AV, et al. Association
of mitral annulus calcification, aortic valve
sclerosis and aortic root calcification with
abnormal myocardial perfusion single pho-
ton emission tomography in subjects age < or
= 65 years old, J Am Coll Cardiol 38:1988–
1993, 2001.
52. O’Keefe Jr. JH, Barnhart CS, Bateman TM.
Comparison of stress echocardiography and
stress myocardial perfusion scintigraphy for
diagnosing coronary artery disease and as-
sessing its severity, Am J Cardiol 75:25D–34D,
1995.
53. Badruddin SM, Ahmad A, Mickelson J, et al.
Supine bicycle versus post-treadmill exercise
echocardiography in the detection of myocar-
dial ischemia: a randomized single-blind
crossover trial, J Am Coll Cardiol 33:1485–
1490, 1999.
54. Ashley EA, Myers J, Froelicher V. Exercise
testing in clinical medicine, Lancet 356:1592–
1597, 2000.
55. Metz LD, Beattie M, Hom R, et al. The prog-
nostic value of normal exercise myocardial
perfusion imaging and exercise echocardiog-
raphy: a meta-analysis, J Am Coll Cardiol
49:227–237, 2007.
56. Bouzas-Mosquera A, Peteiro J, Alvarez-Gar-
cia N, et al. Prognostic value of exercise echo-
cardiography in patients with left bundle
branch block, JACC Cardiovasc Imaging
2:251–259, 2009.
57. Picano E, Palinkas A, Amyot R. Diagnosis of
myocardial ischemia in hypertensive patients,
J Hypertens 19:1177–1183, 2001.
58. Argyle RA, Ray SG. Stress and strain: double
trouble or useful tool? Eur J Echocardiogr
10:716–722, 2009.
59. Voigt JU, Exner B, Schmiedehausen K, et al.
Strain-rate imaging during dobutamine stress
echocardiography provides objective evi-
dence of inducible ischemia, Circulation
107:2120–2126, 2003.
60. Ishii K, Suyama T, Imai M, et al. Abnormal
regional left ventricular systolic and diastolic
function in patients with coronary artery
disease undergoing percutaneous coronary
intervention: clinical significance of post-
ischemic diastolic stunning, J Am Coll Cardiol
54(17):1589–1597, 2009.
61. Davidavicius G, Kowalski M, Williams RI, et
al. Can regional strain and strain rate mea-
surement be performed during both dobuta-
mine and exercise echocardiography, and do
regional deformation responses differ with
different forms of stress testing? J Am Soc
Echocardiogr 16:299–308, 2003.
62. Goebel B, Arnold R, Koletzki E, et al. Exercise
tissue Doppler echocardiography with strain
rate imaging in healthy young individuals:
feasibility, normal values and reproducibility,
Int J Cardiovasc Imaging 23:149–155, 2007.
63. Kowalski M, Herregods MC, Herbots L, et al.
The feasibility of ultrasonic regional strain
and strain rate imaging in quantifying dobu-
tamine stress echocardiography, Eur J Echo-
cardiogr 4:81–91, 2003.
64. Hanekom L, Jenkins C, Jeffries L, et al. Incre-
mental value of strain rate analysis as an ad-
junct to wall-motion scoring for assessment
of myocardial viability by dobutamine echo-
cardiography: a follow-up study after revas-
cularization, Circulation 112:3892–3900,
2005.
65. Caiani EG, Corsi C, Zamorano J, et al. Im-
proved semiautomated quantification of left
ventricular volumes and ejection fraction
using 3-dimensional echocardiography with a
full matrix-array transducer: comparison
with magnetic resonance imaging, J Am Soc
Echocardiogr 18:779–788, 2005.
66. Hoffmann R, Barletta G, von Bardeleben S, et
al. Analysis of left ventricular volumes and
function: a multicenter comparison of cardiac
magnetic resonance imaging, cine ventricu-
lography, and unenhanced and contrast-en-
hanced two-dimensional and three-dimen-
sional echocardiography, J Am Soc Echocar-
diogr 27:292–301, 2014.
67. Peteiro J, Pinon P, Perez R, et al. Comparison
of 2- and 3-dimensional exercise echocar-
diography for the detection of coronary ar-
tery disease, J Am Soc Echocardiogr 20:959–
967, 2007.
68. Jenkins C, Haluska B, Marwick TH. Assess-
ment of temporal heterogeneity and regional
motion to identify wall motion abnormalities
using treadmill exercise stress three-dimen-
sional echocardiography, J Am Soc Echocar-
diogr 22:268–275, 2009.
ch13.indd 300
03.04.2019 11:53:28
301
14 Стресс-эхокардиография
без физической нагрузки
для диагностики ишемической
болезни сердца
VICTORIA DELGADO, MD, PHD • JEROEN J. BAX, MD, PHD
Стресс-тесты с фармакологической
нагрузкой и протоколы тестов
Стресс-эхокардиография
с добутамином
Стресс-эхокардиография
с дипиридамолом
Стресс-эхокардиография с эргоновином
Стресс-эхокардиография у пациентов
с электрокардиостимуляторами
Точность стресс-эхокардиографии
без физической нагрузки
при диагностике ишемической
болезни сердца
Оценка жизнеспособности миокарда
Стресс-эхокардиография
без физической нагрузки
для оценки прогноза
Контрастная стресс-эхокардиография
с фармакологической нагрузкой
Новые подходы
в стресс-эхокардиографии
Трехмерная стресс-эхокардиография
Резерв коронарного кровотока
Тканевая допплерография и двухмерная
спекл-трекинг эхокардиография
Стресс-эхокардиография
с фармакологической нагрузкой
в клинической практике
Стресс-эхокардиография (стресс-ЭхоКГ) является
основным методом визуализации в диагностике и
выявлении риска у пациентов с ишемической бо-
лезнью сердца (ИБС). Стресс-индуцированные на-
рушения локальной сократимости миокарда явля-
ются маркером ишемии, что выражается в дисба-
лансе потребности в кислороде и его потреблении и
характеризуется последовательностью событий, ко-
торые начинаются с неоднородности кровотока и
метаболических изменений (обратимые нарушения
перфузии миокарда), затем возникает локальная си-
столическая дисфункция (нарушения сократимости
миокарда), появляются изменения на электрокар-
диограмме (ЭКГ) и боль в груди. Для точной диа-
гностики значимой ИБС с помощью стресс-ЭхоКГ
нужно достичь максимальной нагрузки. Для стресс-
ЭхоКГ наиболее широко используют физическую
нагрузку, но у 30–40% пациентов ее нельзя прове-
сти вследствие их неспособности к субмаксималь-
ной физической нагрузке либо невозможно интер-
претировать данные ЭКГ [1]. Для проведения ЭхоКГ
с физической нагрузкой нужен специалист с боль-
шым опытом для ограничения влияния на качество
изображения эффектов гипервентиляции и чрез-
мерных движений грудной клетки, что может сни-
жать диагностическую точность. Стресс-ЭхоКГ с
фармакологической нагрузкой является надежным
и широко применяемым в клинической практике
альтернативным методом диагностики ИБС, а так-
же для определения риска у тяжелых пациентов (па-
циентов с подозрением на ИБС, пациентов с диабе-
том, пациентов, перенесших экстракардиальную
операцию и др.) [1, 2]. Пациентам, которым проти-
вопоказана фармакологическая нагрузка, можно
повести стресс-ЭхоКГ с чреспищеводной электро-
стимуляцией предсердий. Однако этот способ при-
меняют не часто.
Важным показанием к стресс-ЭхоКГ является не-
обходимость оценить жизнеспособность миокарда
у пациентов с ишемической систолической дис-
функцией левого желудочка (ЛЖ). Миокард с дис-
функцией в покое, имеющий потенциал к восста-
новлению после реваскуляризации, обычно отве-
чает на низкую нагрузку улучшением локальной
сократимости миокарда (сократительный резерв).
Если при использовании низкой нагрузки участки
миокарда остаются дисфункциональными, то это
обычно свидетельствует о наличии рубцовых изме-
ch14.indd 301
03.04.2019 11:53:41
302
ЧАСТЬ III Ишемическая болезнь сердца
меряют с помощью манжеты в начале исследования
и на каждом его этапе. ЭхоКГ (исходные и на каж-
дом этапе исследования) обычно проводят в пара-
стернальных позициях по короткой и длинной
осям, апикальной четырехкамерной позиции, апи-
кальной двухкамерной позиции и апикальной по-
зиции по длинной оси. С целью обеспечения срав-
нительного анализа предпочтителен квадратный
формат экрана монитора. Анализ и оценку сократи-
мости миокарда обычно выполняют с использова-
нием 16- или 17-сегментной модели ЛЖ по четы-
рехзначной шкале и связанных с соответствующи-
ми бассейнами коронарных артерий (см. рис. 12 .2)
[5]. Диагностические конечные точки стресс-ЭхоКГ
с фармакологической нагрузкой: максимальная до-
за препарата, достижение нужной ЧСС, появление
новых нарушений локальной сократимости мио-
карда (акинезия) минимум в двух смежных сегмен-
тах ЛЖ (рис. 14.1), сильная боль в груди и ишеми-
ческие изменения на ЭКГ (> 2 Мв в сегменте ST в
двух соседних отведениях) [1]. Недиагностические
(ниже субмаксимального уровня) конечные точки:
гипертензия (систолическое АД (САД) > 220 мм
рт. ст. или диастолическое АД (ДАД) > 120 мм
рт. ст.), гипотензия (падение > 40 мм рт. ст.), над-
желудочковая или желудочковая аритмия и поли-
морфные нарушения желудочкового ритма [1].
СТРЕСС-ЭХОКАРДИОГРАФИЯ С ДОБУТАМИНОМ
Для выявления ишемии миокарда стресс-ЭхоКГ с
добутамином обычно выполняют при непрерыв-
ной внутривенной инфузии препарата в течение
2–3 мин с возрастающей скоростью введения от 5 до
40 мкг/кг/мин или до тех пор, пока не будет достиг-
нута диагностическая конечная точка. Если на фоне
инфузии высокой дозы добутамина нужная ЧСС не
достигнута, то вводят внутривенно атропин, начи-
ная с дозы 0,25 мг и доводя до 1 мг. Для оценки жиз-
неспособности миокарда обычно используют про-
токол с применением низких доз добутамина (мак-
нений миокарда (нежизнеспособный миокард).
При высоких нагрузках и развитии ишемии можно
наблюдать двухфазную реакцию: начальное улуч-
шение локальной сократимости и последующее ее
ухудшение по мере увеличения ЧСС (критический
стеноз). Стресс-ЭхоКГ с добутамином — однин из
наиболее широко применяемых методов оценки
жизнеспособного миокарда, что обусловлено ее без-
опасностью и относительно низкой стоимостью.
Точность диагностики с помощью стресс-ЭхоКГ
зависит от визуализации эндокардиальной поверх-
ности ЛЖ. Применение контрастных средств улуч-
шает диагностическую точность и прогностиче-
скую значимость стресс-ЭхоКГ [3]. Более того, та-
кие дополнительные возможности визуализации,
как трехмерная трансторакальная эхокардиография
(3D-ТТЭхоКГ), тканевая допплерография и опреде-
ление скорости деформации, усовершенствовали
стресс-ЭхоКГ, при этом стали возможными более
краткие протоколы получения данных, а также объ-
ективная и количественная оценка локальной со-
кратимости [4].
В этой главе описаны методы стресс-ЭхоКГ без
физической нагрузки (различные фармакологиче-
ские и нефармакологические нагрузки), применяе-
мые в клинической практике, а также их диагности-
ческая точность и прогностическая ценность при
обследовании пациентов с предполагаемой или ди-
агностированной ИБС.
СТРЕССТЕСТЫ С ФАРМАКОЛОГИЧЕСКОЙ
НАГРУЗКОЙ И ПРОТОКОЛЫ ТЕСТОВ
Добутамин и дипиридамол (или аденозин и регаде-
нозон) являются наиболее широко используемыми
препаратами для фармакологических нагрузок. До-
бутамин вызывает ишемию за счет увеличения по-
требности миокарда в кислороде, оказывая ино-
тропный и хронотропный эффекты. Дипирида-
мол — вазодилататор, введение которого вызывает
ишемию за счет снижения субэндокардиального
кровоснабжения и феномена обкрадывания. В табл.
14.1 перечислены характеристики и механизмы дей-
ствия этих двух препаратов. Другие препараты,
включая дофамин, не были рассмотрены в связи с
их ограниченной способностью к увеличению ЧСС
и нежелательными реакциями на ткани организма
вследствие выхода этих препаратов из внутриве-
нозного пространства; изопротеренол, вследствие
описанной низкой толерантности к нему у пациен-
тов; а также эргоновин, который применяют для ди-
агностики спазма сосудов.
Обычно стресс-ЭхоКГ без физической нагрузки
выполняют с одновременным мониторингом ЭКГ и
артериального давления (АД). Результаты ЭКГ в 12
отведениях принимают за исходные показатели. По
ходу исследования каждую минуту оценивают на-
личие ишемических изменений и аритмии. АД из-
Характеристики Добутамин
Дипиридамол
(аденозин)
Рецепторы
α1-, β1-, и β2-
адренорецепторы
Аденозин A2
Гемодинамические
механизмы
Повышает крово-
снабжение
Снижает крово-
снабжение
Физиологические
мишени
Миокард
Коронарные
артериолы
Клетки-мишени
Миоциты
Гладкомышеч-
ные клетки
Антидот
β-блокаторы
Аминофиллин
Противопоказания Тахиаритмия,-
гипертония
Астма, бради-
аритмия
ТАБЛИЦА 14.1 Фармакологические стрессоры
ch14.indd 302
03.04.2019 11:53:41
303
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Рис. 14.1 A Стресс-эхокардиография с добутамином. 60 -летнему мужчине с болью в груди была назначена стресс-ЭхоКГ с добутамином для диагности-
ки ишемии миокарда. Изображения в апикальной двухкамерной позиции на исходном уровне (А), при низкой дозе добутамина (Б), максимально высокой дозе
добутамина (В) и при восстановлении до исходного уровня (Г). При введении добутамина в максимально высокой дозе обнаружена гипокинезия апикальных сег-
ментов (острие стрелки), указывающая на ишемию левой передней нисходящей коронарной артерии. На видео — стресс-ЭхоКГ в четырех- и трехкамерной по-
зициях.
А
Б
Г
В
симально 20 мкг/кг/мин), при которых достигается
инотропный эффект (при более высокой дозе на-
блюдается хронотропный эффект). Реакция ЧСС и
АД в разных группах пациентов может различаться.
Среди 2968 пациентов с неустановленной ИБС и не
принимающих вазоактивные препараты реакция
АД во время стресс-ЭхоКГ с добутамином варьиру-
ет в зависимости от возраста, пола пациента и при-
менения атропина [6]. САД повышалось от исход-
ного уровня до максимального на 2,9 мм рт. ст.
(± 24 мм рт. ст.), тогда как ДАД снижалось на 7,4 мм
рт. ст. (± 14 мм рт. ст.). Эти изменения чаще проис-
ходили у мужчин и у более молодых пациентов, чем
у женщин и пожилых пациентов. Дополнительное
использование атропина ведет к большему увеличе-
нию САД и меньшему снижению ДАД. У пациентов
с гипертензией повышение может отмечаться чаще,
тогда как у пациентов с систолической дисфункци-
ей ЛЖ или у пациентов с многососудистым пора-
жением при ИБС может наблюдаться слабо выра-
женная реакция. Значения максимальной ЧСС и
АД, полученные при стресс-ЭхоКГ с добутамином
(примерно 20 000), обычно ниже, чем таковые при
стресс-ЭхоКГ с физической нагрузкой. Это может
повлиять на чувствительность этого метода при
определении тяжелой ИБС. При изменении показа-
телей гемодинамики для прекращения действия до-
бутамина (с атропином или без него) можно вну-
тривенно ввести бета-блокаторы, что быстро вос-
становит гемодинамику даже после максимально
высокой дозы добутамина. Выраженные побочные
действия добутамина, помимо тяжелой ишемии
миокарда: тяжелая гипертензия, опасная для жизни
аритмя или летальный исход (3 случая на 1000 па-
циентов) [7, 8], предсердная тахиаритмия, желудоч-
ковая экстрасистолия, недержание мочи, тревож-
ность (которая может усиливаться при введении
атропина) и гипотензия. Гипотензия может раз-
виться вследствие сосудорасширяющего эффекта
высокой дозы добутамина, нарушения сократимо-
сти предсердий (из-за предсердной аритмии), об-
струкции ВТЛЖ или тяжелой ишемии.
СТРЕСС-ЭХОКАРДИОГРАФИЯ С ДИПИРИДАМОЛОМ
Диагностика ишемии миокарда с помощью стресс-
ЭхоКГ с дипиридамолом (или аденозином) основа-
на на перераспределении кровотока между зонами
миокарда, кровоснабжение которых осуществляет-
ся по нормальным или стенозированным коронар-
ным артериям. Контрастная ЭхоКГ кровоснабже-
ния миокарда позволяет определять нарушения ко-
ронарного кровотока, которые ведут к нарушениям
ch14.indd 303
03.04.2019 11:53:41
304
ЧАСТЬ III Ишемическая болезнь сердца
локальной сократимости, следовательно, протоко-
лы с дипиридамолом лучше подходят для визуали-
зации перфузии, чем для анализа нарушений сокра-
тимости.
У пациентов с ИБС были описаны два типа фе-
номена обкрадывания, вызываемые стресс-тестами
с вазодилататорами. При феномене вертикального
обкрадывания резко снижается перфузия вследствие
выраженного стеноза эпикардиальной коронарной
артерии, что приводит к снижению давления субэн-
докардиальной перфузии и кровотока. Феномен го-
ризонтального обкрадывания характеризуется нали-
чием коллатеральной циркуляции между двумя си-
стемами сосудов и снижением кровотока в системе
с более выраженным стенозом. Стресс-ЭхоКГ с ди-
пиридамолом традиционно заключается во введе-
нии 0,84 мг/кг в течение > 10 мин в два этапа: сна-
чала дозу 0,56 мг/кг вводят в течение > 4 мин и по-
сле дополнительных 4 мин вводят 0,28 мг/кг в течение
> 2 мин. Протокол с общей дозой 0,84 мг/кг в тече-
ние > 6 мин можно использовать с целью повыше-
ния чувствительности данного теста. Аденозин при-
меняют в максимальной дозе 140 мкг/кг/мин в тече-
ние > 6 мин. Для завершения исследования, а также
при появлении нежелательных эффектов, связан-
ных с дипиридамолом, вводят внутривенно 240 мг
аминофиллина. Побочными эффектами, связанны-
ми с дипиридамолом, являются покраснение кожи,
головная боль, бронхоспазм, полная атриовентри-
кулярная блокада сердца. Стресс-тест с дипирида-
молом противопоказан пациентам с тяжелой об-
структивной болезнью легких (с выраженной реак-
тивностью воздухоносных путей) и пациентам с
атриовентрикулярной блокадой в анамнезе. Регаде-
нозон является селективным агонистом аденозино-
вых A2A-рецепторов с быстрым пиком активности
и продолжительностью действия от 2 до 5 мин, что
может быть использовано в радионуклидных иссле-
дованиях с визуализацией перфузии миокарда [9].
Будучи селективным агонистом аденозиновых A2A-
рецепторов, регаденозон безопасен при примене-
нии у пациентов, страдающих незначительным или
умеренным раздражением дыхательных путей или
обструктивной болезнью легких. Кроме того, в 3-й
фазе клинических испытаний нет подтвержденных
данных о развитии атриовентрикулярной блокады
высокой степени. Однако пациенты с атриовентри-
кулярной блокадой в анамнезе и умеренной или тя-
желой астмой не были включены в исследование,
таким образом, применение регаденозона у этих
двух групп пациентов противопоказано. Регадено-
зон при стресс-ЭхоКГ применяли главным образом
в исследованиях с контрастной ЭхоКГ в режиме ре-
ального времени для оценки наличия нарушений
перфузии миокарда. Сбор данных выполнялся от 0
до2мин,от2до4миниот4до6минпослеодно-
кратного внутривенного введения 400 мкг регадено-
зона в течение 10 сек [10].
СТРЕСС-ЭХОКАРДИОГРАФИЯ С ЭРГОНОВИНОМ
Стресс-ЭхоКГ с эргоновином можно применять для
выявления ишемии миокарда, вызванной спазмом
артерии. Стресс-тест с эргоновином обычно выпол-
няют в лаборатории, применяя катетеры, но также
возможна внутренняя иньекция 50 мкг малеата эр-
гоновина каждые 5 мин до появления ишемии ми-
окарда или до тех пор, пока не будет достигнута
максимальная доза 0,35 мг. Эффекты эргоновина
могут быть нейтрализованы после введения нифе-
дипина сублингвально.
СТРЕСС-ЭХОКАРДИОГРАФИЯ У ПАЦИЕНТОВ
С ЭЛЕКРОКАРДИОСТИМУЛЯТОРАМИ
У пациентов с имплантированным электрокардио-
стимулятором стресс-ЭхоКГ можно выполнить при
увеличении частоты стимуляции для достижения
требуемой ЧСС. Обычно кардиостимуляцию начи-
нают со 100 уд/мин и повышают частоту каждые
2 мин на 10 уд/мин, пока не будет достигнута необ-
ходимая ЧСС или другие конечные величины ЧСС.
Кардиостимуляция желудочков приводит к диссин-
хронии сокращений и нарушению сократимости
стенки желудочка, но локальное утолщение стенки
может быть оценено лишь в той степени, насколь-
ко позволяет качество изображения. Кардиостиму-
ляция предсердий не приводит к этим нарушениям.
Стресс-ЭхоКГ с кардиостимуляцией проводят так-
же в сочетании с введением добутамина для усиле-
ния инотропного эффекта.
ТОЧНОСТЬ СТРЕСС-ЭХОКАРДИОГРАФИИ
БЕЗ ФИЗИЧЕСКОЙ НАГРУЗКИ ПРИ ДИАГНОСТИКЕ
ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Диагностика ИБС с помощью ЭхоКГ основана на
выявлении нарушений локальной сократимости в
покое или во время стресс-теста. Асинергия мио-
карда в покое указывает на предшествующий ин-
фаркт миокарда (ИМ) или тяжелое стенотическое
поражение русла коронарных артерий, приводящее
к ишемии в покое и последующей дисфункции ЛЖ.
Появление новых нарушений локальной сократи-
мости во время стресс-теста указывает на стеноти-
ческое поражение русла коронарных артерий при
ИБС. Качественное описание сократимости мио-
карда в покое и на пике стресс-теста дает возмож-
ность диагностировать нормальный, ишемизиро-
ванный, жизнеспособный миокард и рубцовые из-
менения миокарда (табл. 14.2). Количественную
оценку индекса сократимости миокарда осущест-
вляют пошагово с целью качественного анализа
прогноза, последующей выживаемости и стратифи-
кации риска, особенно у пациентов из группы ри-
ска.
Добутамин благодаря своей безопасности и не-
высокой стоимости является наиболее широко при-
ch14.indd 304
03.04.2019 11:53:42
305
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
меняемым в США препаратом для стресс-ЭхоКГ в
тех случаях, когда стресс-ЭхоКГ с физической на-
грузкой противопоказана. Так сложилось, что в Ев-
ропе в основном применяют дипиридамол. Неко-
торые метаанализы объединяют доказательства,
полученные в ряде исследований, в которых срав-
нивается диагностическая точность методов стресс-
ЭхоКГ с добутамином и дипиридамолом с другими
визуализирующими методиками так же, как срав-
ниваются два этих стресс-теста [11–14].
По объединенным данным метаанализов в 11 ис-
следованиях с общим количеством 35 268 пациен-
тов сравнивали диагностическую точность стресс-
ЭхоКГ с добутамином (18 142 пациента) с дипи-
ридамолом (9341 пациент) и с аденозином (1194
пациента), однофотонной эмиссионной компью-
терной томографии со стресс-тестом (ОФЭКТ) и
электронно-лучевой компьютерной томографией
(ЭЛКТ) [12]. Исследования показали, что различия
в результатах этих неинвазивных методов визуали-
зации были очень малы, но у стресс-ЭхоКГ была
значительно более высокая специфичность и более
низкая чувствительность по сравнению со стресс-
ОФЭКТ и ЭЛКТ (табл. 14.3, рис. 14.2) [12].
В другом метаанализе (82 исследования) было
показано, что: (1) стресс-ЭхоКГ с дипиридамолом
имеет более низкую чувствительность (70%, 95%
ДИ 66–74%) и более высокую специфичность (93%,
95% ДИ 90–95%) по сравнению с стресс-ОФЭКТ с
дипиридамолом (чувствительность 89%, 95% ДИ
84–93%, специфичность 65%, 95% ДИ 54–74%);
(2) стресс-ЭхоКГ с добутамином имеет сходную
чувствительность (80%, 90% ДИ 77–83%), но более
высокую специфичность (84%, 95% ДИ 80–86%) по
сравнению с ОФЭКТ стресс-ЭхоКГ с добутамином
(чувствительность 82%, 95% ДИ 77–87%, и специ-
фичность 75%, 95% ДИ 70–79%) [13].
В метаанализе (62 исследования, 6881 пациент),
который провели Geleijnse и соавт., была также из-
Миокард
В покое
При стрессе
Нормаль-
ный
Нормокинезия
Нормокинезия или ги-
перкинезия
Ишемизи-
рованный
Нормокинезия
Гипокинезия, акинезия
или дискинезия
Жизнеспо-
собный
Акинезия
Гипокинезия или нормо-
кинезия
Рубцовые
изменения
Акинезия или
дискинезия
Акинезия или дискине-
зия
ТАБЛИЦА 14.2
Качественный анализ локальной
сократимости в покое и на пике
стресс-теста и соответствующие
миокардиальные субстраты
Тест
Исследования (n)
Чувствительность, %
(ДИ 95%)
Специфичность, %
(ДИ 95%)
InDOR (ДИ 95%)
ЭхоКГ с физической нагрузкой
55
82,7 (80,2–85,2)
84,0 (80,4–87,6)*
3,0 (2,7–3,3)
ЭхоКГ с аденозином
11
79,2 (72,1–86,3)
91,5 (87,3–95,7)
3,0 (2,5–3,5)
ЭхоКГ с дипиридамолом
58
71,9 (68,6–75,2)
94,6 (92,9–96,3)*
3,0 (2,8–3,2)
ЭхоКГ с добутамином
102
81,0 (79,1–82,9)
84,1 (82,0–86,1)*
2,9 (2,7–3,0)
Комплексная ЭхоКГ
226
79,1 (77,6–80,5)
87,1 (85,7–88,5)*
2,9 (2,8–3,0)
ОФЭКТ с физической нагрузкой
48
88,1 (85,8–90,3)†
68,8 (62,8–74,8)
2,7 (2,6–3,0)
ОФЭКТ с аденозином
14
90,5 (89,0–91,9)£
81,0 (73,5–88,6)
3,4 (3,0–3,8)§
ОФЭКТ с дипиридамолом
23
90,4 (87,3–93,5)£
75,4 (66,2–84,6)
2,7 (2,3–3,1)
ОФЭКТ с добутамином
16
83,6 (78,4–88,8)
75,1 (71,1–79,0)
2,5 (2,1–2,9)
Комплексная ОФЭКТ
103
88,1 (86,6–89,6)£
73,0 (69,1–76,9)
2,8 (2,6–3,0)
ЭЛКТ
21
93,1 (90,7–95,6)£
54,5 (45,3–63,8)
2,6 (2,2–3,0)
* Неперекрывающиеся ДИ, указывающие на статистически более высокую специфичность, чем у соответствующей стресс-ОФЭКТ.
† Неперекрывающиеся ДИ, указывающие на статистически более высокую чувствительность, чем у соответствующей стресс-ЭхоКГ.
£ Неперекрывающиеся ДИ, указывающие на статистически более высокую чувствительность, чем у всех других тестов, за исключением
стресс-ОФЭКТ с аденозином и стресс-ОФЭКТ дипиридамолом, и статистически более низкую специфичность, чем у всех других тестов,
за исключением стресс-ОФЭКТ с физической нагрузкой.
§ Неперекрывающиеся ДИ, указывающие на статистически более высокий InDOR по сравнению с стресс-ОФЭКТ с физической нагрузкой
и стресс-ОФЭКТ добутамином и ЭЛКТ.
InDOR — натуральный log odds ratio; ДИ — доверительный интервал; ОФЭКТ — однофотонная эмиссионная компьютерная томография;
ЭЛКТ — электронно-лучевая компьютерная томография; ЭхоКГ — эхокардиография.
[Heijenbrok-Kal MH, Fleischmann KE, Hunink MG. Stress echocardiography, stress single-photon-emission computed tomography and electron
beam computed tomography for the assessment of coronary artery disease: a meta-analysis of diagnostic performance. Am Heart J 154[3]:415–423,
2007.]
ТАБЛИЦА 14.3 Чувствительность, специфичность, Log odds ratio и соответствующие 95% ДИ
неинвазивных методов визуализации
ch14.indd 305
03.04.2019 11:53:42
306 ЧАСТЬ III Ишемическая болезнь сердца
Рис. 14 .2 Диагностическая точность стресс-эхокардиографии с фармакологической нарузкой. (А) Рассчитанные чувствительность и специфичность
стресс-ЭхоКГ в сравнении с электронно-лучевой компьютерной томографией (ЭЛКТ) и однофотонной эмиссионной компьютерной томографии (ОФЭКТ) со стресс-
тестом. (Б) Сравнение стресс-ЭхоКГ, стресс-ОФЭКТ и ЭЛКТ. Значительных различий стресс-ЭхоКГ с фармакологической нагрузкой при выявлении тяжелой ИБС
не обнаружено [Heijenbrok-Kal MH, Fleischmann KE, Hunink MG. Stress echocardiography, stresssingle-photon-emission computed tomography and electron beam com-
puted tomography for the assessment of coronary artery disease: a meta-analysis of diagnostic performance. Am Heart J 154(3):415–423, 2007].
1,0
1,0
0
1
2
3
4
5
100% Специфичность
Log odds ratio (95% ДИ)
Стресс-ЭхоКГ с физической нагрузкой
Стресс-ЭхоКГ с аденозином
Стресс-ЭхоКГ с дипиридамолом
Стресс-ЭхоКГ с добутамином
Стресс-ОФЭКТ с физической нагрузкой
Стресс-ОФЭКТ с аденозином
Стресс-ОФЭКТ с дипиридамолом
Стресс-ОФЭКТ с добутамином
ЭЛКТ
Комбинация
0,8
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
0,8
0,6
0,6
0,4
0,4
0,2
0,2
0,0
0,0
ЭЛКТ
Стресс-ЭхоКГ
Стресс-ОФЭКТ
А
Б
учена диагностическая точность стресс-ЭхоКГ с до-
бутамином [11]. Общая чувствительность и специ-
фичность составили 81 и 82% соответственно и за-
висели от индивидуальных особенностей пациента,
целесообразности направления пациента и таких
технических факторов, как оценка положительного
результата при стресс-ЭхоКГ с добутамином. В част-
ности, включение пациентов с перенесенным ранее
ИМ и нарушениями локальной сократимости мио-
карда привело к более высокой чувствительности
при стресс-ЭхоКГ с добутамином, что, вероятно,
связано с лежащей в их основе более тяжелой ИБС.
Выявление значимого стеноза коронарных арте-
рий (стеноз ≥ 50% относительно ≥ 70%) также мо-
жет влиять на результаты стресс-ЭхоКГ с фармако-
логической нагрузкой [11, 15, 16]. Оптимальными
пороговыми предикторами положительного ре-
зультата стресс-ЭхоКГ с добутамином были следу-
ющие: диаметр просвета сосуда ≤ 1,07 мм, стеноз
52% или более, площадь коронарного стеноза 75%
или более [16].
Для стресс-ЭхоКГ с дипиридамолом стеноз 60% —
оптимальный предиктор положительного результа-
та [15]. Если учитывать индексы функционально
значимого стеноза коронарной артерии, которые
получают при расчете значения коллатерального
кровотока, то при оценке стеноза коронарной арте-
рии корреляция между нарушениями локальной
сократимости, вызванными добутамином, и фрак-
цией резерва кровотока предпочтительнее, чем ана-
томические особенности. Это также верно для стресс-
ЭхоКГ с дипиридамолом, которая дает меньше лож-
ноположительных результатов, чем стресс-ЭхоКГ с
добутамином [15].
В двух метаанализах была оценена относитель-
ная эффективность различных фармакологических
нагрузок при выполнении стресс-ЭхоКГ с целью
диагностики значимой ИБС [14, 17]. E . Picano и со-
авт. исследовали 435 пациентов и установили, что
применение добутамина и дипиридамола имело со-
поставимую точность при диагностике поражения
русла коронарных артерий более чем в 50% случаев
[14]. На рис. 14.3 показана диагностическая точ-
ность стресс-эхокардиографии с дипиридамолом и
добутамином при диагностировании более чем 50%
случаев стенозов коронарной артерии в различных
исследованиях [18–22]. Y Noguchi и соавт. показали,
что ЧПЭхоКГ с предсердной электростимуляцией и
ЭхоКГ с аденозином были, соответственно, наибо-
лее и наименее избирательными тестами при диа-
гностике значимой ИБС, тогда как стресс-тесты с
добутамином и дипиридамолом показали среднюю
избирательность (рис. 14.4) [17].
При назначении стресс-ЭхоКГ пациенту с пред-
полагаемой или установленной ИБС выбор теста за-
висит от индивидуальных особенностей пациента,
локальных технических возможностей и компе-
тентности. Также должны быть учтены механизм
ишемии и нежелательные реакции организма на
стресс-тест. У пациентов, неспособных выполнять
физическую нагрузку, страдающих гипертензией
тяжелой степени или с повышенным риском пред-
сердной или желудочковой аритмии, тест с дипири-
дамолом (или аденозином) предпочтителльнее те-
ста с добутамином. Однако при наличии атриовен-
трикулярной блокады или тяжелой обструктивной
болезни легких более подходящим стресс-тестом
является тест с добутамином по сравнению с тестом
с дипиридамолом или аденозином. Более того, на-
личие кардиомиопатии, микроангиопатии и выра-
женной гипертрофии ЛЖ негативно влияет на точ-
ность результата стресс-ЭхоКГ. Для диагностики
ch14.indd 306
03.04.2019 11:53:42
307
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Рис.14.3 Точность стресс-эхокардиографии с фармакологической нагрузкой при диагностике стеноза коронарных артерий > 50%. На графике
показана точность стресс-ЭхоКГ с добутамином в сравнении со стресс-ЭхоКГ с дипиридамолом [Picano E, Molinaro S, Pasanisi E. The diagnostic accuracy of phar-
macological stress echocardiography for the assessment of coronary artery disease: a meta-analysis. Cardiovasc Ultrasound 6:30, 2008].
100
80
85
85 84
84 84
88 87
92 90
88 86
75
Добутамин
Дипиридамол
Salustri [21]
(n=46)
San Roman [22]
(n = 102)
Исследование EPIC [20]
(n = 110)
Loimaala [18]
(n=60)
Nedelicovic [19]
(n = 117)
Все
(n = 435)
60
40
20
0
%
Рис. 14 .4 Средневзвешенные значения чувствительности и специфичности различных стресс-тестов, используемых при диагностике значимой
ишемической болезни сердца. Наиболее селективным методом является ЧПЭхоКГ с предсердной стимуляцией, затем идут ТТЭхоКГ с предсердной стимуля-
цией, стресс-ЭхоКГ с физической нагрузкой, стресс-ЭхоКГ с дипиридамолом, стресс-ЭхоКГ с добутамином и стресс-ЭхоКГ с аденозином [Noguchi Y, Nagata-Ko-
bayashi S, Stahl JE, Wong JB. A meta-analytic comparison of echocardiographic stressors. Int J Cardiovasc Imaging 21:189–207, 2005].
100
80
82,6 84,4
68,4
80,9
79,6
85,1
71
92,2
90,7
86,1
86,2
91,3
Стресс-ЭхоКГ
с физической
нагрузкой
Стресс-ЭхоКГ
с аденозином
Стресс-ЭхоКГ
с добутамином
Стресс-ЭхоК
с дипиридамолом
ТТЭхоКГ
с предсердной
стимуляцией
ЧПЭхоКГ
с предсердной
стимуляцией
Специфичность
Чувствительность
60
40
20
0
%
ch14.indd 307
03.04.2019 11:53:42
308 ЧАСТЬ III Ишемическая болезнь сердца
каждого метода визуализации. Недавний анализ 158
исследований показал, что при прогнозировании
восстановления локальной или общей функции
ЛЖ позитронно-эмиссионная томография (ПЭТ) с
флуородеоксиглюкозой (ФДГ) обладает наиболь-
шей чувствительностью после ОФЭКТ, тогда как
стресс-ЭхоКГ с добутамином имеет высокую специ-
фичность [23]. Интересен тот факт, что все методы
визуализации имели более высокую чувствитель-
ность (80–92%), чем специфичность (54–78%), что
определенно предполагает переоценку восстановле-
ния функции. Однако анализ некоторых патофи-
зиологических факторов позволяет понять, почему
не улучшается функция жизнеспособного миокарда
после реваскуляризации. Это тяжелое повреждение
клеток и выраженная степень дилатации ЛЖ, боль-
шие субэндокардиальные рубцовые изменения (ко-
торые лучше исследовать с помощью МРТ сердца с
поздним усилением при контрастировании с гадо-
ишемии можно с большей успешностью использо-
вать физиологические нагрузки или инвазивные
функциональные методы.
ОЦЕНКА ЖИЗНЕСПОСОБНОСТИ МИОКАРДА
У пациентов с ИБС и хронической левожелудоч-
ковой недостаточностью выявление дисфункции
миокарда после реваскуляризации — характерный
критерий жизнеспособности миокарда. При ише-
мической дисфункции миокарда отмечаются умень-
шение резерва коронарного кровотока и сократи-
тельного резерва, нарушения перфузии миокарда и
метаболизма. После реваскуляризации эти функ-
ции могут быть восстановлены. Дисфункция, кото-
рая после реваскуляризации не восстанавливается,
характеризуется значительным рубцеванием мио-
карда. Миокард отвечает на кратковременную ише-
мию снижением сократительной способности, ко-
торое может сохраняться в течение нескольких
часов или суток даже после восстановления коро-
нарного кровотока. Это состояние называют оглу-
шенным миокардом (табл. 14.4). Повторяющиеся
эпизоды оглушения или стойкое снижение коро-
нарного кровотока может приводить к гибернации
миокарда — более выраженной стадии со снижени-
ем сократительного резерва и перфузии миокарда,
но с сохранным метаболизмом. В итоге снижение
коронарного кровотока ведет к гибели кардиомио-
цитов и рубцовым изменениям миокарда и крово-
ток не будет восстановлен даже после реваскуляри-
зации.
Эффективные методы оценки жизнеспособно-
сти миокарда и предотвращения возобновления ло-
кальной и полной дисфункции ЛЖ, развития сим-
птомов сердечной недостаточности и определения
долгосрочного прогноза после реваскуляризации
было предметом многих исследований с использо-
ванием неинвазивных методов визуализации [23].
Радионуклидное исседование, стресс-ЭхоКГ с добу-
тамином, магнитно-резонансная визуализация —
наиболее широко используемые методики для оцен-
ки жизнеспособности миокарда в клинической
практике. В табл. 14.5 приведены маркеры жизне-
способности миокарда, оцениваемые с помощью
Миокард
Резерв коронарного
кровотока
Сократительный
резерв
Перфузия
Метаболизм
Рубцовые
изменения
Нормальный
Норма
Норма
Норма
Норма
Отсутствие
Оглушенный
Снижение
Норма
Норма
Норма
Отсутствие
Гибернирующий
Существенное снижение
Патология
Патология
Патология
Отсутствие
С рубцовыми изме-
нениями
Существенное снижение
Отсутствие
Отсутствие
Отсутствие
Наличие
ТАБЛИЦА 14.4 Оценка патофизиологических механизмов дисфункции миокарда при ишемической болезни сердца
Метод визуализации
Маркер жизнеспособности
миокарда
Стресс-ОФЭКТ
с таллием-201
Перфузия, целостность клеточ-
ной мембраны
с технецием-99m
Перфузия, целостность клеточ-
ной мембраны, интактность
митохондрий
ПЭТ с ФДГ
Метаболизм глюкозы
Стресс-ЭхоКГ
с добутамином в низ-
ких дозах
Сократительный резерв
МРТ
Введение добутамина
в низких дозах
Сократительный резерв
Контрастирование с ис-
пользованием гадоли-
ния
Рубцовая ткань
ОФЭКТ — однофотонная эмиссионная компьютерная томогра-
фия; ПЭТ — позитронно-эмиссионная томография; ФДГ —
фтордезоксиглюкоза.
ТАБЛИЦА 14.5 Методы визуализации для оценки
жизнеспособности миокарда
ch14.indd 308
03.04.2019 11:53:42
309
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
линием), длительная гибернация перед реваскуля-
ризацией, неполная реваскуляризация и ишемиче-
ское повреждение во время реваскуляризации, веду-
щее к рубцеванию ткани, расчет времени оценки
функции после реваскуляризации. С клинической
точки зрения улучшение долгосрочного исхода по-
сле реваскуляризации, вероятно, более значимо,
чем улучшение локальной и общей функции ЛЖ.
Многие ретроспективные исследования продемон-
стрировали связь между жизнеспособным миокар-
дом и улучшением исхода [23, 24]. В объединенных
данных метаанализа исследований с участием 3848
пациентов, которым оценивали жизнеспособность
миокарда перед хирургической реваскуляризацией,
показано, что среди пациентов с жизнеспособным
миокардом, которым провели реваскуляризацию,
смертность в пересчете на год (3,6%) была наимень-
шей по сравнению с пациентами с жизнеспособным
миокардом, получающими лекарственную терапию
(11,6%), и пациентами с нежизнеспособным мио-
кардом (10,7% — среди получавших лекарственную
терапию и 9,1% — после реваскуляризации) [23].
Однако в рандомизированном исследовании 1212
пациентов с сердечной недостаточностью вслед-
ствие ИБС (ФВ ЛЖ ≤ 35%) и анатомией русла коро-
нарных артерий, подходящей для хирургической
реваскуляризации, были разделены с целью наибо-
лее эффективной лекарственной терапии (n = 602)
или оптимальной терапии и шунтирования коро-
нарной артерии (n = 610) [25]. У пациентов после
реваскуляризации коронарных артерий был значи-
тельно более низкий уровень смертности или го-
спитализации по поводу сердечно-сосудистых па-
тологий по сравнению с пациентами, получающи-
ми лекарственную терапию (58% vs 68%, p < 0,001)
[26]. Во включенном в анализ исследовании 601 па-
циенту проводили оценку жизнеспособности мио-
карда (группа из 298 пациентов, которые получали
лекарственную терапию с шунтированием коронар-
ной артерии, vs группа из 303 пациентов, которым
была назначена лекарственная терапия). Было пока-
зано, что пациенты с наличием жизнеспособного
миокарда имели более низкий уровень смертности
по сравнению с пациентами, у которых был нежиз-
неспособный миокард (37% vs 51%, p = 0,003) [26].
Однако после учета фракции выброса и объема ЛЖ,
симптомов сердечной недостаточности и сопут-
ствующих хронических заболеваний жизнеспособ-
ность миокарда не оказалась независимым прогно-
стическим показателем. Была исследована большая
часть сегментов с жизнеспособным миокардом и
нормальной сократительной функцией, у которых
не предполагалось улучшение после реваскуляриза-
ции, способное повлиять на результаты, исключая
ошибки выборки и метода визуализации, использу-
емого для оценки жизнеспособности миокарда
(стресс-ЭхоКГ с добутамином и стресс-ОФЭКТ с
технецием-99).
В случае применения низких доз добутамина (5–
10 мкг/кг/мин) улучшается сократительная функ-
ция жизнеспособного миокарда, но нежизнеспособ-
ный миокард не восстанавливается.
Во многих лабораториях есть расширенные про-
токолы с высокими дозами (свыше 20 мкг/кг/мин),
допускающие хронотропные реакции. Если жизне-
способный миокард кровоснабжается коронарной
артерией со значительным стенотическим пораже-
нием, повышение ЧСС приведет к ишемии и двух-
фазной реакции, которая характеризуется началь-
ным улучшением сократительной функции (при
низкой дозе) и последующим ее ухудшением (при
высокой дозе) (рис. 14.5). Двухфазная реакция —
наиболее специфический маркер восстановления
функции миокарда после реваскуляризации коро-
нарных артерий. Различные варианты двухфазной
реакции, в результате которой несокращающиеся в
покое сегменты могут обнаружиться во время
стресс-ЭхоКГ с добутамином, а также патофизиоло-
гические механизмы приведены в табл. 14.6 .
СТРЕСС-ЭХОКАРДИОГРАФИЯ БЕЗ ФИЗИЧЕСКОЙ
НАГРУЗКИ ДЛЯ ОЦЕНКИ ПРОГНОЗА
Прогностическая значимость стресс-ЭхоКГ была
продемонстрирована в различных популяциях па-
циентов с предполагаемой или установленной ИБС.
Нормальный результат стресс-ЭхоКГ (нормальная
систолическая функция ЛЖ и отсутствие наруше-
ний локальной сократимости в покое и во время
стресс-теста) свидетельствует о хорошем прогнозе и
невысокой частоте неблагоприятных событий. При
выявлении сниженной систолической функции ЛЖ
в покое и отсутствии новых нарушений сократимо-
сти, вызванных стресс-тестом и индуцирующих
ишемию, риск сердечно-сосудистых событий сред-
ний [2]. Пациенты с нарушением локальной сокра-
тимости 3 или более сегментов при стресс-тесте
имеют в 4 раза больший риск развития ИБС по
сравнению с пациентами с отрицательным резуль-
татом стресс-ЭхоКГ [27].
Более того, стресс-ЭхоКГ играет важную роль в
установлении групп низкого, среднего и высокого
риска среди пациентов с подозреваемой или уста-
новленной ИБС и для назначения наиболее опти-
мальной терапии.
Стратификация риска после острого ИМ являет-
ся наиболее частым показанием к стресс-ЭхоКГ,
особенно если при первичном вмешательстве пол-
ная реваскуляризация не была выполнена. С помо-
щью стресс-ЭхоКГ можно выявить пациентов, у ко-
торых клинический исход улучшит коронарное
вмешательство, и пациентов, которым будет доста-
точно лекарственной терапии [28–32]. 152 пациен-
там, которым проводили тромболизис по поводу
острого ИМ, выполнили стресс-ЭхоКГ с добутами-
ном на 4–14-е сут после ИМ. Степень выраженности
ch14.indd 309
03.04.2019 11:53:42
310
ЧАСТЬ III Ишемическая болезнь сердца
Рис. 14.5 Оценка жизнеспособности миокарда с помощью стресс-эхокардиографии с добутамином. 80 -летний пациент с ИБС, ФВ ЛЖ 45% и гипо-
кинезией апикальных сегментов. При коронарной ангиографии была установлена субтотальная окклюзия левой передней нисходящей артерии. Провели стресс-
ЭхоКГ с добутамином (в нужной дозе). Сократимость миокарда апикальных сегментов улучшилась, т.е . миокард жизнеспособный. Оценивали двухфазную реак-
цию в апикальных сегментах на введение добутамина в высокой дозе, указывающую на наличие ишемии (более специфичный маркер жизнеспособности миокар-
да). A Видеоизображения в апикальных четырех- и трехкамерной позициях в режиме реального времени.
ишемии миокарда независимо совпадали с частотой
сердечной смерти (9%) и случаями нефатального
ИМ, повышенным риском рецидивирующей стено-
кардии и операций по поводу реваскуляризации в
течение последующих 15 ± 19 мес [30]. Дискуссион-
ной оставалась оценка жизнеспособности миокарда
после острого ИМ с помощью стресс-ЭхоКГ с добу-
тамином (в низких дозах) [28–32]. У 411 пациентов
после острого ИМ была проанализирована прогно-
стическая значимость корреляции между жизнеспо-
собностью миокарда и ишемией, оцениваемых с по-
мощью стресс-ЭхоКГ с добутамином [33]. Пациен-
тов разделили на 4 группы по наличию: (1) только
жизнеспособного миокарда; (2) только ишемии мио-
карда; (3) сочетания жизнеспособного миокарда и
ишемии; (4) рубцов. Среди пациентов с сочетанием
жизнеспособного миокарда и ишемии была более
высокая частота сердечной смерти, нефатального
ИМ и нестабильной стенокардии, при которых бы-
ла нужна госпитализация в среднем после 23 после-
дующих месяцев по сравнению с пациентами из
других групп, особенно по сравнению с группой па-
циентов с наличием только ишемии. Сочетание
жизнеспособного миокарда и ишемии было связано
со значительно более низкой безрецидивной выжи-
ваемостью (HR 3, 95% ДИ 1,8–11, p = 0,001) [33].
Стресс-ЭхоКГ с фармакологической нагрузкой
является надежным методом стратификации риска
у пациентов с сахарным диабетом. Ассоциирован-
ная периферическая сосудистая патология и нейро-
патия ограничивают возможности диагностики и
прогностическую оценку стресс-теста с физической
нагрузкой у определенных пациентов. У пациентов
с сахарным диабетом ИБС часто остается невыяв-
Добутамин
Миокард
Тип сократимости
В покое
Низкая доза
Высокая доза
Жизнеспособный Двухфазный
Гипокинезия, акинезия
Улучшение
Ухудшение
Немедленное ухудшение Гипокинезия, акинезия
Ухудшение
Ухудшение
Стойкое улучшение
Гипокинезия, акинезия
Улучшение
Улучшение
Наличие рубцов Без изменений
Гипокинезия, акинезия
Гипокинезия, акинезия
Гипокинезия, акинезия
ТАБЛИЦА 14.6 Оценка жизнеспособности миокарда с помощью стресс-эхокардиографии с добутамином
ch14.indd 310
03.04.2019 11:53:42
311
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
ленной, а 60% ИМ не диагностируют вследствие не-
достатка симптомов [34]. Результаты последних ис-
следований скрининга бессимптомных пациентов с
сахарным диабетом с помощью стресс-ОФЭКТ с
фармакологической нагрузкой и КТ коронарных со-
судов [35, 36] показали, что такой скрининг не сни-
жает частоту сердечной смерти при нефатальном
ИМ настолько долго, насколько точно контролиру-
ются другие факторы риска сердечно-сосудистой
патологии. Согласно рекомендациям стандартный
скрининг ИБС у этих пациентов не рекомендован.
В противоположность этому, у пациентов с сахар-
ным диабетом и предполагаемой ИБС наличие ин-
дуцируемой ишемии миокарда во время стресс-
ЭхоКГ с фармакологической нагрузкой ассоцииру-
ется с неблагоприятным прогнозом [37]. У 2835
пациентов с сахарным диабетом и предполагаемой
или установленной ИБС, которым проводили
стресс-ЭхоКГ с физической нагрузкой (16%) или
фармакологической нагрузкой (с добутамином —
21%, с дипиридамолом — 63%), индуцируемая ише-
мия миокарда независимо коррелировала с повы-
шенным риском смерти по различным причинам
(HR 1,54, 95% ДИ 1,32–1,80, p < 0,001).
У пациентов, перенесших экстракардиальное хи-
рургическое вмешательство, прогностическую зна-
чимость степени ишемии миокарда оценивали с по-
мощью стресс-ЭхоКГ с фармакологической нагруз-
кой [38]. Основной причиной периоперационной
ишемии миокарда является стеноз коронарной ар-
терии, который приводит к снижению кровотока во
время периоперационных изменений гемодинами-
ки и, соответственно, к несоответствию кровоснаб-
жения миокарда его метаболическим потребностям.
Еще одной причиной ишемии миокарда может
быть отрыв атеросклеротической бляшки.
Кардиальные осложнения составляют 42% всех
осложнений при экстракардиальных вмешатель-
ствах. Более того, интеграция клинических факто-
ров, результатов исследования сердца и оценки
стресса от хирургической операции лежит в основа-
нии стратификации риска пациентов с предполага-
емой или диагностированной ИБС, которым пла-
нируют экстракардиальное хирургическое вмеша-
тельство [39].
Особый интерес представляют пациенты, пере-
несшие сосудистое хирургическое вмешательство,
поскольку у них не может быть достигнут ишеми-
ческий порог во время нагрузочной ЭКГ. В этом
случае наиболее удобной может быть фармакологи-
ческая нагрузка. Стресс-ЭхоКГ с добутамином или
дипиридамолом имеет очень высокую отрицатель-
ную прогностическую значимость (90–100%), ука-
зывающую на то, что отрицательный результат ас-
социируется с очень низкой частотой заболеваемо-
сти в связи с патологией сердечной деятельности
при проведении экстракардиальных хирургических
операций [38, 40, 41].
Das и соавт. исследовали 530 пациентов с пред-
полагаемой или диагностированной ИБС, которые
подвергались несосудистому хирургическому вме-
шательству, и показали, что стресс-ЭхоКГ с добута-
мином имеет отрицательную прогностическую зна-
чимость в 100% случаев: у всех пациентов с патоло-
гией сердца (1 сердечная смерть, 31 нефатальный
ИМ) определялась индуцированная ишемия [40].
Наличие ишемии (появление новых нарушений ло-
кальной сократимости) или достижение 60% макси-
мальной ЧСС для данного возраста при стресс-
ЭхоКГ с добутамином позволяет классифицировать
популяцию пациентов на группы с низкой (60%),
средней (32%) и высокой (8%) частотой послеопе-
рационных нефатальных и фатальных ИМ. Частота
патологии у пациентов из групп низкого, среднего
и высокого риска была 0, 9 и 43% соответственно.
Результаты исследования Echo Persantine Interna-
tional Cooperative с участием 509 пациентов, под-
вергшихся экстракардиальному сосудистому хи-
рургическую вмешательству, показали, что измене-
ние индекса локальной сократимости миокарда в
покое и во время стресс-ЭхоКГ с дипиридамолом
было независимым предиктором поздней сердеч-
ной смерти (чувствительность 60,4%, специфич-
ность 84%, отрицательная прогностическая значи-
мость 92%) [41]. Основываясь на имеющихся дока-
зательствах и в соответствии с современными
рекомендациями стресс-ЭхоКГ перед хирургиче-
ской операцией высокого риска показана пациен-
там с 2 или более клиническими факторами риска и
низкой функциональной способностью (< 4 MET)
(рекомендации класса IC), а перед хирургической
операцией высокого и среднего риска — пациентам
с 1 или 2 клиническими факторами риска и низкой
функциональной возможностью (< 4 MET) (реко-
мендации класса IIbC).
КОНТРАСТНАЯ СТРЕСС-ЭХОКАРДИОГРАФИЯ
С ФАРМАКОЛОГИЧЕСКОЙ НАГРУЗКОЙ
Стресс-ЭхоКГ с фармакологической нагрузкой за-
висит от адекватной визуализации границ эндокар-
да ЛЖ. Для улучшения воспроизводимости и повы-
шения диагностической точности используют кон-
трастное средство, которое может проходить по
легочным сосудам и обеспечивать контрастирова-
ние ЛЖ, в результате облегчается интерпретация
общей и локальной функций ЛЖ (рис. 14.6).
В исследовании с участием 135 пациентов, кото-
рым проводили стресс-ЭхоКГ с фармакологической
и/или физической нагрузкой и инвазивную коро-
нарную ангиографию, Moir и соавт. показали, что
использование контрастных средств (микропузырь-
ков с перфлутреном, Definity, Bristol Myers Squibb
Imaging, Billerica, MA) увеличивало чувствитель-
ность стресс-ЭхоКГ (от 80 до 91%, p = 0,03), при
этом специфичность достоверно не изменялась (от
ch14.indd 311
03.04.2019 11:53:43
312
ЧАСТЬ III Ишемическая болезнь сердца
А
Б
Рис. 14 .6 A Контрастная стресс-эхокардиография с добутамином. (А) Изображения ЛЖ в апикальной трехкамерной позиции в покое, при введении до-
бутамина в низкой и высокой дозе и при возвращении к исходному состоянию без контрастного средства. (Б) Изображены ЛЖ в тех же условиях, но с исполь-
зованием контрастного средства. Апикальные сегменты визуализируются лучше.
Рис. 14 .7 Влияние контрастного средства на чувствительность, спец-
ифичность и диагностическую точность стресс-эхокардиографии с
добутамином. При использовании контрастных средств улучшаются чувстви-
тельность и специфичность (незначительно) и диагностическая точность (p =
0,002) стресс-эхокардиографии с добутамином.
72 до 77%, p = 0,25) [42]. Эти результаты были до-
полнены данными исследования OPTIMIZE — ран-
домизированного перекрестного исследования 101
пациента со средней и высокой вероятностью ИБС,
которым проводили две стресс-ЭхоКГ с добутами-
ном (одну с контрастированием, другую без контра-
стирования) [3]. Процентное соотношение сегмен-
тов, которые адекватно визуализировались при
контрастировании, повышалось с 72% (± 24%) до
95%(±8%)ис67%(±28%)до96%(±7%)всосто-
янии покоя (p < 0,001 для обоих исследований).
Кроме того, чувствительность и специфичность
определения ИБС повышалась с 75 до 80% и с 51 до
55% соответственно при использовании результи-
рующего контрастирования для улучшения диагно-
стической точности с 53 до 66% (р = 0,002) (рис.
14.7). Также было показано, что использование кон-
трастного средства эффективнее по затратам и ком-
пенсирует стоимость проведения повторного тести-
рования [43]. В соответствии с рекомендациями Amer-
ican Society of Echocardiography, European Association
of Cardiovascular Imaging и American College of Car-
diology использование контрастных средств показа-
но для оценки ЛЖ при стресс-ЭхоКГ [1, 44].
Кроме этого, продемонстрирована сравнимая
диагностическая точность определения ИБС с по-
мощью контрастной ЭхоКГ и радионуклидного ис-
следования миокарда, но контрастная ЭхоКГ имеет
определенные преимущества: лучшие простран-
ственное и временное разрешения и отсутствие ио-
низирующего излучения [45]. В различных иссле-
дованиях сравнивали диагностическую значимость
контрастной ЭхоКГ миокарда с анализом локаль-
ной сократимости во время стресс-ЭхоКГ с добута-
мином, вазодилататором или с физической нагруз-
кой [46–49]. В большом европейском мультицен-
тровом исследовании сравнивали диагностическую
точность при использовании контрастного средства
(микропузырьки из сернистого гексафторида, Sono
100
80
80
51
55
53
66
75
Чувствительность
Специфичность Диагностическая
точность
Без контрастирования Контрастирование
60
40
20
0
%
Vue, Bracco Imaging SpA, Milan, Italy) при ЭхоКГ ми-
окарда и ОФЭКТ, синхронизированную с ЭКГ, при
выявлении значимой ИБС, используя в качестве
стандарта инвазивную коронарную ангиографию
[49]. В исследовании участвовали 516 пациентов с
предполагаемой или установленной ИБС. Им вы-
полняли контрастную ЭхоКГ в апикальных четы-
рех-, двух- и трехкамерной позициях в покое и при
стресс-ЭхоКГ с дипиридамолом. Контрастное сред-
ство с микропузырьками из сернистого гексафтори-
да вводили непрерывно с начальной скоростью
1 мл/мин, которую затем корректировали с целью
ch14.indd 312
03.04.2019 11:53:43
313
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
А
Б
В
ЛЖ чувствительность, специфичность и диагности-
ческая точность была 61, 64 и 64% соответственно
(p < 0,001 только для чувствительности). Чувстви-
тельность анализа перфузии миокарда была наибо-
лее высокой во время первых двух минут после вве-
дения регаденозона, тогда как чувствительность
при анализе локальной сократимости миокарда бы-
ла более высокой с 4 по 6 мин после введения пре-
парата.
В современном рандомизированном исследова-
нии также оценивали прогностическую значимость
контрастной ЭхоКГ в режиме реального времени.
Исследование было проведено с участием 1649 со-
поставимых по возрасту пациентов мужского и
женского пола, предварительно протестированных
на наличие ИБС [47]. Рандомизацию пациентов
проводили на основании данных, полученных с по-
мощью стандартной стресс-ЭхоКГ и контрастной
ЭхоКГ в режиме реального времени с добутамином
или физической нагрузкой. За последующие в сред-
нем 2,5 года (диапазон 0–3,9 года) были зарегистри-
рованы 62 летальных исхода, 12 ИМ и проведено
85 реваскуляризаций. У пациентов мужского пола
прогноз был менее благоприятный и при стандарт-
ной стресс-ЭхоКГ, и при контрастной ЭхоКГ мио-
карда в режиме реального времени (HR 2,07 и 2,14
соответственно). Частота неблагоприятных собы-
тий была значительно выше среди мужчин при
нормальной (1,6% vs 5,4%, p = 0,002) и патологиче-
ской стандартной стресс-ЭхоКГ (16,4% vs 34,8%, p =
0,02,), но не при нормальной (3,7% vs 5,8%, p = 0,41)
и патологической контрастной ЭхоКГ в режиме ре-
ального времени (18,6% vs 17,8%, p = 0,90). Это ука-
зывает на то, что прогностическая значимость до-
полнительного анализа перфузии миокарда и ло-
кальной сократимости миокарда ЛЖ отмечается
только у пациентов мужского пола с неустановлен-
ной ИБС.
Рис. 14 .8 Контрастная эхокардиография миокарда для диагностики ишемической болезни сердца. Данный пациент имеет обратимый дефект перфу-
зии миокарда в передней стенке в покое (А) и на пике нагрузки (Б), соответствующий 80% стенозу при коронарной ангиографии (В) [Senior R, Moreo A, Gaibazzi
N et al. Comparison of sulfur hexafluoride microbubble (SonoVue)-enhanced myocardial contrast echocardiography with gated single-photon emission computed tomogra-
phy for detection of significant coronary artery disease: a large European multicenter study. J Am Coll Cardiol 62:1353–1361, 2013].
получения наилучшего качества изображения. По-
сле достижения стабильности инфузии разрушение
микропузырьков осуществлялось с механическим
индексом 0,9. Изображение получали в режиме ре-
ального времени с низкой мощностью (механиче-
ский индекс 0,1) при 8–10 сердечных циклов (рис.
14.8). Считается, что перфузия миокарда в покое и
при стресс-тесте нормальная, если не наблюдается
нарушений перфузии во время 5 сердечных циклов
в покое или во время 2 сердечных циклов при стресс-
тесте. Признаки ишемии миокарда — видимая не-
однородность или субэндокардиальный дефект на-
полнения, или задержка наполнения во время 3 или
более сердечных циклов либо в 2 или более смеж-
ных сегментах ЛЖ.
При инвазивной коронарной ангиографии у 161
(31,2%) пациента наблюдали стеноз коронарных ар-
терий как минимум в 70% случаев (у 131 пациен-
та — однососудистое поражение, у 30 — многосо-
судистое поражение русла коронарных артерий). С
помощью контрастной ЭхоКГ миокарда в режиме
реального времени была показана более высокая
чувствительность контрастной ЭхоКГ по сравне-
нию с ОФЭКТ (75,2% vs 49,1%, p < 0,001), но более
низкая специфичность (52,4% vs 80,6%, p < 0,001).
Также сравнили диагностическую точность кон-
трастной ЭхоКГ с анализом локальной сократимо-
сти миокарда 100 пациентов, направленных на ин-
вазивную коронарную ангиографию [48].
При использовании регаденозона в качестве фар-
макологической нагрузки учитывали данные в по-
кое и в течение двух минут через 6 мин после вве-
дения. Чувствительность, специфичность и диагно-
стическая точность контрастной ЭхоКГ миокарда в
режиме реального времени при определении более
чем в 70% случаев стеноза коронарных артерий со-
ставили 84, 63 и 72% соответственно, тогда как при
исследовании локальной сократимости миокарда
ch14.indd 313
03.04.2019 11:53:43
314
ЧАСТЬ III Ишемическая болезнь сердца
А
Б
НОВЫЕ ПОДХОДЫ В СТРЕСС-ЭХОКАРДИОГРАФИИ
При стресс-ЭхоКГ с фармакологической нагрузкой
оценивают в 2D-режиме локальную сократимость
миокарда ЛЖ, изменение толщины и движение ми-
окарда с одновременным сравнением многих сег-
ментов ЛЖ, совершающих как правильное движе-
ние, так и движения, ограниченные соседними сег-
ментами. Этот анализ очень субъективен и зависит
от опыта исследователя и качества изображения.
Трехмерная ЭхоКГ позволяет оценить все сегменты
ЛЖ и преодолеть некоторые ограничения 2D-режима,
предотвращая внеосевые изображения и искажения
в области верхушки. Более того, визуализация де-
формации и определение скорости деформации
миокарда позволяют количественно оценить изме-
нения локальной функции ЛЖ, что снижает вариа-
бельность результатов исследований, проводимых
одним исследователем. Измерение резерва коронар-
ного кровотока в левой передней нисходящей коро-
нарной артерии в покое и на пике стресс-теста с
фармакологической нагрузкой повышает диагно-
стическую чувствительность стресс-ЭхоКГ. В этом
разделе собраны доказательства пользы использо-
вания стресс-ЭхоКГ с фармакологической нагруз-
кой для диагностики ИБС и жизнеспособности мио-
карда.
ТРЕХМЕРНАЯ СТРЕСС-ЭХОКАРДИОГРАФИЯ
При стресс-ЭхоКГ с фармакологической нагрузкой
объемные данные получают в апикальной позиции
и с синхронизацией с ЭКГ. Полное трехмерное изо-
бражение ЛЖ получают из 4–7 изображений, полу-
чаемых во время 4–7 сердечных циклов с целью по-
лучения наиболее качественного изображения (рис.
14.9). Данные анализируют автономно, что позво-
ляет провести томографическую оценку локально-
го утолщения миокарда на каждом этапе исследова-
ния. Matsumura и соавт. сравнили диагностическую
точность трехмерного и двухмерного исследований
сократимости миокарда с помощью стресс-ЭхоКГ с
добутамином и ОФЭКТ с таллием-201 у 56 пациен-
Рис. 14 .9 Трехмерная стресс-эхокардиография. (А) Томографические срезы для трехмерной реконструкции ЛЖ. (Б) Полнообъемный срез ЛЖ.
тов. При использовании ОФЭКТ в качестве реко-
мендованного стандарта чувствительность, специ-
фичность и точность двухмерной и трехмерной
стресс-ЭхоКГ с добутамином была сопоставима (86,
83 и 84% vs 86, 80 и 82% соответственно) [50]. Сбор
данных осуществлялся значительно быстрее также
при 3D- и 2D-стресс-ЭхоКГ (29 ± 4 сек vs 68 ± 6 сек,
p < 0,001). Сходные результаты были представлены
Aggeli и соавт., которые применяли контрастное
средство для усиления границ эндокарда [51]. В на-
стоящее время лаборатории могут интегрировать
данные трехмерного исследования ЛЖ с данными
стандартной двухмерной стресс-ЭхоКГ.
РЕЗЕРВ КОРОНАРНОГО КРОВОТОКА
Оценка резерва коронарного кровотока в левой пе-
редней нисходящей артерии при стресс-ЭхоКГ с ди-
пиридамолом продемонстрировала поэтапную диа-
гностическую ценность этого метода для анализа
локальной сократимости миокарда. Резерв коронар-
ного кровотока — это показатель способности ко-
ронарной артерии расширяться в ответ на повыше-
ние метаболических потребностей миокарда. Резерв
коронарного кровотока вычисляют как разницу
между усиленным кровотоком на пике стресс-теста
и кровотоком в покое. С помощью импульсно-вол-
новой допплерографии можно измерить скорость
кровотока в среднем участке левой передней нисхо-
дящей артерии. Характерной особенностью этого
кровотока является двухфазность кривой при им-
пульсно-волновой допплерографии: более низкий
пик — во время систолы и более высокий пик — во
время диастолы (рис. 14.10). Резерв коронарного
кровотока рассчитывают как отношение максималь-
ной скорости кровотока во время диастолы на пике
стресс-теста к исходной скорости кровотока. Значе-
ние < 2 указывает на тяжелый стеноз коронарной
артерии (> 70%).
Проведенный недавно метаанализ исследований
725 пациентов (355 — с выраженным стенозом ле-
вой передней нисходящей артерии, 370 — без ИБС),
ch14.indd 314
03.04.2019 11:53:44
315
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Рис. 14.10 Оценка резерва коронарного кровотока при стресс-эхо-
кардиографии. С помощью импульсно-волновой допплерографии можно из-
мерить максимальную скорость кровотока в левой передней нисходящей ар-
терии во время систолы (S) и во время диастолы (D). После введения препа-
рата наблюдается ускорение коронарного кровотока во время диастолы. Отно-
шение максимальной скорости кровотока во время диастолы при нагрузке к
таковой в покое, т.е . резерв коронарного кровотока (РКК), является критерием
тяжести стеноза коронарных артерий. Значение 2,5 и более указывает на уме-
ренную ИБС, значение между 2 и 2,5 —на умеренный стеноз (40–70%), зна-
чение менее 2 — на тяжелый стеноз (70–90%), при значении < 1 наблюдается
субтотальная окклюзия русла коронарных артерий (стеноз > 90%).
D
см/сек
30
В
п
о
к
о
е
П
р
и
н
а
г
р
у
з
к
е
0
0
90
D
S
S
t’
РКК = Максимальная скорость
при нагрузке во время диастолы/
Скорость в покое
Норма ≥ 2,5
ствие значимого стеноза коронарной артерии [4].
Однако на скорость движения миокарда влияет эф-
фект подтягивания от смежных сегментов и общих
движений сердца, что снижает скорость движения
миокарда. Исследование деформации миокарда с
помощью тканевой допплерографии или двухмер-
ной спекл-трекинг ЭхоКГ позволяет количественно
оценить локальное укорочение или утолщение. Эти
методы визуализации менее зависимы от поступа-
тельных движений или эффекта подтягивания.
Деформация миокарда — это изменение длины
или толщины сегментов относительно их исходно-
го размера. Скорость деформации — это скорость,
с которой происходит изменение длины или тол-
щины сегментов. Деформация и скорость деформа-
ции при тканевой допплерографии зависят от угла
сканирования. Локальную деформацию в апикаль-
ных позициях (ультразвуковой луч выравнивают
вдоль стенки миокарда и измеряют продольную де-
формацию и скорость деформации) и в позиции по
короткой оси (измеряют утолщение переднесеп-
тальной и задней стенок, а также укорочение в по-
перечном направлении септальной и латеральной
стенок).
В отличие от этого, двухмерная спекл-трекинг
ЭхоКГ является методом оценки разнонаправлен-
ной деформации (продольной, радиальной и цир-
кулярной), не зависящим от угла сканирования.
Первым при ишемии повреждается субэндокар-
диальный слой. Поскольку продольное сокращение
в большей степени связана с субэндокардиальными
волокнами, ухудшение продольной деформации
при ишемии выявляется раньше, чем ухудшение
радиальной. Более того, ишемия не только снижает
величину деформации, но и замедляет ее начало,
что ведет к смещению пика продольной деформа-
ции (постсистолическое укорочение). Постсистоли-
ческое укорочение свидетельствует о начальной ста-
дии ишемии миокарда и обусловлено со снижением
субэндокардиального кровотока [54].
Различные виды продольной деформации, ско-
рости деформации и постсистолического укороче-
ния при стресс-ЭхоКГ с добутамином представлены
в табл. 14.7 . Диагностическая ценность деформа-
ции, выявленной при тканевой допплерографии и
двухмерной спекл-трекинг ЭхоКГ, для диагностики
значимой ИБС была продемонстрирована в различ-
ных исследованиях (табл. 14.8) [55–60]. Индекс
постсистолического укорочения при тканевой доп-
плерографии (отношение постсистолического уко-
рочения к максимальному укорочению) на пике
стресс-теста был важнейшим параметром для иден-
тификации индуцированной ишемии миокарда у
44 пациентов, которым назначена стресс-ЭхоКГ с
добутамином и радионуклидное исследование пер-
фузии миокарда [58]. У 102 пациентов с установ-
ленной или предполагаемой ИБС, которым назна-
чена стресс-ЭхоКГ с добутамином и последующая
которым проводили стандартную стресс-ЭхоКГ с
дипиридамолом, показал, что дополнение анализа
резерва коронарного кровотока к анализу локаль-
ной сократимости миокарда повышает чувстви-
тельность и диагностическую точность с 67 до 90%
и с 79 до 89% соответственно [52]. В более поздних
работах Lowenstein и соавт. продемонстрировали
прогностическую значимость резерва коронарного
кровотока у 651 пациента, которым проводили
стресс-ЭхоКГ с добутамином или дипиридамолом
[53]. Пациенты с нормальным резервом коронарно-
го кровотока имели лучшую выживаемость, не за-
висящую от нефатального ИМ, реваскуляризации и
летального исхода вследствие сердечно-сосудистых
заболеваний, по сравнению с пациентами с нару-
шенным резервом коронарного кровотока (95% vs
80%, p < 0,001), независимо от вида фармакологи-
ческой нагрузки [53].
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ И ДВУХМЕРНАЯ
СПЕКЛ-ТРЕКИНГ ЭХОКАРДИОГРАФИЯ
Измерение скорости движения миокарда во время
систолы и диастолы с помощью тканевой доппле-
рографии позволяет количественно оценить нару-
шение локальной продольной деформации вслед-
ch14.indd 315
03.04.2019 11:53:44
316
ЧАСТЬ III Ишемическая болезнь сердца
Добутамин
Миокард
Характеристики
В покое
Низкая доза
Высокая доза
Нормальный
Максимальная скорость систоличе-
ской деформации
В норме
Развитие
Дальнейшее развитие
Систолическая деформация
В норме
Развитие
Дальнейшее развитие
Постсистолическое укорочение
Отсутствие
Отсутствие
Отсутствие
Острая ишемия Максимальная скорость систоличе-
ской деформации
Снижение
Дальнейшее снижение Дальнейшее снижение
Систолическая деформация
Снижение
Дальнейшее снижение Дальнейшее снижение
Постсистолическое укорочение
Наличие
Выраженное
Дальнейшее усиление
Оглушенный
миокард
Максимальная скорость систоличе-
ской деформации
Снижение
Развитие
Дальнейшее улучшение
Систолическая деформация
Снижение
Развитие
Развитие до снижения
Постсистолическое укорочение
Наличие
Снижение
Отсутствие
Гибернирующий
миокард
Максимальная скорость систоличе-
ской деформации
Снижение
Развитие
Снижение
Систолическая деформация
Снижение
Развитие
Снижение
Постсистолическое укорочение
Наличие
Выраженное
Дальнейшее усиление
Нетрансмураль-
ный инфаркт
Максимальная скорость систоличе-
ской деформации
Значительное
снижение
Снижение
Дальнейшее снижение
Систолическая деформация
Значительное
снижение
Снижение
Дальнейшее снижение
Постсистолическое укорочение
Наличие
Выраженное
Дальнейшее усиление
Трансмуральный
инфаркт
Максимальная скорость систоличе-
ской деформации
Без деформации Без изменений
Без изменений
Систолическая деформация
Без деформации Без изменений
Без изменений
Постсистолическое укорочение
Отсутствие
Без изменений
Без изменений
ТАБЛИЦА 14.7 Типы продольной деформации в покое и во время стресс-эхокардиографии с добутамином
Первый
автор,
год
Количество
пациентов
Метод
визуализации
Характеристики
пациентов
Контроль Параметры
Прогностическая
значимость
Voigt,
2003
[58]
44
Тканевая доп-
плерография
Установленная
или предпола-
гаемая ИБС
ОФЭКТ
и КАГ
Систолическая
деформация
Максимальная
скорость систо-
лической де-
формации
Постсистоличе-
ское укорочение
Индекс постси-
столического
укорочения
Пороговое значение > 35%
для индекса постсистоли-
ческого укорочения имело
чувствительность 82% и
специфичность 85%
для предполагаемой ИБС
Weide-
mann,
2007
[59]
30
Тканевая доп-
плерография
Установленный
умеренный
стеноз коро-
нарных арте-
рий
КАГ + ФРК Максимальная
скорость систо-
лической де-
формации
Систолическая
деформация
Постсистоличе-
ское укорочение
Изменение максимальной
скорости систолической
деформации от уровня в
покое до пика стресс-теста
было наилучшим параме-
тром при определении
ИБС (площадь под кривой
0,90, чувствительность
89%, специфичность 86%)
ТАБЛИЦА 14.8 Визуализация деформации при стресс-эхокардиографии с добутамином с целью определения
тяжелой ишемической болезни сердца
ch14.indd 316
03.04.2019 11:53:44
317
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Первый
автор,
год
Количество
пациентов
Метод
визуализации
Характеристики
пациентов
Контроль Параметры
Прогностическая
значимость
Ingul,
2007
[56]
197
Тканевая доп-
плерография
Спекл-трекинг
ЭхоКГ
n=76(сИБС)
n=61(без
ИБС)
n=60(сниз-
ким риском
ИБС)
КАГ
(стеноз
≥ 50%)
Максимальная
скорость систо-
лической де-
формации
Конечно-систо -
лическое укоро-
чение
Постсистоличе-
ское укорочение
Индекс постси-
столического
укорочения
Максимальная скорость си-
столической деформации
имела наибольшую пло-
щадь под кривой для уста-
новления ИБС (0,90)
Hanekom,
2007
[55]
150
Тканевая доп-
плерография
Спекл-трекинг
ЭхоКГ
Клинически
показанная
стресс-ЭхоКГ
с добутамином
(исключая зна-
чительно сни-
женную
ФВЛЖ,
БЛНПГ, пред-
шествующее
КШ, тяжелый
порок сердца)
КАГ
(стеноз
≥ 70%)
Максимальная
скорость систо-
лической де-
формации
Деформация в
конце систолы
Постсистоличе-
ское укорочение
Индекс постси-
столического
укорочения
Дельта скорости
деформации
Точность определения мак-
симальной скорости систо-
лической деформации при
тканевой допплерографии
и спекл-трекинг ЭхоКГ
была схожа в областях
кровоснабжения ЛПНА
(79% vs 78%) и ЛОА (73%
vs 67%), но ниже, чем
при спекл-трекинг ЭхоКГ
в области кровоснабжения
ПКА(74%vs59%,p =
0,008)
Ng, 2009
[57]
102
Спекл-трекинг
ЭхоКГ
Клинически
показанная
стресс-ЭхоКГ
с добутамином
КАГ
(стеноз
≥ 50%)
Глобальная систо-
лическая про-
дольная дефор-
мация
Глобальная цир-
кулярная де-
формация
Глобальная ради-
альная дефор-
мация и ско-
рость деформа-
ции
Чувствительность для гло-
бальной продольной, цир-
кулярной и радиальной де-
формаций 84,2, 73,9, 78,3%
соответственно
Глобальная продольная де-
формация и WMSI имели
сравнимую диагностиче-
скую точность (85,2% vs
82,1%, p = 0,70), точность
общей циркулярной и ра-
диальной деформации бы-
ла ниже (75,7% и 70,3% со-
ответственно)
Yu, 2013
[60]
76
Спекл-трекинг
ЭхоКГ
n = 34 (тяжелая
ИБС с пораже-
нием 3 сосудов
и сохранной
ФВЛЖ)
n=42(кон-
троль)
КАГ
(стеноз
≥ 70%)
Глобальная и сег-
ментарная про-
дольная дефор-
мация
Максимальная
скорость систо-
лической де-
формации
Циркулярная
деформация
и скорость
деформации
Максимальная скорость си-
столической деформации
при низкой дозе добутами-
на была независимым пре-
диктором многососудисто-
го поражения при ИБС
(OR 1,63; 95% ДИ 1,12–
2,82)
WMSI — индекс сократимости миокарда; БЛНПГ — блокада левой ножки пучка Гиса; ИБС — ишемическая болезнь сердца; КАГ — коро-
нарная ангиография; КШ — коронарное шунтирование; ЛОА — левая огибающая артерия; ЛПНА — левая передняя нисходящая арте-
рия; ПКА — правая коронарная артерия; ФВЛЖ — фракция выброса левого желудочка; ФРК — фракция резерва кровотока.
[Joyce E, Delgado V, Bax JJ, Marsan NA. Advanced techniques in dobutamine stress echocardiography: focus on myocardial deformation analysis.
Heart 101:72–81, 2015.]
ТАБЛИЦА 14.8
окончание
Визуализация деформации при стресс-эхокардиографии с добутамином с целью определения
тяжелой ишемической болезни сердца
ch14.indd 317
03.04.2019 11:53:44
318
ЧАСТЬ III Ишемическая болезнь сердца
коронарная ангиография, изменения разнонаправ-
ленной деформации в покое были оценены с помо-
щью спекл-трекинг ЭхоКГ, а также при применении
добутамина в низкой и высокой дозах [57]. Про-
дольная деформация для диагностики ИБС была
более значимой, чем циркулярная и радиальная
(диагностическая точность для продольной, цирку-
лярной и радиальной деформаций составляла 85, 76
и 70% соответственно) (рис. 14.11). Hanekom и со-
авт. сравнивали с помощью стресс-ЭхоКГ с добута-
мином и коронарной ангиографии диагностиче-
скую точность определения деформации при ткане-
вой допплерографии и двухмерной спекл-трекинг
ЭхоКГ у 150 пациентов [55]. Оба метода показали
сопоставимую диагностическую точность при вы-
явлении ишемии в бассейне левой передней нисхо-
дящей артерии. Однако спекл-трекинг ЭхоКГ имела
более низкую диагностическую точность по сравне-
нию с тканевой допплерографии. Это можно объ-
яснить более высокой зависимостью спекл-трекинг
ЭхоКГ от качества изображения, которое может
быть хуже в области ЛПНА.
При оценке жизнеспособности миокарда по де-
формации можно выделить различные виды дис-
функции ЛЖ (см. табл. 14.7). Оглушенный миокард
характеризуется сниженными деформацией и ско-
ростью деформации и постсистолическим укороче-
нием в покое, тогда как во время стресс-теста с до-
бутамином деформация и скорость деформации
нормализуются, а постсистолическое укорочение
нивелируется. В гибернирующем миокарде при вве-
дении добутамина в низкой дозе отмечается отно-
сительное увеличение деформации и скорости де-
формации, однако более высокие дозы добутамина
приводят к уменьшению деформации и скорости
деформации, тогда как постсистолическое укороче-
ние остается на исходном уровне в течение всего ис-
следования. При трансмуральном ИМ (рубцовые
изменения) деформация в покое и после введения
низкой дозы добутамина не выявляется, но может
обнаруживаться удлинение после введении добута-
мина в высокой дозе.
В различных исследованиях была проанализиро-
вана ценность деформации и скорости деформации
для прогнозирования восстановления локальной
функции после реваскуляризации (табл. 14.9) [61–
65]. Bansal и соавт. в исследовании с 55 пациентов с
ИБС и дисфункцией ЛЖ показали, что продольная
деформация при тканевой допплерографии в конце
систолы и максимальная скорость систолической
деформации при стресс-ЭхоКГ с добутамином в
низкой дозе имели поэтапную ценность выше ана-
лиза локальной сократимости миокарда для про-
гнозирования функционального восстановления
ЛЖ после реваскуляризации (площадь под кривой
0,79, 0,79 и 0,74 соответственно) [61].
СТРЕСС-ЭХОКАРДИОГРАФИЯ
С ФАРМАКОЛОГИЧЕСКОЙ НАГРУЗКОЙ
В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностическая точность и прогностическая зна-
чимость стресс-ЭхоКГ с фармакологической на-
грузкой в современной клинической практике не
вызывает сомнений. Скрининг ИБС — одна из
наиболее важных причин направления пациента
на диагностические исследования, включающие
нагрузочную ЭКГ, стресс-ЭхоКГ, радионуклидное
исследование или МРТ сердца, КТ сердца и коро-
нарную ангиографию. С помощью коронарной ан-
Рис. 14.11 Спекл-трекинг эхокардиография при стресс-эхокардиографии с добутамином. 68 -летний пациент после инфаркта миокарда и первичной
чрескожной реваскуляризации левой огибающей артерии. Реваскуляризация была неполной (вмешательство только в месте повреждения). В медиальном сегмен-
те выявлена патология правой коронарной артерии (80%). Через 3 месяца при стресс-ЭхоКГ с добутамином выявлено снижение продольной деформации в ба-
зальном заднебоковом сегменте и деформация на исходном уровне медиального бокового сегмента. После введения добутамина в низкой дозе наблюдали улуч-
шение продольной деформации в этих сегментах и дальнейшее улучшение при введении добутамина в высокой дозе, что характерно для оглушенного миокарда.
В других сегментах также отмечалось улучшение продольной деформации. При введении добутамина в высокой дозе в базальном и среднем сегментах нижней
и задней стенок наблюдалось ослабление продольной деформации, что свидетельствует об ишемии миокарда и значительном повреждении правой коронарной
артерии. Общая продольная деформация ЛЖ при введении добутамина в низкой дозе увеличивается (от –19,7% до –21 ,3%), а при введении добутамина в вы-
сокой дозе —уменьшается (от –19,7% до –17%).
ch14.indd 318
03.04.2019 11:53:44
319
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Первый
автор, год
Количество
пациентов
Метод
визуализации
Характеристики
пациентов
Жизнеспособность
миокарда
Параметры
Прогностическая
значимость
Hoffmann,
2002 [64]
37
Тканевая доп-
плерография
Предшествую-
щий инфаркт
миокарда со
сниженной
ФВЛЖ
Стресс-ЭхоКГ с до-
бутамином: улуч-
шение ≥ 1 степени
по WMSI в пато-
логических сег-
ментах в покое
Максимальная
скорость систо-
лической де-
формации
Площадь под кри-
вой максимальной
скорости систоли-
ческой деформа-
ции для прогнози-
рования рубцовых
изменений была
0,89 (95% ДИ 0,88–
0,90)
Hanekom,
2003 [63]
55
Тканевая доп-
плерография
Предшествую-
щий инфаркт
миокарда со
сниженной
ФВЛЖ
Локальное
(по WMSI) и гло-
бальное (повыше-
ние ФВЛЖ ≥ 5%)
восстановление
функции ЛЖ
за 9 мес после ре-
васкуляризации
Скорость дефор-
мации
Систолическая
деформация
Постсистоличе-
ское укороче-
ние
Индекс постси-
столического
укорочения и
изменение этих
параметров
Изменение скорости
деформации имело
большую чувстви-
тельность, чем
WMSI (80% vs
73%) и сходную
специфичность
Fujimoto,
2010 [62]
48
Тканевая доп-
плерография
При введении
добутамина
в высокой дозе
Продолжительное
изменение WMSI
на пике нагрузки
или при введении
добутамина в низ-
кой дозе, следую-
щее за ухудшени-
ем при введении
добутамина в вы-
сокой дозе
Общая деформа-
ция
Постсистоличе-
ское укороче-
ние
Индекс постси-
столического
укорочения
L/TS
Площадь под кри-
вой L/TS для про-
гнозирования
функционального
восстановления
была 0,89 по срав-
нению с 0,78 для
WMSI
Bansal,
2010 [61]
55
Тканевая доп-
плерография
Спекл-трекинг
ЭхоКГ
Установленная
ИБС и ФВЛЖ
< 45%
Улучшение локаль-
ной сократимости
миокарда (на сег-
мент) через 9 мес
после реваскуля-
ризации
Максимальная
скорость систо-
лической де-
формации
Конечно-систо -
лическая де-
формация
Продольная,
циркулярная
и радиальная
деформации
и скорость
деформации
Максимальная ско-
рость систоличе-
ской деформации,
конечно-систоли -
ческая деформа-
ция, деформация
при введении до-
бутамина в низкой
дозе были незави-
симыми предикто-
рами функцио-
нального восста-
новления ЛЖ
Rosner,
2012 [65]
72
Тканевая доп-
плерография
Пациенты,
которым на-
значена КШ
после предопе-
рационной
МРТ
Разница между вре-
менем выброса
≥ 4,4% и предше-
ствующим КШ
и через 8–10 мес
после КШ
Систолическая
деформация
(пик и время
выброса), сред-
нее значение
скорости систо-
лической де-
формации,
постсистоличе-
ское укороче-
ние, индекс
постсистоличе-
ского укороче-
ния
Увеличение систо-
лической деформа-
ции во время
стресс-ЭхоКГ с до-
бутамином (пло-
щадь под кривой
для прогнозирова-
ния функциональ-
ного восстановле-
ния 0,79)
L/TS — отношение систолического удлинения к сумме конечно-систолического укорочения и постсистолического укорочения; WMSI —
индекс сократимости миокарда; ДИ — доверительный интервал; ИБС — ишемическая болезнь сердца; КШ — коронарное шунтирова-
ние; ЛЖ — левый желудочек; ФВЛЖ — фракция выброса левого желудочка.
[Joyce E, Delgado V, Bax JJ, Marsan NA. Advanced techniques in dobutamine stress echocardiography: focus on myocardial deformation analysis.
Heart 101:72–81, 2015.]
ТАБЛИЦА 14.9 Визуализация деформации при стресс-эхокардиографии с добутамином
для оценки жизнеспособности миокарда
ch14.indd 319
03.04.2019 11:53:45
320
ЧАСТЬ III Ишемическая болезнь сердца
гиографии выявляется стеноз коронарных артерий
при ИБС у пациентов, которым может быть про-
ведена реваскуляризация. Методы визуализации с
радиационным излучением весьма дороги и ассо-
циируются с небольшим риском осложнений. Со-
гласно современным данным, стеноз коронарных
артерий при ИБС выявляют менее чем у 50% па-
циентов с помощью инвазивной коронарной ан-
гиографии [66]. В ряде исследований с целью диа-
гностики стенотического поражения коронарных
артерий при ИБС использовали коронарную ан-
гиографию с компьютерной томографией. Были
показаны высокие чувствительность, специфич-
ность и отрицательная прогностическая значи-
мость этого метода [67, 68].
В последние годы увеличивается применение
стресс-ЭхоКГ с фармакологической нагрузкой из-за
большого количества пациентов, неспособных к
физической нагрузке и с коморбидными состояни-
ями (фибрилляция предсердий, предшествующее
чрескожное коронарное вмешательство, ожирение),
что является противопоказанием к применению
йодсодержащего контрастного средства или снижа-
ет качество изображений при коронарной ангиогра-
фии с компьютерной томографией [69].
Стресс-ЭхоКГ с фармакологической нагрузкой
является ценной альтернативой радионуклидному
исследованию, поскольку ее можно провести у по-
стели больного без радиационного облучения. При
этом стресс-ЭхоКГ с фармакологической нагрузкой
имеет сходную чувствительность и более высокую
специфичность, а также большую прогностическую
значимость: с помощью стресс-ЭхоКГ с фармаколо-
гической нагрузкой можно формировать подгруп-
пы с низким, средним и высоким риском среди па-
циентов с предполагаемой или установленной ИБС,
а также выбрать наиболее оптимальную тактику ле-
чения пациента.
В табл. 14.10 перечислены показания к ЭхоКГ без
физической нагрузки у пациентов с предполагае-
мой или установленной ИБС [1, 70–72]. У пациен-
тов с хронической систолической дисфункцией ЛЖ,
которые являются кандидатами на реваскуляриза-
цию коронарных артерий, оценка жизнеспособно-
сти миокарда с помощью стресс-ЭхоКГ с добутами-
ном показана с целью прогноза восстановления ло-
кальной и общей функций ЛЖ и выживаемости.
Применение контрастных средств при ЭхоКГ с це-
лью уточнения границ эндокарда повышает диа-
гностическую точность стресс-ЭхоКГ с фармаколо-
гической нагрузкой. Дальнейшее развитие методов
количественной оценки деформации миокарда по-
может минимизировать влияние субъективной оцен-
ки на результаты исследования.
Показания
Соответствующие Сомнительные Несоответствующие Класс
Пациенты с симптомами, у которых ЭКГ не подлежит
интерпретации, неспособные к физической нагрузке
или нагрузочной ЭКГ с субмаксимальной нагрузкой
+I
Неоднозначный выраженный стеноз коронарной артерии +
I/IIa*
Симптомы после коронарной реваскуляризации
+
I
Пациенту с низкой толерантностью к физической нагруз-
ке перед несердечной хирургической операцией с высо-
ким риском
+I
Оценка жизнеспособности миокарда при ишемической
болезни сердца
+I
Пациенты без симптомов после КШ (≥ 5 лет)
или ЧКВ (≥ 2 лет)
+
IIb
Пациенты без симптомов и с низким риском ИБС
+
III
Перед вмешательством со средним риском пациенту
с высокой толерантностью к физической нагрузке
+
III
Низкая вероятность при предварительном обследовании,
интерпретируемая ЭКГ, пациент способен выполнять
физическую нагрузку
+
III
Пациенты без симптомов после КШ (< 5 лет)
или ЧКВ (< 2 лет)
+
III
* В соответствии с рекомендациями European Society of Cardiology (2013) [70].
ИБС — ишемическая болезнь сердца; КШ — коронарное шунтирование; ЧКВ — чрескожное коронарное вмешательство; ЭКГ — электро-
кардиограмма.
[European Association of Cardiovascular Imaging [1], American Society of Echocardiography [71], American College of Cardiology [72] и Europe-
an Society of Cardiology [70].]
ТАБЛИЦА 14.10 Показания к эхокардиографии без физической нагрузки у пациентов
с предполагаемой или установленной ишемической болезнью сердца
ch14.indd 320
03.04.2019 11:53:45
321
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
Препарат
Протокол внутривенного введения
Клинические показания
Добутамин
5, 10, 20, 30, 40 мкг/кг/мин
(± 0,25–1 мг атропина)
Диагностика ишемии:
• Новые нарушения локальной сократимости миокарда
• Деформация (скорость деформации)
• Нарушения перфузии миокарда (с использованием
контрастного средства)
• Резерв коронарного кровотока
5, 10, 20 мкг/кг/мин
Оценка жизнеспособности миокарда:
• Нарушения локальной сократимости миокарда
• Визуализация деформации и определение скорости
деформации
Вазодилататоры
Дипиридамол
0,56мг/кгза4мин+0,28мг/кг>2мин
или 0,84 мг/кг > 6 мин
Диагностика ишемии:
• Новые нарушения локальной сократимости миокард
• Резерв коронарного кровотока
• Нарушения перфузии миокарда
• Визуализация деформации и определение скорости
деформации
Оценка жизнеспособности миокарда:
• Нарушения сократимости миокарда
• Нарушения перфузии миокарда
• Резерв коронарного кровотока
• Визуализация деформации и определение скорости
деформации
Аденозин
140 мкг/кг/мин > 6 мин
Регаденозон
400 мкг за 10 сек
СВОДНАЯ ИНФОРМАЦИЯ
Стресс-эхокардиография с фармакологической нагрузкой: протоколы и клинические показания
ЛИТЕРАТУРА
1. Sicari R, Nihoyannopoulos P, Evangelista A,
et al. Stress Echocardiography Expert Con-
sensus Statement — Executive Summary:
European Association of Echocardiography
(EAE) (a registered branch of the ESC), Eur
Heart J 30:278–289, 2009.
2. Biagini E, Elhendy A, Bax JJ, et al. The use of
stress echocardiography for prognostication
in coronary artery disease: an overview, Curr
Opin Cardiol 20:386–394, 2005.
3. Plana JC, Mikati IA, Dokainish H, et al. A
randomized cross-over study for evaluation
of the effect of image optimization with
contrast on the diagnostic accuracy of dobu-
tamine echocardiography in coronary artery
disease The OPTIMIZE Trial, JACC Cardio-
vasc Imaging 1:145–152, 2008.
4. Joyce E, Delgado V, Bax JJ, Marsan NA. Ad-
vanced techniques in dobutamine stress echo-
cardiography: focus on myocardial deforma-
tion analysis, Heart 101:72–81, 2015.
5. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quan-
tification by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, Eur Heart J Car-
diovasc Imaging 16:233–270, 2015.
6. Abram S, Arruda-Olson AM, Scott CG, et
al. Typical blood pressure response during
dobutamine stress echocardiography of pa-
tients without known cardiovascular disease
who have normal stress echocardiograms,
Eur Heart J Cardiovasc Imaging, 2015 [Epub
ahead of print.] .
7. Picano E, Mathias Jr. W, Pingitore A, et al.
Safety and tolerability of dobutamine-atro-
pine stress echocardiography: a prospective,
multicentre study. Echo Dobutamine Inter-
national Cooperative Study Group, Lancet
344:1190–1192, 1994.
8. Secknus MA, Marwick TH. Evolution of do-
butamine echocardiography protocols and
indications: safety and side effects in 3,011
studies over 5 years, J Am Coll Cardiol
29:1234–1240, 1997.
9. Al JW, Iskandrian AE. Regadenoson: a new
myocardial stress agent, J Am Coll Cardiol
54:1123–1130, 2009.
10. Porter TR, Adolphson M, High RR, et al.
Rapid detection of coronary artery stenoses
with real-time perfusion echocardiography
during regadenoson stress, Circ Cardiovasc
Imaging 4:628–635, 2011.
11. Geleijnse ML, Krenning BJ, van Dalen BM, et
al. Factors affecting sensitivity and specific-
ity of diagnostic testing: dobutamine stress
echocardiography, J Am Soc Echocardiogr
22:1199–1208, 2009.
12. Heijenbrok-Kal MH, Fleischmann KE, Hun-
ink MG. Stress echocardiography, stress sin-
gle-photon-emission computed tomography
and electron beam computed tomography for
the assessment of coronary artery disease: a
meta-analysis of diagnostic performance, Am
Heart J 154:415–423, 2007.
13. Kim C, Kwok YS, Heagerty P, Redberg R.
Pharmacologic stress testing for coronary
disease diagnosis: a meta-analysis, Am Heart
J 142:934–944, 2001.
14. Picano E, Molinaro S, Pasanisi E. The diag-
nostic accuracy of pharmacological stress
echocardiography for the assessment of coro-
nary artery disease: a meta-analysis, Cardio-
vasc Ultrasound 6:30, 2008.
15. Beleslin BD, Ostojic M, Djordjevic-Dikic A, et
al. Integrated evaluation of relation between
coronary lesion features and stress echocar-
diography results: the importance of coro-
nary lesion morphology, J Am Coll Cardiol
33:717–726, 1999.
16. Segar DS, Brown SE, Sawada SG, et al. Dobu-
tamine stress echocardiography: correlation
with coronary lesion severity as determined
by quantitative angiography, J Am Coll Car-
diol 19:1197–1202, 1992.
17. Noguchi Y, Nagata-Kobayashi S, Stahl JE,
Wong JB. A meta-analytic comparison of
echocardiographic stressors, Int J Cardiovasc
Imaging 21:189–207, 2005.
18. Loimaala A, Groundstroem K, Pasanen M,
et al. Comparison of bicycle, heavy isomet-
ric, dipyridamole-atropine and dobutamine
stress echocardiography for diagnosis of
myocardial ischemia, Am J Cardiol 84:1396–
1400, 1999.
19. Nedeljkovic I, Ostojic M, Beleslin B, et al.
Comparison of exercise, dobutamine-atropine
and dipyridamole-atropine stress echocardiog-
raphy in detecting coronary artery disease,
Cardiovasc Ultrasound 4:22, 2006.
20. Pingitore A, Picano E, Colosso MQ, et al. The
atropine factor in pharmacologic stress echo-
cardiography. Echo Persantine (EPIC) and
Echo Dobutamine International Cooperative
(EDIC) Study Groups, J Am Coll Cardiol
27:1164–1170, 1996.
21. Salustri A, Fioretti PM, McNeill AJ, et al.
Pharmacological stress echocardiography in
ch14.indd 321
03.04.2019 11:53:45
322
ЧАСТЬ III Ишемическая болезнь сердца
the diagnosis of coronary artery disease and
myocardial ischaemia: a comparison between
dobutamine and dipyridamole, Eur Heart J
13:1356–1362, 1992.
22. San Roman JA, Vilacosta I, Castillo JA, et al.
Selection of the optimal stress test for the
diagnosis of coronary artery disease, Heart
80:370–376, 1998.
23. Schinkel AF, Bax JJ, Poldermans D, et al. Hiber-
nating myocardium: diagnosis and patient out-
comes, Curr Probl Cardiol 32:375–410, 2007.
24. Allman KC, Shaw LJ, Hachamovitch R,
Udelson JE. Myocardial viability testing and
impact of revascularization on prognosis in
patients with coronary artery disease and left
ventricular dysfunction: a meta-analysis, J
Am Coll Cardiol 39:1151–1158, 2002.
25. Velazquez EJ, Lee KL, Deja MA, et al. Coro-
nary-artery bypass surgery in patients with
left ventricular dysfunction, N Engl J Med
364:1607–1616, 2011.
26. Bonow RO, Maurer G, Lee KL, et al. Myocar-
dial viability and survival in ischemic left ven-
tricular dysfunction, N Engl J Med 364:1617–
1625, 2011.
27. Shaw LJ, Berman DS, Picard MH, et al. Com-
parative definitions for moderate-severe isch-
emia in stress nuclear, echocardiography, and
magnetic resonance imaging, JACC Cardio-
vasc Imaging 7:593–604, 2014.
28. Bigi R, Galati A, Curti G, et al. Prognostic
value of residual ischaemia assessed by ex-
ercise electrocardiography and dobutamine
stress echocardiography in low-risk patients
following acute myocardial infarction, Eur
Heart J 18:1873–1881, 1997.
29. Carlos ME, Smart SC, Wynsen JC, Sagar KB.
Dobutamine stress echocardiography for risk
stratification after myocardial infarction,
Circulation 95:1402–1410, 1997.
30. Previtali M, Fetiveau R, Lanzarini L, et al.
Prognostic value of myocardial viability and
ischemia detected by dobutamine stress echo-
cardiography early after acute myocardial in-
farction treated with thrombolysis, J Am Coll
Cardiol 32:380–386, 1998.
31. Salustri A, Ciavatti M, Seccareccia F, Pala-
mara A. Prediction of cardiac events after un-
complicated acute myocardial infarction by
clinical variables and dobutamine stress test,
J Am Coll Cardiol 34:435–440, 1999.
32. Sicari R, Picano E, Landi P, et al. Prognostic
value of dobutamine-atropine stress echo-
cardiography early after acute myocardial
infarction. Echo Dobutamine International
Cooperative (EDIC) Study, J Am Coll Cardiol
29:254–260, 1997.
33. Bigi R, Desideri A, Bax JJ, et al. Prognostic
interaction between viability and residual
myocardial ischemia by dobutamine stress
echocardiography in patients with acute myo-
cardial infarction and mildly impaired left
ventricular function, Am J Cardiol 87:283–
288, 2001.
34. Ryden L, Grant PJ, Anker SD, et al. ESC
Guidelines on diabetes, pre-diabetes, and car-
diovascular diseases developed in collabora-
tion with the EASD: the Task Force on diabe-
tes, pre-diabetes, and cardiovascular diseases
of the European Society of Cardiology (ESC)
and developed in collaboration with the Eu-
ropean Association for the Study of Diabetes
(EASD), Eur Heart J 34:3035–3087, 2013.
35. Muhlestein JB, Lappe DL, Lima JA, et al. Ef-
fect of screening for coronary artery disease
using ct angiography on mortality and car-
diac events in high-risk patients with diabe-
tes: the FACTOR-64 randomized clinical trial,
JAMA 312:2234–2243, 2014.
36. Young LH, Wackers FJ, Chyun DA, et al. Car-
diac outcomes after screening for asymptom-
atic coronary artery disease in patients with
type 2 diabetes: the DIAD study: a randomized
controlled trial, JAMA 301:1547–1555, 2009.
37. Cortigiani L, Borelli L, Raciti M, et al. Predic-
tion of mortality by stress echocardiography
in 2835 diabetic and 11 305 nondiabetic pa-
tients, Circ Cardiovasc Imaging 8(5), 2015.
38. Sicari R. Perioperative risk stratification in
non cardiac surgery: role of pharmacological
stress echocardiography, Cardiovasc Ultra-
sound 2:4, 2004.
39. Kristensen SD, Knuuti J, Saraste A, et al. 2014
ESC/ESA Guidelines on non-cardiac surgery:
cardiovascular assessment and management:
The Joint Task Force on non-cardiac surgery:
cardiovascular assessment and management
of the European Society of Cardiology (ESC)
and the European Society of Anaesthesiology
(ESA), Eur Heart J 35:2383–2431, 2014.
40. Das MK, Pellikka PA, Mahoney DW, et al. As-
sessment of cardiac risk before nonvascular
surgery: dobutamine stress echocardiography
in 530 patients, J Am Coll Cardiol 35:1647–
1653, 2000.
41. Sicari R, Ripoli A, Picano E, et al. Long-term
prognostic value of dipyridamole echocar-
diography in vascular surgery: a large-scale
multicenter study, Coron Artery Dis 13:49–
55, 2002.
42. Moir S, Shaw L, Haluska B, et al. Left ventric-
ular opacification for the diagnosis of coro-
nary artery disease with stress echocardiog-
raphy: an angiographic study of incremental
benefit and cost-effectiveness, Am Heart J
154:510–518, 2007.
43. Tardif JC, Dore A, Chan KL, et al. Economic
impact of contrast stress echocardiography
on the diagnosis and initial treatment of pa-
tients with suspected coronary artery disease,
J Am Soc Echocardiogr 15:1335–1345, 2002.
44. Mulvagh SL, Rakowski H, Vannan MA, et al.
American Society of Echocardiography Con-
sensus Statement on the Clinical Applications
of Ultrasonic Contrast Agents in Echocar-
diography, J Am Soc Echocardiogr 21:1179–
1201, 2008.
45. Porter TR, Xie F. Contrast echocardiography:
latest developments and clinical utility, Curr
Cardiol Rep 17:569, 2015.
46. Gaibazzi N, Reverberi C, Lorenzoni V, et al.
Prognostic value of high-dose dipyridamole
stress myocardial contrast perfusion echocar-
diography, Circulation 126:1217–1224, 2012.
47. Laiq Z, Smith LM, Xie F, et al. Differences in
patient outcomes after conventional versus
real time perfusion stress echocardiography
in men versus women: a prospective ran-
domised trial, Heart 101:559–564, 2015.
48. Porter TR, Adolphson M, High RR, et al.
Rapid detection of coronary artery stenoses
with real-time perfusion echocardiography
during regadenoson stress, Circ Cardiovasc
Imaging 4:628–635, 2011.
49. Senior R, Moreo A, Gaibazzi N, et al. Com-
parison of sulfur hexafluoride microbubble
(SonoVue)-enhanced myocardial contrast
echocardiography with gated single-photon
emission computed tomography for detec-
tion of significant coronary artery disease: a
large European multicenter study, J Am Coll
Cardiol 62:1353–1361, 2013.
50. Matsumura Y, Hozumi T, Arai K, et al. Non-
invasive assessment of myocardial ischaemia
using new real-time three-dimensional dobu-
tamine stress echocardiography: comparison
with conventional two-dimensional methods,
Eur Heart J 26:1625–1632, 2005.
51. Aggeli C, Giannopoulos G, Misovoulos P, et
al. Real-time three-dimensional dobutamine
stress echocardiography for coronary artery
disease diagnosis: validation with coronary
angiography, Heart 93:672–675, 2007.
52. Rigo F. Coronary flow reserve in stress-echo
lab. From pathophysiologic toy to diagnostic
tool, Cardiovasc Ultrasound 3:8, 2005.
53. Lowenstein JA, Caniggia C, Rousse G, et al.
Coronary flow velocity reserve during phar-
macologic stress echocardiography with
normal contractility adds important prog-
nostic value in diabetic and nondiabetic
patients, J Am Soc Echocardiogr 27:1113–
1119, 2014.
54. Blessberger H, Binder T. Two dimensional
speckle tracking echocardiography: clinical
applications, Heart 96:2032–2040, 2010.
55. Hanekom L, Cho GY, Leano R, et al. Com-
parison of two-dimensional speckle and
tissue Doppler strain measurement during
dobutamine stress echocardiography: an an-
giographic correlation, Eur Heart J 28:1765–
1772, 2007.
56. Ingul CB, Stoylen A, Slordahl SA, et al. Au-
tomated analysis of myocardial deformation
at dobutamine stress echocardiography: an
angiographic validation, J Am Coll Cardiol
49:1651–1659, 2007.
57. Ng AC, Sitges M, Pham PN, et al. Incremen-
tal value of 2-dimensional speckle tracking
strain imaging to wall motion analysis for de-
tection of coronary artery disease in patients
undergoing dobutamine stress echocardiog-
raphy, Am Heart J 158:836–844, 2009.
58. Voigt JU, Exner B, Schmiedehausen K, et
al. Strain-rate imaging during dobutamine
stress echocardiography provides objective
evidence of inducible ischemia, Circulation
107:2120–2126, 2003.
59. Weidemann F, Jung P, Hoyer C, et al. Assess-
ment of the contractile reserve in patients
with intermediate coronary lesions: a strain
rate imaging study validated by invasive
myocardial fractional flow reserve, Eur Heart
J 28:1425–1432, 2007.
60. Yu Y, Villarraga HR, Saleh HK, et al. Can
ischemia and dyssynchrony be detected dur-
ing early stages of dobutamine stress echocar-
diography by 2-dimensional speckle tracking
echocardiography? Int J Cardiovasc Imaging
29:95–102, 2013.
61. Bansal M, Jeffriess L, Leano R, et al. Assess-
ment of myocardial viability at dobutamine
echocardiography by deformation analysis
using tissue velocity and speckle-tracking,
JACC Cardiovasc Imaging 3:121–131, 2010.
62. Fujimoto H, Honma H, Ohno T, et al. Lon-
gitudinal Doppler strain measurement for
assessment of damaged and/or hibernating
myocardium by dobutamine stress echocar-
diography in patients with old myocardial
infarction, J Cardiol 55:309–316, 2010.
63. Hanekom L, Jenkins C, Jeffries L, et al. In-
cremental value of strain rate analysis as an
adjunct to wall-motion scoring for assess-
ment of myocardial viability by dobutamine
echocardiography: a follow-up study after re-
vascularization, Circulation 112:3892–3900,
2005.
64. Hoffmann R, Altiok E, Nowak B, et al. Strain
rate measurement by Doppler echocardiog-
raphy allows improved assessment of myo-
ch14.indd 322
03.04.2019 11:53:45
323
14 Стресс-эхокардиография без физической нагрузки для диагностики ишемической болезни сердца
cardial viability inpatients with depressed
left ventricular function, J Am Coll Cardiol
39:443–449, 2002.
65. Rosner A, Avenarius D, Malm S, et al. Per-
sistent dysfunction of viable myocardium
after revascularization in chronic ischaemic
heart disease: implications for dobutamine
stress echocardiography with longitudinal
systolic strain and strain rate measurements,
Eur Heart J Cardiovasc Imaging 13:745–755,
2012.
66. Patel MR, Peterson ED, Dai D, et al. Low di-
agnostic yield of elective coronary angiogra-
phy, N Engl J Med 362:886–895, 2010.
67. CT coronary angiography in patients with
suspected angina due to coronary heart dis-
ease (SCOT-HEART): an open-label, paral-
lel-group, multicentre trial, Lancet 385:2383–
2391, 2015.
68. Schuetz GM, Zacharopoulou NM, Schlatt-
mann P, Dewey M. Meta-analysis: noninva-
sive coronary angiography using computed
tomography versus magnetic resonance im-
aging, Ann Intern Med 152:167–177, 2010.
69. Rozanski A, Gransar H, Hayes SW, et al.
Temporal trends in the frequency of induc-
ible myocardial ischemia during cardiac
stress testing: 1991 to 2009, J Am Coll Cardiol
61:1054–1065, 2013.
70. Montalescot G, Sechtem U, Achenbach S, et
al. 2013 ESC guidelines on the management
of stable coronary artery disease: the Task
Force on the management of stable coronary
artery disease of the European Society of Car-
diology, Eur Heart J 34:2949–3003, 2013.
71. Pellikka PA, Nagueh SF, Elhendy AA, et al.
American Society of Echocardiography recom-
mendations for performance, interpretation,
and application of stress echocardiography, J
Am Soc Echocardiogr 20:1021–1041, 2007.
72. Wolk MJ, Bailey SR, Doherty JU, et al. ACCF/
AHA/ASE/ASNC/HFSA/HRS/SCAI/SCCT/
SCMR/STS 2013 multimodality appropriate
use criteria for the detection and risk assess-
ment of stable ischemic heart disease: a report
of the American College of Cardiology Foun-
dation Appropriate Use Criteria Task Force,
American Heart Association, American Soci-
ety of Echocardiography, American Society
of Nuclear Cardiology, Heart Failure Society
of America, Heart Rhythm Society, Society
for Cardiovascular Angiography and Inter-
ventions, Society of Cardiovascular Comput-
ed Tomography, Society for Cardiovascular
Magnetic Resonance, and Society of Thoracic
Surgeons, J Am Coll Cardiol 63:380–406,
2014.
ch14.indd 323
03.04.2019 11:53:45
ch14.indd 324
03.04.2019 11:53:45
Пороки клапанов
сердца
ЧАСТЬ
ЧАСТЬ IV
ch15.indd 325
03.04.2019 11:54:00
ch15.indd 326
03.04.2019 11:54:01
327
15 Аортальный стеноз
NIKOLAUS JANDER, MD • JAN MINNERS, MD, PHD
Стадии заболевания
Морфология клапана
Нарушения гемодинамики
Скорость кровотока и средний
градиент давления
Уравнение непрерывности потока
для вычисления площади
аортального клапана
Индекс ударного объема
Индекс скорости
Чреспищеводная эхокардиография
и планиметрия площади клапана
Клинические трудности при оценке
степени аортального стеноза
Точность и вариабельность измерений
Влияние аортального кровотока
Анатомическое отверстие клапана
и эффективная площадь клапана
Восстановление давления
Несоответствие показателей
степени аортального стеноза
Индексирование к размеру тела
Сопутствующая артериальная гипертензия
Изменения левого желудочка
при аортальном стенозе
Гипертрофия и ремоделирование
Диастолическая функция
Систолическая функция
Индекс ударного объема
Продольная деформация
Сопутствующая патология
Аортальная регургитация
Подклапанная обструкция
Кальцификация фиброзного кольца
митрального клапана и митральная
регургитация
Ишемическая болезнь сердца
Легочная гипертензия
Альтернативные методы диагностики
Стресс-тест с физической нагрузкой
Катетеризация сердца
Компьютерная томография сердца
Магнитно-резонансная томография
сердца
Клинические подходы
Прогностическая значимость
Тактика, направленная на снижение
степени стеноза или прекращение
его прогрессирования
Определение сроков протезирования
аортального клапана
Пациенты с симптомами
Пациенты без симптомов
Аортальный стеноз с низким градиентом
давления и сниженной фракцией
выброса
Аортальный стеноз с низким градиентом
давления и сохранной фракцией
выброса
Пациенты с показаниями к другим
хирургическим вмешательствам
на сердце
Аортальный стеноз (АС) является наиболее распро-
страненным пороком клапанов сердца в развитых
странах. Аортальный склероз, предшественник АС,
встречается у более чем 25% пациентов старше 65
лет. Распространенность АС увеличивается с воз-
растом: среди пациентов старше 75 лет АС диагно-
стируют в 3% случаев. Со старением населения и
широким применением эхокардиографии (ЭхоКГ)
и методов чрескожного вмешательства количество
пациентов с АС увеличивается.
Кальцификация аортального клапана — наи-
более частая причина АС. Стеноз трехстворчатого
аортального клапана чаще встречается у пожилых
пациентов и начинается с активного патологическо-
го процесса, характеризующегося воспалением, ли-
пидной инфильтрацией и кальцификацией. Кроме
того, в терминальной стадии болезни включаются
механизмы, напоминающие образование костной
ткани. Кальцификация аортального клапана — про-
грессирующее заболевание, при котором кальци-
фикация и фиброз створок в значительной степени
содействуют прогрессированию нарушений гемо-
динамики. Врожденный двухстворчатый аорталь-
ный клапан наблюдается примерно в 50% иссечен-
ных стенозированных клапанов во время протези-
рования, что указывает на недооценку врожденных
аномалий аортального клапана. После облучения
средостения в связи с лечением опухоли могут воз-
никнуть нарушения функции клапанов, среди кото-
рых АС является наиболее распространенным по-
ражением [1]. Ревматическая болезнь сердца редко
встречается в Европе и Северной Америке, но яв-
ляется самой распространенной причиной поро-
ков клапанов во всем мире. В регионах с высокой
распространенностью ревматической болезни серд-
ца ревматический АС обычно сочетается с пороком
митрального клапана.
СТАДИИ ЗАБОЛЕВАНИЯ
У пациентов с АС отмечается длительный бессим-
птомный период от появления аортального скле-
роза до тяжелого АС. Стенокардия, одышка, голо-
вокружение или даже обморок при физической на-
ch15.indd 327
03.04.2019 11:54:01
328
ЧАСТЬ IV Пороки клапанов сердца
грузке являются типичными симптомами тяжелого
АС. Клинически выраженная застойная хрониче-
ская сердечная недостаточность, как правило, явля-
ется исходом поздней стадии заболевания и прояв-
лением левожелудочковой недостаточности.
В действующем руководстве рекомендуют клас-
сифицировать АС по стадиям на основе интеграции
симптомов, морфологии клапана, степени стеноза и
функции ЛЖ (табл. 15 .1) [2]:
•
стадия A: наличие риска развития порока клапа-
на, например у пациентов с аортальным склеро-
зом или двухстворчатым аортальным клапаном;
•
стадия B: прогрессирующий порок клапана, эк-
вивалентный легкому и умеренному АС;
•
стадия C: бессимптомный тяжелый АС, опреде-
ляемый анатомией клапана и показателями ге-
модинамики с подгруппами нормальной и нару-
шенной функции ЛЖ;
•
стадия D: тяжелый АС с симптомами, включая
подгруппы с низким потоком/низким градиен-
том и сниженной или сохранной фракцией вы-
броса.
МОРФОЛОГИЯ КЛАПАНА
Аортальный клапан в норме имеет три одинаковые
по размеру створки (рис. 15 .1). При патологии аор-
тальный клапан может быть одностворчатым, двух-
створчатым и четырехстворчатым. Двухстворчатый
аортальный клапан встречается в большинстве слу-
чаев. Его створки обычно имеют разный размер, на
большей створке часто видна линия сращения двух
створок. Это затрудняет дифференцировку с трех-
створчатым аортальным клапаном, поэтому кла-
пан следует оценивать в момент его открытия. От-
верстие трехстворчатого аортального клапана на-
поминает треугольник или звезду с тремя лучами,
тогда как двухстворчатый аортальный клапан в мо-
мент открытия имеет форму линзы или щели. В по-
зиции по длинной оси во время систолы обычно на-
блюдается формирование купола из-за неразделен-
ных створок. Базальная часть створок может иметь
сохранную мобильность, поэтому нередко степень
АС недооценивают. Типичный ревматический АС
характеризуется симметричным фиброзом, ретрак-
цией и частичным сращением краев створок и, воз-
можно, формированием купола во время откры-
тия клапана. Ревматическому АС часто сопутствуют
аортальная регургитация и поражение митрально-
го клапана. Определенная степень кальцификации
обычно присутствует при любой форме АС, хо-
тя описаны случаи врожденного АС без кальцифи-
кации. Кальцификацию подразделяют на слабую
(изолированные, мелкие очаги), умеренную (мно-
жественные, более крупные очаги) и тяжелую (экс-
тенсивное утолщение всех створок) [3]. При тяже-
лой кальцификации точная этиологическая харак-
теристика АС может быть затруднена.
Морфологию аортального клапана оценивают в
левой парастернальной позиции по длинной и ко-
роткой осям левого желудочка (ЛЖ) с применением
режима «Масштабирование». Диаметр выходного
тракта левого желудочка (ВТЛЖ) и открытие стено-
зированного клапана лучше всего визуализируются
в позиции по длинной оси, а как количество ство-
рок и степень кальцификации лучше всего оцени-
вать в позиции по короткой оси. Иногда датчик не-
обходимо смещать от грудины вдоль межреберных
промежутков для оптимального отображения сте-
нозированного отверстия. По морфологии аорталь-
ного клапана можно предварительно оценить сте-
пень АС, однако прямая планиметрия (трассировка
анатомического отверстия клапана и определение
его площади) в трансторакальной позиции обычно
невозможна. Детально оценить морфологию аор-
тального клапана, вид и степень АС, а также каль-
цификацию позволяет мультипланарная чреспи-
щеводная эхокардиография (ЧПЭхоКГ).
В дополнение к визуализации анатомии клапа-
на с помощью 2D-ЭхоКГ можно использовать доп-
плерографию, которая позволит отличить клапан-
ную обструкцию от подклапанной и надклапанной.
Обычно обструкция наблюдается на уровне ВТЛЖ,
однако иногда возможна подклапанная обструкция
или обструкция в области среднего отдела ЛЖ в со-
четании с АС. Локализация стеноза обычно соответ-
ствует месту турбулентного потока, выявляемого
при цветовом допплеровском картировании крово-
тока в апикальной трех- или пятикамерной пози-
ции. Для обнаружения последовательных участков
обструкции может понадобиться многоступенчатое
сканирование вдоль межжелудочковой перегород-
ки от середины желудочка до аортального клапана
с помощью импульсно-волновой допплерографии.
У пациентов с АС часто наблюдается дилатация
корня аорты и восходящего отдела аорты. Измере-
ния выполняют в нескольких позициях по длинной
оси, следуя за ходом восходящего отдела аорты. Хо-
тя возможна постстенотическая дилатация, обуслов-
ленная гемодинамическими факторами, первичные
патологические изменения медии аорты, существу-
ющие у пациентов с врожденным пороком аорталь-
ного клапана, способствуют дальнейшей дилатации
аорты и поэтому при врожденном АС более выраже-
ны (рис. 15.2).
НАРУШЕНИЯ ГЕМОДИНАМИКИ
Максимальная скорость кровотока (Vmax), средний
градиент давления и площадь аортального клапа-
на (ПАК) являются наиболее важными параметра-
ми для оценки степени АС, их следует оценивать у
всех пациентов с АС [4]. Для этого необходимо из-
мерить скорость аортального кровотока на уровне
клапана, скорость престенотического потока (пото-
ка в ВТЛЖ чуть ниже аортального клапана) и ВТЛЖ
ch15.indd 328
03.04.2019 11:54:01
329
15 Аортальный стеноз
Стадия
Определение
Анатомия клапана
Гемодинамика
Изменения гемодинамики
A
Риск развития АС Двухстворчатый аор-
тальный клапан или
другая врожденная
аномалия клапана
Склероз аортального
клапана
Аортальная Vmax < 2 м/сек
Отсутствуют
B
Прогрессиру-
ющий АС
Кальцификация ство-
рок двухстворчатого
или трехстворчатого
клапана от легкой до
умеренной с некото-
рым ограничением
подвижности створок
во время систолы
Ревматическое пора же-
ние клапана с слияни-
ем комиссур
Умеренный АС: Vmax = 2,0–2,9 м/сек
или средний ΔP<20ммрт. ст.
Умеренный АС: Vmax = 3,0–4,0 м/сек
или средний ΔP = 20–40 мм рт. ст.
Может наблюдаться
нарушение в раннюю
диастолу
Нормальная ФВЛЖ
Тяжелый бессимптомный АС
C1
Тяжелый бессим-
птомный АС
Выраженная кальци-
фикация створок или
врожденный стеноз
с выраженным огра-
ничением раскрытия
створок
Vmax > 4 м/сек или средний
ΔP>40ммрт.ст.
ПАК < 1,0 см2 в большинстве
случаев или индексированная
ПАК < 0,6 см2/м2
Диастолическая дисфункция
ЛЖ
Слабовыраженная гипертро-
фия ЛЖ
Нормальная ФВЛЖ
C2
Тяжелый бессим-
птомный АС
с дисфункций
ЛЖ
Выраженная кальци-
фикация створок или
врожденный стеноз с
сильным ограничени-
ем раскрытия створок
Vmax > 4 м/сек или средний ΔP > 40 мм
рт. ст.
ПАК < 1,0 см2 в большинстве случаев
или индексированная ПАК < 0,6 см2/
м2
ФВЛЖ < 50%
Тяжелый симптомный АС
D1
Тяжелый сим-
птомный АС
с высоким гра-
диентом давле-
ния
Выраженная кальци-
фикация створок или
врожденный стеноз с
сильным ограничени-
ем раскрытия створок
Vmax > 4 м/сек или средний ΔP > 40 мм
рт. ст.
ПАК < 1,0 см2 в большинстве случаев
или индексированная ПАК < 0,6 см2/
м2, но может быть больше при ком-
плексе АС + АР
Диастолическая дисфункция
ЛЖ
Слабовыраженная гипертро-
фия ЛЖ
Может наблюдаться легоч-
ная гипертензия
D2
Тяжелый сим-
птомный АС
с низким по-
током/низким
градиентом дав-
ления и снижен-
ной ФВЛЖ
Выраженная кальцифи-
кация створок с выра-
женным ограничением
раскрытия створок
ПАК<1,0см2сVmaxвпокое≤4м/сек
или средний ΔP≤40ммрт. ст.
При стресс-ЭхоКГ с добутамином
ПАК<1,0см2иVmax>4м/секили
средний ΔP > 40 мм рт. ст. при лю-
бой скорости потока
Диастолическая дисфункция
ЛЖ
Гипертрофия ЛЖ
ФВЛЖ < 50%
D3
Тяжелый сим-
птомный АС
с низким по-
током/низким
градиентом и
нормальной
ФВЛЖ
Выраженная кальцифи-
кация створок с выра-
женным ограничением
раскрытия створок
ПАК<1,0см2сVmaxвпокое≤4м/сек
или средний ΔP≤40ммрт. ст.
Индексированная ПАК < 0,6 см2/м2
Индекс ударного объема < 35 мл/м2
Измеряют при нормальном артери-
альном давлении у пациента
Увеличение относительной
толщины стенок ЛЖ
Малый размер полости ЛЖ с
низким ударным объемом
Рестриктивный тип напол-
нения во время диастолы
ФВЛЖ ≥ 50%
ACC — American College of Cardiology; AHA — American Heart Association; ΔP — градиент давления; Vmax — максимальная скорость; АР —
аортальная регургитация; АС — аортальный стеноз; ЛЖ — левый желудочек; ПАК — площадь аортального клапана; ФВ — фракция вы-
броса; ФВЛЖ — фракция выброса левого желудочка.
[Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: executive summa-
ry. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 63:2438–2488,
2014.]
ТАБЛИЦА 15.1 Стадии аортального стеноза
ch15.indd 329
03.04.2019 11:54:01
330 ЧАСТЬ IV Пороки клапанов сердца
или размер фиброзного кольца. Эти же параметры
используют для расчета индекса ударного объема и
индекса скорости — важных показателей наруше-
ний гемодинамики в особых условиях (рис. 15 .3,
15.4).
СКОРОСТЬ КРОВОТОКА И СРЕДНИЙ ГРАДИЕНТ ДАВЛЕНИЯ
Систолическую скорость антеградного аортального
кровотока через стенозированный клапан измеря-
ют с помощью непрерывно-волновой допплерогра-
фии в нескольких позициях. Для получения макси-
мальной скорости обязательно направление ультра-
звукового луча параллельно кровотоку. Цветовое
допплеровское картирование кровотока может по-
мочь определить его направление, но трехмерная
ориентация струи может быть непредсказуемой.
Начинают исследование в апикальной пятикамер-
ной позиции, затем изменяют положение датчика
таким образом, чтобы ультразвуковой луч был па-
раллелен ВТЛЖ, перемещая датчик несколько дор-
сальнее и латеральнее к верхушке. Для четкого ото-
бражения следует снизить коэффициент усиления,
максимальную скорость развертки, а также опти-
мизировать масштаб. Ошибочные сигналы с раз-
мытыми границами или пиком следует игнориро-
вать. Затем исследование продолжают из парастер-
нального доступа. Для ориентации ультразвукового
луча параллельно кровотоку можно использовать
цветовое допплеровское картирование кровотока.
Иногда для визуализации в модифицированной по-
зиции нужен специальный датчик. Редко исполь-
зуют супрастернальную, левую парастернальную и
субкостальную позиции. Чрезвычайно важно точ-
но определить максимальную скорость, чтобы ис-
ключить недооценку степени АС, особенно когда
морфологические изменения не соответствуют за-
регистрированной скорости. Позицию, в которой
была зарегистрирована максимальная скорость, не-
обходимо учитывать в последующих исследовани-
ях. Максимальную скорость аортального кровото-
ка измеряют на пике сигнала, постэкстрасистоличе-
ские сокращения учитывать не следует. У пациентов
с фибрилляцией предсердий следует провести реги-
страцию в течение 5–10 последовательных сердеч-
ных циклов (рис. 15 .5).
Зная максимальную скорость кровотока можно
рассчитать максимальный градиент давления с по-
мощью упрощенного уравнения Бернулли:
ΔР = 4V22,
где ΔР — градиент давления; V2 — максимальная
скорость стенотического кровотока.
Исходное уравнение Бернулли — сложная фор-
мула, описывающая общую связь между скоростью
и градиентом давления при стенотических пораже-
ниях, с учетом (среди прочего) ускорения потока и
потерь при трении, которыми в клинической прак-
тике можно пренебречь. В упрощенном уравнении
Бернулли отсутствует скорость престенотического
потока V1, что допустимо только в том случае, если
V1 мала. Если V1 > 1,2 м/сек, следует использовать
полное уравнение Бернулли:
Рис. 15.1 Этиология аортального стеноза. Строение нормального, ревматического и кальцифицированного трехстворчатого аортального клапана и врожденно-
го двухстворчатого аортального клапана во время диастолы (А) и систолы (Б). ЛКА — левая коронарная артерия; ПКА — правая коронарная артерия.
Нормальный
ПКА
ЛКА
Ревматический
Кальцифицированный
Двухстворчатый
Б
А
ch15.indd 330
03.04.2019 11:54:01
331
15 Аортальный стеноз
ΔР=4(V22–V1
2),
где ΔР — градиент давления; V2 — максимальная
скорость стенотического кровотока; V1 — скорость
престенотического потока.
Среднюю скорость и интеграл скорости кровото-
ка определяют, отслеживая внешний контур сигна-
ла. Вычисляют среднее значение нескольких мгно-
венных скоростей (средняя скорость) и интегри-
руют по времени (интеграл скорости кровотока).
Интеграл скорости кровотока используют в урав-
нении непрерывности потока для вычисления ПАК.
Средний градиент давления рассчитывают путем
усреднения мгновенных градиентов во время вы-
броса. Скоростью престенотического потока обыч-
но пренебрегают.
Максимальную скорость аортального кровото-
ка и средний градиент давления получают из од-
ного и того же сигнала при непрерывно-волновой
допплерографии и они тесно коррелируют (рис.
15.6). Максимальная скорость аортального крово-
тока > 4 м/сек и средний градиент давления > 40 мм
рт. ст. указывают на тяжелый АС.
УРАВНЕНИЕ НЕПРЕРЫВНОСТИ ПОТОКА
ДЛЯ ВЫЧИСЛЕНИЯ ПЛОЩАДИ АОРТАЛЬНОГО КЛАПАНА
Если функция ЛЖ и выброс снижены, для опреде-
ления степени АС нужны дополнительные, менее
зависящие от потока параметры [5, 6]. Для этого по
уравнению непрерывности потока рассчитывают
ПАК, исходя из предположения, что через ВТЛЖ и
аортальный клапан проходит один и тот же удар-
ный объем. Ударный объем при ЭхоКГ вычисляют
по следующему уравнению:
Ударный объем = А1 × VTI1 = A2 × VTI2,
где A1 — площадь ВТЛЖ; VTI1 — интеграл скоро-
сти кровотока в ВТЛЖ; A2 — площадь аортального
клапана; VTI2 — интеграл скорости кровотока через
аортальный клапан.
Три из четырех компонентов уравнения непре-
рывности потока могут быть измерены (А1, VTI1 и
VTI2), а затем рассчитывают ПАК:
ПАК = A2 = A1 × VTI1/VTI2.
Поскольку время выброса потока в ВТЛЖ и че-
рез аортальный клапан считают равными, вместо
Рис. 15.2 Особенности двухстворчатого аортального клапана. (А) Открытый двухстворчатый клапан часто имеет форму линзы или щели. (Б, В) Из-за раз-
ного размера двух створок кровоток и струя регургитации имеют эксцентрическое направление (стрелки), поэтому исследование следует проводить в нескольких
позициях. (Г) A Дилатация корня аорты и восходящего отдела аорты (стрелка). Неразделенность створок обусловливает сохранение их базальной подвижности,
что может привести к недооценке степени аортального стеноза. (Д) A При формировании купола во время систолы следует тщательно изучить наименьшее отвер-
стие (по дистальным участкам створок). (Е) A Отверстие клапана лучше всего оценивать в 3D-режиме .
Диастола
Систола
А
Б
В
Г
Д
Е
ch15.indd 331
03.04.2019 11:54:02
332
ЧАСТЬ IV Пороки клапанов сердца
интегралов скорости кровотока можно использо-
вать максимальные или средние скорости, что упро-
щает уравнение [7]:
ПАК=A2=A1×V1/V2.
Рис. 15.3 Уравнение непрерывности потока и взаимосвязь между
площадью аортального клапана, индексом скорости и ударным объ-
емом. Ударный объем (см3, или 1 мл) в выходном тракте левого желудочка
(ВТЛЖ) и в области стеноза считают равным. Ударный объем в обеих локали-
зациях определяется произведением площади (см2) (A1 — площадь престено-
тической области, A2 — площадь стенотической области) и интеграла скорости
кровотока (VTI, см) во время систолы. Престенотический поток в ВТЛЖ изме-
ряют с помощью импульсно-волновой допплерографии (PW), а стенотический
поток через аортальный клапан — с помощью непрерывно-волновой доппле-
рографии (CW). Площадь ВТЛЖ рассчитывают по его диаметру (d). Площадь
аортального клапана (ПАК) рассчитывают по этим трем параметрам. Индекс
скорости (VR) и ударный объем (УО) вычисляют по параметрам, которые также
используют в уравнении непрерывности потока. ПАК всегда содержит инфор-
мацию об ударном объеме. Ошибка измерений (как правило, недооценка диа-
метра ВТЛЖ) приводит к заниженной оценке ПАК и ударного объема. Индекс
скорости дает информацию о соотношении ПАК и площади ВТЛЖ, которую
можно использовать в качестве параметра степени аортального стеноза в по-
следующем наблюдении, если диаметр ВТЛЖ считать постоянным.
Престенотическая
область
Стенотическая
область
PW
VTI1
CW
VTI2
d
ПАК =
VR=
ВТЛЖ
ВТЛЖ
A1×VTI1=A2×VTI2
А1 = πr2 = π(d/2)2
VTI1
VTI2
×A1
VTI1
VTI2
VTI1
VTI2
УО=VTI1×A1
При использовании максимальных скоростей зна-
чение ПАК будет выше, поскольку эти скорости от-
ражают наибольшую возможную ПАК при макси-
мальном потоке, тогда как средние скорости дают
среднее значение ПАК (в течение всей фазы систо-
лы). Для учета размера тела ПАК можно проиндек-
сировать относительно площади поверхности тела
(ППТ):
ИПАК = ПАК/ППТ,
где ИПАК — площадь аортального клапана, индек-
сированная к площади поверхности тела. О тяже-
лом АС свидетельствует ПАК < 1,0 см2 или ИПАК
< 0,6 см2/м2.
СКОРОСТЬ ПОТОКА В ВЫХОДНОМ ТРАКТЕ ЛЕВОГО ЖЕЛУДОЧКА
Скорость престенотического потока (V1) в преде-
лах ВТЛЖ измеряют с помощью допплерографии
в апикальной пятикамерной позиции. Контроль-
ный объем располагают вблизи аортального клапа-
на. Положение датчика должно быть оптимизиро-
вано таким образом, чтобы ультразвуковой луч был
параллелен ВТЛЖ, включая положения несколько
дорсальнее и латеральнее к верхушке. Для получе-
ния четкого, плавного и ламинарного сигнала не-
обходимо снизить коэффициент усиления, макси-
мальную скорость развертки, использовать фильтр
стенок сосудов и оптимизировать масштаб. Опти-
мальный сигнал ламинарного потока не показыва-
ет спектральное рассеивание с острым краем и чер-
ным центром. Контрольный объем должен быть
расположен как можно ближе к аортальному клапа-
ну. Правильного позиционирования контрольно-
го объема можно достичь, медленно перемещаясь
от аортального клапана по ВТЛЖ до тех пор, пока
сигнал потока не изменится с турбулентного на ла-
минарный. Для измерений используют первую по-
зицию с ламинарным потоком. Среднюю скорость
и интеграл скорости кровотока получают путем от-
слеживания внешнего контура сигнала. Как и для
скорости потока через аортальный клапан, вычис-
ляют среднее значение нескольких мгновенных ско-
ростей (средняя скорость) и интегрируют по време-
ни (интеграл скорости кровотока). Интеграл скоро-
сти кровотока (VTI1) используют для расчета ПАК.
Кроме того, он необходим для расчета ударного
объема (см. рис. 15 .3).
ДИАМЕТР ВЫХОДНОГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА
Диаметр ВТЛЖ измеряют в середине систолы (во
время его максимального увеличения) в левой пара-
стернальной позиции по длинной оси ЛЖ в режи-
ме «Масштабирование». Для получения максималь-
ного переднезаднего размера может понадобиться
несколько попыток. Измерения следует проводить
как можно ближе к аортальному клапану от вну-
треннего левого края до внутреннего правого края
и от перегородочной стенки до фиброзного контак-
ch15.indd 332
03.04.2019 11:54:02
333
15 Аортальный стеноз
та между аортальным и митральным клапанами па-
раллельно аортальному клапану. Для правильной
идентификации гистогематического барьера нуж-
но оптимальное качество изображения. Площадь
ВТЛЖ (A1) рассчитывают по формуле:
А1 = πr2 = π(d/2)2,
где d — диаметр ВТЛЖ.
Для расчета ПАК или ударного объема нужно
знать площадь ВТЛЖ.
ИНДЕКС УДАРНОГО ОБЪЕМА
В последнее время было признано, что снижение
трансклапанного потока может наблюдаться и у
пациентов с нормальной систолической функци-
ей ЛЖ, поэтому индекс ударного объема (ударный
объем обычно индексируют к площади поверхности
тела) теперь стал важным параметром при оценке
степени АС, поскольку позволяет выявить сниже-
ние потока у пациентов с сохранной фракцией вы-
броса. Тяжелый АС с низким потоком/низким гра-
диентом давления и сохранной фракцией выброса
в настоящее время относят к стадии D3 с неспец-
ифическим концентрическим ремоделированием
ЛЖ. Ударный объем рассчитывают как произведе-
ние интеграла скорости престенотического потока и
площади ВТЛЖ. Ударный объем отражает не толь-
ко глобальную функцию ЛЖ, но и размеры ЛЖ и
сопутствующую аортальную или митральную ре-
гургитацию, поэтому имеет некоторые преимуще-
ства перед ФВ при оценке ВТЛЖ. Индекс ударного
объема 35 мл/м2 или более в состоянии покоя счита-
ется нормальным, тогда как индекс ударного объе-
ма < 35 мл/м2 свидетельствует о низком потоке.
ПАК и ударный объем рассчитываются по инте-
гралу скорости престенотического потока и диаме-
тру ВТЛЖ (см. рис. 15 .3), т.е . ПАК всегда несет ин-
формацию о ударном объеме. И наоборот, погреш-
ность измерения (как правило, заниженная оценка
диаметра ВТЛЖ) приведет к заниженной оценке как
ПАК, так и ударного объема. В связи с этим значе-
ние ударного объема необходимо соотнести с объ-
емом желудочка, измеренным в 2D-режиме или
3D-режиме. Соотнесение допплеровского и анато-
мического ударного объема может дать более убе-
дительные доказательства снижения потока. Кроме
того, подтвердить снижение трансклапанного пото-
ка могут косвенные признаки, включая фибрилля-
Рис. 15.4 Оценка степени аортального стеноза. (А) Оценка функции ЛЖ по фракции выброса (ФВ). (Б) A Оценка морфологии, степени кальцификации и от-
крытия клапана в позиции по длинной оси. (В) A Дальнейшая оценка морфологии и количества створок в позиции по короткой оси. (Г) Измерение максимальной
скорости, среднего градиента давления и интеграла скорости кровотока с помощью непрерывно-волновой допплерографии. (Д) Измерение скорости престеноти-
ческого потока и интеграла скорости кровотока в ВТЛЖ с помощью импульсно-волновой допплерографии. (Е) Диаметр ВТЛЖ (d), измеренный в режиме «Масшта-
бирование» для расчета площади ВТЛЖ. На изображениях ― тяжелый стеноз кальцифицированного трехстворчатого аортального клапана со средним градиентом
давления 55 мм рт. ст., расчетной площадью аортального клапана 0,6 см2 и снижением ФВ до 45%.
ФВ 45%
d=21мм
d
А
Б
В
Г
Д
Е
ch15.indd 333
03.04.2019 11:54:03
334
ЧАСТЬ IV Пороки клапанов сердца
Рис. 15.5 Оценка степени аортального стеноза при фибрилляции предсердий. (А) Диаметр ВТЛЖ (d) измеряют в режиме «Масштабирование» в середине
систолы. (Б) Мгновенные максимальные скорости престенотического и стенотического потоков можно оценить с помощью непрерывно-волновой допплерографии.
(В, Г) Средние максимальные скорости престенотического и стенотического потоков можно оценить в течение 5–10 последовательных сердечных циклов. Индекс
скорости престенотического и стенотического потоков используют для расчета площади аортального клапана (в данном случае ПАК = 0 ,6 см2).
d=20мм
0,6 м/сек
0,8 м/сек
0,7 м/сек
3,4 м/сек
0,59 м/сек
3,1 м/сек
3,9 м/сек
2,9 м/сек
d
А
Б
Г
В
Рис. 15.6 Корреляция показателей степени аортального стеноза у пациентов с нормальной фракцией выброса. (А) Сильная корреляция между мак-
симальной скоростью аортального потока и средним градиентом давления. Показатели практически точно пересекают точку пороговых значений для тяжелого аор-
тального стеноза (4 м/сек ― для максимальной скорости аортального потока, 40 мм рт. ст. ― для среднего градиента давления). (Б) Связь между площадью аор-
тального клапана и средним градиентом давления, выявляемым у 30% пациентов с дискордантной оценкой степени аортального стеноза (ПАК < 1,0 см2, средний
градиент давления ≤ 40 мм рт. ст.). Для сравнения приведена соответствующая прогностическая кривая, полученная из формулы Горлина, предполагающая нор-
мальный сердечный выброс (6 л/мин, ЧСС 75 уд/мин) [Minners J, Allgeier M, Gohlke-Baerwolf C, et al. Inconsistencies of echocardiographic criteria for the grading of aor-
tic valve stenosis. Eur Heart J 29:1043–1048, 2008].
Максимальная скорость потока (м/сек)
Средний градиент давления (мм рт. ст .)
39%
1%
120
2,0
1,5
1,0
0,5
100
80
60
40
С
р
е
д
н
и
й
г
р
а
д
и
е
н
т
д
а
в
л
е
н
и
я
(
м
м
р
т
.
с
т
.
)
П
л
о
щ
а
д
ь
а
о
р
т
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
(
с
м
2
)
20
0
2,0 3,0 4,0
5,0
6,0
7,0
8,0
0
1%
30%
30%
39%
Прогностическая кривая
Эмпирически подобранная кривая
20
40
60
80 100 120
6%
53%
r 0,94
p 0,01
А
Б
ch15.indd 334
03.04.2019 11:54:04
335
15 Аортальный стеноз
цию предсердий, выраженную гипертрофию и ми-
тральную или трикуспидальную регургитацию.
ИНДЕКС СКОРОСТИ
Расчет площади ВТЛЖ представляет собой ахилле-
сову пяту оценки ПАК, что обусловлено не только
низкой воспроизводимостью во время измерения
диаметра ВТЛЖ [8], но и часто овальной, а не круг-
лой формой ВТЛЖ. Индекс скорости (VR) можно
рассчитать по следующей формуле:
VR = VTI1/VTI2 или VR = V1/V2.
Индекс скорости используют как упрощенный
показатель степени АС, меньше зависящий от по-
тока, чем максимальная скорость аортального пото-
ка или средний градиент давления. Пренебрежение
диаметром ВТЛЖ является ограничением точности
вычислений при малом и очень большом выходном
тракте [9]. Индекс скорости является полезным па-
раметром при продолжительном наблюдении па-
циента, т.к. считается, что индивидуальный диа-
метр ВТЛЖ неизменен в течение продолжительно-
го периода. VR < 0,25 указывает на тяжелый стеноз.
Индекс скорости обычно оценивают по макси-
мальным скоростям престенотического (V1) и пост-
стенотического (V2) потоков при непрерывно-вол-
новой допплерографии. Этот показатель можно
использовать в качестве контроля при измерении
скорости престенотического потока. Индекс скоро-
сти приобретает большое значение при фибрилля-
ции предсердий, когда следующие друг за другом
сердечные циклы варьируют в широком диапазо-
не (см. рис. 15 .5). В этом случае престенотический и
постстенотический потоки оценивают в течение по
меньшей мере 5 сердечных циклов. Индекс скоро-
сти как компонент уравнения непрерывности пото-
ка можно использовать для вычисления ПАК при
фибрилляции предсердий.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
И ПЛАНИМЕТРИЯ ПЛОЩАДИ КЛАПАНА
Мультипланарная ЧПЭхоКГ позволяет детально из-
учить морфологию клапана. Планиметрия анато-
мического отверстия клапана осуществима в боль-
шинстве случаев и может быть очень полезна в слу-
чае несоответствий гемодинамических показателей
степени стеноза у пациентов с умеренным или тя-
желым стенозом при оценке с помощью ТТЭхоКГ.
Однако даже без прямого измерения анатомическо-
го отверстия клапана степень АС можно оценить по
морфологии клапана.
При планиметрии аортальный клапан отобража-
ется в центре позиции по длинной оси. Затем опре-
деляется соответствующая перпендикулярная по-
зиция по короткой оси, и полученное в результате
изображение увеличивается. Параметры изображе-
ния следует настраивать аккуратно. Точное опреде-
ление гистогематического барьера — необходимое
условие адекватного отслеживания на стробоско-
пических изображениях (рис. 15 .7). Анатомическое
отверстие клапана визуализируется в середине си-
столы, и может понадобиться несколько измерений,
особенно при выраженной кальцификации. В двух-
створчатых аортальных клапанах с куполообразной
морфологией максимальное ограничение потока
наблюдается на краях створок, поэтому обязатель-
но тщательное обследование самого маленького от-
верстия в позиции по короткой оси в самой высокой
точке по направлению потока для предотвращения
переоценки анатомического отверстия клапана. Од-
новременное отображение двух перпендикулярных
плоскостей может помочь определить подходящую
для планиметрии позицию по короткой оси.
Кроме того, ЧПЭхоКГ позволяет четко опреде-
лить морфологию ВТЛЖ, что может быть трудно
при ТТЭхоКГ. Диаметр ВТЛЖ измеряют, как при
ТТЭхоКГ. ЧПЭхоКГ полезно при наличии допол-
нительной обструкции ВТЛЖ, обусловленной фи-
брозной мембраной или систолическим смещени-
ем митрального клапана кпереди. Диаметр ВТЛЖ
можно измерить в условиях отличного качества
изображения, сравнить с данными ТТЭхоКГ и пе-
ресчитать ПАК, если это необходимо, комбинируя
данные ТТЭхоКГ и ЧПЭхоКГ (см. рис. 15 .7).
Современные датчики с матричной решеткой
обеспечивают визуализацию в режиме реального
времени и автономную количественную оценку по-
лученных объемных данных. Это может помочь в
определении анатомического отверстия клапана с
помощью ЧПЭхоКГ в трудных случаях, например
при двухстворчатом аортальном клапане (см. рис.
15.2) [10]. Несмотря на ограничения, связанные с
выраженной кальцификацией, применимость дан-
ного метода в клинической практике оказалась хо-
рошей [11]. Кроме того, метод позволяет отобра-
жать овальную форму ВТЛЖ и выполнять прямую
планиметрию.
КЛИНИЧЕСКИЕ ТРУДНОСТИ ПРИ ОЦЕНКЕ
СТЕПЕНИ АОРТАЛЬНОГО СТЕНОЗА
ТОЧНОСТЬ И ВАРИАБЕЛЬНОСТЬ ИЗМЕРЕНИЙ
Максимальная скорость аортального потока и сред-
ний градиент давления являются надежными пока-
зателями степени АС, если максимальная скорость
успешно идентифицирована в нескольких позици-
ях (рис. 15 .8). Уравнение непрерывности потока да-
ет достоверные значения ПАК (при условии, что все
компоненты уравнения оценены правильно), кото-
рая представляет собой второй по важности показа-
тель степени АС. Однако отмечается тенденция к за-
вышению скорости престенотического потока, по-
скольку допплерография измеряет скорость потока
в центре ВТЛЖ, ошибочно исходя из однородной
и прямоугольной эпюры скоростей. С другой сто-
ch15.indd 335
03.04.2019 11:54:05
336 ЧАСТЬ IV Пороки клапанов сердца
роны, площадь ВТЛЖ обычно недооценивается из-
за овальной формы (с более коротким переднезад-
ним диаметром, измеренным во время ТТЭхоКГ и
2D-ЧПЭхоКГ). Было высказано предположение, что
небольшое завышение скорости престенотического
потока компенсируется незначительно заниженной
оценкой площади ВТЛЖ [12].
Вариабельность данных допплерографии у од-
ного и того же исследователя и между исследовате-
лями высока (коэффициент корреляции 0,9, коэф-
фициент вариации 3,7–7,7%), но, по-видимому, ни-
же для диаметра ВТЛЖ и, следовательно, ПАК [8]. В
связи с этим ПАК, рассчитанная по уравнению не-
прерывности потока, считают менее точной, поэто-
му результат должен быть округлен до не более чем
одной цифры (максимально до двух).
ВЛИЯНИЕ АОРТАЛЬНОГО КРОВОТОКА
Максимальная скорость и средний градиент дав-
ления сильно зависят от потока. По этой причине
ПАК используют как менее зависимый от потока
показатель степени АС. Однако открытие жестких,
кальцифицированных створок в определенной сте-
пени зависит от сил, направленных на открывание
[13], поэтому на фоне фактического потока необхо-
димо оценивать не только скорость и градиент, но
и ПАК. Это особенно важно при небольшой ПАК
в сочетании с низким средним градиентом давле-
ния из-за нарушения функции ЛЖ. Стимуляцию
добутамином сокращения ЛЖ используют для уве-
личения трансклапанного потока и оценки степе-
ни АС в условиях нормализованного потока и раз-
личения псевдотяжелого АС от истинного тяжелого
АС путем демонстрации резерва открывания клапа-
на при увеличении силы, направленной на него [14,
15]. Скорость потока через стенозированный клапан
рассчитывают как ударный объем, деленный на вре-
мя выброса (мл/сек). Скорее всего, это самый адек-
ватный параметр, характеризующий силы открыва-
ния, поэтому его рекомендуется использовать при
стимуляции добутамином.
АНАТОМИЧЕСКОЕ ОТВЕРСТИЕ КЛАПАНА
И ЭФФЕКТИВНАЯ ПЛОЩАДЬ КЛАПАНА
По уравнению непрерывности потока вычисляют
эффективную ПАК, которая меньше площади ана-
томического отверстия клапана, т.к. после анато-
мического отверстия клапана поток сужается (vena
contracta), а затем в восходящем отделе аорты воз-
никает турбулентный поток (рис. 15 .9). Величина
Рис. 15.7 Ревматический аортальный стеноз. 5 -летний пациент с тяжелым ревматическим митральным стенозом и сопутствующим аортальным стенозом.
(А) Импульсно-волновая допплерография ВТЛЖ. (Б) Непрерывно-волновая допплерография аортального клапана. (В) Измерение диаметра (d) ВТЛЖ в режиме
«Масштабирование». Расчетная площадь аортального клапана равна 1,2 см2. (Г) A На ЧПЭхоКГ видно слияние правой и левой коронарных створок. (Д) Площадь
анатомического отверстия аортального клапана равна 1,4 см2. (Е) A Измерение диаметра (d) ВТЛЖ при ЧПЭхоКГ в позиции по длинной оси. Площадь аортально-
го клапана, рассчитанная по дополнительному измерению диаметра ВТЛЖ, равна 1,4 см2.
d=23мм
d=24,5мм
d
d
Площадь анатомического
отверстия 1,4 см2
А
Б
В
Г
Д
Е
ch15.indd 336
03.04.2019 11:54:05
337
15 Аортальный стеноз
несоответствия между эффективной ПАК и площа-
дью анатомического отверстия клапана зависит от
размера и формы отверстия, т.е . разница возрастает
при небольшом аортальном клапане, плоском кла-
пане и при наличии эксцентрической струи. Значи-
тельные различия между площадью анатомическо-
го отверстия клапана и эффективной ПАК обычно
наблюдаются у пациентов с двухстворчатым клапа-
ном и эксцентрическим потоком [16]. Однако в кли-
нической практике существенное несоответствие
между площадью анатомического отверстия и эф-
фективной ПАК должно в первую очередь служить
поводом для тщательной оценки соответствующих
параметров, в частности диаметра ВТЛЖ (для рас-
чета эффективной ПАК).
ВОССТАНОВЛЕНИЕ ДАВЛЕНИЯ
Восстановление давления — явление, при котором
потери энергии в стенотическом потоке преобразу-
ются в энергию давления в восходящем отделе аор-
ты, что приводит к более низкому градиенту давле-
ния между ЛЖ и аортой, чем при измерении в не-
посредственной близости от аортального клапана.
Этим можно объяснить некоторые различия пока-
Рис. 15.8 Тяжелый стеноз двухстворчатого аортального клапана. (А) A В позиции по короткой оси аортального клапана видны тяжелая кальцификация,
щелевидное отверстие клапана во время систолы (слияние правой коронарной и некоронарной створок). (Б) Дилатация восходящего отдела аорты. (В) Измере-
ние диаметра (d) ВТЛЖ в позиции по длинной оси в режиме «Масштабирование». (Г) Импульсно-волновая допплерография ВТЛЖ вблизи аортального клапана.
(Д) Непрерывно-волновая допплерография аортального клапана в апикальной позиции (средний градиент давления 39 мм рт. ст.). (Е) Непрерывно-волновая доп-
плерография аортального клапана в правой парастернальной позиции демонстрирует более высокие скорости (средний градиент давления 59 мм рт. ст.). Рассчи-
танная область клапана составляет 0,9 см2.
d=26мм
d=50мм
Слияние
створок
d
d
А
Б
В
Г
Д
Е
Рис. 15.9 Площадь анатомического отверстия клапана и эффектив-
ная площадь аортального клапана. Поток крови проходит через стенози-
рованный аортальный клапан, далее сжимается до эффективной площади аор-
тального клапана (ПАК) (vena conracta), затем в восходящем отделе аорты ста-
новится турбулентным. Разница между площадью анатомического отверстия
клапана и эффективной ПАК увеличивается в случае небольшого аортально-
го клапана, при плоском клапане, по сравнению с клапаном с куполообразной
морфологией, и при наличии эксцентрической струи. ВТЛЖ — выходной тракт
левого желудочка.
Площадь анатомического
отверстия клапана
Эффективная
ПАК
ВТЛЖ
ch15.indd 337
03.04.2019 11:54:07
338 ЧАСТЬ IV Пороки клапанов сердца
зателей среднего градиента давления, измеренных
с помощью катетера и при допплерографии, по-
скольку последний метод не учитывает восстанов-
ление давления (при катетеризации давление обыч-
но регистрируется после восстановления давления).
Степень восстановления давления зависит от раз-
ницы между эффективной ПАК и площадью восхо-
дящего отдела аорты. Чем меньше отверстие клапа-
на по отношению к диаметру аорты, тем больше бу-
дет турбулентность и меньше энергии может быть
затрачено на восстановление давления [17]. Следо-
вательно, выраженное восстановление давления на-
блюдается при наличии легкого или умеренного
АС, когда диаметр восходящего отдела аорты отно-
сительно небольшой (< 30 мм).
Для учета восстановления давления был предло-
жен индекс потерь энергии (ИПЭ), предполагая, что
градиент давления был следствием стеноза без вос-
становления давления. ИПЭ рассчитывают по сле-
дующей формуле:
ИПЭ = ИПАК × ААо/(ААо – ПАК),
где AАо — площадь поперечного сечения восходя-
щего отдела аорты в синотубулярном соединении;
ИПАК — площадь аортального клапана, индекси-
рованная к площади поверхности тела; ПАК — пло-
щадь аортального клапана.
Было показано, что ИПЭ обеспечивает прогно-
стической информацией, но не лучше, чем другие
показатели степени АС у пациентов с легким и уме-
ренным АС [18]. В клинической практике следует
учитывать восстановление давления при высоком
градиенте давления или несоответствии степени АС
диаметру восходящего отдела аорты (< 30 мм).
НЕСООТВЕТСТВИЕ ПОКАЗАТЕЛЕЙ
СТЕПЕНИ АОРТАЛЬНОГО СТЕНОЗА
О тяжелом АС свидетельствуют Vmax > 4 м/сек, сред-
ний градиент давления > 40 мм рт. ст. и ПАК < 1 см2
(см. табл. 15 .1). Как правило, у пациента может на-
блюдаться несоответствие между средним градиен-
том давления и ПАК: ПАК < 1,0 см2 указывает на
тяжелый АС, а средний градиент давления < 40 мм
рт. ст. свидетельствует об умеренном АС. Такое не-
соответствие может быть связано с низким пото-
ком, что приводит к относительно низкому средне-
му градиенту давления, несмотря на выраженный
АС. Такая ситуация возможна как при сниженной,
так и при нормальной фракции выброса (стадии D2
и D3 соответственно), что может быть прямым или
косвенным признаком уменьшения потока, поэто-
му необходимо тщательно искать причину этого
несоответствия (см. ранее).
Несоответствие между средним градиентом дав-
ления и ПАК может быть результатом ошибки из-
мерений, а также небольших размеров тела пациен-
та и врожденных несоответствий между пороговы-
ми значениями. Ошибка измерения, скорее всего,
связана с заниженной оценкой площади ВТЛЖ (см.
ранее). Таким образом, при несоответствии сред-
него градиента давления и ПАК необходимо, пре-
жде всего, тщательно пересмотреть все измерения,
в частности диаметр ВТЛЖ. При небольших разме-
рах тела следует использовать ПАК, индексирован-
ную к площади поверхности тела (ИПАК) (см. да-
лее). Только после исключения этих причин можно
считать, что несоответствие между ПАК и средним
градиентом давления действительно указывает на
тяжелый АС. Было показано, что средний градиент
давления 40 мм рт. ст. соответствовал ПАК = 0,8–
0,9 см2 (вместо 1,0 см2) в условиях нормального по-
тока (т.е. нормальная фракция выброса и нормаль-
ный индекс ударного объема), а ПАК = 1,0 см2 со-
ответствовала среднему градиенту давления 30 мм
рт. ст. (а не 40 мм рт. ст.) [19, 20]. Это означает, что
ПАК < 1,0 см2 является более ранним маркером тя-
желого АС, когда средний градиент давления еще
> 40 мм рт. ст. АС при несоответствии показателей
ПАК и среднего градиента давления при нормаль-
ном потоке называют тяжелым АС с нормальным
потоком/низким градиентом давления. Такой АС
имеет характеристики, схожие с таковыми умерен-
ного АС [21–26].
ИНДЕКСИРОВАНИЕ К РАЗМЕРУ ТЕЛА
Максимальная скорость аортального потока и сред-
ний градиент давления — независимые от размера
тела показатели степени АС, а ПАК, напротив, имеет
сильную зависимость от размеров тела. ПАК, индек-
сированная к площади поверхности тела (ИПАК),
успешно устраняет эту зависимость и улучшает со-
поставимость показателей [27]. У пациентов с не-
большими размерами тела более низкая потреб-
ность в кислороде, меньше размер полостей сердца
и более низкий ударный объем, чем у крупных лю-
дей, и, следовательно, более низкий средний гради-
ент давления. Таким образом, ПАК = 0,9 см2 у паци-
ента с небольшими размерами тела свидетельствует
об умеренном стенозе, а у крупного пациента — о
тяжелом стенозе. Однако использование рекомен-
дованного порогового значения ИПАК = 0,6 см2/м2
завышает степень стеноза у пациентов с большой
площадью поверхности тела [28] в связи с ожире-
нием [29], поэтому применимо только у пациентов
с малым размером тела (площадью поверхности те-
ла < 1,6 м2) [30]. В качестве альтернативы можно ис-
пользовать другой показатель степени АС — индекс
скорости, который не зависит от размера тела и по-
тока и для которого не нужно измерять ВТЛЖ [31].
СОПУТСТВУЮЩАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Неконтролируемая гипертензия может приводить
к снижению ударного объема и уменьшению сред-
него градиента давления и ПАК [32], поэтому при
ch15.indd 338
03.04.2019 11:54:07
339
15 Аортальный стеноз
оценке степени АС артериальное давление должно
быть ниже 140/90 мм рт. ст. Необходимо обязатель-
но указывать значение артериального давления при
ЭхоКГ.
ИЗМЕНЕНИЯ ЛЕВОГО ЖЕЛУДОЧКА
ПРИ АОРТАЛЬНОМ СТЕНОЗЕ
ГИПЕРТРОФИЯ И РЕМОДЕЛИРОВАНИЕ
Практически у всех пациентов со значительным
АС наблюдается гипертрофия или ремоделирова-
ние ЛЖ различной степени. Развитие гипертро-
фии ЛЖ зависит от генетических факторов, пола,
индекса массы тела и наличия артериальной гипер-
тензии, следовательно, слабо коррелирует с тяже-
стью АС. Ремоделирование характеризуется отно-
сительной толщиной стенки (ОТС = 2 × Толщи-
на задней стенки/Конечно-диастолический размер)
и индексом массы миокарда ЛЖ. Оба параметра в
пределах нормального диапазона указывают на со-
ответствие норме. О концентрическом ремоделиро-
вании свидетельствуют ОТС > 0,42 и нормальный
индекс массы миокарда ЛЖ, о концентрической ги-
пертрофии — ОТС > 0,42, индекс массы миокарда
ЛЖ > 95 г/м2 (у женщин) и > 115 г/м2 (у мужчин),
об эксцентрической гипертрофии — увеличенный
индекс массы миокарда ЛЖ и ОТС ≤ 0,42. В ходе не-
скольких исследований было продемонстрировано
неблагоприятное влияние увеличенной массы мио-
карда ЛЖ [33] и концентрического ремоделирова-
ния [34] на исход у пациентов с АС. Патологическое
утолщение стенки ЛЖ также может наблюдать-
ся при сопутствующем амилоидозе, что нередко
встречается у пожилых пациентов, и при гипертро-
фической кардиомиопатии.
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ
Диастолическая дисфункция наблюдается на ран-
ней стадии заболевания и соотносима с наличием у
пациента симптомов (см. главу 9) [35].
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ
Выраженная систолическая дисфункция ЛЖ явля-
ется признаком поздней стадии АС и может быть
обусловлена сопутствующим поражением миокар-
да. Нарушения локальной сократимости миокарда
всегда должны вызывать подозрение о сопутствую-
щей ишемической болезни сердца (ИБС). Глобаль-
ная систолическая функция определяется при ви-
зуальной оценке, количественной оценке фракции
укорочения (если нарушения локальной сократи-
мости миокарда исключены) и фракции выброса
методом Симпсона или с помощью 3D-ЭхоКГ (см.
главу 7). Фракцию выброса 50% или более считают
нормальной, или сохранной. Однако для поддер-
жания нормального ударного объема большинству
пациентов с АС нужна более высокая фракция вы-
броса (от 60 до 70%), поскольку часто ЛЖ умень-
шен в результате концентрического ремоделиро-
вания. Дооперационная фракция выброса имеет
сильную корреляцию с общей выживаемостью па-
циентов после протезирования клапанов: наихуд-
шие исходы при фракции выброса < 50%; постепен-
ное улучшение исходов при фракции выброса от 50
до 59%; самый низкий риск летального исхода при
фракции выброса не менее 60%. Эта корреляция не
зависит от симптомного статуса пациента[36].
ИНДЕКС УДАРНОГО ОБЪЕМА
Индекс ударного объема в настоящее время самый
важный и наиболее изученный маркер функции
ЛЖ у пациентов с АС, т.к. снижение ударного объ-
ема признано показателем снижения функции же-
лудочков даже при нормальной фракции выброса
[37, 38]. Сниженный ударный объем ассоциируется
с летальным исходом у пациентов с АС и фракцией
выброса не менее 50%, причем наибольшая смерт-
ность наблюдается при индексе ударного объема
< 35 мл/м2 [39]. Смертность также была увеличена
среди пациентов с индексом ударного объема, рав-
ным 43 мл/м2, по сравнению с пациентами, у кото-
рых этот показатель превышал 43 мл/м2.
ПРОДОЛЬНАЯ ДЕФОРМАЦИЯ
Фракция выброса по-прежнему остается наиболее
распространенным параметром оценки функции
ЛЖ, но имеет ограничения, поскольку является по-
казателем преимущественно радиальной деформа-
ции, тогда как концентрическое ремоделирование
и фиброз миокарда (наблюдаемые у большинства
пациентов с АС) могут приводить к нарушению
продольной деформации, которая неадекватно от-
ражается на фракции выброса. В связи с этим бы-
ло предложено включить в обследование пациен-
тов с АС оценку продольной деформации (см. главу
8) или систолического смещения фиброзного коль-
ца митрального клапана. Были предложены порого-
вые значения глобальной продольной деформации
(–15%) [40–43] и смещения фиброзного кольца ми-
трального клапана (9 мм), но для их широкого вне-
дрения в клиническую практику нужны дополни-
тельные исследования [44, 45].
СОПУТСТВУЮЩАЯ ПАТОЛОГИЯ
Сопутствовать АС могут аортальная регургитация,
подклапанная обструкция и кальцификация фи-
брозного кольца митрального клапана. К потен-
циальным последствиям АС и последующего из-
менения ЛЖ относят митральную регургитацию,
расширение левого предсердия (ЛП), легочную ги-
пертензию, нарушение функции правого желудоч-
ка (ПЖ), трикуспидальную регургитацию, застой в
нижней полой вене и появление плевральной жид-
ch15.indd 339
03.04.2019 11:54:07
340
ЧАСТЬ IV Пороки клапанов сердца
Рис. 15.10 Комбинированный порок аортального клапана: аортальный стеноз и аортальная регургитация. 56-летний пациент с двухстворчатым аор-
тальным клапаном, легким аортальным стенозом и тяжелой аортальной регургитацией. (А) В М-режиме продемонстрировано эксцентрическое ремоделирование.
(Б) Максимальная скорость 4,3 м/сек при непрерывно-волновой допплерографии. (В) Увеличенная скорость (1,3 м/сек) престенотического потока. (Г) Большой ди-
аметр ВТЛЖ (28 мм), площадь аортального клапана 1,7 см2, индекс ударного объема 111 мл/м2. (Д, Е) 2D-ЧПЭхоКГ и 3D-ЧПЭхоКГ отверстия аортального клапана.
Визуализация легкого аортального стеноза. (Ж) A Цветовая допплерография демонстрирует тяжелую аортальную регургитацию.
d=28мм
А
Б
В
Г
Д
Е
Ж
кости. Такое количество сопутствующих заболева-
ний свидетельствует о необходимости комплексно-
го эхокардиографического обследования всех паци-
ентов с АС.
АОРТАЛЬНАЯ РЕГУРГИТАЦИЯ
Аортальная регургитация отмечается во всех случа-
ях АС. При ревматическом и дегенеративном сте-
нозе трехстворчатого аортального клапана обыч-
но визуализируется центральная струя регургита-
ции, и оценить степень АС обычно просто. Однако
при врожденном пороке аортального клапана, осо-
бенно двухстворчатом, часто пролабирует бо
́
льшая
(неразделенная) створка, в результате возникает
эксцентрическая струя регургитации, при которой
нужно тщательное обследование для исключения
недооценки АС (см. рис. 15 .2).
Выраженная аортальная регургитация проявля-
ется увеличением ударного объема, что приводит
к повышению градиента давления. Максимальная
скорость и средний градиент давления не отража-
ют стенотический компонент, но свидетельствуют
об общей гемодинамической нагрузке и полезны
для принятия клинического решения [46]. Тяжесть
стенотического поражения можно достоверно оце-
нить по ПАК, которая не зависит от ударного объе-
ма. С увеличением аортальной регургитации ремо-
делирование ЛЖ становится все более эксцентри-
ческим (рис. 15 .10). Сохранная фракция выброса
и индекс ударного объема могут вводить в заблуж-
дение относительно нормальной функции ЛЖ, по-
скольку оба показателя не учитывают объем регур-
гитации и, следовательно, не отражают эффектив-
ный выброс.
ПОДКЛАПАННАЯ ОБСТРУКЦИЯ
При субаортальном стенозе или динамической об-
струкции ВТЛЖ с прогрессирующей гипертрофией
или гипертрофической кардиомиопатией может на-
блюдаться сопутствующая подклапанная обструк-
ция. По мере увеличения скорости престенотиче-
ского потока все более существенным становится
завышение степени АС при оценке его по макси-
мальной скорости аортального потока и среднему
градиенту давления с помощью упрощенного урав-
нения Бернулли. При значительно увеличенной
максимальной скорости престенотического потока
(например, > 1,2 м/сек) лучше использовать полное
ch15.indd 340
03.04.2019 11:54:07
341
15 Аортальный стеноз
Рис. 15.11 Комбинированный порок аортального клапана: аортальный стеноз и подклапанная обструкция. Такая совокупность структурных наруше-
ний не позволяет достоверно определить степень аортального стеноза. (А) A A Выраженная кальцификация аортального клапана (АК), небольшой ВТЛЖ, каль-
цификация фиброзного кольца митрального клапана и передней створки митрального клапана (ПСМК) и парадоксальное систолическое движение передней створ-
ки митрального клапана (SAM-синдром). (Б) Непрерывно-волновая допплерография демонстрирует два отдельных сигнала: первый ― с среднесистолическим пи-
ком, возникающим на аортальном клапане, второй ― с позднесистолическим пиком, возникающим из-за обструкции на входе в ВТЛЖ. (В) Непрерывно-волновая
допплерография аортального клапана в правой парастернальной позиции. (Г) A Позиция по короткой оси аортального клапана. (Д) Импульсно-волновая доппле-
рография ВТЛЖ вблизи аортального клапана. (Е) Импульсно-волновая допплерография сопутствующего митрального стеноза.
SAM-синдром
ПСМК
АК
А
Б
В
Г
Д
Е
уравнение Бернулли и рассчитать ПАК. Оценка сте-
пени АС может стать практически невозможной, ес-
ли АС сопутствует подклапанная обструкция.
Непрерывно-волновая допплерография может
дать некоторое представление об общем повыше-
нии давления. Однако расходящиеся контрольные
моменты времени максимальной обструкции, про-
странственная неоднородность потока в ВТЛЖ и
его форма не позволяют провести последователь-
ные измерения (рис. 15 .11). В этой сложной ситу-
ации информация о морфологии становится осо-
бенно важной. Ее лучше всего получать с помощью
ЧПЭхоКГ, которая продемонстрирует локализацию
и генез подклапанной обструкции и морфологиче-
ские критерии степени АС. Следует отметить, что
любое уменьшение постнагрузки, например проте-
зирование аортального клапана, может усугубить
динамическую подклапанную обструкцию, что не-
обходимо проанализировать после комплексной
доперационной ЭхоКГ. Нередко для устранения об-
струкции ВТЛЖ необходима дополнительная сеп-
тальная миэктомия.
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Кальцификацию фиброзного кольца митрально-
го клапана выявляют примерно у 50% пациентов,
подвергаемых изолированному протезированию
аортального клапана. Кальцификация фиброзно-
го кольца митрального клапана ассоциируется с по-
жилым возрастом, стенозом трехстворчатого аор-
тального клапана и почечной недостаточностью без
увеличения риска сопутствующей митральной ре-
гургитации [47]. Митральная регургитация обычно
сопутствует АС, часто без структурных изменений
и связана с перегрузкой давлением и диастоличе-
ской дисфункцией. Она коррелирует с ухудшением
результатов, и ее нормализация наблюдается только
у 50% пациентов, перенесших изолированное хирур-
гическое и транскатетерное протезирование клапана
[48, 49].
При оценке тяжести обоих поражений необхо-
димо учитывать значительную гемодинамическую
взаимосвязь. Выраженная митральная регургита-
ch15.indd 341
03.04.2019 11:54:09
342
ЧАСТЬ IV Пороки клапанов сердца
ция может напрямую снизить ударный объем и, со-
ответственно, градиент давления, приводящий к со-
вокупности симптомов тяжелого АС со сниженным
потоком/низким градиентом давления, несмотря на
нормальную фракцию выброса. Таким образом, не-
обходим расчет ударного объема. С другой сторо-
ны, повышенное давление в ЛЖ из-за АС может
приводить к увеличению объема регургитации, по-
этому предпочтительнее прямое измерение объема
регургитации. Оценка причины митральной регур-
гитации обязательна, поскольку уменьшение ми-
тральной регургитации после протезирования аор-
тального клапана более вероятно при вторичной ре-
гургитации, чем при первичной [50].
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
ИБС наблюдается примерно у 50% пациентов с АС
и оказывает значительное влияние на прогноз [51].
Всегда следует искать признаки ИБС, например на-
рушения локальной сократимости миокарда. По-
скольку клинические симптомы АС и ИБС накла-
дываются друг на друга, проведение функциональ-
ных тестов связано с серьезными ограничениями и
даже противопоказано пациентам с симптомами. В
большинстве случаев нужна коронарная ангиогра-
фия для выявления или исключения выраженной
ИБС, особенно при планировании протезирования
аортального клапана.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Систолическое давление в легочной артерии оце-
нивают по максимальной систолической скорости
трикуспидальной регургитации и расчетному дав-
лению в нижней полой вене (см. главу 32). Легочная
гипертензия у пациентов с АС независимо связана
с продольной и диастолической дисфункцией ЛЖ
[52], ухудшением результатов вмешательства и по-
вышенной послеоперационной летальностью [53–
56]. Интересно, что эта корреляция была замечена у
женщин, тогда как у мужчин не было повышенного
риска летального исхода при любой степени легоч-
ной гипертензии [57]. Легочная гипертензия может
немного снизиться после протезирования аорталь-
ного клапана, но остается предиктором ухудшения
отдаленного исхода [58, 59].
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ
СТРЕСС-ТЕСТ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
Стресс-тест с физической нагрузкой рекомендует-
ся выполнять всем пациентам с тяжелым АС при
отсутствии симптомов, т.к. симптомы могут поя-
виться во время теста. Кроме того, несоответству-
ющая реакция артериального давления на физиче-
скую нагрузку является маркером неблагоприятных
событий в будущем [60]. В связи с этим снижение
толерантности к физической нагрузке и несоответ-
ствующее повышение артериального давления бы-
ли включены в рекомендации по протезированию
аортального клапана [2, 61]. Связь между кровото-
ком и градиентом давления является предиктором
ответа на физическую нагрузку у большинства па-
циентов [62]. В последнее время в ходе небольших
исследований было отмечено, что увеличение сред-
него градиента давления > 20 мм рт. ст. и индуци-
рованная физической нагрузкой легочная гипер-
тензия > 60 мм рт. ст., измеренная во время стресс-
ЭхоКГ, связаны с неблагоприятными событиями в
будущем у пациентов с тяжелым АС без симптомов
[63–65]. Однако относительная ценность проведе-
ния стресс-ЭхоКГ у пациентов без симптомов еще
должна быть установлена.
КАТЕТЕРИЗАЦИЯ СЕРДЦА
В настоящее время катетеризацию сердца с целью
оценки степени АС редко проводят по клиническим
показаниям. Тем не менее перед транскатетерным
протезированием аортального клапана часто оце-
нивают гемодинамику. Следует учитывать некото-
рые принципиальные различия между измерения-
ми с помощью ЭхоКГ и измерениями при катетери-
зации [17].
ГРАДИЕНТ ДАВЛЕНИЯ
Разница амплитуд полного колебания градиента
давления от максимума к минимуму при катетери-
зации указывает на падение максимального давле-
ния во время систолы от ЛЖ до восходящего отде-
ла аорты независимо от контрольного момента вре-
мени каждого максимума, тогда как максимальный
градиент давления при допплерографии является
максимальным мгновенным градиентом давления
во время систолы (рис. 15 .12). Средний градиент
давления рассчитывают с помощью двух методов
на основе одних и тех же принципов, расхождения в
значениях могут возникнуть в случае восстановле-
ния давления. При допплерографии максимальный
градиент давления измеряют от ЛЖ до vena contracta
(эффективная ПАК) и восстановление давления не
учитывается (см. ранее), однако при катетеризации
градиент давления обычно регистрируется в аорте
после восстановления давления, следовательно, яв-
ляется показателем истинного градиента.
ПЛОЩАДЬ АОРТАЛЬНОГО КЛАПАНА
При катетеризации ПАК рассчитывают по форму-
ле Горлина:
ПАК = СВ/(K × ΔРср),
где СВ — сердечный выброс; K — константа; ΔPср —
средний градиент давления.
Первоначально по формуле Горлина рассчиты-
вали эффективную ПАК как при допплерографии,
но впоследствии была введена эмпирическая кон-
ch15.indd 342
03.04.2019 11:54:10
343
15 Аортальный стеноз
Рис. 15.12 Определение градиента давления. Одновременное измере-
ние давления в ЛЖ и аорте у пациента с аортальным стенозом выявляет раз-
ницу между максимальным давлением в ЛЖ и максимальным давлением в
аорте (красная стрелка) и разницу между средними значениями давлений в
ЛЖ и аорте (черная стрелка). Разница амплитуд полного колебания градиен-
та давления от максимума к минимуму при катетеризации указывает на паде-
ние максимального давления во время систолы от ЛЖ до восходящего отдела
аорты независимо от контрольного момента времени каждого максимума, тог-
да как максимальный градиент при допплерографии является максимальным
мгновенным градиентом давления во время систолы. Средний градиент давле-
ния ― это среднее значение мгновенных градиентов давления во время систо-
лы, которые определяют при допплерографии и катетеризации.
Средний градиент давления
Время
012345
V4
Д
а
в
л
е
н
и
е
(
м
м
р
т
.
с
т
.
)
150
200
100
50
0
станта K для преобразования эффективной ПАК в
площадь анатомического отверстия клапана (и уче-
та различных единиц) [17]. Различия в измерении
градиента давления и между площадью анатомиче-
ского отверстия клапана и эффективной ПАК по-
зволяют объяснить большинство различий в оцен-
ке ПАК с помощью допплерографии и катетериза-
ции. В целом при катетеризации средний градиент
давления несколько ниже, а ПАК немного больше,
чем при ЭхоКГ. Тем не менее существенного рас-
хождения в оценке степени АС с помощью обоих
методов, скорее всего, нет [66].
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ СЕРДЦА
Современная компьютерная томография (КТ) по-
зволяет оценить площадь анатомического отвер-
стия клапана в условиях высокого качества изобра-
жения. Площадь анатомического отверстия клапа-
на, полученная с помощью КТ, хорошо коррелирует
с площадью анатомического отверстия клапана, из-
меренной при ЧПЭхоКГ [67].
Определение морфологии и диаметра ВТЛЖ по-
зволяет более точно рассчитать эффективную ПАК
при ТТЭхоКГ с допплерографией. Однако ПАК,
рассчитанная после измерения ВТЛЖ при КТ, бу-
дет больше, чем при расчете по диаметру ВТЛЖ при
ТТЭхоКГ. Такой подход не улучшает коэффициент
соответствия степени АС и прогноз, по сравнению с
одним только ТТЭхоКГ [68, 69].
Кальцификация аортального клапана, выявлен-
ная при КТ, коррелирует со степенью АС [70], более
быстрым прогрессированием патологии и снижени-
ем выживаемости [51]. В настоящее время возмож-
ность точной количественной оценки кальцифика-
ции предоставляет дополнительную информацию,
не зависящую от эхокардиографических показате-
лей степени АС, и в сомнительных случаях может
быть важным параметром [71, 72].
Дополнительное преимущество КТ — возмож-
ность одновременной оценки ИБС, которая наблю-
дается примерно у 50% пациентов с АС. Определе-
ние размера фиброзного кольца аортального кла-
пана и аортально-подвздошного сосудистого русла
при планировании транскатетерного протезирова-
ния аортального клапана стало возможным и обя-
зательным [73].
МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ СЕРДЦА
МРТ сердца стала альтернативным методом оцен-
ки анатомического отверстия клапана и ВТЛЖ. Ре-
зультаты ее аналогичны таковым ТТЭхоКГ. Однако
МРТ сердца имеет потенциал для измерения потока
в ВТЛЖ и стенозированном клапане в 4D-режиме.
Было отмечено хорошее соответствие результатам
ЭхоКГ [12, 74]. С помощью МРТ сердца можно из-
мерить объем ЛЖ, фракцию выброса и массу мио-
карда ЛЖ, особенно в исследовательских целях или
когда плохое качество изображения при ТТЭхоКГ
не позволяет оценить эти параметры.
Уникальной особенностью МРТ сердца является
возможность количественной оценки фиброза мио-
карда, который ассоциируется с нарушением сокра-
тимости продольных волокон миокарда ЛЖ и, как
было показано, является предиктором неблагопри-
ятных событий у пациентов с АС [44, 75, 76].
КЛИНИЧЕСКИЕ ПОДХОДЫ
Рекомендуется следующая последовательность оцен-
ки АС с помощью ЭхоКГ:
1. Визуализация анатомии клапана для выявления
места обструкции и предварительной оценки
степени стеноза.
2. Измерение скорости аортального кровотока в
нескольких позициях; вычисление среднего гра-
диента давления.
3. Измерение скорости престенотического потока и
диаметра ВТЛЖ для расчета ПАК, уделяя особое
внимание оценке диаметра ВТЛЖ.
4. Оценка функции ЛЖ в М-режиме (толщина
стенки) и с помощью двухмерной или трехмер-
ной визуализации (фракция выброса).
5. Проверка наличия аортальной регургитации,
митральной регургитации и подклапанного сте-
ch15.indd 343
03.04.2019 11:54:10
344
ЧАСТЬ IV Пороки клапанов сердца
ноза; если они есть, нужно следовать конкрет-
ным рекомендациям (см. соответствующие раз-
делы).
6. Индексирование ПАК к площади поверхности
тела при размере тела пациента < 1,6 м2.
7. Вычисление индекса потерь энергии для учета
восстановления давления, если синотубулярное
соединение менее 30 мм.
8. При несоответствии ПАК (< 1,0 см2) и среднего
градиента давления (< 40 мм рт. ст.) необходимо
проверить все показатели (прежде всего диаметр
ВТЛЖ), искать косвенные признаки состояний,
сопровождающихся низким потоком (фибрил-
ляция предсердий, выраженная гипертрофия,
митральная регургитация) и считать индекс
ударного объема; сделать перекрестную провер-
ку индекса ударного объема со значениями, по-
лученными в ходе объемных измерений. В спор-
ных случаях оценки степени АС следует рассмо-
треть проведение ЧПЭхоКГ (для планиметрии
анатомического отверстия аортального клапана)
или КТ (для количественной оценки кальцифи-
кации).
9. При ФВ < 50%, ПАК < 1,0 см2 и среднем градиен-
те давления < 40 мм рт. ст. следует рассмотреть
проведение стресс-ЭхоКГ с добутамином (для
исключения псевдотяжелого АС).
Эхокардиографические параметры всегда сле-
дует оценивать в комплексе с клинической карти-
ной. Наличие симптомов, обусловленных АС, оста-
ется самым важным клиническим маркером худ-
шего прогноза, если не выполнить протезирование
аортального клапана. Появление симптомов у ра-
нее бессимптомных пациентов и повышение у них
артериального давления при стресс-тесте с физиче-
ской нагрузкой имеет важное значение для опреде-
ления тактики клинического ведения. При несоот-
ветствии результатов ЭхоКГ клиническим проявле-
ниям необходима новая тщательная оценка, в связи
с чем могут понадобиться дополнительные диагно-
стические исследования. На рис. 15 .13 приведен ал-
горитм диагностики АС и эхокардиографические
показатели для количественной оценки степени АС
и определения его стадии. В табл. 15 .2 перечислены
особые ситуации при оценке АС, при которых мо-
гут понадобиться дополнительные исследования.
Рис. 15.13 Определение стадии аортального стеноза. Эхокардиографические показатели и их пороговые значения (слева) используют для определения ста-
дии аортального стеноза (АС). Желтый цвет ― необходимость дальнейшей оценки; красный цвет ― предпочтительное протезирование аортального клапана; зеле-
ный цвет ― дальнейшее консервативное лечение. Стресс-ЭхоКГ с добутамином можно провести для дифференцировки пациентов с аортальным стенозом и низ-
ким градиентом и сниженной фракцией выброса (ФВ). Недавно при этом стресс-тесте был выявлен псевдотяжелый стеноз у пациентов с сохранной фракцией вы-
броса [99]. СГД ― средний градиент давления; ПАК ― площадь аортального клапана.
Аортальный стеноз
С
Г
Д
>
4
0
м
м
р
т
.
с
т
.
Стадия D1
Стадия D3
Средний градиент давления 40 мм рт. ст.
Площадь аортального клапана 1,0 см2
Фракция выброса 50%
Индекс ударного объема 35 мл/м2
Добутамин:
ПАК < 1,0 см2 или
СГД>40ммрт.ст.
Нет
Нет
Да
Да
Стадия D2
П
А
К
≥
1
,
0
с
м
2
ПАК < 1,0 см2
ФВ<50%
Ф
В
≥
5
0
%
≤ 35 мл/м2
>
3
5
м
л
/
м
2
СГД≤40ммрт.ст.
АС с высоким
градиентом давления
Умеренный АС
АС с низким
градиентом давления
Тяжелый АС
с низким градиентом давления
Тяжелый АС с низким градиентом
давления и нормальной ФВ
Тяжелый АС с низким
градиентом и сниженной ФВ
АС с нормальным потоком/
низким градиентом давления
Псевдотяжелый АС
Стойкий тяжелый АС
Псевдотяжелый АС
Стойкий тяжелый АС
АС с низким потоком/
низким градиентом давления
ch15.indd 344
03.04.2019 11:54:10
345
15 Аортальный стеноз
Особая ситуация
Потенциальная причина
Решение
Небольшой аортальный кла-
пан (ПАК < 1,0 см2) и низкий
градиент (средний градиент
давления ≤ 40 мм рт. ст.)
Маленькие размеры тела (ППТ
< 1,6 м2)
Расчет ИПАК
Ошибки измерения (наиболее
часто заниженная оценка диа-
метра ВТЛЖ)
Новое измерение показателей степени АС
Использование дополнительных позиций
Оправдана ЧПЭхоКГ для визуализации ВТЛЖ
и морфологии клапана
Сниженная фракция выброса
(< 50%)
Стресс-ЭхоКГ с добутамином
Снижение ударного объема
при нормальной фракции
выброса (≥ 50%)
Расчет ИУО, поиск косвенных признаков снижения ИУО
Оценка морфологии (ЧПЭхоКГ), оправдана КТ (коли-
чественная оценка кальцификации), оправдана стресс-
ЭхоКГ с добутамином (см. текст)
Митральная регургитация
Расчет ИУО
Отсутствие других причин
Анализ несоответствия пороговых значений ПАК и СГД
относительно степени АС
Высокий градиент давления
(средний градиент давления
> 40 мм рт. ст.) и большая об-
ласть клапана (ПАК ≥ 1,0 см2)
Ошибки измерения
Новое измерение показателей степени АС
Высокий поток вследствие аор-
тальной регургитации, бради-
кардии, анемии, лихорадки,
артериовенозных шунтов
(гемодиализа)
Расчет ИУО
Общее пора жение клапана можно считать тяжелым
Несоответствие между гемоди-
намическими показателями
АС и морфологией клапана
Ошибки измерения
Новое измерение показателей степени АС
Использование дополнительных позиций
Оправдана ЧПЭхоКГ для визуализации ВТЛЖ
и морфологии клапана
Двухстворчатый аортальный кла-
пан: образование купола может
создать впечатление сохранного
открытия клапана
Использование дополнительных позиций
(эксцентрическая струя)
Оправдана 3D-ЧПЭхоКГ для лучшей визуализации
морфологии клапана
Эксцентрическая струя: занижен-
ная оценка скорости стенотиче-
ского потока
Использование дополнительных позиций
Обструкция ВТЛЖ: оценка сте-
пени АС с помощью обычных
измерений проблематична
Оценка морфологии клапана (ЧПЭхоКГ)
Восходящий отдел аорты < 30 мм:
восстановление давления
Расчет ИПЭ
Большие различия между пло-
щадью анатомического отвер-
стия клапана и эффективной
ПАК
Учет методологических расхождений между площадью
анатомического отверстия клапана и эффективной ПАК
(см. в тексте)
Наличие симптомов
при умеренном АС
Заниженная оценка скорости сте-
нотического потока
Использование дополнительных позиций
АС не является причиной сим-
птомов
Необходимо рассмотреть другие заболевания с этими
симптомами
Умеренный АС может быть
с симптомами, особенно у мо-
лодых и активных пациентов
Следует рассмотреть протезирование клапана, если АС
является наиболее вероятной причиной симптомов
АС — аортальный стеноз; ВТЛЖ — выходной тракт левого желудочка; ИПЭ — индекс потери энергии; ИУО — индекс ударного объема;
КТ — компьютерная томография; ПАК — площадь аортального клапана; ИПАК — площадь аортального клапана, индексированная к
площади поверхности тела; СГД — средний градиент давления; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 15.2 Оценка степени аортального стеноза в особых ситуациях
ch15.indd 345
03.04.2019 11:54:10
346
ЧАСТЬ IV Пороки клапанов сердца
ПРОГНОСТИЧЕСКАЯ ЗНАЧИМОСТЬ
ЭхоКГ является источником не только диагности-
ческой, но и прогностической информации с ря-
дом полезных показателей для прогнозирования
краткосрочных, среднесрочных и долгосрочных ис-
ходов до и после протезирования аортального кла-
пана, а также оценки хирургического риска. Таким
образом, результаты ЭхоКГ влияют на тактику ве-
дения пациентов с АС. Например, диагностирован-
ный при ЭхоКГ изолированный аортальный скле-
роз связан с увеличением примерно на 50% риска
смерти от сердечно-сосудистых причин даже при
отсутствии гемодинамически значимой обструк-
ции [77]. Максимальная скорость потока призна-
ка наилучшим показателем исхода при АС. В двух
проспективных исследованиях изучали клиниче-
ские исходы у бессимптомны пациентов, делая ак-
цент на максимальной скорости потока [78, 79]. Бы-
ло продемонстрировано постепенное увеличение
вместе с этим показателем тяжести стеноза и кли-
нических событий (рис. 15 .14; табл. 15 .3, 15.4). Бы-
ло установлено, что частота событий в год (леталь-
ный исход или протезирование клапана) составляет
0% у пациентов с максимальной скоростью пото-
ка < 3 м/сек. Начиная с 4 м/сек показатели смерт-
ности в течение 1 года существенно возрастают, что
позволяет в настоящее время считать это значение
клинически обоснованной пороговой величиной
для тяжелого стеноза. У пациентов с максимальной
скоростью > 5,5 м/сек частота событий в течение 1
года достигает 76%. Быстрый рост максимальной
скорости (> 0,3 м/сек) также можно считать преди-
ктором будущих неблагоприятных событий. Бо-
лее быстрое прогрессирование АС отмечается у па-
циентов с более высокой степенью кальцификации
[51] и с обструкцией клапана, а также у пациентов с
ИБС. Прогностическую информацию, полученную
на основе среднего градиента давления, можно счи-
тать эквивалентной, поскольку максимальная ско-
рость потока и средний градиент давления тесно
коррелируют (см. рис. 15 .6) [19]. ПАК также связа-
на с исходом у пациентов с АС, но в меньшей степе-
ни. Другие показатели степени АС, а именно индекс
скорости и индекс потерь энергии, имели дополни-
тельную прогностическую значимость, однако не
превысили ценность максимальной скорости по-
тока [18, 31]. Прогностическая значимость индек-
са ударного объема, фракции выброса, легочной ги-
пертензии и гипертрофии ЛЖ обсуждена в соответ-
ствующих разделах.
Внезапная сердечная смерть без предшествую-
щих симптомов (0,2–3,1% в год) при тяжелом АС,
по-видимому, не ассоциируется со степенью АС, а
может быть частично обусловлена сопутствующи-
ми заболеваниями, например ИБС (табл. 15 .5).
ТАКТИКА, НАПРАВЛЕННАЯ НА СНИЖЕНИЕ
СТЕПЕНИ СТЕНОЗА ИЛИ ПРЕКРАЩЕНИЕ
ЕГО ПРОГРЕССИРОВАНИЯ
Учитывая сильную корреляцию гиперхолестерине-
мии и кальцификации аортального клапана, было
проведено 3 рандомизированных клинических ис-
следования с участием в общей сложности 2297 па-
циентов. В ходе исследований был отмечен поло-
жительный эффект гиполипидемической терапии
на исходы АС. Однако не было изменений гемоди-
намического прогрессирования АС и клинических
исходов при лечении аторвастатином в ходе иссле-
дования SALTIRE (Scottish Aortic Stenosis and Lip-
id-Lowering Trial), симвастатином-эзетимибом —
исследовании SEAS и розувастатином в ходе иссле-
дования ASTRONOMER (Aortic Stenosis Progression
Observation: Measuring Effects of Rosuvastatin) [80–
82]. Рекомендована тактика контроля артериальной
гипертензии [83], но до настоящего времени нет
специальной терапии для снижения или прекраще-
ния прогрессирования клапанной обструкции. Сле-
дуя концепции естественного течения заболевания
(перехода от склероза к стенозу и увеличения степе-
ни нарастания стеноза в процессе болезни) в насто-
ящее время изучают специфические патофизиоло-
гические пути, связанные с различными стадиями
заболевания, включая сигнализацию оксида азота и
кальцификацию тканей [84].
Рис. 15.14 Исходы у бессимптомных пациентов с аортальным стенозом в соответствии с максимальной скоростью потока. В ходе двух эпохаль-
ных исследований Otto [78] и Rosenhek [79] продемонстрировано постепенное увеличение клинических событий в будущем с увеличением максимальной скорости.
100
100
80
60
40
20
0
80
60
40
20
0
01 23
Длительность наблюдения (годы)
Vmax < 3,0 м/сек
p < 0,0001
Vmax = 4 ,0–5,0 м/сек
Vmax = 5,0–5,5 м/сек
Vmax ≥ 5,5 м/сек
Vmax = 3,0–4,0 м/сек
Vmax > 4,0 м/сек
В
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
с
о
б
ы
т
и
й
(
%
)
В
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
с
о
б
ы
т
и
й
(
%
)
Длительность наблюдения (годы)
12
24
36
48
60
0
ch15.indd 346
03.04.2019 11:54:10
347
15 Аортальный стеноз
Первый
автор, год
Тип исследо-
вания
Клиническое со-
стояние пациента
на начало исследо-
вания
n
Средний срок
наблюдения
(годы)
Увеличение
среднего ΔP
(мм рт. ст ./год)*
Увеличение
Vmax
(м/сек/год)*
Уменьшение
ПАК
(см2/год)*
Эхокардиографические исследования
Otto, 1989
[100]
Проспектив-
ное
Без симптомов
42 1,7
8
0,36 ± 0,31
0,1 (0–0,5)
Roger, 1990
[101]
Ретроспек-
тивное
АС на ЭхоКГ
112 2,1
0,23 ± 0,37
Faggiano, 1992
[102]
Проспектив-
ное
АС на ЭхоКГ
45 1,5
0,4 ± 0,3
0,1 ± 0,13
(−0,7–0,1)
Peter, 1993
[103]
Ретроспек-
тивное
АС на ЭхоКГ
49 2,7
7,2
Brener, 1995
[104]
Ретроспек-
тивное
АС на ЭхоКГ
394 6,3
0,14
Otto, 1997 [78] Проспектив-
ное
Без симптомов
123 2,5
7±7
0,32 ± 0,34
0,12 ± 0,19
Bahler, 1999
[105]
Ретроспек-
тивное
АС на ЭхоКГ
91 1,8
2,8
0,2
0,04
Palta, 2000
[106]
Ретроспек-
тивное
АС на ЭхоКГ
170 1,9
0,10 ± 0,27
Rosenhek,
2000 [3]
Проспектив-
ное
Vmax > 4,0 м/сек
128 1,8
Медленное
0,14 ± 0,18
Быстрое
0,45 ± 0,38
Rosenhek,
2004 [51]
Ретроспек-
тивное
Vmax = 2,5–3,9 м/сек 176 3,8
0,24 ± 0,30
Kearney, 2012
[107]
Проспектив-
ное
АС на ЭхоКГ
147 6,5±4
5,0 ± 5,2
0,11 ± 0,20
Nguyen, 2015
[108]
Проспектив-
ное
АС на ЭхоКГ
149 2,9
3±3
Эхокардиография во время вмешательства
Novaro, 2001
[109]
Ретроспек-
тивное
ПАК = 1,0–1,8 см2 174 1,7
Терапия статинами
Без статинов
0,06 ± 0,16
0,11 ± 0,18
Bellamy, 2002
[110]
Ретроспек-
тивное
ПАК < 2,0 см2
156 3,7
Терапия статинами
Без статинов
0,04 ± 0,15
0,09 ± 0,17
Rosenhek,
2004 [111]
Ретроспек-
тивное
Vmax > 2,5 м/сек
211 2,0
Терапия статинами
Без статинов
0,1 ± 0,41
0,39 ± 0,42
Cowell, 2005
[80]
Проспектив-
ное
Vmax > 2,5 м/сек
134 2,1
Терапия статинами
Без статинов
0,2 ± 0,21
0,2 ± 0,21
0,08 ± 0,11
0,08 ± 0,11
Moura, 2007
[112]
Проспектив-
ное
ПАК = 1,0–1,5 см2 121 1,4
Терапия статинами
Без статинов
0,4 ± 0,38
0,24 ± 0,30
0,05 ± 0,12
0,1 ± 0,09
Rossebо* [81] Проспектив-
ное
Vmax = 2,5–4,0 м/сек 1873 5,4
Терапия статинами
2,7 ± 0,1
Без статинов
2,8 ± 0,1
0,15 ± 0,01
0,16 ± 0,01
0,03 ± 0,01
0,03 ± 0,01
Chan [82]
Проспектив-
ное
Vmax = 2,5–4,0 м/сек 269 3,5
Терапия статинами
3,8 ± 4,4
Без статинов 3,9
± 4,9
0,08 ± 0,21
0,07 ±0,15
Bull [113]
Проспектив-
ное
Vmax > 3,0 м/сек
100 1,0
Рамиприл
Без рамиприла
0,03
0,12
0,0
0,2
* Среднее значение ± стандартная ошибка.
ΔP — градиент давления; Vmax — максимальная скорость аортального потока; АС — аортальный стеноз; ПАК — площадь аортального кла-
пан; ЭхоКГ — эхокардиография.
ТАБЛИЦА 15.3 Гемодинамическое прогрессирование стеноза аортального клапана
ch15.indd 347
03.04.2019 11:54:10
348
ЧАСТЬ IV Пороки клапанов сердца
Первый автор,
год
Критерии отбора
Количество
пациентов
Возраст па-
циента (лет)
Срок наблюде-
ния (месяцы)
Степень аортального
стеноза
Выживаемость
без событий
Kelly, 1988
[114]
Vmax ≥ 3,5 м/сек
51
63±19
15±10
ΔP=68±19ммрт.ст. 60%,2года
Pellikka, 1990
[115]
Vmax ≥ 4,0 м/сек
143
72 (40–94)
20
Vmax = 4,4 (4–6,4) м/сек 62%, 2 года
Kennedy, 1991
[116]
Умеренный АС при
катетеризации
66
67±10
35
ПАК = 0,92 ± 0,13 см2 59%, 4 года
Otto, 1997 [78] Аномальный
клапан с Vmax
> 2,6 м/сек
123
63±16
30
Vmax < 3,0 м/сек
Vmax = 3–4 м/сек
Vmax > 4 м/сек
84%, 2 года
66%, 2 года
21%, 2 года
Rosenhek, 2000
[3]
Vmax ≥ 4,0 м/сек
128
60±18
22±18
Vmax 5,0 ± 0,7 м/сек
67%, 1 год
56%, 2 года
33%, 4 года
Rosenhek, 2004
[51]
Аномальный
клапан с Vmax =
2,5–3,9 м/сек
176
58±19
48±19
Vmax = 3,1 ± 0,4 м/сек 95%, 1 год
75%, 2 года
60%, 5 лет
Pellikka 2005
[117]
Vmax ≥ 4,0 м/сек
622
72±11
65±48
Vmax = 4,4 ± 0,4 м/сек 82%, 1 год
67%, 2 года
33%, 5 лет
Rossebо, 2008
[81]
Vmax = 2,5–4,0 м/сек 1873
68±9
52 (среднее зна-
чение)
Vmax = 3,1 ± 0,55 м/сек Прибл. 65%, 5
лет
Lancellotti, 2010
[40]
ИПАК ≤ 0,6 см2/м2 163
70±10
20±19
ИПАК ≤ 0,6 см2/м2
50%, 2 года
44%, 4 года
Kang, 2010
[118]
Vmax ≥ 4,5 м/сек
95
63±12
58 (среднее зна-
чение)
Vmax=4,9±0,4м/сек 71±5%,2года
47±5%,4года
28±6%,6лет
Rosenhek, 2010
[79]
Vmax ≥ 5,0 м/сек
116
67±15
41 (среднее зна-
чение)
Vmax = 5,0–5,5 м/сек
Vmax ≥ 5,5 м/сек
43%, 2 года
25%, 2 года
Kearney, 2013
[107]
АС на ЭхоКГ
239
74±6
60
Слабо выраженный
Умеренный
Тяжелый
66±5%
23±7%
20±10%
Yechoor, 2013
[119]
Vmax = 3,0–4,0 м/сек 104
74±10
22
Умеренный АС с не-
благоприятным
влиянием сопутству-
ющих заболеваний
48%, 1 год
24%, 3 года
15%, 5 лет
Maes, 2014 [24] ИПАК ≤ 0,6 см2/м2 220
76±13
78±11
28
Высокий градиент
(> 40 мм рт. ст.)
Низкий градиент
(≤ 40 мм рт. ст.)
35±7%
59±5%
Taniguchi, 2015
[120]
Vmax > 4,0 м/сек, или
ΔP>40ммрт.ст.,
или ПАК < 1,0 см2
1517
78±9
44
ПАК = 0,79 ± 0,16 см2 82%, 1 года
48%, 3 года
17%, 5 лет
ΔP — градиент давления; Vmax — максимальная скорость аортального потока; АС — аортальный стеноз; ПАК — площадь аортального кла-
пана; ИПАК — площадь аортального клапана, индексированная к площади поверхности тела.
ТАБЛИЦА 15.4 Выживаемость бессимптомных пациентов с аортальным стенозом
ch15.indd 348
03.04.2019 11:54:10
349
15 Аортальный стеноз
ОПРЕДЕЛЕНИЕ СРОКОВ ПРОТЕЗИРОВАНИЯ
АОРТАЛЬНОГО КЛАПАНА
Срок протезирования в первую очередь определяет-
ся наличием симптомов. После появления симпто-
мов исход будет неутешителен, если не проводить
протезирование аортального клапана. Существу-
ют убедительные доказательства того, что вмеша-
тельство на клапанном аппарате облегчает симпто-
мы и продлевает жизнь [85]. С другой стороны, у
бессимптомных пациентов с нормальной функци-
ей ЛЖ вмешательство лучше отложить, поскольку
риск внезапной смерти и тяжелых спонтанных ос-
ложнений ниже, чем риск вмешательства: 3% (изо-
лированное хирургическое протезирование) vs 5%
(комбинация протезирования и шунтирования)
[86]. Показания к протезированию перечислены в
табл. 15 .6 [2, 61], обобщены в следующем разделе
и проиллюстрированы на рис. 15.15 . Транскатетер-
ная имплантация аортального клапана теперь ста-
ла обычной альтернативой хирургическому проте-
зированию клапана у пациентов из группы высоко-
го риска (см. главу 16).
ПАЦИЕНТЫ С СИМПТОМАМИ
Протезирование аортального клапана рекомендова-
но всем пациентам с тяжелым АС, высоким гради-
ентом давления и наличием симптомов (стадия D1).
Протезирование аортального клапана необходимо
выполнить пациентам, у которых симптомы только
при стресс-тесте с физической нагрузкой.
Классическая триада симптомов АС — стенокар-
дия, одышка и обморок — наблюдается на поздних
стадиях заболевания. Многие пациенты имеют не-
специфические симптомы, например снижение то-
лерантности к физической нагрузке и одышку при
физической нагрузке, что может быть частично об-
условлено сопутствующими заболеваниями — ги-
пертензией, ожирением или хроническим заболева-
нием легких. В связи с этим количественная оценка
степени АС с помощью ЭхоКГ может стать един-
ственным доказательством, что протезирование
клапана облегчит симптомы или будет показано по
другим причинам. С другой стороны, нередка недо-
оценка симптомов, т.к . пациенты могут бессозна-
тельно ограничивать физическую активность по-
Первый автор, год
Количество
пациентов
Срок наблюде-
ния (месяцы)*
Степень АС
Внезапная смерть
Vmax (м/сек)†
ПАК (см2)
Количество
%вгод
Kelly, 1988 [114]
51
18
≥ 3,5
0
0
Faggiano, 1992 [102]
37
24
0,85 ± 0,15
0
0
Otto, 1997 [78]
114
30
3,6 ± 0,6
0
0
Rosenhek, 2000 [3]
128
22
≥ 4,0
1
0,4
Amato, 2001 [60]
66
15
≤ 1,0
4
4,8
Das, 2005 [121]
125
12
≤ 1,4
0
0
Pellikka, 2005 [117]
270
65
≥ 4,0
11
0,75
Rossebо, 2008 [81]
1873
52
2,5–4,0
40
0,5
Monin, 2009 [122]
211
22
≥ 3,0
≤1
2
0,5
Lancellotti, 2010 [40]
163
20
ИПАК ≤ 0,6 см2/м2
3
1,1
Kang, 2010 [118]
95
59
≥ 4,5
≥ 0,75
9
1,9
Marechaux, 2010 [65] 135
20
≤ 1,5
1
0,4
Rosenhek, 2010 [79]
116
41
≥ 5,0
1
0,3
Taniguchi, 2015 [120] 291
44
Vmax > 4,0 м/сек,
илиΔP>40мм
рт. ст., или ПАК
< 1,0 см2
ПАК 0,75 ± 0,18 см2 18£
1,2
Всего
3675
32
90
0,85
* Средняя продолжительность наблюдения.
† На начало исследования.
£ В 8 случаях были симптомы, в 10 — симптомы отсутствовали.
ΔP — градиент давления; Vmax — максимальная скорость аортального потока; АС — аортальный стеноз; ИПАК — площадь аортального
клапана, индексированная к площади поверхности тела; ПАК — площадь аортального клапана.
ТАБЛИЦА 15.5 Частота внезапной смерти у пациентов с аортальным стенозом
ch15.indd 349
03.04.2019 11:54:10
350 ЧАСТЬ IV Пороки клапанов сердца
AHA/ACC [2]
ESC/EACTS [61]
Пороговые значения тяжелого аортального стеноза
Vmax ≥ 4 м/сек; средний градиент давления ≥ 40 мм рт. ст.
Vmax > 4 м/сек; средний градиент давления > 40 мм рт. ст.
ПАК ≤ 1,0 см2; ИПАК ≤ 0,6 см2/м2
ПАК < 1,0 см2; ИПАК < 0,6 см2/м2
Индекс скорости < 0,25
Дисфункция ЛЖ: фракция выброса < 50%
Дисфункция ЛЖ: фракция выброса < 50%
Низкий поток: индекс ударного объема < 35 мл/м2
Низкий поток: индекс ударного объема < 35 мл/м2
Пациенты с симптомами
Тяжелый АС с высоким градиентом давления и симптомами,
обусловленными АС (I; B)
Тяжелый АС и наличие симптомов, обусловленных АС (I; B)
Тяжелый АС с высоким градиентом давления и появление сим-
птомов при физической нагрузке (I; B)
Тяжелый АС и симптомы, обусловленные АС, при физиче-
ской нагрузке (I; C)
АС с низким потоком/низким градиентом давления, снижен-
ной ФВ, Vmax ≥ 4 м/сек и ПАК ≤ 1,0 см2 при любой дозе добута-
мина (IIa; B)
АС с низким потоком/низким градиентом давления, снижен-
ными ФВ и резервом кровотока (IIa; C)
АС с низким потоком/низким градиентом давления и нормаль-
ной ФВ, нормальным уровнем артериального давления, если
данные указывают на АС как наиболее вероятную причину
симптомов (IIa; C)
АС с низким потоком/низким градиентом давления и нор-
мальной ФВ после тщательного подтверждения степени АС
(IIa; C)
АС с низким потоком/низким градиентом давления и снижен-
ной ФВ без резерва кровотока (IIb; C)
Пациенты без симптомов
ТяжелыйАСиФВ<50%(I;B)
Тяжелый АС и ФВ < 50% с отсутствием другой причины (I; C)
Тяжелый АС и снижение толерантности к физической нагрузке
или падение артериального давления при физической нагруз-
ке (IIa; B)
Тяжелый АС и падение артериального давления при физиче-
ской нагрузке ниже исходного уровня (IIa; C)
Vmax > 5,0 м/сек и низкий хирургический риск (IIa; B)
Vmax > 5,5 м/сек и низкий хирургический риск (IIa; C)
Тяжелый АС с нормальной ФВ с быстрым прогрессированием
(IIb; C)
Тяжелый АС с нормальной ФВ и выраженной кальцификаци-
ей с быстрым прогрессированием (> 0,3 м/сек/год) (IIa; C)
Тяжелый АС с нормальной ФВ, низким хирургическим ри-
ском и высоким уровнем мозгового натрийуретического
пептида (IIb; C)
Тяжелый АС с нормальной ФВ, низким хирургическим ри-
ском и увеличением
ΔPср > 20 мм рт. ст. при физической нагрузке (IIb; C)
Тяжелый АС с нормальной ФВ, низким хирургическим ри-
ском и чрезмерной гипертрофией ЛЖ при отсутствии гипер-
тензии (IIb; C)
Пациенты, подвергаемые другим операциям на сердце
Тяжелый АС и другие операции на сердце (I; B)
Тяжелый АС и другие операции на сердце (I; C)
Умеренный АС и другие операции на сердце (IIa; C)
Умеренный АС и другие операции на сердце (IIa; C)
Примечание. Класс I — показано; класс IIa — следует рассматривать; класс IIb — может быть рассмотрено. Уровни достоверности: B —
данные, полученные в результате рандомизированных исследований; C — консенсусное заключение экспертов и/или небольшие, и/или
ретроспективные исследования/реестры.
ACC — American College of Cardiology; AHA — American Heart Association; EACTS — European Association for Cardio-Thoracic Surgery; ESC —
European Society of Cardiology; ΔPср — средний градиент давления; Vmax — максимальная скорость аортального потока; АС — аортальный
стеноз; ЛЖ — левый желудочек; ПАК — площадь аортального клапана; ИПАК — площадь аортального клапана, индексированная к пло-
щади поверхности тела; ФВ — фракция выброса.
ТАБЛИЦА 15.6 Сравнение рекомендаций AHA/ACC и ESC/EACTS по протезированию аортального клапана
у пациентов с аортальным стенозом
ch15.indd 350
03.04.2019 11:54:10
351
15 Аортальный стеноз
этому лучше всем бессимптомным пациентам про-
вести стресс-тест с физической нагрузкой.
ПАЦИЕНТЫ БЕЗ СИМПТОМОВ
Бессимптомным пациентам протезирование аор-
тального клапана показано при наличии тяжело-
го АС (стадия C2) и ФВ < 50%, при сниженной то-
лерантности к физической нагрузке или снижении
артериального давления при физической нагруз-
ке, а также при очень тяжелом АС (стадия C1, Vmax
≥ 5,0 м/сек) и при низком хирургическом риске.
Протезирование аортального клапана может быть
рассмотрено у пациентов с тяжелым АС при отсут-
ствии симптомов (стадия C1), быстром прогресси-
ровании заболевания и низким хирургическим ри-
ском.
АОРТАЛЬНЫЙ СТЕНОЗ С НИЗКИМ ГРАДИЕНТОМ
ДАВЛЕНИЯ И СНИЖЕННОЙ ФРАКЦИЕЙ ВЫБРОСА
У пациентов с АС и сниженной фракцией выброса
для принятия клинических решений обычно нуж-
на дополнительная диагностика. Сниженный поток
при нарушенной функции ЛЖ (ФВ < 50%) препят-
ствует соответствующему увеличению градиента
давления, несмотря на значительно уменьшенную
ПАК (< 1,0 см2). Сниженный поток также может
препятствовать полному открытию клапана из-за
снижения сил открывания [13], что не позволяет
определить степень АС только по градиенту давле-
ния и ПАК в состоянии покоя. С целью восстанов-
ления нормального (или почти нормального) пото-
ка этим пациентам внутривенно вводят низкую до-
зу добутамина с постепенным ее увеличением (5, 10
Рис. 15.15 Алгоритм принятия решений о протезировании аортального клапана. ΔPmax — максимальный градиент давления; Vmax — максимальная ско-
рость потока; АД — артериальное давление; АС — аортальный стеноз; ПАК — площадь аортального клапана; ПрАК — протезирование аортального клапана (хи-
рургическое или транскатетерное); ФВЛЖ — фракция выброса левого желудочка [Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guide-
lines. J Am Coll Cardiol 63:2438–2488, 2014].
Аортальный клапан
со сниженным открытием
во время систолы
Тяжелый АС
Vmax ≥ 4 м/сек
ΔPmax≥40ммрт.ст.
Наличие симптомов
(стадия D1)
Отсутствие симптомов
(стадия С)
ФВЛЖ < 50%
(стадия C2)
Другие операции
на сердце
Vmax ≥ 5 м/сек
ΔPmax≥60ммрт.ст.,
низкий хирургический риск
Нарушения
при тесте на тредмиле
ΔVmax > 0,3 м/сек/год,
низкий хирургический риск
Vmax 3−3,9 м/сек
ΔPmax 20−39 мм рт. ст .
Наличие
симптомов
Отсутствие симптомов
(стадия В)
Другие операции
на сердце
АС ― вероятная
причина симптомов
ФВЛЖ < 50%
Стресс-ЭхоКГ
с добутамином,
ПАК≤1см2
иVmax≥4м/сек
(стадия D2)
ПАК≤1см2
иФВЛЖ≥50%
(стадия D3°)
ПрАК
(класс IIa)
Да
Нет
ПрАК
(класс IIa)
ПрАК
(класс I)
ПрАК
(класс IIb)
ch15.indd 351
03.04.2019 11:54:10
352
ЧАСТЬ IV Пороки клапанов сердца
Рис. 15.16 Стресс-эхокардиография с добутамином при аортальном стенозе с низким градиентом давления и сниженной фракцией выброса.
При увеличении дозы добутамина с 10 до 20 единиц ударный объем (УО) увеличивается с 42 до 79 мл (А–В), средний градиент давления ― с 14 до 23 мм рт. ст.
(Г–Е), а индекс скорости (VR) ― с 0,24 до 0,31. При диаметре ВТЛЖ 21 мм площадь аортального клапана (ПАК) равна 0,85 см2 в состоянии покоя и 1,1 см2 ― при
самой высокой дозе добутамина. Таким образом, увеличение ударного объема позволяет определить резерв открывания аортального клапана и диагностировать
псевдотяжелый аортальный стеноз.
VR 0,24
ПАК 0,85 см2
ПАК 0,94 см2
ПАК 1,1 см2
VR 0,27
VR 0,31
Добутамин 20
Добутамин 10
Покой
УО42мл
Покой
Добутамин 10
Добутамин 20
УО 63мл
УО79мл
А
Б
В
Г
Д
Е
и 20 мкг/кг/мин). В случае стойкого тяжелого сте-
ноза восстановление нормального потока увеличи-
вает средний градиент давления до более чем 40 мм
рт. ст., но ПАК не изменяется (< 1,0 см2). Если ПАК
увеличивается при минимальном изменении сред-
него градиента давления, ставят диагноз «псевдотя-
желый стеноз» (рис. 15 .16). Было показано, что псев-
дотяжелый стеноз можно лечить медикаментозно и
получить результаты, сходные с результатами лече-
ния сердечной недостаточности без АС [87], тогда
как у пациентов с действительно тяжелым АС по-
ложительный результат достигается после протези-
рования клапана. В группе пациентов с отсутстви-
ем сократительного резерва (увеличение ударного
объема < 20%) при стимуляции добутамином дол-
госрочную выживаемость может обеспечить только
протезирование клапана, несмотря на высокую по-
слеоперационную летальность [88, 89]. У пациен-
тов со средним градиентом давления < 20 мм рт. ст.
в состоянии покоя прогноз наихудший независимо
от метода терапии. В ходе последующих исследова-
ний необходимо определить значимость транскате-
терной имплантации аортального клапана для этих
пациентов.
АОРТАЛЬНЫЙ СТЕНОЗ С НИЗКИМ ГРАДИЕНТОМ ДАВЛЕНИЯ
И СОХРАННОЙ ФРАКЦИЕЙ ВЫБРОСА
Значительно уменьшенную ПАК (< 1,0 см2), низ-
кий средний градиент давления (< 40 мм рт. ст.) и
сохранную фракцию выброса (≥ 50%) выявляют у
30% пациентов с АС. Данное состояние было опи-
сано в разделе о несоответствии между различными
показателями степени АС. У большинства пациен-
тов с АС, низким градиентом давления и сохранной
фракцией выброса отмечается нормальный крово-
ток (рис. 15 .17), на что указывает нормальный ин-
декс ударного объема (≥ 35 мл/м2), а также характе-
ch15.indd 352
03.04.2019 11:54:10
353
15 Аортальный стеноз
Рис. 15.17 Аортальный стеноз с нормальным потоком, низким градиентом давления и сохранной фракцией выброса. Измерения скорости пре-
стенотического потока (А) и скорости аортального потока (Б) и диаметра ВТЛЖ (В) для расчета площади аортального клапана (в этом случае 0,9 см2). (Г) A При
ТТЭхоКГ в позиции по короткой оси видна умеренная кальцификация аортального клапана. (Д, Е) A ЧПЭхоКГ в позиции по короткой оси подтверждает наличие
треугольного отверстия, нетяжелую обструкцию и площадь аортального клапана 1,0 см2.
d=21мм
ПАК 1,0 см2
А
Б
В
Г
Д
Е
ристики и исходы, сходные с таковыми у пациентов
с умеренным АС (тяжелый АС с нормальным пото-
ком/низким градиентом давления) [21, 23–26, 90]. В
таком случае протезирование аортального клапана
не нужно (рис. 15 .18).
При АС с низким градиентом давления и нор-
мальной фракцией выброса нередко нужны (поми-
мо новых тщательных измерений) дополнительные
диагностические методы и интеграция клиниче-
ских и эхокардиографических данных для приня-
тия решения, если есть сомнения относительно степе-
ни АС. Помочь в оценке может ЧПЭхоКГ. С помо-
щью ЧПЭхоКГ при высоком качестве изображения
можно получить подробную информацию о мор-
фологии аортального клапана, измерить анатоми-
ческое отверстие клапана и диаметр ВТЛЖ путем
планиметрии. Количественная оценка кальцифика-
ции клапана при КТ обеспечивает прогностической
информацией, превышающей данные ЭхоКГ, и что
может быть особенно полезно при АС с низким гра-
диентом давления [70–72].
У пациентов с АС с низким потоком/низким гра-
диентом давления и сохранной фракцией выбро-
са (стадия D3) наблюдается сниженный поток (рис.
15.19), на что указывает сниженный индекс ударно-
го объема (< 35 мл/м2) из-за малых размеров желу-
дочка и снижения продольной сократимости [90,
91], обусловленных гипертрофией и фиброзом ЛЖ
[92]. Это состояние, вероятно, наиболее соответ-
ствует тяжелому АС, предшествующему неспеци-
фическому процессу концентрического ремодели-
рования ЛЖ [90], что исключает скорее высокий
градиент давления, чем позднюю стадию АС с высо-
ким градиентом давления [93]. В ретроспективных
исследованиях пациенты в этом состоянии имели
худший прогноз [22, 94, 95]. Положительный ре-
ch15.indd 353
03.04.2019 11:54:11
354
ЧАСТЬ IV Пороки клапанов сердца
Рис. 15.19 Тяжелый аортальный стеноз с низким потоком, низким градиентом давления и сохранной фракцией выброса. 82-летний пациент с не-
большим гипертрофированным ЛЖ и фракцией выброса 52%. (А) Импульсно-волновая допплерография ВТЛЖ вблизи аортального клапана. (Б) Непрерывно-вол-
новая допплерография аортального клапана. (В) Измерение диаметра (d) ВТЛЖ в позиции по длинной оси в режиме «Масштабирование». Область аортального
клапана равна 0,8 см2. (Г) Дополнительное измерение диаметра ВТЛЖ при ЧПЭхоКГ в позиции по длинной оси. (Д) Выраженная кальцификация трехстворчатого
аортального клапана при ЧПЭхоКГ по короткой оси. (Е) Планиметрия площади аортального клапана.
ПАК 0,8 см2
d=22мм
d=22мм
d
d
А
Б
В
Г
Д
Е
Рис. 15.18 Общая выживаемость и выживаемость после лекарственной терапии при различных скорости потока и градиента давления у пациен-
тов с сохранной фракцией выброса (≥ 50%). Сниженный поток (СП) ― при индексе ударного объема < 35 мл/м2; низкий градиент (НГ) ― при среднем гради-
енте давления < 40 мм рт. ст. При СП/НГ ― осторожный прогноз, при НП/НГ ― исход благоприятный. НормП/ВГ — нормальный поток/высокий градиент; НормП/
НГ — нормальный поток/низкий градиент; НП/ВГ — низкий поток/высокий градиент; НП/НГ — низкий поток/низкий градиент [Eleid MF, Sorajja P, Michelena HI,
et al. Flow-gradient patterns in severe aortic stenosis with preserved ejection fraction: clinical characteristics and predictors of survival. Circulation 128:1781–1789, 2013].
100
80
60
40
20
0
3
Общая выживаемость (годы)
Выживаемость
после лекарственной терапии (годы)
НП/ВГ
НП/НГ
НормП/ВГ
НормП/НГ
НП/ВГ
НП/НГ
НормП/ВГ
НормП/НГ
В
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
В
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
100
80
60
40
20
0
012
0123
ch15.indd 354
03.04.2019 11:54:13
355
15 Аортальный стеноз
зультат был при протезировании аортального кла-
пана [96], хотя исходы после вмешательства были
хуже, чем у пациентов с АС с высоким градиентом
давления [44, 97, 98]. В связи с этим протезирова-
ние аортального клапана считают целесообразным
у пациентов с тяжелым АС с низким потоком/низ-
ким градиентом давления, наличием симптомов и
сохранной фракцией выброса (стадия D3), у кото-
рых артериальное давление нормальное и ФВЛЖ
не менее 50%, если по клиническим, гемодинамиче-
ским и анатомическим данным наиболее вероятной
причиной симптомов является обструкция клапана.
Интересно, что у пациентов с АС с низким по-
током/низким градиентом давления и сохранной
фракцией выброса (стадия D3) может наблюдать-
ся снижение сил открывания клапана, как у паци-
ентов со сниженной фракцией выброса (стадия D2).
Для определения степени АС может понадобиться
стресс-ЭхоКГ с добутамином, по результатам кото-
рой в 30% случаев классифицируют псевдотяжелый
стеноз (см. рис. 15.13) [29], однако клиническую зна-
чимость этих результатов еще предстоит уточнить.
ПАЦИЕНТЫ С ПОКАЗАНИЯМИ К ДРУГИМ
ХИРУРГИЧЕСКИМ ВМЕШАТЕЛЬСТВАМ НА СЕРДЦЕ
Протезирование аортального клапана показано не
только пациентам с тяжелым АС, оно также целе-
сообразно у пациентов с умеренным АС (стадия B)
при скорости аортального потока 3,0–4,0 м/сек или
среднем градиенте давления от 20 до 40 мм рт. ст.,
если этим пациентам проводят хирургическое вме-
шательство на сердце по другим показаниям.
БЛАГОДАРНОСТЬ
Мы хотели бы поблагодарить профессора Rosenhek
за табл. 15 .3 –15 .5, которые были адаптированы из
предыдущего издания.
Измерения
Параметр
Метод/позиция
Технические аспекты
Примечание
Скорость аортального
потока
Непрерывно-волновая
допплерография
Несколько позиций
Расположение ультразвукового луча
параллельно стенотическому по-
току
Высокий фильтр движения
миокарда
Максимальная скорость
развертки
Оптимизированный исходный уро-
вень и масштаб
Тщательная оценка максималь-
ной скорости потока в несколь-
ких позициях
Скорость престеноти-
ческого потока
Импульсно-волновая
допплерография
Апикальная пятикамерная
позиция
Контрольный объем около
аортального клапана
Снижение чувствительности
Низкий фильтр движения
миокарда
Максимальная скорость
развертки
Оптимизированный исходный уро-
вень и масштаб
Тщательный поиск последнего
сигнала ламинарного потока
внутри ВТЛЖ по направлению
потока до возникновения тур-
булентности
Диаметр ВТЛЖ
2D-режим
Парастернальная позиция
по длинной оси
Оптимизированное качество
изображения
Режим «Масштабирование»
Середина систолы
Рядом и параллельно аортальному
клапану
Внутренний край
Несколько попыток измерения
максимального переднезаднего
диаметра
Можно также измерить
с помощью ЧПЭхоКГ
при высоком качестве
изображения
Планиметрия
с помощью
ЧПЭхоКГ
2D-режим или 3D-режим
Позиция по короткой оси
аортального клапана
Оптимизированное качество
изображения
Режим «Масштабирование»
Середина систолы
Распознавание гистогематического
барьера перед трассировкой на
стробоскопических изображениях
Рекомендуется измерить несколь-
ко раз
При куполообразной морфоло-
гии двухстворчатого аортально-
го клапана может понадобиться
визуализация в 3D-режиме
Нужен опытный специалист
в области эхокардиографии
Полезно в случае малоинформа-
тивности ТТЭхоКГ и новом
измерении диаметра ВТЛЖ
СВОДНАЯ ИНФОРМАЦИЯ
Аортальный стеноз
ch15.indd 355
03.04.2019 11:54:15
356 ЧАСТЬ IV Пороки клапанов сердца
Расчет параметров
Параметр
Вычисление
Пороговое значение
при тяжелом АС [61]
Эффективность/ограничения
Максимальная ско-
рость аортального
кровотока (Vmax)
Максимальное значение
скорости стенотического
потока при спектральной
непрерывно-волновой доп-
плерографии
> 4 м/сек
Наилучший показатель
степени АС
Постепенное увеличение
нежелательных событий
с увеличением Vmax
Зависит от потока
Средний градиент
давления (ΔPср)
При непрерывно-волновой
допплерографии: ΔPср = Σ
(V12+V22+...Vn2)×4/n
>40ммрт.ст.
Абсолютно коррелирует с Vmax
и предоставляет почти идентич-
ную информацию
Площадь аортального
клапана (ПАК) по
уравнению непре-
рывности потока
ПАК = VTI1/VTI2 × Площадь
ВТЛЖ
< 1,0 см2
Менее зависит от потока, чем
Vmax и ΔPср
Необходим при снижении потока
Необходим расчет области ВТЛЖ
(возможны ошибки измерения)
Индексированная
ПАК
ИПАК = ПАК/ППТ
< 0,6 см2/м2
Необходим при небольшом
размере тела пациента
(ППТ < 1,6 м2)
Завышает степень АС у крупных
пациентов и пациентов с ожи-
рением
Индекс ударного объ-
ема (ИУО)
ИУО = VTI1 × Площадь
ВТЛЖ/ППТ
Сниженный поток: ≤ 35 мл/м2
Важный показатель при оценке
низкого потока и выявления
тяжелого АС с низким ΔPср
и сохранной фракцией выброса
Возможны ошибки измерения;
следует подтвердить показате-
лем объема ЛЖ и/или косвен-
ными признаками снижения
потока
Индекс скорости (VR) VR = VTI1/VTI2
< 0,25
Идеальный показатель
для наблюдения пациента,
если диаметр ВТЛЖ можно
считать постоянным
Индекс потерь энер-
гии (ИПЭ)
ИПЭ = ИПАК × AАо/(AАо −
ПАК)
< 0,6 см2/м2
Полезен, если предполагается
восстановление давления (паци-
енты с диаметром восходящего
отдела аорты < 30 мм)
Vn — мгновенные стенотические скорости; VTI — интеграл скорости кровотока; VTI1 — интеграл скорости престенотического потока;
VTI2 — интеграл скорости стенотического потока; AАо — площадь восходящего отдела аорты в синотубулярном соединении; АС — аор-
тальный стеноз; ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; ИПАК — площадь аортального клапана, индекси-
рованная к площади поверхности тела; ИУП — индекс ударного объема; ПАК — площадь аортального клапана; ППТ — площадь поверх-
ности тела; ТТЭхоКГ — трансторакальня эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Аортальный стеноз
ch15.indd 356
03.04.2019 11:54:15
357
15 Аортальный стеноз
ЛИТЕРАТУРА
1. Hull MC, Morris CG, Pepine CJ, Mendenhall
N. Valvular dysfunction and carotid, subcla-
vian, and coronary artery disease in survivors
of Hodgkin lymphoma treated with radiation
therapy, JAMA 290:2831–2837, 2003.
2. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
executive summary. A report of the Ameri-
can College of Cardiology/American Heart
Association Task Force on Practice Guide-
lines, J Am Coll Cardiol 63:2438–2488, 2014.
3. Rosenhek R, et al. Predictors of outcome in
severe, asymptomatic aortic stenosis, N Engl J
Med 343:611–617, 2000.
4. Baumgartner H, et al. Echocardiographic as-
sessment of valve stenosis: EAE/ASE recom-
mendations for clinical practice, Eur J Echo-
cardiogr 10:1–25, 2009.
5. Otto CM, et al. Determination of the stenotic
aortic valve area in adults using Doppler
echocardiography, J Am Coll Cardiol 7:509–
517, 1986.
6. Nistri S, et al. Incremental prognostic value of
multiparametric echocardiographic assess-
ment for severe aortic stenosis, Int J Cardiol
172:e356–e358, 2014.
7. Otto CM, Pearlman AS, Gardner CL, et al.
Simplification of the Doppler continuity
equation for calculating stenotic aortic valve
area, J Am Soc Echocardiogr 1:155–157, 1988.
8. Geibel A, Go
rnandt L, Kasper W, Buben-
heimer P. Reproducibility of Doppler echo-
cardiographic quantification of aortic and
mitral valve stenoses: comparison between
two echocardiography centers, Am J Cardiol
67:1013–1021, 1991.
9. Michelena HI, et al. Inconsistent echocardio-
graphic grading of aortic stenosis: is the left
ventricular outflow tract important? Heart
99:921–931, 2013.
10. Machida T, et al. Value of anatomical aortic
valve area using real-time three-dimensional
transoesophageal echocardiography in pa-
tients with aortic stenosis: a comparison be-
tween tricuspid and bicuspid aortic valves,
Eur Heart J Cardiovasc Imaging 16:1120–1128,
2015.
11. Saura D, et al. Aortic valve stenosis planime-
try by means of three-dimensional trans-
esophageal echocardiography in the real
clinical setting: feasibility, reliability and sys-
tematic deviations, Echocardiography 32:508–
515, 2014.
12. Garcia J, Kadem L, Larose E, et al. Compari-
son between cardiovascular magnetic reso-
nance and transthoracic Doppler echocar-
diography for the estimation of effective ori-
fice area in aortic stenosis, J Cardiovasc Magn
Reson 13:25, 2011.
13. Burwash IG, et al. Flow dependence of mea-
sures of aortic stenosis severity during exer-
cise, J Am Coll Cardiol 24:1342–1350, 1994.
14. Clavel MA, et al. Predictors of outcomes in
low-flow, low-gradient aortic stenosis results
of the multicenter TOPAS study, Circulation
118:S234–S242, 2008.
15. Blais C, et al. Projected valve area at normal
flow rate improves the assessment of stenosis
severity in patients with low-flow, low-gradi-
ent aortic stenosis the multicenter TOPAS
(truly or pseudo-severe aortic stenosis) study,
Circulation 113:711–721, 2006.
16. Abbas AE, et al. The role of jet eccentricity in
generating disproportionately elevated trans-
aortic pressure gradients in patients with aor-
tic stenosis, Echocardiography 32:372–382,
2015.
17. Weyman AE, Scherrer-Crosbie M. Aortic ste-
nosis: physics and physiology—what do the
numbers really mean? Rev Cardiovasc Med
6:23–32, 2005.
18. Bahlmann E, et al. Prognostic value of energy
loss index in asymptomatic aortic stenosis,
Circulation 127:1149–1156, 2013.
19. Minners J, Allgeier M, Gohlke-Baerwolf C, et
al. Inconsistencies of echocardiographic crite-
ria for the grading of aortic valve stenosis, Eur
Heart J 29:1043–1048, 2008.
20. Minners J, et al. Inconsistent grading of aortic
valve stenosis by current guidelines: haemo-
dynamic studies in patients with apparently
normal left ventricular function, Heart Br
Card Soc 96:1463–1468, 2010.
21. Jander N, et al. Outcome of patients with low-
gradient “severe” aortic stenosis and pre-
served ejection fraction, Circulation 123:887–
895, 2011.
22. Lancellotti P, et al. Clinical outcome in as-
ymptomatic severe aortic stenosis, J Am Coll
Cardiol 59:235–243, 2012.
23. Eleid MF, Sorajja P, Michelena HI, et al. Flow-
gradient patterns in severe aortic stenosis with
preserved ejection fraction: clinical character-
istics and predictors of survival, Circulation
128:1781–1789, 2013.
24. Maes F, et al. Natural history of paradoxical
low gradient severe aortic stenosis, Circ Car-
diovasc Imaging 7:717–722, 2014.
25. Tribouilloy C, et al. Low-gradient, low-flow
severe aortic stenosis with preserved left ven-
tricular ejection fraction, J Am Coll Cardiol
65:55–66, 2015.
26. Kang DH, et al. Watchful observation versus
early aortic valve replacement for symptom-
atic patients with normal flow, low-gradient
severe aortic stenosis, Heart 101:1375–1381,
2015.
27. Minners J, et al. Adjusting parameters of aor-
tic valve stenosis severity by body size, Heart
Br Card Soc 100:1024–1030, 2014.
28. Jander N, et al. Indexing aortic valve area by
body surface area increases the prevalence of
severe aortic stenosis, Heart 100:28–33, 2014.
29. Rogge BP, et al. Impact of obesity and non-
obesity on grading the severity of aortic valve
stenosis, Am J Cardiol 113:1532–1535, 2014.
30. Saito T, et al. Prognostic value of aortic valve
area index in asymptomatic patients with se-
vere aortic stenosis, Am J Cardiol 110:93–97,
2012.
31. Jander N, et al. Velocity ratio predicts out-
comes in patients with low gradient severe
aortic stenosis and preserved EF, Heart Br
Card Soc 100:1946–1953, 2014.
32. Eleid MF, Nishimura RA, Sorajja P, Borlaug
BA. Systemic hypertension in low-gradient
severe aortic stenosis with preserved ejection
fraction, Circulation 128:1349–1353, 2013.
33. Cioffi G, et al. Prognostic effect of inappro-
priately high left ventricular mass in asymp-
tomatic severe aortic stenosis, Heart 97:301–
307, 2011.
34. Duncan AI, et al. Influence of concentric left
ventricular remodeling on early mortality af-
ter aortic valve replacement, Ann Thorac Surg
85:2030–2039, 2008.
35. Stewart RAH, et al. Left ventricular systolic
and diastolic function assessed by tissue Dop-
pler imaging and outcome in asymptomatic
aortic stenosis, Eur Heart J 31:2216–2222,
2010.
36. Dahl JS, et al. Effect of left ventricular ejec-
tion fraction on postoperative outcome in
patients with severe aortic stenosis undergo-
ing aortic valve replacement, Circ Cardiovasc
Imaging 8:e002917, 2015.
37. Herrmann HC, et al. Predictors of mortality
and outcomes of therapy in low-flow severe
aortic stenosis: a placement of aortic trans-
catheter valves (PARTNER) trial analysis,
Circulation 127:2316–2326, 2013.
38. Magne J, et al. Prognosis importance of low
flow in aortic stenosis with preserved LVEF,
Heart 101:781–787, 2015.
39. Eleid MF, et al. Survival by stroke volume
index in patients with low-gradient normal
EF severe aortic stenosis, Heart 101:23–29,
2015.
40. Lancellotti P, et al. Risk stratification in as-
ymptomatic moderate to severe aortic steno-
sis: the importance of the valvular, arterial
and ventricular interplay, Heart 96:1364–
1371, 2010.
41. Dahl JS, et al. Global strain in severe aortic
valve stenosis relation to clinical outcome af-
ter aortic valve replacement, Circ Cardiovasc
Imaging 5:613–620, 2012.
42. Kearney LG, et al. Global longitudinal strain
is a strong independent predictor of all-
cause mortality in patients with aortic steno-
sis, Eur Heart J Cardiovasc Imaging 13:827–
833, 2012.
43. Nagata Y, et al. Prognostic value of LV defor-
mation parameters using 2D and 3D speckle-
tracking echocardiography in asymptomatic
patients with severe aortic stenosis and pre-
served LV ejection fraction, JACC Cardiovasc
Imaging 8:235–245, 2015.
44. Clavel MA, et al. Comparison between trans-
catheter and surgical prosthetic valve implan-
tation in patients with severe aortic stenosis
and reduced left ventricular ejection fraction,
Circulation 122:1928–1936, 2010.
45. Luszczak J, et al. Assessment of left ventricle
function in aortic stenosis: mitral annular
plane systolic excursion is not inferior to
speckle tracking echocardiography derived
global longitudinal peak strain, Cardiovasc
Ultrasound 11:45, 2013.
46. Zilberszac R, et al. Outcome of combined ste-
notic and regurgitant aortic valve disease, J
Am Coll Cardiol 61:1489–1495, 2013.
47. Takami Y, Tajima K. Mitral annular calcifica-
tion in patients undergoing aortic valve re-
placement for aortic valve stenosis, Heart Ves-
sels 31:183–188, 2014.
48. Harling L, et al. Aortic valve replacement for
aortic stenosis in patients with concomitant
mitral regurgitation: should the mitral valve
be dealt with? Eur J Cardiothorac Surg
40:1087–1096, 2011.
49. Nombela-Franco L, et al. Clinical impact and
evolution of mitral regurgitation following
transcatheter aortic valve replacement: a me-
ta-analysis, Heart 101:1395–1405, 2015.
50. Unger P, et al. Mitral regurgitation in patients
with aortic stenosis undergoing valve replace-
ment, Heart 96:9–14, 2010.
51. Rosenhek R. Mild and moderate aortic steno-
sis. Natural history and risk stratification by
echocardiography, Eur Heart J 25:199–205,
2004.
52. Ahn HS, et al. Determinants of pulmonary
hypertension development in moderate or
severe aortic stenosis, Int J Cardiovasc Imaging
30:1519–1528, 2014.
53. Faggiano P, et al. Pulmonary artery hyperten-
sion in adult patients with symptomatic val-
ch15.indd 357
03.04.2019 11:54:15
358 ЧАСТЬ IV Пороки клапанов сердца
vular aortic stenosis, Am J Cardiol 85:204–
208, 2000.
54. Malouf JF, et al. Severe pulmonary hyperten-
sion in patients with severe aortic valve steno-
sis: clinical profile and prognostic implica-
tions, J Am Coll Cardiol 40:789–795, 2002.
55. Melby SJ, et al. Impact of pulmonary hyper-
tension on outcomes after aortic valve re-
placement for aortic valve stenosis, J Thorac
Cardiovasc Surg 141:1424–1430, 2011.
56. Lucon A, et al. Prognostic implications of
pulmonary hypertension in patients with se-
vere aortic stenosis undergoing transcatheter
aortic valve implantation: study from the
FRANCE 2 registry, Circ Cardiovasc Interv
7:240–247, 2014.
57. Lindman BR, et al. Risk stratification in pa-
tients with pulmonary hypertension under-
going transcatheter aortic valve replacement,
Heart 101:1656–1664, 2015.
58. Roselli EE, Abdel Azim A, Houghtaling PL, et
al. Pulmonary hypertension is associated with
worse early and late outcomes after aortic
valve replacement: implications for trans-
catheter aortic valve replacement, J Thorac
Cardiovasc Surg 144:1067–1074, 2012. e2.
59. O’Sullivan CJ, et al. Effect of pulmonary hy-
pertension hemodynamic presentation on
clinical outcomes in patients with severe
symptomatic aortic valve stenosis undergoing
transcatheter aortic valve implantation in-
sights from the new proposed pulmonary
hypertension classification, Circ Cardiovasc
Interv 8:e002358, 2015.
60. Amato MCM, Moffa PJ, Werner KE, Ramires
JAF.Treatment decision in asymptomatic aor-
tic valve stenosis: role of exercise testing,
Heart 86:381–386, 2001.
61. Vahanian A, et al. Guidelines on the manage-
ment of valvular heart disease (version 2012):
the Joint Task Force on the Management of
Valvular Heart Disease of the European Soci-
ety of Cardiology (ESC) and the European
Association for Cardio-Thoracic Surgery
(EACTS), Eur J Cardiothorac Surg 42:S1–S44,
2012.
62. Otto CM, Pearlman AS, Kraft CD, et al. Phys-
iologic changes with maximal exercise in as-
ymptomatic valvular aortic stenosis assessed
by Doppler echocardiography, J Am Coll Car-
diol 20:1160–1167, 1992.
63. Lancellotti P, et al. Prognostic importance of
quantitative exercise doppler echocardiogra-
phy in asymptomatic valvular aortic stenosis,
Circulation 112:I377–I382, 2005.
64. Lancellotti P, et al. Determinants and prog-
nostic significance of exercise pulmonary
hypertension in asymptomatic severe aortic
stenosis, Circulation 126:851–859, 2012.
65. Marechaux S, et al. Usefulness of exercise-
stress echocardiography for risk stratification
of true asymptomatic patients with aortic
valve stenosis, Eur Heart J 31:1390–1397,
2010.
66. Lauten J, et al. Invasive hemodynamic char-
acteristics of low gradient severe aortic steno-
sis despite preserved ejection fraction, J Am
Coll Cardiol 61:1799–1808, 2013.
67. Abdulla J, et al. Evaluation of aortic valve
stenosis by cardiac multislice computed to-
mography compared with echocardiography:
a systematic review and meta-analysis, J Heart
Valve Dis 18:634–643, 2009.
68. Clavel M-A, et al. Aortic valve area calculation
in aortic stenosis by CT and Doppler echocar-
diography, JACC Cardiovasc Imaging 8:248–
257, 2015.
69. Kamperidis V, et al. Low gradient severe aor-
tic stenosis with preserved ejection fraction:
reclassification of severity by fusion of Dop-
pler and computed tomographic data, Eur
Heart J 36:2087–2096, 2015.
70. Cueff C, et al. Measurement of aortic valve
calcification using multislice computed to-
mography: correlation with haemodynamic
severity of aortic stenosis and clinical impli-
cation for patients with low ejection fraction,
Heart Br Card Soc 97:721–726, 2011.
71. Clavel M-A, et al. The complex nature of dis-
cordant severe calcified aortic valve disease
grading, J Am Coll Cardiol 62:2329–2338,
2013.
72. Clavel M-A, et al. Impact of aortic valve cal-
cification, as measured by MDCT, on sur-
vival in patients with aortic stenosis, J Am Coll
Cardiol 64:1202–1213, 2014.
73. Blanke P, et al. Combined assessment of aor-
tic root anatomy and aortoiliac vasculature
with dual-source CT as a screening tool in
patients evaluated for transcatheter aortic
valve implantation, Am J Roentgenol 195:872–
881, 2010.
74. Barone-Rochette G, et al. Aortic valve area,
stroke volume, left ventricular hypertrophy,
remodeling, and fibrosis in aortic stenosis as-
sessed by cardiac magnetic resonance imag-
ing: comparison between high and low gradi-
ent and normal and low flow aortic stenosis,
Circ Cardiovasc Imaging 6:1009–1017, 2013.
75. Weidemann F, et al. Impact of myocardial
fibrosis in patients with symptomatic severe
aortic stenosis, Circulation 120:577–584,
2009.
76. Dweck MR, Boon NA, Newby DE. Calcific
aortic stenosis, J Am Coll Cardiol 60:1854–
1863, 2012.
77. Otto CM, Lind BK, Kitzman DW, et al. As-
sociation of aortic-valve sclerosis with cardio-
vascular mortality and morbidity in the el-
derly, N Engl J Med 341:142–147, 1999.
78. Otto CM, et al. Prospective study of asymp-
tomatic valvular aortic stenosis. Clinical,
echocardiographic, and exercise predictors of
outcome, Circulation 95:2262–2270, 1997.
79. Rosenhek R, et al. Natural history of very
severe aortic stenosis, Circulation 121:151–
156, 2010.
80. Cowell SJ, et al. A randomized trial of inten-
sive lipid-lowering therapy in calcific aortic
stenosis, N Engl J Med 352:2389–2397, 2005.
81. Rossebo AB, et al. Intensive lipid lowering
with simvastatin and ezetimibe in aortic ste-
nosis, N Engl J Med 359:1343–1356, 2008.
82. Chan KL, et al. Effect of Lipid lowering with
rosuvastatin on progression of aortic stenosis:
results of the aortic stenosis progression ob-
servation: measuring effects of rosuvastatin
(ASTRONOMER) trial, Circulation 121:306–
314, 2010.
83. Rieck AE, et al. Hypertension in aortic steno-
sis: implications for left ventricular structure
and cardiovascular events, Hypertension
60:90–97, 2012.
84. Otto CM, Prendergast B. Aortic-valve steno-
sis—from patients at risk to severe valve ob-
struction, N Engl J Med 371:744–756, 2014.
85. Vasques F, Messori A, Lucenteforte E, Bian-
cari F. Immediate and late outcome of pa-
tients aged 80 years and older undergoing
isolated aortic valve replacement: a system-
atic review and meta-analysis of 48 studies,
Am Heart J 163:477–485, 2012.
86. Agarwal A, et al. In-hospital mortality and
stroke after surgical aortic valve replacement:
a nationwide perspective, J Thorac Cardiovasc
Surg 150:571–578, 2015.
87. Fougeres E, et al. Outcomes of pseudo-severe
aortic stenosis under conservative treatment,
Eur Heart J 33:2426–2433, 2012.
88. Levy F, et al. Aortic valve replacement for
low-flow/low-gradient aortic stenosis, J Am
Coll Cardiol 51:1466–1472, 2008.
89. Tribouilloy C, et al. Outcome after aortic
valve replacement for low-flow/low-gradient
aortic stenosis without contractile reserve on
dobutamine stress echocardiography, J Am
Coll Cardiol 53:1865–1873, 2009.
90. Mehrotra P, et al. Differential left ventricular
remodelling and longitudinal function distin-
guishes low flow from normal-flow pre-
served ejection fraction low-gradient severe
aortic stenosis, Eur Heart J 34:1906–1914,
2013.
91. Adda J, et al. Low-flow, low-gradient severe
aortic stenosis despite normal ejection frac-
tion is associated with severe left ventricular
dysfunction as assessed by speckle-tracking
echocardiography: a multicenter study, Circ
Cardiovasc Imaging 5:27–35, 2012.
92. Herrmann S, et al. Low-gradient aortic valve
stenosis, J Am Coll Cardiol 58:402–412, 2011.
93. Dahl JS, et al. Development of paradoxical
low-flow, low-gradient severe aortic stenosis,
Heart 101:1015–1023, 2015.
94. Hachicha Z, Dumesnil JG, Bogaty P, Pibarot
P. Paradoxical low-flow, low-gradient severe
aortic stenosis despite preserved ejection frac-
tion is associated with higher afterload and
reduced survival, Circulation 115:2856–2864,
2007.
95. Clavel M-A, et al. Outcome of patients with
aortic stenosis, small valve area, and low-
flow, low-gradient despite preserved left ven-
tricular ejection fraction, J Am Coll Cardiol
60:1259–1267, 2012.
96. Ozkan A, Hachamovitch R, Kapadia SR, et al.
Impact of aortic valve replacement on out-
come of symptomatic patients with severe
aortic stenosis with low gradient and pre-
served left ventricular ejection fraction, Cir-
culation 128:622–631, 2013.
97. Mohty D, et al. Outcome and impact of sur-
gery in paradoxical low-flow, low-gradient
severe aortic stenosis and preserved left ven-
tricular ejection fraction: a cardiac catheter-
ization study, Circulation 128:S235–S242,
2013.
98. Eleid MF, et al. Causes of death and predictors
of survival after aortic valve replacement in
low flow vs. normal flow severe aortic stenosis
with preserved ejection fraction, Eur Heart J
Cardiovasc Imaging 16:1270–1275, 2015.
99. Clavel M-A, et al. Stress Echocardiography to
assess stenosis severity and predict outcome
in patients with paradoxical low-flow, low-
gradient aortic stenosis and preserved LVEF,
JACC Cardiovasc Imaging 6:175–183, 2013.
100. Otto CM, Pearlman AS, Gardner CL. Hemo-
dynamic progression of aortic stenosis in
adults assessed by Doppler echocardiography,
J Am Coll Cardiol 13:545–550, 1989.
101. Roger VL, et al. Progression of aortic stenosis
in adults: new appraisal using Doppler echo-
cardiography, Am Heart J 119:331–338, 1990.
102. Faggiano P, et al. Rate of progression of val-
vular aortic stenosis in adults, Am J Cardiol
70:229–233, 1992.
103. Peter M, Hoffmann A, Parker C, et al. Pro-
gression of aortic stenosis. Role of age and
concomitant coronary artery disease, Chest
103:1715–1719, 1993.
ch15.indd 358
03.04.2019 11:54:15
359
15 Аортальный стеноз
104. Brener SJ, Duffy CI, Thomas JD, Stewart WJ.
Progression of aortic stenosis in 394 patients:
relation to changes in myocardial and mitral
valve dysfunction, J Am Coll Cardiol 25:305–
310, 1995.
105. Bahler RC, Desser DR, Finkelhor RS, et al.
Factors leading to progression of valvular
aortic stenosis, Am J Cardiol 84:1044–1048,
1999.
106. Palta S, Pai AM, Gill KS, Pai RG. New insights
into the progression of aortic stenosis: impli-
cations for secondary prevention, Circulation
101:2497–2502, 2000.
107. Kearney LG, et al. Progression of aortic ste-
nosis in elderly patients over long-term fol-
low up, Int J Cardiol 167:1226–1231, 2013.
108. Nguyen V, et al. Haemodynamic and ana-
tomic progression of aortic stenosis, Heart Br
Card Soc 101:943–947, 2015.
109. Novaro GM, et al. Clinical factors, but not
C-reactive protein, predict progression of cal-
cific aortic-valve disease: the Cardiovascular
Health Study, J Am Coll Cardiol 50:1992–
1998, 2007.
110. Bellamy MF, Pellikka PA, Klarich KW, et al.
Association of cholesterol levels, hydroxy-
methylglutaryl coenzyme-A reductase inhibi-
tor treatment, and progression of aortic ste-
nosis in the community, J Am Coll Cardiol
40:1723–1730, 2002.
111. Rosenhek R, et al. Statins but not angioten-
sin-converting enzyme inhibitors delay pro-
gression of aortic stenosis, Circulation
110:1291–1295, 2004.
112. Moura LM, et al. Rosuvastatin affecting aor-
tic valve endothelium to slow the progression
of aortic stenosis, J Am Coll Cardiol 49:554–
561, 2007.
113. Bull S, et al. A prospective, double-blind, ran-
domized controlled trial of the angiotensin-
converting enzyme inhibitor Ramipril In
Aortic Stenosis (RIAS trial), Eur Heart J Car-
diovasc Imaging 16:834–841, 2015.
114. Kelly TA, et al. Comparison of outcome of
asymptomatic to symptomatic patients older
than 20 years of age with valvular aortic ste-
nosis, Am J Cardiol 61:123–130, 1988.
115. Pellikka PA, Nishimura RA, Bailey KR, Tajik
AJ. The natural history of adults with asymp-
tomatic, hemodynamically significant aortic
stenosis, J Am Coll Cardiol 15:1012–1017,
1990.
116. Kennedy KD, Nishimura RA, Holmes DR,
Bailey KR. Natural history of moderate aortic
stenosis, J Am Coll Cardiol 17:313–319, 1991.
117. Pellikka PA, et al. Outcome of 622 adults with
asymptomatic, hemodynamically significant
aortic stenosis during prolonged follow-up,
Circulation 111:3290–3295, 2005.
118. Kang DH, et al. Early surgery versus conven-
tional treatment in asymptomatic very severe
aortic stenosis, Circulation 121:1502–1509,
2010.
119. Yechoor P, et al. The natural history of mod-
erate aortic stenosis in a veteran population, J
Thorac Cardiovasc Surg 145:1550–1553, 2013.
120. Taniguchi T, et al. Initial surgical versus con-
servative strategies in patients with asymp-
tomatic severe aortic stenosis, J Am Coll Car-
diol 66:2827–2838, 2015.
121. Das P. Exercise testing to stratify risk in aortic
stenosis, Eur Heart J 26:1309–1313, 2005.
122. Monin J-L, et al. Risk score for predicting
outcome in patients with asymptomatic aor-
tic stenosis, Circulation 120:69–75, 2009.
ch15.indd 359
03.04.2019 11:54:15
ch15.indd 360
03.04.2019 11:54:15
361
16 Транскатетерная имплантация
аортального клапана
DAVID MESSIKAZEITOUN, MD, PHD • MARINA URENA, MD, PHD
Отбор пациентов
Степень аортального стеноза
Оценка риска
Особые сопутствующие состояния
Планирование процедуры
Измерение фиброзного кольца
аортального клапана и определение
размера протеза
Расстояние между плоскостью
фиброзного кольца аортального
клапана и устьями коронарных артерий
Гипертрофия базального отдела
перегородки
Кальцификация аортального клапана
Контроль вмешательства
и осложнений
Контроль с помощью чреспищеводной
эхокардиографии
Роль чреспищеводной эхокардиографии
при транскатетерном протезировании
аортального клапана
Непосредственные осложнения
Краткосрочные и среднесрочные
результаты
Гемодинамические характеристики
имплантированного протеза
Околоклапанная регургитация
Тромбоз
Инфекционный эндокардит
Дегенерация протеза
Заключение
Транскатетерная имплантация аортального клапана
(ТИАК) с момента своего появления в 2002 г. полу-
чила широкое применение. Во всем мире выполне-
но свыше 100 000 процедур. В настоящее время ТИ-
АК рекомендуется пациентам с тяжелым аорталь-
ным стенозом (АС), у которых отмечается высокий
хирургический риск или есть противопоказания к
операции. С 2002 г. техника ТИАК постоянно моди-
фицируется и улучшается, в частности формируют-
ся мультидисциплинарные команды, в которых
специалисты в области визуализации играют важ-
ную роль как в отборе пациентов для ТИАК, так и
при оценке технических вопросов. Доработка при-
меняемых при ТИАК материалов и устройств сде-
лала их более удобными для пациентов с разными
анатомическими вариантами патологии, а умень-
шение размеров протезов значительно снизило
«агрессивность» процедуры. Все это привело к по-
степенному увеличению показателя эффективно-
сти и снижению частоты осложнений и, как след-
ствие, к более широкому распространению метода.
Несмотря на отсутствие данных о среднесрочных и
долгосрочных результатах, вероятен прогресс отно-
сительно проведения ТИАК у пациентов с проме-
жуточным и даже низким операционным риском.
В настоящее время протезы для ТИАК можно
подразделить на расширяемые баллоном и саморас-
ширяющиеся, а протезы нового поколения имеют
особые характеристики, например возможность по-
вторного позиционирования и извлечения. В насто-
ящее время наиболее широко используемыми в
клинической практике являются протез Sapien, рас-
ширяемый баллоном (Edwards Lifesciences Inc., Ir-
vine, Calif.), и саморасширяющийся протез CoreValve
(Medtronic, Minneapolis, Minn.).
В этой главе рассматривается роль эхокардиогра-
фии (ЭхоКГ) при ТИАК по поводу тяжелого АС. Со
временем возрастет значение ТИАК и при изолиро-
ванной аортальной регургитации (АР). Транстора-
кальная эхокардиография (ТТЭхоКГ), чреспище-
водная эхокардиография (ЧПЭхоКГ) и такие новые
методы, как трехмерная (3D) ЭхоКГ, имеют решаю-
щее значение при отборе пациентов, планировании
и контроле процедуры, а также оценке немедлен-
ных, краткосрочных, среднесрочных и долгосроч-
ных результатов. Важно отметить, что результаты
ЭхоКГ следует интегрировать с результатами дру-
гих методов визуализации — рентгеноскопии, вы-
полняемой во время процедуры, компьютерной то-
мографии (КТ) и магнитно-резонансной томогра-
фии (МРТ).
ОТБОР ПАЦИЕНТОВ
СТЕПЕНЬ АОРТАЛЬНОГО СТЕНОЗА
Поскольку ТИАК выполняют симптомным пациен-
там с тяжелым АС, сначала следует оценить степень
АС [1, 2]. Классические критерии — площадь аор-
ch16.indd 361
03.04.2019 11:54:28
362
ЧАСТЬ IV Пороки клапанов сердца
тального клапана (ПАК) < 1 см2, средний градиент
давления (СГД) > 40 мм рт. ст. и максимальная ско-
рость кровотока (Vmax) > 4 м/сек [3]. Оценка степе-
ни АС может быть затруднена в связи с особыми ус-
ловиями проведения ТИАК, поскольку у пациентов
часто наблюдается систолическая дисфункция ле-
вого желудочка (ЛЖ), ПАК < 1 см2, СГД < 40 мм
рт. ст. и Vmax < 4 м/сек.
ЭхоКГ в покое не позволяет отличить истинный
тяжелый АС (тяжелый АС со вторичной дисфунк-
цией ЛЖ, обусловленной АС) от псевдотяжелого
(умеренный АС с дисфункцией ЛЖ, обусловленной
сопутствующей ишемической болезнью сердца или
дилатационной кардиомиопатией). У пациентов из
этой подгруппы можно провести стресс-ЭхоКГ с до-
бутамином в низкой дозе. При истинном тяжелом
АС ПАК остается меньше 1 см2, но СГД и Vmax уве-
личиваются (в идеале — выше пороговых значе-
ний). В случае псевдотяжелого АС инотропный от-
вет и увеличение сердечного выброса > 20% приво-
дят к большему открытию аортального клапана, в
результате ПАК становится равной 1 см2 или более,
тогда как СГД и Vmax не изменяются. Тем не менее
возможен атипичный ответ или незначительное уве-
личение сердечного выброса (при отсутствии сокра-
тительного резерва). У таких пациентов с дисфунк-
цией ЛЖ желательно помимо стресс-ЭхоКГ с добу-
тамином провести дополнительные исследования.
Было показано, что степень кальцификации аор-
тального клапана, количественно оцениваемая при
КТ, имеет сильную корреляцию с АС с выраженны-
ми нарушениями гемодинамики в отсутствие дис-
функции ЛЖ [4]. Оценка степени кальцификации
аортального клапана — не зависящий от потока ме-
тод. Пороговые значения для тяжелого АС опреде-
ляются индексом Агатстона и составляют 1250 еди-
ниц для женщин и 2000 — для мужчин [5]. Оценка
степени кальцификации аортального клапана с по-
мощью КТ помогает отличить тяжелый АС от псев-
дотяжелого, в отличие от неточной визуальной и ка-
чественной эхокардиографической оценки [6]. Сле-
дует отметить, что данные методы исследования
являются взаимодополняющими, т.к. результаты
стресс-ЭхоКГ с добутамином не всегда достоверны,
а предлагаемые пороговые значения кальцифика-
ции аортального клапана не обладают чувствитель-
ностью и специфичностью в 100%. Кроме того, бы-
ло установлено, что наличие сократительного ре-
зерва является важным прогностическим фактором
исхода [7]. У пациентов с очень низким градиентом
давления (СГД < 20 мм рт. ст.) [8], особенно при от-
сутствии сократительного резерва, эффективность
ТИАК спорна, и ее практическая ценность граничит
с нецелесообразностью. В некоторых клиниках вы-
полняют «диагностическую» баллонную вальвуло-
пластику для определения возможности улучшения
функционального состояния ЛЖ. Для оценки фи-
броза миокарда и его необратимого повреждения
также можно использовать МРТ, однако нужны до-
полнительные исследования целесообразности ее
проведения [9, 10].
Несоответствие степени стеноза нормальной фрак-
ции выброса ЛЖ представляет собой еще одну важ-
ную особенность, с которой могут столкнуться кли-
ницисты. Так, у 30% пациентов с ПАК < 1 см2 СГД
может быть < 40 мм рт. ст. в отсутствие систоличе-
ской дисфункции ЛЖ (фракция выброса ЛЖ > 50%)
[11]. Этих пациентов (чаще всего это женщины с
гипертрофией ЛЖ) можно разделить на две группы
в зависимости от индекса ударного объема аорталь-
ного клапана (отношение ударного объема к пло-
щади поверхности тела): (1) ≤ 35 мл/м2; (2) > 35 мл/
м2. Последняя группа — пациенты с АС с парадок-
сально низким потоком/низким градиентом давле-
ния [12]. Обсуждаются распространенность и рас-
пределение по этим группам пациентов с несоот-
ветствием степени стеноза нормальной фракции
выброса, а также прогноз и тактика ведения. По дан-
ным литературы, только у более 50% из этих паци-
ентов действительно тяжелый АС. Важным прогно-
стическим фактором является, по-видимому, низ-
кий ударный объем [13], особенно в случае, когда
после ТИАК его значение не увеличивается (см. гла-
ву 15) [14, 15].
ОЦЕНКА РИСКА
В настоящее время ТИАК рекомендуется пациен-
там, относящимся к группе повышенного хирурги-
ческого риска или имеющим противопоказания к
операции. Однако в большинстве стран наблюдает-
ся тенденция к использованию данного метода у па-
циентов с низким хирургическим риском. Оценка
риска зависит в основном от анамнеза, сопутствую-
щих заболеваний и клинических симптомов, коли-
чественно измеренных с помощью шкал. Чаще все-
го используют Euroscore ΙΙ и шкалу Society of Tho-
racic Surgery [STS] [16–19]. Важно отметить, что эти
шкалы были разработаны для оценки хирургиче-
ского риска без учета таких анатомических патоло-
гий, как «фарфоровая» аорта и деформация груд-
ной клетки. ЭхоКГ позволяет дополнительно сни-
зить хирургический риск. Помимо систолической
функции ЛЖ, важными эхокардиографическими
параметрами являются систолическое давление в
легочной артерии, расширение и дисфункцияя пра-
вого желудочка (ПЖ) и связанный с этим клапан-
ный порок, включая митральную регургитацию
(МР).
ОСОБЫЕ СОПУТСТВУЮЩИЕ СОСТОЯНИЯ
ДВУХСТВОРЧАТЫЙ АОРТАЛЬНЫЙ КЛАПАН
Частота двухстворчатого аортального клапана —
1–2% в общей популяции и около 50% среди паци-
ентов с тяжелым АС, которым показано хирургиче-
ское вмешательство [20]. Сначала двухстворчатый
ch16.indd 362
03.04.2019 11:54:28
363
16 Транскатетерная имплантация аортального клапана
аортальный клапан считали противопоказанием к
ТИАК из-за риска неполного раскрытия протеза [21].
По данным ЭхоКГ, двухстворчатый аортальный
клапан наблюдается у 5–10% пациентов, в отноше-
нии которых рассматривают возможность выпол-
нения ТИАК, хотя при тяжелой кальцификации
клапана трудно оценить его анатомию. Вполне ве-
роятно, что ТИАК была успешной у значительного
количества пациентов с тяжелым АС, несмотря на
наличие недиагностированного двухстворчатого
аортального клапана. В настоящее время КТ, вы-
полняемая рутинно перед ТИАК, позволяет выя-
вить двухстворчатый аортальный клапан.
Возможными причинами неполного раскрытия
протеза у пациентов с двухстворчатым аортальным
клапаном являются отличия его анатомического
строения от строения трехстворчатого аортального
клапана и наличие выраженной, эксцентрической и
часто массивной кальцификации. Кроме того, более
большой размер фиброзного кольца и обычно со-
путствующие АР и аортопатия могут привести к на-
рушению положения клапана. Тем не менее клини-
ческие отчеты, а также масштабные серийные ис-
следования показали необоснованность этих
опасений и доказали возможность проведеия у па-
циентов со стенозом двухстворчатого аортального
клапана ТИАК с использованием как протезов, рас-
ширяемых баллоном, так и саморасширяющихся
протезов [22–24]. Есть сообщения о результатах
ТИАК у нескольких сотен пациентов с двухстворча-
тым аортальным клапаном: успешность 85–90%, но
с тенденцией к более высокой частоте околоклапан-
ной АР. Таким образом, опытный хирург успешно
проводит ТИАК пациентам с АС и двухстворчатым
аортальным клапаном, т.е. такой клапан не следует
рассматривать как абсолютное противопоказание к
выполнению данной процедуры.
МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Примерно у 15–20% пациентов, которым планиру-
ют ТИАК, наблюдается сопутствующая умеренная
или тяжелая МР, которую обычно не корректируют.
В связи с этим крайне важно оценить влияние МР
на результат вмешательства, а также вероятность
снижения ее степени. Причинами изменения МР
после ТИАК являются снижение давления в ЛЖ в
ближайшем периоде и обратное ремоделирование
ЛЖ в отдаленном периоде. Важно разработать ин-
дивидуальную тактику ведения пациента, опираясь
на лежащий в основе МР механизм, т.е . определить
МР вторичная (нормальное строение клапана с ре-
гургитацией, обусловленной ремоделированием ЛЖ)
или первичная (повреждение митрального клапа-
на). Трудности с оценкой механизма МР возникают
у пожилых пациентов, особенно при наличии каль-
цификации створок или фиброзного кольца ми-
трального клапана. При сочетании механизмов мо-
жет наблюдаться комбинированный порок.
Недавний метаанализ [25] данных 8015 пациен-
тов (для сравнения результатов) и 1278 пациентов
(для оценки изменений степени МР после проведе-
ния ТИАК) показал, что:
•
умеренная или тяжелая МР коррелирует пример-
но с двукратным увеличением 30-дневной леталь-
ности и летальности в течение одного года.
•
у пациентов с умеренной МР наблюдается сни-
жение ее степени в 48% случаев, в 49% случаев
степень оставалась неизменной и увеличивалась
в 3% случаев, тогда как у пациентов с тяжелой
МР снижение ее степени наблюдалось в 57% слу-
чаев, а в 43% случаев МР оставалась тяжелой. Но-
вая тяжелая МР была обусловлена в основном
поражением клапана во время процедуры.
•
у пациентов после имплантации саморасширяю-
щегося протеза отмечается более высокий пока-
затель летальности и меньшее снижение степени
МР по сравнению с пациентами, кому импланти-
ровали протез, расширяемый баллоном. Причи-
нами этого могут быть более длинные каркасы у
саморасширяющихся протезов, которые могут
нарушать подвижность передней створки ми-
трального клапана, более высокая частота около-
клапанной регургитации и более частая имплан-
тация кардиостимулятора.
•
факторами, связанными со снижением МР, были
расширение и дисфункция ЛЖ, вторичная МР и
отсутствие хронической фибрилляции предсер-
дий или легочной гипертензии.
Таким образом, многие вопросы остаются без от-
ветов. Следует подчеркнуть, что в ходе этих иссле-
дований количественную оценку МР не проводили.
МР не исследовали в централизованных лаборато-
риях, а степень ее определяли по-разному. Кроме
того, в связи с учетом только выживших пациентов
оценка изменений МР может быть необъективной.
Различие между первичной и вторичной МР часто
отсутствует, несмотря на их несомненно различный
клинический эффект и течение после процедуры.
При обследовании кандидата на ТИАК с помощью
ЭхоКГ должен быть установлен механизм МР, точ-
но описан подклапанный аппарат митрального кла-
пана и количественно определена степень МР (по-
роговые значения эффективной площади отверстия
и объема регургитации для тяжелой вторичной и
первичной МР различны). У пациентов с тяжелым
АС и первичной тяжелой МР методом выбора явля-
ется комбинированная процедура, даже если вме-
шательство на двух клапанах значительно увеличи-
вает хирургический риск.
В случае вторичной тяжелой МР решение следу-
ет принимать индивидуально с учетом вероятности
снижения степени МР после протезирования аор-
тального клапана (вплоть до полного отказа от вме-
шательства, если оно нецелесообразно). У пациен-
тов с умеренной МР, независимо от того, первичная
она или вторичная, сначала следует провести кор-
ch16.indd 363
03.04.2019 11:54:28
364
ЧАСТЬ IV Пороки клапанов сердца
рекцию АС, особенно если пациент не является хо-
рошим кандидатом на хирургическое протезирова-
ние аортального клапана. Во время операции и по-
сле нее необходим тщательный контроль водного
баланса со снижением посленагрузки.
ГИПЕРТРОФИЯ И ОБСТРУКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Перед процедурой во время обследования с помо-
щью ЭхоКГ необходимо идентифицировать и четко
определить — ЛЖ гипертрофированный или ги-
пердинамический, особенно при его обструкции в
состоянии покоя. Дело в том, что после ТИАК бы-
строе восстановление посленагрузки может приве-
сти к обструкции ЛЖ или увеличению ее степени,
индуцируя парадоксальное систолическое движе-
ние передней створки митрального клапана, что
приводит к снижению сердечного выброса и карди-
огенному шоку. Рефлекторный подход к инотроп-
ной поддержке будет сопровождаться дальнейшим
нарушением гемодинамики. Вместо этого кардио-
логи и анестезиологи должны использовать бета-
блокаторы, избегая как инотропной поддержки, так
и уменьшения посленагрузки. Интраоперационная
ЭхоКГ позволяет оценить проблему и определиться
с тактикой лечения.
АНЕВРИЗМА ВОСХОДЯЩЕГО ОТДЕЛА АОРТЫ
Перед ТИАК необходимо оценить размеры аорталь-
ных синусов и восходящего отдела аорты. У паци-
ентов с тяжелым АС и расширением восходящего
отдела аорты в первую очередь необходимо рассмо-
треть хирургическое вмешательство. Показанием к
нему будет диаметр восходящего отдела аорты
> 55 мм или > 50 мм при двухстворчатом аорталь-
ном клапане (фактор риска) [26]. Если вмешатель-
ство в основном обусловлено пороком клапана,
предложено пороговое значение диаметра, равное
45 мм, даже при низком уровне доказательности. У
пациентов с АС, которым планируют ТИАК, пока-
зания нужно оценивать индивидуально, но важно
отметить, что имплантация саморасширяющегося
протеза не рекомендуется, если диаметр корня аор-
ты менее 27 мм (при протезе 26 мм) или менее 29 мм
(при протезах 29 и 31 мм), или более 43 мм (это
ограничение не относится к новому поколению са-
морасширяющихся протезов Evolut R., Medtronic,
Minneapolis, Minn.).
АТЕРОМАТОЗ АОРТЫ
Крупные мобильные аортальные включения (ате-
росклеротические бляшки) и тромбы, определяе-
мые с помощью ЧПЭхоКГ, могут рассматриваться
в качестве противопоказаний к ТИАК. Хотя уровень
доказательности невелик, поскольку многие центры
перестали выполнять ЧПЭхоКГ до и после ТИАК. В
связи с этим неизвестно, повысилась ли частота ин-
сульта и эмболических осложнений из-за атерома-
тоза аорты. Следует сказать, что у этих пациентов
можно применять устройства противоэмболиче-
ской защиты.
ВНУТРИСЕРДЕЧНЫЕ МАССЫ
Пациенты с тромбозом ЛЖ должны быть исключе-
ны из списка кандидатов на ТИАК, особенно если у
них диагностирована ишемическая кардиомиопа-
тия, выраженные нарушения сократимости мио-
карда или тяжелая дисфункция ЛЖ и низкий сер-
дечный выброс. Использование контрастного сред-
ства позволяет облегчить обнаружение тромбов.
Тромбоз ЛЖ является абсолютным противопоказа-
нием к ТИАК, тогда как тромбоз левого предсердия
(ЛП) — относительное противопоказание. Тромбоз
ЛП выявляют с помощью ЧПЭхоКГ до или во вре-
мя ТИАК, также тромбоз может быть диагностиро-
ван с помощью КТ. ЧПЭхоКГ может быть рекомен-
дована пациентам с инсультом в анамнезе или фи-
брилляцией предсердий. В случае тромбоза ЛП
может быть использовано устройство противоэм-
болической защиты.
ПЛАНИРОВАНИЕ ПРОЦЕДУРЫ
ИЗМЕРЕНИЕ ФИБРОЗНОГО КОЛЬЦА
АОРТАЛЬНОГО КЛАПАНА
И ОПРЕДЕЛЕНИЕ РАЗМЕРА ПРОТЕЗА
В табл. 16.1 представлены размеры протезов по-
следнего поколения (саморасширяющихся и рас-
ширяемых баллоном), соответствующие размерам
фиброзного кольца аортального клапана. Неточное
измерение фиброзного кольца может стать причи-
ной серьезных осложнений. Завышенная оценка
размера фиброзного кольца аортального клапана
может привести к его разрыву, тогда как занижен-
ная оценка может привести к околоклапанной АР
или смещению протеза.
Размер фиброзного кольца можно измерить с
помощью ТТЭхоКГ, ЧПЭхоКГ, мультиспиральной
компьютерной томографии (МСКТ) и МРТ (реже).
Измерять фиброзное кольцо надо в середине систо-
лы в области прикрепления створок. При измере-
нии с помощью ТТЭхоКГ в парастернальной пози-
ции по длинной оси следует использовать режим
«Масштабирование», а при измерении с помощью
ЧПЭхоКГ надо использовать апикальную позицию
по длинной оси (120–140°) (рис. 16.1). Измерять
нужно в течение 3–5 сокращений сердца с усредне-
нием результата. Размер фиброзного кольца, изме-
ренный с помощью ТТЭхоКГ, обычно хуже воспро-
изводим и меньше, чем размер, измеренный при
ЧПЭхоКГ. Используя МСКТ, можно измерить раз-
мер фиброзного кольца по длинной и короткой
осям, его площадь и периметр. МСКТ обычно завы-
шает размеры фиброзного кольца, поскольку при
ЭхоКГ и МСКТ используют разные ориентиры.
Фиброзное кольцо аортального клапана пред-
ставляет собой сложную трехмерную структуру, по-
ch16.indd 364
03.04.2019 11:54:28
365
16 Транскатетерная имплантация аортального клапана
ТТЭхоКГ
МСКТ
Синус Вальсальвы
Трехкамерная позиция
23,3 мм (2D)
Фиброзное кольцо
Аорта
Левое предсердие
ЧПЭхоКГ
Рис. 16.1 Измерение фиброзного кольца аортального клапана. Измерение кольца с помощью трансторакальной эхокардиографии (ТТЭхоКГ), чреспище-
водной эхокардиографии (ЧПЭхоКГ) и мультиспиральной компьютерной томографии (МСКТ). Обратите внимание на сложное cтроение фиброзного кольца аор-
тального клапана [Messika-Zeitoun D, Serfaty JM, Brochet E, et al. Multimodal assessment of the aortic annulus diameter: implications for transcatheter aortic valve im-
plantation. J Am Coll Cardiol 55:186–194, 2010].
хожую на корону [27]. Створки аортального клапа-
на имеют полулунную форму и прикрепляются по
всему периметру корня аорты, начиная от базально-
го отдела ЛЖ до дистальной области синотубуляр-
ного соединения. Образуется как бы два кольца:
нижнее — виртуальное, формирующееся путем со-
единения точек прикрепления створок в базальном
отделе ЛЖ, и верхнее — в верхней части «короны»,
соответствующее синотубулярному соединению (см.
рис. 16.1). Измерения при МСКТ проводят на уров-
не виртуального кольца, тогда как при ЭхоКГ — в
другой плоскости (рис. 16.2) [28]. Кроме этого, фи-
брозное кольцо аортального клапана имеет оваль-
ную, а не круглую форму.
Размеры расширяемого баллоном
протеза Sapien 3
Размеры саморасширяющегося
протеза Corevalve Evolut R
20 мм
23 мм
26 мм
29 мм
23 мм
26 мм
29 мм
Номинальная площадь протеза, мм2
314
415
531
661
–
–
–
Размер фиброзного кольца
(данные ЧПЭхоКГ), мм
16–19
18–22
21–25
24–28
18–20
20–23
23–27
Размер фиброзного кольца в базаль-
ном отделе левого желудочка, мм
18,6–21
20,7–23,4 23,4–26,4 26,2–29,5
–
–
–
Площадь фиброзного кольца, мм2
273–345
338–430
430–546
540–680
–
–
–
Периметр, мм
–
–
–
–
56–63
63–72
72–85
ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 16.1 Размеры расширяемого баллоном протеза и саморасширяющегося протеза,
соответствующие размеру фиброзного кольца
ch16.indd 365
03.04.2019 11:54:28
366 ЧАСТЬ IV Пороки клапанов сердца
Таким образом, при определении размеров про-
теза для ТИАК вопрос заключается в том, какой из
методов визуализации обеспечит наилучшие ре-
зультаты с клинической точки зрения. Согласно
данным литературы, измерения при МСКТ обеспе-
чивают такие же хорошие результаты, как и изме-
рения при ЭхоКГ, большинство центров прибегают
в основном к помощи МСКТ [29–32]. Однако офи-
циального сравнения этих двух методов визуализа-
ции не было. В ходе большинства исследований бы-
ло отмечено превосходство МСКТ, заключающееся
в отсутствии «эхо-слепых» зон. В ходе недавнего ис-
следования с применением МСКТ отмечалась более
низкая частота околоклапанной АР, по сравнению с
частотой, наблюдаемой при тактике, основанной на
применении ЭхоКГ, однако у 20% пациентов не
учитывали результаты МСКТ [33]. В связи с этим не
следует пренебрегать эхокардиографическими из-
мерениями, а рассматривать ЭхоКГ в качестве кон-
трольного метода, особенно при пороговых значе-
ниях.
Есть сообщения, что 3D-ЧПЭхоКГ (рис. 16.3) яв-
ляется таким же точным и надежным методом, как
МСКТ [34, 35]. В отличие от МСКТ, 3D-ЧПЭхоКГ
позволяет анализировать любое количество сердеч-
ных циклов и усреднять результаты измерения фи-
брозного кольца, однако 3D-ЧПЭхоКГ больше не
выполняют рутинно, поскольку для измерений и
анализа нужен квалифицированный персонал. Кро-
ме того, пространственное и временное разрешения
3D-ЧПЭхоКГ уступают таковым 2D-ЧПЭхоКГ и, в
отличие от измерений в сагиттальной (переднезад-
ней) плоскости, измерения во фронтальной плоско-
сти в поперечном сечении все еще затруднены
(ограничение всех методов ЭхоКГ). Стоит отметить,
что результаты МСКТ также зависят от специали-
ста, выполняющего визуализацию.
Расширяемый баллоном протез Sapien 3 (Ed-
wards Lifesciences, Irvine, Calif.) доступен в четырех
размерах (20, 23, 26 и 29 мм), что позволяет прово-
дить вмешательство при размере фиброзного коль-
ца в сагиттальной плоскости (размер при ЭхоКГ) в
Рис. 16.2 Трехмерное строение фиброзного кольца аортального клапана. Фиброзное кольцо аортального клапана и его измерение с помощью чреспи-
щеводной эхокардиографии (ЧПЭхоКГ) (красная стрелка) и мультиспиральной компьютерной томографии (МСКТ) (желтые стрелки) на уровне виртуального коль-
ца (голубой цвет). Обратите внимание, что при ЧПЭхоКГ измерение проводят в другой плоскости относительно виртуального кольца [Serfaty JM, Himbert D, Es-
posito-Farese M, et al. Measurement of the aortic annulus diameter using transesophageal echocardiography and multislice computed tomography—are they truly compa-
rable? Can J Cardiol 30:1073–1079, 2014].
ЧПЭхоКГ
Z
Y
X
МСКТ
ch16.indd 366
03.04.2019 11:54:30
367
16 Транскатетерная имплантация аортального клапана
диапазоне от 16 до 28 мм. При превышении разме-
ра фиброзного кольца, определяемого по формуле:
([Номинальная площадь протеза/Площадь фиброз-
ного кольца в поперечном сечении] – 1) × 100), реко-
мендуется имплантация протеза Sapien предыдуще-
го поколения, однако значительное превышение
размера фиброзного кольца (> 20%) связано с по-
вышенным риском разрыва корня аорты [36]. Так-
же было предложено использовать больший размер
протеза с неполным расширением баллона. Для
протеза Sapien 3 достаточно меньшего превышения
размера (от –5 до 5%).
Саморасширяющиеся протезы также выпускают
в четырех размерах (от 18 до 29 мм), но еще нет про-
теза Evolut R с размером 31 мм. Обычно рекоменду-
ется превышение периметра фиброзного кольца на
10–15%, что соответствует большему превышению
размера, чем при использовании значения площади.
РАССТОЯНИЕ МЕЖДУ ПЛОСКОСТЬЮ
ФИБРОЗНОГО КОЛЬЦА АОРТАЛЬНОГО КЛАПАНА
И УСТЬЯМИ КОРОНАРНЫХ АРТЕРИЙ
При хирургическом протезировании клапана створ-
ки аортального клапана иссекают, а во время ТИАК
их оставляют на месте и смещают к стенке аорты.
При наличии коротких синусов Вальсальвы или
длинных створок аортального клапана может про-
изойти обструкция коронарных артерий, которая
приведет к инфаркту миокарда. Таким образом, об-
струкция устьев коронарных артерий, как правило,
обусловлена нативными створками клапана, а не
протезом. В связи с этим следует обязательно изме-
рить расстояние между плоскостью фиброзного
кольца аортального клапана и устьями коронарных
артерий. Расстояние менее 10 мм является противо-
показанием к ТИАК [37]. Оценку этого расстояния
обычно проводят с помощью МСКТ [38, 39] при
Рис. 16.3 Измерение фиброзного кольца аортального клапана с помощью чреспищеводной эхокардиографии. Определение размеров фиброзного
кольца аортального клапана на уровне виртуального кольца с помощью 3D-ЭхоКГ и многопланарной реконструкции [Hahn RT, Little SH, Monaghan MJ, et al. Rec-
ommendations for comprehensive intraprocedural echocardiographic imaging during TAVR. JACC Cardiovasc Imaging 8:261–287, 2015].
Минимальный размер 21,1 мм
Максимальный размер 24,1 мм
Площадь 414 мм2
ch16.indd 367
03.04.2019 11:54:30
368 ЧАСТЬ IV Пороки клапанов сердца
подготовке к ТИАК. Несколько исследователей пред-
ложили использовать 3D-ЧПЭхоКГ [34], но ограни-
чения 3D-ЧПЭхоКГ не позволяют точно измерить
это расстояние.
ГИПЕРТРОФИЯ БАЗАЛЬНОГО ОТДЕЛА ПЕРЕГОРОДКИ
У 25% пациентов с АС наблюдается гипертрофия
базального отдела перегородки. Выраженная гипер-
трофия перегородки в этом отделе и сужение ВТЛЖ
могут привести к проталкиванию баллона или про-
теза в аорту, препятствуя точному размещению про-
теза. Для безопасной имплантации протеза необхо-
димо расстояние между перегородкой и плоскостью
фиброзного кольца, равное 10 мм, однако у проте-
зов нового поколения этого ограничения может не
быть.
КАЛЬЦИФИКАЦИЯ АОРТАЛЬНОГО КЛАПАНА
Кальцификация аортального клапана — основной
механизм развития АС, т.е. АС без кальцификации
не встречается (по крайней мере при дегенератив-
ных поражениях). ЭхоКГ предоставляет качествен-
ную, но неточную оценку степени кальцификации,
в отличие от МСКТ. Степень и, что более важно, ло-
кализация кальцификации ассоциируются с выра-
женностью околоклапанной АР и перипротезных
осложнений [40–42]. Несмотря на важность этой ин-
формации, она, по-видимому, не оказывает суще-
ственного влияния на принятие решения о необхо-
димости выполнения ТИАК.
КОНТРОЛЬ ВМЕШАТЕЛЬСТВА
И ОСЛОЖНЕНИЙ
КОНТРОЛЬ С ПОМОЩЬЮ ЧРЕСПИЩЕВОДНОЙ
ЭХОКАРДИОГРАФИИ
ПЕРЕД ИМПЛАНТАЦИЕЙ
Перед имплантацией следует провести комплекс-
ную оценку состояния клапанов сердца. ЧПЭхоКГ
позволяет исследовать все четыре клапана, включая
выявление МР, определение ее механизма и степе-
ни, оценку полостей сердца и диаметра аорты с из-
мерением фиброзного кольца. Перед трансапикаль-
ной ТИАК с помощью ТТЭхоКГ и ЧПЭхоКГ опре-
деляют локализацию верхушки для обеспечения
хирургического доступа и оптимального места для
канюляции.
БАЛЛОННАЯ ВАЛЬВУЛОПЛАСТИКА
Особое внимание следует уделить оценке АР и ее ме-
ханизма после баллонной вальвулопластики. Острая
травматическая АР может негативно влиять на ге-
модинамику, в результате понадобится быстрое
расправление протеза. Проводник может временно
нарушить подвижность створок (разрешается после
его удаления). Непрерывный мониторинг во время
баллонной вальвулопластики позволяет опреде-
лить окончательное положение нативных створок и
массивной кальцификации относительно устьев
коронарных артерий с прогнозированием риска их
обструкции (см. далее). Номинальное внутреннее
давление при баллонной аортальной вальвулопла-
стике может служить косвенным показателем раз-
мера фиброзного кольца аортального клапана при
определении соответствующего размера протеза
[43].
УСТАНОВКА И РАСПРАВЛЕНИЕ ПРОТЕЗА
При использовании протеза, расширяемого балло-
ном, важно учитывать укорочение и движение про-
теза во время расправления. Укорочение и движе-
ние протеза происходит асимметрично: более выра-
жено в его нижней части (желудочковый край — до
3 мм), чем в его верхней части (аортальный край —
< 1 мм). Врач должен также учитывать, что рентге-
носкопические ориентиры (нижняя граница сину-
сов Вальсальвы) расположены на 2–3 мм ниже же-
лудочкового края (сравните с эхокардиографическим
ориентиром — уровнем прикрепления створок на-
тивного аортального клапана) (рис. 16.4).
Верхний край протеза должен полностью при-
крывать створки нативного аортального клапана,
но располагаться ниже синотубулярного соедине-
ния. Для оптимального окончательного размеще-
ния протеза (желудочковый край на 2–3 мм ниже
уровня прикрепления створок нативного аорталь-
ного клапана) во время электростимуляции средняя
часть протеза должна располагаться примерно на
30–40% ниже плоскости фиброзного кольца аор-
тального клапана. Гофрированный стент следует
отличать от баллона, для этого необходимо снизить
коэффициент усиления и лучше визуализировать с
помощью 3D-ЭхоКГ, чем 2D-ЭхоКГ (рис. 16.5). Раз-
мещение протеза Sapien 3 отличается тем, что коро-
че только желудочковый край протеза.
Саморасширяющийся протез первого поколения
рекомендуется имплантировать не менее чем на 2 мм,
но не более чем на 6 мм ниже плоскости фиброзно-
го кольца. Для предотвращения неправильного раз-
мещения протеза важно расправлять его медленно.
Сначала расправление происходит некоаксиально,
т.к. желудочковый край направлен кпереди. После
расправления протез поворачивают и выравнивают
параллельно аорте. Для саморасширяющихся про-
тезов последнего поколения рекомендуется анало-
гичное расположение (на 2–6 мм ниже плоскости
фиброзного кольца).
РОЛЬ ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
ПРИ ТРАНСКАТЕТЕРНОМ ПРОТЕЗИРОВАНИИ
АОРТАЛЬНОГО КЛАПАНА
Во многих центрах ТИАК еще выполняют под об-
щей анестезией и контролем с помощью ЧПЭхоКГ.
ch16.indd 368
03.04.2019 11:54:31
369
16 Транскатетерная имплантация аортального клапана
Благодаря технологическому усовершенствованию
и миниатюризации ультразвуковых систем, а также
повышению квалификации специалистов по ТИАК
произошел переход от хирургического подхода с ис-
пользованием больших проводников и устройств
и общей анестезии к полностью транскатетерной
процедуре, которую можно выполнить под мест-
ным обезболиванием. При этом всегда осуществля-
ют контроль с помощью рентгеноскопии, исполь-
зование ЧПЭхоКГ обсуждается.
Основным препятствием для интрапроцедурной
ЧПЭхоКГ является необходимость общей анесте-
зии. Хотя риски общей анестезии (и ЧПЭхоКГ) очень
низки, однако с ней может быть связана более дли-
тельная госпитализация. Однако ЧПЭхоКГ позво-
ляет провести комплексное допроцедурное обсле-
дование и мониторинг баллонной вальвулопласти-
ки (размещения и расправления протеза), а также
быструю и точную оценку осложнений. У пациен-
тов со слабо выраженной или умеренной кальци-
Рис. 16.4 Транскатетерная имплантация протеза. (A) Желаемое положение отноительно рентгеноскопических ориентиров (нижняя граница синусов Валь-
сальвы, зеленая линия) и эхокардиографических ориентиров (уровень прикрепления створок аортального клапана, красная линия) перед раздуванием баллона
(во время электростимуляции). (Б–Г) Укорочение протеза и движение его к аорте, не зависящее от оператора [Hahn RT, Kodali S, Tuzcu EM, et al. Echocardiograph-
ic imaging of procedural complications during balloon-expandable transcatheter aortic valve replacement. JACC Cardiovasc Imaging 8:288–318, 2015].
Нативный ритм
Окончательное положение
Навязанный ритм
А
Б
Г
В
Рис. 16.5 A Размещение протеза, расширяемого баллоном, под кон-
тролем трехмерной чреспищеводной эхокардиографии. Гофрирован-
ный стент (желтая скобка) следует отличать от баллона.
Баллон
Аорта
ch16.indd 369
03.04.2019 11:54:31
370
ЧАСТЬ IV Пороки клапанов сердца
фикацией размещение как расширяемых с помо-
щью баллона, так и саморасширяющихся протезов
под контролем только с помощью рентгеноскопии
может быть затруднительным. В этой ситуации мо-
жет помочь ЧПЭхоКГ.
С помощью ЧПЭхоКГ можно оценить правиль-
ность раскрытия протеза (положение, форма, гра-
диент и движение створок), степень и локализацию
АР (околоклапанная или внутрипротезная), глобаль-
ную и локальную систолическую функцию ЛЖ и
функцию митрального клапана, что важно для про-
филактики осложнений. В конце процедуры с по-
мощью ЧПЭхоКГ из глубокого трансгастрального
доступа можно рассчитать эффективную площадь
аортального клапана по уравнению непрерывности
потока. Напротив, ТТЭхоКГ является субоптималь-
ным методом визуализации, особенно в положении
пациента лежа на спине, т.к. могут быть пропуще-
ны такие осложнения, как аортальная гематома или
разрыв фиброзного кольца. ЧПЭхоКГ имеет луч-
шую разрешающую способность и, что важно, не
создает препятствий для транскатетерных или хи-
рургических манипуляций (например, дренирова-
ния перикарда).
Преимущества и недостатки интрапроцедурной
ЧПЭхоКГ перечислены в табл. 16.2 . В ходе недавних
исследований было продемонстрировано, что ин-
трапроцедурная ЧПЭхоКГ необязательна для безо-
пасности выполения ТИАК [44–46]. Однако эти
данные предоставили крупные специализирован-
ные центры, поэтому информация не может быть
обобщена для новых программ или небольших
клиник. Кроме того, отказ от интрапроцедурной
ЧПЭхоКГ может привести к поздней диагностике
фатальных осложнений, в связи с этим проведение
ТТЭхоКГ является обязательным. При появлении
подозрений на гемодинамическую нестабильность
следует незамедлительно выполнить ТТЭхоКГ и на-
чать общую анестезию с экстренным введением
зонда для ЧПЭхоКГ. Врач должен иметь в виду, что
с расширением показаний к ТИАК у пациентов с
низким хирургическим риском безопасность —
важный критерий вмешательства, поэтому быстрая
диагностика осложнений и последующее адекват-
ное лечение имеют первостепенное значение.
НЕПОСРЕДСТВЕННЫЕ ОСЛОЖНЕНИЯ
Непосредственные осложнения возникают сразу
или через несколько часов после ТИАК. Этот раздел
посвящен кардиальным осложнениям, которые мож-
но диагностировать с помощью ЭхоКГ, т.е . сосуди-
стые осложнения, нарушения проводимости и арит-
мия не рассматриваются. В случае острой гемодина-
мической нестабильности или кардиогенного шока
прежде всего должны быть оценены и исключены
кардиальные осложнения.
РАЗРЫВ ФИБРОЗНОГО КОЛЬЦА
Разрыв фиброзного кольца — редкое (< 1%), одна-
ко крайне опасное осложнение [47]. Разрыв может
быть неограниченным (рис. 16.6) или, реже, ограни-
ченным — периаортальным или в виде гематомы.
Данное осложнение возникает после имплантации
протеза или раздувания баллона. Летальность высо-
кая, особенно при неограниченном разрыве. Диа-
гностика с помощью ТТЭхоКГ часто бывает затруд-
нена, обычно нужна ЧПЭхоКГ или МСКТ. К факто-
рам, связанным с разрывом фиброзного кольца,
относят умеренную или выраженную кальцифика-
цию ВТЛЖ или субаннулярную кальцификацию,
превышение размера протеза (≥ 20%) и постдилата-
ция баллона [36].
ПЕРИКАРДИАЛЬНАЯ ЖИДКОСТЬ И ТАМПОНАДА СЕРДЦА
Тампонада сердца может быть обусловлена разры-
вом фиброзного кольца, расслоением аорты или
перфорацией желудочков. По данным литературы,
частота тампонады сердца составляет от 1 до 7%.
Перфорация ПЖ может быть следствием установ-
ки электрода водителя ритма, а перфорация ЛЖ —
введения проволочного проводника катетера. По-
следнее чаще происходит у пациентов с малым
гипердинамическим ЛЖ. Данное осложнение кли-
нически проявляется кардиогенным шоком. Обыч-
но наблюдается гетерогенная плотная перикарди-
альная жидкость, которая при ЧПЭхоКГ визуали-
зируется в трансгастральной позиции, а при
ТТЭхоКГ — в субкостальной позиции (рис. 16.7).
Часто выполняют экстренную пункцию, может по-
надобиться хирургическое вмешательство в зави-
Преимущества
Недостатки
Комплексная оценка перед процедурой
Контроль процедуры
Быстрая и точная оценка результатов и осложнений процедуры
Более высокое качество визуализации, чем при трансторакальной эхокардиографии
Не создает препятствий для манипуляций во время вмешательства
Общая анестезия
Полуинвазивная процедура
Риск ротоглоточных и желудочно-пи -
щеводных осложнений
ТАБЛИЦА 16.2 Преимущества и недостатки интрапроцедурной чреспищеводной эхокардиографии
при транскатетерной имплантации протеза аортального клапана
ch16.indd 370
03.04.2019 11:54:33
371
16 Транскатетерная имплантация аортального клапана
Факторами риска являются женский пол, неболь-
шой размер корня аорты (диаметр синуса Вальсаль-
вы < 30 мм) и протез, расширяемый баллоном. Бо-
лее низкую частоту обструкции коронарных арте-
рий при имплантации саморасширяющихся протезов
можно объяснить строением каркаса стента и жест-
ким соблюдением требований к диаметру корня
аорты (≥ 27 мм или ≥ 29 мм в зависимости от раз-
мера протеза). Следует отметить, что у большин-
ства пациентов с обструкцией коронарных артерий
расстояние между фиброзным кольцом и левой ко-
ронарной артерией составляет < 12 мм. Это порого-
вое значение более точное, чем пороговое значение
в 10 мм, предложенное в экспертном заключении по
ТИАК в 2012 г. [37].
Важными параметрами, которые также необхо-
димо учитывать, являются абсолютная длина створ-
ки и ее отношение к высоте синусов Вальсальвы. У
пациентов, которым ранее выполняли коронарное
шунтирование, гемодинамические последствия об-
струкции коронарных артерий могут отсутствовать.
НЕПРАВИЛЬНОЕ РАСПОЛОЖЕНИЕ ПРОТЕЗА, НАРУШЕНИЕ
ЕГО ФУНКЦИИ И ТЯЖЕЛАЯ АОРТАЛЬНАЯ РЕГУРГИТАЦИЯ
Неправильное расположение протеза способствует
развитию АР и нарушению функции митрального
клапана. Оценка причины и механизма АР имеет
первостепенное значение, причем важно отличить
околоклапанную АР от внутрипротезной, посколь-
ку методы лечения могут быть разными. Выражен-
ная центральная АР обусловлена неправильным
расположением протеза или нарушением работы
его створок, что наблюдается при чрезмерном рас-
ширении протеза. В этом случае обычно нужна по-
вторная имплантация протеза («клапан в клапане»).
Эту центральную АР следует отличать от централь-
ной АР, обусловленной проводником. Степень та-
А
Б
Рис. 16.6 Разрыв фиброзного кольца. Неограниченный разрыв фиброзного кольца аортального клапана (красные стрелки) после имплантации протеза, рас-
ширяемого баллоном (желтые стрелки), диагностированный с помощью ЧПЭхоКГ в позициях по длинной оси (A) A и короткой оси (Б) A.
симости от механизма повреждения и риска повто-
рения.
ОБСТРУКЦИЯ КОРОНАРНЫХ АРТЕРИЙ И ИНФАРКТ МИОКАРДА
Обструкция коронарных артерий редкое (< 1%), но
жизнеопасное осложнение ТИАК с 30-дневной ле-
тальностью до 41% [48, 49]. Причиной обструкции
коронарных артерий могут быть многие факторы.
В большинстве случаев обструкция коронарных ар-
терий обусловлена смещением кальцифицированных
створок нативного аортального клапана к устьям
коронарных артерий. Чаще всего поражается левая
коронарная артерия.
Рис. 16.7 A Тампонада сердца после имплантации протеза. Обратите
внимание, что правые полости почти незаметны. ЛЖ
—
левый желудочек;
ЛП — левое предсердие; ПЖ — правый желудочек; ПП — правое предсер-
дие.
ПЖ
ПП
ЛЖ
ЛП
ch16.indd 371
03.04.2019 11:54:33
372
ЧАСТЬ IV Пороки клапанов сердца
кой АР не выше умеренной, и после удаления про-
водника наблюдается ее разрешение.
Слишком низкое расположение протеза, расши-
ряемого баллоном, может привести к смещению про-
теза. Кальцифицированные свободные края натив-
ных створок могут воздействовать с силой, направ-
ленной вниз, и дополнительно подталкивать протез
(рис. 16.8). Слишком низкое размещение саморас-
ширяющегося протеза связано с повышенным ри-
ском нарушения проводимости (и необходимостью
применения кардиостимулятора), МР и околокла-
панной АР, тогда как слишком высокое размещение
связано с повышенным риском околоклапанной
АР, смещением протеза и обструкцией коронарных
артерий (рис. 16.9). Может быть предпринята по-
пытка репозиции небольшого имплантированного
протеза.
Причиной тяжелой АР также могут быть недо-
статочное неполное раскрытие протеза (рис. 16.10).
У пациентов с недостаточным раскрытием протеза
и низким риском разрыва фиброзного кольца мож-
но выполнить постдилатацию с хорошими шанса-
ми на успех [50]. Осложнения постдилатации: раз-
рыв фиброзного кольца, смещение протеза, обструк-
ция коронарных артерий и повреждение створок
протеза.
ОСТРАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Острую МР может вызвать запутывание сверхжест-
кого проводника в подклапанном аппарате митраль-
ного клапана. Репозиция проводника может разре-
шить МР и предотвратить травматический отрыв
сухожильных хорд. У пациентов с небольшим ги-
пертрофированным ЛЖ острая функциональная
МР может быть обусловлена обструкцией ЛЖ и па-
радоксальным систолическим движением передней
створки митрального клапана. Другими причинами
МР могут быть перфорация створок, отрыв сухо-
жильных хорд и молотящая створка. Низкое распо-
ложение саморасширяющегося протеза может при-
вести к ущемлению передней створки митрального
клапана, отрыву сухожильных хорд, молотящей
створке и тяжелой МР (рис. 16.11).
КАРДИОГЕННЫЙ ШОК
При кардиогенном шоке обычно наблюдаются все
перечисленные ранее осложнения. Таким образом,
если при катетеризации сердца у пациента возни-
кает кардиогенный шок, следует рассмотреть ве-
А
Б
Рис. 16.8 Низкое размещение протеза, расширяемого баллоном. (A) A Над протезом (желтая стрелка) визуализируется нативный аортальный клапан
(красная стрелка). (Б) A Через несколько суток протез сместился в выходной тракт к основанию нативных створок.
Рис. 16.9 A Низкое размещение саморасширяющегося протеза. Ви-
зуализация при ТТЭхоКГ в проекции по длинной оси. Желудочковый край про-
теза (стрелка) находится намного ниже нативного аортального кольца. ЛЖ —
левый желудочек; ЛП — левое предсердие.
ЛП
ЛЖ
ch16.indd 372
03.04.2019 11:54:33
373
16 Транскатетерная имплантация аортального клапана
роятность разрыва фиброзного кольца, тампонады
сердца, острой тяжелой АР или МР, обструкции ко-
ронарных артерий и инфаркта миокарда. Кардио-
генный шок также может быть связан со сверхчаст-
ной электростимуляцией у пациентов с ишемиче-
ской дисфункцией ЛЖ или обструкцией ЛЖ и
парадоксальным систолическим движением перед-
ней створки митрального клапана, возникающими
при быстром восстановлении постнагрузки после
ТИАК.
КРАТКОСРОЧНЫЕ И СРЕДНЕСРОЧНЫЕ
РЕЗУЛЬТАТЫ
ГЕМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
ИМПЛАНТИРОВАННОГО ПРОТЕЗА
Необходимо измерить максимальный и средний
градиенты давления и с помощью уравнения не-
прерывности потока рассчитать эффективную
площадь отверстия клапана. В табл. 16.3 представ-
лено определение дисфункции протеза согласно
Рис. 16.10 Неполное раскрытие саморасширяющегося протеза. (А) A Неполное раскрытие протеза привело к тяжелой аортальной регургитации (крас-
ная стрелка). Обратите внимание на овальную форму каркаса стента в позиции по короткой оси (желтая стрелка). (Б) A После выполнения баллонной дилата-
ции каркас приобрел круглую форму (желтая стрелка). Заметно улучшение расположения каркаса с легкой или умеренной остаточной околоклапанной регургита-
цией (красная стрелка).
Рис. 16.11 Острая травматическая митральная регургитация. (A) ТТЭхоКГ демонстрирует низкое размещение саморасширяющегося протеза (стрелка).
(Б) A На ЧПЭхоКГ виден отрыв сухожильных хорд (стрелка). (В) A Тяжелая митральная регургитация при цветовой допплерографии. ЛЖ — левый желудо-
чек; ЛП — левое предсердие.
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
ЛП
А
Б
В
2
2
2
2
А
Б
ch16.indd 373
03.04.2019 11:54:34
374
ЧАСТЬ IV Пороки клапанов сердца
VARC-2 (Valve Academic Research Consortium-2)
[51]. Для пациентов с малой площадью поверхно-
сти тела и с избыточной массой тела следует ис-
пользовать соответствующие абсолютные порого-
вые значения.
Для расчета площади нативного клапана при АС
нужно точное определение ударного объема по ди-
аметру ВТЛЖ и интегралу скорости кровотока в
ВТЛЖ. Для протеза, расширяемого баллоном, инте-
грал скорости кровотока в ВТЛЖ измеряют на уров-
не желудочкового края протеза, а диаметр ВТЛЖ
равен диаметру стента на уровне желудочкового
края [52]. Для саморасширяющегося протеза еще
Количественные параметры
Норма
Стеноз протезированного клапана*
Легкий
Умеренный/тяжелый
Зависящие от потока†
Максимальная скорость кровотока (м/сек)
<3
3–4
>4
Средний градиент давления (мм рт. ст .)
<20
20–40
>40
Не зависящие от потока
Отношение допплеровских скоростей£
> 0,35
0,25–0,35
< 0,25
Эффективная площадь отверстия (см2)§
> 1,1
0,8–1,1
< 0,8
Эффективная площадь отверстия (см2)¶
> 0,9
0,6–0,9
< 0,6
Параметр
Несоответствие протез–пациент
Незначительное
Умеренное Выраженное
Индексированная эффективная площадь отверстия (см2/м2)#
> 0,85
0,65–0,85
< 0,65
Индексированная эффективная площадь отверстия (см2/м2)@
> 0,90
0,60–0,90
< 0,60
Параметр
Регургитация на протезированом клапане
Легкая
Умеренная Тяжелая
Полуколичественный
Диастолический ретроградный поток
в нисходящем отделе аорты
Отсутствует или
кратковременный
в раннюю
диастолу
Умеренный Выраженный в
течение всей фазы
диастолы
Циркулярная околоклапанная регургитация
на протезированном клапане (%)$
< 10%
10–29%
≥ 30%
Количественный£
Объем регургитации (мл/удар)
<30мл
30–59 мл
≥60мл
Фракция регургитации (%)
< 30%
30–49%
≥ 50%
EROA (см2)
0,10 см2
0,10–0,29 см2 ≥ 0,30 см2
*
При нормальном или почти норальном ударном объеме(50–70 мл).
† Включая сопутствующую аортальную регургитацию.
£ Для ВТЛЖ > 2,5 см, критерий значимого стеноза — < 0,20.
§ При ППТ ≥ 1,6 см2 (зависит от размера протеза и размера нативного фиброзного кольца).
¶ ПриППТ<1,6см2.
# При ИМТ < 30 кг/см2.
@ При ИМТ ≥ 30 кг/см2.
$ Не имеет хорошей доказательности и может завышать оценку, по сравнению с количественной допплеровской оценкой.
EROA — эффективная площадь отверстия регургитации; ВТЛЖ — выходной тракт левого желудочка; ИМТ — индекс массы тела; ППТ —
площадь поверхности тела.
[Kappetein AP, Head SJ, Genereux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation: the Valve Academ-
ic Research Consortium-2 consensus document. J Am Coll Cardiol 60:1438–1454, 2012.]
ТАБЛИЦА 16.3 Определение дисфункции протеза согласно Valve Academic Research Consortium-2
остается спорным вопрос о том, где следует изме-
рять диаметр ВТЛЖ — на уровне желудочкового
края протеза или на уровне вращения створок про-
теза. В случае уменьшения эффективной площади
отверстия клапана показатель скорости кровотока
при допплерографии можно использовать для от-
личия дисфункции протеза от несоответствия про-
тез–пациент.
Было показано, что протезы для ТИАК обладают
превосходными гемодинамическими характеристи-
ками, по сравнению с биологическими протезами,
имплантируемыми хирургически (средний гради-
ент давления у них такой же, как у бескаркасных
ch16.indd 374
03.04.2019 11:54:37
375
16 Транскатетерная имплантация аортального клапана
А
Б
В
биологических протезов), а также предотвращают
тяжелое несоответствие протез–пациент [53, 54].
В исследовании PARTNER пациенты, подверг-
шиеся ТИАК и хирургическому протезированию
клапана биологическим протезом, были рандоми-
зированы 1 : 1. У пациентов из группы ТИАК была
значительно более высокая постпроцедурная пло-
щадь аортального клапана и более низкий транс-
протезный градиент давления, несмотря на боль-
ший ударный объем [55]. После хирургического
протезирования клапана биологическим протезом
несоответствие протез–пациент встречалось чаще и
в более выраженной степени, чем после ТИАК: ча-
стота тяжелого несоответствия (площадь аорталь-
ного клапана, индексированная к площади поверх-
ности тела, < 0,65 см2/м2) в группе хирургического
протезирования составила 28% по сравнению с 20%
в группе ТИАК. Преимущества протезов для ТИАК
имеют особое значение у пациентов с малым фи-
брозным кольцом аортального клапана (< 20 мм):
частота тяжелого несоответствия протез–пациент
составляет 19%, в отличие от 34% при хирургиче-
ском протезировании клапана.
ОКОЛОКЛАПАННАЯ РЕГУРГИТАЦИЯ
При оценке АР необходимо учитывать как централь-
ную, так и околоклапанную регургитацию, которые
следует суммировать. Точная оценка степени и ме-
ханизма АР имеет решающее значение при выборе
вмешательства (баллонной дилатации или имплан-
тации второго протеза). Для предотвращения око-
локлапанной регургитации разработали новые про-
тезы, например Sapien 3. Центральная АР встреча-
ется редко.
В некоторых исследованиях была продемонстри-
рована связь между степенью околоклапанной АР и
исходами, а именно летальностью, у протезов, рас-
ширяемых баллоном, и у саморасширяющихся
протезов [56–58]. По данным литературы, частота и
степень околоклапанной АР варьирует в диапазоне
от 7 до 70%. Одной из причин такой вариабельно-
сти может быть отсутствие стандартизированной
оценки. В целом, частота околоклапанной АР не ме-
нее степени 2 или умеренной составляет 15–20% с
тенденцией к увеличению при имплантации само-
расширяющегося протеза, по сравнению с проте-
зом, расширяемым баллоном [59]. Однако после
внедрения протезов нового поколения частота око-
локлапанной АР значительно снизилась [60]. Ре-
зультаты всех исследований согласуются, демон-
стрируя корреляцию умеренной и тяжелой около-
клапанной АР с двукратным или трехкратным
увеличением летальности. Напротив, значение лег-
кой околоклапанной АР еще обсуждается [59, 61].
Основными факторами околоклапанной АР явля-
ются низкое расположение протеза и кальцифика-
ция клапана (степень, локализация и асимметрич-
ное распространение) [42, 62–65].
Во всех руководствах содержатся рекомендации
по количественному определению околоклапанной
АР, но такая оценка с помощью ЭхоКГ сложна, по-
скольку при околоклапанной АР часто наблюдают-
ся множественные эксцентрические струи регурги-
тации (рис. 16.12). Кроме того, они могут идти вдоль
ВТЛЖ или затенятся стентом протеза. Следователь-
но, параметры, используемые для оценки АР на на-
тивном клапане [66], в случае протезирования либо
практически невозможны, либо непригодны. В ре-
комендациях VARC-2 (см. табл. 16.3) по-прежнему
предлагается эхокардиографическая оценка, осно-
ванная на интегративном подходе [51]. Основным
методом оценки околоклапанной АР является цве-
товая допплерография, поскольку с ее помощью
можно подтвердить наличие регургитации, опреде-
Рис. 16.12 Околоклапанная аортальная регургитация. (A) ТТЭхоКГ в парастернальной позиции по короткой оси. (Б) При ЦДК визуализируется несколько
струй регургитации. (В) Циркулярное распространение околоклапанной аортальной регургитации (скобка).
ch16.indd 375
03.04.2019 11:54:37
376
ЧАСТЬ IV Пороки клапанов сердца
лить количество струй, их направление и локализа-
цию. При этом следует использовать все возмож-
ные доступы и позиции.
Была предложена количественная оценка регур-
гитации в парастернальной позиции по короткой
оси, основанная на циркулярном распространении
струи, хотя уровень доказательности, подтверждаю-
щий целесообразность этого подхода, и предлагае-
мые пороговые значения все еще ограничены [51].
Околоклапанную АР подразделяют на отсутству-
ющую, малую (незначительная струя в позиции по
короткой оси), легкую (длина дуги струи регургита-
ции в позиции по короткой оси составляет < 10%
окружности фиброзного кольца аортального клапа-
на), умеренную (длина дуги струи регургитации в
позиции по короткой оси составляет 10–30% окруж-
ности фиброзного кольца аортального клапана)
или тяжелую (длина дуги струи регургитации в по-
зиции по короткой оси составляет > 30% окружно-
сти фиброзного кольца аортального клапана). Сто-
ит отметить, что этот параметр может существенно
завышать степень околоклапанной АР, поскольку
струя может быть циркулярной и существенно ва-
рьировать в зависимости от уровня оценки. В связи
с этим крайне важно оценивать этот параметр на
уровне возникновения струи. Кроме того, при сум-
мировании нескольких струй результат может быть
неточным. В качестве показателя можно использо-
вать диастолический ретроградный поток в нисхо-
дящем отделе аорты, но было установлено, что в на-
тивных клапанах этот показатель является специ-
фичным, но имеет плохую чувствительность [67].
Рассчитать объем регургитации и эффективную
площадь отверстия регургитации можно по разни-
це между митральным ударным объемом или удар-
ным объемом в легочной артерии и аортальным
ударным объемом. Однако расчет митрального
ударного объема или ударного объема в легочной
артерии непростая задача.
В большинстве случаев невозможно количествен-
но оценить степень околоклапанной АР с помощью
метода PISA. Недавно была предложена классифи-
кация, в которой легкую и умеренную аортальную
регургитацию подразделяют на две степени каждую
(легкую и от легкой до умеренной, умеренную и от
умеренной до тяжелой соответственно). Обоснова-
нием создания пятиступенчатой классификации
стали сложность оценки околоклапанной АР и ча-
сто возникающие сомнения при определении ее сте-
пени с помощью трехступенчатой классификации
[68]. Такая неопределенность подчеркивает практи-
ческую ценность других параметров, в частности
ширины vena contracta и площади и диаметра струи
регургитации в месте ее образования.
Количественная оценка с помощью МРТ — бо-
лее надежный и воспроизводимый метод, т.к . при
2D-ЭхоКГ часто занижается оценка степени АР [34,
69, 70]. С помощью 3D-ЭхоКГ можно преодолеть
некоторые ограничения 2D-ЭхоКГ, но 3D-ЭхоКГ
имеет низкие временно
́
е и пространственное разре-
шение [34]. Оба метода визуализации нуждаются в
валидации, поскольку все еще отсутствуют под-
тверждения достоверности.
ТРОМБОЗ
В последнее время внимание исследователей при-
влек риск тромбоза биологического протеза клапа-
на [71–73]. Ранее этот риск считали очень низким,
но в недавних отчетах как по хирургическому про-
тезированию клапана, так и по ТИАК, было указа-
но, что тромбоз биологического протеза клапана —
нередкое явление. Тромбоз протеза после ТИАК
обычно протекает бессимптомно, но влияние тром-
боза на клинический исход, в частности инсульт и
транзиторную ишемическую атаку, еще надо изу-
чать. После ТИАК тромбоз развивается обычно в
течение 2 лет, но тромб может обраоваться и через
30 сут после вмешательства [73]. Описанная в лите-
ратуре частота составляет < 1% [72], хотя весьма ве-
роятно, что ранее тромбоз протеза после ТИАК ди-
агностировали редко. Систематическое обследова-
ние с помощью КТ показало, что частота тромбоза
протеза после ТИАК составляет 13–40%, причем у
многих пациентов процесс протекает с субклиниче-
скими изменениями гемодинамики [73]. К эхокар-
диографическим признакам тромбоза относят за-
медление и быстрое увеличение чресклапанного
градиента давления сразу после имплантации при
нормальной функции протезированного клапана,
утолщение створок, ограничение их подвижности,
а также тромботические наложения. Подвижные мас-
сы наблюдаются редко.
При подозрении на тромбоз оценка створок с по-
мощью ТТЭхоКГ может быть затруднена, рекомен-
дуется выполнение ЧПЭхоКГ. Также полезным ме-
тодом диагностики является КТ (рис. 16.13). У боль-
шинства пациентов эффективна антикоагулянтная
терапия — пероральный прием антагонистов вита-
мина K, приводящая к исчезновению тромботиче-
ских масс и улучшению показателей гемодинамики
со значительным снижением чресклапанного гра-
диента давления. Причин тромбоза протезов до сих
пор неясны, не разработана и схема оптимальной
антикоагулянтной терапии после ТИАК. Сообще-
ния о субклиническом уменьшении подвижности
створок, диагностированном с помощью КТ или
ЧПЭхоКГ, тщательно контролирует FDA.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Как при всех искусственных клапанах, инфекцион-
ный эндокардит может возникать и на протезах для
ТИАК. Зарегистрированная ежегодная заболевае-
мость инфекционным эндокардитом составляет от
0,5 до 3,4% в расчете на пациент-год [74–76]. В боль-
шинстве случаев инфекционный эндокардит разви-
ch16.indd 376
03.04.2019 11:54:37
377
16 Транскатетерная имплантация аортального клапана
А
Б
Г
В
вался в течение первого года после имплантации.
Клиническая картина такая же, как после хирурги-
ческого протезирования клапана: лихорадка, общая
слабость, хроническая сердечная недостаточность и
эмболические осложнения. Наиболее частые возбу-
дители — стафилококки и энтерококки. Данные
ЭхоКГ также схожи: наиболее частая находка — ве-
гетации на створках протеза и каркасе стента, а так-
же на митральном клапане. Реже наблюдаются вну-
трипротезная аортальная регургитация, абсцессы,
фистулы и псевдоаневризмы. ТТЭхоКГ может быть
неинформативна, поэтому при подозрении на ин-
фекционный эндокардит рекомендуется проведе-
ние ЧПЭхоКГ. При отрицательном результате, но
наличии крайней клинической настороженности,
исследование можно повторить через 5–7 сут. Так-
тика ведения большинства пациентов консерватив-
ная, поскольку они, как правило, имеют высокий
риск в связи с преклонным возрастом и множе-
ственными сопутствующими заболеваниями. Про-
гноз плохой: внутрибольничная летальность — до
47% и летальностью в течение одного года — 66%
[74].
ДЕГЕНЕРАЦИЯ ПРОТЕЗА
Последующая ЭхоКГ рекомендуется через 6 меся-
цев после выписки и в дальнейшем ежегодно. Важ-
но отметить, что из-за потенциальных ошибок и
трудностей измерения настоятельно рекомендуется
использовать результаты исходного обследования
пациента в качестве основы для сравнения с резуль-
татами исследований после имплантации. В ходе
продолжительного (до 5 лет) последующего наблю-
дения была продемонстрирована отличная гемоди-
намическая эффективность протезирования [77,
78]. По мере увеличения продолжительности экс-
плуатации протезов для ТИАК и имплантации их
пациентам из групп промежуточного и низкого хи-
Рис. 16.13 Тромбоз протезированного аортального клапана. Тромбоз протеза 26 SAPIEN XT через 6 мес после успешной имплантации. При ЧПЭхоКГ в
позициях по длинной оси A A (A, Б) и короткой оси (В, Г) визуализируется ограничение подвижности створок с уменьшением открытия клапана [Latib A, Mes-
sika-Zeitoun D, Maisano F, et al. Reversible Edwards Sapien XT dysfunction due to prosthesis thrombosis presenting as early structural deterioration. J Am Coll Cardiol
61:787–789, 2012].
ch16.indd 377
03.04.2019 11:54:37
378
ЧАСТЬ IV Пороки клапанов сердца
рургического риска вопрос о продолжительности
срока службы протеза приобретает все большую ак-
туальность. На сегодняшний день в литературе опи-
саны лишь единичные случаи дегенерации протеза,
но у большинства пациентов, подвергшихся им-
плантации, еще не достигнут критический семилет-
ний порог. Оценка дегенерации протеза основана на
гемодинамических характеристиках (см. табл. 16.3),
на прямой оценке состоятельности протеза и его
створок и появления новой внутрипротезной АР.
ЗАКЛЮЧЕНИЕ
ЭхоКГ играет ведущую роль при принятии реше-
ния о проведении ТИАК. Результаты эхокардиогра-
фического обследования имеют решающее значе-
ние при отборе пациентов, оценке степени АС, опе-
рационного риска, степени МР и ее механизма,
выявления двухстворчатого аортального клапана, а
также для планирования процедуры. ЭхоКГ — ос -
новной метод визуализации для оценки и ранней
диагностики осложнений вмешательства, а также
его среднесрочных и долгосрочных результатов.
Важно отметить, что результаты ЭхоКГ должны
быть интегрированы с результатами других мето-
дов визуализации, особенно с результатами КТ, ко-
торая заняла важное место в планировании проце-
дуры ТИАК, позволяя точно определять размер
протеза, оценивать аорту на всем протяжении и ее
связь с коронарными артериями.
ТТЭхоКГ ЧПЭхоКГ
КТ
Отбор пациентов
Оценка степени аортального стеноза
+++
+
+ (кальциевый индекс)
Анатомия аортального клапана (двухстворчатый или трехстворчатый) +
++
+++
Степень и механизм митральной регургитации
++
+++
−
Обструкция левого желудочка
+++
++
−
Аневризма восходящего отдела аорты
++
+++
+++
Избыточный атероматоз аорты
−
+++
++
Внутрисердечные массы
++ (ЛЖ) ++ (ЛП)
+
Планирование процедуры
Определение размера протеза
+
+ (3D-ЭхоКГ ++) +++
Расстояние до устьев коронарных артерий
−
+ (3D-ЭхоКГ)
+++
Степень и локализация кальцификации
+
++
+++
Контроль процедуры
Расположение и раскрытие протеза
+
++
−
Интрапроцедурные осложнения
++
+++
−
Краткосрочные и среднесрочные результаты
Гемодинамические характеристики
+++
++
−
Околоклапанная регургитация
++
+++
−
Тромбоз
+
+++
+++
Инфекционный эндокардит
++
+++
+
Дегенерация протеза
++
+++
+
КТ — компьютерная томография; ЛЖ — левый желудочек; ЛП — левое предсердие; ТТЭхоКГ — трансторакальная эхокардиография;
ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Транскатетерная имплантация протеза в аортальной позиции
ch16.indd 378
03.04.2019 11:54:38
379
16 Транскатетерная имплантация аортального клапана
ЛИТЕРАТУРА
1. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012): The Joint Task
Force on the Management of Valvular Heart
Disease of the European Society of Cardiol-
ogy (ESC) and the European Association for
Cardio-Thoracic Surgery (EACTS), Eur Heart
J 33:2451–2496, 2012.
2. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC Guideline for the Manage-
ment of Patients With Valvular Heart Dis-
ease: executive summary: a report of the
American College of Cardiology/American
Heart Association Task Force on Practice
Guidelines, Circulation 129:2440–2492, 2014.
3. Baumgartner H, Hung J, Bermejo J, et al.
Echocardiographic assessment of valve steno-
sis: EAE/ASE recommendations for clinical
practice, J Am Soc Echocardiogr 22:1–23, 2009.
4. Messika-Zeitoun D, Aubry MC, Detaint D, et
al. Evaluation and clinical implications of aor-
tic valve calcification by electron beam com-
puted tomography, Circulation110356–362,
2004.
5. Clavel MA, Messika-Zeitoun D, Pibarot P, et
al. The complex nature of discordant severe
calcified aortic valve disease grading: new in-
sights from combined Doppler echocardio-
graphic and computed tomographic study, J
Am Coll Cardiol 62:2329–2338, 2013.
6. Cueff C, Serfaty JM, Cimadevilla C, et al.
Measurement of aortic valve calcification us-
ing multislice computed tomography: corre-
lation with haemodynamic severity of aortic
stenosis and clinical implication for patients
with low ejection fraction, Heart 97:721–726,
2011.
7. Monin JL, Monchi M, Gest V, et al. Aortic
stenosis with severe left ventricular dysfunc-
tion and low transvalvular pressure gradients:
risk stratification by low-dose dobutamine
echocardiography, J Am Coll Cardiol 37:2101–
2107, 2001.
8. Tribouilloy C, Levy F, Rusinaru D, et al. Out-
come after aortic valve replacement for low-
flow/low-gradient aortic stenosis without
contractile reserve on dobutamine stress
echocardiography, J Am Coll Cardiol 53:1865–
1873, 2009.
9. Eltchaninoff H, Durand E, Borz B, et al. Bal-
loon aortic valvuloplasty in the era of trans-
catheter aortic valve replacement: acute and
long-term outcomes, Am Heart J 167:235–
240, 2014.
10. Pedersen WR, Goldenberg IF, Pedersen CW,
et al. Balloon aortic valvuloplasty in high risk
aortic stenosis patients with left ventricular
ejection fractions < 20%, Catheter Cardiovasc
Interv 84:824–831, 2014.
11. Minners J, Allgeier M, Gohlke-Baerwolf C, et
al. Inconsistencies of echocardiographic crite-
ria for the grading of aortic valve stenosis, Eur
Heart J 29:1043–1048, 2008.
12. Hachicha Z, Dumesnil JG, Bogaty P, Pibarot
P. Paradoxical low-flow, low-gradient severe
aortic stenosis despite preserved ejection frac-
tion is associated with higher afterload and
reduced survival, Circulation 115:2856–2864,
2007.
13. Eleid MF, Sorajja P, Michelena HI, et al. Flow-
gradient patterns in severe aortic stenosis with
preserved ejection fraction: clinical character-
istics and predictors of survival, Circulation
128:1781–1789, 2013.
14. Le Ven F, Freeman M, Webb J, et al. Impact
of low flow on the outcome of high-risk pa-
tients undergoing transcatheter aortic valve
replacement, J Am Coll Cardiol 62:782–788,
2013.
15. Le Ven F, Thebault C, Dahou A, et al. Evolu-
tion and prognostic impact of low flow after
transcatheter aortic valve replacement, Heart
101:1196–1203, 2015.
16. Nashef SA, Sharples LD, Roques F, Lock-
owandt U: EuroSCORE II and the art and
science of risk modelling, Eur J Cardiothorac
Surg 43:695–696, 2012.
17. O’Brien SM, Shahian DM, Filardo G, et al.
The Society of Thoracic Surgeons 2008 car-
diac surgery risk models: part 2—isolated
valve surgery, Ann Thorac Surg 88(1
Suppl):S23–42, 2009.
18. Roques F, Nashef SA, Michel P, et al. Risk
factors and outcome in European cardiac sur-
gery: analysis of the EuroSCORE multina-
tional database of 19030 patients, Eur J Car-
diothorac Surg 15:816–822, 1999. discussion
822-813.
19. Shahian DM, O’Brien SM, Filardo G, et al.
The Society of Thoracic Surgeons 2008 car-
diac surgery risk models: part 3 — valve plus
coronary artery bypass grafting surgery, Ann
Thorac Surg 88(1 Suppl):S43–62, 2009.
20. Roberts WC, Ko JM: Frequency by decades of
unicuspid, bicuspid, and tricuspid aortic
valves in adults having isolated aortic valve
replacement for aortic stenosis, with or with-
out associated aortic regurgitation, Circula-
tion 111:920–925, 2005.
21. Zegdi R, Ciobotaru V, Noghin M, et al. Is it
reasonable to treat all calcified stenotic aortic
valves with a valved stent? Results from a hu-
man anatomic study in adults, J Am Coll Car-
diol 51:579–584, 2008.
22. Himbert D, Pontnau F, Messika-Zeitoun D,
et al. Feasibility and outcomes of transcathe-
ter aortic valve implantation in high-risk pa-
tients with stenotic bicuspid aortic valves, Am
J Cardiol 110:877–883, 2012.
23. Mylotte D, Lefevre T, Sondergaard L, et al.
Transcatheter aortic valve replacement in bi-
cuspid aortic valve disease, J Am Coll Cardiol
64:2330–2339, 2014.
24. Yousef A, Simard T, Webb J, et al. Transcath-
eter aortic valve implantation in patients with
bicuspid aortic valve: a patient level multi-
center analysis, Int J Cardiol 189:282–288,
2015.
25. Nombela-Franco L, Eltchaninoff H, Zahn R,
et al. Clinical impact and evolution of mitral
regurgitation following transcatheter aortic
valve replacement: a meta-analysis, Heart
101:1395–1405, 2015.
26. Erbel R, Aboyans V, Boileau C, et al. 2014
ESC Guidelines on the diagnosis and treat-
ment of aortic diseases: document covering
acute and chronic aortic diseases of the tho-
racic and abdominal aorta of the adult. The
Task Force for the Diagnosis and Treatment
of Aortic Diseases of the European Society of
Cardiology (ESC), Eur Heart J 35:2873–2926,
2014.
27. Messika-Zeitoun D, Serfaty JM, Brochet E, et
al. Multimodal assessment of the aortic an-
nulus diameter: implications for transcatheter
aortic valve implantation, J Am Coll Cardiol
55:186–194, 2010.
28. Serfaty JM, Himbert D, Esposito-Farese M, et
al. Measurement of the aortic annulus diam-
eter using transesophageal echocardiography
and multislice computed tomography—are
they truly comparable? Can J Cardiol
30:1073–1079, 2014.
29. Willson AB, Webb JG, Labounty TM, et al.
3-dimensional aortic annular assessment by
multidetector computed tomography pre-
dicts moderate or severe paravalvular regur-
gitation after transcatheter aortic valve re-
placement: a multicenter retrospective analy-
sis, J Am Coll Cardiol 59:1287–1294, 2012.
30. Jilaihawi H, Kashif M, Fontana G, et al. Cross-
sectional computed tomographic assessment
improves accuracy of aortic annular sizing
for transcatheter aortic valve replacement and
reduces the incidence of paravalvular aortic
regurgitation, J Am Coll Cardiol 59:1275–
1286, 2012.
31. Gurvitch R, Webb JG, Yuan R, et al. Aortic
annulus diameter determination by multide-
tector computed tomography: reproducibili-
ty, applicability, and implications for trans-
catheter aortic valve implantation, JACC Car-
diovasc Interv 4:1235–1245, 2011.
32. Hamdan A, Guetta V, Konen E, et al. Defor-
mation dynamics and mechanical properties
of the aortic annulus by 4-dimensional com-
puted tomography: insights into the func-
tional anatomy of the aortic valve complex
and implications for transcatheter aortic valve
therapy, J Am Coll Cardiol 59:119–127, 2012.
33. Binder RK, Webb JG, Willson AB, et al. The
impact of integration of a multidetector com-
puted tomography annulus area sizing algo-
rithm on outcomes of transcatheter aortic
valve replacement: a prospective, multicenter,
controlled trial, J Am Coll Cardiol 62:431–438,
2013.
34. Altiok E, Koos R, Schroder J, et al. Compari-
son of two-dimensional and three-dimen-
sional imaging techniques for measurement
of aortic annulus diameters before transcath-
eter aortic valve implantation, Heart 97:1578–
1584, 2011.
35. Khalique OK, Kodali SK, Paradis JM, et al.
Aortic annular sizing using a novel 3-dimen-
sional echocardiographic method: use and
comparison with cardiac computed tomogra-
phy, Circ Cardiovasc Imaging 7:155–163,
2014.
36. Barbanti M, Yang TH, Rodes Cabau J, et al.
Anatomical and procedural features associ-
ated with aortic root rupture during balloon-
expandable transcatheter aortic valve replace-
ment, Circulation 128:244–253, 2013.
37. Holmes Jr. DR, Mack MJ, Kaul S, et al. 2012
ACCF/AATS/SCAI/STS expert consensus
document on transcatheter aortic valve re-
placement, J Am Coll Cardiol 59:1200–1254,
2012.
38. Tops LF, Wood DA, Delgado V, et al. Nonin-
vasive evaluation of the aortic root with mul-
tislice computed tomography. implications
for transcatheter aortic valve replacement, J
Am Coll Cardiol Imaging 1:321–330, 2008.
39. Leipsic J, Gurvitch R, Labounty TM, et al.
Multidetector computed tomography in
transcatheter aortic valve implantation, JACC
Cardiovasc Imaging 4:416–429, 2011.
40. Ewe SH, Ng AC, Schuijf JD, et al. Location
and severity of aortic valve calcium and im-
plications for aortic regurgitation after trans-
catheter aortic valve implantation, Am J Car-
diol 108:1470–1477, 2011.
41. Khalique OK, Hahn RT, Gada H, et al. Quan-
tity and location of aortic valve complex cal-
cification predicts severity and location of
paravalvular regurgitation and frequency of
post-dilation after balloon-expandable trans-
ch16.indd 379
03.04.2019 11:54:38
380 ЧАСТЬ IV Пороки клапанов сердца
catheter aortic valve replacement, JACC Car-
diovasc Interv 7:885–894, 2014.
42. John D, Buellesfeld L, Yuecel S, et al. Correla-
tion of device landing zone calcification and
acute procedural success in patients undergo-
ing transcatheter aortic valve implantations
with the self-expanding CoreValve prosthesis,
JACC Cardiovasc Interv 3:233–243, 2010.
43. Babaliaros VC, Liff D, Chen EP, et al. Can
balloon aortic valvuloplasty help determine
appropriate transcatheter aortic valve size? J
Am Coll Cardiol Intv1580–586, 2008.
44. Babaliaros V, Devireddy C, Lerakis S, et al.
Comparison of transfemoral transcatheter
aortic valve replacement performed in the
catheterization laboratory (minimalist ap-
proach) versus hybrid operating room (stan-
dard approach): outcomes and cost analysis,
JACC Cardiovasc Interv 7:898–904, 2014.
45. Durand E, Borz B, Godin M, et al. Trans-
femoral aortic valve replacement with the
Edwards SAPIEN and Edwards SAPIEN XT
prosthesis using exclusively local anesthesia
and fluoroscopic guidance: feasibility and 30-
day outcomes, JACC Cardiovasc Interv 5:461–
467, 2012.
46. Greif M, Lange P, Nabauer M, et al. Transcu-
taneous aortic valve replacement with the
Edwards SAPIEN XT and Medtronic CoreV-
alve prosthesis under fluoroscopic guidance
and local anaesthesia only, Heart 100:691–
695, 2014.
47. Genereux P, Head SJ, Van Mieghem NM, et
al. Clinical outcomes after transcatheter aor-
tic valve replacement using valve academic
research consortium definitions: a weighted
meta-analysis of 3,519 patients from 16 stud-
ies, J Am Coll Cardiol 59:2317–2326, 2012.
48. Ribeiro HB, Nombela-Franco L, Urena M, et al.
Coronary obstruction following transcatheter
aortic valve implantation: a systematic review,
JACC Cardiovasc Interv 6:452–461, 2013.
49. Ribeiro HB, Webb JG, Makkar RR, et al. Pre-
dictive factors, management, and clinical out-
comes of coronary obstruction following
transcatheter aortic valve implantation: in-
sights from a large multicenter registry, J Am
Coll Cardiol 62:1552–1562, 2013.
50. Barbanti M, Petronio AS, Capodanno D, et al.
Impact of balloon post-dilation on clinical
outcomes after transcatheter aortic valve re-
placement with the self-expanding CoreValve
prosthesis, JACC Cardiovasc Interv 7:1014–
1021, 2014.
51. Kappetein AP, Head SJ, Genereux P, et al.
Updated standardized endpoint definitions
for transcatheter aortic valve implantation:
the Valve Academic Research Consortium-2
consensus document, J Am Coll Cardiol
60:1438–1454, 2012.
52. Clavel MA, Rodes-Cabau J, Dumont E, et al.
Validation and characterization of transcath-
eter aortic valve effective orifice area mea-
sured by Doppler echocardiography, JACC
Cardiovasc Imaging 4:1053–1062, 2011.
53. Clavel MA, Webb JG, Pibarot P, et al. Com-
parison of the hemodynamic performance of
percutaneous and surgical bioprostheses for
the treatment of severe aortic stenosis, J Am
Coll Cardiol 53:1883–1891, 2009.
54. Jilaihawi H, Chin D, Spyt T, et al. Prosthesis-
patient mismatch after transcatheter aortic
valve implantation with the Medtronic-Core-
valve bioprosthesis, Eur Heart J 31:857–864,
2010.
55. Pibarot P, Weissman NJ, Stewart WJ, et al:
Incidence and sequelae of prosthesis-patient
mismatch in transcatheter versus surgical
valve replacement in high-risk patients with
severe aortic stenosis: a PARTNER trial co-
hort—a analysis, J Am Coll Cardiol 64:1323–
1334, 2014.
56. Tamburino C, Capodanno D, Ramondo A, et
al. Incidence and predictors of early and late
mortality after transcatheter aortic valve im-
plantation in 663 patients with severe aortic
stenosis, Circulation 123:299–308, 2011.
57. Gilard M, Eltchaninoff H, Iung B, et al. Reg-
istry of transcatheter aortic-valve implanta-
tion in high-risk patients, N Engl J Med
366:1705–1715, 2012.
58. Sinning JM, Hammerstingl C, Vasa-Nicotera
M, et al. Aortic regurgitation index defines
severity of peri-prosthetic regurgitation and
predicts outcome in patients after transcath-
eter aortic valve implantation, J Am Coll Car-
diol 59:1134–1141, 2012.
59. Van Belle E, Juthier F, Susen S, et al. Postpro-
cedural aortic regurgitation in balloon-ex -
pandable and self-expandable transcatheter
aortic valve replacement procedures: analysis
of predictors and impact on long-term mor-
tality: insights from the FRANCE2 Registry,
Circulation 129:1415–1427, 2014.
60. Binder RK, Stortecky S, Heg D, et al. Proce-
dural results and clinical outcomes of trans-
catheter aortic valve implantation in Switzer-
land: an observational cohort study of Sapien
3 versus Sapien XT transcatheter heart valves,
Circ Cardiovasc Interv 8:e002653, 2015.
61. Kodali S, Pibarot P, Douglas PS, et al. Para-
valvular regurgitation after transcatheter aor-
tic valve replacement with the Edwards Sa-
pien valve in the PARTNER trial: character-
izing patients and impact on outcomes, Eur
Heart J 36:449–456, 2015.
62. Athappan G, Patvardhan E, Tuzcu EM, et al.
Incidence, predictors, and outcomes of aortic
regurgitation after transcatheter aortic valve
replacement: meta-analysis and systematic
review of literature, J Am Coll Cardiol
61:1585–1595, 2013.
63. Nombela-Franco L, Rodes-Cabau J, DeLaro-
chelliere R, et al. Predictive factors, efficacy,
and safety of balloon post-dilation after
transcatheter aortic valve implantation with a
balloon-expandable valve, JACC Cardiovasc
Interv 5:499–512, 2012.
64. Unbehaun A, Pasic M, Dreysse S, et al. Trans-
apical aortic valve implantation: incidence
and predictors of paravalvular leakage and
transvalvular regurgitation in a series of 358
patients, J Am Coll Cardiol 59:211–221, 2012.
65. Detaint D, Lepage L, Himbert D, et al. Deter-
minants of significant paravalvular regurgita-
tion after transcatheter aortic valve: implan-
tation impact of device and annulus discon-
gruence, JACC Cardiovasc Interv 2:821–827,
2009.
66. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the
severity of native valvular regurgitation with
two-dimensional and Doppler echocardiog-
raphy, J Am Soc Echocardiogr 16:777–802,
2003.
67. Messika-Zeitoun D, Detaint D, Leye M, et al.
Comparison of semiquantitative and quanti-
tative assessment of severity of aortic regur-
gitation: clinical implications, J Am Soc Echo-
cardiogr 24:1246–1252, 2011.
68. Pibarot P, Hahn RT, Weissman NJ, Monaghan
MJ. Assessment of paravalvular regurgitation
following TAVR: a proposal of unifying grad-
ing scheme, JACC Cardiovasc Imaging 8:340–
360, 2015.
69. Cawley PJ, Hamilton-Craig C, Owens DS, et
al. Prospective comparison of valve regurgita-
tion quantitation by cardiac magnetic reso-
nance imaging and transthoracic echocar-
diography, Circ Cardiovasc Imaging 6:48–57,
2014.
70. Ribeiro HB, Le Ven F, Larose E, et al. Cardiac
magnetic resonance versus transthoracic
echocardiography for the assessment and
quantification of aortic regurgitation in pa-
tients undergoing transcatheter aortic valve
implantation, Heart 100:1924–1932, 2014.
71. Egbe AC, Pislaru SV, Pellikka PA, et al. Bio-
prosthetic valve thrombosis versus structural
failure: clinical and echocardiographic pre-
dictors, J Am Coll Cardiol 66:2285–2294,
2015.
72. Latib A, Naganuma T, Abdel-Wahab M, et al.
Treatment and clinical outcomes of trans-
catheter heart valve thrombosis, Circ Cardio-
vasc Interv 8(4):e001779, 2015.
73. Makkar RR, Fontana G, Jilaihawi H, et al.
Possible subclinical leaflet thrombosis in bio-
prosthetic aortic valves, N Engl J Med
373:2015–2024, 2015.
74. Amat-Santos IJ, Messika-Zeitoun D,
Eltchaninoff H, et al. Infective endocarditis
after transcatheter aortic valve implantation:
results from a large multicenter registry, Cir-
culation 131:1566–1574, 2015.
75. Latib A, Naim C, De Bonis M, et al. TAVR-
associated prosthetic valve infective endocar-
ditis: results of a large, multicenter registry, J
Am Coll Cardiol 64:2176–2178, 2014.
76. Olsen NT, De Backer O, Thyregod HG, et al.
Prosthetic valve endocarditis after transcath-
eter aortic valve implantation, Circ Cardiovasc
Interv 8(4):e001939, 2015.
77. Kapadia SR, Leon MB, Makkar RR, et al.
5-year outcomes of transcatheter aortic valve
replacement compared with standard treat-
ment for patients with inoperable aortic ste-
nosis (PARTNER 1): a randomised controlled
trial, Lancet 385:2485–2491, 2015.
78. Mack MJ, Leon MB, Smith CR, et al. 5 -year
outcomes of transcatheter aortic valve re-
placement or surgical aortic valve replace-
ment for high surgical risk patients with aor-
tic stenosis (PARTNER 1): a randomised
controlled trial, Lancet 385:2477–2484, 2015.
79. Hahn RT, Little SH, Monaghan MJ, et al. Rec-
ommendations for comprehensive intrapro-
cedural echocardiographic imaging during
TAVR, JACC Cardiovasc Imaging 8:261–287,
2015.
80. Hahn RT, Kodali S, Tuzcu EM, et al. Echocar-
diographic imaging of procedural complica-
tions during balloon-expandable transcathe-
ter aortic valve replacement, JACC Cardiovasc
Imaging 8:288–318, 2015.
81. Latib A, Messika-Zeitoun D, Maisano F, et al.
Reversible Edwards Sapien XT dysfunction
due to prosthesis thrombosis presenting as
early structural deterioration, J Am Coll Car-
diol 61:787–789, 2012.
ch16.indd 380
03.04.2019 11:54:38
381
17 Аортальная регургитация
APTUR EVANGELISTA, MD, PHD • LAURA GALIAN GAY, MD
Этиология
Изменения створок
Изменения корня аорты
Степень аортальной регургитации
Цветовая допплерография
Импульсно-волновая допплерография
Непрерывно-волновая допплерография
Интеграция допплеровских параметров
для оценки степени регургитации
Альтернативные методы
Размеры и систолическая функция
левого желудочка
Размеры и сократительная способность
левого желудочка
Оценка сократительного резерва
Оценка изменений корня аорты
и восходящего отдела аорты
Функция аортального клапана и корня
аорты
Естественное течение и серийные
исследования при хронической
аортальной регургитации
Консервативное лечение
и определение оптимальных сроков
проведения операции
Лекарственная терапия
Показания к хирургическому лечению
Хирургическое лечение
Роль эхокардиографии
Осложнения после хирургического
вмешательства
Результаты хирургического лечения
и последующее наблюдение
Острая аортальная регургитация
Острое расслоение аорты типа А
Инфекционный эндокардит
Другие причины острой аортальной
регургитации
Заключение
Аортальная регургитация (АР) характеризуется ре-
троградным (обратным) потоком крови во время
диастолы из аорты в левый желудочек (ЛЖ). Кли-
нические проявления заболевания варьируют и за-
висят от целого ряда факторов, в т.ч . от остроты
процесса, соответствия диаметра аорты и разме-
ров ЛЖ, состояния гемодинамики и тяжести по-
ражений. Хроническая АР может в течение мно-
гих лет быть компенсированной, острая АР приво-
дит к быстрой декомпенсации и, если ее не лечить,
к летальному исходу. Допплерография — основной
метод диагностики и определения степени АР. Для
определения механизмов АР используют двухмер-
ную (2D) эхокардиографию (ЭхоКГ). Распростра-
ненность АР зависит от возраста пациента, диаме-
тра корня аорты и этнической группы. Распростра-
ненность хронической АР составляет от 5 до 10%.
В большинстве случаев это АР незначительной или
легкой степени, умеренная или тяжелая АР менее
распространена (0,5–2,7%) [1]. По данным исследо-
вания Euro Heart Survey on Valvular Disease, АР отме-
чалась у 13,3% пациентов с одиночным поражением
нативных клапанов левых отделов сердца [2]. Точ-
ное определение степени регургитации и ее влияния
на функцию ЛЖ имеет важное значение для консер-
вативного лечения и определения сроков хирурги-
ческого вмешательства. ЭхоКГ — наиболее исполь-
зуемый неинвазивный метод оценки АР. С помо-
щью ЭхоКГ оценивают не только этиологию, но и
дилатацию восходящего отдела аорты, степени ре-
гургитации и ее влияние на функцию желудочков.
Для этого используют методы количественной и ка-
чественной оценки. Рекомендуется комплексный
подход к оценке с учетом нескольких параметров.
ЭТИОЛОГИЯ
АР может возникать в результате ряда причин,
включая аномалии створок аортального клапана,
подклапанных структур, а также корня аорты и фи-
брозного кольца (табл. 17.1). Первичное пораже-
ние створок возможно в результате врожденных
или приобретенных причин. Ревматический порок
сердца остается наиболее распространенной причи-
ной АР в развивающихся странах. В развитых стра-
нах все более распространенными причинами АР
становятся двухстворчатый аортальный клапан (у
молодых пациентов) и заболевания восходящего
отдела аорты (у пожилых пациентов) [3, 4].
Эхокардиографическая оценка анатомии ство-
рок аортального клапана, фиброзного кольца и кор-
ня аорты важна не только для определения причи-
ны, но и для прогноза и лечения АР.
Для измерения выходного тракта ЛЖ, фиброз-
ного кольца аортального клапана и синусов аорты
принято использовать парастернальную позицию
ch17.indd 381
03.04.2019 11:54:51
382
ЧАСТЬ IV Пороки клапанов сердца
Аномалии створок
аортального клапана
Описание/признаки
Заболевания корня
аорты
Описание/признаки
Двухстворчатый
аортальный клапан
и другие врожденные
аномалии
Во время систолы видны две створки
с двумя комиссурами и отверстие
эллиптической формы. Наиболее
типично сращение комиссур справа
налево (70%)
Идиопатическая
дилатация корня
аорты
Дилатация на уровне синусов Валь-
сальвы
Склероз аортального
клапана
Кальцификация центральной части
створки
Аортоаннулярная
эктазия
Дилатация фиброзного кольца
и корня аорты
Ревматическая болезнь
сердца
Сращение комиссур, утолщение и ре-
тракция створок. Кальцификация на
поздних стадиях
Синдром Марфана Дилатация аорты (главным образом
корня). В восходящем отделе аорте
обычно происходит ее расслоение
Миксоматозное
поражение клапанов
Утолщение и избыточность ткани
створок. Пролапс в выходной тракт
во время диастолы
Синдром Элерса–
Данло
Крайне высокая хрупкость сосудов,
что может приводить к дилатации
аорты, ее разрыву или расслоению
Инфекционный
эндокардит
Вегетации могут мешать закрытию кла-
пана во время диастолы. Возможна
перфорация створок
Несовершенный
остеогенез
Дилатация корня аорты. Расслоение
аорты происходит редко
Системные воспали-
тельные заболевания
Утолщение створок или образование
узелков/вегетаций на свободном крае
створки
Расслоение аорты
Расширение или разрыв фиброзного
кольца аортального клапана, асим-
метричное смещение уровня коап-
тации или пролапс интимы через
аортальный клапан
Антифосфолипидный
синдром
Утолщение створок и образование
узелков/вегетаций
Сифилитический
аортит
Дилатация или аневризма восходя-
щего отдела аорты
Анорексигенные
препараты
Утолщение и ретракция створок
Субаортальный стеноз Вторичные изменения, обусловленные
ударом высокоскоростной систоличе-
ской струи в створку
Фенестрация
Мальформация в раннем эмбриональ-
ном периоде. Локализация на свобод-
ном крае створки или возле комиссур
ТАБЛИЦА 17.1 Этиология хронической аортальной регургитации
по длинной оси. В этой позиции, равно как и в па-
растернальной позиции по короткой оси, можно
измерить толщину створок и определить их мор-
фологию при оптимальном акустическом доступе
[5]. В некоторых исследованиях с помощью транс-
торакальной эхокардиографии (ТТЭхоКГ) не смог-
ли выявить причин АР в 20% случаях. В таких слу-
чаях для оценки механизма АР и измерения корня
аорты следует провести чреспищеводную эхокарди-
ографию (ЧПЭхоКГ).
ИЗМЕНЕНИЯ СТВОРОК
Существует несколько заболеваний, которые при-
водят к АР из-за изменения створок:
1. Врожденные пороки, включая одностворчатый,
двухстворчатый и четырехстворчатый аорталь-
ный клапан. При врожденных пороках чрезмер-
ное давление на створки изменяет структуру кла-
пана и приводит к АР (в основном из-за пролапса
или фиброза створок с ретракцией комиссураль-
ных краев). У детей и подростков чаще наблюда-
ется изолированная АР, у взрослых АР может со-
четаться с прогрессирующим аортальным стено-
зом, вызванным фиброзом и кальцификацией. В
позиции по длинной оси отмечается асимметрия
расположения зоны коаптации створок и их вы-
бухание во время систолы или пролапс во вре-
мя диастолы. Изображение в позиции по корот-
кой оси более специфично. Диагноз «двухствор-
чатый аортальный клапан» подтверждают, если
во время систолы визуализируются две створ-
ки с двумя комиссурами, формирующими от-
верстие эллиптической формы (рис. 17 .1) [6, 7].
Изображение во время диастолы может имити-
ровать трехстворчатый аортальный клапан, ког-
да выявляется линия сращения. Трехмерная (3D)
ЭхоКГ позволяет лучше выявлять морфологиче-
ские детали двухстворчатого аортального клапа-
на (ДАК) [8]. Наиболее часто (> 70%) срастают-
ся правая и левая коронарные створки. Положе-
ние двухстворчатого аортального клапана может
ch17.indd 382
03.04.2019 11:54:51
383
17 Аортальная регургитация
быть связано с локализацией дилатации аорты,
возникшей из-за неправильного направления
струи, и турбулентным систолическим потоком
в восходящем отделе аорте [9, 10]. Было выска-
зано предположение, что ДАК типа 1 (сращение
правой и левой коронарных створок) ассоцииру-
ется с большим диаметром синуса, чем ДАК типа
2 (сращение правой коронарной створки и неко-
ронарной створки) и ДАК типа 3 (сращение ле-
вой коронарной створки и некоронарной створ-
ки). Для ДАК типа 2 обычно характерны тур-
булентный поток в восходящем отделе аорты и
расширение дуги аорты (см. рис. 17 .1) [6]. Око-
ло 50% пациентов моложе 30 лет имеют расши-
рение аорты. В данной популяции риск развития
аневризмы (> 45 мм) в течение 25 лет составля-
ет 26% [11]. Причиной вторичной АР могут быть
такие врожденные пороки, как дефект межжелу-
дочковой перегородки или подклапанный аор-
тальный стеноз.
2. Склероз аортального клапана приводит к АР из-
за кальцификации центральной части створок
(чаще наблюдается у пожилых людей).
3. Ревматическое заболевание характеризуется сра-
щением комиссур, утолщением и ретракцией
створок аортального клапана, что обычно при-
водит к формированию центральной струи ре-
гургитации.
4. Эндокардит может приводить к острой АР или
перфорации створок (см. главу 22), или к нару-
шению их коаптации во время диастолы при на-
личии вегетаций [12].
5. Миксоматозная дегенерация приводит к пораже-
нию как аортального, так и митрального клапа-
нов. Створки имеют избыточную ткань, утолща-
ются и удлиняются, возможно провисание в вы-
ходной тракт левого желудочка (ВТЛЖ) во время
диастолы (рис. 17 .2) [13].
6. Фенестрация аортального клапана — это порок
развития, формирующийся в эмбриональном пе-
риоде. В основном фенестрация наблюдается на
краях створки и возле комиссур. В большинстве
случаев фенестрация не имеет функционального
значения, хотя могут изменяться в процессе ста-
рения организма. Крупные фенестрации могут
приводить к хронической регургитации, а отрыв
сухожильных хорд при фенестрации может стать
причиной крайне тяжелой регургитации [14, 15].
Иногда фенестрацию удается визуализировать в
2D-режиме с высоким разрешением, но целесоо-
бразнее их распознавать с помощью ЧПЭхоКГ.
7. Менее распространенными причинами утолще-
ния створок являются прием препаратов или об-
лучение, небактериальный тромбэндокардит,
системная красная волчанка и другие воспали-
тельные заболевания. Иногда вторичные нару-
шения происходят при транскатетерном проте-
зировании аортального клапана [16].
ИЗМЕНЕНИЯ КОРНЯ АОРТЫ
АР может быть также обусловлена изменением гео-
метрии структур, поддерживающих створки клапа-
на. Такие изменения в развитых странах наиболее
распространены у больных после хирургического
лечения изолированной АР [4].
Фиброзное кольцо аортального клапана пред-
ставляет собой геометрически сложную анатомиче-
скую структуру в виде короны. Створки аортально-
го клапана крепятся к фиброзному кольцу в обла-
сти трех комиссур и в трех нижних точках в средней
части створки. Расширение у основания корня аор-
ты приводит к появлению АР вследствие наруше-
ния коаптации удлиненных створок [17].
Дилатация корня аорты может быть вызвана раз-
личными причинами, включая синдром Марфана,
НКС
ЛКС
ПП
ПП
ЛП
ЛП
ПКС–ЛКС
ПКС–НКС
ПЖ
ПЖ
А
Б
Рис. 17 .1 Двухстворчатый аортальный клапан в парастернальной позиции по короткой оси. (А) A Сращение правой и левой коронарных створок (пе-
реднезадний тип двухстворчатого аортального клапана). (Б) A Сращение правой коронарной и некоронарной створок (праволевый тип двухстворчатого аорталь-
ного клапана). Стрелки указывают на линию сращения створок. ЛКС — левая коронарная створка; ЛП — левое предсердие; НКС — некоронарная створка; ПЖ —
правый желудочек; ПКС — правая коронарная створка; ПП — правое предсердие.
ch17.indd 383
03.04.2019 11:54:51
384
ЧАСТЬ IV Пороки клапанов сердца
аортоаннулярную эктазию (рис. 17 .3), синдром Элер-
са–Данло, несовершенный остеогенез, атеросклеро-
тическую аневризму, хроническую гипертензию,
расслоение аорты (рис. 17 .4), сифилитический аор-
тит и различные системные воспалительные забо-
левания (см. главы 34, 38).
В некоторых исследованиях c использованием
многофакторного анализа было показано, что арте-
риальная гипертензия не является предиктором АР.
Это подтверждает результаты более ранних иссле-
дований, показавших, что артериальная гипертен-
зия ассоциируется с умеренным увеличением диа-
метра корня аорты [18] без АР, когда возраст вклю-
чен в исследование как фактор риска. Roberts и
соавт. [4] проанализировали причины изолирован-
ной АР у 268 пациентов после протезирования аор-
тального клапана и показали, что с помощью ЭхоКГ,
ангиографии и гистологического исследования при-
чину патологии не удалось установить в более чем
30% случаев. Пациенты с неясной этиологией АР
были старше других по возрасту. У 91% была диа-
гностирована гипертензия, у 29% — выявлены не-
большие отложения кальция в створке аортального
клапана.
СТЕПЕНЬ АОРТАЛЬНОЙ РЕГУРГИТАЦИИ
ЦВЕТОВАЯ ДОППЛЕРОГРАФИЯ
Цветовая допплерография — основной метод ди-
агностики и количественной оценки степени АР в
клинической практике [19, 20]. Струя регургитации
состоит из трех компонентов: проксимальной зо-
ны, vena contracta (перешейка струи регургитации)
и дистальной зоны [20]. Площадь потока регургита-
ции слабо коррелирует со степенью АР (в основном
при острой и подострой АР), на которую частично
влияют градиент диастолического давления «аорта–
ЛЖ» и эластичность ЛЖ [21, 22]. Несмотря на эти
ограничения, легкую и умеренную хроническую
АР можно различить, если использовать одни и те
же настройки. Поток полностью визуализируется в
различных апикальных позициях (рис. 17.5) [23]. В
нашей практике [23] при хронической АР площадь
потока регургитации < 4 см2 или > 7 см2 была ха-
рактерна для легкой и умеренной регургитации со-
ответственно. Однако из-за вариабельности пара-
метров оборудования [23, 24] определять площадь
потока регургитации не рекомендуется. Этот метод
ЛЖ
ЛП
Ao
ПЖ
Рис. 17 .2 A Пролапс правой коронарной створки (стрелка) аорталь-
ного клапана при миксоматозной дегенерации. Обратите внимание, что
левый желудочек (ЛЖ) значительно расширен (КДР 68 мм) вследствие тяже-
лой хронической аортальной регургитации. Ао — аорта; ЛП — левое предсер-
дие; ПЖ — правый желудочек.
ЛЖ
Ao
Рис. 17 .3 A Аортоаннулярная эктазия. Парастернальная позиция по длин-
ной оси. Расширено и фиброзное кольцо аортального клапана (28 мм, красная
стрелка), и аорта (Ао) (49 мм, голубая стрелка). ЛЖ — левый желудочек.
ЛЖ
Ao
Рис. 17.4 A Острая вторичная аортальная регургитация при расслое-
нии аорты типа A. Парастернальная позиция по длинной оси. Стрелками ука-
зано отслоение интимы корня аорты, ЛЖ — левый желудочек.
ch17.indd 384
03.04.2019 11:54:52
385
17 Аортальная регургитация
следует использовать лишь при визуальной оцен-
ке АР. Если обнаружена не только небольшая цен-
тральная струя АР, необходимо использовать мето-
ды полуколичественной оценки.
МЕТОДЫ ПОЛУКОЛИЧЕСТВЕННОЙ ОЦЕНКИ
СТЕПЕНИ АОРТАЛЬНОЙ РЕГУРГИТАЦИИ
Оценка по ширине vena contracta. Измерение этого
параметра является одним из наилучших методов
оценки степени АР [19, 20]. Vena contracta — это са-
мое узкое место струи регургитации на уровне аор-
тального клапана, сразу за областью конвергенции
потока. Таким образом, ширина vena contracta мень-
ше ширины струи регургитации в ВТЛЖ. Ширину
vena contracta измеряют в парастернальной позиции
по длинной оси ЛЖ (рис. 17 .6) и оценивают эффек-
тивную площадь отверстия регургитации (EROA).
Чтобы оптимизировать измерения, рекомендуется
использовать режимы «Узкий сектор» и «Масшта-
бирование». При пределе Найквиста от 50 до 60 см/
сек ширина vena contracta < 3 мм соответствует лег-
кой АР, а ширина > 6 мм указывает на умеренную
АР [25, 26]. Поскольку vena contracta часто прикры-
та створками, точно измерить ее в некоторых ситу-
ациях трудно, особенно в случае кальцификации
клапана. Метод оценки АР по ширине vena contracta
имеет ограничения при отверстии регургитации эл-
липтической или неправильной формы. Было пред-
ложено оценивать умеренную и тяжелую АР с помо-
щью 3D-ЭхоКГ по площади vena contracta (< 20 см2
и > 60 см2 соответственно) [27].
Оценка по отношению ширины проксимальной
зоны струи регургитации к диаметру ВТЛЖ. Ши-
рину проксимальной зоны измеряют в парастер-
нальной позиции по длинной оси ниже отверстия
аортального клапана (в месте соединения ВТЛЖ и
фиброзного кольца аортального клапана). Отно-
шение < 25% соответствует легкой АР, отношение
> 65% — тяжелой АР [28]. Однако абсолютный по-
казатель ширины проксимальной зоны имеет ана-
логичные точность и воспроизводимость, что и это
отношение, поэтому может быть достаточно изме-
рить только ширину проксимальной зоны, что про-
ще при регулярном наблюдении пациента. Ширина
проксимальной зоны струи регургитации > 10 мм
является показателем тяжелой АР (рис. 17 .7), а ши-
рина < 7 мм — легкой АР [23]. Этот метод име-
ет некоторые ограничения. Ширину проксималь-
ной зоны струи регургитации следует измерять
перпендикулярно направлению струи. Однако экс-
центрические потоки регургитации, направленные
преимущественно к передней створке митрально-
Б
ЛП
ЛП
ПЖ
ЛЖ
ЛЖ
А
Б
Рис. 17 .5 Аортальная регургитация при цветовой допплерографии. (А) A Эксцентрическая струя аортальной регургитации, направленная в сторону ми-
трального клапана, лучше визуализируется в апикальной трехкамерной позиции. (Б) A Очень эксцентрическая струя аортальной регургитации, которая в апи-
кальной пятикамерной позиции визуализируется параллельно межжелудочковой перегородке. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый
желудочек.
ЛЖ
Ао
Рис. 17 .6 Измерение ширины vena contracta аортальной регургитации.
Парастернальная позиция по длинной оси. Vena contracta (стрелки) — это са-
мый узкий участок струи регургитации (в этом случае 7 мм), располагающий-
ся сразу за отверстием аортального клапана. Ао — аорта; ЛЖ — левый же-
лудочек.
ch17.indd 385
03.04.2019 11:54:52
386 ЧАСТЬ IV Пороки клапанов сердца
ЛЖ
Ао
А
Б
Рис. 17.7 Ширина проксимальной зоны струи регургитации и ее отношение к диаметру выходного тракта левого желудочка при выраженной
аортальной регургитации. (А) A Цветовая допплерография в парастернальной позиции по длинной оси. Аортальная регургитация занимает > 65% диаметра
выходного тракта левого желудочка. (Б) Цветовая допплерография в М-режиме. Аортальная регургитация во время диастолы. Ао — аорта; ЛЖ — левый желу-
дочек.
ЛЖ
Ао
А
Б
Рис. 17.8 Тяжелая вторичная аортальная регургитация при двухстворчатом аортальном клапане. (А) Vena contracta (стрелки) эксцентрической струи
регургитации, направленной в сторону митрального клапана, равна 5 мм. (Б) В позиции по короткой оси определяется отверстие регургитации эллиптической фор-
мы (стрелки), позволяющее предположить бо
́
льшую степень аортальной регургитации. Ао — аорта; ЛЖ — левый желудочек.
го клапана или межжелудочковой перегородке, как
правило, занимают небольшую часть проксималь-
ного отдела выходного тракта, поэтому могут ка-
заться узкими, что приведет к недооценке степени
регургитации [23]. С другой стороны, центральный
поток регургитации имеет тенденцию к увеличе-
нию в выходном тракте (эффект распыления), что
может приводить к переоценке степени регургита-
ции.
Оценка по отношению площади поперечного се-
чения струи регургитации к площади ВТЛЖ. Отно-
шение < 25% соответствует легкой АР, а отношение
> 65% — тяжелой АР [19, 20]. По нашим данным,
площадь поперечного сечения потока регургита-
ции > 1 см2 свидетельствует о тяжелой АР (рис. 17 .8)
[23]. Измерение в парастернальной позиции по ко-
роткой оси имеет ограничения: даже небольшие по-
грешности в определении площади ВТЛЖ приво-
дят к значительным различиям в оценке площа-
ди струи, особенно при наличии эксцентрических,
диффузных потоков или потоков, берущих начало
вдоль линии коаптации створок. Кроме того, при
использовании этой позиции качество изображе-
ния является субоптимальным более чем в 20% слу-
чаев.
МЕТОДЫ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ
Метод PISA (метод определения площади прокси-
мальной зоны струи регургитации), или метод кон-
вергенции потока, не так широко используют при
АР по сравнению с митральной регургитацией. Ме-
тод PISA менее чувствителен к условиям нагрузки
[29–31], однако технически более сложный. Область
PISA идеально визуализируется в апикальной или
ch17.indd 386
03.04.2019 11:54:53
387
17 Аортальная регургитация
VAP
Valiasing
r=0,9см
VTIAP
r=0,9см
Valiasing = 32 см/сек
VAP = 464 см/сек
VTIAP = 203,5 см
EROA = 6,28 × r2 × Valiasing/VAP
EROA = 6,28 × (0,9 см)2 × 32 см/сек/464 см/сек = 0,35 см2
Rvol = EROA × VTIAP
Rvol=0,35см2×203,5см=71см3
Рис. 17 .9 A Метод PISA. Количественная оценка степени аортальной регургитации (АР) методом PISA свидетельствует о тяжелой АР: эффективная площадь
отверстия регургитации (EROA) ≥ 0,3 см2, объем регургитации (Rvol) ≥ 60 мл/уд). Для получения полусферической области PISA предел Найквиста (Valiasing) сме-
щен в сторону струи АР. r — радиус потока регургитации; VАР — максимальная скорость аортальной регургитации; VTI — интеграл скорости кровотока.
правой парастернальной позиции (рис. 17 .9). Инте-
ресующая область может быть увеличена с помо-
щью режима «Масштабирование». Сектор сканиро-
вания необходимо сделать как можно более узким,
чтобы максимально увеличить частоту кадров. За-
тем предел Найквиста смещают в направлении по-
тока АР для оптимизации измерения радиуса обла-
сти PISA. Для вычисления площади нужна отчетли-
вая визуализация полусферической области PISA.
Максимальный поток вычисляют по формуле:
2πr2, умноженное на минимальную скорость, при
которой происходит искажение допплеровского
спектра (Valiasing) (предел Найквиста).
EROA вычисляют путем деления максимального
потока АР на максимальную мгновенную скорость
АР (VАР), полученную с помощью непрерывно-вол-
новой допплерографии:
EROA = 6,28 × r2 × Valiasing/Максимальная VАР.
Объем регургитации равен произведению EROA на
интеграл скорости кровотока (VTI) потока АР. При
использовании этого метода возможно суммирова-
ние погрешностей каждой переменной уравнения,
поэтому его не рекомендуют использовать рутин-
но исследователям с небольшим опытом. Степень
АР классифицируют следующим образом: EROA
< 10 мм2 или объем АР < 30 мл/уд — легкая АР;
EROA>30мм2илиобъемАР>60мл—тяжелая
АР [31]. Если изображение получают из апикально-
го доступа, метод PISA значительно недооценивает
степень АР при наличии отверстия эллиптической
формы [32] или эксцентрических потоков АР [30,
33]. В этой ситуации визуализация области PISA в
парастернальный позиции по длинной оси повы-
шает точность метода [19, 20].
ИМПУЛЬСНО-ВОЛНОВАЯ ДОППЛЕРОГРАФИЯ
Диастолический ретроградный поток в грудной ча-
сти нисходящего отдела аорты. Простым методом
определения значимой АР является импульсно-вол-
новая допплерография в супрастернальной пози-
ции на уровне перешейка аорты. Контрольный объ-
ем должен быть помещен немного дистальнее места
отхождения подключичной артерии. Ультразвуко-
вой луч следует направить, насколько это возмож-
но, вдоль длинной оси аорты. Ретроградный поток
должен определяться на протяжении большей части
диастолы. Короткий ретроградный поток в раннюю
диастолу в восходящем и нисходящем отделах аор-
ты может быть связан с эластичностью аорты.
Для оценки степени регургитации также важно
оценить продолжительность и скорость ретроград-
ного потока [34]. Скорость потока в конце диасто-
лы, превышающая 20 см/сек, является показателем
тяжелой АР.
По нашим данным, голодиастолический ретро-
градный поток с VTI диастолического потока > 15 см
или с аналогичным значением VTI систолического
антеградного потока является надежным качествен-
ным признаком тяжелой АР (рис. 17.10). Однако на
эти измерения оказывают влияние частота сердеч-
ных сокращений, длительность фазы диастолы и
растяжимость аорты.
Диастолический ретроградный поток в брюш-
ной части нисходящего отдела аорты. Выраженный
голодиастолический ретроградный поток в брюш-
ной части нисходящего отдела аорты является край-
не специфическим признаком тяжелой АР [19–21].
Оценка этого потока рекомендуется, если она воз-
можна (рис. 17 .11).
ch17.indd 387
03.04.2019 11:54:54
388 ЧАСТЬ IV Пороки клапанов сердца
Рис. 17 .10 Голодиастолический ретроградный поток в грудной части
нисходящего отдела аорты при тяжелой аортальной регургитации.
Конечно-диастолическая скорость составляет 35 см/сек.
А
Б
Рис. 17 .11 Поток в брюшной части нисходящего отдела аорты. (А) Короткий диастолический поток при умеренной аортальной регургитации. (Б) Панди-
астолический ретроградный поток при тяжелой аортальной регургитации.
А
Б
Рис. 17 .12 Аортальная регургитация при непрерывно-волновой доп-
плерографии с различной скоростью замедления потока во время
диастолы. (А) Умеренная аортальная регургитация. (Б) Острая тяжелая аор-
тальная регургитация. Время полуспада давления значительно меньше по
сравнению с (А).
НЕПРЕРЫВНО-ВОЛНОВАЯ ДОППЛЕРОГРАФИЯ
Непрерывно-волновая допплерография потока АР
позволяет косвенно оценить степень АР. Чем интен-
сивнее спектрограмма АР по сравнению со спектро-
граммой систолического антеградного потока, тем
большее количество эритроцитов отражает ультра-
звуковые сигналы и тем больше объем АР.
ВРЕМЯ ЗАМЕДЛЕНИЯ ПОТОКА РЕГУРГИТАЦИИ
Замедление потока регургитации отражает разницу
давлений в аорте и в ЛЖ во время диастолы. Обыч-
но замедление потока лучше всего регистрирует-
ся в апикальной четырехкамерной позиции (рис.
17.12). Однако при умеренной АР и наличии экс-
центрического потока регургитации трудно полу-
чить адекватную спектрограмму. При этом неред-
ко отмечается совмещение диапазонов умеренной
и тяжелой регургитации [23]. Скорость потока ре-
гургитации и время полуспада давления (РНТ) от-
ражают степень регургитации и конечно-диастоли-
ческое давление в ЛЖ. При увеличении степени АР
происходит снижение диастолического давления в
аорте и увеличение конечно-диастолического дав-
ления в ЛЖ. В результате скорость потока регурги-
тации в конце диастолы снижается, а РНТ умень-
шается. РНТ < 200 мсек соответствует тяжелой АР,
РНТ > 500 мсек свидетельствует о легкой АР [35, 36].
Однако на эти параметры влияют растяжимость же-
лудочка, давление в ЛЖ, общее периферическое со-
судистое сопротивление и эластичность аорты [37,
38]. Использование РНТ наиболее эффективно при
острой АР, т.е . до изменений полости ЛЖ из-за по-
стоянной перегрузки объемом [21].
ИНТЕГРАЦИЯ ДОППЛЕРОВСКИХ ПАРАМЕТРОВ
ДЛЯ ОЦЕНКИ СТЕПЕНИ РЕГУРГИТАЦИИ
Лучший способ оценить степень АР — интегриро-
вать результаты нескольких допплеровских мето-
дов [39, 40]. Предложен алгоритм оценки степени
АР (рис. 17 .13). Степень АР легко определить, сопо-
ставив показатели различных методов, в частности
ch17.indd 388
03.04.2019 11:54:54
389
17 Аортальная регургитация
АР при цветовой
допплерографии
Vena contracta
Брюшная часть
нисходящего отдела аорты
Тяжелая
АР
Легкая
АР
Импульсно-
волновая
допплерография,
Rvol и ROA
АР > легкой
Голодиастолический
ретроградный поток
Неинформативно
<0,3см
>0,6см
Центральная струя
Ширина струи < 25% ВТЛЖ
Невыраженная АР
при непрерывно-волновой
допплерографии
Непрерывно-
волновая
допплерография,
PHT
Рис. 17.13 Алгоритм оценки степени аортальной регургитации при эхокардиографии. АР — аортальная регургитация; PHT — время полуспада давле-
ния; ROA — площадь отверстия регургитации; Rvol — объем регургитации; ВТЛЖ — выходной тракт левого желудочка [Otto CM: Textbook of Clinical
EchocАРdiography, ed 4. Philadelphia, 2009, Elsevier].
ширину vena contracta и голодиастолический ретро-
градный поток в проксимальном участке и брюш-
ной части нисходящего отдела аорты [23]. Когда
показатели при различных методах противоречат
друг другу, необходимо искать технические и фи-
зиологические причины этого и полагаться на дан-
ные, которые имеют лучшее качество. Количествен-
ные параметры позволяют классифицировать уме-
ренную регургитацию в одну из двух подгрупп (от
легкой до умеренной и от умеренной до тяжелой) и
преодолеть некоторые ограничения методов полу-
количественной оценки [31]. Методы количествен-
ной оценки технически более сложные, исследова-
тель должен иметь адекватный опыт. Кроме этого,
если качество изображения неидеально, возможно
суммирование погрешностей каждой переменной
[19, 20].
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ
ЧПЭхоКГ. Этот метод визуализации используют
для количественной оценки АР у пациентов с пло-
хой акустической доступностью (рис. 17 .14). Ви-
зуализация vena contracta в позиции по длинной
оси (130°) при ЧПЭхоКГ и цветовом допплеров-
ском картировании кровотока позволяет точно оце-
нить степень АР [41]. При отсутствии значительной
кальцификации аортального клапана ЧПЭхоКГ с
цветовым допплеровским картированием кровото-
ка позволяют выполнить планиметрию потока ре-
гуритации [42, 43]. Для тяжелой АР характерны ши-
рина vena contracta > 6 мм и площадь > 7,5 мм2 со-
ответственно. Диастолический ретроградный поток
в нескольких местах нисходящего отдела аорты, об-
наруженный с помощью бипланарной ЧПЭхоКГ,
может подтвердить тяжелую АР [43].
3D-ЭхоКГ. Исследования показали возможности и
точность 3D-ТТЭхоКГ при количественной оценке
АР (рис. 17 .15). Измерение vena contracta проводят
Рис. 17 .14 A Пролапс створки аортального клапана. При ЧПЭхоКГ ви-
ден пролапс створки аортального клапана (А), приводящий к тяжелой аорталь-
ной регургитации (Б). Vena contracta (стрелки) имеет ширину 7 мм. Ао — аор-
та; ЛЖ — левый желудочек; ПЖ — правый желудочек.
ЛЖ
ЛП
Ao
А
Б
последовательно. Сначала с помощью 3D-ТТЭхоКГ
получают хорошего качества изображение струи АР
из парастернального доступа в позиции по длин-
ной оси (или из апикального доступа в переднезад-
ней плоскости, если изображение из парастерналь-
ного доступа имеет низкое качество). Изображение
аорты при 3D-ТТЭхоКГ с цветовой допплерогра-
фией получают на уровне vena contracta чуть ниже
створок аортального клапана в плоскости, распо-
ложенной строго перпендикулярно потоку АР [28,
33]. Затем определяют максимальную площадь ve-
na contracta по короткой оси во время систолы. Что-
бы точно определить мгновенный объем регурги-
тации, площадь vena contracta следует умножить на
VTI [33].
ch17.indd 389
03.04.2019 11:54:55
390 ЧАСТЬ IV Пороки клапанов сердца
Магнитно-резонансное исследование. Текущие ре-
комендации допускают использование магнитно-
резонансной томографии (MРТ) сердца для неинва-
зивной оценки АР (рис. 17 .16), когда диагностика с
помощью ЭхоКГ затруднена. Объем регургитации
можно рассчитать как разницу объемов антеград-
ного и ретроградного потоков в восходящем отделе
аорты с помощью фазово-контрастного картирова-
ния [44]. Фракция регургитация 33% и более явля-
ется предиктором благоприятного исхода хирур-
гического вмешательства после трех лет наблюде-
ния [45]. Хорошая воспроизводимость данных МРТ
при количественной оценке объема регургитации
и фракции регургитации указывает на потенциал
этого метода для последующего наблюдения паци-
ента и мониторинга реакции организма пациента на
терапию [46]. Как и ЭхоКГ, МРТ позволяет оценить
голодиастолический ретроградный поток в нисхо-
дящем отделе аорты.
800
700
600
500
400
300
200
100
0
–10 0
Время (мсек)
П
о
т
о
к
(
м
л
/
с
е
к
)
0
250
500 750
1000
А
Б
Г
В
Рис. 17 .16 Магнитно-резонансная томография сердца пациента с аортальной регургитацией. (А) A Изображение сбалансированной свободной пре-
цессии. В осевой косой проекции приточного и отточного отделов ЛЖ выявляется аортальная регургитация второй степени. (Б) Осевая косая проекция корня аор-
ты немного выше аортального клапана на уровне измененной коронарной артерии (раскрытие устья) (стрелки). (В) Фазово-контрастное картирование скорости
кровотока. Центральный поток аортальной регургитации имеет белый цвет (стрелки). (Г) Зависимость потока в восходящем отделе аорты от времени. Антеград-
ный поток —121 мл/уд, ретроградный поток — 43 мл/уд, фракция регургитации — 36%.
Рис. 17 .15 A 3D-ТТЭхоКГ при аортальной регургитации. Во время диа-
столы визуализируется отверстие регургитации (стрелки).
ch17.indd 390
03.04.2019 11:54:55
391
17 Аортальная регургитация
РАЗМЕРЫ И СИСТОЛИЧЕСКАЯ ФУНКЦИЯ
ЛЕВОГО ЖЕЛУДОЧКА
РАЗМЕРЫ И СОКРАТИТЕЛЬНАЯ СПОСОБНОСТЬ
ЛЕВОГО ЖЕЛУДОЧКА
ЭхоКГ — диагностический метод, который наибо-
лее широко используют для оценки размеров ЛЖ,
его объемов и фракции выброса (ФВ) (см. главу 7).
В парастернальной позиции по длинной оси опре-
деляют конечно-диастолический и конечно-систо-
лический размеры ЛЖ. Для оптимизации направ-
ления ультразвукового луча используют 2D- или
3D-режим. Наиболее точные измерения с более вы-
сокой воспроизводимостью по-прежнему прово-
дят в M-режиме, когда более четкая идентифика-
ция границ эндокарда [47] и отличное временно
́
е
разрешение. Однако иногда даже под контролем
2D-ЭхоКГ невозможно направить ультразвуковой
луч перпендикулярно длинной оси ЛЖ, что обяза-
тельно для получения истинных размеров ЛЖ по
короткой оси.
Размер полости и толщину стенки ЛЖ также
можно оценить в парастернальной позиции по ко-
роткой оси на уровне сухожильных хорд митраль-
ного клапана, проведя прямые измерения, или в
M-режиме при условии, что курсор M-режима рас-
положен перпендикулярно межжелудочковой пере-
городке и задней стенки ЛЖ. Конечно-диастоличе-
ский и конечно-систолический объемы ЛЖ получа-
ют из апикального доступа, используя бипланарный
метод Симпсона. Если качество изображения хуже
оптимального, для улучшения четкости изображе-
ния эндокардиальной поверхности можно выпол-
нить контрастирование левых отделов сердца. Важ-
но отметить, что 2D-ЭхоКГ имеет ограничения, т.к.
в апикальных позициях возможно укорочение ис-
тинной длины ЛЖ. При серийных исследованиях
просмотр предыдущих изображений позволяет ми-
нимизировать вариабельность параметров, связан-
ную с изменениями плоскости, места измерения и
укорочения длины ЛЖ в апикальной позиции. Не-
значительные изменения параметров клинически
незначимы. Решение об операции принимают на
основе последовательных и согласующихся измене-
ний при серийных исследованиях [21]. Если пока-
затели приближаются к значениям, которые явля-
ются показанием к хирургическому вмешательству,
целесообразно провести повторные исследования
в течение более короткого интервала времени или
подтвердить альтернативными методами.
ФВЛЖ относится к основным параметрам сокра-
тительной функции ЛЖ. При пороговых значени-
ях ФВЛЖ могут быть полезны параметры тканевой
допплерографии, например скорость деформации
миокарда, но они еще недостаточно изучены. Два
исследования показали, что максимальная скорость
смещения фиброзного кольца митрального клапана
во время систолы < 9 см/сек является предиктором
развития осложнений, связанных с сократитель-
ным резервом ЛЖ [48, 49]. Последние исследования
свидетельствуют о том, что визуализация деформа-
ции в 2D-режиме может быть полезна не только для
оценки субклинической дисфункции миокарда [50]
с сохранной ФВ [51], но и для оценки прогноза си-
столической дисфункции ЛЖ после операции [50].
В недавней публикации было указано, что у па-
циентов с аортальной регургитацией ЛЖ в покое,
напряжение ПЖ и систолическое смещение фи-
брозного кольца трикуспидального клапана при на-
грузке независимо связаны с необходимостью ран-
него хирургического вмешательства [52].
В случаях неоптимальной ЭхоКГ или получении
неопределенных результатов показано проведение
МРТ. МРТ является «золотым стандартом» для ко-
личественной оценки ФВ. В случаях несоответствия
между тяжестью АР и функцией ЛЖ для диагности-
ки ишемической болезни сердца и дилатационной
кардиомиопатии могут быть эффективны другие
методы исследования, например компьютерная то-
мография (КТ) или МРТ [53, 54].
ОЦЕНКА СОКРАТИТЕЛЬНОГО РЕЗЕРВА
Стресс-ЭхоКГ с физической нагрузкой может быть
показана при неопределенной связи между симпто-
мами и систолической функцией ЛЖ. В этой под-
группе пациентов стресс-тест с физической нагруз-
кой очень эффективен в выявлении симптомов или
определении функционального состояния ЛЖ [54].
Оценка сократительного резерва показана паци-
ентам с тяжелой АР и сомнительными симптома-
ми или пороговыми показателями ФВЛЖ (от 50 до
55%) либо конечно-диастолического размера (око-
ло 50 мм или 25 мм/м2). Отсутствие сократитель-
ного резерва является прогностическим фактором
функции ЛЖ после операции [55]. Основным огра-
ничением метода является вариабельность параме-
тров ФВ при стресс-ЭхоКГ с физической нагрузкой.
ОЦЕНКА ИЗМЕНЕНИЙ КОРНЯ АОРТЫ
И ВОСХОДЯЩЕГО ОТДЕЛА АОРТЫ
Диагностика патологии корня аорты и дилатации
восходящего отдела аорты является важной ча-
стью обследования пациентов с АР. ЭхоКГ позволя-
ет точно оценить диаметр корня аорты и вести по-
следующее динамическое наблюдение. Пациентам с
дилатацией аорты показано проведение МРТ и КТ
для оценки эволюции изменений восходящего от-
дела аорты, обнаруженных при ЭхоКГ, особенно
когда может понадобиться хирургическое лечение.
ФУНКЦИЯ АОРТАЛЬНОГО КЛАПАНА И КОРНЯ АОРТЫ
Корень аорты представляет собой участок аорты,
который поддерживает створки аортального кла-
пана. Корень аорты сверху ограничен синотубуляр-
ch17.indd 391
03.04.2019 11:54:56
392
ЧАСТЬ IV Пороки клапанов сердца
ным соединением, снизу — аортожелудочковым со-
единением. Корень аорты состоит из синусов, ство-
рок и комиссур аортального клапана и фиброзных
треугольников.
Синотубулярное соединение имеет круглую
форму, в основном состоит из эластичной ткани
и поддерживает периферические зоны прикрепле-
ния створок клапана. Створки аортального клапа-
на имеют вид полумесяца и прикрепляются к стенке
аорты, их закрытие обеспечивает полную централь-
ную коаптацию. Уровень коаптации створок нахо-
дится посередине между нижним уровнем их при-
крепления и зонами комиссур.
Аортожелудочковое соединение, или основание
корня аорты, определяется нижним уровнем при-
крепления створок и фиброзных треугольников.
Для описания этой области обычно использу-
ют термин фиброзное кольцо аортального клапана.
Однако этот термин не совсем точен, т.к. подразу-
мевает структуру круглой формы. Примерно 45%
окружности корня аорты прикрепляется к мышеч-
ной части межжелудочковой перегородки, а 55% —
к ее фиброзной части. Фиброзная ткань является
мембранозной частью межжелудочковой перего-
родки и фиброзного каркаса сердца, которые соеди-
няют переднюю створку митрального клапана и ко-
рень аорты [56].
ЭхоКГ позволяет оценить механизм АР в дина-
мике [17]. Точное измерение корня аорты необхо-
димо для понимания механизма АР, определения
оптимального времени и стратегии клапаносохра-
няющего вмешательства на аортальном клапане.
Прежде всего следует измерить:
•
фиброзное кольцо аортального клапана (рассто-
яние между местом соединения базальных отде-
лов створок клапана и корнем аорты);
•
синусы Вальсальвы (максимальный диаметр);
•
синотубулярное соединение (диаметр корня аор-
ты на уровне комиссур и стенки аорты);
•
тубулярный тракт (максимальный диаметр вос-
ходящего отдела аорты дистальнее синотубуляр-
ного соединения);
•
высоту зоны коаптации (максимальное расстояние
между первой точкой протодиастолической коап-
тации створок и плоскостью фиброзного кольца на
уровне прикрепления створок) (рис. 17 .17) [57];
•
длину зоны коаптации (расстояние смыкания
створок в протодиастолу) (см. рис. 17 .17);
•
выбухание створок (максимальная площадь вы-
бухания желудочковой поверхности створок от-
носительно плоскости фиброзного кольца).
Высота зоны коаптации наиболее четко связана с
функциональной АР при диастолическом пролаби-
ровании створок (см. рис. 17 .17). При использова-
нии порогового значения 11 мм чувствительность и
специфичность составляют > 95%. Если длина зоны
коаптации < 4 мм, то риск выраженной АР крайне
велик. Ограничение подвижности створок больше
зависит от несоответствия диаметров синотубуляр-
ного соединения и фиброзного кольца, а не от ди-
аметра проксимального участка аорты. Пороговое
значение > 1,6 мм четко идентифицирует диастоли-
ческое выбухание створок и в значительной степени
коррелирует со степенью АР [58, 59].
Ао
ЛП
ЛЖ
СТС
Фиброзное кольцо
Синус
Высота зоны коаптации
Длина зоны
коаптации
А
Б
Рис. 17 .17 Функциональная аортальная регургитация. (А) A Парастернальная позиция по длинной оси. Визуализируется аортальный клапан и корень аор-
ты у пациента с ограничением подвижности створок во время диастолы и высотой зоны коаптации створок 14 мм. (Б) Схематическое изображение корня аорты.
АК — аортальный клапан; Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие; СТС — синотубулярное соединение [Schäfers HJ, Schmied W, Psych
D, et al. Cusp height in aortic valves. J Thorac Cardiovasc Surg 146:269–274, 2013].
ch17.indd 392
03.04.2019 11:54:56
393
17 Аортальная регургитация
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ И СЕРИЙНЫЕ
ИССЛЕДОВАНИЯ ПРИ ХРОНИЧЕСКОЙ
АОРТАЛЬНОЙ РЕГУРГИТАЦИИ
Прогрессирование АР характеризуется нескольки-
ми параметрами, включая степень АР, изменения
аортального клапана и компенсаторную реакцию ЛЖ.
Для хронической АР характерны продолжитель-
ная бессимптомная стадия и медленное расширение
ЛЖ. При хронической АР ЛЖ адаптируется к пере-
грузке объемом за счет ряда компенсаторных меха-
низмов, включая увеличение конечно-диастоличе-
ского объема и растяжимости, а также эксцентриче-
скую гипертрофию, что компенсирует увеличенный
объем крови и стабилизирует сердечный выброс без
увеличения давления наполнения. Компенсаторная
стадия может длиться десятилетиями. В конечном
итоге резерв преднагрузки истощается и/или гипер-
трофия становится неадекватной, в результате даль-
нейшее увеличение постнагрузки приводит к сни-
жению ФВ. Этот переход может быть скрытым, т.е .
некоторые пациенты остаются бессимптомными,
пока не проявится тяжелая дисфункция ЛЖ. Стадия
декомпенсации характеризуется прогрессирующим
существенным увеличением ЛЖ, изменением гео-
метрии полости сферической формы, повышением
диастолического давления, увеличением систоличе-
ской нагрузки на стенку ЛЖ (т.е . чрезмерной пост-
нагрузкой), а также снижением ФВ [60].
Нет ни одного крупного исследования естествен-
ного течения АР у бессимптомных пациентов с нор-
мальной систолической функцией ЛЖ. В последних
рекомендациях [54, 61], подготовленных на основе
12 исследований с участием 1173 пациентов, сред-
ний период наблюдения был 6,5 года (табл. 17 .2) [3,
62–69]. Частота прогрессирования симптомов и/или
систолической дисфункции ЛЖ составляла в год в
среднем 4,3%, бессимптомной дисфункции ЛЖ —
1,2%, внезапной смерти — 0,2% [54]. Следует под-
черкнуть, что свыше 25% пациентов умирали или
у них развивалась систолическая дисфункция еще
до появления симптомов [63, 64, 68].
Размеры ЛЖ имеют существенную прогностиче-
скую значимость. У пациентов с исходным конеч-
но-систолическим размером > 50 мм вероятность
летального исхода, развития симптомов и/или дис-
функции ЛЖ составила 19%, у пациентов с конеч-
но-систолическим размером от 40 до 50 мм — 6%,
а при размере < 40 мм — 0% [63]. Таким образом,
динамическое наблюдение бессимптомных пациен-
тов с помощью ЭхоКГ обязательно. У 25% бессим-
птомных пациентов со сниженной систолической
функцией симптомы появились в течение года [62–
72]. У симптомных пациентов, получавших консер-
вативное лечение, летальность в течение года соста-
вила от 10 до 20% [61, 71, 72].
У бессимптомных больных с сохранной систо-
лической функцией размеры ЛЖ и показатель его
Исследование
Количество
пациентов
Средний период
наблюдения
(годы)
Частота прогрессирования
симптомов, увеличения
смертности или дисфункции
ЛЖ(%вгод)
Частота прогрессирования
бессимптомной
дисфункции ЛЖ (% в год)
Смертность
(количество
пациентов)
Bonow [62, 63]
104
8,0
3,8
0,5
2
Scognamiglio*
30
4,7
2,1
2,1
0
Siemienczuk [64] 50
3,7
4,0
0,5
0
Scognamiglio [65] 74
6,0
5,7
3,4
0
Tornos [66]
101
4,6
3,0
1,3
0
Ishii [67]
27
14,2
3,6
–
0
Borer [68]
104
7,3
6,2
0,9
4
TАРasoutchi [70] 72
10,0
4,7
0,1
0
Evangelista [69] 31
7,0
3,6
–
1
Detaint [31]
251
8,0
5,0
–
33
Pizarro†
294
3,5
10,0
2,8
5
Olsen [31]
35
1,6
14,3
–
0
* Scognamiglio R, Fasoli G, Dalla VS. Progression of myocardial dysfunction in asymptomatic patients with severe aortic insuffi ciency. Clin Cardiol
9:151–156, 1986.
† Pizarro R, Bazzino OO, Oberti PF, et al. Prospective validation of the prognostic usefulness of B-type natriuretic peptide in asymptomatic patients
with chronic severe aortic regurgitation. J Am Coll Cardiol 58:1705–1714, 2011.
ЛЖ — левый желудочек.
ТАБЛИЦА 17.2 Исследование естественного течения болезни у бессимптомных пациентов с аортальной регургитацией
ch17.indd 393
03.04.2019 11:54:56
394
ЧАСТЬ IV Пороки клапанов сердца
функции представляют собой исходную информа-
цию, с которой сравнивают результаты дальнейших
измерений. Пациенты с легкой или умеренной АР
должны проходить обследование ежегодно, а ЭхоКГ
им выполняют каждые 3 года [73]. Всех пациентов
с тяжелой АР и нормальной функцией ЛЖ следу-
ет обследовать через 6 мес после первого обследова-
ния. Если параметры ЛЖ и/или ФВ значительно из-
менились и приближаются к пороговым значениям
показаний к хирургическому вмешательству, следу-
ющее обследование нужно провести через 6 мес [54,
61]. У пациентов со стабильными параметрами об-
следования проводят ежегодно. Пациенты с дилата-
цией аорты и особенно с синдромом Марфана или
двухстворчатым аортальным клапаном подлежат
ежегодному эхокардиографическому контролю. Ес-
ли восходящий отдел аорты в верхней части сино-
тубулярного соединения не визуализируется очень
хорошо, рекомендуется провести КТ или МРТ, т.к .
показания к операции после КТ и МРТ могут быть
основаны на увеличении аорты, а не на размерах
ЛЖ или его функции [12].
КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ И ОПРЕДЕЛЕНИЕ
ОПТИМАЛЬНЫХ СРОКОВ ПРОВЕДЕНИЯ ОПЕРАЦИИ
ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
Лекарственная терапия не может существенно сни-
зить объем регургитации при нормотензивной хро-
нической тяжелой АР, т.к. площадь отверстия ре-
гургитации относительно постоянна и диастоличе-
ское артериальное давление уже снижено. Только
в двух рандомизированных контролируемых ис-
следованиях было показано значимое уменьшение
конечно-диастолического размера ЛЖ и увеличе-
ние ФВ на фоне приема гидралазина или нифеди-
пина (табл. 17 .3) [65, 74]. Однако последнее рандо-
мизированное исследование свидетельствовало о
неэффективности терапии эналаприлом или нифе-
дипином по сравнению с плацебо [69], поэтому их
назначение не рекомендуется, за исключением слу-
чаев артериальной гипертензии (систолическое ар-
териальное давление > 140 мм рт. ст.) или выявле-
ния сердечной недостаточности перед операцией
[54, 61].
Применение β-блокаторов при АР ранее счита-
ли противопоказанным, т.к. сердечный выброс под-
держивается за счет увеличения частоты сердечных
сокращений, а снижение частоты сокращений мо-
жет увеличить время диастолы и диастолический
объем регургитации [54].
ПОКАЗАНИЯ К ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ
Показания к операции основываются на симпто-
мах, функции и размерах ЛЖ и дилатации аорты.
Определение функции и размеров ЛЖ имеет пер-
востепенное значение для адекватного лечения АР.
Существует нелинейная связь между дооперацион-
ной степенью дилатации ЛЖ и послеоперационной
ФВ [75]. Конечно-систолический размер желудочка
меньше зависит от нагрузки и, следовательно, явля-
ется более надежным предиктором исхода по срав-
нению с конечно-диастолическими параметрами. В
некоторых случаях рекомендуется индексирование
к площади поверхности тела, особенно у пациентов
с небольшой массой тела и у женщин [72, 76, 77].
Автор
исследования
Цель
исследования
Количество
пациентов
Длительность
наблюдения
(годы)
Исследуемый
препарат и препарат
сравнения (n)
Пациенты
Результаты
Evangelista
[69]
Изучить влияние
сосудорасширяю-
щей терапии
на функцию ЛЖ
и время до про-
тезирования аор-
тального клапана
95
7
Немаскированный
нифедипин (32)
или немаскиро-
ванный эналаприл
(32) в сравнении
с группой, не по-
лучавшей лечение
(31)
Бессимптом-
ные, тяже-
лая хрони-
ческая АР и
нормальная
функция ЛЖ
Нет достоверной
разницы в часто-
те протезирова-
ния аортального
клапана
Нет достоверной
разницы в степе-
ни АР, размерах
ЛЖ или фрак-
ции выброса ЛЖ
Scognomiglio
[65]
Определить влия-
ние сосудорасши-
ряющей терапии
на необходимость
протезирования
аортального кла-
пана
143
6
Нифедипин (69) в
сравнении с дигок-
сином (74)
Бессимптом-
ные, тяже-
лая хрони-
ческая АР и
нормальная
функция ЛЖ
В группе нифе-
дипина частота
протезирования
аортального кла-
пана достоверно
ниже
АР — аортальная регургитация; ЛЖ — левый желудочек.
ТАБЛИЦА 17.3 Рандомизированные контролируемые исследования эффективности сосудорасширяющей терапии
ch17.indd 394
03.04.2019 11:54:57
395
17 Аортальная регургитация
СИМПТОМНЫЕ ПАЦИЕНТЫ
С ДИСФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА
Не следует отказывать в хирургическом лечении
симптомным пациентам с тяжелой дисфункци-
ей ЛЖ (ФВ < 30%) или выраженной его дилатаци-
ей (после исключения других возможных причин
патологии) хотя у этих пациентов послеоперацион-
ные результаты хуже [78, 79] и вероятность восста-
новления систолической функции ниже, чем у боль-
ных, прооперированных на более ранней стадии за-
болевания. Пациенты со значительно сниженной ФВ
имеют более высокую вероятность развития послео-
перационной сердечной недостаточности в отдален-
ном периоде, однако за 10 лет наблюдения такое ос-
ложнение отмечалось только у 25% пациентов. Даже
у пациентов с ФК IV по NYHA возможно улучшение
функции ЛЖ и клинической симптоматики, хотя
летальность, связанная с протезированием аорталь-
ного клапана, приближается к 10% [78–80].
СИМПТОМНЫЕ ПАЦИЕНТЫ С НОРМАЛЬНОЙ СИСТОЛИЧЕСКОЙ
ФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА
Хирургическое лечение показано пациентам с нор-
мальной систолической функцией ЛЖ и ФВ > 50%
в покое, имеющим ФК III или IV по NYHA. У мно-
гих пациентов с ФК II по NYHA и одышкой при-
чины симптомов неясны, хотя период наблюдения
может быть адекватным, а визуализация с физиче-
ской нагрузкой для определения причин симптомов
эффективна. При пороговых значениях ФВЛЖ мо-
жет быть полезна оценка других параметров с по-
мощью тканевой допплерографии и исследовании
скорости деформации.
БЕССИМПТОМНЫЕ ПАЦИЕНТЫ
СО СНИЖЕННОЙ ФРАКЦИЕЙ ВЫБРОСА
Хирургическое лечение показано бессимптомным
пациентам с дисфункцией ЛЖ (ФВ < 50%), одна-
ко следует учитывать динамику данных ЭхоКГ при
проведении стресс-тестов с физической нагрузкой.
Можно использовать и другие методы для под-
тверждения систолической дисфункции ЛЖ.
БЕССИМПТОМНЫЕ ПАЦИЕНТЫ
С НОРМАЛЬНОЙ ФРАКЦИЕЙ ВЫБРОСА
Хирургическое лечение также показано пациентам
с нормальной ФВ и выраженной дилатацией ЛЖ
(КДР > 65 мм или КСР > 50 мм, или КСР, индек-
сированный к площади поверхности тела, > 22 мм/
м2) [54, 61]. Несмотря на отсутствие изменений ФВ,
увеличение конечно-систолического индекса ЛЖ
(45 мл/м2 и более) является предиктором неблаго-
приятных сердечно-сосудистых событий при лю-
бой степени АР [17]. Большинство пациентов с вы-
раженной дилатацией ЛЖ и сохранной ФВ имеют
высокий риск развития осложнений и снижение то-
лерантности к физической нагрузке.
СОПУТСТВУЮЩАЯ ПАТОЛОГИЯ КОРНЯ АОРТЫ
Дилатация восходящего отдела аорты является од-
ной из наиболее распространенных причин изоли-
рованной АР. В этих случаях АР обычно нетяже-
лая, поэтому показания к операции должны осно-
вываться главным образом на степени дилатации
аорты, а не степени АР. Дилатация корня аорты или
восходящего отдела аорты > 55 мм является пока-
занием к хирургическому лечению независимо от
степени АР [54]. У пациентов с синдромом Марфа-
на показанием к хирургическому лечению служит
меньший диаметр аорты (50 мм) [54, 61]. Пациен-
там с синдромом Марфана, у родственников кото-
рых было расслоение аорты или быстрое увеличе-
ние ее диаметра (> 5 мм/год), операция показана,
когда диаметр корня аорты составляет 45 мм [61].
При определении показаний к хирургическому вме-
шательству пациентам с ДАК и с диаметром аорты
от 50 до 55 мм нужно учитывать возраст, массу те-
ла, сопутствующие заболевания, тип хирургиче-
ской операции и наличие дополнительных факто-
ров риска, включая коарктацию аорты, системную
гипертензию, аортальный стеноз или быстрое уве-
личение диаметра аорты (> 3 мм/год) [11].
При тяжелой АР и необходимости протезирова-
ния аортального клапана следует рассмотреть воз-
можность протезирования восходящего отдела аор-
ты, когда диаметр аорты > 50 мм или > 45 мм с уче-
том возраста, площади поверхности тела, этиологии
порока клапана, наличия ДАК, интраоперационную
формы и толщины восходящего отдела аорты [81].
При замене корня аорты ориентируются на нижние
пороговые значения, если планируют восстановле-
ние аортального клапана в центрах с большим опы-
том операций по восстановлению корня и восходя-
щего отдела аорты.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Традиционное лечение изолированной АР заключа-
ется в протезировании аортального клапана меха-
ническим или биологическим протезом. Протези-
рование аортального клапана легочным аутотран-
сплантатом осуществляют в особых ситуациях, в
основном у детей и подростков [82].
В течение последних 20 лет для устранения АР бы-
ли разработаны различные техники реконструкции
аортального клапана [83]. Потенциальные преиму-
щества реконструктивной хирургии аортального
клапана по сравнению с его протезированием — бо-
лее низкая частота тромбоэмболических осложне-
ний; отсутствие необходимости длительной анти-
коагулянтной терапии; низкий риск развития эндо-
кардита.
Реконструкции аортального клапана все чаще
отдают предпочтение при различной патологии,
приводящей к значительной АР [84, 85]. Несмотря
на преимущества, предметом озабоченности была
ch17.indd 395
03.04.2019 11:54:57
396 ЧАСТЬ IV Пороки клапанов сердца
длительность реконструктивного вмешательства и
его различная успешность, значительно зависящая
от этиологии, механизмов дисфункции аортально-
го клапана и опыта хирурга [83, 84].
Реконструкция аортального клапана может быть
успешной у пациентов с аневризмой аорты или ее
корня, у больных с двухстворчатым аортальным
клапаном и пролапсом створки при минимальном
склерозе. При дилатации корня аорты независимо
от этиологии проводят комплексную замену аор-
тального клапана, корня аорты и восходящего от-
дела аорты механическим или биологическим кон-
дуитом. Все чаще при лечении аневризмы аорты
проводят клапаносохраняющее вмешательство. По-
мимо этого, если синусы Вальсальвы не изменены,
можно провести надкоронарную замену восходя-
щего отдела аорты.
В последние годы все чаще применяют технику
реконструкции створок клапана. Были предложе-
ны различные хирургические техники: пликация,
резекция избыточной ткани, увеличение створки
с помощью заплаты из аутоперикарда или искус-
ственной заплаты. Первоначальные результаты вы-
глядят многообещающими, большое значение име-
ют опыт хирурга и техника реконструкции [86–88].
При выборе типа хирургического лечения сле-
дует также учитывать возраст пациента [85]. Ес-
ли предполагается реконструкция клапана или кла-
паносохраняющее вмешательство, необходимо до
операции провести ЧПЭхоКГ, чтобы точно опреде-
лить анатомию створок и восходящего отдела аор-
ты [17].
РОЛЬ ЭХОКАРДИОГРАФИИ
Роль ЭхоКГ заключается в определении механиз-
ма регургитации, описании анатомии клапанов и
определении возможности их реконструкции [17].
При 2D-ТТЭхоКГ не всегда удается установить при-
чину плохой коаптации створок. Механизм АР луч-
ше всего определять с помощью ЧПЭхоКГ [17]. Ме-
ханизм АР существенно влияет на лечение пациен-
тов, особенно при расширении восходящего отдела
аорты и планировании клапаносохраняющего вме-
шательства. Предложены несколько функциональ-
ных классификаций, но в практике наиболее широ-
ко используют классификацию Carpentier, адапти-
рованную для АР (рис. 17.18) [89].
Дисфункция типа I: размеры фиброзного кольца
аортального клапана, синусов Вальсальвы и синоту-
булярного соединения превышают верхние грани-
цы нормы и других причин АР не установлено. Дис-
функцию типа I подразделяют на: тип Ia — аневриз-
ма восходящего отдела аорты; тип Ib — аневризма
корня аорты (см. рис. 17 .17); тип Ic — изолирован-
ная дилатация фиброзного кольца; тип Id — перфо-
рация створки после травмы или перенеснного эн-
докардита.
Дисфункция типа II: эксцентрическая струя АР,
пролапс или фенестрация створки. Пролапс створки
диагностируют в случае провисания свободного края
одной или нескольких створок аортального клапа-
на ниже плоскости фиброзного кольца. При ЧПЭ-
хоКГ, как и в хирургии, выделяют три вида про-
лапса: молотящая створка, обширный пролапс и
ограниченный пролапс. Молотящую створку ди-
Дисфункция
Ia
Ib
Ic
Id
Ремоделирование
СТС:
аутотрансплантат
восходящего
отдела аорты
Пластика
заплатой:
аутоперикард
или бычий
перикард
Реконструкция
створок:
укорочение,
декальцифи-
кация, заплата
Клапаносохра-
няющее
вмешательство:
реимплантация
или
ремоделирование
c СКА
СКА
СКА
СКА
СКА
СКА
Аннулопластика
СТС
Дисфункция типа I
(нормальная подвижность створок,
дилатация фиброзного кольца или перфорация створки)
Дисфункция
типа II
(пролапс
створки)
Дисфункция
типа III
(рестрикция
типа II)
Механизм
Техника
реконструкции
(первичная)
Техника
реконструкции
(вторичная)
Устранение
пролапса:
пликация,
треугольная
резекция,
заплата
Рис. 17.18 Классификация дисфункции аортального клапана с описанием механизмов аортальной регургитации и техники реконструкции.
СКА — субкомиссуральная аннулопластика; СТС — синотубулярное соединение [Boodhwani M, de Kaerchove L, Glineur D, et al. Repair-oriented classification of aor-
tic insufficiency: impact on surgical techniques and clinical outcomes. J Thorac CАРdiovasc Surg 137:286–294, 2009].
ch17.indd 396
03.04.2019 11:54:57
397
17 Аортальная регургитация
агностируют при ее флотации в ВТЛЖ в позиции
по длинной оси. Ограниченный пролапс створки
проявляется пролабированием в ВТЛЖ дистально-
го участка створки, при этом в позиции по длинной
оси обычно визуализируется выбухание тела створ-
ки, в позиции по короткой оси — небольшой струк-
туры круглой или овальной формы вблизи свобод-
ного края створки. Обширный пролапс проявля-
ется пролабированием свободного края створки в
ВТЛЖ. Пролабирование тела створки лучше всего
визуализируется в позиции по короткой оси ВТЛЖ,
непосредственно под клапаном, где створка выявля-
ется в виде большой структуры круглой или оваль-
ной формы (см. рис. 17 .2, 17.14). Фенестрацию сво-
бодного края створки диагностируют при наличии
эксцентрического потока АР, возможно сочетание с
пролапсом створки [14, 15]. Идентифицировать не-
большие дефекты около свободного края поражен-
ной створки обычно помогают тщательный осмотр
створки по длинной оси, цветовое допплеровское
картирование и визуализация в шкале оттенков се-
рого.
Дисфункция типа III: избыточная ткань створки
аортального клапана или фиброэластический дефи-
цит (утолщенные, ригидные створки с ограничен-
ной подвижностью и разрушенной тканью вслед-
ствие перенесенного эндокардита, значительная
кальцификация).
Интраоперационную ЧПЭхоКГ проводят с целью
оценки функционального результата и выявления
пациентов с риском раннего рецидива АР [90]. Ос-
новное внимание следует обращать на объем и на-
правление струи регургитации. Появление эксцен-
трической струи ассоциируется с избыточным коли-
чеством ткани створки и пролапсом. Центральный
поток регургитации свидетельствует об ограничен-
ной подвижности и дефиците ткани створки. Ис-
следование с помощью ЧПЭхоКГ позволяет иден-
тифицировать тип пролапса створки аортально-
го клапана, что имеет первостепенное значение для
успешности клапаносохраняющего вмешательства,
т.к . диагностические ошибки являются частой при-
чиной неудач при подобных операциях [91].
ОСЛОЖНЕНИЯ ПОСЛЕ ХИРУРГИЧЕСКОГО
ВМЕШАТЕЛЬСТВА
При дисфункции типа I, когда струя АР имеет цен-
тральное направление и перпендикулярна ВТЛЖ,
хирургическая коррекция заключается в замене вос-
ходящего отдела аорты и выполнении субкомис-
суральной аннулопластики (рис. 17 .19). Если струя
АР не перпендикулярна ВТЛЖ, следует заподозрить
поражение восходящего отдела аорты (дисфунк-
цию типа II). Направление потока АР к митраль-
ному клапану или межжелудочковой перегородке
определяется наиболее пролабирующим сегментом
створки, в этом случае хирургическая реконструк-
ция клапана обязательна [89].
При дисфункции типа Ib, вторичной относи-
тельно аневризмы корня аорты, показание к опера-
ции часто определяется диаметром аорты, а не сте-
пенью АР. Даже у пациентов с тяжелой АР одна или
несколько створок остаются почти неизмененными
вследствие асимметричного характера дилатации
корня аорты. Если после клапаносохраняющих опе-
раций пролапс сохраняется [56], может возникнуть
необходимость в реконструкции клапана с целью
предотвращения развития острой регургитации.
Среди пациентов с АР, подвергавшихся рекон-
структивным вмешательствам, у пациентов с дис-
функцией типа III чаще выявляется значительная
АР. Основной причиной неблагоприятного исхода
у пациентов с рецидивирующей тяжелой АР явля-
ется остаточный пролапс.
В течение последних лет хирургические техни-
ки, применяемые при двухстворчатом аортальном
клапане, значительно усовершенствовали. Некото-
рые хирурги считают, что двухстворчатый аорталь-
ный клапан является предиктором несостоятель-
ности клапана после реконструкции и повторной
операции [87], но недавние исследования показа-
ли более оптимистичные долгосрочные результа-
ты [92, 93]. Эхокардиографическими признаками
необходимости повторной операции у пациентов
с двухстворчатым аортальным клапаном считают
высоту зоны коаптации створок после операции
< 9 мм, длину зоны коаптации < 4 мм, аортоже-
лудочковый диаметр > 28 мм, ориентация комис-
сур < 160° [92]. ЧПЭхоКГ после реконструктивного
вмешательства позволяет выявить функциональ-
ные и морфологические особенности, приводящие
к развитию регургитации: постоянная остаточная
АР, длина зоны коаптации < 4 мм, уровень коапта-
ции ниже уровня аортального кольца, и дилатация
фиброзного кольца аортального клапана. 3D-ЭхоКГ
и КТ с высоким разрешением — перспективные ме-
тоды диагностики патологии аортального клапана.
РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
И ПОСЛЕДУЮЩЕЕ НАБЛЮДЕНИЕ
С появлением консервативной хирургии аорталь-
ного клапана, включая клапаносохраняющие и ре-
конструктивные операции, лечение тяжелой АР зна-
чительно изменилось. Операционная летальность
при этих вмешательствах низкая, а отдаленные ре-
зультаты хорошие. Внутрибольничная летальность
после реконструкции клапана и клапаносохраняю-
щих вмешательствах составляет < 2% [83, 84], а по-
сле имплантации легочного аутотрансплантата —
около 2% и не увеличивается, несмотря на слож-
ность операции [94].
После протезирования аортального клапана ре-
комендуется пристальное краткосрочное и средне-
срочное врачебное наблюдение с оценкой состояния
протезированного клапана и функции ЛЖ. Паци-
ch17.indd 397
03.04.2019 11:54:57
398 ЧАСТЬ IV Пороки клапанов сердца
ентам с искусственным клапаном ЧПЭхоКГ следует
проводить повторно в случае изменения клиниче-
ской картины, что позволит своевременно выявить
нарушение функции клапанов. Пациенты с биоло-
гическим протезом клапана должны ежегодно про-
ходить ТТЭхоКГ после первых 10 лет даже в отсут-
ствие изменений клинического статуса [54]. Паци-
ентам с ДАК после хирургического вмешательства
показаны серийные КT или MРТ каждые 2 года. Па-
циентам после протезирования восходящего отдела
аорты с или без вмешательства на аортальном кла-
пане проводят ЭхоКГ каждый год для оценки ди-
аметра оставшегося корня аорты, а также КТ или
МРТ грудной и брюшной частей нисходящего отде-
ла аорты каждые 3–5 лет.
ОСТРАЯ АОРТАЛЬНАЯ РЕГУРГИТАЦИЯ
При острой тяжелой АР большой объем регургита-
ции внезапно поступает в нормальный ЛЖ, кото-
рый не успел адаптироваться к перегрузке объемом.
Резкое увеличение диастолического потока в нор-
мальном ЛЖ ведет к заметному росту конечно-ди-
астолического давления и уменьшению сердечного
выброса. В тяжелых случаях увеличение давления
наполнения желудочка в сочетании с уменьшением
диастолического давления в аорте ведет к быстро-
му выравниванию аортального давления и конеч-
но-диастолического давления ЛЖ [95]. Возникшей
тахикардии часто недостаточно для компенсации
снижения сердечного выброса, и развивается карди-
альный шок. В результате повышения конечно-ди-
астолического давления в ЛЖ происходит отек лег-
ких. Кроме того, уменьшается резерв коронарного
кровотока, в результате может развиться субэндо-
кардиальная ишемия миокарда. Причины острой
АР перечислены в табл. 17.4 .
Многие физикальные признаки хронической тя-
желой АР в острой стадии отсутствуют, поэтому
диагностировать острую тяжелую АР сложно или
ее можно недооценить. Физикальные признаки АР:
тахикардия, сложный для аускультации диастоли-
ческий шум, сердечная недостаточность, однако ар-
териальное давление может быть в норме, а перифе-
Аортальная регургитация
Клинические
проявления
Хирургические
техники
Тяжелая
Створки аортального клапана
Норма
Пролапс
Рестрикция
Дилатация восходящего
отдела аорты с нормальным
корнем аорты
Коррекция
пролапса +
пластика
фиброзного
кольца или
протезирование
клапана
Коррекция пролапса
+ реимплантация,
ремоделирование
Протезирование
клапана или
реконструкция
(декальцификация,
коррекция створок
+ пластика
фиброзного
кольца)
Аллотрансплантат
восходящего отдела аорты
Субкомиссуральная
аннулопластика
Реимплантация,
ремоделирование
Дилатация
корня аорты
Нормальный
корень аорты
Дилатация или расслоение
корня аорты
Симптомы или ФВЛЖ < 50%
КДР>65мм
КСР>50мм(>25мм/м2)
Диаметр восходящего отдела аорты > 55 мм,
синдром Марфана или ДАК
с факторами риска дилатации ≥ 50 мм
Рис. 17 .19 Алгоритм лечения пациентов с хронической аортальной регургитацией. ДАК — двухстворчатый аортальный клапан; КДР — конечно-диасто-
лический размер; КСР — конечно-систолический размер; ФВЛЖ — фракция выброса левого желудочка.
ch17.indd 398
03.04.2019 11:54:57
399
17 Аортальная регургитация
рических признаков АР нет. Отсутствие физикаль-
ных признаков хронической тяжелой АР затрудняет
определение острой АР, поэтому диагноз обычно
ставят с помощью ЭхоКГ.
ЭхоКГ имеет важное значение для диагностики
и оценки степени АР, выявления ее причин и опре-
деления влияния острой АР на гемодинамику ЛЖ.
Эхокардиографические признаки острой тяжелой
АР перечислены в табл. 17 .4 . При острой тяжелой
АР отмечается преждевременное закрытие митраль-
ного клапана (до систолы желудочка), что связано с
быстрым увеличением диастолического давления
в ЛЖ из-за объема аортальной регургитации. Пре-
ждевременное закрытие митрального клапана луч-
ше всего визуализируется в M-режиме, поскольку
этот режим имеет лучшее временно
́
е разрешение
по сравнению с 2D-режимом и позволяет оценить
раннее закрытие клапана [21].
Количественные параметры регургитации, кото-
рые используют при оценке хронической АР, менее
полезны при острой АР. Гемодинамические данные
отражают вариабельность площади отверстия ре-
гургитации и объема регургитации в зависимости
от постнагрузки и условий нагрузки [31]. ЧПЭхоКГ
показана пациентам с острой АР при подозрении на
острое расслоение аорты, эндокардит, травму и при
неясной этиологии АР. Пациентам с острой АР не-
обходимо срочное или неотложное хирургическое
вмешательство для коррекции патологии, являю-
щейся причиной острой перегрузки объемом ЛЖ.
Вид операции определяется причинами, лежащими
в основе изменений.
ОСТРОЕ РАССЛОЕНИЕ АОРТЫ ТИПА А
АР часто осложняется острым расслоением аорты
типа A (41–76%) [35]. О необходимости раннего хи-
рургического вмешательства в этом случае хорошо
известно, но оптимальная тактика лечения АР оста-
ется спорной (см. главу 34). На протяжении многих
лет предпочтение отдавали протезированию аор-
тального клапана, однако недавно появились со-
общения о благоприятных исходах в ближайшем и
отдаленном периодах после клапаносохраняюще-
го вмешательства. ЧПЭхоКГ позволяет определить
механизм и степень АР, которая осложняет острое
расслоение аорты типа A. Данные ЧПЭхоКГ помо-
гают хирургу отличить изменение геометрии аор-
ты, поддающееся восстановлению, от патологии,
при которой необходимо протезирование.
С помощью ЧПЭхоКГ можно определить пять
механизмов АР (первые три считают устранимыми
без протезирования клапана, у некоторых пациен-
тов выявляют более 1 механизма):
1. Неполное закрытие неизмененных створок, свя-
занное с их подтягиванием из-за расширения си-
нотубулярного соединения.
2. Пролапс створки из-за разрыва в месте ее при-
крепления при отслойке интимы, которая рас-
пространяется ниже синотубулярного соедине-
ния в область корня аорты.
3. Пролапс отслоившегося лоскута интимы через
нормально сформированные створки, приводя-
щий к нарушению их коаптации (см. рис. 17 .4).
4. ДАК в сочетании с пролапсом створки, не свя-
занным с расслоением аорты.
Причины
Расслоение аорты
Инфекционный эндокардит нативного клапана
Инфекционный эндокардит искусственного клапана
Травма
Спонтанный разрыв или пролапс створки аортального клапана из-за дегенерации
биологического протеза
Перфорация створок на фоне заболеваний соединительной ткани
Разрыв створки с фенестрацией
Спонтанное расхождение комиссур клапана
После хирургической или катетерной вальвулопластики
Специфические признаки
Vena contracta > 6 мм
Преждевременное закрытие митрального клапана
Вспомогательные признаки Время полуспада давления < 200 мсек
Голодиастолический ретроградный поток в брюшной части нисходящего отдела аорты
Нормальные размеры левого желудочка и сохранная его функция
Количественные параметры Эффективная площадь отверстия регургитации ≥ 0,30 см2
Объем регургитации ≥ 60 мл/уд
ТАБЛИЦА 17.4 Причины и эхокардиографические признаки при острой тяжелой аортальной регургитации
ch17.indd 399
03.04.2019 11:54:57
400
ЧАСТЬ IV Пороки клапанов сердца
5. Утолщение створок при дегенеративных измене-
ниях, приводящее к нарушению коаптации ство-
рок.
ЧПЭхоКГ играет важную роль в определении оп-
тимальной стратегии лечения пациентов с расслое-
нием аорты типа A и тяжелой АР. Movsowitz и со-
авт. [96] исследовали 43 пациентов, которым про-
вели хирургическое вмешательство на аорте. В 77%
случаев аортальный клапан был сохранен, результа-
ты вмешательств были отличными.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Сердечная недостаточность, вызванная тяжелой
аортальной или митральной регургитацией, отно-
сится к наиболее распространенным осложнениям
инфекционного эндокардита и представляет собой
одно из основных показаний к хирургическому ле-
чению (см. главу 22). Сердечная недостаточность ча-
ще развивается при поражении инфекционным эн-
докардитом аортального клапана, чем митрально-
го [97]. Сердечная недостаточность от умеренной
до тяжелой степени — основной предиктор внутри-
больничной летальности и летальности в течение
6 мес. Острая АР на фоне инфекционного эндокар-
дита может стать результатом разрыва или перфо-
рации створки, а в некоторых случаях — образова-
ния на створке вегетаций. У пациентов с инфекци-
онным эндокардитом протезированного клапана
острая АР развивается в случае несостоятельности
протеза. ТТЭхоКГ и ЧПЭхоКГ играют решающую
роль в диагностике и оценке степени АР, а также об-
наружения вегетаций и других клапанных осложне-
ний.
При острой тяжелой АР, связанной с инфекци-
онным эндокардитом, больные нуждаются в не-
медленной антибиотикотерапии и интенсивном ле-
карственном лечении. Если гемодинамика не улуч-
шается, спасти жизнь больному может неотложное
протезирование аортального клапана. При стабили-
зации клинической ситуации показано применение
антибиотиков в течение нескольких суток до опера-
ции под строгим клиническим и эхокардиографи-
ческим контролем [98, 99]. Эффективность хирур-
гического лечения пациентов с инфекционным эн-
докардитом и сердечной недостаточностью четко
доказана [100].
Результаты интраоперационной ЧПЭхоКГ для
оценки состояния фиброзного кольца (подтверж-
дения его интактности и отсутствия недренирован-
ных абсцессов) имеют решающее значение при хи-
рургическом вмешательстве.
ДРУГИЕ ПРИЧИНЫ ОСТРОЙ АОРТАЛЬНОЙ РЕГУРГИТАЦИИ
Острая АР может возникать в результате травмати-
ческого поражения аортального клапана, воспале-
ния и перфорации створки на фоне дисплазии со-
единительной ткани, после хирургической или ка-
тетерной вальвулопластики, в результате разрыва
створки с фенестрацией или расхождения комис-
сур клапана. Разрыв створки при травме или фене-
страции подлежит устранению, но при АР показано
протезирование клапана. При хирургическом лече-
нии следует учитывать результаты интраопераци-
онной ЧПЭхоКГ и анатомические особенности па-
циента.
ЗАКЛЮЧЕНИЕ
ЭхоКГ — метод выбора при диагностике и оценке
степени АР. Наиболее полезным параметром оцен-
ки АР в клинической практике является определение
ширины vena contracta с помощью цветовой доппле-
рографии, но количественно определить степень
АР помогут другие параметры допплерографии, на-
пример диастолический ретроградный поток в нис-
ходящем отделе аорты или площадь проксималь-
ной зоны струи регургитации. Ширину vena contrac-
ta следует подтвердить дополнительными методами
количественной оценки (если это возможно) с со-
поставлением результатов нескольких методов доп-
плерографии. ЭхоКГ также важна при описании
анатомии, определении механизмов регургитации
и целесообразности реконструкции клапана. Вос-
ходящий отдел аорты следует измерять в 4 местах:
на уровне фиброзного кольца, синусов Вальсальвы,
синотубулярного соединения и тубулярной части .
Расширение восходящего отдела аорты, особенно
на уровне синотубулярного соединения, может вы-
звать вторичную АР. Если планируют реконструк-
цию клапана или клапаносохраняющее вмешатель-
ство, обязательно выполняют интраоперацион-
ную ЧПЭхоКГ, чтобы оценить функциональный
результат и риск раннего рецидива АР. Наиболее
важные параметры при оценке риска и определе-
ния сроков хирургического вмешательства — раз-
меры ЛЖ, объем ЛЖ и фракция выброса. В ранней
диагностике нарушений сокращения желудочка (до
изменения фракции выброса) могут быть полезны
показатели деформации и скорости деформации
миокарда. Если ЭхоКГ малоинформативна или об-
щая оценка АР вызывает сомнения, можно выпол-
нить МРТ, т.к. она обеспечит точной информацией
о степени АР и функции ЛЖ.
ch17.indd 400
03.04.2019 11:54:57
401
17 Аортальная регургитация
П
а
р
а
м
е
т
р
ы
С
т
е
п
е
н
ь
а
о
р
т
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
И
з
м
е
р
е
н
и
я
П
о
з
и
ц
и
и
П
р
е
и
м
у
щ
е
с
т
в
а
/
н
е
д
о
с
т
а
т
к
и
Л
е
г
к
а
я
У
м
е
р
е
н
н
а
я
Т
я
ж
е
л
а
я
Ц
в
е
т
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
П
о
л
у
к
о
л
и
ч
е
с
т
в
е
н
н
ы
е
п
а
р
а
м
е
т
р
ы
Ш
и
р
и
н
а
v
e
n
a
c
o
n
t
r
a
c
t
a
(
с
м
)
*
<
0
,
3
0
,
3
–
0
,
6
>
0
,
6
Н
а
у
р
о
в
н
е
а
о
р
т
а
л
ь
-
н
о
г
о
к
л
а
п
а
н
а
,
н
и
ж
е
з
о
н
ы
к
о
н
в
е
р
г
е
н
ц
и
и
П
а
р
а
с
т
е
р
н
а
л
ь
-
н
а
я
п
о
д
л
и
н
-
н
о
й
о
с
и
Н
е
в
о
з
м
о
ж
н
о
т
о
ч
н
о
и
з
м
е
р
и
т
ь
п
р
и
о
т
в
е
р
с
т
и
и
р
е
г
у
р
г
и
т
а
ц
и
и
н
е
к
р
у
-
г
л
о
й
и
л
и
н
е
п
р
а
в
и
л
ь
н
о
й
ф
о
р
м
ы
л
и
б
о
в
с
л
у
ч
а
е
с
и
л
ь
н
о
й
к
а
л
ь
ц
и
ф
и
-
к
а
ц
и
и
к
л
а
п
а
н
а
Ш
и
р
и
н
а
с
т
р
у
и
р
е
г
у
р
г
и
т
а
ц
и
и
(
с
м
)
<
0
,
4
(
д
л
я
ц
е
н
т
р
а
л
ь
-
н
о
й
с
т
р
у
и
)
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
-
н
и
я
:
о
т
0
,
4
д
о
0
,
7
(
о
т
л
е
г
к
о
й
д
о
у
м
е
р
е
н
н
о
й
)
;
0
,
7
–
1
(
о
т
у
м
е
р
е
н
н
о
й
д
о
т
я
ж
е
л
о
й
)
>
1
д
л
я
ц
е
н
т
р
а
л
ь
-
н
о
й
с
т
р
у
и
,
р
а
з
-
л
и
ч
н
а
я
д
л
я
э
к
с
-
ц
е
н
т
р
и
ч
е
с
к
о
й
с
т
р
у
и
С
р
а
з
у
н
и
ж
е
а
о
р
т
а
л
ь
-
н
о
г
о
к
л
а
п
а
н
а
П
а
р
а
с
т
е
р
н
а
л
ь
-
н
а
я
п
о
д
л
и
н
-
н
о
й
о
с
и
Э
к
с
ц
е
н
т
р
и
ч
е
с
к
а
я
с
т
р
у
я
,
ц
е
н
т
р
а
л
ь
-
н
а
я
с
т
р
у
я
с
э
ф
ф
е
к
т
о
м
р
а
с
п
ы
л
е
-
н
и
я
О
т
н
о
ш
е
н
и
е
с
т
р
у
и
р
е
-
г
у
р
г
и
т
а
ц
и
и
к
ш
и
р
и
н
е
В
Т
Л
Ж
(
%
)
<
2
5
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
-
н
и
я
:
2
5
–
4
5
(
о
т
л
е
г
к
о
й
д
о
у
м
е
р
е
н
н
о
й
)
;
4
6
–
6
4
(
о
т
у
м
е
р
е
н
н
о
й
д
о
т
я
ж
е
л
о
й
)
≥
6
5
С
р
а
з
у
н
и
ж
е
а
о
р
т
а
л
ь
-
н
о
г
о
к
л
а
п
а
н
а
П
а
р
а
с
т
е
р
н
а
л
ь
-
н
а
я
п
о
д
л
и
н
-
н
о
й
о
с
и
Т
е
ж
е
,
ч
т
о
п
р
и
и
з
м
е
р
е
н
и
и
ш
и
р
и
н
ы
с
т
р
у
и
О
т
н
о
ш
е
н
и
е
с
т
р
у
и
р
е
г
у
р
-
г
и
т
а
ц
и
и
к
п
л
о
щ
а
д
и
п
о
п
е
р
е
ч
н
о
-
г
о
с
е
ч
е
н
и
я
В
Т
Л
Ж
(
%
)
<
5
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
-
н
и
я
:
5
–
2
0
;
2
1
–
5
9
≥
6
0
П
л
о
щ
а
д
ь
п
о
т
о
к
а
П
о
к
о
р
о
т
к
о
й
о
с
и
Н
е
б
о
л
ь
ш
и
е
п
о
г
р
е
ш
н
о
с
т
и
в
и
з
м
е
-
р
е
н
и
и
В
Т
Л
Ж
м
о
г
у
т
п
р
и
в
е
с
т
и
к
с
у
щ
е
с
т
в
е
н
н
ы
м
р
а
з
л
и
ч
и
я
м
в
п
л
о
-
щ
а
д
и
п
о
т
о
к
а
.
С
у
б
о
п
т
и
м
а
л
ь
н
о
е
к
а
-
ч
е
с
т
в
о
и
з
о
б
р
а
ж
е
н
и
я
в
2
0
%
с
л
у
ч
а
е
в
К
о
л
и
ч
е
с
т
в
е
н
н
ы
е
п
а
р
а
м
е
т
р
ы
E
R
O
A
(
с
м
2
)
<
0
,
1
0
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
-
н
и
я
:
0
,
1
0
–
0
,
1
9
(
о
т
л
е
г
к
о
й
д
о
у
м
е
р
е
н
н
о
й
)
;
0
,
2
0
–
0
,
2
9
(
о
т
у
м
е
р
е
н
н
о
й
д
о
т
я
ж
е
-
л
о
й
)
≥
0
,
3
0
М
е
т
о
д
о
м
P
I
S
A
E
R
O
A
=
6
,
2
8
×
r
2
×
V
a
l
i
a
s
i
n
g
/
V
А
Р
.
П
р
е
д
е
л
Н
а
й
к
в
и
с
т
а
д
о
л
ж
е
н
б
ы
т
ь
и
з
м
е
н
е
н
в
с
т
о
р
о
н
у
с
т
р
у
и
А
Р
.
Р
а
д
и
у
с
о
б
л
а
с
т
и
P
I
S
A
и
з
м
е
р
я
ю
т
п
о
п
о
л
у
с
ф
е
р
е
А
п
и
к
а
л
ь
н
а
я
п
я
т
и
к
а
м
е
р
н
а
я
и
л
и
п
а
р
а
с
т
е
р
-
н
а
л
ь
н
а
я
Т
е
х
н
и
ч
е
с
к
и
с
л
о
ж
н
о
е
и
з
м
е
р
е
н
и
е
.
О
ш
и
б
к
а
в
л
ю
б
о
й
и
з
п
е
р
е
м
е
н
н
ы
х
м
о
ж
е
т
п
о
в
л
и
я
т
ь
н
а
к
о
н
е
ч
н
ы
й
р
е
з
у
л
ь
т
а
т
.
E
R
O
A
м
о
ж
е
т
н
е
п
о
л
н
о
-
с
т
ь
ю
у
ч
и
т
ы
в
а
т
ь
э
к
с
ц
е
н
т
р
и
ч
е
с
к
у
ю
с
т
р
у
ю
О
б
ъ
е
м
р
е
г
у
р
г
и
т
а
ц
и
и
(
R
v
o
l
)
(
м
л
/
у
д
)
<
3
0
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
-
н
и
я
:
3
0
–
4
4
;
4
5
–
5
9
≥
6
0
R
v
o
l
=
E
R
O
A
×
V
T
I
А
Р
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
п
а
р
а
м
е
т
р
ы
п
р
и
о
ц
е
н
к
е
с
т
е
п
е
н
и
а
о
р
т
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
ch17.indd 401
03.04.2019 11:54:57
402
ЧАСТЬ IV Пороки клапанов сердца
П
а
р
а
м
е
т
р
ы
С
т
е
п
е
н
ь
а
о
р
т
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
И
з
м
е
р
е
н
и
я
П
о
з
и
ц
и
и
П
р
е
и
м
у
щ
е
с
т
в
а
/
н
е
д
о
с
т
а
т
к
и
Л
е
г
к
а
я
У
м
е
р
е
н
н
а
я
Т
я
ж
е
л
а
я
И
м
п
у
л
ь
с
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
Д
и
а
с
т
о
л
и
ч
е
с
к
и
й
р
е
т
р
о
-
г
р
а
д
н
ы
й
п
о
т
о
к
в
п
р
о
к
-
с
и
м
а
л
ь
н
о
м
у
ч
а
с
т
к
е
г
р
у
д
н
о
й
ч
а
с
т
и
н
и
с
х
о
д
я
-
щ
е
г
о
о
т
д
е
л
а
а
о
р
т
ы
К
о
р
о
т
к
и
й
н
е
г
о
л
о
д
и
-
а
с
т
о
л
и
ч
е
-
с
к
и
й
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
н
и
я
С
к
о
р
о
с
т
ь
п
о
т
о
к
а
>
2
0
с
м
/
с
е
к
в
к
о
н
-
ц
е
д
и
а
с
т
о
л
ы
и
л
и
V
T
I
>
1
5
м
м
Г
о
л
о
д
и
а
с
т
о
л
и
ч
е
с
к
и
й
р
е
т
р
о
г
р
а
д
н
ы
й
п
о
-
т
о
к
и
V
T
I
С
у
п
р
а
с
т
е
р
н
а
л
ь
-
н
а
я
,
с
р
а
з
у
д
и
с
-
т
а
л
ь
н
е
е
у
с
т
ь
я
п
о
д
к
л
ю
ч
и
ч
н
о
й
а
р
т
е
р
и
и
З
а
в
и
с
и
т
о
т
Ч
С
С
,
д
л
и
т
е
л
ь
н
о
с
т
и
д
и
а
-
с
т
о
л
ы
и
р
а
с
т
я
ж
и
м
о
с
т
и
а
о
р
т
ы
Д
и
а
с
т
о
л
и
ч
е
с
к
и
й
р
е
-
т
р
о
г
р
а
д
н
ы
й
п
о
т
о
к
в
б
р
ю
ш
н
о
й
ч
а
с
т
и
н
и
с
х
о
-
д
я
щ
е
г
о
о
т
д
е
л
а
а
о
р
т
ы
К
о
р
о
т
к
и
й
в
р
а
н
н
ю
ю
д
и
а
с
т
о
л
у
П
р
о
м
е
ж
у
т
о
ч
н
ы
е
з
н
а
ч
е
н
и
я
В
ы
р
а
ж
е
н
н
ы
й
г
о
л
о
-
д
и
а
с
т
о
л
и
ч
е
с
к
и
й
Г
о
л
о
д
и
а
с
т
о
л
и
ч
е
с
к
и
й
р
е
т
р
о
г
р
а
д
н
ы
й
п
о
-
т
о
к
В
и
з
у
а
л
и
з
а
ц
и
я
б
р
ю
ш
н
о
й
ч
а
с
т
и
н
и
с
х
о
-
д
я
щ
е
г
о
о
т
д
е
л
а
а
о
р
т
ы
С
х
о
ж
и
с
п
р
о
к
с
и
м
а
л
ь
н
ы
м
у
ч
а
с
т
к
о
м
н
и
с
х
о
д
я
щ
е
г
о
о
т
д
е
л
а
а
о
р
т
ы
Н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
P
H
T
(
м
с
е
к
)
†
>
5
0
0
5
0
0
–
2
0
0
<
2
0
0
И
з
м
е
р
е
н
и
е
P
H
T
с
м
о
м
е
н
т
а
с
н
и
ж
е
н
и
я
с
и
г
н
а
л
а
р
е
г
у
р
г
и
т
а
-
ц
и
и
В
л
и
я
е
т
э
л
а
с
т
и
ч
н
о
с
т
ь
п
о
л
о
с
т
е
й
с
е
р
д
-
ц
а
,
д
а
в
л
е
н
и
е
,
о
б
щ
е
е
п
е
р
и
ф
е
р
и
ч
е
-
с
к
о
е
с
о
с
у
д
и
с
т
о
е
с
о
п
р
о
т
и
в
л
е
н
и
е
и
р
а
с
т
я
ж
и
м
о
с
т
ь
а
о
р
т
ы
.
П
а
р
а
м
е
т
р
м
е
н
е
е
п
о
к
а
з
а
т
е
л
е
н
п
р
и
х
р
о
н
и
ч
е
-
с
к
о
й
А
Р
,
к
о
г
д
а
Л
Ж
а
д
а
п
т
и
р
о
в
а
л
с
я
к
п
е
р
е
г
р
у
з
к
е
о
б
ъ
е
м
о
м
*
П
р
и
п
р
е
д
е
л
е
Н
а
й
к
в
и
с
т
а
в
5
0
–
6
0
с
м
/
с
е
к
.
†
P
H
T
у
м
е
н
ь
ш
а
е
т
с
я
п
р
и
в
о
з
р
а
с
т
а
н
и
и
д
и
а
с
т
о
л
и
ч
е
с
к
о
г
о
д
а
в
л
е
н
и
я
в
Л
Ж
и
л
е
ч
е
н
и
и
в
а
з
о
д
и
л
а
т
а
т
о
р
а
м
и
.
М
о
ж
е
т
б
ы
т
ь
у
д
л
и
н
е
н
в
с
л
у
ч
а
е
а
д
а
п
т
а
ц
и
и
Л
Ж
к
х
р
о
н
и
ч
е
с
к
о
й
т
я
ж
е
л
о
й
А
Р
.
E
R
O
A
—
э
ф
ф
е
к
т
и
в
н
а
я
п
л
о
щ
а
д
ь
о
т
в
е
р
с
т
и
я
р
е
г
у
р
г
и
т
а
ц
и
и
;
P
H
T
—
в
р
е
м
я
п
о
л
у
с
п
а
д
а
д
а
в
л
е
н
и
я
;
P
I
S
A
—
п
л
о
щ
а
д
ь
п
р
о
к
с
и
м
а
л
ь
н
о
й
з
о
н
ы
с
т
р
у
и
р
е
г
у
р
г
и
т
а
ц
и
и
;
V
T
I
—
и
н
т
е
г
р
а
л
с
к
о
р
о
с
т
и
к
р
о
-
в
о
т
о
к
а
;
А
Р
—
а
о
р
т
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
;
В
Т
Л
Ж
—
в
ы
х
о
д
н
о
й
т
р
а
к
т
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
.
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
о
к
о
н
ч
а
н
и
е
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
п
а
р
а
м
е
т
р
ы
п
р
и
о
ц
е
н
к
е
с
т
е
п
е
н
и
а
о
р
т
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
ch17.indd 402
03.04.2019 11:54:57
403
17 Аортальная регургитация
ЛИТЕРАТУРА
1. Singh JP, Evans JC, Levy D, et al. Prevalence
and clinical determinants of mitral, tricuspid,
and aortic regurgitation (the Framingham
Heart Study), Am J Cardiol 83:897–902, 1999.
2. Iung B, Baron G, Butchart EG, et al. A pro-
spective survey of patients with valvular heart
disease in europe: the euro heart survey on
valvular heart disease, Eur Heart J 24:1231–
1243, 2003.
3. Tarasoutchi F, Grinberg M, Spina GS, et al.
Ten-year clinical laboratory follow-up after
application of a symptom-based therapeutic
strategy to patients with severe chronic aortic
regurgitation of predominant rheumatic eti-
ology, J Am Coll Cardiol 41:1316–1324, 2003.
4. Roberts WC, Ko JM, Moore TR, et al. Causes
of pure aortic regurgitation in patients having
isolated aortic valve replacement at a single
US tertiary hospital (1993-2005), Circulation
114:422–429, 2006.
5. Muraru D, Badano LP, Vannan M, et al. As-
sessment of aortic valve complex by three-
dimensional echocardiography: a framework
for its effective application in clinical prac-
tice, Eur Heart J Cardiovasc Imaging 13:541–
555, 2012.
6. Schaefer BM, Lewin MB, Stout KK, et al. The
bicuspid aortic valve: an integrated pheno-
typic classification of leaflet morphology and
aortic root shape, Heart 94:1634–1638, 2008.
7. Siu SC, Silversides K. Bicuspid aortic valve
disease, J Am Coll Cardiol 55:2789–2800,
2010.
8. Espinola-Zavaleta N, Munoz-Castellanos L,
Attie
́
F, et al. Anatomic three-dimensional
echocardiographic correlation of bicuspid
aortic valve, J Am Soc Echocardiogr 16:46–53,
2003.
9. Tadros TM, Klein MD, Shapira OM. As-
cending aortic dilatation associated with
bicuspid aortic valve. pathophysiology, mo-
lecular biology, and clinical implications,
Circulation 119:880–890, 2009.
10. Verma S, Siu SC. Aortic dilatation in patients
with bicuspid aortic valve, N Engl J Med
370:1920–1929, 2014.
11. Michelena HI, Khanna AD, Mahoney D, et al.
Incidence of aortic complications in patients
with bicuspid aortic valves, JAMA 306:1104–
1112, 2011.
12. Evangelista A, Gonza
́
lez-Alujas MT. Echo-
cardiography in infective endocarditis, Heart
90:614–617, 2004.
13. Iung B, Baron G, Butchart EG, et al. A pro-
spective survey of patients with valvular heart
disease, Eur Heart J 24:1231–1243, 2003.
14. Akiyama K, Hirota K, Taniyasu N, et al.
Pathogenetic significance of myxomatous
degeneration in fenestration-related massive
aortic regurgitation, Circ J 68:439–443, 2004.
15. Scha
fers HJ, Langer F, Glombitza P, et al.
Aortic valve reconstruction in myxomatous
degeneration of aortic valves: are fenestra-
tions a risk factor for repair failure? J Thorac
Cardiovasc Surg 139:660–664, 2010.
16. Lerakis S, Hayekk SS, Douglas PS. Paravalvul-
ar aortic leak after transcatheter aortic valve
replacement: current knowledge, Circulation
127:397–407, 2013.
17. Le Polain de Waroux JB, Pouleur AC, et al.
Functional anatomy of aortic regurgitation.
accuracy, prediction of surgical repairabil-
ity and outcome implications of transe-
sophageal echocardiography, Circulation
116(Suppl):I264–I269, 2007.
18. Teixido-Tura G, Almeida AL, Choi EY, et al.
Determinants of aortic root dilatation and
reference values among young adults over a
20-year period: coronary artery risk develop-
ment in young adults study, Hypertension
66:23–29, 2015.
19. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the
severity of native valvular regurgitation with
two-dimensional and doppler echocardiog-
raphy, J Am Soc Echocardiogr 16:777–802,
2003.
20. Lancelloti P, Tribouilloy C, Hagendorff A,
et al. European Association of Echocardiog-
raphy recommendations for the assessment
of valvular regurgitation. Part 1: aortic and
pulmonary regurgitation (native valve dis-
ease), Eur J Echocardiogr 11:223–244, 2010.
21. Thomas JD, O’Shea JP, Rodriguez L, et al.
Impact of orifice geometry on the shape of
jets. an in vitro doppler color flow study, J Am
Coll Cardiol 17:901–908, 1991.
22. Taylor AL, Eichhorn EJ, Brickner ME, et
al. Aortic valve morphology: an important
in vitro determinant of proximal regurgitant
jet width by doppler color flow mapping, J
Am Coll Cardiol 16:405–412, 1990.
23. Evangelista A, Garcia del Castillo H, Calvo F,
et al. Strategy for optimal aortic regurgitation
quantification by doppler echocardiography:
agreement among different methods, Am
Heart J 139:773–781, 2000.
24. Smith MD, Grayburn PA, Michael D, et
al. Observer variability in the quantitation
of doppler color flow jet areas for mitral
and aortic regurgitation, J Am Coll Cardiol
11:579–584, 1988.
25. Perry GJ, Helmcke F, Nanda NC, et al. Evalua-
tion of aortic insufficiency by doppler colour
flow mapping, J Am Coll Cardiol 9:952–959,
1987.
26. Tribouilloy CM, Enriquez-Serrano M, Bailey
KR, et al. Assessment of severity of aortic re-
gurgitation using the width of the vena con-
tracta: a clinical color doppler imaging study,
Circulation 102:558–564, 2000.
27. Eren M, Eksik A, Gorgulu S, et al. Determina-
tion of vena contracta and its value in evalu-
ating severity of aortic regurgitation, J Heart
Valve Dis 11:567–575, 2002.
28. Perez de Isla L, Zamorano J, Fernandez-
Golfin C, et al. 3D color-doppler echocardi-
ography and chronic aortic regurgitation: a
novel approach for severity assessment, Int J
Cardiol 166:640–645, 2013.
29. Tribouilloy CM, Enriquez-Serrano M, Fett
SL, et al. Application of the proximal flow
convergence method to calculate the effective
regurgitant orifice area in aortic regurgita-
tion, J Am Coll Cardiol 32:1032–1039, 1998.
30. Pouleur AC, de Waroux JB, Goffinet C, et al.
Accuracy of the flow convergence method
for quantification of aortic regurgitation in
patients with central versus eccentric jets, Am
J Cardiol 102:475–480, 2008.
31. Detaint D, Messika-Zeitoun D, Maalouf J, et
al. Quantitative echocardiographic determin-
ants of clinical outcome in asymptomatic pa-
tients with aortic regurgitation: a prospective
study, JACC Cardiovasc Imaging 1:1–11, 2008.
32. Pirat B, Little SH, Igo SR, et al. Direct meas-
urement of proximal isovelocity surface area
by real-time three-dimensional color doppler
for quantitation of aortic regurgitant volume:
an in vitro validation, J Am Soc Echocardiogr
22:306–313, 2009.
33. Ewe SH, Delgado V, van der Geest R, et al.
Accuracy of three-dimensional versus two-
dimensional echocardiography for quantifi-
cation of aortic regurgitation and validation
by three-dimensional three-directional vel-
ocity-encoded magnetic resonance imaging,
Am J Cardiol 112:560–566, 2013.
34. Tribouilloy C, Avine
́
eP,ShenWF,etal.End
diastolic flow velocity just beneath the aortic
isthmus assessed by pulsed doppler echo-
cardiography: a new predictor of the aortic
regurgitant fraction, Br Heart J 65:37–40,
1991.
35. Griffin BP, Flachskampf FA, Siu S, et al. The
effects of regurgitant orifice size, chamber
compliance, and systemic vascular resistance
on aortic regurgitant velocity slope and pres-
sure half-time, Am Heart J 122(4 Pt1):1049–
1056, 1991.
36. Grayburn PA, Handshoe R, Smith MD, et al.
Quantitative assessment of the hemodynam-
ic consequences of aortic regurgitation by
means of continuous wave doppler record-
ings, J Am Coll Cardiol 10:135–141, 1987.
37. Griffin BP, Flachskampf FA, Reimold SC, et
al. Relationship of aortic regurgitant velocity
slope and pressure half-time to severity of
aortic regurgitation under changing haemo-
dynamic conditions, Eur Heart J 15:681–685,
1994.
38. De Marchi SF, Windecker S, Aeschbacher BC,
et al. Influence of left ventricular relaxation
on the pressure half-time of aortic regurgita-
tion, Heart 82:607–613, 1999.
39. Gottdiener JS, Panza JA, John Sutton M, et al.
Testing the test: the reliability of echocardiog-
raphy in the sequential assessment of valvular
regurgitation, Am Heart J 144:115–121, 2002.
40. Zarauza J, Ares M, Gonza
́
lez Vilchez F, et al.
An integrated approach to the quantification
of aortic regurgitation by doppler echocardi-
ography, Am Heart J 136:1030–1041, 1998.
41. Willett DL, Hall SA, Jessen ME, et al. Assess-
ment of aortic regurgitation by transesopha-
geal color doppler imaging of the vena con-
tracta: validation against an intraoperative
aortic flow probe, J Am Coll Cardiol 37:1450–
1455, 2001.
42. Sato Y, Kawazoe K, Kamata J, et al. Clinical
usefulness of the effective regurgitant orifice
area determined by transesophageal echo-
cardiography in patients with eccentric aortic
regurgitation, J Heart Valve Dis 6:580–586,
1997.
43. Sutton DC, Kluger R, Ahmed SU, et al. Flow
reversal in the descending aorta: a guide to
intraoperative assessment of aortic regurgita-
tion with transesophageal echocardiography,
J Thorac Cardiovasc Surg 108:576–582, 1994.
44. Gabriel RS, Renapurkar R, Bolen MA, et al.
Comparison of severity of aortic regurgita-
tion by cardiovascular magnetic resonance
versus transthoracic echocardiography, Am J
Cardiol 108:1014–1020, 2011.
45. Myerson SG, d’Arcy J, Mohiaddin R, et al.
Aortic regurgitation quantification using
cardiovascular magnetic resonance: asso-
ciation with clinical outcome, Circulation
126:1452–1460, 2012.
46. Cawley PJ, Hamilton-Craig C, Owens DS, et
al. Prospective comparison of valve regurgita-
tion quantitation by cardiac magnetic reson-
ch17.indd 403
03.04.2019 11:54:57
404
ЧАСТЬ IV Пороки клапанов сердца
ance imaging and transthoracic echocardiog-
raphy, Circ Cardiovasc Imaging 6:48–57, 2013.
47. Lang RM, Badano LP, Mor-AVi V, et al. Rec-
ommendations for cardiac chamber quan-
tification by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, J Am Soc Echo-
cardiogr 28:1–39, 2015.
48. Vinereanu D, Ionescu AA, Fraser G. Assess-
ment of left ventricular long axis contraction
can detect early myocardial dysfunction in
asymptomatic patients with severe aortic re-
gurgitation, Heart 85:30–36, 2001.
49. Paraskevaidis IA, Kyrzopoulos S, Farmakis D,
et al. Ventricular long-axis contraction as an
earlier predictor of outcome in asymptomatic
aortic regurgitation, Am J Cardiol 100:1677–
1682, 2007.
50. Olsen NT, Sogaard P, Larsson HB, et al.
Speckle-tracking echocardiography for pre-
dicting outcome in chronic aortic regur-
gitation during conservative management
and after surgery, JACC Cardiovasc Imaging
4:223–230, 2011.
51. Ewe SH, Haeck ML, Ng AC, et al. Detection
of subtle left ventricular systolic dysfunction
in patients with significant aortic regurgita-
tion and preserved left ventricular ejection
fraction: speckle tracking echocardiographic
analysis, Eur Heart J Cardiovasc Imaging,
2015. [Epub ahead of print.] .
52. Kusunose K, Agarwal S, Marwick TH, et al.
Decision making in asymptomatic aortic re-
gurgitation in the era of guidelines: incremen-
tal values of resting and exercise cardiac dys-
function, Circ Cardiovasc Imaging 7:352–362,
2014.
53. Le Polain de Waroux JB, Pouleur AC, Gof-
finet C, et al. Combined coronary and late-
enhanced multidetector-computed tomog-
raphy for delineation of the etiology of left
ventricular dysfunction: comparison with
coronary angiography and contrast-enhanced
cardiac magnetic resonance imaging, Eur
Heart J 29:2544–2551, 2008.
54. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Thorac Cardiovasc
Surg 148:e1–e132, 2014.
55. Wahi S, Haluska B, Pasquet A, et al. Exercise
echocardiography predicts development of
left ventricular dysfunction in medically and
surgically treated patients with asymptomatic
severe aortic regurgitation, Heart 84:606–614,
2000.
56. Fazel SS, David TE. Aortic valve-sparing
operations for aortic root and ascending aor-
tic aneurysms, Curr Opin Cardiol 22:497–503,
2007.
57. Scha
fers HJ, Schmied W, Marom G, et al.
Cusp height in aortic valves, J Thorac Cardio-
vasc Surg 146:269–274, 2013.
58. La Canna G, Maisano F, De Michele L, et al.
Determinants of the degree of functional aor-
tic regurgitation in patients with anatomically
normal aortic valve and ascending thoracic
aorta aneurysm. Transoesophageal Doppler
echocardiography study, Heart 95:130–136,
2009.
59. Evangelista A, Flachskampf Erbel R, et al.
Echocardiography in aortic diseases: EAE
recommendations for clinical practice, Eur J
Echocardiogr 11:645–658, 2010.
60. Gaasch WH, Sundaram M, Meyer TH. Man-
aging asymptomatic patients with chronic
aortic regurgitation, Chest 111:1702–1709,
1997.
61. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012), Eur Heart J
33:2451–2496, 2012.
62. Bonow RO, Rosing DR, McIntosh CL, et al.
The natural history of asymptomatic patients
with aortic regurgitation and normal left
ventricular function, Circulation 68:509–517,
1983.
63. Bonow RO, Lakatos E, Maron BJ, et al. Serial
long-term assessment of the natural history
of asymptomatic patients with chronic aor-
tic regurgitation and normal left ventricular
systolic function, Circulation 84:1625–1635,
1991.
64. Siemienczuk D, Greenberg B, Morris C, et al.
Chronic aortic insufficiency: factors associ-
ated with progression to aortic valve replace-
ment, Ann Intern Med 110:587–592, 1989.
65. Scognamiglio R, Rahimtoola SH, Fasoli G, et
al. Nifedipine in asymptomatic patients with
severe aortic regurgitation and normal left
ventricular function, N Engl J Med 331:689–
694, 1994.
66. Tornos MP, Olona M, Permanyer-Miralda
G, et al. Clinical outcome of severe asymp-
tomatic chronic aortic regurgitation: a long-
term prospective follow-up study, Am Heart
J 130:333–339, 1995.
67. Ishii K, Hirota Y, Suwa M, et al. Natural his-
tory and left ventricular response in chronic
aortic regurgitation, Am J Cardiol 78:357–361,
1996.
68. Borer JS, Hochreiter C, Herrold EM, et al.
Prediction of indications for valve replace-
ment among asymptomatic or minimally
symptomatic patients with chronic aortic
regurgitation and normal left ventricular per-
formance, Circulation 97:525–534, 1998.
69. Evangelista A, Tornos P, Sambola A, et al.
Long-term vasodilator therapy in patients
with severe aortic regurgitation, N Engl J Med
353:1342–1349, 2005.
70 Tarasoutchi F, Grinberg M, Spina GS, et al.
Ten-year clinical laboratory follow-up after
application of a symptom-based therapeutic
strategy to patients with severe chronic aortic
regurgitation of predominant rheumatic eti-
ology, J Am Coll Cardiol 41:1316–1324, 2003.
71. Aronow WS, Ahn C, Kronzon I, et al. Prog-
nosis of patients with heart failure and un-
operated severe aortic valvular regurgitation
and relation to ejection fraction, Am J Cardiol
74:286–288, 1994.
72. Dujardin KS, Enriquez-Sarano M, Schaff
HV, et al. Mortality and morbidity of aortic
regurgitation in clinical practice: a long-term
follow-up study, Circulation 99:1851–1857,
1999.
73. Kusunose K, Cremer PC, Tsutsui RS, et al. Re-
gurgitant volume informs rate of progressive
cardiac dysfunction in asymptomatic patients
with chronic aortic or mitral regurgitation,
JACC Cardiovasc Imaging 8:14–23, 2015.
74. Greenberg BH, DeMots H, Murphy E, et al.
Beneficial effects of hydralazine on rest and
exercise hemodynamics in patients with
chronic severe aortic insufficiency, Circula-
tion 62:49–55, 1980.
75. Tornos P, Olona M, Permanyer-Miralda G, et
al. Heart failure after aortic valve replacement
for aortic regurgitation: prospective 20-year
study, Am Heart J 136:681–687, 1998.
76. Enriquez-Sarano M, Tajik AJ. Clinical prac-
tice: aortic regurgitation, N Engl J Med
351:1539–1546, 2004.
77. Sambola A, Tornos P, Ferreira-Gonzalez I,
Evangelista A. Prognostic value of preopera-
tive indexed end-systolic left ventricle diam-
eter in the outcome after surgery in patients
with chronic aortic regurgitation, Am Heart J
155:1114–1120, 2008.
78. Chaliki HP, Mohty D, Avierinos J-F, et al.
Outcomes after aortic valve replacement in
patients with severe aortic regurgitation and
markedly reduced left ventricular function,
Circulation 106:2687–2693, 2002.
79. Tornos P, Sambola A, Permanyer-Miralda G,
et al. Long-term outcome of surgically treated
aortic regurgitation: influence of guidelines
adherence toward early surgery, J Am Coll
Cardiol 47:1012–1017, 2006.
80. Bonow RO, Dodd JT, Maron BJ, et al. Long-
term serial changes in left ventricular func-
tion and reversal of ventricular dilatation
after valve replacement for chronic aortic re-
gurgitation, Circulation 78:1108–1120, 1988.
81. Borger MA, Preston M, Ivanov J, et al. Should
the ascending aorta be replaced more fre-
quently in patients with bicuspid aortic valve
disease? J Thorac Cardiovasc Surg 128:677–
683, 2004.
82. Chiappini B, Absil B, Rubay J, et al. The Ross
procedure: clinical and echocardiographic
follow-up in 219 consecutive patients, Ann
Thorac Surg 83:1285–1289, 2007.
83. Kari FA, Siepe M, Sievers HH, et al. Repair of
the regurgitant bicuspid or tricuspid aortic
valve: background, principles, and outcomes,
Circulation 128:854–863, 2013.
84. Pacini D, Ranocchi F, Angeli E, et al. Aortic
root replacement with composite valve graft,
Ann Thorac Surg 76:90–98, 2003.
85. Hiratzka LF, Bakris GL, Beckman JA, et al.
2010 ACCF/AHA/AATS/ACR/ASA/SCA/
SCAI/SIR/STS/SVM guidelines for the diag-
nosis and management of patients with thor-
acic aortic disease, Circulation 122:e410, 2010.
86. Mazzitelli D, Stamm C, Rankin JS, et al. Leaf-
let reconstructive techniques for aortic valve
repair, Ann Thorac Surg 98:2053–2060, 2014.
87. Jasinsky MJ, Gocol R, Malinowski M, et al.
Predictors of early and medium-term out-
come of 200 consecutive aortic valve and root
repairs, J Thorac Cardiovasc Surg 149:123–
129, 2015.
88. Charitos EI, Stierle U, Tietze C, et al. Clin-
ical outcomes and lessons learned with aortic
valve repair in 508 patients, J Heart Valve Dis
23:550–557, 2014.
89. Khoury El, Glineur D, Rubay J, et al. Func-
tional classification of aortic root/valve ab-
normalities and their correlation with etiolo-
gies and surgical procedures, Curr Opin Car-
diol 20:115–121, 2005.
90. Petterson GB, Crucean AC, Savage R, et al.
Towards predictable repair of regurgitant
aortic valve. a systematic morphology-
directed approach to bicommissural repair, J
Am Coll Cardiol 52:40–49, 2008.
91. David TE, Armstrong S, Maganti M, et al.
Long-term results of aortic valve-sparing
operations in patients with Marfan syn-
drome, J Thorac Surg 138:859–864, 2009.
92. Aicher D, Kunihara T, Abou Issa O, et al.
Valve configuration determines long-term re-
sults after repair of the bicuspid aortic valve,
Circulation 123:178–185, 2011.
ch17.indd 404
03.04.2019 11:54:57
405
17 Аортальная регургитация
93. Svensson LG, Al Kindi AH, Vivacqua A, et al.
Long-term durability of bicuspid aortic valve
repair, Ann Thorac Surg 97:1539–1547, 2014.
94. Takkenberg JJ, Klieverik LM, Schoof PH, et
al. The Ross procedure: a systematic review
and meta-analysis, Circulation 119:222–228,
2009.
95. Stout KK, Verrier E. Acute valvular regurgita-
tion, Circulation 119:3232–3241, 2009.
96. Movsowitz HD, Levine RA, Higenberg AD,
et al. Transesophageal echocardiography.
Description of the mechanisms of aortic re-
gurgitation in acute type A aortic dissection:
implications for aortic valve repair, J Am Coll
Cardiol 36:884–890, 2000.
97. Tornos P, Iung B, Permanyer-Miralda G, et al.
Infective endocarditis in europe: lessons from
the euro heart survey, Heart 91:571–575,
2005.
98. Habib G, Lancellotti P, Antunes MJ, et al.
2015 ESC guidelines for the management of
infective endocarditis: the task force for the
management of infective endocarditis of the
european society of cardiology (ESC), Eur
Heart J, 2015. [Epub ahead of print.] .
99. Prendergast BD, Tornos P. Surgery for infect-
ive endocarditis: who and when? Circulation
121:1141–1152, 2010.
100. Vikram HR, Buenconsejo J, Hasbun R,
Quagliarello VJ. Impact of valve surgery on
6-month mortality in adults with complicat-
ed, left-sided native valve endocarditis: a pro-
pensity analysis, JAMA 290:3207–3214, 2003.
ch17.indd 405
03.04.2019 11:54:57
ch17.indd 406
03.04.2019 11:54:57
407
18 Митральная регургитация
JUDY HUNG, MD • FRANCESCA NESTA DELLING, MD • ROMAIN CAPOULADE, PHD
Анатомия и патофизиология
Анатомия митрального клапана
Механизмы митральной
регургитации
Количественная оценка
митральной регургитации
Методы цветовой
допплерографии
Методы определения объемов
с помощью импульсно-волновой
допплерографии
Дополнительные данные
эхокардиографии и допплерографии
Роль трехмерной эхокардиографии
Значение гемодинамических и
физиологических факторов
Интегративный подход при оценке
митральной регургитации
Хирургическое вмешательство
Течение заболевания
Выбор времени проведения
вмешательства
Клинические аспекты
Митральная регургитация (МР) — распространен-
ная клапанная патология, которая в значительной
мере обусловливает заболеваемость и смертность
при сердечно-сосудистых заболеваниях [1–9]. В хо-
де популяционного исследования частота легкой
или умереной МР составила 20% среди взрослых
[10–12]. В США около 30 000 пациентов ежегодно
подвергаются оперативным вмешательствам на ми-
тральном клапане в связи со значительной (умерен-
ной или тяжелой) МР [13]. МР может быть первич-
ной (патология клапана) или вторичной (ишемиче-
ской или функциональной).
Первичная МР возникает в результате патологи-
ческих изменений створок, например пролапса, мо-
лотящей створки, или поражений подклапанного
аппарата митрального клапана при инфекционном
эндокардите. Вторичная МР обусловлена ишемиче-
ским или миопатическим поражением левого желу-
дочка (ЛЖ) с последующим его ремоделированием
в основании папиллярных мышц. Важно различать
первичную и вторичную МР, поскольку от этого за-
висит тактика лечения.
В клинической практике важную роль играет точ-
ная количественная оценка МР. Появление в начале
1980-х гг . допплерографии предоставило возмож-
ность неинвазивной количественной оценки МР.
Тактика ведения пациента с МР всецело зависит от
точного определения ее причины и степени выра-
женности. В этой главе рассмотрены механические
причины МР, ее количественная оценка и влияние
результатов на принятие клинических решений.
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
АНАТОМИЯ МИТРАЛЬНОГО КЛАПАНА
ЭМБРИОЛОГИЯ И СТРОЕНИЕ МИТРАЛЬНОГО КЛАПАНА
Аппарат митрального клапана формируется путем
деламинации миокарда желудочков после образова-
ния атриовентрикулярных клапанов из эндокарди-
альных подушек. К аппарату митрального клапана
относятся фиброзное кольцо, створки, сухожиль-
ные хорды и папиллярные мышцы. Для понимания
функции митрального клапана и механизма пер-
вичной и вторичной МР важно досконально знать
анатомическое строение его аппарата.
ФИБРОЗНОЕ КОЛЬЦО МИТРАЛЬНОГО КЛАПАНА
Фиброзное кольцо митрального клапана — часть
фиброзного скелета сердца. Оно представляет собой
фиброзно-мышечную структуру, которая располо-
жена между левым предсердием (ЛП) и ЛЖ и слу-
жит местом прикрепления створок. Площадь по-
перечного сечения фиброзного кольца митрально-
го клапана (CSAФКМК) — 5 –11 см2 (в среднем 7 см2).
В норме фиброзное кольцо митрального клапа-
на похоже на букву D и имеет седловидную фор-
му: две части (передняя и задняя) направлены вверх
(к ЛП) и две части (медиальная и латеральная) на-
правлены вниз (к ЛЖ) [14, 15]. Результаты исследо-
ваний in vitro и с помощью компьютерного модели-
рования показали, что такая форма наиболее опти-
мальна для минимизации нагрузки на створки при
их открывании и закрывании [16–19].
ch18.indd 407
03.04.2019 11:55:09
408
ЧАСТЬ IV Пороки клапанов сердца
Передняя часть фиброзного кольца митрально-
го клапана (прямой участок буквы D) имеет общую
стенку с фиброзным кольцом аортального клапана
в месте прикрепления некоронарной и левой коро-
нарной створок. Эту общую стенку называют inter-
valvular f ibrosa, или фиброзным контактом между
аортальным и митральным клапанами. Длина зад-
ней части фиброзного кольца превышает протя-
женность передней части. Из-за фиброзных уплот-
нений передняя часть фиброзного кольца более
ригидна, чем задняя часть, и относительно фикси-
рована, поэтому дилатация фиброзного кольца ми-
трального клапана происходит преимущественно в
его задней части [20]. Фиброзное кольцо митраль-
ного клапана находится в движении в течение всего
сердечного цикла и подвержено влиянию механиз-
мов сокращения и наполнения полостей.
СТВОРКИ МИТРАЛЬНОГО КЛАПАНА
У митрального клапана две створки — передняя и
задняя. Площадь поверхности и толщина перед-
ней створки больше задней (рис. 18.1). Передняя
створка прикрепляется к передней части фиброзно-
Аортальный
клапан
Левый коронарный синус
Некоронарный синус
Фиброзный контакт
между аортальным и митральным клапанами
Передняя створка
A2
P2
Задняя створка
Переднелатеральная
комиссура
Заднемедиальная
комиссура
A1
A3
P1
P3
Рис. 18.1 Створки митрального капана. Вид митрального клапана со сто-
роны левого предсердия (аналогично изображению клапана при 3D-ЧПЭхоКГ).
Передняя створка (anterior, A) больше задней (posterior, P), но имеет меньшую
длину по окружности фиброзного кольца. У каждой створки есть три сегмен-
та — переднелатеральный (1), средний (2) и заднемедиальный (3), которые
обозначают согласно номенклатуре Carpentier как А1, А2 , А3 (передняя створ-
ка) и Р1, Р2 , Р3 (задняя створка). С помощью этой номенклатуры специалисты
по ультразвуковой диагностике и хирурги указывают локализацию дисфунк-
ции клапана.
го кольца митрального клапана и посредством фи-
брозного контакта между аортальным и митраль-
ным клапанами связана с некоронарной и левой ко-
ронарной створками аортального клапана. Задняя
створка имеет серповидную форму меньшую пло-
щадь поверхности, чем передняя, несмотря на бо
́
ль-
шую длину прикрепления к фиброзному кольцу.
Передняя и задняя створки соединены между собой
посредством заднемедиальной и переднелатераль-
ной комиссур. Каждую створку разделяют на три
сегмента: А1 и Р1 — переднелатеральные, А2 и Р2 —
средние и А3 и Р3 — заднемедиальне (см. рис. 18.1).
Сегменты задней створки отделены друг от друга
тонкими расщелинами.
СУХОЖИЛЬНЫЕ ХОРДЫ И ПАПИЛЛЯРНЫЕ МЫШЦЫ
Сухожильные хорды митрального клапана, кото-
рых обычно 25, представляют собой тонкие фи-
брозные структуры из коллагена, оплетающего эла-
стиновые волокна. Сухожильные хорды соединяют
папиллярные мышцы и створки митрального кла-
пана. Во время систолы папиллярные мышцы со-
кращаются и фиксируют створки, обеспечивая сим-
метричную их коаптацию и предотвращая пролапс
в ЛП.
Папиллярные мышцы крепятся между апикаль-
ной части и средней трети свободной стенки ЛЖ.
Папиллярные мышцы делятся на переднелатераль-
ную и заднемедиальную [21]. Самая большая из
них — переднелатеральная. Она имеет тело и две
головки (переднюю и заднюю). Кровоснабжение
этой мышцы осуществляется первой ветвью тупо-
го края огибающей артерии и первой диагональной
ветвью передней нисходящей артерии. Заднемеди-
альная папиллярная мышца меньше по размеру и
имеет два тела и три головки (переднюю, промежу-
точную и заднюю). Кровоснабжение этой мышцы в
90% случаев осуществляется из задней нисходящей
артерии (ветвью правой коронарной артерии), а в
10% случаев — из огибающей артерии и, следова-
тельно, более уязвима в случае ишемии [22].
От каждой папиллярной мышцы к каждой створ-
ке отходит равное количество сухожильных хорд. К
медиальной половине каждой створки прикрепля-
ются сухожильные хорды, отходящие от заднеме-
диальной папиллярной мышцы, к латеральной по-
ловине каждой створки — сухожильные хорды, ко-
торые идут от переднелатеральной папиллярной
мышцы (рис. 18.2).
МЕХАНИЗМЫ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
МР подразделяют на первичную и вторичную. Ме-
ханизм первичной МР связан с патологией клапана
(створок и сухожильных хорд), в то время как ос-
новной механизм вторичной МР обусловлен дила-
тацией ЛЖ вследствие ишемического или миопати-
ческого процесса, который приводит к изменению
ch18.indd 408
03.04.2019 11:55:10
409
18 Митральная регургитация
ПС
A3
A2
A1
P3
P1
P2
ЗС
ПЛПМ
ЗМПМ
Рис. 18.2 Сухожильные хорды митрального клапана. К медиальной по-
ловине каждой створки (А3 и половина А2; Р3 и половина Р2) прикрепляют-
ся сухожильные хорды, отходящие от заднемедиальной папиллярной мышцы
(ЗМПМ), а к латеральной половине каждой створки (А1 и половина А2; Р1 и
половина Р2) прикрепляются сухожильные хорды, отходящие от переднелате-
ральной папиллярной мышцы (ПЛПМ). Первичные сухожильные хорды (стрел-
ки) имеют ветвящиеся участки и размещаются на краю створок. ЗС — задняя
створка; ПС — передняя створка [Mills SE, editor. Histology for pathologists, ed
3. Baltimore, MD , 2007, Lippincott Williams and Wilkins].
Первичная митральная регургитация
Дегенеративные нарушения
Пролапс митрального клапана
Утолщение/ кальцификация
Ревматическое заболевание
Утолщение створок с ограничением подвижности задней створки
Сочетанный порок митрального клапана (МС и МР)
Инфекционный эндокардит
Вегетации, деструкция тканей (см. главу 22)
Перфорация створок
Системное воспалительное заболевание
Болезнь Либмана–Сакса (см. главу 35)
Злокачественное заболевание
Кахектический эндокардит
Генетические нарушения соединительной ткани
(например, синдром Марфана, синдром Элерса–Данло)
Избыточная ткань створок (см. главу 38)
Облучение
Диффузное утолщение и кальцификация створок
Сочетанный порок митрального клпана (МС и МР)
Прием лекарственных препаратов
(например, анорексигена, эрготомина)
Диффузное утолщение створок
Врожденные патологии
Раздвоенный/парашютообразный митральный клапан
Вторичная митральная регургитация
Структурные изменения митрального клапана
Ишемическая болезнь сердца, кардиомиопатия и др.
Дилатация фиброзного кольца митрального клапана
Обычно при фибрилляции предсердий
МП — митральная регургитация; МС — митральный стеноз.
ТАБЛИЦА 18.1 Механизмы митральной регургитации
нормальных геометрических соотношений ми-
трального клапана и ЛЖ. При вторичной МР мор-
фология створок соответствует норме. В табл. 18.1
приведены причины первичной и вторичной МР.
ПЕРВИЧНАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Дегенеративное поражение митрального клапана —
причина большинства случаев первичной МР. Деге-
неративное поражение митрального клапана вклю-
чает пролапс митрального клапана (ПМК), неспеци-
фическую кальцификацию и утолщение створок,
обусловленные возрастными изменениями и раз-
личными сопутствующими заболеваниями (хрони-
ческой болезнью почек, сахарным диабетом и арте-
риальной гипертензией). Органическое поражение
митрального клапана — еще один широко исполь-
зуемый термин для первичного порока митрально-
го клапана, главным образом ПМК.
ПМК характеризуется смещением его створок во
время систолы по меньшей мере на 2 мм от плоско-
сти фиброзного кольца (рис. 18.3) [14]. ПМК может
сопутствовать МР или утолщение створок. У паци-
ентов с эхокардиографическими признаками утол-
щения створок на аутопсии обычно определяются
миксоматозные изменения. По данным современ-
ных исследований частота ПМК составляет при-
близительно 2,4%. Ежегодно в США большинство
из 10 000 изолированных операций на митральном
клапане выполняют по поводу МР, обусловленной
ПМК [13, 23].
Давно признан семейный характер ПМК с ауто-
сомно-доминантным типом наследования и пере-
менной пенетрантностью в зависимости от возрас-
та и пола [24]. На сегодняшний день описано три
локуса на хромосомах 11, 16 и 13, которые отвеча-
ют за аутосомно-доминантный несиндромальный
ПМК, что указывает на гетерогенность заболева-
ния [25–27]. К ПМК относят изменения от пролап-
са створки до молотящей створки. Легкая степень
ПМК («минимальное систолическое смещение» и
ch18.indd 409
03.04.2019 11:55:10
410
ЧАСТЬ IV Пороки клапанов сердца
Коаптация
Коаптация
Коаптация
ПЖ
ПЖ
ПЖ
ЛЖ
ЛП
ЛЖ
ЛЖ
Ао
Ао
Ао
А
Б
В
Рис. 18.4 Анатомические варианты пролапса митрального клапана. Визуализация в парастернальной позиции по длинной оси. Наблюдается минимальное
систолическое смещение (А) и аномальное смещение коаптации створок кпереди (Б), а также пролапс задней створки митрального клапана (В). Заметно полное
провисание задней створки (стрелки) относительно передней створки. При пролапсе четко видно смещение створки относительно отверстия митрального клапана
(пунктирная линия) в сторону левого предсердия (ЛП). Пролапс задней створки митрального клапана и смещение коаптации створок кпереди— характерные при-
знаки, включая увеличенную высоту сопоставления и удлинение задней створки. Aо — аорта; ЛЖ — левый желудочек; ПЖ — правый желудочек.
Рис. 18.3 A Пролапс митрального клапана. В парастернальной позиции
по длинной оси продемонстрирован пролапс задней створки митрального кла-
пана — смещение ее на 2 мм и более в сторону левого предсердия от плоско-
сти фиброзного кольца (желтая линия) во время систолы.
«аномальное смещение коаптации створок кпере-
ди») впервые были описаны при наблюдении се-
мейных ПМК [27] (рис. 18.4А, Б). Фенотип мини-
мального систолического смещения и аномального
смещения коаптации створок кпереди вносит вклад
в чрезмерную подвижность створок, а также движе-
ния в сторону ЛП, пролапса задней створки относи-
тельно передней (даже при отсутствии диагности-
ческой количественной оценки) и асимметричной
коаптации. Кроме того, при аномальном смещении
коаптации створок избыточная ткань створки так-
же может смещаться кпереди со смещением зоны
коаптации в направлении перегородки и корня аор-
ты, аналогично пролапсу задней створки (см. рис.
18.4Б, В).
Молотящая створка характеризуется выгиба-
нием ее в обратную сторону с потерей нормальной
вогнутой формы (рис. 18.5), в результате дисталь-
ный участок створки перемещается в ЛП. Молотя-
щая створка почти всегда ассоциируется с тяжелой
МР и отрывом первичных или краевых сухожиль-
ных хорд. Редко молотящая створка может быть об-
условлена только удлинением сухожильной хорды.
В любом случае при молотящейся створке наблюда-
ется недостаточная коаптация створок.
ПМК часто наблюдается при фиброэластическом
дефиците или болезни Барлоу [28–31]. Фиброэласти-
ческий дефицит проявляется нарушением структуры
или функции соединительной ткани створки (рис.
18.6). Фиброэластический дефицит обычно диагно-
стируют у пациентов на шестом десятилетии жиз-
ни при остро возникшей МР, обусловленной, ско-
рее всего, отрывом сухожильной хорды митрально-
го клапана [30]. Как правило, отрыв сухожильных
хорд происходит вследствие прогрессирующего их
ослабления и удлинения. Обычно поражается сред-
ний сегмент задней створки, а сами створки обыч-
но без изменений размеров или свойств ткани [32].
В случае болезни Барлоу происходит патологи-
ческое отложение мукополисахаридов на створках
и сухожильных хордах, в результате створки ста-
новятся утолщенными и чрезмерно увеличенны-
ми, а сухожильные хорды удлиняются, что и приво-
дит к пролапсу (рис. 18.7). Это заболевание обычно
ch18.indd 410
03.04.2019 11:55:10
411
18 Митральная регургитация
го клапана > 5 мм в М-режиме связана с повышен-
ным риском внезапной смерти, инфекционного эн-
докардита и МР [36, 37], этот показатель не является
независимым прогностическим фактором леталь-
ности и тяжести порока клапана [38].
К другим причинам МР, связанной с поражени-
ем клапана, относят инфекционный эндокардит,
включая вальвулит с утолщением створок, вегета-
ции с разрушением и перфорацией створки (рис.
18.8).
В развитых странах МР, обусловленная ревма-
тическим поражением, встречается относительно
редко и, как правило, сочетается с ревматическим
стенозом митрального клапана. Ревматическое по-
ражение митрального клапана остается распростра-
ненной причиной МР в развивающихся странах
[39]. Механизм ревматической МР связан с утолще-
нием створок, рубцеванием или ограничением под-
вижности задней створки, что препятствует пол-
ной коаптации створок (рис. 18.9). Эти проявления
сходны с МР, вызванной приемом анорексигена или
других лекарственных препаратов.
К редким причинам МР относят небактериаль-
ный пристеночный тромбоэндокардит (появление
на митральном клапане стерильных вегетаций, воз-
никающих на фоне злокачественных новообразо-
ваний и системных воспалительных заболеваний)
[40], и поражения митрального клапана, вызванные
облучением или приемом лекарственных препара-
тов.
Кальцификация фиброзного кольца митраль-
ного клапана с распространением на тела створок
часто приводит к комбинированному пороку ми-
трального клапана — стенозу и регургитации. У не-
большого количества взрослых пациентов МР обу-
Рис. 18.5 A Молотящая створка митрального клапана. Модифициро-
ванная апикальная позиция по длинной оси. Молотящая створка митрального
клапана возникает в случае отрыва или удлинения сухожильной хорды.
Молотящая
створка
Отрыв
сухожильной хорды
А
Б
Рис. 18.6 Молотящая створка при фиброэластическом дефиците митрального клапана. (А) 2D-ЧПЭхоКГ. Пролапс и флотация сегмента Р2 (стрелка).
(Б) A 3D-ЧПЭхоКГ. Пролапс и флотация сегмента Р2 (*), ассоциированное с отрывом сухожильной хорды (стрелка).
наблюдается у молодых женщин и протекает отно-
сительно стабильно до четвертого десятилетия [30,
33]. При болезни Барлоу поражение створок носит
диффузный и комплексный характер с пролапсом
и миксоматозной дегенерацией нескольких сегмен-
тов одной или обеих створок вследствие избыточ-
ной ткани створки, ее утолщения и/или отрыва не-
скольких сухожильных хорд. У пациентов с болез-
нью Барлоу также часто наблюдается дилатация
фиброзного кольца и различная степень кальцифи-
кации его и подклапанного аппарата, в частности
задней части фиброзного кольца и переднемедиаль-
ной папиллярной мышцы [31, 34].
При ПМК с умеренной или тяжелой степенью
МР и ФВ < 50% прогноз неблагоприятный [35].
Несмотря на то что толщина створок митрально-
ch18.indd 411
03.04.2019 11:55:11
412
ЧАСТЬ IV Пороки клапанов сердца
А
Б
Рис. 18.7 Пролапс двух створок митрального клапана при болезни Барлоу. (А) 2D-ЧПЭхоКГ. Пролапс обеих створок (стрелки). (Б) A 3D-ЧПЭхоКГ. Диф-
фузное поражение обеих створок.
словлена врожденным пороком митрального кла-
пана.
У детей наиболее распространенным пороком
развития, приводящим к МР, является ПМК [41]. К
недостаточной коаптации створок приводит расще-
пление передней створки митрального клапана (по-
рок, который чаще всего встречается в комплексе с
открытым атриовентрикулярным каналом или, ре-
же, изолированно) [42]. Другие врожденные пороки
митрального клапана, в частности митральный кла-
пан с двойным отверстием и парашютообразный
митральный клапан, часто приводят к комбиниро-
ванному пороку митрального клапана — регурги-
тации и стенозу [43].
ВТОРИЧНАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Вторичная МР возникает в результате ишемическо-
го или миопатического ремоделирования ЛЖ. При
этом створки в основном соответствуют норме. Ме-
ханизм вторичной МР — дилатация или ишемиче-
ская деформация миокарда в основании папилляр-
ных мышц, что приводит к латеральному смеще-
нию и неполной коаптации створок митрального
клапана. Смыкающие силы при сокращении ЛЖ
направлены на противодействие силам подтягива-
ния. При вторичной МР силы подтягивания прео-
долевают смыкающие силы, что препятствует пра-
вильной коаптации створок (рис. 18.10). Менее
частая причина вторичной МР — дилатация фи-
А
Б
В
Рис. 18.8 Инфекционный эндокардит митрального клапана. (А) Крупные вегетации на митральном клапане (стрелка). (Б) Фенестрация створки (белые
стрелки) и вегетации (желтая стрелка). (В) Митральная регургитация (стрелки).
ch18.indd 412
03.04.2019 11:55:11
413
18 Митральная регургитация
брозного кольца митрального клапана без призна-
ков дилатации или дисфункции ЛЖ и/или подтяги-
вания створок митрального клапана. Это чаще всего
наблюдается в сочетании с фибрилляцией предсер-
дий, при которой вклад в развитие МР вносит дис-
функция фиброзного кольца митрального клапана.
Вторичная МР наблюдается чаще первичной, т.к.
частота ишемической болезни сердца намного пре-
вышает частоту первичных пороков митрально-
го клапана. Частота развития легкой или более вы-
раженной МР после инфаркта миокарда составля-
ет до 50% и связана с неблагоприятным прогнозом
[5, 6, 44]. У 50% пациентов с хронической сердечной
недостаточностью, обусловленной систолической
дисфункцией, наблюдается умеренная или тяжелая
степень МР [7–9].
Вторичная МР может быть ишемической либо
функциональной. Ишемическая МР возникает ис-
ключительно в результате ишемической болезни
сердца. Существенное значение при ишемической
МР имеет отрыв папиллярной мышцы, частота сре-
ди пациентов с инфарктом миокарда составляет
Рис. 18.9 Ревматическая митральная регургитация. (А, Б) При ревматическом пороке митрального клапана задняя створка становится ригидной (стрелки).
(В, Г) Митральная регургитация в результате нарушения коаптации створок.
Г
В
А
Б
1,0% [45]. Также ишемическая МР может развиться
в результате острой ишемии миокарда. В этом слу-
чае МР носит транзиторный характер и разрешается
после разрешения острой ишемии. Чаще наблюда-
ется ишемическая МР, обусловленная хроническим
ремоделированием ЛЖ после инфаркта миокар-
да, которое приводит к деформации геометрии ми-
трального клапана [46]. Акинезия, рубец или анев-
ризма в зоне инфаркта либо ишемия миокарда в
основании папиллярных мышц сопровождаются
латеральным смещением вовлеченных папилляр-
ных мышц, что приводит к подтягиванию створок
митрального клапана и неполному его закрытию
(рис. 18.11). Эхокардиографические признаки: об-
разование «тента», который лучше всего визуали-
зируется в апикальной четырехкамерной позиции
в середине систолы, утрата нормальной выпуклой
формы и формирование вогнутой формы и изгиб
передней створки в результате подтягивания (рис.
18.12). Поскольку папиллярные мышцы располо-
жены вдоль нижнебоковой и заднебоковой стенок,
частота ишемической МР выше при инфаркте зад-
ch18.indd 413
03.04.2019 11:55:12
414
ЧАСТЬ IV Пороки клапанов сердца
Рис. 18.10 Механизм вторичной митральной регургитации. (А) Нормальное строение митрального клапана. Нормальный угол между папиллярной мышцей
(ПМ) и плоскостью фиброзного кольца митрального клапана (пунктирная линия) обеспечивают нормальное натяжение сухожильных хорд. (Б) При заболевании
происходит смещение папиллярной мышцы или изменение формы левого желудочка (ЛЖ) (как при ишемической болезни сердца), что препятствует нормально-
му подтягиванию сухожильных хорд, в результате силы, направленные на закрытие клапана, ослабевают, и клапан закрывается неполностью. Дилатация фиброз-
ного кольца митрального клапана в дальнейшем может способствовать ограничению закрытия створок. Ао — аорта; ЛП — левое предсердие; МР — митральная
регургитация.
ПМ
ЛЖ
ЛП
ПМ
Подтягивание
сухожильных
хорд
Ао
Ао
МР
Ослабление сил,
направленных
на закрытие клапана
Ограничение
закрытия
клапана
Смещение
папиллярной
мышцы
Изменение
формы ЛЖ
Нормальное натяжение
сухожильных хорд
А
Б
Рис. 18.11 Аневризма нижней стенки левого желудочка. (А) Аневризма (стрелки) нижней стенки после инфаркта миокарда. (Б) Это приводит к изменению
стенки, которое влечет за собой подтягивание створок, неполное закрытие клапана и развитие митральной регургитации.
А
Б
ch18.indd 414
03.04.2019 11:55:13
415
18 Митральная регургитация
ней стенки, чем при инфаркте передней [47]. Одна-
ко ишемическая МР может развиться при любом
обширном инфаркте миокарда, который сопрово-
ждается значительной дилатацией и ремоделиро-
ванием ЛЖ, оказывающими влияние на геометрию
митрального клапана.
Термин функциональная митральная регургита-
ция используют как синоним вторичной митраль-
ной регургитации. Функциональная МР возникает в
результате деформации аппарата митрального кла-
пана, обусловленной кардиомиопатией или ишеми-
ческой болезнью сердца. Механизмы развития ише-
мической МР (обусловленной ишемической болез-
нью сердца) и функциональной МР (обусловленной
кардиомиопатией) схожи.
КЛАССИФИКАЦИЯ CARPENTIER
Кардиохирург Carpentier предложил свою класси-
фикацию дисфункции митрального клапана, осно-
ванную на подвижности его створок и используе-
мую преимущественно кардиохирургами [48]. При
дисфункции типа I подвижность створок соответ-
ствует норме, а МР возникает вследствие дилата-
ции фиброзного кольца митрального клапана. Дис-
функция типа II обусловлена чрезмерной подвиж-
ностью створок (пролапс или молотящая створка).
При дисфункции типа III типа подвижность ство-
рок ограничена. Дисфункцию типа III подразделя-
ют на типы IIIa и IIIb. При типе IIIa подвижность
створок ограничена как во время систолы, так и во
время диастолы, как при ревматической МР. Ише-
мическая и функциональная МР относятся дис-
функции типа IIIb, при которой ограничение под-
вижности створок наблюдается во время систолы.
КРАТКАЯ ИНФОРМАЦИЯ О МЕХАНИЗМАХ
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
•
Первичная МР возникает вследствие пораже-
ния митрального клапана (створок и сухожиль-
ных хорд); наиболее распространенная первич-
ная МР — ПМК.
•
ПМК наблюдается у большинства пациентов, ко-
торым провели оперативное вмешательство на
митральном клапане по поводу МР.
•
ПМК имеет различные проявления: от изолиро-
ванного пролапса сегмента створки (фиброэла-
стический дефицит) до диффузного поражения
створок с миксоматозными изменениями (бо-
лезнь Барлоу).
•
Вторичная МР обусловлена дилатацией или ише-
мической деформацией миокарда в основании
папиллярных мышц.
КОЛИЧЕСТВЕННАЯ ОЦЕНКА
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
ЭхоКГ — основной неинвазивный метод визуали-
зации при диагностике и определении тактики ве-
дения порока митрального клапана. ЭхоКГ позво-
ляет определить как структурное поражение серд-
ца, так и нарушения его гемодинамики. Трехмерная
эхокардиография (3D-ЭхоКГ) расширила возмож-
ности визуализации. В настоящее время 3D-ЭхоКГ
применяют интраоперационно.
Для количественной оценки клапанной недо-
статочности в клинической практике наиболее ча-
сто используют цветовую допплерографию с целью
оценки струи регургитации.
Рис. 18.12 A Ишемическая митральная регургитация. Эхокардиографические признаки — образование «тента» (лучше всего визуализируется в апикаль-
ной четырехкамерной проекции в середине систолы), когда створки митрального клапана смыкаются выше плоскости фиброзного кольца (пунктирная линия), утра-
та нормальной выпуклой формы и формирование вогнутой формы (красные стрелки), изгиб передней створки (белая стрелка) вследствие подтягивания вторич-
ной сухожильной хорды.
ch18.indd 415
03.04.2019 11:55:13
416
ЧАСТЬ IV Пороки клапанов сердца
Струя регургитации состоит из трех компонен-
тов: проксимальной зоны (проксимальнее створок
клапана), vena contracta, или перешейка струи регур-
гитации, и дистальной зоны (рис. 18.13А) [49]. Об-
ратите внимание, что анатомическое отверстие ре-
гургитации находится на уровне створок (см. рис.
18.13Б), а vena contracta представляет собой самый
узкий участок струи регургитации на уровне ство-
рок или немного дистальнее, поскольку конверген-
ция потока продолжается за пределами анатоми-
ческого отверстия. Дистальная зона струи регур-
Рис. 18.13 Гидродинамика струи регургитации. (А) Три компонента струи регургитации: (1) проксимальная зона струи регургитации (область PISA), также на-
зываемая зоной конвергенции потока; (2) vena contracta (VC); (3) дистальная зона струи регургитации. (Б) Эффективная площадь отверстия регургитации — это
площадь самого узкого участка струи регургитации, называемого vena contracta или перешейком струи регургитации и обычно находящегося дистальнее анатоми-
ческого отверстия [Roberts BJ, Grayburn P: Color flow imaging of the vena contracta: technical considerations, JASE 16:1002–1006, 2003].
Область PISA
Створки
Vena contracta
Дистальная струя
С
т
р
у
я
Струя
VC
PISA
Площадь анатомического
отверстия
Площадь эффективного
отверстия
А
Б
гитации представляет собой поток регургитации в
принимающей полости.
МЕТОДЫ ЦВЕТОВОЙ ДОППЛЕРОГРАФИИ
ОПРЕДЕЛЕНИЕ ПЛОЩАДИ ДИСТАЛЬНОЙ ЗОНЫ
СТРУИ РЕГУРГИТАЦИИ
Площадь дистальной зоны струи регургитации (SДСР)
определяют в пределах ЛП во время систолы [50, 51].
Максимальную SДСР определяют в нескольких пози-
циях и затем вычисляют среднюю площадь. Пло-
А
Б
Рис. 18.14 Площадь струи регургитации и vena contracta. (А) Оценка митральной регургитации по соотношению площади дистальной зоны струи регургита-
ции и площади левого предсердия. Площадь дистальной зоны струи регургитации отмечена пунктирной линией, площадь левого предсердия — сплошной линией.
(Б) Vena contracta (стрелки) — самый узкий участок струи регургитации на уровне створок или немного дистальнее их.
ch18.indd 416
03.04.2019 11:55:14
417
18 Митральная регургитация
щадь SДСР МР нормализуют относительно площади
ЛП (SЛП) [52, 53], для этого SДСР МР и SЛП измеря-
ют во время систолы и вычисляют отношение SДСР/
SЛП (рис. 18.14A) [53, 54]. SДСР/SЛП < 20% соответ-
ствует легкой МР, а SДСР/SЛП > 40% — тяжелой МР
(табл. 18.2) [55]. Поскольку поток при МР поступа-
ет в ограниченную полость, то на характер струи МР
влияет ряд факторов, в том числе физическое огра-
ничение стенками ЛП, увеличение наполнения ЛП
за счет потока МР и поток из легочных вен.
Одним из факторов, влияющих на точность
определения степени МР с помощью отношения
SДСР/SЛП, является линейная зависимость SДСР и SЛП.
Тем не менее это не всегда соответствует действи-
тельности, в некоторых случаях объем МР боль-
ше, чем показывает отношение SДСР/SЛП (например,
при хронической МР, когда произошло значитель-
ное ремоделирование ЛП).
Эксцентрическая струя МР сталкивается со стен-
ками ЛП, что приводит к уменьшению потока МР.
Кроме того, возможен эффект Коанда —стремле-
ние кровотока следовать по направлению к стенке
или вдоль нее. Этот эффект влияет на направление
и характер струи МР [52, 56]. Эксцентрическая струя
МР, которая выходит за пределы плоскости ультра-
звукового луча, может быть недооценена. Таким об-
разом, оценка МР по отношению SДСР/SЛП наиболее
эффективен при центральной струе регургитации
[52, 55].
На результаты измерения дистальной зоны
струи МР также могут влиять настройки ультразву-
ковой системы. Увеличение коэффициента усиле-
ния может привести к завышенной оценке разме-
ра струи. Напротив, слишком низкий коэффициент
усиления может стать причиной недооценки разме-
ра. Низкий предел Найквиста сопровождается пе-
реоценкой струи МР, поскольку кровоток с низкой
скоростью, который наблюдается в ЛП, будет вклю-
чены в струю МР. Предел Найквиста для цветово-
го допплеровского картирования струи МР должен
быть не менее 50 см/сек.
Важно отметить, что SДСР зависит от гемодина-
мики [55, 57–61]. Результаты исследований показа-
ли, что размер струи регургитации в некоторой сте-
пени зависит от давления вытеснения крови через
митральный клапан, которое определяется градиен-
том систолического давления в ЛЖ и в ЛП [58, 61],
т.е . на размер струи регургитации могут влиять со-
стояния, при которых изменяется системное арте-
риальное давление или давление в ЛП [57, 59].
Таким образом, метод SДСР — относительно про-
стой и широко применяемый метод качественной
оценки МР, но его надежность ограничивает ряд
технических и физиологических факторов [56, 62].
Тем не менее метод SДСР можно использовать в ка-
честве метода контроля, особенно для исключения
умеренной или тяжелой МР, поскольку малая дис-
тальная зона струи регургитации (< 20%) с узкой ve-
na contracta и/или без видимой проксимальной зо-
ны струи регургитации может указывать на умерен-
ную или менее выраженную МР.
ИЗМЕРЕНИЕ ШИРИНЫ VENA CONTRACTA
Ширину vena contracta измеряют в парастернальной
позиции по длинной оси. Если это невозможно, из-
меряют в апикальной позиции по длинной оси, по-
скольку диапазон нормальных значений ширины
vena contracta был определен относительно передне-
заднего размера (см. рис. 18.14Б) [49, 54, 63–68].
Поскольку ширина vena contracta находится в уз-
ком диапазоне, даже небольшие неточности изме-
рения могут оказать значительное влияние на сте-
пень МР. Необходимо оптимизировать область vena
contracta — применить усиление, провести регули-
ровку глубины и секторальных настроек разреше-
ния при цветовой допплерографии. Кроме того, в
некоторых случаях определить самый узкий уча-
сток струи регургитации сложно, потому что vena
contracta может плохо визуализироваться или быть
затенена створками. Измерение ширины vena con-
tracta менее подвержено влиянию условий физио-
логической нагрузки и, следовательно, более вос-
производим, чем метод определения SДСР [54, 63].
В табл. 18.2 приведены значения vena contracta
соответственно степени МР: ширина vena contracta
Регургитация Референсные значения параметров
Легкая
Струя МР отсутствует или площадь цен-
тральной струи МР < 20% площади ЛП
при допплерографии
Ширина vena contracta < 0,3 см
Умеренная
Площадь центральной струи МР 20–40%
площади ЛП или поздняя систолическая
эксцентрическая струя МР
Ширина vena contracta < 0,7 см
Объем регургитации < 60 мл
Фракция регургитации < 50%
Площадь эффективного отверстия
регургитации < 0,40 см2
Степень при ангиографии 1–2+
Тяжелая
Площадь центральной струи МР > 40%
ЛП или голосистолическая эксцентриче-
ская струя МР
Ширина vena contracta ≥ 0,7 см
Объем регургитации ≥ 60 мл
Фракция регургитации > 50%
Площадь эффективного отверстия
регургитации ≥ 0,40 см2
Степень при ангиографии 3–4+
ЛП — левое предсердие; МР — митральная регургитация.
[Nishimura R, Otto C, Bonow R, et al. AHA/ACC 2014 guideline for
management of patients with valvular heart disease, Circulation
129:e650, 2014.]
ТАБЛИЦА 18.2
Параметры митральной регургитации,
определяемые при цветовой
допплерографии
ch18.indd 417
03.04.2019 11:55:15
418
ЧАСТЬ IV Пороки клапанов сердца
Рис. 18.15 Метод PISA. (А) Проксимальная зона струи регургитации. Соглас-
но принципу гидродинамики, по мере приближения потока к круглому отвер-
стию образуются последовательные полусферические зоны с постепенным
уменьшением площади поверхности и увеличением скорости потока: чем бли-
же к отверстию, тем выше скорость потока. Черные стрелки указывают направ-
ление потока при приближении к области PISA. (Б) Измерять радиус области
PISA следует в оптимальной зоне (синий цвет), поскольку часть области PISA,
удаленная от отверстия регургитации (оранжевый цвет), имеет овальную фор-
му и оценка потока может быть завышена, а часть области PISA вблизи отвер-
стия регургитации (желтый цвет) имеет уплощенную форму, вследствие чего
оценка потока может быть занижена. Следует избегать измерения радиуса в
частях области PISA, обозначенных сиреневым цветом, поскольку потоки здесь
направлены непараллельно ультразвуковому лучу. r — радиус.
Створки
Поток регургитации
Поток регургитации
Створки
Направление потока непараллельно ультразвуковому лучу
Зона овальной PISA: завышенная оценка скорости потока
Зона уплощенной PISA: заниженная оценка скорости потока
Оптимальная зона для измерения PISA
А
Б
< 3 мм соответствуют легкой МР, 0,3–0,69 — уме-
ренной МР, 0,7 и более — тяжелой МР. При умерен-
ной МР диапазон значений vena contracta широкий,
что ограничивает применение этого показателя в
качестве количественного. Тем не менее легко изме-
ряемая ширина vena contracta — применимый в кли-
нике полуколичественный показатель МР.
ОПРЕДЕЛЕНИЕ ПЛОЩАДИ ПРОКСИМАЛЬНОЙ ЗОНЫ
СТРУИ РЕГУРГИТАЦИИ
Метод определения площади проксимальной зоны
струи регургитации (proximal isovelocity surface area,
PISA) основан на принципе гидродинамики, соглас-
но которому по мере приближения потока к кру-
глому отверстию образуются последовательные по-
лусферические зоны с постепенным уменьшением
площади поверхности и увеличением скорости по-
тока (изоскоростные поверхности) (рис. 18.15) [69].
Этот принцип может быть применен к струе МР, в
которой область PISA представляет собой полусфе-
рическую зону проксимальнее створок митрально-
го клапана на стороне ЛЖ [60, 69–75].
Согласно закону сохранения массы, поток через
отверстие регургитации равен площади поверхно-
сти полусферической зоны, умноженной на предел
Найквиста:
Поток через отверстие регургитации =
2πr2 × Предел Найквиста,
где r — радиус полусферической зоны.
После вычисления потока через отверстие регур-
гитации, можно рассчитать эффективную площадь
отверстия регургитации (EROA) и объем МР.
EROA = Поток через отверстие регургитации/
Максимальная скорость струи регургитации.
Максимальную скорость струи регургитации из-
меряют с помощью непрерывно-волновой доппле-
рографии (рис. 18.16).
Поскольку EROA рассчитывают из максималь-
ной скорости струи регургитации, то полученное с
помощью метода PISA значение EROA представля-
ет собой максимальную площадь отверстия регур-
гитации.
Для расчета объема регургитации (Rvo l) необхо-
димо EROA умножить на интеграл скорости крово-
тока (VTI) МР (VTIМР), определенного при непре-
рывно-волновой допплерографии:
Rvol = EROA × VTIМР.
Фракцию регургитации рассчитывают путем де-
ления объема регургитации на ударный объем.
Фракцию выброса можно рассчитать следующим
образом:
(Конечно-диастолический объем –
Конечно-систолический объем)/Конечно-диасто-
лический объем.
Для оптимизации измерения радиуса рекомен-
дуется изменить исходный уровень предела Най-
квиста в направлении потока регургитации. Обыч-
но предел Найквиста, равный 30–45 см/сек, обеспе-
чивает оптимальный баланс между максимальным
разрешением по радиусу и целостностью формы
области PISA. Очень низкий предел Найквиста при-
водит к завышенной оценке области PISA, при этом
увеличивается осевой размер. И наоборот, высокий
предел Найквиста минимизируют область PISA, что
затрудняет точное измерение [70, 74, 76–79].
В зависимости от причины МР скорость ее по-
тока и EROA во время систолы могут меняться [80,
81]. Это следует учитывать при принятии реше-
ch18.indd 418
03.04.2019 11:55:15
419
18 Митральная регургитация
ния, в какой момент фазы систолы измерять ради-
ус PISA. Например, при функциональной МР на-
блюдается характерные две максимальные скорости
потока регургитации в раннюю и позднюю систо-
лу, тогда как в середине систолы скорость регурги-
тации наименьшая. У пациентов с ПМК максималь-
ная скорость потока регургитации наблюдается с
середины до конца систолы. Для ревматической МР
скорость потока регургитации постоянна на про-
тяжении всей систолы. Не следует измерять ради-
ус PISA в самом начале и конце систолы, т.к . в это
время створки клапана либо только открылись, ли-
бо начинают закрываться, поэтому скорость пото-
ка может быть непостоянной. Как правило, изме-
рять радиус PISA следует одновременно с измере-
нием максимальной скорости регургитации (если
измерение проводят с помощью непрерывно-вол-
новой допплерографии). Точность и воспроизводи-
мость метода PISA в значительной степени зависит
от особого внимания к методам сбора данных и из-
мерений. Область PISA должна быть оптимизиро-
вана путем увеличения коэффициента усиления и
настройкой глубины соответственно разрешению,
причем область PISA и створки митрального клапа-
на должны занимать бо
́
льшую часть сектора. Изме-
рять PISA нужно после выравнивания ультразвуко-
вого луча параллельно направлению потока.
ГЕОМЕТРИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ
НА ПЛОЩАДЬ ПРОКСИМАЛЬНОЙ ЗОНЫ
СТРУИ РЕГУРГИТАЦИИ
Теоретически метод PISA позволяет точно количе-
ственно оценить МР. Тем не менее необходимо учи-
тывать ряд технических и практических аспектов
метода PISA. На область PISA влияет геометрия от-
верстия [69], что важно учитывать при исследова-
нии эксцентрических участков области PISA. На-
пример, при молотящей створке митрального кла-
пана к ложному увеличению радиуса области PISA
приводит, как правило, ее искажение, обусловлен-
ное близостью стенки ЛП [71]. Для преодоления
этого искажения при расчете площади можно при-
менить угловой поправочный коэффициент [69].
Корректировку выполняют путем умножения вы-
численной площади на α/180, где α — угол между
створкой митрального клапана и областью PISA,
ограниченной стенкой ЛП [82]. Корректировка для
эксцентрических участков области PISA приводит
к дополнительным ошибкам при расчете скорости
потока регургитации. Кроме того, не всегда воз-
можно точно измерить угол α. Трудности коррек-
тировки ограничили использование метода PISA на
практике.
ТЕХНИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ
НА ПЛОЩАДЬ ПРОКСИМАЛЬНОЙ ЗОНЫ
СТРУИ РЕГУРГИТАЦИИ
Специалист должен измерять радиус области PISA
при скоростях Найквиста, которые достоверно ото-
бражаются при цветовом допплеровском картиро-
вании. Одно из основных ограничений метода PISA
связано с тем, что при измерении радиуса области
PISA на разных расстояниях от отверстия резуль-
таты варьируют в широком диапазоне из-за вари-
абельности полусферической зоны. Область PISA
изменяется в зависимости от локализации относи-
тельно отверстия регургитации [69, 78, 79]. Вблизи
отверстия часть области PISA уплощена, тогда как в
Рис. 18.16 Метод PISA для количественной оценки митральной регургитации. (А) Стрелки указывают на выпадение допплеровского сигнала в области
PISA, где поток перпендикулярен ультразвуковому лучу. Радиус области PISA составляет 0,7 см. Предел Найквиста равен 30,8 см/сек. Максимальная скорость по-
тока регургитации = 2π(0,7 см)2 × 30,8 см/сек = 95 см3/сек. (Б) Максимальная скорость митральной регургитации равна 454 см/сек. Эффективная площадь отвер-
стия регургитации (EROA) равна: 95 см3/сек ÷ 454 см/сек = 0 ,21 см2.
Максимальная скорость митральной регургитации 454 см/сек
r=0,7см
Б
А
ch18.indd 419
03.04.2019 11:55:15
420
ЧАСТЬ IV Пороки клапанов сердца
наиболее удаленной от отверстия регургитации ча-
сти область PISA приобретает удлиненную или бо-
лее овальную форму. В результате таких изменений
области PISA возможна систематически завышен-
ная оценка потока, наиболее удаленного от отвер-
стия регургитации, и заниженная оценка потока
вблизи отверстия. Кроме того, необходимо избегать
измерений радиуса в области PISA, где поток на-
правлен непараллельно ультразвуковому лучу. Это
приводит к недооценке потока. На рис. 18.15Б пока-
зана оптимальное место для измерения радиуса об-
ласти PISA, а также участки, в которых его не следу-
ет измерять.
При расчете PISA исходят из геометрического до-
пущения, что отверстие регургитации круглое (т.е .
область PISA имеет полусферическую форму), од-
нако отверстие регургитации может быть не кру-
глым, а овальным, например в случае эффекта под-
тягивания створок митрального клапана при вто-
ричной МР [83–85]. Геометрическое допущение,
что область PISA имеет полусферическую форму,
приведет к недооценке потока регургитации, осо-
бенно в случае прямоугольного отверстия регур-
гитации [74]. Геометрическое допущение о полу-
овальной форме области PISA улучшает точность
количественной оценки МР [75, 86]. Однако рассчи-
тать PISA при полуовальной форме области слож-
но, т.к. в этом случае необходимо измерение трех
ортогонально ориентированных радиусов, которые
нужно интегрировать. Это значительно усложняет
метод PISA и ограничивает его клиническое приме-
нение.
По сравнению с методом определения SДСР метод
PISA менее подвержена влиянию таких настроек ап-
парата, как усиление, фильтр движения миокарда,
частота смены кадров или размер сектора [70].
РАЗЛИЧНЫЕ РЕФЕРЕНСНЫЕ ЗНАЧЕНИЯ ПЛОЩАДИ
ЭФФЕКТИВНОГО ОТВЕРСТИЯ РЕГУРГИТАЦИИ В ЗАВИСИМОСТИ
ОТ ПРИЧИНЫ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
В недавних руководствах [87, 88] предложены раз-
личные референсные значения EROA и объема ре-
гургитации для определения степени МР в зави-
симости от ее причины (табл. 18.3, см. также табл.
18.2). Для первичной тяжелой МР пороговые зна-
чения EROA и объема регургитации составляют
≥ 0,4 см2 и ≥ 60 мл соответственно, при вторичной
МР — ≥ 0,2 см2 и > 30 мл соответственно. Разница
пороговых значений зависит от причины и частич-
но основана на более неблагоприятных прогности-
ческих показателях для умеренной или тяжелой вто-
ричной МР [6, 62, 87, 88]. Тем не менее существуют
важные аспекты использования более низких стан-
дартных пороговых значений EROA для вторичной
МР. Во-первых, прогностические данные основаны
на ретроспективном анализе с потенциальной си-
стематической ошибкой отбора [89, 90]. Во-вторых,
значения EROA и объема регургитации зависят от
объема ЛЖ, что может обусловить более низкие
значения EROA при вторичной МР. Наконец, пред-
положение о полусферической форме области PISA
приводит к недооценке EROA и объема регурги-
тации, и при вторичной МР заниженное значение
EROA будет соответствовать большей степени МР,
чем при первичной МР, вероятно, вследствие более
овальной формы области PISA [84, 85].
В силу этих ограничений в руководствах остает-
ся рекомендация придерживаться интегративного
подхода при оценке МР и использовать допплеро-
графию для получения дополнительной информа-
ции степени МР [87, 88, 90].
МЕТОДЫ ОПРЕДЕЛЕНИЯ ОБЪЕМОВ
С ПОМОЩЬЮ ИМПУЛЬСНО-ВОЛНОВОЙ
ДОППЛЕРОГРАФИИ
Для расчета скорости потока и ударного объема с
помощью методов определения объемов исполь-
зуют импульсно-волновую допплерографию (рис.
18.17). Ударный объем рассчитывают путем умно-
жения VTI притока через фиброзное кольцо клапа-
на на CSAФКМК. Объем МР можно рассчитать по по-
току через клапаны [91, 92]:
Объем митральной регургитации =
Приток через митральный клапан – Отток
через аортальный клапан.
Степень
Параметры
Легкая
Струя МР отсутствует или площадь центральной струи МР < 20% площади ЛП при допплерографии
Ширина vena contracta < 0,30 см
Умеренная
Площадь эффективного отверстия регургитации < 0,20 см2
Объем регургитации < 30 мл
Фракция регургитации < 50%
Тяжелая
Площадь эффективного отверстия регургитации ≥ 0,20 см2
Объем регургитации ≥ 30 мл
Фракция регургитации ≥ 50%
ЛП — левое предсердие; МР — митральная регургитация.
[Nishimura R, Otto C, Bonow R, et al. AHA/ACC 2014 guideline for management of patients with valvular heart disease, Circulation 129:e650, 2014.]
ТАБЛИЦА 18.3 Референсные значения параметров легкой, умеренной и тяжелой вторичной митральной регургитации,
определяемых при цветовой допплерографии
ch18.indd 420
03.04.2019 11:55:15
421
18 Митральная регургитация
Аорта
ЛЖ
МР
АК
МК
Рис. 18.17 Метод определения объемов при количественной оценке
митральной регургитации. Схематически представлен метод определения
объемов для расчета объема митральной регургитации (МР). При отсутствии
значительной аортальной регургитации объем митральной регургитации равен
притоку через митральный клапан (белая стрелка) минус отток через аорталь-
ный клапан (черная стрелка). АК — аортальный клапан; ЛЖ — левый желудо-
чек; МК — митральный клапан.
Приток через митральный клапан рассчитывают
по формуле:
VTI притока через митральный клапан ×
CSAФКМК.
VTI притока через митральный клапан следует
измерять на уровне плоскости фиброзного кольца
митрального клапана, где измеряют CSAФКМК.
Предполагается, что фиброзное кольцо митраль-
ного клапана круглое, поэтому CSAФКМК рассчиты-
вают следующим образом:
CSAФКМК = πr2,
где r — 1/2 диаметра фиброзного кольца, измерен-
ного в апикальной четырехкамерной позиции.
Однако фиброзное кольцо митрального клапана
имеет D-образную форму, которая больше соответ-
ствует овалу, чем кругу. Использование геометри-
ческого допущения о круглой форме фиброзного
кольца целесообразно у пациентов с умеренной МР
и меньше, поскольку при этом происходит дила-
тация кольца. Для расчета площади овального фи-
брозного кольца митрального клапана используют
формулу
πab/2,
где а и b — диаметры, измеренные в апикальных че-
тырех- и двухкамерных позициях.
Отток через аортальный клапан вычисляют пу-
тем умножения VTI оттока через аортальный кла-
пан на площадь выходного тракта ЛЖ, при этом
предполагается отсутствие аортальной регургита-
ции. В противном случае можно использовать от-
ток из легочного ствола при отсутствии значитель-
ной регургитации на клапане легочной артерии.
Таким образом, при отсутствии аортальной регур-
гитации объем митральной регургитации можно
получить путем вычитания из ударного объема ЛЖ
объема оттока через аортальный клапан.
Простые в теории методы определения объемов
для расчета кровотока и площади фиброзного коль-
ца подвержены повышенной вариабельности из-за
измерений, осуществляемых с помощью импуль-
сно-волновой допплерографии. Для получения вос-
производимых результатов необходима основатель-
ная подготовка специалистов. Кроме того, посколь-
ку в формуле вычисления площади радиус возводят
в квадрат, даже незначительное отклонение в изме-
рении приводит к увеличению погрешности [91].
Для минимизации ошибок измерений важно четко
визуализировать фиброзное кольцо.
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ ЭХОКАРДИОГРАФИИ
И ДОППЛЕРОГРАФИИ
ХАРАКТЕР КРОВОТОКА В ЛЕГОЧНЫХ ВЕНАХ
Характер кровотока в легочных венах позволяет под-
твердить степень МР. Систолический реверсивный
кровоток в легочных венах, выявленный с помо-
щью ТТЭхоКГ, имеет чувствительность 61% и спец-
ифичность 92% для тяжелой МР, определенной по
методу PISA [93]. В ходе исследований с использова-
нием ЧПЭхоКГ была продемонстрирована чувстви-
тельность 82–90% и специфичность 100% систоли-
ческого реверсивного кровотока в качестве призна-
ка тяжелой МР [94, 95].
ГОЛОСИСТОЛИЧЕСКАЯ И НЕГОЛОСИСТОЛИЧЕСКАЯ
СТРУЯ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
Степень МР оценивают по общему объему регурги-
тации во время систолы. Количественные и полуко-
личественные показатели при цветовой допплеро-
графии рассчитывают по мгновенному значению во
время систолы и принимают эти показатели как по-
стоянные на протяжении систолы [77]. Для неголо-
систолической струи МР данное допущение не при-
менимо. Общий объем неголосистолической струи
МР редко находится в диапазоне тяжелой МР [96].
Неголосистолическая струя МР часто наблюдается от
середины систолы до поздней систолы при ПМК без
молотящей створки. При тяжелой МР почти всегда
присутствует голосистолическая струя. Если моло-
тящая створка возникает вследствие отрыва краевой
сухожильной хорды, то струя МР становится голо-
систолический. Таким образом, молотящая створка,
как правило, ассоциируется с тяжелой МР.
ch18.indd 421
03.04.2019 11:55:15
422
ЧАСТЬ IV Пороки клапанов сердца
МАКСИМАЛЬНАЯ СКОРОСТЬ Е
Тяжелая МР приводит к увеличению объемной на-
грузки ЛП, что часто проявляется повышением мак-
симальной скорости Е. Однако объемная нагрузка
ЛП также может быть и при других нарушениях, по-
этому повышение максимальной скорости Е — не-
специфический признак тяжелой МР. Кроме того,
скорость Е зависит от эластичности ЛП, т.е . у паци-
ентов со значительным объемом МР и очень подат-
ливым ЛП может не наблюдаться повышения ско-
рости Е. Максимальная скорость Е > 1,5 м/сек ука-
зывает на тяжелую МР [55].
СТРУЯ МИТРАЛЬНОЙ РЕГИРГИТАЦИИ
ПРИ НЕПРЕРЫВНОВОЛНОВОЙ ДОППЛЕРОГРАФИИ
Непрерывно-волновая допплерография МР позво-
ляет косвенно оценить степень МР. Чем интенсив-
нее эхо-сигнал, тем большее количество эритроци-
тов его отражают, следовательно, тем больше объем
МР. Кроме того, чем выше интенсивность эхо-сиг-
нала при непрерывно-волновой допплерографии,
тем больше вероятность тяжелой МР. В ходе иссле-
дований было продемонстрировано, что интенсив-
ность сигнала коррелирует со степенью МР в срав-
нении с ангиографическим стандартом [97, 98].
МОРФОЛОГИЯ МИТРАЛЬНОГО КЛАПАНА
И РАЗМЕРЫ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
Морфология митрального клапана может дать важ-
ные подсказки при оценке МР. Наличие у митраль-
ного клапана апикального «тента» связано с функ-
циональной МР, которая развивается при кардио-
миопатии с поражением ЛЖ [22, 99–101]. Вегетации
на клапане, молотящая створка и отрыв папилляр-
ных мышц связаны с тяжелой МР. Увеличение раз-
меров ЛП и ЛЖ ассоциируется со значительной МР.
Однако увеличение полостей левых отделов серд-
ца наблюдается в разных клинических ситуациях,
например при аритмии и кардиомиопатии, следо-
вательно, не является характерным признаком тя-
желой МР. Повышенное систолическое давление в
ПЖ также свидетельствует о клинически значимой
МР вследствие воздействия объема регургитации на
малый круг кровообращения.
РОЛЬ ТРЕХМЕРНОЙ ЭХОКАРДИОГРАФИИ
3D-ЭхоКГ позволяет осуществлять прямую пла-
ниметрию vena contracta и определять эффектив-
ную площадь отверстия регургитации (EROA). На
измерение EROA с помощью 3D-ЭхоКГ не влия-
ют геометрические допущения, которые необходи-
мо учитывать при измерении EROA в 2D-режиме.
Для планиметрии vena contracta необходимо полу-
чить полноразмерное трехмерное изображение цве-
товой допплерографии. Для увеличения частоты
кадров следует сузить размер сектора. Используя
программное обеспечение для многопланарной ре-
конструкции, две взаимно перпендикулярные пло-
скости, направленные параллельно струи регурги-
тации, обрезают поперек, затем третью плоскость
ориентируют перпендикулярно направлению струи
и выравнивают до тех пор, пока плоскость не до-
стигнет уровня vena contracta. Площадь vena contrac-
ta определяют во время систолы с помощью прямой
планиметрии при цветовой допплерографии (рис.
18.18) [102]. Валидация исследований показала эф-
фективность трехмерной прямой планиметрии
площади vena contracta и ее корреляцию с EROA,
полученной методом определения объемов с по-
мощью допплерографии [102–105]. Важным огра-
ничением трехмерной прямой планиметрии пло-
щади vena contracta является относительно низкое
пространственное разрешение, особенно во внеосе-
вых позициях. Для оптимизации пространственно-
го разрешения необходимо отрегулировать макси-
мальное разрешение и получать объемные данные
при максимальном количестве сердечных циклов,
если это возможно. Трехмерная прямая планиме-
трия площади vena contracta наиболее эффективна
при умеренной или тяжелой МР из-за ограниченно-
го пространственного разрешения. Этот метод за-
меняет метод EROA и предоставляет дополнитель-
ную информацию, особенно в сомнительных ситу-
ациях [90].
ЗНАЧЕНИЕ ГЕМОДИНАМИЧЕСКИХ
И ФИЗИОЛОГИЧЕСКИХ ФАКТОРОВ
Степень МР зависит от гемодинамических факто-
ров, объема циркулирующей крови, постнагруз-
ки (артериальное давление) и приема инотропных
препаратов, которые могут вводить интраопераци-
онно или в отделении реанимации и интенсивной
терапии. Увеличение объема крови или постнагруз-
ки приводит к усилению МР. Инотропные препара-
ты, например добутамин, снижают степень МР за
счет снижения постнагрузки и увеличения сокра-
тимости, что приводит к уменьшению размера по-
лости и может маскировать МР, присутствующую
в нормальном физиологическом состоянии. Кро-
ме того, при острой ишемии миокарда степень МР
может усугубиться из-за нарушения функции па-
пиллярных мышц или снижения глобальной функ-
ции ЛЖ, что приводит к снижению сил закрытия
митрального клапана. В идеале степень МР следует
определять при оптимизированном состоянии на-
грузки и без приема инотропных препаратов.
Помимо динамического характера МР, который
определяется состоянием гемодинамики и физио-
логическим состоянием, может отмечаться вариа-
бельность МР во время систолы в зависимости от
причины МР. При ПМК с молотящей створкой мак-
симальная струя МР наблюдается с середины систо-
лы до ее конца. Для вторичной МР характерны два
пика (в раннюю систолу и в позднюю систолу) и
спад в середине систолы [80, 106].
ch18.indd 422
03.04.2019 11:55:15
423
18 Митральная регургитация
ИНТЕГРАТИВНЫЙ ПОДХОД ПРИ ОЦЕНКЕ
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
Поскольку не существует единой референсной си-
стемы для определения степени МР и для каждого
метода есть ограничения, руководства [87, 88] со-
держат рекомендации по интегративному подходу
к оценке МР, т.е. определению степени МР по не-
скольким параметрам [7]. Интегративный подход
включает методы количественной и полуколиче-
ственной оценки — метод PISA, определение ши-
рины vena contracta, отношения SДСР к площади ЛП
и методы определения объемов. Кроме того, при
определении степени МР следует учитывать допол-
нительные данные — характер кровотока в легоч-
ных венах, МР (голосистолическая и неголосисто-
лическая струя), высота Е-волны и интенсивность
сигнала регургитации при непрерывно-волновой
допплерографии. При несоответствии результатов
исследования или плохом качестве изображений не-
обходимо провести трехмерную допплерографию
для определения площади vena contracta и/или МРТ
сердца.
Итак, интегративный подход к оценке МР вклю-
чает:
•
методы полуколичественной оценки — опреде-
ление SДСР и ширины vena contracta;
•
методы количественной оценки — расчет EROA
или объема регургитации, фракции регургита-
ции с помощью метода PISA или трехмерной
импульсно-волновой допплерографии, если это
технически возможно при умеренной или более
выраженной степени МР;
•
дополнительные данные — ретроградный кро-
воток в легочных венах, максимальная скорость
митрального кровотока в раннюю диастолу (E),
расширение полостей ЛП и ЛЖ, гипертрофия
ЛЖ, повышенное систолическое давление в ПЖ
и патоморфология митрального клапана;
•
трехмерная прямая планиметрия vena contracta с
использованием цветовой допплерографии. Мо-
жет быть эффективна при определении степе-
ни МР и в качестве дополнения к 2D-ЭхоКГ, осо-
бенно когда есть сомнения относительно степени
МР.
Рис. 18.18 Трехмерная прямая планиметрия vena contracta. (А, Б) Одновременное изображение двух ортогональных плоскостей, параллельных направлению
струи регургитации. (В) Третью (обрезающую) плоскость, ориентированную перпендикулярно направлению струи, перемещают по ходу струи до тех пор, пока не бу-
дет визуализироваться vena contracta. (Г) Площадь vena contracta определяют с помощью прямой планиметрии во время цветовой допплерографии.
А
Б
Г
В
ch18.indd 423
03.04.2019 11:55:15
424
ЧАСТЬ IV Пороки клапанов сердца
ХИРУРГИЧЕСКОЕ ВМЕШАТЕЛЬСТВО
ТЕЧЕНИЕ ЗАБОЛЕВАНИЯ
При МР в ЛП возвращается значительный объем
фракции выброса ЛЖ. Для поддержания одного и
того же ударного объема происходит компенсатор-
ная дилатация ЛЖ и увеличение фракции выброса
ЛЖ, что приводит к гипердинамической функции
желудочка. Со временем ЛЖ утрачивает способ-
ность компенсировать увеличенную объемную на-
грузку, и фракция выброса ЛЖ начинает снижать-
ся, при этом увеличивается конечно-систолический
объем ЛЖ.
Развитие МР может быть острым, как при остром
инфекционном эндокардите митрального клапа-
на, или хроническим, что обычно наблюдается при
ПМК. Кроме того, острая МР может возникать на
фоне хронической МР, например после формиро-
вания молотящей створки вследствие отрыва сухо-
жильной хорды у пациента с хронической МР, обу-
словленной ПМК.
Клинические проявления и патофизиология
острой и хронической МР отличаются. При острой
МР ЛП не может приспособиться к внезапно воз-
росшей объемной нагрузке, поскольку времени, не-
обходимого для ремоделирования предсердий, бы-
ло недостаточно. Это приводит к острому отеку лег-
ких, повышению давления в правых отделах сердца
и тяжелой одышке. При этом компенсаторно раз-
вивается гипердинамическая функция ЛЖ, но из-за
недостаточной дилатации, которая необходима для
сохранения ударного объема, снижается сердечный
выброс и возникает гипотензия. Лечение острой МР
направлено на быстрое снижение нагрузки назна-
чением лекарственных препаратов, влияющих на
постнагрузку (если артериальное давление позво-
ляет это сделать), или с помощью внутриаорталь-
ной баллонной контрпульсации. Однако часто это
временные меры. В конечном счете основное лече-
ние — хирургическая коррекция.
При хронической МР для ремоделирования ЛЖ
времени достаточно. Дополнительная объемная на-
грузка на ЛЖ приводит к эксцентрической гипер-
трофии. При гистологическом исследовании мио-
карда выявляют гипертрофию миоцитов, преиму-
щественно за счет последовательного включения
добавочных саркомеров, что сопровождается удли-
нением мышечных волокон. Процесс ремоделиро-
вания приводит к дилатации ЛЖ и усилению сокра-
тимости миокарда, что проявляется гипердинами-
ческой функцией ЛЖ, обеспечивающей увеличение
общего объема выброса для сохранения ударного
объема.
Аналогичным образом происходит ремоделиро-
вание ЛП. Дилатация приводит к увеличению рас-
тяжимости для размещения объема регургитации.
Это сопровождается снижением давления, обуслов-
ленным ретроградным кровотоком, что передается
непосредственно в малый круг кровообращения. В
результате наблюдается менее выраженное повы-
шение давления в правых отделах сердца и одыш-
ка. Со временем по мере прогрессирования ремо-
делирования и постепенного замещения миоцитов
интерстициальным фиброзом, ЛЖ утрачивает спо-
собность к компенсации [2, 107, 108]. Объем ЛЖ
продолжает увеличиваться в условиях неполной
компенсации, что приводит к уменьшению фрак-
ции выброса ЛЖ преимущественно за счет значи-
тельного увеличения конечно-систолического объ-
ема. Ударный объем снижается, и начинает разви-
ваться сердечная недостаточность.
У пациентов с хронической тяжелой МР сим-
птомы могут отсутствовать в течение длительного
периода времени: с момента постановки диагноза
проходит в среднем от 5 до 10 лет до того, как разо-
вьются симптомы или возникнут другие показания
к хирургическому вмешательству [2, 107, 108].
У пациентов с хронической первичной МР кон-
сервативное лечение препаратами, снижающими
постнагрузку, может быть неэффективным [109,
110]. Поскольку патофизиология МР ассоциирует-
ся не только с увеличением постнагрузки, терапия
этими препаратами не влияет на механическую дис-
функцию и фактически может маскировать разви-
тие дисфункции ЛЖ путем его разгрузки.
ВЫБОР ВРЕМЕНИ ПРОВЕДЕНИЯ ВМЕШАТЕЛЬСТВА
В руководствах при определении прогноза и так-
тики лечения выделяют четыре стадии МР: стадия
А — пациенты без МР, но с риском ее развития; ста-
дия В — пациенты с прогрессирующей МР; стадия
С — пациенты с бессимптомной тяжелой МР; ста-
дия D — пациенты с симптомной тяжелой МР [88].
Терапевтическое вмешательство проводят преиму-
щественно при стадиях C и D. Терапевтическая так-
тика зависит от механизма МР, поскольку лечение
первичной и вторичной МР различное.
ЛЕЧЕНИЕ ПЕРВИЧНОЙ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
В табл. 18.4 представлены рекомендации класса I
показаний к хирургическому протезированию или
пластике митрального клапана при первичной тя-
желой МР, обусловленной пороком клапана. Хи-
рургическое вмешательство необходимо выполнять
пациентам с симптомами и фракцией выброса ЛЖ
> 30% и пациентам без симптомов, но с дилатаци-
ей ЛЖ или фракцией выброса ЛЖ < 60%. Пациен-
ты без симптомов с тяжелой МР и сохранной функ-
цией ЛЖ — сложная для лечения группа. Показа-
ния к ранней хирургической пластике митрального
клапана пациентов с хронической тяжелой МР, у ко-
торых отсутствуют симптомы и сохранна функция
ЛЖ, определяют по IIа классу при отборе пациентов
с высокой вероятностью восстановления митраль-
ного клапана (> 95%) и низкой оперативной леталь-
ch18.indd 424
03.04.2019 11:55:16
425
18 Митральная регургитация
ностью (≤ 1%). В табл. 18.4 также приведены показа-
ния II и III классов к оперативному вмешательству
на митральном клапане при первичной тяжелой
МР. Пластика митрального клапана ассоциируется
с лучшей выживаемостью, по сравнению с протези-
рованием митрального клапана. Если пластика ми-
трального клапана невозможна, то при его протези-
ровании следует сохранять сухожильные хорды.
Одно из затруднений — установление истинного
отсутствия симптомов, поскольку снижение функ-
циональных возможностей может быть неспецифи-
ческим симптомом, следствием ухудшения физиче-
ского состояния и возрастных изменений. Кроме
того, некоторые пациенты по мере прогрессирова-
ния заболевания снижают свою активность и не за-
мечают снижения функциональных возможностей.
В этих случаях стресс-ЭхоКГ с физической нагруз-
кой позволяет оценить функциональные возмож-
ности и гемодинамические показатели, в частно-
сти изменение давления в правых отделах сердца и
функцию клапанов и желудочков в ответ на физи-
ческую нагрузку.
ЛЕЧЕНИЕ ВТОРИЧНОЙ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
Оптимального лечения вторичной МР пока нет. Раз-
витие МР (даже легкой) после инфаркта миокарда
ассоциируется со снижением выживаемости [3, 4].
Неизвестно, приведет ли коррекция МР к улучше-
нию течения сердечно-сосудистой патологии и по-
казателей летальности и общей выживаемости [87,
88, 111, 112]. В ходе исследований не было проде-
монстрировано улучшения выживаемости паци-
Показания
Класс
Уровень
достоверности
Операция на МК рекомендуется пациентам с симптомами при хронической первичной тяжелой МР
(стадия D) и ФВЛЖ > 30%
IB
Операция на МК рекомендуется пациентам без симптомов при хронической первичной тяжелой
МР и дисфункции ЛЖ (ФВЛЖ 30–60% и/или КСР ЛЖ ≥ 40 мм, стадия C2)
IB
Пластика МК рекомендуется пациентам с хронической первичной тяжелой МР, ограниченной
задней створкой, у которых есть показания к хирургическому протезированию
IB
Пластика МК рекомендуется пациентам с хронической первичной тяжелой МР с вовлечением
передней створки или обеих створок при возможности успешного и надежного восстановления
клапана и при наличии показаний к хирургическому протезированию
IB
Сопутствующая пластика или протезирование МК показаны пациентам с хронической первичной
МР, которым проводят операцию на сердце по другим показаниям
IB
Пластика МК может быть обоснованной у пациентов без симптомов хронической первичной
тяжелой МР (стадия C1) с сохранной функцией ЛЖ (ФВЛЖ > 60% и КСР ЛЖ < 40 мм), у которых
вероятность успешной и надежной реконструкции клапана без остаточной МР > 95% при леталь-
ности < 1% в случае проведения в специализированном центре
IIa
B
Пластика МК может быть обоснованной у пациентов без симптомов хронической неревматической
первичной тяжелой МР (стадия C1) и сохранной функцией ЛЖ, у которых высока вероятность
успешной и надежной реконструкции клапана на фоне (1) вновь возникшей ФП или (2) легочной
гипертензии в состоянии покоя (систолическое артериальное давление в ЛА > 50 мм рт. ст .)
IIa
B
Сопутствующая пластика МК может быть обоснованной у пациентов с хронической первичной
умеренной МР (стадия B), которым проводят операцию на сердце по другим показаниям
IIa
C
Операция на МК может быть рассмотрена у пациентов с симптомами хронической первичной
тяжелой МР и ФВЛЖ ≤ 30% (стадия D)
IIb
Пластика МК может быть рассмотрена у пациентов с ревматическим пороком митрального клапана
при наличии показаний к хирургическому лечению, если вероятна успешная и надежная пластика
или если надежность долгосрочной антикоагулянтной терапии под сомнением
IIb
B
Транскатетерная пластика МК может быть рассмотрена у пациентов с выраженными симптомами
(ФК III/IV по NYHA) хронической первичной тяжелой МР (стадия D), у которых вероятна доста-
точная продолжительность жизни, но слишком высок хирургический риск из-за серьезных сопут-
ствующих заболеваний
IIb
B
Протезирование МК не следует выполнять для лечения изолированной первичной тяжелой МР,
ограниченной менее чем 1/2 задней створки, за исключением случаев, когда попытки пластики МК
были безуспешны или неэффективны
III: Harm B
NYHA — New York Heart Association; КСР ЛЖ — конечно -систолический размер левого желудочка; ЛА — легочная артерия; ЛЖ — левый
желудочек; МК — митральный клапан; ФВЛЖ — фракция выброса левого желудочка; ФП — фибрилляция предсердий.
[Nishimura R, Otto C, Bonow R, et al. AHA/ACC 2014 guideline for management of patients with valvular heart disease, Circulation 129:e650, 2014.]
ТАБЛИЦА 18.4 Рекомендации по хирургическому лечению хронической первичной митральной регургитации
ch18.indd 425
03.04.2019 11:55:16
426
ЧАСТЬ IV Пороки клапанов сердца
ентов с умеренной или тяжелой ишемической МР,
которых подвергали пластике митрального клапа-
на во время операции коронарного шунтирования
(КШ) [111, 112]. Это можно объяснить тем, что вто-
ричная МР не была вовлечена в кардиомиопатиче-
ский процесс или не была непосредственно влияю-
щим сопутствующим заболеванием, и летальность
могла быть обусловлена неблагоприятным воздей-
ствием увеличенной объемной нагрузки на ремоде-
лирование и функцию ЛЖ. Поскольку отсутствует
единое мнение относительно эффективности опе-
ративного вмешательства на митральном клапане у
пациентов с вторичной тяжелой МР, рекомендации
класса I класс отсутствуют.
У пациентов с умеренной или тяжелой ишемиче-
ской МР хирургическую пластику или протезирова-
ние митрального клапана выполняют чаще всего во
время КШ. Для большинства пациентов с ишеми-
ческой МР предпочтительнее пластика митрально-
го клапана, чем его протезирование. Это было под-
тверждено в ходе ретроспективных исследований,
которые продемонстрировали лучшую выживае-
мость среди пациентов, которые перенесли пласти-
ку митрального клапана, по сравнению с пациента-
ми, которым была выполнено его протезирование
[113, 114]. В руководствах [87–88] рекомендова-
но выполнять оперативное вмешательство на ми-
тральном клапане при вторичной тяжелой МР во
время КШ или протезирования аортального клапа-
на (рекомендации класса IIa) (см. табл. 18.5).
Cardiothoracic Surgical Network (CTSN) провели
при поддержке NIH/NHLBI (National Institutes of
Health/National Heart, Lung, and Blood Institute) ран-
домизированное исследование с участием паци-
ентов с ишемической тяжелой МР, которым была
выполнена реконструктивная аннулопластика или
протезирование митрального клапана. Различий в
основной конечной точке (индекс конечно-систо-
лического объема ЛЖ в течение 1 года) между эти-
ми группами не было. Это позволяет предполо-
жить, что пластика и протезирование митрального
клапана при тяжелой ишемической МР сопостави-
мы по исходам [111, 112].
Выполнение пластики митрального клапана у
пациентов с умеренной ишемической МР является
рекомендацией класса IIb. Было проведено два ран-
домизированных исследования, в ходе которых из-
учали эффективность пластики митрального кла-
пана при умеренной ишемической МР во время
КШ. Небольшое рандомизированное исследование
RIME (Randomized Ischemic Mitral Evaluation) с уча-
стием 75 пациентов, которые перенесли либо толь-
ко КШ, либо КШ с пластикой митрального клапана,
продемонстрировало улучшение функционального
состояния с положительной динамикой максималь-
ного потребления кислорода в группе КШ с пла-
стикой митрального клапана [115]. CTSN провела
более крупное рандомизированное исследование
умеренной ишемической МР с аналогичными груп-
пами, но в качестве основной конечной точки был
индекс конечно-систолического объема ЛЖ. В хо-
де этого исследования не было выявлено различий
между группой КШ и группой КШ с пластиой ми-
трального клапана [112]. Консервативное лечение
должно быть направлено на устранение первичной
дисфункции ЛЖ. В частности, назначение ИАПФ и
бета-блокаторов, а также ресинхронизация, приве-
ло к снижению степени МР в этой группе пациен-
тов [116–119].
КЛИНИЧЕСКИЕ АСПЕКТЫ
•
Принимать клиническое решение по поводу ле-
чения МР следует на основании данных ЭхоКГ о
механизме, степени МР и функции ЛЖ.
•
Важно отличать первичную МР, обусловленную
патологией клапана, от вторичной, обусловлен-
ной поражением желудочков, поскольку тактика
лечения их различна.
•
МР может быть острой, хронической или острой
на фоне хронического течения.
•
Показания класса I к хирургическому вмешатель-
ству (пластике или протезированию митрально-
го клапана): (1) пациенты с симптомами и фрак-
цией выброса ЛЖ не менее 30%; (2) пациенты
без симптомов с признаками дисфункции ЛЖ
(фракция выброса ЛЖ 30–60% и/или конечно-
Показания
Класс
Уровень
достоверности
Операция на МК может быть обоснованной у пациентов с хронической вторичной тяжелой МР
(стадии C и D), которым планируют коронарное шунтирование или протезирование аортально-
го клапана
IIa
C
Операция на МК может быть рассмотрена у пациентов с выраженными симптомами
(ФК III/IV по NYHA) с хронической вторичной тяжелой МР (стадия D)
IIb
B
Операция на МК может быть рассмотрена у пациентов с хронической вторичной умеренной МР
(стадия B), которым планируют другую операцию на сердце
IIb
C
NYHA — New York Heart Association; МК — митральный клапан; МР — митральная регургитация.
[Nishimura R, Otto C, Bonow R, et al. AHA/ACC 2014 guideline for management of patients with valvular heart disease, Circulation 129:e650, 2014.]
ТАБЛИЦА 18.5 Рекомендации по хирургическому лечению хронической вторичной тяжелой митральной регургитации
ch18.indd 426
03.04.2019 11:55:16
427
18 Митральная регургитация
систолический размер ЛЖ ≥ 40 мм); (3) пациен-
ты с тяжелой первичной МР, которым проводят
операцию на сердце по другим показаниям.
•
Ранняя пластика митрального клапана является
рекомендацией класса IIa для пациентов без сим-
птомов с тяжелой первичной МР и сохранной
функцией ЛЖ при высокой (> 95%) вероятности
восстановления митрального клапана и низкой
послеоперационной летальности (< 1%).
•
Терапия вторичной МР заключается в консерва-
тивном лечении первичной дисфункции ЛЖ ин-
гибиторами ИАПФ и бета-блокаторами (в дан-
ной группе пациентов это приводит к снижению
степени МР).
•
При вторичной МР рекомендации класса I по
оперативному вмешательству на митральном
клапане отсутствуют.
•
При тяжелой вторичной МР вмешательство на
митральном клапане (пластика или протезиро-
вание митрального клапана) во время КШ или
протезирования аортального клапана является
рекомендацией класса IIa.
Параметр
Метод измерения
Преимущества
Недостатки
Клинические
референсные значения
Площадь дис-
тальной зоны
струи регур-
гитации
Определение отношения максимальной
площади дистальной зоны струи ре-
гургитации к площади ЛП
Оценка в апикальной позиции
Предел Найквиста ≥ 50 см/сек
Простой, тех-
нически менее
требователь-
ный
Зависит от настроек
аппарата и физио-
логического состо-
яния
Экцентрическая
струя регургита-
ции может быть
недооценена
Легкая и менее:
< 20% площади ЛП
Умеренная: 20–39% пло-
щади ЛП (измерять по
самой подходящей из
нескольких централь-
ных струй)
Тяжелая: ≥ 40% площа-
ди ЛП
Vena contracta
Измерение самого узкого места струи
регургитации (как правило, на уровне
створок или немного дистальнее)
Нет необходимости менять масштаб
или предел Найквиста
Измерения следует проводить в пара-
стернальной позиции по длинной оси в
режиме «Масштабирование»; избегай-
те измерений в двухкамерной позиции,
поскольку референсное значение уста-
новлено для позиции по длинной оси
Для уверенности в полном отображении
vena contracta следует сканировать че-
рез отверстие митрального клапана с
наклоном датчика в медиально-лате-
ральном направлении
Простые прямые
измерения
Меньше зависит
от физиологи-
ческого состо-
яния, чем пло-
щадь дисталь-
ной зоны струи
регургитации
Узкий референсный
диапазон, поэто-
му возможны за-
труднения при ви-
зуализации и даже
небольшая неточ-
ность измерения
приводит к изме-
нению степени МР
Легкая и менее: < 0,3 см
Умеренная: 0,3–0,69 см
Тяжелая: ≥ 0,7 см
EROA мето-
дом PISA в
2D-режиме
Увеличьте область PISA в апикальной че-
тырех-, двух- или трехкамерной пози-
ции; выберите позицию, когда область
PISA отображена наилучшим образом
Сместите исходный уровень в направле-
нии потока митральной регургитации;
ТТЭхоКГ в апикальной позиции: сме-
стите исходный уровень вниз к нижне-
му пределу Найквиста 30–45 см/сек (в
зависимости от уровня, при котором
контур полусферы оптимален)
Получите запись в течение 2–3 ударов
Выберите область PISA хорошо сфор-
мированных полусфер во время си-
столы (или в ее середине) или начала
Т-волны на ЭКГ
Измерьте радиус от вершины области
PISA до основания полусферы
Измерьте максимальную скорость струи
митральной регургитации и VTI с по-
мощью непрерывно-волновой доппле-
рографии
Позволяет коли-
чественно оце-
нить МР
Технически слож-
ный, с высокой ва-
риабельностью ре-
зультатов
Геометрические до-
пущения могут
привести к недо-
оценке истинной
EROA
Эксцентрические
области PISA огра-
ничены стенками
или створками
Референсные значения
зависят от механиз-
ма МР:
Первичная МР
Умеренная или менее:
< 0,4 см2
Тяжелая: ≥ 0,4 см2
Вторичная МР
Умеренная или менее:
< 0,2 см2
Тяжелая: ≥ 0,2 см2
СВОДНАЯ ИНФОРМАЦИЯ
Митральная регургитация
ch18.indd 427
03.04.2019 11:55:16
428
ЧАСТЬ IV Пороки клапанов сердца
Параметр
Метод измерения
Преимущества
Недостатки
Клинические
референсные значения
Vena contracta в
3D-режиме
Оптимизируйте параметры 3D-режима:
частоту кадров и пространственное
разрешение
Проведите цветовую допплерографию
в 3D-режиме
Используя многопланарную рекон-
струкцию в 3D-режиме, выровняйте
ортогональные плоскости vena contrac-
ta для локализации самого узкого ме-
ста струи регургитации
Выполните обрезку в поперечной пло-
скости до уровня самого узкого участ-
ка струи регургитации
Позволяет вы-
полнить пря-
мую планиме-
трию EROA
без учета гео-
метрических
допущений
или физиоло-
гических пред-
положений
При плохом лате-
ральном разреше-
нии часто проис-
ходит переоценка
истинной EROA
Технически сложно
получить при цве-
товой допплеро-
графии оптималь-
ные объемные дан-
ные для измерения
vena contracta
Референсные значения
отсутствуют, но подо-
бен EROA при PISA в
2D-режиме
Первичная МР
Умеренная и менее:
< 0,4 см2
Тяжелая: ≥ 0,4 см2
Вторичная МР
Умеренная и менее:
< 0,2 см2
Тяжелая: ≥ 0,2 см2
Трехмерная
допплерогра-
фия для изме-
рения объема
митральной
регургитации
Определите VTI митрального прито-
ка на уровне фиброзного кольца ми-
трального клапана
Измерьте размер фиброзного кольца
митрального клапана в середине си-
столы
Определите VTI и диаметр ВТЛЖ
Позволяет коли-
чественно оце-
нить Rvol ми-
тральной ре-
гургитации
Можно исполь-
зовать при пло-
хой визуализа-
ции струи или
при наличии
эксцентриче-
ской струи или
множествен-
ных
Технически слож-
ный, необходимо
несколько измере-
ний с изменением
техники
Невозможно вы-
полнить при зна-
чительной (уме-
ренной и более
выраженной) аор-
тальной регурги-
тации
Референсные значения
основаны на механиз-
ме МР*
Первичная МР
Умеренная или менее:
объем регургитации
<60мл;
фракция регургитации
< 50%
Тяжелая:
объем регургитации:
≥60мл;
фракция регургитации
≥ 50%
Вторичная МР
Умеренная и менее:
объем регургитации <
30 мл;
фракция регургитации
< 50%
Тяжелая:
объем регургитации ≥ 30
мл;
фракция регургитации
≥ 50%
Другие параметры
Реверсивный
кровоток в ле-
гочных венах
Измерение в апикальной позиции
При наличии эксцентрической струи ре-
гургитации оценку лучше проводить
в легочных венах, где струя регургита-
ции прямая
Относитель-
но специфи-
ческий, но не
чувствитель-
ный показатель
тяжелой МР
Технические затруд-
нения связаны
с глубиной кон-
трольного объема
Оценку лучше про-
водить с помощью
ЧПЭхоКГ
Наличие реверсивного
кровотока в легочных
венах указывает на тя-
желую МР
Дилатация по-
лостей ЛП и
ЛЖ
ЛП измеряют методом длина–объем
или бипланарным методом Симпсона,
объем ЛЖ определяют методом дисков
Широко приме-
нимый метод,
исчерпываю-
щие данные
Неспецифический
параметр, посколь-
ку на полости вли-
яют (помимо МР)
другие факторы
Отклонение индексиро-
ванного объема ЛП* >
34 мл/м2
Объем ЛЖ†
КДО нормальные зна-
чения:
мужчины: 62–150 мл;
женщины: 46–106 мл;
КСО нормальные зна-
чения:
мужчины: 21–61 мл;
женщины: 14–42 мл
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Митральная регургитация
ch18.indd 428
03.04.2019 11:55:16
429
18 Митральная регургитация
Параметр
Метод измерения
Преимущества
Недостатки
Клинические
референсные значения
Скорость E
Измерение в апикальной четырехкамер-
ной позиции
Простое воспро-
изводимое из-
мерение
Неспецифический
показатель, по-
скольку скорость
Е зависит (поми-
мо объема МР) от
ряда факторов: на-
грузки, растяжи-
мости ЛЖ, нали-
чия стеноза ми-
трального клапана
Скорость E > 1,5 м/сек
указывает на тяжелую
МР
Профиль струи
митральной
регургитации
при непре-
рывно-волно-
вой доппле-
рографии
Определение в апикальной позиции, па-
раллельно струе митральной регурги-
тации
Важно, чтобы датчик зарегистрировал
полный профиль, особенно при экс-
центрической струе регургитации
Простое изме-
рение
Чувствительный
показатель
Возможны затруд-
нения при реги-
страции профиля
эксцентрической
струи
Неспецифический
показатель степе-
ни МР
Интенсивный сигнал
при непрерывно-вол -
новой допплерогра-
фии указывает на тяже-
лую МР
V-образный профиль
при непрерывно-вол -
новой допплерогра-
фии указывает на тяже-
лую МР
Голосистоличе-
ская и неголо-
систолическая
струя регур-
гитации
Продолжительность струи регургита-
ции на протяжении систолы можно
измерить с помощью цветового доп-
плеровского картирования кровото-
ка или цветовой допплерографии в
М-режиме
Параметр струи
для коли-
чественно-
го определе-
ния объема
митральной ре-
гургитации
Технические факто-
ры могут повли-
ять на определение
струи митральной
регургитации как
голосистолической
(эксцентрическая
струя, частота ка-
дров)
Голосистолическая струя
митральной регурги-
тации почти всегда ас-
социируется с тяже-
лой МР
Неголосистолическая
струя митральной ре-
гургитации может на-
блюдаться при умерен-
ной или менее выра-
женной МР
* Nishimura R, Otto C, Bonow R, et al. AHA/ACC 2014 guideline for management of patients with valvular heart disease, Circulation 129:e650, 2014.
† Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and the European association of cardiovascular imaging, J Am Soc Echocardiogr 28:1–39, 2015.
EROA — эффективная площадь отверстия регургитации; PISA — площадь проксимальной зоны струи регургитации; Rvol — объем ре-
гургитации; VTI — интеграл скорости кровотока; ВТЛЖ — выходной тракт левого желудочка; КДО — конечно-диастолический объем;
КСО — конечно -систолический объем; ЛЖ — левый желудочек; ЛП — левое предсердие; ТТЭхоКГ — трансторакальная эхокардиогра-
фия; ЭКГ — электрокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Митральная регургитация
ЛИТЕРАТУРА
1. Ling HL, Enriquez-Sarano M, Seward JB, et
al. Clinical outcome of mitral regurgitation
due to flail leaflets, N Eng J Med 335:1417–
1423, 1996.
2. Rosen SE, Borer JS, Hochreiter C, et al. Natu-
ral history of the asymptomatic/minimally
symptomatic patient with severe mitral regur-
gitation secondary to mitral valve prolapse
and normal right and left ventricular perfor-
mance, Am J Cardiol 74:374–380, 1994.
3. Clemens JD, Horwitz RI, Jaffe CC, et al. A
controlled evaluation of the risk of bacterial
endocarditis in persons with mitral-valve pro-
lapse, N Engl J Med 307:776–781, 1982.
4. Nishimura RA, McGoon MD, Shub C, et al.
Echocardiographically documented mitral-
valve prolapse. Long-term follow-up of 237
patients, N Engl J Med 313:1305–1309, 1985.
5. Lamas GA, Mitchell GF, Flaker GC, et al.
Clinical significance of mitral regurgitation
after acute myocardial infarction. Survival
and Ventricular Enlargement Investigators,
Circulation 96:827–833, 1997.
6. Grigioni F, Enriquez-Sarano M, Zehr KJ, et al.
Ischemic mitral regurgitation. Long-term
outcome and prognostic implications with
quantitative Doppler assessment, Circulation
103:1759–1764, 2001.
7. Stevenson LW, Bellil D, Grover-McKay M, et
al. Effects of afterload reduction (diuretics
and vasodilators) on left ventricular volume
and mitral regurgitation in severe congestive
heart failure secondary to ischemic or idio-
pathic dilated cardiomyopathy, Am J Cardiol
60:654–658, 1987.
8. Junker A, Thayssen P, Nielsen B, Andersen
PE. The hemodynamic and prognostic sig-
nificance of echo-Doppler-proven mitral re-
gurgitation in patients with dilated cardiomy-
opathy, Cardiology 83:14–20, 1993.
9. Koelling TM, Aaronson KD, Cody RJ, et al.
Prognostic significance of mitral regurgita-
tion and tricuspid regurgitation in patients
with left ventricular systolic dysfunction, Am
Heart J 144:524–529, 2002.
10. Nkomo VT, Gardin JM, Skelton TN, et al. Bur-
den of valvular heart diseases: a population-
based study, Lancet 368:1005–1011, 2006.
ch18.indd 429
03.04.2019 11:55:16
430
ЧАСТЬ IV Пороки клапанов сердца
11. Jones EC, Devereux RB, Roman MJ, et al.
Prevalence and correlates of mitral regurgita-
tion in a population-based sample (the Strong
Heart Study), Am J Cardiol 87:298–304, 2001.
12. Singh JP, Evans JC, Levy D, et al. Prevalence
and clinical determinants of mitral, tricuspid
and aortic regurgitation, Am J Cardiol 83:897–
902, 1999.
13. Gammie JS, Sheng S, Griffith BP, et al. Trends
in mitral valve surgery in the United States:
results from the Society of Thoracic Surgeons
Adult Cardiac Surgery Database, Ann Thorac
Surg 87:1431–1437, 2009.
14. Levine RA, Triulzi MO, Harrigan P, Weyman
AE. The relationship of mitral annular shape
to the diagnosis of mitral valve prolapse, Cir-
culation 75:756–767, 1987.
15. Kopuz C, Erk K, Baris YS, et al. Morphometry
of the fibrous ring of the mitral valve, Annals
Anat 177:151–154, 1995.
16. Jimenez JH, Liou SW, Padala M, et al. A sad-
dle-shaped annulus reduces systolic strain on
the central region of the mitral valve anterior
leaflet, J Thorac Cardiovasc Surg 134:1562–
1568, 2007.
17. Padala M, Hutchison RA, Croft LR, et al.
Saddle shape of the mitral annulus reduces
systolic strains on the P2 segment of the pos-
terior mitral leaflet, Ann Thorac Surg 88:1499–
1504, 2009.
18. Kunzelman KS, Reimink MS, Cochran RP.
Annular dilatation increases stress in the mi-
tral valve and delays coaptation: a finite ele-
ment computer model, Cardiovasc Surg
5:427–534, 1997.
19. Kunzelman KS, Cochran RP, Chuong C, et al.
Finite element analysis of the mitral valve, J
Heart Valve Dis 2:326–340, 1993.
20. Mihalatos DG, Joseph S, Gopal A, et al. Mitral
annular remodeling with varying degrees and
mechanisms of chronic mitral regurgitation,
J Am Soc Echocardiogr 20:397–404, 2007.
21. Dreyfus GD, Bahrami T, Alayle N, et al. Re-
pair of anterior leaflet prolapse by papillary
muscle repositioning: a new surgical option,
Ann Thorac Surg 71:1464–1470, 2001.
22. Godley RW, Wann LS, Rogers EW, et al. In-
complete mitral leaflet closure in patients
with papillary muscle dysfunction, Circula-
tion 63:565–571, 1981.
23. Freed LA, Levy D, Levine RA, et al. Preva-
lence and clinical outcome of mitral-valve
prolapse, N Engl J Med 341:1–7, 1999.
24. Devereux RB, Brown WT, Kramer-Fox R,
Sachs I. Inheritance of mitral valve prolapse:
effect of age and sex on gene expression, Ann
Intern Med 97:826–832, 1982.
25. Disse S, Abergel E, Berrebi A, et al. Mapping
of a first locus for autosomal dominant myx-
omatous mitral-valve prolapse to chromo-
some 16p11.2-p12.1, Am J Hum Genet
65:1242–1251, 1999.
26. Freed LA, Acierno Jr. JS, Dai D, et al. A locus
for autosomal dominant mitral valve prolapse
on chromosome 11p15.4, Am J Hum Genet
72:1551–1559, 2003.
27. Nesta F, Leyne M, Yosefy C, et al. New locus for
autosomal dominant mitral valve prolapse on
chromosome 13: clinical insights from genetic
studies, Circulation 112:2022–2030, 2005.
28. Barlow JB, Pocock WA. Billowing, floppy,
prolapsed or flail mitral valves? Am J Cardiol
55:501–502, 1985.
29. Carpentier A, Chauvaud S, Fabiani JN. Re-
constructive surgery of mitral valve incompe-
tence: ten year appraisal, J Thorac Cardiovasc
Surg 79:338–348, 1980.
30. Anyanwu AC, Adams DH. Etiologic classifi-
cation of degenerative mitral valve disease:
barlow’s disease and fibroelastic deficiency,
Semin Thorac Cardiovasc Surg 19:90–96, 2007.
31. Adams DH, Anyanwu AC, Rahmanian PB, et
al. Large annuloplasty rings facilitate mitral
valve repair in Barlow’s disease, Ann Thorac
Surg 82:2096–2100, 2006. discussion 2101.
32. Barber JE, Kasper FK, Ratliff NB, et al. Me-
chanical properties of myxomatous mitral
valves, J Thorac Cardiovasc Surg 122:955–962,
2001.
33. Chandra S, Salgo IS, Sugeng L, et al. Charac-
terization of degenerative mitral valve disease
using morphologic analysis of real-time
three-dimensional echocardiographic images:
objective insight into complexity and plan-
ning of mitral valve repair, Circ Cardiovasc
Imaging 4:24–32, 2011.
34. Fornes P, Heudes D, Fuzellier JF, et al. Cor-
relation between clinical and histologic pat-
terns of degenerative mitral valve insuffi-
ciency: a histomorphometric study of 130
excised segments, Cardiovasc Pathol 8:81–92,
1999.
35. Avierinos JF, Gersh BJ, Melton 3rd LJ, et al.
Natural history of asymptomatic mitral valve
prolapse in the community, Circulation
106:1355–1361, 2002.
36. Devereux RB, Kramer-Fox R, Shear MK, et al.
Diagnosis and classification of severity of mi-
tral valve prolapse: methodologic, biologic,
and prognostic considerations, Am Heart J
113:1265–1280, 1987.
37. Zuppiroli A, Rinaldi M, Kramer-Fox R, et al.
Natural history of mitral valve prolapse, Am
J Cardiol 75:1028–1032, 1995.
38. Avierinos JF, Detaint D, Messika-Zeitoun D,
et al. Risk, determinants, and outcome impli-
cations of progression of mitral regurgitation
after diagnosis of mitral valve prolapse in a
single community, Am J Cardiol 101:662–667,
2008.
39. Rothenbuhler M, O’Sullivan CJ, Stortecky S,
et al. Active surveillance for rheumatic heart
disease in endemic regions: a systematic re-
view and meta-analysis of prevalence among
children and adolescents, Lancet Glob Health
2:e717–e726, 2014.
40. Roldan CA, Shively BK, Crawford MH. An
echocardiographic study of valvular heart
disease associated with systemic lupus erythe-
matosus, N Engl J Med 335:1424–1430, 1996.
41. Sattur S, Bates S, Movahed MR. Prevalence of
mitral valve prolapse and associated valvular
regurgitations in healthy teenagers undergo-
ing screening echocardiography, Exp Clin
Cardiol 15:e13–e15, 2010.
42. Kohl T, Silverman NH. Comparison of cleft
and papillary muscle position in cleft mitral
valve and atrioventricular septal defect, Am J
Cardiol 77:164–169, 1996.
43. Bano-Rodrigo A, Van Praagh S, Trowitzsch E,
Van Praagh R. Double-orifice mitral valve: a
study of 27 postmortem cases with develop-
mental, diagnostic and surgical consider-
ations, Am J Cardiol 61:152–160, 1988.
44. Bursi F, Enriquez-Sarano M, Nkomo VT, et
al. Heart failure and death after myocardial
infarction in the community: the emerging
role of mitral regurgitation, Circulation
111:295–301, 2005.
45. Clements Jr. SD, Story WE, Hurst JW, et al.
Ruptured papillary muscle, a complication of
myocardial infarction: clinical presentation,
diagnosis, and treatment, Clin Cardiol 8:93–
103, 1985.
46. Levine RA, Schwammenthal E. Ischemic mi-
tral regurgitation on the threshold of a solu-
tion: from paradoxes to unifying concepts,
Circulation 112:745–758, 2005.
47. Kumanohoso T, Otsuji Y, Yoshifuku S, et al.
Mechanism of higher incidence of ischemic
mitral regurgitation in patients with inferior
myocardial infarction: quantitative analysis
of left ventricular and mitral valve geometry
in 103 patients with prior myocardial infarc-
tion, J Thorac Cardiovasc Surg 125:135–143,
2003.
48. Carpentier A. Cardiac valve surgery — the
“ French correction”,, J Thorac Cardiovasc
Surg 86:323–337, 1983.
49. Roberts BJ, Grayburn PA. Color flow imaging
of the vena contracta in mitral regurgitation:
technical considerations, J Am Soc Echocar-
diogr 16:1002–1006, 2003.
50. Miyatake K, Izumi S, Okamoto M, et al. Semi-
quantitative grading of severity of mitral re-
gurgitation by real-time two-dimensional
Doppler flow imaging technique, J Am Coll
Cardiol 7:82–88, 1986.
51. Omoto R, Yokote Y, Takamoto S, et al. The
development of real-time two-dimensional
Doppler echocardiography and its clinical sig-
nificance in acquired valvular diseases. With
special reference to the evaluation of valvular
regurgitation, Jpn Heart J 25:325–340, 1984.
52. Enriquez-Sarano M, Tajik AJ, Bailey KR,
Seward JB. Color flow imaging compared
with quantitative Doppler assessment of se-
verity of mitral regurgitation: influence of
eccentricity of jet and mechanism of regurgi-
tation, J Am Coll Cardiol 21:1211–1219, 1993.
53. Spain MG, Smith MD, Grayburn PA, et al.
Quantitative assessment of mitral regurgita-
tion by Doppler color flow imaging: angio-
graphic and hemodynamic correlations, J Am
Coll Cardiol 13:585–590, 1989.
54. Fehske W, Omran H, Manz M, et al. Color-
coded Doppler imaging of the vena contracta
as a basis for quantification of pure mitral
regurgitation, Am J Cardiol 73:268–274, 1994.
55. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the
severity of native valvular regurgitation with
two-dimensional and Doppler echocardiogra-
phy, J Am Soc Echocardiogr 16:777–802, 2003.
56. Chen C, Thomas JD, Anconina J, et al. Impact
of impinging wall jet on color Doppler quan-
tification of mitral regurgitation, Circulation
84:712–720, 1991.
57. Maciel BC, Moises VA, Shandas R, et al. Ef-
fects of pressure and volume of the receiving
chamber on the spatial distribution of regur-
gitant jets as imaged by color Doppler flow
mapping. An in vitro study, Circulation
83:605–613, 1991.
58. Hoit BD, Jones M, Eidbo EE, et al. Sources of
variability for Doppler color flow mapping of
regurgitant jets in an animal model of mitral
regurgitation, J Am Coll Cardiol 13:1631–
1636, 1989.
59. Yellin EL, Yoran C, Sonnenblick EH, et al.
Dynamic changes in the canine mitral regur-
gitant orifice area during ventricular ejection,
Circ Res 45:677–683, 1979.
60. Rivera JM, Mele D, Vandervoort PM, et al.
Physical factors determining mitral regurgita-
tion jet area, Am J Cardiol 74:515–516, 1994.
61. Simpson IA, Valdes-Cruz LM, Sahn DJ, et al.
Doppler color flow mapping of simulated
in vitro regurgitant jets: evaluation of the ef-
fects of orifice size and hemodynamic vari-
ables, J Am Coll Cardiol 13:1195–1207, 1989.
ch18.indd 430
03.04.2019 11:55:16
431
18 Митральная регургитация
62. Lancellotti P, Moura L, Pierard LA, et al. Eu-
ropean Association of Echocardiography rec-
ommendations for the assessment of valvular
regurgitation. Part 2: mitral and tricuspid re-
gurgitation (native valve disease), Eur J Echo-
cardiogr 11:307–332, 2010.
63. Baumgartner H, Schima H, Kuhn P. Value
and limitations of proximal jet dimensions
for the quantitation of valvular regurgitation:
an in vitro study using Doppler flow imaging,
J Am Soc Echocardiogr 4:57–66, 1991.
64. Lesniak-Sobelga A, Olszowska M, Pienazek P,
et al. Vena contracta width as a simple method
of assessing mitral valve regurgitation. Com-
parison with Doppler quantitative methods, J
Heart Valve Dis 13:608–614, 2004.
65. Zhou X, Jones M, Shiota T, Yamada I, Teien
D, Sahn DJ. Vena contracta imaged by Dop-
pler color flow mapping predicts the severity
of eccentric mitral regurgitation better than
color jet area: a chronic animal study, J Am
Coll Cardiol 30:1393–1398, 1997.
66. Grayburn PA, Fehske W, Omran H, et al.
Multiplane transesophageal echocardiogra-
phic assessment of mitral regurgitation by
Doppler color flow mapping of the vena
contracta, Am J Cardiol 74:912–917, 1994.
67. Hall SA, Brickner ME, Willett DW, et al. As-
sessment of mitral regurgitation by Doppler
color flow mapping of the vena contracta,
Circulation 95:636–642, 1997.
68. Heinle SK, Hall SA, Brickner E, et al. Com-
parison of vena contracta width by multi-
plane transesophageal echocardiography with
quantitative Doppler assessment of mitral
regurgitation, Am J Cardiol 81:175–179, 1998.
69. Vandervoort PM, Thoreau DH, Rivera JM, et
al. Automated flow rate calculations based on
digital analysis of flow convergence proximal
to regurgitant orifices, J Am Coll Cardiol
22:535–541, 1993.
70. Utsunomiya T, Ogawa T, Tang HA. Doppler
color flow mapping of the proximal isoveloc-
ity surface area: a new method for measuring
volume flow rate across a narrowed orifice, J
Am Soc Echocardiogr 4:338–348, 1991.
71. Rodriguez L, Anconina J, Flachskampf FA, et
al. Impact of finite orifice size on proximal
flow convergence. Implications for Doppler
quantification of valvular regurgitation, Circ
Res 70:923–930, 1992.
72. Recusani F, Bargiggia GS, Yoganathan AP, et
al. A new method for quantification of regur-
gitant flow rate using color Doppler flow im-
aging of the flow convergence region proxi-
mal to a discrete orifice. An in vitro study,
Circulation 83:594–604, 1991.
73. Bargiggia GS, Tronconi L, Sahn DJ, et al. A
new method for quantification of mitral re-
gurgitation based on color flow Doppler im-
aging of flow convergence proximal to regur-
gitant orifice, Circulation 84:1481–1489, 1991.
74. Utsunomiya T, Ogawa T, Doshi R. Doppler
color flow “proximal isovelocity surface area”
method for estimating volume flow rate: ef-
fects of orifice shape and machine factors, J
Am Coll Cardiol 17:1103–1111, 1991.
75. Rivera JM, Vandervoort PM, Thoreau DH, et
al. Quantification of mitral regurgitation with
the proximal flow convergence method: a
clinical study, Am Heart J 124:1289–1296,
1992.
76. Utsunomiya T, Doshi F, Patel D. Calculation
of volume flow rate by the proximal isoveloc-
ity surface area method: simplified approach
using color Doppler zero baseline shift, J Am
Coll Cardiol 22:277–282, 1993.
77. Enriquez-Sarano M, Miller FA, Hayes SN, et
al. Effective mitral regurgitation orifice area:
clinical use and pitfalls of the proximal isove-
locity surface area method, J Am Coll Cardiol
25:703–709, 1995.
78. Schwammenthal E, Chen C, Giesler M, et al.
New method for accurate calculation of re-
gurgitant flow rate based on analysis of Dop-
pler color flow maps of the proximal flow
field. Validation in a canine model of mitral
regurgitation with initial application in pa-
tients, J Am Coll Cardiol 27:161–172, 1996.
79. Moises VA, Maciel BC, Hornberger LK, et al. A
new method for noninvasive estimation of
ventricular septal defect shunt flow by Doppler
color flow mapping: imaging of the laminar
flow convergence region on the left septal sur-
face, J Am Coll Cardiol 18:824–832, 1991.
80. Schwammenthal E, Chen C, Benning F, et al.
Dynamics of mitral regurgitant flow and ori-
fice area. Physiologic application of the prox-
imal flow convergence method: clinical data
and experimental testing, Circulation 90:307–
322, 1994.
81. Enriquez-Sarano M, Sinak LJ, Tajik AJ, et al.
Changes in effective regurgitant orifice
throughout systole in patients with mitral
valve prolapse. A clinical study using the
proximal isovelocity surface area method,
Circulation 92:2951–2958, 1995.
82. Pu M, Vandervoort PM, Griffin BP, et al.
Quantification of mitral regurgitation by the
proximal convergence method using trans-
esophageal echocardiography. Clinical valida-
tion of a geometric correction for proximal
flow constraint, Circulation 92:2169–2177,
1995.
83. Little SH, Igo SR, Pirat B, et al. In vitro valida-
tion of real-time three-dimensional color
Doppler echocardiography for direct mea-
surement of proximal isovelocity surface area
in mitral regurgitation, Am J Cardiol 99:1440–
1447, 2007.
84. Yosefy C, Levine RA, Solis J, et al. Proximal
flow convergence region as assessed by real-
time 3-dimensional echocardiography: chal-
lenging the hemispheric assumption, J Am Soc
Echocardiogr 20:389–396, 2007.
85. Zeng X, Levine RA, Hua L, et al. Diagnostic
value of vena contracta area in the quantifica-
tion of mitral regurgitation severity by color
Doppler 3D echocardiography, Circ Cardio-
vasc Imaging 4:506–513, 2011.
86. Hopmeyer J, He S, Thorvig KM, et al. Estima-
tion of mitral regurgitation with a hemiellip-
tic curve-fitting algorithm: in vitro experi-
ments with native mitral valves, J Am Soc
Echocardiogr 11:322–331, 1998.
87. Vahanian A, Alfieri O, Andreotti F, et al. Guide-
lines on the management of valvular heart dis-
ease (version 2012). Joint task force on the man-
agement of valvular heart disease of the Euro-
pean Society of Cardiology (ESC); European
Association for Cardio-Thoracic Surgery
(EACTS), Eur Heart J 33:2451–2496, 2012.
88. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
63:e57–e185, 2014.
89. Marwick TH, Zoghbi WA, Narula J. Redraw-
ing the borders: considering guideline revi-
sion in functional mitral regurgitation, JACC
Cardiovasc Imaging 7:333–335, 2014.
90. Grayburn PA, Carabello B, Hung J, et al. De-
fining “severe” secondary mitral regurgita-
tion: emphasizing an integrated approach, J
Am Coll Cardiol 64:2792–2801, 2014.
91. Rokey R, Sterling LL, Zoghbi WA, et al. De-
termination of regurgitant fraction in isolated
mitral or aortic regurgitation by pulsed Dop-
pler two-dimensional echocardiography, J
Am Coll Cardiol 7:1273–1278, 1986.
92. Ascah KJ, Stewart WJ, Jiang L, et al. A Dop-
pler-two-dimensional
echocardiographic
method for quantitation of mitral regurgita-
tion, Circulation 72:377–383, 1985.
93. Enriquez-Sarano M, Dujardin KS, Tribouilloy
CM, et al. Determinants of pulmonary ve-
nous flow reversal in mitral regurgitation and
its usefulness in determining the severityof
the mitral regurgitation, Am J Cardiol 83:535–
541, 1999.
94. Castello R, Pearson AC, Lenzen P, Labovitz
AJ. Effect of mitral regurgitation on pulmo-
nary venous velocities derived from trans-
esophageal echocardiography color-guided
pulsed Doppler imaging, Am Coll Cardiol
17:1499–1506, 1991.
95. Kamp O, Huitink H, Van Eenige MJ, et al.
Value of pulmonary venous flow characteris-
tics in the assessment of severity of native
mitral valve regurgitation: an angiographic
correlated study, J Am Soc Echocardiogr 5:
239–246, 1992.
96. Topilsky Y, Michelena H, Bichara V, et al.
Mitral valve prolapse with mid-late systolic
mitral regurgitation: pitfalls of evaluation and
clinical outcome compared with holosystolic
regurgitation, Circulation 125:1643–1651,
2012.
97. Utsunomiya T, Patel D, Doshi R, et al. Can
signal intensity of the continuous wave Dop-
pler regurgitant jet estimate severity of mitral
regurgitation? Am Heart J 123:166–171, 1992.
98. Jenni R, Ritter M, Eberli F, et al. Quantifica-
tion of mitral regurgitation with amplitude-
weighted mean velocity from continuous
wave Doppler spectra, Circulation 79:1294–
1299, 1989.
99. Otsuji Y, Gilon D, Jiang L, et al. Restricted
diastolic opening of the mitral leaflets in pa-
tients with left ventricular dysfunction: evi-
dence for increased valve tethering, J Am Coll
Cardiol 32:398–404, 1998.
100. Yiu SF, Enriquez-Sarano M, Tribouilloy C, et al.
Determinants of the degree of functional mitral
regurgitation in patients with systolic left ven-
tricular dysfunction: a quantitative clinical
study, Circulation 102:1400–1406, 2000.
101. Nesta F, Otsuji Y, Handschumacher MD, et al.
Leaflet concavity: a rapid visual clue to the
presence and mechanism of functional mitral
regurgitation, J Am Soc Echocardiogr 16:1301–
1308, 2003.
102. Kahlert P, Plicht B, Schenk IM, et al. Direct
assessment of size and shape of noncircular
vena contracta area in functional versus or-
ganic mitral regurgitation using real-time
three-dimensional echocardiography, J Am
Soc Echocardiogr 21:912–921, 2008.
103. Marsan NA, Westenberg JJ, Ypenburg C, et al.
Quantification of functional mitral regurgita-
tion by real-time 3D echocardiography:
comparison with 3D velocity-encoded cardiac
magnetic resonance, JACC Cardiovasc Imag-
ing 2:1245–1252, 2009.
104. Yosefy C, Hung J, Chua S, et al. Direct mea-
surement of vena contracta area by real-time
3-dimensional echocardiography for assess-
ch18.indd 431
03.04.2019 11:55:16
432
ЧАСТЬ IV Пороки клапанов сердца
ing severity of mitral regurgitation, Am J
Cardiol 104:978–983, 2009.
105. Zabaneh D, Gaunt TR, Kumari M, et al. Ge-
netic variants associated with Von Willebrand
factor levels in healthy men and women
identified using the HumanCVD BeadChip,
Annals Hum Genet 75:456–467, 2011.
106. Hung J, Otsuji Y, Handschumacher MD, et al.
Mechanism of dynamic regurgitant orifice
area variation in functional mitral regurgita-
tion: physiologic insights from the proximal
flow convergence technique, J Am Coll Car-
diol 33:538–545, 1999.
107. Enriquez-Sarano M, Avierinos JF, Messika-
Zeitoun D, et al. Quantitative determinants of
the outcome of asymptomatic mitral regurgi-
tation, N Engl J Med 352:875–883, 2005.
108. Rosenhek R, Rader F, Klaar U, et al. Outcome
of watchful waiting in asymptomatic severe
mitral regurgitation, Circulation 113:2238–
2244, 2006.
109. Tischler MD, Rowan M, LeWinter MM. Ef-
fect of enalapril therapy on left ventricular
mass and volumes in asymptomatic chronic,
severe mitral regurgitation secondary to mi-
tral valve prolapse, Am J Cardiol 82:242–245,
1998.
110. Host U, Kelbaek H, Hildebrandt P, et al. Ef-
fect of Ramipril on mitral regurgitation sec-
ondary to mitral valve prolapse, Am J Cardiol
80:655–658, 1997.
111. Acker MA, Parides MK, Perrault LP, et al.
Mitral-valve repair versus replacement for
severe ischemic mitral regurgitation, N Engl J
Med 370:23–32, 2014.
112. Smith PK, Puskas JD, Ascheim DD, et al.
Surgical treatment of moderate ischemic mi-
tral regurgitation, N Engl J Med 371:2178–
2188, 2014.
113. Gillinov M. Atrial fibrillation surgery in
nonrheumatic mitral valve disease, J Interv
Card Electrophysiol 20:101–107, 2007.
114. Grossi EA, Goldberg JD, LaPietra A, et al.
Ischemic mitral valve reconstruction and re-
placement: comparison of long-term survival
and complications, J Thorac Cardiovasc Surg
122:1107–1124, 2001.
115. Chan KM, Punjabi PP, Flather M, et al. Coro-
nary artery bypass surgery with or without
mitral valve annuloplasty in moderate func-
tional ischemic mitral regurgitation: final re-
sults of the Randomized Ischemic Mitral
Evaluation (RIME) Trial, Circulation 126:
2502–2510, 2012.
116. Bonow RO, Masoudi FA, Rumsfeld JS, et al.
ACC/AHA classification of care metrics:
performance measures and quality metrics: a
report of the American College of Cardiology/
American Heart Association Task Force on
Performance Measures, Circulation 118:
2662–2666, 2008.
117. Capomolla S, Febo O, Gnemmi M, et al. Beta-
blockade therapy in chronic heart failure:
diastolic function and mitral regurgitation
improvement by carvedilol, Am Heart J
139:596–608, 2000.
118. Linde C, Leclercq C, Rex S, et al. Long-term
benefits of biventricular pacing in congestive
heart failure: results from the MUltisite
STimulation in cardiomyopathy (MUSTIC)
study, J Am Coll Cardiol 40:111–118, 2002.
119. Breithardt OA, Sinha AM, Schwammenthal E,
et al. Acute effects of cardiac resynchroniza-
tion therapy on functional mitral regurgita-
tion in advanced systolic heart failure, J Am
Coll Cardiol 41:765–770, 2003.
120. Lang RM, Badano LP, Mor-Avi V, et al.
Recommendations for cardiac chamber
quantification by echocardiography in adults:
an update from the American Society of
Echocardiography and the European associa-
tion of cardiovascular imaging, J Am Soc
Echocardiogr 28:1–39, 2015.
ch18.indd 432
03.04.2019 11:55:16
433
19 Чреспищеводная эхокардиография
во время реконструкции клапана
при митральной регургитации
DANIEL H. DRAKE, MD • KAREN G. ZIMMERMAN, BS • DAVID A. SIDEBOTHAM, MBCHB
Достоверно установлено превосходство реконструк-
ции митрального клапана над его протезированием
при лечении первичной митральной регургитации
[1, 2]. При надлежащем отборе пациентов пластика
митрального клапана может быть оптимальным ва-
риантом лечения и вторичной митральной регурги-
тации.
Чреспищеводная эхокардиография (ЧПЭхоКГ) —
идеальный метод визуализации при определении
возможности выполнения пластики митрального
клапана и контроле реконструктивного хирургиче-
ского вмешательства [3, 4]. В этой главе внимание ак-
центировано на использовании ЧПЭхоКГ в качестве:
(1) метода контроля реконструктивного хирургиче-
ского вмешательства; (2) выявлении осложнений по-
сле пластики. Показания к хирургическому вмеша-
тельству и количественная оценка митральной ре-
гургитации с помощью ЭхоКГ описаны в главе 18.
ПЛАСТИКА МИТРАЛЬНОГО КЛАПАНА
ПОД КОНТРОЛЕМ ЭХОКАРДИОГРАФИИ
Для большинства пациентов с тяжелой митральной
регургитацией пластика клапана является предпо-
чтительным вариантом лечения [1]. Эхокардиогра-
фия (ЭхоКГ) во время вмешательства позволяет по-
лучить ценную информацию о патоморфологии ми-
трального клапана, что помогает принять решение
о хирургической тактике и, следовательно, способ-
ствует достижению благоприятного результата.
В руководстве American College of Cardiology/
American Heart Association (ACC/AHA) по ведению
пациентов с клапанным пороком сердца для полу-
чения оптимального результата пластики митраль-
ного клапана рекомендуется бригадный подход к
лечению пациентов с комбинированными порока-
ми сердца в специализированном медицинском
центре (с участием квалифицированных хирургов,
Пластика митрального клапана
под контролем эхокардиографии
Ключевые моменты анатомии
Поражения митрального клапана
Дегенеративное поражение
Инфекционный эндокардит
Ревматическое поражение
Лучевой некроз
Дистрофическая кальцификация
Отрыв папиллярной мышцы
Вторичное поражение
Чреспищеводная эхокардиография
митрального клапана
Стандартная мультипланарная
визуализация
Метод осевой визуализации
Трехмерная визуализация
Чреспищеводная эхокардиография
перед операцией
Дегенеративное поражение
Инфекционный эндокардит
Ревматическое поражение
Отрыв папиллярной мышцы
Вторичное поражение
Комбинированное поражение
Хирургические техники пластики
митрального клапана под контролем
эхокардиографии
Дегенеративное поражение
Инфекционный эндокардит
Ревматическое поражение
Отрыв папиллярной мышцы
Вторичное поражение
Чреспищеводная эхокардиография
после пластики
Строение и функция створок
Остаточная митральная регургитация
Вновь возникший митральный стеноз
Дисфункция желудочка
Парадоксальное систолическое
движение передней створки
митрального клапана
ch19.indd 433
03.04.2019 11:55:28
434
ЧАСТЬ IV Пороки клапанов сердца
кардиологов, анестезиологов и специалистов по
ультразвуковой диагностике сердца) [1].
Есть несколько принципов бригадного подхода к
пластике под контролем ЭхоКГ.
Во-первых, пациенты, имеющие показания к ре-
конструкции, должны быть направлены к хирургу,
который специализируется на митральном клапане.
Важным фактором, определяющим результат, яв-
ляется объем хирургического вмешательства: более
высокая вероятность успешной пластики и мень-
шая частота осложнений отмечаются при операци-
ях большого объема [5, 6].
Во-вторых, существенное значение имеет надле-
жащая визуализация митрального клапана. Для
первоначальной оценки митральной регургитации
и последующего наблюдения достаточно трансто-
ракальной эхокардиографии (ТТЭхоКГ) [1], а для
оценки успешности пластики и выбора хирургиче-
ской техники нужна количественная оценка пато-
морфологии митрального клапана. Трехмерная чре-
спищеводная эхокардиография (3D-ЧПЭхоКГ) пре-
доставляет бесценную информацию о локализации
и механизме митральной регургитации, по сравне-
нию с данными, полученными при ТТЭхоКГ или
стандартной ЧПЭхоКГ [7–13]. Количественный ана-
лиз с помощью трехмерной мультипланарной ре-
конструкции позволяет провести воспроизводимые
измерения клапана и створок, что помогает при-
нять решение относительно хирургической тактики
[4]. В идеале ЧПЭхоКГ следует выполнять перед
операцией, поскольку это помогает хирургу сплани-
ровать хирургическое вмешательство, а пациенту —
подписать информированное согласие на опера-
цию.
В-третьих, ЧПЭхоКГ должны выполнять врачи
(обычно кардиологи или анестезиологи), которые
имеют соответствующую подготовку и опыт. Реко-
мендации по подготовке и аттестации врачей по
ЧПЭхоКГ обобщены в руководстве American Society
of Echocardiography (ASE) и Society of Cardiovascular
Anesthesiologists по проведению квалификационно-
го экзамена по ЧПЭхоКГ [14]. Огромное значение
имеет помощь квалифицированного специалиста
по ультразвуковому исследованию сердца, особен-
но при количественном анализе объемных данных.
ASE опубликовало предложения по расширению
обучения ультразвуковому исследованию сердца
[15]. Помимо обучения и аттестации в области
ЧПЭхоКГ, важно, чтобы практикующий клиницист
обладал подробными знаниями анатомии и патоло-
гии митрального клапана.
В-четвертых, для обеспечения достоверности и
воспроизводимости полученных данных следует
использовать стандартизованный подход к визуа-
лизации с помощью ЧПЭхоКГ. Измерения нужно
проводить в соответствующих позициях, используя
унифицированные подходы к отображению изо-
бражений и количественной оценке.
Наконец, чрезвычайно важно использовать стан-
дартную терминологию. Например, при обозначе-
нии сегментов створок следует применять термины
из номенклатуры Carpentier, а не такие термины,
как медиальный гребень. Термины молотящая створ-
ка и пролапс нужно использовать только в конкрет-
ных случаях. Следует избегать таких неоднознач-
ных слов, как вздутие или легкая плюс регургитация.
КЛЮЧЕВЫЕ МОМЕНТЫ АНАТОМИИ
Для точной оценки патофизиологии дисфункции
митрального клапана необходимо знание его нор-
мального анатомического строения.
Митральный клапан состоит из двух створок, фи-
брозного кольца, сухожильных хорд и папилляр-
ных мышц и связанного с ними миокарда левого
желудочка (ЛЖ) (рис. 19.1). Фиброзное кольцо име-
ет седловидную форму [16, 17]. Во время систолы
фиброзное кольцо укорачивается по переднезадней
оси и сгибается по комиссуральной оси, что приво-
дит к углублению «седла» [18–20]. Укорачивание и
сгибание во время систолы способствуют сближе-
нию створок клапана, в частности в раннюю систо-
лу, когда давление в желудочке слишком низкое для
закрытия клапана [18, 21].
Прикрепление задней створки к фиброзному
кольцу имеет бо
́
льшую протяженность, чем у пе-
редней створки, а длина от основания до дистально-
го участка меньше, чем у передней створки. В зад-
ней створке четко определяются три анатомические
расщелины, которых нет в передней створке. Длина
задней створки по окружности во время систолы
уменьшается с формированием между сегментами
складок, что способствует коаптации створок и за-
крытию клапана. Длина передней створки по окруж-
ности во время систолы существенно не меняется,
поэтому складки не образуются. Сегменты перед-
ней створки обозначают, используя номенклатуру,
предложенную Carpentier [22]. Створки прикрепле-
ны к переднелатеральной и заднемедиальной ко-
миссурам. Коаптация створок происходит на уров-
не плоскости фиброзного кольца или ниже. В нор-
ме длина линии сопоставления створок составляет
от 8 до 10 мм в конце систолы. Ниже комиссур на-
ходятся соответственно переднелатеральная и за-
днемедиальная папиллярные мышцы. Каждая па-
пиллярная мышца симметрично поддерживает обе
створки.
Кровоснабжение переднелатеральной папилляр-
ной мышцы осуществляется ветвями левой перед-
ней нисходящей артерии и огибающей артерии,
тогда как правая коронарная артерия — единствен-
ный источник кровоснабжения заднемедиальной
папиллярной мышцы.
Створки прикреплены к папиллярным мышцам
посредством сухожильных хорд. Первичные (крае-
вые) сухожильные хорды идут к свободным краям
ch19.indd 434
03.04.2019 11:55:28
435
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Клапан легочной
артерии
Аортальный
клапан
Правая
коронарная
артерия
Переднелатеральная
папиллярная мышца
Клапан легочной артерии
Posterior
Anterior
Medial
Lateral
Аортальный клапан
Трикуспидальный
клапан
Заднемедиальная
папиллярная мышца
Митральный
клапан
Трикуспи-
дальный
клапан
Ножка пучка Гиса
Коронарный синус
Митральный
клапан
Огибающая
артерия
Область ушка ЛП
Фиброзный контакт
между митральным
и аортальным клапанами
Левая коронарная
артерия
A1
A2
A3
P3
P2
P1
А
Б
Рис. 19.1 Топографическая анатомия митрального клапана. Вид со стороны левого предсердия (ЛП). (A) Систола. В норме в задней створке митрально-
го клапана есть две естественные расщелины, разделяющие заднюю створку на три сегмента — P1 , P2 и P3 согласно номенклатуре Carpentier. Сегмент P1 при-
лежит к ушку левого предсердия, а сегмент P3 — к трикуспидальному клапану. В передней створке естественные расщелины отсутствуют, но ее сегменты обо-
значают аналогично — A1 , A2 и A3. (Б) Диастола. Переднелатеральная и заднемедиальная папиллярные мышцы симметрично поддерживают переднюю и за-
днюю створки: переднелатеральная — сегменты A1 и P1 и переднелатеральную часть сегментов A2 и P2; заднемедиальная мышца — сегменты A3 и P3 и
заднелатеральную часть сегментов A2 и P2.
створок, вторичные (промежуточные) сухожиль-
ные хорды прикрепляются к желудочковой поверх-
ности створок между краем и фиброзным кольцом.
Третичные (базальные) сухожильные хорды кре-
пятся к основанию задней створки и комиссураль-
ным створкам или фиброзному кольцу.
ПОРАЖЕНИЯ МИТРАЛЬНОГО КЛАПАНА
Поражения митрального клапана разделяют на пер-
вичные или вторичные. Первичные поражения воз-
никают в результате нарушений, непосредственно
изменяющих анатомию клапана, а также вследствие
миксоматозной дегенерации, инфекционного эндо-
кардита, ревматической болезни и отрыва папил-
лярной мышцы. Вторичные поражения обусловле-
ны нарушениями, которые приводят к искажению
геометрии ЛЖ (как правило, из-за дилатации ЛЖ).
Независимо от причины, митральная регургита-
ция возникает вследствие дисфункции. Классифи-
кация дисфункции митрального клапана по Carpen-
tier представлена на рис. 19.2 [23]. Связь между по-
ражением клапана и дисфункцией четко описывает
концепция митральной трапеции (рис. 19.3).
ДЕГЕНЕРАТИВНОЕ ПОРАЖЕНИЕ
Дегенеративное поражение — наиболее распростра-
ненная форма поражения митрального клапана, ко-
торая включает весь спектр патологии от фиброэла-
стического дефицита до болезни Барлоу [24, 25].
Фиброэластический дефицит характеризуется тон-
кой ослабленной тканью створки из-за недостаточ-
ности мукополисахаридов, коллагена и эластичных
волокон. Отмечается также незначительная избы-
точность ткани створки. Патологический процесс
обычно затрагивает один сегмент створки. Ми-
тральная регургитация возникает вследствие отры-
ва сухожильной хорды, что приводит к формирова-
нию молотящей створки. Чаще наблюдается пора-
жение задней створки, как правило, сегмента P2.
Невовлеченные сегменты створки морфологически
не изменены, а фиброзное кольцо митрального кла-
пана обычно незначительно расширено [26].
Болезнь Барлоу представляет собой генерализо-
ванный процесс, который характеризуется избыт-
ком и утолщением ткани створок и удлинением
первичных сухожильных хорд. Обычно наблюдает-
ся заметная дилатация фиброзного кольца, более
выраженная по комиссуральной оси [27]. При бо-
лезни Барлоу уменьшается систолическое укороче-
ние и сгибание фиброзного кольца [26]. При гисто-
логическом исследовании определяется накопление
во внеклеточном матриксе гликозаминогликанов
(миксоматозная дегенерация) [28, 29]. Митральная
регургитация возникает в результате пролапса
створки, причем могут быть поражены несколько
сегментов. Кроме того, в результате отрыва первич-
ной сухожильной хорды может сформироваться
ch19.indd 435
03.04.2019 11:55:28
436
ЧАСТЬ IV Пороки клапанов сердца
молотящая створка. С болезнью Барлоу ассоцииру-
ются щели или расхождение расщелин задней створ-
ки, их наличие также способствует развитию ми-
тральной регургитации.
Болезнь Барлоу может быть как самостоятель-
ным заболеванием, так и сопутствовать различным
генетически обусловленным системным заболева-
ниям, например синдрому Марфана [30]. Болезнь
Барлоу также ассоциируется с гипертрофической
кардиомиопатией, двухстворчатым аортальным
клапаном и дистрофической кальцификацией [31,
32]. Миксоматозная дегенерация трикуспидального
клапана наблюдается у 40–50% пациентов с болез-
нью Барлоу [33]. Прогрессирование болезни Барлоу
обычно связано с дизъюнкцией фиброзного кольца
митрального клапана, приводящей к увеличению
расстояния между створками в задней части фиброз-
ного кольца [34].
Терминология, используемая при описании деге-
неративных поражений, недостаточно систематизи-
рована. Хирурги широко использует термины фи-
броэластический дефицит и болезнь Барлоу. Неред-
ко в качестве синонима дегенеративного поражения
используют термин миксоматозное поражение ми-
трального клапана.
С точки зрения хирурга большое значение име-
ют две особенности дегенеративного поражения:
(1) распространенность (один сегмент, несколько
сегментов, поражение обеих створок); (2) количе-
ство избыточной ткани створок. Поскольку терми-
ны болезнь Барлоу и фиброэластический дефицит
отражают эти различия, в этой главе будут исполь-
зованы эти термины.
У большинства пациентов с дегенеративным по-
ражением возможно успешное выполнение пласти-
ки. При изолированной молотящей задней створке
частота выполнения пластики приближается к 100%
[35]. При комбинации с поражением передней
створки или поражении двух створок частота вы-
полнения пластики несколько ниже — около 90%
[4, 36].
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Инфекционный эндокардит нативного клапана серд-
ца обычно развивается на фоне уже существующе-
го клапанного порока. Для митрального клапана
это обычно ревматическое или дегенеративное по-
ражения. Инфекционный эндокардит также ассо-
циируется с сахарным диабетом, почечной недоста-
точностью, иммуносупрессией и имплантацией
устройств, например электрода кардиостимулято-
ра. Характерный признак инфекционного эндокар-
дита — вегетации, которые появляются в результа-
те отложения фибрина и тромбоцитов в месте по-
вреждения эндокарда. Вегетации в дальнейшем мо-
гут инфицироваться микроорганизмами, циркули-
рующими в крови. Наиболее распространенные
возбудители — стафилококки и стрептококки (80%)
[37]. Митральная регургитация возникает в резуль-
тате перфорации створки или отрыва сухожильной
хорды, что часто происходит в месте прикрепления
вегетаций. Также в прилежащих структурах могут
сформироваться абсцессы и фистулы.
У большинства пациентов с инфекционным эн-
докардитом митрального клапана возможно вы-
полнение пластики, что коррелирует с низкой ле-
I
II
IIIa
IIIb
Рис. 19.2 A Классификация дисфункции митрального клапана по Carpentier. Дисфункция типа I характеризуется наличием митральной регургитации
при нормальной подвижности створок. Например митральная регургитация вследствие дилатации фиброзного кольца, перфорации створки и разрыва створки.
Дисфункция типа I также может возникать в результате комбинации дегенеративного и вторичного поражений. При дисфункции типа II наблюдается чрезмерная
подвижность створок. Например, пролапс и молотящая створка вследствие дегенеративного поражения. При дисфункции типа III отмечается ограниченная под-
вижность створок. Дисфункцию типа III подразделяют на два подтипа. При дисфункции типа IIIa ограничение подвижности створок наблюдается во время диа-
столы. Например, в результате ревматического поражения, вальвулопатии, индуцированной облучением, и дистрофической кальцификации. При дисфункции ти-
па IIIb ограничение подвижности створок наблюдается во время систолы. Дисфункция типа IIIb может быть симметричной (при дилатационной кардиомиопатии)
и асимметричной (при инфаркте миокарда).
ch19.indd 436
03.04.2019 11:55:29
437
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Рис. 19.3 Митральная трапеция. Взаимосвязь между поражением клапана и структур подклапанного аппарата с последующей дисфункцией створок можно
описать с помощью концепции митральной трапеции. Эта концепция помогает понять патоморфологию митрального клапана и планировать хирургическое вме-
шательство. (A) Положение митральной трапеции относительно фиброзного кольца. (Б) Митральная трапеция в норме. Митральную трапецию строят по четырем
точкам в одной плоскости: (1) переднелатеральная комиссура; (2) заднемедиальная комиссура; (3) основание переднелатеральной папиллярной мышцы; (4) ос-
нование заднемедиальной папиллярной мышцы. Боковые стороны трапеции — это линии, соединяющие основания папиллярных мышц с комиссурами. Верхнее
основание трапеции представляет собой линию, которая соединяет комиссуры (межкомиссуральное расстояние). Нижнее основание трапеции — это линия, со-
единяющая основания папиллярных мышц (расстояние между папиллярными мышцами). (В) Дегенеративное поражение (болезнь Барлоу) проявляется расши-
рением фиброзного кольца и удлинением сухожильных хорд и папиллярных мышц. Расстояние между папиллярными мышцами обычно не изменяется, однако
межкомиссуральное расстояние обычно заметно увеличено. Митральная регургитация возникает в результате чрезмерной подвижности створок (дисфункция ти-
па II по Carpentier). (Г) Асимметричное вторичное поражение. Отмечается смещение заднемедиальной папиллярной мышцы латерально и апикально, что приво-
дит к увеличению расстояния между папиллярными мышцами с незначительным удлинением сухожильных хорд и папиллярных мышц (или без удлинения). Рас-
ширение фиброзного кольца умеренное, а межкомиссуральное расстояние увеличено незначительно. Подвижность створок ограничена асимметрично во время
систолы (дисфункция типа IIIb по Carpentier). (Д) Симметричное вторичное поражение. Отмечается латеральное и апикальное смещение обеих папиллярных мышц,
что приводит к выраженному увеличению расстояния между папиллярными мышцами и ограничению его укорочения во время систолы. При этом может наблю-
даться незначительное удлинение сухожильных хорд и папиллярных мышц. Межкомиссуральное расстояние часто значительно увеличено. Подвижность створок
ограничена симметрично во время систолы (дисфункция типа IIIb по Carpentier). (Е) Сочетание дегенеративного и вторичного поражений. Обычно при таком со-
четании увеличивается как межкомиссуральное расстояние, так и расстояние между папиллярными мышцами. Дегенеративное поражение приводит к расшире-
нию фиброзного кольца, удлинению сухожильных хорд и папиллярных мышц и существенному смещению створок относительно плоскости фиброзного кольца
(дисфункция типа II по Carpentier). Последующая дилатация желудочка приводит к латеральному и апикальному смещению папиллярных мышц (створки возвра-
щаются в плоскость фиброзного кольца) и ограничению подвижности створок (дисфункция типа IIIb по Carpentier).
Переднелатеральная
папиллярная мышца
Заднемедиальная
папиллярная мышца
Передняя створка
А
Б
В
Г
Д
Е
ch19.indd 437
03.04.2019 11:55:29
438
ЧАСТЬ IV Пороки клапанов сердца
тальностью и отсутствием необходимости в по-
вторной операции [38, 39]. При распространенной
деструкции створок или наличии абсцесса либо фи-
стулы нужно протезирование клапана.
РЕВМАТИЧЕСКОЕ ПОРАЖЕНИЕ
Ревматическая болезнь сердца — наиболее распро-
страненная причина клапанных пороков сердца в
развивающихся странах. В развитых странах ревма-
тическая болезнь сердца мало распространена, она
является причиной около 20% случаев клапанных
пороков сердца [40]. Ревматическая болезнь приво-
дит к утолщению, фиброзу и кальцификации ство-
рок и подклапанных структур. В Европе около 85%
случаев митрального стеноза и 15% случаев ми-
тральной регургитации обусловлены ревматиче-
ской болезнью сердца [41]. Митральный стеноз воз-
никает в результате сращения комиссур, тогда как
митральная регургитация возникает вследствие
подтягивания створок и сухожильных хорд.
У многих пациентов с ревматической митраль-
ной регургитацией выполнить хирургическую пла-
стику затруднительно и невозможно. В такой ситу-
ации показано протезирование клапана. У тех паци-
ентов, кому выполнили пластику клапана, в 80–90%
случаев повторное вмешательство было не нужно
длительное время [42–44].
ЛУЧЕВОЙ НЕКРОЗ
Симптомы дисфункции клапана, индуцированной
облучением средостения, появляются через 10–20
лет после облучения [45, 46]. Митральная регурги-
тация возникает в результате утолщения, подтяги-
вания и кальцификации створок и подклапанного
аппарата. Сопутствующими нарушениями могут
быть рестриктивная кардиомиопатия, кальцифика-
ция магистральных сосудов, стеноз коронарных со-
судов, констриктивный перикардит, нарушения
проводимости и фиброз легких. При наличии пока-
заний к оперативному лечению обычно проводят
протезирование клапана.
ДИСТРОФИЧЕСКАЯ КАЛЬЦИФИКАЦИЯ
Дистрофическая кальцификация — распространен-
ное у пожилых пациентов поражение клапана и
имеет те же факторы риска, что и атеросклероз [47,
48]. Кальцификация прежде всего поражает фи-
брозное кольцо, но может распространяться и на те-
ла створок. Дистрофическая кальцификация обыч-
но не приводит к гемодинамически значимой дис-
функции митрального клапана, однако осложняет
проведение операции по другим показаниям, осо-
бенно при дегенеративных поражениях.
ОТРЫВ ПАПИЛЛЯРНОЙ МЫШЦЫ
Отрыв папиллярной мышцы происходит вследствие
инфаркта миокарда. Обычно наблюдается отрыв
заднемедиальной папиллярной мышцы, поскольку
ее кровоснабжает только одна артерия — правая ко-
ронарная. Полный отрыв папиллярной мышцы
приводит к высокоскоростной регургитации. При
полном отрыве нужна экстренная операция, обыч-
но включающая протезирование митрального кла-
пана. Частичный отрыв (одной головки) папилляр-
ной мышцы, как правило, вызывает тяжелую регур-
гитацию, но не высокоскоростную. При частичном
отрыве оперативное вмешательство может быть от-
срочено, допустимо выполнение пластики клапана.
ВТОРИЧНОЕ ПОРАЖЕНИЕ
Основной механизм вторичной митральной регур-
гитации — дилатация ЛЖ, которая приводит к сме-
щению папиллярных мышц латерально и апикаль-
но и сопровождается подтягиванием створок во вре-
мя систолы [49, 50]. Связь между дилатацией ЛЖ
и митральной регургитацией достаточно сложная.
Митральная регургитация чаще наблюдается после
нижнего и заднего инфаркта миокарда, чем после
переднего, несмотря на более выраженную дилата-
цию ЛЖ в последнем случае [51, 52]. Это несоответ-
ствие можно объяснить локальными функциональ-
ными различиями миокарда, которые влияют на
положение папиллярных мышц относительно друг
на друга и створок клапана. Например, такие важ-
ные механизмы вторичной митральной регургита-
ции, как увеличение расстояния между папилляр-
ными мышцами и уменьшение его укорочения во
время систолы не зависят от степени дилатации ЛЖ
[49]. При этом всегда выявляется дилатация фи-
брозного кольца [53, 54].
Подтягивание створок может быть асимметрич-
ным или симметричным. Наиболее часто встреча-
ется асимметричное подтягивание, которое обычно
происходит в результате очагового ремоделирова-
ния базального нижнего или нижнелатерального
сегмента ЛЖ после нижнего или заднего инфаркта
миокарда, который приводит к латеральному сме-
щению заднемедиальной папиллярной мышцы.
Подтягивание задней створки более заметно с более
выраженным поражением сегмента P3 [55, 56]. При
этом наблюдается деформация передней створки
главным образом вследствие повышенного натяже-
ния вторичных сухожильных хорд, идущих от за-
днемедиальной папиллярной мышцы. Дилатация
фиброзного кольца асимметрична и наиболее выра-
жена по переднезадней оси [53]. Размеры желудоч-
ка и фракция выброса ЛЖ могут соответствовать
норме [51, 57].
Симметричное подтягивание створок происхо-
дит в результате глобальной дилатации ЛЖ, чаще
всего вследствие дилатационной кардиомиопатии
или глобального ремоделирования после большого
(обычно переднего) инфаркта миокарда [56, 58].
Наблюдаются апикальное и латеральное смещение
ch19.indd 438
03.04.2019 11:55:29
439
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
обеих папиллярных мышц и симметричная дилата-
ция фиброзного кольца [53]. Обычно отмечается
заметная сферическая гипертрофия ЛЖ [59] со зна-
чительным снижением фракции выброса ЛЖ. Сим-
метричное подтягивание створок из-за сфериче-
ской гипертрофии ЛЖ в результате хронической
тяжелой митральной регургитации также может
быть у пациентов с дегенеративным поражением.
Есть ограниченные и противоречивые данные о
роли хирургической пластики в лечении вторичной
митральной регургитации. В ходе небольшого ран-
домизированного исследования с участием пациен-
тов с тяжелой ишемической митральной регургита-
цией было продемонстрировано, что простая анну-
лопластика митрального кольца ассоциируется с
повышением частоты рецидивов умеренной или
тяжелой регургитации по сравнению с протезиро-
ванием клапана (32% vs 2,3%, р < 0,001) [60]. В ходе
другого небольшого исследования с участием паци-
ентов с умеренной ишемической митральной ре-
гургитацией было показано, что дополнительная
аннулопластика во время реваскуляризации коро-
нарных артерий ассоциируется с повышенной ча-
стотой послеоперационных осложнений [61]. Ни в
одном из этих двух небольших исследований не ис-
пользовали ЭхоКГ для выбора техники хирургиче-
ского вмешательства. Это противоречит данным
исследования хирургического лечения ишемиче-
ской сердечной недостаточности [62], в ходе кото-
рого сравнивали реваскуляризацию коронарных ар-
терий, реваскуляризацию коронарных артерий с ре-
конструкцией желудочка и лекарственную терапию
пациентов с низкой фракцией выброса ЛЖ.
Среди 1460 пациентов, рандомизированных по
реваскуляризации коронарных артерий, у 234 также
было выполнено оперативное вмешательство на
митральном клапане (пластика в 94% случаев). Опе-
рация на митральном клапане, выполненная одно-
временно с реваскуляризацией коронарных арте-
рий, коррелировала со значительным улучшением
показателей краткосрочной и долгосрочной выжи-
ваемости [63]. Частично затруднения были обу-
словлены тем, что реконструктивная аннулопласти-
ка была неуспешной при выраженном подтягива-
нии створок [57, 64, 65]. Отбор пациентов с помощью
ЭхоКГ и более сложные техники аннулопластики
помогут улучшению результатов реконструктивных
операций при вторичной регургитации [4].
Вторичная регургитация также может возникать
из-за динамической обструкции выходного тракта
ЛЖ у пациентов с гипертрофической кардиомиопа-
тией или изолированной асимметричной гипертро-
фией перегородки [66, 67]. Основным механизмом
митральной регургитации является гипертрофия пе-
регородки, что приводит к парадоксальному систо-
лическому движению передней створки митрально-
го клапана, или SAM-синдрому (передняя створка
митрального клапана оказывается в выходном трак-
те ЛЖ) (см. главу 26). Однако у некоторых пациен-
тов с гипертрофической кардиомиопатией развива-
ются обструкция выходного тракта ЛЖ и тяжелая
митральная регургитация и в отсутствие гипертро-
фии перегородки. Механизмами митральной регур-
гитации в этом случае могут быть увеличение дли-
ны передней створки, нарушение прикрепления су-
хожильных хорд, а также расщепление папиллярной
мышцы [68]. В данной ситуации обычно показана
пластика митрального клапана с миоэктомией или
без нее.
В отличие от гипертрофической кардиомиопа-
тии, асимметричная гипертрофия перегородки озна-
чает изолированную гипертрофию передней части
основания перегородки. Это поражение ассоцииру-
ется с пожилым возрастом, артериальной гипертен-
зией, сахарным диабетом, аортальным стенозом и
дистрофической кальцификацией [69]. При асим-
метричной гипертрофии перегородки хирургиче-
ское вмешательство обычно не нужно, поскольку
после пластики по поводу дегенеративного пораже-
ния возможно развитие SAM-синдрома.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
МИТРАЛЬНОГО КЛАПАНА
СТАНДАРТНАЯ МУЛЬТИПЛАНАРНАЯ ВИЗУАЛИЗАЦИЯ
При визуализации в 2D-режиме правильной иден-
тификации сегментов створок способствует знание
взаимосвязи между анатомией и данными ЭхоКГ.
Стандартные позиции ЧПЭхоКГ при визуализации
митрального клапана показаны на рис. 19.4 .
Позиция по длинной оси и комиссуральная по-
зиция из среднего отдела пищевода параллельны
осям клапана и, следовательно, являются наиболее
важными для количественной оценки патологии
сегментов створок митрального клапана (рис. 19.5).
Позиция по длинной оси параллельна переднезад-
ней оси, и при прохождении и ультразвукового лу-
ча через центр клапана отображается поверхность
сопоставления сегментов P2 и A2. Поворот датчика
против часовой стрелки (влево) перемещает обзор
в сторону переднелатеральной комиссуры и визуа-
лизируются сегменты P1 и A1. Поворот датчика по
часовой стрелке (вправо) перемещает обзор в сто-
рону заднемедиальной комиссуры и визуализиру-
ются сегменты P3 и A3. Комиссуральная позиция
перпендикулярна позиции по длинной оси и парал-
лельна комиссуральной оси. В этой позиции при
прохождении ультразвукового луча через центр
клапана слева визуализируется поверхность сопо-
ставления сегментов P3 и A3, справа — поверхность
сопоставления сегментов A1 и P1.
В четырех- и двухкамерной позициях из средне-
го отдела пищевода изображение находится под
углом к осям клапана. Следовательно, эти позиции
менее применимы для количественной оценки па-
тологии сегментов створок.
ch19.indd 439
03.04.2019 11:55:29
440
ЧАСТЬ IV Пороки клапанов сердца
P2
P3
P3
P2
УЛП
P1
A2
Нижняя
стенка
Передняя
стенка
змПМ
A2
плПМ
A2
A1
A3
P3 P2
P1
ЛЖ ПСМК
ЛП
A2
A2
A2
A1
A1
A1
P1
P2
P3
A2
A3
A1
A1
P1
P1
P2
P2
P3
P3
A2
A2
A3
A3
A1
P1
P2
P3
A2
A3
A3
A3
Поворот
влево
Поворот
вправо
Поворот
вправо
Поворот
влево
А
Б
Г
В
Д
Е
Ж
Рис. 19.4 Стандартные позиции чреспищеводной эхокардиографии в 2D-режиме для оценки митрального клапана. (А) Позиция по длинной оси из
среднего отдела пищевода. (Б) Комиссуральная позиция из среднего отдела пищевода. (В) Двухкамерная позиция из среднего отдела пищевода. (Г) Четырехка-
мерная позиция из среднего отдела пищевода. (Д) Трансгастральный доступ, позиция по длинной оси. (Е) Трансгастральный доступ, модифицированная комис-
суральная позиция. (Ж) Трансгастральный доступ, позиция по короткой оси. Сплошные линии указывают положения плоскостей сканирования в разных стандар-
ных позициях. Пунктирными линиями в позиции по длинной оси и в комиссуральной позиции из среднего отдела пищевода обозначены модифицированные по-
зиции после поворота датчика влево (против часовой стрелки) или вправо (по часовой стрелке). Использование ориентиров, указанных на рис. 19.8 , гарантирует,
что в позиции по длинной оси достоверно отображается поверхность сопоставления сегментов A2 и P2, а в комиссуральной позиции — поверхности сопоставле-
ния сегментов A1 и P1 и сегментов A3 и P3. Пунктирные линии в четырехкамерной позиции из среднего отдела пищевода обозначают модифицированные пози-
ции после сгибания зонда кпереди или продвижения и сгибания зонда кзади. змПМ — заднемедиальная папиллярная мышца; ЛЖ — левый желудочек; ЛП —
левое предсердие; плПМ — переднелатеральная папиллярная мышца; ПСМК — передняя створка митрального клапана; УЛП — ушко левого предсердия (пре-
доставлено David Sidebotham).
ch19.indd 440
03.04.2019 11:55:29
441
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
К сожалению, даже при тщательной ЧПЭхоКГ в
2D-режиме нельзя быть уверенным в точной иден-
тификации сегментов створок в конкретной проек-
ции. В ходе одного исследования было продемон-
стрировано, что при визуализации из среднего от-
дела пищевода общая точность правильной
идентификации сегментов створок опытными ане-
стезиологами составила всего 30% [70]. При этом в
позиции по длинной оси из среднего отдела пище-
вода правильность идентификации сегментов A2 и
P2 была 70%, а идентификация сегментов A1 и P1 и
A3 и P3 — 14% и 6% соответственно. Правильная
идентификация сегментов створок в комиссураль-
ной позиции составила 92%. Основная причина
низкой точности в позиции по длинной оси заклю-
чается в отсутствии явных анатомических ориенти-
ров (рис. 19.6). Для преодоления этих ограничений
был предложен метод осевой визуализации [4].
МЕТОД ОСЕВОЙ ВИЗУАЛИЗАЦИИ
Математически фиброзное кольцо митрального
клапана почти соответствует гиперболическому па-
раболоиду [16] с тремя ортогональными осями: пе-
реднезадней (ось Х), комиссуральной (ось Y) и вер-
тикальной (ось Z). Ось митральный клапан — вер-
хушка ЛЖ представляет собой линию, которая идет
от верхушки ЛЖ до центра клапана и приблизи-
тельно параллельна оси Z (рис. 19.7) [4].
При перпендикулярном расположении комиссу-
ральной позиции относительно позиции по длин-
ной оси с пересечением по оси «митральный кла-
пан — верхушка ЛЖ» достоверно визуализируются
нужные сегменты створок (см. рис. 19.4А, Б). Кроме
того, визуализация параллельно оси «митральный
клапан — верхушка ЛЖ» гарантирует, что изобра-
жение перпендикулярно относительного фиброз-
ного кольца и что измерения будут точными. Ана-
томические ориентиры и признаки распространен-
ных патологий митрального клапана показаны на
рис. 19.8 .
ТРЕХМЕРНАЯ ВИЗУАЛИЗАЦИЯ
Для трехмерной визуализации следует использо-
вать режим «Широкий сектор» и режим «Масшта-
бирование» [14, 71]. В качестве области исследова-
ния для захвата трехмерного изображения следует
использовать в 2D-режиме позицию по длинной
оси и комиссуральную позицию. Размер сектора
следует скорректировать таким образом, чтобы он
захватывал все фиброзное кольцо, створки и часть
аортального клапана в течение всего сердечного
цикла. Для стандартной визуализации в 3D-режиме
можно захватить объемные данные в течение одно-
го сердечного цикла. Для предотвращения непри-
емлемо низкой частоты кадров при цветовой доп-
плерографии в 3D-режиме необходимо захватить
объемные данные в течение нескольких сердечных
циклов. Клапан должен отображаться со стороны
предсердия в хирургической ориентации (аорталь-
ный клапан должен находиться на 12 часах условно-
го циферблата непосредственно над митральным
клапаном) [4, 14, 71, 72]. Такая ориентация позво-
ляет отобразить все сегменты митральных створок
одновременно и обеспечивает взаимопонимание
специалиста в области ЭхоКГ и хирурга. Дополни-
тельные данные могут быть получены при визуали-
зации клапана со стороны ЛЖ. При этом аорталь-
ный клапан также должен быть на 12 часах услов-
ного циферблата над митральным клапаном.
Количественный анализ объемных данных с ис-
пользованием мультипланарной реконструкции по-
зволяет точно и воспроизводимо индексировать из-
менения створок (высоту пролапса, высоту «тента»,
Рис. 19.5 Визуализация митрального клапана в поперечном сечении.
(А) Расположение переднезадней и комиссуральной осей. (Б, В) Пунктирными
линиями обозначены позиции из среднего отдела пищевода: по длинной оси,
комиссуральная, четырехкамерная и двухкамерная. При правильном располо-
жении датчика позиции по длинной оси и комиссуральная позиция перпенди-
кулярны друг другу и выровнены относительно переднезадней и комиссураль-
ной осей клапана соответственно. Напротив, четырех- и двухкамерная позиции
располагаются под углом к осям клапана. Следовательно, измерение фиброз-
ного кольца и створок следует проводить в позиции по длинной оси и комис-
суральной позиции.
Переднезадняя ось
A1
A2
P2
P1
A3
P3
Комиссуральная ось
Комиссуральная позиция
Четырехкамерная позиция
Двухкамерная позиция
Позиция по длинной оси
А
Б
В
ch19.indd 441
03.04.2019 11:55:30
442
ЧАСТЬ IV Пороки клапанов сердца
углы закрытия и т.д.) для измерения в позиции по
длинной оси и в комиссуральной позиции. Методы
анализа объемных данных и устранения параллакса
описаны на рис. 19.9 и 19.10 соответственно.
Анализ ЛЖ с помощью полнообъемных данных
также применим для подтверждения причины и тя-
жести поражения митрального клапана, особенно у
пациентов со вторичными поражениями.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
ПЕРЕД ОПЕРАЦИЕЙ
Определение времени хирургического вмешатель-
ства при митральной регургитации основано на ее
патофизиологии (степени регургитации и функции
ЛЖ), а техника определяется патоморфологией. Та-
ким образом, основными задачами ЧПЭхоКГ перед
операцией являются определение механизма ми-
тральной регургитации, идентификация локализа-
ции поражениий и количественная оценка дефор-
мации створок. На рис. 19.11 представлены прин-
ципы определения патоморфологической стадии
поражения митрального клапана на основе данных
ЭхоКГ, что облегчает выбор подходящей техники
реконструкции. Количественная оценка степени ре-
гургитации обычно менее важна, исключение со-
ставляют пациенты со вторичной митральной ре-
гургитацией, которым планируют реваскуляриза-
цию коронарных артерий. В этой ситуации степень
митральной регургитации, возможно, не была точ-
но определена или изменилась со времени преды-
дущей оценки.
В соответствии с рекомендациями всем пациен-
там следует проводить комплексную ЧПЭхоКГ [14]
A1
A1
A2
A2
A3
A3
P3
P3
P2
P1
A1
A1
A2
A2
A3
A3
P3
P3
P2
P2
P1
P1
P1
P2
Изображение
Смещение датчика вперед-назад
c
e
a
a
d
b
Вращение
Изображения
Смещение датчика вперед-назад
Вращение
e
a
d
b,c
Рис. 19.6 Анатомические ориентиры при визуализации из среднего отдела пищевода в позиции по длинной оси и комиссуральной позиции.
(А) Смещение датчика вперед-назад или поворот датчика из стандартной позиции по длинной оси приводит к минимальным, но важным изменениям изображе-
ния, позволяющим оценить сегменты створок митрального клапана. (Б) Смещение датчика вперед-назад или поворот датчика из комиссуральной позиции при-
водит к изменениям изображения, совпадающих с изменениями в сегментах. Метод осевой визуализации позволяет преодолеть неточности позиции по длинной
оси. Изображения a–e на (Б) справа соответствуют линиям срезов [Sidebotham DA, Allen SJ, Gerber IL, Fayers T: Intraoperative transesophageal echocardiography for
surgical repair of mitral regurgitation. J Am Soc Echocardiogr 27:345–366 , 2014].
А
Б
ch19.indd 442
03.04.2019 11:55:30
443
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
с особым вниманием к митральному клапану и свя-
занным с ним структурам, в частности ЛЖ и трику-
спидальному клапану. Митральный клапан необхо-
димо исследовать во всех стандартных позициях,
используя 2D-режим и цветовую допплерографию.
Также необходима визуализация в 3D-режиме со
стороны предсердия с цветовой допплерографией
или без нее. Размеры фиброзного кольца и дефор-
мацию створок следует оценивать в позиции по
длинной оси и в комиссуральной позиции. Кон-
кретные признаки следует искать в соответствии с
патогенезом основного заболевания.
ДЕГЕНЕРАТИВНОЕ ПОРАЖЕНИЕ
Наличие молотящей створки или пролапса следует
оценивать по сопоставлению сегментов A1 и P1, A2
и P2, A3 и P3 (табл. 19.1). При молотящей створке
ее дистальный участок во время систолы находится
непосредственно в левом предсердии (ЛП). В конце
систолы в ЛП можно обнаружить оторванную су-
хожильную хорду. Пролапс определяется как купо-
лообразное выпячивание тела створки над плоско-
стью фиброзного кольца более чем на 2 мм [25].
При пролапсе створке ее дистальный участок на-
правлен к ЛЖ, отрыва сухожильных хорд не наблю-
дается. На практике пролапс < 5 мм редко связан со
значительной митральной регургитацией и обычно
хирургическая коррекция не нужна. При пролапсе
и молотящей створке наблюдается эксцентрическая
струя митральной регургитации, направленная от
пораженного сегмента.
Важно определить функциональную значимость
пролапса створки. Для этого проводят близкую об-
резку изображения по предсердной поверхности.
Наиболее легко при визуализации в 3D-режиме рас-
познается наличие щелей или расхождений расще-
лин задней створки в раннюю диастолу (рис. 19.12).
Близкая обрезка по предсердной поверхности при
цветовой допплерографии в 3D-режиме может под-
твердить наличие щелей путем демонстрации струй
регургитации, которые смещены от линии сопо-
ставления створок.
Дизъюнкция фиброзного кольца митрального
клапана легко определяется в позиции по длинной
оси и в комиссуральной позиции. При тяжелой
дизъюнкции (> 10 мм) необходима консультация
хирурга, поскольку может понадобиться хирурги-
ческая коррекция.
Пациенты с болезнью Барлоу подвержены риску
развития после операции SAM-синдрома. Прогно-
стические факторы риска SAM-синдрома показаны
на рис. 19.13 [73].
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Необходимо определить локализацию и размер ве-
гетаций, а также механизм регургитации (табл. 19.2).
Вегетации наиболее часто локализуются на той сто-
роне клапана, которая расположена выше по крово-
Z
X
Y
Ось «митральный клапан —
верхушка ЛЖ»
А
Б
Рис. 19.7 Оси фиброзного кольца митрального клапана. (A) Фиброзное кольцо митрального клапана напоминает гиперболический параболоид с тремя
ортогональными осями: переднезадней (ось X), комиссуральной (ось Y) и вертикальной (ось Z). (Б) Ось «митральный клапан — верхушка левого желудочка»
представляет собой линию, проходящую от верхушки левого желудочка к центру клапана (линия пересечения переднезадней (X–Z) и комиссуральной (Y–Z) пло-
скостей). Визуализация параллельно или перпендикулярно оси «митральный клапан — верхушка левого желудочка» минимизирует геометрическое искажение
при расположении под углом. Визуализация вдоль переднезадней оси отображает поверхность сопоставления сегментов A2 и P2, визуализация вдоль комиссу-
ральной оси — поверхность сопоставления сегментов A1 и P1 и A3 и P3. Использование метода осевой визуализации описано на рис. 19.8 , позиция из среднего
отдела пищевода по длинной оси соответствует переднезадней плоскости, а комиссуральная позиция — комиссуральной плоскости [Б — Drake DH, Zimmerman
KG, Hepner AM, Nichols CD: Echo-guided mitral repair. Circ Cardiovascular Imaging 7:132–141 , 2014].
ch19.indd 443
03.04.2019 11:55:30
444
ЧАСТЬ IV Пороки клапанов сердца
2D-режим,
позиция по длинной оси, диастола
2D-режим,
комиссуральная позиция, диастола
2D-режим,
комиссуральная позиция, систола
3D-режим,
комиссуральная позиция, систола
3D-режим,
трансгастральный доступ, систола
P2
P3
P3
P3
A3
A3
A1
A1
A1
A3
A2
P2
P1
P3
P1
P1
P1
A2
P2
A2
A2
A2
P2
змПМ
плПМ
A2
2D-режим,
позиция по длинной оси, систола
2D-режим,
трансгастральный доступ, систола
3D-режим,
позиция по длинной оси, систола
А
Рис. 19.8 A Получение изображений методом осевой визуализации и примеры распространенной патологии митрального клапана. (A) Мульти-
планарные изображения в 2D-режиме приведены в шкале оттенков серого в виде секторов. Анатомические ориентиры для осевой визуализации получены из изо-
бражений во время диастолы. Эти ориентиры позволяют ориентировать позицию по длинной оси и комиссуральную позицию параллельно оси «митральный кла-
пан — верхушка ЛЖ» и перпендикулярно друг другу во время систолы, когда проводят измерения. Анатомические ориентиры для позиции по длинной оси во
время систолы: (1) комиссура между левой и некоронарной створками аортального клапана (желтая точка); (2) максимальная ширина фиброзного кольца по пе-
реднезадней оси (красные точки); (3) верхушка ЛЖ (синяя точка). Анатомические ориентиры для комиссуральной позиции: (1) свободно расположенный сегмент
A2; (2) максимальная ширина фиброзного кольца по комиссуральной оси (зеленые точки); (3) верхушка ЛЖ (синяя точка). На изображении во время систолы из-
меряют фиброзное кольцо и положение створок. Во время систолы в позиции по длинной оси отображается переднезадняя ось, сегменты A2 и P2 и поверхность
их сопоставления, в комиссуральной позиции — комиссуральная ось, сегменты A1, P1 , A3 и P3 и поверхности их сопоставления. Важно, чтобы все ориентиры
визуализировались на протяжении всего сердечного цикла. Каждое изображение в шкале оттенков серого получают с помощью цветового допплеровского кар-
тирования кровотока примерно на таком же протяжении сердечного цикла. Затем, не перемещая датчик, применяют режим «Масштабирование» для получения
осевых двухмерных и цветных изображений, сфокусированных на митральном клапане. Анатомические ориентиры для получения трехмерных изображений те же,
что и для стандартной мультипланарной визуализации. Начальные объемные данных получают с помощью режима «Широкий сектор» с цветовой допплерогра-
фией и без нее. Не смещая датчик, получают дополнительные объемные данные в режиме «Масштабирование», снова с цветовой допплерографией и без нее.
Затем проводят анализ объемных данных с помощью мультипланарной реконструкции для получения двухмерных изображений по длинной оси и комиссураль-
ной оси (см. рис. 19.9) [Drake DH, Zimmerman KG, Hepner AM, Nichols CD: Echo-guided mitral repair. Circ Cardiovascular Imaging 7:132–141 , 2014].
ch19.indd 444
03.04.2019 11:55:30
445
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Б
ФЭД или легкая миопатия
дисфункция
типа I, систола
ФЭД
дисфункция
типа II, систола
Болезнь Барлоу
дисфункция
типа II, систола
Гипертрофическая
кардиомиопатия
дисфункция
типа IIIb, систола
Дегенеративное
поражение
дисфункция
типа IIIb, систола
Ревматическое
поражение
дисфункция типа IIIa,
диастола
П
о
з
и
ц
и
и
я
л
е
в
о
г
о
п
р
е
д
с
е
р
д
и
я
П
о
з
и
ц
и
я
п
о
д
л
и
н
н
о
й
о
с
и
К
о
м
и
с
с
у
р
а
л
ь
н
а
я
п
о
з
и
ц
и
я
П
о
л
н
о
о
б
ъ
е
м
н
о
е
и
з
о
б
р
а
ж
е
н
и
е
Рис. 19.8 окончание A Получение изображений методом осевой визуализации и примеры распространенной патологии митрального клапана.
(Б) Примеры распространенной патологии. Изображения получены с помощью количественного анализа объемных данных. Верхний ряд — объемные трехмер-
ные изображения митрального клапана со стороны предсердия. Два средних два ряда — позиция по длинной оси и комиссуральная позиция из среднего отде-
ла пищевода, полученные в режиме «Масштабирование» объемных данных при мультипланарной реконструкции. Нижний ряд — позиция по длинной оси, в ко-
торую включена верхушка левого желудочка из полнообъемных данных, полученных с помощью мультипланарной реконструкции. Все изображения относятся к
поздней систоле, кроме изображений клапана с ревматическим поражением, которые относятся к поздней диастоле. Изображения в первом столбце демонстри-
руют нормальную подвижность створок (дисфункция типа I по Carpentier). Наблюдается легкая дилатация фиброзного кольца и плохое сопоставление сегментов
в центре в позиции по длинной оси. Изображения во втором столбце демонстрируют молотящую створку (дисфункция типа II по Carpentier) с поражением сег-
мента P2 у пациента с фиброэластическим дефицитом (ФЭД). Остальные ткани створок, фиброзное кольцо и левого желудочка в норме. Изображения в третьем
столбце демонстрируют мультисегментный пролапс (дисфункция типа II по Carpentier) у пациента с болезнью Барлоу. Во всех позициях видна излишняя ткань
створок. В комиссуральной позиции заметно значительное расширение фиброзного кольца. На полнообъемном изображении определяется сопутствующая гипер-
трофия основания перегородки. Изображения в четвертом столбце получены у пациента с гипертрофической кардиомиопатией и SAM-синдромом (дисфункция
типа IIIb по Carpentier). SAM-синдром и гипертрофия перегородки хорошо видны в позиции по длинной оси. Изображения в пятом столбце получены у пациента
с дегенеративным поражением, которое сопровождается подтягиванием створок во время систолы (дисфункция типа IIIb по Carpentier). В позиции по длинной
оси и в комиссуральной позиции видно значительное подтягивание обеих створок. На полномасштабном изображении видна выраженная дилатация левого же-
лудочка. Изображения в шестом столбце получены у пациента с ревматическим поражением. Подвижность створок ограничена во время систолы (не показано) и
диастолы (показано), что соответствует дисфункции типа IIIa по Carpentier. Подтягивание створок и уменьшение подвижности створок во время диастолы замет-
ны во всех позициях, но наилучшим образом — в позиции по длинной оси. змПМ — заднемедиальная папиллярная мышца; плПМ — переднелатеральная па-
пиллярная мышца [Drake DH, Zimmerman KG, Hepner AM, Nichols CD. Echo-guided mitral repair. Circ Cardiovascular Imaging 7:132–141 , 2014].
ch19.indd 445
03.04.2019 11:55:31
446
ЧАСТЬ IV Пороки клапанов сердца
Рис. 19.9 A Анализ объемных данных при мультипланарной реконструкции. Полнообъемные и масштабированные объемные данные должны быть по-
лучены из среднего отдела пищевода в позиции по длинной оси и в комиссуральной позиции (см. рис. 19.8). Затем проводят анализ объемных данных (3DQ,
Philips Healthcare, Andover, MA). Для анализа выбирают изображения в позднюю систолу. В режиме «Масштабирование» показаны три двухмерных изображения
в ортогональных плоскостях: (А) в позиции по длинной оси; (Б) в комиссуральной позиции; (В) в позиции по короткой оси. (Г) Трехмерное изображение. Анализ
объемных данных: (1) изображения должны быть увеличены и сначала включена блокировка плоскостей для сохранения красной, зеленой и синей плоскостей в
вертикальном положении. Отключение блокировки плоскости в последующем допускается, если в позиции по длинной оси (красный сектор) плоскость фиброз-
ного кольца не параллельна короткой оси (красный сектор, синяя линия); (2) трехмерное изображение поворачивают до тех пор, пока аортальный клапан не ока-
жется на 12 часах условного циферблата над митральным клапаном (т.е . в хирургической ориентации). (3) 3D-режим переключают на 2D-режим для облегчения
устранения параллакса (см. рис. 19.10), после чего снова включают 3D-режим; (4) в позиции по длинной оси и в комиссуральной позиции синюю линию переме-
щают так, чтобы она была на одном уровне с фиброзным кольцом или немного выше его (т.е . на стороне ЛП). Затем в позиции по длинной оси синюю линию
перемещают так, чтобы комиссура между левой и некоронарной створками аортального клапана определялась в позиции по короткой оси; (5) в позиции по ко-
роткой оси красную линию перемещают так, чтобы она пересекала комиссуру между левой и некоронарной створками аортального клапана, а на трехмерном изо-
бражении пересекала митральный клапан центрально по максимальной ширине вдоль переднезадней оси. Зеленую линию выравнивают таким образом, чтобы
она была перпендикулярна красной линии, а на трехмерном изображении пересекала митральный клапан центрально по максимальной ширине вдоль комиссу-
ральной оси; (6) Снова проверяют параллакс и устраняют его при наличии. В случае правильного расположения цветных линий позиция по длинной оси (красный
сектор) пересекает плоскость сопоставления сегментов A2 и P2, а в комиссуральной позиции (зеленый сектор) — пересекает плоскость сопоставления сегментов
A1 и P1 и сегментов A3 и P3 (предоставлено Daniel Drake).
А
Б
P2
P3
P1
A3
A1
A1
P1
P3
A2
P2
A3
A2
Г
В
ch19.indd 446
03.04.2019 11:55:31
447
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Параллакс отсутствует
Параллакс
А
Б
В
Рис. 19.10 A Метод устранения параллакса. (A) Объемные данные митрального клапана в хирургической ориентации. Две перпендикулярные цветные опор-
ные линии свидетельствуют о том, что позиция по длинной оси (зеленая линия) и комиссуральная позиция (красная линия) пересекают центр митрального кла-
пана в правильном положении, однако незначительное восприятие глубины по красной и зеленой линиям на правом изображении указывает на наличие парал-
лакса. (Б) Визуализация митрального клапана в режиме среза. Левое изображение перпендикулярно относительно исследователя, параллакс отсутствует. В этом
случае две плоскости появляются в виде цветных линий без эхо-сигналов или признаков восприятия глубины. Правое изображение неперпендикулярно исследо-
вателю, что означает наличие параллакса. В этом случае есть эхо-сигналы и восприятие глубины. При наличии параллакса невозможно определить, где две пло-
скости пересекают трехмерное изображение. (В) Визуализация митрального клапана в 3D-режиме. Пунктирными красной и зеленой линиями на правом изобра-
жении обозначено фактическое пересечение изображения митрального клапана двумя плоскостями. Для устранения параллакса необходимо в режиме среза из-
менить позицию по длинной оси и комиссуральную позицию так, чтобы эхо-сигналы исчезли, а остались только красная и зеленая линии (предоставлено Daniel
Drake).
ch19.indd 447
03.04.2019 11:55:33
448
ЧАСТЬ IV Пороки клапанов сердца
А
Б
Г
В
Д
I стадия
II стадия
III стадия
IV стадия
ch19.indd 448
03.04.2019 11:55:34
449
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Рис. 19.11 Определение стадии поражения митрального клапана. (A) Дегенеративное поражение. I стадия — дилатация фиброзного кольца. II стадия —
изолированный пролапс/молотящая створка. III стадия — распространенный пролапс/молотящая задняя створка. IV стадия — прогрессирование процесса с по-
ражением обеих створок. (Б) Инфекционный эндокардит. I стадия — только вегетации без перфорации. II стадия — изолированная перфорация створки. III ста-
дия — деструкция фиброзного кольца. IV стадия — обширная деструкция с вовлечением фиброзного кольца. (В) Ревматическое поражение. I стадия — изоли-
рованное рубцевание и кальцификация задней створки с минимальным вовлечением сухожильных хорд и комиссур. II стадия — обширная деструкция задней
створки и структур подклапанного аппарата. III стадия — поражение обеих створок или подклапанного аппарата. IV стадия —выраженное сращение комиссур и
обширная кальцификация створок и подклапанного аппарата. (Г) Вторичное (миопатическое) поражение. I стадия — простая дилатация фиброзного кольца; II–IV
стадии — подтягивание створок (от слабого до выраженного) с прогрессирующим смещением створок и подклапанного аппарата. Степень подтягивания см. рис.
19.14 . (Д) Гипертрофическая кардиомиопатия. I стадия — гипертрофия перегородки без обструкции выходного тракта левого желудочка или SAM-синдрома. II
стадия — гипертрофическая кардиомиопатия с обструкцией выходного тракта левого желудочка и митральной регургитацией вследствие SAM-синдрома. III ста-
дия — гипертрофическая кардиомиопатия и SAM-синдром со значительными нарушениями функции створок или папиллярных мышц. IV стадия — гипертрофи-
ческая кардиомиопатия и SAM-синдром со значительной гипертрофией левого желудочка, распространяющейся за пределы выходного тракта левого желудочка
на полость и верхушку левого желудочка.
току (на предсердной поверхности). Следует прове-
рить, есть ли перфорации или значительная деструк-
ция створок. Визуализация в 3D-режиме со стороны
желудочка нужна для отображения перфораций, ко-
торые могут быть прикрыты вегетациями при ви-
зуализации со стороны предсердий. Выявить регур-
гитацию, обусловленную перфорацией, позволяет
визуализация в 3D-режиме со стороны предсердий с
цветовой допплерографией. Кроме этого, следует
провести тщательный поиск абсцессов и свищевых
ходов. Для выявления фистул может понадобиться
визуализация в модифицированных позициях с
допплерографией или без нее.
РЕВМАТИЧЕСКОЕ ПОРАЖЕНИЕ
Успешность пластики при ревматической митраль-
ной регургитации зависит от размера ткани створ-
ки и степени поражения подклапанного аппарата
(табл. 19.3). Обязательно нужна тщательная оценка
подвижности створок и степени кальцификации
клапана. Ревматическая митральная регургитация
часто ассоциируется с формированием на дисталь-
ных участках створок характерного «завернутого
края». Подвижность створок лучше всего оценивать
в позиции по длинной оси из среднего отдела пи-
щевода, тогда как подклапанный аппарат лучше
всего визуализируется в трансгастральной двухка-
мерной позиции и комиссуральной позиции из
среднего отдела пищевода.
ОТРЫВ ПАПИЛЛЯРНОЙ МЫШЦЫ
При отрыве папиллярной мышцы важно опреде-
лить, какая мышца поражена, где место отрыва (ос-
нование или головка мышцы) и является ли отрыв
полным или частичным. Лучше всего подходят для
определения места и вида отрыва мышц трансга-
стральная двухкамерная позиция и комиссуральная
позиция из среднего отдела пищевода.
ВТОРИЧНОЕ ПОРАЖЕНИЕ
Клиническая картина вторичной митральной ре-
гургитации крайне вариабельна (табл. 19.4), поэто-
му степень регургитации следует оценивать при на-
грузке, которую приравнивают к состоянию бодр-
ствования. Степень регургитации оценивают по
ширине vena contracta и методом PISA [1]. Обратите
внимание, что при оценке тяжелой вторичной ре-
гургитации применяют более низкие пороговые
значения эффективной площади отверстия регур-
гитации, полученные методом PISA, чем при оцен-
ке первичной регургитации (см. главу 18) [1].
Характер (асимметричный или симметричный)
и степень подтягивания створок следует оценивать
из среднего отдела пищевода в позиции по длинной
оси. Подтягивание створок количественно опреде-
ляют по высоте и площади «тента», углам закрытия
сегментов A2 и P2 и инверсии передней створки
(рис. 19.14). При асимметричном подтягивании
створок обычно наблюдается эксцентрическая струя
регургитации, направленная к пораженной стороне
(т.е. кзади). При симметричном подтягивании ство-
рок струя регургитации чаще направлена более цен-
трально. При асимметричном подтягивании ство-
рок максимальная дилатация фиброзного кольца
обычно наблюдается по переднезадней оси, при сим-
метричном подтягивании створок дилатация фиброз-
ного кольца отмечается как по переднезадней, так и
по комиссуральной оси. Отличить симметричное
подтягивание створок от асимметричного также по-
могают измерение фракции выброса ЛЖ, размеров
ЛЖ и определение локализации нарушений сокра-
тимости миокарда.
КОМБИНИРОВАННОЕ ПОРАЖЕНИЕ
Дисфункция митрального клапана — следствие не-
скольких патологических процессов. Возможны три
причины дисфункции.
Во-первых, частым осложнением ревматическо-
го или дегенеративного поражения может быть ин-
фекционный эндокардит (рис. 19.15). Дифференци-
ровать вегетации и миксоматозные изменения быва-
ет очень сложно.
Во-вторых, дегенеративное поражение может со-
четаться со вторичным поражением. У пациентов с
дегенеративным поражением важно идентифици-
ch19.indd 449
03.04.2019 11:55:36
450
ЧАСТЬ IV Пороки клапанов сердца
Параметр
Исследование
Значение
Размеры фиброзного
кольца
2D-ЧПЭхоКГ: позиция по длинной оси из среднего
отдела пищевода и комиссуральная позиция
3D-ЧПЭхоКГ: МПР, позиция по длинной оси и ко-
миссуральная позиция
Выраженная дилатация по комиссуральной оси
ассоциируется с болезнью Барлоу. Визуализа-
ция определить размер опорного кольца для
аннулопластики, количественно оценить тя-
жесть поражения и установить причину
Локализация
и степень пролапса/
флотации
2D-ЧПЭхоКГ: все стандартные позиции из среднего
отдела пищевода (см. рис. 19.6); наиболее примени-
мы позиция по длинной оси и комиссуральная по-
зиция
3D-ЧПЭхоКГ: позиция ЛП; МПР, позиция по длин-
ной оси и комиссуральная позиция
Поражение одного сегмента указывает на ФЭД;
наиболее часто поражается сегмент P2. Пора-
жение нескольких сегментов указывает на бо-
лезнь Барлоу. Поражение передней створки
или обеих створок вызывает больше всего за-
труднений при пластике. Подходящую техни-
ку пластики выбирают с помощью ЧПЭхоКГ
(см. рис. 19.18A)
Пролапс митрального
клапана
2D-ЧПЭхоКГ: позиция по длинной оси и комиссу-
ральная позиция из среднего отдела пищевода
3D-ЧПЭхоКГ: МПР, позиция по длинной оси и ко-
миссуральная позиция
При пролапсе < 5 мм в позднюю систолу
вмешательство нужно редко. Ассоциируется
с митральной регургитацией
Щель митрального
клапана
2D-ЧПЭхоКГ: позиция по длинной оси из среднего
отдела пищевода
3D-ЧПЭхоКГ: позиция ЛП с цветовой допплерогра-
фией и близкой обрезкой по предсердной поверх-
ности; МПР с выравниванием двух плоскостей для
отображения дефекта (см. рис. 19.12)
Может понадобиться пластика в рамках хирур-
гического вмешательства
Дизъюнкция
2D-ЧПЭхоКГ: позиция по длинной оси и комиссу-
ральная позиция из среднего отдела пищевода
3D-ЧПЭхоКГ: МПР, позиция по длинной оси и ко-
миссуральная позиция
Может понадобиться пластика в рамках хирур-
гического вмешательства
Факторы риска пара-
доксального систо-
лического движения
передней створки
2D-ЧПЭхоКГ: позиция по длинной оси из среднего
отдела пищевода (см. рис. 19.13)
3D-ЧПЭхоКГ: МПР, позиция по длинной оси
Повышен риск при болезни Барлоу, минима-
лен — при ФЭД. При повышенном риске не-
обходима модификация хирургической про-
цедуры
Кальцификация
и ее локализация
2D-ЧПЭхоКГ: все стандартные позиции из среднего
отдела пищевода (см. рис. 19.6); для оценки под-
клапанного аппарата особую ценность представля-
ет трансгастральная двухкамерная позиция
Приводит к акустическому затенению. Затруд-
няет хирургическое вмешательство. Может
понадобиться хирургическая резекция
Локализация, направ-
ление струи и сте-
пень регургитации
2D-ЧПЭхоКГ + цветовая допплерография: позиция
по длинной оси и комиссуральная позиция
из среднего отдела пищевода. Струя идет от сег-
мента с пролапсом/флотацией. Степень
регургитации определяют по ширине vena contracta
и методом PISA (из среднего отдела пищевода
в позиции по длинной оси)
3D-ЧПЭхоКГ + цветовая допплерография: позиция
ЛП с близкой обрезкой по предсердной поверхно-
сти. Степень регургитации определяют по площа-
ди vena contracta с помощью МПР
Струи, смещенные от линии сопоставления
створок, указывают на наличие щели. Слож-
ная струя или множественные струи указыва-
ют на болезнь Барлоу. При пролапсе одного
сегмента створки струя регургитации наблю-
дается не всегда
Размеры и функция
ЛЖ
2D-ЧПЭхоКГ: ФВЛЖ в стандартных позициях из
среднего отдела пищевода
3D: объемный параметрический анализ. Можно
получить объемные данные, определить ФВЛЖ
и провести анализ сегментов створок
Тяжелая дисфункция ЛЖ — маркер повышен-
ного интраоперационного риска. Возможно
ухудшение после вмешательства, для сравне-
ния нужны дооперационные измерения
Наличие и степень
трикуспидальной
регургитации
2D-ЧПЭхоКГ: четырехкамерная позиция из среднего
отдела пищевода. Степень регургитации оценива-
ют по ширине vena contracta
Может понадобиться хирургическое вмеша-
тельство на трикуспидальном клапане
(при трикуспидальной регургитации выше
легкой или при дилатации фиброзного коль-
ца>4см)
Давление в легочной
артерии
2D-ЧПЭхоКГ + импульсно-волновая допплерогра-
фия: скорость струи трикуспидальной регургита-
ции (несколько позиций из среднего отдела пище-
вода)
Тяжелая легочная гипертензия указывает
на повышенный интраоперационный риск,
для сравнения нужны дооперационные изме-
рения
ТАБЛИЦА 19.1 Оценка дегенеративного поражения митрального клапана с помощью чреспищеводной эхокардиографии
ch19.indd 450
03.04.2019 11:55:36
451
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Рис. 19.12 Щель митрального клапана. Мультипланарная реконструкция объемных данных с устранением параллакса. Для демонстрации щели были полу-
чены двухмерные изображения в позиции по длинной оси (А) (зеленый сектор) и комиссуральной позиции (Б) (красный сектор). Расположение этих плоскостей
можно увидеть на (В) и (Г). Обратите внимание, что зеленая и красная плоскости остаются параллельны оси «митральный клапан — верхушка ЛЖ». Между сег-
ментами P1 и P2 определяется щель (Б, Г), а на (А) — отсутствие ткани задней створки. В данном случае в этой области клапана при трехмерной цветовой доп-
плерографии была видна регургитация (не показана). Пластика дефекта была выполнена путем простого наложения шва.
Щель
A2
P2
P1
P1
P2 P3
A2
А
Б
Г
В
Параметр
Исследование
Значение
Размеры и функция
ПЖ
2D-ЧПЭхоКГ: четырехкамерная позиция из среднего
отдела пищевода
Для сравнения нужны дооперационные изме-
рения
PISA — площадь проксимальной зоны струи регургитации; ЛЖ — левый желудочек; ЛП — левое предсердие; МПР — мультипланарная ре-
конструкция; ПЖ — правый желудочек; ФВЛЖ — фракция выброса левого желудочка; ФЭД — фиброэластический дефицит; ЧПЭхоКГ —
чреспищеводная эхокардиография.
ТАБЛИЦА 19.1
окончание
Оценка дегенеративного поражения митрального клапана с помощью чреспищеводной эхокардиографии
ch19.indd 451
03.04.2019 11:55:36
452
ЧАСТЬ IV Пороки клапанов сердца
ЗС
ПС
Аорто-митральный угол
Толщина
перегородки
Л
С
–
П
С
С
Рис. 19.13 Прогностические факторы риска послеоперационного па-
радоксального систолического движения передней створки митраль-
ного клапана по данным дооперационной эхокардиографии. На повы-
шенный риск указывают [73]: (1) длина задней створки (ЗС) > 1,5 см; (2) дли-
на передней створки (ПС) > 2,0 см; (3) отношение длины задней створки к
длине передней створки < 1,3; (4) расстояние между линией сопоставления и
переднесептальной стенкой (ЛС–ПСС) < 2,5 см; (5) аорто-митральный угол
< 120°; (6) толщина перегородки > 1,5 см; (7) конечно-диастолический размер
левого желудочка < 45 мм. Исключая последний показатель, все измерения
следует проводить в позднюю систолу из среднего отдела пищевода в пози-
ции по длинной оси.
ровать подтягивание створок, обусловленное дила-
тацией ЛЖ, т.к. это влияет на выбор хирургической
техники. В этом случае подтягивание створок наи-
более выражено в морфологически неизмененных
сегментах. Пролапс сегментов створок может быть
менее выражен, поскольку из-за нарушения геоме-
трии ЛЖ и дилатации фиброзного кольца умень-
шается его высота. Как правило, наблюдаются при-
знаки миксоматозных изменений (утолщение ство-
рок, избыточная ткань). Характерны также заметное
увеличение ЛЖ с частым снижением фракции вы-
броса ЛЖ и выраженная дилатация фиброзного коль-
ца. Количественный анализ митрального клапана и
функции ЛЖ в 3D-режиме особенно полезен для
определения механизма регургитации (рис. 19.16).
В-третьих, субклиническая гипертрофическая кар-
диомиопатия может осложняться ишемической бо-
лезнью сердца (рис. 19.17). Важно определить, что
является основной причиной регургитации: подтя-
гивание створок или обструкция выходного тракта
ЛЖ и SAM-синдром. Применима количественная
оценка функции ЛЖ в 3D-режиме. Признаки ги-
пертрофической кардиомиопатии — нормальная
фракция выброса ЛЖ, гипертрофия перегородки и
сужение выходного тракта ЛЖ. Признаки ишеми-
ческой кардиомиопатии — подтягивание створок,
увеличение объема ЛЖ и ремоделирование его с во-
влечением базальной нижней и нижнебоковой сте-
нок.
ХИРУРГИЧЕСКИЕ ТЕХНИКИ ПЛАСТИКИ
МИТРАЛЬНОГО КЛАПАНА ПОД КОНТРОЛЕМ
ЭХОКАРДИОГРАФИИ
Цель пластики — восстановление нормальной гео-
метрии, размера и функции митрального клапана.
Для этого необходимо достаточное, но не чрезмер-
ное, количество свободной подвижной ткани ство-
рок с соответствующей площадью зоны коаптации
на уровне плоскости фиброзного кольца или ниже
нее [4]. Для коррекции дилатации фиброзного коль-
ца, улучшения сопоставления и предотвращения
дальнейшего ремоделирования фиброзного кольца
всем пациентам следует имплантировать ремодели-
рующее опорное кольцо [74]. Техники пластики
митрального клапана в зависимости от патоморфо-
логии приведены на рис. 19.18.
ДЕГЕНЕРАТИВНОЕ ПОРАЖЕНИЕ
Классический подход к лечению пролапса задней
створки (резекция) был популяризирован Carpentier.
При ограниченной флотации задней створки, харак-
терной для фиброэластического дефицита, доста-
точно узкой треугольной резекции (см. рис. 19.11A,
II стадия; 19.18A). Более распространенный пролапс
и флотация задней створки, обычно наблюдаемые
при болезни Барлоу, можно скорректировать с по-
мощью сегментарной резекции и скользящей пла-
стики задней створки (см. рис. 19.11A, III стадия;
19.18A). Чтобы избежать развития SAM-синдрома в
послеоперационном периоде из-за избыточной тка-
ни задней створки может понадобиться уменьшение
высоты ее сегментов, в которых пролапса нет. При
пролапсе передней створки с ограниченным вовле-
чением сегментов можно выполнить узкую резек-
цию или транспозицию сухожильной хорды. При
более распространенном пролапсе передней створки
может понадобиться укорочение папиллярных
мышц (см. рис. 19.11A, IV стадия; 19.18A). Резекция
створок, особенно в случае минимальной избыточ-
ности их ткани, может привести к уменьшению зо-
ны коаптации и увеличению натяжения створки, что
является прогностическим признаком неудачной
пластики. Тем не менее резекция имеет отличные
долгосрочные результаты [75].
Недавно в качестве альтернативы резекции створ-
ки оторванные и удлиненные сухожильные хорды
стали заменять на искусственные хорды из полите-
трафторэтилена [76, 77]. Потенциальные преиму-
щества данного метода — обеспечение большей по-
верхности сопоставления, сохранение подвижности
створки и снижение ее натяжения, а также исполь-
зование при аннулопластике опорного кольца боль-
шего размера. Отрицательно повлиять на результат
пластики может неадекватная длина искусственной
хорды, даже если ее измеряли предварительно. Оба
метода имеют схожую долгосрочную надежность
[78, 79].
ch19.indd 452
03.04.2019 11:55:37
453
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Параметр
Исследование
Значение
Предсуществующее
пора жение МК
(дегенеративное,
ревматическое)
2D-ЧПЭхоКГ: все стандартные позиции из среднего от-
дела пищевода (см. рис. 19.6); наиболее применимы
позиция по длинной оси и комиссуральная позиция
3D-ЧПЭхоКГ: позиция ЛП; МПР, позиция по длинной
оси и комиссуральная позиция
Может понадобиться пластика для кор-
рекции поражения
Размер фиброзного
кольца
Как при дегенеративном пора жении (см. табл. 19.1)
Помогает определить размер опорного
кольца для аннулопластики, степень ре-
гургитации и ее причину
Наличие, размер
и локализация
вегетаций
2D-ЧПЭхоКГ: все стандартные позиции из среднего от-
дела пищевода (см. рис. 19.6)
3D-ЧПЭхоКГ: позиция ЛП
Дает представление о риске эмболии
Нужно хирургическое удаление
Наличие и локализация
перфораций
2D-ЧПЭхоКГ: все стандартные позиции из среднего от-
дела пищевода (см. рис. 19.6)
3D-ЧПЭхоКГ + цветовая допплерография: позиция ЛП
и ЛЖ (для визуализации перфораций, прикрытых ве-
гетациями); МПР настройкой плоскостей в 2D-режиме
для отображения дефекта
Необходима пластика во время операции
Наличие и локализация
фистул и абсцессов
2D-ЧПЭхоКГ + цветовая допплерография: все стандарт-
ные позиции из среднего отдела пищевода (см. рис.
19.6). Могут понадобиться модифицированные пози-
ции, сфокусированные на предполагаемом поражении
3D-ЧПЭхоКГ + цветовая допплерография: МПР с на-
стройкой плоскостей в 2D-режиме для модифициро-
ванных позиций
Необходима пластика во время операции.
Высокая вероятность необходимости
протезирования клапана
Локализация,
направление струи
и степень
регургитации
Как при дегенеративном пора жении (см. табл. 19.1)
Струи, смещенные от линии сопоставле-
ния створок, указывают на перфора-
цию. Сложные или множественные
струи указывают на перфорацию и зна-
чительную деструкцию створок
Поражение других
клапанов или структур
Комплексная оценка с помощью стандартных позиций.
Тщательная оценка электродов кардиостимулятора
Может понадобиться оперативное вме-
шательство на клапанах и хирургиче-
ская санация и/или удаление электро-
дов кардиостимулятора
ЛЖ — левый желудочек; ЛП — левое предсердие; МК — митральный клапан; МПР — мультипланарная реконструкция.
ТАБЛИЦА 19.2 Оценка инфекционного эндокардита с помощью чреспищеводной эхокардиографии
Следует рассмотреть несколько вопросов, касаю-
щихся болезни Барлоу. В случае возникших при
этом заболевании щелей или дизъюнкции фиброз-
ного кольца может понадобиться пластика. При вы-
раженной дистрофической кальцификации может
понадобиться резекция кальцифицированной тка-
ни, пластика фиброзного кольца и связанной с ним
ткани створки [80]. Для пациентов с повышенным
риском развития SAM-синдрома после операции
может понадобиться модификация хирургической
техники (см. рис. 19.11A, IV стадия; 19.11Д, I стадия;
19.13). В данной ситуации важно подобрать опор-
ное кольцо для аннулопластики достаточного раз-
мера. При избыточном количестве ткани задней
створки допустимо выполнить либо расширенную
резекцию створки, либо сместить заднюю створку в
ЛЖ путем имплантации коротких искусственных
хорд. В идеале предсердная поверхность задней
створки должна быть меньше 1,5 см (не должна пре-
вышать 2,0 см). При избыточной ткани передней
створки можно выполнить овальную резекцию,
укорочение папиллярной мышцы, иссечение вто-
ричных сухожильных хорд или имплантировать
опорное кольцо большего размера. При использо-
вании искусственных хорд в случае пролапса перед-
ней створки важно правильно выбрать их длину,
поскольку слишком короткие хорды приводят к
смещению зоны коаптации ближе к выходному
тракту ЛЖ.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Хирургическое лечение инфекционного эндокарди-
та включает удаление вегетаций и поврежденных
ch19.indd 453
03.04.2019 11:55:37
454
ЧАСТЬ IV Пороки клапанов сердца
Параметр
Проекции
Значение
Размер фиброзного кольца
Как при дегенеративном поражении
(см. табл. 19.1)
Помогает определить размер опорного кольца
для аннулопластики, оценить степень
регургитации и установить причину
Подвижность, утолщение
и подтягивание створок
или подклапанных структур
2D-ЧПЭхоКГ: все стандартные позиции из
среднего отдела пищевода (см. рис. 19.6);
для оценки подклапанного аппарата особое
значение имеет трансгастральная
двухкамерная позиция
Являются показанием к определенному
хирургическому вмешательству:
хирургическая санация, увеличение створки
путем наложения заплаты и т.д.
Кальцификация фиброзного
кольца, клапана и
подклапанного аппарата
2D-ЧПЭхоКГ: все стандартные позиции из
среднего отдела пищевода (см. рис. 19.6);
для оценки подклапанного аппарата в
особое значение имеет трансгастральная
двухкамерная позиция
Может понадобиться хирургическое удаление
кальцификатов или хирургическая санация
Локализация, направление
струи и степень
регургитации
Как при дегенеративном поражении
(см. табл. 19.1)
Показатель эффективности пластики клапана
Наличие и степень
сопутствующего
митрального стеноза
(комбинированное
поражение митрального
клапана)
2D-ЧПЭхоКГ + непрерывно-волновая
допплерография: градиент диастолического
давления и время полуспада давления
3D-ЧПЭхоКГ: область МК оценивают
с помощью МПР
Может понадобиться выделение комиссур
при реконструктивном вмешательстве
Наличие тромбов в ЛП
или ушке ЛП
2D-ЧПЭхоКГ: все стандартные позиции
из среднего отдела пищевода проекции
(см. рис. 19.6)
Только при наличии сопутствующего
митрального стеноза
Поражение других клапанов Как при инфекционном эндокардите
(см. табл. 19.2)
Как при инфекционном эндокардите
(см. табл. 19.2)
ЛП — левое предсердие; МК — митральный клапан; МПР — мультипланарная реконструкция.
ТАБЛИЦА 19.3 Оценка ревматического поражения с помощью чреспищеводной эхокардиографии
частей створок, ушивание перфораций путем нало-
жения швов или заплаты из аутоперикарда. Иногда
нужна имплантация искусственных хорд.
РЕВМАТИЧЕСКОЕ ПОРАЖЕНИЕ
При пластике в случае ревматической митральной
регургитации обычно удаляют поврежденные части
створок и подклапанного аппарата. Как правило,
удлиняют переднюю створку и проводят рекон-
струкцию подклапанного аппарата.
ОТРЫВ ПАПИЛЛЯРНОЙ МЫШЦЫ
В идеале хирургическую пластикю оторванной па-
пиллярной мышцы следует отложить на время вос-
становления миокарда и демаркации зоны инфар-
кта. При частичном отрыве (одной головки) папил-
лярной мышцы можно выполнить пластику путем
прямого наложения шва. Восстановить папилляр-
ную мышцу при полном ее отрыве можно путем ре-
имплантации к фиброзному утолщению и наложе-
ния шва, транспозиции сухожильной хорды или
имплантации искусственной хорды для дополни-
тельной поддержки створки (при необходимости)
[81, 82].
ВТОРИЧНОЕ ПОРАЖЕНИЕ
Наиболее распространенной техникой хирургиче-
ской коррекции при вторичной митральной регур-
гитации является реконструктивная аннулопластика
опорным кольцом (см. рис. 19.11Г, I стадия; 19.18Б).
Однако в качестве изолированной техники ее при-
меняют только при слабо выраженном подтягива-
ch19.indd 454
03.04.2019 11:55:37
455
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Параметр
Исследование
Значение
Размер фиброзного кольца
Как при дегенеративном пора жении (см. табл.
19.1)
Помогает определить размер опорного
кольца для аннулопластики, оценить
степень регургитации и установить
причину. Позволяет прогнозировать
успешность реконструктивной
аннулопластики при выраженной
дилатации (см. табл. 19.6)
Степень подтягивания створок
(площадь «тента», высота
«тента», угол закрытия передней
створки, угол закрытия задней
створки, инверсия передней
створки, расстояние между
папиллярными мышцами)
2D-ЧПЭхоКГ: позиция под длинной оси из
среднего отдела пищевода (см. рис. 19.14)
3D-ЧПЭхоКГ: МПР, позиция под длинной оси
Позволяет прогнозировать успешность
реконструктивной аннулопластики
при выраженной дилатации (см. табл.
19.6)
Характер подтягивания створок
2D-ЧПЭхоКГ: позиция по длинной оси
и комиссуральная позиция из среднего
отдела пищевода
3D-ЧПЭхоКГ: МПР, позиция по длинной оси
и комиссуральная позиция с настройкой
сканирования по длинной оси для
перемещения плоскости вдоль линии
сопоставления створок
Помогает определить хирургическое
вмешательство (см. рис. 19.18)
Объем, фракция выброса
и нарушения локальной
сократимости миокарда ЛЖ
Как при дегенеративном пора жении
(см. табл. 19.1)
Показатель интраоперационного риска
Степень митральной
регургитации
Как при дегенеративном пора жении (см. табл.
19.1). Обратите внимание на снижение
порогового значения для тяжелой
регургитации по сравнению с первичной
митральной регургитацией. Степень
регургитации зависит от нагрузки
Указывает на необходимость
хирургического вмешательства
у пациентов, перенесших первичную
реваскуляризацию коронарных
артерий
Наличие и степень
трикуспидальной регургитации
Как при дегенеративном пора жении
(см. табл. 19.1)
Как при дегенеративном поражении
(см. табл. 19.1)
Давление в легочной артерии
Как при дегенеративном пора жении
(см. табл. 19.1)
Как при дегенеративном поражении
(см. табл. 19.1)
Размеры и функция ПЖ
Как при дегенеративном пора жении
(см. табл. 19.1)
Как при дегенеративном поражении
(см. табл. 19.1)
ЛЖ — левый желудочек; МПР — мультипланарная реконструкция; ПЖ — правый желудочек.
ТАБЛИЦА 19.4 Оценка вторичного поражения с помощью чреспищеводной эхокардиографии
нии створок. Прогностические признаки неуспеш-
ности реконструктивной аннулопластики опорным
кольцом перечислены в табл. 19.5 [83]. Для сниже-
ния частоты неблагоприятного исхода реконструк-
тивной аннулопластики при выраженном подтяги-
вании створок (см. рис. 19.11Г, II–IV стадии) было
разработано несколько дополнительных техник. К
ним относятся иссечение вторичных сухожильных
хорд, транспозиция сухожильных хорд, сближение
папиллярных мышц, иссечение аневризмы желу-
дочка и увеличение передней створки путем нало-
жения заплаты (аугментация) (см. рис. 19.18Б).
Есть сообщение об обнадеживающих результа-
тах поэтапного вмешательства при выраженном
подтягивании створок, начиная от реконструктив-
ной аннулопластики до иссечения вторичных сухо-
жильных хорд и, наконец, увеличения размера пе-
редней створки путем наложения заплаты [4]. Од-
нако при прогрессирующем вторичном поражении
аннулопластики и иссечения сухожильных хорд мо-
жет быть недостаточно, следует рассмотреть воз-
можность увеличения размера передней створки
путем наложения заплаты и сближения папилляр-
ных мышц [4, 84–86]. В настоящее время ни одна из
этих дополнительных техник не утверждена, и
большинство хирургов при выраженном подтяги-
вании створок предпочитает выполнять протезиро-
вание митрального клапана.
ch19.indd 455
03.04.2019 11:55:37
456
ЧАСТЬ IV Пороки клапанов сердца
У пациентов с болезнью Барлоу и вторичным
подтягиванием створок при дилатации ЛЖ суще-
ствует риск развития SAM-синдрома после аннуло-
пластики опорным кольцом (см. рис. 19.3Е, 19.16).
В таком случае, несмотря на минимальный пролапс,
необходимо уменьшить высоту задней створки пу-
тем овальной резекции, сегментэктомии и скользя-
щей пластики задней створки либо имплантацией
коротких искусственных хорд.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
ПОСЛЕ ПЛАСТИКИ
После пластики исследование с помощью ЧПЭхоКГ
должно быть сфокусировано на: (1) оценке морфо-
логии и функции створок, (2) определении наличия
и степени остаточной митральной регургитации;
(3) исключении таких осложнений, как митральный
стеноз, дисфункция желудочка и SAM-синдром. Ис-
ключить остаточную регургитацию обычно позво-
ляет стандартная визуализация в 2D- и 3D-режиме
с цветовой допплерографией или без нее. Однако
при наличии значительной остаточной митральной
регургитации для определения ее механизма и ло-
кализации струй полезно провести количественную
оценку в 3D-режиме.
СТРОЕНИЕ И ФУНКЦИЯ СТВОРОК
Створки должны широко раскрываться во время
диастолы и полностью закрываться во время систо-
Угол закрытия сегмента P2
Угол закрытия сегмента А2
Угол изгиба сегмента А2
Высота зоны коаптации
Площадь «тента»
Расстояние между
папиллярными
мышцами
Рис. 19.14 A Показатели подтягивания створок при вторичной митральной регургитации. Угол закрытия сегмента A2 в норме составляет < 25–30°, а
угол закрытия сегмента P2 — < 30–35°. Значения, превышающие 40–45°, указывают на выраженное подтягивание створок [83]. В норме инверсия передней
створки отсутствует (т.е. угол изгиба равен 180°). Расстояние между папиллярными мышцами > 2,0 см в середине систолы часто наблюдается у пациентов с ише-
мической митральной регургитацией [93]. Уменьшение расстояния между папиллярными мышцами во время систолы (< 0,9 см) коррелирует с ишемической ми-
тральной регургитацией (от умеренной до тяжелой) [49]. Измерение этих показателей позволяет прогнозировать эффективность реконструкции клапана с помо-
щью опорного кольца при лечении миопатической митральной регургитации (предоставлено David Sidebotham и Daniel Drake).
ch19.indd 456
03.04.2019 11:55:37
457
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
лы. Сопоставление створок должно быть на уровне
плоскости фиброзного кольца или чуть ниже и не
находиться в выходном тракте ЛЖ. Высота зоны ко-
аптации должна быть не менее 5 мм (в идеале
> 8 мм). Опорное кольцо для аннулопластики долж-
но быть расположено правильно.
Нормальный внешний вид митрального клапана
после операции зависит от основного заболевания
и хирургической техники. После резекции задней
створки зона коаптации створок может оказаться в
акустической тени опорного кольца, что затруднит
оценку высоты зоны коаптации (будет похоже на
одностворчатый клапан). Пластика с имплантацией
искусственных хорд обычно обеспечивает легко ви-
зуализируемую коаптацию. Если короткие искус-
ственные хорды использовали для смещения избы-
точной ткани задней створки в ЛЖ, то сопоставле-
ние происходит ниже плоскости фиброзного кольца
и смещается кзади. И наоборот, если искусственные
хорды использовали для коррекции молотящей зад-
ней створки, которая возникла в результате фибро-
эластического дефицита, то сопоставление будет
происходить на уровне или чуть ниже плоскости
фиброзного кольца и более центрально.
Вегетации
сегмента P1
Флотация
сегмента P3
Флотация
сегмента P3
Вегетации
сегмента P1
Рис. 19.15 Сочетание дегенеративного поражения и инфекционного эндокардита. Спиральная мультипланарная реконструкция объемных данных. Для
демонстрации патологических изменений получены двухмерные изображения в поперечном сечении в стандартных позициях по длинной оси (А) и комиссураль-
ной позиции (Б). (В) У основания сегмента Р1 определяются крупные вегетации, они видны и на (А). На (Б) и (В) видна флотация сегмента P3. (Г) Расположение
зеленой и красной плоскостей показано на трехмерном изображении. Параллакс устранен, поэтому положение красной и зеленой плоскости четко соответствует
их пересечению на трехмерном изображении со стороны ЛП. Хирургическое лечение заключалось в удалении вегетаций сегмента P1, реконструкции фиброзного
кольца вблизи сегмента P1, узкой резекции сегмента P3 и аннулопластике опорным кольцом.
А
Б
Г
В
ch19.indd 457
03.04.2019 11:55:38
458
ЧАСТЬ IV Пороки клапанов сердца
После пластики митрального клапана по поводу
вторичного поражения передняя створка должна
выглядеть нормальной, с минимальным подтягива-
нием и удовлетворительной коаптацией чуть ниже
плоскости фиброзного кольца. Инверсия передней
створки должна быть устранена полностью. Однако
часто наблюдается остаточное подтягивание задней
створки, особенно при запущенных поражениях.
ОСТАТОЧНАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Оценку остаточной регургитации следует прово-
дить после восстановления функции сердца после
отключения искусственного кровообращения и при
нормальной гемодинамике. Это особенно важно
после хирургической коррекции вторичного пора-
жения, поскольку в этом случае обычно нарушает-
ся функция ЛЖ, а нарушения сократимости, пред-
нагрузки и постнагрузки оказывают значительное
влияние на степень регургитации.
Наличие умеренной или тяжелой остаточной ре-
гургитации является показанием к ревизии пласти-
ки или протезированию клапана [87, 88]. О долго-
срочных последствиях легкой остаточной митраль-
ной регургитации данных немного, тем не менее
следует исключать остаточную регургитацию. При
принятии решения о ревизии пластики в случае лег-
кой остаточной регургитации следует учитывать ве-
роятность улучшения результата пластики, риск по-
Позиция левого предсердия
Позиция по длинной оси
P2
P2
2,3
2,4
5,1
4,4
КДО 164 мл
КСО 106 мл
УО58мл
ФВ 35%
КДО 179 мл
КСО 113 мл
УО66мл
ФВ 37%
Комиссуральная позиция
Параметрический анализ
А
Б
Рис. 19.16 Сочетание дегенеративного поражения и вторичного поражения. Представлены изображения митрального клапана и левого желудочка двух
разных пациентов с сочетанием дегенеративного и вторичного поражений митрального клапана. В первом столбце — трехмерные изображения (позиция левого
предсердия). Во втором и третьем столбцах — двухмерные изображения в позиции по длинной оси и в комиссуральной позиции в режиме «Масштабирование».
Для анализа выбраны изображения в позднюю систолу. В четвертом столбце представлены параметрические трехмерные изображения левого желудочка. (A) Па-
циент с длительно текущей болезнью Барлоу и тяжелой митральной регургитацией. При визуализации в позиции левого предсердия видна избыточная ткань, ха-
рактерная для этой болезни. В позиции по длинной оси определяются прогностические факторы риска развития SAM-синдрома после операции: удлинение сег-
мента P2 (> 2 см), уменьшение аорто-митрального угла и выраженное утолщение основания перегородки. Комиссуральная ширина увеличена (5,1 см, норма
< 3,5 см), что характерно для болезни Барлоу. Однако в позиции по длинной оси и в комиссуральной позиции определяется минимальный пролапс створок. Ре-
зультаты параметрического анализа демонстрируют расширение левого желудочка и снижение фракции выброса левого желудочка. Несмотря на нормальную
подвижность створок, реконструктивная аннулопластика опорным кольцом противопоказана в связи с повышенным риском развития SAM-синдрома после опе-
рации. (Б) Пациент, недавно перенесший инфаркт миокарда, с умеренной митральной регургитацией и показаниями к реваскуляризации коронарных артерий.
Сначала предположили, что регургитация имеет ишемический генез. Однако при визуализации в позиции левого предсердия определяется легкий пролапс зад-
ней створки, что свидетельствует о дегенеративном поражении. В позиции по длинной оси и в комиссуральной позиции признаки пролапса отсутствуют, но уве-
личены длина задней створки (2,4 см) и комиссуральная ширина (4,4 см), что также указывает на дегенеративное поражение. Важно отметить минимальное под-
тягивание створок, нехарактерное для изолированной вторичной регургитации. Результаты объемного параметрического анализа демонстрируют дилатацию ЛЖ
и снижение фракции выброса ЛЖ. Пациенту провели реваскуляризацию коронарных артерий, но впоследствии развилась тяжелая митральная регургитация, об-
условленная пролапсом обеих створок. КДО — конечно-диастолический объем; КСО — конечно-систолический объем; УО — ударный объем; ФВ — фракция
выброса.
ch19.indd 458
03.04.2019 11:55:38
459
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Рис. 19.17 Сочетание ишемической болезни сердца и гипертрофической кардиомиопатии. Изображения получены при количественном анализе объ-
емных данных в режиме «Масштабирования» (А–В) и полнообъемных данных левого желудочка (Г) у пациента с гипертрофической кардиомиопатией и подтяги-
ванием створок, обусловленным вторичной дилатацией левого желудочка на фоне ишемической болезни сердца. Изображения митрального клапана получены в
позднюю систолу. Параллакс устранен таким образом, чтобы позиция по длинной оси (А) и комиссуральная позиция (Б) в 3D-режиме были точно расположены
в позиции левого предсердия (В). В позиции по длинной оси отмечается выраженная гипертрофия передней части основания перегородки (2,9 см) на протяже-
нии 2,6 см. Кроме того, определяется образование умеренного «тента» (площадь «тента» 0,9 см2), а линия сопоставления располагается приблизительно на 1 см
ниже плоскости фиброзного кольца. Подтягивание преимущественно затрагивает сегмент A2, что заметно в комиссуральной позиции. SAM-синдром не наблюда-
ется ни в позиции по длинной оси, ни в комиссуральной позиции. Ограничение подвижности створок также наблюдается в позиции левого предсердия. Резуль-
таты объемного параметрического анализа ЛЖ демонстрируют выраженную дилатацию левого желудочка при относительно сохранной фракции выброса. Полу-
ченные данные указывают на митральную регургитацию, обусловленную в основном дилатацией левого желудочка (ишемическая кардиомиопатия), и субклини-
ческую гипертрофическую кардиомиопатию. В этом случае реваскуляризация коронарных артерий с миоэктомией перегородки может спровоцировать рецидив
митральной регургитации из-за нескорректированного подтягивания створок. Выполнение реваскуляризации коронарных артерий и реконструктивной аннулопла-
стики опорным кольцом может спровоцировать развитие SAM-синдрома после операции. В данном случае для эффективной и длительной пластики нужна ком-
бинация реваскуляризации, миоэктомии перегородки, иссечения вторичных сухожильных хорд, аугментации передней створки и реконструктивной аннулопласти-
ки опорным кольцом. КДО — конечно-диастолический объем; КСО — конечно-систолический объем; УО — ударный объем; ФВ — фракция выброса.
2,6
D7
КДО 210 мл
КСО 87 мл
УО 124 мл
ФВ 59%
D9
1,0
A5
0,9 см2
2,9
А
Б
Г
В
ch19.indd 459
03.04.2019 11:55:39
460
ЧАСТЬ IV Пороки клапанов сердца
Дегенеративное поражение
Укорочение
папиллярных
мышц
Скользящая
пластика
Имплантация
искусственной
хорды
Треугольная
резекция
Аннулопластика
опорным кольцом
Иссечение
вторичных
сухожильных
хорд
Сближение
папиллярных мышц
Аугментация
передней створки
Протезирование клапана
Вторичное поражение
Площадь «тента»
Комиссуральная ширина
P2
P2
P2
A2
P1
К
о
л
и
ч
е
с
т
в
о
с
е
г
м
е
н
т
о
в
с
п
р
о
л
а
п
с
о
м
У
г
о
л
з
а
к
р
ы
т
и
я
с
е
г
м
е
н
т
а
А
2
P1
A1
P3
P3
A3
Аннулопластика
опорным кольцом
А
Б
Рис. 19.18 A Хирургические техники в зависимости от патоморфологии митрального клапана. Вмешательство основано на анатомических данных,
полученных с помощью эхокардиографии. (A) Дегенеративное поражение. Эхокардиографические критерии, определяющие технику лечения дегенеративного за-
болевания — комиссуральная ширина и количество сегментов с пролапсом. Слева направо: аннулопластика опорным кольцом, треугольная резекция, импланта-
ция искусственной хорды, скользящая пластика задней створки, укорочение папиллярных мышц в сочетании со скользящей пластикой задней створки. (Б) Вто-
ричное (миопатическое) поражение. Эхокардиографические критерии, определяющие технику лечения вторичного заболевания, — п лощадь «тента» и угол за-
крытия сегмента A2. Слева направо: реконструктивная аннулопластика опорным кольцом, иссечение вторичных сухожильных хорд, сближение папиллярных мышц,
аугментация передней створки, протезирование клапана. Аннулопластику опорным кольцом выполняют при завершения любого реконструктивного вмешательства
[Drake D, Zimmerman K, Sidebotham D: Comment on surgical treatment of moderate ischemic mitral regurgitation. N Engl J Med 372:1771–1773, 2015].
ch19.indd 460
03.04.2019 11:55:40
461
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Параметр
Исследования Пороговое значение
Чувствительность/
специфичность (%)
Размер фиброзного кольца митрального клапана
ЧПЭхоКГ
≥37мм
84/76
Площадь «тента»
ЧПЭхоКГ
≥ 1,6 см2
80/54
ТТЭхоКГ
≥ 2,5 см2
64/95
Высота «тента»
ЧПЭхоКГ
>1см
–
ТТЭхоКГ
>1см
64/90
Угол закрытия задней створки
ТТЭхоКГ
≥ 45°
100/95
Конечно-диастолический объем левого желудочка
ТТЭхоКГ
≥145мл
90/90
Расстояние между папиллярными мышцами
ТТЭхоКГ
>20мм
96/97
Систолический индекс сферичности*
ТТЭхоКГ
≥ 0,7
100/100
Диастолическая функция
ТТЭхоКГ
Рестриктивная
* Индекс сферичности — соотношение длинной и короткой осей ЛЖ. Описание других параметров см. в тексте.
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Magne J, Senechal M, Pibarot P: Ischemic mitral regurgitation: a complex multifaceted disease. Cardiology 112:244–259, 2009.]
ТАБЛИЦА 19.5 Прогностические признаки рецидива митральной регургитации после реконструктивной аннулопластики
при лечении ишемической митральной регургитации
Оставшийся пролапс (дегенеративное поражение)
Оставшееся подтягивание створок (вторичное поражение)
Нескорректированные щели (дегенеративное поражение)
Неадекватная коаптация створок
Натяжение створок, вызывающее расхождение расщелин
задней створки (дегенеративное пора жение, результат ре-
зекции створок)
Перфорация створок (например, опорным кольцом при ан-
нулопластике или в результате неправильного наложения
шва)
Парадоксальное систолическое движение передней створки
(болезнь Барлоу, гипертрофическая кардиомиопатия)
ТАБЛИЦА 19.6 Механизмы остаточной митральной
регургитации после пластики
вторного искусственного кровообращения и риск
поздней повторной операции.
Степень остаточной регургитации следует опре-
делять количественно, измеряя ширину или пло-
щадь vena contracta (см. главу 18). Метод PISA не
подходит для количественной оценки легкой регур-
гитации, т.к. в этом случае зона конвергенции по-
тока недостаточна для точного измерения. Ширину
vena contracta нужно измерять в позиции по длин-
ной оси из среднего отдела пищевода с поворотами
датчика влево и вправо и сканировании вдоль ли-
нии сопоставления створок. Для анализа следует
выбрать самую узкую часть струи регургитации и
определить среднее значение нескольких измере-
ний. Площадь vena contracta определяют с помощью
планиметрии объемных данных. Короткую струю,
которая наблюдается только в одном или двух изо-
бражениях в раннюю систолу и обычно со временем
уменьшается, следует игнорировать.
Остаточная регургитация может разрешиться по
мере восстановления функции желудочка. В связи
целесообразно подождать до 30 мин после отключе-
ния искусственного кровообращения, прежде чем
принимать окончательное решение об эффективно-
сти пластики.
При наличии недопустимой остаточной регур-
гитации важно определить ее механизм (табл. 19.6)
и локализацию места регургитации. Сканирование
вдоль линии сопоставления створок в позиции по
длинной оси из среднего отдела пищевода позволя-
ет определить нескорректированный пролапс ство-
рок или их подтягивание.
В случае выявления в 2D-режиме деформации
створки количественную оценку можно провести в
3D-режиме. Определить анатомическое положение
остаточной регургитации (рис. 19.19) позволяет ви-
зуализация с помощью цветовой допплерографии
в 3D-режиме со стороны предсердия с близкой об-
резкой по клапану. С помощью этой техники также
можно выявить нескорректированные щели и рас-
хождение расщелин задней створки.
ВНОВЬ ВОЗНИКШИЙ МИТРАЛЬНЫЙ СТЕНОЗ
Клинически значимый митральный стеноз встреча-
ется редко, но может появиться в результате оста-
точной дисфункции ревматической этиологии, ма-
лого размера имплантированного опорного кольца
или наличия глубоких складок в области комиссур.
Оценка митрального стеноза затруднена из-за уве-
личенного диастолического кровотока, обусловлен-
ного тахикардией, гипердинамической сократимо-
ch19.indd 461
03.04.2019 11:55:40
462
ЧАСТЬ IV Пороки клапанов сердца
Рис. 19.19 A Остаточная регургитация после пластики митрального клапана. Изображения были получены с помощью мультипланарной реконструк-
ции из наборов осевых объемных данных с цветовой допплерографией. Для демонстрации остаточной регургитации были получены двухмерные изображения в
поперечном сечении (А, Б) из стандартных позиций по длинной оси и комиссуральной позиции. Расположение плоскостей показано на трехмерном изображении
(вид из предсердия) (Г). (В) Позиция по короткой оси. Остаточная регургитация видна во всех позициях. Эта легкая остаточная регургитация возникла в перед-
ней части фиброзного кольца (примерно на 1 часе условного циферблата) в результате разрыва шва, наложенного для фиксации опорного кольца для аннуло-
пластики. Во время повторного вмешательства на клапане после подключения аппарата искусственного кровообращения удалось с помощью ЭхоКГ найти место
регургитации. В этой области были наложены швы, и регургитация была устранена.
А
Б
Г
В
стью миокарда и снижением эластичности желу-
дочка, что часто наблюдается после искусственного
кровообращения. Часто в раннем послеоперацион-
ном периоде после пластики отмечается средний
градиент диастолического давления до 5 мм рт. ст.
Результаты ретроспективнго анализа с участием 557
пациентов продемонстрировали, что средний гра-
диент диастолического давления 7 мм рт. ст. или
выше ассоциируется с необходимостью проведения
повторной операции [89].
ДИСФУНКЦИЯ ЖЕЛУДОЧКА
После операции на митральном клапане часто на-
блюдается дисфункция ЛЖ. Увеличение постнагруз-
ки после коррекции митральной регургитации усу-
губляет предсуществующую дисфункцию ЛЖ, а
травматизация огибающей артерии приведет к но-
вым нарушениям сократимости задней и боковой
стенок ЛЖ. В связи с плохой защитой миокарда,
воздушной эмболии правой коронарной артерии и
обострения ранее существовавшей легочной гипер-
тензии может развиться транзиторная дисфункция
ПЖ.
ПАРАДОКСАЛЬНОЕ СИСТОЛИЧЕСКОЕ ДВИЖЕНИЕ
ПЕРЕДНЕЙ СТВОРКИ МИТРАЛЬНОГО КЛАПАНА
SAM-синдром после операции наблюдается, как
правило, у пациентов с болезнью Барлоу или гипер-
трофической кардиомиопатией. SAM-синдром луч-
ше всего диагностировать из среднего отдела пище-
ch19.indd 462
03.04.2019 11:55:40
463
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Позиция левого предсердия
Позиция по длинной оси
Комиссуральная позиция
А
Б
Рис. 19.20 Парадоксальное систолическое движение передней створки после операции. Изображения получены в позднюю систолу с помощью мно-
гопланарной реконструкции объемных данных без цветовой и при цветовой допплерографией после пластики митрального клапана. В первом столбце представ-
лены трехмерные изображения в позиции левого предсердия. Во втором и третьем столбце приведены двухмерные изображения в позиции по длинной оси и в
комиссуральной позиции. Обратите внимание, что для демонстрации патологических изменений расположение комиссуральной позиции немного смещено от стан-
дартного положения (А, зеленая линия). (A) На трехмерном изображении в позиции левого предсердия видно подтягивание сегмента A2. В позиции по длинной
оси определяется изгиб передней створки митрального клапана в выходной тракт левого желудочка, что является признаком SAM-синдрома. В комиссуральной
позиции заметно, как передняя створка загибается назад и прилежит к передней части опорного кольца. (Б) На трехмерном изображении в позиции левого пред-
сердия определяется струя регургитации, распространяющаяся назад в ЛП, а в области аортального клапана заметна систолическая турбулентность. В позиции
по длинной оси подтверждается наличие ретроградной струи регургитации и турбулентность в выходном тракте левого желудочка. Комиссуральная позиция так-
же подтверждает наличие турбулентности в пределах опорного кольца, что соответствует тяжелой митральной регургитации.
вода в позиции по длинной оси. К характерным
признакам относятся смещение передней створки
митрального клапана в выходной тракт ЛЖ, высо-
коскоростной турбулентный поток в выходном трак-
те ЛЖ и ретроградная струя митральной регургита-
ции (рис. 19.20).
Необходимо измерить скорость кровотока в вы-
ходном тракте ЛЖ с помощью непрерывно-волно-
вой допплерографии в трансгастральной позиции.
Максимальная скорость кровотока наблюдается,
как правило, в поздней систоле, что на спектрограм-
ме проявляется характерным колебанием волны с
резким максимумом.
Максимальную скорость кровотока в выходном
тракте ЛЖ < 2 м/сек в сочетании с легкой митраль-
ной регургитацией можно проигнорировать, небла-
гоприятных последствий не будет. Терапия более
выраженного SAM-синдрома осуществляется путем
нагрузки объемом, назначения сосудосуживающих
препаратов и прекращения инотропной поддержки.
Лекарственная терапия обычно эффективна, лишь
в исключительных случаях нужна хирургическая
ревизия [90]. Неэффективная лекарственная тера-
пия при скорости кровотока в выходном тракте ЛЖ
< 3,5 м/сек и легкой или умеренной митральной ре-
гургитации — показание к хирургической ревизии
[91]. Варианты дальнейшей пластики: имплантация
опорного кольца большего размера, смещение ли-
нии сопоставления створок кзади и ограниченная
миоктомия [92].
ch19.indd 463
03.04.2019 11:55:41
465
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
Метод
визуализации/
оценка
Позиция
Применимость
Примечания
Комиссуральная
из среднего от-
дела пищевода
(осевая)
Как при комиссуральной позиции
из среднего отдела пищевода
Осевая визуализация обеспечивает про-
хождение плоскости изображения че-
рез комиссуральную ось и пересече-
ние плоскости сопоставления сегмен-
товA1иP1,A3иP3.
Сбор и анализ данных описаны см. рис.
19.8–19.10
Размеры и функция
ЛЖ
2D-ЭхоКГ: модифицированный метод Симпсона (четырех-
и двухкамерная позиции из среднего отдела пищевода)
Предоставляет данные объемов ЛЖ
и ФВЛЖ
3D-ЭхоКГ: количественный анализ объемных данных
Предоставляет данные об объеме ЛЖ,
ФВЛЖ и нарушениях сократимости
миокарда. Применимо для оценки
подтягивания створок при вторичной
митральной регургитации и оценки
вторичной митральной регургитации
при наличии дегенеративного заболе-
вания
Степень регургита-
ции (см. главу 18)
Ширина vena contracta, эффективная площадь отверстия ре-
гургитации: метод PISA, площадь vena contracta
Тяжелая органическая митральная ре-
гургитация: ширина vena contracta
≥ 0,7 см, эффективная площадь отвер-
стия регургитации ≥ 0,4 см2
Тяжелая вторичная митральная регур-
гитация: ≥ 0,2
с
м2
PISA — площадь проксимальной зоны струи регургитации; AК — аортальный клапан; ЛЖ — левый желудочек; ЛП — левое предсердие;
МПР — мультипланарная реконструкция; ПЖ — правый желудочек; ФВЛЖ — фракция выброса левого желудочка.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Хирургическая пластика митрального клапана
ЛИТЕРАТУРА
1. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC Guideline for the Manage-
ment of Patients With Valvular Heart Disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, Circulation 129:e521–
e643, 2014.
2. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012): The Joint Task
Force on the Management of Valvular Heart
Disease of the European Society of Cardiol-
ogy (ESC) and the European Association for
Cardio-Thoracic Surgery (EACTS), Eur Heart
J 33:2451–2496, 2012.
3. Sidebotham DA, Allen SJ, Gerber IL, Fayers T.
Intraoperative transesophageal echocardiogra-
phy for surgical repair of mitral regurgitation,
J Am Soc Echocardiogr 27:345–366, 2014.
4. Drake DH, Zimmerman KG, Hepner AM,
Nichols CD. Echo-guided mitral repair, Circ
Cardiovasc Imaging 7:132–141, 2014.
5. Bolling SF, Li S, O’Brien SM, et al. Predictors
of mitral valve repair: clinical and surgeon
factors, Ann Thorac Surg 90:1904–1911, 2010.
6. Kilic A, Shah AS, Conte JV, et al. Operative
outcomes in mitral valve surgery: combined
effect of surgeon and hospital volume in a
population-based analysis, J Thorac Cardio-
vasc Surg 146:638–646, 2013.
7. Enriquez-Sarano M, Freeman WK, Tribouil-
loy CM, et al. Functional anatomy of mitral
regurgitation: accuracy and outcome implica-
tions of transesophageal echocardiography, J
Am Coll Cardiol 34:1129–1136, 1999.
8. Pepi M, Tamborini G, Maltagliati A, et al.
Head-to-head comparison of two- and three-
dimensional transthoracic and transesopha-
geal echocardiography in the localization of
mitral valve prolapse, J Am Coll Cardiol
48:2524–2530, 2006.
9. Reynolds HR, Jagen MA, Tunick PA, Kronzon
I. Sensitivity of transthoracic versus trans-
esophageal echocardiography for the detection
of native valve vegetations in the modern era,
J Am Soc Echocardiogr 16:67–70, 2003.
10. Ben Zekry S, Nagueh SF, Little SH, et al.
Comparative accuracy of two- and three-di-
mensional transthoracic and transesophageal
echocardiography in identifying mitral valve
pathology in patients undergoing mitral valve
repair: initial observations, J Am Soc Echocar-
diogr 24:1079–1085, 2011.
11. La Canna G, Arendar I, Maisano F, et al. Real-
time three-dimensional transesophageal
echocardiography for assessment of mitral
valve functional anatomy in patients with
prolapse-related regurgitation, Am J Cardiol
107:1365–1374, 2011.
12. Izumo M, Shiota M, Kar S, et al. Comparison
of real-time three-dimensional transesopha-
geal echocardiography to two-dimensional
transesophageal echocardiography for quan-
tification of mitral valve prolapse in patients
with severe mitral regurgitation, Am J Cardiol
111:588–594, 2013.
13. Biaggi P, Jedrzkiewicz S, Gruner C, et al.
Quantification of mitral valve anatomy by
three-dimensional transesophageal echocar-
diography in mitral valve prolapse predicts
surgical anatomy and the complexity of mi-
tral valve repair, J Am Soc Echocar-
diogr25758–765, 2012.
14. Hahn RT, Abraham T, Adams MS, et al.
Guidelines for performing a comprehensive
transesophageal echocardiographic examina-
tion: recommendations from the American
Society of Echocardiography and the Society
of Cardiovascular Anesthesiologists, J Am Soc
Echocardiogr 26:921–964, 2013.
15. Mitchell C, Miller Jr. FA, Bierig SM, et al.
Advanced Cardiovascular Sonographer: a
proposal of the American Society of Echocar-
diography Advanced Practice Sonographer
ch19.indd 465
03.04.2019 11:55:41
466
ЧАСТЬ IV Пороки клапанов сердца
Task Force, J Am Soc Echocardiogr 22:1409–
1413, 2009.
16. Levine RA, Triulzi MO, Harrigan P, Weyman
AE. The relationship of mitral annular shape
to the diagnosis of mitral valve prolapse,
Circulation 75:756–767, 1987.
17. Silbiger JJ, Bazaz R. Contemporary insights
into the functional anatomy of the mitral
valve, Am Heart J 158:887–895, 2009.
18. Grewal J, Suri R, Mankad S, et al. Mitral annular
dynamics in myxomatous valve disease: new
insights with real-time 3-dimensional echocar-
diography, Circulation 121:1423–1431, 2010.
19. Silbiger JJ. Anatomy, mechanics, and patho-
physiology of the mitral annulus, Am Heart J
164:163–176, 2012.
20. Levack MM, Jassar AS, Shang EK, et al. Three-
dimensional echocardiographic analysis of
mitral annular dynamics: implication for
annuloplasty selection, Circulation 126(11
Suppl 1):S183–188, 2012.
21. Salgo IS, Gorman 3rd JH, Gorman RC, et al.
Effect of annular shape on leaflet curvature
in reducing mitral leaflet stress, Circulation
106:711–717, 2002.
22. Carpentier A. Cardiac valve surgery — the
“French correction.”, J Thorac Cardiovasc
Surg 86:323–337, 1983.
23. Carpentier A, Adams DH, Filsoufi F, editors.
The functional classif ication, Carpentier’s re-
constructive valve surgery. From valve analy-
sis to valve reconstructionSt Louis, 2010,
Saunders Elsevier.
24. Anyanwu AC, Adams DH. Etiologic classifi-
cation of degenerative mitral valve disease:
Barlow’s disease and fibroelastic deficiency,
Semin Thorac Cardiovasc Surg 19:90–96, 2007.
25. Foster E. Clinical practice. Mitral regurgita-
tion due to degenerative mitral-valve disease,
N Engl J Med 363:156–165, 2010.
26. Clavel MA, Mantovani F, Malouf J, et al.
Dynamic phenotypes of degenerative myxo-
matous mitral valve disease: quantitative
3-dimensional echocardiographic study, Circ
Cardiovasc Imaging 8:e002989, 2015.
27. Obase K, Weinert L, Hollatz A, et al. Leaflet-
chordal relations in patients with primary and
secondary mitral regurgitation, J Am Soc
Echocardiogr 28:1302–1308, 2015.
28. Gupta V, Barzilla JE, Mendez JS, et al. Abun-
dance and location of proteoglycans and hy-
aluronan within normal and myxomatous
mitral valves, Cardiovasc Pathol 18:191–197,
2009.
29. Han RI, Black A, Culshaw G, et al. Structural
and cellular changes in canine myxomatous
mitral valve disease: an image analysis study,
J Heart Valve Dis 19:60–70, 2010.
30. Delling FN, Vasan RS. Epidemiology and
pathophysiology of mitral valve prolapse:
new insights into disease progression, genet-
ics, and molecular basis, Circulation 129:
2158–2170, 2014.
31. Maron MS, Olivotto I, Harrigan C, et al. Mitral
valve abnormalities identified by cardiovascu-
lar magnetic resonance represent a primary
phenotypic expression of hypertrophic cardio-
myopathy, Circulation 124:40–47, 2011.
32. Charitos EI, Hanke T, Karluss A, et al. New
insights into bicuspid aortic valve disease: the
elongated anterior mitral leaflet, Eur J Cardio-
thorac Surg 43:367–370, 2013.
33. Ogawa S, Hayashi J, Sasaki H, et al. Evalua-
tion of combined valvular prolapse syndrome
by two-dimensional echocardiography, Cir-
culation 65:174–180, 1982.
34. Eriksson MJ, Bitkover CY, Omran AS, et al.
Mitral annular disjunction in advanced
myxomatous mitral valve disease: echocar-
diographic detection and surgical correction,
J Am Soc Echocardiogr 18:1014–1022, 2005.
35. Johnston DR, Gillinov AM, Blackstone EH, et
al. Surgical repair of posterior mitral valve
prolapse: implications for guidelines and
percutaneous repair, Ann Thorac Surg
89:1385–1394, 2010.
36. Castillo JG, Anyanwu AC, Fuster V, Adams
DH. A near 100% repair rate for mitral valve
prolapse is achievable in a reference center:
implications for future guidelines, J Thorac
Cardiovasc Surg 144:308–312, 2012.
37. Hoen B, Duval X. Clinical practice. Infective
endocarditis, N Engl J Med 368:1425–1433,
2013.
38. Shimokawa T, Kasegawa H, Matsuyama S, et
al. Long-term outcome of mitral valve repair
for infective endocarditis, Ann Thorac Surg
88:733–739, 2009.
39. Iung B, Rousseau-Paziaud J, Cormier B, et al.
Contemporary results of mitral valve repair
for infective endocarditis, J Am Coll Cardiol
43:386–392, 2004.
40. Iung B, Vahanian A. Epidemiology of valvu-
lar heart disease in the adult, Nature Rev
Cardiol 8:162–172, 2011.
41. Iung B, Baron G, Butchart EG, et al. A pro-
spective survey of patients with valvular heart
disease in Europe: The Euro Heart Survey on
Valvular Heart Disease, Eur Heart J 24:1231–
1243, 2003.
42. Chauvaud S, Fuzellier JF, Berrebi A, et al.
Long-term (29 years) results of reconstructive
surgery in rheumatic mitral valve insuffi-
ciency, Circulation 104(12 Suppl 1):I12–I15,
2001.
43. Choudhary SK, Talwar S, Dubey B, et al.
Mitral valve repair in a predominantly rheu-
matic population. Long-term results, Tex
Heart Inst J 28:8–15, 2001.
44. Dillon J, Yakub MA, Kong PK, et al. Com-
parative long-term results of mitral valve re-
pair in adults with chronic rheumatic disease
and degenerative disease: is repair for “burnt-
out” rheumatic disease still inferior to repair
for degenerative disease in the current era? J
Thorac Cardiovasc Surg 149:771–777, 2015.
45. Hull MC, Morris CG, Pepine CJ, Mendenhall
NP. Valvular dysfunction and carotid, subcla-
vian, and coronary artery disease in survivors
of hodgkin lymphoma treated with radiation
therapy, JAMA 290:2831–2837, 2003.
46. Groarke JD, Nguyen PL, Nohria A, et al.
Cardiovascular complications of radiation
therapy for thoracic malignancies: the role for
non-invasive imaging for detection of cardio-
vascular disease, Eur Heart J 35:612–623,
2014.
47. Elmariah S, Budoff MJ, Delaney JA, et al.
Risk factors associated with the incidence and
progression of mitral annulus calcification:
the multi-ethnic study of atherosclerosis, Am
Heart J 166:904–912, 2013.
48. Boon A, Cheriex E, Lodder J, Kessels F. Car-
diac valve calcification: characteristics of pa-
tients with calcification of the mitral annulus
or aortic valve, Heart 78:472–474, 1997.
49. Kalra K, Wang Q, McIver BV, et al. Temporal
changes in interpapillary muscle dynamics as
an active indicator of mitral valve and left
ventricular interaction in ischemic mitral re-
gurgitation, J Am Coll Cardiol 64:1867–1879,
2014.
50. Otsuji Y, Levine RA, Takeuchi M, et al.
Mechanism of ischemic mitral regurgitation,
J Cardiol 51:145–156, 2008.
51. Kumanohoso T, Otsuji Y, Yoshifuku S, et al.
Mechanism of higher incidence of ischemic
mitral regurgitation in patients with inferior
myocardial infarction: quantitative analysis
of left ventricular and mitral valve geometry
in 103 patients with prior myocardial infarc-
tion, J Thorac Cardiovasc Surg 125:135–143,
2003.
52. Song JM, Qin JX, Kongsaerepong V, et al.
Determinants of ischemic mitral regurgita-
tion in patients with chronic anterior wall
myocardial infarction: a real time three-di-
mensional echocardiography study, Echocar-
diography 23:650–657, 2006.
53. Daimon M, Saracino G, Gillinov AM, et al.
Local dysfunction and asymmetrical defor-
mation of mitral annular geometry in isch-
emic mitral regurgitation: a novel computer-
ized 3D echocardiographic analysis, Echocar-
diography 25:414–423, 2008.
54. Vergnat M, Jassar AS, Jackson BM, et al.
Ischemic mitral regurgitation: a quantitative
three-dimensional echocardiographic analy-
sis, Ann Thorac Surg 91:157–164, 2011.
55. Pierard LA, Carabello BA. Ischaemic mitral
regurgitation: pathophysiology, outcomes
and the conundrum of treatment, Eur Heart
J 31:2996–3005, 2010.
56. Silbiger JJ. Mechanistic insights into ischemic
mitral regurgitation: echocardiographic and
surgical implications, J Am Soc Echocardiogr
24:707–719, 2011.
57. Kron IL, Hung J, Overbey JR, et al. Predicting
recurrent mitral regurgitation after mitral
valve repair for severe ischemic mitral regur-
gitation, J Thorac Cardiovasc Surg 149:752–
761, 2015.
58. Lee AP, Acker M, Kubo SH, et al. Mechanisms
of recurrent functional mitral regurgitation
after mitral valve repair in nonischemic di-
lated cardiomyopathy: importance of distal
anterior leaflet tethering, Circulation
119:2606–2614, 2009.
59. Nagasaki M, Nishimura S, Ohtaki E, et al. The
echocardiographic determinants of func-
tional mitral regurgitation differ in ischemic
and non-ischemic cardiomyopathy, Int J
Cardiol 108:171–176, 2006.
60. Acker MA, Parides MK, Perrault LP, et al.
Mitral-valve repair versus replacement for
severe ischemic mitral regurgitation, N Engl J
Med 370:23–32, 2013.
61. Smith PK, Puskas JD, Ascheim DD, et al.
Surgical treatment of moderate ischemic mi-
tral regurgitation, N Engl J Med 371:2178–
2188, 2014.
62. Velazquez EJ, Lee KL, O’Connor CM, et al.
The rationale and design of the Surgical
Treatment for Ischemic Heart Failure
(STICH) trial, J Thorac Cardiovasc Surg
134:1540–1547, 2007.
63. Wrobel K, Stevens SR, Jones RH, et al. Influ-
ence of baseline characteristics, operative
conduct, and postoperative course on 30-day
outcomes of coronary artery bypass grafting
among patients with left ventricular dysfunc-
tion: results from the Surgical Treatment for
Ischemic Heart Failure (STICH) Trial, Circu-
lation 132:720–730, 2015.
64. van Garsse L, Gelsomino S, Luca F, et al. Im-
portance of anterior leaflet tethering in pre-
dicting recurrence of ischemic mitral regurgi-
tation after restrictive annuloplasty, J Thorac
Cardiovasc Surg 143(4 Suppl):S54–59, 2012.
ch19.indd 466
03.04.2019 11:55:41
467
19 Чреспищеводная эхокардиография во время реконструкции клапана при митральной регургитации
65. Kongsaerepong V, Shiota M, Gillinov AM, et
al. Echocardiographic predictors of successful
versus unsuccessful mitral valve repair in
ischemic mitral regurgitation, Am J Cardiol
98:504–508, 2006.
66. Hensley N, Dietrich J, Nyhan D, et al. Hyper-
trophic cardiomyopathy: a review, Anesth
Analg 120:554–569, 2015.
67. Gersh BJ, Maron BJ, Bonow RO, et al. 2011
ACCF/AHA guideline for the diagnosis and
treatment of hypertrophic cardiomyopathy: a
report of the American College of Cardiology
Foundation/American Heart Association
Task Force on Practice Guidelines, J Am Coll
Cardiol 58:e212–260, 2011.
68. Patel P, Dhillon A, Popovic ZB, et al. Left
ventricular outflow tract obstruction in hy-
pertrophic cardiomyopathy patients without
severe septal hypertrophy: implications of
mitral valve and papillary muscle abnormali-
ties assessed using cardiac magnetic resonance
and echocardiography, Circ Cardiovasc Imag-
ing 8:e003132, 2015.
69. Elliott PM, Anastasakis A, Borger MA, et al.
2014 ESC Guidelines on diagnosis and man-
agement of hypertrophic cardiomyopathy:
the Task Force for the Diagnosis and Manage-
ment of Hypertrophic Cardiomyopathy of
the European Society of Cardiology, Eur
Heart J 35:2733–2779, 2014.
70. Mahmood F, Hess PE, Matyal R, et al. Echo-
cardiographic anatomy of the mitral valve: a
critical appraisal of 2-dimensional imaging
protocols with a 3-dimensional perspective, J
Cardiothorac Vasc Anesth 26:777–784, 2012.
71. Lang RM, Badano LP, Tsang W, et al. EAE/
ASE recommendations for image acquisition
and display using three-dimensional echocar-
diography, J Am Soc Echocardiogr 25:3–46,
2012.
72. Mahmood F, Warraich HJ, Shahul S, et al.
Technical communication: en face view of
the mitral valve: definition and acquisition,
Anesth Analg 115:779–784, 2012.
73. Hymel BJ, Townsley MM. Echocardiographic
assessment of systolic anterior motion of the
mitral valve, Anesth Analg 118:1197–1201,
2014.
74. Carpentier A, Adams DH, Filsoufi F, editors.
Valve exposure, intraoperative valve analysis,
and reconstruction, Carpentier’s reconstruc-
tive valve surgery. From valve analysis to
valve reconstructionSt Louis, 2010, Saunders
Elsevier.
75. Braunberger E, Deloche A, Berrebi A, et al.
Very long-term results (more than 20 years)
of valve repair with Carpentier’s techniques
in nonrheumatic mitral valve insufficiency,
Circulation 104(12 Suppl 1):I8–I11, 2001.
76. Perier P, Hohenberger W, Lakew F, et al.
Toward a new paradigm for the reconstruc-
tion of posterior leaflet prolapse: midterm
results of the “respect rather than resect” ap-
proach, Ann Thorac Surg 86:718–725, 2008.
77. Adams DH, Rosenhek R, Falk V. Degenera-
tive mitral valve regurgitation: best practice
revolution, Eur Heart J 31:1958–1966, 2010.
78. David TE, Armstrong S, McCrindle BW,
Manlhiot C. Late outcomes of mitral valve
repair for mitral regurgitation due to degen-
erative disease, Circulation 127:1485–1492,
2013.
79. Seeburger J, Falk V, Borger MA, et al. Chor-
dae replacement versus resection for repair of
isolated posterior mitral leaflet prolapse: a
egalite, Ann Thorac Surg 87:1715–1720, 2009.
80. Papadopoulos N, Steuer K, Doss M, et al. Is
removal of calcium bar during mitral valve
surgery safe? Long-term clinical outcome of
109 consecutive patients, J Cardiovasc Surg
56:473–482, 2015.
81. Bouma W, Wijdh-den Hamer IJ, Koene BM,
et al. Predictors of in-hospital mortality after
mitral valve surgery for post-myocardial in-
farction papillary muscle rupture, J Cardio-
thorac Surg 9:171, 2014.
82. Fasol R, Lakew F, Wetter S. Mitral repair in
patients with a ruptured papillary muscle, Am
Heart J 139:549–554, 2000.
83. Magne J, Senechal M, Dumesnil JG, Pibarot
P. Ischemic mitral regurgitation: a complex
multifaceted disease, Cardiology 112:244–259,
2009.
84. Fattouch K, Lancellotti P, Castrovinci S, et al.
Papillary muscle relocation in conjunction
with valve annuloplasty improve repair re-
sults in severe ischemic mitral regurgitation, J
Thorac Cardiovasc Surg 143:1352–1355, 2012.
85. Fattouch K, Castrovinci S, Murana G, et al.
Papillary muscle relocation and mitral annu-
loplasty in ischemic mitral valve regurgita-
tion: midterm results, J Thorac Cardiovasc
Surg 148:1947–1950, 2014.
86. Calafiore AM, Refaie R, Iaco AL, et al.
Chordal cutting in ischemic mitral regurgita-
tion: a propensity-matched study, J Thorac
Cardiovasc Surg 148:41–46, 2014.
87. Meyer MA, von Segesser LK, Hurni M, et al.
Long-term outcome after mitral valve repair:
a risk factor analysis, Eur J Cardiothorac Surg
32:301–307, 2007.
88. Suri RM, Schaff HV, Dearani JA, et al. Sur-
vival advantage and improved durability of
mitral repair for leaflet prolapse subsets in the
current era, Ann Thorac Surg 82:819–826,
2006.
89. Riegel AK, Busch R, Segal S, et al. Evaluation
of transmitral pressure gradients in the intra-
operative echocardiographic diagnosis of
mitral stenosis after mitral valve repair, PLoS
One 6:e26559, 2011.
90. Kuperstein R, Spiegelstein D, Rotem G, et al.
Late clinical outcome of transient intraopera-
tive systolic anterior motion post mitral valve
repair, J Thorac Cardiovasc Surg 149:471–476,
2015.
91. Varghese R, Anyanwu AC, Itagaki S, et al.
Management of systolic anterior motion after
mitral valve repair: an algorithm, J Thorac
Cardiovasc Surg 143(Suppl 4):S2–7, 2012.
92. Ibrahim M, Rao C, Ashrafian H, et al. Mod-
ern management of systolic anterior motion
of the mitral valve, Eur J Cardiothorac Surg
41:1260–1270, 2012.
93. Hsuan CF, Yu HY, Tseng WK, et al. Quantita-
tion of the mitral tetrahedron in patients with
ischemic heart disease using real-time three-
dimensional echocardiography to evaluate
the geometric determinants of ischemic mi-
tral regurgitation, Clin Cardiol 36:286–292,
2013.
ch19.indd 467
03.04.2019 11:55:41
ch19.indd 468
03.04.2019 11:55:42
464
ЧАСТЬ IV Пороки клапанов сердца
Метод
визуализации/
оценка
Позиция
Применимость
Примечания
Визуализация анато-
мии клапана в
2D-режиме + цве-
товая допплерогра-
фия
По длинной оси
из среднего от-
дела пищевода
Переднезадний размер
Сегменты A2 и P2 и поверхность сопо-
ставления
Пролапс и молотящая створка; высота
пролапса
Дизъюнкция фиброзного кольца
митрального клапана
Прогностические факторы риска пара-
доксального систолического движения
передней створки митрального клапана
(см. рис. 19.13)
Количественная оценка подтягивания
створок (см. рис. 19.15)
Направление струи регургитации
Ширина vena contracta
Радиус PISA
Трудно быть уверенным в точном рас-
положении плоскости сканирования
(см. рис. 19.6). Для решения этой про-
блемы используйте осевую визуализа-
цию, которая обеспечивает прохожде-
ние плоскости изображения через пе-
реднезаднюю ось и пересечение
поверхности сопоставления сегментов
A2иP2
Комиссуральная
из среднего от-
дела пищевода
Комиссуральный размер
Сегменты A1 и P1, A3 и P3 и поверхно-
сти их сопоставления
Направление струи регургитации
Осевая визуализация обеспечивает про-
хождение плоскости изображения че-
рез переднезаднюю ось и пересечение
поверхности сопоставления сегментов
A1иP1,A3иP3
Четырехкамерная
из среднего от-
дела пищевода
Морфология створок митрального кла-
пана и направление струи митральной
регургитации
Функция ПЖ, размер фиброзного кольца
трикуспидального клапана и степень
трикуспидальной регургитации)
Изображение располагается под углом
к оси клапана. Избегайте измерения в
этой позиции створок митрального
клапана и размера фиброзного кольца
митрального клапана
Двухкамерная из
среднего отдела
пищевода
Морфология створок митрального кла-
пана и направление струи МР
Как для четырехкамерной позиции
из среднего отдела пищевода
Трансгастральная
двухкамерная
Оценка подклапанного аппарата
Трансгастральная
пятикамерная и
по длинной оси
Оценка после пластики динамической
обструкции выходного тракта ЛЖ с не-
прерывно-волновой допплерографией
Важно обеспечить выравнивание уль-
тразвукового луча относительно кро-
вотока в выходном тракте ЛЖ
Визуализация
анатомии клапана
в 3D-режиме + цве-
товая допплерогра-
фия
Позиция ЛП
Идентификация анатомической локали-
зации поражения клапана (пролапс,
молотящая створка, вегетации, перфо-
рации, щель, кальцификация)
и струи регургитации
Площадь vena contracta
В качестве исходных используйте изо-
бражения в позиции по длинной оси
и комиссуральной позиции из средне-
го отдела пищевода (см. рис. 19.8). Для
облегчения ориентирования нужно
визуализировать ушко ЛП и AК (АК
должен быть на 12 часах условного
циферблата)
Близкая обрезка по предсердной по-
верхности с цветовой допплерографи-
ей позволяет определить струю регур-
гитации
Позиция ЛЖ
Идентификация перфораций, затенен-
ных вегетациями при оценке в позиции
ЛП
АК должен быть на 12 часах условного
циферблата
Количественная
оценка в
3D-режиме (МПР)
По длинной оси
из среднего от-
дела пищевода
(осевая)
Как по длинной оси из среднего отдела
пищевода
Осевая визуализация обеспечивает про-
хождение плоскости изображения че-
рез переднезаднюю ось и пересечение
поверхности сопоставления сегментов
A2иP2
Сбор и анализ данных см. рис. 19.8–
19.10
СВОДНАЯ ИНФОРМАЦИЯ
Хирургическая пластика митрального клапана
ch19.indd 464
03.04.2019 11:55:41
469
Транскатетерная пластика
митрального клапана
ERNESTO E. SALCEDO, MD • ROBERT A. QUAIFE, MD • MICHAEL S. KIM, MD • JOHN D. CARROLL, MD
Транскатетерные методы лечения
митральной регургитации
Краткий обзор
Транскатетерная пластика митрального
клапана методом «край в край»
Использование эхокардиографии
при отборе пациентов
Определение этиологии
митральной регургитации
Дегенеративная митральная регургитация
Функциональная митральная
регургитация
Смешанная митральная регургитация
Определение степени митральной
регургитации
Умеренно тяжелая митральная
регургитация
Тяжелая митральная регургитация
Эхокардиографические критерии
возможности выполнения
транскатетерной пластики
митрального клапана методом
«край в край»
Контроль во время вмешательства
Пункция межпредсердной перегородки
Продвижение системы MitraClip
в левое предсердие
Управление доставляющим катетером
и системой доставки
Выравнивание клипсы
Продвижение клипсы в левый желудочек
Захват створок
Высвобождение клипсы и оценка
остаточной митральной регургитации
Рекомендации по размещению
дополнительных клипс
Извлечение доставляющего катетера
Исследование ятрогенного дефекта
межпредсердной перегородки
Оценка возможных осложнений
Оценка результатов
Альтернативные методы визуализации
Последние достижения
и перспективы
20
Несмотря на снижение частоты ревматических по-
роков сердца, распространенность митральной ре-
гургитации (МР) увеличивается, и по мере старения
населения эта тенденция сохранится [1, 2]. Кардио-
хирургия занимает центральное место в лечении
пациентов с прогрессирующими клапанными по-
роками сердца, но в некоторых случаях вместо от-
крытых операций выполняют транскатетерные или
гибридные вмешательства [3–5].
В руководстве American Heart Association/Ameri-
can College of Cardiology (AHA/ACC) по лечению
клапанных пороков сердца 2014 г. и руководстве Eu-
ropean Society of Cardiology (ESC) по тактике веде-
ния пациентов с клапанными пороками сердца
2012 г. подробно описаны вмешательства, показан-
ные пациентам с симптомной тяжелой МР, включая
рекомендации по хирургическому протезированию
митрального клапана, хирургической и транскате-
терной пластике митрального клапана [6, 7]. При
сравнении транскатетерной и хирургической пла-
стики митрального клапана в лечении тяжелой МР
не было выявлено ухудшения результатов в случае
использования системы MitraClip (Abbott Vascular,
Santa Cla ra, CA) при лечении симптомной тяжелой
МР по сравнению со стандартной хирургической
операцией на клапанах [8].
В согласительных документах Mitral Valve Aca-
demic Research Consortium были приняты принци-
пы и дизайн клинических испытаний и определе-
ния ожидаемых результатов для транскатетерной
пластики и протезирования митрального клапана, а
также было отмечено, что эхокардиография (ЭхоКГ)
является основным методом определения причины,
механизма и степени МР и влияния ее на структуры
и функцию сердца [11, 12].
В этой главе рассмотрена роль эхокардиографии
при отборе пациентов, контроле во время вмеша-
тельства и оценке его результатов у пациентов с МР.
ТРАНСКАТЕТЕРНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
КРАТКИЙ ОБЗОР
У пациентов с высоким оперативным риском или
наличием противопоказаний к операции альтерна-
тивным методом хирургической пластике или про-
тезированию стала транскатетерная пластика и про-
тезирование митрального клапана [9, 10]. Разрабо-
ch20.indd 469
03.04.2019 11:55:55
470
ЧАСТЬ IV Пороки клапанов сердца
тано несколько техник транскатетерной пластики
митрального клапана для каждого компонента под-
клапанного аппарата (рис. 20.1) [13–15]. Каждая
техника адаптирована к лечению различной пато-
логии митрального клапана. Недавно получены со-
общения о первом опыте транскатетерного проте-
зирования митрального клапана [16]. Для успешно-
го проведения таких вмешательств крайне важны
точная оценка морфологии и функции митрально-
го клапана. ЭхоКГ играет ключевую роль при отбо-
ре пациентов, контроле во время вмешательства и
оценке немедленных и долгосрочных результатов
[3, 4].
В настоящее время также разработана техника
транскатетерного протезирования митрального
клапана, а также новые подходы к транскатетерной
пластике митрального клапана, но они в основном
находятся на этапе исследований [13], поэтому в
этой главе основное внимание уделяется транскате-
терной пластике методом «край в край» (рис. 20.2).
Значительная часть знаний и опыта, полученных
при отборе пациентов, контроле во время вмеша-
тельства и оценке результатов транскатетерной пла-
стики методом «край в край», можно применить к
новым техникам по мере их внедрения в клиниче-
скую практику.
Транскатетерная пластика митрального клапа-
на — это общее название различных техник. Систе-
ма MitraClip — основное устройство, которое ис-
пользуют при транскатетерной пластике митраль-
ного клапана методом «край в край». Это устройство
одобрено FDA и получило знак соответствия евро-
пейским стандартам (CE Mark).
ТРАНСКАТЕТЕРНАЯ ПЛАСТИКА МИТРАЛЬНОГО КЛАПАНА
МЕТОДОМ «КРАЙ В КРАЙ»
Из всех доступных техник транскатетерной пласти-
ки митрального клапана наибольшее распростране-
ние получила пластика митрального клапана мето-
дом «край в край». На сегодняшний день большая
часть пациентов, подвергшихся транскатетерному
вмешательству, были оперированы этим методом.
К 2015 г. более 25 000 пациентам во всем мире бы-
ло проведено лечение с помощью системы Mitra-
Clip. Впервые вмешательство было выполнено в Ве-
несуэле в июне 2003 г., в июле 2003 г. доктор Ted
Feldman провел это вмешательство в США, в Евро-
пе первым его выполнил доктор Olaf Franzen в сен-
тябре 2008 г.
В ходе нескольких американских и международ-
ных проспективных клинических испытаний и ре-
гистровых исследований (табл. 20.1) было проде-
монстрировано, что у пациентов с высоким хирур-
гическим риском вмешательства на митральном
клапане транскатетерная пластика митрального
клапана методом «край в край» выполнима, безо-
пасна и эффективна в плане снижения степени МР
с последующим уменьшением клинической сим-
птоматики, снижением частоты госпитализаций по
поводу сердечной недостаточности, улучшением
качества жизни и значительным ремоделированием
левого желудочка (ЛЖ) [10, 17–34]. ЭхоКГ играет
центральную роль при отборе пациентов, контроле
во время вмешательства и оценке немедленных и
долгосрочных результатов [26, 29, 35–40].
ИСПОЛЬЗОВАНИЕ ЭХОКАРДИОГРАФИИ
ПРИ ОТБОРЕ ПАЦИЕНТОВ
У пациентов с умеренно тяжелой (3+) или тяжелой
(4+) дегенеративной МР, а также с высоким и чрез-
мерным хирургическим риском эффективной бу-
дет, вероятнее всего, транскатетерная пластика ми-
трального клапана. При МР в качестве метода визу-
ализации первого выбора рекомендуется двухмерная
(2D) трансторакальная эхокардиография (ТТЭхоКГ),
которой часто бывает достаточно для постановки
диагноза и определения причины и степени МР.
Двухмерную чреспищеводную эхокардиографию
(ЧПЭхоКГ) используют для подробного изучения
морфологии створок митрального клапана и пла-
нирования вмешательства. Трехмерная (3D) ЧПЭ-
хоКГ предоставляет анатомически наглядные изо-
бражения створок митрального клапана и помогает
обосновать выполнение транскатетерной пластики
митрального клапана.
Помимо изучения морфологии и функции ми-
трального клапана, ЭхоКГ также используют для
количественной оценки размеров, объема и фрак-
ции выброса ЛЖ. Для оценки объема и фракции
выброса ЛЖ рекомендуется бипланарный метод
дисков Симпсона при 2D-ТТЭхоКГ [41].
Транскатетерная пластика митрального клапана
методом «край в край» противопоказана пациентам
с активным инфекционным эндокардитом, ревма-
тическим пороком, малым фиброзным кольцом ми-
трального клапана или наличием внутрисердечного
тромба. ЭхоКГ помогает исключить все эти состоя-
ния. Неблагоприятное влияние на результаты транс-
катетерной пластики митрального клапана методом
«край в край» могут оказать следующие патологи-
ческие изменения: массивная кальцификация фи-
брозного кольца митрального клапана, щели ми-
трального клапана, чрезмерная длина или ширина
молотящей створки, а также недостаточная глубина
и протяженность зоны коаптации створок (рис.
20.3). ЧПЭхоКГ позволяет лучше всего определить
локализацию струи регургитации относительно
сегментов A1–A3 и P1–P3.
ОПРЕДЕЛЕНИЕ ЭТИОЛОГИИ
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
В ходе большинства исследований, посвященных
транскатетерной пластике митрального клапана,
ch20.indd 470
03.04.2019 11:55:55
471
20 Транскатетерная пластика митрального клапана
Рис. 20.1 Транскатетерная пластика митрального клапана. В настоящее время наиболее распространенным вмешательством является транскатетерная
пластика митрального клапана методом «край в край» с помощью системы MitraClip. Во время транскатетерной пластики воздействуют на все компоненты под-
клапанного аппарата митрального клапана: на створки — система MitraClip (Abbott Laboratories, Abbott Park, IL , USA) (А); на левый желудочек — система iCoapsys
(Myocor Inc., M inneapolis, MN, USA) (больше не используют) (Б); на сухожильные хорды — NeoChord DS 1000 (NeoChord Inc., M inneapolis, MN, USA) (В); на фи-
брозное кольцо — Carillon Mitral Contour System (Cardiac Dimensions Inc., Kirkland, WA, USA) (Г). БСВ — большая вена сердца.
Створки
Сухожильные хорды
Зажим
Доставляющий
катетер
Удлиненный кончик
захваченной створки
Нити для восстановления
сухожильной хорды
Плечико
Передняя
подушка
Дистальный
фиксатор в БВС
Зажимные
канюли
Проксимальный
фиксатор в КС
Доставляющий
катетер
Задние
подушки
Аннулярная
П
о
д
к
л
а
п
а
н
н
а
я
с
т
р
у
н
а
Фиброзное кольцо
Левый желудочек
Л
е
н
т
о
ч
н
ы
й
с
о
е
д
и
н
и
тель
Папиллярная
А
Б
В
Г
было принято подразделять МР на дегенеративную,
или первичную (органическую, структурную), т.е .
истинный порок клапана, и функциональную, или
вторичную (без структурных нарушений митраль-
ного клапана. Функциональная МР развивается в
результате ишемической болезни сердца или дила-
тационной кардиомиопатии.
Важно отличать функциональную МР от дегене-
ративной МР, поскольку для каждой из них есть
четкие эхокардиографические критерии отбора па-
циентов для транскатетерной пластики митрально-
го клапана (см. рис. 20.3) и небольшие различия при
определении степени МР.
ДЕГЕНЕРАТИВНАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Дегенеративный порок митрального клапана наи-
более часто обусловливает необходимость опера-
тивного лечения МР [42]. В ходе большинства ис-
ch20.indd 471
03.04.2019 11:55:55
472
ЧАСТЬ IV Пороки клапанов сердца
Доставляющий
катетер
Створка митрального
клапана
Зажим
Плечико
ЛЖ
Овальная
ямка
следований транскатетерной пластики митрального
клапана дегенеративная МР была основной патоло-
гией митрального клапана. Существует несколько
форм дегенеративной МР, диагностируемых с по-
мощью ЭхоКГ [43, 44]: от легкого пролапса одного
сегмента митрального клапана (как правило, при
фиброэластическом дефиците) до выраженного
пролапса нескольких сегментов при болезни Барлоу
и отрыва сухожильных хорд с флотацией сегмента
створки (рис. 20.4). В идеальной ситуации струя ре-
гургитации должна быть центральной (пролапс сег-
ментов A2/P2), но транскатетерную пластику ми-
трального клапана методом «край в край» можно
выполнить и у пациентов с пролапсом или флота-
цией любого сегмента, только увеличивается веро-
ятность запутывания системы доставки клипсы в
подклапанном аппарате.
ФУНКЦИОНАЛЬНАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Оптимальный подход к лечению функциональной
МР не определен, но растет интерес к применению
в этих случаях транскатетерной пластики митраль-
ного клапана. У пациентов с ишемической и неише-
мической функциональной МР створки обычно
структурно не изменены, МР обусловлена наруше-
нием их коаптации (рис. 20.5) вследствие подтяги-
вания створок, формирования так называемого
«тента» или дилатации фиброзного кольца ми-
трального клапана. У некоторых пациентов задняя
створка из-за ограниченной подвижности остается
в полуоткрытом положении на протяжении всего
сердечного цикла, а передняя створка во время си-
столы пролабирует. Ограниченную подвижность
задней створки во время систолы, наблюдаемую
при функциональной МР, нужно отличать от пора-
жения клапана при карциноиде, системной красной
волчанке и ревматической болезни, при которой,
помимо ограниченной подвижности створки во
время систолы и диастолы, обычно наблюдается
утолщение створок, главным образом на кончиках
свободных краев, утолщение сухожильных хорд и
сращение комиссур (важный признак ревматиче-
ского поражения).
СМЕШАННАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
У некоторых пациентов МР может быть смешанной
в результате комбинации дегенеративных и функ-
циональных поражений. Например, развитие у па-
циента с пролапсом митрального клапана (рис. 20.6)
инфаркта миокарда или дилатации и дисфункции
ЛЖ служит дополнительным компонентом МР.
Тем не менее всегда следует попытаться определить,
Рис. 20.2 Система MitraClip. Система MitraClip с доставляющим катетером, введенным в ЛП через межпредсердную перегородку в области овальной ямки, и
клипса с открытыми плечиками в левом желудочке (ЛЖ) около свободных краев створок митрального клапана.
ch20.indd 472
03.04.2019 11:55:56
473
20 Транскатетерная пластика митрального клапана
Название
Описание
Результаты
Эхокардиографические
параметры
EVEREST I (США,
2003–2006, n = 55)
[30]
Предварительная оценка безопасности
и эффективности применения
системы MitraClip в лечении хрониче-
ской умеренно тяжелой (3+) или
тяжелой (4+) МР
ТПМК методом «край в край» безо-
пасно выполнима с достижением
в течение 6 мес значительного
снижения степени МР у большин-
ства пациентов
Степень МР 3+ или 4+,
ПОМК>4см2,ФВ>
30%,КСРЛЖ<55мм
Анатомия митрального
клапана, подходящая
для имплантации
системы MitraClip
EVEREST II RCT
(США, 2005–2008,
n = 279) [10,
31–33]
Рандомизированное контролируемое
исследование, в ходе которого сравни-
вали снижение степени МР после
установки системы MitraClip во время
стандартной операции на митральном
клапане. Изучали как дегенеративную,
так и функциональную МР
ТПМК была менее эффективна в
плане уменьшения МР, чем стан-
дартная операция, но имела пре-
восходную безопасность и схожие
результаты
Степень МР 3+ или 4+,
ПОМК>4см2,ФВ>
30%,КСРЛЖ<55мм
Анатомия митрального
клапана, подходящая
для имплантации
системы MitraClip
EVEREST II HRR
(США, 2007–2008,
n=78)[50]
Регистровое исследование пациентов
с высоким хирургическим риском.
Изучали как дегенеративную, так
и функциональную МР
Установка системы MitraClip
привела к значительному сниже-
нию степени МР, клинических
проявлений и уменьшению ЛЖ
в течение 12 мес у пациентов
с высоким хирургическим риском
Степень МР 3+ или 4+,
ПОМК>4см2,ФВ>
30%,КСРЛЖ<55мм
Анатомия митрального
клапана, подходящая
для имплантации
системы MitraClip
REALISM HR
(США, 2009–2013)
[58]
Оценка результатов ТПМК у пациентов
с тяжелой дегенеративной МР и
высоким хирургическим риском
ТПМК у пациентов с высоким
хирургическим риском безопасно
и обеспечивает хорошие клиниче-
ские результаты, включая сниже-
ние частоты повторной госпита-
лизации, функциональные улуч-
шения и благоприятное ремодели-
рование ЛЖ в течение 1 года
Для отбора пациентов
для ТПМК использо-
вали ТТЭхоКГ и
ЧПЭхоКГ
ACCESS-EU (США,
2009,Iэтапn=
567,IIэтапn=
280) [22, 24]
Европейское проспективное многоцен-
тровое нерандомизированное постре-
гистрационное исследование ранних и
среднесрочных результатов лечения с
помощью установки системы
MitraClip
Пациенты, перенесшие вмешатель-
ство по установке системы
MitraClip, — пожилые люди из
группы высокого риска, в основ-
ном с функциональной МР.
В этой группе использование
системы MitraClip эффективно
с низкими показателями внутри-
больничной летальности и небла-
гоприятных событий
Для отбора пациентов
использовали
ТТЭхоКГ и ЧПЭхоКГ
RESHAPE-HF
(Европа, 2016, n =
800) [58a]
Рандомизация между установкой
системы MitraClip и лекарственной
терапией
Проводят в настоящее время
Функциональная МР
COAPT (США,
2012–2018, n =
420) [59]
Рандомизация между установкой
системы MitraClip и лекарственной
терапией
Проводят в настоящее время
Функциональная МР
TRAMI Registry
(Германия, 2010–
2013, n = 1064)
[21, 60, 61]
Многоцентровое национальное реги-
стровое исследование ТПМК
Пациенты, перенесшие вмешатель-
ство по установке системы
MitraClip, — в основном пожилые
люди со значительными сопут-
ствующими заболеваниями и
высоким или неприемлемым
хирургическим риском. У боль-
шинства пациентов отмечалась
вторичная МР, у многих ФВЛЖ
была сниженной
Функциональная МР
(≈ 70% пациентов) и
дегенеративная МР
ТАБЛИЦА 20.1 Клинические испытания и регистровые исследования применения системы MitraClip
ch20.indd 473
03.04.2019 11:55:56
474
ЧАСТЬ IV Пороки клапанов сердца
Название
Описание
Результаты
Эхокардиографические
параметры
GRASP-IT (Италия,
2013, 2015,
n = 117) [25, 62]
Отчет о результатах ТПМК с помощью
системы MitraClip у пациентов с МР ≥
3+ и высоким риском для стандарт-
ного хирургического лечения
ТПМК с помощью системы
MitraClip безопасна и имела уме-
ренную эффективность
Первичной конечной
точкой было отсут-
ствие летального
исхода, операции по
поводу дисфункции
митрального клапана
илиМР≥3+через30
сути1год
TVTSPR (Европа,
2011–2012,
n = 628) [18]
Независимое международное регистро-
вое исследование
ТПМК ассоциируется с хорошими
немедленными результатами,
низкими показателями осложне-
ний и устойчивым снижением
в течение 1 года степени МР и
клинических симптомов
ЭхоКГ: КДО ЛЖ, КСО
ЛЖ, объем ЛП, ФВ,
степень МР, количе-
ственная оценка МР,
средний трансми-
тральный градиент
давления, СДЛА
MARS (Азиатско-
Тихоокеанский
регион, 2011–2013,
n = 142) [17]
Азиатско-Тихоокеанское регистровое
исследование установки системы
MitraClip включает данные 8 центров
из 5 стран Азиатско-Тихоокеанского
региона
ТПМК с помощью системы
MitraClip эффективна в плане
уменьшения МР и демонстрирует
благоприятные краткосрочные
результаты
У 53,5% (n = 76) паци-
ентов была функцио-
нальная МР, у 45,8%
(n = 65) — дегенера-
тивная МР, у 0,7%
(n = 1) — смешанная
МР
MITRA_FR
(Франция, 2015,
n = 288) [34]
Рандомизированное контролируемое
национальное исследование по оценке
эффективности и безопасности уста-
новки системы MitraClip и только
оптимальной лекарственной терапии
(контрольная группа) у пациентов с
симптомной вторичной тяжелой МР
Проводят в настоящее время
Функциональная МР
STS-ACC TVT
Registry (США)
[62a]
Проспективное регистровое исследова-
ние с участием всех пациентов, пере-
несших лечение с помощью уста-
новки системы MitraClip после его
одобрения FDA для лечения пациен-
тов с дегенеративной МР и высоким
хирургическим риском
Проводят в настоящее время.
В первоначальном отчете о
первых 564 пациентах (средний
возраст — 83 года) благоприят-
ный результат наблюдался в 92%
случаях, внутрибольничная
летальность составила 2,3%
У большинства пациен-
тов (86%) с дегенера-
тивной МР.
Уменьшение МР до 2+
или менее отмечалось
у 93% пациентов
FDA — Food and Drug Administration; КДО — конечно-диастолический объем; КСО — конечно-систолический объем; КСР — конечно -си-
столический размер; ЛЖ — левый желудочек; МР — митральная регургитация; ПОМК — площадь отверстия митрального клапана;
СДЛА — систолическое давление в легочной артерии; ТПМК — транскатетерная пластика митрального клапана; ТТЭхоКГ — трансто-
ракальная эхокардиография; ФВ — фракция выброса; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 20.1
окончание
Клинические испытания и регистровые исследования применения системы MitraClip
чем обусловлен преобладающий тип МР: первич-
ным или вторичным поражением митрального кла-
пана.
ОПРЕДЕЛЕНИЕ СТЕПЕНИ
МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
Точное количественное определение степени МР
имеет важное значение при отборе пациентов для
транскатетерной пластики митрального клапана.
Foster и соавт. [39] опубликовали данные ЭхоКГ, по-
лученные в ходе первых операций с использовани-
ем системы MitraClip, и описали систематический и
интегративный подход к анализу степени МР на мо-
мент включения в исследование и при последую-
щем наблюдении, включая количественные показа-
тели.
Анализ показал возможность введения система-
тического стандартизованного эхокардиографиче-
ского протокола для оценки критериев включения
в многоцентровое клиническое исследование и эф-
фективности уменьшения МР. Такой подход стал
ch20.indd 474
03.04.2019 11:55:56
475
20 Транскатетерная пластика митрального клапана
Рис. 20.3 Морфологические критерии отбора пациентов для пластики митрального клапана методом «край в край» при дегенеративной и функ-
циональной митральной регургитации. (А) У пациентов с дегенеративной митральной регургитацией морфологические критерии отбора включают длину мо-
лотящей створки < 10 мм и ширину молотящей створки < 15 мм. (Б) У пациентов с функциональной митральной регургитацией длина зоны коаптации створок
должна быть 2 мм или более, а глубина — < 11 мм. Эти значения обусловлены длиной плечика клипсы и глубиной проникновения доставляющего катетера.
Длина < 10 мм
Ширина < 15 мм
Длина зоны
коаптации ≥ 2 мм
Глубина зоны
коаптации < 11 мм
А
Б
стандартом для последующих исследований и под-
черкнул ключевую роль ЭхоКГ в наблюдении паци-
ентов, которым выполняли транскатетерную пла-
стику митрального клапана. В результате пришли к
общему мнению, что необходимым условием для
отбора пациента в качестве кандидата на проведе-
ние транскатетерной пластики митрального клапа-
на является умеренно тяжелая (3+) или тяжелая (4+)
МР. American Association of Echocardiography и Eu-
ropean Association of Cardiovascular Imaging опубли-
ковали руководства и рекомендации по оценке сте-
пени МР [45, 46]. В этих руководствах, а также в не-
скольких обзорных статьях [47, 48] подчеркивается
интегративный и комплексный подход, включаю-
щий множество количественных параметров для
оценки МР: качественные данные (морфология ми-
ch20.indd 475
03.04.2019 11:55:56
476
ЧАСТЬ IV Пороки клапанов сердца
А
1
2
3
Б
1
2
В
трального клапана, размер и форма струи регурги-
тации при цветовом допплеровском картировании
кровотока, характеристики струи регургитации при
спектральной допплерографии), полуколичествен-
ные параметры (ширина vena contracta, характери-
стики кровотока в легочных венах и скорости ми-
трального кровотока) и количественные параметры
(эффективная площадь отверстия регургитации,
объем регургитации). Оценка объема ЛЖ и ФВЛЖ,
а также систолического давления в легочной арте-
рии предоставляют дополнительную информацию.
Первоначальную оценку степени МР следует вы-
полнять с помощью ТТЭхоКГ пациенту в клиниче-
ски стабильном и бодрствующем состоянии, по-
скольку седация и общая анестезия могут повлиять
на степень регургитации, т.к. изменяют условия на-
грузки. Также очень важно во время ТТЭхоКГ реги-
стрировать артериальное давление и учитывать сте-
пень МР в зависимости от этого показателя.
УМЕРЕННО ТЯЖЕЛАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
У пациентов с умеренно тяжелой МР (3+) при цве-
товом допплеровском картировании кровотока от-
мечаются средний размер струи регургитации (створ-
ки клапана могут быть патологически изменены),
средний размер зоны конвергенции потока, плот-
ный и параболический сигнал от струи регургита-
ции при непрерывно-волновой допплерографии,
средняя ширина vena contracta, систолическое при-
тупление кровотока в легочной вене, эффективная
площадь отверстия регургитации от 20 до 29 мм2 и
объем регургитации от 30 до 44 мл.
Рис. 20.4 Дегенеративная митральная регургитация. Пациент с дегенеративной митральной регургитацией, отрывом сухожильных хорд и флотацией сег-
мента P2 (желтые стрелки). (А) 2D-ЧПЭхоКГ, средний отдел пищевода: четырехкамерная позиция, угол 0° (А1 A); комиссуральная позиция, угол 60° (А2); вы-
ходной тракт левого желудочка, угол 120° (А3). (Б) 2D-ЧПЭхоКГ, средний отдел пищевода, позиция выходного тракта левого желудочка. (В) A 3D-ЧПЭхоКГ.
Стрелка указывает на флотирующую створку.
ch20.indd 476
03.04.2019 11:55:57
477
20 Транскатетерная пластика митрального клапана
ПС
ЗС
А
Б
В
Г
ТЯЖЕЛАЯ МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
У пациентов с тяжелой МР при цветовом доппле-
ровском картировании кровотока обычно наблюда-
ется большая струя регургитации (площадь цен-
тральной струи регургитации > 40% площади лево-
го предсердия (ЛП)), ширина vena contracta — 7 мм
и более, большая зона конвергенции потока (радиус
≥ 9 мм), плотный треугольный сигнал от струи ре-
гургитации при непрерывно-волновой допплеро-
графии, систолический ретроградный поток в ле-
гочных венах, скорость митрального кровотока в
раннюю диастолу (E) > 1,5 м/сек, эффективная пло-
щадь отверстия регургитации > 40 мм2 и объем ре-
гургитации ≥ 60 мл. Все эти параметры необходимо
оценивать тщательно. Чем они больше, тем выше
вероятность того, что МР действительно тяжелая
(рис. 20.7).
ЭХОКАРДИОГРАФИЧЕСКИЕ КРИТЕРИИ
ВОЗМОЖНОСТИ ВЫПОЛНЕНИЯ
ТРАНСКАТЕТЕРНОЙ ПЛАСТИКИ МИТРАЛЬНОГО
КЛАПАНА МЕТОДОМ «КРАЙ В КРАЙ»
При определении с помощью ЭхоКГ возможности
выполнения транскатетерной пластики митрально-
го клапана методом «край в край» в случае умерен-
но тяжелой или тяжелой МР следует оценить мор-
фологию митрального клапана. Важными являются
следующие параметры: длина и подвижность ство-
рок, степень их утолщения и кальцификации, нали-
чие или отсутствие щелей и площадь фиброзного
кольца митрального клапана. В идеале длина задней
створки должна составлять 10 мм и более, а пло-
щадь фиброзного кольца митрального клапана —
4 см2 и более. При субоптимальных показателях
Рис. 20.5 Функциональная митральная регургитация. (А) A Открытый митральный клапан (позиция левого предсердия). Передняя створка (ПС) и задняя
створка (ЗС) полностью открыты. (Б) Во время систолы при закрытии створок видна область неполного их сопоставления (стрелки). (В) Струя регургитации за-
полняет бо
́
льшую часть левого предсердия. (Г) Трехмерная цветовая допплерография. Вдоль линии неполного сопоставления створок митрального клапана (стрел-
ки) видна струя регургитации.
ch20.indd 477
03.04.2019 11:55:58
478
ЧАСТЬ IV Пороки клапанов сердца
УЛП
Диастола
Ранняя систола
Середина систолы
ПС
ПС
ЗС
*
*
*
*
ЗС
А
Б
Рис. 20.6 Смешанная митральная регургитация. Пациент с дегенеративным пороком митрального клапана с пролапсом сегментов A1 и P1 митрального кла-
пана и ограниченной подвижностью задней створки вследствие подтягивания сегмента P3. На изображениях, полученных во время диастолы со стороны левого
предсердия (ЛП) A (А) и со стороны левого желудочка (ЛЖ) A (Б), видны открытые передняя створка (ПС) и задняя створка (ЗС), а также неизмененные пе-
реднелатеральная комиссура (желтая
*
) вблизи ушка левого предсердия (УЛП) и заднемедиальная комиссура (зеленая
*
). В раннюю систолу латеральные сег-
менты закрываются первыми, а коаптация медиальных сегментов происходит в середину систолы.
транскатетерную пластику митрального клапана
методом «край в край» выполнить можно, однако
при этом манипуляция сопряжена с большими тех-
ническими трудностями и значительно снижается
вероятность благоприятного исхода.
Противопоказаниями к транскатетерной пласти-
ке митрального клапана методом «край в край» яв-
ляются наличие щелей или перфораций створок
митрального клапана, тяжелая кальцификация сво-
бодных краев створок в области их захвата плечи-
ками клипсы, ревматический порок митрального
клапана и митральный стеноз (табл. 20.2, 20.3).
КОНТРОЛЬ ВО ВРЕМЯ ВМЕШАТЕЛЬСТВА
Благоприятный результат транскатетерной пласти-
ки митрального клапана методом «край в край» в
значительной степени зависит от опыта интервен-
ционного кардиолога и взаимодействия его со спе-
циалистом по ультразвуковой диагностике и вспо-
могательным персоналом, а также наличия четкого
и хорошо спланированного протокола. Специалист
по ультразвуковой диагностике, обеспечивающий
визуализацию, должен быть хорошо информиро-
ван о тонкостях и этапах всего вмешательства, что-
бы предвидеть потребности интервенционного кар-
диолога в визуализации [38, 49]. Кроме того, специ-
алист по ультразвуковой диагностике должен быть
знаком с внешним, рентгеноскопическим и эхокар-
диографическим видом проводников, катетеров и
доставляющих устройств (рис. 20.8 –20.10).
Пока интервенционный кардиолог выполняет
начальную катетеризацию сердца и получает дан-
ные о гемодинамике, специалист по ультразвуковой
диагностике с помощью ЧПЭхоКГ уточняет основ-
ные параметры, характеризующие патологию ми-
трального клапана, степень МР, наличие или отсут-
ствие ретроградного легочного кровотока, исход-
ные градиент давления на митральном клапане,
размеры и функцию ЛЖ, а также проверяет отсут-
ствие противопоказаний к продолжению установки
системы MitraClip (например, тромбоз ушка ЛП).
Кроме того, специалист по ультразвуковой диа-
гностике должен определить наилучшие позиции,
которые следует использовать для контроля во вре-
мя вмешательства (табл. 20.4, рис. 20.11, см. рис.
20.8).
ПУНКЦИЯ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
После получения сосудистого доступа к правой бе-
дренной вене первым (и, возможно, самым важ-
ным) этапом транскатетерной пластики митраль-
ного клапана методом «край в край» является пунк-
ch20.indd 478
03.04.2019 11:55:59
479
20 Транскатетерная пластика митрального клапана
А
1
2
3
4
Б
В
Г
5
1
2
Рис. 20.7 Характеристики митральной регургитации. ЧПЭхоКГ пациента с тяжелой функциональной митральной регургитацией до клипирования. (А) Изо-
бражения (от 0° до 150°) характеризуют степень и направление струи митральной регургитации (А1 A, А3 A, А4 A). (Б) Определяется большая (9 мм) пло-
щадь проксимальной зоны струи регургитации. (В) A Бипланарная визуализация в позиции выходного тракта левого желудочка (ВТЛЖ) (B1) и в комиссураль-
ной позиции (B2) демонстрирует размер и направление струи митральной регургитации. (Г) Ретроградный поток в левой верхней легочной вене, отражающий тя-
жесть митральной регургитации.
ция перегородки. Для пункции предпочтительно
выбирать место в задней верхней части овальной
ямки. В идеале место пункции должно располагать-
ся примерно на 4 см выше линии коаптации ство-
рок митрального клапана (см. рис. 20.11). Однако
высота места пункции может варьировать в зависи-
мости от патологии митрального клапана. Напри-
мер, в случае молотящей створки высота места
пункции обычно 4,2–4,5 см для обеспечения доста-
точного сжатия клипсы во время захвата. Затраты
времени на выбор правильного места пункции оку-
паются значительным упрощением продвижения
устройства к митральному клапану.
Поиск правильного места пункции облегчают
изображения в двух плоскостях при 3D-ЧПЭхоКГ,
если наблюдать за местом образования «тента» на
перегородке в переднезадней и верхненижней пло-
скостях. Мы считаем, что использование бикаваль-
ной позиции и ортогональной четырехкамерной по-
зиции помогает измерить расстояния между фи-
брозным кольцом и местом пункции. Пункцию
часто выполняют под рентгеноскопическим контро-
лем, но есть метод, с помощью которого можно на-
ложить рентгеноскопическое и ультразвуковое изо-
бражения для успешной пункции.
Выра женная дисфункция ЛЖ с ФВ < 25%
Выра женная дилатация ЛЖ с конечно-систолическим
размером > 55 мм
Площадь отверстия митрального клапана < 4 см2
Ширина молотящей створки > 15 мм;
длина молотящей створки > 10 мм
Кальцификация сегментов A2 и P2 в области захвата
плечиками клипсы
Значительная щель между сегментами A2 и P2
в области захвата плечиками клипсы
Флотация двух створок или выра женный пролапс обеих
створок
Отсутствие первичной и вторичной сухожильных хорд
в области захвата створок плечиками клипсы
ЛЖ — левый желудочек; ФВ — фракция выброса.
[Mauri L, Garg P, Massaro JM, et al. The EVEREST II Trial: design and
rationale for a randomized study of the evalve mitraclip system com-
pared with mitral valve surgery for mitral regurgitation, Am Heart J
160:23–29, 2010.]
ТАБЛИЦА 20.2
Противопоказания к транскатетерной
пластике митрального клапана методом
«край в край» с помощью системы
MitraClip при дегенеративной митральной
регургитации (EVEREST II)
ch20.indd 479
03.04.2019 11:56:00
480
ЧАСТЬ IV Пороки клапанов сердца
Проводник
Доставляющий
катетер
Система
MitraClip
Плечики открыты
Линия
коаптации
створок
ЛЖ
Створки
А
Б
В
Г
Д
Е
Рис. 20.8 Основные этапы размещения системы MitraClip. (А) Проведение доставляющего катетера и проводника через межпредсердную перегородку.
(Б) Систему MitraClip высвобождают из доставляющего катетера. (В) Выравнивание клипсы с открытыми плечиками перпендикулярно линии коаптации створок
митрального клапана. (Г) Систему MitraClip передвигают в левый желудочек (ЛЖ) через область максимальной митральной регургитации. (Д) Захват створок ми-
трального клапана. (Е) Створки захвачены, со стороны левого предсердия визуализируется митральный клапан с двойным отверстием (предоставлено Abbott
Vascular).
ТТЭхоКГ
ЧПЭхоКГ
Легкая или умеренная митральная регургитации
ФВЛЖ<20%или>50%
КСРЛЖ>70мм
Систолическое давление в легочной артерии > 70 мм рт. ст .
Площадь отверстия митрального клапана < 4 см2
Умеренная или выраженная дисфункция ПЖ
Порок трикуспидального или аортального клапана, при
котором необходима хирургическая операция или
вмешательство
Наличие второй значительной струи регургитации
Непригодность молотящей створки для захвата ее плечиками
клипсы
Кальцификация свободных краев створок в области их захвата
плечиками клипсы
Значительная щель в месте размещения клипсы
Отсутствие первичной и вторичной сухожильных хорд
в области захвата створки плечиками клипсы
Длина молотящей створки < 1 см
Эхокардиографические признаки наличия внутрисердечных
масс, тромба или вегетаций
* https://clinicaltrials.gov/ct2/show/NCT01626079?term=COAPT&rank=1 . Доступно с 15 августа 2016 г.
КСР — конечно-систолический размер; ЛЖ — левый желудочек; ПЖ — правый желудочек; ТТЭхоКГ — трансторакальная эхокардиогра-
фия; ФВ — фракция выброса; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 20.3 Противопоказания к транскатетерной пластике митрального клапана методом «край в край»
с помощью системы MitraClip при функциональной митральной регургитации (COAPT)*
ch20.indd 480
03.04.2019 11:56:01
481
20 Транскатетерная пластика митрального клапана
ПРОДВИЖЕНИЕ СИСТЕМЫ MitraClip В ЛЕВОЕ ПРЕДСЕРДИЕ
После пункции перегородки расширитель и прово-
дник одновременно продвигают в ЛП. Затем прово-
дник направляют в левую верхнюю легочную вену,
чтобы обеспечить стабильность и контроль уста-
новки доставляющего катетера, который использу-
ют для транскатетерной пластики митрального кла-
пана методом «край в край». Контроль с помощью
ЧПЭхоКГ помогает интервенционному кардиологу
направить проводник в легочную вену и не повре-
дить ушко ЛП. Затем управляемый проводниковый
катетер продвигают примерно на 2 см в ЛП и под-
тверждают это на ЭхоКГ, измерив расстояние от
кольца на кончике катетера до межпредсердной пе-
регородки (см. рис. 20.11E). Затем доставляющий
катетер с системой MitraClip продвигают в ЛП,а за-
тем перемещают ближе к митральному клапану в
нижней части ЛП. Непрерывная визуализация ло-
кализации системы MitraClip помогает предотвра-
тить травматизацию или перфорацию стенок пред-
сердия при перемещении клипсы по ЛП.
УПРАВЛЕНИЕ ДОСТАВЛЯЮЩИМ КАТЕТЕРОМ
И СИСТЕМОЙ ДОСТАВКИ
Как доставляющим катетером, так и системой до-
ставки клипсы можно управлять, чтобы обеспечить
продвижение системы доставки клипсы над ми-
тральным клапаном по пологой траектории, а затем
ниже его — в ЛЖ, и локализацию створок для раз-
мещения клипсы. Управление обеспечивается соот-
ветствующими настройками этих устройств. Дей-
ствия контролируют с помощью 2D- и 3D-ЧПЭхоКГ
для оптимизации положения системы доставки
клипсы в латерально-медиальной и переднезадней
проекциях.
ВЫРАВНИВАНИЕ КЛИПСЫ
После выравнивания клипсы относительно линии
коаптации створок под углом 90° над предполагае-
мым местом клипирования плечики клипсы откры-
вают. Открытую клипсу выдвигают в область мак-
симальной струи митральной регургитации, что хо-
рошо видно при цветовой допплерографии (рис.
20.12A, Б). При 3D-ЧПЭхоКГ в позиции митрально-
го клапана клипсу располагают перпендикулярно
линии коаптации створок (см. рис. 20.12Д), вращая
ручку системы доставки клипсы по часовой или
против часовой стрелки.
ПРОДВИЖЕНИЕ КЛИПСЫ В ЛЕВЫЙ ЖЕЛУДОЧЕК
После выравнивания клипсы и открытия ее плечи-
ков на 180° клипсу продвигают через митральный
клапан в ЛЖ. Открытая клипса с углом раскрытия
плечиков < 180° при правильной ориентации будет
определяться на ЭхоКГ в позиции выходного трак-
та левого желудочка (ВТЛЖ) как острие стрелки (см.
рис. 20.12В). В комиссуральной позиции клипса бу-
дет визуализироваться в профиль. Для этого этапа
пластики предпочтительнее использовать бипла-
нарную 3D-ЭхоКГ.
ЗАХВАТ СТВОРОК
Для контроля с помощью ЭхоКГ захвата створок
раскрытой до 120° клипсой, расположенной в ЛЖ,
используют позицию ВТЛЖ. При отведении клип-
сы назад в ЛП осуществляют контроль ее располо-
жения по отношению к передней и задней створкам
путем непрерывной визуализации, чтобы располо-
жить открытые плечики клипсы близко к нужным
участкам передней и задней створок (см. рис. 20.12Г).
Зажимы закрыты
Зажимы открыты
17 мм
Угол плечиков 0°
Угол плечиков 120°
Угол плечиков 180°
Угол плечиков > 180°
Рис. 20.9 Различные положения плечиков клипсы и зажимов системы MitraClip (предоставлено Abbott Vascular).
ch20.indd 481
03.04.2019 11:56:03
482
ЧАСТЬ IV Пороки клапанов сердца
После подтверждения правильного размещения
клипсы зажимы опускают для фиксации створок
открытыми плечиками, и клипсу наполовину за-
крывают. На этом этапе проводят эхокардиографи-
ческую оценку правильности захвата створок. Во-
первых, оценивают длину участка каждой створки,
заключенного в полузакрытую клипсу. Длина участ-
ков должна быть достаточной для захвата. Во-
вторых, при захвате остаточное движение створок
должно быть минимальным. После подтверждения
правильного размещения клипсы оценивают сте-
пень уменьшения регургитации и остаточную ре-
гургитацию с помощью цветовой допплерографии.
Затем клипсу закрывают полностью (нередко после
этого сразу уменьшается струя регургитации). Если
остаточная МР выражена, то клипсу не отпускают.
Зажимы открывают, и систему доставки с клипсой
снова продвигают в ЛЖ для лучшего размещения
клипсы.
ВЫСВОБОЖДЕНИЕ КЛИПСЫ И ОЦЕНКА
ОСТАТОЧНОЙ МИТРАЛЬНОЙ РЕГУРГИТАЦИИ
После подтверждения стабильного положения
клипсы, надлежащего захвата створок и уменьше-
ния МР клипсу высвобождают под контролем с по-
мощью рентгеноскопии и ЧПЭхоКГ, затем прово-
Расширитель
с проводником
Управляемый
проводниковый
катетер
Доставляющий
катетер
Клипса
Компоненты
Рентгеноскопия
2D-ЧПЭхоКГ
3D-ЧПЭхоКГ
*
*
*
*
А
Б
В
Г
Рис. 20.10 Визуализация компонентов системы MitraClip. Вид различных компонентов системы MitraClip при рентгеноскопии, 2D - и 3D-ЧПЭхоКГ. (А) Рас-
ширитель (
*
) при ЭхоКГ имеет вид штопора. (Б) Кольцо на конце управляемого проводникового катетера (
*
) визуализируется как две параллельные линии. Рас-
стояние от них до перегородки свидетельствует о том, как далеко от нее находится управляемый проводниковый катетер в левом предсердии. (В) Клипса (
*
) по-
сле высвобождения из доставляющего катетера представляет собой эхопозитивный объект, обычно с несколькими реверберациями. (Г) После открытия плечиков
и выравнивания клипсы перпендикулярно линии коаптации створок митрального клапана (
*
) клипса в позиции выходного тракта ЛЖ внешне напоминает острие
стрелки. ЧПЭхоКГ — чреспищеводная эхокардиография.
ch20.indd 482
03.04.2019 11:56:03
483
20 Транскатетерная пластика митрального клапана
Этап
Задача
Метод визуализации/
позиции
Примечания
Пункция
межпредсердной
перегородки
Выбор места пункции
Расположение катетера Перча/иглы
Размещение дилататора
в перегородке
Пункция
2D/3D-ЧПЭхоКГ,
средний отдел
пищевода, угол 0°
3D, бипланарная
бикавальная позиция
и позиция по короткой
оси аортального
клапана
Для пункции предпочтительным
является верхняя и задняя часть
овальной ямки
Место пункции должно
располагаться примерно на 4 см
выше зоны коаптации створок
митрального клапана
Продвижение системы
MitraClip в левое
предсердие
Продвижение проводника к ЛВЛВ
Продвижение расширителя
и управляемого проводникового
катетера через перегородку
Удаление расширителя и проводника
Перемещение системы доставки
клипсы через управляемый
проводниковый катетер
2D/3D-ЧПЭхоКГ
Убедитесь, что управляемый
проводниковый катетер
находится на расстоянии
1–2смвЛП
Убедитесь в непрерывной
визуализации кончика клипсы,
когда он продвигается в ЛП
Управление
доставляющим
катетером и
системой доставки
Доставляющим катетером и системой
доставки можно управлять для
движения по прямой траектории
над митральным клапаном до
створок и размещения клипсы, а
затем в ЛЖ
2D/3D-ЧПЭхоКГ
2D- и 3D-ЧПЭхоКГ используют
для оптимизации визуализации
в латерально-медиальном
и переднезаднем направлениях
Выравнивание клипсы Направление клипсы к месту
максимальной регургитации
Выравнивание клипсы в
переднезаднем и латерально-
медиальном направлениях
Выравнивание открытых плечиков
клипсы перпендикулярно линии
коаптации створок митрального
клапана
3D, бипланарная
визуализация:
позиция ВТЛЖ
и комиссуральная
позиция
3D-ЧПЭхоКГ
в позиции ЛП
В позиции ВТЛЖ открытая клипса
отображается как острие стрелки
Продвижение клипсы
в левый желудочек
Продвижение клипсы через МК в
приточный отдел ЛЖ
3D, бипланарная
визуализация:
позиция ВТЛЖ и
комиссуральная
позиция
Помните об изменении
ориентации клипсы при ее
продвижении в ЛЖ
Захват створок
После открытия клипсы на 180°
ее оттягивают назад для захвата
обеих створок
Как только створки захвачены,
за жимы закрывают
Захват обеих створок подтверждают
в нескольких позициях
2D-ЧПЭхоКГ, позиция
ВТЛЖ
3D-ЧПЭхоКГ в режиме
реального времени для
подтверждения захвата
На протяжении всего этапа
необходимо сохранять плоскость
ЧПЭхоКГ таким образом, чтобы
клипса визуализировалась в виде
острия стрелки
3D-ЧПЭхоКГ в режиме реального
времени обеспечивает лучшую
визуализацию и подтверждение
захвата обеих створок
Оценка остаточной
МР
Проводят до и после установки
клипсы
2D-ЧПЭхоКГ с цветовой
допплерографией в
нескольких позициях
3D-ЧПЭхоКГ,
бипланарная позиция
3D-ЧПЭхоКГ с цветовой
допплерографией
После размещения клипсы струя
регургитации может смещаться,
поэтому для оценки остаточной
МР нужна визуализация
в нескольких позициях
В дополнение к ЧПЭхоКГ
до клипирования, в которых
отображалась тяжелая МР,
используют еще несколько
позиций
САД должно быть около 140 мм
рт. ст.
Градиенты давления
на митральном
клапане
Средний и максимальный градиенты
давления для каждого отверстия
Непрерывно-волновая
допплерография
в комиссуральной
позиции
Выровняйте скорости параллельно
сигналу притока при цветовой
допплерографии
ТАБЛИЦА 20.4 Контроль транскатетерной пластики митрального клапана методом «край в край»
ch20.indd 483
03.04.2019 11:56:04
484
ЧАСТЬ IV Пороки клапанов сердца
Этап
Задача
Метод визуализации/
позиции
Примечания
Оценка возможности
размещения
дополнительной
клипсы
При остаточной МР, превышающей
легкую, и градиенте давления на
митральном клапане < 7 мм рт. ст.
рассматривают возможность
размещения дополнительной
клипсы
2D/3D-ЧПЭхоКГ
с цветовой
допплерографией
Оцените возможность
продвижения дополнительной
клипсы медиально или
латерально до ее размещения
Размещение
дополнительной
клипсы
Клипсу отсоединяют, как только
достигают нужного и стабильного
ее положения, а также уменьшения
МР
2D/3D-ЧПЭхоКГ
После размещения
дополнительной клипсы
необходимо повторно оценить
МР, поскольку может измениться
степень и направление струи МР
Извлечение
доставляющего
катетера
Под непрерывным контролем
с помощью рентгеноскопии
и ЭхоКГ извлекают доставляющий
катетер
2D/3D-ЧПЭхоКГ
При извлечении доставляющего
катетера контролируйте
положение его острого конца,
чтобы предотвратить
повреждение мягких тканей
Исследование
ятрогенного ДМПП
Оценка расположения, формы и
размера дефекта, а также
направления кровотока через
дефект
2D/3D-ЧПЭхоКГ с
цветовой импульсно-
волновой
допплерографией и
без нее для
определения
направления
кровотока
При большом ДМПП с
двунаправленным сбросом крови
рассмотрите возможность
установки окклюдера
Оценка осложнений
Перикардиальная жидкость,
тампонада сердца; сцепление, отрыв
сухожильных хорд; повреждение
створок митрального клапана;
эмболизация; прикрепление
устройства к одной створке
2D/3D-ЧПЭхоКГ с
цветовой импульсно-
волновой и
непрерывно-волновой
допплерографией и
без нее
Для выявления неожиданных
находок достаточно сравнения
результатов комплексного
внутрипроцедурного
исследования с результатами
исходного исследования
ВТЛЖ — выходной тракт левого желудочка; ДМПП — дефект межпредсердной перегородки; ЛВЛВ — левая верхняя легочная вена; ЛЖ —
левый желудочек; ЛП — левое предсердие; МК — митральный клапан; МР — митральная регургитация; САД — систолическое артери-
альное давление; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 20.4
окончание
Контроль транскатетерной пластики митрального клапана методом «край в край»
дят окончательную оценку остаточной регургита-
ции в нескольких позициях (рис. 20.13), сравнивая
с исходными показателями МР. Для валидации дан-
ного сравнения постнагрузка должна быть анало-
гична систолическому артериальному давлению.
РЕКОМЕНДАЦИИ ПО РАЗМЕЩЕНИЮ
ДОПОЛНИТЕЛЬНЫХ КЛИПС
Возможность размещения дополнительных клипс
следует рассматривать при остаточной МР > 2+,
анатомии клапана, позволяющей это сделать, и от-
сутствии выраженного митрального стеноза, инду-
цированного клипсой (обычно стеноз диагностиру-
ют при среднем градиенте давления на митральном
клапане 6–8 мм рт. ст.) (рис. 20.14).
ИЗВЛЕЧЕНИЕ ДОСТАВЛЯЮЩЕГО КАТЕТЕРА
После высвобождения клипсы доставляющий кате-
тер с острым концом извлекают под контролем с
помощью ЧПЭхоКГ и рентгеноскопии для мини-
мизации риска травмирования мягких тканей ЛП.
Затем удаляют управляемый проводниковый кате-
тер, и в области его расположения остается ятроген-
ный дефект межпредсердной перегородки.
ИССЛЕДОВАНИЕ ЯТРОГЕННОГО ДЕФЕКТА
МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
У всех пациентов вследствие размещения крупного
(24 Fr, или 8,7 мм) доставляющего катетера остает-
ся дефект в месте пункции межпредсердной перего-
родки (рис. 20.15). У большинства пациентов отно-
сительно небольшой дефект не вызывает гемодина-
мических проблем и может спонтанно закрыться в
течение нескольких месяцев. Однако у некоторых
пациентов размер дефекта может оказаться значи-
тельным, тогда понадобиться его закрытие в конце
вмешательства. Определить необходимость закры-
тия дефекта межпредсердной перегородки можно с
ch20.indd 484
03.04.2019 11:56:04
485
20 Транскатетерная пластика митрального клапана
ЛП
ЛП
ПП
ЛП
ПП
ВПВ
ВПВ
КС
ПП
ПЖ
ЛВЛВ
УЛП
ЛП
ЛП
ЛП
АВ
ПП
ПП
ПП
МПП
ЛЖ
А
Б
В
Г
Д
Е
помощью ЭхоКГ, измерив размер дефекта и опре-
делив направление кровотока. Если движение крови
происходит главным образом слева направо, то за-
крывать дефект обычно не нужно. Однако если на-
блюдается двунаправленный сброс крови или сброс
преимущественно справа налево, то для предотвра-
щения системной гипоксемии следует рассмотреть
возможность закрытия дефекта. К группе риска раз-
вития системной гипоксемии относят пациентов с
повышенным давлением в ПП и сниженным давле-
нием в ЛП при уменьшении МР.
ОЦЕНКА ВОЗМОЖНЫХ ОСЛОЖНЕНИЙ
На протяжении всего вмешательства специалист по
ультразвуковой диагностике должен быть насторо-
жен относительно таких осложнений, как перикар-
диальная жидкость, тампонада сердца, образование
тромбов на системе MitraClip и повреждение ство-
рок. Подходящий момент для систематического по-
иска возможных осложнений — окончание вмеша-
тельства. Перед завершением вмешательства и на-
чалом инактивации гепарина с помощью протамина
специалист по ультразвуковой диагностике должен
определить размер дефекта межпредсердной пере-
городки и направление кровотока через него, убе-
диться в отсутствии перикардиальной жидкости,
выраженного митрального стеноза и тромбов, а
также подтвердить стабильность клипсы. При нео-
бычном движении клипсы следует заподозрить от-
рыв одной створки (т.е. закрытая клипса удержива-
ет не обе створки, а только одну).
ОЦЕНКА РЕЗУЛЬТАТОВ
Роль ЭхоКГ при оценке краткосрочных и долгосроч-
ных результатов транскатетерной пластики митраль-
ного клапана методом «край в край» с помощью си-
стемы MitraClip хорошо известна (см. табл. 20.1):
ЭхоКГ играет центральную роль при определении
размеров и функции ЛЖ, объема ЛП и установлении
причины и степени МР.
Рис. 20.11 Пункция межпредсердной перегородки. (A) В четырехкамерной позиции отображена рекомендуемое место пункции перегородки (белая стрел-
ка), расположенная на расстоянии примерно 4 см от зоны коаптации створок митрального клапана (желтая стрелка). (Б) A В бикавальной позиции видна дефор-
мация среднего отдела межпредсердной перегородки (МПП) (стрелка). (В) A Катетер (стрелка) в левом предсердии (ЛП) сразу после пункции перегородки, на-
блюдаются несколько пузырьков воздуха. (Г) Проводник (стрелки) продвигают в левую верхнюю легочную вену (ЛВЛВ) для проведения катетеров. (Д) Ввод в
ЛП расширителя и проводника (стрелки). Расширитель имеет характерный вид штопора. (Е) Доставляющий катетер с двумя металлическими кольцами на конце
введен в ЛП на расстоянии около 2 см от перегородки (красная стрелка). Кольца отображаются как две параллельные линии (черные стрелки). АВ — атриовен-
трикулярный клапан; ВПВ — верхняя полая вена; КС — коронарный синус; ЛЖ — левый желудочек; ПЖ — правый желудочек; ПП — правое предсердие;
УЛП — ушко левого предсердия.
ch20.indd 485
03.04.2019 11:56:04
486
ЧАСТЬ IV Пороки клапанов сердца
ЛП
ЛП
ЛП
ЛП
ЛП
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
А
Б
В
Г
Д
Е
Ж
В ходе первых клинических испытаний было
продемонстрировано, что транскатетерная пласти-
ка митрального клапана методом «край в край» с
помощью системы MitraClip приводит к стойкому
снижению степени МР до умеренной или менее в
течение 12 мес [30, 39, 50]. Кроме того, эхокардио-
графические и гемодинамические показатели после
транскатетерной пластики митрального клапана
методом «край в край» с помощью системы Mitra-
Clip указывают на уменьшение площади митраль-
ного клапана без признаков клинически значимого
митрального стеноза либо сразу после размещения
клипсы, либо в течение 12 мес наблюдения [29, 51].
Транскатетерная пластика митрального клапана ме-
тодом «край в край» ассоциируется с низкой часто-
той осложнений и смертности у большинства паци-
ентов с быстрым уменьшением МР до < 2+, а также
с длительным отсутствием рецидива МР и необхо-
димости повторного оперативного вмешательства у
многих пациентов [31]. Транскатетерная пластика
менее эффективна в плане уменьшения МР, чем
обычная операция, но имеет высокий уровень без-
опасности и схожую положительную динамику
клинических исходов [10]. Кроме того, после транс-
катетерной пластики митрального клапана методом
«край в край» в последующем можно хирургиче-
ским путем удалить клипсу и провести хирургиче-
скую пластику или протезирование митрального
клапана с хорошими результатами. С помощью
ЭхоКГ также было установлено большее снижение
МР при использовании одной клипсы, по сравне-
нию с использованием двух клипс, а также влияние
Рис. 20.12 Продвижение устройства в левом желудочке и захват створок. (А–Г) Одновременные бипланарные изображения клипсы, расположенной чуть
выше центра митрального клапана (А), в области максимальной струи митральной регургитации A (Б), продвижение клипсы с открытыми плечиками в левом
желудочке (ЛЖ) (В) и захват створок (Г). (Д–Ж) Трехмерные изображения клипсы с открытыми плечиками: со стороны левого предсердия (ЛП) (Д); в ЛЖ около
створок митрального клапана (Е); захват створок (Ж).
ch20.indd 486
03.04.2019 11:56:06
487
20 Транскатетерная пластика митрального клапана
А
Б
В
Г
Д
Е
Ж
З
1
2
3
4
5
Б
А
В
Г
Рис. 20.13 Оценка митральной регургитации после клипирования. ЧПЭхоКГ того же пациента, что и на рис. 20.12 . (А) A Несколько изображений (от 0°
до 120°). Видно значительное уменьшение митральной регургитации (от 4+ до 1+) после размещения клипсы (А1 A, А3 A, А5 A). (Б) Митральный клапан с
двойным отверстием, позиция левого предсердия). (В) Митральный клапан, позиция левого желудочка. (Г) При цветовой 3D-ЧПЭхоКГ в позиции левого предсер-
дия визуализируется остаточная митральная регургитация (узкая струя оранжевого цвета).
Рис. 20.14 Размещение дополнительной клипсы у пациента с пролапсом митрального клапана. (А) A Очень эксцентрическая струя регургитации.
(Б) Митральная регургитация является вторичной по отношению к пролапсу сегментов A2 и A3. (В) A Две струи митральной регургитации: в области заднеме-
диальной комиссуры и в области сегментов A2 и P2. (Г) A Клипсу располагают перпендикулярно линии коаптации створок вблизи заднемедиальной комиссуры.
(Д) Клипса установлена. (Е) A Отмечается остаточная митральная регургитация, необходимо рассмотреть возможность размещения второй клипсы. (Ж) A Вто-
рая клипса определяется в непосредственной близости от первой клипсы. (З) A После размещения клипс есть две, но очень маленькие струи остаточной ми-
тральной регургитации.
ch20.indd 487
03.04.2019 11:56:07
488
ЧАСТЬ IV Пороки клапанов сердца
ЛП
ПП
ПП
ЛП
А
Б
В
Г
Д
Е
Рис. 20.15 Оценка гемодинамики после клипирования. После размещения клипсы оценивают с помощью непрерывно-волновой допплерографии градиент
давления через латеральное (А) и медиальное (Б) отверстия митрального клапана. Средние значения равны 6 и 5 мм рт. ст. соответственно. (В) Стойкость ле-
гочной гипертензии оценивают по скорости струи трикуспидальной регургитации. (Г–Е) Оценка ятрогенного дефекта межпредсердной перегородки в месте пунк-
ции после клипирования. (Г) A При цветовой допплерографии видны небольшой дефект межпредсердной перегородки (стрелка) и сброс крови слева направо.
(Д) При непрерывно-волновой допплерографии определяется сброс крови слева направо с преобладанием кровотока во время систолы. (Е) При пробе с пузырь-
ковым контрастированием в левом предсердии (ЛП) видны несколько микропузырьков (стрелка), что указывает на незначительный сброс крови справа налево.
ПП — правое предсердие.
толщины передней створки митрального клапана
на степень остаточной МР [37].
Степень уменьшения объемов ЛЖ и ЛП после
транскатетерной пластики митрального клапана
методом «край в край» коррелирует с уменьшением
МР до 1+ или 2+ [52]. В ходе клинических исследо-
ваний некоторым пациентам, перенесшим транска-
тетерную пластику митрального клапана, понадо-
билось хирургическое вмешательство в ранние сро-
ки по поводу остаточной МР. Однако после первого
года наблюдения количество таких ситуаций было
незначительно. В настоящее время документально
подтверждено сохранение стабильных результатов
у большинства пациентов в течение нескольких лет
[23].
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ВИЗУАЛИЗАЦИИ
В настоящее время к стандартным методам визуа-
лизации до транскатетерной пластики митрального
клапана, контроля во время вмешательства и оцен-
ки его результатов относят рентгеноскопию и
2D/3D-ТТЭхоКГ и 2D/3D-ЧПЭхоКГ. Дополнитель-
ную информацию как до, так и после транскатетер-
ной пластики митрального клапана могут предоста-
вить МРТ сердца и мультиспиральная компьютер-
ная томография (МСКТ) [53, 54]. Оба эти метода
позволяют точно оценить размеры, объемы и функ-
цию ЛЖ, а также объем ЛП. С помощью МРТ серд-
ца, как и при 3D-ЭхоКГ, можно точно количествен-
но оценить МР, эффективную площадь отверстия
регургитации и объем регургитации у пациентов с
функциональной МР [55], однако в настоящее вре-
мя МРТ редко используют для этого. МСКТ доказа-
ла свою пригодность при определении морфологии
митрального клапана [56, 57], но ее также редко ис-
пользуют в клинической практике.
ПОСЛЕДНИЕ ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ
ЭхоКГ при транскатетерной пластике митрального
клапана необходима для отбора пациентов, контро-
ля во время вмешательства и оценки его результа-
тов. Проводят 2D/3D-ТТЭхоКГ и 2D/3D-ЧПЭхоКГ,
а также спектральную и цветовую допплерографию
на разных этапах вмешательства.
3D-ЧПЭхоКГ, благодаря своим дополнительным
возможностям при исследовании анатомии, теперь
стала частью стандартного контроля транскатетер-
ной пластики митрального клапана. Технологиче-
ские достижения в области ЭхоКГ будут способство-
вать улучшению ведению пациентов с МР, которым
ch20.indd 488
03.04.2019 11:56:09
489
20 Транскатетерная пластика митрального клапана
показана транскатетерная пластика митрального кла-
пана.
Новая система EchoNav (EchoNav, Philips, Ando-
ver, MA), которая позволяет объединять изображе-
ния 3D-ЧПЭхоКГ и рентгеноскопии в режиме ре-
ального времени (рис. 20.16), обеспечивает деталь-
ную визуализацию мягких тканей нужной области
и позволяет выделить область или особо важную
точку на 3D-ЭхоКГ с одновременной маркировкой
на рентгеноскопическом изображении.
Обработка трехмерных изображений в режиме
off-line позволяет моделировать фиброзное кольцо
митрального клапана и створки, предоставляя до-
полнительную информацию о строении митраль-
ного клапана (рис. 20.17). Вероятно, это поможет
оценивать различные типы МР при рассмотрении
вопроса о возможности выполнения транскатетер-
ной пластики митрального клапана, а практикую-
щим врачам объяснит деформацию подклапанного
аппарата, которая происходит при транскатетерной
пластике митрального клапана методом «край в
край» и при других методах пластики митрального
клапана.
Трехмерная цветовая допплерография поможет
определить размер и происхождение струи регурги-
тации, а миниатюризация датчиков ЧПЭхоКГ упро-
стит контроль с помощью ЭхоКГ транскатетерной
пластики митрального клапана.
А
Б
В
Г
Рис. 20.16 Объединение изображений 3D-ЧПЭхоКГ и рентгеноскопии. (A) Систему EchoNav, которая позволяет объединить эхокардиографические и рент-
геноскопические изображения в режиме реального времени, используют для отображения межпредсердной перегородки и плоскости отверстия митрального кла-
пана. Знание взаимоотношений этих структур чрезвычайно важно при подготовке к пункции перегородки. (Б) Систему EchoNav использовали для точного опре-
деления места пункции перегородки при транскатетерной пластике митрального клапана методом «край в край». На объединенном трехмерном изображении пра-
вого предсердия и межпредсердной перегородки маркер указывает на расположение направляющего проводникового катетера. Расстояние до плоскости отверстия
митрального клапана 4,0 см. (В) Объединение рентгеноскопического и ультразвукового изображений створок митрального клапана. Этот усовершенствованный
метод визуализации облегчает продвижение и выравнивание системы доставки клипсы. (Г) Вторую клипсу размещают при цветовом допплеровском картирова-
ии кровотока, что позволяет определить локализацию струи остаточной регургитации.
ch20.indd 489
03.04.2019 11:56:09
490
ЧАСТЬ IV Пороки клапанов сердца
До пластики митрального клапана методом «край в край»
Ao
Модель
Передняя
створка
Задняя
створка
Позиция
по короткой оси
Ao
Модель
Передняя
створка
Задняя
створка
Позиция
по короткой оси
После пластики митрального клапана методом «край в край»
Бикомиссуральная позиция
Четырехкамерная позиция
Бикомиссуральная позиция
Четырехкамерная позиция
Рис. 20.17 Трехмерная модель митрального клапана. В настоящее время можно создать автономную трехмерную модель митрального клапана. Обозначив
несколько точек на изображении фиброзного кольца митрального клапана и его створках в трех ортогональных позициях (комиссуральной, четырехкамерной и
по короткой оси), создают трехмерную модель створок митрального клапана и его фиброзного кольца, а также фиброзного кольца аортального клапана. Эта мо-
дель отображает изменения морфологии фиброзного кольца у пациента с дегенеративной митральной регургитацией после транскатетерной пластики митраль-
ного клапана. Обратите внимание на значительное укорочение переднезаднего размера фиброзного кольца, которое произошло после пластики методом «край в
край». Наиболее заметно это изменение в позиции по короткой оси и на трехмерной модели. Также обратите внимание на пролапс сегмента P2, который отмеча-
ется в позиции по короткой оси и на трехмерной модели до клипирования и отсутствует после пластики. Ао — аорта.
Этап
Задачи
Примечания
Выбор метода транскатетер-
ной пластики митрального
клапана
Створки: System MitraClip (Abbott Vascular, Abbott
Park, IL)
Сухожильные хорды (протезирование): NeoChord
DS (NeoChord, Inc., Minneapolis, MN)
Фиброзное кольцо: Carillon Mitral Contour System
(Cardiac Dimensions, Kirkland, WA)
Левый желудочек: iCoapsys System* (Myocor, Inc,
Maple Grove, MN)
Пластика методом «край в край»
с помощью системы MitraClip в насто-
ящее время является наиболее распро-
страненным и единственным методом,
одобренным FDA
Отбор пациентов, которым
может быть успешно выпол-
нена транскатетерная пла-
стика митрального клапана
Определение этиологии и степени МР: наличие
функциональной или дегенеративной умеренно
тяжелой (3+) или тяжелой (4+) МР и высокого
хирургического риска
ЭхоКГ играет центральную роль при
отборе кандидатов на транскатетер-
ную пластику митрального клапана
Контроль во время
вмешательства
Пункция межпредсердной перегородки
Продвижение системы MitraClip в ЛП
Выравнивание клипсы
Продвижение клипсы в ЛЖ
Захват створок
Высвобождение клипсы
Оценка остаточной МР
Оценка необходимости размещения дополнитель-
ной клипсы
Извлечение доставляющего катетера
2D- и 3D-ЧПЭхоКГ с цветовой доппле-
рографией или без нее
Особенно полезны одновременные
бипланарные изображения, получен-
ные на основе трехмерных
изображений
СВОДНАЯ ИНФОРМАЦИЯ
Роль эхокардиографии при транскатетерной пластике митрального клапана методом «край в край»
ch20.indd 490
03.04.2019 11:56:10
491
20 Транскатетерная пластика митрального клапана
Оценка немедленных
результатов
Подтверждение уменьшения МР
Оценка стабильности клипсы
Отсутствие осложнений
Предпочтительнее использовать 2D- и
3D-ЧПЭхоКГ с цветовой и спектраль-
ной допплерографией
Поиск осложнений
Перикардиальная жидкость
Размер ДМПП и направление сброса крови через
дефект
Значительный митральный стеноз
Тромб
Нестабильность клипсы
Специалист по ультразвуковой диагно-
стике отслеживает эти осложнения на
протяжении всего вмешательства
Оценка долгосрочных
результатов
Многочисленные международные проспективные
клинические исследования и регистровые исследо-
вания выполнения транскатетерной пластики
митрального клапана методом «край в край» паци-
ентам с высоким хирургическим риском
Точно установлена роль ЭхоКГ
в оценке результатов транскатетерной
пластики митрального клапана
с помощью системы MitraClip у паци-
ентов с МР
Альтернативные методы
визуализации
МРТ сердца
КТ сердца
Предоставляют дополнительную
информацию, но используют редко
Перспективы
Трехмерное моделирование митрального клапана
Объединение изображений 3D-ЧПЭхоКГ и
рентгеноскопии
Миниатюризация датчиков ЧПЭхоКГ и использова-
ние трехмерной цветовой допплерографии
На разных этапах развития и клиниче-
ского использования
* Больше не применяют.
FDA — Food and Drug Administration; ДМПП — дефект межпредсердной перегородки; ЛЖ — левый желудочек; ЛП — левое предсердие;
МК — митральный клапан; МР — митральная регургитация; МРТ — магнитно -резонансная томография; ЧПЭхоКГ — чреспищеводная
эхокардиография; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Роль эхокардиографии при транскатетерной пластике митрального клапана методом «край в край»
ЛИТЕРАТУРА
1. Nkomo VT, Gardin JM, Skelton TN, et al.
Burden of valvular heart diseases: a popula-
tion-based study, Lancet 368:1005–1011,
2006.
2. Iung B, Baron G, Butchart EG, et al. A pro-
spective survey of patients with valvular heart
disease in Europe: the Euro Heart Survey on
Valvular Heart Disease, Eur Heart J 24:1231–
1243, 2003.
3. Salcedo E, Carroll J. Echocardiography in pa-
tient assessment and procedural guidance in
structural heart disease interventions. In Car-
roll J, Webb J, editors: Structural heart disease
interventions, Philadelphia, 2012, Lippincott
Williams & Wilkins.
4. Schoenhagen P, Bax J. Transcatheter repair of
valvular heart disease and periprocedural im-
aging, Int J Cardiovasc Imaging 27:1113, 2011.
5. Carroll JD, Edwards FH, Marinac-Dabic D, et
al. The STS-ACC transcatheter valve therapy
national registry: a new partnership and in-
frastructure for the introduction and surveil-
lance of medical devices and therapies, J Am
Coll Cardiol 62:1026–1034, 2013.
6. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Thorac Cardiovasc
Surg 148:e1–e132, 2014.
7. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012): the Joint Task
Force on the Management of Valvular Heart
Disease of the European Society of Cardiol-
ogy (ESC) and the European Association for
Cardio-Thoracic Surgery (EACTS), Eur J Car-
diothorac Surg 42:S1–S44, 2012.
8. Wan B, Rahnavardi M, Tian DH, et al. A me-
ta-analysis of MitraClip system versus surgery
for treatment of severe mitral regurgitation,
Ann Cardiothorac Surg 2:683–692, 2013.
9. Al Amri I, van der Kley F, Schalij MJ, et al.
Transcatheter mitral valve repair therapies for
primary and secondary mitral regurgitation,
Future Cardiol 11:153–169, 2015.
10. Feldman T, Foster E, Glower DD, et al. Per-
cutaneous repair or surgery for mitral regur-
gitation, N Engl J Med 364:1395–1406, 2011.
11. Stone GW, Vahanian AS, Adams DH, et al.
Clinical trial design principles and endpoint
definitions for transcatheter mitral valve re-
pair and replacement: part 1: clinical trial de-
sign principles: a consensus document from
the Mitral Valve Academic Research Consor-
tium, J Am Coll Cardiol 66:278–307, 2015.
12. Stone GW, Adams DH, Abraham WT, et al.
Clinical trial design principles and endpoint
definitions for transcatheter mitral valve re-
pair and replacement: part 2: endpoint defi-
nitions: a consensus document from the Mi-
tral Valve Academic Research Consortium, J
Am Coll Cardiol 66:308–321, 2015.
13. Feldman T, Young A. Percutaneous ap-
proaches to valve repair for mitral regurgita-
tion, J Am Coll Cardiol 63:2057–2068, 2014.
14. Sarraf M, Feldman T. Percutaneous interven-
tion for mitral regurgitation, Heart Fail Clin
11:243–259, 2015.
15. Goldberg SL, Feldman T. Percutaneous mitral
valve interventions: overview of new ap-
proaches, Curr Cardiol Rep 12:404–412, 2010.
16. Abdul-Jawad Altisent O, Dumont E, Dage-
nais F, et al. Initial experience of transcatheter
mitral valve replacement with a novel trans-
catheter mitral valve: procedural and 6-month
follow-up results, J Am Coll Cardiol 66:1011–
1019, 2015.
17. Yeo KK, Yap J, Yamen E, et al. Percutaneous
mitral valve repair with the MitraClip: early
results from the MitraClip Asia-Pacific Reg-
istry (MARS), EuroIntervention 10:620–625,
2014.
18. Nickenig G, Estevez-Loureiro R, Franzen O,
et al. Percutaneous mitral valve edge-to-edge
repair: in-hospital results and 1-year follow-
up of 628 patients of the 2011-2012 Pilot Eu-
ropean Sentinel Registry, J Am Coll Cardiol
64:875–884, 2014.
19. Glower DD, Kar S, Trento A, et al. Percutane-
ous mitral valve repair for mitral regurgita-
tion in high-risk patients: results of the
EVEREST II study, J Am Coll Cardiol 64:172–
181, 2014.
20. Cameron HL, Bernard LM, Garmo VS, et al.
A Canadian cost-effectiveness analysis of
transcatheter mitral valve repair with the Mi-
traClip system in high surgical risk patients
with significant mitral regurgitation, J Med
Econ 17:599–615, 2014.
ch20.indd 491
03.04.2019 11:56:11
492
ЧАСТЬ IV Пороки клапанов сердца
21. Schillinger W, Hunlich M, Baldus S, et al. Acute
outcomes after MitraClip therapy in highly
aged patients: results from the German TRAns-
catheter Mitral valve Interventions (TRAMI)
Registry, EuroIntervention 9:84–90, 2013.
22. Reichenspurner H, Schillinger W, Baldus S, et
al. Clinical outcomes through 12 months in
patients with degenerative mitral regurgita-
tion treated with the MitraClip(R) device in
the ACCESS-EUrope Phase I trial, Eur J Car-
diothorac Surg 44:e280–e288, 2013.
23. Mauri L, Foster E, Glower DD, et al. 4-year
results of a randomized controlled trial of
percutaneous repair versus surgery for mitral
regurgitation, J Am Coll Cardiol 62:317–328,
2013.
24. Maisano F, Franzen O, Baldus S, et al. Percu-
taneous mitral valve interventions in the real
world: early and 1-year results from the AC-
CESS-EU, a prospective, multicenter, non-
randomized post-approval study of the Mi-
traClip therapy in Europe, J Am Coll Cardiol
62:1052–1061, 2013.
25. Grasso C, Capodanno D, Scandura S, et al.
One- and twelve-month safety and efficacy
outcomes of patients undergoing edge-to-
edge percutaneous mitral valve repair (from
the GRASP Registry), Am J Cardiol 111:1482–
1487, 2013.
26. Foster E, Kwan D, Feldman T, et al. Percuta-
neous mitral valve repair in the initial EVER-
EST cohort: evidence of reverse left ventricu-
lar remodeling, Circ Cardiovasc Imaging
6:522–530, 2013.
27. Armoiry X, Brochet E, Lefevre T, et al. Initial
French experience of percutaneous mitral
valve repair with the MitraClip: a multicentre
national registry, Arch Cardiovasc Dis 106:
287–294, 2013.
28. Baldus S, Schillinger W, Franzen O, et al. Mi-
traClip therapy in daily clinical practice: ini-
tial results from the German transcatheter
mitral valve interventions (TRAMI) registry,
Eur J Heart Fail 14:1050–1055, 2012.
29. Herrmann HC, Rohatgi S, Wasserman HS, et
al. Mitral valve hemodynamic effects of per-
cutaneous edge-to-edge repair with the Mi-
traClip device for mitral regurgitation, Cath-
eter Cardiovasc Interv 68:821–828, 2006.
30. Feldman T, Wasserman HS, Herrmann HC,
et al. Percutaneous mitral valve repair using
the edge-to-edge technique: six-month results
of the EVEREST Phase I Clinical Trial, J Am
Coll Cardiol 46:2134–2140, 2005.
31. Feldman T, Kar S, Rinaldi M, et al. Percuta-
neous mitral repair with the MitraClip sys-
tem: safety and midterm durability in the ini-
tial EVEREST (Endovascular Valve Edge-to-
Edge REpair Study) cohort, J Am Coll Cardiol
54:686–694, 2009.
32. Mauri L, Garg P, Massaro JM, et al. The
EVEREST II Trial: design and rationale for a
randomized study of the evalve mitraclip sys-
tem compared with mitral valve surgery for
mitral regurgitation, Am Heart J 160:23–29,
2010.
33. Glower D, Ailawadi G, Argenziano M, et al.
EVEREST II randomized clinical trial: predic-
tors of mitral valve replacement in de novo
surgery or after the MitraClip procedure, J
Thorac Cardiovasc Surg 143:S60–S63, 2012.
34. Obadia JF, Armoiry X, Iung B, et al. The MI-
TRA-FR study: design and rationale of a ran-
domised study of percutaneous mitral valve
repair compared with optimal medical man-
agement alone for severe secondary mitral re-
gurgitation, EuroIntervention 10:1354–1360,
2015.
35. Attizzani GF, Ohno Y, Capodanno D, et al.
Gender-related clinical and echocardiogra-
phic outcomes at 30-day and 12-month fol-
low up after MitraClip implantation in the
GRASP registry, Catheter Cardiovasc Interv
85:889–897, 2015.
36. Pleger ST, Schulz-Schonhagen M, Geis N, et
al. One year clinical efficacy and reverse car-
diac remodelling in patients with severe mi-
tral regurgitation and reduced ejection frac-
tion after MitraClip implantation, Eur J Heart
Fail 15:919–927, 2013.
37. Armstrong EJ, Rogers JH, Swan CH, et al.
Echocardiographic predictors of single versus
dual MitraClip device implantation and long-
term reduction of mitral regurgitation after
percutaneous repair, Catheter Cardiovasc In-
terv 82:673–679, 2013.
38. Silvestry FE, Rodriguez LL, Herrmann HC, et
al. Echocardiographic guidance and assess-
ment of percutaneous repair for mitral regur-
gitation with the Evalve MitraClip: lessons
learned from EVEREST I, J Am Soc Echocar-
diogr 20:1131–1140, 2007.
39. Foster E, Wasserman HS, Gray W, et al.
Quantitative assessment of severity of mitral
regurgitation by serial echocardiography in a
multicenter clinical trial of percutaneous mi-
tral valve repair, Am J Cardiol 100:1577–1583,
2007.
40. Wunderlich NC, Siegel RJ. Peri-intervention-
al echo assessment for the MitraClip proce-
dure, Eur Heart J Cardiovasc Imaging 14: 935–
949, 2013.
41. Kou S, Caballero L, Dulgheru R, et al. Echo-
cardiographic reference ranges for normal
cardiac chamber size: results from the NOR-
RE study, Eur Heart J Cardiovasc Imaging 15:
680–690, 2014.
42. Delling FN, Vasan RS. Epidemiology and
pathophysiology of mitral valve prolapse:
new insights into disease progression, genet-
ics, and molecular basis, Circulation 129:
2158–2170, 2014.
43. Adams DH, Anyanwu AC, Sugeng L, Lang
RM. Degenerative mitral valve regurgitation:
surgical echocardiography, Curr Cardiol Rep
10:226–232, 2008.
44. Anyanwu AC, Adams DH. Etiologic classifi-
cation of degenerative mitral valve disease:
Barlow’s disease and fibroelastic deficiency,
Semin Thorac Cardiovasc Surg 19:90–96, 2007.
45. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the se-
verity of native valvular regurgitation with
two-dimensional and Doppler echocardiogra-
phy, J Am Soc Echocardiogr 16:777–802, 2003.
46. Lancellotti P, Tribouilloy C, Hagendorff A, et
al. Recommendations for the echocardiograph-
ic assessment of native valvular regurgitation:
an executive summary from the European As-
sociation of Cardiovascular Imaging, Eur Heart
J Cardiovasc Imaging 14:611–644, 2013.
47. Grayburn PA, Weissman NJ, Zamorano JL.
Quantitation of mitral regurgitation, Circula-
tion 126:2005–2017, 2012.
48. Zamorano JL, Fernandez-Golfin C, Gonza-
lez-Gomez A. Quantification of mitral regur-
gitation by echocardiography, Heart 101:146–
154, 2015.
49. Zamorano JL, Badano LP, Bruce C, et al. EAE/
ASE recommendations for the use of echo-
cardiography in new transcatheter interven-
tions for valvular heart disease, Eur Heart J
32:2189–2214, 2011.
50. Whitlow PL, Feldman T, Pedersen WR, et al.
Acute and 12-month results with catheter-
based mitral valve leaflet repair: the EVER-
EST II (Endovascular Valve Edge-to-Edge Re-
pair) High Risk Study, J Am Coll Cardiol
59:130–139, 2012.
51. Herrmann HC, Kar S, Siegel R, et al. Effect of
percutaneous mitral repair with the MitraClip
device on mitral valve area and gradient, Eu-
roIntervention 4:437–442, 2009.
52. Grayburn PA, Foster E, Sangli C, et al. Rela-
tionship between the magnitude of reduction
in mitral regurgitation severity and left ven-
tricular and left atrial reverse remodeling af-
ter MitraClip therapy, Circulation 128:1667–
1674, 2013.
53. Delgado V, Kapadia S, Marsan NA, et al. Mul-
timodality imaging before, during, and after
percutaneous mitral valve repair, Heart
97:1704–1714, 2011.
54. Van de Heyning CM, Magne J, Vrints CJ, et
al. The role of multi-imaging modality in pri-
mary mitral regurgitation, Eur Heart J Cardio-
vasc Imaging 13:139–151, 2012.
55. Marsan NA, Westenberg JJ, Ypenburg C, et al.
Quantification of functional mitral regurgi-
tation by real-time 3D echocardiography:
comparison with 3D velocity-encoded cardi-
ac magnetic resonance, JACC Cardiovasc Im-
aging 2:1245–1252, 2009.
56. Shanks M, Delgado V, Ng AC, et al. Mitral
valve morphology assessment: three-dimen-
sional transesophageal echocardiography ver-
sus computed tomography, Ann Thorac Surg
90:1922–1929, 2010.
57. Delgado V, Tops LF, Schuijf JD, et al. Assess-
ment of mitral valve anatomy and geometry
with multislice computed tomography, JACC
Cardiovasc Imaging 2:556–565, 2009.
58. Lim DS, Reynolds MR, Feldman T, et al. Im-
proved functional status and quality of life in
prohibitive surgical risk patients with degen-
erative mitral regurgitation after transcathe-
ter mitral valve repair, J Am Coll Cardiol
64:182–192, 2014.
58a. RESHAPE-HF. https://clinicaltrials.gov/ct2/
show/NCT02444286?term=RESHAPE-
HF&rank=1. Accessed August,15,2016
59. COAPT Clinical Trial. https://www.clinical-
trials.gov/ct2/show/NCT01626079?term
=
COAPT&rank = 1Accessed March 2, 2016.
60. Wiebe J, Franke J, Lubos E, et al. Percutane-
ous mitral valve repair with the MitraClip sys-
tem according to the predicted risk by the lo-
gistic EuroSCORE: preliminary results from
the German Transcatheter Mitral Valve Inter-
ventions (TRAMI) Registry, Catheter Cardio-
vasc Interv 84:591–598, 2014.
61. Schillinger W, Senges J. [TRAMI (Transcatheter
Mitral Valve Interventions) register. The Ger-
man mitral register], Herz 38:453–459, 2013.
62. Adamo M, Capodanno D, Cannata S, et al.
Comparison of three contemporary surgical
scores for predicting all-cause mortality of
patients undergoing percutaneous mitral
valve repair with the MitraClip system (from
the multicenter GRASP-IT registry), Am J
Cardiol 115:107–112, 2015.
62a. Mack MJ, Brennan JM, Brindis R, et al. STS/
ACC TVT Registry. Outcomes following
transcatheter aortic valve replacement in the
United States, JAMA 310(19):2069–2077, 2013.
ch20.indd 492
03.04.2019 11:56:11
493
21 Митральный стеноз
BERNARD IUNG, MD, ALEC VAHANIAN, MD
Основные принципы
и эхокардиографический подход
Постановка диагноза
Оценка степени тяжести
Оценка гемодинамических изменений
Оценка изменений левого предсердия
Оценка анатомического строения
клапана
Митральная регургитация
Сопутствующие поражения
Тромбоэмболические осложнения
Использование разных методов
эхокардиографии
Методика, количественная
оценка и анализ полученных данных
До проведения баллонной митральной
комиссуротомии
Во время баллонной митральной
комиссуротомии
В раннем периоде после баллонной
митральной комиссуротомии
Во время последующего наблюдения
Клиническое применение
Результаты выполнения баллонной
митральной комиссуротомии
Значение для отбора пациентов
Изучение применения
Потенциальные ограничения
и перспективы
Альтернативные варианты
Эхокардиография (ЭхоКГ) играет ключевую роль
при оценке митрального стеноза (МС). Как и при
других пороках клапанов сердца, она заменила ин-
вазивные методы исследования для оценки степени
тяжести МС и его последствий. Эхокардиографиче-
ский анализ анатомии клапана играет важную роль
при дифференциальной диагностике ревматическо-
го порока сердца и при выборе наиболее подходя-
щего вмешательства, что представляет особый ин-
терес при развитии метода баллонной митральной
комиссуротомии (БМК). Накапливающийся опыт
из отчетов больших серийных исследований о ре-
зультатах выполнения БМК с разнообразием подм-
ножества пациентов с долгосрочными результатами
позволяет внести уточнения в руководства относи-
тельно типа и времени проведения вмешательств
по поводу МС.
В отличие от других пороков клапанов, основной
причиной развития МС по-прежнему остается рев-
матическая болезнь сердца [1]. Бремя ревматиче-
ской болезни сердца все еще остается высоким в
развивающихся странах, где ее распространенность
оценивается в пределах 1–7 на 1000 детей школьно-
го возраста при клиническом скрининге и 20–30 на
1000 при систематическом эхокардиографическом
скрининге [2]. По данным южноафриканского кли-
нического центра ревматическая болезнь сердца
по-прежнему составляла 72% пороков клапанов в
период с 2006 по 2007 г., а МС наблюдался в 30%
случаев ревматической болезни сердца [3]. Средний
возраст при постановке диагноза составлял 43 года.
В развивающихся странах ревматическая болезнь
сердца у детей часто проявляется преобладающей
митральной регургитацией, с последующим веро-
ятным прогрессированием МС [3]. Постановка ди-
агноза ревматической болезни сердца у детей долж-
на производится на основании сочетания морфоло-
гических нарушений и результатов допплеровского
анализа кровотока [4]. Для скрининга больших
популяций были предложены упрощенные диагно-
стические критерии, оцениваемые с помощью пор-
тативных эхокардиографических устройств [4].
Несмотря на резкое снижение частоты возникно-
вения острой ревматической лихорадки в западных
странах, ревматическая болезнь сердца не исчезла, в
частности, из-за наличия иммигрантов из стран, где
ревматическая лихорадка имеет широкое распро-
странение. В результате европейского кардиологи-
ческого исследования ревматическая болезнь сердца
по-прежнему составляла 22%, а МС — 9% всех по-
роков нативных клапанов в Европе [5]. В западных
странах МС встречается у пожилых пациентов, у
которых отмечается более выраженное нарушение
анатомического строения клапана по сравнению с
пациентами в странах с эндемичной острой ревма-
тической лихорадкой, при которой порок клапанов
проявляется в более раннем возрасте с меньшей
деформацией клапана.
В недавнем исследовании, в котором приняло
участие 1300 пациентов из 42 турецких клиниче-
ских центров, большинство пороков клапанов было
обусловлено ревматической болезнью сердца (46%
In-21_для нас.indd 493
03.04.2019 12:00:22
494
ЧАСТЬ IV Пороки клапанов сердца
случаев), за которыми следуют дегенеративные при-
чины (29%) [6].
Помимо эпидемиологической динамики, с мо-
мента первого описания в 1984 г. и последующего
развития БМК тактика ведения МС резко измени-
лась [7]. Возможность лечения МС с помощью про-
цедуры низкого риска постепенно привела к расши-
рению показаний к интервенционному вмешатель-
ству. В то же время техническое усовершенствование
ультразвукового исследования увеличило возмож-
ность неинвазивной оценки тяжести порока клапа-
на и его последствий, а также описания изменений
анатомического строения.
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЙ ПОДХОД
Цели эхокардиографического исследования МС
можно кратко сформулировать следующим обра-
зом: диагностика, оценка степени тяжести и послед-
ствий поражений клапана, оценка анатомического
строения клапана и оценка сопутствующих заболе-
ваний.
ПОСТАНОВКА ДИАГНОЗА
Трансторакальная эхокардиография (ТТЭхоКГ)
является обязательной при наличии клинического
подозрения на МС. Учитывая снижение осведом-
ленности о МС в западных странах и трудности
аускультативной диагностики, МС может быть
диагностирован только при ТТЭхоКГ, которая
проводится для установления причины необъяс-
нимой одышки или тромбоэмболических ослож-
нений.
Диагностика ревматического МС главным обра-
зом основывается на результатах двумерной (2D)
ЭхоКГ, при которой в парастернальной и апикаль-
ной проекциях отмечаются утолщение и ограниче-
ние движения (снижение подвижности) створок,
сращение комиссур и вовлечение подклапанного
аппарата с утолщением, сращением и укорочением
хорд. Парастернальная короткоосевая проекция
имеет особое значение для оценки сращения ко-
миссур и локализации утолщения или кальцифи-
кации створок. Оценка анатомии створок и под-
клапанного аппарата подробно описана далее в
этой главе.
Анализ анатомического строения играет важную
роль в дифференциальной диагностике ревматиче-
ского МС и МС, обусловленного другими причина-
ми, при которых обычно невозможна процедура
БМК.
Врожденный МС встречается редко и может быть
вызван различными поражениями створок (сраще-
нием краев створок или комиссур) и подклапанного
аппарата, как, например, парашютный клапан с
одной папиллярной мышцей.
Лекарственный порок клапана чаще всего прояв-
ляется недостаточностью клапана. Также при этом
могут наблюдаться утолщение, снижение подвиж-
ности и гибкости митральных створок и укорочение
хорд, что также наблюдается при ревматическом
пороке клапана. Принятие во внимание этих мор-
фологических признаков позволяет улучшить диа-
гностику лекарственного порока клапанов сердца
по сравнению с критериями управления по контро-
лю за пищевыми продуктами и лекарственными
препаратами США (FDA) [8]. Лекарственный порок
клапана иногда может проявляться как МС, даже со
сращением комиссур [9].
Воспалительные заболевания также приводят к
рестриктивному пороку митрального клапана, ко-
торый часто сочетает в себе стеноз без сращения
комиссур и недостаточность.
Дегенеративный кальцифицирующий порок ми-
трального клапана встречается в основном у пожи-
лых, особенно при наличии факторов риска сердеч-
но-сосудистых заболеваний или кальцифицирую-
щего порока аортального клапана. Кальцификация
преобладает в области фиброзного кольца митраль-
ного клапана, причем в большинстве случаев воз-
никают незначительные гемодинамические измене-
ния или они отсутствуют. Значительный МС может
быть следствием распространения кальцификации
на створки митрального клапана, что приводит к
снижению их подвижности, без сращения комиссур
[10]. Тем не менее может быть трудно определить
точную причину, особенно у пожилых пациентов с
кальцификацией (рис. 21 .1).
ОЦЕНКА СТЕПЕНИ ТЯЖЕСТИ
Оценка степени тяжести МС основана на определе-
нии площади клапана (табл. 21 .1) [11]. Градиент не
является надежным маркером тяжести стеноза кла-
пана, поскольку он демонстрирует выраженную
зависимость от частоты сердечных сокращений и
сердечного выброса. Для оценки области митраль-
ного клапана могут быть использованы различные
методы.
• Планиметрия митрального отверстия, выполня-
емая трансторакально в парастернальной проек-
ции по короткой оси и является эталонным ме-
тодом измерения, поскольку только при этом
методе выполняется прямое измерение площади
клапана и его результаты тесно коррелирует с
анатомическим строением [11, 12]. Планиметрия
не предполагает гипотез относительно условий
нагрузки, зависящей от сердечных камер или
обусловленной пороком клапана. Для проведе-
ния планиметрии требуется особой опыт, гаран-
тирующий соответствие площади поперечного
сечения кончикам створок. Митральное отвер-
стие должно быть исследовано в середине диа-
столы, а настройка коэффициента усиления не
In-21_для нас.indd 494
03.04.2019 12:00:23
495
21 Митральный стеноз
должна быть слишком высокой, поскольку об-
ласть клапана может быть недооценена [11].
• Обычно используется метод времени полуспада
давления, поскольку он легко выполним при хо-
рошем качестве допплеровского сигнала транс-
митрального кровотока с четко определенным
линейным наклоном допплеровской E-волны.
Когда скорость замедления бимодальна, время
полуспада давления необходимо рассчитывать в
середине диастолы, а не по ранней скорости за-
медления. Время полуспада давления зависит не
только от площади клапана, но также от ком-
плайнса камеры и связанной с ней аортальной
регургитацией, и данный метод нельзя использо-
вать в качестве единственного метода оценки
тяжести МС [11].
• В основе уравнения непрерывности потока ле-
жит соотношение между ударными объемами в
выходных трактах левого желудочка (ЛЖ) и пра-
вого желудочка (ПЖ), а также интеграл скорости
трансмитрального кровотока. Его точность огра-
ничена потенциальными ошибками нескольких
измерений и допущением округлой формы вы-
ходного тракта ЛЖ и фиброзного кольца ми-
трального клапана [11]. Результаты этого метода
справедливы только при отсутствии значитель-
ной митральной регургитации и могут демон-
стрировать заниженную оценку площади клапа-
на по сравнению с планиметрией.
• Метод площади формирующейся струи ми-
тральной регургитации основан на полусфери-
ческой форме конвергенции трансмитрального
кровотока, что наблюдается при цветовой доп-
плерографии. Этот метод может быть использо-
ван при наличии значительной митральной ре-
гургитации. Однако он технически трудоемок и
требует многократных измерений. Использова-
ние М-режима улучшает его точность, позволяя
одновременно измерять объем и скорость крово-
тока [11].
• Утверждалось, что ригидность митрального кла-
пана является в меньшей степени зависимым от
условий кровотока показателем степени тяжести
МС. Однако, как было показано, это показатель
не имеет никакого дополнительного значения
при оценке тяжести МС, отличного от площади
клапана, поэтому к использованию он не реко-
мендован (см. табл. 21 .1) [11].
ОЦЕНКА ИЗМЕНЕНИЙ ГЕМОДИНАМИКИ
Средний митральный градиент, который оценива-
ется с помощью импульсно-волновой или непре-
рывно-волновой допплерографии, не является на-
дежным маркером степени тяжести МС, поскольку
он сильно зависит от частоты сердечных сокраще-
ний и условий кровотока. Однако данный метод
предоставляет информацию о последствиях МС,
поскольку является основным фактором, определя-
ющим увеличение давления на входе в левое пред-
сердие (ЛП) и малом круге кровообращения. Сред-
ний градиент также имеет прогностическое значе-
ние после выполнения БМК. Контрольный объем
при импульсно-волновой допплерографии должен
быть установлен на уровне кончиков створок или
сразу за ними.
Допплеровский градиент в большинстве случаев
оценивается в апикальной позиции. Непрерывно-вол-
новая допплерография обеспечивает регистрацию
максимальных скоростей кровотока. Допплеров-
ский луч должен быть ориентирован таким обра-
Рис. 21.1 Порок митрального клапана, обусловленный лекарственными препаратами. При гистологическом исследовании выявлено дегенеративное
кальцифицирующее поражение митрального клапана. (A) Парастернальная позиция по короткой оси, демонстрирующая митральный стеноз с открытыми комис-
сурами и кальцификацией задней части фиброзного кольца митрального клапана (стрелка). (Б) A 3D-ЧПЭхоКГ в позиции левого предсердия демонстрирует
распространенную кальцификацию фиброзного кольца (красная стрелка) и подтверждает отсутствие сращения комиссур (черная стрелка).
А
Б
In-21_для нас.indd 495
03.04.2019 12:00:23
496
ЧАСТЬ IV Пороки клапанов сердца
Измерение
Единицы
измерения Формула/метод Принцип
Преимущества Недостатки
Площадь клапана
Планиметрия с
помощью
2D-ЭхоКГ
см2
Отслеживание
митрального
отверстия с
помощью
2D-ЭхоКГ
Прямое измерение
анатомической
ПОМК
Точность
Независимость
от других
факторов
Требуется опытный
специалист
Не всегда выполним (плохие
акустические окна,
выраженная кальцифика-
ция клапана)
Время полуспада
давления
см2
220/T1/2
Скорость снижения
трансмитрального
кровотока обратно
пропорциональна
ПОМК
Легко
выполним
Зависим от других факторов
(комплаенса ПП и ЛП,
диастолической функции
ЛЖ)
Уравнение
непрерывности
см2
ПОМК = ПСВТЛЖ
· VTIаорт /
VTIмитр
Объем кровотока
через аортально и
митральное отвер-
стия равны
Независимость
от условий
кровотока
Несколько измерений
(источники ошибок)
Недостоверно при значи-
тельной АР или МР
PISA
см2
ПОМК=π×r2×
(Valiasing /
максимальная
Vмитр) · (α/180°)
ПОМК оценивается
путем деления
объема митрального
кровотока на
максимальную
скорость диастоличе-
ского митрального
кровотока
Независим от
условий
кровотока
Технически сложен
Средний градиент
мм рт. ст.
ΔPмитр = 4V2
митр
Градиент давления,
рассчитанный на
основании скорости
по уравнению
Бернулли
Легко
выполним
Зависим от частоты сердеч-
ных сокращений и
условий кровотока
Систолическое
давление в
легочной артерии
мм рт. ст.
СДЛА =
4V2
трикусп +
давление в ПП
Сложение давления в
ПП и максимального
градиента между ПЖ
иПП
Выполним
у большин-
ства пациен-
товсМС
Произвольная оценка
давления в ПП
Отсутствует оценка рези-
стентности легочных
сосудов
Средний градиент
и систолическое
давление в
легочной артерии
при физической
нагрузке
мм рт. ст.
ΔPмитр = 4V2
митр
СДЛА =
4V2
трикусп +
Давление в ПП
Оценка градиента и
СДЛА при увеличе-
нии нагрузки
Инкрементная
ценность в
оценке
толерантности
Требуется опытный
специалист
Отсутствует валидация для
принятия решений
Резистентность
клапана
дин
сек–1
·см
–5
__
МКрез =
ΔPмитр /
(ППСВТЛЖ ×
VTIаорт/ВДН)
Резистентность к
кровотоку, обуслов-
ленная МС
Первоначально
предлагалась
меньшая
зависимость
от кровотока,
но не
подтверждена
Отсутствует прогностиче-
ская ценность
Отсутствует четкое порого-
вое значения для определе-
ния степени тяжести
Не представляет никакого
дополнительного значения
по сравнению с площадью
клапана
Уровень рекомендаций: 1: Применим у всех пациентов (желтый); 2: Целесообразно при необходимости получения дополнительной
информации при отборе пациентов (зеленый); 3: Не рекомендуется (синий).
ΔP — градиент; PISA— площадь формирующейся струи митральной регургитации; r — радиус полусферы; T1/2 — время полуспада дав-
ления; V — скорость; Valiasing — предел Найквиста; VTI — интеграл скорости кровотока; АР — аортальная регургитация; ВДН — время
диастолического наполнения; ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; ЛП — левое предсердие; МКрез —
резистентность митрального клапана; МР — митральная регургитация; МС — митральный стеноз; ПЖ — правый желудочек; ПОМК —
площадь отверстия митрального клапана; ПП — правое предсердие; ППС — площадь поперечного сечения; СДЛА — систолическое
давление в легочной артерии; ЭхоКГ — эхокардиография.
[Baumgartner H, Hung J, Bermejo J, et al. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice. J Am Soc
Echocardiogr 22:1–23, 2009.]
ТАБЛИЦА 21.1 Подходы к оценке митрального стеноза
In-21_для нас.indd 496
03.04.2019 12:00:24
497
21 Митральный стеноз
зом, чтобы не допустить недооценку скоростей.
Максимальный градиент представляет небольшой
интерес, поскольку он еще более зависит от эла-
стичности ЛП и диастолической функции ЛЖ, чем
средний градиент [11]. При фибрилляции предсер-
дий средний градиент следует усреднять по пяти
циклам как можно ближе к нормальной частоте
сердечных сокращений. Всегда необходимо реги-
стрировать частоту сердечных сокращений, при
которой измеряются градиенты.
Систолическое давление в легочной артерии оце-
нивается по допплеровской скорости кровотока
через трикуспидальный клапан. Диастолическое и
среднее давление в легочной артерии может быть
получено на основании данных легочного кровото-
ка. Допплеровские оценки давления в легочной ар-
терии хорошо коррелируют с измерениями путем
катетеризации правого отдела сердца, который
остается эталонным методом [13].
ОЦЕНКА ИЗМЕНЕНИЙ ЛЕВОГО ПРЕДСЕРДИЯ
Расширение ЛП обусловлено хронической пере-
грузкой давлением. Измерение движения по време-
ни может быть неточным, поскольку в большинстве
случаев расширение носит не сферический харак-
тер. Предпочтение следует отдать оценке объема
ЛП с помощью двухпроекционного метода измере-
ния площади и длины (биплановый метод), по-
скольку данный метод демонстрирует наиболее
точные результаты и выраженную корреляцию с
другими маркерами риска развития тромбоэмболи-
ческих осложнений [14].
ОЦЕНКА АНАТОМИЧЕСКОГО СТРОЕНИЯ КЛАПАНА
Детальный анализ различных компонентов ми-
трального клапана необходим для постановки диа-
гноза, а также помогает при выборе типа вмеша-
тельства (рис. 21 .2):
• Анализ подвижности створок лучше всего вы-
полнять в длинноосевой парастернальной про-
екции.
• Утолщение створок, равное 5 мм и более, счита-
ется значительным.
• Кальцификация створок может быть заподозре-
на при наличии повышенной яркости эхосигна-
ла.
• Степень сращения комиссур оценивается в ко-
роткоосевой парастернальной проекции.
• Патологические изменения подклапанного ап-
парата оцениваются в длинноосевой парастер-
нальной и апикальной проекциях, в которых
выявляются утолщение, сращение или укороче-
ние хорд.
В эхокардиографическом заключении следует
точно указать выраженность и локализацию каждо-
го патологического процесса, особенно в отноше-
нии комиссуральных областей.
Оценка сращения комиссур важна для диффе-
ренциальной диагностики ревматического МС от
МС, обусловленного другими причинами, в частно-
сти дегенеративного кальцифицирующего МС.
Полное сращение обеих комиссур обычно указыва-
ет на серьезный ревматический МС [11]. И наобо-
рот, отсутствие сращения комиссур не исключает
значительный МС, обусловленный другими причи-
нами, или ревматический МС в случае рестеноза,
что вызвано ригидностью клапана с постоянным
открытием комиссур.
Выявление кальцификации с помощью ультра-
сонографических критериев может быть спорным.
Для кальцификации специфично только акустиче-
ское затенение, тогда как очаговая яркость может
быть обусловлена также фиброзом. В связи с этим
у некоторых пациентов требуется подтверждение
кальцификации с помощью рентгеноскопического
исследования [15]. Для точной оценки локализации
и степени кальцификации клапана может использо-
ваться компьютерная томография, но ее примени-
мость для оценки анатомического строения клапана
при ревматическом МС еще не изучена.
МИТРАЛЬНАЯ РЕГУРГИТАЦИЯ
Выявление и количественное определение сопут-
ствующей митральной регургитации имеет важное
значение при выборе вмешательства. Количествен-
ное обследование должно быть комплексным, что
предпочтительнее, чем методы, которые использу-
ют цветовое допплеровское картирование струи ре-
гургитации в ЛП [16]. Наличие митральной регур-
гитации не влияет на достоверность количественной
оценки МС, за исключением уравнения непрерыв-
ности потока.
СОПУТСТВУЮЩИЕ ПОРАЖЕНИЯ
Обычно на фоне МС наблюдается дисфункция три-
куспидального клапана. Чаще всего это проявляется
функциональной трикуспидальной регургитацией,
которая обусловлена постоянно повышенным дав-
лением в легочной артерии, что приводит к дилата-
ции ПЖ и нарушению коаптации створок трику-
спидального клапана, несмотря на его нормальное
анатомическое строение.
Любой метод количественной оценки трикуспи-
дальной регургитации имеет выраженную зависи-
мость от условий нагрузки. Это объясняет тенден-
цию больше полагаться на измерение фиброзного
кольца трикуспидального клапана, чем на количе-
ственную оценку регургитации, поскольку эти дан-
ные предоставляют информацию о необходимости
дополнительной коррекции функциональной три-
куспидальной недостаточности у пациентов, под-
вергающихся операции на клапанах левого отдела
сердца [16]. Однако трехмерная форма фиброзного
кольца трикуспидального клапана создает пробле-
In-21_для нас.indd 497
03.04.2019 12:00:25
498
ЧАСТЬ IV Пороки клапанов сердца
мы относительно надежности и воспроизводимости
обычных измерений в 2D-режиме диаметра фи-
брозного кольца трикуспидального клапана.
Ревматический порок трикуспидального клапана
встречается гораздо реже и характеризуется утолще-
нием и уменьшением подвижности створок. Количе-
ственная оценка стеноза трикуспидального клапана
главным образом основана на среднем градиенте
[11]. При необходимости выполняется количествен-
ный анализ сопутствующего ревматического поро-
ка аортального клапана с помощью стандартных
методов. Тяжелый аортальный стеноз может быть
связан с низким градиентом, т.к. часто при МС сни-
жается ударный объем. Необходим количественный
анализ площади аортального клапана с помощью
уравнения непрерывности и/или планиметрии аор-
тального клапана при ТТЭхоКГ или чреспищевод-
ной эхокардиографии (ЧПЭхоКГ) [11]. Расширение
ЛЖ и систолическая дисфункция нетипичны для
МС, и изначально следует исследовать пациента на
предмет наличия сопутствующей недостаточности
клапана или ишемической болезни сердца.
ТРОМБОЭМБОЛИЧЕСКИЕ ОСЛОЖНЕНИЯ
Диагностика тромбоза ЛП основана на результатах
ЧПЭхоКГ, которая демонстрирует более высокую
чувствительность, чем ТТЭхоКГ, особенно при ло-
кализации тромба в ушке ЛП. Также может быть
использована компьютерная томография с особы-
ми методиками для предотвращения артефактов,
которые могут вызвать постановку неверного диа-
гноза [17].
ЭхоКГ также играет важную роль в стратифика-
ции риска развития тромбоэмболии. Расширение
ЛП служит фактором риска тромбоэмболии. Объем
ЛП > 60 мл/м2 площади поверхности тела ассоции-
рован с наличием суррогатных маркеров риска раз-
вития тромбоэмболии [14]. Характер ремоделиро-
вания ЛП, по-видимому, ассоциирован с риском
развития тромбоэмболии, который в большей сте-
пени увеличивается при сферической форме ЛП, а
не при овальной [18]. Спонтанное эхоконтрастиро-
вание в ЛП является сильным прогностическим
фактором риска развития тромбоэмболии у паци-
ентов с МС.
Рис. 21 .2 Оценка анатомического строения клапанов перед проведением баллонной митральной комиссуротомии. ТТЭхоКГ. (A) A В парастеналь-
ной позиции по длинной оси продемонстрирован утолщенный некальцифицированный подвижный клапан. (Б) В парастенальной позиции по длинной оси отме-
чается умеренное поражение подклапанного аппарата (длина хорды 13,6 мм). (В) A В парастернальной позиции по короткой оси отмечается утолщение кончиков
створок и сращение обеих комиссур. (Г) A Трехмерное изображение в парастернальной позиции по короткой оси видно утолщение клапана и сращение обеих
комиссур.
А
Б
В
Г
In-21_для нас.indd 498
03.04.2019 12:00:25
499
21 Митральный стеноз
ИСПОЛЬЗОВАНИЕ РАЗНЫХ МЕТОДОВ ЭХОКАРДИОГРАФИИ
Комплексная оценка МС в большинстве случае мо-
жет быть выполнена с помощью ТТЭхоКГ, также
ТТЭхоКГ играет важную роль во время процедуры
БМК для контроля открытия клапана и количе-
ственной оценки митральной недостаточности.
В редких случаях при низком качестве ТТЭхоКГ
может потребоваться ЧПЭхоКГ. Однако основным
показанием к ЧПЭхоКГ является выявление тром-
боза ЛП перед выполнением БМК.
ЭхоКГ с физической нагрузкой используется в
основном у пациентов без симптомов.
МЕТОДИКА, КОЛИЧЕСТВЕННАЯ ОЦЕНКА
И АНАЛИЗ ПОЛУЧЕННЫХ ДАННЫХ
Значение некоторых параметров, определяемых с
помощью ЭхоКГ, может отличаться в зависимости
от того, выполняется ли ЭхоКГ с целью первона-
чальной оценки или для оценки результатов интер-
венционной процедуры сразу или при последую-
щем наблюдении.
ДО ПРОВЕДЕНИЯ БАЛЛОННОЙ
МИТРАЛЬНОЙ КОМИССУРОТОМИИ
ФУНКЦИЯ КЛАПАНА
Изначально определением умеренного МС служила
площадь клапана от 1,0 до 1,5 см2, а тяжелого МС —
площадь клапана < 1,0 см2 [11, 19]. На практике
наиболее актуально пороговое значение 1,5 см2,
поскольку при большей площади отсутствуют ге-
модинамические изменения в покое. Общепринято
рассматривать возможность вмешательства при
площади митрального клапана меньше 1,5 см2 [20,
21]. В результате в недавних рекомендациях Амери-
канской кардиологической ассоциации (AHA) и
Американской кардиологической коллегии (ACC)
для определения тяжелого МС была рассмотрена в
качестве порогового значения площадь 1,5 см2 [20].
Рекомендуется учитывать размер тела пациента,
хотя в литературе отсутствуют утвержденные ин-
дексированные по площади поверхности тела зна-
чения.
Главным недостатком использования планиме-
трии является завышенная оценка площади клапа-
на из-за ненадлежащего позиционирования плоско-
сти измерения над кончиками створок. Лучший
способ предотвратить это выполнить медленное
сканирование от верхушки к основанию и выбрать
самое узкое отверстие. Использование 3D-ЭхоКГ в
режиме реального времени для оптимизации пози-
ционирования плоскости измерения улучшает вос-
производимость и точность планиметрии, особенно
менее опытными специалистами в области ЭхоКГ
[22].
3D-ЧПЭхоКГ в режиме реального времени пре-
доставляет возможность выполнить точные и вос-
производимые измерения области митрального
клапана и может быть использована у пациентов
при низком качестве изображения из транстора-
кальных окон [23].
Технические трудности, присущие планиметрии,
оправдывают систематическое использование мето-
да времени полуспада давления, учитывая его огра-
ничения из-за искажающих факторов. Как показы-
вает наша практика, самые значительные расхожде-
ния результатов данного метода и планиметрии
наблюдаются у пациентов старше 60 лет и у паци-
ентов с фибрилляцией предсердий не только после,
но и до проведения БМК [24].
В современной практике для стандартной оценки
МС рекомендовано использовать 2D-планиметрию
и метод времени полуспада давления (рис. 21 .3).
Другие методы используются только в том случае,
если традиционные измерения являются неубеди-
тельными или не соответствуют клиническим дан-
ным (см. табл. 21 .1) [11].
СТРОЕНИЕ КЛАПАНА
Разработаны различные подходы к объединению
анатомических особенностей МС для прогнозиро-
вания результатов БМК и, следовательно, для облег-
чения отбора пациентов.
Наиболее широко используемая шкала оцен-
ки — это полуколичественная шкала Wilkins, в ко-
торой 4 компонента оцениваются от 1 до 4 баллов:
подвижность, толщина, кальцификация створок и
нарушение функции подклапанного аппарата (та-
бл. 21 .2). Баллы по четырем компонентам суммиру-
ются, в результате чего получается окончательный
показатель в диапазоне от 4 до 16 баллов [25].
Шкала Cormier — это еще один подход, осно-
ванный на глобальной оценке строения митраль-
ного клапана, с распределением по трем группам в
соответствии с лучшим вариантом хирургического
вмешательства: пациенты 1-й группы — опти-
мальные кандидаты для закрытой комиссурото-
мии, пациенты 2-й группы более подходят для
открытой комиссуротомии, а лечение пациентов
3-й группы обычно проводят путем замены клапа-
на (табл. 21.3). Соответствующие диапазоны бал-
лов по шкале Wilkins составляют 7–9 баллов для
1-й группы, 8–12 баллов для 2-й группы и 10–15
баллов для 3-й группы [26].
Эти две шкалы были разработаны в начале раз-
вития БМК, поэтому хорошо была изучена их кор-
реляция с немедленными и отдаленными результа-
тами БМК.
Общим ограничением этих двух шкал оценки
является отсутствие информации о локализации
утолщения и кальцификации створок, в частности,
в отношении комиссур, что может повлиять на ре-
зультаты БМК [27–29]. Еще одним недостатком со-
временных шкал оценки является то, что соответ-
In-21_для нас.indd 499
03.04.2019 12:00:27
500 ЧАСТЬ IV Пороки клапанов сердца
ствующие значения каждого нарушения требуют
обсуждения. В частности, вероятно, недооценено
значение недостаточности подклапанного аппарата
[30].
Морфология комиссур была включена в шкалу
оценки в целях прогнозирования возникновения
тяжелой митральной недостаточности после БМК.
Однако не изучалась его прогностическое значение
для непосредственного открытия клапана и позд-
них результатов [31]. Эта шкала оценки требует
валидации в ходе больших серийных исследований
и не имеет широкого применения на практике. Не-
давно было описано включение в шкалу оценки
анатомического строения комиссур с хорошими
прогностическими результатами для немедленных
результатов БМК [32].
Баллы Подвижность
Утолщение
Кальцификация
Утолщение подклапанного аппарата
1
Высокая подвижность
клапана с ограничением
только кончиков створок
Толщина створок
почти соответствует
норме (4–5 мм)
Единичная область
повышенной
эхо-яркости
Минимальное утолщение чуть ниже
митральных створок
2
Нормальная подвижность
створки в средней части и
у основания
Средняя часть створки
не изменена,
значительное
утолщение краев
(5–8 мм)
Рассеянные области
ограничены краями
створки
Утолщение хордовых структур,
занимающее1/3 длины хорды
3
В фазе диастолы наблюда-
ется продвижение
клапана, в основном от
основания
Утолщение всей
створки (5–8 мм)
Яркость распространя-
ется на среднюю
часть створки
Утолщение распространяется на
дистальную треть хорд
4
Минимальное движение в
фазе диастолы, либо его
отсутствие
Значительное утолще-
ние всей створки (>
8–10 мм)
Выраженная яркость,
занимающая
большую часть
створки
Выраженное утолщение и укороче-
ние всех хордовых структур,
распространяющееся до сосочковых
мышц
* Общий балл — это сумма баллов четырех компонентов (диапазон от 4 до 16 баллов).
[Wilkins GT, Weyman AE, et al. Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome
and the mechanism of dilatation. Br Heart J 60:299–308, 1988.]
ТАБЛИЦА 21.2 Оценка анатомического строения митрального клапана по шкале Wilkins*
Пока еще нет масштабных сравнительных оце-
нок прогностического значения различных шкал,
которые могли бы привести к рекомендации ис-
пользования какой-либо одной из них. Для специа-
листа в области ЭхоКГ лучшим решением является
использование хорошо изученного метода анализа
с включением анатомии клапана наряду с другими
клиническими и эхокардиографическими данны-
ми. Эхокардиографическое заключение должно со-
держать подробное описание анатомического стро-
ения митрального клапана, а не представлять толь-
ко сумму баллов по шкалы оценки [19].
ЭХОКАРДИОГРАФИЯ С ФИЗИЧЕСКОЙ НАГРУЗКОЙ
ЭхоКГ с физической нагрузкой позволяет оцени-
вать митральный градиент и систолическое давле-
Рис. 21 .3 Оценка степени митрального стеноза перед проведением баллонной митральной комиссуротомии. Соответствие между оценками с помо-
щью (A) A планиметрии (ТТЭхоКГ, парастернальная позиция по короткой оси; площадь клапана 0,90 см2) и (Б) метода полуспада давления (непрерывно-волно-
вая допплерография диастолического митрального кровотока; площадь клапана 0,85 см2). Средний градиент давления равен 8 мм рт. ст.
А
Б
In-21_для нас.indd 500
03.04.2019 12:00:27
501
21 Митральный стеноз
Эхокардио-
графическая
группа
Анатомическое строение митрального
клапана
1-я
Гибкая некальцифицированная передняя
митральная створка с легким пора жением
подклапанного аппарата (т.е. тонкие
хорды длиной ≥ 10 мм)
2-я
Гибкая не кальцифицированная передняя
митральная створка с тяжелым пораже-
нием подклапанного аппарата (т.е.
утолщенные хорды длиной < 10 мм)
3-я
Кальцификация митрального клапана
любой степени, оцениваемая с помощью
рентгеноскопии, независимо от состояния
подклапанного аппарата
[Iung B, Cormier B, Ducimetiere P, et al. Immediate results of percutane-
ous mitral commissurotomy. A predictive model on a series of 1514
patients. Circulation 94:2124–2130, 1996.]
ТАБЛИЦА 21.3 Оценка анатомического строения
митрального клапана по шкале Cormier
ние в легочной артерии по мере увеличения уровня
нагрузки. Для этого подхода в настоящее время
используют ЭхоКГ после физической нагрузки, что
сопровождается быстрыми изменениями сопрово-
ждаясь ростом частоты сердечных сокращений.
Ударный объем и площадь клапана сложнее оце-
нить во время физической нагрузки, их анализ вы-
полняется только в исследовательских целях. В до-
полнение к оценке объективной функциональной
толерантности, современные руководства содержат
рекомендации использовать ЭхоКГ с физической
нагрузкой для оценки среднего градиента и давле-
ния в легочной артерии при несоответствии между
результатами ЭхоКГ в покое и клинической карти-
ной [20, 21]. Однако в настоящее время отсутствуют
пороговые значения среднего градиента и систоли-
ческого давления в легочной артерии при физиче-
ской нагрузке, которые могли бы указывать на
рассмотрение возможности выполнения вмеша-
тельства у пациентов без наличия симптомов. Как
показывает наш опыт, тип ограничивающих сим-
птомов (одышка или усталость) больше связаны с
характером увеличения митрального градиента, а
не с уровнем среднего градиента или систолическо-
го давления в легочной артерии при максимальной
нагрузке [33].
ВО ВРЕМЯ БАЛЛОННОЙ МИТРАЛЬНОЙ КОМИССУРОТОМИИ
ЭхоКГ также имеет важное значение в лаборатории
катетеризации, в частности, при использовании ме-
тодики Inoue (рис. 21 .4) [34]. Основными преиму-
ществами баллона Inoue являются его простота ис-
пользования, отчасти связанная с его способностью
к фиксации с возможностью выполнения поэтап-
ного раздувания и постепенным увеличением диа-
метра баллона. ТТЭхоКГ позволяет оценить пло-
щадь клапана, степень открытия комиссур, средний
градиент и митральную недостаточность после
каждого раздувания баллона, указывая на необхо-
димость продолжения раздувания баллона или пре-
кращение процедуры. Для контроля БМК следует
использовать планиметрию, потому что при этом
метод времени полуспада давления не всегда наде-
жен, а средний градиент зависит от изменений ус-
ловий нагрузки или частоты сердечных сокраще-
ний. ЭхоКГ в лаборатории катетеризации также
позволяет оперативно обнаружить перикардиаль-
ный выпот, который представляет собой редкое, но
серьезное осложнение при транссептальной катете-
ризации.
В сложных ситуациях во время БМК может по-
требоваться ЧПЭхоКГ, главным образом для кон-
троля транссептальной катетеризации (рис. 21 .5).
Из-за дискомфорта пациента при проведении ЧПЭ-
хоКГ процедура обычно выполняется под общей
анестезией.
РАННИЙ ПЕРИОД ПОСЛЕ БАЛЛОННОЙ
МИТРАЛЬНОЙ КОМИССУРОТОМИИ
Сразу после БМК планиметрия с помощью двух-
мерной ЭхоКГ представляет собой эталонный ме-
тод измерения площади митрального клапана. Этот
Рис. 21.4 Катетерная баллонная митральная комиссуротомия с помо-
щью баллона Inoue. Катетер вводится через межпредсердную перегородку
и баллон раздувается в просвете митрального клапана. Узкая часть баллона
располагается в области митрального отверстия, и продолжение надувания
приводит к открытию комиссур. (A) Правая передняя косая позиция. (Б) Левая
передняя косая позиция.
А
Б
In-21_для нас.indd 501
03.04.2019 12:00:28
502
ЧАСТЬ IV Пороки клапанов сердца
метод позволяет визуализировать открытие комис-
сур, что должно быть включено в отслеживание
площади клапана. В данной ситуации метод време-
ни полуспада давления неточен, возможно, из-за
резких изменений жесткости сердечной камеры или
наличия сброса крови справа налево в месте пунк-
ции перегородки [11]. Однако метод времени полу-
спада давления демонстрирует хорошую специфич-
ность, несмотря на низкую чувствительность, для
выявления хорошего открытия клапана, что может
быть применимо при технических затруднениях
исследования [24].
Эхокардиографическая оценка степени раскры-
тия каждой комиссуры в высокой степени сопоста-
вима с характером ближайших и отдаленных функ-
циональных результатов БМК [35]. Таким образом,
степень открытия комиссур представляет собой
дополнительный маркер ближайших результатов
БМК (рис. 21 .6). Этот показатель также применим
при оценке исходного уровня для интерпретации
последующего эхокардиографического наблюде-
ния. 3D-ЭхоКГ в режиме реального времени позво-
ляет улучшить качество оценки степени открытия
комиссур [22, 23].
Хотя градиент не представляет собой надежный
маркер тяжести МС, после БМК его следует оцени-
вать в связи с прогностическим значением относи-
тельно отдаленных функциональных результатов. У
пациентов, у которых изначально отмечалась легоч-
ная гипертензия, обычно наблюдалось снижение
давления в легочной артерии в раннем периоде после
БМК, хотя по истечении нескольких месяцев прояв-
ления ее становились более выраженными [36].
В большинстве случаев после БМК может наблю-
даться незначительное увеличение митральной не-
достаточности. Умеренная митральная недостаточ-
ность часто связана с неполным закрытием свобод-
ных краев или комиссур из-за их утолщения и
ригидности [37]. В этих случаях при цветовой
допплерографии определяются центральные или
комиссуральные небольшие струи регургитации, а
при 2D-ЭхоКГ отсутствуют признаки травматиче-
ского повреждения. При выраженной митральной
недостаточности следует тщательно оценивать ее
механизм, при необходимости используя ЧПЭхоКГ
и обращая внимание на травматические поврежде-
ния. Травматическая митральная недостаточность в
основном обусловлена разрывом створки вне ко-
миссуры и часто ассоциирована с отсутствием от-
крытия комиссур, на что указывают результаты
ЭхоКГ, и что подтверждается при хирургическом
вмешательстве (рис. 21 .7) [37]. Также часто наблю-
даются повреждения подклапанного аппарата, что
в большинстве случаев представлено разрывами
хорд, тогда как частичный или полный разрыв со-
сочковых мышц встречается реже. Эти поврежде-
ния приводят к крайне тяжелой митральной недо-
статочности у пациентов с гибкими створками.
Другие результаты после процедурной ЭхоКГ
имеют менее важное значение в ведении пациентов.
Обычно в области пункции перегородки с помо-
щью ЧПЭхоКГ определяется сброс крови из одного
предсердия в другое [38]. Как правило, наблюдается
незначительные шунты, которые в большинстве
случаев постепенно закрываются. Через 6 месяцев
после БМК небольшие остаточные шунты наблюда-
ются менее чем 10% у пациентов [38]. Обычно после
успешной БМК снижается интенсивность спонтан-
ного контрастирования в ЛП, и этот процесс может
протекать до шести месяцев [39].
ПОСЛЕДУЮЩИЕ НАБЛЮДЕНИЯ
ЭхоКГ при последующем наблюдении выполняется
для оценки общих характеристик функции клапана
и последствий процедуры. Наиболее распростра-
ненное осложнение — это рестеноз, который обыч-
но характеризуется площадью клапана < 1,5 см2 и
потерей > 50% начального усиления в площади
отверстия клапана, хотя стандартное определение
отсутствует [34, 40]. При оценке анатомии клапана
Рис. 21 .5 ЧПЭхоКГ во время баллонной митральной комиссуротомии. (A) A Пункция межпредсердной перегородки (стрелка). (Б) A 3D-ЧПЭхоКГ де-
монстрирует расположение баллона (стрелка) в отверстии митрального клапана (предоставлено Dr. Brochet).
А
Б
In-21_для нас.indd 502
03.04.2019 12:00:29
503
21 Митральный стеноз
у пациентов с рестенозом особое внимание следует
обратить на степень сращения комиссур, поскольку
это помогает определить дальнейшую тактику в
пользу повторной БМК или хирургического вмеша-
тельства.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
В ходе одноцентровых и многоцентровых серийных
исследований был выполнен анализ ближайших и
отдаленных (до 20 лет) результатов БМК, и были
определены прогностические факторы, что поло-
жительно отразилось на отборе пациентов.
РЕЗУЛЬТАТЫ ВЫПОЛНЕНИЯ БАЛЛОННОЙ
МИТРАЛЬНОЙ КОМИССУРОТОМИИ
НЕЭФФЕКТИВНОСТЬ И ОСЛОЖНЕНИЯ
Двумя основными причинами неэффективности
являются невозможность выполнения пункции пе-
регородки или размещения баллона в просвете ми-
трального отверстия. Частота неэффективности в
ПСМК
ЗСМК
Рис. 21 .7 Тяжелая митральная недостаточность, осложняющая бал-
лонную митральную комиссуротомию. Механизм связан с разрывом пе-
редней створки (стрелка), что отмечается в интраоперационной проекции ми-
трального клапана. ЗСМК — задняя створка митрального клапана; ПСМК —
передняя створка митрального клапана (предоставлено Dr Raffoul).
Рис. 21.6 Митральный стеноз с кальцификацией переднелатеральной комиссуры (стрелки). (A) A ТТЭхоКГ перед выполнением баллонной митраль-
ной комиссуротомии (короткая ось проекция; площадь клапана: 1,2 см2. (Б) A 3D-ТТЭхоКГ перед выполнением баллонной митральной комиссуротомии (проек-
ция со стороны ЛП). (В) A ТТЭхоКГ после выполнения баллонной митральной комиссуротомии (проекция короткая ось, полное открытие заднемедиальной ко-
миссуры; площадь клапана: 1,65 см2). (Г) A 3D-ТТЭхоКГ после выполнения баллонной митральной комиссуротомии (проекция со стороны ЛЖ, полное открытие
заднемедиальной комиссуры).
А
Б
В
Г
In-21_для нас.indd 503
03.04.2019 12:00:31
504
ЧАСТЬ IV Пороки клапанов сердца
серийных исследованиях с участием квалифициро-
ванных бригад составляет примерно 1% [40–44].
Более высокие показатели были зарегистрированы
у бригад с меньшим опытом, что отражает важность
накопления опыта [15, 45].
Тяжелые осложнения встречаются редко и, сле-
довательно, для их оценки необходимы большие
серийные исследования (табл. 21 .4) [40–52]. Боль-
ничная смертность наблюдается менее чем у 1%
пациентов, и обычно эти пациенты находятся в
плохом клиническом состоянии из-за преклонного
возраста или серьезных нарушений гемодинамики.
В результате перфорации транссептальной иглой
или металлическим проводником катетера возника-
ет тампонада. Риск тромбоэмболических осложне-
ний обычно ниже 2%. Эмболия в основном обу-
словлена фибринозно-тромботическими сгустками.
Они могут возникать, несмотря на систематический
скрининг тромбоза ЛП с помощью ЧПЭхоКГ. Тех-
ническое упрощение подхода, характерное для тех-
ники Inoue, способствуют снижению частоты ос-
ложнений, в частности тампонады, и частично
объясняет широкое использование этой техники
[53].
Тяжелая травматическая митральная недоста-
точность является наиболее распространенным тя-
желым осложнением БМК, возникающим в 1–10%
случаев. В попытках определить прогностические
факторы не было получено достоверных результа-
тов, что может быть связано с небольшим количе-
ством проанализированных случаев и различиями
в методах, используемых для определения тяжелой
митральной недостаточности [31, 37]. Тяжелая ми-
тральная недостаточность чаще наблюдается у па-
циентов с очень выраженным МС и у пациентов с
выраженным поражением створок и подклапанного
аппарата, особенно при неоднородности локализа-
ции патологических изменений створок [31]. Одна-
ко развитие тяжелой митральной недостаточности
у любого пациента по-прежнему в значительной
степени не поддается прогнозу. Тяжелая острая ми-
тральная недостаточность часто требует хирургиче-
ского вмешательства в сроки не более нескольких
недель или месяцев, но редко представляет собой
экстренную ситуацию.
Осложнения процедуры чаще встречаются в не-
больших клиниках и в значительной степени зави-
сят от опыта интервенционного кардиолога [45].
Это подтверждается в ходе анализа общенацио-
нальной базы данных Соединенных Штатов Амери-
ки, по результатам которого оперативный объем
демонстрировал тесную корреляцию с общими ко-
нечными показателями осложнений процедуры и
летальности [54]. В ходе этого серийного исследова-
ния отмечалось увеличение частоты осложнений
процедуры в период с 1998 по 2010 гг., что может
быть связано с увеличением возраста пациентов и
частоты сопутствующих заболеваний, а также со
снижением среднегодового оперативного объема
[54]. Эти результаты подчеркивают необходимость
проведения БМК опытными специалистами в круп-
ных центрах [20, 21].
БЛИЖАЙШИЕ РЕЗУЛЬТАТЫ
После БМК наблюдается приблизительное удвое-
ние площади митрального клапана у пациентов,
которым процедура была выполнена с помощью
различных техник (табл. 21 .5) [40–44, 46–52, 55, 56].
В ходе серийного исследования, включающего кате-
теризацию сердца, было продемонстрировано зна-
чительное снижение давления в ЛП и легочной ар-
терии и увеличение сердечного выброса. Однако в
настоящее время вряд ли будут проводиться инва-
зивные исследования в рамках стандартного обсле-
дования.
Для упрощения интерпретации и сравнения ре-
зультатов серийных исследований ближайшие ре-
зультаты также выражаются согласно двухкомпо-
нентному конечному показателю, который чаще
всего представляет собой объединение конечной
площади клапана не менее 1,5 см2 без наличия ми-
тральной недостаточности выше 2 степени из 4.
Анатомическое строение митрального клапана,
оцениваемое с помощью ЭхоКГ, независимо от ис-
пользуемой шкалы оценки, является сильным про-
гностическим фактором ближайших результатов
БМК [15, 42, 46–49, 51]. Согласно анализа ближай-
ших результатов БМК пороговое значение по шкале
Wilkins установлено на уровне 8 баллов. Однако
прогностическое значение всех шкал оценки огра-
ничено, о чем свидетельствует низкий коэффици-
ент корреляции (r = –0,15) между оценкой по шкале
Wilkins и конечной площадью клапана [57]. В ходе
крупных серийных исследований, участие в кото-
рых принимали пациенты с различными характе-
ристиками, было продемонстрировано, что на бли-
жайшие результаты БМК сильное влияние оказыва-
ют дополнительные факторы [15, 57, 58]. Пожилой
возраст и малая площадь клапана являются не
только значимыми прогностическими факторами
неудовлетворительных ближайших результатов, но
также имеют схожее или более выраженное прогно-
стическое значение, чем кальцификация клапана
[15, 58].
Была отмечена менее обоснованная корреляция
между неблагоприятными ближайшими результа-
тами и ранее выполнявшейся комиссуротомией или
изначальной митральной недостаточностью, кото-
рые могут быть связаны с дифференциальным эф-
фектом согласно других характеристик, что отража-
ется значительным взаимодействием. Исходя из
нашей практики, сочетание возраста и предшеству-
ющей комиссуротомии означает, что ранее выпол-
нявшаяся комиссуротомия является фактором неу-
довлетворительных ближайших результатов только
у пациентов старше 50 лет [15].
In-21_для нас.indd 504
03.04.2019 12:00:34
505
21 Митральный стеноз
Ведущий автор
Пациенты
(n)
Возраст
(лет)
Больничная
смертность
(%)
Тампонада
(%)
Эмболиче-
ские
осложнения
(%)
Выраженная
митральная
недостаточность
(%)
Arora [43] (1987–2000)
4850
27
0,2
0,2
0,1
1,4
Chen [a41] (1985–1994)
4832
37
0,1
0,8
0,5
1,4
Iung [44] (1986–2001)
2773
47
0,4
0,2
0,4
4,1
Neumayer [49] (1989–2000)
1123
57
0,4
0,9
0,9
6,0
Palacios [48] (1986–2000)
879
55
0,6
1,0
1,8
9,4
Jneid [50] (1986–2000)
876
55
0,6
0,8
1,7
9,1
NHLBI Registry [45] (1987–1989)*
n<25
25≤n<100
n≥100
738
54
2
1
0,3
6
4
2
4
2
1
4
3
3
Ben Farhat [42] (1987–1998)
654
33
0,5
0,6
1,5
4,6
Hernandez [40] (1989–1995)
620
53
0,5
0,6
—
4,0
Fawzy [51] (1989–2006)
578
32
0
0,9
0,5
1,6
Meneveau [46] (1986–1996)
532
54
0,2
1,1
—
3,9
Tomai [52] (1991–2010)
527
55
0,4
0,4
0,2
4,9
Stefanadis [47] (1988–1996)*
441
44
0,2
0
0
3,4
* Многоцентровые серийные исследования.
ТАБЛИЦА 21.4 Тяжелые осложнения баллонной митральной комиссуротомии
Площадь митрального
отверстия (см2)
Ведущий автор
Пациенты
(n)
Возраст
(лет)
До БМК
После БМК Метод
Chen [41]
4832
37
1,1
2,1
Баллон Inoue
Arora [43]
4850
27
0,7
1,9
Баллон Inoue или двойной баллон или
комиссуротомия металлическим стентом
Iung [44]
2773
47
1,0
1,9
Баллон Inoue, одинарный или двойной
баллон
Neumayer [49]
1123
57
1,1
1,8
Баллон Inoue
Palacios [48]
879
55
0,9
1,9
Баллон Inoue или двойной баллон
Jneid [50]
876
55
0,9
1,9
Баллон Inoue или двойной баллон
Ben Farhat [42]
654
33
1,0
2,1
Баллон Inoue или двойной баллон
Hernandez [40]
561
53
1,0
1,8
Баллон Inoue
Fawzy [51]
547
32
0,9
2,0
Баллон Inoue
Meneveau [46]
532
54
1,0
1,7
Баллон Inoue или двойной баллон
Tomai [52]
527
55
1,0
1,9
Баллон Inoue
Eltchaninoff [56]
500
34
0,9
2,1
Комиссуротомия металлическим стентом
Stefanadis [47]
441
44
1,0
2,1
Модифицированная одинарный или
двойной баллон или баллон Inoue
(ретроградная)
Kang [55] (рандо-
мизированное
сравнение)
152
150
42
40
0,9
0,9
1,8
1,9
Баллон Inoue
Двойной баллон
БМК — баллонная митральная комиссуротомия.
ТАБЛИЦА 21.5
Ближайшие результаты баллонной митральной комиссуротомии: увеличение площади отверстия
митрального клапана
In-21_для нас.indd 505
03.04.2019 12:00:34
506 ЧАСТЬ IV Пороки клапанов сердца
Хотя у пациентов с кальцификацией клапана сред-
няя площадь клапана ниже, у большинства из них
БМК имеет хорошие результаты без большого коли-
чества осложнений, что служит обоснованием для
использования БМК в качестве терапии первой ли-
нии при других благоприятных характеристиках [59].
В соответствии с выявленными прогностически-
ми факторами результаты серийных исследований
с участием преимущественно молодых пациентов с
благоприятным анатомическим строением демон-
стрируют очень хорошие ближайшие результаты
[41–43, 51].
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
В большинстве серийных исследований оценка от-
даленных результатов после БМК основана на кли-
нических результатах, поскольку стандартизиро-
ванное эхокардиографическое последующее на-
блюдение может столкнуться с затруднениями при
наблюдении нескольких пациентов в течение дли-
тельного периода времени.
Отдаленные результаты следует интерпретиро-
вать в соответствии с характером ближайших ре-
зультатов. У большинства пациентов с остаточным
стенозом или тяжелой митральной недостаточность
после БМК требуются оперативное вмешательство,
сроки которого во многом зависят от сопутствую-
щих заболеваний и тактики медицинской бригады.
И наоборот, сердечно-сосудистые осложнения ред-
ко возникают после успешной БМК, и у большин-
ства пациентов отмечается устойчивое функцио-
нальное улучшение (рис. 21 .8). Митральный ресте-
ноз является наиболее распространенной причиной
позднего клинического ухудшения после успешной
хирургической комиссуротомии [40, 60, 61].
В целом, отдаленные результаты БМК удовлет-
ворительны, однако имеется широкий диапазон
клинических исходов (табл. 21 .6) [40, 42, 46–48, 51,
52, 62–64]. Выраженные расхождения связаны с раз-
личиями в характеристиках пациентов. Результаты
серийных исследований, выполнявшихся в разви-
вающихся странах с участием преимущественно
молодых пациентов с благоприятным анатомиче-
ским строением, демонстрируют более высокие
показатели бессобытийной выживаемости, чем ре-
зультаты серийных исследований, выполнявшихся
в западных странах с участием пожилых пациентов
с менее благоприятным анатомическим строением.
Более длительный срок последующего наблюде-
ния после БМК был при проведении серийных ис-
следований в европейской популяции со средним
возрастом 49 или 55 лет и субоптимальными анато-
мическими характеристиками [52, 62]. В ходе двух
серийных исследований с участием 912 и 482 паци-
ентов, у которых была успешно выполнена БМК,
получены постоянные значения 20-летних показа-
телей сердечно-сосудистой выживаемости без вме-
шательства (повторная БМК или оперативное вме-
шательство), которые составили 38% (±2%) и 36%
(± 5%) соответственно. Соответствующие показате-
ли составили 33% (±2%) и 21% (±5%) при учете
функционального класса (ФК) I или II по NYHA при
последующем наблюдении (см. рис. 21 .8) [52, 62].
Анатомическое строение клапана служит одним
из прогностических факторов отдаленных клиниче-
ских исходов (рис. 21 .9) [40, 42, 46–48, 51, 52, 62–64].
0
0
0
5
10
Последующее наблюдение (годы)
С
у
м
м
а
р
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
б
е
з
л
е
т
а
л
ь
н
о
г
о
и
с
х
о
д
а
и
п
о
в
т
о
р
н
о
г
о
в
м
е
ш
а
т
е
л
ь
с
т
в
а
(
%
)
15
20
3
90
225
360
527
Количество пациентов
в группе риска
0%
20%
40%
60%
80%
100%
20
40
60
80
100
24681
01
2
Годы
Хорошие ближайшие
результаты
Все пациенты
Неблагоприятные
промежуточные результаты
Количество пациентов
в группе риска
912
1024
112
839
870
31
761
777
16
673
687
14
620
630
10
507
516
9
446
465
9
375
383
8
111
114
3
237
242
5
45
47
2
Хорошие ближайшие результаты (n = 912)
Все пациенты (n = 1024)
Неблагоприятные ближайшие результаты (n = 112)
Х
о
р
о
ш
и
е
ф
у
н
к
ц
и
о
н
а
л
ь
н
ы
е
р
е
з
у
л
ь
т
а
т
ы
(
%
)
14161820
Рис. 21 .8 Долгосрочные результаты после хороших ближайших результатов баллонной митральной комиссуротомии. (A) Хорошие функциональ-
ные результаты (сердечно-сосудистая выживаемость без вмешательства и с ФК I или II по NYHA) у 912 пациентов. (Б) Бессобытийная выживаемость у 482 паци-
ентов [Bouleti C, Iung B, Laouénan C, et al. Late results of percutaneous mitral commissurotomy up to 20 years: development and validation of a risk score predicting late
functional results from a series of 912 patients. Circulation 125:2119–2127, 2012; Tomai F, Gaspardone A, Versaci F, et al. Twenty year follow-up after successful percutaneous
balloon mitral valvuloplasty in a large contemporary series of patients with mitral stenosis. Int J Cardiol 177:881–885, 2014].
А
Б
In-21_для нас.indd 506
03.04.2019 12:00:34
507
21 Митральный стеноз
Помимо отклонений в анатомическом строении
клапана, основными прогностическими факторами
неудовлетворительных отдаленных результатов слу-
жат старший возраст и такие последствия МС, как
ФК по NYHA и наличие фибрилляции предсердий
(табл. 21 .7). Эти прогностические факторы согласу-
ются с предыдущим опытом хирургической комис-
суротомии [61].
Даже у пациентов с хорошими ближайшими ре-
зультатами степень открытия клапана оказывает
влияние на отдаленные результаты [40, 52, 62, 64].
Помимо площади клапана после выполнения про-
цедуры средний митральный градиент после БМК
также представляет собой сильный прогностиче-
ский фактор отдаленных клинических результатов
[62]. Степень открытий комиссур тесно связана с
площадью клапана и градиентом после выполнения
процедуры, но по результатам многомерного ана-
лиза не имела инкрементальной прогностической
ценности для отдаленной без событий выживаемо-
сти [35]. Сохранение высокого градиента после
БМК, несмотря на хорошее открытие клапана, мо-
жет быть связано с ограничением резерва клапана,
обусловленным потерей эластичности, что может
способствовать развитию позднего рестеноза. Раз-
личные прогностические факторы отдаленных
функциональных исходов могут быть скомбиниро-
ваны с помощью шкалы оценки, которая позволяет
оценивать хорошие функциональные исходы у от-
дельного пациента в соответствии с первоначаль-
ными характеристиками и ближайшим результатом
БМК (рис. 21 .10, см. также табл. 21 .7) [62].
В ходе серийного исследования, включающего по-
следовательные эхокардиографические обследования,
было продемонстрировано постепенное уменьшение
средней площади митрального клапана с течением
времени согласно линейному образу [40, 60]. Ежегод-
ное уменьшение площади клапана варьирует в разных
серийных исследованиях в соответствии с различия-
ми в характеристиках пациентов, что приводит к не-
однородности оценки частоты рестеноза. Напротив,
увеличение легкой или умеренной митральной недо-
статочности не наблюдается [40].
ОСОБЫЕ ПОДГРУППЫ
Рестеноз после ранее проведенной комиссуротомии
У пациентов с рестенозом после ранее проведенной
закрытой или открытой комиссуротомии БМК вы-
полнима и позволяет избежать повторного опера-
ционного вмешательства, при условии, что рестеноз
обусловлен бикоммуссуральным сращением [65,
66]. Даже если результаты менее удовлетворитель-
ны, чем на нативных клапанах, мы зарегистрирова-
ли 19% показатель 19% 20-летних хороших функ-
циональных исходов после успешной БМК [66].
Отсутствовало различие отдаленных функциональ-
ных результатов в зависимости от типа первичной
комиссуротомии (на закрытом или открытом серд-
це, или БМК) [66]. Возможность отложить на позд-
ний срок операцию по меньшей мере на 10 лет у
половины пациентов позволяет отсрочить возник-
новение осложнений, обусловленных протезом,
потому что у большинства пациентов с рестенозом
оперативное вмешательство включает замену кла-
Ведущий автор
Пациенты (n)
Возраст (лет)
Максимальное
последующее
наблюдение (годы)
Бессобытийная
выживаемость (%)
Bouleti [62]
1024
49
20
34*, 30†
Palacios [48]
879
55
12
33†
Ben Farhat [42]
654
34
10
72†
Hernandez [40]
561
53
7
69†
Fawzy [c51]£
547
32
19
28†
Meneveau [46]
532
54
7,5
52†
Tomai [c52]£
482
55
20
36*, 21†
Stefanadis [47]
441
44
9
75†
Song [64]
402
44
9
90*
Orrange [63]
132
44
7
65*
* Выживаемость без вмешательства (протезирование митрального клапана или повторная баллонная митральная комиссуротомия).
† Выживаемость без вмешательства и ФК I или II по NYHA.
£ Пациенты с хорошими ближайшими результатами.
ТАБЛИЦА 21.6 Отдаленные результаты (более пяти лет) баллонной митральной комиссуротомии
In-21_для нас.indd 507
03.04.2019 12:00:35
508 ЧАСТЬ IV Пороки клапанов сердца
Скорректированное
отношение рисков (95% ДИ) p
Баллы по шкале
(из 13)
Возраст (лет) и окончательная площадь отвер-
стия митрального клапана (см2)
<50иПОМК≥2,00
10
< 50 и ПОМК 1,50–2,00 или
50–70 и ПОМК > 1,75
2,1 (1,6–2,9)
< 0,0001
2
50–70 и ПОМК 1,50–1,75 или
≥70иПОМК≥1,50
5,1 (3,5–7,5)
< 0,0001
5
Анатомическое строение клапана и пол
Кальцификации отсутствует
Кальцификация клапана
Женщины
Мужчины
1
1,2 (0,9–1,6)
2,3 (1,6–3,2)
0,18
< 0,0001
0
0
3
Ритм и функциональный класс по NYHA
Синусовый ритм или
Фибрилляция предсердий и I–II класс по NYHA
Фибрилляция предсердий и III–IV класс по NYHA
1
1,8 (1,4–2,3)
< 0,0001
0
2
Конечный средний митральный градиент
(мм рт. ст.)
≤3
3–6
≥6
1
(1,0–1,8)
2,5 (1,8–3,5)
0,05
< 0,0001
0
1
3
* Площадь митрального отверстия ≥ 1,5 см2 без недостаточности > 2/4. Многофакторный анализ и определение прогностической шкалы
оценки отдаленных результатов. Соответствие между оценкой по шкале и прогнозируемым отдаленным результатом показано на рис.
21.10 .
NYHA — New York Heart Association; ДИ — доверительный интервал; ПОМК — площадь отверстия митрального клапана; ФК — функ-
циональный класс.
[Bouleti C, Iung B, Laoue
́
nan C, et al. Late results of percutaneous mitral commissurotomy up to 20 years: development and validation of a risk score
predicting late functional results from a series of 912 patients. Circulation 125:2119–2127, 2012.]
ТАБЛИЦА 21.7
Прогностические факторы неблагоприятных отдаленных функциональных результатов
после хороших ближайших результатов баллонной митральной комиссуротомии*
пана. Наиболее эффективна БМК при рестенозе у
молодых пациентов [66].
По мере роста числа процедур БМК чаще наблю-
дается рестеноз. У отдельных пациентов может быть
выполнена повторная БМК с хорошими средне-
срочными клиническими результатами, особенно у
молодых пациентов со слабо выраженной кальци-
фикацией или ее отсутствием [65, 67], но у пожилых
пациентов с кальцифицированными клапанами
эффективность процедуры менее убедительна [68,
69]. Возможность выполнения повторной БМК по-
зволяет отсрочить оперативное вмешательство. Это
отражается показателем 20-летней сердечно-сосу-
дистой выживаемости без вмешательства (повтор-
ная БМК или хирургическое вмешательство) после
успешной БМК равным 38%, и его увеличением до
46% при учете сердечно-сосудистой выживаемости
без оперативного вмешательства. При возрасте па-
циентов < 50 лет на момент первичной БМК наблю-
далась особая эффективность повторной БМК с
показателем 20-летней выживаемости без хирурги-
ческого вмешательства равным 57% (рис. 21 .11)
[67].
Эхокардиографическая оценка анатомического
строения клапана должна включать тщательное
обследование степени повторного сращения ко-
миссур. Результаты повторной БМК менее удов-
летворительны у пациентов с неполным сращени-
ем комиссур. Независимо от типа первичной ко-
миссуротомии, БМК не следует рассматривать в
случае постоянного открытия обеих комиссур
(рис. 21.12).
Пожилой возраст
Теоретически пожилые пациенты не могут быть
хорошими кандидатами для БМК, потому что у них
наблюдается сочетание прогностических факторов
неудовлетворительных ближайших и отдаленных
результатов, в частности, помимо пожилого возрас-
та, кальцификации клапана, фибрилляции предсер-
дий и выраженной симптоматики. Несмотря на
неблагоприятное анатомическое строение, часто
достигаются хорошие ближайшие результаты, но
последующее ухудшение развивается быстрее, чем
у более молодых пациентов [70–73]. Однако следует
сопоставлять эти результаты с возможным вариан-
In-21_для нас.indd 508
03.04.2019 12:00:35
509
21 Митральный стеноз
02468101214161820
0–2 балла по шкале оценки
3–5 баллов по шкале оценки
6–13 баллов по шкале оценки
Годы
0–2 балла по шкале оценки
3–5 баллов по шкале оценки
6–13 баллов по шкале оценки
81
146
69
78
138
55
71
122
47
66
111
36
62
94
32
58
81
28
53
71
22
49
53
17
37
28
10
20
10
1
6
3
0
Х
о
р
о
ш
и
е
ф
у
н
к
ц
и
о
н
а
л
ь
н
ы
е
р
е
з
у
л
ь
т
а
т
ы
(
%
)
0
20
40
60
80
100
Количество пациентов
в группе риска
Рис. 21.10 Прогностические факторы хороших отдаленных функциональных результатов баллонной митральной комиссуротомии. В шкале
оценки используются прогностические факторы сердечно-сосудистой выживаемости без вмешательства и I или II функциональный класс по NYHA (см. табл. 21 .7).
Продемонстрированы наблюдаемые показатели (цветные линии) с 95% доверительным интервалом и прогнозируемыми показателями (черные линии) [Bouleti C,
Iung B, Laouénan C, et al. Late results of percutaneous mitral commissurotomy up to 20 years: development and validation of a risk score predicting late functional results
from a series of 912 patients. Circulation 125:2119–2127, 2012].
том оперативного вмешательства, которое связано
с высоким риском в этой популяции. Даже при не-
благоприятном анатомическом строении митраль-
ного клапана БМК можно рассматривать в качестве
паллиативной процедуры у пожилых пациентов с
тяжелым симптоматическим МС.
При эхокардиографическом обследовании сле-
дует уделить особое внимание верификации ревма-
тической этиологии и ее дифференциальной диа-
гностики с дегенеративным МС. Это заболевание
распространено у пожилых пациентов, но редко
вызывает серьезный МС. Дегенеративный МС ха-
рактеризуется обширной кальцификацией ми-
трального кольца, уплотнением створок и откры-
тыми комиссурами (рис. 21 .13). Поскольку при
этом отсутствует сращение комиссур, дегенератив-
ный МС не подлежит БМК.
Молодые пациенты
Тяжелый ревматический МС может встречаться у
молодых пациентов в странах с эндемичной ревма-
тической лихорадкой. В ходе двух серийных иссле-
дований получены приемлемые результаты БМК,
выполненной у пациентов моложе 20 лет с последу-
ющим наблюдением в течение 12 лет [74, 75]. Ре-
зультаты, как правило, были лучше, чем у взрослых,
а отдаленные функциональные исходы не отлича-
лись, при этом показатели бессобытийной выжива-
0
0
0246
8101214161820
Годы
Х
о
р
о
ш
и
е
ф
у
н
к
ц
и
о
н
а
л
ь
н
ы
е
р
е
з
у
л
ь
т
а
т
ы
(
%
)
0
20
40
60
80
100
1–2 ЭхоКГ группа
3 ЭхоКГ-группа + женщины
3 ЭхоКГ-группа + мужчины
10
20
30
40
50
60
70
80
90
100
20406080100120
Оценка по шкале
ЭхоКГ ≥ 12
Оценка по шкале
ЭхоКГ ≤ 8
Оценка по шкале
ЭхоКГ 9–11
Время последующего наблюдения (месяцы)
Б
е
с
с
о
б
ы
т
и
й
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
p < 0,0001
140 160 180
Рис. 21 .9 Влияние анатомического строения клапана на отдаленные результаты баллонной митральной комиссуротомии. (A) Влияние эхокарди-
ографической группы Cormier. (Б) Влияние оценки по шкале Wilkins. ЭхоКГ — эхокардиография [Bouleti C, Iung B, Laouénan C, et al. Late results of percutaneous
mitral commissurotomy up to 20 years: development and validation of a risk score predicting late functional results from a series of 912 patients. Circulation 125:2119–2127,
2012; Palacios IF, Sanchez PL, Harrell LC, et al. Which patients benefit from percutaneous mitral balloon valvuloplasty? Prevalvuloplasty and postvalvuloplasty variables that
predict long-term outcome. Circulation 105:1465–1471, 2002].
А
Б
In-21_для нас.indd 509
03.04.2019 12:00:35
510
ЧАСТЬ IV Пороки клапанов сердца
емости варьировали в пределах 70–80% через 10 лет.
БМК также представляет собой валидированный
метод лечения МС у детей младше 12 лет [76].
Беременные женщины
Гемодинамические изменения во время беременно-
сти ухудшают клиническое течение МС, что может
поставить под угрозу прогноз как матери, так и
плода, особенно при родах. Поэтому во время бере-
менности требуется вмешательство у женщин с со-
хранением симптомов, несмотря на медикаментоз-
ную терапию [77]. БМК может быть благополучно
выполнено во время беременности с хорошей пере-
носимость плода [77]. Увеличение риска развития
тромбоэмболии во время беременности придает
особое значение ЧПЭхоКГ, которую для уменьше-
ния дискомфорта пациента лучше всего выполнять
под анестезией непосредственно перед процедурой.
ЗНАЧЕНИЕ ДЛЯ ОТБОРА ПАЦИЕНТОВ
ПРОТИВОПОКАЗАНИЯ
Противопоказания к БМК приведены в табл. 21 .8 .
Хотя были зарегистрированы случаи проведения
БМК с помощью баллона Inoue у пациентов с тром-
бозом ушка ЛП, опыт применения остается ограни-
ченным. Стойкий тромбоз ЛП, даже при локализа-
ции тромба в ушке ЛП, в большинстве случаев
служит противопоказанием в связи с потенциаль-
ной опасностью, связанной с миграцией тромбов
[20, 21]. Однако при стабильном состоянии пациен-
та следует отложить принятие решения до повтор-
ной ЧПЭхоКГ после как минимум 2 месяцев опти-
мальной антикоагулянтной терапии. Было отмече-
но, что тромбоз ЛП исчезает примерно у одного из
четырех пациентов после 6 месяцев антикоагулянт-
ной терапии, в основном при наличии небольшого
тромба и слабо выраженным спонтанным контра-
стированием ЛП [78].
Митральная недостаточность выше легкой сте-
пени или более 2 класса из 4, определенная с помо-
щью полуколичественного подхода, является про-
тивопоказанием к БМК [20, 21]. Хотя пороговые
значения, полученные на основе количественной
эхокардиографии, не были подтверждены ни одним
исследованием, к ним относятся эффективное от-
верстие регургитации, превышающее 20 мм2 или
объем регургитации > 30 мл/удар. У пациентов с
пограничной митральной недостаточностью веро-
ятно выполнение БМК при благоприятном анато-
мическом строении клапана.
Рис. 21 .12 A Рестеноз митрального клапана после ранее выполнен-
ной открытой комиссуротомии. ТТЭхоКГ в парастернальной позиции по
короткой оси. Обе комиссуры открыты (стрелки), рестеноз обусловлен ригид-
ностью клапана и подклапанного аппарата.
Выживаемость без оперативного
вмешательства на митральном клапане
Выживаемость без вмешательства
на митральном клапане
504
504
478
478
442
442
409
402
371
355
343
322
314
288
280
254
199
176
116
96
52
38
912
912
855
855
786
783
707
697
612
591
548
521
490
456
419
384
273
244
137
115
61
47
02468101214161820
46±2%
38±2%
57±3%
45±3%
Годы
Б
е
с
с
о
б
ы
т
и
й
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
Б
е
с
с
о
б
ы
т
и
й
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
0
20
Выживаемость без оперативного
вмешательства на митральном клапане
Выживаемость без вмешательства
на митральном клапане
02468101214161820
0
20
40
60
80
100
40
60
80
100
Годы
Количество пациентов в группе риска
Количество пациентов в группе риска
Рис. 21 .11 Сердечно-сосудистая выживаемость без повторного вмешательства после баллонной митральной комиссуротомии. Сравнение пока-
зателей сердечно-сосудистой выживаемости без повторного вмешательства (хирургической или повторной баллонной митральной комиссуротомии) и без хирур-
гической операции после хороших ближайших результатов баллонной митральной комиссуротомии. (A) Показатели во всей группе из 912 пациентов. (Б) Показа-
тели у 504 пациентов, которые были моложе 50 лет на момент первичной баллонной митральной комиссуротомии [Bouleti C, Iung B, Himbert D, et al. Reinterventions
after percutaneous mitral commissurotomy during long-term follow-up, up to 20 years: the role of repeat percutaneous mitral commissurotomy. Eur Heart J 34:1923–1930,
2013].
А
Б
In-21_для нас.indd 510
03.04.2019 12:00:35
511
21 Митральный стеноз
Кальцификация клапана служит противопоказа-
нием к БМК в редких случаях, при обширном ее
распространении или локализации в обеих комис-
сурах [20, 21].
Другие противопоказания связаны с заболевани-
ями сердца, требующими хирургической коррек-
ции. Особое внимание следует уделить определе-
нию степени аортального стеноза, чтобы избежать
его недооценку. Напротив, сопутствующая умерен-
ная аортальная недостаточность без последствий
для ЛЖ не служит противопоказанием к БМК, по-
тому что ее прогрессирование протекает медленно.
Оперативное вмешательство предпочтительнее при
наличии тяжелого сопутствующего органического
порока трикуспидального клапана или выраженной
функциональной трикуспидальной недостаточно-
сти с значительным расширением трикуспидально-
го кольца. С другой стороны, выраженная функци-
ональная трикуспидальная недостаточность может
уменьшаться после БМК.
ВЫБОР ПРОЦЕДУРЫ
В настоящее время имеются данные в поддержку
процедуры БМК в качестве процедуры выбора у
молодых пациентов. Молодой возраст ассоцииро-
ван с благоприятным анатомическим строением
клапана, причем обе характеристики служат силь-
ными прогностическими факторами хороших бли-
жайших и отдаленных результатов [72]. В ходе
рандомизированных исследований, проведенных в
таких же однородных популяциях, было продемон-
стрировано, что средне- и долгосрочные результаты
БМК были такими же хорошими, как и результаты
открытой комиссуротомии, и аналогичными или
превосходили результаты закрытой комиссурото-
мии [79–82]. Кроме того, возможность проведения
консервативного лечения, которое может быть по-
вторно проведено у отдельных пациентов, имеет
особое значение у молодых пациентов, включая
детей и подростков, для предотвращения повтор-
ных хирургических вмешательств. Тем не менее ряд
хороших кандидатов для выполнения БМК в разви-
вающихся странах не может воспользоваться этой
процедурой из-за стоимости баллона. Это оправды-
вает попытки снизить стоимость устройств, таких
как многодорожечной системы и металлического
комиссуротома. Возможность повторного исполь-
зования металлической части чрескожного комис-
суротома значительно снижает стоимость процеду-
ры [56].
Принятие решения сложнее у пожилых пациен-
тов, у которых обычно наблюдаются искажение
анатомического строения створок и подклапанного
аппарата, включая кальцификацию, и которые
представляют собой большинство пациентов с МС
в западных странах [44, 71]. Они образуют гетеро-
генную группу, в которой невозможно выполнить
рандомизированные исследования, а сравнитель-
ные исследования не позволяют учитывать все по-
тенциальные отягощающие факторы [83]. Не сле-
дует отказывать пациентам в проведении БМК
Стойкий тромбоз левого предсердия (включая ушко
левого предсердия)
Митральная недостаточность выше легкой степени
Массивная и бикомиссуральная кальцификация
Тяжелый сопутствующий порок аортального клапана
Выра женный органический стеноз трикуспидального
клапана или тяжелая функциональная недостаточность
с расширением фиброзного кольца
Выра женная сопутствующая ишемическая болезнь сердца,
требующая коронарного шунтирования
ТАБЛИЦА 21.8
Противопоказания к баллонной
митральной комиссуротомии
Рис. 21 .13 Митральный стеноз, обусловленный дегенеративным кальцифицирующим пороком митрального клапана. (A) A При 3D-ЧПЭхоКГ
(позиция ЛП) определяется выраженная кальцификация фиброзного кольца (белые стрелки) и створок (черная стрелка) митрального клапана без сращения ко-
миссур. (Б) Трехмерная реконструкция на основании компьютерной томографии демонстрирует циркулярную кальцификацию фиброзного кольца митрального
клапана с распространением на створки.
А
Б
In-21_для нас.indd 511
03.04.2019 12:00:36
512
ЧАСТЬ IV Пороки клапанов сердца
только на основании неблагоприятного анатомиче-
ского строения клапана, учитывая низкую прогно-
стическую ценность только этой характеристики.
Хорошие ближайшие и среднесрочные результаты
могут быть получены у пациентов с неблагоприят-
ным анатомическим строением митрального клапа-
на, даже при кальцификации клапана [72, 84, 85].
Отбор пациентов должен основываться на глобаль-
ной оценке, чему может способствовать прогности-
ческий анализ и получение многофакторных моде-
лей, которые позволяют оценивать результаты БМК
в соответствии с индивидуальными характеристи-
ками пациента [21, 58, 62].
У пациентов с искажением анатомического стро-
ения клапанов рассматривать возможность выпол-
нения БМК можно при других благоприятных ха-
рактеристиках, особенно молодом возрасте, площа-
ди митрального клапана 1,0–1,5 см2, наличии
умеренных симптомов (ФК II по NYHA) и синусо-
вом ритме. Прогностические модели показывают
высокую вероятность хороших ближайших и отда-
ленных результатов в этой группе пациентов [15,
58, 62]. За исключением пациентов с обширной
кальцификацией клапана, БМК может обеспечить
устойчивое функциональное улучшение при каль-
цифицирующем МС. Очень хорошие результаты
наблюдаются у пациентов моложе 50 лет, у которых
показатели хорошего функционального результата
составляют 57% через 10 лет и 21% через 20 лет [85].
При сравнении результатов БМК у пациентов с
кальцифицированными клапанами и у пациентов,
у кого кальцификация клапана отсутствовала, необ-
ходимо учитывать тот факт, что у пациентов с каль-
цифицирующим МС также обычно наблюдаются
более неблагоприятные клинические характеристи-
ки. Различия в отдаленных результатах менее выра-
жены при сравнении подгрупп пациентов с некаль-
цифицированными и кальцифицированными кла-
панами, учитывая влияние отягощающих факторов
(рис. 21 .14) [85].
БМК позволяет отсрочить хирургическое вме-
шательство на несколько лет у отдельных пациен-
тов с ревматическим МС и кальцификацией клапа-
на, тем самым отдалить осложнения, обусловленные
протезом, поскольку возможное оперативное вме-
шательство у этих пациентов в большинстве случа-
ев представляет собой замену клапана. С другой
стороны, вероятность устойчивого долгосрочного
улучшения гораздо ниже у пожилых пациентов с
неблагоприятным анатомическим строением ми-
трального клапана, выраженным стенозом, тяжелой
симптоматикой и фибрилляцией предсердий [48,
62] Кроме того, актуальность откладывая оператив-
ного вмешательства может быть спорной в этой
возрастной группе. Таким образом, операция на
митральном клапане, часто сочетающаяся с пласти-
кой трикуспидального клапана, может рассматри-
ваться как метод лечения первой линии при прием-
лемом оперативном риске (рис. 21 .15). При выборе
между БМК и оперативным вмешательством в этих
сложных ситуациях также необходимо учитывать
опыт интервенционных кардиологов и хирургов, а
также пожелания проинформированного пациента.
В западных странах наблюдается тенденция вы-
полнять БМК у пациентов старшего возраста с бо-
лее серьезным искажениями анатомического строе-
ния клапана [44]. По результатам Euro Heart Survey
хирургическая комиссуротомия составляла лишь
4% вмешательств, выполняемых по поводу МС в
2001 г., тогда как БМК выполнялась у 34% пациен-
тов, а замена клапана в 62% [5]. В общенациональ-
ной административной базе данных, учитывающей
работу 20% госпиталей в США, в период с 1998 по
2010 гг. наблюдалось снижение количества проце-
дур БМК, а средний возраст пациентов увеличился
с58летв1998г.до63летв2010г.[54].
ВЫБОР ВРЕМЕНИ ПРОВЕДЕНИЯ ПРОЦЕДУРЫ
Существует общее мнение относительно рекомен-
даций вмешательства, будь то чрескожное или опе-
ративное, у пациентов с наличием симптомов, у
которых при МС площадью клапана < 1,5 см2 [20,
21]. Лучшее понимание прогноза МС, особенно в
отношении риска развития тромбоэмболических
осложнения или гемодинамической декомпенса-
ции, и доступность вмешательства с низким риском
привела к рассмотрению возможности выполнения
БМК у отдельных пациентов на ранней стадии. Ре-
зультаты сравнительного проспективного серийно-
го исследования сообщают о более высоких показа-
телях 11-летней без событий о выживаемости при
проведении БМК у пациентов с ФК I и II по NYHA
по сравнению с ФК III и IV [86].
Во время последующего наблюдения учитывали
тромбоэмболические осложнения. Разница остава-
лась значительной после подгона правил отбора с
учетом различий в характеристиках пациентов.
Особая эффективность наблюдалась у пациентов с
риском тромбоэмболических осложнений, как на-
пример при фибрилляции предсердий или ранее
возникавших эмболических осложнениях [86]. Од-
нако возможность выполнения вмешательства как
правило не рассматривается при МС с площадью
клапана > 1,5 см2, поскольку вариабельность про-
грессирования служит аргументом против профи-
лактической БМК [20, 21]. Возможность выполне-
ния БМК можно рассматривать у пациентов с по-
граничной площадью клапана при наличии
симптомов или легочной гипертензии.
Эффективность БМК была продемонстрирована
при разных маркерах риска развития тромбоэмбо-
лии при МС: спонтанном контрастировании ЛП,
размере и сократимости ЛП, скорости кровотока в
ушке ЛП и активации коагуляции в ЛП [39, 87, 88].
Хотя эффективность БМК при риске развития
тромбоэмболии не была продемонстрирована в хо-
In-21_для нас.indd 512
03.04.2019 12:00:36
513
21 Митральный стеноз
де рандомизированных исследований, в ходе ретро-
спективного и перспективного серийного исследо-
вания было показано, что эффективность БМК
сильно коррелировала с уменьшением риска разви-
тия тромбоэмболии у пациентов с МС и фибрилля-
цией предсердий [89, 90].
При МС, помимо особых случаев, таких как бе-
ременность, труднее оценить риск развития острых
гемодинамических осложнений. ЭхоКГ с физиче-
ской нагрузкой представляет потенциальный инте-
рес, поскольку она предоставляет дополнительную
информацию, сравнимую с результатами изначаль-
ной оценки, хотя для рекомендации в проведении
вмешательства отсутствует пороговое значение ми-
трального градиента или систолического давления
в легочной артерии. Рекомендации по БМК соглас-
но современных руководств приведены в табл. 21.9 .
НАУЧНОЕ ОБОСНОВАНИЕ ИССЛЕДОВАНИЙ
СТРЕССЭХОКАРДИОГРАФИЯ
Изменения степени тяжести МС и его последствий
могут наблюдаться при изменениях гемодинамиче-
ских условий, что подтверждалось сочетанием фи-
зической нагрузки или фармакологического теста в
сочетании с инвазивными измерениями. Позже они
Количество пациентов в группе риска
710
314
638
232
586
191
529
158
497
133
416
100
374
81
321
62
206
36
104
10
42
5
196
196
177
165
156
144
137
123
116
93
103
77
88
65
70
51
43
29
24
8
7
3
38±2%
Некальцифицированный клапан
Кальцифицированный клапан
12±3%
р < 0,0001
Годы
Х
о
р
о
ш
и
е
ф
у
н
к
ц
и
о
н
а
л
ь
н
ы
е
р
е
з
у
л
ь
т
а
т
ы
(
%
)
Х
о
р
о
ш
и
е
ф
у
н
к
ц
и
о
н
а
л
ь
н
ы
е
р
е
з
у
л
ь
т
а
т
ы
(
%
)
20
40
60
80
100
02468101214161820
0
Количество пациентов в группе риска
Некальцифицированный клапан
Кальцифицированный клапан
18±4%
28±5%
p = 0,005
Годы
20
40
60
80
100
02468101214161820
0
Рис. 21 .14 Отдаленные результаты баллонной митральной комиссуротомии в зависимости от наличия кальцификации клапана при рентгено-
скопическом исследовании или ее отсутствия. (A) Показатели во всей группе из 1024 пациентов. (Б) В двух равных по степени риска подгруппах, каждая
из которых состоит из 196 пациентов [Bouleti C, Iung B, Himbert D, et al. Relationship between valve calcification and long-term results of percutaneous mitral
commissurotomy for rheumatic mitral stenosis. Circ Cardiovasc Interv 7:381–389 , 2014].
А
Б
Рис. 21 .15 Рестеноз после ранее выполненной баллонной митральной комиссуротомии. Кальцификация клапана у 71-летнего пациента с фибрилля-
цией предсердий и трикуспидальной регургитацией. (А) При ТТЭхоКГ в парастернальной позиции по короткой оси определяется кальцификация заднемедиальной
комиссуры и частичное открытие переднелатеральной комиссуры (стрелка). A На видеоизображении — 3D-ЧПЭхоКГ. (Б) A При ТТЭхоКГ в апикальной четы-
рехкамерной позиции определяются расширение правой полости и дилатация фиброзного кольца трикуспидального клапана (47 мм). Данному пациенту выпол-
нили протезирование митрального клапана и аннулопластику трикуспидального клапана.
А
Б
In-21_для нас.indd 513
03.04.2019 12:00:36
514
ЧАСТЬ IV Пороки клапанов сердца
Рекомендации AHA/ACC 2014 г.
Рекомендации ESC/EACTS 2012 г.
Пациенты с наличием симптомов
Чрескожная баллонная митральная комиссуротомия
рекомендована для пациентов с наличием симптомов
при тяжелом МС (площадь митрального отверстия ≤ 1,5
см2, стадия D) и подходящие морфологии клапана при
отсутствии тромбоза ЛП или умеренно тяжелой МР (IA)
Чрескожная баллонная митральная комиссуротомия
может быть рассмотрена для пациентов с симптомами с
площадью митрального отверстия > 1,5 см2 при наличии
данных о гемодинамически значимом МС, основанной
на давление заклинивания в легочной артерии > 25 мм
рт. ст. или среднем митральном градиенте > 15 мм рт. ст.
при физической нагрузке (IIbC)
Чрескожная баллонная митральная комиссуротомия
может быть рассмотрена для пациентов с тяжелыми
симптомами (III–IV класс по NYHA) с выраженным МС
(площадь митрального отверстия ≤ 1,5 см2, стадия D),
субоптимальным анатомическим строением клапана,
которые не могут быть кандидатами для хирургического
вмешательства или находятся в группе высокого хирур-
гического риска (IIbC)
Пациенты с митральным стенозом и площадью отверстия
клапана ≤ 1,5 см2:
• Пациенты с наличием симптомов и подходящими характери-
стиками для чрескожной баллонной митральной комиссурото-
мии* (IB)
• Пациенты с наличием симптомов и противопоказаний для
операции или высоким хирургическим риском (IC)
• В качестве стартовой терапии у пациентов с наличием симпто-
мов и неблагоприятным анатомическим строением, но без
наличия неблагоприятных клинических характеристик* (IIaC)
Пациенты без симптомов
Чрескожная баллонная митральная комиссуротомия
рекомендована для пациентов без симптомов с очень
выра женным МС (площадь митрального отверстия
≤ 1,0 см2, стадия C) и подходящим анатомическим
строением клапана при отсутствии тромбоза ЛП или
умеренно тяжелой МР (IIaC)
Чрескожная баллонная митральная комиссуротомия
может быть рассмотрена для пациентов без симптомов
с выраженным МС (площадь митрального отверстия
≤ 1,5 см2, стадия C) и подходящим анатомическим
строением клапана при отсутствии тромбоза ЛП или
умеренно тяжелой МР, у кого впервые выявлена фибрил-
ляция предсердий (IIbC)
Пациенты без симптомов с митральным стенозом и площадью
отверстия клапана < 1,5 см2, без неудовлетворительных характе-
ристик* и:
• Высокий риск развития тромбоэмболии (эмболия в анамнезе,
массивное спонтанное контрастирование в ЛП, недавно возник-
шая или пароксизмальная фибрилляция предсердий) (IIaC)
и/или
• Высокий риск гемодинамической декомпенсации (систолическое
давление в легочной артерии > 50 мм рт. ст. в покое, необходи-
мость проведения крупной некардиологической операции,
желание забеременеть) (IIaC)
*
Неблагоприятные характеристики для чрескожной баллонной митральной комиссуротомии: клинические (пожилой возраст, комис-
суротомия в анамнезе, ФК IV по NYHA, хроническая фибрилляция предсердий, выраженная легочная гипертензия); анатомические
(сумма баллов по эхокардиографической шкале > 8, по шкале Cormier — от 3 (кальцификация митрального клапана любой степени,
определяемая при рентгеноскопии), очень маленькая площадь отверстия митрального клапана, выраженная трикуспидальная
регургитация).
ACC — American College of Cardiology; AHA — American Heart Association; EACTS — European Association for CardioThoracic Surgery; ESC —
European Society of Cardiology; NYHA — New York Heart Association; ЛП — левое предсердие; МР — митральная регургитация; МС —
митральный стеноз.
[Vahanian A, Alfieri O, Andreotti F, et al. Guidelines on the management of valvular heart disease (version 2012): The Joint Task Force on the Man-
agement of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery
(EACTS). Eur Heart J 33:2451–2496, 2012; Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC Guideline for the Management of Patients
With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines.
Circulation 129:e521–e643, 2014.]
ТАБЛИЦА 21.9 Рекомендации по баллонной митральной комиссуротомии у пациентов с митральным стенозом
были заменены стресс-ЭхоКГ, преимущество кото-
рой заключается в возможности проводить повтор-
ные неинвазивные измерения.
ЭхоКГ с физической нагрузкой — наиболее фи-
зиологический подход. В ходе различных серийных
исследований постоянно демонстрировалось увели-
чение среднего градиента и систолического давле-
ния в легочной артерии при субмаксимальных или
максимальных нагрузках. Тем не менее существует
значительная неоднородность в нарастании ми-
трального градиента и систолического давления в
легочной артерии, а также ударного объема, кото-
рый не связан с изначальной степенью тяжести МС.
Возможным объяснением могут служить различия
и в изменении площади митрального клапана, оце-
ниваемого согласно уравнению непрерывности, и
ударного объема. Увеличение площади клапана при
физической нагрузке связано с увеличением удар-
In-21_для нас.indd 514
03.04.2019 12:00:37
515
21 Митральный стеноз
но-желудочковая жесткость измеряемый в мил-
лилитрах на миллиметр ртутного столба,
рассчитывается по формуле: 1270 × (площадь ми-
трального клапана/наклон E-волны), где площадь
клапана выражена в см2 и наклон E-волны в см/сек2.
Предсердно-желудочковая жесткость служит значи-
мым показателем давления в легочной артерии в
состоянии покоя и имеет значимое прогностическое
значение, превосходящее площадь клапана и сред-
ний градиент [92]. Следовательно, различия по
предсердно-желудочковому комплаенсу объясняют
широкий диапазон давления в легочной артерии,
которое может наблюдаться при определенном
уровне МС в зависимости от площади клапана.
Низкий предсердно-желудочковый комплаенс глав-
ным образом обусловлен низким комплаенсом ЛП,
а также коррелирует, даже больше, чем в состоянии
покоя, с более высоким давлением в легочной арте-
рии при физических нагрузках и наличием более
тяжелых симптомов [92].
Кроме того, недавно в ходе проспективного се-
рийного исследования с участием 140 пациентов с
разной степенью тяжести МС было показано, что
предсердно-желудочковая жесткость оказывает
влияние на выживаемость без устранения патоло-
гии [95]. По итогам многофакторного анализа с
медианным наблюдением в течение 22 месяцев
предсердно-желудочковая жесткость является хоро-
шим прогностическим фактором выживаемости
без вмешательства в сочетании с классом по NYHA
и площадью митрального клапана до проведения
БМК [95]. Предсердно-желудочковаая жесткость
также коррелировала с необходимостью вмеша-
тельства в подгруппе пациентов, у которых изна-
чально не было симптомов. Предсердно-желудоч-
ковая жесткость равная 4 мл/мм рт. ст. или менее
выявила подгруппу пациентов с высоким риском
последующего вмешательства [95]. Предсердно-же-
лудочковая жесткость также сильно коррелирует с
систолическим давлением в легочной артерии и
возникновением одышки во время физической на-
грузки [33, 92]. Тем не менее предсердно-желудоч-
ковая жесткость не является частью стандартной
оценки МС, она может быть полезна у пациентов, у
которых наблюдается расхождение симптоматики и
степени тяжести МС, оцененной по площади клапа-
на. Использование данного показателя при приня-
тии решений у пациентов без симптомов требует
дальнейшего изучения.
ОЦЕНКА АНАТОМИЧЕСКОГО СТРОЕНИЯ КЛАПАНА
Учитывая ограничения широко используемых шкал
оценки для прогнозирования результатов БМК, бы-
ли разработаны альтернативные подходы, в частно-
сти, с учетом локализации поражения клапана по
отношению к комиссурам. В ходе серийного иссле-
дования было продемонстрировано, что комиссу-
ральное расположение утолщения и кальцифика-
ного объема. И наоборот, ударный объем не увели-
чивается, если при физической нагрузке не проис-
ходит значительного изменения площади клапана
[91, 92]. Эти два разных процесса не зависят от
разницы в изначальной степени МС, а связаны с
искажением анатомического строения клапана [91].
Уровень увеличения систолического давления в ле-
гочной артерии при физической нагрузке связан с
характером ограничивающих симптомов, будь то
одышка или усталость.
Добутаминовая стресс-ЭхоКГ при МС является
менее физиологическим подходом, чем ЭхоКГ с фи-
зической нагрузкой, но она также связана со значи-
тельным увеличением среднего градиента и систо-
лического давления в легочной артерии по срав-
нению со значениями, полученными в покое.
Единственное исследование, в ходе которого была
проанализирована взаимосвязь между результатами
стресс-ЭхоКГ и клиническим исходом, было основа-
но на добутаминовой стресс-ЭхоКГ. Результаты
этого исследования продемонстрировали, что сред-
ний градиент на митральном клапане во время доб-
утаминовой стресс-ЭхоКГ является независимым
прогностическим фактором в клинических событи-
ях в течение последующего 5-летнего наблюдения,
его пороговое значение составляет 18 мм рт. ст. Ин-
крементальное прогностическое значение было осо-
бенно выражено у пациентов, у которых площадь
клапана составляла от 1,0 до 1,5 см2 [93]. В ходе еще
одного исследования с использованием добута-
миновой стресс-ЭхоКГ было продемонстрировано
большее значение резерва клапана (более выражен-
ное увеличение площади клапана) у пациентов, у
которых ранее выполнялась комиссуротомия по
сравнению с пациентами с нативным МС [94].
Стресс-ЭхоКГ применима для уточнения инфор-
мации о гемодинамических последствиях МС. Тем
не менее ее применение при принятии решений
необходимо оценивать с помощью дальнейших
перспективных исследований. Особая необходи-
мость этого заключается в возможности определе-
ния пороговых значений или характера увеличения
градиента и давления в легочной артерии, что мо-
жет привести к рассмотрению выполнения вмеша-
тельства у пациентов с МС без наличия симптомов.
ОЦЕНКА ПРЕДСЕРДНОЖЕЛУДОЧКОВОЙ ЖЕСТКОСТИ
Снижение давления перед клапаном, наблюдаемое
при МС в фазу диастолы, зависит от площади кла-
пана, а также от комбинации жесткости ЛП и ЛЖ.
Чистый предсердно-желудочковый комплаенс бы-
ло изначально рассчитан с помощью инвазивных
методов оценки гемодинамики. Неинвазивная
оценка выполняется с помощью допплерографии
с момента валидации и комбинации определения
площади клапана с помощью планиметрии и на-
клона E-волны по допплеровскому сигналу транс-
митрального кровотока [92, 95]. Чистая предсерд-
In-21_для нас.indd 515
03.04.2019 12:00:37
516
ЧАСТЬ IV Пороки клапанов сердца
ции клапана влияет на ближайшие результаты БМК
[27–29] и может способствовать увеличению риска
тяжелой митральной недостаточности, осложняю-
щей БМК [31]. Недавно была разработана шкала
оценки с учетом поражения областей комиссур в
комбинации с 4 эхокардиографическими показате-
лями, 3 из которых являются количественными
(табл. 21 .10) [32]:
• площадь митрального клапана с помощью 2D-
планиметрии;
• максимальное смещение створок, измеряемое по
расстоянию между митральным кольцом и мак-
симальной диастолической экскурсией створок;
• комиссуральное соотношение площадей, изме-
ряемое в проекции парастернальной короткой
оси, количественно определяет асимметрию и
утолщение комиссур;
• вовлечение подклапанного аппарата, определяе-
мое как его отсутствие или слабо выраженное
вовлечение и распространенное вовлечение.
Эта шкала оценки оказалась воспроизводимой и
улучшила прогнозирование ближайших результатов
БМК по сравнению со шкалой оценки Wilkins, в том
числе в независимой популяции. В ходе однофактор-
ного, но не многофакторного анализа, показатели
шкалы оценки коррелировали со среднесрочной вы-
живаемостью без вмешательства [32].
Таким образом, существуют различные подходы
к улучшению оценки анатомического строения кла-
пана, объединению более точных шкал оценки и
исследованию механических свойств клапана. Од-
нако более сложные исследования затруднительны
в плане их использования в современной практике
и воспроизводимости. Более того, необходимо до-
казать их инкрементальную прогностическую цен-
ность для результатов в сравнении с современными
валидированными многофакторными подходами.
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ
И ПЕРСПЕКТИВЫ
Несмотря на техническое усовершенствование, со-
храняются ограничения в целесообразности или
значимости некоторых эхокардиографических ис-
следований при МС. Хотя планиметрия является
эталонным методом измерения, у пациентов с пло-
хими эхокардиографическими окнами или в случае
выраженной деформации клапана она может быть
невыполнима даже опытными специалистами. Сле-
дует использовать другие методы измерения, ин-
терпретация которых должна производится при
учете их собственных ограничений [96].
Допплерография позволяет оценить давление в
легочной артерии у большинства пациентов. Одна-
ко с помощью ультразвуковых методов невозмож-
но достоверно оценить давление заклинивания ле-
гочных капилляров и, следовательно, резистент-
ность легочных сосудов. У большинства пациентов
легочная гипертензия является пассивной из-за
увеличения давления в ЛП без изменения рези-
стентности легочных сосудов. Однако у некоторых
пациентов, как правило, при длительном течении
болезни, наблюдается увеличение резистентности
легочных сосудов вследствие их поражения. У этих
пациентов выше риск оперативного вмешательства,
в связи с чем при возможности следует прибегнуть
к БМК, поскольку ее проведение обеспечивает
функциональное улучшение и стойкое улучшение
гемодинамики [36]. У пациентов с выраженной ле-
гочной гипертензией, которая не соответствует сте-
пени МС или застою крови легких, выявленному
при рентгенографии грудной клетки целесообразна
оценка резистентности легочных сосудов с помо-
щью катетеризации правых отделов сердца.
Ограничения шкал оценки анатомического стро-
ения для прогнозирования ближайших и отдален-
ных результатов БМК были рассмотрены ранее.
Показатель
Встречаемость (n [%])
Отношение рисков (95% ДИ) p
Баллы по шкале*
Площадь митрального
отверстия ≤ 1 см2
73 (36)
2,73 (1,32–5,66)
0,007 2
Максимальное смещение
створок ≤ 12 мм
71 (35)
3,40 (1,65–6,99)
0,001 3
Соотношение площадей
комиссур ≥ 1,25
75 (37)
3,10 (1,51–6,38)
0,002 3
Вовлечение подклапан-
ного аппарата†
37 (18)
3,23 (1,35–7,71)
0,008 3
* В соответствии с суммой баллов определяют три группы риска: низкий (17%) — 0 –3 балла; средний (56%) — 4–5 баллов; высокий
(74%) — 6–11 баллов.
† Отсутствие утолщения, легкое или выра женное утолщение.
ДИ — доверительный интервал.
[Nunes MCP, Tan TC, Elmariah S, et al. The echo score revisited: impact of incorporating commissural morphology and leaflet displacement to the
prediction of outcome for patients undergoing percutaneous mitral valvuloplasty. Circulation 129:886–895, 2014.]
ТАБЛИЦА 21.10
Баллы по шкале с использованием количественной эхокардиографической оценки для прогноза
ближайших результатов баллонной митральной комиссуротомии
In-21_для нас.indd 516
03.04.2019 12:00:37
517
21 Митральный стеноз
Учитывая большое количество факторов, определя-
ющих результаты БМК, существует низкая вероят-
ность того, что какая-либо эхокардиографическая
шкала оценки может обеспечить оптимальное про-
гнозирование результатов БМК. Может быть умест-
ной комбинированная оценка с использованием
компьютерной томографии для количественной
оценки кальцификации клапана. Оптимизация от-
бора пациентов, вероятно, может быть обусловлена
включением улучшенной анатомической оценки с
помощью ЭхоКГ и других методов визуализации, а
также других переменных показателей, таких как
стрессовые показатели гемодинамики в многофак-
торные модели, а не оптимизацией одной шкалы
оценки.
АЛЬТЕРНАТИВНЫЕ ВАРИАНТЫ
Катетеризация правых и левых отделов сердца по-
зволяет оценить площадь клапана с помощью фор-
мулы Горлина. Формулу Горлина иногда называют
эталонным методом, однако это по большому счету
традиция. Данные экспериментальных и клиниче-
ских исследований вносят сомнения относительно
справедливости формулы Горлина в случаях сер-
дечной недостаточности и сразу после выполнения
БМК [97]. Этим объясняется рекомендация ограни-
чивать применение инвазивной оценки тяжести МС
редкими случаями, при которых неубедительны
данные ЭхоКГ или имеется несоответствие между
различными показателями и клинической оценкой
[20, 21]. Катетеризация правого отдела сердца пока-
зана при подозрении на сосудистую легочную ги-
пертензию. В современной практике основным по-
казанием для инвазивных исследований является
оценка сопутствующей ишемической болезни серд-
ца с применением коронарографии. Тем не менее
катетеризация сердца по-прежнему широко приме-
няется, в частности, как плановое исследование при
коронарографии, хотя это не подкреплено рекомен-
дациями [5].
Магнитно-резонансная томография и компью-
терная томография являются валидированными
альтернативными неинвазивными методами иссле-
дования, применяемыми для планиметрии ми-
трального клапана [98, 99]. Эти методы могут быть
полезны при нецелесообразности 2D-ЭхоКГ или
недостоверности ее результатов. Митральный гра-
диент также может быть оценен с помощью фазо-
во-контрастного кодирования скорости записи маг-
нитно-резонансной томографии, но достоверность
этой оценки не определена. Опыт использования
внутрисердечной ЭхоКГ ограничен. Этот метод мо-
жет быть полезен для исключения тромбоза ЛП или
в сложных случаях для контроля пункции пере-
городки, что позволяет избежать использования
ЧПЭхоКГ под общей анестезией [100]. Высокая
стоимость оборудования одноразового применения
ограничивает его использование.
Опыт применения БМК, полученный за период
> 20 лет, подтвердил его эффективность не только у
молодых пациентов с благоприятным анатомиче-
ским строением клапана, но и у менее подходящих
кандидатов. Большинство потенциальных кандида-
тов на БМК живут в развивающихся странах, где
основная задача заключается в своевременной диа-
гностике и лечении ревматических пороков сердца,
сталкиваясь с финансовыми ограничениями. В за-
падных странах при ревматическом МС часто на-
блюдаются субоптимальные анатомические состоя-
ния, и проблема заключается в выборе наиболее
подходящего вмешательства. У ряда пациентов БМК
может быть эффективным, потому что прогности-
ческие факторы ее результатов в действительности
мультифакториальные.
При отборе пациентов не следует всецело опи-
раться на анатомическое строение клапана, а пола-
гаться на комплексную оценку, сочетающую клини-
ческие и эхокардиографические данные. Для совер-
шенствования процесса принятия решений при
выборе наиболее подходящей процедуры, а также
определения срока вмешательства на разных стади-
ях заболевания необходимо продолжать выполнять
оценку результатов БМК в ходе крупных серийных
исследований или в определенных подгруппах необ-
ходимо.
In-21_для нас.indd 517
03.04.2019 12:00:37
518
ЧАСТЬ IV Пороки клапанов сердца
К
о
м
п
о
н
е
н
т
М
е
т
о
д
в
и
з
у
а
л
и
з
а
ц
и
и
П
о
з
и
ц
и
я
И
з
м
е
р
е
н
и
е
И
н
т
е
р
п
р
е
т
а
ц
и
я
О
г
р
а
н
и
ч
е
н
и
я
/
п
р
и
м
е
ч
а
н
и
я
С
т
е
п
е
н
ь
т
я
ж
е
с
т
и
2
D
/
3
D
-
Т
Т
Э
х
о
К
Г
Н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
*
Н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
*
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
п
о
к
о
р
о
т
к
о
й
о
с
и
А
п
и
к
а
л
ь
н
а
я
А
п
и
к
а
л
ь
н
а
я
П
л
а
н
и
м
е
т
р
и
я
В
р
е
м
я
п
о
л
у
с
п
а
д
а
д
а
в
л
е
н
и
я
С
р
е
д
н
и
й
г
р
а
д
и
е
н
т
З
н
а
ч
и
т
е
л
ь
н
ы
й
М
С
п
р
и
П
О
М
К
<
1
,
5
с
м
2
П
О
М
К
=
2
2
0
/
В
р
е
м
я
п
о
л
у
с
п
а
д
а
д
а
в
л
е
н
и
я
З
н
а
ч
и
т
е
л
ь
н
ы
й
М
С
п
р
и
П
О
М
К
<
1
,
5
с
м
2
Т
я
ж
е
л
ы
й
М
С
в
е
р
о
я
т
е
н
п
р
и
>
1
0
м
м
р
т
.
с
т
.
М
о
ж
е
т
б
ы
т
ь
з
а
т
р
у
д
н
и
т
е
л
ь
н
ы
м
о
п
р
е
д
е
л
е
н
и
е
э
т
а
л
о
н
н
о
г
о
и
з
м
е
р
е
н
и
я
н
а
и
м
е
н
ь
ш
е
г
о
о
т
в
е
р
с
т
и
я
П
р
о
щ
е
,
ч
е
м
п
л
а
н
и
м
е
т
р
и
я
,
н
о
з
а
в
и
с
и
т
о
т
и
с
к
а
ж
а
ю
щ
и
х
ф
а
к
т
о
р
о
в
О
ч
е
н
ь
з
а
в
и
с
и
т
о
т
у
с
л
о
в
и
й
к
р
о
в
о
т
о
к
а
.
Н
и
з
к
а
я
д
о
с
т
о
в
е
р
н
о
с
т
ь
о
ц
е
н
к
и
т
я
ж
е
с
т
и
,
н
о
и
м
е
е
т
п
р
о
г
н
о
с
т
и
ч
е
с
к
у
ю
ц
е
н
н
о
с
т
ь
П
р
и
ф
и
б
р
и
л
л
я
ц
и
и
п
р
е
д
с
е
р
д
и
й
в
ы
п
о
л
н
я
е
т
с
я
с
р
е
д
н
е
е
и
з
м
е
р
е
н
и
е
(
в
с
е
и
з
м
е
р
е
н
и
я
)
А
н
а
т
о
м
и
-
ч
е
с
к
о
е
с
т
р
о
е
н
и
е
2
D
-
Т
Т
Э
х
о
К
Г
3
D
-
Т
Т
Э
х
о
К
Г
2
D
/
3
D
-
Ч
П
Э
х
о
К
Г
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
п
о
д
л
и
н
н
о
й
и
к
о
р
о
т
к
о
й
о
с
я
м
А
п
и
к
а
л
ь
н
а
я
ч
е
т
ы
р
е
х
к
а
м
е
р
н
а
я
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
п
о
д
л
и
н
н
о
й
о
с
и
А
п
и
к
а
л
ь
н
а
я
д
в
у
х
к
а
м
е
р
н
а
я
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
п
о
д
л
и
н
н
о
й
и
к
о
р
о
т
к
о
й
о
с
я
м
0
–
1
8
0
°
У
т
о
л
щ
е
н
и
е
,
э
л
а
с
т
и
ч
н
о
с
т
ь
к
л
а
п
а
н
а
П
о
д
к
л
а
п
а
н
н
ы
й
а
п
п
а
р
а
т
С
р
а
щ
е
н
и
е
к
о
м
и
с
с
у
р
У
т
о
л
щ
е
н
и
е
,
э
л
а
с
т
и
ч
н
о
с
т
ь
к
л
а
п
а
н
а
,
с
р
а
щ
е
н
и
е
к
о
м
и
с
с
у
р
Р
а
с
с
м
о
т
р
и
т
е
м
а
к
с
и
м
а
л
ь
н
о
е
у
т
о
л
щ
е
н
и
е
и
н
е
о
д
н
о
р
о
д
н
о
с
т
ь
О
п
р
е
д
е
л
и
т
е
м
е
с
т
о
п
о
л
о
ж
е
н
и
е
я
р
к
и
х
з
о
н
(
ф
и
б
р
о
з
н
ы
е
у
з
е
л
к
и
и
л
и
к
а
л
ь
ц
и
ф
и
к
а
ц
и
я
)
,
о
с
о
б
е
н
н
о
о
т
н
о
с
и
т
е
л
ь
н
о
к
о
м
и
с
с
у
р
О
ц
е
н
и
т
е
у
т
о
л
щ
е
н
и
е
,
у
к
о
р
о
ч
е
н
и
е
и
с
р
а
щ
е
н
и
е
х
о
р
д
В
и
з
у
а
л
и
з
и
р
у
й
т
е
к
о
м
и
с
с
у
р
у
ц
е
л
и
к
о
м
Т
а
к
а
я
ж
е
о
ц
е
н
к
а
,
к
а
к
п
р
и
2
D
-
Э
х
о
К
Г
М
о
ж
е
т
б
ы
т
ь
с
л
о
ж
н
о
д
и
ф
ф
е
р
е
н
ц
и
р
о
в
а
т
ь
к
а
л
ь
ц
и
ф
и
к
а
ц
и
ю
и
с
п
л
о
ш
н
о
й
ф
и
б
р
о
з
В
о
б
ы
ч
н
ы
х
ш
к
а
л
а
х
о
ц
е
н
к
и
а
н
а
т
о
м
и
ч
е
с
к
о
г
о
с
т
р
о
е
н
и
я
н
е
у
ч
и
т
ы
в
а
е
т
с
я
л
о
к
а
л
и
з
а
ц
и
я
н
а
р
у
ш
е
н
и
й
Ч
а
с
т
о
н
е
д
о
о
ц
е
н
и
в
а
е
т
с
я
п
о
р
а
ж
е
н
и
е
п
о
д
к
л
а
п
а
н
н
о
г
о
а
п
п
а
р
а
т
а
Л
у
ч
ш
а
я
д
о
с
т
о
в
е
р
н
о
с
т
ь
,
ч
е
м
п
р
и
2
D
-
Э
х
о
К
Г
.
О
с
о
б
е
н
н
о
з
н
а
ч
и
м
о
п
р
и
р
е
с
т
е
н
о
з
а
х
В
о
с
н
о
в
н
о
м
п
р
и
н
и
з
к
о
м
к
а
ч
е
с
т
в
е
т
р
а
н
с
т
о
р
а
к
а
л
ь
н
о
г
о
и
з
о
б
р
а
ж
е
н
и
я
о
к
о
н
С
о
ч
е
т
а
н
н
а
я
н
е
д
о
с
т
а
-
т
о
ч
н
о
с
т
ь
Т
Т
Э
х
о
К
Г
,
ц
в
е
т
о
в
о
е
д
о
п
п
л
е
р
о
в
с
к
о
е
к
а
р
т
и
р
о
в
а
н
и
е
Т
Т
Э
х
о
К
Г
,
ц
в
е
т
о
в
о
е
д
о
п
п
л
е
р
о
в
с
к
о
е
к
а
р
т
и
р
о
в
а
н
и
е
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
д
л
и
н
н
а
я
о
с
ь
,
а
п
и
к
а
л
ь
н
а
я
ч
е
т
ы
р
е
х
-
и
д
в
у
х
к
а
м
е
р
н
а
я
0
–
1
8
0
°
П
е
р
е
ш
е
е
к
р
е
г
у
р
г
и
т
а
ц
и
и
Э
ф
ф
е
к
т
и
в
н
о
е
о
т
в
е
р
с
т
и
е
р
е
г
у
р
г
и
т
а
ц
и
и
О
б
ъ
е
м
р
е
г
у
р
г
и
т
а
ц
и
и
Т
е
ж
е
и
з
м
е
р
е
н
и
я
Б
М
К
п
р
о
т
и
в
о
п
о
к
а
з
а
н
а
,
е
с
л
и
э
ф
ф
е
к
т
и
в
н
о
е
о
т
в
е
р
с
т
и
е
р
е
г
у
р
г
и
т
а
ц
и
и
>
0
,
2
0
с
м
2
и
/
и
л
и
о
б
ъ
е
м
р
е
г
у
р
г
и
т
а
ц
и
и
>
3
0
м
л
А
н
а
л
и
з
м
е
х
а
н
и
з
м
а
н
е
д
о
с
т
а
т
о
ч
н
о
с
т
и
п
о
с
л
е
Б
М
К
(
п
о
и
с
к
р
а
з
р
ы
в
а
с
т
в
о
р
к
и
)
Н
а
к
о
л
и
ч
е
с
т
в
е
н
н
у
ю
о
ц
е
н
к
у
м
о
г
у
т
в
л
и
я
т
ь
у
с
л
о
в
и
я
н
а
г
р
у
з
к
и
П
р
и
м
е
н
и
м
о
с
т
ь
Ч
П
Э
х
о
К
Г
д
л
я
а
н
а
л
и
з
а
м
е
х
а
н
и
з
м
а
н
е
д
о
с
т
а
т
о
ч
н
о
с
т
и
п
о
с
л
е
Б
М
К
Л
е
в
о
е
п
р
е
д
с
е
р
д
и
е
2
D
-
Т
Т
Э
х
о
К
Г
Ч
П
Э
х
о
К
Г
П
а
р
а
с
т
е
р
н
а
л
ь
н
а
я
к
о
р
о
т
к
а
я
о
с
ь
А
п
и
к
а
л
ь
н
а
я
ч
е
т
ы
р
е
х
-
и
д
в
у
х
к
а
м
е
р
н
а
я
0
–
1
8
0
°
Д
и
а
м
е
т
р
Л
П
П
л
о
щ
а
д
ь
Л
П
О
б
ъ
е
м
Л
П
Т
р
о
м
б
о
з
Л
П
Р
а
с
ш
и
р
е
н
и
е
п
р
и
о
б
ъ
е
м
е
Л
П
>
3
4
м
л
/
м
2
П
П
Т
О
б
ъ
е
м
Л
П
>
6
0
м
л
/
м
2
П
П
Т
к
о
р
р
е
л
и
р
у
е
т
с
д
р
у
г
и
м
и
м
а
р
к
е
р
а
м
и
р
и
с
к
а
р
а
з
в
и
т
и
я
э
м
б
о
л
и
и
О
б
с
л
е
д
у
й
т
е
Л
П
ц
е
л
и
к
о
м
и
у
ш
к
о
Л
П
,
г
д
е
ч
а
щ
е
в
с
е
г
о
л
о
к
а
л
и
з
у
ю
т
с
я
т
р
о
м
б
ы
Н
и
з
к
а
я
н
а
д
е
ж
н
о
с
т
ь
д
и
а
м
е
т
р
а
П
р
е
д
п
о
ч
т
и
т
е
л
ь
н
о
о
ц
е
н
и
в
а
т
ь
п
л
о
щ
а
д
ь
и
л
и
о
б
ъ
е
м
Ч
П
Э
х
о
К
Г
о
б
я
з
а
т
е
л
ь
н
а
п
е
р
е
д
Б
М
К
(
н
и
з
к
а
я
ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
Т
Т
Э
х
о
К
Г
)
М
о
ж
е
т
б
ы
т
ь
т
р
у
д
н
о
о
т
л
и
ч
и
т
ь
т
р
о
м
б
о
з
о
т
с
п
о
н
т
а
н
н
о
г
о
к
о
н
т
р
а
с
т
и
р
о
в
а
н
и
я
Д
а
в
л
е
н
и
е
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
Н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
*
А
п
и
к
а
л
ь
н
а
я
М
а
к
с
и
м
а
л
ь
н
а
я
с
к
о
р
о
с
т
ь
с
т
р
у
и
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
+
р
а
с
ч
е
т
н
о
е
д
а
в
л
е
н
и
е
в
П
П
П
о
в
ы
ш
е
н
н
о
е
,
е
с
л
и
>
3
5
м
м
р
т
.
с
т
.
В
ы
р
а
ж
е
н
н
а
я
л
е
г
о
ч
н
а
я
г
и
п
е
р
т
е
н
з
и
я
п
р
и
>
6
0
м
м
р
т
.
с
т
.
М
е
н
е
е
д
о
с
т
о
в
е
р
н
а
,
ч
е
м
к
а
т
е
т
е
р
и
з
а
ц
и
я
с
е
р
д
ц
а
.
Н
е
в
о
з
м
о
ж
н
о
о
ц
е
н
и
т
ь
р
е
з
и
с
т
е
н
т
н
о
с
т
ь
л
е
г
о
ч
н
ы
х
с
о
с
у
д
о
в
*
П
р
и
и
с
п
о
л
ь
з
о
в
а
н
и
и
н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
д
о
л
ж
е
н
б
ы
т
ь
о
п
т
и
м
и
з
и
р
о
в
а
н
у
г
о
л
з
а
х
в
а
т
а
л
у
ч
а
у
л
ь
т
р
а
з
в
у
к
о
в
о
г
о
л
у
ч
а
.
Б
М
К
—
б
а
л
л
о
н
н
а
я
м
и
т
р
а
л
ь
н
а
я
к
о
м
и
с
с
у
р
о
т
о
м
и
я
;
Л
П
—
л
е
в
о
е
п
р
е
д
с
е
р
д
и
е
;
М
С
—
м
и
т
р
а
л
ь
н
ы
й
с
т
е
н
о
з
;
П
П
—
п
р
а
в
о
е
п
р
е
д
с
е
р
д
и
е
;
П
О
М
К
—
п
л
о
щ
а
д
ь
м
и
т
р
а
л
ь
н
о
г
о
о
т
в
е
р
с
т
и
я
;
П
П
Т
—
п
л
о
щ
а
д
ь
п
о
в
е
р
х
н
о
с
т
и
т
е
л
а
;
Т
Т
Э
х
о
К
Г
—
т
р
а
н
с
т
о
р
а
к
а
л
ь
н
а
я
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
я
;
Ч
П
Э
х
о
К
Г
—
ч
р
е
с
п
и
щ
е
в
о
д
н
а
я
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
я
.
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
П
о
д
х
о
д
к
п
р
и
о
б
р
е
т
е
н
и
ю
и
а
н
а
л
и
з
у
д
а
н
н
ы
х
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
и
п
р
и
м
и
т
р
а
л
ь
н
о
м
с
т
е
н
о
з
е
In-21_для нас.indd 518
03.04.2019 12:00:37
519
21 Митральный стеноз
ЛИТЕРАТУРА
1. Iung B, Vahanian A. Epidemiology of ac-
quired valvular heart disease, Can J Cardiol
30:962–970, 2014.
2. Marijon E, Mirabel M, Celermajer DS, Jouven
X. Rheumatic heart disease, Lancet 379:953–
964, 2012.
3. Sliwa K, Carrington M, Mayosi BM, et al.
Incidence and characteristics of newly diag-
nosed rheumatic heart disease in urban Afri-
can adults: insights from the heart of Soweto
study, Eur Heart J 31:719–727, 2010.
4. Marijon E, Celermajer DS, Tafflet M, et al.
Rheumatic heart disease screening by echo-
cardiography: the inadequacy of World
Health Organization criteria for optimizing
the diagnosis of subclinical disease, Circula-
tion 120:663–668, 2009.
5. Iung B, Baron G, Butchart EG, et al. A pro-
spective survey of patients with valvular heart
disease in Europe: the Euro Heart Survey on
Valvular Heart Disease, Eur Heart J 24:1231–
1243, 2003.
6. Demirbag R, Sade LE, Aydin M, et al. The
Turkish registry of heart valve disease, Turk
Kardiyol Dern Ars 41:1–10, 2013.
7. Inoue K, Owaki T, Nakamura T, et al. Clinical
application of transvenous mitral commis-
surotomy by a new balloon catheter, J Thorac
Cardiovasc Surg 87:394–402, 1984.
8. Marechaux S, Rusinaru D, Jobic Y, et al. Food
and Drug Administration criteria for the di-
agnosis of drug-induced valvular heart dis-
ease in patients previously exposed to ben-
fluorex: a prospective multicentre study, Eur
Heart J Cardiovasc Imaging 16:158–165, 2015.
9. Jobic Y, Etienne Y, Bruneval P, Ennezat PV.
Benfluorex-induced mitral stenosis: a
misknown etiology, Int J Cardiol 177:e174–
e175, 2014.
10. Iwataki M, Takeuchi M, Otani K, et al. Cal-
cific extension towards the mitral valve causes
non-rheumatic mitral stenosis in degenera-
tive aortic stenosis: real-time 3D transoesoph-
ageal echocardiography study, Open Heart
1:e000136, 2014.
11. Baumgartner H, Hung J, Bermejo J, et al.
Echocardiographic assessment of valve steno-
sis: EAE/ASE recommendations for clinical
practice, J Am Soc Echocardiogr 21:1–23, 2009.
quiz 101-102.
12. Faletra F, Pezzano Jr. A, Fusco R, et al. Mea-
surement of mitral valve area in mitral steno-
sis: four echocardiographic methods com-
pared with direct measurement of anatomic
orifices, J Am Coll Cardiol 28:1190–1197,
1996.
13. Sohrabi B, Kazemi B, Mehryar A, et al. Cor-
relation between pulmonary artery pressure
measured by echocardiography and right
heart catheterization in patients with rheu-
matic mitral valve stenosis (a prospective
study), Echocardiography 33:7–13, 2015.
14. Keenan NG, Cueff C, Cimadevilla C, et al.
Usefulness of left atrial volume versus diam-
eter to assess thromboembolic risk in mitral
stenosis, Am J Cardiol 106:1152–1156, 2010.
15. Iung B, Cormier B, Ducimetiere P, et al. Im-
mediate results of percutaneous mitral com-
missurotomy. A predictive model on a series
of 1514 patients, Circulation 94:2124–2130,
1996.
16. Lancellotti P, Tribouilloy C, Hagendorff A, et
al. Recommendations for the echocardiograph-
ic assessment of native valvular regurgitation:
an executive summary from the European As-
sociation of Cardiovascular Imaging, Eur Heart
J Cardiovasc Imaging 14:611–644, 2013.
17. Choi BH, Ko SM, Hwang HK, et al. Detection
of left atrial thrombus in patients with mitral
stenosis and atrial fibrillation: retrospective
comparison of two-phase computed tomog-
raphy, transoesophageal echocardiography
and surgical findings, Eur Radiol 23:2944–
2953, 2013.
18. Nunes MC, Handschumacher MD, Levine
RA, et al. Role of LA shape in predicting
embolic cerebrovascular events in mitral ste-
nosis: mechanistic insights from 3D echocar-
diography, JACC Cardiovasc Imaging 7:453–
461, 2014.
19. Wunderlich NC, Beigel R, Siegel RJ. Manage-
ment of mitral stenosis using 2D and 3D
echo-Doppler imaging, JACC Cardiovasc Im-
aging 6:1191–1205, 2013.
20. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC Guideline for the Manage-
ment of Patients With Valvular Heart Dis-
ease: A Report of the American College of
Cardiology/American Heart Association Task
Force on Practice Guidelines, Circulation
129:e521–e643, 2014.
21. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012): The Joint Task
Force on the Management of Valvular Heart
Disease of the European Society of Cardiol-
ogy (ESC) and the European Association for
Cardio-Thoracic Surgery (EACTS), Eur Heart
J 33:2451–2496, 2012.
22. Messika-Zeitoun D, Brochet E, Holmin C, et
al. Three-dimensional evaluation of the mi-
tral valve area and commissural opening be-
fore and after percutaneous mitral commis-
surotomy in patients with mitral stenosis, Eur
Heart J 28:72–79, 2007.
23. Min SY, Song JM, Kim YJ, et al. Discrepancy
between mitral valve areas measured by two-
dimensional planimetry and three-dimen-
sional transoesophageal echocardiography in
patients with mitral stenosis, Heart 99:253–
258, 2013.
24. Messika-Zeitoun D, Meizels A, Cachier A, et
al. Echocardiographic evaluation of the mitral
valve area before and after percutaneous mi-
tral commissurotomy: the pressure half-time
method revisited, J Am Soc Echocardiogr
18:1409–1414, 2005.
25. Wilkins GT, Weyman AE, Abascal VM, et al.
Percutaneous balloon dilatation of the mitral
valve: an analysis of echocardiographic vari-
ables related to outcome and the mechanism
of dilatation, Br Heart J 60:299–308, 1988.
26. Iung B, Cormier B, Ducimetiere P, et al. Func-
tional results 5 years after successful percuta-
neous mitral commissurotomy in a series of
528 patients and analysis of predictive fac-
tors, J Am Coll Cardiol 27:407–414, 1996.
27. Fatkin D, Roy P, Morgan JJ, Feneley MP.
Percutaneous balloon mitral valvotomy with
the Inoue single-balloon catheter: commis-
sural morphology as a determinant of out-
come, J Am Coll Cardiol 21:390–397, 1993.
28. Cannan CR, Nishimura RA, Reeder GS, et al.
Echocardiographic assessment of commis-
sural calcium: a simple predictor of outcome
after percutaneous mitral balloon valvotomy,
J Am Coll Cardiol 29:175–180, 1997.
29. Sutaria N, Shaw TR, Prendergast B, North-
ridge D. Transoesophageal echocardiographic
assessment of mitral valve commissural mor-
phology predicts outcome after balloon mi-
tral valvotomy, Heart 92:52–57, 2006.
30. Turgeman Y, Atar S, Rosenfeld T. The sub-
valvular apparatus in rheumatic mitral steno-
sis: methods of assessment and therapeutic
implications, Chest 124:1929–1936, 2003.
31. Padial LR, Freitas N, Sagie A, et al. Echocar-
diography can predict which patients will
develop severe mitral regurgitation after per-
cutaneous mitral valvulotomy, J Am Coll
Cardiol 27:1225–1231, 1996.
32. Nunes MC, Tan TC, Elmariah S, et al. The
echo score revisited: Impact of incorporating
commissural morphology and leaflet dis-
placement to the prediction of outcome for
patients undergoing percutaneous mitral
valvuloplasty, Circulation 129:886–895, 2014.
33. Brochet E, Detaint D, Fondard O, et al. Early
hemodynamic changes versus peak values:
what is more useful to predict occurrence of
dyspnea during stress echocardiography in
patients with asymptomatic mitral stenosis? J
Am Soc Echocardiogr 24:392–398, 2011.
34. Iung B, Vahanian A. Rheumatic mitral valve
disease. In Otto CM, Bonow RO, editors:
Valvular heart disease. A companion to
Braunwald’s heart disease, ed 2, Philadelphia,
2014, Elsevier Saunders.
35. Messika-Zeitoun D, Blanc J, Iung B, et al.
Impact of degree of commissural opening
after percutaneous mitral commissurotomy
on long-term outcome, JACC Cardiovasc Im-
aging 2:1–7, 2009.
36. Krishnamoorthy KM, Dash PK, Radhakrish-
nan S, Shrivastava S. Response of different
grades of pulmonary artery hypertension to
balloon mitral valvuloplasty, Am J Cardiol
90:1170–1173, 2002.
37. Essop MR, Wisenbaugh T, Skoularigis J, et al.
Mitral regurgitation following mitral balloon
valvotomy. Differing mechanisms for severe
versus mild-to-moderate lesions, Circulation
84:1669–1679, 1991.
38. Manjunath CN, Panneerselvam A, Srinivasa
KH, et al. Incidence and predictors of atrial
septal defect after percutaneous transvenous
mitral commissurotomy—a transesophageal
echocardiographic study of 209 cases, Echo-
cardiography 30:127–130, 2013.
39. Cormier B, Vahanian A, Iung B, et al. Influ-
ence of percutaneous mitral commissuroto-
my on left atrial spontaneous contrast of
mitral stenosis, Am J Cardiol 71:842–847,
1993.
40. Hernandez R, Banuelos C, Alfonso F, et al.
Long-term clinical and echocardiographic
follow-up after percutaneous mitral valvulo-
plasty with the Inoue balloon, Circulation
99:1580–1586, 1999.
41. Chen CR, Cheng TO. Percutaneous balloon
mitral valvuloplasty by the Inoue technique:
a multicenter study of 4832 patients in China,
Am Heart J 129:1197–1203, 1995.
42. Ben-Farhat M, Betbout F, Gamra H, et al.
Predictors of long-term event-free survival
and of freedom from restenosis after percu-
taneous balloon mitral commissurotomy, Am
Heart J 142:1072–1079, 2001.
43. Arora R, Kalra GS, Singh S, et al. Percutane-
ous transvenous mitral commissurotomy:
immediate and long-term follow-up results,
Catheter Cardiovasc Interv 55:450–456, 2002.
44. Iung B, Nicoud-Houel A, Fondard O, et al.
Temporal trends in percutaneous mitral com-
missurotomy over a 15-year period, Eur Heart
J 25:701–707, 2004.
45. Complications and mortality of percutaneous
balloon mitral commissurotomy: A report
from the National Heart, Lung, and Blood
In-21_для нас.indd 519
03.04.2019 12:00:37
520
ЧАСТЬ IV Пороки клапанов сердца
Institute Balloon Valvuloplasty Registry, Cir-
culation 85:2014–2024, 1992.
46. Meneveau N, Schiele F, Seronde MF, et al.
Predictors of event-free survival after percu-
taneous mitral commissurotomy, Heart
80:359–364, 1998.
47. Stefanadis CI, Stratos CG, Lambrou SG, et al.
Retrograde nontransseptal balloon mitral
valvuloplasty: immediate results and interme-
diate long-term outcome in 441 cases—a
multicenter experience, J Am Coll Cardiol
32:1009–1016, 1998.
48. Palacios IF, Sanchez PL, Harrell LC, et al.
Which patients benefit from percutaneous
mitral balloon valvuloplasty? Prevalvulo-
plasty and postvalvuloplasty variables that
predict long-term outcome, Circulation
105:1465–1471, 2002.
49. Neumayer U, Schmidt HK, Fassbender D, et
al. Early (three-month) results of percutane-
ous mitral valvotomy with the Inoue balloon
in 1,123 consecutive patients comparing vari-
ous age groups, Am J Cardiol 90:190–193,
2002.
50. Jneid H, Cruz-Gonzalez I, Sanchez-Ledesma
M, et al. Impact of pre- and postprocedural
mitral regurgitation on outcomes after percu-
taneous mitral valvuloplasty for mitral steno-
sis, Am J Cardiol 104:1122–1127, 2009.
51. Fawzy ME. Long-term results up to 19 years
of mitral balloon valvuloplasty, Asian Cardio-
vasc Thorac Ann 17:627–633, 2009.
52. Tomai F, Gaspardone A, Versaci F, et al.
Twenty year follow-up after successful per-
cutaneous balloon mitral valvuloplasty in a
large contemporary series of patients with
mitral stenosis, Int J Cardiol 177:881–885,
2014.
53. Chandrashekhar Y, Westaby S, Narula J. Mi-
tral stenosis, Lancet 374:1271–1283, 2009.
54. Badheka AO, Shah N, Ghatak A, et al. Balloon
mitral valvuloplasty in the United States: a
13-year perspective, Am J Med 127:1126,
2014.
55. Kang DH, Park SW, Song JK, et al. Long-term
clinical and echocardiographic outcome of
percutaneous mitral valvuloplasty: random-
ized comparison of Inoue and double-balloon
techniques, J Am Coll Cardiol 35:169–175,
2000.
56. Eltchaninoff H, Koning R, Derumeaux G,
Cribier A. [Percutaneous mitral commissur-
otomy by metallic dilator. Multicenter expe-
rience with 500 patients], Arch Mal Coeur
Vaiss 93:685–692, 2000.
57. Multicenter experience with balloon mitral
commissurotomy: NHLBI Balloon Valvulo-
plasty Registry Report on immediate and
30-day follow-up results. The National Heart,
Lung, and Blood Institute Balloon Valvulo-
plasty Registry Participants, Circulation
85:448–461, 1992.
58. Cruz-Gonzalez I, Sanchez-Ledesma M, San-
chez PL, et al. Predicting success and long-
term outcomes of percutaneous mitral valvu-
loplasty: a multifactorial score, Am J Med
122:581, 2009.
59. Dreyfus J, Cimadevilla C, Nguyen V, et al.
Feasibility of percutaneous mitral commis-
surotomy in patients with commissural mitral
valve calcification, Eur Heart J 35:1617–1623,
2014.
60. Wang A, Krasuski RA, Warner JJ, et al. Serial
echocardiographic evaluation of restenosis
after successful percutaneous mitral commis-
surotomy, J Am Coll Cardiol 39:328–334,
2002.
61. Hickey MS, Blackstone EH, Kirklin JW, Dean
LS: Outcome probabilities and life history
after surgical mitral commissurotomy: impli-
cations for balloon commissurotomy, J Am
Coll Cardiol 17:29–42, 1991.
62. Bouleti C, Iung B, Laouenan C, et al. Late
results of percutaneous mitral commissurot-
omy up to 20 years: development and valida-
tion of a risk score predicting late functional
results from a series of 912 patients, Circula-
tion 125:2119–2127, 2012.
63. Orrange SE, Kawanishi DT, Lopez BM, et al.
Actuarial outcome after catheter balloon
commissurotomy in patients with mitral ste-
nosis, Circulation 95:382–389, 1997.
64. Song JK, Song JM, Kang DH, et al. Restenosis
and adverse clinical events after successful
percutaneous mitral valvuloplasty: immedi-
ate post-procedural mitral valve area as an
important prognosticator, Eur Heart J
30:1254–1262, 2009.
65. Fawzy ME, Hassan W, Shoukri M, et al. Im-
mediate and long-term results of mitral bal-
loon valvotomy for restenosis following pre-
vious surgical or balloon mitral commissur-
otomy, Am J Cardiol 96:971–975, 2005.
66. Bouleti C, Iung B, Himbert D, et al. Long-
term efficacy of percutaneous mitral com-
missurotomy for restenosis after previous
mitral commissurotomy, Heart 99:1336–
1341, 2013.
67. Bouleti C, Iung B, Himbert D, et al. Reinter-
ventions after percutaneous mitral commis-
surotomy during long-term follow-up, up to
20 years: the role of repeat percutaneous mi-
tral commissurotomy, Eur Heart J 34:1923–
1930, 2013.
68. Pathan AZ, Mahdi NA, Leon MN, et al. Is
redo percutaneous mitral balloon valvulo-
plasty (PMV) indicated in patients with post-
PMV mitral restenosis? J Am Coll Cardiol
34:49–54, 1999.
69. Kim JB, Ha JW, Kim JS, et al. Comparison of
long-term outcome after mitral valve replace-
ment or repeated balloon mitral valvotomy in
patients with restenosis after previous bal-
loon valvotomy, Am J Cardiol 99:1571–1574,
2007.
70. Iung B, Cormier B, Farah B, et al. Percutane-
ous mitral commissurotomy in the elderly,
Eur Heart J 16:1092–1099, 1995.
71. Sutaria N, Elder AT, Shaw TR. Long term
outcome of percutaneous mitral balloon val-
votomy in patients aged 70 and over, Heart
83:433–438, 2000.
72. Shaw TR, Sutaria N, Prendergast B. Clinical
and haemodynamic profiles of young, middle
aged, and elderly patients with mitral stenosis
undergoing mitral balloon valvotomy, Heart
89:1430–1436, 2003.
73. Chmielak Z, Klopotowski M, Demkow M, et
al. Percutaneous mitral balloon valvuloplasty
beyond 65 years of age, Cardiol J 20:44–51,
2013.
74. Gamra H, Betbout F, Ben Hamda K, et al.
Balloon mitral commissurotomy in juvenile
rheumatic mitral stenosis: a ten-year clinical
and echocardiographic actuarial results, Eur
Heart J 24:1349–1356, 2003.
75. Fawzy ME, Stefadouros MA, Hegazy H, et al.
Long term clinical and echocardiographic
results of mitral balloon valvotomy in chil-
dren and adolescents, Heart 91:743–748,
2005.
76. Kothari SS, Ramakrishnan S, Kumar CK, et
al. Intermediate-term results of percutaneous
transvenous mitral commissurotomy in chil-
dren less than 12 years of age, Catheter Car-
diovasc Interv 64:487–490, 2005.
77. Regitz-Zagrosek V, Blomstrom Lundqvist C,
Borghi C, et al. ESC Guidelines on the man-
agement of cardiovascular diseases during
pregnancy: The Task Force on the Manage-
ment of Cardiovascular Diseases during Preg-
nancy of the European Society of Cardiology
(ESC), Eur Heart J 32:3147–3197, 2011.
78. Silaruks S, Thinkhamrop B, Kiatchoosakun S,
et al. Resolution of left atrial thrombus after
6 months of anticoagulation in candidates for
percutaneous transvenous mitral commissur-
otomy, Ann Intern Med 140:101–105, 2004.
79. Reyes VP, Raju BS, Wynne J, et al. Percutane-
ous balloon valvuloplasty compared with
open surgical commissurotomy for mitral
stenosis, N Engl J Med 331:961–967, 1994.
80. Turi ZG, Reyes VP, Raju BS, et al. Percutane-
ous balloon versus surgical closed commis-
surotomy for mitral stenosis. A prospective,
randomized trial, Circulation 83:1179–1185,
1991.
81. Ben Farhat M, Ayari M, Maatouk F, et al.
Percutaneous balloon versus surgical closed
and open mitral commissurotomy: seven-
year follow-up results of a randomized trial,
Circulation 97:245–250, 1998.
82. Rifaie O, Abdel-Dayem MK, Ramzy A, et al.
Percutaneous mitral valvotomy versus closed
surgical commissurotomy. Up to 15 years of
follow-up of a prospective randomized study,
J Cardiol 53:28–34, 2009.
83. Song JK, Kim MJ, Yun SC, et al. Long-term
outcomes of percutaneous mitral balloon
valvuloplasty versus open cardiac surgery, J
Thorac Cardiovasc Surg 139:103–110, 2010.
84. Hildick-Smith DJ, Taylor GJ, Shapiro LM.
Inoue balloon mitral valvuloplasty: long-term
clinical and echocardiographic follow-up of a
predominantly unfavourable population, Eur
Heart J 21:1690–1697, 2000.
85. Bouleti C, Iung B, Himbert D, et al. Relation-
ship between valve calcification and long-
term results of percutaneous mitral commis-
surotomy for rheumatic mitral stenosis, Circ
Cardiovasc Interv 7:381–389, 2014.
86. Kang DH, Lee CH, Kim DH, et al. Early per-
cutaneous mitral commissurotomy vs. con-
ventional management in asymptomatic
moderate mitral stenosis, Eur Heart J
33:1511–1517, 2012.
87. Porte JM, Cormier B, Iung B, et al. Early as-
sessment by transesophageal echocardiogra-
phy of left atrial appendage function after
percutaneous mitral commissurotomy, Am J
Cardiol 77:72–76, 1996.
88. Peverill RE, Harper RW, Gelman J, et al. De-
terminants of increased regional left atrial
coagulation activity in patients with mitral
stenosis, Circulation 94:331–339, 1996.
89. Chiang CW, Lo SK, Ko YS, et al. Predictors
of systemic embolism in patients with mitral
stenosis. A prospective study, Ann Intern Med
128:885–889, 1998.
90. Liu TJ, Lai HC, Lee WL, et al. Percutaneous
balloon commissurotomy reduces incidence
of ischemic cerebral stroke in patients with
symptomatic rheumatic mitral stenosis, Int J
Cardiol 123:189–190, 2008.
91. Dahan M, Paillole C, Martin D, Gourgon R.
Determinants of stroke volume response to
exercise in patients with mitral stenosis: a
Doppler echocardiographic study, J Am Coll
Cardiol 21:384–389, 1993.
92. Schwammenthal E, Vered Z, Agranat O, et al.
Impact of atrioventricular compliance on
In-21_для нас.indd 520
03.04.2019 12:00:38
521
21 Митральный стеноз
pulmonary artery pressure in mitral stenosis:
an exercise echocardiographic study, Circula-
tion 102:2378–2384, 2000.
93. Reis G, Motta MS, Barbosa MM, et al. Dobu-
tamine stress echocardiography for noninva-
sive assessment and risk stratification of pa-
tients with rheumatic mitral stenosis, J Am
Coll Cardiol 43:393–401, 2004.
94. Okay T, Deligonul U, Sancaktar O, Kozan O.
Contribution of mitral valve reserve capacity
to sustained symptomatic improvement after
balloon valvulotomy in mitral stenosis: impli-
cations for restenosis, J Am Coll Cardiol
22:1691–1696, 1993.
95. Nunes MC, Hung J, Barbosa MM, et al. Im-
pact of net atrioventricular compliance on
clinical outcome in mitral stenosis, Circ Car-
diovasc Imaging 6:1001–1008, 2013.
96. Otto CM, Davis KB, Holmes Jr. DR, et al.
Methodologic issues in clinical evaluation of
stenosis severity in adults undergoing aortic
or mitral balloon valvuloplasty. The NHLBI
Balloon Valvuloplasty Registry, Am J Cardiol
69:1607–1616, 1992.
97. Segal J, Lerner DJ, Miller DC, et al. When
should Doppler-determined valve area be bet-
ter than the Gorlin formula? Variation in
hydraulic constants in low flow states, J Am
Coll Cardiol 9:1294–1305, 1987.
98. Helvacioglu F, Yildirimturk O, Duran C, et al.
The evaluation of mitral valve stenosis: com-
parison of transthoracic echocardiography
and cardiac magnetic resonance, Eur Heart J
Cardiovasc Imaging 15:164–169, 2014.
99. Messika-Zeitoun D, Serfaty JM, Laissy JP, et
al. Assessment of the mitral valve area in pa-
tients with mitral stenosis by multislice com-
puted tomography, J Am Coll Cardiol 48:411–
413, 2006.
100. Green NE, Hansgen AR, Carroll JD. Initial
clinical experience with intracardiac echocar-
diography in guiding balloon mitral valvulo-
plasty: technique, safety, utility, and limita-
tions, Catheter Cardiovasc Interv 63:385–394,
2004.
In-21_для нас.indd 521
03.04.2019 12:00:38
In-21_для нас.indd 522
03.04.2019 12:00:38
523
радкой более чем в 90% случаев, и приблизительно
такой же процент пациентов имеет положительные
гемокультуры, связанные с этим заболеванием [3].
Большинство больных имеют клинические симпто-
мы продолжительностью < 1 мес [3]. Примерно у
50% пациентов выслушиваются новые или опреде-
ляется динамика сердечных шумов, связанных с
клапанной регургитацией или другой патологией
эндокарда. Однако очень небольшой процент боль-
ных имеет периферические проявления классиче-
ского, подострого ИЭ (узелки Ослера), язвочки
Джейнвея), точечные кровоизлияния, пятна Рота)
[3].
Связь между инфекционным поражением эндо-
карда и клиническими проявлениями ИЭ уже при-
знается на протяжении более века. Однако клиниче-
ская картина заболевания неспецифична, что ставит
под вопрос точность прижизненной диагностики
[8]. В 1977 г. Jr. L.L. Pelletier и R.G . Petersdorf пред-
ложили критерии диагностики случаев заболевания
ИЭ, которые основывались в основном на клиниче-
ских данных и непрерывной бактериемии [9]. Хотя
был сделан первый шаг к стандартизации диагно-
стики ИЭ, эти критерии имели высокую специфич-
ность, но им не хватало чувствительности. В 1981 г.
C.F. Von Reyn и соавт. расширили данные клиниче-
ские критерии и предложили следующие категории
диагностики при подозрении на ИЭ: неподтвер-
жденный, возможный, вероятный, несомненный
[10]. Эти изменения увеличили чувствительность и
специфичность диагностики, однако не включали
инструментальные данные поражения эндокарда,
сравнительно нового метода ЭхоКГ. Впоследствии,
в 1994 г., опубликованы критерии диагностики
Дьюка, предложенные D.T . Durack и соавт. [11].
Диагностика и лечение инфекционного эндокарди-
та (ИЭ) значительно улучшились с появлением эхо-
кардиографии (ЭхоКГ). Первое применение ЭхоКГ
для диагностики ИЭ было описано в 1973 г. Dillon
и соавт. [4], использовавшими M-режим для визуа-
лизации вегетаций. С помощью этого метода мож-
но документировать высокочастотные колебания
вегетаций и нарушение целостности аортальной
или митральной створки (рис. 22 .1). Однако M-ре-
жим не позволяет оценивать размер поражения,
морфологические особенности и точную локализа-
цию конкретных участков пораженной створки по
сравнению с двухмерным методом (2D) в режиме
реального времени, впервые описанным Gilbert и
соавт. [5]. Вместе с широким внедрением 2D-ЭхоКГ
с улучшенным пространственным разрешением,
которое дает чреспищеводная эхокардиография
(ЧПЭхоКГ) [6], ЭхоКГ стала методом выбора при
подозрении на ИЭ. ЭхоКГ не только демонстрирует
доказательства наличия инфекции эндокарда, полу-
ченные неинвазивным путем, но также дает важную
гемодинамическую информацию о наличии и тяже-
сти клапанной регургитации и других структурных
осложнениях и имеет важное значение в принятии
клинических решений. По этим причинам ЭхоКГ
считается необходимой во всех случаях подозрения
на ИЭ [7].
ОСНОВНЫЕ ПРИНЦИПЫ ДИАГНОСТИКИ
И ЭХОКАРДИОГРАФИЧЕСКИЙ МЕТОД
Клинические данные позволяют выявить предра-
сполагающие факторы развития ИЭ и направить в
нужное русло использование ЭхоКГ для подтвер-
ждения этого диагноза. ИЭ ассоциируется с лихо-
22 Инфекционный эндокардит
ZAINAB SAMAD, MBBS, MHS • ANDREW WANG, MD
Основные принципы диагностики
и эхокардиографический метод
Методика проведения, количественная
оценка и интерпретация данных
Диагностика эндокардита
Общие представления
Обследование пациентов с бактериемией
Обследование пациентов с протезными
клапанами
Обследование пациентов
с имплантированными электронными
устройствами
Целесообразность лечения
Целесообразность последующего
наблюдения
Использование научных разработок
Потенциальные ограничения
и будущие направления
Альтернативные подходы
In-22_для нас.indd 523
03.04.2019 12:00:58
524
ЧАСТЬ IV Пороки клапанов сердца
ИЭ [3]. При эхокардиографическом исследовании
вегетации выявляются в виде неправильной фор-
мы, колеблющихся, очаговых, эхогенных масс на
створках клапанов, хордах или других эндокарди-
альных поверхностях, соприкасающихся с турбу-
лентной струей регургитации, или септальных де-
фектов. Как правило, вегетации располагаются на
поверхности с низким давлением высокоскорост-
ной струи, и, следовательно, при регургитации, ве-
гетации находятся на предсердной стороне ми-
трального и трикуспидального клапанов или желу-
дочковой поверхности аортального и легочного
клапанов. Вегетации обычно имеют эхогенность,
аналогичную среднему слою миокарда, могут иметь
гетерогенную структуру с эхогенными и эхонега-
тивными зонами. Вегетации могут также выявлять-
ся на экстракардиальных структурах, таких как
внутрисердечные устройства. Осложнением вегета-
тивного процесса может являться перфорация
створки клапана, которая визуализируется в виде
дефекта в области тела створки клапана с потоком
крови через отверстие.
Для исключения вегетаций необходимо провести
оптимизацию настроек прибора, таких как частота
кадров, размер сектора, регулировку серой шкалы,
зоны фокусировки и выполнить тщательное иссле-
дование, включая нестандартные позиции. Увеличе-
ние коэффициента усиления и неправильная на-
стройка зон фокусировки приводят к увеличению
изображения размеров вегетаций. С другой сторо-
ны, цветовое картирование с изменением частоты
повторения импульсов ухудшает визуализацию
вегетаций. Размер вегетаций определяется с учетом
разрешающей способности датчика, при последую-
щих исследованиях, если имеются клинические
показания, необходимо использовать одинаковые
настройки прибора.
Вегетации при ЭхоКГ следует дифференциро-
вать от других аналогичных дополнительных обра-
зований, таких как эндокардит Либмана–Сакса
(неинфекционный), дегенеративных изменений,
наложений Ламбла, тромбов и опухолей. Так как не
существует надежных эхокардиографических кри-
териев, с помощью которых можно дифференци-
ровать инфекционное поражение эндокарда от
неинфекционного, ключ к правильной диагности-
ке заключается в интеграции результатов ультраз-
вукового исследования с клиническими данными.
Визуализация вегетаций может быть затруднена
при тяжелой дегенерации клапанного аппарата,
особенно при выраженной кальцификации створок
клапанов.
Деструкция ткани сердца при ИЭ может приве-
сти к другим структурным осложнениям, которые
могут быть диагностированы с помощью ЭхоКГ.
Околоклапанный абсцесс — осложнение, встречаю-
щееся в 30–40% случаев ИЭ, как указывалось в
Рис. 22 .1 Эхокардиограмма в M-режиме при вегетации на аортальном
клапане. Обратите внимание на слоистые эхо-сигналы (стрелка) в фазу диа-
столы у пациента с эндокардитом аортального клапана.
Данные критерии впервые объединили эхокардио-
графические признаки поражения эндокарда, ми-
кробиологические и клинические критерии. Дейст-
вительно, поражение эндокарда, в т.ч . новые кла-
панные регургитации, внутрисердечные вегетации,
абсцесс фиброзного кольца, появление несостоя-
тельности протезированного клапана, стали одним
из двух основных диагностических критериев обна-
ружения случаев ИЭ согласно критериям Дьюка,
наряду с микробиологическими критериями.
Впоследствии в ходе нескольких сравнительных
исследований критериев Фон Рейна и критериев
Дьюка в различных группах больных обнаружена
более высокая чувствительность критериев Дьюка
по сравнению с ранними способами диагностики
заболевания [12–19]. Отрицательная прогностиче-
ская ценность этих критериев составила > 92% с
высокой чувствительностью (100%) и специфично-
стью (88%) [20, 21]. Последняя модификация кри-
териев Дьюка (табл. 22 .1) увеличила специфичность
диагностики [22].
МЕТОДИКА ПРОВЕДЕНИЯ, КОЛИЧЕСТВЕННАЯ
ОЦЕНКА И ИНТЕРПРЕТАЦИЯ ДАННЫХ
Эхокардиографическими признаками ИЭ являются
вегетации, абсцесс, аневризма, фистула, перфора-
ция створки клапана и несостоятельность протези-
рованного клапана (табл. 22 .2) [23]. Вегетации не-
редко образуются в зоне эрозий эндокарда, на фоне
приобретенного порока сердца (рис. 22.2 –22 .5).
Деструкция в области эндокардиальной поверхно-
сти приводит в адгезии тромбоцитов, отложениям
фибрина, куда оседают микроорганизмы при тран-
зиторной бактериемии и формируются инфициро-
ванные вегетации. Вегетации визуализируются
приблизительно у 90% пациентов с определенным
In-22_для нас.indd 524
03.04.2019 12:00:58
525
22 Инфекционный эндокардит
Модифицированные критерии Дьюка
Степень вероятности
Основные критерии
Положительная гемокультура при инфекционном
эндокардите (ИЭ)
Типичные для ИЭ микробы из двух отдельных гемокультур: зеленящие
стрептококки, Streptococcus bovis, группа HACEK, Staphylococcus aureus
или внебольничный энтерококк при отсутствии первичного очага
инфекции; или
Микроорганизмы, соответствующие ИЭ, полученные из стабильно положи-
тельных гемокультур: как минимум две положительные гемокультуры из
образцов крови, взятых с интервалом больше 12 час, или все три или боль-
ше четырех отдельно взятых гемокультур
Единичная положительная гемокультура при Coxiella burrnetti или титр
антител IgG фазы > 1 : 800
Признаки вовлечения эндокарда
Эхокардиограмма, характерная для IE, определяемая следующим образом:
Подвижная внутрисердечная масса в области клапана или опорной
структуры
Абсцесс
Вновь возникшее частичное зияние протезного клапана
Вновь возникшая клапанная регургитация
Малые критерии
Предполагаемая предрасположенность к сердечному заболеванию или упо-
требление инъекционных наркотиков
Лихорадка, температура > 38°C
Сосудистые явления, артериальные эмболы, септические легочные инфар-
кты, микотическая аневризма, внутричерепное кровоизлияние, субконъ-
юнктивальное кровоизлияние и язвочки Джейнвея
Иммунологические признаки:
гломерулонефрит, узелки Ослера, пятна Рота, ревматоидный фактор
Микробиологические признаки: положительные гемокультуры, не отвеча-
ющие большим критериям, перечисленным ранее, или серологические
признаки активной инфекции организма, характерной для ИЭ
Безусловный ИЭ
Патологические критерии
1. Микроорганизмы, выявленные при культи-
вировании или гистологическом исследова-
нии вегетаций, эмболии вегетациями или
внутрисердечный абсцесс; или
2. Патологические поражения; вегетации или
внутрисердечный абсцесс, идентифицирован-
ные при гистологическом исследовании, ука-
зывающие на активный эндокардит
Клинические критерии
1. 2 больших критерия; или
2. 1 большой и 3 малых критерия; или
3. 5 малых критериев
Возможный инфекционный эндокардит
1. 1 большой критерий и 1 малый критерий;
или
2. 3 малых критерия
Неподтвержденный ИЭ
1. Альтернативный диагноз, объясняющий при-
знаки инфекционного эндокардита; или
2. Разрешение синдрома инфекционного эндо-
кардита при продолжительности антибакте-
риальной терапией ≤ 4 дней; или
3. Отсутствие патологических признаков
инфекционного эндокардита при хирургиче-
ском вмешательстве или аутопсии с антибак-
териальной терапией в течение < 4 дней; или
4. Не соответствие критериям возможного
инфекционного эндокардита, перечисленным
ранее
[Li JS, Sexton DJ, Mick N, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 30:633–638,
2000.]
ТАБЛИЦА 22.1 Модифицированные критерии Дьюка и степень вероятности инфекционного эндокардита
ранних сообщениях [6], обнаружен лишь у 14%
пациентов с определенным ИЭ по данным совре-
менного исследования [3] (рис. 22.6). Абсцесс яв-
ляется результатом инвазивной инфекции, кото-
рая распространяется в основном по прилежащим
тканям, наиболее часто связан с поражением аор-
тального клапана. Появление новых нарушений
атриовентрикулярной проводимости, ухудшение
клинической картины, постоянная бактериемия
или лихорадка при эндокардите аортального кла-
пана, внутривенное введение препаратов, инвазив-
ная патогенная микрофлора (стафилококк) и на-
личие протезированного клапана должны служить
основанием для поиска абсцесса корня аорты (рис.
22.7) [24].
ЧПЭхоКГ — диагностический метод, который
используют, когда существуют клинические осно-
вания для подозрения на абсцесс. Абсцесс диагно-
стируют ЧПЭхоКГ при визуализации «зоны утол-
щения» или «гетерогенных эхогенных масс или
эхонегативного просветления» в области миокарда
или зоне фиброзного кольца [6]. При цветовом кар-
тировании наличие потока в зоне поражения под-
тверждает диагноз. Абсцессы, развивающиеся при
поражении нативных клапанов, обычно выявляют-
ся в области фиброзного кольца аортального клапа-
на в месте прикрепления корня аорты и передней
створки митральной клапана. Поражение может
распространяться на межжелудочковую перегород-
ку, выносящий тракт правого желудочка (ПЖ),
межпредсердную перегородку и переднюю створку
митрального клапана. Абсцесс, расположенный в
области задней части фиброзного кольца митраль-
ного клапана с кальцификацией, трудно визуализи-
ровать [25]. В группе больных ICE в 22% случаев
определенного ИЭ аортального клапана были обна-
ружены околоклапанные абсцессы [24]. Эти паци-
енты в большинстве случаев имели протезирован-
ные клапаны и коагулазонегативные стафилококко-
вые инфекции. Хирургический опыт указывает на
большую частоту формирования абсцессов, кото-
рые не визуализируются при ЧПЭхоКГ [25].
Новая околоклапанная регургитация вокруг
протезированного клапана может также свидетель-
ствовать о наличии абсцесса или инфицировании
пришивного кольца протеза.
In-22_для нас.indd 525
03.04.2019 12:00:59
526
ЧАСТЬ IV Пороки клапанов сердца
Эхокардиогра-
фические данные Патология
Эхокардиографические
особенности и измерения
Ошибки
Клиническое
значение
Вегетации
Колонии микроор-
ганизмов с фибри-
ном и другими
воспалительными
клеточными эле-
ментами, фикси-
рованными к
эндотелиальной
поверхности
сердца
Эхогенные дискретные массы
неправильной формы
Фиксированные к внутрен-
ней поверхности сердца
Осциллирующие массы под-
тверждают диагноз, но не
обязательны
Измерение максимального
размера
Ложноотрицательный резуль-
тат (−):
Маленький размер; на
широком основании, не
осциллирующие; дегенера-
тивные изменения клапана;
некорректная настройка
усиления
Ложноположительный
результат (+):
Послеоперационные измене-
ния; кальцификация
клапана; Либмана–Сакса;
наложения Ламбла; тромбы;
опухоль
Размер и локализа-
ция взаимосвя-
заны с эмболиче-
ским риском
Большой размер
может говорить о
низкой вероятно-
сти излечения
только
антибиотиками
Абсцесс
Полостью с
гнойным экссуда-
том сформирован-
ная влажным
некрозом
Утолщенная область или
дополнительная масса в
миокарде или зоне фиброз-
ного кольца
Негомогенной структуры с
эхогенными и эхонегатив-
ными участками
Ложноотрицательный резуль-
тат (−):
Отсутствие потока; при фор-
мировании абсцесса;
настройки усиления; при
кальцификации фиброзного
кольца в области задней
створки митрального
клапана
Ложноположительный
результат (+):
Послеоперационные измене-
ния после имплантации
клапана, включая околокла-
панную регургитацию;
настройки усиления
Может быть связан
с аномальностью
проводимости
Показание к хирур-
гической
операции
Фистула
Аномальное сооб-
щение между
двумя различными
внутрисердечными
пространствами
через неанатоми-
ческие каналы
Сброс крови слева направо
при цветовой
допплерографии
Зарегистрированное изобра-
жение должно содержать
данные о зоне интереса
Непрерывно-волновая доп-
плерография выявляет
высокоскоростную струю
через дефект
Ложноотрицательный резуль-
тат (−):
Маленький дефект; маскиру-
ющийся клапанной регурги-
тацией или турбулентным
потоком
Ложноположительный
результат (+):
Клапанная регургитация или
другой турбулентный поток;
но отсутствует высокоско-
ростная струя через дефект
при допплерографии
Сердечная недоста-
точность из-за
сброса крови слева
направо
Показание к
операции
Перфорация
створки
Дефект в теле
створки клапана с
наличием крово-
тока через дефект
Цветовая допплерография
позволяет документировать
сброс крови через
перфорацию
Полипозиционное сканиро-
вание позволяет дифферен-
цировать перфорацию от
клапанной регургитации
3DE позволяет определить
точную локализацию пер-
форации перед операцией
Количественная оценка
регургитации
Ложноотрицательный резуль-
тат (−):
Слишком большое усиление;
маленький дефект; струя
регургитации маскирует
поток через перфорацию
Ложноположительный
результат(+):
Перерыв эхосигналов; в
области комиссур или
расщепления
Увеличивает
тяжесть регургита-
ции и вероятность
сердечной
недостаточности
ТАБЛИЦА 22.2 Патологические признаки инфекционного эндокардита: эхокардиографические проявления
и их клиническое значение
In-22_для нас.indd 526
03.04.2019 12:00:59
527
22 Инфекционный эндокардит
Ао
ЛЖ
ЛП
Рис. 22 .2 Двухмерная трансторакальная эхокардиография вегетации
на аортальном клапане. Парастернальная позиция по длинной оси. Видна
гетерогенная масса неправильной формы (стрелка), фиксированная к створке
аортального клапана и пролабирующая в выходной тракт левого желудочка
(ЛЖ). Aо — аорта; ЛП — левое предсердие.
Эхокардиогра-
фические данные Патология
Эхокардиографические
особенности и измерения
Ошибки
Клиническое
значение
Несостоятель-
ность протези-
рованного
клапана
Колебательное дви-
жение протезиро-
ванного клапана с
экскурсией > 15°
хотя бы в одном
направлении
Струя регургитации опреде-
ляется при цветовой
допплерографии
Количественная оценка
степени регургитации
Ложноотрицательный резуль-
тат (−):
Околоклапанная регургитация
не визуализируется
Ложноположительный
результат(+):
Нормальное движение кольца
в период сердечного цикла
Околоклапанная
регургитация
может приводить
к развитию сер-
дечной недоста-
точности,
гемолизу
Является показа-
нием к неотлож-
ной операции
Инфицирование
имплантирован-
ного электрон-
ного внутрисер-
дечного
устройства
Подвижные массы
на внутрисердеч-
ном устройстве
(электроде) на
фоне лихорадки,
бактериемии, и/
или эмболических
событий
Вегетации выглядят как
массы, фиксированные к
электроду устройства
Тщательный поиск вегета-
ций по ходу внутрисердеч-
ного устройства
Оценка сочетанного клапан-
ного инфицирования
Ложноотрицательный резуль-
тат (−):
Вегетации на экстракардиаль-
ной части устройства
Ложноположительный
результат (+):
Тромб
Главным образом
лечится с
помощью удале-
ния устройства и
использования
антибиотикотера-
пии
ТАБЛИЦА 22.2
окончание
Патологические признаки инфекционного эндокардита: эхокардиографические проявления
и их клиническое значение
Если абсцесс идентифицирован, он требует тща-
тельного исследования для исключения его распро-
странения; дополнительная информация имеет
важное значение для выбора вида восстановитель-
ной хирургии. Нарушение структурной целостно-
сти клапана, наличие клапанной регургитации, ве-
гетаций и утолщения прилежащих тканей помогают
дифференцировать абсцесс нативного аортального
клапана от жидкости в поперечном синусе перикар-
да. Взаимосвязь результатов исследования также
имеет важное значение для диагностики абсцесса у
больных с протезированными клапанами в аор-
тальной позиции. Послеоперационные изменения,
в т.ч . эхогенное пространство между пришивным
кольцом и корнем аорты с или без околоклапанной
регургитации, могут представлять диагностическую
дилемму у пациентов с протезом клапана и лихо-
радкой. В таких случаях регистрация хронического
течения процесса может быть очень полезной по
сравнению с интраоперационными данными ЧПЭ-
хоКГ, если таковые имеются.
В редких случаях воздействие на абсцесс высоко-
го внутрисосудистого давления и прогрессирующей
инфекции может привести к формированию псевдо-
аневризмы (цветовая допплерография демонстри-
рует поток в эхогенном пространстве, прилежащем
к кровотоку). Из-за дальнейшей деструкции ткани
околоклапанные полости или псевдоаневризмы мо-
гут образовывать фистулы (аортально-предсердные
или аортально-желудочковые), перфорации ство-
рок и даже перфорации миокарда. Образование
фистулы ос ложняет 1,6% случая ИЭ нативного кла-
пана и 3,5% случая эндокардита протезированного
клапана в группе из 4681 пациента с определенным
ИЭ [26] (см. рис. 22 .7). Фистула возникает с одина-
ковой частотой в области трех синусов Вальсальвы.
Фистулы из правого или некоронарного синуса
обычно прослеживаются и сообщаются с ПЖ, тогда
как фистулы из левого коронарного синуса имеют
сообщение с левым предсердием (ЛП) [27]. ЧПЭ-
In-22_для нас.indd 527
03.04.2019 12:00:59
528
ЧАСТЬ IV Пороки клапанов сердца
Ао
ЛЖ
ЛП
Рис. 22 .3 Вегетации на аортальном клапане при 2D-ЧПЭхоКГ. В позициях по длинной оси (слева) и короткой оси (справа) определяются вегетации и
гетерогенные массы. Вегетации фиксируются к правой коронарной створке (стрелки). Aо — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие.
Рис. 22 .4 Вегетации на митральном клапане. (A) A 2D-ТТЭхоКГ в позиции по длинной оси с увеличенным изображением пришивного кольца протеза
митрального клапана и больших гетерогенных масс на обоих створках. (Б) Допплерография митрального клапана, показывающее высокий диастолический гра-
диент давления, а также обструкцию митрального клапана.
А
Б
3D beats 1
Рис. 22 .5 ЧПЭхоКГ кольца митрального клапана с вегетациями. (A) A ЧПЭхоКГ в позиции по длинной оси того же пациента, что на рис. 22 .3 . (Б) Трех-
мерная ЧПЭхоКГ кольца митрального клапана с обструкцией отверстия массивными вегетациями.
А
Б
In-22_для нас.indd 528
03.04.2019 12:00:59
529
22 Инфекционный эндокардит
хоКГ является методом выбора для исследования
этих структурных осложнений. Цветовая допплеро-
графия демонстрирует турбулентный, аномальный
поток в эхогенном пространстве и шунтирование
крови через фистулу с камерами сердца.
Прогрессирующее разрушение тканей может
также приводить к разрыву хорд митрального кла-
пан при ИЭ нативного клапана и несостоятельности
протеза при эндокардите протезированного клапа-
на. Несостоятельность протеза — это редко встре-
чающееся, тяжелое осложнение ИЭ, которое являет-
ся предиктором неблагоприятного исход для па-
циента. При эхокардиографическом исследовании
несостоятельность протеза определяется при коле-
бательном его движении с отклонением на 15 гра-
дусов и более хотя бы в одном направлении (рис.
22.8). Это структурное нарушение часто сопрово-
ждается тяжелой околоклапанной регургитацией.
В дополнение к этим осложнениям ИЭ необходи-
мо помнить, что новая клапанная регургитация мо-
жет быть связана с инфекцией эндокарда и является
диагностическим критерием ИЭ Дьюка. Важное зна-
чение имеют определение механизма регургитации,
а также количественная оценка ее тяжести. Тяжелая
регургитация плохо переносится клинически из-за
острого начала и отсутствия времени для развития
компенсаторных механизмов желудочка и является
показанием к хирургическому вмешательству.
У пациентов с механическими протезированны-
ми клапанами полное обследование требует исполь-
зования комбинации трансторакального и чреспи-
щеводного доступов. Трансторакальная эхокардио-
графия (ТТЭхоКГ) позволяет визуализировать
клапан со стороны желудочка, но имеет ограниче-
Рис. 22 .7 Абсцесс корня аорты. При 2D-ЧПЭхоКГ, перпендикулярные срезы аортального клапана, видны утолщение и гетерогенная эхоплотность (стрелки)
аортального кольца, наиболее заметные в соединении передней створки митрального клапана и аортального клапана.
ЛЖ
ЛП
ЛП
Ао
ЛЖ
Ао
Рис. 22.6 Околоклапанный абсцесс протезированного клапана. (А) A 2D-ЧПЭхоКГ в позиции по длинной оси. Виден механический протез аортального
клапана (АК) во время систолы. Обратите внимание на большое гипоэхогенное пространство сзади клапана. (Б) ЧПЭхоКГ с цветовой допплерографией механи-
ческого протеза аортального клапана. Видна выраженная околоклапанная регургитация из-за плохого сопоставления створок клапана. Aо — аорта; ЛЖ — левый
желудочек; ЛП — левое предсердие.
А
Б
In-22_для нас.indd 529
03.04.2019 12:01:01
530 ЧАСТЬ IV Пороки клапанов сердца
ния для исследования структур с предсердной сто-
роны створок из-за ослабления ультразвукового
пучка и тени от протеза. По той же причине оценка
клапанной регургитации при протезах митрального
и трикуспидального клапанов является проблема-
тичной при трансторакальном доступе. Допплеро-
графия может быть использована для исследования
регургитации протезированных клапанов с исполь-
зованием интеграла линейной скорости кровотока.
ЧПЭхоКГ позволяет эффективней проводить оцен-
ку клапанной регургитации и диагностику вегета-
ций с предсердной стороны протезированных кла-
панов (см. рис. 22 .5).
У пациентов с имплантированными электрон-
ными внутрисердечными устройствами (ИВСУ)
регистрируется большое число артефактов, поэто-
му диагностические возможности ЧПЭхоКГ значи-
тельно превосходят ТТЭхоКГ при подозрении на
инфицирование ИВСУ у таких пациентов [28–30].
Визуализация из позиции проксимального отдела
верхней полой вены при ЧПЭхоКГ может выявить
вегетации, фиксированные к ИВСУ, которые труд-
но визуализировать другими методами. Во время
исследования необходимо проводить визуализацию
имплантированного устройства на всем протяже-
нии его прохождения через сосудистые и сердечные
структуры. Важное значение имеет тщательная
оценка состояния клапанного аппарата сердца из-за
часто встречающегося сопутствующего поражения
клапанов, особенно трикуспидального клапана
(рис. 22 .9, 22.10).
ДИАГНОСТИКА ЭНДОКАРДИТА
ЦЕЛЕСООБРАЗНОСТЬ ДИАГНОСТИКИ
Диагностическая ценность ЭхоКГ зависит от не-
скольких составляющих: выбора метода ЭхоКГ,
размера вегетаций, расположения вегетаций, пора-
жения нативного или протезированного клапана,
наличия кальцификации клапана (повышает чувст-
вительность, но снижает специфичность выявления
вегетации) и наличия клапанной дегенерации. При
ТТЭхоКГ приблизительно в 15% случаев имеются
ограничения диагностических возможностей из-за
факторов, связанных с пациентом, таких как ожи-
рение, наличие патологии легких и деформации
грудной клетки. Хотя вегетации с размерами от 2 до
5 мм могут быть обнаружены при ТТЭхоКГ, чувст-
вительность ТТЭхоКГ в диагностике таких незначи-
тельных размеров патологии низкая (≈ 40%) [31].
Чувствительность ТТЭхоКГ наиболее высокая при
поражении трикуспидального клапана из-за близ-
ПЖ
ПП
Рис. 22 .9 A Вегетации на трикуспидальном клапане. ТТЭхоКГ. Обратите
внимание на гетерогенные эхогенные массы (стрелки) на передней и септаль-
ной створках трикуспидального клапана. ПЖ
—
правый желудочек; ПП —
правое предсердие.
ПЖ
ПП
ЛП
Ао
1 м/сек
4 м/сек
Рис. 22 .8 Абсцесс с аортально-правожелудочковой фистулой. (A) 2D-ЧПЭхоКГ и цветовая допплерография по короткой оси аортального клапана, демон-
стрирующие сброс крови слева направо (стрелка) между аортой (Ao) и правым желудочком (ПЖ). На трикуспидальном клапане определяются большие вегетации,
а яркий эхосигнал от внутрисердечного устройства виден в области правого предсердия (ПП). (Б) Непрерывно-волновая допплерография, показывающая разницу
в характеристиках потока крови между фистулой от аорты к ПЖ (слева) с непрерывным систолическим и диастолическим потоком, а также высокоскоростной
систолический ток крови, согласующийся с дефектом, затрагивающим и мышечную, и мембранозную часть межжелудочковой перегородки у другого пациента
(справа).
А
Б
In-22_для нас.indd 530
03.04.2019 12:01:01
531
22 Инфекционный эндокардит
кого его расположения к передней грудной стенке.
В исследовании пациентов, получавших внутри-
венное введение препаратов при подозрении на
правосторонний ИЭ, диагностика вегетаций из
ТТЭхоКГ доступа столь же успешна, как и при ЧПЭ-
хоКГ, однако ЧПЭхоКГ дает более эффективную
характеристику вегетаций [32]. Диагностическая
ценность ТТЭхоКГ при подозрении на ИЭ самая
высокая у пациентов, имеющих от умеренной до
высокой вероятность этого заболевания [33] (на-
пример, у пациентов с новыми или изменившими-
ся сердечными шумами и бактериемией). Низкая
чувствительность ТТЭхоКГ при визуализации веге-
таций или абсцессов не позволяет проводить диаг-
ностику ИЭ на основании отрицательных результа-
тов исследования. Несмотря на низкую чувстви-
тельность ТТЭхоКГ, метод часто используется для
первичной диагностики при определении наличия
и тяжести поражения клапанов сердца и оценки
функционального состояния желудочков. Отрица-
тельное предсказательное значение ТТЭхоКГ при
диагностике ИЭ может быть улучшено с помощью
более высокого качества изображения, а также сле-
дующих критериев: (1) отсутствие внутрисердеч-
ных клапанов или другого протезного материала;
(2) отсутствие стеноза и малая регургитация сердеч-
ных клапанов; (3) отсутствие морфологической
аномалии клапанов сердца; (4) отсутствие ВПС при
первичном обследовании и отсутствие перикарди-
ального выпота; (5) отсутствие вегетаций или под-
вижных объектов на ТТЭхоКГ [34]. У пациентов с
низкой вероятностью ИЭ и нормальными результа-
тами ТТЭхоКГ следует искать другую патологию,
нежели ИЭ, а не переходить к исследованию ЧПЭ-
хоКГ. ТТЭхоКГ также рекомендуется для переоцен-
ки пациентов высокого риска с определенным ИЭ
(с вирулентными микроорганизмами, клиническим
ухудшением, постоянной или периодической лихо-
радкой, новыми сердечными шумами или постоян-
ной бактериемией).
Хотя ТТЭхоКГ и ЧПЭхоКГ дают идентичные ре-
зультаты примерно у 50% пациентов с подозрением
на ИЭ, ЧПЭхоКГ предоставляет дополнительную
диагностическую информацию у большого процен-
та пациентов [35]. ЧПЭхоКГ имеет несколько ос-
новных преимуществ по сравнению с ТТЭхоКГ для
оценки ИЭ. Это лучшее пространственное разреше-
ние из-за более высокой частоты датчика, отсутст-
вие акустических помех от соседних структур, со
стороны легких и грудной клетки, близкое располо-
жение к задним структурам сердца, таким как ми-
тральный клапан и ЛП. ЧПЭхоКГ позволяет визуа-
лизировать вегетации размером от 1 до 2 мм, а
также вегетации от 2 до 5 мм с чувствительностью
почти 100% [31]. Выполнение ЧПЭхоКГ показано
пациентам с высокой клинической вероятностью
ИЭ и негативным результатом ТТЭхоКГ [36].
Особые подгруппы пациентов, которым следу-
ет выполнять ЧПЭхоКГ даже в качестве первич-
ного метода визуализации (без предшествующей
ТТЭхоКГ) для диагностики ИЭ, включают (1) па-
циентов с протезированными сердечными клапа-
нами, а также тех, у кого имеется подозрение на
ИЭ; (2) пациентов с постоянной стафилококковой
бактериемией без известных источников или вну-
трибольничной стафилококовой бактериемией;
(3) пациентов с подозрением на инфицирование
ИВСУ (рис.22 .11). Опыт показывает, что ЧПЭхоКГ
эффективней ТТЭхоКГ для диагностирования ИЭ
нативного клапана легочной артерии [37], хотя он
поражается реже остальных клапанов и, как прави-
ло, связан с ВПС. У больных с подозрением на куль-
туронегативный ИЭ (≈ 10% всех случаев определен-
ного ИЭ) ЧПЭхоКГ имеет более высокую чувстви-
тельность, чем ТТЭхоКГ, для диагностики признаков
поражения эндокарда [38].
Анализ эффективности затрат также подтвер-
ждает целесообразность использования ЭхоКГ, в
частности ЧПЭхоКГ. Heidenreich и соавт. показали,
что при подозрении на ИЭ диагностическая тактика
с использованием ЧПЭхоКГ как первичного метода
визуализации является более экономически оправ-
данной, чем многоэтапное применение ТТЭхоКГ, и
является лучшей стратегией по сравнению с одной
эмпирической антибактериальной терапией [39]. В
этом исследовании ЧПЭхоКГ была оптимальной
для пациентов, которые имели априорную вероят-
ность ИЭ от 4 до 60%, с меньшими затратами по
сравнению с использованием ТТЭхоКГ в качестве
первичного исследования.
ПП
ПЖ
Рис. 22 .10 Инфицирование имплантированного электронного внутри-
сердечного устройства. При ЧПЭхоКГ в 2D-режиме определяются гетеро-
генные, неопределенной формы массы (стрелка), фиксированные к внутрисер-
дечному электроду. Трикуспидальный клапан интактен. ПЖ — правый желу-
дочек; ПП — правое предсердие.
In-22_для нас.indd 531
03.04.2019 12:01:02
532
ЧАСТЬ IV Пороки клапанов сердца
Рекомендации по применению ТТЭхоКГ и ЧПЭ-
хоКГ в случаях возможного или определенного ИЭ
представлены в табл. 22 .3, 22.4 . Важно отметить, что
ценность диагностического метода, такого как
ЭхоКГ, является оптимальной в соответствии с кли-
ническими данными и вероятностью предваритель-
ного диагноза (2–3%). Хотя существует несколько
эмпирических данных количественной оценки ве-
роятности предположительного диагноза заболева-
ния, существует общее мнение, что определенные
критерии увеличивают вероятность заболевания
(табл. 22 .5). Современные данные литературы пока-
зывают, что технологиями визуализации, такими
как ЭхоКГ, нередко злоупотребляют в определен-
ных клинических ситуациях, например при подо-
зрении на ИЭ. Kurupuu и соавт. показали, что 53%
эхокардиограмм можно было бы избежать без по-
тери диагностической точности с помощью просто-
го алгоритма у пациентов с низкой вероятностью
предположительного диагноза [39а]. Аналогичным
образом Greaves и соавт. показали, что отсутствие
пяти простых клинических критериев связано с ну-
левой вероятностью ИЭ по данным ТТЭхоКГ:
(1) васкулиты или эмболические эпизоды; (2) цен-
тральный венозный доступ; (3) относительно не-
давнее введение внутривенных препаратов; (4) про-
тезированные клапаны сердца и (5) позитивные
гемокультуры [40]. В совокупности эти исследова-
ния показали, что у пациентов с очень низкой веро-
ятностью предварительного диагноза заболевания
ЭхоКГ можно избежать без потери точности диаг-
ностики. Оценка возможного ИЭ в конкретных
клинических ситуациях обсуждается далее.
ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ С БАКТЕРИЕМИЕЙ
Поскольку клиническая картина эндокардита очень
изменчива и зависит от этиологии, а также наличия
или отсутствия предрасполагающих факторов, ран-
нее подозрение на ИЭ имеет решающее значение
для ранней диагностики. Наличие предрасполагаю-
щих факторов, предшествующих эпизодам ИЭ, в
т.ч . протезированные клапаны, ВПС и сердечная
недостаточность или другие стигмы эндокардита,
лихорадка > 72 час, должны служить основанием
для исследования гемокультур и проведения визуа-
лизации.
Бактериемия с типичными микроорганизмами,
включая зеленящий стрептококк, Streptococcus bovis,
группы HACEK, S. aureus или внебольничный энте-
рококк, при отсутствии основного источника ин-
фицирования являются основными критерием для
ИЭ. Таким образом, при обнаружении бактериемии
с типичными микроорганизмами должно быть про-
ведено исследование для исключения поражений
эндокарда с помощью ТТЭхоКГ. Если при ТТЭхоКГ
доступе визуализация плохого качества и получен-
ные результаты недостоверны или негативны, пока-
зано проведение ЧПЭхоКГ.
Бактериемия золотистым стафилококком (S. aureus)
любого происхождения является фактором риска
развития ИЭ, поэтому диагноз должен рассматри-
ваться с учетом тщательного клинического обследо-
вания и диагностического тестирования. При виру-
лентных микроорганизмах, таких как золотистый
стафилококк, которые способны вызвать ИЭ на
неизмененных клапанах сердца, заболеваемость
ИЭ высокая (≈ 30%) [41, 42].
Среди 59 пациентов с ИЭ, вызванным золоти-
стым стафилококком, в проспективном исследова-
нии предполагаемым источником бактериемии
был внутрисосудистый катетер в 39%. Аналогич-
ным образом в группе из 922 пациентов с доказан-
ным ИЭ из 39 мест в 16 странах проспективного
исследования золотистый стафилококк был наибо-
лее распространенной причиной ИЭ, составившей
35,7% всех случаев, и предполагаемым источником
являлся внутрисосудистый катетер в 39% случаев
[43, 44]. Эти исследования также подчеркивают
связь между ассоциированной с наличием катетера
бактериемией и ИЭ. Недавно Palraj и его коллеги
предложили двухэтапный алгоритм для оценки
бактериемии S. aureus с помощью ЧПЭхоКГ в зави-
симости от клинических показателей на 1-й и 5-й
дни. Если в 1-й день оценка бактериемии была 4 или
более (внебольничная бактериемия S. aureus при
Подозрение на ИЭ
Норма
НЕТ
Диагноз иной
ТТЭхоКГ
ЧПЭхоКГ
Лекарственная терапия
или хирургическое лечение
Дальнейшее
клиническое наблюдение
Предполагаемые осложнения,
неблагоприятный исход,
рецидив
Дополнительные
исследования:
ТТЭхоКГ, ЧПЭхоКГ, КТ
Показания к ЧПЭхоКГ:
Наличие внутрикардиальной нагрузки
Бактериемия S. aureus
Протезированный клапан, персистирующая
лихорадка, бактериемия
Назокраниальная бактериемия S. aureus
Неинформативная ТТЭхоКГ
ДА
Патология
Рис. 22.11 Клиническое применение эхокардиографии в диагностике
и лечении инфекционного эндокардита. ИЭ — инфекционный эндокар-
дит; КТ — компьютерная томография.
In-22_для нас.indd 532
03.04.2019 12:01:02
533
22 Инфекционный эндокардит
Показания
Уровень
доказательности
Класс I
1. ТТЭхоКГ рекомендуется для диагностики инфекционного эндокардита, обнаружения клапанных
вегетаций с или без положительной гемокультуры
B
2. ТТЭхоКГ рекомендуется для оценки тяжести нарушений гемодинамики при поражении клапанов,
связанном с известным инфекционным эндокардитом
B
3. ТТЭхоКГ рекомендуется для диагностики осложнений инфекционного эндокардита (т.е. абсцессов,
перфораций и шунтов)
B
4. ТТЭхоКГ рекомендуется для переоценки пациентов с высоким риском (т.е. с вирулентными микро-
организмами, клиническим ухудшением, персистирующей или периодической лихорадкой, новым
шумом или персистирующей бактериемией)
C
Класс IIa
ТТЭхоКГ целесообразно для диагностики инфекционного эндокардита протезированного клапана при
персистирующей лихорадке без бактериемии или нового шума
C
Класс IIb
ТТЭхоКГ следует рассматривать для переоценки эндокардита протезированного клапана на фоне анти-
биотикотерапии при отсутствии клинического ухудшения
C
Класс III
ТТЭхоКГ не показана для переоценки неосложненного (включая отсутствие регургитации на исходной
эхокардиограмме) эндокардита нативного клапана во время антибиотикотерапии при отсутствии кли-
нического ухудшения, новых физикальных данных или персистирующей лихорадке
C
Критерии целесообразности
Шкала целесообраз-
ности (1–9)
1. Первичное обследование при подозрении на инфекционный эндокардит с положительными гемо-
культурами или новым шумом
A (9)
2. Транзиторная лихорадка без бактериемии или нового шума
I (2)
3. Транзиторная бактериемия с возбудителем, нетипичным для инфекционного эндокардита и/или
документированным неэндоваскулярным источником инфекции
I (3)
4. Переоценка ИЭ с высоким риском прогрессирования и развития осложнений, при изменении кли-
нического статуса или результатов обследования сердца
A (9)
5. Рутинное обследование при неосложненном инфекционном эндокардите, когда не предполагается
никаких изменений в лечении
I (2)
* American College of Cardiology Foundation Appropriate Use Criteria (Task F), American Society (Task E), American Heart (Task A), American
Society of Nuclear (Task C), Heart Failure Society (Task A), Heart Rhythm (Task S), Society for Cardiovascular (Task A), Interventions, Society of
Critical Care (Task M), Society of Cardiovascular Computed (Task T), Society for Cardiovascular Magnetic (Task R), Douglas PS, Garcia MJ, Haines
DE, et al: ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for Echocardiography. A report of the Amer-
ican College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association,
American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and
Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Res-
onance Endorsed by the American College of Chest Physicians. J Am Coll Cardiol 57:1126–1166, 2011.
А — целесообразное использование; I — нецелесообразное использование; ТТЭхоКГ — трансторакальная эхокардиография.
ТАБЛИЦА 22.3 Практические рекомендации и критерии целесообразности использования трансторакальной
эхокардиографии при подозрении или известном инфекционном эндокардите ACC/AHA*
наличии внутрисердечного протеза или госпиталь-
ная бактериемия S. aureus при наличии кардиова-
скулярного имплантируемого электронного устрой-
ства), то исследование имеет низкую чувствитель-
ность (21%), но высокую специфичность (96%),
тогда в ЧПЭхоКГ рекомендуется оптимизировать
чувствительность. Напротив, если на 5-й день оцен-
ка составляла < 2 (госпитальная или нозокомиаль-
ная бактериемия S. aureus при отсутствии внутри-
сердечного протеза и бактериемия, которая длится
< 72 час), то исследование было связано с более
высокой чувствительностью (98,8%) и прогности-
ческой ценностью отрицательного результата
98,5%, что предполагало, что ЧПЭхоКГ можно от-
ложить [45]. Эти исследования также подчеркивают
связь между бактериемией, связанной с наличием
катетера, и ИЭ. В случаях, когда имеется низкое кли-
ническое подозрение на ИЭ и гемокультуры свиде-
In-22_для нас.indd 533
03.04.2019 12:01:02
534
ЧАСТЬ IV Пороки клапанов сердца
Показатели
Уровень достоверности
Класс I
1. ЧПЭхоКГ рекомендуется для оценки тяжести поражения клапанов у пациентов с симпто-
мами инфекционного эндокардита
C
2. ЧПЭхоКГ рекомендуется для диагностики ИЭ у пациентов с приобретенными пороками
сердца, положительными гемокультурами и отсутствием данных при ТТЭхоКГ
C
3. ЧПЭхоКГ рекомендуется для диагностики осложнений ИЭ, влияющих на прогноз и
лечение (т.е. абсцессов, перфораций и шунтов)
C
4. ЧПЭхоКГ рекомендуется в качестве метода исследования первой линии для диагностики
эндокардита протезированного клапана и выявления его осложнений
C
5. ЧПЭхоКГ рекомендуется для предоперационного обследования пациентов с известным
ИЭ, за исключением очевидной необходимости операции по данным ТТЭхоКГ и экстрен-
ных случаев, когда предоперационная ЧПЭхоКГ приводит к задержке операции
C
6. Интраоперационная ЧПЭхоКГ показана пациентам с ИЭ подлежащим хирургическому
лечению
C
Класс IIa
ЧПЭхоКГ целесообразна для диагностики возможного ИЭ у пациентов с персистирующей
стафилококковой бактериемией без известного источника
C
Класс IIb
ЧПЭхоКГ можно считать оправданной для диагностики ИЭ у пациентов с нозокомиальной
стафилококковой бактериемией
C
Критерии целесообразности
Шкала целесообразности (1–9)
1. Оценка структуры и функции клапанов для определения показаний при планировании
хирургического вмешательства
A (9)
2. Для диагностики инфекционного эндокардита с низкой вероятностью предварительного
диагноза (т.е. транзиторная лихорадка, известные альтернативные источники инфекции
или отрицательные гемокультуры/атипичные для эндокардита микроорганизмы)
I (3)
3. Для диагностики инфекционного эндокардита с умеренной или высокой вероятностью
предварительного диагноза (т.е . стафилококковая бактериемия, фунгемия, протезирован-
ные клапаны или внутрисердечные устройства)
A (9)
* American College of Cardiology Foundation Appropriate Use Criteria (Task F), American Society (Task E), American Heart (Task A), American
Society of Nuclear (Task C), Heart Failure Society (Task A), Heart Rhythm (Task S), Society for Cardiovascular (Task A), Interventions, Society of
Critical Care (Task M), Society of Cardiovascular Computed (Task T), Society for Cardiovascular Magnetic (Task R), Douglas PS, Garcia MJ, Haines
DE. et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for Echocardiography. A report of the Amer-
ican College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association,
American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and
Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Res-
onance Endorsed by the American College of Chest Physicians. J Am Coll Cardiol 57:1126–1166, 2011.
А — целесообразное использование; I — нецелесообразное использование; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ —
чреспищеводная эхокардиография.
ТАБЛИЦА 22.4 Практические рекомендации и критерии целесообразности использования чреспищеводной
эхокардиографии при подозрении или известном инфекционном эндокардите ACC/AHA*
тельствуют о загрязнении с поверхности кожи (ко-
агулазонегативный стафилококк), должна быть
проведена качественная ТТЭхоКГ, для исключения
ИЭ и следует рассмотреть другие варианты диагно-
зов. С прогностической точки зрения с помощью
ЭхоКГ также можно получить важную информа-
цию о левостороннем ИЭ нативных клапанов, выз-
ванным S. aureus (золотистый стафилококк), что
может оказаться полезным для определения группы
риска, а также решениях о вмешательстве. В анали-
зе ICE Prospective Echo Cohort Registry данные эхо-
кардиографического исследования о внутрисердеч-
ном абсцессе и фракции выброса левого желудочка
(ЛЖ) менее чем в 40% независимо предотвращает
внутригоспитальную смертность и полученные
данные о внутрисердечном абсцессе и перфорации
клапана независимо предотвращают смертность в
первый год [46].
ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ
С ПРОТЕЗИРОВАННЫМИ КЛАПАНАМИ
Протезированные клапаны являются предраспола-
гающим фактором для развития ИЭ, и неизбежно
такие пациенты являются группой высокого риска.
In-22_для нас.indd 534
03.04.2019 12:01:02
535
22 Инфекционный эндокардит
Ранее считалось, что на эндокардиты протезов при-
ходится лишь 1–5% всех случаев ИЭ. Недавнее про-
спективное многонациональное групповое обсерва-
ционное исследование показало, что из 2670 паци-
ентов ≈ 20% имели определенный эндокардит
протезированного клапана. По сравнению с ИЭ
нативного клапана внутрибольничная летальность
была высокой (23%) в этой группе пациентов, не-
смотря на идентичные осложнения и хирургические
вмешательства [47]. После транскатетерной замены
аортального клапана недавний большой многоцен-
тровый реестр, состоящий из 7944 пациентов, отме-
чал 0,67% случаев ИЭ (0,50% в течение первого го-
да). Уровень госпитализации и смертности за 1 год
составил 47% и 66% соответственно [48].
Эти данные подчеркивают агрессивный характер
эндокардита протезированного клапана и вновь
напоминают нам о необходимости ранней диагно-
стики ИЭ и проведении хирургического вмешатель-
ства. Лихорадка у пациентов с протезированными
клапанами, наряду с такими факторами риска, как
бактериемия и постоянные катетеры, должна увели-
чивать клиническое подозрение и привести к актив-
ному поиску ИЭ. S . aureus является наиболее рас-
пространенным возбудителем при эндокардите
протезированного клапана. В другом исследовании
пациентов с протезированными клапанами и бакте-
риемией, связанной с S. aureus, было установлено,
что 50% пациентов имели эндокардит независимо
от времени, прошедшего с момента имплантации
протеза [49]. Инфекция, вызванная S. aureus, и ин-
фекция, ассоциированная с медицинской помощью,
были сильными предикторами смертности в боль-
шой когорте эндокардита протезированного клапа-
на [47].
Эндокардит протезированного клапана также
создает проблему для диагностической визуализа-
ции, т.к. выявление патологии, которая главным
образом распространяется на околоклапанные тка-
ни, и такие осложнения, как парапротезная регурги-
тация, несостоятельность протеза, абсцесс фиброз-
ного кольца и формирование фистулы, могут мас-
кироваться акустической тенью и артефактами
реверберации от протеза. Вегетации на протезиро-
ванных клапанах не всегда могут быть достоверно
обнаружены при ТТЭхоКГ. ЧПЭхоКГ предпочти-
тельней для проведения диагностики при подозре-
нии на ИЭ протезированных клапанов, в исследова-
ниях показано, что метод имеет более высокую
чувствительность для обнаружения вегетаций по
сравнению с ТТЭхоКГ [49, 50]. ЧПЭхоКГ, отличаю-
щаяся значительной диагностической достоверно-
стью, рекомендуется в качестве метода выбора для
диагностики эндокардита искусственного клапана и
оценки его осложнений [51]. В проспективном ис-
следовании 72 пациентов с подозрением на эндо-
кардит эндопротеза, которые прошли клиническую,
микробиологическую и эхокардиографическую
оценку и которым была выполнена позитронно-
эмиссионная томография (ПЭТ) или компьютерная
томография (КТ), в 50% случаев вокруг протезиро-
ванного клапана отмечалось аномальное поглоще-
ние 18-фтордезоксиглюкозы (ФДГ). Добавление
аномального поглощения ФДГ вокруг протезиро-
ванного клапана в качестве нового основного ди-
агностического критерия значительно повысило
чувствительность модифицированных критериев
Дьюка, что привело к увеличению госпитализаций,
для определения эндокардита протезированного
клапана, с 70 до 97% в связи со значительным сокра-
щением числа возможных случаев эндокардита
протезированного клапана. Таким образом, ПЭТ
или КТ могут оказаться полезным дополнительным
методом исследования при подозрении на эндокар-
дит протезированного клапана [52].
Следует отметить, что эхокардиографическая
дифференциальная диагностика между дегенера-
Клинические признаки
Оценка вероятности
предварительного
диагноза
Группа вириданс стрептококковой
бактериемии
14% (95% ДИ 6–22%)
Необъяснимая бактериемия
5–40%
Бактериемия с недавним приемом
инъекционных препаратов
31% (95% ДИ
19–44%)
Лихорадка с недавним приемом
инъекционных препаратов
при госпитализации
13% (95% ДИ 7–19%)
Положительные гемокультуры
и предрасполагающие заболева-
ния сердца
> 50%
Положительные гемокультуры
и новый шум регургитации
> 90%
Отсутствие васкулита/эмболических
явлений, центрального венозного
доступа, предшествующего
приема инъекционных препара-
тов, протезированного клапана и
положительной гемокультуры
0%
Твердый альтернативный диагноз
или разрешение эндокардита в
течение 4 дней
<2%
Грамотрицательная бактериемия
с четким экстракардиальным
источником инфекции
<2%
[Heidenreich PA, Masoudi FA, Maini B, et al. Echocardiography in pa-
tients with suspected endocarditis: a cost-effectiveness analysis. Am J
Med 107:198–208, 1999; Greaves K, Mou D, Patel A, Celermajer DS.
Clinical criteria and the appropriate use of transthoracic echocardiog-
raphy for the exclusion of infective endocarditis. Heart 89:273–275,
2003.]
ТАБЛИЦА 22.5 Вероятность предварительного диагноза
«инфекционный эндокардит»
In-22_для нас.indd 535
03.04.2019 12:01:02
536 ЧАСТЬ IV Пороки клапанов сердца
тивными изменениями и вегетациями незначитель-
ных размеров не всегда возможна, даже с помощью
ЧПЭхоКГ. Кроме того, парапротезные нити, кото-
рые можно наблюдать в первые послеоперацион-
ные месяцы, могут привести к неправильной интер-
претации данных [53, 54].
ИССЛЕДОВАНИЕ ПАЦИЕНТОВ С ИМПЛАНТИРОВАННЫМИ
ЭЛЕКТРОННЫМИ ВНУТРИСЕРДЕЧНЫМИ УСТРОЙСТВАМИ
В последние годы наблюдается увеличение частоты
инфицирования внутрисердечных устройств (по-
стоянных кардиостимуляторов, имплантирован-
ных кардиовертеров-дефибрилляторов, протезиро-
ванных клапанов сердца или протезных материалов,
желудочковых аппаратов вспомогательного крово-
обращения). C.H. Cabell с коллегами сообщили об
увеличении данной патологии с 0,94 до 2,11 на 1000
пользователей страховой программы Medicare в пе-
риод с 1990 по 1999 г. [55]. Однако уровень ИЭ на-
тивного клапана оставался стабильным в течение
этого периода (от 0,26 до 0,36 на 1000 пользовате-
лей).
Визуализация с помощью ЭхоКГ, в частности
ЧПЭхоКГ, является неотъемлемой частью исследо-
вания пациентов с подозрением на инфицирование
имплантированных ИВСУ [28–30]. ЧПЭхоКГ осо-
бенно показана пациентам с бактериемией S. aureus
и ИВСУ, т.к. частота развития ИЭ в таких случаях
высокая [41, 45].
Следует отметить, что отсутствие соответствую-
щих дополнительных масс при ЧПЭхоКГ не исклю-
чает инфицирования [29]. И наоборот, визуализа-
ция масс в сердце с помощью ЭхоКГ может указы-
вать на тромб или инфицированную вегетацию.
Диагностика инфицирования внутрисердечного
устройства требует тщательной клинической оцен-
ки, т.к. дифференцировать эти образования с помо-
щью ЭхоКГ невозможно, в ретроспективном обзоре
показано, что в 5% случаев фиксированные внутри-
сердечные массы расценивались как тромбы [56].
При отсутствии клинических подозрений на ИЭ
дополнительные массы, которые были обнаружены
у пациентов с отрицательными гемокультурами и
отсутствием других критериев инфицирования, ве-
роятнее всего, являются тромбами, не требующими
проведения антибиотикотерапии. Из-за низкой
чувствительности ТТЭхоКГ менее пригодна для
исключения диагноза ИЭ имплантированных ИВСУ,
особенно у взрослых. Тем не менее ряд прогности-
ческих признаков лучше выявляются с помощью
ТТЭхоКГ по сравнению с ЧПЭхоКГ, а именно: экс-
судат в перикарде, дисфункция желудочка, давление
в легочной артерии и количественная оценка кла-
панной регургитации. На рис. 22 .12 представлен
предлагаемый алгоритм диагностики и лечения при
инфицированном имплантированном ИВСУ с по-
мощью ЧПЭхоКГ.
ЦЕЛЕСООБРАЗНОСТЬ ЛЕЧЕНИЯ
В основе лечения лежат своевременная диагностика,
назначение приема соответствующих антибиоти-
ков, рассмотрение возможности проведения хирур-
гического вмешательства и комплексный подход.
ЭхоКГ играет важную роль в лечении ИЭ, для оцен-
ки продолжительности антибиотикотерапии, иден-
тификации осложнений, требующих экстренной
хирургии, особенно с учетом прогностических фак-
торов, которые могут потребовать хирургического
вмешательства, а не только консервативной тера-
пии.
Критерии Дьюка были разработаны для увеличе-
ния чувствительности диагностики случаев ИЭ,
однако их возможное прогностическое значение
оценивалось в одноцентровом исследовании наше-
го учреждения. У 267 пациентов с определенным
или возможным ИЭ согласно критериям Дьюка
ранние эхокардиографические признаки ИЭ, такие
как вегетации или новая клапанная регургитация,
как дискретные переменные не были связаны с вну-
трибольничной летальностью [57].
Диагностическая визуализация при подозрении
на ИЭ обычно проводится в течение первых не-
скольких дней после госпитализации, из них при-
близительно у 90% пациентов с определенным ИЭ
выявляются вегетации. Исходя из этого, были тща-
тельно изучены характеристики вегетаций, такие
как размер, мобильность, место прикрепления и
форма, в качестве критериев стратификации риска
пациентов с ИЭ, особенно с риском развития эмбо-
лических осложнений. В нескольких исследованиях
показано, что вегетации размером > 10 мм с повы-
шенной мобильностью являются предикторами
эмболических событий [58, 59]. Было обнаружено,
что эмболические осложнения при ИЭ являются
сильным, независимым предиктором внутриболь-
ничной летальности [57]. В одном многоцентровом
проспективном исследовании из 384 пациентов с
определенным ИЭ вегетации с диаметром > 15 мм
были независимым предиктором одногодичной ле-
тальности (рис. 22.13) [60]. В другом недавнем об-
сервационном исследовании 132 пациентов с лево-
сторонним ИЭ в ≈ 40% случаев с вегетациями диа-
метром не менее 15 мм ранняя операция, в течение
7 дней после диагностики, ассоциировалась со зна-
чительно более низким риском эмболических собы-
тий по сравнению с обычным лечением и операци-
ей, отложенной до развития осложнения (рис. 22 .14)
[61]. В недавнем небольшом рандомизированном
исследовании ранней хирургии и традиционной
терапии было подтверждено сокращение случаев
эмболии после раннего хирургического вмешатель-
ства при левостороннем ИЭ. Пациенты, которым
было выполнено хирургическое вмешательство в
течение первых 48 час, не имели эмболических со-
бытий к 6-й неделе по сравнению с 21% пациентов,
In-22_для нас.indd 536
03.04.2019 12:01:02
537
22 Инфекционный эндокардит
Подозрение на инфицирование ИВСУ
Гемокультура
Отрицательная гемокультура
Положительная гемокультура или предшествующая антибиотикотерапия
Имплантация нового ИВСУ
Вегетация клапана
Вегетация протеза
Отрицательная ЧПЭхоКГ
Есть S. aureus
Нет
S. aureus
Карманная
инфекция
Гемокультура (+)
ЧПЭхоКГ (+)
Повторная гемокультура
после удаления ИВСУ
Вегетация
клапана
Только
вегетация
протеза
Новый имплант ИВСУ
через 14 дней
после первой отрицательной
гемокультуры крови
Новый имплант ИВСУ
при повторной отрицательной
гемокультуре, остающейся
таковой в течение 72 час
Гемокультура (+)
ЧПЭхоКГ (–)
Повторная гемокультура
после удаления ИВСУ
Имплант при повторной отрицательной
гемокультуре, остающейся таковой
как минимум в течение 72 час
Карманная инфекция генератора/
эрозия протеза или генератора
Отрицательная гемокультура
в течение 72 час
Новый имплант ИВСУ,
после надлежащей санации
кармана генератора
Эрозия генератора/
протеза
Антибиотикотерапия
в течение
10–14 дней†
При лечении
инфекционного
эндокардита
следовать
предписаниям АНА†
Осложненные,
т.е. септический
тромбоз вен,
остеомиелит и др.
Антибиотикотерапия
в течение
4–6 недель†
Антибиотикотерапия
в течение
2 недель†
Антибиотикотерапия
в течение 2–4 недель†;
повторная ЧПЭхоКГ,
если проведена
2-недельная терапия
Неосложненные
ЧПЭхоКГ
Антибиотикотерапия
в течение
7–10 дней†
Рис. 22.12 Управление инфицированным имплантированным внутрисердечным устройством. (A) Алгоритм лечения взрослых пациентов с инфициро-
ванным имплантированным внутрисердечным устройством (ИВСУ). (Б) Алгоритм имплантации нового ИВСУ у пациентов после удаления инфицированного
устройства. AHA, Американская кардиологическая ассоциация. * История болезни, физикальное обследование, рентгенограмма грудной клетки, электрокардио-
грамма и параметры внутрисердечного устройства являются стандартными основными обследованиями перед удалением ИВСУ. † Продолжительность антибио-
тикотерапии должна учитываться со дня эксплантации устройства [Baddour LM, Epstein AE, Erickson CC, et al. Update on cardiovascular implantable electronic device
infections and their management: a scientific statement from the American Heart Association. Circulation 121:458–477, 2010].
Б
А
In-22_для нас.indd 537
03.04.2019 12:01:02
538 ЧАСТЬ IV Пороки клапанов сердца
которым проводился обычный курс лечения. Не
было различий во внутрибольничной или 6-месяч-
ной смертности между группами лечения [62] Та-
ким образом, текущие методические рекомендации
ACC/AHA признают, что проведение операции при
ИЭ нативного клапана можно рассматривать у па-
циентов с мобильными вегетациями > 10 мм с или
без эмболий (класс рекомендаций IIb, уровень дока-
зательности В) [51].
Хотя характеристики вегетаций очевидно важны
для стратификации риска, основывать принятие
клинических решений, касающихся операций, ис-
ключительно на этом параметре проблематично
из-за значительной вариабельности эхокардиогра-
фических характеристик вегетаций. В исследовании
Heinle и соавт. полное согласие исследователей бы-
ло достигнуто в отношении размера вегетаций
только в 73%, мобильности — в 57%, формы — в
37%, места прикрепления — в 40% случаев [63]. Эти
данные также подчеркивают необходимость тща-
тельной стандартизации исследований. Кроме того,
было установлено, что риск эмболии быстро умень-
шается в течение первой недели на фоне терапии
антибиотиками (рис. 22 .15) [64], положительный
эффект медикаментозной терапии следует учиты-
вать, когда рассматривается вопрос о хирургиче-
ском лечении для профилактики эмболических
осложнений при ИЭ.
После того как произошло эмболическое ослож-
нение, остаточные вегетации создают риск рециди-
ва эмболии. Однако рутинное наблюдение за эмбо-
лией при ИЭ показало, что ≈ 50% случаев связаны с
эмболическими событиями в мозге, селезенке, по-
чках или легких, большинство этих эмболических
осложнений являются бессимптомными. В этой
ситуации решение о хирургическом лечении снова
затруднено учитывая субклинический характер
этих осложнений и постепенное снижение риска
эмболических событий при антибактериальной те-
рапии. И наоборот, бессимптомные инфаркты моз-
га были связаны с плохим прогнозом ИЭ и, как
правило, не увеличивали риск хирургического вме-
шательства при отсутствии кровоизлияния в мозг,
абсцесса или тяжелых неврологических нарушений
[65].
По сравнению с ТТЭхоКГ ЧПЭхоКГ имеет луч-
шие возможности для обнаружения осложнений,
таких как околоклапанные абсцессы [6] или регур-
гитации, перфорации створок [66], внутрисердеч-
ный шунт и вторичное поражение митрально-аор-
тальной межклапанной ткани [67]. Многие из этих
эхокардиографических осложнений ИЭ являются
показаниями к ранней хирургии при лечении ИЭ
(табл. 22 .6), поскольку они вряд ли будут излечены
только с помощью антибактериальной терапии.
Диагностика абсцесса имеет важное прогностиче-
ское значение и оказывает влияние на тактику лече-
ния. В редких случаях можно использовать антиби-
отикотерапию при внутрисердечном абсцессе, хотя
это лечение, как правило, назначается пациентам,
имеющим противопоказания к хирургическому ле-
чению. Подавляющему большинству больных с
внутрисердечным абсцессом требуется операция на
сердце для удаления омертвевших тканей и санации
зоны поражения (класс рекомендаций I, уровень
1,0
0,8
0,6
0,4
0,2
0,0
400
0
100
200
300
p = 0,001
L≤15мм
84±2%
69±4%
L>15 мм
В
ы
ж
и
в
а
е
м
о
с
т
ь
Время (дни)
100
80
60
40
0
135
Б
е
с
с
о
б
ы
т
и
й
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
Годы
Нет, риск
ОП
ОБЫЧ
64
68
59
50
49
44
38
38
27
28
ОП 5-летний уровень выживаемости 93 ± 3%
ОБЫЧ 5-летний уровень выживаемости 73 ± 5%
р = 0,0016
Объединенные конечные точки
ОП
ОБЫЧ
19
23
Количество пациентов
в группе риска
Рис. 22.13 Выживаемость при инфекционном эндокардите, стратифи-
цированная по длине вегетацией. L — длина вегетаций [Thuny F, Di Salvo
G, Belliard O, et al. Risk of embolism and death in infective endocarditis: prognostic
value of echocardiography: a prospective multicenter study. Circulation 112:69–75,
2005].
Рис. 22 .14 Влияние раннего хирургического лечения на бессобытий-
ную выживаемость при инфекционном эндокардите. Пациенты после
ранней операции (ОП) имели более низкий уровень эмболии, но уровень
летальности аналогичный пациентам, у которых использовалась обычная
(ОБЫЧ) стратегия ожидания операции [Kim D-HK, Lee M-Z , Yun S-C , et al. Impact
of early surgery on embolic events in patients with infective endocarditis. Circulation
122[suppl 1]:S17–S22, 2010].
In-22_для нас.indd 538
03.04.2019 12:01:02
539
22 Инфекционный эндокардит
доказательности С), затруднение диагностики аб-
сцесса с помощью ЭхоКГ приводит к отсрочке про-
ведения хирургического вмешательства [25]. В не-
давнем исследовании влияние раннего хирургиче-
ского вмешательства на выживаемость больных с
ИЭ нативного клапана оценивали с использованием
показателя предрасположенности и инструменталь-
ных переменных для корректировки ошибки при
выборе лечения. В этой проспективной многонаци-
ональной группе исследователи обнаружили значи-
тельное снижение внутрибольничной летальности,
связанной с ранней хирургией, по сравнению с ме-
дикаментозной терапией (12,1% vs 20,7%) и для
пациентов с околоклапанными осложнениями
(внутрисердечный абсцесс или формирование фи-
стулы, обнаруженные при ЭхоКГ) (снижение абсо-
35
30
25
20
15
10
5
0
–
4
3
–
2
9
–
1
9
–
1
3
–
1
1
–
8
–
6
–
4
–
2
0
2
4
6
8
1
0
1
2
1
6
1
9
2
2
2
6
2
8
4
3
5
4
6
5
К
о
л
и
ч
е
с
т
в
о
и
н
с
у
л
ь
т
о
в
Дни от начала антибиотикотерапии
Рис. 22.15 Частота инсультов при инфекционном эндокардите в зависимости от продолжительности антибиотикотерапии [Dickerman SA, Abrutyn
E, Barsic B, et al. The relationship between the initiation of antimicrobial therapy and the incidence of stroke in infective endocarditis: an analysis from the ICE Prospective
Cohort Study [ICE-PCS]. Am Heart J 154:1086–1094, 2007].
Эхокардиографические данные
Класс по ACC/AHA*
Класс индикации и сроков по ESC†
Тяжелая дисфункция клапана или фистула, вызывающая
сердечную недостаточность
I
I (срочное или немедленное лечение)
Абсцесс
I
I (срочное лечение)
Большая (> 10 мм) подвижная вегетация на нативном
клапане, связанная с выра женной клапанной
регургитацией
IIa
IIa (срочное лечение)
Повторная эмболия с персистирующей вегетацией на фоне
соответствующей антибактериальной терапии
IIa
I (срочное лечение)
Высокоустойчивый организм (например, грибы) или
стойкая бактериемия (> 5–7 дней после начала соответст-
вующей антибактериальной терапии при отсутствии
другого источника)
I
I (срочное лечение/отсроченное)
Инфекция ИВСУ
I
I
* Baddour LM, Wilson WR, Bayer AS, et al; on behalf of the American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki
Disease of the Council on Cardiovascular Disease in the Young, Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia,
and Stroke Council: Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for
healthcare professionals from the American Heart Association. Circulation 132:1435–1486, 2015.
† Habib G, Lancellotti P, Antunes MJ, et al/ 2015 ESC guidelines for the management of infective endocarditis: the Task Force for the Management
of Infective Endocarditis of the European Society of Cardiology (ESC) endorsed by: European Association for Cardio-Thoracic Surgery (EACTS),
the European Association of Nuclear Medicine (EANM). Eur Heart J 36: 3075–3128, 2015.
ACC — American College of Cardiology; AHA — American Heart Association; ESC —European Society of Cardiology; ИВСУ — имплантирован-
ное внутрисердечное устройство.
ТАБЛИЦА 22.6 Эхокардиографические данные, которые представляют собой показания к раннему хирургическому
вмешательству при инфекционном эндокардите
In-22_для нас.indd 539
03.04.2019 12:01:02
540
ЧАСТЬ IV Пороки клапанов сердца
лютного риска 17,3%, p < 0,001). Кроме того, хи-
рургическое вмешательство является «золотым
стандартом» для подтверждения абсцесса, обнару-
женного с помощью ЭхоКГ.
При ИЭ, осложненном образованием фистулы, с
шунтированием крови слева направо, увеличивает-
ся риск или тяжесть сердечной недостаточности. В
результате отмечается очень высокая внутриболь-
ничная летальность (41%), несмотря на использова-
ние хирургического лечения в подавляющем боль-
шинстве случаев [24]. Развитие внутрисердечных
фистул предвещает неблагоприятный исход, что
требует проведения неотложного хирургического
вмешательства.
Наконец, количественная оценка тяжести регур-
гитации и определение ее влияния на сердечную
недостаточность как осложнения ИЭ являются важ-
ными прогностическими факторами. Острая регур-
гитация, развивающаяся без компенсаторной экс-
центрической гипертрофии, плохо переносится
клинически, что потенциально может приводить к
неблагоприятному исходу и является общеприня-
тым критерием для хирургического вмешательства.
У пациентов с сердечной недостаточностью (NYHA
3 или 4), осложненной левосторонним ИЭ натив-
ных клапанов, хирургическое лечение приводит к
отчетливому увеличению выживаемости по сравне-
нию с медикаментозной терапией (рис. 22 .16). Хи-
рургическая коррекция у больных без или с умерен-
ной сердечной недостаточностью является малоэф-
фективной для увеличения общей выживаемости
[68]. Даже у пациентов без явных признаков сердеч-
ной недостаточности тяжелая регургитация лево-
стороннего клапана сердца относится к неблагопри-
ятным прогностическим критерием и является по-
казанием к операции. При тяжелой митральной или
аортальной регургитации, которая отчетливо выяв-
ляется при ЭхоКГ, необходимо проводить при-
стальное наблюдение за состоянием гемодинамики
пациента, часто в условиях интенсивной терапии. В
этой ситуации снижение артериального давления
или синусовая тахикардия могут предвещать острую
декомпенсацию даже без классических признаков
сердечной недостаточности.
В случаях ИЭ с механическими осложнениями,
такими как абсцессы, фистулы, тяжелая клапанная
регургитация или несостоятельность протеза, пока-
зано проведение интраоперационной ЧПЭхоКГ для
оценки процесса восстановления этих дефектов.
Действительно, интраоперационная ЧПЭхоКГ в
настоящее время считается обычным делом в боль-
шинстве центров. Shapira и соавт. проанализирова-
ли значение ЧПЭхоКГ у 59 пациентов с диагнозом
«инфекционный эндокардит».
По данным авторов, интраоперационная ЧПЭ-
хоКГ с искусственным кровообращением привела к
изменению хирургической тактики в 11,5% случаев
[69, 70]. Во время операции задачи ЭхоКГ включают
оценку функции не только патологического клапа-
на, но и других клапанов и смежных структур. По-
сле отключения искусственного кровообращения
ЧПЭхоКГ должна подтвердить адекватность восста-
новления или замены и документировать успешное
закрытие фистулы. Околоклапанные протечки, об-
условленные техническими факторами, должны
быть выявлены, подтверждены и зарегистрирова-
ны, чтобы избежать в дальнейшем неопределенно-
сти относительно этиологии развития протечки и
исключения рецидива инфицирования. Визуализа-
ция после искусственного кровообращения, часто
требует увеличения постнагрузки, чтобы достичь
типичного амбулаторного состояния и избежать
недооценки степени и значимости регургитации и
убедиться в закрытии патологических коммуника-
ций. Следует отметить, что увеличение постнагруз-
ки не всегда может имитировать реальное физиоло-
гическое состояние во время бодрствования и может
приводить к неточной оценке послеоперационного
состояния [7, 71].
ЭхоКГ применяется для анализа эффективности
затрат при определении продолжительности лече-
ния в условиях острого ИЭ, а также определения
необходимости хирургического вмешательства.
Rosen и соавт. оценили эффективность затрат ЧПЭ-
хоКГ при определении продолжительности терапии
у пациентов с бактериемией, связанной с инфици-
рованием катетера (71а). В этом исследовании срав-
нивали три стратегии лечения: (1) эмпирическое
0
Хирургическое
вмешательство
Класс I–II NYHA
126
114
572
332
Класс III–IV NYHA
Без хирургического
вмешательства
Без хирургического
вмешательства
Хирургическое
вмешательство
10
20
В
н
у
т
р
и
г
о
с
п
и
т
а
л
ь
н
а
я
с
м
е
р
т
н
о
с
т
ь
,
%
30
40
50
60
70
Количество
пациентов
в группе риска
Рис. 22.16 Влияние хирургического лечения инфекционного эндокар-
дита нативного клапана левых отделов сердца на выживание и
развитие сердечной недостаточности. NYHA — Нью-Йоркская ассоциа-
ция сердца [Kiefer T, Park L, Tribouilloy C, et al. Association between valvular
surgery and mortality among patients with infective endocarditis complicated by
heart failure. JAMA 306:2239–2247, 2011].
In-22_для нас.indd 540
03.04.2019 12:01:03
541
22 Инфекционный эндокардит
лечение в течение 4 недель (длительный курс);
(2) эмпирическое лечение в течение 2 недель лече-
ния антибиотиками; (3) терапия, управляемая ре-
зультатами ЧПЭхоКГ. В стратегии под управлением
ЧПЭхоКГ положительная ЧПЭхоКГ диктует прове-
дение длительного курса антибактериальной тера-
пии, а отрицательная ЧПЭхоКГ требует проведения
короткого курса терапии. Эффективность стратегии
эмпирического длительного курса и стратегии,
управляемой результатами ЧПЭхоКГ, превосходи-
ли эмпирическую стратегию с коротким курсом
лечения. Когда в расчет берутся расходы, стратегия,
управляемая результатами ЧПЭхоКГ, превосходит
эмпирическую стратегию с длительным курсом,
которая стоит > 1,5 млн долларов в год сохраненной
жизни с поправкой на ее качество. В аналогичном
исследовании, используя дерево решений и анализ
Маркова, L. Liao и соавт. [72] показали, что управ-
ляемая ЭхоКГ стратификация риска осложнений и
целесообразности раннего хирургического вмеша-
тельства была экономически более привлекатель-
ной (с точки зрения затрат) стратегий лечения,
улучшив конечный результат для предельных из-
держек до 50 тыс. на сохраненный год жизни с по-
правкой на ее качество.
Приблизительно у 50% пациентов с ИЭ прово-
дится операция на клапанах сердца во время учет-
ной госпитализации. После того как принято реше-
ние о проведении оперативного вмешательства,
важно предоставить хирургу точные данные, каса-
ющиеся анатомии клапана для планирования опе-
рации. Эта предоперационная диагностика пред-
ставляет особую ценность, когда рассматривается
возможность реконструктивной операции, а не за-
мены пораженного митрального клапана. Помимо
этого, у пациентов с аортальным абсцессом рассма-
тривается возможность имплантации гомотранс-
плантата, что требует точного измерения диаметра
фиброзного кольца. После хирургического вмеша-
тельства на клапане при ИЭ сразу после операции
показано проведение ТТЭхоКГ. Результаты этого
исследования служат исходными данными для
оценки гемодинамики протезированного или вос-
становленного клапана, а также функции желудоч-
ков для последующих сравнений, согласно клини-
ческим показаниям.
ПРАКТИЧЕСКАЯ ЦЕННОСТЬ
ОТДАЛЕННЫХ РЕЗУЛЬТАТОВ
Не существует рекомендаций по периодичности
проведения эхокардиографических исследований
при ИЭ без осложнений. S. Rohmann и соавт. [73]
оценивали диагностическое значение ЧПЭхоКГ в
наблюдении за клиническим развитием болезни у
83 пациентов с эхокардиографическими признака-
ми ИЭ. Каждому пациенту в этой группе проведено
не менее двух последовательных ЧПЭхоКГ. Иссле-
дование показало, что пациенты с увеличившимися
в размерах вегетациями или вегетациями без дина-
мики чаще имели осложнения после установления
диагноза и начала терапии, а именно протезирова-
ние клапана, эмболические осложнения, околокла-
панные абсцессы и летальный исход, по сравнению
с группой пациентов с уменьшившимися в разме-
рах вегетациями. Хотя эти данные свидетельствуют
о том, что многочисленные эхокардиографические
исследования могут быть полезны в определении
прогноза у больных с ИЭ, нередко отмечается неце-
лесообразное чрезмерное использование этого ис-
следования. M.L. Vieira и соавт. оценили диагности-
ческое значение повторных исследований ТТЭхоКГ
и ЧПЭхоКГ среди пациентов с подозрением на ИЭ
[74]. За 3-летний период исследовано 262 пациента
с 266 эпизодами подозрения на ИЭ с помощью
ЭхоКГ. Авторы обнаружили, что повторное иссле-
дование назначалось часто: ТТЭхоКГ назначалась
хотя бы раз у 192 (72,2%) пациентов, а повторная
ЧПЭхоКГ у 49 (18,4%) пациентов. В среднем прово-
дилось 2,4 ТТЭхоКГ и 1,2 ЧПЭхоКГ исследования
по поводу каждого подозрения на ИЭ. При второй
и третьей повторной ТТЭхоКГ дополнительная ди-
агностическая информация получена у 34 (26,7%)
пациентов, а при второй и третьей ЧПЭхоКГ допол-
нительная информация обнаружена у 25 (19,7%)
пациентов из 127 эпизодов с определенным ИЭ.
После третьей ТТЭхоКГ и ЧПЭхоКГ дополнитель-
ной диагностической информации не было зафик-
сировано.
В недавно опубликованных критериях целесоо-
бразности применения ТТЭхоКГ и ЧПЭхоКГ прове-
дение рутинного исследования при ИЭ без ослож-
нений считается неоправданным, когда не предпо-
лагается никаких изменений в лечении. У больных
с определенным ИЭ при развитии тревожной кли-
нической симптоматики, появление новой атрио-
вентрикулярной блокады, постоянной лихорадки,
бактериемии, прогрессирующей сердечной недоста-
точности или динамика шумов в области сердца во
время или после курса терапии, требуется проведе-
ние повторной ЭхоКГ (ТТЭхоКГ или ЧПЭхоКГ) для
оценки структурных осложнений (класс I рекомен-
даций, уровень доказательности А). Так как у всех
пациентов с ИЭ в анамнезе сохраняется высокий
риск рецидива инфекции в течение неопределенно-
го времени, ТТЭхоКГ необходима для определения
исходных состояния морфологии клапана и функ-
ции сердца, после завершения антибактериальной
терапии (класс IIb рекомендаций, уровень доказа-
тельности С).
ИСПОЛЬЗОВАНИЕ НАУЧНЫХ РАЗРАБОТОК
С появлением трехмерной (3D) ЧПЭхоКГ в режиме
реального времени, которая позволяет получать
полный объем данных, можно точно определить
In-22_для нас.indd 541
03.04.2019 12:01:03
542
ЧАСТЬ IV Пороки клапанов сердца
анатомические структуры, характеристики вегета-
ций и их местоположение. Полученные срезы по-
зволяют выявлять структуры и потоки, не визуали-
зируемые с помощью ЧПЭхоКГ или ТТЭхоКГ. Это
является перспективным методом исследования
пациентов с протезированными клапанами и вну-
трисердечными устройствами. Первоначальный
опыт использования 3D-ЧПЭхоКГ у больных с эн-
докардитом протезированного клапана показывает,
что 3D-ЧПЭхоКГ дает дополнительную информа-
цию, которую нелегко получить с помощью стан-
дартной 2D-ЧПЭхоКГ [75]. Liu и соавт. выполняли
2D- и 3D-ТТЭхоКГ в реальном масштабе времени у
46 пациентов с определенным ИЭ. Чувствитель-
ность обоих методов составляла 91,6%, а специфич-
ность 3D-ЭхоКГ в реальном масштабе времени
была выше (100% vs 88,2% соответственно) [75a].
Хотя эти данные и обнадеживают, необходимо про-
ведение дальнейших исследований, чтобы опреде-
лить роль 3D-ЭхоКГ в диагностике и лечении ИЭ.
Кроме того, с точки зрения перспектив клиническо-
го исхода необходимы дополнительные исследова-
ния для оценки прогностического значения данных
ЭхоКГ при ИЭ и их динамики после лечения.
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ
И БУДУЩИЕ НАПРАВЛЕНИЯ
Как описывалось ранее, ЭхоКГ — важный диагно-
стический метод при использовании в надлежащих
клинических сценариях с соответствующей вероят-
ностью предварительного диагноза заболевания.
Его чрезмерное использование связано с затратами,
которых можно избежать. Ложноположительные
результаты могут привести к ненужному лечению,
возможным осложнениям и увеличению расходов
на медицинское обслуживание. Кроме того, при
инвазивных процедурах, таких как ЧПЭхоКГ, есть
небольшой, но определяемый риск развития ослож-
нений, связанный с наркозом и введением датчика,
это аспирация, перфорация пищевода, появление
аритмий сердца, дыхательная недостаточность и
дискомфорт пациента. Примерно у 10% больных с
ИЭ не выявляются вегетации или другие изменения
эндокарда при постановке диагноза, что, вероятно,
связано с плохой акустической доступностью. При
лечении таких пациентов следует руководствовать-
ся клиническим подозрением на ИЭ, в частности
для пациентов с протезированными клапанами и
тех, кто соответствует критериям определенного
ИЭ согласно большим и малым критериям.
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
ПЭТ или КТ могут улучшить чувствительность мо-
дифицированных критериев Дьюка в случае ИЭ у
пациентов с бактериемией и протезными клапана-
ми или ИВСУ. Другие методы исследования, такие
как магнитно-резонансная томографии с контра-
стированием, являются многообещающими для
обнаружения околоклапанного абсцесса, тромбоза,
связанного с вегетациями, клапанных осложнений
и фистул между аортой и камерами сердца, хотя
временное разрешение может ограничить примене-
ние метода для обнаружения вегетаций (уровень
доказательности С). Использование магнитно-резо-
нансной томографии сердца с контрастированием
ограничено при исследовании пациентов с ИВСУ, и
процедура часто невозможна у больных в критиче-
ском состоянии. Компьютерная томография сердца
также используется для обнаружения абсцесса кор-
ня аорты, но риск облучения, а также временное
разрешение являются ограничением ее широкого
использования.
Клинический опыт применения этих методов у
пациентов с ИЭ ограничен и их рабочие характери-
стики (чувствительность и специфичность) по
сравнению с ЭхоКГ не очень хорошо изучены [76–
78]. В результате этого никакой другой метод с ви-
зуализацией для диагностики поражения эндокарда
и осложнений ИЭ не является приемлемой альтер-
нативой ЭхоКГ в клинической практике.
In-22_для нас.indd 542
03.04.2019 12:01:03
543
22 Инфекционный эндокардит
Метод
Характеристики Техника исследования
«Ловушки»
ТТЭхоКГ Вегетации
Получение увеличенного и высокочастотного изображения
(основной режим без выведения всех клапанов). По воз-
можности следует использовать высокочастотный зонд
Получение изображения всех клапанов с цветовой допплеро-
графией и без нее
Размер вегетаций следует измерять в пределах разрешающих
характеристик датчика
Визуализация вегетаций
может быть затруднена
тяжелой дегенерацией кла-
панов, особенно при выра-
женной кальцификации
створок клапанов
ЧПЭхоКГ Абсцессы и
свищи
При абсцессе на ЧПЭхоКГ визуализируется «утолщенная
область» или «масса с гетерогенным эхогенным или гипоэ-
хогенным видом» в области миокарда или в области
фиброзного кольца
После выявления абсцесса необходимо провести тщательный
осмотр, чтобы исключить его распространение в смежные
области
Необходимо исследовать пораженный клапан по часовой и
против часовой стрелки, в верхних и нижних отделах как
по короткой, так и по длинной оси
Использование цветовой допплерографии при исследовании
корня аорты с соседними структурами помогает исключить
фистулы
При обнаружении аномальных соединений следует использо-
вать импульсно-волновой и непрерывно-волновой доппле-
рографии для определения направления и скорости тока
Постоперационные измене-
ния, в том числе гипоэхо-
генное пространство между
кольцом протезного клапана
и корнем аорты с или без
клапанной регургитации,
могут представлять собой
диагностическую дилемму у
пациента с протезным кла-
паном и лихорадкой. В
таких случаях необходимо
проведение ЧПЭхоКГ
интраоперационно, если
оно доступно, что может
быть очень полезно для
регистрации хронологии
аномалии
ТТЭхоКГ/
ЧПЭхоКГ
Протезные
клапаны
У пациентов с механическими протезными клапанами для
полного обследования требуется использование комбина-
ции трансторакальных и чреспищеводных методов
Получение стандартных и увеличенных изображений протез-
ных клапанов как с помощью трансторакального, так и чре-
спищеводного доступа
Тени и реверберации арте-
фактов могут маскировать
кольцо и основание протеза
аортального клапана при
проведении ЧПЭхоКГ
ТТЭхоКГ/
ЧПЭхоКГ
ИВСУ
При визуализации проксимальных отделов верхней полой
вены на ЧПЭхоКГ можно выявить вегетации, прикреплен-
ные к ИВСУ, которые трудно визуализировать другими
способами
Во время обследования важно визуализировать весь ход про-
тезного устройства в сосудистой и сердечной структурах.
Необходимо получать изображение верхней полой вены и
правого предсердия в разных плоскостях (особенно по
короткой оси у основания и при бикавальном
сканировании)
Тщательная оценка сердечных клапанов также важна из-за
высокой скорости потока на клапане, особенно на
трикуспидальном
Использование трехмерного изображения может помочь
определить положение протеза, а также наличие вегетаций
У пациентов с ИВСУ сущест-
вует значительное количе-
ство артефактов, и
ЧПЭхоКГ превосходит
ТТЭхоКГ при подозрении
на инфекцию ИВСУ
ИВСУ — электронное внутрисердечное устройство; ТТЭхокг — трансторакальная эхокардиография; ЧПЭхокг — чреспищеводная эхокар-
диография.
СВОДНАЯ ИНФОРМАЦИЯ
Практический подход к приобретению, измерению и интерпретации эхокардиографических данных
In-22_для нас.indd 543
03.04.2019 12:01:03
544
ЧАСТЬ IV Пороки клапанов сердца
ЛИТЕРАТУРА
1. Delahaye F, Goulet V, Lacassin F, et al. Char-
acteristics of infective endocarditis in France
in 1991. A 1-year survey, Eur Heart J 16:394–
401, 1995.
2. Berlin JA, Abrutyn E, Strom BL, et al. Inci-
dence of infective endocarditis in the Dela-
ware Valley, 1988-1990, Am J Cardiol 76:933–
936, 1995.
3. Murdoch DR, Corey GR, Hoen B, et al.
Clinical presentation, etiology, and outcome
of infective endocarditis in the 21st century:
the International Collaboration on Endocar-
ditis-Prospective Cohort Study, Arch Intern
Med 169:463–473, 2009.
4. Dillon JC, Feigenbaum H, Konecke LL, et al.
Echocardiographic manifestations of valvular
vegetations, Am Heart J 86:698–704, 1973.
5. Gilbert BW, Haney RS, Crawford F, et al.
Two-dimensional echocardiographic assess-
ment of vegetative endocarditis, Circulation
55:346–353, 1977.
6. Daniel WG, Mugge A, Martin RP, et al. Im-
provement in the diagnosis of abscesses as-
sociated with endocarditis by transesophageal
echocardiography, N Engl J Med 324:795–800,
1991.
7. Baddour LM, Wilson WR, Bayer AS, et al.
Infective endocarditis: diagnosis, antimicro-
bial therapy, and management of complica-
tions: a statement for healthcare professionals
from the Committee on Rheumatic Fever,
Endocarditis, and Kawasaki Disease, Council
on Cardiovascular Disease in the Young, and
the Councils on Clinical Cardiology, Stroke,
and Cardiovascular Surgery and Anesthesia,
American Heart Association: endorsed by the
Infectious Diseases Society of America, Cir-
culation 111:e394–434, 2005.
8. Osler W. Gulstonian lectures on malignant
endocarditis: lectures 1–3, Lancet 1:415–418,
1885.
9. Pelletier Jr. LL, Petersdorf RG. Infective en-
docarditis: a review of 125 cases from the
University of Washington Hospitals, 1963–
72, Medicine (Baltimore) 56:287–313, 1977.
10. Von Reyn CF, Levy BS, Arbeit RD, et al. In-
fective endocarditis: an analysis based on
strict case definitions, Ann Intern Med
94:505–518, 1981.
11. Durack DT, Lukes AS, Bright DK. New crite-
ria for diagnosis of infective endocarditis:
utilization of specific echocardiographic
findings. Duke endocarditis service, Am J
Med 96:200–209, 1994.
12. Andres E, Baudoux C, Noel E, et al. The value
of the von reyn and the duke diagnostic cri-
teria for infective endocarditis in internal
medicine practice. A study of 38 cases, Eur J
Intern Med 14:411–414, 2003.
13. Perez-Vazquez A, Farinas MC, Garcia-Palo-
mo JD, et al. Evaluation of the Duke criteria
in 93 episodes of prosthetic valve endocardi-
tis: could sensitivity be improved? Arch Intern
Med 160:1185–1191, 2000.
14. Stockheim JA, Chadwick EG, Kessler S, et al.
Are the Duke criteria superior to the beth is-
rael criteria for the diagnosis of infective en-
docarditis in children? Clin Infect Dis
27:1451–1456, 1998.
15. Heiro M, Nikoskelainen J, Hartiala JJ, et al.
Diagnosis of infective endocarditis. Sensitiv-
ity of the Duke vs von reyn criteria, Arch
Intern Med 158:18–24, 1998.
16. Sekeres MA, Abrutyn E, Berlin JA, et al. An
assessment of the usefulness of the Duke
criteria for diagnosing active infective endo-
carditis, Clin Infect Dis 24:1185–1190, 1997.
17. Martos-Perez F, Reguera JM, Colmenero JD.
Comparable sensitivity of the Duke criteria
and the modified Beth Israel criteria for diag-
nosing infective endocarditis, Clin Infect Dis
23:410–411, 1996.
18. Olaison L, Hogevik H. Comparison of the
von reyn and Duke criteria for the diagnosis
of infective endocarditis: a critical analysis of
161 episodes, Scand J Infect Dis 28:399–406,
1996.
19. Hoen B, Selton-Suty C, Danchin N, et al.
Evaluation of the Duke criteria versus the
Beth Israel criteria for the diagnosis of infec-
tive endocarditis, Clin Infect Dis 21:905–909,
1995.
20. Cecchi E, Parrini I, Chinaglia A, et al. New
diagnostic criteria for infective endocarditis.
A study of sensitivity and specificity, Eur
Heart J 18:1149–1156, 1997.
21. Dodds GA, Sexton DJ, Durack DT, et al.
Negative predictive value of the Duke criteria
for infective endocarditis, Am J Cardiol
77:403–407, 1996.
22. Li JS, Sexton DJ, Mick N, et al. Proposed
modifications to the Duke criteria for the
diagnosis of infective endocarditis, Clin Infect
Dis 30:633–638, 2000.
23. Sachdev M, Peterson GE, Jollis JG. Imaging
techniques for diagnosis of infective endocar-
ditis, Cardiol Clin 21:185–195, 2003.
24. Anguera I, Miro JM, Cabell CH, et al. Clinical
characteristics and outcome of aortic endo-
carditis with periannular abscess in the Inter-
national Collaboration on Endocarditis
Merged Database, Am J Cardiol 96:976–981,
2005.
25. Hill EE, Herijgers P, Claus P, et al. Abscess in
infective endocarditis: the value of trans-
esophageal echocardiography and outcome: a
5-year study, Am Heart J 154:923–928, 2007.
26. Anguera I, Del Rio A, Miro JM, et al. Staphy-
lococcus lugdunensis infective endocarditis:
description of 10 cases and analysis of native
valve, prosthetic valve, and pacemaker lead
endocarditis clinical profiles, Heart 91:e10,
2005.
27. Kang N, Wan S, Ng CS, Underwood MJ. Peri-
annular extension of infective endocarditis,
Ann Thorac Cardiovasc Surg 15:74–81, 2009.
28. Victor F, De Place C, Camus C, et al. Pace-
maker lead infection: echocardiographic fea-
tures, management, and outcome, Heart
81:82–87, 1999.
29. Baddour LM, Epstein AE, Erickson CC, et al.
Update on cardiovascular implantable elec-
tronic device infections and their manage-
ment: a scientific statement from the Ameri-
can Heart Association, Circulation 121:458–
477, 2010.
30. Chu VH, Bayer AS. Use of echocardiography
in the diagnosis and management of infective
endocarditis, Curr Infect Dis Rep 9:283–290,
2007.
31. Khandheria BK. Suspected bacterial endocar-
ditis: to TEE or not to TEE, J Am Coll Cardiol
21:222–224, 1993.
32. San Roman JA, Vilacosta I, Zamorano JL, et
al. Transesophageal echocardiography in
right-sided endocarditis, J Am Coll Cardiol
21:1226–1230, 1993.
33. Lindner JR, Case RA, Dent JM, et al. Diagnos-
tic value of echocardiography in suspected
endocarditis. An evaluation based on the
pretest probability of disease, Circulation
93:730–736, 1996.
34. Sivak JA, A.N. V, Navar-Boggan AM, et al.
Negative predictive value of transthoracic
echocardiography for infective endocarditis
in the modern era, Circulation 130:10–S,
2014.
35. Roe MT, Abramson MA, Li J, et al. Clinical
information determines the impact of trans-
esophageal echocardiography on the diagno-
sis of infective endocarditis by the duke cri-
teria, Am Heart J 139:945–951, 2000.
36. Erbel R, Rohmann S, Drexler M, et al. Im-
proved diagnostic value of echocardiography
in patients with infective endocarditis by
transoesophageal approach. A prospective
study, Eur Heart J 9:43–53, 1988.
37. Shapiro SM, Young E, Ginzton LE, Bayer AS.
Pulmonic valve endocarditis as an underdiag-
nosed disease: role of transesophageal echo-
cardiography, J Am Soc Echocardiogr 5:48–51,
1992.
38. Kupferwasser LI, Darius H, Muller AM, et al.
Diagnosis of culture-negative endocarditis:
the role of the duke criteria and the impact of
transesophageal echocardiography, Am Heart
J 142:146–152, 2001.
39. Heidenreich PA, Masoudi FA, Maini B, et al.
Echocardiography in patients with suspected
endocarditis: a cost-effectiveness analysis,
Am J Med 107:198–208, 1999.
39a. Kuruppu JC, Corretti M, Mackowiak P, et al.
Overuse of transthoracic echocardiography
in the diagnosis of native valve endocarditis,
Arch Intern Med 162:1715–1720, 2002.
40. Greaves K, Mou D, Patel A, Celermajer DS.
Clinical criteria and the appropriate use of
transthoracic echocardiography for the exclu-
sion of infective endocarditis, Heart 89:273–
275, 2003.
41. Fowler Jr. VG, Li J, Corey GR, et al. Role of
echocardiography in evaluation of patients
with Staphylococcus aureus bacteremia: expe-
rience in 103 patients, J Am Coll Cardiol
30:1072–1078, 1997.
42. Abraham J, Mansour C, Veledar E, et al.
Staphylococcus aureus bacteremia and endo-
carditis: the Grady Memorial Hospital experi-
ence with methicillin-sensitive S aureus and
methicillin-resistant S aureus bacteremia, Am
Heart J 147:536–539, 2004.
43. Fowler Jr. VG, Sanders LL, Kong LK, et al.
Infective endocarditis due to Staphylococcus
aureus: 59 prospectively identified cases with
follow-up, Clin Infect Dis 28:106–114, 1999.
44. Fowler Jr. VG, Miro JM, Hoen B, et al. Staph-
ylococcus aureus endocarditis: a consequence
of medical progress, JAMA 293:3012–3021,
2005.
45. Palraj BR, Baddour LM, Hess EP, et al. Pre-
dicting Risk of Endocarditis using a clinical
Tool (PREDICT): scoring system to guide use
of echocardiography in the management of
Staphylococcus aureus bacteremia, Clin Infect
Dis 61:18–28, 2015.
46. Lauridsen TK, Park L, Tong SY, et al. Echo-
cardiographic findings predict in-hospital
and 1-year mortality in left-sided native valve
staphylococcus aureus endocarditis: analysis
from the International Collaboration on En-
docarditis-Prospective Echo Cohort Study,
Circ Cardiovasc Imaging 8:e003397, 2015.
47. Wang A, Athan E, Pappas PA, et al. Contem-
porary clinical profile and outcome of pros-
thetic valve endocarditis, JAMA 297:1354–
1361, 2007.
48. Amat-Santos IJ, Messika-Zeitoun D, Eltchani-
noff H, et al. Infective endocarditis after
transcatheter aortic valve implantation: re-
In-22_для нас.indd 544
03.04.2019 12:01:03
545
22 Инфекционный эндокардит
sults from a large multicenter registry, Circu-
lation 131:1566–1574, 2015.
49. Birmingham GD, Rahko PS, Ballantyne 3rd
F. Improved detection of infective endocardi-
tis with transesophageal echocardiography,
Am Heart J 123:774–781, 1992.
50. Mugge A, Daniel WG, Frank G, Lichtlen PR.
Echocardiography in infective endocarditis:
reassessment of prognostic implications of
vegetation size determined by the transtho-
racic and the transesophageal approach, J Am
Coll Cardiol 14:631–638, 1989.
51. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, Circulation 129:e521–
643, 2014.
52. Saby L, Laas O, Habib G, et al. Positron emis-
sion tomography/computed tomography for
diagnosis of prosthetic valve endocarditis:
increased valvular 18F-fluorodeoxyglucose
uptake as a novel major criterion, J Am Coll
Cardiol 61:2374–2382, 2013.
53. Lengyel M. The impact of transesophageal
echocardiography on the management of
prosthetic valve endocarditis: experience of
31 cases and review of the literature, J Heart
Valve Dis 6:204–211, 1997.
54. Rozich JD, Edwards WD, Hanna RD, et al.
Mechanical prosthetic valve-associated
strands: pathologic correlates to transesopha-
geal echocardiography, J Am Soc Echocardiogr
16:97–100, 2003.
55. Cabell CH, Heidenreich PA, Chu VH, et al.
Increasing rates of cardiac device infections
among Medicare beneficiaries: 1990-1999,
Am Heart J 147:582–586, 2004.
56. Lo R, D’Anca M, Cohen T, Kerwin T. Inci-
dence and prognosis of pacemaker lead-asso-
ciated masses: a study of 1,569 transesopha-
geal echocardiograms, J Invasive Cardiol
18:599–601, 2006.
57. Chu VH, Cabell CH, Benjamin Jr. DK, et al.
Early predictors of in-hospital death in infective
endocarditis, Circulation 109:1745–1749, 2004.
58. Di Salvo G, Habib G, Pergola V, et al. Echo-
cardiography predicts embolic events in in-
fective endocarditis, J Am Coll Cardiol
37:1069–1076, 2001.
59. Tischler MD, Vaitkus PT. The ability of veg-
etation size on echocardiography to predict
clinical complications: a meta-analysis, J Am
Soc Echocardiogr 10:562–568, 1997.
60. Thuny F, Di Salvo G, Belliard O, et al. Risk of
embolism and death in infective endocarditis:
prognostic value of echocardiography: a pro-
spective multicenter study, Circulation
112:69–75, 2005.
61. Kim DH, Kang DH, Lee MZ, et al. Impact of
early surgery on embolic events in patients
with infective endocarditis, Circulation
122:S17–S22, 2010.
62. Kang DH, Kim YJ, Kim SH, et al. Early sur-
gery versus conventional treatment for infec-
tive endocarditis, N Engl J Med 366:2466–
2473, 2012.
63. Heinle S, Wilderman N, Harrison JK, et al.
Value of transthoracic echocardiography in
predicting embolic events in active infective
endocarditis. Duke endocarditis service, Am J
Cardiol 74:799–801, 1994.
64. Dickerman SA, Abrutyn E, Barsic B, et al. The
relationship between the initiation of antimi-
crobial therapy and the incidence of stroke in
infective endocarditis: an analysis from the
ICE Prospective Cohort Study (ICE-PCS),
Am Heart J 154:1086–1094, 2007.
65. Cooper HA, Thompson EC, Laureno R, et al.
Subclinical brain embolization in left-sided in-
fective endocarditis: results from the evaluation
by MRI of the brains of patients with left-sided
intracardiac solid masses (EMBOLISM) pilot
study, Circulation 120:585–591, 2009.
66. De Castro S, Cartoni D, d’Amati G, et al.
Diagnostic accuracy of transthoracic and
multiplane transesophageal echocardiogra-
phy for valvular perforation in acute infective
endocarditis: correlation with anatomic find-
ings, Clin Infect Dis 30:825–826, 2000.
67. Karalis DG, Bansal RC, Hauck AJ, et al.
Transesophageal echocardiographic recogni-
tion of subaortic complications in aortic valve
endocarditis. Clinical and surgical implica-
tions, Circulation 86:353–362, 1992.
68. Kiefer T, Park L, Tribouilloy C, et al. Asso-
ciation between valvular surgery and mortal-
ity among patients with infective endocarditis
complicated by heart failure, JAMA 306:
2239–2247, 2011.
69. Shanewise JS, Cheung AT, Aronson S, et al.
ASE/SCA guidelines for performing a com-
prehensive intraoperative multiplane trans-
esophageal echocardiography examination:
recommendations of the American Society of
Echocardiography Council for Intraoperative
Echocardiography and the Society of Cardio-
vascular Anesthesiologists Task Force for
Certification in Perioperative Transesopha-
geal Echocardiography, J Am Soc Echocardiogr
12:884–900, 1999.
70. Shapira Y, Vaturi M, Weisenberg DE, et al.
Impact of intraoperative transesophageal
echocardiography in patients undergoing
valve replacement, Ann Thorac Surg 78:579–
583, 2004. discussion 583-584.
71. Mestres CA, Fita G, Azqueta M, Miro JM.
Role of echocardiogram in decision making
for surgery in endocarditis, Curr Infect Dis
Rep 12:321–328, 2010.
71a. Rosen AB, Fowler Jr. VG, Corey GR. Cost-
effectiveness of transesophageal echocardiog-
raphy to determine the duration of therapy
for intravascular catheter-associated Staphy-
lococcus aureus bacteremia, Ann Intern Med
130:810–820, 1999.
72. Liao L, Kong DF, Samad Z, et al. Echocardio-
graphic risk stratification for early surgery
with endocarditis: a cost-effectiveness analy-
sis, Heart 94:e18, 2007.
73. Rohmann S, Erbel R, Darius H, et al. Predic-
tion of rapid versus prolonged healing of
infective endocarditis by monitoring vegeta-
tion size, J Am Soc Echocardiogr 4:465–474,
1991.
74. Vieira ML, Grinberg M, Pomerantzeff PM, et
al. Repeated echocardiographic examinations
of patients with suspected infective endocar-
ditis, Heart 90:1020–1024, 2004.
75. Kort S. Real-time: 3-dimensional echocar-
diography for prosthetic valve endocarditis:
initial experience, J Am Soc Echocardiogr
19:130–139, 2006.
75a. Liu YW, Tsai WC, Lin CC. Usefulness of real-
time three-dimensional echocardiography for
diagnosis of infective endocarditis, Scand
Cardiovasc J 43:318–323, 2009.
76. Cowan JC, Patrick D, Reid DS. Aortic root
abscess complicating bacterial endocarditis.
Demonstration by computed tomography, Br
Heart J 52:591–593, 1984.
77. Allum C, Knight C, Mohiaddin R, Poole-
Wilson P. Images in cardiovascular medicine.
Use of magnetic resonance imaging to dem-
onstrate a fistula from the aorta to the right
atrium, Circulation 97:1024, 1998.
78. Akins EW, Slone RM, Wiechmann BN, et al.
Perivalvular pseudoaneurysm complicating
bacterial endocarditis: MR detection in five
cases, AJR Am J Roentgenol 156:1155–1158,
1991.
79. Douglas PS, Garcia MJ, Haines DE., American
College of Cardiology Foundation Appropri-
ate Use Criteria Task F, American Society of
E, American Heart A, American Society of
Nuclear C, Heart Failure Society of A, Heart
Rhythm S, Society for Cardiovascular A, In-
terventions, Society of Critical Care M, Soci-
ety of Cardiovascular Computed T, Society
for Cardiovascular Magnetic R., et al. ACCF/
ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/
SCCT/SCMR 2011 appropriate use criteria
for echocardiography. a report of the Ameri-
can College of Cardiology Foundation Ap-
propriate Use Criteria Task Force, American
Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, and Society for Cardiovascular Mag-
netic Resonance Endorsed by the American
College of Chest Physicians, J Am Coll Car-
diol 57:1126–1166, 2011.
80. Baddour LM, Wilson WR, Bayer AS, et al.
Infective endocarditis in adults: diagnosis,
antimicrobial therapy, and management of
complications: a scientific statement for
healthcare professionals from the American
Heart Association, Circulation 132:1435–
1486, 2015.
81. Habib G, Lancellotti P, Antunes MJ, et al.
2015 ESC guidelines for the management of
infective endocarditis: the Task Force for the
Management of Infective Endocarditis of the
European Society of Cardiology (ESC) en-
dorsed by: European Association for Cardio-
Thoracic Surgery (EACTS), the European
Association of Nuclear Medicine (EANM),
Eur Heart J 36:3075–3128, 2015.
In-22_для нас.indd 545
03.04.2019 12:01:03
In-22_для нас.indd 546
03.04.2019 12:01:03
547
На данный момент допплеровская эхокардиогра-
фия стала неотъемлемой частью клинической диа-
гностики протезированных клапанов сердца. Одна-
ко, к сожалению, эхокардиография все еще имеет
множество недостатков, включая технические осо-
бенности, а также наличие артефактов и затенений
из-за конструкции протезов. Несмотря на это, ряд
важных параметров рассчитываются и оцениваются
при исследовании функции протезов. После им-
плантации клапана, его функция определяется глав-
ным образом гемодинамическими характеристика-
ми. Но для глубокого понимания гемодинамики
протезов необходимо иметь ясное представление
физических законов, которые влияют на функцию
и характеристики клапанов. Поэтому целью этой
главы является описание основных определений и
принципов гидродинамики, механических характе-
ристик клапанов.
ПРИНЦИПЫ ГИДРОДИНАМИКИ
СОХРАНЕНИЕ МАССЫ
Принцип сохранения массы имеет важное значение
для оценки эффективной площади отверстия кла-
пана. Сохранение массы или принцип непрерывно-
сти, представляет собой баланс объема жидкости.
Например, изменение объема определенного участ-
ка аорты, левого желудочка в течение времени. Дан-
ный объем называют контрольным, а его измерения
часто используют для определения потока, средней
его скорости, площади потока. Примеры контроль-
23 Гемодинамика протезированных
клапанов сердца
AJIT P. YOGANATHAN, BS, PHD • VRISHANK RAGHAV, PHD
Принципы гидродинамики
Сохранение массы
Механическая энергия
Уравнение Бернулли
Анализ энергии контрольного объема
Механизмы механической потери энергии
Конверсия и потеря механической
энергии при стенозах
Применение гидродинамики
к протезам клапанов сердца
Падение давления
Допплеровский градиент
Эффективная площадь отверстия
Объем регургитации
Потеря механической энергии
Параметры потери энергии
Оценка протезов клапанов in vivo
Гемодинамика нативных клапанов
сердца
Гемодинамика конкретных моделей
протезов клапанов
Механические протезы клапанов
Биологические протезы клапанов
Транскатетерные клапаны
Перспективы
ных объемов, например, при оценке митрального
клапана с сохранением массы, измерения аорты на
различных уровнях, представлены на рис. 23.1 .
Сохранение массы в контрольном объеме можно
выразить в виде:
Скорость накопления массы =
Скорость входа массы – Скорость выхода массы.
(23.1)
В сердечно-сосудистой системе можно предполо-
жить, что плотность крови является постоянным
показателем, т.к. она состоит в основном из несжи-
маемой жидкости, а тепловое расширение или со-
кращение незначительно из-за небольшого диапа-
зона разбежки в температуре тела. Поскольку масса
является результатом плотности и объема, то сохра-
нение массы можно выразить как сохранение объе-
ма:
Скорость накопления объема = Скорость ввода
объема – Скорость объемного вывода.
(23.2)
С математической точки зрения это представляет:
(23.3)
где Qin — общая скорость потока, которая попадает
в контрольный объем; Qout — общие потери потока
из контрольного объема; Vi — контрольный объем
в начале измерения; Vf — размер контрольного объ-
ема после наблюдения за промежуток времени t.
fi
in
out
(V V)
=Q
Q
t
−
−
In-23_для нас.indd 547
03.04.2019 12:01:17
548
ЧАСТЬ IV Пороки клапанов сердца
Могут быть несколько источников входов и вы-
ходов потока, и, таким образом:
(23.4)
Если далее предположить, что количество кон-
трольного объема не изменяется со временем, то
левая часть уравнения 23.3 равна нулю, а сохране-
ние массы может быть выражено как:
(23.5)
Это применимо для большинства кровеносных
сосудов, особенно если пренебречь повышенным
давлением. Зачастую, скорость потока в линейных
сосудах можно представить в виде средней осевой
скорости () и площади поперечного сечения (А).
Таким образом, уравнение 23.5 превращается в:
(23.6)
Примером такой ситуации является кровоток
через протез аортального клапана. Скорость движе-
ния жидкости, которая перемещается от клапана
вверх в аорте, должна быть равна скорости движе-
ния крови, которая регистрируется в нисходящей
аорте. Данный принцип лежит в основе при расчете
эффективной площади отверстия при допплеров-
ской эхокардиографии.
f
i
in(1)
in(2)
in(3)
out(1)
out(2)
out(3)
1
(VV)=(Q+Q +Q)
t
(Q+Q+Q)
−
−
in
out
Q=Q
in
out
in
out
vA=vA
МЕХАНИЧЕСКАЯ ЭНЕРГИЯ
Механическая энергия представляет собой вид спо-
собности ускорять массу вещества на определенное
расстояние. Энергия на единицу объема имеет те же
размеры, что и давление. В сердечно-сосудистой
системе лучше всего энергия прикладывается на
единицу объема, потому что большинство врачей
привыкли работать с единицами давления. Однако
крайне важно рассматривать давление только в виде
одной из нескольких форм механической энергии.
Показано, что давление (p) является формой ме-
ханической энергии на единицу объема, представ-
ляя собой силу (Fp) на единицу площади (A). При
перемещении массы на определенное расстояние
(d) применяется определенная сила при которой
выполняется работу, затрачивая энергию давления
(Ep). Площадь, на которую действует сила, умно-
женная на одно и то же расстояние, представляет
собой объем (V):
(23.7)
Давление не является единственной формой ме-
ханической энергии в сердечно-сосудистой системе.
Возникновение ускорения из-за силы тяжести (g)
создает другую форму механической энергии на
единицу объема. Гравитация ускоряет тело с массой
(m) с силой (Fg). Если эта сила перемещает массу
вертикально (h), то она тратит гравитационную
энергию (Eg). Энергия на единицу объема получает-
ся путем подстановки плотности (ρ) вместо массы
на единицу объема:
ppp
EFdF
=
=
=p
VAdA
Аортальный
клапан
Аорта
Левое
предсердие
Митральный
клапан
Контрольный
объем
Контрольный
объем
A2
A2
A1
A1
V2
V2
V1
V1
Рис. 23.1 Анализ контрольного объема для определения площади клапана. Контрольные объемы, которые используются для определения площади
митрального (А) и аортального (Б) клапанов. V1 и V2 представляют собой среднюю скорость кровотока, который проходит над областью А1 и А2.
А
Б
In-23_для нас.indd 548
03.04.2019 12:01:17
549
23 Гемодинамика протезированных клапанов сердца
(23.8)
Также механическая энергия в единице объема
присутствует в сердечно-сосудистой системе в виде
кинетической энергии (энергия движения). Если
масса (m) движется со скоростью (ν), то она содер-
жит в себе кинетическую энергию, которая эквива-
лентна половине произведения массы на квадрат
скорости:
(23.9)
Таким же образом, энергия на единицу объема
получается путем подстановки плотности массы на
единицу объема. Соответственно, в сердечно-сосу-
дистой системе присутствует три формы механиче-
ской энергии.
Основным источником механической энергии в
кровообращении является работа левого желудоч-
ка. Его сокращение создает повышение давления в
полости. Согласно формуле 23.7, перемещение опре-
деленного объема жидкости заданным давлением
приводит к генерации механической энергии. Вся
энергия, которая генерируется одним желудочком в
течение одного сердечного цикла, представлена на
рис. 23.2 . Данный график представляет собой пока-
затели давления и объема внутри желудочка. Кри-
вая между точками 1 и 2 отражает период диастоли-
ческого наполнения, когда митральный клапан от-
крыт. Закрытие митрального клапана происходит в
точке 2, когда начинается период изоволюмического
gg
EFdmgh
=
=
= ρgh
VVV
2
2
k
1
mv
E
1
2
=
=
ρv
VV2
4
120
80
40
0
0
20
40
60
80
1
3
2
Объем левого желудочка (мл)
Д
а
в
л
е
н
и
е
в
л
е
в
о
м
ж
е
л
у
д
о
ч
к
е
(
м
м
р
т
.
с
т
.
)
Рис. 23.2 Кривая зависимости давления от объема. Диаграмма давле-
ние–объем левого желудочка. Заштрихованная область отражает энергию,
которая передается потоку за одно сокращение желудочка.
напряжения. В период между точками 2 и 3 объем
крови в желудочке остается постоянным с постепен-
ным нарастанием давления. В точке 3 происходит
открытие аортального клапана. С этого момента
начинается систолический выброс, когда желудочек
перемещает кровь в аорту. В точке 4 происходит
закрытие аортального клапана с последующим пе-
риодом — изоволюмическое расслабление. В тече-
ние всего периода объем желудочка остается посто-
янным с плавным снижением давления. Падение
давления возвращает желудочек в то состояние, в
котором он был в точке 1. Энергия, генерируемая
желудочком в течение одного сердечного цикла,
эквивалентна интегралу кривой давления–объем
(заштрихованная область на рис. 23.2). Энергия на
единицу объема эквивалентна интегралу от кривой
давления–объем, деленного на ударный объем. Это
примерно равно среднему увеличению давления
левого желудочка от диастолы к систоле. Таким об-
разом, желудочек создает энергию в виде давления,
однако эта энергия преобразуется в гравитацион-
ную и кинетическую энергию в другом месте сер-
дечно-сосудистой системы.
УРАВНЕНИЕ БЕРНУЛЛИ
Давление, гравитационная и кинетическая энергии
могут быть свободно преобразованы из одной в
другую без потери энергии. Этот процесс произве-
ден в уравнении Бернулли, которое применимо для
ламинарного потока. Уравнение связывает давле-
ние, гравитационную и кинетическую энергию на
единицу объема между двумя пространственными
точками вдоль пути кровотока (место 1 и 2, где точ-
ка 2 находится ниже по потоку, чем точка 1):
(23.10)
Уравнение Бернулли для ламинарных потоков
отражает то, что механическая энергия в точке 1 и
2 одинакова, однако может существовать в различ-
ных формах. Из этого следует, что при уменьшении
давления при удалении от точки 1 и при приближе-
нии к 2, система может быть сбалансирована увели-
чением скорости либо высоты водного столба без
потери энергии. Поэтому падение давления не со-
провождается потерей механической энергии при
увеличении гравитационной либо кинетической
энергии. Позже любое из этих давлений может быть
преобразовано назад в энергию давления.
Иногда в уравнение Бернулли вводят дополни-
тельные переменные для учета эффекта неламинар-
ного течения с потерей механической энергии:
(23.11)
22
11
122
2
11
ρv+ρgh+p=ρv+ρgh+p
22
2
22
11
122
2
1
11v
ρv+ρgh+p=ρv+ρgh+p+ρ
s+Φ
22t
∂
∂
∂
∫
In-23_для нас.indd 549
03.04.2019 12:01:18
550 ЧАСТЬ IV Пороки клапанов сердца
где s представляет собой расстояние между точками
1 и 2, а Φ обозначает потерю механической энергии
на единицу объема. Дополнительные переменные в
правой части уравнения представляют собой вклад
ускорения жидкости в энергию потока и превраще-
ние механической энергии в тепло, соответственно,
между точками 1 и 2. Для выражения потери энер-
гии при помощи изменения уравнения 23.11 полу-
чается следующее:
(23.12)
АНАЛИЗ ЭНЕРГИИ КОНТРОЛЬНОГО ОБЪЕМА
Более подробный анализ энергии потока жидкости
через клапан может быть проведен с использовани-
ем контрольного объема. Уравнение Бернулли опи-
сывает преобразование энергии и ее потерю вдоль
линии тока жидкости и является упрощенным ва-
риантом анализа энергии жидкостей, проходящих
через клапан. Использование контрольного объема
обеспечивает проведение трехмерного анализа
энергии жидкости в любой момент сердечного цик-
ла. Если предположить, что контрольный объем
представляет собой всю кровь вокруг клапана, как
показано на рис. 23.3, то использование перемен-
ных в уравнении Навье–Стокса приводит к следую-
щей формуле [1]:
2
22
12
12
12
1
1v
Φ=(p p)+ ρ(v v)+ρg(h h) ρ s
2t
∂
−
−
−−
∂
∂
∫
Скорость м/сек
01
1
0
–1
2
Р
а
д
и
а
л
ь
н
о
е
р
а
с
с
т
о
я
н
и
е
(
с
м
)
(23.13)
где S — напряжение сдвига; T — деформация сдви-
га; P — давление; u — скорость; A — поверхность
контрольного объема; n — нормальное направле-
ние на поверхности контрольного объема; g — сила
тяжести; V — контрольный объем. Нижние индек-
сы i и j относятся к любой из трех декартовых коор-
динат в соответствии с обозначениями Эйнштейна.
Уравнение 23.13 можно описать словами:
Рассеивание энергии = Энергия, определя-
емая градиентом давления – Энергия, преоб-
разованная в гравитационную потенциаль-
ную энергию – Энергия, преобразованная в
кинетическую энергию.
(23.14)
Градиент давления на клапане частично преобра-
зуется в кинетическую энергию, которая использу-
ется для ускорения жидкости и частично направле-
на для противодействия действию силы тяжести;
остаток теряется в виде тепла и звука.
МЕХАНИЗМЫ ПОТЕРИ МЕХАНИЧЕСКОЙ ЭНЕРГИИ
Механическая энергия может быть преобразована в
тепло и звук посредством трения, создаваемого
между клетками крови, которые движутся с разной
скоростью и трением, создаваемым между кровью
и стенками сосуда. Тепло и звук, возникающие в
результате трения, не могут легко перейти обратно
в механическую энергию, и эта энергия, рассеивает-
ся в системе кровообращения. Эти потери из-за
трения принимают одну из двух форм: потери на
трение и турбулентные потери. Дополнительная
энергия также эффективно рассеивается из-за ре-
гургитации на клапанах. Все формы потери энергии
описаны в следующих разделах.
ПОТЕРИ НА ТРЕНИЕ
В результате сил трения жидкость, прилегающая к
твердой границе, движется с той же скоростью, что
и граница. В случае кровеносного сосуда это озна-
чает, что жидкость, которая непосредственно при-
2
ij ij
ii
ii
i
d1
STdV= P(u n)dA ρugdV
ρu dV
dt2
−⋅
−
−
∫∫∫∫
Рис. 23.4 Профиль скорости в кровеносном сосуде. Вариация скорости
на радиальном расстоянии в кровеносном сосуде. Данные изменения опосре-
дованы вязкостью крови.
Аорта
Аортальный
клапан
Левое
предсердие
Правый
желудочек
Левый
желудочек
Митральный
клапан
Рис. 23.3 Анализ контрольного объема аортального клапана. Оценка
контрольного объема для анализа потери энергии на аортальном клапане.
In-23_для нас.indd 550
03.04.2019 12:01:18
551
23 Гемодинамика протезированных клапанов сердца
легает к стенке сосуда, не перемещается, независимо
от того, насколько быстро движется окружающий
поток. При удалении от границы скорость может
увеличиться. Это приводит к возникновению раз-
ницы скорости жидкости относительно радиально-
го расстояния внутри сосуда (рис. 23.4). Вязкость,
способность жидких компонентов или молекул
«прилипать» друг к другу, создают трение между
жидкими компонентами в непосредственной бли-
зости, если они движутся с разной скоростью. Это
и есть механизм потери энергии на трение, или на
«вязкость». Потери обычно увеличиваются с воз-
растанием потока крови и резко снижаются при
увеличении радиуса сосуда. Вот почему вазодилата-
торы эффективны для снижения нагрузки на левый
желудочек.
ТУРБУЛЕНТНЫЕ ПОТЕРИ
Обычно данный тип потерь не характерен для сосу-
дистой системы, однако при их наличии, они пре-
восходят по величине потери на «вязкость». Турбу-
лентный поток крови характеризуется хаотически-
ми флуктуациями в пространстве и времени. Это
связано с тем, что инерция потока слишком велика
для сил трения, чтобы стабилизировать движение
жидкости или гасить турбулентные вторичные дви-
жения. Хаотическая флуктуация в пространстве и
времени приводит к перемешиванию жидкости,
причем в определенных точках сосудистой системы
из-за этого отмечаются крайне высокие показатели
напряжения сдвига. Следовательно, из-за этого воз-
растает потеря энергии на трение.
Нарушение инерции движения жидкости в ли-
нейном сосуде может возникнуть из-за небольших
неровностей или шероховатостей на поверхности
сосуда. При ламинарном потоке все небольшие на-
рушения инерции компенсируются вязкостью кро-
ви, а флуктуация и турбулентный характер потока
будут минимально выражены. В турбулентном по-
токе все эти изменения усиливаются, т.к. одной
силы вязкости недостаточно для ослабления нару-
шений. Аналогичный пример можно сопоставить с
идущим и бегущим человеком. При спотыкании
сложнее поддержать равновесие во время бега, чем
во время ходьбы, т.к. инерцию движения тела слож-
нее контролировать.
Тенденция к турбулентному характеру потока
жидкости зависит от отношения сил инерции к
силам трения в потоке. Сила инерции движущего-
ся потока — это сила, необходимая для приведения
потока в состояние покоя. Сила трения данного
потока основана на напряжении сдвига вязкости,
действующей на твердые поверхности. В сосу-
дистом русле это отношение выражается числом
Рейнольдса:
(23.15)
Re
Dvρ
N=
μ
1
23
4
Давление
Кинетическая
энергия
Э
н
е
р
г
и
я
н
а
е
д
и
н
и
ц
у
о
б
ъ
е
м
а
(
м
м
р
т
.
с
т
.
)
Рис. 23.5 Сохранение энергии в месте стеноза. Давление и кинетическая
энергия теряются и преобразуются при прохождении потока через стеноз.
Поток сужается от 1 до 2 точки. Самое узкое место локализовано между 2 и 3
точкой с последующим расширением потока от 3 до 4 отметки.
где D — внутренний диаметр сосуда; v — средняя
скорость потока; ρ — плотность жидкости; мк —
вязкость жидкости. Низкое число Рейнольдса ха-
рактеризует ламинарный поток, а высокое число
Рейнольдса турбулентный. Точка перехода между
двумя состояниями называется критическим чис-
лом Рейнольдса и отличается для разных систем
жидкостей. Для потока через прямую трубу крити-
ческое число Рейнольдса составляет приблизитель-
но 2000, а поток становится полностью турбулент-
ным при числе Рейнольдса приблизительно 6000
[2]. Поток через маленькие круглые отверстия соз-
дает явление, более известное, как свободная струя.
Для ламинарного свободного потока критическое
число Рейнольдса составляет приблизительно 1000,
при этом полностью турбулентный поток отмеча-
ется при числах Рейнольдса, превышающих 3000 [3,
4]. Данный показатель снижается из-за острых углов
и изгибов потока либо при наличии неровностей на
стенке сосуда. Кроме того, для возникновения тур-
булентного тока крови должно пройти достаточно
времени, чтобы нивелировать все противодейству-
ющие силы. Однако в пульсирующем потоке при
слишком высокой частоте импульса турбулентность
может быть не выражена из-за недостаточного вре-
мени для ее развития. Таким образом, число Рей-
нольдса увеличивается [5].
РЕГУРГИТАЦИЯ НА КЛАПАНАХ
При наличии регургитации на клапанах, сердце
должно компенсировать данное нарушение, при-
кладывая больше энергии для прокачки дополни-
тельного объема крови. Кровь, которая прошла че-
рез клапан, не способствует более лучшей циркуля-
ции, а энергия, используемая для проталкивания
дополнительного объема в фазу сокращения, счита-
In-23_для нас.indd 551
03.04.2019 12:01:18
552
ЧАСТЬ IV Пороки клапанов сердца
ется потерянной. При протезировании клапанов
сердца, регургитация включает в себя потоки как
около- так и трансклапанные, образуя заключитель-
ный объем. Заключительный объем — это то коли-
чество крови, которое протекает назад через клапан
до его полного закрытия. Трансклапанная регурги-
тация — это дополнительные потоки через отвер-
стие клапанов. В биологических протезах при каль-
цификации створок возникает нарушение их коап-
тации, что в свою очередь вызывает регургитацию.
В механических клапанах потоки регургитации от-
мечаются через зазоры между створками при их
закрытом состоянии. Околоклапанная регургита-
ция возникает из-за неправильного прикрепления
кольца протеза к тканям сердца. Такая ситуация
может возникнуть при несостоятельности швов.
КОНВЕРСИЯ И ПОТЕРЯ МЕХАНИЧЕСКОЙ ЭНЕРГИИ
ПРИ СТЕНОЗАХ
Для того, чтобы показать, как механическая энергия
переходит в другие формы либо рассеивается, то
лучше всего обратиться к рис. 23.5, которая изобра-
жает изменения механической энергии при стенозе
аорты. На рисунке показано как преобразование,
так и потери энергии, кинетическая и энергия дав-
ления, при прохождении крови перед, после и в
месте стеноза.
Первый отрезок от 1 до 2 точки представляет
собой сужение потока. Так как уравнение нераз-
рывности утверждает, что скорость в точке 2 выше,
чем в точке 1, следовательно, кинетическая энер-
гия возрастает от 1 ко 2 точке. Данное увеличение
происходит за счет высокой энергии давления.
Относительно небольшое количество общей энер-
гии теряется при сжатии потока. Большая часть
потерянной энергии потока рассеивается из-за
вязкости. Однако после резкого сокращения про-
исходит небольшое разделение потока. Это проис-
ходит потому, что импульсы потока заставляет его
сходиться в течение короткого периода после суже-
ния (см. рис. 23.5). Резкое сужение из-за стеноза
приводит к большей потери энергии, нежели чем
постепенное.
Второй отрезок от 2 до 3 точки представляет со-
бой определенную длину с постоянной площадью
поперечного сечения. Уравнение непрерывности
потока утверждает, что скорость в точке 2 и 3 оди-
накова. Поэтому здесь отсутствует потеря кинети-
ческой энергии, а общая потеря равна энергии дав-
ления. Градиент давления, который эквивалентен
потере общей энергии на единицу объема, присущ
для неветвящихся сосудов с постоянной площадью
поперечного сечения. Общая энергия теряется в
данном случае лишь в зоне устья стеноза. При ла-
минарном течении потока все потери относятся к
«вязким», а при наличии достаточного импульса
относят к турбулентным.
Наконец, на постстенотическом участке, от 3 до
4 точки, теряется наибольшее количество общей
энергии. Вся эта энергия является кинетической по
своей природе, что объясняет, почему градиент при
допплерографии коррелирует с общей потерей ме-
ханической энергии. Однако допплерография не
полностью определяет все рассеивание энергии,
поскольку часть кинетической энергии преобразу-
ется в давление. Этот феномен объясняет сохране-
ние давления в участке сосуда после места стеноза.
На рисунке видно, почему градиент давления может
вводить в заблуждение при оценке рассеянной дви-
жущей силы потока. Поэтому следует учитывать,
что хоть давление увеличивается в данном участке,
но общее количество потерянной энергии большое.
ПРИМЕНЕНИЕ ГИДРОДИНАМИКИ
К ПРОТЕЗАМ КЛАПАНОВ СЕРДЦА
ПАДЕНИЕ ДАВЛЕНИЯ
Снижение давления на клапане сердца обычно ис-
пользуется для оценки количества энергии, которая
теряется при прохождении жидкости через него.
Это можно измерить непосредственно при помощи
инвазивных катетеров. Уравнение 23.16 отражает,
что перепад давления на клапане эквивалентен по-
тери энергии на единицу объема при пренебреже-
нии изменений кинетической, гравитационной
энергии и локальным ускорением потока. Следуя из
закона сохранения массы (см. Уравнение 23.6), из-
менения кинетической энергии незначительны при
одинаковом диаметре сосудов в местах измерения
давления вверху и внизу по течению, особенно при
нахождении точки в достаточном удалении от кла-
пана. Изменения гравитационной незначительны
Время (мсек)
Д
а
в
л
е
н
и
е
(
м
м
р
т
.
с
т
.
)
Диапазон градиента
(от пика до пика)
Пиковый градиент
Пиковый градиент
Давление в аорте
Давление в желудочке
Рис. 23.6 Градиент давления на клапане. Различие в среднем градиенте
давления, пиковом градиенте давления и градиенте давления от пика до пика
на аортальном клапане.
In-23_для нас.indd 552
03.04.2019 12:01:19
553
23 Гемодинамика протезированных клапанов сердца
при нахождении пациента на спине, т.к. имеется
несущественная разница высоты между местами
измерения вверху и внизу по току крови. При на-
хождении пациента в вертикальном положении
разница высоты на 5 см приводит к снижению дав-
ления на 3,9 мм рт. ст.
Изменения локального ускорения потока незна-
чительны, если измерение проводится при реги-
страции пиковой скорости потока на клапане (часто
называется пиковым градиентом), поскольку в дан-
ном случае пиковая скорость потока находится в
максимальной точке и больше не ускоряется. Эф-
фект ускорения незначителен, если измерения усред-
няются за весь сердечный цикл (часто называется
средним градиентом). Это связано с тем, что жид-
кость вначале ускоряется, а затем замедляется к
возвращению в исходное состояние, таким образом,
член ускорения интегрируется во времени и стано-
вится равным нулю. Примечательно, что пиковый
градиент давления представляет собой потерю
энергии во время фазы пика потока, тогда как сред-
ние градиенты представляют собой среднюю поте-
рю энергии за весь период прохождения потока
через клапан. Таким образом, пиковый градиент
всегда выше среднего. Также часто падение давле-
ния описывается через градиенты с разницей между
двумя пиками. Различия между пиковыми градиен-
тами показаны на рис. 23.6 .
ДОППЛЕРОВСКИЙ ГРАДИЕНТ
Потери энергии при прохождении крови через кла-
пан лучше всего определяются при прямой катете-
ризации, однако чаще всего это проводят при помо-
щи эхокардиографии. Для оценки количества дав-
ления, которое преобразуется в кинетическую
энергию при сжатии жидкости от клапана до точки
максимального пика, используется упрощенная
Уравнение 23.12, с нивелированием преобразования
энергии в гравитационную.
(23.16)
где Δp — перепад давления (p1–p2) при сжатии по-
тока в мм рт. ст.; Vups — скорость перед сжатием в
см/сек; Vmax — скорость в точке максимального
сжатия потока в см/сек. Константа «4» используется
для учета плотности крови и конверсии единиц. Все
это предполагает, что потери энергии и изменения
гравитационной энергии и локального ускорения
незначительны по мере того, как поток сжимается.
Предположения об изменениях кинетической энер-
гии, эффекте ускорения, использовании градиента
среднего градиента в зависимости от пикового гра-
диента и энергии гравитационного потенциала та-
кие же, как те, которые обсуждались ранее в разделе,
посвященному падению давления.
Таким образом, преобразование из давления в
кинетическую энергию из-за сокращения потока
22
max
ups
Δp=4(v
v)
−
(см. рис. 23.5) является величиной, которая измере-
на при оценке градиента давления с помощью доп-
плеровской эхокардиографии. Большая часть этой
конвертированной энергии будет потеряна после
расширения сосуда, поскольку кинетическая энер-
гия выше и ниже по течению от места расширения
примерно одинакова согласно уравнению 23.6. Од-
нако из-за того, что градиент на допплерографии
измеряется между верхней точкой и самым узким
местом потока, то здесь не учитывается восстанов-
ление исходных параметров давление, которое про-
исходит ниже места сужения, что может завышать
потерю энергии.
Еще одна проблема при оценке градиентов при
допплерографии — это правильное позициониро-
вание датчика. Если датчик расположен наклонно
относительно оси потока, то получаемая скорость
будет недооценивать истинную скорость струи [6],
а градиент давления будет занижен. Поскольку
ошибки, которые возникают в результате восста-
новления давления и наклонного расположения
датчика, имеют тенденцию уравновешивать друг
друга, поэтому допплеровское ультразвуковое ис-
следование может время от времени точно отражать
изменения давления, полученным при катетериза-
ции. Тем не менее, бывают случаи, когда градиент
при допплерографии имеет значительные клиниче-
ские ошибки.
Дополнительные осложнения при использова-
нии допплерографии для оценки общей потери
энергии в механических протезах возникают из-за
того, что в этих клапанах имеется несколько отвер-
стий и сопротивление потоку на каждом из них
может различаться. Поэтому измерения скорости
на одном отверстии не отражают всю характеристи-
ку градиентов давления или общей энергии при
прохождении потока через клапан.
При сравнении градиентов на механических кла-
панах, полученных при катетеризации и допплеро-
графии, отмечается значительная разница показате-
лей, что привело к тому, что Управлением по кон-
тролю за продуктами и лекарствами эмпирически
были разработаны поправочные коэффициенты
для каждой из конструкции клапанов [7]. В некото-
рых исследованиях указано, что существует незна-
чительная разница между градиентами давления при
допплерографии и катетеризации, особенно в отно-
шении средних градиентов [6]. Однако из-за потен-
циальных проблем с допплерографией, ее следует
использовать с осторожностью при оценке механи-
ческих клапанов. Часто уравнение 23.16 упрощают,
предполагая, что скорость потока крайне мала отно-
сительно максимальной скорости в пределах зоны
стеноза:
(23.17)
Данное уравнение хорошо работает при крайней
степени стеноза отверстия, т.к. скорость потока вну-
2
max
Δp=4v
In-23_для нас.indd 553
03.04.2019 12:01:19
554
ЧАСТЬ IV Пороки клапанов сердца
три стеноза действительно намного выше по срав-
нению со скоростью потока выше по течению. Дан-
ную особенность можно использовать только в
биологических протезах с высокой степенью каль-
фицикации.
ЭФФЕКТИВНАЯ ПЛОЩАДЬ ОТВЕРСТИЯ
Оценка клапана при перепаде давления и градиен-
тов при допплерографии в значительной степени
зависит от скорости потока. Эффективная пло-
щадь отверстия представляет собой не анатомиче-
скую площадь, а площадь поперечного сечения
струи, которая выходит из клапана в наиболее уз-
ком месте (vena contracta). Размер эффективной
площади отверстия зависит от характера сужения,
а также от размера самого отверстия. Резкое суже-
ние имеет меньшую эффективную площадь отвер-
стия, нежели, чем постепенное сужение одной и
той же области. Эффективную площадь отверстия
относят к параметрам клапана, которые не зависят
от сердечного выброса и частоты сердечных сокра-
щений.
Эксперименты in vivo [8, 9] и in vitro [1] показа-
ли, что на этот параметр может влиять скорость
потока. При наличии биологических протезов,
более высокая скорость потока провоцирует более
широкое открытие клапана, увеличивая эффек-
тивную площадь отверстия, растягивая створки
кнаружи. В механических клапанах изменения
протекающего объема приводят к различным дан-
ным скорости на диаметре самого узкого места
[10], что вызывает незначительные изменения эф-
фективной площади отверстия. Однако все изме-
нения параметра крайне незначительны, поэтому
в большинстве случаев всеми погрешностями
можно пренебречь [11].
Эффективную площадь отверстия (EOA) можно
оценить при помощи уравнения непрерывности
(уравнение 23.18) на эхокардиографии в области
выше по току крови (Aups), с учетом среднего вре-
менного значения в точке максимального сужения:
(23.18)
Импульсно-волновую допплерографию исполь-
зуют для измерения скорости восходящего потока,
а непрерывно-волновую допплерографию — для
оценки максимальной скорости.
Если принять показатели EOA и Aups в виде по-
стоянных в систолу, то вместо скорости возможно
использовать интеграл скорости кровотока (VTI).
VTI — это область на кривой графика соотношения
скорости и времени. Верхняя граница определяется
при помощи планаметрии в В-режиме. Таким обра-
зом, клинически применимое уравнение приобре-
тает вид:
ups ups
max
Av
EOA =
v
(23.19)
Также для оценки эффективной площади отвер-
стия с использованием катетера можно использо-
вать формулу Горлина. Она представляет собой
комбинацию уравнения 23.6 и уравнения 23.16 либо
23.17
(23.20)
где EOA представлена в см2; Q — средняя скорость
потока во время прямого потока в единицу времени
в см3/сек; Δp — среднее снижение давления на кла-
пане во время прохождения через него потока в мм
рт. ст.
Константа 51.6 в знаменателе используется для
учета плотности крови и конверсии единиц. Эф-
фективная площадь отверстия отличается от пло-
щади аортального клапана, первоначально описан-
ной Горлиным [12], которая представляла собой
геометрическую область отверстия клапана, между
свободными краями створок Эффективная пло-
щадь отверстия представляет собой область потока
немного ниже от собственно отверстия клапана,
там, где поток немного суживается. Таким образом,
коэффициент 44,3 использовался при вычислении
площади аортального клапана, то для расчета эф-
фективной площади отверстия должен использо-
ваться коэффициент 51,6. С помощью данного ме-
тода можно получить эффективную площадь при
инвазивной катетеризации сердца или при неинва-
зивном эхокардиографическом исследовании. Δp
непосредственно измеряется при помощи катете-
ров, а Q вычисляется путем измерения сердечного
выброса (СВ) при помощи метода Фика (термоди-
люция и разведение красителя) [13], частоты сокра-
щения сердца (ЧСС) и длительности систолы (ДС):
(23.21)
Однако имеется вероятность, что при оценке ка-
тетером можно переоценить эффективную пло-
щадь отверстия из-за механизма восстановления
давления. Однако уравнение представленное ранее
крайне полезно при отдельной оценке коэффициен-
та потери энергии при различной степени тяжести
стеноза аорты.
При неинвазивном эхокардиографическом под-
ходе Q оценивается площадью по потоку (Aups),
умноженной на интеграл по времени (VTIups), а Δp
оценивается градиентом по допплеру с использова-
нием уравнения 23.16 или 23.17 .
(23.22)
ups
ups
max
A VTI
EOA =
VTI
Q
EOA =
51.6 Δp
CO
Q=
HR SD
⋅
ups
ups
A VTI
EOA =
51.6 Δp
⋅
In-23_для нас.indd 554
03.04.2019 12:01:19
555
23 Гемодинамика протезированных клапанов сердца
Использование уравнений 23.16 или 23.17 будет
иметь те же предположения, которые описаны в
разделах допплеровских градиентов и давлений,
поэтому их следует применять с осторожностью.
При использовании формулы 23.20 и 23.22 сле-
дует учитывать важный момент, что все перемен-
ные в уравнениях являются средними значениями
потока через клапан сердца. в течении систолы или
диастолы. Мгновенные показатели давления и по-
тока нельзя использовать в данных уравнениях. Это
связано с тем, что уравнение Горлина выведено с
использованием уравнения Бернулли для ламинар-
ного потока и, следовательно, является недействи-
тельной в ситуациях с большим ускорением или
замедлением кровотока. Например, при оценке Δp
при помощи эхокардиографии, следует использо-
вать либо среднее значения от нескольких градиен-
тов давления, которые расположены равномерно в
фазе прямого потока, либо среднее время интегри-
рования данных по градиенту давления. Для оценки
Q при проведении эхокардиографии рекомендуется
использовать интеграл скорости по времени, учи-
тывая скорость в фазу прямого потока.
Также, при наличии аортальной регургитации
все средние значения могут быть недостоверными
[14]. Оценка скорости прямого потока, не связанная
с эхокардиографией (метод Фика, термодилюция и
применение контрастных веществ), является усред-
ненным показателем по всему сердечному циклу
(Qnet). В отсутствие регургитации все методы могут
быть использованы для оценки средней скорости
потока во время систолы. Однако если присутствует
аортальная регургитация, то прямое применение
формулы Горлина приведет к недооценке эффек-
тивной площади отверстия:
30
25
20
15
10
5
0
–5
0
200
Объем обратного тока
Объем регургитации
Объем закрытия
400
600
800
1000
Время одного сердечного цикла (мсек)
С
к
о
р
о
с
т
ь
п
о
т
о
к
а
в
а
о
р
т
е
(
л
/
м
и
н
)
Рис. 23.7 Объем регургитации. Объем регургитации, закрытия и обратного
тока на аортальном клапане.
(23.23)
где RF — представляет собой фракцию аортальной
регургитации.
В экспериментальной модели работы протеза
клапана in vitro, EOA оценивается при помощи
уравнения Горлина, т.к. в данной системе легко по-
лучить измерения давления и скорости потока.
Объем потока можно измерить при помощи раз-
личных датчиков, а давление при помощи катете-
ров непосредственно вверху и внизу течения при
помощи коммерческих манометров. В данном экс-
перименте использовалось следующее уравнение
для расчета EOA [15]:
(23.24)
где EOA представлена в единицах см2, QRMS пред-
ставляет собой квадратный корень объема потока в
единицу времени (мл/сек) в фазе прямого потока, а
Δpmean — среднее снижение давления на клапане во
время фазы прямого потока в мм рт. ст.
Существует также показатель производительно-
сти для оценки сопротивления потоку на клапане,
который основан на эффективной площади отвер-
стия. Это отношение EOA к пришивному кольцу
протеза (Asew):
(23.25)
Индекс производительности дает представление
о том, насколько хорошо дизайн клапана соответ-
ствует общей и эффективной площади отверстия
протеза. Показатель зависит от размера клапана и
позволяет нормализовать эффективную площадь
отверстия.
ОБЪЕМ РЕГУРГИТАЦИИ
Качественную оценку потери энергии потока по-
зволяет провести данные о падении давления, доп-
плеровских градиентов, эффективной площади
отверстия. Энергия также может теряться из-за на-
личия регургитации из-за того, что градиент давле-
ния на клапане меняет свое направление. В норме
имеется небольшая регургитация во время закры-
тия створок. Кроме того, створки механических
протезов не смыкаются полностью, что также при-
водит к постоянной регургитации в норме. Поток
регургитации характеризуют объемом крови во
время и после закрытия створок. Объем регургита-
ции — общий объем регургитирующей жидкости
за одно сокращение сердца. Он равен сумме объе-
мов при смыкании створок и после закрытия кла-
пана. Любой поток через клапан после его закрытия
расценивается как регургитация (рис. 23.7).
net
Q
Q=
(1 RF)
−
RMS
mean
Q
EOA =
51.6 Δp
sew
EOA
PI=
A
In-23_для нас.indd 555
03.04.2019 12:01:19
556 ЧАСТЬ IV Пороки клапанов сердца
Объем регургитации при протезах клапанов
определяется их типом, размером и анатомическим
положением. Биологические протезы характеризу-
ются небольшим объемом регургитации при за-
крытии, а также отсутствием потоков в закрытом
положении в норме. Двухстворчатые механические
протезы, как правило, имеют больший объем регур-
гитации, чем при наклонной конструкции диска
клапана [16]. Чем больше размер клапана, тем более
выражен объем регургитации. Наибольший объем
регургитации отмечается при наличии высоких гра-
диентов давления при закрытии с продолжитель-
ным временем регургитации.
Из-за наличия регургитации отмечается боль-
шое количество потери энергии [16]. В большин-
стве случаев, крайне редко отмечается регургитация
на протезах клапанов, однако нарушение их струк-
туры может приводить к выраженным потокам.
Для того, чтобы разграничить нормальную функ-
цию клапана от нарушенной, важно различать нор-
мальный объем регургитации и дополнительные
потоки при заболеваниях. При оценке протезов
клапанов in vitro, объем регургитации легко оцени-
вают при помощи коммерческих датчиков потока
или методами велосиметрии (например, измери-
тель скорости частиц или лазерная допплеровская
велосиметрия). Прямой расчет потери энергии, ко-
торая возникает в результате регургитации, можно
провести при помощи уравнения 23.29, которое
описано далее.
Большинство методов количественного опреде-
ления объема регургитации используют формулу
контрольного объема и сохранения массы. При не-
инвазивной количественной оценке потока регур-
гитации на эхокардиографии, наиболее часто ис-
пользуемым способом является метод площади
формирующейся струи регургитации (ПФСР) [17–
20], который применим для биологических клапа-
нов. Принцип ПФСР основан на том, что объем
крови регургитации, поступающей через отверстие,
должен ускоряться для того, чтобы достичь макси-
мальной скорости в самом узком месте. Если отвер-
стие имеет округлую форму, то область ускорения
должна быть осесимметричной относительно цен-
тра отверстия. Таким образом, перед отверстием
регургитации можно определить серию полусфери-
ческих изоскоростных контуров. Уравнение 23.5
указывает, что если конечный объем не изменяет
свой размер, то количество жидкости, которое вхо-
дит в объем, должно выйти из него. При совпадении
конечного объема с полусферическим контуром и
отверстием регургитации:
(23.26)
где Vups — среднее значение скорости во времени на
радиальном расстоянии (r) выше по течению от
отверстия регургитации, а t представляет собой вре-
мя, в течение которого длится регургитации за один
2
ups
RV=2πr v t
сердечный цикл. Выражение 2πr2 в этом уравнении
представляет собой площадь поверхности полусфе-
рического контура, окружающего контрольный
объем.
ПОТЕРЯ МЕХАНИЧЕСКОЙ ЭНЕРГИИ
На потерю энергии на клапане указывают градиент
давления и цифры эффективной площади отвер-
стия. Однако они не являются прямыми показате-
лями потери механической энергии, которая долж-
на была бы измеряться в джоулях или ваттах.
Прямое измерение потери механической энер-
гии возможно in vitro при помощи уравнения 23.12
(анализ уравнения Бернулли), так и с уравнением
23.15 (анализ контрольного объема. При интегра-
ции уравнения 23.12 в один сердечный цикл, то
конечный член становится равным нулю из-за пе-
риодичности и повторяемости потока жидкости
через клапан. Гравитационный потенциальный
энергетический член уравнения обычно крайне мал
и им можно пренебречь. Остальную часть можно
упростить до:
(23.27)
где Φcycle — потеря энергии за цикл; Q — объемный
расход, а нижние индексы 1 и 2 отражают места
выше и ниже клапана, соответственно. Heinrich с
коллегами [21] измерили потери энергии за сердеч-
ный цикл в механическом двухстворчатом протезе
St. Jude Medical и механическом дисковом клапане
Medtronic Hall и выявили, что существенных разли-
чий в потере энергии между этими двумя клапана-
ми не было. Наблюдалось увеличение потери энер-
гии при возрастании ударного объема и частоты
сердечных сокращений. Уравнение 23.13 можно
упростить следующим образом, предположив, что
преобразование энергии в гравитационную потен-
циальную энергию мало:
(23.28)
где Φinst — мгновенная потеря энергии; KE — кине-
тическая энергия контрольного объема, а нижние
индексы 1 и 2 отражают места измерения выше и
ниже клапана соответственно. Yap с коллегами [1]
провели измерение мгновенной потери энергии на
трехстворчатом клапане и выявили, что большая
часть энергии теряется в конце систолы, когда на-
растает отрицательный градиент давления и поток
крови принимает реверсивный характер. Также от-
мечено, что потеря энергии возрастает при увели-
чении ударного объема и частоты сердечных сокра-
щений.
Для того, чтобы вычислить потерю энергии при
регургитации на клапане, нужно предположить, что
22
cycle
1
1
2
2
cycle
11
Φ=QP+ρv
P+ρvdt
22
⎡⎤
⎛
⎞⎛
⎞
−
⎜
⎟⎜
⎟
⎢⎥
⎝
⎠⎝
⎠
⎣⎦
∫
inst
1
2
dKE
Φ =Q(P P)
dt
⋅−−
In-23_для нас.indd 556
03.04.2019 12:01:19
557
23 Гемодинамика протезированных клапанов сердца
вся механическая энергия, которая и вызывает ре-
гургитацию, рассеивается:
(23.29)
где Φregurg — полная потеря энергии регургитации
за один сердечный цикл; Q — объемный регургита-
ции, а нижние индексы 1 и 2 отражают места изме-
рения выше и ниже клапана на котором имеется
регургитация, соответственно. Azadani с коллегами
[22] применили данный подход при оценке потери
энергии из-за регургитации на транскатетерных
протезах и выявили, что потеря энергии из-за ре-
гургитации может достигать до одной трети от об-
щей потери на данном клапане.
Потеря энергии на клапане зависит от объема
потока крови, плотности и вязкости жидкости, раз-
мера клапана (который должен быть сопоставим с
площадью поверхности тела), а также формы кла-
пана (например, наличие либо отсутствие стеноза).
Полноценный анализ при помощи pi-теоремы Бу-
кингема указывает на то, что потеря энергии может
быть безразмерной при корреляции на площадь
поверхности тела в квадрате [23]. При нормализа-
ции параметров масштабирования, потери энергии
зависят от числа Рейнольдса и формы клапана:
(23.30)
(23.31)
regurg
1
2
regurg
Φ = Q(PP)dt
⋅−
∫
3
2
Q
ερ
BSA
∝
Re
3
2
ε
= f(N ,S)
Q
ρ
BSA
где ε — диссипация энергии; ρ — плотность; Q —
скорость потока; ППТ — площадь поверхности те-
ла; NRE — число Рейнольдса; S — безразмерный
коэффициент.
Однако в клинике прямое измерение потери
энергии широко не используется при оценке клапа-
нов сердца in vivo, хоть параметры энергоэффектив-
ности являются прямым измерением вклада состо-
яния клапана в сердечную недостаточность (сердеч-
ная недостаточность может быть интерпретирована
как неспособность сердца генерировать достаточное
количество энергии для преодоления ее потери в
циркуляции). Dasi с коллегами [23] выявили, что у
пациентов с тяжелой стадией стеноза аортального
клапана с низким кровотоком и значительным гра-
диентом давления может быть обманчиво нормаль-
ные цифры эффективной площади отверстия, од-
нако при анализе потери энергии стало очевидно,
что у них имеется тяжелая форма заболевание серд-
ца. Atkins с коллегами опубликовали обзор анализа
механической потери энергии на клапанах сердца
[24].
ПАРАМЕТРЫ ПОТЕРИ ЭНЕРГИИ
Как видно на рис. 23.5, гораздо больше механиче-
ской энергии теряется при расширении потока, чем
при его сжатии. Это особенно актуально в биологи-
ческих клапанах из-за постепенного характера со-
кращения потока в области узкого места. Локализа-
ция потери энергии в области расширения потока
значительно упрощает задачу, позволяя моделиро-
вать потери энергии, которые возникают при стено-
зах аортального клапана из-за постстенотического
расширения. Полная потеря энергии на единицу
80
60
40
20
0
С
р
е
д
н
и
й
г
р
а
д
и
е
н
т
(
м
м
р
т
.
с
т
.
)
С
р
е
д
н
и
й
г
р
а
д
и
е
н
т
(
м
м
р
т
.
с
т
.
)
0,4
0,6
0,8
1,0
1,2
1,2
1,4
1,6
1,8
2,0
1,4
Индексированная эффективная площадь отверстия (см2/ м2)
Индексированная эффективная площадь отверстия (см2/ м2)
50%
40%
30%
20%
10%
покой
50%
40%
30%
20%
10%
покой
20
10
0
Рис. 23.8 Взаимосвязь между градиентом давления на клапане и индексированной эффективной площадью отверстия. Взаимосвязь между
средним градиентом давления и индексированной эффективной площадью отверстия для (А) аортальных биопротезов и (Б) митральных биопротезов, которая
была изучена in vitro в системе при условии нормального сердечного индекса 3,0 л/мин/м2 в состоянии покоя и от 10% до 50% увеличения ударного объема во
время физических нагрузок [Dumesnil JG, Yoganathan AP. Valve prosthesis hemodynamics and the problem of high transprosthetic pressure gradients. Eur J Cardiothorac
Surg 6(Suppl 1): S34–S37; discussion S38, 1992].
А
Б
In-23_для нас.indd 557
03.04.2019 12:01:20
558 ЧАСТЬ IV Пороки клапанов сердца
0
200
Аорта
Аортальный
клапан
Систола
Диастола
400
600
800
1000
100
300
500
700
900
Время (мсек)
Изоволюмическое
расслабление
Изоволюмическое
напряжение
Д
а
в
л
е
н
и
е
П
о
т
о
к
Э
К
Г
Митральный клапан
QRS
(комплекс на ЭКГ)
Т
Р
Левое предсердие
Левый желудочек
Рис. 23.9 Графики давления и потока. График давления и потоков левых
отделов сердца.
объема при резком расширении может быть полу-
чена с использованием уравнений 23.6 и 23.12 и
формы сохранения импульса [25]:
(23.32)
где Φ отражен в мм рт. ст., а Vmax — средняя ско-
рость в точке максимального сужения потока в см/
сек. Таким образом, уравнение 23.32, подобно вос-
становлению давления, выступает в виде функции
эффективной площади отверстия и площади попе-
речного сечения аорты. Поскольку это отношение
площади приближается к нулю, то потери энергии
на единицу объема в расширенном месте сосуда
приравнивается к допплеровским градиентам. Та-
ким образом, в случаях сильного клапанного стено-
за допплеровский градиент эквивалентен механиче-
ским потерям энергии на единицу объема. Преиму-
щество использования уравнения 23.32 вместо
перепада давления или допплеровского градиента
заключается в том, что оно позволяет оценить по-
терю энергии при помощи не инвазивной эхокар-
диографии. При использовании данной формулы
2
2
max
aorta
EOA
Φ=4v 1
A
⎛⎞
−
⎜⎟
⎝⎠
нужно принимать площадь поперечного сечения
аорты на уровне синотубулярного соединения, т.к .
расщепление потока исчезает сразу после прохож-
дения его через синусы Вальсальвы.
Потеря энергии в уравнении 23.32, также как и
падение давления, зависит от скорости потока. Же-
лательно определить параметр, который тесно свя-
зан с потерей энергии, но относительно независим
от скорости потока при оценке функции протеза
клапана. Такой параметр можно получить, заменив
в уравнении 23.32 допплеровский градиент на урав-
нении 23.30. Данный параметр называется коэффи-
циентом потери энергии (КПЭ) [26]:
(23.33)
где EOA измеряется при помощи эхокардиографии,
используя либо уравнение 23.18, либо уравнение
23.20. Коэффициент потерь энергии эквивалентен
уравнению 23.23, если Δp в уравнении 23.23 измеря-
ется датчиками давления, которые расположены
достаточно далеко вниз по потоку, чтобы учиты-
вать восстановление энергии. Преимущество ис-
пользования коэффициента потери энергии вместо
эффективной площади отверстия заключается в
том, что коэффициент потерь энергии основан на
восстановленном давлении.
ОЦЕНКА ПРОТЕЗОВ КЛАПАНОВ IN VIVO
Оценка протезов клапанов in vivo проводится в кли-
нических условиях, когда у пациентов после их
имплантации возникает нарушение функции серд-
ца. Протезы клапанов зачастую имеют более узкое
отверстие, уменьшая свободное пространство в
аорте. Однако, в некоторых случаях регистрируют-
ся очень высокие градиенты давления, несмотря на
нормальную функцию протеза [27]. Наиболее веро-
ятная причина этого является несоответствие про-
тез–пациент, когда имплантированный клапан
слишком мал для обеспечения нормального сердеч-
ного выброса для размера тела пациента. Пациенты
с гипертрофированным сердцем или кальцифици-
рующим стенозом аорты особенно подвержены
возникновению несоответствия протез–пациент,
поскольку у них крайне трудно имплантировать
протез нужного размера. Несоответствие протез–
пациент влияет на физическую работоспособность
пациента, а также на послеоперационную леталь-
ность [28]. Для выявления несоответствия необхо-
димо провести эхокардиографическую оценку эф-
фективной площади отверстия протеза и сравнить
его с нормальными показателями для данного типа
и модели клапана, указанной в литературе произво-
дителя. Если эффективная площадь отверстия ни-
же, чем указано в источниках, то, вероятно, суще-
aorta
aorta
A EOA
ELCo =
A
EOA
−
In-23_для нас.indd 558
03.04.2019 12:01:20
559
23 Гемодинамика протезированных клапанов сердца
Измерение профиля скорости дистальнее аор-
тального клапана, выполнялось при помощи допле-
ровской эхокардиографии у здоровых людей [26].
Скорость кровотока в пик систолы составляет
1,35 ± 0,35 м/сек, а на уровне кольца аортального
клапана профиль относительно плоский. Как пра-
вило, ближе к стенке перегородки наблюдается не-
большое смещение данных скорости (на 10% мень-
ше от скорости по центральной оси), что вызвано
ориентацией аортального клапана относительно
длинной оси левого желудочка. Это было подтверж-
дено многими экспериментальными методами, в
том числе при помощи анемометрии [29, 30], доп-
плеровской эхокардиографии [31], магнитно-резо-
нансной томографии [32].
Характер тока крови также играет крайне важ-
ную роль в надлежащей функции клапана. Завихре-
ния формируются во время систолы за каждой
створкой в области синуса. В экспериментах in vitro
были попытки связать влияние завихрений на эф-
фективное закрытие клапана [33, 34]. Было доказа-
но, что для закрытия створок вихревые потоки не
требуются, однако способствуют более быстрому
закрытию клапана, уменьшая регургитацию [35].
Профиль скорости на митральном клапане был
детально изучен на моделях свиней, т.к. их анато-
мия сердца сопоставима с человеческой [36]. Здесь,
как и на аортальном клапане, наблюдается неболь-
шое смещение профиля. Это зависит от конкретной
геометрии митрального клапана, характера крово-
тока в диастолу, а также от позиции допплеровско-
го датчика. Когда ультразвуковой луч направлен на
митральное кольцо, то ранняя пиковая диастоличе-
ская скорость составляет 63,6 ± 16,1 см/сек, а поздняя
диастолическая пиковая скорость 53,7 ± 10,8 см/сек.
При направлении луча на створки, то ранняя пико-
вая диастолическая скорость была 82,9 ± 30,8 см/сек,
а пиковая поздняя диастолическая скорость состав-
ляла 39,6 ± 14,2 см/сек.
ствует дисфункция протеза. С другой стороны, если
эффективная площадь отверстия близка к той, что
описана в литературе, и, тем не менее, существует
высокий градиент давления, то, вероятно, суще-
ствует несоответствие протез–пациент. Исследова-
ние in vitro показало, что индексированная эффек-
тивная площадь отверстия обратно пропорцио-
нальна среднему градиенту давления, как показано
на рис. 23.8 . Кроме того, в случае несоответствия
при небольшой индексированной эффективной
площади отверстия, физическая нагрузка будет вы-
зывать нарастание среднего градиента давления.
ГЕМОДИНАМИКА НАТИВНЫХ КЛАПАНОВ СЕРДЦА
Для того, чтобы эффективно анализировать поток
через протезы клапанов сердца в митральной или
аортальной позиции, крайне важно понимать усло-
вия, в которых функционируют клапаны в норме.
На рис. 23.9 показаны типичные кривые давления и
потока у здоровых людей как в аортальном и ми-
тральном клапанах. Во время систолы разница дав-
ления, которая необходима для прокачки крови
через аортальный клапан, составляет несколько
миллиметров ртутного столба. Различия диастоли-
ческого давления в аортальном клапане намного
больше, чем систолические и составляют обычно
около 80 мм рт. ст. Клапан закрывается ближе к
конечной фазе систолы с очень небольшим обрат-
ным потоком. Поток крови через митральный кла-
пан двухфазный во время диастолы, как показано
на рис. 23.9 . Первый пик, E-волна, обусловлен ре-
лаксацией желудочков, а второй пик A-волны вы-
зван сокращением левого предсердия. Это означает,
что митральный клапан открывается и закрывается
дважды в течение каждого сердечного цикла. Также
следует указать, что все клапаны сердца закрыты во
время изоволюмического сокращения и расслабле-
ния.
Рис. 23.10 Типы протезов клапанов сердца. (A) Дисковый. (Б) Двухстворчатый. (В–Д) Каркасные протезы (Е) Каркасный биопротез. (В — Carpentier–Edwards
PERIMOUNT Magna; Г — Medtronic Hancock 2; E — St. Jude Medical Biocor).
А
Б
Г
Д
Е
В
In-23_для нас.indd 559
03.04.2019 12:01:20
560 ЧАСТЬ IV Пороки клапанов сердца
Тип клапана
Клапан
Место измерения
Максимальная
скорость (см/сек)
Пиковое напряжение
сдвига (дин/см2)
Шарикового типа Starr–Edwards 1260
12 мм ниже по потоку 220
1850
Наклонный тип
Bjo
rk–Shiley Convexo-concave
7 мм ниже по потоку
200
3400
11 мм ниже по потоку 200
1800
Bjo
rk–Shiley Monostrut
8 мм ниже по потоку
200
1250
11 мм ниже по потоку 200
800
Medtronic–Hall
13 мм ниже по потоку 200
1500
Omnicarbon
14 мм ниже по потоку 225
2000
Двухстворчатый
St. Jude Medical Standard
13 мм ниже по потоку 210
1500
Duramedics
13 мм ниже по потоку 210
2300
CarboMedics
12 мм ниже по потоку 228
1520
Стентированный
биопротез
Carpentier–Edwards Porcine 2625
15 мм ниже по потоку 370
4500
Carpentier–Edwards Porcine 2650
15 мм ниже по потоку 200
2000
Carpentier–Edwards Pericardial 2900 17 мм ниже по потоку 180
1000
Hancock MO Porcine 250
10 мм ниже по потоку 330
2900
Hancock II Porcine 410
18 мм ниже по потоку 260
2500
Ionescu–Shiley Standard Pericardial 27 мм ниже по потоку 230
2500
Hancock Pericardial
18 мм ниже по потоку 170
2100
Нестентированный
биопротез
Medtronic Freestyle†
На уровне кончиков
створок
125
10 мм от кончиков
створок
100
Toronto Stentless Porcine Valve
(TSPV)†
На уровне кончиков
створок
150
10 мм от кончиков
створок
125
* ЧСС 70 уд/мин; сердечный выброс 5 л/мин; аортальное давление 120/80 мм рт. ст.
† Данные получены in vitro с помощью допплерографии.
н/д — нет данных.
ТАБЛИЦА 23.1 Пиковая систолическая скорость и напряжение сдвига на протезах аортального клапана размерами 27 мм*
В левом желудочке завихрения возникают при
прохождении крови через митральный клапан.
Bellhouse предположил, что завихрения помогают
закрыть створки в конце диастолы [34]. Позднее
было показано, что это играет роль только в раннем
закрытии митрального клапана, а в поздней фазе
закрытия преобладает вклад давления левого желу-
дочка [37].
Из-за наличия ограничений протезов клапанов
пиковые скорости обычно выше, а профили скоро-
сти резко отличаются от характеристик в нативных
клапанах. Напряжения сдвига в протезах также зна-
чительно выше из-за высоких скоростей и турбу-
лентного тока крови. Величина напряжения сильно
зависит от типа протеза клапана. При эффективной
оценке функции протезов клапанов крайне важно
знать сходства и различия между типами клапанов
с точки зрения их величин напряжений, скоростей
и характеристик потока.
ГЕМОДИНАМИКА КОНКРЕТНЫХ МОДЕЛЕЙ
ПРОТЕЗОВ КЛАПАНОВ
Вот уже более 40 лет в кардиохирургии используют-
ся протезы клапанов сердца. На данный момент все
протезы можно разделить на три основные катего-
рии: механические, биологические и транскатетер-
ные клапаны. Механические клапаны представляют
собой протезы, выполненные из небиологических
тканей, и имеют три различные конструкции: дис-
ковые, двухстворчатые, шариковые. Биологические
клапаны представляют собой протезы, изготовлен-
ные из тканей животных, их можно классифициро-
вать как каркасные, бескаркасные и гомографты.
Транскатетерные протезы являются новейшим ме-
тодом имплантации клапанов. По существу, они
представляют собой биологические клапаны, кото-
рые имплантируются при помощи катетеров. На
рис. 23.10 представлены примеры протезов каждого
In-23_для нас.indd 560
03.04.2019 12:01:20
561
23 Гемодинамика протезированных клапанов сердца
Тип клапана
Клапан
Размер Объем регургитации (мл/уд) EOA (см2)†
ИП
Шарикового типа
Starr–Edwards 1260
27
5,5
1,75
0,30
25
4,3
1,62
0,33
21
2,5
1,23
0,36
Наклонный тип
Bjo
rk–Shiley Convexo-concave
27
8,5
2,59
0,45
25
7,3
2,37
0,48
21
5,5
1,54
0,45
Bjo
rk–Shiley Monostrut
27
9,2
3,34
0,58
25
7,6
2,62
0,53
23
6,9
2,00
0,48
21
5,9
1,45
0,42
19
5,5
1,07
0,38
Medtronic–Hall
27
9,6
3,64
0,64
25
8,4
3,07
0,62
23
7,3
2,26
0,54
20
6,2
1,74
0,51
Двухстворчатый
St. Jude Standard
27
10,8
4,09
0,71
25
9,9
3,23
0,66
23
8,3
2,24
0,54
21
6,8
1,81
0,52
19
6,8
1,21
0,43
St. Jude Regent
29
13,5
4,98
0,75
27
12,3
4,40
0,77
25
11,2
3,97
0,81
23
10,3
3,47
0,83
21
9,0
2,81
0,81
19
7,6
2,06
0,73
17
6,3
1,56
0,69
CarboMedics
27
7,5
3,75
0,65
25
6,1
3,14
0,64
23
6,51
2,28
0,55
21
3,4
1,66
0,48
19
3,0
1,12
0,40
Стентированные
биопротезы
Carpentier–Edwards Porcine 2625
27
<3
1,95
0,34
25
<2
1,52
0,31
21
<2
1,28
0,37
Carpentier–Edwards Porcine 2650
27
<2
2,74
0,48
25
<2
2,36
0,48
21
<2
1,38
0,40
19
<2
1,17
0,41
Carpentier–Edwards Pericardial 2900 27
<3
3,70
0,64
25
<2
3,25
0,66
21
<2
1,88
0,54
19
<2
1,56
0,55
ТАБЛИЦА 23.2 Данные гемодинамики in vitro для протезов аортальных клапанов*
In-23_для нас.indd 561
03.04.2019 12:01:20
562
ЧАСТЬ IV Пороки клапанов сердца
Тип клапана
Клапан
Размер Объем регургитации (мл/уд) EOA (см2)†
ИП
Hancock Porcine 242
27
<3
2,14
0,37
25
<2
1,93
0,39
23
<2
1,73
0,42
21
<2
1,31
0,38
19
<2
1,15
0,41
Hancock MO Porcine 250
25
<2
2,16
0,44
23
<2
1,94
0,47
21
<2
1,43
0,41
19
<2
1,22
0,43
Hancock II Porcine 410
27
<2
2,36
0,41
25
<2
2,10
0,43
23
<2
1,81
0,44
21
<2
1,48
0,43
Ionescu–Shiley Standard Pericardial 27
<3
2,35
0,41
Medtronic Mosaic Porcine
29
<3
3,15
0,48
27
<2
2,81
0,49
25
<2
2,11
0,43
23
<2
1,74
0,42
21
<1
1,54
0,44
CarboMedics Mitroflow Pericardial 29
<4
3,71
0,56
23
<3
2,12
0,51
19
<2
1,34
0,47
Нестентированные
биопротезы
Medtronic Freestyle Porcine
27
<4
3,75
0,65
25
<4
3,41
0,69
23
<3
2,69
0,65
21
<2
2,17
0,63
19
<2
1,84
0,65
* ЧСС 70 уд/мин; сердечный выброс 5 л/мин; артериальное давление 120/80 мм рт. ст.
† Вычислена по уравнению 23.24.
EOA — эффективная площадь отверстия; ИП — индекс производительности.
ТАБЛИЦА 23.2
окончание
Данные гемодинамики in vitro для протезов аортальных клапановa
типа, а на рис. 23.18 (далее в главе) приведены при-
меры основных конструкций транскатетерных кла-
панов, используемых в Соединенных Штатах и Ев-
ропе.
Несмотря на значительный прогресс в создании
протезов с использованием новых материалов и
совершенствованием физиологических свойств
конструкций клапанов, остается несколько про-
блем, которые присущи протезам. Существующие
проблемы связаны с гемодинамикой клапанов или
локальной механикой жидкости, включают (1)
тромбоз и тромбоэмболию, (2) гемолиз, (3) на-
растание тканей, (4) повреждение эндотелия и (5)
регургитацию. Наличие больших напряжений
сдвига может привести к повреждению формен-
ных элементов крови, активации тромбоцитов и
инициированию биохимических процессов, влия-
ющих на коагуляцию. Критическое повреждение
красных клеток крови происходит при напряже-
нии сдвига жидкости до 800 дин/см2 [38]. Однако
это может произойти и на более низких показате-
лях в диапазоне от 10 до 100 дин/см2 в присутствии
посторонних инородных поверхностей [39, 40].
Кроме того, было показано, что активация и по-
вреждение тромбоцитов проявляются при напря-
жении сдвига в пределах от 100 до 500 дин/см2 [41].
Время контакта клеток крови с инородной поверх-
ностью выступает существенным фактором при
In-23_для нас.indd 562
03.04.2019 12:01:20
563
23 Гемодинамика протезированных клапанов сердца
Тип клапана
Клапан
Размер Объем регургитации (мл/уд) EOA (см2)† ИП
Шарикового типа
Starr–Edwards 1260
30
1,99
0,28
28
1,66
0,27
26
1,56
0,29
Наклонный тип
Bjo
rk–Shiley Standard
31
3,40
0,45
29
6,7
2,79
0,42
25
2,15
0,44
Bjo
rk–Shiley Convexo-concave
29
10,1
2,96
0,45
27
8,3
2,28
0,40
25
2,03
0,41
Medtronic–Hall
31
10,0
3,53
0,47
29
10,0
3,53
0,53
27
8,9
2,73
0,47
25
7,2
2,23
0,45
Двухстворчатый
St. Jude Medical Standard
31
13,1
3,67
0,48
29
10,9
3,40
0,51
27
9,7
2,81
0,49
Стентированный биопротез
Hancock Porcine 342
35
<4
2,72
0,28
33
<4
2,54
0,30
31
<4
2,36
0,31
29
<4
2,11
0,32
27
<2
1,77
0,31
25
<2
1,63
0,33
Hancock II Porcine
33
<4
2,66
0,31
31
<3
2,29
0,30
29
<3
2,05
0,31
27
<2
1,78
0,31
25
<2
1,59
0,32
Carpentier–Edwards Porcine 6650 27
<2
2,03
0,35
Carpentier–Edwards Porcine 6900 27
<2
2,68
0,47
Carpentier–Edwards Porcine 6625 31
<4
2,58
0,39
Edwards SAV
33
1,60
31
1,58
29
1,56
27
1,32
25
1,20
Edwards Perimount
33
2,80
31
2,76
29
2,70
27
1,92
25
1,76
Ionescu–Shiley Standard
Pericardial
31
<5
3,00
0,40
27
<2
1,77
0,31
ТАБЛИЦА 23.3 Данные гемодинамики in vitro для протезов митральных клапанов*
In-23_для нас.indd 563
03.04.2019 12:01:21
564
ЧАСТЬ IV Пороки клапанов сердца
Тип клапана
Клапан
Размер Объем регургитации (мл/уд) EOA (см2)† ИП
25
<2
1,61
0,33
Mosaic Porcine
33
<4
2,38
0,28
31
<3
2,26
0,30
29
<3
2,02
0,31
27
<2
1,71
0,30
25
<2
1,55
0,32
St. Jude Biocor Pericardial
31
2,53
29
1,48
33
2,04
29
1,96
Нестентированный биопротез Mitral Valve Allograft£
25
3,38
0,69
23
1,80
0,43
* ЧСС 70 уд/мин; сердечный выброс 5 л/мин.
† Вычислена по уравнению 23.24.
£ Оценку in vitro проводили при 5 л/мин.
EOA — эффективная площадь отверстия; ИП — индекс производительности; н/д — нет данных.
ТАБЛИЦА 23.3
окончание
Данные гемодинамики in vitro для протезов митральных клапанов*
определении критического уровня сдвига напря-
жения. Кроме этого, наличие разделений потока и
областей стагнации образуют локальные зоны,
которые способствуют росту тромбообразования,
паннусных тканей [42].
Изучение механики жидкости на протезах про-
водится in vitro при помощи различных тестов,
включающих в себя моделирование перепадов дав-
ления, объемов регургитации (закрытия и утечки),
полей дистальной и проксимальной скорости, а
также турбулентных мест. Взаимосвязь между меха-
никой жидкости и развитием специфических ос-
ложнений при протезировании изучается более
двух десятков лет многими исследователями. Ис-
следования in vitro сконцентрированы на количе-
ственном определении локальных уровней напря-
жения сдвига жидкости при помощи методов изме-
рения потока, таких как лазерной допплеровской
анемометрии и ультразвуковой велосиметрии. Та-
бл. 23.1 отражает уровни пиковой скорости и на-
пряжения сдвига турбулентного тока на моделях
27 мм аортальных протезов при их клиническом
применении, а эффективные показатели площади и
показатели производительности для таких клапа-
нов представлены в табл. 23.2, 23.3 .
В данном разделе описывается механика жидко-
сти в зависимости от конструкции протезов клапа-
нов сердца. Сюда не включено сравнение многих
конструкций протезов, однако их можно найти от-
дельно по каждому производителю. Описаны анте-
градные и ретроградные поля потоков. Все характе-
ристики потоков исследованы в эксперименте in vitro
в нашей лаборатории (если не указано другое). В
большинстве случаев данные были получены при
помощи аортальных протезов размерами 25 и 27 мм,
которые проверялись в физиологических условиях
пульсирующего потока с сердечным выбросом от 5,0
до 6,0 д/мин и частотой сердечных сокращений 70 уд/
мин. Для каждого случая приведены точные условия
эксперимента (размер клапана, сердечный выброс,
частота сердечных сокращений, давление).
МЕХАНИЧЕСКИЕ ПРОТЕЗЫ КЛАПАНОВ
Существует три основных вида механических кла-
панов — дисковые, двухстворчатые и шариковые.
Эти клапаны отличаются главным образом типом и
функцией запирающего устройства. Хоть каждая из
конструкций по-своему влияет на механику клапа-
нов, все три вида имеют общие характеристики
потока, а именно четко визуализируемые прямые
потоки наряду с турбулентными завихрениями. На
данный момент наиболее широко используемыми
механическими протезами выступают двухстворча-
тые и дисковые. Характеристики антеградного по-
тока и регургитации для этих механических проте-
зов приведены в табл. 23.4.
БИОЛОГИЧЕСКИЕ ПРОТЕЗЫ КЛАПАНОВ
На данный момент существует три основных вида
тканевых клапанов, которые представляю собой
каркасный либо бескаркасный ксенотрансплантат,
либо гомографт. В основном эти клапаны отлича-
ются типом и структурой. Тканевые клапаны менее
тромбогенны по сравнению с механическими кла-
панами и поэтому не требуют приема антикоагу-
лянтной терапии. Однако эти клапаны подвержены
In-23_для нас.indd 564
03.04.2019 12:01:21
565
23 Гемодинамика протезированных клапанов сердца
Клапан
Характеристика
Антеградный поток
Нормальный поток
регургитации
Ориентация
Наклонный тип Состоит из кругового
закрывающего диска,
который может вра-
щаться вокруг оси
(см. рис. 23.10A).
Металлические рас-
порки используются
для крепления диска
внутри корпуса
клапана. Как правило,
диск открывается на
60–80° относительно
кольца
В клапане имеется два
отверстия по обе
стороны диска. Струя
через главное отверстие
полукруглая по сечению,
с пиковой систолической
скоростью около 2 м/сек
в аортальной позиции.
Если опорная стойка
перекрывает второсте-
пенное отверстие
(клапаны Bjo
rk–Shiley и
Medtronic Hall), то отме-
чаются две струи потока.
Если имеются две
стойки, то отмечается
три струи; если нет
стойки (Omni Carbon
valve), то будет одна
струя. Скорость потока
составляет 30–40% от
основной скоростей кро-
вотока (рис. 23.11)
В норме отмечается
низкий поток
регургитации из-за
небольшого объема
закрытия
В митральной позиции пред-
почтительна ориентация
протеза с наклоном дисков к
свободной стенке левого
желудочка, а не к перего-
родке [43] для того, чтобы
минимизировать изменение
скорости и турбулентность
внутри желудочков. В аор-
тальной позиции предпоч-
тительной ориентацией
является расположение
основного отверстия к
правой задней стенке аорты.
Было выявлено, что эта
ориентация минимизирует
турбулентность и потери
энергии [44, 45]
Двухстворчатый
клапан
Состоит из двух
створок, обычно изго-
товленных из пиро-
литического углерода,
которые на шарнирах
прикреплены к
корпусу клапана (см.
рис. 23.10Б). Створки
разделяют поток на
три части, два основ-
ных боковых отвер-
стия и центральное
вспомогательное
отверстие. Снижение
давления и эффектив-
ная площадь отвер-
стия сопоставимы с
дисковыми
клапанами.
Угол раскрытия
створок варьирует
между 75–90°
Из отверстия выходят три
струи (рис. 23.12, 23.14).
В большинстве клапанов
через боковые отверстия
проходит больший
объем потока.
Напряжение сдвига на
клапане St. Jude Medical
ниже по течению пред-
ставлено на рис. 23 .14
[46]. Большая часть
напряжения сдвига воз-
никает непосредственно
за створками из-за
неравномерной скорости
потока между централь-
ным и боковым отвер-
стиями. Анализ напря-
жения Рейнольдса
показал напряжение
сдвига в той же области
(см. рис. 23 .14Б)
Конструкция двух-
створчатых клапа-
нов допускает
больший объем
регургитации, чем
при дисковых про-
тезах. Потоки
регургитации воз-
никают в основном
через шарниры
(рис. 23 .13, 23.16) и
сохраняется в диа-
столу. Также неко-
торые потоки
имеются между
створками.
Исследования пока-
зали, что потоки
через шарнирный
механизм вносят
основной вклад в
тромбоз [47]. Поток
регургитации
составляет 2–3 м/сек
с высоким напряже-
нием сдвига 3000
дин/см2 (см. рис.
23.13) [48, 49]. На
данный момент
имеются несколько
вариантов кон-
струкции шарнир-
ных механизмов,
которые представ-
лены на рис. 23.15
[47, 50–53]
В митральной позиции отме-
чаются две возможные ори-
ентации, которые соответ-
ствуют «анатомической» —
перпендикулярно между
отточной частью в аорту и
митральному притоку, и
«антианатомической», при
которой зазор между створ-
ками параллелен аорто-ми -
тральному контакту.
Исследования in vitro пока-
зали, что антианатомическое
положение приводит к
появлению диастолического
потока, который направлен
в выходной тракт желу-
дочка, тогда как при анато-
мической ориентации
клапана диастолический
поток возвращается к
клапану
В положении аорты Travis с
коллегами [44] выявили, что
при ориентации открытых
створок по направлению
проксимально
Минимизируется потеря
энергии, тогда как Kleine и
коллеги [45] обнаружили,
что турбулентность, созда-
ваемая на клапане, была
минимальной при ориента-
ции бокового отверстия к
правой задней стенке аорты
ТАБЛИЦА 23.4 Типы механических клапанов, их функция и механика жидкости
In-23_для нас.indd 565
03.04.2019 12:01:21
566 ЧАСТЬ IV Пороки клапанов сердца
Клапан
Характеристика
Антеградный поток
Нормальный поток
регургитации
Снижение давления
Каркасный
ксенографт
Наиболее распространен-
ный тип клапана,
который состоит из трех
биологических створок,
полученных из клапана
аорты свиньи или
бычьего перикарда,
и установленных на
металлическом или
полимерном стентиро-
ванном кольце. Для фик-
сации биологического
материала используются
различные методы
Все свиные каркасные клапаны
слегка маломерны в больших
размерах. Для всех клапанов
характерно наличие цен-
тральной большой струи
(рис. 23 .17). Клапаны нового
поколения имеют более
плоские профили скорости,
чем предыдущие модели
Объем регургитации
составляет приблизи-
тельно 1 мл/уд в боль-
шинстве каркасных
клапанов. В основном
регургитация отсут-
ствует, а наличие
дополнительных
потоков указывает на
некомпетентность
клапана или на его
нарушение
Новое поколение
перикардиальных
клапанов имеет
перепад давления,
аналогичный диско-
вым клапанам
Бескаркасный
ксенографт
Свиные, бычьи и лошади-
ные ксенографты не
имеют в своей структуре
жестких стентов из-за
сложности конструкции.
Оптимальная произво-
дительность зависит от
геометрии анатомии
пациента и размера
клапана
Поток имеет равномерное
ускорение на протяжении
всего клапана, ниже по
потоку скорость имеет
плоский профиль [54]. Также
для этих клапанов нехарак-
терно наличие потока с
высоким градиентом, в
отличие от каркасных
протезов
Бескаркасные клапаны
имеют сопоставимые
объемы закрытия с
каркасными при
одних и тех же усло-
виях потока. Функция
митральных ксено-
графтов напрямую
зависит от метода
имплантации
Отсутствие стентов и
манжет позволяет
имплантировать
большие размеры
клапанов при одина-
ковом размере
аорты. Таким
образом, перепад
давления аналогичен
механическим про-
тезам [54–56]
Гомографт
Криоконсервированные
клапаны человека
использовались более
двух десятилетий в аор-
тальной позиции.
Аортальные гомографы
обычно имплантируются
в виде всего корня, тогда
как митральные гомо-
графы имплантируются
лишь в виде створок
с подшиванием их
к нативным папилляр-
ным мышцам
Как и при нативных клапанах,
пиковая скорость немного
выше при уменьшенной
эффективной площади
отверстия, что обусловлено
меньшей площадью выход-
ного тракта
В норме определяются
лишь небольшие
объемы закрытия.
Гемодинамика
митральных гомогра-
фов имеет прямую
зависимость от
способа их импланта-
ции. Например, пра-
вильное позициони-
рование папиллярных
мышц позволяет пол-
ностью устранить
регургитацию
Имеет более низкий
перепад давления и
меньшую эффек-
тивную площадь
отверстия, чем в
механических и кар-
касных клапанах
ТАБЛИЦА 23.5 Типы биологических протезов клапанов, их функция и механика жидкости
кальцификации створок и износу материала, что
приводит к разрушению клапана из-за возникнове-
ния разрывов. Кальцификация ткани часто предше-
ствует разрыву створок. Все конструкции биопроте-
зов обладают гибкостью, имеют одно отверстие без
центральной регургитации в норме. Антеградный
поток, регургитация и характеристика снижения
давления для каждого типа клапана приведены в
табл. 23.5 .
ТРАНСКАТЕТЕРНЫЕ КЛАПАНЫ
Новым дополнением в протезировании клапанов
сердца выступают транскатетерные методы им-
плантации. Транскатетерный клапан представляет
собой биологический аортальный протез на стенте
в закрытом состоянии, который можно завести в
сердце при помощи доставочной системы. Данные
клапаны начали применять для пациентов с высо-
ким риском, например у пожилых людей либо стра-
Аорта: Medtronic–Hall
200
100
0
Скорость в см/сек
Аорта: Medtronic–Hall
200
100
0
200
100
0
Скорость в см/сек
Рис. 23.11 Область антеградного потока. Профиль скорости ниже по те-
чению от 27 мм двухстворчатого клапана Medtronic–Hall в пик систолы.
(А) Осевая линия на 15 мм ниже по течению и (Б) горизонтальная линия через
боковые отверстия 13 мм вниз по течению.
А
Б
In-23_для нас.indd 566
03.04.2019 12:01:21
567
23 Гемодинамика протезированных клапанов сердца
дающих диабетом, у которых гораздо меньше шан-
сов выжить при замене клапана на открытой опера-
ции. Транскатетерные методы позволяют избежать
остановки сердца, искусственного кровообращения,
снизить продолжительность процедуры, тем самым
снизив риски. Несмотря на то, что транскатетерная
имплантация клапанов показала более худшие ре-
зультаты в сравнении с традиционным хирургиче-
ским протезированием, но данный метод лучше,
чем другие доступные варианты [57].
Доступ для имплантации осуществляется через
бедренную артерию либо пункционно через вер-
хушку сердца. В первом случае катетер заводят че-
рез бедренную артерию к аорте, во втором случае,
протез вводят непосредственно в полость левого
желудочка. При наличии кальцификации клапана
вначале выполняют баллонную пластику для его
раскрытия. Затем производят установку клапана
путем раздутия второго баллона. На данный мо-
мент существует несколько видов конструкций
транскатетерных клапанов, как показано на рис.
23.18. Ведущими моделями, которые в настоящее
время одобрены для клинического использования в
США Управлением по контролю за продуктами и
лекарствами являются клапаны Edwards Sapien XT и
Medtronic CoreValve. Также имеются два других ве-
дущих проекта, которые в настоящее время прохо-
дят клинические испытания — это клапан Boston
Scientific Lotus и клапан St. Iude Medical Portico.
Клапан Sapien XT представляет собой трехстворча-
тый клапан из бычьего перикарда, установленный
на каркасе из нержавеющей стали или кобальта-хро-
ма. CoreValve представляет собой трехстворчатый
Аорта: St. Jude
200
100
0
Скорость в см/сек
Аорта: St. Jude
200
100
0
Скорость в см/сек
Рис. 23.12 Область антеградного потока. Профиль скорости ниже по те-
чению от 27 мм двухстворчатого клапана St. Jude Medical в пик систолы.
(А) Осевая линия на 13 мм ниже по течению и (Б) горизонтальная линия через
боковые отверстия 13 мм вниз по течению.
А
Б
Плоский уровень
Дно кармана
шарнира
Выход
потока
1 м/с
Антеградный
поток
Антеградный
поток
С
е
р
е
д
и
н
а
с
и
с
т
о
л
ы
С
е
р
е
д
и
н
а
д
и
а
с
т
о
л
ы
Внешняя сторона
кармана шарнира
δ
φ
ε
Дно кармана
шарнира
6115
5030
2215
2930
1330
2300
4865
3430
Вход
потока
Рис. 23.13 Область ретроградного потока. (A) Поля потока на различном
уровне двухстворчатого механического клапана в фазе обратного тока жидко-
сти. (Б) Напряжение сдвига в различных местах около шарниров, которое
получено при помощи гидродинамического моделирования в динамике [66].
А
Б
VSmax
CFD, 3D
RSmax
123
20 80 140
260
200
Рис. 23.14 Область антеградного потока. (А) Напряжения сдвига вязкости крови ниже по течению от механического двухстворчатого клапана за единицу
времени в N/м2, полученное при помощи трехмерного моделирования текучей среды в динамике. (Б) Напряжение сдвига турбулентного потока ниже по течению
от механического двухстворчатого клапана за единицу времени в N/м2, полученных при помощи экспериментальной системы [46].
А
Б
In-23_для нас.indd 567
03.04.2019 12:01:21
568 ЧАСТЬ IV Пороки клапанов сердца
Вид сверху
Вид сверху
Вид сверху
Вид сверху
Вид сверху
Область шарнира
Вид сбоку
Вид сбоку
Вид сбоку
Вид сбоку
Вид сбоку
Фаза антеградного потока
Антеградный поток
Антеградный поток
Фаза обратного потока
Реверсивный поток
St. Jude Medical
Carbomedics
Створка
Створка
Створка
Створка
Створка
Створка
Створка
Створка
Шарнир
Карман
Шарнир
Карман
Шарнир
Карман
Шарнир
Карман
Высокая
скорость
Структура
вихревого потока
Низкая скорость
Обратные потоки
Обратные потоки
Область
замедленного
потока
Область
замедленного потока
Область
рециркуляции
Peg
регургитация
Рельеф
Medtronic Parallel
Medtronic Advantage
Столкновение
двух завихрений
Спиральный поток
Разделение потока
Низкая
скорость
Обратные
потоки
Сниженный
поток
Ускоренный
поток
Вторичный
уровень
Базовый уровень
Рис. 23.15 Область ретроградного потока. Характеристики потока на шарнирах в различных двухстворчатых механических клапанов сердца [47, 50–53].
In-23_для нас.indd 568
03.04.2019 12:01:21
569
23 Гемодинамика протезированных клапанов сердца
Аорта: С-Е перикардиальный клапан
200
00
0
Скорость в см/сек
Рис. 23.17 Поле антеградного потока. Профиль центральной скорости на
17 мм ниже по потоку 27 мм перикардиального клапана Carpentier–Edwards в
пик систолы.
На момент публикации книги, в США в настоя-
щее время одобрено только два клапана для клини-
ческого применения. Несмотря на динамическое
развитие технологий, в сообществах существует
значительная обеспокоенность по поводу долговеч-
ности транскатетерных устройств по сравнению с
хирургически имплантированными протезами кла-
панов. Недавние исследования также сообщают о
случаях тромбоза створок, что приводит к умень-
шению их подвижности [58, 59].
ОБЛАСТИ АНТЕГРАДНОГО ПОТОКА
Испытания на стенде транскатетерных клапанов
показали, что они имеют EOA около 1,8 см2 и сред-
ний градиент давления 8,3 мм рт. ст., что сопоста-
вимо с каркасными биопротезами [22]. В клиниче-
ских испытаниях показано, что EOA клапанов со-
ставляет от 1,5 до 1,8 см2 с градиентом давления
около 10 мм рт. ст. [60, 61] Поле антеградной скоро-
сти в пик систолы на транскатетерном клапане,
аналогичное Medtronic CoreValve, что отражено на
рис. 23.19 при двух разных условиях работы сердца
и в зависимости от двух разных уровней позицио-
нирования транскатетерного клапана [62].
НОРМАЛЬНЫЙ ПОТОК РЕГУРГИТАЦИИ
В отличие от биологических протезов, регургитация
на транскатетерных клапанах очень распространена.
Легкая и умеренная степень регургитации наблюда-
ется более чем в 50% случаев, а тяжелая степень ре-
гургитации отмечена в 5% случаев [60, 61, 63, 64]. В
основном случае наблюдается околоклапанная ре-
гургитация, потоки которой проходят между карка-
сом клапана и нативными тканями, а не через непо-
средственное отверстие. Поскольку имплантируе-
мый клапан просто прижимается к нативным тканям
давлением, создаваемым стентом, то полное приле-
гание стенки с каркасом не может быть достигнуто
в большинстве случаев, особенно если нативный
аортальный клапан сильно кальцифицирован и
клапан из свиного перикарда, который установлен
на нитиноловом каркасе. Профиль стента CoreValve
длиннее, чем у клапана Sapien XT, поскольку он при
имплантации располагается более проксимально и
растягивается на дистальных участках для закрепле-
ния в восходящей аорте. Boston Scientific Lotus так-
же представляет собой трехстворчатый клапан из
бычьего перикарда на плетеном каркасе из нитино-
ла. Это первый транскатетерный клапан, который
можно имплантировать, а затем собрать его назад
при необходимости. Клапан St.Jude Medical Portico
также представляет собой трехстворчатый клапан
из бычьего перикарда на каркасе из нитинола, кото-
рый похож по геометрии на CoreValve. Этот клапан
также можно репозиционировать.
Рис. 23.16 Область потока при эхокардиографии. (А) Антеградный поток. Двухмерное цветовое допплеровское картирование кровотока двухстворчатого
протеза в физиологических условиях при пульсирующем потоке. (Б) Ретроградный поток. Двухмерное цветовое допплеровское картирование кровотока двух-
створчатого протеза в физиологических условиях при пульсирующем потоке.
А
Б
In-23_для нас.indd 569
03.04.2019 12:01:21
570
ЧАСТЬ IV Пороки клапанов сердца
представляет собой очень неровную поверхность
для транскатетерного клапана. Околоклапанная ре-
гургитация может вызывать сильное напряжение
сдвига и приводить к образованию сгустков, что
может объяснить высокую частоту сосудистых ос-
ложнений (от 10 до 15% случаев) [61, 65].
ПЕРСПЕКТИВЫ
Исследования протезов клапанов сердца будут раз-
виваться по нескольким курсам в будущем: разра-
ботка полимерных протезов, создание клапанов
при помощи генной инженерии, разработка новых
методов фиксации биологических тканей, совер-
шенствование конструкций и материалов механи-
ческих клапанов, улучшение технологии транскате-
терной имплантации (устройств для доставки си-
стем и самой конструкции клапанов).
Полимерные клапаны могут стать хорошей аль-
тернативной вместо биологических и механических
протезов с низкой склонностью к кальцификации и
образованию тромбов. Также не исключено разви-
тие генной инженерии, которая позволит выращи-
вать живые клапаны аорты в лаборатории с исполь-
зованием собственных клеток и тканей пациента.
Потенциальные преимущества данного метода за-
ключаются в отсутствии реакции отторжения, ана-
логичной гемодинамической функции, что приве-
дет к более длительному сроку службы. На данный
момент ксенотрансплантаты фиксируются в глута-
ральдегиде, который делает ткани более жесткими,
препятствуя нормальной гемодинамике.
Создание новых методов фиксации может улуч-
шить гемодинамические свойства тканей, увели-
чить долговечность и функциональный срок служ-
бы ксенотрансплантатов. В отношении механиче-
ских клапанов, основное внимание будет уделяться
снижению тромбогенности. Это можно будет до-
стигнуть путем разработки биосовместимых по-
крытий и материалов на основе нанотехнологий, а
также улучшения геометрии клапана для уменьше-
ния регургитации на протезах. Первым шагом в
данном исследовании будет улучшение понима-
ния повреждения элементов крови, активации
тромбоцитов и формирования тромбов.
Несмотря на то, что транскатетерные методы
имплантации клапанов обеспечивают проведение
процедуры миниинвазивным способом, существу-
ет множество проблем с долговечностью протезов,
околоклапанной утечкой, тромбоэмболическими
осложнениями, включая инсульты. В настоящее
время они предназначены для использования у па-
Рис. 23.18 Типы конструкций транскатетерных протезов. Основные конструкции транскатетерных протезов, одобренных Управлением по контролю за
продуктами и медикаментами США (А, Б) и проходящих клинические испытания (В, Г). (A) The Edwards Sapien XT. (Б) The Medtronic CoreValve. (В) The Boston
Scientific Lotus valve. (Г) The St Jude Medical Portico valve.
А
Б
В
Г
In-23_для нас.indd 570
03.04.2019 12:01:22
571
23 Гемодинамика протезированных клапанов сердца
Контрольное изображение
Сердечный выброс
5 л/мин
Сердечный выброс
2,5 л/мин
Подклапанная позиция
Надклапанная позиция
Рис. 23.19 Поля антеградного потока в транскатетерных протезах. Поля скорости движения частиц потока во время пика систолы. Пунктирные линии
отображают скорость, равную 0,5 м/сек и указывают на степень систолического потока. Белые круги указывают на завихрения потока, а стрелки — направление
вращения [Kumar G, Raghav V, Lerakis S, et al. High transcatheter valve replacement may reduce washout in the aortic sinuses: an in-vitro study, J Heart Valve Dis
24:22–29, 2015].
циентов с высоким хирургическим риском, т.к. еще
не имеется доказательной базы использования дан-
ных клапанов у хирургических пациентов с низким
риском. Будущее развитие технологии позволит
расширить их применение у пациентов из группы
низкого риска. Также в настоящее время ведутся
исследования и разработки по развитию транскате-
терных митральных и трехстворчатых клапанов.
БЛАГОДАРНОСТЬ
Исследования протезов клапанов сердца были вы-
полнены на базе нашей лаборатории сердечно-сосу-
дистой гидродинамики в Georgia Tech с поддержкой
грантами Управления по контролю за продуктами и
лекарствами, Американской ассоциации сердца, ин-
дустрии клапанов сердца и благодаря пожертвовани-
ям Tom и Shirley Gurley, the Lilla Boz Foundation.
Использование принципа сохранения массы по отношению к контрольному объему позволяет вычислить скорости потока,
площадь поверхности объема на основе измеряемых величин
Механическая энергия на единицу объема представляет собой работу, которая приводит кровоток в движение
Давление — одна из форм механической энергии наряду и с другими (кинетической и гравитационной). Каждая из форм
может свободно быть преобразована в другую без потерь. Потери давления и потери механической энергии на единицу
объема не эквивалентны, т.к. давление может восстановиться после его падения
Эффективными методами по снижению потерь механической энергии в циркуляции включает в себя постепенное обеспечение
расширения потока, отсутствие изгибов и углов на пути прохождения потока, а также увеличение радиуса сосуда
Допплеровские градиенты измеряются путем преобразования давления в кинетическую энергию при прохождении через
протез клапана. Он не обеспечивает измерение механической потери энергии, хоть оно тесно связано с ним
Эффективная площадь отверстия протеза клапана представляет собой площадь поперечного сечения потока в месте его наи-
меньшего сжатия. Он равен либо меньше площади анатомического отверстия
Потери механической энергии происходят из-за наличия регургитационного потока. Потери энергии при регургитации
намного больше, чем при обычном потоке, особенно в механических протезах митрального клапана
СВОДНАЯ ИНФОРМАЦИЯ
Динамика жидкости на протезах клапанов сердца
In-23_для нас.indd 571
03.04.2019 12:01:22
572
ЧАСТЬ IV Пороки клапанов сердца
ЛИТЕРАТУРА
1. Yap CH, Dasi LP, Yoganathan AP. Dynamic
hemodynamic energy loss in normal and
stenosed aortic valves, J Biomech Eng
132:021005, 2010.
2. Batchelor G. An introduction to f luid mechanics,
Cambridge, 1994, Cambridge University Press.
3. Blevins R. Applied f luid dynamics handbook,
New York, 1984, Van Nostrand Reinhold
Company.
4. McNaughton KJ, Sinclair CG. Submerged jets
in short cylindrical flow vessels, J Fluid Mech
25:367–375, 1966.
5. Nerem RM, Seed WA. An in vivo study of
aortic flow disturbances, Cardiovasc Res 6:1–
14, 1972.
6. Stewart SF, Herman BA, Nell DM, Retta SM.
Effects of valve characteristics on the accu-
racy of the Bernoulli equation: a survey of
data submitted to the U.S. FDA, J Heart Valve
Dis 13:461–466, 2004.
7. Knebel F, Gliech V, Walde T, et al. High con-
cordance of invasive and echocardiographic
mean pressure gradients in patients with a
mechanical aortic valve prosthesis, J Heart
Valve Dis 14:332–337, 2005.
8. Stewart WJ, Jiang L, Mich R, et al. Variable
effects of changes in flow rate through the
aortic, pulmonary and mitral valves on valve
area and flow velocity: impact on quantitative
Doppler flow calculations, J Am Coll Cardiol
6:653–662, 1985.
9. Burwash IG, Pearlman AS, Kraft CD, et al.
Flow dependence of measures of aortic steno-
sis severity during exercise, J Am Coll Cardiol
24:1342–1350, 1994.
10. DeGroff CG, Shandas R, Valdes-Cruz L.
Analysis of the effect of flow rate on the
Doppler continuity equation for stenotic ori-
fice area calculations: a numerical study,
Circulation 97:1597–1605, 1998.
11. Garcia D, Pibarot P, Landry C, et al. Estima-
tion of aortic valve effective orifice area by
Doppler echocardiography: effects of valve
inflow shape and flow rate, J Am Soc Echocar-
diogr 17:756–765, 2004.
12. Gorlin R, Gorlin SG. Hydraulic formula for
calculation of the area of the stenotic mitral
valve, other cardiac valves, and central circu-
latory shunts, I. Am Heart J 41:1–29, 1951.
13. Fagard R, Conway J. Measurement of cardiac
output: Fick principle using catheterization,
Eur Heart J 11(Suppl I):1–5, 1990.
14. Scotten LN, Walker DK, Dutton JW. Modi-
fied gorlin equation for the diagnosis of
mixed aortic valve pathology, J Heart Valve
Dis 11:360–368, 2002. discussion 368.
15. Yoganathan AP, He Z, Casey Jones S. Fluid
mechanics of heart valves, Annu Rev Biomed
Eng 6:331–362, 2004.
16. Struber M, Campbell A, Richard G, Laas J.
Hydrodynamic function of tilting disc pros-
theses and bileaflet valves in double valve
replacement, Eur J Cardiothorac Surg 10:422–
427, 1996.
17. Recusani F, Bargiggia GS, Yoganathan AP, et
al. A new method for quantification of regur-
gitant flow rate using color Doppler flow
imaging of the flow convergence region
proximal to a discrete orifice. An in vitro
study, Circulation 83:594–604, 1991.
18. Utsunomiya T, Doshi R, Patel D, et al. Regur-
gitant volume estimation in patients with
mitral regurgitation: initial studies using color
Doppler “proximal isovelocity surface area”
method, Echocardiography 9:63–70, 1992.
19. Utsunomiya T, Ogawa T, Doshi R, et al. Dop-
pler color flow “proximal isovelocity surface
area” method for estimating volume flow
rate: effects of orifice shape and machine fac-
tors, J Am Coll Cardiol 17:1103–1111, 1991.
20. Utsunomiya T, Ogawa T, Tang HA, et al.
Doppler color flow mapping of the proximal
isovelocity surface area: a new method for
measuring volume flow rate across a nar-
rowed orifice, J Am Soc Echocardiogr 4:338–
348, 1991.
21. Heinrich RS, Fontaine AA, Grimes RY, et al.
Experimental analysis of fluid mechanical
energy losses in aortic valve stenosis: impor-
tance of pressure recovery, Ann Biomed Eng
24:685–694, 1996.
22. Azadani AN, Jaussaud N, Matthews PB, et al.
Energy loss due to paravalvular leak with
transcatheter aortic valve implantation, Ann
Thorac Surg 88:1857–1863, 2009.
23. Dasi LP, Pekkan K, de Zelicourt D, et al. He-
modynamic energy dissipation in the cardio-
vascular system: generalized theoretical anal-
ysis on disease states, Ann Biomed Eng
37:661–673, 2009.
24. Akins CW, Travis B, Yoganathan AP. Energy
loss for evaluating heart valve performance, J
Thorac Cardiovasc Surg 136:820–833, 2008.
25. Garcia D, Pibarot P, Dumesnil JG, et al. As-
sessment of aortic valve stenosis severity: A
new index based on the energy loss concept,
Circulation 101:765–771, 2000.
26. Garcia D, Jean GD, Louis-Gilles D, et al. Dis-
crepancies between catheter and Doppler es-
timates of valve effective orifice area can be
predicted from the pressure recovery phe-
nomenon: practical implications with regard
to quantification of aortic stenosis severity, J
Am Coll Cardiol 41:435–442, 2003.
27. Dumesnil JG, Yoganathan AP. Valve prosthe-
sis hemodynamics and the problem of high
transprosthetic pressure gradients, Eur J Car-
diothorac Surg 6(Suppl 1):S34–S37, 1992.
discussion S38.
28. Pibarot P, Dumesnil JG. Hemodynamic and
clinical impact of prosthesis-patient mis-
match in the aortic valve position and its
prevention, J Am Coll Cardiol 36:1131–1141,
2000.
29. Paulsen PK, Hasenkam JM. Three-dimen-
sional visualization of velocity profiles in the
ascending aorta in dogs, measured with a hot-
film anemometer, J Biomech 16:201–210,
1983.
30. Paulsen PK. Use of a hot-film anemometer
system for cardiovascular studies, with special
reference to the ascending aorta, Dan Med
Bull 36:430–443, 1989.
31. Rossvoll O, Samstad S, Torp HG, et al. The
velocity distribution in the aortic anulus in
normal subjects: a quantitative analysis of
two-dimensional Doppler flow maps, J Am
Soc Echocardiogr 4:367–378, 1991.
32. Kilner PJ, Yang GZ, Mohiaddin RH, et al.
Helical and retrograde secondary flow pat-
terns in the aortic arch studied by three-direc-
tional magnetic resonance velocity mapping,
Circulation 88(5 Pt 1):2235–2247, 1993.
33. Bellhouse B, Bellhouse F. Fluid mechanics of
model normal and stenosed aortic valves, Circ
Res 25:693–704, 1969.
34. Bellhouse BJ. Velocity and pressure distribu-
tions in the aortic valve, J Fluid Mech 37:587–
600, 1969.
35. Reul H, Talukder N. Heart valve mechanics.
In Hwang NHC, Gross DR, Patel DJ, editors:
Quantitative cardiovascular studies, clinical
and research applications of engineering
principles, Baltimore, 1979, University Park
Press, pp 527–564.
36. Kim WY, Bisgaard T, Nielsen SL, et al. Two-
dimensional mitral flow velocity profiles in pig
models using epicardial Doppler echocardiog-
raphy, J Am Coll Cardiol 24:532–545, 1994.
37. Reul H, Talukder N, Muller EW. Fluid me-
chanics of the natural mitral valve, J Biomech
14:361–372, 1981.
38. Lu PC, Lai HC, Liu JS. A reevaluation and
discussion on the threshold limit for hemoly-
sis in a turbulent shear flow, J Biomech
34:1361–1364, 2001.
39. Mohandas N, Hochmuth RM, Spaeth EE.
Adhesion of red cells to foreign surfaces in
the presence of flow, J Biomed Mater Res
8:119–136, 1974.
40. Blackshear PL. Hemolysis at prosthetic sur-
faces. In Hair MR, editor: Chemistry of bio-
surfaces, New York, 1972, Marcel Dekker, pp
523–561.
41. Klaus S, Korfer S, Mottaghy K, et al. In vitro
blood damage by high shear flow: human
versus porcine blood, Int J Artif Organs
25:306–312, 2002.
42. Yoganathan AP, Wick TM, Reul H. The influ-
ence of flow characteristics of prosthetic
heart valves on thrombus formation. In
Butchart EG, Bodnar W, editors: Current is-
sues in heart valve disease: thrombosis, embo-
lism and bleeding, London, 1992, ICR Pub-
lishers, pp 123–148.
43. Jones M, McMillan ST, Eidbo EE, et al. Evalua-
tion of prosthetic heart valves by Doppler flow
imaging, Echocardiography 3:513–525, 1986.
44. Travis BR, Heinrich RS, Ensley AE, et al. The
hemodynamic effects of mechanical pros-
thetic valve type and orientation on fluid
mechanical energy loss and pressure drop in
in vitro models of ventricular hypertrophy, J
Heart Valve Dis 7:345–354, 1998.
45. Kleine P, Perthel M, Nygaard H, et al.
Medtronic Hall versus St. Jude Medical me-
chanical aortic valve: downstream turbu-
lences with respect to rotation in pigs, J Heart
Valve Dis 7:548–555, 1998.
46. Ge L, Dasi LP, Sotiropoulos F, Yoganathan
AP. Characterization of hemodynamic forces
induced by mechanical heart valves: Reynolds
vs. viscous stresses, Ann Biomed Eng 36:276–
297, 2008.
47. Ellis JT, Travis BR, Yoganathan AP. An in vi-
tro study of the hinge and near-field forward
flow dynamics of the St. Jude Medical Regent
bileaflet mechanical heart valve, Ann Biomed
Eng 28:524–532, 2000.
48. Simon HA, Dasi LP, Leo HL, Yoganathan AP.
Spatio-temporal flow analysis in bileaflet
heart valve hinge regions: potential analysis
for blood element damage, Ann Biomed Eng
35:1333–1346, 2007.
49. Ellis JT, Healy TM, Fontaine AA, et al. An
in vitro investigation of the retrograde flow
fields of two bileaflet mechanical heart valves,
J Heart Valve Dis 5:600–606, 1996.
50. Saxena R, Lemmon J, Ellis J, Yoganathan A. An
in vitro assessment by means of laser Doppler
velocimetry of the Medtronic Advantage
bileaflet mechanical heart valve hinge flow, J
Thorac Cardiovasc Surg 126:90–98, 2003.
51. Leo HL, He Z, Ellis JT, Yoganathan AP. Micro-
flow fields in the hinge region of the Carbo-
Medics bileaflet mechanical heart valve design,
J Thorac Cardiovasc Surg 124:561–574, 2002.
52. Gross JM, Shu MC, Dai FF, et al. A micro-
structural flow analysis within a bileaflet
In-23_для нас.indd 572
03.04.2019 12:01:23
573
23 Гемодинамика протезированных клапанов сердца
mechanical heart valve hinge, J Heart Valve
Dis 5:581–590, 1996.
53. Ellis JT, Yoganathan AP. A comparison of the
hinge and near-hinge flow fields of the St
Jude medical hemodynamic plus and regent
bileaflet mechanical heart valves, J Thorac
Cardiovasc Surg 119:83–93, 2000.
54. Yoganathan AP, Eberhardt CE, Walker PG.
Hydrodynamic performance of the Medtron-
ic Freestyle Aortic Root Bioprosthesis, J Heart
Valve Dis 3:571–580, 1994.
55. Nagy ZL, Fisher J, Walker PG, Watterson KG.
The effect of sizing on the in vitro hydrody-
namic characteristics and leaflet motion of
the Toronto SPV stentless valve, J Thorac
Cardiovasc Surg 117:92–98, 1999.
56. Eriksson MJ, Brodin LA, Dellgren GN, Rade-
gran K. Rest and exercise hemodynamics of
an extended stentless aortic bioprosthesis, J
Heart Valve Dis 6:653–660, 1997.
57. Kapadia SR, Goel SS, Svensson L, et al. Char-
acterization and outcome of patients with
severe symptomatic aortic stenosis referred
for percutaneous aortic valve replacement, J
Thorac Cardiovasc Surg 137:1430–1435, 2009.
58. De Marchena E, Mesa J, Pomenti S, et al.
Thrombus Formation Following Transcathe-
ter Aortic Valve Replacement, JACC: Cardio-
vasc Interv 8:728–739, 2015.
59. Makkar RR, Fontana G, Jilaihawi H, et al.
Possible subclinical leaflet thrombosis in bio-
prosthetic aortic valves, N Eng J Med
373:2015–2024, 2015.
60. Webb JG, Pasupati S, Humphries K, et al. Per-
cutaneous transarterial aortic valve replace-
ment in selected high-risk patients with aortic
stenosis, Circulation 116:755–763, 2007.
61. Vahanian A, Alfieri O, Al-Attar N, et al.
Transcatheter valve implantation for patients
with aortic stenosis: a position statement
from the European Association of Cardio-
Thoracic Surgery (EACTS) and the European
Society of Cardiology (ESC), in collaboration
with the European Association of Percutane-
ous Cardiovascular Interventions (EAPCI),
Eur Heart J 29:1463–1470, 2008.
62. Kumar G, Raghav V, Lerakis S. High trans-
catheter valve replacement may reduce wash-
out in the aortic sinuses: an in-vitro study, J
Heart Valve Dis 24:22–29, 2015.
63. Clavel MA, Webb JG, Pibarot P, et al. Com-
parison of the hemodynamic performance of
percutaneous and surgical bioprostheses for
the treatment of severe aortic stenosis, J Am
Coll Cardiol 53:1883–1891, 2009.
64. Grube E, Buellesfeld L, Mueller R, et al. Prog-
ress and current status of percutaneous aortic
valve replacement: results of three device
generations of the CoreValve Revalving sys-
tem, Circ Cardiovasc Interv 1:167–175, 2008.
65. Vetter HO, Yoganathan AP, Fontaine AA, et
al. Hydrodynamic characteristics of a new
stentless mitral valve allograft: in vitro results.
In Leipschs D, editor: 3rd International Sym-
posium on Biofluid Mechanics, Munich,
1994, VDI, pp 287–294.
66. Simon HA, Ge L, Borazjani I, et al. Simulation
of the three-dimensional hinge flow fields of
a bileaflet mechanical heart valve under aortic
conditions, Ann Biomed Eng 38:841–853,
2010.
In-23_для нас.indd 573
03.04.2019 12:01:23
In-23_для нас.indd 574
03.04.2019 12:01:23
575
ОСЛОЖНЕНИЯ И ДИСФУНКЦИЯ
ИСКУССТВЕННЫХ КЛАПАНОВ СЕРДЦА
«Золотым стандартом» диагностики, оценки, кон-
троля функции искусственных клапанов сердца и
осложнений, связанных с ними, остается допплеро-
графия (рис. 24.1). При проведении исследования
используются те же основные принципы, которые
применяются при оценке нативных клапанов, одна-
ко с некоторыми особенностями и оговорками, ко-
торые присущи для протезов, что освещено в этой
главе.
НЕСООТВЕТСТВИЕ ПРОТЕЗ-ПАЦИЕНТ
Несоответствие протез–пациент (НПП) не относит-
ся к дисфункции искусственного клапана как тако-
вой. Эта проблема возникает, когда эффективная
площадь отверстия (EOA) клапана с сохранной
функцией слишком мала по отношению к телу па-
циента (и, следовательно, к сердечному выбросу),
24 Диагностика и количественная
оценка дисфункции протезированных
клапанов сердца
HAÏFA MAHJOUB, MD, PHD • ABDELLAZIZ DAHOU, MD, MSC • JEAN G. DUMESNIL, MD •
PHILIPPE PIBAROT, DVM, PHD
Осложнения и дисфункция
искусственных клапанов сердца
Несоответствие протез-пациент
Тромбоз искусственных клапанов
и образование паннусов
Изменение структуры клапанов
Инфекционный эндокардит
Основные принципы
допплерэхокардиографической
оценки функции искусственных
клапанов
Временные интервалы проведения
эхокардиографии
Клинические данные
Диагностика и оценка стеноза
протезов клапанов сердца
Морфология и подвижность створок
Количественные параметры
Диагностика и оценка регургитации
на протезах клапанов сердца
Регургитация на протезах аортальных
клапанов
Регургитация после протезирования
на митральном клапане
Косвенные признаки и последствия
регургитации протеза митрального
клапана
Роль стресс-эхокардиографии
Протезы клапанов правых отделов
сердца
Стенозы протезов трехстворчатых
клапанов
Регургитация на протезах трехстворчатого
клапана
Протезы клапана легочной артерии
Интерпретация данных
допплерэхокардиографии
Высокие градиенты на протезе
Низкий уровень потока
Интраоперационная эхокардиография
Допплерэхокардиография при лечении
специфических осложнений после
протезирования клапанов сердца
Тромбоз протезов
Эндокардит протезов клапанов сердца
Заключение
что приводит к регистрации высоких градиентов на
клапане. Наиболее распространенным в клиниче-
ской практике параметром идентификации НПП
является индексированная EOA, т.е . EOA протеза,
разделенная на площадь поверхности тела пациента
[1, 2]. В табл. 24.1 приведены значения индексиро-
ванной EOA, которые обычно используются для
определения НПП, что помогает оценить его тя-
жесть в зависимости от типа протеза. У пациентов
с ожирением для определения НПП следует исполь-
зовать нижнюю границу показателей индексиро-
ванной EOA. Для проведения дифференцированно-
го диагноза между НПП и дисфункции протеза
клапана необходимо использовать трансторакаль-
ную эхокардиографию (ТТЭхоКГ).
ТРОМБОЗ ИСКУССТВЕННЫХ КЛАПАНОВ
И ОБРАЗОВАНИЕ ПАННУСОВ
Обструкция протеза возможна из-за образования
тромбов (см. рис. 24.1А), паннуса (см. рис. 24.1Б)
In-24_для нас.indd 575
03.04.2019 12:01:39
576
ЧАСТЬ IV Пороки клапанов сердца
либо их комбинации. Образование паннуса наблю-
дается как в биологических, так и механических
протезах. Паннус представляет собой медленно
прогрессирующую подклапанную обструкцию, из-
за которой возникают трудности при визуализации,
и, следовательно, ухудшается дифференциальная
диагностика. Паннус обычно встречается у пациен-
тов с нормальными показателями свертывающей
системы, но с подострым либо хроническим тече-
нием основного заболевания [3]. Тромбоз следует
подозревать у любого пациента с любым протезом
клапана сердца, у которого за последнее время на-
чали нарастать одышка и усталость [4]. Насторо-
женность должна быть еще выше, если в анамнезе
имеется недавний перерыв или прием субтерапев-
тических доз антикоагулянтной терапии. В таких
случаях следует незамедлительно провести обследо-
вание, включая в себя чреспищеводную эхокардио-
графию (ЧПЭхоКГ), особенно при протезах ми-
трального клапана. Тромбозы клапанов чаще всего
Рис. 24.1 Удаленные протезы клапанов после их поражения. (А) A Обструктивный тромбоз протеза Lillehei–Kaster. (Б) A Образование паннуса с наруше-
нием раскрытия створок на протезе St. Jude Medical. (В) A Разрыв внешнего кольца и створки протеза Bjork–Shiley. (Г) A Дегенерация и кальцификация створки
биологического (свиного) протеза. (Д) Тромбоз саморасширяющегося транскатетерного протеза. (Е) Дегенерация, кальцификация створки и стеноз транскатетер-
ного протеза аортального клапана (предоставлено: А и В — Drs. Jacques Métras; Б — Christian Couture, Québec Heart & Lung Institute, Québec; Г — Gosta Petterson,
Cleveland Clinic, Cleveland; Д — Latib A, Naganuma T, Abdel-Wahab M, et al. Treatment and clinical outcomes of transcatheter heart valve thrombosis. Circ Cardiovasc Interv
8, 2015; F — Seeburger J, Weiss G, Borger MA, Mohr FW: Structural valve deterioration of a Corevalve prosthesis 9 months after implantation. Eur Heart J 34:1607, 2013).
А
Б
Г
В
Е
Д
In-24_для нас.indd 576
03.04.2019 12:01:39
577
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
наблюдаются у пациентов с механическими проте-
зами наряду с неадекватной антитромботической
терапией. Также тромбоз наблюдается после тран-
скатетерной имплантации биологических протезов,
особенно в раннем (3 месяца) послеоперационном
периоде (см. рис. 24.1Д) [5, 6].
ИЗМЕНЕНИЕ СТРУКТУРЫ КЛАПАНОВ
Механические протезы обладают отличной долго-
вечностью, а изменение структуры клапанов встре-
чается чрезвычайно редко в современных моделях.
В прошлом нередко описывали разрушение основа-
ния, створок, развитие дисфункции из-за адсорб-
ции липидов (см. рис. 24.1В). Изменение структуры
биологических протезов клинически выражается в
виде прогрессирующего стеноза из-за кальцифика-
ции створок либо в виде регургитации из-за разры-
вов (см. рис. 24.1Г, 24.1Е). Изменение структуры —
одна из главных причин разрушения биологических
протезов, и случаи повторных операций в течение
15 лет достигают 30% [7, 8].
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Эндокардит искусственных клапанов сердца явля-
ется наиболее тяжелой формой инфекционного
эндокардита и встречается у 1–6% пациентов с
Легкое либо клинически
невыраженное
Умеренное
Выраженное
Протезы аортальных клапанов
Индексированная EOA* (прогнозированная
либо полученная)
ИМТ < 30 кг/м2
ИМТ <(в ориг. ≥) 30 кг/м2
> 0,85
> 0,70
0,85–0,66
0,70–0,56
≤ 0,65
≤ 0,55
Разница (измеренная EOA – эталонная EOA)
(см2)†
< 0,25
< 0,25
< 0,25
Структура и подвижность клапанов
Обычно нормальная
Обычно
нормальная
Обычно нормальная
Протезы митральных клапанов
Индексированная EOA (прогнозированная
либо полученная)
ИМТ < 30 кг/м2
ИМТ ≥ 30 кг/м2
> 1,2
> 1,0
1,2–0,91
1,0–0,76
≤ 0,90
≤ 0,75
Разница (измеренная EOA – эталонная EOA)
(см2)†
< 0,30
< 0,30
< 0,30
Структура и подвижность клапанов
Обычно нормальная
Обычно
нормальная
Обычно нормальная
* Данные критерии применимы при наличии нормального ударного объема (50–90 мл).
† См. табл. 24.4 и 24.5 для определения нормальных показателей EOA в зависимости от размера и модели протеза.
EOA — эффективная площадь отверстия; ИМТ — индекс массы тела.
ТАБЛИЦА 24.1 Критерии допплерэхокардиографии для определения и количественной оценки несоответствия
протез–пациент
протезами, что составляет от 10 до 30% от общего
числа всех случаев данного заболевания [9]. Эндо-
кардит искусственных клапанов протекает чрезвы-
чайно тяжело с высокой смертностью (30–50%).
Ключевую роль в диагностике и прогностической
оценке течения эндокардита играет эхокардиогра-
фия (ЭхоКГ), поскольку диагноз основывается
преимущественно на положительных гемокуль-
турах и данных ЭхоКГ, включая наличие вегета-
ций, парапротезных абсцессов, околоклапанной
регургитации [9, 10]. На данный момент лечение и
диагностика эндокардита искусственных клапанов
составляет сложную задачу, поэтому должен при-
меняться мультидисциплинарный подход, вклю-
чая командную работу кардиологов, кардиохирур-
гов.
ОСНОВНЫЕ ПРИНЦИПЫ ОЦЕНКИ ФУНКЦИИ
ИСКУССТВЕННЫХ КЛАПАНОВ С ПОМОЩЬЮ
ДОППЛЕРОГРАФИИ
Главный метод оценки функции искусственного
клапана — допплерография. Оценка проводится
согласно тем же принципам, которые соблюдаются
при диагностике нативных клапанов, однако с неко-
торыми нюансами. ЭхоКГ включает в себя двухмер-
In-24_для нас.indd 577
03.04.2019 12:01:40
578
ЧАСТЬ IV Пороки клапанов сердца
ную (2D) визуализацию искусственных клапанов,
их створок, морфологии, измерение градиента на
клапане и EOA, оценка локализации и степени ре-
гургитации, размера и систолической функции ле-
вого желудочка (ЛЖ), а также систолического дав-
ления в легочной артерии.
ВРЕМЕННЫЕ ИНТЕРВАЛЫ ПРОВЕДЕНИЯ ЭХОКАРДИОГРАФИИ
Первую послеоперационную ТТЭхоКГ после им-
плантации протеза проводят минимум от 6 недель
до 3 месяцев для оценки результатов и данное ис-
следование принимается за эталон для последую-
щего сравнения показателей при выявлении ухуд-
шений, осложнений. Повторную ЧПЭхоКГ реко-
мендуется проводить всем пациентам с протезами
при наличии явной клинической симптоматики и
признаках дисфункции импланта [10]. В руковод-
ствах за 2014 г. American College of Cardiology (ACC)/
American Heart Association (AHA) рекомендуется
проводить ежегодную ТТЭхоКГ у пациентов с био-
логическими протезами клапанов спустя 10 лет
после имплантации даже при отсутствии клиниче-
ской картины нарушений [10]. Однако некоторые
исследования указывают, что около 25–30% паци-
ентов с биологическими протезами в аортальной
позиции имеют некоторую степенью его дегенера-
ции и дисфункции за период менее чем 10 лет после
оперативного вмешательства [11–13]. Полученные
результаты способствуют более частому проведе-
нию ЭхоКГ спустя 5 лет после имплантации, соглас-
но рекомендациям American Society of Echocardiog-
raphy (ASE) 2009 г. [14]. У пациентов с механиче-
скими клапанами при отсутствии изменения
клинического статуса, рутинная ежегодная ЭхоКГ
не показана [10]. После проведения транскатетер-
ного протезирования аортального клапана (ТПАК)
ТТЭхоКГ проводится в идеале в течение первых 30
дней, спустя 6 месяцев (необязательно), 1 год с по-
следующим повтором ежегодно [15].
КЛИНИЧЕСКИЕ ДАННЫЕ
Причина проведения ЭхоКГ и связь с симптомами
пациента должно быть четко задокументировано.
Интерпретация допплеровских данных зависит от
типа и размера протеза, поэтому эти данные также
должны быть отражены в заключении. Врачу необ-
ходимо четко знать точный тип и модель клапана,
т.к. даже у одного и того же производителя характе-
ристики конструкции, и гемодинамические свой-
ства могут существенно отличаться в разных поко-
лениях (например, модели St. Jude Standard в срав-
нении с HP и Regent). Также следует указывать
используемый хирургический доступ для имплан-
тации клапана (срединная стернотомия, министер-
нотомия, передняя правая торакотомия и т.д .), либо
транскатетерная (трансбедренная, трансподмышеч-
ная, через аорту, нижние полые вены и т.д.). Во
время проведения ЭхоКГ необходимо измерять
давление и частоту сердечных сокращений. Нако-
нец, необходимо выяснить рост, массу тела, рассчи-
тать площадь поверхности тела, индекс массы тела
для оценки наличия и степени тяжести НПП (см.
табл. 24.1) и индексированные размеры ЛЖ.
ДИАГНОСТИКА И ОЦЕНКА СТЕНОЗА
ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА
При появлении впервые шума при аускультации с
симптомами застойной сердечной недостаточности
у пациентов с протезами аортального клапана необ-
ходимо провести ТТЭхоКГ по срочным показаниям,
а при показаниях — и ЧПЭхоКГ. Изначально мож-
но заподозрить стеноз протеза случайно на рутин-
ном исследовании, обнаружив аномально высокую
скорость потока и градиенты. В табл. 24.2, 24.3 от-
мечены эхокардиографические критерии для диа-
гностики и количественной оценки стеноза протеза
клапана.
МОРФОЛОГИЯ И ПОДВИЖНОСТЬ СТВОРОК
На эхокардиографическом изображении должно
быть отражено сшивающее кольцо, окклюдер кла-
пана и область вокруг него. Часто бывает затрудни-
тельно визуализировать шар или диск механиче-
ских клапанов из-за реверберации и затенений, ко-
торые возникают из-за компонентов протеза. Для
оценки подвижности створок протеза клапана в
митральной позиции чаще всего используют левую
парастернальную позицию по короткой оси. Обыч-
но створки биологических протезов выглядят утон-
ченными с отсутствием ограничений движений, а
также без признаков пролапса. Бескаркасные про-
тезы, аллотрансплантаты либо аутотрансплантаты
клапанов часто бывают неотличимы от нативных.
Стенозы клапана обычно связывают с аномальной
морфологией протеза или нарушению подвижно-
сти створок (рис. 24.2, см. табл. 24.2, 24.3). В случае
механических клапанов уменьшается подвижность
окклюдера либо вообще исчезает (см. рис. 24.2А).
Часто на уровне кольца протеза либо шарнирного
механизма визуализируются тромбы, паннусы ли-
бо вегетации. В отношении биологических протезов
стеноз чаще всего связан с утолщением, кальцифи-
кацией и сниженной подвижностью листочков (см.
рис. 24.2Б). Однако стеноз биопротезов также мо-
жет быть связан с тромбозом, образованием панну-
са или вегетаций (см. рис. 24.1Д).
Хорошую визуализацию подвижности, калици-
фикации и утолщения створок, обнаружение веге-
таций при эндокардите, тромбоз, паннус обеспечи-
вает двухмерная (2D) и трехмерная (3D) ЧПЭхоКГ
(рис. 24.3) [16]. Оценка подвижности створок меха-
нических клапанов крайне затруднена на ЭхоКГ.
Наиболее экономически эффективный и наименее
In-24_для нас.indd 578
03.04.2019 12:01:40
579
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
Норма
Возможный стеноз
Достоверно наличие
стеноза
Механический или биологический протез
Норма
Чаще нарушена*
Нарушена*
Количественные параметры допплерографии
Максимальная скорость (м/сек)†, £
<3
3–3,9
≥4
Средний градиент (мм рт. ст.)†, £
<20
20–34
≥35
Индекс допплеровской скорости†
≥ 0,35
0,25–0,34
< 0,25
Эффективная площадь отверстия (EOA) (см2)†
> 1,1
0,8–1,1
< 0,8
Разница (измеренная EOA – эталонная EOA) (см2)†, §
< 0,30
0,30–0,6
≥ 0,60
Контур протока регургитации¶
Трехугольный
ранний пик
Промежуточный пик Симметричный пик
Время ускорения (мсек)¶
<80
80–100
> 100
Отношение времени ускорения/время выброса левого
желудочка
< 0,32
0,32–0,37
> 0,37
Изменения параметров эхокардиографии в динамике
Увеличение среднего градиента (мм рт. ст.)
<10
10–19
≥10
Стресс-эхокардиография
Увеличение среднего градиента (мм рт. ст.)
<10
10–19
≥20
* Механические протезы: неподвижные либо ограниченные в движении створки, тромбы, паннусы; нарушения биологических протезов:
утолщение или кальцификация створок, тромбоз, паннусы. Подвижность и морфологию створок оценивают с помощью ТТЭхоКГ,
ЧПЭхоКГ, кинофлуороскопии (для механических клапанов) либо на компьютерной томографии.
† Данные критерии применимы при наличии нормального ударного объема (50–90 мл).
£ Данные параметры зависят от низкого либо высокого уровня потока, включая низкий выброс ЛЖ и наличие сопутствующей регургита-
ции на протезе.
§ Смотри табл. 24.4 для определения нормальных показателей эффективной площади отверстия в зависимости от размера и модели
протеза.
¶ На эти параметры влияет функция ЛЖ и частота сердечных сокращений.
[American Society of Echocardiography from Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves
with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography’s Guidelines and Standards Committee
and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee,
Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European
Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College
of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society
of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 22:975–1014, 2009.]
ТАБЛИЦА 24.2 Критерии допплерэхокардиографии для обнаружения и количественной оценки стеноза протезов
аортального клапана
инвазивный метод для этих целей мы считаем кла-
панную кинофлуороскопию (рис. 24.4). Также воз-
можно применение мультиспиральной компьютер-
ной томографии (КТ) для оценки подвижности
створок как механических, так и биологических
клапанов. Недавние исследования показали, что для
выявления нарушений подвижности створок, кото-
рые потенциально связаны с тромбозами клапанов
у пациентов после транскатетерной или хирургиче-
ской имплантации биологических протезов в аор-
тальную позицию, наилучшим методом является
4D КТ [6].
КОЛИЧЕСТВЕННЫЕ ПАРАМЕТРЫ
Количественные параметры функции протезного
клапана включают в себя оценку скорости потоков,
градиенты давлений, EOA и индексированные ско-
рости согласно допплерографии.
ОЦЕНКА СКОРОСТИ ПОТОКА И ГРАДИЕНТА НА ПРОТЕЗЕ
Принципы оценки и измерения скорости потока
через протезы клапанов аналогичны тем, которые
используются при осмотре нативных клапанов. Ис-
следование включает проведение импульсно-вол-
новой, непрерывно-волновой и цветовой доппле-
рографии с использованием нескольких плоскостей
для оптимальной записи и минимизации угла меж-
ду ультразвуковым лучом и направлением потока.
Оценка протезов клапана аорты проводится с не-
скольких позиций датчика, включая в себя вид через
верхушку, парастернальную, правую надключич-
ную, супрастернальную. Измерение скорости и гра-
диентов осуществляют с того положения, на кото-
рым визуализируются максимальные скорости [14].
Примечательно, что гидродинамика может суще-
ственно отличаться между механическими и натив-
ными клапанами (рис. 24.5). При одностворчатых
In-24_для нас.indd 579
03.04.2019 12:01:40
580 ЧАСТЬ IV Пороки клапанов сердца
Норма
Возможный стеноз Достоверно наличие стеноза
Структура и подвижность клапанов
Механический или биологический протез
Норма
Чаще нарушена*
Нарушена*
Количественные параметры допплерографии
Максимальная скорость (м/сек)†, £
< 1,9
1,9–2,5
≥ 2,5
Средний градиент (мм рт. ст.)†, £
≤5
6–10
≥10
Индекс допплеровской скорости†
< 2,2
2,2–2,5
> 2,5
Эффективная площадь отверстия (EOA) (см2)†
≥2
1–2
<1
Разница (измеренная EOA – эталонная EOA) (см2)†,¶ < 0,30
0,30–0,6
≥ 0,60
Время полуспада градиента давления (мсек)§
< 130
130–200
> 200
Изменения параметров эхокардиографии в динамике
Увеличение среднего градиента (мм рт. ст.)
<3
3–5
>5
Стресс-эхокардиография
Увеличение среднего градиента (мм рт. ст.)
<5
5–12
>12
* Механические протезы: неподвижные либо ограниченные в движении створки, тромбы, паннусы; нарушения биологических протезов:
утолщение или кальцификация створок, тромбоз, паннусы. Подвижность и морфологию створок оценивают с помощью ТТЭхоКГ,
ЧПЭхоКГ, кинофлуороскопии (для механических клапанов), либо на компьютерной томографии.
† Данные критерии применимы при наличии нормального ударного объема (50–90 мл).
£ Данные параметры зависят от низкого либо высокого уровня потока, включая низкий выброс ЛЖ и наличие сопутствующей регургита-
ции на протезе.
§ На эти параметры влияет функция ЛЖ и частота сердечных сокращений.
¶ См. табл. 24 .5 для определения нормальных показателей эффективной площади отверстия в зависимости от размера и модели протеза.
[American Society of Echocardiography from Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves
with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography’s Guidelines and Standards Committee
and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee,
Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European
Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College
of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society
of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 22:975–1014, 2009.]
ТАБЛИЦА 24.3 Критерии допплерэхокардиографии для обнаружения и количественной оценки стеноза протезов
митрального клапана
клапанах виден эксцентричный поток, а при двух-
створчатых регистрируются три отдельные струи.
Поскольку потоки могут иметь эксцентричный ха-
рактер, то следует использовать мультимодальную
непрерывно-волновую допплерографию для полу-
чения наиболее хорошего сигнала и расчета скорости
через протез. Иногда возможна регистрация ано-
мально высоких градиентов и скоростей через цен-
тральное отверстие механических двухстворчатых
протезов в аортальной или митральной позиции
[17]. Данное явление может привести к переоценке
градиентов с неверным толкованием EOA, вызвав
ложное подозрение на дисфункцию протеза.
Градиент давления рассчитывают с помощью
упрощенного уравнения Бернулли:
ΔP=4×VPr
2,
где VPr
2 — скорость струи потока в м/сек.
У пациентов с аортальным протезами и высо-
кой скоростью потока или узким выходным трак-
том ЛЖ (ВТЛЖ), скорость проксимальнее протеза
может быть увеличена и ей можно пренебречь.
Если проксимальная скорость ВТЛЖ (VВТЛЖ) пре-
вышает 1,5 м/сек, то более точную оценку гради-
ента давления проводят с помощью следующего
уравнения:
ΔP=4×VPr
2 − VВТЛЖ
2.
При стенозах протеза обычно отмечается увели-
чение максимальной скорости потока или среднего
градиента (≥ 3 м/сек или ≥ 20 мм рт. ст. для протезов
в аортальной позиции и ≥ 1,9 м/сек или ≥ 6 мм рт. ст.
в митральной) (см. табл. 24.2, 24.3). Однако следует
иметь в виду, что высокая скорость или градиенты
не являются доказательством стеноза протеза, и мо-
гут представлять собой вторичные изменения из-за
НПП, регургитации, локализованной высокой ско-
рости центрального потока в механических двух-
створчатых клапанах. Значительная регургитация
на протезе может привести к увеличению скорости
потока, что вызывает увеличение градиентов.
В раннем послеоперационном периоде после им-
плантации бескаркасных биологических протезов,
особенно в подкоронарную позицию, наблюдается
In-24_для нас.indd 580
03.04.2019 12:01:40
581
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
более высокий градиент, который снижается в тече-
ние следующих 3 месяцев. Это связано с регрессией
отека стенки аорты, которая соприкасается с проте-
зом и/или ремоделированием выходного тракта ЛЖ.
ФОРМА ПОТОКА И ВРЕМЯ ЕГО УСКОРЕНИЯ
Форму потока на протезе относят к качественным
показателям, который используют для оценки функ-
ции протеза клапана в аортальной позиции наряду
с другими количественными показателями. В на-
тивном клапане скорость потока при непрерыв-
но-волновой допплерографии имеет треугольную
форму с ранней максимальной скоростью и неболь-
шим временем ускорения (ВУ, время от возникно-
вения потока до приобретения максимальной ско-
рости, < 80 мсек) (рис. 24.6). При стенозе клапана
наблюдается более округлый контур потока со ско-
ростью, близкой к максимальной и увеличенным
временем ускорения (> 100 мсек) (см. рис. 24.6, табл.
24.2, 24.3) [14]. Однако основное ограничение ис-
пользование параметра времени ускорения состоит
в том, что он сильно зависит от хронотропного
эффекта. Для того чтобы учесть это ограничение,
некоторые специалисты предложили индексиро-
вать время ускорения до времени выброса из ЛЖ
(ВВЛЖ). Отношение > 0,37 указывает на наличие
стеноза протеза аортального клапана [18]. Преиму-
ществом данного показателя является то, что он не
зависит от угла допплеровского луча относительно
направления потока. Но на показатель влияет систо-
лическая функция ЛЖ. Например, у пациента без
нарушения функции протеза наряду с сопутствую-
щей сниженной сократительной функцией миокар-
да может отмечаться округлый контур скорости с
более поздним временем пика скорости, что также
может встретиться у пациентов с НПП.
Рис. 24 .2 Оценка морфологии протезированного клапана и подвижности створок. (А) A Визуализация механического протезированного клапана во
время диастолы. Неподвижная створка (красная стрелка) и подвижная створка (синяя стрелка). (Б) A Утолщение и снижение подвижности створок биологического
протеза аортального клапана во время систолы (стрелка). (В) A Оторванная створка на биологическом протезе аортального клапана (стрелка). (Г) A Регургитация
(стрелка) на биологическом протезе аортального клапана. Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; ПП — правое
предсердие (предоставлено: Б — Dr John Chambers, Guy’s and St Thomas Hospitals, London, UK; В и Г — Dr Bibiana Cujec, Mazankowski Heart Institute, Edmonton,
Canada).
ЛЖ
ЛЖ
ЛЖ
ПЖ
ПЖ
ПЖ
Ао
Ао
ПП
ЛП
ЛП
ЛП
А
Б
В
Г
In-24_для нас.indd 581
03.04.2019 12:01:40
582
ЧАСТЬ IV Пороки клапанов сердца
ЭФФЕКТИВНАЯ ПЛОЩАДЬ ОТВЕРСТИЯ
EOA протезированного аортального клапана рассчи-
тывается с помощью уравнения, аналогичному для
нативного клапана [19–21]:
EOA = (ППСвтлж × VTIвтлж)/VTIPr,
где ППСвтлж — площадь поперечного сечения вы-
ходного тракта ЛЖ, VTIвтлж — интеграл скорости
кровотока в выходном тракте ЛЖ при импуль-
сно-волновой допплерографии, VTIPr — интеграл
скорости кровотока на протезе аортального клапана
при непрерывно-волновой допплерографии.
При расчете EOA протеза аортального клапана
следует иметь в виду некоторые особенности:
1. Площадь поперечного сечения выходного тракта
ЛЖ основывается на измерении диаметра непо-
средственно под границей стента либо кольца
протеза при визуализации по длинной оси, что
предполагает изображение круглой геометрии.
Часто это измерение провести сложно из-за ре-
верберации и артефактов, вызванных стентами
или кольцами протеза. Особое внимание следует
заострить на том, чтобы ошибочно не принять
внутреннюю границу стента или кольца протеза
за диаметр выходного тракта ЛЖ. Для снижения
влияния артефактов на визуализацию рекомен-
дуется проводить оценку через нижнюю парас-
тернальную позицию датчика. Не допускается
определение EOA протеза аортального клапана с
заменой диаметра выходного тракта ЛЖ на раз-
мер кольца клапана [22].
2. Крайне аккуратно следует оценивать скорости
потока в выходном тракте ЛЖ, избегая подкла-
панной зоны протеза. Луч при импульсно-вол-
новой допплерографии следует направлять ниже
апикальной границы стента либо кольца протеза.
Измерение интеграла скорости потока выходно-
го тракта ЛЖ и его диаметра рекомендуется про-
водить примерно в одном и том же месте.
3. Интеграл скорости потока на протезе можно по-
лучить в той же позиции датчика, которая ис-
пользуется для измерения максимальной скоро-
сти и градиентов.
4. При наличии сопутствующей регургитации на
протезе аортального клапана возможно исполь-
зовать метод уравнения непрерывности, т.к. и
Рис. 24 .3 Трехмерная чреспищеводная эхокардиография. Увеличенное изображение протеза. (A) Двухстворчатый механический протез, вид со стороны ЛП.
(Б) Биологический протез митрального клапана, вид со стороны ЛЖ. (В) Кольцо для аннулопластики, вид со стороны ЛП. (Г) Вид со стороны ЛП на механический
двухстворчатый протез митрального клапана. Виден незначительный тромбоз (стрелки) без нарушения подвижности створок. (Д) Вид со стороны en face ЛП на
шариковый протез (имплантированный в митральное кольцо) в митральной позиции. (Е) Однодисковый протез в митральной позиции, вид со стороны ЛП [Lang RM,
Tsang W, Weinert L, et al. Valvular heart disease: the value of 3-dimensional echocardiography. J Am Coll Cardiol 58:1933–1944, 2011].
А
Б
В
Г
Д
Е
In-24_для нас.indd 582
03.04.2019 12:01:41
583
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
числитель, и знаменатель, увеличиваются в ана-
логичной пропорции.
Имеются некоторые особенности визуализации
после транскатетерной имплантации аортальных
клапанов. Как и после хирургическом позициони-
ровании протезов, диаметр и скорость в выходном
тракте ЛЖ следует измерять прямо под стентом.
Отмечается значительное ускорение потока в желу-
дочковой части стента (между входом в него и кла-
паном), особенно после расширения клапанов бал-
лоном [23, 24]. Следовательно, использование им-
пульсно-волновой допплерографии в данной части
стента приведет к завышению EOA и ударного объе-
ма. Однако при использовании саморасширяющих-
ся клапанов (CoreValve), створки крепятся высоко в
стенте, и, следовательно, на апикальной части стен-
та имеется минимальное ускорение потока или во-
все отсутствует. В данном случае при имплантации
стента в нижнюю часть выходного тракта ЛЖ, из-
мерение диаметра и скорости потока в ВТЛЖ про-
водят в апикальной части (первые 5 мм) стента.
EOA протезов митральных клапанов рассчиты-
вается по уравнению непрерывности с использова-
нием данные о выходном тракте ЛЖ:
EOA = (ППСвтлж × VTIвтлж)/VTIPr,
где VTIPr — интеграл скорости кровотока на проте-
зе митрального клапана, полученный при непре-
рывно-волновой допплерографии (рис. 24.7).
Рис. 24 .4 Альтернативные способы визуализации для выявления дисфункции протезов клапанов. (A) A Кинофлуороскопия для оценки подвижности
створок механических протезов. Неподвижная створка двухстворчатого механического клапана в митральной позиции (стрелка). (Б) A Компьютерная томография
при оценке подвижности створок механического протеза: неподвижная створка (белая стрелка), тромбоз (черная стрелка). (В–Е) Мультиспиральная компьютерная
томография при выявлении клинически незначимого тромбоза при хирургическом (Д, Е) и транскатетерном (В, Г) протезировании аортального клапана: тромбоз
(черные стрелки), створка с ограниченной подвижностью (белые стрелки). ЛЖ — левый желудочек; ЛП — левое предсердие [B — предоставлено Dr. Steven A.
Goldstein, Washington Hospital Center. C -F, Adapted with permission from Makkar RR, Fontana G, Jilaihawi H, et.al. Possible subclinical leaflet thrombosis in bioprosthetic
aortic valves. N Engl J Med 373:2015–2024, 2015].
ЛП
ЛЖ
А
Б
В
Г
Е
Д
In-24_для нас.indd 583
03.04.2019 12:01:43
584
ЧАСТЬ IV Пороки клапанов сердца
Нормальный протез
Время ускорения
СГ=24ммрт.ст.
ИДС = 0,4
ВУ=58мсек
ВУ/ВВЛЖ = 0,31
СГ=47ммрт.ст.
ИДС = 0,2
ВУ = 126 мсек
ВУ/ВВЛЖ = 0,45
Время выброса
Время ускорения
Время выброса
Протез с обструкцией
Рис. 24 .6 Параметры динамики выброса потока при выявлении стеноза протеза аортального клапана. Обратите внимание на закругленную кривую
скорости потока при обструкции протеза (справа) и ранней максимальной скорости в нормальном клапане (слева). ВВЛЖ
— время выброса из левого желудочка;
ВУ — время ускорения; ИДС — индекс допплеровской скорости; СГ — средний градиент [Ben Zekry S, Saad RM, Ozkan M, et al. Flow acceleration time and ratio of
acceleration time to ejection time for prosthetic aortic valve function. JACC Cardiovasc Imaging 4:1161–1170, 2011].
Рис. 24.5 Изменения скорости и давления в выносном тракте левого желудочка и восходящем отделе аорты при наличии каркасного биоло-
гического протеза (А) и двухстворчатого механического протеза (Б). Из-за восстановления давления скорость и систолическое артериальное давление
(САД) выше в восходящем отделе аорты (Ао), чем на уровне vena contracta (VC). Это особенно выражено в двухстворчатом клапане, в котором скорость выше в
центральном отверстии (ЦО) и, таким образом, градиент падения давления на этом уровне выше (ΔP). Допплеровские градиенты оцениваются по максимальной
скорости на уровне перешейка потока регургитации и представляют собой максимальное падение давления, тогда как инвазивная оценка градиентов обычно
отражает разницу (ΔPNET) между систолическим давлением левого желудочка (СДЛЖ) и восходящим отделом аорты. EOA — эффективная площадь отверстия;
ЛО — латеральное отверстие; УО — ударный объем выходного тракта левого желудочка [American Society of Echocardiography from Zoghbi WA, Chambers JB,
Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound: a report From the American Society of Echocardiogra-
phy’s Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging
Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of
Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American
Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and
Canadian Society of Echocardiography. J Am Soc Echocardiogr 22:975–1014, 2009].
Поток
Поток
А
р
т
е
р
и
а
л
ь
н
о
е
д
а
в
л
е
н
и
е
СДЛЖ
УО
EOAVC
Ао
САДVC
САД
ΔPVC
ΔPNET
УО
СДЛЖ
ΔPNET
САД
САДЛО
САДЦО
ΔPЛО ΔPЦО
Ао
ЛО
ЛО
ЦО
А
р
т
е
р
и
а
л
ь
н
о
е
д
а
в
л
е
н
и
е
А
Б
In-24_для нас.indd 584
03.04.2019 12:01:44
585
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
При оценке EOA протезов митральных клапанов
следует учитывать несколько важных особенностей:
1. Невозможно использовать метод уравнения не-
прерывности, при наличии умеренной митраль-
ной либо аортальной регургитации.
2. Метод оценки времени полуспада градиента дав-
ления (ВПГД) (аналогичный тому, который ис-
пользуется при стенозе нативного митрального
клапана) недействителен для оценки EOA проте-
зов [25, 26]. Время полуспада сильно зависит от
хронотропии, растяжимости левого предсердия
(ЛП) и ЛЖ. Соответственно, у пациентов с тахи-
кардией или со снижением атриовентрикуляр-
ной проводимости могут отмечаться нормаль-
ные показатели ВПГД, несмотря на наличие
значительного стеноза протеза. Тем не менее
время полуспада давления полезно при наличии
значительной задержки (> 200 мсек, см. табл.
24.3, рис. 24.7Б) или отмечается значительное
удлинение времени от одного визита к последу-
ющему, несмотря на аналогичную частоту сер-
дечных сокращений.
EOA от 0,8 до 1,2 см2 и от 1,0 до 2,0 см2 указыва-
ет на наличие возможного стеноза на протезе аор-
тального или митрального клапанов, соответствен-
но (см. табл. 24.2, 24.3), тогда как значения < 0,8 см2
(аортальная) или ниже 1,0 см2 (митральная пози-
ция) указывают наличие значительного стеноза.
Данные пороговые значения описаны в рекоменда-
ция АОЭ [14] имеют некоторые ограничения из-за
того, что некоторые цифры перекрываются с пока-
зателями нормы EOA для некоторых моделей кла-
панов. Согласно нашему опыту, подтверждение
стеноза протеза клапана лучше проводить путем
сравнения полученного EOA с эталонным значени-
ем EOA для каждой конкретной модели и размера
протеза, имплантированного пациенту, а не с при-
менением фиксированных пороговых значений у
всех пациентов [27]. В табл. 24.4, 24.5 указаны нор-
мальные значения EOA для наиболее часто исполь-
зуемых протезов клапанов в аортальной и митраль-
ной позиции. При наличии разницы между эталон-
ным и измеренным EOA > 0,30 см2 следует
заподозрить стеноз, а при разнице > 0,60 см2 есть
вероятность значительного стеноза (см. табл. 24.2,
24.3) [28, 29].
ИНДЕКС ДОППЛЕРОВСКОЙ СКОРОСТИ
Индекс допплеровской скорости представляет со-
бой безразмерное соотношение интеграла скорости
кровотока выходного тракта ЛЖ к интегралу ско-
рости кровотока на протезе аортального клапана:
Индекс допплеровской скорости = VTIВТЛЖ/VTIАо .
Вместо интегралов при вычислении индекса доп-
плеровской скорости можно использовать макси-
мальные скорости VВТЛЖ и VАо . В случае с протезами
в митральной позиции индекс допплеровской ско-
рости рассчитывают путем деления интеграла ско-
рости кровотока на протезе на интеграл на выход-
ном тракте ЛЖ: Индекс допплеровской скорости =
VTIМК/VTIВТЛЖ. Все эти параметры могут быть по-
лезны для оценки степени стеноза клапана, особен-
но при невозможности рассчитать площадь попе-
речного сечения выходного тракта ЛЖ [30]. Индекс
Нормальный протез
Максимальная Е = 1,6 м/сек
Средний градиент = 4 мм рт. ст.
ВПГД = 180 мсек
Максимальная Е = 2,8 м/сек
Средний градиент = 23 мм рт. ст.
ВПГД = 390 мсек
Протез с обструкцией
Рис. 24 .7 Непрерывно-волновая допплерография при оценке скорости в нормальном протезе в митральной позиции (А) и при обструкции (Б).
Увеличение максимальной скорости Е, среднего градиента давления, времени полуспада градиента давления (ВПГД) при обструкции протеза клапана.
Б
А
In-24_для нас.indd 585
03.04.2019 12:01:45
586 ЧАСТЬ IV Пороки клапанов сердца
Размер протеза (мм)
19
21
23
25
27
29
Каркасные биопротезы
Mosaic
1,1 ± 0,2
1,2 ± 0,3
1,4 ± 0,3
1,7 ± 0,4
1,8 ± 0,4
2,0 ± 0,4
Hancock II
–
1,2 ± 0,2
1,3 ± 0,2
1,5 ± 0,2
1,6 ± 0,2
1,6 ± 0,2
Carpentier-Edwards Perimount
1,1 ± 0,3
1,3 ± 0,4
1,50 ± 0,4
1,80 ± 0,4
2,1 ± 0,4
2,2 ± 0,4
Carpentier-Edwards Magna
1,3 ± 0,3
1,5 ± 0,3
1,8 ± 0,4
2,1 ± 0,5
–
–
Biocor (Epic)
1,0 ± 0,3
1,3 ± 0,5
1,4 ± 0,5
1,9 ± 0,7
–
–
Trifecta*
1,41
1,63
1,8
2,02
2,20
2,35
Mitroflow
1,1 ± 0,2
1,2 ± 0,3
1,4 ± 0,3
1,6 ± 0,3
1,8 ± 0,3
–
Бескаркасные биопротезы
Medtronic Freestyle
1,2 ± 0,2
1,4 ± 0,2
1,5 ± 0,3
2,0 ± 0,4
2,3 ± 0,5
–
St. Jude Medical Toronto SPV
–
1,3 ± 0,3
1,5 ± 0,5
1,7 ± 0,8
2,1 ± 0,7
2,7 ± 1,0
Prima Edwards
–
1,3 ± 0,3
1,6 ± 0,3
1,9 ± 0,4
–
–
Механические клапаны
Medtronic-Hall
1,2 ± 0,2
1,3 ± 0,2
–
–
–
–
St. Jude Medical Standard
1,0 ± 0,2
1,4 ± 0,2
1,5 ± 0,5
2,1 ± 0,4
2,7 ± 0,6
3,2 ± 0,3
St. Jude Medical Regent
1,6 ± 0,4
2,0 ± 0,7
2,2 ± 0,9
2,5 ± 0,9
3,6 ± 1,3
4,4 ± 0,6
MCRI On-X
1,5 ± 0,2
1,7 ± 0,4
2,0 ± 0,6
2,4 ± 0,8
3,2 ± 0,6
3,2 ± 0,6
Carbomedics Standard and Top Hat 1,0 ± 0,4
1,5 ± 0,3
1,7 ± 0,3
2,0 ± 0,4
2,5 ± 0,4
2,6 ± 0,4
ATS Medical†
1,1 ± 0,3
1,6 ± 0,4
1,8 ± 0,5
1,9 ± 0,3
2,3 ± 0,8
–
* Эффективная площадь отверстия выражена в средних значениях согласно данным литературы. Для получения эталонных показателей
требуется боле глубокий анализ.
† Размеры клапанов ATS Medical представлены в 18, 20, 22, 24 и 26 мм.
[American Heart Association from Pibarot P, Dumesnil JG. Prosthetic heart valves: Selection of the optimal prosthesis and long-term management.
Circulation 119:1034–1048, 2009.]
ТАБЛИЦА 24.4 Нормальные значения площади эффективного отверстия протезов аортальных клапанов
Размер протеза (мм)
25
27
29
31
33
Каркасные биопротезы
Medtronic Mosaic
1,5 ± 0,4
1,7 ± 0,5
1,9 ± 0,5
1,9 ± 0,5
–
Hancock II
1,5 ± 0,4
1,8 ± 0,5
1,9 ± 0,5
2,6 ± 0,5
2,6 ± 0,7
Carpentier-Edwards Perimount
1,6 ± 0,4
1,8 ± 0,4
2,1 ± 0,5
–
–
Механические клапаны
St. Jude Medical Standard
1,5 ± 0,3
1,7 ± 0,4
1,8 ± 0,4
2,0 ± 0,5
2,0 ± 0,5
MCRI On-X†
2,2 ± 0,9
2,2 ± 0,9
2,2 ± 0,9
2,2 ± 0,9
2,2 ± 0,9
* Эффективная площадь отверстия выражена в средних значениях согласно данным литературы. Для получения эталонных показателей
требуется боле глубокий анализ.
† Клапан On-X имеет только один размер для протезов 27–29 и 31–33 мм. Более того, размер кольца и створок идентичен во всех моделях
(от 25 до 33 мм); меняется только размер шовного кольца.
[American Heart Association from Pibarot P, Dumesnil JG. Prosthetic heart valves: Selection of the optimal prosthesis and long-term management.
Circulation 119:1034–1048, 2009.]
ТАБЛИЦА 24.5 Нормальные значения площади эффективного отверстия протезов митральных клапанов*
In-24_для нас.indd 586
03.04.2019 12:01:46
587
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
допплеровской скорости снижается (≤ 0,35) при
наличии стеноза протеза аортального клапана (см.
табл. 24.2), и увеличивается (≥ 2,2) при наличии
стеноза протеза митрального клапана (см. табл.
24.3). При наличии значительного стеноза протеза
аортального клапана индекс допплеровской скоро-
сти обычно составляет < 0,25 и > 2,5 при митраль-
ном. Показано, что пороговые значения для проте-
зов аортальных клапанов < 0,35, а не < 0,30, увели-
чивают чувствительность (> 90%) при выявлении
легкой и умеренной дисфункции (см. табл. 24.2) [28,
29].
ДИАГНОСТИКА И ОЦЕНКА РЕГУРГИТАЦИИ
НА ПРОТЕЗАХ КЛАПАНОВ СЕРДЦА
Подход к диагностике и оценке регургитации на
протезах клапанов сердца аналогичен к такому же
при оценке нативных и включает в себя проведение
цветовой допплерографии с измерением определен-
ных показателей [31]. Однако требуется проявлять
осторожность, чтобы не спутать физиологическую
от патологической регургитации. В норме у механи-
ческих клапанов отмечается небольшой поток ре-
гургитации, называемый обратным истечением.
Данный «встроенный» механизм регургитации пре-
дотвращает застой крови и образование тромбов,
вымывая их. В отличие от патологических потоков,
струя обратного истечения характеризуется корот-
кой продолжительностью, симметричностью и узо-
стью. У биологических клапанов также отмечается
незначительная степень центральной регургитации
в норме. Бескаркасные протезы, аортальные алло-
трансплантаты, легочные аутотрансплантаты (опе-
рация Росса) зачастую имеют незначительные пото-
ки регургитации.
В случае наличия патологической регургитации
важно локализовать место возникновения струй,
чтобы отключить околоклапаную от чресклапан-
ной. Наиболее распространенными причинами чрес-
клапанной регургитации в отдаленном послеопера-
ционном периоде является дегенерация с кальци-
фикацией и разрывом створок в биологических
протезах, а при механических образование тромбов
или паннусов. Кроме того, при использовании бес-
каркасных протезов чаще отмечается аортальная
недостаточность из-за дилатации корня аорты, в
отличие от биологических или механических им-
плантов [32, 33]. Крайне важно проводить регуляр-
ную (каждые 2 года) оценку размеров корня (на
уровне кольца, синуса и синотубулярного соедине-
ния) и восходящего отдела аорты. При наличии
признаков дилатации или аортальной недостаточ-
ности рекомендуется проводить наблюдение еще
чаще.
Околоклапанная регургитация встречается го-
раздо чаще после ТИАК, чем после хирургической
имплантации аортального или митрального клапа-
на. После хирургической имплантации возникнове-
ние остаточных околоклапанных потоков бывает
крайне редко, поэтому при значительной степени
регургитации необходимо выполнять сразу же кор-
рекцию. Значительная околоклапанная регургита-
ция может развиться в отдаленном послеопераци-
онном периоде из-за эндокардита.
РЕГУРГИТАЦИЯ НА ПРОТЕЗАХ АОРТАЛЬНЫХ КЛАПАНОВ
ОЦЕНКА ИЗОБРАЖЕНИЙ
Крайне важно при оценке на ЧПЭхоКГ и ТТЭхоКГ
степени регургитации на протезе клапанов полу-
чить цветные допплеровские изображения с не-
скольких планов и в нескольких плоскостях (рис.
24.8). Оптимальную визуализацию протеза аор-
тального клапана на ТТЭхоКГ позволяет получить
парастернальная позиция по длинной и короткой
осям, трех- и пятикамерный вид, а также через вер-
хушку. Визуализация вне осей может помочь при
определении локализации возникновения струи.
Большинство позиций датчика для оценки регурги-
тации на протезе митрального клапана включают в
себя те же, что и для аортальных протезов, с добав-
лением субкостальной позиции. При визуализации
протезов аортальных клапанов наблюдается мень-
шее количество артефактов и проблем с изображе-
нием, чем при митральных протезах [14]. Однако
околоклапанные потоки по задней поверхности
после транскатетерной имплантации аортального
клапана могут частично либо полностью быть не
видны через парастернальную позицию. Потоки
околоклапанной регургитации зачастую многочис-
ленны, эксцентричны и имеют неправильную фор-
му (рис. 24.9, 24.10, см. рис. 24.8) [14, 34, 35]. Кроме
того, они ограничены стенками выходного тракта
ЛЖ, могут быть замаскированы частично или пол-
ностью из-за акустического затенения, из-за каль-
цификации нативного кольца аорты или от стента
протеза. Поэтому поиск и количественная оценка
околоклапанной регургитации бывает крайне за-
труднена на ТТЭхоКГ.
При наличии сложностей на ТТЭхоКГ при опре-
делении локализации возникновения (околокла-
панных либо чресклапанных) потоков регургита-
ции, выявления ее механизмов и осложнений (фло-
тация створок, наличие паннуса, тромбов, вегетаций,
формирование абсцессов, несостоятельность или
неправильное расположение стента после транска-
тетерной имплантации) (см. рис. 24.2В, Г, 24.8, 24.9,
24.10) рекомендуется использовать ЧПЭхоКГ [16].
Ограничение ЧПЭхоКГ выражаются в возникнове-
нии акустических затенений по передней области
протеза при позиции датчика в среднем отделе пи-
щевода. Важно отметить, что при наличии наряду с
аортальным, митрального протеза, может возник-
нуть значительное затенение и нечеткость выходно-
го тракта ЛЖ. В таких случаях крайне важно прове-
In-24_для нас.indd 587
03.04.2019 12:01:46
588 ЧАСТЬ IV Пороки клапанов сердца
сти оценку протеза из позиции датчика в полости
желудка.
ПАРАМЕТРЫ СТЕПЕНИ ТЯЖЕСТИ РЕГУРГИТАЦИИ
НА ПРОТЕЗАХ АОРТАЛЬНОГО КЛАПАНА
Все принципы и методы, которые используются для
оценки степени тяжести аортальной регургитации
[31] используются и при протезах. Следует пом-
нить, что имеется ограниченное количество данных
о применении и валидации полуколичественных и
количественных параметров в отношении протезов
клапанов, например ширины струи регургитации и
ее перешейка, эффективной площади струи регур-
гитации, ее объема и фракции [36, 37]. Учитывая,
что все параметры аортальной регургитации имеют
свои ограничения и подвержены ошибочным под-
счетам, рекомендуется использовать комплексный
многопараметрический подход (табл. 24.6). Обыч-
но во всех рекомендациях по оценке регургитации
на протезах клапанов ее делят на три степени: мяг-
кую, умеренную и тяжелую [14]. Однако некоторые
специалисты предложили более развернутую систе-
му классификации (пять степеней вместо трех), где
мягкую степень подразделяют на два подкласса:
мягкая и умеренно мягкая, умеренную на умерен-
ную и умеренно тяжелую [35, 38].
ПАРАМЕТРЫ ЦВЕТНОЙ ДОППЛЕРОГРАФИИ
При проведении допплеровского исследования пре-
дел Найквиста необходимо установить между 40 и
70 см/сек. Ширина перешейка регургитации (при
возможности ее визуализации) может быть измере-
на непосредственно с парастернальной или апи-
кальной позиции датчика. В отличие от нативных
клапанов, ширину перешейка бывает сложно оце-
нить через парастернальную позицию из-за затене-
ния, которое вызвано кольцом протеза или стентом.
Соотношение диаметра струи регургитации или
диаметра выходного тракта ЛЖ при оценке их с
парастернальной позиции по короткой и длинной
оси необходимо проводить чуть ниже протеза (см.
табл. 24.6, рис. 24.8, 24.9).
В отличие от нативной регургитации или чре-
склапанной регургитации на протезе, перешеек
Рис. 24 .8 Околоклапанная регургитация после транскатетерной имплантации протеза аортального клапана. ТТЭхоКГ по короткой A (А) и длинной
A (Б) осям, пятикамерная A (В), трехкамерная A (Г) позиции, на которых визуализируется умеренная околоклапанная регургитация на транскатетерном протезе
аортального клапана. Есть большой передний и малый задний потоки (стрелки). Задний поток не виден с парастернальной позиции датчика. Протяженность
передней струи составляет от 15 до 20%. Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
ПЖ
ЛЖ
ЛЖ
ЛЖ
Ао
Ао
Ао
ЛП
ЛП
ЛП
ЛП
А
Б
Г
В
In-24_для нас.indd 588
03.04.2019 12:01:46
589
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
околоклапанной регургитации зачастую не цирку-
лярный и нерегулярный (см. рис. 24.8 –24.10). В ко-
нечном итоге все ограничениях двухмерных и
стандартных допплеровских измерений при коли-
чественном определении околоклапанной регур-
гитации должна преодолеть трехмерная ЭхоКГ. На
данный момент имеются исследования с использо-
ванием 3D-ТТЭхоКГ, которые показали возмож-
ность измерения перешейка регургитации (см. табл.
24.6) [39, 40].
Степень околоклапанной регургитации: для по-
луколичественной оценки тяжести следует крайне
внимательно оценивать узкую часть потока регур-
гитации по короткой оси на уровне кольца (хирур-
гический протез), либо в нижней части стента
(транскатетерный биопротез), что позволяет опре-
делить периферическую протяженность регурги-
тации. Данный параметр определяют, визуально
оценивая приблизительно на скольких часах
расположен поток регургитации (с образным
представлением 9 часов на створке трехстворча-
того клапана) (см. табл. 24.6, рис. 24.10). Окруж-
ность затем отражается в процентах. Значение от 10
до 30% соответствует умеренной степени регургита-
ции, а > 30% тяжелой степени [15]. Однако окруж-
ность околоклапанной регургитации часто может
существенно варьироваться в зависимости от пло-
скости визуализации. Таким образом, крайне важно
оценить стент по всей его длине с использованием
короткой оси, при которой перешеек регургитации
виден наиболее четко. Плоскость выше стента либо
в его верхней части может недооценить регургита-
цию, в то время как плоскость выходного тракта
ЛЖ может переоценить степени тяжести регургита-
ции из-за резкого расширения потока после его са-
мого узкого места. Точная оценка потока регургита-
ции становится еще сложней и менее надежной при
наличии нескольких струй либо при их эксцентрич-
Рис. 24.9 Околоклапанная регургитация при цветовой допплерографии. (А) Эксцентрическая струя при умеренной околоклапанной регургитации (стрел-
ка) на каркасном биологическом протезе аортального клапана. (Б) A Визуализация при ТТЭхоКГ с цветовой допплерографией центральной струи регургитации
(белая стрелка) и задней струи регургитации (красная стрелка). Задняя струя во время систолы сливается с потоком через митральный клапан (желтая стрелка),
что затрудняет визуализацию и оценку степени регургитации. (В) Легкая околоклапанная регургитация (красные стрелки) и нормальная физиологическая регур-
гитация (белые стрелки) на двухстворчатом механическом протезе митрального клапана. (Г) A Тяжелая околоклапанная регургитация (стрелка) на биологиче-
ском протезе митрального клапана. Виден диастолический поток из левого предсердия (ЛП) в левый желудочек (ЛЖ) через парапротезную фистулу. Ао — аор-
та; ПЖ — правый желудочек (предоставлено: А — Dr John Chambers; В и Г — предоставлено Dr Arsène Basmadjan, Montreal Heart Institute, Montreal, Canada).
ПЖ
Ао
Ао
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
ЛЖ
ЛП
Г
В
А
Б
In-24_для нас.indd 589
03.04.2019 12:01:47
590 ЧАСТЬ IV Пороки клапанов сердца
ном характере. При наличии множества потоков, их
перешеек может находиться на разных уровнях, что
требует оценку изображения в разных плоскостях.
Эксцентрический характер особенно присущ перед-
ним потокам регургитации (см. рис. 24.9А), которые
направлены перпендикулярно короткой оси, что
может привести к переоценке степени тяжести. Так
и в обратном случае можно недооценить степень
тяжести, если струя регургитации не занимает боль-
шую протяженность, но имеет большую радиаль-
ную ширину (см. рис. 24.10Г, Д). Исследования по-
казали, что данный критерий плохо коррелирует с
тяжестью околоклапанной регургитации, которая
оценивается на магнитно-резонансной томографии
(МРТ) [41, 42], поэтому оценку околоклапанной
регургитации следует проводить не только в пози-
ции по короткой оси, она должна быть изучена со
всех сторон.
ПАРАМЕТРЫ СПЕКТРАЛЬНОЙ ДОППЛЕРОГРАФИИ
Для оценки степени тяжести регургитации на кла-
пане могут использоваться некоторые параметры
допплерографии, включая интенсивность сигнала,
ВПГД при непрерывно-волновой допплерографии,
время и скорость изменения диастолического пото-
ка в нисходящем отделе аорты (рис. 24.11, см. табл.
24.6). Однако точность всех этих параметров зача-
стую ограниченна в раннем послеоперационном
периоде из-за острого характера регургитации и
сопутствующей умеренной диастолической дис-
функции. Кроме того, время полуспада давления
сильно зависит от частоты сердечных сокращений.
Для подтверждения степени регургитации ис-
пользуется оценка реверсивного потока в нисхо-
дящем отделе аорты и измерение конечной диа-
столической скорости с помощью импульсной
допплерографии. Наличие реверсивного голодиа-
столического потока в нисходящем отделе аорты
указывает на наличие умеренной или тяжелой
аортальной регургитации, особенно при уравнива-
нии цифр интеграла скорости кровотока в обе сто-
роны и с конечной диастолической скоростью
> 20 см/сек (см. рис. 24.11, табл. 24.6) [43]. Возник-
новение реверсивного потока в нисходящем отделе
аорты сильно зависит от податливости стенок маги-
стрального сосуда, поэтому повышенная жесткость
может привести к ложноположительным результа-
там. В некоторых исследованиях отмечено, что го-
лодиастолический реверсивный поток наблюдается
у пожилых пациентов с жесткой аортой даже при
отсутствии значительной аортальной регургитации
[44]. Все это значительно ограничивает возмож-
ность применения данного параметра у пациентов
после замены аортального клапана, особенно после
Рис. 24 .10 Степень околоклапанной регургитации. При ТТЭхоКГ по короткой оси визуализируется околоклапанная регургитация различной степени (стрелки).
(А) Незначительная околоклапанная регургитация (менее 5%). (Б) Незначительная околоклапанная регургитация (5–15%). (В, Г) Околоклапанная регургитация
от незначительной до умеренной степени (от 15 до 25%). (Д) Околоклапанная регургитация от незначительной до умеренной степени (от 15 до 25%), но струя
более широкая. (Е) Околоклапанная регургитация от умеренной до тяжелой степени (более 25%) [Pibarot P, Hahn RT, Weissman NJ, Monaghan MJ. Assessment of
paravalvular regurgitation following TAVR: a proposal of unifying grading scheme. JACC Cardiovasc Imaging 8:340-360 , 2015].
А
Б
В
Г
Д
Е
In-24_для нас.indd 590
03.04.2019 12:01:48
591
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
ТИАК, учитывая то, что данная группа населения,
как правило, старше и имеет довольно жесткую аор-
ту из-за атеросклеротических процессов.
КОЛИЧЕСТВЕННЫЕ ПАРАМЕТРЫ
Такие количественные методы, как оценка площади
изоскоростной струи митральной регургитации,
редко применимы к протезам аортальных клапанов
[14]. Однако объем регургитации можно оценить,
вычислив разницу между ударными объемами ЛЖ
Невыраженная степень
Умеренная
степень
Тяжелая степень
Структура клапана и его подвижность
Механический или биологический протез
Обычно в норме
Обычно
нарушена*
Обычно нарушена*
Параметры допплерографии (качественные или полуколичественные)
Ширина потока регургитации в начальной точке
(% от диаметра ВТЛЖ): цветная допплерография
Узкий (≤ 30)
Промежуточный
(31–60)
Широкий (> 60)
Ширина vena contracta (мм): цветная
допплерография
<4
4–6
>6
Площадь vena contracta (мм2): трехмерная цветовая
допплерография
<20
20–40
>40
Глубина потока: непрерывно-волновая
допплерография
Слабая
Глубокая
Глубокая
Скорость замедления струи (ВПГД, мсек): непре-
рывно-волновая допплерография†
Медленно (> 500)
Переменчиво
(200–500)
Обрывисто (< 200)
Отношение оттока ЛЖ к оттоку правого желу-
дочка: импульсно-волновая допплерография
(отношение ударных объемов либо интегралов
скорости кровотока)
Немного увеличено (>
1,2)
Умеренно (> 1,5) Значительно увеличено
(> 1,8)
Реверсивный характер потока во время диастолы
в нисходящем отделе аорты: импульсно-волновая
допплерография£
Отсутствует либо
выражен
незначительно
Промежуточный Голодиастолический
(конечно-диастоличе-
ская скорость > 20 см/
сек)
Степень околоклапанной регургитации (%)§
<10
10–30
>30
Параметры допплерографии (количественные)
Фракция регургитации (%)
<30
30–50
>50
Непрямые показатели
Размер левого желудочка¶
Нормальный
Нормальный/либо
расширен
Расширен
* Нарушения механических протезов: околоклапанная регургитация, неподвижность створок; нарушения биологических протезов: утолще-
ние, кальцификация створок, пролапс, околоклапанная регургитация; нарушения транскатетерных клапанов: неправильная позиция стента.
† Параметр зависит от растяжимости ЛЖ. Соответственно, низкий чресклапанный конечно-диастолический градиент в аорте с умеренной/
выра женной диастолической дисфункцией ЛЖ может дать ложноположительный результат.
£ Параметр зависит от растяжимости аорты и может дать ложноположительный результат у взрослых пациентов с атеросклерозом аорты.
§ Применимо только при околоклапанной регургитации.
¶ Применимо к хронической послеоперационной регургитации после протезирования аортального клапана в отсутствии других причин.
ВПГД — время полуспада градиента давления; ВТЛЖ — выходной тракт ЛЖ.
[American Society of Echocardiography from Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves
with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography’s Guidelines and Standards Committee
and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee,
Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European
Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College
of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society
of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 22:975–1014, 2009.]
ТАБЛИЦА 24.6 Критерии допплерографии для оценки степени тяжести регургитации
(центральной и околоклапанной) на протезе аортального клапана
и правого желудочка (ПЖ), при условии отсутствия
значительной регургитации на клапане легочной
артерии (см. рис. 24.11, табл. 24.6). Но данный по-
казатель подвержен влиянию различных перемен-
ных, что в значительной степени связано с трудно-
стью измерения диаметра выходного тракта ПЖ с
помощью ТТЭхоКГ [40]. Более современный метод
основан на 3D-оценке скорости на цветном доппле-
ре в режиме реального времени. Допплерэхокарди-
ография позволяет автоматизировать количествен-
In-24_для нас.indd 591
03.04.2019 12:01:49
592
ЧАСТЬ IV Пороки клапанов сердца
ную оценку скорости потока и его объема в любой
заданной области сердца на цветном изображении
[45]. Данный метод обеспечивает высокую точность
и воспроизводимость для количественного опреде-
ления объема притока через митральный клапан и
ударного объема через аортальный клапан. Потен-
циально, использование данного метода для изме-
рения объема потока в ЛЖ и ПЖ обеспечило бы
более точную оценку регургитации на протезах
клапанов сердца.
ИНТЕГРАТИВНАЯ МУЛЬТИПАРАМЕТРИЧЕСКАЯ ОЦЕНКА
РЕГУРГИТАЦИИ НА ПРОТЕЗАХ АОРТАЛЬНЫХ КЛАПАНОВ
Оценка степени тяжести регургитации на протезе
аортального клапана более затруднительна, чем при
нативных клапанах из-за наличия околоклапанных
потоков и их эксцентрического характера (см. рис.
24.8 –24.10). Оценка степени тяжести регургитации
должна быть комплексной, интегративной и осно-
вываться на мультипараметрическом подходе, кото-
рый включает в себя качественные и полуколиче-
ственные показатели, приведенные в табл. 24.6 . При
выявлении умеренной и менее степени регургита-
ции с помощью данного подхода, то дальнейшее
исследование не выполняется. С другой стороны,
при наличии подозрения на более выраженную сте-
пень регургитации, то необходимо применить при
диагностике количественные параметры, включая
измерение перешейка струи регургитации, ее объе-
ма и фракции. Степень тяжести регургитации легко
ВТПЖ
ЛА
ЛЖ
ППГД: 546 мсек
ППГД: 243 мсек
Конечно-диастолическая скорость:
22,5 см/сек
ВТПЖ
ЛА
Ао
Рис. 24.11 Параметры допплерографии при оценке регургитации на протезе аортального клапана. (A, Б) Время полуспада градиента давления (ВПГД),
получаемый на непрерывно-волновой допплерографии, используется для оценки степени тяжести аортальной регургитации. На (А) ВПГД увеличен (546 мсек),
что указывает на незначительную регургитацию, в то время как на (Б) ВПГД укорочен (243 мсек), указывая на серьезную степень регургитации. (В) Импульсно-
волновая допплерография нисходящего отдела аорты. (Г) Для дифференцирования степени регургитации используется оценка наличия реверсивного потока и
конечно-диастолической скорости при импульсно-волновой допплерографии. Данный пациент имеет голодиастолический реверсивный поток с высокой конечно-
диастолической скоростью (22,5 см/сек), что указывает на тяжелую степень регургитации. (Д, Е) Количественная оценка объема регургитации проводится путем
расчета разницы в ударном объеме выходного тракта ЛЖ минус ударный объем выходного тракта правого желудочка (ВТПЖ) из диаметра ВТПЖ (Д) и интеграла
скорости кровотока ВТПЖ при импульсно-волновой допплерографии (Е). Диаметр ВТПЖ оценивают как со стороны выходного тракта ПЖ, так и по короткой оси
(Д). Для лучшей визуализации границ выходного тракта возможно использование цветной допплерографии. Ао — аорта; ЛА — легочная артерия; ЛЖ — левый
желудочек [Pibarot P, Hahn RT, Weissman NJ, Monaghan MJ. Assessment of paravalvular regurgitation following TAVR: a proposal of unifying grading scheme. JACC
Cardiovasc Imaging 8:340–360 , 2015].
А
Б
В
Г
Д
Е
In-24_для нас.indd 592
03.04.2019 12:01:50
593
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
подтвердить, если различные параметры согласу-
ются друг между другом. Однако параметры не
всегда коррелируют друг с другом, из-за чего требу-
ется проведение более глубокого анализа, изучения
физиологических и технических причин для разъ-
яснения этих расхождений, и в конечном счете по-
лагаться на те данные, которые являются более
точными и достоверными для протезов клапанов.
Также не следует забывать о косвенных признаках
дисфункции протезов, например, при хронической
регургитации происходит расширение ЛЖ.
При получении спорных данных на ТТЭхоКГ
либо при наличии несоответствия симптомов с кар-
тиной на ЭхоКГ следует назначить проведение МРТ
[35, 46]. На МРТ используются те же пограничные
показатели, что и на ТТЭхоКГ (т.е. ≥ 30%: умерен-
ная, ≥ 50%: тяжелая степень) [35].
РЕГУРГИТАЦИЯ НА ПРОТЕЗЕ МИТРАЛЬНОГО КЛАПАНА
ОЦЕНКА ИЗОБРАЖЕНИЙ
Оценка регургитации на протезе в митральной по-
зиции на ТТЭхоКГ крайне проблематична, т.к . на
ЛП наслаивается акустическое затенение из-за ме-
таллических компонентов импланта [14]. Данная
проблема встречается чаще при механических, чем
биологических протеза. Четкую визуализацию ЛП
и струи регургитации обеспечивает ЧПЭхоКГ, од-
нако в данном случае акустическое затенение накла-
дывается на ЛЖ (см. рис. 24.9). Таким образом,
комплексная оценка функции протеза в митраль-
ной позиции часто требует проведения как ТТЭ-
хоКГ, так и ЧПЭхоКГ, особенно при подозрении на
дисфункцию клапана.
Регургитацию на протезе в митральной позиции
при проведении ТТЭхоКГ следует подозревать при
наличии следующих признаков: схождение потоков
на стороне протеза в ЛЖ во время систолы, увели-
ченная максимальная скорость E (> 2 м/сек) или
средних градиентов (> 6 мм рт. ст.); индекс доппле-
ровской скорости > 2,2; необъяснимое появление
либо прогрессирование имеющейся легочной арте-
риальной гипертензии, расширение с гиперкинезом
стеноз ЛЖ (табл. 24.7) [30]. ЧПЭхоКГ проводят при
наличии клинической симптоматики регургитации
либо ее картины на ТТЭхоКГ [16]. ЧПЭхоКГ позво-
ляет оценить митральную регургитацию, опреде-
лить степень тяжести, локализацию и механизм ее
возникновения [47, 48]. На цветной допплерогра-
фии видны околоклапанные струи регургитации,
которые идут из ЛЖ в ЛП за кольцом протеза и
часто имеющие эксцентрический характер (см. рис.
24.9). Важное значение для определения направле-
ния и объема потоков регургитации имеет проведе-
ние исследования в нескольких плоскостях. Для
оценки локализации и причины возникновения
регургитации используют трехмерную ЧПЭхоКГ
(см. рис. 24.3).
ПАРАМЕТРЫ СТЕПЕНИ ТЯЖЕСТИ РЕГУРГИТАЦИИ
ПРОТЕЗА МИТРАЛЬНОГО КЛАПАНА
Оценка тяжести регургитации на протезе в ми-
тральной позиции крайне затруднена, т.к. все коли-
чественные параметры имеют свои ограничения и
не могут быть использованы у всех пациентов.
Поэтому рекомендуется применять комплексный
подход, который объединяет данные, полученные с
помощью ТТЭхоКГ и ЧПЭхоКГ (см. табл. 24.7).
Протез создает затенения и артефакты, что за-
трудняет оценку области регургитации в ЛП. Не-
большая тонкая струя (ее площадь < 4 см2, < 20% от
ЛП) обычно соответствует умеренной митральной
регургитации, однако зачастую ее недооценивают,
поэтому всегда следует исключить тяжелую степень
регургитации, которым характерно наличие широ-
ких потоков ≥ 8 см2, > 40% от ЛП) [14]. Ширина
перешейка струи регургитации < 3, 3–6 и > 6 мм
соответствует мягкой, умеренной и тяжелой степе-
ни регургитации (см. табл. 24.7) [37]. Значительное
завихрение струи внутри предсердия, а также нали-
чие ретроградного систолического потока в одной
или нескольких легочных венах характерны для
значительной митральной регургитации. Для оцен-
ки кровотока по легочным венам предпочтительно
использование ЧПЭхоКГ. Для подтверждения тяже-
сти регургитации рекомендуется использовать не-
прерывно-волновую допплерографию (см. табл. 24.7).
Метод PISA используется в сочетании с непре-
рывно-волновой допплерографии для оценки эф-
фективной площади отверстия регургитации [31,
49]. Однако из-за того, что потоки носят эксцентри-
ческий характер, метод PISA бывает трудно приме-
нить. Учитывая все эти важные ограничения, для
количественного определения регургитации объем-
ный метод зачастую более предпочтителен, чем
метод PISA [14].
Расчет ударного объема регургитации заключа-
ется в вычитании ударного объема выходного трак-
та ЛЖ из общего ударного объема ЛЖ, полученно-
го на 2D-ЭхоКГ. Общий ударный объем ЛЖ также
может быть получен с помощью метода Симпсона.
Тем не менее данный метод зачастую недооценива-
ет объем ЛЖ и его выходного тракта. Альтернатив-
ным способом является расчет общего ударного
объема путем умножения фракции выброса ЛЖ,
полученной методом Симпсона, на конечно-диа-
столический объем ЛЖ, полученный по формуле
Тейхольца (т.е. способ, обратный методу Дюмени-
ля) [50].
Трехмерная ЭхоКГ также может повысить точ-
ность оценки общего ударного объема ЛЖ, особен-
но с использованием контрастных средств для уси-
ления эндокардиальной границы [51]. Фракция
выброса > 60% при нормальном или увеличенном
ЛЖ, а также уменьшенный ударный объем выход-
ного тракта ЛЖ, повышают вероятность того, что у
In-24_для нас.indd 593
03.04.2019 12:01:50
594
ЧАСТЬ IV Пороки клапанов сердца
Невыраженная степень
Умеренная степень
Тяжелая степень
Структура клапана и его подвижность
Механический или биологический
протез
Обычно в норме
Обычно нарушена*
Обычно нарушена*
Параметры допплерографии (качественные или полуколичественные)
Ширина перешейка струи регургита-
ции (мм)
<3
3–5,9
≥6
Площадь потока по цветному
допплеру†
Маленький, центральный
поток (обычно < 4 см2
или < 20% от площади
ЛП)
Изменчиво
Большой центральный поток
(обычно > 8 см2 или > 40%
от площади ЛП) либо
наличие струи, которая
направлена в полость ЛП
Схождение потоков в одной точке
Нет либо минимальное
Умеренное
Значительное
Глубина потока МР: непрерывно-вол -
новая допплерография
Слабая
Глубокая
Глубокая
Контур потока МР: непрерывно-волно-
вая допплерография£
Параболический
Обычно
параболический
Пикообразный, треугольный
Поток по легочным венам: импуль-
сно-волновая допплерография
Превалирование во время
систолы
Снижение во время
систолы
Возникновение реверсивного
потока во время систолы
Индекс допплеровской скорости:
импульсно-волновая допплерография
< 2,2
2,2–2,5
> 2,5
Параметры допплерографии (качественные)
Объем регургитации (мл)
<30
30–59
>60
Фракция регургитации (%)
<30
30–50
>50
Эффективная площадь отверстия
регургитации (мм2)
<20
20–39
≥40
Непрямые показатели
Размер левого желудочка§
Нормальный
Нормальный/уме-
ренно расширен
Расширен
Размер левого предсердия¶
Нормальный
Нормальный/уме-
ренно расширен
Расширен
Легочная гипертензия (СДЛА ≥ 50 мм
рт. ст. в состоянии покоя и ≥ 60 мм
рт. ст. при физической нагрузке)
Обычно отсутствует
Изменчиво
Обычно присутствует
* Нарушения механических протезов: неподвижность, околклапанная регургитация нарушение биологических протезов: утолщенеие,
кальцификация створок либо пролапс, либо околоклапанная регургитация.
† Параметр более применим к центральным, нежели эксцентрическим, потокам.
£ На этот параметр влияет растяжимость ЛЖ.
§ Применимо к хронической послеоперационной регургитации после протезирования аортального клапана в отсутствии других причин.
¶ Применимо только для околоклапанной регургитации.
ЛП — левое предсердие; МР — митральная регургитация; СДЛА — систолическое давление в легочной артерии.
[American Society of Echocardiography from Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves
with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography’s Guidelines and Standards Committee
and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee,
Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European
Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College
of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society
of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 22:975–1014, 2009.]
ТАБЛИЦА 24.7 Критерии допплерэхокардиографии для оценки степени тяжести регургитации
(центральной и околоклапанной) на протезе митрального клапана
In-24_для нас.indd 594
03.04.2019 12:01:50
595
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
пациента имеется значительная митральная регур-
гитация. Учитывая все проблемы и ограничения
количественной оценки регургитации на протезе в
митральной позиции, всегда следует использовать
комплексный, мультипараметрический и интегра-
тивный подход (см. табл. 24.7).
КОСВЕННЫЕ ПРИЗНАКИ И ПОСЛЕДСТВИЯ РЕГУРГИТАЦИИ
ПРОТЕЗА МИТРАЛЬНОГО КЛАПАНА
Для подтверждения степени тяжести дисфункции
протеза, и, в частности, регургитации на нем, мож-
но использовать оценку размера и функции ЛЖ и
ЛП, а также систолического артериального давле-
ния в легких (см. табл. 24.6, 24.7). В частности, все
эти измерения можно сравнить с предыдущими
описанными параметрами, наличие которых, наво-
дит на мысль о присутствии регургитации, которую
трудно визуализировать. В присутствии гемодина-
мически значимой регургитации на протезе аор-
тального либо митрального клапана наблюдается
дилатация ЛЖ и увеличение объема ЛЖ, что можно
использовать в качестве сравнительной оценки
пред- и послеоперационного состояния пациента.
Однако если объем ЛЖ не снижается после замены
клапана из-за наличия регургитации или характе-
ризуется прогрессированием из-за наличия стеноза,
то следует заподозрить гемодинамическую регурги-
тацию от других факторов. С другой стороны, при
хронической регургитации на протезе аортального
или митрального клапана, отсутствие дилатации
ЛЖ и ЛП свидетельствует о незначительном объеме
струй.
РОЛЬ СТРЕСС-ЭХОКАРДИОГРАФИИ
Протезы клапанов с сохранной и нарушенной
функцией могут продуцировать появление гради-
ентов в состоянии покоя на ТТЭхоКГ, поэтому
стресс-ЭхоКГ может быть крайне полезна для под-
тверждения либо исключения наличия гемодина-
мически значимого стеноза или НПП, особенно при
несоответствии между симптомами пациента и ге-
модинамикой на протезе на ЭхоКГ [52–56]. В отли-
чие от протезов с нормальной функцией, имеющи-
ми локализовано высокие градиенты (см. рис. 24.5),
наличие стеноза клапана или значительное повы-
шение НПП обычно связано с заметным увеличе-
нием градиентов и давления в легочной артерии с
появлением симптомов и нарушением толерантно-
сти физической нагрузки при проведении стресс-Э -
хоКГ [56]. Абсолютное увеличение средних гради-
ентов на 20 мм рт. ст. и более в аортальном, на 12 мм
рт. ст. и более в митральном положении предпола-
гает серьезную дисфункцию протеза или наличие
НПП (см. табл. 24.2, 24.3) [52–55, 57]. Пиковое
стрессовое давление в легочной артерии 60 мм
рт. ст. и более отражает наличие гемодинамически
значимого стеноза протеза, регургитации или НПП
[56, 57]. Высокие градиенты в покое и при стрессе
характерны для протезов меньшего размера (≤ 21 мм
для аортальных и ≤ 25 мм для митральных клапа-
нов) [58]. Проведение теста с физической нагрузкой
крайне полезно для выявления симптомов у паци-
ентов с дисфункцией протезов или НПП, даже в тех
случаях, когда они утверждают, что жалобы отсут-
ствуют.
ПРОТЕЗЫ КЛАПАНОВ ПРАВЫХ ОТДЕЛОВ СЕРДЦА
СТЕНОЗЫ ПРОТЕЗОВ ТРЕХСТВОРЧАТЫХ КЛАПАНОВ
Скорость кровотока на трехстворчатом клапане ме-
няется не только из-за продолжительности сердеч-
ного цикла, но и из-за дыхания. Таким образом, при
проведении допплерографии и измерении показа-
телей, необходимо усреднить значения, даже при
наличии фибрилляции предсердий. Подозрение на
стеноз протеза трехстворчатого клапана возникает
при нарушении морфологии и подвижности ство-
рок клапана, превышении максимальной скорости
> 1,9 м/сек, средний градиент составляет 6 мм рт. ст.
и более, а время его полуспада 130 мсек и более
(табл. 24.8) [14]. Критерии оценки степени тяжести
регургитации аналогичны тем, которые использу-
ются при оценке нативных клапанов [14, 31]. Реко-
мендуется проводить ЧПЭхоКГ у всех пациентов,
которые имеют клинические проявления стеноза
или регургитации на трехстворчатом клапане, либо
если эти изменения выявлены на ТТЭхоКГ.
РЕГУРГИТАЦИЯ НА ПРОТЕЗАХ
ТРЕХСТВОРЧАТОГО КЛАПАНА
Для скрининга протезов трехстворчатых клапанов
используется цветная допплерография. Чем более
крупные потоки простираются вглубь правого
предсердия, тем выше степень тяжести регургита-
ции. Оценка перешейка потока регургитации обыч-
но оценивают с четырехкамерной позиции, исполь-
зуя те же настройки, что и для регургитации на
митральном клапане. Рекомендуется усреднять все
получаемые цифры на два-три удара сердца. Размер
перешейка потока > 7 мм указывает на тяжелую
степень, тогда как 6 мм и менее относят к мягкой
или умеренной регургитации. Однако часто бывает
сложно измерить ширину перешейка из-за акусти-
ческих затенений. Также сложно получить истин-
ный размер при наличии нескольких потоков ре-
гургитации.
ПРОТЕЗЫ КЛАПАНА ЛЕГОЧНОЙ АРТЕРИИ
При наличии утолщений или неподвижности ство-
рок, сужения при цветном картировании, увеличе-
ние максимальной скорости > 3,2 м/сек при биоло-
гических протезах или > 2,5 м/сек на аллотранс-
In-24_для нас.indd 595
03.04.2019 12:01:51
596 ЧАСТЬ IV Пороки клапанов сердца
Норма
Подозрение
на стеноз*
Качественные
Структура и подвижность
клапана
Норма Часто
нарушены†
Полуколичественные
Время полуспада градиента дав-
ления (мсек)
< 130
≥ 130
Индекс допплеровской скорости < 2
≥2
Параметры допплерографии (количественные)
Максимальная скорость (м/сек)£ < 1,9
≥ 1,9
Средний градиент (мм рт. ст.)£ < 6
≥6
* Учитывая изменения из-за дыхательного цикла, следует записать
данные за 3–5 сердечных циклов.
† Створки утолщены и неподвижны.
£ Может быть увеличен в сочетании с регургитацией на клапане.
ТАБЛИЦА 24.8
Критерии допплерэхокардиографии
для оценки степени тяжести стеноза
протеза трехстворчатого клапана
Норма
Подозрение на стеноз
Качественные параметры
Структура и подвижность клапана
Норма
Часто нарушены*
Цветной поток
Норма
Сужение цветного потока
Параметры допплерографии (полуколичественные)
Время полуспада градиента давления (мсек)
< 230
≥ 230
Параметры допплерографии (количественные)
Максимальная скорость (м/сек)†, £
< 3,2 для биопротезов
< 2,5 для аллотрансплантатов
≥ 3,2 для биопротезов
≥ 2,5 для аллотрансплантатов
Средний градиент (мм рт. ст.)
< 20 для биопротезов
< 15 для аллотрансплантатов
≥ 20 для биопротезов
≥ 15 для аллотрансплантатов
* Створки утолщены и неподвижны.
† Критерий применим для нормального ударного объема (50–90 мл) и скорости потока (200–300 мл/сек).
£ Увеличение максимальной скорости — более показательный параметр.
ТАБЛИЦА 24.9 Критерии допплерэхокардиографии для оценки степени тяжести
стеноза протеза клапана легочной артерии
плантатах, нарушение функций ПЖ, увеличение
систолического давления в ПЖ (табл. 24.9) следует
заподозрить стеноз протеза легочной артерии. Сте-
пень тяжести регургитации на протезах оценивается
с использованием интегративного подхода, анало-
гичного при оценке нативного клапана [14, 31].
ИНТЕРПРЕТАЦИЯ ДАННЫХ
ДОППЛЕР-ЭХОКАРДИОГРАФИИ
ВЫСОКИЕ ГРАДИЕНТЫ НА ПРОТЕЗЕ
Крайне сложно провести дифференциальную диа-
гностику при регистрации высоких градиентов на
протезах клапанов сердца, нежели, чем при оценке
нативных клапанов. Действительное, существует
несколько потенциальных причин повышенных
градиентов. Наиболее распространенной причиной
является развитие НПП, к другим потенциальным
причинам относят дисфункцию клапана, централь-
ная регургитация в двухстворчатых клапанах, а
также технические ошибки при проведении иссле-
дования [14, 27]. На рис. 24.12, 24.13 представлены
алгоритмы, которые помогают при интерпретации
высоких градиентов после протезирования ми-
трального клапана (ПМК) или протезирования аор-
тального клапана (ПАК) [59].
ПРОТЕЗЫ АОРТАЛЬНОГО КЛАПАНА
После исключения возможных технических оши-
бок, а также учитывая, что НПП — одна из наиболее
частых причин появления высоких градиентов по-
сле ПАК, первым шагом в алгоритме (см. рис. 24.12)
стоит расчет индексированной EOA, т.е. EOA, де-
ленной на площадь поверхности тела (ППТ) с ис-
пользованием эталонных значений для соответ-
ствующего типа и размера протеза (см. табл. 24.4).
Если получаемый результат < 0,85 см2/м2, то можно
предположить, что у пациента имеется НПП, и, в
зависимости от его степени тяжести (см. табл. 24.1),
оно может частично либо полностью быть причи-
ной высоких градиентов. Важно понимать, что на-
ряду с НПП, также может присутствовать дисфунк-
ция протеза. Для того чтобы определить клиниче-
ское влияние градиента, следует помнить, что
изолированный градиент зачастую меньше у паци-
ентов с небольшим диаметром аорты (т.е . < 3,0 см).
В таких случаях рекомендуется рассчитывать индекс
потери энергии [60].
Для определения причины повышенных гради-
ентов при отсутствии НПП или его незначительной
In-24_для нас.indd 596
03.04.2019 12:01:51
597
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
Высокие градиенты после ПАК
Да
Нормальные
значения
EOA*/ППТ
ЧПЭхоКГ
Rинофлуороскопия
Шаг 1
Предполагаемый индекс
EOA < 0,85 см2/м2
Предположение
Стеноз протеза
Да
Предположение:
Высокая скорость потока/регургитация
Подклапанная обструкция
Техническая ошибка
Локальные высокие градиенты
(на двухстворчатых клапанах)
Нет
Шаг 2
Атипичная морфология/подвижность створок
ИДС < 0,35
EOA < эталонных EOA (Δ > 0,3 см2)
Градиент растет в течении ПН (Δ > 10 мм рт. ст .)
EOA уменьшается, а ИДС увеличивается
в течение ПН
ВВ/ВИ > 0,37 мсек
Предположение:
Несоответствие протез-пациент
Степень тяжести? < 0,65: тяжелый
Рис. 24 .12 Алгоритм интерпретации высоких градиентов давления после протезирования аортального клапана. EOA — эффективная площадь
отверстия; ВВ — время ускорения; ВИ — время изгнания; ИДС — индекс допплеровской скорости; ПАК — протезирование аортального клапана; ПН — период
наблюдения; ППТ — площадь поверхности тела; ЧПЭхоКГ — чреспищеводная эхокардиография.
*
Для уточнения нормальных данных протезов аортальных клапанов см. табл. 24 .4 .
Высокие градиенты после ПМК
Да
Нормальные
значения
EOA*/ППТ
ЧПЭхоКГ
Кинофлуороскопия
Шаг 1
Предполагаемый индекс
EOA < 1,2 см2/м2
Предположение
Стеноз и/или
регургитация
на протезе
Да
Предположение:
Высокая скорость потока
Техническая ошибка
Локальные высокие градиенты
Нет
Шаг 2
Атипичная морфология/подвижность створок
ИДС > 2,2
EOA < эталонных EOA (Δ > 0,3 см2)
Градиент растет в течение ПН (Δ > 5 мм рт. ст .)
EOA уменьшается, а ИДС увеличивается в течении ПН
ВПГД > 130 мсек
Предположение:
Несоответствие протез-пациент
Степень тяжести?
< 0,9: тяжелый
Рис. 24 .13 Алгоритм интерпретации высоких градиентов давления после протезирования митрального клапана. EOA — эффективная площадь
отверстия; ВВ — время ускорения; ВПГД — время полуспада градиента давления; ИДС — индекс допплеровской скорости; ПМК — протезирование митрального
клапана; ПН — период наблюдения; ППТ — площадь поверхности тела; ЧПЭхоКГ — чреспищеводная эхокардиография;.
*
Для уточнения нормальных параметров протезов аортальных клапанов см. табл. 24 .5 .
In-24_для нас.indd 597
03.04.2019 12:01:51
598 ЧАСТЬ IV Пороки клапанов сердца
тяжести, следующим важным шагом будет тща-
тельная оценка морфологии и подвижности ство-
рок. Из-за того что на ТТЭхоКГ и даже ЧПЭхоКГ
часто невозможно адекватно визуализировать дви-
жение створок механических протезов, использует-
ся кинофлуороскопия (см. рис. 24.12).
При наличии нарушения подвижности створок
(рис. 24.14, 24.15, см. рис. 24.2), то следует подозре-
вать стеноз протеза клапана, что можно подтвер-
дить с помощью следующего: (1) измеренная на
ЭхоКГ EOA протеза значительно ниже, чем эталон-
ные значения для того же типа и размера импланта;
(2) EOA и индекс допплеровской скорости снизи-
лись, а скорость и градиент достоверно увеличились
во время исследований (см. табл. 24.4, рис. 24.12,
24.15). При нормальной морфологии и подвижно-
сти сворок, отсутствии отклонений в EOA и индексе
допплеровской скорости, высокие градиенты могут
быть связаны с НПП, подклапанным стенозом, тех-
ническими ошибками (например, при оценке ре-
гургитации на протезе митрального клапана при
наличии у пациента протеза аортального клапана).
Следует отметить, что наличие значительных шун-
тов при протезе аортального клапана может косвен-
но увеличивать поток через сам протез, и, таким
образом, приводить к увеличению регистрируемых
градиентов с нормальными показателями EOA. Вы-
сокие градиенты могут быть также вызваны нали-
чием центрального потока в двухстворчатых клапа-
нах (см. рис. 24.5Б).
ПРОТЕЗЫ МИТРАЛЬНЫХ КЛАПАНОВ
Аналогичный алгоритм существует для оценки вы-
соких градиентов и скоростей на протезах митраль-
Рис. 24 .14 Применение чреспищеводной эхокардиографии для диагностики и при лечении тромбоза протезированного клапана. (А) Пациент с
обструкцией двухстворчатого механического протеза в митральной позиции. Желтая стрелка указывает на большой тромб; белая стрелка — на паннус; синяя
стрелка — на подвижную створку; зеленая стрелка — на неподвижную створку. (Б) A Обструкция двухстворчатого механического протеза в митральной позиции
большим тромбом (желтая стрелка). Зеленая стрелка указывает на реверберацию неподвижной створки, окруженной тромбом, синяя стрелка — на подвижную
створку. (В) A Паннус (белые стрелки) двухстворчатого механического протеза. Одна створка (зеленая стрелка) имеет ограниченную подвижность, другая створка
подвижна (синяя стрелка). (Г) A Утолщение створок (стрелки) биологического протеза митрального клапана с высоким максимальным и средним градиентами
давления (29 и 18 мм рт. ст. соответственно) из-за тромбоза. Обструкция устранена благодаря приему аспирина. ЛЖ — левый желудочек; ЛП — левое предсердие
[A — Courtesy of Dr Steven Goldstein, Washington Hospital Center. B и C — Courtesy Dr John Chambers, Guy’s and St Thomas Hospitals, London, UK. D , Courtesy Dr
Bibiana Cujec, Mazankowski Heart Institute, Edmonton, Canada].
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
ЛЖ
ЛЖ
А
Г
В
Б
In-24_для нас.indd 598
03.04.2019 12:01:51
599
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
ных клапанов (см. рис. 24.13). Однако следует отме-
тить, что пограничные значения индексированного
EOA и допплеровских скоростей отличаются от та-
ковых для протезов аортального клапана. На по-
следнем шаге алгоритма, при нормальной подвиж-
ности створок, а индекс допплеровской скорости
< 2,2, то следует заподозрить скрытую трансклапан-
ную или околоклапанную митральную регургита-
цию и провести ЧПЭхоКГ. Аналогичная ситуация
может быть связана с регистрацией высоких гради-
ентов в центральном отверстии на двухстворчатых
протезах (см. рис. 24.5).
НИЗКИЙ УРОВЕНЬ ПОТОКА
У пациентов с низким уровнем кровотока из-за дис-
функции ЛЖ, градиенты на протезах могут быть
незначительно или умеренно повышены, несмотря
на наличие значительно выраженного НПП [27, 61].
Градиенты действительно сильно зависят от крово-
тока, поэтому может возникнуть их «псевдонорма-
лизация» в условиях низкого потока. Регистрация
небольших градиентов в сочетании с небольшой
EOA (см. табл. 24.2, 24.3) позволяет получить до-
полнительные данные. Для проведения дифферен-
цированного диагноза между истинным либо псев-
достенозом у пациентов с протезами и низким
сердечным выбросом при низких градиентах при
аортальном, либо митральном стенозах использу-
ют стресс-ЭхоКГ с добутамином. При наличии
псевдостеноза или псевдо-НПП остаточных низких
потоков через протез недостаточно для полного
раскрытия створок. Однако при проведении
Рис. 24.15 Тромбоз протеза после транскатетерной имплантации. На ЧПЭхоКГ видно утолщение и уменьшение подвижности створок (стрелка) протези-
рованного клапана A (А) с рестриктивным потоком через него A (В), высокими максимальным и средним градиентами давления (100 и 61 мм рт. ст. соответ-
ственно) и небольшая EOA (0,91 см2) (Д). Данный пациент получал лечение варфарином. Через 2 месяца были выполнены ЧПЭхоКГ и ТТЭхоКГ. Видны нормальная
морфология и подвижность створок, отсутствуют признаки тромбоза A (Б), рестрикции потока нет A (Г), гемодинамика нормальная: максимальный и средний
градиенты давления — 30 и 16 мм рт. ст. соответственно, EOA = 1 ,72 см2 (Е). Ао — аорта; ЛЖ — левый желудочек; ПЖ — правый желудочек.
ПЖ
ПЖ
ЛЖ
ЛЖ
Ао
Ао
А
Б
В
Г
Д
Е
In-24_для нас.indd 599
03.04.2019 12:01:52
600 ЧАСТЬ IV Пороки клапанов сердца
стресс-ЭхоКГ с добутамином у данной группы па-
циентов отмечается существенное увеличение EOA
клапана из-за увеличения потока с отсутствием или
незначительным повышением градиентов. С дру-
гой стороны, истинное НПП или стеноз связаны с
отсутствием или минимальным увеличением EOA,
заметным увеличением градиентов (> 20 мм рт. ст.
в аорте), а также с появлением косвенных призна-
ков (дисфункция ЛЖ, увеличение давления в легоч-
ной артерии и т.д.). Тем не менее стресс-ЭхоКГ с
добутамином не позволяет провести дифференциа-
цию между стенозом протеза и НПП. Для этих це-
лей применяют алгоритмы, представленные на рис.
24.12 и 24.13, с оценкой EOA и индекса допплеров-
ских скоростей при нормализации сердечного вы-
броса из-за проведения стресс-ЭхоКГ.
ИНТРАОПЕРАЦИОННАЯ ЭХОКАРДИОГРАФИЯ
Наиболее распространенными причинами дис-
функции протезов во время операций являются
тромбоз клапанов, захват створками хорд механи-
ческим протезом в митральной позиции, разрыв
или перфорация створок протеза. При неправиль-
ном раскрытии, позиционировании или миграции
стеноза транскатетерных биологических клапанов
может возникнуть стеноз или регургитация.
Обычно перед отключением аппарата искус-
ственного кровообращения на ЧПЭхоКГ во время
операции могут регистрироваться небольшие око-
локлпанные потоки регургитации (в 10–25% случа-
ев) [62, 63], которые значительно уменьшаются
либо вовсе исчезают после введения протамина,
спустя несколько дней, недель и месяцев после опе-
рации из-за развития процесса заживления. Уме-
ренная или тяжелая околоклапанная регургитация
(в 1–2%) после ПАК и ПМК требует возобновления
искусственного кровообращения с коррекцией дан-
ных осложнений.
Эхокардиографическая оценка в сразу после опе-
рации считается не достоверной из-за ремоделиро-
вания ЛЖ, высокого сердечного выброса, тахикар-
дии и гемодинамических изменений. Кроме этого,
проведение ТТЭхоКГ затруднительно из-за наличия
разреза, стерильных наклеек на ране. Основная за-
дача интраоперационной ЭхоКГ — выявить нали-
чие транс- либо околоклапанной регургитации с
точным измерением пиковых и средних градиентов,
а при возможности, EOA, индекса допплеровской
скорости. Однако при проведении ЭхоКГ в раннем
послеоперационном периоде могут возникнуть не-
которые проблемы. (1) Некачественные изображе-
ния приводят к ошибочному измерению диаметра
выходного тракта ЛЖ. (2) Скорость потока на вы-
ходном тракте ЛЖ может быть увеличена из-за
высокого сердечного выброса или динамической
обструкции из-за временного ремоделирования
ЛЖ, гиповолемии, использования кардиотониче-
ских препаратов. (3) Возникновение околоклапан-
ного отека или гематомы при имплантации бескар-
касного биопротеза в подкоронарную позицию
может вызвать регистрацию более низкой EOA, и
более высоким градиентам в раннем послеопераци-
онном периоде. Градиенты обычно снижаются в
течении следующих трех месяцев из-за регрессии
околоклапанного отека, гематомы, окончанию ре-
моделирования выходного тракта ЛЖ.
По этим причинам, определение высоких гради-
ентов в ранний послеоперационный период не сле-
дует воспринимать крайне серьезно. Первым шагом
является оценка наличия и степень тяжести НПП
путем вычисления прогнозируемой индексирован-
ной EOA (см. рис. 24.12, 24.13). Это не требует ис-
пользования допплерографии, и, таким образом,
метод может использоваться независимо от каче-
ства изображения и состояния гемодинамики паци-
ента. Частично или полностью высокие градиенты
объяснимы из-за наличия НПП. В отсутствии НПП
необходимо исключить некоторые вышеупомяну-
тые состояния и технические ошибки, прежде чем
выставить заключение о дисфункции протеза. Вна-
чале нужно определить, не связан ли градиент с
высокой скоростью потока в выходном тракте ЛЖ.
Если у пациента был стеноз аорты, то это может
привести к ремоделированию и временному суже-
нию выходного тракта. Также этому может способ-
ствовать использование инотропных препаратов
при отключении аппарата искусственного кровоо-
бращения. Поэтому при регистрации высоких
трансклапанных градиентов, особенно при их связи
с нарушением движения створок, рекомендуется
наблюдение пациентов с повторной оценкой на
ЭхоКГ через 3–6 месяцев.
ДОППЛЕР-ЭХОКАРДИОГРАФИЯ ПРИ ЛЕЧЕНИИ
СПЕЦИФИЧЕСКИХ ОСЛОЖНЕНИЙ ПОСЛЕ
ПРОТЕЗИРОВАНИЯ КЛАПАНОВ СЕРДЦА
ТРОМБОЗ ПРОТЕЗОВ
При подозрении на возникновении тромбоза про-
теза клапанов следует провести срочную ЭхоКГ, а
при возможности ЧПЭхоКГ (рис. 24.16, также см.
рис. 24.14, 24.15) [3]. Вначале выполняют комплекс-
ную ТТЭхоКГ, с особым вниманием оценивая под-
вижность створок, гемодинамическую функцию
клапана, оценку наличия тромбов или паннуса. В
редких случаях, развитие массивного тромбоза про-
теза приводит к нестабильной гемодинамике, и в
этих ситуациях ЧПЭхоКГ не проводится, т.к. это
показание к экстренной хирургической операции
[3]. В остальных случаях ЧПЭхоКГ предоставляет
важную диагностическую информацию, которая
может повлиять и изменить тактику консерватив-
ного лечения (см. рис. 24.14, 24.16). Более полную
картину с различных сторон протеза позволяет по-
In-24_для нас.indd 600
03.04.2019 12:01:53
601
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
лучить трехмерная ЭхоКГ и, соответственно, увели-
чить процент выявления паннусов и тромбов (см.
рис. 24.3Г) [64]. Однако даже у ЧПЭхоКГ имеются
свои ограничения. В отличие от ТТЭхоКГ, протезы
в аортальной позиции более трудно оценить, чем в
митральной, также как и вызывает трудности визу-
ализация желудочковой стороны протеза митраль-
ного клапана.
К прямым признакам тромбоза протеза клапа-
нов сердца относят неподвижность либо снижен-
ную мобильность створок, наличие тромба с обеих
сторон протеза как с обструкцией, так и без нее (см.
рис. 24.2А, 24.14, 24.15). Важно проводить диффе-
ренциальную диагностику между тромбами и фи-
брозным паннусом, который представляет кольце-
вую структуру и визуализируется в видео плотного
неподвижного эхо-участка (см. рис. 24.14). Форми-
рование паннуса чаще происходит на протезах в
аортальной позиции, а при развитии их на протезах
митральных клапанов, чаще всего они развиваются
на предсердной стороне (см. рис. 24.14). Также важ-
но различать незначительные тромбы между нитя-
ми и швами. Обычно они представляют собой тон-
кие (1 мм) подвижные фибриновые нити с перемен-
ной длиной (5–15 мм), которые чаще наблюдаются
со стороны предсердий [3]. Хоть клиническая зна-
чимость этих нитей остается неопределенной, нет
Подозрение
на тромбоз протеза клапана
Оценка степени тяжести нарушения
гемодинамики на ТТЭхоКГ (I)
Оценка размера тромба на ЧПЭхоКГ (I)
Имеется высокий риск
или противопоказание
к проведению
хирургического лечения
Класс по NYHA III–IV
Проведение
фибринолитической
терапии
+ повторение ЧПЭхоКГ
Экстренная хирургия (I):
тромбэктомия или
замена клапана
Экстренная хирургия (IIa):
тромбэктомия
или замена клапана
Фибринолитическая терапия
при персистирующем
тромболизисе после
IV терапии гепарином (IIa)
?
Подвижный или большой
тромб (≥ 5–10 мм или 0,8 см2)
Недавнее начало заболевания
(< 14 дней)
Класс по NYHA I–II
Маленький тромб (< 0,8 см2)
Тромбоз протезов клапанов
левых отделов сердца
Тромбоз протезов клапанов
правых отделов сердца
Оценка подвижности створок
на ЧПЭхоКГ, МКТ
или кинофлуороскопии (IIa)
Рис. 24 .16 Алгоритм оценки и лечения тромбоза протезов клапанов сердца. NYHA — Нью-Йоркская ассоциация кардиологов; КТ — компьютерная
томография; МКТ — мультиспиральная компьютерная томография; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография
[Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/
American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 63:e57–185, 2014].
никаких доказательств, что они связаны с повыше-
нием риска эмболии [3]. Точную информацию о
мобильности створок механических протезов пред-
ставляют кинофлуороскопия и КТ, особенно при
неубедительных данных на ЧПЭхоКГ. Также КТ
рекомендуется проводить для дифференциации
тромба и паннуса [65].
Важнейшие факторы, которые следует учиты-
вать при принятии решения в отношении лечения,
являются: (1) наличие обструкции протеза; (2) раз-
меры и мобильность тромба; (3) клиническое состо-
яние пациента и его гемодинамика (см. рис. 24.14,
24.15) [10, 66]. Интересно отметить, что с момента
начала использования ЧПЭхоКГ, стали чаще хирур-
гические вмешательства, чем фибринолиз из-за
того, что улучшилась оценка тромбоэмболических
рисков [61]. На рис. 24.16 отображен алгоритм, ко-
торый рекомендован ААС (AHA)/АКК (ACC) в
2014 г. по поводу оценки и лечения тромбозов про-
тезов [10].
ЭНДОКАРДИТ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА
Главными основаниями для выставления диагноза
инфекционного эндокардита являются эхокардио-
графические данные, а проведение ЧПЭхоКГ явля-
ется обязательным условием при эндокардите про-
In-24_для нас.indd 601
03.04.2019 12:01:53
602
ЧАСТЬ IV Пороки клапанов сердца
тезов из-за более высокой чувствительности (90–
100%) при выявлении вегетаций, абсцессов и
околоклпанного поражения (рис. 24.17) [67]. По
сравнению с эндокардитом нативных клапанов, при
поражении протезов отмечается более низкая ча-
стота вегетаций, однако более высокий процент
абсцессов и околоклапанных поражений. Чувстви-
тельность и специфичность ЧПЭхоКГ и ТТЭхоКГ
ниже при эндокардите протезов, чем при заболева-
ниях нативных клапанов [9]. Компоненты протезов
могут препятствовать обнаружению вегетаций и
абсцессов. Более того, часто бывает трудно диффе-
ренцировать вегетации или дегенерацию биологи-
ческих протезов от инфекционных поражений.
Следовательно, при эндокардите протезов часто
наблюдается отрицательная эхокардиограмма и не
позволяет исключить заболевание. Если при пер-
вичном проведении ЧПЭхоКГ диагноз не под-
тверждается, однако остается подозрение на нали-
чие инфекционного эндокардита, то исследование
следует повторять в течение 5–7 дней либо исполь-
зовать альтернативный способ визуализации, на-
пример, позитронно-эмиссионную томографию [9,
68]. Инфекционный эндокардит следует заподо-
зрить в возникновении новых потоков околокла-
панной регургитации даже в отсутствии вегетаций
и абсцессов.
ЧПЭхоКГ обладает более высокой чувствитель-
ность, чем ТТЭхоКГ, особенно при эндокардите
протеза в митральной позиции. Околоклапанные
поражения чаще встречаются при эндокардите аор-
тального клапана [9]. Вовлечение окружающих
тканей при инфекционном эндокардите зависит от
времени заражения, типа протеза. В механических
протезах инфекция обычно распространяется на
соединения между кольцом клапана и кольцом для
сшивания протеза, что приводит к развитию около-
клапанного абсцесса, псевдоаневризм и фистул,
тогда как в биологических протезах инфекция чаще
всего затрагивает створки, что приводит к их разры-
ву, перфорации и появлению вегетаций (см. рис.
24.17). Если эндокардит развивается в раннем по-
слеоперационном периоде и связан с интраопера-
ционным заражением, то инфекция обычно затра-
гивает околопротезные ткани, а в биологических
протезах створки.
Рис. 24 .17 Чреспищеводная эхокардиография при диагностике и лечении инфекционного эндокардита протезированного клапана. (А) A Большие
вегетации на створках биологического протеза митрального клапана, пролабирующие в левое предсердие (ЛП) во время систолы (стрелка). (Б) A Вегетации (белая
стрелка) на транскатетерном биологическом протезе и утолщение некоронарного синуса, что указывает на наличие абсцесса (желтая стрелка). (В) Псевдоаневризма
(стрелка) корня аорты (Ао) у пациента с биологическим протезом аортального клапана. (Г) A При цветовой допплерографии виден поток в псевдоаневризме
(стрелка). ЛЖ — левый желудочек; ПЖ — правый желудочек (А, В, Г — предоставлено Dr Gilbert Habib, Hôpital La Timone, Marseille, France).
ЛП
ЛП
ЛП
Ао
ЛЖ
ПЖ
ЛЖ
Ао
ЛЖ
А
Б
Г
В
In-24_для нас.indd 602
03.04.2019 12:01:53
603
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
ЗАКЛЮЧЕНИЕ
Основным методом визуализации при выявлении и
количественном определении дисфункции протезов
клапанов сердца, оценки осложнений и влияния этих
состояний на функцию сердца является допплерэхо-
кардиография. Однако конструкция протезов создает
некоторые проблемы с точки зрения сложности визу-
ализации. Ключом к адекватной оценке функции
протезов клапанов является интеграция комплексно-
го подхода, который объединяет как прямые, так и
косвенные параметры, полученные на ЧПЭхоКГ и
ТТЭхоКГ. В качестве дополнения или подтверждения
данных ЭхоКГ, выявления и количественного опре-
деления дисфункции протеза и осложнений могу
использоваться КТ, МРТ, кинофлуороскопия, пози-
тронно-эмиссионная томография.
Дисфункция протезов
клапанов сердца/осложнения Визуализация
Эхокардиографическая оценка
Несоответствие
протез–пациент
2D/3D-ТТЭхоКГ/ЧПЭхоКГ: оценка морфологии/
подвижности створок
Непрерывно-волновая допплерография при
оценке протеза
Импульсно-волновая допплерография для ВТЛЖ
Расчет EOA: (ППСВТЛЖ × VTI ВТЛЖ)/VTIPr
Сравнение EOA пациента с нормальными показа-
телями для каждой модели клапанов
Расчет ИДС:
Аортальный клапан
VTIВТЛЖ/VTIАо
Митральный клапан: VTIМК/VTIВТЛЖ
Альтернативная визуализация: кинофлуороско-
пия, КТ
Нормальная морфология/подвижность
створок
Высокая скорость/градиенты на клапане
EOA близка к норме
Малая индексированная EOA
Промежуточный ИДС
Умеренное увеличение соотношения
ВУ/ВИЛЖ
Стеноз на протезах клапанов
сердца
Все, что перечислено выше
Атипичная морфология/подвижность
створок
Высокая скорость/градиенты на клапане
EOA < нормальных значений
Малая индексированная EOA
Низкий ИДС (аорта); высокий ИДС
(митральный клапан)
Увеличение соотношения ВУ/ВИЛЖ
Увеличенное время полуспада градиента
давления (митральный клапан)
Регургитация на протезах
клапанов сердца
Цветной допплер с разных позиций
Оценка ширины перешейка потока регургитации
Визуальная оценка ширины потока регургитации
Визуальная оценка протяженности околоклапан-
ной регургитации
Непрерывно-волновая допплерография для
оценки потока регургитации
Оценка площади струи регургитации
Импульсно-волновая допплерография ВТЛЖ
и 2D-ТТЭхоКГ для измерения диаметра ВТЛЖ
Импульсно-волновая допплерография ВТПЖ
и 2D-ТТЭхоКГ для измерения диаметра ВТПЖ
Расчет объема регургитации: УОВТЛЖ – УОВТПЖ
(в аорте)
Расчет фракции регургитации: ПЖ/УОВТЛЖ
Импульсно-волновая допплерография нисходя-
щего отдела аорты
Трансклапанная или околоклапанная
регургитация
Критерии степени тяжести регургитации:
Большой перешеек потока регургитации
и/или большая ширина отверстия
Высокий процент степени околоклапанной
регургитации
Глубокий сигнал на непрерывно-волновой
допплерографии
Большой объем регургитации и его
фракция
Короткое время полуспада градиента дав-
ления (в аорте)
Голодиастолический реверсивный характер
кровотока в аорте с высокой конечно-ди-
астолической скоростью (в аорте)
Тромбоз протезов клапанов
сердца
2D/3D-ТТЭхоКГ/ЧПЭхоКГ: оценка подвижности
и морфологии створок, локализация и размер
тромба
Непрерывно-волновая допплерография: оценка
стеноза на клапане
Цветовая допплерография: оценка регургитации
на клапане
Альтернативная визуализация: кинофлуороско-
пия (для механических протезов 0), КТ
Аномальная морфология и подвижность
створок
Наличие тромбоза
Наличие стеноза и/или регургитации
СВОДНАЯ ИНФОРМАЦИЯ
Дисфункция протезов клапанов сердца
In-24_для нас.indd 603
03.04.2019 12:01:53
604
ЧАСТЬ IV Пороки клапанов сердца
ЛИТЕРАТУРА
1. Pibarot P, Dumesnil JG. Prosthesis-patient
mismatch: definition, clinical impact, and
prevention, Heart 92:1022–1029, 2006.
2. Pibarot P, Dumesnil JG. Valve prosthesis-pa-
tient mismatch, 1978 to 2011: from original
concept to compelling evidence, J Am Coll
Cardiol 60:1136–1139, 2012.
3. Roudaut R, Serri K, Lafitte S. Thrombosis of
prosthetic heart valves: diagnosis and thera-
peutic considerations, Heart 93:137–142, 2007.
4. Butchart EG, Gohlke-Barwolf C, Antunes MJ,
et al. Recommendations for the management
of patients after heart valve surgery, Eur
Heart J 26:2463–2471, 2005.
5. Latib A, Naganuma T, Abdel-Wahab M, et al.
Treatment and clinical outcomes of trans-
catheter heart valve thrombosis, Circ Cardio-
vasc Interv 8, 2015.
6. Makkar RR, Fontana G, Jilaihawi H, et al.
Possible subclinical leaflet thrombosis in bo-
prosthetic aortic valves, N Engl J Med
373:2015–2024, 2015.
7. Ruel M, Kulik A, Rubens FD, et al. Late inci-
dence and determinants of reoperation in
patients with prosthetic heart valves, Eur J
Cardiothorac Surg 25:364–370, 2004.
8. Schoen FJ, Levy RJ. Calcification of tissue
heart valve substitutes: progress toward un-
derstanding and prevention, Ann Thorac Surg
79:1072–1080, 2005.
9. Habib G, Lancellotti P, Antunes MJ, et al.
2015 ESC Guidelines for the management of
infective endocarditis: the task force for the
management of infective endocarditis of the
European Society of Cardiology (ESC) En-
dorsed by: European Association for Cardio-
Thoracic Surgery (EACTS), the European
Association of Nuclear Medicine (EANM),
Eur Heart J 36:3075–3128, 2015.
10. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC Guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American heart association task force on
practice guidelines, Circulation 129:e521–
e643, 2014.
11. Lorusso R, Gelsomino S, Luca F, et al. Type 2
diabetes mellitus is associated with faster de-
generation of bioprosthetic valve: results
from a propensity score-matched italian
multicenter study, Circulation 125:604–614,
2012.
12. Mahjoub H, Mathieu P, Larose E, et al. Deter-
minants of aortic bioprosthetic valve calcifi-
cation assessed by multidetector CT, Heart
101:472–477, 2015.
13. Mahjoub H, Mathieu P, Se
́
ne
́
chal M, et al.
ApoB/ApoA-I ratio is associated with in-
creased risk of bioprosthetic valve degenera-
tion, Am Coll of Cardiol 61:752–761, 2013.
14. Zoghbi WA, Chambers JB, Dumesnil JG, et al.
Recommendations for evaluation of pros-
thetic valves with echocardiography and dop-
pler ultrasound: a report From the American
Society of Echocardiography’s Guidelines
and Standards Committee and the Task Force
on Prosthetic Valves, developed in conjunc-
tion with the American College of Cardiology
Cardiovascular Imaging Committee, Cardiac
Imaging Committee of the American Heart
Association, the European Association of
Echocardiography, a registered branch of the
European Society of Cardiology, the Japanese
Society of Echocardiography and the Cana-
dian Society of Echocardiography, endorsed
by the American College of Cardiology Foun-
dation, American Heart Association, Euro-
pean Association of Echocardiography, a
registered branch of the European Society of
Cardiology, the Japanese Society of Echocar-
diography, and Canadian Society of Echocar-
diography, J Am Soc Echocardiogr 22:975–
1014, 2009.
15. Kappetein AP, Head SJ, Genereux P, et al.
Updated standardized endpoint definitions
for transcatheter aortic valve implantation:
the valve academic research Consortium-2
consensus document, Eur J Cardiothorac Surg
42:S45–S60, 2012.
16. Bach DS. Transesophageal echocardiographic
(TEE) evaluation of prosthetic valves, Cardiol
Clin 18:751–771, 2000.
17. Baumgartner H, Hung J, Bermejo J, et al.
Echocardiographic assessment of valve steno-
sis: EAE/ASE recommendations for clinical
practice, J Am Soc Echocardiogr 22:1–23, 2009.
18. Ben Zekry S, Saad RM, Ozkan M, et al. Flow
acceleration time and ratio of acceleration
time to ejection time for prosthetic aortic
valve function, JACC Cardiovasc Imaging
4:1161–1170, 2011.
19. Otto CM, Pearlman AS, Comess KA, et al.
Determination of the stenotic aortic valve
area in adults using doppler echocardiogra-
phy, J Am Coll Cardiol 7:509–517, 1986.
20. Chafizadeh ER, Zoghbi WA. Doppler echo-
cardiographic assessment of the St-Jude
medical prosthetic valve in the aortic position
using the continuity equation, Circulation
83:213–223, 1991.
21. Dumesnil JG, Honos GN, Lemieux M,
Beauchemin J. Validation and applications of
indexed aortic prosthetic valve areas calcu-
lated by doppler echocardiography, J Am Coll
Cardiol 16:637–643, 1990.
22. Pibarot P, Honos GN, Durand LG, Dumesnil
JG. Substitution of left ventricular outflow
tract diameter with prosthesis size is inade-
quate for calculation of the aortic prosthetic
valve area by the continuity equation, J Am
Soc Echocardiogr 8:511–517, 1995.
23. Clavel MA, Webb JG, Pibarot P, et al. Com-
parison of the hemodynamic performance of
percutaneous and surgical bioprostheses for
the treatment of severe aortic stenosis, J Am
Coll Cardiol 53:1883–1891, 2009.
24. Shames S, Koczo A, Hahn R, et al. Flow char-
acteristics of the SAPIEN aortic valve: the
importance of recognizing in-stent flow ac-
celeration for the echocardiographic assess-
ment of valve function, J Am Soc Echocardiogr
25:603–609, 2012.
25. Bitar JN, Lechin ME, Salazar G, Zoghbi WA.
Doppler echocardiographic assessment with
the continuity equation of St. Jude medical
mechanical prostheses in the mitral valve
position, Am J Cardiol 76:287–293, 1995.
26. Dumesnil JG, Honos GN, Lemieux M,
Beauchemin J. Validation and applications of
mitral prosthetic valvular areas calculated by
Doppler echocardiography, Am J Cardiol
65:1443–1448, 1990.
Дисфункция протезов
клапанов сердца/осложнения Визуализация
Эхокардиографическая оценка
Эндокардит протезов клапа-
нов сердца
2D/3D-ТТЭхоКГ/ЧПЭхоКГ: оценка целостности
створок и околоклапанного пространства
Непрерывно-волновая допплерография: оценка
стеноза на клапане
Цветовая допплерография: оценка регургитации
на клапане
Альтернативная визуализация: ПЭТ, КТ
Вегетации, разрушение створок, околокла-
панные абсцессы, расхождение створок,
стеноз и/или регургитация
VTI — индекс скорости кровотока; VTIPR — индекс скорости кровотока на протезе; VTIВТЛЖ — индекс скорости кровотока выходного тракта
левого желудочка; ВИЛЖ — время изгнания из левого желудочка; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт
правого желудочка; ВУ — время ускорения; ИДС — индекс допплеровской скорости; КТ — компьютерная томография; ППС — площадь
поперечного сечения; ПЭТ — позитронно-эмиссионная томография; УО — ударный объем; EOA — эффективная площадь отверстия.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Дисфункция протезов клапанов сердца
In-24_для нас.indd 604
03.04.2019 12:01:54
605
24 Диагностика и количественная оценка дисфункции протезированных клапанов сердца
27. Pibarot P, Dumesnil JG. Prosthetic heart
valves: selection of the optimal prosthesis and
long-term management, Circulation 119:
1034–1048, 2009.
28. Smadi O, Garcia J, Pibarot P, et al. Accuracy
of doppler-echocardiographic parameters for
the detection of aortic bileaflet mechanical
prosthetic valve dysfunction, Eur Heart J
Cardiovasc Imaging 15:142–151, 2014.
29. Muratori M, Montorsi P, Maffessanti F, et al.
Dysfunction of bileaflet aortic prosthesis: ac-
curacy of echocardiography versus fluoroscopy,
J Am Coll Cardiol Imaging 6:196–205, 2013.
30. Fernandes V, Olmos L, Nagueh SF, et al. Peak
early diastolic velocity rather than pressure
half-time is the best index of mechanical
prosthetic mitral valve function, Am J Car-
diol 89:704–710, 2002.
31. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the
severity of native valvular regurgitation with
two-dimensional and doppler echocardiogra-
phy, J Am Soc Echocardiogr 16:777–802, 2003.
32. Christ T, Claus B, Borck R, et al. The St. Jude
Toronto stentless bioprosthesis: up to 20 years
follow-up in younger patients, Heart Surg
Forum 18:E129–E133, 2015.
33. Milano AD, Dodonov M, Celiento M, et al.
The Sorin freedom stentless pericardial valve:
clinical and echocardiographic performance at
10 years, Int J Artif Organs 35:481–488, 2012.
34. Hahn RT, Pibarot P, Stewart WJ, et al. Com-
parison of transcatheter and surgical aortic
valve replacement in severe aortic stenosis: a
longitudinal study of echocardiography pa-
rameters in cohort A of the PARTNER Trial
(placement of aortic transcatheter valves), J
Am Coll Cardiol 61:2514–2521, 2013.
35. Pibarot P, Hahn RT, Weissman NJ, Monaghan
MJ. Assessment of paravalvular regurgitation
following TAVR: a proposal of unifying grad-
ing scheme, JACC Cardiovasc Imaging 8:340–
360, 2015.
36. Rallidis LS, Moyssakis IE, Ikonomidis I, Ni-
hoyannopoulos P. Natural history of early
aortic paraprosthetic regurgitation: a five-year
follow-up, Am Heart J 138:351–357, 1999.
37. Vitarelli A, Conde Y, Cimino E, et al. Assess-
ment of severity of mechanical prosthetic
mitral regurgitation by transoesophageal
echocardiography, Heart 90:539–544, 2004.
38. Hahn RT, Pibarot P, Weissman NJ, et al. As-
sessment of paravalvular aortic regurgitation
after transcatheter aortic valve replacement:
intra-core laboratory variability, J Am Soc
Echocardiogr 28:415–422, 2015.
39. Goncalves A, Almeria C, Marcos-Alberca P,
et al. Three-dimensional echocardiography in
paravalvular aortic regurgitation assessment
after transcatheter aortic valve implantation,
J Am Soc Echocardiogr 25:47–55, 2012.
40. Altiok E, Frick M, Meyer CG, et al. Com-
parison of two- and three-dimensional trans-
thoracic echocardiography to cardiac mag-
netic resonance imaging for assessment of
paravalvular regurgitation after transcatheter
aortic valve implantation, Am J Cardiol
113:1859–1866, 2014.
41. Ribeiro HB, Le VF, Larose E
́
, et al. Cardiac
magnetic resonance versus transthoracic
echocardiography for the assessment and
quantification of aortic regurgitation in pa-
tients undergoing transcatheter aortic valve
implantation, Heart 100:1924–1932, 2014.
42. Orwat S, Diller GP, Kaleschke G, et al. Aortic
regurgitation severity after transcatheter aor-
tic valve implantation is underestimated by
echocardiography compared with MRI, Heart
100:1933–1938, 2014.
43. Tribouilloy C, Avinee P, Shen W, et al. End
diastolic flow velocity just beneath aortic
isthmus assessed by pulsed doppler echocar-
diography: a new predictor of aortic reurgi-
tant fraction, Br Heart J 65:37–40, 1991.
44. Svedlund S, Wetterholm R, Volkmann R, Cai-
dahl K. Retrograde blood flow in the aortic
arch determined by transesophageal doppler
ultrasound, Cerebrovasc Dis 27:22–28, 2009.
45. Thavendiranathan P, Liu S, Datta S, et al.
Automated quantification of mitral inflow
and aortic outflow stroke volumes by three-
dimensional real-time volume color-flow
doppler transthoracic echocardiography:
comparison with pulsed-wave doppler and
cardiac magnetic resonance imaging, J Am Soc
Echocardiogr 25:56–65, 2012.
46. Hahn RT. Assessment of paravalvular regur-
gitation after transcatheter aortic valve re-
placement, Interventional Cardiology Clinics
4:53–66, 2015.
47. Alton M, Pasierski TJ, Orsinelli DA, et al.
Comparison of transthoracic and transesoph-
ageal echocardiography in evaluation of 47
Starr-Edwards prosthetic valves, J Am Coll
Cardiol 20:1503–1511, 1992.
48. Daniel LB, Grigg LE, Weisel RD, Rakowski H.
Comparison of transthoracic and transesoph-
ageal assessment of prosthetic valve dysfunc-
tion, Echocardiography 7:83–95, 1990.
49. Lancellotti P, Moura L, Pierard LA, et al.
European Association of Echocardiography
recommendations for the assessment of val-
vular regurgitation. Part 2: mitral and tricus-
pid regurgitation (native valve disease), Eur J
Echocardiogr 11:307–332, 2010.
50. Dumesnil JG, Dion D, Yvorchuk K, et al. A
new, simple and accurate method for deter-
mining ejection fraction by doppler echocar-
diography, Can J Cardiol 11:1007–1014, 1995.
51. Hung J, Lang R, Flachskampf F, et al. 3D
echocardiography: a review of the current
status and future directions, J Am Soc Echo-
cardiogr 20:213–233, 2007.
52. Chambers J, Rimington H, Rajani R, et al.
Hemodynamic performance on exercise:
comparison of a stentless and stented bio-
logical aortic valve replacement, J Heart Valve
Dis 13:729–733, 2004.
53. Fries R, Wendler O, Schieffer H, Scha
fers
H-J. Comparative rest and exercise hemody-
namics of 23-mm stentless versus 23-mm
stented aortic bioprostheses, Ann Thorac Surg
69:817–822, 2000.
54. Pibarot P, Dumesnil JG. Effect of exercise on
bioprosthetic valve hemodynamics, Am J
Cardiol 83:1593, 1999.
55. Pibarot P, Dumesnil JG, Jobin J, et al. Hemo-
dynamic and physical performance during
maximal exercise in patients with an aortic
bioprosthetic valve. Comparison of stentless
versus stented bioprostheses, J Am Coll Car-
diol 34:1609–1617, 1999.
56. Picano E, Pibarot P, Lancellotti P, et al. The
emerging role of exercise testing and stress
echocardiography in valvular heart disease, J
Am Coll Cardio 54:2251–2260, 2009.
57. Magne J, Lancellotti P, Pie
́
rard LA. Exercise-
induced changes in degenerative mitral regur-
gitation, J Am Coll Cardiol 56:300–309, 2010.
58. Levy F, Donal E, Biere L, et al. Hemody-
namic performance during exercise of the
new St. Jude Trifecta aortic bioprosthesis:
results from a French multicenter study, J Am
Soc Echocardiogr 27:590–597, 2014.
59. Dumesnil JG, Pibarot P. Prosthesis-patient
mismatch: an update, Curr Cardiol Rep
13:250–257, 2011.
60. Garcia D, Pibarot P, Dumesnil JG, et al. As-
sessment of aortic valve stenosis severity: a
new index based on the energy loss concept,
Circulation 101:765–771, 2000.
61. Roudaut R, Lafitte S, Roudaut MF, et al.
Management of prosthetic heart valve ob-
struction: fibrinolysis versus surgery. Early
results and long-term follow-up in a single-
centre study of 263 cases, Arch Cardiovasc Dis
102:269–277, 2009.
62. Davila-Roman VG, Waggoner AD, Kennard
ED, et al. Prevalence and severity of paravalvu-
lar regurgitation in the artificial valve endocar-
ditis reduction trial (AVERT) echocardiography
study, J Am Coll Cardiol 44:1467–1472, 2004.
63. O’Rourke DJ, Palac RT, Malenka DJ, et al.
Outcome of mild periprosthetic regurgitation
detected by intraoperative transesophageal
echocardiography, J Am Coll Cardiol 38:163–
166, 2001.
64. Singh P, Inamdar V, Hage FG, et al. Useful-
ness of live/real time three-dimensional
transthoracic echocardiography in evaluation
of prosthetic valve function, Echocardiogra-
phy 26:1236–1249, 2009.
65. Tanis W, Habets J, van den Brink RB, et al.
Differentiation of thrombus from pannus as
the cause of acquired mechanical prosthetic
heart valve obstruction by non-invasive im-
aging: a review of the literature, Eur Heart J
Cardiovasc Imaging 15:119–129, 2014.
66. Huang G, Schaff HV, Sundt TM, Rahimtoola
SH. Treatment of obstructive thrombosed
prosthetic heart valve, J Am Coll Cardiol
62:1731–1736, 2013.
67. Gould FK, Denning DW, Elliott TS, et al.
Guidelines for the diagnosis and antibiotic
treatment of endocarditis in adults: a report
of the Working Party of the British Society
for Antimicrobial Chemotherapy, J Antimi-
crob Chemother 67:269–289, 2012.
68. Saby L, Laas O, Habib G, et al. Positron emis-
sion tomography/computed tomography for
diagnosis of prosthetic valve endocarditis:
increased valvular 18F-fluorodeoxyglucose
uptake as a novel major criterion, J Am Coll
Cardiol 61:2374–2382, 2013.
69. Seeburger J, Weiss G, Borger MA, Mohr FW.
Structural valve deterioration of a corevalve
prosthesis 9 months after implantation, Eur
Heart J 34:1607, 2013.
70. Lang RM, Tsang W, Weinert L, et al. Valvular
heart disease: the value of 3-dimensional
echocardiography, J Am Coll Cardiol 58:1933–
1944, 2011.
71. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
63:e57–185, 2014.
72. Haverich A, Wahlers TC, Borger MA, et al.
Three-year hemodynamic performance, left
ventricular mass regression, and prosthetic-
patient mismatch after rapid deployment
aortic valve replacement in 287 patients, J
Thorac Cardiovasc Surg 148:2854–2860, 2014.
73. Yadlapati A, Diep J, Barnes M, et al. Compre-
hensive hemodynamic comparison and fre-
quency of patient-prosthesis mismatch be-
tween the St. Jude Medical trifecta and epic
bioprosthetic aortic valves, J Am Soc Echocar-
diogr 27:581–589, 2014.
In-24_для нас.indd 605
03.04.2019 12:01:54
In-24_для нас.indd 606
03.04.2019 12:01:54
Кардиомиопатия
и заболевания
перикарда
E’
E’’
A’
A’’
S’
S’
S’
ЧАСТЬ
ЧАСТЬ V
In-25_для нас.indd 607
03.04.2019 12:02:14
In-25_для нас.indd 608
03.04.2019 12:02:14
609
25 Дилатационная кардиомиопатия
RICHARD K. CHENG, MD, MS • SOFIA CAROLINA MASRI, MD
Классификация дилатационной
кардиомиопатии
Эпидемиология
Клинические проявления
Критерии значимости для
эхокардиографии
Эхокардиографические признаки
дилатационной кардиомиопатии
Систолическая функция левого
желудочка
Тканевая допплер-эхокардиография,
деформация и скорость деформации
Систолическая функция левого
желудочка и прогноз
Размер и форма левого желудочка
Диастолическая функция левого
желудочка
Вторичная митральная регургитация
Сократительный резерв левого
желудочка
Вовлечение правых отделов сердца
Семейный скрининг
Другие заболевания сердца,
проявляющиеся подобно
дилатационной кардиомиопатии
Некомпактный миокард левого
желудочка
Стресс-индуцированная кардиомиопатия
Миокардиты
Сердечная ресинхронизирующая
терапия
Внутрижелудочковая диссинхрония
Межжелудочковая задержка
Ответ на сердечную
ресинхронизирующую терапию
Изменения диастолической функции
при сердечной ресинхронизирующей
терапии
Ведение пациентов-неответчиков на
сердечной ресинхронизирующей
терапии
Прицельное размещение электрода
в левом желудочке
Рекомендации по ресинхронизирующей
сердечной терапии
Шкала риска сердечной
недостаточности
КЛАССИФИКАЦИЯ ДИЛАТАЦИОННОЙ
КАРДИОМИОПАТИИ
Точное определение кардиомиопатий является слож-
ным, поэтому было проведено несколько пересмо-
тров систем классификации. По классификации
кардиомиопатий, разработанной экспертами ВОЗ в
1995 г. на основе патофизиологии и клинических
проявлений, были выделены следующие группы:
дилатационная, гипертрофическая, рестриктивная,
аритмогенная дисплазия ПЖ и неклассифицируе-
мые кардиомиопатии [1]. Классификация Всемир-
ной организации здравоохранения по-прежнему
применима в клинической практике, поскольку
позволяет конкретные случаи быстро отнести к
определенной группе, основываясь на результатах
визуализации и описательных параметрах. В 2006 г.
для интеграции геномных и молекулярных данных
[2] классификация была пересмотрена American
Heart Association (AHA), а в 2008 г. — и European
Society of Cardiology [3], выделившим морфофунк-
циональные фенотипы в соответствии с дополни-
тельными генетическими данными AHA. Недавняя
схема MOGE(S) 2013 г. классифицирует нозологию,
обобщая пять признаков, присущих кардиомиопа-
тиям: морфофункциональную характеристику
(M — morphofunctional phenotype), вовлечение ор-
ганов (O — organ(s) involvement), тип семейного
генетического наследования (G — genetic inheritance
pattern), этиологию (E — etiological annotation),
функциональное состояние (S — functional status)
[4]. В этой главе термин дилатационная кардиоми-
опатия используется в качестве описательного для
клинических и диагностических признаков, наблю-
даемых при эхокардиографии (ЭхоКГ), чтобы сфо-
кусировать внимание на кардиомиопатиях, харак-
теризующихся преимущественно дилатацией лево-
го желудочка (ЛЖ) и систолической дисфункцией
ЛЖ независимо от причины, в соответствии с клас-
сификацией ВОЗ.
Ишемическая болезнь сердца обсуждается крат-
ко, потому что ее клинические проявления часто
схожи с проявлениями дилатационной кардиомио-
патии (ДКМП).
ЭПИДЕМИОЛОГИЯ
Распространенность ДКМП, скорректированная по
возрасту, в США составляет 36 случаев на 100 000
населения [5]. У 25–50% пациентов, не имеющих
клинически идентифицируемой причины ДКМП,
выявляют положительный результат при генетиче-
ском скрининге с применением имеющихся в на-
стоящее время тестов. При выявлении двух или
In-25_для нас.indd 609
03.04.2019 12:02:14
610
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
более идиопатических случаев ДКМП у близких
родственников на основе данных семейного анам-
неза, по крайней мере в трех поколениях, диагно-
стируется семейная форма ДКМП [6].
Тип наследования семейной кардиомиопатии яв-
ляется изменчивым с выраженной генетической
гетерогенностью; большинство мутаций являются
аутосомно-доминантными, но возможны и другие
типы наследования. Более 50 одиночных генов свя-
заны с фенотипом ДКМП, включая мутации в генах,
кодирующих цитоскелетные, нуклеоскелетные, ми-
тохондриальные и кальцийсвязывающие белки [7].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
ДКМП включает гетерогенную группу поражений
миокарда, характеризующуюся дилатацией ЛЖ и
снижением фракции выброса (ФВ) ЛЖ при отсут-
ствии других причин для увеличения постнагрузки
или перегрузки объемом. Поражение миокарда свя-
зано с аномальным соотношением давления и объ-
ема, что приводит к дилатации и эксцентричному
ремоделированию ЛЖ (рис. 25 .1) с увеличением
общей массы сердца. Традиционные диагностиче-
ские критерии включают ФВ ЛЖ < 45%, фракцию
сокращения < 25%, а конечный диастолический
размер ЛЖ > 112% от расчетного индексированного
на площадь поверхности тела (ППТ) [8].
Ремоделирование ЛЖ является динамическим
процессом и обусловлено дисбалансом между на-
пряжением стенки миокарда и нормальной ограни-
чивающей силой, создаваемой вязкоэластическим
коллагеновым матриксом. По мере увеличения на-
пряжения стенки механорецепторы клеточной по-
верхности активируют матриксные металлопротеи-
назы миокарда, что приводит к деградации внекле-
точного коллагенового матрикса и в результате к
дилатации ЛЖ. Постепенное увеличение размера
ЛЖ, непропорционально большее по короткой оси
относительно длинной оси, приводит к изменениям
геометрии ЛЖ от нормального вытянутого эллипса
к сферической форме. Это ремоделирование может
быть охарактеризовано индексом сферичности (от-
ношением продольный размер/поперечный размер,
у здоровых людей > 1,5), который на поздних ста-
диях ДКМП приближается к 1.
Более сферическая форма ЛЖ влияет на другие
аспекты динамики ЛЖ, в первую очередь, на увели-
чение конечного диастолического напряжения стен-
ки ЛЖ, что препятствует сократительной эффек-
тивности. Дополнительно к увеличенному объему
ЛЖ, утолщение его стенки приводит к дальнейшему
повышению нагрузки и снижению сократительной
функции. Увеличенная сферическая геометрия и
эксцентрическое ремоделирование приводят к де-
формации митрального кольца и подклапанного
аппарата, что препятствует правильному смыканию
(коаптации) створок митрального клапана и спо-
собствует развитию вторичной митральной регур-
гитации (МР). Таким образом, изменения в ремо-
делированном желудочке приводят к дальнейшей
дилатации ЛЖ. Сильная обратная связь существу-
ет между конечным систолическим напряжением
стенки ЛЖ и ФВ таким образом, что чем больше
напряжение стенки, тем ниже ФВ. При прогресси-
рующем снижении сократимости и увеличении
объема ЛЖ снижается скорость кровотока внутри
ЛЖ и создается относительный застой, который
иногда визуализируется как спонтанное контрасти-
рование при ЭхоКГ. Это сочетание факторов пред-
располагает к формированию тромбов в ЛЖ (рис.
25.2).
Для возникновения ДКМП существует множест-
во причин, и есть много других заболеваний сердца,
которые напоминают ДКМП (табл. 25 .1). У людей с
ДКМП обычно при обследовании выявляются при-
знаки и симптомы левосторонней сердечной недо-
статочности (СН). Пациенты жалуются на ограни-
чение функциональных способностей, связанное с
одышкой при нагрузке. У них наблюдается ортоп-
ноэ (одышка в положении лежа) и пароксизмальная
ночная одышка, обусловленные перегрузкой объе-
мом. При вовлечении правых отделов сердца воз-
никает отек нижних конечностей и вздутие живота
с признаками почечной дисфункции.
Визуализация сердца имеет первостепенное зна-
чение для диагностики ДКМП и дает представление
ПЖ
ПЖ
ПП
Ао
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
ЛП
Рис. 25.1 Дилатационная кардиомиопатия. ТТЭхоКГ пациента с идиопа-
тической дилатационной кардиомиопатией. (А) A Парастернальная позиция
по длинной оси левого желудочка (ЛЖ). (Б) A Парастернальная позиция по
короткой оси ЛЖ. (В) A Апикальная четырехкамерная позиция. (Г) A Апи-
кальная двухкамерная позиция. Снижение систолической функции и дилата-
ция ЛЖ вследствие перегрузки объемом с компенсаторным увеличением
толщины стенки и непараллельным увеличением радиуса полости, т.е . эксцен-
трической гипертрофии. Ao — аорта; ЛЖ — левый желудочек; ЛП — левое
предсердие; ПЖ — правый желудочек
А
Б
Г
В
In-25_для нас.indd 610
03.04.2019 12:02:14
611
25 Дилатационная кардиомиопатия
ЛЖ
ЛЖ
ПЖ
Рис. 25.2 A Тромб в левом желудочке. Эхокардиографическое проявление тромба в левом желудочке (ЛЖ) (стрелки) в апикальной четырехкамерной пози-
ции и парастернальной позиции по короткой оси ЛЖ. ПЖ — правый желудочек.
о причинно-следственных механизмах. Обследова-
ние на ранних стадиях заболевания будет демон-
стрировать слабо выраженную дилатацию ЛЖ и
незначительно сниженную ФВ при нормальной
толщине стенок. По мере прогрессирования болез-
ни происходит дальнейшая дилатация ЛЖ, истон-
чение стенок ЛЖ и снижение систолической функ-
ции. Регионарное изменение движения стенок с
большей вероятностью связано с ишемическими
процессами, особенно если нарушения соответству-
ют зоне кровоснабжения определенной коронарной
артерии.
При ранее перенесенном инфаркте миокарда
рубцовая ткань в зоне повреждения является тон-
кой и эхогенной, и может образоваться аневризма
(рис. 25.3). У пациентов с неишемическими причи-
нами нарушений могут также определяться некото-
рые регионарные изменения в движении стенок,
поскольку базальные задние сегменты часто демон-
стрируют лучшую сохранность функции по срав-
нению с другими стенками. При одновременной
гипертрофии с дилатацией и дисфункцией ЛЖ
дифференциальная диагностика проводится с тер-
минальной стадией гипертонической болезни и
инфильтративной кардиомиопатией с прогресси-
рующим ремоделированием.
КРИТЕРИИ ЗНАЧИМОСТИ ДЛЯ ЭХОКАРДИОГРАФИИ
AHA/American College of Cardiology (ACC) предо-
ставляют рекомендации I класса для определения
структуры ЛЖ и других нарушений при эхокардио-
графической визуализации, которые облегчают по-
нимание клинических проявлений СН. Повторная
эхокардиографическая визуализация должна быть
проведена лицам с клиническими изменениями и
тем, кому планируется лечение специфической си-
столической дисфункции с помощью таких им-
плантируемых устройств, как кардиовертер-дефи-
бриллятор (ИКД) [9].
ACC/American Society of Echocardiography (ASE)/
AHA также предоставляют соответствующие крите-
рии использования ЭхоКГ для кардиомиопатий,
которые соответствуют руководствам по СН ACCF/
AHA, но с более детализированными уточнениями
[10]. Наиболее применимые рекомендации для си-
столической СН и ДКМП приведены в табл. 25 .2 .
ЭХОКАРДИОГРАФИЧЕСКИЕ ПРИЗНАКИ
ДИЛАТАЦИОННОЙ КАРДИОМИОПАТИИ
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
У всех пациентов с ДКМП необходимо проводить
оценку систолических параметров ЛЖ. Информа-
цию о комплексной оценке систолической функции
ЛЖ смотри в главе 7. Наиболее распространенным
методом количественной оценки ФВ ЛЖ является
двухмерная (2D) визуализация с использованием
метода суммирования дисков в двух плоскостях
(модифицированный алгоритм Симпсона) (рис.
25.4А–Г). Латеральное разрешение в апикальном
сечении ЛЖ при 2D-визуализации имеет сущест-
венные ограничения. Трехмерная (3D) ЭхоКГ (см.
рис. 25 .4Д) обеспечивает более точное определение
объема ЛЖ, его массы и ФВ, главным образом из-за
устранения необходимости в геометрических пред-
положениях (табл. 25 .3).
Для оценки пациентов с ДКМП сохраняют акту-
альность конкретные результаты при исследова-
нии в М-режиме. Отдаленность пика Е МК от
МЖП (расстояние Е-МЖП в норме 6 мм) (рис.
In-25_для нас.indd 611
03.04.2019 12:02:14
612
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Диагноз
Характерные особенности, выявляемые при эхокардиографии, и примечания
Идиопатическая дилатационная кардио-
миопатия, включая семейный тип
Классические проявления, включая дилатацию ЛЖ, увеличение индекса сферично-
сти и систолическую дисфункцию ЛЖ
Ишемическая болезнь сердца
Регионарные нарушения движения стенки, эхогенность и истончение стенки,
обусловленное наличием рубца, возможно формирование аневризмы в области
перенесенного ранее инфаркта
Гипертензивная болезнь сердца
Терминальная стадия гипертензивной болезни сердца может проявляться дилата-
цией и систолической дисфункцией ЛЖ. В большинстве случаев отмечается
гипертрофия ЛЖ, что бывает сложно дифференцировать с поздними стадиями
инфильтративных болезней сердца
Амилоидоз
Обычно наблюдается утолщение миокарда, перикардиальный выпот, рестриктив-
ные нарушения, расширение левого предсердия и формирование внутрисердеч-
ного тромба; дилатация обычно отсутствует; ФВ ЛЖ обычно сохранена до
поздних стадий заболевания
Саркоидоз
Дилатация ЛЖ, истончение перегородки, снижение ФВ, аневризма желудочка
и может возникать эхогенность тканей сердца в связи с формированием рубца;
часто регионарные нарушения движения стенки в областях, не соответствующих
бассейнам коронарных артерий
Гемохроматоз
Слабо выра женная дилатация ЛЖ или ее отсутствие, незначительное утолщение
стенки, нарушение диастолических параметров
Миокардит
Нарушения движения стенки могут быть как диффузными, так и регионарными;
степень дилатации ЛЖ может быть различна; миокард может быть утолщен из-за
отека; может присутствовать перикардиальный выпот
Гиперэозинофильный синдром
Проявления зависят от стадии. На ранней стадии практически нормальные эхокар-
диографические показатели. На более поздних стадиях — ламинарный тромбоз
в областях поврежденного эндокарда, нарушения клапанов, обусловленные
фиброзно-воспалительным ремоделированием, и повышение эхогенности мио-
карда в связи с фиброзом, наиболее часто поражающим нижнебоковую стенку
Системные воспалительные заболевания
(например, системная красная вол-
чанка, ревматоидный артрит и т.д.)
Проявления могут быть различными и неспецифичными в зависимости от состоя-
ния. Может наблюдаться вовлечение клапанов, перикарда, миокарда и/или коро-
нарных сосудов (см. главу 35)
Токсическое воздействие: алкоголь,
кокаин
Может проявляться подобно идиопатической ДКМП. При алкогольной кардиомио-
патии часто отмечается дилатация ЛЖ и увеличение сферичности. Изменения
являются обратимыми при отмене употребления алкоголя
Химиотерапия: доксорубицин,
трастузумаб
Проявления могут быть сходными с идиопатической ДКМП
Заболевания щитовидной железы
Проявления могут быть сходными с идиопатической ДКМП
Некомпактность ЛЖ
Выра женные трабекулы ЛЖ с расширенными межтрабекулярными углублениями;
в более поздних стадиях поражения отмечается дилатация ЛЖ со снижением ФВ
Перипартальная кардиомиопатия
Проявления могут быть сходными с идиопатической ДКМП. Диагностика часто
осуществляется на основании времени, прошедшего после недавней беременности
Синдром Такоцубо
Гипокинезия верхушки при сохранности кинетики базальных сегментов; часто
четко идентифицируется стрессовый фактор. Большинство случаев разрешается
с нормализацией функции ЛЖ
ВПС
Различные проявления в зависимости от анатомии и вовлечения структур сердца
ВПС — врожденный порок сердца; ДКМП — дилатационная кардиомиопатия; ФВ — фракция выброса.
[Thomas DE, Wheeler R, Yousef ZR, Masani ND. The role of echocardiography in guiding management in dilated cardiomyopathy. Eur J
Echocardiogr10:iii, 15–21, 2009.]
ТАБЛИЦА 25.1 Дифференциальная диагностика дилатационной кардиомиопатии
In-25_для нас.indd 612
03.04.2019 12:02:15
613
25 Дилатационная кардиомиопатия
ЛЖ
ЛЖ
ЛП
Ао
Рис. 25.3 A A Ишемическая болезнь сердца. У пациента в анамнезе
инфаркт миокарда в зоне кровоснабжения левой передней нисходящей арте-
рии с признаками нарушения сократимости переднего, переднесептального и
апикального сегментов, истончение миокарда и эхогенный рубец в этих облас-
тях с формированием верхушечной аневризмы (стрелки). Ao — аорта; ЛЖ —
левый желудочек; ЛП — левое предсердие.
25.5) является косвенным признаком сниженной
ФВ, прогрессирующее увеличение расстояния Е-
МЖП, ассоциировано с ухудшением систоличе-
ской функции. Более плавное смыкание аорталь-
ного клапана отражает уменьшение потока выбро-
са и ударного объема крови. Старым индексом
продольной систолической функции ЛЖ является
смещение фиброзного кольца МК при измерении
в М-режиме (нормальное значение > 10 мм). Су-
ществует прямая связь между экскурсией кольца
МК и ФВ, снижению экскурсии соответствует сни-
жение ФВ. Однако это справедливо только при
наличии общей систолической дисфункции, по-
скольку экскурсия фиброзного кольца МК не по-
Целесообразно (показано)
7. Клинические симптомы или признаки, соответствующие кардиальному диагнозу, если известны, случаи головокруже-
ния/предобморочное состояние/обморок (включая, но не ограничиваясь, стенозом аорты, гипертрофической кардиомио-
патией или СН) (С, 9)
70. Первоначальный осмотр пациентов с установленной или подозреваемой СН (систолической или диастолической)
на основании симптомов, признаков или при выявлении нарушений по результатам анализов (С, 9)
71. Повторный осмотр пациентов с установленной СН (систолической или диастолической) при изменении клинического
статуса или результатов кардиологического обследования при отсутствии видимых изменений при медикаментозном
лечении или соблюдении диеты (С, 8)
73. Повторный осмотр пациентов с установленной СН (систолической или диастолической) для определения лечения (С, 9)
76. Первичный осмотр или повторный осмотр после реваскуляризации и/или оптимальной лекарственной терапии для
определения кандидатов для аппаратной терапии и/или для оптимального выбора устройства (С, 9)
78. Наличие симптомов при ранее имплантированном устройстве электрической стимуляции сердца, возможно обусловлен-
ных неполадками устройства или его субоптимальной настройкой (С, 8)
81. Определение кандидатов на установку устройства для вспомогательного кровообращения (С, 9)
86. Первичная оценка установленной или предполагаемой кардиомиопатии (например, рестриктивной, инфильтративной,
дилатационной, гипертрофической или наследственной кардиомиопатии) (С, 9)
87. Повторная оценка установленной кардиомиопатии при изменении клинического статуса или результатов кардиологиче-
ского обследования, или для определения дальнейшей терапии (С, 9)
90. Оценка результатов скрининга структуры и функции сердца у родственников первой степени пациента с наследственной
кардиомиопатией (С, 9)
Неопределенно (возможно)
72. Повторная оценка пациента с установленной СН (систолической или диастолической) при изменении клинического
статуса или данных кардиологического исследования с явными признаками изменений под влиянием лекарственной
терапии или диеты (НО, 4)
75. Регулярное наблюдение (≥ 1 раза в год) пациентов с СН (систолической или диастолической) при отсутствии изменений
в клиническом статусе или результатах кардиологического обследования (НО, 6)
77. Первичная оценка оптимизации устройства СРТ после имплантации (НО, 6)
89. Регулярное наблюдение (≥ 1 раза в год) пациентов с установленной кардиомиопатией без изменения клинического
статуса или результатов кардиологического обследования (НО, 5)
Нецелесообразно (не показано)
74. Регулярное наблюдение (< 1 раза в год) пациентов с СН (систолической или диастолической) при отсутствии изменений
в клиническом статусе или результатах кардиологического обследования (НС, 2)
88. Регулярное наблюдение (< 1раза в год) при установленной кардиомиопатии без изменения клинического статуса или
результатов кардиологического обследования (НС, 2)
* От 1 до 9 — баллы соответствия.
НО — неопределенные; НС — несоответствующие; С — соответствующие. СН — сердечная недостаточность; СРТ — сердечная ресинхро-
низирующая терапия.
[Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 appropriate use criteria for
echocardiography. A report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of
Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society,
Society for Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography,
Society for Cardiovascular Magnetic Resonance American College of Chest Physicians. J Am Soc Echocardiogr 24:229267, 2011.]
ТАБЛИЦА 25.2 Критерии* ASE для целесообразности применения эхокардиографии в диагностике сердечной
недостаточности и кардиомиопатии
In-25_для нас.indd 613
03.04.2019 12:02:15
615
25 Дилатационная кардиомиопатия
Метод визуализации
Ограничения
2D (двухмерная) ЭхоКГ
Предпочтительными являются количественные методы оценки ФВ
ЛЖ, такие как метод суммирования дисков в двух плоскостях
Расположение датчика или угловое смещение могут
привести к сокращению ракурса
Для количественной оценки ФВ ЛЖ существуют геоме-
трические ограничения
При возникновении ошибки с границами трассировки
рассмотрите вариант контрастирования, если границы
эндокарда четко не определены
Плохая воспроизводимость связана с различиями
в методах получения изображений
3D (трехмерная) ЭхоКГ
Улучшено качество визуализации и одновременная двухпроекцион-
ная визуализация по сравнению с 2D-ЭхоКГ
Автоматическое обнаружение поверхности эндокарда ЛЖ меньше
зависит от геометрических ограничений — может быть лучше,
чем 2D, когда форма ЛЖ деформирована
Более низкое временное и пространственное разреше-
ние, чем у 2D-ЭхоКГ
Артефакты движения могут помешать получению
изображения
Деформация миокарда
Оценивает продольное сжатие, циркулярное укорочение и радиаль-
ное утолщение
Может выполняться с использованием либо тканевой допплерогра-
фии, либо спекл-трекинга
Зависит от угла при применении тканевой допплерогра-
фии для оценки деформации
Сигнальный шум и реверберация могут создавать арте-
факты и ограничивать спекл-трекинг
Внеплоскостное движение сердца не может быть зафик-
сировано ни при одном методе визуализации
Во многих случаях может потребоваться постобработка,
что может потребовать много времени
Радионуклидная визуализация
Радионуклидная ангиография
ОЭКТ
ПЭТ — лучшее пространственное и временное разрешение,
чем у ОЭКТ
Требуется стабильная, регулярная частота сердечных
сокращений для ОЭКТ и ПЭТ
Необходима коррекция поглощения излучения
Не предоставляет информацию о других параметрах
сердца, таких как диастолическая функция, клапаны
и т.д.
Лучевая нагрузка
МСКТ сердца
Многофазное получение изображения может обеспечить оценку
ФВ; ретроспективная синхронизация используется для восстанов-
ления изображений на протяжении всего сердечного цикла
Может обеспечить объемную оценку ФВ
Более высокое пространственное разрешение, чем у МРТ сердца
и эхокардиографии
Требуется медленный сердечный ритм для соответству-
ющей синхронизации
Плохое временное разрешение; может быть трудно диф-
ференцировать достоверно точные фазы сердечного
цикла
Лучевая нагрузка
МРТ сердца
Более высокое пространственное разрешение, чем у 2D
эхокардиографии
Схожее временное разрешение с 2D-эхокардиографией
Меньшее влияние прилежащей костной ткани или воздуха
по сравнению с эхокардиографией
Менее выраженное геометрическое ограничение — объемный
анализ выполняется в небольших сегментах
Позволяет достоверно оценить функцию ПЖ
Превосходное выявление границы между пулом крови
и эндокардом
Отсутствие излучения (по сравнению с МСКТ или радиоизотоп-
ными исследованиями)
Для получения непрерывных срезов всего ЛЖ требуется
несколько задержек дыхания
Прерывистость охвата или неправильная ориентировка
срезов ЛЖ может возникать при переменном дыхании
Требуется последующая обработка изображений
Требуется сравнительно длительное время сбора данных
Несовместимо с некоторыми медицинскими устройст-
вами, содержащими металлические компоненты
ЛЖ— левый желудочек; МРТ — магнитно -резонансная томография; МСКТ — мультиспиральная компьютерная томография; ОЭКТ —
однофотонная эмиссионная компьютерная томография; ПЖ— правый желудочек; ПЭТ — позитронно-эмиссионная томография; ФВ —
фракция выброса; ЭхоКГ— эхокардиография.
ТАБЛИЦА 25.3 Методы визуализации для оценки систолической функции левого желудочка
In-25_для нас.indd 615
03.04.2019 12:02:16
614
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
зволяет выявить дистальные или очаговые регио-
нарные нарушения.
Ударный объем крови и сердечный выброс мож-
но рассчитать по интегралу линейной скорости
кровотока, полученному при импульсно-волновой
допплерографии в выносящем тракте ЛЖ. Решаю-
щее значение имеет точное определение диаметра
выносящего тракта ЛЖ, поскольку при возведении
в квадрат радиуса для вычисления ударного объема
крови незначительные ошибки существенно возра-
стают. При ДКМП снижаются как ударный крови,
так и сердечный выброс. У пациентов с тяжелой
систолической дисфункцией скорость и интеграл
линейной скорости кровотока в выносящем тракте
ЛЖ могут меняться от удара к удару, что клиниче-
ски проявляется альтернирующим пульсом (рис.
25.6).
Скорость нарастания давления в ЛЖ в фазе ран-
ней систолы, dP/dt max, является еще одним пока-
зателем сократительной способности ЛЖ. Показа-
тель dP/dt позволяет оценить скорость увеличения
давления в ЛЖ, с предположением, что увеличение
силы сокращения приведет к более высоким значе-
ниям данного показателя. Нормальные значения
для dP/dt max составляют от 1000 до 1200 мм рт. ст./
сек, и при ДКМП наблюдается их значительное сни-
ПЖ
ПЖ
ПП
ПП
ЛП
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
ЛЖ
ЛЖ
Рис. 25.4 Количественная оценка фракции выброса у пациента с дилатационной кардиомиопатией. Оценка фракции выброса методом суммирования
дисков (в двух плоскостях) в апикальной четырехкамерной позиции (А, Б) и апикальной двухкамерной позиции (В, Г) в 2D-режиме. (Д) A ЭхоКГ в 3D-режиме
обеспечивает более точное определение объема ЛЖ и ФВ, позволяя преодолеть геометрические ограничения допущений. ЛП — левое предсердие; ПЖ — пра-
вый желудочек; ПП — правое предсердие.
А
Б
В
Г
Д
In-25_для нас.indd 614
03.04.2019 12:02:15
617
25 Дилатационная кардиомиопатия
нительную информацию для 2D-ЭхоКГ. Механика
систолического сокращения ЛЖ представляет со-
бой сложные скоординированные действия, вклю-
чающие интеграцию продольного сжатия, кругово-
го («циркулярного») сокращения и радиального
утолщения. Скорость, деформация и скорость де-
формации тканей снижены при ДКМП и дают пред-
ставление о механизме дисфункции ЛЖ. Для полу-
чения полной информации об этих методах визуа-
лизации см. главу 8.
Тканевая допплерография позволяет количест-
венно оценить как глобальную, так и регионарную
функции и синхронизацию сердечной деятельнос-
ти. Продольная систолическая скорость смещения
кольца МК (Sa) или скорость движения миокарда
(Sm, норма > 6 см/сек) отражают продольное дви-
жение желудочка и коррелируют как с ФВ, так и с
инвазивным показателем dP/dT [13]. Субэндокар-
диальные волокна миокарда играют важную роль в
продольной сократительной функции миокарда и
особенно чувствительны к нарушениям, оценка Sm
позволяет выявить незначительную систолическую
дисфункцию ЛЖ. Усредненное значение макси-
мальной систолической скорости миокарда, изме-
ренной в 6 точках кольца МК и составляющее
> 5,4 см/сек, свидетельствует о нормальной ФВ с
чувствительностью 88% и специфичностью 97%
[14].
Несмотря на значимость тканевой допплерогра-
фии, скорость движения миокарда, измеренная с ее
помощью, подвержена влиянию поступательного
движения сердца и угла сканирования. Это ограни-
чение может быть преодолено путем измерения
деформации миокарда посредством визуализации
деформации и скорости деформации. Скорость де-
формации и смещения миокарда выше в базальных
сегментах по сравнению с верхушкой, о чем свиде-
тельствует сокращение основания при относитель-
но неизменной верхушке. В нормальном сердце
значения продольной деформации обычно состав-
ляют от –15 до –25% при скорости деформации от
1 до 1,5 в сек или выше. С помощью режима отсле-
живания пятна можно выявить субклиническую
дисфункцию ЛЖ, даже при сохранности ФВ и сег-
ментарной функции, что предоставляет прогности-
ческую информацию у пациентов с СН [15].
ДКМП сопровождается ухудшением всех показа-
телей деформации, включая продольную (рис. 25 .7),
циркулярную и радиальную деформации, а также
нарушением вращения вокруг оси. Миокардиаль-
ные волокна, участвующие в процессе деформации,
при вовлечении в патологический процесс изменя-
ют величину продольной и циркулярной деформа-
ции. Исследования показали, что определение гло-
бальной продольной деформации (GLS — global
longitudinal strain) методом отслеживания пятна
превосходит показатель ФВ ЛЖ для определения
риска развития СН у пациентов [16].
Недавно был применен метод 3D-стрейн визуа-
лизации в режиме реального времени для оценки
смещения кольца митрального клапана по всей его
окружности, что позволило дать более точную
оценку его сложной экскурсии и деформации [17].
Было показано, что глобальная деформация являет-
ся чувствительным параметром для выявления не-
значительной систолической дисфункции ЛЖ. В
ходе исследования, включавшего когорту здоровых
людей и пациентов с СН, наблюдалось прогресси-
рующее снижение параметров глобальной дефор-
мации при проведении 3D-стрейн ЭхоКГ с увеличе-
нием стадии СН от A до D (ACCF/AHA), причем на
стадии D отмечались самые низкие значения. Толь-
ко показатель глобальной деформации позволил
выявить небольшие различия между пациентами с
СН на стадии A и здоровыми людьми [18].
При ДКМП происходит уменьшение амплитуды
ротации ЛЖ на уровне основания и верхушки, что
уменьшает скорость скручивания и раскручивания
ЛЖ [19]. Вследствие ремоделирования ЛЖ при
ДКМП механическое преимущество субэпикарди-
альных мышечных волокон уменьшается, а скручи-
вание (твист) ЛЖ уменьшается по мере увеличения
объема полости ЛЖ. Таким образом, на поздних
стадиях ДКМП происходит парадоксальное обрат-
ное вращение ЛЖ (вращение основания против ча-
совой стрелки, а конечное систолическое вращение
верхушки по часовой стрелке).
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
И ПРОГНОЗ
Систолическая дисфункция ЛЖ является надежной
детерминантой функциональной способности и
общего прогноза. ФВ часто используется в качестве
основного прогностического фактора в клиниче-
ских условиях, как было подтверждено в ходе мно-
гочисленных исследований по мере снижения ФВ
увеличивается риск летальных исходов [20–22]. ФВ
ЛЖ позволяет идентифицировать пациентов с по-
вышенным риском внезапной смерти, и считается
наиболее важным параметром для показаний по
имплантации кардиовертера-дефибриллятора.
У пациентов с плохим качеством визуализации
для стратификации риска используют тканевую доп-
плерографию, поскольку менее зависима от качест-
ва изображения. Например, вариабельность воспро-
изводимости показателя Sm у различных исследова-
телей составляет от 4 до 8%. В исследовании пациентов
с хронической СН показатель Sm был самым силь-
ным предиктором летального исхода или показаний
к трансплантации сердца с пороговым значением,
равным 2,8 см/сек [23].
При выявлении нарушений показателей, полу-
ченных другими методами оценки сердечной функ-
ции, таких как dP/dt и индекс производительности
миокарда, была продемонстрирована корреляция с
In-25_для нас.indd 617
03.04.2019 12:02:17
616
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Зубец В
Е–МЖП
Рис. 25.5 Результаты эхокардиографии в M-режиме при дилатацион-
ной кардиомиопатии. Эхокардиография в М-режиме была выполнена на
уровне митрального клапана в левой парастернальной позиции по длинной оси
левого желудочка. Увеличены размеры левого желудочка, укорочена фракция
сокращения и увеличено расстояние Е–МЖП. Также присутствует зубец B,
свидетельствующий о повышенном конечном диастолическом давлении в ле-
вом желудочке.
TAPSE
Dist 0.972 см
Время 306 мсек
Vel 6.85 см/сек
PG 0ммрт.ст.
Рис. 25.6 Альтернирующий пульс и дисфункция ПЖ при дилатационной кардиомиопатии. На верхнем левом изображении показано округление профи-
ля аортального клапана (белые стрелки) в М-режиме, а на верхнем правом изображении продемонстрирован пример альтернирующего пульса с изменением
ударного объема с каждым ударом (красные стрелки). Внизу показано снижение функции правого желудочка: слева — снижение систолического смещения
фиброзного кольца трикуспидального клапана (TAPSE) и систолической скорости (s′) у данного пациента.
жение. Оценку dP/dt производят на основании из-
мерения струи МР, а измерение эксцентрических
струй приводит к некорректным оценкам. Кроме
того, dP/dt также зависит от преднагрузки, постна-
грузки и частоты сердечных сокращений, меняю-
щихся при различных состояниях.
Индекс производительности миокарда, предло-
женный C. Tei и коллегами [11], является допплеро-
графическим показателем, позволяющим дать об-
щую оценку систолической и диастолической эф-
фективности. Преимущества заключаются в том,
что он не зависит от частоты сердечных сокраще-
ний, артериального давления и геометрии желудоч-
ка. Индекс производительности миокарда отражает
тяжесть заболевания и имеет возрастающую про-
гностическую ценность по сравнению с другими
параметрами при ДКМП при пороговом значении
приблизительно 0,4 [12]. Увеличение значения оз-
начает ухудшение сердечной производительности.
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ,
ДЕФОРМАЦИЯ И СКОРОСТЬ ДЕФОРМАЦИИ
Тканевая допплерография и режим отслеживания
пятен (speckle tracking) могут предоставить допол-
In-25_для нас.indd 616
03.04.2019 12:02:16
618
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
низкой выживаемостью. Значение dP/dt ниже 600,
выявленное в ходе исследования пациентов с СН,
указывает на повышенный риск летального исхода
или на необходимость проведения пересадки сердца
[24]. В ходе другого исследования, проведенного с
участием 285 пациентов с хронической СН, кото-
рым проводилась сердечная ресинхронизирующая
терапия (СРТ), исходное значение dP/dt ниже 650 мм
рт. ст./сек или ниже 900 мм рт. ст./сек после прове-
дения СРТ коррелировало с неблагоприятными
клиническими исходами через 1 год, включая все
случаи летальности, трансплантации сердца или
использование аппарата вспомогательного кровоо-
бращения (искусственного ЛЖ) [25]. У пациентов с
ДКМП индекс производительности миокарда выше
0,77 позволяет прогнозировать значительно более
низкую 1-, 3- и 5-летнюю выживаемость (75, 36 и
26% соответственно) по сравнению с индексом про-
изводительности миокарда ниже 0,77 (92, 83 и 78%
соответственно) [12, 26].
Нарушение глобальной продольной деформации
(GLS) ЛЖ связано с более тяжелой дисфункцией ЛЖ
и предоставляет дополнительную прогностическую
информацию к ФВ. В ходе исследования с участием
194 пациентов с хронической систолической СН
проводилась оценка данных допплерографии для
прогноза и лечения, путем определения деформа-
ции ЛЖ с помощью режима отслеживания пятна.
Значения показателя GLS ЛЖ –6,95% или более ста-
ло независимым прогностическим фактором сер-
дечных событий (смерть, пересадка сердца и госпи-
тализация в связи с СН в течение 5 лет) при СН как
ишемического, так и неишемического генеза, неза-
висимо от возраста, ФВ и E/e’ (отношения ранней
скорости Е кровотока через митральный клапан к
ранней диастолической скорости е’ движения ми-
трального фиброзного кольца), и обладал большей
прогностической значимостью, чем ФВ ЛЖ. Гло-
бальная циркулярная деформация (GCS) ЛЖ –7,15%
или более служила прогностическим показателем
неблагоприятных явлений только у пациентов с не-
ишемической СН (рис. 25 .8) [27].
В другой группе из 416 пациентов с хронической
систолической СН продольная, циркулярная и ра-
диальная деформации ЛЖ, а также скорость дефор-
мации коррелировали с общей смертностью, транс-
плантацией сердца и установкой искусственного
ЛЖ в течение последующего периода наблюдения,
равного 8,9 года. Применение параметров деформа-
ции дополнительно к ФВ ЛЖ повысило предсказа-
тельную ценность при прогнозировании клиниче-
ских результатов [28].
ЛЖ
ПЖ
ПП ЛП
ЛЖ
ЛЖ
Peak systolic strain
HR (avg.) = 62 bpm
EDV (bi-plane) = 519 .2 ml
ESV (bi-plane) = 397 .0 ml
EF (bi-plane) = 23 .5%
Time SD = 97.6 ms
AP3 L. strain = -11 .1%
AP4 L. strain = - 3.0%
AP2 L. strain = - 5.3%
Global L. strain = -6 .3%
ЛП
ЛП
Ао
Рис. 25.7 Снижение глобальной продольной деформации при дилатационной кардиомиопатии. Оценка глобальной продольной деформации в апи-
кальной четырехкамерной позиции A (А), апикальной двухкамерной позиции A (Б) и апикальной трехкамерной позиции A (В). (Г) Глобальная продольная
деформация заметно нарушена во всех позициях (–6 ,3%). Ao — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; ПП —
правое предсердие.
А
Б
Г
В
In-25_для нас.indd 618
03.04.2019 12:02:17
619
25 Дилатационная кардиомиопатия
РАЗМЕР И ФОРМА ЛЕВОГО ЖЕЛУДОЧКА
Увеличение размеров как конечного систолическо-
го, так и конечного диастолического ЛЖ в значи-
тельной мере связано с неблагоприятными исхода-
ми. Анализ результатов клинического исследования
Studies of Left Ventricular Dysfunction (SOLVD) по-
казал, что конечный систолический диаметр > 5,0 см
является прогностическим фактором увеличения
смертности [21]. В группе пациентов с идиопатиче-
ской ДКМП пороговым значением повышенного
риска смертности оказался конечный диастоличе-
ский размер > 7,6 см [29]. Аналогичным образом
увеличение систолического и диастолического объ-
емов ЛЖ коррелирует с повышением риска небла-
гоприятных исходов [30]. Исследование, в ходе ко-
торого производилась оценка эхокардиографиче-
ских параметров у пациентов с СН на поздней
стадии, показало, что индекс конечного диастоличе-
ского объема ЛЖ 120 мл/м2 являлся сильным про-
гностическим фактором летальности [30]. Более
того, ряд исследований подтвердил ценность после-
довательных изменений параметров ремоделирова-
ния ЛЖ для прогнозирования клинических резуль-
татов у пациентов с дилатацией ЛЖ или уменьше-
нием ФВ [31, 32].
Увеличение массы ЛЖ из-за гипертрофии мио-
цитов при ДКМП самостоятельно приводит к ухуд-
шению прогноза [21, 31]. Изменение массы ЛЖ на
одно среднее квадратичное отклонение (в среднем
298 ± 103 г) может увеличить относительный риск
смерти на целых 1,3 [21]. По мере ремоделирования
ЛЖ при ДКМП он все больше теряет свою эллип-
тическую форму и становится более сферическим.
Конечный систолический и конечный диастоличе-
ский индексы сферичности < 1,5 являются прогно-
стическими факторами снижения способности пе-
реносить физическую нагрузку и неблагоприятных
долгосрочных результатов [33].
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Почти у всех пациентов с систолической дисфунк-
цией наблюдается нарушение релаксации и сниже-
ние эластичности желудочка различной степени.
Оценка диастолической функции ЛЖ должна быть
неотъемлемой частью алгоритма обследования па-
циентов с ДКМП (для получения полной информа-
ции об оценке диастолической функции см. главу
9). Нарушение диастолического наполнения ЛЖ
тесно связано с функциональным состоянием и
прогнозом. У пациентов с систолической дисфунк-
цией гемодинамика значительно отличается в зави-
симости от степени диастолической дисфункции.
Большинство эхокардиографических исследова-
ний диастолической функции проводится с приме-
нением допплеровского режима. Тем не менее един-
ственной показательной находкой в M-режиме
ЭхоКГ является B-зубец (см. рис. 25 .5), который
возникает в результате задержки смыкания сворок
митрального клапана, что в результате приводит к
появлению небольшой зазубрины (выемки) между
точками сопоставления створок. Эта находка корре-
лирует с повышенным конечным диастолическим
давлением в ЛЖ, обычно превышающим 20 мм
рт. ст.
Пациенты с СН и нарушениями диастолической
функции, в частности рестриктивными, характери-
зующимися высокими значениями отношения E/A,
укорочением времени замедления волны Е транс-
митрального кровотока, увеличением E/e’ и низким
показателем e′ (рис. 25 .9), имеют повышенную ле-
тальность. При обследовании пожилых и пациен-
тов среднего возраста митральный коэффициент
E/A > 1,5 коррелировал с двукратных повышением
показателя общей смертности и трехкратным уве-
личением смертности, обусловленной сердечными
причинами, даже после корректировки по сопутст-
вующим заболеваниям [34]. В клиническом иссле-
довании, включавшем пациентов с прогрессирую-
щей ХСН, было показано, что время замедления
кровотока < 150 мсек обладает предсказательной
способностью относительно комбинированной ко-
нечной точки смерти, госпитализации по поводу
СН и трансплантации сердца [30]. После стратифи-
кации пациентов с СН на основе ФВ ЛЖ и E/e′ наи-
больший риск повторной госпитализации и сердеч-
ной смерти был отмечен у пациентов с ФВ 40% или
меньше и E/e’ — 15 или более [35]. Наличие ре-
стриктивного типа нарушения диастолической
функции коррелирует с высокой смертностью и
необходимостью пересадки сердца [36].
1-Специфичность
Прогнозирование неблагоприятных исходов
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
(
%
)
1,0
0,8
0,6
0,4
0,2
0,0
0
0,2
0,6
0,4
0,8
1,0
ГПД ЛЖ (AUC = 0,662, p < 0,001)
ГЦД ЛЖ (AUC = 0,588, p = 0,034)
ФВ ЛЖ (AUC = 0,645, p = 0,001)
Рис. 25.8 Кривые прогнозирования летального исхода, пересадки
сердца или прогрессирования сердечной недостаточности на основе
глобальной продольной деформации (ГПД) левого желудочка (ЛЖ),
глобальной циркулярной деформации (ГЦД) и фракции выброса (ФВ)
ЛЖ. Область под кривой ГПД была наибольшей с минимальной точкой отсе-
чения –6 ,95%. Синяя линия отражает ГПД ЛЖ; зеленая линия отражает ГЦД
ЛЖ; красная линия обозначает ФВ ЛЖ [Zhang KW, French B, May Khan A, et al.
Strain improves risk prediction beyond ejection fraction in chronic systolic heart
failure. J Am Heart Assoc 3:e000550, 2014].
In-25_для нас.indd 619
03.04.2019 12:02:17
620
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Даже у пациентов с менее выраженной диастоли-
ческой дисфункцией, включая нарушение релакса-
ции или псевдонормализацию митрального крово-
тока, все же отмечается повышенный риск, хотя и
не в той же степени, что при рестриктивном типе
нарушений. В исследовании по оценке пациентов,
госпитализированных по поводу обострения СН,
было показано увеличение общей смертности и по-
вторной госпитализации по поводу СН у пациентов
с рестриктивным типом диастолической дисфунк-
ции, по сравнению с пациентами, у которых от-
мечалось нарушение релаксации по данным доп-
плерографии, предшествовавшей госпитализации.
Летальность в группе пациентов с диастолической
дисфункцией псевдонормального типа не отлича-
лась от уровня в группах пациентов с диастоличе-
ской дисфункцией рестриктивного типа или нару-
шением релаксации, хотя показатель повторной
госпитализации был выше, чем в группе с наруше-
нием релаксации [37].
Размер ЛП является важным прогностическим
маркером у пациентов с СН и ДКМП. ЛП вносит
вклад в увеличение систолического объема у паци-
ентов с выраженной СН. Таким образом, дилатация
ЛП может нарушать гемодинамику и коррелирует с
более высокими показателями смертности и госпи-
тализации по поводу сердечно-сосудистой патоло-
гии. Индексирование диаметра ЛП позволяет дать
более точные оценки благодаря нормализации раз-
мера ЛП для каждого человека. В исследовании, в
ходе которого производилась оценка различных
параметров у пациентов с дисфункцией ЛЖ, вклю-
чая демографические данные, клинические крите-
рии и эхокардиографические допплеровские изме-
рения, размер ЛП > 26 мм/м2 был самым значимым
прогностическим фактором летального исхода [38].
Размеры ЛП определялись с помощью биплановых
методик, поскольку форма ЛП часто является асим-
метричной, что ограничивает точность одномерно-
го измерения [10]. У пациентов с ДКМП объем ЛП
> 68,5 мл/м2 коррелировал с заметным повышением
риска, по сравнению с теми, у кого отмечался мень-
ший объем ЛП, и представлял собой самостоятель-
ный прогностический фактор даже после учета на-
личия фибрилляция предсердий, объема ЛЖ, ФВ
ЛЖ, МН и отношения E/A [21, 39].
Другим важным показателем диастолической
дисфункции относительно независимым от нагруз-
ки и частоты сердечных сокращений является
трансмитральная скорость распространения пото-
ка, зарегистрированная с помощью цветового доп-
плеровского картирования кровотока в M-режиме.
В здоровом сердце скорость распространения пото-
ка превышает 50 мм/сек. Снижение данного показа-
теля связано с нарушением релаксации ЛЖ за счет
уменьшения градиента давления между ЛП и ЛЖ.
Показатель скорости распространения потока по-
зволяет оценить эффективный компонент релакса-
ции в фазу диастолы, но непригоден для достовер-
ного определения эластичности ЛЖ. Соотношение
скорости Е трансмитрального кровотока к скорости
распространения потока (E/Vp) > 1,5 является
Сглаживание контура систолического
потока в легочной вене
Снижение скорости e’
перегородочной стенки ЛЖ
Снижение скорости
e’ боковой стенки ЛЖ
Увеличение коэффициента E/A и короткое время
замедления кровотока
Рис. 25.9 A Рестриктивный тип наполнения у пациента с дилатационной кардиомиопатией. Наблюдается заметное увеличение коэффициента E/A,
короткое время замедления кровотока, снижение скорости e’ перегородочной и боковой стенок и сглаживание контура систолического потока в легочной вене. В
данном случае наблюдается также спонтанное эхоконтрастирование в левом желудочке (ЛЖ), что указывает на снижение скоростей потока.
In-25_для нас.indd 620
03.04.2019 12:02:17
621
25 Дилатационная кардиомиопатия
предиктором повышения КДДЛЖ (конечного ди-
астолического давления в ЛЖ) > 15 мм рт. ст. с
диагностической точностью положительного и
отрицательного результатов, равных 93 и 72%
соответственно [40, 41].
ОТНОСИТЕЛЬНАЯ МИТРАЛЬНАЯ НЕДОСТАТОЧНОСТЬ
По мере прогрессирования ДКМП формируется
относительная МН (рис. 25 .10) вследствие сочета-
ния ремоделирования и увеличения сферичности с
гипертрофией ЛЖ, снижения силы сокращения,
обусловленного систолической дисфункцией, дила-
тации и уплощения митрального кольца, апикаль-
ного и бокового смещения папиллярных мышц, и
внутрижелудочковой диссинхронии боковой и пе-
регородочной стенок ЛЖ (рис. 25 .11) [42, 43].
При прогрессирующем ремоделировании ЛЖ
происходит деформация митрального клапанного
аппарата, что приводит к формированию тента или
«шатра» (натяжения) створок. Площадь тента мож-
но рассчитать в середину систолы из левой пара-
стернальной позиции по длинной оси ЛЖ, измеряя
площадь, ограниченную плоскостью клапанного
кольца и точкой коаптации створок митрального
клапана. Площадь тента митрального клапана силь-
но коррелирует с тяжестью относительной МН, а
значение 3,4 см2 или выше связано с повышенным
риском летального исхода или госпитализации по
поводу СН [44]. Прогрессирование тяжести МН у
пациентов с СН является независимым прогности-
ческим фактором неблагоприятных исходов [30]. В
ходе исследования с участием пациентов с СН была
отмечена корреляция ФВ ЛЖ, равной 35% или ме-
нее, и тяжелой МН с относительным риском леталь-
ного исхода 1,8 [45].
Оценка МН подробно описана в главе 18. Досто-
верная оценка относительной МН может быть
сложной задачей. Стандартное двухмерное исследо-
вание основано на измерении струи митральной
регургитации (МР) в перешейке регургитации или
проксимальной зоне конвергенции, но эти измере-
ния предполагают наличие округлого отверстия.
Однако отверстие при относительной МН обычно
является овальным. Трехмерное эхокардиографи-
ческое измерение позволяет преодолеть это ограни-
чение посредством прямой планиметрии перешей-
ЛП
ЛП
ЛЖ
ЛЖ
Нормальный МК
Относительная митральная недостаточность
Сосочковая
мышца
Ао
ЛЖ
Хорда
Фиброзное кольцо
митрального клапана
ЛП
Искривление
ЛЖ
Смещение
сосочковой
мышцы
Натяжение
хорды Ограничение
закрытия
створок МК
Дилатация
кольца МК
«Выгибание»
створки
кпереди
МР
Ао
ЛЖ
Рис. 25.10 A Вторичная митральная регургитация. У пациента с дилатационной кардиомиопатией происходит деформация фиброзного кольца митрально-
го клапана со смещением папиллярных мышц, в результате возникает центральная струя митральной регургитации (стрелка).
Рис. 25.11 Механизм относительной митральной недостаточности. Соотношение строения митрального клапана (МК) и левого желудочка (ЛЖ) у здоро-
вых людей (слева) и при патологических состояниях (справа, относительная митральная недостаточность) (см. главу 18). АО — аорта; ЛП — левое предсердие;
МР — митральная регургитация [Hung J, Capoulade R. Therapy for secondary mitral regurgitation: time to cut the chord? Heart 101:996–997, 2015].
In-25_для нас.indd 621
03.04.2019 12:02:18
622
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ка регургитации (рис. 25.12). Тяжесть относитель-
ной МН изменяется во время сердечного цикла, что
также усложняет ее достоверную оценку. В ходе
нескольких исследований было показано, что более
низкие количественные показатели МР коррелиру-
ют с более тяжелой относительной МН по сравне-
нию с первичной МН. В настоящее время общепри-
нятые значения, согласующиеся с тяжелой относи-
тельной МН, включают площадь эффективного
регургитационного отверстия 20 мм2 или более,
объем регургитации 30 мл или более и фракцию
регургитации по меньшей мере 50% [46, 47].
Тактика ведения относительной МН является
сложной, нацеленной на уменьшение симптомов,
сокращение количества госпитализаций и улучше-
ние выживаемости. В основе адекватного медика-
ментозного лечения СН лежит коррекция дисфунк-
ции ЛЖ, которая должна быть назначена с расчетом
на обратное ремоделирование, что может привести
к снижению тяжести МН. СРТ может быть эффек-
тивна у отдельных людей за счет восстановления
синхронного сокращения желудочков, что способ-
ствует обратному ремоделированию, особенно у
пациентов с неишемической кардиомиопатией.
Тяжесть относительной МН снижается примерно у
40–50% пациентов после СРТ [48, 49].
Хотя пластика митрального клапана при относи-
тельной МН может привести к облегчению симпто-
мов и улучшению функции ЛЖ, однако не пред-
ставляет явных преимуществ в выживаемости [50].
В руководстве ACCF/AHA 2014 г. по тактике ведения
пациентов с пороками клапанов сердца предостав-
лены рекомендации класса IIb по пластике или за-
мене митрального клапана у пациентов с тяжелой
симптоматикой (New York Heart Association (NYHA)
III–IV) с хронической тяжелой относительной МН
(стадия D) с персистирующими симптомами, не-
смотря на оптимальную лекарственную терапию
СН и при отсутствии других операций на сердце
[47]. Хотя существует возрастающий интерес к чре-
скатетерной хирургии относительной МН, данные
по этой теме остаются недостаточными. В руковод-
стве по СН ACCF/AHA 2013 г. предоставлена реко-
мендация IIb о том, что чрескатетерная пластика
или хирургия митрального клапана при относи-
тельной МН имеет неопределенное преимущество
и ее следует рассматривать только после тщательно-
го отбора пациентов и проведения оптимальной
лекарственной терапии [9].
СОКРАТИТЕЛЬНЫЙ РЕЗЕРВ ЛЕВОГО ЖЕЛУДОЧКА
У части пациентов с ДКМП может нарастать систо-
лическая функция в ответ на нагрузку. Эта способ-
ность напрямую коррелирует с выживаемостью
[51]. Сократительный резерв можно оценить с по-
мощью стресс-эхокардиографии с инфузией малых
доз добутамина, оценивая изменения систолическо-
го объема, хотя это не является рутинным исследо-
ванием для всех пациентов с ДКМП. Другие методы
определения сократительного резерва включали
параметры сердечного выброса, ФВ ЛЖ, индекс ло-
кальной сократимости и анализ деформации. При
измерении сократительного резерва ЛЖ у пациен-
тов с ДКМП, отмечалась достоверная специфич-
ность (89%), но низкая чувствительность (65%) для
прогнозирования неблагоприятных событий [52].
ВОВЛЕЧЕНИЕ ПРАВЫХ ОТДЕЛОВ СЕРДЦА
Приблизительно у 34% пациентов с ДКМП наблю-
дается вовлечение ПЖ [53]. Количественная оценка
функции ПЖ более затруднительна, чем функции
ЛЖ из-за его сложной анатомии и формы. Дис-
функция ПЖ является независимым прогностиче-
ским фактором сердечно-сосудистой летальности и
госпитализации по поводу СН [53]. У пациентов с
преобладающим вовлечением ЛЖ показатель об-
щей выживаемости лучше и ниже тяжесть митраль-
ной и трикуспидальной регургитации (ТР), по срав-
нению с пациентами с вовлечением обоих желудоч-
ков [54].
В главах 31–33 подробно обсуждается правиль-
ная оценка анатомии и функции ПЖ, легочной
гипертензии и функции клапанов правых отделов
сердца. Систолическое смещение фиброзного коль-
ца трикуспидального клапана (TAPSE) (см. рис.
25.6) обеспечивает дополнительную прогностиче-
скую информацию к часто используемым параме-
трам функционального класса, ФВ ЛЖ и доппле-
ровским параметрам трансмитрального кровотока
у пациентов с ДКМП [55]. Оценка функции ПЖ с
помощью тканевой допплерографии используется
для прогноза. При оценке различных систолических
и диастолических функциональных параметров
ПЖ систолическая скорость смещения фиброзного
кольца трикуспидального клапана < 10,8 см/сек и
индекс Tei для ПЖ, превышающий 1,20, позволяли
прогнозировать самую низкую бессобытийную вы-
живаемость [56]. Измерение глобальной продоль-
ной деформации ПЖ было предложено в качестве
метода количественной оценки механики ПЖ и для
долгосрочного прогнозирования неблагоприятных
событий у пациентов с дисфункцией ЛЖ [57]. По-
добно сократительному резерву ЛЖ, сократитель-
ный резерв ПЖ может быть оценен с помощью
анализа деформации и является дополнительным
прогностическим фактором [58].
У многих пациентов с ДКМП развивается трику-
спидальная регургитация из-за деформации трику-
спидального клапана и дилатации фиброзного
кольца, обусловленной ремоделированием ПЖ.
Трикуспидальная регургитация является независи-
мым прогностическим фактором неблагоприятных
клинических исходов [45]. У пациентов с ДКМП
может развиться повышение давления в легочной
In-25_для нас.indd 622
03.04.2019 12:02:18
623
25 Дилатационная кардиомиопатия
ЛЖ
ЛЖ
ЛП
ЛП
Рис. 25.12 Трехмерная чреспищеводная оценка относительной митральной недостаточности. Овальное отверстие струи перешейка регургитации без
цветного допплера A (A) и с ним A (Б). Представлена деформация митрального кольца и неполная коаптация (стрелки) сворок, приводящая к МР. ЛЖ
—
левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
А
Б
In-25_для нас.indd 623
03.04.2019 12:02:18
624
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
артерии из-за нарушения наполнения ЛЖ или от-
носительной МН, и это коррелирует с худшим про-
гнозом [59]. Упрощенный подход к эхокардиогра-
фической оценке ДКМП показан на рис. 25 .13.
СЕМЕЙНЫЙ СКРИНИНГ
У всех родственников первой степени (включая ро-
дителей) лиц с идиопатической ДКМП необходимо
проводить скрининг с выполнением ЭхоКГ и элек-
трокардиографии (ЭКГ) [9, 60]. В ходе стандартного
скрининга приходится сталкиваться с трудной зада-
чей определения, являются ли слабо выраженные
эхокардиографические изменения ранними при-
знаками ДКМП. Было высказано предположение о
том, что расширение ЛЖ представляет собой самый
ранний признак доклинического поражения при
ДКМП [61]. У членов семьи с первоначально нор-
мальными результатами скрининга сохраняется
повышенной риск для развития заболевания в по-
следующем. Поэтому рекомендовано проведение
повторной ЭхоКГ каждые 3–5 лет [62]. У членов
семьи с идентифицированными мутациями, отве-
чающими за ДКМП, скрининг необходимо прово-
дить чаще — каждые 1–3 года [6].
ДРУГИЕ ЗАБОЛЕВАНИЯ СЕРДЦА, ПРОЯВЛЯЮЩИЕСЯ
ПОДОБНО ДИЛАТАЦИОННОЙ КАРДИОМИОПАТИИ
НЕКОМПАКТНОСТЬ ЛЕВОГО ЖЕЛУДОЧКА
Хотя она обычно не связана с ДКМП, имеет смысл
обсуждения некомпактности ЛЖ, при которой на
поздних стадиях наблюдается дилатация ЛЖ и сни-
жение ФВ. При ЭхоКГ дифференциальным призна-
ком некомпактности являются выраженные трабе-
кулы ЛЖ (рис. 25 .14) с расширенными межтрабеку-
лярными углублениями. Некомпактность возникает
вследствие задержки нормального эмбриогенеза
эндокарда и миокарда, что приводит к нарушению
уплотнения рыхлой сетки волокон и межтрабеку-
лярных углублений, которые образуют миокард во
время эмбрионального периода.
Широко используемые эхокардиографические
критерии изолированной некомпактности были
предложены R. Jenni и коллегами и включают в себя
утолщение стенки ЛЖ с соотношением некомпакт-
ного и компактного слоев миокарда более чем 2 : 1
в левой парастернальной позиции по короткой оси
ЛЖ в конце систолы, заполнение межтрабекуляр-
ных пространств кровью, определяемое с помощью
цветового допплеровского картирования, и отсут-
ствие сосуществующих нарушений сердечной дея-
тельности [63].
Двухслойность миокарда следует оценивать в
нескольких сечениях по короткой оси на уровне
сосочковых мышц и верхушки, поскольку этот по-
казатель вариабелен на разных уровнях. Внеосевые
изображения могут искажать толщину слоев. При-
менение ЭхоКГ с контрастированием позволяет
повысить четкость изображения между компакт-
ным и некомпактным слоями миокарда. Крайне
важно исключить другие патологические процессы,
имеющие проявления, сходные с некомпактностью
миокарда, включая тромбоз ЛЖ, дополнительную
хорду и апикальную гипертрофическую кардиоми-
опатию. Систолическая деформация, скорость де-
формации и ротация ЛЖ при некомпактности
снижаются [64]. Для подтверждения диагноза
оправдано выполнение магнитно-резонансной
компьютерной томографии сердца.
Вовлечение
правого желудочка
ССТК
Фракционное изменение
площади
Деформация ПЖ
Степень тяжести МР
Степень тяжести ТР
Систолическое давление в ЛА
Оценка клапанов
Сократительный
резерв
ЛЖиПЖ
Систолическая
функция ЛЖ
Фракция выброса ЛЖ
dP/dt
ИПМ
Параметры деформации ЛЖ
Тип трансмитрального кровотока,
размер и объем левого предсердия
Систолический размер и объем
Диастолический размер и объем
Сферичность ЛЖ
Масса ЛЖ
Размер и
геометрия ЛЖ
Диастолическая
дисфункция
Рис. 25.13 Упрощенный подход к эхокардиографической оценке дилатационной кардиомиопатии. ИПМ — индекс производительности миокарда;
ЛА — легочная артерия; ЛЖ — левый желудочек; МР — митральная регургитация; ПЖ — правый желудочек; ССТК — систолическое смещение трикуспидаль-
ного кольца; ТР — трикуспидальная регургитация.
In-25_для нас.indd 624
03.04.2019 12:02:20
625
25 Дилатационная кардиомиопатия
ЛЖ
ПЖ
Рис. 25.14 A Некомпактность левого желудочка. В области верхушки
левого желудочка (ЛЖ) определяются трабекулы и межтрабекулярные углуб-
ления (стрелки). ПЖ — правый желудочек.
Адекватное медикаментозное лечение сходно с
лечением при других заболеваниях с систолической
СН. У пациентов с некомпактностью отмечается
риск развития тромбов в пространствах некомпакт-
ного миокарда, поэтому в процессе визуализация
необходимо проведение тщательной оценки трабе-
кул на предмет тромбоза. Независимо от наличия
тромба или его отсутствия общепринято назначе-
ние антикоагулянтной терапии пациентам со сни-
женной ФВ ЛЖ и некомпактностью из-за повышен-
ного риска тромбообразования [65]. Кроме того, у
пациентов с некомпактностью повышен риск пред-
сердной и желудочковой аритмий.
СТРЕССИНДУЦИРОВАННАЯ КАРДИОМИОПАТИЯ
Остро возникшая сердечная стресс-индуцирован-
ная кардиомиопатия (Takotsubo) может иметь раз-
личные проявления, но, как правило, сопровожда-
ется транзиторной систолической дисфункцией
среднего и апикального сегментов ЛЖ. Крайне
важно дифференцировать это состояние от ДКМП,
потому что их прогнозы значительно разнятся.
Предполагаемые механизмы стресс-индуцирован-
ной кардиомиопатии включают чрезмерную симпа-
тическую стимуляцию на фоне избытка адреналина,
коронароспазм и микрососудистую дисфункцию.
Синдром встречается обычно у лиц старше 50 лет и
чаще у женщин, по сравнению с мужчинами [66].
Может повышаться уровень кардиальных биомар-
керов (включая тропонин-I), но при выполнении
коронарографии не выявляется значительного по-
ражения коронарных сосудов.
Диагностические критерии клиники Mayo для
стресс-индуцированной кардиомиопатии включа-
ют (1) транзиторный акинез или дискинезию апи-
кального и среднего сегментов ЛЖ с регионарными
нарушениями движения стенки, в которые вовлече-
ны зоны кровоснабжения более чем одной коронар-
ной артерией; (2) отсутствие обструкции коронар-
ной артерии (ишемической болезни сердца); (3) но-
вые изменения на ЭКГ; (4) отсутствие свежей
тяжелой травмы головы, феохромоцитомы, мио-
кардита и гипертрофической кардиомиопатии [67].
При ЭхоКГ обычно выявляется баллонирование
верхушки ЛЖ (рис. 25 .15) с акинезом среднеапи-
кальной части ЛЖ, хотя регионарные нарушения
могут развиваться по другому типу и в других ло-
кализациях [68, 69]. Обструкция выносящего тракта
ЛЖ может быть обусловлена гиперкинезом базаль-
ных сегментов по сравнению с более дистальными
сегментами [66]. Идентификация обструкции вы-
носящего тракта ЛЖ имеет решающее значение,
поскольку у части пациентов развивается кардио-
генный шок. При наличии обструкции выносящего
тракта ЛЖ следует избегать инотропных препара-
тов, потому что они повышают градиент вынося-
щего тракта ЛЖ и приводят к клинической неста-
бильности. Спекл-трекинг демонстрирует умень-
шение деформации ЛЖ в области сегментов, не
коррелирующих с зоной кровоснабжения какой-ли-
бо одной коронарной артерией. Максимальная де-
формация и скорость деформации снижаются как в
базальной, так и в апикальной областях [70]. В свя-
зи с регионарным акинезом и дискинезом в ЛЖ
повышен риск тромбообразования.
У большинства пациентов нормализация функ-
ции ЛЖ происходит в течение 1–4 недель [68]. Ле-
чение включает назначение оптимальной медика-
ментозной терапии для дисфункции ЛЖ и стан-
дартной симптоматической терапии в случаях
кардиогенного шока.
МИОКАРДИТ
Существует множество состояний, провоцирую-
щих развитие миокардита, среди которых вирусная
инфекция является наиболее распространенной
причиной. Для клинической картины характерны-
ми являются вирусный продромальный период,
боли в груди, симптомы СН и/или кардиогенный
шок. Воспаление миокарда может быть диффузным
или очаговым и может поражать любую камеру
сердца.
Изменения при ЭхоКГ неспецифичны, а призна-
ки миокардита схожи с признаками ДКМП, но от-
личаются быстрым прогрессированием у лиц без
анамнеза установленного сердечного заболевания.
Часто отмечается дилатация ЛЖ, увеличение сфе-
ричности и локальное или диффузное нарушение
подвижности стенки. У заболевших определяются
In-25_для нас.indd 625
03.04.2019 12:02:20
626
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
нарушения диастолической функции, проявляю-
щиеся от нарушения релаксации до нарушения
диастолической функции по рестриктивному типу.
При ЭхоКГ наблюдается эффект увеличения обрат-
ного рассеяния от структур миокарда, обусловлен-
ный изменением плотности миокарда на фоне ми-
оцитолиза и клеточной инфильтрации. Интерсти-
циальный отек увеличивает расстояние между
отражающими поверхностями. В сочетании эти
изменения вызывают более высокую среднюю яр-
кость, гетерогенность и контрастность при ЭхоКГ
[71]. В зависимости от того, является ли миокардит
молниеносным или острым, параметры сердца ме-
няются. Молниеносный миокардит протекает без
значительной дилатации ЛЖ, но часто отмечается
утолщение стенки ЛЖ и значительное снижение
систолической функции. И наоборот, острый мио-
кардит обычно проявляется дилатацией ЛЖ с нор-
мальной толщиной стенок ЛЖ и менее выражен-
ным снижением систолической функции.
Поскольку эхокардиографические признаки ми-
окардита неспецифичны, сложно подтвердить
окончательный диагноз и необходимо исключить
другие причины СН. Оценка деформации миокарда
может быть полезна при постановке диагноза, по-
тому что нарушение деформации при миокардите
носит диффузный и глобальный характер [72]. Маг-
нитно-резонансная томография сердца с гадолини-
ем может помочь в подтверждении диагноза при
выявлении увеличения Т2 интенсивности из-за
отека, раннего контрастирования миокарда, об-
условленного гиперемией и интерстициальным
отеком, и позднего контрастирования субэпикарда
при отсутствии в эндокарде вторичного некроза и
фиброза (рис. 25 .16) [73].
Прогноз последствий перенесенного миокардита
различен: у некоторых пациентов восстанавливает-
ся нормальная функция сердца, тогда как у других
развивается хроническая ДКМП. Несколько пара-
доксально, однако при молниеносном миокардите,
как правило, показатели долгосрочной выживаемо-
сти лучше, по сравнению с острым миокардитом,
если пациенты выживают после начальных прояв-
лений [74]. Лечение аналогично другим причинам
СН, с адекватной медикаментозной терапией и
профилактикой аритмий. Роль иммуносупрессии
остается неясной для лимфоцитарного миокардита
[75, 76], хотя, по-видимому, может быть успешной
для случаев гигантоклеточного миокардита [77] и
эозинофильного миокардита [78].
СЕРДЕЧНАЯ РЕСИНХРОНИЗИРУЮЩАЯ ТЕРАПИЯ
В ходе рандомизированных исследований была
определено влияние СРТ у пациентов с ФВ ЛЖ 35%
или менее, симптоматической СН (II–IV классы
NYHA) и нарушением морфологии и длительности
QRS (> 120 мсек). Однако не у всех пациентов СРТ
ЛЖ
ЛЖ
Рис. 25.15 Баллонирование верхушки левого желудочка у пациента со стресс-индуцированной кардиомиопатией. Вид левого желудочка в конце
диастолы (А, В) и в конце систолы (Б, Г): без контрастирования A (А, Б), с контрастированием A (В, Г). Отмечается акинезия апикальной части ЛЖ (стрелки).
ЛЖ — левый желудочек
А
Б
Г
В
In-25_для нас.indd 626
03.04.2019 12:02:21
627
25 Дилатационная кардиомиопатия
имела положительный ответ; отсутствие лечебного
эффекта было отмечено у от 20 до 40% пациентов в
зависимости от используемых критериев [79].
Сокращение здорового ЛЖ происходит син-
хронно и в равной мере по всей камере. Этот меха-
низм сокращения может быть нарушен при блокаде
левой ножки пучка Гиса или при электростимуля-
ции отдельных областей ЛЖ. В обоих случаях со-
кращение становится недостаточно эффективным,
поскольку происходит опережение сокращения от-
дельных сегментов, а затем их расслабление, тогда
как запаздывающие сегменты продолжает сокра-
щаться. Это приводит к возвратно-поступательно-
му перемещению части объема крови по камере, а
не к ее выталкиванию, что является причиной ча-
стичного снижения систолического эффекта. Сле-
довательно, эффективность насосной функции при
сердечной диссинхронии примерно на 30% ниже.
Обычно механическая диссинхрония определя-
ется, как увеличение времени задержки между раз-
личными сегментами стенки ЛЖ, чаще всего боко-
вой и перегородочной. Цель СРТ у пациентов с СН
с диссинхронией ЛЖ заключается в оптимизации
атриовентрикулярного проведения и наполнения
ЛЖ, координации сокращения ЛЖ путем миними-
зации межжелудочковой и внутрижелудочковой
механической задержки и обеспечении межжелу-
дочковой согласованности.
Улучшенная синхронизация и уменьшение объ-
емов ЛЖ приводят к уменьшению напряжения
стенки ЛЖ и стимулируют обратное ремоделирова-
ние. Это приводит к снижению массы ЛЖ, восста-
новлению геометрии митрального кольца и подкла-
панных структур и уменьшению относительной
МН. В конечном счете это приводит к облегчению
симптомов СН и повышению функциональных
возможностей.
Последнее десятилетие ведется широкая дискус-
сия о преимуществах эхокардиографических пара-
метрах оценки диссинхронии в сравнении с элек-
трокардиографическими (длительности и морфо-
логия QRS) при отборе пациентов для СРТ. В ходе
исследования показателей ответа на сердечную ре-
синхронизацию (Predictors of Response to Cardiac
Resynchronization, PROSPECT) в центральной лабо-
ратории была проведена одновременная оценка 12
эхокардиографических параметров (табл. 25 .4). Это
исследование продемонстрировало большую про-
гностическую вариабельность эхокардиографиче-
ских параметров для клинических исходов (с чувст-
вительностью и специфичностью 6–74 и 35–91%
соответственно) или вероятности снижения конеч-
ного диастолического объема ЛЖ (9–77% и 31–93%
соответственно). Для всех 12 параметров AUC (пло-
щадь под кривой) для прогнозирования клиниче-
ского течения или конечного систолического объе-
ма ЛЖ в ответ на СРТ составляла 0,62 или менее. В
ходе исследования не было продемонстрировано
возможности прогнозирования по одиночному
эхокардиографическому параметру ответа на СРТ
[80]. Такие результаты привели к значительной по-
тере уверенности в способности оценки терапевти-
ческого эффекта СРТ с помощью допплерографии.
Тем не менее исследование PROSPECT часто под-
вергалось критике за субоптимальный отбор паци-
ентов (не у всех пациентов присутствовало значи-
тельное снижение ФВ ЛЖ или выраженная дила-
тация ЛЖ), технические проблемы, связанные с
измерениями и низкой межоператорской воспроиз-
водимостью во время обследования, отсутствие
Систола
ЛЖ
ЛЖ
Диастола
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ПЖ
ПЖ
ПЖ
ПЖ
Рис. 25.16 Изображения по короткой оси у пациента с острым мио-
кардитом. (A) A Эхокардиограмма из левой парастернальной позиции по
короткой оси левого желудочка (ЛЖ) с контрастным усилением эндокарда.
Области активного воспаления (средние сегменты передней и переднеперего-
родочной стенок) выглядят эхогенными на данном изображении (стрелки).
(Б) Верхние изображения: магнитно-резонансная томография (МРТ) по корот-
кой оси демонстрирует акинез средних сегментов передней и переднеперего-
родочной стенок, что соответствует данным эхокардиографии. Внизу слева:
изображение МРТ с Т2-взвешенной спин-эхо визуализацией с высокой интен-
сивностью сигнала в средних сегментах передней и переднеперегородочной
стенок (стрелки) вследствие регионарного отека. Внизу справа: изображение
МРТ с поздним усилением с гадолинием, демонстрирующее регионарное суб-
эпикардиальное усиление (стрелки) соответствующих сегментов стенки.
ПЖ — правый желудочек.
А
Б
In-25_для нас.indd 627
03.04.2019 12:02:21
628
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
нии, жизнеспособности миокарда и размеры камер,
может идентифицировать пациентов с ожидаемой
высокой вероятностью лечебного эффекта СРТ.
ВНУТРИЖЕЛУДОЧКОВАЯ ДИССИНХРОНИЯ
Выделяют три типа сердечной диссинхронии: вну-
трижелудочковую, межжелудочковую и предсерд-
но-желудочковую. Отклонения по времени регио-
нарной механической активации ЛЖ, называемые
внутрижелудочковой диссинхронией, по-видимо-
му, являются основной причиной, обусловливаю-
щей сократительную недостаточность, и в их отно-
шении наиболее эффективна СРТ.
Эхокардиографические
показатели
Описание метода
Режим
эхокардиографии
Пороговое
значение
Задержка движения пере-
городки и задней стенки
Измеряют в M-режиме в левой парастернальной
позиции по короткой оси левого желудочка
M-режим
≥ 130 мсек
Межжелудочковая меха-
ническая задержка
Разница между фазами предизгнания ЛЖ и ПЖ
Импульсноволновой
допплер
≥ 40 мсек
Время наполнения ЛЖ
в соотношении с дли-
тельностью сердечного
цикла
Измеряют через митральный клапан с помощью
допплерографии в процентах
Импульсноволновой
допплер
≤ 40%
Период изоволюмиче-
ского сокращения ЛЖ
Промежуток времени между началом QRS и началом
выброса ЛЖ измеряемый с помощью допплера
Импульсно-волновой
допплер
≥ 140 мсек
Внутрижелудочковая дис-
синхрония сокращения
левой боковой стенки
Процент перекрытия между окончанием сокращения
боковой стенки (М-режим) и началом наполнения ЛЖ
(допплерография)
М-режим и импульсно-
волновой допплер
Отсутствие
перекрытий
Перегородочно-боковая
задержка
Задержка по времени между максимальной систоличе-
ской скоростью в фазу изгнания базального перегоро-
дочного и базального бокового сегментов
Тканевая
допплерография
≥ 60 мсек
Стандартное отклонение
(СО): перегородочно-
боковой задержки
СО времени от QRS до достижения максимальной
систолической скорости в фазе изгнания в 12 сегмен-
тах ЛЖ (6 базальных и 6 срединных)
Тканевая
допплерография
≥ 32 мсек
Отклонение максималь-
ной скорости
Разница максимальной скорости рассчитывается путем
вычитания максимальной от минимальной различных
по времени максимальных скоростей в 6 сегментах
базального уровня
Тканевая
допплерография
≥ 110 мсек
Задержка продольного
сокращения
Задержка продольного сокращения измеряется
в 6 базальных сегментах ЛЖ с систолическим сократи-
тельным компонентом в раннюю диастолу с помощью
тканевой допплерографии и подтверждением
в режиме скорости деформации
Тканевая допплерогра-
фия + режим скорости
деформации
≥ 2 базальных
сегментов
Максимальное смещение Максимальная разница времени достижения макси-
мального систолического смещения для 4 сегментов
Тканевая
допплерография
≥ Среднего
значения
Время достижения макси-
мальной систолической
скорости
Максимальная разница времени достижения макси-
мальной систолической скорости для 6 сегментов
на базальном уровне
Тканевая
допплерография
≥ Среднего
значения
Время до начала систоли-
ческой скорости
Максимальная разница времени до начала систоличе-
ской скорости для 6 сегментов на базальном уровне
Тканевая
допплерография
≥ Среднего
значения
[Chung ES, Leon AR, Tavazzi L, и соавт. Results of the predictors of response to CRT (prospect) trial. Circulation 117:2608–2616, 2008.]
ТАБЛИЦА 25.4 Сводный анализ эхокардиографических прогностических показателей
лечебного эффекта СРТ из исследования PROSPECT
параметров, отражающих деформацию, и отсутст-
вие учета границ рубцов или расположения элек-
трода в ЛЖ. По этой причине многие специалисты
в области ЭхоКГ считают, что исследование PROS-
PECT не является убедительным в ответе на вопрос
о том, играет ли эхокардиографическая оценка дис-
синхронии роль в прогнозировании лечебного эф-
фекта СРТ.
В настоящее время отбор пациентов для СРТ осно-
ван преимущественно на продолжительности QRS.
Тем не менее имеются свидетельства того, что ком-
плексное эхокардиографическое исследование, вклю-
чающее параметры оценки механической диссинхро-
In-25_для нас.indd 628
03.04.2019 12:02:22
629
25 Дилатационная кардиомиопатия
МРЕЖИМ
Простейший подход к количественной оценке вну-
трижелудочковой диссинхронии ЛЖ — это обыч-
ная ЭхоКГ в М-режиме, которая регистрирует за-
держку движения перегородки ЛЖ в сравнении с
движением задней стенки. Было предложено погра-
ничное значение, равное 130 мсек, для прогнозиро-
вания как изменения объема, так и клинических
результатов после СРТ. Тем не менее исследование
PROSPECT выявило высокую степень вариабельно-
сти результатов при использовании этого метода
(16–28%) [80].
ТКАНЕВАЯ ДОППЛЕРЭХОКАРДИОГРАФИЯ
Для количественной оценки диссинхронии может
быть использована оценка скорости продольного
укорочения ЛЖ с помощью тканевой допплер-
эхокардиографии. ASE рекомендует использовать
показатель задержки между участками противо-
положных стенок, полученный как разница во вре-
мени максимальной скорости между переднепере-
городочной и заднебоковой стенками, и Yu индекс,
который рассчитывают как стандартное отклонение
12 пиков систолических скоростей движения ба-
зальных и средних сегментов ЛЖ, измеренных в
трех стандартных апикальных проекциях.
Пороговые значения для прогнозирования кли-
нических событий и обратного ремоделирования
ЛЖ при СРТ составляют 65 мсек для задержки между
противолежащими стенками и 33 мсек для Yu индек-
са [81, 82]. Однако, как показало исследование
PROSPECT, разница в перегородочно-боковой задер-
жке не имела существенных различий у пациентов с
ответом на СРТ и без него. Показатели, полученные
при тканевой допплер-эхокардиографии, не имеют
значимой прогностической ценности и не обладают
должной воспроизводимостью, вариабельность их
результатов > 30%. Ограничение этих методов за-
ключается в том, что продольная ротация сердца
изменяет профиль и амплитуду систолической ско-
рости миокарда, что приводит к неточному измере-
нию диссинхронии ЛЖ с помощью тканевой доп-
плер-эхокардиографии. Кроме того, на параметры
тканевой допплер-эхокардиографии влияют угол
сканирования, эффект привязывания контрольного
объема и поступательное движение миокарда [82].
СПЕКЛТРЕКИНГ ЭХОКАРДИОГРАФИЯ
Диссинхрония ЛЖ может быть оценена путем из-
мерения значений временной разницы максималь-
ной деформации между противоположными сег-
ментами (чаще всего — переднеперегородочной
и заднебоковой стенок). Радиальная деформация
(рис. 25 .17) наименее подвержена нарушению дви-
жения стенки, вызванному ишемической болезнью,
при которой пассивное движение сегмента может
быть важным искажающим фактором.
В ходе проспективного многоцентрового иссле-
дования, изучающего спекл-трекинг и ресинхро-
низацию (Speckle Tracking and Resynchronization,
STAR), радиальная деформация имела наивысшую
чувствительность для прогнозирования положи-
тельной динамики симптомов СН по сравнению с
циркулярной, поперечной и продольной деформа-
циями. У пациентов, получавших СРТ, при отсут-
ствии радиальной или поперечной диссинхронии
на базальном уровне наблюдалось повышение ри-
ска летального исхода, необходимости в трансплан-
тации или имплантации устройства поддержки ЛЖ,
по сравнению с пациентами, у которых отмечалась
диссинхрония. Циркулярная и продольная дефор-
мации являлись прогностическими факторами по-
ложительной реакции на СРТ при выявлении дис-
синхронии, но у трети пациентов с лечебным эф-
фектом СРТ диссинхрония не была установлена
[83]. В ходе других исследований было продемон-
стрировано, что комбинация времени и величины
продольной деформации также может предсказы-
вать ответную реакцию на СРТ [84].
ТРЕХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
Появившаяся 3D-ЭхоКГ в режиме реального време-
ни позволяет выполнить количественную оценку
диссинхронии на основе анализа регионарных из-
менений с синхронизацией по времени достижения
минимальных систолических и максимальных диа-
столических объемов для каждого сегмента (рис.
25.18). Параметры трехмерной систолической дис-
синхронии включают в себя максимальную задер-
жку противоположных сегментов по времени до-
стижения максимальной деформации и систоли-
ческий индекс диссинхронии, измеряемый как
стандартное отклонение времени, затрачиваемо-
го на достижение минимального регионарного объ-
ема для 16 или 17 сегментов. Пороговое значение
индекса 10,4%, по-видимому, является прогности-
ческим для положительного ответа на СРТ, незави-
симо от морфологии и продолжительности QRS
[85]. У пациентов с СН более высокое значение
индекса по сравнению со здоровыми людьми. Трех-
мерное картирование механической активации, по
всей видимости, является многообещающим мето-
дом для определения наилучшего места расположе-
ния электрода, оптимизации терапии и прогнози-
рования лечебного эффекта СРТ [86].
МЕЖЖЕЛУДОЧКОВАЯ ЗАДЕРЖКА
Интервентрикулярная или межжелудочковая за-
держка позволяет судить о механической диссин-
хронии между ПЖ и ЛЖ и определяется путем
измерения задержки между началом выброса ПЖ
и ЛЖ, полученным с помощью импульсно-волно-
вой допплерографии выносящих трактов ПЖ и
ЛЖ соответственно. Интервалы до начала выброса
In-25_для нас.indd 629
03.04.2019 12:02:22
630 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
измеряются от начала QRS до начала потоков вы-
броса ПЖ и ЛЖ. При исследовании межжелудоч-
ковая задержка, превышающая 40 мсек, коррели-
рует с увеличением обратного ремоделирования
после СРТ [87], а равная 49 мсек или более свиде-
тельствует о лучших показателях выживаемости
после СРТ по сравнению с более короткими задер-
жками [88].
РЕАКЦИЯ ОРГАНИЗМА ПАЦИЕНТА НА СЕРДЕЧНУЮ
РЕСИНХРОНИЗИРУЮЩУЮ ТЕРАПИЮ
У 60–65% пациентов наблюдаются лечебные эф-
фекты СРТ. У них выявляется обратное ремоде-
лирование ЛЖ, характеризующееся уменьшением
объема ЛЖ, улучшением систолической функции,
нормализацией диастолической функции и сниже-
нием тяжести МН. Структурные и функциональные
Пик
Пик
КС
(конец систолы)
КС
(конец систолы)
Пик
ЗРДр = Сумма пиковых деформаций (%) —
деформация в точке ЗАК (%) (конец систолы)
для всех 12 базальных и средних сегментов миокарда ЛЖ
ЗРДр = Σ 12(РДПик – РДЗАК)
Рис. 25.17 Радиальная деформация у пациента с желудочковой диссинхронией и положительным лечебным эффектом сердечной ресинхро-
низирующей терапии (СРТ). (A) Расчет задержки радиальной деформации (ЗРДр). Спекл-трекинг кривые радиальной деформации на среднем уровне ЛЖ у
пациента с дилатационной кардиомиопатией и блокадой левой ножки пучка Гиса перед имплантацией СРТ. Ранняя пиковая деформация наблюдается в передне-
перегородочной области (желтый). В остальных сегментах отмечается поздняя пиковая деформация, возникающая после закрытия аортального клапана. Пример
расчета разности между пиковой и конечной систолической (КС) деформацией показан для переднеперегородочного (желтого) и заднего (фиолетового) сегмен-
тов. ЗРДр рассчитывается путем суммирования пиковой радиальной деформации (%) и радиальной деформации (%) при закрытии аортального клапана (ЗАК)
для всех 12 базальных и средних сегментов миокарда ЛЖ. (Б) После имплантации СРТ с более чем 15%-м уменьшением конечного систолического объема ЛЖ
происходит снижение ЗРДр, поскольку отстающие сегменты «ресинхронизируются», что приводит к минимальной остаточной разности между пиковой деформа-
цией и деформацией в точке ЗАК для показанных 6 средних сегментов миокарда; выделены переднеперегородочный (желтый) и задний (фиолетовый) сегменты
[Kydd AC, Khan FZ, O ’Halloran D, et al. Radial strain delay based on segmental timing and strain amplitude predicts left ventricular reverse remodeling and survival after
cardiac resynchronization therapy. Circulation Cardiovasc Imaging; 6:177–184, 2013].
А
Б
In-25_для нас.indd 630
03.04.2019 12:02:22
631
25 Дилатационная кардиомиопатия
изменения, связанные с СРТ, определяются уже
через 3 месяца и обычно становятся более выражен-
ными через 6 месяцев с сохранением в течение од-
ного года у 65–75% «ответчиков» — пациентов, от-
ветивших на СРТ [89]. Уменьшение объемов ЛЖ и
положительная динамика МН в два-три раза более
выраженные при неишемической кардиомиопатии,
по сравнению с ишемической. Независимо от этио-
логии СН, пациенты демонстрируют сходные сте-
пени улучшения физической выносливости и об-
легчения симптомов. Менее выраженный лечебный
эффект СРТ у пациентов с ишемической кардиомио-
патией частично связан с наличием рубца, который
не поддается ресинхронизации.
В ходе анализа MADIT-CRT было продемонстри-
ровано, что обратное ремоделирование при СРТ,
оцененное по эхокардиографическим параметрам,
чаще наблюдалось у женщин, у пациентов с неише-
Стимуляция ПЖ
BiV (бивентрикулярная) стимуляция с более выраженной
глобальной продольной деформацией и менее
выраженной диссинхронией, отмечено двумя стрелками
Площадь региона
в кадре #1 (A1)
Площадь региона
в кадре #n (An)
Расчет площади деформации
Скорость изменения площади
A[n]=(An–A1)/A1×100[%]
Рис. 25.18 3D-деформация и ресинхронизация. Сверху слева: Пример 3D спекл-трекинг эхокардиографии (3D-форма ЛЖ с полуавтоматической регистра-
цией эндокардиальных и эпикардиальных границ и цветовой картой регионарной деформации, а также регионарные кривые деформации). (Сверху справа) Ото-
бражение подхода, используемого для измерения площади деформации. (Снизу) Пример деформационных кривых для правосторонней и бивентрикулярной
стимуляции [Thebault C, Donald E, Bernard A, et al. Real-time three-dimensional speckle tracking echocardiography: a novel technique to quantify global left ventricular
mechanical dyssynchrony. Eur J Echocardiogr 12: 26–32, 2011].
In-25_для нас.indd 631
03.04.2019 12:02:23
632
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
мическими причинами СН, блокадой левой ножки
пучка Гиса, QRS не менее 150 мсек, при предыдущей
госпитализации по поводу СН, с конечным диасто-
лическим объемом ЛЖ 125 мл/м2 и более и объемом
ЛП < 40 мл/м2 [90]. При дальнейшем изучении дан-
ных было отмечено, что женский пол, отсутствие
инфаркта миокарда, QRS не менее 150 мсек, блокада
левой ножки пучка Гиса, индекс массы тела ниже
30 кг/м2 и меньший исходный уровень индекса объ-
ема ЛП были прогностическими факторами «супер-
ответа», определяемого как верхний квартиль из-
менения ФВ ЛЖ в ответ на СРТ (и который кор-
релировал со сниженным риском последующих
сердечных событий) [91]. Необходимость в посто-
янной, а не прерывистой СРТ для индукции обрат-
ного ремоделирования ЛЖ была продемонстриро-
вана через 3 месяца после отмены СРТ в исследуемой
категории пациентов. Отмена СРТ приводила к
дилатации ЛЖ, снижению ФВ и усилению тяжести
МН [92].
ИЗМЕНЕНИЯ ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
ПРИ СЕРДЕЧНОЙ РЕСИНХРОНИЗИРУЮЩЕЙ ТЕРАПИИ
Помимо улучшения систолической функции, СРТ
в некоторой мере снижает диастолическую дис-
функцию. СРТ увеличивает продолжительность
наполнения ЛЖ, отделяет фазу быстрого наполне-
ния от систолического сокращения предсердий,
сокращает межжелудочковую задержку и коорди-
нирует глобальное сокращение и расслабление. Тем
не менее СРТ не способна нормализовать трансми-
тральную максимальную скорость потока во время
пассивного наполнения (пик E), во время сокраще-
ния предсердий (пик А), соотношение E/A или вре-
мя изоволюмического расслабления. При СРТ вре-
мя замедления пика E и индекс производительности
миокарда улучшаются через 3 месяца с прогрессив-
ным улучшением через 12 месяцев. Тем не менее у
пациентов с рестриктивным типом наполнением
ЛЖ наблюдается незначительный диастолический
ответ или его отсутствие на СРТ [93].
ВЕДЕНИЕ ПАЦИЕНТОВ БЕЗ ЛЕЧЕБНОГО ЭФФЕКТА
Приблизительно у 30% пациентов, подвергшихся
СРТ, не удается достичь лечебного ответа. Обще-
признанным лечебным эффектом СРТ является
улучшение функции ЛЖ, уменьшение размеров
или объемов ЛЖ и облегчение симптомов в тече-
ние 6 месяцев после лечения [89]. Было предложе-
но несколько механизмов, объясняющих отсутст-
вие ответа на СРТ.
V. Delgado и его коллеги продемонстрировали,
что более высокие показатели радиальной диссин-
хронии ЛЖ на базальном уровне являются про-
гностическим фактором увеличения лечебного
эффекта СРТ, в то время как дискордантность рас-
положения электрода и наличие рубца миокарда в
сегменте ЛЖ, соответствующем электроду (на ос-
нове анализа радиальной деформации), были не-
зависимыми предикторами худших результатов
[94].
Стандартная оптимизация атриовентрикуляр-
ной и интервентрикулярной задержки с эхокардио-
графическим контролем, проводимая у всех паци-
ентов не привела к существенному улучшению
результатов по сравнению с номинальными на-
стройками.
Несмотря на отсутствие окончательных доказа-
тельств, у пациентов без лечебного эффекта СРТ
следует рассматривать вариант оптимизации атри-
овентрикулярной задержки [94a], особенно когда
при импульсно-волновой допплер-эхокардиогра-
фии выявляется нарушение трансмитрального кро-
вотока по псевдонормальному или рестриктивному
типу наполнения. Если после СРТ при ЭхоКГ транс-
митральный диастолический поток нормальный
или имеет нарушение I степени на заданной эмпи-
рической AV-задержке, никаких дальнейших изме-
нений AV-задержки не требуется. Роль интервент-
рикулярной оптимизации менее ясна, но также
применима преимущественно для пациентов без
лечебного эффекта на СРТ. Кроме того, импульс-
новолновая допплер-эхокардиография выводного
тракта ЛЖ с оценкой ударного объема обычно ис-
пользуется для определения глобальной функции
ЛЖ, и следует проанализировать ее максимальное
увеличение с помощью изменений в настройках
СРТ [95].
ПРИЦЕЛЬНОЕ РАЗМЕЩЕНИЕ ЭЛЕКТРОДА
В ЛЕВОМ ЖЕЛУДОЧКЕ
Теоретически размещение электрода в ЛЖ в месте
наиболее поздней механической активации должно
привести к оптимальной ресинхронизации. Однако
в обычной клинической практике происходит раз-
мещение электрода ЛЖ через коронарный синус
для нацеливания на анатомическую заднюю или
боковую область ЛЖ. Исследователи изучали во-
прос, можно ли улучшить лечебный эффект СРТ,
определяя место наиболее поздней механической
активации ЛЖ, получив данные о деформации при
спекл-трекинг эхокардиографии.
В ходе исследования области установки электро-
да, проведенного с помощью спекл-трекинга (The
Speckle Tracking Assisted Resynchronization Therapy
for Electrode Region, STARTER), сравнивались ре-
зультаты размещения электрода в ЛЖ под контро-
лем ЭхоКГ и стандартного рентгеновского способа.
Для размещения электрода оценивалась радиальная
деформация на базальном и среднем уровнях ЛЖ,
определяя самый последний по времени пик дефор-
мации в восьми сегментах свободных стенок ЛЖ.
Использование эхокардиографического контроля
имело преимущества перед стандартным подходом
In-25_для нас.indd 632
03.04.2019 12:02:24
633
25 Дилатационная кардиомиопатия
у пациентов с дисфункцией ЛЖ и слабо, умеренно
или сильно выраженными симптомами СН при
расчете основной конечной точки летального исхо-
да или госпитализации по поводу СН. Размещение
электрода в ЛЖ под эхокардиографическим контро-
лем также связано с повышением прогностической
ценности эхокардиографических параметров отве-
та на СРТ [96].
Прицельное размещение электрода в ЛЖ для
управляемой сердечной ресинхронизирующей те-
рапии (The Targeted Left Ventricular Lead Placement
to Guide Cardiac Resynchronization Therapy, TARGET)
изучалось в ходе проспективного рандомизирован-
ного исследования с участием пациентов, у которых
было выполнено прицельные размещение электро-
да в ЛЖ, в сравнении с группой пациентов со стан-
дартным неприцельным подходом. Электрод в ЛЖ
размещался в месте наиболее позднего радиального
деформационного утолщения > 10%, что являлось
признаком отсутствия рубца. Целевое размещение
электрода в ЛЖ сопровождалось улучшением пока-
зателя основной конечной точки с уменьшением,
по меньшей мере, на 15% конечного систолического
объема ЛЖ через 6 месяцев. Размещение электрода
в ЛЖ под контролем ЭхоКГ также продемонстриро-
вало улучшение клинического ответа и более низ-
кий уровень смертности или госпитализации, свя-
занной с СН [42].
РЕКОМЕНДАЦИИ ПО СЕРДЕЧНОЙ
РЕСИНХРОНИЗИРУЮЩЕЙ ТЕРАПИИ
В руководстве ASE 2008 г. [97] рекомендуются сле-
дующие параметры при необходимости исследова-
ния диссинхронии: тканевая допплер-эхокардио-
графия для оценки задержки на противоположных
стенках, импульсноволновая допплер-эхокардио-
графия выводящего тракта ПЖ и ЛЖ для оценки
межжелудочковой диссинхронии и M-режим или
спекл-трекинг для оценки радиальной динамики,
включая задержку от перегородки к задней стенке
по радиальной деформации.
В совместном заключении Общества ритма сер-
дца (The Heart Rhythm Society) 2012 г. [98] по СРТ
признано, что всесторонняя оценка параметров
механической диссинхронии может помочь выя-
вить пациентов с более высокой вероятностью ле-
чебного эффекта СРТ, но нельзя исключить прове-
дение у пациента СРТ только на основании резуль-
татов ЭхоКГ.
ШКАЛА РИСКА СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Существуют многочисленные шкалы риска для
прогнозирования неблагоприятных событий у па-
циентов с СН [99–102]. В некоторые из них попы-
тались включить параметры визуализации. Хотя
эти модели содержат большое количество клиниче-
ских и лабораторных данных, в большинстве случа-
ев ФВ ЛЖ является единственным постоянным
эхокардиографическим параметром (табл. 25 .5).
Потенциальная польза применения других эхокар-
диографических параметров для прогностической
оценки неблагоприятных исходов у пациентов с СН
к уже существующим показателям риска требует
дополнительного изучения.
Модели риска
Переменные в моделях
Шкала продолжи-
тельности жизни
при сердечной
недостаточности
(1997) [99]
Артериальное среднее давление,
частота сердечных сокращений
в покое, замедление внутрижелудоч-
ковой проводимости по ЭКГ, макси-
мальное потребление кислорода,
ишемическая этиология, ФВ ЛЖ,
среднее давление заклинивания
легочных капилляров при инвазив-
ном измерении, сывороточный
натрий
Улучшенная
обратная связь
для эффективной
сердечной
терапии
(Enhanced
Feedback for
Effective Cardiac
Treatment,
EFFECT) Model
(2003) [100]
Пожилой возраст, снижение систоли-
ческого давления крови, высокая
частота дыхания, высокий уровень
азота мочевины крови, сопутствую-
щие заболевания (цереброваскуляр-
ная болезнь, деменция, хроническая
обструктивная болезнь легких,
цирроз печени, онкологическое
заболевание)
Сиэтлская модель
сердечной недо-
статочности
(Seattle Heart
Failure Model)
(2006) [101]
Демографические показатели
(возраст, пол, индекс массы тела,
класс тяжести по NYHA, ФВ ЛЖ,
ишемическая этиология, систоличе-
ское давление крови), медикамен-
тозное лечение, данные лаборатор-
ных анализов (сывороточный
натрий, креатинин, холестерин, лей-
коциты, гемоглобин, % лимфоци-
тов, мочевая кислота), аппаратная
поддержка
Модель метаана-
лиза глобальной
группы пациен-
тов с хронической
сердечной недо-
статочностью
(Meta-Analysis
Global Group in
Chronic Heart
Failure (MAGGIC)
model (2012) [102]
Возраст, ФВ ЛЖ, класс тяжести по
NYHA, креатинин сыворотки крови,
сахарный диабет, снижение систоли-
ческого давления крови, снижение
массы тела, время с начала заболева-
ния, регулярное курение, хрониче-
ская обструктивная болезнь легких,
мужской пол, не назначены бета-
адреноблокаторы или ингибиторы
АПФ или блокаторы ангиотензино-
вых рецепторов
NYHA (New York Heart Association) — Нью-Йоркская кардиологи-
ческая ассоциация; АПФ — ангиотензинпревращающий фер-
мент; ФВ ЛЖ — фракция выброса левого желудочка; ЭКГ — элек -
трокардиография.
ТАБЛИЦА 25.5
Модели оценки риска развития сердечной
недостаточности с ассоциированными
переменными
In-25_для нас.indd 633
03.04.2019 12:02:24
634
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
П
о
к
а
з
а
т
е
л
и
о
б
с
л
е
д
о
в
а
н
и
я
П
о
л
у
ч
е
н
и
е
и
з
о
б
р
а
ж
е
н
и
я
Н
е
б
л
а
г
о
п
р
и
я
т
н
ы
е
п
р
о
г
н
о
с
т
и
ч
е
с
к
и
е
м
а
р
к
е
р
ы
ч
а
с
т
о
в
с
т
р
е
ч
а
ю
щ
и
е
с
я
п
р
и
Д
К
М
П
К
о
м
м
е
н
т
а
р
и
и
Ф
у
н
к
ц
и
я
Л
Ж
Ф
р
а
к
ц
и
я
в
ы
б
р
о
с
а
(
Ф
В
)
Л
Ж
с
п
о
м
о
щ
ь
ю
2
D
-
и
3
D
-
в
и
з
у
а
л
и
з
а
ц
и
и
С
м
е
щ
е
н
и
е
ф
и
б
р
о
з
н
о
г
о
к
о
л
ь
ц
а
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
О
ц
е
н
к
а
у
д
а
р
н
о
г
о
о
б
ъ
е
м
а
(
У
О
)
С
к
о
р
о
с
т
ь
и
з
м
е
н
е
н
и
я
д
а
в
л
е
н
и
я
в
Л
Ж
в
о
в
р
е
м
я
и
з
о
в
о
-
л
ю
м
и
ч
е
с
к
о
г
о
с
о
к
р
а
щ
е
н
и
я
(
d
P
/
d
t
)
И
н
д
е
к
с
п
р
о
и
з
в
о
д
и
т
е
л
ь
н
о
с
т
и
м
и
о
к
а
р
д
а
(
И
П
М
)
Г
л
о
б
а
л
ь
н
а
я
п
р
о
д
о
л
ь
н
а
я
д
е
ф
о
р
м
а
ц
и
я
п
р
и
т
к
а
н
е
в
о
м
д
о
п
п
л
е
р
о
в
с
к
о
м
и
с
с
л
е
д
о
в
а
н
и
и
(
Т
Д
И
)
и
л
и
с
п
е
к
л
-
т
р
е
к
и
н
г
О
б
р
а
т
и
т
е
с
ь
к
г
л
а
в
а
м
7
,
8
з
а
п
о
д
р
о
б
н
о
й
и
н
ф
о
р
м
а
ц
и
е
й
о
к
о
л
и
ч
е
с
т
в
е
н
н
о
м
о
п
р
е
д
е
л
е
н
и
и
с
и
с
т
о
л
и
ч
е
с
к
о
й
ф
у
н
к
ц
и
и
Л
Ж
Ф
В
Л
Ж
<
3
5
–
4
0
%
d
P
/
d
t
<
6
0
0
S
m
<
2
,
8
с
м
/
с
е
к
И
П
М
>
0
,
4
Н
а
р
у
ш
е
н
и
е
г
л
о
б
а
л
ь
н
о
й
п
р
о
д
о
л
ь
н
о
й
д
е
ф
о
р
м
а
-
ц
и
и
Л
Ж
П
р
и
2
D
-
в
и
з
у
а
л
и
з
а
ц
и
и
о
г
р
а
н
и
ч
е
н
и
я
м
и
м
о
г
у
т
б
ы
т
ь
р
а
к
у
р
с
и
п
л
о
х
о
е
б
о
к
о
в
о
е
р
а
з
р
е
ш
е
н
и
е
С
м
е
щ
е
н
и
е
м
и
т
р
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
н
е
п
о
к
а
з
а
т
е
л
ь
н
о
п
р
и
о
ч
а
г
о
в
о
м
н
а
р
у
ш
е
н
и
и
д
в
и
ж
е
н
и
я
с
т
е
н
к
и
О
ц
е
н
к
а
У
О
з
а
в
и
с
и
т
о
т
т
о
ч
н
о
с
т
и
и
з
м
е
р
е
н
и
я
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
Л
Ж
И
П
М
н
е
з
а
в
и
с
и
т
о
т
ч
а
с
т
о
т
ы
с
е
р
д
е
ч
н
ы
х
с
о
к
р
а
-
щ
е
н
и
й
Ч
С
С
,
а
р
т
е
р
и
а
л
ь
н
о
г
о
д
а
в
л
е
н
и
я
и
г
е
о
м
е
-
т
р
и
и
Л
Ж
Т
Д
И
з
а
в
и
с
и
т
о
т
у
г
л
а
Д
е
ф
о
р
м
а
ц
и
я
,
и
з
м
е
р
е
н
н
а
я
с
п
о
м
о
щ
ь
ю
с
п
е
к
л
-
т
р
е
к
и
н
г
а
н
е
з
а
в
и
с
и
т
о
т
у
г
л
а
и
л
и
п
о
с
т
у
п
а
т
е
л
ь
-
н
о
г
о
д
в
и
ж
е
н
и
я
с
е
р
д
ц
а
Р
а
з
м
е
р
и
г
е
о
-
м
е
т
р
и
я
Л
Ж
И
з
м
е
р
е
н
и
е
р
а
з
м
е
р
а
и
о
б
ъ
е
м
а
Л
Ж
с
п
о
м
о
щ
ь
ю
2
D
-
Э
х
о
К
Г
М
а
с
с
а
Л
Ж
,
о
ц
е
н
е
н
н
а
я
п
о
к
о
н
е
ч
н
о
м
у
д
и
а
с
т
о
л
и
ч
е
с
к
о
м
у
д
и
а
м
е
т
р
у
и
т
о
л
щ
и
н
е
с
т
е
н
к
и
И
н
д
е
к
с
с
ф
е
р
и
ч
н
о
с
т
и
,
р
а
с
с
ч
и
т
а
н
н
ы
й
п
о
к
о
н
е
ч
н
ы
м
с
и
с
т
о
л
и
ч
е
с
к
и
м
и
к
о
н
е
ч
н
ы
м
д
и
а
с
т
о
л
и
ч
е
с
к
и
м
2
D
л
и
н
е
й
н
ы
м
и
з
м
е
р
е
н
и
я
м
и
л
и
о
б
ъ
е
м
а
м
У
в
е
л
и
ч
е
н
и
е
к
о
н
е
ч
н
о
г
о
с
и
с
т
о
л
и
ч
е
с
к
о
г
о
и
д
и
а
-
с
т
о
л
и
ч
е
с
к
о
г
о
д
и
а
м
е
т
р
о
в
/
о
б
ъ
е
м
о
в
Л
Ж
У
в
е
л
и
ч
е
н
и
е
м
а
с
с
ы
Л
Ж
>
2
9
8
г
И
н
д
е
к
с
с
ф
е
р
и
ч
н
о
с
т
и
Л
Ж
>
1
,
5
И
н
д
е
к
с
и
р
о
в
а
н
н
ы
е
р
а
з
м
е
р
ы
и
о
б
ъ
е
м
ы
Л
Ж
с
у
ч
е
т
о
м
п
л
о
щ
а
д
и
п
о
в
е
р
х
н
о
с
т
и
т
е
л
а
П
р
о
г
р
е
с
с
и
р
у
ю
щ
е
е
р
е
м
о
д
е
л
и
р
о
в
а
н
и
е
Л
Ж
п
р
и
-
в
о
д
и
т
к
у
в
е
л
и
ч
е
н
и
ю
с
ф
е
р
и
ч
е
с
к
о
й
ф
о
р
м
ы
Д
и
а
с
т
о
л
и
-
ч
е
с
к
а
я
ф
у
н
к
ц
и
я
Л
Ж
И
м
п
у
л
ь
с
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
т
р
а
н
с
м
и
т
р
а
л
ь
-
н
о
г
о
к
р
о
в
о
т
о
к
а
и
Т
Д
И
м
и
т
р
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
С
к
о
р
о
с
т
ь
р
а
с
п
р
о
с
т
р
а
н
е
н
и
я
п
о
т
о
к
а
п
о
ц
в
е
т
н
о
м
у
д
о
п
-
п
л
е
р
о
в
с
к
о
м
у
и
с
с
л
е
д
о
в
а
н
и
ю
в
M
-
р
е
ж
и
м
е
И
м
п
у
л
ь
с
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
к
р
о
в
о
т
о
к
а
в
л
е
г
о
ч
н
ы
х
в
е
н
а
х
Р
а
з
м
е
р
Л
П
З
а
п
о
д
р
о
б
н
о
й
и
н
ф
о
р
м
а
ц
и
е
й
о
б
р
а
т
и
т
е
с
ь
к
г
л
а
в
е
9
П
с
е
в
д
о
н
о
р
м
а
л
ь
н
ы
й
т
и
п
н
а
п
о
л
н
е
н
и
я
Р
е
с
т
р
и
к
т
и
в
н
ы
й
т
и
п
н
а
п
о
л
н
е
н
и
я
(
в
ы
с
о
к
и
й
и
н
д
е
к
с
E
/
A
,
в
р
е
м
я
б
ы
с
т
р
о
г
о
з
а
м
е
д
л
е
н
и
я
<
1
5
0
м
с
е
к
,
E
/
e
′
>
1
5
,
с
н
и
ж
е
н
и
е
б
о
к
о
в
о
г
о
и
п
е
р
е
г
о
р
о
д
о
ч
н
о
г
о
e
′
)
У
в
е
л
и
ч
е
н
и
е
о
б
ъ
е
м
а
Л
П
П
о
ч
т
и
у
в
с
е
х
п
а
ц
и
е
н
т
о
в
с
с
и
с
т
о
л
и
ч
е
с
к
о
й
д
и
с
-
ф
у
н
к
ц
и
е
й
н
а
б
л
ю
д
а
е
т
с
я
о
п
р
е
д
е
л
е
н
н
а
я
с
т
е
п
е
н
ь
д
и
а
с
т
о
л
и
ч
е
с
к
о
й
д
и
с
ф
у
н
к
ц
и
и
П
р
о
г
р
е
с
с
и
р
у
ю
щ
а
я
д
и
а
с
т
о
л
и
ч
е
с
к
а
я
д
и
с
ф
у
н
к
ц
и
я
с
в
я
з
а
н
а
с
у
х
у
д
ш
е
н
и
е
м
У
в
е
л
и
ч
е
н
и
е
р
а
з
м
е
р
а
Л
П
н
е
з
а
в
и
с
и
м
о
п
р
о
г
н
о
з
и
-
р
у
е
т
н
е
б
л
а
г
о
п
р
и
я
т
н
ы
е
и
с
х
о
д
ы
В
о
в
л
е
ч
е
н
и
е
п
р
а
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
О
б
р
а
т
и
т
е
с
ь
к
г
л
а
в
е
3
1
з
а
а
н
а
т
о
м
и
е
й
,
ф
у
н
к
ц
и
е
й
и
э
х
о
-
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
о
й
о
ц
е
н
к
о
й
П
Ж
Т
я
ж
е
л
а
я
д
и
с
ф
у
н
к
ц
и
я
П
Ж
С
н
и
ж
е
н
и
е
T
A
P
S
E
(
с
и
с
т
о
л
и
ч
е
с
к
о
е
с
м
е
щ
е
н
и
е
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
Н
а
р
у
ш
е
н
и
е
г
л
о
б
а
л
ь
н
о
й
п
р
о
д
о
л
ь
н
о
й
д
е
ф
о
р
м
а
-
ц
и
и
П
Ж
Ф
у
н
к
ц
и
я
П
Ж
б
о
л
е
е
с
л
о
ж
н
а
д
л
я
к
о
л
и
ч
е
с
т
в
е
н
-
н
о
й
о
ц
е
н
к
и
,
ч
е
м
ф
у
н
к
ц
и
я
Л
Ж
и
з
-
з
а
к
о
м
-
п
л
е
к
с
а
о
с
о
б
е
н
н
о
с
т
е
й
а
н
а
т
о
м
и
и
П
Ж
Д
и
с
ф
у
н
к
ц
и
я
П
Ж
н
е
з
а
в
и
с
и
м
о
п
р
о
г
н
о
з
и
р
у
е
т
с
м
е
р
т
н
о
с
т
ь
и
г
о
с
п
и
т
а
л
и
з
а
ц
и
ю
О
ц
е
н
к
а
к
л
а
п
а
н
о
в
О
б
р
а
т
и
т
е
с
ь
к
г
л
а
в
е
1
8
д
л
я
о
ц
е
н
к
и
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
-
г
и
т
а
ц
и
и
(
М
Р
)
О
б
р
а
т
и
т
е
с
ь
к
г
л
а
в
е
3
3
д
л
я
о
ц
е
н
к
и
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
В
т
о
р
и
ч
н
а
я
М
Р
(
о
т
н
о
с
и
т
е
л
ь
н
а
я
м
и
т
р
а
л
ь
н
а
я
н
е
д
о
с
т
а
т
о
ч
н
о
с
т
ь
)
Т
я
ж
е
л
а
я
в
т
о
р
и
ч
н
а
я
М
Р
(
с
м
.
г
л
а
в
у
1
8
)
П
л
о
щ
а
д
ь
т
е
н
т
а
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
≥
3
,
4
с
м
2
О
ц
е
н
к
а
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
Т
я
ж
е
л
а
я
т
р
и
к
у
с
п
и
д
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
П
о
в
ы
ш
е
н
и
е
д
а
в
л
е
н
и
я
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
В
т
о
р
и
ч
н
а
я
М
Р
в
о
з
н
и
к
а
е
т
в
р
е
з
у
л
ь
т
а
т
е
р
е
м
о
д
е
-
л
и
р
о
в
а
н
и
я
Л
Ж
,
у
м
е
н
ь
ш
е
н
и
я
с
и
л
ы
з
а
к
р
ы
т
и
я
и
з
-
з
а
с
и
с
т
о
л
и
ч
е
с
к
о
й
д
и
с
ф
у
н
к
ц
и
и
,
п
р
о
и
с
х
о
д
и
т
д
и
л
а
т
а
ц
и
я
и
у
п
л
о
щ
е
н
и
е
м
и
т
р
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
,
с
м
е
щ
е
н
и
е
с
о
с
о
ч
к
о
в
ы
х
м
ы
ш
ц
Т
о
ч
н
а
я
о
ц
е
н
к
а
в
т
о
р
и
ч
н
о
й
М
Р
я
в
л
я
е
т
с
я
с
л
о
ж
н
о
й
С
о
к
р
а
т
и
-
т
е
л
ь
н
ы
й
р
е
з
е
р
в
И
н
ф
у
з
и
я
н
и
з
к
и
х
д
о
з
д
о
б
у
т
а
м
и
н
а
и
о
ц
е
н
к
а
с
и
с
т
о
л
и
ч
е
-
с
к
о
г
о
о
б
ъ
е
м
а
,
с
е
р
д
е
ч
н
о
г
о
в
ы
б
р
о
с
а
,
и
н
д
е
к
с
а
л
о
к
а
л
ь
-
н
о
й
с
о
к
р
а
т
и
м
о
с
т
и
и
/
и
л
и
а
н
а
л
и
з
а
д
е
ф
о
р
м
а
ц
и
и
С
н
и
ж
е
н
и
е
с
о
к
р
а
т
и
т
е
л
ь
н
о
г
о
р
е
з
е
р
в
а
Л
Ж
и
П
Ж
с
и
н
ф
у
з
и
е
й
д
о
б
у
т
а
м
и
н
а
Н
а
л
и
ч
и
е
с
о
к
р
а
т
и
т
е
л
ь
н
о
г
о
р
е
з
е
р
в
а
с
в
я
з
а
н
о
с
л
у
ч
ш
и
м
п
р
о
г
н
о
з
о
м
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
Д
и
л
а
т
а
ц
и
о
н
н
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
In-25_для нас.indd 634
03.04.2019 12:02:24
635
25 Дилатационная кардиомиопатия
ЛИТЕРАТУРА
1. Richardson P, McKenna W, Bristow M, et al.
Report of the 1995 World Health Organiza-
tion/International Society and Federation of
Cardiology task force on the definition and
classification of cardiomyopathies, Circula-
tion 93:841–842, 1996.
2. Maron BJ, Towbin JA, Thiene G, et al. Con-
temporary definitions and classification of
the cardiomyopathies: an American Heart As-
sociation Scientific Statement from the
Council on Clinical Cardiology, Heart Failure
and Transplantation Committee; Quality of
Care and Outcomes Research and Functional
Genomics and Translational Biology Interdis-
ciplinary Working Groups; and Council on
Epidemiology and Prevention, Circulation
113:1807–1816, 2006.
3. Elliott P, Andersson B, Arbustini E, et al. Clas-
sification of the cardiomyopathies: a position
statement from the European Society of Car-
diology Working Group on Myocardial and
Pericardial Diseases, Eur Heart J 29:270–276,
2008.
4. Arbustini E, Narula N, Tavazzi L, et al. The
MOGE(S) classification of cardiomyopathy
for clinicians, J Am Coll Cardiol 64:304–318,
2014.
5. Manolio TA, Baughman KL, Rodeheffer R, et
al. Prevalence and etiology of idiopathic di-
lated cardiomyopathy (summary of a Na-
tional Heart, Lung, and Blood Institute work-
shop), Am J Cardiol 69:1458–1466, 1992.
6. Hershberger RE, Lindenfeld J, Mestroni L, et
al. Heart Failure Society of America: Genetic
evaluation of cardiomyopathy—a Heart Fail-
ure Society of America practice guideline, J
Cardiac Fail 15:83–97, 2009.
7. McNally EM, Golbus JR, Puckelwartz MJ:
Genetic mutations and mechanisms in dilated
cardiomyopathy, J Clin Invest 123:19–26,
2013.
8. Thomas DE, Wheeler R, Yousef ZR, Masani
ND: The role of echocardiography in guiding
management in dilated cardiomyopathy, Eur
J Echocardiogr 10:iii15–21, 2009.
9. Yancy CW, Jessup M, Bozkurt B, et al. 2013
ACCF/AHA guideline for the management of
heart failure: a report of the American Col-
lege of Cardiology Foundation/American
Heart Association task force on practice
guidelines, Circulation 128:e240–327, 2013.
10. Douglas PS, Garcia MJ, Haines DE, et al. AC-
CF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SC-
CM/SCCT/SCMR 2011 appropriate use crite-
ria for echocardiography. A report of the
American College of Cardiology Foundation
Appropriate Use Criteria Task Force, Ameri-
can Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, Society for Cardiovascular Magnetic
Resonance American College of Chest Physi-
cians, J Am Soc Echocardiogr 24:229–267, 2011.
11. Tei C, Ling LH, Hodge DO, et al. New index
of combined systolic and diastolic myocar-
dial performance: a simple and reproducible
measure of cardiac function—a study in nor-
mals and dilated cardiomyopathy, J Cardiol
26:357–366, 1995.
12. Dujardin KS, Tei C, Yeo TC, et al. Prognostic
value of a doppler index combining systolic
and diastolic performance in idiopathic-dilat-
ed cardiomyopathy, Am J Cardiol 82:1071–
1076, 1998.
13. Alam M, Wardell J, Andersson E, et al. Assess-
ment of left ventricular function using mitral
annular velocities in patients with congestive
heart failure with or without the presence of
significant mitral regurgitation, J Am Soc
Echocardiogr 16:240–245, 2003.
14. Gulati VK, Katz WE, Follansbee WP, Gorcsan
3rd J: Mitral annular descent velocity by tissue
doppler echocardiography as an index of
global left ventricular function, Am J Cardiol
77:979–984, 1996.
15. Stanton T, Leano R, Marwick TH: Prediction
of all-cause mortality from global longitudi-
nal speckle strain: comparison with ejection
fraction and wall motion scoring, Circ Car-
diovasc Imaging 2:356–364, 2009.
16. Greenberg NL, Firstenberg MS, Castro PL, et
al. Doppler-derived myocardial systolic strain
rate is a strong index of left ventricular con-
tractility, Circulation 105:99–105, 2002.
17. Saito K, Okura H, Watanabe N, et al. Com-
prehensive evaluation of left ventricular
strain using speckle tracking echocardiogra-
phy in normal adults: comparison of three-
dimensional and two-dimensional approach-
es, J Am Soc Echocardiogr 22:1025–1030, 2009.
18. Wen H, Liang Z, Zhao Y, Yang K: Feasibility
of detecting early left ventricular systolic dys-
function using global area strain: a novel in-
dex derived from three-dimensional speckle-
tracking echocardiography, Eur J Echocar-
diogr 12:910–916, 2011.
19. Meluzin J, Spinarova L, Hude P, et al. Left
ventricular mechanics in idiopathic dilated
cardiomyopathy: systolic-diastolic coupling
and torsion, J Am Soc Echocardiogr 22:486–
493, 2009.
20. Wong M, Staszewsky L, Latini R, et al. Sever-
ity of left ventricular remodeling defines out-
comes and response to therapy in heart fail-
ure: Valsartan heart failure trial (val-heft)
echocardiographic data, J Am Coll Cardiol
43:2022–2027, 2004.
21. Quinones MA, Greenberg BH, Kopelen HA,
et al. Echocardiographic predictors of clinical
outcome in patients with left ventricular dys-
function enrolled in the solvd registry and
trials: significance of left ventricular hyper-
trophy. Studies of left ventricular dysfunc-
tion, J Am Coll Cardiol 35:1237–1244, 2000.
22. Solomon SD, Anavekar N, Skali H, et al. In-
fluence of ejection fraction on cardiovascular
outcomes in a broad spectrum of heart failure
patients, Circulation 112:3738–3744, 2005.
23. Nikitin NP, Loh PH, Silva R, et al. Prognostic
value of systolic mitral annular velocity mea-
sured with doppler tissue imaging in patients
with chronic heart failure caused by left ven-
tricular systolic dysfunction, Heart 92:775–
779, 2006.
24. Kolias TJ, Aaronson KD, Armstrong WF:
Doppler-derived dp/dt and –dp/dt predict
survival in congestive heart failure, J Am Coll
Cardiol 36:1594–1599, 2000.
25. Bogaard MD, Houthuizen P, Bracke FA, et al.
Baseline left ventricular dp/dtmax rather than
the acute improvement in dp/dtmax predicts
clinical outcome in patients with cardiac re-
synchronization therapy, EurJ Heart Fail
13:1126–1132, 2011.
26. Anavekar NS, Mirza A, Skali H, et al. Risk
assessment in patients with depressed left
ventricular function after myocardial infarc-
tion using the myocardial performance in-
dex — survival and ventricular enlargement
(save) experience, J Am Soc Echocardiogr
19:28–33, 2006.
27. Motoki H, Borowski AG, Shrestha K, et al.
Incremental prognostic value of assessing left
ventricular myocardial mechanics in patients
with chronic systolic heart failure, J Am Coll
Cardiol 60:2074–2081, 2012.
28. Zhang KW, French B, May Khan A, et al.
Strain improves risk prediction beyond ejec-
tion fraction in chronic systolic heart failure,
J Am Heart Assoc 3:e000550, 2014.
29. Douglas PS, Morrow R, Ioli A, Reichek N:
Left ventricular shape, afterload and survival
in idiopathic dilated cardiomyopathy, J Am
Coll Cardiol 13:311–315, 1989.
30. Grayburn PA, Appleton CP, DeMaria AN, et
al. Investigators BTES: Echocardiographic
predictors of morbidity and mortality in pa-
tients with advanced heart failure: the beta-
blocker evaluation of survival trial (best), J
Am Coll Cardiol 45:1064–1071, 2005.
31. Verma A, Meris A, Skali H, et al. Prognostic
implications of left ventricular mass and ge-
ometry following myocardial infarction: the
valiant (valsartan in acute myocardial infarc-
tion) echocardiographic study, JACC Cardio-
vasc Imaging 1:582–591, 2008.
32. Konstam MA, Rousseau MF, Kronenberg
MW, et al. Effects of the angiotensin convert-
ing enzyme inhibitor enalapril on the long-
term progression of left ventricular dysfunc-
tion in patients with heart failure. Solvd in-
vestigators, Circulation 86:431–438, 1992.
33. Tischler MD, Niggel J, Borowski DT, LeWin-
ter MM: Relation between left ventricular
shape and exercise capacity in patients with
left ventricular dysfunction, J Am Coll Car-
diol 22:751–757, 1993.
34. Bella JN, Palmieri V, Roman MJ, et al. Mitral
ratio of peak early to late diastolic filling ve-
locity as a predictor of mortality in middle-
aged and elderly adults: the strong heart
study, Circulation 105:1928–1933, 2002.
35. Hirata K, Hyodo E, Hozumi T, et al. Useful-
ness of a combination of systolic function by
left ventricular ejection fraction and diastolic
function by E/e′ to predict prognosis in pa-
tients with heart failure, Am J Cardiol
103:1275–1279, 2009.
36. Pozzoli M, Traversi E, Cioffi G, et al. Loading
manipulations improve the prognostic value
of doppler evaluation of mitral flow in pa-
tients with chronic heart failure, Circulation
95:1222–1230, 1997.
37. Whalley GA, Doughty RN, Gamble GD, et al.
Pseudonormal mitral filling pattern predicts
hospital re-admission in patients with conges-
tive heart failure, J Am Coll Cardiol 39:1787–
1795, 2002.
38. Dini FL, Cortigiani L, Baldini U, et al. Prog-
nostic value of left atrial enlargement in pa-
tients with idiopathic dilated cardiomyopathy
and ischemic cardiomyopathy, Am J Cardiol
89:518–523, 2002.
39. Rossi A, Cicoira M, Zanolla L, et al. Determi-
nants and prognostic value of left atrial vol-
ume in patients with dilated cardiomyopathy,
J Am Coll Cardiol 40:1425, 2002.
40. Garcia MJ, Smedira NG, Greenberg NL, et al.
Color M-mode doppler flow propagation ve-
locity is a preload insensitive index of left
ventricular relaxation: animal and human
validation, J Am Coll Cardiol 35:201–208,
2000.
41. Garcia MJ, Ares MA, Asher C, et al. An index
of early left ventricular filling that combined
In-25_для нас.indd 635
03.04.2019 12:02:24
636 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
with pulsed doppler peak E velocity may es-
timate capillary wedge pressure, J Am Coll
Cardiol 29:448–454, 1997.
42. Khan FZ, Virdee MS, Palmer CR, et al. Tar-
geted left ventricular lead placement to guide
cardiac resynchronization therapy: the target
study: a randomized, controlled trial, J Am
Coll Cardiol 59:1509–1518, 2012.
43. Kono T, Sabbah HN, Rosman H, et al. Left
ventricular shape is the primary determinant
of functional mitral regurgitation in heart
failure, J Am Coll Cardiol 20:1594–1598, 1992.
44. Karaca O, Avci A, Guler GB, et al. Tenting
area reflects disease severity and prognosis in
patients with non-ischaemic dilated cardio-
myopathy and functional mitral regurgita-
tion, Eur J Heart Fail 13:284–291, 2011.
45. Koelling TM, Aaronson KD, Cody RJ, et al.
Prognostic significance of mitral regurgita-
tion and tricuspid regurgitation in patients
with left ventricular systolic dysfunction, Am
Heart J 144:524–529, 2002.
46. Asgar AW, Mack MJ, Stone GW. Secondary
mitral regurgitation in heart failure: patho-
physiology, prognosis, and therapeutic con-
siderations, J Am Coll Cardiol 65:1231–1248,
2015.
47. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association task force
on practice guidelines, J Am Coll Cardiol
63:e57–e185, 2014.
48. Onishi T, Marek JJ, Ahmed M, et al. Mecha-
nistic features associated with improvement
in mitral regurgitation after cardiac resyn-
chronization therapy and their relation to
long-term patient outcome, Circ Heart Fail
6:685–693, 2013.
49. van Bommel RJ, Marsan NA, Delgado V, et al.
Cardiac resynchronization therapy as a thera-
peutic option in patients with moderate-se-
vere functional mitral regurgitation and high
operative risk, Circulation 124:912–919, 2011.
50. Wu AH, Aaronson KD, Bolling SF, et al. Im-
pact of mitral valve annuloplasty on mortal-
ity risk in patients with mitral regurgitation
and left ventricular systolic dysfunction, J Am
Coll Cardiol 45:381–387, 2005.
51. Marmor A, Schneeweiss A. Prognostic value
of noninvasively obtained left ventricular
contractile reserve in patients with severe
heart failure, J Am Coll Cardiol 29:422–428,
1997.
52. Otasevic P, Popovic Z, Pratali L, et al. Right
vs. left ventricular contractile reserve in one-
year prognosis of patients with idiopathic
dilated cardiomyopathy: assessment by dobu-
tamine stress echocardiography, Eur J Echo-
cardiogr 6:429–434, 2005.
53. Gulati A, Ismail TF, Jabbour A, et al. The
prevalence and prognostic significance of
right ventricular systolic dysfunction in non-
ischemic dilated cardiomyopathy, Circulation
128:1623–1633, 2013.
54. Lewis JF, Webber JD, Sutton LL, et al. Discor-
dance in degree of right and left ventricular
dilation in patients with dilated cardiomyopa-
thy: recognition and clinical implications, J
Am Coll Cardiol 21:649–654, 1993.
55. Ghio S, Recusani F, Klersy C, et al. Prognostic
usefulness of the tricuspid annular plane sys-
tolic excursion in patients with congestive
heart failure secondary to idiopathic or isch-
emic dilated cardiomyopathy, Am J Cardiol
85:837–842, 2000.
56. Meluzin J, Spinarova L, Hude P, et al. Prog-
nostic importance of various echocardio-
graphic right ventricular functional parame-
ters in patients with symptomatic heart fail-
ure, J Am Soc Echocardiogr 18:435–444, 2005.
57. Motoki H, Borowski AG, Shrestha K, et al.
Right ventricular global longitudinal strain
provides prognostic value incremental to left
ventricular ejection fraction in patients with
heart failure, J Am Soc Echocardiogr 27:726–
732, 2014.
58. Matsumoto K, Tanaka H, Onishi A, et al. Bi-
ventricular contractile reserve offers an incre-
mental prognostic value for patients with di-
lated cardiomyopathy, Eur Heart J Cardiovasc
Imaging 16:1213–1223, 2015.
59. Ghio S, Gavazzi A, Campana C, et al. Indepen-
dent and additive prognostic value of right
ventricular systolic function and pulmonary
artery pressure in patients with chronic heart
failure, J Am Coll Cardiol 37:183–188, 2001.
60. Burkett EL, Hershberger RE. Clinical and ge-
netic issues in familial dilated cardiomyopa-
thy, J Am Coll Cardiol 45:969–981, 2005.
61. Baig MK, Goldman JH, Caforio AL, et al. Fa-
milial dilated cardiomyopathy: cardiac ab-
normalities are common in asymptomatic
relatives and may represent early disease, J
Am Coll Cardiol 31:195–201, 1998.
62. Crispell KA, Hanson EL, Coates K, et al. Pe-
riodic rescreening is indicated for family
members at risk of developing familial dilated
cardiomyopathy, J Am Coll Cardiol 39:1503–
1507, 2002.
63. Jenni R, Oechslin E, Schneider J, et al. Echo-
cardiographic and pathoanatomical charac-
teristics of isolated left ventricular non-com-
paction: a step towards classification as a
distinct cardiomyopathy, Heart 86:666–671,
2001.
64. Bellavia D, Michelena HI, Martinez M, et al.
Speckle myocardial imaging modalities for
early detection of myocardial impairment in
isolated left ventricular non-compaction,
Heart 96:440–447, 2010.
65. Weiford BC, Subbarao VD, Mulhern KM.
Noncompaction of the ventricular myocar-
dium, Circulation 109:2965–2971, 2004.
66. Gianni M, Dentali F, Grandi AM, et al. Apical
ballooning syndrome or Takotsubo cardio-
myopathy: a systematic review, Eur Heart J
27:1523–1529, 2006.
67. Bybee KA, Kara T, Prasad A, et al. Systematic
review: transient left ventricular apical bal-
looning: a syndrome that mimics ST-segment
elevation myocardial infarction, Ann Intern
Med 141:858–865, 2004.
68. Sharkey SW, Lesser JR, Zenovich AG, et al.
Acute and reversible cardiomyopathy pro-
voked by stress in women from the United
States, Circulation 111:472–479, 2005.
69. Wittstein IS, Thiemann DR, Lima JA, et al.
Neurohumoral features of myocardial stun-
ning due to sudden emotional stress, N Engl
J Med 352:539–548, 2005.
70. Baccouche H, Maunz M, Beck T, et al. Echo-
cardiographic assessment and monitoring of
the clinical course in a patient with tako-
tsubo cardiomyopathy by a novel 3d-speckle-
tracking-strain analysis, Eur J Echocardiogr
10:729–731, 2009.
71. Lieback E, Hardouin I, Meyer R, et al. Clinical
value of echocardiographic tissue character-
ization in the diagnosis of myocarditis, Eur
Heart J 17:135–142, 1996.
72. Afonso L, Hari P, Pidlaoan V, et al. Acute
myocarditis: can novel echocardiographic
techniques assist with diagnosis? Eur J Echo-
cardiogr 11:E5, 2010.
73. Friedrich MG, Sechtem U, Schulz-Menger J,
et al. Cardiovascular magnetic resonance in
myocarditis: a JACC white paper, J Am Coll
Cardiol 53:1475–1487, 2009.
74. McCarthy 3rd RE, Boehmer JP, Hruban RH,
et al. Long-term outcome of fulminant myo-
carditis as compared with acute (nonfulmi-
nant) myocarditis, N Engl J Med 342:690–695,
2000.
75. Chen HS, Wang W, Wu SN, Liu JP. Cortico-
steroids for viral myocarditis, Cochrane Data-
base Syst Rev 10:CD004471, 2013.
76. Mason JW, O’Connell JB, Herskowitz A, et al.
A clinical trial of immunosuppressive therapy
for myocarditis. The myocarditis treatment
trial investigators, N Engl J Med 333:269–275,
1995.
77. Cooper Jr. LT, Berry GJ, Shabetai R. Idio-
pathic giant-cell myocarditis—natural history
and treatment. Multicenter giant cell myocar-
ditis study group investigators, N Engl J Med
336:1860–1866, 1997.
78. Fozing T, Zouri N, Tost A, et al. Management
of a patient with eosinophilic myocarditis and
normal peripheral eosinophil count: case re-
port and literature review, Circ Heart Fail
7:692–694, 2014.
79. Yu CM, Sanderson JE, Gorcsan 3rd J. Echocar-
diography, dyssynchrony, and the response
to cardiac resynchronization therapy, Eur
Heart J 31:2326–2337, 2010.
80. Chung ES, Leon AR, Tavazzi L, et al. Results
of the predictors of response to CRT (pros-
pect) trial, Circulation 117:2608–2616, 2008.
81. Yu CM, Sanderson JE, Marwick TH, Oh JK.
Tissue doppler imaging a new prognosticator
for cardiovascular diseases, J Am Coll Cardiol
49:1903–1914, 2007.
82. Mor-Avi V, Lang RM, Badano LP, et al. Cur-
rent and evolving echocardiographic tech-
niques for the quantitative evaluation of car-
diac mechanics: ASE/EAE consensus state-
ment on methodology and indications
endorsed by the Japanese Society of Echocar-
diography, J Am Soc Echocardiogr 24:277–313,
2011.
83. Tanaka H, Nesser HJ, Buck T, et al. Dyssyn-
chrony by speckle-tracking echocardiogra-
phy and response to cardiac resynchroniza-
tion therapy: results of the speckle tracking
and resynchronization (STAR) study, Eur
Heart J 31:1690–1700, 2010.
84. Lim P, Buakhamsri A, Popovic ZB, et al. Lon-
gitudinal strain delay index by speckle track-
ing imaging: a new marker of response to
cardiac resynchronization therapy, Circula-
tion 118:1130–1137, 2008.
85. Kapetanakis S, Bhan A, Murgatroyd F, et al.
Real-time 3D echo in patient selection for
cardiac resynchronization therapy, JACC
Cardiovasc Imaging 4:16–26, 2011.
86. Tanaka H, Hara H, Saba S, Gorcsan 3rd J.
Usefulness of three-dimensional speckle
tracking strain to quantify dyssynchrony and
the site of latest mechanical activation, Am J
Cardiol 105:235–242, 2010.
87. Cazeau SJ, Daubert JC, Tavazzi L, et al. Re-
sponders to cardiac resynchronization thera-
py with narrow or intermediate QRS com-
plexes identified by simple echocardiograph-
ic indices of dyssynchrony: the desire study,
Eur J Heart Fail 10:273–280, 2008.
88. Cleland JG, Freemantle N, Erdmann E, et al.
Long-term mortality with cardiac resynchro-
nization therapy in the Cardiac Resynchroni-
In-25_для нас.indd 636
03.04.2019 12:02:24
637
25 Дилатационная кардиомиопатия
zation-Heart Failure (CARE-HF) trial, Eur J
Heart Fail 14:628–634, 2012.
89. Sutton MG, Plappert T, Hilpisch KE, et al.
Sustained reverse left ventricular structural
remodeling with cardiac resynchronization at
one year is a function of etiology: quantitative
doppler echocardiographic evidence from the
Multicenter Insync Randomized Clinical
Evaluation (MIRACLE), Circulation 113:266–
272, 2006.
90. Goldenberg I, Moss AJ, Hall WJ, et al. Predic-
tors of response to cardiac resynchronization
therapy in the Multicenter Automatic Defi-
brillator Implantation Trial With Cardiac Re-
synchronization Therapy (MADIT-CRT),
Circulation 124:1527–1536, 2011.
91. Hsu JC, Solomon SD, Bourgoun M, et al. Pre-
dictors of super-response to cardiac resyn-
chronization therapy and associated improve-
ment in clinical outcome: the MADIT-CRT
(Multicenter Automatic Defibrillator Im-
plantation Trial With Cardiac Resynchroni-
zation Therapy) study, J Am Coll Cardiol
59:2366–2373, 2012.
92. Yu CM, Chau E, Sanderson JE, et al. Tissue
Doppler echocardiographic evidence of re-
verse remodeling and improved synchronic-
ity by simultaneously delaying regional con-
traction after biventricular pacing therapy in
heart failure, Circulation 105:438–445, 2002.
93. St John Sutton M, Ghio S, Plappert T, et al.
Group RErRiSlvdS: Cardiac resynchroniza-
tion induces major structural and functional
reverse remodeling in patients with New York
Heart Association class i/ii heart failure, Cir-
culation 120:1858–1865, 2009.
94. Delgado V, van Bommel RJ, Bertini M, et al.
Relative merits of left ventricular dyssyn-
chrony, left ventricular lead position, and
myocardial scar to predict long-term survival
of ischemic heart failure patients undergoing
cardiac resynchronization therapy, Circula-
tion 123:70–78, 2011.
94a. Mullens W, Grimm RA, Verga T, et al. In-
sights from a cardiac resynchronization opti-
mization clinic as part of a heart failure dis-
ease management program, J Am Coll Cardiol
53:765–773, 2009.
95. European Heart Rhythm A, European Society
of C, Heart Rhythm S, Heart Failure Society
of A, American Society of E, American Heart
A, European Association of Echocardiogra-
phy of ESC, Heart Failure Association of ESC
Daubert JC, Saxon L, Adamson PB, et al. 2012
EHRA/HRS expert consensus statement on
cardiac resynchronization therapy in heart
failure: Implant and follow-up recommenda-
tions and management, Europace 14:1236–
1286, 2012.
96. Saba S, Marek J, Schwartzman D, et al. Echo-
cardiography-guided left ventricular lead
placement for cardiac resynchronization
therapy: results of the speckle tracking as-
sisted resynchronization therapy for elec-
trode region trial, Circ Heart Fail 6:427–434,
2013.
97. Gorcsan 3rd J, Abraham T, Agler DA, et al.
Echocardiography for cardiac resynchroniza-
tion therapy: recommendations for perfor-
mance and reporting—a report from the
American Society of Echocardiography Dys-
synchrony writing group endorsed by the
Heart Rhythm Society, J Am Soc Echocardiogr
21:191–213, 2008.
98. Daubert JC, Saxon L, Adamson PB, et al. 2012
EHRA/HRS expert consensus statement on
cardiac resynchronization therapy in heart
failure: implant and follow-up recommenda-
tions and management, Heart Rhythm
9:1524–1576, 2012.
99. Aaronson KD, Schwartz JS, Chen TM, et al.
Development and prospective validation of a
clinical index to predict survival in ambula-
tory patients referred for cardiac transplant
evaluation, Circulation 95:2660–2667, 1997.
100. Lee DS, Austin PC, Rouleau JL, et al. Predict-
ing mortality among patients hospitalized for
heart failure: derivation and validation of a
clinical model, JAMA 290:2581–2587, 2003.
101. Levy WC, Mozaffarian D, Linker DT, et al.
The Seattle heart failure model: prediction of
survival in heart failure, Circulation 113:1424–
1433, 2006.
102. Pocock SJ, Ariti CA, McMurray JJ, et al. Pre-
dicting survival in heart failure: a risk score
based on 39 372 patients from 30 studies, Eur
Heart J 34:1404–1413, 2013.
In-25_для нас.indd 637
03.04.2019 12:02:24
In-25_для нас.indd 638
03.04.2019 12:02:24
639
26 Гипертрофическая кардиомиопатия
ANNA WOO, MD, SM
Генетика
Диагностика
Диагностические критерии
Семейный скрининг
Дифференциальная диагностика
Заболевания, имитирующие
гипертрофическую кардиомиопатию
Болезни накопления
Спортивное сердце
Гипертрофия межжелудочковой
перегородки у пожилых
Гипертрофия левого желудочка
Локализация и типы гипертрофии
Технические факторы
Обструкция выносящего тракта левого
желудочка
Патофизиология
Переднее систолическое движение
створки митрального клапана
Оценка с помощью допплерографии
Технические аспекты
Недостаточность митрального клапана
Стресс-тесты и другие
провокационные пробы
Подтипы гипертрофической
кардиомиопатии
Асимметрическая апикальная
гипертрофическая кардиомиопатия
Обструкция средней части желудочка
и аневризма верхушки
Гипертрофическая кардиомиопатия
у пожилых
Диастолическая дисфункция
Факторы, способствующие снижению
диастолической функции
Оценка диастолической функции
Асинхронная релаксация
Размер и функция левого предсердия
Новые эхокардиографические методы
Деформация
Трехмерная эхокардиография
Тактика ведения пациентов
с обструкцией выносящего тракта
левого желудочка
Хирургическая миоэктомия
Аблация этанолом межжелудочковой
перегородки
Сравнительная характеристика методов
лечения
Эхокардиографические
прогностические факторы
клинических исходов
Гипертрофическая кардиомиопатия (ГКМП) имеет
характерные клинические, эхокардиографические и
гемодинамические признаки [1]. ГКМП определяют
как гипертрофию левого желудочка (ЛЖ) при от-
сутствии другого сердечного или системного забо-
левания, которое может вызвать утолщение стенки
(рис. 26.1) [1]. Эпидемиологические исследования
приводят данные об уровне распространенности
ГКМП, равном приблизительно 0,2% общей попу-
ляции [1, 2]. Эхокардиография (ЭхоКГ) является
главным методом визуализации, используемым
при оценке пациентов с ГКМП [3]. За последние 50
лет ЭхоКГ сыграла решающую роль в установлении
патофизиологии ГКМП, позволяя определить ее
морфологическую и гемодинамическую тяжесть и
оценить ранние и поздние ответы на различные
методы лечения [3]. Эхокардиографические иссле-
дования также предоставили неоценимую инфор-
мацию об эпидемиологии, наследовании и прогнозе
ГКМП. Возможность выполнять серийные неинва-
зивные исследования делает ЭхоКГ методом выбора
при скрининге, диагностике и последующем на-
блюдении пациентов с этим заболеванием [3]. Кро-
ме того, эхокардиографический контроль имеет
важное значение при инвазивных методах редукции
межжелудочковой перегородки (МЖП), хирургиче-
ской миоэктомии и аблации этанолом [3].
ГЕНЕТИКА
ГКМП представляет собой наследственное заболе-
вание с аутосомно-доминантным типом наследо-
вания. Оно возникает в результате генетического
дефекта одного из генов, кодирующих белки сер-
дечного саркомерного аппарата [4]. Впервые гене-
тический дефект был описан в конце 1980-х гг ., и с
тех пор > 1400 различных мутаций среди по мень-
шей мере 8 генов были связаны с ГКМ [1, 4]. Му-
тации в генах, кодирующих тяжелую цепь β-мио-
зина (MYH7) и миозинсвязывающий протеин C
(MYBPC3), составляют примерно 70% идентифици-
рованных мутаций [4]. Вероятность выявления
мутации, вызывающей болезнь, при генетическом
анализе является вариабельной. Генетический ана-
лиз на основании результатов ЭхоКГ может быть
потенциально полезным для выявления пациентов
с более высокой вероятностью наличия положи-
тельного генотипа: в ходе исследовании с участием
382 пациентов диагностическая значимость генети-
ческого анализа составляла 79% у пациентов с мор-
In-26_для нас.indd 639
03.04.2019 12:02:39
640
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
основную роль в диагностике ГКМП [11, 12]. Эхо-
кардиографический показатель асимметричной ги-
пертрофии перегородки, определяемый как отно-
шение толщины стенки перегородки к толщине
нижней (задней) стенки при значениях 1,3 или более
демонстрирует выраженную корреляцию с ГКМП
[13]. Максимальная толщина стенки ЛЖ (чаще все-
го МЖП) обычно равна не менее 15 мм [1, 13]. Тол-
щина стенки от 13 до 14 мм считается пограничный
значением для постановки диагноза «гипертрофи-
ческая кардиомиопатия», особенно при наличии
других вспомогательных признаков (например, се-
мейного анамнеза ГКМП) [1]. Другие нарушения,
связанные с обструктивной ГКМП, например пара-
доксальное систолическое движение передней створ-
ки митрального клапана (SAM-синдром), выявля-
ются также при других состояниях и не считаются
патогномоничными для ГКМП [14]. Диагноз «ги-
пертрофическая кардиомиопатия» у детей выстав-
ляется при превышении более чем на два стандарт-
ных отклонения среднего значения толщины стенок
ЛЖ (с поправкой на возраст и площадь поверхности
тела) [1, 15]. Примерно у 30% пациентов ГКМП
сочетается с обструкцией выносящего тракта левого
желудочка (ВТЛЖ), которая обычно определяется
как градиент в ВТЛЖ в покое, равный 30 мм рт. ст.
или более [1].
СЕМЕЙНЫЙ СКРИНИНГ
У родственников первой степени (родители, братья
и сестры, дети) пациентов с ГКМП необходимо про-
вести скрининг по этому заболеванию [1]. Посколь-
ку ГКМП является аутосомно-доминантным забо-
леванием, у детей пациентов с выявленным ГКМП
вероятность наследования равна 50% [1]. Методы
скрининга для членов семьи включают в себя сбор
анамнеза, физикальное обследование, электрокар-
диографию в 12 отведениях и ЭхоКГ. Генетическое
тестирование стало более широко доступным в по-
следние годы [4]. Тем не менее вероятность поло-
жительного генетического результата у пробанда
(т.е . у пациента с ГКМП) составляет около 50%,
поскольку не все гены, отвечающие за ГКМП, иден-
тифицированы [4]. ЭхоКГ — рекомендуемый ме-
тод визуализации при серийном скрининге ГКМП
[1, 3]. Скрининг по ГКМП рекомендуется проводить
как минимум с 12 лет. У детей пациентов с верифи-
цированной ГКМП следует проводить скрининг до
12 лет в следующих случаях: у ребенка наблюдают-
ся симптомы, имеется другая клиническая насторо-
женность относительно гипертрофии ЛЖ, если он
участвует в спортивных соревнованиях или семей-
ный анамнез отягощен преждевременной смертью,
связанной с ГКМП [1]. Затем повторные исследова-
ния выполняются каждые 12–18 месяцев в подрост-
ковом возрасте до достижения физической зрелости
(обычно в возрасте 18–21 года). Поскольку симпто-
Рис. 26.1 Патологоанатомические находки при гипертрофической
кардиомиопатии. Патологоанатомический макропрепарат сердца пациента с
гипертрофической кардиомиопатией и обструкцией выносящего тракта ЛЖ,
который внезапно умер. Обратите внимание на асимметричную гипертрофию
с заметным утолщением межжелудочковой перегородки и сужением вынося-
щего тракта между основанием перегородки и передней створкой митрально-
го клапана. Передняя створка утолщена и фиброзирована, на эндокардиальной
поверхности проксимальной перегородки имеется рубец от многократного
контакта митральной створки и перегородки (стрелка).
фологией обратного искривления перегородки по
сравнению с 8% у пациентов с морфологией сигмо-
видной перегородки (основания перегородки) [5].
Остается неясным генотип, определяющий фе-
нотип этого заболевания. В ходе некоторых иссле-
дований было показано, что у пациентов с наличи-
ем мутаций MYH7 наблюдается более раннее начало
гипертрофии и большая ее выраженность, чем у
пациентов с мутациями, не связанными с MYH7 [6,
7]. Никаких существенных различий в степени ги-
пертрофии у пациентов с различными мутациями
гена MYH7 выявлено не было [8, 9]. Мутации гена
MYBPC3 были связаны с отсроченной пенетрантно-
стью (проявлением фенотипа) [6]. Однако в ходе
одного крупного исследования при сравнении па-
циентов с мутациями генов актиновых нитей, мио-
зиновых нитей или MYBPC3 не было выявлено
различий в степени выраженности и начале гипер-
трофии [10].
ДИАГНОСТИКА
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ
Диагностика ГКМП основана на выявлении гипер-
трофии ЛЖ при отсутствии других причин, таких
как системная гипертензия или стеноз аортального
клапана, которые могут привести к утолщению
стенки (рис. 26.2) [1]. М-режим ЭхоКГ приобретает
In-26_для нас.indd 640
03.04.2019 12:02:39
641
26 Гипертрофическая кардиомиопатия
Норма
Апикальная ГКМП
ГКМП с гипертрофией перегородки и SAM
Концентрическая ГЛЖ
Рис. 26.2 Различные виды гипертрофии левого желудочка. Схематическое изображение различных форм гипертрофии левого желудочка (ГЛЖ), в пара-
стернальной длинноосевой проекции. (Сверху слева) Нормальная толщина стенок у здорового человека. (Сверху справа) Концентрическая ГЛЖ с равномерным
утолщением межжелудочковой перегородки и свободных стенок ЛЖ. Это форма гипертрофии наиболее часто встречается у пациентов с системной гипертензией,
стенозом аортального клапана или сердцем атлета. (Снизу слева) Напротив, у пациентов с апикальной гипертрофической кардиомиопатией (ГКМП) наблюдается
гипертрофия преимущественно апикальных сегментов. Обратите внимание, что в области основания межжелудочковой перегородки гипертрофия не отмечается,
а дистальная полость ЛЖ уменьшена. У пациентов с апикальной ГКМП в фазу систолы наблюдается почти полная облитерация дистальной полости ЛЖ. (Снизу
справа) Более распространенная форма ГКМП включает асимметричную гипертрофию межжелудочковой перегородки. Свободная стенка ЛЖ нормальная или
незначительно утолщена. У пациентов с обструктивной формой ГКМП обычно наблюдается сужение выносящего тракта ЛЖ, смещение митрального аппарата
кпереди и парадоксальное систолическое движение передней створки митрального клапана (SAM-синдром).
мы ГКМП могут проявиться в пожилом возрасте,
скрининг у взрослых обычно рекомендуется выпол-
нять каждые 5 лет [1]. Сравнительный анализ ЭхоКГ
и магнитно-резонансной томографии (МРТ) сердца
у носителей гена ГКМП без проявления заболева-
ния продемонстрировал два основных результата:
(1) было отмечено 90% диагностическое соответст-
вие между этими двумя методами при оценке тол-
щины стенок ЛЖ в норме и (2) при измерении
толщины стенки ЛЖ с помощью МРТ значения
были на 19% ниже, чем при ЭхоКГ [16].
В ходе генетических и эхокардиографических
исследований было продемонстрировано, что у ге-
нотип-положительных родственников пациентов с
ГКМП может наблюдаться минимальная гипертро-
фия (максимальная толщина стенки ЛЖ < 13 мм),
определяемая эхокардиографически [6, 9]. Пациен-
ты с положительным генотипом расширяют клини-
ческий спектр ГКМП и демонстрируют, что любая
толщина стенок ЛЖ может указывать на это тяже-
лое наследственное заболевание [1]. Тканевая доп-
плерография позволяет идентифицировать нару-
шения до начала гипертрофии ЛЖ у пациентов с
положительным генотипом, относящихся к группе
доклинической ГКМП. При первом исследовании с
помощью тканевой допплерографии пациентов с
положительным генотипом и отсутствием гипер-
трофии наблюдается снижение систолической и
ранней диастолической скоростей (e′) (рис. 26.3)
[17].
Специфические пороговые значения тканевых
допплеровских скоростей показали чувствитель-
ность 100% и специфичность не менее 90% при
прогнозировании положительности генотипа. Бо-
лее того, серийные эхокардиографические иссле-
дования документально подтверждали дальнейшее
снижение тканевых допплеровских скоростей и
развитие клинически выраженной гипертрофии в
течение 2-летнего наблюдения [18], хотя по резуль-
татам других исследований сообщалось о значимом
перекрытии значений тканевых допплеровских си-
столической скорости и скорости e′ между группой
пациентов с положительным генотипом при отсут-
ствии гипертрофии и контрольной группой [19,
20]. В ходе этих же исследований было продемон-
стрировано, что тканевая допплеровская скорость e′
и связанные с ней эхокардиографические показате-
ли (гипердинамическая функция ЛЖ [19] и соотно-
шение толщины стенок [20]) весьма специфичны
при идентификации носителей мутаций.
In-26_для нас.indd 641
03.04.2019 12:02:40
642
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ЗАБОЛЕВАНИЯ, ИМИТИРУЮЩИЕ
ГИПЕРТРОФИЧЕСКУЮ КАРДИОМИОПАТИЮ
С помощью ЭхоКГ возможно выявление несколь-
ких отличающихся нарушений при ГКМП, которые
часто называются фенокопиями (табл. 26.1) [21].
ГКМП, обусловленную дефектом саркомерного ге-
на, следует отличать от врожденных пороков разви-
тия и синдромов, например синдромов Noonan или
LEOPARD (Lentigines, Electrocardiographic abnorma-
lities, Ocular hypertelorism, Pulmonary stenosis, Ab-
normal genitalia, Retardation of growth, Deafness [лен-
тиго, электрокардиографические аномалии, глазной
гипертелоризм, стеноз легочного ствола, аномалия
развития гениталий, задержка роста, тугоухость]).
Диспропорциональная гипертрофия МЖП может
возникать при гипертрофии правого желудочка
(ПЖ) и D-транспозиции магистральных сосудов
[22]. Другие негенетические причины гипертрофии
Синдромная гипертрофическая кардиомиопатия
Синдром Noonan
Синдром LEOPARD
Атаксия Фредерика
Непропорциональная гипертрофия межжелудочковой
перегородки
Гипертрофия правого желудочка
D-транспозиция магистральных сосудов
Другие причины гипертрофии левого желудочка
Сердце атлета
Системная гипертензия
Стеноз аортального клапана
Фиброзный подклапанный аортальный стеноз
Надклапанный аортальный стеноз
Метаболические расстройства
Болезнь Фабри
Болезнь накопления гликогена
Болезнь накопления мукополисахаридов
Гипотиреоз
Инфильтративная кардиомиопатия
Амилоидоз
Саркоидоз
LEOPARD — лентигиноз, электрокардиографические аномалии,
глазной гипертелоризм, стеноз легочного ствола, аномалия раз-
вития гениталий, задержка роста, тугоухость (Lentigines, Electro-
cardiographic abnormalities, Ocular hypertelorism, Pulmonary steno-
sis, Abnormal genitalia, Retardation of growth, Deafness).
ТАБЛИЦА 26.1
Дифференциальная диагностика
гипертрофической кардиомиопатии
с помощью эхокардиографии
Рис. 26.3 Эхокардиографические находки у носителей гена гипертро-
фической кардиомиопатии без признаков гипертрофии. (A) A Пара-
стернальная длинноосевая проекция у 50-летней женщины с сильным семей-
ным анамнезом гипертрофической кардиомиопатии и мутацией гена миозин-
связывающего белка C без симптомов. Максимальная толщина стенки ЛЖ,
измеренная у основания переднеперегородочной области, составляет 10 мм.
Соотношение толщины перегородка/задняя стенка составляет 1,4 , и относи-
тельная толщина стенок 0,46. (Б) Скорости трансмитрального кровотока де-
монстрируют немного увеличенное время замедления. (В) Тканевые доппле-
ровские скорости, измеренные в латеральной части фиброзного кольца ми-
трального клапана, указывают на снижение ранней диастолической скорости
(e′ = 0 ,11 м/сек), что свидетельствует о нарушении релаксации желудочков.
Эти эхокардиографические нарушения, вероятно, представляют собой ранние
проявления гипертрофической кардиомиопатии до развития клинически выра-
женной гипертрофии.
А
Б
В
In-26_для нас.indd 642
03.04.2019 12:02:40
643
26 Гипертрофическая кардиомиопатия
ЛЖ включают спортивное сердце или сердце атлета
(см. далее), системную гипертензию и аортальный
стеноз. Вторичная гипертрофия при этих заболева-
ниях обычно концентрическая, но может также от-
мечаться очаговая гипертрофия МЖП различной
степени или SAM-синдром [14]. Вторичное утолще-
ние стенки, не связанное с гипертрофией миоцитов,
может отмечаться при болезнях нарушения обмена
веществ (болезни накопления, см. далее), гипотире-
озе [23] или инфильтративных кардиомиопатиях
(рис. 26.4) [24]. Увеличение толщины стенки у па-
циентов с нарушениями обмена веществ или ин-
фильтративными кардиомиопатиями обычно но-
сит концентрический характер, однако может иног-
да проявляться непропорциональным утолщением
МЖП. Кроме того, при инфильтративных кардио-
миопатиях, таких как амилоидоз сердца, наблюда-
ется рестриктивный тип диастолического напол-
нения.
БОЛЕЗНИ НАКОПЛЕНИЯ, ТЕЗАУРИСМОЗЫ
Болезни накопления (тезаурисмозы) следует учи-
тывать при обследовании пациентов с неизвестной
этиологией утолщения стенки ЛЖ. Болезнь Фабри
представляет собой сцепленное с Х-хромосомой
рецессивное заболевание, возникающее в результа-
те дефицита фермента α-галактозидазы и проявля-
ющееся мультиорганным поражением или изоли-
рованным поражением сердца [25]. Болезнь Фабри
была диагностирована у 7 из 230 пациентов муж-
ского пола с гипертрофией ЛЖ (3% распространен-
ность), у всех этих пациентов гипертрофия носила
концентрический характер [25]. Среди пациентов
мужского пола с диагнозом «гипертрофическая кар-
диомиопатия» болезнь Фабри была диагностирова-
на у 6% пациентов в возрасте 40 лет и старше и у
1% пациентов младше 40 лет. У 5 пациентов отме-
чался концентрический характер гипертрофии и у
1 пациента — асимметрический [26]. Наконец, в
ходе Фрамингемского исследования сердца (Fra-
mingham Heart Study) в большой территориальной
когорте с участием 1862 пациентов, которым была
выполнена ЭхоКГ, у 1 пациента из выборки 50 па-
циентов с неизвестной этиологией утолщения сте-
нок ЛЖ была выявлена мутация гена α-галактозида-
зы (GLA), вызывающего болезнь Фабри [27]. Особо
внимание относительно вероятности наличия бо-
лезни Фабри следует уделить пациентам мужского
пола с (1) концентрическим характером гипертро-
фии ЛЖ и (2) отсутствием семейного анамнеза
Рис. 26.4 Эхокардиография 63-летнего мужчины с одышкой при физической нагрузке. (A, Б) A A В парастернальной позиции по длинной оси и
апикальной четырехкамерной позиции наблюдается диффузное утолщение стенок ЛЖ (19 мм), нормальная систолическая функция ЛЖ и расширение обоих
предсердий. (В) Важной находкой в апикальной четырехкамерной позиции выносящего тракта ЛЖ и митрального клапана является наличие систолического
движения передней створки, которое гораздо чаще встречается у пациентов с гипертрофической кардиомиопатией, чем у пациентов с болезнями накопления или
инфильтративной кардиомиопатией. (Г) В субкостальной позиции наблюдается увеличение толщины стенок как ЛЖ, так и ПЖ с толщиной свободной стенки ПЖ
12 мм. (Д, Е) Импульсно-волновая допплерография скоростей трансмитрального кровотока фиксирует увеличение отношения ранней диастолической скорости
(E) к поздней диастолической скорости (A) кровотока (отношение E/A = 3), что нехарактерно для пожилого пациента с гипертрофической кардиомиопатией. Тка-
невые допплеровские ранние диастолические скорости (e′), измеренные в латеральной части фиброзного кольца митрального клапана, заметно снижены (0,05 м/
сек), а отношение E/e′ увеличено до 19. Характер утолщения стенки и нарушения диастолического наполнения позволили заподозрить амилоидоз сердца, что
было подтверждено при последующих исследованиях (магнитно-резонансная томография и эндомиокардиальная биопсия).
А
Б
В
Г
Д
Е
In-26_для нас.indd 643
03.04.2019 12:02:41
644
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ГКМП или при наследовании, сцепленным с X-хро-
мосомой [26].
Гликогенозы также могут имитировать ГКМП.
Мутации гена АМФ-протеинкиназы γ2 (PRKAG2)
вызывают гликоген-ассоциированную кардиомио-
патию, мутации гена лизосомального мембранного
белка 2 (LAMP2) вызывают болезнь Данона, а мута-
ции гена кислой α-1,4-глюкозидазы вызывают бо-
лезнь Помпе [28]. В когорте из 75 пациентов с ги-
пертрофией неясной этиологии у 40 пациентов
(53%) были идентифицированы мутации генов
саркомерного белка, у 1 пациента (1%) — дефект
PRKAG2, а у 2 пациентов (3%) — мутации LAMP2
[28]. В другой когорте из 24 пациентов с утолщени-
ем стенки и предвозбуждением желудочков (син-
дром Вольфа–Паркинсона–Уайта) мутации генов
PRKAG2 и LAMP2 были обнаружены у 7 (29%) и 4
(17%) пациентов соответственно. Ни у одного из
этих пациентов не было генетических дефектов,
вызывающих болезнь Фабри или Помпе [28].
СПОРТИВНОЕ СЕРДЦЕ
Дифференциальный диагноз между ГКМП и сер-
дцем атлета может быть сложной задачей. Толщина
стенки ЛЖ у 2% профессиональных спортсменов
может составлять 13 мм или более (до 15–16 мм),
что указывает на возможность наличия ГКМП [29].
Конечный диастолический размер ЛЖ может быть
увеличен (> 55 мм) у более чем 30% профессиональ-
ных спортсменов [29]. Способность отличить фи-
зиологическую гипертрофию при сердце атлета и
патологическую гипертрофию при ГКМП может
быть менее сложной у женщин, поскольку толщина
стенок ЛЖ профессиональных женщин-спортсме-
нов находится в диапазоне от 6 до 12 мм, что не
превышает стандартизированные по возрасту пре-
делы данного показателя [30]. Способствует поста-
новке диагноза «гипертрофическая кардиомиопа-
тия» наличие следующего: (1) семейный анамнез
ГКМП, (2) электрокардиографические нарушения,
(3) асимметричная гипертрофия (или другие нео-
бычные формы гипертрофии), (4) полость ЛЖ
< 45 мм, (5) расширение левого предсердия (ЛП) и
(6) нарушение наполнения ЛЖ (табл. 26.2) [31]. В
некоторых случаях при утрате физической формы
у спортсменов требуется определить, происходит
ли обратное развитие гипертрофии ЛЖ [31]. Сра-
внительная характеристика общих клинических,
эхокардиографических и допплеровских данных
при основных заболеваниях, имитирующих ГКМП,
приведена в табл. 26.3 .
ГИПЕРТРОФИЯ МЕЖЖЕЛУДОЧКОВОЙ
ПЕРЕГОРОДКИ У ПОЖИЛЫХ
У пожилых пациентов может быть трудно провести
различие между ГКМП и гипертонической болез-
нью сердца. Искривление аорты и сигмовидная
МЖП у пожилых могут формироваться как воз-
растное изменение [32]. Термины, используемые
для описания этого явления, — сигмовидная перего-
родка, выпячивание перегородки и дискретная или
частичная гипертрофия верхнего отдела перегород-
ки. Нет единого мнения, можно ли эти нарушения
считать подтипом ГКМП или они являются вариан-
том анатомической нормы. Другие данные эхокар-
диографического обследования, которые более со-
поставимы с выпячиванием перегородки, а не с
ГКМП у пожилых людей, включают фокальную
гипертрофию, протяженностью < 3 см в базальном
сегменте передней части МЖП, выпячивание фо-
кальной гипертрофии в ВТЛЖ, нормальный конеч-
ный диастолический диаметр ЛЖ и отсутствие ха-
рактерных эхокардиографических признаков ГКМП
[33]. Эхокардиографические и клинические особен-
ности ГКМП у пожилых людей описаны далее в
этой главе.
ГИПЕРТРОФИЯ ЛЕВОГО ЖЕЛУДОЧКА
ЛОКАЛИЗАЦИЯ И ТИПЫ ГИПЕРТРОФИИ
Двухмерная (2D) ЭхоКГ значительно увеличила
способность выявлять полный объем, локализацию
и тяжесть гипертрофии миокарда [34–36]. Для ком-
плексного трансторакального эхокардиографиче-
ского исследования нужна визуализация из не-
скольких сечений, включая парастернальную про-
екцию по длинной оси, парастернальные проекции
по короткой оси и апикальные проекции (рис. 26.5).
Гипертрофическая
кардиомиопатия
Сердце
атлета
Локальная (или
асимметричная) картина
гипертрофии ЛЖ
+
−
Полость ЛЖ < 45 мм
+
−
Полость ЛЖ > 55 мм
−
+
Расширение ЛП
+
−
Нарушение наполнения ЛЖ +
−
Семейный анамнез ГКМП
+
−
Увеличение VO2 > 110%
−
+
Снижение толщины
стенки ЛЖ при потере
физической формы
−
+
«+» — присутствует; «−»
—
отсутствует; VO2 — максимальное по -
требление кислорода; ГКМП — гипертрофическая кардиомиопа-
тия; ЛЖ — левый желудочек; ЛП — левое предсердие [Maron BJ,
Maron MS. Hypertrophic cardiomyopathy. Lancet 381:242–255, 2013.]
ТАБЛИЦА 26.2
Дифференциальная диагностика
сердца атлета и гипертрофической
кардиомиопатии
In-26_для нас.indd 644
03.04.2019 12:02:41
645
26 Гипертрофическая кардиомиопатия
Диагноз
Клиническая
картина
Характерные
признаки по ЭКГ
Характерные признаки по
2D-ЭхоКГ
Характерные признаки при
допплерографии
Гипертро-
фическая
кардиомио-
патия
Одышка, боль в
груди, предоб-
морочные состо-
яния/обмороки
(чаще при физи-
ческой нагрузке),
систолический
шум изгнания
(динамический)
в подгруппе с об-
струкцией ВТЛЖ
Признаки ГЛЖ ±
картина псевдоин-
фаркта
Паттерн ГЛЖ: асимме-
тричная (обычно перего-
родка)
Систолическая функция
ЛЖ: нормальная/гипер-
динамическая; систоли-
ческая дисфункция у 4%;
± переднее систолическое
движение
Диастолическая функция ЛЖ:
нарушение релаксации ЛЖ
Непрерывно-волновая доппле-
рография: увеличение скорости
кровотока ВТЛЖ (конечно-систо-
лический пик) с кинжаловидным
допплеровским спектральным про-
филем, возникающим в покое/при
провокации у двух третей пациен-
тов (т.е. динамическая обструкция
ВТЛЖ)
Болезнь
накопления
гликогена
Вариабельна
Признаки ГЛЖ ±
предвозбуждение
Паттерн гипертрофии:
Концентрическая/диф-
фузная ГЛЖ; ± вовлече-
ние ПЖ
Систолическая функция
ЛЖ: нормальная
Диастолическая функция ЛЖ:
вариабельна
Амилоидоз
Одышка ± призна-
киправо-иле-
вожелудочковой
недостаточности,
± системное по-
ражение других
органов
Низкий вольтаж
Паттерн ГЛЖ: Концент-
рическая/асимметричная;
± вовлечение ПЖ
Миокардиальные призна-
ки: «пятнистая» структура
миокарда
Систолическая функция
ЛЖ: нормальная; снижена
на поздних стадиях забо-
левания
Створки клапана: ± утол-
щены
Продольная деформация:
«апикальное щажение»
картина сниженной про-
дольной деформации
Диастолическая функция ЛЖ:
рестриктивный тип нарушений
Непрерывно-волновая допплеро-
графия: ± динамическая
обструкция ВТЛЖ
Сердце атлета Отсутствие симпто-
мов (обычно)
Нормальная/при-
знаки ГЛЖ
Паттерн ГЛЖ: концентри-
ческая
Систолическая функция
ЛЖ: нормальная/гипер-
динамическая
Диастолическая функция ЛЖ: нор-
мальная
Гипертониче-
ское сердце
Вариабельная
Признаки ГЛЖ
Паттерн ГЛЖ: концент-
рическая ± сигмовидная
форма основания перего-
родки у пожилых
Диастолическая функция ЛЖ: нор-
мальная/нарушение релаксации
ЛЖ
ВТЛЖ — выносящий тракт левого желудочка; ГЛЖ — гипертрофия левого желудочка; ЛЖ — левый желудочек; ПЖ — правый желудочек;
ЭКГ — электрокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 26.3 Корреляция клинических и эхокардиографических данных при утолщении стенки левого желудочка
Измерения сегментов стенок получают из парастер-
нальных коротко-осевых проекций, выполняемых
на трех уровнях: (1) базальном (уровень митраль-
ного клапана), (2) среднем (уровень сосочковых
мышц) и (3) верхушечном.
Наиболее часто гипертрофия встречается в обла-
сти передней части МЖП, что было подтверждено
в ходе большого последовательного серийного ис-
следования с участием 600 пациентов, в котором
этот вид гипертрофии определялся более чем у 80%
пациентов с ГКМП [36]. Были предложены различ-
ные классификационные системы для разделения
ГКМП на морфологические подтипы. Одна из них
основана на локализации гипертрофии: (1) тип I —
изолированно в передней части перегородки; (2) тип
II — пансептальная гипертрофия (вовлечение пе-
редней и задней частей перегородки); (3) тип III —
распространение гипертрофии на переднебоковую
стенку; (4) тип IV — все другие виды гипертрофии
[34]. Более поздний подход к классификации раз-
личных морфологических подтипов основан на
строении перегородки и форме полости ЛЖ: (1) сиг-
мовидная перегородка — выраженное базальное
выпячивание перегородки, обычно полость ЛЖ
овальной формы с вогнутой в нее перегородкой;
(2) обратное искривление перегородки, преоблада-
In-26_для нас.indd 645
03.04.2019 12:02:41
646
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ющая выпуклость в полость ЛЖ в области среднего
отдела желудочка, полость ЛЖ имеет форму полу-
месяца; (3) нейтральная перегородка, полностью
прямая перегородка, которая не является ни выпу-
клой, ни вогнутой по отношению к полости ЛЖ;
(4) апикальная, преобладающее локализация ги-
пертрофии в области верхушки [5]. Наконец, у
пациентов с ГКМП редко наблюдается концентри-
ческий характер гипертрофии ЛЖ (все гипертро-
фированные сегменты утолщены в равной степе-
ни), в ходе исследования с участием 600 пациентов
с ГКМП уровень распространенности составил 1%
[36].
ТЕХНИЧЕСКИЕ ФАКТОРЫ
В эхокардиографической оценке ГКМП имеются
важные технические особенности. Эхокардиогра-
фическое исследование требует пристального вни-
мания к правильной регулировке положения луча
для минимизации ошибки при измерении толщи-
ны стенки и соответствующей идентификации ги-
пертрофии с необычной локализацией. Косой срез
полости ЛЖ может спровоцировать ложное появле-
ние асимметричной гипертрофии перегородки и
завышенной оценке толщины стенки. Также нали-
чие мышечного модераторного пучка ПЖ или су-
хожилия ЛЖ может привести к переоценке толщи-
ны перегородки.
И наоборот, поскольку гипертрофия может быть
достаточно локальной или располагаться эксцент-
рично [34–36], более атипичные формы ГКМП, та-
кие как изолированная гипертрофия боковой сте-
нки либо асимметричная гипертрофия верхушки
сердца, могут быть пропущены при исследовании в
стандартных парастернальных длинноосевых про-
екциях.
Диагноз «апикальная гипертрофическая кардио-
миопатия» при ЭхоКГ может быть пропущен, если
апикальные сегменты искажены или апикальные
проекции получены с техническими нарушениями.
У пациентов с подозрением на апикальную ГКМП,
а также при технически неадекватной визуализации
для улучшения определения эндокарда рекоменду-
ется использовать эхокардиографическое усиление
с контрастированием [37].
ОБСТРУКЦИЯ ВЫНОСЯЩЕГО ТРАКТА
ЛЕВОГО ЖЕЛУДОЧКА
ПАТОФИЗИОЛОГИЯ
При ЭхоКГ в M-режиме выявляется SAM-синдром
[12] и среднесистолическая выемка аортального кла-
Рис. 26.5 Комплексная эхокардиографическая оценка степени, выраженности и локализации гипертрофии у пациентов с гипертрофической
кардиомиопатией. Оптимальная оценка требует визуализации из нескольких трансторакальных окон. Парастернальная длинноосевая A (A), парастернальная
короткоосевая на уровне основания A (Б), апикальная четырехкамерная A (В) и апикальная длинноосевая (Г) проекции у 28-летней женщины с обструктивной
гипертрофической кардиомиопатией. Максимальная толщина стенки составила 29 мм. Гипертрофия распространяется на сегменты основания передней и перед-
нелатеральной стенок (Б). Апикальная визуализация (В и Г) демонстрирует конфигурацию перегородки по типу обратного искривления, которое характеризуется
выпячиванием среднего отдела перегородки в направлении полости ЛЖ, что обычно наблюдается у молодых пациентов с гипертрофической кардиомиопатией.
А
Б
Г
В
In-26_для нас.indd 646
03.04.2019 12:02:41
647
26 Гипертрофическая кардиомиопатия
пана [38] как признаки динамической обструкции
ВТЛЖ при ГКМП. Достижения в области 2D-ЭхоКГ
и допплеровской технике дали дополнительную
информацию о механизмах, ответственных за об-
струкцию выносящего тракта (табл. 26.4). Морфо-
логические особенности ГКМП, которые способст-
вуют обструкции ВТЛЖ, включают сужение выно-
сящего тракта гипертрофированной перегородкой
[39], врожденные патологические изменения ство-
рок митрального клапана [40, 41], переднее смеще-
ние митрального аппарата [39, 41], и переднюю
эктопию сосочковых мышц [41].
Как правило, существует тесная взаимосвязь
между степенью гипертрофии ЛЖ и наличием об-
струкции ВТЛЖ. Обструкция ВТЖЛ в покое связа-
на с большой нагрузкой, обусловленной гипертро-
фией [35]. Митральные створки у пациентов с
ГКМП удлиняются [41, 42]. Смыкание створок
происходит аномально в области их тела, а не на
кончиках [40, 41]. У пациентов с увеличением ми-
трального клапана наблюдается «типичный» SAM-
синдром и контакт дистальной и центральной ча-
стей передней митральной створки с перегородкой.
Напротив, у пациентов с митральным клапаном
нормального размера отмечается «нетипичный»
SAM-синдром, вовлекающий большую часть тела
передней митральной створки и связанные с ним
сухожильные хорды с небольшим изгибом перед-
ней митральной створки [43]. Кроме того, при
ГКМП дистальные концы сосочковых мышц сме-
щены вперед и друг к другу. Это приводит к умень-
шению относительного натяжения сухожильных
нитей к телу передней митральной створки, что
проявляется относительным провисанием хорд в
центральной и передней частях створки [41]. Умень-
шение хордального натяжения более вероятно, ког-
да расстояние от дистального конца сосочковых
мышц митральных створок уменьшается за счет
комбинации гипертрофии у основания сосочковых
мышц и увеличения длины створки.
ПЕРЕДНЕЕ СИСТОЛИЧЕСКОЕ ДВИЖЕНИЕ
СТВОРКИ МИТРАЛЬНОГО КЛАПАНА
Хотя природа гидродинамических сил на передней
митральной створке остается спорной, считается,
что передняя митральная створка дистально по от-
ношению к месту сопоставление подвергается эф-
фекту Вентури и/или влекущей силе [44]. Вследст-
вие этого возникает SAM-синдром, и дистальный
конец передней створки митрального клапана под-
вергается резкому переднему и верхнему искривле-
нию, что приводит к контакту митральной створки
и перегородки в ранней и средней систоле (рис.
26.6). Существует тесная взаимосвязь между разви-
тием SAM-синдрома и обструктивным градиентом
давления, что было продемонстрировано у пациен-
тов, подвергающихся одновременной катетериза-
ции сердца и ЭхоКГ в М-режиме (рис. 26.7) [45]. С
помощью ЭхоКГ в М-режиме было выделено три
степени выраженности SAM-синдрома: (1) легкая —
расстояние SAM–перегородка > 10 мм; (2) умерен-
ная — расстояние SAM–перегородка 10 мм или ме-
нее или кратковременный контакт митральной
створки и перегородки (< 30% эхокардиографиче-
ской систолы); (3) тяжелая — длительный контакт
SAM и перегородки, продолжающийся по меньшей
мере 30% эхокардиографической систолы) [46].
ОЦЕНКА С ПОМОЩЬЮ ДОППЛЕРОГРАФИИ
Допплеровский метод позволяет получить важную
информацию о выраженности и уровне обструкц
ии у пациентов с ГКМП [3]. Обструкция выходного
тракта возникает вторично по отношению к SAM-
синдрому и при цветовом допплеровском картиро-
вании представлена в виде мозаичного рисунка [3].
Сигналы при импульсно-волновой допплерографии
можно регистрировать последовательно от верхуш-
ки ЛЖ к выносящему тракту. Максимальная ско-
рость кровотока (Vmax) возрастает по мере приб-
лижения контрольного объема к месту контакта
передней митральной створки и перегородки. Не-
прерывно-волновая допплерография из апикально-
го доступа с лучом, направленным поперек ВТЛЖ,
может использоваться для определения Vmax в месте
обструкции (рис. 26.8). У пациентов с обструкцией
ВТЛЖ наблюдается характерный контур спектраль-
ной линии асимметричной вогнутой слева формы
[3]. Это происходит из-за относительно быстрого
начального увеличения скорости кровотока, за ко-
торым следует более постепенное увеличение ско-
рости в ВТЛЖ, приводящее к формированию пика
в поздней систоле, в результате чего возникает кин-
жаловидный допплеровский контур. Возможна не-
которая вариабельность формы допплеровского
сигнала [47]. Градиент пика (ΔP) может быть оценен
с помощью модифицированного уравнения Бер-
нулли (ΔP = 4Vmax
2) [47, 48]. Существует выражен-
ная корреляция между градиентом давления, оп-
Сужение выносящего тракта левого желудочка
Гипертрофия перегородки
Переднее смещение митрального аппарата
Переднее смещение сосочковых мышц
Гидродинамические силы (эффект Вентури и сила сопро-
тивления), приводящие к переднему систолическому
движению
Быстрый ранний выброс из левого желудочка
Удлиненные митральные створки
ТАБЛИЦА 26.4
Факторы, способствующие динамической
обструкции выносящего тракта левого
желудочка
In-26_для нас.indd 647
03.04.2019 12:02:42
648
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ределяемым с помощью непрерывно-волновой доп-
плерографии, и данными, полученными во время
инвазивной регистрации гемодинамики при катете-
ризации сердца [47, 48].
ТЕХНИЧЕСКИЕ АСПЕКТЫ
Существуют важные технические аспекты в отно-
шении выполнимости и интерпретации допплеров-
ских исследований у пациентов с ГКМП. В ходе
сравнения непрерывно-волновой допплерографии
с катетеризацией сердца у 16% пациентов не уда-
лось получить различимый сигнал из ВТЛЖ [47].
Отсутствие возможности получить четкое спект-
ральное отображение ВТЖЛ может быть обуслов-
лено неадекватными трансторакальными окнами
или искаженной геометрией ЛЖ. Кроме того, необ-
ходимо различать высокоскоростной систоличе-
ский сигнал, поступающий из выносящего тракта
от сигнала митральной регургитации (см. рис. 26.8).
Спектральный профиль митральной регургитации
характеризуется более ранним началом, более рез-
ким начальным увеличением скорости и более вы-
сокой максимальной скоростью, чем скорость сиг-
нала выносящего тракта. Систолические струи с
максимальной скоростью кровотока > 5,5 м/сек
(расчетный градиент > 120 мм рт. ст.), скорее всего,
обусловлены митральной регургитацией, а не об-
струкцией ВТЖЛ [47]. Дальнейшая дифференциа-
ция этих двух струй может быть достигнута путем
ориентации датчика медиальнее и кпереди, вдали от
ЛЖ
ВТЛЖ
ЛП
Рис. 26.6 Механизм динамической обструкции выносящего тракта и митральной регургитации. В начале систолы (А) точка сопоставления (стрелка)
находится в области тела митральных створок. В фазу ранней систолы (Б) и в середине систолы (В) происходит переднее и базальное движение остаточной
длины передней митральной створки (толстая стрелка) с контактом с перегородкой и нарушением сопоставления створок. Образовавшийся промежуток между
створками (тонкая стрелка) приводит к образованию направленной кзади струи митральной регургитации в полости левого предсердия (сиреневая область). Со-
ответствующие чреспищеводные 2D-проекции (Г) с цветовой визуализацией кровотока (Д) у пациента с обструктивной гипертрофической кардиомиопатией де-
монстрируют гипертрофию перегородки, переднее движение передней створки митрального клапана и цветовую турбулентность в выносящем тракте левого же-
лудочка (ВТЛЖ) с направленной кзади митральной регургитацией. Острия стрелок указывают на нарушение сопоставления створок. ЛЖ
—
левый желудочек;
ЛП — левое предсердие [A–C
—
Grigg LE, Wigle ED, Williams WG, et al. Transesophageal Doppler echocardiography in obstructive hypertrophic cardiomyopathy:
clarification of pathophysiology and importance in intraoperative decision making. J Am Coll Cardiol 20:42–52 , 1992].
А
Б
В
Г
Д
In-26_для нас.indd 648
03.04.2019 12:02:42
649
26 Гипертрофическая кардиомиопатия
струи митральной регургитации. Тем не менее все
еще в высокоскоростном сигнале обструкции ВТЛЖ
могут сохраняться помехи от струи митральной
регургитации. Это затруднение в диагностике осо-
бенно часто встречается у пациентов с сопутствую-
щим врожденным пороком митрального клапана и
более централизованной струей митральной регур-
гитации. Несмотря на оптимальную визуализацию,
корректировку настроек прибора и учет различий
во времени и контуре этих систолических струй,
провести различие между этими разными доппле-
ровскими сигналами иногда может быть трудно
[47]. Кроме того, могут быть зарегистрированы
ложные систолические сигналы, которые по внеш-
нему виду отличаются от истинного сигнала скоро-
сти ВТЛЖ; у них обычно поздний начальный подъ-
ем систолической скорости и узкий и остроконеч-
ный пик в конечной систоле. Эти систолические
сигналы, вероятно, происходят из участков облите-
рации полости ЛЖ [47]. Наконец, важно различать
динамический градиент ВТЖЛ от стойкой субаор-
тальной обструкции (вследствие субаортальной
мембраны) или стеноза аортального клапана [3].
НЕСОСТОЯТЕЛЬНОСТЬ МИТРАЛЬНОГО КЛАПАНА
Контакт передней створки митрального клапана и
перегородки и переднее смещение задней створки
приводят к нарушению сопоставления, в результате
чего в створках образуется воронкообразная щель,
в которой возникает митральная регургитация, пре-
имущественно в середине систолы до поздней си-
столы (см. рис. 26.6) [49]. У пациентов с обструктив-
ной ГКМП и отсутствием независимого порока
митрального клапана обычно наблюдается направ-
ленная кзади струя митральной регургитации (рис.
26.9) [49, 50]. Митральная регургитация, обуслов-
ленная обструктивной ГКМП, как было показано,
зависит от степени SAM-синдрома и длины и под-
вижности задней створки, которые определяют
размер щели между ними и степень сопоставления
створок митрального клапана в середине систолы
[51]. Эти результаты были подтверждены в ходе
исследования, которое продемонстрировало значи-
тельную корреляцию между цветной областью ми-
тральной струи регургитации и градиентом ВТЛЖ
[50].
Наличие не направленной кзади струи митраль-
ной регургитации позволяет предположить вро-
жденный порок митрального клапана независимо
от SAM-синдрома. Независимые поражения ми-
трального клапана могут быть идентифицированы
с помощью ЭхоКГ и обычно связаны с пролапсом
митрального клапана, разрывом хорд, кальцифика-
цией фиброзного кольца митрального клапана или
травмой створки (см. рис. 26.9) [50]. Вторичный
контакт митральной створки с перегородкой об-
условлен фиброзом и утолщением передней ми-
тральной створки (и субаортальным фиброзом и
утолщением эндокарда перегородки). Обычно мио-
эктомия успешна для устранения митральной ре-
гургитации, направленной кзади, без необходимо-
сти выполнения протезирования митрального кла-
пана [50].
СТРЕСС-ИССЛЕДОВАНИЯ И ДРУГИЕ
ПРОВОКАЦИОННЫЕ ТЕСТЫ
Динамическая обструкция ВТЛЖ часто встречается
у пациентов с ГКМП: у трети из них отмечается
базальная обструкция ВТЛЖ (или обструкция в
Рис. 26.7 Результаты 2D-эхокардиографии и М-режима при динамической обструкции выносящего тракта. Парастернальная длинноосевая 2D-
проекция (A) и визуализация в М-режиме (Б), выполненные на уровне дистальных концов митральных створок у 20-летнего мужчины с прогрессированием
симптоматики, обусловленной гипертрофической кардиомиопатией. (A) Систолическое переднее движение передней митральной створки к перегородке. Может
наблюдаться резкое искривление дистальной части передней створки, как в этом случае. (Б) Соответствующее отслеживание в M-режиме демонстрирует класси-
ческий длительный контакт передней митральной створки с перегородкой в фазу систолы (острия стрелок). У пациента толщина перегородки составляла 30 мм
и градиент выносящего тракта ЛЖ в покое равнялся 107 мм рт. ст.
А
Б
In-26_для нас.indd 649
03.04.2019 12:02:42
650 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
покое) (градиент ВТЛЖ в покое ≥ 30 мм рт. ст.), у
одной трети — провокационная (или латентная)
обструкция ВТЛЖ (градиент ВТЛЖ в покое < 30 мм
рт. ст., провокационный градиент ВТЛЖ ≥ 30 мм
рт. ст.), и у трети пациентов имеет место необструк-
тивная ГКМП (как градиент в покое, так и провока-
ционный градиент ВТЛЖ < 30 мм рт. ст.) (табл.
26.5) [1]. У пациентов с градиентом ВТЛЖ в покое
< 30 мм рт. ст. рекомендуется проведение провока-
ционных тестов для оценки латентной обструкции
ВТЖЛ (табл. 26.6) [3, 52]. Обструкция может быть
спровоцирована следующими способами: (1) сни-
жение преднагрузки (проба Вальсальвы, положение
стоя), (2) снижение постнагрузки (ингаляция амил-
нитрата), (3) снижение как преднагрузки, так и
постнагрузки (прием под язык изосорбида дини-
трата) или (4) увеличение сократительной способ-
ности (физическая нагрузка). В ходе нескольких
исследований были рассмотрены различные спосо-
бы выявления латентной обструкции ВТЛЖ (см.
табл. 26.6). Методом предпочтения для определения
градиента ВТЛЖ является нагрузочная проба, по-
скольку это наиболее физиологический способ про-
вокации. В частности, рекомендуется тестирование
с физической нагрузкой на беговой дорожке, по-
скольку оно наилучшим образом отражает степень
обструкции ВТЛЖ, возникающую во время ежед-
невной физической активности (рис. 26.10) [3].
Проведение нагрузочных проб целесообразно у
пациентов с наличием симптомов и при градиенте
ВТЛЖ в покое < 50 мм рт. ст. [1] Во время проведе-
ния нагрузочных проб осуществляется мониторинг
пациента с помощью электрокардиографии и се-
рийной регистрации артериального давления, про-
водимой для установления его реакции на физиче-
скую нагрузку [1]. В ходе клинических испытаний с
участием крупной когорты пациентов с ГКМП
проводились нагрузочные пробы, безопасность ко-
торых была подтверждена для этой группы пациен-
тов. Частота серьезных осложнений или аритмий
была очень низкой [53, 54]. В ходе одного крупного
исследования с участием 426 пациентов с ГКМП,
прошедших тестирование с нагрузкой на беговой
дорожке, в 1,2% случаев было зарегистрирована
кратковременная неустойчивая желудочковая тахи-
кардия [55].
ТИПЫ ФИЗИЧЕСКОЙ НАГРУЗКИ
У ПАЦИЕНТОВ С ГКМП
Были изучены различные способы проб с физиче-
ской нагрузкой, в том числе беговая дорожка [53,
56–58] и велоэргометрия, упражнения на велоэрго-
метре в вертикальном положении [59–61], в поло-
жении лежа на спине [62], и полулежачем положе-
нии (50°) [63], описанные в различных публикациях
(см. табл. 26.6) [52]. Провокационные тесты с физи-
ческой нагрузкой приводят к значительному увели-
чению градиента ВТЛЖ. При проведении тестиро-
Рис. 26.8 Дифференцировка градиента ВТЛЖ и митральной регурги-
тации. Непрерывно-волновая допплерография пациента с обструктивной ГКМП
в ВТЛЖ в области обструкции (A), промежуточном положении (Б) и в области
митральной регургитации (В). Струя обструкции ВТЛЖ начинается после зуб-
ца QRS, предшествует низкоскоростному пресистолическому потоку и имеет
характерное изменение ускорения. Скорость в ВТЛЖ 4,2 м/сек соответствует
градиенту давления 71 мм рт. ст. (по уравнению Бернулли). Струя митральной
регургитации имеет более высокую скорость (В) и начинается раньше в фазу
систолы. Скорость струи митральной регургитации равна 7 м/сек. Нужно избе-
гать наложения сигнала струи ВТЛЖ и струи митральной регургитации.
А
Б
В
In-26_для нас.indd 650
03.04.2019 12:02:43
651
26 Гипертрофическая кардиомиопатия
Тип ГКМП
Градиент
вВТЛЖвпо-
кое (мм рт. ст.)
Градиент
в ВТЛЖ после
провокации
(мм рт. ст .)
Обструктивная ГКМП
в покое
≥30
Провокационная (или
латентная) обструк-
тивная ГКМП
<30
≥30
Необструктивная
ГКМП
<30
<30
ВТЛЖ — выходной тракт левого желудочка; ГКМП — гипертро-
фическая кардиомиопатия.
ТАБЛИЦА 26.5
Гемодинамическая классификация
гипертрофической кардиомиопатии
вания с физической нагрузкой на беговой дорожке,
стресс-индуцированный градиент ВТЛЖ измеряет-
ся сразу после нагрузочной пробы, при этом паци-
ент быстро принимает положение лежа на левом
боку на кровати (рис. 26.11) [53]. Допплеровское
исследование градиента ВТЛЖ и визуализацию
SAM-синдрома рекомендовано выполнять в тече-
ние 1 мин после прекращения упражнений [52].
Альтернативный подход заключался в проведении
параллельной ЭхоКГ с измерением градиента ВТЛЖ
во время выполнения вертикальных упражнений на
велоэргометре [59, 60]. Важно отметить, что в ходе
одного исследования с участием 74 пациентов не
было выявлено существенной разницы между на-
грузочным градиентом ВТЛЖ, полученным при
одновременной эхокардиографической визуализа-
ции с выполнением упражнений в вертикальном
положении на велоэргометре, и градиентом ВТЛЖ,
измеренным непосредственно после физической
нагрузки в положении лежа на спине [61]. Хотя на-
грузочная проба на велоэргометре в положении на
спине имеет преимущество относительной легко-
сти получения эхокардиографических изображений
во время физических упражнений, в ходе одного
исследования с одновременной ЭхоКГ и катетериза-
цией правых отделов сердца был продемонстриро-
ван важный недостаток, заключающийся в том, что
при велоэргометрии в положении лежа на спине
происходит увеличение ЛП и давления в легочной
артерии [62]. Следовательно, увеличение предна-
грузки во время тестирования ограничивает увели-
чение градиента ВТЛЖ [3, 62]. Другим важным на-
блюдением этого исследования было то, что гради-
Рис. 26.9 Направление струи митральной регургитации и причины ее возникновения. (A) A 2D-эхокардиография и цветовая допплерография в пара-
стернальной длинноосевой проекции у 48-летнего мужчины с гипертрофической кардиомиопатией и обструкцией выносящего тракта ЛЖ в покое. В выносящем
тракте присутствует цветовая турбулентность и струя митральной регургитации, направленная кзади. (Б) В апикальной длинноосевой проекции определяется
гипертрофия перегородки, изгиб передней митральной створки и переднее систолическое движение к основанию передней части перегородки. (В) При цветовой
допплерографии определяется струя митральной регургитации, связанная с передним систолическим движением. Заметно выраженное отклонение струи кзади.
(Г) A Другая причина обструктивной гипертрофической кардиомиопатии у 68-летнего мужчины. В парастернальной длинноосевой проекции определяется
кальцификация фиброзного кольца митрального клапана и центральная струя митральной регургитации. (Д) В апикальной длинноосевой проекции хорошо визу-
ализируется гипертрофия перегородки у данного пациента и выраженная кальцификация фиброзного кольца митрального клапана. (Е) В апикальной длинноосе-
вой проекции с помощью цветового допплера определяется струя митральной регургитации, направленная более центрально и медиально. Причиной митральной
регургитации является кальцификация фиброзного кольца митрального клапана и незначительное переднее систолическое движение.
А
Б
В
Г
Д
Е
In-26_для нас.indd 651
03.04.2019 12:02:43
652
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
С
п
о
с
о
б
п
р
о
в
о
к
а
ц
и
и
В
е
д
у
щ
и
й
а
в
т
о
р
К
о
л
и
ч
е
с
т
в
о
п
а
ц
и
е
н
т
о
в
Г
В
Т
Л
Ж
в
п
о
к
о
е
(
м
м
р
т
.
с
т
.
)
Г
В
Т
Л
Ж
п
р
и
п
р
о
в
о
к
а
ц
и
и
(
м
м
р
т
.
с
т
.
)
%
с
Г
В
Т
Л
Ж
в
п
о
к
о
е
≥
3
0
м
м
р
т
.
с
т
.
%
с
Г
В
Т
Л
Ж
п
р
и
п
р
о
в
о
к
а
ц
и
и
≥
3
0
м
м
р
т
.
с
т
.
С
р
а
в
н
е
н
и
е
с
п
о
с
о
б
о
в
п
р
о
в
о
к
а
ц
и
и
Ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
(
б
е
г
о
в
а
я
д
о
р
о
ж
к
а
/
в
е
л
о
э
р
г
о
м
е
т
р
и
я
в
п
о
л
о
ж
е
н
и
и
в
е
р
т
и
к
а
л
ь
н
о
с
и
д
я
)
и
п
р
о
б
а
В
а
л
ь
с
а
л
ь
в
ы
M
a
r
o
n
[
5
3
]
2
0
1
4
±
9
м
м
р
т
.
с
т
.
4
5
±
4
9
м
м
р
т
.
с
т
.
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
и
1
8
±
2
3
м
м
р
т
.
с
т
.
В
а
л
ь
с
а
л
ь
в
а
:
г
р
у
п
п
а
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
Г
В
Т
Ж
Л
3
0
-
4
9
)
;
3
3
±
3
4
м
м
р
т
.
с
т
.
(
В
а
л
ь
с
а
л
ь
в
а
:
г
р
у
п
п
а
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
Г
В
Т
Ж
Л
≥
5
0
м
м
р
т
.
с
т
.
)
5
5
3
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
п
р
о
т
и
в
2
1
(
В
а
л
ь
с
а
л
ь
в
а
)
В
а
л
ь
с
а
л
ь
в
а
п
о
с
р
а
в
н
е
н
и
ю
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
:
Ч
У
В
С
=
4
0
%
С
П
Е
Ц
=
1
0
0
%
Т
е
с
т
и
р
о
в
а
н
и
е
с
н
а
г
р
у
з
к
о
й
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
,
п
р
о
б
а
В
а
л
ь
с
а
л
ь
в
ы
и
п
о
л
о
ж
е
н
и
е
с
т
о
я
J
o
s
h
i
[
5
7
]
5
3
2
5
м
м
р
т
.
с
т
.
(
с
р
е
д
н
я
я
в
е
л
и
ч
и
н
а
)
1
0
0
м
м
р
т
.
с
т
.
(
п
р
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
)
,
6
4
м
м
р
т
.
с
т
.
(
В
а
л
ь
с
а
л
ь
в
а
)
,
4
4
м
м
р
т
.
с
т
.
(
в
п
о
л
о
ж
е
н
и
и
с
т
о
я
)
(
с
р
е
д
н
я
я
в
е
л
и
ч
и
н
а
)
3
0
†
7
0
†
(
п
р
и
В
а
л
ь
с
а
л
ь
в
а
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
)
,
5
0
†
(
в
п
о
л
о
ж
е
н
и
и
с
т
о
я
)
П
о
л
о
ж
е
н
и
е
с
т
о
я
п
о
с
р
а
в
н
е
н
и
ю
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
:
r
=
0
,
2
8
,
p
<
0
,
0
5
Т
е
с
т
и
р
о
в
а
н
и
е
с
н
а
г
р
у
з
к
о
й
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
£
(
о
д
н
о
в
р
е
м
е
н
н
о
п
о
с
р
а
в
н
е
н
и
ю
с
в
о
с
с
т
а
н
о
в
л
е
н
и
е
м
[
в
е
р
т
и
к
а
л
ь
н
о
е
п
о
л
о
ж
е
н
и
е
]
)
и
п
о
л
о
ж
е
н
и
е
с
т
о
я
M
i
r
a
n
d
a
[
6
4
]
1
7
4
9
±
2
4
м
м
р
т
.
с
т
.
8
3
±
3
5
м
м
р
т
.
с
т
.
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
,
9
6
±
3
5
м
м
р
т
.
с
т
.
(
в
о
с
с
т
а
н
о
в
л
е
н
и
е
[
в
е
р
т
и
к
а
л
ь
н
о
е
п
о
л
о
ж
е
н
и
е
]
)
п
о
с
р
а
в
н
е
н
и
ю
с
6
2
±
2
9
м
м
р
т
.
с
т
.
(
п
о
л
о
ж
е
н
и
е
с
т
о
я
)
6
5
8
2
Т
е
с
т
и
р
о
в
а
н
и
е
с
н
а
г
р
у
з
к
о
й
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
и
а
м
и
л
н
и
т
р
и
т
M
a
r
w
i
c
k
[
5
6
]
5
7
1
3
±
1
0
м
м
р
т
.
с
т
.
4
7
±
3
9
м
м
р
т
.
с
т
.
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
п
о
с
р
а
в
н
е
н
и
ю
с
4
9
±
3
9
м
м
р
т
.
с
т
.
(
а
м
и
л
н
и
т
р
и
т
)
0
†
3
7
†
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
и
4
4
†
(
a
м
и
л
н
и
т
р
и
т
)
А
м
и
л
н
и
т
р
и
т
п
о
с
р
а
в
н
е
н
и
ю
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
:
r
=
0
,
5
4
,
p
<
0
,
0
0
0
1
Т
е
с
т
и
р
о
в
а
н
и
е
с
н
а
г
р
у
з
к
о
й
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
и
и
з
о
с
о
р
б
и
д
а
д
и
н
и
т
р
а
т
Z
e
m
a
n
e
k
[
5
8
]
7
7
1
9
±
1
6
м
м
р
т
.
с
т
.
6
2
±
4
3
м
м
р
т
.
с
т
.
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
и
4
5
±
4
0
м
м
р
т
.
с
т
.
(
и
з
о
с
о
р
б
и
д
ч
е
р
е
з
5
–
1
0
м
и
н
)
1
9
7
1
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
п
р
о
т
и
в
5
5
(
и
з
о
с
о
р
б
и
д
)
и
з
о
с
о
р
б
и
д
п
о
с
р
а
в
н
е
н
и
ю
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
:
Ч
У
В
С
Т
=
7
6
%
С
П
Е
Ц
=
1
0
0
%
Т
е
с
т
и
р
о
в
а
н
и
е
с
н
а
г
р
у
з
к
о
й
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
£
(
о
д
н
о
в
р
е
м
е
н
н
о
п
о
с
р
а
в
н
е
н
и
ю
с
в
о
с
с
т
а
н
о
в
л
е
н
и
е
м
[
п
о
л
о
ж
е
н
и
е
л
е
ж
а
]
)
D
i
m
i
t
r
o
w
[
6
5
]
2
9
3
3
–
8
3
м
м
р
т
.
с
т
.
(
и
н
т
е
р
в
а
л
)
0
3
4
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
)
п
р
о
т
и
в
1
4
(
в
о
с
с
т
а
н
о
в
л
е
н
и
е
[
п
о
л
о
ж
е
н
и
е
л
е
ж
а
]
)
Т
А
Б
Л
И
Ц
А
2
6
.
6
С
в
о
д
н
а
я
т
а
б
л
и
ц
а
р
е
з
у
л
ь
т
а
т
о
в
о
с
н
о
в
н
ы
х
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
х
и
с
с
л
е
д
о
в
а
н
и
й
п
о
п
р
о
в
о
к
а
ц
и
и
о
б
с
т
р
у
к
ц
и
и
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
п
р
и
г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
о
й
к
а
р
д
и
о
м
и
о
п
а
т
и
и
*
In-26_для нас.indd 652
03.04.2019 12:02:44
653
26 Гипертрофическая кардиомиопатия
С
п
о
с
о
б
п
р
о
в
о
к
а
ц
и
и
В
е
д
у
щ
и
й
а
в
т
о
р
К
о
л
и
ч
е
с
т
в
о
п
а
ц
и
е
н
т
о
в
Г
В
Т
Л
Ж
в
п
о
к
о
е
(
м
м
р
т
.
с
т
.
)
Г
В
Т
Л
Ж
п
р
и
п
р
о
в
о
к
а
ц
и
и
(
м
м
р
т
.
с
т
.
)
%
с
Г
В
Т
Л
Ж
в
п
о
к
о
е
≥
3
0
м
м
р
т
.
с
т
.
%
с
Г
В
Т
Л
Ж
п
р
и
п
р
о
в
о
к
а
ц
и
и
≥
3
0
м
м
р
т
.
с
т
.
С
р
а
в
н
е
н
и
е
с
п
о
с
о
б
о
в
п
р
о
в
о
к
а
ц
и
и
В
е
л
о
э
р
г
о
м
е
т
р
и
я
в
в
е
р
т
и
к
а
л
ь
н
о
м
п
о
л
о
ж
е
н
и
и
£
N
i
s
t
r
i
[
6
1
]
7
4
1
0
м
м
р
т
.
с
т
.
§
3
9
±
3
5
м
м
р
т
.
с
т
.
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
[
в
е
р
т
и
к
а
л
ь
н
о
е
п
о
л
о
ж
е
н
и
е
]
)
п
р
о
т
и
в
4
4
±
4
0
м
м
р
т
.
с
т
.
(
п
о
с
л
е
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
[
п
о
л
о
ж
е
н
и
е
л
е
ж
а
]
)
0
3
9
(
ф
и
з
и
ч
е
с
к
а
я
н
а
г
р
у
з
к
а
[
в
е
р
т
и
к
а
л
ь
н
о
е
п
о
л
о
ж
е
н
и
е
]
п
р
о
т
и
в
4
1
(
п
о
с
л
е
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
[
п
о
л
о
ж
е
н
и
е
л
е
ж
а
]
)
В
е
л
о
э
р
г
о
м
е
т
р
и
я
в
в
е
р
т
и
к
а
л
ь
н
о
м
п
о
л
о
ж
е
н
и
и
п
о
с
р
а
в
н
е
н
и
ю
с
п
е
р
и
о
д
о
м
п
о
с
л
е
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
(
п
о
л
о
ж
е
н
и
е
л
е
ж
а
)
:
R
2
=
0
,
9
7
4
В
е
л
о
э
р
г
о
м
е
т
р
и
я
в
в
е
р
т
и
к
а
л
ь
н
о
м
п
о
л
о
ж
е
н
и
и
£
S
c
h
w
a
m
m
e
n
t
h
a
l
[
5
9
]
1
0
7
5
±
2
4
м
м
р
т
.
с
т
.
1
4
0
±
4
2
м
м
р
т
.
с
т
.
1
0
0
1
0
0
В
е
л
о
э
р
г
о
м
е
т
р
и
я
в
в
е
р
т
и
к
а
л
ь
н
о
м
п
о
л
о
ж
е
н
и
и
£
S
h
a
h
[
6
0
]
8
7
1
2
±
7
м
м
р
т
.
с
т
.
6
1
±
5
4
м
м
р
т
.
с
т
.
0
6
2
П
о
л
о
ж
е
н
и
е
с
т
о
я
и
п
р
о
б
а
В
а
л
ь
с
а
л
ь
в
ы
J
o
s
h
i
[
5
7
]
9
8
3
6
±
3
9
м
м
р
т
с
т
;
2
5
м
м
р
т
.
с
т
.
(
с
р
е
д
н
е
е
з
н
а
ч
е
н
и
е
)
4
4
м
м
р
т
.
с
т
.
(
п
о
л
о
ж
е
н
и
е
с
т
о
я
)
и
6
4
м
м
р
т
.
с
т
.
(
В
а
л
ь
с
а
л
ь
в
а
)
(
с
р
е
д
н
е
е
з
н
а
ч
е
н
и
е
)
4
3
4
1
(
п
о
л
о
ж
е
н
и
е
с
т
о
я
,
в
г
р
у
п
п
е
и
з
н
а
ч
а
л
ь
н
о
б
е
з
о
б
с
т
р
у
к
ц
и
и
)
П
о
л
о
ж
е
н
и
е
с
т
о
я
п
р
о
т
и
в
В
а
л
ь
с
а
л
ь
в
а
:
r
=
0
,
4
0
,
p
<
0
,
0
0
1
*
З
н
а
ч
е
н
и
я
Г
В
Т
Л
Ж
п
р
е
д
с
т
а
в
л
е
н
ы
к
а
к
с
р
е
д
н
е
е
з
н
а
ч
е
н
и
е
±
с
т
а
н
д
а
р
т
н
о
е
о
т
к
л
о
н
е
н
и
е
(
е
с
л
и
н
е
у
к
а
з
а
н
о
и
н
о
е
)
.
С
п
о
с
о
б
и
з
м
е
р
е
н
и
я
Г
В
Т
Л
Ж
п
р
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
:
в
ы
п
о
л
н
я
е
т
с
я
о
д
н
о
в
р
е
-
м
е
н
н
о
в
о
в
р
е
м
я
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
†
В
и
с
с
л
е
д
о
в
а
н
и
и
о
п
у
б
л
и
к
о
в
а
н
о
п
о
р
о
г
о
в
о
е
з
н
а
ч
е
н
и
е
Г
В
Т
Л
Ж
≥
5
0
м
м
р
т
.
с
т
.
(
в
м
е
с
т
о
п
о
р
о
г
о
в
о
г
о
з
н
а
ч
е
н
и
я
Г
В
Т
Л
Ж
≥
3
0
м
м
р
т
.
с
т
.
)
£
О
б
о
з
н
а
ч
а
е
т
и
з
м
е
р
е
н
и
я
г
р
а
д
и
е
н
т
а
В
Т
Л
Ж
,
в
ы
п
о
л
н
я
е
м
ы
е
о
д
н
о
в
р
е
м
е
н
н
о
в
о
в
р
е
м
я
в
ы
п
о
л
н
е
н
и
я
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
(
в
о
т
л
и
ч
и
е
о
т
и
з
м
е
р
е
н
и
й
п
о
с
л
е
з
а
в
е
р
ш
е
н
и
я
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
и
)
.
§
С
о
о
б
щ
а
е
т
с
я
,
ч
т
о
с
к
о
р
о
с
т
ь
к
р
о
в
о
т
о
к
а
В
Т
Л
Ж
в
п
о
к
о
е
с
о
с
т
а
в
и
л
а
1
,
6
±
0
,
5
м
/
с
е
к
.
r
—
к
о
э
ф
ф
и
ц
и
е
н
т
к
о
р
р
е
л
я
ц
и
и
P
e
a
r
s
o
n
;
Г
В
Т
Л
Ж
—
г
р
а
д
и
е
н
т
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
;
Г
К
М
П
—
г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
;
и
з
о
с
о
р
б
и
д
—
и
з
о
с
о
р
б
и
д
а
д
и
н
и
т
р
а
т
(
п
о
д
я
з
ы
к
)
;
С
П
Е
Ц
—
с
п
е
ц
и
ф
и
ч
н
о
с
т
ь
п
р
и
о
п
р
е
д
е
л
е
н
и
и
г
р
а
д
и
е
н
т
а
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
;
Ч
У
В
С
Т
—
ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
п
р
и
о
п
р
е
д
е
л
е
н
и
и
г
р
а
д
и
е
н
т
а
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
.
[
C
h
u
n
S
,
W
o
o
A
.
E
c
h
o
c
a
r
d
i
o
g
r
a
p
h
y
i
n
h
y
p
e
r
t
r
o
p
h
i
c
c
a
r
d
i
o
m
y
o
p
a
t
h
y
:
i
n
w
i
t
h
s
t
r
a
i
n
,
o
u
t
w
i
t
h
s
t
r
a
i
n
i
n
g
?
J
A
m
S
o
c
E
c
h
o
c
a
r
d
i
o
g
r
2
8
:
2
0
4
–
2
0
9
,
2
0
1
5
.
]
Т
А
Б
Л
И
Ц
А
2
6
.
6
о
к
о
н
ч
а
н
и
е
С
в
о
д
н
а
я
т
а
б
л
и
ц
а
р
е
з
у
л
ь
т
а
т
о
в
о
с
н
о
в
н
ы
х
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
х
и
с
с
л
е
д
о
в
а
н
и
й
п
о
п
р
о
в
о
к
а
ц
и
и
о
б
с
т
р
у
к
ц
и
и
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
п
р
и
г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
о
й
к
а
р
д
и
о
м
и
о
п
а
т
и
и
*
In-26_для нас.indd 653
03.04.2019 12:02:44
654
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ент ВТЛЖ значительно увеличился в фазе
восстановления после физической нагрузки, что,
как полагали, связано с быстрым снижением часто-
ты сердечных сокращений и венозного возврата
после прекращения упражнений и последующим
уменьшением объема ЛЖ [62]. В других более мел-
ких серийных исследованиях пытались установить
градиент ВТЛЖ во время выполнения пациентом
нагрузочной пробы на беговой дорожке [64, 65].
Однако, учитывая технические проблемы получе-
ния точного сигнала ВТЛЖ во время этой физиче-
ской активности, применимость этого подхода
остается неясной [52].
ДРУГИЕ МЕТОДЫ ПРОВОКАЦИИ
В ходе нескольких исследований была рассмотрена
применимость различных методов провокации для
выявления обструкции ВТЛЖ. Наиболее распро-
страненный метод, проба Вальсальвы, имеет значи-
тельные ограничения. В ходе двух исследований
было продемонстрировано, что градиент ВТЛЖ
после пробы Вальсальвы значительно ниже, чем
градиент ВТЛЖ после физической нагрузки (см.
рис. 26.11) [53, 57]. Кроме того, проба Вальсальвы
имела чувствительность только 40% для выявления
провокационного градиента ВТЛЖ 30 мм рт. ст. или
выше по сравнению с индуцированным физиче-
ской нагрузкой градиентом ВТЛЖ [53]. Ингаляция
амилнитрита является полезным методом провока-
ции обструкции ВТЛЖ (рис. 26.12) [56]. В ходе ис-
следования с участием 57 пациентов с ГКМП без
наличия обструкции ВТЛЖ в покое провокацион-
ные градиенты ВТЛЖ, вызванные ингаляцией
амилнитрита и физической нагрузкой на беговой
дорожке,былисхожи(49±39ммрт.ст.и47±39мм
рт. ст. соответственно). Однако фактическая корре-
TISO.4 MI 1 .2
СТРЕСС
СТРЕСС
Рис. 26.10 Эхокардиография с физической нагрузкой пациентов с гипертрофической кардиомиопатией. (А, Б) ЭхоКГ в покое в парастернальной
позиции по длинной оси A (А) и апикальной четырехкамерной позиции (Б) пациента, 20 лет, с выраженной асимметричной гипертрофией перегородки и без
обструкции выходного тракта ЛЖ. Пациент выполнял физическую нагрузку (тредмил) в вертикальном положении. (В, Г) Визуализация сразу после максимальной
нагрузки (в течение 1 мин после прекращения упражнения) в положении пациента лежа на левом боку. В парастернальной позиции по длинной оси A (В) отме-
чались SAM-синдром и облитерация полости ЛЖ. В апикальной четырехкамерной позиции (Г) обнаружено удлинение передней створки митрального клапана с
SAM-синдромом.
А
Б
В
Г
In-26_для нас.indd 654
03.04.2019 12:02:44
655
26 Гипертрофическая кардиомиопатия
ляция между градиентами ВТЛЖ после ингаляций
амилнитрита и после физической нагрузки была не
очень высокой [56]. Важно отметить, что амилни-
трит не широко доступен. Другие описанные мето-
ды провокации обструкции ВТЛЖ (положение стоя
[57], прием под язык из изосорбида нитрита [58])
менее эффективны, чем физическая нагрузка [52].
Стресс-ЭхоКГ с добутамином не рекомендуется,
если только она не проводится в специализирован-
ной клинике, поскольку может быть трудно отли-
чить допплеровский сигнал облитерации полости
от истинного сигнала ВТЛЖ [3]. Добутамин-инду-
цированная обструкция может наблюдаться у зна-
чительной части пациентов без ГКМП; при иссле-
довании 394 пациентов ее частота составила 17,5%
[66], и клиническая значимость этого метода прово-
кации сомнительна.
ПОДТИПЫ ГИПЕРТРОФИЧЕСКОЙ
КАРДИОМИОПАТИИ
АСИММЕТРИЧЕСКАЯ АПИКАЛЬНАЯ
ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ
Впервые асимметричная апикальная ГКМП была
описана в литературе японскими исследователями
в 1970-х гг. [67]. Асимметричная апикальная ГКМП
представляет собой вариант ГКМП, встречающийся
у 7–8% пациентов с ГКМП (в неазиатских специа-
лизированных по ГКМП клиниках) [68, 69]. Специ-
фические особенности пациентов с асимметричной
апикальной ГКМП включают наличие гигантских
отрицательных T-зубцов (не менее 10 мм) в груд-
ных отведениях электрокардиограммы и конфи-
гурацию полости ЛЖ по типу карточного пикового
туза (рис. 26.13). Эхокардиографические показате-
Вальсальва
СТРЕСС
Рис. 26.11 Различия в величине градиента выносящего тракта ЛЖ при использовании различных методов провокации. Непрерывно-волновая
допплерография. Спектральный профиль градиента выносящего тракта ЛЖ, полученный в покое (A), после пробы Вальсальвы (Б) и сразу после физической
нагрузки на беговой дорожке (В) у молодого пациента с гипертрофической кардиомиопатией. Скорость кровотока выносящего тракта в покое — 2 ,0 м/сек (соот-
ветствует градиенту в покое 16 мм рт. ст.), увеличение скорости до 3,1 м/сек после пробы Вальсальвы (т.е . градиент 39 мм рт. ст.). Градиент после пробы
Вальсальвы значительно меньше градиента, возникающего после физической нагрузки (скорость кровотока выносящего тракта 4,7 м/сек, соответствующий
вызванному физической нагрузкой субаортальному градиенту 86 мм рт. ст.). Тестирование с нагрузкой на беговой дорожке — более физиологический метод
провокации у пациентов с гипертрофической кардиомиопатией. (Г) Сравнение зарегистрированных методом наложения двух спектральных профилей непрерыв-
но-волновой допплерографии, скорости кровотока выносящего тракта в покое (более уплощенная кривая с более низкой скоростью струи) и наложение струи
митральной регургитации (параболическая форма кривой, скорость 6 м/сек).
А
Б
Г
В
In-26_для нас.indd 655
03.04.2019 12:02:45
656 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
(задней) стенки не менее 1,5 [68]. Может отмечаться
апикальное смещение сосочковых мышц [69]. При
неадекватном определении эндокарда диагноз мо-
жет быть пропущен. Контрастная ЭхоКГ может
быть полезна для выявления случаев апикальной
гипертрофии (рис. 26.14) [37], особенно у пациен-
тов с инверсией гигантского Т-зубца при электро-
кардиографии. Сердечная МРТ также позволяет
идентифицировать апикальную ГКМП при невоз-
можности поставить диагноз с помощью ЭхоКГ [3].
При выраженном утолщении стенки верхушки не-
обходимо проводить дифференциальную диагно-
стику с тромбозом верхушки, опухолью верхушки
ЛЖ, некомпактной кардиомиопатией и фиброэла-
стозом эндокарда [69]. Нарушения, связанные с
апикальной ГКМП, включают выпячивание вер-
хушки (персистирующую верхушечную полость,
размер которой превышает размер полости средне-
го отдела желудочка в конечной систоле, отсутствие
истончения стенки верхушки) и аневризму верхуш-
ки ЛЖ (дискретные, тонкостенные, дискинетиче-
ские или акинетические сегменты верхушки с отно-
сительно широкой связью с камерой ЛЖ (рис.
26.15) [69]. При исследовании когорты из 193 паци-
ентов с апикальной ГКМП выпячивание верхушки
было обнаружено у 29 пациентов (15%), в том числе
у 6 пациентов (3%) — апикальные аневризмы
[69]. Значительные сердечно-сосудистые осложне-
ния (чаще фибрилляция предсердий) наблюдались
у 30% пациентов с апикальной ГКМП [68, 69].
ОБСТРУКЦИЯ СРЕДНЕЙ ЧАСТИ ЖЕЛУДОЧКА
И АНЕВРИЗМА ВЕРХУШКИ
ГКМП с обструкцией среднего отдела желудочка
встречается гораздо реже, чем ГКМП, связанная с
SAM-синдромом и обструкцией ВТЛЖ [70]. Эхо-
кардиографические признаки этого состояния вклю-
чают: (1) облитерацию среднего отдела желудочка,
вызванную гипертрофией перегородки и сближе-
нием стенок сегментов среднего отдела ЛЖ (и часто
сосочковых мышц); (2) градиент давления среднего
отдела желудочка в покое по меньшей мере 30 мм
рт. ст., выявляемый с помощью цветовой и им-
пульсно-волновой допплерографии; (3) отсутствие
SAM-синдрома МК [70]. В ходе исследования, про-
веденного в Японии с участием 490 пациентов с
ГКМП, была обнаружена обструкция среднего отде-
ла желудочка у 46 пациентов (9%), у 13 из которых
отмечалось сочетание с образованием аневризмы
верхушки (т.е. 28% пациентов с обструкцией сред-
него отдела желудочка и 3% общей когорты). У па-
циентов с обструкцией среднего отдела желудочка
наблюдалась более высокая частота неблагоприят-
ных исходов, связанных с ГКМП [70]. В ходе иссле-
дования с участием 1299 пациентов с ГКМП, кото-
рым выполняли ЭхоКГ и МРТ, были выявлены
аневризмы верхушки в 2% случаев [71]. Большин-
ли изолированной апикальной ГКМП включают:
(1) преобладающую гипертрофию апикальных сег-
ментов ЛЖ (с максимальной толщиной стенки в
одном из апикальных сегментов), (2) толщину стен-
ки верхушки не менее 15 мм, (3) соотношение мак-
симальной толщины стенки верхушки и нижней
ВАЛЬСАЛЬВА
АМИЛНИТРИТ
Рис. 26.12 Определение провокационного градиента выносящего
тракта ЛЖ с помощью пробы Вальсальвы и ингаляции амилнитрита.
(A) Непрерывно-волновая допплерография в апикальной длинноосевой про-
екции определяет скорость кровотока выносящего тракта в покое 2,1 м/сек
(расчетный градиент 17 мм рт. ст.). (Б) Градиент выносящего тракта после
пробы Вальсальвы предположительно равен 42 мм рт. ст. (В) Измерение
градиента выносящего тракта после вдыхания амилнитрита у того же пациен-
та демонстрирует характерное позднее систолическое увеличение скорости с
кинжаловидной конфигурацией и предположительным провокационным гра-
диентом 84 мм рт. ст.
А
Б
В
In-26_для нас.indd 656
03.04.2019 12:02:46
657
26 Гипертрофическая кардиомиопатия
против, у более молодых пациентов отмечается
тенденция к формированию обратного искривле-
ния перегородки (полость ЛЖ в форме полумесяца
и аномальная выпуклость перегородки) [5, 72]. Со-
путствующая кальцификация фиброзного кольца
митрального клапана является общей чертой ГКМП
у пожилых людей и был отмечен более чем 50%
одной когорты, состоящей из 28 пациентов с ГКМП
пожилых [72]. Механизмы, приводящие к обструк-
ции ВТЛЖ при ГКМП у пожилых, отличаются от
механизмов, наблюдаемых у более молодых паци-
ентов. У пожилых пациентов относительно неболь-
шое сердце и искаженная геометрия выносящего
тракта. Кальцификация фиброзного кольца ми-
трального клапана приводит к переднему смеще-
нию митрального аппарата, сужению выносящего
тракта и уменьшению изгиба митральных створок.
ство аневризм верхушки (68%) были небольшого
(наибольшая ширина или длина < 2 см) или средне-
го (2–4 см) размера. У 9 пациентов с аневризмой
верхушки наблюдалась обструкция среднего отдела
желудочка (74 ± 42 мм рт. ст.) без SAM-синдрома
[71]. Пациенты со средними или большими (> 4 см)
аневризмами верхушки имели повышенный риск
осложнений, связанных с ГКМП [71].
ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ У ПОЖИЛЫХ
ГКМП у пожилых людей является разновидностью
этого состояния с некоторыми отличительными
эхокардиографическими особенностями. У пожи-
лых пациентов с ГКМП, как правило, наблюдается
более умеренная степень гипертрофии. Полость
ЛЖ у пожилых пациентов обычно имеет овальную
форму с нормальной кривизной перегородки. На-
Рис. 26.13 Эхокардиографические особенности асимметричной апикальной гипертрофической кардиомиопатии. (A) Парастернальная короткоосевая
проекция на уровне верхушки выявляет гипертрофию апикальных сегментов. Визуализация в апикальной четырехкамерной A (Б), двухкамерной A (В), и
длинноосевой проекциях (Г) выявляет выраженную гипертрофию апикальных сегментов. Также визуализируется апикальное смещение сосочковых мышц. Полость
ЛЖ имеет классическую конфигурацию карточного туза «пик», лучше всего определяемую в апикальной двухкамерной проекции (В).
А
В
Б
Г
In-26_для нас.indd 657
03.04.2019 12:02:46
658 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Связанная с этим обструкция ВТЛЖ зарегистриро-
вана у многих пациентов из данной когорты иссле-
дования, причем частота SAM-синдрома равна 71%,
а частота обструкции ВТЛЖ в покое или при про-
вокации (определяемой как градиент ВТЛЖ > 20 мм
рт. ст.) равна 61% [72]. Кроме того, наличие кальци-
фикации фиброзного кольца митрального клапана
деформирует митральное кольцо и может привести
к возникновению центральной струи митральной
регургитации, часто отличающейся от направлен-
ной кзади струи митральной регургитации, об-
условленной SAM-синдромом [50].
ДИАСТОЛИЧЕСКАЯ ДИСФУНКЦИЯ
ФАКТОРЫ, СПОСОБСТВУЮЩИЕ СНИЖЕНИЮ
ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
При ГКМП нарушается диастолическое наполнение
ЛЖ, что может привести к одышке при нагрузке,
повышению давления наполнения и прогрессирую-
щему расширению ЛП. Диастолическая дисфунк-
ция при ГКМП влияет как на релаксацию желудоч-
ков, так и на ригидность камеры ЛЖ [1]. В табл. 26.7
приведены факторы, способствующие диастоличе-
скому наполнению при ГКМП [35]. Нарушение ре-
лаксации ЛЖ является вторичным по отношению к
увеличению нагрузки на сжатие сердечной мышцы,
уменьшению релаксационных нагрузок, уменьше-
нию инактивации и увеличению неравномерности.
Ранняя сократительная нагрузка при обструкции
выносящего тракта нарушает и замедляет начало
расслабления. Уменьшаются основные релаксаци-
онные нагрузки, коронарное и желудочковое на-
полнение. Вторичная перегрузка кальцием при ги-
пертрофии или ишемии приводит к инактивации
актин-миозиновых поперечных мостиков миофи-
брилл. Дальнейшее ослабление релаксации обус-
ловлено неравномерностью нагрузки и инактива-
Рис. 26.14 Выявление апикальной гипертрофической кардиомиопатии с дополнительным применением эхокардиографического контрастиро-
вания. (A) Выявление инверсии T-зубца в грудных отведениях 12-канальной электрокардиограммы позволяет заподозрить ишемическую болезнь сердца или
лежащую в основе кардиомиопатию. (Б) В парастернальной длинноосевой проекции определяется умеренная гипертрофия базальных сегментов (размер основа-
ния передней части перегородки составляет 12 мм, а основания нижней стенки — 10 мм). (В) Определение эндокарда сегментов стенки желудочка затруднитель-
но при визуализации в апикальной четырехкамерной проекции. Дистальная полость ЛЖ маленькая. (Г) A Учитывая подозрительную электрокардиограмму,
пациенту было введено ультразвуковое контрастное средство, что привело к превосходной визуализации гипертрофированных апикальных сегментов, в резуль-
тате чего пациенту был поставлен диагноз «апикальная гипертрофическая кардиомиопатия».
А
Б
В
Г
In-26_для нас.indd 658
03.04.2019 12:02:47
659
26 Гипертрофическая кардиомиопатия
ции в разных сегментах ЛЖ. Ригидность камеры
прямо пропорциональна массе миокарда и степени
миокардиального фиброза и обратно пропорцио-
нальна объему камеры ЛЖ.
ОЦЕНКА ДИАСТОЛИЧЕСКОЙ ФУНКЦИИ
Нарушение релаксации ЛЖ является преобладаю-
щим видом диастолической дисфункции, выявлен-
ной у пациентов с ГКМП. Трансмитральный кро-
воток обычно характеризуется увеличением време-
ни изоволюмического расслабления, уменьшением
ранней фазы наполнения ЛЖ (E), увеличением вре-
мени замедления кровотока и увеличением напол-
нения предсердий (A). В ходе важного исследования
с участием 35 пациентов с обструктивной ГКМП, у
которых одновременно выполнялась ЭхоКГ и инва-
зивное гемодинамическое исследование, не было
обнаружено существенной корреляции между пара-
метрами трансмитрального кровотока или крово-
тока в легочных венах и значениями диастолическо-
го давления в ЛЖ, измеренными инвазивно [73]. В
этом исследовании с помощью тканевой допплеро-
графии и цветового М-режима оценивались два
индекса релаксации: латеральная тканевая доппле-
ровская протодиастолическая скорость (e′) фиброз-
ного кольца митрального клапана и скорость рас-
пространения потока (VP) соответственно. Имела
место хорошая корреляция между инвазивно изме-
ренным диастолическим давлением ЛЖ перед со-
кращением предсердий (т.е . давление preA ЛЖ) и
(1) отношением скорости кровотока через митраль-
ный клапан E к латеральной скорости e′ (E/e′) и
(2) отношением скорости кровотока через митраль-
ный клапан E к скорости распространения потока
(E/VP). Коэффициенты корреляции давления preA
в ЛЖ к отношениям E/e′ и E/VP составляли соответ-
ственно 0,76 и 0,67 [73]. Напротив, в ходе еще одно-
Рис. 26.15 Эхокардиографическая оценка аневризмы верхушки. (A, Б) Эндокард апикальных сегментов определяется плохо. Форма дистальной полости
позволяет заподозрить некоторое выпячивание ЛЖ. (В, Г) A A В соответствующих апикальной четырехкамерной и апикальной длинноосевой проекциях с
контрастированием полости ЛЖ определены границы истонченных стенок дистальной части верхушки, сохранение полости верхушки в фазу систолы и дискине-
зия верхушки. Контрастное средство создает завихрения в полости верхушки, но тромб не определяется. Несмотря на наличие облитерации среднего отдела
желудочка, допплеровские признаки градиента среднего отдела желудочка отсутствуют.
А
В
Б
Г
In-26_для нас.indd 659
03.04.2019 12:02:47
660 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
го исследования с участием 100 пациентов с ГКМП
была продемонстрирована менее выраженная кор-
реляция (коэффициент корреляции 0,44), когда
отношение E/e′ (с использованием перегородочной
e′) сравнивали со средним давлением ЛП, измерен-
ным с помощью прямой транссептальной пункции
[74]. Следует отметить, что при ГКМП может быть
существенное различие между давлением preA ЛЖ
и средним давлением ЛП, в зависимости от растя-
жимости ЛЖ, высоты V-волны при регистрации
давления ЛП и относительного вклада сокращения
предсердий [74]. Латеральная и перегородочная
протодиастолические скорости при тканевой доп-
плерографии фиброзного кольца митрального кла-
пана ниже у пациентов с ГКМП по сравнению со
здоровыми лицами (рис. 26.16) [75]. Было обнару-
жено, что отношение E/e′ обратно пропорциональ-
но максимальному потреблению кислорода [75].
Измерение протодиастолических скоростей с помо-
щью тканевой допплерографии, проводимое у лиц
с положительным генотипом без гипертрофии ЛЖ,
позволило предположить, что диастолическая дис-
функция может предшествовать началу гипертро-
фии (см. «Семейный скрининг при гипертрофиче-
ской кардиомиопатии») [17–19].
АСИНХРОННАЯ РЕЛАКСАЦИЯ
При неодновременной релаксации, наблюдаемой у
пациентов с ГКМП, в период изоволюмической ре-
Релаксация
Нагрузка
Нагрузка на сократимость сердечной мышцы
Динамическая обструкция выносящего тракта левого
желудочка
Нагрузка во время релаксации
Нагрузка в фазу поздней систолы
Конечно-систолическая деформация (восстанавливающие
силы)
Наполнение коронарных артерий
Наполнение желудочков
Инактивация
Перегрузка миокарда кальцием
Неравномерность нагрузки и инактивации
(неравномерность сокращения сердечной мышцы
и релаксации)
Ригидность камер
Масса миокарда
Объем левого желудочка
Ригидность миокарда (фиброз)
[Wigle ED, Sasson Z, Henderson M, et al. Hypertrophic cardiomyopa-
thy. The importance of the site and extent of hypertrophy. A review.
Prog Cardiovasc Dis 28:1–83, 1985.]
ТАБЛИЦА 26.7
Факторы, влияющие на диастолическую
функцию при гипертрофической
кардиомиопатии
Рис. 26.16 Определение диастолической функции. Импульсно-волновая допплерография трансмитрального кровотока (A) и легочного венозного кровотока
(Б) и тканевая допплерография (В) регистрируют снижение релаксации желудочков у пациента с необструктивной гипертрофической кардиомиопатией. Преобла-
дание увеличения систолической скорости легочного венозного кровотока (Б) и нормальное отношение ранней диастолической скорости трансмитрального кро-
вотока (Д) к допплеровской ранней диастолической (e′) скорости (E/e′ = 7) указывают на нормальное давление наполнения левых отделов сердца. (Г) Характер
трансмитрального кровотока у другого молодого пациента с необструктивной гипертрофической кардиомиопатией. (Д, Е) Тканевая допплерография фиброзного
кольца митрального клапана обычно демонстрирует более низкие ранние диастолические скорости перегородочной части, по сравнению с латеральной частью.
А
Б
В
Г
Д
Е
In-26_для нас.indd 660
03.04.2019 12:02:48
661
26 Гипертрофическая кардиомиопатия
лаксации могут возникать потоки внутри полости
ЛЖ. Асинхронная релаксация у пациентов с асим-
метричной гипертрофией перегородки приводит к
более раннему расслаблению верхушки. Поток кро-
ви от основания ЛЖ к верхушке, наблюдаемый во
время изоволюмической релаксации, называется
внутриполостным «потоком изоволюмической ре-
лаксации» [76]. Из-за времени его возникновения и
внешнего вида поток периода изоволюмической
релаксации можно спутать с сигналом ранней диа-
столической скорости трансмитрального кровотока
[76]. В качестве варианта, у пациентов с ГКМП во
время изоволюмической релаксации может наблю-
даться внутриполостной поток от верхушки к осно-
ванию. Раньше этот поток был описан как диасто-
лический парадоксальный струйный поток, что
указывает на более высокое диастолическое давле-
ние в камере верхушки, чем в основной полости
ЛЖ, и более раннюю релаксацию проксимальных
сегментов ЛЖ [77].
РАЗМЕР И ФУНКЦИЯ ЛЕВОГО ПРЕДСЕРДИЯ
Размер ЛП при ГКМП зависит от нескольких фак-
торов, таких как диастолическая дисфункция, ми-
тральная регургитация и, возможно, первичная
миопатия предсердий [3]. Увеличение переднезад-
него диаметра ЛП (оцениваемого в парастерналь-
ной длинноосевой проекции) коррелирует с повы-
шенным риском неблагоприятных исходов, связан-
ных с ГКМП [78]. Поскольку объем ЛП наиболее
точно отражает размер ЛП, рекомендуется исполь-
зовать измерение объема ЛП, проиндексированного
на площадь поверхности тела [3].
У пациентов с более высокими объемами ЛП
наблюдается более высокое отношение E/e′, более
высокая частота встречаемости нарушения диасто-
лического наполнения и более высокий процент
сердечно-сосудистых осложнений [79]. Для опре-
деления функционального состояния ЛП оценива-
ют три основные функции ЛП: (1) резервуарную
функцию (во время в фазу систолы желудочков и
изоволюмической релаксации), (2) кондуитную
функцию (в фазу ранней диастолы) и (3) сократи-
тельную (насосную) функцию (во время в фазу
систолы предсердий). Определение объемов ЛП во
время различных фаз предсердий позволяет оце-
нить функции ЛП и может быть использовано для
расчета ударного объема ЛП и фракции выброса
ЛП [3].
Визуализация деформации ЛП позволила прове-
сти более прямую оценку функции ЛП. Значения
продольной деформации предсердия, полученные с
помощью тканевой допплерографии в режиме
стрейн и 2D-стрейн во время всех фаз сердечного
цикла, были сниженными у пациентов с ГКМП, по
сравнению с группой контроля и лицами с другими
типами ГЛЖ [80]. Как правило, 2D-стрейн предсер-
дий является более воспроизводимым методом ис-
следования и требует меньшего времени, чем ткане-
вая допплерография в режиме стрейн [80].
НОВЫЕ ЭХОКАРДИОГРАФИЧЕСКИЕ МЕТОДЫ
ВИЗУАЛИЗАЦИЯ ДЕФОРМАЦИИ
2D-спекл-трекинг ЭхоКГ — современный метод
количественной оценки глобальной и регионарной
функций миокарда. У пациентов с ГКМП были ис-
следованы все виды деформации миокарда (про-
дольная, циркулярная и радиальная деформация) и
механизмы вращения (вращение верхушки и скру-
чивание) [81, 82]. В ходе исследований деформации
миокарда в когорте ГКМП были обнаружены отли-
чия по разным параметрам деформации, по сравне-
нию с группой контроля [83]. У носителей генов
ГКМП, у которых еще не было признаков гипертро-
фии ЛЖ, систолическая деформация не имела су-
щественных отличий от систолической деформации
у лиц группы контроля [84]. Выявление сниженной
продольной деформации, вероятно, указывает на
поражение желудочка при ГКМП. Спекл-трекинг
ЭхоКГ также может играть важную роль в диффе-
ренциальной диагностике между ГКМП и другими
причинами утолщения стенок ЛЖ. В ходе ключево-
го исследования, в котором изучались регионарные
различия продольной деформации у пациентов с
различными причинами утолщения стенок ЛЖ
(амилоидоз сердца, ГКМП и аортальный стеноз),
была выявлена картина «апикального щажения» у
пациентов с амилоидозом (т.е. сохранение продоль-
ной деформации в апикальных сегментах) [85].
Напротив, у пациентов с ГКМП имело место замет-
ное снижение продольной деформации в перегоро-
дочных сегментах [85]. Формирование клинически
выраженной систолической дисфункции ЛЖ, обо-
значаемой «фазой дилатации», «терминальной ста-
дией ГКМП», или «конечной стадией ГКМП», на-
блюдается у 2–5% пациентов с ГКМП [3].
При наблюдении со стороны верхушки ЛЖ
основание сердца вращается по часовой стрелке, а
верхушка ЛЖ — против часовой стрелки, при этом
возникает скручивающее движение ЛЖ [3, 83].
Скручивание ЛЖ во время выброса приводит к на-
капливанию потенциальной энергии в мышечных
волокнах и миокардиальном матриксе. С началом
релаксации желудочков сохраненная энергия вы-
свобождается, как раскручивающаяся пружина, что
приводит к всасыванию и наполнению во время
быстрого раннего диастолического расслабления
[83]. У пациентов с ГКМП отмечается нормальное
скручивание, но направление вращения на уровне
среднего отдела желудочка происходит по часовой
стрелке (и следует за направлением основания сер-
дца), в отличие от наблюдаемого у здоровых людей
движения против часовой стрелки (рис. 26.17) [82].
У пациентов с ГКМП начало раскручивания ЛЖ
значительно задерживается [86]. В ходе исследова-
In-26_для нас.indd 661
03.04.2019 12:02:49
662
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ния с участием 45 пациентов с ГКМП, наблюдалась
значительная корреляция между задержкой раскру-
чивания ЛЖ и конечным диастолическим давлени-
ем ЛЖ, отношением E/e′ и конечным диастоличе-
ским объемом ЛЖ. Кроме того, наблюдалась выра-
женная корреляция между задержкой раскручивания
ЛЖ и максимальным потреблением кислорода [86].
ТРЕХМЕРНАЯ ЭХОКАРДИОГРАФИЯ
Применение текущих трехмерных (3D) методов
ЭхоКГ в режиме реального времени (с использова-
нием матричных датчиков) при ГКМП в основном
сфокусировано на выносящем тракте и митральном
аппарате. 3D-ЭхоКГ позволяет количественно оце-
нить размер створок митрального клапана и взаи-
моотношения перегородки и сосочковых мышц для
определения геометрических факторов, связанных
с обструкцией ВТЛЖ [87]. В ходе исследования с
помощью трансторакальной 3D-ЭхоКГ и специаль-
ного программного обеспечения с участием 47 па-
циентов с обструктивной и необструктивной ГКМП
была продемонстрирована большая площадь по-
верхности створок митрального клапана и более
короткие промежутки между папиллярными мыш-
цами у пациентов с обструкцией ВТЛЖ [87]. Наи-
меньшая площадь поперечного сечения ВТЛЖ (в
фазу систолы) демонстрировала выраженную кор-
реляцию с пиковым градиентом давления ВТЛЖ
(коэффициент корреляции 0,83) [87]. Эти результа-
ты были подтверждены в ходе другого исследова-
ния, в котором использовались объемная 3D-ви -
зуализация и автономный анализ, чтобы проде-
монстрировать значительную корреляцию между
градиентом ВТЛЖ в покое и объемом тента ми-
трального клапана, расстоянием между областью
сопоставления и перегородкой и расстоянием меж-
ду сосочковыми мышцами [88].
ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ С ОБСТРУКЦИЕЙ
ВЫНОСЯЩЕГО ТРАКТА ЛЕВОГО ЖЕЛУДОЧКА
Для лечения обструктивной ГКМП используют три
различных класса лекарственных средств: β-адре-
ноблокаторы, дизопирамид и блокаторы кальцие-
вых каналов. Считается, что механизм действия
этих лекарственных средств заключается в умень-
шении сократимости миокарда, что приводит к
снижению скорости выброса ЛЖ, задержке начала
SAM-синдрома МК и, как следствие, снижению об-
струкции выносящего тракта и митральной регур-
гитации. Кроме того, β-адреноблокаторы и блока-
торы кальциевых каналов снижают степень ишемии
миокарда и частоту сердечных сокращений, что
приводит к продлению диастолы и увеличению пас-
сивного наполнения желудочков [1]. Тем не менее
верапамил следует использовать с осторожностью у
пациентов с обструктивной ГКМП, поскольку его
прием может привести к вазодилатации и усугубле-
нию обструкции выносящего тракта [1]. Консерва-
тивное лечение ГКМП может быть оптимизировано
путем мониторинга ответа на терапию с помощью
серийных эхокардиографических и допплеровских
исследований. У пациентов с выраженными при-
знаками устойчивости к лечению и обструкцией
ВТЛЖ следует рассматривать инвазивные способы
редукции перегородки [1]. Хотя в 1980-х и 1990-х гг.
был некоторый первоначальный энтузиазм по по-
воду двухкамерной электрической стимуляции сер-
дца в качестве варианта лечения обструктивной
ГКМП, результаты последующих исследований
показали неполное облегчение симптомов и устра-
нение градиента ВТЛЖ с помощью данного метода
[1]. Вследствие этого двухкамерную электрическую
стимуляцию сердца обычно применяют у пожилых
пациентов с тяжелыми сопутствующими заболева-
ниями, которые не могут быть кандидатами на
аблацию перегородки этанолом или хирургическую
миоэктомию [1].
ХИРУРГИЧЕСКАЯ МИОЭКТОМИЯ
РОЛЬ ИНТРАОПЕРАЦИОННОЙ ЭХОКАРДИОГРАФИИ
Миоэктомия перегородки проводится в течение по-
следних 50 лет для лечения тяжелой обструктивной
ГКМП. Миоэктомия перегородки остро купирует
Группа контроля
ГКМП
РС
РД
Рис. 26.17 Ротация и скручивание желудочка при гипертрофической
кардиомиопатии (ГКМП). Схематическое изображение изменений ротации
и скручивания ЛЖ у пациента с ГКМП по сравнению с пациентами контрольной
группы. Основное различие определяется на среднем уровне, ротация которо-
го у пациентов с ГКМП происходит в противоположном направлении (по часо-
вой стрелке, если смотреть со стороны верхушки), в отличие от пациентов
контрольной группы. Таким образом, при ГКМП ротация среднего отдела же-
лудочка следует за основанием. Напротив, у пациентов контрольной группы
ротация среднего отдела желудочка следует за верхушкой (против часовой
стрелки). РД — ранняя диастола; РС — ранняя систола [Carasso S, Yang H,
Woo A, et al. Systolic myocardial mechanics in hypertrophic cardiomyopathy: novel
concepts and implications for clinical status, J Am Soc Echocardiogr 21:675–683 ,
2008].
In-26_для нас.indd 662
03.04.2019 12:02:49
663
26 Гипертрофическая кардиомиопатия
обструкцию выносящего тракта, расширяя ВТЛЖ,
что приводит к уменьшению SAM-синдрома МК и
снижению динамической обструкции выносящего
тракта. ЭхоКГ полезна при идентификации подхо-
дящих для хирургической миоэктомии пациентов.
Предоперационные эхокардиографические показа-
тели, предсказывающие симптоматическую пользу
хирургической миоэктомии, включают асимме-
тричную гипертрофию, выраженный SAM-синдром
митрального клапана и увеличение времени изово-
люмической релаксации [89]. Кроме того, предопе-
рационная ЭхоКГ играет важную роль в выявлении
дополнительных поражений, требующих хирурги-
ческого лечения.
Хирургическая миоэктомия выполняется из
трансаортального доступа и является технически
сложной, учитывая ограниченную экспозицию и
визуализацию гипертрофированной перегородки.
До введения интраоперационной ЭхоКГ распро-
странение и степень гипертрофии перегородки оце-
нивались с помощью хирургической пальпации и
предоперационной трансторакальной ЭхоКГ. Важ-
ным событием в хирургическом лечении обструк-
тивной ГКМП стало использование чреспищевод-
ной ЭхоКГ (ЧПЭхоКГ). Интраоперационный эхо-
кардиографический контроль при хирургическом
вмешательстве(ах) позволяет оценить ближайшие
результаты и исключить серьезные осложнения [3].
Интраоперационная ЧПЭхоКГ позволяет детально
определить глубину, ширину и протяженность тре-
буемой хирургической резекции, степень SAM-син-
дрома и обструкции ВТЛЖ, а также дать количест-
венную оценку и определить механизм(ы) митраль-
ной регургитации (рис. 26.18) [3, 49]. Протяженность
Рис. 26.18 Интраоперационная чреспищеводная эхокардиография при хирургической миоэктомии. (A) Перед началом резекции субаортальной
мышцы в чреспищеводной длинноосевой проекции определяют границы гипертрофии верхней части перегородки и контакт дистального конца передней митраль-
ной створки с основанием перегородки. Промежуток между двумя митральными створками хорошо визуализирован. (Б) Цветовая допплерография демонстри-
рует выраженную турбулентность в выносящем тракте в фазу систолы и одновременно большую кзади направленную струю митральной регургитации, исходящую
из промежутка между створками. (В) Интраоперационное исследование после резекции субаортальной части межжелудочковой перегородки проводится для
оценки адекватности миоэктомии. В данном случае наблюдается истончение основания перегородки, расширение выносящего тракта ЛЖ и отсутствие переднего
систолического переднего движения. (Г) При цветовой допплерографии выносящего тракта не выявлено турбулентности в субаортальной области и значимой
митральной регургитации.
А
Б
Г
В
In-26_для нас.indd 663
03.04.2019 12:02:49
664
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
гипертрофии перегородки измеряется от основания
правой коронарной створки аортального клапана в
длинноосевой проекции. Планируемая протяжен-
ность резекции намечается на 1 см ниже точки кон-
такта передней створки митрального клапана с
основанием перегородки. Градиент ВТЛЖ может
быть измерен из трансгастрального доступа в пози-
ции по длинной оси с помощью непрерывно-вол-
новой допплерографии, когда ультразвуковой луч
направлен параллельно выносящему тракту. Нали-
чие струи митральной регургитации, направленной
не кзади, указывает на независимый порок митраль-
ного клапана или митрального аппарата [50].
После хирургического иссечения основания пе-
регородки повторная эхокардиографическая визуа-
лизация позволяет немедленно оценить адекват-
ность миоэктомии [3, 49]. С помощью интраопе-
рационной ЭхоКГ можно определить наличие
значительной остаточной обструкции выносящего
тракта или гемодинамически значимой митральной
регургитации. Также интраоперационная ЭхоКГ
позволяет выявлять такие операционные осложне-
ния, как дефект межжелудочковой перегородки
(ДМЖП) и дисфункция ЛЖ [3, 49]. Значение интра-
операционной ЭхоКГ было продемонстрировано в
ходе исследования с участием 256 пациентов, у ко-
торых с помощью интраоперационной ЧПЭхоКГ
были обнаружены неожиданные находки в 17%
случаев до подключения к аппарату искусственного
кровообращения и в 7% случаев сразу после его
подключения. Интраоперационная ЭхоКГ после
подключения к аппарату искусственного крово-
обращения повлекла за собой дополнительные хи-
рургические вмешательства в 4% случаев [90].
РЕЗУЛЬТАТЫ ПОСЛЕ МИОЭКТОМИИ
Изучение исходов хирургической миоэктомии, ко-
торую проводят в квалифицированных специали-
зированных клиниках, показало отличные ранние и
долгосрочные послеоперационные результаты [1,
91]. ЭхоКГ после миоэктомии позволяет идентифи-
цировать возможные осложнения, включая ятро-
генный ДМЖП (< 1% пациентов) [1], аортальную
регургитацию и кровотечение из септальных арте-
рий. Аортальная регургитация может развиваться
после операции и, как правило, не является гемоди-
намически значимой [3]. Кровотечение из септаль-
ных артерий представляет собой диастолический
цветовой поток, направленный от основания пере-
городки к выносящему тракту, развивающийся в
результате хирургического пересечения септальных
артерий, сообщающихся с полостью ЛЖ [92].
При последовательном наблюдении пациентов
после миоэктомии также важно проводить эхокар-
диографические исследования в состоянии покоя и
с провокационными пробами. В ходе нескольких
исследований было зафиксировано значительное
сокращение или устранение остаточного градиента
выносящего тракта у большинства пациентов после
миоэктомии, что привело к существенной и про-
должительной положительной динамике в клини-
ческой картине [1, 91]. Кроме того, в ходе недавнего
исследования, в котором проводилось сравнение
инвазивного и консервативного лечения пациентов
с обструктивной ГКМП, было продемонстрирова-
но, что инвазивное лечение приводит к улучшению
общей (но не связанной с ГКМП) выживаемости
[93].
АБЛАЦИЯ ЭТАНОЛОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Аблация этанолом МЖП — инвазивный метод,
который заключается в селективной инъекции эта-
нола в септальную артерию, отходящую от перед-
ней нисходящей ветви левой коронарной артерии.
Это приводит к окклюзии септальной артерии и
локализованному инфаркту гипертрофированной
МЖП, что сопровождается локальным ее истонче-
нием, расширением ВТЛЖ и снижением степени
обструкции ВТЛЖ [1]. Клинические испытания
метода аблации этанолом МЖП впервые были
описаны в 1990-х гг . Выбор соответствующей сеп-
тальной артерии, подлежащей инъекции, опреде-
лялся уменьшением градиента ВТЛЖ после вре-
менной окклюзии определенного сосуда баллон-
ным катетером. Однако ключевым моментом в
этом методе стало использование интраопераци-
онной ЭхоКГ. Контрастная ЭхоКГ играет важную
роль в контроле и мониторинге аблации этанолом
МЖП [3, 94–96]. ЭхоКГ в лаборатории катетериза-
ции сердца может быть выполнена с помощью
трансторакального или чреспищеводного подхода,
причем в большинстве клиник используется пер-
вый подход [3].
Внутриартериальное введение эхоконтрастного
средства позволяет определить специфическую ло-
кализацию участка, кровоснабжаемого септальной
артерией передней нисходящей ветви левой коро-
нарной артерии. Сосудистый бассейн, определен-
ный с помощью контрастной ЭхоКГ, представляет
собой область контакта передней створки митраль-
ного клапана с базальной частью МЖП, который
вызывает обструкцию ВТЛЖ (рис. 26.19). Место
контакта створки с перегородкой обычно примыка-
ет к зоне ускорения кровотока и цветовой турбу-
лентности в выносящем тракте [94]. После введения
контрастного средства сегменты МЖП, которые
кровоснабжаются септальной артерией, становятся
непрозрачными. Пространственная протяженность
контрастности миокарда может быть определена из
нескольких трансторакальных окон. Контрастный
эффект этанола имеет то же распределение, что и
контрастное средство, и внутриартериальная инъ-
екция этанола обычно сопровождается повышен-
ной эхогенностью и отражательной способностью.
Важно отметить, что из-за опасений относительно
In-26_для нас.indd 664
03.04.2019 12:02:50
665
26 Гипертрофическая кардиомиопатия
безопасности ультразвуковых контрастных средств
Управление США по санитарному надзору за каче-
ством пищевых продуктов и медикаментов реко-
мендовало не использовать внутриартериальное
введение ультразвуковых контрастных средств [37].
Вследствие этого в качестве альтернативы для иден-
тификации целевой септальной артерии возможно
использование активных рентгенконтрастных ве-
ществ, обеспечивающих приемлемую степень кон-
трастности миокарда [37].
Интраоперационная контрастная ЭхоКГ демон-
стрирует лучшие результаты, по сравнению со стра-
тегией выбора целевого сосуда с помощью пробной
окклюзии баллонным катетером [94]. Использова-
ние контрастной ЭхоКГ связано с более коротким
временем вмешательства, меньшим количеством
Рис. 26.19 Интраоперационный эхокардиографический контроль аблации этанолом межжелудочковой перегородки. (A) Изображение в 2D-режиме
из апикальной четырехкамерной позиции, полученное на исходном этапе, указывает на гипертрофию перегородки и переднее систолическое движения передней
створки. (Б) Режим цветовой допплерографии в этой же проекции до индуцированного этанолом инфаркта демонстрирует наличие цветовой турбулентности,
локализованной в выносящем тракте ЛЖ. В среднем отделе желудочка цветовая турбулентность отсутствует. (В) Эхокардиографическая визуализация после
введения эхоконтрастного средства и последующей инъекции этанола в первую септальную артерию передней нисходящей ветви левой коронарной артерии.
Контрастное средство и этанол затемняют проксимальную часть перегородки в области кровоснабжения целевой септальной артерии. (Г) Дополнительная цвето-
вая допплерография подтверждает, что область контрастирования прилежит к точке цветовой турбулентности в выносящем тракте, и что целевой инфаркт нахо-
дится в области гипертрофированной перегородки, обуславливающей динамическую обструкцию.
А
Б
В
Г
In-26_для нас.indd 665
03.04.2019 12:02:50
666 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
инъецированного этанола, меньшей площадью ин-
фаркта и значительно более высоким числом паци-
ентов, у которых более чем на 50% снизилась ве-
личины градиента ВТЛЖ (92% против 70%). Пре-
восходство этого эхокардиографического подхода
подтверждалось при 3-месячном наблюдении поло-
жительной динамикой как по функциональному
классу, так и по величине градиента ВТЛЖ [94].
Контрастная ЭхоКГ неоценима при выявлении кон-
трастного усиления в зонах, удаленных от области
контакта митральной створки и перегородки (на-
пример, свободная стенка ЛЖ или верхушка, сво-
бодная стенка ПЖ, сосочковая мышца) (рис. 26.20)
[96]. Контрастное усиление в областях вне МЖП
требует выбора другого сосуда для инъекции или
отказа от процедуры [96]. Кроме того, размер инду-
цированного инфаркта, определяемый с помощью
планиметрии области, накапливающей контраст,
коррелирует с большим риском осложнений после
проведения аблации этанолом МЖП [97]. Вследст-
вие этого контрастная ЭхоКГ оптимизирует абла-
цию этанолом МЖП, позволяя выполнять при-
цельное введение этанола путем ограничения обла-
сти индуцированного инфаркта областью контакта
митральной створки с перегородкой, что миними-
зирует осложнения, вызванные проведением проце-
дуры. Аблация этанолом МЖП приводит к по-
степенному и эффективному снижению градиента
ВТЛЖ. Часто наблюдается трехфазный гемоди-
намический ответ после проведения процедуры:
(1) немедленное снижение градиента ВТЛЖ после
инъекции этанола, (2) раннее повышение уровня
градиента ВТЛЖ (через 3 дня после процедуры) и
(3) снижение величины обструкции ВТЛЖ в тече-
ние трехмесячного наблюдения [98]. Долгосрочный
положительный эффект является результатом по-
степенного истончения стенки и постепенного сни-
жения провокационного градиента ВТЛЖ и гради-
ента ВТЛЖ в покое [99].
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА МЕТОДОВ ЛЕЧЕНИЯ
В настоящее время существует множество методов
лечения обструктивной ГКМП. Лекарственные пре-
параты обладают вариабельной эффективностью
по снижению градиента выносящего тракта. Па-
циенты, у которых остаются симптомы, несмотря
на отрицательную инотропную терапию, являются
кандидатами на хирургическую миоэктомию или
аблацию этанолом МЖП, выполняемую в специа-
лизированных клиниках [1]. Применение двухка-
мерной электрокардиостимуляции ограничивается
пожилыми пациентами, у которых имеются серьез-
ные сопутствующие заболевания, исключающие
возможность использования других инвазивных
методик. В ходе нескольких нерандомизированных
исследований проводилось сравнение результатов
аблации этанолом МЖП и миоэктомии [1, 100, 101].
Два метаанализа не показали существенных разли-
чий в показателях ранней смертности и аналогич-
ные улучшения в функциональном классе после
проведения миоэктомии или аблации этанолом
МЖП [100, 101]. Потребность в постоянном кардио-
стимуляторе после аблации этанолом МЖП была
выше [1, 100, 101]. Не было отмечено существенных
различий в среднесрочной кардиальной выживае-
мости при использовании этих двух методик [1].
Остаточный градиент ВТЛЖ в покое ниже у паци-
ентов, перенесших хирургическую миоэтомию
[100,101]: в одном метаанализе было отмечено, что
градиент ВТЛЖ в покое после проведения вмеша-
ЛЖ
ПЖ
ЛП
КОН
КОН
КОН
Рис. 26.20 Предотвращение осложнений аблации этанолом межжелудочковой перегородки с помощью контрастной эхокардиографии. Интрао-
перационная контрастная эхокардиография во время аблации этанолом межжелудочковой перегородки позволяет целенаправленно ввести этанол. После внутри-
артериальной инъекции эхоконтрастного средства (КОН), трансторакальная визуализация в апикальной четырехкамерной проекции (А) и апикальной трехкамерной
проекции (Б) демонстрирует контрастирование основания и средне-задней и передней частей межжелудочковой перегородки. Однако в апикальной двухкамерной
проекции (В) определяется контрастное затемнение нижней стенки. Вследствие этого выбранный сосуд не подходит для инъекции этанола. Не было выявлено
никаких других септальных артерий, процедура была отменена, и пациент направлен на миоэктомию перегородки. ЛЖ — левый желудочек; ЛП — левое пред-
сердие; ПЖ — правый желудочек.
А
Б
В
In-26_для нас.indd 666
03.04.2019 12:02:51
667
26 Гипертрофическая кардиомиопатия
тельства составил 5–17 мм рт. ст. (миоэктомия) и
11–25 мм рт. ст. (аблация этанолом МЖП) [100].
Тем не менее после инфаркта, вызванного этано-
лом, долгосрочные риски поздних желудочковых
аритмий и внезапной сердечной смерти неопреде-
ленные [1]. Вследствие этого хирургическая миоэк-
томия остается вариантом выбора лечения молодых
здоровых пациентов, тогда как аблация этанолом
МЖП более применима у пациентов с очень высо-
кими хирургическими рисками [1]. Миоэктомия
также предпочтительна у пациентов с сопутствую-
щими заболеваниями, требующими особого вни-
мания при операции (например, эпикардиальное
заболевание коронарных артерий, пороках клапа-
нов) или в редких случаях кардиогенного шока,
когда необходимо быстро уменьшить градиент
ВТЛЖ (рис. 26.21).
ЭхоКГ предоставляет необходимую информа-
цию для определения наиболее подходящего типа
инвазивной редукции МЖП для каждого конкрет-
ного пациента. Данные ЭхоКГ, полученные до про-
ведения процедуры, позволяющие предположить
хороший результат после аблации этанолом МЖП,
представляют собой толщину МЖП 18 мм или ме-
нее (в области SAM-синдрома) и градиент ВТЛЖ в
покое < 100 мм рт. ст. [102] Кроме того, проведение
аблации этанолом МЖП не рекомендуется при тол-
щине стенки > 30 мм, поскольку в случаях выра-
женной гипертрофии произойдет недостаточное
истончение перегородки [1]. Пациенты, у которых
планируется любой метод инвазивной редукции
перегородки, должны быть обследованы в клинике,
специализирующихся на выполнении этих вмеша-
тельств [1].
Аблация этанолом МЖП и хирургическая мио-
эктомия являются сложными методами. Важно от-
метить, что обе процедуры должны выполняться в
клиниках, специалисты которых владеют техни-
ческим и эхокардиографическим опытом. Перед
проведением процедуры необходима комплексная
эхокардиографическая оценка для выявления паци-
ентов с сопутствующими заболеваниями, требую-
щими хирургической коррекции. Эффективность
как аблации этанолом МЖП, так и миоэктомии
зависит от опытного интраоперационного эхокар-
диографического контроля с контрастной ЭхоКГ
при аблации этанолом и ЧПЭхоКГ при миоэкто-
мии. Интраоперационный эхокардиографический
контроль является необходимым условием для
идентификации сегментов перегородки, требую-
щих химической или хирургической редукции, не-
медленной оценки градиента ВТЛЖ в ответ на ре-
дукцию перегородки или миоэктомию и монито-
ринг возможных осложнений.
КЛИНИЧЕСКИЕ ФАКТОРЫ:
• Гемодинамическая нестабильность,
требующая быстрого снижения градиента
• Необходимость хирургической операции
по сопутствующей патологии
• Коронарная анатомия не позволяет
выполнить АЭМП
КЛИНИЧЕСКИЕ ФАКТОРЫ:
• Пациент не является кандидатом
на операцию на открытом сердц
из-за серьезных сопутствующих
заболеваний
• Отсутствие специализированной
хирургической клиники
Факторы, позволяющие отдать предпочтение миоэктомии
или абляции этанолом межжелудочковой перегородки
МИОЭКТОМИЯ
АБЛАЦИЯ
ЭТАНОЛОМ
ЭХО ФАКТОРЫ:
• Выраженная гипертрофия
перегородки (≥ 30 мм)
• Аномалии митрального аппарата/
сосочковых мышц,
способствующие обструкции
• Градиент ВТЛЖ в состоянии покоя
≥100ммрт.ст.
• Обструкция на уровне среднего отдела
желудочка (вместо уровня ВТЛЖ)
ЭХО ФАКТОРЫ:
• Легкая или умеренная гипертрофия
перегородки (в идеале ≤ 18 мм)
• Локальная цветовая турбулентность
в выносящем тракте
Рис. 26.21 Выбор метода инвазивной редукции перегородки (хирургическая миоэктомия или аблация этанолом межжелудочковой перегород-
ки [АЭМП]). Клинические и эхокардиографические факторы помогают принять решение о проведении хирургической миоэктомии или АЭМП. Эхокардиография
играет решающую роль в выявлении подходящих кандидатов для этих процедур: хирургическая миоэктомия является вариантом выбора у пациентов со выра-
женной гипертрофией в ассоциации с патологией митрального аппарата или сосочковой(ых) мышцы или у пациентов со выраженной обструкцией на уровне
среднего отдела желудочка (а не выносящего тракта). См. текст для получения дополнительной информации.
In-26_для нас.indd 667
03.04.2019 12:02:51
668 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ЭХОКАРДИОГРАФИЧЕСКИЕ ПРОГНОСТИЧЕСКИЕ
ФАКТОРЫ КЛИНИЧЕСКИХ ИСХОДОВ
В ходе нескольких исследований были изучены раз-
личные факторы риска внезапной сердечной смер-
ти у пациентов с ГКМП в попытке улучшить оцен-
ку риска относительно широко распространенных
заболеваний, которые имеют частоту внезапной
смерти приблизительно 1% в год [1]. Стратифика-
ция риска при ГКМП является сложной задачей,
поскольку основные факторы риска, связанные с
внезапной смертью при ГКМП, как правило, име-
ют низкую положительную прогностическую цен-
ность. ЭхоКГ все чаще дает важную информацию
об отдаленных результатах у пациентов с ГКМП.
Существует три эхокардиографических показателя,
связанных с ухудшением прогноза при ГКМП:
(1) максимальная толщина стенки ЛЖ больше
30 мм, (2) градиент ВТЛЖ в покое по меньшей мере
30 мм рт. ст. и (3) расширение ЛП. В ходе крупного
исследования с участием 480 пациентов было обна-
ружено, что максимальная толщина стенки ЛЖ (в
подгруппе с шагом 5 мм) независимо увеличивает
риск внезапной смерти [103]. В настоящее время
наличие максимальной толщины стенки ЛЖ 30 мм
и более считается разумным показанием для про-
филактической установки имплантируемого кар-
диовертер-дефибриллятора [1]. Тем не менее поло-
жительное прогностическое значение толщины
стенки 30 мм или более для внезапного летального
исхода на самом деле довольно мало — 16% в ходе
вышеупомянутого исследования [103] и 13% в ходе
другого крупного исследования с участием 630 па-
циентов [104]. Кроме того, в ходе последнего иссле-
дования также было продемонстрировано, что нали-
чие клинических факторов риска (рецидивные об-
мороки неизвестной этиологии, семейный анамнез
рецидивной ранней внезапной смерти, неустойчи-
вая желудочковая тахикардия и аномальная реакция
артериального давления на физическую нагрузку)
было лучшим предиктором внезапной смерти, чем
изолированный показатель толщины стенки [104].
В ходе комплексного исследования с участием
1101 пациента с ГКМП выявление обструкции
ВТЛЖ в покое, определяемой пороговым значени-
ем градиента ВТЛЖ в покое не менее 30 мм рт. ст.,
значительно увеличило риск внезапной смерти и
смерти, связанной с ГКМП [105]. Как и при макси-
мальной толщине стенок ЛЖ, положительное про-
гностическое значение градиента ВТЛЖ в покое,
равного 30 мм рт. ст. или более, для внезапного
смертельного исхода было очень низким (7%), тог-
да как отрицательная прогностическая значимость
обструкции ВТЛЖ была высокой (95%) [105]. При
многофакторном анализе в ходе большого исследо-
вания с участием 649 пациентов с ГКМП и обструк-
цией ВТЛЖ в покое было отмечено, что градиент
ВТЛЖ в покое по меньшей мере 64 мм рт. ст. был
независимым предиктором смерти, связанной с
ГКМП [93].
Аналогичные результаты были обнаружены в
ходе другого ретроспективного исследования с уча-
стием 544 пациентов с ГКМП и провокационной
обструкцией ВТЛЖ или обструкцией ВТЛЖ в по-
кое, и минимальными симптомами при включении
пациента в исследование; скорость кровотока ВТЛЖ
в покое > 4 м/сек была связана со значительно по-
вышенным риском общей смертности и смерти,
связанной с ГКМП [106]. Наконец, увеличенный
переднезадний диаметр ЛП демонстрировал значи-
тельную корреляцию с неблагоприятным исходом
при ГКМП: диаметр ЛП 45 мм или более являлся
сильным прогностическим фактором развития фи-
брилляции предсердий [78]. Данные 1491 пациента
из итальянского реестра по ГКМП свидетельствуют
о том, что диаметр ЛП > 48 мм коррелирует с по-
вышенным риском смертности от всех причин,
смертности, связанной с ГКМП и сердечной недо-
статочностью (но не внезапной смертью) [107]. В
подгруппе пациентов, перенесших хирургическую
миоэктомию, наличие предоперационного диаме-
тра ЛП не менее 46 мм было независимым факто-
ром риска увеличения общей и связанной с ГКМП
смертности после операции [91].
In-26_для нас.indd 668
03.04.2019 12:02:51
669
26 Гипертрофическая кардиомиопатия
К
л
и
н
и
ч
е
с
к
о
е
с
о
с
т
о
я
н
и
е
и
л
и
п
о
д
т
и
п
ы
Г
К
М
П
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
п
о
к
а
з
а
т
е
л
и
М
е
т
о
д
ы
в
и
з
у
а
л
и
з
а
ц
и
и
Д
о
к
л
и
н
и
ч
е
с
к
а
я
Г
К
М
П
(
т
.
е
.
Г
К
М
П
б
е
з
п
р
и
з
н
а
-
к
о
в
г
и
п
е
р
т
р
о
ф
и
и
)
Т
о
л
щ
и
н
а
с
т
е
н
о
к
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
<
1
3
м
м
↓
Т
к
а
н
е
в
ы
е
д
о
п
п
л
е
р
о
в
с
к
и
е
с
и
с
т
о
л
и
ч
е
с
к
а
я
и
д
и
а
-
с
т
о
л
и
ч
е
с
к
а
я
с
к
о
р
о
с
т
и
И
с
п
о
л
ь
з
у
й
т
е
м
е
т
о
д
ы
2
D
-
Э
х
о
К
Г
и
т
к
а
н
е
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
С
в
я
з
а
н
а
с
2
D
-
п
о
к
а
з
а
т
е
л
я
м
и
(
г
и
п
е
р
д
и
н
а
м
и
ч
е
с
к
а
я
ф
у
н
к
ц
и
я
Л
Ж
,
с
о
о
т
н
о
ш
е
н
и
е
т
о
л
щ
и
н
ы
с
т
е
н
о
к
)
,
в
ы
с
о
к
о
с
п
е
ц
и
ф
и
ч
н
ы
м
и
д
л
я
в
ы
я
в
л
е
н
и
я
п
а
ц
и
е
н
т
о
в
с
п
о
л
о
ж
и
т
е
л
ь
н
ы
м
г
е
н
о
т
и
п
о
м
Р
о
д
с
т
в
е
н
н
и
к
и
п
е
р
в
о
й
с
т
е
п
е
н
и
и
н
д
е
к
с
н
ы
х
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
д
о
л
ж
н
ы
б
ы
т
ь
п
о
д
в
е
р
г
н
у
т
ы
с
е
р
и
й
н
о
м
у
о
б
с
л
е
д
о
в
а
н
и
ю
(
с
5
-
л
е
т
н
и
м
и
и
н
т
е
р
в
а
л
а
м
и
в
з
р
е
л
о
м
в
о
з
р
а
с
т
е
)
н
а
п
р
е
д
м
е
т
р
а
з
-
в
и
т
и
я
к
л
и
н
и
ч
е
с
к
и
в
ы
р
а
ж
е
н
н
о
й
Г
К
М
П
К
л
и
н
и
ч
е
с
к
и
в
ы
р
а
ж
е
н
н
а
я
Г
К
М
П
(
б
е
з
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
)
Д
и
а
г
н
о
с
т
и
к
а
:
т
о
л
щ
и
н
а
с
т
е
н
к
и
Л
Ж
≥
1
5
м
м
(
д
л
я
в
з
р
о
с
л
ы
х
)
;
т
о
л
щ
и
н
а
с
т
е
н
о
к
Л
Ж
>
2
с
т
а
н
д
а
р
т
н
ы
х
о
т
к
л
о
н
е
н
и
й
в
ы
ш
е
с
р
е
д
н
е
г
о
(
у
д
е
т
е
й
)
А
с
и
м
м
е
т
р
и
ч
н
а
я
г
и
п
е
р
т
р
о
ф
и
я
п
е
р
е
г
о
р
о
д
к
и
(
п
е
р
е
-
г
о
р
о
д
к
а
/
с
в
о
б
о
д
н
а
я
с
т
е
н
к
а
≥
1
,
3
)
у
9
9
%
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
П
е
р
е
д
н
я
я
ч
а
с
т
ь
п
е
р
е
г
о
р
о
д
к
и
ч
а
с
т
о
я
в
л
я
е
т
с
я
н
а
и
б
о
-
л
е
е
г
и
п
е
р
т
р
о
ф
и
р
о
в
а
н
н
ы
м
с
е
г
м
е
н
т
о
м
с
т
е
н
к
и
Л
Ж
О
ц
е
н
и
т
е
н
а
л
и
ч
и
е
и
с
т
е
п
е
н
ь
у
т
о
л
щ
е
н
и
я
с
т
е
н
о
к
Л
Ж
в
с
т
а
н
д
а
р
т
н
ы
х
п
р
о
е
к
ц
и
я
х
С
е
г
м
е
н
т
ы
с
т
е
н
о
к
Л
Ж
,
и
з
м
е
р
е
н
н
ы
е
в
п
а
р
а
с
т
е
р
н
а
л
ь
н
ы
х
к
о
р
о
т
к
о
о
с
е
в
ы
х
п
р
о
е
к
ц
и
я
х
(
н
а
у
р
о
в
-
н
е
о
с
н
о
в
а
н
и
я
,
с
р
е
д
н
е
г
о
о
т
д
е
л
а
и
в
е
р
х
у
ш
к
и
)
Г
К
М
П
д
о
п
о
л
н
и
т
е
л
ь
н
о
м
о
ж
н
о
к
л
а
с
с
и
ф
и
ц
и
р
о
в
а
т
ь
п
о
м
о
р
ф
о
л
о
г
и
ч
е
с
к
о
м
у
п
о
д
т
и
п
у
(
н
а
п
р
и
-
м
е
р
,
г
и
п
е
р
т
р
о
ф
и
я
о
с
н
о
в
а
н
и
я
п
е
р
е
г
о
р
о
д
к
и
/
о
б
р
а
т
н
о
е
и
с
к
р
и
в
л
е
н
и
е
п
е
р
е
г
о
р
о
д
к
и
/
н
е
й
т
р
а
л
ь
-
н
а
я
/
а
п
и
к
а
л
ь
н
а
я
)
И
м
п
у
л
ь
с
н
о
в
о
л
н
о
в
а
я
и
т
к
а
н
е
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
м
о
ж
е
т
о
п
р
е
д
е
л
и
т
ь
д
и
а
с
т
о
л
и
ч
е
с
к
у
ю
ф
у
н
к
ц
и
ю
и
п
о
м
о
ч
ь
о
ц
е
н
и
т
ь
н
а
п
о
л
н
е
н
и
е
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
Б
о
л
е
з
н
и
,
и
м
и
т
и
р
у
ю
щ
и
е
Г
К
М
П
,
и
л
и
ф
е
н
о
к
о
п
и
и
Г
К
М
П
К
а
т
е
г
о
р
и
и
ф
е
н
о
к
о
п
и
й
H
C
M
в
к
л
ю
ч
а
ю
т
с
л
е
д
у
ю
щ
и
е
:
(
1
)
С
о
с
т
о
я
н
и
я
,
с
в
я
з
а
н
н
ы
е
с
ф
и
з
и
о
л
о
г
и
ч
е
с
к
о
й
г
и
-
п
е
р
т
р
о
ф
и
е
й
Л
Ж
(
н
а
п
р
и
м
е
р
,
с
е
р
д
ц
е
а
т
л
е
т
а
)
(
2
)
С
о
с
т
о
я
н
и
я
,
с
в
я
з
а
н
н
ы
е
с
п
а
т
о
л
о
г
и
ч
е
с
к
о
й
г
и
п
е
р
-
т
р
о
ф
и
е
й
(
н
а
п
р
и
м
е
р
,
г
и
п
е
р
т
е
н
з
и
в
н
а
я
к
а
р
д
и
о
м
и
-
о
п
а
т
и
я
)
(
3
)
Б
о
л
е
з
н
и
н
а
к
о
п
л
е
н
и
я
и
л
и
з
а
б
о
л
е
в
а
н
и
я
о
б
м
е
н
а
в
е
щ
е
с
т
в
(
н
а
п
р
и
м
е
р
,
б
о
л
е
з
н
ь
Ф
а
б
р
и
)
(
4
)
И
н
ф
и
л
ь
т
р
а
т
и
в
н
ы
е
к
а
р
д
и
о
м
и
о
п
а
т
и
и
(
н
а
п
р
и
-
м
е
р
,
а
м
и
л
о
и
д
о
з
)
Д
и
а
г
н
о
с
т
и
ч
е
с
к
и
е
п
р
и
з
н
а
к
и
в
к
л
и
н
и
ч
е
с
к
о
й
к
а
р
т
и
н
е
,
д
а
н
н
ы
е
э
л
е
к
т
р
о
к
а
р
д
и
о
г
р
а
м
м
ы
,
п
о
к
а
-
з
а
т
е
л
и
2
D
-
Э
х
о
К
Г
и
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
п
о
м
о
г
а
ю
т
п
р
и
о
б
с
л
е
д
о
в
а
н
и
и
п
а
ц
и
е
н
т
о
в
с
у
в
е
л
и
ч
е
н
-
н
о
й
т
о
л
щ
и
н
о
й
с
т
е
н
о
к
Л
Ж
Д
о
п
о
л
н
и
т
е
л
ь
н
у
ю
и
н
ф
о
р
м
а
ц
и
ю
с
м
.
в
т
а
б
л
.
2
6
.
3
Г
К
М
П
с
д
и
н
а
м
и
ч
е
с
к
о
й
о
б
с
т
р
у
к
ц
и
е
й
В
Т
Л
Ж
Д
и
н
а
м
и
ч
е
с
к
а
я
о
б
с
т
р
у
к
ц
и
я
В
Т
Л
Ж
в
с
т
р
е
ч
а
е
т
с
я
у
д
в
у
х
т
р
е
т
е
й
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
Н
а
л
и
ч
и
е
п
е
р
е
д
н
е
г
о
с
и
с
т
о
л
и
ч
е
с
к
о
г
о
д
в
и
ж
е
н
и
я
(
с
л
а
-
б
о
г
о
/
у
м
е
р
е
н
н
о
г
о
/
в
ы
р
а
ж
е
н
н
о
г
о
)
Н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
п
о
з
в
о
л
я
е
т
к
о
л
и
ч
е
с
т
в
е
н
н
о
о
ц
е
н
и
т
ь
г
р
а
д
и
е
н
т
В
Т
Л
Ж
:
Г
р
а
д
и
-
е
н
т
В
Т
Л
Ж
=
4
×
(
С
к
о
р
о
с
т
ь
п
о
т
о
к
а
в
В
Т
Л
Ж
)
2
О
б
с
т
р
у
к
ц
и
я
В
Т
Л
Ж
о
п
р
е
д
е
л
я
е
т
с
я
с
л
е
д
у
ю
щ
и
м
о
б
р
а
-
з
о
м
:
В
п
о
к
о
е
:
г
р
а
д
и
е
н
т
В
Т
Л
Ж
в
п
о
к
о
е
≥
3
0
м
м
р
т
.
с
т
.
П
р
о
в
о
к
а
ц
и
о
н
н
а
я
:
г
р
а
д
и
е
н
т
В
Т
Л
Ж
в
п
о
к
о
е
<
3
0
м
м
р
т
.
с
т
.
,
п
о
с
л
е
п
р
о
в
о
к
а
ц
и
и
≥
3
0
м
м
р
т
.
с
т
.
Н
е
о
б
с
т
р
у
к
т
и
в
н
а
я
:
г
р
а
д
и
е
н
т
В
Т
Л
Ж
в
п
о
к
о
е
и
п
о
с
л
е
п
р
о
в
о
к
а
ц
и
и
<
3
0
м
м
р
т
.
с
т
.
О
ц
е
н
и
т
е
с
п
о
м
о
щ
ь
ю
2
D
-
Э
х
о
К
Г
м
о
р
ф
о
л
о
г
и
ч
е
с
к
и
е
о
с
о
б
е
н
н
о
с
т
и
,
к
о
т
о
р
ы
е
с
п
о
с
о
б
с
т
в
у
ю
т
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
(
с
т
р
о
е
н
и
е
/
т
о
л
щ
и
н
а
п
е
р
е
г
о
р
о
д
к
и
,
в
ы
н
о
с
я
щ
и
й
т
р
а
к
т
,
с
т
в
о
р
к
и
м
и
-
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
)
И
с
п
о
л
ь
з
у
й
т
е
ц
в
е
т
о
в
у
ю
д
о
п
п
л
е
р
о
г
р
а
ф
и
ю
д
л
я
о
п
р
е
д
е
л
е
н
и
я
у
р
о
в
н
я
(
е
й
)
о
б
с
т
р
у
к
ц
и
и
(
В
Т
Л
Ж
/
с
р
е
д
н
и
й
о
т
д
е
л
ж
е
л
у
д
о
ч
к
а
)
О
ц
е
н
и
т
е
м
и
т
р
а
л
ь
н
ы
й
к
л
а
п
а
н
,
с
т
е
п
е
н
ь
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
,
с
в
я
з
а
н
н
о
й
с
S
A
M
-
с
и
н
д
р
о
м
о
м
(
с
т
р
у
я
,
н
а
п
р
а
в
л
е
н
н
а
я
к
з
а
д
и
)
и
н
а
л
и
ч
и
е
н
е
з
а
в
и
с
и
м
о
г
о
п
о
р
о
к
а
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
(
п
р
и
н
а
л
и
ч
и
и
с
т
р
у
и
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
,
н
е
н
а
п
р
а
в
л
е
н
н
о
й
к
з
а
д
и
)
И
с
п
о
л
ь
з
у
й
т
е
ц
в
е
т
о
в
о
й
д
о
п
п
л
е
р
и
н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
д
л
я
о
п
р
е
д
е
л
е
н
и
я
с
т
е
п
е
н
и
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
(
в
п
о
к
о
е
и
п
р
и
п
р
о
в
о
к
а
ц
и
и
)
О
п
р
е
д
е
л
е
н
и
е
с
п
е
к
т
р
а
л
ь
н
о
г
о
п
р
о
ф
и
л
я
п
р
и
н
е
п
р
е
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
с
у
в
е
-
л
и
ч
е
н
н
о
й
с
к
о
р
о
с
т
ь
ю
к
р
о
в
о
т
о
к
а
В
Т
Л
Ж
(
к
и
н
ж
а
л
о
в
и
д
н
ы
й
д
о
п
п
л
е
р
о
в
с
к
и
й
п
р
о
ф
и
л
ь
)
с
т
р
у
и
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
Д
а
л
е
е
п
р
о
в
о
д
и
т
с
я
о
ц
е
н
к
а
с
п
о
м
о
щ
ь
ю
Э
х
о
К
Г
с
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
(
с
и
с
п
о
л
ь
з
о
в
а
н
и
е
м
н
а
г
р
у
з
о
ч
н
о
г
о
т
е
с
т
а
н
а
б
е
г
о
в
о
й
д
о
р
о
ж
к
е
)
д
л
я
о
п
р
е
д
е
л
е
н
и
я
н
а
л
и
ч
и
я
и
н
д
у
ц
и
р
о
в
а
н
н
о
й
ф
и
-
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
о
й
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
Э
х
о
К
Г
и
м
е
е
т
р
е
ш
а
ю
щ
е
е
з
н
а
ч
е
н
и
е
п
р
и
в
ы
б
о
р
е
о
п
т
и
м
а
л
ь
н
о
г
о
с
п
о
с
о
б
а
и
н
в
а
з
и
в
н
о
й
р
е
д
у
к
-
ц
и
и
п
е
р
е
г
о
р
о
д
к
и
И
н
т
р
а
о
п
е
р
а
ц
и
о
н
н
ы
й
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
й
к
о
н
т
р
о
л
ь
(
ч
р
е
с
п
и
щ
е
в
о
д
н
а
я
Э
х
о
К
Г
[
в
о
в
р
е
м
я
м
и
о
э
к
т
о
м
и
и
]
и
л
и
Э
х
о
К
Г
с
к
о
н
т
р
а
с
т
и
р
о
в
а
н
и
е
м
[
в
о
в
р
е
м
я
а
б
л
а
ц
и
и
э
т
а
н
о
л
о
м
М
Ж
П
]
)
и
г
-
р
а
е
т
н
е
з
а
м
е
н
и
м
у
ю
р
о
л
ь
п
р
и
и
н
в
а
з
и
в
н
ы
х
м
е
т
о
д
а
х
р
е
д
у
к
ц
и
и
М
Ж
П
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
Г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
In-26_для нас.indd 669
03.04.2019 12:02:51
670
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
К
л
и
н
и
ч
е
с
к
о
е
с
о
с
т
о
я
н
и
е
и
л
и
п
о
д
т
и
п
ы
Г
К
М
П
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
п
о
к
а
з
а
т
е
л
и
М
е
т
о
д
ы
в
и
з
у
а
л
и
з
а
ц
и
и
А
с
и
м
м
е
т
р
и
ч
е
с
к
а
я
а
п
и
-
к
а
л
ь
н
а
я
Г
К
М
П
В
с
т
р
е
ч
а
е
т
с
я
м
е
н
е
е
ч
е
м
у
1
0
%
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
П
р
е
о
б
л
а
д
а
е
т
г
и
п
е
р
т
р
о
ф
и
я
а
п
и
к
а
л
ь
н
ы
х
с
е
г
м
е
н
т
о
в
Л
Ж
,
с
т
о
л
щ
и
н
о
й
а
п
и
к
а
л
ь
н
о
й
с
т
е
н
к
и
≥
1
5
м
м
и
о
т
н
о
ш
е
н
и
е
м
т
о
л
щ
и
н
ы
а
п
и
к
а
л
ь
н
о
й
/
н
и
ж
н
е
й
с
т
е
-
н
о
к
≥
1
,
5
м
м
У
н
е
к
о
т
о
р
ы
х
п
а
ц
и
е
н
т
о
в
а
с
с
о
ц
и
и
р
о
в
а
н
а
с
в
ы
п
я
ч
и
-
в
а
н
и
е
м
и
л
и
а
н
е
в
р
и
з
м
о
й
в
е
р
х
у
ш
к
и
Р
а
с
с
м
о
т
р
и
т
е
э
х
о
к
о
н
т
р
а
с
т
н
о
е
с
р
е
д
с
т
в
о
д
л
я
у
л
у
ч
ш
е
н
и
я
о
п
р
е
д
е
л
е
н
и
я
э
н
д
о
к
а
р
д
а
н
а
в
е
р
х
у
ш
к
е
в
с
л
у
ч
а
я
х
п
о
д
о
з
р
е
н
и
я
а
п
и
к
а
л
ь
н
о
й
Г
К
М
П
(
н
а
п
р
и
м
е
р
,
н
а
л
и
ч
и
е
и
н
в
е
р
с
и
и
г
и
г
а
н
т
с
к
о
г
о
Т
-
з
у
б
ц
а
п
р
и
э
л
е
к
т
р
о
к
а
р
д
и
о
г
р
а
ф
и
и
)
И
з
у
ч
и
т
е
д
р
у
г
и
е
э
х
о
-
п
р
и
з
н
а
к
и
д
л
я
и
с
к
л
ю
ч
е
н
и
я
с
о
с
т
о
я
н
и
й
,
к
о
т
о
р
ы
е
м
о
г
у
т
и
м
и
т
и
р
о
в
а
т
ь
а
с
и
м
м
е
т
р
и
ч
н
у
ю
а
п
и
к
а
л
ь
н
у
ю
г
и
п
е
р
т
р
о
ф
и
ю
(
н
а
п
р
и
м
е
р
,
н
е
к
о
м
п
р
е
с
с
и
о
н
н
а
я
к
а
р
д
и
о
м
и
о
п
а
-
т
и
я
,
ф
и
б
р
о
э
л
а
с
т
о
з
э
н
д
о
к
а
р
д
а
,
т
р
о
м
б
в
е
р
х
у
ш
к
и
,
о
п
у
х
о
л
ь
в
е
р
х
у
ш
к
и
)
Г
К
М
П
с
о
б
с
т
р
у
к
ц
и
е
й
с
р
е
д
н
е
г
о
о
т
д
е
л
а
ж
е
л
у
-
д
о
ч
к
а
В
с
т
р
е
ч
а
е
т
с
я
у
8
%
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
С
у
ж
е
н
и
е
с
р
е
д
н
е
г
о
о
т
д
е
л
а
ж
е
л
у
д
о
ч
к
а
и
з
-
з
а
с
б
л
и
ж
е
-
н
и
я
п
е
р
е
г
о
р
о
д
к
и
с
с
е
г
м
е
н
т
а
м
и
с
т
е
н
к
и
с
р
е
д
н
е
г
о
о
т
д
е
л
а
Л
Ж
Г
р
а
д
и
е
н
т
с
р
е
д
н
е
г
о
о
т
д
е
л
а
ж
е
л
у
д
о
ч
к
а
в
п
о
к
о
е
≥
3
0
м
м
р
т
.
с
т
.
,
б
е
з
S
A
M
-
с
и
н
д
р
о
м
а
З
н
а
ч
и
т
е
л
ь
н
а
я
д
о
л
я
о
б
с
т
р
у
к
ц
и
и
с
р
е
д
н
е
г
о
о
т
д
е
л
а
ж
е
л
у
д
о
ч
к
а
с
в
я
з
а
н
а
с
а
н
е
в
р
и
з
м
о
й
в
е
р
х
у
ш
к
и
Ц
в
е
т
о
в
о
й
д
о
п
п
л
е
р
м
о
ж
е
т
и
д
е
н
т
и
ф
и
ц
и
р
о
в
а
т
ь
н
а
л
и
ч
и
е
т
у
р
б
у
л
е
н
т
н
о
с
т
и
в
с
р
е
д
н
е
м
о
т
д
е
л
е
ж
е
л
у
д
о
ч
к
а
Г
К
М
П
с
н
а
р
у
ш
е
н
и
е
м
д
и
-
а
с
т
о
л
и
ч
е
с
к
о
г
о
н
а
п
о
л
-
н
е
н
и
я
и
п
о
в
ы
ш
е
н
и
е
м
д
а
в
л
е
н
и
я
н
а
п
о
л
н
е
н
и
я
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
Т
р
а
н
с
м
и
т
р
а
л
ь
н
ы
й
к
р
о
в
о
т
о
к
и
т
к
а
н
е
в
ы
е
д
о
п
п
л
е
-
р
о
в
с
к
и
е
п
о
к
а
з
а
т
е
л
и
д
е
м
о
н
с
т
р
и
р
у
ю
т
к
а
р
т
и
н
у
н
а
-
р
у
ш
е
н
и
я
р
е
л
а
к
с
а
ц
и
и
Л
Ж
↑
т
к
а
н
е
в
о
й
д
о
п
п
л
е
р
о
в
с
к
о
й
р
а
н
н
е
й
д
и
а
с
т
о
л
и
ч
е
с
к
о
й
с
к
о
р
о
с
т
и
(
e
′
)
у
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
Д
л
я
о
ц
е
н
к
и
н
а
р
у
ш
е
н
и
й
р
е
л
а
к
с
а
ц
и
и
и
д
а
в
л
е
н
и
я
н
а
п
о
л
н
е
н
и
я
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
м
о
г
у
т
б
ы
т
ь
п
о
л
у
ч
е
н
ы
д
в
а
п
о
к
а
з
а
т
е
л
я
р
е
л
а
к
с
а
ц
и
и
:
с
п
о
м
о
-
щ
ь
ю
т
к
а
н
е
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
e
′
и
с
п
о
м
о
щ
ь
ю
ц
в
е
т
о
в
о
г
о
М
-
р
е
ж
и
м
а
с
к
о
р
о
с
т
ь
р
а
с
п
р
о
с
т
р
а
н
е
н
и
я
к
р
о
в
о
т
о
к
а
(
V
P
)
Р
а
с
ш
и
р
е
н
и
е
п
о
л
о
с
т
и
Л
П
З
н
а
ч
и
т
е
л
ь
н
а
я
з
а
д
е
р
ж
к
а
р
а
с
к
р
у
ч
и
в
а
н
и
я
Л
Ж
П
е
р
е
д
н
е
з
а
д
н
и
й
д
и
а
м
е
т
р
и
о
б
ъ
е
м
Л
П
(
и
н
д
е
к
с
и
р
у
-
е
т
с
я
п
о
п
л
о
щ
а
д
и
п
о
в
е
р
х
н
о
с
т
и
т
е
л
а
)
↓
З
н
а
ч
е
н
и
е
п
р
о
д
о
л
ь
н
о
й
д
е
ф
о
р
м
а
ц
и
и
п
р
е
д
с
е
р
д
и
я
(
с
п
о
м
о
щ
ь
ю
2
D
-
с
п
е
к
л
-
т
р
е
к
и
н
г
Э
х
о
К
Г
)
у
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
О
ч
е
н
ь
х
о
р
о
ш
а
я
к
о
р
р
е
л
я
ц
и
я
м
е
ж
д
у
и
н
в
а
з
и
в
н
о
и
з
м
е
р
е
н
н
ы
м
д
а
в
л
е
н
и
е
м
p
r
e
A
Л
Ж
и
(
1
)
о
т
-
н
о
ш
е
н
и
е
м
с
к
о
р
о
с
т
и
т
р
а
н
с
м
и
т
р
а
л
ь
н
о
г
о
к
р
о
в
о
т
о
к
а
E
и
л
а
т
е
р
а
л
ь
н
о
й
e
′
(
E
/
e
′
)
и
(
2
)
о
т
н
о
ш
е
-
н
и
е
м
с
к
о
р
о
с
т
и
т
р
а
н
с
м
и
т
р
а
л
ь
н
о
г
о
к
р
о
в
о
т
о
к
а
E
к
с
к
о
р
о
с
т
и
р
а
с
п
р
о
с
т
р
а
н
е
н
и
я
к
р
о
в
о
т
о
к
а
(
E
/
V
P
)
—
к
о
р
р
е
л
я
ц
и
о
н
н
ы
е
к
о
э
ф
ф
и
ц
и
е
н
т
ы
0
,
7
6
и
0
,
6
7
с
о
о
т
в
е
т
с
т
в
е
н
н
о
И
с
с
л
е
д
о
в
а
н
и
е
п
о
с
р
а
в
н
е
н
и
ю
р
о
т
а
ц
и
о
н
н
о
й
м
е
х
а
н
и
к
и
и
о
ц
е
н
к
е
г
е
м
о
д
и
н
а
м
и
к
и
п
о
к
а
з
а
л
о
з
н
а
-
ч
и
т
е
л
ь
н
у
ю
к
о
р
р
е
л
я
ц
и
ю
м
е
ж
д
у
з
а
д
е
р
ж
к
о
й
р
а
с
к
р
у
ч
и
в
а
н
и
я
Л
Ж
и
д
а
в
л
е
н
и
е
м
н
а
п
о
л
н
е
н
и
я
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
Р
а
с
ш
и
р
е
н
и
е
Л
П
(
п
р
и
о
т
с
у
т
с
т
в
и
и
з
н
а
ч
и
т
е
л
ь
н
о
й
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
)
п
о
з
в
о
л
я
е
т
к
о
с
в
е
н
н
о
о
ц
е
н
и
т
ь
д
а
в
л
е
н
и
е
н
а
п
о
л
н
е
н
и
я
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
и
д
а
е
т
п
р
о
г
н
о
с
т
и
ч
е
с
к
у
ю
и
н
ф
о
р
м
а
ц
и
ю
о
п
о
с
л
е
д
у
ю
щ
е
м
р
и
с
к
е
ф
и
б
р
и
л
л
я
ц
и
и
п
р
е
д
с
е
р
д
и
й
и
р
и
с
к
е
с
м
е
р
т
н
о
с
т
и
Ф
у
н
к
ц
и
я
Л
П
м
о
ж
е
т
б
ы
т
ь
о
п
р
е
д
е
л
е
н
а
:
•
О
п
р
е
д
е
л
е
н
и
е
ф
а
з
о
в
ы
х
о
б
ъ
е
м
о
в
Л
П
в
р
а
з
л
и
ч
н
ы
х
ф
а
з
а
х
п
р
е
д
с
е
р
д
и
я
(
р
а
с
ч
е
т
у
д
а
р
н
о
г
о
о
б
ъ
-
е
м
а
и
ф
р
а
к
ц
и
и
в
ы
б
р
о
с
а
Л
П
)
•
2
D
-
в
и
з
у
а
л
и
з
а
ц
и
я
д
е
ф
о
р
м
а
ц
и
и
Л
П
(
п
р
я
м
а
я
о
ц
е
н
к
а
ф
у
н
к
ц
и
и
Л
П
)
Г
К
М
П
и
д
р
у
г
и
е
с
и
с
т
о
л
и
-
ч
е
с
к
и
е
н
а
р
у
ш
е
н
и
я
С
и
с
т
о
л
и
ч
е
с
к
а
я
д
и
с
ф
у
н
к
ц
и
я
Л
Ж
(
т
е
р
м
и
н
а
л
ь
н
а
я
с
т
а
д
и
я
/
п
о
з
д
н
я
я
с
т
а
д
и
я
Г
К
М
П
)
в
ы
я
в
л
я
е
т
с
я
у
2
–
5
%
п
а
ц
и
е
н
т
о
в
с
Г
К
М
П
А
н
е
в
р
и
з
м
ы
в
е
р
х
у
ш
к
и
о
п
р
е
д
е
л
я
ю
т
с
я
у
2
%
п
а
ц
и
е
н
-
т
о
в
с
Г
К
М
П
↓
П
р
о
д
о
л
ь
н
а
я
д
е
ф
о
р
м
а
ц
и
я
ж
е
л
у
д
о
ч
к
а
(
с
п
о
м
о
щ
ь
ю
с
п
е
к
л
-
т
р
е
к
и
н
г
Э
х
о
К
Г
)
у
п
а
ц
и
е
н
т
о
в
с
к
л
и
н
и
ч
е
с
к
и
в
ы
р
а
ж
е
н
н
о
й
Г
К
М
П
Э
х
о
К
Г
и
л
и
м
а
г
н
и
т
н
о
-
р
е
з
о
н
а
н
с
н
а
я
т
о
м
о
г
р
а
ф
и
я
м
о
г
у
т
в
ы
я
в
и
т
ь
н
а
л
и
ч
и
е
а
н
е
в
р
и
з
м
ы
в
е
р
-
х
у
ш
к
и
и
о
п
р
е
д
е
л
и
т
ь
е
е
р
а
з
м
е
р
Н
а
л
и
ч
и
е
а
н
е
в
р
и
з
м
ы
в
е
р
х
у
ш
к
и
и
е
е
р
а
з
м
е
р
у
в
е
л
и
ч
и
в
а
ю
т
р
и
с
к
н
е
б
л
а
г
о
п
р
и
я
т
н
ы
х
с
о
б
ы
т
и
й
,
о
б
у
с
л
о
в
л
е
н
н
ы
х
Г
К
М
П
С
п
е
к
л
-
т
р
е
к
и
н
г
Э
х
о
К
Г
п
о
з
в
о
л
я
е
т
д
и
ф
ф
е
р
е
н
ц
и
р
о
в
а
т
ь
р
а
з
л
и
ч
н
ы
е
т
и
п
ы
у
т
о
л
щ
е
н
и
я
с
т
е
н
к
и
Л
Ж
—
к
а
р
т
и
н
а
«
щ
а
ж
е
н
и
я
в
е
р
х
у
ш
к
и
»
(
н
а
п
р
и
м
е
р
,
с
о
х
р
а
н
е
н
и
е
п
р
о
д
о
л
ь
н
о
й
д
е
ф
о
р
м
а
ц
и
и
в
а
п
и
к
а
л
ь
н
ы
х
с
е
г
м
е
н
т
а
х
)
н
а
б
л
ю
д
а
е
т
с
я
п
р
и
а
м
и
л
о
и
д
о
з
е
с
е
р
д
ц
а
,
↓
п
р
о
д
о
л
ь
н
о
й
д
е
ф
о
р
м
а
ц
и
и
в
п
е
р
е
г
о
р
о
д
о
ч
н
ы
х
с
е
г
м
е
н
т
а
х
п
р
и
Г
К
М
П
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
п
р
о
д
о
л
ж
е
н
и
е
Г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
In-26_для нас.indd 670
03.04.2019 12:02:51
671
26 Гипертрофическая кардиомиопатия
К
л
и
н
и
ч
е
с
к
о
е
с
о
с
т
о
я
н
и
е
и
л
и
п
о
д
т
и
п
ы
Г
К
М
П
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
п
о
к
а
з
а
т
е
л
и
М
е
т
о
д
ы
в
и
з
у
а
л
и
з
а
ц
и
и
Г
К
М
П
п
о
с
л
е
х
и
р
у
р
г
и
ч
е
-
с
к
о
й
м
и
о
э
к
т
о
м
и
и
Р
е
з
е
ц
и
р
о
в
а
н
а
п
р
о
к
с
и
м
а
л
ь
н
а
я
ч
а
с
т
ь
о
с
н
о
в
а
н
и
я
п
е
-
р
е
г
о
р
о
д
к
и
Р
а
с
ш
и
р
е
н
в
ы
н
о
с
я
щ
и
й
т
р
а
к
т
Л
Ж
У
с
т
р
а
н
е
н
ы
S
A
M
-
с
и
н
д
р
о
м
и
о
б
у
с
л
о
в
л
е
н
н
а
я
и
м
м
и
-
т
р
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
,
н
а
п
р
а
в
л
е
н
н
а
я
к
з
а
д
и
Л
а
м
и
н
а
р
н
ы
й
к
р
о
в
о
т
о
к
в
в
ы
н
о
с
я
щ
е
м
т
р
а
к
т
е
У
с
т
р
а
н
е
н
г
р
а
д
и
е
н
т
В
Т
Л
Ж
У
л
у
ч
ш
е
н
ы
п
о
к
а
з
а
т
е
л
и
р
а
с
ш
и
р
е
н
и
я
Л
П
и
д
и
а
с
т
о
л
и
-
ч
е
с
к
о
г
о
н
а
п
о
л
н
е
н
и
я
В
о
з
м
о
ж
н
ы
е
о
с
л
о
ж
н
е
н
и
я
в
к
л
ю
ч
а
ю
т
я
т
р
о
г
е
н
н
ы
й
д
е
ф
е
к
т
Д
М
Ж
П
,
а
о
р
т
а
л
ь
н
у
ю
р
е
г
у
р
г
и
т
а
ц
и
ю
(
с
л
а
б
о
в
ы
р
а
ж
е
н
н
а
я
у
ч
е
т
в
е
р
т
и
п
а
ц
и
е
н
т
о
в
)
и
к
р
о
в
о
т
е
ч
е
-
н
и
е
и
з
с
е
п
т
а
л
ь
н
ы
х
а
р
т
е
р
и
й
И
н
т
р
а
о
п
е
р
а
ц
и
о
н
н
а
я
Ч
П
Э
х
о
К
Г
п
о
з
в
о
л
я
е
т
п
р
о
в
е
с
т
и
н
е
м
е
д
л
е
н
н
у
ю
о
ц
е
н
к
у
а
д
е
к
в
а
т
н
о
с
т
и
с
у
б
а
о
р
т
а
л
ь
н
о
й
р
е
з
е
к
ц
и
и
м
ы
ш
ц
—
с
т
е
п
е
н
и
о
с
т
а
т
о
ч
н
о
й
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
,
м
и
т
р
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
,
о
б
у
с
л
о
в
л
е
н
н
о
й
S
A
M
-
с
и
н
д
р
о
м
о
м
И
с
п
о
л
ь
з
у
й
т
е
т
р
а
н
с
т
о
р
а
к
а
л
ь
н
у
ю
Э
х
о
К
Г
д
л
я
п
о
с
л
е
д
о
в
а
т
е
л
ь
н
о
г
о
п
о
с
л
е
о
п
е
р
а
ц
и
о
н
н
о
г
о
н
а
-
б
л
ю
д
е
н
и
я
Г
К
М
П
п
о
с
л
е
а
б
л
а
ц
и
и
э
т
а
н
о
л
о
м
М
Ж
П
Х
а
р
а
к
т
е
р
н
ы
й
т
р
е
х
ф
а
з
н
ы
й
г
е
м
о
д
и
н
а
м
и
ч
е
с
к
и
й
о
т
-
в
е
т
п
о
с
л
е
и
н
ъ
е
к
ц
и
и
э
т
а
н
о
л
а
:
•
Н
е
м
е
д
л
е
н
н
о
е
с
н
и
ж
е
н
и
е
г
р
а
д
и
е
н
т
а
В
Т
Л
Ж
(
в
л
а
б
о
-
р
а
т
о
р
и
и
к
а
т
е
т
е
р
и
з
а
ц
и
и
с
е
р
д
ц
а
)
•
Р
а
н
н
е
е
п
о
в
ы
ш
е
н
и
е
у
р
о
в
н
я
г
р
а
д
и
е
н
т
а
В
Т
Л
Ж
(
ч
е
-
р
е
з
н
е
с
к
о
л
ь
к
о
д
н
е
й
п
о
с
л
е
п
р
о
ц
е
д
у
р
ы
)
•
С
н
и
ж
е
н
и
е
п
о
к
а
з
а
т
е
л
е
й
о
б
с
т
р
у
к
ц
и
и
В
Т
Л
Ж
н
а
п
р
о
т
я
ж
е
н
и
и
3
-
м
е
с
я
ч
н
о
г
о
п
о
с
л
е
д
у
ю
щ
е
г
о
н
а
б
л
ю
-
д
е
н
и
я
П
р
о
г
р
е
с
с
и
в
н
о
е
и
с
т
о
н
ч
е
н
и
е
о
с
н
о
в
а
н
и
я
М
Ж
П
и
р
а
с
-
ш
и
р
е
н
и
е
в
ы
н
о
с
я
щ
е
г
о
т
р
а
к
т
а
↓
(
п
о
с
т
е
п
е
н
н
о
е
)
з
н
а
ч
е
н
и
я
п
р
о
в
о
к
а
ц
и
о
н
н
о
г
о
г
р
а
д
и
-
е
н
т
а
В
Т
Л
Ж
и
г
р
а
д
и
е
н
т
а
В
Т
Л
Ж
в
п
о
к
о
е
Э
х
о
-
к
о
н
т
р
о
л
ь
с
к
о
н
т
р
а
с
т
и
р
о
в
а
н
и
е
м
о
б
л
а
с
т
и
к
р
о
в
о
с
н
а
б
ж
е
н
и
я
(
о
б
е
с
п
е
ч
и
в
а
е
м
о
г
о
в
е
т
в
ь
ю
ц
е
л
е
в
о
й
с
е
п
т
а
л
ь
н
о
й
а
р
т
е
р
и
и
)
м
о
ж
е
т
с
п
о
с
о
б
с
т
в
о
в
а
т
ь
ц
е
л
е
н
а
п
р
а
в
л
е
н
н
о
й
д
о
с
т
а
в
к
е
э
т
а
н
о
л
а
,
о
г
р
а
н
и
ч
и
в
а
я
и
н
д
у
ц
и
р
о
в
а
н
н
ы
й
и
н
ф
а
р
к
т
о
б
л
а
с
т
ь
ю
к
о
н
т
а
к
т
а
м
и
т
р
а
л
ь
н
ы
м
с
т
в
о
р
к
и
и
п
е
р
е
-
г
о
р
о
д
к
и
и
и
з
б
е
г
а
я
р
а
с
п
р
о
с
т
р
а
н
е
н
и
я
н
а
у
ч
а
с
т
к
и
в
н
е
п
е
р
е
г
о
р
о
д
к
и
В
Т
Л
Ж
—
в
ы
х
о
д
н
о
й
т
р
а
к
т
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
;
Г
К
М
П
—
г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
;
М
Ж
П
—
м
е
ж
ж
е
л
у
д
о
ч
к
о
в
а
я
п
е
р
е
г
о
р
о
д
к
а
;
Ч
П
Э
х
о
К
Г
—
ч
р
е
с
п
и
щ
е
в
о
д
н
а
я
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
я
;
Э
х
о
К
Г
—
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
я
.
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
о
к
о
н
ч
а
н
и
е
Г
и
п
е
р
т
р
о
ф
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
In-26_для нас.indd 671
03.04.2019 12:02:51
672
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ЛИТЕРАТУРА
1. Gersh BJ, Maron BJ, Bonow RO, et al. 2011
ACCF/AHA Guideline for the Diagnosis and
Treatment of Hypertrophic Cardiomyopa-
thy: a report of the American College of Car-
diology Foundation/American Heart Associ-
ation Task Force on Practice Guidelines. De-
veloped in collaboration with the American
Association for Thoracic Surgery, American
Society of Echocardiography, American Soci-
ety of Nuclear Cardiology, Heart Failure So-
ciety of America, Heart Rhythm Society,
Society for Cardiovascular Angiography and
Interventions, and Society of Thoracic Sur-
geons, J Am Coll Cardiol 58:e212–e260, 2011.
2. Maron BJ, Gardin JM, Flack JM, et al. Preva-
lence of hypertrophic cardiomyopathy in a
general population of young adults: echocar-
diographic analysis of 4111 subjects in the
CARDIA study, Circulation 92:785–789,
1995.
3. Nagueh SF, Bierig SM, Budoff MJ, et al.
American Society of Echocardiography clini-
cal recommendations for multimodality car-
diovascular imaging of patients with hyper-
trophic cardiomyopathy: endorsed by the
American Society of Nuclear Cardiology,
Society for Cardiovascular Magnetic Reso-
nance, and Society of Cardiovascular Com-
puted Tomography, J Am Soc Echocardiogr
24:473–498, 2011.
4. Maron BJ, Maron MS, Semsarian C. Genetics
of hypertrophic cardiomyopathy 20 years af-
ter: clinical perspectives, J Am Coll Cardiol
60:705–715, 2012.
5. Binder J, Ommen SR, Gersh BJ, et al. Echocar-
diography-guided genetic testing in hypertro-
phic cardiomyopathy: septal morphological
features predict the presence of myofilament
mutations, Mayo Clin Proc 81:459–467, 2006.
6. Niimura H, Bachinski LL, Sangwatanaroj S, et
al. Mutations in the gene for cardiac myosin-
binding protein C and late-onset familial hy-
pertrophic cardiomyopathy, N Engl J Med
338:1248–1257, 1998.
7. Van Driest SL, Jaeger MA, Ommen SR, et al.
Comprehensive analysis of the beta-myosin
heavy chain gene in 389 unrelated patients
with hypertrophic cardiomyopathy, J Am
Coll Cardiol 44:602–610, 2004.
8. Solomon SD, Wolff S, Watkins H, et al. Left
ventricular hypertrophy and morphology in
familial hypertrophic cardiomyopathy asso-
ciated with mutations of the beta-myosin
heavy chain gene, J Am Coll Cardiol 22:498–
505, 1993.
9. Woo A, Rakowski H, Liew JC, et al. Muta-
tions of the beta myosin heavy chain gene in
hypertrophic cardiomyopathy: critical func-
tional sites determine prognosis, Heart
89:1179–1185, 2003.
10. Van Driest SL, Vasile VC, Ommen SR, et al.
Myosin binding protein C mutations and
compound heterozygosity in hypertrophic
cardiomyopathy, J Am Coll Cardiol 44:1903–
1910, 2004.
11. Popp RL, Harrison DC. Ultrasound in the
diagnosis and evaluation of therapy of idio-
pathic hypertrophic subaortic stenosis, Circu-
lation 40:905–914, 1969.
12. Shah PM, Gramiak R, Kramer DH. Ultra-
sound location of left ventricular outflow
obstruction in hypertrophic obstructive car-
diomyopathy, Circulation 40:3–11, 1969.
13. Henry WL, Clark CE, Epstein SE. Asymmet-
ric septal hypertrophy: echocardiographic
identification of the pathognomonic ana-
tomic abnormality of IHSS, Circulation
47:225–233, 1973.
14. Luckie M, Khattar RS. Systolic anterior mo-
tion of the mitral valve - beyond hypertrophic
cardiomyopathy, Heart 94:1383–1385, 2008.
15. Humez FU, Houston AB, Watson J, et al. Age
and body surface area related normal upper
and lower limits of M-mode echocardio-
graphic measurements and left ventricular
volume and mass from infancy to early adult-
hood, Br Heart J 72:276–280, 1994.
16. Valente AM, Lakdawala NK, Powell AJ, et al.
Comparison of echocardiographic and car-
diac magnetic resonance imaging in hypertro-
phic cardiomyopathy sarcomere mutation
carriers without left ventricular hypertrophy,
Circ Cardiovasc Genet 6:230–237, 2013.
17. Nagueh SF, Bachinski LL, Meyer D, et al. Tis-
sue Doppler imaging consistently detects
myocardial abnormalities in patients with
hypertrophic cardiomyopathy and provides a
novel means for an early diagnosis before and
independently of hypertrophy, Circulation
104:128–130, 2001.
18. Nagueh SF, McFalls J, Meyer D, et al. Assess-
ment of diastolic function with Doppler tis-
sue imaging to predict genotype in preclinical
hypertrophic cardiomyopathy, Circulation
108:395–398, 2003.
19. Ho CY, Sweitzer NK, McDonough B, et al.
Tissue Doppler imaging predicts the develop-
ment of hypertrophic cardiomyopathy in
subjects with subclinical disease, Circulation
105:2992–2997, 2002.
20. Gandjbakhch E, Gackowski A, Tezenas du
Montcel S, et al. Early identification of muta-
tion carriers in familial hypertrophic cardio-
myopathy by combined echocardiography
and tissue Doppler imaging, Eur Heart J
31:1599–1607, 2010.
21. Prasad K, Atherton J, Smith GC, et al. Echo-
cardiographic pitfalls in the diagnosis of hy-
pertrophic cardiomyopathy, Heart 82(Suppl
3):III8–III15, 1999.
22. Riggs T, Hirschfeld S, Rajai H: The pediatric
spectrum of dynamic left ventricular ob-
struction, Am Heart J 99:301–309, 1980.
23. Santos AD, Miller RP, Mathew PK, et al.
Echocardiographic characterization of the re-
versible cardiomyopathy of hypothyroidism,
Am J Med 68:675–682, 1980.
24. Yilmaz A, Sechtem U. Diagnostic approach
and differential diagnosis in patients with hy-
pertrophied left ventricles, Heart 100:662–
671, 2014.
25. Nakao S, Takenaka T, Maeda M, et al. An
atypical variant of Fabry’s disease in men
with left ventricular hypertrophy, N Engl J
Med 333:288–293, 1995.
26. Sachdev B, Takenaka T, Teraguchi H, et al.
Prevalence of Anderson-Fabry disease in male
patients with late onset hypertrophic cardio-
myopathy, Circulation 105:1407–1411, 2002.
27. Morita H, Larson MG, Barr SC, et al. Single-
gene mutations and increased left ventricular
wall thickness in the community: the Fram-
ingham Heart Study, Circulation 113:2697–
2705, 2006.
28. Arad M, Maron BJ, Gorham JM, et al. Glyco-
gen storage diseases presenting as hypertro-
phic cardiomyopathy, N Engl J Med 352:362–
372, 2005.
29. Pelliccia A, Maron BJ, Spataro A, et al. The
upper limit of physiological cardiac hypertro-
phy in highly trained elite athletes, N Engl J
Med 324:295–301, 1991.
30. Pelliccia A, Maron BJ, Culasso F, et al. Ath-
lete’s heart in women, JAMA 276:211–215,
1996.
31. Maron BJ, Maron MS. Hypertrophic cardio-
myopathy, Lancet 381:242–255, 2013.
32. Dalldorf FG, Willis PW. Angled aorta (“sig-
moid septum”) as a cause of hypertrophic
stenosis, Hum Pathol 16:457–462, 1985.
33. Krasnow N. Subaortic septal bulge simulates
hypertrophic cardiomyopathy by angulation
of the septum with age, independent of focal
hypertrophy: an echocardiographic study, J
Am Soc Echocardiogr 10:545–555, 1997.
34. Maron BJ, Gottdiener JS, Epstein SE. Patterns
and significance of distribution of left ven-
tricular hypertrophy in hypertrophic cardio-
myopathy, Am J Cardiol 48:418–428, 1981.
35. Wigle ED, Sasson Z, Henderson M, et al. Hy-
pertrophic cardiomyopathy. The importance
of the site and extent of hypertrophy. A re-
view, Prog Cardiovasc Dis 28:1–83, 1985.
36. Klues HG, Schiffers A, Maron BJ. Pheno-
typic spectrum and patterns of left ventricu-
lar hypertrophy in hypertrophic cardiomy-
opathy: morphologic observations and sig-
nificance as assessed by two dimensional
echocardiography in 600 patients, J Am Coll
Cardiol 26:1699–1708, 1995.
37. Mulvagh S, Rakowski H, Vannan MA, et al.
American Society of Echocardiography con-
sensus statement on the clinical applications
of ultrasonic contrast agents in echocardiog-
raphy, J Am Soc Echocardiogr 21:1179–1201,
2008.
38. Boughner D, Schuld RL, Persaud JA: Hyper-
trophic obstructive cardiomyopathy: assess-
ment by echocardiographic and Doppler ul-
trasound techniques, Br Heart J 37:917–923,
1975.
39. Spirito P, Maron BJ. Significance of left ven-
tricular outflow tract cross-sectional area in
hypertrophic cardiomyopathy: a two-dimen-
sional echocardiographic assessment, Circula-
tion 67:1100–1108, 1983.
40. Shah PM, Taylor RD, Wong M. Abnormal
mitral valve coaptation in hypertrophic ob-
structive cardiomyopathy: proposed role in
systolic anterior motion of the mitral valve,
Am J Cardiol 48:258–262, 1981.
41. Jiang L, Levine RA, King ME, Weyman AE.
An integrated mechanism for systolic anteri-
or motion of the mitral valve in hypertrophic
cardiomyopathy based on echocardiographic
observations, Am Heart J 113:633–644, 1987.
42. Woo A, Jedrzkiewicz S. The mitral valve in
hypertrophic cardiomyopathy: it’s a long
story, Circulation 124:9–12, 2011.
43. Klues HG, Roberts WC, Maron BJ. Morpho-
logic determinants of echocardiographic pat-
terns of mitral valve systolic anterior motion
in obstructive hypertrophic cardiomyopathy,
Circulation 87:1570–1579, 1993.
44. Sherrid MV, Chu CK, Delia E, et al. An echo-
cardiographic study of the fluid mechanics of
obstruction in hypertrophic cardiomyopathy,
J Am Coll Cardiol 22:816–825, 1993.
45. Pollick C, Morgan CD, Gilbert BW, et al.
Muscular subaortic stenosis: the temporal re-
lationship between systolic anterior motion
of the anterior mitral leaflet and the pressure
gradient, Circulation 66:1087–1094, 1982.
46. Gilbert BW, Pollick C, Adelman AG, Wigle
ED. Hypertrophic cardiomyopathy: subclas-
sification by M-mode echocardiography, Am
J Cardiol 45:861–872, 1980.
47. Panza JA, Petrone RK, Fananapazir L, Maron
BJ. Utility of continuous wave Doppler echo-
In-26_для нас.indd 672
03.04.2019 12:02:51
673
26 Гипертрофическая кардиомиопатия
cardiography in the noninvasive assessment
of left ventricular outflow tract pressure gra-
dient in patients with hypertrophic cardiomy-
opathy, J Am Coll Cardiol 19:91–99, 1992.
48. Sasson Z, Yock PG, Hatle LK, et al. Doppler
echocardiographic determination of the pres-
sure gradient in hypertrophic cardiomyopa-
thy, J Am Coll Cardiol 11:752–756, 1988.
49. Grigg LE, Wigle ED, Williams WG, et al.
Transesophageal Doppler echocardiography
in obstructive hypertrophic cardiomyopathy:
clarification of pathophysiology and impor-
tance in intraoperative decision making, J Am
Coll Cardiol 20:42–52, 1992.
50. Yu EH, Omran AS, Wigle ED, et al. Mitral
regurgitation in hypertrophic obstructive car-
diomyopathy: relationship to obstruction and
relief with myectomy, J Am Coll Cardiol
36:2219–2225, 2000.
51. Schwammenthal E, Nakatani S, He S, et al.
Mechanism of mitral regurgitation in hyper-
trophic cardiomyopathy: mismatch of poste-
rior to anterior leaflet length and mobility,
Circulation 98:856–865, 1998.
52. Chun S, Woo A. Echocardiography in hyper-
trophic cardiomyopathy: in with strain, out
with straining? J Am Soc Echocardiogr
28:204–209, 2015.
53. Maron MS, Olivotto I, Zenovich AG, et al. Hy-
pertrophic cardiomyopathy is predominantly
a disease of left ventricular outflow tract ob-
struction, Circulation 114:2232–2239, 2006.
54. Drinko JK, Nash PJ, Lever HM, Asher CR.
Safety of stress testing in patients with hyper-
trophic cardiomyopathy, Am J Cardiol
93:1443–1444, 2004.
55. Desai MY, Bhonsale A, Patel P, et al. Exercise
echocardiography in asymptomatic HCM:
exercise capacity, and not LV outflow tract
gradient predicts long-term outcomes, JACC
Cardiovasc Imaging 7:26–36, 2014.
56. Marwick TH, Nakatani S, Haluska B, et al.
Provocation of latent left ventricular outflow
tract gradients with amyl nitrite and exercise
in hypertrophic cardiomyopathy, Am J Car-
diol 75:805–809, 1995.
57. Joshi S, Patel UK, Yao SS, et al. Standing and
exercise Doppler echocardiography in ob-
structive hypertrophic cardiomyopathy: the
range of gradients with upright activity, J Am
Soc Echocardiogr 24:75–82, 2011.
58. Zemanek D, Tomasov P, Homolova S, et al.
Sublingual isosorbide dinitrate for the detec-
tion of obstruction in hypertrophic cardiomy-
opathy, Eur J Echocardiogr 12:684–687, 2011.
59. Schwammenthal E, Schwartzkopff B, Block
M, et al. Doppler echocardiographic assess-
ment of the pressure gradient during bicycle
ergometry in hypertrophic cardiomyopathy,
Am J Cardiol 69:1623–1628, 1992.
60. Shah JS, Esteban MT, Thaman R, et al. Preva-
lence of exercise-induced left ventricular out-
flow tract obstruction in symptomatic pa-
tients with non-obstructive hypertrophic
cardiomyopathy, Heart 94:1288–1294, 2008.
61. Nistri S, Olivotto I, Maron MS, et al. Timing
and significance of exercise-induced left ven-
tricular outflow tract pressure gradients in
hypertrophic cardiomyopathy, Am J Cardiol
106:1301–1306, 2010.
62. Klues HG, Leuner C, Kuhn H. Left ventricu-
lar outflow tract obstruction in patients with
hypertrophic cardiomyopathy: increase in
gradient after exercise, J Am Coll Cardiol
19:527–533, 1992.
63. Reant P, Reynaud A, Pillois X, et al. Com-
parison of resting and exercise echocardio-
graphic parameters as indicators of outcomes
in hypertrophic cardiomyopathy, J Am Soc
Echocardiogr 28:194–203, 2015.
64. Miranda R, Cotrim C, Cardim N, et al. Evalu-
ation of left ventricular outflow tract gradient
during treadmill exercise and in recovery pe-
riod in orthostatic position, in patients with
hypertrophic cardiomyopathy, Cardiovasc
Ultrasound 6:19, 2008.
65. Dimitrow PP, Bober M, Michalowska J, So-
rysz D. Left ventricular outflow tract gradient
provoked by upright position or exercise in
treated patients with hypertrophic cardiomy-
opathy without obstruction at rest, Echocar-
diography 26:513–520, 2009.
66. Luria D, Klutstein MW, Rosenmann D, et al.
Prevalence and significance of left ventricular
outflow tract gradient during dobutamine
echocardiography, Eur Heart J 20:386–392,
1999.
67. Sakamoto T, Tei C, Murayama M, et al. Giant
T wave inversion as a manifestation of asym-
metrical apical hypertrophy (AAH) of the left
ventricle. Echocardiographic and ultrasono-
cardiotomographic study, Jpn Heart J
17:611–629, 1976.
68. Eriksson MJ, Sonnenberg B, Woo A, et al.
Long-term outcome in patients with apical
hypertrophic cardiomyopathy, J Am Coll
Cardiol 39:638–645, 2002.
69. Binder J, Attenhofer Jost CH, Klarich KW, et
al. Apical hypertrophic cardiomyopathy:
prevalence and correlates of apical outpouch-
ing, J Am Soc Echocardiogr 24:775–781, 2011.
70. Minami Y, Kajimoto K, Terajima Y, et al.
Clinical implications of midventricular ob-
struction in patients with hypertrophic car-
diomyopathy, J Am Coll Cardiol 57:2346–
2355, 2011.
71. Maron MS, Finley JJ, Bos JM, et al. Preva-
lence, clinical significance, and natural his-
tory of left ventricular apical aneurysms in
hypertrophic cardiomyopathy, Circulation
118:1541–1549, 2008.
72. Lever HM, Karam RF, Currie PJ, Healy BP.
Hypertrophic cardiomyopathy in the elderly.
Distinctions from the young based on cardiac
shape, Circulation 79:580–589, 1989.
73. Nagueh SF, Lakkis NM, Middleton KJ, et al.
Doppler estimation of left ventricular filling
pressures in patients with hypertrophic car-
diomyopathy, Circulation 99:254–261, 1999.
74. Geske JB, Sorajja P, Nishimura RA, Ommen
SR. Evaluation of left ventricular filling pres-
sures by Doppler echocardiography in pa-
tients with hypertrophic cardiomyopathy:
correlation with direct left atrial pressure
measurement at cardiac catheterization, Cir-
culation 116:2702–2708, 2007.
75. Matsumura Y, Elliott PM, Virdee MS, et al.
Left ventricular diastolic function assessed
using Doppler tissue imaging in patients with
hypertrophic cardiomyopathy: relation to
symptoms and exercise capacity, Heart
87:247–251, 2002.
76. Sasson Z, Hatle L, Appleton CP, et al. Intra-
ventricular flow during isovolumic relax-
ation: description and characterization by
Doppler echocardiography, J Am Coll Car-
diol 10:539–546, 1987.
77. Nakamura T, Matsubara K, Furukawa K, et al.
Diastolic paradoxic jet flow in patients with
hypertrophic cardiomyopathy: evidence of
concealed apical asynergy with cavity oblitera-
tion, J Am Coll Cardiol 19:516–524, 1992.
78. Olivotto I, Cecchi F, Casey SA, et al. Impact
of atrial fibrillation on the clinical course of
hypertrophic cardiomyopathy, Circulation
104:2517–2524, 2001.
79. Yang H, Woo A, Monakier D, et al. Enlarged
left atrial volume in hypertrophic cardiomy-
opathy: a marker for disease severity, J Am
Soc Echocardiogr 18:1074–1082, 2005.
80. Paraskevaidis IA, Panou F, Papadopoulos C,
et al. Evaluation of left atrial longitudinal
function in patients with hypertrophic car-
diomyopathy: a tissue Doppler imaging and
two-dimensional strain study, Heart 95:483–
489, 2009.
81. Serri K, Reant P, Lafitte M, et al. Global and
regional myocardial function quantification
by two-dimensional strain: application in hy-
pertrophic cardiomyopathy, J Am Coll Car-
diol 47:1175–1181, 2006.
82. Carasso S, Yang H, Woo A, et al. Systolic
myocardial mechanics in hypertrophic car-
diomyopathy: novel concepts and implica-
tions for clinical status, J Am Soc Echocar-
diogr 21:675–683, 2008.
83. Geyer H, Caracciolo G, Abe H, et al. Assess-
ment of myocardial mechanics using speckle
tracking echocardiography: fundamentals
and clinical applications, J Am Soc Echocar-
diogr 23:351–369, 2010.
84. Ho CY, Carlsen C, Thune JJ, et al. Echocar-
diographic strain imaging to assess early and
late consequences of sarcomere mutations in
hypertrophic cardiomyopathy, Circ Cardio-
vasc Genet 2:314–321, 2009.
85. Phelan D, Collier P, Thavendiranathan P, et
al. Relative apical sparing of longitudinal
strain using two-dimensional speckle-track-
ing echocardiography is both sensitive and
specific for the diagnosis of cardiac amyloi-
dosis, Heart 98:1442–1448, 2012.
86. Wang J, Buergler JM, Veerasamy K, et al. De-
layed untwisting: the mechanistic link be-
tween dynamic obstruction and exercise tol-
erance in patients with hypertrophic obstruc-
tive cardiomyopathy, J Am Coll Cardiol
54:1326–1334, 2009.
87. Kim DH, Handschumacher MD, Levine RA,
et al. In vivo measurement of mitral leaflet
surface area and subvalvular geometry in pa-
tients with asymmetrical septal hypertrophy:
insights into the mechanism of outflow tract
obstruction, Circulation 122:1298–1307, 2010.
88. Hwang HJ, Choi EY, Kwan J, et al. Dynamic
change of mitral apparatus as potential cause
of left ventricular outflow tract obstruction
in hypertrophic cardiomyopathy, Eur J Echo-
cardiogr 12:19–25, 2011.
89. McCully RB, Nishimura RA, Bailey KR, et al.
Hypertrophic obstructive cardiomyopathy:
preoperative echocardiographic predictors of
outcome after septal myectomy, J Am Coll
Cardiol 27:1491–1496, 1996.
90. Ommen S, Park SH, Click RL, et al. Impact
of intraoperative transesophageal echocar-
diography in the surgical management of
hypertrophic cardiomyopathy, Am J Cardiol
90:1022–1024, 2002.
91. Woo A, Williams WG, Choi R, et al. Clinical
and echocardiographic determinants of long-
term survival after surgical myectomy in ob-
structive hypertrophic cardiomyopathy, Cir-
culation 111:2033–2041, 2005.
92. Awasthi A, Wormer D, Heggunje PS, Obeid
A. Long-term follow-up of acquired coro-
nary artery fistula after septal myectomy for
hypertrophic cardiomyopathy, J Am Soc
Echocardiogr 15:1104–1107, 2002.
93. Ball W, Ivanov J, Rakowski H, et al. Long-
term survival in patients with resting obstruc-
In-26_для нас.indd 673
03.04.2019 12:02:51
674
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
tive hypertrophic cardiomyopathy: compari-
son of conservative versus invasive treatment,
J Am Coll Cardiol 58:2313–2321, 2011.
94. Faber L, Seggewiss H, Gleichmann U. Percu-
taneous transluminal septal myocardial abla-
tion in hypertrophic obstructive cardiomy-
opathy: results with respect to intraproce-
dural myocardial contrast echocardiography,
Circulation 98:2415–2421, 1998.
95. Nagueh SF, Lakkis NM, He ZX, et al. Role of
myocardial contrast echocardiography during
nonsurgical septal reduction therapy for hy-
pertrophic obstructive cardiomyopathy, J Am
Coll Cardiol 32:225–229, 1998.
96. Faber L, Ziemssen P, Seggewiss H. Targeting
percutaneous transluminal septal ablation for
hypertrophic obstructive cardiomyopathy by
intraprocedural echocardiographic monitoring,
J Am Soc Echocardiogr 13:1074–1079, 2000.
97. Monakier D, Woo A, Puri T, et al. Usefulness
of myocardial contrast echocardiographic
quantification of risk area for predicting
postprocedural complications in patients un-
dergoing septal ethanol ablation for obstruc-
tive hypertrophic cardiomyopathy, Am J Car-
diol 94:1515–1522, 2004.
98. Yoerger DM, Picard MH, Palacios IF, et al.
Time course of pressure gradient response
after first alcohol septal ablation for obstruc-
tive hypertrophic cardiomyopathy, Am J Car-
diol 97:1511–1514, 2006.
99. Mazur W, Nagueh SF, Lakkis NM, et al. Re-
gression of left ventricular hypertrophy after
nonsurgical septal reduction therapy for hy-
pertrophic obstructive cardiomyopathy, Cir-
culation 103:1492–1496, 2001.
100. Alam M, Dokainish H, Lakkis NM. Hypertro-
phic obstructive cardiomyopathy—alcohol
septal ablation vs. myectomy: a meta-analy-
sis, Eur Heart J 30:1080–1087, 2009.
101. Agarwal S, Tuzcu EM, Desai MY, et al. Up-
dated meta-analysis of septal alcohol ablation
versus myectomy for hypertrophic cardio-
myopathy, J Am Coll Cardiol 55:823–834,
2010.
102. Sorajja P, Binder J, Nishimura RA, et al. Pre-
dictors of an optimal clinical outcome with
alcohol septal ablation for obstructive hyper-
trophic cardiomyopathy, Catheter Cardiovasc
Interv 81:E58–E67, 2013.
103. Spirito P, Bellone P, Harris KM, et al. Magni-
tude of left ventricular hypertrophy and risk
of sudden death in hypertrophic cardiomy-
opathy, N Engl J Med 342:1778–1785, 2000.
104. Elliott PM, Gimeno Jr. B, Mahon NG, et al.
Relation between severity of left-ventricular
hypertrophy and prognosis in patients with
hypertrophic cardiomyopathy, Lancet
357:420–424, 2001.
105. Maron MS, Olivotto I, Betocchi S, et al. Effect
of left ventricular outflow tract obstruction
on clinical outcome in hypertrophic cardio-
myopathy, N Engl J Med 348:295–303, 2003.
106. Sorajja P, Nishimura RA, Gersh BJ, et al. Out-
come of mildly symptomatic or asymptom-
atic obstructive hypertrophic cardiomyopa-
thy, J Am Coll Cardiol 54:234–241, 2009.
107. Nistri S, Olivotto I, Betocchi S, et al. Prognos-
tic significance of left atrial size in patients
with hypertrophic cardiomyopathy (from the
Italian registry for hypertrophic cardiomy-
opathy), Am J Cardiol 98:960–965, 2006.
In-26_для нас.indd 674
03.04.2019 12:02:51
675
ОПРЕДЕЛЕНИЕ И ПАТОФИЗИОЛОГИЯ
Рестриктивные кардиомиопатии представляют со-
бой гетерогенную группу патологических измене-
ний сердечной мышцы, которые на поздних стади-
ях характеризуется выраженным увеличением ри-
гидности миокарда ЛЖ. Это приводит к повышению
давления наполнения ЛЖ, расширению ЛП и, в
конечном итоге, к венозному застою в малом круге
кровообращения, вторичной легочной гипертензии
и, часто, к снижению сердечного выброса. Ригид-
ность миокарда может быть обусловлена различны-
ми процессами: увеличением объема интерстици-
альной ткани в миокарде или эндокардиальным
фиброэластозом, повреждением белков саркомера,
таких как титин, и инфильтрацией или накоплени-
ем продуктов при системных заболеваниях (напри-
мер, избыточное сывороточное железо и амилоид-
ные белки) или при болезнях накопления (липиды
и гликоген). Классификация рестриктивных карди-
омиопатий представлена в табл.27 .1 . Наиболее рас-
пространенным инфильтративным поражением
миокарда в развитых странах мира является амило-
идоз сердца.
Почти при всех рестриктивных кардиомиопати-
ях наблюдается прогрессирующее нарушение диа-
столической функции сердца, хорошо описанное и
легко определяемое с помощью диастолических
показателей допплерографии. На ранних стадиях
заболевания отмечается нормальный размер ЛЖ и
сохраненная фракция выброса со слабо выражен-
ными нарушениями диастолической функции, а
именно нарушением релаксации ЛЖ. При прогрес-
сировании заболевания фракция выброса ЛЖ
обычно остается в пределах нормы, но снижается
податливость миокарда, что сопровождается повы-
шением давления наполнения ЛЖ и ЛП и приводит
к расширению предсердий. Увеличение давления в
ЛП «нормализует» раннее диастолическое наполне-
ние за счет застоя в легочных венах. Гипертрофия
ЛП становится важным компенсаторным механиз-
мом сохранения нормального конечно-диастоличе-
ского объема ЛЖ и сердечного выброса. На поздних
стадиях заболевания отмечается «рестриктивная
физиология» с падением и участками плато типич-
ной гемодинамической волны. На этой стадии нуж-
но очень высокое давление наполнения для чрезвы-
чайно неподатливого ЛЖ, при этом высокоскорост-
ное раннее диастолическое наполнение резко пре-
кращается из-за быстрого повышения давления в
ЛЖ. Из-за систолической недостаточности ЛП зна-
чительно уменьшается наполнение во время его
сокращения. Обычно наблюдаются симптомы сер-
дечной недостаточности и функционального огра-
ничения вследствие застоя в легочных венах и, во
многих случаях, снижения ударного объема и сер-
дечного выброса. На этой стадии размер ЛЖ и
фракция выброса зависят от причины заболевания,
причем, как правило, степень выраженности диа-
столических нарушений превышает систолическую
дисфункцию. Диастолическая рестриктивная физи-
ология характеризуется импульсно-волновым доп-
плеровским соотношением трансмитрального кро-
вотока E/A > 2,5, временем замедления трансми-
трального кровотока < 150 мсек, временем
замедления диастолической волны в легочной вене
< 160 мсек, временем изоволюмической релаксации
27 Рестриктивная кардиомиопатия
TASNEEM Z. NAQVI, MD, MMM • CHRISTOPHER P. APPLETON, MD
Определение и патофизиология
2D эхокардиографические
и допплеровские признаки
Визуализация в М-режиме
Визуализация в 2D-режиме
Спектральная допплерография
Показатели
Двухмерная спекл-трекинг ЭхоКГ
Специфические рестриктивные
кардиомиопатии
Амилоидоз
Идиопатическая рестриктивная
кардиомиопатия
Гиперэозинофильный синдром
и эндомиокардиальный фиброэластоз
Гемохроматоз
Саркоидоз
Болезни накопления
Лекарственная рестриктивная
кардиомиопатия
Пострадиационная кардиомиопатия
Другие причины развития рестриктивной
кардиомиопатии
Дифференциальная диагностика
рестриктивной кардиомиопатии
и констриктивного перикардита
In-27_для нас.indd 675
03.04.2019 12:03:04
676
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Неинфильтративная
Идиопатическая
Склеродермия
Инфильтративная
Первичный амилоидоз
Семейный амилоидоз
Старческий системный амилоидоз
Вторичный амилоидоз
Саркоидоз
Болезнь Гоше
Синдром Гурлера
Болезни накопления
Гемохроматоз
Болезнь накопления гликогена
Болезнь Фабри
Эндомиокардиальная Эндомиокардиальный
фиброэластоз
Гиперэозинофильный синдром
Карциноид
Склеродермия
Синдром Элерса–Данлоса
Системная красная волчанка
Опухолевые метастазы
Облучение
Токсическое воздействие
антрациклина
Фиброз эндокарда, обусловленный
лекарственными препаратами
(антрациклин, серотонин, мети-
сергид, эрготамин, препараты,
содержащие ртуть, бусульфан,
хлорохин)
ТАБЛИЦА 27.1 Классификация рестриктивной
кардиомиопатии
< 50 мсек, снижением перегородочной и латераль-
ной скоростей e′ (3–4 см/сек), отношением E/e′ > 15,
и заметным увеличением индекса объема ЛП
(> 50 мл/м2) (рис. 27 .1). Выявление этих признаков
указывает на очень плохой прогноз и высокий по-
казатель смертности в течение 1 года.
С целью диагностики рестриктивных кардиоми-
опатий на более ранних, поддающихся лечению
стадиях, недавно было описано несколько новых
эхокардиографических методик, включая доппле-
ровские и другие режимы визуализации сердца. 2D
спекл-трекинг визуализация деформаций является
многообещающим методом, который даже при ми-
нимальном утолщении стенки ЛЖ позволяет выя-
вить снижение глобальной продольной деформа-
ции с ее сохранением в области верхушки ЛЖ у
пациентов с амилоидозом сердца. Подобное сохра-
нение деформации в области верхушки не наблю-
дается при других формах увеличения массы ЛЖ,
таких как гипертоническая болезнь сердца, гипер-
трофическая кардиомиопатия и аортальный стеноз.
Магнитно-резонансная томография (МРТ) сердца с
диффузным контрастированием гадолинием субэн-
докардиальной области утолщенного миокарда ЛЖ
является признаком наличия амилоида. При утол-
щении стенок ЛЖ, обусловленном гипертрофией,
подобная картина не наблюдается. МРТ сердца с
контрастированием гадолинием также может по-
мочь идентифицировать у отдельных пациентов
утолщение стенки, обусловленное болезнью Фабри.
Дальнейший прогресс в области трехмерной (3D)
ЭхоКГ с более точной оценкой массы и объема ЛЖ
и 3D-визуализации деформации с улучшением ко-
личественного определения систолической и диа-
столической функции ЛЖ позволят диагностиро-
вать рестриктивные кардиомиопатии на более
ранней стадии.
2D-ЭХОКАРДИОГРАФИЧЕСКИЕ
И ДОППЛЕРОВСКИЕ ПРИЗНАКИ
Эхокардиографическая оценка при рестриктивной
кардиомиопатии включает комплексное исследова-
ние с помощью различных эхокардиографических
методов, включая M-режим, 2D-режим, цветовую
допплерографию, непрерывно-волновую и импуль-
сно-волновую допплерографию для оценки диасто-
лической функции (табл. 27 .2, 27.3). К новым мето-
дам, позволяющим определить структурные осо-
бенности тканей ЛЖ, относятся 2D-визуализация
деформации и МРТ сердца с контрастированием
гадолинием, особенно при амилоидозе сердца.
ВИЗУАЛИЗАЦИЯ В М-РЕЖИМЕ
Для определения размеров камеры ЛЖ и толщины
межжелудочковой перегородки и задней стенки, а
также для расчета массы ЛЖ используют визуали-
зацию в длинноосевых и короткоосевых парастер-
нальных проекциях.
Для оценки скорости распространения кровото-
ка и измерения времени изоволюмической релакса-
ции используют цветовой M-режим в апикальной
четырехкамерной проекции, с размещением курсо-
ра M-режима в центре ЛЖ [2]. Значения скорости
распространения кровотока выражаются в см/сек, в
норме значения их составляют > 50 см/сек.
2D-ВИЗУАЛИЗАЦИЯ
Парастернальные позиции позволяют качественно
оценить характер структуры миокарда. 2D-парас-
тернальные проекции используются при ориента-
ции размещения курсора M-режима перпендику-
лярно по отношению к полости ЛЖ. В настоящее
время визуализация в 2D-режиме в парастерналь-
ных позициях по длинной и короткой осям являет-
ся наиболее часто используемой для определения
In-27_для нас.indd 676
03.04.2019 12:03:04
677
27 Рестриктивная кардиомиопатия
толщины стенки, массы и размеров ЛЖ. Короткоо-
севая проекция среднего отдела желудочка также
используется для оценки радиальной и циркуляр-
ной деформации ЛЖ и скорости деформации всех
сегментов миокарда с помощью спекл-трекинг и
скорости деформации передней части межжелудоч-
ковой перегородки и нижнебоковой стенки мето-
дом тканевой допплерографии.
Апикальные позиции позволяют оценить фрак-
цию выброса ЛЖ бипланарным методом Симпсона.
Естественная вариабельность измерения фракции
выброса ЛЖ составляет ± 5%, и у 30% пациентов
отмечается отсутствие визуализации границы эндо-
карда. Использование контрастирования повышает
точность измерений объема и фракции выброса
ЛЖ. По сравнению с 2D-ЭхоКГ без контрастирова-
ния, измерение объема ЛЖ с помощью 2D [3] и
3D- ЭхоКГ [4] с контрастированием демонстрирует
лучшую воспроизводимость и результаты, сходные
с результатами МРТ. Продольную деформацию и
скорость деформации ЛЖ оценивают в апикальных
четырех-, трех- и двухкамерных сфокусированных
проекциях ЛЖ, а деформацию и скорость деформа-
ции правого желудочка (ПЖ) — в сфокусирован-
ной проекции ПЖ при частоте 50–80 кадров в се-
кунду. Нормальные значения для глобальной про-
дольной деформации ЛЖ составляют > –20%, для
глобальной деформации ПЖ — >
–20%, а для де-
формации свободной стенки ПЖ — >
– 25%.
СПЕКТРАЛЬНАЯ ДОППЛЕРОГРАФИЯ
Парастернальные и апикальные проекции позволя-
ют оценить диастолическую функцию ЛЖ и ПЖ и
давление наполнения. Методы регистрации данных
при непрерывно-волновой и импульсно-волновой
допплерографии подробно описаны в данном руко-
водстве. Показатели непрерывно-волновой и им-
пульсно-волновой допплерографии, используемые
для оценки различных стадий рестриктивной карди-
омиопатии, кратко излагаются здесь:
Импульсно-волновая допплерография трансми-
трального кровотока используется для измерения
скоростей пиковой митральной E-волны и A-вол-
ны, отношения E/A, времени замедления E-волны и
продолжительности митральной A-волны.
Импульсно-волновая допплерография легочных вен
используется для измерения пиковых систоличе-
ских и диастолических скоростей кровотока в ле-
гочных венах (S- и D-волны), времени замедления
диастолической волны и скорости и продолжитель-
ности реверсивных потоков в предсердии (рис.
27.2). При технически сложных исследованиях ис-
пользование контраста улучшает импульсно-вол-
новой допплеровский сигнал легочных вен.
s′
s′
e′
a′
Рис. 27.1 Допплеровские признаки поздней стадии рестриктивной кардиомиопатии. Импульсно-волновая допплерография трансмитрального кровотока
(A) демонстрирует рестриктивный паттерн с высокой скоростью E, резкой скоростью замедления и малой скоростью A. Тканевая допплерография (Б) выявляет
низкую скорость е′ и а′. Кровоток в легочной вене (В) демонстрирует увеличенную и продолжительную скорость реверсии кровотока в предсердии, что соответ-
ствует высокому давлению наполнения ЛЖ. При непрерывно-волновой допплерографии (Г) определяется митральная регургитации с относительно низкой ско-
ростью и медленной скоростью замедления, что связано с высоким диастолическим давлением в ЛЖ и нарушением диастолической релаксации.
А
Б
Г
В
In-27_для нас.indd 677
03.04.2019 12:03:05
678
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
M-режим и цветовой M-режим
Знак квадратного корня в межжелудочковой перегородке и нижнебоковое движение
стенки
Гипертрофия миокарда неизвестной этиологии
Малые размеры ЛЖ
Уменьшение Vp
Увеличение ВИВР на ранних стадиях, укорочение ВИВР на поздних стадиях
Двухмерные показатели
Уменьшение объемов ЛЖ
Сохраненная систолическая функция ЛЖ (ранние стадии)
Двухстороннее увеличение предсердий
Гипертрофия миокарда неизвестной этиологии
Пятнистость миокарда
Утолщение межпредсердной перегородки
Равномерное утолщение атривентрикулярного клапана
Незначительный перикардиальный выпот
Тромбы в желудочке и области верхушки, несмотря на подвижность прилежащей стенки
Импульсно-волновая допплерогра-
фия митрального кровотока
Большая E-волна, маленькая A-волна; отношение E/A > 2
Короткое ВЗК < 150 мсек; короткое ВИВР < 60 мсек
Отсутствие существенных изменений в митральной E-волне, времени замедления крово-
тока или ВИВР при пробе Вальсальвы
Картина нарушения релаксации с отношением E/A < 1 и ВЗК на ранних стадиях
Псевдонормальный и обратимый рестриктивный паттерн на промежуточных стадиях
Импульсно-волновая допплерогра-
фия трикуспидального кровотока
Рестриктивное наполнение; повышенное отношение E/A и короткое ВЗК; на вдохе даль-
нейшее укорочение ВЗК и минимальное изменение отношения E/A
Легочные вены
Расширение легочных вен, доминирующий диастолический паттерн и отношение С/Д
< 0,5
Выраженная реверсия скорости кровотока в предсердие с продолжительностью а-волны
легочные вены — предсердие > продолжительности а-волны трансмитрального
кровотока
Быстрое время замедления кровотока D-волны на поздних стадиях
Отсутствие респираторной вариабельности D-волны
Митральная регургитация
Увеличение dP/dt на ранних стадиях, уменьшение dP/dt на поздних стадиях и повыше-
ние давления наполнения ЛП [САД – 4(скорость МР)2]
Трикуспидальная регургитация
Систолическое давление в легочной артерии [4 × (струя трикуспидальной регургитации2
(см/сек)]
Легочная регургитация
Диастолическое давление в легочной артерии [4 × (струя трикуспидальной регургита-
ции2 (см/сек)] плюс давление в ПП
Показатели цветовой
допплерографии
Митральная и трикуспидальная регургитация вследствие поражения створок или сосоч-
ковых мышц (как при эндомиокардиальном фиброэластозе)
Трикуспидальная регургитация является вторичной по отношению к легочной
гипертензии
Диастолическая МР вследствие повышения конечно-диастолического давления в ЛЖ
Диастолическая трикуспидальная регургитация и МР вследствие АВ-блокады первой
степени или полной блокады сердца
Тканевая допплерография фиброз-
ного кольца митрального клапана
Отношение E/E′ для оценки давления наполнения ЛЖ; при рестриктивной кардиомиопа-
тии обычно E′ < 8 см/сек и E/E′ > 15 вследствие повышения давления наполнения
Тканевая допплерография фиброз-
ного кольца трикуспидального
клапана
Снижение функции ПЖ < 1 см/сек
Давление в ПП E/E′ > 6
Исследование в цветовом
M-режиме
При рестриктивной кардиомиопатии Vp < 45 см/сек; E/Vp > 1,5 может быть использо-
вано для оценки давления наполнения ЛЖ
Кровоток в печеночной вене
Расширение печеночной вены, отношение С/Д < 0,5
Выраженная реверсия кровотока в предсердиях, увеличивающаяся на вдохе
Нижняя полая вена
Расширение (> 2,1 см) со снижением респираторной вариабельности (< 50%)
Vp — скорость распространения кровотока; АВ — атриовентрикулярный; ВЗК — время замедления кровотока; ВИВР — время изоволю-
мической релаксации; Д — диастолический; ЛЖ — левый желудочек; ЛП — левое предсердие; МР — митральная регургитация; ПЖ —
правый желудочек; ПП — правое предсердие; С — систолический; САД — систолическое артериальное давление.
ТАБЛИЦА 27.2 Эхокардиографические признаки рестриктивной кардиомиопатии
In-27_для нас.indd 678
03.04.2019 12:03:06
679
27 Рестриктивная кардиомиопатия
Методы диагностики
Результаты
Ограничения
2D/допплер-ЭхоКГ
ГЛЖ
ГЛЖ является неспецифической при наличии сопут-
ствующей патологии у пожилых пациентов и
гипертензии. При позднем выявлении данной пато-
логии выбор тактики лечения ограничивается или
ухудшается прогноз. Невоспроизводимость
измерений затрудняет последующее наблюдение
Рестриктивный тип наполнения
Не предоставляет информации об этиологии
амилоидоза
Системные маркеры
Легкие цепи, сывороточный амилоидный
Р-компонент, тропонин и про-МНУП
при первичном амилоидозе
Биопсия
Позволяет определить специфическую
причину рестриктивной
кардиомиопатии
Процедурные риски
Язык, подкожная жировая
клетчатка, почки,
костный мозг, слизистая
оболочка желудка, сли-
зистая оболочка прямой
кишки и ЭМБ
Отложение эозинофильных масс в интер-
стиции при окраске гемемотоксилин-эо-
зином, светло-зеленое двойное лучепре-
ломление при окраске конго красным и
фибриллярный белок при ЭМБ при
амилоидозе сердца
Неопределенность в отношении пределов ошибок
выборочного исследования при мониторинге
болезни
Катетеризация сердца
Падение и плато
Процедурные риски
Лучевая нагрузка
Систолическое давление в ПЖ обычно
>50ммрт.ст.
КДДЛЖчастона>5ммрт.ст.>чем
КДД ПЖ
КДД ПЖ < 1/3 от систолического давле-
ниявПЖ
КТ
Нормальная толщина перикарда
Лучевая нагрузка
побочные эффекты контрастного средства
МРТ
Высокое пространственное разрешение и
определение контрастности ткани.
Глобальное субэндокардиальное позднее
контрастирование гадолинием на
поздней стадии амилоидоза сердца и
снижение Т1 различия между миокар-
дом и кровью обеспечивают высокую
(97%) достоверность на поздней стадии
амилоидоза сердца
Использование на ранних стадиях заболевания не
оценивалось
Ядерная сцинтиграфия с
99 Тс пирофосфатом или
сканирование с индием,
меченным к системному
амилоиду
Сканирование с Tc пирофосфатом позво-
ляет дифференцировать амилоидоз, свя-
занный с легкими цепями иммуноглобу-
лина, и связанные с транстиретином
семейный и старческий амилоидоз.
Сильное накопление при транстире-
тин-ассоциированном амилоидозе
демонстрирует 100% достоверности
Лучевая нагрузка
Накопление индия в сердце при первич-
ном амилоидозе и в различных органах
при системном амилоидозе
Tc — технеций; ГЛЖ — гипертрофия левого желудочка; ЛЖ — левый желудочек; МНУП — мозговой натрийуретичекий пептид; КДД—
конечно-диастолическое давление; КТ — компьютерная томография; МРТ — магнитно -резонансная томография; ПЖ — правый желу-
дочек; ЭМБ — эндомиокардиальная биопсия; ЭхоКГ — эхокардиография.
ТАБЛИЦА 27.3 Другие методы диагностики рестриктивной кардиомиопатии
In-27_для нас.indd 679
03.04.2019 12:03:06
680 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Импульсно-волновая тканевая допплерография фи-
брозного кольца митрального клапана в апикальной
четырехкамерной проекции используется для изме-
рения систолической, ранней и поздней диастоли-
ческой скоростей смещения митрального кольца
(S′, E′ и A′′) в медиальном и латеральном углу ми-
трального кольца.
ПОКАЗАТЕЛИ
Специфические эхокардиографические признаки
различных типов рестриктивных кардиомиопатий
приведены в табл. 27.2. Рестриктивные кардиомиопа-
тии характеризуются концентрическим ремоделиро-
ванием с выраженным увеличением толщины стенки
относительно размера полости ЛЖ и нормального
или уменьшенного конечно-диастолического объема
ЛЖ (рис. 27.3). В последнее время было продемон-
стрировано, что измерение массы ЛЖ с помощью
3D-ЭхоКГ обладает лучшей воспроизводимостью,
чем измерение при 2D-ЭхоКГ, и его результаты схожи
с результатами МРТ сердца [5]. Расширение предсер-
дий коррелирует со степенью диастолической дис-
функции; легкая, умеренная и тяжелая диастоличе-
ская дисфункция отражает постепенное увеличение
ригидности ЛЖ, давления наполнения и индексиро-
ванного объема ЛП (см. рис. 27.3).
s′
Рис. 27 .2 Диастолическая дисфункция при рестриктивной кардиомиопатии. Импульсно-волновая допплерография трансмитрального кровотока у 33-лет-
него мужчины с анамнезом терминальной стадии почечной недостаточности и инфильтративной рестриктивной кардиомиопатии, обусловленной оксалозом (A).
Увеличение отношения E/A и короткое время замедления E-волны (160 мсек) указывает на ригидность ЛЖ. Кратковременность А-волны 100 мсек свидетельству-
ет о значительном увеличении давления в ЛЖ во время сокращения предсердий — ригидность ЛЖ приводит к укорочению продолжительности А-волны,
вследствие давления в ЛЖ, значительно превышающего давление в ЛП. Отмечается прямая волна между E- и A-волнами, демонстрирующая «трехфазный»
диастолический трансмитральный кровоток, характерный для повышенного давления наполнения. (Б) Допплерография легочных вен подтверждает ригидность
ЛЖ, поскольку реверсия А-волны легочной вены длится 80 мсек (короткая красная пунктирная линия продолжается > 35 мсек, чем при остановке прямого
A-потока).
А
Б
In-27_для нас.indd 680
03.04.2019 12:03:06
681
27 Рестриктивная кардиомиопатия
Согласно современным рекомендациям ASE [6]
на основе объема ЛП, измеренного методом Симпсо-
на, выделены три степени расширения ЛП: слабая
(> 34 мл/м2), умеренная (40–47 мл/м2) и выражен-
ная (> 48 мл/м2).
ИМПУЛЬСНОВОЛНОВАЯ ДОППЛЕРОГРАФИЯ
ТРАНСМИТРАЛЬНОГО КРОВОТОКА
Диастолические показатели при прогрессировании
рестриктивной кардиомиопатии обычно демонст-
рируют нарастание ряда нарушений диастоличе-
ской функции, от нарушения релаксации до псевдо-
нормального типа наполнения, что обусловлено
уменьшением растяжимости камеры, приводящим
в итоге к рестриктивному типу наполнения (см. рис.
27.1, 27.2). На ранних стадиях заболевания тип на-
полнения трансмитрального кровотока демонстри-
рует типичную картину нарушения релаксации,
характеризующуюся отношением E/A ниже 1, удли-
ненным временем замедления E-волны трансми-
трального кровотока и изоволюмической релакса-
ции. По мере прогрессирования заболевания уве-
личивается ригидность ЛЖ, причем повышение
давление в ЛП приводит к псевдонормализации
трансмитрального кровотока. Этот паттерн распоз-
нается при выявлении расширения ЛП и снижения
скорости e′ фиброзого кольца митрального клапа-
на, а также купирования нарушений релаксации
Рис. 27.3 2D эхокардиографические признаки старческого амилоидоза. 2D -ЭхоКГ у 84-летнего афроамериканца со старческим амилоидозом, деменци-
ей, застойной сердечной недостаточностью, фибрилляцией предсердий и хронической почечной недостаточностью. Парастернальные позиции по длинной оси A
(A), короткой оси (Б), апикальная четырехкамерная позиция A (В) и апикальная двухкамерная позиция (Г) пациента с амилоидозом сердца. Выраженная гене-
рализованная гипертрофия наблюдается во всех позициях. Обратите внимание на вид миокарда по типу матового стекла, расширение обоих предсердий и пра-
вого желудочка (ПЖ) и небольшой объем перикардиальной жидкости (стрелки), а также расширение нижней полой вены, что свидетельствует о повышении
давления в правом предсердии (ПП). ЛЖ — левый желудочек; ЛП — левое предсердие.
ПЖ
ПЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
ЛП
ПП
А
Б
Г
В
In-27_для нас.indd 681
03.04.2019 12:03:07
682
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
после пробы Вальсальвы. При выраженных нару-
шениях податливости желудочков развивается про-
грессирующая диастолическая дисфункция, харак-
теризующаяся повышенной скоростью E и сниже-
нием функций ЛП вследствие его систолической
недостаточности. Время замедления трансмитраль-
ного кровотока уменьшается в результате быстрого
увеличения давления в ранней диастоле, приводя-
щего к снижению градиента давления левого пред-
сердия (см. рис. 27 .1, 27.2). Из-за снижения функции
ЛП и ограничения позднего диастолического пред-
сердно-желудочкового градиента давления, обу-
словленного повышением диастолического давле-
ния в ЛЖ, уменьшается амплитуда сократимости
предсердий. Первоначально этот рестриктивный
паттерн трансмитрального кровотока купирует-
ся при снижении преднагрузки с помощью пробы
Вальсальвы или приема нитроглицерина или диу-
ретика. Наконец, при формировании необратимого
рестриктивного паттерна существенных изменений
после ослабления преднагрузки не наблюдается.
Из-за заметного повышения конечно-диастоличе-
ского давления в ЛЖ может возникать диастоличе-
ская митральная регургитация, особенно при нали-
чии блокады сердца первой степени.
ИМПУЛЬСНОВОЛНОВАЯ ДОППЛЕРОГРАФИЯ ЛЕГОЧНЫХ ВЕН
На ранних стадиях заболевания кровоток в легоч-
ных венах может демонстрировать преобладание
систолического паттерна с соотношением систоли-
ческий/диастолический > 1, также могут наблю-
даться обратные потоки в предсердие в пределах
нормы. По мере развития нарушений податливости
ЛП постепенно возрастает скорость и продолжи-
тельность волны A (см. рис. 27 .1, 27.2). Характерны-
ми признаками рестриктивной кардиомиопатии
наряду с прогрессивным нарастанием нарушений
податливости являются снижение систолических и
увеличение диастолических волн в легочных венах
при допплерографии (см. рис. 27 .1). Из-за снижения
податливости ЛП, повышения среднего давления в
ЛП [7] и давления в ЛЖ наблюдается притупление
систолической волны.
При наличии фибрилляции предсердий наблю-
дается заметное притупление систолической волны
в легочных венах с митральной регургитацией или
без нее из-за потери S1 или раннего систолического
компонента наполнения легочных вен, связанного с
релаксацией предсердий после их сокращения. Ди-
астолическая волна в легочных венах, обусловлен-
ная градиентом давления легочные вены — ЛП,
возникающего во время атриовентрикулярного на-
полнения в раннюю диастолу ЛЖ, зависит от тех же
факторов, которые влияют на раннюю скорость
трансмитрального кровотока и время ее замедле-
ния. Следовательно, на поздних стадиях заболева-
ния наблюдается высокая диастолическая волна с
сокращением временем замедления кровотока. При
нарушении релаксации и податливости ЛЖ увели-
чение конечно-диастолического давления в ЛЖ
приводит к минимальному атриовентрикулярно-
му наполнению при сокращении предсердий, и
может возникать выраженная и продолжительная
реверсивная волна А в легочных венах, которая
превышает по продолжительности предсердный
трансмитральный кровоток (см. рис. 27.1, 27.2).
Наконец, ухудшение сократимости ЛП, обуслов-
ленное механической предсердной недостаточно-
стью, приводит к уменьшению амплитуды и про-
должительности предсердной волны в легочных
венах.
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА
В отличие от зависящих от нагрузки паттернов им-
пульсно-волнового допплеровского трансмитраль-
ного кровотока и кровотока в легочных венах, тка-
невая допплерография перегородочной и латераль-
ной частей митрального кольца с исследованием
движения ткани миокарда напрямую позволяет
более достоверно и непосредственно провести ко-
личественную оценку релаксации миокарда и отно-
сительно независима от нагрузки [8]. По мере про-
грессирования заболевания наблюдается уменьше-
ние амплитуды ранней волны движения миокарда,
так что отношение волны трансмитрального крово-
тока E и волны митрального кольца E′ постепенно
увеличивается (см. рис. 27.1). На поздних стадиях
рестриктивной кардиомиопатии у пациентов на-
блюдается значительное снижение скорости диа-
столического движения. Определение тканевых
допплеровских скоростей используются в качестве
метода дифференциальной диагностики констрик-
тивного перикардита (при котором допплеровские
скорости движения митрального кольца сохранены
или увеличены) и рестриктивной кардиомиопатии
[9]. Снижение систолической и диастолической ско-
ростей ПЖ отражает глобальное нарушение релак-
сации миокарда.
ЦВЕТОВОЙ МРЕЖИМ
В цветовом M-режиме возможно измерение ранней
скорости распространения кровотока в полость ЛЖ
в качестве показателя релаксации ЛЖ. Нарушение
релаксации ЛЖ приводит к постепенному сниже-
нию скорости распространения кровотока и задерж-
ке в достижении им верхушки ЛЖ. В отличие от
импульсно-волновой допплерографии, цветовой
М-режим позволяет получить пространственную
информацию наряду с показателями скорости и
времени и относительно независим от нагрузки;
однако его выполнение технически сложнее. Замед-
ление, равное 100 см/сек, позволяет разграничить
констриктивный перикардит и рестриктивную кар-
диомиопатию. При констрикции достижение мак-
симальной скоростью верхушки происходит почти
In-27_для нас.indd 682
03.04.2019 12:03:08
683
27 Рестриктивная кардиомиопатия
мгновенно, по сравнению со значительной задерж-
кой при рестрикции.
ТКАНЕВАЯ ДОППЛЕРОГРАФИЯ
И ПРОДОЛЬНАЯ ДЕФОРМАЦИЯ
ЭхоКГ с оценкой продольной систолической дефор-
мации позволяет точнее определить систолическую
дисфункцию при амилоидозе [10]. Тканевая доп-
плерография может применяться для выявления
нарушения систолической функции ЛЖ, даже если
признаки сердечной недостаточности отсутствуют
при стандартной 2D и допплеровской ЭхоКГ.
ОГРАНИЧЕНИЯ МЕТОДА И ВОЗМОЖНЫЕ ОШИБКИ
ПРИ ИМПУЛЬСНОВОЛНОВОЙ ДОППЛЕРОГРАФИИ
И ЦВЕТОВОМ МРЕЖИМЕ
Влияние угла между направлениями ультразвуко-
вого луча и кровотоком, амплитуды отраженных
эхо-сигналов, рассеяния, скорости развертки, пре-
дела Найквиста и фильтров нижней стенки остают-
ся важными аспектами, влияющими на результат
допплерографии [11], включая тканевую допплеро-
графию. Контрольный объем при тканевой доппле-
рографии должен быть размещен на границе кольца
и основания миокарда. Контрольный объем пере-
мещается в зависимости от динамики стенки мио-
карда таким образом, что выбранная область анали-
зируемого миокарда желудочка не всегда одна и та
же, что может спровоцировать наложение артефак-
тов движения на импульсно-волновые допплеров-
ские изображения. Из-за физиологической вариа-
бельности от сокращения к сокращению сердца по
данным импульсно-волновой тканевой допплеро-
графии необходимо получить среднее значение,
рассчитанное по протяжении нескольких сердечных
циклов. Скорость распространения кровотока не
может быть измерена, когда у пациента невозможно
определить переднюю линию волны раннего на-
полнения в связи с плохой эхогенностью, при от-
сутствии непрерывности кровотока или при отсут-
ствии апикального кровотока из-за снижения пря-
мого распространения кровотока. В этих случаях
необходимо снизить предел Найквиста. У пациен-
тов со значительным расширением ЛЖ, при кото-
ром наблюдается усиление трансмитрального кро-
вотока вдоль заднебоковой стенки, параллельное
выравнивание курсора М-режима к кровотоку мо-
жет быть затруднено и приводит к ложно занижен-
ной оценке скорости распространения.
2D СПЕКЛ-ТРЕКИНГ ВИЗУАЛИЗАЦИЯ ДЕФОРМАЦИИ
В отличие от тканевой допплерографии, 2D-визуа-
лизация деформации не зависит от угла сканирова-
ния на интересующие области и, следовательно,
может использоваться в нескольких плоскостях для
получения продольного, циркулярного и радиаль-
ного движения миокарда.
СПЕЦИФИЧЕСКИЕ РЕСТРИКТИВНЫЕ
КАРДИОМИОПАТИИ
Инфильтративные процессы и болезни обмена
веществ, включая амилоидоз, гемохроматоз, сар-
коидоз, болезнь Фабри и болезни накопления гли-
когена, являются наиболее распространенными
причинами рестриктивных кардиомиопатий. К
менее распространенным формам рестриктивных
кардиомиопатий относят фиброз эндокарда, свя-
занный с гиперэозинофильным синдромом (кар-
диомиопатия Леффлера) и идиопатическую ре-
стриктивную кардиомиопатию (см. табл. 27.1).
ЭхоКГ играет важную роль в определении инфиль-
тративных кардиомиопатий [12]. Некоторые ха-
рактерные эхокардиографические признаки наи-
более часто встречающихся рестриктивных карди-
омиопатий описаны в следующих разделах, хотя
ни один из них не обладает абсолютной чувстви-
тельностью или специфичностью для постановки
диагноза. В большинстве случаев требуется тща-
тельное изучение клиники и проведение эндомио-
кардиальной биопсии.
АМИЛОИДОЗ
Амилоидоз является наиболее распространенной
установленной причиной рестриктивного кардио-
логического заболевания.
ОПРЕДЕЛЕНИЕ
Было описано четыре различных типа амилоидоза,
лежащих в основе заболевания:
Первичный AL-амилоидоз (иммуноглобулиновый
амилоидоз) является наиболее распространенным
типом амилоидоза сердца с частотой встречаемости
в общей популяции 0,3 случая на 100 000 человек. У
> 50% пациентов наблюдается поражение сердца.
При окраске гемотоксилин-эозином биопсийного
материала [13] у 80% пациентов идентифицируют-
ся эозинофильные депозиты амилоида гамма-лег-
ких цепей, а у оставшейся части пациентов кап-
па-легких цепей, обладающие способностью к свя-
зыванию конго красного (что приводит к зеленому
двойному лучепреломлению в поляризованном
свете) (рис. 27 .4–27 .7). При электронной микроско-
пии наблюдается характерный фибриллярный пат-
терн. Если комбинация клинической картины и
данных ЭхоКГ позволяет заподозрить амилоидоз
[14], то для иммунологического анализа основного
амилоидного белка может быть получен материал
из тканей вне сердца с помощью менее инвазивного
способа [15]. При выявлении депозитов амилоида в
биоптатах из тканей вне сердца (подкожной жиро-
вой клетчатки, почек, костного мозга, языка, слизи-
стой оболочки желудка и, реже, слизистой оболочки
прямой кишки) и наличии характерных эхокардио-
графических признаков проведения эндомиокарди-
альной биопсии не нужно. Комбинация биопсии
In-27_для нас.indd 683
03.04.2019 12:03:08
684
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 27 .5 Градиент выносящего тракта ЛЖ при AL-амилоидозе. (A) A Апикальная трехкамерная проекция, демонстрирующая неоднозначность оценки
допплеровского сдвига частоты в выносящем тракте ЛЖ при цветовой допплерографии, и ускорение кровотока вследствие переднего систолического движения
митрального клапана. (Б) С помощью непрерывно-волновой допплерографии определен пиковый внутрижелудочковый градиент 108 мм рт. ст.
А
Б
Рис. 27.4 Эхокардиографические признаки AL-амилоидоза. У 61-летнего мужчины с хронической почечной недостаточностью и нефротической протеину-
рией (6,9 г/сут) результаты нефробиопсии продемонстрировали отложение в интерстиции, стенке сосудов и клубочках бесклеточных, аморфных эозинофильных
масс с сильным светло-зеленым двойным лучепреломлением в поляризованном свете при окраске на конго-красный и беспорядочное распределение фибрилл,
определяемое при электронной микроскопии. В материале наблюдается иммунореактивность к антителам моноклональных лямбда-цепей, выявленная путем
иммунофлюоресценции, что соответствует амилоиду AL-типа. (A) Апикальная четырехкамерная позиция (ЛЖ на изображении слева), демонстрирует помутнение
миокарда ЛЖ и ПЖ по типу «матового стекла». (Б) Апикальная позиция по длинной оси с систолическим движением передней створки митрального клапана.
(В) Субкостальная позиция, демонстрирующая небольшой перикардиальный экссудат (
*
).
*
А
Б
В
In-27_для нас.indd 684
03.04.2019 12:03:08
685
27 Рестриктивная кардиомиопатия
подкожной жировой клетчатки и окраски конго
красным костного мозга позволяет поставить диа-
гноз у 90% пациентов с амилоидозом.
Семейный амилоидоз, или наследственный ами-
лоидоз, встречается реже, чем первичный амилои-
доз. Он обусловлен аутосомно-доминантной мута-
цией, чаще всего в гене белка транстиретина [16]. К
общим признакам относится периферическая ней-
ропатия, почечная недостаточность, вегетативная
дисфункция с преимущественно желудочно-ки-
шечными симптомами и кардиомиопатия [17]. Ма-
кроглоссия не наблюдается, поражение почек встре-
чается реже, чем при AL-амилоидозе.
Старческий системный амилоидоз (дикий тип се-
мейного амилоидоза) встречается примерно у 25%
пациентов старше 80 лет. При старческом систем-
ном амилоидозе поражаются в основном предсер-
дия (91%) и реже наблюдается изолированное пора-
жение предсердий или поражение всего сердца (см.
рис. 27 .3) [18, 19]. Старческий амилоидоз не всегда
протекает доброкачественно и может привести к
сердечной недостаточности, фибрилляции предсер-
дий и нарушениям проводимости. Амилоидоз, обу-
словленный диким типом транстиретина, важно
учитывать при оценке патофизиологии сердечной
Рис. 27 .7 Оценка продольной деформации в режиме спекл-трекинг
при AL-амилоидозе. Данные о деформации миокарда при 2D исследовании
в режиме спекл-трекинг представлены в виде диаграммы «бычий глаз», де-
монстрирующей сохранение апикальной деформации (красная область в цен-
тре) и выраженное снижение деформации в области сегментов основания
(светло-розовые сегменты).
A
E
S’
E’
E’
E’
E’
E’
E’’
E’
A’
A’
A’
A’
A’
A’’
A’
S’
S’
S’
S’
S’
S’
S’
S’
S’
S’
S’
Рис. 27 .6 Допплеровские признаки AL-амилоидоза. (A) Импульсно-волновая допплерография трансмитрального кровотока. (Б) Тканевая допплерография
медиальной части кольца. (В) Тканевая допплерография латеральной части кольца. (Г) Тканевая допплерография кольца трикуспидального клапана. Коэффици-
ент реверсии трансмитрального кровотока E/A, как показано на рис. (А), может наблюдаться при рестриктивной кардиомиопатии. Заметное увеличение времени
изоволюмической релаксации (красные линии на рис. Б , Г) свидетельствует о нарушении релаксации ЛЖ (Б, В) и ПЖ (Г) наряду с заметным снижением скоростей
E′ как ЛЖ (Б, В), так и ПЖ (Г). Скорости S′ и A′ сохранны.
А
Б
Г
В
In-27_для нас.indd 685
03.04.2019 12:03:10
686 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
недостаточности у пациентов с сохраненной фрак-
цией выброса ЛЖ. В ходе одного исследования [20]
умеренные или выраженные депозиты транстире-
тина в интерстиции, указывающие на старческий
системный амилоидоз в качестве основной причи-
ны сердечной недостаточности, были выявлены у 5
(5%) пациентов (отношение рисков 3,8 по сравне-
нию с группой контроля).
Вторичный амилоидоз характеризуется реактив-
ными амилоидными фибриллами — реактантами
острой фазы при системных воспалительных состо-
яниях, включая туберкулез, лепру, ревматоидный
артрит, семейную средиземноморскую лихорадку,
синдром воспаленного кишечника, хронические
заболевания легких и хронические инфекции.
ПРИЗНАКИ ПОРАЖЕНИЯ СЕРДЦА
Рестриктивная кардиомиопатия является основным
признаком амилоидоза сердца. Поражение сердца
встречается у примерно 50% пациентов с первич-
ным амилоидозом, и у около 25% присутствуют
клинические признаки сердечной недостаточности.
Замещение нормальных сократительных элементов
миокарда депозитами амилоида приводит к нару-
шению клеточного метаболизма, транспорта каль-
ция, регуляции рецепторов и отеку клетки. По-
вреждение также может быть обусловлено цирку-
лирующими легкими цепями без образования
амилоидных фибрилл. Миокард, пораженный при
амилоидозе, становится плотным, эластичным и
неподатливым [21]. Вовлечение проводящей систе-
мы сердца может приводить к фиброзу синоатри-
ального и атриовентрикулярного узлов, а также к
вовлечению волокон Пуркинье и пучка Гиса, что
сопровождается различными типами блокады серд-
ца и аритмий [22]. К другим признакам поражения
сердца относятся легочное сердце, возникающее в
результате амилоидной инфильтрации сосудистой
системы легких, что приводит к легочной гипертен-
зии, и картина псевдоинфаркта на электрокардио-
грамме (ЭКГ) при отсутствии эпикардиальной ко-
ронарной болезни, обусловленная отложением де-
позитов амилоида в сосудах микроциркуляторного
русла [23].
Примерно у 50% пациентов с AL-амилоидозом и
у 25% пациентов с семейным амилоидозом наблю-
дается низкий вольтаж ЭКГ. Картина инфаркта
миокарда на ЭКГ может наблюдаться даже при от-
сутствии эпикардиальной коронарной болезни из-
за отложения депозитов амилоида в сосудах микро-
циркуляторного русла у примерно 47% пациентов
[24].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Две трети пациентов с амилоидозом — мужчины.
Средний возраст начала клинических проявлений
составляет около 67 лет. Симптомы включают уста-
лость, нефротический синдром, потерю веса, пери-
ферическую нейропатию, гепатомегалию, повыше-
ние уровня щелочной фосфатазы, моноклональную
гаммопатию, макроглоссию (AL), периорбитальную
пурпуру (AL) и синдром запястного канала с обеих
сторон (семейный амилоидоз). Симптомы сердеч-
ной недостаточности включают в себя правосторон-
нюю сердечную недостаточность, обмороки при
физической нагрузке, обусловленные снижением
сердечного выброса, ортостатическую гипотензию,
связанную с вегетативной нейропатией, желудоч-
ковые аритмии, фибрилляцию предсердий с эмбо-
лическим инсультом, блокадой сердца и стенокар-
дией (из-за поражения мелких артерий). Циркуля-
ция свободных легких цепей иммуноглобулинов
встречается у более чем 98% пациентов с первич-
ным амилоидозом, и их выявление используют
для определения прогноза и ответа на химиотера-
пию.
Уровень в сыворотке крови мозгового натрийу-
ретического пептида > 5000 нг/л и тропонина Т
> 0,06 мкг/л, фракция выброса ЛЖ < 60% и клини-
чески выраженная сердечная недостаточность свя-
заны с худшим исходом [25].
ВИЗУАЛИЗАЦИЯ
Эхокардиография
2D-эхокардиографические признаки включают
утолщение стенки ЛЖ и увеличение массы ЛЖ,
сохранение фракции выброса ЛЖ вплоть до позд-
них стадий заболевания, нормальный или малень-
кий объем желудочка, увеличение толщины межже-
лудочковой перегородки и задней стенки (> 1,2 см),
увеличение толщины стенки ПЖ (> 7 мм), расши-
рение предсердий и повышение давления в ПП.
«Блестящий» пестрый внешний вид появляется
только на поздних стадиях заболевания и не очень
помогает в ранней диагностике. Обнаружение по-
вышенной эхогенности миокарда с помощью ос-
новного изображения продемонстрировало чув-
ствительность 87% и специфичность 81% в группе
пациентов с амилоидозом сердца, по сравнению с
пациентами с гипертрофией ЛЖ из группы контро-
ля [26]; однако в ходе более позднего исследования
при мультивариантном регрессивном анализе было
показано, что единственными полезными параме-
трами стал низкий вольтаж и утолщение межжелу-
дочковой перегородки, в отличие от пятнистости
миокарда [27].
Перспективная идентификация преломляющих
эхокардиограмм неточна, поскольку результат за-
висит от исследователя и технических манипуляций
во время визуализации и использования гармони-
ческой визуализации. Появление блестящей пятни-
стости может также наблюдаться при миокардите с
тяжелым фиброзом и довольно распространено
при гипертрофической кардиомиопатии, а также
при других инфильтративных заболеваниях мио-
карда [28].
In-27_для нас.indd 686
03.04.2019 12:03:11
687
27 Рестриктивная кардиомиопатия
Цветовые допплеровские признаки включают
недостаточность клапанов и диастолическую ми-
тральную и трикуспидальную регургитацию, свя-
занные с повышением диастолического давления в
ЛЖ или нарушениями проводимости [29].
Допплерография
Импульсно-волновая и тканевая допплерография
при оценке диастолической функции ЛЖ и давле-
ния наполнения демонстрируют нарушение релак-
сации на ранних стадиях и повышение давления
наполнения ЛЖ на более поздних стадиях [30],
повышение систолического легочного давления
[31], и периодическую динамическую обструкцию
выносящего тракта ЛЖ, имитирующую гипертро-
фическую кардиомиопатию (см. рис. 27 .4–27 .6)
[32]. Снижение функции ЛЖ позволяет предполо-
жить отсутствие гипертрофической кардиомиопа-
тии. Импульсно-волновая тканевая допплерогра-
фия митрального кольца остается наиболее точ-
ным способом оценки ранней диастолической
дисфункции ЛЖ у пациентов с AL-амилоидозом.
Часто встречается субклиническая дисфункция
ПЖ [33].
Визуализация деформации и скорости деформа-
ции с помощью тканевой допплерографии или
спекл-трекинга демонстрирует относительное со-
хранение продольной деформации в области вер-
хушки. Выявление апикального щажения с помо-
щью методики спекл-трекинг является чувстви-
тельным и специфичным признаком амилоидоза
сердца (см. рис. 27 .7) [34]. У 206 пациентов с AL-а-
милоидозом, подтвержденным биопсией, с медиа-
ной продолжительности наблюдения 1207 дня, по-
роговое значение средней продольной деформации,
полученной при тканевой допплерографии, позво-
ляющее выявить поражение миокарда, составля-
ло –10,65%. Показатели продольной деформации,
полученные с помощью тканевой допплерографии,
предоставляют важную дополнительную информа-
цию для оценки исхода, сопоставимую с клиниче-
скими показателями (возраст, индекс Карновского
[35] [шкала общего состояния пациента] и функци-
ональный класс по критериям Нью-Йоркской кар-
диологической ассоциации (NYHA) и серологиче-
скими биомаркерами. Для ранней диагностики по-
ражения сердца у пациентов с AL-амилоидозом
также применим показатель скорости деформации
ПЖ. В ходе исследования с участием 249 пациентов
с AL-амилоидозом прогностическими факторами
летального исхода были показатели скорости де-
формации срединного сегмента свободной стенки
ПЖ, полученные с помощью тканевой допплеро-
графии (отношение рисков 1,3), отношение скоро-
стей наполнения желудочка в ранней и поздней
фазах E/A (отношение рисков 1,3), систолическое
давление в ПЖ (отношение рисков 1,02), уровень
мозгового натрийуретического пептида (отноше-
ние рисков 1,4), уровень тропонина Т (отношение
рисков 1,6), мужской пол (отношение рисков 2,2) и
плевральный выпот (отношение рисков 3,6) [36].
Деформация и скорость деформации шести сегмен-
тов основания ЛЖ, измеренные с помощью ткане-
вой допплерографии, также являлись прогностиче-
скими показателями до трансплантации стволовых
клеток и после ее проведения [37], наряду с пиковой
скоростью трикуспидальной регургитации.
Оценка глобальной продольной деформации с
помощью методики 2D-стрейн имела большую
значимость, чем оценка продольной деформации с
помощью тканевой допплерографии, и наряду с
диастолической дисфункцией является единствен-
ным прогностическим фактором для выживания
[38]. В ходе этого исследования показатель гло-
бальной продольной деформации, полученный с
помощью 2D-стрейн до начала химиотерапии,
также имел большую ценность, чем уровни пато-
логических свободных легких цепей или тропони-
на, и был единственным независимым прогности-
ческим фактором, кроме индекса Карновского у
пациентов с сохраненной фракцией выброса ЛЖ
(≥ 50%).
Магнитно-резонансная томография
Амилоидоз проявляется диффузным субэндокар-
диальным или трансмуральным поздним контра-
стированием гадолинием ЛЖ из-за увеличения
объема распределения и замедления кинетики вы-
мывания в областях внеклеточного фиброза или
инфильтрации белка, что также может наблюдаться
в стенках ПЖ и ПП.
Позднее контрастирование гадолинием при ами-
лоидозе сердца обладает чувствительностью 80%,
специфичностью 85% и диагностической ценно-
стью 85% отрицательного результата [30] и корре-
лирует с высокой степенью инфильтрации амило-
идом интерстиция и клиническими прогностиче-
скими факторами, такими как функциональный
класс по критериям Нью-Йоркской кардиологиче-
ской ассоциации, толщина ЛЖ и концентрация
тропонина Т и про-мозгового натрийуретического
пептида. Характерный паттерн позднего контрасти-
рования всей субэндокардиальной поверхности с
распространением на прилежащий миокард крайне
редко определяется у пациентов, у которых амило-
идоз не подтверждается с помощью биопсии, и
имеет чувствительность 88% и специфичность 95%
[39].
Другие методы МРТ включают Т1-картирова-
ние — бесконтрастный метод, основанный на вре-
мени Т1-релаксации миокарда с прямым количе-
ственным определением доли объема внеклеточной
жидкости миокарда. Была продемонстрирована
специфическая диагностическая и прогностическая
ценность позднего контрастирования при оценке
амилоидоза [39], проявляющегося характерным
In-27_для нас.indd 687
03.04.2019 12:03:11
688 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
паттерном поражения всей субэндокардиальной
поверхности и распространением на прилежащий
миокард. Этот паттерн редко наблюдается у паци-
ентов, у которых амилоидоз не подтверждается с
помощью биопсии, и имеет чувствительность 88%
и специфичность 95%.
Радионуклидная визуализация
Сцинтиграфия с использованием введения мечено-
го индием сывороточного амилоидного белка
123I-SAP может быть использована для диагности-
ки, определения локализации и мониторинга выра-
женности системного амилоидоза [40].
Широкое распространение получило ядерное
сканирование с пирофосфатом технеция. Этот ме-
тод обладает очень хорошей специфичностью, но
неизвестна чувствительность на ранних стадиях
заболевания [41]. Положительные результаты при
сканировании с пирофосфатом Tc демонстрируют
достоверность 100% при ТТР (семейном и старче-
ском) амилоидозе. Отрицательные результаты ска-
нирования сердечного амилоида характерны для
пациентов с первичным амилоидозом [42].
ИДИОПАТИЧЕСКАЯ РЕСТРИКТИВНАЯ КАРДИОМИОПАТИЯ
Идиопатическая рестриктивная кардиомиопатия —
редкая нозологическая форма, возникающая в лю-
бом возрасте с преобладанием у пожилых женщин.
В отличие от других форм рестриктивной кардио-
миопатии при этом заболевании обычно отмечает-
ся нормальная амплитуда зубца QRS и толщина
стенки левого желудочка. Идиопатическая рестрик-
тивная кардиомиопатия составляет 2–5% всех кар-
диомиопатий у детей [43]. Наблюдается двухсто-
роннее расширение предсердий на фоне отсутствия
гипертрофии или минимального ее проявления. В
литературе описаны мутации генов, отвечающих за
синтез десмина и сердечного тропонина I [44].
Идиопатическая рестриктивная кардиомиопатия
проявляется выраженным двухсторонним расши-
рение предсердий. Часто наблюдается фибрилляция
предсердий [45]. Более чем у двух третей пациентов
сохраняется систолическая функция ЛЖ с нормаль-
ным или сниженным диастолическим объемом ЛЖ.
Идиопатическая рестриктивная кардиомиопатия
является диагнозом исключения при отсутствии
других причин кардиомиопатии, таких как болезни
соединительной ткани, карциноидный синдром,
амилоидоз, гемохроматоз, эозинофильный син-
дром, злокачественные образования, облучение,
прием кардиотоксических препаратов или злоупо-
требление алкоголем. По сравнению с амилоидозом
сердца, при идиопатической рестриктивной карди-
омиопатии часто сохраняется продольная функция,
измеряемая с помощью тканевой допплерографии
[46]. Эндомиокардиальная биопсия демонстрирует
интерстициальный фиброз от легкой до выражен-
ной степени и слабо выраженную гипертрофию
миоцитов. Интерстициальный фиброз, выявляе-
мый при этом заболевании, редко оказывает влия-
ние на сокращение пучков миокардиальных воло-
кон, но способен препятствовать дилатации желу-
дочков и тем самым ограничивать диастолическое
растяжение.
Естественное течение идиопатической рестрик-
тивной кардиомиопатии характеризуется высокими
показателями смертности с 1- и 5-летней выживае-
мостью — 64 и 37% соответственно. Размер ЛП
> 60 мм коррелирует с плохим прогнозом. У детей
медиана выживаемости составляет 2 года [47]. Наи-
более сильным прогностическим фактором для
выживания у детей является степень увеличения
отношения ЛП-аорта с последующей манифестаци-
ей давления в концевых легочных капиллярах и
конечно-диастолического давления в ЛЖ. Симпто-
мы во время манифестации не позволяют предска-
зать исход.
ГИПЕРЭОЗИНОФИЛЬНЫЙ СИНДРОМ
И ЭНДОМИОКАРДИАЛЬНЫЙ ФИБРОЭЛАСТОЗ
Гиперэозинофильный синдром представляет собой
лейкопролиферативное нарушение, характеризую-
щееся идиопатической устойчивой эозинофилией в
периферической крови (> 1,5 × 109/л) и нарушением
функции внутренних органов, обусловленным эо-
зинофильной инфильтрацией. Наиболее частой
причиной заболеваемости и смертности является
нарушение функции сердца. Эндокардиальный фи-
броз и воспаление миокарда приводят к рестрик-
тивной кардиомиопатии [48], сердечной недоста-
точности и формированию пристеночных тромбов
в желудочке.
К клиническим признакам относятся одышка,
асцит, периферические отеки и правожелудочковая
недостаточность, являющиеся общими клиниче-
скими проявлениями поражения ПЖ и бивентри-
кулярного поражения. Утолщение эндокарда с
ограничением подвижности створок атриовентри-
кулярного клапана наблюдается при эндокардите
Леффлера и эндомиокардиальном фиброэластозе,
характеризующимися фиброзом эндокарда и мио-
карда в области притока и верхушки ЛЖ. Вовлече-
ние сосочковых мышц в фиброзный процесс в по-
следующем приводит к недостаточности атриовен-
трикулярного клапана. Происходит прогрессивное
уменьшение размеров полости ЛЖ [49].
К эхокардиографическим признакам относят
признак Мерлона (гиперсокращение основания) на
фоне нарушений в области верхушки [50]. В М-ре-
жиме наблюдается признак «квадратного корня» в
области перегородки и задней стенки. В течение
гиперэозинофильного синдрома выделяют три ста-
дии: некроза, тромбоза и фиброза. Часто при ЭхоКГ
на ранних стадиях заболевания определяется слоис-
In-27_для нас.indd 688
03.04.2019 12:03:11
689
27 Рестриктивная кардиомиопатия
Нормальная толщина створок митрального и
трехстворчатого клапанов, несмотря на выражен-
ную регургитацию, вовлечение сосочковых мышц,
облитерация верхушки ЛЖ, и нормальный или
уменьшенный размер желудочка при наличии вы-
раженной недостаточности клапана, позволяет
дифференцировать это состояние с ревматической
болезнью сердца.
У пациентов с правосторонним эндокардиаль-
ным фиброзом наблюдаются клинические призна-
ки, схожие с клиническими признаками констрик-
тивного перикардита. Наличие нормальной тол-
щины перикарда, облитерация верхушки ПЖ и
выраженное расширенное ПП позволяет отличить
эндомиокардиальный фиброэластоз от констрик-
тивного перикардита.
Облитерация верхушки ЛЖ как во время систо-
лы, так и во время диастолы отличает эндомиокар-
диальный фиброэластоз от апикальной гипертро-
фической кардиомиопатии, при которой облитера-
ция наблюдается только во время систолы.
Нормальный размер желудочков при наличии
выраженной кардиомегалии, определяемой при
рентгенографии грудной клетки, и нормальный
размер и систолическая функция ЛЖ отличает его
от дилатационной кардиомиопатии.
Гигантское ПП и апикальная облитерация вер-
хушки ПЖ позволяют заподозрить наличие болез-
ни Эбштейна. Однако нормальное прикрепление
створок трикуспидального клапана и очаговое по-
ражение областей притока и выносящего тракта
ПЖ служат отличительными признаками правосто-
тый тромб и утолщение миокарда, что позднее не
визуализируется из-за фиброза (рис. 27 .8). Наблю-
дается инверсия нормального размера сердца с
уменьшением камер желудочков и расширением
предсердий.
При поражении обеих сторон сердца обнаружи-
вается выраженное двухстороннее расширение
предсердий. Для поздней стадии заболевания харак-
терен рестриктивный тип наполнения. Вплоть до
поздней стадии заболевания наблюдается мини-
мальное изменение трансмитральной и транстри-
куспидальной скоростей кровотока, что позволяет
дифференцировать эндомиокардиальный фибро-
ластоз от констриктивного перикардита.
Рестриктивный паттерн наблюдается при пора-
жении обеих сторон с заметным укорочением вре-
мени замедления транстрикуспидального кровото-
ка. Также определяется перикардиальный выпот
различной степени. ЭхоКГ, по-видимому, является
единственным неинвазивным методом, позволяю-
щим выявить эндомиокардиальное поражение на
ранних стадиях [51]. Предполагают, что более ран-
ним маркером заболевания, возникающим еще до
появления эхокардиографических признаков, явля-
ется эозинофилия в периферической крови наряду
с увеличением уровня сердечного тропонина Т при
отсутствии других установленных причин для ее
возникновения.
Эндомиокардиальная биопсия демонстрирует
фиброзное утолщение эндокарда, представленное
коллагеновыми волокнами без наличия эластиче-
ских волокон, и иногда организованный тромб.
Рис. 27 .8 Гиперэозинофильная кардиомиопатия. Случай острого эозинофильного миокардита у 61-летнего мужчины с наличием тромба в области верхуш-
ки ЛЖ. После проявления гриппоподобных симптомов, одышки, общей слабости и снижения фракции выброса ЛЖ до 29% пациент прошел месячный курс
кортикостероидной терапии. На момент постановки диагноза показатель фракции выброса ЛЖ повысился до 52%, наблюдалось слабо выраженное утолщение
стенок ЛЖ, конечно-диастолический размер ЛЖ составил 57 мм. В периферической крови отмечалась эозинофилия в популяции лимфоцитов. Уровень тропони-
на незначительно выше, чем 0,012 (7,9 на момент постановки диагноза), а уровень N-терминального промозгового натрийуретического пептида составлял 1190.
(А) A В апикальной четырехкамерной позиции визуализируется тромб в области верхушки ЛЖ. (Б) При МРТ с гадолинием отмечались контрастирование в об-
ласти верхушки ЛЖ (стрелка) и тромб (*).
*
А
Б
In-27_для нас.indd 689
03.04.2019 12:03:11
690 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
роннего эндомиокардиального фиброэластоза от
болезни Эбштейна.
Раннее назначение альфа-интерферона и стерои-
дов и положительный ответ на лечение могут при-
вести к остановке фиброзного процесса, облегче-
нию симптомов и улучшению прогноза у этих па-
циентов.
ГЕМОХРОМАТОЗ
Наиболее распространенная форма наследственно-
го гемохроматоза включает генные мутации C282Y
в гене HFE. За это заболевание отвечают, как гены
HFE, так и гены не-HFE [52]. Отложение железа в
различных тканях организма приводит к их токси-
ческому повреждению. У пациентов часто наблюда-
ются неспецифические симптомы общего недо-
могания и заторможенности. Для верификации
диагноза может потребоваться проведение биохи-
мического анализа, визуализации и генетического
тестирования [53]. Исследование, в ходе которого
проводилось сравнение данных эхокардиографиче-
ского обследования пациентов с первичным ге-
мохроматозом и здоровыми лицами, показало, что
дилатация камер и глобальная систолическая дис-
функция являются общими признаками, и что ги-
пертрофия не является признаком кардиомиопатии
при гемохроматозе (рис. 27 .9) [54]. Увеличение
толщины может быть ранним проявлением заболе-
вания с прогрессированием до дилатационной кар-
диомиопатии на более поздних стадиях. Перегрузка
миокарда железом может быть оценена по неодно-
родной картине Т2 взвешенных изображений, воз-
никающей при накоплении железа (рис. 27 .10) [55].
ЛЖ
ЛП
Ао
Рис. 27.9 A Данные эхокардиографии при наследственном гемохро-
матозе. Цветовая допплерография в апикальной позиции по длинной оси у
56-летнего мужчины с наследственным гемохроматозом демонстрирует ми-
тральную регургитацию от умеренной до тяжелой степени (стрелка). Ao —
аорта; ЛЖ — левый желудочек; ЛП — левое предсердие.
САРКОИДОЗ
Саркоидоз представляет собой гранулематозное за-
болевание неизвестной этиологии с предрасполо-
женностью к определенным этническим группам,
таким как афроамериканцы. Часто при саркоидозе
первичным проявлением болезни является пораже-
ние легких. Выявление в эндомиокардиальном
биоптате гранулем без казеозного некроза имеет
низкую чувствительность (19,2%) для постановки
диагноза [56] из-за неоднородного распределения
патологических изменений и с преимущественным
скоплением гранулем в базальной части межжелу-
дочковой перегородки, где биопсию выполнить
сложнее. Поражение сердца отмечается у 25% паци-
ентов с системным саркоидозом.
Рестриктивная кардиомиопатия при саркоидозе
встречается редко, у 5% пациентов. Манифестацией
саркоидоза сердца могут быть аритмии, включая
обусловленную рубцами желудочковую тахикар-
дию [57], и внезапная смерть. Саркоидоз может
ошибочно диагностироваться как идиопатическая
или аритмогенная ПЖ кардиомиопатия. Из-за
слабой информативности эндомиокардиальной
биопсии диагноз часто выставляется на основании
комбинации данных электрокардиограммы, холте-
ровского мониторирования, ЭхоКГ, визуализации
перфузии миокарда, МР-томографии [58], и в по-
следнее время с помощью позитронно-эмиссион-
ной томографии с фтордезоксиглюкозой (18F) [59].
При саркоидозе контрастирование проявляется не-
однородно, а именно, у основания перегородки и
основания переднелатеральной стенки, и часто не
соответствует области кровоснабжения определен-
ной коронарной артерии. При радиоизотопном
сканировании (с таллием 201 или sestamibi) [60]
могут определяться дефекты поглощения радиои-
зотопов. Уровень мозгового натрийуретического
пептида является полезным биомаркером для иден-
тификации поражения сердца при наличии нор-
мальной фракции выброса.
Эхокардиографические признаки саркоидоза
сердца включают диастолическую дисфункцию с
сохранной систолической функцией [61], наруше-
ние подвижности стенок, аневризму ЛЖ, систоли-
ческую дисфункцию, дилатацию камер сердца с
нарушением проводимости и диастолической ми-
тральной и трикуспидальной регургитацией и пе-
рикардиальный выпот (рис. 27 .11). Поражение при
саркоидозе более выражено в верхних отделах меж-
желудочковой перегородки, где может наблюдаться
истончение, нарушения подвижности стенки и
асимметричная гипертрофия перегородки [62]. На
поздних стадиях заболевания при прогрессирова-
нии интерстициального фиброза может возникать
истончение стенки желудочка.
Прогноз при поражении сердца неблагоприя-
тен. Пробная стероидная и иммуносупрессивная
терапия применяется у пациентов с наличием сим-
In-27_для нас.indd 690
03.04.2019 12:03:12
691
27 Рестриктивная кардиомиопатия
Рис. 27 .10 МРТ при наследственном гемохроматозе. Интенсивность сигнала при МРТ зависит от концентрации протонов в ткани (например, в жире, воде,
белке или миокарде). Контраст на МРТ-изображениях регулируется путем изменения параметров импульсного режима (длина, время, время повторения импуль-
са и время эхо-задержки (время между начальным импульсом и отраженным сигналом)). Для каждого изображения увеличено время эхо-задержки; чем быстрее
затемняется изображение, тем больше железа присутствует.
Рис. 27 .11 Эхокардиографические признаки саркоидоза сердца. Мужчина, 52 года, с кардиомиопатией при саркоидозе. Диагноз был поставлен в возрас-
те 34 лет. В возрасте 35 лет в связи с полной блокадой сердца и снижением фракции выброса левого желудочка пациенту возникла необходимость имплантиро-
вать кардиовертер-дефибриллятор и кардиостимулятор. Функциональный класс по NYHA улучшился с IV (на момент постановки диагноза) до II. (А) Парастер-
нальная позиция по длинной оси. (Б) Парастернальная позиция по короткой оси на уровне середины папиллярных мышц. (В) A Апикальная четырехкамерная
позиция (левый желудочек слева). (Г) A Апикальная трехкамерная позиция. На (А) наблюдается истончение базального переднего сегмента, на (Б, Г) — очаго-
вые аневризматические изменения медиального нижнего сегмента, базального нижнебокового сегмента и базального бокового сегмента. Фракция выброса 45%.
А
Б
Г
В
In-27_для нас.indd 691
03.04.2019 12:03:13
692
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
птомов на раннем этапе острого воспаления. В
устойчивых к терапии случаях эффективно при-
менение моноклональных антител к фактору не-
кроза опухолей. Благодаря улучшению технологий
электрокардиостимуляции и антиаритмической
терапии (в том числе имплантируемых кардиовер-
тер-дефибрилляторов и лекарственных препара-
тов) на сегодняшний день при саркоидозе сердца
редко наблюдаются случаи внезапной смерти. Ос-
новной причиной летального исхода при данном
заболевании чаще становится хроническая сердеч-
ная недостаточность. В случае устойчивости к те-
рапии пациентам может быть показана трансплан-
тация сердца.
БОЛЕЗНИ НАКОПЛЕНИЯ [63]
БОЛЕЗНЬ ГОШЕ
Болезнь Гоше — наиболее распространенная лизо-
сомальная болезнь накопления, обусловленная на-
следственным дефицитом лизосомального фермен-
та глюкоцереброзидазы.
Эхокардиографические признаки при ненейро-
нопатическом (взрослом) типе этого заболевания
включают увеличение массы ЛЖ с мышечным вы-
ступом межжелудочковой перегородки, областями
апикальной акинезии и изменения перикарда [64].
БОЛЕЗНЬ ПОМПЕ
Болезнь Помпе (болезнь накопления гликогена)
возникает из-за дефицита альфа-1,4-глюкозидазы и
характеризуется прогрессирующим отложением
гликогена во всех тканях. Болезнь наследуется по
аутосомно-рецессивному типу, встречается с часто-
той1:40000.
Болезнь Помпе приводит к повышению уровня
мышечного фермента креатинфосфокиназы, лак-
татдегидрогеназы, аланинаминотрансферазы и ас-
партатаминотрансферазы в 90–95% случаев. Диа-
гноз верифицируется с помощью определения
дефицита альфа-глюкозидазы в лейкоцитах, фи-
бробластах или мышечной ткани.
Классическая инфантильная форма заболевания
развивается у детей на первых месяцах жизни и ха-
рактеризуется генерализованной гипотонией, за-
держкой в развитии и сердечно-легочной недоста-
точностью.
Эхокардиографические признаки включают вы-
раженное утолщение межжелудочковой перегород-
ки, свободной и задней стенок ЛЖ [65] с опухоле-
видным изменением сосочковых мышц, маленькой
полостью ЛЖ и нарушением его функции. Комби-
нация данных ЭхоКГ и электрокардиографии по-
могает в постановке клинического диагноза и опре-
делении степени поражения сердца при этом забо-
левании.
Положительные эффекты применения рекомби-
нантной альфа-глюкозидазы человека зарегистри-
рованы как у пациентов с классической инфантиль-
ной формой [66], так и у пациентов с неклассиче-
ской или поздней формой заболевания [67].
Заместительная ферментная терапия приводит к
обратному развитию гипертрофии сердца и облег-
чает симптомы сердечной и дыхательной недоста-
точности и слабости скелетных мышц, тогда как
поражение периферических мотонейронов не под-
дается лечению [68].
БОЛЕЗНЬ ФАБРИ
Редкий X-сцепленный рецессивный сфинголипи-
доз, возникающий в результате нарушения актив-
ности лизосомального фермента альфа-галактози-
дазы А. Соответственно, у гемизиготных лиц муж-
ского пола заболевание протекает в наиболее
тяжелых формах, а у гетерозиготных лиц женского
пола обычно наблюдается менее выраженная кли-
ническая картина. Ферментативный дефект при
этой лизосомной болезни накопления приводит к
отложению глоботриаозилцерамида в различных
органах, включая кожу, почки, нервную систему,
роговицу и сердце.
При болезни Фабри поражение сердца может
являться как признаком проявления заболевания,
так возникать в сочетании с поражением других
органов.
Эхокардиографические признаки включают рас-
ширение корня аорты, генерализованное асимме-
тричное утолщение стенок миокарда, дисфункцию
миокарда и, в конечном счете, дилатацию камер
сердца и нарушение функции клапанов, в первую
очередь митрального клапана [69]. Утолщение сте-
нок желудочка возникает в результате накопления
глоботриаозилцерамида в кардиомиоцитах и кле-
точной гипертрофии.
У женщин заболевание протекает в субклиниче-
ской форме. Тем не менее, у более половины гете-
розиготных женщин при ЭхоКГ могут выявляться
признаки гипертрофии сердца [70]. Методами ве-
рификации диагноза являются проведение эндоми-
окардиальной биопсии или определение активности
альфа-галактозидазы А в плазме крови. Вакуолиза-
ция саркоплазматического ретикулума — классиче-
ский признак, выявляемый при световой микроско-
пии тканей, окрашенных гематоксилин-эозином.
При электронной микроскопии в саркоплазме кле-
ток миокарда определяются концентрические пла-
стинчатые тельца. В ходе двух исследований болезнь
Фабри была диагностирована у 3–4% мужчин с кон-
центрической гипертрофией ЛЖ [71, 72]. У 4% па-
циентов с болезнью Фабри может встречаться асим-
метричная гипертрофия перегородки.
При отсутствии лечения у пациентов с болезнью
Фабри наблюдается прогрессивное нарушение си-
столической функции ЛЖ. В ходе крупного пере-
крестного исследования когорты пациентов из кли-
нического и генетического регистра болезни Андер-
In-27_для нас.indd 692
03.04.2019 12:03:14
693
27 Рестриктивная кардиомиопатия
сона–Фабри было продемонстрировано, что медиа-
на кумулятивной выживаемости при данном
заболевании составляет 50 лет, что представляет
собой приблизительное 20-летнее сокращение про-
должительности жизни [73].
Было продемонстрировано, что проведение фер-
ментной заместительной терапии приводит к выве-
дению отложений глоботриаозилцерамида из эндо-
телия сосудов [74]. При этом методе лечения также
отмечается снижение массы ЛЖ и улучшение систо-
лической функции [75].
ЛЕКАРСТВЕННАЯ РЕСТРИКТИВНАЯ КАРДИОМИОПАТИЯ
Кардиотоксический эффект при приеме антра-
циклина проявляется фиброзным утолщением эн-
докарда ЛЖ с признаками рестриктивной кардио-
миопатии [76]. Ультраструктурные нарушения ми-
оцитов с утратой миофибрилл и вакуолизацией
цитоплазмы наблюдаются при кардиотоксическом
эффекте как антрациклинов, так и хлорохина. Сра-
зу после отмены хлорохина было продемонстриро-
вано обратное развитие как признаков рестрикции,
так и концентрической гипертрофии ЛЖ [77].
ПОСТРАДИАЦИОННАЯ КАРДИОМИОПАТИЯ
Частота радиационно-индуцированного заболева-
ния сердца растет по мере увеличения выживаемо-
сти пациентов со многими злокачественными ново-
образованиями. Наибольшую группу с радиацион-
но-индуцированной болезнью сердца составляют
пациенты, перенесшие болезнь Ходжкина, за кото-
рыми следуют пациенты, перенесшие неходжкин-
ские лимфомы, злокачественные новообразования
пищевода, тимомы, рак легких, рак молочной желе-
зы и метастатическую семиному (рис. 27 .12). Пора-
жение перикарда является наиболее известным
проявлением радиационно-индуцированной болез-
ни сердца, наблюдаемый клинически у 60–70% па-
циентов, перенесших облучение средостения [78]. К
проявлениям заболевания относятся острый пери-
кардит, перикардиальный экссудат с тампонадой
или без нее, а также констриктивный перикардит.
Почти у всех пациентов, у которых развивается ра-
диационно-индуцированная болезнь сердца, через
3–4 нед после облучения возникает перикардиаль-
ный экссудат с относительной синусовой тахикар-
дией. Эти проявления могут носить транзиторный
характер. Через 6–12 мес после облучения возника-
ют поздние повреждения, проявляющиеся перикар-
диальным экссудатом с последующим поражением
миокарда и склерозом коронарных сосудов, завися-
щий от поля и дозы облучения. Обычно наблюда-
ется обструктивное поражение сегментов устья ко-
ронарных артерий и основного ствола левой коро-
нарной артерии. У пациентов с установленными
факторами риска ишемической болезни сердца по-
вышен риск постлучевого обструктивного пораже-
ния коронарных сосудов [81].
При наличии констриктивных заболеваний ра-
диационно-индуцированная рестриктивная карди-
омиопатия может быть сопутствующей. В подоб-
ных случаях наблюдается комбинация эхокардио-
графических признаков (рис. 27 .13) [79]. Важными
факторами риска радиационно-индуцированного
заболевания сердца являются предшествующая хи-
миотерапия, радиационное облучение, превышаю-
щее 4000 рад, и локализация поля облучения рядом
с сердцем и на левой стороне грудной клетки [82].
В течение последующего 12-летнего наблюдения
было обнаружено, что применение доксорубицина
у детей при остром лимфобластном лейкозе связа-
но с хроническим прогрессирующим нарушением
функции сердца и развитием рестриктивной карди-
омиопатии, характеризующейся снижением массы
сердца, уменьшением размера, истончением стенки
и также снижением систолической функции ЛЖ.
Несмотря на то, что кардиомиопатия чаще наблю-
далась после лечения доксорубицином в высоких
дозах, были отмечены случаи ее возникновения
даже после применения низких доз доксорубицина
[83].
Рис. 27 .12 Данные двухмерной эхокардиографии при радиационно-индуцированной кардиомиопатии. 59-летний мужчина с хронической одышкой
при физической нагрузке и лучевой терапией по поводу лимфомы Ходжкина в анамнезе, нуждающийся в биопротезировании митрального клапана. (A) A
В апикальной четырехкамерной позиции определяется парадоксальное движение межжелудочковой перегородки и биопротез митрального клапана обычного
вида (на изображении ЛЖ и ЛП располагаются слева). (Б) A В субкостальной позиции определяется фиксация ПЖ к диафрагме перикардиальными спайками.
(В) A В субкостальной позиции визуализируется расширенная нижняя полая вена с уменьшением спадения на вдохе.
А
Б
В
In-27_для нас.indd 693
03.04.2019 12:03:14
694
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
У всех пациентов, перенесших облучение груд-
ной клетки, необходимо выполнять серийное кар-
диологическое обследование, особенно у тех, кто
получил > 5000 рад в области сердца. Превентивные
меры включают соответствующую защиту сердца и
применение наименьшей возможной дозы облуче-
ния.
Gustavsson и его коллеги [80] обнаружили сниже-
ние сократимости ЛЖ у 44%, уменьшение диасто-
лического размера ЛЖ у 28% и признаки диастоли-
ческой дисфункции у 50% пациентов, перенесших
облучение средостения. Наиболее заметным пато-
логическим изменением является диффузный ин-
терстициальный фиброз, наблюдаемый главным
образом в правом желудочке, что обусловлено,
по-видимому, широким использованием передних
полей облучения. Это сопровождается, как правило,
развитием рестриктивной кардиомиопатии, приво-
дящей к застойной сердечной недостаточности.
Обструктивное поражение коронарных артерий
Рис. 27 .13 Данные импульсно-волновой допплерографии при кардиомиопатии, индуцированной облучением. 59-летний мужчина с хронической
одышкой при физической нагрузке и лучевой терапией по поводу лимфомы Ходжкина в анамнезе, нуждающийся в биопротезировании митрального клапана.
(A) Импульсно-волновая допплерография трансмитрального кровотока демонстрирует незначительную респираторную вариабельность и рестриктивный тип на-
полнения с коротким временем замедления кровотока (стрелка) (несмотря на наличие 29-миллиметрового биопротеза митрального клапана), что свидетельству-
ет о ригидности ЛЖ с высоким давлением наполнения. (Б) Визуализация кровотока через трикуспидальный клапан с помощью импульсно-волновой допплеро-
графии демонстрирует минимальную A-волну — «прямой кровоток» на вдохе (с заметным обратным кровотоком из предсердия в печеночную вену, указывающим
на недостаточность ПЖ). Время замедления трикуспидального кровотока постепенно укорачивается на вдохе (стрелки). Время замедления кровотока во время
апноэ составляет 210 мсек, во время первого удара на вдохе — 180 мсек, а во время второго удара на вдохе — 160 мсек, что указывает на недостаточность ПЖ.
(В) Импульсно-волновая допплерография печеночной вены. Скорости ниже базовой линии отражают венозный приток в сердце, а выше базовой линии — обрат-
ный ток в печеночную вену. При вдохе (белые стрелки) время притока сокращается (показано более крутым наклоном сигнала скорости) и увеличивается ревер-
сия A-волны (красные стрелки) в печеночную вену, что свидетельствует о недостаточности ПЖ вследствие увеличения его объема на вдохе. Эти изменения со-
гласуются с сокращением времени замедления трикуспидального кровотока, наблюдаемого с помощью импульсно-волновой допплерографии (Б). Эти признаки
характерны для рестриктивной кардиомиопатии, а не перикардиальной констрикции. (Г) Отслеживание давления ЛЖ и ПЖ демонстрирует выравнивание конеч-
ных диастолических давлений ПЖ и ЛЖ. На вдохе увеличивается наклон подъема как быстрых волн заполнения ПЖ, так и ЛЖ (красная стрелка). Согласование
систолического давления ЛЖ и ПЖ во время вдоха и выдоха показано черными пунктирными стрелками. Данные признаки характерны для рестриктивной кар-
диомиопатии, а не перикардиальной констрикции. Эти признаки наблюдались, несмотря на дегидратацию и состояние венозной дилатации во время катетериза-
ции сердца со снижением систолического артериального давления со 140 мм рт. ст. в начале процедуры до 85 мм рт. ст. во время катетеризации. Полученные
данные согласуются с сокращением времени замедления трикуспидального кровотока, оцениваемого с помощью продемонстрированной ранее импульсно-вол-
новой допплерографии.
90
70
81
81
80
77
77
82
82
80
20
30
10
0
14
14
12
14
13
10
14
40
50
60
32
32
29
28
32
32
30
100
Вдох
Вдох
Выдох
А
Б
Г
В
In-27_для нас.indd 694
03.04.2019 12:03:14
695
27 Рестриктивная кардиомиопатия
обычно вовлекает сегменты коронарных артерий и
основной ствол левой коронарной артерии, с более
высоким риском, по-видимому, у пациентов с уста-
новленными факторами риска развития ишемиче-
ской болезни сердца [81]. Важными факторами
риска развития радиационно-индуцированной бо-
лезни сердца являются предшествующая химиоте-
рапия, радиационное облучение, превышающее
4000 рад, и локализация поля облучения рядом с
сердцем и с левой стороны грудной клетки [82]. В
течение последующего 12-летнего наблюдения бы-
ло обнаружено, что применение доксорубицина у
детей при остром лимфобластном лейкозе связано
с хроническим прогрессирующим нарушением
функции сердца и развитием рестриктивной карди-
омиопатии, характеризующейся снижением массы
сердца, уменьшением размера, истончением стенки
и также снижением систолической функции ЛЖ.
Несмотря на то что кардиомиопатия чаще наблю-
далось после лечения доксорубицином в высоких
дозах, были отмечены случаи ее возникновения
даже после применения низких доз доксорубицина
[83].
ДРУГИЕ ПРИЧИНЫ РАЗВИТИЯ
РЕСТРИКТИВНОЙ КАРДИОМИОПАТИИ
Проявления метастатических злокачественных лим-
фом может быть сходно с рестриктивной кардио-
миопатией [84]. Болезни соединительной ткани,
такие как склеродермия и системная красная вол-
чанка, карциноидная болезнь сердца [85], а также
поздние стадии гипертрофической обструктивной
кардиомиопатии могут сопровождаться признака-
ми рестриктивной кардиомиопатии (рис. 27 .14).
Первичная оксалурия может быть причиной редкой
формы инфильтративной кардиомиопатии [86]. У
пациентов с рестриктивной кардиомиопатией мо-
гут встречаться кальцинированные эндокардиаль-
ные полоски, обусловленные эластической псевдок-
сантомой.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
РЕСТРИКТИВНОЙ КАРДИОМИОПАТИИ
И КОНСТРИКТИВНОГО ПЕРИКАРДИТА
У всех пациентов с непропорционально выражен-
ной правосердечной недостаточностью на фоне
нормальной или незначительно сниженной систо-
лической функции ЛЖ и нормальной клапанной
функцией необходимо рассматривать возможность
наличия констриктивного перикардита и рестрик-
тивной кардиомиопатии. Учитывая, что пери-
кардэктомия может оказать положительный эф-
фект в лечении констриктивного перикардита, и
что проведение эксплоративной операции при ре-
стриктивной кардиомиопатии нежелательно, важно
дифференцировать эти два заболевания. Ряд иссле-
дований предоставляет информацию о специфиче-
ских 2D и допплеровских признаках, которые помо-
гают провести дифференциальную диагностику
между рестриктивной кардиомиопатией и кон-
стриктивным перикардитом [92, 96, 97]. Эхокар-
диографические признаки дифференциальной
диагностики рестриктивной кардиомиопатии и
состояний, сопровождающихся констриктивным
перикардитом, приведены в табл. 27 .4 . Анамнез
предшествующего перикардита, оперативного вме-
шательства и облучения позволяет с большей веро-
ятностью диагностировать констрикцию. Кальци-
ноз перикарда на рентгенограмме грудной клетки и
утолщение перикарда при компьютерной томогра-
фии являются диагностическими признаками кон-
стрикции. В некоторых случаях компьютерная то-
мография не позволяет дифференцировать пери-
E
E
L
L
A
A
Мвзк
90 мсек
HR 60
HR 40
Рис. 27 .14 Терминальная стадия гипертрофической кардиомиопатии. У 67-летнего пациента с гипертрофической кардиомиопатией наблюдается нараста-
ние сердечной недостаточности на фоне приема пропранолола в низких дозах. Частота сердечных сокращений составляла 46 уд/мин; артериальное давление —
90/58 мм рт. ст.; наблюдается вздутие шейных вен и периферические отеки; на ЭКГ отмечены признаки гипертрофии ЛЖ с глубокими инвертированными зубца-
ми Т. (A) A В апикальной четырехкамерной позиции визуализируется выраженное расширение ЛП (левые отделы сердце на изображении слева). (Б) Импуль-
сно-волновая допплерография трансмитрального кровотока демонстрирует короткое время замедления митральной E-волны 90 мсек (красная стрелка).
(В) Цветовой M-режим показывает заметную L-волну и небольшую А-волну, что указывает на повышенную ригидность ЛЖ. Трансмитральное наполнение начи-
нается до того, как ЛЖ расслабляется, что приводит к быстрому повышению давления и очень короткому времени замедления трансмитрального кровотока (Мвзк).
Когда ЛЖ наконец начинает расслабляться, давление в ЛЖ падает и восстанавливается ЛП-ЛЖ -градиент, что приводит к возникновению L-волны наполнения.
Маленькая A-волна указывает на ригидность ЛЖ после E-волны и L-волны наполнения, а также на нарушение систолической сократительной функции ЛП.
А
Б
В
In-27_для нас.indd 695
03.04.2019 12:03:15
696 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рестриктивная
кардиомиопатия
Констриктивный перикардит
Перикард
В пределах нормы
Утолщен
ЛЖ
Маленький
Маленький
Может наблюдаться систоличе-
ская дисфункция
Систолическая функция обычно не нарушена, но может
отмечаться нарушение, особенно после АКШ или
облучения
Дрожание перегородки
отсутствует
Дрожание или смещение перегородки
Предсердие
Обычно расширено
Обычно не расширено, но на поздних стадиях может
наблюдаться расширение
Трансмитральный и трикуспи-
дальный кровоток
Увеличение отношения E/A,
короткое ВЗК
Увеличение отношения E/A, короткое ВЗК
Отсутствие респираторной
> 25% увеличение скорости E трансмитрального кровотока
на выдохе
вариабельности скорости E
> 25% увеличение скорости E трикуспидального кровотока
на вдохе
Диастолическая МР
Диастолическая МР
Скорости тканевой
допплерографии
Заметное снижение
От нормальных до увеличенных (парадоксальное движение
фиброзного кольца), медиальная E′, латеральная E′ (ревер-
сивное движение фиброзного кольца)
Циркулярная деформация
Норма
Снижена
Пиковая радиальная деформа-
ция основания ЛЖ
Норма
Снижена
Скручивание
Норма
Снижено
Продольная деформация
основания
Снижена
Норма
Скорость раскручивания
верхушки
Норма
Снижена
Кровоток в легочных венах
Снижение (0,5) отношения С/Д Отношение С/Д = 1
Выраженная реверсия в
предсердие
Снижение S- и D-волн на вдохе
Отсутствие значительной
респираторной
вариабельности
Нижняя полая вена
Расширена
Расширена
Печеночные вены
Сниженное соотношение С и Д Вдох: минимальное увеличение скоростей в С и Д; выдох:
снижение диастолического кровотока и диастолическая
реверсия, отношение реверсии кровотока на выдохе и
вдохе > 0,79, > 25% увеличение реверсии кровотока в
предсердии на выдохе, по сравнению с вдохом
Пиковое давление ЛА
>40ммрт.ст.
<40ммрт.ст.
Цветовой M-режим
Снижение Vp < 45 см/сек
Нормальная или увеличенная > 100 см/сек
Допплерография митрального
кольца
Низкая скорость < 8 см/сек
Высокая скорость ≥ 8 см/сек
АКШ — аорто-коронарное шунтирование; ВЗК — время замедления кровотока; Д — диастолический; ЛА — легочная артерия; ЛЖ —
левый желудочек; МР — митральная регургитация; С — систолический.
[Kushwaha S, Fallon JT, Fuster V. Restrictive cardiomyopathy. N Eng J Med 336:267–276, 1997; Goldstein JA: Cardiac tamponade, constrictive
pericarditis, and restrictive cardiomyopathy. Curr Probl Cardiol 29:503–567, 2004.]
ТАБЛИЦА 27.4 Эхокардиографические признаки рестриктивной кардиомиопатии и констриктивного перикардита
In-27_для нас.indd 696
03.04.2019 12:03:15
697
27 Рестриктивная кардиомиопатия
кардиальную жидкость и утолщенные ткани
перикарда. Магнитно-резонансная томография
обеспечивает комплексную визуализацию перикар-
да, обладая большей эффективностью в определе-
нии перикардиального экссудата и толщины пери-
карда, чем компьютерная томография и ЭхоКГ. В
силу сказанного ранее, компьютерная томография
или магнитно-резонансная томография должны
использоваться при невозможности поставить диа-
гноз с помощью ЭхоКГ [87]. Чувствительность
трансторакальной 2D-ЭхоКГ в определении утол-
щенного перикарда является низкой, по сравнению
с чреспищеводной эхокардиографией (ЧПЭхоКГ).
Толщина перикарда не менее 3 мм, измеренная с
помощью ЧПЭхоКГ, демонстрирует чувствитель-
ность 95% и специфичность 86% для диагностики
утолщения перикарда [88]. Тем не менее примерно
у 18% пациентов с хирургически подтвержденной
констрикцией толщина перикарда при неинвазив-
ной визуализации может быть не увеличена из-за
неоднородного характера его поражения [89]. Ре-
зультаты хирургической перикардэктомии наибо-
лее благоприятны у пациентов с идиопатическим
перикардитом с последующей послеоперационной
констрикцией.
Как при констриктивном перикардите, так и при
рестриктивной кардиомиопатии наблюдается по-
вышение внутрисердечного давления наполнения.
Тем не менее, ригидный перикард характеризуется
двумя патофизиологическими процессами, имею-
щими специфические эхокардиографические при-
знаки, отличающие его от ригидного желудочка.
Важнейшие патофизиологические процессы при
констриктивном перикардите — диссоциация вну-
тригрудного и внутрисердечного давления и повы-
шенное взаимодействие желудочков. Таким обра-
зом, отрицательное давление в грудной клетке во
время вдоха не передается в сердечные камеры, что
приводит к уменьшению трансмитрального гради-
ента во время фазы вдоха, вторичному значитель-
ному снижению давления в легочных венах, по
сравнению с диастолическим давлением в ЛЖ. Вза-
имодействие желудочков не наблюдается при ре-
стриктивной кардиомиопатии. При констриктив-
ном перикардите происходит резкое диастолическое
смещение межжелудочковой перегородки в сторону
ЛЖ во время вдоха и к ПЖ во время выдоха. Доп-
плеровская ЭхоКГ помогает выявить повышенное
взаимодействие желудочков при констриктивном
перикардите, демонстрируя выраженные респира-
торные вариации в допплеровском митральном и
трикуспидальном потоках. Характерная респира-
торная вариабельность в допплеровских скоростях
кровотока у пациентов с констрикцией, не наблю-
даемая у пациентов с рестрикцией, включает более
чем на 25% увеличение скорости трансмитрального
кровотока E на выдохе и снижение скорости диасто-
лического кровотока в печеночных венах; более чем
на 25% увеличение диастолических реверсивных
потоков в печеночной вене, по сравнению со скоро-
стью кровотока на вдохе; большая респираторная
вариабельность кровотока в легочных венах; и
систолическая скорость кровотока в легочных венах
ниже диастолической скорости кровотока во время
дыхания [90, 91]. Ранняя диастолическая скорость
митрального кольца (E′), измеряемая с помощью
тканевой допплерографии, может использоваться
для дифференциальной диагностики констриктив-
ного перикардита и рестриктивной кардиомиопа-
тии [9]. У пациентов с констриктивным перикарди-
том отмечается значительное увеличение E′ в пере-
городочной части кольца, чем у пациентов с
первичной рестриктивной кардиомиопатией или с
амилоидозом сердца. В частности, пороговое значе-
ние E′ не менее 8 см/сек позволяет дифференциро-
вать эти два состояния с высокой чувствительно-
стью и специфичностью (чувствительность 95% и
96%-я специфичность). При отсутствии диагности-
ческих признаков респираторной вариабельности
чрезмитрального кровотока более чем 25%, нор-
мальное значение скорости митрального кольца E′,
наблюдаемое у пациентов с констрикцией, помога-
ет дифференцировать констриктивный перикардит
от рестриктивной кардиомиопатии [98].
Подобно увеличенной скорости митрального
кольца E′, сохраняющаяся диастолическая функция
у пациентов с констрикцией проявляется скоростью
быстрого распространения в цветовом М-режиме
> 100 см/сек. У пациентов с констрикцией макси-
мальная скорость достигает верхушку почти мгно-
венно, по сравнению с наличием значительной за-
держки у пациентов с рестрикцией. Даже если ис-
следование кровотока через митральный клапан и в
легочных венах не позволяет поставить диагноз,
методы тканевой допплерографии и цветового
М-режима позволяют правильно дифференциро-
вать констриктивный перикардит и рестриктивную
кардиомиопатию. Наличие смещения межжелудоч-
ковой перегородки в сочетании с медиальной e′,
равной по крайней мере 9 см/сек, или коэффициент
диастолической реверсии в печеночной вене на вы-
дохе, составляющей по меньшей мере 0,79, с чув-
ствительностью 87% и специфичностью 91% корре-
лирует с диагнозом перикардиальной констрикции
и позволяет дифференцировать его от рестриктив-
ной кардиомиопатии. У некоторых пациентов, ко-
торым проводили форсированный диурез, нагрузка
объемом помогает выявить специфические особен-
ности констриктивного перикардита [92]. Альтер-
нативно, сокращение преднагрузки помогает выя-
вить респираторную вариабельность у пациентов с
повышенной нагрузкой объемом [93]. У некоторых
пациентов может наблюдаться сочетание признаков
рестриктивной кардиомиопатии и констриктивно-
го перикардита. К этой группе относятся пациенты
с активным миокардитом, пострадиационной кар-
In-27_для нас.indd 697
03.04.2019 12:03:15
698 ЧАСТЬ V Кардиомиопатия и заболевания перикарда
диомиопатией или другими формами кардиомио-
патии. У пациентов с клиническими и эхо-доппле-
ровскими признаками рестриктивной кардиомио-
патии все же необходимо исключить констрикцию.
Результаты использования 2D-спекл-трекинг по-
казали, что деформация ЛЖ ограничена при кон-
стриктивном перикардите в циркулярном направ-
лении, а при рестриктивной кардиомиопатии — в
продольном [94]. Продольная тканевая допплеров-
ская скорость E′ 5 см/сек имела чувствительность
92% и специфичность 90%, пиковая скорость рас-
кручивания –50°/сек имела чувствительность 57% и
специфичность 95%, а скручивание (твист) ЛЖ 10°
имело чувствительность 83% и специфичность 84%
при дифференцировании констриктивного пери-
кардита от рестриктивной кардиомиопатии. В част-
ности, средняя скорость, полученная с помощью
тканевой допплерографии, усредненная из четы-
рех базальных сегментов ЛЖ, превышающая 5 см/
сек, позволила разделить всех пациентов с кон-
стрикцией и рестрикцией, тогда как отмечалось
перекрытие результатов для уровня мозгового на-
трийуретического пептида и импульсно-волновой
допплеровской скорости базального сегмента пе-
регородки [95].
При выявлении клинических и эхо-допплеров-
ских признаков рестриктивной кардиомиопатии
необходимо провести биохимические тесты для
определения причины рестриктивной кардиомио-
патии, такие как электрофорез белков в сыворотке
крови или моче, определение уровня железа и т.д.;
следует рассмотреть возможность проведения эндо-
миокардиальной биопсии. В ряде исследований
были опубликованы данные о специфических 2D и
допплеровских признаках, помогающих дифферен-
цировать рестриктивную кардиомиопатию от кон-
стриктивного перикардита [92, 96, 97]. Учитывая
положительный терапевтический эффект пери-
кардэктомии у отдельных пациентов с констрик-
тивным перикардитом и нежелательном диагности-
ческом хирургическом вмешательстве при рестрик-
тивной кардиомиопатии, важна дифференциальная
диагностика этих двух заболеваний. Эхокардиогра-
фические признаки дифференциальной диагности-
ки рестриктивной кардиомиопатии и констриктив-
ного перикардита приведены в табл. 27 .4 .
Ранняя диастолическая скорость митрального
кольца (E′), измеренная с помощью тканевой доп-
плерографии, может быть использована для диф-
ференциации констриктивного перикардита от ре-
стриктивной кардиомиопатии [9]. E’ в перегородоч-
ной части кольца значительно выше у пациентов с
констриктивным перикардитом, чем у пациентов с
первичной рестриктивной кардиомиопатией или
амилоидозом сердца. В частности, пограничное зна-
чение E’ не менее 8 см/сек позволяет различить эти
два заболевания с высокой чувствительностью и
специфичностью (95% чувствительность и 96%
специфичность). Даже у пациентов, не имеющих
диагностической вариабельности трансмитрально-
го кровотока на вдохе более чем 25%, сохранение
скорости митрального кольца E’ в пределах нормы
помогает дифференцировать констриктивный пе-
рикардит от ограничительной кардиомиопатии
[98–100].
Подобно увеличенной скорости митрального
кольца E’, сохранение диастолической функции у
пациентов с констрикцией проявляется скоростью
быстрого распространения в цветовом М-режиме
> 100 см/сек. У пациентов с констрикцией кровь
быстро достигает верхушки, по сравнению со зна-
чительной задержкой у пациентов с рестрикцией.
Даже если при исследовании кровотока через ми-
тральный клапан и в легочных венах диагностиче-
ских признаков не выявлено, методы тканевой
допплерографии и цветового M-режима позволяют
правильно дифференцировать констриктивный
перикардит и рестриктивную кардиомиопатию.
Другим характерным признаком, определяемым с
помощью импульсно-волновой допплерографии,
является возникновение диастолической реверсии
кровотока в печеночной вене на выдохе при кон-
стрикции, в отличие от диастолической реверсии
кровотока на вдохе при рестриктивной кардиомио-
патии (см. рис. 27 .13).
Часто эхокардиографические признаки не явля-
ются достоверными, и необходимо проведение ка-
тетеризации с оценкой гемодинамики и выполне-
нием эндомиокардиальной биопсии. Было предло-
жено три критерия для дифференциации этих
состояний: (1) выравнивание давления (разница
между конечно-диастолическим давлением в ПЖ и
конечно-диастолическим давлением в ЛЖ < 5 мм
рт. ст. более характерна для констрикции). (2) Кон-
стрикция чаще сопровождается незначительным
подъемом систолического давления в ПЖ (< 50 мм
рт. ст.), тогда как при рестрикции систолическое
давление в ПЖ обычно превышает 50 мм рт. ст. (3)
При констрикции конечно-диастолическое давле-
ние в ПЖ превышает одну треть систолического
давления в ПЖ, тогда как при рестрикции это зна-
чение составляет менее одной трети.
In-27_для нас.indd 698
03.04.2019 12:03:16
699
27 Рестриктивная кардиомиопатия
Показатель
Метод
визуализации Проекция
Получение
изображений
Измерения
Интерпретация
Толщина стенки
ЛЖ
2D, M-режим,
3D
ПДО, ПКО,
апикальная,
субкосталь-
ная
Горизонтально
МЖП в парастер-
нальных
проекциях
МЖП, ЗС, ОТС,
масса ЛЖ
(M-режим, 2D и
3D)
Гипертрофия миокарда неу-
становленной этиологии
Размер ЛЖ
2D, M-режим
ПДО, ПКО
Перпендикулярно к
МЖП
КДД ЛЖ, КСР
ЛЖ
Обычно небольшие размеры
ЛЖ
Объем ЛЖ
2D, 3D
Апикальная
четырех-,
двух- и
трехкамер-
ная
Без ракурсов, при
необходимости
контраст
КСО ЛЖ, КДО
ЛЖ, УО
Уменьшение объемов ЛЖ
Структура мио-
карда ЛЖ
2D
ПДО, ПКО
Может наблюдаться пятни-
стость миокарда; иногда
тромбы в верхушке или
желудочке, несмотря на
нормальную подвижность
прилежащей стенки
Движение МЖП
2D, M-режим
ПДО, ПКО,
апикальная,
субкосталь-
ная
Визуально
Признак квадратного корня
в МЖП и нижнебоковое
движение стенки
Размер ЛП
2D
ПДО, апи-
кальная
проекция
Проекция предсер-
дия без ракурса
ПЗ диаметр,
объем/м2
Обычно выра женное расши-
рение ЛП
Размер ПП
2D
Апикальная
четырехка-
мерная
Проекция верхушки
без ракурса, с
фокусированием
на ПЖ
ПЗ диаметр ЛП,
объем/м2
Обычно выра женное расши-
рение ПП
Размер ПЖ
2D
ПДО, ПКО,
путь
притока
ПЖ, апи-
кальная
четырехка-
мерная,
субкосталь-
ная
КД длина ПЖ,
КД диметр
ВТПЖ, основа-
ния и среднего
отдела ПЖ
Перикард
2D, M-режим
ПДО, ПКО,
путь
притока
ПЖ, апи-
кальная
четырехка-
мерная,
субкосталь-
ная
Респираторная
вариабельность
кровотока через
митральный, три-
куспидальный
клапаны, в ЛВ и
печеночной вене
Экссудат,
толщина и
яркость
Может наблюдаться неболь-
шой перикардиальный
экссудат
Клапаны
2D, M-режим,
цветовая
допплерогра-
фия
ПДО, ПКО,
апикальные
Сфокусированные
на клапан проек-
ции, использова-
ние увеличения
изображения
Степень
регургитации
Равномерное утолщение
атриовентрикулярного
клапана, иногда утолщение
межпредсердной
перегородки
Количественное
оценка регургита-
циипоPISAис
помощью уравне-
ния
непрерывности
Митральная и трикуспидаль-
ная регургитация, обуслов-
ленные поражением
створок или сосочковых
мышц (как при эндомио-
кардиальном фиброзе)
СВОДНАЯ ИНФОРМАЦИЯ
Рестриктивная кардиомиопатия
In-27_для нас.indd 699
03.04.2019 12:03:16
700
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Рестриктивная кардиомиопатия
Показатель
Метод
визуализации Проекция
Получение
изображений
Измерения
Интерпретация
Вероятно, вторичная трику-
спидальная регургитация
по отношению к легочной
гипертензии
Диастолическая МР обуслов-
лена повышением конеч-
но-диастолического давле-
ниявЛЖ
Диастолическая трикуспи-
дальная и МР обусловлены
АВ-блокадой первой
степени или полной блока-
дой сердца
Функция ЛЖ
2D, M-режим,
3D, спекл-
трекинг
ПДО, ПКО,
апикальные
проекции
Проекции без
ракурса, при необ-
ходимости кон-
траст, 3D
ФУ, подвижность
стенок, КДО
ЛЖ, КСО ЛЖ,
ФВЛЖ (бипла-
нарный метод
Симпсона),
3D-объемы
На ранних стадиях ФВЛЖ
нормальная или повышена,
на более поздних стадиях
умеренное снижение
функции ЛЖ
Трансмитральный
кровоток
Импульсно-
волновая
допплерогра-
фия
Апикальная
четырехка-
мерная
Выравнивание
параллельно
кровотоку
E, A, E/A, ВЗК E,
A продолжи-
тельность E/E′
Высокая E-волна, низкая
A-волна; отношение E/A
больше 2
Короткое ВЗК, < 150 мсек;
короткое ВИВР, < 60 мсек
Никаких существенных
изменений митральной
E-волны, ВЗК или ВИВР
при пробе Вальсальвы
Паттерн нарушения релакса-
циисотношениемE:A<1
и увеличением ВЗК на
ранних стадиях
Псевдонормальный и обра-
тимый рестриктивный тип
на промежуточных стадиях
Кровоток в ЛВ
Импульсно-
волновая
допплерогра-
фия
Апикальная
четырехка-
мерная
(может
быть
использо-
вана двух-
или
трехкамер-
ная)
Параллельная ори-
ентация, кон-
трольный объем
0,5 см в пределах
ЛВ
Отношение С : Д,
Д ВЗК, продол-
жительность A
Расширение легочных вен,
доминирующий диастоли-
ческий паттерн и отноше-
ниеС:Д<0,5
Выра женная скорость ревер-
сии кровотока предсердий
с продолжительностью
а-волны легочные-предсер-
дие > продолжительности
а-волны трансмитрального
кровотока
На поздних стадиях быстрое
время замедления D-волны
Отсутствие респираторных
изменений D-волны
Движение
митрального
кольца
Тканевая
допплерогра-
фия
Апикальная
четырехка-
мерная
Соответствующий
коэффициент уси-
ления, масштаб и
частота кадров
E′, E/E′ (медиаль-
ная и
латеральная)
Отношение E/E′ для оценки
давления наполнения ЛЖ;
при рестриктивной кардио-
миопатии E′ обычно
<8см/секиE/E′>15в
связи с повышением давле-
ния наполнения
In-27_для нас.indd 700
03.04.2019 12:03:16
701
27 Рестриктивная кардиомиопатия
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Рестриктивная кардиомиопатия
Показатель
Метод
визуализации Проекция
Получение
изображений
Измерения
Интерпретация
Скорость
распространения
Цветовой
M-режим
Апикальная
четырехка-
мерная
Узкий сектор, мас-
штабирование
ЛЖ, уменьшение
цветовой доппле-
ровской шкалы
Наклон Vp,
ВИВР,EиA
волн
При рестриктивной кардио-
миопатии Vp обычно
< 45 см/сек; E/Vp > 1,5 и
может быть использовано
для оценки давления
наполнения ЛЖ
ВИВР
Непрерывно-
волновая доп-
плерография,
импульсно-
волновая доп-
плерография,
M-режим
Апикальные
проекции
Соответствующая
частота кадров
ВИВР
Увеличение ВИВР на ранних
стадиях, уменьшение ВИВР
на поздних стадиях
Давление в легоч-
ной артерии
Непрерывно-
волновая доп-
плерография
допплер
Путь притока
ПЖ, апи-
кальная
четырехка-
мерная,
субкосталь-
ная
При необходимости
используйте кон-
трастирование
физраствором
СДЛА
Обычно повышено
Давление ПП
2D, M-режим
Субкосталь-
ная
Длинная петля,
чтобы показать
эффект дыхания
носом
Размер НПВ и
респираторная
вариабельность
Расширение с уменьшенной
респираторной вариабель-
ностью; увеличением на
поздних стадиях
Функция ПЖ
2D, тканевая
допплерогра-
фия
ПДО, ПКО,
путь
притока
ПЖ, апи-
кальная
четырехка-
мерная,
субкосталь-
ная
TAPSE, S′,
фракция изме-
нения площади,
ГПД ПЖ,
деформация
свободной
стенки ПЖ
Снижена на более поздних
стадиях; может быть
снижена при тканевой доп-
плерографии и визуализа-
ции деформации на более
ранних стадиях
Диастолическая
функция ПЖ
Импульсно-
волновая доп-
плерография,
цветовая доп-
плерография,
M-режим
Субкосталь-
ная
Параллельное
выравнивание по
цветному доппле-
ровскому крово-
току, усиление,
глубина и
настройка
масштаба
Импульсно-
волновая доп-
плерография
кровотока в
ПЖ, размер
печеночной
вены, отноше-
ние С/Д, диасто-
лическая ско-
рость кровотока
на вдохе и диа-
столическая
реверсия
кровотока
Рестриктивное наполнение;
увеличение отношения E/A
и укорочение ВЗК; на вдохе
дальнейшее сокращение
ВЗК и минимальное изме-
нение отношения E/A, рас-
ширение печеночной вены,
отношение С/Д < 0,5 и
выраженная реверсия кро-
вотока в предсердиях, уве-
личивающаяся на вдохе
PISA — площадь проксимальной зоны струи регургитации; TAPSE — систолическое смещение фиброзного кольца трикуспидального
клапана; Vp — скорость распространения кровотока; АВ — атриовентрикулярный; ВЗК — время замедления кровотока; ВИВР — время
изоволюмической релаксации; ВТПЖ — выходной тракт правого желудочка; ГПД — глобальная продольная деформация; Д — диасто-
лический; ЗС — задняя стенка; КДО — конечно -диастолический объем; КСР — конечно-систолический размер; КСО — конечно-систо -
лический объем; ЛВ — легочные вены; ЛЖ — левый желудочек; ЛП — левое предсердие; МЖП — межжелудочковая перегородка;
МР — митральная регургитация; НПВ — нижняя полая вена; ОТС — относительная толщина стенки; ПДО — парастернальная длинно-
осевая; ПЖ — правый желудочек; ПЗ — переднезадний; ПКО — парастернальная короткоосевая; ПП — правое предсердие; С — систо -
лический; СДЛА — систолическое давление в легочной артерии; УО — ударный объем; ФВ — фракция выброса; ФУ — фракция укоро-
чения.
In-27_для нас.indd 701
03.04.2019 12:03:16
702
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ЛИТЕРАТУРА
1. Thamilarasan M, Klein AL. Restrictive car-
diomyopathy: diagnostic and prognostic im-
plications. In Otto CM, editor: The practice of
clinical echocardiography, ed 2, Philadelphia,
2002, WB Saunders.
2. Takatsuji H, Mikami T, Urasawa K, et al. A
new approach for evaluation of left ventricu-
lar diastolic function: spatial and temporal
analysis of left ventricular filling flow propa-
gation by color M-mode Doppler echocar-
diography, J Am Coll Cardiol 27:365–371,
1996.
3. Thomson HL, Basmadjian AJ, Rainbird AJ, et
al. Contrast echocardiography improves the
accuracy and reproducibility of left ventricu-
lar remodeling measurements: a prospective,
randomly assigned, blinded study, J Am Coll
Cardiol 38:867–875, 2001.
4. Jenkins C, Moir S, Chan J, et al. Left ven-
tricular volume measurement with echocar-
diography: a comparison of left ventricular
opacification, three-dimensional echocar-
diography, or both with magnetic resonance
imaging, Eur Heart J 30:98–106, 2009.
5. Mor-Avi V, Sugeng L, Weinert L, et al. Fast
measurement of left ventricular mass with
real-time three-dimensional echocardiogra-
phy: comparison with magnetic resonance
imaging, Circulation 110:1814–1818, 2014.
6. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
7. Appleton CP, Gonzalez MS, Basnight MA.
Relationship of left atrial pressure and pul-
monary venous flow velocities: importance
of baseline mitral and pulmonary venous
flow patterns studied in lightly sedated dogs,
J Am Soc Echocardiogr 7:264–275, 1994.
8. Nagueh SF, Middleton KJ, Kopelen HA, et al.
Doppler tissue imaging: a noninvasive tech-
nique for evaluation of left ventricular relax-
ation and estimation of filling pressures, J Am
Coll Cardiol 30:1527–1533, 1997.
9. Garcia MJ, Rodriguez L, Ares M, et al. Dif-
ferentiation of constrictive pericarditis from
restrictive cardiomyopathy: assessment of left
ventricular diastolic velocities in longitudinal
axis by Doppler tissue imaging, J Am Coll
Cardiol 27:108–114, 1996.
10. Buss SJ, Emami M, Mereles D, et al. Longitu-
dinal left ventricular function for prediction
of survival in systemic light-chain amyloido-
sis: incremental value compared with clinical
and biochemical markers, J Am Coll Cardiol
60:1067–1076, 2012.
11. Nagueh SF, Appleton CP, Gillebert TC, et al.
Recommendations for the evaluation of left
ventricular diastolic function by echocardiog-
raphy, J Am Soc Echocardiogr 22:107–133,
2009.
12. Klein AL, Oh JK, Miller FA, et al. Two-dimen-
sional and Doppler echocardiographic assess-
ment of infiltrative cardiomyopathy, J Am
Soc Echocardiogr 1:48–59, 1988.
13. Gertz M. Immunoglobulin light chain amyloi-
dosis: 2014 update on diagnosis, prognosis, and
treatment, Am J Hematol 89:1133–1140, 2014.
14. Moyssakis I, Triposkiadis F, Rallidid L, et al.
Echocardiographic features of primary, sec-
ondary and familial amyloidosis, Eur J Clin
Invest 29:484–489, 1999.
15. Arbustini E, Verga L, Concardi M, et al. Elec-
tron and immuno-electron microscopy of
abdominal fat identifies and characterizes
amyloid fibrils in suspected cardiac amyloi-
dosis, Amyloid 9:108–114, 2002.
16. Gertz MA, Kyle RA, Thibodeau SN. Familial
amyloidosis: a study of 52 North American-
born patients examined during a 30-year pe-
riod, Mayo Clin Proc 67:428–440, 1992.
17. Dubrey SW, Davidoff R, Skinner M, et al.
Progression of ventricular wall thickening
after liver transplantation for familial amy-
loidosis, Transplantation 64:74–80, 1997.
18. Olson LJ, Gertz MA, Edwards WD, et al. Se-
nile cardiac amyloidosis with myocardial
dysfunction. Diagnosis by endomyocardial
biopsy and immunohistochemistry, N Engl J
Med 317:738–742, 1987.
19. Quarta CC, Solomon SD, Uraizee I, et al. Left
ventricular structure and function in ttr-re -
lated versus al cardiac amyloidosis, Circula-
tion 129:1840–1849, 2014.
20. Mohammed SF, Mirzoyev SA, Edwards WD,
et al. Left ventricular amyloid deposition in
patients with heart failure and preserved ejec-
tion fraction, JACC Heart Fail 2:113–122,
2014.
21. Kushwaha SS, Fallon JT, Fuster V. Restrictive
cardiomyopathy, N Engl J Med 336:267–276,
1997.
22. Reisinger J, Dubrey SW, Lavalley M, et al.
Electrophysiologic abnormalities in AL (pri-
mary) amyloidosis with cardiac involvement,
J Am Coll Cardiol 30:1046–1051, 1997.
23. Neben-Wittich MA, Wittich CM, Mueller PS,
et al. Obstructive intramural coronary amy-
loidosis and myocardial ischemia are com-
mon in primary amyloidosis, Am J Med
118:1287, 2005.
24. Dubrey SW, Cha K, Simms RW, et al. Elec-
trocardiography and Doppler echocardiogra-
phy in secondary (AA) amyloidosis, Am J
Cardiol 77:313–315, 1996.
25. Palladini G, Campana C, Klersy C, et al. Se-
rum N-terminal pro-brain natriuretic peptide
is a sensitive marker of myocardial dysfunc-
tion in AL amyloidosis, Circulation 107:2440–
2445, 2003.
26. Falk H, Plehn JF, Deering T, et al. Sensitivity
and specificity of the echocardiographic fea-
tures of cardiac amyloidosis, Am J Cardiol
59:418–422, 1987.
27. Rahman JE, Helou EF, Gelzer-Bell R, et al.
Noninvasive diagnosis of biopsy-proven car-
diac amyloidosis, J Am Coll Cardiol 43:410–
415, 2004.
28. Picano E, Pinamonti B, Ferdeghini EM, et al.
Two-dimensional echocardiography in myo-
cardial amyloidosis, Echocardiography 8:253–
259, 1991.
29. Garcia M, Thomas J, Klein A. New Doppler
echocardiographic applications for the study
of diastolic function, J Am Coll Cardiol
32:865–875, 1998.
30. Syed IS, Glockner JF, Feng D, et al. Role of
cardiac magnetic resonance imaging in the
detection of cardiac amyloidosis, JACC Car-
diovasc Imaging 3:155–164, 2010.
31. Klein AL, Hatle LK, Taliercio CP, et al. Prog-
nostic significance of Doppler measures of
diastolic function in cardiac amyloidosis: a
Doppler echocardiography study, Circulation
83:808–816, 1991.
32. Seward JB, Casaclang-Verzosa G. Infiltrative
cardiovascular diseases: cardiomyopathies
that look alike, J Am Coll Cardiol 55:1769–
1779, 2010.
33. Meluzin J, Spinarova L, Bakala J, et al. Pulsed
Doppler tissue imaging of the velocity of
tricuspid annular systolic motion; a new,
rapid, and non-invasive method of evaluating
right ventricular systolic function, Eur Heart
J 22:340–348, 2001.
34. Koyama J, Ray-Sequin PA, Falk RH. Longitu-
dinal myocardial function assessed by tissue
velocity, strain, and strain rate tissue Doppler
echocardiography in patients with AL (pri-
mary) cardiac amyloidosis, Circulation 107:
2446–2452, 2003.
35. Karnofskv DA, Burchenal JH. The clinical
evaluation of chemotherapeutic agents in
cancer. In Macleod CM, editor: Evaluation of
chemotherapeutic agents, New York, 1949,
Columbia University Press.
36. Bellavia D, Pellikka PA, Dispenzieri A, et al.
Comparison of right ventricular longitudinal
strain imaging, tricuspid annular plane sys-
tolic excursion, and cardiac biomarkers for
early diagnosis of cardiac involvement and
risk stratification in primary systematic (AL)
amyloidosis: a 5-year cohort study, Eur Heart
J Cardiovasc Imaging 13:680–689, 2012.
37. Bellavia D, Abraham RS, Pellikka PA, et al.
Utility of Doppler myocardial imaging, car-
diac biomarkers, and clonal immunoglobulin
genes to assess left ventricular performance
and stratify risk following peripheral blood
stem cell transplantation in patients with
systemic light chain amyloidosis (AL), J Am
Soc Echocardiogr 24:444–454, 2011.
38. Buss SJ, Emami M, Mereles D, et al. Longitu-
dinal left ventricular function for prediction
of survival in systemic light-chain amyloido-
sis: incremental value compared with clinical
and biochemical markers, J Am Coll Cardiol
60:1067–1076, 2012.
39. Maceira AM, Prasad SK, Hawkins PN, et al.
Cardiovascular magnetic resonance and prog-
nosis in cardiac amyloidosis, J Cardiovasc
Magn Res 10:54–59, 2008.
40. Hawkins PN, Lavender JP, Pepys MB. Evalu-
ation of systemic amyloidosis by scintigraphy
with 123I-labeled serum amyloid P compo-
nent, N Engl J Med 323:508–513, 1990.
41. Bokhari S, Castano A, Pozniakoff T, et al.
(99m)Tc-pyrophosphate scintigraphy for
differentiating light-chain cardiac amyloido-
sis from the transthyretin-related familial and
senile cardiac amyloidoses, Circ Cardiovasc
Imaging 6:195–201, 2013.
42. Varr BC, Liedtke M, Arai S, et al. Heart trans-
plantation and cardiac amyloidosis: approach
to screening and novel management strategies,
J Heart Lung Transplant 31:325–331, 2012.
43. Lipschutz SE, Sleeper LA, Towbin JA, et al.
The incidence of pediatric cardio-myopathy
in two regions of the United States, N Engl J
Med 348:1647–1655, 2003.
44. Mogenson J, Kubo T, Duque M, et al. Idio-
pathic restrictive cardiomyopathy is part of
the clinical expression of cardiac troponin I
mutations, J Clin Invest 111:209–216, 2003.
45. Ammash NM, Seward JB, Bailey KR, et al.
Clinical profile and outcome of idiopathic
restrictive cardiomyopathy, Circulation
101:2490–2496, 2000.
46. Enrica Perugini E, Rapezzi C, Reggiani LB, et
al. Comparison of ventricular long-axis func-
tion in patients with cardiac amyloidosis
versus idiopathic restrictive cardiomyopathy,
Am J Cardiol 95:146–149, 2005.
47. Russo LM, Webber SA. Idiopathic restrictive
cardiomyopathy in children, Heart 91:1199–
1202, 2005.
In-27_для нас.indd 702
03.04.2019 12:03:16
703
27 Рестриктивная кардиомиопатия
48. Berensztein C, Pineiro D, Marcotegui M, et al.
Usefulness of echocardiography and Doppler
echocardiography in endomyocardial fibro-
sis, J Am Soc Echocardiogr 13:385–392, 2000.
49. Hassan WM, Fawzy ME, Al Helaly S, et al.
Pitfalls in diagnosis and clinical, echocardio-
graphic, and hemodynamic findings in endo-
myocardial fibrosis. A 25-year experience,
Chest 128:3985–3999, 2005.
50. Berensztein C, Pineiro D, Marcotegui M, et al.
Usefulness of echocardiography and Doppler
echocardiography in endomyocardial fibro-
sis, J Am Soc Echocardiogr 13:385–392, 2000.
51. Zientek DM, King DL, Dewan SJ, et al. Hype-
reosinophilic syndrome with rapid progres-
sion of cardiac involvement and early echo-
cardiographic abnormalities, Am Heart J
130:1295–1298, 1995.
52. Ekanayake D, Roddick C, Powell LW. Recent
advances in hemochromatosis: a 2015 update:
a summary of proceedings of the 2014 confer-
ence held under the auspices of Hemochroma-
tosis Australia, Hepatol Int 9:174–182, 2015.
53. Cecchetti G, Binda A, Piperno A, et al. Car-
diac alterations in 36 consecutive patients
with idiopathic haemochromatosis: poly-
graphic and echocardiographic evaluation,
Eur Heart J 12:224–230, 1991.
54. Olson LJ, Baldus WP, Tajik AJ. Echocardio-
graphic features of idiopathic hemochroma-
tosis, Am J Cardiol 60:885–889, 1987.
55. Noetzli LJ, Carson SM, Nord AS, et al. Lon-
gitudinal analysis of heart and liver iron in
thalassemia major, Blood 112:2973, 2008.
56. Uemura A, Morimoto S, Hiramitsu S, et al.
Histologic diagnostic rate of cardiac sarcoid-
osis: evaluation endomyocardial biopsies, Am
Heart J 138:299–302, 1999.
57. Koplan BA, Soejima K, Baughman K, et al.
Refractory ventricular tachycardia secondary
to cardiac sarcoid: electrophysiologic charac-
teristics, mapping, and ablation, Heart
Rhythm 3:924–929, 2006.
58. Smedema JP, Snoep G, van Kroonenburgh
MP, et al. The additional value of gadolinium-
enhanced MRI to standard assessment for
cardiac involvement in patients with pulmo-
nary sarcoidosis, Chest 128:1629–1637, 2005.
59. Skali H, Schulman AR, Dorbala AR. 18F-FDG
PET/CT for the assessment of myocardial
sarcoidosis, Curr Cardiol Rep 15:352, 2013.
60. Le Guludec D, Menad F, Faraggi M, et al.
Myocardial sarcoidosis: clinical value of
technetium-99m sestamibi tomoscintigraphy,
Chest 106:1675–1682, 1994.
61. Fahy GJ, Marwick T, McCreery CJ, et al. Dop-
pler echocardiographic detection of left ven-
tricular diastolic dysfunction in patients with
pulmonary sarcoidosis, Chest 109:62–66, 1996.
62. Sekiguchi M, Yazaki Y, Isobe M, Hiroe M.
Cardiac sarcoidosis: diagnostic, prognostic,
and therapeutic considerations, Cardiovasc
Drugs Ther 10:495–510, 1996.
63. Alizad A, Seward JB. Echocardiographic fea-
tures of genetic diseases: part 2. Storage dis-
ease, J Am Soc Echocardiogr 13:164–170, 2000.
64. Saraclar M, Atalay S, Kocak N, Ozkutlu S.
Gaucher’s disease with mitral and aortic in-
volvement: echocardiographic findings, Pedi-
atr Cardiol 13:56–58, 1992.
65. De Dominicis E, Finocchi G, Vincenzi M, et
al. Echocardiographic and pulsed Doppler
features in glycogen storage disease type II of
the heart (Pompe’s disease), Acta Cardiol
46:107–114, 1991.
66. Klinge L, Straub V, Neudorf U, Voit T. En-
zyme replacement therapy in classical infantile
pompe disease: results of a ten-month follow-
up study, Neuropediatrics 36:6–11, 2005.
67. Winkel LP, Van den Hout JM, Kamphoven
JH, et al. Enzyme replacement therapy in late-
onset Pompe’s disease: a three-year follow-
up, Ann Neurol 55:495–502, 2004.
68. Amalifitano A, Bengur AR, Morse RP, et al.
Recombinant human acid alpha-glucosidase
enzyme therapy for infantile glycogen storage
disease type II: results of a phase I/II clinical
trial, Genet Med 3:132–138, 2001.
69. Towbin JA, Roberts R. Cardiovascular diseases
due to genetic abnormalities. In Schlant RC,
Alexander RW, editors: The heart arteries and
veins, ed 8, New York, 1994, McGraw-Hill.
70. Kampmann C, Baehner F, Whybra C, et al.
Cardiac manifestations of Anderson-Fabry
disease in heterozygous females, J Am Coll
Cardiol 40:1668–1674, 2002.
71. Nakao S, Takenaka T, Maeda M, et al. An
atypical variant of Fabry’s disease in men
with left ventricular hypertrophy, N Engl J
Med 333:288–293, 1995.
72. Sachdev B, Takenaka T, Teraguchi H, et al.
Prevalence of Anderson-Fabry disease in male
patients with late onset hypertrophic cardio-
myopathy, Circulation 105:1407–1411, 2002.
73. MacDermot KD, Homes A, Miners AH. An-
derson-Fabry disease: clinical manifestations
and impact of disease in a cohort of 98 hemi-
zygous males, J Med Genet 38:750–760, 2001.
74. Eng CM, Guffon N, Wilcox WR, et al. Safety
and efficacy of recombinant human alpha
galactosidase A replacement in Fabry disease,
N Engl J Med 345:9–16, 2001.
75. Weidemann F, Breunig F, Beer M, et al. Im-
provement of cardiac function during en-
zyme replacement therapy in patients with
Fabry disease: a prospective strain rate imag-
ing study, Circulation 108:1299–1301, 2003.
76. Mortensen SA, Olsen HS, Baandrup U.
Chronic anthracycline cardiotoxicity: haemo-
dynamic and histopathological manifesta-
tions suggesting a restrictive endomyocardial
disease, Br Heart J 55:274–282, 1986.
77. Naqvi TZ, Luthringer D, Marchevsky A, et al.
Chloroquine induced cardiomyopathyecho-
cardiographic features, J Am Soc Echocardiogr
18:383–387, 2005.
78. Veinot JP, Edwards WD. Pathology of radia-
tion-induced heart disease: a surgical and
autopsy study of 27 cases, Hum Pathol 27:
766–773, 1996.
79. Yamada H, Tabata T, Jaffer SJ, et al. Clinical
features of mixed physiology of constriction
and restriction: echocardiographic character-
istics and clinical outcome, Eur J Echocardiogr
8:185–194, 2007.
80. Gustavsson A, Eskilsson T, Landberg T, et al.
Late cardiac effects after mantle radiotherapy
in patients with Hodgkin’s disease, Ann Oncol
1:355–363, 1990.
81. King V, Constine LS, Clark D, et al. Symp-
tomatic coronary artery disease after mantle
irradiation for Hodgkin’s disease, Int J Radiat
Oncol Biol Phys 36:881–889, 1996.
82. Glanzmann C, Kaufmann P, Jenni R, et al.
Cardiac risk after mediastinal irradiation for
Hodgkin’s disease, Radiother Oncol 46:51–62,
1998.
83. Lipshultz SE, Lipsitz SR, Sallan SE, et al.
Chronic progressive cardiac dysfunction
years after doxorubicin therapy for child-
hood acute lymphoblastic leukemia, J Clin
Oncol 23:2629–2636, 2005.
84. Roberts WC, Glancy DL, DeVita Jr. VT. Heart
in malignant lymphoma (Hodgkin’s disease,
lymphosarcoma, reticulum cell sarcoma and
mycosis fungoides): a study of 196 autopsy
cases, Am J Cardiol 22:85–107, 1968.
85. Pellikka PA, Tajik AJ, Khandheria BK, et al.
Carcinoid heart disease: clinical and echocar-
diographic spectrum in 74 patients, Circula-
tion 87:1188–1196, 1993.
86. Seward JB, Casaclang-Verzosa G. Infiltrative
cardiovascular diseases cardiomyopathies that
look alike, J Am Coll Cardiol 55:1769–1779,
2010.
87. Wang ZJ, Reddy GP, Gotway MB, et al. CT
and MR imaging of pericardial disease, Ra-
diographics 23(Spec. No):S167–180, 2003.
88. Ling LH, Oh JK, Tei C, et al. Pericardial thick-
ness measured with transesophageal echocar-
diography: feasibility and potential clinical
usefulness, J Am Coll Cardiol 29:1317–1323,
1997.
89. Talreja DR, Edwards WD, Danielson GK, et
al. Constrictive pericarditis in 26 patients with
histologically normal pericardial thickness,
Circulation 108:1852–1857, 2003.
90. Hatle L, Appleton C, Popp R. Differentiation
of constrictive pericarditis and restrictive
cardiomyopathy by Doppler echocardiogra-
phy, Circulation 79:357–370, 1989.
91. Klein AL, Cohen GI, Pietrolungo JF. Differen-
tiation of constrictive pericarditis from restric-
tive cardiomyopathy by Doppler transesopha-
geal echocardiographic measurements of re-
spiratory variations in pulmonary venous
flow, J Am Coll Cardiol 22:1935–1943, 1993.
92. Abdalla IA, Murray RD, Lee JC, et al. Does
rapid volume loading during transesophageal
echocardiography differentiate constrictive
pericarditis from restrictive cardiomyopathy?
Echocardiography 19:125–134, 2002.
93. Oh JK, Tajik AJ, Appleton CP, et al. Preload
reduction to unmask the characteristic Dop-
pler feature of constrictive pericarditis. A new
observation, Circulation 95:796–799, 1997.
94. Sengupta PP, Krishnamoorthy VK, Ab-
hayaratna WP, et al. Disparate patterns of left
ventricular mechanics differentiate constric-
tive pericarditis from restrictive cardiomyopa-
thy, JACC Cardiovasc Imaging 1:29–38, 2008.
95. Sengupta PP, Krishnamoorthy VK, Ab-
hayaratna WP, et al. Comparison of useful-
ness of tissue Doppler imaging versus brain
natriuretic peptide for differentiation of
constrictive pericardial disease from restric-
tive cardiomyopathy, Am J Cardiol 102:357–
362, 2008.
96. Ha JW, Oh J, Ling L, et al. Annulus para-
doxus: transmitral flow velocity to mitral
annular velocity ratio is inversely propor-
tional to pulmonary capillary wedge pressure
in patients with constrictive pericarditis, Cir-
culation 104:976–978, 2001.
97. Klodas E, Nishimura RA, Appleton CP, et al.
Doppler evaluation of patients with constric-
tive pericarditis use of tricuspid regurgitation
velocity curves to determine enhanced ven-
tricular interaction, J Am Coll Cardiol 28:652–
657, 1996.
98. Ha JW, Oh JK, Ommen SR, et al. Diagnostic
value of mitral annular velocity for constric-
tive pericarditis in the absence of respiratory
variation in mitral inflow velocity, J Am Soc
Echocardiogr 15:1468–1471, 2002.
99. Kushwaha S, Fallon JT, Fuster V. Restrictive
cardiomyopathy, N Eng J Med 336:267–276,
1997.
100. Goldstein JA. Cardiac tamponade, constric-
tive pericarditis, and restrictive cardiomyopa-
thy, Curr Probl Cardiol 29:503–567, 2004.
In-27_для нас.indd 703
03.04.2019 12:03:16
In-27_для нас.indd 704
03.04.2019 12:03:16
705
Несмотря на их относительно небольшое число,
заболевания перикарда имеют множество причин
(табл. 28.1) и могут привести к опасным для жизни
состояниям. Они обычно имитируют другие забо-
левания и, если их не учитывать при дифферен-
циальной диагностике, могут быть пропущены.
Обычно лечение является возможным при пра-
вильной диагностике патологического состояния.
По этим причинам заболевания перикарда давно
представляют интерес для медицинского сообще-
ства [1]. Констриктивный перикардит, перикарди-
альный выпот и тампонада полости перикарда, а
также острый перикардит остаются наиболее важ-
ными и часто встречающимися нозологическими
формами. Реже встречаются врожденное отсутствие
перикарда и перикардиальные кисты.
Визуализацию сердца необходимо проводить в
сочетании с тщательным сбором анамнеза, физи-
кальным осмотром, выполнением электрокардио-
граммы, рентгенограммы грудной клетки и соот-
ветствующих лабораторных исследований. Ком-
плексное эхокардиографическое исследование
рекомендовано всем пациентам с подозрением
на заболевание перикарда [2, 3]. Эта рекомендация
основана на возможности оценить с помощью эхо-
кардиографии как анатомические, так и гемодина-
мические нарушения, наряду с широкой доступно-
стью, переносимостью, отсутствием ионизирую-
щего излучения и относительной экономической
эффективностью данного метода. Для подтвержде-
ния результатов или получения дополнительной
диагностической информации может потребо-
ваться также визуализация методом «поперечных
срезов» с помощью компьютерной томографии и
магнитного резонанса, но в большинстве случаев
эхокардиография остается методом выбора визу-
альной диагностики [4].
АНАТОМИЯ И ФУНКЦИЯ ПЕРИКАРДА
АНАТОМИЯ ПЕРИКАРДА
Перикард окружает сердце и состоит из фиброзного
мешка и серозной оболочки [5, 6]. Снаружи фи-
брозный мешок представляет собой плотное анато-
мическое образование, фиксированное к крупным
сосудам сверху, грудине спереди, позвоночнику
сзади и диафрагме снизу. Внутри серозная оболочка
представлена одним слоем мезотелиальных клеток,
который выстилает эпикардиальный жир и называ-
ется висцеральным перикардом. Этот слой распро-
страняется до проксимальной части аорты, легоч-
ной артерии, полой вены и легочных вен, а затем
загибается назад по внутренней поверхности фи-
брозного мешка. Вместе серозная оболочка и фи-
брозный мешок образуют париетальный перикард.
Пространство между висцеральным и париеталь-
ным перикардом содержит вариабельное количе-
ство жидкости и ограничено сверху прикреплением
фиброзного перикарда к крупным сосудам, а сза-
ди — изгибом серозной оболочки вокруг легочных
вен и полой вены (рис. 28.1). В результате этих из-
гибов образуются две перикардиальные пазухи.
28 Заболевания перикарда
TERRENCE D. WELCH, MD
Анатомия и функция перикарда
Анатомия перикарда
Перикардиальная жидкость
Функции перикарда
Перикардиальное давление
и респираторные воздействия
на гемодинамику в норме
Патофизиология компрессионных
перикардиальных заболеваний
Эхокардиографическая оценка
заболеваний перикарда
Констриктивный перикардит
Определение и этиология
Патологическая анатомия
и патофизиология
Клинические проявления и лечение
Эхокардиографическая диагностика
Дифференциальная диагностика
с рестриктивной кардиомиопатией
Экссудативно-констриктивный
перикардит и транзиторный
констриктивный перикардит
Перикардиальный выпот
Эхокардиографическая диагностика
Тампонада полости перикарда
Определение и этиология
Патофизиология
Эхокардиографическая диагностика
Регионарная тампонада
Перикардиоцентез под контролем
эхокардиографии
Острый перикардит
Врожденное отсутствие перикарда
Киста перикарда
In-28_для нас.indd 705
03.04.2019 12:04:28
706
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Идиопатическое поражение
Инфекционные болезни
Бактериальные (включая туберкулез, Chlamydia, боррелиоз,
Treponema pallidum, Haemophilus, Meningococcus, Pneumococ-
cus, Gonococcus)
Грибковые (включая Candida, гистоплазмоз)
Вирусные (включая Коксаки, эховирус, паротит, Эпштейна–
Барр, цитомегаловирус, Varicella, краснуха, вирус
иммунодефицита человека, парвовирус B19)
Паразитарные (включая Toxoplasma, Echinococcus, Entamoeba
histolytica)
Травма
Тупая или проникающая травма
Операции на сердце
Сердечные
Инфаркт миокарда
Синдром Дресслера
Выпот и тампонада также могут быть вызваны разрывом
миокарда или расслоением аорты
Системные воспалительные заболевания
Включая ревматоидный артрит, системную красную вол-
чанку, системный склероз, синдром Рейтера
Новообразования
Первичные доброкачественные или злокачественные
опухоли перикарда
Вторичные (включая опухоли легких, молочных желез,
желудка, толстой кишки, лейкозы, меланому)
Нарушение обмена веществ и болезни эндокринной
системы
Включая почечную недостаточность, гипотиреоз, недоста-
точность коры надпочечников
Другие
Облучение средостения
Асбестоз легких
ТАБЛИЦА 28.1 Причины заболеваний перикарда
Косая пазуха расположена позади левого предсер-
дия (ЛП) и ограничена легочными венами и нижней
полой веной. Поперечная пазуха располагается вы-
ше ЛП и ограничена крупными артериями, верхней
полой веной и крышей ЛП (см. рис. 28.1). Основным
источником кровоснабжения перикарда являются
околосердечно-диафрагмальные артерии, которые
являются ветвями внутренних грудных артерий.
Венозный дренаж осуществляется через околосер-
дечно-диафрагмальные вены, которые затем впада-
ют в плечеголовные вены. Перикард получает сим-
патическую, парасимпатическую и сенсорную ин-
нервацию; диафрагмальный нерв обеспечивает
сенсорный компонент.
ПЕРИКАРДИАЛЬНАЯ ЖИДКОСТЬ
Перикардиальное пространство обычно содержит
от 20 до 60 мл (в среднем 20–25 мл) жидкости у че-
ловека средних параметров [5]. Эта жидкость пред-
ставляет собой ультрафильтрат плазмы и содержит
белки, электролиты и фосфолипиды. Дренаж пери-
кардиальной жидкости осуществляется лимфатиче-
скими протоками вдоль эпикардиальной поверхно-
сти и в париетальном перикарде.
ФУНКЦИИ ПЕРИКАРДА
Предполагается, что, не являясь жизненно важным,
перикард выполняет полезные связочные, мем-
бранные и механические функции [7]. Связочная
функция заключается в обеспечении фиксирован-
ного положения сердца в грудной клетке. Мембран-
ные функции включают уменьшение трения между
сердцем и соседними анатомическими образовани-
ями и обеспечение барьера для воспаления или ин-
фекции. Механические функции более сложны и
могут включать ограничение чрезмерной острой
дилатации камер, сохранение диастолических кри-
вых давления–объема желудочков и посредничество
соединения или взаимодействия сердечных камер.
ПЕРИКАРДИАЛЬНОЕ ДАВЛЕНИЕ И РЕСПИРАТОРНЫЕ
ВОЗДЕЙСТВИЯ НА ГЕМОДИНАМИКУ В НОРМЕ
Давление в перикардиальном пространстве влияет
на наполнение сердечных камер посредством со-
отношения трансмурального давления, определяе-
мого как давление внутри сердечных камер минус
перикардиальное давление [7–9]. Изменения вну-
триплеврального давления обычно приводят к
соответствующим изменениям перикардиального
давления. Эти колебания давления в норме вызы-
вают незначительные респираторные изменение
ударного объема УО левого желудочка (ЛЖ) и
артериального системного давления [7, 10]. На
вдохе отрицательное внутриплевральное давление
увеличивает градиент между системным венозным
резервуаром и правыми отделами сердца, а также
увеличивает давление трансмурального растяже-
ния миокарда для правых сердечных камер. Это
приводит к увеличению венозного возврата в пра-
вое сердце, которое внешне расширяется. Таким
образом, общий объем сердца увеличивается [11].
Наблюдается соответствующее, небольшое сниже-
ние наполнения левого сердца, которое, вероятно,
является многофакторным по происхождению [7,
10]. В отличие от правого сердца, градиент давле-
ния для наполнения левого сердца не должен уве-
личиваться на вдохе, потому что легочные вены
и левые сердечные камеры являются внутри-
плевральными и подвержены тем же изменениям
давления. Повышение преднагрузки для правого
желудочка (ПЖ) может привести к уменьшению
In-28_для нас.indd 706
03.04.2019 12:04:29
707
28 Заболевания перикарда
Правый диафрагмальный нерв
и околосердечно-диафрагмальные
сосуды
Верхняя полая вена
Поперечный синус перикарда
Верхняя полая вена
Правые легочные вена
Медиастинальная часть
париетальной плевры
(срезанный край)
Перикард (срезанный край)
Нижняя полая вена
Линия слияния фиброзного
перикарда с диафрагмой
Левый диафрагмальный нерв и
околосердечно-диафрагмальные
сосуды
Легочный ствол (бифуркация)
Левое легкое
Левые легочные вены
Перикард (срезанный край)
Косой перикардиальный синус
Пищеводный выступ
Диафрагмальная часть
перикарда
Медиастинальная часть
париетальной плевры
(срезанный край)
Восходящая аорта
Дуга аорты
Рис. 28.1 Анатомия перикарда. Перикардиальная сумка с удаленным сердцем: передний вид [Netter FH. Atlas of human anatomy, ed 1, 1989, Ciba-Geigy
Pharmaceutical].
диастолического растяжения ЛЖ путем снижения
транссептального диастолического градиента дав-
ления. Эффективная постнагрузка для ЛЖ может
быть увеличена за счет отрицательного внутри-
плеврального давления. Комбинация уменьшен-
ной преднагрузки и увеличенной постнагрузки во
время вдоха приводит к незначительному умень-
шению ударного объема УО ЛЖ и систолического
артериального давления (менее 10 мм рт. ст.) . Эти
изменения претерпевают обратное развитие с уве-
личением внутриплеврального давления, которое
происходит на выдохе. Как описано далее в этой
главе, заболевания перикарда могут создавать про-
странственные ограничения или относительно
«изолировать» сердечные камеры от изменений
внутриплеврального давления, которые могут уве-
личить респираторные изменения наполнения
правых и левых отделов сердца и сердечного вы-
броса.
ПАТОФИЗИОЛОГИЯ КОМПРЕССИОННЫХ
ПЕРИКАРДИАЛЬНЫХ ЗАБОЛЕВАНИЙ
Перикард в норме обладает некоторой эластично-
стью, а его «растянутый» объем представляет собой
максимальный перикардиальный объем. Разница
между максимальным объемом перикарда и объе-
мом сердца представляет собой перикардиальный
«резервный объем», в котором сердце периодически
расширяется во время дыхательных движений. В
условиях нормальных дыхательных усилий и при
отсутствии заболеваний перикарда этот резервный
объем является адекватным, и, как полагают, «пери-
кардиальное ограничение» существенно не влияет
на сердечное наполнение. С другой стороны, при
компрессионных заболеваниях перикарда объем
перикардиального резерва уменьшается, поскольку
перикард становится относительно неэластичным,
как в случае констрикции, или потому, что в пери-
кардиальном пространстве увеличивается содержа-
ние жидкости под давлением, как в случае тампо-
нады. При экссудативно-констриктивном заболе-
вании может возникать комбинация этих двух
процессов. В условиях перикардиального ограниче-
ния общий объем сердца определяется перикардом,
и желудочки должны конкурировать друг с другом
за пространство. Выявление этого состояния имеет
решающее значение в эхокардиографической диа-
гностике. Расширение ПЖ во время вдоха должно
происходить за счет ЛЖ. Это усиленное взаимодей-
ствие желудочков проявляется смещением межже-
лудочковой перегородки влево (рис. 28.2). Увели-
ченное наполнение ЛЖ во время выдоха сопрово-
In-28_для нас.indd 707
03.04.2019 12:04:29
708
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ждается смещением межжелудочковой перегородки
назад к ПЖ и уменьшением наполнения ПЖ [12,
13].
Различие в наполнении правого и левого сердца
также возникает потому, что патологически изме-
ненный перикард «изолирует» сердце таким обра-
зом, что перикардиальное и внутрисердечное давле-
ние больше не изменяются под влиянием колебаний
внутриплеврального давления. Это явление назы-
вается диссоциацией внутриплеврального и внутри-
сердечного давления. Во время вдоха происходит
снижение внутриплеврального и легочного веноз-
ного давлений, тогда как перикардиальное давление
и давление в левой сердечной камере изменяется в
меньшей степени.
Таким образом, градиент давления наполнения
левого сердца уменьшается, что приводит к умень-
шению преднагрузки для ЛЖ и последующему
снижению ударного объема УО. В начале выдоха
повышается внутриплевральное давление и гради-
ент давления наполнения левого сердца. Хотя дис-
социация внутриплеврального и внутрисердечного
давления описана при тампонаде, как показано на
рис. 28.3, она, по всей видимости, является основ-
ным механизмом констрикции. Эти два принципа
усиленного взаимодействия желудочков и диссоциа-
ции внутриплеврального и внутрисердечного давле-
ния объясняют явление парадоксального пульса
(снижение систолического артериального давления
на > 10 мм рт. ст. на вдохе), наблюдаемого у неко-
торых пациентов с констриктивным перикардитом
и у большинства пациентов с тампонадой.
При прогрессирующем компрессионном заболе-
вании перикарда резервный объем полностью исче-
зает, а перикардиальный объем постоянно ограни-
чивает объем сердца во время дыхательного цикла.
Это приводит к постепенному повышению давле-
ния в венозной фазе, снижению сердечного выбро-
са и ухудшению клинических проявлений сердеч-
ной недостаточности. При тампонаде перикарди-
альное давление может превышать внутрисердечное
давление, что приводит к компрессии камеры, гру-
бому нарушению наполнения сердца и острому
опасному для жизни гемодинамическому коллапсу.
ЭХОКАРДИОГРАФИЧЕСКАЯ ОЦЕНКА
ЗАБОЛЕВАНИЙ ПЕРИКАРДА
Для создания оптимального «перикардиального
протокола исследования», позволяющего точно
определить наличие компрессионного заболевания
перикарда, к стандартной трансторакальной эхо-
кардиограмме (ТТЭхоКГ) необходимо добавить
несколько компонентов. Эти компоненты представ-
лены в табл. 28.2 . В идеале визуализация должна
выполняться с одновременной регистрацией нор-
мального, а не усиленного дыхания.
КОНСТРИКТИВНЫЙ ПЕРИКАРДИТ
ОПРЕДЕЛЕНИЕ И ЭТИОЛОГИЯ
Констриктивный перикардит — это форма сердеч-
ной недостаточности, при которой патологически
измененный перикард уплотняется и ограничивает
диастолическое наполнение. При многих заболева-
ниях в патологический процесс может вовлекаться
перикард, что приводит к констриктивному пери-
кардиту (см. табл. 28.1). Чаще всего констриктив-
ный перикардит считают идиопатическим или свя-
занным с предшествующей операцией на сердце,
облучением грудной клетки или перикардитом
[14–17]. Менее распространенные причины вклю-
чают ревматологические заболевания, инфекции,
онкологические заболевания, травмы и асбестоз.
Туберкулез в настоящее время является редкой при-
чиной констрикции в странах Северной Америки и
Европы, но по-прежнему широко распространен в
Южной Африке [18].
Рис. 28.2 Смещение межжелудочковой перегородки. A Апикальная четырехкамерная позиция. Усиленное взаимодействие желудочков при констриктивном
перикардите отражает респираторно обусловленное смещение межжелудочковой перегородки (стрелка). Межжелудочковая перегородка смещается влево во
время вдоха (А) и возвращается обратно — во время выдоха (Б). Такой же процесс наблюдается при тампонаде сердца. ЛЖ — левый желудочек; ПЖ — правый
желудочек
ПЖ
ПЖ
ЛЖ
ЛЖ
А
Б
In-28_для нас.indd 708
03.04.2019 12:04:29
709
28 Заболевания перикарда
ЛЖ
Д
а
в
л
е
н
и
е
(
м
м
р
т
.
с
т
.
)
Вд
Вд
В норме
Тампонада
15
5
0
–5
–10
Давление
в концевых
легочных капиллярах
ЭГН
ЭГН
ЛК
ЛВ
ЛВ
ЛК
ЛП
ЛП
Внутриперикардиальное
давление
Д
а
в
л
е
н
и
е
(
м
м
р
т
.
с
т
.
)
15
10
5
0
–5
–10
Давление
в концевых
легочных капиллярах
Внутриперикардиальное
давление
Внутригрудное давление
ЛЖ
Внутригрудное давление
Рис. 28.3 Диссоциация внутриплеврального и внутрисердечного давления при констриктивном заболевании перикарда. Сверху, в норме изменения
внутригрудного давления передаются как на перикардиальную сумку, так и на легочные вены. Эффективный градиент наполнения (ЭГН) незначительно изменя-
ется во время дыхания. Внизу, при констриктивном заболевании перикарда изменения внутригрудного давления передаются на легочные вены (ЛВ), но не на
перикардиальную сумку. ЭГН падает во время вдоха. Хотя этот рисунок отражает изменения при тампонаде, эти процессы более выражены при констрикции.
Вд — вдох; ЛК — легочные капилляры [Sharp JT, Bunnell IL, Holland JF, et al. Hemodynamics during induced cardiac tamponade in man. Am J Med 29:640–646,
1960].
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Патологические изменения, проявляющиеся кон-
стрикцией, обычно наблюдаются в париетальном
перикарде, но также могут вовлекать и висцераль-
ный перикард и даже прилежащий эпикард. Боль-
шинство случаев констрикции являются хрониче-
скими процессами, протекающими на протяжении
многих лет, и обусловлены рубцеванием, кальци-
фикацией и часто утолщением перикарда. Тем не
менее утолщение перикарда не является обязатель-
ным для постановки диагноза, поскольку в 18%
случаев толщина его не изменяется [19]. В некото-
рых случаях воспаление может быть основным вы-
являемым патологическим процессом, что, с боль-
шой вероятностью, может говорить о подостром,
поддающимся лечению заболевании с потенциаль-
но транзиторным характером течения.
При констрикции патологически изменен-
ный, уплотненный перикард утрачивает «резерв-
ный объем» и постепенно ограничивает способ-
ность сердца к расширению и наполнению. На-
чинают проявляться и служат основой для
эхокардиографической и инвазивной гемодина-
мической диагностики констриктивного пери-
кардита патофизиологические принципы усилен-
ного взаимодействия желудочков и диссоциации
внутриплеврального и внутрисердечного давления,
описанные ранее [11, 20].
Поскольку сердечный объем и диастолическое
наполнение желудочков постепенно ограничивают-
ся, наблюдается повышение давления наполнения и
его выравнивание в сердечных камерах. Повыше-
ние давления в предсердиях приводит к быстрому
раннему диастолическому наполнению желудочков,
которое резко заканчивается при достижении объе-
ма, ограниченного констриктивным перикардом.
Это проявляется крутым глубоким нисходящим ко-
леном у волнообразной кривой яремного венозного
давления. Рост венозного давления и снижение сер-
дечного выброса приводит к прогрессированию
клинических симптомов.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ЛЕЧЕНИЕ
Клиническая картина представлена синдромом сер-
дечной недостаточности, часто развивающейся бес-
симптомно и характеризующейся одышкой при
In-28_для нас.indd 709
03.04.2019 12:04:30
710
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Переменная
Чувствительность
(%)
Специфичность
(%)
Положительная
предсказательная
ценность результата (%)
Отрицательная
предсказательная
ценность результата (%)
Индивидуальные переменные
1. Смещение межжелудоч-
ковой перегородки
93
69
92
74
2. Изменение митральной
скорости E ≥ 14,6%†
84
73
92
55
3. Медиальная скорость e′
≥ 9 см/сек
83
81
94
57
4. Медиальная e′/латераль-
ная e′ ≥ 0,91
75
85
95
50
5. Коэффициент ПВ на
выдохе ≥ 0,79£
76
88
96
49
Комбинация номеров 1, 3 и 5§
1(силибез3и/или5)
93
69
92
74
1и3(силибез5)
80
92
97
56
1с3или5
87
91
97
65
1с3и5
64
97
99
42
* Пограничные значения для непрерывных переменных были выбраны из ROC анализа.
† На основе формулы [(скорость на выдохе – скорость на вдохе) / скорость на вдохе × 100]; значение будет немного ниже, если исполь-
зуется рекомендуемая в настоящее время формула [(скорость на выдохе – скорость на вдохе) / скорость на выдохе × 100].
£ Коэффициент ПВ = скорость диастолической реверсии кровотока / скорость прямого потока.
§ Определяются на основе эхокардиографических показателей (выделены жирным шрифтом), которые независимо коррелировали с
диагнозом констриктивного перикардита.
ПВ — печеночная вена .
[Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging
7:526–534, 2014.]
ТАБЛИЦА 28.2 Характеристика информативности пяти основных эхокардиографических показателей для диагностики
констриктивного перикардита*
физической нагрузке и признаками венозного за-
стоя, в том числе повышением яремного венозного
давления, асцитом и отеками [14]. У некоторых
пациентов из-за печеночного застоя возникают ре-
цидивные плевральные выпоты или развивается
цирроз. Клинические признаки констрикции почти
полностью перекрываются признаками правосто-
ронней сердечной недостаточности, что часто соз-
дает затруднения для диагностики [21]. Дифферен-
циальная диагностика обычно включает сердечную
недостаточность с сохраненной фракцией выброса,
тяжелую трикуспидальную регургитацию, тяжелую
легочную гипертензию и инфаркт ПЖ, но наиболее
проблематичной остается дифференциальная диа-
гностика с рестриктивной кардиомиопатией. Лече-
ние хронической констрикции заключается в пол-
ном хирургическом удалении перикарда. В незначи-
тельном числе случаев констриктивный процесс
является подострым в связи с воспалением перикар-
да, и его проявления могут быть ослаблены или
устранены с помощью проведения противовоспа-
лительной терапии [22].
ЭХОКАРДИОГРАФИЧЕСКАЯ ДИАГНОСТИКА
Диагностика констриктивного перикардита остает-
ся сложной задачей, но облегчается благодаря опре-
делению специфических гемодинамических при-
знаков констрикции, которые можно идентифици-
ровать с помощью эхокардиографии. В дополнение
к ранее описанным принципам усиленного взаимо-
действия желудочков и диссоциации внутри-
плеврального и внутрисердечного давления при
констрикции отмечаются специфические диастоли-
ческие свойства миокарда, которые позволяют бо-
лее уверенно диагностировать констрикцию и про-
вести дифференцировку с рестриктивной кардио-
миопатией [12, 23–25]. Таким образом, специальный
перикардиальный протокол эхокардиографии дает
крайне важную возможность использования дву-
мерной (2D) спектральной допплеровской и ткане-
вой допплеровской визуализации для выявления
поддающихся лечению форм сердечной недоста-
точности. Обследование должно начинаться с пяти
основных эхокардиографических показателей, ко-
торые были получены в результате самого большо-
In-28_для нас.indd 710
03.04.2019 12:04:30
711
28 Заболевания перикарда
го, слепого исследования с участием контрольной
группы пациентов с констрикцией (n = 130) при
сравнении с пациентами с рестрикцией или тяже-
лой трикуспидальной регургитацией (n = 36) в кли-
нике Mayo (см. табл. 28.2) [26]. Тем не менее нет
универсальных общепринятых диагностических
критериев, и в процессе диагностики должна учи-
тываться вся доступная эхокардиографическая ин-
формация.
НАРУШЕНИЯ ПОДВИЖНОСТИ
МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ:
Оценка подвижности и положения межжелудочко-
вой перегородки часто дает первый ключ к диагно-
стике констриктивного перикардита, в связи с этим
анализ подвижности включен во все стандартные
эхокардиографические исследования, поэтому при
наличии невыясненной этиологии нарушения под-
вижности межжелудочковой перегородки у пациен-
тов с клиническими симптомами сердечной недо-
статочности необходимо своевременно выполнить
полный перикардиальный протокол эхокардиогра-
фии.
Смещение межжелудочковой перегородки
Обусловленное дыханием смещение положения
межжелудочковой перегородки является проявле-
нием ранее описанных принципов усиленного вза-
имодействия желудочков и диссоциации внутри-
плеврального и внутрисердечного давления. Сни-
жение наполнения левых камер сердца на вдохе
обязательно приведет к смещению межжелудочко-
вой перегородки к ЛЖ (рис. 28.4; см. также рис.
28.2). Увеличение наполнения левых камер сердца
на выдохе приводит к тому, что межжелудочковая
перегородка смещается назад к ПЖ. С самой высо-
кой зарегистрированной чувствительностью (93%)
и независимой корреляцией с диагнозом констрик-
ции это выявленное нарушение может быть самым
важным эхокардиографическим критерием [26].
Вибрация межжелудочковой перегородки
В дополнение к смещению межжелудочковой пере-
городки при дыхании почти всегда наблюдается
нарушение диастолического движения перегородки
от удара к удару (независимо от фазы дыхательного
цикла), которое лучше всего можно назвать вибра-
цией и визуализировать как при помощи 2D, так и
в M-режиме, а также с помощью тканевой доппле-
рографии (см. рис. 28.4) [27].
Это колебательное диастолическое движение пе-
регородки может быть связано с усиленным взаи-
модействием желудочков в миллисекундных значе-
ниях, которое возникает из-за малозаметного раз-
личия во времени открытия трикуспидального и
митрального клапана и сокращения правого пред-
сердия (ПП) и ЛП [28–30]. Вибрация перегородки,
вероятно, менее применима с клинической точки
зрения, чем респираторно обусловленное смещение
перегородки, потому что перегородочные наруше-
ния движения от удара к удару являются относи-
тельно распространенными (например, вследствие
нарушения проводимости и при состояниях после
операций на сердце) и, по-видимому, менее специ-
фичными для констрикции (в литературе описано
у 44% пациентов с рестриктивной кардиомиопати-
ей или тяжелой трикуспидальной регургитацией)
[26].
Рис. 28.4 Визуализация смещения межжелудочковой перегородки при констриктивном перикардите. Парастернальная позиция по длинной оси в
М-режиме средней части межжелудочковой перегородки. Обратите внимание на смещение межжелудочковой перегородки влево во время вдоха (красная
стрелка) и диастолическое дрожание перегородки от удара к удару. Голубая стрелка — смещение межжелудочковой перегородки обратно по время выдоха [Welch
TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 7:526–534, 2014].
In-28_для нас.indd 711
03.04.2019 12:04:30
712
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 28.5 Импульсно-волновая допплерография кровотока в печеночной вене при констриктивном перикардите. Субкостальная позиция. Обратите
внимание на выраженный диастолический ретроградный поток во время выдоха (желтая стрелка). Коэффициент реверсии потока в печеночной вене во время
выдоха определяют как скорость ретроградного потока (синяя стрелка), деленная на скорость антеградного потока (зеленая стрелка), т.е . 0 ,35 м/сек : 0,30 см/
сек = 1 ,2 . Красная стрелка — вдох [Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc
Imaging 7:526–534, 2014].
РЕСПИРАТОРНЫЕ ИЗМЕНЕНИЯ В ДОППЛЕРОВСКОМ ПРОФИЛЕ
ПЕЧЕНОЧНОЙ ВЕНЫ: ВЫРАЖЕННАЯ ДИАСТОЛИЧЕСКАЯ РЕВЕРСИЯ
КРОВОТОКА НА ВЫДОХЕ
Допплеровский профиль печеночной вены зависит
от гемодинамики правого сердца и может быть ис-
пользован для выявления диссоциации внутри-
плеврального и внутрисердечного давления и уси-
ленного взаимодействия желудочков при подозре-
нии на констриктивный перикардит. Прямой поток
в печеночной вене при констрикции обычно двух-
фазный, с систолической волной и более выражен-
ной диастолической волной. Эта картина возникает
из-за того, что повышенное давление в ПП препят-
ствует венозному возврату во время систолы, а от-
крытие трикуспидального клапана позволяет
увеличить венозный возврат в ранней диастоле.
Кратковременная реверсия кровотока обычно на-
блюдаются в конце систолы и в диастолу. Диагноз
констрикции может быть выставлен на основе
изменений этих потоков во время дыхательного
цикла. Увеличение наполнения левого сердца во
время выдоха приводит к смещению межжелудоч-
ковой перегородки назад к ПЖ таким образом, что
происходит уменьшение наполнения правого серд-
ца. Отмечается снижение диастолической скорости
прямого потока в печеночной вене и значительное
увеличение пресистолической реверсии кровотока
(рис. 28.5, 28.6) [12, 23]. Хотя наиболее часто этот
показатель оценивается качественно, его можно
определить количественно с помощью коэффици-
ента диастолической реверсии кровотока в печеноч-
ной вене на выдохе [26]. Этот коэффициент был
определен как скорость диастолической реверсии
кровотока на выдохе, деленная на диастолическую
скорость прямого потока, и поэтому включает как
прогнозируемое снижение диастолического прямо-
го потока, так и значительное увеличение диастоли-
ческой реверсии кровотока. При рестрикции и тя-
желой трикуспидальной регургитации правосто-
роннее наполнение не в такой степени нарушается
на выдохе, вследствие чего скорость диастолическо-
го прямого потока на выдохе выше и скорость диа-
столической реверсии кровотока менее выражена (и
может быть, по сути, более заметной во время вдо-
ха). Таким образом, высокие значения коэффици-
ента реверсии кровотока ожидаются при констрик-
ции (1,4 ± 0,7), в отличие от рестрикции или тяжелой
трикуспидальной регургитации (0,5 ± 0,4) [26].
Было описано, что коэффициент реверсии кровото-
ка ≥ 0,79 является одним из наиболее специфичных
(88%) показателей для констрикции и независимо
коррелирует с диагнозом [26].
СКОРОСТЬ ДВИЖЕНИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА
Сохранная или увеличенная e′
Допплерография также позволяет определить спец-
ифические релаксационные характеристики мио-
карда при констриктивном перикардите. Скорость
раннего диастолического движения фиброзного
кольца митрального клапана (e′) является показате-
лем диастолической релаксации и, предположи-
тельно, будет снижена при рестриктивной кардио-
миопатии и большинстве других форм сердечной
In-28_для нас.indd 712
03.04.2019 12:04:30
713
28 Заболевания перикарда
недостаточности, но не при «чистом» констриктив-
ном перикардите. Как было установлено, сохранен-
ная или повышенная скорость e′ (рис. 28.7) являет-
ся важным показателем для отличия констрикции
от рестрикции [24, 25]. Увеличение скорости ранне-
го диастолического движения медиального сегмента
митрального кольца e′ независимо коррелирует с
диагнозом констриктивного перикардита, а меди-
альная скорость e′ 9 см/сек или более позволяет
дифференцировать констрикцию от рестрикции
или тяжелой трикуспидальной регургитации с чув-
ствительностью 83% и специфичностью 81% [26].
Важным ограничением использования этой скоро-
сти, регистрируемой в «единственной точке», явля-
ется то, что на нее могут влиять другие процессы,
такие как кальцификация фиброзного кольца, или
неравномерность распространения патологическо-
го процесса в перикарде или миокарде [31]. Также
предполагается, что митральная скорость e′ варьи-
рует в зависимости от причины констрикции. При
констрикции, обусловленной ранее проводимой
лучевой терапией или оперативным вмешатель-
ством на сердце, наблюдается относительно более
низкое значение скорости e′, по сравнению с идио-
патической констрикцией или констрикцией, свя-
занной с ревматическими заболеваниями или ранее
перенесенным перикардитом [26]. Пациенты, у ко-
торых проводилась лучевая терапия, представляют
собой особо сложную группу, поскольку часто у
них наблюдается комбинация компонента рестрик-
ции в дополнение к констрикции.
Реверсное движение фиброзного кольца
При оценке констрикции также может быть полез-
ным сравнение медиальных и латеральных скоро-
стей кровотока. В отличие от наблюдаемой в норме
Рис. 28.6 Цветовая допплерография печеночной вены при констриктивном перикардите. Визуализация в цветном M-режиме (субкостальное окно)
печеночной вены (ПВ) у пациента с констриктивным перикардитом. Во время выдоха наблюдается выраженная диастолическая реверсия кровотока (стрелки).
ПВ
В
Рис. 28.7 Тканевая допплерография при констриктивном перикардите. Визуализация медиальной части (стрелка) (А) и латеральной части (стрелка) (Б)
фиброзного кольца митрального клапана в обратной четырехкамерной позиции. Обратите внимание, что при нормальной или незначительно увеличенной скоро-
сти смещения фиброзного кольца митрального клапана в раннюю диастолу (e′) скорость движения медиальной части превышает таковую латеральной части
(annulus reversus) [Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 7:526–534,
2014].
А
Б
In-28_для нас.indd 713
03.04.2019 12:04:30
714
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
картины, при которой латеральная e′ превышает
медиальную e′, при констрикции часто значение
медиальной скорости e′ равно или превышает значе-
ние латеральной (см. рис. 28.7). Это явление было
названо annulus reversus. Оно, как полагают, связано
с фиксацией латерального миокарда к пораженному
перикарду с «компенсацией» медиальным сегмен-
том движения фиброзного кольца [32]. Однако от-
ношение медиальной скорости e′ к латеральной не
выявило независимой корреляции с диагнозом кон-
стриктивного перикардита, и поэтому абсолютную
ценность приобретает значение медиальной e′ как
более важный эхокардиографический показатель.
Парадоксальное движение фиброзного кольца
Сохраненная или увеличенная скорость e′ при кон-
стриктивном перикардите также приводит к более
низкому, чем предполагалось, соотношению скоро-
стей E/e′ несмотря на повышенное давление напол-
нения. Это явление было названо annulus paradoxus
[33]. Предметом споров остается наличие истинной
обратной связи между E/e′ и давлением заклинива-
ния легочных капилляров [33–35].
РЕСПИРАТОРНАЯ ВАРИАБЕЛЬНОСТЬ
ТРАНСМИТРАЛЬНОГО КРОВОТОКА
При констриктивном перикардите, как правило,
повышается давление наполнения, поэтому соотно-
шение скоростей трансмитрального кровотока в
фазу раннего наполнения (E) и позднего наполне-
ния (А) обычно является псевдонормальным или
рестриктивным и почти всегда превышает 0,8 [23,
36, 37]. Диссоциация внутриплеврального и вну-
трисердечного давления обычно выявляется при
допплеровском исследовании как снижение скоро-
сти раннедиастолического наполнения E на вдохе
(рис. 28.8). В начале выдоха с увеличением градиен-
та для наполнения левого сердца скорость раннеди-
астолического наполнения E увеличивается.
Процент изменения скорости раннедиастоличе-
ского наполнения E во время дыхания будет варьи-
ровать в зависимости от метода измерения и расче-
та. В соответствии с текущими рекомендациями
сравниваем первый удар на выдохе с первым ударом
на вдохе и для расчета процента изменения исполь-
зуем следующую формулу: [(Скорость на выдохе –
Скорость на вдохе)/Скорость на выдохе × 100] [4].
При ее использовании изменение митральной ско-
рости раннего наполнения E колеблется от 15 до
35% при констрикции [12, 23, 26, 38]. В литературе
описано, что вариабельность в диапазоне от 10 до
15% является оптимальной границей для отличия
констрикции от рестрикции с чувствительностью
84% и специфичностью от 73 до 91% [26, 38]. Одна-
ко существует несколько причин, почему изменение
митральной скорости раннедиастолического напол-
нения E обычно считается полезным, но не необхо-
димым для диагностики констрикции. Во-первых,
умеренное изменение митральной скорости ранне-
го наполнения E может наблюдаться при отсутствии
констрикции с вариацией до 12% при рестрикции
или тяжелой трикуспидальной регургитации [26].
Во-вторых, у пятой части пациентов с констрикци-
ей могут отсутствовать характерные изменения
скорости раннедиастолического наполнения E, ве-
роятно, из-за гиперволемии и очень высокого дав-
ления в ЛП. Повторное допплеровское исследова-
ние после проведения манипуляций, направленных
Рис. 28.8 Импульсно-волновая допплерография митрального кровотока при констриктивном перикардите. Визуализация в апикальной позиции на
уровне дистальных концов открытых створок митрального клапана. Обратите внимание на уменьшение скорости Е во время вдоха (красная стрелка) и увеличение
во время выдоха (желтая стрелка) [Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc
Imaging 7:526–534, 2014].
In-28_для нас.indd 714
03.04.2019 12:04:31
715
28 Заболевания перикарда
на снижение преднагрузки, например, перевод па-
циента в ортостатическое положение или положе-
ние сидя, может продемонстрировать более значи-
тельные изменения скорости раннедиастолического
наполнения E в этих случаях [39]. В -третьих, у па-
циентов с предсердной аритмией могут наблюдать-
ся изменения скорости раннедиастолического на-
полнения E, которые отражают периоды меняюще-
гося диастолического наполнения, вследствие чего
диссоциация между внутриплевральным и внутри-
сердечным давлением не может быть идентифици-
рована достоверно. Таким образом, изменение ми-
тральной скорости раннедиастолического наполне-
ния E не демонстрирует значительного различия
между констрикцией и другими нарушениями при
наличии фибрилляции или трепетания предсердий
[26]. В-четвертых, и в заключение, при многопара-
метрическом анализе не было отмечено независи-
мой корреляции изменения митральной скорости
раннедиастолического наполнения E и констрик-
ции, вероятно, из-за вышеперечисленных факторов
[26].
ДРУГИЕ ЭХОКАРДИОГРАФИЧЕСКИЕ ПОКАЗАТЕЛИ
Показатели двухмерного исследования и М-режима
• Расширение нижней полой вены, как маркер повы-
шенного венозного давления, является предпо-
лагаемым, но не специфичным для диагностики
констрикции. В клинике Mayo в группе из 130
пациентов с констрикцией у всех, кроме пяти,
отмечалось расширение нижней полой вены, ко-
торая определялась диаметром более 2,1 см и/
или спадением менее 50% на вдохе или при «вдо-
хе носом» [26].
• Утолщение перикарда ожидаемо в 85% случаев,
но не является необходимым для диагностики
констрикции, и лучше оценивается с помощью
компьютерной томографии или сердечной маг-
нитно-резонансной томографии [26]. Чреспи-
щеводная эхокардиография (ЧПЭхоКГ), вероят-
но, предоставляет более достоверные данные,
чем ТТЭхоКГ, при измерении толщины пери-
карда, хотя обычно не применяется [40].
• Перикардиальный выпот наблюдается не постоян-
но (в 10–24% случаев, требующих перикардэкто-
мии) и может свидетельствовать о наличии экссу-
дативно-констриктивного перикардита [26, 41].
• Диастолическая «задержка» или «уплощение» при
расширении свободной стенки ЛЖ в диастоле
может быть оценена как с помощью 2D-визуали-
зации, так и с помощью M-режима [42].
• Искажение контура желудочка в результате явно
констриктивного перикардита может быть опре-
делено в 34% случаев и, вероятно, является весь-
ма специфическим показателем [26].
• Выраженная фиксация свободной стенки ПЖ с
диафрагмой и печенью, в отличие от нормально-
го свободного «скользящего» движения во время
сердечного цикла, было зарегистрировано у 61%
пациентов с констрикцией, но, по-видимому, не
является специфичной для диагноза [26].
Допплеровские показатели
• Несмотря на то что большое внимание придают
респираторным изменениям в печеночном и ми-
тральном допплеровских профилях, характер-
ные изменения скорости кровотока также были
описаны для аорты, легочной артерии, трику-
спидального клапана и легочных вен.
• Согласно ранее полученным данным, во время
вдоха происходит средние снижение скорости
аортального кровотока на 14%, увеличение ско-
рости кровотока в легочной артерии на 16% и
увеличение трикуспидальной скорости раннедиа-
столического наполнения E на 48–55% [12, 23].
• Несмотря на то, что при констрикции обычно не
выполняется, ЧПЭхоКГ является наилучшим
методом визуализации для оценки респираторно
обусловленных изменений допплеровского про-
филя легочных вен. Наиболее ценными показа-
телями являются: (1) значительное повышение
отношения систолической и диастолической
скорости прямого потока, по сравнению с ре-
стрикцией и (2) более выраженное увеличение
(> 18%) пиковой диастолической скорости пря-
мого потока во время выдоха при констрикции,
в отличие от рестрикции [38, 43]. Увеличение на
выдохе диастолической скорости прямого пото-
ка в легочной вене отражает увеличение доппле-
ровских скоростей, определенных в других зонах
в левом сердце во время выдоха.
• Другие допплеровские показатели, описанные
для правого сердца, включают в себя увеличение
пиковой скорости и интеграла скорости потока
трикуспидальной регургитации, и преждевре-
менное прекращение струи регургитации на ле-
гочном клапане во время вдоха [44, 45].
• Допплеровский цветовой M-режим более слож-
ный в использовании, но также может быть по-
лезен для дифференциальной диагностики кон-
стрикции от рестрикции путем оценки замедле-
ния распространения потока, которое связано с
релаксационными свойствами желудочков и
имеет тенденцию к повышению (> 100 см/сек)
при констрикции [38].
• Допплеровская оценка верхней полой вены являет-
ся важным компонентом эхокардиографическо-
го перикардиального протокола, поскольку она
помогает дифференцировать констрикцию от
обструктивной болезни легких и других состоя-
ний, которые могут вызывать «ложноположи-
тельные» результаты эхокардиографического
обследования при отсутствии заболеваний пе-
рикарда. При обструктивной болезни легких
респираторная вариабельность допплеровских
In-28_для нас.indd 715
03.04.2019 12:04:31
716
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
скоростей обусловлена выраженными колеба-
ниями внутриплеврального давления и сопро-
вождается значительным увеличением (35% или
более) скорости кровотока от верхней полой ве-
ны к правому предсердию во время вдоха [46].
Напротив, при констриктивном перикардите
скорость прямого потока в верхней полой вене
на вдохе значительно не увеличивается и может
даже уменьшаться (рис. 28.9). Это является эхо-
кардиографическим коррелятом «симптома Кус-
смауля» или увеличения яремного венозного
давления на вдохе, которое иногда наблюдается
при констрикции. «Плоский» допплеровский
профиль верхней полой вены при констрикции
резко отличается от нарастающего прямого по-
тока в печеночной вене на вдохе (см. рис. 28.5).
Обнаружение этого явления, вероятно, связано с
конкурирующими потоками из верхней и ниж-
ней полых вен (и, следовательно, печеночных
вен) при высоком давлении в ПП. Кровотоку в
печеночной и нижней полой венах во время вдо-
ха способствует повышение внутрибрюшного
давления, возникающее из-за опущения диа-
фрагмы [47]. Это увеличение возврата из нижней
полой вены ограничивает приток из верхней
полой вены, потому что сердечное наполнение
снижено за счет патологически измененного пе-
рикарда.
Визуализация деформации
Спекл-трекинг визуализация деформации предо-
ставляет дополнительную информацию о специфи-
ческих механических нарушениях миокарда при
констрикции и является еще одним методом диф-
ференциальной диагностики констрикции и ре-
стрикции. Глобальная продольная систолическая
деформация обычно сохраняется при констрикции
и снижается при рестрикции [48]. Циркулярная
систолическая деформация, скручивание и раннее
диастолическое раскручивание, наоборот, как пра-
вило, уменьшаются при констрикции и остаются
сохранными при рестрикции. Считается, что это
связано с тем, что субэндокардиальные мышечные
волокна, отвечающие за продольную деформацию,
поражаются при рестрикции, тогда как субэпикар-
диальные мышечные волокна, отвечающие за цир-
кулярную деформацию, поражаются при констрик-
ции.
Также были продемонстрированы значительные
различия регионарной продольной систолической
деформации. Так, при констрикции регионарная
деформация миокарда обратно пропорциональна
толщине прилежащего перикарда, измеренной с
помощью магнитно-резонансной томографии [49].
Продольная деформация латеральных стенок ЛЖ и
ПЖ снижена, по сравнению с перегородочной стен-
кой, поскольку они фиксированы к патологически
измененному перикарду (рис. 28.10). При рестрик-
ции не предполагаются регионарные различия в
такой же степени, благодаря чему соотношение ла-
теральной деформации ЛЖ к деформации перего-
родки может использоваться для дифференциаль-
ной диагностики констрикции и рестрикции [49].
Различие между латеральной и перегородочной де-
Рис. 28.9 Импульсно-волновая допплерография кровотока в верхней полой вене при констриктивном перикардите. Визуализация в правой надклю-
чичной позиции. Обратите внимание, что скорость антеградного потока во время вдоха не увеличивается (желтая стрелка) (в данном случае фактически снижа-
ется). Красная стрелка — скорость во время выдоха.
In-28_для нас.indd 716
03.04.2019 12:04:31
717
28 Заболевания перикарда
формациями, по-видимому, устраняется после пе-
рикардэктомии.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
С РЕСТРИКТИВНОЙ КАРДИОМИОПАТИЕЙ
Констриктивный перикардит и рестриктивная кар-
диомиопатия могут иметь сходные проявления,
несмотря на различные патофизиологические меха-
низмы их развития. Нарушение диастолического
наполнения вызвано ригидностью миокарда при
рестрикции и снижением эластичности перикарда
при констрикции. Поэтому их лечение заметно от-
личается, и констрикция может быть «излечена»
путем удаления патологически измененного пери-
карда или иногда с помощью противовоспалитель-
ной терапии. Комплексная эхокардиография предо-
ставляет важную информацию, которая может быть
использована для дифференциальной диагностики
этих двух патологий. В табл. 28.3 приведены важ-
ные эхокардиографические отличительные призна-
ки констрикции и рестрикции.
2D-эхокардиографическая оценка морфологии
сердца обычно не является диагностической. При
констрикции утолщение перикарда может быть бо-
лее распространенным, но ТТЭхоКГ не позволяет
дать этому точную оценку. Расширение ЛП и утол-
щение стенки желудочка чаще могут наблюдаться
при рестрикции. Расширение нижней полой вены
отмечается при обеих патологиях.
Ключевым в диагностике констрикции и диффе-
ренциальной диагностике с рестрикцией является
выявление эхокардиографических признаков ее
патофизиологических особенностей, описанных
ранее и включающих (1) усиленное взаимодействие
желудочков, (2) диссоциацию внутриплеврального
и внутрисердечного давления и (3) специфические
релаксационные свойства миокарда. Несмотря на
необходимость учета всех данных эхокардиогра-
фии, три эхокардиографических показателя демон-
стрируют независимую корреляцию с диагнозом
констриктивного перикардита и поэтому, вероятно,
являются наиболее важными: (1) смещение межже-
лудочковой перегородки, (2) сохраненная или уве-
личенная медиальная e′ и (3) значительно увеличен-
ная диастолическая реверсия кровотока в печеноч-
ной вене на выдохе [26]. Выявление смещения
межжелудочковой перегородки вместе с любым из
Рис. 28.10 Визуализация деформации при констриктивном перикардите. Продольная систолическая деформация (спекл-трекинг) у пациента с констрик-
тивным перикардитом в виде кольцевидной диаграммы. Практически нормальное значение глобальной средней продольной систолической деформации (–17,8%).
Выраженное снижение латеральной деформации по сравнению с перегородочной деформацией из-за эффекта ограничения патологически измененным перикар-
дом.
Пиковая систолическая деформация
In-28_для нас.indd 717
03.04.2019 12:04:32
718
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Констрикция
Рестрикция
Респираторно обу-
словленное смеще-
ние межжелудоч-
ковой перегородки
Наблюдается
Отсутствует
Диастолическая
реверсия крово-
тока в печеночной
вене
Отмечается на
выдохе
Отмечается на
вдохе
Митральная меди-
альная скорость e′
Сохранена или
увеличена
Снижена
Респираторная
вариабельность
митральной ско-
рости E
Обычно
выражена
Минимальная
Продольная систо-
лическая
деформация
Глобальная
сохранена,
латеральная
снижена по
сравнению с
перегородоч-
ной
Глобальная
снижена без зна-
чительной регио-
нарной
неоднородности
ТАБЛИЦА 28.3 Констрикция и рестрикция: характерные
эхокардиографические показатели
двух других показателей дает оптимальное сочета-
ние чувствительности (87%) и специфичности
(91%). Наличие этих изменений не предполагается
при рестрикции, которая обычно характеризуется
трансмитральным кровотоком рестриктивного ти-
па, значительным увеличением диастолической ре-
версии кровотока в печеной вене на вдохе (а не на
выдохе) и низкой медиальной скоростью e′. Смеще-
ние межжелудочковой перегородки, связанное с
дыханием, и колебание трансмитральной скорости
наполнения, как правило, отсутствуют при рестрик-
ции.
Не существует общепринятого алгоритма для
эхокардиографической диагностики констриктив-
ного перикардита. Один из алгоритмов, предложен-
ный клиникой Mayo, представлен на рис. 28.11 [36].
Как при констрикции, так и при рестрикции пред-
полагается расширение нижней полой вены и соот-
ношение митрального E к A, равное по меньшей
мере 0,8. Выявление респираторно обусловленного
смещения межжелудочковой перегородки является
высокочувствительным начальным признаком. По-
сле этого определение сохраненной медиальной
скорости e′ и/или значительно увеличенной диасто-
лической реверсии кровотока в печеночной вене на
выдохе обеспечивает постепенное повышение спец-
ифичности для диагностики констрикции. В неко-
торых случаях констрикция может сочетаться с ре-
стрикцией. Неожиданно низкая скорость e′ при
наличии других показателей, свидетельствующих о
констрикции, может быть ключевым признаком.
Если диагноз остается неустановленным после тща-
тельной клинической оценки и выполнения пери-
кардиального эхокардиографического протокола,
рекомендуется дополнительное исследование, кото-
рое может включать гемодинамическую катетериза-
цию, компьютерную томографию и/или сердечную
магнитно-резонансную томографию.
ЭКССУДАТИВНО-КОНСТРИКТИВНЫЙ ПЕРИКАРДИТ
И ТРАНЗИТОРНЫЙ КОНСТРИКТИВНЫЙ
ПЕРИКАРДИТ
Существует некоторое наложение констриктивных
перикардиальных синдромов. Экссудативно-кон -
стриктивный перикардит является диагностиче-
ским термином, используемым при скоплении пе-
рикардиальной жидкости между листками кон-
стриктивного перикарда, причем констриктивная
гемодинамика сохраняется даже после удаления
перикардиальной жидкости [50, 51]. Ограниченные
данные свидетельствуют о том, что это редко встре-
чающаяся нозологическая форма, идентифициро-
ванная у 8% пациентов, которым был назначен пе-
рикардиоцентез [51]. Подозрение на экссудатив-
но-констриктивный перикардит, как правило,
возникают при сохранении повышенного яремного
венозного давления или давления в ПП после
успешно выполненного терапевтического перикар-
диоцентеза. Ожидается, что эхокардиографическая
визуализация с использованием перикардиального
протокола будет демонстрировать признаки кон-
стрикции, несмотря на устранение экссудата. Экссу-
дативно-констриктивный перикардит чаще всего
возникает вследствие идиопатического перикардита
и злокачественных новообразований, но также мо-
жет наблюдаться после облучения, операций на
сердце и туберкулезного перикардита [51]. В неко-
торых случаях может потребоваться перикардэкто-
мия, что является технически сложной задачей, по-
скольку чаще всего наблюдается вовлечение висце-
рального перикарда, который необходимо удалять
путем острой диссекции по поверхности сердца. В
других случаях улучшения можно достичь при про-
ведении противовоспалительной терапии.
У меньшего количества пациентов с констрикци-
ей было описано наличие воспалительного транзи-
торного констриктивного перикардита, который
разрешался в течение от нескольких недель до ме-
сяцев после назначения противовоспалительной
терапии [22, 52]. В ходе серийного исследования с
участием 212 пациентов с констрикцией транзитор-
ный характер отмечался у 36 (17%) больных [22]. В
большинстве этих случаев (67%) был выявлен экс-
судативно-констриктивный процесс. Определение
того, у каких пациентов констрикция носит потен-
циально транзиторный характер, лучше всего вы-
полнять с помощью оценки сывороточных марке-
ров воспаления и сердечной магнитно-резонансной
томографии; эхокардиография не представляет
In-28_для нас.indd 718
03.04.2019 12:04:32
719
28 Заболевания перикарда
ценности для решения этого вопроса [53]. Позднее
усиление с гадолинием перикарда позволяет пред-
положить воспалительный процесс и, следователь-
но, потенциальную обратимость состояния.
ПЕРИКАРДИАЛЬНАЯ ЖИДКОСТЬ
Большое число состояний может сопровождаться
избыточным накоплением перикардиальной жид-
кости; все причины могут быть грубо классифици-
рованы на идиопатические, инфекционные, трав-
матические, сердечные, воспалительные, неопла-
стические, метаболические и другие (в том числе
радиационные) (см. табл. 28.1). К механизмам, ле-
жащим в основе образования перикардиального
выпота, относятся обструкция лимфатического
протока, повышенное центральное венозное давле-
ние и повышенная проницаемость перикарда.
Эхокардиография рекомендована в качестве пер-
вичной диагностической визуализации и использу-
ется для идентификации наличия перикардиально-
го экссудата, оценки размера или объема выпота и
определения его гемодинамического значения [4].
ЭХОКАРДИОГРАФИЧЕСКАЯ ДИАГНОСТИКА
Перикардиальный выпот определяется как эхопро-
зрачное пространство между эпикардом и парие-
тальным перикардом. Если оно наблюдается только
в систолу, то количество жидкости является физио-
логическим или незначительным. Выявляемое на
протяжении всего сердечного цикла количество
жидкости превышает физиологическое (> 50 мл)
[4]. Жидкость может располагаться в окружающем
сердце пространстве и легко визуализироваться,
реже, может быть осумкована и выявляться только
в некоторых окнах визуализации.
Перикардиальный экссудат необходимо отли-
чать от неперикардиальных процессов и вариантов
анатомической нормы. Левосторонний плевраль-
ный выпот может имитировать задний перикарди-
альный экссудат. Решающее значение в диффдиа-
гностике имеет прослеживание связи жидкости с
нисходящей частью грудной аорты в парастерналь-
ном окне визуализации: перикардиальная жидкость
будет определяться перед аортой, а плевральная
жидкость — нет (рис. 28.12) [54]. Эпикардиальный
слой жира может имитировать перикардиальный
экссудат, но в отличие от жидкости он относитель-
но эхопозитивен и движется вместе с миокардом
(рис. 28.13). Напротив, трансудативный перикарди-
альный выпот, как правило, эхопрозрачный и не-
подвижный [4].
Эта эхопрозрачность не может быть характерна
для экссудативных перикардиальных выпотов, ко-
торые часто содержат пряди или спайки. Также в
перикардиальном пространстве могут присутство-
вать кровь или опухоль. Наличие эхопозитивного
сгустка в перикардиальном пространстве является
Плетора НПВ
Да
Да
0
≥1
0
1
2
Нет Констрикция маловероятна*
Смещение межжелудочковой перегородки во время дыхания
Констрикция подтверждена
Констрикция вероятна
Констрикция маловероятна*
Констрикция возможна*
* При подозрении на констриктивный перикардит
необходимо рассмотреть дальнейшую визуализацию
или инвазивные методы оценки гемодинамики.
1. Медиальная скорость e′≥ 9 см/сек
2. Коэффициент реверсии
кровотока на вдохе в ПВ ≥ 0,79
1. Медиальная скорость e′≥ 9 см/сек
2. Коэффициент реверсии кровотока
навдохевПВ≥0,79
Митральное Е/А > 0,8
Отсутствует
Присутствует
Рис. 28.11 Алгоритм диагностики констриктивного перикардита, основанный на критериях клиники Mayo [26]. Обратите внимание, что у пациентов
с обструктивной болезнью легких или повышенным дыхательным усилием может отмечаться усиленное взаимодействие желудочков, и нормальное значение e′,
особенно у молодых пациентов. В этой ситуации для дифференциальной диагностики с констрикцией может служить заметная респираторно обусловленная
вариабельность скорости кровотока, наблюдаемая в верхней полой вене. Числа обозначают количество наблюдаемых критериев в зеленых ячейках. A — скорость
кровотока в систолу предсердий позднего наполнения; E — скорость кровотока через митральное кольцо в ранней диастолической фазе; e′ — скорость крово-
тока через митральное кольцо в ранней диастолической фазе; НПВ — нижняя полая вена; ПВ — печеночная вена [Syed FF, Schaff HV, Oh JK. Constrictive
pericarditis — a curable diastolic heart failure. Nature reviews. Cardiology 11:530–544 , 2014].
In-28_для нас.indd 719
03.04.2019 12:04:32
720
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
особенно зловещим признаком, который может
возникать при перфорации миокарда или расслаи-
вающей аневризме восходящей аорты (рис. 28.14).
Сгусток или осумкованный выпот в перикардиаль-
ном пространстве является иногда трудно распозна-
ваемой причиной очаговой компрессии камеры и
гемодинамического коллапса, особенно после опе-
рации на сердце; как правило, требуется транспище-
водная визуализация или визуализация методом
«поперечного среза» (рис. 28.15) [4, 55–57].
Полуколичественная классификация перикарди-
ального экссудата методом 2D-эхокардиографии
основана на измерении ободка жидкости между
эпикардом и париетальным перикардом в конце
диастолы. Небольшой выпот имеет ободок разме-
ром менее 10 мм; умеренный выпот имеет ободок
Рис. 28.12 Перикардиальная жидкость при визуализации в 2D-режи-
ме. В парастернальной позиции по длинной оси визуализируются перикарди-
альная жидкость (красная стрелка) и плевральная жидкость. Перикардиальная
жидкость локализуется перед грудной частью нисходящего отдела аорты
(НАо). Плевральная полость и коллабированное легкое определяются позади.
Два слоя жидкости разделяет париетальный перикард (белая стрелка). ЛЖ —
левый желудочек.
Рис. 28.13 Жировая ткань перикарда. В парастернальной позиции по
длинной оси виден выступающий жировой слой (красная стрелка). На самом
деле существует два слоя, разделенных париетальным перикардом (белая
стрелка). ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый
желудочек.
Рис. 28.14 A Тромбоз полости перикарда. В полости перикарда наблю-
дается усиление эхо-сигнала от сгустков крови (красная стрелка) вследствие
перфорации миокарда при манипуляции. Париетальный перикард указан бе-
лой стрелкой. ЛЖ — левый желудочек; ПЖ — правый желудочек.
ЛЖ
Плевральная
полость
НАо
ПЖ
ЛЖ
ЛП
ПЖ
ЛЖ
Рис. 28.15 A Ограниченный объем перикардиальной жидкости. В па-
растернальной позиции по длинной оси визуализируется ограниченный объем
жидкости (стрелка), что приводит к коллапсу правого желудочка (ПЖ) во
время диастолы. ЛЖ — левый желудочек (предоставлено Sunil Mankad, MD).
ПЖ
ЛЖ
от 10 до 20 мм; а большой выпот имеет ободок более
20 мм [4].
Также иногда используются дополнительная
классификация на незначительный (ободок < 5 мм)
и очень большой (ободок > 25 мм). При любом зна-
чительном выпоте следует указывать распределение
жидкости для принятия решения о целесообразно-
сти чрескожного вмешательства и выбора опти-
мального доступа при необходимости его выполне-
ния.
ТАМПОНАДА ПОЛОСТИ ПЕРИКАРДА
ОПРЕДЕЛЕНИЕ И ЭТИОЛОГИЯ
Тампонада сердца представляет собой потенциаль-
но опасное для жизни состояние сердечной недоста-
In-28_для нас.indd 720
03.04.2019 12:04:32
721
28 Заболевания перикарда
точности, при котором происходит нарушение
сердечного наполнения из-за скопления избыточ-
ной перикардиальной жидкости под давлением.
Тампонада может быть обусловлена любым состоя-
нием или осложнением, приводящим к увеличению
содержания жидкости в перикардиальном про-
странстве. Диагноз должен опираться на клиниче-
скую оценку, которая основывается на эхокардио-
графических данных. Тампонаду, пожалуй, лучше
всего рассматривать как спектр гемодинамических
нарушений, а не феномен «все или ничего».
ПАТОФИЗИОЛОГИЯ
Несмотря на то, что перикард в норме имеет огра-
ниченную способность к «растяжению», резко нака-
пливаемый перикардиальный выпот быстро запол-
няет резервный объем и снижает перикардиальную
растягивающую способность, вследствие чего пери-
кардиальное давление начинает быстро нарастать
(рис. 28.16). При более медленном накоплении вы-
пота перикард способен растягиваться в большей
степени, и в нем может содержаться больший объем
жидкости до начала быстрого роста перикардиаль-
ного давления [58]. Повышение перикардиального
давления приводит к снижению трансмурального
давления растяжения миокарда (давление внутри
сердечной камеры минус перикардиальное давле-
ние) и тем самым уменьшает сердечное наполнение,
сначала правого сердца, но в конечном итоге всех
сердечных камер, объем которых ограничен пери-
кардиальной жидкостью в условиях фиксированно-
го общего перикардиального объема. Таким обра-
зом, снижение эластичности растянутого перикарда
обуславливает растяжимость всех сердечных камер,
размер которых уменьшается и диастолическое дав-
ление в них сравнивается и эквивалентно перикар-
диальному давлению [9, 59].
Из-за пространственных ограничений фиксиро-
ванного общего перикардиального объема при там-
понаде наполнение желудочков происходит в ущерб
друг другу, что приводит к характерным клиниче-
ским проявлениям. Это повышенное, или увеличен-
ное взаимодействие желудочков (на рис. 28.2 проде-
монстрировано аналогичное явление при констрик-
ции) считается одним из основных механизмов
возникновения парадоксального пульса (снижение
систолического артериального давления на > 10 мм
рт. ст. на вдохе), выявляемого у большинства паци-
ентов с тампонадой [10].
Как было описано ранее, в норме наблюдается
незначительное респираторное изменение ударного
объема левого желудочка и систолического артери-
ального давления. При тампонаде эти изменения
становится значительно выраженными (и не пара-
доксальными). При тампонаде во время вдоха
по-прежнему будет наблюдаться увеличение веноз-
ного возврата в правое сердце, но поступление это-
го объема может быть осуществлено только путем
смещения межжелудочковой перегородки влево,
потому что расширение ПЖ наружу невозможно.
Будет снижаться наполнение и выброс ЛЖ, что при-
ведет к уменьшению ударного объема и систоличе-
ского артериального давления во время вдоха [10,
60]. Обратные изменения наблюдаются на выдохе.
Несмотря на то что диссоциация внутриплеврально-
го и внутрисердечного давления с уменьшением гра-
диента давления между легочными венами и ЛП на
вдохе предполагается [59] в качестве дополнитель-
ного вспомогательного механизма, она не всегда
выявлялась в ходе экспериментальных исследова-
ний и, вероятно, играет лишь второстепенную роль
(см. рис. 28.3) [10, 60]. Другими словами, заполнен-
ный жидкостью перикард может оказывать некото-
рое «изолирующее» воздействие на изменения вну-
трисердечного давления, но не такое выраженное,
как патологически измененный перикард при кон-
стриктивном перикарде.
По мере нарастания перикардиального давления
системное и легочное венозное давление также
должны увеличиваться для сохранения наполне-
ния. Наполнение предсердий большей частью про-
исходит в систолу, чем в диастолу, потому что
объем сердца и перикардиальное давление времен-
но уменьшаются только в раннюю систолу [4].
Диастолическое наполнение желудочков постепен-
но снижается, что приводит к притуплению нисхо-
дящего колена у волнообразной кривой яремной
вены. Дополнительно к увеличению венозного дав-
ления могут включаться другие компенсаторные
механизмы: тахикардия и артериальная вазокон-
стрикция. В конечном счете, происходит их деком-
пенсация, и при отсутствии вмешательства возни-
кает гемодинамический коллапс.
30
25
20
15
10
5
0
–5
20
10
0
50
40
30
100 200
В
н
у
т
р
и
п
е
р
и
к
а
р
д
и
а
л
ь
н
о
е
д
а
в
л
е
н
и
е
(
с
м
в
о
д
.
с
т
.
)
Объем перикардиальной жидкости (мл)
Рис. 28.16 Связь между объемом перикарда и перикардиальным
давлением в норме. Связь между объемом перикарда и перикардиальным
давлением у пациента с нормальной анатомией перикарда (красная линия) и
типичными показателями у пациента, у которого постепенно развился перикар-
диальный выпот (синяя линия) [Edmunds HL. Cardiac surgery in the adult, New
York, 1997, McGraw–Hill].
In-28_для нас.indd 721
03.04.2019 12:04:33
722
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ЭХОКАРДИОГРАФИЧЕСКАЯ ДИАГНОСТИКА
Эхокардиография является основным методом ви-
зуализации при подозрении на тампонаду [4]. Пе-
рикардиальный выпот может вызвать спектр гемо-
динамических эффектов, а эхокардиография помо-
гает определить их наличие у конкретного пациента.
Обследование при тампонаде имеет много общего
с обследованием при констрикции, несмотря на
их различные патофизиологические механизмы.
Специальный перикардиальный эхокардиогра-
фический протокол позволяет характеризовать
выпот и идентифицировать коллапс камеры, рас-
ширение нижней полой вены и респираторно обу-
словленные изменения право- и левостороннего
наполнения сердца (см. табл. 28.2). Эту информа-
цию следует рассматривать в сочетании с клиниче-
ской оценкой у постели больного. В случаях, когда
данные эхокардиографии не согласуются с диагно-
зом тампонады, но присутствует повышенная кли-
ническая настороженность, может потребоваться
серийная эхокардиография.
ХАРАКТЕРИСТИКА ПЕРИКАРДИАЛЬНОГО ВЫПОТА
Эхокардиографическое исследование начинается с
идентификации перикардиального выпота, который
обычно определяется в умеренном или большом ко-
личестве. Сердце может выполнять характерные «ка-
чающиеся» движения внутри жидкости, которые
проявляются электрокардиографическим признаком
электрической альтернации. Однако даже неболь-
шой или очаговый выпот может вызвать опасную
для жизни тампонаду при острых состояниях после
травмы, расслоения аорты, разрыва миокарда, ос-
ложняющего инфаркт, или перфорации в результате
осложнения проведения манипуляций на сердце.
СЕРДЕЧНЫЙ КОЛЛАПС
При повышении перикардиального давления выше
давления в сердечной камере произойдет компрес-
сия или коллапс этой камеры. Это явление, как
правило, носит фазный характер в течение сердеч-
ного цикла в результате происходящих динамиче-
ских изменений трансмурального давления мио-
карда. Поскольку стенки правых сердечных камер
более податливы, то чаще всего поражается правое
сердце. Клинически это характеризуется компрес-
сией, инверсией или коллапсом камеры.
Компрессия, инверсия и коллапс
правого предсердия
Поскольку давление в ПП, как правило, самое низ-
кое в течение сердечного цикла, изначально наблю-
дается коллапс ПП, что считается высокочувстви-
тельным признаком повышенного перикардиаль-
ного давления и тампонады [61–63]. Коллапс ПП
обычно возникает в конце диастолы желудочков
(около зубца R на электрокардиограмме) и может
сохраняться во время желудочковой систолы до тех
пор, пока за счет наполнения не увеличится пред-
сердное давление выше перикардиального (рис.
28.17). Хотя кратковременный коллапс может воз-
никать при отсутствии клинической картины там-
понады и, следовательно, не имеет специфичности,
по имеющимся сведениям, коллапс, сохраняющий-
ся на протяжении, по крайней мере, одной трети
сердечного цикла, является высокочувствительным
(94%) и специфическим (100%) признаком тампо-
нады [63]. Повышенное давление в ПП и желудоч-
ковая стимуляция ритма сердца могут снизить на-
дежность этого признака [63].
Компрессия, инверсия и коллапс правого желудочка
Предполагается, что коллапс ПЖ будет наблюдать-
ся при более высоком уровне перикардиального
давления, чем коллапс ПП, что делает его в целом
менее чувствительным, но более специфическим
признаком тампонады [61, 64–67]. Коллапс ПЖ воз-
никает в раннюю диастолу, когда объем и давление
в желудочке являются самыми низкими, и сохраня-
ется до увеличения давления в желудочке выше
перикардиального за счет наполнения (рис. 28.18).
Эхокардиографическое исследование лучше всего
выполнять с помощью комбинации 2D-визуализа-
ции и M-режима.
Изначально коллапс более выражен во время
выдоха, но с нарастанием тампонады будет наблю-
даться на протяжении всего дыхательного цикла.
Установлено, что коллапс ПЖ связан с гемодинами-
чески значимым снижением сердечного выброса,
несмотря на сохранение уровня системного артери-
ального давления [68]. Однако коллапс ПЖ не мо-
жет быть достоверным признаком тампонады в
случаях, когда имеется гипертрофия ПЖ или значи-
тельное увеличение диастолического давления, что
может наблюдаться при легочной гипертензии или
гиперволемии [68, 69].
Коллапс полостей левого сердца
Поскольку давление в ЛП обычно выше, чем давле-
ние в ПП, коллапс ЛП является менее распростра-
ненным явлением при тампонаде [62]. Тем не менее,
коллапс ЛП — это специфический признак тампо-
нады, который может наблюдаться самостоятельно
в случаях тампонады с легочной гипертензией или
регионарной тампонады после травмы или опера-
ции на сердце (рис. 28.19) [70, 71]. Коллапс камеры
ЛЖ, по-видимому, является еще более редким яв-
лением, но может возникать при ограниченном
выпоте, возникающем после травмы или хирурги-
ческого вмешательства [70, 72].
ПОЛНОКРОВИЕ НИЖНЕЙ ПОЛОЙ ВЕНЫ
В большинстве случаев тампонады нарушение сер-
дечного наполнения сопровождается увеличением
венозного давления. Полнокровие нижней полой
In-28_для нас.indd 722
03.04.2019 12:04:33
723
28 Заболевания перикарда
вены (уменьшение диаметра на < 50% во время глу-
бокого вдоха или «вдоха носом») является одним из
эхокардиографических коррелятов увеличения ве-
нозного давления и, как было показано, является
высокочувствительным (97%) для тампонады [66].
Поэтому этот признак ожидаем при эхокардиогра-
фической оценке тампонады. Однако полнокровие
нижней полой вены может возникать при любых
причинах повышения венозного давления и не яв-
ляется специфическим признаком для диагностики
тампонады.
РЕСПИРАТОРНАЯ ВАРИАБЕЛЬНОСТЬ
ПРАВО И ЛЕВОСТОРОННЕГО СЕРДЕЧНОГО НАПОЛНЕНИЯ
Из-за усиленного взаимодействия желудочков, дву-
мерное исследование, как правило, выявляет респи-
раторно обусловленное изменение положения меж-
желудочковой перегородки со смещением к ЛЖ на
вдохе и к ПЖ на выдохе (рис. 28.20).
Рис. 28.19 A Коллапс левого и правого предсердий во время диа-
столы при тампонаде сердца. Апикальная четырехкамерная позиция. Ви-
зуализируется коллапс левого предсердия (ЛП) (белая стрелка) и правого
предсердия (ПП) (красная стрелка), сохраняющийся до систолы желудочков.
ЛЖ — левый желудочек; ПЖ — правый желудочек.
Перикардиальная
жидкость
ПЖ
ЛЖ
ЛП
ПП
Рис. 28.17 Коллапс правого предсердия во время диастолы при тампонаде сердца. (А) A 2D-ЭхоКГ в парастернальной позиции по короткой оси.
Коллапс правого предсердия (ПП) (белая стрелка) во время диастолы сохраняется до систолы желудочков. Красная стрелка указывает на перикардиальную
жидкость. (Б) ЭхоКГ в M-режиме. Коллапс правого предсердия (стрелка). АК — аортальный клапан; ЛП — левое предсердие; ПЖ — правый желудочек.
ПП
ПЖ
АК
ПП
ЛП
Свободная
стенка ПП
А
Б
Рис. 28.18 Коллапс правого желудочка во время диастолы при тампонаде сердца. (А) A 2D-ЭхоКГ в парастернальной позиции по длинной оси.
Коллапс правого желудочка (ПЖ) (белая стрелка) сохраняется до поздней диастолы. Красная стрелка указывает на перикардиальную жидкость. (Б) Коллапс
правого желудочка (стрелка) в M-режиме. ЛЖ — левый желудочек; ЛП — левое предсердие.
ПЖ
ЛЖ
ЛП
Свободная
стенка ПЖ
А
Б
In-28_для нас.indd 723
03.04.2019 12:04:34
724
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Циклическая вариабельность право- и левосто-
роннего сердечного наполнения также может быть
выявлена с помощью допплерэхокардиографии
[13, 73, 74]. Из-за усиленного взаимодействия желу-
дочков право- и левосторонние допплеровские ско-
рости будут изменяться в зависимости от дыхания
прямо противоположно относительно друг друга.
На вдохе наполнение правого сердца увеличивается
за счет наполнения левого сердца, и на выдохе на-
блюдается обратное явление. Соответственно, три-
куспидальная скорость раннедиастолического на-
полнения E будет возрастать на вдохе и уменьшать-
ся на выдохе, с процентным изменением, обычно
превышающим 60%, и рассчитывается как: [(ско-
рость на выдохе – скорость на вдохе) / скорость на
выдохе × 100, используя первые удары на выдохе и
вдохе] (рис. 28.21) [4, 13]. Ожидается, что скорость
кровотока в легочной артерии будет меняться со-
гласно трикуспидальной скорости потока. В то же
время скорость кровотока через митральный кла-
пан будет возрастать на выдохе и уменьшаться на
вдохе с процентным изменением, обычно превы-
шающим 30% (см. рис. 28.21) [4, 13, 73]. Иногда при
тампонаде изменение пиковой скорости наполне-
ния может возникать даже при диастолическом
наполнении, главным образом обусловленном со-
кращением предсердий (регистрируется как волна
А в профиле митрального притока) [4]. Ожидается,
что скорость кровотока в легочных венах и аорте
изменится в соответствии со скоростью кровотока
через митральный клапан. Также в клинической
практике описаны часто наблюдаемые респиратор-
ные изменения времени изоволюмической релакса-
ции ЛЖ (увеличение на вдохе) и времени выброса
(увеличение на выдохе) [13].
Дыхательная вариабельность допплеровского
профиля печеночной вены может также быть кли-
нически полезна при диагностике тампонады. Ожи-
дается, что при тампонаде будет преобладать систо-
лический прямой поток в печеночной вене, потому
что давление в предсердиях снизится только во
время сокращения желудочков (рис. 28.22). Поэто-
му по мере нарастания тампонады диастолический
прямой поток в печеночной вене уменьшается и, в
конечном счете, становится неопределяемым с по-
мощью допплера. На вдохе происходит увеличение
скорости прямого потока в печеночной вене. С на-
чалом выдоха, когда преимущественно происходит
наполнение левого сердца за счет правого, диасто-
лический прямой поток в печеночной вене будет
заметно уменьшаться или возникать реверсия кро-
вотока [13, 73]. Аналогичные явления наблюдаются
в верхней полой вене. Нарушение кровотока в пе-
ченочной вене (систолическое преобладание и
уменьшение на выдохе или диастолическая ревер-
сия кровотока) имеет высокую положительную
диагностическую и отрицательную прогностиче-
Рис. 28.20 Смещение межжелудочковой перегородки при тампонаде
сердца. ЭхоКГ в М-режиме в парастернальной позиции по короткой оси.
Смещение межжелудочковой перегородки (белая стрелка) в сторону левого
желудочка (ЛЖ) во время вдоха, что свидетельствует об усиленном взаимо-
действии желудочков. Красные стрелки указывают на перикардиальную жид-
кость. ПЖ — правый желудочек.
ПЖ
ЛЖ
Рис. 28.21 Респираторная вариабельность скорости наполнения желудочков. Допплерография кровотока через трикуспидальный (А) и митральный (Б)
клапаны. Во время вдоха увеличивается скорость E трикуспидального кровотока и уменьшается скорость E митрального кровотока (последний удар во время
вдоха отмечен стрелками). Во время выдоха происходит снижение скорости E трикуспидального кровотока и увеличение скорости E митрального кровотока.
А
Б
In-28_для нас.indd 724
03.04.2019 12:04:34
725
28 Заболевания перикарда
скую ценность при тампонаде [64]. Однако, иссле-
дование печеночной вены при тампонаде является
технически сложным и в большинстве случаев не
удается достигнуть диагностического качества.
СОЧЕТАНИЕ КОЛЛАПСА КАМЕРЫ С НАРУШЕНИЕМ
КРОВОТОКА В ПЕЧЕНОЧНОЙ ВЕНЕ:
ОЦЕНКА РАБОТОСПОСОБНОСТИ
В ходе проспективного исследования с участием 110
пациентов с умеренным и большим перикардиаль-
ным выпотом (у 38 пациентов с наличием тампона-
ды, у 72 пациентов — без нее) проводили оценку
работоспособности камеры при коллапсе, наруше-
ние кровотока в печеночной или верхней полой
вене и их комбинацию (табл. 28.4) [64]. Было обна-
ружено, что отсутствие коллапса камеры свидетель-
ствует об отсутствии тампонады и, соответственно,
имеет самую высокую чувствительность (90%).
Наличие нарушения венозного кровотока в сочета-
нии с коллапсом ПП и желудочка демонстрировало
высокую корреляцию с наличием тампонады и име-
ло самую высокую специфичность (98%).
РЕГИОНАРНАЯ ТАМПОНАДА
Локальное сдавление сердечной камеры может воз-
никнуть в результате ограниченного выпота или
гематомы (см. рис. 28.15). С наибольшей вероятно-
стью это может произойти после операции на серд-
це [71]. Диагностика может быть сложной в связи с
отсутствием типичных клинических симптомом и
эхокардиографических признаков. Поэтому необ-
ходим высокий индекс клинического подозрения, и
эхокардиографическая визуализация должна вклю-
чать тщательный поиск локальной компрессии лю-
бой сердечной камеры, включая ЛП и ЛЖ [70–72].
Это может потребовать ЧПЭхоКГ, особенно в слу-
чаях, когда качество трансторакального изображе-
ния является субоптимальным [4, 55, 56]. Если со-
храняется неопределенность в отношении наличия
ограниченного выпота или гемодинамический эф-
фект выпота, для диагностических и терапевтиче-
ских целей может потребоваться инвазивная гемо-
динамическая оценка или даже хирургическое ис-
следование [71].
ПЕРИКАРДИОЦЕНТЕЗ ПОД КОНТРОЛЕМ ЭХОКАРДИОГРАФИИ
Как только тампонада подтверждена клинически,
наиболее эффективным и потенциально жизненно
необходимым лечением является быстрое удаление
перикардиальной жидкости. Это наиболее быстро
достигается с помощью чрескожного перикардио-
центеза, который в большинстве случаев стал про-
цедурой выбора [2]. Описано, что при выполнении
«вслепую» с использованием субксифоидального
доступа в качестве стандарта чрезкожный перикар-
диоцентез успешен в 86% случаев, приблизительно
в 4% случаев связан с летальным исходом и с ри-
ском гемоперикарда вследствие прободения сердца
по меньшей мере в 11% случаев [75]. Проведение
Рис. 28.22 Профиль кровотока в печеночной вене при тампонаде
сердца во время допплерографии. При задержке дыхания антеградный
поток (ниже базовой линии) наблюдается только во время систолы (S). Во
время вдоха систолический антеградный поток увеличивается и появляется
диастолический (D) антеградный поток. С первым ударом во время выдоха
определяется диастолический ретроградный кровоток (стрелка) [Klein AL, Ab-
bara S, Agler DA, et al. American Society of Echocardiography clinical recommenda-
tions for multimodality cardiovascular imaging of patients with pericardial disease:
endorsed by the Society for Cardiovascular Magnetic Resonance and Society of
Cardiovascular Computed Tomography. J Am Soc Echocardiogr 26:965–1012,
2013].
D
D
D
SS
S
S
S
Задержка дыхания
Вдох
Выдох
Чувствительность
(%)
Специфичность
(%)
Любой коллапс
90
65
Коллапс ПП
68
66
Коллапс ПЖ
60
90
Коллапс ПП + ПЖ 45
92
Нарушение веноз-
ного кровотока*
75
91
Нарушение веноз-
ного кровотока +
коллапс 1 камеры
67
91
Нарушение веноз-
ного кровотока +
коллапс 2 камер
37
98
*
Нарушение венозного (печеночная вена или верхняя полая ве-
на) кровотока определяется как: выраженное преобладание
систолического над диастолическим компонентом, наибольшая
выра женность этой разницы во время выдоха, и диастолическая
реверсия кровотока на выдохе.
[Merce J, Sagrista-Sauleda J, Permanyer-Miralda G, et al. Correlation
between clinical and Doppler echocardiographic findings in patients
with moderate and large pericardial effusion: implications for the
diagnosis of cardiac tamponade. Am Heart J 138(4 Pt 1):759–764,
1999.]
ТАБЛИЦА 28.4
Оценка информативности
эхокардиографических показателей
при диагностике тампонады
In-28_для нас.indd 725
03.04.2019 12:04:35
726
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
процедуры под контролем 2D-эхокардиографии
значительно улучшило эффективность и безопас-
ность манипуляции, и поэтому рекомендован при
возможности [76]. Эхокардиографическая визуали-
зация позволяет идентифицировать оптимальное
место введения иглы, и обеспечивает ее прямую
визуализацию во время входа в перикардиальную
жидкость. В ходе крупнейшего опубликованного
серийного исследования, проведенного в клинике
Mayo, было выполнено 1127 перикардиоцентезов в
течение 21 года с процедурным успехом в 97% слу-
чаев и значительными осложнениями в 1,2% случа-
ев [77]. По сообщению, основными осложнениями
в этом исследовании были летальный исход (1 па-
циент), разрыв сердца (5), разрыв сосуда (1), пнев-
моторакс (5), инфекция (1) и устойчивая желудоч-
ковая тахикардия (1).
ПРОТИВОПОКАЗАНИЯ
Чрескожный перикардиоцентез относительно
противопоказан при тампонаде, возникшей в ре-
зультате расслоения аорты, проникающей травмы
грудной клетки или разрыва миокарда [2, 76, 78].
В этих случая показана хирургическая тактика ве-
дения. Тяжелая коагулопатия также является отно-
сительным противопоказанием [2, 76]. Хотя любая
форма травматического гемоперикарда традици-
онно считалась показанием к операции, тампонада
вследствие перфорации сердца во время инвазив-
ной диагностической или терапевтической проце-
дуры во многих случаях может быть успешно
устранена с помощью чрескожного перикардио-
центеза [79].
ЭТАПЫ ПРОЦЕДУРЫ
Процедурный подход к перикардиоцентезу под
контролем эхокардиографии хорошо описан [76,
80, 81]. Онлайн-видео Fitch и его коллег является
особенно полезным источником информации [76].
Хотя предполагается некоторая стационарная вари-
абельность, далее приводится краткое изложение
основных принципов процедуры с акцентом на
роль эхокардиографии.
1. Выберите и отметьте оптимальное место для вве-
дения иглы. Эхокардиографическая визуализа-
ция должна использоваться для определения
наиболее прямого и безопасного пути к самому
большому скоплению жидкости. Возможны пе-
риксифоидный, парастернальный и апикальный
доступы. Парастернальный доступ использовал-
ся чаще всего в крупнейших опубликованных
серийных исследованиях [77]. При использова-
нии этого доступа следует позаботиться о том,
чтобы избежать травматизации внутренней
грудной артерии, которая проходит латерально
по краю грудины, и межреберных сосудов, кото-
рые проходят вдоль нижних краев ребер.
2. При визуализации выпота из оптимального ме-
ста доступа обратите внимание на угол наклона
датчика и расстояние между кожей и жидкостью.
Угол наклона датчика должен быть воспроизве-
ден в трехмерном (3D) пространстве с помощью
иглы для перикардиоцентеза.
3. Обеспечьте стерильное поле и проведите мест-
ную анестезию вдоль предполагаемого места
введения иглы.
4. Выполните перикардиоцентез. В идеале для мо-
ниторинга во время процедуры второй оператор
или эхокардиографист производят визуализа-
цию из окна, удаленного от места прокола. Пра-
вильное положение иглы может быть подтверж-
дено путем введения солевого раствора, который
должен визуализироваться только в перикарди-
альном пространстве.
5. Установите катетер типа «пигтейл» в перикарди-
альное пространство. Дренируйте перикардиаль-
ную жидкость как можно полнее. Для под-
тверждения этого используйте эхокардиографи-
ческую визуализацию. Катетер обычно оставляют
на месте в течение 1–3 дней, до тех пор, пока в
результате прерывистой аспирации не получит-
ся приблизительно 50 мл жидкости в течение
24 час. Ограниченное эхокардиографическое ис-
следование должно быть проведено повторно
для подтверждения устранения выпота до удале-
ния катетера.
ОСТРЫЙ ПЕРИКАРДИТ
Острый перикардит возникает при воспалении пе-
рикарда и может быть результатом многочислен-
ных состояний, в том числе перечисленных в табл.
28.1 . В большинстве случаев он является идиопати-
ческим и предположительно вирусной этиологии
[82, 83]. Диагноз устанавливается при выявлении
двух или более из следующих факторов: (1) боль в
груди, указывающая на перикардит, (2) шум трения
перикарда, (3) типичные электрокардиографиче-
ские изменения и (4) вновь возникший или про-
грессирующий перикардиальный выпот [83]. Таким
образом, эхокардиография рекомендована в тече-
ние 24 час во всех случаях после начала клинических
проявлений для оценки выпота и при его наличии
для исключения тампонады [4]. Во многих случаях
выпот отсутствует и эхокардиограммы будут в ос-
новном нормальными. К другим возможным эхо-
кардиографическим признакам, предполагающим
перикардиальный процесс, относят увеличение яр-
кости или толщины перикарда, или констриктив-
ную физиологию. В некоторых случаях регионарное
нарушение движения стенок ЛЖ может возникнуть
из-за сопутствующего миокардита. Эхокардиогра-
фия также позволяет оценивать другие причины
боли в груди. Например, регионарные нарушения
движения стенки ЛЖ, возникающие в зоне кро-
In-28_для нас.indd 726
03.04.2019 12:04:35
727
28 Заболевания перикарда
воснабжения коронарной артерии, с большей веро-
ятностью указывают на острый коронарный син-
дром, чем перикардит.
Как компьютерная томография сердца, так и
магнитно-резонансная томография предлагают до-
полнительную информацию о перикарде и могут
быть полезны при недостоверности диагноза, без-
результатности противовоспалительной терапии
или в случае наличия осложнений [4].
В табл. 28.5 приведено соотношение клиниче-
ских проявлений и эхокардиографических показа-
телей при остром перикардите и других наиболее
распространенных перикардиальных синдромах.
ВРОЖДЕННОЕ ОТСУТСТВИЕ ПЕРИКАРДА
Редко перикард может отсутствовать при рождении.
Дефект может быть частичным, чаще всего включа-
ющим левую часть перикарда, или полным, при
котором отсутствует весь перикард. В литературе
описано, что у 30% пациентов эта патология соче-
тается с врожденными пороками сердца, в том чис-
ле дефектом межпредсердной перегородки, двух-
створчатым аортальным клапаном, открытым арте-
риальным протоком и тетрадой Фалло [84]. У
пациентов с врожденным отсутствием перикарда
симптомы могут отсутствовать, или наблюдается
пароксизмальный стреляющий дискомфорт в груд-
ной клетке или одышка. Редко часть сердца может
выходить через частичный перикардиальный де-
фект (формирование грыжи), что приводит к
острым осложнениям, таким как инфаркт миокарда
с повышением ST или даже внезапная смерть из-за
ущемления сердца [85, 86]. Хирургическое лечение
может быть необходимо у пациентов с наличием
тяжелых симптомов или формированием грыжи
сердца в области частичного дефекта.
Отсутствие перикарда приводит к отличной от
нормальной эхокардиографической картине во
многих аспектах (рис. 28.23). Сердце, как правило,
смещается влево и приобретает каплевидную фор-
му, характеризующуюся удлинением предсердий и
луковицеобразной формой желудочков [84]. Дру-
гие признаки включают в себя более высоко и более
латерально расположенные окна визуализации,
повышенную подвижность сердца, парадоксальные
или уплощенные систолические движения межже-
лудочковой перегородки и аномальное покачивание
сердца [87].
Клинические проявления
Эхокардиографические данные
Констриктивный
перикардит
Могут включать одышку при физи-
ческой нагрузке и признаки веноз-
ного застоя (повышение венозного
давления, асцит и отеки)
Смещение межжелудочковой перегородки
Диастолическая реверсия кровотока в печеночной вене на выдохе
Сохранная или увеличенная медиальная скорость e′, часто меди-
альная скорость e′ > латеральной скорости e′
Респираторная вариабельность митральной скорости E
Плетора нижней полой вены
Снижение латеральной продольной деформации по сравнению с
медиальной
Перикардиальный
выпот
Вариабельность зависит от причины;
может протекать бессимптомно и
выявляться случайно
Перикардиальный выпот может быть как малозначительным, так
и очень большим, окружать сердце со всех сторон или быть
ограниченным; эхопозитивность зависит от характера жидкости
(транссудат, экссудат или кровь)
Тампонада
Вариабельны; часто неспецифиче-
ские; могут включать гипотензию,
тахикардию, увеличение венозного
давления и парадоксальный пульс
Коллапс камер
Плетора нижней полой вены
Респираторная вариабельность наполнения правого и левого
сердца и венозного кровотока
Острый перикардит Характерная боль в груди и электро-
кардиографические изменения;
может присутствовать шум трения
перикарда
Может присутствовать выпот, что позволяет поставить диагноз
Нарушения подвижности стенок желудочка предполагают сопут-
ствующий миокардит или альтернативный диагноз
Может наблюдаться физиология тампонады или констрикции
ТАБЛИЦА 28.5 Заболевания перикарда: соотношение клинической картины и эхокардиографических данных
Рис. 28.23 A Врожденное отсутствие перикарда. При визуализации в
апикальной четырехкамерной проекции (противоположная ориентация) проде-
монстрированы характерные эхокардиографические признаки врожденного
отсутствия перикарда. Обратите внимание, что сердце смещено влево и при-
обретает каплевидную конфигурацию (предоставлено Sunil Mankad, MD).
ЛЖ
ПЖ
ПП
ЛП
In-28_для нас.indd 727
03.04.2019 12:04:35
728
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
КИСТА ПЕРИКАРДА
Перикардиальные кисты — редкие, доброкаче-
ственные образования, обычно случайно выявляе-
мые на рентгенограмме грудной клетки или эхокар-
диограмме. Чаще всего они расположены в правом
кардиодиафрагмальном угле, но также могут встре-
чаться в левом кардиодиафрагмальном угле или в
других местах [88]. При эхокардиографическом
исследовании киста перикарда определяется в виде
круглого или овального эхопрозрачного простран-
ства, окруженного стенкой, прилежащей к границе
сердца (рис. 28.24) [89]. Кисты перикарда обычно
протекают доброкачественно, и при отсутствии
симптомов терапия не требуется. Однако имеются
отдельные сообщения об осложнениях кист, вклю-
чая тампонаду и эрозию в прилежащие анатомиче-
ские структуры [88].
БЛАГОДАРНОСТЬ
Авторы выражают благодарность Bradley I. Munt,
MD, Robert R. Moss, MD и Jasmine Grewal, MD, ко-
торые написали предыдущую версию этой главы,
некоторые элементы ее были сохранены.
Рис. 28.24 A Киста перикарда. При визуализации в субкостальной четы-
рехкамерной позиции видна киста перикарда, прилежащая к правой границе
сердца (предоставлено Sunil Mankad, MD).
ЛЖ
ПЖ
ПП
ЛП
Киста
ЛИТЕРАТУРА
1. Spodick DH. Medical history of the pericar-
dium. The hairy hearts of hoary heroes, Am J
Cardiol 26:447–454, 1970.
2. Maisch B, Seferovic PM, Ristic AD, et al.
Guidelines on the diagnosis and management
of pericardial diseases executive summary;
The task force on the diagnosis and manage-
ment of pericardial diseases of the European
Society of Cardiology, Eur Heart J 25:587–
610, 2004.
3. Douglas PS, Garcia MJ, Haines DE, et al.
ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/
SCCM/SCCT/SCMR 2011 appropriate use
criteria for echocardiography. A report of the
American College of Cardiology Foundation
Appropriate Use Criteria Task Force, Ameri-
can Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, and Society for Cardiovascular Mag-
netic Resonance Endorsed by the American
College of Chest Physicians, J Am Coll Car-
diol 57:1126–1166, 2011.
4. Klein AL, Abbara S, Agler DA, et al. American
Society of Echocardiography clinical recom-
mendations for multimodality cardiovascular
imaging of patients with pericardial disease:
endorsed by the Society for Cardiovascular
Magnetic Resonance and Society of Cardio-
vascular Computed Tomography, J Am Soc
Echocardiogr 26:965–1012, 2013.
5. Holt JP. The normal pericardium, Am J Car-
diol 26:455–465, 1970.
6. Ishihara T, Ferrans VJ, Jones M, et al. Histo-
logic and ultrastructural features of normal
human parietal pericardium, Am J Cardiol
46:744–753, 1980.
7. Spodick DH. The normal and diseased peri-
cardium: current concepts of pericardial
physiology, diagnosis and treatment, J Am
Coll Cardiol 1:240–251, 1983.
8. Boltwood Jr. CM. Ventricular performance
related to transmural filling pressure in clini-
cal cardiac tamponade, Circulation 75:941–
955, 1987.
9. Spodick DH. Acute cardiac tamponade, N
Engl J Med 349:684–690, 2003.
10. McGregor M. Current concepts: pulsus para-
doxus, N Engl J Med 301:480–482, 1979.
11. Anavekar NS, Wong BF, Foley TA, et al. Index
of biventricular interdependence calculated
using cardiac MRI: a proof of concept study in
patients with and without constrictive pericar-
ditis, Int J Cardiovasc Imaging 29:363–369,
2013.
12. Hatle LK, Appleton CP, Popp RL. Differen-
tiation of constrictive pericarditis and restric-
tive cardiomyopathy by Doppler echocar-
diography, Circulation 79:357–370, 1989.
13. Appleton CP, Hatle LK, Popp RL. Cardiac
tamponade and pericardial effusion: respira-
tory variation in transvalvular flow velocities
studied by Doppler echocardiography, J Am
Coll Cardiol 11:1020–1030, 1988.
14. Ling LH, Oh JK, Schaff HV, et al. Constrictive
pericarditis in the modern era: evolving clinical
spectrum and impact on outcome after peri-
cardiectomy, Circulation 100:1380–1386, 1999.
15. Bertog SC, Thambidorai SK, Parakh K, et al.
Constrictive pericarditis: etiology and cause-
specific survival after pericardiectomy, J Am
Coll Cardiol 43:1445–1452, 2004.
16. Szabo G, Schmack B, Bulut C, et al. Constric-
tive pericarditis: risks, aetiologies and out-
comes after total pericardiectomy: 24 years of
experience, Eur J Cardiothorac Surg 44:1023–
1028, 2013. discussion 1028.
17. George TJ, Arnaoutakis GJ, Beaty CA, et al.
Contemporary etiologies, risk factors, and
outcomes after pericardiectomy, Ann Thorac
Surg 94:445–451, 2012.
18. Mutyaba AK, Balkaran S, Cloete R, et al.
Constrictive pericarditis requiring pericardi-
ectomy at Groote Schuur Hospital, Cape
Town, South Africa: causes and perioperative
outcomes in the HIV era (1990–2012), J Tho-
rac Cardiovasc Surg 148:3058–3065, 2014.
19. Talreja DR, Edwards WD, Danielson GK, et
al. Constrictive pericarditis in 26 patients with
histologically normal pericardial thickness,
Circulation 108:1852–1857, 2003.
20. Talreja DR, Nishimura RA, Oh JK, Holmes
DR. Constrictive pericarditis in the modern
era: novel criteria for diagnosis in the cardiac
catheterization laboratory, J Am Coll Cardiol
51:315–319, 2008.
21. Nishimura RA. Constrictive pericarditis in
the modern era: a diagnostic dilemma, Heart
86:619–623, 2001.
22. Haley JH, Tajik AJ, Danielson GK, et al. Tran-
sient constrictive pericarditis: causes and
natural history, J Am Coll Cardiol 43:271–275,
2004.
23. Oh JK, Hatle LK, Seward JB, et al. Diagnostic
role of Doppler echocardiography in con-
In-28_для нас.indd 728
03.04.2019 12:04:36
729
28 Заболевания перикарда
К
о
м
п
л
е
к
с
н
о
е
д
в
у
м
е
р
н
о
е
и
д
о
п
п
л
е
р
о
в
с
к
о
е
о
б
с
л
е
д
о
в
а
н
и
е
с
о
д
н
о
в
р
е
м
е
н
н
о
й
р
е
г
и
с
т
р
а
ц
и
е
й
д
ы
х
а
н
и
я
и
о
с
о
б
ы
м
а
к
ц
е
н
т
о
м
н
а
с
л
е
д
у
ю
щ
и
х
п
о
к
а
з
а
т
е
л
я
х
П
о
к
а
з
а
т
е
л
ь
М
е
т
о
д
в
и
з
у
а
л
и
з
а
ц
и
и
П
р
о
е
к
ц
и
я
Р
е
г
и
с
т
р
а
ц
и
я
О
ц
е
н
к
а
П
р
и
м
е
ч
а
н
и
я
П
о
д
в
и
ж
н
о
с
т
ь
м
е
ж
ж
е
-
л
у
д
о
ч
к
о
в
о
й
п
е
р
е
г
о
р
о
д
к
и
2
D
и
M
-
р
е
ж
и
м
П
а
р
а
с
т
е
р
н
а
л
ь
-
н
а
я
(
д
л
и
н
н
о
-
и
к
о
р
о
т
к
о
о
с
е
-
в
а
я
)
и
а
п
и
к
а
л
ь
н
а
я
Р
а
с
ш
и
р
е
н
н
ы
е
п
е
т
л
и
(
н
а
п
р
и
м
е
р
,
1
0
с
е
р
д
е
ч
-
н
ы
х
ц
и
к
л
о
в
)
О
ц
е
н
и
т
е
с
м
е
щ
е
н
и
е
п
е
р
е
г
о
р
о
д
к
и
в
о
в
р
е
м
я
д
ы
х
а
н
и
я
(
к
Л
Ж
в
о
в
р
е
м
я
в
д
о
х
а
,
к
П
Ж
н
а
в
ы
д
о
х
е
)
Р
е
с
п
и
р
а
т
о
р
н
о
о
б
у
с
л
о
в
л
е
н
н
о
е
с
м
е
щ
е
н
и
е
м
е
ж
ж
е
л
у
д
о
ч
к
о
в
о
й
п
е
р
е
г
о
р
о
д
к
и
с
в
и
д
е
т
е
л
ь
-
с
т
в
у
е
т
о
б
у
с
и
л
е
н
н
о
м
в
з
а
и
м
о
д
е
й
с
т
в
и
и
ж
е
л
у
д
о
ч
к
о
в
,
ч
т
о
н
а
б
л
ю
д
а
е
т
с
я
п
р
и
к
о
н
-
с
т
р
и
к
ц
и
и
и
т
а
м
п
о
н
а
д
е
Т
р
а
н
с
м
и
т
р
а
л
ь
н
ы
й
к
р
о
в
о
т
о
к
И
м
п
у
л
ь
с
н
о
-
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
А
п
и
к
а
л
ь
н
а
я
В
к
л
ю
ч
и
т
е
м
е
д
л
е
н
н
у
ю
с
к
о
р
о
с
т
ь
р
а
з
в
е
р
т
к
и
с
п
р
о
д
о
л
ж
и
т
е
л
ь
н
о
й
р
е
г
и
с
т
р
а
ц
и
е
й
О
ц
е
н
и
т
е
р
е
с
п
и
р
а
т
о
р
н
у
ю
в
а
р
и
а
-
б
е
л
ь
н
о
с
т
ь
с
к
о
р
о
с
т
и
в
п
и
к
е
E
(
с
н
и
ж
е
н
и
е
н
а
в
д
о
х
е
,
п
о
в
ы
ш
е
н
и
е
н
а
в
ы
д
о
х
е
)
О
б
ы
ч
н
о
и
з
м
е
н
е
н
и
е
н
а
1
5
–
3
5
%
п
р
и
к
о
н
-
с
т
р
и
к
ц
и
и
и
>
3
0
%
п
р
и
т
а
м
п
о
н
а
д
е
;
р
а
с
с
м
о
-
т
р
и
т
е
т
а
к
ж
е
о
ц
е
н
к
у
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
р
о
в
о
т
о
к
а
,
о
т
т
о
к
а
Л
Ж
и
с
к
о
р
о
с
т
и
л
е
г
о
ч
-
н
о
г
о
о
т
т
о
к
а
Т
к
а
н
е
в
а
я
д
о
п
п
л
е
р
о
г
р
а
-
ф
и
я
ф
и
б
р
о
з
н
о
г
о
к
о
л
ь
ц
а
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
И
м
п
у
л
ь
с
н
о
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
А
п
и
к
а
л
ь
н
а
я
М
е
д
и
а
л
ь
н
ы
й
и
л
а
т
е
-
р
а
л
ь
н
ы
й
с
е
г
м
е
н
т
ф
и
б
р
о
з
н
о
г
о
к
о
л
ь
ц
а
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
О
ц
е
н
и
т
е
м
е
д
и
а
л
ь
н
у
ю
с
к
о
р
о
с
т
ь
e
′
и
с
р
а
в
н
и
т
е
е
е
с
л
а
т
е
р
а
л
ь
н
о
й
с
к
о
-
р
о
с
т
ь
ю
e
′
П
р
и
к
о
н
с
т
р
и
к
ц
и
и
п
р
е
д
п
о
л
а
г
а
е
т
с
я
с
о
х
р
а
н
е
-
н
и
е
(
≥
9
с
м
/
с
е
к
)
и
л
и
у
в
е
л
и
ч
е
н
и
е
м
е
д
и
а
л
ь
-
н
о
й
с
к
о
р
о
с
т
и
e
′
;
м
е
д
и
а
л
ь
н
а
я
с
к
о
р
о
с
т
ь
e
′
ч
а
с
т
о
в
ы
ш
е
,
ч
е
м
л
а
т
е
р
а
л
ь
н
а
я
с
к
о
р
о
с
т
ь
e
′
К
р
о
в
о
т
о
к
в
п
е
ч
е
н
о
ч
-
н
о
й
в
е
н
е
И
м
п
у
л
ь
с
н
о
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
,
в
о
з
м
о
ж
н
о
ц
в
е
т
н
о
й
M
-
р
е
ж
и
м
С
у
б
к
о
с
т
а
л
ь
н
а
я
У
в
е
л
и
ч
е
н
и
е
(
z
o
o
m
)
,
р
а
з
м
е
р
к
о
н
т
р
о
л
ь
н
о
г
о
о
б
ъ
е
м
а
д
о
3
–
4
м
м
,
в
к
л
ю
ч
и
т
ь
м
е
д
л
е
н
н
у
ю
с
к
о
р
о
с
т
ь
р
а
з
в
е
р
т
к
и
с
п
р
о
д
о
л
ж
и
т
е
л
ь
н
о
й
р
е
г
и
с
т
р
а
ц
и
е
й
О
ц
е
н
и
т
е
в
ы
р
а
ж
е
н
н
ы
е
и
з
м
е
н
е
н
и
я
д
и
а
с
т
о
л
и
ч
е
с
к
о
г
о
к
р
о
в
о
т
о
к
а
н
а
в
ы
д
о
х
е
;
р
а
с
с
м
о
т
р
и
т
е
в
о
з
м
о
ж
-
н
о
с
т
ь
р
а
с
ч
е
т
а
к
о
э
ф
ф
и
ц
и
е
н
т
а
в
а
р
и
а
б
е
л
ь
н
о
с
т
и
д
и
а
с
т
о
л
и
ч
е
с
к
о
й
р
е
в
е
р
с
и
и
к
р
о
в
о
т
о
к
а
в
п
е
ч
е
н
о
ч
-
н
о
й
в
е
н
е
н
а
в
ы
д
о
х
е
П
р
е
д
п
о
л
а
г
а
е
т
с
я
в
ы
р
а
ж
е
н
н
а
я
р
е
в
е
р
с
и
я
к
р
о
-
в
о
т
о
к
а
н
а
в
ы
д
о
х
е
к
а
к
п
р
и
к
о
н
с
т
р
и
к
ц
и
и
(
к
о
э
ф
ф
и
ц
и
е
н
т
о
б
р
а
т
н
о
г
о
п
о
т
о
к
а
>
0
,
7
9
)
,
т
а
к
и
п
р
и
т
а
м
п
о
н
а
д
е
Н
и
ж
н
я
я
п
о
л
а
я
в
е
н
а
2
D
,
в
о
з
м
о
ж
н
о
М
-
р
е
ж
и
м
С
у
б
к
о
с
т
а
л
ь
н
а
я
С
т
а
н
д
а
р
т
н
а
я
И
з
м
е
р
ь
т
е
д
и
а
м
е
т
р
и
%
с
п
а
д
е
н
и
я
п
р
и
«
в
д
о
х
е
н
о
с
о
м
»
П
р
и
к
о
н
с
т
р
и
к
ц
и
и
и
т
а
м
п
о
н
а
д
е
п
р
е
д
п
о
л
а
г
а
-
е
т
с
я
п
л
е
т
о
р
а
(
д
и
а
м
е
т
р
>
2
,
1
с
м
и
/
и
л
и
к
о
л
л
а
п
с
<
5
0
%
п
р
и
н
о
с
о
в
о
м
д
ы
х
а
н
и
и
)
;
н
е
с
п
е
ц
и
ф
и
ч
е
с
к
и
й
п
р
и
з
н
а
к
В
е
р
х
н
я
я
п
о
л
а
я
в
е
н
а
И
м
п
у
л
ь
с
н
о
в
о
л
н
о
в
а
я
д
о
п
п
л
е
р
о
г
р
а
ф
и
я
П
р
а
в
а
я
н
а
д
к
л
ю
ч
и
ч
-
н
а
я
М
е
д
л
е
н
н
а
я
с
к
о
р
о
с
т
ь
р
а
з
в
е
р
т
к
и
И
з
у
ч
и
т
ь
и
з
м
е
н
е
н
и
е
с
и
с
т
о
л
и
ч
е
-
с
к
о
й
с
к
о
р
о
с
т
и
п
р
я
м
о
г
о
п
о
т
о
к
а
в
о
в
р
е
м
я
д
ы
х
а
т
е
л
ь
н
о
г
о
ц
и
к
л
а
П
р
е
д
п
о
л
а
г
а
е
т
с
я
н
е
б
о
л
ь
ш
о
е
и
з
м
е
н
е
н
и
е
с
и
с
т
о
л
и
ч
е
с
к
о
й
с
к
о
р
о
с
т
и
п
р
я
м
о
г
о
п
о
т
о
к
а
п
р
и
к
о
н
с
т
р
и
к
ц
и
и
(
п
о
с
р
а
в
н
е
н
и
ю
с
х
р
о
н
и
-
ч
е
с
к
о
й
о
б
с
т
р
у
к
т
и
в
н
о
й
б
о
л
е
з
н
ь
ю
л
е
г
к
и
х
)
;
п
р
е
д
п
о
л
а
г
а
е
т
с
я
с
н
и
ж
е
н
и
е
д
и
а
с
т
о
л
и
ч
е
с
к
о
г
о
п
р
я
м
о
г
о
п
о
т
о
к
а
(
и
л
и
д
а
ж
е
в
о
з
н
и
к
н
о
в
е
н
и
е
р
е
в
е
р
с
и
и
к
р
о
в
о
т
о
к
а
)
н
а
в
ы
д
о
х
е
п
р
и
т
а
м
п
о
н
а
д
е
К
о
л
л
а
п
с
к
а
м
е
р
(
п
р
и
н
а
л
и
ч
и
и
п
е
р
и
к
а
р
д
и
-
а
л
ь
н
о
г
о
в
ы
п
о
т
а
)
2
D
,
М
-
р
е
ж
и
м
В
с
е
о
к
н
а
в
и
з
у
а
л
и
з
а
ц
и
и
В
к
л
ю
ч
и
т
е
р
а
с
ш
и
р
е
н
-
н
ы
е
п
е
т
л
и
(
н
а
п
р
и
-
м
е
р
,
1
0
с
е
р
д
е
ч
н
ы
х
ц
и
к
л
о
в
)
О
ц
е
н
и
т
е
и
н
в
е
р
с
и
ю
и
л
и
к
о
л
л
а
п
с
л
ю
б
о
й
с
е
р
д
е
ч
н
о
й
к
а
м
е
р
ы
;
к
о
л
л
а
п
с
П
П
в
п
о
з
д
н
е
й
д
и
а
с
т
о
л
е
(
о
ц
е
н
и
т
е
п
р
о
д
о
л
ж
и
т
е
л
ь
н
о
с
т
ь
п
о
о
т
н
о
ш
е
н
и
ю
к
с
е
р
д
е
ч
н
о
м
у
ц
и
к
л
у
)
,
к
о
л
л
а
п
с
П
Ж
в
р
а
н
н
е
й
д
и
а
с
т
о
л
е
К
о
л
л
а
п
с
к
а
м
е
р
ы
с
в
и
д
е
т
е
л
ь
с
т
в
у
е
т
о
п
о
в
ы
ш
е
-
н
и
и
п
е
р
и
к
а
р
д
и
а
л
ь
н
о
г
о
д
а
в
л
е
н
и
я
и
,
в
о
з
-
м
о
ж
н
о
,
т
а
м
п
о
н
а
д
е
В
и
з
у
а
л
и
з
а
ц
и
я
д
е
ф
о
р
м
а
ц
и
и
С
п
е
к
л
-
т
р
е
к
и
н
г
(
с
и
с
т
о
-
л
и
ч
е
с
к
а
я
,
п
р
о
д
о
л
ь
н
а
я
)
А
п
и
к
а
л
ь
н
а
я
С
т
а
н
д
а
р
т
н
а
я
О
ц
е
н
и
т
е
г
л
о
б
а
л
ь
н
у
ю
и
р
е
г
и
о
н
а
р
-
н
у
ю
д
е
ф
о
р
м
а
ц
и
ю
;
с
р
а
в
н
и
т
е
б
о
к
о
в
у
ю
с
т
е
н
к
у
с
п
е
р
е
г
о
р
о
д
о
ч
н
о
й
Г
л
о
б
а
л
ь
н
а
я
п
р
о
д
о
л
ь
н
а
я
д
е
ф
о
р
м
а
ц
и
я
,
о
б
ы
ч
н
о
с
о
х
р
а
н
я
ю
щ
а
я
с
я
п
р
и
к
о
н
с
т
р
и
к
ц
и
и
;
д
е
ф
о
р
м
а
ц
и
я
л
а
т
е
р
а
л
ь
н
о
й
с
т
е
н
к
и
ч
а
с
т
о
с
н
и
ж
е
н
а
п
о
с
р
а
в
н
е
н
и
ю
с
д
е
ф
о
р
м
а
ц
и
е
й
п
е
р
е
г
о
р
о
д
о
ч
н
о
й
с
т
е
н
к
и
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
Э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
й
п
р
о
т
о
к
о
л
п
р
и
п
о
д
о
з
р
е
н
и
и
н
а
з
а
б
о
л
е
в
а
н
и
е
п
е
р
и
к
а
р
д
а
In-28_для нас.indd 729
03.04.2019 12:04:36
730
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
strictive pericarditis, J Am Coll Cardiol
23:154–162, 1994.
24. Garcia MJ, Rodriguez L, Ares M, et al. Dif-
ferentiation of constrictive pericarditis from
restrictive cardiomyopathy: assessment of left
ventricular diastolic velocities in longitudinal
axis by Doppler tissue imaging, J Am Coll
Cardiol 27:108–114, 1996.
25. Ha JW, Ommen SR, Tajik AJ, et al. Differen-
tiation of constrictive pericarditis from re-
strictive cardiomyopathy using mitral annular
velocity by tissue Doppler echocardiography,
Am J Cardiol 94:316–319, 2004.
26. Welch TD, Ling LH, Espinosa RE, et al. Echo-
cardiographic diagnosis of constrictive peri-
carditis: Mayo Clinic criteria, Circ Cardiovasc
Imaging 7:526–534, 2014.
27. Sengupta PP, Mohan JC, Mehta V, et al. Dop-
pler tissue imaging improves assessment of
abnormal interventricular septal and posteri-
or wall motion in constrictive pericarditis, J
Am Soc Echocardiogr 18:226–230, 2005.
28. Himelman RB, Lee E, Schiller NB. Septal
bounce, vena cava plethora, and pericardial
adhesion: informative two-dimensional echo-
cardiographic signs in the diagnosis of peri-
cardial constriction, J Am Soc Echocardiogr
1:333–340, 1988.
29. Coylewright M, Welch TD, Nishimura RA.
Mechanism of septal bounce in constrictive
pericarditis: a simultaneous cardiac catheteri-
sation and echocardiographic study, Heart
99:1376, 2013.
30. Tei C, Child JS, Tanaka H, Shah PM. Atrial
systolic notch on the interventricular septal
echogram: an echocardiographic sign of con-
strictive pericarditis, J Am Coll Cardiol
1:907–912, 1983.
31. Sengupta PP, Mohan JC, Mehta V, et al. Ac-
curacy and pitfalls of early diastolic motion
of the mitral annulus for diagnosing constric-
tive pericarditis by tissue Doppler imaging,
Am J Cardiol 93:886–890, 2004.
32. Reuss CS, Wilansky SM, Lester SJ, et al. Using
mitral ‘annulus reversus’ to diagnose con-
strictive pericarditis, Eur J Echocardiogr
10:372–375, 2009.
33. Ha JW, Oh JK, Ling LH, et al. Annulus para-
doxus: transmitral flow velocity to mitral
annular velocity ratio is inversely propor-
tional to pulmonary capillary wedge pressure
in patients with constrictive pericarditis, Cir-
culation 104:976–978, 2001.
34. Alraies MC, Kusunose K, Negishi K, et al.
Relation between echocardiographically esti-
mated and invasively measured filling pres-
sures in constrictive pericarditis, Am J Cardiol
113:1911–1916, 2014.
35. Welch TD, Oh JK. Constrictive pericarditis:
the mitral annulus remains paradoxical, Am J
Cardiol 115:704, 2015.
36. Syed FF, Schaff HV, Oh JK. Constrictive
pericarditis—a curable diastolic heart failure,
Nature Rev Cardiol 11:530–544, 2014.
37. Welch TD, Oh JK. Constrictive pericarditis:
old disease, new approaches, Curr Cardiol Rep
17:20, 2015.
38. Rajagopalan N, Garcia MJ, Rodriguez L, et al.
Comparison of new Doppler echocardio-
graphic methods to differentiate constrictive
pericardial heart disease and restrictive car-
diomyopathy, Am J Cardiol 87:86–94, 2001.
39. Oh JK, Tajik AJ, Appleton CP, et al. Preload
reduction to unmask the characteristic Doppler
features of constrictive pericarditis—a new
observation, Circulation 95:796–799, 1997.
40. Ling LH, Oh JK, Tei C, et al. Pericardial thick-
ness measured with transesophageal echocar-
diography: feasibility and potential clinical
usefulness, J Am Coll Cardiol 29:1317–1323,
1997.
41. Cameron J, Oesterle SN, Baldwin JC, Hancock
EW. The etiologic spectrum of constrictive
pericarditis, Am Heart J 113:354–360, 1987.
42. Voelkel AG, Pietro DA, Folland ED, et al.
Echocardiographic features of constrictive
pericarditis, Circulation 58:871–875, 1978.
43. Klein AL, Cohen GI, Pietrolungo JF, et al. Dif-
ferentiation of constrictive pericarditis from
restrictive cardiomyopathy by doppler trans-
esophageal echocardiographic measurements
of respiratory variations in pulmonary venous
flow, J Am Coll Cardiol 22:1935–1943, 1993.
44. Klodas E, Nishimura RA, Appleton CP, et al.
Doppler evaluation of patients with constric-
tive pericarditis: use of tricuspid regurgitation
velocity curves to determine enhanced ven-
tricular interaction, J Am Coll Cardiol 28:652–
657, 1996.
45. Gilman G, Ommen SR, Hansen WH, Higano
ST. Doppler echocardiographic evaluation of
pulmonary regurgitation facilitates the diag-
nosis of constrictive pericarditis, J Am Soc
Echocardiogr 18:892–895, 2005.
46. Boonyaratavej S, Oh JK, Tajik AJ, et al. Com-
parison of mitral inflow and superior vena
cava Doppler velocities in chronic obstructive
pulmonary disease and constrictive pericardi-
tis, J Am Coll Cardiol 32:2043–2048, 1998.
47. Takata M, Beloucif S, Shimada M, Robotham
JL. Superior and inferior vena caval flows
during respiration: pathogenesis of Kuss-
maul’s sign, Am J Physiol 262(3 Pt 2):H763–
770, 1992.
48. Sengupta PP, Krishnamoorthy VK, Ab-
hayaratna WP, et al. Disparate patterns of left
ventricular mechanics differentiate constric-
tive pericarditis from restrictive cardiomyopa-
thy, JACC Cardiovasc Imaging 1:29–38, 2008.
49. Kusunose K, Dahiya A, Popovic ZB, et al.
Biventricular mechanics in constrictive peri-
carditis comparison with restrictive cardio-
myopathy and impact of pericardiectomy,
Circ Cardiovasc Imaging 6:399–406, 2013.
50. Hancock EW. Subacute effusive-constrictive
pericarditis, Circulation 43:183, 1971.
51. Sagrista-Sauleda J, Angel J, Sanchez A, et al.
Effusive-constrictive pericarditis, New Engl J
Med 350:469–475, 2004.
52. Sagristasauleda J, Permanyermiralda G, Can-
dellriera J, et al. Transient cardiac constric-
tion—an unrecognized pattern of evolution
in effusive acute idiopathic pericarditis, Am J
Cardiol 59:961–966, 1987.
53. Feng D, Glockner J, Kim K, et al. Cardiac
magnetic resonance imaging pericardial late
gadolinium enhancement and elevated in-
flammatory markers can predict the revers-
ibility of constrictive pericarditis after antiin-
flammatory medical therapy: a pilot study,
Circulation 124:1830–1837, 2011.
54. Haaz WS, Mintz GS, Kotler MN, et al. 2 Di-
mensional echocardiographic recognition of
the descending thoracic aorta—value in dif-
ferentiating pericardial from pleural effu-
sions, Am J Cardiol 46:739–743, 1980.
55. Kochar GS, Jacobs LE, Kotler MN. Right atrial
compression in postoperative cardiac patients—
detection by transesophageal echocardiography,
J Am Coll Cardiol 16:511–516, 1990.
56. Brooker RF, Farah MG. Postoperative left
atrial compression diagnosed by transesopha-
geal echocardiography, J Cardiothorac Vasc
Anesth 9:304–307, 1995.
57. Duvernoy O, Larsson SG, Persson K, et al.
Pericardial-effusion and pericardial compart-
ments after open-heart-surgery—an analysis
by computed-tomography and echocardiog-
raphy, Acta Radiol 31:41–46, 1990.
58. Spodick DH. Acute cardiac tamponade, N
Engl J Med 349:684–690, 2003.
59. Reddy PS, Curtiss EI, Otoole JD, Shaver JA.
Cardiac-tamponade—hemodynamic obser-
vations in man, Circulation 58:265–272,
1978.
60. Shabetai R, Fowler NO, Fenton JC, Masangka
M. Pulsus paradoxus, J Clin Invest 44:1965,
1882.
61. Singh S, Wann LS, Schuchard GH, et al. Right
ventricular and right atrial collapse in patients
with cardiac-tamponade — a combined echo-
cardiographic and hemodynamic-study, Cir-
culation 70:966–971, 1984.
62. Kronzon I, Cohen ML, Winer HE. Diastolic
atrial compression—a sensitive echocardio-
graphic sign of cardiac-tamponade, J Am Coll
Cardiol 2:770–775, 1983.
63. Gillam LD, Guyer DE, Gibson TC, et al. Hy-
drodynamic compression of the right atrium:
a new echocardiographic sign of cardiac tam-
ponade, Circulation 68:294–301, 1983.
64. Merce J, Sagrista-Sauleda J, Permanyer-
Miralda G, et al. Correlation between clinical
and Doppler echocardiographic findings in
patients with moderate and large pericardial
effusion: implications for the diagnosis of
cardiac tamponade, Am Heart J 138(4 Pt
1):759–764, 1999.
65. Armstrong WF, Schilt BF, Helper DJ, et al.
Diastolic collapse of the right ventricle with
cardiac-tamponade — an echocardiographic
study, Circulation 65:1491–1496, 1982.
66. Himelman RB, Kircher B, Rockey DC,
Schiller NB. Inferior vena cava plethora
with blunted respiratory response: a sensi-
tive echocardiographic sign of cardiac tam-
ponade, J Am Coll Cardiol 12:1470–1477,
1988.
67. Engel PJ, Hon H, Fowler NO, Plummer S.
Echocardiographic study of right ventricular
wall motion in cardiac-tamponade, Am J Car-
diol 50:1018–1021, 1982.
68. Leimgruber PP, Klopfenstein HS, Wann LS,
Brooks HL. The hemodynamic derangement
associated with right ventricular diastolic col-
lapse in cardiac-tamponade — an experimen-
tal echocardiographic study, Circulation 68:
612–620, 1983.
69. Klopfenstein HS, Cogswell TL, Bernath GA,
et al. Alterations in intravascular volume af-
fect the relation between right ventricular
diastolic collapse and the hemodynamic se-
verity of cardiac-tamponade, J Am Coll Car-
diol 6:1057–1063, 1985.
70. Fusman B, Schwinger ME, Charney R, et al.
Isolated collapse of left-sided heart chambers
in cardiac tamponade: demonstration by two-
dimensional echocardiography, Am Heart J
121(2 Pt 1):613–616, 1991.
71. Chuttani K, Tischler MD, Pandian NG, et al.
Diagnosis of cardiac-tamponade after cardi-
ac-surgery—relative value of clinical, echo-
cardiographic, and hemodynamic signs, Am
Heart J 127:913–918, 1994.
72. Chuttani K, Pandian NG, Mohanty PK, et al.
Left-ventricular diastolic collapse—an echo-
cardiographic sign of regional cardiac-tam-
ponade, Circulation 83:1999–2006, 1991.
In-28_для нас.indd 730
03.04.2019 12:04:36
731
28 Заболевания перикарда
73. Burstow DJ, Oh JK, Bailey KR, et al. Cardiac
tamponade: characteristic Doppler observa-
tions, Mayo Clin Proc 64:312–324, 1989.
74. Leeman DE, Levine MJ, Come PC. Doppler
echocardiography in cardiac-tamponade—
exaggerated respiratory variation in transval-
vular blood-flow velocity integrals, J Am Coll
Cardiol 11:572–578, 1988.
75. Krikorian JG, Hancock EW. Pericardiocente-
sis, Am J Med 65:808–814, 1978.
76. Fitch MT, Nicks BA, Pariyadath M, et al.
Emergency pericardiocentesis, New Engl J
Med 366:E17–U19, 2012.
77. Tsang TS, Enriquez-Sarano M, Freeman WK, et
al. Consecutive 1127 therapeutic echocardio-
graphically guided pericardiocenteses: clinical
profile, practice patterns, and outcomes span-
ning 21 years, Mayo Clin Proc 77: 429–436, 2002.
78. Isselbacher EM, Cigarroa JE, Eagle KA. Car-
diac-tamponade complicating proximal aor-
tic dissection—is pericardiocentesis harmful,
Circulation 90:2375–2378, 1994.
79. Tsang TSM, Freeman WK, Barnes ME, et al.
Rescue echocardiographically guided pericar-
diocentesis for cardiac perforation complicat-
ing catheter-based procedures—the Mayo
Clinic experience, J Am Coll Cardiol 32:1345–
1350, 1998.
80. Salem K, Mulji A, Lonn E. Echocardiograph-
ically guided pericardiocentesis—the gold
standard for the management of pericardial
effusion and cardiac tamponade, Can J Car-
diol 15:1251–1255, 1999.
81. Tsang TSM, Freeman WK, Sinak LJ, Seward
JB. Echocardiographically guided pericardi-
ocentesis: evolution and state-of-the-art
technique, Mayo Clinic Proceed 73:647–652,
1998.
82. Troughton RW, Asher CR, Klein AL. Pericar-
ditis, Lancet 363:717–727, 2004.
83. LeWinter MM. Acute pericarditis, New Engl J
Med 371:2410–2416, 2014.
84. Abbas AE, Appleton CP, Liu PT, Sweeney JP.
Congenital absence of the pericardium: case
presentation and review of literature, Int J
Cardiol 98:21–25, 2005.
85. Wilson SR, Kronzon I, Machnicki SC, Ruiz
CE. A constrained heart: a case of sudden
onset unrelenting chest pain, Circulation 130:
1625–1631, 2014.
86. Shah AB, Kronzon I. Congenital defects of
the pericardium: a review, Eur Heart J Cardio-
vasc Imaging 16:821–827, 2015.
87. Connolly HM, Click RL, Schattenberg TT, et
al. Congenital absence of the pericardium:
echocardiography as a diagnostic tool, J Am
Soc Echocardiogr 8:87–92, 1995.
88. Patel J, Park C, Michaels J, et al. Pericardial
cyst: case reports and a literature review,
Echocardiogr J Cardiol 21:269, 2004.
89. Pezzano A, Belloni A, Faletra F, et al. Value of
two-dimensional echocardiography in the
diagnosis of pericardial cysts, Eur Heart J
4:238–246, 1983.
In-28_для нас.indd 731
03.04.2019 12:04:36
In-28_для нас.indd 732
03.04.2019 12:04:36
733
29 Трансплантация сердца
AUDREY H. WU, MD, MPH • THEODORE J. KOLIAS, MD
Обследование перед трансплантацией
сердца
Оценка степени риска при сердечной
недостаточности
Оценка донорского сердца
Строение и функциональное состояние
аллотрансплантата
Оперативная техника трансплантации
Толщина стенки, систолическая и
диастолическая функция левого
желудочка
Строение и функциональное состояние
правого сердца
Строение и функциональное состояние
аллотрансплантата при остром
отторжении
Посттрансплантационный мониторинг
Стандартное последующее наблюдение
Перикардиальный выпот
Эндомиокардиальная биопсия
под контролем эхокардиографии
Диагностика васкулопатии сердечного
аллотрансплантата
Коронарография с внутрисосудистым
ультразвуком
Стресс-эхокардиография
Визуализации перфузии миокарда
Трансплантация сердца — это метод выбора лече-
ния пациентов, являющихся потенциальными кан-
дидатами, с терминальной стадией сердечной недо-
статочности. Ежегодно в мире проводится > 3500
трансплантаций сердца у взрослых. На момент
трансплантации примерно у 40% реципиентов про-
водится терапия инотропными препаратами, при
этом около одной трети требуется какая-либо фор-
ма механической поддержки кровообращения, ча-
ще всего сердечная помпа левого желудочка (ЛЖ).
Данные международных реестров демонстрируют
нескорректированный показатель 1-летней выжи-
ваемости после трансплантации сердца около 85%.
Более поздние тенденции в выборочных характери-
стиках реципиентов отражают изменения в популя-
ции и возможность проводить трансплантацию у
пациентов с высокой степенью операционного ри-
ска, включая реципиентов с врожденными порока-
ми сердца или тех, кто подвергается повторной пе-
ресадке сердца, сенсибилизированным реципиен-
там или пациентам с тяжелой сопутствующей
патологией, такой как сахарный диабет, артериаль-
ная гипертензия или ранее перенесенные операции
на сердце. В течение первого года после транс-
плантации значительная доля летальных исходов
обусловлена недостаточностью трансплантата и
инфицированием, тогда как после первого года наи-
более частыми причинами смерти становятся васку-
лопатия сердечного аллотрансплантата (трансплан-
тационная коронарная болезнь), поздняя недоста-
точность трансплантата (вероятно, в результате
васкулопатии сердечного аллотрансплантата) и ма-
лигнизация [1].
ОБСЛЕДОВАНИЕ
ПЕРЕД ТРАНСПЛАНТАЦИЕЙ СЕРДЦА
ОЦЕНКА СТЕПЕНИ РИСКА
ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Оценка степени риска при систолической сердечной
недостаточности способствует определению прио-
ритетности кандидатов на передовые методы лече-
ния, включая трансплантацию сердца или механи-
ческую поддержку кровообращения. В целом, от-
дельные эхокардиографические параметры, кроме
фракции выброса, не включаются в общепринятые
комбинированные шкалы оценки риска при про-
гнозировании сердечной недостаточности, но неко-
торые показатели помогают оценить прогноз. В
табл. 29.1 [2–9] приведены эхокардиографические
критерии неблагоприятного прогноза при наличии
систолической сердечной недостаточности.
При оценке гемодинамики у потенциальных ре-
ципиентов, подлежащих трансплантации сердца,
особое внимание уделяют дисфункции правого же-
лудочка (ПЖ) или наличию легочной гипертензии
и ее обратимости. У пациентов с терминальной
стадией сердечной недостаточности вследствие по-
вышения посткапиллярного давления наполнения
может развиться вторичная легочная гипертензия.
Продолжительно существующая легочная гипер-
тензия может привести к ремоделированию стенки
In-29_для нас.indd 733
03.04.2019 12:04:59
734
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Показатель
Описание
Корреляция с результатами
Низкая фракция
выброса ЛЖ
Является компонентом составных шкал
риска, таких как Сиэтлская модель сер-
дечной недостаточности [2]
Более низкая фракция выброса ЛЖ коррелирует с более
высоким риском (связана с высоким риском неблагоприят-
ных исходов)
Отсутствие обрат-
ного ремодели-
рования ЛЖ [3]
В ходе одного исследования наблюдалось у
37% пациентов с идиопатической дилата-
ционнойкардиомиопатией. Определяется
как наличие на промежуточных этапах
последующего наблюдения (24 ± 7 мес)
(1) увеличения ФВЛЖ ≥ 10% или при
последующем наблюдении ФВЛЖ ≥ 50%
и (2) снижение индексированного конеч-
ного диастолического диаметра ЛЖ
≤ 33 мм/м2
В моделях с мультивариантным анализом отсутствие обрат-
ного ремоделирования желудочка было независимым про-
гностическим фактором летального исхода/транспланта-
ции сердца (КР 0,44, 95% ДИ 0,25–0,78), недостаточности
насосной функции/трансплантации сердца (КР 0,24, 95%
ДИ 0,07–0,84) и скоропостижной смерти/желудочковой
аритмии (КР 0,39, 95% ДИ 0,21–0,74)
Наличие функци-
ональной
митральной
регургитации [4]
В ходе различных исследований наблюда-
лось у 25–30% пациентов с систоличе-
ской сердечной недостаточностью
В ходе различных исследований демонстрировалась незави-
симая связь с показателем долгосрочной общей летально-
сти (ОР 1,88, 95% ДИ 1,23–2,86), 5-летней летальностью
(КР 1,23, 95% ДИ 1,13–1,34) и летального исхода или госпи-
тализации по поводу сердечной недостаточности с медиан-
ной последующего наблюдения 2,5 года (КР 1,5, 95% ДИ
1,2–1,9).
Неизвестно, является ли связь причинно-следственной и
улучшается ли прогноз при уменьшении митральной
регургитации
Показатели допплерографии
Рестриктивный
тип трансми-
трального крово-
тока (время
замедления
трансмитраль-
ного кровотока)
[5]
Время замедления трансмитрального кро-
вотока определяется как время между
пиком E-волны и пересечением кривой
или касательной с нулевой отметкой
базовой линии. Рестриктивный тип
наполнения определяется при E/A ≥ 2
или значении E/A между 1 и 2 с временем
замедления < 140 мсек
Время замедления трансмитрального кровотока ≤ 125 мсек
независимо коррелирует с показателем общей летальности
(ОР 1,93, 95% ДИ 1,4–3,7) при средней продолжительности
наблюдения 29 ± 11 мес
dP/dt, −dP/dt [6] dP/dt определяется как ΔP/Δt, где ΔP =
разница в градиенте давления ЛЖ — ЛП
от 1 м/сек до 3 м/сек, измеренная при
непрерывно-волновой допплерографии
струи митральной регургитации.
ΔP/Δt = 32 мм рт. ст./Δt
−dP/dt, определяемый по диастолическому
спаду спектра митральной регургитации,
используя время от 3 до 1 м/сек
Группы риска, связанные с производными допплерографии,
коррелировали с результатами: группа низкого риска опре-
делялась как dP/dt ≥ 600, группа промежуточного риска —
как dP/dt < 600 плюс –dP/dt ≥ 450, а группа высокого
риска — dP/dt < 600 плюс –dP/dt < 450. В моделях с муль-
тивариантным анализом группа риска, определяемая по
производным допплерографии, независимо коррелировала
с отсутствием событий (сердечная смерть, кандидат 1-й
очереди на трансплантацию сердца в общей базе обмена
трансплантатами или экстренная имплантация сердечной
помпы) (ОР 3,07, p = 0,0002)
Показатели тканевой допплерографии
Систолическая
скорость
митрального
кольца [7]
Измерение с помощью тканевой доппле-
рографии скоростей митрального кольца
включают продольную систолическую
скорость митрального кольца (Sm) и
раннюю (Em) и позднюю (Am) диастоли-
ческую скорости митрального кольца.
Низкие скорости митрального кольца
позволяют предположить дисфункцию
ЛЖ
В моделях с мультивариантным анализом было продемон-
стрировано, что продольная систолическая скорость
митрального кольца независимо коррелировала с леталь-
ным исходом и трансплантацией сердца (КР 0,65, 95% ДИ
0,46–0,91)
ТАБЛИЦА 29.1 Эхокардиографические критерии неблагоприятного прогноза и потенциальной необходимости проведения
трансплантации сердца при систолической сердечной недостаточности
In-29_для нас.indd 734
03.04.2019 12:04:59
735
29 Трансплантация сердца
Показатель
Описание
Корреляция с результатами
Митральное E/e′
[8]
Отношение ранней диастолической скоро-
сти кровотока через митральный клапан
(E) и ранней диастолической скорости
митрального кольца (e′)
В моделях с мультивариантным анализом было продемон-
стрировано, что E/e′ независимо связано со смертностью от
сердечно-сосудистых заболеваний (КР 1,30, 95% ДИ 1,10–
1,19) при последующем наблюдении пациентов, не превы-
шающем 2 года
Показатели тканевой допплерографии
Показатели систо-
лической
функции
(деформация),
полученные с
помощью
спекл-трекинг
[9]
Пиковая систолическая деформация опре-
деляется как максимальное отрицатель-
ное значение кривой деформации в фазу
систолы. Глобальная циркулярная дефор-
мация и глобальная продольная дефор-
мация, рассчитанные как деформация
(%) = (L[конечная систолическая] –
L[конечная диастолическая]) /
L(конечная диастолическая) × 100, где L =
длина сегмента миокарда ЛЖ
В моделях с мультивариантным анализом было продемон-
стрировано, что глобальная циркулярная деформация была
независимо связана с повторной госпитализацией по
поводу сердечной недостаточности или с сердечной
смертью (КР 1,15, 95% ДИ 1,04–1,28)
P — давление; Т — время; ДИ — доверительный интервал; КР — коэффициент риска; ЛЖ — левый желудочек; ЛП — левое предсердие;
ОР — относительный риск; ФВ — фракция выброса.
ТАБЛИЦА 29.1
окончание
Эхокардиографические критерии неблагоприятного прогноза и потенциальной необходимости проведения
трансплантации сердца при систолической сердечной недостаточности
легочной артерии, характеризующейся гипертро-
фией среднего слоя и фиброзом интимы, а также к
персистирующей легочной гипертензии, не подда-
ющейся консервативной терапии («стойкая легоч-
ная гипертензия»). Наличие легочной гипертензии
до проведения трансплантации, особенно в случае
ее необратимости при приеме сосудорасширяющих
препаратов или обратимости за счет системной ги-
потензии, связано с повышенным риском летально-
го исхода, обычно вследствие острой правожелу-
дочковой недостаточности [10]. У пациентов с
ограниченной обратимостью легочной гипертензии
и умеренно сохраненной функцией ПЖ целесоо-
бразно в качестве переходного этапа перед проведе-
нием трансплантации устанавливать сердечную
помпу ЛЖ, поскольку продолжительное снижение
нагрузки ЛЖ с ее помощью может способствовать
регрессии легочной гипертензии и, следовательно,
создать благоприятные условия для транспланта-
ции (рис. 29.1) [11].
Оценка центральной гемодинамики может быть
осуществлена путем прямого инвазивного измере-
ния с помощью катетера в легочной артерии или
неинвазивным расчетным способом с помощью
эхокардиографии (ЭхоКГ). Оценка систолического
давления в легочной артерии, полученная с помо-
щью допплеровского измерения скорости трику-
спидальной регургитации, тесно коррелируют с
результатами инвазивных измерений у пациентов с
сердечной недостаточностью [12]. Более полная
эхокардиографическая оценка гемодинамики воз-
можна с использованием следующих расчетов [13]:
Сердечный выброс = (Частота сердечных
сокращений) (VTIВТЛЖ) π (DВТЛЖ/2)2.
Среднее давление в правом предсердии =
= –1,263 + 0,01116 × Ac,
где Ac — показатель ускорения (см/сек2) раннего
трикуспидального наполнения; D — диаметр; ВТ-
ЛЖ — выносящий тракт левого желудочка; VTI —
интеграл скорости кровотока.
Систолическое давление в легочной артерии =
= ДПП + 4(VТРmax)2,
где VТРmax — это максимальная скорость потока
трикуспидальной регургитации; ДПП — давление в
правом предсердии.
ДЗЛК = 32,16 + (–0,1045Е) + (0,1345А) +
+ (–0,17ВЗК) + (4,95Е/А).
Резистентность легочных сосудов (РЛС) =
= [(ФП/ВУП)/ОВ],
где ДЗЛК — это давление заклинивания в легочных
капиллярах; ПП — период предизгнания; ВУП —
время ускорения потока; ОВС — общее время
систолы, измеренные с помощью импульсно-вол-
новой допплерографии систолического кровото-
ка в легочной артерии (рис. 29.2). Хотя использо-
вание неинвазивных показателей резистентности
легочных сосудов может снизить потребность в
проведении серийной катетеризации правых отде-
лов сердца у кандидатов, подлежащих транспланта-
ции сердца, эхокардиографические показатели мо-
гут быть менее точными в случаях пограничной
резистентности легочных сосудов (РЛС 2–4 ед. Вуда)
[14]. У пациентов с устойчивой или декомпенсиро-
ванной сердечной недостаточностью наблюдается
вариабельность точности других показателей вну-
трисердечного давления наполнения, полученных с
In-29_для нас.indd 735
03.04.2019 12:04:59
736
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
помощью тканевой допплерографии (соотношение
митрального E/e′), по сравнению с инвазивными
измерениями [15, 16].
ОЦЕНКА ДОНОРСКОГО СЕРДЦА
Оценка потенциального донорского сердца на при-
годность к трансплантации имеет жизненно важное
значение для оптимизации результатов после пере-
садки. Как правило, потенциальные донорские
сердца ведутся согласно конкретным протоколам
по подготовке к забору, хранению и транспланта-
ции, при этом тактика ведения обычно включает
ЭхоКГ и катетеризацию легочной артерии. Для
определения пригодности сердца к трансплантации
проводится эхокардиографическая оценка регио-
нарного и глобального нарушения подвижности
стенки, клапанной дисфункции или врожденных
аномалий. Хотя при первоначальной оценке может
наблюдаться регионарное или глобальное наруше-
ние подвижности стенок, в некоторых случаях со-
кратительная функция может быть восстановлена с
помощью лекарственной терапии, особенно если
дисфункция связана с гибелью головного мозга или
вызвана катехоламинами. Серийные эхокардио-
граммы часто могут подтвердить улучшение сокра-
тительной функции при восстановлении гемодина-
мики и коррекции метаболических нарушений [17].
Однако, чем ниже начальная фракция выброса, тем
меньше вероятность того, что сердце будет оптими-
зировано для трансплантации, поскольку этот по-
казатель, вероятно, отражает внутренние и необра-
тимые причины сократительной дисфункции.
В ходе анализа данных реестра отмечалось нали-
чие слабо выраженной гипертрофии ЛЖ (1,1–1,3 см)
Годы
В
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
100
90
80
70
60
50
40
30
012345678
1–< 3 ед. Вуда (n = 8730)
5+ ед. Вуда (n = 880)
3–< 5 ед. Вуда (n = 2794)
1–<3vs3–<5:р=0,0120
Никакие другие парные сравнения
не были значимыми при р < 0,05
Рис. 29.1 Взаимосвязь между резистентностью легочных сосудов до трансплантации и выживаемостью после трансплантации сердца. Анализ
Каплана–Мейера выживаемости после трансплантации сердца в сопоставлении с дотрансплантационной резистентностью легочных сосудов. У пациентов с наи-
большей резистентностью легочных сосудов (РЛС) (3–< 5 ед. Вуда) отмечалось выраженное снижение показателя выживаемости, по сравнению с группой паци-
ентов с минимальной резистентностью легочных сосудов (РЛС 1–< 3 ед. Вуда) (p = 0,012) [Lund LH, Edwards LB, Kucheryavaya AY, et al. The registry of the International
Society for Heart and Lung Transplantation: thirty-first official adult heart transplant report — 2014; focus theme: retransplantation. J Heart Lung Transplant 33:996–1008,
2014].
РЛС =
АДЛср – ДЗЛК
СВ
3,3 ед. Вуда
=
ПП/ВУП
ОВ
Неинвазивная РЛС
ОВ=ПП+ВИ
ВИ = 0,212 сек
Т
р
и
к
у
с
п
и
д
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
С
и
с
т
о
л
и
ч
е
с
к
и
й
к
р
о
в
о
т
о
к
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
ПП = 0,0095 сек
ВУП = 0,095
3,2 сек–1
=
РЛС =
Рис. 29.2 Результаты непрерывно-волновой допплерографии потока
трикуспидальной регургитации (сверху) и результаты импульсно-вол-
новой допплерографии легочного кровотока (снизу) одного и того же
пациента, у которого при инвазивном измерении РЛС = 3,3 ед. Вуда.
АДЛср — среднее артериальное давление в легочной артерии; ВИ — время
изгнания; ВУП — время ускорения потока в легочной артерии; ДЗЛК — дав-
ление заклинивания в легочных капиллярах; ОВ — общее время; ПП — пери-
од предызгнания; РЛС — резистентность легочных сосудов; СВ — сердечный
выброс [Temporelli PL, Scapellato F, Eleuteri E, et al. Doppler echocardiography in
advanced systolic heart failure. Circ Heart Fail 3:387–394, 2010].
In-29_для нас.indd 736
03.04.2019 12:04:59
737
29 Трансплантация сердца
в 38%, и от умеренной до выраженной гипертрофии
ЛЖ (≥ 1,4 см) в 5,6% донорских сердец. На совре-
менном этапе рост показателя смертности после
трансплантации не связан с гипертрофией ЛЖ са-
мой по себе, но коррелирует с сопутствующим стар-
шим возрастом донора или более продолжитель-
ным временем ишемии [18]. Фармакологическая
стресс-ЭхоКГ является потенциальным методом
для расширения группы потенциальных доноров.
Маргинальные сердца (от доноров более старшего
возраста или доноров с сопутствующей патологи-
ей) без нарушения подвижности стенки в состоянии
покоя и нормальным ответом на фармакологиче-
ский стресс-тест могут быть благополучно исполь-
зованы для трансплантации [19].
СТРОЕНИЕ И ФУНКЦИОНАЛЬНОЕ
СОСТОЯНИЕ АЛЛОТРАНСПЛАНТАТА
ОПЕРАТИВНАЯ ТЕХНИКА ТРАНСПЛАНТАЦИИ
При более старом методе биатриальной трансплан-
тации сердца сохраняются предсердные манжеты
реципиента с двух сторон для прямого анастомоза
аллотрансплантата. При данном подходе формиру-
ются большие полости предсердий с длинными
линиями шва, что приводит к нарушению геоме-
трии и функции предсердий. Большие размеры и
анатомическое искажение предсердий создают ус-
ловия для патологических изменений митрального
и трикуспидального клапанов и образования пред-
сердного тромба [20, 21]. Бикавальный метод с на-
ложением отдельных кавальных анастомозов и
анастомозов легочных вен получил популярность в
конце 1980-х гг . и в настоящее время является наи-
более часто используемым. Трансплантация с ис-
пользованием биатриального метода сопряжена с
более высокой частотой спонтанного контрастиро-
вания и тромбоза предсердий, выявляемых с помо-
щью ЭхоКГ, и риском развития системной артери-
альной эмболии, что не наблюдается при бикаваль-
ном методе [22–24]. Тромбы предсердий обычно
локализуются в плохо визуализируемых при тран-
сторакальной эхокардиографии (ТТЭхоКГ) обла-
стях, таких как ушко донорского левого предсердия
(ЛП) или задняя стенка, и для их визуализации
требуются проведение чреспищеводной эхокардио-
графии (ЧПЭхоКГ) [25]. Помимо размера и геоме-
трии предсердий, более приближенных к нормаль-
ным параметрам, бикавальный метод сопровожда-
ется более физиологичной функцией предсердий с
показателями сократительной способности пред-
сердий, сравнимыми с показателями в группе кон-
троля [26, 27]. Сокращение ЛП у пациентов, пере-
несших трансплантацию, по-видимому, в большей
степени влияет на ударный объем ЛЖ, чем у паци-
ентов, у которых трансплантация не выполнялась,
причем донорский компонент ЛП вносит больший
вклад в опорожнение предсердий, чем компонент
предсердия реципиента [27, 28]. Таким образом,
пациент, подвергшийся трансплантации, может
плохо переносить условия, при которых нарушает-
ся вклад предсердий в сердечный выброс, например,
предсердные тахиаритмии (рис. 29.3, 29.4).
ТОЛЩИНА СТЕНКИ, СИСТОЛИЧЕСКАЯ
И ДИАСТОЛИЧЕСКАЯ ФУНКЦИИ ЛЕВОГО ЖЕЛУДОЧКА
Вскоре после трансплантации происходит увеличе-
ние массы и конечного диастолического объема
ЛЖ. Эти изменения могут исчезать либо сохранять-
ся в течение многих лет, не оказывая неблагоприят-
ных последствий на фракцию выброса, хотя вскоре
может проявиться малозаметное снижение систо-
лической сократительной способности [29–31]. При
отсутствии осложнений, вызывающих дисфункцию
трансплантата, в течение по меньшей мере 10–15 лет
после трансплантации систолическая функция же-
лудочка аллотрансплантата обычно остается в пре-
делах нормы. Частой находкой является гипертро-
фия ЛЖ, а также послеоперационное движение
межжелудочковой перегородки [31–33].
Сразу же после трансплантации сердца повыша-
ется давление наполнения вследствие бивентрику-
лярного нарушения систолической и диастоличе-
ской функции, характеризующееся увеличением
индекса производительности миокарда, снижением
Аортальный анастомоз
Анастомоз
легочной
артерии
Анастомоз
нижней
полой вены
Анастомоз
верхней
полой вены
Рис. 29.3 Практически завершенная трансплантация сердца (бика-
вальный метод). Показаны анастомозы аллотрансплантата. Сердечный ал-
лотрансплантат соединяется с помощью анастомозов с верхней и нижней по-
лыми венами, легочной артерией, аортой и ЛП реципиента.
In-29_для нас.indd 737
03.04.2019 12:04:59
738
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
скоростей E′ и S′, измеряемых с помощью тканевой
допплерографии, укорочением времени изоволю-
мической релаксации и времени замедления E-вол-
ны и увеличением отношения E/A (рис. 29.5). Этот
гемодинамический профиль улучшается в течение
от первых нескольких недель до нескольких меся-
цев после проведения трансплантации и может
продолжать нормализоваться в течение нескольких
лет, либо сохраняться в незначительной степени
[34–36]. Рестриктивная физиология изначально по-
сле трансплантации может быть обусловлена ком-
бинацией ишемического повреждения миокарда,
легочной гипертензии реципиента и объемной пе-
регрузки. Тогда как стойкая рестриктивная физио-
логия может быть связана с несоответствием по
размеру донора–реципиента, ишемическим фибро-
зом, отторжением или увеличением постнагрузки
из-за системной гипертензии.
Частота выявления диастолической дисфункции
с течением времени снижается, но у небольшой ча-
сти пациентов (в ходе нескольких серийных иссле-
дований описано до 10–15%) диастолические нару-
шения наблюдаются по истечении раннего послео-
перационного периода. Диастолическая дисфункция
ПЖ (повышенное давление в правом предсердии
[ПП]/ ударный объем) была связана с повышенной
летальностью [37]. Как правило, у реципиентов с
констриктивно-рестриктивной гемодинамикой на-
Рис. 29.4 Сравнение при эхокардиографии биатриального и бикавального методов трансплантации. По сравнению с бикавальным методом (Б) биа-
триальный метод (А) сопровождается значительным расширением предсердий. На ЭхоКГ видны линии шва на предсердиях (стрелки). ЛЖ — левый желудочек;
ЛП — левое предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
ЛЖ
ЛЖ
ПЖ
ПЖ
ПП
ЛП
ЛП
ПП
А
Б
EE
A
A
Рис. 29.5 Скорости кровотока через митральный клапан демонстрируют нормальное отношение E/A и нормальную скорость замедления с
нормальной диастолической функцией (А) по сравнению с «рестриктивным» типом наполнения с увеличенной скоростью E с резким замедле-
нием и сниженной скоростью A (Б). A — скорость позднего наполнения; E — скорость раннего наполнения.
А
Б
In-29_для нас.indd 738
03.04.2019 12:04:59
739
29 Трансплантация сердца
блюдалось более высокое правостороннее и лево-
стороннее давления наполнения, более короткое
время изоволюмической релаксации ЛЖ и время
замедления E-волны, а также более высокие ми-
тральное и трикуспидальное отношения E/A. Стой-
кие диастолические нарушения, наблюдаемые после
истечения раннего посттрансплантационного пери-
ода, как правило, связаны с неблагоприятными кли-
ническими исходами, включая криз отторжения,
симптомы сердечной недостаточности и летальный
исход [38, 39]. Причины стойкой диастолической
дисфункции, возникающей после трансплантации,
определены не полностью, но, вероятно, к ним от-
носятся кумулятивное иммунно-опосредованное
повреждение, фиброз, вызванный иммунным или
неиммунным повреждением, и васкулопатия сер-
дечного аллотрансплантата.
СТРОЕНИЕ И ФУНКЦИОНАЛЬНОЕ
СОСТОЯНИЕ ПРАВОГО СЕРДЦА
Длительное повышение давления наполнения ЛЖ
обычно приводит к развитию вторичной легочной
гипертензии, степень проявления которой, как пра-
вило, снижается в течение нескольких недель или
месяцев после трансплантации сердца до нормаль-
ного или почти нормального уровня. Процесс изме-
нения структуры и функции правых отделов сердца
после трансплантации протекает параллельно раз-
решению легочной гипертензии и объемной пере-
грузки, тем не менее некоторое расширение ПЖ
может сохраняться длительное время [40, 41]. Не-
смотря на отклонения в размере и функции правых
отделов сердца, при отсутствии выраженной трику-
спидальной регургитации, клинические признаки и
симптомы сердечной недостаточности, как правило,
не наблюдаются [32].
Причиной трикуспидальной регургитации, воз-
никающей вскоре после трансплантации, чаще все-
го является недостаточность ПЖ и предоперацион-
ная и послеоперационная легочная гипертензия
[42]. К возникновению же поздней трикуспидаль-
ной регургитации чаще приводит повреждение
клапана во время проведения эндомиокардиальной
биопсии (рис. 29.6). Выраженность трикуспидаль-
ной регургитации, определяемая с помощью интра-
операционной ЧПЭхоКГ, может служить показате-
лем дисфункции ПЖ и, по-видимому, коррелирует
с низким показателем долгосрочной выживаемости.
В ходе серийного исследования с участием 181 па-
циента было показано, что в 20% донорских сердец
на момент трансплантации присутствовала трику-
спидальная регургитация по меньшей мере слабой
степени выраженности, что демонстрировало силь-
ную корреляцию с наличием дисфункции ПЖ и
показателем 5-летней летальности [43]. По оценкам,
у 15% пациентов через 10 лет после трансплантации
наблюдается тяжелая трикуспидальная регургита-
ция. Эти пациенты подвержены повышенному ри-
ску сердечной недостаточности, и у них может быть
необходимо проведение замены трикуспидального
клапана [44, 45].
СТРОЕНИЕ И ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
АЛЛОТРАНСПЛАНТАТА ПРИ ОСТРОМ ОТТОРЖЕНИИ
Острое отторжение аллотрансплантата обычно ха-
рактеризуется лимфоцитарной инфильтрацией с
некрозом миоцитов (клеточное отторжение) либо
без него [46]. Антитело-опосредованное отторже-
ние представляет собой более редкую, хуже изучен-
ную форму, характеризующуюся активацией эндо-
телиоцитов и отложением комплемента, в первую
очередь в сосудах микроциркуляторного русла [47].
Нарушения при отторжении аллотрансплантата,
выявляемые с помощью ЭхоКГ, могут включать
изменения систолической и диастолической функ-
ции и увеличение массы или толщины стенок ЛЖ.
В настоящее время золотым стандартом диагности-
ки отторжения является эндомиокардиальная
биопсия, несмотря на то, что этот метод ограничен
рисками, присущими инвазивной процедуре,
ошибкой выборки, стоимостью и дискомфортом
пациента. Несмотря на то что сама по себе ЭхоКГ не
является методом окончательной диагностики от-
торжения, она дает представление об изменениях,
которые происходят при этом процессе, и может с
успехом применятся в качестве дополнительного
метода диагностики.
Впервые возникшая систолическая дисфункция
при развитии острого отторжения обычно является
поздним симптомом и указывает на более высокую
скорость отторжения, сопряженную с гемодинами-
ческими нарушениями и клиническими симптома-
ми, а также с более неблагоприятным прогнозом.
Подавляющее большинство кризов отторжения не
сопровождаются систолическими нарушениями,
Рис. 29.6 A Молотящая створка (стрелка) трикуспидального клапана
с трикуспидальной регургитацией у реципиента, перенесшего транс-
плантацию сердца. ПЖ — правый желудочек; ПП — правое предсердие.
ПЖ
ПП
In-29_для нас.indd 739
03.04.2019 12:05:00
740
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
при этом обычно отсутствуют значительные изме-
нения эхокардиографических параметров систоли-
ческой функции. Самыми ранними проявлениями
острого отторжения являются нарушения диасто-
лического наполнения [38, 48]. Увеличение степени
тяжести отторжения связано с постепенным сокра-
щением времени изоволюмической релаксации и
временем полуспада давления и, возможно, увели-
чением максимальной скорости раннего трансми-
трального кровотока [48–50]. После лечения остро-
го отторжения показатели диастолической дис-
функции обычно возвращаются к исходным
значениям [50]. Тем не менее в целом диастоличе-
ские показатели, такие как митральная E-волна,
время замедления кровотока, время изоволюмиче-
ской релаксации, тканевая допплерографическая
ранняя диастолическая (E′) волна и поздняя диа-
столическая (A′) волна, недостаточно чувствитель-
ны для достоверной диагностики острого отторже-
ния [51].
Индекс производительности миокарда, опреде-
ляемый как отношение суммы времени изоволю-
мического сокращения и времени изоволюмической
релаксации ко времени изгнания, представляет со-
бой единый комплексный показатель систоличе-
ской и диастолической функции миокарда. Не-
смотря на то, что в некоторых исследованиях
предполагается корреляция между индексом про-
изводительности миокарда и наличием острого
отторжения, данный показатель демонстрировал
низкую чувствительность и специфичность, и эта
взаимосвязь определялась не постоянно. Парал-
лельное уменьшение времени изоволюмической
релаксации и увеличение времени изоволюмиче-
ского сокращения, свидетельствующих о развитии
нарушений диастолической и систолической функ-
ций, соответственно, при остром отторжении при-
водило к полному уравнительному влиянию на
индекс производительности миокарда [52–54].
Традиционные допплеровские показатели диа-
столической функции, такие как допплеровские
показатели трансмитрального кровотока, зависят
не только от параметров диастолической функции
желудочков, но и от условий желудочковой нагруз-
ки, и у реципиентов трансплантата, в частности, от
диастолических нарушений аллотрансплантата,
которые могут развиваться исходно вне зависимо-
сти от острого отторжения. Тканевая допплеров-
ская визуализация — это метод оценки систоличе-
ской и диастолической функции ЛЖ путем измере-
ния систолической (S′) и ранней (E′) и поздней (A′)
диастолических скоростей движения фиброзного
кольца митрального клапана. Несмотря на то, что
поздняя диастолическая скорость (A′) митрального
кольца и систолическая скорость (S′) митрального
кольца, по-видимому, являются чувствительными
маркерами острого тяжелого отторжения, они не
особо специфичны [55]. К тому же увеличение
специфичности в незначительной степени отмеча-
ется при использовании как систолических, так и
диастолических параметров тканевой допплерогра-
фии. Волнообразная комбинированная макси-
мальные систолическая и диастолическая скорости
митрального кольца (амплитуда колебаний), изме-
ренная с помощью тканевой допплерографии, была
значительно ниже у пациентов с наличием отторже-
ния любой степени, и может с успехом использо-
ваться для исключения выраженного отторжения
[56].
Несмотря на то что, вероятно, показатели ткане-
вой допплерографии демонстрируют чувствитель-
ность к определению различных степеней острого
отторжения или его исключению, в случае падения
значений показателей ниже предельного значения
рабочих характеристик аппарата, они, по всей види-
мости, не являются надежными инструментами
дифференциации острого отторжения от других
причин ослабления сокращения или релаксации.
Эта низкая специфичность отражает наложение
фоновых диастолических нарушений, обусловлен-
ных физиологией трансплантата, затрудняющих
выявление ранней диастолической дисфункции,
связанной с острым отторжением. Изучается воз-
можность использования новых методов для выяв-
ления и мониторинга острого отторжения, таких
как визуализация деформации и скорости деформа-
ции [57].
Самостоятельно взятый показатель изменения
толщины стенок ЛЖ не проявил себя достаточно
чувствительным критерием для диагностики кле-
точного отторжения [58]. Увеличение массы ЛЖ
при отторжении может быть результатом нараста-
ния интерстициального отека или пропотевания
фибрина через сосудистую стенку. Значительное
увеличение массы ЛЖ было описано при кризах
антитело-опосредованного отторжения [59].
ПОСТТРАНСПЛАНТАЦИОННЫЙ МОНИТОРИНГ
СТАНДАРТНОЕ ПОСЛЕДУЮЩЕЕ НАБЛЮДЕНИЕ
Общий обзор единых рекомендаций по стандартно-
му последующему наблюдению реципиентов, пере-
несших трансплантацию сердца, представлен на
рис. 29.7 . ЭхоКГ является основным методом стан-
дартного мониторинга строения и функции ал-
лотрансплантата, компонентом стресс визуализа-
ции для отслеживания васкулопатии сердечного
аллотрансплантата и дополнением к эндомиокар-
диальной биопсии при диагностике острого оттор-
жения. Элементы стандартной эхокардиограммы
для реципиентов, перенесших трансплантацию
сердца, приведены в табл. 29.2 . При подозрении
острого отторжения у пациентов необходимо уде-
лить особое внимание к выявлению изменений в
показателях систолической и диастолической функ-
ции на эхокардиограмме.
In-29_для нас.indd 740
03.04.2019 12:05:00
741
29 Трансплантация сердца
Эндомиокардиальная
биопсия для контроля отторжения
EMB — До 6–12 мес:
периодическое проведение ЭМБ
1–5 год: продолжительный период
(например, раз в 4–6 мес)
для реципиентов группы высокого риска
EMB — По истечении 5 лет: регулярное
проведение ЭМБ необязательно,
в зависимости от клинической оценки
и наличия риска позднего отторжения
Васкулопатия сердечного аллотрансплантата
Визит последующего наблюдения
Если восстановление
протекает гладко,
считается оправданным
1 мес: раз в 7–10 дней
2мес:разв14дней
3–12 мес: раз в месяц
1 год и далее:
один раз в 3–6 мес
Регулярный мониторинг
уровня
иммунодепрессантов
Лекарственная терапия
Острое отторжение
Обследование на предмет
онкологического заболевания
Предполагается
острое отторжение?
• Пожизненное наблюдение
в центре трансплантации
• Частота посещений зависит
от времени, прошедшего после
трансплантации, послеоперационного
клинического течения
• Рассмотрите стандартную
эхокардиографию для мониторинга
строения и функции сердца,
в том числе клапанных нарушений
Неинвазивный мониторинг острого
отторжения у пациентов группы
низкого риска
• Вызванные желудочковые потенциалы,
в специализированных центрах
• Определение профиля генной
экспрессии с 6 мес до 5 лет
• Для мониторинга отторжения не
рекомендуется использовать другие
стандартные неинвазивные методы
(включая ЭКГ, методы визуализации,
ЭхоКГ или определение уровня
биомаркеров)
• Первичная профилактика: контроль
классических факторов риска,
статинотерапия
• Рассмотрите возможность ежегодно
или раз в два года выполнять
коронарографию
• Рассмотрите возможность проведения
коронарографии с ВСУЗИ через 4–6
нед и 1 год для исключения
ишемической болезни донорского
сердца и выявления быстро
прогрессирующей ВСА
• При отсутствии ВСА на 3–5-й год рассмотрите менее частое проведение
обследования
• Для реципиентов, у которых инвазивное исследование не представляется
возможным, применима стресс-ЭхоКГ и сцинтиграфия миокарда
Тактика ведения пациентов с хроническими заболеваниями почек, сахарным диабетом,
артериальной гипертензией, остеопорозом, как правило, соответствует общей группе с учетом
потенциального взаимодействия лекарственных средств с трансплантационными препаратами
• ЭМБ позволяет как
можно ранее
подтвердить диагноз
• Для оценки
гемодинамики
рассмотрите
эхокардиографию и
катетеризацию правых
отделов сердца
• Стандартный общепринятый скрининг
на рак молочной железы, толстой
кишки, предстательной железы
• Завершается обследованием на
предмет рака кожи
Если при стандартной
ЭМБ диагностировано
быстроразвивающееся
отторжение, то
необходимо проводить
лечение, даже при
отсутствии симптомов
Рис. 29.7 Единые рекомендации по стандартному последующему наблюдению реципиентов, перенесших трансплантацию сердца. ВСА — васку-
лопатия сердечного аллотрансплантата; ВСУЗИ — внутрисосудистое ультразвуковое исследование; ЭМБ — эндомиокардиальная биопсия; ЭКГ — электрокар-
диография; ЭхоКГ — эхокардиография [Costanzo MR, Dipchand A, Starling R, et al. The International Society for Heart and Lung Transplantation. Guidelines for the care
of heart transplant recipients. J Heart Lung Transplant 29:914–956, 2010].
In-29_для нас.indd 741
03.04.2019 12:05:00
742
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 29.8 A Острая недостаточность аллотрансплантата. У 56-летнего мужчины, перенесшего трансплантацию сердца, в последующем развился кардио-
генный шок в связи с острой недостаточностью аллотрансплантата. Визуализация в позиции по короткой оси ЛЖ в фазу диастолы (слева) и систолы (справа) со
снижением сократительной функции. В последующем после курса интенсивной иммуносупрессивной терапии у пациента произошло восстановление функции в
течение нескольких дней.
Должна включать, но не обязательно ограничиваться следующим:
Эхокардиографические методы Проекция
Оцениваемые показатели
2D (± 3D)
Парастернальные длинно- и короткоосевая
проекции; апикальная четырехкамерная,
двухкамерная и длинноосевая проекции;
апикальная 3D объемная
Толщина стенки ЛЖ
Фракция выброса ЛЖ
Регионарная подвижность стенки ЛЖ
систолическая функция ПЖ
Размеры сердечных камер
Наличие и размер перикардиального
экссудата
2D и цветовая допплеровская
оценка клапанов
Парастернальные длинно- и короткоосевая
проекции; проекция приносящего тракта
ПЖ; апикальная четырехкамерная, двухка-
мерная и длинноосевая проекции; субко-
стальные проекции
Морфология створок (особенно трикуспи-
дального клапана, который мог быть трав-
мирован при выполнявшейся ранее
биопсии ПЖ)
Регургитация на клапанах
Импульсно-волновая допплеро-
графия трансмитрального
кровотока
Апикальная четырехкамерная проекция
Отношение E/A и время замедления
E-волны для оценки диастолической
функции
Тканевая допплерография
Апикальная четырехкамерная проекция
Скорости перегородочного и латерального
сегментов митрального кольца для оценки
диастолической функции
Непрерывно-волновая доппле-
рография струи трикуспидаль-
ной регургитации
Приносящий тракт ПЖ, парастернальная
короткоосевая, апикальная четырехкамер-
ная проекции
Максимальная скорость трикуспидальной
регургитации (v), систолическое давление в
ПЖ (СДПЖ = 4v2 + оценочное давление в
ПП)
Рассмотрите возможность
выполнения 2D в режиме
спекл-трекинг
Апикальная четырехкамерная, двухкамерная
и длинноосевая проекции
Глобальная продольная деформация (наибо-
лее чувствительный показатель функции
ЛЖ)
* Включает, но не обязательно ограничивается.
ЛЖ — левый желудочек; ПЖ — правый желудочек; ПП — правое предсердие.
ТАБЛИЦА 29.2 Стандартная эхокардиограмма для реципиента, подвергающегося трансплантации сердца*
In-29_для нас.indd 742
03.04.2019 12:05:00
743
29 Трансплантация сердца
Рис. 29.9 A Острая недостаточность аллотрансплантата и восстановление. Позиция по короткой оси ЛЖ в фазу диастолы (слева) и систолы (справа)
с существенно нормализованной систолической функцией.
Рис. 29.10 A Перикардиальная жидкость. ЭхоКГ в апикальной четырех-
камерной позиции. У мужчины, 47 лет, перенесшего трансплантацию сердца
1 мес назад. Через 4 дня после эндомиокардиальной биопсии появились
симптомы тампонады сердца. Стрелки указывают на перикардиальную жид-
кость, расположенную циркулярно. ЛЖ
—
левый желудочек; ПЖ — правый
желудочек.
Рис. 29.11 A Перикардиальная жидкость. ЭхоКГ в парастернальной
позиции по длинной оси. Стрелки указывают на перикардиальную жидкость,
расположенную циркулярно. ЛЖ
—
левый желудочек; ПЖ — правый
желудочек.
ЛЖ
ПЖ
ЛЖ
ПЖ
In-29_для нас.indd 743
03.04.2019 12:05:01
744
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 29.12 Эндомиокардиальная биопсия с доступом через правую
внутреннюю яремную вену. Биоптом продвигается через полость ПП и
трикуспидальный клапан в полость ПЖ. Образцы получают преимущественно
из области межжелудочковой перегородки для снижения риска перфорации и
тампонады сердца, который возрастает при выполнении биопсии в области
свободной стенки ПЖ.
Рис. 29.13 Биопсия правого желудочка аллотрансплантата сердца
под контролем ЭхоКГ. Стрелка указывает на дистальный конец биоптома,
продвигаемый через полость правого предсердия (ПП) и трикуспидальный
клапан в полость правого желудочка (ПЖ) для получения образца из межже-
лудочковой перегородки. ЛЖ — левый желудочек; ЛП — левое предсердие.
ЛЖ
ЛП
ПП
ПЖ
Рис. 29.14 Эндомиокардиальная биопсия под рентгеноскопическим
контролем. Дистальный конец биоптома, незадолго до забора биоптата, с
открытыми браншами, расположен в полости ПЖ.
ПЕРИКАРДИАЛЬНЫЙ ВЫПОТ
Ранние послеоперационные нарушения, которые
могут быть диагностированы и оценены с помо-
щью ЭхоКГ, включают в себя перикардиальный
выпот или тампонаду, дисфункцию ПЖ, трикуспи-
дальную регургитацию и острую недостаточность
аллотрансплантата (рис. 29.8, 29.9). Ожидаемая ча-
стота возникновения в послеоперационном периоде
умеренного и выраженного перикардиального вы-
пота колеблется от 9% до 35%. Значительная часть
этих выпотов, по-видимому, не оказывает отрица-
тельного влияния на краткосрочные или средне-
срочные результаты, включая длительность пребы-
вания в стационаре и продолжительность жизни, и
отсутствует корреляция с возникновением оттор-
жения [60–62]. Вероятность развития перикарди-
ального выпота после трансплантации сердца мо-
жет быть выше у пациентов, у которых операции на
сердце ранее не выполнялись, или у пациентов с
уменьшенным размером сердца [60, 61]. Естествен-
ная динамика развития этих экссудатов варьирует в
широких пределах, с оценкой необходимости по-
следующего вмешательства с проведением пери-
кардиоцентеза в пределах приблизительно 10–45%
(в ходе более раннего серийного исследования про-
ведение перикардэктомии требовалось у меньшей
части пациентов), но с заметным снижением этого
значения с течением времени [61–63]. Некоторые
In-29_для нас.indd 744
03.04.2019 12:05:01
745
29 Трансплантация сердца
2D-ЭхоКГ
RT-3DE
Рис. 29.15 Эндомиокардиальная биопсия под контролем 3D-ЭхоКГ. (Слева) 2D-ЭхоКГ в апикальной четырехкамерной проекции с хорошим определением
границ миокарда. Биоптом только частично расположен в полости ПЖ. (Справа) 3D-ЭхоКГ с улучшенной четкостью демонстрирует дистальный конец и стержень
биоптома. RT -3DE — трехмерная эхокардиография в режиме реального времени [Amitai ME, Schnittger I, Popp RL, et al. Comparison of three-dimensional echocar-
diography to two-dimensional echocardiography and fluoroscopy for monitoring of endomyocardial biopsy. Am J Cardiol 99:864–866 , 2007].
1. Сосудистый доступ
a. Ультразвуковой контроль сосудистого доступа в
режиме реального времени
b. Обработка кожи антисептиком, стерильные
салфетки
c. Местный анестетик
d. Стандартный набор венозных направляющих катете-
ров, включая иглу для доступа, проволочный прово-
дник катетера и интродьюсер (обычно интродьюсер
7–9 -го калибра по французской шкале, в зависимо-
сти от размера биопсийных щипцов и предпочтений
оператора). Для первоначального доступа при
небольших венах можно использовать комплект
микроинтродьюсеров (4 и 5 F)
e. Для прямого введения биоптома в полость ПЖ
следует рассматривать более длинные интродьюсеры
(45 см)
2. Визуализация
a. Рентгеноскопия, или
b. Эхокардиография
Изучается 3D-ЭхоКГ на предмет повышения точности
3. Биопсия
a. Биопсийные щипцы (обычно в пределах 7–9 F). Для
небольших пациентов можно рассмотреть интро-
дьюсеры и биопсийные щипцы педиатрических раз-
меров (5 F)
b. Контейнер для биопсийного материала. Обычно
формалин для стандартного окрашивания гематок-
силином и эозином
4. Гемодинамика
a. При необходимости получения данных о централь-
ной гемодинамике устанавливается катетер в легоч-
ной артерии
ПЖ — правый желудочек; ЭхоКГ — эхокардиография.
ТАБЛИЦА 29.3
Образец контрольного перечня
процедур для проведения
эндомиокардиальной биопсии
авторы обнаружили связь между отсроченным,
персистирующим или нарастающим перикарди-
альным экссудатом и вероятностью возникновения
и тяжестью отторжения [64, 65]. Несмотря на то, что
перикардиальная жидкость обычно является сте-
рильной, учитывая измененный иммунитет паци-
ентов, необходимо исключить инфекционный про-
цесс или новообразование. Если у пациента недавно
выполнялась биопсия миокарда, также следует ис-
ключить перфорацию сердца (рис. 29.10, 29.11).
ЭНДОМИОКАРДИАЛЬНАЯ БИОПСИЯ
ПОД КОНТРОЛЕМ ЭХОКАРДИОГРАФИИ
Несмотря на свои ограничения, эндомиокардиаль-
ная биопсия остается золотым стандартом диагно-
стики отторжения аллотрансплантата. Биопсий-
ный катетер обычно вводится через правую вну-
треннюю яремную вену или реже через левую
внутреннюю яремную вену или бедренную вену
(рис. 29.12–29.14). Традиционно при получении
биопсий использовалась рентгеноскопия для на-
правления наконечника биопсийного катетера к
межжелудочковой перегородке. Эхокардиографи-
ческий контроль с успехом стал применяться при
проведении эндомиокардиольной биопсии, де-
монстрируя ряд преимуществ, заключающихся в
отсутствии лучевой нагрузки, мобильности и пре-
доставлении информации о структуре и функцио-
нальном состоянии сердца. Частота осложнений
при проведении биопсии под контролем ЭхоКГ
чрезвычайно низка и сопоставима с таковой при
биопсии с рентгенологическим контролем (около
In-29_для нас.indd 745
03.04.2019 12:05:02
746
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Чувствительность
(%)
Специфичность
(%)
ППЦ
(%)
ОПЦ
(%)
Клинические исходы при
выявлении нарушений при
обследовании
ЭКГ с физической нагруз-
кой [88]
0–38
90–100
0–100
45–88
Незначительное количество
опубликованных данных
ЭхоКГ с физической
нагрузкой [85, 86]
15–25
85–86
67
32
Незначительное количество
опубликованных данных
Добутаминовая стресс-
ЭхоКГ [79, 81–83, 90, 91]
64–90
55–95
40–92
62–90
Летальный исход, инфаркт
миокарда, сердечная недо-
статочность, стенокардия
Радионуклидная визуали-
зация перфузии
миокарда
Сцинтиграфия с таллием-
201, технецием-99 [88,
91–94]
ПЭТ с рубидием-82 [89,
95]
21–90
Н/С
55–100
Н/С
42–75
Н/С
75–96
Н/С
Летальный исход, острый
коронарный синдром,
госпитализация по поводу
сердечной недостаточности
КТ, коронарная ангиогра-
фия [96, 97]
70–97
80–> 99
48–89
77–100
Незначительное количество
опубликованных данных
КТ — компьютерная томография; Н/С — нет сведений; ОПЦ — отрицательная прогностическая ценность; ППЦ — положительная
прогностическая ценность; ПЭТ — позитронно-эмиссионная томография; ЭКГ — электрокардиография; ЭхоКГ — эхокар-
диография.
ТАБЛИЦА 29.4 Сравнительный анализ различных методов при диагностике васкулопатии сердечного аллотрансплантата
Рис. 29.16 Внутрисосудистое ультразвуковое исследование васкулопатии сердечного аллотрансплантата. На коронарограмме (А) пациента, пере-
несшего трансплантацию сердца, не отмечается значительного сужения просвета. Тем не менее с помощью внутрисосудистой ультразвуковой визуализации
среднего отдела левой передней нисходящей коронарной артерии (Б) обнаружена крупная атеросклеротическая бляшка.
А
Б
In-29_для нас.indd 746
03.04.2019 12:05:03
747
29 Трансплантация сердца
0,4% от всех проведенных биопсий или намного
ниже у опытных специалистов) [66, 67]. Одним из
недостатков является то, что первоначальное вве-
дение и продвижение биоптома из верхней полой
вены до входа в ПП не визуализируется с помощью
ЭхоКГ. Развитие тяжелой трикуспидальной регур-
гитации в аллотрансплантате коррелирует с об-
щим количеством выполненных биопсий, пред-
положительно, в результате непреднамеренного
повреждения аппарата трикуспидального клапана
биопсийным катетером [68]. Несмотря на то, что
такие меры, как использование длинного интро-
дьюсера для введения биоптома непосредственно в
ПЖ, снижают риск развития трикуспидальной ре-
гургитации, не было окончательно установлено,
снижает ли этот риск проведение биопсии при стан-
дартном эхокардиографическом контроле. Также
было предложено использование трехмерной (3D)
ЭхоКГ для повышения точности биопсии по срав-
нению методами традиционной двухмерной (2D)
ЭхоКГ и рентгеноскопии [69, 70]. Кроме того, ис-
следовались новые методы диагностики отторже-
ния, такие как определение профиля генной экс-
прессии [71], которые могут быть использованы в
качестве дополнения или, в конечном счете, заме-
нить биопсию (рис. 29.15; табл. 29.3).
Клиническое
проявление
Результаты ЭхоКГ
Корреляция
Систолическая сер-
дечная недостаточ-
ность (до проведе-
ния
трансплантации)
Признаки систолической и диастолической дис-
функции: фракция выброса, тканевая доппле-
рография, функциональная митральная регур-
гитация (см. табл. 29.1)
Повышенный риск летального исхода и необходимо-
сти в трансплантации сердца
Легочная гипертен-
зия, повышение
резистентности
легочных сосудов
при систолической
сердечной
недостаточности
Оценка давления в легочной артерии с
помощью допплерографического измерения
скорости трикуспидальной регургитации
Резистентность легочных сосудов = [(ПП/AcT)/
ОВ], где ПП — период предизгнания; AcT —
время ускорения; ОВ — общее время систолы,
измеренные с помощью импульсно-волновой
допплерографии систолического кровотока в
легочной артерии
Повышенный риск послеоперационной правожелу-
дочковой недостаточности
Систолическая и
диастолическая
дисфункция сер-
дечного
аллотрансплантата
Стандартная 2D, импульсно-волновая и непре-
рывно-волновая допплерография; оценка с
помощью тканевой допплерографии
Вновь возникшая систолическая дисфункция обычно
связана с высокой тяжестью острого отторжения
или может быть проявлением выра женной ВСА
Диастолическая дисфункция может быть ранним
проявлением острого отторжения или ВСА
Обычно, при успешной терапии острого отторжения
систолические и диастолические нарушения носят
обратимый характер
Трикуспидальная
регургитация в
сердечном
аллотрансплантате
Вероятно, более широкое распространение
молотящей створки по сравнению с пациен-
тами, не подвергшимися трансплантации,
связано с тем, что ее причиной часто служит
травматизация створки при выполнении эндо-
миокардиальной биопсии
При наличии выра женных гемодинамических изме-
нений могут возникнуть симптомы правожелудоч-
ковой недостаточности и потребоваться хирургиче-
ская пластика трикуспидального клапана
Перикардиальный
экссудат в сердеч-
ном
аллотрансплантате
В послеоперационном периоде может наблю-
даться локализованный перикардиальный экс-
судат. При его значительном объеме могут раз-
виться симптомы тампонады. Применимы
стандартные критерии тампонады
При наличии клинических симптомов тампонады
показан перикардиоцентез. Ранний экссудат, как
правило, связан с периоперационными процессами.
Поздний экссудат может быть связан со стойким
послеоперационным выпотом, осложнением эндо-
миокардиальной биопсии, инфекцией или онколо-
гическим заболеванием
Васкулопатия сер-
дечного
аллотрасплантата
Добутаминовая ЭхоКГ предпочтительнее по
сравнению с ЭхоКГ с нагрузкой на тредмиле в
связи с более достоверной реакцией частоты
сердечных сокращений. Применяются стан-
дартные критерии для интерпретации ишемии
Наличие ВСА связано с неблагоприятным прогно-
зом; может влиять на выбор препаратов
иммуносупрессии
ВСА — васкулопатия сердечного аллотрансплантата; ЭхоКГ — эхокардиография.
ТАБЛИЦА 29.5 Корреляция клинических и эхокардиографических данных
In-29_для нас.indd 747
03.04.2019 12:05:03
748
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ДИАГНОСТИКА ВАСКУЛОПАТИИ
СЕРДЕЧНОГО АЛЛОТРАНСПЛАНТАТА
Васкулопатия сердечного аллотрансплантата — это
ускоренная форма гиперплазии интимы, обуслов-
ленная, вероятно, как иммунными, так и неиммун-
ными процессами, и представляет собой важный
фактор ограничения продолжительности функцио-
нирования и жизнеспособности аллотрансплантата.
Классическим признаком является диффузное «со-
кращение» мелких дистальных сосудов коронарной
сосудистой сети, хотя также могут развиваться сте-
нозы отдельных сосудов, характерные для нативной
ишемической болезни сердца. В дополнение к спец-
ифическим для трансплантата иммунологическим
факторам риска на развитие васкулопатии сердеч-
ного аллотрансплантата оказывают влияние типич-
ные факторы риска развития нативной ишемиче-
ской болезни, такие как дислипидемия и артериаль-
ная гипертензия. Кроме того, прогрессирование
атеросклеротического компонента, присутствую-
щего в донорском аллотрансплантате, по-видимо-
му, не коррелирует с развитием васкулопатии de
novo [72]. Ангиографическая идентификация васку-
лопатии сердечного аллотрансплантата связана с
повышенным риском сердечных событий, в том
числе инфаркта миокарда, сердечной недостаточно-
сти и внезапной смерти. Вследствие денервации
сердца клинические симптомы васкулопатии сер-
Клиническая ситуация
Использование ЭхоКГ
Инициативная
организация (год)
Последующее наблюдение после трансплантации сердца
Обследование на предмет
отторжения
Не рекомендуется использовать ЭхоКГ в качестве альтернативы
эндомиокардиальной биопсии
ISHLT (2010) [98]
ЭхоКГ можно рассматривать как альтернативу эндомиокардиальной
биопсии у младенцев
Диагностика васкулопатии
сердечного
аллотрансплантата
ЭхоКГ с добутамином или нагрузкой на беговой дорожке и сцинти-
графия миокарда могут быть применимы у пациентов, которым
невозможно выполнить инвазивные исследования
Пациенты с систолической сердечной недостаточностью
Вновь возникшая сердечная
недостаточность
Первоначальная оценка строения и функции сердца
HFSA (2010) [99]
ACCF/AHA (2013) [100]
Значительное изменение
в клиническом статусе
Признаки обратного ремоделирования сердца могут улучшить
прогноз
Лечение, существенно влия-
ющее на сердечную
функцию
Признаки обратного ремоделирования могут улучшить прогноз
(например, ответ на медикаментозную терапию или отмену карди-
отоксических препаратов)
Отбор кандидатов на вспо-
могательную аппаратную
терапию
Определение применимости аппаратной терапии (например, про-
филактическая имплантация кардиовертер-дефибриллятора или
устройств для ресинхронизирующей терапии сердца) произво-
дится на основе критериев выброса ЛЖ
ACCF — Американская коллегия кардиологов; AHA — Американская ассоциация сердца; HFSA — Общество сердечной недостаточности
Америки; ISHLT — Международное общество трансплантации сердца и легких; ЛЖ — левый желудочек; ЭхоКГ — эхокардиография.
ТАБЛИЦА 29.6 Рекомендации по применению ЭхоКГ у пациентов до и после проведения трансплантации сердца
дечного аллотрансплантата могут возникать на
поздних стадиях клинического течения и могут
проявляться атипично или отсутствовать.
КОРОНАРОГРАФИЯ С ВНУТРИСОСУДИСТЫМ УЛЬТРАЗВУКОМ
Коронарография относительно нечувствительна к
выявлению ранних стадий васкулопатии аллотранс-
плантата. У трех четвертей пациентов с утолщением
интимы при внутрисосудистом ультразвуковом
исследовании (ВСУЗИ) коронарограммы соответ-
ствуют норме [73]. Коронарография, определяющая
контуры просвета коронарных артерий, не обладает
способностью обнаруживать диффузную и концен-
трическую гиперплазию интимы, которая характер-
на для васкулопатии сердечного аллотрансплантата.
Поскольку ВСУЗИ отражает морфологию сосуди-
стой стенки, этот метод исследования стал золотым
стандартом для выявления васкулопатии сердечно-
го аллотрансплантата, особенно на ранних стадиях.
Степень выраженности васкулопатии сердечного
аллотрансплантата может быть определена количе-
ственно на основании толщины интимы и степени
циркулярного поражения, а также путем определе-
ния изменения объема бляшки с течением времени.
На основании данных ВСУЗИ по классификации
Стэнфорда выделяют следующие классы васкуло-
патии аллотрансплантата: I класс (минимальная,
толщина интимы < 0,3 мм и циркулярное вовлече-
In-29_для нас.indd 748
03.04.2019 12:05:03
749
29 Трансплантация сердца
ние < 180°), II класс (слабовыраженная, толщина
интимы < 0,3 мм и циркулярное поражение > 180°),
III класс (умеренная, толщина интимы 0,3–0,5 мм
или толщина интимы > 0,5 мм и циркулярное вов-
лечение < 180°) и IV класс (тяжелая, толщина инти-
мы>1ммилитолщинаинтимы>0,5ммицир-
кулярное вовлечение > 180°) [74]. Наиболее быстро
степень тяжести васкулопатии сердечного алло-
трансплантата нарастает в первые два года после
трансплантации [75]. Изменения в сосудистой си-
стеме аллотрансплантата в первый год после транс-
плантации, вероятно, являются кумулятивным ре-
зультатом множественных повреждающих факто-
ров, таких как быстрая смерть мозга донора, раннее
отторжение и цитомегаловирусная инфекция, кото-
рые оказывают влияние на иммунный ответ реци-
пиента на аллотрансплантат и, следовательно, на
вероятность развития васкулопатии сердечного ал-
лотрансплантата. Ранние изменения, выявляемые с
помощью ВСУЗИ в течение первого года после
трансплантации, коррелируют с долгосрочным
прогнозом.
Прогрессивное утолщение интимы до 0,5 мм и
более в первый год после трансплантации связано
со значительно более высоким риском развития
ангиографической болезни, нефатальных тяжелых
неблагоприятных сердечных событий и летального
исхода или отторжения трансплантата при последу-
ющем долгосрочном наблюдении (рис. 29.16) [76,
77]. Скорость коронарного кровотока (время замед-
А
Рис. 29.17 A Нормальные результаты стресс-эхокардиографии с добутамином до развития васкулопатии сердечного аллотрансплантата.
У 62-летнего пациента, перенесшего трансплантацию сердца 11 лет назад, регулярно проводилось обследование с помощью стресс-ЭхоКГ с добутамином, ре-
зультаты которой соответствовали норме. Приведены стресс-ЭхоКГ во время диастолы (А) и систолы (Б) с нормальным гипердинамическим ответом на стресс.
Через 9 месяцев у пациента появились новые симптомы сердечной недостаточности, проявившиеся на эхокардиограмме снижением систолической функции.
Б
In-29_для нас.indd 749
03.04.2019 12:05:03
750
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ления скорости диастолического кровотока) и ре-
зерв коронарного кровотока, измеренные с помо-
щью ЭхоКГ с контрастированием, по-видимому,
коррелирует с наличием васкулопатии аллотранс-
плантата и риском неблагоприятных сердечных
событий [78]. Также изучается возможность приме-
нения более новых методов визуализации, базиру-
ющихся на КТ и МРТ, в качестве дополнения или
замены внутрисосудистого ультразвука как золото-
го стандарта для диагностики васкулопатии сердеч-
ного аллотрансплантата.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
Добутаминовая стресс-ЭхоКГ является полезным
методом выявления васкулопатии сердечного ал-
лотрансплантата и получения прогностической
информации. По сравнению с золотым стандар-
том внутрикоронарного ВСУЗИ, добутаминовая
стресс-ЭхоКГ демонстрирует более высокую чув-
ствительность и специфичность для выявления ва-
скулопатии сердечного аллотрансплантата. Поло-
жительные результаты добутаминовой стресс-Э -
Рис. 29.18 Систолическая дисфункция, обусловленная васкулопатией аллотрансплантата сердца. (А, В, Д) ЭхоКГ во время диастолы. (Б, Г, Е) ЭхоКГ
во время систолы. Парастернальная позиция по длинной оси A (А, Б), парастернальная позиция по короткой оси A (В, Г) и апикальная четырехкамерная пози-
ция A (Д, Е) демонстрируют значимое снижение систолической функции. Результаты эндомиокардиальной биопсии отторжение не подтвердили. Коронарная
ангиография выявила диффузное сокращение коронарных сосудов, что соответствует васкулопатии аллотрансплантата сердца.
А
Б
В
Г
Д
Е
In-29_для нас.indd 750
03.04.2019 12:05:03
751
29 Трансплантация сердца
хоКГ связаны с повышенным риском сердечных
событий, включая инфаркт миокарда и сердечную
недостаточность и риском летального исхода [79–
81]. Оценки точности добутаминовой стресс-ЭхоКГ
при диагностике выраженной васкулопатии сердеч-
ного аллотрансплантата несколько варьируют в за-
висимости от того, используется ли метод ангио-
графии или ангиография с ВСУЗИ [82]. В целом
результаты добутаминовой стресс-ЭхоКГ, по-ви -
димому, лучше согласуются с результатами ВСУ-
ЗИ и превосходят результаты радиоизотопного
сканирования перфузии миокарда. Несмотря на то
что ухудшение результатов при серийной добута-
миновой стресс-ЭхоКГ (увеличение количества сег-
ментов с нарушениями подвижности стенки или
оценка движения сегментов ЛЖ, равная ≥ 1,0) де-
монстрирует вариабельную достоверность при диа-
гностике васкулопатии аллотрансплантата с помо-
щью ангиографии или ВСУЗИ [81, 83], ухудшение
само по себе между серийными исследованиями
связано с более высоким риском возникновения
неблагоприятных событий [81]. Повышению диа-
гностической точности стандартной добутамино-
вой стресс-ЭхоКГ способствует дополнительный
количественный анализ с помощью M-режима или
визуализация скорости деформации [81, 84].
Напротив, чувствительность стресс-ЭхоКГ с ис-
пользованием физической нагрузки несколько
ограничена сниженной реакцией частоты сердеч-
ных сокращений на физическую нагрузку, что обу-
словлено денервацией сердца. Оценочные показате-
ли чувствительности ЭхоКГ с физической нагрузкой
для диагностики васкулопатии сердечного алло-
трансплантата составляют всего лишь 15–20% [85,
86]. Более ранние исследования свидетельствуют о
высоком относительном числе ложно негативных
заключений при выявлении умеренно выраженной
ишемической болезни сердца с помощью ангиогра-
EMB — Случайное выявление
отторжения тяжелой степени
при выполнении ЭМБ
EMB — Случайное выявление
вновь возникшего
нарушения гемодинамики (например,
повышение давления наполнения,
снижение сердечного выброса)
при катетеризации правого сердца
как правило, выполняется во
время стандартной ЭМБ)
Доказательства дисфункции
аллотрансплантата
Клиническая настороженность относительно
дисфункции аллотрансплантата
Эхокардиограмма
Коронарография
И (если не еще не выполнено)
ЭМБ
Клинические симптомы
• Вновь возникшие симптомы сердечной
недостаточности, включая
кардиогенный шок
• Снижение функциональных
возможностей
• Обморок, полуобморочное состояние
• Остановка сердечной деятельности
• Вновь возникшие аритмии (такие как
предсердная тахиаритмия, блокада
сердца высокой степени)
EMB CAV — Если сильна клиническая
настороженность относительно ВСА,
рассмотрите предшествующую ЭМБ
• Подтвержденная ВСА
• Поздний пострансплантационный
период без предшествующего
анамнеза отторжения
EMB — При кардиогенном шоке
во время интра-/послеоперационного
периода
• Рассмотрите предшествующую ЭМБ
• Если пациент слишком нестабилен,
чтобы подвергаться ЭМБ
• Предполагаемая первичная
недостаточность трансплантата
(ишемическое/консервационное
повреждение)
• В случае подозрения на сверхострое
отторжение, выполните ЭМБ
Рис. 29.19 Оценка систолической дисфункции у реципиента, перенесшего трансплантацию сердца. ВСА — васкулопатия сердечного аллотрансплан-
тата; ЭМБ — эндомиокардиальная биопсия.
In-29_для нас.indd 751
03.04.2019 12:05:03
752
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
фии [86]. В настоящее время предложены единые
рекомендации по выявлению васкулопатии сердеч-
ного аллотрансплантата с помощью нагрузочного
теста на беговой дорожке или добутаминовой
стресс-ЭхоКГ, или визуализации перфузии миокар-
да при невозможности проведения у пациента ин-
вазивного исследования [87].
ВИЗУАЛИЗАЦИИ ПЕРФУЗИИ МИОКАРДА
Широко распространена визуализация с использо-
ванием радиоактивных меток на основе технеция-99
и таллия-201 при диагностике ишемической болез-
ни сердца у пациентов, не перенесших трансплан-
тацию. Эти тесты основаны на выявлении относи-
тельных различий в коронарном кровотоке, обу-
словленных наличием эпикардиального стеноза
коронарных артерий.
Однако точность данного исследования вариа-
бельна и может быть ограничена характером васку-
лопатии сердечного аллотрансплантата, которая
может включать традиционный фокальный эпи-
кардиальный стеноз и обычно является диффузным
процессом, в который также вовлекаются мелкие
коронарные сосуды. При этом может быть исполь-
зован сосудорасширяющий препарат, такой как
дипиридамол, или физическая нагрузка, хотя ча-
сто наблюдаемая в аллотрансплантате неадекват-
ная реакция частоты сердечных сокращений мо-
жет ограничить применимость тестирования с
физической нагрузкой [88]. В последнее время
была продемонстрирована способность стресс по-
зитронно-эмиссионная томографии (ПЭТ) с ис-
пользованием дипиридамола рубидия-82 прогнози-
ровать неблагоприятные исходы у пациентов, пере-
несших трансплантацию сердца. В ходе одного
исследования нарушения, выявленные с помощью
ПЭТ с рубидием-82, были связаны с повышенным
риском летального исхода, острым коронарным
синдромом и госпитализацией по поводу сердечной
недостаточности (табл. 29.4 –29.6; рис. 29.17 –29.19)
[79, 81–83, 85, 86, 88–100].
Показания До проведения трансплантации
Ранний посттрансплантационный
период
Долгосрочное последующее
наблюдение
Стандарт-
ный мони-
торинг
На основе стандартных рекоменда-
ций по сердечной
недостаточности:
Для оценки впервые возникшей
сердечной недостаточности
Для оценки изменений в клиниче-
ском статусе или после проведе-
ния терапии, которая может
вызвать изменение сердечной
функции (например, медикамен-
тозной или ресинхронизирующей
терапии)
Интраоперационная ЧПЭхоКГ для
мониторинга функции трансплантата
Оценка функции сердечного
аллотрансплантата, включая
стандартные 2D-проекции,
оценку диастолической
функции и оценку клапанов
(см. табл. 29.2)
Интервалы между стандартным
мониторингом с помощью
эхокардиографии определя-
ются клиническим статусом
пациента и практикой специ-
ализированного центра
Обратите внимание на критерии
повышенного риска, которые
могут помочь с оценкой про-
гноза, например отсутствие
обратного ремоделирования ЛЖ с
течением времени или наличие
функциональной митральной
регургитации (см. табл. 29.1)
СВОДНАЯ ИНФОРМАЦИЯ
Обследование до проведения трансплантации и после нее
In-29_для нас.indd 752
03.04.2019 12:05:03
753
29 Трансплантация сердца
Показания До проведения трансплантации
Ранний посттрансплантационный
период
Долгосрочное последующее
наблюдение
Мониторинг
на предмет
развития
осложне-
ний
При клинической настороженности
относительно осложнений, таких как
первичная дисфункция трансплантата
или тампонада
Отторжение
Может проявляться измене-
нием систолической и диасто-
лической функции или уве-
личением массы и толщины
стенок ЛЖ
Диастолические нарушения
могут проявляться в раннем
периоде, но недостаточно
достоверны, чтобы быть
единственными диагностиче-
скими критериями
Впервые возникшая систоличе-
ская дисфункция при остром
отторжении обычно указы-
вает на более выраженную ее
тяжесть с гемодинамическими
нарушениями
Ранняя трикуспидальная регургитация
обычно связана с интраоперационной
или послеоперационной правосторон-
ней сердечной недостаточностью или
легочной гипертензией.
Интраоперационную умеренную или
тяжелую трикуспидальную регургита-
цию следует повторно оценить с
помощью ТТЭхоКГ или ЧПЭхоКГ в
течение 24 час после трансплантации
внимательно отслеживать в течение
нескольких послеоперационных дней
Поздняя трикуспидальная
регургитация
Обычно обусловлена травмати-
зацией при проведении эндо-
миокардиальной биопсии
При выра женных гемодинами-
ческих нарушениях может
потребоваться хирургическая
пластика трикуспидального
клапана
Васкулопатия сердечного
аллотрансплантата
Стресс-ЭхоКГ с добутамином
демонстрирует высокую чув-
ствительность и специфич-
ность при постановке
диагноза
ЭхоКГ с физической нагрузкой
также применима, но может
наблюдаться меньшая досто-
верность результатов, обу-
словленная сниженной реак-
цией частоты сердечных
сокращений у пациентов,
перенесших трансплантацию
Особые
показания
При включении пациента в список
кандидатов на трансплантацию
сердца необходимо оценить пока-
затели легочной гипертензии и
функцию правого сердца
Возможно проведение эндоми-
окардиальной биопсии под
контролем ЭхоКГ, схожей с
рентгеноскопическим контро-
лем по частоте развития
осложнений при выполнении
биопсии
Оценка сердца донора на предмет
повышенного риска развития
дисфункции трансплантата при
наличии регионарных нарушений
подвижности стенок (в состоянии
покоя или при стрессе, постоян-
ных на эхокардиограммах в дина-
мике) или при выраженной
гипертрофии ЛЖ
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Обследование до проведения трансплантации и после нее
In-29_для нас.indd 753
03.04.2019 12:05:03
754
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ЛИТЕРАТУРА
1. Lund LH, Edwards LB, Kucheryavaya AY, et
al. The Registry of the International Society
for Heart and Lung Transplantation: Thir-
tieth Official Adult Heart Transplant Re-
port — 2013; focus theme: age, J Heart Lung
Transplant 32:951–964, 2013.
2. Levy WC, Mozaffarian D, Linker DT, et al.
The Seattle Heart Failure Model: prediction
of survival in heart failure, Circulation
113:1424–1433, 2006.
3. Merlo M, Pyxaras SA, Pinamonti B, et al.
Prevalence and prognostic significance of left
ventricular reverse remodeling in dilated car-
diomyopathy receiving tailored medical treat-
ment, J Am Coll Cardiol 57:1468–1476, 2011.
4. Asgar AW, Mack MJ, Stone GW. Secondary
mitral regurgitation in heart failure: patho-
physiology, prognosis, and therapeutic con-
siderations, J Am Coll Cardiol 65:1231–1248,
2015.
5. Giannuzzi P, Temporelli PL, Bosimini E, et al.
Independent and incremental prognostic value
of Doppler-derived mitral deceleration time of
early filling in both symptomatic and asymp-
tomatic patients with left ventricular dysfunc-
tion, J Am Coll Cardiol 28:383–390, 1996.
6. Kolias TJ, Aaronson KD, Armstrong WF.
Doppler-derived dP/dt and -dP/dt predict
survival in congestive heart failure, J Am Coll
Cardiol 36:1594–1599, 2000.
7. Nikitin NP, Loh PH, Silva R, et al. Prognostic
value of systolic mitral annular velocity mea-
sured with Doppler tissue imaging in patients
with chronic heart failure caused by left ven-
tricular systolic dysfunction, Heart 92:775–
779, 2006.
8. Olson JM, Samad BA, Alam M. Prognostic
value of pulse-wave tissue Doppler parame-
ters in patients with systolic heart failure, Am
J Cardiol 102:722–725, 2008.
9. Cho GY, Marwick TH, Kim HS, et al. Global
2-dimensional strain as a new prognosticator
in patients with heart failure, J Am Coll Car-
diol 54:618–624, 2009.
10. Costard-Jackle A, Fowler MB. Influence of
preoperative pulmonary artery pressure on
mortality after heart transplantation: testing
of potential reversibility of pulmonary hy-
pertension with nitroprusside is useful in de-
fining a high risk group, J Am Coll Cardiol
19:48–54, 1992.
11. Mikus E, Stepanenko A, Krabatsch T, et al.
Reversibility of fixed pulmonary hyperten-
sion in left ventricular assist device support
recipients, Eur J Cardiothorac Surg 40:971–
977, 2011.
12. Lanzarini L, Fontana A, Lucca E, et al. Non-
invasive estimation of both systolic and dia-
stolic pulmonary artery pressure from Dop-
pler analysis of tricuspid regurgitant velocity
spectrum in patients with chronic heart fail-
ure, Am Heart J 144:1087–1094, 2002.
13. Temporelli PL, Scapellato F, Eleuteri E, et al.
Doppler echocardiography in advanced sys-
tolic heart failure: a noninvasive alternative to
Swan-Ganz catheter, Circ Heart Fail 3:387–
394, 2010.
14. Kuppahally SS, Michaels AD, Tandar A, et al.
Can echocardiographic evaluation of cardio-
pulmonary hemodynamics decrease right
heart catheterizations in end-stage heart fail-
ure patients awaiting transplantation? Am J
Cardiol 106:1657–1662, 2010.
15. Mullens W, Borowski AG, Curtin RJ, et al.
Tissue Doppler imaging in the estimation of
intracardiac filling pressure in decompensat-
ed patients with advanced systolic heart fail-
ure, Circulation 119:62–70, 2009.
16. Gellen B, Canoui-Poitrine F, Lesault PF, et al.
Usefulness of tissue Doppler imaging for as-
sessing left ventricular filling pressure in pa-
tients with stable severe systolic heart failure,
Am J Cardiol 112:1619–1624, 2013.
17. Zaroff JG, Babcock WD, Shiboski SC, et al.
Temporal changes in left ventricular systolic
function in heart donors: results of serial
echocardiography, J Heart Lung Transplant
22:383–388, 2003.
18. Wever Pinzon O, Stoddard G, Drakos SG, et
al. Impact of donor left ventricular hypertro-
phy on survival after heart transplant, Am J
Transplant 11:2755–2761, 2011.
19. Leone O, Gherardi S, Targa L, et al. Stress
echocardiography as a gatekeeper to donation
in aged marginal donor hearts: anatomic and
pathologic correlations of abnormal stress
echocardiography results, J Heart Lung Trans-
plant 28:1141–1149, 2009.
20. Angermann CE, Spes CH, Tammen A, et al.
Anatomic characteristics and valvular func-
tion of the transplanted heart: transthoracic
versus transesophageal echocardiographic
findings, J Heart Transplant 9:331–338, 1990.
21. De Simone R, Lange R, Sack RU, et al. Atrio-
ventricular valve insufficiency and atrial ge-
ometry after orthotopic heart transplanta-
tion, Ann Thorac Surg 60:1686–1693, 1995.
22. Bouchart F, Derumeaux G, Mouton-Schleifer
D, et al. Conventional and total orthotopic
cardiac transplantation: a comparative clini-
cal and echocardiographical study, Eur J Car-
diothorac Surg 12:555–559, 1997.
23. Riberi A, Ambrosi P, Habib G, et al. System-
ic embolism: a serious complication after car-
diac transplantation avoidable by bicaval
technique, Eur J Cardiothorac Surg 19:307–
311, 2001. discussion 311-312.
24. Derumeaux G, Habib G, Schleifer DM, et al.
Standard orthotopic heart transplantation
versus total orthotopic heart transplantation.
A transesophageal echocardiography study of
the incidence of left atrial thrombosis, Circu-
lation 92:196–201, 1995.
25. Derumeaux G, Mouton-Schleifer D, Soyer R,
et al. High incidence of left atrial thrombus
detected by transoesophageal echocardiogra-
phy in heart transplant recipients, Eur Heart
J 16:120–125, 1995.
26. Freimark D, Czer LS, Aleksic I, et al. Im-
proved left atrial transport and function with
orthotopic heart transplantation by bicaval
and pulmonary venous anastomoses, Am
Heart J 130:121–126, 1995.
27. Traversi E, Pozzoli M, Grande A, et al. The
bicaval anastomosis technique for orthotopic
heart transplantation yields better atrial func-
tion than the standard technique: an echocar-
diographic automatic boundary detection
study, J Heart Lung Transplant 17:1065–1074,
1998.
28. Boudoulas H, Starling RC, Vavuranakis M, et
al. Left atrial volumes and function in ortho-
topic cardiac transplantation, Am Heart J
129:774–782, 1995.
29. Antunes ML, Spotnitz HM, Clark MB, et al.
Long-term function of human cardiac al-
lografts assessed by two-dimensional echo-
cardiography, J Thorac Cardiovasc Surg
98:275–284, 1989.
30. Tischler MD, Lee RT, Plappert T, et al. Serial
assessment of left ventricular function and
mass after orthotopic heart transplantation: a
4-year longitudinal study, J Am Coll Cardiol
19:60–66, 1992.
31. Globits S, De Marco T, Schwitter J, et al. As-
sessment of early left ventricular remodeling
in orthotopic heart transplant recipients with
cine magnetic resonance imaging: potential
mechanisms, J Heart Lung Transplant 16:504–
510, 1997.
32. Wilhelmi M, Pethig K, Nguyen H, et al. Heart
transplantation: echocardiographic assess-
ment of morphology and function after more
than 10 years of follow-up, Ann Thorac Surg
74:1075–1079, 2002. discussion 1079.
33. StGoar FG, Gibbons R, Schnittger I, et al. Left
ventricular diastolic function. Doppler echo-
cardiographic changes soon after cardiac
transplantation, Circulation 82:872–878, 1990.
34. Corcos T, Tamburino C, Leger P, et al. Early
and late hemodynamic evaluation after car-
diac transplantation: a study of 28 cases, J Am
Coll Cardiol 11:264–269, 1988.
35. Cotts WG, Oren RM. Function of the trans-
planted heart: unique physiology and thera-
peutic implications, Am J Med Sci 314:164–
172, 1997.
36. Goland S, Siegel RJ, Burton K, et al. Changes
in left and right ventricular function of donor
hearts during the first year after heart trans-
plantation, Heart 97:1681–1686, 2011.
37. Tallaj JA, Kirklin JK, Brown RN, et al. Post-
heart transplant diastolic dysfunction is a risk
factor for mortality, J Am Coll Cardiol
50:1064–1069, 2007.
38. Valantine HA, Appleton CP, Hatle LK, et al.
A hemodynamic and Doppler echocardio-
graphic study of ventricular function in long-
term cardiac allograft recipients. Etiology and
prognosis of restrictive-constrictive physiol-
ogy, Circulation 79:66–75, 1989.
39. Ross HJ, Gullestad L, Hunt SA, et al. Early
Doppler echocardiographic dysfunction is as-
sociated with an increased mortality after
orthotopic cardiac transplantation, Circula-
tion 94:289–293, 1996.
40. Hosenpud JD, Norman DJ, Cobanoglu MA,
et al. Serial echocardiographic findings early
after heart transplantation: evidence for re-
versible right ventricular dysfunction and
myocardial edema, J Heart Transplant 6:343–
347, 1987.
41. Bhatia SJ, Kirshenbaum JM, Shemin RJ, et al.
Time course of resolution of pulmonary hy-
pertension and right ventricular remodeling
after orthotopic cardiac transplantation, Cir-
culation 76:819–826, 1987.
42. Cladellas M, Oriol A, Caralps JM. Quantita-
tive assessment of valvular function after
cardiac transplantation by pulsed Doppler
echocardiography, Am J Cardiol 73:1197–
1201, 1994.
43. Anderson CA, Shernan SK, Leacche M, et al.
Severity of intraoperative tricuspid regurgita-
tion predicts poor late survival following car-
diac transplantation, Ann Thorac Surg
78:1635–1642, 2004.
44. Chan MC, Giannetti N, Kato T, et al. Severe
tricuspid regurgitation after heart transplan-
tation, J Heart Lung Transplant 20:709–717,
2001.
45. Huddleston CB, Rosenbloom M, Goldstein
JA, Pasque MK. Biopsy-induced tricuspid re-
gurgitation after cardiac transplantation, Ann
Thorac Surg 57:832–836, 1994. discussion
836-837.
46. Stewart S, Winters GL, Fishbein MC, et al.
Revision of the 1990 working formulation for
the standardization of nomenclature in the
In-29_для нас.indd 754
03.04.2019 12:05:03
755
29 Трансплантация сердца
diagnosis of heart rejection, J Heart Lung
Transplant 24:1710–1720, 2005.
47. Berry GJ, Burke MM, Andersen C, et al. The
2013 International Society for Heart and
Lung Transplantation Working Formulation
for the standardization of nomenclature in
the pathologic diagnosis of antibody-mediat-
ed rejection in heart transplantation, J Heart
Lung Transplant 32:1147–1162, 2013.
48. Amende I, Simon R, Seegers A, et al. Dia-
stolic dysfunction during acute cardiac al-
lograft rejection, Circulation 81:66–70, 1990.
49. Valantine HA, Fowler MB, Hunt SA, et al.
Changes in Doppler echocardiographic in-
dexes of left ventricular function as potential
markers of acute cardiac rejection, Circula-
tion 76:86–92, 1987.
50. Desruennes M, Corcos T, Cabrol A, et al.
Doppler echocardiography for the diagnosis
of acute cardiac allograft rejection, J Am Coll
Cardiol 12:63–70, 1988.
51. Mena C, Wencker D, Krumholz HM, et al.
Detection of heart transplant rejection in
adults by echocardiographic diastolic indices:
a systematic review of the literature, J Am Soc
Echocardiogr 19:1295–1300, 2006.
52. Toumanidis ST, Papadopoulou ES, Saridakis
NS, et al. Evaluation of myocardial perfor-
mance index to predict mild rejection in car-
diac transplantation, Clin Cardiol 27:352–358,
2004.
53. Burgess MI, Bright-Thomas RJ, Yonan N, Ray
SG. Can the index of myocardial perfor-
mance be used to detect acute cellular rejec-
tion after heart transplantation? Am J Cardiol
92:308–311, 2003.
54. Vivekananthan K, Kalapura T, Mehra M, et
al. Usefulness of the combined index of sys-
tolic and diastolic myocardial performance to
identify cardiac allograft rejection, Am J Car-
diol 90:517–520, 2002.
55. Stengel SM, Allemann Y, Zimmerli M, et al.
Doppler tissue imaging for assessing left ven-
tricular diastolic dysfunction in heart trans-
plant rejection, Heart 86:432–437, 2001.
56. Mankad S, Murali S, Kormos RL, et al. Evalu-
ation of the potential role of color-coded tis-
sue Doppler echocardiography in the detec-
tion of allograft rejection in heart transplant
recipients, Am Heart J 138:721–730, 1999.
57. Kato TS, Oda N, Hashimura K, et al. Strain
rate imaging would predict sub-clinical acute
rejection in heart transplant recipients, Eur J
Cardiothorac Surg 37:1104–1110, 2010.
58. Ciliberto GR, Mascarello M, Gronda E, et al.
Acute rejection after heart transplantation:
noninvasive echocardiographic evaluation, J
Am Coll Cardiol 23:1156–1161, 1994.
59. Gill EA, Borrego C, Bray BE, et al. Left ven-
tricular mass increases during cardiac al-
lograft vascular rejection, J Am Coll Cardiol
25:922–926, 1995.
60. Quin JA, Tauriainen MP, Huber LM, et al.
Predictors of pericardial effusion after ortho-
topic heart transplantation, J Thorac Cardio-
vasc Surg 124:979–983, 2002.
61. Hauptman PJ, Couper GS, Aranki SF, et al.
Pericardial effusions after cardiac transplan-
tation, J Am Coll Cardiol 23:1625–1629, 1994.
62. Al-Dadah AS, Guthrie TJ, Pasque MK, et al.
Clinical course and predictors of pericardial
effusion following cardiac transplantation,
Transplant Proc 39:1589–1592, 2007.
63. Almenar L, Osa A, Martinez-Dolz L, et al.
Echocardiographic evaluation of the evolu-
tionary changes after heart transplantation,
Transplant Proc 38:2575–2576, 2006.
64. Ciliberto GR, Anjos MC, Gronda E, et al. Sig-
nificance of pericardial effusion after heart
transplantation, Am J Cardiol 76:297–300,
1995.
65. Valantine HA, Hunt SA, Gibbons R, et al. In-
creasing pericardial effusion in cardiac trans-
plant recipients, Circulation 79:603–609, 1989.
66. Miller LW, Labovitz AJ, McBride LA, et al.
Echocardiography-guided endomyocardial bi-
opsy. A 5-year experience, Circulation 78: 99–
102, 1988.
67. Bedanova H, Necas J, Petrikovits E, et al.
Echo-guided endomyocardial biopsy in heart
transplant recipients, Transpl Int 17:622–625,
2004.
68. Nguyen V, Cantarovich M, Cecere R, Gi-
annetti N. Tricuspid regurgitation after car-
diac transplantation: how many biopsies are
too many? J Heart Lung Transplant 24:S227–
S231, 2005.
69. Amitai ME, Schnittger I, Popp RL, et al. Com-
parison of three-dimensional echocardiogra-
phy to two-dimensional echocardiography
and fluoroscopy for monitoring of endo-
myocardial biopsy, Am J Cardiol 99:864–866,
2007.
70. Platts D, Brown M, Javorsky G, et al. Com-
parison of fluoroscopic versus real-time
three-dimensional transthoracic echocardio-
graphic guidance of endomyocardial biopsies,
Eur J Echocardiogr 11:637–643, 2010.
71. Mehra MR, Uber PA, Benitez RM. Gene-
based bio-signature patterns and cardiac al-
lograft rejection, Heart Fail Clin 6:87–92,
2010.
72. Li H, Tanaka K, Anzai H, et al. Influence of
pre-existing donor atherosclerosis on the de-
velopment of cardiac allograft vasculopathy
and outcomes in heart transplant recipients, J
Am Coll Cardiol 47:2470–2476, 2006.
73. Pinto FJ, Chenzbraun A, Botas J, et al. Feasi-
bility of serial intracoronary ultrasound im-
aging for assessment of progression of inti-
mal proliferation in cardiac transplant recipi-
ents, Circulation 90:2348–2355, 1994.
74. St Goar FG, Pinto FJ, Alderman EL, et al.
Intracoronary ultrasound in cardiac trans-
plant recipients. In vivo evidence of “angio-
graphically silent” intimal thickening, Circu-
lation 85:979–987, 1992.
75. Rickenbacher PR, Pinto FJ, Chenzbraun A, et
al. Incidence and severity of transplant coro-
nary artery disease early and up to 15 years
after transplantation as detected by intravas-
cular ultrasound, J Am Coll Cardiol 25:171–
177, 1995.
76. Kobashigawa JA, Tobis JM, Starling RC, et al.
Multicenter intravascular ultrasound valida-
tion study among heart transplant recipients:
outcomes after five years, J Am Coll Cardiol
45:1532–1537, 2005.
77. Tuzcu EM, Kapadia SR, Sachar R, et al. Intra-
vascular ultrasound evidence of angiographi-
cally silent progression in coronary athero-
sclerosis predicts long-term morbidity and
mortality after cardiac transplantation, J Am
Coll Cardiol 45:1538–1542, 2005.
78. Tona F, Caforio AL, Montisci R, et al. Coro-
nary flow velocity pattern and coronary flow
reserve by contrast-enhanced transthoracic
echocardiography predict long-term outcome
in heart transplantation, Circulation 114:49–
55, 2006.
79. Bacal F, Moreira L, Souza G, et al. Dobuta-
mine stress echocardiography predicts cardiac
events or death in asymptomatic patients
long-term after heart transplantation: 4-year
prospective evaluation, J Heart Lung Trans-
plant 23:1238–1244, 2004.
80. Akosah KO, Olsovsky M, Kirchberg D, et al.
Dobutamine stress echocardiography predicts
cardiac events in heart transplant patients,
Circulation 94:283–288, 1996.
81. Spes CH, Klauss V, Mudra H, et al. Diagnostic
and prognostic value of serial dobutamine
stress echocardiography for noninvasive as-
sessment of cardiac allograft vasculopathy: a
comparison with coronary angiography and
intravascular ultrasound, Circulation 100:
509–515, 1999.
82. Derumeaux G, Redonnet M, Mouton-Schle-
ifer D, et al. Dobutamine stress echocardiog-
raphy in orthotopic heart transplant recipi-
ents. VACOMED Research Group, J Am Coll
Cardiol 25:1665–1672, 1995.
83. Derumeaux G, Redonnet M, Soyer R, et al.
Assessment of the progression of cardiac al-
lograft vasculopathy by dobutamine stress
echocardiography, J Heart Lung Transplant
17:259–267, 1998.
84. Eroglu E, D’Hooge J, Sutherland GR, et al.
Quantitative dobutamine stress echocardiog-
raphy for the early detection of cardiac al-
lograft vasculopathy in heart transplant re-
cipients, Heart 94:e3, 2008.
85. Cohn JM, Wilensky RL, O’Donnell JA, et al.
Exercise echocardiography, angiography, and
intracoronary ultrasound after cardiac trans-
plantation, Am J Cardiol 77:1216–1219, 1996.
86. Collings CA, Pinto FJ, Valantine HA, et al.
Exercise echocardiography in heart transplant
recipients: a comparison with angiography
and intracoronary ultrasonography, J Heart
Lung Transplant 13:604–613, 1994.
87. Costanzo MR, Dipchand A, Starling R, et al.
The International Society of Heart and Lung
Transplantation Guidelines for the care of
heart transplant recipients, J Heart Lung
Transplant 29:914–956, 2010.
88. Fang JC, Rocco T, Jarcho J, et al. Noninvasive
assessment of transplant-associated arterio-
sclerosis, Am Heart J 135:980–987, 1998.
89. McArdle BA, Davies RA, Chen L, et al. Prog-
nostic value of rubidium-82 positron emission
tomography in patients after heart transplant,
Circ Cardiovasc Imaging 7:930–937, 2014.
90. Spes CH, Mudra H, Schnaack SD, et al. Do-
butamine stress echocardiography for nonin-
vasive diagnosis of cardiac allograft vascu-
lopathy: a comparison with angiography and
intravascular ultrasound, Am J Cardiol
78:168–174, 1996.
91. Stork S, Behr TM, Birk M, et al. Assessment
of cardiac allograft vasculopathy late after
heart transplantation: when is coronary angi-
ography necessary? J Heart Lung Transplant
25:1103–1108, 2006.
92. Wu YW, Yen RF, Lee CM, et al. Diagnostic
and prognostic value of dobutamine thalli-
um-201 single-photon emission computed
tomography after heart transplantation, J
Heart Lung Transplant 24:544–550, 2005.
93. Manrique A, Bernard M, Hitzel A, et al. Di-
agnostic and prognostic value of myocardial
perfusion gated SPECT in orthotopic heart
transplant recipients, J Nucl Cardiol 17:197–
206, 2010.
94. Elhendy A, Sozzi FB, van Domburg RT, et al.
Accuracy of dobutamine tetrofosmin myo-
cardial perfusion imaging for the noninvasive
diagnosis of transplant coronary artery steno-
sis, J Heart Lung Transplant 19:360–366, 2000.
95. Wu YW, Chen YH, Wang SS, et al. PET as-
sessment of myocardial perfusion reserve
In-29_для нас.indd 755
03.04.2019 12:05:04
756
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
inversely correlates with intravascular ultra-
sound findings in angiographically normal
cardiac transplant recipients. Journal of nu-
clear medicine: official publication, Soc Nucl
Med 51:906–912, 2010.
96. Wever-Pinzon O, Romero J, Kelesidis I, et al.
Coronary computed tomography angiogra-
phy for the detection of cardiac allograft vas-
culopathy: a meta-analysis of prospective
trials, J Am Coll Cardiol 63:1992–2004, 2014.
97. Pollack A, Nazif T, Mancini D, Weisz G. De-
tection and imaging of cardiac allograft vas-
culopathy, JACC Cardiovasc Imaging 6:613–
623, 2013.
98. Costanzo MR, Dipchand A, Starling R, et al.
The International Society of Heart and Lung
Transplantation Guidelines for the care of
heart transplant recipients, J Heart Lung
Transplant 29:914–956, 2010.
99. Heart Failure Society of A, Lindenfeld J, Al-
bert NM, et al. HFSA 2010 Comprehensive
Heart Failure Practice Guideline, J Cardiac
Fail 16:e1–194, 2010.
100. Yancy CW, Jessup M, Bozkurt B, et al. 2013
ACCF/AHA guideline for the management of
heart failure: a report of the American College
of Cardiology Foundation/American Heart
Association Task Force on Practice Guidelines,
J Am Coll Cardiol 62:e147–e239, 2013.
In-29_для нас.indd 756
03.04.2019 12:05:04
757
30 Эхокардиография при механической
поддержке кровообращения
JAMES N. KIRKPATRICK, MD
Основные принципы механической
поддержки кровообращения
и эхокардиографический подход
Типы устройств вспомогательного
кровообращения
Обследование перед проведением
имплантации
Перипроцедуральный контроль
Постимплантационное наблюдение
и осложнения
Перенаполнение
Недостаточное наполнение
Дисфункция клапанов
Исследования изменения скорости
Технические подробности,
количественная оценка и анализ
полученных данных
Конечно-диастолический размер
левого желудочка
и ориентированность перегородки
Функция желудочков
Раскрытие аортального клапана
Перикард
Канюли
Выбор оптимальных вариантов
Ramp-протокол исследований
Отлучение от устройства и отключение
Клиническое применение и результаты
Потенциальные ограничения
и перспективы
Альтернативные варианты
Механическая поддержка кровообращения (МПК) в
виде устройств вспомогательного кровообращения
играет все более важную роль в лечении терминаль-
ной стадии болезни сердца. Устройства экстракор-
поральной мембранной оксигенации (ЭКМО), раз-
работанные в середине прошлого века, обеспечили
возможность использовать аппарат искусственного
кровообращения, что способствовало дальнейшему
развитию кардиохирургии.
За пределами операционной ЭКМО стала ис-
пользоваться для временной поддержки у детей с
желудочковой недостаточностью. С 1950-х гг . [1]
разрабатывается постоянное замещающее сердеч-
ное устройство, что дает предпосылки к развитию
как искусственного сердца, так и право- и левоже-
лудочковых (ЛЖ) устройств вспомогательного кро-
вообращения (УВК).
УВК первых поколений использовали в качестве
метода поддержки на «переходном этапе восстанов-
ления» у пациентов после перенесенного инфаркта
миокарда [2, 3]. Вскоре показания были расширены,
включая применению УВК для стабилизации паци-
ентов перед проведением трансплантации («пере-
ходный этап к трансплантации») [4–6].
Развитие технологий по уменьшению размеров
УВК, которые можно имплантировать в брюшную
полость или грудную клетку, позволило пациентам
ожидать трансплантации дома. Устройства первого
поколения, все еще используемые для временной
поддержки, имеют размеры небольших холодиль-
ников. Новейшие кардионасосы помещаются в ла-
донь.
Разработки в технологии чрескожной фиксации
устройств расширили возможности временной
поддержки сердца, тем не менее ЭКМО остается
основным методом во многих учреждениях здраво-
охранения. Кроме поддержки желудочков на этапе
восстановления, подготовки к трансплантации или
имплантации долгосрочной платформы УВК, при-
менение временных устройств распространено для
поддержки маргинальных желудочков во время
процедур, сопряженных с высоким риском, таких
как чрескожные вмешательства на коронарных
сосудах или клапанах и комплексные аблации при
аритмиях [7].
Успех УВК первого поколения [8], ограниченное
количество донорских сердец и большое количество
пациентов, исключенных из списка кандидатов на
трансплантацию в связи с возрастом или наличием
сопутствующей патологии, привели к использо-
ванию УВК как метода постоянного лечения [9].
Это применение УВК в качестве метода «конечной
целевой терапии» создало основу для широкого ис-
пользования [10, 11]. У незначительного количества
пациентов, у которых осуществлялась поддержка
с помощью долгосрочных платформ, было проде-
монстрировано достаточное восстановление натив-
ной функции сердца, что позволило рассматривать
In-30_для нас.indd 757
03.04.2019 12:05:15
758
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
вопрос удаления устройства с последующим дли-
тельным восстановлением (табл. 30 .1).
Эхокардиография является наиболее важным
методом визуализации для всех видов МПК. Пе-
ред проведением имплантации эхокардиография
позволяет определить возможные трудности при
установке устройства МПК. Во время импланта-
ции чреспищеводная эхокардиография (ЧПЭхоКГ)
может быть использована для контроля хирургиче-
ского размещения компонентов устройства и уста-
новки его начальных настроек. После имплантации
эхокардиографическая визуализация позволяет
выявить субклиническую дисфункцию устройства
или нативного сердца и оптимизировать настройки
устройства. С помощью эхокардиографии можно
определить причины аварийного сигнала устрой-
ства и возникновения симптомов у пациента. На-
конец, эхокардиография позволяет идентифициро-
вать восстановление желудочков у пациентов, явля-
ющихся кандидатами на эксплантацию устройства.
ОСНОВНЫЕ ПРИНЦИПЫ ПОДДЕРЖКИ
МЕХАНИЧЕСКОГО КРОВООБРАЩЕНИЯ
И ЭХОКАРДИОГРАФИЧЕСКИЙ ПОДХОД
ТИПЫ УСТРОЙСТВ ВСПОМОГАТЕЛЬНОГО КРОВООБРАЩЕНИЯ
Существует три основных типа устройств вспомо-
гательного кровообращения (табл. 30 .2): имплан-
тированные УПЖ, чрескожные устройства МПК и
искусственные сердца.
Показания
n (%)
Переходный этап при постановке в очередь на
трансплантацию
2973 (28,2)
Переходный этап к вероятной трансплантации 2443 (23,2)
Переходный этап к трасплантации с относи-
тельными показаниями
1063 (10,1)
Переходный этап к относительно маловероят-
ной трансплантации
354 (3,4)
Конечная целевая терапия
3516 (33,4)
Переходный этап к восстановлению
93 (0,9)
Резервный вариант лечения
60 (0,6)
Другие
40 (0,4)
* Interagency Registry for Mechanically Assisted Circulatory Support
(Межведомственный реестр устройств механической поддержки
кровообращения). Выживаемость пациентов с непрерывно-по -
точными насосами составляет 80% для 1 года и 70% для 2 лет [21].
ТАБЛИЦА 30.1
Стратегия INTERMACS* для
имплантации желудочковых устройств
вспомогательного кровообращения
ИМПЛАНТИРУЕМОЕ ЛЕВОЖЕЛУДОЧКОВОЕ УСТРОЙСТВО
ВСПОМОГАТЕЛЬНОГО КРОВООБРАЩЕНИЯ
Большинство имплантируемых УВК состоят из на-
соса, приточной канюли, отточной канюли, источ-
ника питания и контроллера. Контроллер получает
данные из насоса и с помощью передатчика управ-
ляет его работой. УВК можно классифицировать в
соответствии с расположением этих компонентов.
Насосы и контроллеры экстракорпоральных УВК
размещают вне тела пациента. Насосы паракорпо-
ральных УВК прикрепляют к телу пациента, но не
внутри. Интракорпоральные УВК имеют имплан-
тируемые насосы с передатчиками, соединяющи-
мися с паракорпоральным или экстракорпораль-
ным контроллером и аккумуляторами или другим
источником питания.
Устройства вспомогательного кровообраще-
ния могут поддерживать ЛЖ (левожелудочковое
устройство вспомогательного кровообращения
[ЛЖУВК]), правый желудочек (ПЖ) (правоже-
лудочковое устройство вспомогательного крово-
обращения [ПЖУВК]), или оба желудочка (би-
вентрикулярное устройство вспомогательного
кровообращения [БиУВК]). Приточная канюля
ЛЖУВК присоединяется к левой сердечной каме-
ре, чаще всего к верхушке ЛЖ. Имплантируемая
отточная канюля прикрепляется к восходящей
или нисходящей части аорты. Приточную ка-
нюлю ПЖУВК присоединяют к правому пред-
сердию (ПП) или ПЖ, а отточную канюлю — к
легочной артерии.
Также устройства подразделяются по механиз-
му работы. УВК первых поколений включали либо
пневматически сжимаемую растяжимую камеру,
либо механизм нажимной пластины для выталки-
вания крови в отточную канюлю. Из-за размера
камеры эти насосы не могут быть имплантирова-
ны маленьким пациентам. Эти устройства раннего
поколения имитируют пульсирующее действие
сердца с помощью однонаправленных впускных и
выпускных клапанов. Можно настроить работу на-
соса с фиксированной скоростью или направить на
поддержание постоянного ударного объема (асин-
хронно к частоте сердечных сокращений). В этом
режиме они использовались у пациентов с рефрак-
терными желудочковыми аритмиями [12].
УВК второго поколения создают непрерывный
поток. Эти устройства, называемые осевыми насо-
сами, имеют вращающийся пропеллер. HeartMate
II (Thoratec, Pleasanton, CA) — это одноосевое
устройство, одобренное управлением по контролю
за продуктами и лекарствами США (FDA) в каче-
стве метода временной поддерживающей терапии
и подготовки для трансплантации и в качестве ко-
нечной целевой терапии. При работе этого устрой-
ства кровь забирается из сердца через приточную
канюлю и перемещается в отточную канюлю (рис.
30.1A). Скорость кровотока зависит от скорости
In-30_для нас.indd 758
03.04.2019 12:05:15
759
30 Эхокардиография при механической поддержке кровообращения
Н
а
з
в
а
н
и
е
(
к
о
м
п
а
н
и
я
)
Р
а
с
п
о
л
о
ж
е
н
и
е
н
а
с
о
с
а
М
е
х
а
н
и
з
м
К
а
н
ю
л
и
О
с
о
б
е
н
н
о
с
т
и
(
р
а
з
м
е
р
/
к
р
о
в
о
т
о
к
)
У
т
в
е
р
ж
д
е
н
н
ы
е
и
/
и
л
и
п
р
е
д
л
о
ж
е
н
н
ы
е
п
о
к
а
з
а
н
и
я
п
р
и
м
е
н
е
н
и
ю
E
x
c
o
r
p
e
d
i
a
t
r
i
c
(
B
e
r
l
i
n
-
H
e
a
r
t
)
Э
к
с
т
р
а
к
о
р
п
о
р
а
л
ь
н
о
е
П
у
л
ь
с
и
р
у
ю
щ
и
й
Б
и
У
В
К
6
р
а
з
л
и
ч
н
ы
х
р
а
з
м
е
р
о
в
н
а
о
с
-
с
о
в
о
т
1
0
д
о
6
0
м
л
О
д
о
б
р
е
н
о
F
D
A
д
л
я
B
T
T
p
-
V
A
D
(
T
h
o
r
a
t
e
c
)
Э
к
с
т
р
а
к
о
р
п
о
р
а
л
ь
н
о
е
П
у
л
ь
с
и
р
у
ю
щ
и
й
Б
и
У
В
К
П
=
в
е
р
х
у
ш
к
а
Л
Ж
,
П
П
О
=
A
s
c
A
o
,
Л
А
Д
о
7
,
2
л
/
м
и
н
н
а
1
1
0
у
д
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
B
T
R
(
п
о
с
л
е
к
а
р
д
и
о
т
о
м
и
и
)
,
B
T
T
,
з
н
а
к
C
E
H
e
a
r
t
M
a
t
e
I
I
(
T
h
o
r
a
t
e
c
)
П
е
р
е
д
н
я
я
б
р
ю
ш
н
а
я
с
т
е
н
к
а
О
с
е
в
о
й
П
=
в
е
р
х
у
ш
к
а
Л
Ж
О
=
A
s
c
A
o
3
–
1
0
л
/
м
и
н
6
0
0
0
–
1
5
0
0
0
о
б
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
B
T
T
,
к
о
н
е
ч
н
о
й
ц
е
л
е
в
о
й
т
е
-
р
а
п
и
и
,
з
н
а
к
C
E
д
л
я
B
T
T
и
к
о
н
е
ч
н
о
й
ц
е
л
е
в
о
й
т
е
р
а
п
и
и
H
e
a
r
t
W
a
r
e
*
H
V
A
D
(
H
e
a
r
t
W
a
r
e
)
П
е
р
и
к
а
р
д
Ц
е
н
т
р
о
б
е
ж
н
ы
й
П
=
в
е
р
х
у
ш
к
а
Л
Ж
O
=
A
s
c
A
o
Д
о
1
0
л
/
м
и
н
2
0
0
0
–
3
0
0
0
о
б
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
B
T
T
,
з
н
а
к
C
E
C
e
n
t
r
i
m
a
g
(
T
h
o
r
a
t
e
c
)
Э
к
с
т
р
а
к
о
р
п
о
р
а
л
ь
н
о
е
Ц
е
н
т
р
о
б
е
ж
н
ы
й
П
=
Л
П
и
л
и
Л
Ж
ч
е
р
е
з
П
В
Л
В
,
П
П
О
=
A
s
c
A
o
,
Л
А
;
и
м
е
ю
щ
и
е
с
я
к
а
-
н
ю
л
и
м
о
г
у
т
б
ы
т
ь
и
с
п
о
л
ь
з
о
в
а
н
ы
п
о
с
р
е
д
с
т
в
о
м
с
о
е
-
д
и
н
и
т
е
л
я
Д
о
9
,
9
л
/
м
и
н
1
5
0
0
–
5
5
0
0
о
б
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
п
о
д
д
е
р
ж
к
и
д
о
6
ч
а
с
о
в
и
п
р
и
H
D
E
д
л
я
п
о
д
д
е
р
ж
к
и
П
Ж
д
о
3
0
д
н
е
й
P
e
d
i
m
a
g
(
T
h
o
r
a
t
e
c
)
Э
к
с
т
р
а
к
о
р
п
о
р
а
л
ь
н
о
е
Ц
е
н
т
р
о
б
е
ж
н
ы
й
Л
е
в
о
-
,
п
р
а
в
о
-
и
л
и
б
и
в
е
н
т
р
и
к
у
л
я
р
-
н
а
я
п
о
д
д
е
р
ж
к
а
Д
о
1
,
5
л
/
м
и
н
О
с
т
р
ы
й
B
T
R
и
л
и
н
а
п
е
р
и
о
д
д
о
п
р
и
н
я
т
и
я
р
е
ш
е
-
н
и
я
I
m
p
e
l
l
a
R
e
c
o
v
e
r
2
.
5
,
5
.
0
,
C
P
(
A
b
i
o
m
e
d
)
В
Т
Л
Ж
Ч
р
е
с
к
о
ж
н
ы
й
Е
д
и
н
с
т
в
е
н
н
а
я
к
а
-
н
ю
л
я
,
р
а
з
м
е
щ
а
е
-
м
а
я
р
е
т
р
о
г
р
а
д
н
о
ч
е
р
е
з
а
о
р
т
а
л
ь
-
н
ы
й
к
л
а
п
а
н
2
,
5
л
/
м
и
н
и
л
и
5
л
/
м
и
н
2
5
0
0
0
–
5
0
0
0
0
о
б
/
м
и
н
и
л
и
1
0
0
0
0
–
3
0
0
0
0
о
б
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
,
з
н
а
к
C
E
T
a
n
d
e
m
H
e
a
r
t
(
C
a
r
d
i
a
c
A
s
s
i
s
t
)
Э
к
с
т
р
а
к
о
р
п
о
р
а
л
ь
н
о
е
П
е
р
и
ф
е
р
и
ч
е
-
с
к
и
й
Т
р
а
н
с
с
с
е
п
т
а
л
ь
н
о
в
Л
П
и
к
а
н
ю
л
я
ц
и
я
б
е
д
р
е
н
н
о
й
а
р
т
е
-
р
и
и
2
–
5
л
/
м
и
н
3
0
0
0
–
7
5
0
0
о
б
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
п
о
д
д
е
р
ж
к
и
д
о
6
ч
а
с
о
в
,
з
н
а
к
C
E
C
a
r
d
i
o
w
e
s
t
(
S
y
n
c
a
r
d
i
a
)
О
И
С
Д
о
9
,
5
л
/
м
и
н
О
д
о
б
р
е
н
о
F
D
A
д
л
я
B
T
T
,
з
н
а
к
C
E
П
р
и
м
е
ч
а
н
и
е
.
Ц
е
н
т
р
а
л
ь
н
ы
е
о
ф
и
с
ы
к
о
м
п
а
н
и
й
:
T
h
o
r
a
t
e
c
(
P
l
e
a
s
a
n
t
o
n
,
C
A
)
,
B
e
r
l
i
n
H
e
a
r
t
(
B
e
r
l
i
n
)
,
H
e
a
r
t
w
a
r
e
(
F
r
a
m
i
n
g
h
a
m
,
M
A
)
,
T
e
r
u
m
o
H
e
a
r
t
(
A
n
n
A
r
b
o
r
,
M
I
)
,
A
b
i
o
m
e
d
(
D
a
n
v
e
r
s
,
M
A
)
,
C
a
r
d
i
a
c
A
s
s
i
s
t
(
P
i
t
t
s
b
u
r
g
h
,
P
A
)
,
S
y
n
c
a
r
d
i
a
(
T
u
c
s
o
n
,
A
Z
)
.
*
Н
а
с
о
с
ы
р
а
з
м
е
щ
е
н
н
ы
е
в
б
л
и
з
и
п
р
и
т
о
ч
н
о
й
к
а
н
ю
л
и
с
о
з
д
а
ю
т
а
р
т
е
ф
а
к
т
ы
п
р
и
в
и
з
у
а
л
и
з
а
ц
и
и
.
A
s
c
A
o
—
в
о
с
х
о
д
я
щ
а
я
а
о
р
т
а
;
B
T
R
—
п
е
р
е
х
о
д
н
ы
й
э
т
а
п
к
в
о
с
с
т
а
н
о
в
л
е
н
и
ю
;
B
T
T
—
п
е
р
е
х
о
д
н
ы
й
э
т
а
п
к
т
р
а
н
с
п
л
а
н
т
а
ц
и
и
;
C
E
—
C
o
n
f
o
r
m
i
t
e
́
E
u
r
o
p
e
́
e
n
e
(
п
р
о
д
у
к
т
с
о
о
т
в
е
т
с
т
в
у
е
т
о
с
н
о
в
н
ы
м
т
р
е
б
о
в
а
н
и
я
м
е
в
р
о
п
е
й
с
к
о
г
о
з
а
к
о
н
о
д
а
т
е
л
ь
с
т
в
а
в
о
б
л
а
с
т
и
о
х
р
а
н
ы
з
д
о
р
о
в
ь
я
,
б
е
з
о
п
а
с
н
о
с
т
и
и
о
х
р
а
н
ы
о
к
р
у
ж
а
ю
щ
е
й
с
р
е
д
ы
)
;
H
D
E
—
h
u
m
a
n
i
t
a
r
i
a
n
d
e
v
i
c
e
e
x
e
m
p
t
i
o
n
;
В
Т
Л
Ж
—
в
ы
х
о
д
н
о
й
т
р
а
к
т
л
е
в
о
г
о
ж
е
л
у
д
о
ч
к
а
;
Л
А
—
л
е
г
о
ч
н
а
я
а
р
т
е
р
и
я
;
О
—
л
о
к
а
л
и
з
а
ц
и
я
о
т
т
о
ч
н
о
й
к
а
н
ю
л
и
;
О
И
С
—
о
б
щ
е
е
и
с
к
у
с
с
т
в
е
н
н
о
е
с
е
р
д
ц
е
;
П
—
л
о
к
а
л
и
з
а
ц
и
я
п
р
и
т
о
ч
н
о
й
к
а
н
ю
л
и
;
П
В
Л
В
—
п
р
а
в
а
я
в
е
р
х
н
я
я
л
е
г
о
ч
н
а
я
в
е
н
а
;
П
Ж
—
п
р
а
в
ы
й
ж
е
л
у
д
о
ч
е
к
.
Т
А
Б
Л
И
Ц
А
3
0
.
2
П
р
и
м
е
р
ы
ж
е
л
у
д
о
ч
к
о
в
ы
х
у
с
т
р
о
й
с
т
в
в
с
п
о
м
о
г
а
т
е
л
ь
н
о
г
о
к
р
о
в
о
о
б
р
а
щ
е
н
и
я
In-30_для нас.indd 759
03.04.2019 12:05:15
760
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
вращения пропеллера, измеряемой в оборотах в
минуту (об/мин), и разности давлений между при-
точной и отточной канюлями. Во время систолы
наблюдается большая скорость кровотока, когда
снижается разница между давлением в аорте и ЛЖ
(давление в ЛЖ повышается при его сокращении),
чем во время диастолы (давление в ЛЖ падает во
время релаксации желудочков и разность давлений
увеличивается). Эти осевые непрерывно-поточные
насосы обеспечивают больший кровоток при более
низких давлениях, чем пульсирующие насосы. В
связи с отсутствием клапанов (которые с течением
времени изнашиваются) эти устройства также об-
ладают более длительным сроком службы [13, 14].
В непрерывно-поточных УВК третьего поколе-
ния используется центробежная сила для прокачки
Осевое непрерывно-поточное ЛЖУВК
Отточная канюля
Приточная
канюля
Внешний
комплект батарей
Осевой насос
Центробежный
насос
Правосторонний насос
Левосторонний
насос
Передатчик
Передатчик
Системный контроллер
Центробежное непрерывно-поточное ЛЖУВК
БиУВК (устройство вспомогательного
кровообращения с поддержкой ЛЖ и ПЖ)
Отточная канюля
Отточная канюля
Приточная канюля
Аорта
Аорта
Легочная
артерия
Аорта
Приточная
канюля
Место выхода
на кожу
Отточная
канюля
Диафрагма
Диафрагма
Приточная
канюля
Рис. 30.1 Устройства вспомогательного кровообращения для желудочка. (A) Осевое непрерывно-поточное ЛЖУВК [HeartMate II, Thoratec, Pleasanton, CA)].
(Б) Центробежное непрерывно-поточное ЛЖУВК [HVAD, HeartWare, Framingham, MA]. (В) БиУВК (устройство вспомогательного кровообращения для ЛЖ и ПЖ).
А
В
Б
In-30_для нас.indd 760
03.04.2019 12:05:15
761
30 Эхокардиография при механической поддержке кровообращения
крови. Данные устройства одобрены FDA в качестве
метода подготовки для трансплантации. Магнит-
ные или гидродинамические силы приподнимают и
вращают дископодобный импеллер, а не пропеллер
(рис. 30 .1Б). Как и в осевых насосах, в центробеж-
ных насосах отсутствуют клапаны, но, кроме этого,
в них отсутствуют подшипники, что может снизить
степень проявления гемолиза.
Как осевые, так и центробежные непрерывно-по-
точные устройства называются «непульсирующи-
ми» УВК, тем не менее остаточная функция желу-
дочков и неоднородные перепады давления между
приточной и отточной канюлями обуславливают
возникновение некоторой пульсации. При исполь-
зовании центробежных УВК обычно наблюдается
более выраженная пульсация, чем при применении
осевых устройств [15]. Новая группа устройств,
включая УВК, которая вызывает большую степень
артифициальной пульсации на фоне непрерывного
потока, проходят клинических исследования [16].
ЧРЕСКОЖНЫЕ УСТРОЙСТВА
МЕХАНИЧЕСКОЙ ПОДДЕРЖКИ КРОВООБРАЩЕНИЯ
Чрескожные устройства МПК устанавливаются че-
рез периферические артерии и вены и могут быть
размещены относительно быстро для обеспечения
временной поддержки. Устройства Impella Recover
2.5 и CP (Abiomed, Danvers, MA) состоят из осевого
(пропеллерного) насоса внутри катетера, который
устанавливается через бедренную артерию, затем
проводится через аорту и аортальный клапан, до-
стигая полость ЛЖ (рис. 30 .2A). Приточный порт
извлекает кровь из выносящего тракта ЛЖ и вытал-
кивает ее через отточный порт в аорту. Устройство
Impella улучшает показатели гемодинамики в слу-
чае тяжелого рефрактерного кардиогенного шока.
В настоящее время также доступно устройство для
поддержки правого желудочка (Impella RP). Более
крупное устройство Impella 5.0 обеспечивает более
значительное увеличение кровотока, но для его
установки требуется хирургическая артериосекция
крупного сосуда. На стадии клинических испыта-
ний находятся новые чрезаортальные устройства,
обеспечивающие кровоток до 5 л/мин и устанавли-
ваемые без оперативного сосудистого доступа.
Устройство TandemHeart (Cardiac Assist, Pitts-
burgh, PA) имеет паракорпоральный центробежный
насос, соединенный с приточным катетером, разме-
щаемым в ЛП через межпредсердную перегородку,
и отточной канюлей, устанавливаемой в дистальной
части аорты через бедренную артерию (рис. 30 .2Б).
Выходное отверстие
Входное отверстие
Катетер типа пигтейл
Приточный
катетер
Насос
Отточный
катетер
Рис. 30 .2 Чрескожное устройство вспомогательного кровообращения для желудочка. (A) Устройство Impella Recover (Abiomed, Danvers, MA) пред-
ставлено осевым насосом (пропеллером), расположенным внутри катетера диаметром 12 Fr, имеющем дистальный приточный порт и проксимальный отточный
порт. Катетер вводится через бедренную артерию, аорту и аортальный клапан в ЛЖ. Для стабилизации в центральном просвете оставляют катетер типа пигтейл.
Приточный порт расположен ниже аортального клапана для извлечения крови из выносящего тракта ЛЖ. Отточный порт расположен в восходящей аорте. Кровоток
зависит от скорости вращения пропеллера и разности давлений в аорте и ЛЖ. При правожелудочковой недостаточности устройство Impella также может быть уста-
новлено через грудную клетку в восходящую аорту или в легочную артерию, откуда оно продвигается выносящий тракт ПЖ. (Б) Устройство TandemHeart (Cardiac
Assist, Pittsburgh, PA) имеет экстракорпоральный центробежный насос, подключенный к приточной канюле диаметром 21 Fr, которая вводится через бедренные
вены и продвигается в ПП, откуда путем межпредсердной септотомии устанавливается в ЛП. Отдельная отточная канюля диаметром 15–17 Fr вводится в бедренную
артерию и продвигается в дистальную аорту. Как вариант, отточный катетер диаметром 12 Fr может быть введен в каждую бедренную артерию. Для поддержки ПЖ
канюля устройства TandemHeart также могут быть расположены в ПП (приточная) и в легочной артерии (отточная).
А
Б
In-30_для нас.indd 761
03.04.2019 12:05:16
762
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Для поддержки ПЖ канюлю TandemHeart можно
также располагать в ПП (приток) и в легочной ар-
терии (отток). Устройство TandemHeart улучшает
показатели сердечного индекса и легочного давле-
ния у пациентов с декомпенсированной сердечной
недостаточностью после перенесенного инфаркта
миокарда и также используется для стабилизации
пациентов с постоянной формой желудочковой та-
хикардии [17].
Устройство Centrimag (Thoratec, Pleasanton, CA)
состоит из паракорпорального центробежного
насоса с магнитно-левитирующим импеллером и
может обеспечивать кровоток до 9,9 л/мин. Он мо-
жет быть подключен через катетеры, помещенные
в любую из сердечных камер, для обеспечения ле-
вожелудочковой (приток — ЛП или ЛЖ, отток —
аорта), правожелудочковой (приток — ПП или ПЖ,
отток — легочная артерия) или бивентрикулярной
поддержки. Устройство Centrimag применялось для
временной поддержки ПЖ у пациентов с долго-
срочным ЛЖУВК.
ИСКУССТВЕННОЕ СЕРДЦЕ
Доступное в настоящее время искусственное сердце
(Syncardia temporary Total Artificial Heart, Syncardia
Inc, Tucson, AZ) заменяет ПЖ и ЛЖ пульсирующи-
ми насосами с формированием анастомоза между
металлическими атриовентрикулярными клапана-
ми и нативными предсердиями. Насосный компо-
нент через передатчики подключается к экстракор-
поральному контроллеру и батарее (рис. 30 .3). В на-
стоящее время устройство Syncardia одобрено FDA
в качестве промежуточного этапа к трансплантации
(см. табл. 30 .2).
ОБСЛЕДОВАНИЕ ПЕРЕД ПРОВЕДЕНИЕМ ИМПЛАНТАЦИИ
К особым критериям установки ЛЖУВК в качестве
конечной целевой терапии относят фракцию вы-
броса (ФВ) ЛЖ менее 25–30%, чаще всего измеряе-
мую с помощью эхокардиографии. Несмотря на то,
что гемодинамические критерии относятся к инва-
зивно определяемым показателям, эхокардиогра-
фия позволяет выполнить неинвазивную оценку
сердечного индекса и внутрисердечного давления.
Небольшой размер желудочка (< 6,3 см) указывает
на более неблагоприятный результат после имплан-
тации ЛЖУВК, возможно, это связано с тем, что
меньшие размеры полостей и тяжелая дисфункция
ЛЖ чаще наблюдаются у пациентов с инфильтра-
тивными кардиомиопатиями [18].
Эхокардиография выявляет факторы, подтверж-
дающие необходимость вмешательства, затрудняю-
щие размещение устройства вспомогательного кро-
вообращения, или помогает определить преимуще-
ства использования определенного типа устройства
по отношению к другим (табл. 30 .3). Особенно важ-
но определить наличие тромбов, поскольку после
установки устройства МПК они могут стать причи-
ной эмболии. Для исключения тромбоза желудочков
у пациентов с неадекватной визуализацией может
потребоваться проведение контрастирования с ми-
кропузырьками. Для обследования левого предсер-
дия (ЛП) и ушек ПП у пациентов с фибрилляцией
или трепетанием предсердий следует использовать
ЧПЭхоКГ. Внутрисердечное шунтирование приво-
дит к системной гипоксемии и/или парадоксальной
эмболии после установки ЛЖУВК с левожелудоч-
ковой декомпрессией и потенциальным градиентом
давления между правыми и левыми отделами. Во
время имплантации необходимо провести платику
с устранением внутрисердечных шунтов. Высокое
давление в ЛП может препятствовать прохождению
контрастного «возбужденного» физраствора через
открытое овальное отверстие (ООО), даже после
пробы Вальсальвы, что приводит к ложноотрица-
тельным результатам исследования при наличии
шунтирования на уровне предсердий.
Умеренная или более выраженная аортальная
регургитация осложняет использование устройств
МПК [19]. Размещение отточной канюли в восходя-
щей аорте или устройства Impella Recover через аор-
тальный клапан может ухудшить изначально суще-
ствующую аортальную регургитацию, что приведет
к циркуляции крови от ЛЖ через насос в аорту и
обратно в ЛЖ. Высокое давление в ЛЖ и низкое
диастолическое давление в корне аорты, обуслов-
ленное тяжелой аортальной регургитацией, могут
привести к снижению давления коронарной перфу-
зии, что усугубляется тем фактом, что устройство
TandemHeart извлекает кровь из ЛП и выталкивает
ее в дистальную аорту (минуя устья коронарных
артерий). Доимплантационная оценка степени
аортальной регургитации осложнена у пациентов с
терминальной стадией сердечной недостаточности,
у которых обычно наблюдается низкое системное
давление и высокое диастолическое давление в ЛЖ.
Аорта
Легочная
артерия
Левое
предсердие
Камеры насоса
Место выхода
на кожу
Правое
предсердие
Рис. 30.3 Искусственное сердце. Syncardia [Syncardia Systems, Inc, Tuc-
son, AZ].
In-30_для нас.indd 762
03.04.2019 12:05:16
763
30 Эхокардиография при механической поддержке кровообращения
Показатель
Осложнение
Тромб в камере сердца
Тромбэктомия во время имплантации
Размещение канюли в альтернативной камере
Внутрисердечное шунтирование
Хирургическая коррекция шунта
Аневризма, искривление, атероскле-
ротическая бляшка аорты
Хирургическая коррекция аневризмы путем установки графта
Размещение имплантированной отточной канюли минуя атеросклеротическую бляшку
Предостережение для использования Impella Recover
Аортальный стеноз (≥ умеренной
степени)
Реплантация биопротезного клапана*
Противопоказание для Impella Recover
Аортальная регургитация (≥ умерен-
ной степени)
Реплантация биопротезного клапана*
Наложение дополнительных швов на створки клапана, Park stitch для противопоставле-
ния двум спайкам
Канюляция нисходящей аорты
Расположение имплантируемой канюли в восходящей аорте минуя аортальный клапан
Осторожность при TandemHeart (смотри в тексте)
Противопоказание для Impella Recover
Митральный стеноз
Вальвулопластика
Реплантация биопротезного клапана*
Размещение приточной канюли в ЛП
Осторожность при Impella Recover
Митральная регургитация
Пластика или реплантация биопротезного клапана*
Осторожность при Impella Recover
Систолическая дисфункция ПЖ
Осторожность при левожелудочковых устройствах МПК
Правожелудочковые устройства МПК
Дефект межжелудочковой перего-
родки
Осторожность при Impella Recover (шунтирование справа на лево)
Коррекция при имплантации*
Дефект межпредсердной перегородки Осторожность при TandemHeart и канюляция ЛП (шунтирование справа налево)
Коррекция при имплантации*
Аневризма межпредсердной
перегородки
Осторожность при TandemHeart и ЭКМО или канюляции предсердия Centrimag (анев-
ризма может втягиваться внутрь виызывать обструкцию канюли)
Выраженная трабекулярность ЛЖ,
аневризмы/дискинезия стенок, до-
бавочная хорда, выраженность греб-
ней, маленькая камера притока
Расположение приточной канюли минуя структуры, которые могут стать причиной
обструкции
Хирургическое удаление трабекул
Хирургическое удаление аневризмы
Повышенная свертываемость крови
(склонность к тромбообразованию)
Следует избегать канюляцию ЛП, осторожность при TandemHeart, ECMO, Centrimag
(застой в шунтированном ЛЖ)
Обеспечьте открытие аортального клапана для «промывание» корня аорты
Достижение повышения МНО, дополнительное назначение антиагрегантных препара-
тов
Перикардиальный экссудат (после де-
компрессии камер с помощью УВК
может произойти коллапс)
Дренирование экссудата
Заболевание периферических
кровеносных сосудов
Осторожность при Impella Recover
Осторожность при TandemHeart
* Механические клапаны обычно не используются у пациентов с УВК, т.к. способствуют тромбооразованию несмотря на антикоагулянт-
ную терапию.
МНО — международное нормализированное отношение; МПК — механическая поддержка кровообращения; УВК — устройство вспомо-
гательного кровообращения.
[Stainback RF, Estep JD, Agler DA, et al. Echocardiography in the Management of Patients with Left Ventricular Assist Devices: Recommendations
from the American Society of Echocardiography. J Am Soc Echocardiogr 28:853–909, 2015.]
ТАБЛИЦА 30.3 Показатели эхокардиографии, указывающие на осложнения при имплантации желудочкового устройства
вспомогательного кровообращения
In-30_для нас.indd 763
03.04.2019 12:05:17
764
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Низкий градиент давления между аортой и ЛЖ мо-
жет артефициально снизить степень регургитации,
обусловленной недостаточностью аортального кла-
пана. В случае аортальной регургитации, превыша-
ющей умеренную степень, аортальный клапан сле-
дует заменить, выполнить пластику или наложить
дополнительные хирургические швы [20].
Несмотря на то, что наличие выраженного ми-
трального стеноза требует коррекции во время
имплантации ЛЖУВК или устройства Impella,
поскольку он препятствует кровотоку в устрой-
ство, наличие аортального стеноза не является
обязательным показанием к реконструктивному
вмешательству, поскольку налаженный кровоток
обходит аортальный клапан. Тем не менее, тяжелый
аортальный стеноз, наложение дополнительных
швов на аортальный клапан для предотвращения
аортальной регургитации, и сращение створок аор-
тального клапана ограничивают сердечный выброс
при отказе насоса ЛЖУВК. Выраженная митральная
регургитация подлежит сглаживанию благодаря
функционированию ЛЖУВК и не создает трудно-
стей при имплантации. Механические протезы аор-
тальных клапанов должны быть заменены биопро-
тезами во время имплантации, поскольку снижение
кровотока через аорту приводит к увеличению
риска тромбоза. При этом функционирующий ме-
ханический протез митрального клапана не требует
замены, поскольку кровоток через митральный кла-
пан сохраняется [20].
Особо важное значение до проведения имплан-
тации имеет идентификация и характеристика
дисфункции ПЖ. Недостаточность ПЖ является
причиной заболеваемости и смертности 10–30% па-
циентов с ЛЖУВК и обычно наблюдается в 13–44%
случаев имплантации ЛЖУВК [21, 22]. Установка
ЛЖУВК приводит к повышению сердечного вы-
броса и увеличению венозного возврата к ПЖ. При
наличии ранее существовавшей дисфункции ПЖ
увеличение преднагрузки может привести к его не-
достаточности [23]. Кроме того, влияние ЛЖУВК
на подвижность перегородки приводит снижению
функцию ПЖ и может способствовать утяжелению
исходной трикуспидальной регургитации. С другой
стороны, декомпрессия ЛЖ с помощью УВК может
вызвать снижение легочного давления и постнагруз-
ки ПЖ, что приводит к улучшению функции ПЖ.
У пациентов с установленной дисфункцией ПЖ
плановое размещение ПЖУВК на ранних стадиях
улучшает показатель выживаемость, по сравнению
с более поздней имплантацией [24]. В связи с потен-
циальным ухудшением функции ПЖ с увеличением
степени выраженности трикупидальной регургита-
ции после имплантации ЛЖУВК в согласованном
экспертном заключении содержатся рекомендации
по проведению пластики трикуспидального клапа-
на, если степень выраженности трикуспидальной
регургитации превышает умеренную [20].
Визуализация восходящей аорты позволяет
выявлять аневризмы, расслоения или наличие
выраженных либо флотирующих атероматозных
бляшек, которые затрудняют размещение отточ-
ной канюли.
ПЕРИПРОЦЕДУРАЛЬНЫЙ КОНТРОЛЬ
Внутрисердечная эхокардиография и ЧПЭхоКГ
обеспечивают визуализацию в режиме реального
времени, направляя размещение канюли в обход
структур сердца, потенциально затрудняющих кро-
воток. Таким образом, контролируя размещение
устройства Impella, приточный порт можно уста-
новить в выносящем тракте ЛЖ, а отточный порт
над аортальным клапаном. Эхокардиографический
контроль при выполнении пункции перегородки
во время установки TandemHeart позволяет предот-
вратить непреднамеренный прокол стенок ЛП, ПП
или корня аорты. Как и при других кардиохирур-
гических процедурах, ЧПЭхоКГ используется для
контроля удаления воздуха перед подключением
искусственного кровообращения. Воздушные пу-
зырьки возникают в области анастомоза канюли и,
если они не были обнаружены до удаления аорталь-
ного зажима, могут приводить к эмболии. На нали-
чие пузырьков воздуха должны быть обследованы
передние структуры, включая восходящую аорту,
ПЖ и передние части ЛЖ [25] (рис. 30.4). Кроме то-
го, перипроцедуральная ЧПЭхоКГ применима для
повторной оценки степени аортальной регургита-
ции, выявления потенциально пропущенного ООО
и определения начальных параметров скорости (см.
раздел «Оптимизация настроек устройства»). После
закрытия грудной клетки, перипроцедурная ЧПЭ-
хоКГ позволяет оценивать изменения местополо-
жения канюли.
ПОСТИМПЛАНТАЦИОННОЕ НАБЛЮДЕНИЕ
И ОСЛОЖНЕНИЯ
Долгосрочное наблюдение с выполнением эхо-
кардиографических исследований (если нет подо-
зрений на нарушение функции устройства МПК)
являются частью протоколов во многих учрежде-
ниях, наблюдающих пациентов с установленными
устройствами вспомогательного кровообращения
(табл. 30 .4). Эти протоколы различаются по частоте
и периодичности эхокардиографии. Цели эхокар-
диограмм заключаются в отслеживании изменений
исходных характеристик нативной сердечной дея-
тельности, оценке работы устройства и выявлении
дисфункции до возникновения клинических сим-
птомов. Например, выявление увеличения степени
выраженности аортальной регургитации с расшире-
нием ЛЖ и определение внутрисердечных тромбов.
Наблюдение с помощью эхокардиографии позво-
ляет проводить изменение скорости для оптимиза-
In-30_для нас.indd 764
03.04.2019 12:05:17
765
30 Эхокардиография при механической поддержке кровообращения
ции устройства, используя эхокардиографические
показатели в качестве критериев оптимальности
настройки (см. описание в тексте далее). В некото-
рых случаях при очередном эхокардиографическом
обследовании может быть выявлено улучшение
сердечной функции, что поднимает вопрос о воз-
можности удаления устройства.
Эхокардиография также выполняется при воз-
никновении таких симптомов, как одышка, отеки
и предобморочное состояние, а также при наличии
аварийных сигналов устройства МПК (табл. 30 .5).
Имеющиеся в настоящее время устройства МПК
снабжены аварийными сигналами, возникающи-
ми при изменениях потребления энергии и/или
кровотока, хотя последние имеют ограничения по
точности. Аварийные сигналы указывают на на-
личие нарушения функции, но для определения ее
причины часто требуется использование методов
визуализации [26] (табл. 30 .6).
ПЕРЕПОЛНЕНИЕ
Регургитация, обструкция и нарушение функции
приводят к переполнению и повышению давления
в поддерживаемом желудочке. Отказ одноходовых
клапанов в пульсирующих УВК приводит к ре-
гургитации. В непрерывно-поточных устройствах
при повышении системного сосудистого сопро-
тивления на канюле может возникать регургита-
ция. Возникающая в результате перегиба, непра-
вильного расположения или тромбоза, обструкция
ЛП
ЛЖ
Рис. 30 .4 Воздух в полости сердца после имплантации левого же-
лудочка устройства вспомогательного кровообращения. ЧПЭхоКГ
в нижнеапикальной двухкамерной позиции из среднего отдела пищевода.
Продемонстрированы пузырьки воздуха (маленькие стрелки) в ЛЖ и ЛП
после размещения в верхушке ЛЖ приточной канюли (контуры обозначены
большими стрелками). Эхокардиография позволяет обнаруживать пузырьки,
возникающие в области анастомоза. Перед отключением искусственного кро-
вообращения желудочки должны быть деаэрированы.
Последующее наблюдение
Акцентирование на проблеме Восстановление
Цель
Определение параметров ЛЖУВК и на-
тивной функции сердца
Ранняя диагностика скрыто протека-
ющих патологических процессов/
дисфункции
Скрининг восстановления
Определение причины клини-
ческих симптомов
Определение причины аварий-
ного сигнала ЛЖУВК
Выявление кандидатов на экспла-
натацию
Хронометраж/
настройки
Обследование для выписки из стацио-
нара после имплантации
Через 1, 3, 6, 12 месяцев
Каждые 6–12 месяцев
Симптомы застойной сердеч-
ной недостаточности
Предобморочное состояние/
обмороки
Аритмии
Высокая интенсивность крово-
тока/мощность
Низкая интенсивность крово-
тока/мощность
Ремоделирование желудочков при
обследовании с помощью ЭхоКГ
или после разрешения инфар-
кта/клинического улучшения
Улучшение систолической функ-
ции при обследовании с помо-
щью ЭхоКГ или после разре-
шения инфаркта/клинического
улучшения
Изменение ско-
рости
Оптимизация параметров:
Наполнение ЛЖ
Открытие АК
АР
Систолическая функция ПЖ
Ramp
Смена позиции
Отлучение/отключение: при ми-
нимальном уровне поддержки
+/– после физической нагрузки
АК — аортальный клапан; АР — аортальная регургитация; ЛЖУВК — левожелудочковое устройство вспомогательного кровообращения.
[Stainback RF, Estep JD, Agler DA, et al: Echocardiography in the Management of Patients with Left Ventricular Assist Devices: Recommendations
from the American Society of Echocardiography. J Am Soc Echocardiogr 28:853–909, 2015.]
ТАБЛИЦА 30.4 Визуализация с помощью эхокардиографии после имплантации устройств механической поддержки
кровообращения
In-30_для нас.indd 765
03.04.2019 12:05:17
766
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Мощность: Измерение среднего энергопотребления устрой-
ства с течением времени. Непосредственно связано со ско-
ростью.
«Перепад напряжения», высокая мощность: увеличение
мощности без увеличения скорости может указывать на
обструкцию
Кровоток: л/мин, непосредственно связан со скоростью и
мощностью. Рассчитывается для долгосрочных ЛЖУВК,
измеряется для ЭКМО.
«Низкий кровоток»:
Явление всасывания
Недостаточность ПЖ
Тампонада
Недостаточное наполнение
Обструкция приточной канюли
Перегиб отточной канюли
Гипертензия
Аритмия
«Высокий кровоток»:
Тромбоз насоса (в действительности высокая мощность с
низким кровотоком)
Сепсис/вазодилатация
Аортальная регургитация
Восстановление нативных функций желудочка
ЛЖУВК — левожелудочковое устройство вспомогательного кро-
вообращения; ЭКМО — экстракорпоральная мембранная окси-
генация.
ТАБЛИЦА 30.5
Показания и аварийные сигналы
контролеров устройств механической
поддержки кровообращения
Обструкция/перенаполнение
↑ЛЖКДР
Перегородка → ПЖ
Спонтанное контрастирование при ЭхоКГ
↑Открытия аортального клапана
↑Скоростей кровотока в канюле
Пульсирующие: пиковый приток > 2,3 м/сек, пиковый от-
ток > 2,1 м/сек*
Непрерывно-поточные: пиковый приток > 1,5 м/сек, пико-
вый отток > 2,0 м/сек*
Регургитация на приточной канюле
Пульсирующие: пиковый отток УВК < 1,8 м/сек
Реверсивные потоки при цветовой, спектральной допплеро-
графии
Обструкция канюли вследствие тромбоза или вегетаций
Недостаточное наполнение
↓ЛЖКДР
Перегородка → ЛЖ
↓Открытие аортального клапана
Перикардиальный экссудат с коллапсом камер
Всасывание сердечных структур в приточную канюлю
↑Скорость в канюле
* Имеются незначительные данные о нормальных скоростях, но
для большинства пациентов с непрерывно-поточными устрой-
ствами пиковые скорости составляют < 1,5 м/сек.
ЛЖКДР — конечно-диастолический размер левого желудочка;
УВК — устройство вспомогательного кровообращения.
ТАБЛИЦА 30.6
Эхокардиографические показатели
дисфункции желудочковых устройств
вспомогательного кровообращения
канюли может быть частичной, полной или пре-
рывистой. Механизмы накачки УВК могут частич-
но или полностью перекрываться, что приводит к
увеличению гемодинамического давления и гемо-
лизу. Наконец, может произойти первичный отказ
компонентов УВК: аккумулятора, контроллера или
насоса. Неисправность насоса может быть резуль-
татом отказа механизмов накачки, но, чаще всего,
обусловлена тромбозом насоса. Последующая ди-
латация желудочка и снижение сердечного выбро-
са могут привести к внутриполостному застою и
образованию тромбов в ЛЖ или корне аорты (рис.
30.5A, Б). Неисправность источника питания или
контроллера могут привести к летальному исходу,
если у пациента отсутствует адекватная остаточная
сердечная функция и беспрепятственный отток из
аорты.
НЕДОСТАТОЧНОЕ НАПОЛНЕНИЕ
Недостаточное наполнение поддерживаемого же-
лудочка приводит к уменьшению размера полости
и может вызвать обструкцию приточной канюли,
обусловленную «всасывающим» воздействием на
нормальные анатомические структуры сердца. По
мере уменьшения размера камеры сердца в просвет
приточной канюли начинают втягиваться трабе-
кулы, сосочковые мышцы, хордовые структуры и
перегородка (рис. 30 .6). Обструкция отверстия при-
водит к снижению кровотока и сердечного выброса,
а также к аритмиям.
Спровоцировать обструкцию приточного от-
верстия может все, что уменьшает преднагрузку,
включая обезвоживание, чрезмерный диурез, сеп-
сис и тампонаду (рис. 30 .7). Недостаточность ПЖ
с невозможностью наполнять левые отделы сердца
также может привести к явлениям всасывания в
ЛЖ.
Кровотечение вызывает особую озабоченность,
поскольку у большей части пациентов с УВК прово-
дится антикоагулянтная терапия для профилактики
тромбоза. У до одной четверти пациентов с УВК в
периимплантационном периоде может потребо-
ваться проведение повторной операции в связи с
возникшим кровотечением [27]. Кроме того, ис-
пользование непрерывно-поточных УВК было свя-
зано с повышенным риском желудочно-кишечного
кровотечения [28].
ДИСФУНКЦИЯ КЛАПАНОВ
Как было описано ранее, относительно слабо вы-
раженная аортальная регургитация, выявляемая до
имплантации устройства, после установки ЛЖУВК
может ухудшиться. В литературе имеются данные
о возникновении через несколько месяцев после
проведенной имплантации выраженной аорталь-
ной регургитации, которую трудно определить
количественно, учитывая, что она может носить не-
In-30_для нас.indd 766
03.04.2019 12:05:17
767
30 Эхокардиография при механической поддержке кровообращения
прерывный характер, присутствуя на протяжении
всей систолы и диастолы. Кроме того, приобретен-
ный аортальный стеноз, обусловленный сращением
створок, является редким, но признанным ослож-
нением как пульсирующих, так и непрерывно-по-
точных устройств [29]. Причина данного процесса
неизвестна, а в результате эхокардиографического
исследования створок клапанов может быть выяв-
лено их относительно нормальное строение. Было
отмечено, что сращению подвергаются как натив-
ные створки, так и створки биопротеза. Сращение
створок представляет значительную проблему у
пациентов с установленными УВК в качестве пе-
реходного этапа для восстановления и может по-
требовать проведения балонной вальвулопластики.
При отсутствии открытия аортального клапана
или при минимальном открытии существует риск
образования тромбов в корне аорты, особенно при
непрерывно-поточных УВК, в связи с более низким,
практически непульсирующим кровотоком [30].
После установки ЛЖУВК обычно наблюдается
снижение степени митральной регургитации, но
устройство Impella Recover может влиять на работу
хордового аппарата или передней створки митраль-
ного клапана, что приводит к увеличению степени
митральной регургитации. Явления всасывания,
ограничивающие работу хорд или папиллярных
мышц, могут приводить к такому же результату.
Как было отмечено ранее, после установки ЛЖУВК
может увеличиться степень трикуспидальной ре-
гургитации, поскольку смещение перегородки и
деформация кольца могут привести к фиксации
створки к перегородке.
Эндокардит, развивающийся на нативных кла-
панах или компонентах устройства МПК, является
еще одной важной проблемой. Инфицирование яв-
ляется одной из пяти основных причин летального
исхода у пациентов с УВК. Инфекционный процесс
часто начинается на месте выхода передатчика [31].
Вегетации на внутрикорпоральных канюлях УВК
или компонентах насоса создают угрозу развития
обструкции и септической эмболии. В данной ситу-
ации часто требуется удаление устройства.
ИССЛЕДОВАНИЯ ИЗМЕНЕНИЯ СКОРОСТИ
ОПТИМИЗАЦИЯ НАСТРОЕК УСТРОЙСТВА
В некоторых случаях настройки устройства МПК
должны быть отрегулированы для разрешения
гемодинамических нарушений или для оптими-
зации сердечной функции. Уменьшение подачи
насоса, объемной производительности насоса или
частоты вращения ротора приводит к увеличению
преднагрузки. Более высокая преднагрузка может
улучшить систолическую функцию ЛЖ, согласно
механизмам Старлинга, увеличивая выброс че-
рез аортальный клапан. Во многих клинических
центрах при установке непрерывно-поточных
устройств считается желательной определенная
степень открытия аортального клапана, что слу-
жит профилактической мерой сращения створок
клапана и образования тромбов. В случае же умень-
шения кровотока ЛЖУВК может привести к пере-
растяжению ЛЖ, снижению остаточной функции и
симптомам застоя.
Увеличение подачи насоса, объемной произво-
дительности насоса или частоты вращения ротора
приводит к снижению преднагрузки желудочков,
что потенциально уменьшает проявления растяже-
ния и застоя. Тем не менее может снизиться систо-
лическая функция ЛЖ и перестать открываться
аортальный клапан, увеличивая риск тромбоза
корня аорты. Чрезмерное снижение подачи насоса
приведет к недостаточному наполнению и сжатию
приточной канюли.
ОПТИМИЗАЦИЯ РАСПОЛОЖЕНИЯ ЧРЕСКОЖНЫХ УСТРОЙСТВ
МЕХАНИЧЕСКОЙ ПОДДЕРЖКИ КРОВООБРАЩЕНИЯ
Расположение чрескожных устройств МПК мо-
жет потребовать управляемой регулировки. Если
устройство Impella сместится в желудочек, то пор-
Рис. 30 .5 Внутрисердечные тромбы после установки ЛЖУВК. (A) Модифицированная апикальная четырехкамерная позиция, демонстрирующая тромб в
верхушке ЛЖ (стрелка) вблизи канюли ЛЖ устройства вспомогательного кровообращения. (Б) Парастернальная позиция по длинной оси, демонстрирующая тромб
в корне аорты (стрелка).
А
Б
In-30_для нас.indd 767
03.04.2019 12:05:17
768
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 30 .7 A Сгусток в перикарде, вызывающий компрессию левого
желудочка. В этой модифицированной апикальной позиции латерально от
стенки ЛЖ определяется крупный тромб (две стрелки). Полость ЛЖ (одна
стрелка) сильно сдавлена.
ция оттока может оказаться ниже аортального кла-
пана (рис. 30 .8A). Если оно смещается в обратном
направлении, то порция притока может оказаться
слишком высоко в ВТЛЖ или в восходящей аорте
(см. рис. 30 .8Б). Датчики давления, расположенные в
каждом порту, могут идентифицировать проблему,
хотя имеются сообщения о потере сигнала датчи-
ка [32]. Устройство TandemHeart, устанавливаемое
трансперегородочно, может смещаться назад в ПП,
всасывая деоксигенированную кровь через приточ-
ную канюлю и доставляя ее в систему циркуляции.
ИССЛЕДОВАНИЯ ПО RAMPПРОТОКОЛУ
Для выявления или подтверждения тромбоза насо-
са существует специальный протокол эхокардио-
графии c изменением подачи. Частота сообщений
о тромбозе насоса возросла после 2011 года [33].
Наличие этого осложнения можно заподозрить при
увеличении потребления энергии и наличии мар-
керов гемолиза, таких как повышение уровня лак-
татдегидрогеназы, снижение уровня гаптоглобина и
высокий уровень гемоглобина вне плазмы. Несмо-
тря на усиленную антикоагулянтную и тромболи-
тическую терапию, часто требуется замена насоса.
Перед началом исследования по ramp-протоколу
необходимо исключить наличие тромба в ЛЖ и
корне аорты, поскольку изменения подачи могут
привести к системной эмболии. Были предложены
различные протоколы визуализации [34, 35], но
основной принцип заключается в следующем: эхо-
кардиографическая визуализация выполняется для
мониторинга эффектов увеличения подачи. При
наличии тромбоза насоса увеличение подачи будет
мало влиять на эхокардиографические параметры,
но при отсутствии тромбоза в насосе увеличение
производительности будет сопровождаться посте-
пенной разгрузкой ЛЖ, что в конечном итоге при-
ведет к явлению всасывания.
ВОССТАНОВЛЕНИЕ ЖЕЛУДОЧКА
Все чаще устройства МПК используются для вре-
менной поддержки пациентов с обратимыми при-
чинами сердечной недостаточности, как острыми
(чрескожные временные устройства), так и хрони-
ЛЖКДР = 3,9 cm
ЛЖ
Ао
ЛП
ЛЖ
Рис. 30.6 Обструкция приточной канюли при маленьком ЛЖ. В парас-
тернальной позиции по длинной оси ЛЖ демонстрируется приточная канюля
ЛЖУВК, расположенная в области верхушки (большие стрелки указывают
на контуры канюли). (A) Маленькая полость желудочка (ЛЖКДР = 3 ,9 см).
(Б) Масштабированная позиция канюли показывает втягивание папиллярных
мышц и сухожильных хорд (маленькая стрелка) в просвет канюли. Цветовая
допплерография демонстрирует цветовой артефакт наложения, указывающий
на увеличенную скорость кровотока вследствие частичной обструкции, под-
твержденной высокими скоростями кровотока и артефактом наложения в ИВ
допплеровском спектральном профиле приточной канюли (В). Ao — аорта;
ЛЖУВК — левожелудочковое устройство вспомогательного кровообращения;
ЛЖКДР — конечно-диастолический размер левого желудочка.
А
Б
В
In-30_для нас.indd 768
03.04.2019 12:05:18
769
30 Эхокардиография при механической поддержке кровообращения
ческими (долгосрочная установка УВК). У паци-
ентов с хронической сердечной недостаточностью
разгрузка желудочка, обусловленная установкой
УВК, может приводить к обратному ремоделирова-
нию, включая нормализацию размеров камер, об-
ратное развитие гипертрофии ЛЖ, восстановление
чувствительности бета-рецепторов и нормализа-
цию транспорта кальция [36–38]. Тем не менее при
декомпрессии снижение преднагрузки приводит
к нарушению систолической функции вследствие
уменьшения растяжения мышечных волокон желу-
дочка. Поэтому снижение систолической функции
при поддержке УВК не обязательно указывает на
прогрессирование дисфункции миокарда. Улучше-
ние систолической функции может быть признаком
переполнения или может предвещать разрешение
острого инфаркта и/или обратное ремоделирование
с течением времени. Ранние клинические резуль-
таты показывают, что фармакологическое воздей-
ствие способно усилить восстановление, вызванное
УВК [39, 40].
Снижение кровотока УВК приведет к увели-
чению пост- и преднагрузки. У пациентов с вос-
становленной сердечной функцией увеличение
преднагрузки приведет к улучшению функции же-
лудочков с сохранением их размера. У пациентов,
зависясящих от поддержки УВК, будет наблюдать-
ся желудочковая недостаточность и/или дилатация
из-за невозможности приспособиться к повыше-
нию пред- и постагрузки.
ТЕХНИЧЕСКИЕ ПОДРОБНОСТИ, КОЛИЧЕСТВЕННАЯ
ОЦЕНКА И АНАЛИЗ ПОЛУЧЕННЫХ ДАННЫХ
Стандартные протоколы эхокардиографической
визуализации предоставляют информацию о стро-
ении, гемодинамике и функциональном состоянии
сердца, поддерживаемого с помощью устройства
вспомогательного кровообращения. Конкретные
показания к обследованию, тип устройства, каню-
лирование, режим и настройки насоса должны быть
отмечены при каждом обследовании, так же, как и
давление крови (измеренное у пациентов с непре-
рывно-поточными устройствами с помощью доп-
плеровской манжеты для получения приблизитель-
ного значения среднего артериального давления).
Определенные характерные результаты заслужива-
ют особого внимания, и для оценки компонентов
устройства необходимо проведение исследования
в специальных проекциях. Сравнение результатов
с ранее выполненными эхокардиограммами имеет
важное значение, поскольку изменения в пара-
метрах исследований последующего наблюдения
могут свидетельствовать о клинической декомпен-
сации. Обследования, проведенные для оценки ос-
ложнений, позволяют определить патологический
процесс. Для обеспечения достоверности измерений
при всех исследованиях должны использоваться од-
ни и те же плоскости визуализации.
КОНЕЧНО-ДИАСТОЛИЧЕСКИЙ РАЗМЕР ЛЕВОГО
ЖЕЛУДОЧКА И ОРИЕНТИРОВАННОСТЬ ПЕРЕГОРОДКИ
Конечно-диастолический размер ЛЖ (ЛЖКДР), из-
меряемый в парастернальной позиции по длинной
оси, является наиболее используемым суррогатным
маркером статуса наполнения у пациентов с МПК.
Он также определяет положение межжелудочковой
перегородки, которая, в свою очередь, отражает
взаимодействие между левым и правым желудоч-
ками. В литературе сообщалось об оптимальной
разгрузке ЛЖ с уменьшением КДР на 20–30% [41].
У большинства пациентов с УВК наблюдается иде-
альное положение перегородки — в нейтральной
позиции между желудочками или с незначитель-
ным отклонением вправо (относительно длинной
оси ЛЖ) (рис. 30 .9). Подобное положение перего-
родки свидетельствует об адекватной декомпрессии
желудочков без недостатка наполнения и, вероятно,
оптимизирует вклад перегородки в сокращение
ПЖ. В случае дисфункции ЛЖУВК и переполне-
Рис. 30 .8 Неправильное положение устройства Impella Recover. (A) A В парастернальной позиции по длинной оси определяется приточный порт устройства
(стрелка, указывающая на конечную точку параллельных линий катетера), располагающийся на 4 см ниже кольца аортального клапана и прилежащий к хордаль-
ному аппарату и заднемедиальной сосочковой мышце. После первоначального соответствующего размещения устройство сместилось в апикальном направлении.
Отточный порт расположен в выносящем тракте ЛЖ, что приводит к выбросу крови в ЛЖ вместо аорты. (Б) A Проксимальный конец (приточный порт) устройства
(стрелка) находится в ВТЛЖ, менее чем на 1 см ниже кольца аортального клапана. После первоначального соответствующего размещения устройство перемести-
лось в обратном направлении, что привело к невозможности забора крови приточным портом из полости ЛЖ.
А
Б
In-30_для нас.indd 769
03.04.2019 12:05:19
770
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Рис. 30 .9 Соответствующее расположение перегородки. В парастер-
нальной позиции по длинной оси продемонстрированы нормальный размер
ЛЖ и нейтральное положение перегородки между ЛЖ и ПЖ, указывающие
на адекватную декомпрессию желудочка. Стрелки, контуры приточной канюли
непрерывно-поточного ЛЖ устройства вспомогательного кровообращения.
ния увеличивается значение ЛЖКДР, что частично
обусловлено смещением перегородки в сторону
ПЖ (рис. 30 .10A). В отличие от осевых устройств,
изменения ЛЖКДР при центробежных устройствах
могут быть не столь точным маркером динамики
наполнения [42].
Обструкция канюли, обусловленная небольшим
ЛЖ и явлением всасывания, может проявляться
уменьшением ЛЖКДР и прогибом перегородки в
сторону ЛЖ. Однако расположение перегородки в
направлении ЛЖ также может быть вызвано высо-
кими давлением в правых отделах (см. рис. 30.10Б).
Также на положение перегородки могут влиять дис-
синхрония вследствие задержки межжелудочковой
проводимости, нарушения подвижности стенки
вследствие ишемии, состояние после перенесенной
стернотомии, перикардиальная констрикция и сти-
муляция ПЖ.
Как правило, воспроизводимым является изме-
рение ЛЖКДР в двухмерной (2D) парастернальной
длинноосевой проекции на кончиках створок ми-
трального клапана [43], что позволяет обнаружи-
вать разницу в размере и положении перегородки
в ходе серийных исследований, а также ответ на
изменения в настройках насоса УВК во время опти-
мизации и при его отключении. Однако при этом
необходимо следить за тем, чтобы запись изобра-
жений каждый раз производилась в одной и той же
плоскости, и измерения выполнялись на одном и
том же уровне. 2D-направленный M-режим может
использоваться при условии, что курсор M-режима
может достигать оси, перпендикулярной стенкам
желудочков. Хотя в литературе по сердечной по-
мощи чаще всего используется прямое значение
ЛЖКДР, вероятно, его следует проиндексировать на
площадь поверхности тела [43]. Оценка положения
перегородки является субъективным показателем,
в настоящее время не имеющим количественного
значения.
ФУНКЦИЯ ЖЕЛУДОЧКОВ
Часто у пациентов с ЛЖУВК из-за артефициально-
го влияния приточной канюли трудно бывает коли-
чественно определить ФВЛЖ с помощью биплано-
вого апикального метода [43]. При наличии МПК
можно рассмотреть возможность использования
микропузырькового контрастирования для улуч-
шения определения границы эндокарда. Вычисле-
нию ФВЛЖ из линейных измерений препятствует
влияние ЛЖУВК на расположение перегородки и
размеры желудочков. Метод Quinones, который
заключается в вычислении ФВЛЖ на основании из-
мерений нескольких диаметров в двух проекциях и
без учета движения верхушки (которая может быть
акинетической у большинства пациентов с УВК),
ПЖ
ЛЖ
ПЖ
ЛЖ
Рис. 30 .10 Нарушение расположения перегородки. (A) A Расширенный ЛЖ со смещением перегородки вправо к ПЖ. В этой позиции не определяется
приточная канюля, но при просмотре видеоклипа не отмечается открытие аортального клапана, что соответствует ЛЖУВК. (Б) A Смещение перегородки влево.
В парастернальной позиции по длинной оси наблюдается диастолическое смещение перегородки в сторону ЛЖ, что указывает на недостаточное наполнение ЛЖ.
Приточная канюля визуализируется в области верхушки.
А
Б
In-30_для нас.indd 770
03.04.2019 12:05:20
771
30 Эхокардиография при механической поддержке кровообращения
теоретически привлекателен, но недостаточно под-
твержден [44].
Для комплексной визуализации функции ПЖ
требуется 2D-оценка размера и систолического
движения, а также тщательная оценка трикуспи-
дальной регургитации и измерения гемодинамики
в правых отделах сердца [45]. Исследование три-
куспидального клапана должно включать оценку
уплощения створок или пролапс, фиксацию ство-
рок к перегородке и дилатацию фиброзного кольца.
Неинвазивное измерение резистентности легочных
сосудов можно использовать в качестве показателя
влияния ЛЖУВК на постнагрузку ПЖ [46].
РАСКРЫТИЕ АОРТАЛЬНОГО КЛАПАНА
При установке устройств МПК в левых отелах
сердца обычно уменьшается открытие аортального
клапана. Относительное открытие аортального кла-
пана может служить маркером участия в сердечном
выбросе как ЛЖУВК, так и желудочка. Аортальный
клапан может открываться минимально, кратко-
временно и периодически или, в случае тяжелой
дисфункции желудочка, вообще не раскрываться.
Кроме того, открытию аортального клапана пре-
пятствует разница между давлением в ЛЖ и в аорте,
поскольку в результате декомпрессии в ЛЖ созда-
ется низкое давление, а отток ЛЖУВК увеличивает
давление в проксимальной аорте. И наоборот, в
случае восстановления желудочка или дисфункции
ЛЖУВК, приводящей к повышению давления в
ЛЖ, может наблюдаться нормальное открытие аор-
тального клапана. Было предложено, на основании
степени и частоты открытия аортального клапана
выделить открытие с каждым сердечным циклом,
периодическое открытие и отсутствие открытия
[47].
Количественная оценка степени открытия мо-
жет быть осуществлена с помощью планиметрии
открытого клапана в короткоосевой проекции или
с помощью линейного измерения расхождения
створок в длинноосевой проекции. Визуализация
в М-режиме с низкой скоростью развертки (25–
50 мм/сек) предоставляет количественную оценку
частоты открытия аортального клапана в про-
центах от зарегистрированных сердечных циклов
(рис. 30 .11). Длительность открытия может быть
измерена с помощью M-режима как время откры-
тия или как процентное значение от интервала
R-R, в котором клапан открыт. Поступательное пе-
редвижение во время систолы может приводить к
смещению аортального клапана относительно дат-
чика M-режима, что сопровождается появлением
отверстия при фактически закрытом клапане.
Открытие может быть подтверждено с помощью
длинной 2D-записи или использования цветового
M-режима [47].
ПЕРИКАРД
2D-визуализация позволяет выявить наличие экс-
судата или тромбов в перикардиальном простран-
стве, сжимающих сердечные камеры, что приво-
дит к недостаточному наполнению и обструкции
приточной канюли (см. рис. 30 .7). Значительное
увеличение кровотока через клапан, оцениваемое
с помощью допплерографии, в поддерживаемом
желудочке не может использоваться в качестве по-
казателя внутриперкардиального давления, потому
что на кровоток влияет работа УВК, которая, в свою
Рис. 30 .11 Открытие аортального клапана. (A) Визуализация в M-режиме из парастернальной позиции по длинной оси демонстрирует снижение степени
открытия аортального клапана с каждым ударом (стрелки), что соответствует нормальному функционированию ЛЖ устройства вспомогательного кровообращения
(ЛЖУВК), предотвращающей формирование тромбов в корне аорты. Двусторонние стрелки показывают продолжительность и степень открытия, что можно изме-
рить для количественного сравнения результатов исследований или работы насоса ЛЖУВК при разных настройках. Увеличение открытия может быть признаком
перенаполнения или восстановления желудочка. (Б) Отсутствие открытия аортального клапана, что может наблюдаться при очень низком остаточном сердечном
выбросе, высокой производительности насоса ЛЖУВК, наложении дополнительных швов на клапан для предотвращения аортальной регургитации или при сра-
щении створок.
А
Б
In-30_для нас.indd 771
03.04.2019 12:05:21
772
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
очередь, зависит от пост- и преднагрузки. Камеры
искусственного сердца непрозрачны для ультразву-
ка, но нативные предсердия, легочные вены, верх-
няя и нижняя полые вены могут быть оценены на
предмет компрессии или коллапса.
КАНЮЛИ
2D-визуализация, особенно с ЧПЭхоКГ, позволяет
определять расположение канюлей и наличие вса-
сывания в них структур сердца (таких как трабеку-
лы, перегородка и хордальные структуры) (см. рис.
30.6). При выполнении исследования с помощью
2D-визуализации также необходимо оценивать
наличие тромбов и вегетаций на канюлях. При-
точные канюли следует отображать во всех окнах.
3D-визуализация может быть использована для
определения локализации канюли и ее взаиморас-
положения по отношению к другим структурам
(например, перегородке). Для приточной канюли
ЛЖУВК в апикальных проекциях наиболее часто
встречается параллельный допплеровский угол об-
лучения звуком. Тем не менее, расположение при-
точной канюли ЛЖУВК может быть вариабельным,
и самый параллельный угол иногда наблюдается в
парастернальной длинноосевой или в подреберной
проекции, особенно если канюля была установлена
из нижнего доступа. Для адекватной визуализации
приточных канюлей устройств МПК, установлен-
ных в другие сердечные камеры, часто требуются
проведение ЧПЭхоКГ (особенно канюли ЭКМО,
Centrimag и TandemHeart, расположенные в пред-
сердиях). Отображение отточной канюли ЛЖУВК,
расположенной в восходящей аорте, иногда трудно
выполнимо с помощью трансторакальной эхокар-
диографии (ТТЭ), и лучше всего она визуализиру-
ется в правой парастернальной, верхней левой па-
растернальной, правой надключичной проекциях
или проекции из яремной ямки (рис. 30 .12A, Б).
Достичь должной визуализации обычно удается с
помощью ЧПЭхоКГ (см. рис. 30 .12В).
Канюля чрескожного УВК Impella Recover обыч-
но хорошо видна в парастернальной длинноосевой
проекции, но для обеспечения визуализации дис-
тального конца может потребоваться расположение
датчика под углом к оси (см. рис. 30 .8). Расстояние
от кольца аортального клапана до приточной каню-
ли является критерием правильного расположения.
При правильной локализации приточный порт
(около дистального конца канюли) находится на
3–4 см ниже аортального клапана. Если расстояние
составляет менее 3 см, то приточная канюля может
находиться в ВТЛЖ или выше аортального клапа-
на; если превышает 4 см, то отточная канюля может
находиться в ВТЛЖ, а не в аорте, что приводит к
неэффективной функции устройства (поскольку
как приток, так отток расположены в одной камере).
Порт оттока идентифицируется не так легко. Иногда
его расположение определяется по струе цветовой
допплерографии, однако часто это затрудняется в
связи с наличием артефактов. При правильном раз-
мещении он должен находиться на 1,5–2 см выше
синусов Вальсальвы [32].
Исследование с помощью цветовой допплеро-
графии нормально расположенных канюлей выяв-
ляет ламинарный поток с минимальным потоком
регургитации или его отсутствием. В случае частич-
ной обструкции приточной или отточной канюли
может наблюдаться искажение контура цветового
потока. При полной обструкции или отказе насо-
са может определяться снижение интенсивность
цветовой доплеровской струи притока. Цветовая
доплеровская струя может также помочь в выборе
наклона датчика для достижения параллельного
Ао
Рис. 30 .12 Визуализация имплантированной отточной канюли левого желудочка устройства вспомогательного кровообращения. (A) Отточная
канюля ЛЖУВК у многих пациентов может быть визуализирована с помощью ЧПЭхоКГ в области правой верхней границы грудины, но выбор окна визуализации
зависит от местоположения имплантированной канюли, что может быть вариабельно. Стрелки, контуры имплантированной канюли. (Б) Несмотря на то что импуль-
сно-волновой допплеровский профиль, являющийся внеосевым по отношению к оси кровотока, демонстрирует нормальный базальный кровоток с наличием систо-
лических пиков. (В) В отличие от приточной канюли (вставленной через стенку верхушки ЛЖ), имплантированная отточная канюля анастомозирует с восходящей
аортой по принципу «конец в бок» (также см. рис. 30 .16Б.). Имплантированную отточную канюлю, как правило, очень легко визуализировать помощью ЧПЭхоКГ
в положении из среднего отдела пищевода на 90–150 градусов, в зависимости от места анастомоза. Стрелки: контуры имплантированной канюли. Ao — корень
аорты.
А
Б
В
In-30_для нас.indd 772
03.04.2019 12:05:21
773
30 Эхокардиография при механической поддержке кровообращения
выравнивания для спектрального допплеровского
опроса.
С помощью импульсно-волновой допплерогра-
фии следует провести исследование внутреннего
пространства входа канюли и непосредственно при-
лежащей области. Исследование с помощью непре-
рывно-волновой допплерографии должно выпол-
няться с выравниванием по длинной оси канюли на
столько, на сколько это возможно. Допплеровские
профили приточной и отточной канюлей в норме
и при нарушениях проиллюстрированы на рис.
30.13. В зависимости от места частичной обструк-
ции произойдет увеличение скоростей притока и
оттока. Полная обструкция, как при тромботиче-
ской окклюзии или перегибе, приводит к потере
допплеровского сигнала или снижению скоростей
в канюлях УВК [48]. Регургитация, обструкция
притока и отказ насоса могут привести к снижению
скорости оттока. Тромбоз насоса может проявлять-
ся в виде снижения «фоновых», «пороговых» или
«базальных» скоростей через приточную канюлю
(обычно определяемые в диастоле, эти скорости об-
условлены функцией УВК, тогда как систолические
пиковые скорости возникают в следствие комби-
нации функции УВК и остаточного систолической
сокращения желудочков, проталкивающей кровь
в канюлю, см. рис. 30.13). Необходимо учитывать
фоновые скорости в соотношении к предыдущим
значениям и систолическим пиковым скоростям
(отношение пиковых к фоновым или пороговым),
а не ставить диагноз обструкции на основании кон-
кретных значений, поскольку часто трудно бывает
достигнуть полного выравнивания угла облучения
звуком приточной канюли [49].
Опрос притока центробежных устройств у
большинства пациентов осложнен наличием арте-
фактов (рис. 30 .14) и, несмотря на недостаточную
достоверность, вместо этого следует использовать
отношение пиковых скоростей оттока графта к фо-
новым или пороговым. Непрерывно-волновая доп-
плерография необходима для определения высоких
скоростей, но в связи с неоднозначностью диапазо-
на на сигнал могут накладываться сигналы других
потоков (например, приток ЛЖУВК и АР).
В табл. 30 .7 приведены формулы, применяемые
для расчета ударного объема при использовании
пульсирующих УВК, кровотока через непрерыв-
но-поточные УВК и регургитации УВК на основе
оценки площади поперечного сечения и ИВ доппле-
Рис. 30.14 Допплеровский артефакт. Желудочковые устройства вспомо-
гательного кровообращения с непрерывно-поточными насосами, расположен-
ными близко к сердцу, создают доплеровские артефакты. На данном рисунке
показано артефициальное заполнение всего допплеровского сектора в парас-
тернальной позиции по длинной оси. Артефакт расположен в среднем отделе
ЛЖ и исключает возможность проведения какой-либо оценки кровотока из или
в приточной канюле (контуры обозначены стрелками).
ПГГ
Рис. 30 .13 Допплеровский профиль канюли левожелудочкового устройства вспомогательного кровообращения (ЛЖУВК). (A) Нормальный непре-
рывно-волновой допплеровский профиль отточного графта ЛЖУВК при ЧПЭхоКГ из среднего отдела пищевода. Пиковая скорость кровотока достигает 0,85 м/сек
(сплошная линия), а пороговая/базальная скорость кровотока равна 0,72 м/сек (пунктирная линия). (Б) Увеличение непрерывно-волновой допплеровской скорости
кровотока в отточном графте ЛЖУВК, полученной с помощью датчика Pedoff на правой верхней границе грудины (ПГГ). Пиковая непрерывно-волновой доппле-
ровская скорость кровотока составляет 2,5 м/сек (сплошная линия). Базальные/пороговые скорости также повышаются до 1,2 м/сек, что указывает на обструкцию
канюли. ПГГ указывает на расположение датчика у правой границе грудины.
А
Б
In-30_для нас.indd 773
03.04.2019 12:05:22
774
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
ровского интеграла скорости кровотока. Поскольку
непрерывно-поточные УВК технически не имеют
дискретного ударного объема, кровоток УВК (в
литрах в минуту) должен быть рассчитан косвенно,
используя остаточный отток через аортальный кла-
пан и отток через легочный клапан или выносящий
тракт ПЖ, или непосредственно путем измерения
времени доплеровского интеграл кровотока за 3
секунды (умножается на 20 секунд для преобразова-
ния в минутный кровоток) [50].
ВЫБОР ОПТИМАЛЬНЫХ ВАРИАНТОВ
Для оптимизации настроек УВК используются
ЛЖКДР, положение перегородки и открытие аор-
тального клапана. Для непрерывно-поточных УВК
скорость ротора регулируется до тех пор, пока пере-
городка не займет нейтральное положение при прак-
тически нормальном ЛЖКДР и не будет достигнуто
открытие аортального клапана в небольшой степе-
ни в течение короткого периода времени и/или с
уменьшенной частотой. Не четко определены опти-
мальные характеристики открытия для предотвра-
щения тромбоза корня аорты и сращения створок
в условиях надлежащей желудочковой декомпрес-
сии. К другим целям оптимизации можно отнести
митральную регургитацию, аортальную регургита-
цию, давление в легочной артерии и полученные с
помощью допплерографии показатели кровотока в
канюлях. Оптимизация функции ПЖУВК и БиУВК
до сих пор описана не очень хорошо, но к ней мо-
гут быть применены те же принципы: размер ПЖ,
Формула
Показатели
Ударный объем (УО) пульсирующих УВК (УВКп)
УОУВКп = π (Dкан/2)2 × VTIкан
Dкан = диаметр канюли (обычно 12–25 мм)
VTIкан = VTI, измеренный на основании ИВ допплеграфического
сигнала непосредственно внутри отверстия канюли
Непрерывно-поточные ЛЖУВК (УВКн)
УОУВКн = [π (DВТПЖ/2)2 × VTIВТПЖ] – [π (DВТЛЖ/2)2 ×
VTIВТЛЖ]
DВТПЖ = диаметр выносящего тракта ПЖ
VTIВТПЖ = VTI выносящего тракта ПЖ
DВТЛЖ = диаметр выносящего тракта ЛЖ
VTIВТЛЖ = VTI выносящего тракта ЛЖ
УОУВКн = VTIкан3с × 20 × π (Dкан/2)2 × C
C = поправочный коэффициент для приточной канюли = (0,67)
VTIкан3с = 3 секундное отслеживание VTI канюли непрерывно-по -
точного УВК
Объем регургитации (ОР) пульсирующих УВК
ОРУВКп = [π (DПР/2)2 × VTIПР] – [π (DОТ/2)2 × VTIОТ]
VTIПР = VTI приточной канюли
VTIОТ = VTI отточной канюли
DОТ = диаметр отточной канюли
DПР = диаметр приточной канюли
Объем регургитации (ОР) непрерывно-поточных УВК
ОРУВКн = [π (Dasc/2)2 × VTIasc] − [π (DЛА/2)2 × VTIЛА]
Dasc = диаметр восхродящей аорты
DЛА = диаметр легочной артерии
VTIasc = VTI восходящей аорты над отточной канюлей
VTIЛА = VTI легочной артерии
D — диаметр; VTI — интеграл скорости кровотока; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желу-
дочка; ИВ — импульсно-волновой; ЛА — легочная артерия; ЛЖУВК — левожелудочковое устройство вспомогательного кровообраще-
ния; УВК — устройство вспомогательного кровообращения.
ТАБЛИЦА 30.7 Допплеровые формулы для объема потока вспомогательного устройства желудочков
расположение перегородки и открытие легочного
клапана.
RAMP-ПРОТОКОЛ ИССЛЕДОВАНИЙ
Эхокардиографические показатели, исследуемые
при выполнении ramp-протокола эхокардиограм-
мы, оценивают структурные и функциональные
изменения, возникающие по мере увеличения
скорости подачи и выявляют явления всасывания.
При условиях отрицательного ответа на ramp (от-
сутствие тромбоза насоса), ЛЖКДР должен умень-
шаться, и аортальный клапан должен демонстри-
ровать уменьшение степени и продолжительности
открытия и, в конце концов, оставаться в закрытым
состоянии на протяжении всего сердечного цик-
ла. Спектральный допплеровский опрос канюлей
должен демонстрировать увеличение базального/
порогового кровотока. Митральное время замедле-
ния кровотока должно увеличиваться, а степень ми-
тральной регургитации может уменьшаться. Уве-
личение левостороннего объема кровообращения
приводит к увеличению возврата крови в ПЖ. Ин-
теграл скорости кровотока выносящего тракта ПЖ,
как показатель сердечного выброса, должен увели-
чиваться по мере того, как функция ПЖ приходит
в соответствие увеличению левостороннего объема
кровообращения с помощью ЛЖУВК. Тем не менее
повышение преднагрузки ПЖ в сочетании со сме-
щением перегородки в сторону ЛЖ может приво-
дить к увеличению трикупидальной регургитации.
Может увеличиваться степень аортальной регур-
In-30_для нас.indd 774
03.04.2019 12:05:22
775
30 Эхокардиография при механической поддержке кровообращения
гитации и/или нарастать центральное давление в
аорте с увеличением оттока в восходящей аорте, что
во время исследования по ramp-протоколу может
привести к невозможности достигнуть декомпрес-
сии ЛЖ и ложноположительному результату [51].
ОТЛУЧЕНИЕ ОТ УСТРОЙСТВА И ОТКЛЮЧЕНИЕ
Перед эксплантацией устройства МПК обычно не-
обходимо провести отлучение с целью демонстра-
ции влияния сниженной поддержки на структуру
и функцию сердца. Различные протоколы обычно
включают эхокардиографию с мониторингом арте-
риального и венозного давления или без него. Для
предотвращения острой декомпенсации проводится
поэтапное снижение поддержки, осуществляемой с
помощью устройства вспомогательного кровообра-
щения. На рис. 30 .15 представлен обзор эхокарди-
ографических параметров, используемых во время
отключения. Если после отключения устройства
уровень необходимой поддержки минимален, со-
гласно некоторым протоколам, требуется проведе-
ние стресс-тестирования с физической нагрузкой
или добутамином. Иногда дополнительно прово-
дится оценка потребления кислорода. Эхокардио-
графическая визуализация с максимальной физиче-
ской нагрузкой проводиться путем стресс-велоэрго-
метрии в положении лежа на спине. При улучшении
показателя ФВЛЖ, увеличении степени открытия
аортального клапана и ударного объема в ответ на
введение добутамина резерв сердца для поддержки
пациента после эксплантации МПК можно считать
удовлетворительным [52].
Менее хорошо описаны эхокардиографические
протоколы отлучения от правосторонних устройств
вспомогательного кровообращения и ЭКМО. Про-
гнозировать восстановление или недостаточность
ПЖ по мере уменьшения кровотока можно на ос-
новании показателей центрального венозного дав-
ления, функции ПЖ, давления наполнения ЛЖ и
трикуспидальной регургитации [53].
Как для отлучения от долгосрочных УВК, так и от
временных чрескожных устройств МПК, неудачные
результаты отключения характеризуется заметным
расширением камеры, увеличением регургитации
на атриовентрикулярном клапане и иногда сниже-
нием систолической функции желудочков.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ И РЕЗУЛЬТАТЫ
Эхокардиография играет важную роль в ведении
пациентов с устройствами МПК: от установления
показаний к МПК до определения причины воз-
никновения аварийного сигнала устройства. Тем не
менее, лишь в небольшом количестве исследований
была продемонстрирована специфичность метода
эхокардиографии.
↓ ЛЖКДР
Перегородка ↔
↑ ФВЛЖ
↑ Параметры систолической
деформации
↑ Открытие АК
↑ ИСК ВТЛЖ
↔МР
↔ Размер ПЖ
↔ Функция ПЖ
Постепенное
снижение
поддержки ЛЖУВК
+ резерв ЛЖ,
кандидаты
на
эксплантацию
Неудачное
отключение
Рассмотрите добутаминовую
стресс-эхокардиографию,
эхокардиографию с физической
нагрузкой на беговой дорожке
или велоэргометрией
↑ ЛЖКДР
Перегородка → ПЖ
↓ Показателей систолической
деформации
↔ Открытие аортального клапана
↑МР
Регургитация на канюле
↑ Давления в ПП
↑ Размера ПЖ
↓ Функции ПЖ
Рис. 30 .15 Отлучение от левожелудочкового устройства вспомогательного кровообращения. В данной схеме указаны эхокардиографические пара-
метры, которые могут быть использованы для определения наличия у пациента восстановления ЛЖ и возможности проведения эксплантации устройства. Те же
параметры, которые использовались во время фазы «отключения», можно оценить с помощью стресс-тестирования с физической нагрузкой или введением
добутамина. К ним относятся ЛЖКДР, ориентацию перегородки, ФВЛЖ , открытие АК, VTI ВТЛЖ , степень МР и размер и функцию ПЖ. Имеется мало данных о
способности любых специфических измерений быть окончательным прогностическим фактором восстановления. АК — аортальный клапан; ВТЛЖ — выносящий
тракт левого желудочка; VTI — интеграл скорости кровотока; ЛА — легочная артерия; ЛЖКДР — конечно-диастолический размер левого желудочка; ЛЖУВК —
левожелудочковое устройство вспомогательного кровообращения; МР — митральная регургитация; ФВЛЖ — фракция выброса левого желудочка.
In-30_для нас.indd 775
03.04.2019 12:05:22
776
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Сообщалось, что данные доимплантационной
эхокардиографии, отражающие строение и функ-
цию ПЖ, позволяют прогнозировать дисфункцию
ПЖ после имплантации ЛЖУВК. Тем не менее, толь-
ко в ходе нескольких исследований была проведена
всесторонняя оценка методов эхокардиографии. В
ходе разных исследований проводился анализ раз-
личных параметров, и большинство исследований
являются одноцентровыми. В ходе исследования,
проведенного в 2015 году, по изучению различных
многокомпонентных факторов риска для развития
постимплантационной недостаточности ПЖ было
выявлено лишь незначительное прогностическое
значение показателей, но в это исследование не бы-
ли включены показатели риска с количественными
эхокардиографическими параметрами [54].
Еще меньше исследований было направлено на
изучение постимплантационной функции ПЖ и
ее влияние на клинические показатели. Результаты
небольшого исследования продемонстрировали
улучшение систолических и диастолических пара-
метров ПЖ, измеренных с помощью оценки дефор-
мации методом спекл-трекинг [55]. Maeder и соавт.
[23] показали, что улучшение функции ПЖ после
имплантации ЛЖУВК коррелировало со снижение
показателя летальности и улучшением функции
почек. Lam и соавт. [56] сообщили, что более 10%-
ное снижение фракционного изменения площади
ПЖ после имплантации предсказывало ухудшение
качества жизни и способности переносить физи-
ческую нагрузку. Simon и соавт. [57] обнаружили,
что функция ПЖ после имплантации коррелирует с
более низким уровнем максимального потребления
кислорода.
Эхокардиографические исследования по ramp-
протоколу могут предсказать тромбоз насоса, вы-
являемый при эксплантации устройства, но частич-
ный тромбоз бывает сложнее определить по теку-
щим измерениям. Таким образом, отрицательные
результаты исследования по ramp-протоколу могут
быть ошибочно успокаивающими при условии на-
личия клинических параметров, позволяющих за-
подозрить тромбоз несмотря на то, что клинические
параметры могут быть чрезвычайно вариабельными
[58]. В ходе исследования по ramp-протоколу в усло-
виях выраженной аортальной регургитации или по-
вышенного системного сосудистого сопротивления
могут отсутствовать изменения размера желудочка,
что приведет к ложноположительным результатам.
В ходе ранних исследований по изучению при-
менения эхокардиографических показателей для
прогнозирования благополучной эксплантации
ЛЖУВК, включая пульсирующие устройства [59].
В ходе одного исследования исходное значение (до
отключения) ЛЖКДР менее 5,5 см и ФВЛЖ более
45% являлись прогностическими факторами вос-
становления ЛЖ, причем у 87,5% этих пациентов
«сердечная стабильность» сохранялась на протя-
жении более 5 лет [60]. Измеренные с помощью
тканевой доплерографии пиковые систолические
скорости движения стенки (S′ больше или равно 8)
как в радиальном, так и в продольном направлени-
ях на основании нижнебоковой стенки также явля-
ется прогностическим фактором восстановления.
В ходе исследования, проведенного в 2010 г. той же
группой ученых, было продемонстрировано, что
5-летняя выживаемость без явлений сердечной не-
достаточности составила 92% у пациентов с ФВЛЖ
более 50% и 79% — у пациентов с ФВЛЖ 45% и бо-
лее, измеренной с помощью эхокардиографии при
«выключенном насосе» [61]. В 2011 году проведено
исследование, в ходе которого изучалось восста-
новление пациентов, у которых были установлены
непрерывно-поточные насосы и проводилась меди-
каментозная терапия. Для определения возможно-
сти проведения эксплантации были использованы
следующие эхокардиографические параметры: при
работе ЛЖУВК в режиме 6000 об/мин в течение 15
минут: (1) ЛЖКДР < 60 мм, (2) ЛЖКСР < 50 мм и
(3) ФВ > 45% [62]. Результаты исследования также
свидетельствуют о том, что у пациентов с ЛЖУВК
положительная реакция при тестировании с физи-
ческой нагрузкой или введением добутамина указы-
вала на восстановление желудочков, позволяющее
выполнить эксплантацию УВК (табл. 30 .8) [40].
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ И ПЕРСПЕКТИВЫ
Эхокардиографическая визуализация в постим-
плантационном периоде имеет ряд трудностей,
связанных с наличием повязок, искусственной вен-
тиляцией легких и расположением пациента, что
мешает произвести оценку в определенных окнах
визуализации. В дополнение к артефактам осла-
Минимальный уровень
ЛЖКДР < 5,5 см
ФВЛЖ > 45–50%
Пиковая продольная систолическая допплеровская скорость
≥ 8 см/сек
Пиковая радиальная систолическая допплеровская скорость
≥ 8 см/сек
Отключение с минимальной поддержкой
(HM II 6000 об/мин после 15 мин)
ЛЖКДР < 6,0 см
ЛЖКСР < 5,0 см
ФВЛЖ > 45%
HM II — HeartMate II левожелудочковое устройство вспомогатель-
ного кровообращения, Thoratec; ЛЖКДР — конечно-диастоли-
ческий размер левого желудочка; ЛЖКСР — конечно-систоличе -
ский размер левого желудочка; ФВЛЖ — фракция выброса лево-
го желудочка.
ТАБЛИЦА 30.8 Клинические прогностические факторы
восстановления
In-30_для нас.indd 776
03.04.2019 12:05:22
777
30 Эхокардиография при механической поддержке кровообращения
бления интенсивности, созданным приточными
канюлями, значительные артефакты обусловлены
непрерывно-поточными роторными устройствами.
УВК с непрерывно-поточными насосами, располо-
женные очень близко к приточной канюле или в
ней непосредственно (см. табл. 30 .2), создают арте-
факты искажений при допплерографии вследствие
ультразвуковых сигналов, возникающих при вра-
щении диска (см. рис. 30 .14). Избегая обследования
в области установленного устройства можно опро-
сить другие структуры сердца с помощью цветовой
и спектральной допплерографии. Но артефакты
цветового наложения или регургитация создают
препятствия для оценки приточной канюли этих
устройств, в следствие чего в них невозможно изме-
рить скорость кровотока. Цветовой или спектраль-
ный опрос отточной канюли остаются неизменен-
ными.
В плоскостях 2D-визуализации не всегда удается
определить ориентацию канюли, расположение от-
верстий и приближенность к желудочковым струк-
турам. Трехмерная (3D) эхокардиография в режиме
реального времени может играть определенную
роль для более точного определения положения
канюли. 3D-визуализация приточной и отточной
канюлей ЛЖУВК достигается из позиции на уровне
среднего отдела пищевода (рис. 30 .16). 3D-ЧПЭхоКГ
также обеспечивает наилучшую визуализацию ка-
нюлей, размещенных в ПП и ЛП. 3D-визуализация
в режиме реального времени может помочь в ото-
бражении всей канюли устройства Impella Recover,
которая обычно располагается под углом к плоско-
сти 2D-визуализации. 3D-эхокардиография в ре-
жиме реального времени позволяет также провести
оценку размера и функции ПЖ, что является вер-
ным прогностическим фактором недостаточности
ПЖ после имплантации.
Стеноз аорты, обусловленный сращением ство-
рок или дегенеративным поражением, трудно под-
дается оценке в условиях ЛЖУВК, поскольку при
этом, как правило, кровоток через клапан неболь-
шой. Выявление и измерение стеноза аорты требует
процедуры отключения устройства для увеличения
степени открытия аортального клапана. Если уве-
личение преднагрузки не сопровождается увели-
чением сердечного выброса, а степень открытия
аортального клапана остается неизменной, можно
ввести добутамин в попытке стимулировать сер-
дечный выброс, как при оценке слабо выраженного
аортального стеноза. Улучшение функции ЛЖ без
увеличения степени открытия аортального клапа-
на свидетельствует о сращении створок (и долж-
но сопровождаться увеличением кровотока через
ЛЖУВК).
Хотя благоприятный ответ при стресс-тести-
ровании с физической нагрузкой или введением
добутамина позволяет предположить восстанов-
ление с возможностью проведения эксплантации,
необходим более точный и независящий от на-
грузки показатель внутреннего резерва миокарда.
Показатели деформации и скорости деформации
миокарда являются лучшими прогностическими
факторами восстановления. Также полезным может
быть показатель изоволюметрического ускорения,
измеряемый с помощью тканевой допплерографии
или метода спекл-трекинга [63].
Значение показателей диастолической функции
и давления в левых отделах сердца сложнее опреде-
лять после размещения устройства вспомогатель-
ного кровообращения. Пульсирующие ЛЖУВК с
асинхронным режимом и непрерывно-поточные
УВК перемещают кровь к верхушке ЛЖ независимо
от релаксации желудочков. В ходе одного исследо-
вания непрерывно-поточных устройств было про-
Рис. 30 .16 Трехмерная визуализация канюлей левожелудочкового устройства вспомогательного кровообращения. (A) При 3D-ЧПЭхоКГ из среднего
отдела пищевода в режиме реального времени продемонстрировано нормальное расположение приточной канюли (стрелка) в области верхушки ЛЖ (преобразо-
ватель объемных данных повернут для обзора областей, расположенных ниже и кзади от передней плоскости). Отсутствует обструкция отверстия какими-либо
структурами сердца. (Б) 3D-ЧПЭхоКГ из среднего отдела пищевода в режиме реального времени демонстрирует отверстие имплантированной отточной канюли
(стрелка) в проксимальной части восходящего отдела аорты. В отличие от приточной канюли имплантированная отточная канюля анастомозирует с аортой по типу
«конец в бок».
А
Б
In-30_для нас.indd 777
03.04.2019 12:05:22
778
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
демонстрировано, что диастолические параметры
могут быть применимы для определения давления
наполнения ЛЖ [64].
АЛЬТЕРНАТИВНЫЕ ВАРИАНТЫ
Магнитно-резонансная томография (МРТ) сердца
обеспечивает высокую точность измерения объема
и функции желудочков. Кроме того, с помощью
МРТ можно точно измерить размер и функцию
ПЖ, что потенциально помогает в прогнозирова-
нии функции ПЖ после имплантации. С помощью
МРТ также можно точно визуализировать аорту и
определить возможные трудности при размещении
устройства Impella Recover и отточной канюли [65].
Однако МРТ нельзя применять после имплантации
устройств МПК нового поколения.
После имплантации может быть использована
компьютерная томография (КТ). Исследования де-
монстрируют высокую чувствительность и специ-
фичность для выявления тромбоза канюли и непра-
вильного расположения приточной канюли [66, 67].
Большинство канюлей не вызывают значительных
артефактов при КТ, и прямая визуализация ориен-
тации канюли легко воспроизводится на основании
совокупности данных. Данный метод позволяет
исследовать канюли на всем протяжении. КТ так-
же обеспечивает отличную визуализацию аорты. К
недостаткам метода КТ можно отнести лучевую на-
грузку и нефротоксичность контрастного вещества,
вызывающую особую настороженность у пациен-
тов с УВК, у которых часто наблюдается нарушение
функции почек.
Несмотря на то, что результаты предваритель-
ных исследований свидетельствуют о том, что
допплеровская оценка легочного давления и ре-
зистентности легочных сосудов применима после
имплантации ЛЖУВК, у большого числа пациен-
тов требуется дальнейшие исследования. В то же
время для выбора тактики лечения могут потре-
боваться инвазивные показатели внутрисердечной
гемодинамики для точного определения давления
наполнения, сердечного выброса и резистентности
легочных сосудов. Инвазивные гемодинамические
показатели также могут быть необходимы для
оценки тяжести поражения клапанов, особенно при
наличии ограничений для эхокардиографической
визуализации.
Параметры
Основные методы визуализации/методики
До имплантации Систолическая функция ЛЖ
ФВЛЖ двухпроекционным дисковым методом
3D-измерение объема
Контрастирование
Размер ЛЖ
ЛЖКДР на дистальных кончиках створок МК (особенно для осевых
устройств)
Двухпроекционный дисковый метод
3D-измерение объема
Контрастирование
Внутрисердечный тромбоз
Тщательное сканирование верхушки ЛЖ
Контрастирование
ЧПЭхоКГ для оценки ушка ЛП (фибрилляция предсердий, трепетание
предсердий)
Размер ПЖ
Стандартные методики (например, базальный, продольный диаметр и
диаметр среднего отдела)
Рассмотрите возможность выполнения 3D
Систолическая функция ПЖ
Стандартные методики (например, фракционное изменение площади,
ССТК, s′ свободной стенки, пиковая систолическая продольная дефор-
мация свободной стенки, VTIВТПЖ)
СДЛА и ДПП
Рассмотрите возможность выполнения 3D
Трикуспидальная регургитация Степень регургитации, превышающая умеренную, является показанием
к проведению пластической операции на трикуспидальном клапане во
время имплантации ЛЖУВК
Проведите интеграцию оценки размера струи регургитации с другими па-
раметрами (например, допплеровсекий спектр печеночной вены, размер
и коллапс НПВ, смещение пежпредсердной перегородки влево, размер
ПП, СДЛА)
СВОДНАЯ ИНФОРМАЦИЯ
Диагностически ориентированное практическое руководство по визуализации
In-30_для нас.indd 778
03.04.2019 12:05:23
779
30 Эхокардиография при механической поддержке кровообращения
Параметры
Основные методы визуализации/методики
Митральная регургитация
Стандартные методы (например, ширина vena contracta, PISA, EROA
и объем регургитации, реверсивный кровоток в легочных венах)
Степень функциональной МР должна снизиться после имплантации
ЛЖУВК
Митральный стеноз
При наличии стеноза митрального клапана во время имплантации
ЛЖУВК должно быть выполнено протезирование клапана
Стандартные методики (например, время полуснижения давления,
пиковый и средний градиенты, площадь, измеренная с помощью
3D-режима)
Интеграция с другими параметрами (например, СДЛА)
Аортальная регургитация
После имплантации может усугубиться
Стандартные методы (например, ширина vena contracta)
Аортальный стеноз
Несмотря на то, что ЛЖУВК работает в обход аортального клапана, при
отказе устройства могут возникнуть серьезные проблемы
Стандартные методики (например, пиковая скорость кровотока, средние
градиенты, ОАК)
Внутрисердечные шунты
После имплантации ЛЖУВК может создаться правосторонний или лево-
сторонний шунт
Контрастирование с возбужденным солевым раствором с пробой Валь-
сальвы позволяет исключить ООО
Аорта
Проксимальная аневризма аорты
Наличие бляшек в дуге и восходящей части аорты
Рассмотрите применение КТ или МРТ
Периоперацион-
ная ЧПЭхоКГ
Аортальная регургитация
Повторная оценка (в условиях анестетической нагрузки может быть вы-
явлена выра женная аортальная регургитация)
Внутриседечные шунты
Повторная оценка для выявления внутрипредсердного шунтирования
Размер ЛЖ и позиция перего-
родки
Используется для контроля настройки оборотов
ЛЖКДР на дистальных кончиках створок МК (особенно для осевых
устройств)
Двухпроекционные дисковые методы
3D-измерение объема
Смещение перегородки влево или вправо
Размер и функция ПЖ
Стандартные методы оценки эффективности устройств МПК (перенапол-
нение при ЛЖУВК, меленький размер камеры ПЖ при ПЖУВК/ЭКМО)
Трикуспидальная регургитация Стандартные методы оценки отягощения, связанного с устройством МПК
Митральная регургитация
Стандартные методы, результаты сравнивают с изначальным уровнем
настройки подачи
Руководство размещения
устройства
Приточная канюля ЛЖУВК направлена на митральный клапан
Приточный порт устройства Impella располагается на 3–4 см ниже аор-
тального клапана
Приточная канюля устройства TandemHeart — в ЛП
Устройство Centrimag — в соответствующей камере
Приточная канюля устройства ЭКМО — в ПП
Дэаэрация
Тщательная обследование передних структур и областей анастомозов
с канюлями
Наблюдение
после имплан-
тации
Систолическая функция ЛЖ
ФВЛЖ двухпроекционным дисковым методом
3D-измерение объема
Контрастирование
Размер ЛЖ
ЛЖКДР на уровне дистальных кончиков створок МК (особенно для осе-
вых устройств), визуализация каждый раз в одной и той же плоскости
Двухроекционный дисковый метод 3D-измерения объема
Контрастирование
Внутрисердечный тромбоз
Тщательное сканирование верхушки ЛЖ, ВТЛЖ и корня аорты
Контрастирование
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Диагностически ориентированное практическое руководство по визуализации
In-30_для нас.indd 779
03.04.2019 12:05:23
780
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Параметры
Основные методы визуализации/методики
Размер ПЖ
Стандартные методы (например, диаметр основания, среднего отдела и
продольный диаметр)
Рассмотрите возможность выполнения 3D
Систолическая функция ПЖ
Стандартные методы (например, фракционное изменение площади,
ССТК, s′ свободной стенки, пиковая скорость продольной деформации
свободной стенки, VTIВТПЖ)
СДЛА и ДПП
Рассмотрите возможность выполнения 3D
Трикуспидальная регургитация После имплантации ЛЖУВК смещение перегородки и фиксация створки
к перегородке может привести к усугублению ТР
Интеграция оценок размера струи и других параметров (например, доп-
плеровский спектр печеночных вен, размер и коллапс НПВ, смещение
межпредсердной перегородки влево, размер ПП, СДЛА)
Митральная регургитация
Ухудшение/неизменность МР может свидетельствовать о перенаполнении
Стандартные методы (например, ширина vena contracta, PISA, EROA и
объем регургитации, реверсивные потоки в легочных венах)
Открытие аортального клапана Показатель систолической функции и наполнения ЛЖ
М-режим в ПДО проекции для оценки створок АК
Цветовой М-режим
Аортальная регургитация
После имплантации может усугубиться и стать непрерывной
Стандартные методы (например, ширина vena contracta), обратите внима-
ние, что при непрерывности степень тяжести увеличивается
Канюли/расположение устрой-
ства и скорости кровотока
Часто требуется внеосевая визуализация
Централизованность расположения приточной канюли ЛЖУВК; доппле-
ровские скорости кровотока: пиковая и базальная/пороговая
Пиковая и базальная/пороговая допплеровские скорости кровотока от-
точного графта
Приточный порт устройства Impella ниже 3–4 см аортального клапана
Приточная канюля устройства TandemHeart в ЛА
Устройство Centrimag в соответствующей камере
Приточная канюля ЭКМО в ПП
Акцент на про-
блемы, возни-
кающие после
имплантации
Систолическая функция ЛЖ
ФВЛЖ двухпроекционным дисковым методом
3D-измерение объема
Контрастирование
Размер ЛЖ
Показатель перенаполнения, нарушение функции устройства, явления
всасывания или недостаточного наполнения (в частности, изменения от
исходного уровня). ЛЖКДР на дистальных кончиках створок МК (осо-
бенно для осевых устройств); каждый раз визуализация в одних и тех же
плоскостях
Двухпроекционный дисковый метод
3D-измерение объема
Контрастирование
Внутрисердечный тромбоз
Причина инсульта, тромбоза устройства
Тщательное сканирование верхушки ЛЖ, ВТЛЖ и корня аорты
Контрастирование
Размер ПЖ
Стандартные методы (например, диаметр основания, среднего отдела и
продольный диаметр)
Рассмотрите возможность выполнения 3D
Систолическая функция ПЖ
Дисфункция может быть причиной аварийного сигнала снижения крово-
тока.
Стандартные методы (например, фракция изменения площади, ССТК, s′
свободной стенки, пиковая систолическая продольная деформация сво-
бодной стенки, VTIВТПЖ)
СДЛА и ДПП
Рассмотрите возможность выполнения 3D
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Диагностически ориентированное практическое руководство по визуализации
In-30_для нас.indd 780
03.04.2019 12:05:23
781
30 Эхокардиография при механической поддержке кровообращения
Параметры
Основные методы визуализации/методики
Трикуспидальная регургитация После имплантации ЛЖУВК смещение перегородки и фиксация створки
к перегородке могут усугубить ТР
Интегрируйте оценки размера струи с другими параметрами (например,
допплеровский спектральный профиль печеночных вен, размер и кол-
лапс НПВ, смещение межпредсердной перегородки влево, размер ПП,
СДЛА)
Митральная регургитация
Ухудшение/неизменность МР может указывать на нарушение функции
устройства или перенаполнение
Стандартные методы (например, ширина vena contracta, PISA, EROA и
объем регургитации, реверсивные потоки в легочных венах)
Открытие аортального клапана Может увеличиваться при перенаполнении и нарушении функции
устройства
Может снижаться при недостаточном наполнении/явлении всасывания
М-режим в ПДО проекции для створок АК
Цветовой М-режим
Аортальная регургитация
После имплантации может усугубляться и становится непрерывной
Стандартные методы (например, ширина vena contracta), но следует обра-
тить внимание, что при постоянном характере степень увеличивается
Расположение канюлей/устрой-
ства
Часто требуется внеосевая визуализация
При ориентации приточной канюли ЛЖУВК на перегородку возможна
обструкция трабекулами
Артефакт наложения цветовой допплерографии, повышение допплеров-
ских спектральных скоростей кровотока, регургитация, подъем отно-
шения пиковой к базальной/пороговой допплеровской спектральной
скорости кровотока позволяют заподозрить тромбоз устройства
Подъем или снижение допплеровских спектральных скоростей кровотока
отточного графта может быть признаком частичной или полной об-
струкции, обусловленной перекрутом или тромбозом, соответственно
Рассмотрите КТ
Приточный порт устройства Impella < или > 3–4 см ниже аортального
клапана
Приточная канюля устройства TandemHeart в ушке ПП или ЛА
Миграция устройства Centrimag
Приточная канюля ЭКМО мигрирует в просвет полой вены
Перикард
Аварийный сигнал снижения кровотока может быть обусловлен тампо-
надой
Компрессия камер может быть более достоверным признаком, чем изме-
нения в притоке и оттоке допплеровского спектра
Оптимизация
после имплан-
тации
Размер ЛЖ
ЛЖКДР на уровне дистальных кончиков створок митрального клапана
(особенно для осевых устройств), каждый раз визуализация должна вы-
полняться на одном и том же уровне
Размер ПЖ
Стандартные методы (например, диаметр основания, среднего отдела и
продольный диаметр)
Систолическая функция ПЖ
Стандартные методы (например, фракция изменения площади, ССТК, s′
свободной стенки, пиковая систолическая продольная деформация сво-
бодной стенки, VTIВТПЖ)
СДЛА и ДПП
Трикуспидальная регургитация Интеграция оценок размера струи и других параметров (например, доп-
плеровского спектрального профиля печеночных вен, размер и коллапс
НПВ, смещение межпредсердной перегородки влево, размер ПП, СДЛА)
Митральная решургитация
Стандартные методы (например, ширина vena contracta, PISA, EROA и
объем регургитации, реверсивные потоки в легочных венах)
Открытие аортального клапана М-режим в ПДО проекции створок АК
Цветовой М-режим
Аортальная регургитация
После имплантации может усугубляться и становиться постоянной
Стандартные методы (например, ширина vena contracta) обратите внима-
ние, что при постоянном характере тяжесть возрастает
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Диагностически ориентированное практическое руководство по визуализации
In-30_для нас.indd 781
03.04.2019 12:05:23
782
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
Параметры
Основные методы визуализации/методики
Исследования
по ramp-
протоколу
после имплан-
тации
Размер ЛЖ
ЛЖКДР на уровне дистальных кончиков створок МК (особенно для осе-
вых устройств), ка ждый раз визуализация должна выполняться в одной
и той же плоскости
Кровоток через митральный
клапан
Время замедления кровотока
Митральная регургитация
Стандартные методы (например, ширина vena contracta, PISA, EROA и
объем регургитации, реверсивные потоки в легочных венах)
Открытие аортального клапана М-режим в ПДО проекции створок АК
Цветовой М-режим
Аортальная регургитация
Может приводить к ложноположительным результатам исследования по
ramp-протоколу
Стандартные методы (например, ширина vena contracta) обратите внима-
ние, что при постоянном характере степень тяжести возрастает
Канюли
Спектральная допплерография приточной канюлю ЛЖУВК позволяет
оценить изменения базальной/пороговой скорости кровотока
Восстановление Размер ЛЖ
ЛЖКДР на уровне дистальных кончиков створок МК (особенно для осе-
вых устройств), ка ждый раз визуализация должна выполняться в одной
и той же плоскости
Систолическая функция ЛЖ
ФВЛЖ двухпроекционным дисковым методом
3D-измерение объема
Контрастирование
Систолическая функция ПЖ
Стандартные методы (например, фракция изменения площади, ССТК, s′
свободной стенки, пиковая систолическая продольная деформация сво-
бодной стенки, VTIВТПЖ)
СДЛА и ДПП
Открытие аортального клапана М-режим в ПДО проекции створок АК
Цветовой М-режим
Канюли
Часто требуется внеосевая визуализация
Цветовая и спектральная допплерография приточной канюли ЛЖУВК
для исключения регургитации во время отключения
EROA — площадь эффективного отверстия регургитации; PISA — площадь проксимальной зоны струи регургитации; VTI — интеграл
скорости кровотока; АК — аортальный клапан; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка;
ДПП — давление в правом предсердии; КТ — компьютерная томография; ЛЖКДР — конечно -диастолический размер ЛЖ; ЛЖУВК — ле-
вожелудочковое устройство вспомогательного кровообращения; МК — митральный клапан; МРТ — магнитно -резонансная томография;
ОАК — область аортального клапана; ООО — открытое овальное отверстие; ПДО — парастернальная длинноосевая; СДЛА — систоли -
ческое давление в легочной артерии; ССТК — систолическое смещение трикуспидального кольца; ТР — трикуспидальная регургитация.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Диагностически ориентированное практическое руководство по визуализации
ЛИТЕРАТУРА
1. Jauhar S: The artificial heart, N Engl J Med
350:542–544, 2004.
2. Hetzer R, Muller JH, Went Y, et al. Bridging-
to-recovery, Ann Thorac Surg 71:S109–S113,
2001.
3. Boehmer JP, Popjes E: Cardiac failure: me-
chanical support strategies, Crit Care Med
34(Suppl):S268–S277, 2006.
4. Friedel N, Viazis P, Schiessler A, et al. Recov-
ery of end-organ failure during mechanical
circulatory support, Eur J Cardiothorac Surg
6:519–522, 1992.
5. Farrar DJ, Hill JD. Recovery of major organ
function in patients awaiting heart transplan-
tation with Thoratec ventricular assist devices,
J Heart Lung Transplant 13:1125–1132, 1994.
6. Frazier OH, Rose EA, Oz MC, et al. Multi-
center clinical evaluation of the HeartMate
vented electric left ventricular assist system
in patients awaiting heart transplantation, J
Thorac Cardiovasc Surg 122:1186–1195, 2001.
7. Dangas GD, Kini AS, Sharma SK, et al. Impact
of hemodynamic support with Impella 2.5
versus intra-aortic balloon pump on prognos-
tically important clinical outcomes in patients
undergoing high-risk percutaneous coronary
intervention (from the PROTECT II random-
ized trial), Am J Cardiol 113:222–228, 2014.
8. Lietz K, Miller LW. Improved survival of pa-
tients with end-stage heart failure listed for
heart transplantation. Analysis of Organ Pro-
curement and Transplantation Network/U.S .
United Network of Organ Sharing Data, 1990
to 2005, J Am Coll Cardiol 50:1282–1290, 2007.
9. Rose EA, Gelijns AC, Moskowitz AJ, et al.
Randomized Evaluation of Mechanical As-
sistance for the Treatment of Congestive
Heart Failure (REMATCH) Study Group.
Long-term mechanical left ventricular assis-
tance for end-stage heart failure, N Engl J Med
345:1435–1443, 2001.
10. Lietz K, Long JW, Kfoury AG, et al. Outcomes
of left ventricular assist device implantation
as destination therapy in the post-REMATCH
era: implications for patient selection, Circu-
lation 116:497–505, 2007.
In-30_для нас.indd 782
03.04.2019 12:05:23
783
30 Эхокардиография при механической поддержке кровообращения
11. Westaby S, Frazier OH, Banning A. Six years
of continuous mechanical circulatory sup-
port, N Engl J Med 355:325–327, 2006.
12. Iqbal I, Ventura HO, Smart FW, Stapleton
DD. Difficult cases in heart failure: left ven-
tricular assist device implantation for the
treatment of recurrent ventricular tachycar-
dia in end stage heart failure, Congest Heart
Fail 5:129–130, 1999.
13. Miller LW, Pagani FD, Russell SD, et al.
Use of a continuous-flow device in patients
awaiting heart transplantation, N Engl J Med
357:885–896, 2007.
14. John R, Kamdar F, Liao K, et al. Improved
survival and decreasing incidence of adverse
events using the HeartMate II left ventricular
assist device as a bridge-to-transplant, Ann
Thorac Surg 86:1227–1234, 2008.
15. Slaughter MS, Rogers JG, Milano CA, et al.
Advanced heart failure treated with continu-
ous-flow left ventricular assist device, N Engl
J Med 361:2241–2251, 2009.
16. Farrar DJ, Bourque K, Dague CP, et al. Design
features, developmental status, and experi-
mental results with the HeartMate III centrif-
ugal left ventricular assist system with a mag-
netically levitated rotor, ASAIO J 53:310–315,
2007.
17. Thiele H, Lauer B, Hambrecht R, et al. Rever-
sal of cardiogenic shock by percutaneous left
atrial-to-femoral arterial bypass assistance,
Circulation 104:2917–2922, 2001.
18. Topilsky Y, Oh JK, Shah DK, et al. Echocar-
diographic predictors of adverse outcomes
after continuous left ventricular assist de-
vice implantation, JACC Cardiovasc Imaging
4:211–222, 2011.
19. John R, Mantz K, Eckman P, et al. Aortic
valve pathophysiology during left ventricular
assist device support, J Heart Lung Transplant
29:1321–1329, 2010.
20. Feldman D, Pamboukian SV, Teuteberg JJ, et
al. The 2013 International Society for Heart
and Lung Transplantation Guidelines for me-
chanical circulatory support: executive sum-
mary, J Heart Lung Transpl 32:157–187, 2013.
21. Kirklin JK, Naftel DC, Pagani FD, et al. Sixth
INTERMACS annual report: a 10,000-patient
database, J Heart Lung Transplant 33:555–
564, 2014.
22. Kormos RL, Teuteberg JJ, Pagani FD, et al.
Right ventricular failure in patients with the
HeartMate II continuous-flow left ventricu-
lar assist device: incidence, risk factors, and
effect on outcomes, J Thorac Cardiovasc Surg
139:1316–1324, 2010.
23. Maeder MT, Leet A, Ross A, et al. Changes in
right ventricular function during continuous-
low left ventricular assist device support, J
Heart Lung Transplant 28:360–366, 2009.
24. Fitzpatrick III JR, Frederick JR, Hiesinger W,
et al. Early planned institution of biventricu-
lar mechanical circulatory support results in
improved outcomes compared with delayed
conversion of a left ventricular assist device
to a biventricular assist device, J Thorac Car-
diovasc Surg 137:971–977, 2009.
25. Tingleff J, Joyce FS, Pettersson G. Intraopera-
tive echocardiographic study of air embolism
during cardiac operations, Ann Thorac Surg
60:673–677, 1995.
26. Horton SC, Khodaverdian R, Chatelain P, et
al. Left ventricular assist device malfunction:
an approach to diagnosis by echocardiogra-
phy, J Am Coll Cardiol 45:1435–1440, 2005.
27. Pagani FD, Miller LW, Russell SD, et al. Ex-
tended mechanical circulatory support with a
continuous-flow rotary left ventricular assist
device, J Am Coll Cardiol 54:312–321, 2009.
28. Crow S, John R, Boyle A, et al. Gastrointesti-
nal bleeding rates in recipients of nonpulsatile
and pulsatile left ventricular assist devices, J
Thorac Cardiovasc Surg 137:208–215, 2009.
29. Mudd JO, Cuda JD, Halushka M, et al. Fusion
of aortic valve commissures in patients sup-
ported by a continuous axial flow left ven-
tricular assist device, J Heart Lung Transplant
27:1269–1274, 2008.
30. Rose AG, Connelly JH, Park SJ, et al. Total
left ventricular outflow tract obstruction due
to left ventricular assist device induced sub-
aortic thrombosis in 2 patients with aortic
valve bioprosthesis, J Heart Lung Transplant
22:594–599, 2003.
31. Topkara VK, Kondareddy S, Malik F, et al.
Infectious complications in patients with left
ventricular assist device: etiology and out-
comes in the continuous flow era, Ann Thorac
Surg 90:1270–1277, 2010.
32. Meyns B, Dens J, Sergeant P, et al. Initial ex-
periences with the Impella device in patients
with cardiogenic shock—Impella support for
cardiogenic shock, Thorac Cardiovasc Surg
51:312–317, 2003.
33. Starling RC, Moazami N, Silvestry SC, et al.
Unexpected abrupt increase in left ventricu-
lar assist device thrombosis, N Engl J Med
370:33–40, 2014.
34. Uriel N, Morrison KA, Garan AR, et al. De-
velopment of a novel echocardiography ramp
test for speed optimization and diagnosis of
device thrombosis in continuous-flow left
ventricular assist devices: the Columbia ramp
study, J Am Coll Cardiol 60:1764–1775, 2012.
35. Estep JD, Vivo RP, Cordero-Reyes AM, et al.
A simplified echocardiographic technique for
detecting continuous-flow left ventricular as-
sist device malfunction due to pump throm-
bosis, J Heart Lung Transplant 33:575–586,
2014.
36. Terracciano CM, Harding SE, Adamson D, et
al. Changes in sarcolemmal Ca entry and sar-
coplasmic reticulum Ca content in ventricular
myocytes from patients with end-stage heart
failure following myocardial recovery after
combined pharmacological and ventricular
assist device therapy, Eur Heart J 24:1329–
1339, 2003.
37. Thohan V, Stetson SJ, Nagueh SF, et al. Cel-
lular and hemodynamics responses of failing
myocardium to continuous flow mechanical
circulatory support using the DeBakey-Noon
left ventricular assist device: a comparative
analysis with pulsatile-type devices, J Heart
Lung Transplant 24:566–575, 2005.
38. Simon MA, Primack BA, Teuteberg J, et al.
Left ventricular remodeling and myocardial
recovery on mechanical circulatory support,
J Card Fail 16:99–105, 2010.
39. Klotz S, Danser AH, Foronjy RF, et al. The
impact of angiotensin converting enzyme in-
hibitor therapy on the extracellular collagen
matrix during left ventricular assist device
support in patients with end-stage heart fail-
ure, J Am Coll Cardiol 49:1166–1174, 2007.
40. Birks EJ, Tansley PD, Hardy J, et al. Left ven-
tricular assist device and drug therapy for
the reversal of heart failure, N Engl J Med
355:1973–1984, 2006.
41. Xydas S, Rosen RS, Ng C, et al. Mechani-
cal unloading leads to echocardiographic,
electrocardiographic, neurohormonal, and
histologic recovery, J Heart Lung Transplant
25:7–15, 2006.
42. Sauer AJ, Meehan K, Gordon R, et al. Echo-
cardiographic markers of left ventricular
unloading using a centrifugal-flow rotary
pump, J Heart Lung Transplant 33:449–450,
2014.
43. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quan-
tification by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39.e14, 2015.
44. Estep JD, Stainback RF, Little SH, et al. The
role of echocardiography and other imaging
modalities in patients with left ventricular as-
sist devices, JACC Cardiovasc Imaging 3:1049–
1064, 2010.
45. Rudski LG, Lai WW, Afilalo J, et al. Guide-
lines for the echocardiographic assessment
of the right heart in adults: a report from
the American Society of Echocardiography
endorsed by the European Association of
Echocardiography, a registered branch of
the European Society of Cardiology, and the
Canadian Society of Echocardiography, J Am
Soc Echocardiogr 23:685–713, 2010.
46. Abbas AE, Fortuin FD, Schiller NB, et al. A
simple method for noninvasive estimation of
pulmonary vascular resistance, J Am Coll Car-
diol 41:1021–1027, 2003.
47. Stainback RF, Estep JD, Agler DA, et al. Echo-
cardiography in the Management of Patients
with Left Ventricular Assist Devices: Recom-
mendations from the American Society of
Echocardiography, J Am Soc Echocardiogr
28:853–909, 2015.
48. Paluszkiewicz L, Gu#rsoy D, Spiliopoulos S,
et al. HeartMate II ventricular assist device
thrombosis—an echocardiographic approach
to diagnosis: can Doppler evaluation of flow
be useful? J Am Soc Echocardiogr 24:350.e1–
350.e4, 2011.
49. Fine NM, Topilsky Y, Oh JK, et al. Role of
echocardiography in patients with intravas-
cular hemolysis due to suspected continuous-
flow LVAD thrombosis, JACC Cardiovasc Im-
aging 6:1129–1140, 2013.
50. Schwarz KQ, Parikh SS, Chen X, et al. Non-
invasive flow measurement of a rotary pump
ventricular assist device using quantitative
contrast echocardiography, J Am Soc Echocar-
diogr 23:324–329, 2010.
51. Adatya S, Holley CT, Roy SS, et al. Echocar-
diographic Ramp test for continuous-flow
left ventricular assist devices: do loading con-
ditions matter? JACC Heart Fail 3:291–299,
2015.
52. Khan T, Delgado RM, Radovancevic B, et al.
Dobutamine stress echocardiography pre-
dicts myocardial improvements in patients
supported by left ventricular assist devices
(LVADs): hemodynamic and histologic evi-
dence of improvement before LVAD explan-
tation, J Heart Lung Transplant 22:137–146,
2003.
53. Cheng JM, den Uil CA, Hoeks SE, et al. Per-
cutaneous left ventricular assist devices vs
intra-aortic balloon pump counterpulsa-
tion for treatment of cardiogenic shock: a
meta-analysis of controlled trials, Eur Heart
J 30:2102–2108, 2009.
54. Kalogeropoulos AP, Kelkar A, Weinberger
JF, et al. Validation of clinical scores for right
ventricular failure prediction after implanta-
tion of continuous-flow left ventricular assist
devices, J Heart Lung Transplant 34:1596–
1603, 2015.
In-30_для нас.indd 783
03.04.2019 12:05:23
784
ЧАСТЬ V Кардиомиопатия и заболевания перикарда
55. Herod JW, Ambardekar AV. Right ventricular
systolic and diastolic function as assessed by
speckle-tracking echocardiography improve
with prolonged isolated left ventricular assist
device support, J Card Fail 20:498–505, 2014.
56. Lam KMT, Ennis S, O’Driscoll G, et al. Ob -
servations from non-invasive measures of
right heart hemodynamics in left ventricular
assist device patients, J Am Soc Echocardiogr
22:1055–1062, 2009.
57. Simon MA, Kormos RL, Murali S, et al. Myo-
cardial recovery using ventricular assist de-
vices: prevalence, clinical characteristics and
outcomes, Circulation 112(9 Suppl):I32–I36,
2005.
58. Birati EY, Quiaoit Y, Wald J, et al. Ventricular
assist device thrombosis: a wide spectrum of
clinical presentation, J Heart Lung Transplant
34:613–615, 2015.
59. Gorcsan J, Severyn D, Murali S, et al. Non-in-
vasive assessment of myocardial recovery on
chronic left ventricular assist device: results
associated with successful device removal, J
Heart Lung Transplant 22:1304–1313, 2003.
60. Dandel M, Weng Y, Siniawski H, et al. Predic-
tion of cardiac stability after weaning from
left ventricular assist devices in patients with
idiopathic dilated cardiomyopathy, Circula-
tion 118(Suppl 1):S94–S105, 2008.
61. Dandel M, Weng Y, Siniawski H, et al. Heart
failure reversal by ventricular unloading in
patients with chronic cardiomyopathy: cri-
teria for weaning from ventricular assist de-
vices, Eur Heart J 32:1148–1160, 2011.
62. Birks EJ, George RS, Hedger M, et al. Reversal
of severe heart failure with a continuous-flow
left ventricular assist device and pharmaco-
logical therapy: a prospective study, Circula-
tion 123:381–390, 2011.
63. Vogel M, Cheung MMH, Li J, et al. Nonin-
vasive assessment of left ventricular force-
frequency relationships using tissue Doppler-
derived isovolumic acceleration validation in
an animal model, Circulation 107:1647–1652,
2003.
64. Estep JD, Vivo RP, Krim SR, et al. Echocar-
diographic evaluation of hemodynamics in
patients with systolic heart failure supported
by a continuous-flow LVAD, J Am Coll Car-
diol 64:1231–1241, 2014.
65. Lohan DG, Krishnam M, Saleh R, et al. MR
imaging of the thoracic aorta, Magn Reson
Imaging Clin North Am 16:213–234, 2008.
66. Raman SV, Sahu A, Merchant AZ, et al.
Noninvasive assessment of left ventricular
assist devices with cardiovascular computed
tomography and impact on management, J
Heart Lung Transplant 29:79–85, 2010.
67. Acharya D, Singh S, Tallaj JA, et al. Use of
gated cardiac computed tomography angi-
ography in the assessment of left ventricular
assist device dysfunction, ASAIO J 57:32–37,
2011.
In-30_для нас.indd 784
03.04.2019 12:05:23
r=0,85см
VCW7мм
Правые отделы
сердца
ЧАСТЬ
ЧАСТЬ VI
In-31_для нас.indd 785
03.04.2019 12:10:15
In-31_для нас.indd 786
03.04.2019 12:10:16
787
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЙ ПОДХОД
Использование эхокардиографии (ЭхоКГ) для
оценки правого желудочка (ПЖ) отличается от та-
ковой левого желудочка (ЛЖ) по многим параме-
трам. Форма ПЖ, асимметричный полумесяц, а
также эндокард, гетерогенность которого характе-
ризуется наличием диффузных трабекул, влияют на
определение его размера. Особая анатомия ПЖ и
его различные сократительные элементы в опреде-
ленной степени влияют на оценку функций ПЖ,
что требует определенной методики и опыта.
В этой главе представлен обзор эхокардиографи-
ческих методик, используемых для оценки размера
и функций ПЖ. Эти методики включают традици-
онные двухмерные (2D) и цветное и спектральное
допплеровские картирования трансторакальной,
чреспищеводной и внутрисердечной (ИКЭ) ЭхоКГ,
а также усовершенствованные методы, такие как
трехмерная (3D) ЭхоКГ и измерения треков спекла
параметров деформации. Также рассматриваются
клинические исходы, связанные с особенностями
различных изображений ПЖ. Дополнительная ин-
формация относительно использования ЭхоКГ в
оценке легочной гипертензии и патологий трику-
спидального клапана и клапана легочной артерии
рассматривается в их связи со структурой и функ-
цией ПЖ.
31 Эхокардиографическое
исследование правого желудочка
ANJALI VAIDYA, MD • JAMES N. KIRKPATRICK, MD
Основные принципы
и эхокардиографический
подход
Анатомия правого желудочка
Физиология правого желудочка
Технические детали,
количественный анализ,
анализ данных
Трансторакальные
эхокардиографические
срезы
Чреспищеводные
эхокардиографические
срезы
Внутрисердечные
эхокардиографические
срезы
Количественная оценка
Толщина и размер стенки
правого желудочка
Систолическая функция
правого желудочка
Диастолическая функция
правого желудочка
Применение в клинике
и выходные данные
Применения в исследованиях
Потенциальные ограничения
и дальнейшие направления
Альтернативные подходы
АНАТОМИЯ ПРАВОГО ЖЕЛУДОЧКА
ПЖ располагается непосредственно позади груди-
ны, как самая передняя структура сердца. Хотя его
расположение позволяет датчику трансторакальной
эхокардиографии (ТТЭхоКГ) находится близко к
нему, грудина, будучи костной структурой, создает
проблемы в получении адекватного окна для четкой
визуализации, особенно при использовании наибо-
лее используемого парастернального подхода. По
существу, для полноценной визуализации ПЖ во
время ТТЭхоКГ необходимо использование субко-
стальной и апикальной позиций. Верхняя граница
ПЖ образована отверстием и створками трикуспи-
дального клапана. Трикуспидальный клапан вклю-
чает в себя перегородочную, переднюю и заднюю
створки, прикрепленные к фиброзному кольцу. Это
относительно апикальное положение фиброзного
кольца трикуспидального клапана по сравнению с
таковым митрального клапана, может быть полез-
ным для распознавания ПЖ и ЛЖ в изображениях,
полученных различными способами.
Если датчик смещается более апикально и соче-
тается с дефектами межпредсердной перегородки
или атриовентрикулярного канала, при таких усло-
виях может быть обнаружена аномалия Эбштейна.
В противоположность ЛЖ и аппарату митрального
клапана, в ПЖ имеются многочисленные сосочко-
вые мышцы, которые удерживают створки трику-
In-31_для нас.indd 787
03.04.2019 12:10:16
788
ЧАСТЬ VI Правые отделы сердца
спидального клапана через связочный аппарат. Са-
мая большая передняя сосочковая мышца связана
непосредственно с мышечной перекладиной и при-
креплена через связки к передней и задней створкам
трикуспидального клапана. В ПЖ имеется множе-
ство задних и септальных сосочковых мышц, иду-
щих от нижней стенки и перегородки ПЖ. Задние
сосочковые мышцы удерживают заднюю и перего-
родочную створки трикуспидального клапана, тог-
да как сосочковые мышцы перегородки удерживают
переднюю и перегородочную створки (табл. 31.1).
ПЖ содержит свободную стенку и внутрижелу-
дочковую перегородку, которые на продольном
срезе вместе образуют форму полумесяца. Мышеч-
ная перекладина простирается через ПЖ от межже-
лудочковой перегородки (МЖП) до передней сто-
роны свободной стенки, и, вместе с апикальным
расположением трикуспидального клапана и обиль-
ными трабекулами ПЖ, может быть использована
для отличия ПЖ от ЛЖ. ПЖ имеет входной (синус)
ТК
МК
МК
АК
Клапан
ЛА
ТК
Сверху
Сзади Справа
Спереди
Слева
Снизу
Спереди
Клапан
ЛА
Сзади
Рис. 31.1 Нормальная анатомия правого желудочка. Слева — левый латеральный срез. Справа — основной срез. Поверхности эндокарда воссозданы с
помощью 3D-эхокардиографии и на основе знаний о реконструкции. Полая сетка — эндокардиальная поверхность ПЖ; сплошной красный — эндокардиальная
поверхность ЛЖ. ПЖ имеет форму полумесяца в позиции по короткой оси, с трикуспидальным клапаном и клапан легочной артерии, широко разделенными
наджелудочковым гребнем. АК — аортальный клапан; КЛА — клапан легочной артерии; МК — митральный клапан; ТК — трикуспидальный клапан [предоставле-
но Dr. Florence H. Sheehan, University of Washington Cardiovascular Research and Training Center].
Сосочковая
мышца
Створки
трикуспидального
клапана
Ассоциированные
структуры правого
желудочка
Передняя
Передняя, задняя
Мышечная переклади-
на, передняя стенка
Задняя
Септальная
Задняя часть свободной
стенки
Септальная Передняя, септаль-
ная
Межжелудочковая пе-
регородка
ТАБЛИЦА 31.1 Анатомия трикуспидального клапана
и выводной (воронка, или конус) отделы, которые
закладываются в эмбриологическом периоде. Вход-
ной отдел пирамидной формы с трабекулярной
поверхностью образован передней и задней свобод-
ными стенками и МЖП. Выводной отдел является
гладким и цилиндрическим по форме (рис. 31.1).
Входной отдел отделен от выводного отдела надже-
лудочковым гребнем, который является мышечным
отростком, идущим вдоль трикуспидального отвер-
стия, МЖП, мышечной перекладины и передней
стенки ПЖ. Он является сократительной структу-
рой, которая ограничивает трикуспидальное отвер-
стие, тянет свободную стенку внутрь в фазу систолы
и участвует в систолическом взаимодействии [1, 2].
Кровоснабжение ПЖ осуществляется преиму-
щественно правой коронарной артерией (рис. 31.2).
Важно отметить, что коронарный кровоток в ПЖ
осуществляется как в фазу диастолы, так и систолы
в нормальном ПЖ, что обусловлено меньшим дав-
лением на стенку, а также внутристеночного напря-
жения, развиваемого ПЖ во время сокращения.
Левая передняя нисходящая артерия снабжает ПЖ
порциями крови через артерию мышечной части,
которая отходит от первого перфоратора перего-
родки. Редко заднебоковые ветви от огибающей
артерии снабжают кровью часть задней стороны
свободной стенки ПЖ. Артериальный конус снаб-
жает током крови воронку. Величина систолической
работы, осуществляемой ПЖ, приблизительно рав-
на четверти таковой ЛЖ, а также имеет место более
низкая экстракция кислорода. В нормальных усло-
виях ПЖ более устойчив к ишемии, что обусловле-
но избыточным снабжением кровью ПЖ наряду с
его низкой метаболической потребностью [3]. Важ-
In-31_для нас.indd 788
03.04.2019 12:10:16
789
31 Эхокардиографическое исследование правого желудочка
ПЖ
ПП
ЛА
Спереди
Парастернальная позиция входящего тракта ПЖ
Парастернальная позиция по длинной оси ВТПЖ
Субкостальная позиция по короткой оси базального ПЖ
Апикальная 5-камерная позиция ПЖ
Л
а
т
е
р
а
л
ь
н
о
Л
а
т
е
р
а
л
ь
н
о
Л
а
т
е
р
а
л
ь
н
о
ЛЖ
ЛЖ
ПЖ
ПЖ
ЛП
ПП
ЛЖ
ПЖ
КС
ЛП
ПП
ЛП
Ао
М
ы
ш
е
ч
н
а
я
п
е
р
е
к
л
а
д
и
н
а
Апикальная 4-камерная позиция ПЖ
Апикальная коронарного синуса позиция ПЖ
Задняя нисходящая артерия
Остроконечная ветвь
Конусная ветвь
Левая передняя нисходящая
артерия
ПЖ
ПП
ЛА
В
Т
П
Ж
ЛП
Ао
ЕЗ
ЛЖ
ВТПЖ
С
п
е
р
е
д
и
С
н
и
з
у
Рис. 31.2 Коронарный кровоток правого желудочка (ПЖ). Ao — аорта; ВТПЖ — выводной тракт правого желудочка; ЕЗ — евстахиева заслонка; КС —
коронарный синус; ЛА — легочная артерия; ЛП — левое предсердие; ЛПНА — левая передняя нисходящая артерия; ПКА — правая коронарная артерия; ПП —
правое предсердие [Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society
of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of
Echocardiography. J Am Soc Echocardiogr 23:685–713, 2010].
но при этом, что гипертрофированный ПЖ, стал-
киваясь с увеличенной постнагрузкой, становится
намного более чувствителен и неприспособлен к
условиям ишемии [4].
Правое предсердие (ПП) образует правую грани-
цу сердца, располагающуюся сверху, позади и спра-
ва от ПЖ. ПП перекачивает кровь из верхней полой
вены сверху и сзади, нижней полой вены снизу, и
сзади коронарного синуса через отверстие коронар-
ного синуса между нижней полой веной и отверсти-
ем трикуспидального клапана. МЖП образует за-
днемедиальную стенку ПП и имеет овальную ямку,
расположенную между отверстиями полых вен.
ФИЗИОЛОГИЯ ПРАВОГО ЖЕЛУДОЧКА
ПЖ перекачивает дезоксигенированную кровь, ко-
торая поступает через полые вены и далее идет в
легкие для газообмена перед возвратом обратно в
левое предсердие (ЛП), затем кровь поступает в
ЛЖ, после чего движется по системному сосудисто-
му руслу. В ходе этого, генерируемый ПЖ сердеч-
ный выброс, подобен таковому ЛЖ (за исключени-
ем случаев внутрикардиального шунтирования),
хотя это происходит со значительно меньшей си-
лой — приблизительно одна шестая от всего мио-
карда. Важным физиологическим различием между
двумя кругами кровообращения, которое учитыва-
ет эту разницу, является значительно меньшая на-
грузка на стенки ПЖ по сравнению с ЛЖ.
Легочные артерии относительно тонкостенные и
расположены дистально в пределах сосудистого
русла, у артериол толщина стенок минимальна. Ма-
лый круг кровообращения короткий и симметрич-
ный с большой площадью поверхности и множе-
ством как последовательных, так и параллельных
сосудов. Вследствие этого, сосуды этого круга кро-
вообращения намного более податливы и ориенти-
рованы на ударный объем ПЖ, сходный с таковым
ЛЖ, который, в свою очередь, встречается с сопро-
тивлением примерно в 5 раз большим, чем ПЖ.
In-31_для нас.indd 789
03.04.2019 12:10:16
790
ЧАСТЬ VI Правые отделы сердца
Таким образом, кровоток в участке ПЖ–легочная
артерия является интенсивным с низким давлени-
ем, тогда как кровоток в участке ЛЖ-аорта является
интенсивным с высоким давлением.
Сокращение ПЖ начинается в месте входа крови
в ПЖ, находящимся за конусом, и вносит неболь-
шой вклад в происхождение общего ударного объ-
ема, вырабатываемого ПЖ. Полный нормальный
паттерн сокращения ПЖ значительно отличается от
паттерна сокращения ЛЖ. ЛЖ сокращается преи-
мущественно в поперечном и продольном направ-
лениях, симметрично. В ПЖ мышечные волокна
располагаются в различных направлениях, так что
большая его часть (около 75%) сокращается в про-
дольном направлении, тогда как меньшая часть
сокращается в горизонтальном, или поперечном
направлении свободной стенки ПЖ. Различия меж-
ду этими типами сокращений имеют важный смысл,
когда для измерения общей функции ПЖ исполь-
зуются дифференциальные методы с различными
способами визуализации [5].
Хирургические процедуры, в которых использу-
ется рассечение перикарда, такие как транспланта-
ция сердца, шунтирование (наложение шунта) ко-
ронарной артерии, или хирургия клапанов приво-
дят к послеоперационному изменению паттерна
сокращения ПЖ. Поскольку 70–75% мышечных
волокон являются продольными, а 25–30% — попе-
речными, после перикардиотомии происходит из-
менение паттерна сокращения таким образом, что
почти половина мышечных волокон становится в
продольном, а другая половина — в поперечном
направлениях, что в основном связано с различием
во взаимодействии между мышечными волокнами
миокарда ПЖ и окружающим его перикардом [6].
Постоянное давление и перегрузка объемом также
может приводить к увеличению кольцевых и ради-
альных влияний в фазу систолы ПЖ [7].
Диастола ПЖ имеет важное отличие от таковой
ЛЖ. Тонкие стенки обеспечивают значительно
большую растяжимость ПЖ, благодаря чему воз-
можно изменение его объема без особых изменений
диастолического давления в ПЖ. По существу, ди-
астолический объем ПЖ больше, чем таковой ЛЖ,
что объясняет тот факт, что фракция нормального
выброса (около 40%) ПЖ может создавать ударный
объем, сходный с таковым ЛЖ. ПЖ обладает боль-
шей способностью адаптироваться к нагрузке объе-
мом по сравнению с ЛЖ [8].
ТЕХНИЧЕСКИЕ ДЕТАЛИ, КОЛИЧЕСТВЕННЫЙ
АНАЛИЗ И ВЫХОДНЫЕ ДАННЫЕ
ЭХОКАРДИОГРАФИЧЕСКИЕ ПОЗИЦИИ
ПРИ ТРАНСТОРАКАЛЬНОЙ ЭХОКАРДИОГРАФИИ
Сложная структура и геометрия ПЖ требует объе-
динения множества срезов для полной и подробной
оценки его размера и функции на ТТЭхоКГ. Пер-
ПЖ
ПП
Рис. 31.3 Трикуспидальный входящий ток, срез. Стрелкой обозначена
задняя створка трикуспидального клапана, наиболее видная на этом срезе.
ПЖ — правый желудочек; ПП — правое предсердие.
вичная стандартная проекция в большинстве про-
токолов ЭхоКГ — парастернальная проекция по
длинной оси, которая дает ограниченный срез верх-
него выводного тракта ПЖ, в отличие от реального
ПЖ. Важно, что его диаметр может увеличиваться
почти на 40%, если срез получен в левом латераль-
ном горизонтальном положении, и это сечение как
таковое не следует использовать регулярно для
определения реального размера ПЖ.
При ТТЭхоКГ в парастернальном положении по
длинной оси с применением медиального и вну-
треннего поворота датчика может быть получен
важный срез притока ПЖ, включающий ПП, три-
куспидальный клапан и ПЖ. В этой проекции могут
быть визуализированы передняя и задняя створки
трикуспидального клапана. Важно отметить, что
это является первичной стандартной проекцией
ТТЭхоКГ, в которой может быть визуализирована
задняя створка. На других срезах легче визуализи-
руются передняя и перегородочная створки (рис.
31.3). Это сечение является весьма полезным для
получения характеристик и количественной оценки
однократной или множественных струй трикуспи-
дальной регургитации при цветном допплеровском
картировании. Кроме того, в этой позиции могут
быть проанализированы механизмы, лежащие в ос-
нове регургитации, среди которых дегенерация или
перфорация и подтягивание створки, связанные с
пейсмейкером, дефибриллятором или дилатацией
фиброзного кольца и недостаточным смыканием
створок. Пульсовая допплеровская волна через три-
куспидальный клапан с изменяемой скоростью за-
писи для оценки фазных дыхательных колебаний
является важной при оценке тампонады. Очень ча-
сто непрерывная допплеровская волна, первона-
чально создается в этом месте для оценки систоли-
ческого давления ПЖ, хотя это следует повторить в
In-31_для нас.indd 790
03.04.2019 12:10:16
791
31 Эхокардиографическое исследование правого желудочка
парастернальной по короткой оси, апикальной че-
тырехкамерной и субкостальной позициях для обе-
спечения наибольшей точности, а также выравни-
вания пика скорости допплеровской волны.
В парастернальной позиции по длинной оси при
переднем и верхнем повороте датчика, может быть
визуализирован выводной тракт ПЖ, имеющий на
срезе клапан легочной артерии и проксимальную
часть легочной артерии. Обычно оценку легочного
клапана в M-режиме проводят в этой проекции для
установления «летающего W» паттерна, наблюдае-
мого в случае легочной гипертензии, ассоциирован-
ной с повышенным сопротивлением сосудов лег-
ких. С помощью цветового допплеровского карти-
рования можно установить наличие и степень
регургитации клапана легочной артерии, определя-
ющей турбулентность, связанную с обструкцией
выводного тракта ПЖ, ассоциированной со стено-
зом клапана легочной артерии или воронки. Это
может быть особенно важным для пациентов-под-
ростков с ВПС, в период их полового созревания.
Для количественной оценки интеграла скорости
кровотока, маркера ударного объема в выводном
тракте ПЖ, следует провести импульсно-волновое
допплеровское исследование.
Оценка диаметра выводного тракта ПЖ в этой
проекции также важна для исследования гемодина-
мики. Примером этого может быть соотношение
Qp/Qs с простым системно-легочным шунтирова-
нием, среди которых дефект межпредсердной или
межжелудочковой перегородки. Профиль импуль-
сно-волнового допплера также важен для количе-
ственного определения растущего времени и каче-
ственной оценки граничащего паттерна, которые
могут варьировать в зависимости от наличия и
степени тяжести повышенного сопротивления со-
судов легких. Эти нюансы могут быть высоко ин-
формативными при использовании эхокардио-
граммы для первичного изображения соответству-
ющего гемодинамического профиля у пациентов с
легочной гипертензией [9, 10].
Кроме того, в парастернальной позиции, пово-
рот на 90° трансторакального датчика позволит
проводить оценку по короткой оси. При выравни-
вании плоскости просмотра по уровню сосочкой
мышцы в пределах полости округлого ЛЖ, ПЖ в
форме полумесяца может быть расценен, как будто
он обернут вокруг ЛЖ. На уровне сосочковой мыш-
цы в позиции по короткой оси легко просматрива-
ется МЖП и межжелудочковая взаимосвязь и взаи-
морасположение между ПЖ и ЛЖ. В условиях пе-
регрузки объемом ПЖ перегородка выравнивается
в фазу диастолы сердечного цикла, т.к . наполнение
ПЖ вызывает смещение перегородки на сторону
ЛЖ (рис. 31.4). Классические примеры включают
умеренную или более выраженную трикуспидаль-
ную регургитацию и выраженную регургитацию
клапана легочной артерии. В противоположность
этому, когда ПЖ сталкивается с повышенной пост-
нагрузкой или сопротивлением, МЖП выравнива-
ется в фазу систолы вследствие относительного
рассогласования (мсек) между сокращениями ПЖ и
ЛЖ во время ранних сокращений в фазу систолы.
Проекция по короткой оси на среднежелудочковом
уровне за пределами перегородки не является ин-
формативной при измерении размера ПЖ или его
систолической функции, потому что площадь по-
перечного сечения значительно варьирует в отно-
шении уровня позиции по короткой оси, и недоста-
точность вышеупомянутых структур затрудняет
воспроизведение срезов от одного исследования к
другому.
ПЖ
ЛЖ
Рис. 31.4 A Систолическое сглаживание межжелудочковой перегородки. В состоянии перегрузки правого желудочка (ПЖ) давлением (например, тром-
боэмболическая болезнь легочной артерии или первичная легочная гипертензия) повышенное систолическое давление ПЖ вызывает сглаживание межжелудоч-
ковой перегородки, что приводит к тому, что левый желудочек (ЛЖ) приобретает форму D.
In-31_для нас.indd 791
03.04.2019 12:10:17
792
ЧАСТЬ VI Правые отделы сердца
В парастернальной проекции по короткой оси
поворот датчика в переднем и верхнем направлени-
ях будет привносить изображение основания серд-
ца, включая короткую ось аортального клапана по
центру сечения, окруженного последовательно ЛП,
межпредсердной перегородкой (МПП), ПП, трику-
спидальным клапаном, выводным трактом ПЖ,
легочным клапаном и легочным стволом. Отсюда
могут быть выполнены подобные допплеровские
исследования через трикуспидальный клапан и кла-
пан легочной артерии, как было представлено ранее
в парастернальной позиции по длинной оси входя-
щего и выводного отделов ПЖ. Визуализация МПП
в этом сечении может быть первично необходимой
при установлении открытого овального окна или
дефекта межпредсердной перегородки, что имеет
существенное значение для анализа дилатации, дис-
функции, повышенного интеграла скорость-время
выводного тракта ПЖ от системно-легочного шун-
тирования и легочной гипертензии.
Апикальная четырехкамерная позиция при
ТТЭхоКГ является наиболее распространенной для
полного исследования геометрии, размера и функ-
ции ПЖ. Именно в этой проекции могут быть ви-
зуализированы и измерены как продольные, так и
поперечные сокращения и внешние патологические
проявления выраженной дилатации ПЖ (как при
артериальной легочной гипертензии) или условиях
выраженной нагрузки на ПЖ), а также полностью
видна свободная стенка. Это позволяет оценить
фракцию изменения площади ПЖ, систолическая
экскурсия плоскости трикуспидального кольца
(СЭПТК) (TAPSE), или тканевое допплерографиче-
ское исследование кольца трикуспидального клапа-
на. На этом срезе хорошо видна нормальная трабе-
куляция ПЖ, которая, за исключением случая не-
компактного миокарда желудочка, является более
выраженной, чем в ЛЖ. Также на этом срезе отра-
жено наличие мышечной перекладины в середине
полости, которая связывает МЖП со свободной
стенкой ПЖ.
В этом сечении может быть установлено утол-
щение стенок и гипертрофия ПЖ, важный клини-
ческий момент, благодаря которому можно рас-
познать причины утолщения стенки ЛЖ, такие как
гипертоническая болезнь сердца (при которой
редко затронут ПЖ) или инфильтрационный про-
цесс, подобно амилоидозу сердца (при котором
часто вовлечены как ЛЖ, так и ПЖ). Трикуспи-
дальный клапан снова может быть рассмотрен в
этой проекции с использованием цветового, по-
стоянно-волнового и импульсно-волнового доп-
плерографического исследования, как было описа-
но ранее. ПП также более полно визуализировано
в апикальной четырехкамерной позиции, и поло-
жение МЖП относительно ПП и ЛП может предо-
ставить важную информацию о наличии повы-
шенного давления наполнения правого или левого
отделов сердца. Подобным образом при повороте
датчика кпереди и кзади с допплерографическим
исследованием вдоль МПП можно идентифициро-
вать открытое овальное окно или дефект межпред-
сердной перегородки.
Для стандартной апикальной четырехкамерной
позиции датчик нужно располагать около средней
подмышечной линии выровненной по верхушке
ЛЖ. Затем датчик может быть повернут с целью
получения двух других срезов в апикальной пози-
ции: срез, сфокусированный на ПЖ и модифици-
рованный ПЖ срез в апикальной четырехкамерной
позиции. Срез, сфокусированный на ПЖ, получает-
ся при небольшом повороте основания датчика
вправо к центру датчика над апикальной передне-
боковой стенкой ЛЖ, а не верхушкой ЛЖ. На этом
срезе, сфокусированном на ПЖ, полностью визуа-
лизируется свободная стенка ПЖ, а также наилуч-
шим образом можно измерить размеры и фракцию
изменения площади ПЖ. Модифицированный срез
ПЖ получается при скольжении датчика вправо над
дистальной свободной стенкой ПЖ. На этом срезе
имеется тенденция к укорочению продольного раз-
мера ПЖ, но, как и на срезе, сфокусированном на
ПЖ, позволяет лучше визуализировать свободную
стенку, чем это позволяет стандартная апикальная
четырехкамерная позиция.
Финальная стандартная позиция при ТТЭхоКГ
является субкостальной. Она может быть особенно
полезной, если ПЖ трудно просматривается в апи-
кальной позиции, вследствие ограниченного окна
визуализации, часто связанного с расстоянием меж-
ду ребрами или наличием врожденным заболевани-
ем легких. Хотя количественная оценка размеров
ПЖ менее предпочтительна в этой проекции, оцен-
ка толщины стенки ПЖ вполне выполнима в этом
случае вследствие расположения линии ультразву-
кового пучка, идущей перпендикулярно свободной
стенке. Если парастернальные позиции по короткой
оси ограничены в сборе данных, возможно полу-
чить срез короткой оси на уровне аортального кла-
пана в субкостальной позиции, что позволяет доп-
плеровскому сигналу передаваться от клапанов, как
было приведено ранее.
ЭХОКАРДИОГРАФИЧЕСКИЕ ПОЗИЦИИ
ПРИ ЧРЕСПИЩЕВОДНОМ ИССЛЕДОВАНИИ
Чреспищеводная эхокардиография (ЧПЭхоКГ) мо-
жет быть использована для оценки структур правых
отделов сердца, хотя с определенными предостере-
жениями о том, что ПЖ является отдаленной обла-
стью в среднеэзофагеальных позициях и возникают
определенные трудности при регистрации доппле-
ровского сигнала через клапаны с правой стороны
сердца. Более того, хотя, по сравнению с техниче-
скими ограничениями ТТЭхоКГ, ЧПЭхоКГ может
предоставить визуализацию размеров и функции
In-31_для нас.indd 792
03.04.2019 12:10:17
793
31 Эхокардиографическое исследование правого желудочка
ПЖ, лучше визуализируются параметры ПЖ, полу-
ченные при ТТЭхоКГ.
В средней части пищевода, изображения при зна-
чении угла 0° в поперечной плоскости, визуализи-
руется четырехкамерная позиция, что дает возмож-
ность определить исходное сечение ПЖ (рис. 31.5).
Считается, что оно, как правило, укорочено в этой
проекции в связи с чем может быть получена не
точная оценка размера и функции. При изменении
угла сектора изображения до 90° на этом уровне,
получая изображение в продольной плоскости, дат-
чик ЧПЭхоКГ может быть повернут для визуализа-
ции ПП и верхней полой вены, которая является
самым верхним допустимым срезом для измерения
предсердия и перегородки с оценкой открытого
овального окна при первичном и вторичном дефек-
те межпредсердной перегородки. Более того, здесь
можно дополнительно рассмотреть ПП в удален-
ном поле. Поворот датчика с углом изображения
120° позволяет визуализировать трикуспидальный
клапан и оценить регургитацию. Кроме того, при
расположении датчика на среднем уровне пищево-
да, используют угол в 60°, и при повороте датчика
вправо осуществляется визуализация клапана ле-
гочной артерии и легочного ствола в пределах среза,
располагающемся кпереди в грудной клетке. Пере-
ход на уровень ниже аортального клапана может
обеспечить визуализацию главной легочной арте-
рии с проксимальным разветвлением. По мере про-
движения датчика в желудок для трансгастрального
изображения, срезы, подобно таковым транстора-
кальным субкостальным срезам, могут быть повто-
рены с позиции короткой оси ПЖ и трикуспидаль-
ЛП
ПП
ЛЖ
ПЖ
Рис. 31.5 Чреспищеводная модифицированная четырехкамерная по-
зиция. Из стандартной четырехкамерной позиции, выровненной по центру
верхушки левого желудочка (ЛЖ), датчик поворачивают вправо для лучшей
визуализации правого желудочка (ПЖ). ЛП — левое предсердие; ПП — пра-
вое предсердие.
ного клапана, срез отдаленной области клапана
легочной артерии выводного тракта ПЖ и прокси-
мальной части легочной артерии; и срез близкой
области трикуспидального клапана входного трак-
та. Расположение датчика в глубине желудка пре-
доставляет срез, аналогичный трансторакальному,
полученному из апикальной четырехкамерной по-
зиции.
ЭХОКАРДИОГРАФИЧЕСКИЕ ПОЗИЦИИ
ПРИ ВНУТРИСЕРДЕЧНОМ ИССЛЕДОВАНИИ
Внутрисердечная эхокардиография (ВСЭ) исполь-
зуется гораздо реже и только врачами-исследовате-
лями. Датчик вводится через нижнюю полую вену
в ПП, с визуализацией контроля на мониторе. ВСЭ
может быть полезна для идентификации передней
и септальной створок трикуспидального клапана, и,
в сочетании с цветовым допплеровским картирова-
нием, при круговом повороте может визуализиро-
вать на срезе МПП, важную для подробной иденти-
фикации потенциально открытого овального окна
или дефекта межпредсердной перегородки. При
перемещении датчика от этой уровня далее вверх в
ПП на срезе появляется верхняя полая вена. Пово-
рот датчика на этом уровне дает возможность иден-
тифицирования ее соединения с ПП и терминаль-
ным гребнем. Датчик ВСЭ имеет весьма жесткую
структуру. При прохождении датчика в ПЖ с целью
визуализации выносного тракта ПЖ или клапана
легочной артерии есть некоторый риск желудочко-
вой аритмии вследствие блокады правой ветви пуч-
ка Гиса, подобно риску, который возможен при
продвижении катетера в легочной артерии по ана-
логичной траектории.
КАЧЕСТВЕННЫЙ АНАЛИЗ
РАЗМЕР И ТОЛЩИНА СТЕНКИ ПРАВОГО ЖЕЛУДОЧКА
При гипертрофии ПЖ толщина его стенки > 5 мм.
Измерение толщины стенки ПЖ наилучшим обра-
зом осуществляется в субкостальной позиции, что
обусловлено ориентацией ультразвукового пучка в
направлении к свободной стенке ПЖ. Также важно
не учитывать трабекуляцию при измерении толщи-
ны свободной стенки ПЖ (рис. 31.6). Хотя часть
желудочка может быть рассмотрена в парастерналь-
ном доступе по длинной оси, этот срез захватывает
наклонную секцию ПЖ, изначально содержащую
верхнее основание и выводной тракт ПЖ. Поэтому,
при оценке гипертрофии ПЖ, эту позицию следует
использовать для измерения толщины его свобод-
ной стенки.
Существуют различные способы исследования
ПЖ, хотя наиболее часто используется метод ТТЭ-
хоКГ в апикальной четырехкамерной позиции. В
общем, площадь ПЖ в норме должна составлять не
более 2/3 от площади ЛЖ. Это соотношение может
In-31_для нас.indd 793
03.04.2019 12:10:17
794
ЧАСТЬ VI Правые отделы сердца
меняться, если размер ЛЖ изменяется вследствие
патологии. Соотношение размеров ПЖ и ЛЖ воз-
растает до умеренной (0,7–1,0), средней (1,0–1,5) и
выраженной (> 1,5) гипертрофии ПЖ (рис. 31.7).
Базальный, срединный и продольный диаметры
ПЖ измеряются в апикальной четырехкамерной
позиции, сфокусированной на ПЖ (табл. 31.2). В
этой позиции небольшой поворот датчика может
приводить к значительным изменениям в измере-
ниях. В позиции короткой оси нормальный размер
ПЖ в средней части составляет 3,5 ± 0,2 см и пло-
щадь в норме 18 ± 1,2 см2 [2, 10].
ПЖ
ЛЖ
Расстояние — 0 ,69 см
ПЖ
ПЖ
ПЖ
ЛЖ
ЛЖ
ЛЖ
Рис. 31.6 Измерение толщины стенки правого желудочка. Измерять
толщину свободной стенки правого желудочка (ПЖ) лучше всего в субкосталь-
ной позиции. Толщина > 5 мм расценивается как патология. ЛЖ
—
левый
желудочек.
Рис. 31.7 Относительный размер правого желудочка по сравнению с левым желудочком варьирует в зависимости от степени гипертрофии ПЖ.
(Слева) Нормальное сердце, отношение площади правого желудочка (ПЖ) к площади левого желудочка (ЛЖ) (ПЖ : ЛЖ) приблизительно 0,6 . (В центре) Дила-
тация ПЖ умеренной степени; в этом случае ЛЖ расширен, и ПЖ : ЛЖ относительно меньше, степень абсолютной дилатации ПЖ 0,7 –0 ,8 . (Справа) Дилатация
ПЖ тяжелой степени, с ПЖ: ЛЖ более чем 1,5; ПЖ образует верхушку.
Объем ПЖ измерить трудно вследствие того, что
он имеет неправильную форму и контуры. В апи-
кальной четырехкамерной проекции верхушка ПЖ
при гипертрофии может выглядеть квадратной и
может смещать ЛЖ, образуя собой реальную вер-
хушку сердца при тяжелой степени гипертрофии.
При использовании ЭхоКГ с целью определения
объема ПЖ было применено правило Симпсона о
двусторонней оценке, но требовались прямоуголь-
ные проекции по общей длинной оси. Это не слож-
но осуществить для ЛЖ в апикальной четырехка-
мерной проекции и апикальной двухкамерной
проекции. Однако для ПЖ может быть доступна
только одна плоскость в апикальной четырехкамер-
ной проекции и нет других стандартных сечений,
демонстрирующих правильную прямоугольную
форму. Для вычисления объема ПЖ при эхокарди-
ографическом исследовании может быть использо-
вана одна формула, объединяющая площадь (A) в
апикальной четырехкамерной позиции и длину (L)
в субкостальной позиции:
Объем ПЖ = 2/3A × L [11].
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Функцию ПЖ можно оценить с помощью множе-
ства доступных методов в ЭхоКГ. Обычно ее оцени-
вают с некоторой вариабельностью, основанной на
интерпретации специалиста, выполняющего ЭхоКГ,
подобно как для ЛЖ. В дополнение к сложности
оценки функции ПЖ, как было описано ранее, есть
особая серповидная геометрия, и изменения распо-
ложения и формы при условиях нагрузки объемом
или нагрузки от усиления сопротивления (нагрузки
давлением). Сократительный паттерн ПЖ, обычно
вовлекающий продольные мышечные волокна го-
раздо больше, чем волокна в поперечной плоскости,
In-31_для нас.indd 794
03.04.2019 12:10:17
795
31 Эхокардиографическое исследование правого желудочка
что ограничивает возможность исследование функ-
ции ПЖ основываясь только на визуальную оценку
сократительной функции, вовлекающей свободную
стенку ПЖ.
Двухмерное эхокардиографическое исследова-
ние в апикальной четырехкамерной позиции позво-
ляет измерить фракцию изменения площади ПЖ
(рис. 31.8). Эти измерения проводятся по уравне-
нию ([конечно-диастолическая площадь ПЖ – ко-
нечно-систолическая площадь ПЖ]/конечно-диа-
столическая площадь ПЖ) × 100. Для безошибочно-
го проведения этих измерений решающим является
надежное определение эндокардиального слоя во
время всего сердечного цикла, что может быть огра-
ничено качеством изображения, степенью трабеку-
лярности и дилатации ПЖ, которые не дают полной
визуализации свободной стенки ПЖ в апикальной
четырехкамерной позиции (как это часто бывает в
случае легочной гипертензии или трикуспидальной
регургитации тяжелой степени). По существу, там
имеются элементы значительной вариабельности
между наблюдениями и внутри них, что делает этот
метод менее воспроизводимым в количественном
плане. Для нормального ПЖ фракция изменения
площади равна 49 ± 7% (табл. 31.3) [12].
TAPSE остается общим и относительно простым
альтернативным методом для количественного ана-
лиза функции ПЖ. Латеральное кольцо трикус-
пидального клапана перемещается в продольной
плоскости и измеряется его отклонение во время
сердечного цикла. При использовании М-режима
курсор помещается в области латерального кольца
в апикальной четырехкамерной позиции и измеря-
ется его перемещение во время систолического со-
кращения и движения основания сердца в на-
правлении к верхушке (рис. 31.9) [13]. Подобное
измерение может быть выполнено в апикальной
четырехкамерной позиции, при использовании
двухмерного изображения и непосредственного
измерения перемещения кольца во время сердеч-
ного цикла. Измерение TAPSE является более про-
стым в выполнении и эксплуатации и не требует
проведения автономных анализа или обработки в
случае измерения фракции изменения площади
ПЖ и фракции выброса ПЖ (ФВ ПЖ) с помощью
эхокардиографического исследования. TAPSE легко
воспроизводим, с высокой степенью вариабельно-
сти у специалистов одного или разных профилей.
Все эти преимущества имеют также значительную
перекрестную корреляцию с фракцией изменения
площади ПЖ и ФВ ПЖ внутри различных групп
пациентов [5, 13–15]. Согласно рекомендациям по
количественной оценке сердечной камеры American
Society of Echocardiography нормальным является
TAPSE 24 ± 3,5 мм [12]. Формально нормальный
диапазон значений для TAPSE не установлен. Но,
как правило, здоровые субъекты имеют TAPSE
> 2,0 см с дисфункцией ПЖ не превышающей уро-
вень 1,0–1,4 см (см. табл. 31.3) [13, 15]. Эта оценка
продольной функции ПЖ хорошо выполняется
вследствие преобладающей в норме продольной
природы сокращения ПЖ. Считается, что нормаль-
ное значение TAPSE ниже в послеоперационный
период с порогом близким к 1,6 см, который корре-
лирует с нормальной фракцией изменения площа-
ди ПЖ и нормальной оценкой гемодинамической
функции ПЖ (давление в ПП, сердечный выброс и
сердечный индекс) [6].
Допплеровское исследование ткани может при-
меняться для исследования ПЖ, как и для ЛЖ. Ис-
следование ПЖ с применением этого метода вы-
полняется при помещении допплеровского курсора
на боковое кольцо трикуспидального клапана, по-
добно тому как оценивается TAPSE с помощью
M-модального курсора, и измерение систолической
скорости движения бокового кольца (рис. 31.10).
Это измерение коррелирует с TAPSE и может также
использоваться для количественной оценки систо-
лической функции ПЖ [16]. Это причина постоян-
Нормальное значение
Базальный диаметр
2,5–4,1 см
Срединный диаметр
1,9–3,5 см
Продольный диаметр
5,9–8,3 см
ВТПЖ диаметр (PLAX)
2,0–3,0 см
ВТПЖ проксимальный ди-
аметр
2,1–3,5 см
Толщина свободной стенки
0,1–0,5 см
Конечно-диастолическая
площадь
8,0–20 см2 (женщины)
10–24 см2 (мужчины)
Конечно-систолическая пло -
щадь
3,0–11 см2 (женщины)
3,0–15 см2 (мужчины)
Конечно-диастолическая
площадь, индексированная
к ППТ
4,5–11,5 см2/м2 (женщины)
5,0–12,6 см2/м2 (мужчины)
Конечно-систолическая пло -
щадь, индексированная к
ППТ
1,6–6,5 см2/м2 (женщины)
2,0–7,4 см2/м2 (мужчины)
Конечно-диастолические
объемы, индексированные
к ППТ
32–74 мл/м2 (женщины)
35–87 мл/м2 (мужчины)
Конечно-систолические
объемы индексированные
к ППТ
8,0–36 мл/м2 (женщины)
10–44 мл/м2 (мужчины)
PLAX — парастернальная позиция по длинной оси; ВТПЖ — вы -
ходной тракт правого желудочка; ППТ — площадь поверхности
тела.
[Lang RM, Badano LP, Mor-Avi F, et al. Recommendations for cardiac
chamber quantification by echocardiography in adults: an update from
the American Society of Echocardiography and the European Associa-
tion of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39, 2015.]
ТАБЛИЦА 31.2
Нормальные значения размеров правого
желудочка
In-31_для нас.indd 795
03.04.2019 12:10:18
796
ЧАСТЬ VI Правые отделы сердца
Рис. 31.8 Измерение фракции изменения площади правого желудочка. Апикальная четырехкамерная позиция, сфокусированная на правом желудочке.
У этого пациента систолическая дисфункция обоих желудочков с фракцией изменения площади ПЖ приблизительно 25%. Слева — площадь в конце диастолы
(КД), справа — в конце систолы (КС). Верхние изображения являются идентичными нижним, но на них не указана локализация границ. Трабекулярность следует
включать в помеченную область.
КД
КС
dt не проясняет геометрические характеристики, в
действительности это требует полного спектраль-
ного допплерографического исследования трику-
спидальной регургитации, а также параллельного
выравнивания по струе регургитации. Норматив-
ные данные весьма ограничены, хотя предписания
American Society of Echocardiography определяют
нижний предел нормы — 400 мм рт. ст./сек. Индек-
сирование dP/dt к максимуму систолического дав-
ления в ПЖ, теоретически снижает зависимость от
угла и преднагрузки [17].
Изоволюмическое напряжение определяется как
пик скорости сокращения миокарда во время изо-
волюмического напряжения, поделенное на время
от начала сокращения до максимума скорости со-
кращения (открытие клапанов легочной артерии).
Этот индекс определяется с помощью тканевого
ных ошибок, особенно в связи с зависимостью от
угла сканирования и неспособностью подсчета по-
казателей радиального вклада в систолическую
функцию ПЖ. Нормальная скорость допплеров-
ской пульсовой S волны в ткани составляет 14,1 ±
2,3 см/сек (см. табл. 31.3) [12].
Если сократимость ПЖ уменьшается, уровень
скорости максимального повышения давления (dP/
dt) снижается. Этот уровень может быть измерен
неинвазивно при сочетании упрощенного вида
уравнения Бернулли и измерений трикуспидальной
регургитации, полученных с помощью постоян-
но-волнового допплеровского сигнала. Вследствие
того что в легочном сосудистом русле давление
ниже, интервал времени (dt) измеряется между бо-
лее низкими, чем в левых отделах сердца, скоростя-
ми, обычно 1–2 м/сек (dP = 12 мм рт. ст.). Хотя dP/
In-31_для нас.indd 796
03.04.2019 12:10:18
797
31 Эхокардиографическое исследование правого желудочка
допплерографического исследования трикуспи-
дального кольца и может быть менее зависим от
нагрузки, чем другие индексы [18]. Более низкий
установленный предел 2,2 м/сек2 основан на пред-
ставленных объединенных данных [12], однако не-
которые данные демонстрируют широкий довери-
тельный интервал 95% (1,4–3,0), что ограничивает
его использование в клинике.
В итоге для оценки функции ПЖ служит индекс
Tei. Его уникальность определяется объединением в
нем как систолического, так и диастолического ком-
понентов сердечного цикла. Время изоволюмиче-
ского расслабления (ВИВР), время изоволюмиче-
ского сокращения (ВИВС), время выброса ПЖ
(ВВПЖ) используются с тканевым допплерографи-
ческим исследованием в уравнении:
ВИВР + ВИВС / ВВПЖ.
ВИВР, ВИВС, ВВПЖ могут быть измерены с по-
мощью либо импульсно-волнового, либо тканевого
допплеровского исследования пульсовой доппле-
ровской волной, либо тканевой допплерографией.
ВВПЖ нужно измерять пульсовой допплеровской
волной из легочного выводного тракта и не может
быть записанным в одно время с ВИВР и ВИВС на
трикуспидальном клапане. Вследствие этого изме-
TAPSE = 22 мм
s’
ВВ
ВИВС
ВИВР
Рис. 31.9 Измерение систолического смещения фиброзного кольца
трикуспидального клапана (TAPSE). Датчик в M-режиме направляется
через латеральную часть фиброзного кольца; для направления датчика ис-
пользуют апикальную позицию.
Рис. 31.10 Измерение пика систолической скорости латерального
основания правого желудочка и индекса Tei. Тканевая допплерография
трикуспидального кольца с измерением пика систолической скорости (s′) и
элементы тканевой допплерографии индекса Tei ПЖ (см. в тексте). ВВ — вре-
мя выброса; ВИВР — время изоволюметрического расслабления; ВИВС —
время изоволюметрического напряжения.
Нормальное значение
Систолическая функция
Фракция изменения площади
≥ 35%
TAPSE
≥1,7см
Импульсная допплеровская волна ≥ 9,5 см/сек
Цветовая допплерография
≥ 6,0 см/сек
Трехмерная фракция выброса
≥ 45%
Растяжение свободной стенки
≤ −20%
Индекс Tei
Импульсно-волновая
допплерография
≥ 0,43
Тканевая допплерография
≥ 0,54
Диастолическая функция
Замедление времени E
199–242 мсек
E/A
0,8–2,0
e′≥
7,8 см/сек
E/e′
≤ 6,0
e′/a′
≤ 0,52
TAPSE — систолическое смещение фиброзного кольца трикуспи-
дального клапана.
[Lang RM, Badano LP, Mor-Avi F, et al. Recommendations for cardiac
chamber quantification by echocardiography in adults: an update from
the American Society of Echocardiography and the European Associa-
tion of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39, 2015.]
ТАБЛИЦА 31.3
Нормальные значения функции правого
желудочка
рение в сопоставимых R-R интервалах является
решающим. Ошибки, в случае нерегулярного рит-
ма, могут быть интерпретированы. Индекс Tei при
тканевой допплерографии ПЖ может быть получен
от латеральной части фиброзного кольца трикуспи-
дального клапана вместе с ВИВР, ВИВС и ВВПЖ,
измеренных при этом же сердечном цикле (см. рис.
31.10). Нормальный индекс Tei при импульсно-вол-
новой допплерографии составляет 0,26 ± 0,085 и
при тканевой допплерографии — 0,38 ± 0,08 (см.
табл. 31.3) [12].
In-31_для нас.indd 797
03.04.2019 12:10:19
798
ЧАСТЬ VI Правые отделы сердца
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Диастолическая функция ПЖ, отдельно от опреде-
ления давления в ПП, не является постоянно ис-
пользуемой величиной при всех исследованиях
функции ПЖ. Считается, что диастолическая функ-
ция ПЖ связана с общими важными клиническими
ситуациями, такими как ишемия ПЖ, тромбоэмбо-
лия, легочная гипертензия и другие ситуации, вов-
лекающие левый или оба желудочка, такие как за-
болевание клапанов сердца или трансплантация
сердца. Оценка диастолической функции ПЖ мо-
жет быть полезна для оценки давлений наполнения
правых отделов сердца или при распознавании
ранних стадий заболевания, поражающего ПЖ,
возможно когда систолическая функция и размер
еще не демонстрируют патологию.
Подобно оценке диастолической функции ЛЖ, в
апикальной четырехкамерной позиции, благодаря
импульсно-волновой допплерографии пульсовая
допплеровская волна через трикуспидальный кла-
пан и тканевой допплерографии трикуспидального
кольца, могут быть определены соотношения E/A и
E/e′. Нормальное E/A соответствует 1,4 ± 0,3, и
E/e′ — 4,0 ± 1,0. Нормальная E волна времени замед-
ления через трикуспидальный клапан составляет
180 ± 31 мсек [12]. Кроме того, о диастолической
дисфункции ПЖ также свидетельствует увеличение
диастолического тока печеночной вены и дилатация
ПП (см. табл. 31.3) [19].
Давления наполнения правых отделов сердца
могут быть вычислены при измерении E/e′ через
трикуспидальный клапан и трикуспидальное коль-
цо. Это было показано в немногочисленных иссле-
дованиях выявления корреляции с прямым изме-
рением давления в ПП. E/e′ более чем 4 указывает,
что давление в ПП выше 10 мм рт. ст. с высокой
чувствительностью и специфичностью. У пациен-
тов с трансплантацией сердца для достижения та-
кой же прогностической значимости использовали
это отношение > 8, что, вероятно, является отра-
жением изменения сократительной картины мио-
карда, существующей в послеоперационном со-
стоянии [20, 21].
Как и в случае с исследованием ЛЖ в фазу диа-
столы, тахикардия или аритмия может ограничи-
вать анализ ПЖ в фазу диастолы при соединении
волн E и A или при ухудшении A волны в случаях
фибрилляции предсердий. Наиболее распростра-
ненным способом измерения давления в ПП с по-
мощью ЭхоКГ является определение диаметра ниж-
ней полой вены пациента на вдохе (метод Sniff). В
норме экскурсия нижней полой вены происходит
при снижении внутригрудного давления и кровь
перемещается в ПП из нижней полой вены. Однако,
наряду с повышением давления в ПП, нижняя по-
лая вена расширяется, а инспираторный коллапс
становится не полным или незначительным. Венти-
ляция с положительным давлением делает метод
Sniff ненадежным при изменении взаимосвязей
между центральным венозным давлением и разме-
ром нижней полой вены [22]. Если нижняя полая
вена плохо визуализируется и размер ПП в норме
(конечно-систолическая площадь 18 см2 или мень-
ше), можно заключить, что давление в ПП нормаль-
ное и составляет 5 мм рт. ст. Для оценки давления в
ПП могут быть также использованы трикуспидаль-
ный поток E/e′ и систолическая и диастолическая
допплеровская скорость временного интеграла пе-
ченочной вены (см. главу 32). При проведении
ЭхоКГ ошибки при измерении давления в ПП пере-
ходят на вычисление давлений в легочной артерии.
Особенно это нужно учитывать при «стремитель-
ной» трикуспидальной регургитации, при которой
давление в ПП может значительно повышаться до
20 мм рт. ст.
ПРИМЕНЕНИЕ В КЛИНИКЕ
Спектр клинического использования эхокардиогра-
фического исследования размера и функции ПЖ
достаточно широк. При многих условиях, влияю-
щих на правые отделы сердца, таких как острая ле-
гочная эмболия, легочная гипертензия, инфаркт
ПЖ, аритмогенная кардиомиопатия ПЖ или ВПС,
требуется внимательное исследование параметров
правых отделов сердца. Подобным образом параме-
тры правых отделов сердца также исследуются при
острых и хронических патологиях левых отделов
сердца, чтобы получить важные клинические исхо-
ды, включающие левостороннюю хроническую
систолическую недостаточность и левостороннюю
патологию клапанов. Апноэ во время сна – важный
признак, который указывает на потенциальную
систолическую и диастолическую дисфункцию как
правых, так и левых отделов сердца.
Несмотря на то что количественная оценка пра-
вых отделов сердца основана на методе, описанном
ранее, значительное изменение паттерна сокраще-
ния ПЖ после хирургической операции на сердце
(такой как трансплантация сердца, операция на
клапанах или шунтирование коронарной артерии)
имеет важные значения в отношении оценки значе-
ния TAPSE. Вместо паттерна преобладающего про-
дольного сокращения, после хирургической опера-
ции на сердце около половины систолических со-
кращений ПЖ осуществляются в поперечной
плоскости. Таким образом, считается, что нормаль-
ное значение TAPSE ниже в послеоперационном
периоде с порогом, близким к 1,6 см, что коррели-
рует с нормальной фракцией изменения площади
ПЖ и нормальной гемодинамической оценкой
функции ПЖ (давление в ПП, сердечный выброс и
сердечный индекс) [6].
Хотя предыдущие данные и ранее описанные
методы формируют прочную базу для дальнейших
In-31_для нас.indd 798
03.04.2019 12:10:19
799
31 Эхокардиографическое исследование правого желудочка
исследований, в дальнейшем будет являться пред-
метом преимущественных наблюдений. Исключая
легочную гипертензию, существует ряд определен-
ных данных относительно того, как при принятии
решений на практике в клинике учитывать систо-
лическую дисфункцию ПЖ, не учитывая инфор-
мированности их негативных прогностических
выводов.
В сложных случаях, таких как хроническая сер-
дечная недостаточность при амилоидозе, врожден-
ные заболевания сердца или легочную гипертензию,
требуется использование индекса Tei для дальней-
шей оценки функции ПЖ [23–26].
В частности, индекс Tei ПЖ может способство-
вать выявлению ранней дисфункции ПЖ при этих
патологических состояниях, однако при гипертро-
фии ПЖ может снижаться ВИВР, что повлечет за
собой ошибочно низкое значение систолической
функции ПЖ [27].
Среди многих индексов, которые были приме-
нены в исследованиях, при изучении систоличе-
ской функции ПЖ наиболее широко используе-
мыми становятся TAPSE и фракция изменения
площади ПЖ. Исследования, выборочно показы-
вающие связь систолической дисфункции ПЖ и
клинических исходов, объединены в табл. 31.4
[19, 20, 22, 28–33]. Несмотря на ограничения
вследствие различных методик исследования, а
также небольшого размера ПЖ, данные убеди-
тельно свидетельствуют, что его систолическая
функция коррелирует с прогнозом по широкому
спектру патологий.
Дальнейшие рандомизированные исследования,
направленные на вычисление индексов функции
ПЖ в качестве основы для выбора терапевтических
вмешательств (подобно таковым, исследующим
фракцию выброса ЛЖ (ФВ), в качестве основы для
таких методов лечения, как дефибрилляторы, пре-
параты для лечения систолической сердечной недо-
статочности, замена клапанов, коронарное шунти-
рование) пока не являются доступными. В идеале
благодаря таким исследованиям будет предоставле-
на информация для предписаний, дающих возмож-
ность выбора использования параметров, таких как
TAPSE и фракция изменения площади ПЖ, при
принятии решений в клинике.
Наконец, ЭхоКГ регулярно используют для про-
ведения эндомиокардиальной биопсии. Биопсия
МЖП со стороны ПЖ обычно выполняется через
полую вену, ПП и ПЖ.
Использование ТТЭхоКГ вместе с биопсией ПЖ
может дополнять информацию с целью предотвра-
щения повреждения свободной стенки ПЖ, мини-
мизируя риск перфорации. Это особенно важно
при выполнении биопсии ПЖ интактного сердца
для постановки таких диагнозов как амилоидоз,
лимфоцитарный миокардит, саркоидоз или гиган-
токлеточный миокардит.
ПРИМЕНЕНИЯ ИССЛЕДОВАНИЙ
Расширение использования трехмерной ЭхоКГ при-
вело к значительным корреляциям между эхокардио-
графическим и магнитно-резонансными исследо-
ваниями объема ПЖ. Применение трехмерной ви-
зуализации позволяет вычислять объемы ПЖ вне
зависимости от геометрических предположений [11,
12]. Сопоставимость между трехмерной ЭхоКГ и
МРТ имеет место при вычислении объемов ПЖ и
ФВ ПЖ в норме, а также при легочной гипертензии,
ишемической болезни сердца и ВПС [13–18, 34].
Нормальные значения конечно-диастолического и
систолического объемов ПЖ различаются у мужчин
и женщин (см. табл. 31.2) [12, 35, 36].
Трехмерное эхокардиографическое исследова-
ние, выполняемое с целью определения волюмоме-
трических значений ПЖ в конце систолы и диасто-
лы, может быть использовано для вычисления ФВ
ПЖ. Хотя стандартной оценкой ФВПЖ остается
МРТ сердца, также были описаны данные о наличии
высокой корреляции с МРТ [37].
Изображение деформации способствует расши-
рению использования в клинических и исследова-
тельских эхокардиографических протоколах. Изме-
рение степени деформации при этом может служить
способом распознавания незначительных патологий
сократительной функции ПЖ, не выявляемых с по-
мощью основных, традиционно используемых ме-
тодов. Радиальную деформацию сложнее визуали-
зировать при оценке ПЖ вследствие тонкой стенки
и ограниченной поперечной сократимости ПЖ.
Однако продольное сокращение может быть полу-
чено в апикальной четырехкамерной позиции, что
используется при врожденных патологиях сердца и
других сложных случаях [38, 39]. В целом деформа-
ция меньше в апикальном сегменте и сегменте осно-
вания свободной стенки ПЖ по сравнению со сре-
динной перегородкой, хотя в целом растяжимость
ПЖ выше, чем ЛЖ.
Исследование растяжимости перегородки являет-
ся неполноценным вследствие работы как ЛЖ, так и
ПЖ, и по сути не часто используется для непосред-
ственной оценки общей функции ПЖ [29]. В норме
двухмерное растяжение свободной стенки ПЖ со-
ставляет –29 ± 3,5% с порогом отклонения более чем
–20% (см. табл. 31.3) [12].
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ
И ДАЛЬНЕЙШИЕ НАПРАВЛЕНИЯ
Использование трехмерного и изображения дефор-
мации затруднено из-за различных ограничений
оценок для дисфункции различных степеней. Кро-
ме того, до настоящего времени производители
программного обеспечения не предложили специ-
фический аналитический пакет программ для ана-
лиза ПЖ.
In-31_для нас.indd 799
03.04.2019 12:10:19
Год Исследование n
Популяция Наблюдение
Конечная точка
наблюдения
Результаты
С учетом
2000 Ghioидр.[24] 140 ФВЛЖ<
35%
25 месяцев
Смертельный
исход или
транспланта-
ция
TAPSE ≤ 14 мм → HR 2,6, учте-
но
Возраст, ФВ ЛЖ,
пол, NYHA
класс, время
заполнения или
изгнания
2008 Diniидр.[29] 142 ФВЛЖ≤
45%
МРVC≥5
мм
20 месяцев
Смертельный
исход
TAPSE<16мм→HR2,6
Возраст, ФВ ЛЖ,
пол, NYHA
класс, время
заполнения или
изгнания
2008 Puwanant и др.
[30]
33 ВУЛЖ
6 месяцев
Правожелудоч-
ковая недоста-
точность
TAPSE < 7,5 мм → 91% специ-
фичны, но только 46% чув-
ствительны к после- ВУЛЖ
тяжелая правожелудочковая
недостаточность
Без учета
2006 Forfia и др.
[16]
63 PH (47 с ЛГ) 19 месяцев
Смертельный
исход
Учтено HR 1,16 для каждого
снижения 1 мм TAPSE в груп-
пе ЛГ
Выпот, WHO
класс
2002 Zornoff и др.
[20]
416 ФВЛЖ≤
40%, 11
дней после
ИМ
31 месяц
Смертельный
исход
ФИППЖ < 32% → HR 2,6,
учтено
Возраст, ФВ ЛЖ,
пол, ИМ, СД,
гипертензия,
размер инфар-
кта, курение,
лечение
2008 Anavekar и др.
[28]
522 СДЛЖ или
СН, 0,5–10
дней после
ИМ
25 месяцев
Смешанная
Каждые 5% заболеваний ФИП-
ПЖ → HR 1,53, учитывае-
мая; независимая ФИППЖ,
ассоциированная со всеми
причинами, и смертность от
сердечно-сосудистых патоло-
гий, СН, инсульт
Возраст, ФВ ЛЖ,
СН, Killip класс,
предваритель-
ный ИМ, пер-
вый ИМ, стено-
кардия, СД, ФП,
ХОБЛ, СКФ
2002 Samad и др.
[31]
194 Первый ИМ 24 месяца
Смертельный
исход
TAPSE < 15 мм → повышенная
смертность (p < 0,02)
Возраст, ФВ ЛЖ
2005 Skali и др. [33] 291 1 год после
ИМ
22 месяца
Смертельный
исход
ФИППЖ < 32% → HR 9,7,
учтено
Возраст, ФВ ЛЖ,
пол, СД, арте-
риальное дав-
ление
2005 Scridon и др.
[32]
141 Острый
легочный
эмболизм
1 месяц
Смертельный
исход
КДРПЖ/ КДРЛЖ > 0,9 → вы-
сокая смертность (9% vs 5%
для no TnI утечки, 38% vs
23% для TnI > 0,1 нг/мл)
Возраст, пол, ги-
потензия
2016 Goldraich и др.
[42]
69 ВУЛЖ
Продолжи-
тельность
госпита-
лизации
после им-
плантации
ВУЛЖ
Правожелудоч-
ковая недоста-
точность
Дилатация кольца ТК (ОШ
4,86) связанная с RVF, при-
менение инотропных препа-
ратов
Возраст, пол,
модифициро-
ванная MELD
оценка, ишеми-
ческая этиоло-
гия, централь-
ное венозное
давление
2013 Vivo и др. [43] 109 ВУЛЖ
1 месяц
Правожелудоч-
ковая недоста-
точность
КДРПЖ/КДРЛЖ > 0,75 →
повышенная правожелудоч-
ковая недостаточность (ОШ
5,40, p = 0,012)
Шкалы Matthews
и Kormos
ТАБЛИЦА 31.4
Выборочные исследования, демонстрируемые Ассоциацией клинических результатов и параметров
размера и систолической функции правого желудочка по данным эхокардиографии
800 ЧАСТЬ VI Правые отделы сердца
In-31_для нас.indd 800
03.04.2019 12:10:19
801
31 Эхокардиографическое исследование правого желудочка
Год Исследование n
Популяция Наблюдение
Конечная точка
наблюдения
Результаты
С учетом
2015 Karna и др.
[44]
60 Системный
склероз:
ЛГ, бо-
лезнь
легких,
диасто-
лическая
дисфунк-
ция ЛЖ
Параллель-
ная оценка
Глобальная ми-
окардиальная
функция
Толщина ПЖ прогнозируе-
мый индекс Tei обоих желу-
дочков с чувствительностью
82%
2015 Henein и др.
[45]
34 PH
8 лет
Смертность
Время наполнения ЛЖ, PA
Время ускорения ЛА, давле-
ние в ПП, TR прогнозируе-
мый смертельный исход (p <
0,009)
Возраст, пол
2014 Ameloot и др.
[46]
78 ЛГ, CTEPH 42 месяца
Смертность
КДРПЖ < 410 мм рт. ст.,
TAPSE < 15 мм прогнозируе-
мая смертность (HR 2,67, 95%
ДИ 1,3–5,5, p = 0,007)
TAPSE
2014 Shimony и др.
[47]
768 КШ
96 часов
Фибрилляция
предсердий
Индекс Tei ПЖ
ПЖ прогностическая ФП (ОШ
1,50, 95% ДИ 1,01–2,24)
Возраст, пол,
ИМТ, история
аритмии, ЗПА,
CVA, Кр
CVA — травма сосудов мозга; DT — замедление времени; FAC — фракция изменения площади; HR — коэффициент риска; MELD — модель
конечной стадии заболевания печени; NYHA — New York Heart Association; TAPSE — систолическое смещение фиброзного кольца трику-
спидального клапана; TnI — тропонин I; VC — vena contracta; WHO — World Health Organization; ВУЛЖ — вспомогательное устройство
левого желудочка; ДИ — доверительный интервал; ЗПА — заболевание периферических артерий; ИМ — инфаркт миокарда; ИМТ — ин-
декс массы тела; КДРЛЖ — конечно -диастолический размер левого желудочка; КДРПЖ — конечно -диастолический размер правого желу-
дочка; Кр — креатинин; КШ — коронарное шунтирование ЛГ — легочная гипертензия; МР — митральная регургитация; OHT — ортото-
пический трансплантат сердца; ОШ — отношение шансов; ПВ — перикардиальный выпот; СД — сахарный диабет; СДЛЖ — систоличе-
ская дисфункция левого желудочка; СКФ — скорость клубочковой фильтрации; СН — сердечная недостаточность; CTEPH — хроническая
тромбоэмболическая легочная гипертензия; ТК — трикуспидальный клапан; ТР — трикуспидальная регургитация; ФВ ЛЖ — фракция
выброса левого желудочка; ФИППЖ — фракционное изменение площади правого желудочка; ФП — фибрилляция предсердий; ХОБЛ —
хроническая обструктивная болезнь легких.
ТАБЛИЦА 31.4
окончание
Выборочные исследования, демонстрируемые Ассоциацией клинических результатов и параметров
размера и систолической функции правого желудочка по данным эхокардиографии
Трудоемкость выполнения анализа трехмерной
ЭхоКГ представляет собой определенный недоста-
ток в ее использовании, хотя усовершенствование
программных алгоритмов для определения и вос-
произведения границы ПЖ повышает качество
этого метода [35]. В настоящее время трехмерная
ЭхоКГ не является рекомендованной American
Society of Echocardiography в качестве стандартного
метода исследования объема ПЖ, однако она может
быть использована для последовательной оценки
объема ПЖ у определенного пациента для анализа
прогрессирования заболевания или ответа на тера-
пию. В общем, фракция изменения площади ПЖ
хорошо коррелирует с оценкой трехмерного изо-
бражения фракции выброса ПЖ и не требует таких
трудоемких затрат, как дополнительную обработку
и анализ данных [19].
Регулярное использование изображения дефор-
мации также является невыполнимым вследствие
дополнительных сложностей в получении данных и
их автономной обработке. В исследовательской
установке пик систолического продольного растяже-
ния ПЖ коррелировал с клинически развивающейся
правожелудочковой недостаточностью после при-
менения вспомогательного устройства в ЛЖ [40].
АЛЬТЕРНАТИВНЫЕ ПОДХОДЫ
В дополнение к ЭхоКГ для анализа ПЖ также при-
меняются другие визуализирующие методики. Счи-
тается, что золотым стандартом анатомической и
функциональной оценки ПЖ является МРТ, пото-
му что методики МРТ не требуют геометрических
предположений. Существует определенное отличие
между миокардом и эндокардом, что выражается в
качестве изображения, а также МРТ менее зависимо
от взаимодействия между тканью и воздухом. МРТ
также важно для анализа кровотока и экстраполя-
ции гемодинамических показателей, включающих
ударный объем УО, сердечный выброс и расчет
шунта, например Qp/Qs. Однако МРТ сердца не так
широко распространено, как ТТЭхоКГ и ЧПЭхоКГ,
а клаустрофобия остается реальным ограничением
его широкого применения в клинике. Кроме того,
In-31_для нас.indd 801
03.04.2019 12:10:19
802
ЧАСТЬ VI Правые отделы сердца
тяжелая острая и хроническая почечная недостаточ-
ность потенциально может являться угрожающим
жизни риском нефрогенного системного фиброза.
Компьютерная томография сердца обладает пре-
имуществом простого изображения, вовлекающим
геометрический и трехмерный анализы, но подвер-
гает пациента риску радиационной экспозиции, а
также требует внутривенного введения рентгено-
контрастного средства, что дополнительно служит
риском патологии почек или анафилактической
реакции.
Ядерные методики исследования вместе с оцен-
кой объема циркулирующей крови (равно как и
радионуклеотидная ангиография) также использу-
ются для измерения ФВПЖ без геометрических
предположений. Соотношение с ФВПЖ, исследо-
ванной при МРТ, предпочтительна. Однако вслед-
ствие того, что ядерное исследование привносит
также другие данные о правых отделах сердца и
требует применения радиации, этот метод редко
используется в первую очередь для изучения пра-
вых отделов сердца [41].
БЛАГОДАРНОСТИ
Авторы хотят поблагодарить Christopher E. Kurtz,
MD, Paul R. Forfia, MD, и Susan E. Wiegers, MD, ав-
торов соответствующих глав в предыдущем изда-
нии.
Позиция или параметр
Важные подходы к визуализации/методы
ТТЭхоКГ
Парастернальная позиция по длинной оси
Ограниченный срез верхнего ВТПЖ
Не следует использовать для определения размера ПЖ
Входящий поток ТК (парастернальная позиция
по длинной оси)
Передняя и задняя створки ТК
Струя ТР
ВТПЖ (парастернальная позиция по длинной
оси)
Морфология, стеноз и регургитация клапана легочной артерии
Размер ПП
ВТПЖ VTI (систолическая функция, Qp:Qs для шунта)
ВТПЖ диаметр (Qp:Qs для шунта)
Среднежелудочковая парастернальная позиция
по короткой оси
Позиция с внутрижелудочковой перегородки (перегрузка объемом/давле-
нием ПЖ)
ПЖ короткая ось
Морфология, стеноз, регургитация ТК
Морфология, стеноз, регургитация клапана легочной артерии
МПП (ООО, ДМПП)
ВТПЖ VTI (систолическая функция, Qp:Qs)
Стандартная апикальная четырехкамерная
позиция
Морфология ПЖ
Морфология, стеноз, регургитация ТК
Размеры ПП
Сфокусированный на ПЖ (апикальная
четырехкамерная позиция)
Измерения размеров ПЖ
Морфология ПЖ
ФИППЖ
Позволяет визуализировать свободную стенку
Модифицированная позиция ПЖ
Изображение с апикального ракурса ПЖ и продольное измерение
Позволяет визуализировать свободную стенку
Субкостальная позиция
Толщина свободной стенки ПЖ
Субоптимальный срез для оценки размера и систолической функции
ЧПЭхоКГ
Средний отдел пищевода, апикальная четырех-
камерная позиция (0°)
Морфология ПЖ
Функция ПЖ
Изображение в общем ракурсе размера ПЖ
Средний отдел пищевода, бикавальная позиция
(90°)
Размер ПП
Морфология ПП
ВПВ
НПВ
ООО/ДМПП
Придаток ПП (тромб)
Средний отдел пищевода, позиция трикуспи-
дальный входящий поток (120–130°)
Морфология, стеноз, регургитация ТК
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиографическое исследование правого желудочка
In-31_для нас.indd 802
03.04.2019 12:10:19
803
31 Эхокардиографическое исследование правого желудочка
Позиция или параметр
Важные подходы к визуализации/методы
Средний отдел пищевода, позиция по короткой
оси (60°)
Морфология клапана легочной артерии, стеноз, регургитация
Размеры ПП
Седловидный эмбол легочной артерии
Размер ВТПЖ
Трансгастральный доступ, позиция по корот-
кой оси (90°)
Короткая ось ТК: морфология, стеноз, регургитация
Размер ВТПЖ, ВТПЖ VTI
Морфология, стеноз, регургитация клапана легочной артерии
Размер ЛА
Глубокая трансгастральная позиция (0°)
Эквивалент четырехкамерной позиции
Морфология ПЖ
Функция ПЖ
Субоптимальный для размера ПЖ
Интракардиальная эхокардиография
ПП
Передняя и септальная створки ТК
МПП (ООО/ДМПП)
ВПВ
ПЖ
ВТПЖ
Размер ПП
Количественная оценка
ГПЖ: субкостальная позиция
Субкостальный срез
Свободная стенка > 5мм
Размер: апикальная четырехкамерная позиция Растяжение ПЖ > 2/3 ЛЖ по размеру
Базальный, срединный и продольный диаметры
Площадь в фазу диастолы
Размер: позиция по короткой оси
Среднежелудочковое измерение
Систолическая функция: апикальная четырех-
камерная позиция
FAC (фракционное изменение площади)
TAPSE (возможна недооценка систолической функции в послеоперационном
периоде)
Скорость s’ латеральной части кольца при тканевой допплерографии
dP/dt из ТР непрерывно-волновой допплерографии
Изоволюмическое увеличение при тканевой допплерографии
Индекс Tei при импульсно-волновой допплерографии или тканевой доппле-
рографии (ГПЖ может ошибочно укорачивать IVRT)
Диастолическая функция: апикальная четырех-
камерная позиция
Входящий ток ТК E/A при импульсно-волновой допплерографии
E ВД при импульсно-волновой допплерографии
Латеральный кольцевой e’ при тканевой допплерографии
Растяжение ПП
Диастолическая функция: субкостальная
позиция
Размер и спадение НПВ
Соотношение S/D печеночной вены
Трехмерная эхокардиография
Объемы ПЖ и ФВПЖ
Нет геометрических предположений
Требует адекватного эндокардиального определения
Деформация
Пик продольной систолической деформации
свободной стенки ПЖ
Наибольшая деформация в средней стенке
Требует адекватного эндокардиального определения
dP/dt — изменение общего давления во времени DT, замедление времени; FAC — фракция изменения площади; IVRT — время изоволю-
мического расслабления; S/D — систолический VTI/диастолический VTI; TAPSE — систолическое смещение фиброзного кольца трику-
спидального клапана; VTI — интеграл скорости кровотока; ВПВ — верхняя полая вена; ВТПЖ — выходной тракт правого желудочка;
ГПЖ — гипертрофия правого желудочка; ДМПП — дефект межпредсердной перегородки; ЛА — легочная артерия; МПП — межпред-
сердная перегородка; НПВ — нижняя полая вена; ООО — открытое овальное окно; ТК — трикуспидальный клапан; ТР — трикуспи-
дальная регургитация; ФВПЖ — фракция выброса правого желудочка.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Эхокардиографическое исследование правого желудочка
In-31_для нас.indd 803
03.04.2019 12:10:19
804
ЧАСТЬ VI Правые отделы сердца
ЛИТЕРАТУРА
1. Rushmer RF, Crystal DK, Wagner C. The
functional anatomy of ventricular contrac-
tion, Circ Res 1:162–170, 1953.
2. Santamore WP, Dell’Italia LJ. Ventricular in-
terdependence: significant left ventricular
contributions to right ventricular systolic
function, Prog Cardiovasc Dis 40:289–308,
1998.
3. Lowensohn HS, Khouri EM, Gregg DE, et al.
Phasic right coronary artery blood flow in
conscious dogs with normal and elevated
right ventricular pressures, Circ Res 39:760–
766, 1976.
4. Forman MB, Wilson BH, Sheller JR, et al.
Right ventricular hypertrophy is an impor-
tant determinant of right ventricular infarc-
tion complicating acute inferior left ventricu-
lar infarction, J Am Coll Cardiol 10:1180–
1187, 1987.
5. Kaul S, Tei C, Hopkins JM, Shah PM. Assess-
ment of right ventricular function using two-
dimensional echocardiography, Am Heart J
107:526–531, 1984.
6. Raina A, Vaidya A, Gertz ZM, et al. Marked
changes in right ventricular contractile pat-
tern after cardiothoracic surgery: implica-
tions for post-surgical assessment of right
ventricular function, J Heart Lung Transplant
32:777–783, 2013.
7. Kind T, Mauritz GJ, Marcus JT, et al. Right
ventricular ejection fraction is better reflected
by transverse rather than longitudinal wall
motion in pulmonary hypertension, J Cardio-
vasc Magn Reson 12:35, 2010.
8. Clark TJ, Sheehan FH, Bolson EL. Character-
izing the normal heart using quantitative
three-dimensional echocardiography, Physiol
Meas 27:467–508, 2006.
9. Arkles JS, Opotowsky AR, Ojeda J, et al.
Shape of the right ventricular Doppler enve-
lope predicts hemodynamics and right heart
function in pulmonary hypertension, Am J
Respir Crit Care Med 183:268–276, 2011.
10. Opotowsky AR, Ojeda J, Rogers F, et al. A
simple echocardiographic prediction rule for
hemodynamics in pulmonary hypertension,
Circ Cardiovasc Imaging 5:765–775, 2012.
11. Bommer W, Weinert L, Neumann A, et al.
Determination of right atrial and right ven-
tricular size by two-dimensional echocardiog-
raphy, Circulation 60:91–100, 1979.
12. Lang RM, Badano LP, Mor-Avi F, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
13. Hammarstrom E, Wranne B, Pinto FJ, et al.
Tricuspid annular motion, J Am Soc Echocar-
diogr 4:131–139, 1991.
14. Jiang L, Levine RA, Weyman AE. Echocardio-
graphic assessment of right ventricular vol-
ume and function, Echocardiography 14:189–
206, 1997.
15. Kovalova S, Necas J, Cerbak R, et al. Echocar-
diographic volumetry of the right ventricle,
Eur J Echocardiogr 6:15–23, 2005.
16. Forfia PR, Fisher MR, Mathai SC, et al. Tri-
cuspid annular displacement predicts survival
in pulmonary hypertension, Am J Respir Crit
Care Med 174:1034–1041, 2006.
17. Kanzaki H, Nakatani S, Kawada T, et al. Right
ventricular dP/dt/P(max), not dP/dt(max),
noninvasively derived from tricuspid regurgi-
tation velocity is a useful index of right ven-
tricular contractility, J Am Soc Echocardiogr
15:136–142, 2002.
18. Kjaergaard J, Snyder EM, Hassager C, et al.
Impact of preload and afterload on global
and regional right ventricular function and
pressure: a quantitative echocardiography
study, J Am Soc Echocardiogr 19:515–521,
2006.
19. Rudski LG, Lai WW, Afilalo J, et al. Guide-
lines for the echocardiographic assessment
of the right heart in adults: a report from the
American Society of Echocardiography en-
dorsed by the European Association of
Echocardiography, a registered branch of
the European Society of Cardiology, and the
Canadian Society of Echocardiography, J
Am Soc Echocardiogr 23:685–713, 2010. quiz
786-688 .
20. Zornoff LA, Skali H, Pfeffer MA, et al. Right
ventricular dysfunction and risk of heart fail-
ure and mortality after myocardial infarction,
J Am Coll Cardiol 39:1450–1455, 2002.
21. Kukulski T, Hubbert L, Arnold M, et al. Nor-
mal regional right ventricular function and its
change with age: a Doppler myocardial imag-
ing study, J Am Soc Echocardiogr 13:194–204,
2000.
22. Marangoni S, Vitacca M, Quadri A, et al.
Non-invasive haemodynamic effects of two
nasal positive pressure ventilation modalities
in stable chronic obstructive lung disease pa-
tients, Respiration 64:138–144, 1997.
23. Forfia PR, Fisher MR, Mathai SC, et al. Tri-
cuspid annular displacement predicts survival
in pulmonary hypertension, Am J Respir Crit
Care Med 174:1034–1041, 2006.
24. Ghio S, Recusani F, Klersy C, et al. Prognostic
usefulness of the tricuspid annular plane sys-
tolic excursion in patients with congestive
heart failure secondary to idiopathic or isch-
emic dilated cardiomyopathy, Am J Cardiol
85:837–842, 2000.
25. Hsiao SH, Lin SK, Wang WC, et al. Severe
tricuspid regurgitation shows significant im-
pact in the relationship among peak systolic
tricuspid annular velocity, tricuspid annular
plane systolic excursion, and right ventricular
ejection fraction, J Am Soc Echocardiogr
19:902–910, 2006.
26. Lopez-Candales A, Rajagopalan N, Saxena N,
et al. Right ventricular systolic function is not
the sole determinant of tricuspid annular mo-
tion, Am J Cardiol 98:973–977, 2006.
27. Abdel Rahman MY, Abdul-Khaliq H, Vogel
M, et al. Value of the new Doppler-derived
myocardial performance index for the evalu-
ation of right and left ventricular function
following repair of tetralogy of Fallot, Pediatr
Cardiol 23:502–507, 2002.
28. Anavekar NS, Skali H, Bourgoun M, et al.
Usefulness of right ventricular fractional area
change to predict death, heart failure, and
stroke following myocardial infarction (from
the VALIANT ECHO Study), Am J Cardiol
101:607–612, 2008.
29. Dini FL, Fontanive P, Panicucci E, et al. Prog-
nostic significance of tricuspid annular mo-
tion and plasma NT-proBNP in patients with
heart failure and moderate-to-severe func-
tional mitral regurgitation, Eur J Heart Fail
10:573–580, 2008.
30. Puwanant S, Hamilton KK, Klodell CT, et al.
Tricuspid annular motion as a predictor of
severe right ventricular failure after left ven-
tricular assist device implantation, J Heart
Lung Transplant 27:1102–1107, 2008.
31. Samad BA, Alam M, Jensen-Urstad K. Prog-
nostic impact of right ventricular involve-
ment as assessed by tricuspid annular motion
in patients with acute myocardial infarction,
Am J Cardiol 90:778–781, 2002.
32. Scridon T, Scridon C, Skali H, et al. Prognos-
tic significance of troponin elevation and
right ventricular enlargement in acute pulmo-
nary embolism, Am J Cardiol 96:303–305,
2005.
33. Skali H, Zornoff LA, Pfeffer MA, et al. Prog-
nostic use of echocardiography 1 year after a
myocardial infarction, Am Heart J 150:743–
749, 2005.
34. van der Zwaan HB, Helbing WA, McGhie JS,
et al. Clinical value of real-time three-dimen-
sional echocardiography for right ventricular
quantification in congenital heart disease:
validation with cardiac magnetic resonance
imaging, J Am Soc Echocardiogr 23:134–140,
2010.
35. Gopal AS, Chukwu EO, Iwuchukwu CJ, et al.
Normal values of right ventricular size and
function by real-time 3-dimensional echocar-
diography: comparison with cardiac mag-
netic resonance imaging, J Am Soc Echocar-
diogr 20:445–455, 2007.
36. Graspa J, O’Regan DP, Pavlopoulos H, et al.
Right ventricular remodeling in pulmonary
arterial hypertension with three-dimensional
echocardiography: comparison with cardiac
magnetic resonance imaging, Eur J Echocar-
diogr 11:64–73, 2010.
37. Sheehan FH, Kilner PJ, Sahn DJ, et al. Accu-
racy of knowledge-based reconstruction for
measurement of right ventricular volume and
function in patients with tetralogy of Fallot,
Am J Cardiol 105:993–999, 2010.
38. Weidemann F, Eyskens B, Mertens L, et al.
Quantification of regional left and right ven-
tricular function by ultrasonic strain rate and
strain indexes after surgical repair of tetralo-
gy of Fallot, Am J Cardiol 90:133–138, 2002.
39. Weidemann F, Eyskens B, Jamal F, et al.
Quantification of regional left and right ven-
tricular radial and longitudinal function in
healthy children using ultrasound-based
strain rate and strain imaging, J Am Soc Echo-
cardiogr 15:20–28, 2002.
40. Grant AD, Smedira NG, Starling RC, et al.
Independent and incremental role of quanti-
tative right ventricular evaluation for the pre-
diction of right ventricular failure after left
ventricular assist device implantation, J Am
Coll Cardiol 60:521–528, 2012.
41. Hornung TS, Anagnostopoulos C, Bhardwaj
P, et al. Comparison of equilibrium radionu-
clide ventriculography with cardiovascular
magnetic resonance for assessing the systemic
right ventricle after Mustard or Senning pro-
cedures for complete transposition of the
great arteries, Am J Cardiol 92:640–643, 2003.
42. Goldraich L, Kawajiri H, Foroutan F, et al.
Tricuspid valve annular dilatation as a predic-
tor of right ventricular failure after implanta-
tion of a left ventricular assist device, J Car-
diol Surg 31:110–116, 2016.
43. Vivo R, Cordero-Reyes A, Qamar U, et al.
Increased right-to-left ventricular diameter
ratio is a strong predictor of right ventricular
failure after left ventricular assist device, J
Heart Lung Transplant 32:792–799, 2013.
44. Karna S, Rohit M, Wanchu A. Right ventricu-
lar thickness as a predictor of global myocar-
dial performance in systemic scleroris: a Dop-
pler tissue imaging study, Indian Heart J 6:
521–518, 2015.
In-31_для нас.indd 804
03.04.2019 12:10:19
805
31 Эхокардиографическое исследование правого желудочка
45. Henein M, Gronlund C, Tossavainen E. Right
and left heart dysfunction predict mortality
in pulmonary hypertension, Clin Physiol
Funct Imaging, 2015 June 19 http://dx.doi.
org/10.1111/cpf.12266 [Epub ahead of print].
46. Ameloot K, Palmers P, Vande Bruaene A, et al.
Clinical value of echocardiographic Doppler-
derived right ventricular dp/dt in patients with
pulmonary arterial hypertension, Eur Heart J
Cardiovasc Imaging 15:1411–1419, 2014.
47. Shimony A, Afilalo J, Flynn A, et al. Useful-
ness of right ventricular dysfunction to pre-
dict new-onset atrial fibrillation following
coronary artery bypass grafting, Am J Cardiol
113:913–918, 2014.
In-31_для нас.indd 805
03.04.2019 12:10:19
In-31_для нас.indd 806
03.04.2019 12:10:19
807
32 Легочная гипертензия
DAVID S. CELERMAJER, MBBS, PHD, DSC • DAVID PLAYFORD, MBBS, PHD
Общие принципы
Подтверждение наличия легочной
гипертензии
Оценка давления в правом предсердии
Оценка разницы между давлением
в правом желудочке и в правом
предсердии по профилю
трикуспидальной регургитации
Профиль легочной регургитации
Время ускорения потока в легочной
артерии
Среднесистолическая выемка при
допплерографии выносящего тракта
правого желудочка
Факторы, оказывающие влияние
на давление в легочной артерии
в норме
Определение причины легочной
гипертензии
Общая классификация
Легочная артериальная гипертензия
Легочная гипертензия, обусловленная
ВПС
Легочная гипертензия, обусловленная
поражением левых отделов сердца
Легочная гипертензия, обусловленная
заболеванием легких
Легочная гипертензия, обусловленная
хронической легочной
тромбоэмболической болезнью
Остро возникшая легочная гипертензия
Влияние легочной гипертензии на
правые отделы сердца
Показатели функции правого желудочка
в условиях нагрузки давлением
Размеры правого желудочка
Толщина стенок правого желудочка
Систолическая функция правого
желудочка
Трехмерный анализ систолической
функции правого желудочка
Диастолическая функция правого
желудочка
Движение межжелудочковой перегородки
Оценка легочного сосудистого
сопротивления
Стресс-эхокардиография
с физической нагрузкой и легочная
гипертензия
Диагностический подход при
подозрении на легочную
гипертензию
Часто встречающаяся, обусловленная различными
причинами одышка — наиболее распространенный
симптом легочной гипертензии (ЛГ). Тем не менее
одышка при физической нагрузке не обладает ни
чувствительностью, ни специфичностью для поста-
новки диагноза «легочная гипертензия». Диагно-
стическое обследование пациентов с одышкой
должно включать неинвазивное измерение давле-
ния в легочной артерии (ЛА), а также, если резуль-
таты других исследований не полностью объясняют
наличие симптомов, следует выполнить тщатель-
ное обследование на предмет вероятной ЛГ.
ОБЩИЕ ПРИНЦИПЫ
Часто относительно легкая ЛГ не подозревается или
остается не распознанной, но коррелирует со значи-
тельной заболеваемостью и летальностью [1, 2]. Не
являясь самостоятельным диагнозом, ЛГ служит
серьезным маркером основного заболевания. Ран-
нее выявление и лечение причины ЛГ может со
временем значительно снизить прогрессирование и
симптомы ЛГ.
В терминологии ЛГ иногда возникает путаница.
ЛГ проявляется повышением среднего давления в
легочной артерии (ЛА) выше 25 мм рт. ст. Для под-
тверждения этого состояния обычно требуется про-
ведение катетеризации правых отделов сердца, но
изначально ЛГ распознается с помощью неинвазив-
ных методик. О наличии легочной артериальной
гипертензии (ЛАГ) говорят при ЛГ и нормальном
давлении наполнения левого сердца, определяемом
как давление заклинивания в легочной артерии
< 15 мм рт. ст. При ЛГ легочное сосудистое сопро-
тивление (ЛСС) обычно составляет > 3 единиц ВУД
и рассчитывается как среднее давление в ЛА минус
среднее давление заклинивания в легочной артерии
(в мм рт. ст.), деленное на сердечный выброс в ли-
трах в минуту.
Наиболее распространенный метод эхокардио-
графической оценки давления в ЛА — определение
систолического давления в ЛА, базирующееся на
разнице между систолическим давлением в правом
желудочке (ПЖ) и ПП, измеряемой по максималь-
ной скорости трикуспидальной регургитации (что
может иметь ограничения в связи с как завышен-
ной, так и заниженной оценкой). Таким образом,
специалисты в области эхокардиографии (ЭхоКГ)
обычно оценивают систолическое давление в ЛА
(по струе трикуспидальной регургитации и эхокар-
In-32_для нас.indd 807
03.04.2019 12:10:39
808 ЧАСТЬ VI Правые отделы сердца
диографической оценке давления в ПП), тогда как
определение ЛГ основано на измерении среднего
давления в ЛА, осуществление чего с помощью
ЭхоКГ связано с большими сложностями и мень-
шей точностью. Для ЭхоКГ было предложено по-
граничное значение систолического давления, пре-
вышение которого указывает на наличие ЛГ и со-
ответствует инвазивно измеренным значениям
среднего давления в ЛА. Они кратко изложены в
этой главе далее. Таким образом, у всех пациентов
с подозрением на ЛГ для ее подтверждения необхо-
димо проведение тщательной клинической и эхо-
кардиографической оценки и других обследований.
Зачастую для подтверждения диагноза требуется
выполнение инвазивного исследования гемодина-
мики.
При диагностическом обследовании пациентов с
подозрением на ЛГ или ЛАГ ЭхоКГ дает ответ на
три жизненно важных вопроса.
Присутствует ли ЛГ? Это включает в себя оцен-
ку давления в ПЖ на основании допплеровских
показателей струй трикуспидальной регургитации
и/или легочной регургитации (ЛР), а также времени
ускорения потока в легочной артерии и эхо-оценки
давления в правом предсердии. При условии точ-
ной оценки давления в ЛП возможно определить
или исключить наличие ЛАГ (как подгруппа ЛГ).
Также возможно выполнить оценку ЛСС путем
определения давления в легочной артерии, давле-
ния в ЛП и сердечного выброса, как описано в сле-
дующих разделах.
Можно ли определить основную причину ЛГ (и/
или ЛАГ)? Это включает детальное исследование
функции левых отделов сердца, а также, кроме все-
го прочего, опрос на предмет наличия ВПС.
Каково воздействие ЛГ на правые отделы сердца?
Это в особенности предполагает оценку размера и
сократимости ПЖ.
ПОДТВЕРЖДЕНИЕ НАЛИЧИЯ
ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ
Оценка систолического давления в ЛА основана на
(1) определении (или расчете) давления в ПП, (2)
определение градиента максимального давления
ПЖ-ПП и (3) исключении любого стеноза вынося-
щего тракта ПЖ (в этом случае систолическое дав-
ление в ПЖ будет быть выше, чем систолическое
давление в ЛА). Методы и ограничения для оценки
первых двух показателей описаны в следующих
разделах.
ОЦЕНКА ДАВЛЕНИЯ В ПРАВОМ ПРЕДСЕРДИИ
Для оценки систолического давления в ПЖ обычно
к предполагаемому давлению в ПП добавляют раз-
ность давлений в ПЖ и в ПП. Для неинвазивной
оценки давления в ПП был предложен ряд методов.
Несмотря на то что некоторые лаборатории для
предотвращения вариабельности оценки указыва-
ют постоянное значение давления в ПП (например,
10 мм рт. ст.), в связи с этим подходом возникает
проблема, заключающаяся в переоценке систоличе-
ского давления в ПЖ у пациентов с нормальным
показателем давления в ПП. Рекомендации амери-
канского общества эхокардиографии (ASE) [3] по
оценке давления в ПП заключаются в использова-
нии диаметра и степени инспираторного спадения
нижней полой вены и кратко представлены в табл.
32.1 и на рис. 32.1 . В определенных ситуациях кли-
ническая оценка давления в яремных венах позво-
ляет подтвердить эхографическую оценку давления
в ПП.
Дилатация ПП обычно указывает на хроническое
повышение давления в ПП, обусловленное пороком
трикуспидального клапана или повышением давле-
ния наполнения ПЖ. Признаками дилатации ПП
являются площадь ПП > 18 см2 или объем ПП
> 28 мл/м2.
Степень ДПП
Рассчитанное ДПП (мм рт. ст .)
Эхокардиографические признаки
Нормальное значение
3
НПВ<2,1сми
спадение НПВ > 50% при вдохе носом
Неопределенная
8
При неопределенности показателей НПВ:
Трикуспидальное E:E’ > 6
Скорость кровотока в печеночной вене D > S
Повышенная
15
НПВ≥2,1сми
спадение НПВ < 50% при вдохе носом
* Если НПВ не расширена и не спадается более чем на 50% при вдохе, давление в ПП, вероятно, соответствует норме и предположительно
составляет 3 мм рт. ст. И наоборот, если НПВ дилатирована и не спадается при вдохе носом, предполагается, что давление в ПП состав-
ляет 15 мм рт. ст . Если присутствует только один из этих признаков, то давление является неопределенным и считается равным 8 мм
рт. ст . Если трикуспидальное отношение E/E′ повышено или наблюдается диастолическое преобладание кровотока в печеночной вене,
то можно предположить повышение давления в ПП. Эти рекомендации не применяются у пациентов при вентиляции с положительным
давлением.
ДПП — давление в правом предсердии; НПВ — нижняя полая вена .
ТАБЛИЦА 32.1 Рекомендации американского общества эхокардиографии по оценке давления в правом предсердии [3]*
In-32_для нас.indd 808
03.04.2019 12:10:40
809
32 Легочная гипертензия
Рис. 32.1 Оценка давления в правом предсердии. Визуализация нижней полой вены в 2D-режиме в покое (А, Б), на вдохе (В, Г) и в M-режиме (Д, Е) у
пациентов с нормальным (А, В , Д) и повышенным (Б, Г, Е) давлением в ПП. При нормальном давлении в ПП происходит его снижение на вдохе (вдох носом), что
приводит к коллапсу нижней полой вены более чем на 50%. При повышенном давлении в ПП нижняя полая вена на вдохе не спадается, а расширяется. A На
видеоизображении — нижняя полая вена в покое (Б) и на вдохе (Г) у пациента с повышенным давлением в ПП.
А
Б
В
Г
Д
Е
In-32_для нас.indd 809
03.04.2019 12:10:40
810
ЧАСТЬ VI Правые отделы сердца
ОЦЕНКА РАЗНИЦЫ МЕЖДУ ДАВЛЕНИЕМ
В ПРАВОМ ЖЕЛУДОЧКЕ И В ПРАВОМ ПРЕДСЕРДИИ
ПО ПРОФИЛЮ ТРИКУСПИДАЛЬНОЙ РЕГУРГИТАЦИИ
Наиболее важным эхокардиографическим показа-
телем при ЛГ является повышение систолического
давления в ПЖ (СДПЖ), определяемое по макси-
мальной скорости профиля трикуспидальной ре-
гургитации (рис. 32.2). Непрерывно-волновую доп-
плерографию следует проводить из нескольких по-
зиций для получения самого прямого выравнивания
и размещать курсор таким образом, чтобы получать
максимальную скорость. Обычно для получения
сигнала трикуспидальной регургитации необходи-
мо выполнить визуализацию в парастернальной
проекции притока ПЖ, базальной короткой оси,
апикальной по длинной оси и субкостальной про-
екциях. Из-за эксцентрического характера профиля
трикуспидальной регургитации у некоторых паци-
ентов для оптимизации выравнивания может по-
требоваться визуализация во внеосевой двухмерной
(2D) проекции. Следует проявлять осторожность,
чтобы измерить только четко определенное изобра-
жение спектра и избежать «шума» вокруг спек-
трального сигнала. Это особенно актуально при
применении контрастирования для усиления сигна-
ла трикуспидальной регургитации. Среднее давле-
ние в ЛА может быть рассчитано по скорости три-
куспидальной регургитации с использованием
формулы, полученной D. Chemla и его коллегами
[4]:
Среднее давление в ЛА = (0,61 × СДПЖ) + 2,
где СДПЖ — систолическое давление в ПЖ.
Полученное значение может быть перепровере-
но с помощью среднего давления в ЛА, рассчитан-
ного на основе начальной скорости легочной регур-
гитации (см. далее).
У трети пациентов при ЭхоКГ наблюдается три-
куспидальная регургитация, недостаточная для точ-
ной оценки систолического давления в ПЖ. Для
улучшения неполного профиля трикуспидальной
регургитации были использованы различные мето-
ды. Контрастирование с возбужденным солевым
раствором и внутривенные микропузырьковые
контрастные средства позволяют усилить сигнал
трикуспидальной регургитации.
При наличии дисфункции ПЖ, обусловленной
ЛГ, может наблюдаться неполное закрытие ство-
рок трикуспидального клапана, изначально вы-
званное дисфункцией, а затем смещением саб-
вальвулярного аппарата. Это проявляется нараста-
нием тяжести трикуспидальной регургитации
(рис. 32.3). Таким образом, у большинства паци-
ентов с выраженной дисфункцией ПЖ будет опре-
деляться некоторая измеримая скорость трикупи-
дальной регургитации.
В условиях тяжелой трикуспидальной регургита-
ции в фазу систолы может наблюдаться выравнива-
ние давления между ПЖ и ПП. Это может привести
к притуплению максимальной скорости профиля
трикуспидальной регургитации и потенциальной
недооценке систолического давления в ПЖ.
Легочная гипертензия, идентифицированная с
помощью скорости трикуспидальной регургита-
ции, требует подтверждения с помощью других
измерений, особенно если профиль трикуспидаль-
ной регургитации является неполным. Следует ис-
пользовать другие измерения, такие как профиль
легочной регургитации и время ускорения потока в
Рис. 32.2 Измерение повышенного систолического давления в правом желудочке. (A) В апикальной четырехкамерной позиции, сфокусированной на
ПЖ, с помощью цветовой допплерографии определяется струя трикуспидальной регургитации. Приняты меры для обеспечения выравнивания ультразвукового
луча параллельно направлению струи трикуспидальной регургитации. (Б) Для перешейка трикуспидальной регургитации использована непрерывно-волновая
допплерография с оптимизацией коэффициента усиления, амплитуды и скорость развертки. (В) Затем измерена максимальная скорость кровотока, которую
можно перепроверить с помощью изображения по датчику.
А
Б
В
In-32_для нас.indd 810
03.04.2019 12:10:41
811
32 Легочная гипертензия
легочной артерии, а также суррогатные маркеры
повышенного давления в ПЖ. Решающее значение
в определении повышенного давления в ЛА имеет
катетеризация правых отделов сердца [5].
ПРОФИЛЬ ЛЕГОЧНОЙ РЕГУРГИТАЦИИ
Приблизительно у 10% пациентов с ЛГ наблюдает-
ся значительная легочная регургитация. Диастоли-
ческое давление в ЛА может быть рассчитано по
профилю легочной регургитации с помощью того
же модифицированного уравнения Бернулли и рас-
чета давления в ПП на основании значений скоро-
стей трикуспидальной регургитации (рис. 32.4).
Диастолическое давление в легочной артерии =
= 4 (Конечная скорость ЛР)2 + Давление в ПП,
Среднее давление в легочной артерии =
= 4 (Начальная скорость ЛР)2 + Давление в ПП,
где скорость ЛР — скорость легочной регургитации.
ВРЕМЯ УСКОРЕНИЯ ПОТОКА В ЛЕГОЧНОЙ АРТЕРИИ
При ЛГ может быть усилен ранний выброс в легоч-
ную артерию, что приводит к короткому времени
ускорения потока в легочной артерии. Часто это
связано с более поздним замедлением кровотока в
легочной артерии, что приводит к появлению вы-
емки на допплеровской кривой в середине систолы.
Короткое время ускорения потока в легочной арте-
рии < 90 мсек позволяет предположить ЛСС выше
3 единиц Вуд и наличие ЛГ, как показано на рис.
32.5 [6].
Рис. 32.4 Измерение давления в легочной артерии по показателю
легочного давления из профиля легочной регургитации. Конечно-диа-
столическая скорость кровотока используется для расчета диастолического
давления в легочной артерии, ранняя диастолическая скорость кровотока —
для расчета среднего давления в легочной артерии (см. текст).
ПЖ
V
V
V
ПЖ
ПП
ПП
Рис. 32.3 Тяжелая трикуспидальная регургитация. (A) A 2D-ЭхоКГ
притока правого желудочка (ПЖ). (Б) A Цветовая допплерография. Помимо
дилатации фиброзного кольца отмечается смещение подклапанного аппарата
(стрелки) в дилатированный ПЖ. В результате возникает трикуспидальная
регургитация. (В) При тяжелой трикуспидальной регургитации в фазу систолы
возможно выравнивание давлений в ПЖ и правом предсердии (ПП), что при-
водит к раннему достижению пика и формированию ножеобразного профиля
скорости кровотока. Резкое прекращение систолического нарастания скорости
кровотока является ограничением для применения уравнения Бернулли.
А
Б
В
In-32_для нас.indd 811
03.04.2019 12:10:42
812
ЧАСТЬ VI Правые отделы сердца
СРЕДНЕСИСТОЛИЧЕСКАЯ ВЫЕМКА ПРИ ДОППЛЕРОГРАФИИ
ВЫНОСЯЩЕГО ТРАКТА ПРАВОГО ЖЕЛУДОЧКА
При импульсно-волновой или непрерывно-волно-
вой допплеровской оценке выносящего тракта ПЖ
может быть отмечена среднесистолическая выемка,
как показано на рис. 32.5 . Предполагается, что при-
чиной выемки является отражение волны давления
увеличенным ЛСС, что приводит к временному
уменьшению поступательной скорости. Наличие
выемки с достоверностью указывает на увеличение
ЛСС. Выемка в профиле выносящего тракта ПЖ
использовалась для улучшения чувствительности
нестандартных неинвазивных расчетов ЛСС (см.
раздел об оценке ЛСС).
ФАКТОРЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ
НА ДАВЛЕНИЕ В ЛЕГОЧНОЙ АРТЕРИИ, В НОРМЕ
С возрастом давление в ЛА повышается [7]. В норме
с каждым десятилетием систолическое давление в
ЛА в среднем увеличивается приблизительно на
1 мм рт. ст. Индекс массы тела (ИМТ) также влияет
на давление в ЛА. У людей с индексом массы тела,
превышающем 30 кг/м2, при других нормальных
показателях наблюдается увеличение давления в ЛА
приблизительно на 3 мм рт. ст. (табл. 32.2). При
учете других показателей у мужчин систолическое
давление в ЛА примерно на 1 мм рт. ст. выше, чем
у женщин. При всех остальных нормальных пока-
зателях системное артериальное давление, пульсо-
вое артериальное давление, а также полученное с
помощью ЭхоКГ давление наполнения левого же-
лудочка (ЛЖ) также коррелируют с более высоким
давлением в ЛА, корреляция также связана с увели-
чением возраста [1].
ОПРЕДЕЛЕНИЕ ПРИЧИНЫ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ
ОБЩАЯ КЛАССИФИКАЦИЯ
По основной причине возникновения легочная ги-
пертензия была разделена на пять групп (классифи-
кация ВОЗ) с последующей модификацией на двух
недавних мировых экспертных совещаниях: Dana
Point и NICE [8]. К 1 -й группе относят легочную
артериальную гипертензию, ко 2-й группе — ЛГ,
обусловленную поражением левых отделов сердца,
к 3-й группе — ЛГ, обусловленную заболеваниями
легких, к 4-й группе — ЛГ, обусловленную хрони-
ческой легочной тромбоэмболической болезнью
(CTEPH), и к 5-й группе — ЛГ, обусловленная неяс-
ными или многофакторными механизмами (табл.
32.3). Самая большая группа — это 2-я группа, к
которой относится ЛГ, обусловленная поражением
левых отделов сердца. В табл. 32.4 представлено
соотношение клинических и эхокардиографиче-
ских данных по каждой причине ЛГ.
ЛЕГОЧНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
ЛГ также может возникнуть в связи со специфиче-
скими патологическими изменениями легочных
артерий, которые относятся к группе легочной ар-
териальной гипертензии (ЛАГ), представляющей
собой 1-ю группу классификации. Идиопатическая
легочная артериальная гипертензия (иЛАГ), ЛАГ
вследствие болезней соединительной ткани и ЛАГ
вследствие ВПС являются примерами ЛАГ 1-й
группы. Поскольку ЛАГ была идентифицирована
примерно у 10% пациентов со склеродермией и у
некоторых пациентов со смешанной болезнью со-
единительной ткани, для них рекомендован регу-
лярный эхокардиографический скрининг на пред-
мет давления [9]. При других болезнях соедини-
тельной ткани, при которых ЛГ встречается реже,
пациентам с наличием симптомов (т.е. одышки)
необходимо выполнять эхокардиографическое об-
следование [10].
При отсутствии ВПС у пациентов с ЛАГ наблю-
дается повышение ЛСС с сохранением нормального
значения легочного венозного давления (нормаль-
ного давления наполнения ЛЖ). Это приводит к
дилатации легочных артерий и хронической на-
грузке давлением правых отделов сердца при нор-
мальных показателях левых отделов сердца. Хрони-
ческая перегрузка давлением ПЖ приводит к от-
клонению межжелудочковой перегородки влево
(D-образный ЛЖ, наблюдаемый по короткой оси) и
легкой диастолической дисфункции ЛЖ.
Прием специфических препаратов, расширяю-
щих легочные сосуды, таких как простациклин,
антагонисты рецепторов эндотелина и ингибиторы
фосфодиэстеразы 5-го типа, приводит к замедле-
нию прогрессирования, снижению частоты клини-
чески значимых осложнений и облегчению симпто-
мов, обусловленных ЛАГ, с наиболее выраженными
Рис. 32.5 Время ускорения потока в легочной артерии при легочной
гипертензии. Начальный прямой поток крови может быть увеличен, что при-
водит к быстрому ускорению потока крови через легочный клапан, измеря-
емому временем ускорения потока. Время ускорения потока < 90 мсек указы-
вает на усиление легочного сосудистого сопротивления и легочную гипертен-
зию.
In-32_для нас.indd 812
03.04.2019 12:10:43
813
32 Легочная гипертензия
McQuillan (n = 3790) [7]
Lam (n = 778) [34]
Grossman (n = 6598) [35]
Расчетное давление в ПП (мм рт. ст.)
10
5
5
Поддающаяся анализу струя ТР (%)
69
69
29
Среднее СДЛА ± SD†
28±5ммрт.ст.
27±4ммрт.ст.
31±4
Возрастc
20–40 лет
40–60 лет
Старше 60 лет
≤37ммрт.ст.
≤40ммрт.ст.
≤43ммрт.ст.
—
≤40ммрт.ст.
≤43ммрт.ст.
<34ммрт.ст.
—
—
ИМТ
< 20 кг/м2
20–30 кг/м2
> 30 кг/м2
≤36ммрт.ст.
≤37ммрт.ст.
≤40ммрт.ст.
* Популяционная выборка в ходе исследования, проводимого B.M . McQuillan и его коллегами [7], производилась среди пациентов, отно-
сящихся к специализированному медицинскому центру в Бостоне, в ходе исследования, проводимого C.S. Lam и его коллегами [34] — в
округе Олмстед, штат Миннесота, в ходе исследования, проводимого A. Grossman и его коллегами [35] — среди юношей армейских но-
вобранцев в Израиле.
† Возрастной диапазон для нормального СДЛА был модифицирован на основании оригинальных публикаций для обеспечения сравнение
между исследованиями. Меньшие исследования (< 100 участников исследования) не были включены в данную таблицу.
ИМТ — индекс массы тела; ПП — правое предсердие; СДЛА — систолическое давление в легочной артерии; ТР — трикуспидальная ре-
гургитация.
ТАБЛИЦА 32.2 Краткий обзор крупных исследований, описывающих нормальные эхокардиографические значения
систолического давления в легочной артерии*
Группы легочной гипертензии
Примеры
1-я группа
Легочная артериальная гипертензия (ЛАГ)
Идиопатическая ЛАГ
Семейная ЛАГ
Индуцированная лекарственными препаратами или токсинами
ЛАГ, ассоциированная с другими заболеваниями:
Склеродермией
ВИЧ-инфекцией
Портальной гипертензией
Врожденным пороком сердца
2-я группа
Легочная гипертензия, обусловленная пора жением
левых отделов сердца
Нарушение деятельности миокарда:
Систолическая дисфункция
Диастолическая дисфункция
Наследственная кардиомиопатия
Нарушения притока/оттока:
Пороки клапанов сердца
Врожденная обструкция приносящего или выносящего тракта ЛЖ
3-я группа
Легочная гипертензия, обусловленная заболеваниями
легких
Хроническая обструктивная болезнь легких
Интерстициальная болезнь легких
Нарушения дыхания во сне
Хроническая гипоксия
4-я группа
Хроническая легочная тромбоэмболическая болезнь
Множественная хроническая эмболия легочной артерии
5-я группа
Легочная гипертензия с многофакторными
механизмами
Болезни крови:
Миелопролиферативные заболевания
Хроническая гемолитическая анемия
Саркоидоз
Болезни накопления гликогена
Хроническая почечная недостаточность
* Таблица создана с акцентом на болезни, актуальные для специалистов в области эхокардиографии.
ВИЧ — вирус иммунодефицита человека; ЛЖ — левый желудочек.
ТАБЛИЦА 32.3 Действующая классификация легочной гипертензии*
In-32_для нас.indd 813
03.04.2019 12:10:43
814
ЧАСТЬ VI Правые отделы сердца
ЛГ, обусловленная поражением левых
отделов сердца
ЛГ, обусловленная другими причинами
Расчетное давление в ЛА (мм рт. ст .) > 40
>40
Отношение E:E′
>15
<12
Индексированный объем ЛП (мл/м2) > 34
≤34
Индексированная масса ЛЖ (г/м2)
> 90 (женщины)
> 104 (мужчины)
< 89 (женщины)
< 103 (мужчины)
Левосторонний порок клапана:
Митральная недостаточность
Митральный стеноз
Аортальная недостаточность
Аортальный стеноз
Умеренная или выше умеренной
Любой степени тяжести
Умеренная или выше умеренной
Умеренный или выше умеренного
Легкая или менее выраженная
Легкий или менее выраженный
Легкая или менее выраженная
Легкий или менее выраженный
* Обратите внимание, что для конкретного пациента может существовать несколько причин с их значительным наложением.
ЛА — легочная артерия; ЛГ — легочная гипертензия; ЛЖ — левый желудочек; ЛП — левое предсердие.
ТАБЛИЦА 32.4 Характерные признаки легочной гипертензии, обусловленной поражением левых отделов сердца*
результатами на ранних этапах заболевания. Поэто-
му для назначения специфической терапии важно
определить основную причину ЛГ на ранней стадии
заболевания.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ, ОБУСЛОВЛЕННАЯ
ВРОЖДЕННЫМ ПОРОКОМ СЕРДЦА
Значительные успехи в педиатрической кардиоло-
гии и кардиохирургии за последние 30–40 лет при-
вели к увеличению числа выживших взрослых с
ВПС, у многих из которых наблюдается нагрузка
давлением или объемом на желудочки. У значитель-
ной части этих взрослых пациентов с ВПС отмеча-
ется ЛГ, что коррелирует с худшим функциональ-
ным статусом и неблагоприятным прогнозом для
каждого типа ВПС [11]. В некоторых странах, где
это было зарегистрировано, взрослые с ВПС могут
составлять до трети пациентов, посещающих кли-
ники, специализирующиеся на ЛГ [12].
Общая распространенность ЛАГ, осложняющей
ВПС у взрослых, составляет приблизительно 5%
[12, 13]. Тем не менее в некоторых серийных иссле-
дованиях, в которых участвовали пациенты из
специализированных медицинских центров, рас-
пространенность ЛАГ среди взрослых с ВПС может
составлять примерно 25% [11].
ЛАГ, являющаяся осложнением ВПС, подразде-
ляется на 4 категории [8]:
1. Синдром Эйзенменгера, при котором большие
ВПС осложняются значительным повышением
ЛСС и в конечном счете реверсивным сбросом
крови через дефект, таким образом, что кровоток
направляется «справа налево», с последующей
артериальной гипоксемией и вторичным эри-
троцитозом.
2. ЛАГ, обусловленная сбросом крови слева напра-
во с высоким ЛСС, но без наличия синдрома
Эйзенменгера.
3. ЛАГ, обусловленная небольшими дефектами,
при которых естественное течение заболевания
подобно течению идиопатической ЛАГ.
4. ЛАГ, которая сохраняется после реконструктив-
ной операции (например, после поздней коррек-
ции дефекта межжелудочковой перегородки или
при избыточном сбросе через аортолегочные
шунты, созданных хирургическим путем).
Кроме того, могут наблюдаться некоторые ред-
кие очаговые обструктивные поражения сердца,
которые могут быть врожденными и могут быть
связаны с тяжелой ЛГ и поэтому более похожи на
ЛГ 2 группы (т.е . обусловленные поражением левых
отделов сердца, например тяжелым надклапанным
митральным стенозом).
Риск развития ЛАГ при ВПС явно зависит от
основного поражения, хотя, как полагают, опреде-
ленную роль играют некоторые генетические фак-
торы. Например, при отсутствии коррекции общего
артериального ствола в течение первого года жизни
развивается тяжелое поражение легочных сосудов.
При крупном дефекте межжелудочковой перего-
родки тяжелое поражение легочных сосудов обычно
развивается до достижения 2-летнего возраста, с
большей вероятностью при наличии сопутствую-
щей транспозиции магистральных сосудов. Напро-
тив, пожизненный риск развития ЛАГ при дефектах
межпредсердной перегородки лишь на 10% выше
для дефектов венозного синуса, чем для дефектов
вторичной части, и это указывает на патогенетиче-
скую роль факторов при развитии ЛАГ, отличных
от гемодинамических изменений, обусловленных
ВПС.
В заключение необходимо отметить, учитывая
диагностические категории, у некоторых пациентов
со сложным паллиативным ВПС может наблюдать-
ся сегментарная ЛАГ (например, только в одном
легком, в другом легком наблюдается картина гипо-
In-32_для нас.indd 814
03.04.2019 12:10:44
815
32 Легочная гипертензия
волемии и низкое давление). В предварительных
сообщениях было высказано предположение, что у
таких пациентов может быть получен ответ на
специфическую терапию препаратами, расширяю-
щими легочные сосуды, с обнадеживающими ре-
зультатами на ранних стадиях.
ЭхоКГ играет жизненно важную роль при оценке
ЛАГ в сочетании с ВПС. Значимость ЭхоКГ заклю-
чается в следующем:
1. Позволяет тщательно обозначить анатомию де-
фектов, например размер, точное расположение
и взаимоотношения внутрисердечных и сосуди-
стых структур с ВПС. В этом отношении очень
информативна чреспищеводная ЭхоКГ, особен-
но при дефектах межпредсердной перегородки.
2. Сделать заключение о физиологических измене-
ниях, обусловленных дефектом, можно по на-
правлению и скорости кровотока через дефект, а
с помощью уравнения Бернулли рассчитать дав-
ление в правых отделах сердца, например, в слу-
чае дефекта межжелудочковой перегородки со
сбросом слева направо.
3. Традиционные измерения давления в правых
отделах сердца также могут быть выполнены при
ВПС, хотя и с некоторыми особенностями (на-
пример, при определенных обстоятельствах де-
фекты межжелудочковой перегородки и струи
трикуспидальной регургитации часто могут рас-
полагаться в непосредственной близости). Таким
образом, как было указано ранее, измерение ско-
ростей трикуспидальной и легочной регургита-
ции может предоставить информацию о систо-
лическом и диастолическом давлениях в ПЖ.
4. Последствия нагрузки давлением и объемом
правых отделов сердца вследствие ВПС или по-
ражения легочных сосудов можно определить,
изучая размер и сократимость ПЖ, трикуспи-
дальную регургитацию, размер и давление в ПП.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ, ОБУСЛОВЛЕННАЯ
ПОРАЖЕНИЕМ ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
Поражение левых отделов сердца составляет при-
мерно 70% всех причин ЛГ (группа 2 классифика-
ции Dana Point) (см. табл. 32.3). Наиболее часто
встречается повышение давления наполнения ЛЖ,
обусловленное нарушением релаксации миокарда
ЛЖ, а также может отмечаться сопутствующая
систолическая дисфункция. При диастолическом
наполнении ЛЖ открытие митрального клапана
приводит к выравниванию давления между ЛП и
ЛЖ (при условии отсутствия митрального стеноза).
Аналогичным образом, во время этого периода вы-
равнивается давление в ЛП и легочных венах. Если
увеличивается давление наполнения ЛЖ, то парал-
лельно происходит нарастание давления в легочных
венах. В легочных венах отсутствуют клапаны или
другие механизмы защиты против повышенного
давления, поэтому повышение давления наполне-
ния ЛЖ непосредственно приводит к повышению
давления в капиллярах легких («давление заклини-
вания») и ЛГ.
Конечно-диастолическое давление в левом желу-
дочке (КДДЛЖ) возникает в результате сокращения
предсердий и обычно является самым высоким дав-
лением в желудочке, измеренным в фазу диастолы.
Несмотря на то что измерение КДДЛЖ является
стандартной процедурой, выполняемой во время
катетеризации ЛЖ, его значение может значительно
превышать давление заклинивания в легочных ка-
пиллярах: среднее диастолическое давление ЛЖ с
большей точностью приближается к давлению
заклинивания.
В норме среднее давление в ЛП вносит суще-
ственный вклад в давление в ЛА. При поражении
левых отделов сердца повышение давления в ЛП
играет еще большую роль, вызывая параллельное
повышение давления в легких при условии нор-
мального ЛСС (рис. 32.6A, «пассивная» ЛГ). Однако
у некоторых пациентов тяжесть ЛГ может превы-
шать ожидаемую при самостоятельном поражении
левых отделов сердца (иногда в таких случаях гово-
рят о «несоответствующей» ЛГ). В этой ситуации
происходит повышение ЛСС, а также пассивная ЛГ,
которые в некоторой степени могут быть обрати-
Нормальное значение ЛСС
Увеличенное ЛСС
Диспропорциональное
нарастание с ДЛА
Параллельное
нарастание с ДЛА
СДПЖ
Наполне-
ние ЛЖ
СДПЖ
Наполне-
ние ЛЖ
Увеличение
давления в ЛП
Увеличение
давления в ЛП
Рис. 32.6 Легочная гипертензия, обусловленная поражением левых
отделов сердца. (A) Повышение давления наполнения левого желудочка
(ЛЖ) при отсутствии митрального стеноза приводит к соответствующему по-
вышению давления в левом предсердии (ЛП) и легочного венозного давления
и параллельному повышению давления в легочных капиллярах и легочной.
(Б) У некоторых пациентов дополнительно к пассивному увеличению, обуслов-
ленному подъемом давления в ЛП, развивается повышение легочного сосуди-
стого сопротивления (ЛСС). Это приводит к непропорциональному нарастанию
давления в легочной артерии. ДЛА — давление в легочной артерии; СДПЖ —
систолическое давление в правом желудочке.
А
Б
In-32_для нас.indd 815
03.04.2019 12:10:44
816
ЧАСТЬ VI Правые отделы сердца
мыми (см. рис. 32.6Б, «пассивная» ЛГ с увеличен-
ным ЛСС).
ЛГ, обусловленная поражением левых отделов
сердца, имеет некоторые особенности, которые
помогают при начальной эхокардиографической
оценке. Они приведены в табл. 32.4 . Полезными
маркерами являются признаки увеличения давле-
ния наполнения ЛЖ, расширение ЛП и увеличение
массы ЛЖ, хотя они наблюдаются не всегда. Лево-
сторонний порок клапанов также может вызывать
увеличение давления наполнения ЛЖ или усили-
вать существующие нарушения ЛЖ и увеличивать
давление в легких. Примеры ЛГ, обусловленной
поражением левых отделов сердца, представлены на
рис. 32.7 .
При лечении ЛГ, обусловленной поражением
левых отделов сердца, обычно требуется назначение
диуретиков с целью уменьшения преднагрузки, эф-
фективного снижения давление в малом круге кро-
вообращения. Лечение основного заболевания ле-
вых отделов сердца также может привести к улуч-
шению показателя давление в легочной артерии.
Терапия препаратами, расширяющими легочные
сосуды, такими как антагонисты рецепторов эндо-
телина, является неэффективной, хотя у некоторых
пациентов с ЛГ, обусловленной поражением левых
отделов сердца, успешным может быть ингибиро-
вание фосфодиэстеразы силденафилом [14], осо-
бенно при наличии компонента, связанного с уве-
личением ЛСС.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ, ОБУСЛОВЛЕННАЯ
ЗАБОЛЕВАНИЕМ ЛЕГКИХ
При нарушениях структуры легких, сопровождаю-
щихся потерей легочного вещества (например, хро-
нической обструктивной болезни легких) или фи-
брозом легких (например, интерстициальный пнев-
монит), происходит увеличение ЛСС, однако
давление в легочных капиллярах обычно не изме-
няется. При ЭхоКГ отмечаются те же изменения
легочной артерии и правых отделов сердца, что и
при ЛАГ, причем диагноз выставляется на основе
наличия тяжелого продолжительного заболевания
органов дыхательной системы, выявленного при
функциональной диагностике органов дыхания и
визуализации легких. При тяжелой болезни легких
созданию хороших окон визуализации могут пре-
пятствовать некоторые технические трудности,
включая гиперинфляцию легких, смещение сердца
и одышку, ограничивающие окно визуализации во
время сердечного цикла. В этих случаях для улуч-
шения 2D и допплеровской визуализации может
быть использована контрастная ЭхоКГ. Из-за за -
метной вариабельности внутригрудного давления
на вдохе и выдохе при тяжелой болезни легких мо-
гут возникать респираторные изменения наполне-
ния правых отделов сердца (рис. 32.8).
Гипоксия вызывает вазоконстрикцию легочной
артерии, а при хроническом течении может приво-
дить к увеличению ЛСС, которое при оксигенотера-
пии поддается обратному развитию лишь частично.
У отдельных пациентов эффективным оказывается
прием препаратов, расширяющих легочные сосуды,
например силденафила [15].
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ, ОБУСЛОВЛЕННАЯ ХРОНИЧЕСКОЙ
ЛЕГОЧНОЙ ТРОМБОЭМБОЛИЧЕСКОЙ БОЛЕЗНЬЮ
Множественная острая легочная эмболия, возника-
ющая в разных областях системы кровообращения
легких, может в конечном итоге привести к ремоде-
лированию легочных артерий и хроническому уве-
личению ЛСС. Эти патологические изменения на-
блюдается у 2% пациентов после острой эмболии
легочной артерии [16]. Некоторые эхокардиогра-
фические признаки подобны признакам ЛАГ и ЛГ,
обусловленной заболеванием легких, при этом в
основе диагноза лежит несоответствие вентиляции
и перфузии, в сочетании с результатами функцио-
нальной диагностики органов дыхания и визуали-
зации легких. Как и при других формах ЛГ, иденти-
фикация CTEPH имеет важное значение для выбора
тактики лечения и прогноза. При CTEPH положи-
тельный эффект может быть получен от назначения
препаратов, расширяющих легочные сосуды, но
V
V
Рис. 32.7 Примеры поражения левых отделов сердца, осложнившихся легочной гипертензией. (A) A Трехмерная визуализация ЛЖ пациента с ин-
фильтрацией белками амилоида, приведшей к выраженному увеличению массы ЛЖ, нарушению релаксации миокарда и увеличению объема ЛП. (Б) При рестрик-
тивной кардиомиопатии результаты допплерографии притока ЛЖ отражают увеличение давления наполнения и снижение податливости. (В) У пациента с выра-
женным нарушением систолической функции ЛЖ результаты тканевой допплерографии отражают нарушение релаксации миокарда.
А
Б
В
In-32_для нас.indd 816
03.04.2019 12:10:44
817
32 Легочная гипертензия
наиболее успешным методом лечения является хи-
рургическая легочная тромбоэндартерэктомия. Не-
смотря на то что эта крупная хирургическая проце-
дура получает более широкое признание с демон-
страцией отличных результатов специализирован-
ных центрах, многие пациенты с CTEPH все еще не
получают должного лечения, что подтверждает
важность точной диагностики причины ЛГ. Вен-
тиляционно-перфузионная сцинтиграфия легких
оказывается особенно полезной в обследовании при
подозрении на CTEPH.
ОСТРО ВОЗНИКШАЯ ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
При острой эмболии легочной артерии происходит
резкое повышение СЛЛ, вызывающее снижение
способности правых отделов сердца, работающего в
режиме низкого системного давления, компенсиро-
вать резкое повышение давления в ЛА. В связи с
нарушением систолической функции наблюдается
резкое увеличение размера ПЖ в области основания
и среднего отдела. В апикальной области ПЖ отме-
чается зона относительного щажения, ограничен-
ная латеральной мышечной перекладиной, в кото-
рой систолическая функция остается не измененной
или увеличенной. Этот признак, называемый при-
знаком МакКоннелла, реже может наблюдаться при
декомпенсации хронической перегрузки давлением
ПЖ (рис. 32.9).
При острой перегрузке давлением ПЖ наблюда-
ется систолический прогиб межжелудочковой пере-
городки влево, проявление чего значительно увели-
чено за счет недостаточного наполнения левого
сердца вследствие легочной гиповолемии. При
остро возникшем состоянии диаметр легочной ар-
терии и объем ПП остаются в пределах нормы.
Определение основной причины ЛГ имеет
огромное значение, поскольку для каждой из при-
чин ЛГ свойственна различная патофизиология,
течение болезни и тактика лечения. Соотношение
клинических и эхокардиографических признаков
для идентификации каждой группы ЛГ представле-
но в табл. 32.5 .
ВЛИЯНИЕ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ
НА ПРАВЫЕ ОТДЕЛЫ СЕРДЦА
ПОКАЗАТЕЛИ ФУНКЦИИ ПРАВОГО ЖЕЛУДОЧКА
В УСЛОВИЯХ НАГРУЗКИ ДАВЛЕНИЕМ
ПЖ имеет сложную форму и сильно отличается от
ЛЖ по строению (см. главу 31). При 2D-эхокардио-
графическом исследовании в норме ПЖ в апикаль-
ной четырехкамерной проекции имеет приблизи-
тельно треугольную форму, а в проекции парастер-
нальной по короткой оси — форму полумесяца
(рис. 32.10). В полной мере оценить уникальную
форму ПЖ позволяет метод трехмерной (3D)
ЭхоКГ. На рис. 32.11A продемонстрирована много-
планарная реконструкция правого сердца, а на рис.
32.11Б показан визуализация поверхности внутрен-
него контура ПЖ с помощью 3D-ЭхоКГ (см. рис.
32.11). При ЛГ в ПЖ происходит ряд структурных
и функциональных изменений (табл. 32.6; см. так -
V
ПЖ
ПП
ЛП
ЛЖ
Рис. 32.8 A Респираторная вариабельность наполнения правых от-
делов сердца при тяжелом поражении легких. В данном примере во
время вдоха наблюдается увеличение притока крови к правым отделам сердца,
обусловленное отрицательным внутригрудным давлением. Это сопровождает-
ся дилатацией правых отделов сердца и временным смещением межжелудоч-
ковой перегородки влево (стрелки). ЛЖ
—
левый желудочек; ЛП — левое
предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
ЛЖ
ПЖ
ПП
Рис. 32.9 A Острая перегрузка давлением правого желудочка при
острой эмболии легочной артерии. Отмечается относительное сохранение
размера и функции верхушки правого желудочка (ПЖ), тогда как остальная
часть ПЖ резко расширена, что обусловлено нарушением систолической
функции. При острой эмболии легочной артерии правое предсердие (ПП)
расширяется незначительно. ЛЖ — левый желудочек.
In-32_для нас.indd 817
03.04.2019 12:10:44
818
ЧАСТЬ VI Правые отделы сердца
же рис. 32.10). ПЖ приобретает боле прямоуголь-
ную форму, если смотреть в четырехкамерной про-
екции, причем становится заметна мышечная пере-
кладина, располагающаяся более горизонтально в
поперечном направлении полости ПЖ. В коротко-
осевых проекциях ПЖ округляется за счет его дила-
тации и компрессии межжелудочковой перегород-
ки. Увеличение размера ПЖ и компрессия желудоч-
ковой перегородки могут привести к уменьшению
наполнения ЛЖ в ограниченном перикардиальном
пространстве и при этом может возникнуть желу-
дочковое взаимодействие.
РАЗМЕРЫ ПРАВОГО ЖЕЛУДОЧКА
Стандартно размеры ПЖ оцениваются в четырехка-
мерной сфокусированной на ПЖ проекции (рис.
32.12) [17]. На наличие дилатации указывают диа-
метр > 41 мм в области основания и > 35 мм в сред-
нем отделе ПЖ (табл. 32.7). При получении роти-
рованных проекций из-за конусовидной формы с
Группа легочной
гипертензии
Ожидаемые результаты
эхокардиографии*
1-я группа
Легочная артери-
альная
гипертензия
Одышка при отсутствии других веро-
ятных причин
Нормальные (не увеличенные в
объеме) левые отделы сердца; дила-
тированный ПЖ с признаками пере-
грузки объемом
2-я группа
ЛГ, обусловленная
поражением
левых отделов
сердца
Клинические признаки левожелудоч-
ковой недостаточности
Нарушение систолической и/или диа-
столической функции ЛЖ; порок
митрального или аортального
клапана; дилатация ЛП
3-я группа
ЛГ, обусловленная
заболеванием
легких
Клинические признаки обструктив-
ного или рестриктивного заболева-
ния легких
Эхо-признаки схожи с признаками для
1-й группы
4-я группа
Хроническая
легочная тромбо-
эмболическая
болезнь
В анамнезе ранее перенесенная тром-
боэмболия легочной артерии или
наличие факторов риска эмболии
легочной артерии; антикоагулятная
терапия
Эхо-признаки схожи с признаками для
1-й группы
5-я группа
ЛГ с много-
факторными
механизмами
Анамнез и признаки предшествую-
щего системного заболевания
Легочная гипертензия без признаков,
более соответствующих 1–4-й
группам
* Обратите внимание, что у конкретного пациента может присут-
ствовать несколько причин, и некоторые признаки не являются
специфическими для каждой группы легочной гипертензии.
ЛГ — легочная гипертензия; ЛП — левое предсердие; ПЖ — пра-
вый желудочек.
ТАБЛИЦА 32.5
Соответствие клинических
и эхокардиографических признаков для
каждой причины легочной гипертензии
Группа легочной
гипертензии
В норме
Легочная
гипертензия
Форма правого желудочка
в парастернальной
проекции
Полумесяц Округлая
Форма правого желудочка
в апикальной проекции
Треугольная Прямоугольная
Толщина стенок правого
желудочка (мм)
<5
>5
Правое предсердие (см2)
<18
>18
Межжелудочковая
перегородка
Вогнута
слева
Вогнута справа
ТАБЛИЦА 32.6
Краткий обзор структурных изменений
правых отделов сердца при легочной
гипертензии
постепенным уменьшением размера ПЖ трехмер-
ная ЭхоКГ позволяет провести измерения его мак-
симальной ширины. У очень крупных или малень-
ких пациентов результаты измерения размеров ПЖ
могут выходить за рамки нормального диапазона,
однако после индексации данных показателей по
площади поверхности тела они нормализуются.
ТОЛЩИНА СТЕНОК ПРАВОГО ЖЕЛУДОЧКА
Увеличение толщины стенок ПЖ может возникать
при ЛГ, но не является специфичным для этого ди-
агноза, поскольку также может наблюдаться при
инфильтративных кардиомиопатиях. На наличие
гипертрофии указывает толщина стенки ПЖ
> 5 мм, измеренная вдоль свободной стенки ПЖ в
субкостальной четырехкамерной проекции.
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Для измерения фракционного изменения площади
ПЖ используется та же сфокусированная четырех-
камерная проекция, что и для измерения размеров
ПЖ. Показатель < 35% указывает на нарушение
систолической функции ПЖ (рис. 32.13, 32.14) [17].
Методика измерения фракции изменения площади
описана в главе 31.
Систолическое смещение трикуспидального
кольца (ССТК) является достоверным показателем
продольной систолической функции ПЖ и измеря-
ется с помощью M-режима латерального трикуспи-
дального кольца в той же сфокусированной четы-
рехкамерной проекции, что и размеры ПЖ. Ви-
зуализацию этого смещения можно улучшить,
дополнительно применив с М-режимом тканевую
цветовую допплерографию. При ССТК < 1,7 см с
долей вероятности можно говорить о снижении
систолическая функция ПЖ. S′ ПЖ измеряется с
помощью максимальной систолической тканевой
допплеровской скорости латерального трикуспи-
In-32_для нас.indd 818
03.04.2019 12:10:45
819
32 Легочная гипертензия
дального кольца. В связи с тем, что тканевая доп-
плерография зависима от угла, прежде чем произ-
водить измерения необходимо следить за тем, чтобы
латеральное трикуспидальное кольцо было выров-
нено по центру ультразвукового луча. Из-за интен-
сивности тканевого допплеровского сигнала этот
показатель менее зависит от качества изображения,
чем другие параметры. Хотя с возрастом S′ ПЖ сни-
жается [18], его значение < 10 см/сек указывает на
дисфункцию ПЖ, особенно в сочетании с наруше-
нием ССТК.
Индекс производительности миокарда (ИПМ)
ПЖ является показателем глобальной производи-
тельности ПЖ и измеряется с использованием вре-
мени изоволюмического сокращения ПЖ (ВИВС
ПЖ), времени изоволюмического расслабления
ПЖ (ВИВР ПЖ) и времени выброса ПЖ (рис. 32.15).
ИПМ ПЖ может быть получен с использованием
данных импульсноволновой допплеровской или
миокардиальной скоростей.
ИПМ ПЖ рассчитывается по следующей фор-
муле:
где ИПМПЖ — индекс производительности мио-
карда ПЖ. ВИВР + ВИВС = общее время систолы
ПЖ (от закрытия до открытия трикуспидального
клапана) — время выброса ПЖ (продолжитель-
ность допплеровского импульса выносящего тракта
ПЖ).
Нормальное значение ИПМПЖ составляет мень-
ше 0,44 (см. табл. 32.6).
ТРЕХМЕРНЫЙ АНАЛИЗ СИСТОЛИЧЕСКОЙ ФУНКЦИИ
ПРАВОГО ЖЕЛУДОЧКА
Из-за сложной формы ПЖ 2D-исследования не по-
зволяют в полной мере оценить ее изменения, на-
блюдаемые при ЛГ. 3D-ЭхоКГ обладает рядом тео-
ретических преимуществ по сравнению с 2D-ЭхоКГ,
в частности способностью одновременно наблюдать
выносящий тракт ПЖ и сам ПЖ с созданием объе-
мов ПЖ (см. рис. 32.11). Однако на практике суще-
ствует некоторые проблемы, препятствующие за-
IVRT + IVCT
RIMP =
ET
ПЖ
ПЖ
ПЖ
ПЖ
ПП
ПП
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
V
Рис. 32.10 Форма правого желудочка в норме и при повышении легочного давления. (A) A Характерная треугольная форма правого желудочка (ПЖ)
при оценке в апикальной четырехкамерной проекции, сфокусированной на ПЖ. (Б) A В норме в проекции по короткой оси среднего отдела ПЖ имеет форму
полумесяца. (В, Г) A A При перегрузке давлением ПЖ в фазе систолы наблюдается уплощение межжелудочковой перегородки в сторону левого желудочка
(ЛЖ). ЛП — левое предсердие; ПП — правое предсердие.
А
Б
Г
В
In-32_для нас.indd 819
03.04.2019 12:10:45
820
ЧАСТЬ VI Правые отделы сердца
Рис. 32.12 Измерение размеров правого желудочка в апикальной
четырехкамерной проекции, сфокусированной на правом желудочке.
Базальные измерения производятся на правожелудочковой стороне трикуспи-
дального кольца в фазу диастолы, а размеры среднего отдела ПЖ у основания
мышечной перекладины.
хвату изображения объема ПЖ. Технически очень
сложно визуализировать выносящий тракт ПЖ и
клапан легочной артерии только из апикальных
проекций, поэтому также может потребоваться ви-
зуализация в парастернальной проекции, в связи с
чем необходимо произвести автономное объедине-
ние данных объема с присущими этому допущени-
ями и рисками.
Передняя стенка ПЖ часто плохо визуализиру-
ется из апикальных проекций, поэтому полная
оценка объема требуют алгоритмических предполо-
жений. Наконец, большинство алгоритмов для рас-
чета объема основаны на моделях ПЖ в норме, и
при условии измененного ПЖ под влиянием ЛГ
анализ может быть менее точным. Несмотря на то
что 3D-анализ функции ПЖ является перспектив-
ным, до устранения этих практических затруднений
мы рекомендуем в комплексную оценку функции
ПЖ по-прежнему включать 2D-исследование. В та-
бл. 32.6 приведены 3D-эхокардиографические пока-
затели при ЛГ. Во время 3D-анализа функции ПЖ
Рис. 32.11 3D-эхокардиография применима для демонстрации изменения формы правого желудочка при перегрузке давлением. (A) A Муль-
типлановая реконструкция правых отделов сердца. (Б) A Визуализация поверхности внутреннего контура ПЖ с помощью 3D-эхокардиографии. (В) A При ле-
гочной гипертензии ПЖ приобретает более прямоугольную форму, что продемонстрировано в четырехкамерной проекции.
А
Б
В
In-32_для нас.indd 820
03.04.2019 12:10:46
821
32 Легочная гипертензия
Показатель
Нарушение
Скорость трикуспидальной регургитации
(м/сек)
> 2,75
Систолическое давление в легочной
артерии (мм рт. ст.)
>40
Начальная скорость легочной регургита-
ции (м/сек)
2
Конечная скорость легочной регургитации
(м/сек)
> 1,5
Диаметр основания правого желудочка
(мм)
>42
Диаметр среднего отдела правого желу-
дочка (мм)
>35
Дистальный диаметр ВТПЖ по ПКО (мм) > 27
Конечно-систолическая площадь правого
предсердия (см2)
>18
Систолическое смещение трикуспидаль-
ного кольца (мм)
<17
S′ правого желудочка (см/сек)
<10
Импульсно-волновой допплеровский
ИПМ правого желудочка
≥ 0,44
Тканевой допплеровский ИПМ правого
желудочка
≥ 0,55
Фракционное изменение площади (%)
< 35%
3D-оценка правого желудочка:
Конечно-диастолический объем (мл/м2)
≥87
(мужчины)
≥74
(женщины)
Конечно-систолический объем (мл/м2)
≥45
(мужчины)
≥36
(женщины)
Фракция выброса (%)
<45
Диастолическая функция:
отношение E/A
<0,8или>2,1
Время замедления кровотока (мсек)
< 120 мсек
Толщина стенок правого желудочка в суб-
костальной проекции
>0,5см
S′ — систолическая тканевая допплеровская скорость смещения
латерального трикуспидального кольца; ВТПЖ — выходной
тракт правого желудочка; ИПМ — индекс производительности
миокарда; ПКО — парастернальная короткая ось.
ТАБЛИЦА 32.7 Краткий обзор нарушения показателей
при легочной гипертензии
максимальный и минимальный объемы ПЖ следу-
ет выбирать вручную, а трабекулы и мышечные
перекладины необходимо включать в полость ПЖ.
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Диастолическая функция ПЖ оценивается с помо-
щью импульсно-волновой допплерографии трику-
спидального притока, тканевой допплерографии
латерального трикуспидального кольца и 2D-оцен-
ки размера и способности к спадению нижней по-
лой вены. Эти параметры описаны в главе 31. Необ-
ходимо следить за тем, чтобы допплеровская оценка
трикуспидального кольца выполнялась в проекции,
сфокусированной на ПЖ, при этом латеральное
трикуспидальное кольцо в фазе систолы должно
опускаться прямо к датчику.
В табл. 32.6 приведены нарушения показателей
диастолической функции при ЛГ.
ДВИЖЕНИЕ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
При начале роста систолического давления в ПЖ
более важной становится общая для него и ЛЖ
связь с межжелудочковой перегородкой. Разность
систолического давления между ПЖ и ЛЖ умень-
шается, что сопровождается уплощением межжелу-
дочковой перегородки, как показано на рис. 32.16. В
результате этого в фазу систолы ЛЖ приобретает
D-форму, а ПЖ — O -форму. При низком систем-
ном артериальном давлении этот признак увеличи-
вается, а при увеличении системного артериального
давления может быть малозаметными или отсут-
ствовать, даже при наличии значительной ЛГ. При
условиях перегрузки давлением уплощение межже-
лудочковой перегородки наблюдается преимуще-
ственно в фазе систолы. Это можно количественно
определить с помощью индекса эксцентричности
ПЖ, измеренного в проекции парастернальной по
короткой оси по прямой линии от нижнебоковой
стенки ЛЖ поперек перегородки к боковой стенке
ПЖ. Соотношение ПЖ\ЛЖ > 1,0 указывает на пе-
регрузку давлением ПЖ.
Диастола
Систола
Рис. 32.13 Измерение размеров правого желудочка в апикальной
четырехкамерной проекции, сфокусированной на правом желудочке.
Фракционное изменение площади измеряется по визуализации границы эндо-
карда в фазу диастолы (A) и фазу систолы (Б) с расчетом отношения этих
двух показателей.
А
Б
In-32_для нас.indd 821
03.04.2019 12:10:47
822
ЧАСТЬ VI Правые отделы сердца
М-режим
Цветовая тканевая допплерография
Тканевая допплеровская скорость
Рис. 32.14 Измерение функции правого желудочка в апикальной че-
тырехкамерной проекции, сфокусированной на правом желудочке.
Систолическое смещение трикуспидального кольца — это дистанция, на
смещается латеральное трикуспидальное кольцо в фазу систолы, измеряемая
с помощью M-режима (вверху) или M-режима, выполняемого во время цвето-
вой тканевой допплерографии (посередине). Систолическая функция также
может быть измерена с помощью тканевых доплеровских скоростей систоли-
ческого опускания трикуспидального кольца (S′) (внизу).
Рис. 32.15 Расчет индекса производительности миокарда правого
желудочка и легочного сосудистого сопротивления. Измеряется время
от закрытия до открытия трикуспидального клапана (продолжительность ТР;
A), а также время выброса выносящего тракта ПЖ (Б). Для получения индек-
са производительности миокарда ПЖ разница между ними делится на время
выброса выносящего тракта ПЖ. Легочное сосудистое сопротивление измеря-
ется с помощью скорости трикуспидальной регургитации (A) и VTI выносяще-
го тракта ПЖ (В). Формулы, используемые для вычисления ЛСС, представле-
ны в тексте.
А
Б
В
In-32_для нас.indd 822
03.04.2019 12:10:47
823
32 Легочная гипертензия
При развитии правожелудочковой недостаточ-
ности происходит нарушение диастолической
функции ПЖ, что приводит к повышению диасто-
лическое давление в ПЖ. Если давление наполне-
ния ПЖ превышает давление наполнения ЛЖ,
уплощение межжелудочковой перегородки наблю-
дается в фазе диастолы. Повышение давления на-
полнения ПЖ, приводящее к диастолическому
уплощению перегородки, также может возникать
при значительных трикуспидальной или легочной
регургитации. Диастолическое уплощение межже-
лудочковой перегородки увеличивается при пере-
грузке объемом, но уменьшается при сопутствую-
щей диастолической дисфункции ЛЖ или гипер-
трофии ЛЖ.
Обратите внимание, что систолическое и диасто-
лическое нарушение движения перегородки может
также наблюдаться при наличии блокады пучка
Гиса, при кардиостимуляции и после перенесенных
операций на сердце. Эти признаки нагрузки давле-
нием в фазах систолы и диастолы имеют важное
значение для общей оценки правых отделов сердца
не только при ЛГ, но также и при недостаточной ТР
для оценки систолического давления в ПЖ.
Структурные изменения правых отделов сердца,
наблюдаемых при ЛГ, кратко изложены в табл. 32.7 .
ОЦЕНКА ЛЕГОЧНОГО
СОСУДИСТОГО СОПРОТИВЛЕНИЯ
В норме легочное кровообращение — это система
низкого давления с низким сосудистым сопротив-
лением, при этом ЛСС снижается или остается не-
изменным при физической нагрузке [19]. ЛСС мож-
но рассматривать как степень препятствия для
кровотока, влияющую как на давление в легких, так
и на сердечный выброс. Золотым стандартом для
оценки ЛСС является катетеризация правых отде-
лов сердца, при чем ЛСС (PVR) рассчитывается
следующим образом:
где СДЛА (MPAP) — это среднее давление в легоч-
ной артерии, ДЗЛА (PAWP) — давление заклинива-
ния в легочной артерии, СВ (CO) — сердечный
выброс (Qp).
Был предложен ряд методов оценки ЛСС с ис-
пользованием ЭхоКГ, в каждом из которых приме-
ним принцип зависимости давление от сердечного
выброса (т.е . отношение давления в ЛА к сердечно-
му выбросу).
Широко применима следующая формула, пред-
ложенная Abbas и коллегами [20]:
где СТР (TRV) — скорость трикуспидальной регур-
гитации в м/сек и VTIВТПЖ — интеграл скорости
кровотока выносящего тракта ПЖ (в см). ЛСС, рав-
ное более чем 2 ед. Вуда, предполагает его аномаль-
ное увеличение.
У пациентов с ЛСС выше 6 ед. Вуда исходная
формула менее точна, и недавно для них было пред-
ложено второе уравнение [21]:
На ЛСС также влияет давление в легочной вене:
повышенное давление в левом предсердии (ЛП)
снижает ЛСС. Увеличение давления в ЛП на 5 мм
рт. ст. приводит к уменьшению ЛСС на 1 единицу
Вуд [22]. Неинвазивная оценка давления наполне-
MPAP PAWP
PVR(Woodunits) =
CO
RV
VTI
T
PVR=10×
+ 0.16
RV outflow tract
2
RV
VTI
T
PVR =5.19×
0.4
RV outflow tract
ПДО
ПКО
A4К
ПЖ
ПП
ПЖ
ПЖ
Ао
ЛЖ
ЛЖ
ЛП
ЛП
ЛЖ
Рис. 32.16 Движение межжелудочковой перегородки во время систолы — показатель перегрузки давлением правого желудочка. Компрессия
межжелудочковой перегородки во время систолы, соответствующая систолической перегрузке давлением правого желудочка (ПЖ), в парастернальной позиции
по длинной оси (ПДО) A (А), в позиции по короткой оси (ПКО) A (Б) и в апикальной четырехкамерной позиции (А4К) A (В) одного и того же пациента с вы-
раженной дилатацией ПЖ. Смещение межжелудочковой перегородки влево преимущественно во время систолы приводит к ограничению размеров левого желу-
дочка (ЛЖ). Ао — аорта; ЛП — левое предсердие; ПП — правое предсердие.
А
Б
В
In-32_для нас.indd 823
03.04.2019 12:10:49
824
ЧАСТЬ VI Правые отделы сердца
ния ЛЖ может оказаться полезным дополнением
при разработке новой схемы определения ЛСС.
Когда при неинвазивной оценке возникает подо-
зрение на увеличение ЛСС, подтвердить его позво-
ляет наличие других отклонений, таких как появле-
ние систолической выемки во время допплерогра-
фии выносящего тракта ПЖ, снижение времени
ускорения потока в легочной артерии и признаки
перегрузки ПЖ давлением.
СТРЕСС-ЭХОКАРДИОГРАФИЯ С ФИЗИЧЕСКОЙ
НАГРУЗКОЙ И ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
В 2009 г. из определения ЛГ было исключено поня-
тие «высокое давление в ЛА, вызванное физической
нагрузкой», главным образом потому, что возраст-
ных нормативных значений для давления в ЛА при
физической нагрузке не существует, а также пото-
му, что при повышение давления в ЛА отсутствует
информация о повышении скорости потока (для
оценки сопротивления в бассейне легочных сосу-
дов). Тем не менее признается, что выраженный
скачок давления в ЛА при физической нагрузке у
некоторых пациентов может быть предшественни-
ком ЛГ и может иметь плохой прогноз [23].
Таким образом, значительное количество специ-
алистов предлагает измерять давление в легочной
артерии в условиях стресса, например, при физиче-
ской нагрузке или после введения добутамина, что-
бы обеспечить раннюю диагностику заболеваний
легочных сосудов и отследить их естественную ди-
намику.
Поскольку давление в ЛА после прекращения
выполнения упражнений быстро падает, важно
оценить систолическое давление в ЛА именно во
время физической нагрузки. По этой причине оцен-
ка ЛГ в условиях стресса лучше всего проводится
путем стационарной полусупинированной эргоме-
трии с наклонами вбок. Даже при использовании
специально разработанного для этого оборудова-
ния технически сложно получить все необходимые
показатели при максимальной нагрузке, особенно
когда пациент сдерживает дыхание, поэтому следу-
ет выполнять только ключевые измерения. Они
должны проводиться как в начале исследования, так
и в момент максимальной нагрузки. Диаметр выно-
сящего тракта ЛЖ, измеренный в начале исследова-
ния, также может использоваться для оценки сер-
дечного выброса при физической нагрузке. Из-за
технических трудностей при получении точных
показателей при максимальной нагрузке, в качестве
способа увеличения сердечного выброса при ЭхоКГ
может использоваться добутамин. Чтобы миними-
зировать вазомоторные эффекты в бассейне легоч-
ных сосудов, добутамин назначают в дозах 20 мкг/
кг/мин или менее.
В начале исследования систолическое давление в
ЛА оценивается по скорости трикуспидальной ре-
гургитации с использованием показателя давления
в ПП (правом предсердии). Затем определяется
систолическое смещение трикуспидального кольца,
производится оценка левых отделов сердца, в том
числе отношения скоростей кровотока через ми-
тральный клапан в ранней систолической фазе и
через митральное кольцо в ранней диастолической
фазе (отношение E/E′), и интеграла скорости крово-
тока (VTI) в выносящем тракте ЛЖ. В результате
сердечный выброс может быть рассчитан с исполь-
зованием диаметра выносящего тракта ЛЖ, полу-
ченного в состоянии покоя, и максимальной часто-
ты сердечных сокращений во время измерения VTI
в выносящем тракте ЛЖ.
У лиц с нормальным систолическим давлением
в ПЖ в состоянии покоя увеличение данного пока-
зателя при физической нагрузке может наблюдать-
ся, когда заметно увеличивается сердечный выброс,
даже при нормальном значении ЛСС. Данный эф-
фект особенно заметен у выносливых спортсменов
[24, 25]. Однако аналогичное увеличение систоличе-
ского давления в ПЖ может возникать и при мень-
шей нагрузке у человека с одышкой из-за незначи-
тельного увеличения ЛСС [26], диастолической
дисфункции или порока клапана сердца. Консенсус
относительно того, какой показатель важнее — аб-
солютное систолическое давление в ПЖ при нагруз-
ке или степень увеличения систолического давления
в ПЖ — не принят. Значение отношения скоростей
кровотока через митральный клапан в ранней
систолической фазе и через митральное кольцо в
ранней диастолической фазе (отношение E:E′), ко-
торое попадает в «промежуточный диапазон» (8–12)
в состоянии покоя, не является надежным маркером
повышенного давления наполнения ЛЖ при физи-
ческой нагрузке [27] либо после приема добутамина
[28].
Как правило, увеличение систолического давле-
ния в ПЖ более чем на 15 мм рт. ст. при низкой
нагрузке (5–6 эквивалентов метаболической актив-
ности при упражнении на беговой дорожке [29] или
50 Вт на велоэргометре [30, 31]) позволяет предпо-
ложить увеличение ЛСС.
И наоборот, отсутствие повышения (> 30 мм
рт. ст. при 50–75 Вт) систолического давления в ПЖ
при физической нагрузке указывает на ухудшение
сократительной способности ПЖ [23], что связано
с худшим прогнозом. Отсутствие повышения
систолического давления в ПЖ также связано с на-
рушением максимального потребления кислорода
(VO2).
При ЛАГ (легочной артериальной гипертензии)
наблюдается увеличение ЛСС при нормальном дав-
лении в ЛП. При физической нагрузке, когда увели-
чивается сердечный выброс, это соотношение ста-
новится еще более очевидным. Увеличение среднего
давления в легочной артерии (СДЛА) может быть
выражено в качестве функции сердечного выброса
In-32_для нас.indd 824
03.04.2019 12:10:50
825
32 Легочная гипертензия
(Q). Кривая этого соотношения, или наклон P-Q,
изучается с помощью стресс-ЭхоКГ. Среднее давле-
ние в легочной артерии оценивается по скорости
легочной регургитации (ЛР) и систолическому дав-
лению в ПЖ (СДПЖ) как:
Среднее давление в ЛА = Начальная скорость
ЛРили0,6×СДПЖ+2.
Сердечный выброс измеряется с использованием
диаметра выносящего тракта ЛЖ, VTI выносящего
тракта ЛЖ и частоты сердечных сокращений. При
отсутствии шунтов общее ЛСС будет равно:
ЛСС = СДЛА⁄Q мм рт. ст./л/мин,
где ЛСС — легочное сосудистое сопротивление;
СДЛА — среднее давление в легочной артерии; Q —
сердечный выброс.
Во время физической нагрузки увеличение сер-
дечного выброса и частоты сердечных сокращений
значительнее, чем после инфузии добутамина. Од-
нако получение точных показателей ЛСС во время
нагрузки технически затруднено, поэтому часто
используется именно добутамин. При ЛГ наблюда-
ется менее выраженное увеличение сердечного вы-
броса во время нагрузки, чем у здоровых лиц, в
основном из-за нарушения увеличения ударного
объема ЛЖ.
У здоровых лиц после введения добутамина в
дозе 20 мкг/кг/мин среднее давление в ЛА должно
повышаться приблизительно на 1 мм рт. ст. на ка-
ждое увеличение значения сердечного выброса,
выраженное в л/мин (т.е . наклон P-Q составляет
приблизительно 1 мм рт. ст./л/мин). У пациентов с
ЛАГ среднее давление в ЛА повышается, примерно,
на 5 мм рт. ст. на каждое увеличение сердечного
выброса, выраженное в л/мин (т.е. наклон кривой
давление-кровоток составляет приблизительно
5 мм рт. ст./л/ мин) [32]. Предполагаемый предел
отклонений составляет 3 мм рт. ст./л/мин [33]. Бо-
лее высокий наклон кривой давление-кровоток
связан с ухудшением функционального статуса по
классификации Нью-йоркской ассоциации кардио-
логов.
ДИАГНОСТИЧЕСКИЙ ПОДХОД
ПРИ ПОДОЗРЕНИИ НА ЛЕГОЧНУЮ ГИПЕРТЕНЗИЮ
ЛАГ проявляется характерным поражением правых
отделов сердца оставляя левые отделы сердца ин-
тактными, однако вследствие компрессионного
эффекта при нагрузке давлением на ПЖ может на-
блюдаться аномальное наполнение ЛЖ.
1. Измерение функции ПЖ при нагрузке давле-
нием: существует несколько характерных из-
менений структуры и функции ПЖ, которые
наблюдаются при ЛГ и могут быть измерены с
помощью 2D- и 3D-ЭхоКГ.
2. Размеры ПЖ: всегда следует измерять базаль-
ные и средние размеры ПЖ.
3. Толщина стенки ПЖ: Толщина стенки ПЖ в
фазу диастолы > 5 мм позволяет предположить
хроническую нагрузку давлением на ПЖ.
4. Систолическая функция ПЖ должна измерять-
ся всегда. Должны определяться такие показа-
тели, как фракционное изменение площади
ПЖ и ССТК. Также может быть полезен индекс
производительности миокарда правого желу-
дочка (ИПМПЖ).
5. 3D-анализ систолической функции ПЖ позво-
ляет выявить изменение формы ПЖ, особенно
при нагрузке давлением.
6. Оценка диастолической функции ПЖ должна
включать такие показатели, как скорость потока
через трикуспидальный клапан, скорость релак-
сации латерального трикуспидального кольца и
спадение нижней полой вены в цикле дыхания.
7. Движение межжелудочковой перегородки яв-
ляется индикатором перегрузки давлением
правых отделов сердца и взаимодействия меж-
ду ПЖ и ЛЖ во время сердечного цикла.
8. ЛСС можно оценить путем определения соот-
ношения между давлением в ЛА и сердечным
выбросом. Данное исследование должно вы-
полняться в рамках комплексной оценки ле-
гочной гипертензии.
9. Стресс-ЭхоКГ и ЛГ: ЛГ может привести к де-
компенсации правых отделов сердца при физи-
ческой нагрузке. У пациентов с аномальным
ЛСС, но при нормальном легочном давлении в
состоянии покоя, легочное давление может
значительно повышаться при физической на-
грузке, что также можно определить при оцен-
ке правых отделов сердца.
10. Оценка ЛСС с помощью стресс-ЭхоКГ: при уве-
личении сердечного выброса, например, при
физической нагрузке, происходит повышение
давления в ЛА. Это повышение выражено при
легочной артериальной гипертензии, что может
быть измерено с помощью стресс-ЭхоКГ.
11. Определение этиологии легочной гипертензии:
при хронических заболеваниях и у пациентов
в возрасте причин развития легочной гипер-
тензии может быть несколько, что создает ин-
дивидуальные диагностические проблемы.
12. Диагностический подход при подозрении на
легочную гипертензию: сложные взаимоотно-
шения между левыми и правыми отделами
сердца, а также легочным кровообращением
требуют систематического диагностического
подхода. На рис. 32.17 представлен наш подход.
13. Мониторинг легочной гипертензии и ответа
ПЖ: пациентам с легочной гипертензией тре-
буется регулярное эхокардиографическое на-
блюдение, в том числе сравнение с предыду-
щими исследованиями для оценки прогресси-
рования заболевания и/или эффективности
терапии ЛАГ.
In-32_для нас.indd 825
03.04.2019 12:10:50
826
ЧАСТЬ VI Правые отделы сердца
Легочная гипертензия
СДЛА > 40 мм рт. ст . (максимальная скорость ТР)
ДДЛА > 20 мм рт. ст . (конечная скорость ЛР)
Среднее давление в ЛА > 25 мм рт. ст .
(ранняя скорость ЛР)
Эхокардиографические признаки поражения
левых отделов сердца отсутствуют:
Детальная оценка правых отделов сердца
Систолическая функция ПЖ (ФИП ПЖ, ССТК)
Диастолическая функция ПЖ
Легочное сосудистое сопротивление
Эхокардиографические признаки поражения
левых отделов сердца:
Расширение левого предсердия (ИО ЛП > 35 мл/м2)
Систолическая дисфункция ЛЖ
Диастолическая дисфункция ЛЖ (E:E’ > 15)
Увеличение массы ЛЖ
Значительный порок клапана
Выполните обследование лежащего в основе
поражения левых отделов сердца
Катетеризация правых отделов сердца
при неполном объяснении легочной
гипертензии
Выполните обследование для:
3-й группы (поражение легких)
4-й группы (CTEPH)
5-й группы (системные заболевания)
1-й группы (ЛАГ)
Катетеризацию правых отделов сердца
Рис. 32.17 Диагностический подход при клинической настороженности относительно наличия у пациента легочной гипертензии. CTEPH — хро-
ническая легочная тромбоэмболическая болезнь; ДДЛА — диастолическое давление в легочной артерии; ЛА — легочная артерия; ЛАГ — легочная артериальная
гипертензия; ЛЖ — левый желудочек; ЛП — левое предсердие; ЛР — легочная регургитация; ПЖ — правый желудочек; СДЛА — систолическое давление в
легочной артерии; ССТК — систолическое смещение трикуспидального кольца; ТР — трикуспидальная регургитация; ФИП — фракционное изменение площади.
ЛИТЕРАТУРА
1. Lam CS, Borlaug BA, Kane GC, et al. Age-
associated increases in pulmonary artery sys-
tolic pressure in the general population, Cir-
culation 119:2663–2670, 2009.
2. Strange G, Playford D, Stewart S, et al. Pul-
monary hypertension: prevalence and mor-
tality in the Armadale echocardiography co-
hort, Heart 98:1805–1811, 2012.
3. Rudski LG, Lai WW, Afilalo J, et al. Guide-
lines for the echocardiographic assessment of
the right heart in adults: a report from the
American Society of Echocardiography en-
dorsed by the European Association of Echo-
cardiography, J Am Soc Echocardiogr 23:685–
713, 2010.
4. Chemla D, Castelain V, Humbert M, et al.
New formula for predicting mean pulmonary
artery pressure using systolic pulmonary ar-
tery pressure, Chest 126:1313–1317, 2004.
5. Taleb M, Khuder S, Tinkel J, Khouri SJ. The
diagnostic accuracy of Doppler echocardiog-
raphy in assessment of pulmonary artery sys-
tolic pressure: a meta-analysis, Echocardiogra-
phy 30:258–265, 2013.
6. Tossavainen E, So
derberg S, Gro
nlund C, et al.
Pulmonary artery acceleration time in identi-
fying pulmonary hypertension patients with
raised pulmonary vascular resistance, Eur
Heart J Cardiovasc Imaging 14:890–897, 2013.
7. McQuillan BM, Picard MH, Leavitt M, Wey-
man AE. Clinical correlates and reference
intervals for pulmonary artery systolic pres-
sure among echocardiographically normal
subjects, Circulation 104:2797–2802, 2001.
8. Simonneau G, Gatzoulis MA, Adatia I, et al.
Updated clinical classification of pulmonary
hypertension, J Am Coll Cardiol 62:D34–D41,
2013.
9. Phung S, Strange G, Chung LP, et al. Preva-
lence of pulmonary arterial hypertension in
an Australian scleroderma population: scree-
ning allows for earlier diagnosis, Int Med J
39:682–691, 2009.
10. Consensus statement on the management of
pulmonary hypertension in clinical practice
in the UK and Ireland, Heart 94(Suppl 1):i1–
i41, 2008.
11. Engelfriet PM, Duffels MGJ, Mo
ller T, et al.
Pulmonary arterial hypertension in adults
born with a heart septal defect: the Euro
Heart Survey on adult congenital heart dis-
ease, Heart 93:682–687, 2007.
12. van Riel ACMJ, Schuuring MJ, van Hessen
ID, et al. Contemporary prevalence of pul-
monary arterial hypertension in adult con-
genital heart disease following the updated
clinical classification, Int J Cardiol 174:299–
305, 2014.
13. Silversides CK, Salehian O, Oechslin E, et al.
Canadian Cardiovascular Society 2009 Con-
sensus Conference on the management of
adults with congenital heart disease: complex
congenital cardiac lesions, Can J Cardiol
26:e98–e117, 2010.
14. Lindman BR, Zajarias A, Madrazo JA, et al.
Effects of phosphodiesterase type 5 inhibi-
tion on systemic and pulmonary hemody-
namics and ventricular function in patients
with severe symptomatic aortic stenosis, Cir-
culation 125:2353–2362, 2012.
15. Zhao L, Mason NA, Morrell NW, et al. Silde-
nafil inhibits hypoxia-induced pulmonary
hypertension, Circulation 104:424–428, 2001.
16. Galie
́
N, Palazzini M, Leci E, Manes A. Cur-
rent therapeutic approaches to pulmonary
arterial hypertension, Rev Esp Cardiol 63:708–
724, 2010.
17. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39.e14, 2015.
18. Innelli P, Esposito R, Olibet M, et al. The impact
of ageing on right ventricular longitudinal func-
tion in healthy subjects: a pulsed tissue Doppler
study, Eur J Echocardiogr 10:491–498, 2009.
19. Kovacs G, Olschewski A, Berghold A,
Olschewski H. Pulmonary vascular resistanc-
es during exercise in normal subjects: a sys-
tematic review, Eur Resp J 39:319–328, 2012.
20. Abbas AE, Fortuin FD, Patel B, et al. Nonin-
vasive measurement of systemic vascular re-
sistance using Doppler echocardiography, J
Am Soc Echocardiogr 17:834–838, 2004.
21. Abbas AE, Franey LM, Marwick T, et al. Non-
invasive assessment of pulmonary vascular
resistance by Doppler echocardiography, J
Am Soc Echocardiogr 26:1170–1177, 2013.
22. Sorajja P, Nishimura RA. Measurement of
pulmonary pressures and pulmonary resis-
tance: is Doppler ready for prime time? J Am
Soc Echocardiogr 26:1178–1179, 2013.
23. Gru
nig E, Tiede H, Enyimayew EO, et al. As-
sessment and prognostic relevance of right
ventricular contractile reserve in patients with
severe pulmonary hypertension, Circulation
128:2005–2015, 2013.
24. D’Andrea A, Naeije R, D’Alto M, et al. Range
in pulmonary artery systolic pressure among
highly trained athletes, Chest 139:788–794,
2011.
25. Argiento P. Exercise stress echocardiography
of the pulmonary circulation: limits of nor-
mal and sex differences, Chest 142:1158–
1165, 2012.
26. Collins N. Abnormal pulmonary vascular re-
sponses in patients registered with a systemic
autoimmunity database: Pulmonary Hyper-
tension Assessment and Screening Evaluation
using stress echocardiography (PHASE-I),
Eur J Echocardiogr 7:439–446, 2006.
27. Talreja DR, Nishimura RA, Oh JK. Estimation
of left ventricular filling pressure with exercise
by Doppler echocardiography in patients with
normal systolic function: a simultaneous echo-
cardiographic-cardiac catheterization study, J
Am Soc Echocardiogr 20:477–479, 2007.
28. Egstrup M, Gustafsson I, Andersen MJ, et al.
Haemodynamic response during low-dose
dobutamine infusion in patients with chronic
systolic heart failure: comparison of echocar-
In-32_для нас.indd 826
03.04.2019 12:10:50
827
32 Легочная гипертензия
П
о
н
я
т
и
е
В
ы
п
о
л
н
е
н
н
ы
е
и
з
м
е
р
е
н
и
я
М
е
т
о
д
О
т
к
л
о
н
е
н
и
я
о
т
н
о
р
м
ы
И
н
т
е
р
п
р
е
т
а
ц
и
я
Е
с
т
ь
л
и
л
е
г
о
ч
н
а
я
г
и
п
е
р
т
е
н
з
и
я
?
Д
а
в
л
е
н
и
е
в
П
П
С
п
а
д
е
н
и
е
Н
П
В
в
с
у
б
к
о
с
т
а
л
ь
н
о
й
д
л
и
н
н
о
о
с
е
в
о
й
п
р
о
е
к
ц
и
и
Н
П
В
Д
и
а
м
е
т
р
>
2
,
1
с
м
С
п
а
д
е
н
и
е
н
а
в
д
о
х
е
н
о
с
о
м
<
5
0
%
Д
а
в
л
е
н
и
е
в
П
П
>
1
5
м
м
р
т
.
с
т
.
В
ы
с
о
т
а
Я
В
Д
К
л
и
н
и
ч
е
с
к
а
я
о
ц
е
н
к
а
>
6
с
м
п
р
и
4
5
°
Д
а
в
л
е
н
и
е
в
П
П
>
1
5
м
м
р
т
.
с
т
.
П
л
о
щ
а
д
ь
П
П
А
п
и
к
а
л
ь
н
а
я
ч
е
т
ы
р
е
х
к
а
м
е
р
н
а
я
п
р
о
е
к
-
ц
и
я
,
с
ф
о
к
у
с
и
р
о
в
а
н
н
а
я
н
а
П
Ж
>
1
8
с
м
2
Х
р
о
н
и
ч
е
с
к
о
е
п
о
в
ы
ш
е
н
и
е
д
а
в
л
е
н
и
я
в
П
П
Р
а
з
н
и
ц
а
д
а
в
л
е
н
и
й
в
П
Ж
и
П
П
М
а
к
с
и
м
а
л
ь
н
а
я
с
к
о
р
о
с
т
ь
Т
Р
в
н
е
с
к
о
л
ь
-
к
и
х
п
р
о
е
к
ц
и
я
х
>
2
,
7
5
м
/
с
е
к
О
ц
е
н
к
а
С
Д
П
Ж
:
з
а
в
и
с
и
т
о
т
в
о
з
р
а
с
т
а
и
И
М
Т
С
Д
Л
А
С
Д
П
Ж
=
4
(
С
Т
Р
)
2
+
д
а
в
л
е
н
и
е
в
П
П
>
4
0
м
м
р
т
.
с
т
.
Н
е
п
р
е
д
п
о
л
а
г
а
е
т
с
т
е
н
о
з
а
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
:
з
а
в
и
с
и
т
о
т
в
о
з
р
а
с
т
а
и
И
М
Т
Р
а
з
н
и
ц
а
д
а
в
л
е
н
и
й
в
Л
А
и
П
Ж
Н
а
ч
а
л
ь
н
а
я
с
к
о
р
о
с
т
ь
Л
Р
>
2
5
м
м
р
т
.
с
т
.
О
ц
е
н
к
а
с
р
е
д
н
е
г
о
Д
Л
А
Р
а
з
н
и
ц
а
д
а
в
л
е
н
и
й
в
Л
А
и
П
Ж
К
о
н
е
ч
н
а
я
с
к
о
р
о
с
т
ь
Л
Р
>
1
5
м
м
р
т
.
с
т
.
О
ц
е
н
к
а
д
и
а
с
т
о
л
и
ч
е
с
к
о
г
о
Д
Л
А
В
р
е
м
я
у
с
к
о
р
е
н
и
я
п
о
т
о
к
а
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
П
р
о
д
о
л
ж
и
т
е
л
ь
н
о
с
т
ь
п
о
д
ъ
е
м
а
н
е
п
р
е
-
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
в
с
к
о
й
в
о
л
н
ы
н
а
к
л
а
п
а
н
е
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
<
9
0
м
с
е
к
У
к
а
з
ы
в
а
е
т
н
а
Л
С
С
>
3
е
д
и
н
и
ц
W
o
o
d
П
о
ч
е
м
у
в
о
з
н
и
к
а
е
т
л
е
г
о
ч
н
а
я
г
и
п
е
р
т
е
н
з
и
я
?
1
,
3
,
4
,
и
5
г
р
у
п
п
ы
л
е
г
о
ч
н
о
й
г
и
п
е
р
т
е
н
з
и
и
Л
е
г
о
ч
н
а
я
г
и
п
е
р
т
е
н
з
и
я
б
е
з
п
р
и
з
н
а
к
о
в
п
о
р
а
ж
е
н
и
я
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
Т
р
е
б
у
е
т
с
я
и
з
у
ч
е
н
и
е
о
с
н
о
в
н
о
й
п
р
и
ч
и
н
ы
1
-
я
г
р
у
п
п
а
,
о
б
у
с
л
о
в
л
е
н
-
н
а
я
В
П
С
О
п
и
ш
и
т
е
т
о
ч
н
о
е
м
е
с
т
о
п
о
л
о
ж
е
н
и
е
д
е
ф
е
к
т
а
п
о
о
т
н
о
ш
е
н
и
ю
к
а
р
т
е
р
и
я
м
и
д
р
у
г
и
м
с
т
р
у
к
т
у
р
а
м
с
е
р
д
ц
а
с
т
р
у
к
т
у
р
а
м
Р
а
с
ч
е
т
п
о
р
а
ж
е
н
и
я
с
п
о
м
о
щ
ь
ю
у
р
а
в
н
е
н
и
я
Б
е
р
н
у
л
л
и
И
с
п
о
л
ь
з
у
й
т
е
с
т
а
н
д
а
р
т
н
ы
е
и
з
м
е
р
е
н
и
я
л
е
г
о
ч
н
о
й
г
и
п
е
р
т
е
н
з
и
и
О
ц
е
н
и
т
е
в
л
и
я
н
и
е
о
б
ъ
е
м
а
и
д
а
в
л
е
н
и
я
н
а
п
р
а
в
ы
е
о
т
д
е
л
ы
с
е
р
д
ц
а
Л
А
Г
п
р
и
с
и
н
д
р
о
м
е
Э
й
з
е
н
м
е
н
г
е
р
а
Л
А
Г
п
р
и
с
б
р
о
с
е
к
р
о
в
и
с
л
е
в
а
н
а
п
р
а
в
о
,
п
о
в
ы
ш
е
н
и
и
Л
С
С
,
н
о
б
е
з
Э
й
з
е
н
м
е
н
г
е
р
а
Л
А
Г
п
р
и
м
а
л
ы
х
д
е
ф
е
к
т
а
х
Л
А
Г
п
о
с
л
е
х
и
р
у
р
г
и
ч
е
с
к
о
й
к
о
р
р
е
к
ц
и
и
2
-
я
г
р
у
п
п
а
л
е
г
о
ч
н
о
й
г
и
п
е
р
т
е
н
з
и
и
:
п
о
р
а
ж
е
-
н
и
е
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
И
з
м
е
р
ь
т
е
ф
р
а
к
ц
и
ю
в
ы
б
р
о
с
а
Л
Ж
в
п
а
р
а
с
т
е
р
н
а
л
ь
н
ы
х
и
а
п
и
к
а
л
ь
н
ы
х
п
р
о
е
к
ц
и
я
х
<
5
0
%
С
и
с
т
о
л
и
ч
е
с
к
а
я
д
и
с
ф
у
н
к
ц
и
я
Л
Ж
И
з
м
е
р
ь
т
е
д
и
а
с
т
о
л
и
ч
е
с
к
у
ю
ф
у
н
к
ц
и
ю
О
т
н
о
ш
е
н
и
е
E
:
E
′
>
1
5
П
о
в
ы
ш
е
н
н
о
е
д
а
в
л
е
н
и
е
н
а
п
о
л
н
е
н
и
я
Л
Ж
Б
и
п
л
а
н
о
в
о
е
и
з
м
е
р
е
н
и
е
о
б
ъ
е
м
а
Л
П
в
а
п
и
к
а
л
ь
н
ы
х
п
р
о
е
к
ц
и
я
х
О
б
ъ
е
м
Л
П
>
3
4
м
л
/
м
2
И
з
м
е
р
ь
т
е
м
а
с
с
у
Л
Ж
с
п
о
м
о
щ
ь
ю
б
и
п
л
а
н
о
в
о
г
о
м
е
т
о
д
а
и
з
м
е
р
е
н
и
я
п
л
о
щ
а
д
ь
–
д
л
и
н
а
М
у
ж
ч
и
н
ы
>
1
0
4
г
/
м
2
Ж
е
н
щ
и
н
ы
>
9
0
г
/
м
2
О
ц
е
н
и
т
ь
п
а
т
о
л
о
г
и
ю
к
л
а
п
а
н
о
в
П
о
д
р
о
б
н
о
с
т
и
с
м
.
в
т
е
к
с
т
е
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
П
о
д
о
з
р
е
н
и
е
н
а
л
е
г
о
ч
н
у
ю
г
и
п
е
р
т
е
н
з
и
ю
In-32_для нас.indd 827
03.04.2019 12:10:50
828
ЧАСТЬ VI Правые отделы сердца
П
о
н
я
т
и
е
В
ы
п
о
л
н
е
н
н
ы
е
и
з
м
е
р
е
н
и
я
М
е
т
о
д
О
т
к
л
о
н
е
н
и
я
о
т
н
о
р
м
ы
И
н
т
е
р
п
р
е
т
а
ц
и
я
К
а
к
о
в
о
в
л
и
я
н
и
е
н
а
п
р
а
в
ы
е
о
т
д
е
л
ы
с
е
р
д
ц
а
?
Ф
о
р
м
а
П
Ж
В
и
з
у
а
л
ь
н
а
я
о
ц
е
н
к
а
в
п
а
р
а
с
т
е
р
н
а
л
ь
н
ы
х
к
о
р
о
т
к
о
о
с
е
в
ы
х
и
а
п
и
к
а
л
ь
н
ы
х
ч
е
т
ы
р
е
х
к
а
м
е
р
н
ы
х
п
р
о
е
к
ц
и
я
х
П
К
О
:
с
и
с
т
о
л
и
ч
е
с
к
о
е
у
п
л
о
щ
е
н
и
е
м
е
ж
ж
е
л
у
д
о
ч
к
о
в
о
й
п
е
р
е
г
о
р
о
д
к
и
О
к
р
у
г
л
а
я
ф
о
р
м
а
П
Ж
А
п
и
к
а
л
ь
н
а
я
ч
е
т
ы
р
е
х
к
а
м
е
р
н
а
я
:
п
р
я
м
о
у
г
о
л
ь
н
а
я
ф
о
р
м
а
П
Ж
Г
о
р
и
з
о
н
т
а
л
ь
н
о
е
п
о
л
о
ж
е
н
и
е
м
ы
ш
е
ч
-
н
о
й
п
е
р
е
к
л
а
д
и
н
ы
П
Ж
У
к
а
з
ы
в
а
е
т
н
а
п
е
р
е
г
р
у
з
к
у
д
а
в
л
е
н
и
е
м
П
Ж
И
н
д
е
к
с
э
к
с
ц
е
н
т
р
и
ч
н
о
с
т
и
П
Ж
О
т
н
о
ш
е
н
и
е
р
а
з
м
е
р
о
в
П
Ж
к
Л
Ж
в
П
К
О
п
р
о
е
к
ц
и
и
с
р
е
д
н
е
г
о
о
т
д
е
л
а
ж
е
л
у
д
о
ч
к
о
в
>
1
,
0
У
к
а
з
ы
в
а
е
т
н
а
п
е
р
е
г
р
у
з
к
у
д
а
в
л
е
н
и
е
м
П
Ж
Р
а
з
м
е
р
ы
П
Ж
Ч
е
т
ы
р
е
х
к
а
м
е
р
н
а
я
п
р
о
е
к
ц
и
я
,
с
ф
о
к
у
с
и
-
р
о
в
а
н
н
а
я
н
а
П
Ж
О
с
н
о
в
а
н
и
е
П
Ж
>
4
2
м
м
С
р
е
д
н
и
й
о
т
д
е
л
П
Ж
>
3
5
м
м
Т
о
л
щ
и
н
а
с
т
е
н
о
к
П
Ж
С
в
о
б
о
д
н
а
я
с
т
е
н
к
а
П
Ж
в
с
у
б
к
о
с
т
а
л
ь
н
о
й
ч
е
т
ы
р
е
х
к
а
м
е
р
н
о
й
п
р
о
е
к
ц
и
и
>
5
м
м
Г
и
п
е
р
т
р
о
ф
и
я
П
Ж
н
а
б
л
ю
д
а
е
т
с
я
п
р
и
х
р
о
н
и
-
ч
е
с
к
о
й
п
е
р
е
г
р
у
з
к
е
д
а
в
л
е
н
и
е
м
Ф
р
а
к
ц
и
о
н
н
о
е
и
з
м
е
н
е
н
и
е
п
л
о
щ
а
д
и
П
Ж
Ч
е
т
ы
р
е
х
к
а
м
е
р
н
а
я
п
р
о
е
к
ц
и
я
,
с
ф
о
к
у
с
и
-
р
о
в
а
н
н
а
я
н
а
П
Ж
<
3
5
%
Н
а
р
у
ш
е
н
и
е
с
и
с
т
о
л
и
ч
е
с
к
о
й
ф
у
н
к
ц
и
и
П
Ж
С
и
с
т
о
л
и
ч
е
с
к
о
е
с
м
е
щ
е
-
н
и
е
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
М
-
р
е
ж
и
м
л
а
т
е
р
а
л
ь
н
о
г
о
т
р
и
к
у
с
п
и
д
а
л
ь
-
н
о
г
о
к
о
л
ь
ц
а
в
ч
е
т
ы
р
е
х
к
а
м
е
р
н
о
й
п
р
о
е
к
ц
и
и
,
с
ф
о
к
у
с
и
р
о
в
а
н
н
о
й
н
а
П
Ж
<
1
7
м
м
Н
а
р
у
ш
е
н
и
е
с
и
с
т
о
л
и
ч
е
с
к
о
й
ф
у
н
к
ц
и
и
П
Ж
С
и
с
т
о
л
и
ч
е
с
к
а
я
с
к
о
р
о
с
т
ь
п
л
о
с
к
о
с
т
и
т
р
и
к
у
с
п
и
-
д
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
Т
к
а
н
е
в
а
я
д
о
п
п
л
е
р
о
в
с
к
а
я
в
и
з
у
а
л
и
з
а
ц
и
я
л
а
т
е
р
а
л
ь
н
о
г
о
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
г
о
к
о
л
ь
ц
а
в
ч
е
т
ы
р
е
х
к
а
м
е
р
н
о
й
п
р
о
е
к
ц
и
и
,
с
ф
о
к
у
с
и
р
о
в
а
н
н
о
й
н
а
П
Ж
<
1
0
с
м
/
с
е
к
Н
а
р
у
ш
е
н
и
е
с
и
с
т
о
л
и
ч
е
с
к
о
й
ф
у
н
к
ц
и
и
П
Ж
И
н
д
е
к
с
T
e
i
П
Ж
с
п
о
м
о
щ
ь
ю
и
м
п
у
л
ь
с
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
(
с
м
.
т
е
к
с
т
)
>
0
,
4
4
У
к
а
з
ы
в
а
е
т
к
а
к
н
а
с
и
с
т
о
л
и
ч
е
с
к
у
ю
,
т
а
к
и
н
а
д
и
а
с
т
о
л
и
ч
е
с
к
у
ю
д
и
с
ф
у
н
к
ц
и
ю
П
Ж
Л
С
С
и
л
и
(
с
м
.
т
е
к
с
т
)
Л
С
С
>
3
е
д
и
н
и
ц
ы
В
у
д
(
п
о
в
ы
ш
е
н
и
е
д
а
в
л
е
н
и
я
в
Л
П
с
н
и
ж
а
е
т
Л
С
С
)
П
о
з
в
о
л
я
е
т
п
р
е
д
п
о
л
о
ж
и
т
ь
п
р
е
к
а
п
и
л
л
я
р
н
у
ю
Л
Г
С
т
р
е
с
с
-
Э
х
о
К
Г
Г
р
а
д
и
е
н
т
д
а
в
л
е
н
и
я
в
П
Ж
–
П
П
>
1
5
м
м
р
т
.
с
т
.
п
о
д
ъ
е
м
н
а
н
е
з
н
а
ч
и
-
т
е
л
ь
н
ы
й
у
р
о
в
е
н
ь
;
н
е
с
п
о
с
о
б
н
о
с
т
ь
к
у
в
е
л
и
ч
е
н
и
ю
п
р
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
Б
ы
с
т
р
о
е
н
а
р
а
с
т
а
н
и
е
С
Д
Л
А
п
р
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
у
к
а
з
ы
в
а
е
т
н
а
п
о
в
ы
ш
е
н
и
е
Л
С
С
.
У
п
а
ц
и
е
н
т
о
в
с
Л
Г
н
е
с
п
о
с
о
б
н
о
с
т
ь
к
у
в
е
л
и
ч
е
-
н
и
ю
г
р
а
д
и
е
н
т
а
п
р
и
ф
и
з
и
ч
е
с
к
о
й
н
а
г
р
у
з
к
е
у
к
а
з
ы
в
а
е
т
н
а
н
а
р
у
ш
е
н
и
е
с
о
к
р
а
т
и
т
е
л
ь
н
о
г
о
р
е
з
е
р
в
а
П
Ж
И
з
м
е
р
е
н
и
е
у
г
л
а
н
а
к
л
о
н
а
к
р
и
в
о
й
P
–
Q
(
п
о
д
р
о
б
н
о
с
т
и
с
м
.
в
т
е
к
с
т
е
)
П
о
в
ы
ш
е
н
и
е
С
Д
П
Ж
>
3
м
м
р
т
.
с
т
.
/
л
/
м
и
н
V
T
I
—
и
н
т
е
г
р
а
л
с
к
о
р
о
с
т
и
к
р
о
в
о
т
о
к
а
;
В
И
В
Р
—
в
р
е
м
я
и
з
о
в
о
л
ю
м
и
ч
е
с
к
о
г
о
р
а
с
с
л
а
б
л
е
н
и
я
;
В
И
В
С
—
в
р
е
м
я
и
з
о
в
о
л
ю
м
и
ч
е
с
к
о
г
о
с
о
к
р
а
щ
е
н
и
я
;
В
П
С
—
в
р
о
ж
д
е
н
н
ы
й
п
о
р
о
к
с
е
р
д
ц
а
;
В
Т
П
Ж
—
в
ы
-
х
о
д
н
о
й
т
р
а
к
т
п
р
а
в
о
г
о
ж
е
л
у
д
о
ч
к
а
;
Д
Л
А
—
д
а
в
л
е
н
и
е
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
;
Л
А
—
л
е
г
о
ч
н
а
я
а
р
т
е
р
и
я
;
Л
А
Г
—
л
е
г
о
ч
н
а
я
а
р
т
е
р
и
а
л
ь
н
а
я
г
и
п
е
р
т
е
н
з
и
я
;
Л
Г
—
л
е
г
о
ч
н
а
я
г
и
п
е
р
т
е
н
з
и
я
;
Л
Р
—
л
е
г
о
ч
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
;
Л
С
С
—
л
е
г
о
ч
н
о
е
с
о
с
у
д
и
с
т
о
е
с
о
п
р
о
т
и
в
л
е
н
и
е
;
Н
П
В
—
н
и
ж
н
я
я
п
о
л
а
я
в
е
н
а
;
П
К
О
—
п
р
о
е
к
ц
и
я
п
о
к
о
р
о
т
к
о
й
о
с
и
;
С
Д
Л
А
—
с
и
с
т
о
л
и
ч
е
с
к
о
е
д
а
в
л
е
н
и
е
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
;
С
Д
-
П
Ж
—
с
и
с
т
о
л
и
ч
е
с
к
о
е
д
а
в
л
е
н
и
е
в
п
р
а
в
о
м
ж
е
л
у
д
о
ч
к
е
;
С
Т
Р
—
с
к
о
р
о
с
т
ь
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
;
Т
Р
—
т
р
и
к
у
с
п
и
д
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
;
Я
В
Д
—
я
р
е
м
н
о
е
в
е
н
о
з
н
о
е
д
а
в
л
е
н
и
е
.
I
V
R
T
+
I
V
C
T
E
T
R
V
T
1
0
×
+
0
.
1
6
V
T
I
R
V
O
T
2
R
V
V
T
I
T
5
.
1
9
×
0
.
4
R
V
O
T
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
о
к
о
н
ч
а
н
и
е
П
о
д
о
з
р
е
н
и
е
н
а
л
е
г
о
ч
н
у
ю
г
и
п
е
р
т
е
н
з
и
ю
In-32_для нас.indd 828
03.04.2019 12:10:50
829
32 Легочная гипертензия
diographic and invasive measurements, Eur
Heart J Cardiovasc Imaging 14:659–667, 2013.
29. Collins N, Bastian B, Quiqueree L, et al. Ab-
normal pulmonary vascular responses in pa-
tients registered with a systemic autoimmu-
nity database: Pulmonary Hypertension As-
sessment and Screening Evaluation using
stress echocardiography (PHASE-I), Eur J
Echocardiogr 7:439–446, 2006.
30. Ha JW, Choi D, Park S, et al. Determinants
of exercise-induced pulmonary hypertension
in patients with normal left ventricular ejec-
tion fraction, Heart 95:490–494, 2009.
31. Mahjoub H, Levy F, Cassol M, et al. Effects
of age on pulmonary artery systolic pressure
at rest and during exercise in normal adults,
Eur J Echocardiogr 10:635–640, 2009.
32. Lau EMT, Vanderpool RR, Choudhary P, et
al. Dobutamine stress echocardiography for
the assessment of pressure-flow relationships
of the pulmonary circulation, Chest 146:959–
966, 2014.
33. Lewis GD, Bossone E, Naeije R, et al. Pulmo-
nary vascular hemodynamic response to ex-
ercise in cardiopulmonary diseases, Circula-
tion 128:1470–1479, 2013.
34. Lam CS. Age-associated increases in pulmo-
nary artery systolic pressure in the general
population, Circulation 119:2663–2670, 2009.
35. Grossman A, Prokupetz A, Benderly M, et al.
Pulmonary artery pressure in young healthy
subjects, J Am Soc Echocardiogr 25:357–360,
2012.
In-32_для нас.indd 829
03.04.2019 12:10:50
In-32_для нас.indd 830
03.04.2019 12:10:50
831
33 Патология клапанов правых отделов
сердца у взрослых
CHARLES J. BRUCE, MB, CHB • HEIDI M. CONNOLLY, MD
Болезни трикуспидального клапана
Трикуспидальная регургитация
История вопроса
Основные принципы
и эхокардиографический подход
к диагнозу
Технические детали, количественная
оценка и анализ данных
Клиническое применение и данные
исходов
Потенциальные ограничения
Трикуспидальный стеноз
История вопроса
Основные принципы
и эхокардиографические подходы
Технические детали, количественная
оценка и анализ данных
Клиническое применение
и данные исходов
Дополнительные подходы
Стеноз легочного клапана
История вопроса
Основные принципы
и эхокардиографические подходы
Технические детали, количественная
оценка и анализ данных
Клиническое применение, данные
исходов
Дополнительные подходы
Регургитация на клапане легочной
артерии
История вопроса
Основные принципы
и эхокардиографические подходы
Технические детали, количественная
оценка и анализ данных
Клиническое применение, данные
исходов
Дополнительные подходы
Исторически патологии клапанов правых отделов
сердца уделялось меньше внимания, чем левых от-
делов, в т.ч . из-за того, что эти повреждения внача-
ле хорошо переносятся, что связано с продолжи-
тельным латентным бессимптомным периодом.
Более того, поскольку трикуспидальная регургита-
ция (ТР) часто является результатом поражения
клапанов левых отделов сердца, а легочная регурги-
тация (ЛР) — результат врожденной патологии
сердца, основные нарушения имеют тенденцию к
доминированию в клинической практике. Сейчас
признано, что патология клапанов правых отделов
сердца, даже вторичная по отношению к другим
нарушениям, не является благоприятной и отрица-
тельно влияет на заболеваемость и смертность.
Вследствие этого клиницисты должны не только
определять наличие поражения клапанов правых
отделов сердца, но и стремиться понимать патофи-
зиологию этих процессов и выбирать соответству-
ющие подтверждающие обследования, вовремя
направлять пациентов на лечение, в т.ч . хирургиче-
ское. Эхокардиография (ЭхоКГ) играет во всем этом
решающую роль.
БОЛЕЗНИ ТРИКУСПИДАЛЬНОГО КЛАПАНА
Комплекс трикуспидального клапана (ТК) состоит
из кольца, створок, правого желудочка (ПЖ), сосоч-
ковых мышц и сухожильных хорд. Нормальный ТК
имеет три парусоподобные створки разного разме-
ра: переднюю, заднюю и септальную (рис. 33 .1А).
Передняя створка обычно наибольшая и анатоми-
чески наиболее постоянна из трех; другие створки
часто варьируют в размере и расположении. Створ-
ки прикрепляются к кольцу ТК, неплоской структу-
ре с эллиптической седловидной формой [1]. Так
же, как и створки МК, створки ТК удерживаются
сухожильными хордами, прикрепленными к па-
пиллярным мышцам, которые обычно располага-
ются тремя группами (передняя, задняя, перегоро-
дочная), по очереди отходящими от стенки ПЖ под
каждой из трех комиссур. Хорды ТК также могут
прямо крепиться к свободной стенке ПЖ, что отме-
чается и в ПЖ, и в левом желудочке (ЛЖ).
ТРИКУСПИДАЛЬНАЯ РЕГУРГИТАЦИЯ
ИСТОРИЯ ВОПРОСА
Дифференциальная диагностика первичной пато-
логии клапана и дисфункции клапана в результате
легочной гипертензии или первичных болезней
правых отделов сердца — важный первый шаг при
обследовании пациентов с ТР. Первичные анатоми-
ческие изменения ТК, такие как пролапс ТК или эн-
докардит, относительно редко являются причиной
ТР. Чаще ТР является результатом легочной гипер-
In-33_для нас.indd 831
03.04.2019 12:11:07
832
ЧАСТЬ VI Правые отделы сердца
тензии, которая, в свою очередь, часто является ре-
зультатом болезней левых отделов сердца.
ОСНОВНЫЕ ПРИНЦИПЫ И ЭХОКАРДИОГРАФИЧЕСКИЙ
ПОДХОД К ДИАГНОЗУ
В настоящее время ЭхоКГ является референсным
стандартом для диагностики и оценки ТР. Из-за
неспецифичности симптомов и скудных проявле-
ний при клиническом осмотре выраженная ТР ча-
сто является случайной находкой во время обследо-
вания с помощью ЭхоКГ при патологии левых от-
делов сердца.
Оценка ТР с помощью ЭхоКГ следует тем же
принципам, что и оценка поражения левых отделов
сердца, и не только подтверждает ее наличие и вы-
раженность, но также дает важную информацию
относительно этиологии. Неинвазивное определе-
ние давления в ЛА и оценка влияния ТР на размеры
и функцию ПЖ — основной компонент ЭхоКГ-ис-
следования. Следует заметить, что вычисление дав-
ления в ЛА может быть неточным при выраженной
ТР. Это связано со сложностью в расчете давления
в правом предсердии (ПП) и возможными погреш-
ностями при использовании уравнения Бернулли
для состояний с ламинарным течением. Подходы к
оценке размеров и функции ПЖ с помощью ЭхоКГ
и определение давления в ЛА обсуждаются в дета-
лях в главе 31.
ТЕХНИЧЕСКИЕ ДЕТАЛИ, КОЛИЧЕСТВЕННАЯ ОЦЕНКА
И АНАЛИЗ ДАННЫХ
ОПРЕДЕЛЕНИЕ ПРИЧИНЫ ТРИКУСПИДАЛЬНОЙ РЕГУРГИТАЦИИ
Определение причины ТР требует тщательной
оценки морфологии створок ТК, размеров фиброз-
ного кольца, подклапанного аппарата, размеров и
функции ПЖ (табл. 33 .1). Следует выявить наличие
сопутствующих болезней клапанов левых отделов
сердца или внутрисердечных шунтов, а наличие
внутрисердечных устройств (например, электродов
пейсмекеров или дефибрилляторов) требует тща-
тельной оценки подвижности створок ТК. Также
важной является оценка влияния поражения клапа-
нов на размеры и функцию ПЖ [2–4].
ТТЭхоКГ в 2D-режиме ТК включает позиции
приносящего отдела и по короткой оси из парастер-
нального доступа и четырехкамерную позицию как
из апикального, так и из субкостального доступов.
Визуализация при ЭхоКГ в 2D-режиме всех трех
створок в одной позиции затруднительна [5]. Сеп-
тальная и передняя створки хорошо видны из парас-
тернальной по короткой оси и апикальной четырех-
камерной позиций [6]. Изображение со смещением
датчика спереди назад в апикальной четырехкамер-
ной или субкостальной позиции может преодолеть
затруднения в надежной идентификации задней
створки. Заднюю створку идентифицируют, когда
ЛК
МК
ТК
ПЖ
З
П
С
Рис. 33.1 Анатомия нормального трикуспидального клапана. (А) Макропрепарат сердца. Срез соответствует изображению на (Б). Отмечены септальная
(С), передняя (П) и задняя (З) створки трикуспидального клапана (ТК). (Б) ЧПЭхоКГ из трансгастрального доступа в позиции трикуспидального клапана по корот-
кой оси (31°) (в пределах желтых линий на (А)). A На видеоизображении при 3D-ТТЭхоКГ видны митральный клапан (слева) и трикуспидальный клапан (справа)
(вид снизу). Возле септальной створки виден электрод водителя ритма (эхогенная точка), из-за которого нарушается коаптация створок. КЛА — клапан легочной
артерии; МК — митральный клапан; ПЖ — правый желудочек; ТК — трикуспидальный клапан (Б — предоставлено Dr William D. Edwards, Department of Labora-
tory Medicine and Pathology, Mayo Clinic College of Medicine).
А
Б
In-33_для нас.indd 832
03.04.2019 12:11:08
833
33 Патология клапанов правых отделов сердца у взрослых
Врожденные
Болезнь Эбштейна
Дисплазия ТК
Гипоплазия ТК
Щель ТК
Двойное отверстие ТК
Неприкрытое отверстие ТК
Болезни ПЖ
Дисплазия ПЖ
Эндомиокардиальный фиброз
Увеличение давления в правых отделах сердца
Приобретенные
Расширение кольца
Поражение клапанов левых отделов сердца
Эндокардит
Травма
Карциноидная болезнь сердца
Ревматоидные болезни сердца
Пролапс ТК
Ятрогенные (радиация, препараты, биопсия, водитель
ритма, имплантированный кардиодефибрилятор)
Расширение ПЖ
Легочная гипертензия
Первичная легочная гипертензия
Вторичная, вызванная пора жением левых отделов сердца
(заболевания клапанов, кардиомиопатия и т.д.)
Перегрузка ПЖ объемом
Дефект межпредсердной перегородки
Аномальный дренаж легочных вен
ПЖ — правый желудочек; ТК — трикуспидальный клапан.
ТАБЛИЦА 33.1 Причины трикуспидальной регургитации
виден коронарный синус, поскольку эта структура
тоже расположена сзади. Дополнительно заднюю
створку ТК иногда можно визуализировать из па-
растернальной позиции по короткой оси и позиции
приносящего отдела ПЖ при ротации датчика на 90°
по часовой стрелке, в результате чего получается
двухкамерная позиция правых отделов сердца. Трех-
мерная (3D) трансторакальная эхокардиография
(ТТЭхоКГ) позволяет получить вид ТК по короткой
оси в режиме реального времени, показывая одно-
временно все три створки и места их крепления к
кольцу ТК. При ЧПЭхоКГ ТК часто лучше виден из
трансгастральных позиций по длинной и короткой
осям с поворотом датчика по направлению к правой
стороне пациента (см. рис. 33.1Б). Эти позиции обе-
спечивают единственную возможность визуализи-
ровать ТК спереди en face с помощью ЭхоКГ в
2D-режиме. Также ТК может быть визуализирован
из среднепищеводной четырехкамерной и базаль-
ной позиции по короткой оси [7].
Приблизительно в 80% случаев существенной
ТР, она является «функциональной» по природе [3].
Функциональная ТР по определению не связана с
первичной патологией створок ТК, а, скорее, явля-
ется результатом увеличение давления ПЖ и/или
перегрузки объемом, что приводит к дилатации
ПЖ, смещению подклапанного аппарата, дилата-
ции трикуспидального кольца или комбинации
этих причин.
По данным изображения в 2D-режиме средний
диаметр кольца в норме составляет 31 ± 1 мм при
измерении в одной плоскости из апикальной четы-
рехкамерной позиции. Однако это измерение мо-
жет ввести в заблуждение, поскольку трикуспи-
дальное кольцо — это движущаяся структура и его
размеры меняются во время сердечного цикла и
фаз дыхания [8, 9]. Более того, трикуспидальное
кольцо имеет сложную 3D-седловидную форму,
что делает оценку в 2D-режиме затруднительной.
ЭхоКГ в 3D-режиме показала, что при нарастании
функциональной ТР трикуспидальное кольцо
прогрессивно уплощается и становится более кру-
глым, с тенденцией к расширению от септолате-
рального и заднесептального к переднелатерально-
му направлениям [1, 8]. Таким образом, ЭхоКГ в
3D-режиме сдержала обещание в отношении луч-
шего определения размеров и геометрии три-
куспидального кольца, преодолев ограничения,
свойственные изображению в 2D-режиме. Су-
ществует прямая зависимость между диаметром
кольца и забрасываемым обратно объемом при ТР.
Диастолический диаметр > 40 мм (или > 21 мм/м2)
обычно сопровождается существенным расшире-
нием кольца и связан с увеличенным риска сохра-
няющийся или прогрессирующей ТР после изоли-
рованного хирургического вмешательства на ми-
тральном клапане[3].
Причины клинически значимой ТР объединены
в табл. 33 .1 . Кроме того, умеренная или больше сте-
пень ТР, независимо от первичной причины, обыч-
но порождает дополнительную ТР из-за неблаго-
приятных гемодинамических последствий пере-
грузки ПЖ объемом, что приводит к медленному,
но непреклонному клиническому и гемодинамиче-
скому ухудшению.
Функциональная ТР как результат легочной ги-
пертензии наблюдается у пациентов с выраженной
патологией левых отделов сердца, часто ревматиче-
ской по происхождению; у пациентов с первичной
легочной гипертензией и у пациентов с патологией
легких, ведущей к формированию легочного сердца
[10]. Как правило, когда систолическое давление в
ЛА повышается свыше 55 мм рт. ст., ТР может об-
In-33_для нас.indd 833
03.04.2019 12:11:09
834
ЧАСТЬ VI Правые отделы сердца
наруживаться, несмотря на анатомически нормаль-
ные створки ТК; в то время как ТР, превышающая
небольшую степень, обнаруживаемая при наличии
более низкого систолического давления (< 40 мм
рт. ст.), свидетельствует о структурных нарушениях
створок клапана или подклапанного аппарата [3,
11]. Функциональная ТР также является результа-
том расширения трикуспидального кольца у паци-
ентов с увеличением ПЖ при инфаркте ПЖ, дила-
тационной КМП или лево-правом шунтировании
крови при таких пороках, как дефект межпредсерд-
ной перегородки или аномальный дренаж легочных
вен [12–14].
Первичная патология ТК, приводящая к ТР, мо-
жет быть результатом тупой травмы, ятрогенных
повреждений или прямого вовлечения створок в
специфический процесс. Когда причина — электро-
ды временного пейсмекера или внутреннего карди-
одефибриллятора, механизм повреждения клапана
различен. Он может быть связан с ущемлением
трикуспидального аппарата электродами, прямой
перфорацией створок во время их установки, фи-
бротической адгезией электродов к створке, отры-
вом или разрывом створок ТК при извлечении
электродов [15]. Использование 3D-ЭхоКГ в режи-
ме реального времени может чаще оказаться полез-
нее для определения причины осложнений, связан-
ных с имплантатами (см. рис. 33 .1Б). Поскольку
повреждения створок у пациентов, подвергшихся
установке имплантатов с электродами, могут быть
недооценены, оправдан высокий клинический ин-
декс подозрения, в частности когда у этих пациен-
тов отмечается прогрессирование недостаточности
правых отделов сердца.
Может произойти прямая травма от трансвеноз-
ной эндомиокардиальной биопсии, в частности
у пациентов, ожидающих трансплантации сердца,
которые подвергаются повторным биопсиям при
наблюдении (рис. 33 .2) [16]. ЭхоКГ-контроль (с ис-
пользованием 2D-методики или 3D в режиме реаль-
ного времени) во время биопсии может предотвра-
тить опасность повреждения ТК или подклапанного
аппарата.
Створки ТК и поддерживающие структуры так-
же могут повреждаться косвенно при тупой травме
грудной клетки, наиболее часто после автодорож-
ных происшествий, что проявляется разрывом па-
пиллярных мышц, клапана или хорд. Рутинное
использование ЭхоКГ при обследовании пострадав-
ших с тупой травмой грудной клетки повышает
выявление травматической ТР, преодолевая ограни-
чения анамнестического и клинического обследова-
ния.
Прямое повреждение ТК может произойти в ре-
зультате инфекционного или токсического эндо-
кардита [16, 17]. Инфекционный эндокардит пра-
вых отделов сердца может быть манифестацией
злоупотребления внутривенными наркотическими
препаратами [3, 18]. Он также все чаще отмечается
у пациентов с постоянными венозными катетерами,
используемыми для диализа или химиотерапии,
или с инфицированными пейсмекерами или дефи-
брилляторными устройствами. Причиной таких
инфекций ТК в 80% случаев является Staphylococcus
ПЖ
ПЖ
ПЖ
ЛЖ
ЛЖ
ЛП
ЛП
ПП
ПП
ПП
Рис. 33 .2 Осложнения эндомиокардиальной биопсии. (А) A При цветовой допплерографии в апикальной четырехкамерной позиции наблюдается легкая
трикуспидальная регургитация. (Б) A В той же позиция видна эксцентрическая, латерально направленная струя выраженной трикуспидальной регургитации.
(В) A Увеличенное изображение трикуспидального клапана. Определяются оторванные сухожильные хорды (стрелка). ЛЖ
—
левый желудочек; ЛП — левое
предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
А
Б
В
In-33_для нас.indd 834
03.04.2019 12:11:09
835
33 Патология клапанов правых отделов сердца у взрослых
aureus [3]. Редко токсический или неинфекционный
эндокардит может встречаться при наличии болез-
ней соединительной ткани, таких как системная
красная волчанка, ревматоидный артрит или анти-
фосфолипидный синдром [19]. ТК также может
быть непосредственно поврежден у 30–50% пациен-
тов с ревматической болезнью МК [20].
Препараты-активаторы серотонина также могут
приводить к ТР путем прямого повреждения ство-
рок клапана. Эта связь была впервые описана у ал-
калоидов спорыньи, эрготамина и метисергида,
используемых при лечении мигрени [21]. Препара-
ты от анорексии — фенфлурамин и дексфенфлура-
мин, а также перголид и каберголин, агонисты до-
памина, оба используемые при лечении болезни
Паркинсона и синдрома беспокойных ног, также
могут приводить к ТР со сходным механизмом
[22–24]. Гистопатологические изменения, связан-
ные с лекарственными препаратами, которые отме-
чаются при поражении клапанов, включают фибро-
пролиферативный ответ, возникающий посред-
ством 5-HT2B рецепторов [25]. Эти патологические
признаки сходны с теми, которые наблюдаются при
карциноидной болезни сердца.
Карциноидная болезнь сердца — редкая, но ха-
рактерная форма поражения клапанов, которая в
первую очередь поражает клапаны правых отделов
сердца. Карциноид — это опухоль, которая растет
из аргентафинных клеток. Изначально опухоль
обычно локализуется в тонкой кишке и метастази-
рует в печень. Первичная опухоль и метастазы вы-
рабатывают активные вещества, включая серото-
нин. Установлено, что серотонин является факто-
ром, вовлеченным в развитие и прогрессирование
поражения клапанов у пациентов с карциноидным
синдромом [26]. Карциноидная болезнь сердца
включает сочетание ТР (рис. 33 .3) с реже встречаю-
щимся стенозом и легочного стеноза (ЛС) и ЛР.
Патология клапанов левых отделов сердца встреча-
ется примерно у 10% пациентов с карциноидной
болезнью клапанов, как правило в результате шун-
тирования крови из правого предсердия (ПП) в
левое предсердие (ЛП) через незакрытое овальное
окно и, реже, в результате карциноида бронхов или
активной карциноидной болезни с высокими уров-
нями циркулирующего серотонина [27]. Редко кар-
циноидная болезнь клапанов встречается у пациен-
тов без метастазов в печень; в этих случаях следует
искать карциноид яичников [28].
Облучение средостения может напрямую пора-
жать створки ТК. Связанные с ним поствоспали-
тельный фиброз и кальцификация, которые обычно
проявляются через 5 и более лет после радиацион-
ного воздействия, приводят к смещению створок,
вызывающему ТР [3, 29, 30]. Оценка и лечение ТР в
этом случае может осложняться сопутствующей
дисфункцией других клапанов сердца и поражени-
ем перикарда, миокарда и коронарных артерий.
Эндомиокардиальный фиброз, который преиму-
щественно встречается в тропической Африке, вы-
зывает фиброз верхушек папиллярных мышц,
утолщение и укорочение створок и хорд, что ведет
к регургитации. Этот процесс может затрагивать
как МК, так и ТК.
Врожденные причины ТР редки и включают
врожденный пролапс ТК, который может встре-
чаться как изолированная аномалия или сочетаться
с ПМК и другими аномалиями соединительной
ткани [31, 32]. Наиболее часто встречающаяся
врожденная причина ТР — это аномалия Эбштейна
(рис. 33 .4) [33]. При аномалии Эбштейна отмечают-
ся апикальное смещение септальной и задней ство-
рок ТК в ПЖ и различные варианты фиксации пе-
редней створки. Выраженность ТР зависит от выра-
женности прилегания створок к стенке ПЖ, степени
фиксации кольца и фенестрации створок клапана.
ПЖ
ПП
ТР
Рис. 33 .3 Карциноидная болезнь сердца. (A) A Двухмерное ЭхоКГ-изображение в фазу систолы (позиция приносящего тракта ПЖ) демонстрирует утол-
щенные септальную и переднюю створки трикуспидального клапана (острия) и увеличение ПЖ и ПП. (Б) A Цветная допплерография демонстрирует выраженную
трикуспидальную регургитацию (ТР) у того же пациента. Отмечается ламинарный цветовой поток (синий), заполняющий расширенное правое предсердие (ПП).
ПЖ — правый желудочек.
А
Б
In-33_для нас.indd 835
03.04.2019 12:11:09
836 ЧАСТЬ VI Правые отделы сердца
Открытое овальное окно или дефект МПП встреча-
ются более чем у 50% пациентов с аномалией Эб-
штейна. Также следует иметь в виду возможность
наличия ЛС и ДМЖП [34].
ОПРЕДЕЛЕНИЕ ВЫРАЖЕННОСТИ
ТРИКУСПИДАЛЬНОЙ РЕГУРГИТАЦИИ
Характеристика степени ТР основана на интегриро-
ванной оценке различных показателей, рекомен-
дованных Американской ассоциации кардиологов
(AHA), Американским кардиологическим обще-
ством (ACC), Американским обществом эхокарди-
ографии (ASE) и Европейской ассоциацией по эхо-
кардиографии (ESE) (табл. 33 .2, 33.3) [3, 35].
От 80 до 90% пациентов, направляемых на ЭхоКГ,
имеют какую-либо степень ТР [36]. При скрининге
на значимую ТР часто полагаются в первую очередь
на визуальную оценку площади струи при цветовой
допплерографии. Когда эта методика используется
в исследовательских целях, рассчитывают отноше-
ние площади струи к площади ПП. Эти площади
измеряют из одной и той же позиции после того,
как убеждаются, что глубина сектора позволяет ви-
зуализировать целиком ПП. При площади струи
> 10 см2 или отношении «площадь струи–площадь
ПП» 30% и более предполагают наличие выражен-
ной ТР [4, 7]. Однако, несмотря на то что была от-
мечена корреляция площади струи с ангиографиче-
ским определением [37, 38] и количественным
допплеровским ЭхоКГ-методом [39], были обнару-
жены значительные ограничения этого подхода.
Метод площади струи регургитации, даже если она
скорригирована для полученных размеров камеры,
сильно ограничен своей зависимостью от гемодина-
мических условий [40], инструментальных устано-
вок [41] и взаимодействием струи и принимающей
камеры [42]. Соответственно, между размером
струи и выраженностью ТР существует только по-
средственная корреляция [9, 39, 43–45]. Выражен-
ность ТР также может быть недооценена при цвето-
вой допплерографии, если струя эксцентрична,
потому что размер струи может не определяться в
стандартных позициях.
Количественная оценка выраженности ТР при
цветовом допплеровском исследовании возможна
определением площади эффективного отверстия
регургитации и измерением ширины перешейка
регургитации (vena contracta). Vena contracta — это
наименьшая часть потока регургитации непосред-
ственно над областью конвергенции потока и перед
расширением турбулентной струи регургитации и
гидродинамически она соответствует площади эф-
фективного отверстия регургитации. Изображение
обычно получают из апикальной позиции с исполь-
зованием самого узкого угла сектора для оптимиза-
ции частоты смены кадров. Цветовое усиление ре-
гулируют пошагово до получения максимального
уровня цветового усиления, не добавляющего сиг-
налы от областей, внешних потоку. Если необходи-
мо, следует изменить позицию датчика для оптими-
зации визуализации области конвергенции потока
и регургитантного потока проксимальнее и дис-
тальнее ТК. При использовании увеличения (zoom)
зоны интереса визуализируется vena contracta (рис.
33.5) [45]. Измерение ширины vena contracta прово-
дят в середине систолы, при этом следует вывести
среднее значение из более чем четырех последова-
тельных сердечных циклов [45]. Ширина vena
ЛП
ПП
ТР
ЛП
ПП
АПЖ
АПЖ
ПЖ
ПЖ
ПЖ
ЛЖ
ЛЖ
ЛЖ
Рис. 33 .4 Аномалия Эбштейна. (А) Макропрепарат сердца с аномалией Эбштейна, которая характеризуется апикальным смещением септальной створки три-
куспидального клапана (острие стрелки) и различными вариантами фиксации передней створки. Между креплением септальной створки и фиброзным кольцом
находится атриализованная камера правого желудочка (АПЖ). (Б) A 2D-ЭхоКГ в апикальной четырехкамерной позиции (верхушкой вниз), ориентация соответ-
ственно макропрепарату. (В) A При цветовой допплерографии отмечается выраженная трикуспидальная регургитация (ТР) из-за сопутствующего поражения
клапана приводящая к выраженному расширению правых отделов сердца. ЛЖ — левый желудочек; ЛП — левое предсердие; ПП — правое предсердие (A —
предоставлено Dr. William D. Edwards, Department of Laboratory Medicine and Pathology, Mayo Clinic College of Medicine).
А
Б
В
In-33_для нас.indd 836
03.04.2019 12:11:10
837
33 Патология клапанов правых отделов сердца у взрослых
Р
у
к
о
в
о
д
с
т
в
о
A
H
A
/
A
C
C
п
о
с
е
р
д
е
ч
н
о
-
с
о
с
у
д
и
с
т
ы
м
з
а
б
о
л
е
в
а
н
и
я
м
:
с
т
а
д
и
и
Т
Р
с
к
л
и
н
и
ч
е
с
к
и
м
и
и
Э
х
о
К
Г
-
д
а
н
н
ы
м
и
С
т
а
д
и
я
О
п
р
е
д
е
л
е
н
и
е
А
н
а
т
о
м
и
я
к
л
а
п
а
н
а
Г
е
м
о
д
и
н
а
м
и
к
а
к
л
а
п
а
н
а
П
о
с
л
е
д
с
т
в
и
я
г
е
м
о
д
и
н
а
м
и
к
и
С
и
м
п
т
о
м
ы
А
Р
и
с
к
Т
Р
П
е
р
в
и
ч
н
а
я
–
С
л
а
б
ы
е
р
е
в
м
а
т
и
ч
е
с
к
и
е
и
з
м
е
н
е
н
и
я
–
С
л
а
б
ы
й
п
р
о
л
а
п
с
–
Д
р
у
г
о
е
(
н
а
п
р
и
м
е
р
,
И
Э
с
в
е
г
е
т
а
ц
и
-
я
м
и
,
р
а
н
н
е
е
ф
о
р
м
и
р
о
в
а
н
и
е
к
а
р
ц
и
н
о
и
д
а
,
р
а
д
и
а
ц
и
я
)
–
В
н
у
т
р
и
к
о
л
ь
ц
е
в
о
й
в
о
д
и
т
е
л
ь
р
и
т
м
а
П
Ж
и
л
и
э
л
е
к
т
р
о
д
и
м
п
л
а
н
т
и
р
о
-
в
а
н
н
о
г
о
д
е
ф
и
б
р
и
л
л
я
т
о
р
а
–
П
о
с
л
е
п
е
р
е
с
а
д
к
и
с
е
р
д
ц
а
(
с
в
я
з
а
н
о
с
б
и
о
п
с
и
е
й
)
Ф
у
н
к
ц
и
о
н
а
л
ь
н
а
я
–
Н
о
р
м
а
–
Р
а
н
н
е
е
р
а
с
ш
и
р
е
н
и
е
к
о
л
ь
ц
а
Н
е
т
и
л
и
с
л
е
д
ы
Т
Р
Н
е
т
Н
е
т
и
л
и
с
в
я
з
а
н
н
ы
е
с
д
р
у
г
и
м
с
о
с
у
д
и
с
т
ы
м
п
о
р
а
ж
е
н
и
е
м
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
и
л
и
л
е
г
о
ч
н
ы
х
с
о
с
у
д
о
в
В
П
р
о
г
р
е
с
с
и
р
у
-
ю
щ
а
я
Т
Р
П
е
р
в
и
ч
н
а
я
–
П
р
о
г
р
е
с
с
и
р
у
ю
щ
е
е
у
х
у
д
ш
е
н
и
е
с
о
с
т
о
я
н
и
я
с
т
в
о
р
о
к
/
и
х
р
а
з
р
у
ш
е
н
и
е
–
П
р
о
л
а
п
с
о
т
у
м
е
р
е
н
н
о
г
о
д
о
в
ы
р
а
ж
е
н
н
о
г
о
,
о
т
д
е
л
ь
н
ы
е
р
а
з
р
ы
в
ы
х
о
р
д
Ф
у
н
к
ц
и
о
н
а
л
ь
н
а
я
–
Р
а
н
н
е
е
р
а
с
ш
и
р
е
н
и
е
к
о
л
ь
ц
а
–
У
м
е
р
е
н
н
о
е
о
г
р
а
н
и
ч
е
н
и
е
п
о
д
в
и
ж
-
н
о
с
т
и
с
т
в
о
р
о
к
С
л
а
б
а
я
Т
Р
–
П
л
о
щ
а
д
ь
ц
е
н
т
р
а
л
ь
н
о
й
с
т
р
у
и
<
5
,
0
с
м
2
–
Ш
и
р
и
н
а
v
e
n
a
c
o
n
t
r
a
c
t
a
н
е
о
п
р
е
д
е
л
я
е
т
с
я
–
П
л
о
т
н
о
с
т
ь
и
к
о
н
т
у
р
с
т
р
у
и
п
р
и
н
е
п
р
е
-
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
:
м
я
г
к
а
я
,
п
а
р
а
б
о
л
и
ч
е
с
к
а
я
–
Т
о
к
к
р
о
в
и
в
п
е
ч
е
н
о
ч
н
о
й
в
е
н
е
:
с
и
с
т
о
л
и
ч
е
-
с
к
о
е
п
р
е
о
б
л
а
д
а
н
и
е
У
м
е
р
е
н
н
а
я
Т
Р
–
П
л
о
щ
а
д
ь
ц
е
н
т
р
а
л
ь
н
о
й
с
т
р
у
и
5
–
1
0
с
м
2
–
Ш
и
р
и
н
а
v
e
n
a
c
o
n
t
r
a
c
t
a
<
0
,
7
0
с
м
–
П
л
о
т
н
о
с
т
ь
и
к
о
н
т
у
р
с
т
р
у
и
п
р
и
н
е
п
р
е
-
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
:
п
л
о
т
н
а
я
,
р
а
з
л
и
ч
н
ы
х
ц
в
е
т
о
в
–
Т
о
к
к
р
о
в
и
в
п
е
ч
е
н
о
ч
н
о
й
в
е
н
е
:
с
и
с
т
о
л
и
ч
е
-
с
к
о
е
с
г
л
а
ж
и
в
а
н
и
е
С
л
а
б
а
я
Т
Р
–
Н
о
р
м
а
л
ь
н
ы
е
р
а
з
м
е
р
ы
П
Ж
/
П
П
/
Н
П
В
У
м
е
р
е
н
н
а
я
Т
Р
–
Н
е
т
р
а
с
ш
и
р
е
н
и
я
П
Ж
–
Н
е
т
и
л
и
с
л
а
б
о
е
р
а
с
ш
и
р
е
н
и
е
П
П
–
Н
е
т
и
л
и
с
л
а
б
о
е
р
а
с
ш
и
р
е
н
и
е
Н
П
В
с
н
о
р
м
а
л
ь
н
ы
м
и
к
о
л
е
б
а
-
н
и
я
м
и
п
р
и
д
ы
х
а
н
и
и
–
Н
о
р
м
а
л
ь
н
о
е
д
а
в
л
е
н
и
е
в
П
П
Н
е
т
и
л
и
с
в
я
з
а
н
н
ы
е
с
д
р
у
г
и
м
с
о
с
у
д
и
с
т
ы
м
п
о
р
а
ж
е
н
и
е
м
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
и
л
и
л
е
г
о
ч
н
ы
х
с
о
с
у
д
о
в
С
Б
е
с
с
и
м
п
-
т
о
м
н
а
я
:
в
ы
р
а
ж
е
н
н
а
я
Т
Р
П
е
р
в
и
ч
н
а
я
–
М
о
л
о
т
я
щ
а
я
и
л
и
в
ы
р
а
ж
е
н
н
о
и
з
м
е
н
е
н
н
а
я
с
т
в
о
р
к
а
Ф
у
н
к
ц
и
о
н
а
л
ь
н
а
я
–
В
ы
р
а
ж
е
н
н
о
е
р
а
с
ш
и
р
е
н
и
е
к
о
л
ь
ц
а
–
(
>
4
0
м
м
и
л
и
2
1
м
м
/
м
2
)
–
В
ы
р
а
ж
е
н
н
о
е
о
г
р
а
н
и
ч
е
н
и
е
п
о
д
в
и
ж
н
о
с
т
и
с
т
в
о
р
о
к
П
л
о
щ
а
д
ь
ц
е
н
т
р
а
л
ь
н
о
й
с
т
р
у
и
>
1
0
,
0
с
м
2
Ш
и
р
и
н
а
v
e
n
a
c
o
n
t
r
a
c
t
a
>
0
,
7
0
с
м
П
л
о
т
н
о
с
т
ь
и
к
о
н
т
у
р
с
т
р
у
и
п
р
и
н
е
п
р
е
р
ы
в
-
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
:
п
л
о
т
н
а
я
,
т
р
е
у
г
о
л
ь
н
а
я
с
р
а
н
н
и
м
п
и
к
о
м
Т
о
к
к
р
о
в
и
в
п
е
ч
е
н
о
ч
н
о
й
в
е
н
е
:
о
б
р
а
т
н
ы
й
с
и
с
т
о
л
и
ч
е
с
к
и
й
Р
а
с
ш
и
р
е
н
и
е
П
Ж
/
П
П
/
Н
П
В
с
о
с
н
и
ж
е
н
н
ы
м
и
к
о
л
е
б
а
н
и
я
м
и
Н
П
В
п
р
и
д
ы
х
а
н
и
и
У
в
е
л
и
ч
е
н
н
о
е
д
а
в
л
е
н
и
е
П
П
с
c
-
V
в
о
л
н
а
м
и
М
о
ж
е
т
н
а
б
л
ю
д
а
т
ь
с
я
д
и
а
с
т
о
л
и
ч
е
-
с
к
о
е
у
п
л
о
щ
е
н
и
е
м
е
ж
ж
е
л
у
д
о
ч
к
о
-
в
о
й
п
е
р
е
г
о
р
о
д
к
и
Н
е
т
и
л
и
с
в
я
з
а
н
н
ы
е
с
д
р
у
г
и
м
с
о
с
у
д
и
с
т
ы
м
п
о
р
а
ж
е
н
и
е
м
л
е
в
ы
х
о
т
д
е
л
о
в
с
е
р
д
ц
а
и
л
и
л
е
г
о
ч
н
ы
х
с
о
с
у
д
о
в
D
В
ы
р
а
ж
е
н
н
а
я
Т
Р
с
с
и
м
п
т
о
-
м
а
м
и
П
е
р
в
и
ч
н
а
я
–
М
о
л
о
т
я
щ
а
я
и
л
и
в
ы
р
а
ж
е
н
н
о
и
з
м
е
н
е
н
н
а
я
с
т
в
о
р
к
а
Ф
у
н
к
ц
и
о
н
а
л
ь
н
а
я
–
В
ы
р
а
ж
е
н
н
о
е
р
а
с
ш
и
р
е
н
и
е
к
о
л
ь
ц
а
(
>
4
0
м
м
и
л
и
2
1
м
м
/
м
2
)
–
В
ы
р
а
ж
е
н
н
о
е
о
г
р
а
н
и
ч
е
н
и
е
п
о
д
в
и
ж
-
н
о
с
т
и
с
т
в
о
р
о
к
П
л
о
щ
а
д
ь
ц
е
н
т
р
а
л
ь
н
о
й
с
т
р
у
и
>
1
0
,
0
с
м
2
Ш
и
р
и
н
а
v
e
n
a
c
o
n
t
r
a
c
t
a
>
0
,
7
0
с
м
П
л
о
т
н
о
с
т
ь
и
к
о
н
т
у
р
с
т
р
у
и
п
р
и
п
р
и
н
е
п
р
е
-
р
ы
в
н
о
-
в
о
л
н
о
в
о
й
д
о
п
п
л
е
р
о
г
р
а
ф
и
и
:
п
л
о
т
н
а
я
,
т
р
е
у
г
о
л
ь
н
а
я
с
р
а
н
н
и
м
п
и
к
о
м
Т
о
к
к
р
о
в
и
в
п
е
ч
е
н
о
ч
н
о
й
в
е
н
е
:
о
б
р
а
т
н
ы
й
с
и
с
т
о
л
и
ч
е
с
к
и
й
И
з
м
е
н
е
н
и
я
П
Ж
/
П
П
/
Н
П
В
п
р
и
д
ы
х
а
н
и
и
У
в
е
л
и
ч
е
н
н
о
е
д
а
в
л
е
н
и
е
П
П
с
c
-
V
в
о
л
н
а
м
и
Д
и
а
с
т
о
л
и
ч
е
с
к
о
е
у
п
л
о
щ
е
н
и
е
м
е
ж
ж
е
л
у
д
о
ч
к
о
в
о
й
п
е
р
е
г
о
р
о
д
к
и
С
н
и
ж
е
н
и
е
с
и
с
т
о
л
и
ч
е
с
к
о
й
ф
у
н
к
ц
и
и
П
Ж
н
а
п
о
з
д
н
и
х
с
т
а
д
и
я
х
У
т
о
м
л
я
е
м
о
с
т
ь
,
с
е
р
д
ц
е
б
и
е
н
и
е
,
о
д
ы
ш
к
а
,
в
з
д
у
т
и
е
ж
и
в
о
т
а
,
а
н
о
р
е
к
с
и
я
,
о
т
е
к
[
N
i
s
h
i
m
u
r
a
R
A
,
O
t
t
o
C
M
,
B
o
n
o
w
R
O
,
e
t
a
l
.
2
0
1
4
A
H
A
/
A
C
C
g
u
i
d
e
l
i
n
e
f
o
r
t
h
e
m
a
n
a
g
e
m
e
n
t
o
f
p
a
t
i
e
n
t
s
w
i
t
h
v
a
l
v
u
l
a
r
h
e
a
r
t
d
i
s
e
a
s
e
:
a
r
e
p
o
r
t
o
f
t
h
e
A
m
e
r
i
c
a
n
C
o
l
l
e
g
e
o
f
C
a
r
d
i
o
l
o
g
y
/
A
m
e
r
i
c
a
n
H
e
a
r
t
A
s
s
o
c
i
a
t
i
o
n
T
a
s
k
F
o
r
c
e
o
n
P
r
a
c
t
i
c
e
G
u
i
d
e
l
i
n
e
s
.
J
T
h
o
r
a
c
C
a
r
d
i
o
v
a
s
c
S
u
r
g
1
4
8
:
e
1
–
1
3
2
,
2
0
1
4
.
]
Т
А
Б
Л
И
Ц
А
3
3
.
2
С
т
а
д
и
и
т
р
и
к
у
с
п
и
д
а
л
ь
н
о
й
р
е
г
у
р
г
и
т
а
ц
и
и
In-33_для нас.indd 837
03.04.2019 12:11:11
838 ЧАСТЬ VI Правые отделы сердца
Параметр
Параметры записи
Применение/преимущества
Ограничения
Морфология три-
куспидального
клапана
Визуальная оценка
Из различных позиций
Молотящий клапан специфиче-
ский признак выраженной ТР
Другие нарушения являются не-
специфическими для выражен-
ной ТР
Диаметр кольца
трикуспидального
кольца
Апикальная четырехкамерная
позиция
От внутреннего латерального
край к перегородочному вну-
треннему краю
Дилатация — признак выра жен-
ной ТР
Дилатация может быть и при дру-
гих заболеваниях
Необходимо подтверждение при
дальнейших исследованиях
Цветовой поток
струи при ТР
Оптимизировать цветовые на-
стройки
Оценивать в двух позициях
Необходимо измерять кровяное
давление
Простота использования
Позволяет оценить ориентацию
струи при ТР в пространстве
Хороший метод скрининга для
дифференцировки слабой от
выраженной ТР
Могут быть неточности при опре-
делении выра женности ТР
Зависит от технических и гемоди-
намических факторов
Недооценивает эксцентричную
струю, прилежащую к стенке
ПЖ (эффект Коанда)
Толщина VC
Апикальная четырехкамерная
позиция
Оптимизировать цветовые на-
стройки
Найти три компонента струи
регургитации (VC, PISA, струя
в ПП)
Для увеличения частоты кадров
сузьте цветовую область и
уменьшите глубину изобра-
жения
Расширьте выбранную зону
(приближение)
Используйте кино-повтор для
определения наилучшего ка-
дра для измерения
Измерьте наименьшую VC (рас-
положенную сразу дистальнее
отверстия регургитации, пер-
пендикулярную направлению
струи)
Относительно быстрый и про-
стой
Относительно независим от гемо-
динамических и инструменталь-
ных факторов
Не зависит от утечек в других
клапанах
Хорош при большой ТР: диффе-
ренцировка слабой от выра жен-
ной степени
Может быть использован при
эксцентрической струе
Не подходит при многочисленных
струях
Малые значения; малые ошибки
в вычислениях приводят к боль-
шим ошибкам в процентах
Промежуточные значения необхо-
димо подтверждать
Подвержен воздействию систоли-
ческих изменений в струе регур-
гитации
Метод PISA
Апикальная четырехкамерная
позиция
Оптимизировать цветовое ото-
бражение потоков при ТР
Увеличить изображение трику-
спидального клапна с регурги-
тацией
Снизить предел Найквиста
(точка отсчета для цветового
потока)
С помощью продольного раз-
ложения выбрать наилучшее
изображение области
Включить и выключить цвета,
чтобы определить отверстие
сТР
Измерить радиус PISA в середи-
ну систолы, используя первое
смещение и вдоль направле-
ния ультразвукового луча
Измерить пиковую скорость ТР
и интеграл скорости кровотока
VTI (непрерывно-волновая
допплерография)
Рассчитать скорость потока,
ОЭРО, Об. Р.
Может быть использован при
эксцентрической струе
Не зависит от этиологии ТР или
утечек в других клапанах
Количественный: определяет
степень дефекта (ОЭРО) и пере-
грузки объемом (Об. Р.)
Большая конвергенция потоков
при 28 см/сек предупреждает о
выраженной ТР
На форму области PISA влияют:
–
Предел Найквиста
–
Некруглая форма отверстия
–
Систолические изменение
в регургитационном потоке
–
Прилежащие структуры
(помехи потока)
–
Ошибки при измерении ради-
уса во время вычисления PISA
возводятся в квадрат
–
Вариабельность результатов
у различных экспертов
–
Подтвержден лишь нескольки-
ми исследованиями
ТАБЛИЦА 33.3 Эхокардиографические параметры, используемые для оценки выраженности трикуспидальной регургитации
In-33_для нас.indd 838
03.04.2019 12:11:11
839
33 Патология клапанов правых отделов сердца у взрослых
Параметр
Параметры записи
Применение/преимущества
Ограничения
Вид струи ТР
при непрерыв-
но-волновой доп-
плерографии
Апикальная четырехкамерная
позиция
Простой и легкодоступный метод Качественная, дополнительная
находка
При эксцентрической струе слож-
но добиться полного сигнала
Кровоток в пече-
ночной вене
Субкостальная позиция
Контрольный объем импуль-
сно-волновой в печеночной
вене
Простой метод
Систолический обратный поток
крови является специфическим
признаком выра женной ТР
Зависит от давления в ПП, фи-
брилляции предсердий
Скорость в пике Е
Апикальная четырехкамерная
позиция
Контрольный объем импуль-
сно-волновой на кончиках
створок трикуспидального
клапана
Простой и легкодоступный метод
Обычно увеличен при выражен-
ной ТР
Зависит от давления в ПП, фи-
брилляции предсердий
Дополнительная находка
Размер предсердий
иПЖ
Предпочтительнее использовать
размеры ПЖ из апикальной
четырехкамерной позиции
Дилатация — признак хрониче-
ской выраженной ТР
Нормальные размеры почти всег-
да исключают возможность вы-
раженной хронической ТР
Дилатация наблюдается и при
других состояниях (неспецифи-
ческий признак)
Размеры сердца могут быть изме-
нены при острой выраженной ТР
EROA — площадь эффективного отверстия регургитации; VC — vena contracta; VTI — интеграл скорости кровотока; PISA — площадm
проксимальной зоны струи регуритации; Об. Р. — объем регургитации; ТР — трикуспидальная регургитация.
[Lancellotti P, Moura L, Pierard LA, et al. European Association of Echocardiography recommendations for the assessment of valvular regurgitation.
Part 2: mitral and tricuspid regurgitation (native valve disease). Eur J Echocardiogr 11:307–332, 2010.]
ТАБЛИЦА 33.3
окончание
Эхокардиографические параметры, используемые для оценки выраженности трикуспидальной регургитации
Конвергенция
потока
Vena contracta = 0,6 см
∗∗
Vena
contracta
Струя
Рис. 33 .5 Измерение vena contracta. Пример потока трикуспидальной регургитации из апикальной позиции с определением трех компонентов регургитантно-
го потока (слева) и измерением ширины vena contracta (справа; звездочки) [Tribouilloy CM, Enriquez-Sarano M, Bailey KR, et al. Quantification of tricuspid regurgitation
by measuring the width of the vena contracta with Doppler color flow imaging: a clinical study. J Am Coll Cardiol 36:472–478, 2000].
In-33_для нас.indd 839
03.04.2019 12:11:11
840
ЧАСТЬ VI Правые отделы сердца
r=0,85см
Ширина VC 7 мм
ПЖ
ПП
α=230
ЛЖ
ТРИЛС 124 см
ТРмаксимальная скорость 380 см/сек
RFLOW=(2Π×r2×Vr)×α/180
RFLOW = (6,28 × 0,852 × 40) × 230/180
RFLOW = 232 см3
ЭОР = Объем потока/Пиковая скорость MP
ЭОР = 232/380 = 0,6 см2
Рис. 33.6 Количественное измерение выраженности трикуспидальной регургитации (ТР) методом радиуса проксимальной струи регургитации.
Это изображение получено у пациента с выраженной легочной гипертензией при легочной тромбоэмболии. Струя ТР широкая, ширина vena contracta (ШVC;
верхняя левая часть, пунктирная линия) 0,7 см, что соответствует выраженной ТР. Проиллюстрирован расчет эффективного отверстия регургитации (ЭОР, ERO)
на основании допплеровских показателей, описанный в тексте. Отметьте коррекцию угла, проиллюстрированную на верхнем правом изображении. У данного па-
циента эффективное отверстие регургитации 0,6 см2, что соответствует выраженной ТР. r — радиус полусферы; ЛЖ — левый желудочек; ПЖ — правый желу-
дочек; ПП — правое предсердие.
contracta 6,5 мм и более свидетельствует о выражен-
ной ТР с чувствительностью 89% и специфично-
стью 93%. Это измерение имеет лучшую корреля-
цию с эффективным отверстием регургитации, чем
площадь струи ТР и отношение площади струи ТР
к площади ПП. На основании опубликованных ре-
комендаций по оценке ТР при размере vena contracta
> 0,7 см (в соответствии со специфичностью и по-
ложительной предсказательной ценностью) имеет-
ся выраженная ТР [3, 4, 46, 47].
Количественная допплеровская оценка также
возможна методом измерения площади формирую-
щейся струи митральной регургитации, хотя он
требует коррекции угла [4]. Цветовое допплеров-
ское изображение проксимальной конвергенции
потока ТР получают из апикальной или параапи-
кальной позиции с увеличением зоны интереса.
Положение датчика следует подобрать для миними-
зации угла между средней линией конвергенции
потока и ультразвуковым лучом. Шкалу скорости
цветового потока делают максимальной, а изоли-
нию смещают вниз до тех пор, пока четко не будет
визуализирована область конвергенции потока.
После смещения вниз цветовой изолинии измеря-
ют радиус конвергенции потока в середине систолы
и отмечают соответствующую скорость предела
Найквиста. Затем рассчитывают отношение α/180,
где — α угол перевернутой систолической воронки
ТК (измеренной очерчиванием из той же апикаль-
ной позиции) для оценки формы ТК. С этим попра-
вочным углом затем рассчитывают среднесистоли-
ческий мгновенный регургитантный поток как:
Rflow = (2π × r2 × Vr) × (α/180),
где Rflow — регургитантный поток; r — радиус;
Vr — соответствующая скорость предела Найквиста.
Площадь эффективного отверстия регургитации за-
тем рассчитывают, как
ERO = Rflow/V,
где ERO — эффективное отверстие регургитации;
V — максимальная скорость регургитации (рис.
33.6). Эффективное отверстие регургитации 0,4 см2
и более и RV 45 мл и более считаются диагностиче-
ским порогом выраженной ТР [7, 44]. Хотя метод
площади проксимальной струи регургитации яв-
ляется количественным [18], он не используется
In-33_для нас.indd 840
03.04.2019 12:11:12
841
33 Патология клапанов правых отделов сердца у взрослых
широко в клинической практике из-за того, что
требует временных затрат, технического опыта в
достижении коррекции угла и не очень хорошо
ратифицирован.
В большинстве случаев форма непрерывно-вол-
нового допплер-сигнала ТР у пациентов с менее чем
выраженной ТР параболическая. У пациентов с вы-
раженной ТР непрерывно-волновая струя регурги-
тации может иметь плотный сигнал и кинжалопо-
добную форму в результате быстрого выравнивания
давлений между ПП и ПЖ (рис. 33.7).
Вспомогательные ЭхоКГ-признаки у пациентов
с выраженной ТР включают: повышение скорости
трикуспидального притока (1 м/сек или более),
дилатацию нижней полой вены > 2 см и реверсив-
ный систолический поток в печеночных венах [4,
9, 47–49]. Практическая ценность, преимущества и
ограничения этих измерений, оценка и градация
выраженности ТР суммированы в табл. 33 .2, 33.3
[4, 35].
Следует отметить динамические изменения вы-
раженности ТР при дыхании. Происходят большие
дыхательные вариации ТР с поразительным увели-
чением на вдохе vena contracta, эффективного отвер-
стия регургитации и RV. Это происходит главным
образом в результате выраженной пластичности
ПЖ, его расширения на вдохе, что ведет к увеличе-
нию фиброзного кольца и его меньшему систоли-
ческому прикрытию створками ТК, увеличенное
натяжение клапана также делает вклад в плохую
коаптацию. Таким образом, при количественной
оценке выраженности ТР следует иметь в виду
большие дыхательные вариации, избегать измере-
ния наибольших значений и обеспечивать измере-
ния, включающие более чем полный дыхательный
цикл (рис. 33 .8) [9].
Также, выраженность ТР может быть трудна для
оценки или недооцениваться при ЧПЭхоКГ из-за
ограниченного выбора позиций и субоптимального
выравнивания угла при допплерографии.
A
D
S
Рис. 33 .7 Допплеровские данные при небольшой и выраженной трикуспидальной регургитации. (A) Непрерывно-волновая допплерография потока
через трикуспидальный клапан (ТК) демонстрирует низкоскоростную систолическую струю (2 м/сек) с симметрично закругленными границами, что соответствует
небольшой регургитации на ТК. Измерение максимальной систолической скорости дает непрямую оценку систолического давления в ПЖ с помощью модифици-
рованного уравнения Бернулли. (Б) Импульсно-волновой допплеровский сигнал в печеночной вене в сочетании с электрокардиографической кривой демонстри-
рует нормальный поток в печеночной вене у данного пациента с небольшой трикуспидальной регургитацией. Видны систолический (S) и диастолический (D) по-
токи из печеночной вены в нижнюю полую вену (поток обнаруживается ниже базовой линии) и предсердный реверсивный поток (A), представляющий нормальный
рефлюкс потока в печеночные вены в результате сокращения предсердия. (В) Плотный систолический сигнал при непрерывно-волновой допплерографии у паци-
ента с выраженной трикуспидальной регургитацией. При выраженной трикуспидальной регургитации форма струи регургитации треугольная или «кинжаловидная»
с ранним пиком (острия стрелок) в результате раннего выравнивания давлений между ПП и ПЖ. (Г) Импульсно-волновой допплеровский сигнал потока в пече-
ночной вене демонстрирует как предсердный (острие), так и систолический реверсивные потоки (острия), свидетельствуя о повышении давления в ПП и выра-
женной трикуспидальной регургитации у пациента с синусовым ритмом. Этот систолический реверс отражает ретроградный поток в печеночных венах, который
может быть определен клинически как пульсация печени. Систолический реверс печеночных вен может не быть специфичным для выраженной трикуспидальной
регургитации, если имеется фибрилляция предсердий.
А
Б
Г
В
In-33_для нас.indd 841
03.04.2019 12:11:13
842
ЧАСТЬ VI Правые отделы сердца
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ И ИСХОДЫ
Выраженная ТР оказывает значительный эффект на
клинический исход и выживание. В табл. 33 .2 пере-
числены стадии (от А до D) первичной и функцио-
нальной ТР в соответствии с протоколами по забо-
леванием клапанов сердца, разработанных АСС/
AHA [3]. Пациенты с выраженной ТР (стадия D)
имеют значительное снижение объема физической
активности в результате нарушения ответа СВ [50].
ТР также негативно влияет на долговременное вы-
живание, что было отмечено у пациентов с МС
после чрескожной баллонной митральной вальву-
лопластики [51] и в ретроспективном исследовании
> 5 тыс. пациентов, у которых повышение выра-
женности ТР ассоциировалось с худшим выжива-
нием независимо от фракции выброса (ФВ) ЛЖ или
давления в ЛА. Более того, выраженная ТР ассоци-
ировалась с плохим прогнозом независимо от воз-
раста, систолической функции обоих желудочков и
размеров ПЖ (рис. 33 .9) [52].
Независимое влияние ТР на прогноз было оце-
нено D. Messika-Zeitoun и соавт. [16]. Они описали
исход молотящих створок ТК у пациентов, наблю-
давшихся в клинике Mayo более чем за 20-летний
Трикуспидальная
регургитация
Вдох
Поток = 121 мл/сек
ЭРО = 0,42 см2
Поток = 58 мл/сек
ЭРО = 0,18 см2
R=0,91см
R=0,63см
Скорость ТР = 289 см/сек
Скорость ТР = 331 см/сек
Выдох
0
Выраженная ТР
Небольшая ТР
Нет ТР
Умеренная ТР
100
В
ы
ж
и
в
а
е
м
о
с
т
ь
300
4106 3158 2298 1591 1043 573 183
500 700 900 1100 1300 1500
Количество пациентов в группе риска
Дни
p < 0,0001
0,0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,0
Рис. 33 .8 Метод конвергенции проксимального потока: влияние дыхания на выраженность трикуспидальной регургитации (ТР). Пример количе-
ственного измерения трикуспидальной регургитации на вдохе и выдохе. Показаны измерения регургитации потока с помощью метода конвергенции потока
(вверху) и максимальной скорости с помощью непрерывно-волновой допплерографии (внизу) с расчетом площади эффективного отверстия регургитации (ЭРО)
на вдохе (слева) и выдохе (справа). Дыхательная кривая поднимается на вдохе и опускается на выдохе. Во время вдоха максимальная скорость снижается, ре-
гургитантный поток увеличивается и эффективное отверстие регургитации значительно увеличивается [Topilsky Y, Tribouillov C, Michelena HI, et al. Pathophysiology
of tricuspid regurgitation: quantitative Doppler echocardiographic assessment of respiratory dependence. Circulation 122:1505–1513, 2010].
Рис. 33.9 Кривые выживаемости Каплана–Мейера для всех пациентов
с трикуспидальной регургитацией. Выживаемость значительно хуже у
пациентов с умеренной и выраженной трикуспидальной регургитацией (ТР)
[Sagie A, Schwammenthal E, Newell J, et al. Significant tricuspid regurgitation is a
marker for adverse outcome in patients undergoing percutaneous balloon mitral
valvuloplasty, J Am Coll Cardiol 24:696–702, 1994].
In-33_для нас.indd 842
03.04.2019 12:11:14
843
33 Патология клапанов правых отделов сердца у взрослых
период [16]. 60 пациентов с молотящим ТК были
разделены на три группы в зависимости от симпто-
мов и сопутствующих сердечно-сосудистых заболе-
ваний. Половина пациентов подверглись оператив-
ному вмешательству (27 — пластике и 6 — замене
ТК). Естественное течение ТР из-за молотящих
створок без сопутствующих сердечно-сосудистых
заболеваний показало повышение риска ФП, небла-
гоприятных симптомов, СН, операций и смерти
(рис. 33 .10). Симптоматическое улучшение было
отмечено у 88% пациентов, перенесших операцию.
Уровень долговременного выживания без операции
у пациентов с ТР в результате молотящих створок
по сравнению с ожидаемым уровнем выживания у
попарно подобранной популяции США показал
превышение смертности (4,5%; P < 0,01). В этих
исследованиях заслуживает внимания влияние уве-
личения правых камер сердца у пациентов с выра-
женной ТР, даже у не имеющих симптоматики.
Клинический исход, стратифицированный в соот-
ветствии со степенью увеличения правых камер
сердца, показал значимые различия в неблагопри-
ятных событиях при наличии выраженного увели-
чения правых камер сердца (рис. 33.11). Также было
отмечено повышение заболеваемости при увеличе-
нии правых отделов сердца даже у бессимптомных
пациентов. Риск операции по пластике или замене
ТК для этих пациентов низок, и можно рассчиты-
вать на симптоматическое улучшение. К сожале-
нию, даже после успешного восстановления сохра-
няется риск аритмии, поскольку операции в боль-
шинстве случаев выполняются на далеко зашедшей
стадии.
Клинический статус пациента и причина пора-
жения ТК обычно определяют соответствующую
терапевтическую стратегию (табл. 33 .4; рис. 33.12)
[3]. Если обнаружена причина, которую можно ис-
править, ее лечат в первую очередь, если это воз-
можно.
Эффективное лечение симптоматической регур-
гитации ТК демонстрирует только хирургия ТК. В
институте авторов, где исходы операций по поводу
болезней ТК превосходны, пластика или замена ТК
рекомендуется пациентам с выраженной ТР и с лю-
бым нижеперечисленным условием:
1. Симптомами снижения СВ, снижающейся спо-
собностью переносить физическую нагрузку или
рефрактерной к терапии правосердечной недо-
статочностью.
2. Патологией МК или другими болезнями сердца,
при которых необходима операция.
3. Прогрессивным увеличением или дисфункцией
ПЖ.
4. Некоторым бессимптомным пациентам, таким
как пациенты с посттравматическим молотящим
ТК с выраженной ТР.
Оперативное лечение также рекомендуется па-
циентам с умеренной и более ТР, которым плани-
руются другие операции на сердце. Рекомендации
2014 г. ACC/AHA в отношении выбора времени
пластики или замены ТК и аналогичные рекомен-
дации ESC 2012 г. обобщены в табл. 33 .4, 33.5 и на
рис. 33 .12 [3, 47]. Предикторы долговременного
исхода после замены ТК по поводу выраженной ТР
включают шкалу заболеваемости Charlson, выра-
0
0
20
40
60
80
100
ФП
69±9
56±11
34±12
Симптомы или ХСН
Симптомы или ХСН, ФП , операция или смерть
С
о
б
ы
т
и
я
(
%
)
Лет после обнаружения молотящего трикуспидального клапана
3456789101112131415
12
0
0
20
40
60
86±9
39±11
80
Степень увеличения
100
С
о
б
ы
т
и
я
(
%
)
12345
Невыраженное увеличение правых камер сердца
Значительное увеличение правых отделов сердца
Рис. 33.10 Исходы при выраженной трикуспидальной регургитации
вследствие молотящих створок. Кривые Каплана–Мейера отображают
частоту появления новых фибрилляций предсердий (ФП) (2,8% ежегодно):
симптомы класса III или IV, или симптомы хронической сердечной недостаточ-
ности (ХСН) (4,4% ежегодно); комплексный конечный показатель в исследова-
нии и первое проявление симптомов или сердечной недостаточности, новых
ФП, операций на ТК или смерти (6,5% в год) [Messika-Zeitoun D, Thomson H,
Bellamy M, et al. Medical and surgical outcome of tricuspid regurgitation caused
by flail leaflets, J Thorac Cardiovasc Surg 128:296–302, 2004].
Рис. 33 .11 Исходы у пациентов с выраженной трикуспидальной ре-
гургитацией в зависимости от степени увеличения правых отделов
сердца. Кривые Каплана–Мейера отображают частоту комплексных конечных
точек исследуемых симптомов или сердечной недостаточности, новых фи-
брилляций предсердий, операций на сердце или смерти у пациентов с первич-
ным консервативным ведением. Отметьте, что пациенты с выраженной трику-
спидальной регургитацией вследствие высокой скоростью створок и выражен-
ным увеличением правых камер сердца имеют б2ольшую частоту событий
[Messika-Zeitoun D, Thomson H, Bellamy M, et al. Medical and surgical outcome
of tricuspid regurgitation caused by flail leaflets, J Thorac Cardiovasc Surg 128:296–
302, 2004].
In-33_для нас.indd 843
03.04.2019 12:11:14
844
ЧАСТЬ VI Правые отделы сердца
Трикуспидальная регургитация: медикаментозная терапия
Рекомендации
Класс† Уровень£
Диуретики целесообразны у пациентов с выраженной ТР и признаками правосторонней СН (стадия D) IIa
C
У пациентов с выраженной функциональной ТР следует задуматься о применении терапии, направ-
ленной на снижение повышенного давления в ЛА или уменьшении сопротивления легочных сосудов
(стадия С и D)
IIb
C
Трикуспидальная регургитация: вмешательства
Рекомендации
КР
УД
Хирургическое вмешательство на трикуспидальном клапане рекомендовано пациентам с выра женной
ТР (стадии С и D) и подвергающимся операции на клапанах левых отделов сердца
IC
Восстановление трикуспидального клапана может принести пользу пациентам со слабой, умеренной и
более выраженной ТР (стадия В) во время операции на клапанах левых отделов сердца при: 1) дилата-
ции кольца трикуспидального клапана или 2) сведений о ранее имевшейся правосторонней СН
IIa
B
Хирургическое вмешательство на трикуспидальном клапане может принести пользу пациентам с
симптомами, обусловленными выраженной первичной ТР, которые не поддаются медикаментозной
терапии (стадия D)
IIa
C
Можно думать о восстановлении трикуспидального клапана у пациентов с умеренной функциональ-
ной ТР (стадия В) и гипертензией в ЛА, подвергающихся операции на клапанах левых отделов сердца
IIb
C
Можно думать о хирургическом вмешательстве на трикуспидальном клапане у пациентов без или с
минимальными симптомами и выраженной первичной ТР (стадия С), и прогрессирующими стадия-
ми умеренной, или более выраженной, дилатации ПЖ, или систолической дисфункции
IIb
C
У пациентов, перенесших операцию на клапанах левой стороны сердца и не имеющих выраженной
легочной гипертензии или систолической дисфункции ПЖ, при персистирующих симптомах, свя-
занных с выра женной ТР (стадия D), может быть целесообразна реоперация для изолированного вос-
становления трикуспидального клапана или его замены
IIb
C
* Стадии ТР представлены в табл. 33.2.
† Рекомендации класса I: польза >>> риск; процедура/терапия должна быть проведена/назначена. Рекомендации класса IIa: польза >> риск;
необходимы дополнительные исследования; процедуру/терапию целесообразно провести/назначить. Рекомендации класса IIb: польза
≥ риск; необходимы дополнительные более широкие исследования; могут быть полезны дополнительные данные; возможность проце-
дуры/терапии следует принять во внимание. Рекомендации класса III: нет пользы или вреда.
£ Уровень доказательности A: данные получены в результате многочисленных рандомизированных клинических испытаний или метаана-
лиза; оценка проводилась на большой группе людей. Уровень доказательности B: данные получены в результате одного рандомизиро-
ванного испытания или нерандомизированных исследований; оценка ограниченной группы людей. Уровень доказательности C: согла-
сованное мнение экспертов, описание случаев или стандарты оказания медицинской помощи; исследование на очень небольшой группе
людей.
КР — класс рекомендаций; ЛА — легочная артерия; СН — сердечная недостаточность; ТР — трикуспидальная регургитация; УД — уровень
доказательности.
[Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the
American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc Surg 148:e1–132, 2014.]
ТАБЛИЦА 33.4 Рекомендации по ведению пациентов с поражениями клапанов сердца ACC/AHA 2014 г.*
женность симптомов и индекс работы миокарда
ПЖ [9].
Раннее хирургическое вмешательство следует
выбирать для пациентов с выраженной ТР в резуль-
тате тупой травмы грудной клетки, поскольку дол-
говременный прогноз молотящих створок ТК пло-
хой [16], а вероятность восстановления велика.
Когда выраженная симптоматическая ТР является
результатом перфорации или смещения створок
электродами пейсмекера, их смена или репозиция
могут уменьшить степень ТР [53]. Если смена или
репозиция невозможны, следует выполнить пла-
стику или замену ТК [15].
При карциноидной болезни сердца наилучшее
лечение для влияния на благоприятный прогноз
выживаемости пациента — операция с заменой кла-
пана [26]. Показания для операции включают про-
грессирование симптомов и сердечной недостаточ-
ности правых отделов сердца. Бессимптомные па-
циенты с выраженной карциноидной болезнью
сердца могут нуждаться в замене клапана для воз-
можности проведения частичной резекции печени
или пересадки печени.
У пациентов с выраженной ТР в результате ле-
гочной гипертензии, связанной с легочной тромбо-
эмболией, изолированная легочная тромбэндар-
In-33_для нас.indd 844
03.04.2019 12:11:15
845
33 Патология клапанов правых отделов сердца у взрослых
терэктомия продемонстрировала снижение легоч-
ной гипертензии; обычно она уменьшает ТР без
необходимости сопутствующей аннулопластики
ТК, даже если имеется дилатация трикуспидального
кольца [54]. Напротив, ТР в результате тяжелой
первичной легочной гипертензии, как правило,
изолированно лечится легочными вазодилататора-
ми и диуретиками из-за высокого риска заболевае-
мости и смертности, связанных с заменой клапана,
и плохим общим прогнозом.
Руководство по болезням клапанов сердца ACC/
AHA 2014 рекомендует аннулопластику ТК при опе-
рациях на клапанах левых отделов сердца, если три-
куспидальное кольцо расширено (> 40 мм или
> 21 мм/м2), даже если имеется лишь небольшая ТР
[3]. Интересно, что большое число исследований,
основанных на наблюдениях, документально под-
тверждают уменьшение выраженности ТР при чре-
скожной баллонной митральной вальвулопластике,
проведенной у пациентов с МС, высокой легочной
гипертензией и значительной функциональной ТР
[55, 56]. Тем не менее у пациентов с выраженной
функциональной ТР пластика ТК совместно с заме-
ной МК лучше, чем изолированная чрескожная
баллонная митральная вальвулопластика, особенно
если имеется ФП или увеличение ПЖ [57].
К сожалению, у пациентов, которые ранее под-
верглись операциям по поводу болезней клапанов
левых отделов сердца и у которых впоследствии
проявилась симптоматическая выраженная ТР, пло-
хие перспективы. У этих пациентов может быть
проведено повторное хирургическое вмешатель-
ство специально по поводу ТР с допустимым пока-
зателем ранней смертности (8,8%). У выживших
можно ожидать значительное симптоматическое
улучшение. Однако показатель поздней смертно-
сти, спрогнозированный по возрасту и числу пред-
шествующих операций на сердце, остается высоким
(показатель бессобытийной выживаемости 41,6 ±
9,2%) [58]. Было показано, что видеоуправляемые
эндоскопические малоинвазивные операции для
коррекции болезней предсердно-желудочковых
клапанов после предшествующих операций на
сердце не только осуществимы, но также являются
окончательными с меньшей, чем предсказывалось,
смертностью. Тем самым они обеспечивают лече-
ние таких пациентов и являются альтернативой
стандартным повторным операциям на открытом
сердце [59]. Изучалось также применение транска-
тетерных вмешательств у пациентов с высоким
хирургическим риском. Через катетер клапаны рас-
полагались либо на месте нативного ТК [60], либо у
полых вен [61, 62], а восстановление ТК происходи-
ло с помощью проволоки, стягивающей заднюю
часть кольца или восстановлением «край в край» с
помощью скоб [63, 64].
Показания для хирургического вмешательства
при трикуспидальной регургитации
Трикуспидальная
регургитация
Класс I
Класс IIa
Класс IIb
Прогрессирующая
функциональная ТР
(стадия В)
Расширение
трикуспидального
кольца*
Легочная гипертензия
новорожденных
без расширения
трикуспидального
кольца
Восстановление
ТК (IIa)
Восстановление
или замена
ТК (IIa)
Восстановление
ТК (IIb)
Восстановление
или замена
ТК (I)
Восстановление
или замена
ТК (I)
Восстановление или замена
ТК (IIb)
Функциональная
Функциональная
Первичная
Первичная
Повторная операция
Симптоматическая
выраженная ТР
(стадия D)
Умеренная
Легкая
При левосторонней
клапанной
операции
При левосторонней
клапанной
операции
Прогрессирующая
дисфункция
ПЖ
Сохранная
функция ПЖ,
невыраженная
легочная
гипертензия
новорожденных
Асимптоматическая
выраженная
ТР (стадия С)
При левосторонней
клапанной
операции
Рис. 33.12 Показания для хирургического вмешательства при трикуспидальной регургитации. Класс рекомендаций показан в табл. 33 .4 . Стадии — в
табл. 33 .2 . ТР — трикуспидальная регургитация; ТК — трикуспидальный клапан [Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management
of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc
Surg 148:e1–e132, 2014].
In-33_для нас.indd 845
03.04.2019 12:11:15
846
ЧАСТЬ VI Правые отделы сердца
Класс*
Уровень†
Хирургическое вмешательство показано пациентам с симптомами выраженного ТС£
IС
Хирургическое вмешательство показано пациентам с выра женным ТС, подвергающимся вмешатель-
ству на клапанах левых отделов сердца§
IС
Хирургическое вмешательство показано пациентам с выра женной первичной или вторичной ТР,
подвергающимся вмешательству на клапанах левых отделов сердца
IС
Хирургическое вмешательство показано пациентам с симптомами выраженной изолированной пер-
вичной ТР без выраженной дисфункции ПЖ
IС
Следует думать о хирургическом вмешательстве у пациентов с умеренной первичной ТР, подвергаю-
щимся вмешательству на клапанах левых отделов сердца
IIa
С
Следует думать о хирургическом вмешательстве у пациентов со слабой или умеренной вторичной
ТР и расширенным кольцом (≥ 40 мм или > 21 мм/м2), подвергающимся вмешательству на клапа-
нах левых отделов сердца
IIa
С
Следует думать о хирургическом вмешательстве у пациентов без или со слабо выра женными сим-
птомами, страдающих от выраженной изолированной первичной ТР и прогрессирующей дилата-
ции ПЖ или ухудшения функции ПЖ
IIa
С
После хирургического вмешательства на клапанах левых отделов сердца, следует думать об операции
у пациентов с выра женной ТР, которые обладают симптомами или у которых прогрессирует дила-
тация или дисфункция ПЖ, в отсутствие нарушений функции клапанного аппарата слева, выра-
женной дисфункции ПЖ или ЛЖ и выраженном пора жении легочных сосудов
IIa
С
*
Рекомендации класса I: доказательства и/или общее согласие, что вмешательство благоприятно, полезно и эффективно. Рекомендации
класса II: противоречивые данные и/или расхождение мнений о пользе/эффективности вмешательства или лечения. Рекомендации
класса IIa: совокупность доказательств/мнений в пользу пользы/эффективности вмешательства. Рекомендации класса IIb: о пользе/
эффективности меньше доказательств/мнений. Рекомендации класса III: доказательства или общее согласие, что вмешательство не
является полезным или эффективным, а в некоторых случаях может быть опасным.
† Уровень доказательности A: данные получены в результате многочисленных рандомизированных клинических испытаний или метаа-
нализа. Уровень доказательности B: данные получены в результате одного рандомизированного испытания или большого количества
нерандомизированных исследований. Уровень доказательности C: согласованное мнение экспертов и/или исследования на небольших
группах, ретроспективные исследования или регистры.
£ Чреcкожная баллонная вальвулопластика может быть предпринята в качестве первого подхода при изолированном ТС.
§ Чреcкожная баллонная вальвулопластика может быть предпринята, если на митральном клапане может быть выполнена ЧМК в качестве
первого подхода при изолированном ТС.
ЛЖ — левый желудочек; ПЖ — правый желудочек; ТР — трикуспидальная регургитация; ТС — трикуспидальный стеноз; ЧМК — чрес-
кожная митральная комиссуротомия.
[Vahanian A, Baumgartner H, Bax J, et al. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular
Heart Disease of the European Society of Cardiology. Eur Heart J 28:230–268, 2007.]
ТАБЛИЦА 33.5 Трикуспидальная регургитация: показания к хирургическому вмешательству при болезнях трикуспидального
клапана (Европейские рекомендации 2012 г.)
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ
В отношении оценки ТР с помощью ЧПЭхоКГ су-
ществуют ограничения. ТК плохо визуализируется
при ЧПЭхоКГ, главным образом из-за его передне-
го расположения вдали от датчика и, в частности,
из-за тонкости его створок. Также выраженность ТР
может быть трудно определить, или она может быть
недооценена при ЧПЭхоКГ с допплеровским иссле-
дованием из-за ограничения доступных позиций и
субоптимального выравнивания угла. Эти прису-
щие методу ограничения вряд ли будут преодолены
в будущем.
Хотя ЭхоКГ в 3D-режиме теоретически позволит
обойти много ограничений, связанных с ЭхоКГ в
2D-режиме. Например, одновременное отображе-
ние всех трех створок. Или позволит более точно
оценить максимальные размеры и пространствен-
ную геометрию седловидного трикуспидального
кольца. Нет доказательств, что оценка в 3D-режиме
приводит к лучшему выбору пациентов для опера-
тивных вмешательств и улучшает хирургические
исходы. Другие препятствия, связанные с внедрени-
ем ЭхоКГ-оценки в 3D-режиме, включают: отсут-
ствие стандартизованных измерений и специаль-
ных компьютерных программ для облегчения ана-
лиза трикуспидального кольца и створок. И наконец,
в будущем ЭхоКГ в 3D-режиме реального времени
может быть использована для контроля при прове-
дении транскатетерных вмешательств для лечения
ТР.
ТРИКУСПИДАЛЬНЫЙ СТЕНОЗ
ИСТОРИЯ ВОПРОСА
В развитых странах трикуспидальный стеноз (ТС) —
исключительно редкое клиническое состояние, в
частности из-за того, что примерно в 90% случаев в
его основе лежит ревматическая болезнь сердца.
In-33_для нас.indd 846
03.04.2019 12:11:15
847
33 Патология клапанов правых отделов сердца у взрослых
Причем среди пациентов с ревматической болезнью
МК лишь 3–5% имеют сопутствующий ТС [65, 66].
К редким причинам ТС относятся: карциноидная
болезнь сердца [67], врожденные аномалии, инфек-
ционный эндокардит с большими (часто грибковы-
ми) вегетациями и болезнь Виппла [68]. Миксома
ПП может проявляться признаками и симптомами,
имитирующими обструкцию на уровне ТК (табл.
33.6).
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЕ ПОДХОДЫ
ЭхоКГ не дает возможности окончательной диагно-
стики выраженности ТС и раскрытия его этиологии.
Степень поражения количественно оценивается с
помощью НВД определением среднего градиента и
площади клапана при стенозе клапана.
Ревматическое поражение ТК параллельно изме-
нениям, видимым при ревматической болезни МК,
включает расплавление комиссур и диастолическое
куполообразное выбухание с утолщением и укоро-
чением хорд ТК. По данным ЭхоКГ признаки могут
быть слабо выраженными, таким образом, пораже-
ние ТК может быть не замечено, если не будет уде-
лено специальное внимание анатомии и движению
ТК у пациентов с ревматической болезнью МК.
ТЕХНИЧЕСКИЕ ДЕТАЛИ, КОЛИЧЕСТВЕННАЯ ОЦЕНКА
И АНАЛИЗ ДАННЫХ
Оценка степени ТС включает расчет двух факторов:
1. Среднего градиента давления во время обеих фаз
дыхания;
2. Площади клапана по времени градиента давле-
ния (предполагаемая постоянная для определе-
ния площади ТК — 190) [7, 69].
В отличие от оценки МС изображение в 2D-ре-
жиме отверстия ТК по короткой оси редко осуще-
ствимо.
Трикуспидальный стеноз (ТС) считается выра-
женным, когда средний градиент составляет 5 мм
рт. ст. или более и время полуспада 190 мсек или
более, а площадь клапана составляет 1,0 см2 и менее
[3, 7]. С ним также связаны расширение ПП и ниж-
ней полой вены.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ, ДАННЫЕ ИСХОДОВ
Консервативное лечение при выраженном ТС обыч-
но неэффективно, поскольку диурез для снижения
системной венозной перегрузки кроме того умень-
шает и СВ; таким образом, настоятельно рекомен-
дуется операция. Если имеется ФП, важен контроль
частоты сокращения желудочков для обеспечения
диастолического наполнения. ТС, требующий опе-
ративного вмешательства, наиболее часто является
результатом ревматической болезни сердца и лучше
всего лечится с помощью замены клапана (табл.
33.7) [3, 47].
Баллонная вальвулотомия ТК рекомендуется при
ТС различной этиологии. Однако частым осложне-
нием этой процедуры является выраженная ТР, и
результаты при ее развитии плохие [3, 70, 71].
ДОПОЛНИТЕЛЬНЫЕ ПОДХОДЫ
ТС может быть оценен при катетеризации с измере-
нием чресклапанного градиента давления и расчета
площади клапана, но она редко бывает необходима
из-за простоты и точности ЭхоКГ-оценки [72–74].
СТЕНОЗ ЛЕГОЧНОГО КЛАПАНА
ИСТОРИЯ ВОПРОСА
Легочной клапан — это полулунный клапан с тремя
створками (передней, левой и правой); обычно он
расположен спереди, слева и чуть выше аортально-
го клапана. Как правило, размеры колец легочного
и аортального клапана совпадают. Легочной клапан
продолжает мышечный путь оттока из ПЖ и, в от-
Ревматические болезни сердца
Врожденный стеноз трикуспидального клапана
Опухоли правого предсердия
Карциноидная болезнь сердца
Эндомиокардиальныйй фиброз
Вегетации клапанов
Опухоли внесердечной локализации
ТАБЛИЦА 33.6 Причины стеноза трикуспидального
клапана
Рекомендации
КР* УД*
Оперативное вмешательство на ТК рекомен-
довано для пациентов с выра женным ТС,
подвергающихся вмешательству на клапанах
левых отделов сердца
IC
Оперативное вмешательство на ТК
рекомендовано для пациентов с
изолированным, симптоматически
выраженным ТС
IC
У пациентов с изолированным,
симптоматически выраженным ТС без
сопутствующей ТР можно думать о
чрескожной баллонной трикуспидальной
комиссуротомии
IIb C
* См. табл. 33 .4 для определений КР и УД.
КР — класс рекомендации; ТС— трикуспидальный стеноз; УД —
уровень доказательности.
[Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline
for the management of patients with valvular heart disease: a report of
the American College of Cardiology/American Heart Association Task
Force on Practice Guidelines. J Thorac Cardiovasc Surg 148:e1–132,
2014.]
ТАБЛИЦА 33.7
Рекомендации ACC/AHA 2014 г.
по вмешательствам у пациентов
с трикуспидальным стенозом
In-33_для нас.indd 847
03.04.2019 12:11:15
848
ЧАСТЬ VI Правые отделы сердца
личие от левой стороны сердца, тут нет связи между
трикуспидальными створками и полулунным кла-
паном — это уникальная черта ПЖ.
Клапанный ЛС обычно является изолированным
врожденным или генетическим нарушением, со-
ставляя от 80 до 90% врожденных обструкций вы-
носящего тракта ПЖ при отсутствии других соче-
танных врожденных пороков сердца (ВПС).
Патологический легочный клапан можно клас-
сифицировать как бескомиссуральный, уникомис-
суральный, двухстворчатый или диспластичный
(рис. 33 .13). Карциноидная болезнь сердца и ревма-
тическая болезнь клапанов могут сочетаться с ЛС;
при обоих состояниях в большинстве случаев ЛС
обнаруживают в сочетании с ЛР и вовлечением три-
куспидального либо других клапанов.
Пациенты с легким или умеренным ЛС бессим-
птомны; у них имеется минимальное прогрессиро-
вание болезни и превосходный прогноз. Аускульта-
тивные данные при ЛС включают: тон легочного
выброса, который уменьшается по интенсивности
на вдохе, и шум легочного выброса, который увели-
чивается на вдохе. ЭКГ при легком и умеренном ЛС
в норме [75].
Выраженный ЛС может быть бессимптомным
или вызывать слабость и диспноэ. Системное или
супрасистемное давление в ЛЖ в результате ЛС мо-
жет приводить к снижению переносимости физиче-
ских нагрузок, головокружению при напряжении,
синкопе и иногда к недостаточности правых отделов
сердца [75]. При выраженном ЛС часто отмечаются
волна «а» при обследовании яремных вен и толчок
ПЖ. Выслушивается систолический шум легочного
выброса, и его можно пропальпировать на левой
верхней границе грудины с радиацией на шею. С
увеличением выраженности ЛС щелчок выброса
смещается ближе к первому сердечному тону и
иногда исчезает; второй сердечный тон становится
широко расщепленным. Может выслушиваться
четвертый сердечный тон правых отделов сердца.
ЭКГ при выраженном ЛС характеризуется увели-
чением ПП, отклонением оси вправо, гипертрофи-
ей ПЖ и признаками перегрузки ПЖ. На рентгено-
грамме грудной клетки могут отмечаться дилатация
ствола и, особенно, левой ЛА, ослабление сосуди-
стого рисунка легких и, иногда, кальцификация
легочного клапана.
Врожденный диспластический легочной клапан
с ЛС, неправильные черты лица и изменение интел-
лекта являются признаками синдрома Нунан — ау-
тосомно-доминантного расстройства с различной
пенетрантностью.
Рис. 33 .13 Врожденные болезни легочного клапана. Патологический легочный клапан можно классифицировать как бескомиссуральный (A) с куполообраз-
ным систолическим выбуханием створок клапана и эксцентрическим отверстием; уникомиссуральный (Б); двухстворчатый со сращенными комиссурами (В) или
диспластичный (Г) с выраженным утолщением и деформацией створок клапана [Dr. William D. Edwards, Department of Laboratory Medicine and Pathology, Mayo
Clinic College of Medicine. With permission, from Otto CM, Bonow RO: Valvular heart disease, ed 3. Philadelphia, 2009, WB Saunders].
А
Б
Г
В
In-33_для нас.indd 848
03.04.2019 12:11:15
849
33 Патология клапанов правых отделов сердца у взрослых
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЕ ПОДХОДЫ
ТТЭхоКГ является диагностическим методом выбо-
ра для первоначального диагноза и последующего
наблюдения при ЛС [75]. ЭхоКГ-обследование сле-
дует тем же основным принципам, как и при оцен-
ке АС (см. главу 15), и не только подтверждает на-
личие и выраженность ЛС, но также должно давать
важную информацию в отношении его причины.
Неинвазивная оценка давления в ПЖ и оценка раз-
меров и функции ПЖ — основные компоненты
ЭхоКГ-обследования, необходимые для определе-
ния тактики лечения.
ТЕХНИЧЕСКИЕ ДЕТАЛИ, КОЛИЧЕСТВЕННАЯ ОЦЕНКА
И АНАЛИЗ ДАННЫХ
Двухмерная ЭхоКГ демонстрирует утолщенные
края легочного клапана с систолическим куполоо-
бразным выбуханием и сниженную подвижность
створок, что обычно лучше определяется из парас-
тернальной, субкостальной (рис. 33 .14) и иногда из
развернутой вперед апикальной позиций. Также
при ЭхоКГ в 2D-режиме может отмечаться наличие
подклапанной, кольцевой или надклапанной об-
струкции.
Толщина стенок и функция ПЖ обеспечивают
косвенную оценку степени ЛС и адаптации ПЖ к
перегрузке давлением. Может стать выраженным
постстенотическое расширение ЛА, но степень рас-
ширения не связана с выраженностью ЛС.
Выраженность ЛС определяется с помощью НВД
по максимальной скорости и пиковому и среднему
градиенту потока через клапан. Профиль НВД при
ЛС схож с допплеровским сигналом при аорталь-
ном стенозе, но лучше обнаруживается из левого
верхнего парастернального или субкостального до-
ступа. Как правило, при ЛС отмечают наибольший
моментальный градиент потока [76] и исторически
он используется для определения времени вмеша-
тельства, как и указано в протоколах [77]. Сегодня
установлено, что с помощью этой методики выра-
женность ЛС переоценивалась. Средний градиент
ЛС лучше коррелирует с полученными катетериза-
цией межпиковыми градиентами, чем пиковый
моментальный градиент [78]. В конечном счете при
решении вопроса о необходимости вмешательства
важна корреляция эхокардиографических доппле-
ровских градиентов с другими клиническими дан-
ными [77].
Следует проводить ПВД-исследование скорости
через легочное кольцо; если проксимальная ско-
рость > 1 м/сек, используется модифицированное
уравнение Бернулли:
ΔP=4(V22−V1
2)
для расчета максимального моментального гради-
ента.
При оценке выраженности ЛС важна интеграция
всех доступных эхокардиографических допплеров-
ских данных, потому что пиковый и средний гради-
енты могут быть ниже у пациентов с выраженным
ЛС и сниженной функцией ПЖ, сниженным СВ и
выраженной ТР, что потенциально может вести к
недооценке выраженности ЛС.
ПЖ
ЛЖ
Рис. 33 .14 Выраженный стеноз клапанов легочной артерии. (A) ЭхоКГ
в 2D-режиме пациента с выраженным стенозом легочного клапана. Наилучшее
выравнивание между допплеровским лучом и сигналом легочного потока по-
лучено из субкостального доступа по длинной оси с направлением датчика
вперед. Отмечалась выраженная гипертрофия правого желудочка (ПЖ), и
имелось систолическое выбухание легочного клапана (острие). (Б) Макси-
мальная скорость, зарегистрированная с помощью непрерывно-волновой
допплерографии для расчета чресклапанного градиента давления (острие),
соответствовала пиковому градиенту более чем 100 мм рт. ст. Отметьте позд-
ний пиковый инфундибулярный градиент (острия) из-за динамической об-
струкции выносящего тракта ПЖ. ЛЖ — левый желудочек [Б — предоставле-
но Otto CM, Bonow RO. Valvular heart disease, ed 3. Philadelphia, 2009, WB
Saunders].
А
Б
In-33_для нас.indd 849
03.04.2019 12:11:16
850 ЧАСТЬ VI Правые отделы сердца
Площадь легочного клапана, как правило, не
описывают при ЭхоКГ из-за неточности в измере-
нии диаметра выносящего тракта ПЖ. ПВД-обсле-
дование печеночных вен может продемонстриро-
вать значительное пресистолическое диастоличе-
ское обратное течение, аналогичное возрастающей
волне «а» яремных вен, которая отмечается при
выраженном ЛС (рис. 33 .15).
Выраженный ЛС определяют как пиковый доп-
плеровский градиент > 50 мм рт. ст., умеренный
ЛС — как пиковый градиент от 30 до 50 мм рт. ст.
и легкий ЛС — как пиковый градиент < 30 мм рт. ст.
[77].
ЧПЭхоКГ редко обеспечивает улучшение визуа-
лизации легочного клапана по сравнению с ТТЭ-
хоКГ из-за интерпозиции бронхов между датчиком
и легочным клапаном (причина затенения), и из-за
того, что передняя позиция легочного клапана на-
ходится в дальнем поле изображения. Легочный
клапан лучше всего визуализируется с помощью
мультипланового чреспищеводного датчика, по-
вернутого примерно на 90°, в результате чего выво-
дится позиция по длинной оси выносящего тракта
ПЖ и легочный клапан с АК в косой ориентации по
короткой оси. Как альтернатива, легочный клапан
может быть визуализирован в поперечном сечении
(0° поворота) с помощью датчика на уровне бифур-
кации ЛА для получения изображения, обращенно-
го прямо на сам клапан от бифуркации.
Трехмерная ЭхоКГ при ЧПЭхоКГ и ТТЭхоКГ в
некоторых случаях может позволить улучшить ви-
зуализацию морфологии легочного клапана [79].
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ, ДАННЫЕ ИСХОДОВ
Пациенты с ЛС нуждаются в пожизненном квали-
фицированном клиническом и ЭхоКГ-наблюдении.
Частота повторных осмотров зависит от выражен-
ности повреждения и результатов проведенного
вмешательства. Пациенты с легким ЛС нуждаются
в осмотрах раз в 5 лет с клиническим и эхокардио-
графическим допплеровским обследованием. Па-
циенты с умеренным ЛС должны осматриваться с
клиническим и эхокардиографическим допплеров-
ским обследованием каждые 2–5 лет, а пациенты с
выраженным ЛС, которые не имели вмешательств,
должны осматриваться с обследованием ежегодно
[75, 77].
Регулярное клиническое и эхокардиографиче-
ское наблюдение рекомендовано для всех пациентов
после баллонной вальвулопластики легочного кла-
пана или хирургического лечения ЛС с особым
вниманием к оценке степени ЛР и влияния на пра-
вые отделы сердца. Частота осмотров должна быть
подобрана индивидуально на основании выражен-
ности гемодинамических нарушений, но не реже,
чемразв5лет.
Частота бессимптомной выживаемости при ЛС
хорошая и зависит от выраженности обструкции. В
исследовании Second Natural History Study с долго-
временным наблюдением 592 пациентов с ЛС отме-
чена частота общей выживаемости в 25 лет 96%
[80]. В этих хирургических наблюдениях бессим-
птомной выживаемость была связана с доопераци-
онным градиентом давления на легочной клапан.
Операцией в Second Natural History Study была
хирургическая вальвулотомия. Повторные опера-
ции отмечены лишь у 4% в течение 10-летнего пе-
риода наблюдения [80]. В последующем в отдален-
ном периоде исследовании 90 пациентов с ЛС,
пролеченных оперативно, повторные операции
понадобились в 15%, преимущественно из-за ЛР
(9%). При последнем обследовании в наблюдении
умеренная или выраженная ЛР имелась у 37%, что
обосновывает важность последующего клиническо-
го и ЭхоКГ наблюдения после хирургических вме-
шательств [81].
Хирургическая помощь при ЛС рекомендована
всем пациентам с пиковым градиентом > 60 мм
рт. ст. Дополнительные рекомендации по вмеша-
тельствам объединены в табл. 33 .8 [77].
Чреcкожная легочная баллонная вальвулопла-
стика является процедурой выбора для детей и
D
a
14
12
10
8
6
4
2
0
-2
-4
x
y
v
S
Рис. 33 .15 Выраженный стеноз клапанов легочной артерии. Сигнал
импульсноволновой допплерографии от печеночной вены (А) и данные о
давлении в ПП (Б) у пациента с выраженным стенозом легочного клапана.
Обратите внимание на увеличенный обратный ток в позднюю диастолу (пре-
систолу) по печеночной вене (стрелка) — это явление аналогично яремной
венозной «a» волне у пациентов со стенозом легочного клапана. D — диасто-
лическая волна; S — систолическая волна; v — сокращение желудочков;
x — снижение x; y — снижение y.
А
Б
In-33_для нас.indd 850
03.04.2019 12:11:17
851
33 Патология клапанов правых отделов сердца у взрослых
взрослых с выраженным или симптоматическим
клапанным ЛС и имеет низкий риск заболеваемо-
сти, смертности и повторного стеноза. У асимпто-
матических пациентов с ЛС, которым не показана
баллонная вальвулопластика, а хирургическое вме-
шательство является единственным возможным
вариантом лечения, операцию следует проводить
только если давление в ПЖ выше 80 мм рт. ст. [77,
82–84].
Легочная баллонная вальвулопластика снижает
градиент ЛС путем разрыва комиссур, и, таким об-
разом, пациенты с диспластичным легочным клапа-
ном (например, пациенты с синдромом Нунан) в
большинстве случаев имеют субоптимальные ре-
зультаты. В регистре вальвулопластики и ангиопла-
стики врожденных аномалий), который включает
784 случая, средний чресклапанный градиент спадал
с 71 до 28 мм рт. ст. у пациентов с типичным ЛС и
с 79 до 49 мм рт. ст. у пациентов с диспластичным
ЛС [85, 86]. Легочная баллонная вальвулопластика
не рекомендуется пациентам с приобретенным ЛС,
связанным с карциноидом или ревматической бо-
лезнью, из-за характера поражения клапана, частого
сочетания с ЛР и сопутствующего поражения дру-
гих, нелегочных, клапанов.
Выраженный ЛС часто ассоциируется с некото-
рой степенью подклапанной мышечной обструк-
ции в результате гипертрофии миокарда ПЖ (см.
рис. 33 .14). После уменьшения ЛС инфундибуляр-
ная обструкция может временно усугубиться, но
затем регрессирует в течение месяцев с окончатель-
ным рассасыванием [85, 87]. Острая выраженная
мышечная обструкция может создать «ПЖ-самоу-
бийцу», что ведет к супрасистемному давлению в
ПЖ с последующим цианозом и гемодинамиче-
ской нестабильностью. Перед легочной баллонной
вальвулопластикой рекомендуется терапия бе-
та-блокаторами для предупреждения или сниже-
ния выраженности этого осложнения; их прием,
как правило, прекращается через 3–6 месяцев после
процедуры.
После легочной баллонной вальвулопластики
описана высокая частота встречаемости ЛР; при
последующем наблюдении 57% детей имели уме-
ренную или выраженную ЛР [88, 89]. Хирургиче-
ская вальвулотомия или замена клапана может быть
предпочтительнее у пациентов с неблагоприятной
морфологией легочного клапана, гипоплазирован-
ным легочным кольцом, фиксированным подкла-
панным или надклапанным ЛС, выраженной ЛР,
Уровень доказательности
Класс*
Баллонная вальвулотомия рекомендована для бессимптомных пациентов с куполообразным легочным клапаном и од-
номоментным пиковым допплеровским градиентом > 60 мм рт. ст . или средним допплеровским градиентом > 40 мм
рт. ст . (в сочетании с менее чем умеренной ЛР)
IB
Баллонная вальвулотомия рекомендована для симптоматичных пациентов с куполообразным легочным клапаном
и одномоментным пиковым допплеровским градиентом > 50 мм рт. ст. или средним допплеровским градиентом
> 30 мм рт. ст. (в сочетании с менее чем умеренной ЛР)
IC
Хирургическое лечение рекомендовано пациентам с выраженным ЛС в сочетании с гипоплазией легочного кольца,
выраженной ЛР, подклапанным ЛС или надклапанным ЛС. Хирургическое лечение также предпочтительнее для
большинства диспластичных легочных кланов и при сопутствующей выраженной ТР или при необходимости про-
ведения процедуры Maze
IC
Операции на выносящем выходном тракте ПЖ и легочном клапане следует выполнять хирургам с квалификацией
и опытом работы с ВПС
IB
Баллонная вальвулотомия может быть приемлема у бессимптомных пациентов с диспластичным легочным кланом
и одномоментным пиковым допплеровским градиентом > 60 мм рт. ст. или средним допплеровским градиентом
>40ммрт.ст.
IIbC
Баллонная вальвулотомия может быть приемлема у некоторых симптоматичных пациентов с диспластичным легоч-
ным кланом и одномоментным пиковым допплеровским градиентом > 50 мм рт. ст. или средним допплеровским
градиентом > 30 мм рт. ст.
IIbC
Баллонная вальвулотомия не рекомендуется бессимптомным пациентам с мгновенным пиковым допплеровским
градиентом < 50 мм рт. ст. при наличии нормального сердечного выброса
IIIC
Баллонная вальвулотомия не рекомендуется симптоматичным пациентам с ЛС или выраженной ЛР
IIIC
Баллонная вальвулотомия не рекомендуется симптоматичным пациентам с мгновенным максимальным допплеров-
ским градиентом < 30 мм рт. ст.
IIIC
* См. табл. 33.4 для определения класса рекомендации.
ЛР — регургитация на легочном клапане; ЛС — стеноз легочного клапана; ПЖ — правый желудочек; ТР — трикуспидальная регургитация.
[Warnes C, Williams RB, Child J, et al. American College of Cardiology; American Heart Association Task Force on Practice Guidelines (Writing
Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease); American Society of Echocardiography; Heart
Rhythm Society; International Society for Adult Congenital Heart Disease; Society for Cardiovascular Angiography and Interventions; Society of
Thoracic Surgeons. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease. J Am Coll Cardiol 52:e1–e121, 2008.]
ТАБЛИЦА 33.8 Рекомендации по оперативному лечению пациентов с легочным стенозом
In-33_для нас.indd 851
03.04.2019 12:11:18
852
ЧАСТЬ VI Правые отделы сердца
другими поражениями сердца, требующими опера-
тивного вмешательства, или с плохим результатом
легочной баллонной вальвулопластики. Выбор типа
протеза легочного клапана должен быть индивиду-
альным, но предпочтение обычно отдается биоло-
гическим клапанам [90–92].
ДОПОЛНИТЕЛЬНЫЕ ПОДХОДЫ
ДЭхоКГ-оценка выраженности ЛС остается затруд-
нительной у пациентов с субоптимальным каче-
ством эхокардиографического изображения. Аль-
тернативные возможности изображения, включая
ТТЭхоКГ в 3D-режиме с цветовым картированием,
могут обеспечить дополнительные данные, но
нуждаются в подтверждении. МРТ и КТ сердца сле-
дует проводить для лучшего определения уровня
обструкции; эти технологии, в частности, помога-
ют, когда имеются множественные уровни обструк-
ции выносящего тракта ПЖ или когда качество
ЭхоКГ ниже оптимального. Катетеризацию сердца
следует рассматривать, когда имеется расхождение
данных, для подтверждения размера, выраженности
и уровня обструкции или для облегчения вмеша-
тельства.
РЕГУРГИТАЦИЯ НА ЛЕГОЧНОМ КЛАПАНЕ
ИСТОРИЯ ВОПРОСА
ЛР может возникать из-за первичных, физиологи-
ческих, или вторичных причин. Первичные при-
чины ЛР могут быть: врожденными, обусловлен-
ными иммунитетом (ревматические), системные
(карциноид), или инфекционные (эндокардит).
Вторичная или функциональная ПР происходит у
пациентов с нормальным легочным клапаном, но
с расширением ЛА или выраженной легочной ги-
пертензией.
Часто при исследовании нормальных сердец с
помощью допплер-ЭхоКГ можно обнаружить лег-
кие и умеренные степени ЛР. У взрослых выражен-
ная патологическая ЛР наиболее часто является след-
ствием предшествующих вмешательств по поводу
ВПС, таких как размещением заплаты в выносящем
тракте при коррекции тетрады Фалло с [93], или
вальвулотомии (хирургической или баллонной) по
поводу изолированного врожденного ЛС [81].
У пациентов с длительно существующей выра-
женной ЛР в конце концов развивается прогресси-
рующее расширение ПЖ и снижение функции ПЖ
в фазу систолы. Эти нарушения могут вести к не-
возможности увеличения СВ при физических на-
грузках, прогрессивной ТР из-за расширения коль-
ца, повышению склонности к предсердным и желу-
дочковым аритмиям и в конечном счете к
недостаточности правых отделов сердца.
В результате увеличения ПЖ у пациентов с ЛР
может появляться парастернальный толчок. Шум
ЛР обычно мягкий, диастолический; убывающий
шум лучше слышно в левой верхней грудинной
области. Он начинается после тона легочного за-
крытия и может сопровождаться шумом легочного
систолического выброса. Увеличение интенсивно-
сти шума может отмечаться на вдохе или у пациен-
тов с легочной гипертензией.
Дилатированный ПЖ с нарушенной функцией в
сочетании с длительно существующей ЛР может
вызывать удлинение QRS, желудочковые аритмии и
внезапную смерть. Связь между увеличением ПЖ,
нарушением его функции и неблагоприятными ис-
ходами отмечена у пациентов при коррекции тетра-
ды Фалло трансаннулярной заплатой [94]. Радио-
графия грудной клетки может продемонстрировать
вторичную кардиомегалию из-за правостороннего
увеличения камер сердца и расширения ЛА.
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЕ ПОДХОДЫ
ТТЭхоКГ является диагностическим методом выбо-
ра для подтверждения наличия и определения сте-
пени ЛР, информации о ее причинах. Это также
важный инструмент при последующем наблюдении
пациентов с ЛР [82, 95]. ЭхоКГ-обследование про-
водится в соответствии с теми же принципами, что
и оценка регургитации на АК (см. главу 17). Неин-
вазивная оценка размеров и функции ПЖ важны,
т.к. на их основе составляется прогноз и тактика
ведения.
ТЕХНИЧЕСКИЕ ДЕТАЛИ, КОЛИЧЕСТВЕННАЯ ОЦЕНКА
И АНАЛИЗ ДАННЫХ
Диагноз ЛР обычно ставят с помощью ЭхоКГ, а
степень определяют с помощью цветового доппле-
ровского изображения. Незначительная или легкая
степень ЛР определяется у большинства здоровых
людей [96]. Эхокардиографические и допплеров-
ские параметры, которые используются в оценке
ЛР, перечислены в табл. 33 .9 [4].
Механизм ЛР обычно определяют с помощью
ЭхоКГ-оценки в 2D-режиме выносящего тракта
ПЖ и легочного клапана из парастернальной по-
зиции по короткой и длинной осям, и, иногда,
апикальной и субкостальной позиций. Идентифи-
кация анатомической патологии легочного клапа-
на, такой как отсутствие легочного клапана, моло-
тящая створка, ограничение подвижности или
расширение кольца, может позволить определить
причину и установить размеры выраженности ЛР.
Размеры и функция ПЖ являются косвенными
показателями значимости ЛР и адаптации ПЖ к
перегрузке объемом.
Цветовое допплеровское изображение является
наиболее распространенным первоначальным эхо-
кардиографическим методом, используемым для
установления выраженности ЛР. Если ЛР нере-
In-33_для нас.indd 852
03.04.2019 12:11:18
853
33 Патология клапанов правых отделов сердца у взрослых
Параметры
Практическая ценность/преимущества Недостатки
Размер ПЖ
Увеличение ПЖ чувствительно для
выраженной хронической легочной
регургитации. Нормальные размеры
фактически исключают выра женную
легочную регургитацию
Увеличение встречается при другой патологии
Парадоксальное движение перего-
родки (характерно для перегрузки
давлением)
Простой признак выраженной легочной
регургитации
Неспецифично для легочной регургитации
Протяженность струи — цветовая
допплерография
Простота исполнения
Слабая корреляция с выраженностью легоч-
ной регургитации
Ширина vena contracta
Простой количественный метод, хоро-
шо работающий и для других клапа-
нов
Более сложен в исполнении; требует хорошего
изображения легочного клапана; отсутствие
опубликованных ратифицирующих данных
Темп замедления струи — непре-
рывно-волновая допплерография
Простота исполнения
Резкое замедление неспецифично для выра-
женной легочной регургитации
Количественный анализ потока —
импульсно-волновая допплеро-
графия
Представляет количественно поток и
фракцию регургитации
Предмет существенных ошибок из-за трудно-
стей в измерении легочного кольца меняю-
щегося выносящего выходного тракта ПЖ;
плохо ратифицирован
ПЖ — правый желудочек.
[Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional
and Doppler echocardiography. J Am Soc Echocardiogr 16:777–802, 2003.]
ТАБЛИЦА 33.9 Эхокардиографические и допплеровские параметры выраженности легочной регургитации
стриктивная и легочное давление низкое, цветовая
допплеровская карта потока может быть ламинар-
ной [4, 97].
Выраженность ЛР в основном определяется ши-
риной и продолжительностью струи; на эти факто-
ры, в свою очередь, оказывают влияние градиент
давления ЛАПЖ, объем регургитации и давление в
ПЖ. ЛР легкой степени сопровождается тонкой ре-
гургитирующей струей; при ЛР средней степени
окрашенная струя расширяется, но все еще меньше
50% ширины кольца легочного клапана (рис. 33 .16)
[98]. При выраженной ЛР струя широкая голодиа-
столическая (рис. 33 .17), заполняет пути оттока и
больше половины кольца легочного клапана. При
выраженной длительно существующей ЛР и более
выраженных диастолических нарушениях ПЖ,
выравнивание давления в ЛА и ПЖ в раннюю ди-
астолу приводит к раннему и внезапному обрыву
цветового и НВД-сигнала. Таким образом, опираясь
только на цветовой поток струи, можно недооце-
нить выраженность ЛР. Поэтому важно использо-
вать информацию о ширине vena contracta и конту-
ре НВД-сигнала и плотности, чтобы опознать выра-
женную ЛР (см. рис. 33 .17) [99]. Быстрое замедление
НВД с временем полуспада давления < 100 мсек
предполагают выраженную ЛР, но неспецифичны.
Равные интенсивности антеградного и ретроград-
ного потоков через легочный клапан предполагают
выраженную ЛР, но на них влияют диастолические
свойства ПЖ и давление наполнения. КДД в ПЖ
может превосходить давление в ЛА во время сокра-
щения предсердия, что приводит к антеградному
потоку через легочный клапан во время сокраще-
ния предсердий. ПВД-определение отношения ре-
версивного к поступательному интегралов скоро-
стей кровотока в легочных артериях используется
для оценки процента потока ЛР [98].
ЧПЭхоКГ оценка легочного клапана непростая
задача; причины этого перечислены в разделе о ЛС.
Легочный клапан может лучше всего визуализиро-
ваться с помощью мультипланового чреспищевод-
ного датчика, повернутого примерно на 90°, в ре-
зультате чего позиция по длинной оси выходного
тракта ПЖ и легочный клапан с АК оказываются в
косой ориентации по короткой оси. Это в целом
позволяет визуализировать размер струи ЛР и vena
contracta. Дополнительно легочный клапан может
быть визуализирован в поперечной плоскости (0°
поворота) с помощью датчика на уровне бифурка-
ции ЛА для получения изображения, которое смо-
трит на легочный клапан прямо от бифуркации.
Эта позиция обеспечивает соответствующий угол
обзора, оптимизирующий выравнивание луча для
регистрации допплеровских показателей. Обычно в
качестве первичного диагностического метода визу-
ализации при подозрении на болезни легочного
клапана ЧПЭхоКГ не проводят.
Трехмерная ТТЭхоКГ или ЧПЭхоКГ в некоторых
случаях может позволить улучшить визуализацию
морфологии легочного клапана [79, 100].
При оценке пациентов с ЛР следует уделить вни-
мание систолической и диастолической бивентри-
In-33_для нас.indd 853
03.04.2019 12:11:18
854
ЧАСТЬ VI Правые отделы сердца
кулярной функции, т.к. эффекты ЛР на ПЖ влияют
на выбор сроков операции [101]. Полная мультимо-
дальная ЭхоКГ-оценка ЛР включает в первую оче-
редь качественную оценку, которая обеспечивает
клинически полезную оценку выраженности ЛР и
осуществима у большинства пациентов [4]. Суще-
ствует недостаточно данных по эхокардиографиче-
ской количественной характеристике ЛР, рекомен-
дованных для рутинного использования. Исследо-
вания по ратификации неудачны из-за трудностей
в получении изображения легочного клапана и
низкой распространенности выраженной ЛР.
Ширина vena contracta — это наименьшая часть
регургитантного потока сразу над областью схожде-
ния потока и перед расширением турбулентной
струи регургитации, которая соответствует области
эффективного отверстия регургитации. Обнаруже-
но, что vena contracta — более точный метод оценки
выраженности ЛР с помощью цветового доппле-
ровского изображения, чем площадь струи регурги-
тации; однако стандарты для ширины vena contracta
ЛР не установлены [98]. При всесторонней оценке
пациентов с ЛР принимают во внимание информа-
цию о размерах и функции ПЖ (табл. 33 .10), что
играет роль при определении сроков замены легоч-
ного клапана [102]. Пока не ясно, найдут ли приме-
нение такие альтернативные методы визуализации,
как деформационный образ, для вычисления опти-
мальных сроков замены легочного клапана у таких
пациентов [103].
МРТ стала распространенным методом диагно-
стики для оценки выраженности регургитации и
размеров и функции ПЖ у пациентов с ЛР [104].
Двухмерные и допплеровские эхокардиографиче-
ские показатели, являющиеся независимыми пре-
дикторами выраженной ЛР по сравнению с МРТ
сердца, включают: ретроградный диастолический
поток в стволе или в ветвях легочных артерий, ши-
рину струи ЛР 50% и более от легочного кольца и
ЛР < 100 мсек [95]. Наиболее ценным эхокардиогра-
Слабая
Умеренная
Выраженная
Рис. 33 .16 Регургитация на легочном клапане. Измерение регургитации на легочном клапане с помощью допплерографии с демонстрацией слабой, уме-
ренной и выраженной степени регургитации (верхний ряд). Спектральный допплерографический режим. Слабая регургитация характеризуется постоянным пото-
ковым градиентом в конце диастолы; умеренная регургитация — выравниванием давлений ГЛА и ПЖ только в конце диастолы, а выраженная регургитация
связана с ранним диастолическим выравниванием давления (нижний ряд). Пульсовая допплерография ЛЛА, показывающая степени обратного тока. ЛЛА
—
левая легочная артерия; ГЛА — главная легочная артерия [Valente AM, Cook S, Festa P, et al. Multimodality imaging guidelines for patients with repaired tetralogy of
fallot: a report from the American Society of Echocardiography: developed in collaboration with the Society for Cardiovascular Magnetic Resonance and the Society for
Pediatric Radiology. J Am Soc Echocardiogr 27:111–141 , 2014].
In-33_для нас.indd 854
03.04.2019 12:11:18
855
33 Патология клапанов правых отделов сердца у взрослых
фическим показателями для оценки выраженности
ЛР после реконструкции выносящего тракта ПЖ
или замены легочного клапана является сочетание
отношения «ширина струи ЛР-кольцо» и ретро-
градного диастолического потока (МРТ — рефе-
рентный метод) [105].
Для определения степени ЛР и ее влияния на
правые отделы сердца можно использовать КТ, од-
нако этот метод не применяется для каждого паци-
ента из-за опасности ионизирующего излучения.
Перед операцией КТ может быть использована,
чтобы определить анатомию коронарных сосудов и
степень атеросклероза. Другие диагностические
процедуры, такие как нагрузочные тесты и катете-
ризация сердца, могут применяться у некоторых
пациентов с ЛР, чтобы помочь определить подходя-
щие время и метод вмешательства.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И ДАННЫЕ ИСХОДОВ
Большинство пациентов с легкой или умеренной
степенью ЛР имеют благоприятное клиническое
течение. Хроническая выраженная ЛР многие годы
хорошо переносится. Однако, в большинстве случа-
ев, происходит дилатация ПЖ, и у пациентов раз-
вивается систолическая дисфункция, аналогичная
эффекту хронической АР на ЛЖ. Выраженная ди-
латация ПЖ ассоциируется с повышенным риском
внезапной смерти, связанной в первую очередь с
аритмиями [94]. Показано, что медикаментозная
терапия неэффективна для снижения степени ЛР
или предупреждения воздействия ЛР на ПЖ. Хоро-
шо установлено воздействие изолированной позд-
ней ЛР; ЛР влияет не только на размеры и функцию
ПЖ, но и на способность переносить физические
нагрузки [106]. Поскольку улучшились возможно-
сти операций и становится все больше известно о
заболеваемости, связанной с длительно существую-
щей ЛР, показания к вмешательствам совершен-
ствуются.
Consensus Guidelines on the Management of Adults
with Congenital Heart Disease рекомендуют протези-
рование легочного клапана при выраженной ЛР и
симптоматике или снижении переносимости физи-
ческих нагрузок (табл. 33 .11). Замена легочного кла-
пана также считается приемлемой у взрослых с пред-
шествующей хирургической коррекцией тетрады
Фалло, выраженной ЛР и: (1) умеренной или выра-
женной дисфункцией ПЖ; (2) умеренным или выра-
женным увеличением ПЖ (По данным МРТ: объем
ПЖ в конец диастолу > 150 мл/м2, > 80 мл/м2, < 47%)
[107–110]; (3) развитием симптоматической или под-
твержденной предсердной или желудочковой арит-
мии; или (4) умеренной или выраженной ТР. В прак-
тике авторов, замена легочного клапана также реко-
мендовалась при: (1) снижении функционального
аэробного объема; (2) выраженной ЛР у пациентов,
нуждающихся в других кардиологических операци-
ЛА
ЛР
Рис. 33 .17 ТТЭхоКГ выраженной регургитации на легочном клапане,
связанной с предшествующей коррекцией тетрады Фалло, и выход-
ной тракт ПЖ. (A) Цветовая допплерография демонстрирует ламинарный
поток в легочную артерию в фазу систолы. (Б) Широкая ламинарная струя
легочной регургитации заполняет выходной тракт ПЖ в фазу диастолы.
(В) Непрерывно-волновая допплерография демонстрирует интенсивный сиг-
нал голодиастолического потока (острие стрелки) через легочный клапан,
быстро снижающийся к изолинии. Здесь нет легочного стеноза (антеградная
скорость 1,0 м/сек), и низкоскоростной диастолический поток означает нор-
мальное диастолическое легочное давление. ЛА — легочная артерия, ЛР —
легочная регургитация [с разрешения Otto CM, Bonow RO: Valvular heart disease,
ed 3. Philadelphia, 2009, WB Saunders].
А
Б
В
In-33_для нас.indd 855
03.04.2019 12:11:19
856 ЧАСТЬ VI Правые отделы сердца
Параметры
Небольшая
Умеренная
Выраженная
Легочный клапан
Нормальный
Нормальный или изме-
ненный
Измененный
Размеры правого желудочка
Нормальные*
Нормальный или дила-
тирован
Дилатирован
Размер струи по данным цветовой доп-
плерографии†
Тонкая (обычно
<10ммвдлину)
с узким основанием
Средняя
Обычно большая, с широким
основанием; может быть корот-
кой по продолжительности
Плотность и темп замедления струи —
непрерывно-волновая допплерогра-
фия£
Неяркая; плавное за-
медление
Плотная; различное
замедление
Плотная; резкое замедление, ран-
нее окончание диастолического
потока
Легочный систолический поток по срав-
нению с системным потоком — им -
пульсно-волновая допплерография§
Немного увеличен
Промежуточный
Сильно увеличен
* При отсутствии других причин увеличения ПЖ. Нормальные 2D-размеры из апикальной четырехкамерной позиции: медио-латераль-
ный конечно-диастолический размер ПЖ ≤ 4,3 см, конечно-диастолическая площадь ПЖ ≤ 35,5 см2.
† При пределе Найквиста 50–60 см/сек.
£ Резкое замедление неспецифично для выраженной ЛР.
§ Пограничные значения объема и фракции регургитации хорошо не утверждены.
[Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional
and Doppler echocardiography. J Am Soc Echocardiogr 16:777–802, 2003.]
ТАБЛИЦА 33.10 Эхокардиографические и допплеровские параметры, используемые для определения
степени выраженности легочной регургитации
Уровень доказательности
Класс/УД*
Операции у взрослых с предшествующей коррекцией тетрады Фалло следует выполнять хирургам с квалифика-
цией и опытом работы с ВПС
IC
Замена легочного клапана показана при выраженной ЛР и симптоматике или снижении толерантности к физиче-
ским нагрузкам
IB
Перед оперативным вмешательством следует установить анатомию коронарных артерий, особенно возможность
наличия аномальной передней нисходящей коронарной артерии в выходном тракте ПЖ
IC
Замена легочного клапана приемлема у взрослых с предшествующей коррекцией тетрады Фалло, выраженной ЛР
и любым из следующих признаков:
1. Умеренная или выраженная дисфункция ПЖ
IIaB
2. Умеренное или выра женное увеличение ПЖ
IIaB
3. Развитие симптоматической или стойкой предсердной или желудочковой аритмии
IIaC
4. Умеренной или выраженной трикуспидальной регургитации
IIaC
* Для определения класса и УД см. табл. 33.4
УД — уровень доказательности; ЛР — легочная регургитация; ПЖ — правый желудочек.
[Warnes C, Williams RB, Child J, et al. American College of Cardiology; American Heart Association Task Force on Practice Guidelines (Writing
Committee to Develop Guidelines on the Management of Adults With Congenital Heart Disease); American Society of Echocardiography; Heart
Rhythm Society; International Society for Adult Congenital Heart Disease; Society for Cardiovascular Angiography and Interventions; Society of
Thoracic Surgeons. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease. J Am Coll Cardiol 52:e1–121, 2008.]
ТАБЛИЦА 33.11 Рекомендации по хирургическому вмешательству у взрослых с легочной регургитацией
ях и (3) при предполагаемом риске аритмии у паци-
ентов с удлиненной или увеличивающейся продол-
жительностью QRS (общая продолжительность QRS
180 мсек или более или снижение продолжительно-
сти QRS 3,5 мсек/год или более) [94]. Размеры ПЖ
стремятся к уменьшению, и функциональное состо-
яние улучшается после замены легочного клапана по
поводу поздней ЛР после хирургической коррекции
тетрады Фалло [108, 109, 111].
Дооперационный подъем натрийуретического
пептида и удлинение QRS может выявить пациен-
тов с худшим исходом в отношении функции и
объемов ПЖ после операции [112]. Однако функ-
ция ПЖ может не восстановиться полностью после
замены легочного клапана, и тогда имеются замет-
ное его увеличение и систолическая дисфункция
[107, 113]. Если рекомендуется хирургическая за-
мена легочного клапана, тип протеза легочного
In-33_для нас.indd 856
03.04.2019 12:11:20
857
33 Патология клапанов правых отделов сердца у взрослых
включая цветовое картирование потока в 3D-режи-
ме, создание деформационного образа и другие ме-
тодики, смогут обеспечить дополнительные данные.
МРТ сердца считается предпочтительным методом
для неинвазивной количественной оценки ЛР и ча-
сто используется для оценки размеров и функции
правых отделов сердца у бессимптомных пациентов
с выраженной ЛР для определения оптимального
времени для замены клапана. Катетеризация сердца
для оценки ЛР проводится редко.
Болезни легочного клапана клинически и с по-
мощью ЭхоКГ недооцениваются. У пациентов с
перегрузкой ПЖ давлением или объемом всегда
следует искать ЛС или ЛР с помощью мультимо-
дального ЭхоКГ.
клапана выбирают индивидуально [91, 92, 114].
Пациенты с врожденной ЛР обычно не являются
кандидатами для чрескожной замены легочного
клапана. Размеры и конфигурация путей оттока из
ПЖ приводит к увеличению риска чресклапанной
регургитации и эмболизации протеза [115, 116].
Чрескожная замена легочного клапана является
разумным вариантом у пациентов с легочным про-
тезом или регургитацией по эластическим артери-
ям [117–119].
ДОПОЛНИТЕЛЬНЫЕ ПОДХОДЫ
Эхокардиографическая количественная оценка ЛР
остается спорной и хорошо не ратифицирована. Бу-
дущие альтернативные возможности визуализации,
Общие подходы
Умеренная или более ТР наиболее часто «функциональная» по своей природе. Это означает, что она не связана с первичной
патологией створок клапана, а является результатом других патологических процессов, вызывающих дилатацию ПЖ, смеще-
ние подклапанного аппарата, дилатацию трикуспидального кольца или сочетание этих причин
ЭхоКГ в настоящее время является референсным стандартом для диагностики и оценки патологии трикуспидального и легоч-
ного клапанов
Для градации ТР необходима комплексная оценка, включающая в 2D-режим, 3D-режим и допплеровские качественные и коли-
чественные параметры
Трикуспидальная регургитация (ТР)
Легочная регургитация (ЛР)
Данные
Данные
Выра женная ТР связана с молотящими или серьезно изме-
ненными створками (первичная), или с широко дилатиро-
ванным кольцом (> 40 мм или > 21 мм/м2), или с заметной
фиксацией створок (функциональная)
ЛР наиболее часто встречается у пациентов, ранее перенес-
ших вмешательство по поводу врожденного ЛС (баллонное
или хирургическое) или тетрады Фалло
Выра женная ТР проявляется площадью центральной струи
> 10 см2, vena contracta > 0,7 см, плотными ранними треу-
гольными пиками при НВД-исследовании струи и систоли-
ческим обратным током в печеночных венах
Выраженная ЛР проявляется широкой окрашенной струей с
ламинарным течением, которое заполняет > 50% кольца
легочного клапана в фазу диастолы; струя на НВД-
исследовании быстро снижается до исходного уровня
Исходы
Исходы
Данные, свидетельствующие о выраженной ТР в результате
молотящей створки, ассоциируются с неблагоприятным
исходом, который благоприятнее при раннем хирургическом
исправлении
Длительно протекающая выраженная ЛР в конце концов при-
водит к расширению правых отделов сердца и их дисфунк-
ции; это, в свою очередь, связано с увеличением тяжести
сердечно-сосудистых нарушений и смертностью
Выра женная регургитация ТК оказывает серьезное воздействие
на клинический исход и выживаемость пациентов с сопут-
ствующими сердечно-сосудистыми болезнями
Клинически, для определения оптимального времени замены
легочного клапана у пациентов с выраженным ЛС использу-
ется Допплер ЭхоКГ, размеры и функциональное состояние
правых отделов сердца по данным КТ или МРТ
Трикуспидальный стеноз (ТС)
Легочной стеноз (ЛС)
Данные
Данные
Выра женный ТС характеризуется средним градиентом ≥ 5 мм
рт. ст., временем полуспада ≥ 190 и площадью клапана
< 1,0 см2
Выраженный легочной стеноз характеризуется пиковым гра-
диентом > 50 мм рт. ст.
Исходы
Исходы
Трикуспидальный стеноз встречается нечасто и, как правило,
никогда не встречался изолированным
Легочный стеноз наиболее часто является изолированным
врожденным поражением сердца
КТ — компьютерная томография; НВД-исследование — непрерывное волновое допплер-исследование; МРТ — магнитно -резонансная
томография.
СВОДНАЯ ИНФОРМАЦИЯ
Аневризма аорты
In-33_для нас.indd 857
03.04.2019 12:11:20
858 ЧАСТЬ VI Правые отделы сердца
ЛИТЕРАТУРА
1. Ton-Nu TT, Levine RA, Handschumacher
MD, et al. Geometric determinants of func-
tional tricuspid regurgitation: insights from
3-dimensional echocardiography, Circulation
114:143–149, 2006.
2. DePace N, Ross J, Iskandrian A, et al. Tricus-
pid regurgitation: noninvasive techniques for
determining causes and severity, J Am Coll
Cardiol 3:1540–1550, 1984.
3. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Thorac Cardiovasc
Surg 148:e1–e132, 2014.
4. Zoghbi WA, Enriquez-Sarano M, Foster E, et
al. Recommendations for evaluation of the
severity of native valvular regurgitation with
two-dimensional and Doppler echocardiogra-
phy, J Am Soc Echocardiogr 16:777–802, 2003.
5. Badano LP, Agricola E, Perez de Isla L, et al.
Evaluation of the tricuspid valve morphology
and function by transthoracic real-time
three-dimensional echocardiography, Eur J
Echocardiogr 10:477–484, 2009.
6. Anwar AM, Geleijnse ML, Soliman OI, et al.
Assessment of normal tricuspid valve anato-
my in adults by real-time three-dimensional
echocardiography, Int J Cardiovasc Imaging
23:717–724, 2007.
7. Oh J, Seward J, Tajik A. The echo manual, ed
3, Lippincott Williams & Wilkins, 2006.
8. Fukuda S, Gillinov AM, Song JM, et al. Echo-
cardiographic insights into atrial and ventricu-
lar mechanisms of functional tricuspid regur-
gitation, Am Heart J 152:1208–1214, 2006.
9. Topilsky Y, Tribouilloy C, Michelena HI, et
al. Pathophysiology of tricuspid regurgita-
tion: quantitative Doppler echocardiographic
assessment of respiratory dependence, Circu-
lation 122:1505–1513, 2010.
10. Cohen S, Sell J, McIntosh C, Clark R. Tri-
cuspid regurgitation in patients with ac-
quired, chronic, pure mitral regurgitation.
II. Nonoperative management, tricuspid
valve annuloplasty, and tricuspid valve re-
placement, J Thorac Cardiovasc Surg 94:488–
497, 1987.
11. Waller BF, Moriarty AT, Eble JN, et al. Etiol-
ogy of pure tricuspid regurgitation based on
anular circumference and leaflet area: analy-
sis of 45 necropsy patients with clinical and
morphologic evidence of pure tricuspid re-
gurgitation, J Am Coll Cardiol 7:1063–1074,
1986.
12. Muller O, Shillingford J. Tricuspid incom-
pentence, Br Heart J 16:195, 1954.
13. Salazar E, Levine H. Rheumatic tricuspid re-
gurgitation, Am J Med 33:111, 1962.
14. Sepulveda G, Lukas D. The diagnosis of tri-
cuspid insufficiency—clinical features in 60
cases with associated mitral valve disease, Cir-
culation 11:552, 1955.
15. Lin G, Nishimura RA, Connolly HM, et al.
Severe symptomatic tricuspid valve regurgita-
tion due to permanent pacemaker or implant-
able cardioverter-defibrillator leads, J Am Coll
Cardiol 45:1672–1675, 2005.
16. Messika-Zeitoun D, Thomson H, Bellamy M,
et al. Medical and surgical outcome of tricus-
pid regurgitation caused by flail leaflets, J
Thorac Cardiovasc Surg 128:296–302, 2004.
17. van Son JA, Danielson GK, Schaff HV, Miller
Jr. FA. Traumatic tricuspid valve insufficien-
cy. Experience in thirteen patients, J Thorac
Cardiovasc Surg 108:893–898, 1994.
18. Chan P, Ogilby JD, Segal B. Tricuspid valve
endocarditis, Am Heart J 117:1140–1146,
1989.
19. Waller BF, Knapp WS, Edwards JE. Marantic
valvular vegetations, Circulation 48:644–650,
1973.
20. Duran C. Tricuspid valve surgery revisited, J
Card Surg 9(2 Suppl):242–247, 1994.
21. Redfield MM, Nicholson WJ, Edwards WD,
Tajik AJ. Valve disease associated with ergot
alkaloid use: echocardiographic and patho-
logic correlations, Ann Intern Med 117:50–52,
1992.
22. Pritchett AM, Morrison JF, Edwards WD, et
al. Valvular heart disease in patients taking
pergolide, Mayo Clin Proc 77:1280–1286,
2002.
23. Schade R, Andersohn F, Suissa S, et al. Dopa-
mine agonists and the risk of cardiac-valve
regurgitation, N Engl J Med 356:29–38, 2007.
24. Zanettini R, Antonini A, Gatto G, et al. Val-
vular heart disease and the use of dopamine
agonists for Parkinson’s disease, N Engl J Med
356:39–46, 2007.
25. Rothman RB, Baumann MH, Savage JE, et al.
Evidence for possible involvement of
5-HT(2B) receptors in the cardiac valvulopa-
thy associated with fenfluramine and other
serotonergic
medications,
Circulation
102:2836–2841, 2000.
26. Moller JE, Pellikka PA, Bernheim AM, et al.
Prognosis of carcinoid heart disease: analysis
of 200 cases over two decades, Circulation
112:3320–3327, 2005.
27. Connolly HM, Schaff HV, Mullany CJ, et al.
Surgical management of left-sided carcinoid
heart disease, Circulation 104(12 Suppl
1):I36–I40, 2001.
28. Chaowalit N, Connolly HM, Schaff HV, et al.
Carcinoid heart disease associated with pri-
mary ovarian carcinoid tumor, Am J Cardiol
93:1314–1315, 2004.
29. Adams MJ, Hardenbergh PH, Constine LS,
Lipshultz SE. Radiation-associated cardiovas-
cular disease, Crit Rev Oncol Hematol 45:55–
75, 2003.
30. Crestanello JA, McGregor CG, Danielson GK,
et al. Mitral and tricuspid valve repair in pa-
tients with previous mediastinal radiation
therapy, Ann Thorac Surg 78:826–831, 2004.
discussion 826–831 .
31. Chandraratna P, Lopez J, Fernandez J, Cohen
L. Echocardiographic detection of tricuspid
valve prolapse, Circulation 51:823–826, 1975.
32. Weinreich D, Burke J, Bharati S, Lev M. Iso-
lated prolapse of the tricuspid valve, J Am Coll
Cardiol 6:475–481, 1985.
33. Attenhofer Jost CH, Connolly HM, Dearani
JA, et al. Ebstein’s anomaly, Circulation
115:277–285, 2007.
34. Celermajer D, Bull C, Till J, et al. Ebstein’s
anomaly: presentation and outcome from fe-
tus to adult, J Am Coll Cardiol 23:170–176,
1994.
35. Lancellotti P, Moura L, Pierard LA, et al. Eu-
ropean Association of Echocardiography rec-
ommendations for the assessment of valvular
regurgitation. Part 2: mitral and tricuspid re-
gurgitation (native valve disease), Eur J Echo-
cardiogr 11:307–332, 2010.
36. Klein A, Burstow D, Tajik A, et al. Age-relat-
ed prevalence of valvular regurgitation in
normal subjects: a comprehensive color flow
examination of 118 volunteers, J Am Soc
Echocardiogr 3:54–63, 1990.
37. Chopra HK, Nanda NC, Fan P, et al. Can
two-dimensional echocardiography and
Doppler color flow mapping identify the
need for tricuspid valve repair? J Am Coll Car-
diol 14:1266–1274, 1989.
38. Suzuki Y, Kambara H, Kadota K, et al. Detec-
tion and evaluation of tricuspid regurgitation
using a real-time, two-dimensional, color-
coded, Doppler flow imaging system: com-
parison with contrast two-dimensional echo-
cardiography and right ventriculography, Am
J Cardiol 57:811–815, 1986.
39. Rivera JM, Vandervoort PM, Vazquez de Prada
JA, et al. Which physical factors determine tri-
cuspid regurgitation jet area in the clinical set-
ting? Am J Cardiol 72:1305–1309, 1993.
40. Switzer DF, Yoganathan AP, Nanda NC, et al.
Calibration of color Doppler flow mapping
during extreme hemodynamic conditions
in vitro: a foundation for a reliable quantita-
tive grading system for aortic incompetence,
Circulation 75:837–846, 1987.
41. Bolger AF, Eigler NL, Pfaff JM, et al. Com-
puter analysis of Doppler color flow mapping
images for quantitative assessment of in vitro
fluid jets, J Am Coll Cardiol 12:450–457, 1988.
42. Cape EG, Yoganathan AP, Weyman AE,
Levine RA. Adjacent solid boundaries alter the
size of regurgitant jets on Doppler color flow
maps, J Am Coll Cardiol 17:1094–1102, 1991.
43. Grossmann G, Stein M, Kochs M, et al. Com-
parison of the proximal flow convergence
method and the jet area method for the as-
sessment of the severity of tricuspid regurgi-
tation, Eur Heart J 19:652–659, 1998.
44. Rivera JM, Vandervoort PM, Morris E, et al.
Visual assessment of valvular regurgitation:
comparison with quantitative Doppler mea-
surements, J Am Soc Echocardiogr 7:480–487,
1994.
45. Tribouilloy CM, Enriquez-Sarano M, Bailey
KR, et al. Quantification of tricuspid regurgi-
tation by measuring the width of the vena
contracta with Doppler color flow imaging: a
clinical study, J Am Coll Cardiol 36:472–478,
2000.
46. Baumgartner FJ, Milliken JC, Robertson JM,
et al. Clinical patterns of surgical endocardi-
tis, J Card Surg 22:32–38, 2007.
47. Vahanian A, Baumgartner H, Bax J, et al.
Guidelines on the management of valvular
heart disease: The Task Force on the Manage-
ment of Valvular Heart Disease of the Euro-
pean Society of Cardiology, Eur Heart J
28:230–268, 2007.
48. Pennestri F, Loperfido F, Salvatori MP, et al.
Assessment of tricuspid regurgitation by
pulsed Doppler ultrasonography of the he-
patic veins, Am J Cardiol 54:363–368, 1984.
49. Sakai K, Nakamura K, Satomi G, et al. Evalu-
ation of tricuspid regurgitation by blood flow
pattern in the hepatic vein using pulsed Dop-
pler technique, Am Heart J 108(3 Pt 1):516–
523, 1984.
50. Groves P, Lewis N, Ikram S, et al. Reduced
exercise capacity in patients with tricuspid
regurgitation after successful mitral valve re-
placement for rheumatic mitral valve disease,
Br Heart J 66:295–301, 1991.
51. Sagie A, Schwammenthal E, Newell J, et al.
Significant tricuspid regurgitation is a marker
for adverse outcome in patients undergoing
percutaneous balloon mitral valvuloplasty, J
Am Coll Cardiol 24:696–702, 1994.
52. Nath J, Foster E, Heidenreich PA. Impact of
tricuspid regurgitation on long-term survival,
J Am Coll Cardiol 43:405–409, 2004.
In-33_для нас.indd 858
03.04.2019 12:11:20
859
33 Патология клапанов правых отделов сердца у взрослых
53. Bove E, Kavey R, Byrum C, et al. Improved
right ventricular function following late pul-
monary valve replacement for residual pul-
monary insufficiency or stenosis, J Thorac
Cardiovasc Surg 90:50–55, 1985.
54. Sadeghi HM, Kimura BJ, Raisinghani A, et al.
Does lowering pulmonary arterial pressure
eliminate severe functional tricuspid regurgi-
tation? Insights from pulmonary thromboen-
darterectomy, J Am Coll Cardiol 44:126–132,
2004.
55. Hannoush H, Fawzy ME, Stefadouros M, et
al. Regression of significant tricuspid regur-
gitation after mitral balloon valvotomy for
severe mitral stenosis, Am Heart J 148:865–
870, 2004.
56. Song JM, Kang DH, Song JK, et al. Outcome
of significant functional tricuspid regurgita-
tion after percutaneous mitral valvuloplasty,
Am Heart J 145:371–376, 2003.
57. Song H, Kang DH, Kim JH, et al. Percutane-
ous mitral valvuloplasty versus surgical treat-
ment in mitral stenosis with severe tricuspid
regurgitation, Circulation 116(11 Suppl):I246–
I250, 2007.
58. Staab ME, Nishimura RA, Dearani JA. Iso-
lated tricuspid valve surgery for severe tricus-
pid regurgitation following prior left heart
valve surgery: analysis of outcome in 34 pa-
tients, J Heart Valve Dis 8:567–574, 1999.
59. Casselman FP, La Meir M, Jeanmart H, et al.
Endoscopic mitral and tricuspid valve surgery
after previous cardiac surgery, Circulation
116(11 Suppl):I270–I275, 2007.
60. Lauten A, Ferrari M, Hekmat K, et al. Hetero-
topic transcatheter tricuspid valve implanta-
tion: first-in-man application of a novel ap-
proach to tricuspid regurgitation, Eur Heart J
32:1207–1213, 2011.
61. Duerr GD, Endlich M, Sinning JM, et al. Sur-
gical banding of the inferior vena cava for the
facilitation of transcatheter valve implanta-
tion in a patient with severe secondary tricus-
pid regurgitation, Eur Heart J 35:2839–2849,
2014.
62. Lauten A, Figulla H, Willich C, et al. Trans-
catheter implantation of the tricuspid valve in
the inferior vena cava: an experimental study,
J Heart Valve Dis 19:807–808, 2010.
63. Schofer J, Bijuklic K, Tiburtius C, et al. First-
in-human transcatheter tricuspid valve repair
in a patient with severely regurgitant tricuspid
valve, J Am Coll Cardiol 65:1190–1195, 2015.
64. Hammerstingl C, Schueler R, Malasa M, et al.
Transcatheter treatment of severe tricuspid
regurgitation with the MitraClip system, Eur
Heart J 37:849–853, 2016.
65. Bousvaros G, Stubington D. Some ausculta-
tory and phonocardiographic features of tri-
cuspid stenosis, Circulation 29:26, 1964.
66. Kitchin A, Turner R. Diagnosis and treatment
of tricuspid stenosis, Br Heart J 16:354, 1964.
67. Pellikka PA, Tajik AJ, Khandheria BK, et al.
Carcinoid heart disease. Clinical and echocar-
diographic spectrum in 74 patients, Circula-
tion 87:1188–1196, 1993.
68. Waller B, Howard J, Fess S. Pathology of tri-
cuspid valve stenosis and pure tricuspid re-
gurgitation—Part III, Clin Cardiol 18:225–
230, 1995.
69. Fawzy ME, Mercer EN, Dunn B, et al. Doppler
echocardiography in the evaluation of tricus-
pid stenosis, Eur Heart J 10:985–990, 1989.
70. Onate A, Alcibar J, Inguanzo R, et al. Balloon
dilation of tricuspid and pulmonary valves in
carcinoid heart disease, Tex Heart Inst J
20:115–119, 1993.
71. Orbe LC, Sobrino N, Arcas R, et al. Initial
outcome of percutaneous balloon valvulo-
plasty in rheumatic tricuspid valve stenosis,
Am J Cardiol 71:353–354, 1993.
72. Guyer D, Gillam L, Foale R, et al. Comparison
of the echocardiographic and hemodynamic
diagnosis of rheumatic tricuspid stenosis, J
Am Coll Cardiol 3:1135–1144, 1984.
73. Perez J, JLudbrook P, Ahumada G. Useful-
ness of Doppler echocardiography in detect-
ing tricuspid valve stenosis, Am J Cardiol
55:601–603, 1985.
74. Shimada R, Takeshita A, Nakamura M, et al.
Diagnosis of tricuspid stenosis by M-mode
and two-dimensional echocardiography, Am
J Cardiol 53:164–168, 1984.
75. Baumgartner H, Bonhoeffer P, De Groot N,
et al. Task Force on the Management of
Grown-up Congenital Heart Disease of the
European Society of Cardiology (ESC). ESC
Guidelines for the management of grown-up
congenital heart disease (new version 2010),
Eur Heart J 31:2915–2957, 2010.
76. Currie PJ, Hagler DJ, Seward JB, et al. Instan-
taneous pressure gradient: a simultaneous
Doppler and dual catheter correlative study, J
Am Coll Cardiol 7:800–806, 1986.
77. Warnes CA, Williams RG, Bashore TM, et al.
ACC/AHA 2008 guidelines for the manage-
ment of adults with congenital heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines (Writing Committee
to Develop Guidelines on the Management of
Adults With Congenital Heart Disease). De-
veloped in Collaboration With the American
Society of Echocardiography, Heart Rhythm
Society, International Society for Adult Con-
genital Heart Disease, Society for Cardiovas-
cular Angiography and Interventions, and
Society of Thoracic Surgeons, J Am Coll Car-
diol 52:e143–e263, 2008.
78. Silvilairat S, Cabalka AK, Cetta F, et al. Echo-
cardiographic assessment of isolated pulmo-
nary valve stenosis: which outpatient Doppler
gradient has the most clinical validity? J Am
Soc Echocardiogr 18:1137–1142, 2005.
79. Lee KJ, Connolly HM, Pellikka PA. Carcinoid
pulmonary valvulopathy evaluated by real-
time 3-dimensional transthoracic echocar-
diography, J Am Soc Echocardiogr 21:407,
2008.
80. Hayes CJ, Gersony WM, Driscoll DJ, et al.
Second natural history study of congenital
heart defects. Results of treatment of patients
with pulmonary valvar stenosis, Circulation
87(2 Suppl):I28–I37, 1993.
81. Roos-Hesselink JW, Meijboom FJ, Spitaels
SE, et al. Long-term outcome after surgery
for pulmonary stenosis (a longitudinal study
of 22–33 years), Eur Heart J 27:482–488,
2006.
82. Baumgartner H, Bonhoeffer P, De Groot
NM, et al. ESC Guidelines for the manage-
ment of grown-up congenital heart disease
(new version 2010), Eur Heart J 31:2915–
2957, 2010.
83. Chen CR, Cheng TO, Huang T, et al. Percu-
taneous balloon valvuloplasty for pulmonic
stenosis in adolescents and adults, N Engl J
Med 335:21–25, 1996.
84. Fawzy ME, Awad M, Galal O, et al. Long-term
results of pulmonary balloon valvulotomy in
adult patients, J Heart Valve Dis 10:812–818,
2001.
85. Fawzy ME, Galal O, Dunn B, et al. Regression
of infundibular pulmonary stenosis after
successful balloon pulmonary valvuloplasty
in adults, Cathet Cardiovasc Diagn 21:77–81,
1990.
86. Stanger P, Cassidy SC, Girod DA, et al. Bal-
loon pulmonary valvuloplasty: results of the
Valvuloplasty and Angioplasty of Congenital
Anomalies Registry, Am J Cardiol 65:775–
783, 1990.
87. Teupe CH, Burger W, Schrader R, Zeiher AM.
Late (five to nine years) follow-up after bal-
loon dilation of valvular pulmonary stenosis
in adults, Am J Cardiol 80:240–242, 1997.
88. Garty Y, Veldtman G, Lee K, Benson L. Late
outcomes after pulmonary valve balloon dila-
tation in neonates, infants and children, J
Invasive Cardiol 17:318–322, 2005.
89. Voet A, Rega F, de Bruaene AV, et al. Long-
term outcome after treatment of isolated pul-
monary valve stenosis, Int J Cardiol 156:11–
15, 2012.
90. Bruce C, Connolly H. Right-sided valve dis-
ease, ed 3, Philadelphia, 2009, Saunders Else-
vier.
91. Jang W, Kim YJ, Choi K, et al. Mid-term re-
sults of bioprosthetic pulmonary valve re-
placement in pulmonary regurgitation after
tetralogy of Fallot repair, Eur J Cardiothorac
Surg 42:e1–e8, 2012.
92. Stulak JM, Dearani JA, Burkhart HM, et al.
The increasing use of mechanical pulmonary
valve replacement over a 40-year period, Ann
Thorac Surg 90:2009–2014, 2010. discussion
2014–2005.
93. Oechslin EN, Harrison DA, Harris L, et al.
Reoperation in adults with repair of tetralogy
of fallot: indications and outcomes, J Thorac
Cardiovasc Surg 118:245–251, 1999.
94. Therrien J, Siu SC, Harris L, et al. Impact of
pulmonary valve replacement on arrhythmia
propensity late after repair of tetralogy of
Fallot, Circulation 103:2489–2494, 2001.
95. Renella P, Aboulhosn J, Lohan DG, et al.
Two-dimensional and Doppler echocardiog-
raphy reliably predict severe pulmonary re-
gurgitation as quantified by cardiac magnetic
resonance, J Am Soc Echocardiogr 23:880–886,
2010.
96. Klein AL, Burstow DJ, Tajik AJ, et al. Age-
related prevalence of valvular regurgitation in
normal subjects: a comprehensive color flow
examination of 118 volunteers, J Am Soc
Echocardiogr 3:54–63, 1990.
97. Silversides CK, Veldtman GR, Crossin J, et al.
Pressure half-time predicts hemodynamically
significant pulmonary regurgitation in adult
patients with repaired tetralogy of fallot, J Am
Soc Echocardiogr 16:1057–1062, 2003.
98. Valente AM, Cook S, Festa P, et al. Multimo-
dality imaging guidelines for patients with
repaired tetralogy of fallot: a report from the
AmericanSsociety of Echocardiography: de-
veloped in collaboration with the Society for
Cardiovascular Magnetic Resonance and the
Society for Pediatric Radiology, J Am Soc
Echocardiogr 27:111–141, 2014.
99. Buck T, Mucci RA, Guerrero JL, et al. The
power-velocity integral at the vena contracta:
a new method for direct quantification of
regurgitant
volume flow,
Circulation
102:1053–1061, 2000.
100. Shimada YJ, Shiota M, Siegel RJ, Shiota T.
Accuracy of right ventricular volumes and
function determined by three-dimensional
echocardiography in comparison with mag-
netic resonance imaging: a meta-analysis
study, J Am Soc Echocardiogr 23:943–953,
2010.
In-33_для нас.indd 859
03.04.2019 12:11:20
860 ЧАСТЬ VI Правые отделы сердца
101. Frigiola A, Giardini A, Taylor A, et al. Echo-
cardiographic assessment of diastolic biven-
tricular properties in patients operated for
severe pulmonary regurgitation and associa-
tion with exercise capacity, Eur Heart J Car-
diovasc Imaging 13:697–702, 2012.
102. Rudski LG, Lai WW, Afilalo J, et al. Guide-
lines for the echocardiographic assessment of
the right heart in adults: a report from the
American Society of Echocardiography en-
dorsed by the European Association of Echo-
cardiography, a registered branch of the Eu-
ropean Society of Cardiology, and the Cana-
dian Society of Echocardiography, J Am Soc
Echocardiogr 23:685–713, 2010.
quiz
786–688 .
103. Sabate Rotes A, Bonnichsen CR, Reece CL, et
al. Long-term follow-up in repaired tetralogy
of Fallot: can deformation imaging help iden-
tify optimal timing of pulmonary valve re-
placement? J Am Soc Echocardiogr 27:1305–
1310, 2014.
104. Geva T. Repaired tetralogy of Fallot: the roles
of cardiovascular magnetic resonance in eval-
uating pathophysiology and for pulmonary
valve replacement decision support, J Cardio-
vasc Magn Reson 13:9, 2011.
105. Puchalski MD, Askovich B, Sower CT, et al.
Pulmonary regurgitation: determining severity
by echocardiography and magnetic resonance
imaging, Congenit Heart Dis 3:168–175, 2008.
106. Harrild DM, Powell AJ, Tran TX, et al. Long-
term pulmonary regurgitation following bal-
loon valvuloplasty for pulmonary stenosis
risk factors and relationship to exercise ca-
pacity and ventricular volume and function,
J Am Coll Cardiol 55:1041–1047, 2010.
107. Buechel ER, Dave HH, Kellenberger CJ, et al.
Remodelling of the right ventricle after early
pulmonary valve replacement in children
with repaired tetralogy of Fallot: assessment
by cardiovascular magnetic resonance, Eur
Heart J 26:2721–2727, 2005.
108. Lee C, Kim YM, Lee CH, et al. Outcomes of
pulmonary valve replacement in 170 patients
with chronic pulmonary regurgitation after
relief of right ventricular outflow tract ob-
struction: implications for optimal timing of
pulmonary valve replacement, J Am Coll Car-
diol 60:1005–1014, 2012.
109. Oosterhof T, van Straten A, Vliegen HW, et al.
Preoperative thresholds for pulmonary valve
replacement in patients with corrected tetral-
ogy of Fallot using cardiovascular magnetic
resonance, Circulation 116:545–551, 2007.
110. Therrien J, Siu S, McLaughlin P, et al. Pulmo-
nary valve replacement in adults late after re-
pair of tetralogy of fallot: are we operating too
late? J Am Coll Cardiol 36:1670–1675, 2000.
111. Babu-Narayan SV, Diller GP, Gheta RR, et al.
Clinical outcomes of surgical pulmonary
valve replacement after repair of tetralogy of
Fallot and potential prognostic value of pre-
operative cardiopulmonary exercise testing,
Circulation 129:18–27, 2014.
112. Westhoff-Bleck M, Girke S, Breymann T, et
al. Pulmonary valve replacement in chronic
pulmonary regurgitation in adults with con-
genital heart disease: impact of preoperative
QRS-duration and NT-proBNP levels on
postoperative right ventricular function, Int J
Cardiol 151:303–306, 2011.
113. Therrien J, Siu SC, McLaughlin PR, et al. Pul-
monary valve replacement in adults late after
repair of tetralogy of fallot: are we operating
too late? J Am Coll Cardiol 36:1670–1675,
2000.
114. Bruce CJ, Connolly HM. Right-sided valve
disease deserves a little more respect, Circula-
tion 119:2726–2734, 2009.
115. Cools B, Brown SC, Heying R, et al. Percuta-
neous pulmonary valve implantation for free
pulmonary regurgitation following conduit-
free surgery of the right ventricular outflow
tract, Int J Cardiol 186:129–135, 2015.
116. Guccione P, Milanesi O, Hijazi ZM, Pongi-
glione G. Transcatheter pulmonary valve im-
plantation in native pulmonary outflow tract
using the Edwards SAPIEN transcatheter
heart valve, Eur J Cardiothorac Surg 41:1192–
1194, 2012.
117. Eicken A, Ewert P, Hager A, et al. Percutane-
ous pulmonary valve implantation: two-cen-
tre experience with more than 100 patients,
Eur Heart J 32:1260–1265, 2011.
118. Kenny D, Hijazi ZM, Kar S, et al. Percutane-
ous implantation of the Edwards SAPIEN
transcatheter heart valve for conduit failure
in the pulmonary position: early phase 1 re-
sults from an international multicenter clini-
cal trial, J Am Coll Cardiol 58:2248–2256,
2011.
119. McElhinney DB, Hellenbrand WE, Zahn EM,
et al. Short- and medium-term outcomes af-
ter transcatheter pulmonary valve placement
in the expanded multicenter US melody valve
trial, Circulation 122:507–516, 2010.
In-33_для нас.indd 860
03.04.2019 12:11:20
ПСМК
ЗСМК
Сосудистые
и системные
заболевания
ЧАСТЬ
ЧАСТЬ VII
In-34_для нас.indd 861
03.04.2019 12:11:36
In-34_для нас.indd 862
03.04.2019 12:11:37
863
34 Травма и расслоение аорты
ANN F. BOLGER, MD
Патофизиология расслоения аорты
Анатомия и гистология
Механическое давление и давление
сдвига
Факторы риска
Спектр острых аортальных синдромов
Расслоение аорты
Внутристенная гематома
Пенетрирующая язва аорты
Травма аорты
Визуализация острых аортальных
синдромов
Компьютерная томография
Магнитно-резонансное изображение
Трансторакальная эхокардиография
Чреспищеводная эхокардиография
Неубедительные данные при
чреспищеводной эхокардиографии
Хирургические вмешательства
Регургитация через аортальный клапан
Регургитация через митральный клапан
Перфузия дистального сосудистого ложа
Обсуждение эндоваскулярного
восстановления
Наблюдение за пациентами после
расслоения аорты
Заключение
Расслаивающая аневризма аорты — жизнеугрожа-
ющее состояние, частотой встречаемости 14 человек
на 100 000 ежегодно [1]. Летальность приблизитель-
но в 70% случаев при остром расслоении аорты,
включающих восходящий отдел аорты, растет по-
часово [2] и достигает 50% к 48-му часу ее существо-
вания. Немедленная диагностика и проведение ле-
чения являются крайне важными факторами выжи-
вания. Большое клиническое значение имеет то, что
симптомы этой патологии у пациента неспецифич-
ны или даже могут вводить в заблуждение.
Диагноз «расслоение аорты» необходимо вклю-
чать в дифференциально-диагностический алго-
ритм у больных с болевым синдромом в грудной
клетке у пациентов группы риска, а также у больных
с одновременным острым поражением нескольких
систем органов без объяснимых причин.
В настоящее время признано, что расслоение
аорты является частью более обширной группы
острой патологии аорты (табл. 34.1), которые могут
иметь сходные особенности острого развития, про-
гноз, методы лечения и этиологию.
Их разделение часто временное, а не этиологиче-
ское: внутристенная гематома и пенетрирующая
язва могут прогрессировать в расслоение аорты при
дальнейшем развитии процесса. Критическая роль
визуализации заключается в том, чтобы определить
особенности острой патологии аорты и факторы
высокого риска, которые требуют экстренного кли-
нического решения. Оптимальный диагностиче-
ский метод для выявления острого расслоения аор-
ты должен быть точным, безопасным и доступным
в широкой медицинской практике.
ПАТОФИЗИОЛОГИЯ РАССЛОЕНИЯ АОРТЫ
АНАТОМИЯ И ГИСТОЛОГИЯ
Стенка аорты имеет три слоя: интима, которая пред-
ставлена одним слоем сосудистого эндотелия; ме-
диа, с концентрическими слоями гладкомышечных
клеток, коллагена, эластина и внеклеточного проте-
огликанового матрикса; и периферическая адвенти-
ция, состоящая из соединительной ткани, которая
связывает аорту с окружающими тканями. Соб-
ственные сосуды сосудистой стенки, которые обе-
спечивают перфузию стенки аорты, располагаются
в адвентиции. Из трех слоев стенки аорты механи-
ческие свойства стенки сосуда обусловливает преи-
мущественно медиа [3]. Гладкие мышцы медии
непосредственно влияют на жесткость стенки при
сокращении. Кроме того, гладкомышечные клетки
являются главным источником компонентов вне-
клеточного матрикса. Они включают волокна эла-
стина, которые могут растягиваться на 300% от их
длины в состоянии покоя без разрыва [4] и являют-
ся важным компонентом, обеспечивающим нор-
мальную пульсацию сосуда. Однако эластин менее
важен в отношении общей прочности аорты, чем
коллаген, который как более жесткий, так и намно-
го более прочный, чем эластин.
Компоненты медии варьируют в различных со-
судах и изменяются с возрастом. В аорте пожилых
пациентов содержание эластина уменьшается, а
коллагена увеличивается, что увеличивает жесткость
сосудистой стенки [4]. Механические свойства сосу-
дов также почти всегда нарушаются при развитии
артериальной гипертензии [5].
In-34_для нас.indd 863
03.04.2019 12:11:37
864
ЧАСТЬ VII Сосудистые и системные заболевания
Тип
Классификация
Расслоение аорты Вовлечение
восходящего
отдела аорты
Стэнфорд тип A
Тип I по Дебейки
Тип II по Дебейки
Университет Алабама
восходящий
Больница
Массачусетс
проксимальный
Восходящий
отдел аорты
не вовлечен
Стэнфорд тип B
Тип III по Дебейки
Университет Алабама
нисходящий
Больница
Массачусетс
дистальный
Интрамуральная
гематома
Пенетрирующая
язва аорты
Травматическое
повреждение
аорты
ТАБЛИЦА 34.1 Классификация острого аортального
синдрома
Диаметр аорты взрослого уменьшается в дис-
тальном направлении от 2,1 см/м2 в области восхо-
дящего отдела аорты до 1,6 см/м2 на уровне дуги
аорты [6]. Размер аорты увеличивается с возрастом
в подростковом периоде на 1–2 мм в год; старение
связано с потерей эластичности и увеличением
жесткости стенки этого сосуда. Стандартизованные
измерения размера аорты проводятся по-разному
взрослыми и педиатрическими кардиологами, и на
разных участках с помощью эхокардиографии
(ЭхоКГ), компьютерной томографией (КТ) и маг-
нитно-резонансной томографией (МРТ). Учитывая
клиническую важность определения и отслежива-
ния размеров аорты у пациентов с риском развития
заболеваний аорты, были предложены специфиче-
ские методы и показатели [7].
МЕХАНИЧЕСКОЕ ДАВЛЕНИЕ И ДАВЛЕНИЕ СДВИГА
Стенка аорты подвергается влиянию механического
давления в радиальном, центробежном или про-
дольном направлениях. В норме на интиму аорты
воздействует небольшая нагрузка давлением. Одна-
ко она подвергается давлению сдвига, которое на-
правлено параллельно стенке сосуда и обусловлено
эффектом воздействия вязкости тока крови. Коли-
чественное выражение давления сдвига варьирует в
зависимости от скорости кровотока через просвет
сосуда и местной геометрии сосуда.
Центробежное давление в основном воздейству-
ет на медию. Этот тип давления (δ) увеличивается в
прямой пропорциональности с радиальным давле-
нием в просвете аорты (P) и радиусом аорты (r) и
уменьшается с увеличением толщины стенки (h):
δ = Pr/2h.
Поэтому становится понятна опасность расши-
рения аорты: при расширении просвета и истонче-
нии стенки аорты центробежное давление на протя-
жении длительного периода времени может превы-
шать норму. Кроме того, геометрия расширенной
аорты прогрессивно изменяется от нормального
цилиндра до эллипса или даже сферы. Это медлен-
но увеличивает центробежное давление, но быстро
повышает продольное давление. Самые атравмати-
ческие разрывы стенки аорты вызваны продольным
давлением, что объясняет, почему они обычно име-
ют поперечное направление [8]. Восходящий отдел
аорты испытывает дополнительное продольное
давление вследствие движения кольца клапана. На-
конец, расширенный сосуд или сосуд с наличием
аневризмы демонстрирует выраженное увеличение
жесткости, в частности, из-за потери эластичности
[9]. Сочетание расширения аорты, истончения стен-
ки и изменения формы определяют стадию, на ко-
торой происходит разрыв интимы и начинается
расслоение аорты.
Аномалии развития интимы и/или медии увели-
чивают резистентность как к давлению сдвига, так
и к центробежному давлению. Недостаточное дав-
ление обоих типов может играть роль в возникно-
вении расслоения аорты. Недостаточное центро-
бежное давление может встретиться, когда воздей-
ствие, вызванное давлением в просвете сосуда,
значительно увеличивается на тонком фиброзном
покрытии атеросклеротической бляшки. При раз-
рыве поражения и формировании небольшой тре-
щины центробежное давление способствует ее углу-
блению вглубь стенки сосуда [4]. Снижение давле-
ния сдвига является результатом неоднородности
свойств стенки сосуда. Даже в норме интрамураль-
ное давление на внутреннюю часть стенки больше,
чем на внешнюю [10]. При наличии атеросклероза
пошаговые изменения сопротивления сдвига воз-
никают между патологически измененными и нор-
мальными участками стенки сосуда. Прогрессирую-
щее расслоение аорты, вероятно, является приме-
ром нарушения сдвига между двумя сегментами
аорты, когда внутренняя поверхность между двумя
сегментами аорты с различной жесткостью приво-
дит к расслоению медии и интимы; два слоя сколь-
зят друг относительно друга, т.к. адгезивные свой-
ства внеклеточного матрикса не могут выдержать
давления сдвига [4].
In-34_для нас.indd 864
03.04.2019 12:11:37
865
34 Травма и расслоение аорты
Однажды возникшее расслоение аорты ведет се-
бя подобно двойной трубке. Интима и внутренняя
эластичная тонкая пластинка медии формируют
внутренний слой, в то время как внешний слой со-
стоит из внешней эластичной тонкой пластинки и
адвентиции. В таком случае давление сдвига будет
прогрессивно отделять эти два слоя, создавая лож-
ный просвет, отделенный от истинного просвета
интимой и внутренней эластической тонкой пла-
стинкой (рис. 34.1). Экспериментально было пока-
зано, что работа на единицу площади ткани, необ-
ходимая для распространения разрыва аорты, не
большая (15,9 ± 0,9 мДж см–2) и не зависит от глу-
бины разрыва [10]. Эти понятия нарушения давле-
ния сдвига и растяжения являются основой для
понимания, почему различные группы пациентов
имеют повышенный риск расслоения аорты. Деге-
неративные изменения эластических волокон, обу-
словленные наследственными изменениями стенки
сосуда, являются основой для возникновения рас-
слоения аорты у пациентов с синдромом Марфана,
Тернера [11], Нунана, Элерса–Данло и незавершен-
ным остеогенезом [8, 12]. У этих больных, так же
как и в других группах пациентов, расширение
аорты является важным признаком нарушения
растяжимости и прогностическим фактором разви-
тия расслоения аорты.
Как нарушения стенки сосуда (нарушения давле-
ния сдвига), так и увеличение давления на стенку
сосуда (нарушение растяжимости) вызванные рас-
ширением сосуда имеют важное значение в группах
риска, не имеющих наследственных факторов. Рас-
слоение аорты у больных с гипертензионными на-
рушениями обычно возникает вследствие повы-
шенного давления на стенку сосуда, умеренного
расширения сосуда и дегенеративных изменений
мышечных волокон медии, которые предрасполага-
ют к разрыву интимы [8]. Влияние давления сдвига
у этой группы больных встречается редко и не име-
ет прогностического значения.
Расслоение аорты, связанное с тупой травмой,
возникает из-за острой и чрезмерной силы, как пра-
вило, при торможении. Наиболее предрасположен-
ным к повреждению является перешеек аорты, ко-
торый относительно фиксирован позвоночными
артериями и артериальной связкой, поэтому более
склонен к повреждению при внезапном торможе-
нии, чем более подвижная, поперечная часть аорты
[13]. Другие уязвимые места включают место от-
хождения правой брахицефалической артерии, осо-
бенно при воздействии вертикальных сил при паде-
нии, и восходящий отдел аорты выше синуса Валь-
сальвы.
ФАКТОРЫ РИСКА
Из-за их высокой распространенности, артериаль-
ная гипертензия, атеросклероз и аневризма аорты
являются наиболее частыми состояниями, которые
приводят к расслоению аорты. До 14% пациентов с
диссекцией аорты, по информации Международно-
го регистра острых расслоений аорты, имели пред-
существующую аневризму аорты [14]. Реже этиоло-
гическими факторами могут быть беременность,
воспалительные процессы, врожденные коллагено-
зы, или двухстворчатый аортальный клапан. Упо-
требление кокаина, травма и ятрогенные нарушения
целостности сосудистой стенки при проведении
хирургических вмешательств или катетеризации
сердца могут быть причиной расслоения аорты
(табл. 34.2) [15–19].
Несмотря на то что расслоение аорты в боль-
шинстве случаев заболевание мужчин среднего и
пожилого возраста, оно может встречаться у жен-
щин и детей. Как утверждалось, так и оспаривалось,
что половина всех расслоений аорты, которые раз-
виваются у женщин в возрасте до 40 лет, связаны с
беременностью, особенно на протяжении третьего
триместра или послеродового периода [20–21]. Рас-
пространенной причиной расслоения аорты у мо-
лодых женщин является синдром Тернера. Данная
группа пациентов подвергаются риску в любом
возрасте, но наибольшим риск считается в подрост-
ковом возрасте и во время беременности [22].
Синдром Марфана, системное заболевание сое-
динительной ткани, вызванное мутациями во вне-
клеточном матриксе протеина фибриллин, является
наиболее распространенным и наиболее изученным
среди генетических причин патологии медии аорты
[23]. Гистологическое исследование стенки аорты у
пациентов с синдромом Марфана выявляет фраг-
ментацию компонентов аорты, особенно эластиче-
ских волокон, и патологическое накопление коллаге-
ЛЖ
Отслойка
интимы
ПКА
ЛП
Ложный
просвет
аорты
Истинный
просвет
аорты
Перикардиальная жидкость
Рис. 34.1 Расслоение аорты. В восходящем отделе аорты определяется
отслойка интимы, который отделяет истинный просвет аорты от ложного про-
света. Отслойка может распространяться до правой коронарной артерии (ПКА),
обусловливая ишемию миокарда, либо дальше — в полость перикарда с об-
разованием перикардиальной жидкости (геморрагической), приводя к тампо-
наде сердца. Кроме того, расслоение может разрушать место прикрепления
створок аортального клапана, в результате увеличивается их подвижность
(стрелка) и возникает аортальная регургитация. ЛЖ
—
левый желудочек;
ЛП — левое предсердие.
In-34_для нас.indd 865
03.04.2019 12:11:37
866 ЧАСТЬ VII Сосудистые и системные заболевания
на и муцина в медии. Эти изменения более выражены
в восходящем отделе аорты, который подвергается
большому пульсационному расширению и соответ-
ственно более высокому давлению на стенку в фазу
систолы [8]. Нарушения эластичности стенки аор-
ты формируются независимо от диаметра аорты.
Эхокардиографические признаки расширения
корня аорты определяется у 60–80% больных с син-
дромом Марфана [24]. Частота клинического тече-
ния синдрома Марфана с прогрессирующим рас-
ширением аорты и возникновением расслоения
аорты вариабельна. Повышенный риск сочетается с
пожилым возрастом, мужским полом, диаметром
корня аорты > 60 мм, скоростью увеличения диаме-
тра аорты и наличием расслоения аорты у родствен-
ников [25, 26]. В одном из исследований больные с
синдромом Марфана были разделены на две группы
в зависимости от скорости увеличения диаметра
аорты. На большом количестве наблюдений пока-
зано, что расслоение аорты возникает у пациентов
с синдромом Марфана даже при отсутствии расши-
рения корня аорты [27].
Пациенты с двухстворчатым аортальным клапа-
ном, наиболее распространенным врожденным по-
роком сердца, в 5% случаев подвергаются риску
расслоения аорты [28]. Как и при синдроме Марфа-
на, гистологическое исследование аорты при двух-
створчатом аортальном клапане демонстрирует
кистозный некроз медии с выраженным увеличени-
ем экспрессии металлопротеаз 2-го и 9-го типов.
Важно помнить, что замена патологически изме-
ненного клапана не устраняет прогрессирования
расширения корня аорты или повышенного риска
ее расслоения. Согласно рекомендациям (табл. 34.3)
замена восходящего отдела аорты показана в том
случае, если диаметр аорты превышает 50 мм [29],
хотя риск расслоения не может четко определяться
только по размерам аорты [30].
СПЕКТР ОСТРЫХ АОРТАЛЬНЫХ СИНДРОМОВ
РАССЛОЕНИЕ АОРТЫ
Расслоение аорты определяется как разделение ин-
тимы и внутреннего слоя медии от наружного слоя
медии и адвентиции аорты, что создает карман ин-
тимы, который отделяет истинный просвет аорты
от ложного просвета, в котором может наблюдаться
активный кровоток или тромбоз просвета. Причи-
ной развития расслоения аорты является поражение
медии, что создает гематому в стенке аорты; после-
дующий разрыв вышележащих тканей создает
пульсирующий кровоток в тканях медии. Место
первичного разрыва обычно имеет поперечное на-
правление и поражает более половины окружности
аорты. В 65% случаев разрыв локализуется на рас-
стоянии до 3 см от устья коронарных сосудов. 10%
разрывов интимы локализуются в нисходящем от-
деле аорты и еще 10% в дуге аорты. Первичный
разрыв редко встречается в брюшном отделе аорты
[31].
Независимо от локализации первичного разрыва
интимы расслоение может прогрессировать дис-
тально, проксимально, а иногда в обоих направле-
ниях.
КЛАССИФИКАЦИЯ
На сегодняшний день используются несколько ви-
дов классификаций расслоения аорты (см. табл.
34.1). Классификация Дебейки основана на разделе-
нии расслоения аорты в зависимости от вовлечения
в процесс восходящего отдела аорты. I тип расслое-
ния характеризуется расслоением восходящего от-
дела аорты с распространением на поперечный от-
дел аорты и дистальный участок часть аорты. II тип
расслоения аорты характеризуется ограничением
Генетические нарушения (Medial Abnormalities)
Синдром Марфана
Синдром Тернера
Синдром Нунана
Синдром Элерса–Данлоса
Незавершенный остеогенез
Врожденные нарушения
Коарктация аорты
Двухстворчатый аортальный клапан
Дегенеративные процессы
Артериальная гипертензия
Атеросклероз сосудов
Изъязвление стенки аорты
Аневризма аорты
Кистозный некроз медии, не связанный с синдромом
Марфана
Травматические причины
Повреждения при торможении
Проникающие повреждения
Прием Геймлиха
Осложнения вмешательств в грудной клетке
Хирургические вмешательства на сердце
Канюлирование
Кросс-клампинг
Замена аортального клапана
Ангиопластика
Коронарных сосудов
Почечных сосудов
Воспалительные заболевания
Сифилис
Гигантоклеточный артериит
Другие состояния
Беременность
Занятия тяжелой атлетикой
Употребление кокаина
Прекращение приема бета-блокаторов
Поликистозная болезнь почек
ТАБЛИЦА 34.2 Группы риска по расслоению аорты
In-34_для нас.indd 866
03.04.2019 12:11:37
867
34 Травма и расслоение аорты
в области восходящего отдела аорты, однако рассло-
ение в дистальном участке сосуда может обусловли-
вать риск поздних осложнений, поэтому выявление
двух изолированных участков расслоения имеет
важное значение для выбора метода лечения и по-
следующего наблюдения [36]. Очень часто встреча-
ются множественные разрывы интимы в дисталь-
ном участке аорты, которые уменьшают давление в
ложном просвете сосуда.
ТЕЧЕНИЕ
Расслоения аорты также разделяют на основании их
течения. Острым считается расслоение аорты на
протяжении 14 дней после возникновения клиниче-
ских симптомов. Хроническое расслоение аорты —
наличие этого состояния через 2 нед после появле-
ния клинических проявлений. Это разделение про-
ведено произвольно. Оно обусловлено тем, что
большинство пациентов с расслоением аорты Тип
A, при отсутствии лечения погибают в течение пер-
вых 2 нед. Хроническое расслоение может диагно-
стироваться как случайная находка или на основа-
нии клинических проявлений. Оно дифференциру-
ется от аневризмы аорты по наличию кармана
интимы и ложного просвета. Это может быть труд-
но выполнить в том случае, если ложный просвет в
значительной степени тромбирован.
ОСЛОЖНЕНИЯ
Осложнений расслоения аорты много и они вариа-
бельны. Обструкция отходящих сосудов может об-
условливать острую ишемию миокарда, форми-
рование инфарктов головного и спинного мозга,
кишечника или почки. Расширение кольца аор-
тального клапана с регургитацией, тампонада серд-
ца вследствие ретроградного распространения на
перикард, открытый разрыв аорты — чрезвычайно
болезненные осложнения.
ВНУТРИСТЕНОЧНАЯ ГЕМАТОМА
Небольшое количество расслоений аорты, которое
оценивается в 3–5%, возникает без видимых нару-
шений интимы [37]. Патологический процесс в та-
ком случае с формированием гематомы стенки
аорты связан с разрывом сосудов vasa vasorum в
области дегенерации интимы, или возможном раз-
рыве атеросклеротической бляшки без повреждения
интимы. Пациенты с этой формой заболевания
имеют пожилой возраст (средний возраст 70 лет, в
сравнении с 56 годами при расслоениях аорты, име-
ющих связь с ее просветом) и обычно — длительно
текущую хроническую артериальную гипертензию.
Клиническое течение сходно с расслоением аор-
ты, с высокой частотой расширения аорты, обу-
словленной дилатацией ложного просвета, выпотом
в полости перикарда и плевры, регургитацией через
аортальный клапан, разрывом аорты и прогресси-
2015 Американское эхокардиографическое общество/
Европейская ассоциация сердечно-сосудистых изображе-
ний. Руководство по мультимодальной визуализации
заболеваний грудной части нисходящего отдела аорты у
взрослых [7]
2014 Европейское общество кардиологов. Руководство по
диагностике и лечению заболеваний аорты [7a]
2014 Отчет Канадского сердечно-сосудистого общества по
поводу лечения заболеваний грудной части нисходящего
отдела отдела аорты [7b]
2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM
рекомендации по диагностике и лечению пациентов с
заболеваниями грудной части нисходящего отдела аорты
[29]
ТАБЛИЦА 34.3 Последние клинические рекомендации
процесса только восходящим отделом аорты. III тип
расслоения по классификации Дебейки повреждает
только нисходящий отдел аорты [32]. Стэнфорд-
ская классификация [33] основана на функциональ-
ном подходе, определяющем вовлекается ли восхо-
дящий отдел аорты, не учитывая локализацию
первичного разрыва интимы и наличие распростра-
нения на дистальный участок аорты. Это отражает
клинические наблюдения, что течение расслоения
аорты, клинический прогноз и каким образом необ-
ходимо вести пациента зависит практически исклю-
чительно от того, распространяется ли процесс на
восходящий отдел аорты. Эта система номенклату-
ры описывает Тип А расслоения как любое рассло-
ение аорты с вовлечением ее восходящего отдела
(включает типы I и II Дебейки) и тип В расслоения
как расслоение, ограниченное нисходящим отделом
аорты (тип III Дебейки).
Клинические схемы классификации расслоения
аорты, описанные выше, не учитывают расположе-
ние места первичного разрыва интимы и распро-
странение расслоения аорты. Эти два фактора име-
ют меньшее прогностическое значение, а их опреде-
ление может быть технически затруднено. При
возможности установить место первичного разрыва
интимы легче выполнить его резекцию. Несмотря
на то что успешная резекция места разрыва не ока-
зывает влияния на частоту ранней и поздней выжи-
ваемости после оперативного вмешательства, но
уменьшает частоту повторных операций в позднем
послеоперационном периоде [34].
Некоторые случаи расслоения аорты могут иметь
несколько первичных разрывов интимы. Два изоли-
рованных участка расслоения аорты у одного паци-
ента могут быть более частым, чем описывалось
ранее. Робертс и Робертс [35] сообщают, что в 3 из
40 случаев проведения патологоанатомического
вскрытия имелись изолированные участки расслое-
ния аорты в проксимальном и дистальном участках
грудной части аорты. Несмотря на то что все ле-
тальные осложнения были обусловлены разрывом
In-34_для нас.indd 867
03.04.2019 12:11:37
868 ЧАСТЬ VII Сосудистые и системные заболевания
рованием до классического расслоения. Ранний
прогноз у пациентов с внутристенной гематомой
аорты может быть несколько лучше, чем у пациен-
тов с острым «сообщающимся» расслоением; это
может отражать тенденцию к образованию тромба
в расслоенном пространстве медии, не сообщаю-
щимся с просветом аорты [38, 39]. Первоначальная
медикаментозная терапии с агрессивным гипотен-
зивным лечением и частым динамическим контро-
лем с использованием средств визуализации, и
плановым оперативным лечением пациентов, у
которых возникли осложнения, может быть пред-
ложена для некоторых пациентов [40].
ПЕНЕТРИРУЮЩАЯ ЯЗВА АОРТЫ
Изъязвление атеросклеротической бляшки во вну-
тренней эластической оболочке аорты создает пене-
трирующую атероматозную язву [41]. Пациенты с
такими язвами, как правило, пожилые и имеют
другие факторы сердечно-сосудистого риска, а так-
же диффузный атеросклероз. Язвы расположены
преимущественно в нисходящем отделе аорты, где
атеросклеротический процесс, как правило, более
выраженный. Они могут прогрессировать до обра-
зования аневризм, внутристеночных гематом, рас-
слоения или разрыва. Противоречивым остается
мнение о выборе медикаментозной терапии или
хирургического лечения этих поражений.
ТРАВМА АОРТЫ
Внутригрудной отдел аорты может повреждаться
при проникающей или тупой травме, в частности,
в случаях, которые связаны с воздействием высоких
энергий и/или выраженного торможения. Местом
поражения чаще всего является перешеек аорты.
Механизм травмы в первую очередь связан с разры-
вом адвентиции. Это создает высокий риск леталь-
ного кровотечения, которое возникает почти в 80%
случаев тупой травмы аорты. В некоторых случаях
структуры средостения сдерживают разрыв, но поч-
ти во всех случаях в течение 24 час при отсутствии
лечения произойдет полный разрыв [42].
Другие манифестации травмы аорты включают
расслоение, внутристеночную гематому, образова-
ние тромбов и ложную аневризму. Несмотря на то,
что незначительные повреждения, такие как не-
большие гематомы, могут разрешаться спонтанно,
прогноз значимых травм аорты неблагоприятный.
Без оперативного лечения летальность в первые 24
час составляет 30%. В течение 1 нед летальность
превышает 50% пациентов [43].
ВИЗУАЛИЗАЦИЯ ОСТРЫХ АОРТАЛЬНЫХ
СИНДРОМОВ
ЭхоКГ является лишь одним из нескольких диагно-
стических методов при остром аортальном синдро-
ме. Выбор преимущества одного метода над другим,
а также клиническая уверенность в положительных
или отрицательных результатах должна быть оце-
нена по отношению к результатам каждой методики
(табл. 34.4 –34.6).
Метаанализ 16 исследований, включающих 1139
пациентов, рассматривает надежность чреспище-
водной эхокардиографии (ЧПЭхоКГ), спиральной
КТ и магнитно-резонансного исследования у этой
группы больных [44]. Чувствительность и специ-
фичность этих методов были эквивалентны. После
стратификации пациентов перед проведением ис-
следования по вероятности наличия расслоения
аорты (признаки высокого риска включали типич-
ную кинжальную боль в груди и спине, гипотонию
и перебои пульса), коэффициент положительного
соответствия диагноза был выше для МРТ. Это
предполагает, что МРТ — наиболее надежный ме-
тод подтверждения расслоения аорты у пациентов с
высокой вероятностью этой патологии до проведе-
ния диагностических исследований.
Спиральная КТ имеет самый низкий отрицатель-
ный коэффициент соответствия из всех трех мето-
дов. Это предполагает, что ее лучше всего исполь-
зовать для исключения расслоения аорты у пациен-
тов с низким риском. Ангиография является
диагностическим методом расслоения аорты, требу-
ющим времени для его проведения, но она позво-
ляет идентифицировать карман интимы и ложный
просвет, а также вовлечение в процесс коронарных
или магистральных сосудов. Однако его чувстви-
тельность и специфичность при расслоении аорты
(88 и 94% соответственно [45]) ограничены тромбо-
зом ложного просвета, внутристенными гематома-
ми и эквивалентностью кровотока в ложном и ис-
тинном просвете аорты [46]. Последнее состояние
является и важным ограничением для КТ, когда
дифференцировать кровоток не позволяет даже ди-
намическая КТ. Постоянное усовершенствование
методов КТ улучшило ее эффективность при оцен-
ке пациентов с расслоением аорты в сравнении с
используемыми ранее методами с меньшим про-
странственным и временным разрешением. Тем не
менее, несмотря на высокую специфичность КТ (до
100% в некоторых случаях), ее отрицательные ре-
зультаты при наличии выраженных клинических
подозрений требуют проведения второго под-
тверждающего исследования. Это утверждение так-
же верно в случае противоречивой клинической
картины.
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
КТ — это мощный и быстрый инструмент для вы-
явления острых аортальных синдромов (рис. 34.2).
Использование ЧПЭхоКГ в отделении неотложных
состояний в таких случаях остается далеко не веду-
щим методом в клиниках, в которых доступно про-
ведение КТ. КТ пациентов с обширными травмами
In-34_для нас.indd 868
03.04.2019 12:11:37
869
34 Травма и расслоение аорты
Методика
Чувствительность (%) Специфичность (%)
Положительное
прогностическое
значение (%)
Отрицательное
прогностическое
значение (%)
Точность (%)
ТТЭхоКГ [70]
77
93
ТТЭхоКГ [71]
59
83
ТТЭхоКГ [72]
83
63
80
70
75
ЧПЭхоКГ [71]
98
77
ЧПЭхоКГ [2]
98
97
98
97
97
ЧПЭхоКГ [72]
100
68
82
100
87
Ангиография [70]
88
94
96
84
Ангиография [2]
88
97
97
85
91
Магнитно-резонансное
исследование [72]
100
100
100
100
100
Магнитно-резонансное
исследование [71]
98
98
Компьютерная томо-
графия [73]
83
100
100
86
Компьютерная томо-
графия [74]
100
100
100
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 34.4 Методы визуализации расслоения аорты
Чувствительность
Специфичность
Обнаружение интрамуральной
гематомы
Идентификация входа
ТТЭхоКГ
++
++
+
–
ЧПЭхоКГ
+++
+++
++
++
КТ
+++
+++
+++
+++
МРТ
+++
+++
+++
+++
КТ — компьютерная томография; МРТ — магнитно-резонансная томография; ТТЭхоКГ — трансторакальная эхокардиография;-
ЧПЭхокг — чреспищеводная эхокардиография.
[Cigarroa JE, Isselbacher EM, DeSanctis RW, Eagle KA. Diagnostic imaging in the evaluation of suspected aortic dissection. Old standards and new
directions. N Engl J Med 328:35–43, 1993; Isselbacher EM: Trends in thoracic aortic aneurysms and dissection: out of the shadows and into the light.
Circulation 130:2267–2268, 2014.]
ТАБЛИЦА 34.5 Методы диагностики острой патологии аорты
и возможным повреждением аорты позволяет по-
лучить значительно более достоверную оценку воз-
можных поражений. Согласованная стратегия фор-
мирования изображения может также опираться на
более чем один метод визуализации, т.к . уникаль-
ные преимущества одного метода могут компенси-
ровать недостатки другого. ЧПЭхоКГ может быть
методом выбора у пациентов при наличии проти-
вопоказаний к проведению контрастной КТ или
магнитно-резонансного сканирования либо быть
методом второго порядка, когда при использовании
вышеуказанных методов визуализируются арте-
факты, что вызывает сомнения в полученных ре-
зультатах.
КТ демонстрирует распространение расслоения
на магистральные сосуды, что не может подтвер-
дить ЧПЭхоКГ. Чаще КТ особенно полезна в слу-
чаях, когда отсутствуют доказательства вовлечения
в процесс дистального участка восходящего отдела
аорты. Другая важная роль КТ заключается в уточ-
нении неоднозначных результатов ЧПЭхоКГ. Ча-
стота ложноотрицательных исследований ЧПЭ-
хоКГ в больших группах пациентов была мини-
мальной [46], и положительные ангиографические
данные или результаты КТ при отрицательных
данных, полученных при ЧПЭхоКГ, встречаются
редко.
МАГНИТНО-РЕЗОНАНСНОЕ ИССЛЕДОВАНИЕ
Чувствительность МРТ для расслоения аорты при-
ближается к 100% (рис. 34.3) [47]. Однако прагма-
тичные проблемы визуализации приводят к тому,
что таким тяжелобольных пациентам, как больные
In-34_для нас.indd 869
03.04.2019 12:11:38
870
ЧАСТЬ VII Сосудистые и системные заболевания
с травмой или необходимостью гемодинамического
мониторинга или инфузии лекарств или пациен-
там, с риском гемодинамического коллапса, продол-
жают выполнять КТ или ЧПЭхоКГ, что является
более предпочтительным в острых ситуациях, за
исключением клинических ситуаций, когда подо-
зрения невелики или пациенты находятся в ста-
бильном состоянии.
Рис. 34.2 Компьютерная томография как метод диагностики рассло-
ения аорты. На компьютерной томографии определяется выраженная анев-
ризматическая дилатация восходящей отдела аорты, с лоскутом интимы, ко-
торый простирается до дуги и нисходящих отделов грудной и брюшной частей
аорты. Сосуды, отходящие от дуги аорты, могут быть идентифицированы.
Компьютерная томография является быстрой и широко доступной; для оценки
наличия и механизма аортальной регургитации или физиологии тампонады,
вызванной перикардиальным выпотом, может потребоваться дополнительная
ТТЭхоКГ или ЧПЭхоКГ.
Регургитация на аортальном
клапане
Вовлечение коронарных
артерий
Перикардиальный
выпот
Вовлечение сосудов
дуги аорты
ТТЭхоКГ
+++
–
+++
–
ЧПЭхоКГ
+++
++
+++
+
КТ
–
+
++
++
МРТ
++
–
++
++
КТ — компьютерная томография; МРТ — магнитно -резонансная томография; ТТЭхоКГ — трансторакальная эхокардиография;-
ЧПЭхокг — чреспищеводная эхокардиография.
[Cigarroa JE, Isselbacher EM, DeSanctis RW, Eagle KA. Diagnostic imaging in the evaluation of suspected aortic dissection. Old standards and new
directions. N Engl J Med 328:35–43, 1993; Isselbacher EM: Trends in thoracic aortic aneurysms and dissection: out of the shadows and into the light.
Circulation 130:2267–2268, 2014.]
ТАБЛИЦА 34.6 Способы обнаружения осложнений острых аортальных синдромов
ТРАНСТОРАКАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Когда подозревается острое расслоение аорты, вре-
мя имеет существенное значение. Трансторакальная
эхокардиография (ТТЭхоКГ) может обеспечить не-
медленные и информативные изображения прокси-
мального участка аорты, дуги и нисходящего отдела
аорты. Хотя изображения ТТЭхоКГ ограничены
«доступным окном» и имеют ограниченную чув-
ствительность, с помощью данного метода можно
получить первые изображения подвижного отслое-
ния интимы или усилить подозрение в отношении
расслоение аорты (рис. 34.4 –34.6), что может по-
мочь в выборе ранней терапии и позволит мобили-
зовать другие ресурсы. Хотя ТТЭхоКГ не является
достаточным методом для исключения расслоения
аорты, ее результаты могут помочь с выбором лече-
нии путем быстрого определения состоятельности
аортального клапана, дисфункции желудочков и
выявления локальных нарушений сократимости.
Также могут быть выявлены тампонада и получены
доказательства обструкции коронарных артерий,
как и другие причины острой боли в груди или ге-
модинамического коллапса, такие как эмболия ле-
гочной артерии.
Большинство отделений неотложной помощи
имеют ультразвуковое оборудование, которое мо-
жет использоваться персоналом для определения
наличия экссудативного перикардита, используя
стандартны исследования FAST (Основные ориен-
тиры ультразвукового исследования при травме).
Важно помнить, что компетентность FAST не рас-
пространяется на обнаружение расслоения, и, не-
смотря на то, что с их помощью можно заметить
перикардиальный выпот, другие явные признаки
расслоения могут остаться незамеченными (рис.
34.7). Учитывая все более широкое использование
персоналом экстренных отделений УЗИ аппарата в
местах оказания медицинской помощи, который
имеет ограничения, эти важные детали могут слу-
жить руководством для принятия ранних решений
о сортировке пациентов в соответствии с получен-
ными изображениями.
Дополнительной и нередкой ситуацией, в кото-
рой ТТЭхоКГ играет важную роль, является обна-
In-34_для нас.indd 870
03.04.2019 12:11:38
871
34 Травма и расслоение аорты
Рис. 34.3 Магнитно-резонансная ангиография как метод диагностики
расслоения аорты. МРТ с усилением гадолином может использоваться для
получения 3D-изображения аорты и ее ветвей. Последующее наблюдение па-
циентов после острого расслоения аорты требует тщательного сопоставления
размеров аорты; магнитно-резонансное исследование является чрезвычайно
полезным для этого методом исследования. Рисунок демонстрирует хрониче-
ское расслоение аорты (стрелка показывает карман интимы), который распро-
страняется до уровня почечных артерий.
ружение пропущенных хронических расслоений
аорты. На амбулаторном этапе с помощью ТТЭхоКГ
можно обнаружить пациентов с аневризмой аорты
или подвижным лоскутом интимы. Поддержание
высокого уровня настороженности является обяза-
тельным, и пациенты с подозрительными «находка-
ми» должны немедленно направляться на дополни-
тельные варианты визуализации.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
Внутригрудной отдел аорты хорошо визуализиру-
ется из пищеводного доступа (рис. 34.8), за исклю-
чением хорошо определяемого «с лепого» пятна,
создаваемого трахеей, расположенной между пище-
водом и сердцем. Оно затеняет часть дистального
участка восходящего отдела аорты, верхний отдел
поперечной дуги и место отхождения магистраль-
ных сосудов. В результате расслоение, ограниченное
этими областями, может быть пропущено при про-
ведении только ЧПЭхоКГ. Это вызывает озабочен-
ность, т.к. клиническая тактика и лечебные подходы
к пациенту в значительной степени зависят от того,
вовлечен ли в процесс проксимальный участок аор-
ты [48]. Несмотря на это, хорошо документировано,
что ЧПЭхоКГ имеет высокую чувствительность и
специфичность для выявления острого расслоения
аорты. Более важным аргументом относительно
проведения ургентной ЧПЭхоКГ при остром аор-
тальном синдроме являются временные задержки в
ее проведении (многие клиники не имеют в немед-
ленной доступности персонал для проведения этого
исследования, и время готовности исчисляется ча-
сами), а также необходимость проведения седации,
что требует согласия пациента. Возможность непол-
ной визуализации всех сегментов грудной части
нисходящего отдела отдела аорты и связанная с
этим неубедительность результатов ограничивают
использование экстренной ЧПЭхоКГ при доступ-
ности других методик, имеющих высокую надеж-
ность.
Многочисленные исследования показали, что
специфичность и чувствительность ЧПЭхоКГ со-
ставляют 98 и 99% соответственно. Наличие участ-
ков сосуда, которые часто недоступны для про-
ведения исследования (дистальный участок вос-
ходящего отдела аорты и верхняя часть дуги
аорты), — важное ограничение, особенно учиты-
вая, что наличие входного отверстия в интиме в
этой области является важным для выбора тактики
ведения больного. Поэтому с целью полной визу-
V
V
Рис. 34.4 Трансторакальная эхокардиография при наиболее ранней диагностике расслоения аорты. Обычно ТТЭхоКГ является методом первого
выбора при в диагностике расслоения аорты. (А) A В парастернальной позиции по длинной оси в проксимальном участке корня аорты визуализирует лоскут
интимы (стрелка). (Б) A При цветовой допплерографии видна аортальная регургитация.
А
Б
In-34_для нас.indd 871
03.04.2019 12:11:38
872
ЧАСТЬ VII Сосудистые и системные заболевания
ного исследования достигает 100% и превышает
специфичность ЧПЭхоКГ, которая составляет 68%.
Авторы подтверждают, что ограничение визуализа-
ции патологии восходящего отдела аорты при ЧПЭ-
хоКГ обусловливает высокую частоту ложнопо-
ложительных результатов. Однако в этом иссле-
довании не использовались строгие критерии
диагностики расслоения аорты (см. обсуждение
далее). Их использование позволяет снизить часто-
ту ложноположительных результатов. ТТЭхоКГ из
подгрудинной вырезки обеспечивает дополнитель-
ные проекции этой области аорты.
ЧПЭхоКГ обеспечивает дополнительную ин-
формацию об общей функции и движении стенок
левого желудочка (ЛЖ) и правого желудочка (ПЖ),
функции аортального и митрального клапанов.
Важно, что при А типе расслоения аорты ЧПЭхоКГ
позволяет выявить и определить выраженность и
механизм развития регургитации через аортальный
Рис. 34.5 A Расслоение нисходящего отдела аорты. Субкостальная
проекция демонстрирует линейное эхо, наводящее на мысль о расслоившемся
лоскуте в нисходящем отделе аорте. В истинном просвете скорость кровотока
меньше по сравнению с ложным просветом.
Рис. 34.7 A Фокусированная сонография при травмах (FAST) для
обследования пациента с болью в груди. Использование в экстренных
отделениях трансторакального ультразвука в формате фокусированной соно-
графии при травмах (FAST) является надежным методом для обнаружения
перикардиального выпота. У данного пациента дополнительные методы поис-
ка расслоения проксимального участка аорты (стрелка) не проводились.
ализации грудной части нисходящего отдела отде-
ла аорты может требоваться сочетанное исполь-
зование различных методик: трансторакального
(часто из области подгрудинной вырезки), чреспи-
щеводного и часто прямого эпиаортальгого или
эпикардиального методов при проведении хирур-
гического вмешательства (рис. 34.9).
ЧПЭхоКГ имеет много преимуществ в диагно-
стике острого расслоения аорты, самое главное из
которых — ее точность. Эрбел и др. [45] сообщают
об исследовании для Европейской группы по изуче-
нию ЭхоКГ, в котором приняло участие 164 паци-
ента с подозрением на острое расслоение аорты.
Оно продемонстрировало чувствительность и спец-
ифичность 99 и 98% соответственно. Другое боль-
шое исследование Неинабера и др. [49] сравнивало
использование ЧПЭхоКГ и магнитно-резонансного
исследования. Как ЧПЭхоКГ, так и магнитно-резо-
нансное исследование имели самую высокую чув-
ствительность; специфичность магнитно-резонанс-
VV
Рис. 34.6 Обструкция дуги аорты при расслоении аорты по типу A. (A) A Парастернальная проекция дуги аорты демонстрирует массу мягких тканей,
совместимую с тромбом (стрелка). (Б) A Цветной допплер демонстрирует ускорение потока в месте попадания в просвет тромбированной области. (В) Компью-
терная томография подтверждает наличие тромбированного ложного просвета, который стенозирует просвет дуги аорты (стрелка).
А
Б
В
In-34_для нас.indd 872
03.04.2019 12:11:38
873
34 Травма и расслоение аорты
клапан, показания к замене или восстановлению
клапана хирургическим путем.
Важное преимущество ЧПЭхоКГ в случае рас-
слоения аорты — возможность ее быстрого прове-
дения и безопасность использования в различных
клинических ситуациях, включая приемное отде-
ление, реанимационные залы и операционные.
ЧПЭхоКГ требует минимальной подготовки боль-
ного, предотвращает необходимости введения кон-
траста и облучения рентгеновскими лучами, как
при КТ и ангиографии, а также устраняет задержку
времени и клинические затруднения, характерные
для магнитно-резонансного исследования.
БЕЗОПАСНОСТЬ ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
Безопасность во время проведения чреспищеводно-
го исследования зависит от адекватности предопе-
рационной подготовки больного с целью устране-
ния болевого синдрома, возбуждения, а также до-
статочной защиты дыхательных путей. Тщательный
мониторинг электрокардиограммы и артериально-
го давления крови являются крайне необходимыми
для предупреждения неблагоприятных воздействий
ЧПЭхоКГ.
В исследовании 54 амбулаторных пациентов
проведение ЧПЭхоКГ сопровождалось повышени-
ем систолического давления у 77% пациентов. В
большинстве случаев это был умеренный подъем (в
среднем на 16 мм рт. ст.), но у некоторых больных
отмечалось острое повышение артериального дав-
ления более чем на 51 мм рт. ст. [50]. Внезапного
увеличения артериального давления должно быть
предотвращено у любого больного с подозрением
на расслоение аорты.
Важными факторами безопасности пациента яв-
ляются мониторинг артериального давления, окси-
генации крови, внутривенная седатация, регионар-
ная анестезия и введение, в случае необходимости,
вазодилататоров и бета-блокаторов. При соблюде-
нии этих методов осторожности большая часть па-
циентов переносят введение зонда в пищевод с
минимальным стрессом и стабильными показате-
лями гемодинамики. Другие часто описываемые
осложнения во время проведения чреспищеводного
исследования — возникновение предсердных и
желудочковых аритмий, избыточная активация
блуждающего нерва с транзиторным предсерд-
но-желудочковым блоком и артериальной гипок-
семией.
ДИАГНОСТИЧЕСКИЕ ОСОБЕННОСТИ
ОСТРОГО АОРТАЛЬНОГО СИНДРОМА ПО ДАННЫМ
ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
Диагноз расслоения аорты при наличии специфи-
ческих критериев является достаточно надежным.
Выявление кармана интимы, визуализация его под-
Рис. 34.9 Прямое эпиаортальное сканирование во время кардиотора-
кальной операции. Интраоперационная эпиаортольная проекция поперечной
дуги аорты у больного с острым расслоением проксимального участка аорты.
Определяется широкое расслоение и значительная подвижность интимы
(стрелки). Заметна полоса линейного артефакта вследствие проведения элек-
трокаутеризации.
Аорта
Аорта
Рис. 34.8 Введение контраста помогает исключить разрыв аорты. ЧПЭхоКГ восходящего отдела аорты свидетельствует о наличии кармана интимы и
возможном разрыве просвета сосуда (A) (стрелка). Введение контрастного средства не подтверждает выход крови за пределы просвета аорты (Ао) (Б).
А
Б
In-34_для нас.indd 873
03.04.2019 12:11:39
874
ЧАСТЬ VII Сосудистые и системные заболевания
вижности, линейные эхоструктуры в просвете сосу-
да и кровоток в истинном и ложном просвете с
обеих сторон от кармана интимы являются призна-
ками, позволяющими установить диагноз с высо-
кой точностью (рис. 34.10). Помощь в диагностике
может оказывать движение лоскута интимы в на-
правлении ложного просвета в фазу систолы. Утол-
щение стенки аорты > 15 мм также может исполь-
зоваться как признак расслоения аорты, свидетель-
ствующий о развитии тромбоза ложного канала,
который затрудняет визуализацию лоскута интимы.
Строгое соблюдение этих критериев позволяет пре-
дотвратить диагностические ошибки вследствие
артефактов изображения и проявлений других за-
болеваний, что сводит к минимуму ложноположи-
тельные результаты. Это особенно важно, потому
что большинство пациентов с подозрением на рас-
слоение аорты имеют признаки заболеваний сосу-
дов, включая поражение грудной части нисходяще-
го отдела отдела аорты. В исследовании 40 больных
с болевым синдромом в грудной клетке, которым
проводилось исключение расслоения аорты и пато-
логии коронарных сосудов, признаки расслоения
аорты (включая атеросклеротические бляшки, вну-
трисосудистые и внесосудистые образования, тром-
бы и расширение аорты) были обнаружены у 16 из
17 пациентов [51]. Существовавшая ранее патоло-
гия аорты, например коарктация аорты, или нали-
чие хирургических вмешательств на аорте в анам-
незе, может оказывать влияние на выбор тактики
ведения больного и является важным резервом для
устранения ошибок в диагностике.
Цветное допплеровское исследование кровотока
при ЧПЭхоКГ является превосходным методом ана-
лиза структуры нарушения кровотока при наличии
расслоения аорты. Кровоток в ложном просвете
вариабелен и имеет отклонения от нормы; истин-
ный просвет, который часто утолщен за счет лож-
ного канала, идентифицируется по направленному
вперед кровотоку в фазу систолы. При крупных
разрывах интимы в проксимальном участке аорты
направление кровотока в близко расположенных
отделах ложного просвета может иметь направле-
ние и время, сходное с истинным просветом, а также
иметь реверсное направление в фазу диастолы. При
наличии более мелких или расположенных более
дистально разрывов интимы кровоток в ложном
просвете менее сходен с кровотоком в истинном
просвете: он может быть направлен в противопо-
ложном направлении, максимальная скорость кро-
вотока может регистрироваться в более поздней
фазе кардиального цикла, что связано с задержкой
кровотока в ложном просвете. Визуализируется
множество медленных участков кровотока в виде
водоворота со спонтанным эхоконтрастированием
или частичным тромбозом. Эти сегменты удалены
от места разрывы интимы или места выхода из лож-
ного просвета, где высокая скорость кровотока
скрывает эти изменения от визуализации. Наконец,
также визуализируются участки полного тромбоза
и необходимо приложить усилие, чтобы опреде-
лить, полностью ли внутрисосудистая гематома
располагается в просвете сосуда, а не является след-
ствием разрыва адвентиции сосуда, образования
псевдоаневризмы или гематомы в стенке сосуда.
Рис. 34.10 Разрыв интимы в области поперечной дуги аорты. (А) В
фазу систолы определяется кровоток из истинного просвета в ложный просвет.
(Б) В фазу диастолы отмечается обратный кровоток, который обеспечивает
декомпрессию ложного просвета. (В) Чередование направления и времени
кровотока, которое подтверждается данными спектральной допплерометрии.
А
Б
В
In-34_для нас.indd 874
03.04.2019 12:11:40
875
34 Травма и расслоение аорты
Множественные сообщения между истинным и
ложным просветом часто идентифицируются при
тщательном сканировании грудного отдела аорты.
Некоторые представляют собой место разрыва ин-
тимы и поступления крови в ложный просвет, дру-
гие являются местом выхода крови из ложного
просвета или имеют кровоток в двух направлениях
(см. рис. 34.10). В местах выхода крови в истинный
просвет из ложного могут возникать одиночные
или множественные разрывы интимы. Точное рас-
положение места разрыва интимы зависит от глуби-
ны проникновения ультразвуковой волны из про-
извольной, но удобной контрольной точки. Запись
этой информации во время проведения процедуры
является полезной не только при проведении хи-
рургического вмешательства в связи с наличием
расслоения аорты, но и является чрезвычайно важ-
ной для сравнения при проведении наблюдения в
послеоперационном периоде с помощью ЧПЭхоКГ,
когда обнаруживается множество из этих разрывов
интимы.
Выявление первичного места разрыва интимы
основывается на определении локализации, размера
и структуры кровотока. В некоторых случаях место
первичного разрыва не может быть четко визуали-
зировано из-за наличия нескольких разрывов или
его расположения в «мертвой точке» для ЧПЭхоКГ,
как это описывалось ранее. Aдачи и др. [52] смогли
идентифицировать место первичного разрыва ин-
тимы у 50 из 57 больных с острым расслоением
аорты. Более успешно это удавалось сделать при
наличии В типа расслоения (90%), чем при наличии
А типа (83%). Идентификация первичного разрыва
интимы является чрезвычайно важной, т.к. резек-
ция этого места при проведении хирургического
вмешательства снижает частоту повторных опера-
ций в последующем.
ОСЛОЖНЕНИЯ РАССЛОЕНИЯ АОРТЫ
Важной целью эхокардиографического исследова-
ния при расслоении аорты является выявление со-
путствующих осложнений. Тип А расслоения аорты
может приводить к возникновению регургитации
через аортальный клапан вследствие расширения
кольца клапана или разрушения створок клапана.
ЧПЭхоКГ может обеспечить детальную морфоло-
гическую информацию о тканях створок клапана и
механизме развития регургитации через аорталь-
ный клапан. Это может оказать помощь в принятии
решении о проведении пластики или замены клапа-
на. Это является явным преимуществом, которое
дополняет особенности КТ и магнитно-резонансно-
го исследования. Выпот в полости перикарда и там-
понада сердца — проявления разрыва аорты вслед-
ствие расслоения, которые часто идентифицируют-
ся при трансторакальном исследовании (рис. 34.11).
Допплеровская визуализация жидкости в полости
перикарда может быть лучше получена из наруж-
ных верхушечных проекций и может заменить пре-
доперационное проведение ЧПЭхоКГ в интересах
более быстрого перемещения пациента в операци-
онную. Другие разрывы аорты могут возникать в
различных местах. Не ограниченный прорыв в сре-
достение или плевральную полость является причи-
ной внезапной смерти. Некоторые разрывы, огра-
ниченные адвентицией аорты, являются причиной
образования псевдоаневризм или гематом. В таких
случаях ЧПЭхоКГ может обнаружить разрыв инти-
мы и распространение гематомы на окружающие
ткани. Важным условием для выявления гематомы
является получение изображения аорты с адекват-
ной глубиной изображения. Кровоизлияние может
быть пропущено, если поле изображения ограничи-
вается ожидаемым контуром аорты. Отсутствие
устранения места кровоизлияния с восстановлени-
ем проксимального участка аорты приводит к бед-
ственным последствиям. Для исключения наличия
кровоизлияния может быть полезным использова-
ние контрастирования (см. рис. 34.11).
Поражение коронарных артерий при расслоении
аорты оказывает важное влияние на исход случая, в
связи с чем постоянно поднимается вопрос об обя-
зательном проведении ангиографии коронарных
сосудов в предоперационном периоде. Поражение
одной или обоих коронарных артерий при остром
расслоении аорты встречается в 10–20% случаев
(рис. 34.12). В исследовании 34 пациентов с рассло-
ением аорты Баллал и др. [53] обнаружили пораже-
ние коронарных артерий при ЧПЭхоКГ в 6 из 7
случаев рассечения коронарных артерий. Примеча-
тельно, что изменения при электрокардиографии
были выявлены только у 2 из 6 больных с пораже-
нием коронарных сосудов. Адекватные проекции
устьев и проксимального отдела сосудов получены
в 88% случаев для левой главной артерии и 50%
случаев для правых коронарных артерий. Визуали-
зация устьев и проксимальных отделов коронарных
сосудов при использовании ЧПЭхоКГ продолжает
улучшаться. Отдельным фактором, оказывающим
влияние на клинический исход, является возможное
наличие сопутствующих заболеваний коронарных
артерий, не связанных с расслоением коронарных
артерий, которые требуют быстрого проведения
ангиографии. Учитывая наличие предшествующих
сосудистых заболеваний, которые встречаются у
многих пациентов с расслоением аорты, не удиви-
тельно, что патология коронарных артерий обнару-
живается у 45% больных с расслоением аорты. Кли-
нические проявления потенциально значимого
стеноза коронарных артерий необходимо сравнить
с риском его устранения и проведения вмешательств
на аорте при остром расслоении аорты. Исследова-
ние 122 пациентов в клинике Кливленда не выявило
достоверных различий во внутрибольничной ле-
тальности между больными, которым проводилась
ургентная ангиография до восстановления расслое-
In-34_для нас.indd 875
03.04.2019 12:11:40
876
ЧАСТЬ VII Сосудистые и системные заболевания
ния аорты и больными без проведения ангиогра-
фии. Три четверти процедур шунтирования коро-
нарных сосудов, выполненных в этом исследова-
нии, проводилось в связи с наличием расслоения
коронарных артерий, а не обструкции коронарных
артерий вследствие предшествующей патологии
этих сосудов [54].
ИНТРАМУРАЛЬНАЯ ГЕМАТОМА
При проведении ЧПЭхоКГ у пациентов с интраму-
ральной гематомой, на изображениях можно увидеть
утолщенную стенку аорты с интрамуральным гипо-
эхогенным пространством, увеличение расстояния
от датчика ЧПЭхоКГ до внутренней стенки аорты и
очаговые искажения поперечно-циркулярной кон-
фигурации аорты. Важным для установки данного
диагноза является отсутствие лоскута интимы или
потока в утолщенной стенке аорты; а также другие
находки, включающие серпообразное или циркуляр-
ное утолщение стенки аорты до 7 мм или более [55].
ЧПЭхоКГ имеет зарегистрированную чувствитель-
ность 100% и специфичность 91% для диагностики
интрамуральной гематомы аорты [56].
ПЕНЕТРИРУЮЩАЯ ЯЗВА АОРТЫ
Эхокардиографические особенности пенетрирую-
щих язв аорты включают кратерообразный дефект
с неровными краями, распространяющийся в аорту
Рис. 34.11 Перикардиальный выпот и активная экстравазация у пациентов с расслоением аорты по типу A. (A) ЧП ЭхоКС в четырехкамерной
проекции у больного с А типом расслоением аорты и выпотом в перикарде. Выполнено введение контрастного средства, определяется контраст в камерах сердца,
но он отсутствует в небольшом количестве выпота в полости перикарда (стрелка). Это говорит о том, что активной экстравазации нет, что означало бы расслоение
с разрывом. Физиологические особенности тампонады сердца не определяются. (Б) Компьютерная томография может быть полезным инструментом для опре-
деления активной экстравазации из разрыва в месте диссекции аорты; у других пациентов с расслоением аорты А типа, краситель можно окрашивать медиасти-
нальные ткани (стрелка).
А
Б
Рис. 34.12 Вовлечение коронарных артерий при расслоении аорты по типу A. (A) Экстренная ангиография у пациента, поступившего в клинику с загру-
динной болью и элевацией сегмента ST на ЭКГ, демонстрирует обструкцию ствола левой коронарной артерии. Последующая ТТЭхоКГ показала карман интимы
восходящего отдела аорты, побуждая к проведению ЧПЭхоКГ. (Б) Короткая ось корня аорты при ЧПЭхоКГ демонстрирует карман интимы проксимальнее места
отхождения левой коронарной артерии (стрелка).
А
Б
In-34_для нас.indd 876
03.04.2019 12:11:41
877
34 Травма и расслоение аорты
[38]. Пенетрирующая язва часто распространяется
на область интрамуральной гематомы. Также отме-
чают отсутствие лоскута интимы, и отсутствия по-
тока внутри ложного просвета, участок поражения
чаще отдельный, чем расширяющийся.
ТРАВМА АОРТЫ
Тупая травма грудной клетки может привести к
расслоению аорты или к субадвентициальному
травматическому разрыву аорты с или без псевдоа-
невризмы [42, 57]. Учитывая, что такие травмы ча-
сто ассоциированы с мультисистемным поражени-
ем, травма лица, пищевода или шейки матки у этих
пациентов делает ЧПЭхоКГ менее подходящим
методом исследования, чем КТ [58]. В случае разры-
ва на ЧПЭхоКГ можно увидеть нарушение аорталь-
ной стенки, сопровождающееся наличием потоков
с обеих сторон толстого неровного лоскута, кото-
рый представляет собой смесь интимы и всей тол-
щины среднего слоя (медии) (рис. 34.13). Пораже-
ние чаще всего ограничено несколькими сантиме-
трами аорты, близко от дуги аорты. На этом
участке может образовываться псевдоаневризма,
которую можно распознать при обнаружении иска-
женного контура аорты, который образуется при
растягивании адвентиции внутрипросветным дав-
лением аорты. Медиастальные гематомы можно
также распознать по увеличенному расстоянии от
поверхности датчика ЧПЭхоКГ до просвета аорты.
НЕУБЕДИТЕЛЬНЫЕ ДАННЫЕ
ПРИ ЧРЕСПИЩЕВОДНОЙ ЭХОКАРДИОГРАФИИ
Прохождение ультразвуковой волны через стенку
пищевода и окружающие ткани может генериро-
вать артефакты от расположенных рядом тканей,
которые часто имеют линейный вид и проходят
параллельно стенке аорты, имитируя карман инти-
мы. У пациентов с выраженным атеросклеротиче-
ским процессом кальцинаты стенки могут давать
сходные артефакты или тени (рис. 34.14). Резкое
расширение аорты может создавать уступ, который
также может напоминать карман интимы. Опреде-
ление, что эти особенности изображения не явля-
ются истинным карманом интимы, зависит от
определения минимальной подвижности этих
структур и однородности кровотока с обеих сторон
от обнаруженной линии. Изменения, приведшие к
появлению дополнительных плоскостей изображе-
ния, являются чрезвычайно полезными в решении
вопроса о наличии артефактов кармана интимы.
Это особенно важно для проксимального участка
восходящего отдела аорты, в котором атеросклеро-
тические изменения или его расширение могут
быть неверно истолкованы как расслоение [49].
Аневризматическое расширение аорты является
еще одним источником ложноположительных ре-
зультатов исследования ЧПЭхоКГ при проведении
исследования с целью выявления расслоения аорты
[59]. Кровоток в участках аневризмы часто имеет
низкую скорость и турбулентность, что напоминает
кровоток в ложном просвете при расслоении аорты.
Отсутствие кармана интимы является важным фак-
тором, позволяющим избежать ошибочного диа-
гноза в этой ситуации. Вероятность того, что карман
интимы не определяется вследствие тромбоза лож-
ного просвета, необходимо исключить путем тща-
тельного сканирования участков аорты, располо-
женных выше и ниже патологической области.
Идентификация слоя интимы проксимальнее и
дистальнее может потребовать повторного исследо-
вания расширенного участка в связи с наличием
подозрения на расслоение аорты.
ХИРУРГИЧЕСКИЕ АСПЕКТЫ
Планирование хирургической коррекции расслое-
ния аорты значительно зависит от многих особен-
ностей, которые обсуждались ранее. Степень рас-
пространения расслоения, расположение первично-
го разрыва интимы, наличие регургитации через
клапан и патологии коронарных артерий являются
чрезвычайно важными факторами для выбора хи-
рургического лечения. Кроме того, интраопераци-
онное ультразвуковое исследование позволяет
определить безопасное место канюлирования сосу-
да, стратегические подходы к восстановлению аор-
тального клапана, необходимость в реимпланата-
ции коронарных сосудов с заменой корня аорты,
подтверждение адекватности кардиопульмонально-
го протеза и даже функцию баллона в аорте (табл.
34.7). Чреспищеводное изображение при проведе-
нии хирургического вмешательства имеет преиму-
Рис. 34.13 Травматический разрыв аорты с тромбозом. ЧПЭхоКГ нис-
ходящего отдела аорты у пациента после дорожно-транспортного происше-
ствия, произошедшего на высокой скорости, демонстрирует большой тромб в
просвете аорты. Имеет место разрыв задней стенки аорты (стрелка), распола-
гающийся у основания тромба, и определяется выход тромба в ткани вокруг
аорты. Разрыв нисходящего отдела аорты в грудном отделе был подтвержден
при проведении ургентного хирургического вмешательства.
In-34_для нас.indd 877
03.04.2019 12:11:41
878
ЧАСТЬ VII Сосудистые и системные заболевания
щества в связи с тем, что оно не перекрывает опе-
рационное поле (как минимум для хирурга, если не
для анестезиолога), поэтому обычно оно использу-
ется в качестве точного монитора движений стенки
ЛЖ и его объема.
Дополнительным методом полного сканирова-
ния аорты является получение интраоперационно-
го изображения с поверхности эпикарда или по-
верхности аорты. Неограниченное количество аку-
стических окон при использовании этого метода
позволяет провести тщательное исследование корня
аорты, места отхождения крупных сосудов, клапа-
нов сердца и движения стенки ЛЖ. «Мертвые» точ-
ки в восходящем отделе аорты и поперечной аорте
при ЧПЭхоКГ могут быть полностью исследованы
с поверхности эпикарда, а место возможного каню-
лирования аорты — с наружной поверхности аор-
ты. Проекции с поверхности эпикарда дают боль-
шую свободу для визуализации и измерения аор-
тального клапана, а также точного измерения
размера кольца клапана перед наложением кардио-
пульмонального шунта для более быстрого выделе-
ния протеза клапана. Положение устьев коронарных
артерий относительно места расслоения аорты и
кольца клапана точно может быть определено с по-
верхности эпикарда, которая также может быть
использована для принятия решения при проведе-
нии хирургического лечения в отношении разме-
щения кондуита между клапаном и протезом, а
также реимплантации устьев коронарных артерий.
Время, необходимое для получения изображения
хирургического поля, может быть ограничено не-
сколькими минутами, поэтому для этого требуется
опытная команда, работающая синхронно с карди-
охирургом, хорошо знакомая с методами ультраз-
вукового исследования с поверхности эпикарда и
проекциями при этом методе исследования. Соче-
танное использование эпикардиальной и чреспи-
щеводной методик гарантирует получение высоко-
качественного ультразвукового изображения всех
сегментов аорты над диафрагмой и исключает лю-
бые сомнения в отношении вовлечения в процесс
восходящего отдела аорты. Изображение с поверх-
ности эпикарда после наложения кардиопульмо-
нального шунта также может быть чрезвычайно
полезным в повторной оценке места проксималь-
ного разрыва интимы и позволяет исследовать ли-
нию шва между аортой и кондуитом.
Чреспищеводное исследование в конце хирурги-
ческого вмешательства на сердце подтверждает со-
стоятельность аортального клапана или протеза
клапана и позволяет быстро провести повторное
вмешательство в случае, если выраженная регурги-
тация через аортальный клапан требует повторной
коррекции. Расположение баллона в просвете аорты
может быть оценено с помощью ЧПЭхоКГ; случай-
ное размещение баллона в ложном просвете может
привести к бедственным последствиям, если оно
сразу не распознается. Кроме того, чреспищеводное
исследование протеза и аорты в послеоперацион-
ном периоде дает исходную информацию для срав-
нения с последующими исследованиями.
РЕГУРГИТАЦИЯ ЧЕРЕЗ АОРТАЛЬНЫЙ КЛАПАН
Регургитация через аортальный клапан осложняет
течение расслоения аорты, оказывает отрицатель-
ное влияние на исход для больного и может дикто-
вать важные изменения в подходах к хирургическо-
му лечению. Сохранение клапана аорты с благопри-
ятным результатом для пациента возможно в 86%
случаев при А типе расслоения [60]. Если имеют
место патологические изменения кольца аортально-
го клапана вследствие синдрома Марфана или экта-
Рис. 34.14 Артефакты чреспищеводной эхокардиографии у пациентов с расслоением аорты. В условиях выраженного атеросклероза (А), извитости
аорты или эктазии (Б) могут наблюдаться артефакты и сложные изображения. Дополнительные методы, такие как компьютерная томография и магнитно-резо-
нансная томография, могут помочь в сложных случаях с изображениями с низкой достоверностью.
А
Б
In-34_для нас.indd 878
03.04.2019 12:11:41
879
34 Травма и расслоение аорты
Оценка прекардиопульмонального шунта
Аорта
Лоскут интимы
Место разрыва интимы*
Внутристеночная гематома
Разрыв аорты
Псевдоаневризма аорты
Дистальное распространение расслоения
Дополнительные разрывы интимы
Структура кровотока в ложном просвете, включая наличие тромбоза ложного просвета
Поражение сосудов, отходящих от аорты*
Состояние коронарных артерий или их расслоения
Поражение отходящих от аорты крупных артерий
Предшествующая патология
Атеросклероз
Коарктация аорты
Локализации предыдущих разрывов
Место восстановительного оперативного лечения в анамнезе*
Аортальный клапан
Наличие регургитации
Сравнение возможности восстановления или замены
Определение размеров для помещения аллотрансплантата
Митральный клапан
Регургитация
Соответствие восстановления против замены
Левый и правый желудочки
Патология движения стенки
Полость перикарда
Наличие выпота
Оценка посткардиопульмонального шунта
Аорта
Подтверждение состоятельности анастомоза
Определение исходного уровня кровотока в ложном просвете и месте дистального разрыва интимы
Аортальный клапан
Подтверждение состоятельности клапана после восстановления
Митральный клапан
Подтверждение состоятельности клапана
Левый и правый желудочки
Движения стенки
Баллон в просвете аорты
Подтверждение расположения в истинном просвете
* Эпикардиальное и/или эпиаортальное сканирование может иметь особое значение для полного определения этих особенностей.
ТАБЛИЦА 34.7 Интраоперационное использование чреспищеводной эхокардиографии при расслоении аорты
зии кольца клапана и аорты, предпочтительной
является его замена вследствие ограничения воз-
можности продолжительности времени рекон-
струкции у этих пациентов. Проведение остановки
сердца для наложения кардиопульмонального шун-
та обычно зависит от способности аортального
клапана обеспечить антеградную перфузию коро-
нарных артерий; поэтому при наличии выраженной
регургитации через аортальный клапан может быть
показано проведение индивидуального канюлиро-
вания устьев коронарных артерий или формирова-
ние ретроперфузии из коронарного синуса. Специ-
фические причины регургитации через аортальный
клапан также важны [61]. Нормальное строение
створок клапана с пролапсом кончиков створок из-
за разрыва основания створок может быть показа-
нием к проведению восстановления аортального
клапана с ресуспензией. Другие случаи могут тре-
In-34_для нас.indd 879
03.04.2019 12:11:41
880 ЧАСТЬ VII Сосудистые и системные заболевания
бовать замены аортального клапана. Специфическое
поражение расположенного рядом корня аорты
также имеет большое значение и может требовать
установки протеза кондуита различной протяжен-
ности. В некоторых случаях используется ал-
лотрансплантат аорты человека, который имеет
преимущества, т.к. устанавливается как естествен-
ный аортальный клапан, так и корень аорты.
При поражении проксимального участка аорты
важное значение имеет расположение и вовлечение
в процесс устьев коронарных артерий. Может тре-
боваться проведение пересадки устьев коронарных
артерий; проведение аортокоронарного шунтиро-
вания может быть неизбежной процедурой при
расслоении в области устьев коронарных артерий.
Коронарные артерии могут быть: повторно подве-
дены путем прямой реимплантации с/без окружаю-
щими тканями аорты, прикреплены к участку про-
теза шунта, полностью заменены с помощью шунта
из бедренной вены или внутренней артерии молоч-
ной железы.
РЕГУРГИТАЦИЯ ЧЕРЕЗ МИТРАЛЬНЫЙ КЛАПАН
Регургитация через митральный клапан является
трудной разновидностью патологии клапанов серд-
ца, сочетающейся с расслоением аорты. Вновь воз-
никшая регургитация может быть связана с нару-
шением движения стенок желудочков, обусловлен-
ной вовлечением устьев коронарных артерий в
патологический процесс, либо острым расширени-
ем ЛЖ при регургитации через аортальный клапан.
В других случаях регургитация через митраль-
ный клапан является следствием предшествовав-
ших нарушений, например проявлением синдрома
Марфана с регургитацией через аортальный клапан.
Определение этиологического фактора регургита-
ции через митральный клапан (например, дегенера-
ция створок клапана, расширение желудочка, или
ишемия сосочковых мышц) могут требовать прове-
дения восстановления клапана или его замены.
Важно подтвердить результаты в раннем перио-
де после наложения кардиопульмонального шунта,
особенно в тех случаях, когда принимается решение
оставить митральный клапан без проведения вме-
шательств на нем, несмотря на наличие регургита-
ции, в надежде на то, что устранение острой ишемии
или дилатации кольца клапана приведут к исчезно-
вению регургитации.
ПЕРФУЗИЯ ПЕРИФЕРИЧЕСКОГО СОСУДИСТОГО ЛОЖА
При остром расслоении аорты сосуды дуги аорты и
питаемые ими органы могут получать перфузию
как через истинный, так и через ложный просвет.
Избыточная перфузия органов может возникать в
том случае, если сохранен просвет сосуда; обструк-
ция потока может быть динамической или статиче-
ской. Мальперфузия коррелирует с ранней смерт-
ностью и обнаруживается при вскрытии до 45% с
расслоением, включающим нисмходящий отдел
аорты [14]. При проведении хирургического вме-
шательства нарушение перфузии может быть вы-
звано реверсным кровотоком, когда кардиопульмо-
нальный шунт осуществляется путем канюлирова-
ния бедренной артерии с облитерацией сообщения
между двумя просветами с помощью кросс-клам-
пинга или путем непосредственного восстановле-
ния участка расслоения.
ОБСУЖДЕНИЕ ЭНДОВАСКУЛЯРНОГО ВОССТАНОВЛЕНИЯ
Эндоваскулярное стентирование является важным
методом лечения и альтернативой открытой опера-
ции у выбранных пациентов с травмой и расслое-
нием аорты. При травматическом разрыве эта мето-
дика имеет более низкую летальность и частоту
осложнений, таких как ишемия позвоночника [62].
ЧП ЭхоКГ оказывает помощь в управлении поста-
новкой стента и выявлении осложнений, связанных
с этой процедурой [63]. ЭхоКГ дает лучшие резуль-
таты в выявлении и разграничении участков несо-
стоятельности стента и является важным дополне-
нием к ангиографии и внутрисосудистому ультраз-
вуковому исследованию при постановке стента и
последующем наблюдении. В этой ситуации вну-
трисосудистое ультразвуковое исследование также
является ценным методом диагностики [64].
НАБЛЮДЕНИЕ БОЛЬНЫХ
ПОСЛЕ РАССЛОЕНИЯ АОРТЫ
Несмотря на успешное хирургическое восстановле-
ние расслоения аорты, в сосуде сохраняется множе-
ство нарушений структуры и кровотока. Дистальнее
места восстановления могут сохраняться карман
интимы и ложный просвет. Ложный просвет может
тромбироваться, либо в нем может сохраняться
кровоток через множественные входные и выход-
ные отверстия. Одно из исследований обнаружило
при магнитно-резонансном исследовании сохране-
ние кармана интимы и ложного просвета сосуда у
100% пациентов в послеоперационном периоде
[65]. Сохраняющийся кровоток в ложном просвете
может быть обнаружен при ЧПЭхоКГ у большей
части больных после хирургического восстановле-
ния аорты. Было предложено, что долгосрочный
прогноз выживания хуже у больных с персистенци-
ей кровотока в ложном просвете [66]. ЧПЭхоКГ
подтверждает, что в местах, где отсутствует сообще-
ние с истинным просветом, развивается кровоток с
низкой скоростью и тромбоз просвета в последую-
щем, тогда как репарация менее вероятна в участках
с выраженными разрывами интимы и сохраняю-
щимся кровотоком в ложном просвете. ЧПЭхоКГ
также может продемонстрировать агрессивные ате-
росклеротические изменения и кальцинаты во
In-34_для нас.indd 880
03.04.2019 12:11:42
881
34 Травма и расслоение аорты
вновь образующейся интиме, которая покрывает
ложный просвет сосуда.
У больных с наличием расслоения аорты в анам-
незе может развиваться прогрессирующая патоло-
гия как в оперированных, так и не оперированных
участках аорты. 25 –40% расслоений аорты увеличи-
ваются с течением времени, частота и распростра-
нение расширения являются первостепенным фак-
тором, диктующим необходимость проведения по-
вторного оперативного вмешательства [67]. Кроме
того, расширение расположенного на расстоянии
участка аорты, который не подвергался оперативно-
му вмешательству, может развиться позже после
перенесенного острого расслоения А типа. Раннее
распознавание прогрессирования заболевания по-
зволяет провести повторную операцию в надежде
на предупреждение разрыва или повторного рас-
слоения. Стремление избежать прогрессирования
заболевания диктует необходимость проведения
тщательного наблюдения после перенесенного рас-
слоения аорты.
После лечения с комбинированными протезами,
псевдоаневризма может сформироваться как вто-
ричное осложнение, обусловленное кровоизлияни-
ем по линии шва [68]. Скопление крови между
протезом и стенкой аорты может обусловливать
развитие подклапанного стеноза аортального кла-
пана [69]. Другие осложнения в послеоперацион-
ном периоде включают эндокардит и развитие анев-
ризм синуса Вальсальвы.
Поскольку симптомы острого повторного рас-
слоения или распространения хронического рассло-
ения не специфические, чрезвычайно важно быстро
оценить ситуацию и сравнить полученные резуль-
таты с признаками при предшествующих изобра-
жениях. Более молодые пациенты имеют синдро-
мом Марфана, поэтому первоначальный разрыв
интимы, как правило, поражает поперечный отдел
аорты, что особенно способствует прогрессирова-
нию заболевания. Поскольку ЧПЭхоКГ не позволя-
ет воспроизводимо измерить истинный диаметр
поперечного отдела расширенной аорты, наличие
подозрения на распространение хронического рас-
слоения аорты требует проведения дополнительных
методов исследования, таких как КТ и магнитно-ре-
зонансное исследование. Прекрасная возможность
для определения кармана интимы, тромбоза ложно-
го канала, структуры кровотока в нем, наличие воз-
можности воспроизводимого измерения размеров
на основании наличия ориентиров делает магнит-
но-резонансное исследование чрезвычайно надеж-
ным методом. Возникновение рецидивирующего
болевого синдрома в грудной клетке или нестабиль-
ных показателей гемодинамики вызывают подозре-
ние на развитие повторного расслоения. В таком
случае ЧПЭхоКГ позволяет выявить новые патоло-
гические изменения и оценить их распространен-
ность. Появление изменений в сравнении с исход-
ными данными после операции или после устра-
нения расслоения аорты оказывают помощь в
выяснении причины и характера процесса.
ЗАКЛЮЧЕНИЕ
Неблагоприятный прогноз у пациентов с острым
расслоением аорты или травматическим поврежде-
нием аорты нуждается в быстром, высокочувстви-
тельном и эффективном диагностическом подходе.
Использование визуализирующих методов в пер-
вые минуты обследования пациента продолжается
до перехода на режим сканирования КТ. ЭхоКГ
остается основным методом при независимой диа-
гностике, лечении и последующем наблюдении па-
циентов с острыми аортальными синдромами.
In-34_для нас.indd 881
03.04.2019 12:11:42
882
ЧАСТЬ VII Сосудистые и системные заболевания
Особенности
ЧПЭхоКГ
Расслоение
Интрамуральная
гематома
Пенетрирующая
язва аорты
Травма аорты
Лоскут интимы
Есть
Нет
Нет
Чаще можно увидеть лоскут
медиального слоя, а не лоскут
интимы
Наличие входного
отверстия в
интиме
Есть
Нет
Нет
Есть
Поток в ложном
просвете
Часто присутствует; ложный
просвет может заполняться
тромбом с устранением види-
мого потока
Нет
Нет
Поток может быть виден в
стенке аорты снаружи меди-
ального лоскута
Обструкция коро-
нарных артерий
Может быть
Нет
Нет
Нет
Тромбоз
В ложном просвете
В стенке аорты
Вокруг язвы
Выступает в просвет или рас-
пространяется в
периадвентиции
Перикардиальный
выпот с тампона-
дой или без нее
Может или не может представ-
лять собой острую экстраваза-
цию; ЧПЭхоКГ может иметь
решающее значение для
оценки; контрастирование
может помочь оценить острую
экстравазацию
Нет
Нет
Может или не может представ-
лять собой острую экстрава-
зацию; может быть связано c
другими тупыми травмами
грудной клетки
Регургитация на
аортальном
клапана/механизм
Разрыв клапана или расшире-
ние кольца клапана, деформа-
ция проксимальных участков
аорты из-за острого расслое-
ния или аневризмы; пролапс
створок
Нет
Нет
Разрыв клапана или расшире-
ние кольца клапана, могут
быть связаны c другими
тупыми травмами грудной
клетки
Окклюзия сосудов
дуги аорты
Может быть
Нет
Нет
Может быть
* Клинически важные сопутствующие находки: функция желудочков, состоятельность других клапанов, другие источники боли в груди
или гемодинамические нарушения.
ЧПЭхоКГ — чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиографические особенности острых аортальных синдромов*
ЛИТЕРАТУРА
1. Olsson C, Thelin S, Stahle E, et al. Thoracic
aortic aneurysm and dissection: increasing
prevalence and improved outcomes reported
in a nationwide population-based study of
more than 14,000 cases from 1987 to 2002,
Circulation 114:2611–2618, 2006.
2. Chirillo F, Marchiori MC, Andriolo L, et al.
Outcome of 290 patients with aortic dissec-
tion: a 12 year multicentre experience, Eur
Heart J 11:311–319, 1990.
3. Lee RT, Kamm RD. Vascular mechanics for
the cardiologist, J Am Coll Cardiol 23:1289–
1295, 1994.
4. Mukherjee DP, Kagan HM, Jordan RE, Fran-
zblau C. Effect of hydrophobic elastin ligands
on the stress-strain properties of elastin fi-
bers, Connect Tissue Res 4:177–179, 1976.
5. Dzau VJ, Safar ME. Large conduit arteries in
hypertension: role of the vascular renin-angio-
tensin system, Circulation 77:947–954, 1988.
6. Erbel R, Eggebrecht H. Aortic dimensions and
the risk of dissection, Heart 92:137–142, 2006.
7. Goldstein SA, Evangelista A, Abbara S, et al.
Multimodality imaging of diseases of the
thoracic aorta in adults: from the American
Society of Echocardiography and the Euro-
pean Association of Cardiovascular Imaging:
endorsed by the Society of Cardiovascular
Computed Tomography and Society for Car-
diovascular Magnetic Resonance, J Am Soc
Echocardiogr 28:119–182, 2015.
7a. Erbel R, Aboyans V, Boileau C. 2014 ESC
Guidelines on the diagnosis and treatment
of aortic diseases: document covering acute
and chronic aortic diseases of the thoracic
and abdominal aorta of the adult. The Task
Force for the Diagnosis and Treatment of
Aortic Diseases of the European Society of
Cardiology (ESC), Eur Heart J 35:2873–
2926, 2014.
7b. Boodhwani M, Andelfinger G, Leipsic J. Ca-
nadian Cardiovascular Society position state-
ment on the management of thoracic aortic
disease, Can J Cardiol 30:577–589, 2014.
8. Robicsek F, Thubrikar MJ. Hemodynamic
considerations regarding the mechanism and
prevention of aortic dissection, Ann Thorac
Surg 58:1247–1253, 1994.
9. MacSweeney ST, Young G, Greenhalgh RM,
Powell JT. Mechanical properties of the aneu-
rysmal aorta, Br J Surg 79:1281–1284, 1992.
10. Carson MW, Roach MR. The strength of the
aortic media and its role in the propagation of
aortic dissection, J Biomech 23:579–588, 1990.
11. Rubin K. Aortic dissection and rupture in
Turner syndrome [Letter], J Pediatr 122:670,
1993.
12. Ashraf SS, Shaukat N, Masood M, et al. Type
I aortic dissection in a patient with osteogen-
esis imperfecta, Eur J Cardiothorac Surg
7:665–666, 1993.
13. Pretre R, Chilcott M. Blunt trauma to the
heart and great vessels, N Engl J Med 336:626–
632, 1997.
14. Hagan PG, Nienaber CA, Isselbacher EM, et
al. The International Registry of Acute Aortic
Dissection (IRAD): new insights into an old
disease, JAMA 283:897–903, 2000.
15. Katz ES, Tunick PA, Colvin SB, et al. Aortic
dissection complicating cardiac surgery: diag-
In-34_для нас.indd 882
03.04.2019 12:11:42
883
34 Травма и расслоение аорты
nosis by intraoperative biplane transesopha-
geal echocardiography, J Am Soc Echocardiogr
6:217–222, 1993.
16. Sakamoto I, Hayashi K, Matsunaga N, et al.
Aortic dissection caused by angiographic pro-
cedures, Radiology 191:467–471, 1994.
17. Dorsey DM, Rose SC. Extensive aortic and
renal artery dissection following percutane-
ous transluminal angioplasty, J Vasc Interv
Radiol 4:493–495, 1993.
18. Hsue PY, Salinas CL, Bolger AF, et al. Acute
aortic dissection related to crack cocaine,
Circulation 105:1592–1595, 2002.
19. Wako E, LeDoux D, Mitsumori L, Aldea GS.
The emerging epidemic of methamphet-
amine-induced aortic dissections, J Card Surg
22:390–393, 2007.
20. Nolte JE, Rutherford RB, Nawaz S, et al. Arte-
rial dissections associated with pregnancy, J
Vasc Surg 21:515–520, 1995.
21. Oskoui R, Lindsay Jr. J. Aortic dissection in
women less than 40 years of age and the un-
importance of pregnancy, Am J Cardiol
73:821–823, 1994.
22. Gravholt CH, Landin-Wilhelmsen K, Stoch-
holm K, et al. Clinical and epidemiological
description of aortic dissection in Turner’s
syndrome, Cardiol Young 16:1–7, 2006.
23. Judge DP, Dietz HC. Marfan’s syndrome,
Lancet 366:1965–1976, 2005.
24. Come PC, Fortuin NJ, White RI, McKusick
VA. Echocardiographic assessment of cardio-
vascular abnormalities in the Marfan syn-
drome. Comparison with clinical findings
and with roentgenographic estimation of
aortic root size, Am J Med 74:465–474, 1983.
25. Legget ME, Unger TA, Osullivan CK, et al.
Aortic root complications in the Marfan’s
syndrome: identification of a lower risk
group, Heart 75:389–395, 1996.
26. Roman MJ, Rosen SE, Kramer-Fox R, Devereux
RB. Prognostic significance of the pattern of
aortic root dilation in the Marfan syndrome, J
Am Coll Cardiol 22:1470–1476, 1993.
27. Roberts WC, Honig HS. The spectrum of
cardiovascular disease in the Marfan syn-
drome: a clinicomorphologic study of 18
necropsy patients and comparison to 151
previously reported necropsy patients, Am
Heart J 104:115–135, 1982.
28. Gleason TG. Heritable disorders predisposing
to aortic dissection, Semin Thorac Cardiovasc
Surg 17:274–281, 2005.
29. Hiratzka LF, Bakris GL, Beckman JA, et al. 2010
ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/
STS/SVM guidelines for the diagnosis and man-
agement of patients with Thoracic Aortic Dis-
ease: a report of the American College of Car-
diology Foundation/American Heart Associa-
tion Task Force on Practice Guidelines,
American Association for Thoracic Surgery,
American College of Radiology, American
Stroke Association, Society of Cardiovascular
Anesthesiologists, Society for Cardiovascular
Angiography and Interventions, Society of In-
terventional Radiology, Society of Thoracic
Surgeons, and Society for Vascular Medicine, J
Am Coll Cardiol 55:e27–e129, 2010.
30. Siddiqi H, Isselbacher E, Suzuki T, et al. Is size
a good predictor of dissection risk in patients
with Marfan syndrome or bicuspid aortic
valves? Insights from the International Regis-
try of Acute Aortic Dissection (IRAD), J Am
Coll Cardiol 59:E1883, 2012.
31. Svensson LG, Labib SB. Aortic dissection and
aortic aneurysm surgery, Curr Opin Cardiol
9:191–199, 1994.
32. DeBakey ME, McCollum CH, Crawford ES,
et al. Dissection and dissecting aneurysms of
the aorta: twenty year follow-up of five hun-
dred twenty seven patients treated surgically,
Surgery 92:1118–1134, 1982.
33. Daily PO, Trueblood HW, Stinson EB, et al.
Management of acute aortic dissections, Ann
Thorac Surg 10:237–247, 1970.
34. Miller DC. Acute dissection of the descending
thoracic aorta, Chest Surg Clin North Am
2:347–378, 1992.
35. Roberts CS, Roberts WC. Aortic dissection
with the entrance tear in the descending tho-
racic aorta: analysis of 40 necropsy patients,
Ann Surg 213:356–368, 1991.
36. Duch PM, Chandrasekaran K, Karalis DG,
Ross Jr. JJ. Improved diagnosis of coexisting
types II and III aortic dissection with multi-
plane transesophageal echocardiography, Am
Heart J 127:699–701, 1994.
37. Tsai TT, Nienaber CA, Eagle KA. Acute aortic
syndromes, Circulation 112:3802, 2005.
38. Ganaha F, Miller DC, Sugimoto K, et al. Prog-
nosis of aortic intramural hematoma with
and without penetrating atherosclerotic ulcer:
a clinical and radiological analysis, Circulation
106:342, 2002.
39. Erbel R, Oelert H, Meyer J, et al. Effect of
medical and surgical therapy on aortic dissec-
tion evaluated by transesophageal echocar-
diography. Implications for prognosis and
therapy. The European Cooperative Study
Group on Echocardiography, Circulation
87:1604–1615, 1993.
40. Song JK, Kim HS, Kang DH, et al. Different
clinical features of aortic intramural hemato-
ma versus dissection involving the ascending
aorta, J Am Coll Cardiol 37:1604–1610, 2001.
41. Harris JA, Bis KG, Glover JL, et al. Penetrating
atherosclerotic ulcers of the aorta, J Vasc Surg
19:90–98, 1994.
42. Vignon P, Gue2ret P, Vedrinne JM, et al. Role
of transesophageal echocardiography in the
diagnosis and management of traumatic aor-
tic disruption, Circulation 92:2959–2968,
1995.
43. Parmley LF, Mattingly TW, Manion WC, et
al. Nonpenetrating traumatic injury of the
aorta, Circulation 17:1086–1101, 1958.
44. Shiga T, Wajima Z, Apfel CC, et al. Diagnos-
tic accuracy of transesophageal echocardiog-
raphy, helical computed tomography, and
magnetic resonance imaging for suspected
thoracic aortic dissection: systematic review
and meta-analysis, Arch Intern Med 166:1350–
1356, 2006.
45. Erbel R, Engberding R, Daniel W, et al. Echo-
cardiography in diagnosis of aortic dissection,
Lancet 1:457–461, 1989.
46. Bansal RC, Chandrasekaran K, Ayala K,
Smith DC. Frequency and explanation of
false negative diagnosis of aortic dissection by
aortography and transesophageal echocar-
diography, J Am Coll Cardiol 25:1393–1401,
1995.
47. Evangelista A, Carro A, Moral S, et al. Imag-
ing modalities for the early diagnosis of acute
aortic syndrome, Nat Rev Cardiol 10:477–486,
2013.
48. Chan KL. Impact of transesophageal echocar-
diography on the treatment of patients with
aortic dissection, Chest 101:406–410, 1992.
49. Nienaber CA, Spielmann RP, von Kodolitsch
Y, et al. Diagnosis of thoracic aortic dissec-
tion: magnetic resonance imaging versus
transesophageal echocardiography, Circula-
tion 85:434–447, 1992.
50. Geibel A, Kasper W, Behroz A, et al. Risk of
transesophageal echocardiography in awake
patients with cardiac diseases, Am J Cardiol
62:337–339, 1988.
51. Chan KL. Usefulness of transesophageal
echocardiography in the diagnosis of condi-
tions mimicking aortic dissection, Am Heart J
122:495–504, 1991.
52. Adachi H, Kyo S, Takamoto S, et al. Early
diagnosis and surgical intervention of acute
aortic dissection by transesophageal color
flow mapping, Circulation 82(Suppl 4):19–23,
1990.
53. Ballal RS, Nanda NC, Gatewood R, et al. Use-
fulness of transesophageal echocardiography
in assessment of aortic dissection, Circulation
84:1903–1914, 1991.
54. Penn MS, Smedira N, Lytle B, et al. Does
coronary angiography before emergency aor-
tic surgery affect in-hospital mortality? J Am
Coll Cardiol 35:889–894, 2000.
55. Song JK, Kim HS, Song JM, et al. Outcomes
of medically treated patients with aortic in-
tramural hematoma, Am J Med 113:181, 2002.
56. Willens HJ, Kessler KM. Transesophageal
echocardiography in the diagnosis of diseases
of the thoracic aorta: part 1. Aortic dissection,
aortic intramural hematoma, and penetrating
atherosclerotic ulcer of the aorta, Chest 116:
1772–1779, 1999.
57. Goarin JP, Catoire P, Jacquens Y, et al. Use of
transesophageal echocardiography for diag-
nosis of traumatic aortic injury, Chest 112:
71–80, 1997.
58. Bruckner BA, DiBardino DJ, Cumbie TC, et
al. Critical evaluation of chest computed to-
mography scans for blunt descending tho-
racic aortic injury, Ann Thorac Surg 81:1339–
1346, 2006.
59. Alter P, Herzum M, Maisch B. Echocardio-
graphic findings mimicking type A aortic
dissection, Herz 31:153–155, 2006.
60. Mazzucotelli JP, Deleuze PH, Baufreton C, et
al. Preservation of the aortic valve in acute
aortic dissection: long-term echocardiograph-
ic assessment and clinical outcome, Ann
Thorac Surg 55:1513–1517, 1993.
61. Movsowitz HD, Levine RA, Hilgenberg AD,
et al. Transesophageal echocardiographic de-
scription of the mechanisms of aortic regur-
gitation in acute type A aortic dissection:
implications for aortic valve repair, J Am Coll
Cardiol 36:884–890, 2000.
62. Xenos ES, Abedi NN, Davenport DL, et al.
Meta-analysis of endovascular vs open repair
for traumatic descending thoracic aortic rup-
ture, J Vasc Surg 48:1343–1351, 2008.
63. Koschyk DH, Nienaber CA, Knap M, et al.
How to guide stent-graft implantation in type
B aortic dissection? Comparison of angiogra-
phy, transesophageal echocardiography, and
intravascular ultrasound, Circulation 112:
I260–I264, 2005.
64. Marty B, Tozzi P, Ruchat P, et al. An IVUS-
based approach to traumatic aortic rupture,
with a look at the lesion from inside, J Endo-
vasc Ther 14:689–697, 2007.
65. Laissy JP, Blanc F, Soyer P, et al. Thoracic
aortic dissection: diagnosis with transesopha-
geal echocardiography versus MR imaging,
Radiology 194:331–336, 1995.
66. Svensson LG, Labib SB. Aortic dissection and
aortic aneurysm surgery, Curr Opin Cardiol
9:191–199, 1994.
67. Crawford ES. The diagnosis and management
of aortic dissection, JAMA 264:2537–2541,
1990.
In-34_для нас.indd 883
03.04.2019 12:11:42
884
ЧАСТЬ VII Сосудистые и системные заболевания
68. Barbetseas J, Crawford S, Safi HJ, et al. Dop-
pler echocardiographic evaluation of pseu-
doaneurysms complicating composite grafts
of the ascending aorta, Circulation 85:212–
222, 1992.
69. Vilacosta I, Camino A, San Roman JA, et al.
Supravalvular aortic stenosis after replace-
ment of the ascending aorta, Am J Cardiol
70:1505–1507, 1992.
70. Miller DC. Surgical management of aortic
dissections: indications, perioperative man-
agement, and long term results. In Doroghazi
RM, Slater EE, editors: Aortic dissection, New
York, 1983, McGraw-Hill.
71. DeSanctis RW, Doroghazi RM, Austen WG,
Bucklet MJ. Aortic dissection, N Engl J Med
317:1060–1067, 1987.
72. Applebaum A, Karp RB, Kirklin JW. Ascend-
ing vs. descending aortic dissections, Ann
Surg 183:296, 1976.
73. Appelbe AF, Walker PG, Yeoh JK, et al. Clini-
cal significance and origin of artifacts in trans-
esophageal echocardiography of the thoracic
aorta, J Am Coll Cardiol 21:754–760, 1993.
74. Yoshida S, Akiba H, Tamakawa M, et al. Tho-
racic involvement of type A aortic dissection
and intramural hematoma: diagnostic accura-
cy-comparison of emergency helical CT and
surgical findings, Radiology 228:430–435,
2003.
In-34_для нас.indd 884
03.04.2019 12:11:42
885
35 Иммунно-опосредованные
системные заболевания
CARLOS A. ROLDAN, MD
Системная красная волчанка
Краткая информация
Поражение сердечно-сосудистой системы
Первичный антифосфолипидный
синдром
Краткая информация
Поражение сердечно-сосудистой системы
Ревматоидный артрит
Краткая информация
Поражение сердечно-сосудистой системы
Анкилозирующий спондилит
Краткая информация
Поражение сердечно-сосудистой системы
Склеродермия
Краткая информация
Поражение сердечно-сосудистой системы
Полимиозит и дерматомиозит
Краткая информация
Поражение сердечно-сосудистой системы
Смешанное заболевание
соединительной ткани
Краткая информация
Поражение сердечно-сосудистой системы
Отдельные виды артериита,
поражающего аорту и ее ветви
Артериит Такаясу
Краткая информация
Поражение сердечно-сосудистой системы
Гигантоклеточный височный артериит
Краткая информация
Поражение сердечно-сосудистой системы
Болезнь Бехчета
Краткая информация
Поражение сердечно-сосудистой системы
Ревматологические заболевания — это хронические
воспалительные заболевания, обусловленные ауто-
иммунными реакциями, чаще встречающиеся у
женщин, чем у мужчин (за исключением анкилози-
рующего спондилита), которые обычно проявля-
ются со второго по пятое десятилетие и служат
причиной значительной заболеваемости и смерт-
ности.
Поражения сердечно-сосудистой системы при
ревматологических заболеваниях наблюдаются ча-
сто и имеют серьезные последствия. Из-за различий
в плане клинических исследований, популяциях и
методах кардиологических исследований оценки
распространенности поражения сердечно-сосуди-
стой системы варьируют в широких пределах (табл.
35.1).
Эхокардиография (ЭхоКГ) играет важную роль
для понимания распространенности, заболеваемо-
сти, особенностей, степени тяжести, течения, про-
гноза и ответа на терапию поражений сердечно-со-
судистой системы, обусловленных ревматологиче-
скими заболеваниями.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
КРАТКАЯ ИНФОРМАЦИЯ
Наиболее важные формы поражения сердца при
системной красной волчанке (СКВ) — эндокардит
Либмана–Сакса, внутрисердечный тромбоз и тром-
боэмболия, ранний атеросклероз, перикардит, по-
ражение миокарда и легочная гипертензия. Пораже-
ния сердечно-сосудистой системы являются третьей
наиболее распространенной причиной смерти при
СКВ после инфекционных и почечных поражений.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ КЛАПАНОВ, ВНУТРИСЕРДЕЧНЫЙ ТРОМБОЗ
И ТРОМБОЭМБОЛИЯ
Эндокардит Либмана–Сакса — типичное пораже-
ние клапанов при СКВ, для которого характерно
наличие вегетациий Либмана–Сакса, утолщение
створок с фиброзом или без него, неинфекционные
перфорации створок, недостаточность клапана и,
редко, стеноз клапана [1–3].
Патогенез эндокардита Либмана–Сакса включа-
ет иммунокомплексное воспаление, обычно отяго-
щенное сопутствующим повышенным тромбо-
образованием, что опосредовано преимущественно
антифосфолипидными антителами. Тем не менее
временная связь поражения клапана с активностью
и степенью тяжести СКВ и антифосфолипидных
антител является вариабельной [1, 2]. Изначально
вегетации Либмана–Сакса были описаны как боро-
давчатые, сероватые или серовато-розовые, сгруп-
пированные, от 1 до 7 мм в диаметре, стерильные
In-35_для нас.indd 885
03.04.2019 12:11:54
886 ЧАСТЬ VII Сосудистые и системные заболевания
Заболевание
Тип поражения Встречаемость (%)* Основные признаки
Системная
красная
волчанка
Вегетации
Либмана–Сакса
10–45
Характерно, но не только при СКВ. Вегетации могут быть вос-
палительные, тромботические или смешанные. Вегетации
часто меняют свой внешний вид, разрешаются, возникают de
novo или повторно. Вегетации служат главным субстратом
кардиоэмболии, наиболее часто (50–80%) в головного мозга
Фиброз створок 30–50
Часто диффузный. Сопутствующая кальцификация встречается
редко
Недостаточность
клапанов
(обычно легкая
или умеренная)
30–50
В острой фазе вальвулита или при присоединении инфекции
может быть тяжелой. Стеноз клапанов наблюдается редко
(< 3%)
Перикардит
10–50
Антинуклеарные антитела в перикардиальной жидкости служат
диагностическим критерием, но не всегда присутствуют. Там-
понада или констрикция встречаются редко
Бессимптомный
выпот
2–20
Вследствие слабого перикардита, гипоальбуминэмии или легоч-
ного сердца
Миокардит/
кардиомиопа-
тия
1–20
Первичный миокардит ассоциирован с антителами к клеточ-
ным антигенам Ro (SS-A) и La (SS-B). Может имитировать
острый коронарный синдром. Хлорохин-индуцированный
тип встречается редко
Ишемическая
болезнь сердца
Функциональная 25–50
Поражаются мелкие и средние сосуды. Нарушение коронарной
вазодилатации или поражение мелких сосудов. Редко наблю-
дается тромбоз мелких сосудов
Атеросклеротиче-
ская
10–30
Необструктивный или обструктивный эпикардиальный атеро-
склероз, осложненный вазоспазмом или тромбозом
Артериит, коро-
нарная тромбо-
эмболия или
тромбоз in situ
без
атеросклероза
Редко
Артериит при высокой активности заболевания; наличие веге-
таций Либмана–Сакса; или повышенный уровень антифосфо-
липидных антител, соответственно
Инфаркт
миокарда
<10
В результате эпикардиального атеросклероза, вазоспазма, тром-
боза in situ, эмболии или артериита
Диастолическая
дисфункция†
15–35
Преимущественно нарушение релаксации ЛЖ
Легочная
гипертензия
5–15
Возникает в результате интерстициального пора жения легких,
васкулита и тромбоэмболии
Первичный анти-
фосфолипид-
ный синдром
Вегетации на
клапанах
10–30
Все клапанные нарушения, особенно вегетации на клапанах,
имеют схожие черты и течение, что и при СКВ. Преимуще-
ственно они тромботические, но могут встречаться воспали-
тельные и смешанные. Эти вегетации также могут изменяться
внешне на протяжении времени, разрешаться или возникать
повторно
Утолщение
клапанов
40–60
Недостаточность
клапанов
30–40
Легочная
гипертензия
20–25
Наиболее часто возникает в результате легочной эмболии, но
также может быть обусловлена легочной вазоконстрикцией
или обструктивной васкулопатией
Ишемическая
болезнь сердца
20–30
Преимущественно функциональное микрососудистое
пора жение
ТАБЛИЦА 35.1 Поражение сердечно-сосудистой системы при ревматологических заболеваниях
In-35_для нас.indd 886
03.04.2019 12:11:54
887
35 Иммунно-опосредованные системные заболевания
Заболевание
Тип поражения Встречаемость (%)* Основные признаки
Пора жение
миокарда
15–30
Редко первичное воспаление. Чаще диастолическая дисфунк-
ция, обусловленная микрососудистой ишемической болезнью
сердца
Ревматоидный
артрит
Ишемическая
болезнь сердца
40–60
Функциональная 25–50
Нарушение коронарной вазодилатации или микрососудистая
ИБС в 2–4 раза чаще, чем в общей популяции. Преимуще-
ственно субклиническая
Атеросклеротиче-
ская
>40
Обычно субклиническая, выявляемая по результатам электрон-
но-лучевой компьютерной томографии. Тем не менее часто
наблюдается умеренно тяжелая обструкция
Артериит
Редко
Клинически трудно поставить диагноз
Инфаркт
миокарда
10–15
Наиболее часто в результате эпикардиального атеросклероза.
Крайне редко из-за коронарного вазоспазма, тромбоза in situ,
эмболии или артериита
Перикардит
≤10
Возникает у пациентов в активной фазе заболевания, при
высоком уровне ревматоидного фактора и узловом пораже-
нии; в перикардиальной жидкости может содержаться ревма-
тоидный фактор
Бессимптомные
выпоты
30–50
Фиброз створок
>30
Фиброз створок не отличается от такового при системной
волчанке
Узелки на
клапанах
≈10
Характерный признак ревматоидного артрита
Недостаточность
клапанов,
легкой степени
или выше
≥ 25%
Миокардит/
кардиомиопа-
тия
<10
Амилоидные отложения или хлорохин-индуцированный тип
встречается редко
Диастолическая
дисфункция
30–75
Преимущественно нарушение релаксации ЛЖ
Легочная
гипертензия
≈20
Анкилозирую-
щий спондилит
Проксимальный
аортит/
вальвулит
20–60
Склероз корня аорты с распространением на основание перед-
ней створки митрального клапана и дилатация корня
аорты — характерные признаки заболевания
Недостаточность
аортального
клапана легкой
степени или
выше
10–40
Снижение подвижности передней створки митрального
клапана также приводит к митральной недостаточности
Субаортальный
выступ
10–40
Характерный признак заболевания
Поражение
проводящей
системы
>20
Возникает в результате распространения склероза корня аорты/
кольца на проксимальную часть перегородки и атриовентри-
кулярный узел
Диастолическая
дисфункция
20–30
Преимущественно нарушение релаксации ЛЖ
Перикардит
<5
Редко наблюдается первичный иммунно-опосредованный тип
Бессимптомный
выпот
<5
ТАБЛИЦА 35.1
продолжение Поражение сердечно-сосудистой системы при ревматологических заболеваниях
In-35_для нас.indd 887
03.04.2019 12:11:55
888 ЧАСТЬ VII Сосудистые и системные заболевания
Заболевание
Тип поражения Встречаемость (%)* Основные признаки
Миокардит/
кардиомиопа-
тия
<5
Редко наблюдается первичный иммунно-опосредованный
миокардит
Склеродермия
Ишемическая
болезнь сердца
Функциональная ≈ 50
Преимущественно вазоспазм или коронарный феномен Рейно
Атеросклеротиче-
ская
<30
Миокардит/
кардиомиопа-
тия
10–50
Наиболее часто обусловлен рецидивирующей ишемией/некро-
зом/фиброзом. Воспаление наблюдается редко
Диастолическая
дисфункция
30–50
Пора жает ЛЖ и ПЖ. Преимущественно нарушение релаксации
Легочная
гипертензия
35–50
Возникает в результате легочного фиброза, васкулита,
вазоспазма или поражения левых отделов сердца
Перикардит
5–20
Бессимптомный
выпот
30–40
Поражение
клапанов
<10
Неспецифическое
Полимиозит/
дерматомиозит
Миокардит/
кардиомиопа-
тия
>25
У пациентов с миозитом чаще наблюдается первичный миокар-
дит. Диастолическая дисфункция наблюдается у 10–40%
пациентов
Перикардит
≈10
Чаще у детей и при перекрестном синдроме
Бессимптомный
выпот
5–25
Ишемическая
болезнь сердца
≈20
Чаще микрососудистое поражение. Часто необструктивный ате-
росклероз. Артериит встречается редко
Поражение
клапанов
Не известно
Неспецифично. Редко наблюдаются вегетации, подобные веге-
тациям Либмана–Сакса
Смешанное забо-
левание соеди-
нительной
ткани
Легочная
гипертензия
≤80
Чаще возникает в результате пролиферативного васкулита и
легочного фиброза
Перикардит
5–30
Бессимптомный
выпот
Не известно
Поражение
клапанов
Не известно
Неспецифично
Миокардит/
кардиомиопа-
тия
<5
Ишемическая
болезнь сердца
Не известно
Преимущественно микрососудистое пора жение
* Вариабельность показателя ставок связана с различиями в характеристиках популяции пациентов, плане исследования и методах диа-
гностики.
† Определены по допплеровским эхокардиографическим критериям.
ИБС — ишемическая болезнь сердца; ЛЖ — левый желудочек; ПЖ — правый желудочек; СКВ — системная красная волчанка.
ТАБЛИЦА 35.1
окончание
Поражение сердечно-сосудистой системы при ревматологических заболеваниях
In-35_для нас.indd 888
03.04.2019 12:11:55
889
35 Иммунно-опосредованные системные заболевания
вегетации, расположенные вдоль точки сопоставле-
ния створок и всегда связанные с утолщением ство-
рок. В центре активных вегетаций наблюдается
мукоидная дегенерация, фибриноидный некроз и
кровоизлияния, окруженные воспалительной ин-
фильтрацией, представленной преимущественно
полиморфноядерными клетками, а по перифе-
рии — скопления тромбоцитов и фибриновые
тромбы. В заживающих вегетациях определяется
пролиферация фибробластов, центральный фи-
броз, образование новых сосудов с минимальной
воспалительной инфильтрацией или ее отсутстви-
ем, а также с наличием по периферии организован-
ных, частично или полностью эндотелизированных
тромбов или их отсутствием. В смешанных вегета-
циях чередуются области активности и заживления
с наложением тромбов разной степени организации
и эндотелизации (рис. 35.1). На одном и том же
клапане могут наблюдаться активные, заживающие
и смешанные вегетации. Характерные особенности
вегетаций Либмана–Сакса при эхокардиографиче-
ском исследовании, особенно двумерной (2D) и
трехмерной (3D) чреспищеводной эхокардиогра-
фии (ЧПЭхоКГ): поражение преимущественно ми-
трального и аортального клапанов; вариабельный
размер, но обычно диаметром < 1 см; фиксирован-
ные овальные или тубулярные выпячивания или
конгломераты; чаще неоднородная эхогенность;
локализация на точке сопоставления створок (пред-
сердная сторона митральных створок и желудочко-
вая сторона аортальных створок), но часто распро-
странение на противоположную сторону створки; и
обычно связь с различной степенью утолщения
створок и недостаточностью клапана (рис. 35.2–35.4,
см. рис. 35.1) [1, 2]. Редко вегетации определяются
на клапанах правых отделов сердца, эндокарде
предсердий или желудочков, митральном или три-
куспидальном подклапанном аппарате или корне
аорты (рис. 35.5) [1–5]. По результатам эхокардио-
графических исследований частота выявления веге-
ЛП
ЛП
ЛЖ
ЛЖ
ПСМК
ПСМК
ПСМК
Створка
Вегетации
Вегетации
Створка митрального клапана
ЗСМК
ЗСМК
Рис. 35.1 Эхокардиографические и гистопатологические особенности эндокардита Либмана–Сакса. Вегетации Либмана–Сакса на митральном кла-
пане. (A) 2D-ЧПЭхоКГ 31-летней женщины с СКВ и повторными эпизодами ТИА демонстрирует наличие крупных округлых фиксированных на широком основании
вегетаций Либмана–Сакса однородной эхогенности на предсердной поверхности у основания задней створки митрального клапана (ЗСМК) (стрелка) и небольших
округлых фиксированных вегетаций на предсердной поверхности передней створки митрального клапана (ПСМК) (острие стрелки). Обе створки диффузно уме-
ренно утолщены. Выявлена лишь легкая митральная регургитация. Пациентке была выполнена замена митрального клапана из-за рецидивирующих ТИА, несмо-
тря на антикоагуляцию. (Б) Крупные вегетации (стрелка) на задней створке и небольшие вегетации (острия стрелок) на передней створке. (В) При гистологическом
исследовании в створке выявлена мононуклеарная инфильтрация и фиброз. Вегетации преимущественно фибринозного характера, хорошо фиксированные к
створке (острие стрелки). (Г) 2D-ЧПЭхоКГ 28-летней женщины с СКВ и острым состоянием спутанности сознания и когнитивной дисфункцией демонстрирует
небольшие округлые вегетации Либмана–Сакса (стрелки) мягкотканной эхогенности на предсердной поверхности передней и задней створок митрального клапа-
на с сопутствующим утолщением и снижением подвижности створок. Пациентке выполнена замена клапана по поводу сопутствующей симптоматической тяжелой
митральной регургитации. (Д) Отмечается диффузное утолщение створок с наличием вегетаций Либмана–Сакса на предсердной поверхности передней створки
(острие стрелки). (Е) Вегетации, фиксированные к створке митрального клапана (стрелки), представлены аморфными эозинофильными фибринозными зерни-
стыми наложениями с примесью гистиоцитов, клеток воспаления и микротромбами на поверхности (острия стрелок). В створке митрального клапана отмечается
очаговая мукоидная дегенерация и фибриноидный некроз без признаков воспаления. ЛЖ — левый желудочек; ЛП — левое предсердие.
А
Б
В
Г
Д
Е
In-35_для нас.indd 889
03.04.2019 12:11:55
890 ЧАСТЬ VII Сосудистые и системные заболевания
ЛП
ЛЖ
ПСМК
ПСМК
ПСМК
Проекция со стороны ЛП
Проекция со стороны ЛЖ
Проекция со стороны ЛЖ
ПСМК
ЗСМК
ЗСМК
ЗСМК
ЗСМК
ЗСМК
Рис. 35 .2 Определение и оценка эндокардита Либмана–Сакса митрального клапана с помощью двухмерной и трехмерной чреспищеводной
эхокардиографии. (A) A При 2D-ЧПЭхоКГ в позиции митрального клапана в режиме «Масштабирование» у 26-летней женщины с системной красной волчан-
кой и инсультом в анамнезе и острой транзиторной ишемической атакой определяются небольшие фиксированные однородной гиперэхогенности овальные
узелки, соответствующие фазе ремиссии вегетаций Либмана–Сакса (стрелки) со стороны левого предсердия (ЛП) на дистальных частях передней (ПСМК)
створки митрального клапана и задней створки митрального клапана (ЗСМК), с незначительным утолщением и выраженным нарушением подвижности створок,
преимущественно задней створки митрального клапана. (Б) A При 3D-ЧПЭхоКГ в позиции митрального клапана со стороны ЛП в фазу систолы определяется
несколько выступающих фиксированных округлых узелков (стрелки) однородной гиперэхогенности, размером от небольших до средних, преимущественно рас-
положенных на кончиках обеих створок с поражением всех сегментов. (В) A При 3D-ЧПЭхоКГ в позиции митрального клапана со стороны левого желудочка (ЛЖ)
в фазу систолы также определяются (1) множественные выступающие со стороны ЛП в сторону ЛЖ узелки (стрелки) однородной эхогенности, размером от не-
больших до средних, локализованные преимущественно на кончиках обеих створок митрального клапана и (2) три умеренно небольшие округлые и тубулярные
фиксированные окрашенные коричневым вегетации, локализованные на кончике и комиссуральной части сегмента P3, кончике P2 и P1 (острия стрелок), позво-
ляющие заподозрить недавнее формирование вегетаций. (Г) 3D-ЧПЭхоКГ в позиции митрального клапана со стороны ЛЖ в фазу диастолы демонстрирует
(1) множественные узелки однородной (стрелки) и неоднородной (острия) эхогенности вдоль кончиков обеих створок митрального клапана; (2) снижение подвиж-
ности обеих створок с фиксацией сегментов P1 и P2; и (3) легкую степень сращения передне-латеральной комиссуры (горизонтальная стрелка). (Д) На среднем
сегменте задней митральной створки определяются фиксированные зернистые выступающие окрашенные серовато-коричневым сгруппированные и сливающие-
ся вегетации Либмана–Сакса (стрелки), расположенные на точке сопоставления и преимущественно на стороне ЛП, но также распространяющиеся через створку
на сторону ЛЖ. (Е) При гистопатологическом исследовании с окраской гематоксилином и эозином материалов секционного исследования выявлено диффузное
утолщение преимущественно кончика задней створки митрального клапана с хорошо фиксированными вегетации в основном на ЛП (стрелки), но с распростра-
нением на сторону ЛЖ, где отмечается организация и эндотелизация.
А
Б
В
Г
Д
Е
In-35_для нас.indd 890
03.04.2019 12:11:55
891
35 Иммунно-опосредованные системные заболевания
таций Либмана–Сакса составляет < 11% при тран-
сторакальной эхокардиографии (ТТЭхоКГ) и 35–
45% при ЧПЭхоКГ [1, 2, 6]. Как стандартный метод
исследования ТТЭхоКГ демонстрирует очень низ-
кую чувствительность и низкую отрицательную
прогностическую ценность для выявления вегета-
ций (11 и 57% соответственно) [6]. Трехмерная
ЧПЭхоКГ, по сравнению с 2D-ЧПЭхоКГ, позволяет
выявить больше вегетаций и определить вегетации
более крупного размера; лучше определить локали-
зацию, распространение, форму и внешний вид
вегетаций; чаще выявлять сопутствующие сраще-
ния комиссур клапана; и определяет более частую
встречаемость вегетаций у пациентов с цереброва-
скулярными заболеваниями (табл. 35.2) [7].
Эмболическое цереброваскулярное заболевание
является наиболее распространенным осложнением
эндокардита Либмана–Сакса. Патологоанатомиче-
ские исследования, включающие серийные соотно-
шения данных магнитно-резонансной томографии
мозга (МРТ) и патологоанатомического исследо-
вания мозга и сердца, транскраниальная доппле-
рография, неконтролируемые или ретроспектив-
ные исследования с использованием 2D-ТТЭхоКГ
и 2D-ЧПЭхоКГ и недавнее полностью интегриро-
ванное контролируемое одномоментное и долго-
временное исследование с использованием 2D-ЧПЭ-
хоКГ продемонстрировали, что у пациентов с веге-
тациями, по сравнению с пациентами, у которых
вегетации отсутствуют, выше показатель цере-
бральной микроэмболии в час, ниже перфузия го-
ловного мозга, чаще наблюдаются инсульты и тран-
зиторные ишемические атаки, тяжелее нейрокогни-
тивная дисфункция и более выражено поражение
мозга.
Вегетации на клапанах служат сильным незави-
симым фактором риска развития инсульта и тран-
зиторной ишемической атаки, нейрокогнитивной
дисфункции, очаговых поражений головного мозга
и комбинации всех трех исходов. Пи наличии веге-
ЛП
Проекция со стороны ЛП
Проекция со стороны ЛП
Проекция со стороны ЛП
ЛЖ
ЛЖ
ЛП
ЛП
ЛП
ЛЖ
АК
АК
ЛЖ
ПСМК
ПСМК
ПСМК
ЗСМК
ПСМК
ЗСМК
ЗСМК
МР
МР
Рис. 35 .3 Характерные признаки эндокардита Либмана–Сакса митрального клапана. (A) A 2D-ЧПЭхоКГ, позиция митрального клапана в режиме
«масштабирование». Видны умеренно крупные округлые фиксированные вегетации Либмана–Сакса однородной мягкотканной эхогенности со стороны ЛП на
дистальных частях передней створки митрального клапана (ПСМК) и задней створки митрального клапана (ЗСМК) (стрелки). Створки имеют значительное
утолщение, подвижность их снижена. (Б, В) A A 3D-ЧПЭхоКГ, позиция митрального клапана со стороны левого предсердия (ЛП) во время систолы (Б) и со
стороны левого желудочка (ЛЖ) во время диастолы (В). Видны крупные, значительно выступающие и перекатывающиеся (со стороны ЛП на сторону ЛЖ во
время диастолы) вегетации с неровной и узловатой поверхностью, тубулярной дольчатой формы, локализованные на стороне ЛП и кончиках передней и задней
створок митрального клапана (стрелки) со сниженной подвижностью и нарушенной коаптацией. (Г) A Цветовая допплерография в позиции ЛП демонстрирует
тяжелую митральную регургитацию (МР). (Д–З) Результаты последующего наблюдения в 2D-режиме A (Д), 3D-режиме (со стороны ЛП) A (Е), 3D-режиме (со
стороны ЛЖ) A (Ж) и при цветовой допплерографии A (З) показывают значительное уменьшение размеров вегетаций на митральном клапане и снижение
митральной регургитации от умеренной до легкой после 6 мес иммуносупрессивной противовоспалительной и двойной антитромбоцитарной терапии. АК
—
аортальный клапан.
А
Б
В
Г
Д
Е
Ж
З
In-35_для нас.indd 891
03.04.2019 12:11:56
892
ЧАСТЬ VII Сосудистые и системные заболевания
таций у пациента сокращается время выживаемости
без вмешательства до инсульта или транзиторной
ишемической атаки, когнитивной несостоятельно-
сти или летального исхода (табл. 35.3; рис. 35.6,
35.7) [8–12]. Эти данные подтверждают, что вегета-
ции Либмана–Сакса служат источником тромбо-
цитарных или фибриновых макро- или микроэм-
болов, которые вызывают окклюзию сосудов голов-
ного мозга, и приводят к уменьшению перфузии
мозга, ишемическому повреждению мозга, инсульту
или транзиторной ишемической атаке, нейрокогни-
тивной дисфункции или инвалидности и входят в
число причинных факторов летального исхода. Ве-
гетации на клапанах левых отделов сердца редко
приводят к эмболии коронарных артерии, а вегета-
ции клапанов правых отделов сердца редко служат
причиной эмболии легких, или парадоксально эм-
болизируют. Эндокардит Либмана–Сакса также
ВТПЖ
Проекция со стороны корня Ао
Проекция со стороны корня Ао
Проекция со стороны корня Ао
Рис. 35 .4 Определение и оценка эндокардита Либмана–Сакса аортального клапана с помощью чреспищеводной 2D- и 3D-эхокардиографии.
(A) A При 2D-ЧЭхоКГ в позиции по короткой оси аортального клапана у 29-летнего мужчины с СКВ и повторными эпизодами ТИА выявлены небольшие области
очагового слабо выраженного утолщения кончика левой коронарной створки (стрелка). (Б) A При 3D-ЧПЭхоКГ в позиции аортального клапана со стороны корня
аорты (Ао) в фазу систолы отмечаются три округлых небольших фиксированных вегетации однородной эхогенности с неровными границами рядом расположен-
ных со стороны аорты и также желудочка и кончике левой коронарной створки (стрелки). Результаты цветовой допплерографии демонстрируют сопутствующую
легкую недостаточность аортального клапана. (В) A При 2D-ЧПЭхоКГ в позиции по короткой оси аортального клапана у 38-летней женщины с недавней ТИА
отмечается слабое фокальное утолщение кончика левой коронарной створки (стрелка). Не коронарная и правая коронарная створки внешне не изменены. (Г) A
3D-ЧПЭхоКГ в позиции аортального клапана со стороны корня аорты демонстрирует две небольшие фиксированные вегетации неправильной формы со стороны
аорты и на кончиках некоронарной и левой коронарной створок (стрелки). Результаты цветовой допплерографии не выявили недостаточности аортального клапа-
на. (Д) A 2D-ЧПЭхоКГ у 27-летнего мужчины с СКВ демонстрирует небольшие тубулярные вегетации однородной эхогенности, локализованные на кончиках
левой коронарной створки как со стороны аорты, так и со стороны ЛЖ (стрелка). (Е) A 3D-ЧПЭхоКГ в позиции аортального клапана со стороны аорты в фазу
диастолы демонстрирует округлую вегетацию мягкотканной эхогенности, локализованную на кончике левой коронарной створки (стрелка). Аортальные створки
внешне не изменены. Недостаточность аортального клапана не отмечается. ВТПЖ — выносящий тракт правого желудочка.
А
В
Д
Б
Г
Е
In-35_для нас.indd 892
03.04.2019 12:11:57
893
35 Иммунно-опосредованные системные заболевания
может осложниться серьезной недостаточностью
клапана, которая возникает в результате рецидив-
ного или острого вальвулита; неинфекционных
перфораций клапана, включая биопротезные створ-
ки; неинфекционного разрыва хорды митрального
клапана; или наложения инфекционного эндокар-
дита, по меньшей мере, у 20% пациентов [2, 12–14].
Инфекционный эндокардит может имитировать,
сопровождать или провоцировать обострение СКВ
и может привести к серьезной дисфункции клапана,
застойной сердечной недостаточности и смерти от
сепсиса. Аналогично, обострение СКВ может ими-
тировать эндокардит (псевдоинфекционный эндо-
кардит).
Естественное течение эндокардита Либмана–
Сакса происходит параллельно первичному заболе-
ванию. Результаты последовательных ЧПЭхоКГ
могут демонстрировать появление вегетаций по-
вторно, и разрешение, изменение внешнего вида
или прогрессирование [2]. Хроническое воспаление
может ускорить склероз клапана с исходом в стеноз.
Кроме того, у пациентов с вегетациями на клапанах
или с умеренной или тяжелой дисфункцией клапа-
нов отмечается трех- и четырехкратное увеличение
общей частоты инсульта, периферической эмболии,
необходимость в операции на клапане или его пла-
стике и летального исхода по сравнению с пациен-
тами с легким поражением клапана или без него [2,
12–14]. Отмечается положительный эффект имму-
носупрессивной противовоспалительной и анти-
тромботической терапии на вегетации клапанов с
корреляцией церебральной эмболии (церебральная
микроэмболия, инсульт или транзиторная ишеми-
ческая атака, нейрокогнитивная дисфункция, пер-
фузия головного мозга и повреждение головного
мозга), но эти данные не были протестированы в
ходе рандомизированных контролируемых иссле-
дований (табл. 35.4; см. рис. 35.7) [12].
Хотя эндокардит Либмана–Сакса имеет характер-
ную эхокардиографическую картину, некоторые его
признаки могут совпадать с признаками тромботи-
ческих и инфицированных вегетаций, острым или
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
ЛЖ
Проекция со стороны ЛЖ
Проекция со стороны ЛЖ
Рис. 35 .5 Внеклапанные вегетации Либмана–Сакса при системной красной волчанке. (A) A При 2D-ЧПЭхоКГ в двухкамерной позиции у 26-летней
женщины с СКВ, инсультом в анамнезе и острой ТИА определяются крупные округлые массы однородной мягкотканной эхогенности, позволяющие заподозрить
недавнее формирование вегетаций (стрелка) на заднемедиальной стенке левого желудочка (ЛЖ), по-видимому, с распространением на хорду. (Б) A 3D-ЧПЭхоКГ
в позиции ЛЖ демонстрирует крупные тубулярные вегетации (стрелки) фиксированные к заднемедиальной стенке ЛЖ с распространением на хордовый аппарат.
(В) A 3D-ЧПЭхоКГ в позиции ЛЖ и подклапанного аппарата митрального клапана демонстрирует вегетации среднего размера на хордах (стрелка) дополнитель-
но к множественным узелкам (вероятно, заживающие и активные вегетации) на кончиках обеих створок митрального клапана. (Г) A При 2D-ЧПЭхоКГ в комис-
суральной позиции у 32-летней женщины с СКВ и острым инсультом определяются крупные округлые однородные вегетации (стрелки) мягкотканной эхогенности,
фиксированные у основания переднебоковой стенки ЛЖ. (Д) A При 2D-ЧПЭхоКГ в четырехкамерной позиции у 23-летней женщины с СКВ и острым инсультом
отмечаются крупные вегетации мягкотканной эхогенности с неровными краями, фиксированные к боковой стенке левого предсердия (ЛП) (стрелки). Также обра-
тите внимание на очень крупные удлиненные сверхподвижные вегетации (острие) мягкотканной эхогенности, расположенные в точке сопоставления и на пред-
сердной стороне передней митральной створки (в видеоролике вегетации показаны на передней и задней митральных створках). Также отмечалось выраженное
утолщение и снижение подвижности преимущественно кончиков створок.
А
Б
В
Г
Д
In-35_для нас.indd 893
03.04.2019 12:11:58
894
ЧАСТЬ VII Сосудистые и системные заболевания
хроническим ревматическим поражением клапанов,
дегенеративным поражением клапанов и наложени-
ями Lambl (Ламбла) (табл. 35.5) [7, 12, 15, 16].
АТЕРОСКЛЕРОЗ
Ранний атеросклероз широко распространен при
СКВ и является основной причиной заболеваемости
Клапан
3D-ЧПЭхоКГ
n=40
2D-ЧПЭхоКГ
n=40
p
Исследования с вегетациями
Митральный клапан
18 (45%)
14 (35%)
0,046*
Аортальный клапан
19 (48%)
12 (30%)
0,008*
Оба клапана
26 (65%)
20 (50%)
0,01*
Количество вегетаций
Митральный клапан
59 (1,48)
42 (1,05)
0,09†
Аортальный клапан
31 (0,78)
15 (0,38)
< 0,001†
Оба клапана
90 (2,25)
57 (1,43)
0,001†
Размер вегетаций
Вегетации на митральном клапане (диаметр, мм)
9,16 ± 5,76
5,3 ± 4,15
0,03£
Вегетации на аортальном клапане (диаметр, мм)
5,59 ± 1,61
3,9 ± 1,26
0,005£
Локализация вегетаций
Передняя створка митрального клапана
35 (0,88)
19 (0,48)
0,02§
Переднелатеральные (A1, P1) или заднемедиальные (A3, P3) сегменты
26 (0,65)
12 (0,30)
0,046§
Левый желудочек или как предсердная, так и желудочковая сторона (сквозное
распространение) митральных створок
11 (0,28)
6 (0,15)
0,04§
Пора жение 2 или 3 смежных сегментов
15 (0,38)
7 (0,18)
0,03§
Левая коронарная створка
9 (0,23)
3 (0,08)
0,05§
Некоронарная створка
14 (0,35)
5 (0,13)
0,002§
Кончик коронарной створки
18 (0,45)
8 (0,20)
0,009§
Край коронарной створки
10 (0,25)
2 (0,05)
0,004§
С желудочковой на аортальную сторону (сквозное распространение)
11 (28%)
1 (3%)
0,02§
Как аортальная, так и аортальная и желудочковая стороны
16 (40%)
3 (8%)
0,01§
Сращение комиссур
Переднелатеральная комиссура
5 (13%)
2 (5%)
0,08
Заднемедиальная комиссура
6 (15%)
1 (3%)
0,03
Обе комиссуры митрального клапана
8 (20%)
2 (5%)
0,01
Отсутствие поражения комиссур аортального клапана
4 (10%)
0
0,08
Отсутствие поражения комиссур митрального или аортального клапанов
12 (30%)
2 (5%)
0,002
* Парное сравнение с помощью теста McNemar; формат — количество исследований с вегетациями (%).
† Парное сравнение с помощью регрессии Пуассона; формат — количество вегетаций (среднее количество вегетаций на исследование).
£ Парное сравнение с помощью парного t-критерия; формат — средний диаметр или площадь ± стандартное отклонение.
§ Все значения p получены с помощью регрессии Пуассона; формат — количество вегетаций (среднее количество вегетаций на исследова-
ние).
ЧПЭхоКГ — чреспищеводная эхокардиография.
[Roldan CA, Tolstrup K, Macias L, et al. Libman-Sacks Endocarditis: Detection, Characterization, and Clinical Correlates by Three-Dimensional
Transesophageal Echocardiography. J Am Soc Echocardiogr 28:770–779, 2015.]
ТАБЛИЦА 35.2 Определение и характеристика вегетаций Либмана–Сакса
с помощью трехмерной и двухмерной чреспищеводной эхокардиографии
и смертности. После учета классических факторов
риска развития атеросклероза показатели распро-
страненности его субклинической формы у пациен-
тов с СКВ в 2–4 раза выше, чем в аналогичной кон-
трольной группе. Ранние функциональные про-
явления атеросклероза определяются снижением
запаса коронарного кровотока, оцениваемого с по-
In-35_для нас.indd 894
03.04.2019 12:11:58
895
35 Иммунно-опосредованные системные заболевания
Нарушение
Пациенты с наличием вегетаций
(n=39)
Пациенты без вегетаций
(n=37)
p
Микроэмболия
Микроэмболия правой
или левой СМА
12 (31%)
21 случаев/56,6 час
5 (14%)
7 случаев/55 час
Скорректированное
отношение рисков* 3,0,
p=0,01
НПСКВ, n (%)†
Острый инсульт/ТИА
22 (56%)
1 (3%)
< 0,001
Острая общая НПСКВ
26 (67%)
4 (11%)
< 0,001
Нейрокогнитивная Z-шкала оценки, среднее значение ± СО
Внимание
− 2,36 ± 3,00
− 0,82 ± 0,91
0,02£
Память
− 1,75 ± 1,27
− 0,79 ± 1,00
0,001£
Скорость обработки
информации
− 1,90 ± 1,92
− 0,90 ± 1,15
0,04£
Исполнительные
функции
− 3,31 ± 3,60
− 1,68 ± 2,53
0,03£
Моторная функция
− 4,38 ± 7,40
− 1.40 ± 1,54
0,005£
В общем
− 2,42 ± 2,32
− 1,17 ± 0,98
0,01§
Очаговое поражение головного мозга, n (%)
Очаговое поражение
головного мозга
28 (72%)
12/36 (34%)¶
< 0,001
Инфаркт головного
мозга
14 (36%)
0/36
< 0,001
Поражение белого веще-
ства головного мозга
25/37 (68%)
12/36 (34%)
0,005
* Регрессия Пуассона с повторными измерениями, скорректированными для открытого овального окна, аневризмы межпредсердной пе-
регородки, атеросклероза сонной артерии или аорты и антифосфолипидных антител.
† НПСКВ — нейропсихиатрическая системная красная волчанка, включая инсульт, транзиторную ишемическую атаку, острое состояние
спутанного сознания, когнитивную дисфункцию или судороги.
£ Критерий Уилкоксона.
§ p = 0,02 после одновременной корректировки на возраст, индекс депрессии, преморбидный интеллект и образование.
¶ Одному из пациентов без вегетаций не было выполнено МРТ из-за клаустрофобии.
СМА — средняя мозговая артерия; СО — среднеквадратичное отклонение; ТИА — транзиторная ишемическая атака.
[Roldan CA, Sibbitt WL Jr, Qualls CR, et al. Libman-Sacks endocarditis and embolic cerebrovascular disease. JACC Cardiovasc Imaging 6:973–983,
2013.]
ТАБЛИЦА 35.3 Взаимосвязь вегетаций Либмана–Сакса с нарушением мозгового кровообращения
мощью ЭхоКГ с дипиридамолом или аденозином,
снижение периферической артериальной вазодила-
тации или увеличение плотности сонных артерий
или аорты (рис. 35.8A –В) [17–20]. Ранний субкли-
нический атеросклероз также проявляется увели-
чением распространенности (30–45%) кальцифика-
ции коронарных артерий, выявляемой с помощью
компьютерной томографии (КТ), увеличением тол-
щины комплекса интима-медиа и бляшек сонных
артерий и аорты, определяемой с помощью ульт-
развуковой эхографии и ЧПЭхоКГ, или более диф-
фузным воспалением стенок коронарных сосудов,
определяемом с помощью МРТ с контрастировани-
ем (89% против 24% у пациентов без СКВ) (см. рис.
35.8Г, Д) [21–23]. Ранний субклинический атеро-
склероз служит прогностическим фактором 35%
повышения риска развития инфаркта миокарда,
чрескожных коронарных вмешательств, аорто-ко-
ронарного шунтирования, инсульта и летального
исхода.
У пациентов с активной фазой СКВ острый ко-
ронарный синдром чаще всего возникает из-за не-
обструктивного или обструктивного эпикардиаль-
ного атеросклероза, усугубляемого повышенным
сосудистым тонусом или тромбообразованием, и
редко — коронарным артериитом, коронарной эм-
болией из клапанных вегетаций или тромбозом in
situ без атеросклероза [24]. Клинические, электро-
кардиографические, серологические и эхокардио-
графические признаки волчаночного миоперикар-
дита или миокардита имитируют острый ко-
ронарный синдром. Эти клинические сценарии
In-35_для нас.indd 895
03.04.2019 12:11:58
896 ЧАСТЬ VII Сосудистые и системные заболевания
предполагают, что ЭхоКГ в покое и с физической
нагрузкой может демонстрировать снижение чув-
ствительности и специфичности для выявления
эпикардиальной ишемической болезни сердца
(ИБС) при наличии загрудинных болей у пациен-
тов с СКВ. Поэтому при подозрении на острый ко-
ронарный синдром у пациентов с СКВ может быть
целесообразно проведение коронарографии.
Стандартная общемедицинская терапия в соче-
тании со специфической иммуносупрессивной про-
тивовоспалительной терапией может быть рассмо-
трена до проведения чрескожного коронарного
вмешательства высокого риска или операции аор-
токоронарного шунтирования у пациентов с острым
коронарным синдромом без повышения ST-сегмен-
та, или одновременно с этими процедурами у паци-
ентов с инфарктом миокарда с повышением ST-сег-
мента.
ПОРАЖЕНИЕ МИОКАРДА
Поражение миокарда, проявляющееся преимуще-
ственно в форме субклинической диастолической
дисфункции желудочков, часто встречается у па-
циентов с СКВ и имеет мультифакторный патоге-
нез. Одна из доминирующих причин — эндотели-
альная дисфункция, обусловленная микрососуди-
стой ИБС, которая характеризуется уменьшением
резерва коронарного кровотока, выявляемого с
помощью допплеровской ТТЭхоКГ с дипиридамо-
лом или аденозином [17, 18]. Второй частой при-
чиной может быть широко распространенная
(25–35%) артериальная гипертензия. Кроме того,
ранняя ригидность периферических артерий, не
связанная с гипертензией, может привести к уве-
личению постнагрузки на ЛЖ и массы ЛЖ, а также
диастолической дисфункции. В ходе контролируе-
мого исследования с участием молодых пациентов
ЛП
ЛЖ
ПСМК
ЗСМК
ЗСМК
Рис. 35.6 Эндокардит Либмана–Сакса и эмболия сосудов головного мозга. (A) A 2D-ЧПЭхоКГ у 55-летней женщины с системной красной волчанкой и
транзиторной ишемической атакой демонстрирует продолговатые фиксированные вегетации Либмана–Сакса (стрелка) среднего размера и неоднородной эхоген-
ности на задней створке митрального клапана (ЗСМК) со стороны левого предсердия (ЛП). Отмечается умеренное утолщение и склероз со снижением подвиж-
ности средней и дистальной частей передней створки митрального клапана (ПСМК) и ЗСМК. (Б) Результаты транскраниальной допплерографии демонстрируют
признаки микроэмболии при спектральной допплерографии (верхняя стрелка) и просвет сосудов (нижняя стрелка), отслеживание левой средней мозговой артерии
(красный M-режим) и передней соединительной артерии (синий М-режим). (В) МРТ головного мозга демонстрирует множественные двухсторонние околожелу-
дочковые инфаркты и глубокие инфаркты белого вещества головного мозга различного размера (стрелки). Общая нейрокогинтивная Z-оценка указывает на вы-
раженную нейрокогнитивную дисфункцию. (Г) При гистопатологическом исследовании (окраска гематоксилином и эозином, ×40) видны утолщение и фиброз
задней створки митрального капана с наличием плотно фиксированных бородавчатых фибринозных вегетаций (стрелка). (Д) Гистопатологическое исследование
головного мозга (× 20, окрашивание гематоксилином и эозином). Подострый инфаркт головного мозга на границе белого и серого вещества с некротическим
детритом и умеренной воспалительной инфильтрацией (стрелка). (Е) Гистопатологическое исследование головного мозга (окрашивание гематоксилином и эозином,
× 100). Фибриновый тромб (стрелка) в крупном сосуде головного мозга. Множественные подострые и старые микроинфаркты и фибриновые тромбы в мелких
сосудах с неоангиогенезом — признаки хронической эмболии сердца (в обоих полушариях головного мозга). ЛЖ — левый желудочек.
А
Б
В
Г
Д
Е
In-35_для нас.indd 896
03.04.2019 12:11:58
897
35 Иммунно-опосредованные системные заболевания
с СКВ, которым выполнялась ЧПЭхоКГ для одно-
временной оценки диастолической функции ЛЖ и
ригидности грудной части нисходящего отдела
аорты, было продемонстрировано, что у пациен-
тов с СКВ более высокая степень ригидности аорты
независимо от классических атерогенных факто-
ров риска и атеросклероза аорты, больше масса
ЛЖ и более выражена диастолическая дисфункция
ЛЖ; у пациентов с СКВ ригидность аорты корре-
лирует с увеличением объема левого предсердия
(ЛП), массы ЛЖ и диастолической дисфункции
ЛЖ; и ригидность аорты независимо связана с ди-
астолической дисфункцией ЛЖ (см. рис. 35.8A –В)
[25]. Редко причиной служат васкулиты мелких
сосудов, коронарный артериит и первичный мио-
кардит. Редко первичным проявлением активной
фазы СКВ может быть острый миокардит, прояв-
ляющийся застойной сердечной недостаточностью
с глобальной или сегментарной дисфункцией ЛЖ.
Наконец, имеются сообщения о самопроизвольно
обратимой глобальной кардиомиопатии, подоб-
ной стрессовой и индуцированной хингамином
кардиомиопатии или рестриктивной кардиомио-
патии [26–27]. В ходе контролируемых серийных
допплер-эхокардиографических исследований с
участием пациентов без симптомов системной или
ЛП
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЗСМК
ЗСМК
ЗСМК
ЗСМК
ПСМК
ПСМК
ПСМК
ПСМК
Рис. 35 .7 Эндокардит Либмана–Сакса и эмболия сосудов головного мозга: эффект от терапии. (A) A ЧПЭхоКГ в четырехкамерной позиции у
18-летней женщины с СКВ и острой гомонимной гемианопсией, спутанностью сознания и когнитивной дисфункцией демонстрирует крупные округлые фиксиро-
ванные однородные мягкотканные эхогенные вегетации Либмана–Сакса (стрелка) на дистальной и средней части передней митральной створки (ПСМК) со сто-
роны левого предсердия (ЛП). (Б) Транскраниальная допплерография у данной пациентки демонстрирует наличие микроэмболов в просвете правой средней
мозговой артерии при спектральной допплерографии (верхняя стрелка) и в сосуде t (нижняя стрелка). (В) Диффузная взвешенная визуализация головного
мозга демонстрирует наличие двусторонних острых париетальных инфарктов (стрелки). Общая нейрокогнитивная оценка пациентки соответствовала умеренной
нейрокогнитивной дисфункции. (Г) A После 9 нед иммуносупрессивной и антикоагуляционной терапии повторная визуализация продемонстрировала разрешение
вегетаций митрального клапана, а также разрешение эмболии мелких сосудов головного мозга, уменьшение поражений головного мозга и значительное улучше-
ние ее общей нейрокогнитивной оценки до легкой нейрокогнитивной дисфункции. (Д) A 2D-ЧПЭхоКГ с увеличением у 21-летней женщины с СКВ и инсультом в
анамнезе и острой ТИА демонстрирует округлые фиксированные вегетации Либмана–Сакса умеренно небольшого размера, неоднородной эхогенности (стрелки)
на дистальной части передней створки митрального клапана (ПСМК) и задней створки митрального клапана (ЗСМК) со стороны ЛП в сочетании с утолщением и
снижением подвижности створок. (Е) Транскраниальная допплерография демонстрирует наличие микроэмбоов в левой средней мозговой артерии (стрелки).
(Ж) МРТ демонстрирует старый инфаркт головного мозга (острия стрелок) и множественные небольшие поражения белого вещества головного мозга (стрелки).
Общая нейрокогнитивная оценка соответствовала тяжелой нейрокогнитивной дисфункции. (З) A После 3 мес иммуносупрессивной противовоспалительной те-
рапии и приема антикоагулянтов повторная визуализация продемонстрировала разрешение вегетаций на передней створке митрального клапана и значительное
уменьшение размера (стрелка) вегетаций на задней створке митрального клапана, а также снижение церебромикроэмболии, уменьшение поражений белого ве-
щества головного мозга и значительное улучшение в ее глобальной нейрокогнитивной оценке. ЛЖ — левый желудочек.
А
Б
В
Г
Д
Е
Ж
З
In-35_для нас.indd 897
03.04.2019 12:11:59
898 ЧАСТЬ VII Сосудистые и системные заболевания
Показатель
Первичное исследование
Последующее исследование
Значение p*
ЧПЭхоКГ, среднее значение ± СО
Вегетации (n)
2,0 ± 1,41
1,33 ± 1,28
0,03
Вегетации (площадь, см2)
0,38 ± 0,46
0,18 ± 0,19
0,09
Транскраниальная допплерография, n (%)
Микроэмболия правой или
левой СМА
У 5 пациентов (28%) 14
микроэмоболов
0
0,007†
Нейрокогнитивная Z-шкала оценки, среднее значение ± СО
p*
Внимание
− 3,55 ± 4,24
−2,26 ± 3,20
0,002
Память
−1,62 ± 1,64
−0,88 ± 1,61
0,001
Моторная функция
−6,43 ± 10,46
−2,32 ± 2,70
0,002
Глобальная когнитивная
дисфункция
−3,12 ± 3,08
−1 .86 ± 2,32
< 0,001
Перфузия головного мозга (мл/мин/100 г/ткани) среднее значение ± СО Δ%/p*
Все серое вещество
28,10 ± 18,04
33,87 ± 15,02
34%/0,02
Все белое вещество
14,36 ± 9,73
17,47 ± 6,88
38%/0,02
Нагрузка повреждения головного мозга, медиана (IQR)
Нагрузка повреждения голов-
ного мозга в целом (см3)
0,68 (0,17, 3,93)
0,55 (0,07, 1,74)
0,03
* Ранговые критерии Уилкоксона.
† Регрессия Пуассона с повторными измерениями.
IQR — интерквартильная широта; СМА — средняя мозговая артерия; СО — среднеквадратичное отклонение; ЧПЭхоКГ — чреспищевод-
ная эхокардиография.
[Roldan CA, Sibbitt WL Jr, Qualls CR, et al. Libman-Sacks endocarditis and embolic cerebrovascular disease. JACC Cardiovasc Imaging 6:973–983,
2013.]
ТАБЛИЦА 35.4 Эффект от противовоспалительной и антитромбоцитарной терапии на вегетации Либмана–Сакса
и корреляция с нарушением кровообращения головного мозга
легочной гипертензии и с нормальной систоличе-
ской функцией ЛЖ была показана высокая рас-
пространенность (15–35%) диастолической дис-
функции ЛЖ и правого желудочка (ПЖ) [28, 29].
Для выявления диастолической и систолической
дисфункции желудочков на ранней стадии более
чувствительны продольная, циркулярная и ради-
альная деформация миокарда и скорость деформа-
ции, а также показатели тканевой допплерографии,
чем допплеровские параметры митрального при-
тока. Субклиническая диастолическая дисфункция
ЛЖ чаще встречается у пациентов с более продол-
жительным течением и более высокой активно-
стью и степенью тяжести заболевания. У молодых
пациентов с активной фазой СКВ и неизмененны-
ми коронарными артериями диастолическая дис-
функция ЛЖ, указывающая на микрососудистую
ИБС, связана с обратимыми, стойкими и смешан-
ными нарушениями перфузии миокарда. В отли-
чие от диастолической дисфункции желудочков,
частота распространенности систолической дис-
функции составляет < 20% при неселективном
выборе пациентов. Однако клинические и прогно-
стические последствия субклинической диастоли-
ческой и систолической дисфункции ЛЖ и ПЖ при
СКВ не определены. Кроме того, допплер-эхокарди-
ография ограничена в возможности определения
причины желудочковой дисфункции. МРТ сердца с
T2-взвешенной визуализацией для оценки отека и
контрастированием гадолинием для оценки фибро-
за позволяет лучше дифференцировать, обусловлен
ли патогенез поражения миокарда васкулитом, ми-
окардитом или инфарктом миокарда [30].
ПОРАЖЕНИЕ ПЕРИКАРДА
У ≈ 50% пациентов с СКВ отмечается по крайней
мере один приступ симптоматического перикарди-
та. Большинство приступов носят острый характер,
и они обычно связаны с активной фазой СКВ. Там-
понада сердца и констриктивный перикардит на-
блюдаются редко (< 2%) [31, 32]. Редко острый пе-
рикардит и тампонада сердца могут быть началь-
ным проявлением СКВ.
Выпот без сопровождающих признаков и сим-
птомов перикардита у пациента с СКВ может воз-
никать в результате легкого перикардита, гипоаль-
буминемии или легочной гипертензии с легочным
сердцем. Бессимптомные выпоты являются частой
случайной находкой (≈ 20%) у госпитализирован-
ных пациентов в активной фазе СКВ.
ЭхоКГ — стандартный метод оценки при подо-
зрении на перикардит при СКВ для определения
In-35_для нас.indd 898
03.04.2019 12:11:59
899
35 Иммунно-опосредованные системные заболевания
Заболевание
Поражаемые структуры
Ключевые характеристики
Функциональные последствия
Системная
красная
волчанка
Преимущественно поража-
ются митральный и аор-
тальный клапаны, реже —
хорды, трикуспидальный
клапан и клапан легочной
артерии, кольца не
затрагиваются
Вегетации Либмана–Сакса: массы обычно
< 1 см в диаметре, с неоднородной спо-
собностью отра жать эхо-сигнал (но без
кальцификации) и с неровными грани-
цами; различной формы (округлые,
тубулярные, выпуклые или сросшиеся).
Прикреплены к створке на широком
основании. Самостоятельное движение
обычно не отмечается. Пора жение может
располагаться в любой части створки на
предсердной стороне митрального
клапана и желудочковой стороне аор-
тального клапана, но часто распростра-
няется через створку на противополож-
ную сторону. Часто отмечается диффуз-
ное утолщение или склероз створок с
легкой степенью сращения комиссур;
редко наблюдается незначительная
кальцификация
Часто наблюдается митральная
недостаточность или недоста-
точность аортального клапана
умеренно легкой степени, но
стеноз встречается редко.
Источник эмболии, сопряжен-
ный с высоким риском
Первичный
антифосфо-
липидный
синдром
Преимущественно поража-
ются митральный и аор-
тальный клапаны; реже —
хорды, трикуспидальный
клапан и клапан легочной
артерии; кольца не
затрагиваются
Вегетации, подобные вегетациям
Либмана–Сакса со схожими характери-
стиками, что и при СКВ
Часто наблюдается умеренно
легкая митральная недостаточ-
ность или недостаточность аор-
тального клапана. Источник
эмболии высокого риска
Ревматоидный
артрит
Створки митрального, аор-
тального клапана; реже —
кольца и хорды; не затра-
гивает трикуспидальный
клапан и клапан легочной
артерии
Ревматоидные узелки: массы обычно
< 1 см в диаметре с однородной мяг-
котканной эхогенностью и неровными
границами; обычно округлой формы.
Локализуются в любой части створки;
утолщение/склероз створок обычно
незначительно или отсутствуют.
Вегетации, подобные вегетациям
Либмана–Сакса наблюдаются редко
Редко наблюдается митральная
недостаточность или недоста-
точность аортального клапана
большей степени, чем легкая.
Разрыв узелков может привести
к тяжелой недостаточности
клапана. Реже ассоциируется с
кардиоэмболией. Ассоциирован
с острым или рецидивирую-
щим вальвулитом. Схожие
характеристики, как и при СКВ.
Высокий эмболический потен-
циал. Редко после вальвулита
наблюдается стеноз
Анкилозирую-
щий
спондилит
Проксимальный участок
аорты, кольцо и аорталь-
ный клапан, основание
передней створки
митрального клапана;
задняя створка митраль-
ного клапана
Склероз, ригидность и дилатация корня
аорты с распространением на кольцо.
Обычно наблюдается легкий склероз аор-
тального клапана. Субаортальный
выступ: очаговое утолщение основания
передней створки митрального клапана,
которое возникает в результате удлине-
ния корня аорты и склероза кольца
Часто наблюдается недостаточ-
ность аортального клапана уме-
ренно легкой степени или
митральная недостаточность.
Сообщения о стенозе
отсутствуют
Ревматическая
болезнь
сердца
В 90% поражается митраль-
ный или аортальный
клапан; в 10% — трику-
спидальный клапан или
клапан легочной артерии;
кольца клапанов и корень
аорты не затрагиваются
Чаще поражаются края створок митраль-
ного клапана и хорды, а также часто
наблюдается сращение комиссур; при
тяжелом поражении склероз распростра-
няется на основание створок и даже на
сосочковую мышцу. Может встречаться
выраженная кальцификация. При очаго-
вом поражении склерозе может прояв-
ляться в виде масс, но очень высокой
эхогенности, которая не характерна для
других поражений, за исключением деге-
неративных. Характер поражения краев
створок аортального клапана схож
Сращение краев створок и укоро-
чение хорд приводит к ограни-
чению движения створок
митрального клапана; можно
наблюдать подобное движение
аортальных створок с формиро-
ванием тента. При преоблада-
нии сращения наблюдается
стеноз; при преобладании
ретракции — недостаточность
ТАБЛИЦА 35.5 Ключевые эхокардиографические признаки поражения клапанов при особых заболеваниях
In-35_для нас.indd 899
03.04.2019 12:11:59
900 ЧАСТЬ VII Сосудистые и системные заболевания
Заболевание
Поражаемые структуры
Ключевые характеристики
Функциональные последствия
Дегенеративное
заболевание
Створки и кольца митраль-
ного и аортального клапа-
нов; часто вовлекаются
хорды и кончики сосочко-
вых мышц
Склероз сконцентрирован в основании
створок и колец с прогрессирующим рас-
пространением на среднюю часть
створок; кончики вовлекаются редко.
При очаговом поражении склероз может
проявляться в виде масс или узелков.
Узелки на аортальном клапане чаще
локализуются у основания в области
комиссур
Преобладание кальцификации
кольца наблюдается в митраль-
ном клапане с реже встречаю-
щимся склерозом створок,
обычно ограниченным задней
створкой. Митральная недоста-
точность редко превышает
легкую степень, стеноз наблю-
дается редко и протекает суб-
клинически или в легкой
степени. Склероз и сращение
створок аортального клапана
приводит к стенозу, а смещение
створок приводит к недостаточ-
ности аортального клапана,
чаще легкой степени
Инфекцион-
ный
эндокардит
Изолированный эндокардит
нативного аортального
клапана составляет 55–60%
случаев. Изолированный
эндокардит митрального
клапана составляет 25%
случаев. Поражение аор-
тального и митрального
клапанов составляет около
15% случаев. Клапаны
правых отделов сердца
поражаются в 5–10%
случаев
Острый: массы с однородной мягкоткан-
ной эхогенностью и неровными грани-
цами; крайне вариабельного размера и
формы, обычно на узком основании,
часто на ножке. Почти всегда поражение
подвижно независимо от подлежащих
структур, чаще совершает качательные
движения. Поражения митрального и
трикуспидального клапанов в фазу
систолы пролабирует в предсердия; пора-
жение аортального клапана и клапан
легочной артерии в фазу диастолы про-
лабирует в выносящий тракт. Пора жение
чаще фиксировано к дистальной трети
створки. При пора жении аортального
клапана могут появиться дополнитель-
ные вегетации на передней створке
митрального клапана и хордах. Хрониче-
ский: очаговое утолщение или повыше-
ние эхогенности створок или хорд.
Может пора жаться не только дистальная
часть створки. Часто наблюдается
фиброз и кальцификация
Часто наблюдается недостаточ-
ность клапанов и обычно
тяжелой степени; стеноз натив-
ных клапанов наблюдается
редко. Могут возникать перфо-
рации створки и абсцессы.
Часто наблюдается
кардиоэмболия
Наложения на
клапане или
наложения
Ламбла
Преимущественно выявля-
ются на митральном и
аортальном клапане со
схожей частотой. Редко
определяются на клапанах
правых отделов сердца
Выявляется с помощью ЧПЭхоКГ, реже с
помощью ТТЭхоКГ. Со схожей высокой
частотой (35–40%) у здоровых людей,
пациентов со смешанным заболеванием
соединительной ткани и пациентов с
подозрением на кардиоэмболию. Преоб-
ладает нитевидный тип, представленный
тонкими (0,6–2 мм в ширину), продолго-
ватыми (4–16 мм) высоко подвижными
структурами, которые наблюдаются на
уровне или рядом с точкой сопоставле-
ния створок, на предсердной стороне во
в время систолы для митрального и три-
куспидального клапанов и на желудочко-
вой стороне в фазу диастолы для аор-
тального клапана. Редко встречается пла-
стинчатый тип, который короче в длину
и шире в диаметре, в связи с чем может
имитировать вегетации. Поражение
нескольких клапанов отмечается у
20–25% лиц
Наложения на клапане не ассоци-
ированы с дисфункцией клапа-
нов; сохраняются без измене-
ний со временем; не связаны со
старением, клиническими или
лабораторными параметрами
атерогенности, тромбообразова-
ния или воспаления; и не
связаны с повышенным
уровнем риска развития
кардиоэмболии
СКВ — системная красная волчанка; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 35.5
окончание
Ключевые эхокардиографические признаки поражения клапанов при особых заболеваниях
In-35_для нас.indd 900
03.04.2019 12:12:00
901
35 Иммунно-опосредованные системные заболевания
размера выпота и поиска признаков тампонады.
При СКВ перикардите тампонада встречается редко,
но высокая заболеваемость этого осложнения и ве-
роятность инфицирования требуют тщательной
оценки. Большой перикардиальный выпот с при-
знаками тампонады или без них у пациента в актив-
ной фазе СКВ требует более ранней диагностики
(направленной на исключение инфицирования)
или терапевтического (в связи с быстрым прогрес-
сированием или геморрагической трансформацией)
перикардиоцентеза под контролем ЭхоКГ, сопрово-
ждаемых интенсивной иммуносупрессивной про-
тивовоспалительной терапией. Следует избегать
перикардиальной фенестрации из-за часто наблю-
дающегося сочетанного серозита (перитонит и плев-
рит) и повышенного риска инфицирования. В ред-
ких случаях СКВ перикардит может осложниться
констриктивным перикардитом. ЭхоКГ — эффек-
тивный метод скрининга для исследования кон-
стрикции. Однако ЭхоКГ нечувствительна в плане
выявления легкого или умеренного утолщения пе-
рикарда. МРТ или КТ сердца представляют собой
методы предпочтения для оценки толщины пери-
карда и являются важными дополнительными ме-
тодами исследования при наличии эхокардиогра-
фических признаков констрикции.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
У 5–15% пациентов с СКВ встречается легочная ги-
пертензия, которая характеризуется систолическим
давлением в легочной артерии, равном 40 мм рт. ст.
или более, определяемым с помощью допплер-эхо-
кардиографии. Наиболее распространенные причи-
ны включают тромбоэмболию, интерстициальное
поражение легких, поражение левых отделов сердца
и васкулит [33, 34]. Связь легочной гипертензии с
В
окончание
систолы
Нормальная ТИМ Ао = 0,8 мм
Отклонение ТИМ Ао = 1,2 мм
Бляшка Ао = 3,3 мм
E’
E
A
ВИВР
A’
окончание
диастолы
окончание
систолы
окончание
диастолы
Рис. 35.8 Оценка ригидности и атеросклероза аорты с помощью ЧПЭхоКГ при системной красной волчанке. (A) 2D- ЧПЭхоКГ в M-режиме в позиции
по короткой оси среднего отдела грудной части нисходящего отдела аорты (Ao) у 27-летней женщины с СКВ демонстрирует значение конечно-систолического (SD)
и конечно-диастолического (DD) диаметров 17,3 и 16 мм соответственно. Расчетный модуль упругости по давлению и деформации (PSEM), точно установленный
показатель статической артериальной ригидности, равен [k(sBP−dBP)/(sD−dD/dD)]/10 000, где k = 133,3 — это коэффициент перевода из мм рт. ст. в Nm-2
(единицы Паскаля), sBP — систолическое давление в плечевой артерии, dBP — диастолическое давление в плечевой артерии, sD — систолический диаметр и
dD — диастолический диаметр и составляет 7,9 ед. (нормальное значение). (Б) 2D-ЧПЭхоКГ в M-режиме в позиции по короткой оси среднего отдела грудной
части нисходящего отдела аорты у 38-летней женщины с СКВ с изменением ригидности аорты и диастолической дисфункцией ЛЖ демонстрирует значения ко-
нечно-систолического и конечно-диастолического диаметров 19 и 18 мм соответственно. Расчетное PSEM составило 11,04 ед. (В) В митральном притоке данной
пациентки выявлено отклонение отношения E/A, равное 0,57, и при тканевой допплерографии — снижение максимальной скорости E′ перегородочной части
митрального кольца до 4,0 см/сек, отношения E′/A′ до 0,5 , времени изоволюмической релаксации (ВИВР) до 87 мсек и отношения митральное E/перегородочное
E′ до 10,5 . (Г) 2D-ЧПЭхоКГ в M-режиме в позиции по короткой оси передней стенки на среднем уровне (30–35 см) грудной части нисходящего отдела аорты
демонстрирует нормальный показатель толщины комплекса интима–медиа (ТИМ), равный 0,8 мм (стрелка) у пациента с СКВ. (Д, Е) 2D-ЧПЭхоКГ в M-режиме у
48-летней женщины с СКВ демонстрируют отклонение ТИМ до 1,2 мм (стрелка) в дистальном участке грудной части нисходящего отдела аорты (Д) и четко
определяемые бляшки в стенке аорты до 3,3 мм толщиной (стрелки) в проксимальном участке (Е) грудной части нисходящего отдела аорты.
А
Б
В
Г
Д
Е
In-35_для нас.indd 901
03.04.2019 12:12:00
902
ЧАСТЬ VII Сосудистые и системные заболевания
феноменом Рейно также предполагает вазоспазм. В
действительности антагонисты рецептора эндоте-
лина-1 облегчают течение легочной артериальной
гипертензии. Прогностические факторы легочной
гипертензии включают патологические изменения
при СКВ и показатели активности; положительная
реакция на рибонуклеопротеин (РНП), раствори-
мое вещество A (SSA — soluble substance A), анти-
фосфолипид и антицентромерные антитела; пере-
крещивание СКВ и склеродермии; и тромбоэмболия
в анамнезе [35]. Обычно для постановки диагноза и
оценки степени тяжести, причины, ответа на тера-
пию и последующего наблюдения легочной гипер-
тензии, ассоциированной с СКВ, используется доп-
плер-эхокардиография в покое и, в отдельных слу-
чаях, с физической нагрузкой.
ПЕРВИЧНЫЙ АНТИФОСФОЛИПИДНЫЙ СИНДРОМ
КРАТКАЯ ИНФОРМАЦИЯ
Для первичного антифосфолипидного синдрома
(ПАФС) характерно следующее:
1. Наличие антифосфолипидных антител
2. Венозный или артериальный тромбоз или ос-
ложненная беременность (потеря плода, преэ-
клампсия или эклампсия)
3. Отсутствие диагностических критериев других
ревматологических заболеваний
Диагноз устанавливается при наличии одного
или нескольких клинических критериев и выявле-
нии одного типа антифосфолипидных антител в
двух или более отдельных заборах проб по меньшей
мере в течение 6 нед. Патогенез поражения сердеч-
но-сосудистой системы при ПАФС может быть об-
условлен функциональной и структурной эндоте-
лиальной дисфункцией, вызванной антифосфоли-
пидными антителами, повышенной агрегацией
тромбоцитов, усилением активации коагуляции по
внутреннему и внешнему пути и ослаблением фи-
бринолиза. Поражение сердечно-сосудистой систе-
мы встречается у 50–75% пациентов с ПАФС и про-
являются поражением клапанов, внутрисердечным
тромбозом и тромбоэмболией, легочной гипертен-
зией, атеросклерозом и поражением миокарда.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ КЛАПАНОВ,
ВНУТРИСЕРДЕЧНЫЙ ТРОМБОЗ И ТРОМБОЭМБОЛИЯ
Поражение клапанов — наиболее распространен-
ное сердечное проявление ПАФС. Распространен-
ность, локализация, признаки и клинические по-
следствия поражения клапана при ПАФС схожи с
эндокардитом Либмана–Сакса при СКВ, и от 7 до
10% случаев ПАФС развиваются при СКВ или
СКВ-подобных заболеваниях (рис. 35.9). Пораже-
ние клапанов проявляется вегетациями (состоящи-
ми в основном из тромбоцитов или фибриновых
тромбов), утолщением клапанов и, реже, недоста-
точностью клапанов [1, 36]. Редко вегетации наблю-
даются на клапанах правых отделов сердца и эндо-
карде предсердий или желудочков, а также вызывать
функциональный стеноз клапана.
Повреждение эндокарда, вызванные внутрисер-
дечными катетерами, проводниками или проте-
зами, связана с более высокой частотой тромбоза и
тромбоэмболии, ассоциированных с устройством.
В ходе контролируемых серийных исследований с
помощью ТТЭхоКГ частота распространенности
поражения клапанов левых отделов сердца колеб-
лется от 30 до 40%, по сравнению с менее чем 5% в
группе контроля [36–38]. По результатам ЧПЭхоКГ
отмечается более высокий показатель распростра-
ненности поражения клапанов (60–80%) [37, 38].
Ожидается, что 3D ЧПЭхоКГ может обеспечить
лучшее выявление и определение вегетаций на кла-
панах и внутрисердечных тромбов, но имеющееся
количество данных ограничено (см. рис. 35.9). Как
и у пациентов с СКВ, вегетации обычно сохраняется
неизменными (50–60%), появляется de novo (20–
30%), разрешаются (20%), редко прогрессируют
(< 20%) или требуется замена клапана (меньше
10%) в течение периода от 1 до 5 лет [37, 38]. Веге-
тации на клапанах левых отделов сердца ассоцииро-
ваны с тромбоэмболией головного мозга (50%),
периферических и коронарных артерий (20–25%) и
внутрибрюшных внутренних органов. Вегетации
на клапанах правых отделов сердца, эндокарде или
связанные с устройством могут вызывать легочную
или парадоксальную эмболию. Отмечается положи-
тельный эффект на вегетации антикоагулянтной
терапии, но эффект иммуносупрессивной проти-
вовоспалительной терапии не определен.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Распространенность легочной гипертензии по ре-
зультатам проспективных эхокардиографических
серийных исследований с участием пациентов с
ПАФС составила не менее 20–25% и в основном
была связана с хронической и рецидивирующей
легочной эмболией и реже с нарушением вазоспаз-
ма или тромботической васкулопатией in situ. Доп-
плер-эхокардиография имеет сходное диагностиче-
ское и клиническое применение при легочной ги-
пертензии, ассоциированной с ПАФС, как и при
СКВ.
АТЕРОСКЛЕРОЗ
У этих пациентов отмечаются высокие показате-
ли распространенности утолщения комплекса
интима-медиа и бляшек сонных артерий [39].
Также у пациентов с ПАФС зарегистрирована вы-
сокая распространенность (20–35%) инфаркта
миокарда и исходы микрососудистого поражения,
тромбоз коронарных артерий in situ или тромбо-
эмболия коронарных артерий. Систематическое
In-35_для нас.indd 902
03.04.2019 12:12:00
903
35 Иммунно-опосредованные системные заболевания
использование стресс-ЭхоКГ или ЭхоКГ в покое
для выявления эпикардиальной ИБС у больных с
ПАФС может демонстрировать низкую чувстви-
тельность, учитывая низкую распространенность
эпикардиального атеросклероза.
ПОРАЖЕНИЕ МИОКАРДА
По результатам контролируемых одномоментных
исследований с участием пациентов с ПАФС без
симптомов сообщается о высокой распространен-
ности диастолической дисфункции ЛЖ, преимуще-
ственно нарушении релаксации. Механизмы диа-
столической дисфункции включают микрососуди-
стую ИБС, тромботическую микроангиопатию и
редко первичное поражение миокарда. В редких
случаях катастрофический ПАФС может прояв-
ляться в виде дилатационной кардиомиопатии с
тромбом ЛЖ. Кроме того, у пациентов с ПАФС с
легочной гипертензией часто встречается диастоли-
ческая дисфункция ПЖ, преимущественно наруше-
ние релаксации.
РЕВМАТОИДНЫЙ АРТРИТ
КРАТКАЯ ИНФОРМАЦИЯ
Клинически выраженное поражение сердечно-сосу-
дистой системы наблюдается у 25–40% пациентов с
ревматоидным артритом и в 40–50% случаев явля-
ется причиной летального исхода [40, 41].
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
АТЕРОСКЛЕРОЗ
После учета классических атерогенных факторов
риска распространенность атеросклероза у пациен-
тов с ревматоидным артритом в 2–3 раза выше, чем
в группе контроля [41]. При неселективном выборе
пациентов преобладающий тип был представлен
функциональной микрососудистой ИБС (≈ 50% и
коррелировал с уровнем асимметричного димети-
ларгинина, эндогенного ингибитора синтазы окси-
да азота), за которой следовали необструктивная
(≈ 25%) и обструктивная эпикардиальная ИБС
(≈ 25%) [42, 43]. Кроме того, у пациентов с тяжелым
ЛП
ЛЖ
Проекция со стороны ЛЖ
ПСМК
Рис. 35 .9 Вегетации, подобные вегетациям Либмана–Сакса, и эмболия сосудов головного мозга при антифосфолипидном синдроме. (A) A При
2D-ЧПЭхоКГ в позиции по длинной оси у 43-летней женщины с антифосфолипидным синдромом и наличием в анамнезе инсульта и острой транзиторной ише-
мической атаки отмечаются округлые фиксированные вегетации, подобные вегетациям Либмана–Сакса среднего размера и однородной мягкотканной эхогенности
(стрелки) на средней и дистальной частях передней створки митрального клапана (ПСМК) со стороны левого желудочка (ЛЖ) без утолщения или снижения
подвижности створки. (Б) A 3D-ЧПЭхоКГ, позиция митрального клапана со стороны ЛЖ, демонстрирует округлые фиксированные вегетации среднего размера
и однородной эхогенности с четко определенными границами на средней и дистальной частях передней створки митрального клапана (три верхние стрелки) с
наличием дополнительной окрашенной коричневым небольшой вегетации (нижняя стрелка) (вероятно недавнее формирование). Также обратите внимание на
неровную узловатую поверхность остальной части митральной створки. (В) Транскраниальная допплерография продемонстрировала наличие микроэмболов в
просвете правой средней мозговой артерии (стрелки). (Г) МРТ головного мозга у данной пациентки выявила старый инфаркт головного мозга (острия) и множе-
ственные небольшие околожелудочковые нарушения и глубокие нарушения белого вещества головного мозга (стрелки). ЛП — левое предсердие.
А
Б
В
Г
In-35_для нас.indd 903
03.04.2019 12:12:00
904
ЧАСТЬ VII Сосудистые и системные заболевания
ревматическим заболеванием наблюдается высокая
распространенность (до 60%) субклинической каль-
цификации коронарной артерии, определяемой с
помощью КТ, в отличие от пациентов, у которых
заболевание началось недавно (43%) и группы кон-
троля (38%). В возрасте от 65 до 70 лет у 75–80%
пациентов с ревматоидным артритом имеются ан-
гиографические признаки ИБС (30% ИБС с пораже-
нием трех сосудов) и высокая частота инфаркта
миокарда (от 4,8 до 5,9 случая на 1000 человеко-лет).
Показатели распространенности и заболеваемости
ИБС у пациентов с ревматоидным артритом схожи
с показателями у больных сахарным диабетом 2-го
типа и коррелируют с утолщением комплекса инти-
ма-медиа и бляшек или ригидностью сонных арте-
рий или аорты [44, 45]. Коронарный артериит, ко-
ронарный тромбоз in situ при отсутствии атероскле-
роза или артериита или коронарная эмболия
наблюдаются редко (рис. 35.10) [46]. У пациентов с
ревматоидным артритом около 40% летальных ис-
ходов обусловлено ИБС [41]. Связанные с ревмато-
идным артритом клинические прогностические
факторы ИБС включают начало ревматоидного
артрита в пожилом возрасте, продолжительную те-
рапию кортикостероидами и длительное течение
болезни (> 10 лет); активные внесуставные, эрозив-
ные полиартикулярные и узловые поражения; и
васкулит. Как и при СКВ, по сравнению с группой
контроля, у пациентов с ревматоидным артритом
отмечается двукратное повышение риска инфаркта
миокарда, застойной сердечной недостаточности,
инсульта и смертности от сердечно-сосудистых за-
болеваний. При остром коронарном синдроме у
пациентов с ревматоидным артритом более высо-
кая частота рецидивов и летальность, чем в группе
контроля (58% против 30% и 40% против 15% соот-
ветственно) [41]. Также показатели заболеваемости
и смертности при чрескожной или хирургической
коронарной реваскуляризации в 2–4 раза выше, чем
в тех же группах контроля.
ЭхоКГ в покое и стресс-ЭхоКГ могут применять-
ся для выявления нарушения движения стенок у
пациентов с обструктивной ИБС, но имеют низкую
чувствительность к микрососудистым поражениям
или коронарному артерииту. ТТЭхоКГ с дипирида-
молом или аденозином используется для оценки
резерва коронарного кровотока у пациентов с ми-
крососудистым поражением. У пациентов с ревма-
тоидным артритом и наличием симптомов часто
наблюдаются признаки ишемии при ЭхоКГ в покое
и с физической нагрузкой, а наличие ишемии при
ЭхоКГ с физической нагрузкой служит прогности-
ческим фактором трехкратного повышения показа-
теля смертность, чем в группе контроля с отрица-
тельными результатами исследования в покое или
при физической нагрузке [47].
Рис. 35 .10 Коронарный артериит при ревматоидном артрите. (A) Данные коронарной ангиографии левой коронарной артерии у 47-летней женщины с
высоко активным ревматоидным артритом, которая поступила в отделение неотложной помощи с 2-недельной нетипичной болью в груди, одышкой при физиче-
ской нагрузке, неспецифическим отклонением ST-T на электрокардиограмме в нижнебоковых отведениях и повышением креатинфосфокиназы мышечного типа
и тропонина I, демонстрирует окклюзию левой передней нисходящей коронарной артерии (верхняя стрелка) и 90% стеноз огибающей артерии (нижняя стрелка).
(Б) При коронарографии правой коронарной артерии у той же пациентки было выявлено 40% стеноз в среднем отделе (верхняя стрелка) и 60–70% стеноз устья
задней нисходящей и заднебоковой ветвей (нижние стрелки). После начала стандартной терапии в сочетании с агрессивной иммуносупрессивной противовоспа-
лительной терапией (пульс-терапия кортикостероидами и циклофосфамидом) были успешно выполнены чрескожные коронарные вмешательства с размещением
стента в передней нисходящей и огибающей артериях. Через неделю после выписки пациентка вновь поступила в стационар с повторным инфарктом миокарда
без повышения ST-сегмента, с подтверждением при повторной ангиографии тяжелого стеноза (быстрое прогрессирование стеноза от 40 до 90%) среднего отдела
правой коронарной артерии, по поводу которого у пациентки успешно выполнено размещение стента. Клиническая и серологическая активность ревматоидного
артрита у этой пациентки с быстро прогрессирующим поражением нескольких коронарных артерий указывает на коронарный артериит с основным атеросклеро-
тическим поражением или без него. У пациентки также наблюдался выраженный митральным и аортальным вальвулит со значительной недостаточностью (см.
рис. 35.13). У пациентки заболевание протекало без осложнений, и она была выписана домой в стабильном состоянии.
А
Б
In-35_для нас.indd 904
03.04.2019 12:12:01
905
35 Иммунно-опосредованные системные заболевания
Как и при СКВ, у пациентов с активным ревма-
тоидным артритом стандартную общемедицин-
скую терапию в сочетании со специфической им-
муносупрессивной противовоспалительной тера-
пией следует рассматривать до или одновременно с
чрескожной или хирургической коронарной рева-
скуляризацией высокого риска при остром коро-
нарном синдроме без повышения сегмента ST или
с повышением сегмента ST, соответственно (см.
рис. 35.10).
ПОРАЖЕНИЕ ПЕРИКАРДА
В результате эхокардиографических исследований
перикардиальные выпоты выявлены у 50% пациен-
тов с ревматоидным артритом, но симптоматиче-
ский перикардит встречается реже. Перикардит
возникает у пациентов в активной фазе заболевания
с соответствующими клиническими и серологиче-
скими характеристиками, как у пациентов с ИБС.
Перикардиальный выпот носит экссудативным и
геморрагическим характер с низким уровнем глю-
козы и может содержать ревматоидный фактор.
Тампонады и констрикции регистрируются редко.
Перикардиальные выпоты без симптомов наблюда-
ются примерно у 25% пациентов и ассоциированы
с почечной недостаточностью, гипоальбуминемией
и легочной гипертензией. Роль ЭхоКГ при ревмато-
идном поражении перикарда сравнима с ее ролью
при СКВ.
ПОРАЖЕНИЕ КЛАПАНОВ
Сообщаемая частота распространенности наруше-
ний клапанов при неселективном выборе пациен-
тов моложе 60 лет составляет всего 30% по резуль-
татам ТТЭхоКГ и почти 60% по результатам ЧЭхоКГ
[48]. Встречается пять форм поражения клапанов:
1. Узелки на клапанах.
2. Излеченный вальвулит с остаточным фиброзом
створок, недостаточностью и реже стенозом.
3. Острый вальвулит с вегетациями, подобными
вегетациям Либмана–Сакса.
4. Острый вальвулит со значительной недостаточ-
ностью [49].
5. Наложение инфекционного эндокардита.
Хотя острый и хронический вальвулит, приводя-
щий к утолщению створок или фиброзу, может
иметь сходные с поражением при СКВ клинические
и эхокардиографические проявления, распростра-
ненность вальвулита, обусловленного ревматоид-
ным артритом, а частота неинфицированных веге-
таций гораздо ниже [48, 49]. Напротив, узелки на
клапанах, по-видимому — характерный признак
ревматоидного артрита. Эти узелки также можно
увидеть на кольцах клапанов, сосочковых мышцах
и эндокарде предсердий и желудочков. При гисто-
логическом исследовании узелки на клапанах напо-
минают подкожные узелки и могут возникать в
результате очагового васкулита.
С помощью ЧПЭхоКГ ревматоидные узелки на
клапанах выявляются у одной трети пациентов;
внешне это небольшие (< 0,5 см2) округлые массы
с однородной отражающей способностью, обычно
располагающиеся на расстоянии друг от друга на
любой части створки [48]. Прилежащая створка
внешне не изменена, или наблюдается слабый ее
склероз. При этом характер поражения отличается
от вегетаций Либмана–Сакса (сравните рис. 35.11 с
рис. 35.1 –35.7). Может развиться острый вальвулит
с наложением вегетаций Либмана–Сакса (рис.
35.12). У половины пациентов наблюдается обычно
легкое утолщение клапана, которое с равной часто-
той носит диффузный или очаговый характер со
схожими проявлениями поражения клапанов левых
отделов сердца и редко распространяется на кольцо
и подклапанный аппарат. Легкая или более недоста-
точность клапана наблюдается у 20–25% пациентов,
но стеноз встречается редко.
Ревматоидное поражение клапана обычно легкое
и протекает бессимптомно. Тем не менее было опи-
сано несколько редких тяжелых проявлений заболе-
вания:
1. Наложение тромбоза клапана на узелки клапана,
вегетации, подобные вегетациям Либмана–Сак-
са, или струны клапана, осложненные системной
эмболией [50, 51].
2. Острый или рецидивирующий вальвулит, кото-
рый приводит к тяжелой недостаточности и ред-
ко стенозу клапана (рис. 35.13) [52].
3. Острая тяжелая недостаточность клапана, обу-
словленная разрывом одиночных или сливаю-
щихся узелков или крупных узелков, что нару-
шает сопоставление створок [53].
4. Аортит с расширением корня аорты и недоста-
точностью аортального клапана.
5. Наложение инфекционного эндокардита.
Краткосрочные и долгосрочные показатели
смертности у пациентов с поражением клапанов
при ревматоидном артрите значительно выше, чем
в группе контроля. 30 -дневная и 1-летняя заболева-
емость и смертность пациентов с ревматоидным
артритом, перенесших замену клапана или, редко,
пластику клапана, в 2–3 раза выше, чем у пациентов
без ревматоидного артрита. Кроме того, у пациен-
тов, перенесших пластику клапанов, более высокие
показатели повторной операции, чем у пациентов
без ревматоидного артрита [54]. Поэтому ранняя
диагностика и агрессивная иммуносупрессивная
противовоспалительная терапия могут замедлить
прогрессирование заболевания и улучшить показа-
тель выживаемости у пациентов без хирургического
вмешательства высокого риска.
ПОРАЖЕНИЕ МИОКАРДА
По результатам серийного допплер-эхокардиогра-
фического исследования у пациентов с ревматоид-
ным артритом распространенность субклинической
In-35_для нас.indd 905
03.04.2019 12:12:01
906 ЧАСТЬ VII Сосудистые и системные заболевания
и клинической дисфункции ЛЖ и ПЖ выше, чем в
группе контроля (30–76% и 25–45% против < 20%
соответственно) [55, 56]. Распространенность суб-
клинической систолической дисфункции ЛЖ ниже,
но превышает этот показатель в группе контроля
(10–15% против ≤ 6%). Наиболее распространенные
патогенетические факторы диастолической дис-
функции желудочков аналогичны тем, которые опи-
саны для СКВ, и включают функциональную ми-
крососудистую ИБС, ригидность периферических
артерий, гипертоническую болезнь сердца и эпикар-
диальную ИБС [55–57]. Клинически выраженный
миокардит встречается редко, обусловлен аутоанти-
телами SS-A/SS-B и может имитировать инфаркт
миокарда с повышением или без повышения ST-сег-
мента [58]. Признаки наличия или перенесенного
ранее миокардита выявлены при аутопсии у 30%
пациентов. Узелки в миокарде, васкулит или амило-
идоз встречаются редко. Имеются сообщения о ре-
стриктивной или дилатационной кардиомиопатии,
ЛП
ЛЖ
ПСМК
ПКС
НКС
ЛП
ПП
НКС
ПКС
Рис. 35 .11 Ревматические бугорки на аортальном клапане у молодой пациентки без наличия симптомов. (A) При ЧПЭхоКГ в позиции по длинной
оси выносящего тракта у 48-летней женщины с ревматоидным артритом определяются округлые однородной мягкотканной эхогенности узелки с четкими грани-
цами, расположенные в средней части некоронарной створки (НКС) аортального клапана (острие). Внешне правая коронарная створка (ПКС) не изменена. Недо-
статочность аортального клапана не определяется. (Б) ЧПЭхоКГ в позиции по короткой оси аортального клапана у 43-летнего мужчины с ревматоидным артритом
демонстрирует четко ограниченный узелок однородной гиперэхогенности на кончике и средней части левой коронарной створки (острие). Обратите внимание на
нормальный внешний вид непораженных частей створки, а также на НКС и ПКС. Выявлена легкая недостаточность аортального клапана. ЛЖ — левый желудочек;
ЛП — левое предсердие; ПС — правое предсердие; ПСМК — передняя створка митрального клапана.
А
Б
ЛП
ЛЖ
ПСМК
ЛП
ПСМК
ЛЖ
ЛП
ПСМК
ЛЖ
Рис. 35 .12 Выраженный митральный вальвулит с вегетациями подобными вегетациям Либмана–Сакса у 52-летней женщины с тяжелым рев-
матоидным артритом и рецидивирующими транзиторными ишемическими атаками. (A) A 2D-ЧПЭхоКГ, четырехкамерная позиция с увеличением, при
проявлении у пациентки транзиторной ишемической атаки демонстрирует выраженное неравномерное утолщение с мягкотканной эхогенностью передней створки
митрального капана (ПСМК) и задней створки митрального капана. Две большие дольчатые массы с нечеткими границами и мягкотканной эхогенностью отмече-
ны на ПСМК и задней створке митрального клапана со стороны предсердия (стрелки). (Б) 2D-ЧПЭхоКГ в четырехкамерной позиции с увеличением спустя 3 мес
приема варфарина, стероидов и ингибиторов рецепторов фактора некроза опухолей альфа демонстрирует уменьшение толщины створок митрального клапана и
размера вегетаций на митральном клапане (стрелка). (В) A При 2D-ЧПЭхоКГ в увеличенной четырехкамерной позиции спустя 6 мес терапии отмечается заметное
уменьшение толщины створок митрального клапана и лишь очень маленькие остаточные вегетации на кончике задней створки митрального клапана со стороны
предсердия (стрелка). Кроме того, произошло уменьшение степени недостаточности митрального клапана от умеренной до незначительной. ЛЖ — левый желу-
дочек; ЛП — левое предсердие.
А
Б
В
In-35_для нас.indd 906
03.04.2019 12:12:01
907
35 Иммунно-опосредованные системные заболевания
обусловленной терапией хлорохином. Наиболее
распространенная причина диастолической дис-
функции ПЖ — легочная гипертензия, но также
может играть роль микрососудистая ИБС. Снижение
продольной, циркулярной и радиальной диастоли-
ческой и систолической деформации и скорости
деформации миокарда, снижение E′ и A′ скоростей
и увеличение отношения E/E′, снижение скорости
распространения цветного потока и увеличение по-
казателя производительности миокарда более чув-
ствительны, чем допплеровские показатели ми-
трального или трикуспидального притока [56].
Также может наблюдаться сопутствующее снижение
сократимости ЛП, определяемое уменьшением гло-
бальной деформации ЛП с увеличением индекса
объема ЛП [59]. Клинические прогностические фак-
торы поражения миокарда аналогичны тем, которые
описаны для ИБС и поражения клапанов [60]. Кроме
того, в ходе крупных серийных исследований был
продемонстрирован высокий уровень распростра-
ненности (35–40%) диастолической застойной сер-
дечной недостаточности с наличием симптомов,
независимо от классических факторов риска диасто-
лической дисфункции. У этих пациентов диасто-
лическая сердечная недостаточность удваивает
риск смертности по сравнению с группой контроля
с диастолической сердечной недостаточностью без
ревматоидного артрита. Уровень заболеваемости
субклиническим поражением миокарда и сердеч-
ной недостаточностью снижается при терапии бло-
каторами факторов некроза опухолей альфа или
блокаторами рецепторов интерлейкинов-1 [61, 62].
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Легочная гипертензия с нормальным давлением в
легочной вене, которая возникает в результате ин-
ЛП
ЛКС
ЛП
ЛЖ
ЛП
ЛП
ПСМК
ЗСМК
Ао
НКС
ПКС
ЛЖ
Рис. 35.13 Острый аортальный и митральный вальвулит при ревматоидном артрите. (A) При 2D-ЧПЭхоКГ в базальном отделе в позиции по короткой
оси аортального клапана у 47-летней женщины с тяжелым ревматоидным артритом в тяжелой форме, которая поступила в отделение экстренной медицинской
помощи с быстро нарастающей одышкой при физической нагрузке и симптомами сердечной недостаточности, определяется выраженное диффузное утолщение
мякготканной эхогенности и снижение подвижности всех створок, изменения наиболее выражены на правой коронарной створке (ПКС). (Б) При цветовой доппле-
ровской ЧПЭхоКГ в позиции по длинной оси аортального клапана определяется тяжелая недостаточность аортального клапана, на что указывает отношение вы-
соты струи регургитации к высоте выносящего тракта левого желудочка (ЛЖ), равное более 65% (стрелка). (В) При ЧПЭхоКГ в позиции по длинной оси аорты
(Ао) определяется диффузное утолщение мягкотканной эхогенности и выраженное снижение подвижности передней створки митрального клапана (ПСМК) и
задней створки митрального клапана (ЗСМК). (Г) При цветовой допплеровской ЧПЭхоКГ в четырехкамерной позиции выявлена большая струя митральной регур-
гитации, направленная кзади и латерально (стрелка), с шириной перешейка регургитации не менее 7 мм, что соответствует тяжелой недостаточности митрально-
го клапана. Эти эхокардиографические данные в контексте клинических данных данной пациентки согласуются с тяжелым острым ревматоидным аортальным и
митральным вальвулитом, осложненным тяжелой недостаточностью митрального и аортального клапанов и сердечной недостаточностью. Дополнительно к
стандартной терапии у пациентки проводилась агрессивная иммуносупрессивная терапия (пульс-терапия кортикостероидами и циклофосфамидом), что привело
к разрешению и стабилизации недостаточности клапанов и клиники, а пациентка была выписана домой в стабильном состоянии. ЛКС — левая коронарная
створка; ЛП — левое предсердие; НКС — некоронарная створка.
А
Б
В
Г
In-35_для нас.indd 907
03.04.2019 12:12:01
908 ЧАСТЬ VII Сосудистые и системные заболевания
терстициального фиброза, легочного васкулита или
облитерирующего бронхиолита, чаще развивается
при поражении левых отделов сердца. В ходе кон-
тролируемого серийного исследования с участием
пациентов без симптомов было продемонстрирова-
но, что показатель распространенности легочной
гипертензии по данным ЭхоКГ в 5 раз выше у па-
циентов с ревматоидным артритом, чем в группе
контроля (21% против 4%), и даже выше у пациен-
тов с наличием симптомов или признаков пораже-
ния легких. Уровень смертности в течение 1 года
после постановки диагноза высок. Ранняя диагно-
стика жизненно важна, потому что на эти состояния
оказывает влияние иммуносупрессивная терапия.
Поэтому при выявлении легочной гипертензии
следует исключить гипертензию в ЛП и поддающу-
юся лечению легочную причину. При диагностике
легочной гипертензии пациентов с наличием или
отсутствием симптомов ЭхоКГ применима не толь-
ко для оценки степени ее тяжести и связанной с ней
диастолической или систолической дисфункции
ПЖ и недостаточности трикуспидального клапана,
но и для оценки краткосрочного и долгосрочного
ответа на терапию.
АНКИЛОЗИРУЮЩИЙ СПОНДИЛИТ
КРАТКАЯ ИНФОРМАЦИЯ
Анкилозирующий спондилит характеризуется вос-
палением позвоночных и крестцово-подвздошных
суставов и увеитом. Часто отмечаются ассоцииро-
ванный проксимальный аортит и аортальный
вальвулит и нарушения проводимости.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
АОРТИТ И ПОРАЖЕНИЕ КАПАНА
Выделяют следующие виды поражения корня аор-
ты и клапанов у пациентов с анкилозирующим
спондилитом:
1. Проксимальный аортит, приводящий к утолще-
нию корня аорты, ригидности, дилатации и ред-
ко формированию аневризмы, каждое из кото-
рых способствуют недостаточности аортального
клапана (рис. 35.14).
2. Аортальный вальвулит, который приводит к
утолщению и ретракции створок, что также при-
водит к недостаточности аортального клапана
(рис. 35.15).
3. Утолщение аортомитрального соединения или
«субаортальный выступ», что вызывает ретрак-
цию передней митральной створки с уменьше-
нием подвижности и несимметричным или не-
полным сопоставлением митральных створок,
что приводит к недостаточности митрального
клапана (см. рис. 35.14, 35.15).
4. Распространение процесса субаортального фи-
брозного на основание перегородки, атриовен-
трикулярный узел, проксимальный пучок His
(Гиса) и ножки пучка или отдельные пучки, вы-
зывающих нарушения проводимости [63–65].
Причина избирательного повреждения прокси-
мального участка аорты неизвестна.
Распространенность клинически выраженного
поражения восходящего отдела аорты и аортального
и митрального клапанов значительно варьирует, но,
вероятно, составляет около 20%. Обычно наблюда-
ется недостаточность аортального или митрального
ЛП
ПСМК
НКС
Корень Ао
ПКС
ЛЖ
ЛЖ
ЛП
НКС
Корень Ао
ПКС
ПСМК
Рис. 35 .14 Поражение корня аорты аортального и митрального клапанов у пациента с анкилозирующим спондилитом. (A) При 2D-ЧПЭхоКГ в
позиции по длинной оси выносящего тракта левого желудочка (ЛЖ) у 31-летнего мужчины с прогрессирующей одышкой при физической нагрузке и диастоли-
ческим шумом определяется выраженное утолщение заднемедиальной стенки корня аорты (Ао) (острие) с распространением на основание некоронарной створки
(НКС) и на основание и среднюю часть передней створки митрального клапана (ПСМК) (субаортальный выступ; стрелка). Также отмечено легкое утолщение
кончика правой коронарной створки (ПКС) и легкая дилатация корня Ао. Пациенту была выполнена замена аортального клапана без затруднений. (Б) При
2D-ЧПЭхоКГ в позиции по длинной оси выносящего тракта ЛЖ у 43-летнего мужчины определяется выраженный склероз корня Ао, более выраженный в области
заднемедиальной стенки (острия) с распространением на основание ПСМК и формированием субаортального выступа (стрелка). Отмечается умеренная дилатация
корня Ао. Некоронарная и правая коронарная створки незначительно очагово утолщены в области кончиков и средней части. Отмечается умеренная недостаточность
аортального клапана. ЛП — левое предсердие.
А
Б
In-35_для нас.indd 908
03.04.2019 12:12:02
909
35 Иммунно-опосредованные системные заболевания
клапанов легкой или умеренной степени. Однако
острый или разрешившийся аортит, острый или
разрешившийся аортальный вальвулит и наложение
инфекционного эндокардита могут привести к тя-
желой недостаточности аортального клапана [65].
В результатах эхокардиографических исследова-
ний, включающих серийные ЧПЭхоКГ, распростра-
ненность утолщения или склероза корня аорты,
повышения ригидности и степени дилатации ва-
рьируют в диапазоне от 20 до 60% пациентов [63].
Утолщение аортального клапана, наблюдаемое у
40% пациентов, проявляется в основном в виде уз-
ловатости аортальных створок. Утолщение ми-
трального клапана, наблюдаемое у одной трети па-
циентов, проявляется в виде утолщения основания
передней митральной створки с формированием
характерного субаортальныго выступа. Недостаточ-
ность клапанов, наблюдаемая почти у половины
пациентов, у трети из них носит умеренный харак-
тер. Поражение корня аорты и клапанов связаны с
продолжительностью заболевания, но не связаны с
его активностью, тяжестью или терапией.
Эффект терапии кортикостероидами или моди-
фицирующими течение болезни противоревмати-
ческими препаратами на поражение корня аорты и
клапанов и нарушения проводимости является не-
определенным. Показатель летальности при замене
клапана у этих пациентов из-за отсутствия полиор-
ганного поражения и редкого использования имму-
носупрессивной терапии, вероятно, схож с показа-
телем смертности среди населения в целом. Однако
замена аортального клапана при активном аортите
связана с более высоким риском несостоятельности
искусственного клапана [66].
НАРУШЕНИЕ ПРОВОДИМОСТИ
Блокада атриовентрикулярной и внутрижелудочко-
вой проводимости встречаются у 20% или более
пациентов с анкилозирующим спондилитом. В ходе
эхокардиографических исследований была проде-
ЛП
ЛП
ЛП
ЛЖ
Ао
Ао
ЛЖ
ЛЖ
Рис. 35.15 Аортальный вальвулит у 37-летнего мужчины с анкилозирующим спондилитом. (A) A При 2D-ЧПЭхоКГ в позиции по длинной оси в
фазу систолы определяется утолщение, ретракция створок и снижение формирования купола, наиболее выраженные на правой коронарной створке (острие).
Также отмечается склероз корня аорты (Ао) и легкое утолщение с распространением на основание передней створки митрального клапана (субаортальный выступ;
стрелка). (Б) A При ЧПЭхоКГ в 2D-режиме в позиции по длинной оси в фазу диастолы отмечается утолщение преимущественно кончиков створок аортального
клапана с ретракцией, что приводит к неполному сопоставлению (стрелка). (В) A При 2D-ЧПЭхоКГ в позиции по длинной оси с цветовой допплерографией
определяется умеренная недостаточность аортального клапана, на что указывают зона конвергенции потока, равная 3 мм (стрелка), перешеек регургитации — 4 мм
и отношение высоты струи к высоте выносящего тракта левого желудочка (ЛЖ) — 40%. (Г) A При 3D-ЧПЭхоКГ аортального клапана со стороны корня Aо в
фазу систолы лучше определяется умеренное диффузное утолщение кончиков створок и снижение подвижности всех трех створок. Также отмечается четкая
овальная узловатость на кончике и желудочковой стороне правой коронарной створки (стрелка). (Д) A В фазу диастолы отмечается ретракция створок, что
приводит неполному сопоставлению в центре (стрелка). (Е) A При 3D-ЧПЭхоКГ с цветовой допплерографией аортального клапана со стороны Ао площадь эф-
фективного отверстия регургитации и площадь перешейка регургитации составили 0,18 и 0,19 см2 соответственно, что свидетельствует об умеренной недостаточ-
ности аортального клапана. ЛП — левое предсердие.
А
Б
В
Г
Д
Е
In-35_для нас.indd 909
03.04.2019 12:12:02
910
ЧАСТЬ VII Сосудистые и системные заболевания
монстрирована связь нарушения проводимости с
утолщением корня аорты и субаортальным высту-
пом, подразумевая распространение фиброза корня
аорты на проксимальную часть перегородки и атри-
овентрикулярный узел [63]. В ходе контролируемых
серийных исследований с помощью тканевой доп-
плер-эхокардиографии было продемонстрировано
увеличение интервалов межпредсердной и внутри-
предсердной электромеханической связи и систоли-
ческая асинхрония ЛЖ [67]. Однако клиническая
значимость этих результатов неясна.
ПОРАЖЕНИЕ МИОКАРДА И ПЕРИКАРДА
Хотя частота случаев поражения миокарда у пациен-
тов с анкилозирующим спондилитом выше, чем у
населения в целом, оно, как правило, протекает суб-
клинически и выявляется случайно. У пациентов с
анкилозирующим спондилитом также наблюдается
микрососудистая ИБС, которая связана с субклини-
ческой диастолической дисфункцией [68]. Кроме
того, связанная с этим ригидность аорты может при-
вести к увеличению постнагрузки на ЛЖ и массы и
диастолической дисфункции ЛЖ [69].
В ходе контролируемых серийных допплер-эхо-
кардиографических исследований с участием паци-
ентов без симптомов младше 50 лет сообщалось о
распространенности диастолической дисфункции на
уровне 9–45%, но систолическая дисфункция ЛЖ
выявлялась редко. По данным спекл-трекинг и тка-
невой допплер-эхокардиографии частота распро-
страненности диастолической дисфункции выше. В
этих исследованиях диастолическая дисфункция не
была сопряжена по времени с возрастом, продолжи-
тельностью или активностью заболевания. Редко
отмечается сердечный амилоидоз с диастолической
сердечной недостаточностью. По клиническим, эхо-
кардиографическим и лабораторным показателям
диастолической дисфункции ЛЖ отмечался вариа-
бельный ответ на блокаторы фактора некроза опухо-
лей альфа [70].
Распространенность поражения перикарда у па-
циентов с анкилозирующим спондилитом незначи-
тельна, и, вероятно, схожа с распространенностью в
общей популяции (< 2%). По результатам эхокар-
диографического исследования в некоторых случа-
ях отмечалось наличие небольшого перикардиаль-
ного выпота.
АТЕРОСКЛЕРОЗ
По сравнению с группой контроля у пациентов с
анкилозирующим спондилитом наблюдаются бо-
лее высокие показатели распространенности суб-
клинического атеросклероза и атеросклероза с на-
личием симптомов, проявляющегося утолщением
комплекса интима-медиа сонных артерий или бля-
шек, повышением ригидности сонных артерий и
аорты, кальцификацией коронарных артерий и
острым коронарным синдромом или инсультом.
Тип их коррелирует с возрастом, активностью и
продолжительностью заболевания.
СКЛЕРОДЕРМИЯ
КРАТКАЯ ИНФОРМАЦИЯ
При склеродермии повышенное наблюдается обра-
зование и разрастание соединительной ткани,
структурные и функциональные изменения мелких
сосудов и отложение иммунных комплексов с пора-
жением кожи, суставов, скелетных мышц и некото-
рых органов, включая сердечно-сосудистую систе-
му. Утолщение кожи и феномен Рейно отмечаются
у более чем 90% пациентов. При диффузном типе
наблюдается симметричный фиброз кожи лица,
туловища и конечностей с частым вовлечением
внутренних органов. При ограниченном кожном
типе наблюдаются изменения кожи конечностей и
лица, при этом внутренние органы обычно не за-
трагиваются.
Субклиническое поражение сердечно-сосуди-
стой системы и поражение с наличием симптомов
отмечается у 60% пациентов со склеродермией.
Преобладающие признаки представлены функцио-
нальными и структурными микрососудистыми
поражениями сердечно-сосудистой системы, мио-
кардитом, легочной и системной гипертензией, об-
условленными поражением сердца, и перикарди-
том. Предсердные и желудочковые аритмии и
нарушения проводимости встречаются реже, но
клинически значимы. В целом, легочная артери-
альная гипертензия и фиброз легких с наличием
легочного сердца или без него, хроническая сердеч-
ная недостаточность и аритмии служат основными
причинами смерти у пациентов со склеродермией.
У афроамериканцев более высокий уровень распро-
страненности диффузной системной склеродермии,
более распространена тяжелая легочная гипертен-
зия и в общем выше показатель смертности, чем у
американцев европейского происхождения [71].
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
АТЕРОСКЛЕРОЗ
При склеродермии наблюдается два основных меха-
низма поражения преимущественно интрамиокар-
диальных коронарных артерий и артериол. Пер-
вый — чрезмерное увеличение вазоконстрикции,
вызванное иммунно-опосредованной воспалитель-
ной эндотелиальной дисфункции. У этих пациен-
тов отмечается высокий уровень асимметричного
диметиларгинина, эндогенного ингибитора синта-
зы оксида азота, а спазм интрамиокардиальных
коронарный артерий сильно коррелирует с перифе-
рическим феноменом Рейно [72]. Второй меха-
низм — это обструктивное поражение мелких
сосудов, которое обусловлено пролиферацией
эндотелия, гипертрофией интимы, миграцией
In-35_для нас.indd 910
03.04.2019 12:12:04
911
35 Иммунно-опосредованные системные заболевания
гладкомышечных клеток в интиму, фибриноид-
ным некрозом, фиброзом и в конечном счете суже-
нием просвета сосудов. В результате развивается
очаговый или диффузный некроз полос сокраще-
ния (обусловленный ишемией и реперфузией) и
фиброз миокарда. Распространенность эпикарди-
ального атеросклеротического поражения имеет
меньшую клиническую значимость, чем поражения
мелких сосудов. Фактически, результаты коронаро-
графии у пациентов без симптомов с диффузной
склеродермией демонстрируют отсутствие измене-
ний коронарных артерий или их эктазию с замедле-
нием кровотока, что указывает на повышение рези-
стентности интрамиокардиальных коронарных со-
судов; менее чем у 50% пациентов с классической
или неклассической стенокардией наблюдается
эпикардиальная ИБС, а у более чем 30% пациентов
с инфарктом миокарда определяются неизменен-
ные эпикардиальные артерии.
Поэтому у этих пациентов редко наблюдается клас-
сический острый коронарный синдром (< 2%).
Ишемическая болезнь сердца чаще всего проявля-
ется в виде подострой или хронической диастоличе-
ской и редко систолической сердечной недостаточ-
ности. Однако в некоторых случаях развивается
острая ишемическая сердечная недостаточность и
внезапная смерть.
Из-за преобладающего поражения мелких сосу-
дов редко наблюдаются классические эхокардиогра-
фические признаки трансмуральной ишемии или
инфаркта миокарда. Результаты контролируемых
серийных исследований с участием молодых паци-
ентов без симптомов с выполнением допплер-ТТЭ -
хоКГ с дипиридамолом или аденозином, добутами-
новой стресс-ЭхоКГ и мультидетекторной КТ отме-
чалось снижение резерва коронарного кровотока
(< 2,5) и нарушения движения стенки у 30–50%
пациентов, по сравнению с менее чем у 5% пациен-
тов из группы контроля, при этом признаки эпи-
кардиальной ИБС обнаружены не были [72].
Поражения мелких сосудов может приводить к
диастолической и реже систолической дисфункции
ЛЖ и ПЖ. Иногда в следствие эпикардиального
коронарного вазоспазма может развиваться транс-
муральный инфаркт миокарда, а его эхокардиогра-
фическая диагностика основана на тех же призна-
ках, что и при атеросклеротической болезни. Холо-
довой прессорный тест с ЭхоКГ и визуализацией
перфузии миокарда демонстрируют транзиторные
нарушения движения стенок, которые соответству-
ют обратимым, стойким или смешанным наруше-
ниям перфузии у пациентов с ангиографически
неизмененными эпикардиальными коронарными
артериями [73]. У пациентов с микрососудистой
ИБС обычно наблюдается повышение ригидности
сонной артерии и аорты, что свидетельствует о
диффузном поражение мелких сосудов, которое
связано с выраженностью и продолжительностью
периферического феномена Рейно, продолжитель-
ностью и тяжестью заболевания и наличием поло-
жительной реакции на атицентромерные антитела
[74, 75]. Симптомы и нарушение подвижности сте-
нок или перфузии миокарда могут быть облегчены
с помощью приема расширяющих коронарные со-
суды препаратов и противовоспалительной терапии
[76].
ПОРАЖЕНИЕ МИОКАРДА
Поражение миокарда чаще наблюдается у пациен-
тов с диффузным поражением кожи, анти-Scl70 и
антицентромерными антителами, перекрываю-
щимся синдромом васкулита, активным перифери-
ческим миозитом, феноменом Рейно и микрососу-
дистой ИБС [72, 76]. Результаты МРТ сердца у этих
пациентов часто демонстрируют нарушения движе-
ния стенок и выраженную T2-взвешенную актив-
ность (показатель активного воспаления) и замед-
ленное контрастирование гадолинием (показатель
фиброза) [77].
Для этого поражения характерен очаговый не-
кроз полос сокращения миоцитов (типичный в
случае ишемии и реперфузии) с фиброзом миокар-
да, который по результатам посмертного серийного
исследования выявляется у до 80% пациентов. Эти
данные свидетельствуют о том, что микрососу-
дистая ИБС является наиболее распространенной
причиной поражения миокарда при склеродермии.
Кроме того, у пациентов со склеродермией отмеча-
ется перегородочный характер инфаркта, желудоч-
ковые аритмии или нарушения проводимости при
электрокардиографии, которые связаны со стойки-
ми нарушениями перфузии перегородки или перед-
не-перегородочной области и соответствуют обла-
стям фиброза миокарда, определенным с помощью
МРТ с контрастированием гадолинием. Дисфунк-
ция миокарда у пациентов со склеродермией также
обусловлена увеличением отложения коллагена в
интерстиции и фиброзом. Аутоиммуно-опосредо-
ванный миокардит встречается редко. Независимо от
патогенеза систолическая сердечная недостаточность
ассоциирована с высоким показателем смертности
(до 80% в течение 1 года).
Результаты контролируемых одномоментных и
продольных серийных допплер-эхокардиографиче-
ских исследований продемонстрировали высокую
частоту встречаемости (30–50%) субклинической
систолической и диастолической дисфункции ЛЖ и
ПЖ при неселективном выборе пациентов среднего
возраста либо с диффузным либо с ограниченным
поражением кожи, в отличие от группы контроля,
в которой этот показатель составил < 10% [77–81].
Низкое отношение E′/A′ или высокое митральное
отношение E/E′ и снижение продольной, циркуляр-
ной и радиальной деформации и скорости дефор-
мации — более чувствительные показатели, чем
показатели митрального и трикуспидального при-
In-35_для нас.indd 911
03.04.2019 12:12:04
912
ЧАСТЬ VII Сосудистые и системные заболевания
тока (60% против 30%, соответственно) [79–81].
Диастолическая дисфункция желудочков коррели-
рует с более высокими уровнями маркеров воспале-
ния и с продолжительностью и выраженностью
феномена Рейно. Увеличение объема и площади
ПЖ и диастолическая дисфункция, выявляемые с
помощью 3D ЭхоКГ, часто наблюдается у пациен-
тов с легочной гипертензией (вторичное поражение
миокарда перегрузкой давлением), но также встре-
чается у пациентов без легочной гипертензии или
повышения давления в ЛП (первичное поражение
миокарда из-за микрососудистой ИБС или миокар-
дита) [82]. У некоторых пациентов с давлением в
легочной артерии, превышающим 35 мм рт. ст., по
результатам тканевой допплерографии ПЖ ско-
рость составила < 11 см/сек. Кроме того, в ходе кон-
тролируемых серийных допплер-эхокардиографи-
ческих исследований с участием пациентов среднего
возраста с соответствующими норме показателями
фракции выброса ЛЖ, фракции выброса ПЖ и дав-
ления в легочной артерии в 15–20% случаев было
продемонстрировано значительно снижение систо-
лической допплеровской скорости на митральном и
трикуспидальном кольцах. Эти данные также сви-
детельствуют о субклинической систолической дис-
функции ЛЖ и ПЖ у данных пациентов. Однако
последствия субклинической диастолической и
систолической дисфункции по-прежнему остаются
не определенными. С точки зрения клиники, диа-
столическая дисфункция ЛЖ и ПЖ разрешаются с
помощью противовоспалительной терапии и прие-
ма вазодилататоров, включая антагонисты эндоте-
лина [70].
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Интерстициальное поражение легких и легочная
артериальная гипертензия являются основными
составляющими и причинами летального исхода
при склеродермии [83–85]. Легочный фиброз может
наблюдаться у 80% пациентов, а легочная гипертен-
зия в покое (давление в легочной артерии ≥40 мм
рт. ст.) и индуцированная физической нагрузкой
(давление в легочной артерии ≥50 мм рт. ст.) с по-
мощью допплер-эхокардиографии или катетериза-
ции правых отделов сердца обнаруживается у 10–20
и 35–50% пациентов соответственно [86–88]. Легоч-
ная гипертензия может быть с равной вероятностью
обусловлена поражением левых отделов сердца
(≈ 40%) и легочной артериальной гипертензией
(≈ 30–40%) и реже поражением легких/гипоксией
(≈ 20–30%) [86]. К группе с повышенным риском
развития легочной гипертензии относят пациентов
с продолжительностью заболевания > 3 лет и диф-
фузной емкостью легких < 60% или функциональ-
ной емкостью < 40%. Легочная артериальная гипер-
тензия, обусловленная воспалительной васкулопа-
тией или легочным вазоспазмом, чаще всего
ассоциирована с ограниченным типом поражения
кожи, феноменом Рейно, показателями эндотели-
альной дисфункции, уровнем антицентромерных
антител, NT-proBNP и эндотелина-1, снижением
диффузионной кислородной емкости и нарушени-
ем накопления в легких галлия и технеция-99m
Sestamibi [89]. У пациентов с легочной гипертензией
независимо от причины легочной гипертензии на-
блюдается снижение показателя выживаемости до
81, 63 и 56% к 1-, 2- и 3-му годам от постановки
диагноза соответственно. Хотя комбинированные
данные результатов тестирования функции внеш-
него дыхания, телеангиэктазии, уровень мочевой
кислоты, антицентромерных антител в сыворотке
крови, proNT-BNP и отклонение электрической оси
сердца вправо по результатам электрокардиогра-
фии демонстрируют высокую чувствительность и
положительную прогностическую ценность (≥ 95%)
для выявления легочной артериальной гипертен-
зии, их низкая специфичность и низкая отрица-
тельная прогностическая ценность (≤ 50%) препят-
ствуют клиническому применению.
Допплер-эхокардиография в покое или с физи-
ческой нагрузкой (в том числе 6-минутная нагрузка
ходьбой) позволяет оценивать систолическое и
среднее давление в легочной артерии, резистент-
ность легочных сосудов, диастолическую и систо-
лическую функцию ЛЖ и давление заклинивания в
легочных капиллярах и, следовательно, помогает
дифференцировать предкапиллярную и посткапил-
лярную легочную гипертензию (рис. 35.16) [90].
Значительное увеличение показателя ЭхоКГ (20 мм
рт. ст. или более) от состояния покоя до пикового
значения наблюдается у 40% пациентов со склеро-
дермией с одышкой при физической нагрузке или
отклонениями в результатах тестирования функции
внешнего дыхания. Систолическое давление в ле-
гочной артерии и резистентность легочных сосудов
демонстрируют отрицательную связь с систоличе-
скими характеристиками ПЖ, измеренными по
систолическому смещению
трикуспидального
кольца, тканевой допплеровской трикуспидальной
S′-скоростью и фракционному изменению площа-
ди ПЖ [89, 90]. Степень тяжести легочной гипер-
тензии, определенная с помощью ЭхоКГ, является
мощным независимым прогностическим фактором
летального исхода при последующем 2-летнем на-
блюдении. Используя в качестве эталонного значе-
ния систолическое давление в легочной артерии
< 30 мм рт. ст., при давлении 30–36 мм рт. ст. отно-
сительный риск летального исхода составляет 1,67,
при 36–40 мм рт. ст. — 2,37, при 40–50 мм рт. ст. —
3,72 и при давлении > 50 мм рт. ст. —
9,75 [85].
Однако допплер-эхокардиография демонстрирует
умеренную чувствительность (≈ 60%) для выявле-
ния легочной гипертензии, по сравнению с катете-
ризацией правых отделов сердца, но очень высокую
специфичность (98%). Поэтому у пациентов с по-
дозрением на симптоматическую легочную гипер-
In-35_для нас.indd 912
03.04.2019 12:12:04
913
35 Иммунно-опосредованные системные заболевания
тензию наилучшим методом для постановки окон-
чательного диагноза и выбора метода лечения мо-
жет быть катетеризации правых отделов сердца.
Согласованное экспертное заключение в отношении
катетеризации правых отделов сердца включает со-
четание прогрессирующей одышки в течение 3 мес,
необъяснимую одышку, ухудшение функциональ-
ного класса одышки по критериям Всемирной орга-
низации здравоохранения (ВОЗ); любые признаки
повышенного давления в правых отделах сердца
или правожелудочковой недостаточности при фи-
зикальном осмотре; систолическое давление в ле-
гочной артерии, превышающее 45 мм рт. ст. и ди-
латацию ПЖ по результатам ЭхоКГ; и диффузион-
ная емкость легких для окиси углерода < 50% [91].
ПОРАЖЕНИЕ ПЕРИКАРДА
Клинически выраженное поражение перикарда или
симптоматическое поражение встречается у 4–17%
пациентов со склеродермией и проявляется в виде
острого перикардита и редко в виде тампонады
сердца или констрикции перикарда. По результатам
посмертных и эхокардиографических серийных
исследований низкий показатель клинической рас-
пространенности не совпадает, особенно при бес-
симптомных перикардиальных (30–50%). При
ПЖ
VTI=16см
Время ускорения кровотока
ВТПЖ = 110 мсек
Максимальная ранняя диастолическая
скорость = 3,2 м/сек
и конечно-диастолическая = 2,2 м/сек
ЛЖ
Рис. 35 .16 Легочная гипертензия при склеродермии. (A) A При ТТЭхоКГ в парастернальной позиции по короткой оси у 48-летней женщины со склеродер-
мией, кальцинозом, феноменом Рейно, пищеводной дискинезией, склеродактилией и телеангиоэктазией (CREST — calcinosis raynaud esophagus sclerosis
teleangiectasiae) с нарастанием в течение 1 мес усталости, одышки при физической нагрузке и отека нижних конечностей определяется выраженная дилатация
правого желудочка (ПЖ), снижение систолической функции ПЖ и нарушение движения межжелудочковой перегородки, обусловленное перегрузкой давлением
и объемом (уплощение перегородки в фазу поздней систолы и ранней диастолы или инверсия в период с середины до поздней диастолы) (стрелка). Также от-
мечался небольшой расположенный сзади перикардиальный выпот. (Б) Максимальная скорость трикуспидальной регургитации (ТР) равна 4,1 м/сек, что, соглас-
но упрощенному уравнению Бернулли (4V2), эквивалентно систолическому давлению в ПЖ 67 мм рт. ст. (В) Дилатация нижней полой вены с минимальным из-
менением при вдохе носом указывает, что давление в ПП равно 15 мм рт. ст. или больше. Следовательно, расчетное систолическое давление в легочной артерии
равно 67 + 15 мм рт. ст. = 82 мм рт. ст.). (Г) В середине систолы отмечается зазубрина (выемка) импульсно-волновой допплеровской скорости кровотока в вы-
носящем тракте правого желудочка (ВТПЖ) (стрелка), что указывает на тяжелую легочную гипертензию. Время ускорения кровотока в ВТПЖ < 80 мсек имеет
очень высокое прогностическое значение для значительной легочной гипертензии, но не очень высокую чувствительность, что наблюдается у данной пациентки,
у которой время ускорения кровотока в ВТПЖ составляло 110 мсек. (Д) На основании конечно-диастолической скорости легочной регургитации, равной 2,2 м/
сек, и , используя формулу 4V2 + давление в ПП, расчетное диастолическое давление в легочной артерии составляет 19 + 15 = 34 мм рт. ст. Кроме того, расчет
среднего давления в легочной артерии (ЛА) производится с использованием следующих формул — [1/3(Систолическое давление в ЛА) + 2/3(Диастолическое
давление в ЛА) или 4 × (Ранняя скорость ЛР (легочная регургитация))2 + Давление в ПП] — в результате получаем 49 мм рт. ст. и 55 мм рт. ст. соответственно.
Наконец, оценку резистентности легочных сосудов у пациентки можно выполнить, применяя формулу 10 × максимальная скорость ТР/интеграл скорости крово-
тока (VTI) ВТПЖ (10 × 4,1 м/сек / 16 см), что равно 2,56 ед. Вуда (> 2 ед. Вуда служит показателем легочной артериальной гипертензии). ЛЖ — левый желудочек.
А
Б
В
Г
Д
In-35_для нас.indd 913
03.04.2019 12:12:04
914
ЧАСТЬ VII Сосудистые и системные заболевания
ЭхоКГ у пациентов с легочной гипертензией и ги-
поальбуминемией часто наблюдаются перикарди-
альные выпоты без симптомов (до 50%). Поражение
перикарда с наличием симптомов в 2–4 раза чаще
встречается у пациентов с диффузной формой, чем
с ограниченной кожной формой заболевания. По-
ражение перикарда редко служит начальным прояв-
лением склеродермии.
ПОРАЖЕНИЕ КЛАПАНОВ
Склеродермия редко приводит к первичному пора-
жению клапанов. В литературе описаны небольшие
массы, схожие с вегетациями Либмана–Сакса, аортит
и недостаточность аортального клапана. Из-за высо-
кой распространенности легочной гипертензии и
легочного сердца, распространена функциональная
недостаточность трикуспидального клапана, преи-
мущественно от легкой до умеренной степени.
ПОЛИМИОЗИТ И ДЕРМАТОМИОЗИТ
КРАТКАЯ ИНФОРМАЦИЯ
Полимиозит и дерматомиозит представляют собой
клинически схожие заболевания, которые характе-
ризуются аутоиммуно-опосредованным воспале-
нием скелетных мышц, что приводит к симметрич-
ной слабости проксимальных мышц. В отличие от
полимиозита, дерматомиозит сопровождается вы-
сыпаниями на лице, шее, груди и разгибательных
поверхностях конечностей. Часто встречаются пе-
рекрывающиеся синдромы, при которых признаки
дерматомиозита или полимиозита сочетаются с
признаками СКВ, ревматоидного артрита и склеро-
дермии. Миокардит, перикардит и функциональная
или структурная микрососудистая ИБС — наиболее
распространенные сердечные проявления полими-
озита и дерматомиозита. Эпикардиальная атеро-
склеротическая ИБС, нарушения проводимости,
нарушение функции клапанов и легочная гипертен-
зия встречаются редко. Вследствие отсутствия кон-
тролируемых одномоментных и продольных иссле-
дований, данные о распространенности сердеч-
но-сосудистых заболеваний сильно варьируют.
Хотя клинически выраженное поражение сердца
может наблюдаться у менее чем 25% пациентов, оно
обусловливает не менее 10% смертности.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ МИОКАРДА
Поражение миокарда возникает в результате ауто-
иммуно-опосредованного миокардита и реже в ре-
зультате функциональной микрососудистой ИБС.
Результаты посмертных серийных исследований
продемонстрировали у > 50% пациентов с полими-
озитом или дерматомиозитом наличие гистологи-
ческих признаков активного или разрешившегося
миокардита. Хотя клиническая распространенность
миокардита неизвестна, у 10–20% пациентов с мио-
кардитом развивается кардиомиопатия. У пациен-
тов с миокардитом обычно наблюдается активный
миозит с поражением скелетных мышц; у > 50%
пациентов с периферическим миозитом также от-
мечается поглощение миокардом пирофосфата тех-
неция-99m. В редких случаях фульминантный мио-
кардит с тяжелой систолической дисфункцией ЛЖ
может быть начальным проявлением заболевания.
Кроме того, симптомы острого миокардита могут
имитировать острый коронарный синдром с повы-
шением ST-сегмента и без повышения ST-сегмента,
повышение уровня CPK-MB и тропонина T, что
обусловлено регенерацией мышц при хроническом
воспалении, и нарушения подвижности стенки по
результатам ЭхоКГ. По результатам серийного доп-
плер-эхокардиографического исследования субкли-
ническая диастолическая дисфункция ЛЖ, преиму-
щественно нарушение релаксация, колеблется в
диапазоне 12–76%, при этом систолическая дис-
функция наблюдается редко [92, 93].
ПОРАЖЕНИЕ ПЕРИКАРДА
Частота распространенности клинически выражен-
ного поражения перикарда у пациентов с полимио-
зитом и дерматомиозитом низкая (≈ 10%). Пери-
кардит чаще встречается у пациентов с перекрест-
ным синдромом и у детей. Перикардит и тампонада
сердца редко бывают начальным проявлением бо-
лезни. По результатам серийного эхокардиографи-
ческого исследования частота встречаемости малого
и бессимптомного перикардиального выпота соста-
вила 25%. Тампонада сердца и констрикция наблю-
даются редко.
АТЕРОСКЛЕРОЗ, ПОРАЖЕНИЕ КЛАПАНОВ
И ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
По данным отчетов у 20–25% пациентов отмечается
эпикардиальная ИБС со стенокардией. Часто может
наблюдаться поражение мелких сосудов, но коро-
нарный артериит встречается редко. В литературе
описано незначительное количество случаев неин-
фицированных вегетаций на клапанах и тяжелого
вальвулита с выраженной недостаточностью, схо-
жих с наблюдаемыми при СКВ [94]. Легочная ги-
пертензия встречается редко, при этом ее клиника,
эхокардиографические проявления, лечение и про-
гноз аналогичны клинике и эхокардиографическим
проявлениям при других ревматологических забо-
леваниях.
СМЕШАННОЕ ЗАБОЛЕВАНИЕ
СОЕДИНИТЕЛЬНОЙ ТКАНИ
КРАТКАЯ ИНФОРМАЦИЯ
Смешанное заболевание соединительной ткани
представляет собой перекрестный синдром с при-
знаками СКВ, ревматоидного артрита, склеродер-
In-35_для нас.indd 914
03.04.2019 12:12:04
915
35 Иммунно-опосредованные системные заболевания
мии и полимиозита. Истинная распространенность
поражения сердца при этом заболевании неизвест-
на, данные различных исследований очень вариа-
бельны (10–80%), причем самые высокие показате-
ли поражения без наличия симптомов отмечаются
по результатам серийных эхокардиографических
исследований.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Легочная гипертензия является распространенным
осложнением смешанного заболевания соедини-
тельной ткани и чаще всего встречается у пациентов
с признаками склеродермии [95–97]. Наиболее ча-
сто это обусловлено пролиферативным васкулитом
мелких и средних легочных артерий и фиброзом
легких. Легочный артериальный вазоспазм и тром-
боэмболия наблюдаются редко. В литературе опи-
сан у пациентов с вазоспазмом благоприятный
краткосрочный и продолжительный эффект от
приема антагонистов эндотелина [97].
ПОРАЖЕНИЕ ПЕРИКАРДА
Поражение перикарда встречается часто, но у боль-
шинства пациентов протекает бессимптомно с не-
большим перикардиальным выпотом, выявляемым
при ЭхоКГ. У 25–30% пациентов наблюдается пери-
кардит с наличием симптомов, что в редких случаях
может быть начальным проявлением заболевания.
Большой перикардиальный выпот с тампонадой
наблюдается редко и имеет положительную дина-
мику при стероидной или другой иммуносупрес-
сивной терапии [98].
ПОРАЖЕНИЕ КЛАПАНОВ И МИОКАРДА
В литературе отсутствует описание каких-либо
специфических поражений клапанов, обусловлен-
ных смешанным заболеванием соединительной
ткани. Миокардит встречается редко, и при выявле-
нии на ранней стадии может носить обратимый
характер при стероидной и циклофосфамидной
пульс-терапии. При ЭхоКГ спектр заболевания ва-
рьирует от диастолической дисфункции до глобаль-
ной или регионарной систолической дисфункции
ЛЖ и хронической сердечной недостаточности [99].
АТЕРОСКЛЕРОЗ
Как и при других ревматологических заболеваниях,
ИБС у пациентов со смешанным заболеванием сое-
динительной ткани преимущественно обусловлена
поражением мелких сосудов. Острый коронарный
синдром может развиться в результате поражения
мелких сосудов, коронарного вазоспазма, тромбоза
in situ, коронарной эмболии из вегетаций на клапа-
нах и редко артериита. Наконец, острый миокардит
может имитировать острый коронарный синдром.
ОТДЕЛЬНЫЕ ВИДЫ АРТЕРИИТА,
ПОРАЖАЮЩЕГО АОРТУ И ЕЕ ВЕТВИ
К классическим артериитам, которые поражают
аорту и ее основные ветви, относят артериит Така-
ясу, гигантоклеточный артериит и болезнь Бехчета.
Этиология этих системных хронических воспали-
тельных состояний не определена, чаще они встре-
чаются у женщин (за исключением болезни Бехчета
в США), клинически проявляются со второго по
седьмое десятилетие жизни и также связаны со зна-
чительной заболеваемостью и смертностью.
АРТЕРИИТ ТАКАЯСУ
КРАТКАЯ ИНФОРМАЦИЯ
Артериит Такаясу — хронический васкулит, кото-
рый поражает крупные сосуды и проявляется (1)
фокальным или диффузным утолщением стенок
сосудов с последующим стенозом, окклюзией или
тромбозом, (2) разрушением эластичной пластинки
и мышечной стенки, приводящее к формированию
аневризм или псевдоаневризм и (3) ригидностью
сосудов и ускоренным атеросклерозом. Провести
дифференциальную диагностику артериита Такая-
су от других артериитов позволяет наличие по
крайней мере трех из шести главных клинических
признаков (табл. 35.6) [100].
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ СОСУДОВ
При артериите Такаясу преимущественно поража-
ются аорта и ее крупные ветви. Хотя обычно изме-
нения отмечаются в грудной и брюшной частях
аорты, клинически болезнь чаще проявляется по-
ражением левой подключичной артерии, за чем
следует поражение сонной, плечеголовной и по-
звоночной артерий. Также часто отмечается пора-
жение легочных артерий. К первоначальным не-
специфическим проявлениям заболевания относят
лихорадка, недомогание, потеря веса и боли в
мышцах, что часто ассоциировано с ранним суб-
клиническим необструктивным васкулитом или в
конечном счете с обструктивным васкулитом или
васкулитом с отсутствием пульса. Проявления фа-
зы отсутствия пульса включают (1) симптомы
динамического нарушения кровообращения с
асимметрией и снижением пульса, а также ау-
скультативный шум на пораженных артериях;
(2) окклюзионное поражение подключичной арте-
рии также приводит к развитию синдрома подклю-
чичного обкрадывания, при котором коллатераль-
ный кровоток из позвоночных артерий к постсте-
нотическому участку артерии вызывает снижение
заднего мозгового кровообращения и неврологи-
ческие проявления, включая обмороки; (3) боль в
груди, одышку, кровохарканье и легочную гипер-
тензию у пациентов с аневризмами или стенозом
In-35_для нас.indd 915
03.04.2019 12:12:05
916
ЧАСТЬ VII Сосудистые и системные заболевания
легочных артерий [101]; (4) острый коронарный
синдром, который развивается в результате аорти-
та восходящей отдела части аорты, что приводит к
сужению устья коронарной артерии, или обуслов-
лен коронарным артериитом; (5) симптоматиче-
скую хроническую, подострую или острую недо-
статочность аортального клапана, которая в основ-
ном обусловлена дилатацией корня аорты и кольца
с утратой их эластической тяги и реже первичным
вальвулитом [102]; (6) гипертензию из-за ригидно-
сти аорты или поражения почечной артерии; и
(7) ускоренный атеросклероз (см. табл. 35.6).
ПОРАЖЕНИЕ СЕРДЦА
Первичное поражение сердца встречается редко
(≤ 10% случаев), но может затрагивать миокард,
эндокард, сердечные клапаны, коронарные артерии
и перикард (табл. 35.7).
ДИАГНОСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ
При диагностике и лечении артериита Такаясу
обычно требуется комплексная визуализация, диа-
гностическая чувствительность и специфичность
которой 95% или выше [103, 104]. ЭхоКГ позволяет
обнаружить и оценить дилатацию корня аорты и
кольца, утолщение стенок сосудов и наличие, сте-
пень тяжести недостаточности аортального клапана
(рис. 35.17). Компьютерная томографическая анги-
ография и МРТ или магнитно-резонансная ангио-
графия (МРА) предоставляют информацию о изме-
нении просвета сосудов (конусовидное, фокальное
или диффузное сужение сосудов, обычно обуслов-
ленное фокальной или диффузной аневризматиче-
ской дилатацией) и утолщение стенки сосуда.
Позитронно-эмиссионная томография (ПЭТ) с
фтор-18-фтордизоксиглюкозой в сочетании с ком-
пьютерной томографической ангиографией позво-
ляет дифференцировать утолщение стенки сосуда,
обусловленное активным воспалением от рубцева-
ния и, тем самым обеспечивает выбор тактики про-
тивовоспалительной терапии. МРА с T2-взвешен-
ной визуализацией позволяет обнаружить утолще-
ние стенки сосуда, обусловленное отеком, а МРА с
контрастированием гадолиния позволяет выявить
образование рубцов в стенках сосудов. Перед про-
цедурами реваскуляризации требуется контрольная
инвазивная ангиография.
ЛЕЧЕНИЕ
Основа терапии артериита Такаясу — прием корти-
костероидов.
ГИГАНТОКЛЕТОЧНЫЙ ВИСОЧНЫЙ АРТЕРИИТ
КРАТКАЯ ИНФОРМАЦИЯ
Гигантоклеточный височный артериит — хрони-
ческий васкулит, который поражает средние и
крупные сосуды с классическим проявлением в
виде височного артериита. Однако часто наблюда-
ется поражение аорты и ее ветвей с клиническими
проявлениями, схожими с проявлениями артерии-
та Такаясу. Гигантоклеточный височный артериит
также можно дифференцировать от других арте-
ритов при наличии по крайней мере трех из пяти
главных клинических признаков (см. табл. 35.6)
[105].
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ СОСУДОВ
Гигантоклеточный височный артериит, как прави-
ло, проявляется височным артериитом, но также
часто наблюдается поражение аорты и ее прокси-
мальных ветвей (рис. 35.18) [106, 107]. Также может
наблюдаться поражение аорты и ее ветвей с отсут-
ствием изменений в височных артериях.
ПОРАЖЕНИЕ СЕРДЦА
Первичное поражение сердца встречается редко и
схоже по клиническим проявлениям с артериитом
Такаясу (см. табл. 35.7).
ДИАГНОСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ И ЛЕЧЕНИЕ
Показания к применению и диагностическая цен-
ность комплексной визуализации при гигантокле-
точном височном артериите аналогичны, как при
артериите Такаясу (см. рис. 35.18) [100, 106, 108].
При ультрасонографической диагностике височ-
ного артериита может определятся гипоэхогенный
«гало» (признак гало) внутри стенки сосуда в до-
полнение к стенозу или окклюзии с чувствитель-
ностью и специфичностью 69 и 82% — для «при-
знака гало», 68 и 78% — для стеноза или окклюзии
и 78 и 88% — для признака гало, стеноза или ок-
клюзии соответственно [109]. Стандартом считает-
ся гистопатологическое исследования биопсии
височной артерии с определением характерных
признаков, но его чувствительность составляет
60–85%. Поэтому часто дополнительно требуется
проведение МРТ или МРА и/или ПЭТ. Однако на-
чало приема кортикостероидов не должно откла-
дываться в ожидании результатов исследования
биопсии или визуализации у пациентов при нали-
чии других диагностических клинических и лабо-
раторных данных.
БОЛЕЗНЬ БЕХЧЕТА
КРАТКАЯ ИНФОРМАЦИЯ
Болезнь Бехчета — это хронический васкулит, ко-
торый поражает мелкие, средние и крупные артерии
и вены. Клинически заболевание проявляется реци-
дивирующими и болезненными оральными и гени-
тальными язвочками (афтами); различными кож-
ными проявлениями; асимметричным, неэрозив-
In-35_для нас.indd 916
03.04.2019 12:12:05
917
35 Иммунно-опосредованные системные заболевания
Признак
Артериит Такаясу
Гигантоклеточный височный
артериит
Болезнь Бехчета
Главные клинические признаки
Возраст начала
≤40лет
>50лет
20–40 лет
Основные симптомы и
физические
показатели
Динамическое нарушение кро-
вообращения на нижних и
верхних конечностях
Снижение пульса на одной или
обеих плечевых артериях
Шум в одной/обеих подклю-
чичных или сонных либо
брюшной части аорты
Разница в систолическом давле-
нии на обеих руках ≥ 10 мм
рт. ст.
Вновь возникшая локализован-
ная цефалгия
Болезненная чувствительность
или замедление пульса на
височной артерии (часто ассо-
циировано с хроническим под-
вывихом нижней челюсти и
зрительными расстройствами,
включая слепоту)
Генитальный афтоз (2 балла)
Передний или задний увеит
либо ангиит сетчатки (2
балла)
Оральный афтоз (1 балл)
Псевдофолликуит или узловая
эритема (1 балл)
Поверхностный флебит,
тромбоз глубоких вен,
тромбоз крупных вен,
тромбоз или аневризмы
артерий (1 балл)
Диагностические
данные
Выявление при визуализации
сужения или окклюзии аорты
и/или ее первичных ветвей
СОЭ > 50 мм/час
Выявление при биопсии височ-
ной артерии некротизирую-
щего артериита с мононуклеар-
ной воспалительной инфиль-
трацией или гранулематозным
воспалением с наличием много-
ядерных гигантских клеток
Патергия: Эритематозная папу-
лезная или пустулезная
реакция (≥ 2 мм в диаметре)
на местное повреждение кожи
(1 балл)
Дифференциальная
диагностика
≥ 3 из перечисленных 6 крите-
риев (91% чувствительность и
98% специфичность)
≥ 3 из перечисленных 5 крите-
риев (94% чувствительность и
91% специфичность)
≥ 3 и 8 баллов (87–97% чув-
ствительность и 89–97%
специфичность)
Другие общие характеристики
Соотношение
женщины/мужчины
7:1
3:2
1 : 1 (в США чаще встречается
у женщин)
Этническая
принадлежность
Азиатская
Европейская
Восточно-азиатская и
средиземноморская
Распространенность
1–3 случая/год/миллион населе-
ния в США и Европе
1 на 500 человек старше 50 лет
1на15000–500000вСШАи
Северной Европе
Ассоциация с HLA
HLA-Bw52, HLA-B39.2
HLA-DR4
HLA-B51
Поражаемое сосуди-
стое русло
Крупные сосуды
Средние и крупные сосуды
Мелкие, средние и крупные
сосуды
Гистологические
признаки
Мононуклеарная и гранулема-
тозная инфильтрация
Мононуклеарная и гранулематоз-
ная инфильтрация
Мононуклеарная и гранулема-
тозная инфильтрация
Маркеры воспаления СОЭ и СРБ обычно повышены СОЭ и СРБ обычно повышены СОЭ и СРБ обычно повышены
Основная
фармакотерапия
Кортикостероиды
Кортикостероиды
Кортикостероиды
Чрескожная или
хирургическая
реваскуляризация
Часто необходима
Необходима реже
Крайне редко необходима
HLA (human leucocyte antigens) — антиген лейкоцитов человека; СОЭ — скорость оседания эритроцитов; СРБ — C -реактивный белок.
ТАБЛИЦА 35.6 Отличительные признаки отдельных артериитов
ным и недеформирующим воспалением суставов
коленей, лодыжек и запястий; рецидивирующим и
двусторонним панувеитом; и паренхиматозным и
непаренхиматозным поражением головного мозга
[110]. На долю офтальмологических, сосудистых и
неврологических поражений приходится самая вы-
сокая заболеваемость и смертность. Дифференци-
альная диагностика болезни Бехчета от других ва-
скулитов основана на наличии по крайней мере трех
из восьми баллов, полученных по шкале оценки
пяти главных клинических признаков (см. табл.
35.6) [111].
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПОРАЖЕНИЕ СОСУДОВ
При болезни Бехчета также происходит утолщение
стенок, стеноз, окклюзия сосудов и формирование
In-35_для нас.indd 917
03.04.2019 12:12:05
918
ЧАСТЬ VII Сосудистые и системные заболевания
Поражение сосудов
Аорта и ее проксимальные ветви (в 25–50% случаев)
1. Аортит
2. Восходящий аортит, приводящий к стенозу устьев коронарных артерий
3. Аневризматическая дилатация восходящего отдела и/или грудной и брюшной частей аорты
4. Псевдоаневризмы аорты
5. Расслаивающаяся аневризма аорты
6. Тромбоз аорты
7. Ригидность и атеросклероз аорты
8. Артериит со стенозом, тромбозом, аневризмами или псевдоаневризмами, дилатация ветвей аорты
Легочные артерии и их ветви (в 15–25% случаев)
1. Легочной артериит
2. Стеноз легочных артерий
3. Тромбоз легочных артерий
4. Формирование аневризм и псевдоаневризм в легочных артериях
Первичное поражение сердца (≤ 10% случаев)
Поражение миокарда
1. Субклиническая диастолическая и систолическая дисфункция
2. Диастолическая дисфункция с наличием симптомов
3. Миокардит с сегментарной или глобальной систолической дисфункцией
4. Дилатационная кардиомиопатия
Субэндокардиальное поражение
1. Эндомиокардиальный фиброз
2. Кальцификация эндокарда
3. Тромбоз предсердий или желудочков (чаще в правых отделах сердца)
4. Псевдоаневризма желудочков
Поражение клапанов сердца
1. Недостаточность аортального клапана или клапана легочной артерии вследствие дилатации аорты или легочной артерии
2. Недостаточность аортального клапана из-за ригидности аортального кольца с уменьшением эластической диастолической
тяги
3. Псевдоинфекционный эндокардит аортального клапана или эндокардит, подобный эндокардиту Либмана–Сакса
4. Недостаточность аортального клапана из-за несостоятельности искусственного капана или формирования псевдоаневризмы
при активном аортите (до 50% случаев)
Ишемическая болезнь сердца
1. Стеноз устьев, окклюзия, тромбоз коронарных артерий вследствие аортита
2. Коронарный артериит
3. Аневризмы и псевдоаневризма коронарной артерии
4. Микрососудистое поражение коронарных артерий
Поражение перикарда
1. Неосложненный острый перикардит
2. Острый перикардит с тампонадой сердца
3. Миоперикардит
ТАБЛИЦА 35.7 Поражения сердечно-сосудистой системы, ассоциированные с артериитом Такаясу,
гигантоклеточным височным артериитом и болезнью Бехчета
аневризм. Поражение сосудов может быть началь-
ным проявлением заболевания примерно в 25%
случаев, чаще встречается у мужчин (соотношение
между мужчинами и женщинами 4 : 1) в течение
третьего десятилетия жизни и чаще проявляется
тромбозом поверхностных или глубоких вен [112].
Поражение артерий также встречается часто, но
крайне вариабельно и обычно затрагивает неболь-
шие сосуды. Тем не менее в трети случаев отмеча-
ется поражение средних и крупных судов (рис.
35.19). В 25% случаев происходит поражение как
артерий, так и вен. У женщин поражение артерий и
сердца может наблюдаться чаще, чем у мужчин.
Наиболее часто поражаются аортальные, подвздош-
ные, бедренные, подколенные и сонные артерии.
Поражение мозговых, почечных и коронарных ар-
терий наблюдается редко. Поражение легочных ар-
терий с формированием аневризм сопровождается
25% смертностью.
ПОРАЖЕНИЕ СЕРДЦА
Первичное поражение сердца наблюдается редко,
имеет схожие клинические проявления с артерии-
том Такаясу и гигантоклеточным височным артери-
In-35_для нас.indd 918
03.04.2019 12:12:05
919
35 Иммунно-опосредованные системные заболевания
итом, и в редких случаях может предшествовать
поражению сосудов (см. табл. 35.7) [112–114].
ДИАГНОСТИЧЕСКАЯ ВИЗУАЛИЗАЦИЯ И ЛЕЧЕНИЕ
Диагностическое значение комплексной визуализа-
ции при болезни Бехчета и ее лечении схоже с тако-
вым при артериите Такаясу и гигантоклеточном
височном артериите (см. рис. 35.19).
Таким образом, поражения сердечно-сосуди-
стой системы часто встречаются при ревматологи-
ческих заболеваниях и неинфекционных артерии-
тах и коррелируют с высокой заболеваемостью и
смертностью. ЭхоКГ играет важную роль в выяв-
лении, определении и оценке степени тяжести и
прогрессирования, а также помогает в выборе и
определении времени и ответа на терапию пораже-
ния сердечно-сосудистой системы, связанного с
ревматологическими заболеваниями (см. табл.
35.1 –35.7). Однако существуют некоторые ограни-
чения ЭхоКГ, поэтому при определенных условиях
могут потребоваться другие дополнительные ме-
тоды визуализации (табл. 35.8).
Ао
ОКА
Ао
Рис. 35 .17 Артериит Такаясу у 22-летнего мужчины, который клинически проявился диастолическим шумом в сердце и шумом на правой
сонной артерии. A (А, Б) A (В) A (Г, Д) A (Е) При 2D-режиме и цветовой допплерографии в парастернальных позициях по длинной и короткой осям
аорты (Ao) и аортального клапана определяется легкая дилатация корня Ао, выраженное циркулярное утолщение стенок корня Ао (стрелки), снижение подвижно-
сти всех трех створок аортального клапана (острия стрелок на Б, Д) и неполное сопоставление створок вследствие дилатации корня Ао и снижения эластичной
тяги фиброзного кольца аортального клапана, что приводит к умеренной центральной недостаточности аортального клапана (стрелки на В, Е). (Ж, З) Результаты
каротидной ультрасонографии демонстрируют выраженное утолщение (3–5 мм) средней, ближней и дальней стенок (стрелки) правой общей каротидной артерии
(ОКА), что приводит к выраженному каротидному стенозу (острие стрелки) и очень высоким систолической и диастолической скоростям кровотока (З). (И) Попе-
речные, сагиттальные и коронарные изображения, полученные с помощью компьютерной томографической ангиографии с наложением изображения при пози-
тронно-эмиссионной томографии, демонстрируют циркулярное утолщение восходящего отдела аорты и грудной части нисходящего отдела аорты (стрелки) со
значительным увеличением метаболической активности на всей Ао (острия стрелок), что свидетельствует об активном аортите.
А
Б
В
Д
Г
Е
Ж
З
И
In-35_для нас.indd 919
03.04.2019 12:12:05
920
ЧАСТЬ VII Сосудистые и системные заболевания
Ао
Ао
Рис. 35 .18 Гигантоклеточный височный артериит с сопутствующей недостаточностью аортального клапана у 62-летнего мужчины. (A, Б) При
поперечной компьютерной томографической ангиографии (КТА) определяется умеренное циркулярное диффузное утолщение грудной части аорты (Ао) (стрелки).
(В, Г) При наложении изображений при позитронно-эмиссионной томографии (ПЭТ) на изображения при КТА выявлено диффузное увеличение метаболической
активности на протяжении всей стенки Ао (стрелки), что указывает на активный аортит. (Д, Е) При наложении изображений ПЭТ и КТА после соответствующей
терапии демонстрируется снижение метаболической активности в стенке Ао, что позволяет предположить разрешение воспаления сосуда. (Ж, З) A A При
визуализации в парастернальной позиции (Ж) и цветовой допплерографии (З) корня Ao и аортального клапана до терапии определяется легкая дилатация корня
Ао, умеренное утолщение передней и задней стенок корня (стрелки), снижение подвижности (острия стрелок) внешне неизмененных створок аортального клапа-
на (Ж) и умеренная центральная аортальная регургитация (стрелка на З). Также отмечалась сопутствующая легкая гипертрофия ЛЖ с умеренной глобальной
гипокинезией ЛЖ и умеренной систолической дисфункцией ЛЖ, обусловленная ассоциированного миокардита.
А
Б
В
Г
Д
Е
Ж
З
In-35_для нас.indd 920
03.04.2019 12:12:06
921
35 Иммунно-опосредованные системные заболевания
Поражения клапанов, внутрисердечный тромбоз и тромбоэмболия
Низкая частота выявления неинфицированных вегетаций с помощью ТТЭхоКГ (менее трети от выявляемых с помощью 2D- или
3D-ЧПЭхоКГ)
При ЧПЭхоКГ в качестве стандартного метода исследования, ТТЭхоКГ демонстрирует очень низкую чувствительность (< 15%)
и низкую отрицательную прогностическую ценность (< 60%) для выявления неинфицированных вегетаций; демонстрирует
низкую чувствительность, специфичность и отрицательную прогностическую ценность (< 60%) для выявления утолщения
клапанов; и заниженную оценку митральной недостаточности и недостаточности аортального клапана
Низкая частота выявления неинфицированных вегетаций с помощью ТТЭхоКГ исключает оценку его специфичности и поло-
жительной прогностической ценности для обнаружения этого поражения.
ТТЭхоКГ ограничена в способности оценивать неинфекционный эндокардит или вальвулит
Таким образом ограничено применение ТТЭхоКГ для оценки пациентов с подозрением на эмболическое цереброваскулярное
заболевание или периферическую артериальную эмболию
ЧПЭхоКГ — полуинвазивный метод и требует высокой квалификации специалиста, поэтому существует потребность в алго-
ритме клинических и лабораторных прогностических факторов, который позволит выполнять ЧПЭхоКГ с высокой диагности-
ческой значимостью для выявления неинфекционного эндокардита, особенно у пациентов с подозрением на кардиоэмболию
Эхокардиографические признаки неинфицированных и инфицированных вегетаций и некоторых вариантов нормы (наложения
Ламбла или узелки Арантиуса) могут быть схожи при 2D- и 3D ЧПЭхоКГ, в связи с чем могут потребоваться дополнительные
клинические и лабораторные данные, включая микробиологическое исследование
ТАБЛИЦА 35.8 Ограничения эхокардиографической оценки поражения сердечно-сосудистой системы,
ассоциированного с ревматологическими заболеваниями и артериитами
Ао
Ао
Ао
Ао
ЛЖ
Рис. 35 .19 Болезнь Бехчета у 30-летнего мужчины с тяжелой рефрактерной гипертензией. (А) Компьютерная томографическая ангиография демон-
стрирует аневризматическую дилатацию восходящего отдела аорты (Ao) и умеренную концентрическую гипертрофию левого желудочка (ЛЖ). (Б) Трехмерная
реконструкция аорты подтверждает наличие аневризматической дилатации в восходящем отделе Ао. (В) МРТ с контрастированием брюшной части Ао демонстри-
рует легкое утолщение стенок Ао и ее ветвей (стрелки), что позволяет заподозрить васкулит. Отмечается диффузное неоднородное сужение почечных артерий
(острия) и дольчатость обеих почек подозрительно относительно ишемического рубцевания. (Г, Д) При 2D-ТТЭхоКГ в парастернальной позиции по короткой оси
Ао (на уровне венечных синусов) в конце диастолы A (Г) и конце систолы (Д) определяется легкая дилатация и умеренное неоднородное утолщение стенок Ао
(стрелки), более выраженное в задней стенке. Была отмечена легкая недостаточность аортального клапана. Наложение изображения при позитронно-эмиссионной
томографии на изображения при КТА (не показано) подтверждает утолщение стенок грудной и брюшной частей Ао без повышения метаболической активности,
что указывает на разрешенный васкулит или васкулит в неактивной фазе.
А
Б
В
Г
Д
In-35_для нас.indd 921
03.04.2019 12:12:07
922
ЧАСТЬ VII Сосудистые и системные заболевания
Поражение миокарда
Несмотря на то что спекл-трекинг и тканевая допплер-эхокардиография высоко чувствительны для определения субклинической
диастолической и систолической дисфункции ЛЖ и ПЖ, не было установлено конкретных пороговых значений для определе-
ния нарушения и степени дисфункции миокарда у молодых пациентов, представленных в основном женщинами
Не определены клинические и прогностические последствия эхокардиографически выявленной субклинической диастолической
и систолической дисфункции ЛЖ и ПЖ
ЭхоКГ также имеет ограничения в определении этиологии субклинических или симптоматических поражений миокарда таких,
как васкулит, миокардит или эпикардиальная ИБС
Ишемическая болезнь сердца
Редко результаты ЭхоКГ в покое или при физической нагрузке выявляют отклонения у пациентов с преимущественно функци-
ональной и структурной микрососудистой ИБС
Данные ЭхоКГ в покое или при физической нагрузке при первичном миоперикардите или миокардите часто перекрываются с
таковыми при остром коронарном синдроме, обусловленном эпикардиальной атеросклеротической ИБС или коронарным
артериитом
Поэтому у пациентов с подозрением на острый коронарный синдром может быть целесообразно выполнение коронарографии
Поражение перикарда
Бессимптомные небольшие перикардиальные выпоты обычно бывают случайной находкой (≈ 20%) у госпитализированных
пациентов с ревматологическими заболеваниями в острой фазе и могут быть связаны с легким перикардитом, гипоальбуминэ-
мией или легочной гипертензией с легочным сердцем или без него
Часто у пациентов с симптомами острого перикардита перикардиальный выпот не обнаруживается
Поэтому у этих пациентов для правильной оценки перикардита требуются дополнительные клинические, электрокардиографи-
ческие и серологические данные
ЭхоКГ нечувствительна для определения слабого или умеренного утолщения перикарда. МРТ сердца и КТ — ва жные дополни-
тельные методы визуализации для оценки утолщения перикарда, если при ЭхоКГ возникли подозрения на констрикцию
перикарда
Легочная гипертензия
При катетеризации правых отделов сердца в качестве стандарта, допплер-эхокардиографии демонстрирует умеренную чувстви-
тельность (около 60%) для выявления легочной гипертензии, при этом отмечается высокая специфичность (98%)
ЭхоКГ может иметь ограничения в дифференциальной диагностике типа или комбинации типов легочной гипертензии
Поэтому при подозрении у пациента симптоматической легочной гипертензии для постановки окончательного диагноза и
выбора метода лечения может потребоваться катетеризация правых отделов сердца
Артерииты, поражающие аорту и ее ветви
ТТЭхоКГ имеет ограничения в оценке корня аорты
С помощью ТТЭхоКГ и ЧПЭхоКГ невозможно распознать, возникло ли утолщение стенки аорты в результате активного воспа-
ления или рубцевания
ЧПЭхоКГ имеет ограничения в оценке патологических изменений дуги аорты и ее основных ветвей
Поэтому в этих условиях КТА с контрастированием или МРА с контрастированием в сочетании с позитронно-эмиссионной
томографией с фтор-18-фтордезоксиглюкозой являются предпочтительными методами диагностики для оценки нарушения
просвета и стенок аорты и ее основных ветвей
ИБС — ишемическая болезнь сердца; КТ — компьютерная томография; КТА — компьютерная томографическая ангиография; ЛЖ —
левый желудочек; МРА — магнитно -резонансная ангиография; МРТ — магнитно-резонансная томография; ПЖ — правый желудочек;
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 35.8
окончание
Ограничения эхокардиографической оценки поражения сердечно-сосудистой системы,
ассоциированного с ревматологическими заболеваниями и артериитами
In-35_для нас.indd 922
03.04.2019 12:12:08
923
35 Иммунно-опосредованные системные заболевания
Клинические проявления
Данные ЭхоКГ
Медикаментозная профилактика
Поражение клапанов, внутрисердечный тромбоз и тромбоэмболия
Эмболия сосудов головного мозга
Эмболия мелких сосудов головного
мозга
Инфаркт/ТИА
Острое состояние спутанности созна-
ния или судороги
Снижение перфузии головного мозга
Очаговое ишемическое поражение
головного мозга
Инфаркт головного мозга
Небольшие очаговые околожелудоч-
ковые и глубокие нарушения
белого вещества головного мозга
Когнитивная дисфункция и
инвалидность
Эмболия периферических артерий,
включая коронарные артерии
Редко, легочная или парадоксальная
эмболия из вегетаций на клапанах
правых отделов сердца или вегета-
ций/тромбоза, ассоциированного
с катерами или электродами
в правых отделах сердца
Острый вальвулит с перфорацией и
тяжелая недостаточностью клапана
или без них
Наложение инфекционного
эндокардита
Вегетации Либмана–Сакса при СКВ
Схожие с вегетациями Либмана–Сакса или тром-
ботические вегетации при ПАФС
Редко, вегетации на эндокарде предсердий или
желудочков при СКВ и ПАФС
Вегетации или тромбы, ассоциированные с кате-
терами или электродами в правых отделах
сердца
Узелки на клапанах и вегетации подобные
Либмана–Сакса при ревматоидном артериите
Наложение инфицированных вегетаций
Ассоциированная недостаточность различной
степени, реже стеноз
ЧПЭхоКГ следует рассмотреть у пациентов с
(1) острым, недавним (в течение 2–4 нед) или
рецидивирующим инсультом или ТИА;
(2) острым, недавним или рецидивирующим
состоянием спутанности сознания, когнитивной
дисфункции или судорогах, если при МРТ
определяются очаговые поражения головного
мозга или при транскраниальной допплерогра-
фии — церебромикроэмболия; (3) эмболии
периферических артерий; (4) умеренной или
более тяжелой недостаточности, определяемой
с помощью ТТЭхоКГ; или (5) подозрении на
наложение инфекционного эндокардита
Основано на специфическом кли-
ническом сценарии с консульта-
цией ревматолога, лекарственная
иммуносупрессивная противовос-
палительная (кортикостероиды
или цитотоксины) и/или анти-
тромботическая терапия для
лечения неинфекционного эндо-
кардита, осложненного вегетаци-
ями на клапанах и эмболией
сосудов головного мозга, или
вальвулита, осложненного значи-
тельной недостаточностью
клапана, могут быть рассмотрены
до рассмотрения оперативного
вмешательства на клапанах с кра-
ткосрочным и долгосрочным
высоким риском (при необходи-
мости, рекомендуется пластика)
Ишемическая болезнь сердца
Часто протекает бессимптомно, или
перекрывается проявлениями вос-
палительными изменениями ске-
летных мышц, или неправильно
интерпретируется как плеврит или
перикардит
Атипическая боль в груди встреча-
ется преимущественно у молодых
женщин
Классическое проявление — острый
коронарный синдром, включая
нестабильную стенокардию,
инфаркт миокарда с повышением
ST-сегмента и без него
Снижение резерва коронарного кровотока по
результатам ЭхоКГ с дипиридамолом или аде-
нозином у пациентов с функциональной
микрососудистой ИБС
В покое или при физической нагрузке или добу-
тамином стресс-индуцированное нарушение
подвижности стенок или перфузии миокарда
наблюдается у пациентов с эпикардиальной
обструктивной ИБС или с коронарным
артериитом
Соотношение с ИБС
Уменьшение дилатации периферических
артериол
Увеличение ригидности сонных артерий и/или
аорты
Кальцификация коронарных артерий по данным
КТ
Утолщение или бляшки комплекса интима-медиа
сонных артерий и аорты по данным каротидной
ультрасоографии и ЧПЭхоКГ соответственно
Основана на специфическом кли-
ническом сценарии с консульта-
цией ревматолога, стандартной
медикаментозной терапией в ком-
бинации с иммуносупрессивной
противовоспалительной терапией
и DMARD могут быть рассмо-
трены до проведения ЧКВ или
АКШ с высоким уровнем кратко-
срочного или долгосрочного
риска при остром коронарном
синдроме без повышения ST-сег -
мента, или одновременно с ЧКВ
или АКШ при инфаркте миокарда
с повышением ST-сегмента
DMARD (стандартные и биологи-
ческие DMARD включают блока-
тор фактора некроза опухолей
альфа, анти-B клеточную терапию
и др.) и вазодилататоры (включая
антогонисты эндотелина) также
могут быть эффективны у паци-
ентов с ревматоидным артритом
и склеродермией
СВОДНАЯ ИНФОРМАЦИЯ
Ревматологические заболевания и артерииты: клинические проявления, соответствие данных эхокардиографии
и медикаментозная профилактика развития ассоциированного поражения сердечно-сосудистой системы
In-35_для нас.indd 923
03.04.2019 12:12:08
924
ЧАСТЬ VII Сосудистые и системные заболевания
Клинические проявления
Данные ЭхоКГ
Медикаментозная профилактика
Поражение миокарда
Субклиническая диастолическая
и систолическая дисфункция ЛЖ
иПЖ
Атипическая или классическая боль
в груди у пациентов с симптомати-
ческой микрососудистой ИБС
Симптомы диастолической и реже
систолической сердечной
недостаточности
Острый коронарный синдром схож
с таковым у пациентов с миопери-
кардитом или миокардитом
Редко, выраженная глобальная кар-
диомиопатия, обусловленная пер-
вичным миокардитом
Редко, транзиторная и рецидивирую-
щая подобная стресс-индуцирован-
ной кардиомиопатия, и хлоро-
хин-индуцированная рестриктив-
ная или дилатационная
кардиомиопатия
Вторичный предсердные или желу-
дочковые аритмии
Классические параметры диастолической дис-
функции, оцениваемые по данным скоростей
митрального притока, тканевой допплерогра-
фии и спекл-ЭхоКГ
Редко в покое или при физической нагрузке
нарушения движения стенок или перфузии
миокарда наблюдаются у пациентов с микросо-
судистой ИБС
Часто в покое сегментарные или глобальные
нарушения подвижности стенки у пациентов с
миоперикардитом или миокардитом или гло-
бальной каридомиопатией
Основано на стандартном клиниче-
ском сценарии с консультацией
ревматолога, иммуносупрессив-
ная противовоспалительная
терапия и DMARD (стандартные
и биологические) и вазодилата-
торы (включая антогонисты эндо-
телина) могут быть рассмотрены
дополнительно к стандартной
лекарственной терапии
Поражение перикарда
Острый перикардит
Умеренный или большой перикарди-
альный выпот без признаков там-
понады сердца
Тампонада сердца
Транзиторный выпотной констрик-
тивный перикардит
Констриктивный перикардит
Бессимптомные невоспалительные
небольшие перикардиальные
выпоты
Редко, но ва жно для исключения,
наложение первичного инфекцион-
ного перикардита
Небольшой перикардиальный выпот или отсут-
ствие выпота
Тромбоцитарные или воспалительные нити
в перикардиальной жидкости
Утолщение перикарда
Классические признаки тампонады сердца и кон-
стриктивного перикардита
У пациентов с активной фазой рев-
матологического заболевания и
большим перикардиальным
выпотом с наличием признаков
тампонады или без них, ранняя
диагностика (направленная на
исключение инфицирования) или
терапевтический (из-за быстрого
прогрессирования или геморраги-
ческой трансформации) перикар-
диоцентез под контролем ЭхоКГ с
последующей интенсивной имму-
носупрессивной противовоспали-
тельной терапией и DMARD
могут быть рассмотрены. У этих
пациентов следует избегать пери-
кардиального окна (фенестрации)
из-за частого сочетания серозита
(перитонит и плеврит) и повы-
шенного риска инфицирования.
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Ревматологические заболевания и артерииты: клинические проявления, соответствие данных эхокардиографии
и медикаментозная профилактика развития ассоциированного поражения сердечно-сосудистой системы
In-35_для нас.indd 924
03.04.2019 12:12:08
925
35 Иммунно-опосредованные системные заболевания
Клинические проявления
Данные ЭхоКГ
Медикаментозная профилактика
Легочная гипертензия
Бессимптомные нарушения строения
ПЖ с субклинической диастоличе-
ской и систолической дисфункцией
Острое или хроническое легочное
сердце с симптомами правожелу-
дочковой недостаточности
Вторичная тахиаритмия предсердий
Систолическое давление в легочной артерии
в покое (≥ 40 мм рт. ст.) или при физической
нагрузке (≥ 50 мм рт. ст.)
Повышение систолического давления в легочной
артерии и резистентности легочных сосудов;
при нормальном давлении в ЛП (I или III тип),
при повышенном давлении в ЛП (II тип)
Легочное сердце (различная степень расширения
правых отделов сердца и диастолическая и/или
систолическая дисфункция ПЖ
Сопутствующая недостаточность трикуспидаль-
ного клапан различной степени
Сопутствующее нарушение движения перего-
родки, обусловленное давлением или/и
объемом ПЖ
Обычно требуется подтверждение
с помощью катетеризации правых
отделов сердца
Основано на специфическом кли-
ническом сценарии с консульта-
цией ревматолога, иммуносупрес-
сивной противовоспалительной
терапии, DMARD и вазодилата-
торы следует рассмотреть допол-
нительно к стандартной лекар-
ственной терапии при I и III
типах легочной гипертензии
Артерииты с поражением аорты и ее ветвей
Симптомы динамического наруше-
ния кровообращения с асимме-
трией и снижением пульса
и с наличием шума на пораженной
артерии
Окклюзионное поражение подклю-
чичной или сонной артерий
Синдром подключичного
обкрадывания
Боль в груди, одышка, кровохарка-
нье и легочная гипертензия у паци-
ентов с аневризмами или стенозом
легочных артерий
Острый коронарный синдром вслед-
ствие аортита восходящего отдела
аорты, который приводит к
сужению устьев коронарных
артерий или вследствие коронар-
ного артериита
Хроническая, подострая или острая
недостаточность аортального
клапана
Гипертензия вследствие ригидности
аорты и/или поражения почечных
сосудов
Ранний атеросклероз
Дилатация корня аорты и кольца, утолщение
стенки и ригидность по результатам ТТЭхоКГ
и ЧПЭхоКГ
Аневризматическая или псевдоаневризматическая
дилатация, утолщение стенки, ригидности
и атеросклероз восходящего и нисходящего
отделов аорты и дуги аорты по результатам
ЧПЭхоКГ
Выявление, определение и характеристика меха-
низма сопутствующей недостаточности аор-
тального клапана
Определение и характеристика сопутствующего
поражения миокарда, эндокарда или перикарда
Определение и характеристика легочной гипер-
тензии, тромбоз правых отделов сердца и выра-
женная дилатация легочных артерий по резуль-
татам ТТЭхоКГ
Определение и характеристика поражения ветвей
аорты требует проведения КТА или МРА
Основано на специфическом кли-
ническом сценарии с консульта-
цией ревматолога, рассматрива-
ется возможность кардиоторо-
кального или сосудистого опера-
тивного вмешательства, или
интервенционная кардиология.
Однако стабилизация с помощью
пероральной или внутривенной
кортикостероидной терапии тяже-
лого аортита, осложненного зна-
чительной недостаточностью
клапана, ИБС, обусловленной
поражением устьев коронарных
артерий, и/или окклюзия ветвей
аорты может быть рассмотрена до
проведения операции на клапане,
коронарных артериях или ветвях
аорты с высоким краткосрочным
и долгосрочным риском или чре-
скожной реваскуляризации из-за
высокой частоты несостоятельно-
сти искусственного клапана,
закрытия или тромбоза обходного
сосудистого шунта и стента
DMARD (disease modifying anti-rheumatic drugs) — модифицирующие заболевание противоревматические препараты; АКШ — аортокоро-
нарное шунтирование; ИБС — ишемическая болезнь сердца; КТ — компьютерная томография; КТА — компьютерная томографическая
ангиография; ЛЖ — левый желудочек; ЛП — левое предсердие; МРА — магнитно-резонансная ангиография; МРТ — магнитно -резо-
нансная томография; ПАФС — первичный антифосфолипидный синдром; ПЖ — правый желудочек; СКВ — системная красная волчан-
ка; ТИА — транзиторная ишемическая атака; ТТЭхоКГ — трансторакальная эхокардиография; ЧКВ — чрескожное коронарное вмеша-
тельство; ЧПЭхоКГ — чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Ревматологические заболевания и артерииты: клинические проявления, соответствие данных эхокардиографии
и медикаментозная профилактика развития ассоциированного поражения сердечно-сосудистой системы
In-35_для нас.indd 925
03.04.2019 12:12:08
926
ЧАСТЬ VII Сосудистые и системные заболевания
ЛИТЕРАТУРА
1. Roldan CA, Shively BK, Lau CC, et al. Sys-
temic lupus erythematosus valve disease by
transesophageal echocardiography and the
role of antiphospholipid antibodies, J Am Coll
Cardiol 20:1127–1134, 1992.
2. Roldan CA, Shively BK, Crawford MH. An
echocardiographic study of valvular heart
disease associated with systemic lupus erythe-
matosus, N Engl J Med 335:1424–1430, 1996.
3. Moaref AR, Afifi S, Rezaian S, Rezaian GR.
Isolated tricuspid valve Libman-Sacks endo-
carditis and valvular stenosis: unusual mani-
festations of systemic lupus erythematosus, J
Am Soc Echocardiogr 23:341.e3–341.e5, 2010.
4. Khalid U, Hirudayaraj P, Lakkis N, et al. Left
atrial thrombus mimicking a myxoma in a
patient with systemic lupus erythematosus,
Hellenic J Cardiol 55:167–170, 2014.
5. Ananthakrishna R, Moorthy N, Bhat P, et al.
A vanishing left ventricular outflow tract
mass: an uncommon manifestation of sys-
temic lupus erythematosus, Echocardiography
31:E222–E223, 2014.
6. Roldan CA, Qualls CR, Sopko KS, Sibbitt Jr.
WL. Transthoracic versus transesophageal
echocardiography for detection of Libman-
Sacks endocarditis: a randomized controlled
study, J Rheumatol 35:224–229, 2008.
7. Roldan CA, Tolstrup K, Macias L, et al. Lib-
man-Sacks Endocarditis: Detection, Charac-
terization, and Clinical Correlates by Three-
Dimensional Transesophageal Echocardiog-
raphy, J Am Soc Echocardiogr 28:770–779,
2015.
8. Roldan CA, Gelgand EA, Qualls CR, et al.
Valvular heart disease as a cause of cerebro-
vascular disease in patients with systemic lu-
pus erythematosus, Am J Cardiol 95:1441–
1447, 2005.
9. Roldan CA, Gelgand EA, Qualls CR, Sibbitt
Jr. WL . Valvular heart disease is associated
with nonfocal neuropsychiatric systemic lu-
pus erythematosus, J Clin Rheumatol 12:3–10,
2006.
10. Roldan CA, Gelgand EA, Qualls CR, Sibbitt
Jr. WL . Valvular heart disease by transtho-
racic echocardiography is associated with fo-
cal brain injury and central neuropsychiatric
systemic lupus erythematosus, Cardiology
108:331–337, 2007.
11. Sibbitt Jr. WL, Brooks WM, Kornfeld M, et
al. Magnetic resonance imaging and brain
histopathology in neuropsychiatric systemic
lupus erythematosus, Semin Arthritis Rheum
40:32–52, 2010.
12. Roldan CA, Sibbitt Jr. WL, Qualls CR, et al.
Libman-Sacks endocarditis and embolic cere-
brovascular disease, JACC Cardiovasc Imaging
6:973–983, 2013.
13. Bouma W, Klinkenberg TJ, van der Horst IC,
et al. Mitral valve surgery for mitral regurgita-
tion caused by Libman-Sacks endocarditis: a
report of four cases and a systematic review
of the literature, J Cardiothorac Surg 5:13,
2010.
14. D’Alessandro LC, Paridon SM, Gaynor JW.
Successful repair of aortic valve perforation
in pediatric Libman-Sacks endocarditis, J
Thorac Cardiovasc Surg 144:e151–e153, 2012.
15. Blanchard DG, Ross RS, Dittrich HC. Non-
bacterial thrombotic endocarditis: assessment
by transesophageal echocardiography, Chest
102:954–956, 1992.
16. Roldan CA, Schevchuck O, Tolstrup K, et al.
Lambl’s excrescences: association with cere-
brovascular disease and pathogenesis, Cere-
brovasc Dis 40:18–27, 2015.
17. Yilmaz S, Caliskan M, Kulaksizoglu S, et al.
Association between serum total antioxidant
status and coronary microvascular functions
in patients with SLE, Echocardiography
29:1218–1223, 2012.
18. Chin CW, Chin CY, Ng MX, et al. Endothe-
lial function is associated with myocardial
diastolic function in women with systemic
lupus erythematosus, Rheumatol Int 34:1281–
1285, 2014.
19. Roldan CA, Joson J, Qualls CR, et al. Prema-
ture aortic stiffness in systemic lupus erythe-
matosus by transesophageal echocardiogra-
phy, Lupus 19:1599–1605, 2010.
20. Roldan CA, Joson J, Sharrar J, et al. Prema-
ture aortic atherosclerosis in systemic lupus
erythematosus: a controlled transesophageal
echocardiographic study, J Rheumatol 37:71–
78, 2010.
21. Roldan PC, Macias L, Roldan CA, et al. Aortic
versus carotid atherosclerosis in systemic lu-
pus erythematosus: which one occurs first? J
Am Coll Cardiol 24:S256, 2012.
22. Roldan PC, Ratliff M, Snider R, et al. Aortic
atherosclerosis in systemic lupus erythemato-
sus, Rheumatology (Sunnyvale)(Suppl 5),
2014. pii: S5–006.
23. Varma N, Hinojar R, D’Cruz D, et al. Coro-
nary vessel wall contrast enhancement imag-
ing as potential direct marker of coronary
involvement. Integration from findings from
CAD and SLE patients, JACC: Cardiovascular
Imaging 7:762–770, 2014.
24. Kocabay G, Alizade E, Pala S. Acute myocar-
dial infarction due to Libman-Sacks endocar-
ditis, J Emerg Med 45:e91–e93, 2013.
25. Roldan CA, Alomari IB, Awad K, et al. Aortic
stiffness is associated with left ventricular
diastolic dysfunction in systemic lupus ery-
thematosus: a controlled transesophageal
echocardiographic study, Clin Cardiol 37:83–
90, 2014.
26. Ishimori ML, Agarwal M, Beigel R, et al. Sys-
temic lupus erythematosus cardiomyopa-
thy—a case series demonstrating a reversible
form of left ventricular dysfunction, Echocar-
diography 31:563–568, 2014.
27. Yogasundaram H, Putko BN, Tien J, et al.
Hydroxychloroquine-induced cardiomyopa-
thy: case report, pathophysiology, diagnosis,
and treatment, Can J Cardiol 30:1706–1715,
2014.
28. Buss SJ, Wolf D, Korosoglou G, et al. Myocar-
dial left ventricular dysfunction in patients
with systemic lupus erythematosus: new in-
sights from tissue Doppler and strain imag-
ing, J Rheumatol 37:79–86, 2010.
29. Huang BT, Yao HM, Huang H. Left ventricu-
lar remodeling and dysfunction in systemic
lupus erythematosus: a three-dimensional
speckle tracking study, Echocardiography
31:1085–1094, 2014.
30. Mavrogeni S, Sfikakis PP, Gialafos E, et al.
Cardiac tissue characterization and the diag-
nostic value of cardiovascular magnetic reso-
nance in systemic connective tissue diseases,
Arthritis Care Res (Hoboken) 66:104–112,
2014.
31. Cheng W, Balachandar R, Mistry P. Cardiac
tamponade: an initial presentation of SLE,
BMJ Case Rep, 2013. pii: bcr2013200011.
32. Oh JY, Chang SA, Choe YH, et al. Transient
constrictive pericarditis in systemic lupus ery-
thematous, Eur Heart J Cardiovasc Imaging
13:793, 2012.
33. Ruiz-Irastorza G, Garmendia M, Villar I, et al.
Pulmonary hypertension in systemic lupus
erythematosus: prevalence, predictors and
diagnostic strategy, Autoimmun Rev 12:410–
415, 2013.
34. Akdogan A, Kilic L, Dogan I, et al. Pulmonary
hypertension in systemic lupus erythematosus:
pulmonary thromboembolism is the leading
cause, J Clin Rheumatol 19:421–425, 2013.
35. Hu
bbe-Tena C, Gallegos-Nava S, Ma
́
rquez-
Velasco R, et al. Pulmonary hypertension in
systemic lupus erythematosus: echocardiog-
raphy-based definitions predict 6-year sur-
vival, Rheumatology (Oxford) 53:1256–1263,
2014.
36. Zuily S, Huttin O, Mohamed S, et al. Valvular
heart disease in antiphospholipid syndrome,
Curr Rheumatol Rep 15:320, 2013.
37. Turiel M, Sarzi-Puttinin P, Peretti A, et al.
Five year follow-up by transesophageal echo-
cardiographic studies in primary antiphos-
pholipid syndrome, Am J Cardiol 96:574–579,
2005.
38. Espinola Zavaleta N, Montes RM, Soto ME, et
al. Primary antiphospholipid syndrome: a
5-year transesophageal echocardiographic fol-
low-up study, J Rheumatol 31:2402–2407, 2004.
39. Ames PRJ, Margarita A, Sokoll KB, et al. Pre-
mature atherosclerosis in primary antiphos-
pholipid syndrome: preliminary data, Ann
Rheum Dis 64:315–317, 2005.
40. Corrao S, Messina S, Pistone G, et al. Heart
involvement in rheumatoid arthritis: system-
atic review and meta-analysis, Int J Cardiol
167:2031–2038, 2013.
41. Douglas KM, Pace AV, Treharne GJ, et al.
Excess recurrent cardiac events in rheumatoid
arthritis patients with acute coronary syn-
drome, Ann Rheum Dis 65:348–353, 2006.
42. Turiel M, Atzeni F, Tomasoni L, et al. Non-
invasive assessment of coronary flow reserve
and ADMA levels: a case-control study of
early rheumatoid arthritis patients, Rheuma-
tology (Oxford) 48:834–839, 2009.
43. Toutouzas K, Sfikakis PP, Karanasos A, et al.
Myocardial ischaemia without obstructive
coronary artery disease in rheumatoid arthri-
tis: hypothesis-generating insights from a
cross-sectional study, Rheumatology (Oxford)
52:76–80, 2013.
44. Vizzardi E, Cavazzana I, Sciatti E, et al. Evalu-
ation of ascending aorta wall in rheumatoid
arthritis by tissue and strain Doppler imaging
during anti-tumor necrosis factor-α therapy,
Clin Cardiol 37:738–743, 2014.
45. Atzeni F, Sarzi-Puttini P, Signorello MC, et al.
New parameters for identifying subclinical
atherosclerosis in patients with primary
Sjo
gren’s syndrome: a pilot study, Clin Exp
Rheumatol 32:361–368, 2014.
46. Acikgo
z E, Yayla C, Acikgo
z SK, et al. Biven-
tricular thrombus and associated myocardial
infarction in a rheumatoid arthritis patient: a
case report and literature review, Clin Rheu-
matol 32:909–912, 2013.
47. Saghir MK, Attenhofer Jost C, Warrington KJ,
et al. Exercise echocardiography in rheuma-
toid arthritis: a case-control study, J Am Soc
Echocardiogr 22:1228–1231, 2009.
48. Roldan CA, DeLong C, Qualls CR, Crawford
MH. Characterization of valvular heart dis-
ease in rheumatoid arthritis by transesopha-
geal echocardiography and clinical correlates,
Am J Cardiol 100:496–502, 2007.
49. Breed ER, Binstadt BA. Autoimmune valvular
carditis, Curr Allergy Asthma Rep 15:491,
2015.
In-35_для нас.indd 926
03.04.2019 12:12:08
927
35 Иммунно-опосредованные системные заболевания
50. Kang H, Baron M. Embolic complications of
a mitral valve rheumatoid nodule, J Rheuma-
tol 31:1001–1003, 2004.
51. Gonzalez-Juanatey C, Garcia-Porrua C, Testa
A, Gonzalez-Gay MA. Potential role of mitral
valve strands on stroke recurrence in rheuma-
toid arthritis, Arthritis Rheum 49:866–867,
2003.
52. Tarkin JM, Hadjiloizou N, Savage HO, et al.
Severe cardiac failure due to rapidly progres-
sive rheumatoid arthritis-associated valvu-
lopathy, Cardiovasc J Afr 23:e1–e3, 2012.
53. Arakawa K, Yamazawa M, Morita Y, et al.
Giant rheumatoid nodule causing simultane-
ous complete atrioventricular block and se-
vere mitral regurgitation: a case report, J
Cardiol 46:77–83, 2005.
54. Stulak JM, Suri RM, Matteson EL, et al. Mitral
valve repair is durable in patients with rheu-
matoid arthritis, Ann Thorac Surg 94:510–515,
2012.
55. Aslam F, Bandeali SJ, Khan NA, et al. Dia-
stolic dysfunction in rheumatoid arthritis: a
meta-analysis and systematic review, Arthritis
Care Res (Hoboken) 65:534–543, 2013.
56. Fine NM, Crowson CS, Lin G, et al. Evalua-
tion of myocardial function in patients with
rheumatoid arthritis using strain imaging by
speckle-tracking echocardiography, Ann
Rheum Dis 73:1833–1839, 2014.
57. Cicek OF, Bayram NA, Ayhan H, et al. As-
sessment of the relationship between aortic
stiffness and left ventricular functions with
echocardiography in patients with Sjo
gren’s
syndrome, Int J Rheum Dis 17:658–663, 2014.
58. Gonzalez FA, Beirao P, Adriao J, et al. Adult-
onset Still’s disease presenting as myopericar-
ditis, BMJ Case Rep, 2014. pii: bcr2013202754.
59. Cetin S, Mustafa G, Keskin G, et al. Inflix-
imab, an anti-TNF-alpha agent, improves left
atrial abnormalities in patients with rheuma-
toid arthritis: preliminary results, Cardiovasc
J Afr 25:168–175, 2014.
60. Midtbo H, Gerdts E, Kvien TK, et al. Disease
activity and left ventricular structure in pa-
tients with rheumatoid arthritis, Rheumatol-
ogy (Oxford) 54:511–519, 2015.
61. Daїen CI, Fesler P, du Cailar G, et al. Etaner-
cept normalises left ventricular mass in pa-
tients with rheumatoid arthritis, Ann Rheum
Dis 72:881–887, 2013.
62. Ikonomidis I, Tzortzis S, Andreadou I, et al.
Increased benefit of interleukin-1 inhibition
on vascular function, myocardial deformation,
and twisting in patients with coronary artery
disease and coexisting rheumatoid arthritis,
Circ Cardiovasc Imaging 7:619–628, 2014.
63. Roldan CA, Chavez J, Weist P, et al. Aortic
root disease and valve disease associated with
ankylosing spondylitis, J Am Coll Cardiol
32:1397–1404, 1998.
64. Ercan S, Cakici M, Davutoglu V, et al. Recur-
rent giant sinus of Valsalva aneurysm and
ankylosing spondylitis, Asian Cardiovasc
Thorac Ann 21:450–452, 2013.
65. Luckie M, Irion L, Khattar RS. Severe mitral
and aortic regurgitation in association with
ankylosing spondylitis, Echocardiography
26:705–710, 2009.
66. Koo HJ, Yang DH, Kang JW, et al. Demon-
stration of prosthetic aortic valve dehiscence
in a patient with noninfectious aortitis by
multimodality imaging: findings of echocar-
diography and computed tomography, Circu-
lation 128:759–761, 2013.
67. Kiris A, Karkucak M, Karaman K, et al. Pa-
tients with ankylosing spondylitis have evi-
dence of left ventricular asynchrony, Echo-
cardiography 29:661–667, 2012.
68. Svea
lv BG, Ta
ng MS, Klingberg E, et al. Preva-
lence of diastolic dysfunction in patients with
ankylosing spondylitis: a cross-sectional study,
Scand J Rheumatol 44:111–117, 2015.
69. Chen Y, Chung HY, Zhao CT, et al. Left ven-
tricular myocardial dysfunction and prema-
ture atherosclerosis in patients with axial
spondyloarthritis, Rheumatology (Oxford)
54:292–301, 2015.
70. Toma
́
s L, Lazu
́
rova
́
I, Pundova
́
L, et al. Acute
and long-term effect of infliximab on hu-
moral and echocardiographic parameters in
patients with chronic inflammatory diseases,
Clin Rheumatol 32:61–66, 2013.
71. Blanco I, Mathai S, Shafiq M, et al. Severity
of systemic sclerosis-associated pulmonary
arterial hypertension in African Americans,
Medicine (Baltimore) 93:177–185, 2014.
72. Vacca A, Montisci R, Garau P, et al. Prognos-
tic impact of coronary microcirculation ab-
normalities in systemic sclerosis: a prospec-
tive study to evaluate the role of non-invasive
tests, Arthritis Res Ther 15:R8, 2013.
73. Papagoras C, Achenbach K, Tsifetaki N, et al.
Heart involvement in systemic sclerosis: a
combined echocardiographic and scintigraphic
study, Clin Rheumatol 33:1105–1111, 2014.
74. Colaci M, Giuggioli D, Manfredi A, et al.
Aortic pulse wave velocity measurement in
systemic sclerosis patients, Reumatismo
64:360–367, 2012.
75. Turiel M, Gianturco L, Ricci C, et al. Silent
cardiovascular involvement in patients with
diffuse systemic sclerosis: a controlled cross-
sectional study, Arthritis Care Res (Hoboken)
65:274–280, 2013.
76. Jurisic Z, Martinovic-Kaliterna D, Marasovic-
Krstulovic D, et al. Relationship between in-
terleukin-6 and cardiac involvement in sys-
temic sclerosis, Rheumatology (Oxford)
52:1298–1302, 2013.
77. Pieroni M, De Santis M, Zizzo G, et al. Rec-
ognizing and treating myocarditis in recent-
onset systemic sclerosis heart disease: poten-
tial utility of immunosuppressive therapy in
cardiac damage progression, Semin Arthritis
Rheum 43:526–535, 2014.
78. Gerede DM, Turhan S, Hural R, et al. Evalu-
ation of global function of the heart in sclero-
derma patients, Echocardiography 32:912–919,
2015.
79. Schattke S, Knebel F, Grohmann A, et al.
Early right ventricular systolic dysfunction in
patients with systemic sclerosis without pul-
monary hypertension: a Doppler tissue and
speckle tracking echocardiography study,
Cardiovasc Ultrasound 22:3, 2010.
80. Cusma
́
Piccione M, Zito C, Bagnato G, et al.
Role of 2D strain in the early identification
of left ventricular dysfunction and in the risk
stratification of systemic sclerosis patients,
Cardiovasc Ultrasound 11:6, 2013.
81. D’Alto M, Cuomo G, Romeo E, et al. Tissue
Doppler imaging in systemic sclerosis: a
3-year longitudinal study, Semin Arthritis
Rheum 43:673–680, 2014.
82. Pigatto E, Peluso D, Zanatta E, et al. Evalua-
tion of right ventricular function performed
by 3D-echocardiography in scleroderma pa-
tients, Reumatismo 66:259–263, 2015.
83. Tyndall AJ, Bannert B, Vonk M. Causes and
risk factors for death in systemic sclerosis: a
study from the EULAR Scleroderma Trials
and Research (EUSTAR) database, Ann Rhe-
um Dis 69:1809–1815, 2010.
84. Chaisson NF, Hassoun PM. Systemic sclero-
sis-associated pulmonary arterial hyperten-
sion, Chest 144:1346–1356, 2013.
85. Hachulla E, Clerson P, Airo P, et al. EUSTAR
co-workers. Value of systolic pulmonary arte-
rial pressure as a prognostic factor of death in
the systemic sclerosis EUSTAR population,
Rheumatology (Oxford) 54:1262–1269, 2015.
86. Gargani L, Pignone A, Agoston G, et al.
Clinical and echocardiographic correlations
of exercise-induced pulmonary hypertension
in systemic sclerosis: a multicenter study, Am
Heart J 165:200–207, 2013.
87. Voilliot D, Magne J, Dulgheru R, et al. Deter-
minants of exercise-induced pulmonary arte-
rial hypertension in systemic sclerosis, Int J
Cardiol 173:373–379, 2014.
88. Ciurzyn
́
ski M, Bienias P, Irzyk K, et al. Exag-
gerated increase of exercise-induced pulmo-
nary artery pressure in systemic sclerosis pa-
tients predominantly results from left ven-
tricular diastolic dysfunction, Clin Res
Cardiol 11:6, 2013.
89. Gopal DM, Doldt B, Finch K, et al. Relation of
novel echocardiographic measures to invasive
hemodynamic assessment in scleroderma-as -
sociated pulmonary arterial hypertension, Ar-
thritis Care Res (Hoboken) 66:1386–1394, 2014.
90. Kusunose K, Yamada H, Hotchi J, et al. Pre-
diction of future overt pulmonary hyperten-
sion by 6-min walk stress echocardiography
in patients with connective tissue disease, J
Am Coll Cardiol 66:376–384, 2015.
91. Avouac J, Huscher D, Furst DE, et al. EPOSS
group. Expert consensus for performing right
heart catheterisation for suspected pulmo-
nary arterial hypertension in systemic sclero-
sis: a Delphi consensus study with cluster
analysis, Ann Rheum Dis 73:191–197, 2014.
92. Wang H, Liu HX, Wang YL, et al. Left ven-
tricular diastolic dysfunction in patients with
dermatomyositis without clinically evident
cardiovascular disease, J Rheumatol 41:495–
500, 2014.
93. Lu Z, Wei Q, Ning Z, et al. Left ventricular
diastolic dysfunction – early cardiac impair-
ment in patients with polymyositis/dermato-
myositis: a tissue Doppler imaging study, J
Rheumatol 40:1572–1577, 2013.
94. Mavrakanas TA, Lobrinus A, Berdague
́
P, et
al. Severe mitral valve regurgitation in poly-
myositis, J Clin Rheumatol 18:367–369, 2012.
95. Gunnarsson R, Andreassen AK, Molberg O,
et al. Prevalence of pulmonary hypertension
in an unselected, mixed connective tissue
disease cohort: results of a nationwide, Nor-
wegian cross-sectional multicentre study and
review of current literature, Rheumatology
(Oxford) 52:1208–1213, 2013.
96. Jeon CH, Chai JY, Seo YI, et al. Pulmonary
hypertension associated with rheumatic dis-
eases: baseline characteristics from the Korean
registry, Int J Rheum Dis 15:e80–e89, 2012.
97. Naclerio C, D’Angelo S, Baldi S, et al. Effi-
cacy of bosentan in the treatment of a patient
with mixed connective tissue disease compli-
cated by pulmonary arterial hypertension,
Clin Rheumatol 29:687–690, 2010.
98. Bezerra MC, Saraiva Jr. F, Carvalho JF, et al.
Cardiac tamponade due to massive pericar-
dial effusion in mixed connective tissue dis-
ease: reversal with steroid therapy, Lupus
13:618–620, 2004.
99. Ve
́
gh J, Hegedus I, Szegedi G, et al. Diastolic
function of the heart in mixed connective
tissue disease, Clin Rheumatol 26:176–181,
2007.
In-35_для нас.indd 927
03.04.2019 12:12:08
928
ЧАСТЬ VII Сосудистые и системные заболевания
100. Arend WP, Michel BA, Bloch DA, et al. The
American College of Rheumatology 1990
criteria for the classification of Takayasu ar-
teritis, Arthritis Rheum 33:1129–1134, 1990.
101. Dong H, Jiang X, Peng M, et al. Percutaneous
transluminal angioplasty for symptomatic
pulmonary stenosis in Takayasu arteritis, J
Rheumatol 41:1856–1862, 2014.
102. Matsuura K, Ogino H, Kobayashi J, et al.
Surgical treatment of aortic regurgitation due
to Takayasu arteritis: long-term morbidity
and mortality, Circulation 112:3707–3712,
2005.
103. Hartlage GR, Palios J, Barron BJ, et al. Multi-
modality imaging of aortitis, JACC Cardiovasc
Imaging 7:605–619, 2014.
104. Goel PK, Moorthy N, Kumar S. The role of
noninvasive imaging in early diagnosis of
clinically masked prepulseless inflammatory
phase of Takayasu’s arteritis, Echocardiogra-
phy 29:59–63, 2012.
105. Hunder GG, Bloch DA, Michel BA, et al. The
American College of Rheumatology 1990
criteria for the classification of giant cell ar-
teritis, Arthritis Rheum 33:1122–1128, 1990.
106. Valente F, Carro A, Moral S, Evangelista A.
Multiple thrombi in the ascending aorta use-
fulness of contrast transesophageal echocar-
diography in a case of Horton’s aortitis, Cir-
culation 128:e44–e45, 2013.
107. Stengl KL, Buchert R, Bauknecht H, Sobesky
J. A hidden giant: Wallenberg syndrome and
aortal wall thickening as an atypical presenta-
tion of a giant cell arteritis, BMJ Case Rep,
2013. pii: bcr2012006994.
108. Palmers PJ, Ameloot K, De Wever W, et al.
An echocardiographic finding leading to the
diagnosis of giant cell arteritis, Eur Heart J
Cardiovasc Imaging 14:434, 2013.
109. Maldini C, Depinay-Dhellemmes C, Tra TT,
et al. Limited value of temporal artery ultra-
sonography examinations for diagnosis of
giant cell arteritis: analysis of 77 subjects, J
Rheumatol 37:2326–2330, 2010.
110. Davatchi F. Diagnosis/classification criteria
for Behcet’s disease, Patholog Res Int 2012:
607921, 2012.
111. Fei Y, Li X, Lin S, et al. Major vascular in-
volvement in Behcet’s disease: a retrospective
study of 796 patients, Clin Rheumatol 32:845–
852, 2013.
112. Geri G, Wechsler B, Thi Huong du L, et al.
Spectrum of cardiac lesions in Behcet disease:
a series of 52 patients and review of the lit-
erature, Medicine (Baltimore) 91:25–34, 2012.
113. Farouk H, Chilali KE, Said K, et al. Value of
certain echocardiographic findings in the
initial suspicion of Behcet’s disease, Echocar-
diography 31:924–930, 2014.
114. Ma WG, Zheng J, Zhu JM, et al. Aortic regur-
gitation caused by Behcet’s disease: surgical
experience during an 11-year period, J Card
Surg 27:39–44, 2012.
In-35_для нас.indd 928
03.04.2019 12:12:08
929
36 Эхокардиография
при метаболических
и пищевых нарушениях
JASON LINEFSKY, MD, MS
Ожирение
Общие данные
Эхокардиографические данные
Клиническое ведение пациентов
Синдром обструктивного апноэ во сне
Общие данные
Эхокардиографические данные
Клиническое ведение пациентов
Сахарный диабет второго типа
и метаболический синдром
Общие данные
Эхокардиографические данные
Клиническое ведение пациентов
Эндокринопатии
Гипертиреоз
Гипотиреоз
Акромегалия
Дефицит гормона роста
Синдром Кушинга
Гиперпаратиреоз
Феохромоцитома
Заболевания печени
Цирротическая кардиомиопатия
Трансплантация печени
Алкоголь
Неалкогольная жировая
болезнь печени
Метаболические и пищевые нарушения, такие как
ожирение, диабет, эндокринопатии и цирроз, име-
ют различную клиническую картину и могут небла-
гоприятно влиять на несколько систем органов.
Обычно присутствуют нарушения со стороны сер-
дечно-сосудистой системы, однако в большинстве
случаев они протекают субклинически и выявляют-
ся только при проведении плановых обследований
(эхокардиография). Заболевания сердечно-сосуди-
стой системы являются основными причинами за-
болеваемости и смертности при многих нарушени-
ях обмена веществ, поэтому их крайне важно выяв-
лять на ранних этапах. Раннее и своевременное
начало лечения основного заболевания может изме-
нить течение болезни сердца (табл. 36 .1). Длитель-
ное воздействие метаболических нарушений приво-
дит к фиброзу миокарда, что в свою очередь прово-
цирует развитие дисфункции сердца и увеличению
смертности.
ОЖИРЕНИЕ
ОБЩИЕ ДАННЫЕ
Ожирение — хроническое заболевание, характери-
зующееся избыточным накоплением жира. Болезнь
является глобальной эпидемией с резким ростом в
течении последних трех десятилетий. В развитых
странах большинство мужчин клинически относят к
категории наличия избыточного веса либо ожире-
ния [1]. Ожирение оказывает серьезное влияние на
общее состояние здоровья, увеличивая риск сердеч-
но-сосудистых заболеваний и на 40% увеличивая
риск смерти от сердечно-сосудистых заболеваний
[2]. Врачи обычно назначают проведение эхокарди-
ографии (ЭхоКГ) людям с ожирением при наличии
симптомов в виде одышки при нагрузке, которая
может быть связана с сердечной дисфункцией либо
снижением кардиореспираторной выносливости [3].
Существует несколько способов определения
ожирения с помощью антропометрических измере-
ний для непосредственного измерения содержания
висцерального жира, однако наиболее практичным
и рекомендуемым методом оценки выступает ин-
декс массы тела (ИМТ) [4]. ИМТ легко вычислить,
разделив массу тела в килограммах на рост в метрах
в квадрате (кг/м2). Категории ИМТ точно страти-
фицируют смертность от сердечно-сосудистых за-
болеваний (табл. 36 .2). Однако индекс отражает
состояние всего тела, поэтому зачастую он может
переоценить либо недооценить ожирение как у
мускулистых людей, так и в азиатской популяции,
соответственно. Дополнительными мерами оценки
абдоминального ожирения являются измерение
окружности талии и процента жировых отложений,
которые предоставляют дополнительную информа-
цию в некоторых клинических ситуациях. Компью-
In-36_для нас.indd 929
03.04.2019 12:12:22
930 ЧАСТЬ VII Сосудистые и системные заболевания
Год
Название
Организация
Содержание
Ожирение
2009
Клинические рекомендации по
оценке, лечению и долгосроч-
ному ведению взрослых паци-
ентов с СОАС [112]
Американская академия медицины
сна
Стратегия скрининга и диагностики СОАС
Варианты лечения СОАС
2011
Бариатрическая хирургия и сер-
дечно-сосудистые факторы
риска [27]
Американская ассоциация сердца
Типы бариатрической хирургии
Осложнения после бариатрических
операций
Эффект от бариатрических операций
на факторы сердечно-сосудистого риска
и выживаемость
2013
Ведение взрослых пациентов
с избыточной массой тела
и ожирением [4]
Американская коллегия кардиологии
Американская ассоциация сердца
Сообщество по проблемам избыточ-
ного веса
Определение рисков в зависимости
от ИМТ
Влияние потери веса на риски
Стратегии диетического питания
Эффективность бариатрических операций
2015
Количественное определение
камер сердца методом эхокар-
диографии у взрослых
Американская организация эхокар-
диографии в Европе
Ассоциация сердечно-сосудистой
визуализации
Индексирование на размеры тела
Стандарты для измерения размеров и
функций камер сердца
Нормальные цифры показателей
эхокардиографии
Диабет
2009
Физические упражнения для
СД-2 [59]
Американская ассоциация сердца
Полезные упра жнения при СД-2
Риски от тренировок
Рекомендации к тренировкам
2015
Новые данные по профилак-
тике сердечно-сосудистых
заболеваний у взрослых
с СД-2 [113]
Американская ассоциация
диабетологов
Американская ассоциация сердца
Новые диагностические критерии для
СД-2
Изменение образа жизни при СД-2
Цели лечения при СД-2
Скрининг сердечно-сосудистых заболева-
ний при СД-2
Заболевания печени
2012
Оценка и лечение заболеваний
сердца у кандидатов на пере-
садку печени и почек [93]
Американская коллегия кардиологии
Американская ассоциация сердца
Оценка/лечение ЗКА у кандидатов на
пересадку
Оценка ЛГ у кандидатов на пересадку
Медикаментозное лечение сердечно-сосу-
дистых заболеваний у кандидатов на
пересадку
2013
Оценка возможности транс-
плантации печени у взрослых
[97]
Американская ассоциация по изуче-
нию заболеваний печени
Американское общество
трансплантации
Показания к трансплантации сердца
Оценка сердца при пересадке печени
ЗКА — заболевания коронарных артерий; ИМТ — индекс массы тела; ЛГ — легочная гипертензия; СД-2
—
сахарный диабет 2-го типа;
СОАС — синдром обструктивного апноэ во время сна.
ТАБЛИЦА 36.1 Клинические рекомендации в отношении кардиологических особенностей
у пациентов с метаболическими расстройствами и нарушением питания
терная томография (КТ) и магнитно-резонансная
томография (МРТ) могут оценить распределение и
массу висцерального жира, однако данные методы
слишком дорогостоящие для клинического приме-
нения.
Прямые патофизиологические последствия ожи-
рения на сердечно-сосудистую систему включают в
себя гемодинамические, нейрогормональные и ме-
таболические измерения (рис. 36.1) [5]. Увеличение
массы жира влечет за собой увеличение объема
крови, сердечного выброса и работу ЛЖ. Больший
венозный приток увеличивает давление наполне-
ния ЛЖ и напряжение на его стенки, что приводит
к ремоделированию сердца с изменением геометрии
ЛЖ в зависимости от продолжительности ожире-
ния и наличия сопутствующих заболеваний.
Исследования на животных и людях показали,
что при ожирении отмечаются воспалительные ре-
In-36_для нас.indd 930
03.04.2019 12:12:22
931
36 Эхокардиография при метаболических и пищевых нарушениях
Категория ВОЗ
ИМТ (кг/м2)
Общая летальность
(мужчины)*
Общая летальность
(женщины)*
Летальность от ИБС*
Дефицит массы тела
< 18,5
18,4
10,5
2,6
Нормальная масса тела
18,5–24,9
14,5
8,9
2,7
Избыточная масса тела
25–29,9
16,9
10,4
3,5
Ожирение I
30–34,9
22,7
13,0
5,8
Ожирение II
35–39,9
28,2
17,0
7,8
Ожирение III (тяжелое)
≥40
34,7
19,2
8,3
* Рассчитанные Whitlock с коллегами годовые проценты на 1000 [2].
ВОЗ — Всемирная организация здравоохранения; ИБС — ишемическая болезнь сердца; ИМТ — индекс массы тела.
ТАБЛИЦА 36.2 Общая летальность и летальность от ишемической болезни сердца,
стратифицированные на индекс массы тела
Сердечный выброс
Гипертрофия
и расширение ПЖ
Чрезмерное накопление жировой ткани
Апноэ во сне/синдром
гиповентиляции при
ожирении
Свободные жировые
массы
Увеличение
объема крови
Системного
сосудистого
сопротивления
Ударный объем ЛЖ
Гипоксия/ ацидоз
Отсутствие изменений
в частоте сердечных
сокращений
Легочная артериальная
гипертензия
Расширение ЛЖ
Гипертензия
Легочная
венозная
гипертензия
ПЖ недостаточность
Напряжение стенки ЛЖ
Гипертрофия ЛЖ
Нейрогормональные
и метаболические
изменения
Неадекватный Адекватный
Систолическая
дисфункция ЛЖ
Диастолическая
дисфункция ЛЖ
ЛЖ недостаточность
Рис. 36 .1 Предположительный патофизиологический путь развития кардиомиопатии при ожирении. Центральные гемодинамические изменения,
возникающие в результате чрезмерного накопления жировой ткани у пациентов с тяжелой степенью ожирения и последующее влияние на морфологию сердца и
функцию желудочков. Гипертрофия левого желудочка (ЛЖ) при тяжелой форме ожирения может быть как эксцентрической, так и концентрической. К факторам,
влияющим на ремоделирование и изменение геометрии ЛЖ, относят тяжесть и продолжительность ожирения, продолжительность и степень выраженности на-
грузки на ЛЖ (гипертония), нейрогуморальные и метаболические нарушения (усиление тонуса симпатической нервной системы, активация ренин-ангиотензин-аль-
достероновой системы, резистентность к инсулину с гиперинсулинемией, резистентность к лептину с гиперлептинемией, дефицит адипонектина, липотоксичность
и липоапоптоз). ПЖ
—
правый желудочек [Alpert MA, Omran J, Mehra A, Ardhanari S. Impact of obesity and weight loss on cardiac performance and morphology in
adults. Prog Cardiovasc Dis 56:391–400, 2014].
In-36_для нас.indd 931
03.04.2019 12:12:22
932
ЧАСТЬ VII Сосудистые и системные заболевания
акции в организме из-за гипертрофированных ади-
поцитов. Увеличение размера центральных висце-
ральных и эпикардиальных жировых отложений
вызывает локальную гипоксию, которая приводит
к нарушению регулирования адипоцитарной сек-
реции провоспалительных цитокинов, например,
факторы некроза опухоли-альфа, интерлейкин-6, а
также сосудосуживающих и фиброзных медиато-
ров, таких как ангиотензин II [6]. Повышенное со-
держание триглицеридов и жирных кислот в карди-
омиоцитах может привести к дисфункции миокарда
[7]. Все эти механизмы, вероятно, ответственны за
развитие кардиомиопатии при ожирении и увели-
чении частоты возникновения клинически значи-
мой сердечной недостаточности [8].
ЭХОКАРДИОГРАФИЧЕСКИЕ ДАННЫЕ
ТЕХНИЧЕСКИЕ ОСОБЕННОСТИ
Ожирение негативно влияет на качество изображе-
ний, ухудшая их. Ультразвуковая волна ослабевает,
проходя через чрезмерный слой жировой ткани
грудной клетки. Во многих эпидемиологических ис-
следованиях увеличение ИМТ связывают с невоз-
можностью проведения эхокардиографических из-
мерений [9]. Для улучшения качества изображения
можно использовать более низкие частоты датчика,
нестандартные виды визуализации, особое позицио-
нирование пациента и применение эхокардиографи-
ческого контрастного средства. Качество эхокардио-
графических изображений ухудшается в большей
степени, чем при компьютерной или магнитно-резо-
нансной томографии, однако последние исследова-
ния могут быть технически невыполнимы при тяже-
лом ожирении из-за превышения пределов веса и
размеров существующих таблиц визуализации. У
пациентов после бариатрических операций возника-
ют сложности в проведении стресс-ЭхоКГ, однако в
большинстве опытных центров возможно проведе-
ние исследований при использовании контрастных
средств [10].
Другими важными техническими особенностями
является масштабирование размеров структур сердца
в отношении тела с ожирением. В настоящее время
Американское сообщество эхокардиографии реко-
мендует использовать относительную метрическую
(линейную) индексацию размеров и массы ЛЖ с пло-
щадью поверхности тела (ППТ) при количественной
оценке [11]. Индексирующие измерения позволяют
нормализовать параметры для оценки патологиче-
ских и физиологических изменений, однако при
сильном ожирении ППТ не позволяет адекватно нор-
мализовать получаемые данные. Альтернативное
индексирование массы ЛЖ на рост показывает более
качественное предсказание развития неблагоприят-
ных осложнений у людей с ожирением. Кроме этого,
аллометрическое (экспоненциальное) масштабиро-
вание измерений ЛЖ дает более точную корректи-
ровку при ожирении [12]. Аналогичным образом,
индексация области аортального клапана на ППТ при
ожирении увеличивает несоответствие между крите-
риями оценки индексированных и неиндексирован-
ных областей клапана при тяжелом стенозе аорты.
Данное несоответствие приводит к возрастанию ко-
личества операций на клапане, не предсказывая риск
возникновения клинически важных осложнений, и,
таким образом, может привести к возникновению
ложных показаний к замене клапана [13].
СТРУКТУРНЫЕ ИЗМЕНЕНИЯ
В течении последних 30 лет сообщается об измене-
нии размеров и геометрии камер сердца при ожире-
нии. Отмечается значительная связь между ожире-
нием и гипертрофией ЛЖ. Распространенность
гипертрофии ЛЖ варьируется от 13 до 75% в зави-
симости от демографических характеристик участ-
ников исследования и наличия общих сопутствую-
щих заболеваний, связанных с ожирением, напри-
мер, гипертония либо апноэ во сне (рис. 36.2). Как
концентрическая, так и эксцентрическая гипертро-
фия ЛЖ может присутствовать при ожирении. Бы-
ло выявлено, что эксцентрическая гипертрофия
развивается при ожирении из-за увеличения сер-
дечного выброса и венозного возврата [14]. Однако
увеличение толщины стенки с концентрическим
ремоделированием и гипертрофией является более
распространенным явлением и чаще встречается у
пожилых пациентов с гипертонией. На тип ремоде-
лирования сердца влияет непосредственно ожире-
ние, его продолжительность и возраст его возник-
новения [15]. Тучные подростки без сопутствующих
заболеваний и при значительной продолжительно-
сти ожирения имеют более толстые стенки и массу
ЛЖ по сравнению со сверстниками с нормальным
весом, тем самым подтверждая прямую связь ожи-
рения с ремоделированием ЛЖ [16].
Расширение ЛП, нормализованное с размером
тела очень часто встречается при ожирении и по-
добно гипертрофии ЛЖ, синергична гипертонии
[17]. Изменение размеров ПЖ и толщины его стен-
ки оценить более сложно с помощью ЭхоКГ из-за
снижения качества изображений и отсутствия стан-
дартизации данные. Wong и соавт. [18] выявили
ассоциацию ожирения с толщиной и объемом стен-
ки ПЖ, однако общая картина этих изменений
крайне мала, а также неизвестен эффект от влияния
сопутствующих заболеваний.
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ
Обычно диастолическая функция нарушается у па-
циентов с ожирением, а наряду с декомпенсацией
приводит к симптомам одышки. Диастолическое
нарушение было достоверно выявлено для ЛЖ как
при релаксации, так и напряжении, однако наибо-
лее распространена картина I класса (расслабление
In-36_для нас.indd 932
03.04.2019 12:12:22
933
36 Эхокардиография при метаболических и пищевых нарушениях
ослаблено) из-за нарушения наполнения через ми-
тральный клапан. Псевдонормальные и ограничен-
ные формы наполнения у людей с ожирением
встречаются редко. Тканевая допплерография на
митральном клапане (e’) уменьшается при ожире-
нии и выступает независимым показателем релак-
сации от нагрузки [19]. Инвазивные исследования
гемодинамически показали более высокое давление
наполнения ЛЖ при выраженном ожирении. Эхо-
кардиографический показатель (Е/е’) также связы-
вают с более высоким ИМТ, независимо от массы
ЛЖ и сопутствующих заболеваний. Известно, что
диастолические нарушения обычно связаны со
структурными изменениями ЛЖ при ожирении,
тем не менее некоторые исследования показали из-
менение диастолических параметров с увеличением
ИМТ независимо от массы ЛЖ и сопутствующих
заболеваний [20]. Прогрессирование ожирения и
его влияние на энергетический метаболизм миокар-
да может объяснить диастолические функциональ-
ные изменения. Изменение диастолы отмечают во
всех возрастных группах, страдающих ожирением,
как детей, так и лиц пожилого возраста по сравне-
нию с контрольными возрастными группами. Сте-
пень тяжести нарушений не зависит от продолжи-
тельности течения ожирения.
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ
Систолическую функцию оценивают путем измере-
ния фракции выброса ЛЖ с помощью ЭхоКГ. Не-
смотря на связанные с ожирением структурные и
гемодинамические изменения, нет убедительных
доказательств того, что тяжелая степень ожирения
само по себе приводит к клинически значимому
снижению фракции выброса. Таким образом, у па-
циентов с ожирением и расширенной кардиомио-
патией следует искать сопутствующие заболевания
[21]. Известно, что фракция выброса сохраняется у
пациентов при концентрическом ремоделировании
и гипертрофии (см. главу 7). Поэтому используют-
ся альтернативные методы для оценки систоличе-
ской функции, такие, как фракция укорочения
средней стенки миокарда и эндокарда (ФУСМ).
Подобно гипертрофии, которая связана с гипертен-
зией, ожирение приводит к возрастанию сокраще-
ния эндокарда, сохраняя фракцию выброса, однако
ФУСМ планомерно уменьшается с увеличением
жира в организме [22]. Ограничением параметров
ФУСМ и фракции выброса является зависимость от
нагрузки, которая меняется при ожирении. Ткане-
вая допплерография обеспечивает независимую
оценку от нагрузки глобальной и регионарной со-
кратимости. Снижение систолического напряжения
обнаружено при увеличении ИМТ (рис. 36 .3) [23].
Однако измерение ФУМС занимает много времени,
поэтому клиническое значение данного показателя
остается неизвестным. Измерение деформации сте-
нок является перспективным методом, однако тре-
бует наличия высококачественных 2D-изображе-
ний, которые бывает трубно получить у пациентов
с ожирением, что требует дальнейшей стандартиза-
ции данного показателя, прежде чем начнется его
использование в обычной клинической практике.
ЭПИКАРДИАЛЬНЫЙ ЖИР
У пациентов с возрастанием массы внутрибрюшно-
го жира отмечается увеличение эпикардиального
жирового слоя [24]. Крайне важно дифференциро-
вать эпикардиальный жир от перикардиальной
жидкости на ЭхоКГ для исключения вероятности
выставления неправильного диагноза. Жир обычно
более эхогенный и яркий, чем миокард, движется во
время сердечного цикла в отличие от перикардиаль-
48
35–42
42–48
>48
52
56
60
64
48
ГТ+
ГТ+
ГТ–
ГТ–
ГТ–
ГТ–
ГТ+
ГТ+
ГТ+
ГТ–
52
56
60
64
М
а
с
с
а
Л
Ж
(
г
/
м
2
,
7
)
ИМТ (кг/м2)
М
а
с
с
а
Л
Ж
(
г
/
м
2
,
7
)
SO2>85
SO2<85
Рис. 36.2 Взаимосвязь гипертензии с ожирением и ночной гипоксией
с индексом массы левого желудочка. (A) Индекс массы левого желудоч-
ка (ЛЖ) постоянно увеличивается по мере увеличения индекса массы тела
(ИМТ). Однако увеличение индекса массы ЛЖ более выражено у пациентов с
гипертензией (ГТ), чем у пациентов без нее. Тестирование выявило синергиче-
скую взаимосвязь ИМТ и систолического артериального давления на индекс
массы ЛЖ. (Б) Связь между выраженностью ночной гипоксемии и индексом
массы ЛЖ у пациентов с и без ГТ. Эффект влияния ночной гипоксемии на
индекс массы ЛЖ более выражен у пациентов с ГТ [Avelar E, Cloward TV, Walker
JM, et al. Left ventricular hypertrophy in severe obesity: interactions among blood
pressure, nocturnal hypoxemia, and body mass. Hypertension 49:34–39 , 2007].
А
Б
In-36_для нас.indd 933
03.04.2019 12:12:22
934
ЧАСТЬ VII Сосудистые и системные заболевания
15
08
10
12
14
16
18
20
202530354045
15
08
10
12
14
16
18
20
202530354045
ИМТ (кг/м2)
ИМТ (кг/м2)
Д
е
ф
о
р
м
а
ц
и
я
(
%
)
Д
е
ф
о
р
м
а
ц
и
я
(
%
)
ной жидкости. Толщину эпикардиального жира
можно измерить с помощью ЭхоКГ (рис. 36 .4). Раз-
мер прослойки служит маркером прогрессирования
как кардиометаболических факторов риска, так и
заболеваний коронарных артерий, которые могут
возникнуть из-за паракринного воздействия адпио-
цитов на сосудистую систему [25]. Однако метод
эхокардиографического измерения имеет ограниче-
ния из-за линейных измерений в одном месте, в то
время как толщина жира умеренно коррелирует с
другими методами визуализации, например, КТ
или МРТ. Потенциальное преимущество не инва-
зивного измерения висцерального и эпикардиаль-
ного жира заключается в том, что возможно выя-
вить нарушения при типе ожирения с нормальным
весом, когда регистрируется повышенное содержа-
ние жировой ткани в организме, но при нормаль-
ном ИМТ.
КЛИНИЧЕСКОЕ ВЕДЕНИЕ ПАЦИЕНТОВ
В подавляющем большинстве случаев причиной
ожирения выступает избыточное поступление ка-
лорий на фоне ограниченной физической активно-
сти. Первое, что необходимо сделать, это изменить
образ жизни с соблюдением низкокалорийной дие-
ты и увеличением активности. Потеря лишнего ве-
са, независимо от способа, приводит к благоприят-
ным изменениям структуры сердца и его функции.
Влияние снижения веса из-за соблюдения диеты в
течении двух лет на функцию и структуру сердца
Рис. 36 .3 Ассоциация индекса массы тела с продольным конечно-систолическим напряжением левого желудочка. График регрессии глобального
продольного конечно-систолического напряжения ЛЖ от индекса массы тела (ИМТ) с корректировкой на возраст. Видна средняя (линия) и 95% доверительный
интервал (тень). Синие линии отображают мужчин, красные линии — женщин [Dalen H, Thorstensen A, Romundstad PR, et al. Cardiovascular risk factors and systolic
and diastolic cardiac function: a tissue Doppler and speckle tracking echocardiographic study. J Am Soc Echocardiogr 24:322–332.e326, 2011].
ЛП
ЛЖ
ПЖ
Ао
Рис. 36 .4 Измерение толщины эпикардиального жира с помощью эхокардиографии. Максимальная толщина эпикардиального жира (красная линия)
видна по длинной оси с парастернальной позиции в конце систолы, как рекомендовано Iacobellis. (А) Толщина эпикардиального жира (граница желтой линии)
измеряется вдоль свободной стенки правого желудочка (ПЖ) перпендикулярно ультразвуковому лучу и кольцу аорты (Ао). (Б) A При резком увеличении толщи-
ны эпикардиального жира вдоль острого края ПЖ у 70-летнего тучного мужчины наибольшую толщину жировой прослойки следует оценивать слева от аорталь-
ного кольца. У данного пациента толщина равна 9 мм, что выше нормы (< 7 мм), и ассоциируется с высоким риском заболеваний коронарных артерий. ЛЖ
—
левый желудочек; ЛП — левое предсердие [Iacobellis G. Local and systemic effects of the multifaceted epicardial adipose tissue depot. Nat Rev Endocrinol 11:363–371,
2015].
А
Б
In-36_для нас.indd 934
03.04.2019 12:12:22
935
36 Эхокардиография при метаболических и пищевых нарушениях
было изучено на 47 пациентов с ожирением без со-
путствующих заболеваний [26]. Небольшая потеря
веса в 10 кг связана с уменьшением индекса массы
ЛЖ, улучшением диастолической релаксации (e’), а
также увеличением сократимости миокарда.
Пациенты, которые продолжительное время
страдают от ожирения либо относятся ко II типу
ожирения с наличием сопутствующих заболева-
ний и которые пытались изменить свой образ жиз-
ни, могут стать потенциальными кандидатами
на бариатрическое хирургическое вмешательство.
Доказано, что бариатрическая хирургия приводит
к значительной потере веса и снижению многих
факторов риска со стороны сердечно-сосудистой
системы по сравнению с консервативными метода-
ми в виде изменения образа жизни [27]. Специали-
сты продемонстрировали регрессию массы ЛЖ,
улучшение диастолических показателей и умень-
шение объемов ЛП после бариатрических вмеша-
тельств [28]. Крупнейшее исследование включало
в себя 423 пациента с ожирением с периодом на-
блюдения 2 г. после бариатрической хирургии,
которые в среднем похудели на 44 кг. Данную
группу сравнили с 733 не хирургическими пациен-
тами, у которых зарегистрирована незначительная
потеря массы тела [29]. После бариатрической хи-
рургии уменьшается масса ЛЖ и толщина его сте-
нок, увеличивается фракция ПЖ. В одном из ис-
следований использовали трехмерную ЭхоКГ в
качестве оценки изменений после бариатрических
операций. Kaier и соавт. [30] обследовании паци-
ентов с тяжелой степенью ожирения без сопутству-
ющих заболеваний и установили, что потеря веса
ввиду проведенной операции приводила к умень-
шению объема и массы ЛЖ и ПЖ. Также наблю-
далось увеличение систолической функции ЛЖ и
ПЖ в виде фракции выброса, а также в общих
измерениях ЭхоКГ, однако стоит отметить, что
показатели находились в нормальном диапазоне
как до, так и после операции. В целом отмечается,
что регрессия массы ЛЖ с нормализацией его ди-
астолического наполнения наблюдается после ба-
риатрических операций, однако значительное вос-
становление систолической функций описано
редко.
Фармакотерапия является менее успешным спо-
собом борьбы с ожирением и связанных с ним ос-
ложнений. Анорексигенные препараты, например,
фенфлурамин и дексфенфлурамин, были запреще-
ны в 1997 г. из-за появившихся сообщениях о уве-
личении митральной и аортальной регургитации у
пациентов, принимавших данные средства. Было
показано, что новый ингибитор аппетита, лорказе-
рин, обладает умеренным эффектом в потере веса
(примерно 4–6 кг) без какого-либо повышенного
риска развития вальвулопатий [31]. Наконец, анта-
гонисты минералокортикоидных рецепторов в со-
четании со спиронолактоном уменьшает развитие
сердечного фиброза и воспаления на моделях крыс
с ожирением. В одном рандомизированном иссле-
довании пациентов с ожирением без сопутствую-
щих заболеваний, прием спиронолактона увеличи-
вал систолическое напряжение, что было связано с
уменьшением биомаркеров фиброза в независимо-
сти от снижения артериального давления [32]. Од-
нако спиронолактон не улучшает диастолические
показатели, а рандомизированные клинические ис-
пытания у пациентов с сердечной недостаточностью
с сохранной фракцией выброса не показали ника-
кой клинической пользы.
СИНДРОМ ОБСТРУКТИВНОГО АПНОЭ ВО СНЕ
ОБЩИЕ ДАННЫЕ
Синдром обструктивного апноэ во сне (СОАС) яв-
ляется наиболее распространенным расстройством
дыхания во сне, причем отмечается все большее
распространенность заболевание с корреляцией с
растущим уровнем ожирения, которое является од-
ним из самых важных факторов риска для развития
СОАС [33]. Заболевание диагностируется с исполь-
зованием полисомнографии с определением как
минимум пяти эпизодов обструкции за час, более
известный, как индекс апноэ-гипопноэ с дневными
симптомами. Индекс апноэ-гипопноэ с 15 или бо-
лее эпизодами считается диагностическим даже без
сопутствующей симптоматики, а большинство
специалистов считает, что данный индекс с показа-
телем > 30 является крайне серьезным признаком.
Тяжелое течение СОАС связывают с увеличением
осложнений со стороны сердечно-сосудистой систе-
мы. Возможные механизмы воздействия СОАС на
сердце включает в себя повышение постнагрузки на
ЛЖ на фоне высокого отрицательного внутригруд-
ного давления, вегетативную дисрегуляцию с повы-
шенным симпатическим тонусом, апноэ-зависимая
гипоксия провоцирует выработку воспалительных
медиаторов, возрастание тромбоэмболической ак-
тивности из-за гиперкоагуляции [34]. У пациентов
с СОАС отмечается чаще артериальная гипертен-
зия, ишемическая болезнь сердца, сердечная недо-
статочность и фибрилляция предсердий по сравне-
нию с людьми без нарушений сна. Симптомы СОАС
зачастую неспецифичны (усталость и дневная сон-
ливость) и обнаруживаются при эхокардиографи-
ческом обследовании, учитывая высокий уровень
связанных с заболеванием сердечно-сосудистых
ССЗ факторов риска.
ЭХОКАРДИОГРАФИЧЕСКИЕ ДАННЫЕ
При тяжелом течении СОАС распространена гипер-
трофия ЛЖ и обнаруживается примерно у 40%
участников исследований [35]. Подобно ожирению,
при СОАС встречается как концентрическая, так и
эксцентрическая форма гипертрофии ЛЖ. Тем не
менее наибольшее количество исследований пока-
In-36_для нас.indd 935
03.04.2019 12:12:23
936 ЧАСТЬ VII Сосудистые и системные заболевания
зало, что эксцентрическая гипертрофия связана с
более серьезной степенью СОАС (рис. 36 .5). Систо-
лические и диастолические изменения ЛЖ также
присутствуют при данном синдроме. Существует
слабая обратная корреляция между степенью тяже-
сти СОАС и фракцией выброса у пациентов без
сопутствующих сердечно-сосудистых заболеваний.
Диастолические показатели у пациентов с СОАС
схожи с цифрами у пациентов с гипертонией и ожи-
рением по сравнению с контрольной группой. Син-
дром ассоциируется со снижением скорости прито-
ка через митральный клапан (Е), более высоким Е/е’
и более низким соотношением Е/А [36]. Также
присутствует увеличение ЛП и снижение функции,
что может встретиться независимо от диастоличе-
ских изменений ЛЖ [37]. В качестве возможного
механизма снижения функции ЛП было выдвинуто
предположение о влиянии фиброза стенки предсер-
дий, что выявлено на магнитно-резонансной томо-
графии. Деформацию ЛП при СОАС легко оценить,
измерив скорость деформации с отслеживанием
спекл-трекинга (рис. 36 .6). Снижение максималь-
ной продольной деформации предсердия связыва-
ют с тяжелой степенью СОАС и повышенным ри-
ском возникновения нарушений со стороны сердеч-
но-сосудистой системы [38, 39].
Зачастую отмечаются изменения легочного дав-
ления, размера и функции ПЖ у пациентов с СОАС.
Легочная гипертензия наблюдается у 20% пациен-
тов. Периодическая гипоксия во время сна резко
меняет гемодинамику в легких через вазоактивные
медиаторы, но большинство пациентов с СОАС не
имеют нарушений со стороны легких и синдрома
гиповентиляции. Связанная с СОАС гипоксия в со-
четании с легочной венозной гипертензией вызыва-
ют дисфункцию ЛЖ, приводя к синергическому
воздействию факторов с повышением артериально-
го давления в легочной артерии. Однако легочная
гипертензия отмечается лишь легкой степени у па-
циентов с данным синдромом. Систолическая функ-
ция ПЖ снижается пропорционально легочной
гипертензии у пациентов с тяжелой формой СОАС
[40].
КЛИНИЧЕСКОЕ ВЕДЕНИЕ ПАЦИЕНТОВ
Потеря лишнего веса в результате изменения обра-
за жизни либо после бариатрической операции
может улучшить течение СОАС в виде изменения
индекса апноэ-гипопноэ. Уменьшение степени
ожирения приводит к улучшению сердечной функ-
ции. Основным методом лечения СОАС является
поддержание положительного давления в дыхатель-
ных путях (ПДДП). ПДДП снижает индекс апно-
э-гипопноэ и уменьшает симптомы дневной сонли-
вости и улучшает качество жизни. Исследования
показали, что у пациентов с терапией ПДДП и СО-
АС снижается смертность в сравнении с контроль-
ной группой, однако рандомизированных исследо-
ваний по данной тематике еще не проводилось. У
пациентов отмечается низкая приверженность к
терапии ПДДП, со средним сроком 4 час за ночь, что
является около 40% от рекомендуемой терапии.
Факторы риска со стороны сердечно-сосудистой
системы уменьшаются при использовании ПДДП
терапии при СОАС. ПДДП улучшает систолическое
артериальное давление у пациентов с гипертонией,
однако изменения обычно незначительны и состав-
ляют в среднем от 2 до 3 мм рт. ст. [41]. В противо-
положность, рандомизированное исследование по
оценке терапии ПДДП у 725 пациентов с СОАС без
сопутствующих заболеваний не позволило снизить
риск возникновения инфаркта либо других ослож-
нений в течении четырехлетнего наблюдения [42].
У пациентов с систолической сердечной недоста-
точностью фракция выброса увеличивалась на 5%
при использовании терапии ПДДП [43]. Улучшение
0
от5до15
от5до15
от15до30
от15до30
>30
>30
<5
<5
5
10
15
20
25
30
35
0
4
8
12
16
20
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
г
и
п
е
р
т
р
о
ф
и
и
(
%
)
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
н
и
з
к
о
й
Ф
В
(
%
)
КГЛЖ
ЭГЛЖ
Индекс апноэ-гипопноэ
Индекс апноэ-гипопноэ
Рис. 36 .5 Ассоциация синдрома обструктивного апноэ во сне с ремоделированием левого желудочка и систолической функций при исследо-
вании состояния сердца во сне. (A) Более высокий индекс апноэ-гипопноэ связывают с большей распространенностью эксцентрической гипертрофии левого
желудочка (ЭГЛЖ). (Б) Степень тяжести синдрома обструктивного апноэ во сне коррелирует с нарушением фракции выброса (ФВ) < 55%. КГЛЖ — концентри-
ческая гипертрофия ЛЖ [Chami HA, Devereux RB, Gottdiener JS, et al. Left ventricular morphology and systolic function in sleep-disordered breathing: the sleep heart
health study. Circulation 117:2599–2607, 2008].
А
Б
In-36_для нас.indd 936
03.04.2019 12:12:23
937
36 Эхокардиография при метаболических и пищевых нарушениях
диастолических параметров ЛЖ и объема ЛП отме-
чается после 6 мес лечения [36]. Кроме этого, может
улучшиться легочное давление и функция ПЖ при
проведении терапии в ночное время [44].
Улучшение функции сердца при терапии ПДДП
может уменьшить процент осложнений со стороны
сердечно-сосудистой системы. В исследовании, в
которое входило 88 пациентов с сердечной недоста-
точностью и СОАС было выявлено, что терапия
ПДДП связано с сокращением смертности и коли-
чеством госпитализаций [45]. Важным значением
при уменьшении степени СОАС является поддер-
жание нормоволемии при сердечной недостаточно-
сти. Задержка жидкости в организме может усугу-
бить течение СОАС, увеличивая окружность шеи со
сдвигом жидкости в окологлоточных мягких тканях,
увеличивая компрессию дыхательных путей. У па-
циентов с сердечной недостаточностью также часто
встречается апноэ центрального генеза. Важно
определить причину расстройства дыхания во сне
чтобы определить последующую терапию. В одном
из рандомизированных исследований (SERVE-HF)
сделали вывод, что применение положительного
давления в дыхательных путях, адаптивная сер-
во-вентиляция, увеличивают смертность у пациен-
тов с сердечной недостаточностью и апноэ во сне
центрального генеза с фракцией выброса 45 и менее
[45a]. Таким образом, серво-вентиляция не должна
применятся у данной группы пациентов.
САХАРНЫЙ ДИАБЕТ ВТОРОГО ТИПА
И МЕТАБОЛИЧЕСКИЙ СИНДРОМ
ОБЩИЕ ДАННЫЕ
Связанная с ожирением резистентность к инсулину
является основным механизмом, который провоци-
рует развитию сахарного диабета (СД) второго типа.
В результате гиперинсулинемии и гипергликемии
развивается дисфункция сосудов, поднятие давле-
ния, дисрегуляция липидов и общее системное вос-
паление. Диабет и факторы риска со стороны сер-
дечно-сосудистой системы в общем называется
Рис. 36.6 Деформация левого предсердия у пациентов с синдромом обструктивного апноэ во сне по сравнению с контрольной группой. Четы-
рехкамерный вид ЛП, с помощью спекл-трекинга оценивается усредненная продольная деформация у здорового человека (А) и у пациента с тяжелой формой
синдрома обструктивного апноэ во сне (Б). Снижение максимальной скорости напряжения ЛП и более низкая систолическая скорость напряжения коррелирует
со сниженной функцией ЛП у пациентов с тяжелой формой синдрома обструктивного апноэ во сне [Altekin RE, Yanikoglu A, Karakas MS, et al. Assessment of left
atrial dysfunction in obstructive sleep apnea patients with the two dimensional speckle-tracking echocardiography. Clin Res Cardiol 101:403–413, 2012].
А
Б
In-36_для нас.indd 937
03.04.2019 12:12:23
938 ЧАСТЬ VII Сосудистые и системные заболевания
«метаболическим синдромом». Наиболее емкое
определение метаболического синдрома (МС) опи-
сывается в III рекомендациях Национальной про-
граммы лечения холестерина у взрослых (табл. 36 .3).
Остается спорным вопрос, является ли МС от-
дельной нозологической единицей либо просто
суммирует сосуществующие факторы риска для
развития СД и сердечно-сосудистых заболеваний.
СД и МС имеют общий спектр патофизиологиче-
ских механизмов, которые связаны с увеличением
вдвое риска возникновения сердечно-сосудистых
осложнений и смертности [46]. Подавляющее боль-
шинство факторов связывают с заболеваниями ко-
ронарных и церебральных артерий, что может при-
водить к инфаркту миокарда [47]. Однако измене-
ния структуры и функции сердца обнаружены
независимо от болезни коронарных артерий и ИМТ
при инсулин-резистентном сахарном диабете. Ги-
пергликемия, липотоксичность, гиперинсулинемия
воздействуют на кардиомиоциты с развитием их
гипертрофии, жесткости, гипоксии и отмирания.
Из-за этого развивается реактивный интерстици-
альный и замещающий фиброз, приводя в итоге
диабетическую кардиомиопатию с диастолической,
и, реже, систолической дисфункцией [48]. Данные
механизмы объясняют плохой клинический исход у
пациентов с сердечной недостаточностью при диа-
бете. При анализе историй болезни 7599 пациентов
с симптоматической сердечной недостаточностью
при СД отмечено, что у данной группы имеется
более высокий коэффициент риска госпитализации
и смертности по поводу нарушений со стороны
сердечно-сосудистой системы как при нормальной,
так и при сниженной фракции выброса с отноше-
нием рисков 2,0 (95% ДИ 1,7–2,4) и 1,6 (95% ДИ от
1,1 до 1,4) соответственно [49].
ЭХОКАРДИОГРАФИЧЕСКИЕ ДАННЫЕ
Подобно ожирению, пациенты с СД имеют гипер-
трофию ЛЖ, которая встречается как в эксцентри-
ческой форме с кардиомиопатией, так и концентри-
ческом виде с сохранением нормальной фракции
выброса. Хотя сопутствующие заболевания при СД
и МС могут влиять на структуру и функцию сердца,
в основном следует обращать внимание на основ-
ные факторы риска. В большом исследовании 4419
пациентов без сердечно-сосудистых заболеваний,
СД независимо ассоциируется со значительно более
высокой индексированной массой ЛЭ и толщины
стенки, хоть среднее увеличение массы составляет
всего около 3 г [50]. Аналогичным образом, более
высокий индекс массы ЛЖ отмечается у пациентов
с метаболическим синдромом по сравнению с груп-
пой лиц без данного заболевания (46,3 ± 11 г/м2,7
против 34,9 ± 6,7 г/м2,7) [51]. Большинство исследо-
ваний ограничено поперечным статистическим
анализом, однако в исследовании MONICA / KORA
диабетики без инфаркта миокарда через 10 лет име-
ли увеличенную массу ЛЖ с эксцентрическим ре-
моделированием с увеличением размера полости
ЛЖ на 7% [52].
СД и МС связывают с изменениями диастоличе-
ских показаний, обнаруженных на обычной ЭхоКГ
и тканевой допплерографии. СД ассоциируется с
более низкими цифрами соотношения Е/А и умень-
шенной скоростью сокращения базальной перего-
родки [53]. Данные показатели диастолы коррели-
руют с тяжестью резистентности к инсулину [54].
Связь диастолической дисфункции с фиброзом из-
учали с помощью ЭхоКГ при учете корреляции со-
держания коллагена миокарда. Kosmala и соавт. [55]
выявили, что пациенты с метаболическим синдро-
мом имеют более низкую скорость диастолы, кото-
рая коррелирует с более высоким уровнем фиброз-
ных биомаркеров в сыворотке крови при интегри-
рованном обратном уровне фиброза миокарда.
Аналогичным образом была снижена систолическая
функция с сохранением фракции выброса, которая
оценивалась по показателю продольной деформа-
ции. Диабетические изменения функции сердца
служат маркерами риска ремоделирования миокар-
да с течением времени, однако достоверно их про-
гностические возможности не установлены [56].
КЛИНИЧЕСКОЕ ВЕДЕНИЕ ПАЦИЕНТОВ
Лечение МС и СД включает в себя изменение обра-
за жизни, а также фармакотерапию. В частности,
терапия СД направлена на снижение гиперглике-
мии, которая измеряется уровнем гликированного
гемоглобина (А1с). Известно, что уровень гликемии
связан с развитием микро и макрососудистых ос-
ложнений наряду с возникновением симптоматиче-
ской сердечной недостаточности. Уровень А1с кор-
релирует с изменениями в структуре сердца, а также
с диастолической и систолической функцией на
ЭхоКГ (рис. 36 .7). Необходимо стремиться к целе-
вому снижению А1с ниже 7%. Тем не менее у пожи-
Увеличенная
окружность талии†
≥ 40 дюймов (102 см) (мужчины)
≥ 35 дюймов (88 см) (женщины)
Повышенные
триглицериды
≥ 150 мг/дл (1,7 ммоль/л) или
Терапия триглицеридами
Снижение
липопротеинов
высокой плотности
< 40 мг/дл (1,03 ммоль/л) (мужчины)
< 50 мг/дл (1,3 ммоль/л) (женщины)
Повышение
давления
≥ 130 мм рт. ст. систола или
≥ 85 мм рт. ст. диастола
Повышенный
уровень глюкозы
натощак
≥ 100 мг/дл или
медикаментозная терапия
повышенного уровня глюкозы
*
Требуется не менее трех из пяти пунктов.
† Меньшая окружность талии применима для азиатской популя-
ции (≥ 90 см для мужчин, ≥ 80 см для женщин).
ТАБЛИЦА 36.3 Метаболический синдром*
In-36_для нас.indd 938
03.04.2019 12:12:24
939
36 Эхокардиография при метаболических и пищевых нарушениях
4,5
5,5
6,5
7,5
8,5
HbA1C (%)
11
12
13
14
140
150
160
4,5
5,5
6,5
7,5
8,5
HbA1C (%)
4,5
5,5
6,5
7,5
8,5
HbA1C (%)
-19
-18
-17
.51
.52
.53
.54
.55
4,5
HbA1C (%)
5,5
6,5
7,5
8,5
М
а
с
с
а
Л
Ж
(
г
)
П
р
о
д
о
л
ь
н
о
е
д
е
ф
о
р
м
а
ц
и
я
(
%
)
Е
/
e
′
п
е
р
е
г
о
р
о
д
к
и
Ф
И
П
П
Ж
(
%
)
лых людей и длительно болеющих СД пациентов с
высоким риском развития сердечно-сосудистых
заболеваний, интенсивная терапия, направленная
на снижение уровня А1с до нормального уровня,
увеличивает смертность, что было выявлено в ис-
следовании ACCORD [57]. Более высокий уровень
смертности может быть вызвана побочными эф-
фектами от препаратов, например гипогликемией,
поэтому необходимо внимательно относиться к
данной группе пациентов при снижении уровня
А1с менее чем на 8%.
Различные методы лечения могут вызвать незна-
чительное улучшение функции сердца при диабе-
тической кардиомиопатии, однако интенсивный
контроль уровня глюкозы не снижает сердечную
недостаточность и смертности. Диета и физические
упражнения непосредственно снижают содержание
липидов в миокарде и оказывают благоприятное
воздействие на функцию сердца в эксперименталь-
ных моделях. Однако изменение образа не приводит
к значительному улучшению. Клиническое испыта-
ние по изучению влияния физической нагрузки у
пациентов с диабетом, продолжающееся в течении
3 лет показало, что диастолическая дисфункция
ухудшается в течении данного периода [58]. Теку-
щие рекомендации советуют иметь 150 мин умерен-
ной физической активности в неделю, что позволя-
ет улучшить гликемический контроль и снизить
риск сосудистых осложнений [59].
Помимо снижения уровня глюкозы в крови, из-
учалось воздействие специфических препаратов СД
на функцию сердца. Они не показали клинической
пользы при диабетической кардиомиопатии и сер-
дечной недостаточности. Более того, пероральные
препараты приводили к ухудшению клинического
течения сердечной недостаточности. Тиазолидине-
Рис. 36 .7 Связь между гликированным гемоглобином и массой левого желудочка, систолической и диастолической функцией левого желудоч-
ка и систолической функцией правого желудочка. Связь между гликированным гемоглобином (HbA1c) и эхокардиографическими параметрами структуры
и функции сердца отражена в виде графиков. Модели сформированы с поправкой на возраст, пол, расу, площадь поверхности тела, индекс массы тела, систо-
лическое давление, частоту сердечных сокращений, гипертензию, курение в анамнезе и хроническое заболевание почек. Центральная линия отражает собой
усредненные значения, а верхние и нижние линии — 95% доверительные интервалы. ЛЖ — левый желудочек; ПЖ — правый желудочек; ФИП — фракционное
изменение площади [Skali H, Shah A, Gupta DK, et al. Cardiac structure and function across the glycemic spectrum in elderly men and women free of prevalent heart
disease: the atherosclerosis risk in the community study. Circ Heart Fail 8:448–454 , 2015].
In-36_для нас.indd 939
03.04.2019 12:12:24
940
ЧАСТЬ VII Сосудистые и системные заболевания
дион пиоглитазона и росиглитазон могут незначи-
тельно улучшать диастолические параметры, одна-
ко приводят к задержке жидкости и увеличивают
риск развития сердечной недостаточности [60].
Применение ситаглиптина (ингибитор дипепти-
дилпептидазы-4) связывают с увеличением риска
госпитализации при сердечной недостаточности
[61]. Данные препараты следует назначать с осто-
рожностью пациентам с прогрессирующими забо-
леваниями.
ЭНДОКРИНОПАТИИ
Эндокринопатии приводят к гормональному дисба-
лансу из-за нарушения регуляции метаболизма ка-
кой-либо железы. Неспособность обеспечивать ме-
таболический гомеостаз приводит к развитию си-
стемных изменений согласно тому, какой гормон
вовлечен в процесс. Заболевания сердца редко
представлены в изолированном виде, чаще всего
возникают различные симптомы из-за поражения
сразу нескольких органов. Изменения со стороны
сердечно-сосудистой системы обычно возникают
из-за нарушений системной гемодинамики и пря-
мого воздействия гормонов на ткань миокарда.
Крайне важно распознать эндокринные нарушения
как потенциальную причину болезней сердца, т.к.
лечение основного заболевания может восстано-
вить сердечную функцию. Полный обзор всех эн-
докринопатий выходит за рамки данного пособия,
но далее отражены наиболее важные заболевания,
ассоциированные с нарушениями со стороны сер-
дечно-сосудистой системы (табл. 36 .4).
ГИПЕРТИРЕОЗ
Увеличение синтеза гормонов щитовидной железы,
тироксина (Т4) и трийодтиронина (Т3) приводит к
резкому метаболическому воздействию практиче-
ски на каждую систему органов человека. Кардио-
миоциты имеют ядерные рецепторы к тиреоидному
гормону, которые при связывании друг с другом
меняют транскрипцию гена, регулирующего вну-
триклеточный метаболизм кальция и миофиламен-
тов [62]. Также проявляется негативный эффект
воздействия на кардиомиоциты в виде изменения
проницаемости ионных каналов, что приводит к
тахикардии. Кроме того, гипертиреоз изменяет ге-
модинамическую нагрузку из-за увеличения объема
крови и снижения системного сосудистого сопро-
тивления. Все это приводит к увеличению сердечно-
го выброса и ремоделированию сердца с течением
времени. Различные исследования при различном
уровне повышения функции щитовидной железы
показали изменения в морфологии ЛЖ. Было вы-
явлено, что гипертрофия ЛЖ связана с выражен-
ным (симптоматическим) гипертиреозом [63]. В
последнее время появились сообщения, что у паци-
ентов с карциномой щитовидной железы и получа-
ющих терапию тироксина имеют более высокую
индексированную массу ЛЖ по сравнению со здо-
ровой группой контроля [64]. Даже при нормаль-
ных показателях щитовидной железы была отме-
чена корреляция с концентрическим ремодели-
рованием миокарда, а более высокий уровень
свободного Т3 связан с уменьшением диастоличе-
ского диаметра ЛЖ и увеличением относительной
толщины стенки [65].
Увеличение сократимости и преднагрузки при-
водит к увеличению фракции выброса при гипер-
тиреоидных нарушениях. Длительная тахикардия и
аритмии предсердий могут приводить к развитию
дилатационной кардиомиопатии в отсутствии лече-
ния. Первоначальный гипертиреоз может усили-
вать расслабление миокарда, но объемная перегруз-
ка и гипертрофия ЛЖ могут приводить к диастоли-
ческой дисфункции с течением времени. Также
может отмечаться развитие легочной гипертензии
как следствие гипертиреоза. Она возникает из-за
общих аутоиммунных реакций, а также из-за того,
что легочная сосудистая сеть не расширяется в ответ
на избыток гормонов щитовидной железы, увели-
чивающие сердечный выброс. Имеются сообщения
о том, что пролапс митрального клапана в большей
степени распространен в группе пациентов с ауто-
иммунным гипертиреозом (болезнь Грейвса).
ГИПОТИРЕОЗ
В отличие от гипертиреоза, обратный эффект на
сердечно-сосудистую систему имеет низкий уро-
вень Т4/Т3. При гипотиреозе отмечается более низ-
кая частота сердечных сокращений, низкое пульсо-
вое давление и снижение сократимости сердца.
Систолическая и диастолическая дисфункции при
гипотиреозе обнаруживаются с помощью тканевой
допплерографии и анализа деформации [66]. Также
отмечается длительное время изоволюмической
релаксации. Глобальная продольная деформация и
3D-фракция выброса ниже при субклиническом
гипотиреозе по сравнению с контрольной здоровой
группой. Данные показатели улучшаются при до-
бавлении терапии гормонов щитовидной железы.
Удержание жидкости в тканях происходит из-за
накопления гликозаминогликанов, что приводит к
микседематозному отеку кожи, а также выделению
жидкости в перикард и плевральные полости [67].
АКРОМЕГАЛИЯ
Чрезмерная продукция гормона роста (ГР) в адено-
ме гипофиза приводит к стимуляции роста различ-
ных мягких тканей и висцеральных органов. Струк-
тура сердца и его функция меняются опосредованно
из-за сочетания прямого эффекта ГР, увеличенной
продукции печени инсулиноподобного фактора ро-
ста-1 (ИФР-1), гипертонических гемодинамических
In-36_для нас.indd 940
03.04.2019 12:12:24
941
36 Эхокардиография при метаболических и пищевых нарушениях
Заболевание
Первичная диагностика
или скрининг-тест
Клинические проявления
ЭхоКГ
Гипертиреоз
↓ ТТГ (< 0,4 мЕд/л)
Непереносимость жары
Тревожность
Сердцебиение
Потеря веса
↑ФВ
↑ МЛЖ
↓ ВИР
↑ Давление ЛА
↑ ЧСС
Пролапс митрального клапана
Гипотиреоз
↑ ТТГ (> 5 мЕд/л)
Непереносимость холода
Усталость
Запоры
Микседема
Анемия
↓ ФВ/ГПД
↑ ВИР
↓e′
↓ ЧСС
Выпот в перикарде
Акромегалия
↑ ИФР-1
ГР>1нг/мл
(2 час после ОТТГ)
Увеличение толщины кожи
Макрогнатия
Макроглоссия
Артропатия
Гипертензия
Гипертрофия двух желудочков
Первая степень диастолической
дисфункции
Митральная регургитация
Аортальная регургитация
Недостаток ГР
↓ ИФР-1
ГР < 4,1 нг/мл после про-
вокационного теста
(ГВГР-аргинин)
Низкий рост (в детстве)
Остеопения/переломы
Недостаток энергии/усталость
Дислипидемия
↓ Масса тела
↓ФВ
↓ МЛЖ
Синдром Кушинга ↑ В течение 24 час сво-
бодного кортизола
в моче и/или низкие
дозы (1 мг) супрессии
дексаметазона
Центральное ожирение
Фиолетовые стрии
Гипертензия
Нарушение менструальных циклов
Нарушение толерантности
к глюкозе
Проксимальная атрофия мышц
Гипертрофия двух желудочков
↓ ФВ/ГПД
Первая степень диастолической
дисфункции
Гиперпаратиреоз ↑ ПТГ (> 65 пг/мл)
Нефролитиаз
Нейропсихиатрические изменения
Болезненность костей/остеопения
Мышечная слабость
Тошнота, рвота
↑ МЛЖ
Кальцификация аортального клапана
Кальцификация митрального клапана
Кальцификация миокарда
Первая степень диастолической
дисфункции
Феохромоцитома
↑ В течение 24 час фрак-
ционных катехолами-
нов и метанефринов
в моче
Головная боль
Повышенное потоотделение
Тахикардия
Гипертензия
Ортостаз
Гипертрофия левого желудочка
Дилатационная кардиомиопатия
Гипокинез верхушки с гиперкинезом
основания (по тику Такоцубо)
e′ — максимальная раннедиастолическая скорость кольца митрального клапана; ВИР — время изволюметрического расслабления; ГВГР —
гормон, высвобождающий гормон роста; ГПД — глобальная продольная деформация; ГР — гормон роста; ИФР — инсулиноподобный
фактор роста; ЛА — легочная артерия; МЛЖ — масса левого желудочка; ОТТГ — оральный тест на толерантность к глюкозе; ПТГ —
паратиреоидный гормон; ТТГ — тиреотропный гормон; ФВ — фракция выброса; ЧСС — частота сердечных сокращений; ЭхоКГ —
эхокардиография.
ТАБЛИЦА 36.4 Клиническая корреляция с эхокардиографическими данными первичных эндокринных расстройств
изменений [68]. Клиническое проявление акромега-
лии крайне выражено, пациенты на протяжении
многих лет страдают от головных болей, утолщения
кожи, изменением лица, опухлости рук и ног, ар-
тропатий и гипертонии. Смертность увеличивается
из-за роста онкологии и сердечно-сосудистых забо-
леваний ССЗ, однако может быть снижена при адек-
ватном контроле уровня гормонов.
Кардиомиопатия при акромегалии может воз-
никнуть даже при кратковременном воздействии
избыточного уровня ГР [69]. Двужелудочковая ги-
пертрофия ЛЖ и диастолическая дисфункция
обычно присутствует у данных пациентов и корре-
лирует с длительностью течения заболевания и ги-
пертензией. 29-летнее ретроспективное исследова-
ние в двух клинических центрах с участием 330 па-
циентов с акромегалией показало, что в конечном
итоге у 3% исследуемых развивалась систолическая
сердечная недостаточность несмотря на подавление
ГР [70]. Развитие гипертрофии ЛЖ можно контро-
лировать у большинства пациентов при лечении
аналогами соматостатина, либо при удалении опу-
холи. Воздействие ГР на соединительную ткань
приводит к постоянному миксоматозному утол-
In-36_для нас.indd 941
03.04.2019 12:12:24
942
ЧАСТЬ VII Сосудистые и системные заболевания
щению клапанов, расширению аорты, митраль-
ной регургитации, которая не купируется даже
при длительном лечении.
ДЕФИЦИТ ГОРМОНА РОСТА
Дефицит ГР может возникнуть в результате травмы
гипофиза. Дефицит в детстве приводит к неболь-
шому росту человека. У взрослых возникший дефи-
цит ГР вызывает остеопению, снижает массу тела с
увеличением жировой массы, повышает риск сер-
дечно-сосудистых заболеваний в связи с дислипиде-
мией и дисфункцией эндотелия. У пациентов с
низким уровнем ГР отмечается меньший размер
ЛЖ и ниже фракция выброса, однако, показатели
улучшаются при начале терапии [71]. Дефицит ГР
распространен у пациентов с сердечной недостаточ-
ностью и связан с плохими исходами лечения. В
некоторых рандомизированных исследованиях бы-
ла изучена терапия дефицита ГР при сердечной
недостаточности. В одном из исследований наблю-
далось умеренное улучшение максимального по-
требления кислорода (12,9–14,5 мл/кг/мин) и фрак-
ции выброса (34–36%), однако улучшения конечно-
го клинического результата не отмечено [72]. На
данный момент не рекомендуется добавление ГР
пациентам с сердечной недостаточностью.
СИНДРОМ КУШИНГА
Избыточная хроническая продукция кортизола
приводит к синдрому Кушинга, который проявля-
ется в виде центрального ожирения, атрофии кожи
(в виде фиолетовых борозд), нарушению менстру-
ального цикла, проксимальной мышечной слабо-
сти, гипертонии, остеопороза и непереносимостью
глюкозы. Увеличение секреции кортизола может
возникнуть из-за опухоли надпочечника, высокого
уровня гормона адренокортикотропина, который
провоцирует развитие аденомы гипофиза (болезнь
Кушинга) либо из-за злокачественных паранеопла-
стических синдромов. Пациенты с синдромом Ку-
шинга имеют более высокий риск смерти от сердеч-
но-сосудистых заболеваний, а прежде всего от ин-
фаркта миокарда и инсультов. К предикторам
летального исхода относят диабет, связанный с из-
бытком кортизола, гипертонию и ожирение, кото-
рые могут привести к развитию атеросклероза ко-
ронарных сосудов [73].
При синдроме Кушинга отмечается ремоделиро-
вание сердца с более высокой массой ЛЖ и утол-
щенными стенками. Подобно другим нарушениям
обмена веществ, отмечается снижение Е/А, e’ и гло-
бальной продольной деформации по сравнению с
группой здоровых пациентов [74]. Многие пациен-
ты с избыточным уровнем кортизола имеют гипер-
тензию, однако изменения функции сердца может
присутствовать и у нормотензивных лиц. Глюко-
кортикоиды вызывают ремоделирование миокарда
и влияют на метаболизм кальция, что было выявле-
но на моделях крыс. Как следствие этого, гиперкор-
тизолизм может иметь прямой клинический эффект
на сердце в независимости от изменений гемодина-
мической нагрузки. Визуализация на ЭхоКГ может
быть ограничена у пациентов с синдромом Кушин-
га из-за чрезмерного центрального ожирения. Не-
давнее исследование, включавшее в себя 18 пациен-
тов с синдромом, подтвердило снижение доли дву-
желудочкового выброса по сравнению с контрольной
группой с помощью магнитно-резонансной томо-
графии [75]. Лечение синдрома в данном исследо-
вании улучшило систолическую функцию и умень-
шило массу ЛЖ.
ГИПЕРПАРАТИРЕОЗ
Паратиреоидный гормон (ПТГ) является основным
регулятором гомеостаза кальция. ПТГ может повы-
шаться при первичной гиперпродукции в паращи-
товидной железе (приводящего к гиперкальциемии)
или из-за вторичных причин, которые провоциру-
ют высвобождение ПТГ, что приводит к гипокаль-
циемии. Первичное действие ПТГ направлено на
скелетную и почечную систему для мобилизации
кальция в сыворотку крови, а также для увеличения
реабсорбции отфильтрованного кальция. Клиниче-
ские признаки и симптомы гиперпаратиреоза пред-
ставлены гиперкальцемическим состоянием, неф-
ролитиазом, полиурией, болями в костях, остеопе-
нией и изменением психического статуса.
Показано, что ПТГ оказывает прямое воздей-
ствие на сердечно-сосудистую систему. Сообщается
о 50% увеличении сердечно-сосудистых осложне-
ний у пациентов с избытком ПТГ [76]. Точный ме-
ханизм воздействия ПТГ на сердечно-сосудистую
систему не ясен, однако отмечаются трофические
эффекты воздействия на кардиомиоциты, наруше-
ния обмена кальция и клеточная перегрузка, гипер-
тония, повреждения почек, что также может приво-
дить к серьезным осложнениям. Прямые послед-
ствия повышенного уровня ПТГ обусловлены
возрастанием частоты ассоциированной сердечной
недостаточности и массой ЛЖ в независимости от
других сердечно-сосудистых факторов риска и био-
маркеров минерального обмена [77].
Степень дисфункции сердца связана с тяжестью
гиперпаратиреоза. В ранних исследованиях проде-
монстрировано, что симптоматические пациенты
со значительным сдвигом уровня кальция и ПТГ
имеют нарушение диастолической функции и уве-
личение кальцификации клапанов и миокарда. Бо-
лее мягкая форма бессимптомного гиперпаратире-
оза, который выявлен биохимическим анализом, не
вызывает значительной дисфункции сердца, однако
увеличивает кальцификацию аортального клапана
[78]. Хирургическое лечение первичного гиперпа-
ратиреоза показано при выраженной симптомати-
ке, высоком уровне кальция, нарушениях со сторо-
In-36_для нас.indd 942
03.04.2019 12:12:24
943
36 Эхокардиография при метаболических и пищевых нарушениях
ны костей и почек. Было выявлено, что после хи-
рургического лечения отмечается регрессия массы
ЛЖ и остановки процессов кальцификации, однако
на данный момент не существует доказанности о
снижении риска развития сердечно-сосудистых за-
болеваний [79].
ФЕОХРОМОЦИТОМА
Катехоламин-секретирующие нейроэндокринные
опухоли могут возникать либо из мозгового веще-
ства надпочечников (феохромоцитомы), либо из
вненадпочечниковой вегетативной ткани (параган-
глиомы), включая сердце и заднее средостение (рис.
36.8) [80]. Чаще всего они доброкачественные, од-
нако в 10% случаев встречаются и злокачественные
формы. Классическая триада симптомов включает
в себя пароксизмальные головные боли, потливость,
тахикардию. Отмечено, что до 90% с феохромоци-
томой имеют гипертензию, а лечение повышенного
давления должно включать в себя комбинирован-
ную терапию альфа- и бета-адренергическими пре-
паратами. Описаны различные кардиологические
варианты проявления феохромоцитомы. У многих
пациентов отсутствуют нарушения со стороны сер-
дечно-сосудистой системы, однако концентриче-
ская гипертрофия и диастолическая дисфункция
ЛЖ могут возникнуть из-за сопутствующей гипер-
тонии, которая может остаться даже после лечения
феохромоцитомы [81]. Препараты с катехоламина-
ми токсичны для кардиомиоцитов и могут приве-
сти к ишемии из-за увеличения потребности мио-
карда в кислороде наряду с сужением просвета ко-
ронарных артерий [82]. Болезнь иногда может быть
представлена систолической дисфункцией ЛЖ с
кардиомиопатией и с выраженным гипокинезом
либо кардиомиопатией Такоцубо [83].
ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Заболевания печени обычно вовлекают в патологи-
ческий процесс сердце через сосудистые изменения,
токсическое повреждение из-за метаболических
расстройств или из-за общей болезни, которая вли-
яет на оба органа (например, алкоголизм). ЭхоКГ —
это первый этап диагностики сердечно-легочных
осложнений цирроза (табл. 36 .5). Кроме того, ЭхоКГ
помогает при выборе кандидатов для транспланта-
ции печени или создании трансяремного внутрипе-
ченочного портосистемного шунта (ТВПШ).
ПП
ЛП
ЛВ
Рис. 36 .8 Функциональная параганглиома сердца. (A) A ТТЭхоКГ в апикальной четырехкамерной позиции у 56-летнего мужчины, который проходил об-
следование после замены аортального клапана. У пациента была трудно поддающаяся лечению гипертония, а при визуализации сердца было выявлено образо-
вание вне сердца у его основания за левым предсердием (ЛП) (стрелка). Дальнейшее обследование с помощью компьютерной томографии (Б) и ЧПЭхоКГ A
A (В, Г) выявили инкапсулированную массу (стрелка) с хорошей васкуляризацией при контрастном усилении (Б) и цветной допплерографии (Г). После взятия
биопсии было установлено, что это экстраадренальная параганглиома, а биохимический анализ выявил, что опухоль функционирует с повышенным уровнем
сыворотки и 24-часовым метанефрином в моче. ЛВ — легочные вены; ЛП — левое предсердие; ПП — правое предсердие.
А
Б
Г
В
In-36_для нас.indd 943
03.04.2019 12:12:24
944
ЧАСТЬ VII Сосудистые и системные заболевания
ЦИРРОТИЧЕСКАЯ КАРДИОМИОПАТИЯ
Прогрессирующие поздние стадии заболевания пе-
чени приводят к ее фиброзу (цирроз) и изменению
микроциркуляции, что ведет к портальной гипер-
тензии и асциту (рис. 36.9). Высокий уровень сер-
дечно-сосудистой заболеваемости и смертности
после трансплантации печени или ТВПШ называ-
ется «цирротической кардиомиопатией». Данное
определение довольно широкое: дисфункция серд-
ца при циррозе, которая не связана с другим забо-
леванием с систолической недостаточностью (фрак-
ция выброса < 55% либо отсутствие увеличения
сердечного выброса при физической нагрузке) или
диастолической дисфункцией, которая измерена
допплерографией (Е/А < 1, длительность периода
уменьшения скорости кровотока через митральный
клапан > 200 мсек, время изоволюмического рассла-
бления > 80 мсек) [84]. В литературе описано мно-
жество патофизиологических механизмов [85].
Наиболее весомым фактором выступает выра-
женная системная вазодилатация, которая приводит
к снижению системного сосудистого сопротивле-
нию и гипердинамической циркуляции. Происхо-
дит депонирование крови с уменьшением предна-
грузки, что в свою очередь активирует компенса-
торные нейрогормональные рефлексы, включая
симпатическую и ренин-ангиотензин-альдостеро-
новую системы. Длительная активация данных
систем наряду с увеличением количества цирку-
лирующих токсичных медиаторов приводит к
развитию фиброза сердца, подавлению работы бе-
та-рецепторов и нарушению передачи сигналов
между клетками.
При проведении ЭхоКГ пациентам с циррозом в
большинстве случаев отмечается нормальная систо-
лическая функция с хорошей фракцией выброса в
состоянии покоя. Однако из-за присутствия гипер-
динамической циркуляции и снижения количества
бета-рецепторов систолическая функция снижается
при стрессе или физической нагрузке [86]. В мо-
мент, когда резервы сердца исчерпываются из-за
выраженной циркуляторной дисфункции, то может
возникнуть рефрактерный асцит и гепатореналь-
ный синдром [87]. Несмотря на нормальную фрак-
цию выброса, в одном из исследований сообщалось
о систолической дисфункции в состоянии покоя по
сравнению со здоровой группой контроля. У паци-
ентов с циррозом отмечались более низкие макси-
мальные показатели продольной деформации
(–20% против –22%, соответственно, р = 0,003) [88].
Однако прогностическое значение продольной де-
формации при циррозе еще изучается.
При циррозе очень распространена диастоличе-
ская дисфункция, которая встречается у 40–60%
пациентов при цирротической кардиомиопатии.
Однако на ее оценку влияет преднагрузка и частота
сердечных сокращений, которые обычно имеют
атипичные цифры при циррозе. Приблизительно
80% случаев диастолической дисфункции при цир-
ротической кардиомиопатии классифицируется как
легкая (класс 1). Показано, что у пациентов после
ТВПШ, снижение Е/А на 1 или менее связано с более
низкой выживаемостью и клиренсом асцита [89]. В
других исследования для определения диастоличе-
ской дисфункции использовали тканевую доппле-
рографию для визуализации митрального кольца,
как рекомендуется Американским обществом эхо-
кардиографии (АОЭ). Использование специфиче-
ского определения диастолической дисфункции по
АОЭ приводит к снижению частоты ее определения
(от 20 до 40%). Данный показатель может претендо-
вать на роль лучшего прогностического фактора
смертности при циррозе [88, 90].
ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
Ортотопическая трансплантация печени (ОТП)
улучшает систолическую и диастолическую функ-
цию сердца у пациентов с цирротической кардио-
миопатией [91]. Однако после ОТП крайне часто
развиваются осложнения со стороны сердечно-со -
судистой системы и составляют до четверти случаев
смертности в момент операции [92]. Эхокардиогра-
фическое исследование для оценки рисков рекомен-
дуется проводить всем пациентам перед ОТП [93].
Помимо оценки систолической и диастолической
функции ЛЖ, необходимо оценивать легочную ги-
пертензию, наличие шунтов, выпота и динамиче-
ской обструкции выходного тракта ЛЖ.
Легочная гипертензия (систолическое давление в
легочной артерии выше 30 мм рт. ст.) наблюдается
у 20% пациентов с циррозом. Значительная легоч-
ная гипертензия со средним давлением > 35 мм
рт. ст. связывают с 50% летальным исходом после
ОТП и является противопоказанием для ее проведе-
ния. Легочная гипертензия может возникнуть из-за
увеличения сердечного выброса при циррозе, одна-
ко крайне высокое повышение давления, которое
увеличивает смертность, связано с повышением
сопротивления сосудов легких. При измерении дав-
ления в легочной артерии на ЭхоКГ выше 45 мм рт.
ст., то рекомендуется проведение катетеризации
правых отделов сердца для оценки сопротивления в
легких, среднего давления и давления заполнения
ЛЖ. У отдельной группы пациентов имеет место
решения вопроса о применении вазодилататоров
при тяжелой форме заболевания и симптомами сер-
дечной недостаточности.
Умеренное повышение давления в легких с вы-
соким сердечным выбросом с сопутствующей ги-
поксемией и одышкой может быть результатом ге-
патолегочного синдрома. Он характеризуется триа-
дой: заболевание печени, внутрилегочная сосудистая
дилатация и артериальная гипоксемия [94]. Паци-
енты с гепатолегочным синдромом обычно имеют
прогрессирующую одышку, которая ухудшается
при принятии вертикального положения (затруд-
In-36_для нас.indd 944
03.04.2019 12:12:25
945
36 Эхокардиография при метаболических и пищевых нарушениях
Патология
ЭхоКГ
Клинический прогноз
Автор исследования
(год)
Цирротическая
кардиомиопатия
Диастолическая
дисфункция
E/A ≤ 1 e′ перегородки < 8 см/сек либо
латеральнее < 10 см/сек
Летальность после ТВПШ (ОР 4,7; 95%
ДИ 1,1–20; p = 0,035)
Независимо увеличивается смертность
от цирроза печени на 8,6% (p = 0,017)
Rabie (2009) [89]
Karagiannakis (2014)
[90]
Систолическая
дисфункция
Уменьшенный сердечный индекс
< 1,5 л/мин/м2*
Ассоциация с развитием гепатореналь-
ного синдрома (43% против 5%,
p = 0,04)
Krag (2010) [114]
ФВ<55%
Является противопоказанием к прове-
дению ОТП, т.к . ассоциируется
с неблагоприятным исходом (хоть
в литературе это не указано)
Ripoll (20080) [115]
Foaud (2009) [92]
Заболевания коро-
нарных артерий
СЭД негативная при ишемии
ПОР 89% для летального исхода и ИМ
после ОТП
Safadi (2009) [116]
Хронотропная недостаточность во
время СЭД < 82% от целевой ЧСС
Увеличивает риск со стороны ССС
после ОТП
22% против 6%, p = 0,01
Максимальная скорость давления
<16333
17% против 5%, p = 0,02
Umphrey (2008) [99]
Печеночный
гидроторакс
Эхопрозрачное пространство либо
позади нисходящего отдела аорты
(левосторонний выпот), либо справа
от ЛП через субкостальную позицию
датчика (правосторонний выпот)
Среди 64 пациентов отмечается леталь-
ность 63% (средняя выживаемость
167 дней) против 0% летальных
исходов у 5 пациентов после ОТП
Badillo (2014) [96]
Гепатолегочный
синдром
Внутри легочное шунтирование: появ-
ление раствора с пузырьками в ЛП
спустя 3 удара сердца после его введе-
ниявПП
Выраженная степень шунтирования на
уровне ЛП — предиктор летального
исхода после ОТП (p = 0,01)
Donovan (1996) [117]
Гипертрофия
левого желудочка
Толщина МЖП > 1,1 см
Увеличение риска 30-дневной послео-
перационной летальности после ОТП
(ОШ 2,84; 95% ДИ 1,12–7,17; p = 0,027)
Safadi (2009) [116]
LVOT обструкция Максимальный градиент в ВТЛЖ
>36ммрт.ст.вовремяСЭДприПВ
допплере
Увеличенный градиент у 43% пациен-
тов; ассоциируется с интраопераци-
онной гипотензией во время ОТП
(p = 0,03)
Maraj (2004) [100]
Послелегочная
гипертензия
СДЛА>60ммрт.ст.
Высокая смертность после ОТП (42%
спустя 9 мес, 71% спустя 36 мес); при
СДЛА > 45 мм рт. ст. на эхокардио-
графии следует провести ангиогра-
фию правых отделов сердца
Ramsay (1997) [118]
* В исследовании использовалась перфузионная визуализация миокарда, однако сердечный выброс можно рассчитать с помощью ТТЭхоКГ.
E/A — максимальная ранняя диастолическая скорость через митральный клапан/поздняя диастолическая скорость; e′ — максимальная скорость в
период ранней диастолы кольца митрального клапана; ВТЛЖ — выходной тракт левого желудочка; ДИ — доверительный интервал; ИМ — ин-
фаркт миокарда; ЛП — левое предсердие; МЖП — межжелудочковая перегородка; ОР — отношение рисков; ОТП — ортотопическая трансплан-
тация печени; ОШ — отношение шансов; ПВ — постоянно -волновой; ПОР — отрицательный прогностический результат; ПП — правое пред-
сердие; СДЛА — систолическое давление в легочной артерии; ССС — сердечно-сосудистая система; СЭД — стресс-эхокардиография с добутами-
ном; ТВПШ — трансяремный внутрипеченочный портосистемный шунт; ФВ — фракция выброса; ЧСС — частота сердечных сокращений;
ЭхоКГ — эхокардиография.
ТАБЛИЦА 36.5 Эхокардиография для оценки рисков при заболеваниях печени
ненное дыхание) из-за возрастания несоответствия
вентиляции и перфузии. Чувствительным тестом
для определения гепатолегочного синдрома являет-
ся контрастная ЭхоКГ, которую следует выполнять
у пациентов с циррозом перед планированием ОТП
(рис. 36 .10).
У пациентов с циррозом может определяться
наличие выпота в плеврах либо перикарде. Гидро-
торакс чаще всего у данной группы возникает с
правой стороны и приводит к появлению одышки.
В одном из исследований плевральный выпот был
выявлен примерно у 5–16% пациентов с циррозом,
In-36_для нас.indd 945
03.04.2019 12:12:25
946
ЧАСТЬ VII Сосудистые и системные заболевания
однако он может возникнуть и в атипичных ситуа-
циях, что требует тщательной диагностики. Нако-
пленная жидкость в брюшной полости при пор-
тальной гипертензии может перемещаться в
плевральные полости через диафрагмальные де-
фекты, и, в редких случаях, в перикардиальную
полость [95]. При наличии выпотов рекомендуется
постановка чрескожного дренажа. Печеночный ги-
дроторакс связывают с плохим прогнозом у паци-
ентов, которым не выполнена ОТП [96].
Пациенты с заболеваниями коронарных арте-
рий, которым выполняется ОТП, имеют на 50%
выше риск летального исхода. Таким образом, всем
кандидатам на ОТП с множественными факторами
риска, включая диабет, гипертонию, возраст старше
60 лет, гипертрофию ЛЖ, курение и дислипидемию,
необходимо выполнить неинвазивную оценку ише-
мии, а именно стресс-ЭхоКГ с добутамином (СЭД)
[97]. СЭД имеет высокую отрицательную прогно-
стическую ценность (около 90%), для послеопера-
ционных результатов ОТП у пациентов с низким и
умеренным риском со стороны сердечно-сосуди-
стой системы. Однако, СЭД имеет низкую чувстви-
тельность в отношении заболеваний коронарных
артерий, поэтому в некоторых случаях необходимо
проведение ангиографии [98]. Во время проведения
СЭД у кандидатов на ОТП следует оценить допол-
нительные неблагоприятные прогностические фак-
торы, такие, как хронотропную некомпетентность,
градиент в выходном тракте ЛЖ [99, 100].
АЛКОГОЛЬ
Хроническое злоупотребление алкоголем может
напрямую привести к заболеваниям печени и серд-
ца. По некоторым оценкам, потребление > 90 г/сут
алкоголя в течении 5 лет может привести к алко-
гольной кардиомиопатии, а более низкое среднесу-
точное потребление 25 г/день в течении 10–12 лет
может вызвать цирроз печени [101]. Следовательно,
сердечная дисфункция может встречаться без цир-
роза, как и нарушения печени без заболеваний серд-
ца. Кроме того, из-за некоторых особенностей в
зависимости от пола и генетики имеются различия
в метаболизме алкоголя, что объясняет, почему не-
которые пациенты защищены от развития дис-
функции органов при высоком хроническом уровне
потребления алкоголя.
В отличие от злоупотребления алкоголя, умерен-
ное принятие небольших доз (2 стандартных доз
напитка в день и менее) связывают с уменьшением
смертности и осложнений со стороны сердечно-со-
судистой системы во многих исследованиях [102,
103]. К потенциальным положительным механиз-
мам относят увеличение липопротеинов высокой
плотности, а также снижении агрегации тромбоци-
тов из-за воздействия алкоголя. Тем не менее оста-
ются противоречивые мнения между низким уров-
нем потребления алкоголя и влияния на здоровье
людей. Исследования на животных показали, что
воздействие высоких концентраций алкоголя при-
водит к структурным и функциональным измене-
ниям миокарда, что в итоге приводит к отмиранию
кардиомиоцитов в результате апоптоза. На моделях
крыс было установлено прямое повреждающее дей-
ствие на митохондрии, изменение чувствительно-
сти миофиламентов к кальцию, а также снижению
синтеза белков [104].
Алкогольная кардиомиопатия диагностируется у
пациентов со злоупотребления алкоголя в анамнезе
не менее 5 лет и при отсутствии другой выявленной
причины развития кардиомиопатии. До появления
симптомов сердечной недостаточности у пациентов
может отмечаться сниженная фракция выброса,
увеличенная масса и объемы ЛЖ [105]. Увеличение
Рис. 36 .9 A Эхокардиографическая визуализация асцита. Субкостальный вид; 49-летний мужчина с цирротическим асцитом (
*
). Эхо-прозрачная область,
огибающая печень (П). ПЖ — правый желудочек; ПП — правое предсердие.
ПЖ
ПП
П
*
*
*
In-36_для нас.indd 946
03.04.2019 12:12:25
947
36 Эхокардиография при метаболических и пищевых нарушениях
толщины стенок, расширение полостей и снижен-
ная релаксация может возникнуть еще до развития
очевидной систолической дисфункции. Диастоли-
ческие изменения, такие, как более низкое отноше-
ние Е/А и более высокое время расслабления, линейно
коррелируют с продолжительностью злоупотребле-
ния алкоголем. У женщин проявление токсического
воздействия алкоголя на сердце более явно по сравне-
нию с мужчинами даже с одинаковым уровнем по-
требления алкоголя, поэтому повышенное употре-
бление алкоголя согласно Национальному институ-
ту алкоголизма Соединенных Штатов определяется
как>7напитковвнеделюуженщин,и>14у
мужчин.
Лечение алкогольной кардиомиопатии включает
в себя типичную терапию сердечной недостаточно-
сти. На данный момент отсутствуют исследования,
которые позволяют выявить различия в терапии
между алкогольной и не алкогольной кардиомиопа-
тией. Однако прекращение или сокращение алко-
голя может улучшить функцию сердца при алко-
гольной кардиомиопатии. Ранние исследования до
начала рутинного применения ингибиторов анги-
отензинпревращающего фермента и бета-блокато-
ров показали, что воздержание от приема алкоголя
может привести к нормализации фракции выброса
у некоторых пациентов. В одном из исследований,
у 37% пациентов с алкогольной кардиомиопатией
(средняя фракция выброса 25%), которые наблюда-
лись в среднем 59 мес, восстановилась функция ЛЖ
с фракцией выброса не менее 40% [106]. Было отме-
чено, что улучшение фракции выброса произошло
у пациентов, которые воздержались от потребления
алкоголя либо снизили до < 80 г/сут, в отличие от
тех, кто продолжил им злоупотреблять. Умеренное
потребление алкоголя связывают с лучшим прогно-
зом при алкогольной кардиомиопатии по сравне-
нию с идиопатическими кардиомиопатиями (рис.
36.11). У пациентов с алкогольной кардиомиопати-
ей отмечается повышенный риск дефицита пита-
тельных веществ и микроэлементов, что может
привести к сердечной недостаточности (например,
недостаток тиамина и селена). При выявленном
недостатке следует назначать витаминные и мине-
ральные добавки.
НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ
Неалкогольная жировая болезнь печени (НЖБП)
характеризуется отложениями жира в печени с или
без ее воспаления при исключении вторичных при-
чин. Обычно она ассоциируется с МС и на данный
момент отмечается рост заболеваемости НЖБП в
развитых странах. У пациентов с признаками вос-
паления (неалкогольного стеарогепатита), НЖБП
может прогрессировать до цирроза, а ожирение и
СД являются факторами риска развития неалко-
гольного стеатогепатита. Основной причиной смер-
ти при НЖБП являются заболевания сердечно-со-
судистой системы. Однако остается неясным, явля-
ется ли НЖБП фактором риска сердечно-сосудистых
осложнений или маркером процессов ожирения.
Подобно ожирению и МС, эхокардиографиче-
ская оценка здоровых людей и пациентов с НЖБП
показала, что НЖБП ассоциируется с гипертрофией
ЛЖ, умеренной продольной деформацией, диасто-
лической дисфункцией и более низким отношени-
ем Е/А и более высоким Е/е′ и увеличением ЛП [107,
108]. Однако влияние общих факторов риска (ожи-
Рис. 36 .10 A Пузырьковая проба при гепатолегочном синдроме. Апикальная четырехкамерная позиция. Пузырьковая проба у 46-летнего мужчины с
циррозом, одышкой и гипоксией. (А) Начало пробы, появление пузырьков в правых отделах сердца. (Б) Спустя 10 сокращений сердца (стрелки) в левом пред-
сердии (ЛП) и левом желудочке (ЛЖ) появились пузырьки, которые попали в камеры из левых легочных вен, что доказывает наличие внутрилегочных шунтов
при гепатолегочном синдроме. ПЖ — правый желудочек; ПП — правое предсердие.
ЛП
ПП
ПЖ
ЛЖ
А
Б
In-36_для нас.indd 947
03.04.2019 12:12:25
948
ЧАСТЬ VII Сосудистые и системные заболевания
рение, гипертония, МС) на результаты ЭхоКГ в этих
исследованиях не оценивали. Тяжесть фиброза при
неалкогольном стеатогепатите была независимо свя-
зана с толщиной эпикардиального жира, наруше-
нием геометрии сердца и диастолической дисфунк-
цией [109]. При анализе популяции пациентов в
исследовании CARDIA, НЖБП независимо ассоци-
ировалась с величиной продольной деформации
даже после поправки на демографические особен-
ности, сердечную недостаточность и метаболиче-
ские факторы риска [110]. Однако значительное
ослабление ассоциативной связи с эхокардиографи-
ческими параметрами наблюдалось при поправке с
учетом ожирения, что указывает на то, что ожире-
ние играет важную роль в развитии сердечной дис-
функции, связанной с НЖБП. Соответственно, у
пациентов с НЖБП необходимо четко дифферен-
цировать метаболические факторы риска.
0
024
p = 0,002
6 6,4
8
10
12
Годы
20
40
50
60
80
100
АКМП
94
71
56
38
30
19
10
188
109
75
43
29
19
7
ИДКМП
6,4
0
024
ИДКМП
АКМП трезвенники
АКМП умеренно пьющие
6
8
10
12
Годы
20
40
50
60
80
100
Умеренно выпивающие
29
24
20
12
11
6
3
60
44
33
23
17
11
6
Абстиненты
188
109
75
43
29
19
7
ИДКМП
С
м
е
р
т
ь
б
е
з
Т
С
(
%
)
ИДКМП
АКМП
С
м
е
р
т
ь
б
е
з
Т
С
(
%
)
АКМП умеренно выпивающие vs АКМП абстиненты, p = 0,22
АКМП умеренно выпивающие vs ИДКМП, p = 0,005
АКМП абстиненты vs ИДКМП, p = 0,03
Количество пациентов в группе риска
Количество пациентов в группе риска
Рис. 36 .11 Выживаемость без трансплантации при идиопатической дилатационной кардиомиопатии и алкогольной кардиомиопатии в соответ-
ствии с употреблением алкоголя. (A) Кривые выживаемости после сердечной смерти, трансплантации сердца у пациентов с алкогольной кардиомиопатией
(АКМП) (синий) и идиопатической дилатационной кардиомиопатией (ИДКМП) (черный). (Б) Кривые выживаемости у пациентов с ИДКМП (черный), с АКМП с
постоянным умеренным употреблением алкоголя (< 80 г/день) (синий) и абстинентами (красный). Цифра ниже оси Х отражает количество пациентов с риском на
каждом временном интервале [Guzzo-Merello G, Segovia J, Dominguez F, et al. Natural history and prognostic factors in alcoholic cardiomyopathy. JACC Heart Fail
3:78–86 , 2015].
А
Б
In-36_для нас.indd 948
03.04.2019 12:12:26
949
36 Эхокардиография при метаболических и пищевых нарушениях
П
а
р
а
м
е
т
р
ы
Э
х
о
К
Г
К
а
р
д
и
о
м
и
о
п
а
т
и
я
п
р
и
о
ж
и
р
е
н
и
и
Д
и
а
б
е
т
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
Ц
и
р
р
о
т
и
ч
е
с
к
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
А
л
к
о
г
о
л
ь
н
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
О
г
р
а
н
и
ч
е
н
и
я
Р
а
з
м
е
р
Л
Ж
У
в
е
л
и
ч
е
н
о
б
ъ
е
м
У
в
е
л
и
ч
е
н
а
т
о
л
щ
и
н
а
с
т
е
н
к
и
П
о
ж
и
л
о
й
в
о
з
р
а
с
т
,
г
и
п
е
р
т
е
н
з
и
я
,
а
п
н
о
э
в
о
с
н
е
п
р
и
в
о
д
я
т
к
к
о
н
ц
е
н
-
т
р
и
ч
е
с
к
о
м
у
р
е
м
о
д
е
л
и
р
о
в
а
н
и
ю
О
б
ы
ч
н
о
н
о
р
м
а
л
ь
н
ы
й
,
о
д
н
а
к
о
м
о
ж
е
т
у
в
е
л
и
ч
и
-
в
а
т
ь
с
я
п
р
и
д
л
и
т
е
л
ь
н
о
м
т
е
ч
е
н
и
и
д
и
а
б
е
т
а
У
м
е
р
е
н
н
о
е
у
в
е
л
и
ч
е
н
и
е
т
о
л
щ
и
н
ы
и
м
а
с
с
ы
(
в
с
р
е
д
н
е
м
н
а
3
г
)
Н
о
р
м
а
л
ь
н
ы
й
р
а
з
м
е
р
,
о
д
н
а
к
о
м
о
ж
е
т
б
ы
т
ь
у
м
е
р
е
н
н
о
р
а
с
ш
и
р
е
н
и
з
-
з
а
д
л
и
т
е
л
ь
н
о
й
г
и
п
е
р
д
и
н
а
м
и
ч
е
с
к
о
й
ц
и
р
к
у
л
я
ц
и
и
Ч
р
е
з
м
е
р
н
о
е
р
а
с
ш
и
р
е
н
и
е
Э
к
с
ц
е
н
т
р
и
ч
е
с
к
а
я
г
и
п
е
р
т
р
о
ф
и
я
Г
е
о
м
е
т
р
и
я
п
р
и
М
-
р
е
ж
и
м
е
и
2
D
-
в
и
з
у
а
л
и
з
а
ц
и
и
3
D
-
в
и
з
у
а
л
и
з
а
ц
и
я
т
р
е
б
у
е
т
в
ы
с
о
-
к
о
г
о
к
а
ч
е
с
т
в
а
и
з
о
б
р
а
ж
е
н
и
й
М
Р
Т
я
в
л
я
е
т
с
я
з
о
л
о
т
ы
м
с
т
а
н
д
а
р
т
о
м
Ф
р
а
к
ц
и
я
в
ы
б
р
о
с
а
В
б
о
л
ь
ш
и
н
с
т
в
е
с
л
у
ч
а
я
х
н
о
р
м
а
л
ь
н
а
я
,
д
а
ж
е
п
о
в
ы
ш
е
н
н
а
я
В
р
а
й
о
н
е
5
9
–
7
4
%
Н
и
ж
н
я
я
г
р
а
н
и
ц
а
н
о
р
м
ы
(
5
0
–
5
5
%
)
п
р
и
с
о
п
у
т
с
т
в
у
ю
щ
и
х
з
а
б
о
л
е
в
а
н
и
я
х
(
г
и
п
е
р
т
е
н
з
и
я
,
С
О
А
С
)
Н
о
р
м
а
л
ь
н
а
я
Г
и
п
е
р
д
и
н
а
м
и
к
а
В
б
о
л
ь
ш
и
н
с
т
в
е
с
л
у
ч
а
е
в
Ф
В
>
6
0
%
Д
о
с
т
о
в
е
р
н
о
с
н
и
ж
е
н
а
Ф
В
<
4
0
%
З
а
в
и
с
и
т
о
т
н
а
г
р
у
з
к
и
С
о
п
у
т
с
т
в
у
ю
щ
и
е
з
а
б
о
л
е
в
а
н
и
я
в
л
и
я
ю
т
н
а
н
а
г
р
у
з
к
у
Т
р
е
б
у
е
т
с
я
в
и
з
у
а
л
и
з
а
ц
и
я
г
р
а
н
и
ц
ы
э
н
д
о
к
а
р
д
а
Г
л
о
б
а
л
ь
н
а
я
п
р
о
-
д
о
л
ь
н
а
я
д
е
ф
о
р
м
а
ц
и
я
Н
и
ж
е
н
а
1
–
2
%
п
о
с
р
а
в
н
е
н
и
ю
с
о
з
д
о
-
р
о
в
ы
м
и
л
ю
д
ь
м
и
С
н
и
ж
е
н
и
е
н
а
3
%
п
о
с
р
а
в
н
е
-
н
и
ю
с
л
ю
д
ь
м
и
б
е
з
д
и
а
б
е
т
а
Н
и
ж
н
я
я
г
р
а
н
и
ц
а
н
о
р
м
ы
Д
о
с
т
о
в
е
р
н
о
н
е
и
з
у
ч
е
н
о
,
м
о
ж
е
т
б
ы
т
ь
с
н
и
ж
е
н
а
п
р
и
с
н
и
ж
е
н
н
о
й
Ф
В
З
а
в
и
с
и
т
о
т
в
р
а
ч
а
,
к
о
т
о
р
ы
й
п
р
о
-
в
о
д
и
т
и
с
с
л
е
д
о
в
а
н
и
е
Н
е
у
с
т
а
н
о
в
л
е
н
о
п
р
о
г
н
о
с
т
и
ч
е
-
с
к
о
е
з
н
а
ч
е
н
и
е
Н
о
р
м
а
л
ь
н
ы
е
п
о
к
а
з
а
т
е
л
и
н
е
у
с
т
а
н
о
в
л
е
н
ы
О
с
о
б
е
н
н
о
с
т
и
п
р
и
т
о
к
а
ч
е
р
е
з
м
и
т
р
а
л
ь
н
ы
й
к
л
а
п
а
н
E
/
A
<
1
А
б
с
о
л
ю
т
н
ы
е
с
к
о
р
о
с
т
и
м
о
г
у
т
б
ы
т
ь
в
ы
ш
е
п
о
с
р
а
в
н
е
н
и
ю
с
к
о
н
т
р
о
л
ь
н
о
й
г
р
у
п
п
о
й
Н
и
ж
н
я
я
г
р
а
н
и
ц
а
E
/
A
У
в
е
л
и
ч
е
н
н
а
я
с
к
о
р
о
с
т
ь
з
а
м
е
д
л
е
н
и
я
E
/
A
<
1
у
6
0
%
п
а
ц
и
е
н
т
о
в
С
н
и
ж
е
н
и
е
п
р
и
д
е
к
о
м
-
п
е
н
с
а
ц
и
и
ц
и
р
р
о
з
а
п
е
ч
е
н
и
К
р
а
й
н
е
в
а
р
и
а
т
и
в
н
о
П
о
к
а
з
а
т
е
л
ь
и
з
м
е
н
я
е
т
с
я
с
т
е
ч
е
-
н
и
е
м
в
о
з
р
а
с
т
а
Т
к
а
н
е
в
а
я
д
о
п
п
л
е
-
р
о
г
р
а
ф
и
я
м
и
т
р
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
(
e
′
)
У
м
е
н
ь
ш
е
н
о
У
м
е
н
ь
ш
е
н
о
Ч
а
щ
е
в
с
е
г
о
в
н
о
р
м
е
,
м
о
ж
е
т
б
ы
т
ь
с
н
и
ж
е
н
о
С
н
и
ж
е
н
о
п
р
и
д
и
л
а
т
а
ц
и
о
н
н
о
й
к
а
р
д
и
о
м
и
о
п
а
-
т
и
и
К
о
р
р
е
к
т
н
а
я
в
и
з
у
а
л
и
з
а
ц
и
я
к
л
а
п
а
н
а
З
а
в
и
с
и
т
о
т
п
о
з
и
ц
и
и
д
а
т
ч
и
к
а
С
и
с
т
о
л
и
ч
е
с
к
о
е
д
а
в
л
е
н
и
е
в
л
е
г
о
ч
н
о
й
а
р
т
е
р
и
и
В
е
р
х
н
я
я
г
р
а
н
и
ц
а
н
о
р
м
ы
л
и
б
о
с
л
е
г
к
а
п
о
в
ы
ш
е
н
о
В
г
р
а
н
и
ц
а
х
2
5
–
4
0
м
м
р
т
.
с
т
.
Н
а
и
б
о
л
е
е
в
ы
с
о
к
и
е
ц
и
ф
р
ы
п
р
и
а
п
н
о
э
в
о
с
н
е
Н
о
р
м
а
л
ь
н
о
е
В
б
о
л
ь
ш
и
н
с
т
в
е
с
л
у
ч
а
е
в
у
в
е
л
и
ч
е
н
о
М
о
ж
е
т
б
ы
т
ь
т
я
ж
е
л
о
й
с
т
е
п
е
н
и
У
в
е
л
и
ч
е
н
о
п
р
и
ц
и
р
р
о
з
е
Н
е
а
д
е
к
в
а
т
н
а
я
о
ц
е
н
к
а
п
р
и
Т
Р
Н
е
а
д
е
к
в
а
т
н
а
я
о
г
и
б
а
ю
щ
а
я
с
п
е
к
т
р
а
З
а
в
и
с
и
т
о
т
п
о
з
и
ц
и
и
д
а
т
ч
и
к
а
Р
а
з
м
е
р
П
Ж
Р
а
с
ш
и
р
е
н
о
п
р
и
а
п
н
о
э
в
о
с
н
е
В
б
о
л
ь
ш
и
н
с
т
в
е
с
л
у
ч
а
е
в
в
н
о
р
м
е
У
м
е
р
е
н
н
о
р
а
с
ш
и
р
е
н
Р
а
с
ш
и
р
е
н
Н
е
п
р
а
в
и
л
ь
н
а
я
ф
о
р
м
а
П
Ж
п
р
и
-
в
о
д
и
т
к
н
е
а
д
е
к
в
а
т
н
о
й
о
ц
е
н
к
е
Д
о
п
о
л
н
и
т
е
л
ь
н
ы
е
к
о
м
м
е
н
т
а
р
и
и
П
р
о
в
е
с
т
и
и
н
д
е
к
с
а
ц
и
ю
с
о
г
л
а
с
н
о
р
о
с
т
у
п
р
и
т
я
ж
е
л
о
й
с
т
е
п
е
н
и
о
ж
и
р
е
н
и
я
И
с
п
о
л
ь
з
у
й
т
е
б
о
л
е
е
н
и
з
к
у
ю
ч
а
с
т
о
т
у
д
а
т
ч
и
к
а
.
П
р
и
з
а
т
р
у
д
н
е
н
н
о
й
в
и
з
у
а
л
и
з
а
ц
и
и
р
е
к
о
м
е
н
д
у
е
т
с
я
и
с
п
о
л
ь
з
о
в
а
т
ь
э
х
о
-
к
о
н
т
р
а
с
т
Н
е
о
б
х
о
д
и
м
о
и
с
к
л
ю
ч
и
т
ь
и
ш
е
м
и
ю
И
з
м
е
н
и
т
ь
ф
а
к
т
о
р
ы
р
и
с
к
а
Р
е
д
к
о
н
а
б
л
ю
д
а
е
т
с
я
д
и
л
а
т
а
-
ц
и
о
н
н
а
я
к
а
р
д
и
о
м
и
о
п
а
т
и
я
П
р
о
в
е
д
е
н
и
е
с
т
р
е
с
с
-
т
е
с
т
а
л
и
б
о
н
а
г
р
у
з
к
и
д
л
я
в
ы
я
в
л
е
н
и
я
х
р
о
н
о
т
р
о
п
-
н
о
й
н
е
к
о
м
п
е
т
е
н
т
н
о
с
т
и
и
о
т
с
у
т
с
т
в
и
е
р
е
з
е
р
в
о
в
с
е
р
д
ц
а
С
л
е
д
у
е
т
у
т
о
ч
н
и
т
ь
а
л
к
о
г
о
л
ь
н
ы
й
а
н
а
м
н
е
з
п
а
ц
и
е
н
т
а
Н
е
о
б
х
о
д
и
м
о
у
ч
и
т
ы
в
а
т
ь
с
о
п
у
т
-
с
т
в
у
ю
щ
и
е
ф
а
к
т
о
р
ы
р
и
с
к
а
С
л
е
д
у
е
т
у
ч
и
т
ы
в
а
т
ь
р
а
з
н
и
ц
у
д
е
м
о
г
р
а
ф
и
ч
е
с
к
и
х
о
с
о
б
е
н
н
о
с
т
е
й
Л
Ж
—
л
е
в
ы
й
ж
е
л
у
д
о
ч
е
к
;
М
Р
Т
—
м
а
г
н
и
т
н
о
-
р
е
з
о
н
а
н
с
н
а
я
т
о
м
о
г
р
а
ф
и
я
;
П
Ж
—
п
р
а
в
ы
й
ж
е
л
у
д
о
ч
е
к
;
С
О
А
С
—
с
и
н
д
р
о
м
о
б
с
т
р
у
к
т
и
в
н
о
г
о
а
п
н
о
э
в
о
с
н
е
;
Т
Р
—
т
р
и
к
у
с
п
и
д
а
л
ь
н
а
я
р
е
г
у
р
г
и
т
а
ц
и
я
;
Ф
В
—
ф
р
а
к
ц
и
я
в
ы
б
р
о
с
а
;
Э
х
о
К
Г
—
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
я
.
С
В
О
Д
Н
А
Я
И
Н
Ф
О
Р
М
А
Ц
И
Я
Н
а
и
б
о
л
е
е
р
а
с
п
р
о
с
т
р
а
н
е
н
н
ы
е
э
х
о
к
а
р
д
и
о
г
р
а
ф
и
ч
е
с
к
и
е
о
с
о
б
е
н
н
о
с
т
и
п
р
и
к
а
р
д
и
о
м
и
о
п
а
т
и
я
х
,
к
о
т
о
р
ы
е
р
а
з
в
и
в
а
ю
т
с
я
п
р
и
м
е
т
а
б
о
л
и
ч
е
с
к
и
х
и
п
и
щ
е
в
ы
х
н
а
р
у
ш
е
н
и
я
х
In-36_для нас.indd 949
03.04.2019 12:12:26
950 ЧАСТЬ VII Сосудистые и системные заболевания
ЛИТЕРАТУРА
1. Ng M, Fleming T, Robinson M, et al.
Global, regional, and national prevalence of
overweight and obesity in children and
adults during 1980–2013: A systematic
analysis for the global burden of disease
study 2013, Lancet 384:766–781, 2014.
2. Whitlock G, Lewington S, Sherliker P, et al.
Body-mass index and cause-specific mor-
tality in 900 000 adults: collaborative analy-
ses of 57 prospective studies, Lancet
373:1083–1096, 2009.
3. Gallagher MJ, Franklin BA, Ehrman JK, et
al. Comparative impact of morbid obesity
vs heart failure on cardiorespiratory fitness,
Chest 127:2197–2203, 2005.
4. Jensen MD, Ryan DH, Apovian CM, et al.
2013 AHA/ACC/TOS guideline for the
management of overweight and obesity in
adults: a report of the American College of
Cardiology/American Heart Association
Task Force on Practice Guidelines and the
Obesity Society, Circulation 129:S102–S138,
2014.
5. Alpert MA, Omran J, Mehra A, Ardhanari
S. Impact of obesity and weight loss on
cardiac performance and morphology in
adults, Prog Cardiovasc Dis 56:391–400,
2014.
6. Fitzgibbons TP, Czech MP. Epicardial and
perivascular adipose tissues and their influ-
ence on cardiovascular disease: Basic
mechanisms and clinical associations, J Am
Heart Assoc 3:e000582, 2014.
7. Rayner JJ, Neubauer S, Rider OJ. The para-
dox of obesity cardiomyopathy and the
potential for weight loss as a therapy, Obes
Rev 16:679–690, 2015.
8. Kenchaiah S, Evans JC, Levy D, et al. Obe-
sity and the risk of heart failure, N Engl J
Med 347:305–313, 2002.
9. Devereux RB, Roman MJ, Liu JE, et al. An
appraisal of echocardiography as an epide-
miological tool. The strong heart study, Ann
Epidemiol 13:238–244, 2003.
10. Supariwala A, Makani H, Kahan J, et al.
Feasibility and prognostic value of stress
echocardiography in obese, morbidly obese,
and super obese patients referred for bariat-
ric surgery, Echocardiography 31:879–885,
2014.
11. Lang RM, Badano LP, Mor-Avi V, et al.
Recommendations for cardiac chamber
quantification by echocardiography in
adults: an update from the American Soci-
ety of Echocardiography and the European
Association of Cardiovascular Imaging, J
Am Soc Echocardiogr 28:1–39.e14, 2015.
12. Zong P, Zhang L, Shaban NM, et al. Left
heart chamber quantification in obese pa-
tients: how does larger body size affect
echocardiographic measurements? J Am Soc
Echocardiogr 27:1267–1274, 2014.
13. Rogge BP, Gerdts E, Cramariuc D, et al.
Impact of obesity and nonobesity on grad-
ing the severity of aortic valve stenosis, Am
J Cardiol 113:1532–1535, 2014.
14. Hu T, Yao L, Gustat J, et al. Which measures
of adiposity predict subsequent left ven-
tricular geometry? Evidence from the Boga-
lusa heart study, Nutr Metab Cardiovasc Dis
25:319–326, 2015.
15. Kishi S, Armstrong AC, Gidding SS, et al.
Association of obesity in early adulthood
and middle age with incipient left ventricu-
lar dysfunction and structural remodeling:
the CARDIA study (coronary artery risk
development in young adults), JACC Heart
Fail 2:500–508, 2014.
16. Mangner N, Scheuermann K, Winzer E, et
al. Childhood obesity: impact on cardiac
geometry and function, JACC Cardiovasc
Imaging 7:1198–1205, 2014.
17. Stritzke J, Markus MR, Duderstadt S, et al.
The aging process of the heart: obesity is the
main risk factor for left atrial enlargement
during aging the MONICA/KORA (moni-
toring of trends and determinations in
cardiovascular disease/cooperative research
in the region of Augsburg) study, J Am Coll
Cardiol 54:1982–1989, 2009.
18. Wong CY, O’Moore-Sullivan T, Leano R, et
al. Association of subclinical right ventricu-
lar dysfunction with obesity, J Am Coll
Cardiol 47611–616, 2006.
19. Wong CY, O’Moore-Sullivan T, Leano R, et
al. Alterations of left ventricular myocar-
dial characteristics associated with obesity,
Circulation 1103081–3087, 2004.
20. Russo C, Jin Z, Homma S, et al. Effect of
obesity and overweight on left ventricular
diastolic function: a community-based
study in an elderly cohort, J Am Coll Car-
diol 57:1368–1374, 2011.
21. Khan MF, Movahed MR. Obesity cardiomy-
opathy and systolic function: obesity is not
independently associated with dilated car-
diomyopathy, Heart Fail Rev 18:207–217,
2013.
22. Lai YH, Liu CC, Kuo JY, et al. Independent
effects of body fat and inflammatory
markers on ventricular geometry, midwall
function, and atrial remodeling, Clin Car-
diol 37:172–177, 2014.
23. Dalen H, Thorstensen A, Romundstad PR,
et al. Cardiovascular risk factors and sys-
tolic and diastolic cardiac function: a tissue
doppler and speckle tracking echocardio-
graphic study, J Am Soc Echocardiogr
24:322–332 .e326, 2011.
24. Iacobellis G, Willens HJ. Echocardiographic
epicardial fat: a review of research and
clinical applications, J Am Soc Echocardiogr
22:1311–1319, 2009. quiz 1417-1318.
25. Iacobellis G. Local and systemic effects of
the multifaceted epicardial adipose tissue
depot, Nat Rev Endocrinol 11:363–371,
2015.
26. de las Fuentes L, Waggoner AD, Moham-
med BS, et al. Effect of moderate diet-in-
duced weight loss and weight regain on
cardiovascular structure and function, J Am
Coll Cardiol 54:2376–2381, 2009.
27. Poirier P, Cornier MA, Mazzone T, et al.
American Heart Association Obesity Com-
mittee of the Council on Nutrition PyA,
and Metabolism: Bariatric surgery and car-
diovascular risk factors: a scientific state-
ment from the American Heart Association,
Circulation 123:1683–1701, 2011.
28. Cuspidi C, Rescaldani M, Tadic M, et al.
Effects of bariatric surgery on cardiac struc-
ture and function: a systematic review and
meta-analysis, Am J Hypertens 27:146–156,
2014.
29. Owan T, Avelar E, Morley K, et al. Favorable
changes in cardiac geometry and function
following gastric bypass surgery: 2-year
follow-up in the Utah obesity study, J Am
Coll Cardiol 57:732–739, 2011.
30. Kaier TE, Morgan D, Grapsa J, et al. Ven-
tricular remodelling post-bariatric surgery:
is the type of surgery relevant? A prospec-
tive study with 3D speckle tracking, Eur
Heart J Cardiovasc Imaging 15:1256–1262,
2014.
31. Fidler MC, Sanchez M, Raether B, et al. A
one-year randomized trial of lorcaserin for
weight loss in obese and overweight adults:
the BLOSSOM trial, J Clin Endocrinol Metab
96:3067–3077, 2011.
32. Kosmala W, Przewlocka-Kosmala M, Szcz-
epanik-Osadnik H, et al. Fibrosis and car-
diac function in obesity: a randomised
controlled trial of aldosterone blockade,
Heart 99:320–326, 2013.
33. Peppard PE, Young T, Barnet JH, et al. In-
creased prevalence of sleep-disordered
breathing in adults, Am J Epidemiol
177:1006–1014, 2013.
34. Kasai T, Floras JS, Bradley TD. Sleep apnea
and cardiovascular disease: a bidirectional
relationship, Circulation 126:1495–1510,
2012.
35. Chami HA, Devereux RB, Gottdiener JS, et
al. Left ventricular morphology and systolic
function in sleep-disordered breathing: the
sleep heart health study, Circulation
117:2599–2607, 2008.
36. Butt M, Dwivedi G, Shantsila A, et al. Left
ventricular systolic and diastolic function in
obstructive sleep apnea: Impact of continu-
ous positive airway pressure therapy, Circ
Heart Fail 5:226–233, 2012.
37. Imai Y, Tanaka N, Usui Y, et al. Severe ob-
structive sleep apnea increases left atrial
volume independently of left ventricular
diastolic impairment, Sleep Breath 19:1249–
1255, 2015.
38. Altekin RE, Yanikoglu A, Karakas MS, et al.
Assessment of left atrial dysfunction in ob-
structive sleep apnea patients with the two
dimensional speckle-tracking echocardiogra-
phy, Clin Res Cardiol 101:403–413, 2012.
39. Cameli M, Lisi M, Focardi M, et al. Left
atrial deformation analysis by speckle
tracking echocardiography for prediction
of cardiovascular outcomes, Am J Cardiol
110:264–269, 2012.
40. Vitarelli A, Terzano C, Saponara M, et al.
Assessment of right ventricular function in
obstructive sleep apnea syndrome and ef-
fects of continuous positive airway pressure
therapy: a pilot study, Can J Cardiol 31:823–
831, 2015.
41. Gottlieb DJ, Punjabi NM, Mehra R, et al.
Cpap versus oxygen in obstructive sleep
apnea, N Engl J Med 370:2276–2285, 2014.
42. Barbe
́
F, Dura
́
n-Cantolla J, Sa
́
nchez-de-la-
Torre M, et al. Effect of continuous positive
airway pressure on the incidence of hyper-
tension and cardiovascular events in non-
sleepy patients with obstructive sleep apnea:
a randomized controlled trial, JAMA
307:2161–2168, 2012.
43. Sun H, Shi J, Li M, Chen X. Impact of con-
tinuous positive airway pressure treatment
on left ventricular ejection fraction in pa-
tients with obstructive sleep apnea: a meta-
analysis of randomized controlled trials,
PLoS One 8:e62298, 2013.
44. Kholdani C, Fares WH, Mohsenin V. Pul-
monary hypertension in obstructive sleep
apnea: is it clinically significant? A critical
analysis of the association and pathophysi-
ology, Pulm Circ 5:220–227, 2015.
45. Kasai T, Narui K, Dohi T, et al. Prognosis of
patients with heart failure and obstructive
sleep apnea treated with continuous positive
airway pressure, Chest 133:690–696, 2008.
In-36_для нас.indd 950
03.04.2019 12:12:26
951
36 Эхокардиография при метаболических и пищевых нарушениях
45a. Cowie MR, Woehrle H, Wegscheider K, et
al. Adaptive servo-ventilation for central
sleep apnea in systolic heart failure, N Engl
J Med 373(12):1095–1105, 2015.
46. Gami AS, Witt BJ, Howard DE, et al.
Metabolic syndrome and risk of incident
cardiovascular events and death: a system-
atic review and meta-analysis of longitudi-
nal studies, J Am Coll Cardiol 49:403–414,
2007.
47. Sarwar N, Gao P, Seshasai SR, et al. Diabetes
mellitus, fasting blood glucose concentra-
tion, and risk of vascular disease: a collab-
orative meta-analysis of 102 prospective
studies, Lancet 375:2215–2222, 2010.
48. Seferovic
́
PM, Paulus WJ. Clinical diabetic
cardiomyopathy: a two-faced disease with
restrictive and dilated phenotypes, Eur
Heart J 36:1718–1727, 2015.
49. MacDonald MR, Petrie MC, Varyani F, et al.
Impact of diabetes on outcomes in patients
with low and preserved ejection fraction
heart failure: an analysis of the candesartan
in heart failure: assessment of reduction in
mortality and morbidity (CHARM) pro-
gramme, Eur Heart J 29:1377–1385, 2008.
50. Skali H, Shah A, Gupta DK, et al. Cardiac
structure and function across the glycemic
spectrum in elderly men and women free of
prevalent heart disease: the atherosclerosis
risk in the community study, Circ Heart Fail
8:448–454, 2015.
51. de las Fuentes L, Brown AL, Mathews SJ, et
al. Metabolic syndrome is associated with
abnormal left ventricular diastolic function
independent of left ventricular mass, Eur
Heart J 28:553–559, 2007.
52. Markus MR, Stritzke J, Wellmann J, et al.
Implications of prevalent and incident dia-
betes mellitus on left ventricular geometry
and function in the ageing heart: the MON-
ICA/KORA Augsburg cohort study, Nutr
Metab Cardiovasc Dis 21:189–196, 2011.
53. Zoroufian A, Razmi T, Taghavi-Shavazi M,
et al. Evaluation of subclinical left ventricu-
lar dysfunction in diabetic patients: longitu-
dinal strain velocities and left ventricular
dyssynchrony by two-dimensional speckle
tracking echocardiography study, Echocar-
diography 31:456–463, 2014.
54. Hwang YC, Jee JH, Kang M, et al. Metabolic
syndrome and insulin resistance are associ-
ated with abnormal left ventricular diastolic
function and structure independent of blood
pressure and fasting plasma glucose level, Int
J Cardiol 159:107–111, 2012.
55. Kosmala W, Przewlocka-Kosmala M, Woj-
nalowicz A, et al. Integrated backscatter as
a fibrosis marker in the metabolic syn-
drome: association with biochemical evi-
dence of fibrosis and left ventricular dys-
function, Eur Heart J Cardiovasc Imaging
13:459–467, 2012.
56. Ernande L, Bergerot C, Girerd N, et al. Lon-
gitudinal myocardial strain alteration is as-
sociated with left ventricular remodeling in
asymptomatic patients with type 2 diabetes
mellitus, J Am Soc Echocardiogr 27:479–488,
2014.
57. Gerstein HC, Miller ME, Byington RP, et al.
Group AtCCRiDS: Effects of intensive glu-
cose lowering in type 2 diabetes, N Engl J
Med 358:2545–2559, 2008.
58. Hare JL, Hordern MD, Leano R, et al. Ap-
plication of an exercise intervention on the
evolution of diastolic dysfunction in pa-
tients with diabetes mellitus: efficacy and
effectiveness, Circ Heart Fail 4:441–449,
2011.
59. Marwick TH, Hordern MD, Miller T, et al.
Council on Clinical Cardiology AHAE,
Cardiac Rehabilitation, and Prevention
Committee, Young CoCDit, Nursing CoC,
Council on Nutrition PyA, and Metabolism,
Research ICoQoCaO: Exercise training for
type 2 diabetes mellitus: impact on cardio-
vascular risk: a scientific statement from the
American Heart Association, Circulation
119:3244–3262, 2009.
60. Lago RM, Singh PP, Nesto RW. Congestive
heart failure and cardiovascular death in
patients with prediabetes and type 2 diabe-
tes given thiazolidinediones: a meta-analysis
of randomised clinical trials, Lancet
370:1129–1136, 2007.
61. Weir DL, McAlister FA, Senthilselvan A, et
al. Sitagliptin use in patients with diabetes
and heart failure: a population-based retro-
spective cohort study, JACC Heart Fail
2:573–582, 2014.
62. Dillmann W. Cardiac hypertrophy and
thyroid hormone signaling, Heart Fail Rev
15:125–132, 2010.
63. Do
rr M, Wolff B, Robinson DM, et al. The
association of thyroid function with car-
diac mass and left ventricular hypertro-
phy, J Clin Endocrinol Metab 90:673–677,
2005.
64. Taillard V, Sardinoux M, Oudot C, et al.
Early detection of isolated left ventricular
diastolic dysfunction in high-risk differen-
tiated thyroid carcinoma patients on TSH-
suppressive therapy, Clin Endocrinol (Oxf)
75:709–714, 2011.
65. Roef GL, Taes YE, Kaufman JM, et al. Thy-
roid hormone levels within reference range
are associated with heart rate, cardiac struc-
ture, and function in middle-aged men and
women, Thyroid 23:947–954, 2013.
66. Tiryakioglu SK, Tiryakioglu O, Ari H, et al.
Left ventricular longitudinal myocardial
function in overt hypothyroidism: a tissue
doppler echocardiographic study, Echocar-
diography 27:505–511, 2010.
67. Klein I, Danzi S. Thyroid disease and the
heart, Circulation 116:1725–1735, 2007.
68. Mosca S, Paolillo S, Colao A, et al. Cardio-
vascular involvement in patients affected by
acromegaly: an appraisal, Int J Cardiol
167:1712–1718, 2013.
69. Fazio S, Cittadini A, Biondi B, et al. Cardio-
vascular effects of short-term growth hor-
mone hypersecretion, J Clin Endocrinol
Metab 85:179–182, 2000.
70. Bihan H, Espinosa C, Valdes-Socin H, et al.
Long-term outcome of patients with acro-
megaly and congestive heart failure, J Clin
Endocrinol Metab 89:5308–5313, 2004.
71. Maison P, Chanson P. Cardiac effects of
growth hormone in adults with growth
hormone deficiency: a meta-analysis, Circu-
lation 108:2648–2652, 2003.
72. Isgaard J, Arcopinto M, Karason K, Citta-
dini A. Gh and the cardiovascular system:
an update on a topic at heart, Endocrine
48:25–35, 2015.
73. Neary NM, Booker OJ, Abel BS, et al. Hy-
percortisolism is associated with increased
coronary arterial atherosclerosis: analysis of
noninvasive coronary angiography using
multidetector computerized tomography, J
Clin Endocrinol Metab 98:2045–2052, 2013.
74. Yiu KH, Marsan NA, Delgado V, et al. In-
creased myocardial fibrosis and left ven-
tricular dysfunction in Cushing’s syndrome,
Eur J Endocrinol 166:27–34, 2012.
75. Kamenicky
́
P, Redheuil A, Roux C, et al.
Cardiac structure and function in Cushing’s
syndrome: a cardiac magnetic resonance
imaging study, J Clin Endocrinol Metab
99:E2144–E2153, 2014.
76. van Ballegooijen AJ, Reinders I, Visser M,
Brouwer IA. Parathyroid hormone and
cardiovascular disease events: a systematic
review and meta-analysis of prospective
studies, Am Heart J165:655–664, 2013.
77. Bansal N, Zelnick L, Robinson-Cohen C, et
al. Serum parathyroid hormone and 25-hy-
droxyvitamin d concentrations and risk of
incident heart failure: the multi-ethnic
study of atherosclerosis, J Am Heart Assoc
3:e001278, 2014.
78. Iwata S, Walker MD, Di Tullio MR, et al.
Aortic valve calcification in mild primary
hyperparathyroidism, J Clin Endocrinol
Metab 97:132–137, 2012.
79. Walker MD, Rundek T, Homma S, et al.
Effect of parathyroidectomy on subclinical
cardiovascular disease in mild primary hy-
perparathyroidism, Eur J Endocrinol
167:277–285, 2012.
80. Li L, Zhu W, Fang L, et al. Transthoracic
echocardiographic features of cardiac pheo-
chromocytoma: a single-institution experi-
ence, Echocardiography 29:153–157, 2012.
81. Weismann D, Liu D, Bergen T, et al. Hyper-
tension and hypertensive cardiomyopathy
in patients with a relapse-free history of
phaeochromocytoma, Clin Endocrinol (Oxf)
82:188–196, 2015.
82. Prejbisz A, Lenders JW, Eisenhofer G, Ja-
nuszewicz A. Cardiovascular manifestations
of phaeochromocytoma, J Hypertens
29:2049–2060, 2011.
83. Park JH, Kim KS, Sul JY, et al. Prevalence
and patterns of left ventricular dysfunction
in patients with pheochromocytoma, J Car-
diovasc Ultrasound 19:76–82, 2011.
84. Wiese S, Hove JD, Bendtsen F, Moller S.
Cirrhotic cardiomyopathy: pathogenesis
and clinical relevance, Nat Rev Gastroen-
terol Hepatol 11:177–186, 2014.
85. Fede G, Privitera G, Tomaselli T, et al. Car-
diovascular dysfunction in patients with
liver cirrhosis, Ann Gastroenterol 28:31–40,
2015.
86. Pellicori P, Torromeo C, Calicchia A, et al.
Does cirrhotic cardiomyopathy exist? 50
years of uncertainty, Clin Res Cardiol
102:859–864, 2013.
87. Nazar A, Guevara M, Sitges M, et al. Left
ventricular function assessed by echocar-
diography in cirrhosis: relationship to sys-
temic hemodynamics and renal dysfunc-
tion, J Hepatol 58:51–57, 2013.
88. Sampaio F, Pimenta J, Bettencourt N, et al.
Systolic and diastolic dysfunction in cir-
rhosis: a tissue-doppler and speckle tracking
echocardiography study, Liver Int 33:1158–
1165, 2013.
89. Rabie RN, Cazzaniga M, Salerno F, Wong F.
The use of e/a ratio as a predictor of out-
come in cirrhotic patients treated with
transjugular intrahepatic portosystemic
shunt, Am J Gastroenterol 104:2458–2466,
2009.
90. Karagiannakis DS, Vlachogiannakos J, An-
astasiadis G, et al. Diastolic cardiac dysfunc-
tion is a predictor of dismal prognosis in
patients with liver cirrhosis, Hepatol Int
8:588–594, 2014.
In-36_для нас.indd 951
03.04.2019 12:12:26
952
ЧАСТЬ VII Сосудистые и системные заболевания
91. Torregrosa M, Aguade
́
S, Dos L, et al. Car-
diac alterations in cirrhosis: reversibility
after liver transplantation, J Hepatol 42:68–
74, 2005.
92. Fouad TR, Abdel-Razek WM, Burak KW, et
al. Prediction of cardiac complications after
liver transplantation, Transplantation 87:
763–770, 2009.
93. Lentine KL, Costa SP, Weir MR, et al. Dis-
ease AHACotKiCDaCoPV: Cardiac disease
evaluation and management among kidney
and liver transplantation candidates: a sci-
entific statement from the American Heart
Association and the American College of
Cardiology Foundation, J Am Coll Cardiol
60:434–480, 2012.
94. Tumgor G. Cirrhosis and hepatopulmonary
syndrome, World J Gastroenterol 20:2586–
2594, 2014.
95. Cheung TK, Tam W, Bartholomeusz D, et
al. Hepatic hydropericardium, J Gastroen-
terol Hepatol 19:109–112, 2004.
96. Badillo R, Rockey DC. Hepatic hydrotho-
rax: clinical features, management, and
outcomes in 77 patients and review of the
literature, Medicine (Baltimore) 93:135–142,
2014.
97. Martin P, DiMartini A, Feng S, et al. Evalu-
ation for liver transplantation in adults:
2013 practice guideline by the American
Association for the Study of Liver Diseases
and the American Society of Transplanta-
tion, Hepatology 59:1144–1165, 2014.
98. Harinstein ME, Flaherty JD, Ansari AH, et
al. Predictive value of dobutamine stress
echocardiography for coronary artery dis-
ease detection in liver transplant candidates,
Am J Transplant 8:1523–1528, 2008.
99. Umphrey LG, Hurst RT, Eleid MF, et al.
Preoperative dobutamine stress echocardio-
graphic findings and subsequent short-term
adverse cardiac events after orthotopic liver
transplantation, Liver Transpl 14:886–892,
2008.
100. Maraj S, Jacobs LE, Maraj R, et al. Inducible
left ventricular outflow tract gradient dur-
ing dobutamine stress echocardiography: an
association with intraoperative hypotension
but not a contraindication to liver trans-
plantation, Echocardiography 21:681–685,
2004.
101. Moller S, Bernardi M. Interactions of the
heart and the liver, Eur Heart J 34:2804–
2811, 2013.
102. Beulens JW, Algra A, Soedamah-Muthu SS,
et al. Alcohol consumption and risk of re-
current cardiovascular events and mortality
in patients with clinically manifest vascular
disease and diabetes mellitus: the second
manifestations of arterial (smart) disease
study, Atherosclerosis 212:281–286, 2010.
103. Dorans KS, Mostofsky E, Levitan EB, et al.
Alcohol and incident heart failure among
middle-aged and elderly men: cohort of
Swedish men, Circ Heart Fail 8:422–427,
2015.
104. Iacovoni A, De Maria R, Gavazzi A. Alco-
holic cardiomyopathy, J Cardiovasc Med
(Hagerstown) 11:884–892, 2010.
105. George A, Figueredo VM. Alcoholic cardio-
myopathy: a review, J Card Fail 17:844–849,
2011.
106. Guzzo-Merello G, Segovia J, Dominguez F,
et al. Natural history and prognostic factors
in alcoholic cardiomyopathy, JACC Heart
Fail 3:78–86, 2015.
107. Sert A, Aypar E, Pirgon O, et al. Left ven-
tricular function by echocardiography, tis-
sue doppler imaging, and carotid intima-
media thickness in obese adolescents with
nonalcoholic fatty liver disease, Am J Car-
diol 112:436–443, 2013.
108. Karabay CY, Kocabay G, Kalayci A, et al.
Impaired left ventricular mechanics in non-
alcoholic fatty liver disease: a speckle-
tracking echocardiography study, Eur J
Gastroenterol Hepatol 26:325–331, 2014.
109. Petta S, Argano C, Colomba D, et al. Epi-
cardial fat, cardiac geometry and cardiac
function in patients with non-alcoholic
fatty liver disease: association with the se-
verity of liver disease, J Hepatol 62:928–
933, 2015.
110. VanWagner LB, Wilcox JE, Colangelo LA, et
al. Association of nonalcoholic fatty liver
disease with subclinical myocardial remod-
eling and dysfunction: a population-based
study, Hepatology 62:773–783, 2015.
111. Avelar E, Cloward TV, Walker JM, et al. Left
ventricular hypertrophy in severe obesity:
interactions among blood pressure, noctur-
nal hypoxemia, and body mass, Hyperten-
sion 49:34–39, 2007.
112. Epstein LJ, Kristo D, Strollo PJ, et al. Medi-
cine AOSATFotAAoS. Clinical guideline for
the evaluation, management and long-term
care of obstructive sleep apnea in adults, J
Clin Sleep Med 5:263–276, 2009.
113. Fox CS, Golden SH, Anderson C, et al.
American Heart Association Diabetes Com-
mittee of the Council on Lifestyle and Car-
diometabolic Health CoCC, Council on
Cardiovascular and Stroke Nursing, Council
on Cardiovascular Surgery and Anesthesia,
Council on Quality of Care and Outcomes
Research, American Diabetes Association:
Update on prevention of cardiovascular
disease in adults with type 2 diabetes melli-
tus in light of recent evidence: a scientific
statement from the American Heart Asso-
ciation and the American Diabetes Associa-
tion, Circulation 132:691–718, 2015.
114. Krag A, Bendtsen F, Henriksen JH, Moller
S. Low cardiac output predicts development
of hepatorenal syndrome and survival in
patients with cirrhosis and ascites, Gut
59:105–110, 2010.
115. Ripoll C, Catalina MV, Yotti R, et al. Car-
diac dysfunction during liver transplanta-
tion: incidence and preoperative predictors,
Transplantation 85:1766–1772, 2008.
116. Safadi A, Homsi M, Maskoun W, et al.
Perioperative risk predictors of cardiac out-
comes in patients undergoing liver trans-
plantation surgery, Circulation 120:1189–
1194, 2009.
117. Donovan CL, Marcovitz PA, Punch JD, et
al. Two-dimensional and dobutamine
stress echocardiography in the preopera-
tive assessment of patients with end-stage
liver disease prior to orthotopic liver trans-
plantation, Transplantation 61:1180–1188,
1996.
118. Ramsay MA, Simpson BR, Nguyen AT, et
al. Severe pulmonary hypertension in liver
transplant candidates, Liver Transpl Surg
3:494–500, 1997.
In-36_для нас.indd 952
03.04.2019 12:12:26
953
37 Эхокардиография у спортсменов
DAVID PRIOR, MBBS, BMEDSC, PHD • MARIA BROSNAN, MBBS, PH
Влияние физической нагрузки
на структуру и функцию сердца
Влияние различных типов физической
нагрузки
Левый желудочек
Структура левого желудочка
Систолическая функция левого
желудочка
Диастолическая функция левого
желудочка
Правый желудочек
Структура правого желудочка
Функция правого желудочка
Предсердия
Аорта
Электрическое ремоделирование
Эффекты разгрузки
Эхокардиографический скрининг
у спортсменов
Методические рекомендации
Стресс-эхокардиография
Технические решения и физиологические
различия
Острые эффекты физической нагрузки
Альтернативные способы
визуализации
Проблемы, связанные
с визуализацией в клинике
Патологии клапанов сердца
у спортсменов
Спортсмены, тренирующие выносливость,
или дилатационная кардиомиопатия
Ремоделирование спортивного сердца
или патологическая гипертрофия
желудочка
Спортсмены, тренирующие выносливость,
или кардиомиопатия правого
желудочка
Определение: может ли спортсмен
продолжать соревноваться без угрозы
здоровью
Регулярные спортивные тренировки являются при-
чиной изменений структуры и функции сердца, что
приводит к прогрессу в спортивных достижениях.
Характер и значимость этих изменений зависит от
типа и объема выполняемых тренировок, но могут
приводить к изменениям параметров структуры
и функции сердца, которые выходят за пределы
нормальных значений общей популяции. Для вра-
ча функциональной ультразвуковой диагностики
сердца важно понимать характеристики «спортив-
ного сердца» и нормальные пределы изменений
такого сердца. Но более важным является понима-
ние того, как отличать эти изменения от заболева-
ний сердца, которые могут встречаться у спортсме-
нов и могут быть связаны с внезапной смертью
сердца. Иногда данные, полученные при проведе-
нии эхокардиографии (ЭхоКГ), могут быть опреде-
ляющими при решении, может ли человек зани-
маться серьезным или любительским спортом. В
этой главе приведены структурные и функциональ-
ные характеристики спортивного сердца, в особен-
ности, как это связано с эхокардиографическим
исследованием, некоторые наиболее значимые про-
блемы в клинике, которые могут быть оценены с
использованием ультразвука сердца, и как эхокар-
диографические данные могут быть использованы
при ведении пациентов.
ВЛИЯНИЕ ФИЗИЧЕСКОЙ НАГРУЗКИ
НА СТРУКТУРУ И ФУНКЦИЮ СЕРДЦА
Известно, что регулярные занятия спортом приво-
дят к изменению структуры и функции сердца,
формируя фенотип, известный как «спортивное
сердце». Периодические нагрузки объемом (предна-
грузка) и давлением (постнагрузка) на сердце во
время тренировки активируют генетические пути,
что выражается в физиологической гипертрофии
сердца и расширении камер сердца, а также измене-
нии вегетативного тонуса и проводимости сердца.
Однако спортивное сердце характеризуется не од-
ним определенным фенотипом, но различными
изменениями, которые варьируют в зависимости от
выбранной спортивной дисциплины и от интенсив-
ности проводимых тренировок. Как правило, более
интенсивные тренировки приводят к более значи-
тельной перестройке сердца, и изменения количе-
ства статических (силовых или с сопротивлением)
и динамических (на выносливость) тренировок бу-
дут определять результирующий фенотип.
Для оценки находятся ли полученные в ходе эхо-
кардиографического исследования данные в физио-
логических пределах или патологических, сначала
необходимо установить: выполняет ли обследуемый
тренировки с физической нагрузкой, достаточные
для формирования спортивного сердца. Изменения
In-37_для нас.indd 953
03.04.2019 12:12:39
954
ЧАСТЬ VII Сосудистые и системные заболевания
в сердце спортсмена, такие как брадикардия, повы-
шенная аэробная выносливость и увеличение массы
левого желудочка, наблюдаются у индивидуумов,
занимающихся непрофессионально спортом > 3 час
в неделю [1], так что основной вопрос при оценке
«спортсменов» заключается в том, выполняют ли
они достаточный объем соответствующих упраж-
нений, это соответственно могло бы объяснить не-
которые изменения, обнаруженные при проведении
ЭхоКГ. Известно, что как объем физической нагруз-
ки, так и изменения в сердце спортсмена не являют-
ся критериями и каждый из них имеет определен-
ный диапазон значений, т.к. больший объем и по-
вышенная интенсивность тренировок приводят к
более значительным изменениям структуры и
функции сердца поэтому решение нужно прини-
мать не только при достижении порога у спортсме-
нов и в соответствии со степенью ремоделирования
сердца. Вследствие этого, зачастую принятие реше-
ния должно быть определено не только тем, соот-
носятся ли размеры сердца с пограничными значе-
ниями спортивного сердца, но также соответствует
ли степень перестройки сердца объему, интенсив-
ности и типу выполняемых тренировок. Таким об-
разом, ожидаемые изменения у спортсмена-люби-
теля могут быть отличны от изменений у элитного
или профессионального спортсмена.
Тренировки с физической нагрузкой, выполняе-
мые спортсменами всех возрастов, от детей до ма-
стеров спорта, и заболевания сердца, от которых
они, вероятно, могут страдать и которые должны
быть дифференцированы от спортивного сердца,
будут зависеть от возраста. Более молодые спор-
тсмены, вероятно, больше зависимы от врожденных
патологий сердца, таких как гипертрофическая
кардиомиопатия, кардиомиопатия ПЖ и аномалии
коронарных артерий. Спортсмены старшего возрас-
та (чаще всего их определяют, как спортсмены
старше 35 лет) больше страдают от приобретенных
заболеваний сердца, например, коронарной болез-
ни сердца, в дополнение к врожденным патологиям,
которые наблюдаются у более молодых спортсме-
нов. Возможно, что изменения в спортивном сердце
могут быть подвержены возрастным изменениям,
но это еще не до конца установлено. Неизвестно,
насколько возраст и при какой интенсивности фи-
зической нагрузки начинал влиять на степень из-
менений сердца спортсмена. Напротив, физические
упражнения могут модулировать соответствующие
возрасту изменения в сердце. У лиц, которые по
собственному желанию на протяжении всей жизни
занимались спортом, было отмечено снижение нор-
мального возраст-зависимого уменьшения подат-
ливости ЛЖ [2].
ВЛИЯНИЕ РАЗЛИЧНЫХ ТИПОВ
ФИЗИЧЕСКОЙ НАГРУЗКИ
Спортивные дисциплины достаточно сильно раз-
личаются по объему статических и динамических
нагрузок, влияющих на сердце, а также относитель-
ной интенсивности этих различных нагрузок. Кон-
цепция того, что различные виды упражнений будут
иметь различные влияния на фенотип сердца, со-
гласно гипотезе Morganroth [3], разработана на ос-
новании данных перекрестного исследования мор-
фологии ЛЖ с применением М-режима измерений
у небольшой группы спортсменов, тренирующих
выносливость (n = 30) и силу (n = 16). При наиболее
незначительном уровне это означает, что при дина-
мических (на выносливость) тренировках имеет
место нагрузка объемом на сердце и при статиче-
ских (силовых) тренировках имеет место нагрузка
давлением на сердце, что выражается в типе пере-
стройки сердца. На основании этого потребовалась
классификация спортивных дисциплин, основан-
ная на характеристиках прикладываемых во время
тренировок физических нагрузок. Упрощенная та-
блица, представляющая эту классификацию, про-
демонстрирована в табл. 37.1 . С более полной клас-
Динамический компонент
Низкий
Средний
Высокий
Статический
компонент
Низкий
Гольф
Крикет
Боулинг
Бейсбол
Фехтование
Волейбол
Хоккей на траве
Бег на длинные дистанции
Футбол
Средний
Стрельба из лука
Дайвинг
Конный спорт
Американский футбол
Прыжки в длину
Бег на короткие
дистанции
Регби
Бег на средние дистанции
Плавание
Баскетбол
Хоккей на льду
Беговые лыжи
Высокий
Метание предметов
Тяжелая атлетика
Спортивная гимнастика
Боевые искусства
Горнолыжный спорт
Бодибилдинг
Сноубординг
Борьба
Велоспорт
Триатлон
Гребля
Каное/каяк
ТАБЛИЦА 37.1 Примеры спортивных дисциплин, объединенных по динамическим (выносливость)
и статическим (сила) компонентам
In-37_для нас.indd 954
03.04.2019 12:12:39
955
37 Эхокардиография у спортсменов
сификацией можно ознакомиться в работе специ-
альной комиссии, возглавляемой Mitchell [4].
При динамической нагрузке имеет место нагруз-
ка объемом на сердечно-сосудистую систему со
значительным увеличением сердечного выброса,
необходимого во время тренировки, что достигает-
ся повышением частоты сердечных сокращений и
ударного объема (УО) и сопровождается увеличе-
нием систолического артериального давления, сни-
жением диастолического давления и только незна-
чительным повышением среднего артериального
давления. Абсолютно динамические виды спорта,
как например марафонский бег, приводят к расши-
рению камер с увеличением сердечных объемов, но
не значительному утолщению стенок сердца (рис.
37.1). При статических нагрузках имеет место более
умеренная нагрузка объемом (преднагрузка) с не-
значительным увеличением частоты сердечных со-
кращений, но характеризуется значительной на-
грузкой давлением (постнагрузкой), что является
результатом повышения систолического, диастоли-
ческого и среднего артериального давления. Тра-
диционная концепция, соответствующая гипотезе
Morganroth, говорит о том, что у спортсменов,
тренирующих выносливость, развивается увели-
чение объемов и размеров полости ЛЖ при нор-
мальной толщине его стенок или их увеличение
развивается пропорционально размерам полостей
(эксцентрическая гипертрофия левого желудочка
[ГЛЖ]). Тогда как у спортсменов, которые выпол-
няют силовые тренировки, развивается утолщение
стенок ЛЖ (концентрическая ГЛЖ) с относительно
нормальными размерами и объемами полости ЛЖ.
Однако современная теория подвергает сомнению
эту концепцию. В подавляющем большинстве ис-
следований последних лет не был подтвержден фе-
номен концентрической гипертрофии у спортсме-
нов, выполняющих силовые нагрузки, у которых
показатели толщины стенок ЛЖ в пределах нор-
мальных показателей для молодых и более старше-
го возраста спортсменов, тренирующих исключи-
тельно силу, а также показатели полости ЛЖ сход-
ные или немного выше, чем в контроле у лиц,
ведущих малоподвижный образ жизни [5–8].
Более того, при проведении перспективных ис-
следований в пользу подтверждения гипотезы Mor-
ganroth о влиянии физической нагрузки на эксцен-
трическую перестройку у испытуемых, тренирую-
щих исключительно выносливость или трениру-
ющих и выносливость и силу, развития концентри-
ческой ГЛЖ у субъектов, тренирующих исключи-
тельно силу, выявлено не было [9, 10]. Возможно,
оценка эффектов силовых тренировок могла быть
не полноценной из-за применения анаболиков в
этой группе спортсменов. Наиболее серьезные из-
менения как в показателях гипертрофии камер
сердца, так и в увеличении его массы были соот-
ветствующим образом продемонстрированы у тех
субъектов, которые заняты спортивной деятель-
ностью с вовлечением комбинации значительных
статических и динамических составляющих, такой
как академическая гребля, гребля на каноэ, вело-
спорт [8, 11, 12]. В этой группе спортсменов так-
же частоту встречаются электрокардиографические
(ЭКГ) изменения [13].
ЭхоКГ играет решающую роль в нашем понима-
нии влияния физической нагрузки на сердце и в
выявлении нормальных изменений в структуре и
функции спортивного сердца, что обусловлено не
инвазивной природой этого метода. Большинство
имеющихся данных о спортивном сердце были об-
условлены эхокардиографическими исследования-
ми у групп спортсменов, которых сравнивали с
контрольной группой здоровых не спортсменов.
Хотя этот метод был существенным в понимании
особенностей спортивного сердца, зачастую в груп-
пе спортсменов присутствовали субъекты с более
крайними фенотипами, которых легче отличить
среди не спортсменов. Это, безусловно, затрудняет
точное определение пограничных значений для
Рис. 37.1 Здоровое молодое сердце (A), сердце профессионального футболиста (Б) и профессионального велосипедиста (В) в апикаль-
ных четырехкамерных проекциях. Секторы были выровнены, и линия помещена на метку глубины сектора 10 см для иллюстрирования степени пере-
стройки сердца в здоровом спортивном сердце у спортсменов, тренирующих выносливость, а также сочетано силу и выносливость.
А
Б
В
In-37_для нас.indd 955
03.04.2019 12:12:39
956 ЧАСТЬ VII Сосудистые и системные заболевания
широкого использования этих показателей во всем
мире, что обусловлено возможным перекрытием
исследуемых параметров между спортсменами, не
спортсменами и субъектами с сердечной патологи-
ей. Кроме того, во многих исследованиях для опре-
деления нормальных показателей не учитывают
особенности различных спортсменов, а также тип и
интенсивность тренировок. В табл. 37.2 представле-
ны нормальные структурные и функциональные
показатели сердца у спортсменов по полу, возрасту
и расовому происхождению.
ЛЕВЫЙ ЖЕЛУДОЧЕК
СТРУКТУРА ЛЕВОГО ЖЕЛУДОЧКА
В результате регулярных тренировок масса ЛЖ уве-
личивается, и характер этого увеличения частично
определяется типом тренировок, выполняемых
спортсменом, как было описано ранее. Для врача
функциональной ультразвуковой диагностики, ко-
торый пытается отличить физиологическую пере-
стройку сердца от его патологии, основным кри-
терием оценки служит то, попадают или нет по-
казатели эхокардиографического исследования в
ожидаемые пределы показателей, допустимых при
данном виде интенсивности выполняемых обследу-
емыми спортсменами физических нагрузок. В боль-
шинстве исследований при определении уровней
нормальных показателей структуры ЛЖ, использо-
вали М-режим для измерения внутренних конечно-
диастолического и конечно-систолического диаме-
тров, толщины перегородочной стенки и конечно-
диастолической толщины задней стенки ЛЖ с
учетом критериев, которые обычно использовались
для определения относительной толщины стенки и,
часто, массы [14]. В других работах были представ-
лены измерения объемов ЛЖ, которые были полу-
чены либо в результате ЭхоКГ, либо магнитно-ре-
зонансной томографии (МРТ) сердца [15].
При исключительно динамических тренировках
масса, объем, размеры ЛЖ и толщина стенки уве-
личиваются [14], хотя степень расширения камер и
утолщения стенок имеют тенденцию оставаться
пропорциональной так, что относительная толщи-
на стенок, по данным многих исследований, сходна
с таковой у не спортсменов. В тренировках с абсо-
лютно статическими нагрузками размеры ЛЖ оста-
ются нормальными или слегка увеличенными с
нормальными или утолщенными стенками. В боль-
шинстве случаев поддерживаемое мнение, что кон-
центрический тип гипертрофии рассматривают как
результат силовых тренировок, является некоррект-
ным, и меньшая по сравнению с нормой полость
ЛЖ может повышать вероятность гипертрофиче-
ской кардиомиопатии.
Наиболее серьезные изменения, наблюдаются у
спортсменов, выполняющих как силовые трени-
ровки, так и тренировки на выносливость, таких как
велосипедисты, пловцы и гребцы. В большинстве
исследований с участием этих спортсменов показа-
но, что они имеют наибольшую массу и размеры
ЛЖ, однако относительная толщина стенок увели-
чена не так, как она увеличена у спортсменов, вы-
полняющих исключительно силовые тренировки.
Следует отметить, что многие исследования были
выполнены с участием спортсменов-любителей и
что изменения, наблюдаемые у элитных и профес-
сиональных спортсменов, могут быть действитель-
но серьезными по сравнению с уровнями показате-
лей, представленных во многих перекрестных ис-
следованиях (см. рис. 37.1).
В результате этих исследований, параметрами
структуры сердца, которые были наиболее широко
использованы для отличия здоровых спортсменов
от таковых с врожденными патологиями сердца, как
например гипертрофическая кардиомиопатия, бы-
ли измерения толщины стенок ЛЖ и относительной
толщины стенок. У спортсменов толщина стенки
< 13 мм у мужчин и 11 мм у женщин считается
нормальной (рис. 37.2). Толщина стенки > 15 мм у
темнокожих мужчин-спортсменов, > 14 мм у свет-
локожих мужчин-спортсменов и > 13 мм у женщин-
спортсменок считаются за пределами нормы. Это
выходит за пределы «серой зоны» между этими
значениями, где может быть необходима диффе-
ренцировка между физиологией и патологией.
Очевидно, что исходные данные, связанные с по-
лом, возрастом и расой влияют на фенотип спортив-
ного сердца. Тогда как направление изменений сход-
но с тренировками, размеры, толщина стенки, и
масса ЛЖ меньше у женщин, чем у мужчин, даже
когда эти показатели пересчитывают на массу тела.
Наиболее распространенные из имеющихся объяс-
нений для этих различий подразумевают под собой
эффекты андрогенов. Однако опубликованные дан-
ные о размерах сердца женщин-спортсменок, осо-
бенно элитных, тренирующих выносливость, явля-
ются разрозненными. Таким образом, дальнейшего
изучения требует вопрос о том, возможно ли разви-
тие адаптации организма у женщин-спортсменок,
также выполняющих большой объем физических
упражнений высокой интенсивности, в той же степе-
ни, что и у мужчин-спортсменов. В настоящее время
для женщин-спортсменок используются различные
уровни нормальных показателей (см. табл. 37.2).
У спортсменов-подростков имеется тенденция к
развитию изменений их спортивного сердца в
меньшей степени, что становится более заметным в
период их полового созревания. Вследствие этого
предлагаются различные уровни нормальных зна-
чений для молодых спортсменов (см. табл. 37.2).
Вопрос о том, являются ли эти различия действи-
тельно свойством развивающегося сердца или это
связанно с меньшим объемом выполняемых трени-
ровок по сравнению со взрослыми спортсменами,
остается открытым. По этим публикациям, спорт-
In-37_для нас.indd 956
03.04.2019 12:12:39
957
37 Эхокардиография у спортсменов
Нормальные
значения
Рекомендованные
по ассоциации
Молодые
спортсмены
кавказского
происхождения
Взрослые
спортсмены
кавказского
происхождения
Молодые
темнокожие
спортсмены
карибского
происхождения
Взрослые
темнокожие
спортсмены
карибского
происхождения
Мужчины
ТСЛЖ (мм)
6–10
6–13 (> 12)
7–14 (> 12)
6–14 (> 12)
8–16 (> 14)
ВРЛЖд (мм)
42–58
45–60 (> 60)
42–66 (> 60)
35–62 (> 60)
44–64 (> 60)
ОТС
0,34–0,37
0,27–0,43
0,37–0,48
0,30–0,58
Линейная масса ЛЖ (г)
88–224
42–465
113–489
109–329
113–618
Масса ЛЖ (г) 2D
96–200
42–465
КДО ЛЖ (мл)
62–150
180–340 (> 330) 65–153
Индекс КДО ЛЖ (мл/м2)
34–74
ФВ ЛЖ (%)
52–72
41–77 (< 45)
50–76 (< 50)
ГПД (%)
14–21
Диаметр ЛП
25–41 (> 40)
29–45 (> 45)
25–44 (> 40)
Индекс объема ЛП (мл/м2) 16–34
25–57
КДО ПЖ (мл)
200–390 (> 375)
ФВ ПЖ (%)
40–58 (< 45)
Женщины
ТСЛЖ (мм)
6–9
6–11 (> 10)
7–11 (> 10)
7–11 (> 10)
6–13 (> 11)
ВРЛЖд (мм)
38–52
41–55 (> 55)
40–66 (> 55)
39–60 (> 55)
Линейная масса ЛЖ (г)
67–162
54–268
67–261
95–322
Масса ЛЖ (г) 2D
66–150
КДО ЛЖ (мл)
46–106
140–260 (> 260)
Индекс КДО ЛЖ (мл/м2)
29–61
ФВ ЛЖ (%)
54–74
44–76 (< 45)
41–78 (< 45)
Диаметр ЛП
24–40 (> 40)
21–41 (> 40)
Индекс объема ЛП (мл/м2) 16–34
17–39
КДО ПЖ (мл)
150–290 (> 280)
ФВ ПЖ (%)
40–67 (< 45)
Примечание. Спортсмены не были разделены согласно типу выполняемых ими тренировок. Вероятно, значения являются патологически-
ми, для которых предписаны дальнейшие исследования, как указано в скобках [14, 16, 17, 35–37, 86–96].
ВРЛЖд — конечно -диастолический внутренний размер левого желудочка; ГПД — глобальная продольная деформация; КДО — конечно -
диастолический объем; ЛЖ — левый желудочек; ЛП — левое предсердие; ОТС — относительная толщина стенки; ПЖ — правый желу-
дочек; ТСЛЖ — толщина стенки левого желудочка; ФВ — фракция выброса.
ТАБЛИЦА 37.2 Представленные в литературе пределы нормальных значений структуры и функции сердца
у спортсменов с учетом пола, возраста и расового происхождения
смены-подростки в большей степени были суб-
элитными спортсменами, которые не тренировали
выносливость, тогда как данные по адаптации серд-
ца в группах элитных спортсменов-подростков,
которые могли 3–4 года выполнять интенсивные
тренировки на выносливость, отсутствуют.
У спортсменов афро-карибского происхождения
также было показано утолщение стенки по сравне-
нию с соответствующими светлокожими спортсме-
нами, таким образом, необходимо использовать
различные уровни значений для определения уров-
ня нормальных показателей. Например, верхнее
нормальное значение толщины стенки у светлоко-
жих спортсменов равен 12 мм, однако у здоровых
мужчин-спортсменов афро-карибского происхож-
дения этот показатель может достигать 15 мм [16]
(см. рис. 37.2). Толщина стенки у темнокожих спор-
тсменов также больше, чем таковая у соответствую-
щих светлокожих спортсменов. Толщина стенки у
светлокожих женщин-спортсменок больше 11 мм
встречается редко, однако у темнокожих женщин-
спортсменок толщина стенки доходит до 13 мм [17].
In-37_для нас.indd 957
03.04.2019 12:12:39
958 ЧАСТЬ VII Сосудистые и системные заболевания
Определение влияния препаратов, повышающих
эффективность тренировок, на структуру и функ-
цию сердца затруднено вследствие того, что боль-
шинство спортсменов неохотно соглашаются на их
применение. В одном исследовании с использова-
нием МРТ сердца у спортсменов, тренирующих
силу, спортсменов разделили на тех, которые при-
меняли анаболики и тех, которые их не применяли
[18]. При этом было показано, что спортсмены,
выполняющие силовые тренировки и не использу-
ющие анаболические стероиды, имели сходную
толщину стенки ЛЖ, объемы желудочков, и фрак-
цию выброса ЛЖ (ФВ)) по сравнению с таковымиу
не спортсменов. Тогда как те спортсмены, которые
принимали анаболические стероиды, имели боль-
шие объемы ЛЖ, более толстые стенки и меньшую
ФВ ЛЖ по сравнению с таковыми показателями как
у не спортсменов, так и у спортсменов, выполняю-
щих силовые тренировки и не принимающих ана-
болические стероиды. Эти данные также были под-
тверждены в исследовании с использованием ЭхоКГ
[19]. Эхокардиографические исследования также
подтверждают то, что применение анаболических
стероидов вызывает отклонения: при допплерогра-
фическом исследовании выявлены нарушения как
систолической [20], так и диастолической функции
[19]. Является ли это возможной причиной того,
что исключительно силовые тренировки действи-
тельно не связаны со значительными изменениями
во время различных исследований структуры ЛЖ,
и что имеющиеся в литературе данные по нормаль-
ному сердцу у спортсменов с исключительно сило-
выми тренировками были измерены на фоне неза-
явленного применения анаболических стероидов, и
причина в повышенном артериальном давлении у
исследуемых участников. В работе Луикса была
проведена МРТ сердца в группе спортсменов, ис-
пользующих сочетанные, силовые и на выносли-
вость, тренировки. При этом были подтверждены
предыдущие данные эхокардиографических иссле-
дований об увеличении объемов ЛЖ и толщины
стенок в данной группе испытуемых [18].
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
На основании двух крупных метаанализов были
представлены данные о сходной ФВ у спортсменов
по сравнению с общей популяцией [5, 14]. Однако
также наблюдали ФВ ЛЖ ниже, чем в покое в норме
с сохранным ударным объемом у здоровых элит-
ных спортсменов, тренирующих выносливость, у
которых отмечали выраженные изменения объемов
всех четырех камер сердца [21]. Иными словами,
здоровому увеличенному ЛЖ требуется менее ак-
тивное сокращение и меньшая ФВ ЛЖ для обеспе-
чения нормального сердечного выброса в покое
(рис. 37.3). В случаях неясности может быть полез-
ной визуализация сердца во время физической на-
грузки для дифференцирования расширенного
спортивного сердца от дилатационной кардиомио-
патии. Таким образом, целесообразно применение
стресс-ЭхоКГ, т.к. у здоровых спортсменов следует
ожидать нормальное увеличение показателей во
время физической нагрузки (см. Острые эффекты
физической нагрузки на сердце).
Меньше известно о влиянии спортивной дея-
тельности на непосредственное измерение функции
миокарда, например, скорость движения тканей
миокарда, деформации и скорости деформации. По
данным большинства исследований, у спортсменов
с покое наблюдались нормальная или супранор-
мальная скорости систолического движения мио-
карда ЛЖ [22, 23]. В качестве точного дискрими-
натора между патологической ГЛЖ LVH и спор-
тивным сердцем было предложено пограничное
значение, равное 9 см/сек для максимальной систо-
лической скорости (s′, усредненная по четырем
участкам кольца митрального клапана) [24]. Однако
в недавних исследованиях было показано, что у
спортсменов с гипертрофической кардиомиопати-
ей (ГКМ), возможно, не изменялись скорости дви-
7
0
5
10
15
20
25
8910111213141516
678910111213
0
5
10
25
35
40
30
15
20
3%
Мужчины
Женщины
Светлокожие спортсмены
Темнокожие спортсмены
Светлокожие спортсмены
Темнокожие спортсмены
К
о
л
и
ч
е
с
т
в
о
с
п
о
р
т
с
м
е
н
о
в
(
%
)
Толщина стенки ЛЖ (мм)
Максимальная толщина стенки ЛЖ (мм)
К
о
л
и
ч
е
с
т
в
о
с
п
о
р
т
с
м
е
н
о
в
(
%
)
Рис. 37.2 Распространенность толщины стенки левого желудочка у мужчин-спортсменов (слева) и женщин-спортсменок (справа) в
соответствии с расовым происхождением. Толщина стенки у темнокожих мужчин-спортсменов и женщин-спортсменок выше, чем у их светлокожих
коллег, 3% темнокожих женщин-спортсменок имеют толщину стенки ЛЖ больше, чем 11 мм, и 18% темнокожих мужчин-спортсменов обладают толщиной
стенки больше, чем 12 мм [16, 17].
In-37_для нас.indd 958
03.04.2019 12:12:39
959
37 Эхокардиография у спортсменов
Не спортсмены
Сердечный выброс = 5 ,0 л/мин
ЧСС = 75 уд/мин
КДОЛЖ=100мл
Ударный объем = 67 мл
ФВЛЖ=67%
Спортсмены,
тренирующие выносливость
Сердечный выброс = 5,0 л/мин
ЧСС = 50 уд/мин
КДОЛЖ=220мл
Ударный объем = 100 мл
ФВЛЖ=45%
Рис. 37.3 A A Влияние дилатации левого желудочка и частоты сердечных сокращений на фракцию выброса левого желудочка, не-
обходимую для поддержания нормального сердечного выброса в покое. Несмотря на идентичные значения сердечного выброса, фракция
выброса (ФВ) левого желудочка (ЛЖ) дилатированного желудочка у спортсменов, тренирующих выносливость, составляет примерно 45%, что выходит
за пределы нижней границы нормальных значений. КДО — конечно-диастолический объем; ЧСС — частота сердечных сокращений.
жения миокарда. Таким образом, у спортсменов с
клиническим подозрением на ГКМ, не следует учи-
тывать значения нормальных систолических скоро-
стей движения миокарда для отличия ГКМ от спор-
тивного сердца [25]. По данным исследований с
измерениями общей продольной деформации в
покое, у спортсменов она ниже, чем у не спортсме-
нов в контрольных группах [26, 27, 28]. Почти так
же, как может казаться, что у тренирующих вынос-
ливость спортсменов ФВ ЛЖ в покое снижена, эти
исследования, по-видимому, отражают неадекват-
ность оценки показателей в покое при определении
функционального резерва, при сниженных скоро-
стях деформации, необходимой для поддержания
нормального ударного объема физиологически
увеличенного сердца в покое. Это отчетливо про-
демонстрировано на ПЖ у спортсменов, тренирую-
щих выносливость, с более низкой скоростью де-
формации ПЖ в покое, чем у обследуемых в группе
контроля, но с нормальным повышением этих по-
казателей при физической нагрузке [29]. В настоя-
щее время такие измерения не считаются стандарт-
ными при исследовании спортивного сердца вслед-
ствие отсутствия нормативных показателей в
большой популяции спортсменов в различных
спортивных дисциплинах, но могут быть полезны-
ми в будущем, особенно для оценки сердечного
резерва при проведении стресс-ЭхоКГ (рис. 37.4).
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
У спортсменов, демонстрирующих в покое повы-
шенную податливость камеры ЛЖ по сравнению с
испытуемыми группы контроля, ведущими мало-
подвижный образ жизни, показатели диастоличе-
ской функции ЛЖ в покое, как правило, нормаль-
ные или супранормальные [30, 12]. Повышение
показателей ранней диастолической функции (мак-
симальная трансмитральная скорость волны E и
максимальная тканевая скорость E′) и поздних диа-
столических индексов (максимальная трансми-
тральная скорость волны A и максимальная ткане-
вая скорость A′) является наиболее выраженным у
спортсменов, тренирующих выносливость [12].
Несмотря на то, что пределы диастолических пара-
метров, таких как E/e′, выше, чем 7,3, были пред-
ложены для отличия спортивного сердца от патоло-
гической ГЛЖ [31], у спортсменов с ГКМ можно
было наблюдать нормальные диастолические по-
казатели [25]. Таким образом, несмотря на то, что
обнаружение патологического наполнения в фазу
диастолы при проведении ЭхоКГ у спортсменов,
вероятно, отражает наличие заболевания миокарда,
показатели наполнения в фазу диастолы, находя-
щиеся в пределах нормы для не спортсменов, не
исключают наличие заболевания.
ПРАВЫЙ ЖЕЛУДОЧЕК
СТРУКТУРА ПРАВОГО ЖЕЛУДОЧКА
Регулярная физическая нагрузка приводит к изме-
нениям структуры и функции ПЖ. Во время физи-
ческой нагрузки ПЖ подвергается нагрузке объе-
мом, сходной с таковой у ЛЖ, но напряжение
стенки повышается больше в ПЖ, чем в левом [32],
что связанно с повышением давления в легочном
стволе (ЛС), которое увеличивается одновременно
с сердечным выбросом.
У спортсменов, по сравнению с не спортсмена-
ми, всегда выявляли увеличенный объем ПЖ, уве-
личенные линейные размеры ПЖ и утолщение
стенки [33]. Величина увеличения объема ПЖ во
время тренировки сходна с величиной увеличения
объема ЛЖ, хотя в некоторые авторы предполага-
ют, что увеличение объема ПЖ немного выше, чем
ЛЖ [32]. Это показано у спортсменов, тренирую-
щих как выносливость, так и силу.
In-37_для нас.indd 959
03.04.2019 12:12:40
960 ЧАСТЬ VII Сосудистые и системные заболевания
Снижение размера полостей не является
признаком спортивных тренировок
Перестройка сердца у спортсмена
Норма
При тренировке
на выносливость
При сочетанной
тренировке
При силовой
тренировке
На практике, при исследовании ПЖ и идентифи-
кации свободной стенки и трабекул, размеров и
площади, может быть целесообразно использова-
ние проекции, сфокусированной на ПЖ (рис. 37.5).
Рекомендовано использование срезов, сфокусиро-
ванных на ПЖ, для количественного анализа пара-
метров ПЖ, таких как линейные размеры ПЖ,
фракционное изменение площади и фракция вы-
броса.
ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
В большинстве исследований предполагается, что
многие измерения функции ПЖ у спортсменов по-
добны и не у спортсменов, хотя некоторые показа-
тели, которые применимы для ЛЖ, могут быть
применимы и для ПЖ. Спортсмены, у которых
сердце максимально дилатировано, могут иметь не-
значительно сниженную фракцию выброса в преде-
лах нормы. Оценку фракционного изменения пло-
щади ПЖ во многих случаях выбирают в качестве
рациональной замены оценки ФВ ПЖ при исполь-
зовании определенных срезов, сфокусированных на
ПЖ. Показатели систолической функции, такие как
систолическая экскурсия кольца трикуспидального
клапана и максимальная систолическая скорость
трикуспидального кольца (RVS′) находятся, как
правило, в пределах нормальных значений. Неболь-
шое снижение деформации базального отдела сво-
бодной стенки ПЖ было отмечено у тренирующих
спортсменов [34]. Однако это приближается к нор-
мальным показателям, т.к., по всей видимости, де-
формация нормализуется во время тренировок [29].
ПРЕДСЕРДИЯ
У спортсменов предсердия больше, чем у не спор-
тсменов (рис. 37.6). В метаанализе было показано,
что увеличение размера ЛП приводит к увеличению
показателей ЛП, при количественной измерении с
учетом передне-заднего размера методом ЭхоКГ в
парастернальной позиции, и увеличении объема
ЛП, индексированного на площадь поверхности
Рис. 37.4 Схематическое представление изменений размера полости и толщины стенки левого желудочка спортивного сердца при
различных типах выполняемых тренировок.
Рис. 37.5 Значение апикальной проекции, сфокусированной на правом желудочке. Стандартная четырехкамерная проекция A (A) и сфокуси-
рованная на ПЖ проекция A (Б) полученная смещением датчика латеральнее к истинной верхушке (сердце профессионального велосипедиста). Стенка
ПЖ трудно визуализируется в стандартной проекции, стенка ПЖ и трабекулы могут быть визуализированы лучше на срезе, сфокусированном на ПЖ.
А
Б
In-37_для нас.indd 960
03.04.2019 12:12:40
961
37 Эхокардиография у спортсменов
тела [35], измеренного методом ЭхоКГ в апикаль-
ных позициях. Размер ЛП в среднем на 4.1 мм боль-
ше, а индекс объема ЛЖ 7,0 мл/м2 больше у элитных
спортсменов по сравнению группой контроля, ве-
дущими малоподвижный образ жизни. Хотя у мно-
гих спортсменов эти показатели находятся в преде-
лах нормы. Pelliccia с соавт. в своей работе показали,
что у 20% соревнующихся спортсменов размеры
ЛП превышают 40 мм [87]. В настоящее время су-
ществуют более стандартизированные данные для
спортсменов, в которых использование размеров
ЛП допустимо скорее, чем индексированный объем
ЛП, что делает измерение более надежным. Сейчас
считают, что индекс объема ЛЖ более предпочтите-
лен при количественной оценке размера ЛП, и, воз-
можно, в дальнейшем будет доступно больше дан-
ных для его измерения [36].
Когда два стандартных отклонения средней вы-
бираются в качестве верхнего предела нормальных
значений у спортсменов, верхний предел размера
ЛП составляет 45 мм для мужчин и 40 мм для жен-
щин, и верхний предел индекса объема ЛП равен
57 мл/м2 у мужчин и 39 мл/м2 у женщин [37]. Как и
размер желудочка, так и размер ЛП увеличены у
спортсменов, тренирующих на выносливость, но
увеличенный размер предсердия также характерен
и для спортсменов, которых тренируют на силу и
при сочетании силовых упражнений с выносливо-
92
4
15
47
62
0
22
30
20
10
0
2324252627282930
33343536
31 32
40
40
60
80
100
120
58
22
12
50
39
28
44
211
911
12
6
3
68
67
<22
28,1–31
31,1–34
34,1–37
37,1 –40
40,1–43
49,1 –52
43,1–46
46,1–49
55,1 –58
22,1–25
25,1–28
52,1–55
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
(
%
)
Спортсмены
Не спортсмены
Индекс объема ЛП (мл/м2)
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
(
%
)
В пределах нормы
(n: 445; 72,5%)
Умеренная дилатация
(n: 150; 24,3%)
Женщины
Мужчины
Выраженная
дилатация
(n: 20; 3,2%)
Индекс объема ЛП (мл/м2)
Рис. 37.6 Размер левого предсердия у спортсменов. Индекс объема левого предсердия (ЛП) в группе спортсменов, сравниваются мужчины и
женщины (А) мужчины-спортсмены и женщины-спортсменки (главным образом, спортсмены, тренирующие выносливость) с не спортсменами (Б). Индекс
объема ЛП больше у мужчин, чем у женщин и больше у спортсменов, чем у не спортсменов. В группе с тренирующими главным образом, на выносливость,
отмечаются в 95% большие значения со средним индексом объема ЛП у 38,9 мл/м2 по сравнению с не спортсменами — 28,4 мл/м2 [A — D’Andrea A,
Riegler L, Cocchia R, et al. Left atrial volume index in highly trained athletes. Am Heart J 159:1155-1161, 2010. B — From Nistri S, Galderisi M, Ballo P, et al.
Determinants of echocardiographic left atrial volume: implications for normalcy. Eur J Echocardiogr 12:826–833 , 2011].
А
Б
In-37_для нас.indd 961
03.04.2019 12:12:40
962
ЧАСТЬ VII Сосудистые и системные заболевания
стью [35]. Таким образом, увеличение ЛП от не-
большого до среднего у спортсменов следует счи-
тать нормальным [38] и должно быть отражено в
предписаниях по оценке диастолической функции
[39], где в основе классификации спортсменов ле-
жит увеличение предсердия, но имеются нормаль-
ные значения для других параметров диастоличе-
ского наполнения. При более значительном увели-
чении следует устанавливать наличие сердечной
патологии. Хотя существует ряд работ, в которых с
помощью ЭхоКГ были выполнены оценочные из-
мерения функции предсердий у спортсменов, тем
не менее, вследствие малочисленных данных, в на-
стоящее время это не может быть рекомендовано
для рутинной оценки и использования в клинике.
Известно, что размер ПП у спортсменов также
увеличивается [40], однако, в настоящее время не
существует полноценных нормативных данных,
чтобы сделать рекомендации по количественному
анализу и нормальным пределам значений. Увели-
чение предсердий может быть значимым с клини-
ческой точки зрения, т.к. предполагают, что увели-
чение размера предсердий является фактором риска
фибрилляции предсердий, которая встречается у
спортсменов, тренирующих долгосрочную вынос-
ливость [41–43].
АОРТА
Увеличение аорты и расслоение аорты были описа-
ны как причины внезапной смерти сердца во время
физической нагрузки [44]. Характерные особенно-
сти при синдроме Марфана такие как высокий рост
и длинные руки, могут давать выгодные преимуще-
ства в спорте, например, в баскетболе. Поэтому у
таких спортсменов точное выявление патологиче-
ского увеличения аорты, которое может приводить
к ее расслоению, является значимым клиническим
исходом. Было показано, что спортсмены обладают
более крупным размером корня аорты на уровне
как обоих синусов Вальсавы, так и фиброзного
кольца аорты [45] по сравнению с контрольными
испытуемыми. И это весьма незначительная число-
вая разница при измерении: синусы — на 3,2 мм
больше, аортального кольца — на 1,6 мм больше у
спортсменов. Вероятно, разница не является клини-
чески значимой, и, возможно, наблюдаемая разница
отражает скорее различия конституции, а не эффек-
ты физической нагрузки, т.к . в большинстве иссле-
дований не были установлены значения в соответ-
ствии со строением тела.
Таким образом, наличие расширения аорталь-
ных синусов следует, в целом, рассматривать как
патологию. Были предложены пороговые значения
патологии: 40 мм у мужчин и 34 мм у женщин [46].
Устья коронарных артерий часто могут быть
визуализированы как при трансторакальной, так и
при чреспищеводной эхокардиографии (ЧПЭхоКГ),
отходящие от корня аорты (рис. 37.7). В одном ис-
следовании выдвинуто предположение, что это от-
носится примерно к 90% спортсменов [47] и яв-
ляется важным при установлении аномалии от-
хождения коронарных артерий. В исследовании,
проведенном позднее, предположили, что следует
использовать стандартный протокол метода визуа-
лизации [48]. Могут понадобиться определенные
срезы для выявления интрамурального хода прок-
симальной части коронарной артерии в пределах
стенки аорты или внутриартериального хода сосуда.
Часто для визуализации проксимальной части как
левой, так и правой коронарных артерий может
быть выбрана проекция по короткой оси на уровне
коронарных синусов.
Аномалия коронарной артерии является значи-
мой причиной внезапной смерти сердца у спор-
тсменов, особенно если левая коронарная артерия
идет от правого синуса или правая коронарная ар-
терия идет от левого синуса. Аномалия огибающей
ветви левой коронарной артерии, идущей от право-
го синуса, с ретроаортальным ходом может быть
причиной характерной двойной линии на уровне
митрального кольца в апикальной четырехкамер-
ной позиции (рис. 37.8). В соответствующих усло-
виях клиники, неспособность визуализировать два
устья, идущих от левого и правого синусов Вальса-
вы, может являться следствием вероятности ано-
мального отхождения и приводит к необходимости
дальнейших исследований, как например, компью-
терная томографическая (КТ), ангиография коро-
нарных сосудов, которые дают возможность поста-
вить окончательный диагноз и описать ход артерий
относительно стенки аорты и других магистральных
сосудов. Визуализация аномального отхождения от
ЛС (ЛА) у взрослых обследуемых может быть более
затруднена.
ЭЛЕКТРИЧЕСКОЕ РЕМОДЕЛИРОВАНИЕ СЕРДЦА
ЭКГ также изменяется вследствие регулярной физи-
ческой нагрузки по некоторым показателям, кото-
рые расценивают как небольшие проявления спор-
тивного сердца, и другим, связанным с более высо-
кой степенью аномалий сердца и заслуживающие
дальнейшего исследования. Широко известно, что у
спортсменов является нормальным: синусовая бра-
дикардия, первая степень атриовентрикулярной
(АВ) блокады, неполная блокада правой ножки
пучка Гиса (БПНП), ранняя реполяризация и изо-
лированные вольтажные критерии гипертрофии
ЛЖ [49] (рис. 37.9A). В последний пересмотр ЭКГ-
критериев были включены выскальзывающий ритм
из атриовентрикулярного соединения, предсердно-
желудочковая блокада Мобитца второй степени
(Венкебаха) первого типа, полная БПНП и изолиро-
ванные вольтажные критерии гипертрофии ПЖ,
как нормальные данные в дополнение к инверсии
In-37_для нас.indd 962
03.04.2019 12:12:41
963
37 Эхокардиография у спортсменов
T-волны с подъемом выпуклого ST сегмента в пра-
вых прекордиальных ЭКГ-отведениях V1–V4 у тем-
нокожих спортсменов [50]. Наиболее часто наб-
людаются изолированные вольтажные критерии
гипертрофии ПЖ у спортсменов нежели у не спор-
тсменов. Однако механизм возникновения этих
признаков на ЭКГ не определен и нет достаточной
корреляции с объемами ПЖ или толщиной стенки
в популяции спортсменов [51]. При отсутствии
признаков деформации ПЖ, таких как депрессия
ST, глубокая инверсия T-волны, или выраженное
отклонение оси, эти данные редко указывают на
лежащую в основе патологию. Хотя нет общепри-
нятых данных по ЭКГ спортсменов, полная БПНП
может быть следствием физиологического увеличе-
ния ПЖ, имеется одно опубликованное исследова-
ние конечно-диастолических площадей увеличен-
ного ПЖ у здоровых спортсменов с полной БПНП
в сравнении с таковыми при неполной БПНП или
нормальным комплексом QRS [52]. Инверсия
T-волны (зубца) в правых прекордиальных отведе-
ниях или инверсия T-волны) в грудных V-отведениях
является одним из диагностических критериев для
аритмогенной кардиомиопатии ПЖ (АКПЖ) [53] и
редко наблюдается у здоровых светлокожих взрос-
лых обследуемых (рис. 37.9Б). Однако на основании
того, что эти данные не являются однозначными,
темнокожие спортсмены и обследуемые афро-ка-
рибского происхождения из группы контроля, веду-
щие малоподвижный образ жизни, как правило, в
меньшей степени демонстрируют инверсию T-вол-
ны (зубца) в V1–V4, обычно предваряемой подъе-
мом выпуклого ST-сегмента [54]. Это привело к
включению этих данных в перечень нормальных
данных ЭКГ у темнокожих спортсменов африкан-
ского происхождения. Однако у светлокожих спор-
тсменов это воспринимается как отклонение от
нормы, с описанной ранее распространенностью
инверсии T-волны (зубца) вне V2 или менее чем 1%
в группах субэлитных светлокожих спортсменов
[55]. Однако в двух исследованиях описана боль-
шая, чем ожидалось, распространенность инверсии
T-волны (зубца) в правых прекордиальных отведе-
ниях у элитных спортсменов, тренирующих вынос-
ливость, по сравнению со спортсменами, не трени-
рующими выносливость, с инверсией T-волны
(зубца), увеличивающейся вне V2 у 4% испытуемых
в одном исследовании, таким образом, соответствуя
главному диагностическому критерию АДПЖ
(АКПЖ) [13, 56]. По-видимому, эти данные ЭКГ не
Рис. 37.7 Трансторакальное эхокардиографическое исследование коронарных артерий. Визуализация устьев коронарных артерий с помощью
ТТЭхоКГ в парастернальных позициях. (A, Б) Визуализация левой коронарной артерии (ЛКА) в парастернальной позиции по короткой оси. (В) Визуали-
зация проксимальной части правой коронарной артерии (ПКА) в парастернальной позиции по короткой оси. (Г) Визуализация проксимальной ПКА в па-
растернальной позиции по длинной оси. Ao — аорта, корень; ВТПЖ — выходной тракт правого желудочка; ЛЖ — левый желудочек.
ВТПЖ
ПКА
ПКА
Ао
Ао
Ао
Ао
ЛЖ
ЛКА
ЛКА
А
Б
Г
В
In-37_для нас.indd 963
03.04.2019 12:12:41
964
ЧАСТЬ VII Сосудистые и системные заболевания
связаны исключительно с увеличенными объемами
ПЖ у светлокожих или темнокожих спортсменов
[57]. В большой группе здоровых светлокожих
спортсменов, тренирующих выносливость, и ис-
пытуемых группы контроля, ведущих малоподвиж-
ный образ жизни, положение верхушки ПЖ, что
касается поверхностных отведений ЭКГ и при ис-
следовании с помощью МРТ сердца, был найден
предупреждающий инверсию T-волны (зубца) в
V2–V3, с латеральным смещением увеличенного
сердца, что выражалось в более близком положении
ПЖ к поверхностным отведениями V2–V3 ЭКГ
[57a]. Это часто бывает заметно при проведении
эхокардиографического исследования с частым ла-
теральным смещением верхушки сердца у спор-
тсменов, тренирующих выносливость, но более
надежно демонстрируется в исследовании МРТ.
Отчетливые эхокардиографические данные о
патологии у спортсменов включают латеральную
инверсию T-волны (зубца), спад ST-сегмента, Q
зубца, блокада левой ножки пучка, выраженное QT
удлинение, изменения синдрома Бругада и частые
преждевременные желудочковые сокращения [58]
(рис. 37.9В). Обычно они не связаны с типичными
паттернами ремоделирования сердца, наблюдаемо-
го в спортивном сердце, и как таковые не считаются
нормальными показателями и являются основани-
ем для дальнейших исследований. При этом часто
в качестве дальнейшего исследования выбирают
ЭхоКГ. Как обсуждалось ранее, только ЭхоКГ не
является достаточной для постановки или исключе-
ния сомнительного диагноза кардиомиопатии по-
сле обнаружения патологии на ЭКГ. Более того, в
некоторых условиях значимости для скрининга и
спортивного участия, как например патологии ион-
ных каналов (синдром длинного QT, синдром Бру-
гада, катехоламинергическая полиморфная желу-
дочковая тахикардия или синдром Вольфа–Пар-
кинсона–Уайта, следует ожидать, что данные
эхокардиографического исследования будут в пре-
делах нормы. Таким образом, эхокардиографиче-
ское исследование не следует считать адекватным
подтверждением отсутствия данной патологии
(рис. 37.9Г). Данные ЭКГ и ЭхоКГ всегда следует
интерпретировать в сочетании с полной клиниче-
ской картиной, которая должна включать исчерпы-
вающие данные физикального обследования, лич-
ный и семейный анамнезы, и часто дальнейшее
исследование, как, например, мониторирование по
Холтеру, ЭКГ во время физической нагрузки и
стресс-ЭхоКГ, сигнал-усредненной ЭКГ, МРТ серд-
ца и семейный скрининг.
ЭФФЕКТЫ РАЗГРУЗКИ
Несмотря на то что не большие, перспективные ис-
следования направлены на изучение обратного ре-
моделирования сердца во время разгрузки, имею-
щиеся данные указывают на то, что изменения в
спортивном сердце начинают регрессировать до
нормы в пределах 6 нед при полном прекращении
спортивных тренировок [10]. В работах было опи-
сано, что толщина стенки ЛЖ и его масса возвраща-
ются в нормальные пределы, хотя встречается более
умеренное уменьшение размера полости ЛЖ через
несколько месяцев и лет после прекращения трени-
ровок [10, 59]. Описаний влияния разгрузки на ПЖ
и предсердия встречается еще меньше [60].
С практической точки зрения одно из главных
затруднений в диагностике при эхокардиографиче-
ЛЖ
Ао
ЛП
Рис. 37.8 Аберрантная огибающая ветвь левой коронарной артерии, идущая от правого коронарного синуса с ретроаортальным ходом.
(A) A Двойная полоса (стрелки), визуализируемая на уровне митрального кольца в четырехкамерной позиции, свидетельствует о патологии. (Б) Артерия
может быть визуализирована в парастернальной позиции по длинной оси. Ao — аорта, корень; ЛЖ — левый желудочек; ЛП — левое предсердие.
А
Б
In-37_для нас.indd 964
03.04.2019 12:12:41
aVR
I
V1
V4
aVL
II
V2
V5
aVF
III
V3
V6
II
II
II
II
aVR
I
V1
V4
aVL
II
V2
V5
aVF
III
V3
V6
II
II
II
II
aVR
I
V1
V4
aVL
II
V2
V5
aVF
III
V3
V6
II
II
II
II
aVR
I
V1
V4
aVL
II
V2
V5
aVF
III
V3
V6
II
Рис. 37.9 ЭКГ спортсменов. (A) Наличие синусовой брадикардии, гипертрофия ЛЖ без изменений T-волны и ранняя реполяризация считаются нор-
мальными у спортсменов. (Б) Наличие инверсии T-волны в грудных V отведениях и волна эпсилон подтверждают аритмогенную кардиомиопатию (дис-
плазию) ПЖ. (В) На этой ЭКГ спортсмена с ГКМП показаны патологические Q-волны и инверсия нижнебоковой и боковой T-волны (зубца) и дает на-
правление для дальнейших исследований. (Г) Информация о синдроме Вольфа–Паркинсона–Уайта, как правило, сочетается с нормальной эхокардио-
граммой и обычно следует из анамнеза или скрининговой ЭКГ.
А
Б
В
Г
In-37_для нас.indd 965
03.04.2019 12:12:41
966 ЧАСТЬ VII Сосудистые и системные заболевания
ском исследовании у спортсменов является раз-
личие между физиологической и патологической
ГЛЖ, как при ГКМ. В публикациях случаев и не-
больших серий экспериментов было описано сни-
жение ГЛЖ у спортсменов с пограничной толщиной
стенки (13–15 мм) во время разгрузки, таким обра-
зом это было предложено в качестве практической
помощи при дифференцировке спортивного сердца
от HCM [60–62]. Однако эта идея тесно связана с
предположением, что у спортсменов с ГКМ патоло-
гическая ГЛЖ не будет ни усугубляться во время
физической нагрузки, ни ослабевать при отмене
спортивных тренировок. Нет перспективных ис-
следований, изучающих влияние спортивных тре-
нировок или разгрузки на морфологию спортивно-
го сердца с генотипически подтвержденной ГКМ. В
единственной публикации случая юноши-футбо-
листа с фенотипической экспрессией ГКМ (ассиме-
тричная септальная или апикальная ГЛЖ), который
имел вынужденное ограничение в спортивных
тренировках в течение 6 мес, описано подобное
уменьшение толщины стенки ЛЖ (обратная пере-
стройка), что наблюдалась у здоровых спортсменов
во время разгрузки [63]. Перспективной концепци-
ей является фенотипическое перекрытие между
АКПЖ и спортивным сердцем у спортсменов, тре-
нирующих выносливость, или «ARVC, вызванная
физической нагрузкой» [64]. Хотя является обще-
признанным, что физическая нагрузка может при-
водить к увеличению фенотипической экспрессии
АКПЖ, реакции сердца на разгрузку у спортсменов
с диагнозом АКПЖ и последующим ограничением
в спортивных тренировках описаны не были.
До тех пор, пока не определяются эффекты раз-
грузки у спортсменов с патологиями сердца, как
например ГКМ и АКПЖ, уменьшение толщины
стенки ЛЖ и размеров сердца, во время разгрузки,
не может считаться единственным надежным кри-
терием отличия физиологической от патологиче-
ской адаптации сердца у спортсменов с неясными
данными эхокардиографического исследования,
такими как пограничное значение толщины стенки
или расширение желудочка. Обычно требуется до-
полнительная информация, включающая клиниче-
скую картину, показатели ЭКГ, сигнал-усредненную
ЭКГ, мониторирование по Холтеру, нагрузочные
пробы, семейный скрининг и МРТ сердца. Серий-
ные проекции сердца всегда рекомендуют в этих
ситуациях, что дает различную, зависимую от воз-
раста пенетрантность врожденных кардиомиопа-
тий.
ЭХОКАРДИОГРАФИЧЕСКИЙ СКРИНИНГ
У СПОРТСМЕНОВ
Показания к ЭхоКГ у спортсменов в основном яв-
ляются аналогичными, как и у не спортсменов [65],
главные отличия в том, как интерпретируются по-
лученные данные. Важные показатели, исследуемые
с помощью метода ЭхоКГ у спортсменов показаны
в табл. 37.4. Существуют, однако, некоторые слу-
чаи, когда показания к ЭхоКГ более приняты для
спортсменов, чем для не спортсменов. Например,
частые желудочковые внеочередные сокращения
или преждевременные желудочковые сокращения
вызванные физической нагрузкой, фибрилляция
предсердий, головокружение, предобморочное со-
стояние, обморок, наличие шумов. Все они система-
тизированы как соответствующие показания к
эхокардиографическому исследованию у спортсме-
на. В некоторых случаях стресс-ЭхоКГ необходима
для обследования спортсмена с симптомами, и по-
казания к стресс-ЭхоКГ у спортсменов кратко пред-
ставлены «Стресс-ЭхоКГ у спортсменов».
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Одним общим показанием в странах, где проводят
предварительный скрининг спортсменов на опреде-
ленное заболевание сердца, которое может стать
причиной внезапной смерти сердца во время спор-
тивной тренировки, является исследование струк-
туры и функции сердца после предварительного
тестирования, как например клиническое исследо-
вание или вызывающая беспокойство ЭКГ для ле-
жащей в основе структурной патологии сердца. В
некоторых странах или в некоторых элитных спор-
тивных дисциплинах скрининг является обязатель-
ным для спортсменов, участвующих в соревнова-
ниях, но в других странах скрининг только реко-
мендуют.
Рекомендации также различаются в разных стра-
нах в зависимости от уровня спортсменов: от люби-
теля до профессионала. Краткий обзор общих реко-
мендаций представлен в табл. 37.3 .
По нормативам США рекомендуют первона-
чальный скрининг с личной и семейной анамнезами
и физикальным обследованием [66]. Дальнейшее
обследование зависит от результатов первоначаль-
ного скрининга, но вероятно будет включать ЭКГ.
По европейским нормативам рекомендуют скри-
нинг с анамнезом, обследованием и ЭКГ [67], так же
как и в Израиле [68]. Международный Олимпий-
ский комитет рекомендует периодический контроль
здоровья спортсменов и предлагает включать лич-
ный анамнез спортсмена, физикальное обследова-
ние и ЭКГ [69]. Некоторые масштабные спортивные
организации, такие как, например, Международная
федерация футбольных ассоциация и Международ-
ный союз велосипедистов имеют специфические
требования к скринингу спортсменов во время со-
ревнований. Хотя допустимо дискутировать насчет
эффективности каждого подхода и всех установок,
ЭхоКГ не рекомендована в качестве исследования
первой линии у спортсменов с отсутствием симпто-
мов, без патологий в семейном анамнезе и врожден-
ных пороков сердца [70]. При этом ЭхоКГ является
In-37_для нас.indd 966
03.04.2019 12:12:42
967
37 Эхокардиография у спортсменов
исследованием второй линии при оценке возмож-
ности структурного заболевания сердца у спортсме-
нов с нарушениями, определяемыми при первич-
ных скрининговых исследованиях.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
ТЕХНИЧЕСКИЕ РЕШЕНИЯ И ФИЗИОЛОГИЧЕСКИЕ РАЗЛИЧИЯ
Вследствие того, что у спортсменов не редки такие
симптомы как учащенное сердцебиение, боль в гру-
ди, сниженная работоспособность с или без одыш-
ки, часто требуется проведение стресс-ЭхоКГ для
оценки этих симптомов. У молодых спортсменов
патологии, такие как аномальное отхождение коро-
нарных артерий, могут быть причиной ишемии
миокарда и, считают, что это фактор риска внезап-
ной остановки сердца во время физической нагруз-
ки. Тогда как у спортсменов старшего возраста мо-
жет развиваться атеросклеротическая болезнь ко-
ронарных артерий, вследствие чего развивается
стенокардия, инфаркт миокарда и внезапная смерть
сердца. При выполнении и интерпретации этих
тестов клиницистам следует понимать, где имеются
сходства, а где различия между популяциями спор-
тсменов и не спортсменов. Иногда при проведении
стресс-ЭхоКГ у спортсменов можно оценивать и
другие показатели, кроме движения стенки ЛЖ и
ишемии миокарда. Реакция ПЖ на физическую на-
грузку может быть очень важной, т.к. возможны
изменения артериального давления в ЛС. Хотя мо-
жет быть необходима некоторая осторожность при
интерпретации изменений давления в ЛС во время
физической нагрузки.
По возможности интенсивность физической на-
грузки следует подбирать в соответствии с нормаль-
ной активностью спортсмена или активностью, при
которой проявляются симптомы патологии. Неко-
США [97]
Италия [67]
Израиль [68]
МОК [69]
Личный анамнез
Рекомендовано
Показано
Показано
Рекомендовано
Семейный анамнез
Рекомендовано
Показано
Показано
Рекомендовано
Физикальное обследование
Рекомендовано
Показано
Показано
Рекомендовано
Электрокардиограмма
Вторая линия
Показано
Показано
Рекомендовано
Эхокардиограмма
Вторая линия
Вторая линия
Вторая линия
Вторая линия
Мониторирование по Холтеру/
суточный регистратор
Вторая линия
Вторая линия
Вторая линия
Вторая линия
МРТ сердца
Вторая линия
Вторая линия
Вторая линия
Вторая линия
Стресс-ЭКГ/стресс-ЭхоКГ
Вторая линия
Вторая линия
Вторая линия
Вторая линия
ЭФ исследование
Вторая линия
Вторая линия
Вторая линия
Вторая линия
КТА КА
Вторая линия
Вторая линия
Вторая линия
Вторая линия
КТА КА — компьютерная томографическая ангиография коронарных артерий; МОК — Международный олимпийский комитет; МРТ —
магнитно-резонансная томография; ЭКГ — электрокардиография; ЭФ — электрофизиология; ЭхоКГ — эхокардиография.
ТАБЛИЦА 37.3 Рекомендации к скринингу спортсменов, у которых отсутствуют симптомы
Левый желудочек
Правый
желудочек
Другие
структуры
Конечно-
диастолический
размер ЛЖ
Толщина сво-
бодной стенки
ПЖ
Индекс объема
ЛП
Толщина септальной
и задней стенки ЛЖ
Размер базаль-
ного отдела
ПЖ
Площадь ПП
Индекс массы ЛЖ
СЭПТК
Подтверждение
нормальной
локализации
устьев коро-
нарных
артерий
Фракция выброса ЛЖ Размер и спада-
емость НПВ
Допплерографическое
исследование выход-
ного потока
митрального
клапана
Скорости и латераль-
ной септальной
части митрального
кольца
Скорости септальной
части митрального
кольца и латераль-
ной части кольца e′
Соотношение E/e′ E/e′
ЛЖ — левый желудочек; ЛП — левое предсердие; ПП — правое
предсердие; ПЖ — правый желудочек; НПВ — нижняя полая
вена; СЭПТК — систолическая экскурсия плоскости трикуспи-
дального кольца.
ТАБЛИЦА 37.4
Рекомендации по важным показателям
эхокардиографического исследования
у спортсменов как часть рутинной
эхокардиографии
In-37_для нас.indd 967
03.04.2019 12:12:42
968 ЧАСТЬ VII Сосудистые и системные заболевания
торые спортсмены могут тренировать отдельные
группы мышц, это значит, что они могут выполнять
упражнения повышенной интенсивности, исполь-
зуя определенный вид стресса, связанного с физи-
ческой нагрузкой. Например, велосипедист может
быть способным достигать более высокой рабочей
нагрузки, если выбирать в качестве нагрузочного
теста велоэргометрию, а не тредмил. Возможно,
чтобы более длительно удерживать достигаемую
максимальную физическую нагрузку у спортсмена,
чем у не спортсмена, иногда может использоваться
модифицированный протокол с большей частотой
повышения рабочей нагрузки. Важно стремиться к
максимальной физической нагрузке и достигать
уровня физической нагрузки, которая приводит к
проявлению симптомов у спортсмена. При этом
данный уровень физической нагрузки может быть
значительно выше такового у не спортсменов.
ОСТРЫЕ ЭФФЕКТЫ ФИЗИЧЕСКОЙ НАГРУЗКИ
Как и у не спортсменов, у спортсменов существует
несколько допустимых нормальных показателей
при проведении стресс-ЭхоКГ. Во время стресса,
вызванного физической нагрузкой, следует повы-
шение артериального давления. Размер полости
ЛЖ будет уменьшаться с постоянным увеличением
толщины всех сегментов стенки в ответ на физиче-
скую нагрузку. В результате этого фракция выброса
ЛЖ (ФВ ЛЖ) будет увеличиваться. В одном иссле-
довании с участием профессиональных американ-
ских футболистов было показано среднее увеличе-
ние ФВ ЛЖ от 58 до 76% во время физической на-
грузки [71]. У элитных спортсменов, тренирующих
выносливость, при значительном увеличении объ-
емов ЛЖ, фракция выброса в покое может быть не
большой, но при этом нормальный ударный объем
и сердечный выброс, в соответствии со степенью
перестройки сердца (см. рис. 37.3).
Полагают, что увеличение ФВ ЛЖ во время фи-
зической нагрузки является важным при диффе-
ренцировки спортивного сердца от дилатационной
кардиомиопатии с незначительно сниженной ФВ
ЛЖ [72], хотя доказательства, подтверждающего
это, а также определенных пороговых величин по-
лучено не было.
Функция ПЖ также была повышена во время
физической нагрузки, и сниженный резерв ПЖ у
спортсменов, тренирующих выносливость, был
связан с наличием аритмии ПЖ [73], предполагаю-
щей перспективное использование этих данных для
идентификации патологий, когда функция в покое
в пределах нормы. С другой стороны, строгие реко-
мендации и пределы значений не были установлены
в полном объеме вследствие нехватки данных ре-
зультатов. Измерения, используемые для количе-
ственной оценки функции ПЖ во время физиче-
ской нагрузки, включали ФВ ПЖ, фракционное
изменение площади ПЖ, систолическую экскурсию
плоскости трикуспидального кольца и систоличе-
ские скорости движения кольца трикуспидального
клапана.
Существует несколько важных факторов, кото-
рые нужно учитывать при стресс-ЭхоКГ у спор-
тсменов. Определение артериального давления в
ЛС во время физической нагрузки использовали
при условиях, таких как стеноз митрального клапа-
на, для обеспечения важной информацией относи-
тельно тяжести болезни клапанов. Следует очень
аккуратно интерпретировать изменения систоличе-
ского давления в ЛС у спортсменов во время физи-
ческой нагрузки. Повышение систолического дав-
ления в ЛС до 70 мм рт. ст. во время интенсивной
физической нагрузки у высоко тренированного
спортсмена не является редкостью, что в иных слу-
чаях могло бы считаться признаком легочной ги-
пертензии тяжелой степени у прочих испытуемых.
Повышение систолического давления в ЛС тесно
связано с рабочей нагрузкой и достигаемым сердеч-
ным выбросом [74] и является скорее феноменом,
возбуждаемым потоками в легочном круге крово-
обращения, с ограниченной сосудорасширяющей
способностью перед увеличивающимся потоком
крови, чем признаком дисфункции легочного круга
кровообращения.
В недавнем исследовании, в котором измерение
давления в ЛС во время физической нагрузки осу-
ществляли инвазивно, было показано, что среднее
давление в ЛС увеличивалось от 1,0 до 1,5 мм рт. ст.
в ответ на каждое увеличение сердечного выброса(
в л/мин) [75, 76]. Таким образом, измерение давле-
ния в ЛС необходимо рассматривать в соотсетствии
с достигаемой рабочей нагрузкой, потому что уве-
личение сердечного выброса от 5 л/мин до 30 л/мин
у спортсменов со средним ДЛС в покое, равным
15 мм рт. ст., может становиться равным от 40 до
52 мм рт. ст. при максимальной физической нагруз-
ке и считаться нормальным феноменом. Систоли-
ческое давление в ЛС, измеренное в покое при про-
ведении ЭхоКГ, также слегка повышенное у спор-
тсменов по сравнению с не спортсменами, и может
достигать 40 мм рт. ст. у спортсменов, что, вероятно,
обусловлено более высоким ударным объемом УО,
который, считается, достигает верхней границы
нормы у спортсменов [77].
АЛЬТЕРНАТИВНЫЕ СПОСОБЫ ВИЗУАЛИЗАЦИИ
В установках, в которых ЭхоКГ недостаточно обе-
спечивает необходимой информацией для обеспе-
чения точной диагностики или в которых требует-
ся дополнительная прогностическая информация,
дополнительные способы визуализации, наиболее
распространенным среди которых является МРТ
сердца, могут быть использованы для получения
дополнительной информации к полученным в ре-
зультате данных эхокардиографического исследо-
In-37_для нас.indd 968
03.04.2019 12:12:42
969
37 Эхокардиография у спортсменов
вания. В случаях, когда объемы желудочков и фрак-
ция выброса не могут быть точно рассчитаны, МРТ
сердца обеспечивает точное измерение этих параме-
тров, хотя объемы, измеренные в ходе МРТ сердца,
имеют тенденцию оказываться большими, чем та-
ковые при измерении с помощью ЭхоКГ. Кроме
того, с помощью МРТ сердца можно получить более
надежные характеристики структуры миокарда, не-
жели при проведении эхокардиографического ис-
следования. Также при проведении МРТ сердца
более реально измерение массы ЛЖ. Наличие отека
миокарда и гиперемии может быть визуализирова-
но в случае предполагаемого миокардита, при со-
блюдении определенной последовательности, и
этот метод может обеспечить дополнительную ин-
формацию при использовании визуализации с при-
менением позднего усиления сигнала гадолинием.
С помощью позднего усиления сигнала гадолинием
идентифицируют наличие увеличенного внекле-
точного объема, который наиболее часто обуслов-
лен фиброзом. Таким образом, может быть полу-
чена дополнительная диагностическая информация
и дополнительная прогностическая значимость в
случаях с подозрением на гипертрофическую кар-
диомиопатию (рис. 37.10, 37.11).
В случаях с подозрением на аномалии коронар-
ной артерии или атеросклероз коронарной артерии
для диагностики может быть использована КТ ан-
гиография коронарных артерий, которая может
предоставить информацию о локализации коро-
нарных устьев, хода коронарных артерий и их вза-
имосвязей с другими структурами полости грудной
клетки, а также о наличии и локализации атероскле-
ротических бляшек. В некоторых случаях это может
приводить к использованию инвазивной коронар-
ной ангиографии.
ЗАТРУДНЕНИЯ ПРИ ВИЗУАЛИЗАЦИИ В КЛИНИКЕ
При отличии спортивного сердца от сердца с пато-
логией важно понимать, что ЭхоКГ предоставляет
только часть общей картины, необходимой для
проведения точной оценки, и не следует получен-
ные данные рассматривать изолированно. Полный
и точный анамнез, включающий подробные семей-
ный анамнез и анамнез при предыдущих спортив-
ных тренировках, полноценное физикальное обсле-
дование, проведение 12-канальной ЭКГ, составляет
основу диагностической оценки. В некоторых слу-
чаях ЭхоКГ в покое может предоставить дополни-
тельную информацию, важную для принятия диа-
гностического решения. Но в определенных случаях
в качестве дополнительных методов визуализации
могут потребоваться: стресс-ЭхоКГ, МРТ сердца, КТ
А
Б
Рис. 37.10 Типичная гипертрофическая кардиомиопатия у футболистов с отсутствием симптомов. Визуализация у профессиональных фут-
болистов мужского пола с отсутствием симптомов, на наличие гипертрофической кардиомиопатии указывает патологическая ЭКГ. (A) В парастернальной
позиции по длинной оси видно утолщение базального отдел передней стенки (стрелки). (Б) Позиция по короткой оси ЛЖ, показывающая асимметричную
гипертрофию стенки. (В, Г) Срезы МРТ сердца подобны таковым на (A) и (Б) после применения контрастирования с гадолинием. Представлено экстен-
сивное позднее усиление передней стенки и стенки с обширным фиброзом (стрелки).
Г
В
In-37_для нас.indd 969
03.04.2019 12:12:42
970
ЧАСТЬ VII Сосудистые и системные заболевания
сердца или катетеризация сердца. Иные виды ис-
следований, такие как мониторирование по Холтеру
и электрофизиологическое исследование или им-
плантируемый петлевой регистратор, могут потре-
боваться в отдельных случаях. Также важным явля-
ется принимать во внимание, что большинство
доказательств, что практические рекомендации в
этой области были основаны на сравнении спор-
тсменов без определенного заболевания с не спор-
тсменами с наличием этого заболевания. В клини-
ческой практике задачей является выявить, здоро-
вый ли спортсмен или с наличием заболевания. При
сравнении в клинической практике спортсменов без
патологии и не спортсменов с заболеванием было
показано, что задача сложная и вполне вероятно,
что параметры визуализации не всегда приемлемы
для оценки, что отражено в недавних исследовани-
ях по гипертрофической кардиомиопатии [25].
БОЛЕЗНЬ КЛАПАНОВ У СПОРТСМЕНОВ
У спортсменов могут быть как врожденные, так и
приобретенные болезни клапанов, что может при-
водить к расширению или гипертрофии желудоч-
ков, внешне сходной с таковой в результате спор-
тивных тренировок, и мало известно об исследова-
нии относительного вклада спортивной тренировки
и болезни клапанов в изменение структуры и
функции сердца. В настоящее время не проведены
перспективные исследования на предмет того, мо-
жет ли физическая нагрузка влиять на развитие
дилатации или гипертрофии желудочка у спортсме-
нов со стенозом клапана или его регургитацией.
В одном небольшом исследовании сравнивали
размеры ЛЖ у футболистов и гандболистов с аор-
тальной или митральной регургитацией умеренной
степени (n = 14) с теми из 14 игроков, которых со-
ответствовали по размерам тела и тренировке и у
которых не было регургитации клапанов [78]. В
результате этого исследования было показано, что
у спортсменов с аортальной или митральной регур-
гитацией умеренной степени конечно-диастоличе-
ский размер ЛЖ, индексированный на площадь
поверхности тела, был немного выше, чем у испы-
туемых с отсутствием регургитации клапана, но
показатели их способности переносить физическую
нагрузку не различались. В другом исследовании с
участием спортсменов и испытуемых, ведущих ма-
лоподвижный образ жизни, с двустворчатым аор-
тальным клапаном и его дисфункцией умеренной
степени, показали прогрессирующее увеличение
ЛЖ у спортсменов, тренирующихся > 5 лет, однако
остальные значения оставались в пределах нормы,
что предполагало скорее нормальный эффект фи-
зической нагрузки, нежели патологический [79].
Ввиду изменения аномальных параметров струк-
туры желудочка в период разгрузки у спортсменов
с болезнью клапана было высказано предположе-
ние, подтверждающее, что параметры желудочка
являются физиологическими и связанны скорее с
физическими нагрузками, чем с болезнью клапана.
Однако долгосрочных исследований, подтвержда-
ющих эту гипотезу, проведено не было. При от-
сутствии систематических данных, рекомендаций
для участия в спортивных тренировках спортсме-
нов с болезнью клапана сердца в основном основа-
ны на заключении экспертов [80–82], и эхокардио-
графическое исследование патологического клапа-
на играет решающую роль при оценке степени
тяжести болезни клапана и ее влияния на функцию
сердца.
ЛЖ
ЛЖ
ЛЖ
ПЖ
ПЖ
ПЖ
Рис. 37.11 Гипертрофическая кардиомиопатия с фокальной гипертрофией передней стенки. Визуализация у молодых женщин-спортсменок
без симптомов, но ЭКГ была с признаками гипертрофичесой кардиомиопатии. (A) В парастернальной позиции по длинной оси патологии не обнаружено,
как и во многих стандартных позициях. (Б) Фокальная гипертрофия передней стенки (стрелка) была обнаружена только во внеосевых проекциях при
систематическом обследовании всего левого желудочка (ЛЖ). (В) Результаты МРТ сердца с контрастированием гадолинием подтвердили наличие фо-
кальной гипертрофии передней стенки (стрелка). ПЖ — правый желудочек.
А
Б
В
In-37_для нас.indd 970
03.04.2019 12:12:42
971
37 Эхокардиография у спортсменов
СПОРТСМЕНЫ, ТРЕНИРУЮЩИЕ ВЫНОСЛИВОСТЬ,
ИЛИ ДИЛАТАЦИОННАЯ КАРДИОМИОПАТИЯ
Дилатация камер сердца может быть весьма выра-
женной у некоторых спортсменов, тренирующих
выносливость, и может быть связана с измерениями
систолической функции ЛЖ и ПЖ, которая у не
спортсменов оказывается ниже нормальных зна-
чений. Таким образом, дилатация камер сердца и
низкая ФВ ЛЖ у спортсменов с отклонениями от
нормы на ЭКГ или симптомами служит важным
диагностическим признаком (рис. 37.12; см. рис.
37.1). В связи с аномальным диастолическим напол-
нением можно предположить, что гипертрофия
сердца является патологической, как это происхо-
дит при функциональной регургитации митраль-
ного и трикуспидального клапанов. Но иная диф-
ференцировка патологии от физиологии при оцен-
ке в покое может быть затруднена.
Полагали, что оценка реакции ЛЖ на физиче-
скую нагрузку может способствовать отличию ди-
латационной кардиомиопатии спортивного сердца
у спортсменов, тренирующих выносливость, не-
смотря на то, что для этого нет достаточных систе-
матических доказательств. В одном исследовании,
проведенном с участием американских футболи-
стов, показано, что во время физической нагрузки
ФВ ЛЖ увеличивается от 58% ± 4% до 76% ± 14%.
В исследованиях с участием пациентов с дилатаци-
онной кардиомиопатией, выполняющих физиче-
скую нагрузку, предположили, что низкая ФВ ЛЖ
не повышается при физической нагрузке, хотя
очевидно существует амплитуда реакций [72]. Так,
увеличение ФВ ЛЖ до нормального уровня при
проведении ЭхоКГ во время физической нагрузки
могло бы служить подтверждением диагноза спор-
тивного сердца, особенно в условиях выполнения
высокой рабочей нагрузки и высокого максималь-
ного потребления кислорода (VO2) при проведении
метаболического нагрузочного теста. Однако точ-
ные пограничные значения на данный момент
определены не были.
Пример дифференцировки дилатационной кар-
диомиопатии от спортивного сердца представлен
на рис. 37.12 . На этом рисунке показаны данные
визуализации сердца молодого испытуемого муж-
ского пола с дилатационной кардиомиопатией, ко-
Рис. 37.12 Затруднение при отличии спортивного сердца от дилатационной кардиомиопатии при трансторакальной эхокардиографии в
покое. (A, В) Данные визуализации у молодых испытуемых мужского пола с дилатационной кардиомиопатией, являющейся следствием мышечной
дистрофии Беккера. (A) В парастернальной позиции по длинной оси показана нормальная толщина стенки ЛЖ с конечно-диастолическим диаметром
ЛЖ, равным 6,0 см. (В) Четырехкамерная позиция при объеме ЛЖ, равном 160 мл и фракция выброса ЛЖ — 49%. (Б) Сопоставление показателей у
молодых профессиональных велосипедистов с отсутствием симптомов. В парастернальной позиции по длинной оси (Б) показана нормальная толщина
стенки с конечно-диастолическим диаметром ЛЖ, равным 5,1 см. (Г) В четырехкамерной позиции при объеме ЛЖ, равном 146 мл и ФВ ЛЖ, равной
47%.
А
Б
Г
В
In-37_для нас.indd 971
03.04.2019 12:12:42
972
ЧАСТЬ VII Сосудистые и системные заболевания
торая является следствием мышечной дистрофии
Беккера, и профессионального велосипедиста. Раз-
мер и функция ЛЖ так же, как и скорость миокарда
и диастолическая функция сердца в покое, являют-
ся сходными у обоих испытуемых. У спортсмена,
тренирующего выносливость, наблюдается дилата-
ция всех четырех камер сердца и ПЖ, и оба пред-
сердия более дилатированы, нежели в случае с ди-
латационной кардиомиопатией. В случаях, подоб-
ных этому, если имеются клинические подозрения,
показатели физической нагрузки являются потен-
циально значимыми для отличия физиологической
адаптации от патологической дилатации.
ПЕРЕСТРОЙКА СЕРДЦА У СПОРТСМЕНОВ
ИЛИ ПАТОЛОГИЧЕСКАЯ ГИПЕРТРОФИЯ ЖЕЛУДОЧКА
Наличие утолщения стенки ЛЖ является распро-
страненной диагностической проблемой у спор-
тсменов, для отличия физиологических случаев от
патологических при полном обследовании часто, в
качестве метода диагностики, используется ЭхоКГ.
В случаях, когда данные ЭхоКГ являются типичны-
ми для патологии, как например гипертрофическая
кардиомиопатия и толщина стенки очевидно за
пределами и нормального уровня значений, и «се-
рой зоны», а также необычное распределение утол-
щенной стенки, результаты исследования можно
уверенно интерпретировать как патологические
(табл. 37.5). В случаях, когда параметры, такие как
толщина стенки, попадают в «серую зону» и карти-
на является общей, требуется дополнительная ин-
формация. Один ключевой момент остается доста-
точно важным при отличии нормы от патологии. У
спортсменов не развивается в достаточной степени
концентрический тип гипертрофии с уменьшенны-
ми размерами полостей. В одном исследовании ко-
нечно-диастолический диаметр ЛЖ меньше, чем
54 мм являлся наиболее надежным критерием для
отличия спортсменов с гипертрофической кардио-
миопатией от группы испытуемых с утолщением
стенки в «серой зоне», от 13 до 15 мм, при чувстви-
тельности и специфичности равных 100% [31]. Ис-
следование было небольшое, но размер ЛЖ равным
образом был использован как параметр дифферен-
цировки спортивного сердца и ГКМ, хотя некоторые
другие авторы полагали, что предельное значение
5,0 см — более надежно при отличии ГКМ от спор-
тивного сердца [83]. Следует отметить, что лучше
выполняется простое измерение нежели измерение
патологического наполнения в фазу диастолы, как
например скорость E′ или отношение E/E′. На самом
деле, может быть более затруднительным отличие
многих спортсменов с ГКМ от здоровых спортсме-
нов, чем отличие от пациентов с аналогичной пато-
логией, ведущих малоподвижный образ жизни, на
котором основана большая часть наших представ-
лений. У спортсменов с ГКМ наблюдаются увели-
ченные полости ЛЖ, менее выраженная ГЛЖ с
нормальными значениями наполнения в фазу диа-
столы, чем у пациентов с аналогичной патологией,
ведущих малоподвижный образ жизни [25]. Как
уже обсуждалось, ранее сложившееся мнение, что
нормальная диастолическая функция может исклю-
чать диагноз ГКМ, не применимо и не является
верным в популяциях спортсменов. Примеры диа-
гнозов, поставленных спортсменам с бессимптом-
ной ГКМ после скринингового исследования на
наличие значимых нарушений методом 12-каналь-
ной ЭКГ, показаны рис. 37.10, 37.11 . Случай, пред-
ставленный на рис. 37.10 показал на эхокардиграм-
ме довольно характерные признаки необструктив-
ной ГКМ с асимметричной гипертрофией
базального и среднего отделов передней перегород-
ки в стандартных эхокардиографических проекци-
ях. С помощью МРТ сердца получены подтвержда-
ющие данные и показано наличие фиброза выра-
женной степени, который был выявлен при позднем
усилении сигнала гадолинием. Случай с женщиной-
спортсменом с отклонениями от нормы на ЭКГ,
представленный на рис. 37.11, был более трудным,
Признаки,
подтверждающие, что это
спортивное сердце
Признаки, подтверждающие,
что это ГКМ
Диастолический размер
полости ЛЖ > 5,5 см
Диастолический размер
полости ЛЖ < 5,0 см
Не характерная картина ГЛЖ
Снижение толщины
стенки ЛЖ при разгрузке
Максимальная толщина стенки
>16мм
VO2max > 45 мл/кг/мин или
> 100% прогностически
Нарушение диастолического
наполнения
Наличие ПСД митрального
клапана
Нетипичные картины ЭКГ,
например глубокая инверсия
T волны или широко распро-
странены изменения ST–T
Семейный анамнез ГКМ
Типичное ПУСГ на МРТ
сердца
ГКМ — гипертрофическая кардиомиопатия; ГЛЖ — гипертрофия
левого желудочка; ЛЖ — левый желудочек; МРТ — магнитно -
резонансная томография; ПСД — систолическое движение перед-
ней створки митрального клапана (переднее систолическое дви-
жение); ПУСГ — позднее усиление сигнала гадолинием; ЭКГ —
электрокардиография.
[Maron BJ. Distinguishing hypertrophic cardiomyopathy from athlete’s
heart: a clinical problem of increasing magnitude and significance.
Heart 91:1380–1382, 2005.]
ТАБЛИЦА 37.5 Отличие спортивного сердца
от гипертрофической кардиомиопатии
In-37_для нас.indd 972
03.04.2019 12:12:43
973
37 Эхокардиография у спортсменов
потому что были выбраны наиболее стандартные
проекции, но требовались внеосевые проекции для
идентификации наличия фокальной гипертрофии
передней стенки. С помощью МРТ сердца также
подтвердили эти данные и установили наличие не-
однородного фиброза в этом участке. В ходе даль-
нейшего исследования был установлен случай ги-
пертрофической кардиомиопатии у ближайшего
родственника. Этот случай демонстрирует важность
полного обследования, которое может включать
внеосевые проекции, особенно если исследование
проводится для дальнейшего изучения ЭКГ с от-
клонениями от нормы.
Трудность случаев дифференцировки гинерали-
зованной гипертрофии от спортивного сердца, ос-
нованная исключительно на структурных характе-
ристиках, представлена на рис. 37.13. И пациент с
гипертензивной болезнью сердца, находящийся в
отделении неотложной помощи с сердечной недо-
статочностью, и велосипедист с умеренным увели-
чением размера полости и утолщением стенки ЛЖ.
Предполагалось, что оценка диастолической функ-
ции является надежным методом для дифференци-
ровки гипертрофической кардиомиопатии от спор-
тивного сердца. Несмотря на то что субъекты, веду-
щие малоподвижный образ жизни, с ГКМ обычно
демонстрируют сниженные индексы диастоличе-
ской функции, и авторы предыдущих исследований
предполагают, что соотношение E/e′ > 7,3 можно
надежно применять для отличия субъектов с ГКМ
от таковых со спортивным сердцем [31], эти данные
следует интерпретировать с осторожностью. Недав-
но было показано, что показатели диастолической
функции у спортсменов с ГКМ часто остаются в
пределах нормы, а также отсутствуют диастоличе-
ские параметры, благодаря которым можно было
достоверно отличить спортсменов с ГКМ от тако-
вых с физиологической ГЛЖ [25]. Таким образом,
несмотря на то, что патологические диастолические
параметры могли бы порождать вопросы о наличии
сердечной патологии, не следует использовать в
качестве подтверждения диагноза нормальные диа-
столические параметры у спортсменов с клинически
предполагаемой ГКМ.
СПОРТСМЕНЫ, ТРЕНИРУЮЩИЕ ВЫНОСЛИВОСТЬ,
ИЛИ КАРДИОМИОПАТИЯ ПРАВОГО ЖЕЛУДОЧКА
Спортивные тренировки приводят к гипертрофии
правых отделов сердца, что в некоторых случаях
может быть более значимым, нежели перестройка
Рис. 37.13 Трудность дифференцировки спортивного сердца от гипертензивной болезни сердца по данным эхокардиографическим.
Парастернальная позиция по длинной оси A A (A, Б) и апикальные четырехкамерные позиции A A (В, Г) у пациента с гипертензивной болезнью
сердца (A, В) и профессионального велосипедиста (Б, Г) с настройкой глубины сходного сектора. Многие параметры очень схожи на 2D-изображении. И
в том и в другом случае наблюдается небольшое утолщение стенки ЛЖ и размер полости ЛЖ у верхнего предела нормы. Фракция выброса ЛЖ была
сходна в обоих случаях и составляла около 55%. Размер ЛП был повышен у пациентов с гипертензией, а размер ПП — у велосипедистов.
Г
В
А
Б
In-37_для нас.indd 973
03.04.2019 12:12:43
974
ЧАСТЬ VII Сосудистые и системные заболевания
левых отделов сердца (см. рис. 37.13). У спортсмена
с учащенным пульсом, с внезапной смертью сердца
в семейном анамнезе, или отклонениями от нормы
на ЭКГ, подтверждающие АКПЖ, как, например,
инверсией T-волны (зубца) в начальных V отведе-
ниях, ЭхоКГ может играть важную роль в диффе-
ренцировке спортивного сердца от АКПЖ Крите-
рии, формирующие часть критериев комиссии по
решению данного вопроса, и которые могут быть
оценены с помощью ЭхоКГ, в большинстве своем,
основаны на наличии увеличенного размера право-
го желудочка, регионарной акинезии ПЖ, дискине-
зии или аневризме, а также снижении ФВ ПЖ до
33% и менее [53]. Все это следует оценивать в слу-
чаях подозрений на АКПЖ у спортсмена, одного
эхокардиографического исследования не достаточ-
но при постановке диагноза АКПЖ и должно рас-
сматриваться в контексте клинического и семейного
анамнеза, с учетом данных 12-ти канальной ЭКГ,
сигнал-усредненной ЭКГ и МРТ сердца. Как показа-
но на рис. 37.14, визуализация ПЖ у спортсменов,
тренирующих выносливость, должна быть выпол-
нена с осторожностью, т.к. трабекулярность и дав-
ление от гепертрофированной мышечной перекла-
дины может приводить к индуцированию аномалии
регионарного движения стенки у здорового спорт-
смена.
В одной работе исследовали клинические, ЭКГ,
эхокардиографические и МРТ-параметры для диф-
ференцировки случаев АКПЖ от спортсменов с или
без правой прекордиальной или латеральной ин-
версией T-волны (зубца) [57]. Следует подчеркнуть,
что в случаях с АКПЖ не было спортсменов с
АКПЖ, таким образом, результаты не направлены
специально на решение этой клинической задачи.
Действительно, было обнаружено, что признаки
асимметричной гипертрофии ПЖ и сниженной
функции ПЖ, измеренной с помощью ФВ ПЖ, или
фракционное изменение площади, подтвердили на-
личие АКПЖ (табл. 37.6). В недавней работе вы-
делили частоту, с которой показатели здоровых
спортсменов удовлетворяют некоторым критериям
АКПЖ (рис. 37.15) [84], и, по-видимому, это связа-
но с гипертрофией правых отделов сердца.
В последние годы была описана вызванная фи-
зической нагрузкой кардиомиопатия ПЖ, которая
может быть причиной желудочковых аритмий и
внезапной смерти сердца [64]. Известен факт повы-
шенной фенотипической экспрессии АКПЖ у субъ-
ектов с явными мутациями десмосомных генов, что
связанно с тренировками на выносливость. У спор-
тсменов с вызванной физической нагрузкой карди-
омиопатией ПЖ не наблюдается выше ожидаемого
уровень генетического полиморфизма [85], связан-
ного с АКПЖ. В результате этого предполагают, что
это не связано с широко известными в настоящее
время мутациями десмосомных генов, но вызвано
чрезмерными тренировками у чувствительных ин-
дивидуумов. Вероятно, это является следствием
суммации эпизодов микроповреждений ПЖ, свя-
занных с тренировками на выносливость и соревно-
ваниями [11].
МОЖЕТ ЛИ СПОРТСМЕН ПРОДОЛЖАТЬ
СОРЕВНОВАТЬСЯ БЕЗ УГРОЗЫ ЗДОРОВЬЮ
В общем, спортсмену с диагнозом структурного за-
болевания сердца, при котором известно, что это
оно связанно с повышенным риском внезапной
смерти сердца, как например гипертрофическая
кардиомиопатия, аритмогенная кардиомиопатия
Рис. 37.14 A A Аритмогенная кардиомиопатия правого желудочка или спортивное сердце. Проекции, сфокусированные на ПЖ, у профес-
сионального велосипедиста, демонстрирующие выдающуюся мышечную перекладину и выраженную трабекулярность верхушки ПЖ (слева: конечно-
диастолический, справа: конечно-систолический). Хотя повышенная трабекулярность не является типичным признаком аритмогенной кардиомиопатии
ПЖ, это может вызывать появление патологии регионарного движения стенки с точкой прикрепления на мышечной перекладине. Установлено, что пато-
логия регионарного движения стенки, наряду с увеличенными объемами ПЖ, относится к главным диагностическим критериям аритмогенной кардиоми-
опатии ПЖ, это состояние может быть излишне диагностировано у элитных спортсменов, тренирующих выносливость.
In-37_для нас.indd 974
03.04.2019 12:12:44
975
37 Эхокардиография у спортсменов
Признаки, подтверждающие, что это спортивное сердце Признаки, подтверждающие, что это АКПЖ
Симметричное увеличение размеров сердца
Фракция выброса ПЖ < 45%
Увеличение только входного отдела ПЖ
Увеличение как входного, так и выходного отделов ПЖ
Ранняя реполяризация на ЭКГ
Аномалии движения стенки ПЖ
Вольтажные критерии ГЛЖ или ГПЖ на ЭКГ
Q волны или низкий вольтаж QRS < 1,8 мВ в прекордиальных
отведениях
Позднее усиление сигнала гадолинием на ЭКГ
>100ВЖКза24час
ВЖК или слабый ответ со стороны АД при проведении
нагрузочной пробы
АД — артериальное давление; АКПЖ — аритмогенная кардиомиопатия (дисплазия) правого желудочка; ВЖК — внеочередные желудоч-
ковые комплексы; ГЛЖ — гипертрофия левого желудочка; ГПЖ — гипертрофия правого желудочка; ПЖ — правый желудочек; ЭКГ —
электрокардиограмма.
[Zaidi A, Sheikh N, Jongman JK, et al. Clinical differentiation between physiological remodeling and arrhythmogenic right ventricular cardiomyopathy
in athletes with marked electrocardiographic repolarization anomalies. J Am Coll Cardiol 65:2702–2711, 2015.]
ТАБЛИЦА 37.6 Отличие спортивного сердца от аритмогенной кардиомиопатии правого желудочка
0%
10%
20%
30%
40%
50%
60%
70%
80%
90%
100%
Элитные
Любители
В
Т
П
Ж
п
п
д
о
В
Т
П
Ж
п
п
д
о
/
П
П
Т
В
Т
П
Ж
1
В
Т
П
Ж
/
П
П
Т
Ф
И
П
П
Ж
ф
Q
R
S
≥
1
1
4
(
м
с
е
к
)
≥
2
/
3
П
а
р
а
м
е
т
р
ы
С
У
Э
К
Г
Рис. 37.15 Распространенность положительных критериев аритмогенной кардиомиопатии (дисплазии) правого желудочка у здоровых
спортсменов. Значительная доля спортсменов, тренирующих выносливость, имеют размеры правого желудочка (ПЖ) за пределами нормы [84]. Раз-
личие между спортивным сердцем и аритмогенной кардиомиопатией ПЖ может быть очень затруднено, и одного эхокардиографического исследования
для этого может быть недостаточно. Корреляция с данными ЭКГ является существенной, и часто для исключения диагноза требуются дальнейшие ис-
следования, такие как МРТ сердца, мониторирование по Холтеру, сигнал-усредненная ЭКГ, семейный анамнез и скрининг, а также последующая визуа-
лизация. Это следует проводить в центре, где имеется опыт исследований как спортивного сердца, так и аритмогенной кардиомиопатии ПЖ. ВТПЖ —
выносной тракт правого желудочка; ВТПЖппдо — выходной тракт правого желудочка в парастернальной позиции по длинной оси; ППТ — площадь
поверхности тела; ФИП — фракция изменения площади; ФQRS — фрагментация комплекса QRS [Jongman JK, Zaidi A, Muggenthaler M, Sharma S.
Relationship between echocardiographic right-ventricular dimensions and signal-averaged ECG abnormalities in endurance athletes. Europace 17:1441–1448, 2015].
1. Достаточный ли объем тренировок выполняет обследуе-
мый, чтобы в его сердце произошли изменения, свой-
ственные спортивному сердцу?
2. Соответствуют ли изменения в сердце обследуемого
типу и интенсивности выполняемых им тренировок?
3. Подтверждают ли данные ЭхоКГ наличие серьезной сер-
дечной патологии при их сопоставлении с возрастом,
полом и расовым происхождением.
4. Достаточно ли был исследован клинический вопрос
и требуются ли в последующем ЭКГ, МРТ сердца,
КТ-ангиография сердца.
КТ — компьютерная томография; МРТ — магнитно -резонансная
томография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 37.7
Ключевые вопросы, возникающие
при проведении эхокардиографии
у спортсмена
ПЖ, дилатационная кардиомиопатия, синдром
Марфана с дилатированной аортой, или аномалии
коронарных артерий, следует рекомендовать не уча-
ствовать в спортивных соревнованиях.
Вследствие этого ЭхоКГ играет решающую роль
в ключевых вопросах у спортсменов (табл. 37.7).
Постановка точного диагноза осуществляется так,
что те индивиды, у которых нормальные изменения
сопоставимы со спортивным сердцем не без осно-
ваний исключаются из соревнований, а тем спор-
тсменам, у которых имеются заболевания, связан-
ные с повышенным риском неблагоприятных ис-
ходов, дают соответствующие рекомендации.
In-37_для нас.indd 975
03.04.2019 12:12:44
976
ЧАСТЬ VII Сосудистые и системные заболевания
Параметр
Способ
Проекция
Тренировка на
выносливость
Силовая
тренировка
Сочетанная
тренировка
Размер ЛЖ:
ВРЛЖд
М-режим
или 2D-режим
Парастернальная по
длинной оси
Повышенная ++ Нормальная или
повышенная +
Повышенная +++
Размер ЛЖ:
объем ЛЖ
2D- или 3D-режим
Апикальная
Повышенная ++ Нормальная или
повышенная +
Повышенная +++
Толщина
стенки ЛЖ
M-режим
или 2D-режим
Парастернальная по
длинной оси
Нормальная
Нормальная или
повышенная*
Повышенная
Фракция
выброса ЛЖ
2D- или 3D-режим
Апикальная
Нормальная
Нормальная
Нормальная или отно-
сительно понижена
(у субъектов с дила-
тированным в значи-
тельной степени
сердцем)
Размер ЛП:
Размер ЛП
или индекс
объема ЛП
2D-режим
Парастернальная по
длинной оси и
апикальная
Повышенная +
Нормальная или
повышенная
Повышенная ++
Размер ПЖ:
размер базаль-
ного отдела и
размер ВТПЖ
2D-режим
Парастернальная по
короткой оси и
апикальная
Увеличенный
диаметр
базального
отдела (по
отношению
к ЛЖ)
Нормальная
Увеличенный основной
диаметр (в отноше-
нии к ЛЖ)
Аортальные
синусы
M-режим
или 2D-режим
Парастернальная по
длинной оси
Нормальная
Нормальная
Нормальная
Диастолическое
наполнение
ЛЖ
Допплерографическое
исследование
Апикальная
Нормальная
Нормальная
Нормальная
* На значения, которые считаются нормальными, может влиять применение препаратов, повышающих эффективность тренировок.
+ — в легкой степени; ++ — в средней степени; +++ — в тяжелой степени.
ВРЛЖд — конечно -диастолический внутренний размер левого желудочка; ВТПЖ — выносной тракт правого желудочка; ЛЖ — левый
желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
СВОДНАЯ ИНФОРМАЦИЯ
Оценка спортивного сердца: степень изменений должна быть пропорциональна объему выполняемой физической нагрузки
ЛИТЕРАТУРА
1. Fagard R. Athlete’s heart, Heart 89:1455–1461,
2003.
2. Bhella PS, Hastings JL, Fujimoto N, et al.
Impact of lifelong exercise “dose” on left
ventricular compliance and distensibility, J
Am Coll Cardiol 64:1257–1266, 2014.
3. Morganroth J, Maron BJ, Henry WL, Epstein
SE. Comparative left ventricular dimensions
in trained athletes, Ann Intern Med 82:521–
524, 1975.
4. Mitchell JH, Haskell W, Snell P, Van Camp
SP. Task Force 8: classification of sports, J Am
Coll Cardiol 45:1364–1367, 2005.
5. Utomi V, Oxborough D, Whyte GP, et al. Sys-
tematic review and meta-analysis of training
mode, imaging modality and body size influ-
ences on the morphology and function of the
male athlete’s heart, Heart 99:1727–1733, 2013.
6. Utomi V, Oxborough D, Ashley E, et al. Pre-
dominance of normal left ventricular geom-
etry in the male ‘athlete’s heart’, Heart
100:1264–1271, 2014.
7. Haykowsky M, Humen D, Teo K, et al. Ef-
fects of 16 weeks of resistance training on left
ventricular morphology and systolic function
in healthy men >60 years of age, Am J Car-
diol 85:1002–1006, 2000.
8. Luijkx T, Cramer MJ, Prakken NH, et al.
Sport category is an important determinant
of cardiac adaptation: an MRI study, Br J
Sports Med 46:1119–1124, 2012.
9. Noseworthy PA, Weiner R, Kim J, et al. Early
repolarization pattern in competitive athletes:
clinical correlates and the effects of exercise
training, Circ Arrhythm Electrophysiol 4:432–
440, 2011.
10. Spence AL, Naylor LH, Carter HH, et al. A
prospective randomised longitudinal MRI
study of left ventricular adaptation to endur-
ance and resistance exercise training in hu-
mans, J Physiol 589(Pt 22):5443–5452, 2011.
11. La Gerche A, Burns AT, Mooney DJ, et al.
Exercise-induced right ventricular dysfunc-
tion and structural remodelling in endurance
athletes, Eur Heart J 33:998–1006, 2012.
12. Baggish AL, Yared K, Weiner RB, et al. Dif-
ferences in cardiac parameters among elite
rowers and subelite rowers, Med Sci Sports
Exerc 42:1215–1220, 2010.
13. Brosnan M, La Gerche A, Kalman J, et al.
Comparison of frequency of significant elec-
trocardiographic abnormalities in endurance
versus nonendurance athletes, Am J Cardiol
113:1567–1573, 2014.
14. Pluim BM, Zwinderman AH, van der Laarse
A, van der Wall EE. The athlete’s heart. A
meta-analysis of cardiac structure and func-
tion, Circulation 101:336–344, 2000.
15. Wernstedt P, Sjostedt C, Ekman I, et al. Ad-
aptation of cardiac morphology and function
to endurance and strength training. A com-
parative study using MR imaging and echo-
cardiography in males and females, Scand J
Med Sci Sport 12:17–25, 2002.
16. Basavarajaiah S, Boraita A, Whyte G, et al.
Ethnic differences in left ventricular remod-
eling in highly-trained athletes relevance to
differentiating physiologic left ventricular
hypertrophy from hypertrophic cardiomy-
opathy, J Am Coll Cardiol 51:2256–2262,
2008.
17. Rawlins J, Carre F, Kervio G, et al. Ethnic
differences in physiological cardiac adapta-
tion to intense physical exercise in highly
trained female athletes, Circulation 121:1078–
1085, 2010.
18. Luijkx T, Velthuis BK, Backx FJ, et al. Ana-
bolic androgenic steroid use is associated with
ventricular dysfunction on cardiac MRI in
strength trained athletes, Int J Cardiol
167:664–668, 2013.
19. Angell PJ, Chester N, Green DJ, et al. Ana-
bolic steroid use and longitudinal, radial, and
circumferential cardiac motion, Med Sci
Sports Exerc 44(4):583–590, 2012.
In-37_для нас.indd 976
03.04.2019 12:12:44
977
37 Эхокардиография у спортсменов
20. D’Andrea A, Caso P, Salerno G, et al. Left
ventricular early myocardial dysfunction after
chronic misuse of anabolic androgenic ste-
roids: a Doppler myocardial and strain imaging
analysis, Br J Sports Med 41:149–155, 2007.
21. Abergel E, Chatellier G, Hagege AA, et al. Se-
rial left ventricular adaptations in world-class
professional cyclists: implications for disease
screening and follow-up, J Am Coll Cardiol
44:144–149, 2004.
22. Zoncu S, Pelliccia A, Mercuro G. Assessment
of regional systolic and diastolic wall motion
velocities in highly trained athletes by pulsed
wave Doppler tissue imaging, J Am Soc Echo-
cardiogr 15:900–905, 2002.
23. Florescu M, Stoicescu C, Magda S, et al. “ Su-
pranormal” cardiac function in athletes re-
lated to better arterial and endothelial func-
tion, Echocardiography 27:659–667, 2010.
24. Vinereanu D, Florescu N, Sculthorpe N, et al.
Differentiation between pathologic and
physiologic left ventricular hypertrophy by
tissue Doppler assessment of long-axis func-
tion in patients with hypertrophic cardiomy-
opathy or systemic hypertension and in ath-
letes, Am J Cardiol 88:53–58, 2001.
25. Sheikh N, Papadakis M, Schnell F, et al.
Clinical profile of athletes with hypertrophic
cardiomyopathy, Circ Cardiovasc Imaging
8:e003454, 2015.
26. Matsumura Y, Elliott PM, Virdee MS, et al.
Left ventricular diastolic function assessed
using Doppler tissue imaging in patients with
hypertrophic cardiomyopathy: relation to
symptoms and exercise capacity, Heart
87:247–251, 2002.
27. Richand V, Lafitte S, Reant P, et al. An ultra-
sound speckle tracking (two-dimensional
strain) analysis of myocardial deformation in
professional soccer players compared with
healthy subjects and hypertrophic cardiomy-
opathy, Am J Cardiol 100:128–132, 2007.
28. Vitarelli A, Capotosto L, Placanica G, et al.
Comprehensive assessment of biventricular
function and aortic stiffness in athletes with
different forms of training by three-dimen-
sional echocardiography and strain imaging,
Eur Heart J Cardiovasc Imaging 14:1010–1020,
2013.
29. La Gerche A, Burns AT, D’Hooge J, et al.
Exercise strain rate imaging demonstrates
normal right ventricular contractile reserve
and clarifies ambiguous resting measures in
endurance athletes, J Am Soc Echocardiogr
25:253–262, 2012.
30. Fagard R, Van den Broeke C, Amery A. Left
ventricular dynamics during exercise in elite
marathon runners, J Am Coll Cardiol 14:112–
118, 1989.
31. Caselli S, Maron MS, Urbano-Moral JA, et al.
Differentiating left ventricular hypertrophy
in athletes from that in patients with hyper-
trophic cardiomyopathy, Am J Cardiol
114:1383–1389, 2014.
32. La Gerche A, Heidbuchel H, Burns AT, et al.
Disproportionate exercise load and remodel-
ing of the athlete’s right ventricle, Med Sci
Sports Exerc 43:974–981, 2011.
33. D’Andrea A, La Gerche A, Golia E, et al. Right
heart structural and functional remodeling in
athletes, Echocardiography 32(Suppl 1):S11–
S22, 2015.
34. Teske AJ, Prakken NH, De Boeck BW, et al.
Echocardiographic tissue deformation imag-
ing of right ventricular systolic function in
endurance athletes, Eur Heart J 30:969–977,
2009.
35. Iskandar A, Mujtaba MT, Thompson PD.
Left atrium size in elite athletes, JACC Cardio-
vasc Imaging 8:753–762, 2015.
36. D’Andrea A, Riegler L, Cocchia R, et al. Left
atrial volume index in highly trained athletes,
Am Heart J 159:1155–1161, 2010.
37. Nistri S, Galderisi M, Ballo P, et al. Determi-
nants of echocardiographic left atrial volume:
implications for normalcy, Eur J Echocardiogr
12:826–833, 2011.
38. Baggish AL. Athletic left atrial dilation: size
matters? JACC Cardiovasc Imaging 8:763–765,
2015.
39. Nagueh SF, Appleton CP, Gillebert TC, et al.
Recommendations for the evaluation of left
ventricular diastolic function by echocardiog-
raphy, J Am Soc Echocardiogr 22:107–133,
2009.
40. Grunig E, Henn P, D’Andrea A, et al. Refer-
ence values for and determinants of right
atrial area in healthy adults by 2-dimensional
echocardiography, Circ Cardiovasc Imaging
6:117–124, 2013.
41. Aizer A, Gaziano JM, Cook NR, et al. Relation
of vigorous exercise to risk of atrial fibrilla-
tion, Am J Cardiol 103:1572–1577, 2009.
42. Mont L, Elosua R, Brugada J. Endurance sport
practice as a risk factor for atrial fibrillation
and atrial flutter, Europace 11:11–17, 2009.
43. Mont L. Arrhythmias and sport practice,
Heart 96:398–405, 2010.
44. Harmon KG, Asif IM, Klossner D, Drezner
JA. Incidence of sudden cardiac death in na-
tional collegiate athletic association athletes,
Circulation 123:1594–1600, 2011.
45. Iskandar A, Thompson PD. A meta-analysis
of aortic root size in elite athletes, Circulation
127:791–798, 2013.
46. Pelliccia A, Di Paolo FM, Quattrini FM. Aor-
tic root dilatation in athletic population, Prog
Cardiovasc Dis 54:432–437, 2012.
47. Zeppilli P, dello Russo A, Santini C, et al.
In vivo detection of coronary artery anoma-
lies in asymptomatic athletes by echocardio-
graphic screening, Chest 114:89–93, 1998.
48. Lorber R, Srivastava S, Wilder TJ, et al.
Anomalous aortic origin of coronary arteries
in the young: echocardiographic evaluation
with surgical correlation, JACC Cardiovasc
Imaging 8:1239–1249, 2015.
49. Corrado D, Biffi A, Basso C, et al. 12-lead
ECG in the athlete: physiological versus
pathological abnormalities, Br J Sports Med
43:669–676, 2009.
50. Drezner JA, Fischbach P, Froelicher V, et al.
Normal electrocardiographic findings: recog-
nising physiological adaptations in athletes,
Br J Sports Med 47:125–136, 2013.
51. Zaidi A, Ghani S, Sheikh N, et al. Clinical
significance of electrocardiographic right
ventricular hypertrophy in athletes: compari-
son with arrhythmogenic right ventricular
cardiomyopathy and pulmonary hyperten-
sion, Eur Heart J 34:3649–3656, 2013.
52. Kim JH, Noseworthy PA, McCarty D, et al.
Significance of electrocardiographic right
bundle branch block in trained athletes, Am J
Cardiol 107:1083–1089, 2011.
53. Marcus FI, McKenna WJ, Sherrill D, et al.
Diagnosis of arrhythmogenic right ventricu-
lar cardiomyopathy/dysplasia: proposed
modification of the Task Force Criteria, Eur
Heart J 31:806–814, 2010.
54. Papadakis M, Carre F, Kervio G, et al. The
prevalence, distribution, and clinical out-
comes of electrocardiographic repolarization
patterns in male athletes of African/Afro-
Caribbean origin, Eur Heart J 32:2304–2313,
2011.
55. Papadakis M, Basavarajaiah S, Rawlins J, et al.
Prevalence and significance of T-wave inver-
sions in predominantly Caucasian adolescent
athletes, Eur Heart J 30:1728–1735, 2009.
56. Wasfy MM, DeLuca J, Wang F, et al. ECG
findings in competitive rowers: normative
data and the prevalence of abnormalities us-
ing contemporary screening recommenda-
tions, Br J Sports Med 49:200–206, 2015.
57. Zaidi A, Sheikh N, Jongman JK, et al. Clinical
differentiation between physiological remod-
eling and arrhythmogenic right ventricular
cardiomyopathy in athletes with marked
electrocardiographic repolarization anoma-
lies, J Am Coll Cardiol 65:2702–2711, 2015.
57a. Brosnan M, Claessen G, Heidbuchel H, et al.
Right precordial T-wave inversion in healthy
endurance athletes can be explained by lat-
eral displacement of the cardiac apex, JACC
Clinical Electrophysiology 1:84–91, 2015.
58. Drezner JA, Ackerman MJ, Anderson J, et al.
Electrocardiographic interpretation in ath-
letes: the ‘Seattle criteria’, Br J Sports Med
47:122–124, 2013.
59. Pelliccia A, Maron BJ, De Luca R, et al. Re-
modeling of left ventricular hypertrophy in
elite athletes after long-term deconditioning,
Circulation 105:944–949, 2002.
60. Weiner RB, Wang F, Berkstresser B, et al.
Regression of “gray zone” exercise-induced
concentric left ventricular hypertrophy dur-
ing prescribed detraining, J Am Coll Cardiol
59:1992–1994, 2012.
61. Maron BJ, Pelliccia A, Spataro A, Granata M.
Reduction in left ventricular wall thickness
after deconditioning in highly trained Olym-
pic athletes, Br Heart J 69:125–128, 1993.
62. Basavarajaiah S, Wilson M, Junagde S, et al.
Physiological left ventricular hypertrophy or
hypertrophic cardiomyopathy in an elite ado-
lescent athlete: role of detraining in resolving
the clinical dilemma, Br J Sports Med 40:727–
729, 2006. discussion 729.
63. de Gregorio C, Speranza G, Magliarditi A, et
al. Detraining-related changes in left ventric-
ular wall thickness and longitudinal strain in
a young athlete likely to have hypertrophic
cardiomyopathy, J Sports Sci Med 11:557–561,
2012.
64. Heidbuchel H, Prior DL, La Gerche A. Ven-
tricular arrhythmias associated with long-
term endurance sports: what is the evidence?
Br J Sports Med 46(Suppl 1):44–50, 2012.
65. American College of Cardiology Foundation
Appropriate Use Criteria Task F, American
Society of E, American Heart A, et al. ACCF/
ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/
SCCT/SCMR 2011 Appropriate Use Criteria
for Echocardiography. A Report of the
American College of Cardiology Foundation
Appropriate Use Criteria Task Force, Ameri-
can Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, Society for Cardiovascular Magnetic
Resonance American College of Chest Physi-
cians, J Am Soc Echocardiogr 24:229–267,
2011.
66. Maron BJ, Levine BD, Washington RL, et al.
Eligibility and disqualification recommenda-
tions for competitive athletes with cardiovas-
In-37_для нас.indd 977
03.04.2019 12:12:44
978
ЧАСТЬ VII Сосудистые и системные заболевания
cular abnormalities: task force 2: prepartici-
pation screening for cardiovascular disease in
competitive athletes: a scientific statement
from the American Heart Association and
American College of Cardiology, J Am Coll
Cardiol 66:2356–2361, 2015.
67. Corrado D, Pelliccia A, Bjornstad HH, et al.
Cardiovascular pre-participation screening of
young competitive athletes for prevention of
sudden death: proposal for a common Euro-
pean protocol. Consensus Statement of the
Study Group of Sport Cardiology of the
Working Group of Cardiac Rehabilitation
and Exercise Physiology and the Working
Group of Myocardial and Pericardial Diseases
of the European Society of Cardiology, Eur
Heart J 26:516–524, 2005.
68. Steinvil A, Chundadze T, Zeltser D, et al.
Mandatory electrocardiographic screening of
athletes to reduce their risk for sudden death
proven fact or wishful thinking? J Am Coll
Cardiol 57:1291–1296, 2011.
69. Ljungqvist A, Jenoure P, Engebretsen L, et al.
The International Olympic Committee (IOC)
Consensus Statement on periodic health
evaluation of elite athletes March 2009, Br J
Sports Med 43:631–643, 2009.
70. La Gerche A, Baggish AL, Knuuti J, et al.
Cardiac imaging and stress testing asymp-
tomatic athletes to identify those at risk of
sudden cardiac death, JACC Cardiovasc Imag-
ing 6:993–1007, 2013.
71. Abernethy WB, Choo JK, Hutter Jr. AM.
Echocardiographic characteristics of profes-
sional football players, J Am Coll Cardiol
41:280–284, 2003.
72. Holloway CJ, Dass S, Suttie JJ, et al. Exercise
training in dilated cardiomyopathy improves
rest and stress cardiac function without
changes in cardiac high energy phosphate
metabolism, Heart 98:1083–1090, 2012.
73. La Gerche A, Claessen G, Dymarkowski S, et
al. Exercise-induced right ventricular dys-
function is associated with ventricular ar-
rhythmias in endurance athletes, Eur Heart J
36:1998–2010, 2015.
74. La Gerche A, MacIsaac AI, Burns AT, et al.
Pulmonary transit of agitated contrast is as-
sociated with enhanced pulmonary vascular
reserve and right ventricular function during
exercise, J Appl Physiol 109:1307–1317, 2010.
75. Lewis GD, Murphy RM, Shah RV, et al. Pul-
monary vascular response patterns during
exercise in left ventricular systolic dysfunc-
tion predict exercise capacity and outcomes,
Circulation Heart Fail 4:276–285, 2011.
76. Lau EM, Vanderpool RR, Choudhary P, et al.
Dobutamine stress echocardiography for the
assessment of pressure-flow relationships of
the pulmonary circulation, Chest 146:959–
966, 2014.
77. D’Andrea A, Naeije R, D’Alto M, et al. Range
in pulmonary artery systolic pressure among
highly trained athletes, Chest 139:788–794,
2011.
78. Langer C, Butz T, Mellwig KP, et al. Elite
athletes with mitral or aortic regurgitation
and their cardiopulmonary capability, Acta
Cardiologica 68:475–480, 2013.
79. Stefani L, Galanti G, Innocenti G, et al. Exer-
cise training in athletes with bicuspid aortic
valve does not result in increased dimensions
and impaired performance of the left ven-
tricle, Cardiol Res Pract 2014:238694, 2014.
80. Pelliccia A, Fagard R, Bjornstad HH, et al.
Recommendations for competitive sports
participation in athletes with cardiovascular
disease: a consensus document from the
Study Group of Sports Cardiology of the
Working Group of Cardiac Rehabilitation
and Exercise Physiology and the Working
Group of Myocardial and Pericardial Diseases
of the European Society of Cardiology, Eur
Heart J 26:1422–1445, 2005.
81. Mellwig KP, van Buuren F, Gohlke-Baerwolf
C, Bjornstad HH. Recommendations for the
management of individuals with acquired
valvular heart diseases who are involved in
leisure-time physical activities or competitive
sports, Eur J Cardiovasc Prev Rehabil 15:95–
103, 2008.
82. Bonow RO, Nishimura RA, Thompson PD, et
al. Eligibility and disqualification recommen-
dations for competitive athletes with cardio-
vascular abnormalities: task force 5: valvular
heart disease: a scientific statement from the
American Heart Association and American
College of Cardiology, Circulation 132:e292–
297, 2015.
83. Pelliccia A, Maron MS, Maron BJ. Assessment
of left ventricular hypertrophy in a trained
athlete: differential diagnosis of physiologic
athlete’s heart from pathologic hypertrophy,
Prog Cardiovasc Dis 54:387–396, 2012.
84. Jongman JK, Zaidi A, Muggenthaler M,
Sharma S. Relationship between echocar-
diographic right-ventricular dimensions and
signal-averaged electrocardiogram abnor-
malities in endurance athletes, Europace
17:1441–1448, 2015.
85. La Gerche A, Robberecht C, Kuiperi C, et al.
Lower than expected desmosomal gene muta-
tion prevalence in endurance athletes with
complex ventricular arrhythmias of right
ventricular origin, Heart 96:1268–1274, 2010.
86. Pelliccia A, Maron BJ, Culasso F, et al. Ath-
lete’s heart in women. Echocardiographic
characterization of highly trained elite female
athletes, JAMA 276:211–215, 1996.
87. Pelliccia A, Maron BJ, Di Paolo FM, et al.
Prevalence and clinical significance of left
atrial remodeling in competitive athletes, J
Am Coll Cardiol 46690–696, 2005.
88. Sheikh N, Papadakis M, Carre F, et al. Car-
diac adaptation to exercise in adolescent ath-
letes of African ethnicity: an emergent elite
athletic population, Br J Sports Med 47:585–
592, 2013.
89. Schmied C, Zerguini Y, Junge A, et al. Car-
diac findings in the precompetition medical
assessment of football players participating in
the 2009 African Under-17 Championships
in Algeria, Br J Sports Med 43:716–721, 2009.
90. Whyte GP, George K, Nevill A, et al. Left
ventricular morphology and function in fe-
male athletes: a meta-analysis, Int J Sports
Med 25:380–383, 2004.
91. Whyte GP, George K, Sharma S, et al. The
upper limit of physiological cardiac hypertro-
phy in elite male and female athletes: the
British experience, Eur J Appl Physiol 92:592–
597, 2004.
92. D’Andrea A, Cocchia R, Riegler L, et al. Left
ventricular myocardial velocities and defor-
mation indexes in top-level athletes, J Am Soc
Echocardiogr 23:1281–1288, 2010.
93. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
94. Prior DL, La Gerche A. The athlete’s heart,
Heart 98:947–955, 2012.
95. Pela G, Li Calzi M, Crocamo A, et al. Ethnic-
ity-related variations of left ventricular re-
modeling in adolescent amateur football
players, Scand J Med Sci Sports 25:382–389,
2015.
96. Prakken NH, Velthuis BK, Bosker AC, et al.
Relationship of ventricular and atrial dilata-
tion to valvular function in endurance ath-
letes, Br J Sports Med 45:178–184, 2011.
97. Maron BJ, Douglas PS, Graham TP, et al. Task
Force 1: preparticipation screening and diag-
nosis of cardiovascular disease in athletes, J
Am Coll Cardiol 45:1322–1326, 2005.
In-37_для нас.indd 978
03.04.2019 12:12:44
979
38 Наследственные заболевания
соединительной ткани
ANDREW CHENG, MD • MARK LEWIN, MD • AARON OLSON, MD
Формы заболеваний соединительной
ткани
Синдром Марфана
Синдром Элерса–Данло
Гомоцистинурия
Другие фибриллинопатии
Синдром Лойеса–Дитца
Двухстворчатый аортальный клапан
Синдром Тернера
Наследственная торакальная
аневризма и расслоение аорты
Гистопатология
Данные эхокардиографии
Аорта в норме
Дилатация аорты
Расслоение аорты
Другие проявления заболеваний аорты
Пролапс митрального клапана
Левый желудочек
Легочная артерия
История болезни
Методы оценки
Возможности оценки
Терапевтические стратегии
Фармакологические
Хирургические
Альтернативные диагностические
подходы
Несмотря на то что болезни соединительной ткани
влияют на многие органы, их воздействие на сер-
дечно-сосудистую систему считается наиболее
опасным. Как известно, эти болезни вызывают по-
степенную дегенерацию кожи, суставов, плевры и
глаз. Хотя поражаться могут как левые, так и правые
отделы сердца, клинически значимая патология
чаще ограничена МК, АК сердца и самой аортой.
В отличие от других форм сердечно-сосудистых
заболеваний, многие пациенты обращаются за ме-
дицинской помощью не из-за симптомов, относя-
щихся к сердечно-сосудистой системе, а в значи-
тельной степени в связи с признаками, связанными
с одной из экстракардиальных систем, указанных
выше.
Кроме того, выявление сердечно-сосудистой па-
тологии может быть обнаружено при скрининговом
исследовании сердца в связи с наличием установ-
ленного или подозреваемого заболевания соедини-
тельной ткани у другого члена семьи. При наличии
кардиальных симптомов болезней соединительной
ткани эхокардиография (ЭхоКГ) является основ-
ным скрининговым исследованием сердца. Для
тщательного исследования пациента, как и при
многих других сердечных заболеваниях, чреспище-
водная эхокардиография (ЧПЭхоКГ) применяется
совместно с трансторакальной эхокардиографией
(ТТЭхоКГ). Кроме того, другие методы неинвазив-
ной визуализации например, компьютерная томо-
графия (КТ) или магнитно-резонансная томогра-
фия (МРТ) в определенных случаях вносят вклад в
диагностику. Хотя синдром Марфана (СМ) является
наиболее распространенным заболеванием соеди-
нительной ткани, приводящим к поражению сер-
дечно-сосудистой системы, другая наследственная и
врожденная патология, как известно, влияет на
структуры сердца аналогичным образом (табл.
38.1). Эти состояния представлены в этой главе.
Кроме того, выделен спектр заболеваний и методы
диагностики.
ФОРМЫ ЗАБОЛЕВАНИЙ
СОЕДИНИТЕЛЬНОЙ ТКАНИ
СИНДРОМ МАРФАНА
СМ является хорошо известным наследственным
заболеванием соединительной ткани с широким
фенотипическим спектром. Основные клинические
проявления заболевания включают сердечно-сосу-
дистую, глазную и костную системы. Диагностика
основывается на нозологии Гента, которая была
пересмотрена международной группой экспертов в
2010 г. (табл. 38 .2, 38.3) [1]. Пересмотренные крите-
рии придали особое значение важнейшим клиниче-
ским признакам: дилатации или расслоению корня
аорты и подвывиху хрусталика.
Обследование детей и подростков на наличие СМ
заслуживает пристального внимания [1]. Рекомен-
дуются периодические обследования с учетом воз-
можности выявления клинических признаков, ко-
In-38_для нас.indd 979
03.04.2019 12:12:57
980 ЧАСТЬ VII Сосудистые и системные заболевания
торые могут прогрессировать со временем и обес-
печивать достижение диагностического критерия.
Однако врачу следует быть благоразумным при
постановке этого диагноза, поскольку он может
вызвать психосоциальный стресс, повлиять на вы-
бор профессии и ограничить возможность заклю-
чения страхового договора. Молодым пациентам
Синдром Марфана
Синдром Лойеса–Дитца
Синдром Элерса–Данло
Гомоцистинурия
Синдром аневризмы и расслоения грудной части нисходя-
щего отдела аорты
Наследственная аневризма грудной части нисходящего
отдела аорты
MASS-фенотип (вовлечение митрального клапана, аорты,
кожи и скелета)
Двухстворчатый аортальный клапан
Коарктация аорты
Синдром пролапса митрального клапана
Синдром Тернера
Несовершенный остеогенез
MASS — Mitral valve prolapse, Aotic dilatation, Skin, Skeleton.
ТАБЛИЦА 38.1
Наследственные и врожденные
заболевания, связанные с дилатацией
аорты или пролапсом митрального
клапана
При наличии семейного анамнеза любое из следующих
положений подтверждает диагноз «синдрома Марфана»
Эктопия хрусталика
Системный показатель ≥ 7
Z-показатель диаметра аoрты на уровне синусов ≥ 2 в воз-
расте старше 20 лет или Z-показатель ≥ 3 в возрасте до
20 лет
При отсутствии семейного анамнеза и без специфических
признаков иного заболевания соединительной ткани
Дилатация Ao на уровне синусов (Z-показатель ≥ 2)
и эктопия хрусталика = Синдром Марфана
Дилатация Ao на уровне синусов (Z-показатель ≥ 2 в воз-
расте старше 20 лет или Z-показатель ≥ 3 в возрасте до
20 лет) и мутация фибриллина-1 = Синдром Марфана
Дилатация Ao на уровне синусов (Z-показатель ≥ 2)
и системный показатель ≥ 7 = Синдром Марфана
Эктопия хрусталика и фибриллин-1 без видимой дилатации
аорты = Синдром Марфана
Примечание. См. табл. 38.3 для системной оценки.
Ao — аорта.
[Loeys BL, Dietz HC, Braverman AC, et al. The revised Ghent nosology
for the Marfan syndrome. J Med Genet 47:476–485, 2010.]
ТАБЛИЦА 38.2 Пересмотренные гентские критерии
диагностики синдрома Марфана
Симптом запястья и большого пальца — 3 (запястье или
большой палец — 1)
Килевидная деформация грудной клетки — 2 (воронко-
образная деформация грудной клетки или асимметрия
грудной клетки — 1)
Деформация задней части стопы — 2 (простое
плоскостопие — 1)
Пневмоторакс — 2
Дуральная эктазия — 2
Протрузия вертлужной впадины — 2
Снижен индекс соотношения верхнего сегмента/нижнего
сегмента туловища и увеличен рука/рост при отсутствии
тяжелого сколиоза — 1
Ограниченное разгибание локтевого сустава — 1
Сколиоз или пояснично-грудной кифоз — 1
Характерные черты лица (3/5: долихоцефалия, энофтальм,
скошенные глазные щели, гипоплазия скуловых костей,
ретрогнатия) — 1
Кожные атрофии — 1
Миопия > 3 диоптрий — 1
Пролапс митрального клапана — 1
*
Системная оценка — это сумма отдельных показателей для ка-
ждой из перечисленных фенотипических характеристик.
ТАБЛИЦА 38.3 Системная оценка* данных
при синдроме Марфана
(моложе 20 лет) с мутацией FBN1 или с СМ в семей-
ном анамнезе и параметрами корня аорты с Z-пока-
зателем < 3 следует ставить диагноз «потенциаль-
ный синдром Марфана», пока следующее обследо-
вание не выявит дальнейшее расширение аорты.
СМ наследуется по аутосомно-доминантному
типу, причем у 25% пациентов представлены спо-
радические новые мутации без семейного анамнеза
[2]. Как только у пациента диагностируют СМ, род-
ственники первой степени родства должны пройти
обследование (медицинский осмотр, при необходи-
мости офтальмологическое обследование и ЭхоКГ).
Пенетрантность, связанная с возрастом, высока, и
межродственные и внутрисемейные вариабельно-
сти хорошо описаны. Моллекулярно-генетическое
исследование гена фибриллин-1 (FBN1) (локус
15q21.1) выявило причинную мутацию приблизи-
тельно у 70–90% пациентов, удовлетворяющих
клинико-диагностическим критериям СМ [3].
Несмотря на значительные усилия, предприня-
тые в определении взаимосвязи генотипа и феноти-
па СМ, почти никаких характерных корреляций
выявлено не было. До сих пор ни одна из них не
оказалась достаточно специфической, чтобы ока-
зать влияние на клиническое ведение больного.
Пациенты, у которых была выявлена наиболее тя-
желая форма СМ (также называемая инфантильным
синдромом Марфана) и идентифицируемая мутация,
In-38_для нас.indd 980
03.04.2019 12:12:58
981
38 Наследственные заболевания соединительной ткани
как правило, имеют мутацию в центральной части
гена между экзонами 24–32 [4–6]. Примечательно,
что в этом регионе также были обнаружены мута-
ции у пациентов с классическими, нетипично тяже-
лыми и более легкими формами СМ и другими
фибриллинопатиям [6–8]. И наоборот, мутации,
которые приводят к легким формам фибриллино-
патии первого типа, также были описаны. Они
включают мутации в C-концевой области FBN1,
которые приводят только к скелетным проявлениям
СМ [9]. Мутации в экзонах 59–65 FBN1 [10] и экзо-
нах 1–10 [11] связаны с фенотипами, которые не
вызывают значительного поражения аорты или
имеют поздно проявляющиеся и относительно лег-
кие сердечно-сосудистые симптомы.
СИНДРОМ ЭЛЕРСА–ДАНЛО
Существует много форм синдрома Элерса–Данло
(EDS), каждая из которых проявляется частными
фенотипическими особенностями. Наиболее рас-
пространенными формами являются тип III, иначе
называемый синдромом доброкачественной гипермо-
бильности, и «классическая» форма, ранее имено-
вавшаяся типами I и II, а теперь расцениваемая как
образующая клинический континуум (включаю-
щий гиперрастяжимость, представляющую собой
сильно ранимую, как «папиросная бумага», плохо
заживающую кожу, сколиоз и грыжи). От одной
четверти до одной трети больных с этими типами
синдрома Элерса–Данло имеют расширение аорты,
но чаще в легкой степени. Расслоение аорты без
предшествующей выраженной дилатации встреча-
ется редко [12–14]. Отдаленный прогноз в отноше-
нии течения и развития аневризмы аорты является
предметом текущих исследований [12, 13]. У этих
пациентов также встречается пролапс митрального
клапана (ПМК). Классические типы и тип III син-
дрома Элерса–Данло наследуются по аутосомно-до-
минантному типу и вызваны нарушением синтеза
коллагена.
Тип IV, или сосудистая форма, считается «злока-
чественной» формой синдрома Элерса–Данло, ко-
торая имеет повышенную склонность к спонтанно-
му разрыву сосудов. Средняя продолжительность
жизни пациентов составляет 51 год. Риску разрыва
подвержены аорта, крупные сосуды мозга и абдоми-
нальные артерии [15]. Местом разрыва артерий
являются: грудная клетка и брюшная полость (50%),
голова и шея (25%), конечности (25%). Крайне ред-
ко сосудистый тип синдрома Элерса–Данло может
являться причиной инсульта у лиц молодого воз-
раста. Средний возраст внутричерепного разрыва
аневризмы, спонтанного разрыва фистулы сонной
артерии в пещеристом синусе и аневризмы шейных
артерий составляет 28 лет [16]. Менее частыми про-
явлениями являются гиперэластичноть тканей и
гипермобильность суставов, но часто наблюдаются
синяки, плохое заживление ран и разрыв желудоч-
но-кишечного тракта. Наследственность — аутосо-
мно-доминантая, с дефектом в гене коллагена III
типа COL3A1 [17].
Нет единого мнения о том, какие мероприятия
следуют проводить у пациентов с синдромом Элер-
са–Данло в качестве скрининга поражения сердеч-
но-сосудистой системы. Мы рекомендуем всем па-
циентам с синдромом Элерса–Данло (вне зависимо-
сти от конкретного типа) пройти скрининговую
ЭхоКГ. Пациентам с сосудистой формой синдрома
рекомендуется обследовать аорту каждые 3–5 лет, а
если есть признаки ее расширения, то чаще. Также
может обнаруживаться АР и поражение митрально-
го клапана. Показания к хирургическому вмеша-
тельству при синдромах классического и III типа
аналогичны СМ и обсуждаются далее в этой главе.
Хрупкая природа крупных сосудов в сосудистой
форме синдрома Элерса–Данло увеличивает число
послеоперационных осложнений и смертность. По-
этому неясно, оправданно ли раннее профилакти-
ческое лечение неразорвавшихся аневризм при со-
судистой форме синдрома Элерса–Данло [18]. Од-
нако успешное лечение аневризм и разрывов может
быть достигнуто при корректной хирургической
технике [19]. ЧПЭхоКГ следует применять с осто-
рожностью из-за возможного поражения желудоч-
но-кишечного тракта.
ГОМОЦИСТИНУРИЯ
Гомоцистинурия определяется наличием избыточ-
ного гомоцистина в моче. Наиболее распространен-
ная форма гомоцистинурии связана с нарушением
обмена веществ, при котором дефицит цистатионин
β-синтазы приводит к повышению метионина в
крови и последующему увеличению в моче его го-
моцистеина-предшественника. Наследование про-
исходит по аутосомно-рецессивному типу при ва-
риабельной фенотипической экспрессии даже в
пределах одной семьи. Клиническая картина может
включать: задержку развития, подвывих хрустали-
ка, коагулопатию и многие из тех же скелетных
особенностей, характерных для СМ, в т.ч . сколиоз,
арахнодактилию, высокий рост и пороки развития
грудной клетки. В отличие от СМ у пациентов с
гомоцистинурией аневризма аорты, как правило, не
наблюдается. С кардиоваскулярной точки зрения у
этих пациентов может развиться артериальный и
венозный тромбоз периферических или церебраль-
ных сосудов как у детей, так и у взрослых [20].
Тромбоз осложняется повреждением сосудов, в т.ч .
дегенерацией среднего слоя аорты и крупных сосу-
дов с гиперплазией интимы и фиброзом, что может
приводить к легочной эмболии с гипертензией так
и к ИБС с вероятным развития ИМ.
ДРУГИЕ ФИБРИЛЛИНОПАТИИ
Как уже говорилось, мутации FBN1 в определенных
фенотипах имеют сходство с СМ, включая ПМК,
In-38_для нас.indd 981
03.04.2019 12:12:58
982
ЧАСТЬ VII Сосудистые и системные заболевания
MASS-фенотип (миопия, ПМК, пограничное рас-
ширение аорты, неспецифические кожные/скелет-
ные признаки), ярко выраженный подвывих хру-
сталика, преобладающие либо изолированные ске-
летные признаки СМ, семейную аневризму или
расслоение аорты [3]. СМ и фенотипы, относящие-
ся к нему, называют 1-м типом фибриллинопатий.
Другое заболевание соединительной ткани, по-
хожее на СМ, — врожденная контрактурная арахно-
дактилия (ВКА), также известная как синдром Бил-
са, обусловлено мутациями фибриллина-2 (FBN2).
Различить эти два синдрома может быть сложно
из-за схожих скелетных осложнений, включающих
арахнодактилию, пороки развития грудной клетки
и сколиоз. Однако врожденная контрактурная арах-
нодактилия обычно представлена контрактурой
нескольких суставов и морщинистым завитком уш-
ной раковины. Периодически выявляется аневриз-
ма корня аорты; помимо этого, может наблюдаться
поражение глаз [21].
СИНДРОМ ЛОЙЕСА–ДИТЦА
Синдром Лойеса–Дитца (СЛД) представляет собой
болезнь соединительной ткани, наследуемую по
аутосомно-доминантному типу, при которой на-
блюдаются артериальные аневризмы и расслоения,
равно как и другие системные поражения [22, 23].
Синдром Лойеса–Дитца характеризуется клиниче-
ской триадой: извитостью артерий и аневризмами,
гипертелоризмом и расщеплением небного язычка
или расщеплением нёба. При этой патологии встре-
чаются аневризмы корня аорты и других артерий.
Извитость артерий наиболее часто поражает сосуды
головы и шеи. Следует обратить внимание, что дис-
секция аорты может происходить при диаметре
меньшем, чем при СМ [22, 24]. Синдром Лойеса–
Дитца связан с нарушением регуляции сигнального
пути трансформирующего фактора роста бета
(TGF-β). На данный момент известны следующие
гены, связанные с СЛД: патологические варианты
генов рецептора TGF-β в субъединицах TGFBR1 и
TGFBR2 [22], переносчик сигнала SMAD3 [25, 26],
лиганд TGFB2 [27]. Недавно было доказано, что
TGFB3 также может вызывать синдромальные анев-
ризмы и диссекции аорты [28].
Специфические диагностические критерии син-
дрома Лойеса–Дитца не были установлены. Как
правило, диагноз ставится тогда, когда у пациента
имеются системные поражения органов и проведе-
но обследование на наличие генетической мутации.
В клинической картине основными 4 группами
признаков являются: сосудистые, скелетные, череп-
но-лицевые и кожные (табл. 38 .4) [22]. В нашей
практике мы проводим генетическое обследование
пациентов с дилатацией корня аорты, которые име-
ют какие-либо признаки из других основных групп
клинических симптомов. Однако некоторые паци-
енты с дилатацией аорты и расслоением имеют
мутации в генах сигнального пути TGF-β без иных
проявлений синдрома Лойеса–Дитца. Такие паци-
енты относятся к группе с аневризмой грудной ча-
сти нисходящего отдела аорты и расслоением сте-
нок, про них будет написано далее. Следует учиты-
вать результаты генетического обследования в
больших семьях даже только при наличии аорталь-
ной или другой артериальной дилатации. В нашей
практике, до тех пор, пока не выявлена другая при-
чина, мы также рассматриваем возможность прове-
дения генетического обследования на предмет мута-
ций генов, связанных с синдромом Лойеса-Дитца у
пациентов, у которых была расслаивающая анев-
ризма аорты диаметром < 5 см.
Синдром Лойеса–Дитца делится на 4 подтипа в
зависимости от варианта патологического гена [29].
Однако значительное количество синдромов явля-
ются общими для подтипов, которые считаются
частью одного и того же клинического континуума
(табл. 38 .5).
Наиболее серьезным осложнением при синдроме
Лойеса–Дитца является аневризма корня аорты и ее
расслоение. Средняя продолжительность жизни
таких пациентов составила 26 лет [22]. Почти у всех
пациентов была расслаивающаяся аневризма корня
Сосудистые
Дилатация корня аорты и расслоение
Аневризмы дистальных артерий и извитость
Скелетные проявления
Воронкообразная или килевидная деформация грудной
клетки
Сколиоз
Гипермобильность суставов
Арахнодактилия
Эквиноварусная деформация стопы
Черепно-лицевые признаки
Глазной гипертелоризм
Удвоение небного язычка (или небный язычок с широким
основанием или выступающим гребнем)
Расщепление нёба
Краниосиностоз
Кожные признаки
Пергаментная кожа
Хрупкость кожных сосудов
Дистрофические шрамы
Другое
Женщины подвержены риску разрыва матки во время
беременности
ТАБЛИЦА 38.4 Клинические признаки синдрома
Лойеса–Дитца
In-38_для нас.indd 982
03.04.2019 12:12:58
983
38 Наследственные заболевания соединительной ткани
Тип СЛД Ген
Связанные особенности
СЛД 1
TGFBR1 Реже встречаются кожные
проявления
СЛД 2
TGFBR2 Реже встречаются черепно-лицевые
проявления (за исключением
удвоения нёбного язычка)
СЛД 3
SMAD3 Ранний остеоартрит; также известен
как аневризмо-остеоартритический
синдром
СЛД 4
TGFB2 Аневризмы аорты и церебральных
сосудов, извитость артерий
и скелетные признаки
СЛД — синдром Лойеса–Дитца.
ТАБЛИЦА 38.5 Классификация синдрома Лойеса–Дитца
аорты. Как уже было сказано, расслоение может
произойти при размерах аорты, которые не счита-
ются высоким риском при СМ (< 5,0 см) и были
зафиксированы в младенческом и раннем детском
возрасте. Около 50% пациентов с синдромом Лойе-
са–Дитца имеют расширение или извитость артерий
помимо расширения корня аорты. Примечательно,
что эти дистальные патологические изменения не
обнаруживаются на ЭхоКГ. Эти сосудистые особен-
ности отличают сосудистые проявления при син-
дроме Лойеса–Дитца от СМ. Дополнительные поро-
ки сердца включают открытый артериальный про-
ток, дефект межпредсердной перегородки, пролапс
митрального клапана и двухстворчатый аортальный
клапан (ДАК).
ДВУХСТВОРЧАТЫЙ АОРТАЛЬНЫЙ КЛАПАН
ДАК является наиболее распространенной формой
врожденного порока сердца, встречается от 0,5 до
2% в популяции [30]. Клинические исследования
выявили коэффициент распространенности ДАК у
родственников первой степени родства, равный 9%,
что подтверждает наследственную природу этой
патологии [31, 32]. Примечательно, что у родствен-
ников первой степени родства была также выявлена
дилатация аорты при отсутствии ДАК [33].
Пациенты с ДАК подвержены повышенному
риску развития аневризмы аорты (рис. 38 .1), что,
по-видимому, является результатом патологиче-
ских изменений в стенке аорты, включающих пони-
жение фибриллина-1, потерю эластических воло-
кон, повышенный апоптоз и измененное располо-
жение гладкомышечных клеток [34]. Пациенты с
ДАК имеют большие размеры аортального кольца,
синусов и восходящего отдела аорты, а также увели-
чение степени дилатации аорты в динамике (рис.
38.2). Исторически термин «постстенотическая ди-
латация» использовался в качестве гемодинамиче-
ского объяснения выявления аневризмы аорты при
наличии ДАК. Однако нынешние исследования
показывают, что эта взаимосвязь обусловлена пато-
логией аорты, которая не зависит от аортального
порока сердца как такового [35, 36]. В прошлом
уровень диссекции аорты у пациентов с ДАК пере-
оценивался — современные исследования показы-
вают, что он сходен или чуть выше, чем у пациентов
с нормальным строением клапанов, но соизмери-
мыми аневризмами [37, 38]. Более того, повышен-
ный риск расслоения аорты у пациентов с двух-
створчатым клапаном ограничивается небольшой
группой лиц в популяции пациентов с ДАК в целом
[39, 40]. Даже после операции по замене ДАК оста-
ется высокий риск расслоения аорты. Поэтому мы
предполагаем, что, по крайней мере, у части попу-
ляции, одновременное наличие ДАК, аневризмы
аорты и ее расслоения является проявлением си-
стемных заболеваний соединительной ткани [41].
Хотя многие факторы могут приводить к рассло-
ению аорты [42], мало известно о том, почему ДАК
предрасполагает к формированию аневризмы и
расслоению. В попытке ответить на этот вопрос
Schaefer и коллеги [43] описали различия в размерах
ЛЖ
ЛЖ
Ао
Ао
Рис. 38 .1 A Двухстворчатый аортальный клапан по длинной оси. У
этого 7-летнего мальчика в фазу систолы наблюдается куполообразное прови-
сание створок аортального клапана (A) с эксцентрическим закрытием створок
клапана в фазу диастолы (Б). Ao — аорта; ЛЖ — левый желудочек.
А
Б
In-38_для нас.indd 983
03.04.2019 12:12:58
984
ЧАСТЬ VII Сосудистые и системные заболевания
аорты и эластичности между различными феноти-
пами. Авторы обнаружили, что у пациентов с 1-м
типом ДАК (переднезаднее расположение створок с
линией сращения или без нее между левой и правой
коронарными створками) отмечаются больший
размер и повышенная ригидность стенок синусов
Вальсальвы (рис. 38.3), чем у пациентов со 2-м ти -
пом ДАК (право-левое расположение створок с ли-
нией сращения или без нее между правой и некоро-
нарной створками). Механизм этих различий может
состоять в том, что строение и эластичность стенки
аорты обычно связаны с морфологией клапана аор-
ты. Гемодинамические различия, связанные с мор-
фологией АК, могут также способствовать генети-
ческой регуляции, изменению кровотока и силы,
действующей на стенку аорты.
СИНДРОМ ТЕРНЕРА
У пациентов с синдромом Тернера — высокий риск
выявления патологии левых отделов сердца, глав-
ным образом ДАК и коарктации аорты [44]. Кроме
того, пациенты с синдромом Тернера имеют более
высокую частоту системной гипертензии (даже при
отсутствии анатомической сердечно-сосудистой
патологии). Расслоение аорты встречается прибли-
зительно у 1,4% пациентов с синдромом Тернера
[45] и чаще выявляется в молодом возрасте (в сред-
нем в возрасте 30 лет) [46]. 80 –90% пациентов с
расслоением аорты также имеют системную гипер-
тензию или ДАК. Было трудно установить критерии
риска, в особенности потому, что большинство
критериев основаны на соматическом развитии
(рост, вес, общая площадь поверхности тела). По-
скольку у пациентов с синдромом Тернера также
отмечается низкий рост, общие детерминанты зави-
симости между соматическим развитием и ожидае-
мым размером аорты остаются проблематичными.
По этой причине определение нормального размера
аорты остается неясным, особенно при наличии или
отсутствии потенциально отягощающих факторов
(гипертензии, ДАК и коарктации аорты). Кроме
того, остается неясным, при каких относительных
размерах аорты должно применяться фармакологи-
ческое и/или хирургическое вмешательство. Нали-
чие распространенной васкулопатии у пациентов с
синдромом Тернера хорошо описано и характери-
зуется жесткостью стенок аорты, артериальной ди-
латацией, утолщением сосудистых стенок и атипич-
ным распространением пульсовой волны [47]. По-
скольку установлено, что пациенты с синдромом
Тернера без данных о патологии аорты или систем-
ной гипертензии имеют изолированную дилатацию
аорты, врожденную аортопатию рекомендуют счи-
тать первичным фенотипическим признаком этого
состояния.
Перекрестное исследование девушек с синдро-
мом Тернера в возрасте до 18 лет выявило ряд ин-
тересных эхокардиографических особенностей [48].
Когда группу пациентов с синдромом Тернера
сравнили с контрольной группой, субъекты с при-
знаками синдрома или без них, которые рассматри-
вались как относящиеся к высокому риску (артери-
альная гипертензия, ДАК, коарктация аорты до или
после хирургического вмешательства или иные на-
рушения системы органов, в т.ч . заболевания почек
и щитовидной железы) имели больший размер
проксимального участка аорты почти во всех случа-
ях. Распространенность болезни у лиц с Z-показате-
лем 2 и более составили: 12% для аортального
Восходящий отдел Ао
Рис. 38 .2 A Дилатация восходящего отдела аорты. У пациента с рис.
38.1 в парастернальной позиции по длинной оси из наивысшего промежутка
наблюдается расширение восходящего отдела аорты (Ао) размером 2,8 см
(4 Z-показатель).
N
R/L
Рис. 38.3 A Двухстворчатый аортальный клапан по короткой оси.
Парастернальная позиция по короткой оси у пациента с дилатацией восходя-
щего отдела аорты в сочетании с двухстворчатым аортальным клапаном. Па-
тология клапана является результатом сращения левой (L) и правой (R) коро-
нарных створок. Определяется линия сращения между левой и правой створ-
ками. N — некоронарная створка.
In-38_для нас.indd 984
03.04.2019 12:12:58
985
38 Наследственные заболевания соединительной ткани
кольца, 20% для корня аорты, 18% для СТС и 30%
для восходящего отдела аорты. Эти показатели рас-
пространенности болезни у лиц с повышенным
относительным риском имели соотношение от 4,8
до 12 раз по сравнению с контрольной популяцией.
Даже при отсутствии ДАК пациенты с синдромом
Тернера имели расширение корня аорты, расшире-
ние СТС и восходящего отдела аорты. Это говорит
о том, что синдром Тернера сам по себе предраспо-
лагает к дилатации аорты. ДАК постепенно усили-
вает этот независимый эффект синдрома Тернера.
Хотя данные, касающиеся дилатации аорты при
наличии синдрома Тернера вызывают очевидные
опасения риска расслоения, необходимы дополни-
тельные исследования, чтобы определить серьез-
ность этого риска. Аналогичным образом, наиболее
глубокое понимание параметров, относящихся к
дилатации и расслоению, позволит нам разработать
протоколы лечения пациентов, соответствующие
специфическим особенностям, присутствующим у
отдельных пациентов с синдромом Тернера. В то же
время по этой проблеме не существует никаких
универсальных терапевтических руководств. В силу
вышесказанного большинство специалистов, зани-
мающихся лечением пациентов с синдромом Тер-
нера, используют те же методы лечения, что и при
ДАК.
НАСЛЕДСТВЕННАЯ АНЕВРИЗМА ГРУДНОЙ ЧАСТИ
НИСХОДЯЩЕГО ОТДЕЛА АОРТЫ И РАССЛОЕНИЕ АОРТЫ
Около 20% пациентов без синдромов, обративших-
ся по поводу аневризмы аорты или ее расслоения,
имеют родственника первой степени родства с ана-
логичными изменениями [49, 50]. Диагноз наслед-
ственной аневризмы грудной части нисходящего
отдела аорты и ее расслоения устанавливается на
основе следующих критериев: прогрессирующее
расширение восходящего отдела аорты, отягощен-
ный семейный анамнез аневризмой и расслоением
аорты и исключение синдромальных причин анев-
ризмы грудной части нисходящего отдела аорты и
расслоения аорты, таких как СМ, синдром Лойеса–
Дитца и синдром Элерса–Данло. Недавно проведен-
ные исследования выявили патогенетические мута-
ции в генах, вовлеченных в сингнальный путь
TGF-β: TGFBR1, TGFBR2, лиганд TGFB2, лиганд
TGFB3 и SMAD3; и в генах, вовлеченных в функцию
гладкомышечных клеток, в частности, в гладкомы-
шечном клеточно-специфическом миозине тяже-
лой цепи 11 (MYH11), гладкомышечно-специфиче-
ском альфа-актине (ACTA2), киназе легких цепей
миозина (MYLK) и цГМФ-зависимой протеинкина-
зе 1 (PRKG1) [51]. Следует отметить, что пациенты
с наследственной аневризмой грудной части нисхо-
дящего отдела и расслоением аорты обращаются за
медицинской помощью раньше пациентов со спон-
танными расслоениями и дилатацией, но позже,
чем пациенты с СМ или синдромом Лойеса–Дитца.
ГИСТОПАТОЛОГИЯ
Фиброзные структуры сердца состоят преимуще-
ственно из протеинов соединительной ткани. Они
служат основой, посредством которой поддержива-
ется структура сократительного миокарда. Соеди-
нительная ткань также часто поддерживает вну-
треннюю структуру крупных кровеносных сосудов
и клапанов. Коллагеновые и эластиновые волокна
находятся под эндокардиальными клетками сердца
и кровеносных сосудов. Пучки коллагеновых воло-
кон I типа образуют каркас для АВ-клапанов и
представляют собой основные элементы фиброз-
ных колец клапанов. Основной структурной под-
держкой крупных кровеносных сосудов являются
эластин и коллаген I и III типов; меньшее количе-
ство коллагена IV, V и VI типов также обеспечивает
прочность стенок сосудов.
Аорта состоит из трех оболочек: внутренней (ин-
тимы), средней (медии) и наружной (адвентиции).
Средняя оболочка состоит из концентрических
слоев гладкомышечных клеток, коллагена и эласти-
на с протеогликанами внеклеточного матрикса. При
заболеваниях соединительной ткани дилатация
корня аорты обусловлена дегенеративными измене-
ниями в результате разрыва и разрушения волокон
эластина, повышения коллагена и отложения про-
теогликанов. Исторически этот процесс получил
название «кистозный медианекроз». Однако в силу
отсутствия первичного некроза и формирования
кист предпочтительным термином является «сре-
динная дистрофия». Молекулярные исследования
выявили механизмы, которые, возможно, лежат в
основе этого процесса. Повышенные уровни ма-
тричных металлопротеиназ, в особенности матрич-
ной металлопротеиназы-2 (ММР-2) и матричной
металлопротеиназы-9 (ММР-9) был обнаружен в
медиальном слое аортальных аневризм [52–56].
Матричная металлопротеиназа-2 и матричная ме-
таллопротеиназа-9 обладают высокой эластолити-
ческой активностью.
ДАННЫЕ ЭХОКАРДИОГРАФИИ
АОРТА В НОРМЕ
Аорта включает пять элементов: корень аорты, ту-
булярную часть восходящего отдела аорты, дугу
аорты, грудную часть нисходящего отдела аорты и
брюшную часть нисходящего отдела аорты. Корень
аорты состоит из фиброзного кольца АК, синуса
Вальсальвы, синотубулярного соединения (СТС) и
восходящего отдела аорты. Принято считать, что
эхокардиографические параметры этих областей
измеряются из левого трансторакального доступа
по длинной оси сердца в раннюю систолу у детей и
в конец диастолы у взрослых (рис. 38 .4). Дуга аорты
лучше всего визуализируется из супрастернальной
ямки (рис. 38 .5). Кроме того, АК и восходящий от-
In-38_для нас.indd 985
03.04.2019 12:12:59
986 ЧАСТЬ VII Сосудистые и системные заболевания
дел аорты у детей могут быть видны из субкосталь-
ного доступа (рис. 38 .6).
У взрослых пациентов размеры аорты зависят от
пола, возраста и площади поверхности тела. Норма-
тивные показатели и их диапазон учитывают дан-
ные факторы. Нормальные значения корня аорты
основаны на работе Roman и коллег [57], которые
измеряли диаметры корня аорты в трех возрастных
группах и с учетом пола. Эти контрольные значения
применяются различными объединениями тора-
кальных хирургов [58–60] (рис. 38 .7; табл. 38 .6).
Следует отметить, что у взрослых с крайними зна-
чениями роста и веса, нормальные значения не
утверждены окончательно, поэтому у таких паци-
ентов оценку измерений корня аорты следует про-
водить с осторожностью.
У детей размеры аорты нормализированы к пло-
щади поверхности тела и оцениваются Z-значени-
ем. Z-значение является количеством стандартных
отклонений для полученного значения от ожидае-
мого среднего значения для данной площади по-
верхности тела, основанном на большом количестве
данных у здоровых детей [61]. По договоренности,
значения в два и более являются превышающими
верхнюю границу нормы.
ДИЛАТАЦИЯ АОРТЫ
При наличии заболеваний соединительной ткани
дилатация аорты может быть в любом отделе аорты:
в области корня аорты, в грудной и брюшной ча-
стях нисходящего отдела аорты. При этом наиболее
типичными участками дилатации являются синусы
А
Б
В
Г
А: ДИСТ 1,35 см
Б: ДИСТ 1,15 см
В: ДИСТ 1,40 см
Г: ДИСТ 1,85 см
13 СМ
87 Гц
Рис. 38.4 Измерение аорты в области синусов. ЭхоКГ 12-летнего ребен-
ка с синдромом Марфана, выполненная в парастернальной позиции по длин-
ной оси. У пациента выраженная дилатация аорты в области синусов Вальсаль-
вы (2 на картинке: 4,39 см; 4,2 Z -показатель) и нормальный диаметр в области
фиброзного кольца аортального клапана (1 на картинке: 2,7 см; 1,6 Z-пока-
затель).
Рис. 38 .5 Изображение дуги аорты. Это изображение из супрастернальной
позиции по длинной оси в конце систолы показывает места для необходимых
измерений: дистальный (ДИСТ) участок восходящего отдела аорты (A) непо-
средственно перед брахиоцефальной артерией, дугу аорты (Б) между брахио-
цефальной артерией и левой сонной артерией, перешеек аорты (В) перед левой
подключичной артерией и проксимальным участком нисходящего отдела
аорты (Г) непосредственно за левой подключичной артерией.
Вальсальвы, СТС и восходящий отдел аорты. Наи-
более распространено сглаживание СТС, когда СТС
и проксимальный участок восходящего отдела аор-
ты имеют сглаженный внешний вид и фактически
одинаковый диаметр, как и синусы Вальсальвы
(рис. 38 .8). Термин сглаживание — качественный и
не связан с определенными измерениями. Фактиче-
ски сглаживание охватывает спектр данных, перво-
начально незначительно измененных с закономер-
ной тенденцией СТС резко изменять направление и
диаметр в области восходящего отдела аорты. Когда
прогрессирует сглаживание, происходит постепен-
ный переход к морфологическим изменениям с
постоянным диаметром сосуда от синусов Валь-
сальвы к проксимальному участку отделу аорты.
Кроме того, когда увеличивается дилатация кор-
ня аорты, может развиваться АР. Это происходит
либо в результате асимметричной дилатации одной
или нескольких створок, либо в результате распро-
страненной дилатации фиброзного кольца АК.
Каждый механизм способствует изменению геоме-
трии аорты, приводя к развитию регургитации (рис.
38.9, 38.10).
В тех случаях, когда грудная часть нисходящего
отдела аорты не может быть полностью исследована
при ТТЭхоКГ, следует использовать другие методы,
такие как ЧПЭхоКГ, МРТ, или КТ с ангиографией.
Нормальные размеры брюшной части нисходя-
щего отдела аорты взрослого человека составляют
2 см на уровне чревного ствола и 1,8 см чуть ниже
почечных артерий. Уменьшение диаметра наблюда-
In-38_для нас.indd 986
03.04.2019 12:12:59
987
38 Наследственные заболевания соединительной ткани
0,4
1,2
1,6
2,0
2,4
2,8
3,2
0,8
А
Б
В
1,2 1,6 2,0
4,2
3,8
3,4
3,0
2,6
2,2
1,6 2,0 2,4
2,4
1,6 2,0 2,4
2,8
3,2
3,6
4,0
4,4
y=1,97+1,12x
See = 0,24
r=0,71
p < 0,0005
Площадь поверхности тела (м2)
Дети и подростки
y=1,02+0,98x
See = 0,18
r=0,93
p < 0,0005
Взрослые 20–39 лет
y=1,92+0,74x
See = 0,37
r=0,40
p < 0,0005
Взрослые старше 40 лет
Рис. 38 .7 Номограммы для нормального диаметра корня аорты. Отношение диаметра корня аорты (вертикальная ось) к площади поверхности тела (го-
ризонтальная ось). Нормальный диапазон размеров аорты у людей младше 20 лет представлен фиолетовым цветом на графике А, для людей в возрасте 20–
39 лет — зеленым цветом на графике Б, для людей старше 40 лет — красным цветом на графике В. See — стандартная ошибка среднего [Roman MJ, Devereux
RB, Kramer-Fox R, O ’Loughlin J. Two-dimensional echocardiographic aortic root dimensions in normal children and adults. Am J Cardiol 64:507–512 , 1989].
ПП
Ао
Ао
ЛЖ
ЛЖ
Рис. 38.6 Аорта в субкостальной позиции у педиатрического пациента. (A) A Субкостальная позиция по короткой оси позволяет увидеть выносящий
тракт левого желудочка (ЛЖ) и восходящий отдел аорты (Ао). (Б) A Субкостальная сагиттальная позиция. ПП — правое предсердие.
А
Б
Абсолютные величины (см)
Индексированные величины (см/м2)
Корень аорты
Мужчины
Женщины
Мужчины
Женщины
Кольцо
2,6 ± 0,3
2,3 ± 0,2
1,3 ± 0,1
1,3 ± 0,1
Синусы Вальсальвы
3,4 ± 0,3
3,0 ± 0,3
1,7 ± 0,2
1,8 ± 0,2
Синотубулярное соединение
2,9 ± 0,3
2,6 ± 0,3
1,5 ± 0,2
1,5 ± 0,2
Проксимальный участок
восходящего отдела аорты
3,0 ± 0,4
2,7 ± 0,4
1,5 ± 0,2
1,6 ± 0,3
Примечание. Референтный диапазон размеров аорты в зависимости от пола. Диаметры корня аорты основаны на 2D-измерениях в конце
диастолы по методу ведущего конца к ведущему концу.
[Roman MJ, Devereux RB, Kramer-Fox R, O’Loughlin J. Two-dimensional echocardiographic aortic root dimensions in normal children and adults.
Am J Cardiol 64:507–512, 1989.]
ТАБЛИЦА 38.6 Нормальные размеры аорты у здоровых взрослых
In-38_для нас.indd 987
03.04.2019 12:12:59
988 ЧАСТЬ VII Сосудистые и системные заболевания
Аневризмы аорты делятся на истинные и лож-
ные (псевдоаневризмы). Истинная аневризма пред-
полагает ослабление и дилатацию всей стенки сосу-
да. Псевдоаневризма происходит тогда, когда дефект
всей толщины стенки аорты позволяет крови цир-
кулировать вне границ артерии. Циркулирующая
кровь заключена в области окружающих мягких
тканей. Наиболее распространенной причиной ис-
тинной аневризмы являются атеросклероз, дегене-
рация медии и расслоение аорты. Псевдоаневризмы
часто являются результатом травмы или инфекции
(например, эндокардита). Аневризма синусов Валь-
сальвы связана с некоторым количеством вторич-
ных феноменов. Расширение аневризмы обычно
идет по пути наименьшего сопротивления в правые
структуры сердца. Пораженные участки могут при-
водить к деформации створки АК, АР, окклюзии
коронарных артерий, обструкции выносящего
тракта ПЖ, ТР, обструкции правой ЛА и обструк-
ции нисходящего отдела аорты [62, 63]. Расширение
синусов может быть обнаружено с помощью ЭхоКГ
в 2D-режиме.
РАССЛОЕНИЕ АОРТЫ
Пациенты с острым расслоением аорты нуждаются
в срочном обследовании и лечении. Оперативная
постановка диагноза является крайне важной для
выделения больных с угрожающими симптомами
от пациентов с менее критичным состоянием. Уро-
вень смертности составляет около 1% в час в первые
48 час у тех пациентов, которые получили срочную
медицинскую помощь и выжили [64]. Кроме того,
при постановке диагноза необходимо учитывать
особенности анатомии и физиологии. Они включа-
ют в себя классификацию расслоения, определение
N
R
L
Рис. 38 .8 A Синдром Лойеса–Дитца. Парастернальная позиция по длин-
ной оси у 18-летнего пациента с умеренной дилатацией корня аорты, привед-
шая к сглаживанию в области синотубулярного соединения. Диаметр аорты в
области синусов Вальсальвы сопоставим с диаметром в синотубулярном сое-
динении.
Рис. 38.9 A Аортальная регургитация из-за расширения корня аорты.
Допплерография из парастернальной позиции по длинной оси у шестилетнего
пациента с мутацией TGFB и расширением корня аорты (3,1 см, 5 Z -значений)
показывает умеренную аортальную регургитацию.
Рис. 38 .10 A Функциональная аортальная регургитация. Слева: изо-
бражение аортального клапана из парастернальной позиции по короткой оси у
пациента, представленного на рис. 38 .9 , визуализируются правая (R), левая (L)
и некоронарная (N) створки в фазу диастолы. Справа: изображение в режиме
цветовой допплерографии демонстрирует центральную струю аортальной ре-
гургитации.
ется, когда аорта приближается к уровню подвздош-
ных артерий. Большинство аневризм брюшной
части нисходящего отдела аорты образуется между
почечными и подвздошными артериями. Клиниче-
ски значимые аневризмы брюшной части нисходя-
щего отдела аорты имеют диаметр > 4 см. От УЗИ
брюшной полости или ЭхоКГ следует ожидать вы-
сокую степень чувствительности и специфичности,
но иногда избыточный вес может препятствовать
полной визуализации. В этих случаях ангиография
брюшной части нисходящего отдела аорты, КТ ли-
бо МРТ аорты должны предоставить данные, с по-
мощью которых будет установлен окончательный
диагноз.
In-38_для нас.indd 988
03.04.2019 12:13:00
989
38 Наследственные заболевания соединительной ткани
места разрыва, выявление кровоизлияния, оценку
АР и поражения той или иной полости сердца [65].
ТТЭхоКГ обеспечивает быструю и легкодоступную
диагностику и во многих случаях может ответить на
все представленные ранее вопросы. ТТЭхоКГ широ-
ко используется для выявления расслоения прокси-
мального участка корня аорты, выявляя прогресси-
рующее расширение ее корня. При этом зачастую
распознается наличие расслаивающей гематомы
[66]. См. главу 34 для получения полной информа-
ции об ЭхоКГ-признаках расслоения аорты.
ДРУГИЕ ПРОЯВЛЕНИЯ ЗАБОЛЕВАНИЙ АОРТЫ
В дополнение к ходу развития дилатации и рассло-
ения аорты в подгруппе пациентов с заболеваниями
соединительной ткани патологическая дилатация
может развиваться после операции на корне аорты.
При исследовании пациентов с СМ был проведен
ретроспективный анализ, основанный на наличии
или отсутствии ранее перенесенной элективной
операции на корне аорты [67]. Комплексный анализ
показал, что проведенная ранее элективная опера-
ция на корне аорты была связанна с четырехкрат-
ным увеличением риска дальнейшей дилатации
нисходящего отдела аорты. Кроме того, увеличение
диаметра нисходящего отдела аорты было связано с
высоким риском расслоения корня аорты независи-
мо от его исходного диаметра. Эти авторы «подняли
предупредительный флаг», обнаружив, что только
у 37% пациентов получены параметры на всех уров-
нях аорты. Это позволило сделать вывод о том, что
у большинства пациентов опасный уровень дилата-
ции аорты не будет распознан даже при проведении
исследований с визуализацией.
ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА
ПМК представляет собой смещение аномально
утолщенных и удлиненных створок МК в ЛП в фа-
зу систолы (рис. 38 .11, 38.12). Это изменение геоме-
трии в строении клапана может привести к непол-
ному смыканию створок и, как следствие, к МР. Со
временем МР приводит к дилатации ЛП и ЛЖ, ко-
торая ухудшает степень регургитации.
В настоящее время ЭхоКГ является принятым
«золотым стандартом» в диагностике и оценке ПМК.
Были установлены ЭхоКГ-критерии для детального
обследования МК; в настоящее время ПМК опреде-
ляется как смещение одной или обеих створок более
чем на 2 мм за уровень фиброзного кольца МК
из парастернальной или апикальной позиции по
длинной оси. Обычно мы диагностируем ПМК из
парастернального доступа, а апикальное изображе-
ние предоставляет только подтверждающую ин-
формацию. ПМК также делится на классическую и
неклассическую формы: классическая форма харак-
теризуется утолщением створки > 5 мм, при неклас-
сической форме толщина составляет < 5 мм. Ослож-
нения в виде эндокардита или тяжелой МР, как
правило, наблюдаются при классической форме
болезни [68]. Заболевания соединительной ткани
чаще связаны с удлинением створок МК, что при-
водит к их пролапсу. При ПМК у взрослых, связан-
ном с кальцификацией, створки менее растянуты,
но более утолщены.
С использованием 3D-режима оценка клапана
была значительно улучшена. Несмотря на то что
ПМК, как правило, является спорадическим случа-
ем, он также может быть связан с заболеваниями
соединительной ткани, в т.ч . c СМ, синдромом
Элерса–Данло, «ломкостью костей» и MASS фено-
типом (см. ранее). В связи с тем что сочетание СМ
и ПМК распространено, возникло подозрение, что
изолированный ПМК может являться результатом
мутации FBN1 [69]. Однако эта связь не была уста-
новлена.
ПМК является наиболее распространенной па-
тологией клапана при СМ, распространенность
которой > 35% [70]. Важно понимать, что рекон-
структивное хирургическое вмешательство может
усугубить постоперационную дилатацию аорты в
результате повышенных гемодинамических нагру-
зок на аорту.
ЛЕВЫЙ ЖЕЛУДОЧЕК
Несмотря на то что поражение дуги аорты и МК
наиболее часто встречаются при заболеваниях сое-
динительной ткани, начальные нарушения систо-
лической и диастолической функций ЛЖ требуют
пояснения.
ЛЖ
Ао
ЛП
Рис. 38 .11 A Митральная регургитация из-за пролапса митрального
клапана. Цветная допплерография в парастернальной позиции по длинной
оси митрального клапана в фазу систолы представляет избыточные хорды,
провисание передней и задней створок митрального клапана и, как следствие,
развитие пролапса митрального клапана и митральной регургитации. Створки
митрального клапана смещены в задне-верхнем направлении в левое предсер-
дие (ЛП). Ao — аорта, корень; ЛЖ — левый желудочек.
In-38_для нас.indd 989
03.04.2019 12:13:01
990 ЧАСТЬ VII Сосудистые и системные заболевания
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ
С помощью МРТ и ЭхоКГ диастолическая функция
ЛЖ была изучена в ряде небольших исследований.
Нарушение диастолической функции ЛЖ было
продемонстрировано с помощью ЭхоКГ по увели-
чению времени замедления кровотока и увеличе-
нию времени изоволюмического расслабления; по-
лученные данные были обусловлены нарушением
эластических свойств миокарда [71]. Отмечен нео-
бычный спектр трансмитрального кровотока, сни-
жение эластичности желудочка (снижение времени
замедления кровотока) и расслабления миокарда
[72]. При тканевой допплеровской ЭхоКГ было по-
казано увеличение фазы раннего диастолического
наполнения с уменьшением скорости движения
фиброзного кольца МК (Ea), что свидетельствует о
нарушении расслабления миокарда [73].
Данные ЭхоКГ, полученные у детей с СМ в воз-
расте 3 лет демонстрируют появление ранней диа-
столической дисфункции (расслабление) ЛЖ [71].
Недавнее исследование диастолической функции
ЛЖ у 40 детей и подростков с СМ по сравнению с
контрольной группой соответствующего возраста
по данным ЭхоКГ свидетельствовало в пользу нару-
шения его расслаблении (отмечалось увеличение
времени замедления кровотока, времени изоволю-
мического расслабления и уменьшение соотноше-
ния митральных скоростей E/A) [74]. Наличие в
раннем возрасте повышенной ригидности миокар-
да, а позднее увеличение жесткости стенки аорты в
связи с ее растяжением [75] могут привести к систо-
лической и диастолической дисфункциям ЛЖ.
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ
Считалось, что сниженная систолическая сократи-
мость при СМ является исключительно вторичным
феноменом, связанным с аортальной или МР. Од-
нако и при отсутствии порока клапана сердца ре-
зультаты исследования показывают, что систоличе-
ская сократимость ЛЖ подвержена негативному
воздействию. В крупномасштабном исследовании
234 взрослых с СМ ни один из пациентов не соот-
ветствовал критериям дилатационной КМП, у не-
большой части пациентов все же было обнаружено
увеличение КСР и КДР ЛЖ и связанного с ними
умеренного ухудшения ФВ [76]. Кроме того, в не-
давнем исследовании сравнивалась функция ЛЖ у
45 пациентов с СМ без симптомов с подобранной
по возрасту здоровой контрольной группой с помо-
щью трехмерной спекл-трекинг ЭхоКГ (3D-STE). У
пациентов с СМ наблюдалась значительное сниже-
ние ФВ ЛЖ по данным (3D-STE) равно как и про-
дольной и окружной деформации [77].
Патогенез систолической и диастолической фун-
кций ЛЖ у пациентов с СМ до конца не ясен, но
наиболее вероятной причиной являются первичные
структурные и функциональные нарушения белка
фибриллин-1. Микрофибриллы, которые служат
материалом для формирования эластических воло-
кон и способствуют их функции, играют важную
роль в опосредованной эластической тяге. Эти ми-
крофибриллы содержат белок фибриллин-1 как
один из своих основных компонентов. Поскольку
мутации в фибриллине-1 препятствуют функции
микрофибрилл, считается, что это, в свою очередь,
ведет к патологии диастолической эластической
тяги ЛЖ.
ЛЕГОЧНАЯ АРТЕРИЯ
В отличие от четко определенной патологии ле-
вых отделов сердца аномалии правых отделов серд-
ца менее известны. При наличии дилатации ЛА
ЛЖ
ЛЖ
Ао
Ао
ЛП
ЛП
Рис. 38 .12 A Пролапс митрального клапана. (A) Парастернальная пози-
ция по длинной оси митрального клапана в позднюю систолу показывает
провисание передней и задней створок митрального клапана и, как следствие,
пролапс митрального клапана. (Б) Парастернальная позиция по длинной оси
митрального клапана в позднюю систолу представляет утолщение краевых
отделов передней и задней створок митрального клапана. Ao — аорта, корень;
ЛЖ — левый желудочек; ЛП — левое предсердие.
А
Б
In-38_для нас.indd 990
03.04.2019 12:13:01
991
38 Наследственные заболевания соединительной ткани
должны быть получены данные периодических
ЭхоКГ-обследований. Среди взрослого населения
была обнаружена хорошая корреляция между про-
грессирующей дилатацией корня аорты и ЛА [78].
Однако опасная патология ЛА в отличие от анев-
ризмы ЛА или расслоения аорты не была описана,
и клиническая значимость этого вывода требует
дальнейшего уточнения.
ИСТОРИЯ БОЛЕЗНИ
Из всех дисплазий соединительной ткани, описан-
ных в этой главе, СМ безусловно разобрано лучше
всего. Большинство пациентов с СМ имеют дилата-
цию восходящего отдела аорты или ее расслоение.
Крайне редко у пациента обнаруживается расслое-
ние нисходящего отдела грудной части нисходяще-
го отдела аорты типа B. Однако существует доказа-
тельство, что выявление прогрессирующей дила-
тации нисходящего отдела аорты прогнозирует
возможное расслоение аорты в этом регионе [67]. В
связи с этим даже при отсутствии выраженной ди-
латации нисходящего отдела аорты были даны
рекомендации, чтобы динамическое обследование
включало тщательный мониторинг всей аорты (от
уровня АК до брюшной части нисходящего отдела
аорты).
Явную (и, как правило, тяжелую) форму СМ
можно наблюдать в молодом возрасте; она носит
название «инфантильный синдром Марфана». Бо-
лезнь с поражением двух и более клапанов является
распространенной; наиболее часто ПМК сопутству-
ют выраженная МР, серьезные скелетные и легоч-
ные эмфизематозные изменения. Хроническая сер-
дечная и дыхательная недостаточность часто приво-
дят к смерти [79].
Беременные женщины с СМ подвержены повы-
шенному риску расслоения аорты; однако риск
низкий при диаметре аорты < 4 см [80]. ЭхоКГ
должны выполняться периодически в течение всей
беременности, особенно во время третьего триме-
стра, когда может произойти ускорение развития
патологии.
По рекомендациям 2010 г. Американского обще-
ства кардиологов/Американской ассоциации серд-
ца/Американского общества торакальных хирургов,
ЭхоКГ нужно проводить при диагностике СМ и
через 6 мес после этого, чтобы оценить размеры
аорты и степень ее расширения [18]. После этого
периодичность наблюдения основывается на разме-
ре аорты пациента, его возрасте, изменениях в па-
раметрах аорты и наличии диссекции аорты в се-
мейном анамнезе. Мы проводим ежегодную оценку
аорты с помощью ЭхоКГ у пациентов с легкой и
умеренной аневризмой аорты (у взрослых, размеры
аорты меньше, чем 4,5 см) при условии, что эти
результаты были стабильны. Визуализация состоит
из ЭхоКГ и КТ или МРТ ангиографии, чтобы не
допустить излишней лучевой нагрузки. Визуализа-
ция проводится чаще, если размер аорты больше
4,5 см или если увеличение аорты больше 5 мм за
год. На рис. 38 .13 приводится стратегия наблюдения
пациентов с СМ.
Поскольку имеются сведения о диссекции аорт
меньших размеров, мы стараемся выполнять визу-
ализацию аорты у пациентов с синдромом Лойеса–
Дитца и с наследственной аневризмой аорты груд-
ной части нисходящего отдела аорты и ее диссекции
каждые 6 мес. Пациентам с синдромом Лойеса–Дит-
ца мы также проводим МРТ исследование сосудов
верхней половины тела каждые 12–18 мес, т.к. син-
дром Лойеса–Дитца влияет на дистальную сосуди-
стую сеть. В табл. 38 .7 суммированы клинические
кардиальные и эхокардиографические данные, вы-
явленные при наиболее распространенных заболе-
ваниях соединительной ткани. Кроме того, рассма-
тривается распространенность этих заболеваний
соединительной ткани в общей популяции.
МЕТОДЫ ОЦЕНКИ
Стандартное изображение в 2D-режиме остается
скрининговым методом для оценки морфологии
клапанов сердца и для измерения размеров аорты.
Точность этого исследования зависит от оператора
и также связана с качеством изображения (в первую
очередь в связи с проблемами телосложения паци-
ента). Косые измерения аорты могут преувеличить
фактические размеры, как это происходит с диаме-
тром аорты, который не получен перпендикулярно
центральной оси аортального кровотока. Такие из-
мерения, как правило, достигаются из парастер-
нального доступа по длинной оси, доступа из
супрастернальной ямки по длинной оси и из суб-
костального подреберного доступа. Некоторые ла-
боратории измеряют синус Вальсальвы в М-режиме.
Хотя это может обеспечить воспроизводимые и
точные измерения, обычно мы проводим все изме-
рения в 2D-режиме в конце диастолы у взрослых и
в раннюю систолу у детей. Кольцо АК, синус Валь-
сальвы и синотобулярное соединение (и прокси-
мальный участок восходящего отдела аорты) визу-
ализируются из парастернального доступа по длин-
ной оси (рис. 38 .14), а также дистальный участок
восходящего отдела аорты (сразу перед отхождени-
ем безымянной артерии), дуга аорты и перешеек
аорты измеряются из супрастернальной ямки (рис.
38.15). У некоторых лиц проксимальный участок
нисходящего отдела аорты может быть получен из
парастернального доступа. В педиатрической прак-
тике распространено получать адекватные изобра-
жения брюшной части и дистального участка груд-
ной части нисходящего отдела аорты из субкосталь-
ной плоскости изображения (рис. 38 .16, 38.17). Мы
стараемся визуализировать и измерить все эти об-
ластей аорты у каждого пациента, который прохо-
дит через лабораторию ЭхоКГ.
In-38_для нас.indd 991
03.04.2019 12:13:01
992
ЧАСТЬ VII Сосудистые и системные заболевания
Наблюдение: чередование
ТТЭхоКГ/МРА каждые
полгода
<4,5см
≥4,5см
≥5,0см
≥5,0см
Синдром Марфана
Первоначальное обследование:
ТТЭхоКГ при постановке диагноза
и через 6 мес. МРА — для оценки всей аорты
Размер корня восходящего
отдела аорты < 4,5 см
≥4,5см
≥5,0см
Наблюдение: ежегодное
чередование ТТЭхоКГ/МРА
<5,0см
Хирургическое
вмешательство
Рост корня аорты
≥ 5,0 мм/год
Продолжать ежегодное
обследование
Продолжать обследование
раз в два года
Рис. 38 .13 Алгоритм обследования взрослых пациентов с синдромом Марфана. МРА — магнитно-резонансная ангиография; ТТЭхоКГ — транстора-
кальная эхокардиография.
Визуализация клапанов может быть улучшена с
помощью 3D-режима. При наличии 3D-изображе-
ний в режиме реального времени структура клапа-
нов и информация об их функции теперь может
быть получена таким образом, что позволит при-
нять оперативные решения касательно природы
патологического процесса. Несмотря на то что
3D-режим также можно использовать для визуали-
зации грудной части нисходящего отдела аорты,
клиническое применение этого нового метода пока
неясно. Возможно, что трехмерная технология с
множественными плоскостями изображения помо-
жет минимизировать количество косых измерений
или измерений, лежащих не вдоль оси аорты, кото-
рые могут быть при использовании лишь двумер-
ной техники. Однако требуется больше опыта для
определения, когда следует использовать трехмер-
ную или двумерную ЭхоКГ, КТ и МРТ ангиографию
аорты.
А
Б
В
Г
МЖП
ПСМК
Рис. 38 .14 Измерения корня аорты при эхокардиографии. На схеме
показано измерение фиброзного кольца аортального клапана (A), размеров в
области синусов Вальсальвы (Б), синотубулярного соединения (В) и прокси-
мального участка восходящего отдела аорты (Г). Измерения выполняют в
раннюю систолу у детей и в позднюю диастолу у взрослых. МЖП — межже-
лудочковая перегородка; ПСМК — передняя створка митрального клапана.
In-38_для нас.indd 992
03.04.2019 12:13:01
993
38 Наследственные заболевания соединительной ткани
Изменение
структур сердца
Характерные признаки
Функциональные
последствия
Распространенность
Синдром
Марфана
Митральный
клапан
Корень аорты
Восходящий отдел
аорты
Пролапс митрального
клапана
Пролапс трехстворчатого
клапана
Дилатация корня аорты
Митральная регургитация
Аортальная регургита-
ция Предрасположен-
ность к расслаивающей
аневризме аорты
3:10000
Синдром
Элерса–Данло
IV типа
Корень аорты
Артерии большого
и малого калибра
Аневризма артерий боль-
шого и малого калибра
Артериовенозные свищи
Аортальная регургитация
Предрасположенность к
расслаивающей
аневризме
Расслоение часто
спонтанное
≈1:250000
Двухстворчатый
аортальный
клапан
Аортальный клапан
Восходящий отдел
аорты
Дисфункция аортального
клапана
Дилатация восходящего
отдела аорты
Аортальная регургитация
Аортальный стеноз
Расслоение восходящего
отдела аорты
≈1:100
Синдром
Лойеса–Дитца
Дуга аорты
Артериальная извитость
Расслоение аорты (воз-
можно при меньшем
диаметре аорты, чем при
синдроме Марфана)
Неизвестна
Синдром
Тернера
Аортальный клапан
Восходящий отдел
аорты
Грудная часть нис-
ходящего отдела
аорты
Двухстворчатый аортальный
клапан
Коарктация аорты
Дилатация восходящего
отдела аорты
Гипертензия
Аортальный стеноз
Аортальная регургитация
Расслоение восходящего
отдела аорты
≈ 1 : 2000–5000 живоро-
жденных девочек
Аневризма
грудной части
нисходящего
отдела аорты
и синдром
расслоения
Грудная часть нис-
ходящего отдела
аорты
Дилатация корня аорты
Аневризма грудной части
нисходящего отдела аорты
Расслоение восходящего
отдела аорты
Расслоение грудной части
нисходящего отдела
аорты
Неизвестна: аневризмы
аорты с летальным
исходом у 15 000
человек в США в год
ТАБЛИЦА 38.7 Сводная таблица клинических и эхокардиографических признаков наиболее распространенных форм
заболеваний соединительной ткани
Нормализация измерений аорты является важ-
ным аспектом, связанным с правильной интерпре-
тацией данных. Точность этих нормализованных
данных особенно важна в педиатрической практике,
где быстрые изменения происходят во время роста.
Размеры аорты были тщательно изучены с помо-
щью ЭхоКГ в 2D-режиме в связи с прогностическим
значением их у пациентов с заболеваниями соеди-
нительной ткани. Как уже упоминалось в предыду-
щем разделе, у детей и взрослых нормальные значе-
ния были представлены на основе ряда показателей,
включая пол, возраст, площадь поверхности тела и
рост [57, 81–86].
При исследовании 52 здоровых младенцев и де-
тей (в возрасте от 1 мес до 15 лет) и 135 здоровых
взрослых (в возрасте от 20 до 74 лет) аорта была
измерена в конце диастолы в парастернальном до-
ступе по длинной оси на четырех уровнях: аорталь-
ного кольца, синусов Вальсальвы, СТС и прокси-
мального участка восходящего отдела аорты при ее
максимальном размере. Следует отметить, что при
этом исследовании измерения в 2D-режиме на
уровне синусов Вальсальвы были больше, чем при
М-режиме. Когда значения в 2D-режиме были стан-
дартизированы на монограммах М-режима, оши-
бочно диагностированная дилатация аорты была
обнаружена у 40% здоровых детей и взрослых [57].
Более того, не существует единственного подхо-
да к методологии измерения диаметра восходящего
отдела аорты. Контрольные значения, полученные
благодаря работе Roman и коллег, основываются на
методе ведущий край к ведущему краю, а также
признаны Американским обществом эхокардио-
графии [57, 60].
Однако рекомендации Американского общества
кардиологов/Американского общества сердца
2010 г. по лечению грудной части нисходящего от-
дела аорты рекомендуют для измерения диаметра
аорты метод от внутреннего края ко внутреннему
краю [58]. В недавнем исследовании двумерной
ЭхоКГ обе методики исследовались на 218 здоровых
взрослых. В среднем, при измерении аорты с помо-
щью метода ведущего края, результаты были на
2 мм больше, чем при измерении методов внутрен-
него края [59]. Но, следует отметить, что метод ве-
дущего края при двумерной ЭхоКГ также дает ре-
In-38_для нас.indd 993
03.04.2019 12:13:02
994
ЧАСТЬ VII Сосудистые и системные заболевания
АБВ
зультат в среднем на 2 мм больше, чем метод вну-
треннего края при КТ [60].
Точные решения являются крайне важными в
отношении того, какой набор данных будет исполь-
зован в качестве стандарта в каждой лаборатории
ЭхоКГ, равно как и при выборе подходящего про-
токола при измерении аорты. Как только метод и
d=1,76см
Рис. 38 .15 Измерения дуги аорты. Из супрастернального доступа по
длинной оси выполняются измерения дистального участка восходящего отде-
ла аорты (A) сразу перед брахиоцефальной артерией, поперечный диаметр
дуги аорты (Б) между брахиоцефальной артерией и левой сонной артерией и
перешеек аорты (В) непосредственно перед левой подключичной артерией.
Рис. 38 .16 Грудная часть нисходящего отдела аорты. Субкостальная
позиция по длинной оси показывает предпочтительное место измерения
дистального участка грудной части нисходящего отдела аорты (стрелка).
Рис. 38 .17 Субкостальная позиция по длинной оси. Показано предпоч-
тительное место измерения брюшной части нисходящего отдела аорты (стрел-
ка) ниже диафрагмы.
опубликованный набор данных одобрен и реализо-
ван на практике, все последующие обследования
пациента должны быть стандартизованы с теми же
техниками и критериями. Если пациенты находятся
в зависимости от отличающихся между собой нор-
мальных наборов данных, то могут иметь место
различные варианты отклонения от нормы. В отли-
чие от использования опубликованных наборов
данных некоторые группы специалистов опирались
как на данные, полученные среди здоровых пациен-
тов контрольных групп, так и на неопубликованные
данные масштабных исследований институтов [87].
В педиатрии пациенты с выраженной дилатаци-
ей аорты часто представляют трудную клиническую
дилемму. Несмотря на то что дилатация аорты мо-
жет быть на 50–70% больше, чем прогнозировалось
при стандартизации к площади поверхности тела,
имеется крайне мало данных, чтобы определить
высокий риск быстрого развития расслоения аорты.
Чтобы лучше прогнозировать риск расслоения аор-
ты в педиатрии, была проведена неинвазивная
оценка дисфункции ее стенки. Для расчета эласти-
ческих свойств аорты у 19 педиатрических паци-
ентов с СМ была использована трансторакальная
визуализация в М-режиме [88]. У пациентов кон-
трольной группы наблюдались существенные от-
личия от пациентов с СМ, у последних отмечалось
снижение растяжимости аорты, увеличение индек-
сов ригидности стенки аорты, небольшое увеличе-
ние систолического диаметра и небольшое увеличе-
ние максимальной систолической площади. Несмо-
тря на то что это исследование не предпринимало
попытку прогнозировать будущий риск, дальней-
шие аналогичные работы могут предоставить педи-
атрам более точные прогностические данные о детях
с заболеваниями соединительной ткани.
In-38_для нас.indd 994
03.04.2019 12:13:02
995
38 Наследственные заболевания соединительной ткани
ВОЗМОЖНОСТИ ОЦЕНКИ
Несмотря на то что ТТЭхоКГ в 2D-режиме и М-ре-
жиме наиболее распространена для оценки состоя-
ния МК и аорты у пациентов с заболеваниями сое-
динительной ткани, следует помнить, что метод
имеет ряд ограничений. Получение данных зависит
от оборудования и специалиста. Измерения разме-
ров аорты зависят от телосложения пациента, и при
этом может иметь место получение завышенных
параметров, если используются косые измерения.
Хотя КТ и МРТ-ангиография применяются чаще,
ЧПЭхоКГ является важной методикой для оценки
аорты у пациентов с плохой акустической доступ-
ностью при трансторакальном исследовании. В до-
полнение к рутинному методу в качестве средства
для достижения точных измерений корня аорты
ЧПЭхоКГ также может быть использована для
оценки характеристик растяжимости аорты. Изме-
рение растяжимости аорты, индекса ригидности и
скорости пульсовой волны также могут быть полу-
чены с помощью данных М-режима при ЧПЭхоКГ
по короткой оси. Тканевая допплерография при
ЭхоКГ (ТДЭхоКГ) была использована у пациентов
с СМ для определения оценки эластичности груд-
ной части нисходящего отдела аорты. Время уско-
рения, максимальная скорость расширения и растя-
жения стенки были рассчитаны при ТДЭхоКГ у 31
пациента с СМ. Данные, полученные на изображе-
ниях ЧПЭхоКГ, показали, что результаты ТДЭхоКГ
дополнили М-режим, совместно выполняя фун-
кцию важного прогностического метода обнару-
жения прогрессирующей дилатации аорты и ее
возможного расслоения [89]. Хотя эти техники из-
мерения широко применяются только для исследо-
вательских целей, использование ЧПЭхоКГ и доп-
плеровской ЭхоКГ для выяснения биофизических
свойств аорты может помочь в определении и
прогнозировании патологии аорты.
ТЕРАПЕВТИЧЕСКИЕ СТРАТЕГИИ
ФАРМАКОЛОГИЧЕСКИЕ СТРАТЕГИИ
Фармакологические стратегии заболеваний соеди-
нительной ткани основаны на исследованиях паци-
ентов с СМ. В течение последних двух десятилетий
стандартом медицинской помощи в лечении СМ с
сопутствующей дилатацией аорты была блокада
β-адренергических рецепторов. Подтверждение это-
го подхода основано на многолетних контрольных
данных, которые оценивали прогрессирование ди-
латации аорты с применением и без применения
блокаторов β-адренергических рецепторов, что де-
монстрирует практическую значимость в подгруппе
этих пациентов [90]. У проходивших лечение паци-
ентов наблюдались более медленное увеличение
корня аорты, меньший риск развития расслоения
аорты, снижение потребности в операции на корне
аорты и меньшая смертность. Данная терапевтиче-
ская стратегия была применена и к взрослым, и к
детям [91]. Хотя терапия не всегда помогает избежать
операции на аорте, в целом хирургического вмеша-
тельства удавалось избежать. Кроме того, было по-
казано, что наличие выраженной дилатации аорты
является менее склонной к терапии блокаторами
β-адренэргических рецепторов, чем ранее начатое
лечение пациента со слабовыраженной дилатацией
аорты [90]. Некоторые исследования выявили улуч-
шение ригидности восходящего отдела аорты, кото-
рое связано с терапией блокаторами β-адренергиче-
ских рецепторов у пациентов с СМ [92, 93], в то
время как другие же не показали никакого эффекта
или выявили ухудшение показателей ригидности
аорты [94]. Начало терапией блокаторами β-адре-
нергических рецепторов обычно основано на под-
твержденном клиническом диагнозе СМ (на основе
модифицированных критериев Гента) и знании ко-
личественно оцененной дилатации корня аорты.
У пациентов с непереносимостью блокаторов
β-адренергических рецепторов по причине реактив-
ных заболеваний дыхательных путей или других
побочных эффектов (например, усталости или го-
ловокружения вследствие гипотонии) для препят-
ствия развитию прогрессирующей дилатации аорты
были использованы другие фармакологические
стратегии. В последнее время, в центре внимания
находится вопрос о том, имеет ли лозартан (блока-
тор рецепторов ангеотензина-1) терапевтический
эффект при синдроме Марфанаы. Миксоматозная
дегенерация МК, дилатация аорты и измененная
легочная альвеолярная перегородка — все признаки
модели СМ у мышей считаются опосредованными
избыточной передачей сигналов TGF-β. Была вы-
двинута гипотеза о том, что лозартан может предот-
вращать развитие аневризмы аорты благодаря сво-
ему свойству сдерживать передачу сигналов транс-
формирующего ростового фактора-β на стенку
аорты. Лечение лозартаном при мышиной модели
СМ, которая имеет мутацию фибриллина-1, показа-
ло гистологическое улучшение в структуре эластич-
ной матрицы стенки аорты. При этом ЭхоКГ под-
твердила уменьшение диаметра аорты в группе,
которая проходила лечение лозартаном [95].
Однако недавние рандомизированные контро-
лируемые исследования у пациентов с СМ показали
противоречивые результаты. В исследовании Дет-
ского сообщества серца (Pediatric Heart Network) —
двойном слепом рандомизированном контролиру-
емом исследовании 608 детей и подростков с СМ, —
сравнивались лозартан и атенолол. Лозартан был не
лучше и не хуже атенолола. Основываясь на эхокар-
диологических данных, разницы в росте аорты или
клинических исходах за трехлетний период не было
[96]. В исследовании COMPARE плацебо или лозар-
тан были добавлены к базовой стандартной терапии
(у 74% пациентов она включала бета-блокаторы).
После 37 мес, лосартан значительно уменьшился
In-38_для нас.indd 995
03.04.2019 12:13:02
996 ЧАСТЬ VII Сосудистые и системные заболевания
размер дилатации аорты по сравненный без приме-
нения лосартан. Однако в исследовании синдрома
Марфана Сартана исследователи и изучили преи-
мущества добавления лосартана к стандартной те-
рапии у 292 пациентов с синдромом Марфаном
(86% были на β-адреноблокаторах).
В этом исследовании не было различий между
влиянием лечения с или без лозартана на расшире-
ние корня аорты или клинические события [97]. К
этому моменту, β-блокаторы остались препаратами
выбора для пациентов с СМ. Лозартан может яв-
ляться разумной альтернативой. Преимущества от
добавления блокаторов рецептора ангиотензина-1 к
β-блокаторам остаются неясны. В ближайшем буду-
щем три текущих исследования могут помочь по-
лучить ответы на это.
Принципы лечения других заболеваний соеди-
нительной ткани с аневризмой аорты, как, напри-
мер, синдром Лойеса–Дитца, аналогичны принци-
пам при СМ. Однако эффективность этой стратегии
не была оценена (т.е. пока не проводилось никаких
клинических испытаний).
ХИРУРГИЧЕСКИЕ СТРАТЕГИИ
У взрослых лиц с СМ пороговой величиной рассмо-
трения протезирования корня аорты является диа-
метр, достигающий 5 см [98, 99]. Очевидный обо-
снованный риск возрастает в четыре раза, когда
размер аорты превышает 6 см при совокупном риске
расслоения или разрыва аорты [98]. Факторы, ис-
пользующиеся для определения хирургических па-
раметров риска, включают по нисходящей линии:
быстрое увеличение аорты (> 0,5 см в год), семейный
анамнез расслоения аорты (особенно при размерах
< 5 см), женщин, планирующих беременность (про-
филактическая замена корня аорты, если диаметр
> 4 см) и сопутствующие показатели умеренной или
тяжелой АР. Однако у некоторых пациентов (даже
при отсутствии факторов, которые могли бы под-
вергнуть их более высокой степени риска) расслое-
ние аорты развивается при диаметре < 5 см [99]. По
этой причине санитарно-просветительная работа
среди пациентов о симптомах расслоения аорты
является крайне важной. Следует отметить, что па-
раметры хирургического вмешательства, как прави-
ло, базируются на наружном диаметре аорты, полу-
чаемом при МРТ или КТ, в отличие от внутреннего
диаметра, обычно видимого на ЭхоКГ. Наружный
диаметр обычно больше внутреннего на 0,2–0,4 см.
У детей младшего возраста с СМ (до подростко-
вого возраста) редко выявление патологии аорты
такой тяжести, при которой может возникнуть во-
прос о хирургическом вмешательстве. Однако, ког-
да эта ситуация действительно существует, реше-
ния, касающиеся определения времени операции на
аорте, осложняются отсутствием адекватных дан-
ных, позволяющих определить, когда риск расслое-
ния аорты достиг неприемлемых уровней. В нашем
учреждении, ребенок с заболеванием соединитель-
ной ткани, не достигший подросткового возраста,
являлся бы кандидатом на операцию при следую-
щих условиях:
•
максимальный нормализованный к площади
поверхности тела размер аорты в 8–10 раз боль-
ше стандартных отклонений от среднего показа-
теля;
•
прогрессирующая дилатация аорты (> 5 мм за
6 мес);
•
семейный анамнез расслоения аорты;
•
дополнительное патологическое нарушение, тре-
бующее вмешательства (например, АР или МР
при ПМК).
Окончательное решение о проведении операции
на аорте в педиатрии обычно основано на менее
четко определенных теоретических аспектах. Зача-
стую максимальный размер аорты составляет > 8–10
стандартных отклонений от нормы от общеприня-
той средней величины (отмечена ранее).
Показания к хирургическому вмешательству для
заболеваний соединительной ткани, кроме СМ, ме-
нее ясны и главным образом базируются на неболь-
шой количестве случаев. Пациенты с синдромом
Лойеса–Дитца подвержены риску расслоения аорты
при ее диаметрах < 5 см. Таким образом, в соответ-
ствии с современными руководствами операцию на
аорте рекомендуют проводить при размере ее вну-
треннего диаметра в восходящем отделе > 4,2 см у
взрослых (по данным ЭхоКГ) и 4,4–4,6 см по данным
КТ или МРТ [100].
Некоторые эксперты рекомендуют проводить
операцию раньше, когда размер восходящего отдела
аорты достигнет 4,0 см [29]. У детей с тяжелыми
системными проявлениями синдрома Лойеса–Дит-
ца следует рассматривать хирургическое вмешатель-
ство, как только диаметр превышает по возрасту
99-й процентиль, а размер кольца АК достигает
1,8–2,0 см, что обеспечивает размещение трансплан-
танта, который может приспособиться к будущему
соматическому росту [18, 24].
У пациентов с мутациями в гладким мышцах
(патологические варианты ACTA2, MYH11, MLCK,
PRKG1) оптимальное время для операции пока не
ясно. Малое число расслоений аорты было отмечено
у пациентов с этими мутациями при диаметрах
< 5 см. Следовательно, хирургическое вмешатель-
ство у этих пациентов может быть обосновано при
диаметре аорты > 4,5 см. Наконец, учитывая высо-
кий уровень осложнений и рыхлость ткани, остает-
ся неясным, целесообразна ли ранняя профилакти-
ческая операция аневризмы аорты у пациентов с
синдромом Элерса–Данло IV типа (сосудистая
форма).
Пациенты с СМ, прошедшие профилактические
операции на аорте имеют значительно лучшие ис-
ходы, чем пациенты с операцией по жизненным
показаниям. В докладе Gott и коллег, у 675 пациен-
In-38_для нас.indd 996
03.04.2019 12:13:02
997
38 Наследственные заболевания соединительной ткани
тов с СМ, перенесших замену аорты, операционная
смертность в случаях операции в плановом порядке
составила 1,5%, по сравнению с 11,7% в случаях
экстренной операции. Пяти- и десятилетняя выжи-
ваемость составила 84% и 75% соответственно [99].
Хирургическое вмешательство при расширении
аорты обычно приобретает либо вид сложного
трансплантанта и сопряженную замену клапана
(техника Бенталла (Bentall)), либо вид операций,
выполняемых тогда, когда АК функционален и по-
этому его сохраняют. Недавнее проспективное ис-
следование, проведенное Coselli и коллегами, срав-
нивало исходы первого года у пациентов с СМ, ко-
торым был заменен аортальный клапан с теми,
кому была проведена операция замены корня аорты,
не затрагивающая аортальный клапан.
После 1 года разницы в смертности или крупных
негативных клапанных событий не было. Однако у
7% пациентов, у которых не был затронут аорталь-
ный клапан, развилась по крайней мере средняя
аортальная регургитация, в то время как в группе с
заменой клапана не было ни одного ее случая. Для
выяснения надежности процедур, щадящих клапан,
необходим более длительный период наблюдения с
периодическим ТТЭхоКГ [101].
В табл. 38 .8 обобщаются текущие подходы к хи-
рургической тактике при СММ, равно как и при
других распространенных заболеваниях соедини-
тельной ткани.
АЛЬТЕРНАТИВНЫЕ ДИАГНОСТИЧЕСКИЕ ПОДХОДЫ
МРТ и КТ сердца можно применять у пациентов с
плохим акустическим окном или нуждаются в де-
тальном обследовании при условии неоднозначных
данных. Это может иметь место у пациентов, когда
нельзя исключить аномальную извитость дуги аор-
ты, дилатацию сонных артерий или виллизиева
круга, расслоение аорты. МРТ и КТ сердца позволя-
ют визуализировать аорту целиком, от корня до
подвздошной бифуркации, включая сосуды дуги
аорты. Однако точность КТ и МРТ зависит от нали-
чия соответствующего оборудования и опыта опе-
ратора (рис. 38 .18). В табл. 38 .9 приведены сильные
стороны и ограничения различных методов оценки
аорты. Достижения в области МРТ позволили оце-
нить эластичность аорты у пациентов с СМ. Было
обнаружено, что у них эластичность аорты снижена.
Карта скоростей МРТ аорты показала сниженную
растяжимость аорты в фазу систолы и повышенное
распространение пульсовой волны. Использование
МРТ с картированием скорости показывает поло-
жительную динамику при терапии с использовани-
ем β-блокаторов со снижением распространения
пульсовой волны. Эти методы не только дают важ-
ную информацию о биофизических свойствах аор-
ты пациентов с заболеваниями соединительной
ткани, но и могут предоставить информацию для
прогнозирования индивидуального риска [102].
Периодичность оценки
Показания к хирургическому вмешательству
Синдром
Марфана
ЭхоКГ ежегодно, если нет быстрого роста аорты
≥ 5 мм/12 мес, или более чем слабая дилатация,
в таком случае ЭхоКГ каждые 6 мес
Размер корня ≥ 50 мм. Раньше, если в семейном анам-
незе есть расслоение аорты; быстрый рост аорты
> 5 мм за 12 мес, женщины, планирующие беремен-
ность или при наличии другого повреждения, требу-
ющего вмешательства (например, умеренная/выра-
женная аортальная регургитация; умеренная/выра-
женная митральная регургитация/пролапс митраль-
ного клапана)
Синдром
Лойеса–Дитца
ЭхоКГ каждые 6 мес, до достижения размера
аорты в 42 мм; МРТ каждые 12–18 мес (включая
изображения головы/шеи/брюшных артерий)
Замена корная аорты, если он > 42 мм
Раньше, если есть другие показания к сердечно-сосуди-
стым операциям
Синдром
Элерса–Данлоса
ЭхоКГ раз в 3–5 лет до развития умеренной
и выра женной дилатации корня аорты,
в таком случае ЭхоКГ ежегодно
Операция на корне аорты, если он > 55 мм
Двухстворчатый
аортальный
клапан
ЭхоКГ раз в 1–3 года при отсутствии аортального
стеноза/регургитации; чаще при прогрессирую-
щем аортальном стенозе/регургитации, дис-
функции левого желудочка, более чем слабой
дилатацией аорты, коарктации аорты
Операция на корне аорты, если он > 55 мм
Раньше, если есть другие показания к сердечно-сосуди-
стым операциям
Синдром
Тернера
ЭхоКГ каждые 3–5 лет независимо от наличия/
отсутствия дилатации аорты; при более чем
слабой дилатации, ЭхоКГ раньше; иначе частота
ЭхоКГ зависит от других факторов (коаркта-
ции, физиологии клапанов, дилатации/дис-
функции левого желудочка)
Операция на корне аорты при размере в диапазоне
40–50 мм и/или при индексе размера аорты > 2,5
Раньше, если есть другие показания к сердечно-сосуди-
стым операциям
МРТ — магнитно -резонансная томография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 38.8 Рекомендованные стратегии ведения пациентов с наиболее частыми заболеваниями соединительной ткани
In-38_для нас.indd 997
03.04.2019 12:13:02
998 ЧАСТЬ VII Сосудистые и системные заболевания
Метод
Преимущества
Ограничения
ТТЭхоКГ
Доступно
Быстро
Можно проводить лежачему пациенту
Неинвазивная
Можно оценить гемодинамическую функцию аорталь-
ного клапана
Обычно хорошо видим корень арты
Четко определены нормативные значения
Нет ионизирующего излучения или йодного контраста
Аорта дистальнее восходящего отдела плохо
визуализируется
Телосложение может влиять на качество
изображения
ЧПЭхоКГ
Лучшее качество изображения по сравнению с ТТЭхоКГ
Доступно
Быстро
Можно проводить лежачему пациенту
Можно оценить гемодинамическую функцию аорталь-
ного клапана
Нет ионизирующего излучения или йодного контраста
Полуинвазивная и неприятная для пациента
процедура
Может требовать седации/анестезии
КТА
Визуализация аорты целиком с прилежащими сосудами
Быстро
Доступно
Неинвазивная
Сосуды можно продемонстрировать в различных
проекциях
Позволяет трехмерно воссоздать аорту и отходящие от
нее сосуды
Воздействие ионизирующего излучения
Воздействие йодного контраста
Невозможно оценить функцию аортального
клапана
МРА
Визуализация аорты целиком с прилежащими сосудами
Неинвазивная
Нет ионизирующего излучения или йодного контраста
Можно оценить гемодинамическую функцию аорталь-
ного клапана
Сосуды можно продемонстрировать в различных
проекциях
Позволяет трехмерно воссоздать аорту и отходящие
от нее сосуды
Противопоказана пациентам с определен-
ными водителями ритма и вживленными
кардиовертерными дефибрилляторами
Долгое время получения изображения
Менее доступна, чем остальные методы
Может требовать седации
КТА — компьютерная томографическая ангиография; МРА — магнитно -резонансная ангиография; ТТЭхоКГ — трансторакальная эхо-
кардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 38.9 Преимущества и ограничения методик визуализации аорты
1
2
3
1:48мм
2:48мм
3:47мм
Рис. 38 .18 Расширение аорты на магнитно-резонансной томографии в коронарной проекции. МРТ в коронарной проекции демонстрирует расширенный
корень аорты у пациента с синдромом Марфана. (A) Двойные косые изображения используются для определения положения синуса Вальсальвы. (Б) Расстояние
между створкой одного синуса и комиссурой параллельного синуса используются для определения размера синуса Вальсальвы.
А
Б
In-38_для нас.indd 998
03.04.2019 12:13:02
999
38 Наследственные заболевания соединительной ткани
Параметр
Позиция
Запись
Измерения
Выносящий тракт
ЛЖ/диаметр
кольца аорталь-
ного клапана
Парастернальная
по длинной оси
Снизить глубину,
сузить сектор,
приближение
В фазу систолу, измерения диаметра выносящего тракта
между передним и задним эндокардом сразу за местами
прикрепления передней и задней створки аортального
клапана
Диаметр синуса
Вальсальвы
Парастернальная
по длинной оси
Снизить глубину,
сузить сектор,
приближение
В конце диастолы (у взрослых) или в конце систолы (у детей).
Измерить максимальный диаметр межу передней правой
коронарной и задней (обычно некоронарной) створкой,
параллельно кольцу аорты и перпендикулярно восходящего
отдела аорты. Методика измерений разнится в зависимости
от лаборатории, могут проводиться измерения от ведущего
конца к ведущему концу или от внутреннего к внутреннему
концу, но они должны быть единообразны для всех измере-
ний аорты
Диаметр синоту-
булярного
соединения
Парастернальная
по длинной оси
Снизить глубину,
сузить сектор,
приближение
В конце диастолы (у взрослых) или в конце систолы (у детей).
Измерить диаметр соединения между передней задней коро-
нарной створкой и восходящим отделом аорты
Диаметр восходя-
щего отдела
аорты
Парастернальная
по длинной оси
Снизить глубину,
сузить сектор,
приближение
В конце диастолы (у взрослых) или в конце систолы (у детей).
Измерить максимальный видимый диаметр, параллельный
аортальному кольцу в тубулярной части восходящего отдела
аорты
Диаметр дуги
аорты
Яремная вырезка Аккуратное позицио-
нирование для полу-
чения наилучшего
качества картинки,
приближение
Визуализировать дугу целиком, включая начало супрааорталь-
ных сосудов. Измерить диаметр дуги аорты сразу прокси-
мальнее начала брахиоцефального ствола, между ним и
левой сонной артерией, и сосудистое сужение сразу перед
подключичной артерией
Брюшная часть
нисходящего
отдела аорта
Субкостальная
Аккуратное позицио-
нирование для полу-
чения наилучшего
качества картинки
Визуализировать аорту из субкостальной позиции. Измерить
наибольший диаметр четко визуализируемой аорты
Примечание. У всех пациентов, особенно во время первичного осмотра, необходимо выполнить полное ЭхоКГ исследование с оценкой
функции желудочков и особо внимательно оценить структуру и работу клапанов.
ЛЖ — левый желудочек.
СВОДНАЯ ИНФОРМАЦИЯ
Оценка пациента с известным или предполагаемым заболеванием соединительной ткани
с помощью трансторакальной эхокардиографии
ЛИТЕРАТУРА
1. Loeys BL, Dietz HC, Braverman AC, et al. The
revised Ghent nosology for the Marfan syn-
drome, J Med Genet 47:476–485, 2010.
2. Gray JR, et al. Ascertainment and severity of
Marfan syndrome in a Scottish population, J
Med Genet 31:51–54, 1994.
3. Dietz H: Marfan syndrome. In Pagon RA,
Adam MP, Ardinger HH, et al. GeneReviews,
Seattle, WA, 2001, University of Washington.
([Internet]. (updated 2014).
4. Dietz H, et al. The question of heterogeneity
in Marfan syndrome, Nat Genet 9:228–231,
1995.
5. Schrijver I, et al. Cysteine substitutions in
epidermal growth factor-like domains of fi-
brillin-1: distinct effects on biochemical and
clinical phenotypes, Am J Hum Genet
65:1007–1020, 1999.
6. Wang M, et al. Recurrent mis-splicing of fi-
brillin exon 32 in two patients with neonatal
Marfan syndrome, Hum Mol Genet 4:607–
613, 1995.
7. Dietz HC, Pyeritz RE. Mutations in the hu-
man gene for fibrillin-1 (FBN1) in the Mar-
fan syndrome and related disorders, Hum
Mol Genet 4:1799–1809, 1995.
8. Nijbroek G, et al. Fifteen novel FBN1 muta-
tions causing Marfan syndrome detected by
heteroduplex analysis of genomic amplicons,
Am J Hum Genet 57:8–21, 1995.
9. Milewicz DM, et al. A mutation in FBN1
disrupts profibrillin processing and results in
isolated skeletal features of the Marfan syn-
drome, J Clin Invest 95:2373–2378, 1995.
10. Palz M, et al. Clustering of mutations associ-
ated with mild Marfan-like phenotypes in the
3’ region of FBN1 suggests a potential geno-
type-phenotype correlation, Am J Med Genet
91:212–221, 2000.
11. Guo D, et al. Familial thoracic aortic aneu-
rysms and dissections: genetic heterogeneity
with a major locus mapping to 5q13-14, Cir-
culation 103:2461–2468, 2001.
12. Leier CV, et al. The spectrum of cardiac de-
fects in the Ehlers-Danlos syndrome, types I
and III, Ann Intern Med 92(2 Pt 1):171–178,
1980.
13. McDonnell NB, et al. Echocardiographic
findings in classical and hypermobile Ehlers-
Danlos syndromes, Am J Med Genet A
140:129–136, 2006.
14. Wenstrup RJ, et al. Prevalence of aortic root
dilation in the Ehlers-Danlos syndrome,
Genet Med4112–117, 2002.
15. Pepin MG, et al. Survival is affected by muta-
tion type and molecular mechanism in vascu-
lar Ehlers-Danlos syndrome (EDS type IV),
Genet Med 16(12):881–888, 2014.
16. North KN, et al. Cerebrovascular complica-
tions in Ehlers-Danlos syndrome type IV,
Ann Neurol 38(6):960–964, 1995.
17. Emanuel BS, et al. Human alpha 1(III) and
alpha 2(V) procollagen genes are located on
the long arm of chromosome 2, Proc Natl
Acad Sci U S A 82:3385–3389, 1985.
18. Hiratzka LF, et al. 2010 ACCF/AHA/AATS/
ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines
for the diagnosis and management of patients
with Thoracic Aortic Disease: a report of the
American College of Cardiology Foundation/
American Heart Association Task Force on
Practice Guidelines, American Association for
Thoracic Surgery, American College of Radiol-
ogy, American Stroke Association, Society of
Cardiovascular Anesthesiologists, Society for
Cardiovascular Angiography and Interventions,
Society of Interventional Radiology, Society of
Thoracic Surgeons, and Society for Vascular
Medicine, Circulation 121:e266–e369, 2010.
19. Ascione R, et al. Emergency repair of type A
aortic dissection in type IV Ehlers-Danlos
syndrome, Cardiovasc Surg 8:75–78, 2000.
In-38_для нас.indd 999
03.04.2019 12:13:03
1000 ЧАСТЬ VII Сосудистые и системные заболевания
20. Mudd SH, et al. The natural history of homo-
cystinuria due to cystathionine beta-synthase
deficiency, Am J Hum Genet 37:1–31, 1985.
21. Gupta PA, et al. FBN2 mutation associated
with manifestations of Marfan syndrome and
congenital contractural arachnodactyly, J
Med Genet 41:e56, 2004.
22. Loeys BL, et al. Aneurysm syndromes caused
by mutations in the TGF-beta receptor, N
Engl J Med 355:788–798, 2006.
23. Loeys BL, et al. A syndrome of altered cardio-
vascular, craniofacial, neurocognitive and
skeletal development caused by mutations in
TGFBR1 or TGFBR2, Nat Genet 37:275–281,
2005.
24. Williams JA, et al. Early surgical experience
with Loeys-Dietz: a new syndrome of aggres-
sive thoracic aortic aneurysm disease, Ann
Thorac Surg 83:S757–S763, 2007. discussion
S785-90.
25. van de Laar IM, et al. Mutations in SMAD3
cause a syndromic form of aortic aneurysms
and dissections with early-onset osteoarthri-
tis, Nat Genet 43:121–126, 2011.
26. Regalado ES, et al. Exome sequencing identi-
fies SMAD3 mutations as a cause of familial
thoracic aortic aneurysm and dissection with
intracranial and other arterial aneurysms,
Circ Res 109:680–686, 2011.
27. Lindsay ME, et al. Loss-of-function muta-
tions in TGFB2 cause a syndromic presenta-
tion of thoracic aortic aneurysm, Nature
Genet 44:922–927, 2012.
28. Bertoli-Avella AM, et al. Mutations in a
TGF-β ligand, TGFB3, cause syndromic aor-
tic aneurysms and dissections, J Am Coll
Cardiol 65:1324–1336, 2015.
29. MacCarrick G, et al. Loeys-Dietz syndrome: a
primer for diagnosis and management, Genet
Med 16:576–587, 2014.
30. Braverman AC, et al. The bicuspid aortic
valve, Curr Probl Cardiol 30:470–522, 2005.
31. Huntington K, Hunter AG, Chan KL. A pro-
spective study to assess the frequency of fa-
milial clustering of congenital bicuspid aortic
valve, J Am Coll Cardiol 30:1809–1812, 1997.
32. Clementi M, et al. Familial congenital bicus-
pid aortic valve: a disorder of uncertain in-
heritance, Am J Med Genet 62:336–338, 1996.
33. Loscalzo ML, et al. Familial thoracic aortic
dilation and bicommissural aortic valve: a
prospective analysis of natural history and
inheritance, Am J Med Genet A 143A:1960–
1967, 2007.
34. Fedak PW, et al. Clinical and pathophysiolog-
ical implications of a bicuspid aortic valve,
Circulation 106:900–904, 2002.
35. Keane MG, et al. Bicuspid aortic valves are
associated with aortic dilatation out of pro-
portion to coexistent valvular lesions, Circu-
lation 102(19 Suppl 3):35–39, 2000.
36. Ferencik M, Pape LA. Changes in size of as-
cending aorta and aortic valve function with
time in patients with congenitally bicuspid
aortic valves, Am J Cardiol 92:43–46, 2003.
37. Verma S, Siu SC. Aortic dilatation in patients
with bicuspid aortic valve, N Engl J Med
370:1920–1929, 2014.
38. Nishimura RA, et al. 2014 AHA/ACC guide-
line for the management of patients with
valvular heart disease: executive summary: a
report of the American College of Cardiolo-
gy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
63:2438–2488, 2014.
39. Roberts CS, Roberts WC. Dissection of the
aorta associated with congenital malforma-
tion of the aortic valve, J Am Coll Cardiol
17:712–716, 1991.
40. Nistri S, et al. Aortic root dilatation in young
men with normally functioning bicuspid
aortic valves, Heart 82:19–22, 1999.
41. Lewin MB, Otto CM. The bicuspid aortic
valve: adverse outcomes from infancy to old
age, Circulation 111:832–834, 2005.
42. Nienaber CA, Eagle KA. Aortic dissection:
new frontiers in diagnosis and management:
Part I: from etiology to diagnostic strategies,
Circulation 108:628–635, 2003.
43. Schaefer BM, et al. Usefulness of bicuspid
aortic valve phenotype to predict elastic prop-
erties of the ascending aorta, Am J Cardiol
99:686–690, 2007.
44. Lin AE, et al. Aortic dilation, dissection, and
rupture in patients with Turner syndrome, J
Pediatr 109:820–826, 1986.
45. Gravholt CH, et al. Clinical and epidemio-
logical description of aortic dissection in
Turner’s syndrome, Cardiol Young 16:430–
436, 2006.
46. Carlson M, Silberbach M. Dissection of the
aorta in Turner syndrome: two cases and re-
view of 85 cases in the literature, J Med Genet
44:745–749, 2007.
47. Ostberg JE, et al. Vasculopathy in Turner
syndrome: arterial dilatation and intimal
thickening without endothelial dysfunction, J
Clin Endocrinol Metab 90:5161–5166, 2005.
48. Lopez L, et al. Turner syndrome is an inde-
pendent risk factor for aortic dilation in the
young, Pediatrics 121:e1622–e1627, 2008.
49. Coady MA, et al. Familial patterns of tho-
racic aortic aneurysms, Arch Surg 134:361–
367, 1999.
50. Biddinger A, et al. Familial thoracic aortic
dilatations and dissections: a case control
study, J Vasc Surg 25:506–511, 1997.
51. Braverman AC. Heritable thoracic aortic an-
eurysm disease: recognizing phenotypes, ex-
ploring genotypes, J Am Coll Cardiol 65:1337–
1339, 2015.
52. Fedak PW, et al. Vascular matrix remodeling
in patients with bicuspid aortic valve malfor-
mations: implications for aortic dilatation, J
Thorac Cardiovasc Surg 126:797–806, 2003.
53. Ikonomidis JS, et al. Expression of matrix
metalloproteinases and endogenous inhibi-
tors within ascending aortic aneurysms of
patients with bicuspid or tricuspid aortic
valves, J Thorac Cardiovasc Surg 133:1028–
1036, 2007.
54. LeMaire SA, et al. Severe aortic and arterial
aneurysms associated with a TGFBR2 muta-
tion, Nat Clin Pract Cardiovasc Med 4:167–
171, 2007.
55. LeMaire SA, et al. Matrix metalloproteinases
in ascending aortic aneurysms: bicuspid ver-
sus trileaflet aortic valves, J Surg Res 123:40–
48, 2005.
56. Segura AM, et al. Immunohistochemistry of
matrix metalloproteinases and their inhibi-
tors in thoracic aortic aneurysms and aortic
valves of patients with Marfan’s syndrome,
Circulation 98(19 Suppl):331–337, 1998. dis-
cussion 337-338.
57. Roman MJ, Devereux RB, Kramer-Fox R,
O’Loughlin J, et al. Two-dimensional echo-
cardiographic aortic root dimensions in nor-
mal children and adults, Am J Cardiol
64:507–512, 1989.
58. Hiratzka LF, Bakris GL, Beckman JA, et al.
2010 ACCF/AHA/AATS/ACR/ASA/SCA/
SCAI/SIR/STS/SVM guidelines for the diag-
nosis and management of patients with Tho-
racic Aortic Disease: a report of the American
College of Cardiology Foundation/American
Heart Association Task Force on Practice
Guidelines, American Association for Tho-
racic Surgery, American College of Radiolo-
gy, American Stroke Association, Society of
Cardiovascular Anesthesiologists, Society for
Cardiovascular Angiography and Interven-
tions, Society of Interventional Radiology,
Society of Thoracic Surgeons, and Society for
Vascular Medicine, Circulation 121:e266–
e369, 2010.
59. Muraru D, et al. Ascending aorta diameters
measured by echocardiography using both
leading edge-to-leading edge and inner edge-
to-inner edge conventions in healthy volun-
teers, Eur Heart J Cardiovasc Imaging 15:415–
422, 2014.
60. Goldstein SA, et al. Multimodality imaging of
diseases of the thoracic aorta in adults: from
the American Society of Echocardiography
and the European Association of Cardiovascu-
lar Imaging: endorsed by the Society of Car-
diovascular Computed Tomography and Soci-
ety for Cardiovascular Magnetic Resonance, J
Am Soc Echocardiogr 28:119–182, 2015.
61. Pettersen MD, et al. Regression equations for
calculation of z scores of cardiac structures in
a large cohort of healthy infants, children,
and adolescents: an echocardiographic study,
J Am Soc Echocardiogr 21:922–934, 2008.
62. Engel PJ, et al. Echocardiographic diagnosis
of congenital sinus of Valsalva aneurysm with
dissection of the interventricular septum,
Circulation 63:705–711, 1981.
63. Shaffer EM, et al. Sinus of Valsalva aneurysm
complicating bacterial endocarditis in an in-
fant: diagnosis with two-dimensional and
Doppler echocardiography, J Am Coll Cardiol
9:588–591, 1987.
64. Khan IA, Nair CK. Clinical, diagnostic, and
management perspectives of aortic dissection,
Chest 122:311–328, 2002.
65. Erbel R, et al. Diagnosis and management of
aortic dissection, Eur Heart J22:1642–1681,
2001.
66. Granato JE, Dee P, Gibson RS. Utility of two-
dimensional echocardiography in suspected
ascending aortic dissection, Am J Cardiol
56:123–129, 1985.
67. Engelfriet PM, et al. Beyond the root: Dilata-
tion of the distal aorta in the marfan syn-
drome, Heart 92:1238–1245, 2006.
68. Marks AR, et al. Identification of high-risk
and low-risk subgroups of patients with mi-
tral-valve prolapse, N Engl J Med 320:1031–
1036, 1989.
69. Dietz HC, et al. Marfan syndrome caused by
a recurrent de novo missense mutation in the
fibrillin gene, Nature 352:337–339, 1991.
70. van Karnebeek CD, et al. Natural history of
cardiovascular manifestations in Marfan syn-
drome, Arch Dis Child 84:129–137, 2001.
71. Savolainen A, et al. Left ventricular function
in children with the Marfan syndrome, Eur
Heart J 15:625–630, 1994.
72. Porciani MC, et al. Diastolic subclinical pri-
mary alterations in Marfan syndrome and
Marfan-related disorders, Clin Cardiol
25:416–420, 2002.
73. De Backer JF, et al. Primary impairment of
left ventricular function in Marfan syndrome,
Int J Cardiol 112:353–358, 2005.
74. Das BB, Taylor AL, Yetman AT. Left ven-
tricular diastolic dysfunction in children and
young adults with Marfan syndrome, Pediatr
Cardiol 27:256–258, 2006.
In-38_для нас.indd 1000
03.04.2019 12:13:03
1001
38 Наследственные заболевания соединительной ткани
75. Hirata K, et al. The Marfan syndrome: abnor-
mal aortic elastic properties, J Am Coll Car-
diol 18:57–63, 1991.
76. Meijboom LJ, et al. Evaluation of left ven-
tricular dimensions and function in Marfan’s
syndrome without significant valvular regur-
gitation, Am J Cardiol 95:795–797, 2005.
77. Abd El Rahman M, et al. Left ventricular
systolic dysfunction in asymptomatic Marfan
syndrome patients is related to the severity of
gene mutation: insights from the novel three
dimensional speckle tracking echocardiogra-
phy, PLoS One 10:e0124112, 2015.
78. Nollen GJ, et al. Pulmonary artery root dilata-
tion in Marfan syndrome: quantitative assess-
ment of an unknown criterion, Heart 87:470–
471, 2002.
79. Gross DM, et al. Severe perinatal Marfan
syndrome, Pediatrics 84:83–89, 1989.
80. Lind J, Wallenburg HC. The Marfan syn-
drome and pregnancy: a retrospective study
in a Dutch population, Eur J Obstet Gynecol
Reprod Biol 98:28–35, 2001.
81. Tacy TA, Vermilion RP, Ludomirsky A.
Range of normal valve annulus size in neo-
nates, Am J Cardiol 75:541–543, 1995.
82. Roge CL, et al. Cardiac structure growth pat-
tern determined by echocardiography, Circu-
lation 57:285–290, 1978.
83. Nidorf SM, et al. New perspectives in the as-
sessment of cardiac chamber dimensions
during development and adulthood, J Am
Coll Cardiol 19:983–988, 1992.
84. Sheil ML, Jenkins O, Sholler GF. Echocardio-
graphic assessment of aortic root dimensions
in normal children based on measurement of
a new ratio of aortic size independent of
growth, Am J Cardiol 75:711–715, 1995.
85. Daubeney PE, et al. Relationship of the di-
mension of cardiac structures to body size: an
echocardiographic study in normal infants
and children, Cardiol Young 9:402–410, 1999.
86. Teixido-Tura G, et al. Determinants of aortic
root dilatation and reference values among
young adults over a 20-year period: Coronary
Artery Risk Development in Young Adults
Study, Hypertension 66:23–29, 2015.
87. Colan S. Normal echocardiographic values in
infants and children (Boston Children’s Hos-
pital; unpublished data).
88. Baumgartner D, et al. Diagnostic power of
aortic elastic properties in young patients with
Marfan syndrome, J Thorac Cardiovasc Surg
129:730–739, 2005.
89. Vitarelli A, et al. Aortic wall mechanics in the
Marfan syndrome assessed by transesopha-
geal tissue Doppler echocardiography, Am J
Cardiol 97:571–577, 2006.
90. Shores J, et al. Progression of aortic dilatation
and the benefit of long-term beta-adrenergic
blockade in Marfan’s syndrome, N Engl J Med
330:1335–1341, 1994.
91. Rossi-Foulkes R, et al. Phenotypic features
and impact of beta blocker or calcium an-
tagonist therapy on aortic lumen size in the
Marfan syndrome, Am J Cardiol 83:1364–
1368, 1999.
92. Groenink M, et al. Changes in aortic distensi-
bility and pulse wave velocity assessed with
magnetic resonance imaging following beta-
blocker therapy in the Marfan syndrome, Am
J Cardiol 82:203–208, 1998.
93. Yin FC, et al. Arterial hemodynamic indexes
in Marfan’s syndrome, Circulation 79:854–
862, 1989.
94. Haouzi A, et al. Heterogeneous aortic response
to acute beta-adrenergic blockade in Marfan
syndrome, Am Heart J 133:60–63, 1997.
95. Habashi JP, et al. Losartan, an AT1 antago-
nist, prevents aortic aneurysm in a mouse
model of Marfan syndrome, Science 312
(5770): 117–121, 2006.
96. Lacro RV, et al. Atenolol versus losartan in
children and young adults with Marfan’s
syndrome, N Engl J Med 371:2061–2071,
2014.
97. Milleron O, et al. Marfan Sartan: a random-
ized, double-blind, placebo-controlled trial,
Eur Heart J 36:2160–2166, 2015.
98. Davies RR, et al. Yearly rupture or dissection
rates for thoracic aortic aneurysms: simple
prediction based on size, Ann Thorac Surg
73:17–27, 2002. discussion 27-8 .
99. Gott VL, et al. Replacement of the aortic root
in patients with Marfan’s syndrome, N Engl J
Med 340:1307–1313, 1999.
100. Hiratzka LF, et al. 2010 ACCF/AHA/AATS/
ACR/ASA/SCA/SCAI/SIR/STS/SVM guide-
lines for the diagnosis and management of
patients with Thoracic Aortic Disease: a re-
port of the American College of Cardiology
Foundation/American Heart Association
Task Force on Practice Guidelines, American
Association for Thoracic Surgery, American
College of Radiology, American Stroke As-
sociation, Society of Cardiovascular Anesthe-
siologists, Society for Cardiovascular Angiog-
raphy and Interventions, Society of Interven-
tional Radiology, Society of Thoracic
Surgeons, and Society for Vascular Medicine,
Circulation 121:e266–e369, 2010.
101. Coselli JS, et al. Early and 1-year outcomes of
aortic root surgery in patients with Marfan
syndrome: a prospective, multicenter, com-
parative study, J Thorac Cardiovasc Surg
147:1758–1766, 2014.
102. Groenink M, et al. Biophysical properties of
the normal-sized aorta in patients with Mar-
fan syndrome: evaluation with MR flow
mapping, Radiology 219:535–540, 2001.
In-38_для нас.indd 1001
03.04.2019 12:13:03
In-38_для нас.indd 1002
03.04.2019 12:13:03
1003
39 Признаки старения, определяемые
при эхокардиографии
MICHAEL A. CHEN, MD, PHD
Основные принципы
и эхокардиографический подход
Естественные изменения сердечной
структуры
Естественные изменения функции сердца
Данные о клинических исходах
Пороки клапанов сердца
Гипертрофия и масса левого желудочка
Базальная гипертрофия
межжелудочковой перегородки
у пожилых
Размеры левого предсердия и исходы
Сердечная недостаточность
Ишемическая болезнь сердца
и стресс-тесты
Кардиогенная тромбоэмболия
Чреспищеводная эхокардиография:
обсуждение у лиц пожилого возраста
Амилоидоз сердца
Оценивается, что в США к 2040 г. 81,2 млн человек
из всего населения будут в возрасте 65 лет или (44,7
млн в 2013 г.), из них 14,2 млн будут старше 85 лет
(6 млн в 2013 г.) [1]. Сердечно-сосудистые заболева-
ния являются ведущей причиной смертей и инвали-
дизации, а возраст — основной фактор риска их
развития. Результаты старения проявляются в изме-
нениях структуры и функций сердечно-сосудистой
системы, как и в повреждениях других органов и си-
стем. Множество обычных, связанных с возрастом
изменений структуры и функции сердечно-сосуди-
стой системы уже сейчас может быть выявлено с по-
мощью эхокардиографии (ЭхоКГ). Это также спра-
ведливо для патологических состояний, которые
наблюдаются у пожилых.
ОСНОВНЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЙ ПОДХОД
Эхокардиографические методики, которые исполь-
зуют для получения изображений и других данных,
одинаковы у пожилых и молодых пациентов.
ЕСТЕСТВЕННЫЕ ИЗМЕНЕНИЯ СЕРДЕЧНОЙ СТРУКТУРЫ
ТОЛЩИНА СТЕНОК И РАЗМЕРЫ ПОЛОСТИ ЛЕВОГО ЖЕЛУДОЧКА
Многочисленные исследования продемонстрирова-
ли утолщение с возрастом стенок левого желудочка
(ЛЖ) без анамнестически подтвержденной гипер-
тензии, порока клапанов сердца или других сердеч-
но-сосудистых заболеваний (рис. 39.1) [2, 3]. В та-
кие перекрестные исследования были вовлечены от
53 до 136 здоровых субъектов, у которых зафикси-
ровано умеренное повышение толщины стенок ЛЖ.
Например, Gardin и соавт. [2] исследовали 136 взрос-
лых (78 мужчин и 58 женщин в возрасте от 20 до 97
лет) без признаков сердечно-сосудистой патологии.
Пациенты были стратифицированы на шесть воз-
растных групп, и было найдено значительное уве-
личение толщины стенок с повышением возраста.
При сравнении наиболее молодой группы (от 21 до
30 лет) с самой возрастной (старше 70 лет) средняя
толщина перегородки увеличивалась с 9,8 до 11,8 мм,
а средняя толщина нижней стенки — с 10,1 до
11,8 мм (увеличение на 20 и 18% соответственно).
МАССА ЛЕВОГО ЖЕЛУДОЧКА
На основании данных, документирующих увели-
чение с возрастом толщины стенок, ряд ранее вы-
полненных эхокардиографических исследований,
включая исследование 700 здоровых лиц японской
национальности в возрасте от 20 до 79 лет, позво-
лил установить связанное с возрастом увеличение
массы ЛЖ (иногда индексированной к массе тела/
росту) [4].
Формула для расчета массы ЛЖ (см. главу 7), ко-
торую обычно используют, была разработана Deve-
reux и соавт. [5]:
Масса ЛЖ (г) = 0,80 × 1,04([VSTd + ВРЛЖд +
PWT]3 – [ВРЛЖд])3 = 0,6,
где VSTд — толщина межжелудочковой перегород-
ки (МЖП) в конце диастолы, ВРЛЖд — внутренний
размер ЛЖ в конце диастолы, PWTд — толщина
задней стенки ЛЖ в конце диастолы.
ch39_условно.indd 1003
03.04.2019 12:15:23
1004 ЧАСТЬ VII Сосудистые и системные заболевания
В противоположность этим находкам поздние
исследования здоровых лиц с помощью магнитно-
резонансной томографии (МРТ), включая исследо-
вание, которое являлось частью Baltimore Longitudi-
nal Study of Aging, подтвердили, что измеренная
при МРТ толщина стенки увеличивается с возрас-
том (особенно в средних отделах желудочка), при-
чем без изменения диастолического размера по ко-
роткой оси (подобно ранее полученным эхокарди-
ографическим данным). С другой стороны, длина
ЛЖ уменьшается со временем у обоих полов. Ко-
нечная оценка массы ЛЖ выявила отсутствие связи
с возрастом у женщин, хотя имеется возрастное
уменьшение у мужчин (вследствие меньшего уве-
личения толщины стенок). Это предполагает, что с
возрастом ЛЖ становится толще и сферичным.
Причина различий в данных, полученных при
ЭхоКГ в M-режиме и двухмерной (2D) ЭхоКГ, с дан-
ными МРТ лежит в разнице алгоритмов, использо-
ванных при расчете массы с помощью ранних ме-
тодик. Эти алгоритмы, как, например, формула,
разработанная Devereaux, рассматривают эллипсо-
идную форму полости и не принимают во внима-
ние изменений ее формы. Эти расчеты менее точны
в случаях, когда, например, полость имеет сфериче-
скую форму. Трехмерная (3D) ЭхоКГ показала себя
точной методикой, чем 2D, при сравнении этих
двух методик в определении массы ЛЖ, как при ис-
следовании с участием людей, так и на животных.
Масса ЛЖ, рассчитанная с помощью 3D-ЭхоКГ, как
было показано, лучше коррелирует с массой ЛЖ по
данным МРТ [6].
ДИАМЕТР КОРНЯ АОРТЫ
С возрастом наблюдается небольшое увеличение
диаметра корня аорты (рис. 39 .2). Отмечается при-
близительно 6% увеличение в нормальной популя-
ции между четвертым и восьмым десятилетием [3].
Это увеличение может быть дополнительным сти-
мулом к развитию гипертрофии ЛЖ, потому что
представляет больший объем крови, который необ-
ходимо вытолкнуть. Важная точность измерений
аорты, т.к. транскатетерную имплантацию аорталь-
ного клапана выполняют все чаще. Использование
компьютерной томографии (КТ) и чреспищевод-
ной ЭхоКГ (ЧПЭхоКГ) в 3D-режиме для этих целей
стала сферой активных исследований (см. главу 16).
American Society of Echocardiography (ASE) реко-
мендует оценивать измерения по номограммам со-
поставления с возрастом и площадью поверхности
тела или с использованием величин, полученных с
помощью аллометрических уравнений [7].
РАЗМЕР ЛЕВОГО ПРЕДСЕРДИЯ
С возрастом происходит значительное увеличение
размеров левого предсердия (ЛП) (рис. 39 .3). По-
скольку ЛП является трехмерной структурой, ASE
полагает, что объем лучше оценивает увеличение ЛП,
чем линейный 2D переднезадний размер [7]. От-
дельные данные предполагают, что расчет объема
ЛП методом площадь-длина, приводит к недооцен-
Рис. 39 .1 Увеличение толщины стенки левого желудочка с возрастом.
Толщина задней стенки левого желудочка (ЛЖ) в позднюю диастолу в милли-
метрах относительно возраста в годах. Для каждой возрастной группы среднее
(кружки) и 95% предсказательный интервал (синяя штриховка) для нормаль-
ных значений отражены для площади поверхности тела (ППТ) 1,8 м2. 95% до-
верительные интервалы также показаны для лиц с ППТ 1,4 м2 (пунктирная ли-
ния) и 2,2 м2 (сплошная линия) [Gardin JM, Henry WL, Savage DD, et al. Echo-
cardiographic measurements in normal subjects: evaluation of an adult population
without clinically apparent heart disease. J Clin Ultrasound 7:439–447, 1979. Copy-
right ©1979, John Wiley & Sons. Воспроизведено с разрешения John Wiley &
Sons, Inc.].
14
12
10
8
6
4
2
0
01020
1,4
1,4
2,2
2,2
30405060708090
Т
о
л
щ
и
н
а
з
а
д
н
е
й
с
т
е
н
к
и
Л
Ж
(
м
м
)
Возраст (годы)
Рис. 39 .2 Увеличение диаметра корня аорты с возрастом. Диаметр кор-
ня аорты в позднюю диастолу в миллиметрах относительно возраста в годах.
Среднее значение для каждой возрастной группы представлено кружками. Зо-
на усов и заштрихованная зона по обе стороны линии с кружками представля-
ют нормальные значения для лиц с площадью поверхности тела (ППТ) 1,8 м2.
95% предсказательные интервалы также показаны для лиц с ППТ 1,4 м2 (пун-
ктирная линия) и 2,2 м2 (сплошная линия) [Gardin JM, Henry WL, Savage DD,
et al. Echocardiographic measurements in normal subjects: evaluation of an adult
population without clinically apparent heart disease. J Clin Ultrasound 7:439–447,
1979. Copyright ©1979, John Wiley & Sons. Воспроизведено с разрешения John
Wiley & Sons, Inc.].
Возраст (годы)
50
40
30
20
10
0
01020
1,4
1,4
2,2
2,2
30405060708090
Д
и
а
м
е
т
р
к
о
р
н
я
а
о
р
т
ы
(
м
м
)
ch39_условно.indd 1004
03.04.2019 12:15:24
1005
39 Признаки старения, определяемые при эхокардиографии
ке по сравнению с МРТ, хотя другие данные свиде-
тельствуют о том, что 3D-ЭхоКГ — точный метод,
по сравнению с МРТ, и имеет лучшую прогности-
ческую значимость [8]. Aurigemma и соавт. [9], в ис-
следовании Cardiovascular Health Study использова-
ли эхокардиографические данные 230 субъектов, не
страдающих сердечно-сосудистыми заболеваниями
в среднем возрасте 75 ± 5 лет, установив референс-
ные границы по полу для размеров и объемов ЛП в
этой популяции. В табл. 39 .1 показаны границы из-
мерений параметров ЛП и клинические данные, от-
носящиеся к пациентам в исследовании.
РАЗМЕРЫ ЛЕВОГО ЖЕЛУДОЧКА
В исследованиях, которые зафиксировали утолще-
ние стенок ЛЖ, измерения конечно-диастолическо-
го и конечно-систолического размеров ЛЖ пока-
зали незначительное уменьшение или даже отсут-
ствие изменений с возрастом (табл. 39 .2) [2, 3, 10].
МРТ и эхокардиографические исследования в 3D-
режиме подтвердили эту тенденцию с увеличением
возраста. Нормальные данные геометрии и функ-
ции ЛЖ, полученные с помощью 3D-ЭхоКГ, приве-
дены в табл. 39 .3 . ASE рекомендует по возможности
использовать 3D-оценку [7]. Замечено, что изме-
ренные с помощью 3D-ЭхоКГ объемы, имели тен-
денцию к большим значениям по сравнению с двух-
мерными, но могли быть недооцененными, если
трабекулярные образования не исключались из ана-
лиза [11, 12]. Поскольку ударный объем — это раз-
ница между конечно-диастолическим и конечно-
систолическим объемами, принято, что ударный
объем ЛЖ, измеренный в покое лежа на спине, так-
же не зависит от возраста.
РАЗМЕРЫ ПРАВОГО ЖЕЛУДОЧКА
Нормальные значения линейных размеров правого
желудочка (ПЖ) по данным 2D-ЭхоКГ, опублико-
ванные ASE, не коррелируют с возрастом [7]. При
исследованиях с помощью 3D-ЭхоКГ и МРТ было
отмечено, что объемы ПЖ уменьшались с возрас-
томна5млза10летдляКДОи3млза10летдля
КСО с соответствующим повышением ФВ на 1% за
10 лет [13, 14]. Это действительно так, несмотря на
то что 3D-ЭхоКГ имеет тенденцию к недооценке
объема ПЖ по сравнению с МРТ. Референсные зна-
чения объемов ПЖ перечислены в табл. 39.4 .
РАЗМЕРЫ ПОЛОСТЕЙ СЕРДЦА
Эхокардиографические значения нормы для пара-
метров аорты и ЛЖ см. табл. 39 .2, 39.3 . Эти значе-
ния должны учитываться при оценке выявленных
нарушений.
КЛАПАНЫ СЕРДЦА
Документально подтверждено, что все четыре кла-
пана сердца морфологически изменяются с возрас-
том. Эти изменения наиболее характерны для левых
отделов, что может объяснить связью с высоким
давлением в соответствующих полостях.
ПЕРИМЕТР КЛАПАННОГО КОЛЬЦА
Было установлено, что периметр фиброзного коль-
ца увеличивается с возрастом. В одном из исследо-
ваний, включавшем 765 пациентов, средний пери-
метр фиброзного кольца, индексированный к пло-
щади поверхности тела, прогрессивно увеличивался
по мере повышения возраста, что было характер-
ным для полулунного клапана по сравнению с три-
куспидальным клапаном. Krovetz [15] провел по-
вторный анализ данных по размерам аортальных
клапанов и нашел, что с 18 до 21 года размер коль-
ца возрастал в линейной прогрессии (рис. 39 .4).
ТОЛЩИНА КЛАПАНА
Аутопсийные исследования 200 сердец без кардио-
логической патологии выявили значительное уве-
личение толщины аортального и митрального кла-
панов с повышением возраста. Это исследование
показало, что лица 20-летнего возраста по сравне-
нию с 60-летними имеют разницу в толщине клапа-
нов в 2 раза [16].
КАЛЬЦИФИКАЦИЯ КЛАПАНОВ
Старение ассоциируется с утолщением и кальцифи-
кацией створок аортального клапана, что носит на-
звание склероза аортального клапана, и подобными
процессами в области митрального и аортального
колец (известными под терминами кальцификация
фиброзного кольца митрального клапана и кальци-
фикация фиброзного кольца аортального клапана
соответственно) (рис. 39 .5, 39.6). Кальций опреде-
Рис. 39 .3 Увеличение размеров левого предсердия с возрастом. Раз-
меры левого предсердия (ЛП) в позднюю диастолу в миллиметрах относитель-
но возраста в годах. Для каждой возрастной группы среднее и 95% предска-
зательный интервал для нормальных значений отражены для трех различных
значений площади поверхности тела (см. рис. 39 .1) [Gardin JM, Henry WL, Sav-
age DD, et al. Echocardiographic measurements in normal subjects: evaluation of
an adult population without clinically apparent heart disease. J Clin Ultrasound
7:439–447, 1979. Copyright ©1979, John Wiley & Sons. Воспроизведено с
разрешения John Wiley & Sons, Inc.].
Возраст (годы)
50
40
30
20
10
0
01020
1,4
1,4
2,2
2,2
30405060708090
Р
а
з
м
е
р
ы
л
е
в
о
г
о
п
р
е
д
с
е
р
д
и
я
(
м
м
)
ch39_условно.indd 1005
03.04.2019 12:15:24
1006 ЧАСТЬ VII Сосудистые и системные заболевания
ляется в основании полулуний аортального клапана
и в области кольца, на конце створок митрального
клапана со стороны предсердия и в области фиброз-
ного кольца митрального клапана. Термин сениль-
ный синдром кальцификации был предложен для
описания пациентов со склерозом аортального кла-
пана, кальцификацией фиброзного кольца ми-
трального клапана и кальцификацией эпикарди-
альных коронарных артерий [17].
Различные исследования пациентов преклонно-
го возраста определили почти 50% наличие таких
патологических изменений. И хотя склероз аорталь-
ного клапана одинаково представлен у лиц обоих
полов, кальцификация фиброзного кольца ми-
трального клапана чаще встречается у женщин. Рас-
пространенность аортального склероза по резуль-
татам метаанализа представлена на рис. 39 .7 .
Распространенность кальцификации фиброзно-
го кольца митрального клапана в зависимости от
возраста по результатам Multi-Ethnic Study of Ath-
erosclerosis представлена на рис. 39 .8 .
ЕСТЕСТВЕННЫЕ ИЗМЕНЕНИЯ ФУНКЦИИ СЕРДЦА
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Фракция выброса в покое, процент фракции укоро-
чения и сердечный выброс по данным ЭхоКГ (2D и
3D), как и по данным радионуклидной вентрикуло-
графии, не меняются с возрастом у здоровых лиц с
нормальным давлением [18]. Для поддержания нор-
Пол
Среднее
Диапазон
Персентиль
0,05
0,50
0,95
Линейные размеры
Размер (см)
Женский
3,0 ± 0,5
1,5–4,2
2,2
3,0
3,9
Мужской
3,4 ± 0,6
2,1–4,8
2,4
3,3
4,4
Длина (см)
Женский
4,6 ± 0,7
2,8–6,1
3,6
4,6
5,7
Мужской
4,8 ± 0,7
3,3–6,7
3,7
4,7
6,1
Ширина (см)
Женский
3,6 ± 0,6
1,9–5,2
2,4
3,6
4,6
Мужской
3,8 ± 0,6
2,4–5,1
2,6
3,7
4,7
Объем
Объем ЛП (мл)
Женский
27,4 ± 10,0
8,7–53,9
12,3
26,4
46,7
Мужской
32,0 ± 10,9
13,9–71,5
17,2
30,1
58,2
Клинические данные
Возраст (годы)
Женский
76,5 ± 4,9
68–91
70
76
85
Мужской
77,3 ± 5,6
68–93
70
75
88
Рост (дюйм)
Женский
62,8 ± 2,2
57,9–68,1
58,4
63,0
66,2
Мужской
67,9 ± 2,5
60,4–75,2
63,8
67,8
71,7
Вес (фунт)
Женский
146±29
84–233
96
144
193
Мужской
173±26
114–254
132
170
222
ППТ (м2)
Женский
1,66 ± 0,17
1,27–2,07
1,37
1,66
1,93
Мужской
1,89 ± 0,16
1,48–2,37
1,60
1,88
2,13
ИМТ (кг/м2)
Женский
25,9 ± 4,6
15,2–39,5
17,9
25,2
34,0
Мужской
26,3 ± 3,2
18,4–37,6
21,6
26,0
31,7
САД (мм рт. ст .)
Женский
128±18
84–181
99
126
158
Мужской
130±17
88–211
109
127
158
ДАД (мм рт. ст.)
Женский
68,4 ± 9,8
42–92
51
69
83
Мужской
70,8 ± 9,6
49–110
56
70
87
* Данные получены у 230 здоровых участников старше 65 лет (средний возраст 76 ± 5 лет).
ИМТ — индекс массы тела; ДАД — диастолическое артериальное давление; диаметр — передне-задний размер ЛП, измеренный в пара-
стернальной позиции по длинной оси; длина — размер ЛП от клапанного кольца к верхней стенке, измеренный в апикальной четырех-
камерной позиции; ППТ — площадь поверхности тела; САД — систолическое артериальное давление; ширина — медиально-латераль-
ный размер ЛП в четырехкамерной позиции.
[Aurigemma GP, Gottdiener JS, Arnold AM, et al. Left atrial volume and geometry in healthy aging: the Cardiovascular Health Study. Circ Cardio-
vasc Imaging 2:282–289, 2009. Copyright © 2009, Lippincott Williams & Wilkins.]
ТАБЛИЦА 39.1 Объемы и геометрия левого предсердия у здоровых лиц старшего возраста*
ch39_условно.indd 1006
03.04.2019 12:15:24
1007
39 Признаки старения, определяемые при эхокардиографии
Параметр
Группа I
(25–44 года)
Группа II
(45–64 года)
Группа III
(65–84 года)
Наклон кривой E-F митрального клапана (мм/сек)
102,3 ± 3,7 (52)
79,0 ± 3,8 (35)*
67,1 ± 5,2 (18)†
Корень аорты, диастола (мм)
30,9 ± 0,6 (45)
32,0 ± 0,6 (34)
32,9 ± 0,8 (17)£
Толщина стенки ЛЖ (мм)
Во время систолы
15,4 ± 0,5 (33)
17,6 ± 0,7 (15)
18,8 ± 0,6 (12)*
Во время диастолы
8,7 ± 0,3 (33)
9,8 ± 0,5 (16)
10,7 ± 0,5 (13)*
Систолическая/м2
7,6 ± 0,3 (33)
9,2 ± 0,3 (15)†
10,0 ± 0,4 (12)†
Диастолическая/м2
4,3 ± 0,1 (33)
5,0 ± 0,2 (16)*
5,7 ± 0,2 (13)†, §
Размеры ЛЖ (мм)
Систолические
34,4 ± 1,1 (37)
32,1 ± 0,89 (17)
32,1 ± 1,4 (11)
Диастолические
51,8 ± 1,03 (37)
50,8 ± 1,3 (17)
51,2 ± 1,4 (11)
Систолические/м2
17,3 ± 0,5 (37)
16,7 ± 0,5 (17)
16,8 ± 0,6 (11)
Диастолические/м2
26,0 ± 0,5 (37)
26,4 ± 0,6 (17)
27,0 ± 0,7 (11)
Фракция укорочения
0,34 ± 0,01 (37)
0,36 ± 0,01 (17)
0,37 ± 0,02 (11)
Vf (об/сек)
1,17 ± 0,04 (37)
1,23 ± 0,04 (17)
1,30 ± 0,08 (11)
* p < 0,01 по сравнению с группой I. Количество пациентов приводится в скобках после среднего значения и стандартного отклонения.
† p < 0,001 по сравнению с группой I.
£ p < 0,05 по сравнению с группой I.
§ p < 0,05 по сравнению с группой II.
Vcf — скорость укорочения циркулярных волокон; об/сек — оборотов в секунду.
[Gerstenblith G, Frederiksen J, Yin FCP, et al. Echocardiographic assessment of a normal adult aging population. Circulation 56:273–277, 1977.]
ТАБЛИЦА 39.2 Средние показатели эхокардиографических параметров в трех возрастных группах
мального времени выброса при в условиях поздне-
го систолического увеличения импеданса аорты, у
пожилых отмечается удлиненная контрактильная
активация ЛЖ [18]. Эта пролонгированная кон-
трактильная активация означает, что при открытии
митрального клапана расслабление миокарда еще
на завершено (по сравнению с лицами молодого
возраста) и поэтому скорость раннего диастоличе-
ского наполнения у пожилых ниже. Исследования
миокарда крыс и собак показали, что изменения со-
кратительной функции (напряжение в покое, мак-
симальное изометрическое напряжение, макси-
мальная скорость нарастания напряжения) не зави-
сят от возраста [18].
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА
Хотя систолическая работоспособность ЛЖ у пожи-
лых сохранена, диастолическая функция ЛЖ с воз-
растом изменяется значительно. Основополагаю-
щие работы в этой области отмечают снижение на-
клона кривой закрытия митрального клапана в
интервале E-F по данным ЭхоКГ в M-режиме [2, 3].
Поздние работы, где использовался импульсно-
волновая допплерография, подтвердили снижение
пика скорости раннего диастолического наполне-
ния (пик E) приблизительно на 50% в возрастном
промежутке от 20 до 80 лет. Имеется сопутствующее
повышение с возрастом пика скорости A, представ-
ляющего позднее наполнение ЛЖ в результате со-
кращения предсердия. Этому предсердному «вбро-
су» крови способствует связанное с возрастом уве-
личение размеров ЛП. Резонно рассматривать
повышенный вклад предсердия в наполнение ЛЖ,
как успешный компенсаторный механизм в ответ
на снижение скорости раннего диастолического на-
полнения утолщенного, менее эластичного желу-
дочка.
Был предложен ряд механизмов, объясняющих
изменения диастолической функции, которые про-
исходят со временем. Эти механизмы включают в
т.ч . снижение уровня накопления кальция в сарко-
плазматическом ретикулуме. Исследования на це-
лых сердцах животных и изолированном миокарде
подтверждают продленное время изоволюмическо-
го расслабления и повышенную ригидность мио-
карда. Склероз створок митрального клапана, веду-
щий к удлинению времени диастолического напол-
нения (позднее закрытие) также был предложен в
качестве одного из возможных механизмов как по-
вышающий постнагрузку.
Данные Framingham Heart Study были использо-
ваны для определения референсных значений для
различных допплеровских параметров у возраст-
ных пациентов (табл. 39 .5) [19]. Эти данные полу-
чены по результатам обследования 114 пациентов
обоего пола в возрасте от 70 до 87 лет, у которых в
ходе скрининга сердечно-сосудистых заболеваний
выявлено не было. Примечательно, что большин-
ство (87%) имело отношение E/A < 1,0, 75% показа-
ли значения < 0,86, а 25% — ниже 0,62. Учитывая,
ch39_условно.indd 1007
03.04.2019 12:15:24
1008 ЧАСТЬ VII Сосудистые и системные заболевания
18–39 лет
40–59 лет
≥60лет
Переменная
Мужчины
(n=40)
Женщины
(n=44)
p
Мужчины
(n=38)
Женщины
(n=54)
p
Мужчины
(n=24)
Женщины
(n=26) p
КДО (мл)
128±27
(182)
98±16
(130)
< 0,0001 119 ± 21
(161)
94±16
(126)
< 0,0001 116 ± 26
(168)
84±12
(108)
< 0,0001
КДО/ППТDB
(мл/м2)
66±11
(88)
60 ± 8 (76) 0,001
61±9(79) 56±8(72) 0,021
62±12(86) 51±7(65) 0,001
КДО/ППТH
(мл/м2)
86±17
(110)
69±10(89) <0,0001 80±13(106) 67±11(89) <0,0001 81±17
(115)
59±8(75) <0,0001
КСО (мл)
50±11
(72)
36±7(50) <0,0001 44±9(62) 33±5(43) <0,0001 44±11(66) 28±6(40) <0,0001
КСО/ППТDB
(мл/м2)
26±5(36) 22±4(30) <0,0001 23±4(31) 20±3(26) <0,0001 23±5(33) 17±4(25) <0,0001
КСО/ППТH
(мл/м2)
33±7(47) 25±5(35) <0,0001 30±6(42) 23±3(29) <0,0001 30±8(46) 20±4(28) <0,0001
УО (мл)
78±17
(44†)
62±10(42†)<0,0001 75±13(49†) 60±14
(32†)
<0,0001 74±15
(44†)
56±9
(38†)
< 0,0001
УО/ППТDB
(мл/м2)
41±7
(27†)
37 ± 5 (27†) 0,027
38±6(24†) 36±6(24†) 0,261
39±7(25†) 34±5
(24†)
0,016
КСО/ППТH
(мл/м2)
53±11
(31†)
43±7(29†) <0,0001 50±8(34†) 44±8(28†) <0,0001 51±10
(31†)
40±6
(28†)
< 0,0001
Фракция
выброса (%)
61±4
(53†)
63 ± 3 (57†) 0,016
63±3(57†) 65±4(57†) 0,009
63±3(57†) 66±5
(56†)
0,008
Масса (г)
149±22
(193)
124±15
(154)
< 0,0001 150 ± 22
(194)
126±16
(158)
< 0,0001 150 ± 23
(196)
118±19
(156)
< 0,0001
Масса/ППТDB
(г/м2)
78±9(96) 75±8(91) 0,250
76±11(98) 75±8(91) 0,450
79±10(99) 72±10
(92)
0,027
Масса/ППТH
(г/м2)
112±16
(144)
96611(118) <0,0001 113±13
(139)
98±11
(120)
< 0,0001 113 ± 15
(143)
92±14
(120)
< 0,0001
Масса/КДО
(г/мл)
1,19 ± 0,16
(1,51)
1,29 ±± 0,16
(1,61)
0,004
1,28 ± 0,20
(1,68)
1,35 ± 0,20
(1,75)
0,078
1,29 ± 0,18
(1,65)
1,42 ± 0,15
(1,72)
0,013
Индекс
сферичности
0,33 ± 0,06
(0,45)
0,34 ± 0,07
(0,48)
0,827
0,35 ± 0,08
(0,51)
0,34 ± 0,06
(0,46)
0,807
0,37 ± 0,08
(0,53)
0,36 ± 0,07
(0,50)
0,684
* Данные представлены как среднее ± SD (верхний предел нормы).
† Нижний предел нормальности.
КДО — конечно -диастолический объем; КСО — конечно-систолический объем; УО — ударный объем.
[Muraru D, Badano LP, Peluso D, et al. Comprehensive analysis of left ventricular geometry and function by three-dimensional echocardiography
in healthy adults. J Am Soc Echocardiogr 26:618–628, 2013.]
ТАБЛИЦА 39.3 Изменения геометрии и функции левого желудочка по данным трехмерной эхокардиографии
в зависимости от возраста и пола*
что у здоровых молодых лиц отношение скоростей
E/A выше 1,0, может быть неуместным использова-
ние его в качестве референсного для оценки диасто-
лической функции у пациентов в возрасте (рис.
39.9) (см. главу 9).
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Помимо оценки фракции выброса ПЖ, как отмече-
но выше, существует множество эхокардиографи-
ческих методов для определения систолической
функции ПЖ (см. главу 31). Один из них — это по-
лученный при тканевой допплерографии параметр
смещения фиброзного кольца трикуспидального
клапана во время систолы, который был определен,
как имеющий зависимость от возраста с четким по-
роговым значением, в результате исследования 298
пациентов. Данные представлены в табл. 39 .6 .
ОТВЕТ СЕРДЦА НА НАГРУЗКУ ДАВЛЕНИЕМ
Типичный ответ в виде повышения давления и ча-
стоты сердечных сокращений (ЧСС) на продолжи-
тельную изометрическую нагрузку с использовани-
ем ручного эспандера у здоровых пожилых лиц на-
рушен по сравнению с молодыми. ЧСС в группе
ch39_условно.indd 1008
03.04.2019 12:15:24
1009
39 Признаки старения, определяемые при эхокардиографии
Рис. 39 .4 Увеличение с возрастом диаметра аорты. Изменения с воз-
растом площади фиброзного кольца аортального клапана. Приведенные дан-
ные касаются пациентов старше 20 лет. Пациенты моложе 20 лет имеют бо
́
ль-
шую площадь аортального клапана, индексированную к площади поверхности
тела, чем рассчитанная по уравнению регрессии [Krovetz LJ. Age-related chang-
es in the size of the aortic valve annulus in man. Am Heart J 90:569–574, 1975].
6
5
4
3
2
1
0
010
2030405060
70 80
Мужчины
Женщины
у = 0,0417 (возраст) + 1,015
r = 0,769
П
л
о
щ
а
д
ь
ф
и
б
р
о
з
н
о
г
о
к
о
л
ь
ц
а
а
о
р
т
а
л
ь
н
о
г
о
к
л
а
п
а
н
а
(
с
м
2
/
м
2
)
Возраст (годы)
Рис. 39 .5 Склероз аортального клапана. Склероз визуализируется в виде ярких очагов на створках аортального клапана (стрелки) как по короткой оси
A (А) во время систолы, так и по длинной оси A (Б) во время диастолы. Ao — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие.
Ао
ЛП
ЛЖ
А
Б
пожилых лиц увеличивается не сильно, но давление
повышается интенсивнее, чем у молодых. В допол-
нение к этим нарушениям отмечается незначитель-
ное увеличение диастолических и систолических
размеров ЛЖ по данным ЭхоКГ, что наблюдается с
увеличением возраста [17]. При назначении бета-
блокаторов для блокирования бета-адренергиче-
ской стимуляции у здоровых лиц молодого и пожи-
лого возраста, которым в последующем вводился
фенилэфрин, размер полости ЛЖ увеличивался в
большей степени в группе пожилых лиц, у которых
ЧСС повышалась меньше, чем в группе молодого
возраста [20]. Это происходит вследствие снижен-
ного сократительного резерва сердца у пожилых в
ответ на повышение постнагрузки, общая систоли-
ческая функция поддерживается за счет увеличения
полости (например, по механизму Франка-Стар-
линга).
Возраст (годы) n (ж, м)
КДО ПЖ (мл/м2)
КСО ПЖ (мл/м2)
ФВПЖ (%)
Женщины
Мужчины
Женщины
Мужчины
Женщины
Мужчины
<30
102 (45, 57) 53 (38, 78)
66 (42, 100)
20 (8, 45)
28 (16, 52)
60 (43, 82)
56 (42, 68)
30–39
96 (50, 46) 50 (38, 77)
58 (35, 85)
18 (11, 38)
23 (12, 38)
63 (50, 78)
60 (47, 74)
40–49
96 (53, 43) 50 (34, 65)
54 (36, 78)
18 (11, 29)
21 (11, 33)
65 (49, 80)
59 (51, 75)
50–59
88 (47, 41) 49 (37, 69)
53 (36, 76)
18 (11, 29)
19 (10, 36)
62 (46, 76)
62 (45, 74)
60–69
69 (39, 30) 46 (26, 64)
52 (37, 86)
17 (8, 26)
19 (10, 36)
61 (50, 79)
63 (49, 79)
≥70
37 (23, 14) 43 (25, 62)
54 (31, 68)
12 (7, 21)
18 (7, 28)
71 (57, 82)
65 (55, 76)
* Данные представлены как медиана (5,95 персентиль).
КДО — конечно-диастолический объем; КСО — конечно -систолический объем; ФВ — фракция выброса.
[Maffessanti F, Muraru D, Esposito R, et al: Age-, body size-, and sex-specific reference values for right ventricular volumes and ejection fraction by
three-dimensional echocardiography: a multicenter echocardiographic study in 507 healthy volunteers. Circ Cardiovasc Imaging 6:700–710, 2013.]
ТАБЛИЦА 39.4 Уровни нормальных значений трехмерных эхокардиографических показателей размеров
и функции правого желудочка при соотнесении к полу и возрасту*
ch39_условно.indd 1009
03.04.2019 12:15:24
1010 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 39.6 Кальцификация фиброзного кольца митрального клапана. Кальцификаты видны в виде ярких очагов вдоль задней части фиброзного кольца
митрального клапана (МК) (стрелки) в парастернальных позициях по длинной оси A (A) и по короткой оси A (Б). Представлен пример казеозной кальцифика-
ции фиброзного кольца митрального клапана (стрелки) в соответствующих позициях A A (В, Г). Ao — аорта; ЛЖ — левый желудочек; ЛП — левое предсер-
дие; ПЖ — правый желудочек.
ЛП
ЛЖ
МК
ПЖ
Ао
А
Б
Г
В
Рис. 39 .7 Прогрессирование аортального склероза с возрастом. Распространенность аортального склероза в зависимости от среднего возраста участни-
ков в исследовании. Средний возраст представлен, как среднее или медиана в соответствии с отчетом по исследованию, а два исследования, где этих данных
нет, на рисунке не представлены. Площадь каждой точки пропорциональна количеству участников в исследовании. Прямая линия отражает график линейной ре-
грессии, который демонстрирует 1,5% (95% доверительный интервал: 0,75–2 ,25%) увеличение распространенности на каждый год повышения среднего возраста
(p 1/4 0,0007, R2 1/4 0,549). КТ — компьютерная томография; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография
[Coffey S, Cox B, Williams MJA. The prevalence, incidence, progression, and risks of aortic valve sclerosis. J Am Coll Cardiol 63:2852–2861, 2014].
Средний возраст участников в исследовании
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
а
о
р
т
а
л
ь
н
о
г
о
с
к
л
е
р
о
з
а
(
%
)
50
0
10
20
30
40
50
60
70
55
60
65
70
75
80
85
90
КТ
ЧПЭхоКГ
ТТЭхоКГ
Обратное
рассеивание
ch39_условно.indd 1010
03.04.2019 12:15:25
1011
39 Признаки старения, определяемые при эхокардиографии
Параметры диастолы
Среднее
значение
Нижние персентили
Медианный
персентиль
Верхние персентили
5%
10%
50%
75%
90%
95%
Скорость E (м/сек)
0,44
0,25
0,26
0,41
0,51
0,69
0,76
Скорость A (м/сек))
0,59
0,38
0,43
0,56
0,68
0,80
0,84
Отношение E/A
0,76
0,48
0,52
0,70
0,86
1,05
1,21
Отношение E/A TVI
1,36
0,79
0,90
1,33
1,57
1,76
1,94
Отношение ФНП
0,40
0,29
0,32
0,40
0,44
0,49
0,52
AT (сек)
0,06
0,02
0,03
0,05
0,07
0,08
0,09
DT (сек)
0,14
0,09
0,10
0,14
0,16
0,19
0,23
AT — время ускорения; DT — время замедления; E/A — отношение максимальных скоростей раннего и позднего наполнения; E/A TVI —
отношение интегралов скоростей в ранней и поздней фазе; скорость A — максимальная скорость A; скорость E — максимальная ско -
рость E; ФНП — фракция наполнения предсердия.
[Sagie A, Benjamin EJ, Golderisi M, et al. Reference values for Doppler indexes of left ventricular diastolic filling in the elderly. J Am Soc Echocar-
diogr 6:570–576, 1993.]
ТАБЛИЦА 39.5 Средние значения и персентили допплеровских параметров диастолического наполнения
у 114 участников исследования старше 70 лет
Рис. 39 .8 Прогрессирование кальцификации фиброзного кольца ми-
трального клапана с возрастом. Распространенность кальцификации фи-
брозного кольца митрального клапана в зависимости от возраста участников.
Multi-Ethnic Study of Atherosclerosis включало 6814 женщин и мужчин в воз-
расте 45–84 лет без явных сердечно-сосудистых заболеваний [Kanjanauthai S,
Nasir K, Katz R, et al. Relationships of mitral annular calcification to cardiovascular
risk factors: the Multi-Ethnic Study of Atherosclerosis [MESA]. Atherosclerosis,
213:558–562, 2010].
Всего
0
10
20
30
40
45–54 года
55–64 года
65–74 года
75–84 года
ОТВЕТ СЕРДЦА НА ФИЗИЧЕСКУЮ НАГРУЗКУ
Многочисленные исследования показали, что мак-
симальное потребление кислорода снижается с воз-
растом. Подобные изменения, вероятно, являются
многофакторными и помимо других факторов на
них влияют сердечный выброс, легочная функция и
мышечная активность. Также было зафиксировано
связанное с возрастом снижение сердечного выбро-
са на максимуме нагрузки, что является результа-
том ранее упомянутого снижения реакции сердеч-
ного ритма на нагрузку. При физической нагрузке
ударный объем сохраняется независимо от возрас-
та. Механизм, способствующий этому, заключается
в увеличении конечно-диастолических объемов ЛЖ
при нагрузке, которые компенсируют возможности
сердца у пожилых к снижению конечно-систоличе-
ского объема. Больший конечно-диастолический
объем ЛЖ достигается, в некоторой степени, в ре-
зультате замедления ЧСС (пролонгирование време-
ни диастолического наполнения), так же как и боль-
ший конечно-систолический объем [21].
Однако ФВ не сильно повышается у пожилых
здоровых лиц по сравнению с молодыми, и они не
могут достигнуть того пикового уровня, который
регистрируется у молодых. Это происходит вслед-
ствие сниженной способности к уменьшению ко-
нечно-систолического объема. Эти находки, вероят-
но, отражают последствия ряда механизмов, кото-
рые включают сниженную сократимость миокарда,
повышенную сосудистую постнагрузку, ограничен-
ную автономную модуляцию сократимости мио-
карда ЛЖ и артериальной постнагрузки, а также не-
соответствие артериально-желудочковой нагрузки
[22].
ДАННЫЕ О КЛИНИЧЕСКИХ ИСХОДАХ
ПОРОКИ КЛАПАНОВ СЕРДЦА
СКЛЕРОЗ АОРТАЛЬНОГО КЛАПАНА
Склероз аортального клапана представляет собой
одну часть спектра кальцифицированных пороков
аортального клапана. Ранний аортальный склероз
характеризуется умеренным утолщением створок
без ограничений потока. На другом конце спектра
располагается аортальный стеноз, который может
прогрессировать до тяжелого кальцификации с
ограничением движения створок и обструкцией вы-
броса ЛЖ. Поражения в раннюю фазу аортального
ch39_условно.indd 1011
03.04.2019 12:15:25
1012 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 39 .9 Типичные диастолические изменения с возрастом. Изменения характера наполнения левого желудочка (ЛЖ) и левого предсердия с возрастом.
Трансмитральный кровоток (верхний ряд) и допплеровское исследование легочных вен (нижний ряд) молодых, среднего возраста и пожилых лиц. Показано раз-
витие изменений наполнения ЛЖ в норме.
E
A
A
A
A
S
S
S
S
D
D
D
D
a
E
Приток в ЛЖ
Поток в легочных венах
Молодые
Среднего возраста
Пожилые
E
E
10–19 лет
(n=40)
20–29 лет
(n=53)
30–39 лет
(n=41)
40–49 лет
(n=52)
50–59 лет
(n=53)
60–69 лет
(n=37)
>70лет
(n=22) p
Максимальная скорость
латеральной части
фиброзного кольца
трикуспидального
клапана Sa (см/сек)
14,8±2,1 14,8±1,6 14,2±1,6 14,6±2,1 13,5±1,7 13,2±1,7 11,7±2,2 >0,0001
(14,2–15,5) (14,3–15,2) (13,7–14,7) (14,0–15,1) (13,0–14,0) (12,7–13,8) (10,7–12,7)
Максимальная скорость Ea
(см/сек)
15,7±2,9 16,1±3,1 14,9±3,2 14,0±2,8 12,4±2,5 12,5±3,2 10,8±1,6 >0,0001
(14,8–16,7) (15,2–16,9) (13,8–15,9) (13,4–15,0) (11,7–13,1) (11,4–13,5) (10,1–11,6)
Максимальная скорость Aa
(см/сек)
9,0 ± 3,3
11,0±3,3 12,1±3,6 13,7±4,0 13,8±3,3 14,8±4,0 13,3±3,2 >0,0001
(8,0–0,1)
(10,1–12,0) (11,0–13,3) (12,6–14,8) (12,9–14,7) (13,4–16,1) (11,9–14,8)
Отношение Ea/Aa
0,8
1,5 ± 0,4
1,3±0,38 1,2±0,9
0,95 ± 0,3 0,892 ± 0,2 0,85 ± 0,2 > 0,0001
(1,7–0,2)
(1,4–1,6) (1,1–1,4) (0,9–1,5) (0,86–1,04) (0,79–0,98) (0,76–0,93)
Отношение E/Ea
0,9
3,9 ± 1,1
3,9 ± 1,0
3,8 ± 0,9
4,4 ± 1,1
4,2 ± 1,4
5,4 ± 1,5
> 0,0001
(3,8–4,4)
(3,5–4,2) (3,6–4,3) (3,6–4,1) (4,1–4,7) (3,7–4,7)
(4,7–6,1)
* Данные представлены как среднее ± SD (95% доверительный интервал).
[Innelli P, Esposito R, Olibet M, et al. The impact of ageing on right ventricular longitudinal function in healthy subjects: a pulsed tissue Doppler
study. Eur J Echocardiogr 10:491–498, 2009.]
ТАБЛИЦА 39.6 Значения импульсно-волновой тканевой допплерографии фиброзного кольца
трикуспидального клапана в соответствии с возрастом*
ch39_условно.indd 1012
03.04.2019 12:15:26
1013
39 Признаки старения, определяемые при эхокардиографии
ца митрального клапана определяется по аналогич-
ным эхографическим сигналам кпереди от левой
задней стенки, сливаясь с ней. Хотя много специа-
листов по ЭхоКГ используют собственные субъек-
тивные критерии для определения тяжести кальци-
фикации фиброзного кольца митрального клапана,
также используют и системный подход [28]. Незна-
чительная кальцификация фиброзного кольца ми-
трального клапана может определяться по вовлече-
нию в процесс менее одной трети периметра (< 3 мм
по ширине) и обычно ограничена углом между зад-
ней створкой митрального клапана и задней стен-
кой ЛЖ. При умеренной кальцификации фиброз-
ного кольца митрального клапана вовлечено менее
двух третей периметра (от 3 до 5 мм по ширине).
Тяжелая кальцификация фиброзного кольца ми-
трального клапана характеризуется поражением
двух третей периметра (> 5 мм по ширине). Она
обычно распространяется ниже всей задней створки
митрального клапана и может представлять зам-
кнутый круг.
Описан также редкий вариант кальцификации
фиброзного кольца митрального клапана, называе-
мый казеозной кальцификацией фиброзного кольца
митрального клапана (см. рис. 39 .6). Эхокардиогра-
фически он представляет большую эхоплотную
структуру с просветлением в центре и ровными
контурами, обычно располагающуюся в задней ча-
сти кольца. Патоморфологически оно состоит из
смеси кальция, холестерина и жирных кислот, и ве-
роятно представляет активный процесс; в одном
продольном исследовании было отмечено, что не-
которые пациенты, у которых исходно имелась
классическая кальцификация фиброзного кольца
митрального клапана, отмечали признаки казеоз-
ной кальцификации, а у некоторых, имевших ка-
зеозную кальцификацию отмечалось «обратное
развитие» в классическую форму [29]. Патоморфо-
логически при операции или аутопсии находки
представляли кальцифицированную оболочку,
окружающую казеозный некроз с включениями хо-
лестерина и жирных кислот. В других случаях нахо-
дили аморфный эозинофильный неклеточный суб-
страт в окружении макрофагов и лимфоцитов [30].
Дифференциальная диагностика с помощью ЭхоКГ
включает опухоли, абсцессы и вегетации. Опухоли
обычно васкуляризованы и не имеют краевой каль-
цификации; абсцессы, как правило, выявляются
при наличии известной инфекции и также обычно
не кальцифицированы; а вегетации при инфекци-
онных эндокардитах также часто сопровождаются
другими признаками инфекции (например, поло-
жительными гемокультурами, лихорадкой) и ти-
пично представлены подвижными эхосигналами,
которые прикреплены к клапану, движутся хаотич-
но и сопровождаются регургитацией. Иногда МРТ
сердца позволяет помочь в дифференциальной
диагностике данной патологии, если клиническая
склероза представляют комплекс очаговых субэндо-
телиальных бляшкоподобных изменений, распола-
гающихся на аортальной стороне створок и распро-
страняющихся на фиброзную оболочку. Эти пора-
жения, возможно, возникают в результате реакции
на повышенную механическую нагрузку или сни-
жение напряжения сдвига. Механическая нагрузка
максимальна в месте прикрепления створок к кор-
ню аорты. Напряжение сдвига определяется, как
наименьшее на уровне некоронарных структур вви-
ду отсутствия диастолического коронарного крово-
тока, что может объяснять их первоочередное пора-
жение [23]. Пациенты с двухстворчатым клапаном
имеют тенденцию к развитию аортального стеноза
на 20 лет раньше, чем те, у кого клапан трикуспи-
дальный, что подтверждает гипотезу о роли меха-
нической нагрузки в патогенезе развития болезни
(двухстворчатый клапан подвержен большим на-
грузкам) [23]. Поражения при склерозе аортального
клапана активны, с выраженной воспалительной
клеточной инфильтрацией, микроскопическими
кальцификатами, накоплением липопротеинов
низкой плотности и липопротеина (a), а также оче-
видной оксидации липопротеинов низкой плотно-
сти [24]. По мере развития процесса кальцифика-
ция нарастает вплоть до костной плотности. В ко-
нечном итоге кальцификация створок может
достичь такой выраженности, что нарушается от-
крытие клапана и развивается гемодинамически
значимый аортальный стеноз. В продольных иссле-
дованиях, регистрировавших прогрессирование от
аортального склероза до аортального стеноза, уме-
ренный стеноз (скорость потока от 3 до 4 м/сек) был
выявлен у 3% пациентов в одном исследовании и у
5% во втором, а тяжелый стеноз (скорость потока
> 4 м/сек) у 2,5% пациентов в обоих исследованиях
[25]. Скорость прогрессирования в двух других ис-
следованиях составила от 1,8 до 1,9% в год [26, 27].
Хотя у подавляющего большинства пациентов про-
грессирование до выраженного аортального стеноза
не происходит, имеющаяся высокая распространен-
ность склероза аортального клапана в возрастной
популяции, абсолютное количество пациентов, ко-
торые могут страдать этим недугом высоко, поэто-
му важно их идентифицировать (см. главу 15).
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА МИТРАЛЬНОГО КЛАПАНА
Как известно, кальцификация фиброзного кольца
митрального клапана характеризуется отложением
кальция и в створках и по периметру кольца. Это
обусловлено его анатомическим расположением.
Передняя кальцификация фиброзного кольца ми-
трального клапана определяется по ярким эхосиг-
налам, локализующимся на уровне передней створ-
ки митрального клапана во время систолы и диасто-
лы, и распространяющимися от кольца к основанию
сердца с переходом на митральный и аортальный
клапаны. Задняя кальцификация фиброзного коль-
ch39_условно.indd 1013
03.04.2019 12:15:26
1014 ЧАСТЬ VII Сосудистые и системные заболевания
картина неопределенна. Хотя обычно это считается
доброкачественным процессом, при симптомах
клапанной дисфункции (митральном стенозе или
регургитации) или эмболии может рассматриваться
вариант хирургического лечения казеозной кальци-
фикации фиброзного кольца митрального клапана.
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА МИТРАЛЬНОГО КЛАПАНА
И НАРУШЕНИЕ ФУНКЦИИ КЛАПАНА
Существует широкий спектр вариантов кальцифи-
кации фиброзного кольца митрального клапана,
а состояние может прогрессировать (рис. 39 .10).
Обычно все начинается с отложения небольших ко-
личеств депозитов кальция в базальном включении
задней створки митрального клапана. Происходит
кальцификация соединительной ткани кольца и
может формироваться гребень или кольцо, окружа-
ющие створки. По мере дальнейшего прогрессиро-
вания они могут выпячиваться в полость ЛЖ за зад-
ней створкой и поднимать створки в сторону ЛП.
Больший объем поражения может сделать основа-
ние задней стенки неподвижным и приводить к раз-
личной степени митральной регургитации. Реально
кальцификация створок встречается не так часто.
Выраженность кальцификации фиброзного кольца
митрального клапана выглядит связанной с тяже-
стью митральной регургитации при ее наличии. В
Multi-Ethnic Study of Atherosclerosis первичным пре-
диктором усугубления тяжести кальцификации
фиброзного кольца митрального клапана была ис-
ходная выраженность кальцификатов [31].
Митральный стеноз вследствие кальцификации
фиброзного кольца митрального клапана встреча-
ется нечасто. В отличие от ревматического митраль-
ного стеноза, при котором имеются комиссураль-
ные спайки, митральный стеноз, ассоциированный
с кальцификацией фиброзного кольца митрального
клапана, створки не спаяны, но повышение скоро-
сти потока происходит в результате уменьшенной
экскурсии фиброзного кольца митрального клапа-
на по причине кальцификации. Недавние исследо-
вания позволили предположить, что когда кальци-
фикация фиброзного кольца митрального клапана
является причиной митрального стеноза, она явля-
ется менее тяжелой, хотя встречается чаще, чем счи-
талось раньше, и также ассоциируется с факторами
риска развития ишемической болезни сердца, и
встречается до 28% случаев у пациентов с хрониче-
скими заболеваниями почек [32].
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И ДРУГАЯ ПАТОЛОГИЯ
Кальцификация фиброзного кольца митрального
клапана ассоциируется с увеличением ЛП и ЛЖ. В
проспективном исследовании 976 пожилых пациен-
тов с кальцификацией фиброзного кольца митраль-
ного клапана и без таковой увеличение ЛП встреча-
лось в 2,4 раза чаще при кальцификации, чем у па-
циентов без нее [33].
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И НАРУШЕНИЕ ПРОВОДИМОСТИ
Вероятно вторично к сопутствующей кальцифи-
кации в области проводящей системы (которая мо-
жет быть продолжающейся по мере распростране-
ния кальция от кольца по МЖП), митральная каль-
цификация связана с нарушениями проведения,
такими как атриовентрикулярная блокада, патоло-
гия синоатриального узла, блокада ножек пучка Ги-
са, блокада левой передней ветви и неспецифиче-
ское нарушение внутрижелудочковой проводимо-
сти [28].
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
Вероятно вследствие сопутствующего увеличения
ЛП, фибрилляция предсердий чаще наблюдается у
пациентов с кальцификацией фиброзного кольца
митрального клапана, чем без нее. В различных ис-
следованиях относительный риск был повышен до
12 раз [34].
Рис. 39 .10 Морфология кальцификации фиброзного кольца митрального клапана. Макропрепарат, представляющий кальцификацию фиброзного коль-
ца митрального клапана. (А) Желудочковая часть митрального клапана имеет узлы депозитов кальция в зоне кольца, прилежащие к створке клапана и хордам
(стрелка). (Б) Посмертная радиография демонстрирует почти O-образную кальцификацию фиброзного кольца митрального клапана (красная стрелка) и кальци-
фицированные коронарные артерии (черные стрелки).
А
Б
ch39_условно.indd 1014
03.04.2019 12:15:26
1015
39 Признаки старения, определяемые при эхокардиографии
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И ТРОМБОЭМБОЛИЯ
Кальцификация фиброзного кольца митрального
клапана связана с рядом состояний, провоцирую-
щих тромбоэмболический инсульт, как то фибрил-
ляция предсердий, митральная регургитация и сте-
ноз, увеличение ЛП и сердечная недостаточность. К
тому же кальцификация фиброзного кольца ми-
трального клапана ассоциируется с атероматозом
аорты, комплексным разрушением аорты и кальци-
фикацией грудной аорты, каждое из которых могут
стать источником тромбоэмболического материала
[35]. Дополнительно к этому есть основание счи-
тать, что кальцификация фиброзного кольца ми-
трального клапана сама по себе может стать источ-
ником тромбоэмболов. Хотя кальцификаты при
кальцификации фиброзного кольца митрального
клапана обычно прикрыты слоем эндотелия, изъяз-
вление выстилающего слоя способствуют выходу
кальция, который становится ядром фибрин-тром-
боцитарного сгустка, приводящего к эмболии [33].
Ряд исследований, проводимых с целью контроля
других факторов, вскрыли связь кальцификации
фиброзного кольца митрального с эмболией голов-
ного мозга с высоким RR до 5,0 [33].
Исследования показали, что кальцификация фи-
брозного кольца митрального клапана является не-
зависимым фактором риска инсульта у пациентов с
фибрилляцией предсердий, как и у тех, кто имеет
синусовый ритм [36]. В Strong Heart Study кальци-
фикация фиброзного кольца митрального клапана,
а не склероз аортального клапана, оказалась мощ-
ным фактором риска для возникновения инсульта
[37]. Это привело ряд авторов к необходимости ре-
комендовать профилактику антикоагулянтами у
пациентов с кальцификацией фиброзного кольца
митрального клапана независимо от характера сер-
дечного ритма [38]. Однако связь кальцификации
фиброзного кольца митрального клапана с инсуль-
том была найдена не во всех исследованиях [39].
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Нарушение морфологии клапана, гемодинамики и
эндотелия были определены, как факторы, предрас-
полагающие к развитию инфекции (инфекционно-
го эндокардита). В частности, особенно высокому
риску подвержены пациенты с кальцификацией
фиброзного кольца митрального клапана и хрони-
ческой почечной недостаточностью [40]. Лечение
пациентов антибиотиками также может быть менее
эффективным, т.к. бессосудистый характер фи-
брозного кольца митрального клапана предраспо-
лагает к появлению периануллярных абсцессов и,
поэтому иногда прибегают к антибиотикопрофи-
лактике у пациентов с кальцификацией фиброзно-
го кольца митрального клапана, которые подверга-
ются инвазивным процедурам. Тем не менее в по-
следнем руководстве American Heart Association не
рекомендуется профилактика при приобретенных
пороках митрального и аортального клапанов [41].
КАЛЬЦИФИКАЦИЯ ФИБРОЗНОГО КОЛЬЦА
МИТРАЛЬНОГО КЛАПАНА И ПОЧЕЧНАЯ ДИСФУНКЦИЯ
Существует повышенный интерес к изучению свя-
зей между болезнями кальцифицирования клапа-
нов сердца и почечной дисфункцией. Данные ис-
следований Cardiovascular Health Study [42] и Fram-
ingham Offspring study [43] показали связь между
хроническим заболеванием почек и кальцификаци-
ей фиброзного кольца митрального клапана, но не
со склерозом аортального клапана. С другой сто-
роны, данные, полученные в Multi-Ethnic Study of
Atherosclerosis показали, связь между нарушенной
функцией почек и кальцификацией фиброзного
кольца митрального клапана только у диабетиков и
не выявили тесной связи между нарушением почеч-
ной функции и кальцификацией фиброзного коль-
ца аортального клапана [44]. Причины этих разли-
чий до сих пор непонятны. Другое исследование
пациентов на диализе показало, что только кальци-
фикация фиброзного кольца митрального клапана,
но не аортальный склероз, по данным ЭхоКГ, ассо-
циировалась с повышенной смертностью после
корректировки для множества факторов риска и на-
личия атеросклероза [45]. ЭхоКГ рекомендована в
качестве инструмента выявления кальцификации
клапанов при стратификации риска руководством
Kidney Disease: Improving Global Outcomes Guide-
lines for Patients with Chronic Kidney Disease Stages 3
to 5 [46].
СКЛЕРОЗ АОРТАЛЬНОГО КЛАПАНА, КАЛЬЦИФИКАЦИЯ
ФИБРОЗНОГО КОЛЬЦА МИТРАЛЬНОГО КЛАПАНА
И СЕРДЕЧНОСОСУДИСТЫЕ ИСХОДЫ
В ряде исследований найдена сильная связь между
кальцификацией фиброзного кольца митрального
клапана и склерозом аортального клапана с небла-
гоприятными сердечно-сосудистыми исходами и
смертностью. Otto и соавт. [47] обнаружили, что у
5621 мужчины и женщины в возрасте 65 лет и
которые вошли в Cardiovascular Health Study, аор-
тальный склероз (без гемодинамически значимой
обструкции выходного тракта) ассоциировался с
почти 50% повышением риска смерти от сердечно-
сосудистых причин и 40% повышением риска ин-
фаркта миокарда. В другом исследовании 2358 по-
жилых пациентов у тех, кто имел склероз аорталь-
ного клапана, риск развития нового кардиального
события был в 1,8 раза выше, чем без него [48]. Дан-
ные исследования Otto, что возраст, мужской пол,
курение, гипертензия и гиперлипидемия ассоции-
рованы с аортальным склерозом, подтверждают
концепцию общего патогенеза кальцификации фи-
ch39_условно.indd 1015
03.04.2019 12:15:26
1016 ЧАСТЬ VII Сосудистые и системные заболевания
брозного кольца аортального клапана и атероскле-
роза сосудов. Больше всего наличие аортального
склероза прогнозирует сердечно-сосудистые и ко-
ронарные события независимо от традиционных
факторов риска или воспалительных биомаркеров,
и, хотя корректировка для кальция в коронарных
артериях уменьшает риск событий, аортальный сте-
ноз остается предиктором, несмотря на полную
коррекцию [49].
Данные Multi-Ethnic Study of Atherosclerosis так-
же связывают кальцификацию фиброзного кольца
митрального клапана с факторами атеросклероза
сосудов и женским полом [31]. В исследовании
Northern Manhattan Study, 1655 лиц в возрасте стар-
ше 40 лет (в среднем 68 лет) без инфаркта миокар-
да или инсульта в анамнезе находились под наблю-
дением в среднем приблизительно 7 лет. Распро-
страненность кальцификации фиброзного кольца
митрального клапана составила 27% и после кор-
ректировки для традиционных сердечно-сосуди-
стых факторов риска было обнаружено, что кальци-
фикация фиброзного кольца митрального клапана
является значимым и независимым предиктором
инфаркта миокарда и сердечной смерти (но не ише-
мического инсульта). Увеличение риска напрямую
связано с тяжестью кальцификации [50].
Используя данные Cardiovascular Health Study,
E. Barasch с соавт. [51] оценили распространенность
и клинические исходы при кальцификации фи-
брозного кольца митрального клапана, склерозе
аортального клапана и кальцификации фиброзного
кольца аортального клапана. Проанализировали
3929 пациентов со средним возрастом 76 лет, 60%
из которых были женского пола. В этом исследова-
нии кальцификация фиброзного кольца митраль-
ного клапана наблюдалась у 42% пациентов, каль-
цификация фиброзного кольца аортального клапа-
на у 44%, склероз аортального клапана у 54%.
Частота наличия всех трех состояний у одного па-
циента была 17%. Лица с этими состояниями име-
ли тенденцию к старшему возрасту, а при кальци-
фикации фиброзного кольца митрального клапана
имели худшие профили риска (например, гипер-
трофию/массу ЛЖ, размеры ЛП, снижение фрак-
ции выброса, утолщение интима-медиа сонных ар-
терий, дислипидемия, повышение С-реактивного
белка), чем те, кто имел склероз аортального клапа-
на и кальцификацию фиброзного кольца аорталь-
ного клапана. К тому же, это исследование показа-
ло, что тяжесть кальцификации фиброзного кольца
митрального клапана (определенная полуколиче-
ственно при 2D-ЭхоКГ) была связана с высокой рас-
пространенностью атеросклероза сосудов независи-
мо от остальных факторов риска. Эти состояния ас-
социировались со значимым повышением риска
сердечно-сосудистых конечных точек, и сильней-
шая связь была в комбинированной группе (каль-
цификация фиброзного кольца митрального клапа-
на, кальцификация фиброзного кольца митрально-
го клапана и склероз аортального клапана) с
сердечной недостаточностью (OR 2,04, 95% до-
верительный интервал 1,34–3,09) (рис. 39 .11, 39.12,
табл. 39 .7).
Суммарные данные по клиническим исходам,
связанным с аортальным склерозом и кальцифика-
Рис. 39 .12 Динамика кальцификации клапанов с возрастом. Распреде-
ление кальцификации фиброзного кольца митрального клапана (КМК), каль-
цификации фиброзного кольца аортального клапана (КАК) и склероза аорталь-
ного клапана (САК) в трех возрастных группах 3929 участников исследования
Cardiovascular Health Study. КМК: р < 0,001; КАК: р < 0,001; САК: р = 0 ,055 [Bar-
asch E, Gottdiener JS, Larsen EKM, et al. Clinical significance of calcification of the
fibrous skeleton of the heart and aortosclerosis in community dwelling elderly. The
Cardiovascular Health Study [CHS]. Am Heart J 151:39–47, 2006].
50
70
60
20
40
30
10
0
85+
<74
75–84
Р
а
с
п
р
о
с
т
р
а
н
е
н
н
о
с
т
ь
(
%
)
Возраст (годы)
КМК
КАК
САК
Рис. 39 .11 Отложения кальция в митральном и аортальном клапанах
у пожилых. Связь между кальцификацией фиброзного кольца митрального
клапана (КМК), кальцификацией фиброзного кольца аортального клапана
(КАК) и склерозом аортального клапана (САК) у 3929 участников Cardiovascu-
lar Health Study. Цифры — общее количество пациентов, проценты— процент
от всей популяции участников исследования [Barasch E, Gottdiener JS, Larsen
EKM, et al. Clinical significance of calcification of the fibrous skeleton of the heart
and aortosclerosis in community dwelling elderly. The Cardiovascular Health Study
[CHS]. Am Heart J 151:39–47, 2006].
1640
42%
999
25%
1004
27%
662
17%
1710
44%
2114
54%
1057
26%
КМК
КАК
САК
ch39_условно.indd 1016
03.04.2019 12:15:26
1017
39 Признаки старения, определяемые при эхокардиографии
цией фиброзного кольца митрального клапана
представлены в табл. 39 .8, 39.9 .
Хотя нет точного подтверждения, большое коли-
чество исследований позволяют предположить
сильную связь между кальцификацией фиброзного
скелета сердца и полулуний аортального клапана и
развитием атеросклероза [52]. Воспаление и нару-
шения липидного метаболизма вместе участвуют в
развитии атеросклероза и кальцификации фиброз-
ного кольца аортального клапана [53]. Однако дру-
гие данные не подтвердили связь воспалительных
маркеров с кальцифицированием аортального кла-
пана [54].
ГИПЕРТРОФИЯ И МАССА ЛЕВОГО ЖЕЛУДОЧКА
Результаты как Framingham Study, так и Cardiovas-
cular Health Study подтвердили, что гипертрофия
ЛЖ является потенциальным предиктором заболе-
ваемости ишемической болезнью сердца и смертно-
сти от нее, сердечной недостаточности и инсульта
[39].
Связь между возрастом и гипертрофией ЛЖ яв-
ляется весьма сложной. Оценка данных Framingham
Heart Study выявила, что возраст, рост, систоличе-
ское давление крови и индекс массы тела являются
значимыми и независимыми предикторами массы
ЛЖ у 4 972 людей в возрасте от 17 до 90 лет. Одна-
ко возраст в дальнейшем не являлся значимым кор-
релятом массы ЛЖ, если пациенты отбирались в хо-
де скрининга из анализа, при наличии у них следу-
ющих состояний: сердечно-сосудистые заболевания
в анамнезе, физикальный осмотр, электрокардио-
грамма, рентгеновское исследование грудной клет-
ки или ЭхоКГ; давление крови выше или равное
140/90; прием лекарств против сердечно-легочных
заболеваний; или превышение или снижение по
крайней мере на 20% от рекомендуемого веса по от-
ношению к росту [55]. Таким образом, похоже, что
повышение массы ЛЖ, наблюдаемое с возрастом
часто связано с сопутствующим сердечно-легоч-
ным заболеванием.
В седьмом отчете Joint National Committee on Pre-
vention, Detection, Evaluation and Treatment of High
Blood Pressure (JNC 7) выявление гипертрофии ЛЖ
у пациентов с артериальной гипертензией рассма-
тривается, как очевидное повреждение органа-ми-
шени и требует назначения агрессивной терапии
для регуляции давления крови [56].
В JNC 8 этот вопрос не рассматривался [57], но в
2011 г. Экспертный согласительный документ по
артериальной гипертензии у пожилых American
College of Cardiology Foundation/American Heart As-
sociation 2011 (Expert Consensus Document on Hyper-
tension in the Elderly statement) указывает на то, что
ЭхоКГ может быть полезна (в большей степени, чем
ЭКГ) для оценки ГЛЖ, что выявляет повышенный
риск сердечно-сосудистых событий, названных вы-
ше, включая внезапную смерть, а также на то, что
уменьшение ГЛЖ ассоциируется со снижением этих
рисков [58].
БАЗАЛЬНАЯ ГИПЕРТРОФИЯ МЕЖЖЕЛУДОЧКОВОЙ
ПЕРЕГОРОДКИ У ПОЖИЛЫХ
Хотя базальная гипертрофия МЖП является типич-
ной для гипертрофической кардиомиопатии, она
также наблюдается у пожилых гипертензивных па-
Уровень
кальцификации
OR (95% ДИ)
Инфаркт
миокарда
Инсульт
Стенокардия
Хроническая сердечная
недостаточность
Реваскуляризация
Кальцификация
фиброзного кольца
митрального клапана
1,70 (1,38–2,09) 1,84 (1,40–2,41) 1,29 (1,11–1,51) 1,69 (1,31–2,17)
1,50 (1,18–1,91)
Кальцификация
фиброзного кольца
аортального клапана
1,17 (0,95–1,54) 1,13 (0,86–1,48) 1,21 (1,03–1,42) 1,75 (1,34–2,27)
1,33 (1,04–1,71)
Склероз фиброзного
клапана аортального
клапана
1,27 (1,03–1,57) 1,16 (0,88–1,53) 1,24 (1,06–1,45) 1,02 (0,79–1,31)
1,07 (0,84–1,37)
КМК+КАК+САК
1,86 (1,32–2,62) 1,95 (1,26–3,03) 1,60 (1,24–2,07) 2,04 (1,34–3,09)
1,85 (1,21–2,84)
* Исследование Cardiovascular Health Study, включающее 3929 участников.
ДИ — доверительный интервал; КАК — кальцификация фиброзного кольца аортального клапана; КМК — кальцификация фиброзного
кольца митрального клапана; САК — склероз аортального клапана.
[Barasch E, Gottdiener JS, Larsen EKM, et al. Clinical significance of calcification of the fibrous skeleton of the heart and aortosclerosis in commu-
nity dwelling elderly. The Cardiovascular Health Study (CHS). Am Heart J 151:39–47, 2006. Воспроизведено с разрешения.]
ТАБЛИЦА 39.7 Отношение шансов (95% ДИ) для ассоциации кальцификации клапана с основными конечными
сердечно-сосудистыми точками, скорректированными по возрасту, полу и расовой принадлежности*
ch39_условно.indd 1017
03.04.2019 12:15:26
1018 ЧАСТЬ VII Сосудистые и системные заболевания
Первый автор,
год, страна
Дизайн
исследования
Пол
Случаи/
сравнения
Поражения
клапанов
Исход
RR (95% ДИ)
Otto, 1999, США
[47]
Популяционное
МЖ
1610/3919
САК
Смертность от
всех причин
СС смертность
1,35 (1,12–1,61)
1,52 (1,12–2,05)
Aronow, 1999,
США [48]
Когортное
МЖ
− /1980
САК
ИБС
1,76 (1,52, 2,03)
Hsu, 2005,
Тайвань [91]
Кросс-секционное МЖ
295/335
САК
ИБС
3,18 (1,52, 6,70)
Kizer, 2005, США
[37]
Когортное
МЖ
86/2723
САК
Инсульт
1,15 (0,45, 2,49)
Taylor, 2005, США
[92]
Когортное
МЖ
− /2279
САК
ИБС
3,82 (1,83, 7,97)
Al-Absi, 2006,
США [93]
Когортное
M
− /60
САК
Смертность от
всех причин
0,97 (0,22, 4,29)
Barasch, 2006,
США [51]
Когортное
МЖ
−/2923
САК
Смертность от
всех причин
1,23 (1,01, 1,50)
СС смертность
1,45 (1,04, 2,02)
Инсульт
1,09 (0,81, 1,46)
Инфаркт
миокарда
1,13 (0,83, 1,54)
da Rosa, 2007,
Бразилия [94]
Когортное
МЖ
−/8585
САК
Смертность от
всех причин
1,04 (0,78, 1,38)
СС смертность
1,38 (0,85, 2,24)
Shah, 2007, США
[95]
Когортное
МЖ
−/814
САК
Смертность от
всех причин
1,20 (0,70, 1,90)
Инфаркт
миокарда
2,40 (1,30, 4,80)
ИБС
1,20 (0,40, 3,90)
Blaha, 2010, США
[96]
Когортное
МЖ
−/8401
КАК
Смертность от
всех причин
1,66 (1,01, 2,72)
Chen, 2011, Китай
[97]
Кросс-секционное МЖ
−/221
КАК
ИБС
2,13 (1,30, 2,96)
Пациенты без
диабета
−/104
3,76 (2,56, 4,95)
Пациенты с
диабетом
Raggi, 2011, США
[45]
Когортное
МЖ
59/144
КАК
Смертность от
всех причин
1,52 (0,89, 2,59)
Owens, 2012, США
[49]
Когортное
МЖ
−/6685
КАК
СС смертность
2,51 (1,22, 5,21)
Инсульт
1,38 (0,84, 2,27)
Инфаркт
миокарда
1,11 (0,73, 1,68)
Valentijn, 2012,
Нидерланды
[98]
Когортное
МЖ
−/1172
САК
Смертность от
всех причин
0,90 (0,70, 1,20)
ИБС — ишемическая болезнь сердца; КАК — кальцификация аортального клапана; САК — склероз аортального клапана; СС — сердеч-
но-сосудистое.
[Pradelli D, Faden G, Mureddu G, et al. Impact of aortic or mitral valve sclerosis and calcification on cardiovascular events and mortality: A meta-anal-
ysis. Int J Card 170:e51–e55, 2013.]
ТАБЛИЦА 39.8 Характеристики исследований, оценивающих связь между склерозом
аортального клапана/кальцификацией аортального клапана и исходом
ch39_условно.indd 1018
03.04.2019 12:15:26
1019
39 Признаки старения, определяемые при эхокардиографии
Первый автор, год, страна Пол
Случаи/
сравнения
Поражение
клапанов
Исход
RR (95% ДИ)
Benjamin, 1992, США [99]
МЖ
−/1159
КМК
Инсульт
1,91 (1,12, 3,25)
Fox, 2003, США [43]
МЖ
621/1197
КМК
Смертность от всех
причин
1,30 (1,03, 1,60)
213/1197
СС смертность
1,50 (1,10, 2,20)
138/1197
Инфаркт миокарда
1,40 (0,80, 2.20)
Kizer, 2005, США [37]
МЖ
86/2723
КМК
Инсульт
1,89 (1,04, 3,41)
Al-Absi, 2006, США [93]
M
−/60
КМК
Смертность от всех
причин
0,85 (0,30, 2,41)
Barasch, 2006, США [51]
МЖ
−/2408
КМК
Смертность от всех
причин
1,33 (1,09, 1,63)
СС смертность
1,79 (1,28, 2,50)
Инсульт
1,13 (0,83, 1,53)
Инфаркт миокарда
1.27 (0,93, 1,75)
Willens, 2006, США [100]
M
−/134
КМК
Смертность от всех
причин
3,98 (1,68, 9,40)
Kohsaka, 2008, США [50]
МЖ
−/1955
КМК
СС смертность
1,53 (1,09, 2,15)
Инсульт
1,34 (0,87, 2,05)
Инфаркт миокарда
1,75 (1,13, 2,69)
Zhang, 2010, Франция [101] МЖ
−/331
КМК
Смертность от всех
причин
1,61 (1,02, 2,54)
Potpara, 2011, Сербия [102] МЖ
73/1056
КМК
Смертность от всех
причин
4,30 (1,80, 10,00)
51/1056
СС смертность
3,50 (1,20, 10,40)
53/1056
Инсульт
3,70 (1,30, 10,30)
25/1056
Инфаркт миокарда
2,20 (0,30, 16,50)
Raggi, 2011, США [45]
МЖ
59/144
КМКл
Смертность от всех
причин
1,73 (1,03, 2,91)
Holtz, 2012, США [103]
МЖ
408/1020
КМК
Смертность от всех
причин
1,30 (0,98, 1,74)
118/1020
Инфаркт миокарда
1,32 (0,81, 2,14)
КМК — кальцификация фиброзного кольца митрального клапана; КМКл — кальцификация митрального клапана; СС — сердечно-сосу-
дистые.
[Pradelli D, Faden G, Mureddu G, et al. Impact of aortic or mitral valve sclerosis and calcification on cardiovascular events and mortality: a meta-anal-
ysis. Int J Card 170:e51–e55, 2013.]
ТАБЛИЦА 39.9 Характеристики когортных исследований, оценивающих связь кальцификации
фиброзного кольца митрального клапана и исходов
циентов, у которых это состояние также называют
изолированным утолщением верхней части межже-
лудочковой перегородки (ИУВЧМП), сигмовидной пе-
регородкой или валиком верхней части межжелудоч-
ковой перегородки (рис. 39 .13). Распространенность
ИУВЧМП достигает величины 10%. Помимо повы-
шения толщины часто наблюдается увеличение уг-
ла между аортой и продольной осью ЛЖ. Это состо-
яние исследовали в Framingham Study. В соответ-
ствии с его определением необходимо выявить
следующие критерии: верхний валик МЖП при ви-
зуальной оценке, толщина верхней части перего-
родки по крайней мере 1,4 см, толщина верхней и
средней части перегородки по крайней мере 1,3 см
и отсутствие нарушения сократимости миокарда
или рубца в средней части перегородки (который
может привести к разнице в толщине). В этом ис-
следовании заболевание было найдено у 52 из 3562
участников (1,5%) и положительные корреляцион-
ные связи были с повышением возраста, артериаль-
ной гипертензией, фракцией укорочения ЛЖ и
кальцификацией фиброзного кольца митрального
клапана, но обратная корреляция — с диастоличе-
ским размером ЛЖ. Отмечено значительное превы-
шение распространенности у тех, чей возраст был
> 85 лет (17,8%). После корректировки для факто-
ров риска, > 15 лет наблюдения, заболевание не ас-
социировалось с сердечно-сосудистыми событиями
или смертностью [59]. Было предположено, что
ИУВЧМП может развиваться вследствие повышен-
ных условий нагрузки, в результате чего возникает
больший стимул к гипертрофии в базальной части
ch39_условно.indd 1019
03.04.2019 12:15:26
1020 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 39 .13 A Изолированное утолщение верхней части межжелудоч-
ковой перегородки. Так называемый верхний валик перегородки, или сиг-
мовидная перегородка, изолированное утолщение верхней части межжелудоч-
ковой перегородки часто встречается у пожилых пациентов с гипертензией.
Цветные линии указывают на локализованную гипертрофию верхней части пе-
регородки. Ao — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие;
ПЖ — правый желудочек.
ПЖ
ЛЖ
ЛП
Ао
Рис. 39 .14 Размеры левого предсердия как предиктор сердечно-со -
судистых событий. Частота сердечно-сосудистых событий в сопоставлении
с размером ЛП в Strong Heart Study 2 084 лиц среднего и пожилого возраста.
Скорректированные кривые выживаемости Kaplan-Meier указывают на первое
сердечно-сосудистое событие в зависимости от наличия или отсутствия уве-
личения ЛП [Kizer JR, Bella JN, Palmieri V, et al. LA diameter as an independent
predictor of first clinical cardiovascular events in middle-aged and elderly adults:
the Strong Heart Study [SHS]. Am Heart J 151:412–418, 2006].
0,25
0,20
0,15
0,10
0,05
0,00
02468
Скорректированный HR = 1,57; р = 0,002
Ч
а
с
т
о
т
а
с
е
р
д
е
ч
н
о
-
с
о
с
у
д
и
с
т
ы
х
с
о
б
ы
т
и
й
Длительность наблюдения (годы)
Увеличенный размер ЛП
Нормальный размер ЛП
ЛЖ из-за больших радиусов продольных волокон в
базальной части перегородки (закон Лапласа), пото-
му что в основании развивается большее давление,
за счет раннего сокращения дистальных сегментов
ЛЖ и за счет форсированного сокращения ПЖ. Од-
нако остается неясным, почему у некоторых паци-
ентов с артериальной гипертензией развивается
только концентрическая гипертрофия, в то время
как у других — преимущественно утолщение пере-
городки. Было бы резонно указывать как утолще-
ние средней части, так и валика МЖП у пациентов
с ее гипертрофией [60]. Клинические находки могут
сигнализировать об артериальной гипертензии у
пациентов, которые не имеют этого диагноза. Хотя
могут быть генетические факторы, которые лежат в
основе заболевания, его следует дифференцировать
от генетической гипертрофической кардиомиопа-
тии. В дополнение к факторам, которые типичны
для гипертрофической кардиомиопатии, таким как
парадоксальное систолическое движение передней
створки митрального клапана, градиент выходного
тракта ЛЖ и митральная регургитация, было пред-
ложено, что скорость в раннюю диастолу по ткане-
вой допплерографии (e′) и отношение допплеров-
ской скорости раннего митрального притока (E) к
скорости e′ могут использоваться для того, чтобы
различить ИУВЧМП и гипертрофическую кардио-
миопатию. В этом исследовании скорость e′ была
выше у пациентов с ИУВЧМП по сравнению с ги-
пертрофической кардиомиопатией (7,1 ± 1,7 см/сек
против 5,4 ± 1,3 см/сек), а отношение E/e′ составля-
ло по крайней мере 13, дифференцируя пациентов
с гипертрофической кардиомиопатией (высокие от-
ношения) от ИУВЧМП с чувствительностью 78% и
специфичностью 90% [61].
РАЗМЕРЫ ЛЕВОГО ПРЕДСЕРДИЯ И ИСХОДЫ
Было отмечено, что увеличение размеров ЛП явля-
ется маркером сердечно-сосудистого риска. В значи-
тельной степени на основании данных исследова-
ний возрастных популяций увеличенное ЛП ассо-
циируется с повышенным риском фибрилляции
предсердий, инсульта и смерти (включая пациентов
с инфарктом миокарда, с митральной регургитаци-
ей, артериальной гипертензией и дилатационной
кардиомиопатией) [62]. Используя данные Strong
Heart Study, Kizer и соавт. [63] показали, что разме-
рыЛП(внорме<3,8смдляженщин,<4,2смдля
мужчин) является независимым предиктором воз-
никновения кардиальных событий после корректи-
ровки для других факторов (клинических, эхокар-
диографических, воспалительных) (рис. 39 .14, табл.
39.10). Как уже отмечалось, объем ЛП стал надеж-
ным показателем сердечно-сосудистого риска. Па-
циентам с митральным стенозом, имеющим си-
нусовый ритм, с тромбом в ЛП или эмболией в
анамнезе будет эффективным назначение антикоа-
гулянтов. Для пациентов без эмболии в анамнезе
или наличия тромба руководствами European Soci-
ety of Cardiology 2012 г. и American College of Cardi-
ology/American Heart Association 2007 г. предложено
то, что применение антикоагулянтов может быть
рассмотрено при увеличении ЛП или густом спон-
ch39_условно.indd 1020
03.04.2019 12:15:27
1021
39 Признаки старения, определяемые при эхокардиографии
танном эхоконтрастировании при ЭхоКГ, хотя и с
низким уровнем доказательности [41, 64]. Рекомен-
дации по клапанной патологии 2014 г. American
College of Cardiology/American Heart Association счи-
тают эту ситуацию спорной [65]. Прослежена взаи-
мосвязь между увеличением ЛП и тромбоэмболи-
ей. Keenan и соавт. [66] сравнили измерения объема
и размеров у пациентов с митральным стенозом и
показали, что объем ЛП в большей степени корре-
лирует с эхокардиографическими показателями ри-
ска тромбоэмболии (максимальная скорость опо-
рожнения ушка ЛП, плотность спонтанного кон-
трастирования ЛП при ЧПЭхоКГ) по сравнению с
размерами ЛП у пациентов с митральным стенозом
(рис. 39 .15). Эти данные можно подтвердить, ис-
пользуя объемные измерения вместо линейных.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Инверсия раннего и позднего систолического на-
полнения с возрастом ведет к сохранению конечно-
диастолического объема и ударного объема (и, как
следствие, сердечного выброса), но снижение эла-
стичности ЛЖ может вызывать повышение конеч-
но-диастолического давления в ЛЖ у пожилых,
особенно при тахикардии (см. главу 9). Это, как
ожидается, может легко провоцировать одышку и
предположительно формировать основу для разви-
тия сердечной недостаточности у некоторых паци-
ентов.
Синдром сердечной недостаточности у пожилых
встречается часто и нарастает с возрастом, как у
мужчин, так и у женщин. Данные National Health
and Nutrition Examination Survey продемонстриро-
вали увеличение распространенности на 1,5 и 1,2%
у мужчин и у женщин, соответственно, в возраст-
ной группе 40–59 лет и на 10,6 и 13,5% в возрасте 80
лет и старше (рис. 39.16) [67]. Сердечная недоста-
точность с нормальной или почти нормальной си-
столической функцией также преобладает у пожи-
лых. Многочисленные популяционные исследова-
ния показали, что 50% и пожилых пациентов с
сердечной недостаточностью имеют нормальную
или почти нормальную систолическую функцию.
Эти исследования также продемонстрировали, что
сердечная недостаточность с сохраненной систоли-
ческой функцией (СНсФВ) распространена у жен-
щин, нежели у мужчин [68]. Поскольку число жен-
щин превосходит мужчин в группах старшего воз-
раста, проблема еще распространена с повышением
возраста.
Клинический исход
Увеличенное ЛП
(n = 461)
Нормальное ЛП
(n = 2343)
p
n
%
n
%
Первое сердечно-сосудистое событие
86
18,7
282
12,0
< 0,001
Фатальная или нефатальная ИБС†
52
11,2
169
7,2
0,003
Фатальный или нефатальный инсульт
15
3,3
51
2,2
0,186
Фатальная или нефатальная ХСН
19
4,1
62
2,6
0,084
Любая смерть от сердечно-сосудистых заболеваний
23
5,0
67
2,9
0,018
* Данные, полученные у 2084 среднего возраста и пожилых участников исследования Strong Heart Study.
† Включая фатальные и нефатальные инфаркты миокарда, внезапную смерть от сердечно-сосудистых заболеваний и другие фатальные и
нефатальные коронарные заболевания.
ИБС — ишемическая болезнь сердца; ХСН — хроническая сердечная недостаточность.
[Kizer JR, Bella JN, Palmieri V, et al. Left atrial diameter as an independent predictor of first clinical cardiovascular events in middle-aged and elderly
adults: the Strong Heart Study (SHS). Am Heart J 151:412–418, 2006.]
ТАБЛИЦА 39.10 Кумулятивные сердечно-сосудистые конечные точки относительно увеличения левого предсердия*
Рис. 39 .15 Влияние размеров левого предсердия на риск тромбоэм-
болии. ROC-кривые измерений левого предсердия (ЛП) (размер ЛП, размер
ЛП, индексированный к ППТ, объем ЛП и объем ЛП, индексированный к ППТ)
в диагностике высокого риска тромбоэмболии (скорость опорожнения придат-
ка ЛП < 25 см/сек и/или густое спонтанное эхоконтрастирование). ППТ — пло-
щадь поверхности тела [Keenan NG, Cueff C, Cimadevilla C, et al. Usefulness of
left atrial volume versus diameter to assess thromboembolic risk in mitral stenosis.
Am J Cardiol 106:1152–1156, 2010. Copyright © 2010, Elsevier].
0,00
0,00
0,20
0,40
100% Специфичность
Объем ЛП/ППТ (мл/м2)
Объем ЛП (мл)
Размер ЛП/ППТ (мл/м2)
Размер ЛП (мм)
0,60
0,80
1,00
0,10
0,20
0,30
0,40
0,50
0,60
Ч
у
в
с
т
в
и
т
е
л
ь
н
о
с
т
ь
0,70
0,80
0,90
1,00
ch39_условно.indd 1021
03.04.2019 12:15:27
1022 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 39 .16 Увеличение распространенности сердечной недостаточности с возрастом. Распространенность сердечной недостаточности в зависимости
от пола и возраста (National Health and Nutrition Examination Survey: 2009–2012). Источник: National Center for Health Statistics and National Heart, Lung and Blood
Institute [Mozaffarian D, Benjamin EJ, Go AS, et al.; on behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee: Heart disease
and stroke statistics — 2015 update: a report from the American Heart Association. Circulation 2015;131:e29–e322].
Мужчины Женщины
Возраст (годы)
П
р
о
ц
е
н
т
о
т
п
о
п
у
л
я
ц
и
и
0
2
4
6
8
10
12
14
16
20-39
40-59
0,2 0,6
1,5 1,2
6,6
4,8
10,6
13,5
60-79
80+
Диастолическая дисфункция
Артериальная гипертензия
Рестриктивная кардиомиопатия
Инфильтративная кардиомиопатия
Гипертрофическая кардиомиопатия
Некомпактная кардиомиопатия
Сердечная недостаточность правых отделов
Тяжелая легочная гипертензия
Инфаркт ПЖ
Аритмогенная дисплазия правого желудочка
Дефект межпредсердной перегородки
Пороки клапанов
Критический стеноз клапана
Выраженная клапанная регургитация
Поражение перикарда
Тампонада сердца
Констриктивный перикардит
Объем в полости сердца
Миксома предсердия
Эозинофильный тромб в предсердии
Стеноз легочной вены
Врожденные заболевания сердца
[Oh JK, Hatle L, Tajik AJ, et al. Diastolic heart failure can be diagnosed
by comprehensive two-dimensional and Doppler echocardiography. J
Am Coll Cardiol 47:500–506, 2006.]
ТАБЛИЦА 39.11
Избранные причины сердечной
недостаточности с сохраненной фракцией
выброса
Существуют несколько причин хронической
сердечной недостаточности при сохраненной систо-
лической функции, отдельные перечислены в табл.
39.11 . Оценка пациентов с сердечной недостаточно-
стью с помощью ЭхоКГ поможет выявить причину
хронической сердечной недостаточности и, тем са-
мым, привести к точной оценке и лечению заболе-
вания. Важно выяснить, насколько распространена
сердечная недостаточность у пожилых и что выжи-
ваемость пациентов с СНсФВ также не снижена (хо-
тя в некоторых исследованиях процент сердечной
недостаточности со сниженной фракцией выброса
иной) [69]. Более того, было показано, что пациен-
ты без синдрома сердечной недостаточности, но с
диастолической дисфункцией также имеют повы-
шенную смертность по сравнению с нормальной
диастолической функцией [70].
Текущий согласительный документ European So-
ciety of Cardiology [71] по диагностике сердечной
недостаточности с нормальной фракцией выброса
включает эхокардиографические измерения нару-
шений диастолической функции, также как поздняя
статья, в которой изложен диагностический подход
[71a] (рис. 39.17).
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА И СТРЕСС-ТЕСТЫ
Изменения, говорящие о диагнозе ишемической
болезни сердца у пожилых выявляются часто, по-
скольку возраст — это основной фактор риска ко-
ронарного заболевания. Могут наблюдаться нару-
шения сократимости миокарда, истончение стенок
и формирование аневризмы после перенесенного
инфаркта.
Стресс-ЭхоКГ (с физической или фармакологи-
ческой нагрузкой) — это методика, которая обычно
используется для оценки ишемической болезни
ch39_условно.indd 1022
03.04.2019 12:15:27
1023
39 Признаки старения, определяемые при эхокардиографии
сердца и иногда для оценки жизнеспособности ми-
окарда (см. главы 13, 14). Методики, используемые
у пожилых, такие же как и для пациентов молодого
возраста. Возрастные нормативы для целевой ЧСС
и времени физической нагрузки широко варьиру-
ют. Помимо этого, чаще используется тредмил, ко-
торый имеет щадящие повышения скорости и угла
наклона (например, модифицированный протокол
Bruce, протоколы Naughton и Balke). Вследствие то-
го, что многие пожилые пациенты имеют комор-
бидные заболевания, которые делают выполнение
физической нагрузки трудновыполнимым или не-
возможным (например, хроническая обструктив-
ная болезнь легких, ортопедическая/суставная пато-
логия, нейромышечные расстройства, поражение
периферических сосудов), использование фармако-
логической нагрузки увеличивает количество паци-
ентов, имеющих возможность проведения стресс-
теста в этой возрастной группе. В этой возрастной
популяции широко используются фармакологиче-
ские агенты, вазодилататоры, такие как аденозин,
дипиридамол, или катехоламины (добутамин).
Исследования у пожилых пациентов, относящи-
еся к стресс-тесту по клиническим показаниям и в
постинфарктной популяции, продемонстрировали
значение стресс-ЭхоКГ (с физической нагрузкой,
аденозином, дипиридамолом или добутамином) в
прогнозировании клинических исходов [72].
Имеются некоторые данные, которые позволяют
предполагать, что стресс-ЭхоКГ с добутамином
(ДСЭ) чувствительна и точна, но также специфич-
на, как и стресс-ЭхоКГ с аденозином (табл. 39 .12).
БЕЗОПАСНОСТЬ
Профиль безопасности этих различных типов
стресс-тестов у пожилых хороший. ЭхоКГ с физи-
ческой нагрузкой подобна стандартному стресс-
тесту с физической нагрузкой в плане безопасности,
хотя некоторая осторожность требуется при пере-
мещении пациентов с тредмила обратно для скани-
рования. В одном исследовании участвовало 454 па-
циента, половина из которых была в возрасте 70 лет
и половина моложе 70 лет, ДСЭ ассоциировалась
с высокой частотой бессимптомной гипотензии
Рис. 39 .17 Диагностика сердечной недостаточности с сохраненной фракцией выброса (СНсФВ). Поэтапный подход к диагностике СНсФВ у пожилых
амбулаторных пациентов с неоднозначными симптомами. Диастолическая функция оценивается с помощью средней скорости e′. Если скорость e′ не изменена,
классическая СНсФВ маловероятна. В случае снижения скорости e′ необходимо выявить наличие повышения давления наполнения ЛЖ. Давление наполнения
ЛЖ может быть определено по среднему отношению E/e′. Высокое отношение E/e′ подтверждает СНсФВ. Низкое отношение E/e′ недиагностично и в таких слу-
чаях необходимо использовать многофакторный подход. Иногда даже после полного спектра неинвазивных процедур диагноз по-прежнему остается сомнитель-
ным. В таких случаях рекомендуется использовать прямой метод определения давления наполнения ЛЖ при катетеризации сердца. Однако необходимо помнить,
что у некоторых пациентов давление в покое может быть нормальным. DT — время замедления; IVRT — время изоволюмического расслабления; NT-proBNP —
N-терминальный промозговой натрийуретический пептид; МР — митральная регургитация; СДЛА — систолическое давление в легочной артерии; Ст — стено-
кардия [Penicka M, Vanderheyden M, Bartunek J. Diagnosis of heart failure with preserved ejection fraction: role of clinical Doppler echocardiography Heart 100:68–76,
2014].
Диастолическая дисфункция?
Средняя е’ < 9 см/сек
Повышенное давление
наполнения ЛЖ?
Среднее E/e’ ≥ 13?
Повышенное давление наполнения ЛЖ?
• E/e’ при стресс-ЭхоКГ ≥ 13
• E/A>2,DTЕ<160мсек,IVRT<60мсек
• Индекс объема ЛП ≥ 34 мл/м2
• СДЛА>36ммрт.ст.
• NT-proBNP > 220 пг/мл
• Фибрилляция предсердий
Констриктивный перикардит
Динамическая МР
Хронотропная недостаточность
Одышка, как эквивалент
стенокардии
Некардиальная одышка
Катетеризация сердца
Симптомы в пользу СНсФВ при ФВ > 50%
СНсФВ
Этап 1
Этап 2
≥2+
Все «–»
СН нет
+/−
+
−
−
+
ch39_условно.indd 1023
03.04.2019 12:15:28
1024 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 39 .18 Стресс-эхокардиография с добутамином и ранним введе-
нием атропина. (A) Традиционный протокол инфузии при стресс-эхо-
кардиографии с добутамином (ДСЭ) и протокол стресс-эхокардиографии
(ЭхоКГ) с добутамином и ранним введением атропина при (Б) стресс-
эхокардиографии с добутамином и ранним введением атропина (РА-ДСЭ).
АД — артериальное давление; ЧСС — частота сердечных сокращений; ЭКГ —
12-канальная электрокардиография [Tsutsui JM, Osorio AF, Lario FA, et al. Com-
parison of safety and efficacy of the early injection of atropine during dobutamine
stress echocardiography with the conventional protocol. Am J Cardiol 94:1367–
1372, 2004. Copyright ©2009, Elsevier].
Исходно
2D-ЭхоКГ
ДСЭ
РА-ДСЭ
ЭКГ
ЧССиАД
2D-ЭхоКГ
ЭКГ
ЧССиАД
Добутамин
5
03691
21
5
Длительность теста:
15мин+1мин
на каждую дозу атропина
Длительность теста:
только время каждого
этапа введения добутамина
16171819
Время (мин)
Время (мин)
10
20
30
40
Атропин 0,25–1 мг
Атропин, с 0,25 до 2 мг, начиная с 20 мкг/кг/мин
при ЧСС < 100 уд/мин
40
Исходно
Добутамин
5
03691
21
5
10
20
30
40
А
Б
(определяемой по падению систолического давле-
ния крови > 20 мм рт. ст.) у пожилых по сравнению
с молодыми пациентами (37% против 12%). Также
отмечалось частая наджелудочковая тахикардия
(7% против 1%) и желудочковые экстрасистолы
(74% против 32%). Была невыраженная тенденция
к частым желудочковой тахикардии (5% против
2%) и фибрилляции предсердий (3% против 0,4%).
Авторы сообщали, что все аритмии купировались с
прекращением инфузии добутамина или при назна-
чении метопролола [73]. Новые протоколы, кото-
рые рекомендуют раннее введение атропина (когда
инфузия добутамина достигает 20 мкг/кг/мин, если
ЧСС ниже 100 уд/мин) при проведении ДСЭ, спо-
собствовали снижению минимальных побочных
эффектов при сходной диагностической точности,
включая возрастную популяцию (рис. 39 .18, табл.
39.13).
Дипиридамол и аденозин могут вызывать брон-
хоспазм, гипотензию и аритмию, и по большей ча-
сти эти эффекты не имеют возрастной зависимости
[74]. Однако у пожилых пациентов, проходящих
стресс-тест с аденозином, может возникать транзи-
торная атриовентрикулярная блокада. В одном ис-
следовании 120 пациентов не моложе 70 лет, это
случалось в 6% тестов [75]. В другом исследовании
это происходило у 18% пациентов не моложе 75 лет
против 8% у лиц моложе 75 лет [76].
Регаденосон — это новый агонист аденозин
A(2A)–специфичных рецепторов, который вслед-
ствие своей селективной природы не вызывает
бронхоспазма или атриовентрикулярную блокаду в
такой степени, как неспецифичные агенты (адено-
зин и дипиридамол) [77]. Он одобрен для проведе-
ния визуализации во время стресс-теста (однофо-
тонной эмиссионной компьютерной томографии)
перфузии миокарда с хорошим профилем перено-
симости и безопасности, включая также пожилых,
но его использование совместно с атропином для
Всего
Чувствительность
Специфичность
Точность
1КА
2КА
3КА
Добутамин
86,5% (77/89)
74% (14/19)
88% (22/25)
91% (41/45)
84% (26/31)
86% (103/120)
Аденозин
66,3% (59/89)
42% (8/19)
76% (19/25)
71% (32/45)
90% (28/31)
72,5% (87/120)
P
< 0,001
0,227
0,124
< 0,01
< 0,001
< 0,001
* Данные в скобках отражают количество пациентов. В это исследование было вовлечено 120 пациентов 70 лет или старше с болью в гру-
ди и с диагнозом или подозрением на ишемическую болезнь сердца, которым проводилась стресс-эхокардиография с добутамином и
аденозином, а также коронарная ангиография.
1КА — поражение одной коронарной артерии; 2КА — поражение двух коронарных артерий; 3КА — пора жение трех коронарных артерий.
[Anthopoulos LP, Bonou MS, Kardaras FG, et al. Stress echocardiography in elderly patients with coronary artery disease: applicability, safety and
prognostic value of dobutamine and adenosine echocardiography in elderly patients. J Am Coll Cardiol 28:52–59, 1996.]
ТАБЛИЦА 39.12 Чувствительность, специфичность и точность стресс-эхокардиографии с аденозином
и с добутамином при выявлении ишемической болезни сердца у пожилых*
ch39_условно.indd 1024
03.04.2019 12:15:28
1025
39 Признаки старения, определяемые при эхокардиографии
Диагностический параметр
ДАСЭ (n = 106)
РА-ДСЭ (n = 106)
p
Чувствительность
53/62, 86% (77–94)
57/68, 84% (75–93)
0,10
Специфичность
34/44, 78% (65–89)
34/38, 90% (79–99)
0,11
Положительная прогностическая значимость
53/63, 84% (75–93)
57/61, 93% (87–99)
0,09
Отрицательная прогностическая значимость
34/43, 79% (69–89)
34/45, 76% (65–86)
0,12
Точность
87/106, 82% (75–89)
91/106, 86% (79–92)
0,08
* Данные включают количество пациентов и процент (соответствующие 95% доверительные интервалы).
ДСЭ — стресс-эхокардиография с добутамином; РА-ДСЭ — стресс-эхокардиография с добутамином и ранним введением атропина.
[Tsutsui JM, Osorio AF, Lario FA, et al. Comparison of safety and efficacy of the early injection of atropine during dobutamine stress echocardiog-
raphy with the conventional protocol. Am J Cardiol 94:1367–1372, 2004.]
ТАБЛИЦА 39.13 Стресс-эхокардиография с добутамином: стандартное или раннее введение атропина
для выявления ишемической болезни сердца*
стресс-ЭхоКГ пока не дало стабильно успешных ре-
зультатов [78, 79]. Он может стать альтернативным
агентом для проведения стресс-ЭхоКГ у пациентов
с реактивными заболеваниями дыхательных путей
и противопоказаниями к использованию добута-
мина.
КАРДИОГЕННАЯ ТРОМБОЭМБОЛИЯ
Кардиальные источник эмболии считаются ответ-
ственными за развитие ишемических инсультов в
20% случаев (см. главу 40) [80]. Эмболизация ком-
понентами кальцификации фиброзного кольца ми-
трального клапана или фрагментами интрааорталь-
ных атеросклеротических поражений часто встре-
чаются у пожилых пациентов (см. рис. 39 .6, 39.10).
Аортальный склероз также ассоциируется с риском
развития инсульта, но независимая связь между
кальцификацией фиброзного кольца аортального
клапана и инфарктами мозга была продемонстри-
ровано только при наличии аортального стеноза
[81], хотя недавний мета-анализ выявил статистиче-
ски значимое 27% повышение риска инсульта при
аортальном склерозе [82]. Как уже говорилось ра-
нее, связь между кальцификацией фиброзного
кольца митрального клапана и инсультом сильнее
[37]. Точно так же, как и у молодых пациентов,
тромбы в ЛЖ (обычно вследствие систолической
дисфункции ЛЖ), тромбы в ЛП (обычно при фи-
брилляции и/или трепетании предсердий), вегета-
ции, парадоксальные эмболы (через незаращенное
овальное окно), миксома и другие опухоли являют-
ся потенциальными источниками эмболии. Фи-
брилляция и трепетание предсердий чаще встреча-
ются у пожилых, но встречаемость незаращенного
овального окна с возрастом снижается. Множество
исследований подтвердили высокую чувствитель-
ность ЧПЭхоКГ в выявлении потенциальных ис-
точников эмболии, также и в возрастной популя-
ции [83].
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ: ОБСУЖДЕНИЕ
У ЛИЦ ПОЖИЛОГО ВОЗРАСТА
ЧПЭхоКГ в целом безопасная методика, хотя воз-
можны осложнения, связанные с седацией или ме-
ханическим повреждением ротоглотки, пищевода
или желудка. Заявленная частота основных ослож-
нений в амбулаторной практике и внеоперативных
условиях независимо от возраста составляет от 0,2
до 0,5%, а смертность < 0,01% [84]. Методика также
показала себя достаточно безопасной у пожилых, но
вследствие коморбидной патологии может давать
больше осложнений. В одном из исследований тран-
зиторная системная гипотония встречалась у пожи-
лых чаще, чем у молодых пациентов (5% против
1,4%), что вероятно было связано с седацией [85]. В
большом одноцентровом исследовании из 10 000
последовательных процедур ЧПЭхоКГ у амбула-
торных пациентов, было зафиксировано всего три
случая перфорации (одна гипофарингеальная, две в
шейном отделе пищевода) и во всех трех это проис-
ходило в результате сложности введения датчика у
пациентов старше 75 лет [86]. Перфорации редки
при отсутствии ранее существовавшей патологии,
которая должна быть установлена перед процеду-
рой, как то предшествующие перфорации, стрикту-
ры пищевода (или резекция пищевода), располо-
женная рядом опухоль, синдром Меллори–Вейса,
недавние гастроинтестинальные хирургические
вмешательства или желудочно-кишечные кровоте-
чения [84].
АМИЛОИДОЗ СЕРДЦА
Амилоидная инфильтрация сердца у пациентов в
возрасте описывалась на протяжении десятилетий и
называлась по-разному старческий амилоидоз серд-
ца или амилоидоз, локализующийся в сердце (см.
главу 27). Однако точным термином, пожалуй, яв-
ляется системный старческий амилоидоз, поскольку
небольшие депозиты амилоида находят в аорте, лег-
ch39_условно.indd 1025
03.04.2019 12:15:28
1026 ЧАСТЬ VII Сосудистые и системные заболевания
ких, желудочно-кишечном тракте, печени и почках
[87]. В дополнение к системному старческому ами-
лоидозу амилоидная инфильтрация сердца случает-
ся при первичном амилоидозе, амилоидозе, связан-
ном с множественной миеломой и при вторичном
амилоидозе, ассоциированным с хроническим вос-
палением. Протеин, определяемый при старческом
амилоидозе отличается от того, который встречает-
ся при первичном амилоидозе, и предвещает на-
много лучший прогноз [88]. В одном аутопсийном
исследовании 244 пациентов старше 60 лет амилоид
был найден в сердце в 50% [89]. Хотя он редко вы-
зывает клинические симптомы и признаки, его ас-
социируют с фибрилляцией предсердий, желудоч-
ковыми аритмиями и сердечной недостаточностью
(особенно при большом объеме поражения) [90].
Исследования показали, что мужчины чаще страда-
ют первичным системным типом, но еще часто от
старческой формы [90]. В исследовании Smith и со-
авт. [90], где сравнивались пациенты со старческим
и первичным амилоидозом, отношение мужчин и
женщин равнялось 5,5 : 1 в группе старческого воз-
раста и 1,6 : 1 для первичного. Пациенты со старче-
ским амилоидозом были старше, средний возраст
составил 83 лет, в то время как лишь 4 из 21 паци-
ента с первичным амилоидозом были старше 70 лет.
Депозиты амилоида могут находиться в миокарде
желудочков и эндокардиальной стенке предсердий.
Менее частые места депозитов при старческом типе
включают клапаны, эпикард и вутримиокардиаль-
ные кровеносные сосуды. Эхокардиографические
признаки амилоидоза сердца включают повышен-
ную эхогенность миокарда «пятнистого» характера,
увеличенную толщину межпредсердной перегород-
ки и утолщение клапанов. Последние две характе-
ристики чаще встречаются при других состояниях.
Обнаружение гипертрофии ЛЖ по данным ЭхоКГ
одновременно с низким вольтажем на электрокар-
диограмме позволяет заподозрить инфильтратив-
ную кардиомиопатию.
Параметр ЭхоКГ
Наиболее частые
находки у пациентов
в возрасте
Клинические исходы
Обсуждение показателей ЭхоКГ
Толщина стенки
ЛЖ
Повышена
Повышенный риск заболеваемости и
смертности ишемической болезнью
сердца, сердечная недостаточность,
инсульт
Разграничение эффектов старения от
существующего СС заболевания (АГ,
АС) может представлять трудность
С учетом возрастных норм
Диаметр корня
аорты
Увеличен
Может стимулировать развитие
гипертрофии
Использование возраст- и ППТ-
скорректированных норм
Измерения с помощью компьютерной
томографии используются при
ТИАК все чаще
Размеры ЛП
Увеличен
Повышенный риск ФП, инсульта,
смерти, ИМ
Оценка объема ЛП, но нелинейно
Использование возраст- и ППТ-
скорректированных норм
Размер полости
ЛЖ
Снижен или без
изменений
Уменьшение размера полости может
наблюдаться у пациентов с СНсФВ,
гипертрофической кардиомиопатией
Эндокардиальная визуализация, трабе-
кулы могут усложнить измерения
Гипертрофия базальной части межже-
лудочковой перегородки по линей-
ным размерам может быть ложной
Размеры ПЖ
Уменьшаются
Увеличение размеров может быть
вследствие патологии левых отделов
сердца, легких
3D ЭхоКГ может давать меньший
объем по сравнению с магнитно-
резонансной томографией
Периметр кольца
клапана
Увеличивается
Увеличение, выраженное, чем типичное,
может свидетельствовать о патологии
Оценивается с учетом возрастных
норм
Толщина створок
клапана
Повышается
выраженные, чем типичные, изменения
могут относиться к патологии
Толстые створки могут усложнить
диагностику склероза, миксоматоз-
ных изменений, инфекции
Аортальный
клапан
Аортальный стеноз
Риск прогрессирования аортального
стеноза
Повышенный риск СС событий: ИМ,
внезапная смерть, инсульт, сердечная
недостаточность
Утолщение и кальцификация ограни-
чивают количественную оценку
Может затруднять обнаружение двух-
створчатого клапана
СВОДНАЯ ИНФОРМАЦИЯ
Признаки старения, определяемые при эхокардиографии
ch39_условно.indd 1026
03.04.2019 12:15:28
1027
39 Признаки старения, определяемые при эхокардиографии
Параметр ЭхоКГ
Наиболее частые
находки у пациентов
в возрасте
Клинические исходы
Обсуждение показателей ЭхоКГ
Митральный
клапан
Кальцификация
фиброзного кольца
митрального клапана
Может быть связано с дисфункцией
клапана (МР, МС)
Повышенный риск СС событий: ИМ,
смерть от СС заболеваний, инсульт,
сердечная недостаточность
Количественная оценка ограничена
В реальности могут быть нарушения
после пластики кольца или опухоли
(например, казеозная кальцификация
фиброзного кольца митрального
клапана)
Параметры диа-
столического
наполнения
E/A < 1,0
Риск СС событий, ФП, СНсФВ
Измерения при допплерографии
трансмитрального кровотока выпол-
няются на уровне концов створок
Нормы скоростей тканевой допплеро-
графии для латеральной части
фиброзного кольца выше по сравне-
нию с медиальной
Находки, обычно выявляемые у
пожилых, также предполагают кли-
ническую патологию
Систолическая
функция ПЖ
Систолическая ско-
рость в латеральной
части кольца трику-
спидального клапана,
определяемая с
помощью тканевой
допплерографии,
снижается с
возрастом
Дисфункция наиболее часто связана с
патологией левых отделов сердца или
легких
Должны использоваться возрастные
нормы для определяемой при ткане-
вой допплерографии систолической
скорости смещения латеральной
части фиброзного кольца трикуспи-
дального клапана
АГ — артериальная гипертензия; АС — аортальный стеноз; ИМ — инфаркт миокарда; МР — митральная регургитация; МС — митраль-
ный стеноз; ППТ — площадь поверхности тела; СНсФВ — сердечная недостаточность с сохраненной фракцией выброса; СС — сердеч-
но-сосудистый; ТИАК — транскатетерная имплантация аортального клапана; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Признаки старения, определяемые при эхокардиографии
ЛИТЕРАТУРА
1. Vincent GK, Velkoff VA. The next four
decades: the older population in the United
States: 2010 to 2050. Current Population
Reports, Washington, DC, 2010, US Census
Bureau.
2. Gardin JM, Henry WL, Savage DD, et al.
Echocardiographic measurements in nor-
mal subjects: evaluation of an adult popu-
lation without clinically apparent heart
disease, J Clin Ultrasound 7:439–447, 1979.
3. Gerstenblith G, Frederiksen J, Yin FC, et al.
Echocardiographic assessment of a normal
adult aging population, Circulation 56:273–
278, 1977.
4. Daimon M, Watanabe H, Abe Y, et al.
Normal values of echocardiographic pa-
rameters in relation to age in a healthy
Japanese population: the JAMP study, Circ
J 72:1859–1866, 2008.
5. Devereux RB, Alonso DR, Lutas EM, et al.
Echocardiographic assessment of left ven-
tricular hypertrophy: comparison to nec-
ropsy findings, Am J Cardiol 57:450–458,
1986.
6. Oe H, Hozumi T, Arai K, et al. Comparison
of accurate measurement of left ventricular
mass in patients with hypertrophied hearts
by real-time three-dimensional echocar-
diography versus magnetic resonance imag-
ing, Am J Cardiol 95:1263–1267, 2005.
7. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quan-
tification by echocardiography in adults:
an update from the American Society of
Echocardiography and the European Asso-
ciation of Cardiovascular Imaging, J Am Soc
Echocardiogr 28:1–39 e14, 2015.
8. Caselli S, Canali E, Foschi ML, et al. Long-
term prognostic significance of three-
dimensional echocardiographic parameters
of the left ventricle and left atrium, Eur J
Echocardiogr 11:250–256, 2010.
9. Aurigemma GP, Gottdiener JS, Arnold AM, et
al. Left atrial volume and geometry in healthy
aging: the Cardiovascular Health Study, Circ
Cardiovasc Imaging 2:282–289, 2009.
10. Dannenberg AL, Levy D, Garrison RJ.
Impact of age on echocardiographic left
ventricular mass in a healthy population
(the Framingham Study), Am J Cardiol
64:1066–1068, 1989.
11. Nikitin NP, Constantin C, Loh PH, et al.
New generation 3-dimensional echocar-
diography for left ventricular volumetric
and functional measurements: comparison
with cardiac magnetic resonance, Eur J
Echocardiogr 7:365–372, 2006.
12. Aune E, Baekkevar M, Rodevand O, Otter-
stad JE. Reference values for left ventricular
volumes with real-time 3-dimensional echo-
cardiography, Scand Cardiovasc J 44:24–30,
2010.
13. Maffessanti F, Muraru D, Esposito R, et
al. Age-, body size-, and sex-specific refer-
ence values for right ventricular volumes
and ejection fraction by three-dimensional
echocardiography: a multicenter echocar-
diographic study in 507 healthy volunteers,
Circ Cardiovasc Imaging 6:700–710, 2013.
14. Tamborini G, Marsan NA, Gripari P, et al.
Reference values for right ventricular vol-
umes and ejection fraction with real-time
three-dimensional echocardiography: eval-
uation in a large series of normal subjects, J
Am Soc Echocardiogr 23:109–115, 2010.
15. Krovetz LJ. Age-related changes in size of
the aortic valve annulus in man, Am Heart
J 90:569–574, 1975.
16. Sahasakul Y, Edwards WD, Naessens JM,
Tajik AJ. Age-related changes in aortic and
mitral valve thickness: implications for two-
dimensional echocardiography based on an
autopsy study of 200 normal human hearts,
Am J Cardiol 62:424–430, 1988.
17. Swinne CJ, Shapiro EP, Lima SD, Fleg JL.
Age-associated changes in left ventricular
diastolic performance during isometric
exercise in normal subjects, Am J Cardiol
69:823–826, 1992.
18. Lakatta EG, Gerstenblith G, Angell CS, et
al. Prolonged contraction duration in aged
myocardium, J Clin Invest 55:61–68, 1975.
19. Sagie A, Benjamin EJ, Galderisi M, et al.
Reference values for Doppler indexes of left
ch39_условно.indd 1027
03.04.2019 12:15:28
1028 ЧАСТЬ VII Сосудистые и системные заболевания
ventricular diastolic filling in the elderly, J
Am Soc Echocardiogr 6:570–576, 1993.
20. Yin FC, Raizes GS, Guarnieri T, et al. Age-
associated decrease in ventricular response to
haemodynamic stress during beta-adrenergic
blockade, Br Heart J 40:1349–1355, 1978.
21. Fleg JL, O’Connor F, Gerstenblith G, et
al. Impact of age on the cardiovascular
response to dynamic upright exercise in
healthy men and women, J Appl Physiol
78:890–900, 1995.
22. Fleg J, Lakatta E. Normal aging of the car-
diovascular system. In Aronow W, Fleg JL,
editors: Cardiovascular disease in the elderly,
ed 3, New York, 2004, Marcel Deckker.
23. Freeman RV, Otto CM. Spectrum of calcific
aortic valve disease: pathogenesis, disease
progression, and treatment strategies, Cir-
culation 111:3316–3326, 2005.
24. Olsson M, Thyberg J, Nilsson J. Presence
of oxidized low density lipoprotein in non-
rheumatic stenotic aortic valves, Arterioscler
Thromb Vasc Biol 19:1218–1222, 1999.
25. Faggiano P, Antonini-Canterin F, Erlicher
A, et al. Progression of aortic valve sclerosis
to aortic stenosis, Am J Cardiol 91:99–101,
2003.
26. Messika-Zeitoun D, Bielak LF, Peyser PA, et
al. Aortic valve calcification: determinants
and progression in the population, Arterio-
scler Thromb Vasc Biol 27:642–648, 2007.
27. Novaro GM, Katz R, Aviles RJ, et al. Clinical
factors, but not C-reactive protein, predict
progression of calcific aortic-valve disease:
the Cardiovascular Health Study, J Am Coll
Cardiol 50:1992–1998, 2007.
28. Nair CK, Thomson W, Ryschon K, et al.
Long-term follow-up of patients with
echocardiographically detected mitral anu-
lar calcium and comparison with age- and
sex-matched control subjects, Am J Cardiol
63:465–470, 1989.
29. Deluca G, Correale M, Ieva R, et al. The
incidence and clinical course of caseous
calcification of the mitral annulus: a pro-
spective echocardiographic study, J Am Soc
Echocardiogr 21:828–833, 2008.
30. de Vrey EA, Scholte AJ, Krauss XH, et al.
Intracardiac pseudotumor caused by mitral
annular calcification, Eur J Echocardiogr
7:62–66, 2006.
31. Elmariah S, Budoff MJ, Delaney JA, et al.
Risk factors associated with the incidence
and progression of mitral annulus calcifica-
tion: the multi-ethnic study of atherosclero-
sis, Am Heart J 166:904–912, 2013.
32. Movva R, Murthy K, Romero-Corral A,
et al. Calcification of the mitral valve and
annulus: systematic evaluation of effects
on valve anatomy and function, J Am Soc
Echocardiogr 26:1135–1142, 2013.
33. Aronow WS, Koenigsberg M, Kronzon I,
Gutstein H. Association of mitral anular
calcium with new thromboembolic stroke
and cardiac events at 39-month follow-up
in elderly patients, Am J Cardiol 65:1511–
1512, 1990.
34. Savage DD, Garrison RJ, Castelli WP, et al.
Prevalence of submitral (anular) calcium
and its correlates in a general population-
based sample (the Framingham Study), Am
J Cardiol 51:1375–1378, 1983.
35. Pujadas R, Arboix A, Anguera N, et al.
Mitral annular calcification as a marker of
complex aortic atheroma in patients with
stroke of uncertain etiology, Echocardiogra-
phy 25:124–132, 2008.
36. Aronow WS, Ahn C, Kronzon I, Gutstein H.
Association of mitral annular calcium with
new thromboembolic stroke at 44-month
follow-up of 2,148 persons, mean age 81
years, Am J Cardiol 81:105–106, 1998.
37. Kizer JR, Wiebers DO, Whisnant JP, et al.
Mitral annular calcification, aortic valve
sclerosis, and incident stroke in adults free
of clinical cardiovascular disease: the Strong
Heart Study, Stroke 36:2533–2537, 2005.
38. Cheitlin MD, Aronow WS. Mitral regurgita-
tion, stenosis, and annular calcification. In
Aronow WS, Fleg JL, editors. Cardiovas-
cular disease in the elderly, ed 3, New York,
2004, Marcel Deckker.
39. Gardin JM, McClelland R, Kitzman D, et
al. M -mode echocardiographic predictors
of six- to seven-year incidence of coronary
heart disease, stroke, congestive heart fail-
ure, and mortality in an elderly cohort (the
Cardiovascular Health Study), Am J Cardiol
87:1051–1057, 2001.
40. Schott CR, Kotler MN, Parry WR, Segal BL.
Mitral annular calcification. Clinical and
echocardiographic correlations, Arch Intern
Med 137:1143–1150, 1977.
41. Bonow RO, Carabello BA, Chatterjee K,
et al. 2008 focused update incorporated
into the ACC/AHA 2006 guidelines for the
management of patients with valvular heart
disease: a report of the American College
of Cardiology/American Heart Association
Task Force on Practice Guidelines (Writing
Committee to revise the 1998 guidelines for
the management of patients with valvular
heart disease). Endorsed by the Society of
Cardiovascular Anesthesiologists, Society
for Cardiovascular Angiography and Inter-
ventions, and Society of Thoracic Surgeons,
J Am Coll Cardiol 52:e1–142, 2008.
42. Asselbergs FW, Mozaffarian D, Katz R,
et al. Association of renal function with
cardiac calcifications in older adults: the
cardiovascular health study, Nephrol Dial
Transplant 24:834–840, 2009.
43. Fox CS, Larson MG, Vasan RS, et al. Cross-
sectional association of kidney function
with valvular and annular calcification: the
Framingham heart study, J Am Soc Nephrol
17:521–527, 2006.
44. Ix JH, Shlipak MG, Katz R, et al. Kidney
function and aortic valve and mitral annu-
lar calcification in the Multi-Ethnic Study
of Atherosclerosis (MESA), Am J Kidney Dis
50:412–420, 2007.
45. Raggi P, Bellasi A, Gamboa C, et al. All-
cause mortality in hemodialysis patients
with heart valve calcification, Clin J Am Soc
Nephrol 6:1990–1995, 2011.
46. Kidney Disease. Improving Global Out-
comes (KDIGO) CKD–MBD Work Group.
KDIGO clinical practice guideline for the
diagnosis, evaluation, prevention, and treat-
ment of chronic kidney disease–mineral
and bone disorder (CKD–MBD), Kidney Int
76(Suppl 113):S1–S130, 2009.
47. Otto CM, Lind BK, Kitzman DW, et al. As-
sociation of aortic-valve sclerosis with car-
diovascular mortality and morbidity in the
elderly, N Engl J Med 341:142–147, 1999.
48. Aronow WS, Ahn C, Shirani J, Kronzon I.
Comparison of frequency of new coronary
events in older subjects with and without
valvular aortic sclerosis, Am J Cardiol
83:599–600, 1999. A598.
49. Owens DS, Budoff MJ, Katz R, et al. Aortic
valve calcium independently predicts coro-
nary and cardiovascular events in a primary
prevention population, JACC Cardiovasc
Imaging 5:619–625, 2012.
50. Kohsaka S, Jin Z, Rundek T, et al. Impact of
mitral annular calcification on cardiovascu-
lar events in a multiethnic community: the
Northern Manhattan Study, JACC Cardio-
vasc Imaging 1:617–623, 2008.
51. Barasch E, Gottdiener JS, Larsen EK, et al.
Clinical significance of calcification of the
fibrous skeleton of the heart and aortoscle-
rosis in community dwelling elderly. The
Cardiovascular Health Study (CHS), Am
Heart J 151:39–47, 2006.
52. Nair CK, Aronow WS, Sketch MH, et al.
Clinical and echocardiographic charac-
teristics of patients with mitral anular
calcification. Comparison with age- and
sex-matched control subjects, Am J Cardiol
51: 992–995, 1983.
53. Mohler 3rd ER, Gannon F, Reynolds C, et al.
Bone formation and inflammation in cardiac
valves, Circulation 103:1522–1528, 2001.
54. Agmon Y, Khandheria BK, Jamil Tajik A, et
al. Inflammation, infection, and aortic valve
sclerosis; insights from the Olmsted County
(Minnesota) population, Atherosclerosis
174:337–342, 2004.
55. Savage DD, Levy D, Dannenberg AL, et
al. Association of echocardiographic left
ventricular mass with body size, blood pres-
sure and physical activity (the Framingham
Study), Am J Cardiol 65:371–376, 1990.
56. Chobanian AV, Bakris GL, Black HR, et
al. The seventh report of the Joint Na-
tional Committee on Prevention, Detec-
tion, Evaluation, and Treatment of High
Blood Pressure: the JNC 7 report, JAMA
289:2560–2572, 2003.
57. James PA, Oparil S, Carter BL, et al. 2014
evidence-based guideline for the manage-
ment of high blood pressure in adults: re-
port from the panel members appointed to
the Eighth Joint National Committee (JNC
8), JAMA 311:507–520, 2014.
58. Aronow WS, Fleg JL, Pepine CJ, et al.
ACCF/AHA 2011 expert consensus docu-
ment on hypertension in the elderly: a re-
port of the American College of Cardiology
Foundation Task Force on Clinical Expert
Consensus documents developed in col-
laboration with the American Academy of
Neurology, American Geriatrics Society,
American Society for Preventive Cardiol-
ogy, American Society of Hypertension,
American Society of Nephrology, Associa-
tion of Black Cardiologists, and European
Society of Hypertension, J Am Coll Cardiol
57:2037–2114, 2011.
59. Diaz T, Pencina MJ, Benjamin EJ, et al.
Prevalence, clinical correlates, and progno-
sis of discrete upper septal thickening on
echocardiography: the Framingham Heart
Study, Echocardiography 26:247–253, 2009.
60. Kelshiker MA, Mayet J, Unsworth B,
Okonko DO. Basal septal hypertrophy,
Curr Cardiol Rev 9:325–330, 2013.
61. Chen-Tournoux A, Fifer MA, Picard MH,
Hung J. Use of tissue Doppler to distinguish
discrete upper ventricular septal hypertrophy
from obstructive hypertrophic cardiomy-
opathy, Am J Cardiol 101:1498–1503, 2008.
62. Tsang TS, Barnes ME, Gersh BJ, et al. Pre-
diction of risk for first age-related cardio-
vascular events in an elderly population: the
incremental value of echocardiography, J
Am Coll Cardiol 42:1199–1205, 2003.
ch39_условно.indd 1028
03.04.2019 12:15:28
1029
39 Признаки старения, определяемые при эхокардиографии
63. Kizer JR, Bella JN, Palmieri V, et al. Left
atrial diameter as an independent predic-
tor of first clinical cardiovascular events in
middle-aged and elderly adults: the Strong
Heart Study (SHS), Am Heart J 151:412–
418, 2006.
64. Vahanian A, Baumgartner H, Bax J, et al.
Guidelines on the management of valvular
heart disease: the Task Force on the Man-
agement of Valvular Heart Disease of the
European Society of Cardiology, Eur Heart
J 28:230–268, 2007.
65. Nishimura RA, Otto CM, Bonow RO, et
al. 2014 AHA/ACC guideline for the man-
agement of patients with valvular heart
disease: a report of the American College
of Cardiology/American Heart Association
Task Force on Practice Guidelines, J Am Coll
Cardiol 63:e57–185, 2014.
66. Keenan NG, Cueff C, Cimadevilla C, et al.
Usefulness of left atrial volume versus diam-
eter to assess thromboembolic risk in mitral
stenosis, Am J Cardiol 106:1152–1156, 2010.
67. Mozaffarian D, Benjamin EJ, Go AS, et al.
Heart disease and stroke statistics—2015
update: a report from the American Heart
Association, Circulation 131:e29–322, 2015.
68. Bursi F, Weston SA, Redfield MM, et al.
Systolic and diastolic heart failure in the
community, JAMA 296:2209–2216, 2006.
69. Badano LP, Albanese MC, De Biaggio P, et
al. Prevalence, clinical characteristics, qual-
ity of life, and prognosis of patients with
congestive heart failure and isolated left
ventricular diastolic dysfunction, J Am Soc
Echocardiogr 17:253–261, 2004.
70. Redfield MM, Jacobsen SJ, Burnett Jr. JC,
et al. Burden of systolic and diastolic ven-
tricular dysfunction in the community:
appreciating the scope of the heart failure
epidemic, JAMA 289:194–202, 2003.
71. Paulus WJ, Tschope C, Sanderson JE, et
al. How to diagnose diastolic heart failure:
a consensus statement on the diagnosis of
heart failure with normal left ventricular
ejection fraction by the Heart Failure and
Echocardiography Associations of the Eu-
ropean Society of Cardiology, Eur Heart J
28:2539–2550, 2007.
71a. Penicka M, Vanderheyden M, Bartunek J.
Diagnosis of heart failure with preserved
ejection fraction: role of clinical Doppler
echocardiograph, Heart 100:68–76, 2014.
72. Smart S, Sagar K, Tresch D. Age-related
determinants of outcome after acute myo-
cardial infarction: a dobutamine-atropine
stress echocardiographic study, J Am Geriatr
Soc 50:1176–1185, 2002.
73. Elhendy A, van Domburg RT, Bax JJ, et al.
Safety, hemodynamic profile, and feasibil-
ity of dobutamine stress technetium myo-
cardial perfusion single-photon emission
CT imaging for evaluation of coronary
artery disease in the elderly, Chest 117:649–
656, 2000.
74. Ranhosky A, Kempthorne-Rawson J. The
safety of intravenous dipyridamole thallium
myocardial perfusion imaging. Intravenous
Dipyridamole Thallium Imaging Study
Group, Circulation 81:1205–1209, 1990.
75. Anthopoulos LP, Bonou MS, Kardaras FG,
et al. Stress echocardiography in elderly
patients with coronary artery disease: ap-
plicability, safety and prognostic value of
dobutamine and adenosine echocardiogra-
phy in elderly patients, J Am Coll Cardiol
28:52–59, 1996.
76. Hashimoto A, Palmar EL, Scott JA, et al.
Complications of exercise and pharmacologic
stress tests: differences in younger and elderly
patients, J Nucl Cardiol 6:612–619, 1999.
77. Al Jaroudi W, Iskandrian AE. Regadenoson:
a new myocardial stress agent, J Am Coll
Cardiol 54:1123–1130, 2009.
78. Porter TR, Adolphson M, High RR, et al.
Rapid detection of coronary artery stenoses
with real-time perfusion echocardiography
during regadenoson stress, Circ Cardiovasc
Imaging 4:628–635, 2011.
79. Shaikh K, Wang DD, Saad H, et al. Feasi-
bility, safety and accuracy of regadenoson-
atropine (REGAT) stress echocardiography
for the diagnosis of coronary artery disease:
an angiographic correlative study, Int J Car-
diovasc Imaging 30:515–522, 2014.
80. Goldstein LB, Bushnell CD, Adams RJ, et
al. Guidelines for the primary prevention
of stroke: a guideline for healthcare pro-
fessionals from the American Heart Asso-
ciation/American Stroke Association, Stroke
42:517–584, 2011.
81. Boon A, Lodder J, Cheriex E, Kessels F.
Risk of stroke in a cohort of 815 patients
with calcification of the aortic valve with or
without stenosis, Stroke 27:847–851, 1996.
82. Coffey S, Cox B, Williams MJ. The preva-
lence, incidence, progression, and risks of
aortic valve sclerosis: a systematic review
and meta-analysis, J Am Coll Cardiol 63(25
Pt A):2852–2861, 2014.
83. Blum A, Reisner S, Farbstein Y. Trans-
esophageal echocardiography (TEE) vs.
transthoracic echocardiography (TTE) in
assessing cardio-vascular sources of emboli
in patients with acute ischemic stroke, Med
Sci Monit 10:521–523, 2004.
84. Hilberath JN, Oakes DA, Shernan SK, et al.
Safety of transesophageal echocardiogra-
phy, J Am Soc Echocardiogr 23:1115–1127,
2010. quiz 1220–1111.
85. Stoddard MF, Longaker RA. The safety of
transesophageal echocardiography in the
elderly, Am Heart J 125(5 Pt 1):1358–1362,
1993.
86. Min JK, Spencer KT, Furlong KT, et al.
Clinical features of complications from
transesophageal echocardiography: a single-
center case series of 10,000 consecutive ex-
aminations, J Am Soc Echocardiogr 18:925–
929, 2005.
87. Cornwell 3rd GG, Murdoch WL, Kyle RA,
et al. Frequency and distribution of senile
cardiovascular amyloid. A clinicopathologic
correlation, Am J Med 75:618–623, 1983.
88. Kyle RA, Spittell PC, Gertz MA, et al. The
premortem recognition of systemic senile
amyloidosis with cardiac involvement, Am
J Med 101:395–400, 1996.
89. Hodkinson HM, Pomerance A. The clinical
significance of senile cardiac amyloidosis: a
prospective clinico-pathological study, Q J
Med 46:381–387, 1977.
90. Smith TJ, Kyle RA, Lie JT. Clinical signifi-
cance of histopathologic patterns of cardiac
amyloidosis, Mayo Clin Proc 59:547–555,
1984.
91. Hsu SY, Hsieh IC, Chang SH, et al. Aortic
valve sclerosis is an echocardiographic in-
dicator of significant coronary disease in
patients undergoing diagnostic coronary
angiography, Int J Clin Pract 59:72–77, 2005.
92. Taylor Jr. HA, Clark BL, Garrison RJ, et al.
Relation of aortic valve sclerosis to risk of
coronary heart disease in African-Ameri-
cans, Am J Cardiol 95:401–404, 2005.
93. Al-Absi AI, Wall BM, Aslam N, et al. Predic-
tors of mortality in end-stage renal disease
patients with mitral annulus calcification,
Am J Med Sci 331:124–130, 2006.
94. da Rosa EM, Sant’anna JR, Oppermann LP,
Castro I. Prognosis of aortic valve sclerosis
in cardiovascular mortality of patients seen
at the cardiology institute of Rio Grande do
Sul, Arq Bras Cardiol 88:234–239, 2007.
95. Shah SJ, Ristow B, Ali S, et al. Acute myo-
cardial infarction in patients with versus
without aortic valve sclerosis and effect of
statin therapy (from the Heart and Soul
Study), Am J Cardiol 99:1128–1133, 2007.
96. Blaha MJ, Budoff MJ, Rivera JJ, et al. Re-
lation of aortic valve calcium detected by
cardiac computed tomography to all-cause
mortality, Am J Cardiol 106:1787–1791,
2010.
97. Chen ZW, Qian JY, Jian Y, et al. Prevalence
and severity of coronary artery disease in
diabetic patients with aortic valve calcifica-
tion, Acta Cardiol 66:15–20, 2011.
98. Valentijn TM, Hoeks SE, Bakker EJ, et al. In-
fluence of aortic valve calcium on outcome
in patients undergoing peripheral vascular
surgery, Am J Cardiol 110:1195–1199, 2012.
99. Benjamin EJ, Plehn JF, D’Agostino RB, et
al. Mitral annular calcification and the risk
of stroke in an elderly cohort, N Engl J Med
327:374–379, 1992.
100. Willens HJ, Chirinos JA, Schob A, et al. The
relation between mitral annular calcifica-
tion and mortality in patients undergoing
diagnostic coronary angiography, Echocar-
diography 23:717–722, 2006.
101. Zhang Y, Safar ME, Iaria P, et al. Car-
diac and arterial calcifications and all-cause
mortality in the elderly: the PROTEGER
Study, Atherosclerosis 213:622–626, 2010.
102. Potpara TS, Vasiljevic ZM, Vujisic-Tesic BD,
et al. Mitral annular calcification predicts
cardiovascular morbidity and mortality in
middle-aged patients with atrial fibrillation:
the Belgrade Atrial Fibrillation Study, Chest
140:902–910, 2011.
103. Holtz JE, Upadhyaya DS, Cohen BE, et al.
Mitral annular calcium, inducible myocar-
dial ischemia, and cardiovascular events
in outpatients with coronary heart disease
(from the Heart and Soul Study), Am J Car-
diol 109:1092–1096, 2012.
ch39_условно.indd 1029
03.04.2019 12:15:28
ch39_условно.indd 1030
03.04.2019 12:15:28
1031
40 Эмболия сосудов большого
круга кровообращения
MARCO R. DI TULLIO, MD
Эмболия сердца
Кардиоэмболический
и криптогенный инсульт
Базовые принципы
и эхокардиографические
подходы
Технические аспекты
Чреспищеводная эхокардиография
в сравнении с трансторакальной
эхокардиографией
Клиническая эффективность
и результаты
Инфаркт миокарда, дисфункция
левого желудочка и тромбоз
Вегетации и ворсинки на клапанах
Внутрисердечные опухоли
Тромбы левого предсердия
и спонтанное эхоконтрастирование
Патология межпредсердной
перегородки
Атеросклеротические бляшки в аорте
Потенциальные ограничения
и альтернативные подходы
ЭМБОЛИЯ СЕРДЦА
Сердце и аорта являются потенциальным источни-
ком эмболов в большой круг кровообращения. При
эмболии из сердца или проксимального участка сег-
мента аорты, чаще всего мишенью является голов-
ной мозг. Поэтому исследование источников кар-
диальных эмболий, особенно необходимо после це-
ребрального эмболического события. Кроме того,
наибольшее количество данных об исходах и про-
филактики повторных эмболий содержится в лите-
ратуре об инсультах. Тем не менее те же эмболиче-
ские источники (с добавлением дистальных участ-
ков сегментов аорты) и принципы их исследования
также применимы к периферическим эмболиям.
КАРДИОЭМБОЛИЧЕСКИЙ
И КРИПТОГЕННЫЙ ИНСУЛЬТ
Инсульт является третьей по частоте причиной
смерти в Соединенных Штатах Америки после бо-
лезней сердца и онкологической патологии. Около
8 млн американцев в возрасте 20 лет и старше пере-
несли инсульт. Каждый год около 795 000 человек
переносят инсульт, в 77% случаев — как первичное
событие [1]. Кроме того, доля бессимптомных ин-
сультов оценивается от 6 до 28%, а число
транзиторных ишемических атак (ТИА), времен-
ных эпизодов неврологической дисфункции, фак-
торы риска которых сходны с инсультом и часто
являются прелюдией к нему, составляет 2,3%, и это,
скорее всего, заниженная оценка [1]. Подавляющее
большинство инсультов (87%) имеют ишемическое
происхождение, это означает, что происходит бло-
кирование кровоснабжения пораженной террито-
рии. Остальная часть приходится на внутримозго-
вые (10%) или субарахноидальные (3%) кровоизли-
яния [1].
Ишемический инсульт имеет определяемый кар-
диальный источник эмболии приблизительно в
20% случаев [2]. Кроме того, случаи, которые не
имеют видимой причины (так называемый крип-
тогенный инсульт), часто имеют клинические про-
явления и заключения, полученные при нейрови-
зуализации, которые наводят на мысль об эмбо-
лической причине события. Установление новых
источников эмболии сердца привело к участию кар-
диологов, а особенно врачей ультразвуковой диа-
гностики, в выявлении и профилактике инсульта.
Эти совместные усилия привели к уменьшению до-
ли инсультов, которые определяются как крипто-
генные [3], и изменениям в лечении и вторичной
профилактики.
БАЗОВЫЕ ПРИНЦИПЫ
И ЭХОКАРДИОГРАФИЧЕСКИЕ ПОДХОДЫ
Трансторакальная эхокардиография (ТТЭхоКГ), осо-
бенно чреспищеводная эхокардиография (ЧПЭхоКГ),
широко используют для поиска источника эмболии
сердца у пациентов с инсультом или ТИА. ТТЭхоКГ
назначается как метод скрининга, способный вы-
явить некоторые источники эмболов (в частности,
ch40_условно.indd 1031
03.04.2019 12:15:44
1032 ЧАСТЬ VII Сосудистые и системные заболевания
верхушечные тромбы левого желудочка (ЛЖ), но
также крупные вегетации на клапанах и внутрисер-
дечные массы) и подсказать клиницисту о необ-
ходимости более инвазивного метода — ЧПЭхоКГ.
С другой стороны, ЧПЭхоКГ является предпочти-
тельным методов в ситуациях, когда ТТЭхоКГ не
может четко визуализировать сердце или структу-
ры аорты, представляющие интерес, и во всех слу-
чаях, когда необходимо изображение с высоким
разрешением этих структур. ЧПЭхоКГ превосходит
ТТЭхоКГ в визуализации межпредсердной перего-
родки и клапанов сердца, позволяя, например, бо-
лее точно установить открытое овальное окно
(ООО) или инфекционный эндокардит (ИЭ).
ЧПЭхоКГ также обеспечивает точную визуализа-
цию таких структур, как ушко левого предсердия
(УЛП) и проксимальный участок грудной части
нисходящего отдела аорты, которые являются важ-
ными объектами исследования при поиске источ-
ников эмболии. В табл. 40.1 представлена клиниче-
ская классификация источников эмболии и наибо-
лее подходящие методы ЭхоКГ для каждого из них.
Возможные сопутствующие
состояния
Возрастная
группа
Лучший метод диагностики
Тромб левого желудочка
Предшествующий инфаркт миокарда,
дилатационная кардиомиопатия
В любом возрасте ТТЭхоКГ
Тромб левого предсердия
или спонтанное
эхоконтрастирование
Фибрилляция предсердий, заболева-
ния митрального клапана
В любом возрасте ЧПЭхоКГ
Вегетации на клапанах
Инфекционный эндокардит (лихорад-
ка, сердечные шумы, симптомы со
стороны систем органов), системная
красная волчанка
В любом возрасте ЧПЭхоКГ/ТТЭхоКГ (менее чув-
ствительна)
Заболевания клапанов
Вариабельны
В любом возрасте ТТЭхоКГ для первоначальной
оценки ЧПЭхоКГ — для углуб-
ленного обследования (особенно
при наличии протеза клапана)
Опухоли сердца (миксома,
фиброэластома, вторичные
злокачественные опухоли)
Отсутствуют или неспецифические
системные симптомы
В любом возрасте ТТЭхоКГ для скрининга
ЧПЭхоКГ при высокой вероятно-
сти отсутствия диагностики
с помощью ТТЭхоКГ
Открытое овальное окно
Отсутствуют
В любом возрасте;
чаще всего у па-
циентов старше
55 лет
ТТЭхоКГ с контрастированием
для скрининга
ЧПЭхоКГ при необходимости
детализации
Аневризма межпредсердной
перегородки
Отсутствуют
В любом возрасте;
чаще всего у па-
циентов старше
55 лет
С целью скрининга — ТТЭхоКГ
Для лучшей визуализации —
ЧПЭхоКГ
Ворсинки клапана
Отсутствуют
В любом возрасте ЧПЭхоКГ
Aтеросклеротические бляш-
ки аорты
Диффузный атеросклероз
Старше 60 лет
ЧПЭхоКГ
ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 40.1 Эхокардиографическая оценка источника кардиоаортальных эмболий
ТЕХНИЧЕСКИЕ АСПЕКТЫ
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ В СРАВНЕНИИ
С ТРАНСТОРАКАЛЬНОЙ ЭХОКАРДИОГРАФИЕЙ
Было неоднократно доказано, что ЧПЭхоКГ имеет
большую чувствительность, чем ТТЭхоКГ, при вы-
явлении источников эмболии сердца. У 231 пациен-
тов с криптогенным инсультом или транзиторны-
ми ишемическими атаками, потенциальный источ-
ник эмболии выявлен в 55% случаев с помощью
ЧПЭхоКГ, и только 16% при ТТЭхоКГ [4]. Крупный
источник эмболии, являющийся абсолютным пока-
занием к назначению антикоагулянтов, был обнару-
жен у 20% пациентов при ЧПЭхоКГ и только у 4%
при ТТЭхоКГ [4]. Большая диагностическая цен-
ность ЧПЭхоКГ была подтверждена в более позд-
нем исследовании 702 последовательных пациентов
с ишемическим инсультом или транзиторной ише-
мической атакой [5]. ЧПЭхоКГ показали соответ-
ствующие результаты в 52,6% случаев, при этом
наиболее распространенными признаками были от-
крытое овальное окно (21,7%) или ранее не диагно-
ch40_условно.indd 1032
03.04.2019 12:15:44
1033
40 Эмболия сосудов большого круга кровообращения
стированные заболевания клапанов сердца (15,8%)
[5]. Ряд исследований [4, 6, 7] показал, что данные
ЧПЭхоКГ могут прямо влиять на выбор терапии
примерно у 20% пациентов с криптогенным ин-
сультом (табл. 40.2). Критерии надлежащего ис-
пользования ЭхоКГ у пациентов с недавними эм-
болическими событиями, разработанные American
College of Cardiology Foundation (при взаимодей-
ствии с крупнейшими диагностическими и клини-
Исследование
Пациенты
Наиболее частые находки
Терапевтические
изменения
Вид изменений
n
М/Ж
Возраст
(лет)
n
%
De Brujin [4] 231 Н/Д
39≤45;
192>45
Бляшки в аорте 30%; тромбы
УЛП 16%
46
20
Начало приема ОА
Harloff [6]
212 125/87 58,2 ± 13,9 ООО 20,3%; бляшки в аорте
17,6%
65
22,6
Начало приема ОА
Khariton [7]
1458 792/726 60,5 (диа-
пазон
17–93)
ООО 11,9%; ИЭ 1,4% бляшки
в аорте 1%; опухоль или опу-
холеподобные массы 0,5%
243
16,7
Начало приема ОА,
закрытие ООО, анти-
биотики при ИЭ,
операция на сердце
ИЭ — инфекционный эндокардит; М/Ж — мужчина или женщина; Н/Д — нет данных; ОА — оральные антикоагулянты; ООО — откры-
тое овальное окно; УЛП — ушко левого предсердия.
ТАБЛИЦА 40.2 Терапевтические изменения, произошедшие в результате использования чреспищеводной эхокардиографии
ТТЭхоКГ для оценки внутри- и внесердечных структур и полостей сердца
Уровень
целесообразности
Подозрение на наличие масс в сердце
Ц (9)
Подозрение на сердечно-сосудистый источник эмболов
Ц (9)
ЧПЭхоКГ как первичное или дополнительное исследование
Поиск сердечно-сосудистого источника эмболов при ненайденном источнике другой локализации
Ц (7)
Поиск сердечно-сосудистого источника эмболов при ранее установленном источнике другой
локализации
С (5)
Поиск сердечно-сосудистого источника эмболов при ранее установленном кардиальном источнике
при котором ЧПЭхоКГ не повлияет на лечение
Н (1)
ЧПЭхоКГ как исследование в период наблюдения
Пересмотр с учетом данных предыдущей ЧПЭхоКГ для оценки промежуточных изменений (например,
состояние тромба после приема антикоагулянтов, состояние вегетаций после антибиотикотерапии)
с целью возможной корректировки лечения
Ц (8)
Подтверждение предыдущих данных ЧПЭхоКГ для оценки промежуточных изменений (например,
состояние тромба после приема антикоагулянтов, состояние вегетаций после антибиотикотерапии)
без намерения изменить тактику лечения
Н (2)
Н — нецелесообразно (медианное значение 1–3); С — сомнительно (медианное значение: 4–6); ТТЭхоКГ — трансторакальная эхокардио-
графия; Ц — целесообразно (медианное значение по литературе: 7–9, увеличивающийся уровень доказательности); ЧПЭхоКГ — чреспи-
щеводная эхокардиография.
[Douglas PS, Garcia MJ, Haines DE, et al. ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/SCCT/SCMR 2011 Appropriate Use Criteria for Echo-
cardiography. A Report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiog-
raphy, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, and Society
for Cardiovascular Magnetic Resonance Endorsed by the American College of Chest Physicians. J Am Coll Cardiol 57:1126–1166, 2011.]
ТАБЛИЦА 40.3 Критерии целесообразного использования эхокардиографии у пациентов
с недавними эмболическими событиями
ческими обществами США) [8], представлены в
табл. 40.3 .
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ И РЕЗУЛЬТАТЫ
ИНФАРКТ МИОКАРДА, ДИСФУНКЦИЯ
ЛЕВОГО ЖЕЛУДОЧКА И ТРОМБОЗ
Инфаркт миокарда (ИМ) и дилатационная кардио-
миопатия являются состояниями, часто связанны-
ch40_условно.indd 1033
03.04.2019 12:15:44
1034 ЧАСТЬ VII Сосудистые и системные заболевания
ми с образованием тромбов в полости ЛЖ (см. гла-
ву 12). В первый месяц после острого инфаркта ми-
окарда частота инсульта составляет от 2 до 3%; 50%
случаев происходят в первые 5 сут [9]. В исследова-
нии 2160 пациентов с инфарктом миокарда частота
инсульта в течение первого месяца составила 22,6 на
100 человек в месяц, что в 44 раза чаще, чем в кон-
трольной группе [10]. Риск инсульта или транзи-
торной ишемической атаки повышается в первых
3–6 мес, а затем он снижается, но все еще в 2–3 раза
выше, чем в контрольной группе, в течение первых
3 лет после инфаркта миокарда [11].
Риск инсульта или транзиторной ишемической
атаки в основном связан с образованием тромба в
зоне инфаркта. По данным метаанализа, наличие
пристеночного тромба, выявленного эхокардиогра-
фически, увеличивает риск инсульта более чем в 5
раз [12]. Частота образования тромбов после ин-
фаркта миокарда передней стенки считается выше,
чем после инфаркта миокарда нижней стенки. В ис-
следовании 642 пациентов с инфарктом миокарда
передней стенки в 6,2% случаев формировался
тромб ЛЖ [13].
Обычно для обнаружения тромба ЛЖ использу-
ется ТТЭхоКГ. При наличии приемлемого изобра-
жения ТТЭхоКГ по крайней мере столь же чувстви-
тельна, как ЧПЭхоКГ, т.к. большинство тромбов
желудочка имеют тенденцию к образованию в его
апикальной области, которая может быть опти-
мально визуализирована при ЧПЭхоКГ. Использо-
вание контрастного средства для окрашивания ЛЖ
повышает чувствительность ТТЭхоКГ, снижая ча-
стоту сомнительных признаков (рис. 40.1, 40.2). В
исследовании 123 пациентов с неубедительными
результатами ТТЭхоКГ введение контрастного сред-
ства выявило тромб в 14 случаях, позволив исклю-
чить его наличие у всех остальных больных [14]. У
33 больных с подозрением на наличие тромба вве-
дение контрастного средства позволило исключить
его наличие у 13 (39%) пациентов. В целом исполь-
зование контрастного средства привело к измене-
нию тактики лечения у большого числа пациентов,
позволив вовремя назначить антикоагулянты или,
наоборот, воздержаться от их необоснованного
применения [14].
Поскольку в большинстве случаев тромбы ЛЖ
образуются в области верхушки, то для их диагно-
стики при ТТЭхоКГ наиболее эффективна верху-
шечная проекция (см. рис. 40.1). При этом могут
быть оценены морфологические характеристики,
такие как размер тромба, выпячивание в полость и
его подвижность. Они играют важную роль в оцен-
ке тромбоэмболического потенциала. Использова-
ние более высокой частоты датчика (3,5 или 5 МГц)
всегда, когда это возможно, может дополнительно
повысить частоту выявления тромба.
Для пациентов с подтвержденным эхокардиогра-
фически тромбом ЛЖ, в дополнение к аспирину
(75–162 мг), который необходим для вторичной
профилактики инфаркта миокарда, рекомендуется
профилактическое использование варфарина для
достижения целевых показателей (2,0–3,0) между-
народного нормализованного отношения (МНО).
Антикоагулянтная терапия у пациентов с мерца-
тельной аритмией должна проводиться на протяже-
нии всей жизни. Рекомендуется продолжать анти-
коагулянтную терапию по крайней мере 3 мес [15]
с продолжением лечения на основе последующих
результатов ЭхоКГ (сохранение тромба ЛЖ, выра-
женность дисфункции ЛЖ). По данным метаанали-
за 25 307 пациентов, прием варфарина с достижени-
ем показателя МНО от 2 до 3 в сочетании с приемом
аспирина привел к резкому снижению количества
инсультов по сравнению с изолированным прие-
мом аспирина (OR 0,43; 95% ДИ 0,27–0,70; р = 0,0007),
однако возрасло количество кровотечений (OR 2,32;
95% ДИ 1,63–3,29; р < 0,00001) [16]. Однако эффек-
тивность системных антикоагулянтов у всех паци-
ентов с инфарктом миокарда передней стенки ЛЖ,
независимо от наличия тромба, находится под во-
просом. У 2482 пациентов, перенесших инфаркт
миокарда передней стенки, использование антико-
агулянтов до 90 сут после инфаркта миокарда не
было связано со значительным снижением риска
развития инсульта на протяжении следующих 4 лет
(HR 0,68; 95% ДИ 0,37–1,26), в то время как лечение
с использованием ингибиторов ангиотензинпрев-
ращающего фермента (HR 0,65; 95% ДИ 0,44–0,95)
ПЖ
ПП
ЛП
ЛЖ
Рис. 40.1 A Большой тромб в области верхушки сердца (стрелка) при
трансторакальной эхокардиографии. ЛЖ — левый желудочек; ЛП — ле-
вое предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
ch40_условно.indd 1034
03.04.2019 12:15:44
1035
40 Эмболия сосудов большого круга кровообращения
ЛЖ
А
Б
Рис. 40.2 Использование контрастного средства для выявления тромба в полости левого желудочка. (А) A При ТТЭхоКГ наблюдается слабая эхо-
генность (стрелка) в области верхушки левого желудочка (ЛЖ). (Б) A Введение контрастного средства в ЛЖ демонстрирует наличие тромбов, заполняющих вер-
хушку (стрелка).
и бета-блокаторов (HR 0,60; 95% ДИ 0,41–0,87), на-
оборот, его снижало [17].
Доступна только отрывочная информация о ча-
стоте образования тромбов и эмболиями цере-
бральных сосудов у пациентов с дилатационной
кардиомиопатией. Частота эмболий, как полагают,
коррелирует с ухудшением функции ЛЖ. Тяжелая
дисфункция ЛЖ может увеличить риск развития
тромбоэмболических осложнений, из-за увеличе-
ния частоты застоя крови и, следовательно, образо-
вания тромбов. Повышение заболеваемости ин-
сультом (до 4% в год [18]) было зарегистрировано
у пациентов с хронической сердечной недостаточ-
ностью, хотя это может быть частично связано с
частым наличием сопутствующей фибрилляции
предсердий. Поскольку сердечная недостаточность
часто сопровождается гиперкоагуляцией, с целью
предотвращения эмболических осложнений прово-
дилась антитромботическая терапия. Хотя антикоа-
гулянты, безусловно, показаны пациентам с сопут-
ствующей мерцательной аритмией, их значение у
пациентов в синусовым ритмом является спорным.
В табл. 40.4 представлены результаты двух круп-
нейших клинических исследований по этой теме
[19, 20]. В обоих исследованиях варфарин, несмотря
на то что ему не удалось снизить частоту сочетан-
ных сердечно-сосудистых событий до целевого зна-
чения, снизил риск инсультов по сравнению с анти-
тромбоцитарными препаратами. Также при приеме
варфарина повысился риск крупных, но не внутри-
мозговых кровотечений.
ВЕГЕТАЦИИ И ВОРСИНКИ НА КЛАПАНАХ
Вегетации на митральном или аортальном клапанах
часто служат источником эмболии сосуды головно-
го мозга и большого круга кровообращения. Невро-
логические осложнения возникают у 20–40% паци-
ентов с инфекционным эндокардитом (см. главу 22)
[21]. Кроме того, немые инфаркты мозга при маг-
нитно-резонансной томографии (МРТ) обнаружи-
ваются примерно у 50% пациентов с инфекцион-
ным эндокардитом [22]. Мишенями для эмболов в
большом круге кровообращения чаще всего стано-
вятся селезенка, печень, почки, подвздошные или
брыжеечные артерии [21]. У 2781 пациентов наибо-
лее распространенными осложнениями инфекци-
онного эндокардита были инсульт (16,9%), перифе-
рические эмболии (22,6%) и сердечная недостаточ-
ность (32,3%). Частота эмболических событий при
инфекционном эндокардите быстро уменьшается
после начала эффективной антибактериальной те-
рапии [21]. У 1437 пациентов с инфекционным эн-
докардитом с преимущественным поражением ле-
вых отделов сердца частота инсульта снизилась с
4,82 на 1000 человек во время первой недели лече-
ния, до 1,71 на 1000 во время второй недели и про-
должала снижаться в дальнейшем, независимо от
пораженного клапана или микроорганизма, вы-
звавшего воспалительный процесс [23]. В целом
только у 3,1% пациентов наблюдался инсульт после
первой недели терапии [23]. Раннее хирургическое
вмешательство может давать достоверное снижение
летальности, особенно у пациентов с высоким ри-
ском осложнений. В исследовании 1552 пациентов с
инфекционным эндокардитом естественного кла-
пана хирургические вмешательства были связаны
со значительным снижением летальности (12,2%
vs 20,1%; p < 0,001) [24]. Пациенты с инсультом
(p = 0,02) или периферическими эмболиями
(p = 0,002) были среди тех, у кого хирургическое ле-
чение оказалось наиболее эффективным [24]. Та-
ким образом, раннее выявление инфекционного эн-
докардита имеет особое значение у больных с эмбо-
лиями из-за потенциального влияния на выбор
метода лечения.
ЧПЭхоКГ является методом выбора для иденти-
фикации вегетаций на клапанах при инфекцион-
ном эндокардите (рис. 40.3). Чувствительность
ch40_условно.indd 1035
03.04.2019 12:15:44
1036 ЧАСТЬ VII Сосудистые и системные заболевания
ТТЭхоКГ в диагностике инфекционного эндокар-
дита составляет лишь около 58–63% [25–27], хотя
его специфичность крайне высока (95–100%) [25–
27]. Продвинутые эхокардиографические методи-
ки, такие как гармоническая визуализация, не де-
монстрируют значительного улучшения чувстви-
тельности ТТЭхоКГ при диагностике вегетаций на
клапанах [28]. Чувствительность ЧПЭхоКГ очень
высока (90–100%), как и его специфичность (98–
100%) [25, 26]. Эхокардиографическими характери-
стиками вегетаций, которые влияют на их эмболи-
ческий потенциал, являются размер (> 10 мм увели-
чивает риск), распространенность (более одной
створки или клапана) и подвижность [29]. Отрица-
тельные результаты ЧПЭхоКГ имеет высокую отри-
цательную прогностическую значимость при ин-
фекционном эндокардите, в диапазоне от 86 до 97%
[30]. Однако если ЧПЭхоКГ выполняется на ранних
стадиях заболевания, она может дать отрицатель-
ные результаты, т.к. вегетации еще формируются,
поэтому рекомендуется задуматься о повторном ис-
следовании в тех случаях, когда клиническое подо-
зрение на инфекционный эндокардит остается вы-
соким [30–32].
Вегетации на протезе клапана еще труднее обна-
ружить с помощью ТТЭхоКГ, потому что сам про-
тез может располагаться между ультразвуковым лу-
чом и вегетациями, особенно в случае протезирова-
ния митрального клапана (см. главу 24). Поэтому
чувствительность ТТЭхоКГ при инфекционном эн-
докардите протезированного клапана очень низкая,
в то время как имеются данные о том, что чувстви-
тельность ЧПЭхоКГ составляет 86–94%, а специ-
фичность 88–100% [33]. Таким образом, ЧПЭхоКГ
рекомендуется в качестве начального диагностиче-
ского теста у всех пациентов с подозрением на ин-
фекционный эндокардит протезированного клапа-
на (рис. 40.4) [34].
Вегетации клапанов или схожие повреждения
могут быть обнаружены и у пациентов без инфек-
ционного эндокардита. Возможные причины их пе-
речислены в табл. 40.5 . Клиническое течение забо-
WATCH [20] (n = 1587)
Медианный период
наблюдения 19 мес
Варфарин (В)
(n = 540)
Аспирин (А)
(n = 523)
Клопидогрел (К)
(n = 524)
р
n
Частота
(%)
n
Частота
(%)
n
Частота
(%)
ВvsА
ВvsК АvsК
Смерть
92
17,0
94 18,0
96
18,3
0,69
0,58
0,88
Ишемический инсульт
3
0,6
12 2,3
12
2,3
0,02
0,02
1,0
Периферическая
эмболия
2
0,4
4 0,8
4
0,8
0,39
0,39
1,0
Легочная эмболия
1
0,2
2 0,4
1
0,2
0,55
0,56
0,98
Большое кровотечение
28
5,2
19 3,6
11
2,1
0,22
0,007
0,14
Внутримозговое
кровотечение
6
1,1
3 0,6
1
0,2
0,34
0,06
0,32
WARCEF [20] (n = 2305)
Медианный период наблюдения 42 мес
Варфарин (В)
(n = 1142) 4045 лет
Аспирин (А)
(n = 1163) 4033 года
HR*
(ДИ 95%)
р
n
Частота/год
(%)
n
Частота/год
(%)
Смерть
268
6,63
263
6,52
1,01 (0,85–1,21) 0,91
Ишемический инсульт
29
0,72
55
1,36
0,52 (0,33–0,82) 0,005
Периферическая эмболия
5
0,015
3
0,007
н/д
0,46
Легочная эмболия
5
0,015
6
0,014
н/д
0,79
Большое кровотечение
72
1,78
35
0,87
2,05 (1,36–3,12) < 0,001
Внутримозговое кровотечение
5
0,12
2
0,05
2,22 (0,43–11,66 0,35
Примечание. Для WATCH приведены кумулятивные частоты событий, для WARCEF — частота событий в год.
* Скорректировано с учетом демографических данных и сердечно-сосудистых факторов риска.
WARCEF — сравнение варфарина с аспирином при сниженной фракции выброса; WATCH — варфарин и антитромбоцитарная терапия
при хронической сердечной недостаточности; ДИ — доверительный интервал; н/д — нет данных.
ТАБЛИЦА 40.4 Антитромботическое лечение и риск эмболии при сердечной недостаточности:
результаты исследований WATCH и WARCEF
ch40_условно.indd 1036
03.04.2019 12:15:45
1037
40 Эмболия сосудов большого круга кровообращения
левания и результаты других диагностических ме-
тодов имеют решающее значение для правильной
постановки диагноза.
Нитевидные ворсинки, также известные как на-
росты Ламбла, являются довольно распространен-
ной находкой при ЧПЭхоКГ митрального и аор-
тального клапанов, особенно у пожилых людей. Ча-
ще они встречаются у женщин и чаще на аортальном,
чем на митральном, клапане (рис. 40.5) [35]. Обыч-
но они представляют собой отложения фибрина,
растущие на краях клапана. Ворсинки клапанов со-
четаются с повышенным риском развития инсульта
или транзиторных ишемических атак в случай-кон-
тролируемых исследованиях [36, 37]. У пациентов с
ворсинками клапанов, случайно обнаруженными
при ЧПЭхоКГ, было отмечено увеличение частоты
инсультов с 1 до 2% при среднем периоде наблюде-
ния 4 года [38]. Однако в другом исследовании у па-
ЛЖ
ЛП
А
Б
Рис. 40.3 Визуализация вегетаций митрального клапана с помощью
чреспищеводной эхокардиографии. (А) A Большая вегетация (стрелка)
в левом предсердии (ЛП) визуализируется на предсердной поверхности зад-
ней створки митрального клапана и на фиброзном кольце митрального клапа-
на. (Б) A Трехмерная визуализация той же вегетации на клапане (стрелка) в
позиции предсердия. ЛЖ — левый желудочек.
ЛП
ЛЖ
КМП
ЛЖ
ЛП
В
А
Б
Рис. 40.4 Визуализация вегетаций на протезе митрального клапана
с помощью чреспищеводной эхокардиографии. (А) A Вегетация (крас-
ная стрелка) визуализируется на предсердной поверхности биологического
протеза. Обратите внимание на подобное естественному клапану изображение
створок, а также распорки, поддерживающие клапан (белые стрелки). (Б) A
Большая вегетация (стрелка) на медиальной части кольца клапана механиче-
ского протеза (КМП). Визуализируются две полуоткрытые створки протеза.
(В) A Тот же пациент что и на (Б). Трехмерное изображение позволяет пока-
зать вегетации на кольце протеза (стрелка) в предсердной (верхней) позиции.
ЛЖ — левый желудочек; ЛП — левое предсердие.
ch40_условно.indd 1037
03.04.2019 12:15:45
1038 ЧАСТЬ VII Сосудистые и системные заболевания
той эмболий (см. главу 46). Это особенно актуально
для двух наиболее распространенных разновидно-
стей опухолей: миксомы и папиллярной фиброэла-
стомы. Примерно 75% всех опухолей сердца явля-
ются доброкачественными, и в 50% случаев они
представлены миксомами [42]. Три из четырех мик-
сом формируются в левом предсердии (ЛП), осо-
бенно в овальном окне межпредсердной перегород-
ки [43], хотя возможно их формирование на клапа-
не или другом участке эндокарда (рис. 40.6А). По
оценкам, от 30 до 40% миксом в конечном итоге
приводят к эмболиям [43], при этом более чем в
50% случаев — в мозговой кровоток. Фрагментиро-
вание опухоли или эмболизация тромба, образо-
вавшегося на поверхности опухоли, описываются в
качестве механизмов эмболоизации. Морфологиче-
ские признаки миксомы являются важным факто-
ром, определяющим риск эмболизации. Крупные
подвижные миксомы или опухоли с наличием вор-
синок более вероятно могут привести к форми-
рованию эмболов, чем имеющие более солидную,
полиповидную структуру [43]. ТТЭхоКГ может
идентифицировать даже относительно небольшие
миксомы (см. рис. 40.6Б). ЧПЭхоКГ, тем не менее
может выявить более мелкие опухоли и определить
морфологические аспекты, имеющие значение для
планирования хирургического удаления, такие как
место прикрепления к стенке и положение относи-
тельно соседних структур сердца (см. рис. 40.6В).
Трехмерное изображение также может помочь при
составлении плана операции, поскольку позволяет
получить изображения, похожие на ту картину, ко-
торую будет наблюдать хирург во время хирургиче-
ского вмешательства (см. рис. 40.6Г). Хирургиче-
ская резекция рекомендуется во всех случаях, осо-
бенно, когда морфологические характеристики
соответствуют высокому риску.
Папиллярные фиброэластомы также обычно свя-
заны с эмболиями мозговых сосудов. Эмболии ча-
сто являются их первым клиническим проявлени-
ем, т.к. преимущественным местом их локализации
являются высокоподвижные створки клапана. Боль-
шинство фиброэластом диагностируют на четвер-
том или пятом десятилетии жизни, часто после эпи-
зода ишемии головного мозга или сердца. В обзоре
725 случаев наиболее частой локализацией был аор-
тальный клапан, затем — митральный клапан, в то
время как наиболее распространенной внеклапан-
ной локализацией является ЛЖ [44]. Среди морфо-
логических характеристик только подвижность
опухоли была независимым предиктором смерти
или не фатальных эмболий [44]. Фиброэластомы
часто расположены на аортальной стороне аорталь-
ного клапана, в отличие от вегетаций, которые име-
ют тенденцию к росту на желудочковой стороне
(рис. 40.7). Клинически значимая папиллярная фи-
броэластома может иметь размер всего в несколько
миллиметров, что делает ЧПЭхоКГ гораздо лучшим
ЛП
ВАо
Рис. 40.5 A Визуализация ворсинок (стрелка) на желудочковой по-
верхности аортального клапана. Две мелкие обызвествленные бляшки
(острия) видны на стенке аорты. ВАо — восходящий отдел аорты; ЛП — ле-
вое предсердие.
Дегенеративное или миксоматозное поражение клапанов
Системная красная волчанка (синдром Либмана–Сакса,
у одного из десяти пациентов)
Системные воспалительные заболевания, антифосфолипид-
ный синдром, злокачественные новообразования (токси-
ческий эндокардит)
Разрыв хорды
Мелкие внутрисердечные опухоли
Наросты Лямбля
ТАБЛИЦА 40.5 Дифференциальный диагноз
при клапанных образованиях
циентов с ворсинками клапанов эмболия наблюда-
лась лишь в 27% [35]. Необходимость проведения
профилактического лечения и его идеальный вари-
ант поэтому остаются неясными. У 619 больных с
острым ишемическим инсультом, которым прово-
дили ЧПЭхоКГ и которым в случайном порядке бы-
ло назначено лечение варфарином или аспирином,
в течение двухлетнего периода наблюдения не было
выявлено повышенного риска повторного инсульта
(HR 1,05; 95% ДИ от 0,70 до 1,57; p = 0,82) [39]. Вор-
синки часто встречаются на протезах клапанов, осо-
бенно митрального. У 300 пациентов с протезами
клапанов левых отделов сердца ворсинки встреча-
лись в 49% случаев [40]. Более низкий уровень коа-
гуляции (МНО < 2,5) был статистически значим и
связан с наличием ворсинок, что позволяет предпо-
ложить, что у этих пациентов может возникнуть не-
обходимость в более «агрессивной» терапии анти-
коагулянтами [40].
ВНУТРИСЕРДЕЧНЫЕ ОПУХОЛИ
Первичные внутрисердечные опухоли встречаются
редко. Так, в серии неотобранных аутопсий они бы-
ли менее чем в 0,2% случаев [41]. При их наличии,
однако, наблюдается ассоциация с высокой часто-
ch40_условно.indd 1038
03.04.2019 12:15:46
1039
40 Эмболия сосудов большого круга кровообращения
вариантом визуализации в сравнении с ТТЭхоКГ.
На рис. 40.8 представлен пример роста фиброэла-
стомы на митральном клапане. Несмотря на отсут-
ствие контролируемых исследований лечения, хи-
рургическая резекция показана для всех пациентов
с клиническими проявлениями. Пациентам без кли-
нических симптомов при неподвижных опухолях
часто назначаются пероральные антикоагулянты, а
резекцию, в свою очередь, следует рассматривать
как метод лечения только при наличии подвижно-
сти опухоли [44].
Первичные злокачественные опухоли сердца
встречаются редко, их частота при аутопсии состав-
ляет 0,001–0,03% [42]. Саркомы являются наиболее
распространенными первичными злокачественны-
ми опухолями сердца [45]. Они проявляются об-
струкцией кровотока, эмболиями в большой круг
кровообращения или мозговые сосуды, клиниче-
скими симптомами со стороны системы кровообра-
щения или общего состояния больного. Метастазы
опухолей сердца встречаются в 20–40 раз чаще, чем
первичные опухоли [41]; легкие являются наиболее
частой локализацией первичной опухоли [46]. При
оценке риска осложнения эмболией подходы в от-
ношении ТТЭхоКГ и ЧПЭхоКГ идентичны таковым
при доброкачественных опухолях. ЧПЭхоКГ также
очень эффективна при оценке распространения
опухоли на прилежащие структуры и кровеносные
сосуды, что может иметь решающее значение для
принятия решения о хирургическом лечении.
ТРОМБЫ ЛЕВОГО ПРЕДСЕРДИЯ
И СПОНТАННОЕ ЭХОКОНТРАСТИРОВАНИЕ
Наличие тромба в ЛП связано со значительным ри-
ском эмболии в большой круг кровообращения.
Тромбоз ЛП, особенно его ушка, является распро-
ЛП
ЛЖ
ЛП
ЛЖ
ПЖ
ПП
ЛП
ПП
М
ПЖ
ЛЖ
А
Б
Г
В
Рис. 40.6 Миксома в левом предсердии. (А) A Миксома (М) на ТТЭхоКГ (стрелка), предсердная сторона передней створки митрального клапана. (Б) A
ТТЭхоКГ у другого пациента визуализирует миксому межпредсердной перегородки малых размеров (стрелка) в области овального окна, выступающую в полость
левого предсердия (ЛП). (В) A ЧПЭхоКГ визуализирует большую миксому (стрелка), практически полностью заполняющую полость левого предсердия и высту-
пающую через митральный клапан. (Г) A Трехмерное изображение опухоли, представленной на (В), позволяет лучше визуализировать локализацию опухоли в
области овального окна (стрелка), что полезно для планирования резекции опухоли. ЛЖ — левый желудочек; ПЖ — правый желудочек; ПП — правое предсер-
дие.
ch40_условно.indd 1039
03.04.2019 12:15:47
1040 ЧАСТЬ VII Сосудистые и системные заболевания
страненным явлением при мерцательной аритмии
(см. главу 42), хотя иногда наблюдается у пациентов
с синусовым ритмом и недавно перенесенным цере-
бральным ишемическим событием, особенно при
наличии дисфункции ЛЖ [47].
Из-за близости к ЛП и, как следствие, возможно-
сти использования высокочастотных датчиков,
ЧПЭхоКГ является методом выбора визуализации
ЛП и особенно его ушка, которое редко удается ви-
зуализировать при ТТЭхоКГ. При использовании
современных датчиков УЛП можно визуализиро-
вать под разными углами и провести тщательное
исследование на наличие тромбов. Можно оценить
наличие нормальных трабекул ушка и гребенчатых
мышц (рис. 40.9А). Чувствительность ЧПЭхоКГ для
обнаружения тромба составляет 90–95%, а его спец-
ифичность 95–100% [48]. Пример тромба в УЛП по-
казан на рис. 40.9Б. Трехмерное изображение может
также способствовать лучшей визуализации тромба
путем предоставления альтернативных проекций
(см. рис. 40.9В). Частота тромбоза ЛП при фибрил-
ляции предсердий составляет более 20% [49]. У па-
циентов с недавними эмболическими событиями
частота тромбоза — 22 –43% [49, 50]. Хотя обычно
тромбы в ЛП встречаются при хронической фи-
брилляции предсердий (27%), они также часто на-
ПП
ЛП
А
Б
Рис. 40.7 Папиллярная фиброэластома малых размеров на аорталь-
ном клапане при чреспищеводной эхокардиографии. (А) A Небольшое
яркое эхопрозрачное образование (стрелка) на аортальной поверхности левой
коронарной створки, позволяющее заподозрить фиброэластому (обратите вни-
мание на подъем левой коронарной артерии). (Б) A Трехмерная визуализа-
ция четко показывает небольшую опухоль (стрелка) во время открытия клапа-
на. ЛП — левое предсердие; ПП — правое предсердие.
ЛП
УЛП
ЛЖ
А
Б
Рис. 40.8 Фиброэластома малых размеров на митральном клапане-
при чреспищеводной эхокардиографии. (А) A В позиции по длинной оси
во время закрытия митрального клапана на его предсердной поверхности вид-
на фиброэластома малых размеров (стрелка). Справа — ушко левого пред-
сердия (УЛП). (Б) A Трехмерная визуализация позволяет рассмотреть ту же
опухоль (стрелка) со стороны предсердия. Так можно лучше оценить размеры
и расположение опухоли (так видит опухоль хирург во время операции после
вскрытия стенки предсердия). Это может помочь спланировать ход операции.
ЛЖ — левый желудочек; ЛП — левое предсердие.
ch40_условно.indd 1040
03.04.2019 12:15:47
1041
40 Эмболия сосудов большого круга кровообращения
блюдаются при фибрилляции предсердий продол-
жительностью менее 3 сут (14%) [49], особенно при
сопутствующих эмболических событиях (21–43%)
[49, 50].
К формированию тромбов в ЛП предраспола-
гают различные состояния. Снижение систоличе-
ской функции ЛЖ демонстрирует увеличение их
частоты, даже у пациентов с синусовым ритмом. У
48 пациентов с синусовым ритмом и фракцией вы-
броса ЛЖ < 45% при ЧПЭхоКГ тромбы предсердия
были выявлены у 10 (21%) [51]. Фракция выброса
ЛЖ < 35% была одним из двух независимых про-
гностических факторов наличия тромба, другим
была скорость кровотока в УЛП 55 см/сек и меньше
[51]. Измерение скорости кровотока в ушке явля-
ется эффективным клиническим маркером риска
тромбообразования. Измерение выполняется с по-
мощью импульсно-волновой допплерометрии на
входе в ушко у всех пациентов при проведении
ЧПЭхоКГ и иногда при ТТЭхоКГ (рис. 40.10А).
У пациентов с нормальным УЛП наблюдается
скорость кровотока от 55 до 80 см/сек, возможно, и
больше. Риск образования тромба возникает при
скорости кровотока < 55 см/сек [52] и увеличивает-
ся по мере ее снижения. В дополнительном исследо-
вании ЧПЭхоКГ в рамках исследования «Преду-
преждение инсульта при фибрилляции предсердий
III» (SPAF III) скорость кровотока 20 см/сек и мень-
ше была связана с увеличением частоты образова-
нии тромбов (17% по сравнению с 5% у пациентов
с более высокой скоростью, р < 0,001) [53].
Снижение скорости кровотока в ЛП также опре-
деляет другой важный признак при ЧПЭхоКГ, свя-
занный с образованием тромбов и повышенным
риском тромбоэмболии, — наличие спонтанного
эхоконтрастирования. Спонтанное эхоконтрасти-
рование определяется как динамические, медленно
вращающиеся эховключения, напоминающие та-
бачный дым в полости предсердия или его ушка
(см. рис. 40.10Б). Спонтанное эхоконтрастирование
представляет собой повышенную эхогенность из-за
агрегации клеток крови при низких скоростях сдви-
га и, поэтому, являются индикаторами застоя крови
или низкой скорости кровотока. Спонтанное кон-
трастирование было связано как с резким (< 25 см/
сек) [54], так и с незначительным или умеренным
(ниже 55 см/сек) уменьшением скорости кровотока
в ушке предсердия [52]. Спонтанное эхоконтрасти-
рование иногда может наблюдаться на ТТЭхоКГ
при состояниях с низкой скоростью кровотока (на-
пример, в ЛЖ или аорте у больных с резко снижен-
ной функцией ЛЖ). Но из-за более высокой часто-
ты датчика и более близкого расположения датчика
к ЛП спонтанное эхоконтрастирование лучше визу-
ализируется при ЧПЭхоКГ.
Точные настройки усиления и сжатия необходи-
мы для оптимизации изображения и увеличения
частоты выявления спонтанного эхоконтрастиро-
ЛП
Ао
ЛП
А
Б
В
Рис. 40.9 Визуализация ушка левого предсердия при чреспищевод-
ной эхокардиографии. (А) A В ушке левого предсердия (ЛП) визуализи-
руются выраженные гребенчатые мышцы (стрелки) в виде множества линей-
ных структур, пересекающих просвет ушка. (Б) A У другого пациента виден
тромб (стрелка) на медиальной стенке ушка возле его верхушки. Также опре-
деляется спонтанное эхоконтрастирование (острие стрелки) — другой важный
предиктор образования тромба и эмболии. (В) A Трехмерное изображение со
стороны предсердия у того же пациента демонстрирует выпячивание тромба
(стрелка) в направлении полости предсердия. Ао — аорта.
ch40_условно.indd 1041
03.04.2019 12:15:48
1042 ЧАСТЬ VII Сосудистые и системные заболевания
вания. Относительно высокие настройки усиления
могут быть необходимы для максимальной частоты
обнаружения данного признака, а артефакты бело-
го шума, возникающие при этих параметрах, обыч-
но можно отличить по их фиксированному положе-
нию и отсутствию вращения. Предсердие и его
ушко необходимо визуализировать в различных
проекциях, должно быть потрачено достаточное ко-
личество времени для обеспечения визуализации
такого часто транзиторного феномена, как спонтан-
ное эхоконтрастирование. Этот признак в ЛП опре-
деляется более чем у 50% пациентов с мерцательной
аритмией, которым проводили ЧПЭхоКГ. В серии с
участием 272 пациентов спонтанное эхоконтрасти-
рование было обнаружено у 161 пациента (59%). В
течение среднего периода наблюдения в 17,5 мес ча-
стота инсульта или других эмболических событий
была выше в 4 раза у пациентов со спонтанным эхо-
контрастированием (12%/год по сравнению с 3%/
год, р = 0,002) [55]. Спонтанное эхоконтрастирова-
ние также коррелировало с увеличением летально-
сти (25 в сравнении с 11 случаями смерти, р = 0,025)
[55]. В исследовании SPAF III наличие спонтанного
эхоконтрастирования почти в 3 раза повышало
риск инсульта [52]. У 295 пациентов с фибрилляци-
ей предсердий, не связанным с патологией клапа-
нов, наличие спонтанного эхоконтрастирования
или тромбов повышало летальность в 3 раза при на-
блюдении в течение 5 лет [56], хотя данная патоло-
гия не была независимым предиктором инсульта
или летального исхода у пациентов, получавших те-
рапию антикоагулянтами (OR 1,55; 95% ДИ 0,50–
4,83).
Переменные, полученные при ЧПЭхоКГ и опи-
санные ранее (тромбы УЛП и снижение скорости
кровотока в нем; спонтанное эхоконтрастирова-
ние), могут также помочь в определении тактики
лечения, направленного на предупреждение тром-
боэмболических осложнений у пациентов с фи-
брилляцией предсердий. Хотя прогностические
шкалы, такие как CHADS2 (сердечная недостаточ-
ность, гипертензия, возраст > 75 лет, сахарный диа-
бет, инсульт или транзиторная ишемическая атака
[дважды], [57]) и CHA2DS2-VASc (в которую добав-
лены сосудистые заболевания, возраст 65–74 года и
женский пол, а также в 2 раза увеличены баллы для
возраста > 75 лет [57]) были разработаны для оцен-
ки вероятности случайных событий [58], некоторые
моменты до сих пор не ясны. В целом пероральные
антикоагулянты рекомендуются при ожидаемом
риске инсульта 2% в год и более; с другой стороны,
пациентам с ожидаемым риском инсульта ниже,
чем 1% в год, можно назначить аспирин или вовсе
обойтись без лечения.
С промежуточной группой риска дела обстоят не
так просто. В Протоколах по фибрилляции пред-
сердий, выпущенных в 2014 г. American College of
Cardiology (ACC)/American Heart Association (AHA)/
Heart Rhythm Society (HRS), рекомендуется начи-
нать прием оральных антикоагулянтов при 2 баллах
по шкале CHA2DS2-VASc, при 0 баллов антитромбо-
тическую терапию проводить не следует [1]. Упоми-
налось о применении других оральных антикоагу-
лянтов, за исключением аспирина, или отсутствии
терапии у пациентов с 1 баллом по шкале CHA2DS2-
VASc, но уровень доказательности был низким. Ис-
пользование ЧПЭхоКГ и выявление одного из эхо-
кардиографических показателей высокого риска
(описаны ранее) может повлиять на выбор лечения
в пользу антикоагулянтной терапии. Среди новых
вариантов лечения стоит отметить оральные инги-
биторы тромбина, которые показали свою эффек-
тивность в предотвращении инсультов при фи-
А
Б
Рис. 40.10 Оценка эмболического потенциала ушка левого предсер-
дия. (А) Исследование ушка с помощью импульсно-волновой допплерогра-
фии. Поскольку опустошение ушка направлено к датчику, то скорости выше
обычного уровня показывают скорость опорожнения. Здесь определяется низ-
кая скорость опорожнения (около 20 см/сек; см. шкалу в правой части экрана
монитора), что связано с увеличенным риском образования тромбов и увели-
чением риска эмболии. (Б) A Пример плотного спонтанного эхоконтрастиро-
вания (стрелки) в левом предсердии. Показаны ортогональные виды визуали-
зации ушка. Настройки выставлены так, чтобы максимально уменьшить шумы.
ch40_условно.indd 1042
03.04.2019 12:15:49
1043
40 Эмболия сосудов большого круга кровообращения
брилляции предсердий, как минимум сравнимую с
варфарином [59–62]. Кроме того, риск серьезных
геморрагических осложнений при их приеме, как
правило, ниже, а также пропадает необходимость в
частых лабораторных тестах (табл. 40.6).
Применение ЧПЭхоКГ при фибрилляции пред-
сердий не ограничивается оценкой наличия тром-
бов или спонтанного эхоконтрастирования. В до-
полнительном ЧПЭхоКГ исследовании SPAF III сре-
ди множества возможных предикторов событий
только спонтанное эхоконтрастирование и слож-
ные бляшки дуги аорты были независимо связаны
с рецидивами сердечно-сосудистых событий. Тера-
пия корригированными дозами варфарина снизила
частоту событий на 75% у пациентов с мерцатель-
ной аритмией и сложными бляшками дуги аорты
(4,0% vs 15,8%, р = 0,02). У пациентов, ЧПЭхоКГ у
которых не идентифицировало такие бляшки, ча-
стота событий была низкой (1,1–1,2% в год) незави-
симо от типа проводимого лечения [52].
ЧПЭхоКГ может также использоваться для ис-
ключения наличия тромбов в ЛП перед кардиовер-
сией при фибрилляции предсердий, устраняя необ-
Исследование, препарат, доза
Пациенты (n)
Частота
событий
(%/год)
HR
р
Нет
превосходства Превосходство
RE-LY [59]
Дабигатран, 150 мг, 2 раза в день
6076
1,11
0,66
< 0,001
< 0,001
Дабигатран, 110 мг, 2 раза в день
6015
1,53
0,91
< 0,001
0,34
Варфарин
6022
1,69
Референсное
значение
Референсное
значение
Референсное
значение
ROCKET AF [60]
Ривароксабан, 20 мг, 1 раз в день
7131
1,7
0,79
< 0,001
0,12
Варфарин
713
2,2
Референсное
значение
Референсное
значение
Референсное
значение
ARISTOTLE [61]
Апиксабан, 5 мг, 2 раза в день
9120
1,27
0,79
< 0,001
0,01
Варфарин
9081
1,60
Референсное
значение
Референсное
значение
Референсное
значение
ENGAGE-AF TIMI 48 [62]
Эдоксабан, 60 мг, 1 раз в день
7035
1,18
0,79
< 0,001
0,08
Эдоксабан, 30 мг, 1 раз в день
7034
1,61
1,07
0,005
0,10
Варфарин
7036
1,50
Референсное
значение
Референсное
значение
Референсное
значение
ARISTOTLE — применение апиксабана для снижения инсульта и других тромбоэмболических событий при фибрилляции предсердий;
ENGAGE-AF TIMI 48 — эффективная антикоагулянтная терапия с оценкой по фактору Ха нового поколения при фибрилляции предсер-
дий — тромболизис при инфаркте миокарда 48; RE-LY
—
рандомизированная оценка длительной антикоагулянтной терапии; ROCKET
AF — сравнение прямого ингибирования фактора Ха путем приема ривароксабана 1 раз в день и антагонистического воздействия на ви-
тамин K в целях профилактики инсульта и эмболий при фибрилляции предсердий.
ТАБЛИЦА 40.6 Клинические исследования, сравнивающие новые оральные системные антикоагулянты
и варфарин при профилактике инсульта и эмболий при неклапанной фибрилляции предсердий
ходимость нескольких недель перед проведением
процедуры приема антикоагулянтов. В исследовании
«Использование ЧПЭхоКГ в оценке кардиоверсии»
(ACUTE) была показана безопасность и эффектив-
ность стратегии сокращения антикоагулянтной тера-
пии перед проведением кардиоверсии, основанной
на показаниях ЧПЭхоКГ (табл. 40.7) [63].
ПАТОЛОГИЯ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Наличие открытого овального окна связано с повы-
шенным риском развития ишемического инсульта,
особенно криптогенного. Овальное окно, нормаль-
ная составляющая кровообращения плода, закры-
вается после рождения, но может оставаться ча-
стично открытым у 15–35% здоровых людей [64].
Аневризма межпредсердной перегородки, ограни-
ченное выпячивание перегородки в любую из камер
предсердия, также связана с повышенным риском
эмболии. Аневризма межпредсердной перегород-
ки редко встречается в общей популяции (≈ 1–4%
пациентов) [65, 66], но если она есть, то сочетается
с открытым овальным окном более чем в 60% слу-
чаев.
ch40_условно.indd 1043
03.04.2019 12:15:49
1044 ЧАСТЬ VII Сосудистые и системные заболевания
ВЫЯВЛЕНИЕ ОТКРЫТОГО ОВАЛЬНОГО ОКНА
Тогда как дефект межпредсердной перегородки —
это фиксированное отверстие, создающее условия
для двунаправленного шунтирования крови, то от-
крытое овальное окно является функциональным
отверстием, открывающееся лишь в том случае, ес-
ли давление в правом предсердии (ПП) превышает
давление в ЛП. Таким образом, методы диагности-
ки открытого овального окна основаны на визуали-
зации право-левого шунта в состоянии покоя или
во время специальных приемов, таких как кашель
или проба Вальсальвы, которые увеличивают дав-
ление в ПП. Обычно используется ТТЭхоКГ или
ЧПЭхоКГ с введением контрастного средства (на-
сыщенные газом, взвешенный солевой или полиже-
латиновые агенты). Рекомендуется 5 инъекций при
различных состояниях (покой, проба Вальсальвы,
кашель).
ЧПЭхоКГ обладает до 100% чувствительностью
и специфичностью в выявлении открытого оваль-
ного окна при использовании цветовой доппле-
рографии и оценке распределения контраста. Рас-
пространенность открытого овального окна при
проведении ЧПЭхоКГ исследования в выборочной
совокупности генеральной популяции составила
24,3% [65], что аналогично наблюдениям при ау-
топсии. При использовании продольной бикаваль-
ной проекции ЧПЭхоКГ часто позволяет провести
прямую визуализацию и измерение открытого
овального окна, полуколичественную оценку вели-
чины шунта (путем подсчета микропузырьков, про-
ходящих через отверстие шунта) и дифференци-
альную диагностику с шунтом, обусловленным
внутрилегочным шунтом, который может быть ис-
ключен путем непосредственной визуализации ле-
гочных вен (рис. 40.11). Для лучшей оценки разме-
ра открытого овального окна можно использовать
трехмерную визуализацию (рис. 40.12А). ЧПЭхоКГ
является очень точным методом выявления анев-
ризмы межпредсердной перегородки, обычно диа-
гностируемой по протрузии перегородки не менее
10 мм с максимальным смещением перегородки от
средней линии в любое предсердие (рис. 40.13А).
Поскольку ЧПЭхоКГ является полуинвазивным
методом, который требует проведения седатации,
его использование целесообразно в диагностически
сомнительных случаях или когда необходима мор-
фологическая характеристика открытого овального
окна (например, когда планируется проведение его
закрытия). С целью скрининга проводят контраст-
ную ТТЭхоКГ. Этот метод визуализации имеет бо-
лее низкую чувствительность, чем ЧПЭхоКГ, при
диагностике открытого овального окна (50–60%),
но недавние достижения в области техники визуа-
лизации улучшили чувствительность (80–90%) (см.
рис. 40.12Б) [67]. В выборочной совокупности гене-
ральной популяции населения при проведении
ТТЭхоКГ с контрастированием открытое овальное
окно было обнаружено в 14,9% [66]. Прямая визуа-
лизация открытого овального окна с помощью
ТТЭхоКГ невозможна, поэтому дифференцировка
его от внутрилегочного шунта основана на времени
появления микропузырьков в левых отделах сердца
(в течение трех сердечных циклов от полного по-
мутнения ПП при открытом овальном окне; за-
держка в случае внутрилегочного шунта). Аневриз-
ма межпредсердной перегородки также может быть
визуализирована при ТТЭхоКГ, хоть и с меньшей
чувствительностью (см. рис. 40.13Б).
РИСК ИНСУЛЬТА
Парадоксальная эмболизация (т.е . эмболия в боль-
шой круг кровообращения тромбов, формирую-
щихся в венах большого круга) является предпола-
гаемым механизмом тромбоэмболий, который под-
тверждается обнаружением у некоторых пациентов
тромба, застрявшего в открытом овальном окне
(рис. 40.14). Взаимосвязь между открытым оваль-
ным окном и криптогенным инсультом была впер-
вые описана у пациентов моложе 55 [68] или 40 [69]
лет, а затем распространилась на пациентов пожи-
лого возраста [70]. Большое исследование с помо-
щью ЧПЭхоКГ подтвердило существование связи
между открытым овальным окном и инсультом в
старшей возрастной группе [71]. В целом данные
свидетельствуют о приблизительно четырехкрат-
Обычное лечение*
(n = 603)
Стратегия с использованием
ЧПЭхоКГ (n = 609)
p
Время кардиоверсии (сутки)
30,6
3,0
< 0,001
Успешная кардиоверсия (%)
65,2
71,1
0,03
Геморрагические осложнения (%)
5,5
2,9
0,03
Эмболические осложнения в течение 8 нед (%)
0,5
0,8
0,5
Примечание. Обе группы получали антикоагулянтную терапию в течение 4 нед после проведения кардиоверсии.
* Антикоагулянтная терапия в течение 3 нед до проведения кардиоверсии.
ACUTE — оценка проведения кардиоверсии с использованием ЧПЭхоКГ; ЧПЭхоКГ — чреспищеводная эхокардиография.
[Klein AL, Grimm RA, Murray RD, et al. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl
J Med 344:1411–1420, 2001.]
ТАБЛИЦА 40.7 Чреспищеводная эхокардиография перед кардиоверсией фибрилляции предсердий: исследование ACUTE
ch40_условно.indd 1044
03.04.2019 12:15:49
1045
40 Эмболия сосудов большого круга кровообращения
ЛП
ПП
ЛП
ПП
А
Б
Рис. 40.11 Визуализация открытого овального окна с помощью чреспищеводной эхокардиографии. (А) A В бикавальной позиции визуализируется
открытое овальное окно (стрелка, слева). Цветовая допплерография демонстрирует наличие шунта между предсердиями (стрелка, справа). Следует обратить вни-
мание на самое маленькое отверстие. (Б) A Открытое овальное окно при контрастной ЧПЭхоКГ. Контрастное средство заполняет правое предсердие (ПП), не-
сколько микропузырьков (стрелка) визуализируются в полости левого предсердия (ЛП). Исследование следует повторить после пробы Вальсальвы и кашля, что-
бы увеличить давление в правом предсердии и тем самым увеличить вероятность сброса крови справа налево.
ном увеличении риска развития инсульта при от-
крытом овальном окне у более молодых пациентов
и двукратном увеличении — у пациентов пожилого
возраста (табл. 40.8).
ВОЗМОЖНЫЕ СОПУТСТВУЮЩИЕ ФАКТОРЫ
В качестве потенциальных инсульта при открытом
овальном окне были предложены анатомические
характеристики межпредсердной перегородки и
ПП. Ширина разделения перегородки по данным
ЧПЭхоКГ имеет прямую корреляцию с повышен-
ным риском развития инсульта. Размеры открыто-
го овального окна 2 мм и более чаще наблюдаются
у пациентов с инсультом эмболического происхож-
дения, установленного на основе критериев визуа-
лизации головного мозга [72]. Размер открытого
овального окна > 4 мм может быть независимым
фактором риска развития рецидива цереброваску-
лярных событий [73]. Степень выраженности шун-
та, определяемая по количеству микропузырьков,
проходящих через открытое овальное окно, подсчи-
танных в ЛП в неподвижном кадре и во многом за-
висит от врача, проводящего исследование, поэто-
му такой подход не может использоваться для на-
дежной стратификации риска.
Наличие аневризмы межпредсердной перегород-
ки также было связано с повышенным риском раз-
вития инсульта (см. рис. 40.13). Поскольку аневриз-
ма межпредсердной перегородки обычно сочетается
с открытым овальным окном, а его величина у па-
циентов с аневризмой межпредсердной перегород-
ки имеет тенденцию к увеличению [74], то повы-
шенный риск инсульта часто считается следствием
наличия открытого овального окна. Однако, по дан-
ным метаанализа, более высокий риск развития ин-
сульта был у пациентов с открытым овальным ок-
ном в сочетании с аневризмой межпредсердной пе-
регородки, чем при наличии каждого из состояний
в отдельности [75]. Среди пациентов, перенесших
инсульт, моложе 55 лет и принимавших аспирин,
частота рецидива инсульта в течение 4 лет была за-
метно выше (15,2%) у тех, у кого открытое овальное
окно сочеталось с аневризмой межпредсердной пе-
регородки, чем у тех, у кого было лишь открытое
овальное окно (2,3%) [76]. По данным МРТ голов-
ного мозга, у пациентов с открытым овальным ок-
ном и аневризмой межпредсердной перегородки, по
сравнению с пациентам с изолированным откры-
тым овальным окном, чаще встречались множе-
ственные острые поражения головного мозга, даже
после учета поправок на размер открытого овально-
го окна, степень выраженности шунта и наличие со-
судистых факторов риска (53% vs 17%; р = 0,01) [77].
Поэтому больший риск инсульта может быть свя-
зан с наличием аневризмы межпредсердной перего-
родки, нежели с наличием сопутствующего откры-
того овального окна. Другие потенциальные меха-
низмы развития инсульта включают образование
тромба in situ, что встречается редко и, возможно,
предрасположенность к развитию предсердных
аритмий.
Выраженная евстахиева заслонка (остаток право-
го клапана венозного синуса плода, который на-
правляет кровь из нижней полой вены в овальное
отверстие) и сеть Киари (нити и волокна, вариа-
бельно соединяющие евстахиеву заслонку с други-
ми структурами предсердий) предположительно
участвуют в формировании риска парадоксальных
ch40_условно.indd 1045
03.04.2019 12:15:49
1046 ЧАСТЬ VII Сосудистые и системные заболевания
ЛП
ЛЖ
Вальсальва
А
Б
Рис. 40.12 Визуализация открытого овального окна с помощью трех-
мерной чреспищеводной эхокардиографии и трансторакальной эхо-
кардиографии. (А) A У пациента на рис. 40.11 трехмерное изображение по-
зволяет лучше визуализировать открытое овальное окно (стрелка). Это осо-
бенно полезно при планировании закрытия дефекта, т.к . позволяет выбрать
размер устройства, с помощью которого будет осуществляться пластика.
(Б) A Визуализация открытого овального окна с помощью ТТЭхоКГ с контра-
стирующим раствором у другого пациента. Контраст заполняет правое пред-
сердие и правый желудочек, делая видимым большой шунт из правых отделов
в левые. ЛЖ — левый желудочек; ЛП — левое предсердие.
ЛП
ПП
ВПВ
ЛЖ
ПЖ
ПП
ЛП
А
Б
Рис. 40.13 Эхокардиографическая визуализация аневризмы меж-
предсердной перегородки. (А) A Визуализация с помощью ЧПЭхоКГ в би-
кавальной позиции. Слева визуализируется большая аневризма межпредсерд-
ной перегородки (стрелка), выпячивающаяся в правое предсердие (ПП). Спра-
ва — открытое овальное окно (острие стрелки) при цветовой допплерографии.
(Б) A Визуализация с помощью ТТЭхоКГ большой аневризмы межпредсерд-
ной перегородки (стрелка), выпячивающейся в левое предсердие (ЛП). ВПВ —
верхняя полая вена; ЛЖ — левый желудочек; ПЖ — правый желудочек.
эмболий, но это пока достоверно не подтверждено.
Эмболия легочных сосудов, инфаркт ПЖ, выра-
женная трикуспидальная регургитация и наличие
вспомогательного устройства в ЛЖ — все это свя-
зано с увеличением объема шунта через открытое
овальное окно.
В нескольких публикациях сообщалось об уве-
личенной частоте тромбоза глубоких вен у больных
с криптогенным инсультом и открытым овальным
окном. Тромбозы вен таза обычно характерны для
молодых пациентов с криптогенным инсультом,
чем для больных с определенной причиной инсуль-
та [78].
Протромботические состояния могут увеличить
вероятность образования тромбов и, следовательно,
частоту парадоксальных эмболий. Увеличение рас-
пространенности мутации гена G20210A и фактора
V Лейден было зарегистрировано у пациентов с
криптогенным инсультом и открытым овальным
окном. Сочетание любого из указанных выше гено-
типов с открытым овальным окном увеличивает
риск инсульта в 4,7 раза [79]. Предполагается связь
между размером открытого овального окна и нали-
чием антифосфолипидных антител. Перенесенные
хирургические вмешательства, травмы или исполь-
зование оральных контрацептивов, может увели-
ch40_условно.indd 1046
03.04.2019 12:15:49
1047
40 Эмболия сосудов большого круга кровообращения
чить вероятность парадоксальной эмболии через
открытое овальное окно.
ПРОФИЛАКТИКА РЕЦИДИВОВ ЭМБОЛИИ
Поскольку парадоксальные эмболии являются пред-
полагаемым механизмом инсульта при открытом
овальном окне, проводились исследования эффек-
тивности профилактической антитромботической
терапии (системная антикоагулянтная терапия вар-
фарином, антитромбоцитарные препараты, такие
как аспирин). В последнее время также использу-
ется транскатетерное закрытие овального окна. В
единственном рандомизированном двойном сле-
пом исследовании медикаментозной терапии, 630
пациентам с некардиоэмболическим инсультом
был в случайном порядке назначен аспирин в дозе
325 мг или варфарин (целевое МНО 1,4–2,8) [80].
После двух лет наблюдения не было выявлено ни-
каких существенных различий в частоте рецидива
инсульта или смерти у пациентов с открытым
овальным окном и без него, как во всей исследуемой
группе (14,8% vs 15,4%; HR 0,96; 95% ДИ 0,62–1,48;
ЛП
ПП
Рис. 40.14 A Визуализация с помощью чреспищеводной эхокардио-
графии большого тромба (стрелка) в открытом овальном окне. Такое
редкое состояние является показанием к немедленному вмешательству (хи-
рургическому удалению, тромболизис и/или антикоагулянтной терапии), т.к .
оно несет крайне большой риск легочной, церебральной или системной эмбо-
лии. ЛП — левое предсердие; ПП — правое предсердие.
Младше 40–55 лет
Распространенность открытого овального окна
p
Исследование
n (пациентов)
Возраст (лет)
Криптогенный инсульт
Контроль
Lechat [68]
26
<55
54% (14/26)
10% (10/100)
< 0,001
Webster [69]
34
<40
56% (19/34)
15% (6/40)
< 0,001
Cabanes [69]*
64
<55
56% (36/64)
18% (9/50)
< 0,001
de Belder [69]*
,†
39
<55
13% (5/39)
3% (1/39)
–
Di Tullio [70]
21
<55
47% (10/21)
4% (1/24)†
< 0,001
Hausmann [70]*
18
<40
50% (9/18)
11% (2/18)
< 0,05
Handke [71]
82
<55
44% (36/82)
14% (7/49)†
< 0,001
ВСЕГО
285
45% (129/284)
11% (36/320)
< 0,001
Старше 40–55 лет
Распространенность открытого овального окна
p
Исследование
n (пациентов)
Возраст (лет)
Криптогенный инсульт
Контроль
De Belder [69]*
,†
64
>55
20% (13/64)
5% (3/56)
< 0,001
Di Tullio [70]
24
>55
38% (9/24)
8% (6/77)†
< 0,001
Hausmann [70]*
20
>40
15% (3/20)
23% (23/98)
Недостоверно
Jones [70]†
57
>50
18% (10/57)
16% (29/183)
Недостоверно
Handke [71]
145
>55
28% (41/145)
12% (28/232)†
< 0,001
ВСЕГО
310
25% (76/310)
14% (89/646)
< 0,001
* Включая различные подтипы инсульта.
† Контрольную группу составили пациенты с инсультом установленной этиологии.
ТАБЛИЦА 40.8 Взаимосвязь между открытым овальным окном и криптогенным инсультом
в различных возрастных группах
ch40_условно.indd 1047
03.04.2019 12:15:50
1048 ЧАСТЬ VII Сосудистые и системные заболевания
р = 0,84), так и в подгруппе пациентов с криптоген-
ным инсульта (14,3% vs 12,7%; HR 1,17; 95% ДИ
0,60–2,37; р = 0,65). Хотя сравнение между типами
антитромботической терапии не являлось основной
целью исследования, не было выявлено никаких су-
щественных различий в рецидивах инсульта или
летальности у пациентов, получавших варфарин
(9,5%) или аспирин (17,9%; HR 0,52; 95% ДИ 0,16–
1,67; р = 0,28). Размер открытого овального окна и
наличие сопутствующей аневризмы межпредсерд-
ной перегородки также не оказывает существенного
влияния на риск повторного инсульта [80]. Это так-
же было подтверждено в более недавнем исследова-
нии [81].
Принимая во внимание эффективность анти-
тромботической терапии в профилактике повтор-
ных инсультов, транскатетерное интервенционное
закрытие открытого овального окна, которое заме-
нило ранее использовавшееся закрытие хирургиче-
ским путем, считается показанным только в том
случае, если его эффективность в рандомизирован-
ных клинических исследованиях при определенной
патологии будет выше медикаментозной терапии
или у больных, которые отказываются или имеют
противопоказания к ее проведению. К настоящему
времени опубликовано три рандомизированных
исследования, сравнивающие закрытие открытого
овального окна с антитромботическим лечением
(табл. 40.9) [82–84]. Во всех трех исследованиях не
удалось продемонстрировать превосходство закры-
тия овального окна в предотвращении рецидивов,
хотя данные позволяют предположить о его боль-
шей эффективности в отдельных подгруппах, таких
как молодые пациенты [84] или с большим объе-
мом шунтирования [83].
ЧПЭхоКГ обычно применяется для контроля за
размещением устройства, закрывающего дефект
овального окна. Однако сейчас считается, что вну-
трисердечная ЭхоКГ (ВСЭхоКГ) по меньшей мере
не уступает по эффективности ЧПЭхоКГ. Дополни-
тельными преимуществами ее являются отсутствие
необходимости в седации пациента или дополни-
тельной эхокардиографической поддержки (см. гла-
ву 6). ТТЭхоКГ может использоваться при оценке
правильной постановки устройства, закрывающего
дефект, а также при оценке возможных осложнений
Исследование
Период
наблюдения
Закрытие овального
окна, % (n)
Медикаментозное
лечение, % (n)
p
CLOSURE 1 [82]
2 года
n=447
n=462
Инсульт
3,1 (12)
3,4 (13)
0,77*
ТИА
3,3 (13)
4,6 (17)
0,39*
Сложные
5,9 (25)
7,7 (30)
0,30*
RESPECT [83]
2,1 год (медиана) n = 499
n=481
Инсульт/смерть (45 сут со времени распределения
по группам или 30 сут с момента имплантации)
1,8 (9)
3,3 (16)
0,08†
Подгруппы
Большой шунт
ООО + АМП
0,8 (2/247)
1,1 (2/280)
4,3 (10/231)
5,3 (9/169)
0,07£
0,10£
PC [84]
4 года (среднее)
n=204
n=210
Инсульт, смерть, ТИА или эмболия перифериче-
ских сосудов
3,4 (7)
5,2 (11)
0,34§
Подгруппы
Возраст < 45 лет
ООО + АМП
1,1 (1/91)
8,5 (4/47)
6,2 (6/97)
3,9 (2/51)
0,10£
0,09£
* Модель пропорциональных рисков Кокса, скорректированная для возраста, аневризмы межпредсердной перегородки, ранее перенесен-
ных ТИА/сердечно-сосудистых событий, курения, гипертензии, гиперхолистеринемии.
† Логарифмический ранговый критерий.
£ Величина Р для взаимосвязи.
§ Модель пропорциональных рисков Кокса.
CLOSURE 1 — оценка системы закрытия перегородки STARFlex у пациентов с инсультом и/или транзиторной ишемической атакой, пред-
положительно вызванной парадоксальной эмболизацией через открытое овальное окно; PC — клиническое исследование, сравниваю-
щие чрескожное закрытие овального окна с помощью устройства Amplatzer PFO Occluder и медикаментозное лечение, у пациентов с эм-
болами из неясного источника; RESPECT — рандомизированная оценка повторного инсульта при сравнении закрытия овального окна
и текущих стандартов лечения; АМП — аневризма межпредсердной перегородки; ООО — открытое овальное окно; ТИА — транзитор-
ная ишемическая атака.
ТАБЛИЦА 40.9 Исследования, сравнивающие закрытие открытого овального окна и антитромботическое
лечение при предотвращении рецидивов цереброваскулярных событий
ch40_условно.indd 1048
03.04.2019 12:15:50
1049
40 Эмболия сосудов большого круга кровообращения
(эрозий перегородки, экссудативного перикардита
и т.д .) (рис. 40.15А). Для выявления остаточных
шунтов используют контрастирование. Подобные
шунты относительно распространены в первый ме-
сяц после операции. ЧПЭхоКГ может понадобится
для лучшей визуализации устройства и оценки та-
ких осложнений, как тромбы или вегетации (см.
рис. 40.15Б, В).
АОРТАЛЬНЫЕ АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ
Наличие атеросклеротических бляшек в аорте явля-
ется фактором риска развития ишемического ин-
сульта и эмболии большого круга кровообращения
особенно у пожилых людей. Связь между бляшка-
ми в проксимальном участке аорты и ишемическим
инсультом впервые была описана в патологоанато-
мическом исследовании, в котором пожилые паци-
енты, умершие от инсульта, значительно чаще име-
ли изъязвленные атеросклеротические бляшки в
аорте, чем пациенты, умершие от других невроло-
гических заболеваний (26% в сравнении с 5%; с по-
правкой на возраст OR 4,0; 95% ДИ 2,1–7,8) [85].
Разница была особенно достоверной у пациентов,
умерших от криптогенного инсульта (61% в сравне-
нии с 28%; корригированное OR 5,7; 95% ДИ 2,4–
13,6) и сохранялась после коррекции на фибрилля-
цию предсердий и заболевания сонных артерий
[85]. Только 3% пациентов с изъязвлением бляшки
были моложе 60 лет.
ЧПЭхоКГ предоставляет прекрасную возмож-
ность исследовать роль атеросклеротических бля-
шек в естественных условиях. ЧПЭхоКГ является
наиболее чувствительным и широко используемым
методом исследования проксимального участка
аорты. Близость пищевода к аорте и отсутствие до-
полнительных структур между ними допускают ис-
пользование высокочастотных ультразвуковых дат-
чиков, что дает изображение сосуда с высоким раз-
решением.
При появлении клиники ишемического инсуль-
та часть аорты, располагающаяся проксимальнее по
отношению к левой подключичной артерии, долж-
на находиться в центре внимания при проведении
исследования, хотя было показано наличие ретро-
градного диастолического кровотока в аорте, что
позволяет предположить возможность эмболии в
сосуды головного мозга из начальных участков нис-
ходящего отдела аорты [86]. Данное предположе-
ние, однако, не было подтверждено недавним мета-
анализом [87].
Аорта может быть точно визуализирована с по-
мощью ЧПЭхоКГ от уровня аортального клапана
до начала ее дуги. Средние и дистальные участки ду-
ги аорты также визуализируются у всех пациентов,
в то время как небольшая часть проксимальной ча-
сти дуги аорты не может быть визуализирована из-
за трахеи. Возможна точная оценка наличия и тол-
щины бляшек, равно как и наличия изъязвлений
Рис. 40.15 Визуализация окклюдера открытого овального окна. (А) A
ТТЭхоКГ, апикальная четырехкамерная позиция. Окклюдер (стрелки) четко ви-
зуализируется со стороны каждого предсердия. (Б) A ЧПЭхоКГ в четырехка-
мерной позиции. Окклюдер полностью перекрывает межпредсердную перего-
родку (стрелки). (В) A Визуализация с помощью ЧПЭхоКГ в бикавальной по-
зиции осложнения закрытия открытого овального окна с помощью окклюдера.
Определяется большое эхогенное образование (стрелки) с обеих сторон окклю-
дера. При хирургическом вмешательстве было установлено, что это инфици-
рованный тромб. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ —
правый желудочек; ПП — правое предсердие.
ЛЖ
ПЖ
ПП
ЛП
ПП
ЛП
ЛП
ПП
ПЖ
ЛЖ
В
А
Б
ch40_условно.indd 1049
03.04.2019 12:15:51
1050 ЧАСТЬ VII Сосудистые и системные заболевания
или тромботических наложений (рис. 40.16А, Б).
ЧПЭхоКГ высокочувствительна и специфична в
выявлении бляшек аорты и тромботических нало-
жений (чувствительность 91%, специфичность
90%) [88]. Чувствительность ЧПЭхоКГ в обнаруже-
нии мелких изъязвлений бляшки, которые могут
нести дополнительный риск эмболии, описывается
как менее оптимальная (примерно 75%). Возмож-
ность повторно измерить толщины бляшки при
ЧПЭхоКС очень хорошая, составляет 84–88% при
диагностике бляшек большого размера (> 4 мм)
[89], которые, как полагают, имеют более высокий
эмболический риск [90].
Многочисленные исследования методом случай–
контроль [90–92] и проспективные исследования
[93–95] с использованием ЧПЭхоКГ подтвердили
роль атеросклеротических бляшек в проксималь-
ном участке отделе аорты в качестве факторов ри-
ска развития инсульта и других эмболических со-
бытий (табл. 40.10). Хотя определение понятия
«большая бляшка» варьировала во всех исследова-
ниях, общий консенсус заключается в том, что тол-
щина бляшки 4 мм и более или 5 мм и более (изме-
ряется перпендикулярно диаметру главного сосуда)
сочетается с более высоким риском эмболии (см.
рис. 40.16А). Однако неясно, связана ли толщина
бляшки напрямую с механизмом инсульта или, ско-
рее, является маркером диффузного атеросклероза,
что предполагает более высокий риск развития ин-
сульта. Однако увеличение толщины бляшки за
1 год было связано с увеличением частоты сердеч-
но-сосудистых событий (инсульт, транзиторная
ишемическая атака, инфаркт миокарда или смерть)
у пациентов с инсультом или транзиторной ишеми-
ческой атакой при медиане периода наблюдения
1,7 года (51% в сравнении с 11%; р < 0,0001) [96].
У отдельных пациентов сложная морфология
бляшки может иметь более достоверную связь с ме-
ханизмом развития инсульта, чем ее толщина. Мор-
фологические особенности, такие как изъязвление
или подвижность, были связаны с повышенным ри-
ском развития инсульта [91], особенно в случае
криптогенным инсульта. С другой стороны, пока-
зано, что кальцификация бляшки снижает риск
последующих сердечно-сосудистых событий. Воз-
можно, это связано с тем, что кальцификация — это
признак более стабильного поражения. ЧПЭхоКГ
является очень чувствительным методом выявле-
ния таких морфологических вариантов, и в особен-
ности наличия подвижных компонентов, которые
накладываются друг на друга, что является призна-
ком наличия тромба (см. рис. 40.16А, Б). С недавне-
го времени использование трехмерного изображе-
ния сделало эту оценку более чувствительной, по-
зволив более полноценно оценить стенку аорты
(рис. 40.16В). Подвижные компоненты, которые на-
кладываются на бляшку в аорте, редко наблюдается
у пожилых пациентов с инсультом; диапазон дан-
Рис. 40.16 Исследование атеросклеротических бляшек дуги аорты с
помощью чреспищеводной эхокардиографии. (А) A Визуализируется
средняя часть дуги аорты перед ее дистальным сегментом. В дистальной ча-
сти находится бляшка толщиной > 7 мм, располагающаяся перпендикулярно
длинной оси дуги аорты. На поверхности интимы определяется большой уча-
сток изъязвления (стрелка). Толщина > 4 мм и изъязвленность поверхности
являются признаками высокого риска эмболии. (Б) A Проксимальнее бляш-
ки на противоположной стенке аорты определяются два подвижных эхоплот-
ных образования (стрелки). Мобильные компоненты бляшки несут крайне вы-
сокий риск эмболии. (В) A При трехмерной визуализации на стенке аорты
выявлены еще два подвижных эхоплотных образования (стрелки) .
В
А
Б
ch40_условно.indd 1050
03.04.2019 12:15:51
1051
40 Эмболия сосудов большого круга кровообращения
ного признака в различных исследованиях 1,6–8,7%
[90, 92, 97]. Однако их наличие представляет собой
крайне серьезный фактор риска эмболии в сосуды
головного мозга [91]. Иногда, у пациентов моложе
60 лет без серьезных атеросклеротических измене-
ний с наличием эмболических осложнений, можно
увидеть подвижный тромб (23 случая из 27 855 ис-
следований ЧПЭхоКГ в многоцентровом кардиоло-
гическом исследовании) [98]. Эти тромбы, как пра-
вило, имеют место прикрепления на атеросклероти-
ческих бляшках небольших размеров и, по всей
видимости, представляют собой редкий вариант
Исследования случай-контроль
Исследование
Случай/
Контроль
(n)
Возраст (лет)
Тип
бляшек
Пациенты
с инсультом (%) Контроль(%)
Корректированное
OR* (95% ДИ)
Amarenco [90] 250/250
≥60
1–3,9 мм
46
22
4,4 (2,8–6,8)
≥4мм
14
2
9,1 (3,3–25,2)
Jones
215/202
≥60
<5мм,
гладкие
33
22
2,3 (1,2–4,2)
≥5мм,
сложные
22
4
7,1 (2,7–18,4)
Di Tullio
106/114
≥40
≥5мм
26
13
2,6 (1,1–5,9)
30/36
<60
3
3
1,2 (0,7–20,2)
76/78
≥60
36
18
2,4 (1,1–5,7)
Di Tullio [92] 255/209
≥55
≥4мм
49
24
2,4 (1,3–4,6)
Проспективные исследования
Исследование
Наличие/
отсутствие
АБА (n)
Продолжительность
наблюдения (мес)
Тип бляшки
Частота
событий при
наличии АБА
(%)
Частота
событий при
отсутствии
АБА (%)
Корректированный
RR* (95% ДИ)
Tunick
42/42
14
≥4мм
33
7
4,3 (1,2–15,0)
Mitusch [93] 47/136
16
≥ 5 мм/под-
вижная в
сравнении с
<5мм
13,7/год
4,1/год
4,3 (1,5–12,0)
FAPS [94]
45/143
24–48
≥4мм
11,9/год
2,8/год
3,8 (1,8–7,8)
26,0/год†
5,9/год†
3,5 (2,1–5,9)
Fujimoto [95] 67/216
40
≥4мм
в сравнении
с<4мм
9,1
2,3
2,0 (0,9–4,2)
51/232
40
≥4мм,рас-
пространяю-
щиеся на
ветви дуги
аорты
9,8
2,9
2,4 (1,1–5,2)
* С учетом традиционных факторов развития инсульта.
† Комбинация рецидивов инсульта и других эмболий.
АБА — атеросклеторические бляшки аорты, ДИ — доверительный интервал.
ТАБЛИЦА 40.10 Атеросклеротические бляшки дуги аорты и риск ишемического инсульта
атеросклеротического поражения, связанного с эм-
болиями у молодых пациентов (рис. 40.17) [98].
При наличии эмболических поражений сосудов
большого круга кровообращения исследование
должно быть расширено до нисходящего отдела
аорты, поскольку атеросклероз в нисходящем отде-
ле аорты встречается чаще, чем в проксимальном
участке [99, 100]. Помимо того что атеросклероти-
ческие поражения аорты могут являться местом
происхождения тромботических эмболов, они мо-
гут формировать атеросклеротические эмболы —
кристаллы холестерина, обычно располагающиеся в
ch40_условно.indd 1051
03.04.2019 12:15:52
1052 ЧАСТЬ VII Сосудистые и системные заболевания
мелких артериолах, спонтанно или после операций
на сосудах, артериографии или антикоагулянтной
терапии [101]. Атеросклеротические эмболии имеет
широкий спектр клинических проявлений, от кли-
нически немых эпизодов, выявляемых только во
время диагностических процедур до сложной кли-
нической картины, которая характеризуется множе-
ственными поражениями органов (головной мозг,
сетчатка глаза, почки, желудочно-кишечный тракт,
нижние конечности). Одновременное или последо-
вательное вовлечение различных сегментов тела
может значительно облегчить правильный диагноз
в случае не выраженных или подострых клиниче-
ских проявлений.
ТЕРАПИЯ И ПРОФИЛАКТИКА РЕЦИДИВА ИНСУЛЬТА
Поскольку считается, что большинство эмболий,
связанных с большими или сложными атеросклеро-
тическими бляшками проксимального участка от-
дела аорты имеет тромбоэмболическое происхож-
дение, а у пациентов с острым инсультом и больши-
ми атеросклеротическими бляшками дуги аорты
[92] была продемонстрирована активация системы
свертывания, то с целью уменьшения частоты реци-
дивов инсульта было предложено проведение си-
стемной антикоагулянтной терапии. Системные ан-
тикоагулянты показаны пациентам с прикреплен-
ным тромбом; но эта группа пациентов составляет
лишь небольшую часть от их общего количества. У
пациентов с большими, но неподвижными бляшка-
ми обсуждаются лучшие варианты профилактики.
У 516 больных с острым ишемическим инсультом,
получавших аспирин или варфарин, антитромбо-
тическое лечение не влияет на частоту развития по-
вторного инсульта и смерти в течение периода на-
блюдения в два года, т.к. крупные бляшки (> 4 мм)
по-прежнему связывают с повышенным риском
развития эмболии (корректированный HR 2,12;
95% ДИ 1,04–4,32), особенно при их сложной мор-
фологии (HR 2,55; 95% ДИ 1,10–5,89). Риск был са-
мым высоким у пациентов с криптогенным инсуль-
том, как для крупных бляшек (HR 6,42; 95% ДИ
1,62–25,46), так и для больших сложных бляшек
(HR 9,50; 95% ДИ 1,92–47,10) [102]. Использование
комбинации аспирина и клопидогреля сравнива-
лось с индивидуально подобранной дозой варфари-
на у пациентов с инсультом и большими (≥ 4 мм)
бляшками, участвующими в исследовании ARCH
(Исследование дуги аорты связанное с мозговыми
осложнениями). К сожалению, недостаточное коли-
чество пациентов (349 пациентов участвовало вме-
сто планируемых 744) и частота событий ниже ожи-
даемой привели к прекращению исследования и
снижению статистической мощности исследования.
На основе полученной информации в течение ме-
дианного периода наблюдения в 3,4 года главный
ожидаемый результат (инсульт, инфаркт миокарда,
периферическая эмболизация, смерть от сердечно-
сосудистых заболеваний или внутримозговое кро-
вотечение) наблюдался у 7,6% пациентов, получав-
ших комбинированную терапию, и у 11,3% полу-
чавших варфарин (логарифмический ранговый
критерий, p = 0,2; скорректированный HR 0,76; 95%
ДИ 0,36–1,61; p = 0,5) [103].
Использование статинов демонстрирует сниже-
ние риска рецидива у пациентов с инсультом в ис-
следовании «Агрессивного снижения уровня холе-
стерина с целью профилактики инсульта» (SPARCL)
[104], но отдельные данные для пациентов с круп-
ными атеросклеротическими бляшками аорты не
были доступны. Показано, что хирургическая эн-
дартерэктомия бляшек с высоким риском имеет
значительный риск развития инсульта во время
проведения операции [105], поэтому является ре-
зервным методом тщательно отобранных случаев.
Эмболии из атеросклеротических поражений
аорты могут иметь разрушительные последствия во
время операции на сердце. У 921 последовательных
пациентов заболеваемость инсультом в послеопера-
ционном периоде составила 8,7% у пациентов с ате-
росклерозом аорты и 1,8% у пациентов без данной
патологии (р < 0,0001). Атеросклероз аорты был са-
мым сильным прогностическим фактором инсуль-
та [106]. При наличии тяжелого атеросклероза аор-
ты, различные модификации катетеризации аорты
или использование аппарата искусственного крово-
обращения могут резко снизить частоту интраопе-
рационного инсульта [107]. ТТЭхоКГ из супрастер-
нальнога доступа может использоваться в качестве
скринингового теста (рис. 40.18). С этой целью во
время операции может выполняться ЧПЭхоКГ или
эпиаортальное ультразвуковое исследование аорты.
Рис. 40.17 A Тромб в дуге аорты. При ЧПЭхоКГ в среднем сегменте дуги
аорты определяется большой подвижный тромб (стрелка). Видно его место
прикрепления к кальцифицированной атеросклеротической бляшке (острие
стрелки).
ch40_условно.indd 1052
03.04.2019 12:15:52
1053
40 Эмболия сосудов большого круга кровообращения
ПОТЕНЦИАЛЬНЫЕ ОГРАНИЧЕНИЯ
И АЛЬТЕРНАТИВНЫЕ ПОДХОДЫ
Несмотря на постоянное улучшение качества изо-
бражения, наиболее важным ограничением ТТЭ-
хоКГ в оценке источника эмболии остается неопти-
мальная визуализация структур сердца у некоторых
пациентов. Для ЧПЭхоКГ наиболее важным огра-
ничением является его полуинвазивный характер,
седация пациента, а также неоптимальные возмож-
ности характеристики тканей (тромб в сравнении с
вегетациями или опухолью или отложение липидов
в сравнении с тромбом как компонентом атероскле-
ротической бляшки). Это может быть исправлено в
будущем. Когда ЧПЭхоКГ не может быть выполне-
на, например из-за патологии пищевода или других
противопоказаний, выбор альтернативных методов
визуализации зависит от предварительной оценки
Рис. 40.18 Визуализация дуги аорты при трансторакальной эхокардиографии в супрастернальной позиции. (А) A Нормальная дуга аорты (ДАо).
Видно место отхождения брахиоцефальной артерии (стрелка), за ней — места отхождения левой сонной и левой подключичной артерии (острия стрелок). (Б) A
Большая атеросклеротическая бляшка (стрелка) в дистальной части дуги аорты. На поверхности бляшки, обращенной в просвет, видно изъязвление (острие стрел-
ки). НАо — нисходящий отдел аорты.
ДАо
НАо
ДАо
НАо
А
Б
вероятного источника эмболии сердца. Реальной
альтернативы ЭхоКГ при оценке вегетаций на кла-
панах при инфекционном эндокардите не суще-
ствуют, что диктует необходимость устанавливать
диагноз на основании клинической картины. Для
внутрисердечных образований КТ или МРТ могут
представлять собой жизнеспособные альтернативы.
Транскраниальная допплерография с введением
контрастного средства и ВСЭхоКГ используются
для оценки пациентов с подозрением на открытое
овальное окно. МРТ показала, что хорошо коррели-
рует с ЧПЭхоКГ в определении бляшек аорты [108]
и позволяет точно определить фиброзный и липид-
ный компоненты бляшки в моделях животных.
Двойная спиральная КТ показала хорошую чув-
ствительность, специфичность, а также общую точ-
ность в обнаружении бляшек аорты в сравнении с
ЧП ЭхоКГ.
ch40_условно.indd 1053
03.04.2019 12:15:52
1054 ЧАСТЬ VII Сосудистые и системные заболевания
Источник эмболии Исследование
Позиция
Измерения
Апикальные тромбы
ЛЖ
ТТЭхоКГ; ЧПЭхоКГ при не-
удовлетворительной визуали-
зации на ТТЭхоКГ
Апикальная четырехкамерная
и двухкамерная позиция;
парастернальная позиция
по короткой оси
Измерить размеры
Измерить выступание в полость ка-
мер и подвижность (увеличение ри-
ска эмболии)
Вегетации клапанов,
нити
ЧПЭхоКГ; у ТТЭхоКГ низкая
чувствительность (может
определить большие вегета-
ции или может быть исполь-
зовано, если клинические по-
дозрения низки)
Поперечные и продольные
проекции для каждого кла-
пана
Измерить размеры вегетации (риск
эмболии увеличивается при разме-
ре > 1 см), количество пора женных
створок, подвижность
Кардиальные опухо-
ли
ТТЭхоКГ; ЧПЭхоКГ для мел-
ких образований
Все стандартные позиции для
ТТЭхоКГ и ЧПЭхоКГ
Оценить размер и подвижность
Оценить возможные наслоенные
тромбы
Тромбы ЛП, СЭК
ЧПЭхоКГ
Визуализация ушка ЛП в раз-
личных позициях; измене-
ние настроек, чтобы мини-
мизировать фоновые шумы
Оценка размеров и подвижности
тромбов
Использование импульсно-волновой
допплерографии для измерения
скорости опустошения ушка левого
предсердия (риск эмболии увели-
чивается при < 55 см/сек; наиболь-
ший риск при скорости < 25 см/сек)
Открытое овальное
окно, аневризма
межпредсердной
перегородки
Для скрининга — ТТЭхоКГ
с введением контрастного
раствора; ЧПЭхоКГ для луч-
шего выявления и морфоло-
гической оценки
ТТЭхоКГ: апикальная четы-
рехкамерная позиция; суб-
костальная позиция при не-
оптимальной визуализации
в парастернальной позиции;
ЧПЭхоКГ: бикавальная пози-
ция наиболее полезна; так-
же может применяться че-
тырехкамерная позиция
ТТЭхоКГ с раствором: оценить время
появления пузырьков в левом пред-
сердии (< 3 циклов сокращений
сердца)
ЧПЭхоКГ: измерить, если возможно,
минимальное разделение первич-
ной и вторичной перегородки, под-
твердить с помощью цветового по-
тока. Допплерография и введение
контрастного раствора
Аневризма межпредсердной перего-
родки: измерить ширину основа-
ния (по меньшей мере 10 мм) и
экскурсию (10 мм, плюс экскурсия
в какое-либо из предсердий)
Атеросклеротические
бляшки прокси-
мального участка
отдела аорты
ЧПЭхоКГ; ТТЭхоКГ для скри-
нинга при противопоказани-
ях к ЧПЭхоКГ
Продольный вид восходяще-
го отдела аорты; попереч-
ный и продольный вид дуги
аорты и видимого сегмента
нисходящего отдела аорты
Супрастернальный вид при
ТТЭхоКГ
Записать количество бляшек
Измерить наибольшую толщину
бляшек (перпендикулярно наиболь-
шему диаметру сосуда; риск увели-
чивается при 4 мм и более)
Оценить морфологию бляшки (гипо-
эхогенность бляшки увеличивает
риск; кальцинированная бляшка
может обладать меньшим риском).
Аккуратно искать подвижные компо-
ненты (тромбы; значительно увели-
чивают риск эмболии)
ЛЖ — левый желудочек; ЛП — левое предсердие; СЭК — спонтанное эхоконтрастирование; ТТЭхоКГ — трансторакальная эхокардиогра-
фия; ЧПЭхоКГ — чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиографическая оценка источников эмболов из сердца и проксимальный участок части аорты
ch40_условно.indd 1054
03.04.2019 12:15:52
1055
40 Эмболия сосудов большого круга кровообращения
ЛИТЕРАТУРА
1. Go AS, Mozaffarian D, Roger VL, et al.
Heart disease and stroke statistics—2014
update: a report from the American Heart
Association, Circulation 129:e28–e292,
2014.
2. Furie KL, Kasner SE, Adams RJ, et al. guide-
lines for the prevention of stroke in patients
with stroke or transient ischemic attack: a
guideline for healthcare professionals from
the American Heart Association/American
Stroke Association, Stroke227–276, 2011.
3. Ay H, Furie KL, Singhal A, et al. An evi-
dence-based causative classification system
for acute ischemic stroke, Ann Neurol
58(5):688–697, 2005 Nov.
4. de Bruijn SF, Agema WR, Lammers GJ, et
al. Transesophageal echocardiography is
superior to transthoracic echocardiography
in management of patients of any age with
transient ischemic attack or stroke, Stroke
37:2531–2534, 2006.
5. Knebel F, Masuhr F, von HW, et al. Trans-
esophageal echocardiography in patients
with cryptogenic cerebral ischemia, Cardio-
vasc Ultrasound 7:15, 2009.
6. Harloff A, Handke M, Reinhard M, et al.
Therapeutic strategies after examination by
transesophageal echocardiography in 503
patients with ischemic stroke, Stroke
37:859–864, 2006.
7. Khariton Y, House JA, Comer L, et al. Im-
pact of transesophageal echocardiography
on management in patients with suspected
cardioembolic stroke, Am J Cardiol
114:1912–1916, 2014.
8. Douglas PS, Garcia MJ, Haines DE, et al.
ACCF/ASE/AHA/ASNC/HFSA/HRS/SCAI/
SCCM/SCCT/SCMR 2011 Appropriate Use
Criteria for Echocardiography. A Report of
the American College of Cardiology Foun-
dation Appropriate Use Criteria Task Force,
American Society of Echocardiography,
American Heart Association, American So-
ciety of Nuclear Cardiology, Heart Failure
Society of America, Heart Rhythm Society,
Society for Cardiovascular Angiography and
Interventions, Society of Critical Care
Medicine, Society of Cardiovascular Com-
puted Tomography, and Society for Cardio-
vascular Magnetic Resonance Endorsed by
the American College of Chest Physicians, J
Am Coll Cardiol 57:1126–1166, 2011.
9. Mooe T, Eriksson P, Stegmayr B. Ischemic
stroke after acute myocardial infarction. A
population-based study, Stroke 28:762–767,
1997.
10. Witt BJ, Brown Jr. RD, Jacobsen SJ, et al. A
community-based study of stroke incidence
after myocardial infarction, Ann Intern Med
143:785–792, 2005.
11. Witt BJ, Brown Jr. RD, Jacobsen SJ, et al. A
community-based study of stroke incidence
after myocardial infarction, Ann Intern Med
143:785–792, 2005.
12. Vaitkus PT, Barnathan ES. Embolic poten-
tial, prevention and management of mural
thrombus complicating anterior myocardial
infarction: a meta-analysis, J Am Coll Car-
diol 22:1004–1009, 1993.
13. Osherov AB, Borovik-Raz M, Aronson D, et
al. Incidence of early left ventricular throm-
bus after acute anterior wall myocardial
infarction in the primary coronary inter-
vention era, Am Heart J 157:1074–1080,
2009.
14. Siebelink HM, Scholte AJ, Van de Viere NR,
et al. Value of contrast echocardiography
for left ventricular thrombus detection
postinfarction and impact on antithrom-
botic therapy, Coron Artery Dis 20:462–466,
2009.
15. O’Gara PT, Kushner FG, Ascheim DD, et al.
2013 ACCF/AHA guideline for the manage-
ment of ST-elevation myocardial infarc-
tion: a report of the American College of
Cardiology Foundation/American Heart
Association Task Force on Practice Guide-
lines, J Am Coll Cardiol 61:e78–e140, 2013.
16. Andreotti F, Testa L, Biondi-Zoccai GG,
Crea F. Aspirin plus warfarin compared to
aspirin alone after acute coronary syn-
dromes: an updated and comprehensive
meta-analysis of 25,307 patients, Eur Heart
J 27:519–526, 2006.
17. Udell JA, Wang JT, Gladstone DJ, Tu JV.
Anticoagulation after anterior myocardial
infarction and the risk of stroke, PLoS One
5:e12150, 2010.
18. Witt BJ, Brown Jr. RD, Jacobsen SJ, et al.
Ischemic stroke after heart failure: a com-
munity-based study, Am Heart J 152:102–
109, 2006.
19. Massie BM, Collins JF, Ammon SE, et al.
Randomized trial of warfarin, aspirin, and
clopidogrel in patients with chronic heart
failure: the Warfarin and Antiplatelet
Therapy in Chronic Heart Failure (WATCH)
trial, Circulation 119:1616–1624, 2009.
20. Homma S, Thompson JL, Pullicino PM, et
al. Warfarin and aspirin in patients with
heart failure and sinus rhythm, N Engl J
Med 366:1859–1869, 2012.
21. Mylonakis E, Calderwood SB. Infective en-
docarditis in adults, N Engl J Med 345:1318–
1330, 2001.
22. Cooper HA, Thompson EC, Laureno R, et
al. Subclinical brain embolization in left-
sided infective endocarditis: results from
the evaluation by MRI of the brains of pa-
tients with left-sided intracardiac solid
masses (EMBOLISM) pilot study, Circula-
tion 120:585–591, 2009.
23. Dickerman SA, Abrutyn E, Barsic B, et al.
The relationship between the initiation of
antimicrobial therapy and the incidence of
stroke in infective endocarditis: an analysis
from the ICE Prospective Cohort Study
(ICE-PCS), Am Heart J 154:1086–1094,
2007.
24. Lalani T, Cabell CH, Benjamin DK, et al.
Analysis of the impact of early surgery on
in-hospital mortality of native valve endo-
carditis: use of propensity score and instru-
mental variable methods to adjust for
treatment-selection bias,
Circulation
121:1005–1013, 2010.
25. Mugge A, Daniel WG, Frank G, Lichtlen
PR. Echocardiography in infective endo-
carditis: reassessment of prognostic impli-
cations of vegetation size determined by
the transthoracic and the transesophageal
approach, J Am Coll Cardiol 14:631–638,
1989.
26. Erbel R, Rohmann S, Drexler M, et al. Im-
proved diagnostic value of echocardiogra-
phy in patients with infective endocarditis
by transoesophageal approach. A prospec-
tive study, Eur Heart J 9:43–53, 1988.
27. Barton TL, Mottram PM, Stuart RL, et al.
Transthoracic echocardiography is still use-
ful in the initial evaluation of patients with
suspected infective endocarditis: evaluation
of a large cohort at a tertiary referral center,
Mayo Clin Proc 89:799–805, 2014.
28. Reynolds HR, Jagen MA, Tunick PA, Kro-
nzon I. Sensitivity of transthoracic versus
transesophageal echocardiography for the
detection of native valve vegetations in the
modern era, J Am Soc Echocardiogr 16:67–
70, 2003.
29. Di Salvo G, Habib G, Pergola V, et al. Echo-
cardiography predicts embolic events in
infective endocarditis, J Am Coll Cardiol
37:1069–1076, 2001.
30. Evangelista A, Gonzalez-Alujas MT. Echo-
cardiography in infective endocarditis,
Heart 90:614–617, 2004.
31. Habib G, Hoen B, Tornos P, et al. Guide-
lines on the prevention, diagnosis, and
treatment of infective endocarditis (new
version 2009): the Task Force on the Pre-
vention, Diagnosis, and Treatment of Infec-
tive Endocarditis of the European Society of
Cardiology (ESC). Endorsed by the Euro-
pean Society of Clinical Microbiology and
Infectious Diseases (ESCMID) and the In-
ternational Society of Chemotherapy (ISC)
for Infection and Cancer, Eur Heart J
30:2369–2413, 2009.
32. Baddour LM, Wilson WR, Bayer AS, et al.
Infective endocarditis: diagnosis, antimi-
crobial therapy, and management of com-
plications: a statement for healthcare pro-
fessionals from the Committee on Rheu-
matic Fever, Endocarditis, and Kawasaki
Disease, Council on Cardiovascular Disease
in the Young, and the Councils on Clinical
Cardiology, Stroke, and Cardiovascular
Surgery and Anesthesia, American Heart
Association: endorsed by the Infectious
Diseases Society of America, Circulation
111:e394–e434, 2005.
33. Lengyel M. The impact of transesophageal
echocardiography on the management of
prosthetic valve endocarditis: experience of
31 cases and review of the literature, J Heart
Valve Dis 6:204–211, 1997.
34. Bonow RO, Carabello BA, Chatterjee K, et
al. 2008 focused update incorporated into
the ACC/AHA 2006 guidelines for the man-
agement of patients with valvular heart
disease: a report of the American College of
Cardiology/American Heart Association
Task Force on Practice Guidelines (Writing
Committee to revise the 1998 guidelines for
the management of patients with valvular
heart disease). Endorsed by the Society of
Cardiovascular Anesthesiologists, Society
for Cardiovascular Angiography and Inter-
ventions, and Society of Thoracic Surgeons,
J Am Coll Cardiol 52:e1–e142, 2008.
35. Leitman M, Tyomkin V, Peleg E, et al.
Clinical significance and prevalence of val-
vular strands during routine echo examina-
tions, Eur Heart J Cardiovasc Imaging
15:1226–1230, 2014.
36. Roberts JK, Omarali I, Di Tullio MR, et al.
Valvular strands and cerebral ischemia. Ef-
fect of demographics and strand character-
istics, Stroke 28:2185–2188, 1997.
37. Cohen A, Tzourio C, Chauvel C, et al. Mitral
valve strands and the risk of ischemic stroke
in elderly patients. The French Study of
Aortic Plaques in Stroke (FAPS) Investiga-
tors, Stroke 28:1574–1578, 1997.
38. Roldan CA, Shively BK, Crawford MH.
Valve excrescences: prevalence, evolution
and risk for cardioembolism, J Am Coll
Cardiol 30:1308–1314, 1997.
ch40_условно.indd 1055
03.04.2019 12:15:52
1056 ЧАСТЬ VII Сосудистые и системные заболевания
39. Homma S, Di Tullio MR, Sciacca RR, et al.
Effect of aspirin and warfarin therapy in
stroke patients with valvular strands, Stroke
35:1436–1442, 2004.
40. Kiavar M, Sadeghpour A, Bakhshandeh H,
et al. Are prosthetic heart valve fibrin
strands negligible? The associations and
significance, J Am Soc Echocardiogr 22:890–
894, 2009.
41. Reynen K. Frequency of primary tumors of
the heart, Am J Cardiol 77:107, 1996.
42. Butany J, Nair V, Naseemuddin A, et al.
Cardiac tumours: diagnosis and manage-
ment, Lancet Oncol 6:219–228, 2005.
43. Reynen K. Cardiac myxomas, N Engl J Med
333:1610–1617, 1995.
44. Gowda RM, Khan IA, Nair CK, et al. Car-
diac papillary fibroelastoma: a comprehen-
sive analysis of 725 cases, Am Heart J
146:404–410, 2003.
45. Neragi-Miandoab S, Kim J, Vlahakes GJ.
Malignant tumours of the heart: a review of
tumour type, diagnosis and therapy, Clin
Oncol R Coll Radiol 19:748–756, 2007.
46. Ekmektzoglou KA, Samelis GF, Xanthos T.
Heart and tumors: location, metastasis,
clinical manifestations, diagnostic ap-
proaches and therapeutic considerations, J
Cardiovasc Med 9:769–777, 2008.
47. Yahia AM, Shaukat A, Kirmani JF, et al.
Prevalence and prediction of left atrial
thrombus in patients with a recent cerebral
ischemic event, who are in sinus rhythm: a
single-center experience, J Neuroimaging
19:323–325, 2009.
48. Agmon Y, Khandheria BK, Gentile F,
Seward JB. Echocardiographic assessment
of the left atrial appendage, J Am Coll Car-
diol 34:1867–1877, 1999.
49. Stoddard MF, Dawkins PR, Prince CR, Am-
mash NM. Left atrial appendage thrombus
is not uncommon in patients with acute
atrial fibrillation and a recent embolic
event: a transesophageal echocardiographic
study, J Am Coll Cardiol 25:452–459, 1995.
50. Manning WJ, Silverman DI, Waksmonski
CA, et al. Prevalence of residual left atrial
thrombi among patients with acute throm-
boembolism and newly recognized atrial
fibrillation, Arch Intern Med 155:2193–2198,
1995.
51. Handke M, Harloff A, Hetzel A, et al. Pre-
dictors of left atrial spontaneous echocar-
diographic contrast or thrombus formation
in stroke patients with sinus rhythm and
reduced left ventricular function, Am J Car-
diol 96:1342–1344, 2005.
52. Handke M, Harloff A, Hetzel A, et al. Left
atrial appendage flow velocity as a quantita-
tive surrogate parameter for thromboem-
bolic risk: determinants and relationship to
spontaneous echocontrast and thrombus
formation—a transesophageal echocardio-
graphic study in 500 patients with cerebral
ischemia, J Am Soc Echocardiogr 18:1366–
1372, 2005.
53. The Stroke Prevention in Atrial Fibrillation
Investigators Committee on Echocardiogra-
phy: Transesophageal echocardiographic
correlates of thromboembolism in high-risk
patients with nonvalvular atrial fibrillation,
Ann Intern Med 128:639–647, 1998.
54. Mugge A, Kuhn H, Nikutta P, et al. Assess-
ment of left atrial appendage function by
biplane transesophageal echocardiography
in patients with nonrheumatic atrial fibril-
lation: identification of a subgroup of pa-
tients at increased embolic risk, J Am Coll
Cardiol 23:599–607, 1994.
55. Leung DY, Black IW, Cranney GB, et al. Prog-
nostic implications of left atrial spontaneous
echo contrast in nonvalvular atrial fibrillation,
J Am Coll Cardiol 24:755–762, 1994.
56. Kleemann T, Becker T, Strauss M, et al.
Prevalence and clinical impact of left atrial
thrombus and dense spontaneous echo con-
trast in patients with atrial fibrillation and
low CHADS2 score, Eur J Echocardiogr
10:383–388, 2009.
57. Lip GY, Halperin JL. Improving stroke risk
stratification in atrial fibrillation, Am J Med
123:484–488, 2010.
58. Gage BF, Waterman AD, Shannon W, et al.
Validation of clinical classification schemes
for predicting stroke: results from the Na-
tional Registry of Atrial Fibrillation, JAMA
285:2864–2870, 2001.
59. Connolly SJ, Ezekowitz MD, Yusuf S, et al.
Dabigatran versus warfarin in patients with
atrial fibrillation, N Engl J Med 361:1139–
1151, 2009.
60. Patel MR, Mahaffey KW, Garg J, et al. Ri-
varoxaban versus warfarin in nonvalvular
atrial fibrillation, N Engl J Med 365:883–891,
2011.
61. Granger CB, Alexander JH, McMurray JJ, et
al. Apixaban versus warfarin in patients
with atrial fibrillation, N Engl J Med 365:
981–992, 2011.
62. Giugliano RP, Ruff CT, Braunwald E, et al.
Edoxaban versus warfarin in patients with
atrial fibrillation, N Engl J Med 369:2093–
2104, 2013.
63. Klein AL, Grimm RA, Murray RD, et al. Use
of transesophageal echocardiography to
guide cardioversion in patients with atrial
fibrillation, N Engl J Med 344:1411–1420,
2001.
64. Hagen PT, Scholz DG, Edwards WD. Inci-
dence and size of patent foramen ovale
during the first 10 decades of life: an au-
topsy study of 965 normal hearts, Mayo
Clin Proc 59:17–20, 1984.
65. Meissner I, Khandheria BK, Heit JA, et al. Pat-
ent foramen ovale: innocent or guilty? Evi-
dence from a prospective population-based
study, J Am Coll Cardiol 47:440–445, 2006.
66. Di Tullio MR, Sacco RL, Sciacca RR, et al.
Patent foramen ovale and the risk of isch-
emic stroke in a multiethnic population, J
Am Coll Cardiol 49:797–802, 2007.
67. Clarke NR, Timperley J, Kelion AD, Ban-
ning AP. Transthoracic echocardiography
using second harmonic imaging with Val-
salva manoeuvre for the detection of right
to left shunts, Eur J Echocardiogr 5:176–181,
2004.
68. Lechat P, Mas JL, Lascault G, et al. Preva-
lence of patent foramen ovale in patients
with stroke, N Engl J Med 318:1148–1152,
1988.
69. Webster MW, Chancellor AM, Smith HJ, et
al. Patent foramen ovale in young stroke
patients, Lancet 2:11–12, 1988.
69a. Cabanes L, Mas JL, Cohen A, et al. Atrial
septal aneurysm and patent foramen ovale
as risk factors for cryptogenic stroke in
patients less than 55 years of age. A study
using transesophageal echocardiography, J
Stroke 24(12):1865–1873, 1993.
69b. de Belder MA, Tourikis L, Leech G, Camm
AJ. Risk of patent foramen ovale for throm-
boembolic events in all age groups, Am J
Cardiol 69(16):1316–1320, 1992.
70. Di Tullio M, Sacco RL, Gopal A, et al. Patent
foramen ovale as a risk factor for cryptogenic
stroke, Ann Intern Med 117:461–465, 1992.
70a. Hausmann D, Mu
gge A, Becht I, et al. Di-
agnosis of patent foramen ovale by trans-
esophageal echocardiography and associa-
tion with cerebral and peripheral embolic
events, Am J Cardiol 70(6):668–672, 1992.
70b. Jones EF, Calafiore P, Donnan GA, et al.
Evidence that patent foramen ovale is not a
risk factor for cerebral ischemia in the el-
derly, Am J Cardiol 74(6):596–599, 1994.
71. Handke M, Harloff A, Olschewski M, et al.
Patent foramen ovale and cryptogenic
stroke in older patients, N Engl J Med
357:2262–2268, 2007.
72. Steiner MM, Di Tullio MR, Rundek T, et al.
Patent foramen ovale size and embolic
brain imaging findings among patients with
ischemic stroke, Stroke 29:944–948, 1998.
73. Schuchlenz HW, Weihs W, Horner S, Que-
henberger F. The association between the
diameter of a patent foramen ovale and the
risk of embolic cerebrovascular events, Am
J Med 109:456–462, 2000.
74. Homma S, Sacco RL, Di Tullio MR, et al.
Atrial anatomy in non-cardioembolic
stroke patients: effect of medical therapy, J
Am Coll Cardiol 42:1066–1072, 2003.
75. Overell JR, Bone I, Lees KR. Interatrial sep-
tal abnormalities and stroke: a meta-analysis
of case-control studies, Neurology 55:1172–
1179, 2000.
76. Mas JL, Arquizan C, Lamy C, et al. Recur-
rent cerebrovascular events associated with
patent foramen ovale, atrial septal aneu-
rysm, or both, N Engl J Med 345:1740–1746,
2001.
77. Bonati LH, Kessel-Schaefer A, Linka AZ, et
al. Diffusion-weighted imaging in stroke
attributable to patent foramen ovale: sig-
nificance of concomitant atrial septum an-
eurysm, Stroke 37:2030–2034, 2006.
78. Cramer SC, Rordorf G, Maki JH, et al. In-
creased pelvic vein thrombi in cryptogenic
stroke: results of the Paradoxical Emboli
from Large Veins in Ischemic Stroke (PEL-
VIS) study, Stroke 35:46–50, 2004.
79. Botto N, Spadoni I, Giusti S, et al. Pro-
thrombotic mutations as risk factors for
cryptogenic ischemic cerebrovascular
events in young subjects with patent fora-
men ovale, Stroke 38:2070–2073, 2007.
80. Homma S, Sacco RL, Di Tullio MR, et al.
Effect of medical treatment in stroke pa-
tients with patent foramen ovale: patent
foramen ovale in Cryptogenic Stroke Study,
Circulation 105:2625–2631, 2002.
81. Serena J, Marti-Fabregas J, Santamarina E,
et al. Recurrent stroke and massive right-to-
left shunt: results from the prospective
Spanish multicenter (CODICIA) study,
Stroke 39:3131–3136, 2008.
82. Furlan AJ, Reisman M, Massaro J, et al.
Closure or medical therapy for cryptogenic
stroke with patent foramen ovale, N Engl J
Med 366:991–999, 2012.
83. Carroll JD, Saver JL, Thaler DE, et al. Clo-
sure of patent foramen ovale versus medical
therapy after cryptogenic stroke, N Engl J
Med 368:1092–1100, 2013.
84. Meier B, Kalesan B, Mattle HP, et al. Percu-
taneous closure of patent foramen ovale in
cryptogenic embolism, N Engl J Med
368:1083–1091, 2013.
85. Amarenco P, Duyckaerts C, Tzourio C, et
al. The prevalence of ulcerated plaques in
ch40_условно.indd 1056
03.04.2019 12:15:53
1057
40 Эмболия сосудов большого круга кровообращения
the aortic arch in patients with stroke, N
Engl J Med 326:221–225, 1992.
86. Harloff A, Strecker C, Frydrychowicz AP,
et al. Plaques in the descending aorta: a
new risk factor for stroke? Visualization of
potential embolization pathways by 4D
MRI, J Magn Reson Imaging 26:1651–1655,
2007.
87. Katsanos AH, Giannopoulos S, Kosmidou
M, et al. Complex atheromatous plaques in
the descending aorta and the risk of stroke:
a systematic review and meta-analysis,
Stroke 45:1764–1770, 2014.
88. Vaduganathan P, Ewton A, Nagueh SF, et al.
Pathologic correlates of aortic plaques,
thrombi and mobile “aortic debris” imaged
in vivo with transesophageal echocardiogra-
phy, J Am Coll Cardiol 30:357–363, 1997.
89. Weber A, Jones EF, Zavala JA, et al. Intrao-
bserver and interobserver variability of
transesophageal echocardiography in aortic
arch atheroma measurement, J Am Soc
Echocardiogr 21:129–133, 2008.
90. Amarenco P, Cohen A, Tzourio C, et al.
Atherosclerotic disease of the aortic arch
and the risk of ischemic stroke, N Engl J
Med 331:1474–1479, 1994.
91. Di Tullio MR, Sacco RL, Savoia MT, et al.
Aortic atheroma morphology and the risk
of ischemic stroke in a multiethnic popula-
tion, Am Heart J 139:329–336, 2000.
92. Di Tullio MR, Homma S, Jin Z, Sacco RL.
Aortic atherosclerosis, hypercoagulability
and stroke: the Aortic Plaques and Risk of
Ischemic Stroke (APRIS) Study, J Am Coll
Cardiol 52:855–861, 2008.
93. Mitusch R, Doherty C, Wucherpfennig H,
et al. Vascular events during follow-up in
patients with aortic arch atherosclerosis,
Stroke 28:36–39, 1997.
94. The French Study of Aortic Plaques in
Stroke Group. Atherosclerotic disease of the
aortic arch as a risk factor for recurrent
ischemic stroke, N Engl J Med 334:1216–
1221, 1996.
95. Fujimoto S, Yasaka M, Otsubo R, et al. Aor-
tic arch atherosclerotic lesions and the re-
currence of ischemic stroke, Stroke
35:1426–1429, 2004.
96. Sen S, Hinderliter A, Sen PK, et al. Aortic
arch atheroma progression and recurrent
vascular events in patients with stroke or
transient ischemic attack, Circulation
116:928–935, 2007.
97. Ueno Y, Kimura K, Iguchi Y, et al. Mobile
aortic plaques are a cause of multiple brain
infarcts seen on diffusion-weighted imag-
ing, Stroke 38:2470–2476, 2007.
98. Laperche T, Laurian C, Roudaut R, Steg PG.
Mobile thromboses of the aortic arch with-
out aortic debris. A transesophageal echo-
cardiographic finding associated with unex-
plained arterial embolism. The Filiale
Echocardiographie de la Societe Francaise
de Cardiologie, Circulation 96:288–294,
1997.
99. Agmon Y, Khandheria BK, Meissner I, et al.
Relation of coronary artery disease and
cerebrovascular disease with atherosclerosis
of the thoracic aorta in the general popula-
tion, Am J Cardiol 89:262–267, 2002.
100. Russo C, Jin Z, Rundek T, et al. Atheroscle-
rotic disease of the proximal aorta and the
risk of vascular events in a population-
based cohort: the Aortic Plaques and Risk
of Ischemic Stroke (APRIS) study, Stroke
40:2313–2318, 2009.
101. Ben-Horin S, Bardan E, Barshack I, et al.
Cholesterol crystal embolization to the di-
gestive system: characterization of a com-
mon, yet overlooked presentation of athe-
roembolism, Am J Gastroenterol 98:1471–
1479, 2003.
102. Di Tullio MR, Russo C, Jin Z, et al. Aortic
arch plaques and risk of recurrent stroke
and death, Circulation 119:2376–2382, 2009.
103. Amarenco P, Davis S, Jones EF, et al. Clop-
idogrel plus aspirin versus warfarin in pa-
tients with stroke and aortic arch plaques,
Stroke 45:1248–1257, 2014.
104. Amarenco P, Goldstein LB, Szarek M, et al.
Effects of intense low-density lipoprotein
cholesterol reduction in patients with stroke
or transient ischemic attack: the Stroke Pre-
vention by Aggressive Reduction in Choles-
terol Levels (SPARCL) trial, Stroke 38:3198–
3204, 2007.
105. Stern A, Tunick PA, Culliford AT, et al.
Protruding aortic arch atheromas: risk of
stroke during heart surgery with and with-
out aortic arch endarterectomy, Am Heart J
138:746–752, 1999.
106. van der LJ, Hadjinikolaou L, Bergman P,
Lindblom D. Postoperative stroke in car-
diac surgery is related to the location and
extent of atherosclerotic disease in the as-
cending aorta, J Am Coll Cardiol 38:131–
135, 2001.
107. Trehan N, Mishra M, Kasliwal RR, Mishra
A. Reduced neurological injury during
CABG in patients with mobile aortic ath-
eromas: a five-year follow-up study, Ann
Thorac Surg 70:1558–1564, 2000.
108. Fayad ZA, Nahar T, Fallon JT, et al. In vivo
magnetic resonance evaluation of athero-
sclerotic plaques in the human thoracic
aorta: a comparison with transesophageal
echocardiography, Circulation 101:2503–
2509, 2000.
ch40_условно.indd 1057
03.04.2019 12:15:53
ch40_условно.indd 1058
03.04.2019 12:15:53
1059
41 Фибрилляция и трепетание
предсердий
NAZEM AKOUM, MD, MS • JORDAN M. PRUTKIN, MD, MHS
Распространенность и последствия
фибрилляции предсердий
Связь ремоделирования предсердий
с фибрилляцией
Эхокардиография у пациентов
с фибрилляцией и трепетанием
предсердий
Размеры предсердий
Функция предсердий
Инсульт и фибрилляция предсердий
Роль ушка левого предсердия
Изменения гемостаза
Чреспищеводная эхокардиография при
лечении фибрилляции предсердий
Фибрилляция предсердий с клапанной
патологии и без нее
Эхокардиография во время процедур
Катетерная аблация фибрилляции
предсердий
Аблация трепетаний предсердий
Закрытие ушка левого предсердия
РАСПРОСТРАНЕННОСТЬ И ПОСЛЕДСТВИЯ
ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Фибрилляция предсердий (ФП) является одной из
наиболее распространенных аритмий сердца, кото-
рая встречается у более чем 3 млн американцев [1].
Достоверная частота трепетания предсердий (ТП)
неизвестна, однако есть данные, что большинство
пациентов с кавотрикуспидальным перешейком
также имеют ФП. Другие формы трепетаний, кото-
рые относят к «атипичным», встречаются после кар-
диохирургических операций, врожденных пороков
сердца, во время лечения антиаритмическими пре-
паратами I класса, а также после катетерной абла-
ции ФП. С точки зрения эхокардиографии (ЭхоКГ)
анализ и оценка ТП схожи с таковыми ФП.
Ожидается, что распространенность ФП возрас-
тет в ближайшие десятилетия[2]. Частично это объ-
ясняется увеличением продолжительности жизни
населения, лучшей диагностики сопутствующих за-
болеваний, снижением смертности от ишемической
болезни сердца и хронической сердечной недоста-
точности. Пожилой возраст связывают с развитием
ФП. По некоторым оценкам, в США около 15% на-
селения старше 65 лет имеют в анамнезе ФП. Дан-
ный процент возрастает до 25% у людей старше 80
лет. Другие сердечно-сосудистые заболевания также
связывают с распространением ФП. К ним относят
ишемическую болезнь сердца, болезни клапанов
сердца, гипертонию, гипертрофическую кардиоми-
опатию, хроническую сердечную недостаточность.
Более высокий процент распространенности ФП
связывают с сердечной недостаточностью с сохран-
ной систолической функцией по сравнению с сер-
дечной недостаточностью со сниженной функцией
[3]. Также ФП ассоциируется с ожирением и син-
дромом обструктивного апноэ во сне, при наличии
двух этих заболеваний частота ФП возрастает.
Фремингемское исследование сердца выявило,
что ФП независимо ассоциируется с повышенной
смертностью [4]. Также ее связывают с увеличени-
ем числа ишемических инсультов, что приводит к
возрастанию количества вызовов скорой помощи,
случаев госпитализации. Все эти факторы ставят
ФП основным источником расходов на здравоохра-
нение в Соединенных Штатах.
СВЯЗЬ РЕМОДЕЛИРОВАНИЯ ПРЕДСЕРДИЙ
С ФИБРИЛЛЯЦИЕЙ
ФП связана с электрофизиологическим и структур-
ным ремоделированиями предсердий. Электрофи-
зиологические нарушения заключаются в уменьше-
нии продолжительности потенциала действия мио-
цитов и снижении скорости выделения кальция [5].
Структурные изменения при ФП включают в себя
потерю кардиомиоцитов, увеличение интерстици-
ального фиброза и отложение коллагена [6]. Иссле-
дования аутопсий выявили, что у пациентов с ФП в
анамнезе отмечается более выраженный фиброз
предсердий по сравнению с пациентами без ФП, не-
зависимо от их возраста [7]. Другое исследование, в
которое были включены пациенты после кардиохи-
рургических вмешательств, отмечает, что в био-
ch41_условно.indd 1059
03.04.2019 12:16:06
1060 ЧАСТЬ VII Сосудистые и системные заболевания
псийном материале пациентов с ФП отмечается бо-
лее высокое содержание коллагена по сравнению с
группой, которая не имеет аритмий в анамнезе. Ис-
следования на животных показали, что ФП приво-
дит к прогрессирующему ремоделированию и нару-
шению структуры предсердий, что часто называют
«ФП порождает ФП» [8]. Все эти ультраструктурные
изменения тканей предсердий часто сопровождают-
ся грубыми морфологическими изменениями, ко-
торые проявляются увеличением размеров предсер-
дий, площади его поверхности и объема, а также
снижением его сократительной функции.
ЭХОКАРДИОГРАФИЯ У ПАЦИЕНТОВ
С ФИБРИЛЛЯЦИЕЙ И ТРЕПЕТАНИЕМ ПРЕДСЕРДИЙ
Клиническая картина у пациентов с ФП и ТП силь-
но различается. У некоторых пациентов практиче-
ски отсутствуют симптомы аритмии, которая диа-
гностируется лишь при физикальном осмотре либо
после проведения электрокардиографии. Встреча-
ются как легкие клинические симптомы (в виде сни-
жения выносливости и толерантности к физиче-
ским нагрузкам, учащенного сердцебиения, болей в
груди и одышки), так и более выраженные (в виде
обмороков, инсультов, транзиторных ишемических
атак).
При выявлении любой электрофизиологической
аномалии ЭхоКГ играет ключевую роль в диагно-
стике (табл. 41.1). Первичное обследование обычно
проводят с помощью трансторакальной эхокардио-
графии (ТТЭхоКГ). ФП и ТП всегда требуют глу-
бокой и полной оценки всего сердца и гемодинами-
ки. Сюда относят качественную и количественную
оценки размеров камер сердца, наличия стенозов
или регургитации на клапанах, систолической фун-
кции желудочков, диастолического наполнения и
степень внутрисосудистого объема. Некоторым па-
циентам проводят чреспищеводную эхокардиогра-
фию (ЧПЭхоКГ) и внутрисердечную эхокардиогра-
фию (ВСЭхоКГ) в ходе лечения ФП.
РАЗМЕРЫ ПРЕДСЕРДИЙ
Для измерения левого предсердия (ЛП) используют
как М-режим, так и двухмерную (2D) ТТЭхоКГ в па-
растернальной позиции по длинной оси [9]. Эти из-
мерения коррелируют с площадью поверхности
предсердия, измеренной по длинной оси, а также с
объемом предсердия, полученным с использовани-
ем компьютерной томографии или магнитно-резо-
нансной томографии [10, 11]. Однако при измере-
нии ЛП зачастую недооценивают его расширение,
особенно при асимметричной дилатации. American
Society of Echocardiography (ASE) рекомендует ис-
пользовать бипланарный метод Симпсона в апи-
кальной четырехкамерной и двухкамерной позици-
ях и рассчитывать объем ЛП с помощью формулы:
Объем левого предсердия (см3 или мл) = 1,7 ×
A4C см2) × (A2C см2) / [(L4C см + L2C см)/2],
где L4C, L2C, A4C и A2C — длины и площади, из-
меренные в апикальной четырехкамерной и двухка-
мерной позициях соответственно (рис. 41.1).
Нормальный объем ЛП согласно данным ЭхоКГ
составляет 22–52 мл у женщин и 18–58 мл у мужчин
либо 22 ± 6 мл/м2 с корректировкой на площадь по-
верхности тела (табл. 41.2) [9].
ФУНКЦИЯ ПРЕДСЕРДИЙ
Функция предсердий включает 2 компонента: (1) ре-
зервуар для поступления крови из полых и легоч-
ных вен и (2) сократительную камеру, которая вно-
сит вклад в наполнение желудочков, подобно ком-
прессору в двигателе внутреннего сгорания.
Оценку механической функции предсердий про-
водят в М-режиме и с помощью допплерографии.
М-режим позволяет оценить и измерить движение
Диагностика Когда показано проведение
Причина
ТТЭхоКГ [95] Как часть стандартного обследования всех пациентов
сФП
Оценка структуры заболеваний сердца, функции
желудочков, клапанной патологии и измерения
размеров ЛП
ЧПЭхоКГ [47,
95]
При планировании кардиоверсии или аблации, если
у пациента продолжается ФП > 48 час либо при неиз-
вестном анамнезе по поводу приема антикоагулянтной
терапии > 3 нед. Некоторые специалисты рекоменду-
ют проведение ЧПЭхоКГ всем пациентам независимо
от статуса антикоагулянтной терапии и ритма
Исключение тромбов внутри сердца с присталь-
ным вниманием на ушко ЛП
ВСЭхоКГ [47,
96, 97]
Во время катетерной аблации ФП либо при закрытии
ушка ЛП
Визуализация при проведении транссептальной
пункции, исключение осложнений, контроль по-
зиции катетера, оценка структур сердца, включая
легочные вены и ушко ЛП
ВСЭхоКГ — внутрисердечная эхокардиография; ЛП — левое предсердие; ТТЭхоКГ — трансторакальная эхокардиография; ФП — фибрил-
ляция предсердий; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 41.1 Рекомендации по использованию эхокардиографии у пациентов с фибрилляцией предсердий
ch41_условно.indd 1060
03.04.2019 12:16:07
1061
41 Фибрилляция и трепетание предсердий
створок митрального клапана даже при аритмии
[13]. При отсутствии стеноза нормальное отклоне-
ние митрального клапана составляет около 13 мм
от закрытого до полностью открытого положения
(рис. 41.2). Подвижность передней створки иногда
используют для оценки функции ЛП, ее снижение
наблюдается при низком сердечном выбросе, повы-
шенном давлении наполнения левого желудочка
(ЛЖ) и при механической дисфункции предсердий
[13].
Трансмитральная допплерография — неинва-
зивный и точный метод оценки потока крови через
митральный клапан во время наполнения желудоч-
ка. Раннее пассивное диастолическое наполнение
Рис. 41 .1 Расчет объема левого предсердия по формуле: объем левого предсердия (см3 или мл) = 1,7 × (A4C см2) × (A2C см2) / [(L4C см + L2C
см)/2]. A4C — четырехкамерная позиция, A2C — двухкамерная позиция. A1 — площадь левого предсердия, четырехкамерный вид через верхушку; A2 — пло-
щадь левого предсердия, апикальная двухкамерная позиция; L — длина левого предсердия; ЛЖ — левый желудочек; ПЖ — правый желудочек; ПП — правое
предсердие [Lang RL, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee
and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiolo-
gy, J Am Soc Echocardiogr 18:1440–1463, 2005].
ЛЖ
ЛЖ
ЛЖ
ЛЖ
А4С
А2С
ПЖ
ПЖ
ПП
ПП
LL
А1
А2
Женщины
Мужчины
Размер ПП по малой оси (см/м2)
1,9 ± 0,3
1,9 ± 0,3
Размер ПП по длинной оси (см/м2) 2,5 ± 0,3
2,4 ± 0,3
Объем ПП на 2D-ЭхоКГ (мл/м2)*
21±6
25±7
ПЗ размер (см)
2,7–3,8
3,0–4,0
Индекс ПЗ размера (см/м2)
1,5–2,3
1,5–2,3
4КВ, индекс площади (см2/м2)
9,3 ± 1,7
8,9 ± 1,5
2КВ, индекс площади (см2/м2)
9,6 ± 1,4
9,3 ± 1,6
4КВ, индекс объема МД (мл/м2)
25,1 ± 7,2
24,5 ± 6,4
4КВ, индекс объема Д (мл/м2)
27,3 ± 7,9
27,0 ± 7,0
2КВ, индекс объема МД (мл/м2)
26,1 ± 6,7
27,1 ± 7,9
2КВ, индекс объема Д (мл/м2)
28,0 ± 7,3
28,9 ± 8,5
Индекс объема ЛП (мл/м2)*
Нор-
маль-
ный
Слегка
увели-
чен
Умеренно
увели-
чен
Крайне
уве-
личен
Нор-
маль-
ный
Слегка
уве-
личен
Умеренно
увеличен
Крайне
увеличен
16–34
35–41
42–48
>48
16–34
35–41 42–48
>48
* Рекомендуется измерить для определения размеров камеры сердца.
2КВ — 2-камерный через верхушку; 4КВ — 4-камерный через верхушку; Д — длина; ЛП — левое предсердие; МД — метод дисков; ПЗ —
переднезадний; ПП — правое предсердие.
[Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 28:1–39, 2015.]
ТАБЛИЦА 41.2 Нормальные размеры левого предсердия
ch41_условно.indd 1061
03.04.2019 12:16:07
1062 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 41.3 Трансторакальная эхокардиография. 2D -спектральное изобра-
жение при импульсно-волновой допплерографии. Оценка скорости потока че-
рез митральный клапан. A — волна наполнения предсердий; E — волна ран-
него диастолического наполнения.
V
E
A
E
A
Рис. 41 .2 В М -режиме видно, что передняя створка митрального кла-
пана двигается без нарушений. При открытии передней створки митраль-
ного клапана регистрируются волны Е и А. Нормальное значение волны А со-
ставляет около 13 мм, а меньшие значения ассоциированы со сниженной ме-
ханической функцией предсердий. Также видны правый желудочек (ПЖ),
межжелудочковая перегородка (МЖП) и левый желудочек (ЛЖ).
ПЖ
МЖП
ЛЖ
Волна Е
Волна А
желудочков описывается в виде волны Е, тогда как
позднее активное наполнение, вызванное сокраще-
нием предсердий, представлено волной А. Размер,
кривая и соотношение волн Е и А зависят от час-
тоты сердечных сокращений, нагрузки и объема
предсердия при импульсно-волновой допплерогра-
фии. Наибольший объемный поток определяется
между кончиками створок митрального клапана
(рис. 41.3).
Для оценки функции ЛП используют высоту
волны А, которая используется для вычисления си-
лы сокращения предсердий [14] и их фракции вы-
броса, которую рассчитывают согласно разницы от
минимума (в конце диастолы желудочков) и макси-
мума (конец систолы желудочков) объема предсер-
дий. Величина волны А зависит от нагрузки и обыч-
но отсутствует во время ФП, что вызывает значи-
тельное ограничение этого метода.
Другой эхокардиографический метод оценки
функции предсердия — отслеживание спекл-тре-
кинга при визуализации деформации стенки. Про-
дольная деформация стенки предсердия оценивает-
ся в средней и латеральных частях в апикальной че-
тырехкамерной позиции. Из полученных данных
генерируют кривые деформации и скорости дефор-
мации (рис. 41.4).
В качестве эталонного показателя нормальной
деформации миокарда предсердий используют мак-
симальную продольную деформацию, которая со-
ставляет 42,2% ± 6,1%, и время максимальной гло-
бальной продольной деформации 368 ± 30 мсек
[15]. Пациенты с ФП, которым проводится визуали-
зация во время наличия синусового ритма, имеют
сниженную фракцию опорожнения ЛП, а также
уменьшенную деформацию боковых стенок пред-
сердий по сравнению с группой контроля без ФП
[16]. Также сниженную деформацию предсердий
имеют пациенты с ФП и высоким уровнем фиброза
стенок предсердий (что выявлено с помощью маг-
нитно-резонансной томографии с накоплением га-
долиния), что указывает на то, что фиброз связан со
сниженной механической функцией предсердий
[17, 18].
Выявлено, что размер и функция предсердий, а
также размеры желудочка и его расслабление могут
предсказать возникновение ФП. Данные Фрамин-
гемского исследования сердца указывают, что уве-
личение отношения Е/А независимо связано с раз-
витием ФП [19, 20]. Нарушение расслабления ЛЖ
также связывают с возникновением ФП у пациен-
тов старше 65 лет [21]. Расширение ЛП, увеличение
площади поверхности и объема на ТТЭхоКГ также
предсказывает развитие ФП [22] независимо от та-
ких параметров, как возраст, диабет, гипертония,
хроническая сердечная недостаточность, заболева-
ния коронарных артерий и инсульта (табл. 41.3).
Размеры правого предсердия (ПП) также увели-
чиваются при ФП и ТП, однако функция и структу-
ра ПП менее изучены, чем показатели левого пред-
сердия. Такие состояния, как хронические заболева-
ния легких, эмболия легочной артерии, легочная
гипертензия влияют на здоровье сердце и также ас-
социируются с ФП и ТП. Оценку размеров ПП ре-
комендуется проводить через четырехкамерный
вид на ТТЭхоКГ (рис. 41.5). Необходимо измерить
его размеры, площадь поверхности и объем. Сокра-
тительная функция ПП менее изучена и понятна.
При нормальной гемодинамике давление в правых
отделах сердца значительно ниже, чем в левых, а ра-
нее пассивное заполнение правого желудочка (ПЖ)
является нормой. Низкое легочное сосудистое со-
противление и незначительная трикуспидальная
ch41_условно.indd 1062
03.04.2019 12:16:07
1063
41 Фибрилляция и трепетание предсердий
регургитация не являются аномальными. Риск ФП
возрастает при сниженном систолическом смеще-
нии фиброзного кольца трикуспидального клапана
у пациентов с систолической сердечной недостаточ-
ностью [7].
Размеры и функцию предсердий можно оценить
с помощью ЧПЭхоКГ. Однако лишь для этих целей
ЧПЭхоКГ не используется в виду инвазивного ха-
рактера процедуры. Тем не менее, данное исследо-
вание дает явное преимущество при оценке ЛП и
ПП в оценке функции, диагностики наличия тром-
бов. Фактически, ЧПЭхоКГ чаще всего проводится
при ФП для исключения либо подтверждения тром-
ба, от результата диагностики будет зависеть такти-
ка лечения ФП с точки зрения снижения частоты
инсультов. В следующих разделах будет более под-
робна описана взаимосвязь ФП и случаев тромбо-
эмболии.
ИНСУЛЬТ И ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
Связь ФП с ишемическим инсультом была выявле-
на по результатам многократных когортных иссле-
дований. Обнаружено, что наличие ФП связывают
с пятикратным увеличением риска развития ин-
сульта [23], а тромбоэмболия, связанная с ФП, яв-
ляется причиной 20% ишемических инсультов [24].
Однако эти цифры не точные, т.к. некоторые ин-
сульты неопределенной этиологии (криптогенные)
также могут быть связаны с ФП. Зачастую инсуль-
Рис. 41 .4 Двухмерная спекл-трекинг ЭхоКГ левого предсердия. (A) Четырехкамерный вид области интереса для оценки спекл-трекинга. (Б) Цветной
M-режим с оценкой деформации левого предсердия (ЛП) во всех отделах во время сердечного цикла. (В) Кривая деформации ЛП (штриховая линия), получен-
ная за шесть сердечных циклов [Teixeira R, Vieira MJ, Goncalves L. Left atrial reservoir phase: deformation analysis. Eur Heart J Cardiovasc Imaging 14[5]:500–501,
2013].
Положительная волна деформации ЛП
Отрицательная волна деформации ЛП
Полная деформация ЛП
А
Б
В
Эхокардиографический
показатель
Ассоциированный риск
Увеличение отношения E/A
ratio на тканевой доппле-
рографии
Увеличивается риск развития
ФП [19]
Увеличение скорости
волны A
U-образные волны связывают
с риском развития ФП [19]
Увеличение размера
предсердий
Увеличивается риск развития
ФП [20]
Увеличение толщины
стенки ЛЖ
Увеличивается риск развития
ФП [20]
Уменьшение фракции
укорочения ЛЖ
Увеличивается риск развития
ФП [20]
Нарушение расслабления,
псевдонормальное напол-
нение желудочков и нару-
шение диастолической
функции
Увеличивается риск развития
ФП [22]
Увеличение объема ЛП
Увеличивается риск рецидива
после катетерной аблации
[99]
Снижение деформации
стенки ЛП
Увеличивается риск рецидива
после катетерной аблации
[100]
ЛЖ — левый желудочек; ЛП — левое предсердие; ФП — фибрил-
ляция предсердий.
ТАБЛИЦА 41.3
Взаимосвязь эхокардиографических
показателей с риском развития
фибрилляции предсердий либо ее
рецидив после катетерной аблации
ch41_условно.indd 1063
03.04.2019 12:16:07
1064 ЧАСТЬ VII Сосудистые и системные заболевания
ты, ассоциированные с ФП, более массивные и при-
водят к большей инвалидизации и смертности по
сравнению с другими типами [4]. Таким образом,
инсульт является одной из главных причин смерти,
заболеваемости и статьей расходов в здравоохране-
нии на ФП, поэтому одна из главных целей лечения
пациентов с ФП заключается в оценке и снижении
рисков.
РОЛЬ УШКА ЛЕВОГО ПРЕДСЕРДИЯ
Считается, что инсульт при ФП обусловлен образо-
ванием тромбов в полости ЛП с последующей эм-
болизацией мозгового кровообращения. При выяв-
лении тромбов в предсердиях у пациентов с ФП в
90% случаев они имеются и в ушке ЛП (УЛП) [25].
Имеется мнение, что образование тромбов в
УЛП у пациентов с ФП опосредовано связано с фак-
торами, сочетающимися с компонентами триады
Вирхова: (1) структурные и функциональные изме-
нения, ведущие к застою крови, (2) повреждение
тканей предсердий и (3) гиперкоагуляции крови и
активации системы гемостаза.
МОРФОЛОГИЯ УШКА ЛЕВОГО ПРЕДСЕРДИЯ
УЛП представляет собой удлиненный трубкообраз-
ный анатомический мешок, который соединен по
переднелатеральной поверхности с ЛП. Исследова-
ния показывают, что ушко является эмбриологиче-
ски ЛП, которое служит резервуаром для поступле-
ния крови в формирующийся ЛЖ. Форма УЛП ва-
рьируется согласно индивидуальным особенностям.
Согласно данным аутопсии, чаще всего ушки состо-
ят из одной и более долей (до четырех), а у боль-
шинства встречается две части [26]. Внутренняя по-
верхность ушка левого предсердия (УЛП) имеет
множество трабекул, которые представлены гребен-
чатыми мышцами и играют роль в сокращении и
опорожнении УЛП. Данная структура контрастиру-
ет с гладкой внутренней поверхностью ЛП, которое
развивается при слиянии развивающих легочных
вен [25]. Анатомическая вариативность УЛП может
вызвать некоторые проблемы при эхокардиографи-
ческой оценке [27]. Кроме того, ретроспективные
исследования выявили, что некоторые анатомиче-
ские формы УЛП (в виде «цветной капусты») связа-
ны с повышенным риском развития инсульта по
сравнению с другими (в виде «куриного крыла»)
[28, 29] (рис. 41.6). Изменение морфологии УЛП от-
мечается у пациентов с ФП. Не скрининговые иссле-
дования показали, что объем УЛП у пациентов с ФП
в три раза больше, чем у людей без ФП в анамнезе.
Также отмечено, что УЛП при ФП имеет большую
площадь поверхности и более широкое устье, сое-
диняющее его с ЛП [25, 30]. Однако не до конца по-
нятно, вносят ли эти морфологические изменения
какой-либо вклад в развитие ФП либо являются
следствием ремоделирования при аритмии.
ФУНКЦИЯ УШКА ЛЕВОГО ПРЕДСЕРДИЯ
Функцию УЛП обычно оценивают с помощью доп-
плерографии, оценивая скорость кровотока через
устье УЛП во время всего сердечного цикла. В ис-
следовании 50 пациентов с сердечно-сосудистыми
заболеваниями на ЧПЭхоКГ измерили скорость со-
кращения УЛП, которая составила 60 ± 14 см/сек, а
скорость наполнения составляла 52 ± 13 см/сек [31].
Другой метод оценки заключается в использовании
тканевой допплерографии. Снижение сократимо-
Рис. 41 .5 Трансторакальная визуализация правого предсердия со стороны верхушки, четырехкамерный вид. Проводят измерение по малой оси
правого предсердия (ПП) между средним отделом боковой стенки и средним отделом перегородки (пунктирная двухсторонняя стрелка). Также в конце систолы
проводят измерение площади ПП по линии трикуспидального клапана (ТК). ЛЖ — левый желудочек; ЛП — левое предсердие.
ПЖ
ЛЖ
ЛП
ТК
ch41_условно.indd 1064
03.04.2019 12:16:08
1065
41 Фибрилляция и трепетание предсердий
Рис. 41 .6 Варианты морфологии ушка левого предсердия. На рисунках представлена корреляция между ЧПЭхоКГ (А, Г, Ж, К), данными ангиокардиогра-
фии (B, E, З, Л) и изображениями компьютерной томографии (В, Е, И, М). Каждая колонка соответствует разным пациентам. Колонка А–В отражает морфологию
«цветной капусты», Г–Е
—
«ветроуказатель», Ж –И
—
«кактус» и К–М
—
«куриное крылышко» [Beigel R, et al. The left atrial appendage: anatomy, function, and
noninvasive evaluation, J Am Coll Cardiol Imaging 7:1251–1265, 2014].
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
сти УЛП приводит к застою крови в нем, что, как
предполагается, способствует образованию тром-
бов.
ИЗМЕНЕНИЯ ТКАНЕЙ УШКА ЛЕВОГО ПРЕДСЕРДИЯ
ФП ассоциируется с развитием эндомиокардиаль-
ного фиброэластоза предсердий. Электронно-ми-
кроскопическое исследование образцов от пациен-
тов с ФП и с заболеваниями митрального клапана
(стеноз либо регургитация) показало, что ФП связа-
на с большими изменениями эндотелия предсер-
дий. Изменения затрагивали чаще всего УЛП, чем
ПП. Кроме этого, развитие фиброэластоза сопрово-
ждается увеличением уровня фактора Виллебранда,
который является маркером повреждения эндоте-
лия [32]. Аналогичные изменения наблюдаются у
пациентов с ФП и без отсутствия клапанной пато-
логии, однако данные исследования еще не про-
ведены. Весь биопсийный материал взят во время
кардиохирургических операций по поводу забо-
леваний клапанов. Неинвазивный метод оценки из-
менений ткани предсердий при ФП является более
предпочтительным.
ИЗМЕНЕНИЯ ГЕМОСТАЗА
Формирование тромба в УЛП имеет некоторую об-
щую патофизиологию с другими образованием
других тромбов, образующихся в других локализа-
циях сердечно-сосудистой системы, что требует ак-
тивации каскада коагуляции, а также включению
тромбоцитарных факторов. Для успешного форми-
рования тромба, баланс между протромботически-
ми и антитромботическими факторами должен спо-
собствовать свертыванию крови. В течение дли-
тельного периода времени у пациентов с ФП
наблюдается колебания между этими факторами.
Наличие тромба в УЛП на ЧПЭхоКГ является лишь
отражением ситуации в данный момент времени.
Но весь каскад процессов, ведущих к образованию
тромбов и их последующему разрешению, недоста-
ch41_условно.indd 1065
03.04.2019 12:16:09
1066 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 41 .8 Импульсно-волновая допплерография ушка левого пред-
сердия у пациента с фибрилляцией предсердий и быстрым ответом
желудочков. В данном примере измерения получены в 1 см от устья ушка.
Скорость составляет 0,4 –0 ,8 м/сек со средней 0,63 см/сек на 10 ударов серд-
ца. Нормальный показатель составляет 0,4 м/сек и больше. При меньшей ско-
рости возрастает риск развития инсульта.
точно изучен. Прием пероральных антикоагулян-
тов замедляет процессы тромбообразования. В од-
ном из исследований, Lim и соавт. выяснили, что
ФП и частота сокращения предсердий в районе
150 уд/мин связаны со значительной активностью
тромбоцитов и активации гемостаза спустя 15 мин
после эпизода ФП [33]. К определяемым факторам
относили p-селектин, CD-40 в качестве маркера вос-
паления тромбоцитов, комплексы тромбин-анти-
тромбин в качестве маркера активации коагуляци-
онного каскада и диметиларгинина в виде маркера
дисфункции эндотелия.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
ПРИ ЛЕЧЕНИИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Восстановление нормального ритма является луч-
шей стратегией. Варианты лечения включают кар-
диоверсию постоянным током, прием антиаритми-
ческих препаратов, радиочастотную катетерную
аблацию. Однако перед любым вмешательством не-
обходимо убедиться в том, что у пациента отсут-
ствуют тромбы, особенно при невозможности уста-
новить продолжительность эпизодов аритмий.
Восстановление ритма сопровождается возвра-
том нормальной сократительной функции УЛП,
что, как предполагается, и вытесняет тромб из его
полости в системное кровообращение. Прямой кон-
такт катетера при аблации с тромбом в УЛП также
может спровоцировать тромбоэмболию. Таким об-
разом, многим пациентам с ФП перед оперативным
вмешательством выполняют ЧПЭхоКГ для поиска
тромбов в УЛП, особенно в тех случаях, когда нет
достоверных данных о приеме пероральных анти-
коагулянтов (рис. 41.7) [34].
В настоящее время ЧПЭхоКГ является золотым
стандартом для выявления тромбоза УЛП [35] в
связи с тем, что тромбы плохо визуализируются на
ТТЭхоКГ. ЧПЭхоКГ представляет собой инвазив-
ную процедуру, которая требует применения ане-
стезии и сознательной седации, сопровождается ин-
тубацией пищевода. Все это может вызвать диском-
фортные ощущения у пациента, а также привести в
редких случаях к осложнениям в виде перфорации
пищевода, аспирационной пневмонии и дисфагии.
Многоплановая и трехмерная (3D) ЧПЭхоКГ по-
зволяет выявить анатомические особенности, в том
числе наличие и ход гребенчатых мышц, подсчи-
тать количество камер УЛП (см. рис. 41.6). Импуль-
сно-волновая допплерография используется для из-
мерения скорости притока и оттока, показатели ко-
торых обычно снижаются
при длительно
персистирующей ФП (рис. 41.8). Нормальные пока-
затели скорости составляют > 0,4 м/сек.
После восстановления нормального ритма серд-
ца рекомендуется проводить антикоагулянтную те-
рапию не менее 4 нед, т.к. период после кардиовер-
сии характеризуется высоким риском тромбообра-
Рис. 41 .7 Тромб в ушке левого предсердия при чреспищеводной эхо-
кардиографии. Для исключения артефактов или принятия трабекул за тромб
необходимо провести диагностику во всех позициях во время всего сердечно-
го цикла. Трабекулы обычно характеризуются линейным ходом с прикреплени-
ем к стенке предсердия. Для хорошей визуализации рекомендуется использо-
вать высокочастотные датчики (7 МГц).
Тромб
зования. Предположительно это связано с задержкой
восстановления нормальной сократительной функ-
ции предсердий после процедуры даже в отсут-
ствии ФП. Прямое воздействие кардиоверсии на си-
стему свертывания и повреждения ткани не изуче-
но.
ЧПЭхоКГ имеет ряд ограничений, одним из наи-
более распространенным является анатомическая
особенность УЛП, изменение его размеров и фор-
мы, включая множественные трабекулы, что приво-
дит к неоднозначному мнению при попытке визуа-
лизировать тромб. Пациентам с ФП может потребо-
ch41_условно.indd 1066
03.04.2019 12:16:09
1067
41 Фибрилляция и трепетание предсердий
ваться проведение повторной ЧПЭхоКГ как часть
общего обследования, т.к. ФП относится к рециди-
вирующим аритмиям несмотря на ранее проведен-
ные вмешательства по ее поводу.
Альтернативный вариант проведения кардио-
версии с использованием ЧПЭхоКГ является четы-
рехнедельный прием пероральных антикоагулян-
тов. Данная стратегия применима лишь у тех паци-
ентов, которые могут придерживаться лечения в
течении всего периода [36].
ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ
С КЛАПАННОЙ ПАТОЛОГИЕЙ И БЕЗ НЕЕ
Фибрилляция предсердий часто встречается вместе
с патологией клапанов сердца различной степени
тяжести, поэтому иногда применяется термин «кла-
панная ФП». Однако данное название является пред-
метом обсуждений среди специалистов в области
кардиологии. Важнейшей особенностью в тактике
лечения ФП с и без клапанной патологии является
оценка риска тромбоэмболии и выбор пероральных
антикоагулянтов. На данный момент имеются ру-
ководства по лечению пациентов с ФП и тяжелой
степенью стеноза митрального клапана, а также при
наличии искусственных клапанов сердца (особенно
в североамериканских руководствах) [37–39]. До-
стоверно известно, что пациенты с вышеупомяну-
тыми заболеваниями клапанов имеют повышен-
ный риск тромбоэмболии и которым рекомендует-
ся постоянный прием витамина К. При появлении
на рынке пероральных антикоагулянтов, которые
не содержат витамин К, некоторые группы пациен-
тов с заболеваниями клапанов были исключены из
клинических испытаний из-за их высокой неодно-
родности. Так, были исключены из исследования
RE-LY, в котором изучали дозировки дабигатрана
против варфарина, пациенты с протезами клапа-
нов, а также с гемодинамически значимыми клапан-
ными заболеваниями сердца, например стенозом,
митральной либо аортальной регургитацией [40]. В
исследованиях ROCKET-AF, ARISTOTLE и EN-
GAGE-AF оценивали применение ривароксабана,
ариксабана, эдоксабана, соответственно, с примене-
нием варфарина, при условии, что группы пациен-
тов с протезами, гемодинамически значимыми сте-
нозами митрального клапана были из них исклю-
чены [41–43]. Анализ этих подгрупп из всех
исследований не показал различий от общего резуль-
тата когортных исследований, что свидетельствует о
сходной эффективности и безопасности данных пре-
паратов у пациентов как с клапанной патологией, так
и без. Было доказано, что дабигатран при использо-
вании у пациентов с механическими клапанами серд-
ца связан с повышенным риском тромбоэмболиче-
ских осложнений и кровотечений [44].
Эхокардиографическая оценка на ТТЭхоКГ и
ЧПЭхоКГ остается стандартным методом диагно-
стики у пациентов с различной формой заболева-
ний клапанов сердца и описывается в отдельных
главах этого пособия.
ЭХОКАРДИОГРАФИЯ ВО ВРЕМЯ ПРОЦЕДУРЫ
КАТЕТЕРНАЯ АБЛАЦИЯ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Было установлено, что триггером ФП выступает
преждевременное сокращение предсердий с им-
пульсом, который образуется в легочных венах. Та-
ким образом предположили, что радиочастотная
аблация преждевременных сокращений предсердий
сможет предотвратить последующие эпизоды ФП
[45]. Первый опыт операций включал аблацию
только легочных вен, в то время как на данный мо-
мент принята методика селективной аблации по
сегментам вокруг устьев легочных вен либо в виде
круговой аблации с правой и левой стороны [46–
48]. Цель процедуры у пациентов с пароксизмаль-
ной ФП заключается в создании электрической изо-
ляции легочных вен, чтобы преждевременное со-
кращение предсердий не провоцировали ФП.
Современные технологии представлены криобал-
лонами, которые позволяют провести изоляцию од-
ной легочной вены за одну-две заморозки [49].
У пациентов с персистирующей ФП используют-
ся различные подходы для увеличения частоты по-
ложительного результата после вмешательства, на-
пример, проведение линейной аблации в качестве
имитации открытой хирургической процедуры «ла-
биринт». Типичные пути, где выполняют аблацию,
включают крышу предсердия, соединяющую верх-
ние легочные вены, митральный перешеек между
левой нижней легочной веной и митральным кла-
паном, а также верхнюю линию, соединяющую ле-
вую верхнюю легочную вену и переднюю створку
митрального клапана [47]. Другие специалисты
предположили, что при снятии электрограммы с
предсердий низкоамплитудные высокочастотные
(< 120 м/сек) электрические сигналы могут иници-
ировать ФП и необходимо проводить дополнитель-
ную аблацию этих очагов [47, 50]. Также пока неяс-
но, улучшает ли ФП линейная или комплексная
фракционная аблация [51, 52].
ВНУТРИСЕРДЕЧНАЯ ЭХОКАРДИОГРАФИЯ
Внутрисердечная эхокардиография (ВСЭхоКГ) ру-
тинно используется в электрофизиологических ла-
бораториях для визуализации анатомии сердца в
режиме реального времени, проведения транссеп-
тальной пункции, определения местоположения и
перемещения катетера, визуализации формирую-
щегося очага аблации и контроля за осложнениями
во время процедур (табл. 41.4). Наиболее часто для
этих целей используется катетеры для ВСЭхоКГ
размером 8 или 10 Fr. Данный катетер можно пози-
ционировать во все стороны, также он позволяет
проводить визуализацию в М-режиме, 2D-режиме,
ch41_условно.indd 1067
03.04.2019 12:16:10
1068 ЧАСТЬ VII Сосудистые и системные заболевания
а также цветовую, непрерывно-волновую тканевую
допплерографию. На данный момент имеются но-
вые модели с возможностью 3D-визуализации. Вто-
рой тип катетеров для ВСЭхоКГ — радиальный тип
размером 9 Fr, однако он имеет меньшую глубину
обзора.
Осложнения
Технические аспекты
Ограничения
Альтернативные
варианты
Перикардиальная
жидкость
При использовании ВСЭхоКГ для визу-
ализации перикардиальной полости
вокруг ПЖ, катетер необходимо заве-
сти в полость желудочка и вращать
его против часовой стрелки. Дальней-
шее вращение позволит визуализиро-
вать ЛЖ
Отсутствуют возможные методы
оценки тампонады сердца на
ВСЭхоКГ. Однако наличие экс-
судата ≥ 1 см считается значи-
тельным. Иногда могут возник-
нуть сложности с заведением ка-
тетера в ПЖ
Для проведения перикар-
диоцентеза возможно
использование
ЧПЭхоКГ или ТТЭхоКГ
Воздушная либо
тромбоэмболия
Визуализация ЛЖ на ВСЭхоКГ с катете-
ром в ПЖ позволяет выявить наруше-
ние сократимости миокарда
Визуализация ЛЖ может быть за-
труднена из-за позиции катете-
ра. Хорошо визуализируется
лишь перегородка и боковая
стенка
ЧПЭхоКГ или ТТЭхоКГ
позволяет визуализиро-
вать ЛЖ, но ТТЭхоКГ
имеет ограничения
в стерильных условиях
Парез диафрагмаль-
ного нерва
Катетер ВСЭхоКГ оттягивают на уро-
вень соединения НПВ/ПП и визуали-
зируют диафрагму/печень и стимули-
руют диафрагмальный нерв. Отсут-
ствие движений диафрагмы указывает
на парез нерва
Данный метод может не отра жать
экскурсию диафрагмы. Также,
при использовании
3D-картирования на ВСЭхоКГ
может быть задержка между са-
мим изображением и отображе-
нием его на экране монитора
Мануальная пальпация
живота, рентгеноско-
пия, электромиограмма
диафрагмы
Тромбоз ЛП
С помощью ВСЭхоКГ можно обнару-
жить тромбы в ЛП либо вокруг доста-
вочной системы
Зачастую можно не заметить ма-
ленькие тромбы, так они могут
образовываться в полости
Можно использовать
ЧПЭхоКГ
Повреждения пище-
вода
Катетер ВСЭхоКГ заводят в ПП и вра-
щается по часовой стрелке до тех пор,
пока не будет виден пищевод
Плохое качество изображений пи-
щевода
Мониторинг температу-
ры пищевода,
3D-картирование с заве-
дением катетера в пи-
щевод, проведение
КТ/МРТ во время про-
цедуры
Повреждения ми-
трального клапана
Редко возникает повреждение митраль-
ного клапана катетером. Визуализация
клапана возможна при позициониро-
вании катетера ВСЭхоКГ в ПП и рота-
ции его по часовой стрелке. Также ка-
тетер можно завести в ПЖ с поворо-
том против часовой стрелки с
визуализацией ЛЖ и митрального
клапана
Визуализация митрального клапа-
на на ВСЭхоКГ часто затруднена
и не позволяет адекватно оце-
нить повреждение и степень ре-
гургитации. Полностью оценить
целостность и работу подкла-
панного хордального аппарата
не представляется возможным
ЧПЭхоКГ позволяет вы-
полнить полную оцен-
ку митрального клапана
Стеноз легочных
вен
ЧПЭхоКГ позволяет оценить диаметр
ЛВ и поток по ним. Импульсно-вол -
новая и цветовая допплерографии из-
меряют ускоренный кровоток и нали-
чие его турбулентного характера. Так-
же ЧПЭхоКГ используется при
баллонной ангиопластике либо уста-
новке стента
ЧПЭхоКГ инвазивная процедура.
Также правые легочные вены
могут плохо визуализироваться
Реальный диаметр ЛВ
позволяет получить КТ
либо МРТ. Количе-
ственное сканирование
перфузии легких позво-
ляет оценить снижение
кровотока в сегментах
легких
ВСЭхоКГ — внутрисердечная эхокардиография; КТ — компьютерная томография; ЛВ — легочные вены; ЛЖ — левый желудочек; ЛП —
левое предсердие; МРТ — магнитно -резонансная томография; НПВ — нижняя полая вена; ПЖ — правый желудочек; ПП — правое пред-
сердие; ТТЭхоКГ — трансторакальная эхокардиография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 41.4 Применение эхокардиографии для оценки осложнений во время аблации фибрилляции предсердий
Оценка анатомии сердца осуществляется при по-
зиционировании датчика в ПП. Начинают визуали-
зацию с трикуспидального клапана и ПЖ, а затем
вращают катетер по часовой стрелке и последова-
тельно оценивают аортальный клапан и выходной
тракт ЛЖ, митральный клапан и УЛП, левые легоч-
ch41_условно.indd 1068
03.04.2019 12:16:10
1069
41 Фибрилляция и трепетание предсердий
ные вены, заднюю стенку ЛП, правую нижнюю ле-
гочную вену и, наконец, правую верхнюю легочную
вену.
ВСЭхоКГ является крайне полезным способом
или даже основным методом для визуализации при
проведении транссептальной пункции [53]. ВСЭ-
хоКГ позволяет четко визуализировать межпред-
сердную перегородку, включая такие аномалии, как
липоматозную гипертрофию, дилатацию корня
аорты, аневризмы перегородки — все, что может за-
труднить проведение транссептальной пункции.
Также возможна визуализация анатомического со-
единения перегородки с аортальным клапаном спе-
реди и стенкой ЛП сзади. Непосредственно перед
пункцией визуализируют положение иглы в обла-
сти овальной ямки. Кончик иглы визуализируется в
виде пятна у перегородки (рис. 41.9). Все это обеспе-
чивает точное позиционирование доставочной си-
стемы и иглы в нужное место, т.к. для различных
процедур может потребоваться пункция разных
мест перегородки. Например, задняя пункция, на-
правленная к левым легочным венам, предпочти-
тельна для радиочастотной аблации, а передняя для
проведения аблации с помощью криобаллонов.
При прохождении катетера в ЛП, часто можно ви-
деть кончик иглы, который свободно «прыгает» в
полости сердца. Также для подтверждения доступа
в ЛП можно использовать пробу с пузырьковым
контрастированием.
Для выполнения радиочастотной аблации при
ФП можно использовать два проводника. Некоторые
хирурги проводят транссептальную пункцию, заво-
дят проводник через перегородку для сохранения до-
ступа в ЛП, а затем через это же отверстие заводят
второй проводник или катетер. ВСЭхоКГ облегчает
визуализацию и проведение второго катетера.
Рис. 41 .9 Транссептальная пункция. Игла для пункции и доставочная си-
стема располагаются в полости правого предсердия с упором кончика иглы в
межпредсердную перегородку (МПП) перед введением ее в левое предсердие
(ЛП).
МПП
Игла для пункции
ЛП
Рис. 41 .10 Тромб в ушке левого предсердия, вид по короткой оси. Ка-
тетер для ВСЭхоКГ заведен в легочную артерию для визуализации ушка под
левой ветвью легочной артерии.
Легочная
артерия
Тромб в ушке левого
предсердия
У пациентов с дефектом межпредсердной пере-
городки и его хирургическим лечением в анамнезе
ВСЭхоКГ позволяет оценить и определить место
пункции. Обычно ее проводят на удалении от за-
платы либо окклюдера, однако, при необходимости,
катетер могут провести и через них [54, 55].
ВСЭхоКГ также используется для оценки тром-
бов в ушке ЛП (рис. 41.10). Как правило, для этого
используют катетер с фазированной решеткой, т.к.
им можно манипулировать внутри сердца для обе-
спечения оптимальной визуализации. УЛП можно
оценивать различными способами, что гарантирует
достоверное подтверждение отсутствия тромба.
Наилучшую визуализацию обеспечивается позиция
в выходном тракте ПЖ [56]. Катетер поворачивают
по часовой стенке, что позволяет вывести УЛП по
длинной оси, включая его устье и боковые придат-
ки. Затем катетер перемещают через клапан и пози-
ционируют в легочную артерию с дальнейшей ви-
зуализацией по короткой оси. Вращение по часовой
стрелке позволяет еще лучше визуализировать
устье УЛП и оценить связь с митральным клапаном
(рис. 41.11). Изображения далее могут дополни-
тельно помочь в оценке анатомии УЛП.
Кроме этого, позиционирование катетера назад
в ПП также позволяет провести визуализацию устья
УЛП, хоть данная позиция затрудняет отчетливую
визуализацию тромбов. Использование высокоча-
стотных датчиков (от 7,5 до 8,5 МГц) обеспечивает
более высокое качество изображений для диффе-
ренцировки тромбов при контрастировании [56].
Визуализация УЛП также проводится при размеще-
нии катетера для ВСЭхоКГ в коронарном синусе,
однако эта позиция технически сложна из-за огра-
ниченной маневренности катетера, размеров и ана-
томии коронарного синуса (см. рис. 41.11) [57, 58].
ch41_условно.indd 1069
03.04.2019 12:16:10
1070 ЧАСТЬ VII Сосудистые и системные заболевания
Позиция в легочной артерии может улучшить ви-
зуализацию УЛП [59]. Отмечено, что полезно обу-
чение по использованию ВСЭхоКГ для обнаруже-
ния тромбов в ЛП. В одном из исследований после
28 проведенных ВСЭхоКГ было выявлено эквива-
лентное количество тромбов с помощью ЧПЭхоКГ
и ВСЭхоКГ [59].
После транссептальной пункции возможно по-
зиционирование катетера для ВСЭхоКГ в ЛП, одна-
ко это может спровоцировать смещение либо вы-
теснение тромба при его наличии [57].
В многоцентровом исследовании выявлено, что
ВСЭхоКГ эквивалентна ЧПЭхоКГ для идентифика-
ции спонтанного контрастирования в ЛП или УЛП,
однако отмечено, что ВСЭхоКГ лучше для оценки
непосредственно в ЛП, а ЧПЭхоКГ — для выявле-
ния формирующегося тромба в УЛП [60]. Еще в од-
ном исследовании было доказано, что ВСЭхоКГ
можно использовать для исключения тромбоза
УЛП при неоднозначных данных на ЧПЭхоКГ [56].
Во время аблации, ВСЭхоКГ используется для оцен-
ки контакта катетера со стенкой предсердия вне ле-
гочных вен и для оценки формирования пара, кото-
рый образуется при достижении температуры ткани
100°C. Обычно образование пара слышно хирургу
даже вне тела. Данный процесс увеличивает риск
перфорации сердца. Во время проведения аблации
ВСЭхоКГ также позволяет выявить формирующий-
ся тромб в ЛП на стенке катетера или проводника
[61]. Предсердно-пищеводная фистула редко воз-
никает после аблации ФП из-за чрезмерного нагре-
вания и охлаждения стенки пищевода во время воз-
действия на стенку ЛП. Существует несколько спо-
собов контроля за целостностью пищевода, включая
в себя установку температурного датчика, бариевую
эзофагограмму, а также ВСЭхоКГ. Пищевод может
смещаться во время проведения интраоперацион-
ной компьютерной или магнитно-резонансной то-
мографии, поэтому ВСЭхоКГ является полезным
дополнением для его локализации [62]. Пищевод
обычно визуализируется на ВСЭхоКГ вдоль задней
стенки ЛП, что позволяет избежать проведения
аблации рядом с ним.
При аблации с использованием криобаллонов
некоторые хирурги используют цветовую доппле-
рографию для оценки окклюзии легочных вен [63,
64]. Если отмечается визуализация кровотока меж-
ду баллоном и стенкой предсердия, то это значит,
что произошла неполная окклюзия и требуется пе-
рестановка баллона (рис. 41.12). Одним из наиболее
частых осложнений при проведении криобаллон-
ной аблации является парез диафрагмального не-
рва. ВСЭхоКГ используется для визуализации диа-
фрагмы во время аблации для снижения вредного
воздействия радиационного излучения от рентгено-
скопии [65].
Изображения на ВСЭхоКГ можно объединить с
3D-электроанатомическим картированием (Carto-
Sound, Biosense Webster, Diamond Bar, Calif) для по-
лучения полной анатомии без вхождения катетера в
полость ЛП [66–69]. Все это позволяет улучшить
визуализацию кончика катетера, расположения пи-
щевода и уменьшить время процедуры.
ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ
ЧПЭхоКГ можно использовать вместо ВСЭхоКГ во
время аблации при ФП т.к. большинство врачей уже
владеют техникой проведения исследования в усло-
виях операционной с использованием седации либо
общей анестезии. Обычно ЧПЭхоКГ используется
Рис. 41 .11 Визуализация ушка левого предсердия на внутрисердеч-
ной эхокардиографии при размещении катетера в коронарном сину-
се. Заведение катетера в коронарный синус может вызвать технические слож-
ности. Но при этом возможно получить четкое изображение ушка левого пред-
сердия (УЛП) и выявить тромб в его полости.
УЛП
Рис. 41 .12 Внутрисердечная эхокардиография, визуализация при про-
ведении аблации криобаллоном в левой нижней легочной вене. Кри-
обаллон расположен поперек межпредсердной перегородки в полости левого
предсердия в устье левой нижней легочной вены (ЛНЛВ), которую плохо вид-
но из-за затенения. На цветовой допплерографии виден резидуальный шунт.
Успех процедуры определяется полной окклюзией легочных вен баллоном.
Межпредсердная
перегородка
Неполная окклюзия
Криобаллон
ch41_условно.indd 1070
03.04.2019 12:16:11
1071
41 Фибрилляция и трепетание предсердий
до аблации ФП для исключения тромба в УЛП, осо-
бенно у пациентов, которые не получают адекват-
ную антикоагулянтную терапию [70]. Использова-
ние ЧПЭхоКГ на протяжении всей процедуры про-
ще и экономически дешевле, чем использование
ВСЭхоКГ. Кроме этого, некоторые врачи предпочи-
тают использовать ЧПЭхоКГ для снижения процен-
та сосудистых осложнений, которые связаны с ис-
пользованием доставочных систем и образования
тромбов на катетерах для ВСЭхоКГ [71]. Использо-
вание ЧПЭхоКГ наряду с рентгеноскопией при
транссептальной пункции связано с низкой часто-
той развития тампонады сердца [72].
3D-ЧПЭхоКГ позволяет лучше визуализировать
межпредсердную перегородку для облегчения транс-
септальной пункции. Данный способ особенно по-
лезен при оценке окклюзии легочных вен при ис-
пользовании криобаллонной аблации. В одном
исследовании было показано, что все легочные ве-
ны возможно визуализировать с помощью 3D-
ЧПЭхоКГ с последующей их окклюзией и электри-
ческой изоляцией [73]. Еще в одном исследовании
описали, что 3D-ЧПЭхоКГ не позволяет хорошо ви-
зуализировать нижние легочные вены из заднего
положения по сравнению с верхними [74].
Однако существует опасение, что проведении
ЧПЭхоКГ наряду с использованием общей анесте-
зии может увеличить риск изъявления пищевода во
время аблации ФП [75]. Это связывают с нагревом
эхо-зонда из-за вибрации пьезоэлектрического кри-
сталла, поглощения энергии ультразвука, механи-
ческой травмы или ишемии от сдавления пищевода
датчиком [75, 76]. Все это может усугубится из-за
необходимого высокого уровня антикоагулянтной
терапии, т.к. во время процедуры аблации время
свертывания крови должно составлять не менее
300 сек. При проведении ЧПЭхоКГ во время абла-
ции ФП у 1110 пациентов было отмечено возникно-
вение гематомы пищевода в 0,27% случаев [77].
Примерно у 1,3% пациентов, которые подверга-
ются аблации из-за ФП, возникает критический сте-
ноз легочных вен [78], однако возможно этот уро-
вень может быть выше, т.к . у многих пациентов это
осложнение протекает бессимптомно. Как правило,
при появлении симптомов выявляют стеноз двух и
более вен [79]. При невозможности оценки стеноза
или неоднозначных данных на КТ и МРТ следует
провести ЧПЭхоКГ. Для оценки степени стеноза из-
меряют размер и скорость потока с помощью цве-
товой и импульсно-волновой допплерографии [80–
82]. Использование ЧПЭхоКГ полезно при балло-
нировании стенозов или при имплантации стентов,
а также для оценки рестенозов [80].
АБЛАЦИЯ ПРИ ТРЕПЕТАНИИ ПРЕДСЕРДИЙ
ВСЭхоКГ иногда используют при аблации ТП. Кри-
тическая область для предотвращения ТП и его ре-
цидивов с помощью аблации является область
устьев полых вен и трикуспидального клапана. Од-
нако зачастую анатомия данной области имеет мно-
жество вариации из-за гребенчатых мышц, трабе-
кул и евстахиевой заслонки, что может вызвать
трудности при манипуляции с катетером и его по-
зиционировании. ВСЭхоКГ используют для визуа-
лизации любых анатомических аномалий, а также
для оценки контакта катетера с миокардом (рис.
41.13) [83–85]. Наилучшую визуализацию обеспе-
чивает позиция катетера в середине ПП с разворо-
том в сторону устьев полых вен и трикуспидально-
го клапана.
ЗАКРЫТИЕ УШКА ЛЕВОГО ПРЕДСЕРДИЯ
Закрытие УЛП выполняют для снижения риска его
тромбоза и последующих инсультов. Наиболее рас-
пространенным методом было хирургическое уда-
ление или лигирование УЛП. Есть данные, что
лигирование УЛП позволяет снизить риск последу-
ющих тромбоэмболических осложнений и с реко-
мендациями класса IIа согласно American College of
Cardiology/American Heart Association у пациентов с
ФП и сопутствующим оперативным вмешатель-
ством на митральном клапане [37]. Однако результа-
ты ЧПЭхоКГ показали, что перевязка УЛП успешна
лишь в 23% случаев против 73% при его иссечении
[86]. Те пациенты, у которых выявлено неудачное
лигирование УЛП, имеют более высокий риск воз-
никновения его тромбоза в последующем [86].
Устройство Watchman (Boston Scientific, Минне-
аполис, Миннесота) в настоящее время одобрено
FDA для клинического использования и снижения
риска тромбоэмболии у пациентов с ФП без клапан-
ной патологии, которые отказываются принимать
антикоагулянты. Watchman имплантируется эндо-
Рис. 41 .13 Внутрисердечная эхокардиография области устьев полых
вен и трикуспидального клапана у пациента с трепетанием предсер-
дий после неудачной аблации. Видна полость, которая не была распозна-
на в предыдущую аблацию. На данный момент провели повторную аблацию с
успешным исходом без рецидивов трепетания предсердий.
Полость
Фиброзное кольцо
трикуспидального клапана
ch41_условно.indd 1071
03.04.2019 12:16:11
1072 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 41 .14 Чреспищеводная эхокардиография при имплантации Watchman. (А) Вид ушка левого предсердия в двух проекциях с измерением его разме-
ров (диаметр устья 1,88 см). (Б) 3D-изображение Watchman после его имплантации.
3D Beats 1
А
Б
кардиально в ушко ЛП для исключения его из кро-
вотока. Watchman состоит из нитинолового каркаса
с 10 активными якорями для фиксации устройства
к стенке УЛП для предотвращения его смещения.
Один его конец обернут в полиэтиленовый тереф-
талат, благодаря которому и происходит процесс
эндотелизации. При метаанализе в двух рандомизи-
рованных исследованиях для оценки использова-
ния варфарина при Watchman было установлено,
что снизилась частота геморрагических инсультов,
летальных исходов из-за сердечно-сосудистой пато-
логии, кровотечений, не связанных с манипуляцией
[87]. Однако наиболее высокая частота ишемиче-
ских инсультов была связана с применением Watch-
man.
Перед имплантацией устройства выполняется
ЧПЭхоКГ для оценки размеров УЛП и решения о
вопросе какое окклюзирующее устройство подой-
дет для конкретного пациента (рис. 41.14). УЛП ото-
бражается при 0°, 45°, 90° и 135°, а максимальный
размер возможно оценить обычно на уровне 135°.
При осмотре на 0°, измерения проводятся со сторо-
ны левой коронарной артерии с позиционировани-
ем датчика в 1–2 см от устья левой верхней легоч-
ной вены. Цель заключается в том, чтобы выбрать
устройство, которое будет на 10–20% больше, чем
размер УЛП. Кроме этого, ЧПЭхоКГ используется
для исключения тромба в УЛП, что является пря-
мым противопоказанием к его окклюзии.
Имплантация устройства происходит под кон-
тролем ЧПЭхоКГ (табл. 41.5) [88–90]. Также ЭхоКГ
помогает при проведении транссептальной пунк-
ции и позиционировании устройства в УЛП.
Watchman должен закрыть все устье УЛП, не высту-
пая слишком далеко в ЛП (выступ 4,2–6,6 мм в за-
висимости от размера устройства). Перед оконча-
тельным размещением устройства необходимо оце-
нить всю анатомию во всех позициях ЧПЭхоКГ.
Для оптимальной фиксации максимальный размер
устройства составляет от 80 до 92% от первоначаль-
ного полученного размера. После раскрытия Watch-
man следует удостовериться в его надежной фикса-
ции и четкой визуализации, что устройство двига-
ется в унисон с УЛП. Для оценки остаточных
шунтов, которые должны быть не более 3 ± 2 мм,
применяют цветовую допплерографию или контра-
стирование. Измерение следует проводить в самом
узком месте потока (vena contracta), когда Watchman
наиболее придвинут к УЛП. ЧПЭхоКГ используется
для оценки осложнений в виде образования пери-
кардиальной жидкости или тромбов на катетере.
Повторную ЧПЭхоКГ выполняют через 45 сут
для оценки успешности закрытия УЛП. Целевым
показателем является отсутствие остаточных шун-
тов > 5 мм, что позволяет отменить варфарин и пе-
рейти на прием аспирина с клопидогрелем. При на-
личии значительных остаточных шунтов, повтор-
ная ЧПЭхоКГ проводится через 6–12 мес. Также
проводят оценку тромбов на самом устройстве и,
при их наличии, продолжают прием варфарина до
исчезновения тромба.
Также существует устройство Amplatzer (St. Jude
Medical, Миннеаполис, Миннесота), которое в на-
стоящее время не одобрено для использования в
Соединенных Штатах, однако имеет разрешение на
использование в Европе. Устройство изготовлено
из нитинола с вставками из дакрона, в виде двух
пластин с талией по центру, а также фиксирующи-
ми якорями. Оно имплантируется подобно Watch-
man. Устройство не должно быть установлено глуб-
же, чем на 1 см в устье предсердия. Обычно его раз-
мещают дистальнее от левой огибающей коронарной
артерии [90].
Последнее устройство, которое используется для
снижения риска тромбоэмболических осложнений,
называется LARIAT (SentreHEART, Пало-Альто, Ка-
лифорния) [91–93]. Устройство не одобрено для за-
крытия УЛП, однако получено разрешение в виде
описания, что оно представлено в виде шовного ма-
териала для перевязки тканей. На данный момент
ch41_условно.indd 1072
03.04.2019 12:16:11
1073
41 Фибрилляция и трепетание предсердий
имеются ограниченные данные о его применении,
и, хоть устройство помогает исключить УЛП из
кровотока, на данный момент отмечается высокий
процент острых осложнений, включая кровотече-
ние, тампонаду сердца и необходимость в выполне-
нии кардиохирургических вмешательств [91, 92].
Также не изучено, действительно ли оно снижает
процент тромбоэмболических осложнений. Проце-
дура имплантации LARIAT включает в себя как воз-
Этап
Измерение*
Интерпретация и/или тактика лечения
Оценка наличия/
отсутствия тром-
боза ЛП
Визуализация УЛП и оценка полости ЛП
для исключения тромбов
Имплантация противопоказана при наличии тромбов
в УЛП
Определение мак-
симального раз-
мера устья
Изображение получается при 0° датчика с
визуализацией поля, которое находится от
левой коронарной артерии до устья ЛВЛВ.
Также проводится оценка на 45°, 90°, 135°
и оцениваются структуры от митрального
клапана до устья ЛВЛВ
Устройство должно быть на 10–20% больше, чем получен-
ный размер устья. Доступные размеры Watchman пред-
ставлены 21, 24, 27, 30 и 33 мм. При размерах устья
≤ 16 мм либо ≥ 32 мм, то имплантация противопоказана
Транссептальная
пункция
Оценка межпредсердной перегородки (в би-
кавальной проекции и проекции по корот-
кой оси) по короткой оси и через вид на
полые вены
Транссептальная пункция проводится в нижнем заднем
отделе перегородки для создания лучшего угла для входа
в УЛП
Оценка ширины
устройства после
имплантации
Убедитесь, что вы достоверно визуализиру-
ется наиболее широкое место, а также ме-
ста фиксации к стенкам УЛП
Размер имплантированного устройства должен быть не
более 80–92% от исходного. Если он составляет > 92%,
то устройство необходимо репозиционировать либо ис-
пользовать Watchman большего размера, т.к . присутству-
ет риск дислокации
Оценка глубины
стояния устрой-
ства
Устройство должно быть в либо сразу дис-
тальнее устья
В зависимости от размера устройства, его конечная часть
может выступать из УЛП на 4,2–6,6 мм. При более глу-
бокой имплантации увеличивается риск эмболизации
устройства. Также при глубоком положении Watchman
может не зафиксироваться к боковым стенкам
Убедитесь, что
устройство за-
фиксировано
Устройство лучше всего визуализируется на
135°, однако можно использовать и другие
виды. Перед имплантацией обычно врач
проводит тракционную пробу
Устройство и УЛП должны быть в тандеме. Если
Watchman двигается отдельно от стенок ушка, то это
указывает на плохую фиксацию и необходимость репо-
зиционирования. Однако слишком жесткая фиксация
может привести к перфорации
Оценка остаточ-
ных шунтов
Используйте цветовую допплерографию для
оценки наличия остаточных шунтов между
устройством и УЛП
Допустимо наличие небольших остаточных шунтов
≤ 5 мм. При их размерах > 5 мм необходимо удалить
данное устройство и имплантировать новое большего
размера
Отсоединение
устройства от до-
ставочной систе-
мы
После отсоединение устройства от доставоч-
ной системы следует еще раз оценить его
позицию, размер и наличие резидуальных
шунтов
Если устройство нестабильно либо сильно уходит в по-
лость ЛП, то его необходимо изъять и имплантировать
новое
Оценка осложне-
ний
Во время, а также после имплантации
устройства, следует провести оценку нали-
чия/отсутствия тромбов, а также перикар-
диальной жидкости
При образовании тромба на катетере, его можно удалить
путем аспирации, увеличения дозы гепарина либо затя-
гивании доставочной системы назад в ПП. При развитии
тампонады сердца следует выполнить перикардиоцентез
* На всех этапах, если не указано другое, визуализация УЛП должна проводиться на 0°, 45°, 90°, 135°.
ЛВЛВ — левая верхняя легочная вена; ЛП — левое предсердие; ПП — правое предсердие; УЛП — ушко левого предсердия.
ТАБЛИЦА 41.5 Чреспищеводная эхокардиография во время имплантации Watchman
для закрытия ушка левого предсердия
можный эндокардиальный, так и эпикардиальный
доступ для размещения нити в виде лассо вокруг
устья УЛП. Для визуализации при транссептальной
пункции используют ЧПЭхоКГ [94], а в некоторых
случаях отмечено, что 3D-ЧПЭхоКГ позволяет по-
лучить улучшенное изображение [93]. Она исполь-
зуется при оценке остаточных потоков из УЛП и пе-
рикардиальной жидкости, которая наблюдается в
10% случаев после процедуры [91].
ch41_условно.indd 1073
03.04.2019 12:16:12
1074 ЧАСТЬ VII Сосудистые и системные заболевания
Вид
исследования
Позиция датчика
Угол изображения/
направление
Цель
Ограничения
ЧПЭхоКГ
Высокая позиция дат-
чика в пищеводе с
визуализацией через
четырех- и двухка-
мерный вид.
Возможно использова-
ние визуализации
в двух проекциях
УЛП необходимо визуали-
зировать на 0°, 45°, 90°
и 135°.
Для улучшения изображе-
ния возможно использо-
вание высокочастотных
датчиков (обычно 7 МГц)
с увеличением
Исключение тромбоза
УЛП
Важно визуализировать все
ЛП, т.к . около 10% тром-
бов образуются вне поло-
сти УЛП.
Артефакты визуализации
из-за гребенчатых мышц
между левой верхней ле-
гочной веной и УЛП могут
создавать ложное мнение
о наличии тромба
Импульсно-волновая
допплерография
Скорости кровотока
в УЛП необходимо
измерять в 1 см от
устья. Нормальная
скорость УЛП со-
ставляет > 0,4 м/сек
ВСЭхоКГ
Выходной тракт ПЖ
Поворот по часовой стрел-
ке выводит УЛП по длин-
ной оси
Исключение тромбоза
УЛП
Следует осторожно переме-
щать катетер для исключе-
ния перфорации
Легочная артерия
Смещение датчика книзу
и срединно позволяет по-
лучить вид УЛП по ко-
роткой оси. Также может
помочь вращение катете-
ра по часовой стрелке
Исключение тромбоза
УЛП
Следует осторожно переме-
щать катетер для исключе-
ния перфорации
Коронарный синус
Продвижение катетера впе-
ред-назад с вращением
позволяет визуализиро-
вать ЛП по длинной оси
Исключение тромбоза
УЛП
Сложность в позициониро-
вании катетера из-за разме-
ров и анатомии коронарно-
го синуса
ЛП
Прямой доступ в ЛП через
транссептальную пунк-
цию
Исключение тромбоза
УЛП
Имеется вероятность дисло-
цировать тромб катетером
ВСЭхоКГ — внутрисердечная эхокардиография; ЛП — левое предсердие; ПЖ — правый желудочек; УЛП — ушко левого предсердия;
ЧПЭхоКГ — чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
Визуализация ушка левого предсердия
ch41_условно.indd 1074
03.04.2019 12:16:12
1075
41 Фибрилляция и трепетание предсердий
ЛИТЕРАТУРА
1. Roger VL, Go AS, Lloyd-Jones DM, et al.
Heart disease and stroke statistics—2012 up-
date: a report from the American Heart As-
sociation, Circulation 125:e2–220, 2012.
2. Go AS, Hylek EM, Phillips KA, et al. Preva-
lence of diagnosed atrial fibrillation in adults:
national implications for rhythm manage-
ment and stroke prevention: the AnTicoagu-
lation and Risk Factors in Atrial Fibrillation
(ATRIA) Study, JAMA 285:2370–2375, 2001.
3. Owan TE, Hodge DO, Herges RM, et al.
Trends in prevalence and outcome of heart
failure with preserved ejection fraction, New
Engl J Med 355:251–259, 2006.
4. Dulli DA, Stanko H, Levine RL. Atrial fibril-
lation is associated with severe acute ischemic
stroke, Neuroepidemiology 22:118–123, 2003.
5. Mary-Rabine L, Albert A, Pham TD, et al.
The relationship of human atrial cellular elec-
trophysiology to clinical function and ultra-
structure, Circ Res 52:188–199, 1983.
6. Kottkamp H. Human atrial fibrillation sub-
strate: towards a specific fibrotic atrial cardio-
myopathy, Eur Heart J 34:2731–2738, 2013.
7. Damy T, Kallvikbacka-Bennett A, Goode K,
et al. Prevalence of, associations with, and
prognostic value of tricuspid annular plane
systolic excursion (TAPSE) among out-pa-
tients referred for the evaluation of heart
failure, J Card Fail 18:216–225, 2012.
8. Ausma J, Wijffels M, Thone F, et al. Struc-
tural changes of atrial myocardium due to
sustained atrial fibrillation in the goat, Circu-
lation 96:3157–3163, 1997.
9. Lang RM, Bierig M, Devereux RB, et al. Rec-
ommendations for chamber quantification: a
report from the American Society of Echo-
cardiography’s Guidelines and Standards
Committee and the Chamber Quantification
Writing Group, developed in conjunction
with the European Association of Echocar-
diography, a branch of the European Society
of Cardiology, J Am Soc Echocardiogr 18:
1440–1463, 2005.
10. Fuster V, Ryden LE, Asinger RW, et al. ACC/
AHA/ESC guidelines for the management of
patients with atrial fibrillation: executive
summary. A Report of the American College
of Cardiology/American Heart Association
Task Force on Practice Guidelines and the
European Society of Cardiology Committee
for Practice Guidelines and Policy Confer-
ences (Committee to Develop Guidelines for
the Management of Patients With Atrial Fi-
brillation): developed in Collaboration With
the North American Society of Pacing and
Electrophysiology, J Am Coll Cardiol 38:
1231–1266, 2001.
11. Vandenberg BF, Weiss RM, Kinzey J, et al.
Comparison of left atrial volume by two-di-
mensional echocardiography and cine-comput-
ed tomography, Am J Cardiol 75:754–757, 1995.
12. Lang RM, Bierig M, Devereux RB, et al. Rec-
ommendations for chamber quantification,
Eur J Echocardiogr 7:79–108, 2006.
13. Gabor GE, Winsberg F. Motion of mitral
valves in cardiac arrythmias: ultrasonic car-
diographic study, Invest Radiol 5:355–360,
1970.
14. Manning WJ, Silverman DI, Katz SE, Douglas
PS. Atrial ejection force: a noninvasive assess-
ment of atrial systolic function, J Am Coll
Cardiol 22:221–225, 1993.
15. Cameli M, Caputo M, Mondillo S, et al. Fea-
sibility and reference values of left atrial
longitudinal strain imaging by two-dimen-
sional speckle tracking, Cardiovasc Ultrasound
7:6, 2009.
16. Di Salvo G, Caso P, Lo Piccolo R, et al. Atrial
myocardial deformation properties predict
maintenance of sinus rhythm after external
cardioversion of recent-onset lone atrial
fibrillation: a color Doppler myocardial
imaging and transthoracic and transesopha-
geal echocardiographic study, Circulation
112:387–395, 2005.
17. Kuppahally SS, Akoum N, Burgon NS, et al.
Left atrial strain and strain rate in patients
with paroxysmal and persistent atrial fibrilla-
tion: relationship to left atrial structural re-
modeling detected by delayed-enhancement
MRI, Circ Cardiovasc Imaging 3:231–239,
2010.
18. Habibi M, Lima JA, Khurram IM, et al. As-
sociation of left atrial function and left atrial
enhancement in patients with atrial fibrilla-
tion: cardiac magnetic resonance study, Circ
Cardiovasc Imaging 8:e002769, 2015.
19. Vasan RS, Larson MG, Levy D, et al. Doppler
transmitral flow indexes and risk of atrial
fibrillation (the Framingham Heart Study),
Am J Cardiol 91:1079–1083, 2003.
20. Vaziri SM, Larson MG, Benjamin EJ, Levy D.
Echocardiographic predictors of nonrheu-
matic atrial fibrillation. The Framingham
Heart Study, Circulation 89:724–730, 1994.
21. Tsang TS, Gersh BJ, Appleton CP, et al. Left
ventricular diastolic dysfunction as a predic-
tor of the first diagnosed nonvalvular atrial
fibrillation in 840 elderly men and women, J
Am Coll Cardiol 40:1636–1644, 2002.
22. Tsang TS, Barnes ME, Gersh BJ, et al. Risks
for atrial fibrillation and congestive heart
failure in patients >/= 65 years of age with
abnormal left ventricular diastolic relaxation,
Am J Cardiol 93:54–58, 2004.
23. Wolf PA, Abbott RD, Kannel WB. Atrial
fibrillation as an independent risk factor
for stroke: the Framingham Study, Stroke
22:983–988, 1991.
24. Mozaffarian D, Benjamin EJ, Go AS, et al.
Heart disease and stroke statistics—2015 up-
date: a report from the American Heart As-
sociation, Circulation 131:e29–322, 2015.
25. Al-Saady N, Obel O, Camm A. Left atrial ap-
pendage: structure, function, and role in
thromboembolism, Heart 82:8, 1999.
26. Veinot JP, Harrity PJ, Gentile F, et al. Anato-
my of the normal left atrial appendage: a
quantitative study of age-related changes in
500 autopsy hearts: implications for echocar-
diographic examination, Circulation 96:3112–
3115, 1997.
27. Willens HJ, Qin JX, Keith K, Torres S. Diag-
nosis of a bilobed left atrial appendage and
pectinate muscles mimicking thrombi on re-
al-time 3-dimensional transesophageal echo-
cardiography, J Ultrasound Med 29:975–980,
2010.
28. Kimura T, Takatsuki S, Inagawa K, et al.
Anatomical characteristics of the left atrial
appendage in cardiogenic stroke with low
CHADS2 scores, Heart Rhythm 10:921–925,
2013.
29. Di Biase L, Santangeli P, Anselmino M, et al.
Does the left atrial appendage morphology
correlate with the risk of stroke in patients
with atrial fibrillation?: results from a multi-
center study, J Am Coll Cardiol 60:531–538,
2012.
30. Shirani J, Alaeddini J. Structural remodeling
of the left atrial appendage in patients with
chronic non-valvular atrial fibrillation: impli-
cations for thrombus formation, systemic
embolism, and assessment by transesophageal
echocardiography, Cardiovasc Pathol 9:95–
101, 2000.
31. Tabata T, Oki T, Fukuda N, et al. Influence
of aging on left atrial appendage flow veloc-
ity patterns in normal subjects, J Am Soc
Echocardiogr 9:274–280, 1996.
32. Goldsmith I, Kumar P, Carter P, et al. Atrial
endocardial changes in mitral valve disease: a
scanning electron microscopy study, Am
Heart J 140:777–784, 2000.
33. Lim HS, Willoughby SR, Schultz C, et al. Ef-
fect of atrial fibrillation on atrial thrombo-
genesis in humans: impact of rate and
rhythm, J Am Coll Cardiol 61:852–860, 2013.
34. Calkins H, Kuck KH, Cappato R, et al. 2012
HRS/EHRA/ECAS expert consensus state-
ment on catheter and surgical ablation of
atrial fibrillation: recommendations for pa-
tient selection, procedural techniques, patient
management and follow-up, definitions,
endpoints, and research trial design, Europace
14:528–606, 2012.
35. Aschenberg W, Schluter M, Kremer P, et al.
Transesophageal two-dimentional echocar-
diography for the detection of left atrial ap-
pendage thrombus, J Am Coll Cardiol 7:4,
1986.
36. January CT, Wann LS, Alpert JS, et al. 2014
AHA/ACC/HRS guideline for the manage-
ment of patients with atrial fibrillation: a re-
port of the American College of Cardiology/
American Heart Association Task Force on
Practice Guidelines and the Heart Rhythm
Society, J Am Coll Cardiol 64:e1–76, 2014.
37. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
63:e57–185, 2014.
38. Vahanian A, Alfieri O, Andreotti F, et al.
Guidelines on the management of valvular
heart disease (version 2012): the Joint Task
Force on the Management of Valvular Heart
Disease of the European Society of Cardiol-
ogy (ESC) and the European Association for
Cardio-Thoracic Surgery (EACTS), Eur J
Cardiothorac Surg 42:S1–44, 2012.
39. Whitlock RP, Sun JC, Fremes SE, et al. Physi-
cians ACoC: Antithrombotic and thrombo-
lytic therapy for valvular disease: antithrom-
botic therapy and prevention of thrombosis,
9th ed: American College of Chest Physicians
Evidence-Based Clinical Practice Guidelines,
Chest 141(2 Suppl):e576S–600S, 2012.
40. Connolly SJ, Ezekowitz MD, Yusuf S, et al.
Dabigatran versus warfarin in patients with
atrial fibrillation, New Engl J Med 361:1139–
1151, 2009.
41. Patel MR, Mahaffey KW, Garg J, et al. Riva-
roxaban versus warfarin in nonvalvular atrial
fibrillation, New Engl J Med 365:883–891,
2011.
42. Granger CB, Alexander JH, McMurray JJV, et
al. Apixaban versus warfarin in patients with
atrial fibrillation, New Engl J Med 365:981–
992, 2011.
43. Giugliano RP, Ruff CT, Braunwald E, et al.
Edoxaban versus warfarin in patients with
atrial fibrillation, New Engl J Med 369:2093–
2104, 2013.
44. Eikelboom JW, Connolly SJ, Brueckmann M,
et al. Dabigatran versus warfarin in patients
ch41_условно.indd 1075
03.04.2019 12:16:12
1076 ЧАСТЬ VII Сосудистые и системные заболевания
with mechanical heart valves, New Engl J Med
369:1206–1214, 2013.
45. Haissaguerre M, Jais P, Shah DC, et al. Spon-
taneous initiation of atrial fibrillation by ec-
topic beats originating in the pulmonary
veins, New Engl J Med 339:659–666, 1998.
46. Pappone C, Rosanio S, Oreto G, et al. Cir-
cumferential radiofrequency ablation of
pulmonary vein ostia: a new anatomic ap-
proach for curing atrial fibrillation, Circula-
tion 102:2619–2628, 2000.
47. Calkins H, Kuck KH, Cappato R, et al. 2012
HRS/EHRA/ECAS expert consensus state-
ment on catheter and surgical ablation of
atrial fibrillation: recommendations for pa-
tient selection, procedural techniques, patient
management and follow-up, definitions,
endpoints, and research trial design: a report
of the Heart Rhythm Society (HRS) Task
Force on Catheter and Surgical Ablation of
Atrial Fibrillation. Developed in partnership
with the European Heart Rhythm Association
(EHRA), a registered branch of the European
Society of Cardiology (ESC) and the Euro-
pean Cardiac Arrhythmia Society (ECAS);
and in collaboration with the American Col-
lege of Cardiology (ACC), American Heart
Association (AHA), the Asia Pacific Heart
Rhythm Society (APHRS), and the Society of
Thoracic Surgeons (STS). Endorsed by the
governing bodies of the American College of
Cardiology Foundation, the American Heart
Association, the European Cardiac Arrhyth-
mia Society, the European Heart Rhythm
Association, the Society of Thoracic Sur-
geons, the Asia Pacific Heart Rhythm Society,
and the Heart Rhythm Society, Heart rhythm
9:632–696, 2012.
48. Arentz T, Weber R, Burkle G, et al. Small or
large isolation areas around the pulmonary
veins for the treatment of atrial fibrillation?
Results from a prospective randomized study,
Circulation 115:3057–3063, 2007.
49. Packer DL, Kowal RC, Wheelan KR, et al.
Cryoballoon ablation of pulmonary veins for
paroxysmal atrial fibrillation: first results of
the North American Arctic Front (STOP AF)
pivotal trial, J Am Coll Cardiol 61:1713–1723,
2013.
50. Nademanee K, McKenzie J, Kosar E, et al. A
new approach for catheter ablation of atrial
fibrillation: mapping of the electrophysiolog-
ic substrate, J Am Coll Cardiol 43:2044–2053,
2004.
51. Kong MH, Piccini JP, Bahnson TD. Efficacy
of adjunctive ablation of complex fraction-
ated atrial electrograms and pulmonary vein
isolation for the treatment of atrial fibrilla-
tion: a meta-analysis of randomized con-
trolled trials, Europace 13:193–204, 2011.
52. Verma A, Jiang CY, Betts TR, et al. Approach-
es to catheter ablation for persistent atrial fi-
brillation, N Engl J Med 372:1812–1822, 2015.
53. Reddy VY, Morales G, Ahmed H, et al. Cath-
eter ablation of atrial fibrillation without the
use of fluoroscopy, Heart Rhythm 7:1644–
1653, 2010.
54. Santangeli P, Di Biase L, Burkhardt JD, et al.
Transseptal access and atrial fibrillation abla-
tion guided by intracardiac echocardiography
in patients with atrial septal closure devices,
Heart Rhythm 8:1669–1675, 2011.
55. Lakkireddy D, Rangisetty U, Prasad S, et al.
Intracardiac echo-guided radiofrequency
catheter ablation of atrial fibrillation in pa-
tients with atrial septal defect or patent fora-
men ovale repair: a feasibility, safety, and
efficacy study, J Cardiovascular Electrophysiol
19:1137–1142, 2008.
56. Ren JF, Marchlinski FE, Supple GE, et al. In-
tracardiac echocardiographic diagnosis of
thrombus formation in the left atrial append-
age: a complementary role to transesophageal
echocardiography, Echocardiography 30:72–
80, 2013.
57. Reddy VY, Neuzil P, Ruskin JN. Intracardiac
echocardiographic imaging of the left atrial
appendage, Heart Rhythm 2:1272–1273, 2005.
58. Ren JF, Callans DJ. Intracardiac echocardiog-
raphy with different approaches for imaging
of left atrial appendage, Heart Rhythm 3:623,
2006. author reply 623-624.
59. Baran J, Stec S, Pilichowska-Paszkiet E, et al.
Intracardiac echocardiography for detection
of thrombus in the left atrial appendage:
comparison with transesophageal echocar-
diography in patients undergoing ablation for
atrial fibrillation: the Action-Ice I Study, Circ
Arrhythm Electrophysiol 6:1074–1081, 2013.
60. Saksena S, Sra J, Jordaens L, et al. A prospec-
tive comparison of cardiac imaging using
intracardiac echocardiography with trans-
esophageal echocardiography in patients with
atrial fibrillation: the intracardiac echocar-
diography guided cardioversion helps inter-
ventional procedures study, Circ Arrhythm
Electrophysiol 3:571–577, 2010.
61. Ren JF, Marchlinski FE, Callans DJ. Left
atrial thrombus associated with ablation for
atrial fibrillation: identification with intracar-
diac echocardiography, J Am Coll Cardiol
43:1861–1867, 2004.
62. Wilson L, Brooks AG, Lau DH, et al. Real-
time CartoSound imaging of the esophagus:
a comparison to computed tomography, Int J
Cardiol 157:260–262, 2012.
63. Schmidt M, Daccarett M, Marschang H, et al.
Intracardiac echocardiography improves pro-
cedural efficiency during cryoballoon abla-
tion for atrial fibrillation: a pilot study, J
Cardiovasc Electrophysiol 21:1202–1207, 2010.
64. Catanzariti D, Maines M, Angheben C, et al.
Usefulness of contrast intracardiac echocar-
diography in performing pulmonary vein
balloon occlusion during cryo-ablation for
atrial fibrillation, Ind Pac Electrophysiol J
12:237–249, 2012.
65. Lakhani M, Saiful F, Bekheit S, Kowalski M.
Use of intracardiac echocardiography for
early detection of phrenic nerve injury during
cryoballoon pulmonary vein isolation, J Car-
diovasc Electrophysiol 23:874–876, 2012.
66. Singh SM, Heist EK, Donaldson DM, et al.
Image integration using intracardiac ultra-
sound to guide catheter ablation of atrial fi-
brillation, Heart Rhythm 5:1548–1555, 2008.
67. Packer DL, Johnson SB, Kolasa MW, et al.
New generation of electro-anatomic map-
ping: full intracardiac ultrasound image inte-
gration, Europace 10(Suppl 3):iii35–41, 2008.
68. Schwartzman D, Zhong H. On the use of
CartoSound for left atrial navigation, J Car-
diovasc Electrophysiol 21:656–664, 2010.
69. Okumura Y, Henz BD, Johnson SB, et al.
Three-dimensional ultrasound for image-
guided mapping and intervention: methods,
quantitative validation, and clinical feasibility
of a novel multimodality image mapping
system, Circ Arrhythm Electrophysiol 1:110–
119, 2008.
70. Steinberg BA, Hammill BG, Daubert JP, et al.
Periprocedural imaging and outcomes after
catheter ablation of atrial fibrillation, Heart
100:1871–1877, 2014.
71. Kerut EK, Hanawalt C, McKinnie J. Trans-
esophageal echocardiography during pul-
monary vein cryoballoon ablation for atri-
al fibrillation, Echocardiography 32:281–290,
2015.
72. Lee G, Sparks PB, Morton JB, et al. Low risk
of major complications associated with pul-
monary vein antral isolation for atrial fibril-
lation: results of 500 consecutive ablation
procedures in patients with low prevalence of
structural heart disease from a single center, J
Cardiovasc Electrophysiol 22:163–168, 2011.
73. Ottaviano L, Chierchia G-B, Bregasi A, et al.
Cryoballoon ablation for atrial fibrillation
guided by real-time three-dimensional tran-
soesophageal echocardiography: a feasibility
study, Europace 15:944–950, 2013.
74. Acena M, Regoli F, Faletra FF, et al. 3D real-
time TEE during pulmonary vein isolation in
atrial fibrillation, JACC Cardiovasc Imaging
7:737–738, 2014.
75. Kumar S, Brown G, Sutherland F, et al. The
transesophageal echo probe may contribute
to esophageal injury after catheter ablation
for paroxysmal atrial fibrillation under gen-
eral anesthesia: a preliminary observation, J
Cardiovasc Electrophysiol 26:119–126, 2015.
76. O’Shea JP, Southern JF, D’Ambra MN, et al.
Effects of prolonged transesophageal echo-
cardiographic imaging and probe manipula-
tion on the esophagus—an echocardiograph-
ic-pathologic study, J Am Coll Cardiol
17:1426–1429, 1991.
77. Kumar S, Ling L-H, Halloran K, et al. Esoph-
ageal hematoma after atrial fibrillation abla-
tion: incidence, clinical features, and sequelae
of esophageal injury of a different sort, Circ
Arrhythm Electrophysiol 5:701–705, 2012.
78. Bhargava M, Di Biase L, Mohanty P, et al.
Impact of type of atrial fibrillation and repeat
catheter ablation on long-term freedom from
atrial fibrillation: results from a multicenter
study, Heart Rhythm 6:1403–1412, 2009.
79. Di Biase L, Fahmy TS, Wazni OM, et al. Pul-
monary vein total occlusion following cath-
eter ablation for atrial fibrillation: clinical
implications after long-term follow-up, J Am
Coll Cardiol 48:2493–2499, 2006.
80. Schneider C, Ernst S, Malisius R, et al. Trans-
esophageal echocardiography: a follow-up
tool after catheter ablation of atrial fibrilla-
tion and interventional therapy of pulmonary
vein stenosis and occlusion, J Interv Card
Electrophysiol 18:195–205, 2007.
81. Sigurdsson G, Troughton RW, Xu X-F, et al.
Detection of pulmonary vein stenosis by
transesophageal echocardiography: compari-
son with multidetector computed tomogra-
phy, Am Heart J 153:800–806, 2007.
82. Schneider C, Ernst S, Bahlmann E, et al.
Transesophageal echocardiography: a screen-
ing method for pulmonary vein stenosis after
catheter ablation of atrial fibrillation, Eur J
Echocardiogr 7:447–456, 2006.
83. Scaglione M, Caponi D, Di Donna P, et al.
Typical atrial flutter ablation outcome: cor-
relation with isthmus anatomy using intra-
cardiac echo 3D reconstruction, Europace
6:407–417, 2004.
84. Bencsik G. Novel strategies in the ablation of
typical atrial flutter: role of intracardiac echo-
cardiography, Curr Cardiol Rev 11:127–133,
2015.
85. Okumura Y, Watanabe I, Ashino S, et al. Ana-
tomical characteristics of the cavotricuspid
isthmus in patients with and without typical
atrial flutter: analysis with two- and three-di-
ch41_условно.indd 1076
03.04.2019 12:16:12
1077
41 Фибрилляция и трепетание предсердий
mensional intracardiac echocardiography, J
Interv Card Electrophysiol 17:11–19, 2006.
86. Kanderian AS, Gillinov AM, Pettersson GB, et
al. Success of surgical left atrial appendage clo-
sure: assessment by transesophageal echocar-
diography, J Am Coll Cardiol 52:924–929, 2008.
87. Holmes DR, Doshi SK, Kar S, et al. Left atrial
appendage closure as an alternative to warfa-
rin for stroke prevention in atrial fibrillation:
a patient-level meta-analysis, J Am Coll Car-
diol 65:2614–2623, 2015.
88. Mra
́
z T, Neuzil P, Mandysova
́
E, et al. Role of
echocardiography in percutaneous occlusion
of the left atrial appendage, Echocardiography
24:401–404, 2007.
89. Palios J, Paraskevaidis I. Thromboembolism
prevention via transcatheter left atrial ap-
pendage closure with transeosophageal echo-
cardiography guidance, Thrombosis 2014,
2014. 832752.
90. Chue CD, de Giovanni J, Steeds RP. The role
of echocardiography in percutaneous left
atrial appendage occlusion, Eur J Echocardiogr
12:i3–10, 2011.
91. Price MJ, Gibson DN, Yakubov SJ, et al.
Early safety and efficacy of percutaneous left
atrial appendage suture ligation: results from
the U.S. transcatheter LAA ligation consor-
tium, J Am Coll Cardiol 64:565–572, 2014.
92. Chatterjee S, Herrmann HC, Wilensky RL, et
al. Safety and procedural success of left atrial
appendage exclusion with the lariat device: a
systematic review of published reports and
analytic review of the FDA MAUDE Data-
base, JAMA Intern Med 175:1104–1109, 2015.
93. Laura DM, Chinitz LA, Aizer A, et al. The role
of multimodality imaging in percutaneous
left atrial appendage suture ligation with the
LARIAT device, J Am Soc Echocardiogr
27:699–708, 2014.
94. Lasala JD, Tolpin DA, Collard CD, Pan W.
Real-time transesophageal echocardiography
for left atrial appendage ligation using the
LARIAT snare device, Anesth Analg 120:1204–
1207, 2015.
95. January CT, Wann LS, Alpert JS, et al. 2014
AHA/ACC/HRS guideline for the manage-
ment of patients with atrial fibrillation: a re-
port of the American College of Cardiology/
American Heart Association Task Force on
practice guidelines and the Heart Rhythm
Society, Circulation 130:e199–267, 2014.
96. Masoudi FA, Calkins H, Kavinsky CJ, et al.
2015 ACC/HRS/SCAI left atrial appendage
occlusion device societal overview, J Am Coll
Cardiol 66:1497–1513, 2015.
97. Silvestry FE, Kerber RE, Brook MM, et al.
Echocardiography-guided interventions, Jour-
nal of the American Society of Echocardiogra-
phy : off icial publication of the American Soci-
ety of Echocardiography. 22(3):213–231, Mar
2009. quiz 316–217.
98. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an
update from the American Society of Echo-
cardiography and the European Association
of Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
99. Costa FM, Ferreira AM, Oliveira S, et al. Left
atrial volume is more important than the type
of atrial fibrillation in predicting the long-
term success of catheter ablation, Int J Car-
diol 184:56–61, 2015.
100. Yasuda R, Murata M, Roberts R, et al. Left
atrial strain is a powerful predictor of atrial
fibrillation recurrence after catheter abla-
tion: study of a heterogeneous population
with sinus rhythm or atrial fibrillation, Eur
Heart J Cardiovasc Imaging 16:1008–1014,
2015.
ch41_условно.indd 1077
03.04.2019 12:16:12
ch41_условно.indd 1078
03.04.2019 12:16:12
1079
42 Опухоли сердца
CHARLES J. BRUCE, MBCHB
Классификация и диагностический
подход
Гистология
Возраст первичной диагностики опухоли
Локализация
Неинвазивные тканевые характеристики
Папиллярная фиброэластома
Клиническая характеристика
Макроскопическая патология
Локализация
Клинические проявления
Эхокардиографическая диагностика
Другие методы визуализации
Дифференциальная диагностика
Миксома
Клиническая характеристика
Локализация
Макроскопическая картина
Эхокардиографические признаки
Другие методы визуализации
Дифференциальная диагностика
Другие доброкачественные опухоли
сердца
Липома и липоматозная гипертрофия
Гемангиома
Рабдомиома
Фиброма
Параганглиома
Первичные злокачественные
опухоли сердца
Саркома
Лимфома
Мезотелиома
Метастатические злокачественные
опухоли сердца
Имплантационное метастазирование
Гематогенное распространение
Лимфогенное распространение
Внутрипросветное внутривенное
распространение
Дифференциальная диагностика
Хотя опухоли сердца встречаются достаточно редко
(по данным аутопсии от 0,001 до 0,03% [1, 2]), они
составляют важную группу сердечно-сосудистой па-
тологии. Правильный диагноз на ранней стадии по-
зволяет своевременно провести лечение и в неко-
торых случаях предотвратить хирургическое вме-
шательство [3–5]. До появления эхокардиографии
(ЭхоКГ) в 1970-х гг. прижизненная диагностика опу-
холей сердца была крайне редким явлением. С ее по-
явлением стала возможной прижизненная иденти-
фикация опухолей сердца, и уровень их диагности-
ки непрерывно растет. ЭхоКГ прекрасно подходит в
качестве первичного метода визуализации пациентов
с подозрением на опухоль сердца, т.к . является про-
стым, неинвазивным, широкодоступным и относи-
тельно недорогим методом (табл. 42.1). Тем не менее
другие исследования, включая компьютерную томо-
графию (КТ) и магнитно-резонансную томографию
(MРТ), дают дополнительную диагностическую ин-
формацию и рассматриваются как вспомогательные
методы [6], потому что предоставляют данные о ста-
дии заболевания, что особенно важно, когда плани-
руется хирургическое вмешательство [7].
У пациентов с опухолями сердца могут наблю-
даться симптомы, связанные с изменениями сер-
дечно-сосудистой системы, или симптомы, свиде-
тельствующие о генерализации процесса. Однако
чаще опухоли сердца выявляют случайно во время
ЭхоКГ, которую проводят по не связанному с пато-
логией показанию. Эти случайно обнаруженные об-
разования обычно представляют собой тромбы или
вегетации, часто возникают в особых клинических
случаях наряду со специфическими сопутствующи-
ми изменениями, обнаруженными на ЭхоКГ [4]. Ес-
ли образование является опухолью, то, вероятнее
всего, оно злокачественное и имеет вторичное про-
исхождение (вследствие известного злокачественно-
го процесса в молочной железе, легких или злокаче-
ственной меланомы). Маловероятно, что образова-
ние представляет собой первичную опухоль сердца.
Первичная опухоль сердца, скорее, будет доброка-
чественной. Если она не связана с клапанами серд-
ца, то с 50% вероятностью это миксома, а если связа-
на, то с вероятностью 2 : 1 это папиллярная фибро-
эластома [8]. Злокачественные первичные опухоли
сердца встречаются редко и составляют примерно
25% первичных опухолей. Они чаще представлены
разновидностью сарком.
Клиническая картина заболевания определяется
локализацией опухоли, а не ее гистологическим
строением [9, 10]. Клиническая значимость добро-
качественной опухоли может быть равнозначна
злокачественной опухоли. Доброкачественные опу-
холи могут быть локально инвазивными, ухудшая
сократимость миокарда или приводя к дисфункции
клапанного аппарата, сердечной недостаточности,
ch42_условно.indd 1079
03.04.2019 12:16:24
1080 ЧАСТЬ VII Сосудистые и системные заболевания
системной или легочной эмболии, нарушению про-
водимости либо фатальной аритмии. Системные
или легочные опухолевые эмболии — важное и от-
носительно часто встречающееся (в 25% случаев)
осложнение, взаимосвязанное с конкретной струк-
турной и анатомической характеристикой опухоли.
Опухоли аортального клапана и левого предсердия
(ЛП) имеют наибольший риск эмболических ос-
ложнений. Кроме того, и это несколько парадок-
сально, пациенты с минимальной симптоматикой,
изменениями гемодинамики и небольшими опухо-
лями имеют больший риск эмболических осложне-
ний, чем пациенты с симптомными опухолями боль-
шего размера [11]. Нередко опухолям сопутствует
перикардиальная жидкость с тампонадой сердца
или без нее. Другие опухоли диагностируют с при-
знаками генерализации процесса и выраженной
симптоматикой.
Достоинство ЭхоКГ — возможность четкого изо-
бражения анатомических структур и патологиче-
ских изменений. Метод позволяет проводить оценку
морфологических особенностей образования, лока-
лизации и подвижности, а также гемодинамических
нарушений при опухолевом процессе [12]. ЭхоКГ
отличается высокой чувствительностью в диагно-
стике эндокардиальных поражений, когда имеется
большой контраст между тканью опухоли и эхоген-
ностью полости сердца, что позволяет дать четкую
оценку размера и подвижности образования. Вну-
трисердечные образования гораздо сложнее диф-
ференцировать, а околосердечные опухоли пред-
ставляют наибольшую трудность для диагностики,
главным образом из-за повышенной эхогенности
перикарда и удаленности процесса. МРТ и КТ име-
ют преимущества перед ЭхоКГ в диагностике опу-
холей такой локализации [14], в определении ста-
дии заболевания, степени инфильтративного роста,
вовлечения перикарда и наличия распространения
опухоли или метастазирования (табл. 42.2). КТ и
МРТ также хорошо определяют степень васкуляри-
зации опухоли и количество жировой ткани в ней.
Трансторакальная эхокардиография (ТТЭхоКГ)
и чреспищеводная эхокардиография (ЧПЭхоКГ)
имеют свои особенности и ограничения в диагно-
стике опухолей сердца. Несмотря на широкую до-
ступность и простоту применения ТТЭхоКГ, мно-
гоплановая ЧПЭхоКГ дает изображение более вы-
сокой четкости, особенно вблизи пищевода. В связи
с этим данный метод не только лучше подходит для
выявления опухолей верхней полой вены, правого
предсердия (ПП), легочных артерий, ЛП и грудной
части нисходящего отдела грудной аорты, но так-
же помогает отличать эти неоплазмы от тромбов и
вегетаций [13]. ЧПЭхоКГ по сравнению с ТТЭхоКГ
имеет большую чувствительность и специфич-
ность, особенно при идентификации опухолей не-
больших размеров. ЧПЭхоКГ также позволяет диф-
ференцировать патологию от нормальных структур
или вариантов строения сердца, например погра-
ничного гребня или липоматозной гипертрофии
межпредсердной перегородки [3]. Однако ЧПЭхоКГ
не подходит для идентификации образований в об-
ласти верхушки левого желудочка (ЛЖ), при нали-
чии клинических признаков необходимо проведе-
ние ТТЭхоКГ.
Далее рассматриваются клинические признаки
опухолей сердца и их распространенность. Пред-
ставлена клиническая классификация, эхокардио-
графическая и патоморфологическая корреляция
самых распространенных типов опухолей в по-
рядке убывания частоты их распространения. Так-
же представлено краткое описание альтернативных
и вспомогательных методов получения изображе-
ния. Кратко рассказывается о состояниях, имитиру-
ющих опухоли сердца.
КЛАССИФИКАЦИЯ И ДИАГНОСТИЧЕСКИЙ ПОДХОД
Классификация образований сердца представлена в
табл. 42.3, методы диагностики — на рис. 42.1 . Наи-
более частые причины внутрисердечных образова-
ний — это тромбы и вегетации. Клинические дан-
ные помогают диагностике. Например, образование
тромбов наиболее часто связано с мерцательной
аритмией или инфарктом ЛЖ в области верхуш-
ки, а вегетации выявляются у больных с приобре-
тенными пороками сердца или протезированны-
ми клапанами.Но если образование сердца на са-
мом деле представляет собой опухоль, ее этиология
Оценка образований сердца
Варианты нормального строения
Дополнительные образования и изменения,
симулирующие опухоль
Тромб
Вегетации
Инфильтративные изменения
Внутрисердечные устройства
Диагностика опухоли
Морфология
Локализация
Место прикрепления
Подвижность
Размер
Форма
Оценка гемодинамики
Вмешательства под контролем эхокардиографии
Чрескожная биопсия
Пункция полости перикарда
Интраоперативная диагностика до и после подключения
аппарата искусственного кровообращения
ТАБЛИЦА 42.1 Роль эхокардиографии в оценке,
диагностике и лечении опухолей сердца
ch42_условно.indd 1080
03.04.2019 12:16:24
1081
42 Опухоли сердца
Эхокардиография
Компьютерная
томография
Магнитно-резонансная
томография
Первичные доброкачественные
Миксома
+++++
+++
+++
Липома
+++
+++++
+++++
Фиброэластома
+++++
++
++
Рабдомиома
+++++
+++
+++
Фиброма
++++
++++
+++
Первичные злокачественные
Саркомы
+++
++++
+++++
Мезотелиомы
++
+++++
++++
Лимфомы
++
++++
+++++
Вторичные опухоли
Распространение контактным путем
+++
+++++
+++++
Венозное распространение
++++
++++
+++++
Метастатическое распространение
++
+++++
++++
Примечание. ++ — может использоваться; +++ — оптимально подходит; ++++ — лучший метод; +++++ — предпочтительный метод.
ТАБЛИЦА 42.2 Методы диагностики опухолей сердца
самыми распространенными доброкачественными
образованиями сердца у взрослых считались миксо-
мы сердца, которые составляли около 80% всех до-
брокачественных опухолей. Однако большинство
данных было получено по результатам аутопсий и
хирургических вмешательств [14]. По данным ис-
следования 323 пациентов, перенесших хирургиче-
ское удаление первичных опухолей сердца в период
с 1957 по 2006 г. в клинике Mayo, у 94% обнаруже-
ны доброкачественные опухоли, из них 50% соста-
вили миксомы. Остальные доброкачественные опу-
холи в порядке убывания частоты встречаемости:
папиллярные фиброэластомы (26%), фибромы
(6%), липомы (4%) и другие, в т.ч . аморфные каль-
цинированные опухоли, гемангиомы, тератомы,
врожденные однокамерные кисты и рабдомиомы.
Современное исследование показывает, что папил-
лярные фиброэластомы встречаются в 2 раза чаще,
чем кардиальные миксомы, что делает их наиболее
часто встречающейся формой доброкачественных
опухолей сердца у взрослых [8]. Этот факт подчер-
кивает возрастающую роль прижизненной диагно-
стики образований сердца в результате широкого
внедрения ЭхоКГ и улучшенного изображения бла-
годаря использованию новейших современных тех-
нологий.
Только около 10% удаленных первичных обра-
зований сердца являются злокачественными, из ко-
торых > 90% — саркомы. Оставшиеся несколько
процентов — лимфомы. Данные клиники Mayo ил-
люстрируют редкую встречаемость первичных зло-
качественных опухолей сердца: они были обнару-
жены только у 34 пациентов в период с 1975 по
часто может быть определена с учетом следующих
факторов:
•
гистологической вероятности;
•
возраста пациента в момент первичного обнару-
жения опухоли;
•
локализации опухоли;
•
неинвазивных характеристикхи тканей.
При таком подходе и интеграции клинических
данных точный диагноз и тактика лечения, как пра-
вило, невозможны без чрескожной или открытой
хирургической биопсии.
ГИСТОЛОГИЯ
Вторичные злокачественные заболевания сердца и
перикарда встречаются значительно чаще (по неко-
торым оценкам, в 30–1000 раз) первичной злокаче-
ственной патологии [1]. В серии случайных ауто-
псий частота метастатического поражения сердца
составила 0,4%; у больных с установленным диагно-
зом рака злокачественное поражение сердца обнару-
жено в 20% случаев [6]. Метастазирование сердца
обычно возникает путем прямого контакта с опухо-
лью венозного, лимфогенного или артериального
распространения. К наиболее часто встречающимся
злокачественным образованиям, приводящим к
вторичному поражению сердца, относят карциному
легких, молочных желез, пищевода, желудка, почек,
меланому, лимфому и лейкемию.
Первичные опухоли сердца встречаются гораздо
реже вторичных злокачественных поражений. Поч-
ти 90% удаленных первичных опухолей сердца яв-
ляются доброкачественными. До недавнего времени
ch42_условно.indd 1081
03.04.2019 12:16:24
1082 ЧАСТЬ VII Сосудистые и системные заболевания
Первичные
опухоли
Вторичные
опухоли
Опухоле-
подобные
образования
Другие
опухоли
Доброкачест-
венные
Распростра-
нение
контактным
путем
Гамартомы
Тромбы
Mиксома
Молочная
железа
Рабдомиома
Вегетация
ПФЭ*
Легкие
Фиброма
КАО
Липома
Пищевод
ПФЭ*
Нормальные
структуры
Злокачест-
венные
Опухоль
средостения
Возрастные
новообразо-
вания
Артефакты
Саркома
Лимфома
Гематогенный
путь
Меланома
Легкие
Молочная
железа
МПС
ЖКТ
Венозный
Почки
Надпочечники
Щитовиная
железа
Легкие
Гепатома
Лимфати-
ческий путь
Лимфома
Лейкемия
Липоматозная
гипертрофия
Реактивная
пролифера-
ция
Наложения
Ламбла
ПФЭ†
* ПФЭ вновь возникшая.
† ПФЭ, возникающая при обструктивной форме гипертрофиче-
ской кардиомиопатии или после травмы эндокарда.
ЖКТ — желудочно-кишечный тракт; КАО — кальцинированная
аморфная опухоль; МПС — мочеполовая система; ПФЭ — папил -
лярная фиброэластома.
ТАБЛИЦА 42.3 Внутрисердечные образования
2007 г. Все опухоли представляли собой саркомы,
наиболее часто встречающимся гистологическим
типом была ангиосаркома (41%).
ВОЗРАСТ ПЕРВИЧНОЙ ДИАГНОСТИКИ ОПУХОЛИ
Частота возникновения опухолей сердца меняется с
возрастом (табл. 42.4), поэтому возраст первичного
выявления образования является дополнительным
диагностическим критерием. Например, рабдомио-
мы и фибромы представляют собой наиболее рас-
пространенную доброкачественную опухоль сердца
у детей.
ЛОКАЛИЗАЦИЯ
Каждый вид опухоли сердца имеет склонность к
определенной локализации (рис. 42.2), что позволя-
ет характеризовать образования в зависимости от
их расположения. Миксомы наиболее часто возни-
кают в ЛП, как правило, имеют ножку, фиксирован-
ную к межпредсердной перегородке. Саркомы так-
же чаще выявляются в ЛП, их нередко до хирурги-
ческого вмешательства ошибочно принимают за
миксому. Ангиосаркомы возникают в основном в
ПП. Для рабдомиом и фибром характерной локали-
зацией являются желудочки сердца. Папиллярные
фиброэластомы, как правило, размещаются на кла-
панах сердца. Метастатическое поражение часто
распространяется на перикард путем прямого кон-
такта, поражение миокарда обычно происходит ге-
матогенным путем, при внутрипросветном мета-
стазировании сердца происходит рост из легочных
вен или нижней полой вены.
НЕИНВАЗИВНЫЕ ТКАНЕВЫЕ ХАРАКТЕРИСТИКИ
ЭхоКГ предоставляет ограниченную, но полезную
информацию, касающуюся свойств тканей (табл.
42.5), в т.ч . эхогенность дополнительного образова-
ния и признаки кальцификации. Усиление кровото-
ка также может быть выявлено с помощью цвето-
вого допплера и контрастной ЭхоКГ. Параметры де-
формации тканей позволяют идентифицировать
дополнительные массы с отсутствием сократимо-
сти, например фибромы. КТ выявляет усиление
кровотока при контрастировании, наличие кальци-
фикации и присутствие жировой ткани. МРТ также
дает информацию об усилении кровотока, присут-
ствии жира, степени отека тканей и содержании же-
леза.
ПАПИЛЛЯРНАЯ ФИБРОЭЛАСТОМА
Истинная частота распространения фиброэластом
неизвестна. Частота случаев папиллярной фибро-
эластомы варьирует по данным разных источни-
ков, и данные, вероятно, занижены, т.к. эти опухо-
ли отличаются бессимптомным течением. Следова-
тельно, происходит недооценка частоты развития
образования в ряде хирургических случаев [15]. Од-
нако, по данным хирургических вмешательств кли-
ники Mayo [24] и Armed Forces Institute of Patholo-
gy [15], папиллярная фиброэластома составила 10%
первичных опухолей сердца и стала второй по ча-
стоте среди самых распространенных первичных
опухолей сердца [4]. С появлением ЭхоКГ и совре-
менных методов визуализации представилась воз-
можность выявлять образования на ранних стади-
ях развития, в литературе увеличилось число сооб-
щений о данной патологии. Так, одно исследование
утверждает, что папиллярная фиброэластома встре-
чается в 2 раза чаще, чем миксомы, что делает фи-
броэластому наиболее распространенным доброка-
чественным образованием сердца у взрослых [8].
Доброкачественные внутрисердечные опухоли в
основном поражают клапаны сердца, составляя 75%
ch42_условно.indd 1082
03.04.2019 12:16:24
1083
42 Опухоли сердца
всех образований клапанов [4]. У пациентов с па-
пиллярными фиброэластомами часто отсутствуют
какие-либо клинические проявления (30%), а диа-
гностирование происходит случайно [4, 16]. Одна-
ко клинические последствия папиллярных фибро-
эластом могут быть тяжелыми, и опухоль может
являться причиной инсульта, транзиторной ише-
мической атаки, системной эмболии и внезапной
сердечной смерти [4, 8, 16].
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Папиллярные фиброэластомы сердца встречаются
во всех возрастных группах, но преимущественно у
взрослых, особенно в возрасте от 40 до 80 лет [4, 16].
Средний возраст выявления образования составля-
ет приблизительно 70 лет, может быть связан с пре-
имущественным использованием ЭхоКГ у пациен-
тов пожилого возраста. Заболевание встречается ча-
ще у женщин [8]. Существует выраженная связь с
Рис. 42 .1 Диагностический алгоритм для оценки внутрисердечных образований, основанный на гистологической схожести, возрасте, локализа-
ции и особенностях изображения. АК — антикоагуляция; ГК — гемокультуры; КТ — компьютерная томография; ЛП — левое предсердие; МПП — межпред-
сердная перегородка; МРТ — магнитно-резонансная томография; ПФЭ — папиллярная фиброэластома; ЭхоКГ — эхокардиография.
?
Нет
Внутрисердечные массы
Тромбы или вегетации?
• Клинические проявления
• Известна первичная опухоль
• Идентификация
первичной
опухоли
• ЛП, фиксирована
к МПП
• Типичная ЭхоКГ
• Желудочек, солитарная
• Визуализация
деформации
• Желудочек,
множественные
• Клапан
• Типичная ЭхоКГ
• Типичная КТ/МРТ
• Гемангиома
• Параганглиома
• Обычно ЛП
• Ангиосаркома
Правое предсердие
Типичная КТ/МРТ
Соответствующее
лечение
Да
Исследование AК или ГК
Переоценка
Опухоль сердца
Гистологическая
схожесть
Вторичная опухоль
Первичная
злокачественная
Первичная
доброкачественная
Лимфома
Мезотелиома
Миксома
Саркома
Возраст?
Взрослые
Дети
Рабдомиома
Фиброма
Другие
Липома
ПФЭ
30-1000x
1x
≈ 80%
≈ 95%
≈5%
Первичная опухоль
≈ 90%
≈ 10%
• Возраст
• Локализация
• Визуализация
ch42_условно.indd 1083
03.04.2019 12:16:24
1084 ЧАСТЬ VII Сосудистые и системные заболевания
Частота случаев (%)
Взрослые
Дети
Миксома
45
15
Липома
20
—
Папиллярная фиброэластома
15
—
Ангиома
5
5
Фиброма
3
15
Гемангиома
5
5
Рабдомиома
1
45
Тератома
<1
15
[Shapiro LM. Cardiac tumours: diagnosis and management. Heart
85:218–222, 2001.]
ТАБЛИЦА 42.4
Сравнительные данные частоты
выявления доброкачественных опухолей
сердца у взрослых и детей
обструктивной гипертрофической кардиомиопати-
ей, а также с повреждением при хирургическом вме-
шательстве, воздействием радиации или нарушени-
ем гемодинамики [17].
МАКРОСКОПИЧЕСКАЯ ПАТОЛОГИЯ
Макроскопически папиллярная фиброэластома —
образование небольшого размера, обычно < 1 см
(средний размер 9 мм), однако в некоторых случаях
достигает 7 см [4]. Опухоли, расположенные в поло-
стях сердца, чаще имеют больший размер по срав-
нению с образованиями на аортальном и митраль-
ном клапанах [16]. Образование имеет характерную
форму в виде цветка с множественными сосочко-
видными листьями, прикрепленными к эндокарду
с помощью короткой ножки, при погружении опу-
холи в гипертонический раствор они напоминают
морскую анемону [16]. Ворсинчатые разрастания в
виде пальмовой ветви узкие, вытянутые и имеют
разветвления, незаметно сливающиеся со структу-
рой клапана. Иногда макроскопическая картина ха-
рактерного ворсинчатого строения опухоли может
прикрываться тромботическими наложениями [15].
Кальцификация данной опухоли происходит редко,
описана по данным литературы только в двух слу-
чаях.
ЛОКАЛИЗАЦИЯ
Папиллярные фиброэластомы обычно развиваются
на клапанах сердца (от 75 до 90%), но также могут
возникать в других отделах сердца: ЛЖ, устье пра-
вой или левой коронарной артерии, ушке ЛП, меж-
предсердной и межжелудочковой перегородке, ПП,
выходном тракте левого желудочка (ВТЛЖ), евста-
хиевой заслонке и сети Киари. Они также встреча-
ются в ушке ПП и выходном тракте правого желу-
дочка (ВТПЖ).
Поражение клапанов левых отделов сердца на-
блюдается в 95%, частота поражения аортального
клапана незначительно выше, чем митрального [4,
16]. Папиллярные фиброэластомы обычно выявля-
ются в средней части клапана, а не в области свобод-
ного края, что является особенностью патологиче-
ских наложений Ламбла (см. далее). Опухоли на
створках аортального клапана очень часто выступа-
ют в просвет (иногда в полость желудочка) и могут
пролабировать через клапан во время диастолы.
Образования, располагающиеся на створках атрио-
вентрикулярных клапанов, выступают в полость
предсердия. Реже образования локализуются в под-
клапанном аппарате митрального и трикуспидаль-
ного клапанов [18, 19]. Папиллярные фиброэласто-
мы обычно единичные, но в некоторых случаях мо-
гут быть множественными (9%) [4, 16].
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Почти 50% папиллярных фиброэластом выявля-
ются случайно во время не связанного с ними эхо-
кардиографического исследования или при поис-
ке в сердце причин эмболии [11, 17]. Как и у боль-
шинства опухолей сердца, клинические проявления
образования зависят от многих факторов, вклю-
чая локализацию и размер опухоли, темп роста и
склонность к развитию эмболии. К наиболее рас-
пространенным проявлениям относятся церебраль-
ная и системная эмболии, окклюзия коронарных ар-
терий. Помимо этого, у пациентов может появиться
сердечная недостаточность и наступить внезапная
сердечная смерть. Причинами эмболии могут яв-
ляться тромботические наложения или фрагмента-
ция ворсин, иногда оба фактора, т.к. в некоторых
случаях подтвержденные фрагменты опухоли вы-
являются в эмболическом материале [4, 16]. В не-
давнем исследовании описывалась частота и кли-
ническое течение данных опухолей у 511 пациен-
тов, которым хирургически удалили папиллярную
фиброэластому или же подозревали ее по данным
ЭхоКГ, но операция не была проведена [8]. У паци-
ентов с эхокардиографическими признаками па-
пиллярной фиброэластомы, но не получивших хи-
рургическое лечение была повышена смертность
и частота сердечно-сосудистых событий. Риск це-
реброваскулярных событий в первый год составил
6%, а на пятый год — 13%. Следует заметить, что
риск инсульта не был связан с размером, подвижно-
стью или локализацией опухоли.
ЭХОКАРДИОГРАФИЧЕСКАЯ ДИАГНОСТИКА
Папиллярные фиброэластомы хорошо диагности-
руются при эхокардиографическом исследовании.
Хотя ТТЭхоКГ позволяет быстро выявлять данные
опухоли, четкость изображения при ЧПЭхоКГ де-
лает метод оптимальным для подтверждения харак-
терных проявлений этих, обычно небольших, под-
ch42_условно.indd 1084
03.04.2019 12:16:25
1085
42 Опухоли сердца
Рис. 42 .2 Распределение и вид дополнительных образований согласно их локализации в сердце. АК — аортальный клапан; ВПВ — верхняя полая
вена; ЛЖ — левый желудочек; ЛП — левое предсердие; МК — митральный клапан; НПВ — нижняя полая вена; ПЖ — правый желудочек; ПП — правое пред-
сердие; ТК — трикуспидальный клапан; УЛП — ушко левого предсердия [Dujardin KS, Click RL, Oh JK. The role of intraoperative transesophageal echocardiography
in patients undergoing cardiac mass removal. J Am Soc Echocardiogr 13:1080–1083, 2000].
ПП/ВПВ
ПП
ПП/НПВ
ТК
АК
МК
УЛП
ЛП
ПЖ
ЛЖ
Миксома
Тромб
Саркома
Рабдомиома
Всего
24
6
3
1
34
Тромб
Фиброма
Метастаз карциномы
молочной железы
Всего
3
2
1
6
Миксома
Эхинококковая киста
Тромб
Меланома
Всего
2
1
1
1
5
Гипернефрома
Рабдомиома
Гепатома
Всего
7
1
1
9
Миксома
Тромб
Меланома
Адренокортикальная
карцинома
Всего
5
2
1
1
9
Карцинома щитовидной
железы
Воспалительная
псевдоопухоль
Всего
1
1
2
Фиброэластома 1
Фиброэластома
1
Фиброэластома
3
Фиброэластома
5
вижных опухолей и играет основную роль при мно-
жественных поражениях [4, 20].
При 2D-ЭхоКГ папиллярные фиброэластомы
определяются как небольшие, подвижные, обычно
имеющие ножку, фиксированную к клапану и ре-
же к эндокардиальной поверхности, образования,
в большинстве случаев флотирующие или прола-
бирующие в полости сердца во время систолы или
диастолы (рис. 42.3). Обычно фиброэластома име-
ет отчетливую «головку», однако может быть пред-
ставлена в виде вытянутых нитевидных ворсин. В
большинстве случаев опухоль имеет ворсинчатый
край с «мерцанием» или «дрожанием» поверхности,
окруженной кровью, что позволяет отличить обра-
зование от тромба [4]. В некоторых случаях фибро-
эластома может не иметь ножки. Иногда при уль-
тразвуковом исследовании опухоль не диагности-
руется из-за небольшого размера или недостаточно
тщательно проведенной визуализации, низкого ко-
эффициента подозрения, помимо этого образова-
ние может маскироваться другими патологически-
ми изменениями или дегенеративными изменени-
ями клапанов [16]. Больным показано проведение
ЧПЭхоКГ при подозрении на то, что папиллярная
фиброэластома является источником эмболов, т.к.
в четверти случаев обследования пациентов толь-
ко с помощью ТТЭхоКГ мелкие фиброэластомы
можно пропустить [8]. Пациентам нашего высоко-
технологического центра, с низким хирургическим
риском или риском < 1% по шкале Общества торо-
кальных хирургов (STS), у которых обнаружена ле-
восторонняя папиллярная фиброэластома (вне за-
висимости от ее размера, подвижности и локализа-
ции) мы рекомендуем задуматься о хирургическом
ее удалении, т.к. только на основании эхокардио-
графических характеристик нельзя определить риск
папиллярных фиброэластом. Если хирургическое
удаление является неприемлемым вариантом, то
назначается долгосрочная антитромбоцитарная те-
рапия. На рис. 42.4 представлен алгоритм.
ДРУГИЕ МЕТОДЫ ВИЗУАЛИЗАЦИИ
Хоть методы КТ и МРТ становятся все быстрее и все
точнее визуализируют клапанные структуры, од-
нако они продолжают представлять меньшую цен-
ность для диагностики фиброэластом по сравнению
с ЭхоКГ. Поскольку опухоли обычно имеют неболь-
шие размеры, прикрепляются и совершают движе-
ния вместе со створками клапана, то при использо-
вании этих методов временные и пространственные
характеристики не всегда точны. Основным ограни-
чением МРТ является появление артефактов, свя-
занных с движением структур сердца [4, 16].
ch42_условно.indd 1085
03.04.2019 12:16:25
1086 ЧАСТЬ VII Сосудистые и системные заболевания
Т
и
п
о
п
у
х
о
л
и
В
о
з
р
а
с
т
п
а
ц
и
е
н
т
а
п
р
и
д
и
а
г
н
о
с
т
и
к
е
С
о
п
у
т
с
т
в
у
ю
щ
и
е
с
и
н
д
р
о
м
ы
Т
и
п
и
ч
н
а
я
л
о
к
а
л
и
з
а
ц
и
я
Т
и
п
и
ч
н
ы
е
м
о
р
ф
о
-
л
о
г
и
ч
е
с
к
и
е
х
а
р
а
к
т
е
-
р
и
с
т
и
к
и
П
р
и
з
н
а
к
и
н
а
Э
х
о
К
Г
П
р
и
з
н
а
к
и
н
а
К
Т
П
р
и
з
н
а
к
и
н
а
М
Р
Т
М
и
к
с
о
м
а
3
0
–
6
0
л
е
т
(
м
о
л
о
ж
е
,
е
с
л
и
с
в
я
з
а
н
а
с
к
о
м
п
л
е
к
с
о
м
К
а
р
н
и
)
К
о
м
п
л
е
к
с
К
а
р
н
и
О
в
а
л
ь
н
а
я
я
м
к
а
м
е
ж
-
п
р
е
д
с
е
р
д
н
о
й
п
е
р
е
-
г
о
р
о
д
к
и
,
ч
а
щ
е
л
е
-
в
о
е
п
р
е
д
с
е
р
д
и
е
,
ч
е
м
п
р
а
в
о
е
Ж
е
л
е
о
б
р
а
з
н
а
я
,
н
а
н
о
ж
к
е
,
с
к
а
л
ь
ц
и
-
ф
и
к
а
ц
и
е
й
,
к
р
о
в
о
-
и
з
л
и
я
н
и
е
м
и
л
и
н
е
-
к
р
о
з
о
м
П
о
д
в
и
ж
н
а
я
о
п
у
-
х
о
л
ь
,
к
о
р
о
т
к
а
я
н
о
ж
к
а
Г
е
т
е
р
о
г
е
н
н
а
я
,
н
е
з
н
а
-
ч
и
т
е
л
ь
н
о
е
о
с
л
а
б
л
е
-
н
и
е
с
и
г
н
а
л
о
в
Г
е
т
е
р
о
г
е
н
н
а
я
,
я
р
к
и
е
н
а
T
2
W
I
;
г
е
т
е
р
о
-
г
е
н
н
о
е
у
с
и
л
е
н
и
е
П
а
п
и
л
-
л
я
р
н
а
я
ф
и
б
р
о
-
э
л
а
с
т
о
м
а
С
р
е
д
н
и
й
,
п
о
ж
и
л
о
й
в
о
з
р
а
с
т
Н
е
т
К
л
а
п
а
н
ы
с
е
р
д
ц
а
Н
е
б
о
л
ь
ш
и
е
(
<
1
с
м
)
,
в
о
р
с
и
н
ч
а
т
ы
е
,
к
о
-
р
о
т
к
а
я
н
о
ж
к
а
,
р
е
д
-
к
о
к
а
л
ь
ц
и
ф
и
к
а
ц
и
я
,
б
е
з
к
р
о
в
о
и
з
л
и
я
н
и
я
и
н
е
к
р
о
з
а
«
М
е
р
ц
а
ю
щ
и
е
»
к
р
а
я
О
б
ы
ч
н
о
и
м
е
ю
т
н
е
-
б
о
л
ь
ш
у
ю
н
о
ж
к
у
,
б
о
л
ь
ш
и
е
о
б
р
а
з
о
-
в
а
н
и
я
и
м
е
ю
т
к
а
л
ь
-
ц
и
ф
и
к
а
ц
и
ю
и
в
о
р
-
с
и
н
ч
а
т
ы
е
к
р
а
я
О
б
ы
ч
н
о
и
м
е
ю
т
н
е
-
б
о
л
ь
ш
у
ю
н
о
ж
к
у
,
б
о
л
ь
ш
и
е
о
б
р
а
з
о
-
в
а
н
и
я
и
м
е
ю
т
в
о
р
-
с
и
н
ч
а
т
ы
е
к
р
а
я
Л
и
п
о
м
а
Л
ю
б
о
й
М
н
о
ж
е
с
т
в
о
ж
и
р
о
в
ы
х
о
б
р
а
з
о
в
а
н
и
й
,
с
в
я
-
з
а
н
н
ы
х
с
т
у
б
е
р
о
з
-
н
ы
м
с
к
л
е
р
о
з
о
м
,
м
о
-
г
у
т
б
ы
т
ь
л
и
п
о
м
а
м
и
и
л
и
а
н
г
и
о
л
и
п
о
м
а
м
и
П
о
л
о
с
т
ь
п
е
р
и
к
а
р
д
а
и
л
и
о
д
н
а
и
з
к
а
м
е
р
с
е
р
д
ц
а
Б
о
л
ь
ш
и
е
,
н
а
ш
и
р
о
-
к
о
м
о
с
н
о
в
а
н
и
и
,
б
е
з
к
а
л
ь
ц
и
ф
и
к
а
ц
и
и
,
к
р
о
в
о
и
з
л
и
я
н
и
я
и
н
е
к
р
о
з
а
О
б
ы
ч
н
о
г
и
п
о
э
х
о
-
г
е
н
н
ы
е
в
п
о
л
о
с
т
и
п
е
р
и
к
а
р
д
а
,
э
х
о
-
г
е
н
н
ы
е
в
к
а
м
е
р
а
х
с
е
р
д
ц
а
Г
о
м
о
г
е
н
н
о
е
о
с
л
а
б
-
л
е
н
и
е
с
и
г
н
а
л
о
в
(
н
е
з
н
а
ч
и
т
е
л
ь
н
о
е
о
с
л
а
б
л
е
н
и
е
)
Г
о
м
о
г
е
н
н
а
я
и
н
т
е
н
-
с
и
в
н
о
с
т
ь
с
и
г
н
а
л
а
(
п
о
в
ы
ш
е
н
н
а
я
T
1
)
;
б
е
з
у
с
и
л
е
н
и
я
Г
е
м
а
н
г
и
-
о
м
а
Л
ю
б
о
й
в
о
з
р
а
с
т
,
с
р
е
д
н
и
й
в
о
з
р
а
с
т
4
0
л
е
т
Н
е
т
Л
ю
б
а
я
.
3
0
%
в
п
р
а
в
о
м
ж
е
л
у
д
о
ч
к
е
,
3
0
%
в
л
е
в
о
м
ж
е
л
у
д
о
ч
к
е
,
2
5
%
в
п
р
а
в
о
м
п
р
е
д
-
с
е
р
д
и
и
М
н
о
г
о
д
о
л
ь
ч
а
т
ы
е
,
о
д
-
н
о
д
о
л
ь
ч
а
т
ы
е
,
к
и
-
с
т
о
з
н
ы
е
,
<
1
–
8
с
м
«
О
д
н
о
р
о
д
н
ы
е
»
э
х
о
-
п
л
о
т
н
ы
е
И
н
т
е
н
с
и
в
н
о
е
ц
е
н
-
т
р
а
л
ь
н
о
е
к
о
н
т
р
а
с
т
-
н
о
е
у
с
и
л
е
н
и
е
Б
ы
с
т
р
о
е
у
с
и
л
е
н
и
е
T
2
W
I
с
и
г
н
а
л
о
в
Р
а
б
д
о
м
и
-
о
м
а
М
л
а
д
е
н
ц
ы
,
д
е
т
и
д
о
4
л
е
т
Т
у
б
е
р
о
з
н
ы
й
с
к
л
е
р
о
з
М
и
о
к
а
р
д
л
е
в
о
г
о
и
п
р
а
в
о
г
о
ж
е
л
у
д
о
ч
-
к
о
в
,
а
о
р
т
а
л
ь
н
ы
й
к
л
а
п
а
н
,
в
ы
х
о
д
н
о
й
т
р
а
к
т
И
н
т
р
а
м
у
р
а
л
ь
н
а
я
,
н
а
ш
и
р
о
к
о
м
о
с
н
о
в
а
-
н
и
и
,
м
н
о
ж
е
с
т
в
е
н
-
н
ы
е
,
р
а
з
н
о
г
о
р
а
з
м
е
-
р
а
,
с
п
о
н
т
а
н
н
ы
й
р
е
-
г
р
е
с
с
Я
р
ч
е
о
к
р
у
ж
а
ю
щ
е
г
о
м
и
о
к
а
р
д
а
П
о
н
и
ж
е
н
н
о
й
п
л
о
т
-
н
о
с
т
и
п
р
и
к
о
н
-
т
р
а
с
т
н
о
й
К
Т
И
н
т
е
н
с
и
в
н
о
с
т
ь
а
н
а
-
л
о
г
и
ч
н
а
T
2
W
I
;
г
и
п
е
р
и
н
т
е
н
с
и
в
-
н
ы
е
о
т
н
о
с
и
т
е
л
ь
н
о
T
2
W
I
Ф
и
б
р
о
м
а
М
л
а
д
е
н
ц
ы
,
д
е
т
и
,
м
о
л
о
д
о
й
в
о
з
р
а
с
т
С
и
н
д
р
о
м
Г
о
р
л
и
н
а
Ж
е
л
у
д
о
ч
к
и
с
е
р
д
ц
а
Б
о
л
ь
ш
и
е
,
и
н
т
р
а
м
у
-
р
а
л
ь
н
ы
е
,
с
к
а
л
ь
ц
и
-
ф
и
к
а
ц
и
е
й
,
б
е
з
к
р
о
-
в
о
и
з
л
и
я
н
и
й
и
н
е
-
к
р
о
з
а
И
н
т
р
а
м
у
р
а
л
ь
н
ы
е
,
к
а
л
ь
ц
и
н
и
р
о
в
а
н
-
н
ы
е
Н
и
з
к
а
я
п
л
о
т
н
о
с
т
ь
,
к
а
л
ь
ц
и
ф
и
к
а
ц
и
я
И
з
о
и
н
т
е
н
с
и
в
н
ы
е
T
1
W
1
;
т
е
м
н
ы
е
T
2
W
I
;
о
б
ы
ч
н
о
с
н
е
з
н
а
ч
и
т
е
л
ь
н
ы
м
у
с
и
л
е
н
и
е
м
и
л
и
е
г
о
о
т
с
у
т
с
т
в
и
е
м
П
а
р
а
г
а
н
-
г
л
и
о
м
а
М
о
л
о
д
о
й
в
о
з
р
а
с
т
И
н
о
г
д
а
м
н
о
г
о
с
и
м
-
п
т
о
м
о
в
,
п
о
ч
т
и
в
с
е
г
-
д
а
с
п
о
р
а
д
и
ч
е
с
к
и
е
Л
е
в
о
е
п
р
е
д
с
е
р
д
и
е
,
к
о
р
о
н
а
р
н
ы
е
а
р
т
е
-
р
и
и
,
к
о
р
е
н
ь
а
о
р
т
ы
Н
а
ш
и
р
о
к
о
м
о
с
н
о
-
в
а
н
и
и
,
и
н
ф
и
л
ь
т
р
а
-
т
и
в
н
а
я
,
с
ч
е
т
к
и
-
м
и
к
о
н
т
у
р
а
м
и
,
р
е
д
-
к
о
к
а
л
ь
ц
и
ф
и
к
а
ц
и
я
,
к
р
о
в
о
и
з
л
и
я
н
и
е
,
н
е
-
к
р
о
з
Э
х
о
г
е
н
н
ы
е
,
о
т
н
о
-
с
и
т
е
л
ь
н
о
н
е
п
о
д
-
в
и
ж
н
ы
е
Н
и
з
к
а
я
п
л
о
т
н
о
с
т
ь
,
с
и
л
ь
н
о
е
у
с
и
л
е
н
и
е
О
б
ы
ч
н
о
и
з
о
и
н
т
е
н
-
с
и
в
н
ы
е
и
л
и
г
е
т
е
-
р
о
г
е
н
н
ы
е
T
1
W
1
,
я
р
к
и
е
T
2
W
I
,
о
т
ч
е
т
-
л
и
в
о
е
у
с
и
л
е
н
и
е
T
1
W
1
—
T
1
-
в
з
в
е
ш
е
н
н
о
е
и
з
о
б
р
а
ж
е
н
и
е
;
T
2
W
I
—
T
2
-
в
з
в
е
ш
е
н
н
о
е
и
з
о
б
р
а
ж
е
н
и
е
;
К
Т
—
к
о
м
п
ь
ю
т
е
р
н
а
я
т
о
м
о
г
р
а
ф
и
я
;
М
Р
Т
—
м
а
г
н
и
т
н
о
-
р
е
з
о
н
а
н
с
н
а
я
т
о
м
о
г
р
а
ф
и
я
.
[
A
r
a
o
z
P
A
,
M
u
l
v
a
g
h
S
L
,
T
a
z
e
l
a
a
r
H
D
,
e
t
a
l
.
C
T
a
n
d
M
R
i
m
a
g
i
n
g
o
f
b
e
n
i
g
n
p
r
i
m
a
r
y
c
a
r
d
i
a
c
n
e
o
p
l
a
s
m
s
w
i
t
h
e
c
h
o
c
a
r
d
i
o
g
r
a
p
h
i
c
c
o
r
r
e
l
a
t
i
o
n
.
R
a
d
i
o
g
r
a
p
h
i
c
s
2
0
:
1
3
0
3
–
1
3
1
9
,
2
0
0
0
.
]
Т
А
Б
Л
И
Ц
А
4
2
.
5
Х
а
р
а
к
т
е
р
и
с
т
и
к
и
п
е
р
в
и
ч
н
ы
х
д
о
б
р
о
к
а
ч
е
с
т
в
е
н
н
ы
х
о
п
у
х
о
л
е
й
с
е
р
д
ц
а
ch42_условно.indd 1086
03.04.2019 12:16:25
1087
42 Опухоли сердца
Рис. 42 .3 Папиллярная фиброэластома. Чаще всего папиллярные фиброэластомы располагаются на клапанах, но их можно найти в любом другом месте
сердца. (А) A Папиллярная фиброэластома (стрелка) крепится к правой коронарной створке аортального клапана. (Б) A Двухмерное изображение по короткой
оси митрального клапана. Видно высокоподвижное образование (стрелка) размером 1 см с волнистым краем, крепящееся к задней створке митрального клапа-
на. (В) A Трехмерное изображение подвижной опухоли (стрелка) и ее связи с сухожильной хордой задней створки. Типичный вид папиллярной фиброэластомы.
Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие.
ЛП
ЛП
Ао
ЛЖ
ЛЖ
А
Б
В
Рис. 42.4 Алгоритм лечения папиллярной фиброэластомы с учетом эхокардиографических данных. STS — Society of Thoracic Surgeons; Ао — аор-
та; ЛП — левое предсердие; ПБЭ — подострый бактериальный эндокардит; СКВ — системная красная волчанка [Tamin SS, Maleszewski JJ, Scott CG, et al. Prog-
nostic and bioepidemiologic implications of papillary fibroelastomas. J Am Coll Cardiol 65:2420–2429, 2015].
На ЭхоКГ левая часть сердца
с возможной папиллярной фиброэластомой
Исключить возможные диагнозы: ПБЭ, СКВ, антифосфолипидные антитела
Кандидат на операцию
Экспертный хирургический центр
Отказ от операции
Увеличенный риск удаления
Выбрать антитромбоцитарное средство
Лечение аспирином
Хирургическое удаление
Наблюдение для исключения
возможного рецидива
• Экспертное мнение кардиолога
• Предпочтения хирурга и/или пациента
• Оценка риска по шкале STS
Папиллярная
фиброэластома
Папиллярная
фиброэластома
Ао
ЛП
ch42_условно.indd 1087
03.04.2019 12:16:25
1088 ЧАСТЬ VII Сосудистые и системные заболевания
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика проводится с тром-
бозом, вегетациями, другими опухолями сердца, де-
генеративной кальцификацией клапанов, наложе-
ниями Ламбла (рис. 42.5). При ЭхоКГ наложения
Ламбла сложно отличить от папиллярной фиброэ-
ластомы [21]. Эти нитевидные образования, впер-
вые описанные Ламблом в 1856 г. [22], по определе-
нию образуются в местах смыкания клапанов и счи-
таются следствием повреждения и износа, которые
образуются как небольшие тромбы на эндокарде со-
прикасающихся краев клапанов в местах незначи-
тельного повреждения эндотелия и напоминают из-
ношенные края старой манжеты. На атриовентри-
кулярных клапанах наложения Ламбла выявляются
в местах смыкания створок на предсердной поверх-
ности, а на полулунных клапанах могут определять-
ся в любом месте. В отличие от папиллярной фибро-
эластомы данные нитевидные образования обычно
не возникают на артериальной стороне полулуний
аортального клапана или пристеночно на эндокарде
[4]. В отличие от папиллярной фиброэластомы нало-
жения Ламбла имеют гораздо большее распростране-
ние, наблюдаются у 85% взрослых, более чем в 90%
случаев со множественными опухолями. В отличие
от них, папиллярная фиброэластома обычно имеет
большие размеры и желеобразную консистенцию и
выявляется на клапанах вдали от границ смыкания
створок. В некоторых случаях фиброэластома опре-
деляется на эндокардиальной поверхности предсер-
дий и желудочков [23]. Несмотря на описанные раз-
личия, иногда возникают трудности при диагности-
Рис. 42 .5 Вегетации и наложения Ламбла можно спутать с папиллярной фиброэластомой. На (А) и (Б) вегетации митрального (А) и аортального A
(Б) клапанов у двух больных с инфекционным эндокардитом, вызванным грамположительным enterococcus faecalis. Вегетация на аортальном клапане (стрелка)
расположена со стороны выходного тракта левого желудочка (ВТЛЖ). Вегетация отличается выраженной подвижностью и аналогично вегетации митрального кла-
пана приводит к деструкции клапана и выраженной аортальной регургитации. В отличие от папиллярной фиброэластомы вегетации не имеют характерной тонкой
ножки и ворсинчатого строения. Папиллярные фиброэластомы обычно не приводят к деструкции клапана. (В, Г) Наложения Ламбла на аортальном клапане (стрел-
ки) во время систолы (В) и во время диастолы A (Г). Эта подвижная нитевидная структура пролабирует через клапан в ВТЛЖ во время диастолы. В отличие от
папиллярной фиброэластомы отсутствует округлой формы основание в области дистального конца, по сравнению с вегетациями не определяются признаки де-
струкции клапана, не считая сопутствующих дегенеративных изменений. Ао — аорта; ЛП — левое предсердие; ПП — правое предсердие.
ВТЛЖ
ЛП
Ao
ВТЛЖ
Ao
ЛП
ЛП
Ao
ПП
А
Б
Г
В
ch42_условно.indd 1088
03.04.2019 12:16:26
1089
42 Опухоли сердца
ке этих двух видов образований неинвазивными
методами.
МИКСОМА
Три четверти всех первичных опухолей сердца яв-
ляются доброкачественными, из них около полови-
ны — это миксомы. Миксомы встречаются во всех
возрастных группах, с наибольшей частотой меж-
ду 30 и 60 годами жизни (ориентировочная часто-
та случаев 45% у взрослых и 15% у детей). Женщи-
ны наиболее подвержены заболеванию [24–26]. Хо-
тя миксомы обычно развиваются спорадически и
выявляются в виде единичного образования в поло-
сти ЛП, отмечены случаи семейных форм миксомы
(7%) [27, 28]. Семейные формы миксомы представ-
ляют собой наследственное аутосомно-доминантное
заболевание в сочетании с двумя и более следующи-
ми изменениями: кожные миксомы (единичные или
множественные), кожный лентигиноз, миксоидный
фиброаденоматоз молочной железы, аденома гипо-
физа, первичная адренокортикальная микроноду-
лярная дисплазия с синдромом Иценко–Кушинга
и тестикулярные опухоли (обычно хондроматозная
остеобластома из клеток Сертоли). Ранее для опи-
сания этих синдромов использовали несколько аб-
бревиатур (LAMB и NAME), в настоящее время син-
дромы сгруппированы в так называемый комплекс
Карни, который назван по имени врача, впервые
описавшего семейный характер данного заболева-
ния (рис. 42.6) [29]. Пациенты этой группы обыч-
но люди молодого возраста, которые могут иметь
герминативную мутацию PRKAR1A [30]. У данных
больных часто выявляются множественные миксо-
мы и характерен повышенный риск развития реци-
дивов после удаления опухоли [31].
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Клинические проявления миксомы, как и большин-
ства опухолей сердца, определяются их локализа-
цией, размером и подвижностью. Эти особенности
опухолевого образования выявляются при прове-
дении ЭхоКГ. У многих пациентов диагностирует-
ся один и более признаков из триады характерных
для миксомы проявлений: эмболия, внутрисердеч-
ная обструкция или конституциональные призна-
ки. Одышка у больных с миксомой может возни-
кать вследствие обструкции атриовентрикулярного
клапана. Иногда, особенно при опухолях неболь-
ших размеров, симптомы могут отсутствовать. Су-
ществует риск развития рецидива опухоли после
удаления. Общий риск рецидива составляет 13%,
гораздо больше риск при семейной форме миксо-
мы по сравнению со спорадической опухолью (22 и
3% соответственно). Опасность рецидива возраста-
ет линейно в течение 4 лет после удаления опухоли,
после чего риск рецидива незначительный. На ос-
новании этого наблюдения рекомендуется прово-
Рис. 42 .6 Комплекс Карни. Женщина, 19 лет, диагноз «инсульт». (А) У па-
циентки диагностированы кожная миксома и лентиго губ. (Б) При ЧПЭхоКГ об-
наружены множественная миксома сердца. Опухоль (красная стрелка) визуа-
лизируется в области левого предсердия (ЛП) вблизи овальной ямки, связана
с передней створкой трикуспидального клапана (белая стрелка). Помимо этого
выявляется миксома в левом желудочке (ЛЖ), фиксированная к передней ча-
сти межжелудочковой перегородки, однако она плохо видна на данном непод-
вижном изображении (острие стрелки). Во время операции была обнаружена
еще одна небольшая миксома в области верхушки правого желудочка (ПЖ),
не обнаруженная во время дооперационного и интраоперационного исследо-
ваний. У больной диагностирован комплекс Карни. После 4 лет рецидива но-
вообразования не было, но через 10 лет на ЭхоКГ были обнаружены множе-
ственнные миксомы в правом желудочке, которые были затем хирургически
удалены. Этот случай подчеркивает важность тщательного поиска множествен-
ных сопутствующих опухолевых поражений. Более того, у пациентов с комплек-
сом Карни оправдано наблюдение свыше 4 лет. ПП — правое предсердие.
ПЖ
ПП
ЛЖ
ЛП
А
Б
дить динамическое эхокардиографическое наблю-
дение пациентов после оперативного вмешатель-
ства каждые полгода в течение 4 лет [17].
ЛОКАЛИЗАЦИЯ
Миксомы сердца обычно определяются в обла-
сти предсердий, 75% из них выявляются в ЛП, 15–
20% — в ПП. Типичной местом прикрепления яв-
ляется межпредсердная перегородка на границе
мембраны овальной ямки [10, 24, 25, 32]. В неко-
торых случаях распространение миксомы может
ch42_условно.indd 1089
03.04.2019 12:16:27
1090 ЧАСТЬ VII Сосудистые и системные заболевания
происходить через овальную ямку в оба предсер-
дия. Миксомы могут также происходить (в поряд-
ке уменьшения частоты случаев) из задней стенки
предсердия, передней стенки предсердия или уш-
ка. Миксомы возникают в левом желудочке (ЛЖ) у
3–4% и у 3–4% пациентов в правом желудочке (ПЖ)
[32]. Опухоли чаще одиночные. Множественные
опухоли или их атипичная локализация предпола-
гают наличие семейной формы миксомы. Имеются
единичные сообщения о миксомах с локализацией
в области клапанов сердца, однако данные формы
встречаются крайне редко.
МАКРОСКОПИЧЕСКАЯ КАРТИНА
Макроскопические данные миксомы сердца весь-
ма разнообразны. Размер опухоли варьирует от 1 до
15 см, обычно 5–6 см. Миксомы обычно имеют поли-
повидную форму, часто имеют тонкую ножку, ред-
ко — на широком основании. Часто округлой или
овальной формы, с гладкой или дольчатой поверх-
ностью (рис. 42.7). Подвижность опухоли определя-
ется ее консистенцией, которая частично варьируется
в зависимости от степени ее фиксации и длины нож-
ки. Полиповидные миксомы обычно компактны и не
имеют тенденции к спонтанной фрагментации. Ме-
нее распространены ворсинчатые или папиллярные
миксомы, имеющие поверхность, представленную
множественными ворсинчатыми удлиненными сег-
ментами, которые отличаются хрупкостью и часто
Рис. 42 .7 Миксома в левом предсердии. Женщина, 64 года, с жалобами на тяжесть в груди и одышку при физической нагрузке в покое в течение 3 мес. При
ЧПЭхоКГ обнаружены типичные признаки большой миксомы в левом предсердии. (А) A Во время систолы в полости левого предсердия видно большое, ово-
идной формы образование (5 см на 7 см) на тонкой ножке, прикрепленной к овальной ямке. (Б) Во время диастолы миксома пролабирует в область митрального
клапана, что приводит к функциональному митральному стенозу (В, Г). Средний градиент давления 14 мм рт. ст. ЛЖ — левый желудочек.
ЛЖ
ЛЖ
ЛЖ
А
Б
Г
В
могут отрываться. Опухоли такого строения отли-
чаются наибольшим риском развития эмболических
осложнений (табл. 42.6) [33]. Помимо риска эмбо-
лий, на поверхности таких опухолей нередко образу-
ются тромбы. При морфологическом исследовании
миксом часто выявляются кисты, участки некроза
и кровоизлияния. Помимо этого, может выявлять-
ся кальцификация образования, однако достаточно
редко, лишь в 10–20% случаев. В отдельных случаях
отмечается инфицирование миксомы.
ЭХОКАРДИОГРАФИЧЕСКИЕ ПРИЗНАКИ
С помощью ЭхоКГ можно определить локализацию,
размер, форму, место прикрепления и подвижность
Морфологические
признаки
Да
(n=10)
Нет
(n=27) p
Ворсинчатая поверхность 90
37
0,007
Размер (мм)
48±17
62±26
0,132
Выраженная кальцифи-
кация
0
15
0,557
* Параметры даны в процентах или средних значениях плюс-минус
стандартное отклонение.
[Acebo E, Val-Bernal JF, Gomez-Roman JJ, Reveulta JM. Chest 123:1379–
1385, 2003.]
ТАБЛИЦА 42.6 Морфологические признаки миксом,
связанных с эмболией*
ch42_условно.indd 1090
03.04.2019 12:16:27
1091
42 Опухоли сердца
миксомы [33]. Множественные миксомы могут быть
пропущены при визуализации, особенно когда врач
настроен на поиск указанной опухоли. Чтобы ис-
ключить множественные опухоли, необходим тща-
тельный анализ изображения всех полостей сердца.
Одним из отличительных признаков является на-
личие характерной короткой ножки, подвижность и
эластичность образования [6]. При выявлении этих
характерных признаков дополнительного образо-
вания в ЛП можно с уверенностью ставить диагноз
миксомы, особенно если ножка берет свое начало в
области межпредсердной перегородки. При ЭхоКГ
структура миксомы отличается однородностью или
с центральными участками гиперэхогенности, свя-
занными с наличием участков некроза и кровоизли-
яния. Внутренняя структура опухоли может также
содержать участки кальцификации. В зависимости
от размера и подвижности миксомы могут приво-
дить к обструкции кровотока, поступающего в ЛЖ
или РЖ, причем степень обструкции может изме-
няться при изменении положения тела больного (см.
рис. 42.7). ЧПЭхоКГ представляет дополнительную
важную информацию, позволяет уточнить место
фиксации образования и морфологические особен-
ности миксом предсердий и желудочков. ЧПЭхоКГ
отличается большей чувствительностью в выявле-
нии опухолей небольших размеров (1–3 мм) и со-
путствующего опухолевого процесса [34].
ДРУГИЕ МЕТОДЫ ВИЗУАЛИЗАЦИИ
Методы КТ и МРТ не дают возможности проводить
точную оценку подвижности, эластичности опу-
холи и тонкой ножки миксомы [6]. Однако, в отли-
чие от ЭхоКГ, КТ и МРТ позволяют дифференци-
ровать структурный состав образования, лучше вы-
являя твердые, жидкие, геморрагические и жировые
составляющие опухоли. КТ и МРТ признаки миксом
сердца могут различаться и в большинстве случаев
отражают общие патоморфологические особенности
строения образования. Из-за студневидной конси-
стенции миксом изображение на КТ характеризует-
ся гетерогенностью с небольшими участками разря-
жения и кальцификации, если она имеется. Опухоль
имеет значительно большую интенсивность сигна-
ла на Т2-взвешенных МРТ. Наличие кальцифика-
ции или гемосидерина может приводить к появле-
нию участков с пониженной интенсивностью сиг-
нала. При контрастировании опухоль обычно имеет
гетерогенную структуру, связанную с наличием не-
кротических участков [6, 35].
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Важное значение имеет дифференциальная диа-
гностика миксомы от вегетаций и тромбов. Обыч-
но ЭхоКГ проявления миксомы достаточно отчет-
ливы. Однако иногда диагноз может быть менее
определенным, особенно в случаях, когда миксома
имеет необычную локализацию или прикрепление,
например, в ушке ЛП. В этих случаях клиническая
картина (фибрилляция предсердий), изменения на
эхокардиограмме (нарушение функции желудоч-
ка, увеличения ЛП и эффект спонтанного эхокон-
трастирования) и результаты КТ и МРТ позволяют
дифференцировать тромб от опухоли. Иногда, если
выявляется дополнительное образование небольших
размеров, назначается антикоагулянтная терапия с
диагностической целью, и повторная визуализация
для оценки ее результатов.
ДРУГИЕ ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ СЕРДЦА
ЛИПОМА И ЛИПОМАТОЗНАЯ ГИПЕРТРОФИЯ
Липоматозная гипертрофия межпредсердной пере-
городки относится к доброкачественным изменени-
ям, не относящимся к опухолевому процессу. Мы
рассматриваем эти изменения, т.к. данную патоло-
гию часто путают с липомой. Липоматозная гипер-
трофия определяется как «отложение жира в обла-
сти межпредсердной перегородки на уровне оваль-
ной ямки, поперечный размер которого превышает
2 см» [15]. Липоматозная гипертрофия затрагива-
ет межпредсердную перегородку, не распространя-
ясь на мембрану овальной ямки [15], что приводит
к характерной гантелеобразной форме перегородки
(рис. 42.8). Эти изменения обусловлены гиперпла-
зией жировых клеток и связаны с увеличением воз-
раста пациентов и ожирением. Липоматозная ги-
пертрофия не неопластический процесс, но может
являться причиной развития предсердных арит-
мий. В некоторых случаях может приводить к об-
струкции верхней полой вены [36]. При ЭхоКГ ис-
следовании визуализируется гиперэхогенная, утол-
щенная межпредсердная перегородка, иногда с
толщиной, достигающей 3 см. В отличие от липо-
матозной гипертрофии липомы менее распростра-
нены. К сожалению, по данным литературы неиз-
вестно точное число описанных случаев, т.к. в ряде
исследований не проводится различий между ли-
помами и липоматозной гипертрофией [15]. Липо-
ма представляет собой гомогенную жировую осум-
кованную опухоль, обычно образующуюся на эпи-
кардиальной поверхности сердца, зачастую опухоль
расположена на широком основании и распростра-
няется в полость перикарда [6]. Субэндокардиаль-
ные липомы часто имеют небольшие размеры и не
имеют ножки, тогда как субэпикардиальные липо-
мы обычно имеют большие размеры. Субэндокар-
диальные липомы также могут иметь широкое ос-
нование, выпячиваясь в просвет полости сердца.
Липомы обычно протекают без клинических про-
явлений, однако в некоторых случаях могут приво-
дить к появлению симптомов из-за локальной ком-
прессии (иногда липомы значительно увеличива-
ются в размерах и весят до 4,8 кг) или приводить к
аритмиям. Иногда опухоль образуется на межпред-
ch42_условно.indd 1091
03.04.2019 12:16:28
1092 ЧАСТЬ VII Сосудистые и системные заболевания
сердной перегородке и распространяется в полость
ЛП, симулируя миксому сердца. Липомы в отличие
от миксом, расположены на широком основании и
не так подвижны. Неудивительно, что ЭхоКГ про-
явления липом могут варьировать в зависимости
от локализации образования. В полости перикар-
да опухоль может визуализироваться как эхогенное
образование, полностью гипоэхогенное или иметь
гипоэхогенные участки. Внутриполостные липо-
мы, в свою очередь, могут выявляться в виде гомо-
генных или гиперэхогенных образований. Причи-
ны столь различных признаков опухолей неизвест-
ны [6].
При диагностической неопределенности, связан-
ной с выявлением липоматозной гипертрофии и
липомы, назначается КТ или МРТ, т.к. данные ме-
тоды отличаются высокой специфичностью в опре-
делении жировой ткани [6, 37]. В связи с тем что для
липоматозной гипертрофии характерна определен-
ная, гантелеобразная форма межпредсердной пе-
регородки и жировая ткань хорошо идентифици-
руется неинвазивными методами, то в проведении
чрескожной тканевой биопсии или хирургической
биопсии нет необходимости [38].
ГЕМАНГИОМА
Гемангиомы представляют собой доброкачествен-
ные сосудистые опухоли, которые составляют от 2,8
до 10% первичных опухолей сердца [39, 40]. Опухо-
ли могут выявляться в различных отделах сердца,
в обоих желудочках, обоих предсердиях, в области
эпикардиальной поверхности и в полости перикар-
да [41, 42]. Гемангиомы чаще встречаются у мужчин,
чем у женщин, у пациентов в любом возрасте, сред-
ний возраст диагностики образования 43 года [43].
Для данных опухолей характерно бессимптомное
течение, и образование обычно выявляется случай-
но при ЭхоКГ, КТ, МРТ или на аутопсии [44]. Разви-
тие симптомов зависит от анатомической локализа-
ции и размера опухоли. Гемангиома может являться
причиной аритмий, образования перикардиальной
жидкости, острой сердечной недостаточности, об-
струкции ВТПЖ, коронарной недостаточности и
внезапной смерти [41]. Согласно оценке 56 паци-
ентов с гемангиомами, приблизительно в 30% слу-
чаев опухоль локализовалась в ПЖ, в 30% — в ЛЖ
и в 25% — в ПП. Также опухоли встречались в об-
ласти межпредсердной, межжелудочковой перего-
родок и в полости ЛП в 10% случаев. В 30% случа-
Рис. 42 .8 Липоматозная гипертрофия межпредсердной перегородки. (А) A ТТЭхоКГ в апикальной четырехкамерной позиции. Определяется гантеле-
образное образование в области межпредсердной перегородки. Мембрана овальной ямки (ОЯ) тонкая, гипертрофия распространяется на верхнюю стенку право-
го предсердия (ПП), где визуализируется опухолевидное образование. (Б) ЭхоКГ в субкостальной позиции (тот же пациент). (В, Г) A ЧПЭхоКГ липоматозной ги-
пертрофии (стрелки) с отсутствием изменений в области ОЯ. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
ПП
ЛП
ЛЖ
ПЖ
ПП
ЛП
ЛП
ЛП
ЛЖ
ОЯ
ОЯ
ПП
ПП
ПЖ
А
Б
Г
В
ch42_условно.indd 1092
03.04.2019 12:16:28
1093
42 Опухоли сердца
ев были обнаружены множественные опухоли. Раз-
мер гемангиом сердца может варьировать от < 1 см
до > 8 см [41]. Морфологически опухоли описыва-
ются по-разному, как одиночные эхоплотные обра-
зования в области межжелудочковой перегородки,
большие многодольчатые дополнительные образо-
вания или однодольчатые образования с кистозной
структурой. Несмотря на то что ЭхоКГ может диа-
гностировать гемангиому и определять ее локализа-
цию, четких эхокардиографических критериев опу-
холи не существует (рис. 42.9). ЧПЭхоКГ позволяет
получить дополнительную информацию о локали-
зации опухоли и провести оценку внутрисердечного
и внесердечного распространения опухоли и опре-
делить место ее прикрепления. Метод также позво-
ляет исключить метастазирование опухоли ПП на
крупные вены [13]. Катетеризация сердца и МРТ
считаются лучшими вспомогательными диагности-
ческими методами. При катетеризации сердца выяв-
ляют характерный «прилив крови к месту опухоли»,
связанный с высокой васкуляризацией образования,
при контрастной МРТ определяется быстрое увели-
чение васкуляризации гемангиомы при первом про-
хождении гадолиния [45].
Динамика развития гемангиом сердца недоста-
точно изучена. Тем не менее в связи со сложностью
прогнозирования гемодинамических последствий
этой опухоли по возможности рекомендовано ее
хирургическое удаление.
РАБДОМИОМА
Эта интрамиокардиальная опухоль является самым
распространенным новообразованием у детей, со-
ставляя 60% детских опухолей сердца, часто диа-
гностируется в первый год жизни или внутриутроб-
но при эхокардиографическом исследовании плода
[40–42, 46, 47] (рис. 42.10). Хорошо известна распро-
страненная связь рабдомиомы с туберозным скле-
розом, аутосомно-доминантным синдромом, харак-
теризующимся гамартомами в некоторых органах,
эпилепсией, умственной отсталостью и характер-
ными нарушениями кожи. Приблизительно у 50%
младенцев с туберозным склерозом выявляется раб-
домиома.
Это почти всегда множественные опухоли, воз-
никающие с одинаковой частотой в ЛЖ и ПЖ,
рост опухоли происходит в стенке желудочка или
на створках атриовентрикулярных клапанов. Раб-
домиомы могут быть от нескольких миллиметров
до нескольких сантиметров и в некоторых случа-
ях могут иметь ножку, нередко приводя к обструк-
ции отточного или приточного отдела желудочка.
Рис. 42 .9 Гемангиома сердца. (А) A ТТЭхоКГ мужчины 53 лет с ишемической болезнью сердца. Случайно обнаружены изменения, рекомендовано проведе-
ние ЧПЭхоКГ. На желудочковой поверхности передней створки митрального клапана определяется тонкостенное эхонегативное образование (стрелка) размером
2 см, соответствующее гемангиоме. (Б) При контрастной ЭхоКГ видно контрастирование опухоли (стрелка), что подтверждает ее сосудистую природу. (В, Г) Дру-
гой пример гемангиомы (острия стрелок) размером 1,7 см на 1,5 см, поражающей евстахиеву заслонку в месте соединения нижней полой вены (НПВ) и правого
предсердия (ПП). Гемангиома имеет четко очерченные границы при пробе с пузырьковым контрастированием. Ao — аорта; ЛЖ — левый желудочек; ЛП — ле-
вое предсердие.
ЛЖ
ЛП
Ao
ПП
НПВ
ЛЖ
ЛП
Ao
ПП
НПВ
А
Б
В
Г
ch42_условно.indd 1093
03.04.2019 12:16:28
1094 ЧАСТЬ VII Сосудистые и системные заболевания
Кровоизлияния и кальцификация встречаются до-
статочно редко [15]. При ЭхоКГ опухоль имеет чет-
кие контуры и выглядит немного ярче окружающе-
го нормального миокарда (рис. 42.11).
Рабдомиомы имеют гипогенную структуру при
контрастной КТ, изоинтенсивные на взвешенных
по Т1 и гиперинтенсивные на взвешенных по Т2
изображениях. Фиброма (также распространенная
опухоль сердца у детей), напротив, определяется
как темные единичные образования, часто с каль-
цификацией на Т2-взвешенных изображениях [48].
Специфическая черта рабдомиом — спонтан-
ный регресс опухолевого процесса. Обычно опу-
холи уменьшаются в размерах или количестве, у
большинства детей до 4 лет. Это явление реже вы-
является у пожилых пациентов, что, вероятно, ком-
пенсируется высокой частотой случаев у детей и
объясняет тот факт, что у взрослых опухоли обыч-
но имеют меньшие размеры по сравнению с детьми.
Эти опухоли связаны с высокой частотой синдрома
Вольфа–Паркинсона–Вайта (синдром предвозбуж-
дения желудочков) и могут увеличивать риск раз-
вития аритмий. В связи с тем что часто наблюдает-
ся спонтанное исчезновение опухоли, у асимптом-
ных пациентов проводится тактика наблюдения. В
редких случаях требуется хирургическое лечение,
если опухоли большого размера приводят к струк-
турным или гемодинамическим осложнениям [49].
ФИБРОМА
Фиброма сердца — это врожденное новообразование,
которое обычно выявляют у детей, треть из которых
младше 1 года. Подобно рабдомиомам, данные опу-
холи нередко диагностируют при внутриутробном
исследовании. Это самое часто оперируемое образо-
вание сердца у детей, и вторая по частоте случаев до-
брокачественная первичная опухоль сердца у детей
по данным аутопсии [15]. Фибромы редко встреча-
ются у взрослых. Выявляются с одинаковой частотой
у мальчиков и у девочек, средний возраст больных с
фибромой 13 лет. Отмечается увеличение числа фи-
бром сердца при синдроме Горлина, аутосомно-до-
минантной патологии, проявляющейся в виде мно-
жественных базальноклеточных карцином, кист че-
люсти, аномалии развития скелета и склонности к
развитию опухолей в различных органах и системах.
У пациентов с фибромами могут наблюдаться арит-
мии, сердечная недостаточность, цианоз, синкопаль-
ные состояния, боль в груди или внезапная смерть. У
30% пациентов заболевание протекает бессимптом-
но [15, 23].
Рис. 42 .11 Туберозный склероз. ТТЭхоКГ в парастернальной позиции по длинной оси A (А) и косой позиции по короткой (Б) оси 10-месячного ребенка с ту-
берозным склерозом, судорожным синдромом, синдромом WPW. Визуализируется множественная внутрисердечная опухоль. Образования прикрепляются к эн-
докардиальной поверхности левого желудочка (ЛЖ) и левого предсердия (красная стрелка) и выходного тракта левого желудочка (белая стрелка). Опухоль в об-
ласти выходного тракта приводит к его небольшой обструкции. Помимо этого, опухоли были выявлены в правом желудочке (ПЖ) (не показано). Эти изменения,
с учетом клинических данных, типичны для рабдомиомы, размер опухоли может уменьшаться со временем.
ПЖ
ПЖ
ЛЖ
А
Б
Рис. 42 .10 Рабдомиома. Фетальная ЭхоКГ в позиции по длинной оси. Опре-
деляется множественная опухоль с четкими границами (острия стрелок). Кар-
тина типична для рабдомиомы сердца. Образования приводят к облитерации
полости правого желудочка (ПЖ). ЛЖ — левый желудочек.
ПЖ
ЛЖ
ch42_условно.indd 1094
03.04.2019 12:16:29
1095
42 Опухоли сердца
Типичной локализацией фибром являются же-
лудочки сердца, с частым поражением свободной
стенки ЛЖ, межжелудочковой перегородки, ПЖ
и реже предсердий. Опухоль обычно представлена
солитарным образованием (в отличие от рабдоми-
ом), имеет четкие контуры, с центрально располо-
женными кальцификатами, без кистозных измене-
ний, некроза и кровоизлияний, хотя эти изменения
могут присутствовать при больших опухолях [15,
33]. ЭхоКГ критерием фибромы является выявле-
ние небольшого, неподвижного, эхогенного обра-
зования в стенке желудочка, нередко приводящего
к обструкции выходного тракта, размерами от 1 до
10 см (в среднем 5 см) [15]. Опухоль может иметь
узловую или дискретную форму и в некоторых слу-
чаях симулирует гипертрофическую кардиомиопа-
тию или гипертрофию межжелудочковой перего-
родки (рис. 42.12) [50].
Поскольку на ЭхоКГ можно увидеть наличие или
отсутствие деформации ткани, то этот метод поле-
зен при определении фибромиомы (состоящей из
коллагена и фибробластов) и отличии ее от рабдо-
миомы (состоящей из измененных миоцитов). В
фибромиомах деформация менее выражена, в от-
личие от рабдомиом и окружающего миокарда.
На КТ фибромы представлены в виде гомоген-
ного дополнительного образования с ослаблени-
ем сигналов от мягких тканей, может отличаться
инфильтративным ростом или четко очерченны-
ми краями. При исследовании нередко выявляется
кальцификация опухоли. На МРТ опухоль опреде-
ляется как гомогенное или гипоинтенсивное на Т2-
взвешенных изображениях и изоинтенсивное обра-
зование относительно миокарда на Т1-взвешенных
изображениях. Исследование с контрастированием
выявляет незначительное или отсутствие усиления
в области образования [6]. МРТ позволяет выявить
степень инфильтрации миокарда, которая может
являться основанием для резекции опухоли [51].
Хирургическое лечение показано больным при
развитии клинической симптоматики и возможно-
сти проведения операции. Бессимптомным пациен-
там удаление опухоли обычно не проводится, т.к.
размеры фибромы сердца многие годы могут оста-
ваться неизменными или даже уменьшаться. Одна-
ко из-за угрозы фатальных аритмий часто рекомен-
дуется оперативное вмешательство, несмотря на
отсутствие симптомов. Трансплантация сердца счи-
тается обоснованной при фибромах больших раз-
меров и опухолях, не подлежащих резекции.
ПАРАГАНГЛИОМА
Данная опухоль встречается крайне редко: до 1992 г.
описано только 30 наблюдений, в последующие
10 лет отмечено 20 случаев. У больных могут выяв-
ляться симптомы избыточного содержания катехо-
ламинов или компрессии примыкающих структур.
При ЭхоКГ исследовании, особенно ЧПЭхоКГ, ви-
зуализируется образование овоидной формы с чет-
кими границами, обычно расположенное в атрио-
вентрикулярной борозде рядом с эпикардиальными
артериями около трикуспидального или митраль-
ного фиброзного кольца (рис. 42.13) [52]. МРТ, КТ
и радионуклидное исследование позволяют диагно-
стировать и определить локализацию параганглио-
мы, расположенной вне надпочечников.
Рис. 42 .12 Фиброма. ЭхоКГ 3-летней девочки с внутрисердечным образова-
нием, обнаруженным в возрасте 18 мес, когда при аускультации были выяв-
лены сердечные шумы. У ребенка клиническая симптоматика отсутствовала.
(А) A ТТЭхоКГ в парастернальной позиции по длинной оси. Определяется
большое (3,5 см на 4 см) солитарное образование однородной структуры, при-
легающее к задней стенке (ЗС) ниже митрального клапана (стрелка), распро-
страняющееся от основания к верхушке левого желудочка (ЛЖ). Внутрисер-
дечная масса не прилегала к атриовентрикулярной борозде и папиллярным
мышцам. Ребенку рекомендовано проведение операции, учитывая риск воз-
никновения желудочковых аритмий и внезапной смерти. (Б, В) Во время опе-
рации обнаружена опухоль белого цвета (стрелка) в задненижних отделах сво-
бодной стенки ЛЖ. Опухоль полностью удалена без рассечения полости ЛЖ.
АК — аортальный клапан; ЛП — левое предсердие; МЖП — межжелудочко-
вая перегородка; ПЖ — правый желудочек [Bruce CJ. Cardiac tumours: diag-
nosis and management. Heart 97:151–160, 2011].
ПЖ
ЛЖ
ЛП
МЖП
ЗС
АК
А
Б
В
ch42_условно.indd 1095
03.04.2019 12:16:29
1096 ЧАСТЬ VII Сосудистые и системные заболевания
Ангиосаркома является наиболее распространен-
ным гистологическим подтипом, с соотношением
частоты случаев у мужчин и женщин 2 : 1. В отли-
чие от других сарком, типичной локализацией опу-
холи является ПП и перикард. Признаки и кли-
нические симптомы ангиосарком неспецифичны и
могут проявляться правожелудочковой сердечной
недостаточностью, симптомами, связанными с по-
ражением перикарда и обструкцией полой вены
[56].
На ЭхоКГ чаще выявляют саркому в виде допол-
нительного образования на широком основании в
полости ПП вблизи нижней полой вены. Возможно
эпикардиальное, эндокардиальное или внутрипо-
лостное распространение опухолевого процесса. На
КТ и МРТ выявляется усиленное кровоснабжение
в области образования, что позволяет поставить
окончательный диагноз. Во время операции часто
обнаруживают локальное распространение опухо-
ли в плевральное средостение. У больных нередко
выявляются метастазы в легкие, продолжитель-
ность жизни после выявления опухоли редко пре-
вышает 6 мес.
Рабдомиосаркомы составляют 20% от обще-
го числа сарком. Множественное поражение мио-
карда отмечается без четкой предрасположенности
к определенной локализации [29]. Фибросаркомы,
гистиосаркомы и остеосаркомы представляют со-
бой гистологические подтипы сарком. Для остео-
сарком характерной локализацией является место
впадения легочных вен, с возможным распростра-
нением опухолевого процесса в эти сосуды, что воз-
можно визуализировать при ЧПЭхоКГ [3].
ПЕРВИЧНЫЕ ЗЛОКАЧЕСТВЕННЫЕ
ОПУХОЛИ СЕРДЦА
Первичные злокачественные опухоли встречают-
ся редко. Метастазирование или вторичные злока-
чественные опухоли, однако, выявляются в 30 раз
чаще. Лишь около 15% первичных опухолей серд-
ца представляют собой злокачественные новооб-
разования. Большинство (95%) первичных злока-
чественных опухолей сердца являются саркомами,
остальные 5% составляют первичные лимфомы и
мезотелиомы сердца [53].
САРКОМА
Саркомы сердца наиболее часто диагностируют в
возрасте от 30 до 50 лет, выявляются с одинаковой
частотой у мужчин и женщин. Опухоль может по-
ражать любой отдел сердца, однако наиболее часто
определяется в левых отделах сердца, особенно в
ЛП. Прогноз заболевания неблагопрятный, опухо-
левый процесс быстро прогрессирует, смерть раз-
вивается в результате обширной локальной ин-
фильтрации, внутриполостной обструкции или ме-
тастазирования, которое часто выявляется уже при
первичной постановке диагноза. Диагностика сар-
ком требует проведения гистологического исследо-
вания, т.к. ЭхоКГ признаки недостаточно специ-
фичны для неинвазивной оценки опухолей различ-
ной гистологической структуры (рис. 42.14, 42.15).
Кроме того, в настоящее время не существует убе-
дительных доказательств, что гистологическая клас-
сификация сарком имеет какое-либо влияние на ис-
ход или лечение [54, 55].
Рис. 42 .13 Параганглиомы сердца. (А) ТТЭхоКГ в субкостальной позиции демонстрирует в полости перикарда эхогенное, овальной формы образование (стрел-
ка) размером 6 см на 5 см с четкими контурами, прилегающее к правой атриовентрикулярной борозде, без распространения в область правого предсердия (ПП).
Сопутствующей перикардиальной жидкости не обнаружено. (Б) ТТЭхоКГ в парастернальной позиции по короткой оси (другой пациент). Образование (стрелка)
прилежит к аортальному клапану (АК), ниже дуги аорты, и фиксировано к левой легочной артерии. Данные локализации характерны для этой редкой опухоли.
ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
ПП
ЛП
ЛЖ
ПЖ
ПП
ПЖ
ЛП
АК
А
Б
ch42_условно.indd 1096
03.04.2019 12:16:31
1097
42 Опухоли сердца
де полиповидных образований на поверхности эн-
докарда. ЭхоКГ отличается высокой чувствительно-
стью в идентификации лимфомы, но для уточнения
диагноза нужно цитологическое подтверждение [57].
МЕЗОТЕЛИОМА
Мезотелиома перикарда — это злокачественная
опухоль перикарда, которая клинически проявляет-
ся в виде перикардита или перикардиальной жид-
кости. В некоторых случаях опухоль проявляется
характерными признаками констриктивного пери-
кардита и правожелудочковой сердечной недоста-
точности. Мезотелиомы чаще встречаются у взрос-
лых. По сравнению с мезотелиомой плевры появ-
ление данных образований не связано с асбестозом.
Хотя встречаются солитарные перикардиальные ме-
зотелиомы, в большинстве случаев они покрыва-
ют большую часть париетального и висцерального
листков перикарда, сдавливая сердце. Опухоль ха-
рактеризуется лишь поверхностным поражение ми-
окарда, что отличает мезетелиому от сарком. Мето-
ды КТ и МРТ позволяют оценить размер опухоле-
вого образования и степень вовлечения миокарда.
ПЕРВИЧНАЯ ЛИМФОМА
Для постановки диагноза первичной лимфомы
сердца необходимо выполнение двух условий:
1. Отсутствии лимфомы снаружи перикарда (по
результатам аутопсии).
2. Выявлении основной массы опухоли в полости
перикарда, связи кардиальных симптомов с лим-
фоматозной инфильтрацией при первичной ди-
агностике.
Несмотря на крайне редкое выявление (1% пер-
вичных опухолей сердца, согласно серии отчетов
Armed Forces Institute of Pathology), частота слу-
чаев лимфомы увеличивается из-за лимфопроли-
феративных заболеваний, связанных с вирусны-
ми инфекциями (вирус Эпштейна–Барр и ВИЧ),
у больных с иммунной недостаточностью после
трансплантации. Обычно лимфома диагностиру-
ется в четвертой декаде жизни, незначительно чаще
у мужчин. Опухоль может поражать любые отделы
сердца, включая перикард. Лимфома в некоторых
наблюдениях характеризуется внутриполостным
ростом и приводит к обструкции. Опухолевое пора-
жение может проявляться в виде узлов и редко в ви-
Рис. 42.14 Биопсия опухоли под контролем эхокардиографии. Женщина 33 лет с жалобами на боль в груди. (А) A ТТТЭхоКГ, апикальная четырехкамер-
ная увеличенная позиция. В правом предсердии (ПП) видны образование неправильной формы (стрелка) и перикардиальная жидкость вокруг правого желудочка
(ПЖ). (Б) При ЧПЭхоКГ визуализируется то же образование (стрелки). Отмечается патологическое уплотнение стенки ПП и области атриовентрикулярной бороз-
ды. (В) Внутрисердечная ЭхоКГ во время чрескожного дренажа перикардиальной жидкости и биопсии опухоли. Ультразвуковой датчик расположен в полости ПП.
(Г) A Визуализация биоптома (стрелка) позволяет избежать повреждения тонкой стенки ПП. При гистологическом исследовании диагностирована ангиосаркома.
ЛЖ — левый желудочек; ЛП — левое предсердие; О — опухоль.
ЛП
ЛЖ
ПЖ
ПП
О
ПП
О
ПЖ
ЛЖ
ЛП
Перикардиальная
жидкость
Перикардиальная
жидкость
А
Б
Г
В
ch42_условно.indd 1097
03.04.2019 12:16:32
1098 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 42 .15 Саркома. Результаты исследования 48-летнего мужчины с прогрессирующей одышкой и обмороками (представлен неоперабельный случай опухоли
сердца). (А) ТТЭхоКГ, парастернальная позиция по длинной оси. Образование (белая стрелка) в полости левого желудочка (ЛЖ) видно плохо, но выявляются
значительные объемы плевральной жидкости и перикардиальной жидкости (красная стрелка). (Б) При ТТЭхоКГ в парастернальной позиции по короткой оси хо-
рошо видны большое (4 см на 2 см на 2 см) многодольчатое внутриполостное образование (белая стрелка) и перикардиальная жидкость (красные стрелки). По-
надобился срочный перикардиоцентез, поскольку развилась тампонада сердца. В общей сложности удалено 800 мл геморрагической жидкости. Наличие гемор-
рагической жидкости характерно для злокачественного поражения. (В) Увеличенное изображение в 2D-режиме подвижного внутрижелудочкового образования
(стрелка), растущего из верхушки ЛЖ. (Г) Трехмерная реконструкция внутрижелудочкового образования (стрелка). При КТ всего тела обнаружено распространен-
ное метастазирование. ПЖ — правый желудочек [Bruce CJ. Cardiac tumours: diagnosis and management. Heart 97:151–160, 2011].
ПЖ
ЛЖ
ЛЖ
ЛЖ
ЛЖ
Плевральная
жидкость
А
Б
Г
В
ch42_условно.indd 1098
03.04.2019 12:16:32
1099
42 Опухоли сердца
МЕТАСТАТИЧЕСКИЕ ЗЛОКАЧЕСТВЕННЫЕ
ОПУХОЛИ СЕРДЦА
По сравнению с первичными опухоли сердца мета-
статические злокачественные неоплазмы имеют зна-
чительно большее распространение. Среди всех ау-
топсий частота случаев составляет около 4% и до-
стигает 20% у больных, умерших от злокачественных
новообразований [58, 59]. Злокачественные опухоли
могут распространяться в область сердца следую-
щим образом: имплантационное распространение,
что обычно наблюдается при опухолях средостения,
гематогенное распространение, лимфогенное рас-
пространение и внутрипросветное внутривенное
распространение по нижней полой вене [60]. Харак-
тер метастатического поражения может быть ло-
кальным или диффузным. Узловые формы могут
выявляться в виде скрытых локализаций или рас-
пространяться на эпикардиальную поверхность
сердца. Выявление перикардиальной жидкости или
тампонады сердца может быть первым проявлени-
ем метастатического поражения сердца. Определить
тип метастатического поражения с помощью неин-
вазивных методов исследования достаточно слож-
но. Правильной диагностике помогает тщательное
изучение анамнеза заболевания и динамики первич-
ного опухолевого очага [56].
ИМПЛАНТАЦИОННОЕ РАСПРОСТРАНЕНИЕ
Большинство вторичных опухолей сердца развива-
ются вблизи опухолей грудной полости, с наиболь-
шей частотой встречаются при раке молочной желе-
зы, легких и карциноме пищевода. Начальные кли-
нические проявления метастатических опухолей
обычно являются результатом поражения перикар-
да, наиболее распространенным эхокардиографи-
ческим признаком которых является перикардиаль-
ная жидкость, в некоторых случаях с тампонадой
сердца.
ГЕМАТОГЕННОЕ РАСПРОСТРАНЕНИЕ
Метастазирование сердца обычно происходит гема-
тогенным путем с одинаковой частотой поражения
правых и левых отделов. В 90% случаев метастази-
рование протекает бессимптомно [29].
Злокачественная меланома менее распространена
по сравнению с карциномой легких или молочной
желез, однако она отличается высоким уровнем ме-
тастазирования в сердце и составляет 50% всех слу-
чаев метастатического поражения сердца по данным
аутопсии. Помимо этого, в настоящее время выяв-
ляется еще большее число случаев поражения серд-
ца, связанное с увеличением частоты развития мела-
номы и повышением выживаемости. При меланоме
может происходить поражение любой полости или
структуры сердца, но в большинстве случаев мета-
стазы локализуются в миокарде, поражение клапа-
нов происходит достаточно редко (рис. 42.16). Glancy
и Roberts [61] обнаружили метастатическое пораже-
ние сердца в 45 из 70 случаев меланомы. В большин-
стве случаев это были множественные небольшие
метастазы по всему сердцу, чаще всего с поражением
ПП. Внутриполостные метастазы при злокачествен-
ной меланоме составляют большинство опублико-
ванных случаев и обычно выявляются случайно. У
больных, имеющих в анамнезе меланому, с карди-
альными симптомами поражение сердца можно об-
Рис. 42 .16 Метастатическая меланома перикарда. (А) ТТЭхоКГ в четырехкамерной апикальной позиции. Виден уплотненный перикард вокруг левого желу-
дочка (ЛЖ) с неровными контурами и неоднородной структурой (белая стрелка). Определяются перикардиальная жидкость от умеренного до выраженного объ-
ема вокруг правого желудочка (ПЖ) и правого предсердия (ПП) (красная стрелка) и большой объем плевральной жидкости (желтая стрелка). (Б) ЧПЭхоКГ муж-
чины 72 лет с жалобами на утомляемость, имеющего в анамнезе меланому. Определяется полиповидная опухоль (О) размером 4 см на 6 см в области ПП, про-
лабирующая в полость ПЖ. Опухоль не фиксируется к межпредсердной перегородке, что отличает данное образование от миксомы, и не проникает из нижней
полой вены (не отображено). Во время операции обнаружена опухоль черного цвета, при гистологическом исследовании подтвержден диагноз «метастатическая
меланома». ЛП — левое предсердие; МЖП — межжелудочковая перегородка.
ЛЖ
ЛП
ПЖ
ЛЖ
МЖП
О
А
Б
ch42_условно.indd 1099
03.04.2019 12:16:34
1100 ЧАСТЬ VII Сосудистые и системные заболевания
Рис. 42 .17 Метастатическая карциноидная опухоль с необычным поражением сердца. (А) В апикальной четырехкамерной позиции визуализируется
связь опухоли с атриовентрикулярной бороздой, что приводит к деформации митрального фиброзного кольца и створки митрального клапана (стрелка). (Б) Па-
растернальная позиция по короткой оси на уровне базального отдела левого желудочка (ЛЖ) демонстрирует большую метастатическую опухоль в области боко-
вой стенки (стрелка). (В, Г) Трехмерное изображение этой же опухоли и ее взаимосвязь с митральным клапаном (стрелки). ЛП — левое предсердие; ПЖ — пра-
вый желудочек; ПП — правое предсердие.
ЛЖ
ЛЖ
ЛЖ
ЛЖ
ЛП
ЛП
ЛП
ПЖ
ПП
А
Б
Г
В
наружить с помощью ТТЭхоКГ или ЧПЭхоКГ, хотя
ЧПЭхоКГ больше подходит для выявления пораже-
ний небольших размеров и оценки подвижности и
места прикрепления образования. МРТ также позво-
ляет определить место интрамурального прикрепле-
ния опухоли и выявляет распространение опухоли
в примыкающие структуры средостения лучше по
сравнению с ЧПЭхоКГ. Метод также дает характер-
ные гиперинтенсивные сигналы на Т1-взвешенных
изображениях в результате парамагнитной очистки
меланином.
Злокачественное карциноидное поражение серд-
ца, которое обычно проявляется поражением кла-
панного аппарата, редко диагностируется при ме-
тастатическом поражении сердца, представленном
внутри миокардиальными образованиями. Обычно
оно происходит при наличии уже известного карци-
ноидного синдрома (рис. 42.17) [62].
ЛИМФОГЕННОЕ РАСПРОСТРАНЕНИЕ
Многие пациенты с метастазами в сердце при лим-
фоме или лейкозе имеют сопутствующее пораже-
ние медиастинальных лимфатических узлов. За-
медление потока лимфы является причиной ре-
троградного распространения опухоли. Лимфомы
образуют скрытые эндомиокардиальные дополни-
тельные образования, которые обычно клинически
не проявляются. Они также могут выглядеть как об-
разования клапанов (рис. 42.18).
ВНУТРИПРОСВЕТНОЕ ВНУТРИВЕННОЕ РАСПРОСТРАНЕНИЕ
Распространение опухоли может происходить по
кровеносным сосудам сердца. Метастазирование
правых полостей сердца при опухолях брюшной по-
лости происходит по нижней полой вене. Таким об-
разом происходит поражение сердца следующими
типами опухолей: рак почки, надпочечников, пече-
ночно-клеточный рак и лейомиосаркома матки. Из
них наибольшее распространение имеет рак почки.
Эти опухоли обычно проявляются в виде больших
вытянутых дополнительных образований внутри
просвета нижней полой вены или происходящих из
нее и выступают в полость ПП, иногда распростра-
няясь до ПЖ [3] (рис. 42.19). Эти внутрипросветные
опухоли отличаются от простых тромбов, т.к . име-
ют гораздо больше «опухолеподобных» признаков и
ch42_условно.indd 1100
03.04.2019 12:16:35
1101
42 Опухоли сердца
обычно выглядят как длинные тонкие вытянутые ве-
нозные слепки сосудов.
С целью диагностики метастазирования приме-
няется ЧПЭхоКГ, метод обеспечивающий превос-
ходную визуализацию путей венозного притока к
сердцу. ЧПЭхоКГ применяется для мониторирова-
ния операции с полной резекцией единым блоком
внутрипросветной опухоли и образования брюш-
ной полости, а также для исключения интраопера-
ционной опухолевой эмболии [3]. В редких случаях
наблюдается прорастание опухоли через открытое
овальное окно, что имитирует подвижный тромб.
При внутрипросветной внутривенной лейомио-
саркоме характерным признаком является выявле-
ние многочисленных точек фиксации образования
к нижней полой вене, что позволяет дифференциро-
вать эти опухоли от рака почек или гепатомы. Рак
щитовидной железы характеризуется распростране-
нием опухолевого процесса вдоль верхней полой ве-
ны в полость ПП, при раке легких также может про-
исходить метастазирование внутрипросветным пу-
тем в ЛП по легочным венам.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При возникновении подозрений на опухоль важно
учесть всю клиническую информацию, например
возраст и предыдущий анамнез злокачественного
образования, а также все ЭхоКГ. Наиболее частой
причиной внутрисердечного образования являет-
ся тромб, за которым по частоте следуют вегетации.
Первичные опухоли сердца встречаются редко, ме-
Рис. 42 .18 Лимфома. Мужчине, 57 лет, с неходжкинской лимфомой в анамнезе был поставлен диагноз «ходжкинская лимфома». На ТТЭхоКГ перед химиоте-
рапией было выявлено внутрисердечное образование, поэтому была выполнена ЧПЭхоКГ. (А) На двухмерной ЧПЭхоКГ хорошо видна опухоль (стрелка), на трех-
мерной ЧПЭхоКГ можно оценить ее объем, форму и широкое основание, на котором она крепится к передней створке митрального клапана (ПСМК). (Б) На трех-
мерном изображении митральный клапан виден сверху (взгляд со стороны хирурга), стрелка указывает на отверстие митрального клапана. (В) Биопсия опухоли
подтвердила узловую склерозирующую лимфому Ходжкина. ЛЖ — левый желудочек; ЛП — левое предсердие.
ЛЖ
ЛП
ПСМК
А
Б
В
Рис. 42 .19 A Почечно-клеточный рак. Примеры типичного венозного распространения опухолевого тромба из почки в нижнюю полую вену (НПВ), что харак-
терно для гипернефромы (почечно-клеточный рак). В просвете НПВ (стрелка, слева) виден сложный опухолевый тромб. Наибольшее дистальное распростране-
ние опухоли — 2 см проксимальнее начала печеночной вены (ПВ). У данного пациента внутрисердечная опухоль не обнаружена. На изображении справа показа-
но проникновение опухоли из НПВ в полость правого предсердия (ПП) (стрелка). Обе опухоли были успешно удалены при кавотомии под контролем интраопера-
ционной ЧПЭхоКГ. ЧПЭхоКГ подтвердила полное удаление опухолевого тромба без эмболизации. ПЖ — правый желудочек.
ПВ
НПВ
ПП
ПЖ
ch42_условно.indd 1101
03.04.2019 12:16:35
1102 ЧАСТЬ VII Сосудистые и системные заболевания
тастатическое поражение сердца обычно происхо-
дит при ранее диагностированной злокачественной
опухоли. Опухоль сердца нередко подозревается,
когда определяется дополнительное образование, в
действительности представляющее необычную то-
мографическую проекцию нормальной структуры
сердца или нормального варианта анатомическо-
го строения сердца. Важно отличать эти особенно-
сти от опухолей сердца. В табл. 42.7 представлены
самые распространенные нормальные структуры
или варианты нормального строения сердца, кото-
рые часто путают с патологическими образования-
ми или опухолями.
Помимо истории болезни, ЭхоКГ также имеет
важное значение в определении этиологии допол-
нительного образования. Тромбы и вегетации име-
ют характерные эхокардиографические признаки,
также их можно дифференцировать друг от друга
и от других сердечных образований по определен-
ной локализации (например, ушко ЛП или верхуш-
ка ЛЖ при тромбах, створки клапана при вегета-
циях) и факторам риска (например, фибрилляция
предсердий, увеличение ЛП, порок митрально-
го клапана, клапанная деструкция и бактериемия).
Тромбы редко встречаются изолированно, тром-
боз ЛЖ обычно наблюдается у больных с ишеми-
ческой болезнью сердца при наличии акинезии или
дискинезии миокарда, с локализацией в аневризме
верхушечной области и сопутствующей дисфунк-
цией ЛЖ. Тромбы в предсердии обычно возникают
в ушке ЛП у пациентов с фибрилляцией предсер-
дий, пороками митрального клапана и увеличени-
ем полости ЛП. В некоторых случаях определяются
дополнительные признаки замедления кровотока,
такие как спонтанное эхоконтрастирование и сни-
жение скорости изгнания крови из ушка ЛП. Для
дифференциальной диагностики тромба и опухоли
проводятся повторные эхокардиографические ис-
следования до и после проведения антикоагулянт-
ной терапии. Тромбы обычно рассасываются по-
сле 4-недельного курса антикоагулянтной терапии,
опухоли при повторном исследовании либо увели-
чиваются в размерах, либо остаются без изменений
(рис. 42.20).
Вегетации также могут имитировать опухоль
сердца. Однако, за исключением папиллярных фи-
броэластом, первичные опухоли клапанов сердца
встречаются крайне редко. Вегетации выглядят как
подвижные эхогенные дополнительные образова-
ния на створках клапана, которые обычно диагно-
стируются у пациентов с уже известным или по-
дозреваемым пороком сердца и бактериемией. В
редких случаях, когда вегетации определяются в от-
сутствие бактериемии, другие изменения, такие как
хронический полиартрит, могут свидетельствовать
об эндокардите Либмана–Сакса. Вегетации на кла-
панах сердца при эндокардите обычно сопровожда-
ются признаками клапанной деструкции и разви-
тием регургитации. Неклапанные вегетации могут
локализоваться в зонах турбулентности потока, с
местом прикрепления к эндокардиальной поверх-
ности желудочка у пациентов с гипертрофической
обструктивной кардиомиопатией или септальными
дефектами.
Инфильтративные нарушения, затрагивающие
сердце, часто симулируют опухолевый процесс
сердца. К ним относится поражение сердца при сар-
коидозе, гранулематозе Вегенера [63], гиперэозино-
фильном синдромоме [64] и туберкулезе. К специ-
Нормальные структуры или варианты
нормального строения сердца
Правое предсердие
Пограничный гребень
Евстахиева заслонка
Сеть Киари
Левое предсердие
Ткани, отделяющие левую верхнюю легочную вену от ушка
левого предсердия (Q-тип, «ватная палочка»)
Правый желудочек
Модераторный пучок
Левый желудочек
Папиллярные мышцы
Дополнительные патологические образования сердца
Внутрисердечные
Тромбы
Клапаны
Вегетации (инфицированные и марантические)
Наложения Ламбла
Флотирующая или пролабирующая створка
Повреждение митрального клапанного аппарата после
протезирования
Жировые отложения в области фиброзного кольца трику-
спидального клапана
Кальцификация фиброзного кольца митрального клапана
Миокард
Асимметричная гипертрофия желудочка
Некомпактный миокард левого желудочка
Гиперэозинофильный синдром
Межпредсердная перегородка
Липоматозная гипертрофия
Аневризма межпредсердной перегородки
Экстракардиальные
Сдавление левого предсердия аортой
Аневризма или фистула коронарной артерии
Потенциальное пространство борозды поперечного синуса
Ателектаз левой нижней доли легкого
Гематома
Грыжа пищеводного отверстия диафрагмы
Жировая инфильтрация перикарда
Опухоль средостения
Внутрисердечные устройства
Искусственный водитель ритма
Катетер легочной артерии
Центральный катетер
ТАБЛИЦА 42.7 Эхокардиографические находки,
имитирующие опухоли сердца
ch42_условно.indd 1102
03.04.2019 12:16:36
1103
42 Опухоли сердца
Рис. 42 .20 A Внутрисердечный тромб. У данного пациента митральный
стеноз проявлялся похолоданием и болью в руке. На трехмерной ЧПЭхоКГ вы-
является образование в левом предсердии. Наличие тонкой ножки, место при-
крепления (межпредседная перегородка) и точная локализация позволяют по-
думать о миксоме. Из-за эмболии в анамнезе и подвижности образования па-
циент был экстренно направлен на операцию. На основании гистологичесских
данных был подтвержден тромб. Этот случай подчеркивает, что наиболее ча-
сто за образование сердца на ЭхоКГ можно принять тромбы.
фическим патологическим изменениям сердца, ко-
торые путают с опухолями сердца [65], относятся
варикоз, фистула коронарных артерий [66], анев-
ризма коронарных артерий [66, 67], аневризма меж-
предсердной перегородки [68, 69], интрамиокарди-
альная гематома после чрескожного вмешательства
[69], кровяная киста и киста перикарда.
Нормальные структуры сердца, которые потен-
циально могут имитировать опухоль: пограничный
гребень (рис. 42.21), евстахиева заслонка, сеть Киари,
липоматозная гипертрофия межпредсердной пере-
городки, ткани между левой верхней легочной ве-
ной и ушком ЛП, визуализируемые при ЧПЭхоКГ и
называемые «ватной палочкой» (Q-тип). Даже диа-
фрагмальная грыжа может быть принята за опухоль
сердца. Грыжу легко идентифицировать, если дать
пациенту выпить газированный напиток, сделать
рентгеновский снимок и подтвердить наличие пу-
зырьков газа в желудке. Знание нормальных анато-
мических структур сердца и нормальных вариантов
строения сердца имеет большое значение для того,
чтобы избежать ненужных дополнительных иссле-
дований, биопсии или оперативных вмешательств
(см. табл. 42.7).
Рис. 42 .21 Пограничный гребень. (А) A В апикальной четырехкамерной позиции в правом предсердии (ПП) определяется гиперэхогенное шаровидной фор-
мы дополнительное образование. (Б) Дополнительное образование (стрелка) в режиме «Масштабирование». (В) При ЧПЭхоКГ из среднего отдела пищевода (0°)
структура хорошо визуализируется. (Г) A После поворота датчика до 90° образование (стрелка) видно в продольном сечении (картина, характерная для погра-
ничного гребня). ВПВ — верхняя полая вена; ЛП — левое предсердие; ПЖ — правый желудочек.
ЛП
ЛП
V
V
ЛП
ПЖ
ПЖ
ВПВ
А
Б
Г
В
ch42_условно.indd 1103
03.04.2019 12:16:36
1104 ЧАСТЬ VII Сосудистые и системные заболевания
РУКОВОДСТВО ПО ПРОЦЕДУРЕ
С точки зрения диагностики и лечения ЭхоКГ не
только играет важную роль среди инвазивных про-
цедур во время диагностической биопсии дополни-
тельных образований сердца, но также имеет важное
значение в диагностическом дренировании предпо-
лагаемой злокачественной перикардиальной жид-
кости. Открытая торакотомия, экстракорпоральное
кровообращение и резекция или открытая биопсия
остаются диагностическим стандартом при опухо-
лях сердца [70–72]. Однако для больных с поражени-
ем (чаще злокачественным) правых отделов сердца,
находящихся в тяжелом состоянии, имеющих неопе-
рабельные опухоли и нуждающихся в диагностиче-
ской биопсии перед химиотерапией, ЧП ЭхоКГ или
интракардиальная ЭхоКГ позволяют определить не-
обходимость в проведении чрескожной биопсии. Ви-
зуализация в режиме реального времени повыша-
ет безопасность выполнения биопсии, снижает риск
случайного повреждения окружающих структур и
способствует повышению эффективности диагно-
стики при направлении биоптома к опухолевой тка-
ни по сравнению с использованием только рентгено-
скопии. При наличии перикардиальной жидкости
ТТЭхоКГ дополняет чрескожный перикардиоцен-
тез. Данная методика проведения процедуры хоро-
шо известна, она не только повышает безопасность,
но также позволяет дать быструю оценку гемодина-
мики после пункции полости перикарда и динамику
изменений после дренажа перикарда.
Интраоперационная ЧПЭхоКГ представляет со-
бой важный метод исследования при хирургическом
вмешательстве. Согласно отчету клиники Mayo, при
операции на сердце, в основном резекции опухоли,
интраоперационная ЧПЭхоКГ предоставила важ-
ную диагностическую информацию, которая при-
вела к изменению хода операции (до и после ис-
кусственного кровообращения) в 16% случаев. Ряд
исследований подтвердил важность выявления опу-
холи непосредственно перед хирургическим разре-
зом кожи во избежание ненужной операции по по-
воду опухоли, которая может эмболизировать в
период между обнаружением образования и хирур-
гическим вмешательством [73].
Опухоли сердца встречаются редко. К дополнительным внутрисердечным образованиям чаще относятся тромбы и вегетации.
Три четверти первичных опухолей сердца являются доброкачественными
Папиллярные фиброэластомы — самые часто встречающиеся доброкачественные опухоли сердца. Определяются в виде неболь-
ших подвижных образований на ножке, подобных анемоне, с ворсинчатым краем. Обычно крепятся на клапанах сердца
Миксома — вторая по распространенности доброкачественная первичная опухоль сердца, возникает спорадически, в виде изо-
лированной опухоли левого предсердия, обычно фиксированной в области овальной ямки с помощью короткой ножки. Мно-
жественные опухоли или атипичная локализация предполагают наличие семейной формы миксомы
Липоматозную гипертрофию межпредсердной перегородки можно спутать с внутрисердечной опухолью, что связано с гантеле-
образной формой межпредсердной перегородки и характерным отсутствием изменений в области мембраны овальной ямки.
Диагноз подтверждается данными МРТ или КТ
Рабдомиома — наиболее распространенная неоплазия сердца у детей. В большинстве случаев встречаются множественные опу-
холи, развиваются в левом и правом желудочках, характеризуются спонтанным уменьшением размеров у большинства детей
младше 4 лет. Рабдомиомы наблюдаются у 50% младенцев с туберозным склерозом
Фиброма сердца является наиболее удаляемой опухолью сердца у детей. Обычно представляет собой одиночное, с четкими гра-
ницами образование с локализацией в желудочках сердца
Только 15% первичных опухолей сердца являются злокачественными, большинство (95%) из которых представляют саркомы.
Саркома не имеют характерных эхокардиографических проявлений, чаще выявляется в полости правого предсердия. Отлича-
ется распространенным инфильтративным ростом и неблагоприятным течением заболевания
Вторичные злокачественные опухоли сердца или метастатическое поражение встречаются в 30 раз чаще по сравнению с первич-
ными новообразованиями. Вторичные опухоли могут распространяться в сердце с помощью прямого контакта, гематогенным,
лимфогенным и внутрипросветным путем. Злокачественная меланома имеет наибольшую частоту метастатического пора же-
ния сердца. Метастазирование сердца при раке почки чаще наблюдается по нижней полой вене
При возникновении подозрений на наличие новообразования сердца важно объединить все клинические данные, чтобы поста-
вить правильный диагноз неинвазивным методом
КТ — компьютерная томография; МРТ — магнитно -резонансная томография.
СВОДНАЯ ИНФОРМАЦИЯ
Практический подход
ch42_условно.indd 1104
03.04.2019 12:16:37
1105
42 Опухоли сердца
ЛИТЕРАТУРА
1. Lam KY, Dickens P, Chan AC. Tumors of the
heart. A 20-year experience with a review of
12,485 consecutive autopsies, Arch Pathol Lab
Med 117:1027–1031, 1993.
2. Reynen K. Frequency of primary tumors of
the heart, Am J Cardiol 77:107, 1996.
3. Goldman JH, Foster E. Transesophageal echo-
cardiographic (TEE) evaluation of intracar-
diac and pericardial masses, Cardiol Clin
18:849–860, 2000.
4. Gowda RM, Khan IA, Nair CK, et al. Cardiac
papillary fibroelastoma: a comprehensive
analysis of 725 cases, Am Heart J 146:404–410,
2003.
5. Piazza N, Chughtai T, Toledano K, et al. Pri-
mary cardiac tumours: eighteen years of
surgical experience on 21 patients, Can J Car-
diol 20: 1443–1448, 2004.
6. Araoz PA, Mulvagh SL, Tazelaar HD, et al. CT
and MR imaging of benign primary cardiac
neoplasms with echocardiographic correla-
tion, Radiographics 20:1303–1319, 2000.
7. Tatli S, Lipton MJ. CT for intracardiac throm-
bi and tumors, Int J Cardiovasc Imaging 21:
115–131, 2005.
8. Tamin SS, Maleszewski JJ, Scott CG, et al.
Prognostic and bioepidemiologic implica-
tions of papillary fibroelastomas, J Am Coll
Cardiol 65:2420–2429, 2015.
9. Colucci WS. Primary tumors of the heart, , ed
6, Philadephia, 2001, WB Saunders.
10. Vander Salm TJ. Unusual primary tumors of
the heart, Semin Thorac Cardiovasc Surg 12:
89–100, 2000.
11. Elbardissi AW, Dearani JA, Daly RC, et al.
Embolic potential of cardiac tumors and out-
come after resection: a case-control study,
Stroke 40:156–162, 2009.
12. Parissis JT, Zezas S, Sfiras N, Kastellanos S.
An atypical left atrial myxoma causing intra-
cavitary pressure gradient and typical dia-
stolic transmitral flow of severe mitral steno-
sis, Int J Cardiol 102:165–167, 2005.
13. Leibowitz G, Keller NM, Daniel WG, et al.
Transesophageal versus transthoracic echo-
cardiography in the evaluation of right atrial
tumors, Am Heart J 130:1224–1227, 1995.
14. McAllister Jr. HA. Primary tumors of the
heart and pericardium, Pathol Ann 14 Pt 2:
325–355, 1979.
15. Burke A. Tumors of the heart and great vessels,
Washington, DC, 1996, Armed Forces Insti-
tute of Pathology.
16. Sun JP, Asher CR, Yang XS, et al. Clinical and
echocardiographic characteristics of papillary
fibroelastomas: a retrospective and prospec-
tive study in 162 patients, Circulation 103:
2687–2693, 2001.
17. Elbardissi AW, Dearani JA, Daly RC, et al.
Survival after resection of primary cardiac
tumors: a 48-year experience, Circulation 118
(14 Suppl):S7–15, 2008.
18. Bottio T, Basso C, Rizzoli G, et al. Case report:
fibroelastoma of the papillary muscle of the
mitral valve: diagnostic implications and re-
view of the literature, J Heart Valve Dis 11:
288–291, 2002.
19. Fabricius AM, Heidrich L, Gutz U, Mohr FW.
Papillary fibroelastoma of the tricuspid valve
chordae with a review of the literature, Car-
diovasc J S Afr 13:122–124, 2002.
20. Kanarek SE, Wright P, Liu J, et al. Multiple
fibroelastomas: a case report and review of
the literature, J Am Soc Echocardiogr 16:373–
376, 2003.
21. Daveron E, Jain N, Kelley GP, et al. Papillary
fibroelastoma and Lambl’s excrescences: echo-
cardiographic diagnosis and differential diag-
nosis, Echocardiography 22:461–463, 2005.
22. Lambl V. Papillare excrescenzen an der
semilunar-klappe der aorta, Wien Med Wochen-
schr 6:244–247, 1856.
23. Okada K, Sueda T, Orihashi K, et al. Cardiac
papillary fibroelastoma on the mitral valve, J
Card Surg 16:335–337, 2001.
24. Keeling IM, Oberwalder P, Anelli-Monti M,
et al. Cardiac myxomas: 24 years of experi-
ence in 49 patients, Eur J Cardiothorac Surg
22:971–977, 2002.
25. Kuon E, Kreplin M, Weiss W, Dahm JB. The
challenge presented by right atrial myxoma,
Herz 29:702–709, 2004.
26. Selkane C, Amahzoune B, Chavanis N, et al.
Changing management of cardiac myxoma
based on a series of 40 cases with long-term
follow-up, Ann Thorac Surg 76:1935–1938,
2003.
27. Akbarzadeh Z, Esmailzadeh M, Yousefi A, et
al. Multicentric familial cardiac myxoma, Eur
J Echocardiogr 6:148–150, 2005.
28. Edwards A, Bermudez C, Piwonka G, et al.
Carney’s syndrome: complex myxomas. Re-
port of four cases and review of the literature,
Cardiovasc Surg 10:264–275, 2002.
29. Shapiro LM. Cardiac tumours: diagnosis and
management, Heart 85:218–222, 2001.
30. Szucs RA, Rehr RB, Yanovich S, Tatum JL.
Magnetic resonance imaging of cardiac rhab-
domyosarcoma. Quantifying the response to
chemotherapy, Cancer 67:2066–2070, 1991.
31. Pinede L, Duhaut P, Loire R. Clinical presen-
tation of left atrial cardiac myxoma. A series
of 112 consecutive cases, Medicine 80:159–
172, 2001.
32. Percell Jr. RL, Henning RJ, Siddique Patel M.
Atrial myxoma: case report and a review of
the literature, Heart Dis 5:224–230, 2003.
33. Acebo E, Val-Bernal JF, Gomez-Roman JJ, Re-
vuelta JM. Clinicopathologic study and DNA
analysis of 37 cardiac myxomas: a 28-year ex-
perience, Chest 123:1379–1385, 2003.
34. Perez de Isla L, de Castro R, Zamorano JL, et
al. Diagnosis and treatment of cardiac myxo-
mas by transesophageal echocardiography,
Am J Cardiol 90:1419–1421, 2002.
35. Restrepo CS, Largoza A, Lemos DF, et al. CT
and MR imaging findings of malignant car-
diac tumors, Curr Probl Diagn Radiol 34:1–11,
2005.
36. Breuer M, Wippermann J, Franke U, Wahlers
T. Lipomatous hypertrophy of the interatrial
septum and upper right atrial inflow obstruc-
tion, Eur J Cardiothorac Surg 22:1023–1025,
2002.
37. Restrepo CS, Largoza A, Lemos DF, et al. CT
and MR imaging findings of benign cardiac
tumors, Curr Probl Diagn Radiol 34:12–21,
2005.
38. Nadra I, Dawson D, Schmitz SA, et al. Lipo-
matous hypertrophy of the interatrial sep-
tum: a commonly misdiagnosed mass often
leading to unnecessary cardiac surgery, Heart
90:e66, 2004.
39. Alsaileek A, Tepe SM, Alveraz L, et al. Diagnos-
tic features of cardiac hemangioma on cardio-
vascular magnetic resonance, a case report, Int J
Cardiovasc Imaging 22:699–702, 2006.
40. McAllister HJ. Tumors of the cardiovascular
system. In Atlas tumor pathology, Washington,
DC, 1978, Armed Forces Institute of Pathology.
41. Kojima S, Sumiyoshi M, Suwa S, et al. Car-
diac hemangioma: a report of two cases and
review of the literature, Heart Vessels 18:153–
156, 2003.
42. Lapenna E, De Bonis M, Torracca L, et al.
Cavernous hemangioma of the tricuspid
valve: minimally invasive surgical resection,
Ann Thorac Surg 76:2097–2099, 2003.
43. Sarjeant JM, Butany J, Cusimano RJ. Cancer
of the heart: epidemiology and management
of primary tumors and metastases, Am J Car-
diovasc Drugs 3:407–421, 2003.
44. Perk G, Yim J, Varkey M, et al. Cardiac cav-
ernous hemangioma, J Am Soc Echocardiogr
18:979, 2005.
45. Moniotte S, Geva T, Perez-Atayde A, et al. Im-
ages in cardiovascular medicine. Cardiac hem-
angioma, Circulation 112:e103–e104, 2005.
46. Freedom RM, Lee KJ, MacDonald C, Taylor G.
Selected aspects of cardiac tumors in infancy and
childhood, Pediatr Cardiol 21:299–316, 2000.
47. Kagan KO, Schmidt M, Kuhn U, Kimmig R.
Ventricular outflow obstruction, valve apla-
sia, bradyarrhythmia, pulmonary hypoplasia
and non-immune fetal hydrops because of a
large rhabdomyoma in a case of unknown
tuberous sclerosis: a prenatal diagnosed car-
diac rhabdomyoma with multiple symptoms,
Bjog 111:1478–1480, 2004.
48. Grebenc ML, Rosado de Christenson ML,
Burke AP, et al. Primary cardiac and pericar-
dial neoplasms: radiologic-pathologic corre-
lation, Radiographics 20:1073–1103, 2000.
quiz 1110–1071, 1112.
49. Becker AE. Primary heart tumors in the pedi-
atric age group: a review of salient pathologic
features relevant for clinicians, Pediatr Car-
diol 21:317–323, 2000.
50. Bruce CJ. Cardiac tumours: diagnosis and man-
agement, Heart 97:151–160, 2011.
51. Gutberlet M, Abdul-Khaliq H, Stiller B, et al.
Giant fibroma in the left ventricle of an in-
fant: imaging findings in magnetic resonance
imaging, echocardiography and angiography,
Eur Radiol 12(Suppl 3):S143–148, 2002.
52. Osranek M, Bursi F, Gura GM, et al. Echocar-
diographic features of pheochromocytoma
of the heart, Am J Cardiol 91:640–643, 2003.
53. Roberts WC. Primary and secondary neoplasms
of the heart, Am J Cardiol 80:671–682, 1997.
54. Burke A. Primary malignant cardiac tumors,
Semin Diagn Pathol 25:39–46, 2008.
55. Simpson L, Kumar SK, Okuno SH, et al. Ma-
lignant primary cardiac tumors: review of a
single institution experience, Cancer 112:
2440–2446, 2008.
56. Butany J, Nair V, Naseemuddin A, et al. Car-
diac tumours: diagnosis and management,
Lancet Oncol 6:219–228, 2005.
57. Tighe DA, Anene CA, Rousou JA, et al. Pri-
mary cardiac lymphoma, Echocardiography
17:345–347, 2000.
58. Biran S, Hochman A, Levij IS, Stern S. Clinical
diagnosis of secondary tumors of the heart and
pericardium, Dis Chest 55:202, 1959.
59. Cohen GU, Perry TM, Evans JM. Neoplastic
invasion of the heart and pericardium, Ann
Intern Med 42:1238–1245, 1955.
60. Longo R, Mocini D, Santini M, et al. Unusual
sites of metastatic malignancy: case 1. Cardiac
metastasis in hepatocellular carcinoma, J Clin
Oncol 22:5012–5014, 2004.
61. Glancy DL, Roberts WC. The heart in malig-
nant melanoma. A study of 70 autopsy cases,
Am J Cardiol 21:555–571, 1968.
62. Pandya UH, Pellikka PA, Enriquez-Sarano M,
et al. Metastatic carcinoid tumor to the heart:
echocardiographic-pathologic study of 11 pa-
tients, J Am Coll Cardiol 40:1328–1332, 2002.
ch42_условно.indd 1105
03.04.2019 12:16:37
1106 ЧАСТЬ VII Сосудистые и системные заболевания
63. Herbst A, Padilla MT, Prasad AR, et al. Car-
diac Wegener’s granulomatosis masquerading
as left atrial myxoma, Ann Thorac Surg
75:1321–1323, 2003.
64. Eroglu E, Di Salvo G, Herbots L, et al. Restrictive
left ventricular filling in hypereosinophilic syn-
drome as a result of partial cavity obliteration
by an apical mass: a strain/strain rate study, J
Am Soc Echocardiogr 16:1088–1090, 2003.
65. Ker J, Van Beljon J. Diaphragmatic hernia
mimicking an atrial mass: a two-dimensional
echocardiographic pitfall and a cause of post-
prandial syncope, Cardiovasc J S Afr 15:182–
183, 2004.
66. Choi BJ, Chang HJ, Choi SY, et al. A coronary
artery fistula with saccular aneurysm mim-
icking a right atrial cystic mass, Jpn Heart J 45:
697–702, 2004.
67. Anfinsen OG, Aaberge L, Geiran O, et al.
Coronary artery aneurysms mimicking cardiac
tumor, Eur J Echocardiogr 5:308–312, 2004.
68. Pappas KD, Arnaoutoglou E, Papadopoulos
G. Giant atrial septal aneurysm simulating a
right atrial tumour, Heart 90:493, 2004.
69. Cheng HW, Hung KC, Lin FC, Wu D. Spon-
taneous intramyocardial hematoma mimick-
ing a cardiac tumor of the right ventricle,
J Am Soc Echocardiogr 17:394–396, 2004.
70. Bruce CJ, Nishimura RA, Rihal CS, et al.
Intracardiac echocardiography in the inter-
ventional catheterization laboratory: pre-
liminary experience with a novel, phased-
array transducer, Am J Cardiol 89:635–640,
2002.
71. Burling F, Devlin G, Heald S. Primary cardiac
lymphoma diagnosed with transesophageal
echocardiography-guided
endomyocardial
biopsy, Circulation 101:E179–E181, 2000.
72. Jurkovich D, de Marchena E, Bilsker M, et al.
Primary cardiac lymphoma diagnosed by
percutaneous intracardiac biopsy with com-
bined fluoroscopic and transesophageal echo-
cardiographic imaging, Catheter Cardiovasc
Interv 50:226–233, 2000.
73. Dujardin KS, Click RI, Oh JK. The role of intra-
operative transesophageal echocardiography in
patients undergoing cardiac mass removal, J Am
Soc Echocardiogr 13:1080–1083, 2000.
ch42_условно.indd 1106
03.04.2019 12:16:38
Врожденные пороки
сердца у взрослых
ЧАСТЬ
ЧАСТЬ VIII
ch43.indd 1107
03.04.2019 12:17:47
ch43.indd 1108
03.04.2019 12:17:47
1109
Эхокардиография (ЭхоКГ) — безопасный метод ис-
следования во время беременности, позволяющий
оценить состояние беременной пациентки с заболе-
ванием сердца. ЭхоКГ используют для оценки уров-
ня риска, при повторном наблюдении беременной
и диагностики возникающих во время беременно-
сти осложнений. Физиологические изменения в ходе
беременности могут имитировать заболевания серд-
ца. Трансторакальная эхокардиография (ТТЭхоКГ)
помогает провести дифференциальную диагности-
ку между этими физиологическими изменениями и
заболеванием сердца. Понимание влияния беремен-
ности на функцию сердца и связанные с этим ри-
ски, а также роли ЭхоКГ в ведении беременной с за-
болеванием сердца лежит в основе тактики лечения
данной группы пациенток. В этой главе описаны
физиологические и эхокардиографические измене-
ния во время беременности и риски, а также роль
ЭхоКГ и общие принципы лечения беременных па-
циенток с заболеваниями сердца.
ФИЗИОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
ВО ВРЕМЯ БЕРЕМЕННОСТИ
Беременность сопровождается адаптивными изме-
нениями объема циркулирующей крови (ОЦК), ко-
43 Заболевания сердца
во время беременности
CANDICE K. SILVERSIDES, MS, MD • SAMUEL C. SIU, MD, SM, MBA
Физиологические изменения
во время беременности
Объем циркулирующей крови
Общее периферическое сосудистое
сопротивление
Сердечный выброс
Данные эхокардиографии во время
нормально протекающей
беременности
Размеры полостей сердца
Скорость внутрисердечного кровотока
при допплерографии
Систолическая и диастолическая
функции левого желудочка
Интерпретация результатов
эхокардиографии во время
беременности
Риски во время беременности
Внутрисердечные шунты
Тетрада Фалло
Коарктация аорты
Аномалия Эбштейна
Транспозиция магистральных сосудов
Гемодинамика после операции Фонтена
Цианотические пороки сердца
Поражения аортального клапана
Поражения митрального клапана
Искусственные клапаны сердца
Аортопатия
Кардиомиопатия
Фетальные и неонатальные риски
Тактика лечения
Предродовой период
Роды и родоразрешение
Послеродовой период
Тактика ведения при осложнениях
Недостатки эхокардиографии
и альтернативные методы
исследования
личества эритроцитов, растяжимости перифериче-
ских сосудов и общего периферического сосудисто-
го сопротивления (ОПСС), частоты сердечных
сокращений (ЧСС) и сердечного выброса (СВ) в ор-
ганизме будущей матери (рис. 43.1) [1]. При отсут-
ствии у беременной заболеваний сердца организм
обычно хорошо переносит изменения гемодинами-
ки, однако патология сердечно-сосудистой системы
может привести к декомпенсации как у беременной,
так и у плода. Во время беременности могут впер-
вые развиться такие заболевания, как кардиомиопа-
тия, индуцированная беременностью, преэкламп-
сия и расслоение коронарных артерий.
ОБЪЕМ ЦИРКУЛИРУЮЩЕЙ КРОВИ
ОЦК начинает увеличиваться уже на 6-й неделе бе-
ременности. Пик наступает к концу II триместра бе-
ременности: ОЦК увеличивается в среднем на 50%
уровня до зачатия. В III триместре беременности
ОЦК перестает увеличиваться. Количество эритро-
цитов у беременной увеличивается в среднем на
40% исходного уровня. Вследствие более выражен-
ного увеличения объема плазмы относительно уве-
личения количества эритроцитов развивается фи-
зиологическая анемия беременных. Повышение
уровня факторов свертывания и снижение фибри-
ch43.indd 1109
03.04.2019 12:17:47
1110 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
нолитической активности способствуют возраста-
нию риска тромбоэмболии во время беременности.
ОБЩЕЕ ПЕРИФЕРИЧЕСКОЕ СОСУДИСТОЕ СОПРОТИВЛЕНИЕ
В течение I триместра беременности происходит
физиологическое увеличение ОЦК со снижением
системного артериального давления в результате
снижения ОПСС. Артериальное давление достигает
минимальных показателей в середине беременно-
сти, затем происходит его нормализация [2, 3]. По-
сле 32-й недели беременности ОПСС медленно рас-
тет до родов. В этом периоде артериальное давление
достигает уровня до зачатия либо превышает его.
СЕРДЕЧНЫЙ ВЫБРОС
СВ начинает увеличиваться уже на 5-й неделе бере-
менности и достигает максимума ближе к концу
II триместра беременности (как правило, после 24-й
недели), а затем до момента родов поддерживается
на уровне, на 30–50% превышающем таковой до за-
чатия [2, 4–6]. Раннее увеличение СВ происходит в
основном из-за повышения ударного объема (УО),
тогда как в поздние сроки беременности увеличива-
ется ЧСС без повышения УО [2, 7]. К концу бере-
менности средняя ЧСС выше исходного уровня на
10–20 уд/мин. СВ может резко уменьшиться при
сдавлении маткой нижней полой вены в положении
беременной на спине. Это устраняется в положении
беременной на левом боку.
При родах происходит дополнительное увеличе-
ние СВ, что обусловлено повышением ЧСС и УО.
Также эти показатели дополнительно повышаются
в ответ на каждое сокращение матки, причем мак-
симальное повышение наблюдается во втором пе-
риоде родов. Сразу после родоразрешения СВ мо-
жет увеличиться до уровня, на 80% превышающего
значение до родов, из-за прекращения сдавления
нижней полой вены и аутотрансфузии из плаценты.
После этого все показатели сердечно-сосудистой си-
стемы возвращаются к исходным значениям. Боль-
шинство показателей нормализуются в раннем пе-
риоде после родов, но полное восстановление мо-
жет занять до 6 месяцев [8].
Первые опубликованные данные об адаптивных
изменениях структуры и функции сердца во время
беременности касались главным образом небольших
групп пациенток без заболеваний сердца, а резуль-
таты измерений после родов расценивали как эк-
вивалент значений до зачатия. Однако согласно
данным небольшого исследования, беременные па-
циентки с заболеваниями клапанов сердца имели
более низкий СВ в сравнении с беременными, у ко-
торых не было заболевания сердца [9]. В другом ис-
следовании проспективно оценивали СВ у 127 бере-
менных с заболеванием сердца и у 45 здоровых бе-
ременных. Примечательно, что в двух группах СВ
не отличался как исходно, так и в III триместре бе-
ременности. Однако в первой группе при снижении
СВ в поздние сроки беременности отмечался повы-
шенный риск развития осложнений у новорожден-
ных [10]. Отсутствие различий в показателях СВ
двух групп в данном исследовании в сравнении с
приведенным ранее исследованием может быть
следствием менее выраженного повреждения кла-
панного аппарата в современной популяции.
ДАННЫЕ ЭХОКАРДИОГРАФИИ ВО ВРЕМЯ
НОРМАЛЬНО ПРОТЕКАЮЩЕЙ БЕРЕМЕННОСТИ
РАЗМЕРЫ ПОЛОСТЕЙ СЕРДЦА
При ЭхоКГ во время нормально протекающей бе-
ременности выявляется увеличение размеров всех
четырех полостей сердца, а также толщины и массы
стенок левого желудочка (ЛЖ) [5, 8, 11]. В табл. 43.1
представлены значения параметров структур серд-
ца в формате «среднее значение ± стандартное от-
5
Срок беременности (недели)
–40
–30
–20
–10
0
10
20
У
в
е
л
и
ч
е
н
и
е
(
%
)
30
40
50
60
СВ
УО
ЧСС
Vплазмы
САД
ДАД
Hb
ОПСС
81216202428323638
Рис. 43.1 Изменения гемодинамики во время беременности. Hb — ге-
моглобин; Vплазмы — объем плазмы; ДАД — диастолическое артериальное
давление; ОПСС — общее периферическое сосудистое сопротивление;
САД — систолическое артериальное давление; СВ — сердечный выброс;
УО — ударный объем; ЧСС — частота сердечных сокращений [Karamermer Y,
Roos-Hesselink JW. Pregnancy and adult congenital heart disease. Expert Rev Car-
diovasc Ther 5:859–869 , 2007].
ch43.indd 1110
03.04.2019 12:17:47
1111
43 Заболевания сердца во время беременности
клонение» у пациенток на поздних сроках во время
нормально протекающей беременности в сравне-
нии с показателями у небеременных пациенток и
матерей после родов. При расчете верхнего предела
95% ДИ (среднее значение + 2 стандартных откло-
нения) для диапазонов показателей во время нор-
мально протекающей беременности было обнару-
жено, что верхние значения равны умеренно ано-
мальным значениям у небеременных пациенток,
поэтому знание изменений, обусловленных бере-
менностью, минимизирует риск ложноположитель-
ной диагностики дисфункции сердца.
СКОРОСТЬ ВНУТРИСЕРДЕЧНОГО КРОВОТОКА
ПРИ ДОППЛЕРОГРАФИИ
Во время беременности наблюдается увеличение
скорости кровотока через клапаны сердца. Умень-
шение ОПСС может снизить выраженность регур-
гитации на клапанах, однако снижению сопутствует
увеличение объема плазмы. В одном исследовании
было показано, что во время беременности проис-
ходит увеличение размеров фиброзных колец ми-
трального и трикуспидального клапанов, а также
клапана легочной артерии, что может привести к
увеличению регургитации на них [12]. Однако та-
Параметры
Метод
визуализации
Среднее
значение
±SD
Срок
беременности
Контрольная
группа
Срок осмотра
контрольной
группы
Количество
беременных, автор
исследования
Площадь ВТЛЖ
(см2)
2D-ЭхоКГ
3,5 ± 0,3
36–40 -я недели 3,2 ± 0,3
После родов
n = 15, Vered [99]
Размеры ЛП (см)
ЭхоКГ
в M-режиме
3,8 ± 0,4
36–40 -я недели 3,4 ± 0,5
После родов
n = 15, Vered [99]
Площадь ЛП (см2) 2D-ЭхоКГ
18±2
32–33 -я недели 15 ± 2
Вне беременности
(n=10)
n = 51, Savu [100]
Площадь ПП (см2) 2D-ЭхоКГ
14,1 ± 3,8 III триместр
беременности
13,1 ± 1,8
После родов
n = 28, Sadaniantz
[101]
КДР ЛЖ (мм)
2D-ЭхоКГ
47±3
32–33 -я недели 44 ± 3
Вне беременности
(n=10)
n = 51, Savu [100]
КСР ЛЖ (мм)
2D-ЭхоКГ
30±3
32–33 -я недели 26 ± 2
Вне беременности
(n=10)
n = 51, Savu [100]
КДО ЛЖ (мл)
Бипланарный
метод
Симпсона
92±14
32–33-я недели 69 ± 10
Вне беременности
(n=10)
n = 51, Savu [100]
КСО ЛЖ (мл)
Бипланарный
метод
Симпсона
34±6
32–33-я недели 26 ± 5
Вне беременности
(n=10)
n = 51, Savu [100]
Толщина перего-
родки (см)
ЭхоКГ
в M-режиме
0,85 ± 0,2 36–39-я недели 0,71 ± 0,1
12 недель
после родов
n = 18, Mabie [7]
Толщина задней
стенки ЛЖ (см)
ЭхоКГ
в M-режиме
1,0 ± 0,1
36–39-я недели 0,84 ± 0,1
12 недель
после родов
n = 18, Mabie [7]
Масса ЛЖ (г)
2D-ЭхоКГ
151±27
32–33 -я недели 115 ± 30
Вне беременности
(n=10)
n = 51, Savu [100]
Индекс массы ЛЖ
(г/м2)
ЭхоКГ
в M-режиме
97±17
36–39-я недели 79 ± 9
12 недель
после родов
n = 18, Mabie [7]
Индекс сферичности 2D-ЭхоКГ
1,7 ± 0,2
32–33 -я недели 2,0 ± 0,1
Вне беременности
(n=10)
n = 51, Savu [100]
Размер фиброзного
кольца митраль-
ного клапана
2D-ЭхоКГ
2,4 ± 0,5
III триместр
беременности
2,1 ± 0,4
После родов
n = 28, Sadaniantz
[101]
Размер фиброзного
кольца трикуспи-
дального клапана
2D-ЭхоКГ
2,7 ± 3,2
III триместр
беременности
1,8 ± 0,3
После родов
n = 28, Sadaniantz
[101]
SD — стандартное отклонение; ВТЛЖ — выходной тракт левого желудочка; КДО — конечно -диастолический объем; КДР — конечно-диа-
столический размер; КСО — конечно -систолический объем; КСР — конечно -систолический размер; ЛЖ — левый желудочек; ЛП — ле-
вое предсердие; ПП — правое предсердие; ЭхоКГ — эхокардиография.
ТАБЛИЦА 43.1 Сравнение эхокардиографических параметров структур сердца у пациенток на поздних сроках
во время нормально протекающей беременности, небеременных пациенток и матерей после родов
ch43.indd 1111
03.04.2019 12:17:47
1112 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
кой вывод был сделан не во всех исследованиях. В
табл. 43.2 в формате «среднее значение ± стандарт-
ное отклонение» приведены показатели скорости
кровотока на поздних сроках во время нормально
протекающей беременности в сравнении с показа-
телями у небеременных пациенток и матерей после
родов.
СИСТОЛИЧЕСКАЯ И ДИАСТОЛИЧЕСКАЯ ФУНКЦИИ
ЛЕВОГО ЖЕЛУДОЧКА
В некоторых исследованиях описано увеличение
фракции выброса ЛЖ во время беременности [2, 5],
но в других исследованиях это опровергается [6, 13,
14]. Независимо от метода измерения скорости кро-
вотока через митральный клапан, наблюдается уве-
личение вклада левого предсердия (ЛП) в наполне-
ние ЛЖ на поздних сроках беременности, что обу-
словлено изменением растяжимости ЛЖ из-за
увеличения его размеров и массы [7, 15]. Эти изме-
нения следует воспринимать как физиологическую
адаптацию к гемодинамике на поздних сроках бере-
менности, а не как диастолическую дисфункцию.
Нормальные значения продольной деформации и
скорости деформации миокарда у беременных,
определяемые при тканевой допплерографии, обыч-
но не отличаются от таковых в стандартной попу-
ляции.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ЭХОКАРДИОГРАФИИ
ВО ВРЕМЯ БЕРЕМЕННОСТИ
Для правильной интерпретации результатов эхо-
кардиографического исследования беременных не-
обходимо в первую очередь учитывать срок бере-
менности (гестационный возраст). Например, в се-
редине беременности степень регургитации может
быть снижена в связи с уменьшением ОПСС, а к
концу беременности может значительно увеличить-
ся, т.к . ОПСС достигнет исходного уровня. Анало-
гично из-за расширения полостей сердца во время
беременности можно не заметить легкий пролапс
митрального клапана. У пациенток с заболеванием
сердца, которое может маскировать физиологиче-
ские изменения во время беременности, необходи-
мо повторно провести ЭхоКГ через 6 месяцев после
родов, когда все гемодинамические параметры нор-
мализуются.
Параметры
Метод визуализации
Среднее
значение
±SD
Срок
беременности
Контроль-
ная группа
Срок осмотра
контрольной
группы
Количество
беременных,
автор исследования
Скорость раннего
диастоличе-
ского наполне-
ния (Е) (см/сек)
Цветовая тканевая
допплерография
свободной стенки ЛЖ
12,1 ± 2,4 III триместр
беременности
14,0 ± 2,4 I триместр
беременно-
сти
n = 47, Vogt [15]
Скорость позд-
него диастоли-
ческого напол-
нения (А)
(см/сек)
Цветовая тканевая
допплерография
свободной стенки ЛЖ
6,2 ± 2,0
III триместр
беременности
5,2 ± 1,6
I триместр
беременно-
сти
n = 47, Vogt [15]
Средняя диасто-
лическая
продольная
деформация
миокарда
Цветовая тканевая
допплерография ЛЖ
на уровне его основа-
ния, середины
и верхушки
− 17,6 ± 1,5 32–33-я недели −19,1 ± 1,5 Вне беремен-
ности
(n=10)
n = 51, Savu [100]
Отношение E/A Поток через митраль-
ный клапан
1,3 ± 0,3
III триместр
беременности
1,6 ± 0,4
После родов
n = 28, Sadaniantz
[101]
Скорость крово-
тока через аор-
тальный клапан
(м/сек)
Непрерывно-волновая
допплерография
1,4 ± 0,2
36–39-я недели 1,1 ± 0,1
12 недель
после родов
n = 18, Mabie [7]
Скорость позд-
него диастоли-
ческого напол-
нения (А)
(см/сек)
Импульсно-волновая
допплерография
0,54 ± 0,11 36–39-я недели 0,46 ± 0,07 12 недель
после родов
n = 18, Mabie [7]
SD — стандартное отклонение; ЛЖ — левый желудочек.
ТАБЛИЦА 43.2 Сравнение эхокардиографических функциональных параметров у пациенток на поздних сроках
во время нормально протекающей беременности, небеременных пациенток и матерей после родов
ch43.indd 1112
03.04.2019 12:17:47
1113
43 Заболевания сердца во время беременности
РИСКИ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Все пациентки, которые имеют в анамнезе заболе-
вание сердца и планируют забеременеть, должны
предварительно проконсультироваться у кардиоло-
га. Оценку рисков должен проводить специалист,
обладающий опытом ведения беременных с сердеч-
но-сосудистыми заболеваниями (ССЗ). Консульта-
ция должна включать оценку возможных рисков
для организма беременной и влияние ee заболева-
ния сердца на здоровье плода. Для минимизации
рисков некоторым пациенткам рекомендуется про-
вести хирургическое лечение ее заболевания до за-
чатия. Также должны быть обсуждены долгосроч-
ное влияние беременности на сердце пациентки.
ЭхоКГ играет решающую роль при консультирова-
нии пациенток с патологией сердца, поскольку опре-
деление рисков зависит от тяжести и характера ос-
новного заболевания сердца, возможности выпол-
нения вмешательства до зачатия и долгосрочного
прогноза.
Помимо рисков со стороны сердечно-сосудистой
системы, необходимо учитывать и другие факторы.
Например, при назначении лекарственной терапии
беременной следует оценивать негативные воздей-
ствия применяемых препаратов на плод. Известно,
что прием беременной таких тератогенов, как алко-
голь, варфарин, гидантоин, литий и вальпроевая
кислота, связан с развитием у плода пороков сердеч-
но-сосудистой системы. В связи с этим следует пре-
кратить прием данных веществ как можно раньше
(если возможно) либо скорректировать дозы и ча-
стоту приема лекарственных средств во время бере-
менности с учетом изменений объема распределе-
ния, скорости клубочковой фильтрации и метабо-
лизма в печени. У пациенток с наследственными
заболеваниями оценка рисков должна включать ме-
дико-генетическую консультацию.
Для комплексной оценки риска во время бере-
менности необходимо учитывать общие факторы
риска и факторы риска, связанные с заболеванием
сердца. К общим факторам относят ССЗ в анамне-
зе, функцию желудочков сердца и работоспособ-
ность пациентки. При возможности следует опреде-
лить индексы стратификации риска, которые про-
гнозируют вероятность осложнений со стороны
сердечно-сосудистой системы, дополняя их факто-
рами, связанными непосредственно с заболеванием
сердца (рис. 43.2, табл. 43.3) [16–20].
Далее в этой главе подробно описаны послед-
ствия, связанные со специфическими заболевания-
ми сердца [21]. Модифицированная классификация
Всемирной организации здравоохранения (ВОЗ) объ-
единяет оценку общих и специфичных для опреде-
ленных заболеваний сердца факторов риска (табл.
43.4) [22–24]. При несоответствии общего индекса
риска и персонализированного индекса риска по
конкретному заболеванию сердца следует ориенти-
роваться на более высокий риск и планировать так-
тику его снижения.
ВНУТРИСЕРДЕЧНЫЕ ШУНТЫ
Сброс крови слева направо (от незначительного до
умеренного) через дефект межпредсердной перего-
родки (ДМПП) типа ostium secundum, рестриктив-
ный дефект межжелудочковой перегородки (ДМЖП)
или открытый артериальный проток (ОАП) могут
быть впервые обнаружены во время беременности
при выслушивании шумов в сердце. Пациентки,
имеющие значительный сброс крови, как правило,
знают о своей патологии либо перенесли в детстве
оперативное вмешательство по коррекции ВПС.
При синдроме Эйзенменгера (цианотический порок
сердца) происходит массивный сброс крови справа
налево с развитием необратимой легочной артери-
альной гипертензии. Это приводит к хроническому
течению синдрома Эйзенменгера.
У неоперированных пациенток со сбросом крови
слева направо (ДМПП типа ostium secundum, ре-
стриктивный ДМЖП, рестриктивный ОАП) обыч-
но низкий риск развития осложнений во время бе-
ременности при сохранной функции желудочков и
отсутствии признаков легочной артериальной ги-
пертензии (рис. 43.3). Изредка у данной группы па-
циентов развивается предсердная аритмия [16, 17,
21, 25, 26]. У пациенток с ДМПП и открытым оваль-
ным окном существует риск развития парадоксаль-
ной эмболии. Этому может способствовать увели-
чение сопротивления сосудов малого круга крово-
обращения или снижение сопротивления сосудов
большого круга кровообращения, что приводит к
Количество предикторов
Предсказанное
значение
Деривация
Валидация
0
0
20
40
60
80
1
>1
%
Рис. 43.2 Частота нарушений функции сердца у беременных соглас-
но шкале оценки риска CARPREG (группы деривации и валидации).
К факторам риска относят функциональный класс III или IV по NYHA, цианоз,
фракцию выброса системного желудочка ниже 40%, обструкцию левых отде-
лов сердца, болезнь сердца в анамнезе до зачатия. Каждый из факторов ри-
ска равен 1 баллу [Siu SC, Sermer M, Colman JM, et al: Prospective multicenter
study of pregnancy outcomes in women with heart disease. Circulation 104:515–
521, 2001].
ch43.indd 1113
03.04.2019 12:17:47
1114 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Факторы риска
CARPREG [16, 17] BACH [20] ZAHARA 1 [18] ROPAC [24] Shanghai [19]
Беременная
Заболевание сердца в анамнезе до зачатия Да
Да
Да
Да
Лекарственная терапия заболевания сердца
до зачатия
Да
Систолическая дисфункция ЛЖ
Да
Да
ФК III или IV по NYHA
Да
Да
Да
Да
Цианоз или насыщение кислородом < 90% Да
Да
Да
Да
Обструкция ЛЖ
Да
Да
Да
Да
Умеренная/тяжелая регургитация
на клапане легочной артерии
Да
Умеренная/тяжелая регургитация
на митральном клапане
Да
Регургитация на клапане легочной артерии
или сниженная функция ПЖ
Да
Механический искусственный клапан
Да
Соответствующие модифицированной
классификации ВОЗ
Да
Курение во время беременности
Да
Плод и новорожденный
Лекарственная терапия болезни сердца
до зачатия
Да
Обструкция ЛЖ
Да
Да
ФК III или IV по NYHA
Да
Да
Цианоз или насыщение кислородом < 90% Да
Курение во время беременности
Да
Да
Многоплодная беременность
Да
Да
Прием антикоагулянтов
Да
Механический искусственный клапан
Да
Цианотический порок сердца
Да
Соответствующие модифицированной
классификации ВОЗ
Да
Легочная артериальная гипертензия (СДЛА
≥50ммрт.ст.)
Да
BACH — Boston Adult Congenital Heart; CARPREG — Cardiac Disease in Pregnancy; NYHA — New York Heart Association; ROPAC — Registry
On Pregnancy and Cardiac Disease; ZAHARA — Zwangerschap bij vrouwen met een Aangeboren HARtAfwijking; ВОЗ — Всемирная организа-
ция здравоохранения; ЛЖ — левый желудочек; ПЖ — правый желудочек; СДЛА — систолическое давление в легочной артерии; ФК —
функциональный класс.
ТАБЛИЦА 43.3 Факторы риска развития во время беременности осложнений у беременной и плода,
у матери и новорожденного
временному сбросу крови справа налево. К более
сложным порокам относят дефект предсердно-же-
лудочковой перегородки (ДПЖП), или атриовен-
трикулярный канал. Кардиолог должен знать, что
данный порок часто сочетается с расщеплением
створок митрального клапана и обструкцией вы-
ходного тракта левого желудочка (ВТЛЖ). При об-
следовании 62 беременных с ДПЖП наблюдались
устойчивое повышение функционального класса
(ФК) по NYHA, развитие аритмий и сердечной не-
достаточности у 23, 19 и 2% пациенток соответ-
ственно [27]. При наличии внутрисердечных шун-
тов в сочетании с легочной гипертензией преобла-
дает риск, связанный с увеличением легочного
сосудистого сопротивления (см. далее).
Массивный сброс крови слева направо обычно
хорошо виден при цветовом допплеровском карти-
ровании (ЦДК) кровотока. Данное состояние харак-
ch43.indd 1114
03.04.2019 12:17:48
1115
43 Заболевания сердца во время беременности
Группа I
Риск
Неосложненный легкий либо умеренный стеноз легочной артерии
Открытый артериальный проток
Пролапс митрального клапана
Успешная коррекция простых пороков сердца (ДМПП, ДМЖП, ОАП,
частичного аномального дренажа легочных вен)
Отсутствие увеличения риска материнской смертно-
сти, отсутствие роста показателя заболеваемости.
Группа II (при отсутствии других болезней сердца)
Риск
Неоперированные ДМПП либо ДМЖП
Неоперированная тетрада Фалло
Незначительное увеличение риска материнской
смертности, увеличение роста заболеваемости
Группа II–III (индивидуально в каждом случае)
Риск
Умеренная левожелудочковая недостаточность
Пороки клапанов сердца, не относящиеся к I или IV группе
Синдром Марфана без дилатации аорты
Диаметр аорты < 45 мм при двухстворчатом аортальном клапане
Оперированная коарктация аорты
Группа III
Риск
Механический искусственный клапан
Системный правый желудочек
Гемодинамика после операции Фонтена
Неоперированный цианотический порок сердца
Другие комбинированные врожденные пороки сердца
Диаметр аорты от 40 до 45 мм при синдроме Марфана
Диаметр аорты 45–50 мм при двухстворчатом аортальном клапане
Значительное увеличение риска материнской смерт-
ности, высокая заболеваемость. Для решения
вопроса о планировании беременности нужно
заключение эксперта. Необходим кардиологиче-
ский и акушерский мониторинг во время беремен-
ности, родов и после них
Группа IV (противопоказания к беременности)
Риск
Легочная гипертензия любой этиологии
Тяжелая систолическая дисфункция левого желудочка (ФВЛЖ < 30%,
класс III–IV NYHA)
Тяжелый стеноз митрального клапана и/или аортального клапана
с клиническими проявлениями
Синдром Марфана с диаметром аорты > 45 мм
Диаметр аорты > 50 мм при двухстворчатом аортальном клапане
Неоперированная критическая коарктация аорты
Чрезвычайно высокий риск материнской смертно-
сти; беременность противопоказана. При зачатии
следует обсудить вопрос о прерывании беременно-
сти. При отказе пациентки от прерывания необхо-
дим мониторинг как при группе III
NYHA — New York Heart Association; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки;
ОАП — открытый артериальный проток; ФВЛЖ — фракция выброса левого желудочка.
[Regitz-Zagrosek V, Blomstrom Lundqvist C, Borghi C, et al. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the
Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J 32:3147–
3197, 2011.]
ТАБЛИЦА 43.4 Модифицированная классификация Всемирной организации здравоохранения риска во время беременности
Рис. 43.3 Дефект межпредсердной перегородки типа ostium secundum. ТТЭхоКГ 36-летней беременной с дефектом межпредсердной перегородки (ДМПП)
типа ostium secundum, расширенным правым желудочком (ПЖ) и высоким систолическим давлением в правом желудочке (70 мм рт. ст.). (А) К III триместру бе-
ременности систолическое давление в правом желудочке повысилось до 90 мм рт. ст., но осложнений во время беременности отмечено не было. (Б) При прове-
дении ЧПЭхоКГ обнаружен дефект межпредсердной перегородки типа ostium secundum (размер 2,4 см). После неудачной попытки закрытия дефекта эндоваску-
лярными методами пациентке выполнили открытую радикальную коррекцию. В отдаленном периоде остаточная легочная артериальная гипертензия не наблюда-
лась. ЛЖ — левый желудочек; ЛП — левое предсердие; ПП — правое предсердие.
ПЖ
ЛЖ
ПП
ЛП
ПП
ЛП
ДМПП типа
ostium secundum
А
Б
ch43.indd 1115
03.04.2019 12:17:48
1116 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
теризунтся перегрузкой объемом желудочка (дила-
тация правого желудочка (ПЖ) при ДМПП, дилата-
ция ЛЖ при ДМЖП и ОАП) либо повышением
систолического давления в легочной артерии. На
поздних сроках беременности эхокардиографиче-
ская оценка ДМПП и ДМЖП из субкостального до-
ступа может быть затруднена из-за размеров матки.
Увеличение СВ может привести к заметному уско-
рению кровотока из полых вен в правое предсердие
(ПП), в результате возможна ложноположительная
диагностика шунта на уровне предсердий. При за-
труднении визуализации из субкостального досту-
па альтернативным доступом является правый или
нижний парастернальный доступ в позиции по
длинной оси.
ТЕТРАДА ФАЛЛО
Как правило, пациентки детородного возраста с те-
традой Фалло перенесли хирургическое вмешатель-
ство в связи с этим пороком еще в детстве. У тех,
кому выполняли трансаннулярную пластику запла-
той, может быть остаточная регургитация на клапа-
не легочной артерии и связанные с этим дилатация
и дисфункция ПЖ. Некоторым пациенткам с целью
устранения регургитации имплантировали искус-
ственный клапан легочной артерии. В случае клапа-
носберегающей операции может наблюдаться оста-
точная обструкция выходного тракта правого желу-
дочка (ВТПЖ). В отдаленном периоде после операции
у пациенток возможны предсердные и, реже, желу-
дочковые аритмии. Пациентки, не оперированные
по поводу тетрады Фалло, редко могут вы
́
носить
здорового ребенка, поскольку при этой патологии,
относящейся к цианотическим порокам сердца, вы-
сок риск осложнений во время беременности.
Перегрузку объемом во время беременности
плохо переносят пациентки со значительными на-
рушениями функции ВТПЖ, дилатацией или дис-
функцией ПЖ. В соответствии со шкалами оцен-
ки риска BACH (Boston Adult Congenital Heart) и
ZAHARA (Zwangerschap bij vrouwen met een Aange-
boren HARtAfwijking), наличие регургитации на
клапане легочной артерии является независимым
предиктором неблагоприятного исхода во время бе-
ременности [20, 28].
Частота осложнений во время беременности при
тетраде Фалло варьирует в широких пределах, но
пациентки с сохранной функцией желудочков и без
значительных остаточных дефектов обычно пере-
носят беременность хорошо [29, 30]. Риск развития
аритмий во время беременности составляет 6%, а
сердечной недостаточности — 2% [28]. Пациентки,
перенесшие хирургическую коррекцию тетрады
Фалло и имеющие тяжелую регургитацию и дис-
функцию ПЖ либо стеноз легочной артерии, под-
вержены более высокому риску развития сердечной
недостаточности во время беременности [29, 30].
Дисфункция ЛЖ наблюдается у молодых пациен-
ток с тетрадой Фалло гораздо реже, но сопряжена со
значительным риском осложнений в течение бере-
менности.
Во время консультации по планированию бере-
менности или первого визита к врачу после зачатия
необходимо выполнить ТТЭхоКГ для оценки степе-
ни риска. У пациенток со значительной регургита-
цией на клапане легочной артерии важно во время
беременности регулярно оценивать размеры ПЖ и
систолическую функцию, а у пациенток с обструк-
цией ВТПЖ — градиент давления в ВТПЖ и систо-
лическое давление в ПЖ. Длительное воздействие
гемодинамических сдвигов, вызванных беременно-
стью, может ухудшить функцию ПЖ. Дилатация
ПЖ и другие неблагоприятные исходы чаще встре-
чаются у пациенток с тетрадой Фалло, имевших бе-
ременности, чем у небеременевших пациенток с
этой патологией [31–33], поэтому после родоразре-
шения следует провести эхокардиографическое ис-
следование.
КОАРКТАЦИЯ АОРТЫ
Неоперированная коарктация аорты редко наблю-
дается у молодых пациенток. Критическая коаркта-
ция аорты препятствует поступлению крови в арте-
риальное русло, расположенное дистальнее места
сужения. У пациенток с неоперированной коаркта-
цией аорты снижение перфузии во время беремен-
ности может негативно влиять на плацентарное кро-
вообращение и приводить к задержке внутриутроб-
ного развития плода и преждевременным родам.
Большинству пациенток с коарктацией аорты вы-
полняют хирургическую коррекцию либо стентиро-
вание места сужения. Однако даже после успешной
операции у данной группы пациенток часто отме-
чается постоянная либо рецидивирующая артери-
альная гипертензия. Артериальная гипертензия, со-
путствующий двухстворчатый аортальный клапан,
аневризма в месте пластики коарктации аорты —
дополнительные риски для беременной пациентки.
На современном этапе развития медицины ред-
ко регистрируют материнскую смертность среди
пациенток с коарктацией аорты, поскольку им в по-
давляющем большинстве случаев до зачатия уже
выполнена хирургическая коррекция дефекта либо
стентирование [34, 35]. Наиболее частым осложне-
нием после хирургической коррекции коарктации
аорты является артериальная гипертензия, индуци-
рованная беременностью, и преэклампсия [16, 17,
36]. Риск развития артериальной гипертензии наи-
более высок у пациенток с неполным восстановле-
нием проходимости аорты. Этот риск растет про-
порционально степени остаточного градиента дав-
ления в месте сужения [34, 35].
Как и при стенозе аортального клапана, во время
беременности градиент давления в месте коаркта-
ch43.indd 1116
03.04.2019 12:17:48
1117
43 Заболевания сердца во время беременности
Рис. 43.4 Коарктация аорты. ТТЭхоКГ 27-летней беременной с коарктацией аорты после стентирования места стеноза. (А) Визуализация стента. (Б) Серия ис-
следований с помощью допплерографии. Отражается исходный уровень градиента давления через стент (до беременности) (Б1), увеличение во время беремен-
ности (из супрастернального доступа) (Б2) и возврат градиента давления к исходному уровню после родов (Б3).
ции аорты либо установки стента увеличивается
(рис. 43.4). Необходимо избегать гипердиагностики
коарктации аорты, основываясь лишь на повыше-
нии скорости или градиента давления, т.к. причина-
ми их повышения также могут быть гипоплазия
аорты и ускоренный кровоток.
К признакам, позволяющим связать повышен-
ный градиент давления с истинной коарктацией
аорты, относят переход турбулентности потока во
время диастолы при допплерографии либо посто-
янно повышенный во время диастолы градиент
давления в грудной или брюшной части нисходя-
щего отдела аорты из субкостального доступа в по-
зиции по длинной оси [37].
Чтобы провести дифференциальную диагности-
ку псевдокоарктации аорты и истинной коарктации
аорты, в некоторых случаях нужно выполнить маг-
нитно-резонансную томографию (МРТ) или ангио-
графию, но использование этих методов во время
беременности может быть ограничено. Кроме это-
го, при ЭхоКГ может недостаточно четко визуали-
зироваться аневризма в месте пластики аорты, и
при подозрении на наличие аневризмы также пона-
добится МРТ.
АНОМАЛИЯ ЭБШТЕЙНА
Выраженность проявлений аномалии Эбштейна
может существенно варьировать. У некоторых па-
циенток отмечается легкая степень аномалии Эб-
штейна, при которой есть небольшая трикуспи-
дальная регургитация и сохранная систолическая
функция ПЖ. Более тяжелые степени аномалии Эб-
штейна ассоциируются с нарушением морфологии
трикуспидального клапана, значительной трику-
спидальной регургитацией и систолической дис-
функцией ПЖ. В этом случае аномалия Эбштейна
сопровождается выраженными клиническими сим-
птомами и ассоциируется с высокой летальностью.
Способность сердца компенсировать изменения
гемодинамики во время беременности зависит от
тяжести порока. Пациентки с легкой степенью ано-
малии Эбштейна редко имеют осложнения, в то
время как при тяжелой степени этой патологии
сердце беременной не справляется с увеличенной
преднагрузкой. Данная группа пациенток имеет вы-
сокий риск декомпенсации, правожелудочковой не-
достаточности и развития аритмии [38, 39]. При ис-
следовании 111 беременных с аномалией Эбштейна
не было выявлено серьезных осложнений со сторо-
ны сердечно-сосудистой системы у пациенток, но
наблюдалось увеличение количества случаев гибели
плода, а также недоношенности и врожденных по-
роков сердца у детей [38]. У пациенток с шунтом на
уровне предсердий направление шунтирования мо-
жет изменяться, а также может наблюдаться увели-
чение сброса крови справа налево, что усиливает ги-
поксию во время беременности и повышает риск
осложнений.
Основной задачей ЭхоКГ являются диагностика
аномалии Эбштейна и оценка шунта на уровне пред-
сердий. Принципы диагностики аномалии Эбштей-
на у беременных и небеременных пациенток не от-
личаются. Частота повторных ТТЭхоКГ во время
беременности определяется тяжестью порока. Врач
должен знать критерии, на основании которых ре-
шается вопрос о возможности хирургической кор-
рекции трикуспидального клапана, и отражать эти
критерии в протоколе исследования.
Грудная часть
нисходящего отдела аорты
Стент
Дуга аорты
Б
А
1
2
3
ch43.indd 1117
03.04.2019 12:17:48
1118 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ТРАНСПОЗИЦИЯ МАГИСТРАЛЬНЫХ СОСУДОВ
Пациенткам с полной транспозицией магистраль-
ных сосудов выполняют операцию предсердного
переключения (операцию Мастарда либо Сеннига),
операцию Растелли или операцию артериального
переключения (операцию Жатене).
Во время операции предсердного переключения по-
ток крови перенаправляют, сформировав внутри-
предсердный туннель, однако морфологически ПЖ
остается в подаортальном положении, т.е . выполня-
ет функцию системного желудочка (рис. 43.5). Эта
операция ассоциируется с такими отдаленными ос-
ложнениями, как дисфункция артериального ПЖ,
регургитация на атриовентрикулярных клапанах,
стеноз и несостоятельность внутрипредсердного
туннеля, дисфункция синусового узла, предсердные
и желудочковые аритмии. Изредка отмечается по-
вышение систолического давления в легочной арте-
рии. Все перечисленные нарушения являются пря-
мыми факторами риска при вынашивании ребенка.
Наиболее частым осложнением во время беремен-
ности являются предсердные аритмии (22%) [40],
реже развивается сердечная недостаточность либо
ухудшается функция желудочков [41–43]. В одном
исследовании было показано, что прогрессирую-
щая дилатация ПЖ (31%) и дисфункция артериаль-
ного ПЖ (25%) зачастую носят необратимый ха-
рактер [43]. Описаны редкие случаи материнской
смертности после операций предсердного переклю-
чения [17, 41–42].
При транспозиции магистральных сосудов с
ДМЖП выполняют операцию Растелли. Суть ее за-
ключается в формировании между ЛЖ и аортой
туннеля и имплантации между ПЖ и легочной ар-
терией кондуита. Данных об исходах беременности
у пациенток, перенесших операцию Растелли, в на-
стоящее время недостаточно. В качестве одного из
осложнений во время беременности описан про-
грессирующий стеноз ВТЛЖ [44].
Операции предсердного переключения стали
стратегией выбора в 1980-х гг ., поэтому на данный
момент многие пациентки еще не достигли дето-
родного возраста для оценки результатов и влияния
процедуры на течение беременности. Есть данные,
что беременность приводит к неблагоприятным ис-
ходам у пациенток с частичной компенсацией оста-
точного порока после хирургического лечения [45].
Врожденная корригированная транспозиция ма-
гистральных сосудов может быть как изолирован-
ной (простая форма), так и сочетаться с другими
врожденными пороками, наиболее часто — с ДМЖП
и стенозом легочной артерии (сложная форма). Па-
циентки с врожденной корригированной транспо-
зицией магистральных сосудов имеют под аортой
морфологически ПЖ с различной степенью дилата-
ции и дисфункции. Риск осложнений во время бе-
ременности зависит от выраженности систоличе-
ской дисфункции артериального ПЖ, регургитации
на атриовентрикулярном клапане и сопутствующих
дефектов. В целом большинство пациенток с удов-
летворительной функцией артериального ПЖ и
нормальной толерантностью к нагрузке осложне-
ний не имеют. Однако есть сообщения, что во вре-
мя беременности возможны сердечная недостаточ-
ность, аритмии, инсульт, инфекционный эндокар-
дит, инфаркт миокарда [46, 47].
Рис. 43.5 A Операция Мастарда. ТТЭхоКГ 30-летней беременной с полной транспозицией магистральных сосудов. Перед операцией предсердного переклю-
чения (операция Мастарда) ей провели предсердную септэктомию по Блелоку–Ханлону. В анамнезе у пациентки было указание на умеренно-тяжелую дилатацию
и систолическую дисфункцию правого желудочка (ПЖ), умеренную регургитацию на атриовентрикулярном клапане. Беременность протекала без осложнений. На
35-й неделе прошли естественные роды. За все время беременности не было отмечено изменений в размерах желудочка и его систолической функции, а также
увеличения регургитации на атриовентрикулярном клапане. ЛЖ — левый желудочек.
Туннель,
сформированный
из заплаты
Артериальный
ПЖ
Венозный
ЛЖ
Артериальный
ПЖ
Венозный
ЛЖ
ch43.indd 1118
03.04.2019 12:17:48
1119
43 Заболевания сердца во время беременности
Пациенткам с транспозицией магистральных со-
судов, включая тех, которые перенесли операцию
Мастарда или Сеннига, во время беременности сле-
дует повторно проводить ТТЭхоКГ для своевремен-
ного выявления снижения систолической функции
артериального ПЖ и изменения его размеров, а так-
же появления регургитации на атриовентрикуляр-
ном клапане [23]. Увеличение систолического дав-
ления в ПЖ может наблюдаться у пациенток после
операции Растелли при стенозе кондуита, что сле-
дует учитывать во время беременности.
ГЕМОДИНАМИКА ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
Операцию Фонтена выполняют при наличии един-
ственного желудочка для перенаправления крови из
ПП или полых вен в легочную артерию. Хотя опе-
рация увеличивает оксигенацию и уменьшает пе-
регрузку объемом имеющегося желудочка, резерв
сердца в увеличении СВ ограничен. Наблюдается
постоянно повышенное системное венозное давле-
ние, а также увеличивается риск тромбоэмболиче-
ских осложнений. Рубцевание и ремоделирование
предсердий создают предпосылки для возникнове-
ния аритмий. Физиологические изменения гемоди-
намики во время беременности плохо переносятся
пациентками, особенно с низкой толерантностью к
физической нагрузке, систолической дисфункцией
желудочка, значительной регургитацией на атрио-
вентрикулярном клапане или рецидивирующей
аритмией.
Крайне важно планировать беременность с оцен-
кой риска после операции Фонтена, т.к. в некоторых
случаях (например, при дисфункции единствен-
ного желудочка или рецидивирующей аритмии) от-
мечается высокий риск осложнений. В этих ситу-
ациях беременность не рекомендуется. Проведено
несколько исследований, в которых изучали исход
беременности после операции Фонтена [48, 49]. Так,
у большинства из 33 пациенток не было осложне-
ний со стороны сердечно-сосудистой системы и
случаев материнской смертности [48]. Наиболее ча-
стым осложнением во время беременности явля-
ются наджелудочковые аритмии, но также могут на-
блюдаться повышение ФК по NYHA, артериальная
гипертензия, преждевременное отхождение около-
плодных вод [48, 49].
Несмотря на относительно неплохие исходы в
отношении сердечно-сосудистой системы у бере-
менной, часто наблюдаются осложнения у плода и
новорожденного. В одном исследовании лишь 45%
беременностей завершились рождением живого ре-
бенка [48]. Отмечается высокий риск спонтанного
аборта в I триместре беременности.
При эхокардиографическом исследовании паци-
енток при первом их обращении после операции
Фонтена обычно оценивают анатомические особен-
ности сердца, функциональное состояние желудоч-
ка и степень регургитации с целью планирования
беременности и для контроля изменений, вызван-
ных беременностью. Важно отметить, что при слож-
ной анатомии сердца после операции Фонтена и
ограниченной акустической доступности у пациен-
ток, перенесших несколько операций, в некоторых
случаях необходима мультимодальная визуализа-
ция, которая включает не только ЭхоКГ, но и МРТ.
Зачастую пациенткам перед кардиоверсией прово-
дят чреспищеводную эхокардиографию (ЧПЭхоКГ),
т.к . после операции Фонтена фибрилляция предсер-
дий представляет большую опасность для жизни и
сопряжена с высоким риском образования тромбов.
ЦИАНОТИЧЕСКИЕ ПОРОКИ СЕРДЦА
Пациентки с цианотическим («синим») пороком серд-
ца, например с синдромом Эйзенменгера, редко мо-
гут вы
́
носить ребенка. У этих пациенток отмечаются
высокий процент спонтанных абортов из-за хрони-
ческой гипоксемии и высокий риск для организма
беременной и плода.
Виды цианотического порока сердца: тетрада Фал-
ло, атрезия легочной артерии с аортолегочными
коллатералями, аномалия Эбштейна с ДМПП, един-
ственный желудочек сердца (атрезия трикуспидаль-
ного клапана). Эти пороки отличаются от синдрома
Эйзенменгера. При данных пороках отсутствует зна-
чительное повышение систолического давления в
легочной артерии, а риск, связанный с беременно-
стью, высок, но он ниже, чем при синдроме Эйзен-
менгера.
В исследовании 96 беременных с цианотическим
пороком сердца осложнения со стороны сердечно-
сосудистой системы (в частности, сердечная недо-
статочность, аритмия, ишемический инсульт) на-
блюдались у 32% обследованных [50]. Есть редкие
случаи смертности среди беременных. Пациенткам
с цианотическим пороком сердца выносить ребенка
удается лишь в 43% случаев, а при сатурации 85% и
менее рождение живого ребенка возможно лишь в
12% случаев [50].
Синдром Эйзенменгера характеризуется поли-
органным поражением, гематологическими, почеч-
ными, неврологическими симптомами, а также на-
рушениями опорно-двигательного аппарата. При-
знаки синдрома Эйзенменгера появляются в случае
развития тяжелой легочной артериальной гипертен-
зии, приводящей к изменению направления сброса
крови и к хроническому цианозу. На фоне данного
синдрома беременность протекает очень неблаго-
приятно из-за высокого легочного сосудистого со-
противления, перегрузки объемом ПЖ и снижения
постнагрузки, что еще больше увеличивает сброс
крови справа налево. Беременность при синдроме
Эйзенменгера противопоказана, т.к. материнская
смертность составляет 28–36% [51–53]. Основными
причинами летального исхода являются правоже-
лудочковая недостаточность, резкое повышение дав-
ления в легочной артерии, эмболия или расслоение
ch43.indd 1119
03.04.2019 12:17:49
1120 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 43.6 A Тяжелый стеноз двухстворчатого аортального клапана. 31-летняя беременная с двухстворчатым аортальным клапаном со створками купо-
лообразной формы. В детстве была проведена баллонная пластика аортального клапана в связи с тяжелым стенозом. При первом посещении врача до родов у
пациентки диагностировали тяжелый стеноз аортального клапана, расширенный корень аорты, гипертрофию левого желудочка (ЛЖ), но систолическая функция
левого желудочка была нормальная. Исходный максимальный градиент давления на клапане составил 71/42 мм рт. ст., площадь аортального клапана была 0,8 см2.
Во время беременности градиент давления увеличился до 108/59 мм рт. ст. На 35-й неделе развилась преэклампсия, в связи с которой выполнили срочное ке-
сарево сечение. У новорожденной девочки обнаружили небольшой ДМЖП. ЛП — левое предсердие.
легочной артерии, внезапная смерть. Пациенткам
с легочной артериальной гипертензией любого ге-
неза все чаще назначают вазодилататоры малого кру-
га кровообращения.
Как правило, пациенток с цианотическим поро-
ком сердца и синдромом Эйзенменгера выявляют
уже до зачатия, т.к. эти заболевания носят хрониче-
ский характер. Пациентки до зачатия или в самом
начале беременности должны быть обследованы с
помощью ТТЭхоКГ для оценки анатомии сердца,
измерения давления в легочной артерии и опреде-
ления систолической функции желудочков. Это не-
обходимо для оценки дальнейшей динамики этих
показателей в ходе беременности. Ввиду того что
данная группа пациенток имеет высокий процент
осложнений, ТТЭхоКГ необходимо проводить каж-
дые 4–6 недель как во время беременности, так и в
послеродовом периоде для контроля функции ПЖ
и давления в легочной артерии.
При синдроме Эйзенменгера большинство слу-
чаев материнской смертности регистрируют в пер-
вый месяц после родов, поэтому клинический и
эхокардиографический мониторинг после рожде-
ния ребенка крайне важен.
ПОРАЖЕНИЯ АОРТАЛЬНОГО КЛАПАНА
Наличие критического стеноза аортального клапана
снижает способность сердца увеличивать СВ. Желу-
дочек гипертрофируется, растяжимость его снижа-
ется, что приводит к росту чувствительности желу-
дочка к снижению преднагрузки. Все перечислен-
ные факторы способствуют во время беременности
увеличению риска развития сердечной недостаточ-
ности, гипотензии, стенокардии и аритмии. Стеноз
аортального клапана у пациенток детородного воз-
раста чаще всего наблюдается при двухстворчатом
аортальном клапане. Такой клапан часто ассоции-
руется с патологией восходящего отдела аорты и ко-
арктацией аорты, что увеличивает риск осложнений
во время беременности. Пациенткам с выраженны-
ми клиническими симптомами стеноза аортального
клапана необходимо провести хирургическую кор-
рекцию до зачатия [54]. При ведении пациенток с
бессимптомным критическим стенозом аортально-
го клапана следует тщательно оценивать все риски
во время планирования беременности. У некоторых
пациенток баллонная пластика аортального клапа-
на до зачатия ребенка позволяет временно улуч-
шить состояние.
Хотя при стенозе аортального клапана материн-
ская смертность низкая, пациентки с тяжелым сте-
нозом аортального клапана имеют высокий риск
развития во время беременности сердечной недо-
статочности, аритмии и стенокардии (рис. 43.6) [21,
55–59]. У пациенток с бессимптомным легким и
умеренным стенозом аортального клапана беремен-
ность обычно протекает без осложнений. Частота
осложнений во время беременности при тяжелом
стенозе аортального клапана составляет 10% (в не-
которых исследованиях была отмечена более высо-
кая частота) [57]. Беременным пациенткам с тяже-
лым стенозом аортального клапана и постоянными
симптомами в покое на фоне стандартной терапии
может быть выполнена баллонная вальвулопласти-
ка. Беременность у пациенток с умеренным или тя-
желым стенозом аортального клапана сопряжена с
увеличением вероятности протезирования аорталь-
ного клапана в сравнении с контрольной группой
Двухстворчатый
аортальный клапан
ЛП
ЛЖ
ch43.indd 1120
03.04.2019 12:17:49
1121
43 Заболевания сердца во время беременности
пациенток со стенозом аортального клапана, но не
в состоянии беременности [57, 60].
Аортальная регургитация чаще всего возникает
у молодых пациенток при наличии у них двухствор-
чатого аортального клапана. Большинство пациен-
ток с легкой или умеренной аортальной регургита-
цией и нормальной систолической функцией ЛЖ
не имеют проблем во время беременности. Однако
пациентки с выраженной аортальной регургитаци-
ей и систолической дисфункцией ЛЖ плохо пере-
носят увеличение ОЦК и СВ во время беременности.
При тяжелом стенозе аортального клапана реко-
мендуется во время беременности часто проводить
ТТЭхоКГ. Нарастание СВ по мере увеличения срока
беременности приводит к увеличению скорости по-
тока и трансклапанного градиента давления [57].
При первом обращении пациентки после родов для
оценки степени стеноза рассчитывают площадь
аортального клапана, которая должна в дальней-
шем оставаться неизменной. В одном из пилотных
исследований было отмечено возрастание степени
скручивания ЛЖ во время беременности, причем
отсутствие данной динамики ассоциировалось с
ухудшением функции сердца и необходимостью
проведения баллонной вальвулопластики [61].
ПОРАЖЕНИЯ МИТРАЛЬНОГО КЛАПАНА
Наиболее частой причиной стеноза митрального
клапана у молодых пациенток является ревматизм.
Очень редко стеноз возникает вследствие врожден-
ных мальформаций этого клапана, например при
парашютообразном митральном клапане. Во время
беременности увеличиваются ОЦК, СВ, ЧСС (со-
кращается время диастолического наполнения), что
может приводить к повышению давления в ЛП и
клиническим проявлениям стеноза митрального
клапана. В этом случае стеноз митрального клапана
может обнаружиться впервые. Другие состояния,
при которых тоже увеличивается ЧСС, например
фибрилляция предсердий, могут приводить к де-
компенсации и отеку легких. При умеренном и тя-
желом стенозе митрального клапана у беременных
часто наблюдаются отек легких и предсердная арит-
мия (рис. 43.7) [24, 56, 62, 63]. В двух крупных аме-
риканских исследованиях у пациенток с легким,
умеренным и тяжелым стенозом митрального кла-
пана отек легких наблюдался в 20, 45, 67% всех слу-
чаев беременности, предсердные аритмии — в 8, 15,
33% соответственно, однако случаев материнской
смертности зафиксировано не было [56, 62]. Редко
отмечаются транзиторные ишемические атаки и
инсульты. В большинстве стран крайне редко реги-
стрируют случаи материнской смертности во время
беременности [24, 63–65], но в некоторых регионах,
например, тропической Африки показатели мате-
ринской смертности очень высоки [66]. При лече-
нии стеноза митрального клапана назначают бета-
блокаторы для снижения ЧСС и проводят терапию
отека легких [67]. При сохранении симптомов на
фоне приема лекарственных средств и при опреде-
ленных анатомических вариантах митрального кла-
пана пациенткам выполняют чрескожную баллон-
ную вальвулопластику во время беременности [67,
68]. Данное вмешательство следует выполнять под
контролем ЧПЭхоКГ для уменьшения воздействия
излучения.
Митральная регургитация у пациенток детород-
ного возраста может быть вызвана ревматизмом,
врожденными пороками сердца и пролапсом ми-
трального клапана. Пациентки с легкой либо уме-
ренной митральной регургитацией и нормальной
систолической функцией ЛЖ обычно благополуч-
Рис. 43.7 Ревматический стеноз митрального клапана. 43-летняя беременная с умеренным ревматическим стенозом митрального клапана, легкой митраль-
ной регургитацией, расширенным левым предсердием (ЛП) и легочной артериальной гипертензией. В III триместре беременности у пациентки развилась хрони-
ческая сердечная недостаточность. Была проведена успешная терапия диуретиками и бета-блокаторами. ЛЖ
—
левый желудочек; ПЖ — правый желудочек;
ПП — правое предсердие.
Дилатированное
ЛП
ПП
ПЖ
ЛЖ
ЛЖ
Стенозированный
митральный клапан
Дилатированное
ЛП
ch43.indd 1121
03.04.2019 12:17:49
1122 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
но переносят беременность. Однако, как и при тя-
желой аортальной регургитации, увеличенные ОЦК
и СВ могут привести к дисфункции желудочков.
Беременным пациенткам с поражением митраль-
ного клапана необходимо выполнить ТТЭхоКГ для
оценки рисков по степени поражения клапана, по-
казателям систолического давления в легочной ар-
терии, размерам ЛП и наличию сопутствующих по-
ражений других клапанов. Увеличение СВ и ЧСС во
время беременности способствует увеличению ско-
рости потока и трансклапанного градиента давле-
ния у пациенток со стенозом митрального клапана.
Площадь митрального клапана, рассчитанная по
времени полуспада давления на клапане, остается во
время беременности неизменной и может быть ис-
пользована для оценки степени поражения клапана
[62]. И во время беременности, и в раннем послеро-
довом периоде рекомендуется периодически прово-
дить ТТЭхоКГ для оценки трансклапанного гради-
ента давления, систолического давления в легочной
артерии и систолической функции желудочков.
ИСКУССТВЕННЫЕ КЛАПАНЫ СЕРДЦА
Существует два типа искусственных клапанов (про-
тезов) сердца: механические и биологические. Бере-
менные пациентки с механическими искусственны-
ми клапанами имеют высокий риск тромбоэмбо-
лических осложнений, особенно тромбоза клапана.
Это может привести к летальному исходу. Во время
беременности происходит физиологическая актива-
ция системы гемостаза, что увеличивает риск тром-
боэмболических осложнений (рис. 43.8). Также воз-
никают трудности во время беременности с назна-
чением антикоагулянтной терапии из-за увеличения
массы тела, изменения активности системы гемо-
стаза и проблем с определением концентрации ге-
парина. Наличие механических искусственных кла-
панов увеличивает риск сердечной недостаточности
и аритмии.
Развитие осложнения у беременной зависит от
многих факторов: основного заболевания сердца,
типа протеза (новые двухстворчатые клапаны менее
тромбогенны), анатомического положения протеза
(тромбоэмболические осложнения чаще возникают
при протезе митрального клапана, чем аортально-
го), функций протеза, типа принимаемых антикоа-
гулянтов (самый низкий процент осложнений на-
блюдается при приеме варфарина, самый высо-
кий — при использовании нефракционированного
гепарина), а также систолической функции ЛЖ. Ос-
новной фактор риска тромбоэмболических ослож-
нений — тип антикоагулянта. Хотя прием варфари-
на дает самый низкий процент осложнений у бере-
менной, его использование связывают с развитием
варфариновой эмбриопатии. Гепарин не проходит
через плаценту, поэтому не вызывает эмбриопатию,
но его применение приводит к осложнениям у бе-
ременной. Показатель материнской смертности и
тромбоэмболических осложнений составляет около
1%. У пациенток с механическими искусственными
клапанами, получающих варфарин, этот показа-
тель составляет 1–3%, а у получающих эквивалент-
ную дозу гепарина — от 5–7 до 13–25% [69, 70]. Все
чаще вместо нефракционированного гепарина вра-
чи назначают беременным с механическими искус-
ственными клапанами сердца низкомолекулярные
гепарины [71, 72]. При терапии варфарином боль-
шие трудности в контроле состояния системы гемо-
стаза возникают во время родов, поскольку в этом
периоде пациентка должна быть переведена с вар-
фарина на гепарин. Многие профессиональные со-
общества — European Society of Cardiology [23],
American College of Cardiology/American Heart Asso-
ciation [54], American College of Chest Physicians —
разработали свои критерии лечения антикоагулян-
тами беременных с механическими искусственны-
ми клапанами [73].
Пациентки с нормально функционирующими
биологическими искусственными клапанами серд-
ца переносят беременность без осложнений. Неко-
торые авторы считают, что беременность может
способствовать дегенерации клапана, но недавние
исследования опровергли это [74].
ЧПЭхоКГ помогает оценить риски во время бе-
ременности, функцию клапанов и желудочков, си-
столическое давление в легочной артерии. Полезны
исходные данные о скорости потоков и транскла-
панных градиентах давления, т.к. эти показатели в
Рис. 43.8 A Тромбоз створки механического искусственного клапа-
на в митральной позиции. 23-летняя беременная с механическим искус-
ственным клапаном фирмы St. Jude после перенесенного инфекционного эн-
докардита. Из-за беременности она не могла принимать варфарин. После ро-
доразрешения в срок у нее была транзиторная ишемическая атака. На ЭхоКГ
установлено увеличение градиента давления на протезированном митральном
клапане и систолического давления в легочной артерии. Также на диске про-
теза со стороны предсердия обнаружен тромб. Понадобилась срочная замена
протеза.
Тромб
на неподвижном
диске
ch43.indd 1122
03.04.2019 12:17:50
1123
43 Заболевания сердца во время беременности
течение беременности увеличиваются. Важно во-
время заметить симптомы тромбоза клапана: одыш-
ку, сердечную недостаточность, приглушение зву-
ков работы механического искусственного клапана
при аускультации и увеличение градиента давления
на нем. При подозрении на тромбоз следует прове-
сти ЧПЭхоКГ для оценки функции клапана. В слу-
чае плохой визуализации для оценки подвижности
створок рекомендуется рентгеноскопия с обязатель-
ной защитой живота свинцовым фартуком.
АОРТОПАТИЯ
Многие пациентки с аортопатией знают о своем ди-
агнозе до зачатия ребенка, но в некоторых случаях
аортопатию впервые выявляют лишь при поступ-
лении в клинику беременной с признаками рассло-
ения аорты.
Наиболее частыми причинами дилатации груд-
ной части нисходящего отдела аорты являются двух-
створчатый аортальный клапан, синдром Марфана,
коарктация аорты. Редко наблюдают синдром Элер-
са–Данло, синдром Тернера, синдром Лойса–Дитца,
синдром семейных аневризм и расслоения грудной
части нисходящего отдела аорты. Изменение гор-
монального фона, увеличение ОЦК и СВ повыша-
ют риск прогрессирования дилатации аорты и ее
расслоения [75].
Риск расслоения аорты или ее дилатации во вре-
мя беременности значительно варьирует в зависи-
мости от вида основного заболевания. Расслоение
аорты наблюдают у пациенток с двухстворчатым
аортальным клапаном, но риск расслоения в этом
случае ниже, чем у пациенток с синдромом Марфа-
на [75]. В настоящее время отсутствуют данные о
пользе назначения бета-блокаторов в период бере-
менности, но многие клиники используют эту груп-
пу лекарственных средств в качестве эмпирической
терапии пациенток с двухстворчатым клапаном для
предотвращения прогрессирования дилатации и
расслоения аорты. Риск расслоения аорты и других
серьезных осложнений выше у пациенток с синдро-
мом Марфана и дилатированной аортой, синдрома-
ми Элерса–Данло и Лойса–Дитца [76]. В целом риск
расслоения аорты во время беременности у пациен-
ток с синдромом Марфана составляет около 3%
[77], хотя в некоторых исследованиях отмечена бо-
лее низкая частота расслоения аорты [78].
При диаметре аорты > 4,5 см вынашивать ребен-
ка не рекомендуется, т.к. при этом очень высок риск
быстрой дилатации корня аорты (рис. 43.9) и рас-
слоения аорты, т.е . риск расслоения аорты напря-
мую связан с ее диаметром.
Если диаметр аорты < 4,0 см, то риск ее расслое-
ния самый низкий (1%). Относительно уровня ри-
ска при диаметре аорты от 4,0 до 4,5 см единого мне-
ния нет; некоторые исследователи отметили отсут-
ствие расслоения аорты в этом случае [79]. В другом
исследовании рекомендуют выполнить протезиро-
вание корня аорты при диаметре 4,4 см или более
перед зачатием ребенка [23]. Следует сказать, что
были случаи расслоения аорты и после оперативно-
го вмешательства. У пациенток с синдромом Мар-
фана и другими наследственными заболеваниями
соединительной ткани могут наблюдаться аорталь-
ная регургитация, пролапс митрального клапана и
митральная регургитация.
Для динамической оценки диаметра аорты у бе-
ременных, которые имеют риски или которым по-
ставлен диагноз «дилатация аорты», используют
ТТЭхоКГ. В соответствии с клиническими рекомен-
дациями у пациенток с синдромом Марфана и/или
двухстворчатым аортальным клапаном следует во
время беременности измерять диаметр аорты на
различных уровнях (корень аорты, восходящий от-
дел аорты, дуга аорты, проксимальный участок нис-
ходящего отдела аорты) каждые 6–8 недель [23].
Рис. 43.9 A Синдром Марфана. ТТЭхоКГ 29-летней беременной с синдромом Марфана, выраженной дилатацией корня аорты и тяжелой аортальной регур-
гитацией. Впервые пациентка была на консультации у кардиолога в конце I триместра беременности. Через 12 недель после родов ей была успешно проведена
клапаносохраняющая замена корня аорты. ЛЖ — левый желудочек.
Дилатированная
аорта
ЛЖ
ch43.indd 1123
03.04.2019 12:17:50
1124 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Компьютерная томография (КТ) и МРТ дают бо-
лее полную информацию об аорте, но их использу-
ют в основном на этапе планирования беременно-
сти или у беременных с подозрением на расслоение
аорты. Осложнения со стороны аорты могут воз-
никнуть и в послеродовом периоде, поэтому клини-
ческий мониторинг и ТТЭхоКГ следует проводить
вплоть до 6-го месяца после родов.
КАРДИОМИОПАТИЯ
Увеличение ОЦК и СВ у пациенток с идиопатиче-
ской дилатационной кардиомиопатией может при-
водить к снижению систолической функции ЛЖ,
сердечной недостаточности и аритмии (рис. 43.10)
[64, 80, 81]. Прекращение сдавления нижней полой
вены маткой и аутотрансфузия крови из сокраща-
ющейся матки во время родов могут привести к до-
полнительным осложнениям. Сердечная недоста-
точность чаще всего развивается в конце II триме-
стра беременности или в течение первого месяца
после родов [80]. В одном из исследований наблю-
дали 36 беременных с дилатационной кардиомио-
патией, осложнения со стороны сердечно-сосуди-
стой системы наблюдались в 39% случаев (14/36)
[81]. К группе высокого риска относят также паци-
енток, имеющих в анамнезе клинически значимую
сердечную недостаточность, умеренную или выра-
женную дисфункцию ЛЖ, а также с ФК III или IV
по NYHA. После родов частота осложнений у паци-
енток с дилатационной кардиомиопатией и выра-
женной систолической дисфункцией ЛЖ значи-
тельно выше, чем в контрольной группе пациенток
с таким же диагнозом, но не в состоянии беремен-
ности [81].
Терапию острой сердечной недостаточности во
время беременности проводят диуретиками, гидра-
лазином и нитратами для снижения постнагрузки.
Не рекомендуется использовать ингибиторы ангио-
тензинпревращающего фермента и блокаторы ан-
гиотензиновых рецепторов из-за их влияния на
функцию почек плода. Если пациентка с систоличе-
ской дисфункцией ЛЖ принимала бета-блокаторы
до зачатия, то терапия должна быть продолжена и
во время беременности.
Периродовая кардиомиопатия (ПКМП) — это
редкое заболевание, представляющее собой «идио-
патическую кардиомиопатию с сердечной недоста-
точностью вследствие систолической дисфункции
ЛЖ в конце беременности либо через несколько ме-
сяцев после родов, при которой не установлены
другие причины развития сердечной недостаточ-
ности» [82]. Факторами риска ПКМП являются мно-
гоплодная беременность, слишком молодой либо
слишком зрелый возраст матери, преэклампсия,
длительный токолиз [83]. Не исключается генетиче-
ская предрасположенность к данному заболеванию.
Симптомы, время их проявления и ТТЭхоКГ помо-
гают установить диагноз. Начало заболевания про-
является по-разному: у некоторых пациенток на-
блюдаются слабо выраженные симптомы сердеч-
ной недостаточности, в то время как у других сразу
развивается кардиогенный шок. Показатели мате-
ринской смертности варьируют от 1 до 30% [84].
Тромб в ЛЖ при первом обращении обнаруживают
у 20% пациенток с ПКМП [85].
При проявлении заболевания во время беремен-
ности необходимо скорректировать схему лечения
сердечной недостаточности таким же образом, как
при дилатационной кардиомиопатии (см. ранее).
Если ПКМП диагностировали после родов, то про-
водят стандартную терапию сердечной недостаточ-
ности. В небольшом исследовании отмечено улуч-
шение состояния пациенток при добавлении к стан-
дартному лечению бромокриптина [86].
При наличии тромба в ЛЖ следует проводить
антикоагулянтную терапию. Пациентки с ПКМП
должны проходить лечение в специализированном
кардиохирургическом центре, в котором есть воз-
можность подключения устройств вспомогательно-
го кровообращения и проведения трансплантации.
При анализе американской популяции у большин-
ства пациенток систолическая функция ЛЖ восста-
навливалась спонтанно [83]. Пациентки с ПКМП в
анамнезе, планирующие следующую беременность,
должны быть предупреждены обо всех рисках по-
вторной ПКМП.
Беременность противопоказана при остаточной
систолической дисфункции ЛЖ, поскольку мате-
ринская смертность в этом случае достигает 19%
[87].
Рис. 43.10 A Кардиомиопатия и тромб в левом желудочке. ТТЭхоКГ
35-летней беременной с кардиомиопатией на фоне приема антрациклина. В
начале беременности систолическая функция левого желудочка (ЛЖ) снизи-
лась и оставалась такой всю беременность. Через 8 недель после рождения
близнецов у матери развилась хроническая сердечная недостаточность. На
ТТЭхоКГ отмечались тяжелая систолическая дисфункция ЛЖ и тромб в его
верхушке.
ЛЖ
Тромб
ch43.indd 1124
03.04.2019 12:17:50
1125
43 Заболевания сердца во время беременности
Гипертрофическая кардиомиопатия — наиболее
распространенный вид наследственной кардиомио-
патии среди пациенток детородного возраста. Ги-
пертрофическая кардиомиопатия характеризуется
гипертрофией ЛЖ различной степени с сопутству-
ющей динамической обструкцией ВТЛЖ или без
нее. Клиническая картина при гипертрофической
кардиомиопатии вариабельна. У некоторых паци-
енток заболевание протекает бессимптомно, в то
время как у других наблюдаются сердечная недоста-
точность (рис. 43.11), желудочковая аритмия либо
наступает внезапная смерть.
Во время родов ухудшению оттока через ВТЛЖ
у пациенток с обструктивной гипертрофической кар-
диомиопатией могут способствовать применение
анестетиков, проба Вальсальвы и кровопотеря. При
сохранной систолической функции ЛЖ, удовлетво-
рительной физической работоспособности, отсут-
ствии значительной обструкции и аритмии бере-
менность обычно протекает без осложнений.
Гемодинамические сдвиги, возникающие во вре-
мя беременности, плохо переносятся пациентками
с более тяжелой стадией заболевания. При этом во
время беременности описаны случаи возникнове-
ния желудочковой тахикардии, фибрилляции пред-
сердий, сердечной недостаточности, стенокардии,
обмороков [64, 88–90]. Случаи материнской смерт-
ности редки, однако возможны среди беременных
из группы высокого риска [88]. Во время родов сле-
дует принимать меры для предотвращения ослож-
нений, связанных с анестезией и кровопотерей.
Если беременная поступает в клинику с симпто-
мами, позволяющими предположить кардиомиопа-
тию, для постановки диагноза используют ТТЭ-
хоКГ. При установленном диагнозе до зачатия для
выявления рисков и наблюдения в ходе беременно-
сти используют ЧПЭхоКГ. Для оценки систоличе-
ской функции ЛЖ и давления в легочной артерии
следует регулярно проводить ТТЭхоКГ [23]. У паци-
енток с обструктивной гипертрофической кардио-
миопатией крайне важно оценивать степень об-
струкции ВТЛЖ. При ТТЭхоКГ необходимо обра-
щать внимание на наличие тромбов в ЛЖ, особенно
у пациенток с ПКМП.
ФЕТАЛЬНЫЕ И НЕОНАТАЛЬНЫЕ РИСКИ
Большинство специалистов по ультразвуковой диа-
гностике, проводящих ЭхоКГ взрослым пациентам,
основное внимание уделяют оценке состояния серд-
ца беременной, однако важно отметить, что многие
риски для беременной также влияют на плод и но-
ворожденного. Например, наличие у беременной
цианотического порока сердца (как оперированно-
го, так и не оперированного) повышает риск гибели
плода независимо от наличия или отсутствия у бе-
ременной синдрома Эйзенменгера [50, 52, 53]. В табл.
43.3 перечислены факторы риска для плода и ново-
рожденного у пациентки с заболеванием сердца.
Беременные женщины с патологией сердца по
сравнению со здоровыми беременными имеют бо-
лее высокий риск развития осложнений у плода и
новорожденного: спонтанный аборт, гибель плода
или смерть новорожденного, низкая масса тела при
рождении, включая массу плода, недостаточную для
гестационного возраста, преждевременные роды,
приводящие к респираторному дистресс-синдрому,
внутрижелудочковому кровоизлиянию у новорож-
денного. Предполагаемой причиной осложнений у
плода и новорожденного служит маточно-плацен-
тарная недостаточность, возникающая из-за сниже-
ния СВ у беременной.
Несмотря на данные пилотных исследований, свя-
зывающих нарушения структуры и функции серд-
ца беременной с осложнениями у плода и новорож-
денного, в качестве основного механизма рассма-
Рис. 43.11 Гипертрофическая кардиомиопатия. ТТЭхоКГ 30-летней беременной с необструктивной гипертрофической кардиомиопатией в результате мута-
ции гена MYH7. В подростковом возрасте ей выполнили миоэктомию, после чего у пациентки развилась полная атриовентрикулярная блокада сердца, и ей им-
плантировали кардиовертер-дефибриллятор. Пациентка принимала бета-блокаторы вплоть до родов, которые прошли естественным путем без осложнений, од-
нако у ребенка после рождения обнаружили гипогликемию (прием бета-блокаторов во время беременности ассоциируется с риском развития у новорожденного
гипогликемии). ЛЖ — левый желудочек; ЛП — левое предсердие; ПП — правое предсердие.
Перегородка
ЛЖ
ЛЖ
ЛП
ЛП
ПП
ch43.indd 1125
03.04.2019 12:17:50
1126 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
тривают снижение СВ [91]. Сниженный кровоток в
артерии пуповины, наблюдаемый при допплеро-
графии и являющийся результатом маточно-пла-
центарной недостаточности, а также СВ рассматри-
вают как независимые предикторы неонатальных
осложнений [10].
При наличии у беременной врожденного порока
сердца, не связанного с генетическим заболеванием,
риск врожденной патологии сердца у ребенка со-
ставляет от 3 до 5%. Обструктивные поражения
левых отделов сердца у родителей ассоциируются с
наследованием в 13–18% случаев. Аутосомно-до-
минантные заболевания у беременной, в частности
синдром Нунан, синдром Вильямса, синдром Хол-
та–Орама, синдром Марфана или синдром делеции
22q11.2, имеют 50% риск передачи заболевания ре-
бенку. С помощью ЭхоКГ следует проводить диа-
гностику врожденного порока сердца у беременной,
особенно у пациенток с наследственными аутосом-
но-доминантными заболеваниями в анамнезе. ЭхоКГ
плода на сроке гестации 18–22 недели выполняют
беременным с врожденным пороком сердца и на-
следственным заболеванием сердца [92].
ТАКТИКА ЛЕЧЕНИЯ
Выявление рисков и тактика ведения беременных
женщин с ССЗ описаны во многих клинических ре-
комендациях. Наиболее подробные из них — Реко-
мендации European Society of Cardiology по вопро-
сам лечения ССЗ во время беременности [23]. Так-
же есть рекомендации по конкретным заболеваниям
American College of Cardiology/American Heart Asso-
ciation, American College of Chest Physicians, Europe-
an Society of Cardiology, Canadian Cardiovascular So-
ciety (табл. 43.5).
ПРЕДРОДОВОЙ ПЕРИОД
Пациентки с высоким риском осложнений во время
беременности должны наблюдаться в профильном
медицинском центре командой врачей разных спе-
циальностей. В состав команды должны входить
кардиолог, перинатолог, анестезиолог с опытом ве-
дения беременных группы высокого риска с заболе-
ваниями сердца. В некоторых случаях следует при-
влечь гематолога, генетика и неонатолога. Оценка
состояния плода во время беременности является
важным компонентом лечебной тактики.
Иногда сложно отличить симптомы ССЗ от фи-
зиологических изменений, происходящих во время
беременности. У беременных женщин часто наблю-
даются усталость, одышка, сердцебиение, головокру-
жение, отеки нижних конечностей. При обследова-
нии можно выявить синусовую тахикардию, сме-
щение верхушечного толчка, пульсацию яремных
вен, расщепление первого или второго сердечного
тона, систолические либо систолодиастолические
шумы. Для того чтобы отличить физиологические
сдвиги от симптомов заболевания сердца, часто ис-
пользуют ТТЭхоКГ.
Для каждой беременной с ССЗ необходимо раз-
работать план ведения беременности. Частоту об-
следований, включая ТТЭхоКГ, подбирают индиви-
дуально в зависимости от рисков для беременной и
плода. В большинстве случаев при заболевании серд-
ца для выявления рисков проводят ТТЭхоКГ при
первом посещении, а затем в III триместре беремен-
ности (во время максимальных изменений гемоди-
намики) и после родов (для сравнения функцио-
нального состояния сердца с исходным уровнем).
Пациенткам с высоким риском осложнений и при
наличии симптомов ТТЭхоКГ проводят чаще.
РОДЫ И РОДОРАЗРЕШЕНИЕ
Родоразрешение через естественные родовые пути
считают оптимальным, т.к. оно связано с меньшей
кровопотерей, более низким риском развития тром-
боза и инфекционных осложнений. Кесарево сече-
ние выполняют беременным с синдромом Марфана
при дилатации корня аорты > 4,5 см либо в случае
преждевременных родов у пациентки, получающей
антикоагулянтную терапию. Некоторые авторы ре-
комендуют выполнять кесарево сечение беремен-
ным с тяжелым стенозом аортального клапана и
синдромом Эйзенменгера [23].
Пациенток с ССЗ из группы высокого риска сле-
дует родоразрешать с участием команды специали-
стов, а их родовую деятельность стимулировать для
прогнозирования времени начала родов (в осталь-
ных случаях стимуляция не нужна). При родах через
естественные пути рекомендуется эпидуральная
анестезия для устранения боли, исключения подъе-
ма уровня катехоламинов и уменьшения колебаний
гемодинамических показателей. Для предотвраще-
ния сдавления аорты и нижней полой вены возмож-
но положение роженицы во время родов на левом
боку. Во втором периоде родов для родовспоможе-
ния можно использовать вакуум-экстрактор либо
акушерские щипцы, что минимизирует потуги [93].
У беременных с тяжелым заболеванием сердца
использовать окситоцин следует с осторожностью,
т.к. он может вызвать вазодилатацию и гипотонию.
Во время родов рекомендуется контролировать ге-
модинамику. При необходимости можно прово-
дить мониторинг с помощью ЭКГ и пульсоксиме-
трии. При выраженной систолической дисфункции
желудочков, тяжелом аортальном стенозе либо ле-
гочной артериальной гипертензии рекомендуется
инвазивный контроль артериального давления.
Для предотвращения парадоксальной эмболии у
беременных с внутрисердечными шунтами в маги-
стральные венозные сосуды устанавливают филь-
тры для улавливания пузырьков воздуха и частиц.
Профилактику инфекционного эндокардита при
неосложненных естественных родах проводить не
рекомендуется [94]. После родов гемодинамика не
ch43.indd 1126
03.04.2019 12:17:51
1127
43 Заболевания сердца во время беременности
Рекомендации
Год
Рекомендации, касающиеся визуализации сердца
Рекомендации American College
of Cardiology/American Heart Asso-
ciation Guidelines по ведению паци-
ентов с клапанными пороками
сердца [54]
2014
При ТТЭхоКГ определяют показания к вмешательству до зачатия при стено-
тических поражениях: при стенозе аортального клапана — максимальная
скорость > 4 м/сек или средний градиент давления ≥ 40 мм рт. ст.; при
стенозе митрального клапана — площадь митрального клапана ≤ 1,5 см2
ТТЭхоКГ следует проводить до зачатия всем беременным с патологией клапа-
нов либо с механическим искусственным клапаном
Беременным следует выполнять ЧПЭхоКГ при подозрении на обструкцию
механического искусственного клапана или эмболию
Положение Canadian Cardiovascular
Society о ведении пациентов с забо-
леванием грудной части нисходя-
щего отдела аорты [102]
2014
При острых состояниях для первичной визуализации следует выполнять КТ
Альтернативным методом при острых состояниях является ЧПЭхоКГ:
(1) если результаты КТ неопределенные; (2) при невозможности из-за неста -
бильности гемодинамики у пациента транспортировать его для проведения
КТ; (3) при интраоперационной визуализации
Рекомендации по ведению специфических заболеваний аорты во время бере-
менности см. в Приложении S3
Клинические рекомендации Ameri-
can College of Chest Physicians по
антитромботической терапии
и профилактике тромбоза, осно-
ванные на доказательной медицине
[73]
2012
Обновленные рекомендации по антитромботической терапии беременных
с механическими искусственными клапанами
Конкретные рекомендации по визуализации отсутствуют
Рекомендации European Society
of Cardiology по ведению пациен-
ток с сердечно-сосудистыми забо-
леваниями во время беременности
[23]
2011
Оценка анатомии и функции сердца — важнейшая составляющая при стра-
тификации рисков и должна включать определение степени стеноза/регур-
гитации, систолической функции желудочков, диаметра аорты (абсолют-
ного и индексированного к площади поверхности тела/росту), размера
шунтов, систолического давления в легочной артерии
При недостаточных данных на ЭхоКГ следует провести МРТ без гадолиния
ЭхоКГ следует выполнять всем беременным с новыми либо непонятными
симптомами со стороны сердечно-сосудистой системы
Рекомендации American College
of Cardiology/American Heart Asso-
ciation по диагностике и ведению
пациентов с заболеваниями
грудной части нисходящего отдела
аорты [103]
2010
Измерять внутренний диаметр аорты следует перпендикулярно потоку крови
При измерении корня аорты необходимо найти самую широкую часть
(обычно располагается по центру)
Для лечения бессимптомной аневризмы восходящего отдела аорты следует
оценить все размеры и скорость роста аневризмы или площадь аорты,
индексированную к росту пациента
Рекомендации European Society
of Cardiology по ведению взрослых
пациентов с врожденными поро-
ками сердца [104]
2010
Оценка анатомии сердца и его функции, степени стеноза/регургитации,
систолической функции желудочка, диаметра аорты, систолического
давления в легочной артерии
МРТ сердца — альтернативный метод визуализации в случае, когда информа-
тивность ЭхоКГ и МРТ одинакова, но изображение при ЭхоКГ имеет недо-
статочное разрешение или в случае пограничных либо неоднозначных
данных ЭхоКГ
МРТ сердца обеспечивает лучшую количественную оценку правого желу-
дочка и регургитации на клапане легочной артерии, а также оценку ветвей
легочного ствола, коллатералей, возврата по легочным венам, массы мио-
карда желудочков или рубца
КТ — компьютерная томография; МРТ — магнитно -резонансная томография; ТТЭхоКГ — трансторакальная эхокардиография;
ЧПЭхоКГ— чреспищеводная эхокардиография; ЭхоКГ — эхокардиография.
ТАБЛИЦА 43.5 Клинические рекомендации 2010–2015 гг. по стратификации рисков и ведению беременных женщин
с сердечно-сосудистыми заболеваниями
сразу возвращается в исходное состояние, поэтому
пациенткам из группы высокого риска мониторинг
следует продолжать вплоть до выписки. Большин-
ству пациенток не нужно выполнять ТТЭхоКГ сра-
зу после родов, но пациенткам с высокими показа-
телями легочной артериальной гипертензии или
выраженной систолической дисфункцией ЛЖ сле-
дует проводить ТТЭхоКГ в раннем послеродовом
периоде для исключения осложнений. Перед выпи-
ской необходимо подобрать лекарственную тера-
пию, которую можно проводить и при грудном
вскармливании [23].
ch43.indd 1127
03.04.2019 12:17:51
1128 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
НЕДОСТАТКИ ЭХОКАРДИОГРАФИИ
И АЛЬТЕРНАТИВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
При увеличении размеров матки в течение беремен-
ности бывает сложно получить изображение из
стандартных доступов, например из субкостально-
го. Во время беременности изменяются размеры же-
лудочков, толщина стенок ЛЖ, масса ЛЖ, транскла-
панные градиенты давления и выраженность регур-
гитации. Если эти параметры во время беременности
ПОСЛЕРОДОВОЙ ПЕРИОД
Риск развития осложнений со стороны сердца есть
и после родов. Обычно пациенток наблюдают в те-
чение 1–2 месяцев после родоразрешения. Послеро-
довые осложнения особенно часто встречаются у
пациенток с синдромом Эйзенменгера и пациенток
с легочной артериальной гипертензией другой этио-
логии, синдромом Марфана и кардиомиопатией.
Эти пациентки должны находиться под тщатель-
ным и более частым наблюдением после родов. Дан-
ной группе пациенток следует проводить ТТЭхоКГ
в послеродовом периоде для оценки функции серд-
ца в динамике.
ТАКТИКА ВЕДЕНИЯ ПРИ ОСЛОЖНЕНИЯХ
При клиническом ухудшении состояния беремен-
ной с ССЗ следует сразу провести ТТЭхоКГ. В табл.
43.6 перечислены частые клинические состояния во
время беременности и связанные с ними заболева-
ния сердца. При необходимости врач должен назна-
чить препараты, которые относительно безопасны
для приема во время беременности: бета-блокато-
ры, соталол, дигоксин, гидралазин, фуросемид. При
развитии аритмии может быть проведена кардио-
версия, которая во время беременности безопасна.
Некоторые центры описывают проведение аблации
без рентгеновского контроля [95].
Чрескожными вмешательствами во время бере-
менности могут быть баллонная вальвулопластика,
катетеризация сердца, чреcкожное коронарное вме-
шательство. Эти операции могут быть успешно вы-
полнены в ходе беременности, но при их проведе-
нии следует минимизировать воздействие облуче-
ния на плод методом экранирования, уменьшения
длительности процедуры, а также используя для до-
ступа лучевую артерию. В опубликованных реко-
мендациях указаны предельно допустимые дозы
облучения при проведении данных процедур у бе-
ременных [23].
Кардиохирургические вмешательства во время
беременности ассоциируются со значительной ма-
теринской смертностью и гибелью плода (6% и 14–
30% соответственно) [96, 97]. Гипотензия у бере-
менной, сокращения матки во время искусственно-
го кровообращения и последующая гипоперфузия
плаценты способствуют развитию у плода гипоксии
и брадикардии. Гибель плода во время кардиохи-
рургической операции у беременной связана с таки-
ми факторами, как возраст, ФК по NYHA, повтор-
ная операция, экстренная операция, способ защиты
миокарда и время аноксии [98]. Чтобы свести к
минимуму риск развития осложнений у плода, во
время операции на сердце пациентки применяют
персонализированные анестезиологические прие-
мы. Кесарево сечение перед подключением аппа-
рата искусственного кровообращения выполняют
только в исключительных случаях.
Болезнь сердца
Клиническое
проявление
Кардиомиопатия
Врожденный порок сердца
Аортопатия
Стеноз клапана
Остановка сердца
Кардиомиопатия
Врожденный порок сердца
Стеноз клапана
Преэклампсия
Сердечная
недостаточность
Гипертензия беременных
Преэклампсия
Коарктация аорты
Гипертензия
Кардиомиопатия
Стеноз клапана
Врожденный порок сердца
Удлиненный интервал QT и другие
аритмии
Аритмия
Стеноз клапана
Врожденный порок сердца
Гипертрофическая кардиомиопатия
Удлиненный интервал QT и другие
аритмии
Обмороки
Синдром Эйзенменгера
Аномалия Эбштейна с большим
ООО/ДМПП
Внутрисердечный шунт
(ДМПП/ООО)
Инсульт или транзи-
торная ишемическая
атака
Расслоение коронарной артерии
Ишемическая болезнь сердца
в анамнезе
Тромбоэмболия
Инфаркт миокарда
Синдром Марфана и другие
наследственные аортопатии
Двухстворчатый аортальный
клапан
Расслоение аорты
Синдром Эйзенменгера
Цианотический порок сердца
Аномалия Эбштейна с большим
ООО/ДМПП
Большие внутрисердечные шунты
(ДМПП/ДМЖП)
Цианоз
ДМЖП — дефект межжелудочковой перегородки; ДМПП — де-
фект межпредсердной перегородки; ООО — открытое овальное
окно.
ТАБЛИЦА 43.6 Клинические проявления болезни сердца
во время беременности
ch43.indd 1128
03.04.2019 12:17:51
1129
43 Заболевания сердца во время беременности
выходят за пределы нормы, их оценку следует по-
вторить после родов.
Отсутствие убедительных данных о безопасно-
сти применения контрастных средств во время бе-
ременности исключает их применение (гадолиний
в качестве контрастного средства во время беремен-
ности противопоказан).
ЧПЭхоКГ проводят в основном до кардиоверсии
для исключения тромбов в ЛП, оценки функции
механического клапана и во время кардиохирурги-
ческих вмешательств. При использовании седации
во время ЧПЭхоКГ следует проводить мониторинг
плода [23]. При отсутствии четкой визуализации на
ЭхоКГ рекомендуется провести МРТ или КТ сердца,
например у пациенток с наследственной аортопати-
ей, в частности синдромом Марфана, и с болью в
груди. МРТ рекомендуется выполнять после I три-
местра беременности, когда магнитное поле в мень-
шей степени может повлиять на развивающийся
плод.
Патология
Возможные осложнения
в период беременности
Параметры, оцениваемые при ЭхоКГ
Дефект межпредсердной
перегородки
Аритмия
Парадоксальная эмболия
Размеры и функция ПЖ
Тип ДМПП
Систолическое давление в ПЖ
Дефект межжелудочковой
перегородки
Аритмия
Хроническая сердечная недостаточность
Размеры и функция ЛЖ
Тип ДМЖП
Градиент давления на ДМЖП
Систолическое давление в ПЖ
Открытый артериальный
проток
Аритмия
Хроническая сердечная недостаточность
Размеры и функция ЛЖ
Градиент давления на ОАП
Систолическое давление в ПЖ
Тетрада Фалло
Аритмия
Правожелудочковая недостаточность
Размеры и функция ПЖ
Систолическая функция ЛЖ
Степень регургитации на клапане легочной
артерии
Градиент давления на ВТПЖ
Степень трикуспидальной регургитации
Систолическое давление в ПЖ
Коарктация аорты
Гипертензия беременных, включая
преэклампсию
Расслоение аорты
Хроническая сердечная недостаточность
Градиент давления на уровне коарктации аорты
Аневризма в месте коррекции коарктации аорты
Гипертрофия ЛЖ
Систолическая функция ЛЖ
Двухстворчатый аортальный клапан
Аномалия Эбштейна
Аритмия
Правожелудочковая недостаточность
Парадоксальная эмболия
Цианоз
Размеры и функция ПЖ
Степень трикуспидальной регургитации
ДМПП/ООО
Транспозиция магистральных
сосудов после операции пред-
сердного переключения (опе-
рация Мастарда, операция
Сеннига)
Хроническая сердечная недостаточность
Ухудшение функции артериального ПЖ
Аритмия
Синдром внезапной смерти
Инфекционный эндокардит
Размеры и функция артериального ПЖ
Степень регургитации на атриовентрикулярном
клапане
Стеноз и несостоятельность туннеля
Транспозиция магистральных
сосудов после операции
артериального переключения
(операция Жатене)
Аритмия
Сердечная недостаточность
Прогрессирующая дилатация аорты
Размеры и систолическая функция ЛЖ
Нарушения локальной сократимости
Диаметр корня аорты
Степень аортальной регургитации
Степень стеноза клапана легочной артерии
Гемодинамика после операции
Фонтена
Аритмия
Сердечная недостаточность
Тромбоэмболические осложнения
(эмболия легочной артерии)
Инфекционный эндокардит
Размеры и функция артериального желудочка
Степень регургитации на атриовентрикулярном
клапане
Размеры предсердий
Тромбы в предсердиях
Проходимость анастомозов после операции
Фонтена
СВОДНАЯ ИНФОРМАЦИЯ
Патологии сердца у беременных
ch43.indd 1129
03.04.2019 12:17:51
1130 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Патология
Возможные осложнения
в период беременности
Параметры, оцениваемые при ЭхоКГ
Синдром Эйзенменгера
Материнская смертность
Сердечная недостаточность
Аритмия
Прогрессирующий цианоз
Эмболия легочной артерии
Разрыв легочной артерии
Кровотечения
Размеры и функция ПЖ
Размеры и систолическая функция ЛЖ
Степень трикуспидальной регургитации
Систолическое давление в ПЖ
Стеноз аортального клапана
Хроническая сердечная недостаточность
Стенокардия
Обморок
Аритмия, включая внезапную смерть
Степень стеноза аортального клапана
Размеры и систолическая функция ЛЖ
Гипертрофия ЛЖ
Стеноз митрального клапана
Аритмия (наиболее часто — фибрилля-
ция предсердий)
Хроническая сердечная недостаточность
Тромбоэмболические осложнения
Степень стеноза митрального клапана
Размеры и систолическая функция ЛЖ
Размеры и систолическая функция ПЖ
Размеры ЛП
Систолическое давление в ПЖ
Биологический искусственный
клапан сердца
Аритмия
Хроническая сердечная недостаточность
Нарушение функции клапана (стеноз
или регургитация)
Размеры и систолическая функция ПЖ и ЛЖ
Систолическое давление в ПЖ
Механический искусственный
клапан сердца
Тромбоэмболические осложнения,
включая тромбоз протезированного
клапана
Аритмия
Сердечная недостаточность
Кровотечения
Нарушение функции клапана (стеноз
или регургитация)
Размеры и систолическая функция ЛЖ и ПЖ
Систолическое давление в ПЖ
Аортопатия
Расслоение аорты
Прогрессирующая дилатация аорты
Хроническая сердечная недостаточность
(у пациенток с аортальной
или митральной регургитацией)
Разрыв сосудов среднего калибра
Разрыв матки
Диаметр аорты
Степень аортальной регургитации
Пролапс митрального клапана
Степень митральной регургитации
Идиопатическая дилатационная
кардиомиопатия
Сердечная недостаточность
Аритмия, включая внезапную смерть
Размеры и систолическая функция ЛЖ
Степень митральной регургитации
Степень трикуспидальной регургитации
Систолическое давление в ПЖ
Периродовая кардиомиопатия
Материнская смертность
Сердечная недостаточность
Аритмия, включая внезапную смерть
Тромбоэмболические осложнения
(тромб в ЛЖ)
Размеры и систолическая функция ЛЖ
Тромб в ЛЖ
Степень митральной регургитации
Степень трикуспидальной регургитации
Систолическое давление в ПЖ
Гипертрофическая
кардиомиопатия
Сердечная недостаточность
Аритмия, включая внезапную смерть
Обморок
Размеры и систолическая функция ЛЖ
Гипертрофия ЛЖ
Размеры ЛП
Обструкция ВТЛЖ
Степень митральной регургитации
ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка; ДМЖП — дефект межжелудочковой перего-
родки; ДМПП — дефект межпредсердной перегородки; ЛЖ — левый желудочек; ЛП — левое предсердие; ОАП — открытый артериаль-
ный проток; ООО — открытое овальное окно; ПЖ — правый желудочек; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Патологии сердца у беременных
ch43.indd 1130
03.04.2019 12:17:51
1131
43 Заболевания сердца во время беременности
ЛИТЕРАТУРА
1. Karamermer Y, Roos-Hesselink JW. Preg-
nancy and adult congenital heart disease, Ex-
pert Rev Cardiovasc Ther 5:859–869, 2007.
2. Robson SC, Hunter S, Boys RJ, Dunlop W.
Serial study of factors influencing changes in
cardiac output during human pregnancy, Am
J Physiol 256:H1060–H1065, 1989.
3. Duvekot JJ, Cheriex EC, Pieters FA, et al. Ear-
ly pregnancy changes in hemodynamics and
volume homeostasis are consecutive adjust-
ments triggered by a primary fall in systemic
vascular tone, Am J Obstet Gynecol 169:1382–
1392, 1993.
4. Clark SL, Cotton DB, Lee W, et al. Central he-
modynamic assessment of normal term preg-
nancy, Am J Obstet Gynecol 161:1439–1442,
1989.
5. Rubler S, Damani PM, Pinto ER.. Cardiac size
and performance during pregnancy estimated
with echocardiography, Am J Cardiol 40:534–
540, 1977.
6. Katz R, Karliner JS, Resnik R. Effects of a nat-
ural volume overload state (pregnancy) on
left ventricular performance in normal hu-
man subjects, Circulation 58:434–441, 1978.
7. Mabie WC, DiSessa TG, Crocker LG, et al. A
longitudinal study of cardiac output in nor-
mal human pregnancy, Am J Obstet Gynecol
170:849–856, 1994.
8. Robson SC, Hunter S, Moore M, Dunlop W.
Haemodynamic changes during the puerpe-
rium: a Doppler and M-mode echocardio-
graphic study, Br J Obstet Gynaecol 94:1028–
1039, 1987.
9. Ueland K, Novy MJ, Metcalfe J. Hemody-
namic responses of patients with heart disease
to pregnancy and exercise, Am J Obstet Gyne-
col 113:47–59, 1972.
10. Wald RM, Silversides CK, Kingdom J, et al.
Maternal cardiac output and fetal Doppler
predict adverse neonatal outcomes in preg-
nant women with heart disease, J Am Heart
Assoc 4, 2015. ii.
11. Campos O. Doppler Echocardiography dur-
ing pregnancy: physiological and abnormal
findings, Echocardiography 13:135–146, 1996.
12. Campos O, Andrade JL, Bocanegra J, et al.
Physiologic multivalvular regurgitation dur-
ing pregnancy: a longitudinal Doppler echo-
cardiographic study, Int J Cardiol 40:265–272,
1993.
13. Mashini IS, Albazzaz SJ, Fadel HE, et al. Se-
rial noninvasive evaluation of cardiovascular
hemodynamics during pregnancy, Am J Ob-
stet Gynecol 156:1208–1213, 1987.
14. Geva T, Mauer MB, Striker L, et al. Effects of
physiologic load of pregnancy on left ventric-
ular contractility and remodeling, Am Heart
J 133:53–59, 1997.
15. Vogt M, Muller J, Kuhn A, et al. Cardiac ad-
aptation of the maternal heart during preg-
nancy: a color-coded tissue Doppler imaging
study — feasibility, reproducibility and
course during pregnancy, Ultraschall Med
36:270–275, 2015.
16. Siu SC, Sermer M, Harrison DA, et al. Risk
and predictors for pregnancy-related compli-
cations in women with heart disease, Circula-
tion 96:2789–2794, 1997.
17. Siu SC, Sermer M, Colman JM, et al. Prospec-
tive multicenter study of pregnancy out-
comes in women with heart disease, Circula-
tion 104:515–521, 2001.
18. Drenthen W, Boersma E, Balci A, et al. Pre-
dictors of pregnancy complications in women
with congenital heart disease, Eur Heart J
31:2124–2132, 2010.
19. Liu H, Huang T, Zhao W, et al. Pregnancy
outcomes and relative risk factors among
Chinese women with congenital heart disease,
Int J Gynaecol Obstet 120:245–248, 2013.
20. Khairy P, Ouyang DW, Fernandes SM, et al.
Pregnancy outcomes in women with congen-
ital heart disease, Circulation 113:517–524,
2006.
21. Drenthen W, Pieper PG, Roos-Hesselink JW,
et al. Outcome of pregnancy in women with
congenital heart disease: a literature review,
J Am Coll Cardiol 49:2303–2311, 2007.
22. Thorne S, MacGregor A, Nelson-Piercy C.
Risks of contraception and pregnancy in
heart disease, Heart 92:1520–1525, 2006.
23. Regitz-Zagrosek V, Blomstrom Lundqvist C,
Borghi C, et al. ESC Guidelines on the man-
agement of cardiovascular diseases during
pregnancy: the Task Force on the Manage-
ment of Cardiovascular Diseases during Preg-
nancy of the European Society of Cardiology
(ESC), Eur Heart J 32:3147–3197, 2011.
24. Roos-Hesselink JW, Ruys TP, Stein JI, et al.
Outcome of pregnancy in patients with struc-
tural or ischaemic heart disease: results of a
registry of the European Society of Cardiol-
ogy, Eur Heart J 34:657–665, 2013.
25. Yap SC, Drenthen W, Pieper PG, et al. Preg-
nancy outcome in women with repaired ver-
sus unrepaired isolated ventricular septal de-
fect, BJOG 117:683–689, 2010.
26. Yap SC, Drenthen W, Meijboom FJ, et al.
Comparison of pregnancy outcomes in wom-
en with repaired versus unrepaired atrial sep-
tal defect, BJOG 116:1593–1601, 2009.
27. Drenthen W, Pieper PG, van der Tuuk K, et
al. Cardiac complications relating to pregnan-
cy and recurrence of disease in the offspring
of women with atrioventricular septal defects,
Eur Heart J 26:2581–2587, 2005.
28. Drenthen W, Boersma E, Balci A, et al. Pre-
dictors of pregnancy complications in women
with congenital heart disease, Eur Heart J
31:2124–2132, 2010.
29. Veldtman GR, Connolly HM, Grogan M, et
al. Outcomes of pregnancy in women with te-
tralogy of Fallot, J Am Coll Cardiol 44:174–
180, 2004.
30. Greutmann M, Von Klemperer K, Brooks R,
et al. Pregnancy outcome in women with con-
genital heart disease and residual haemody-
namic lesions of the right ventricular outflow
tract, Eur Heart J 31:2124–2132, 2010.
31. Uebing A, Arvanitis P, Li W, et al. Effect of
pregnancy on clinical status and ventricular
function in women with heart disease, Int
J Cardiol 139:50–59, 2010.
32. Egidy Assenza G, Cassater D, Landzberg M,
et al. The effects of pregnancy on right ven-
tricular remodeling in women with repaired
tetralogy of Fallot, Int J Cardiol 168:1847–
1852, 2013.
33. Metz TD, Hayes SA, Garcia CY, Yetman AT.
Impact of pregnancy on the cardiac health of
women with prior surgeries for pulmonary
valve anomalies, Am J Obstet Gynecol 209,
2013. 370 e1–6 .
34. Beauchesne LM, Connolly HM, Ammash
NM, Warnes CA. Coarctation of the aorta:
outcome of pregnancy, J Am Coll Cardiol
38:1728–1733, 2001.
35. Vriend JW, Drenthen W, Pieper PG, et al.
Outcome of pregnancy in patients after re-
pair of aortic coarctation, Eur Heart J
26:2173–2178, 2005.
36. Krieger EV, Landzberg MJ, Economy KE, et
al. Comparison of risk of hypertensive com-
plications of pregnancy among women with
versus without coarctation of the aorta, Am J
Cardiol 107:1529–1534, 2011.
37. Tan JL, Babu-Narayan SV, Henein MY, et al.
Doppler echocardiographic profile and in-
dexes in the evaluation of aortic coarctation
in patients before and after stenting, J Am
Coll Cardiol 46:1045–1053, 2005.
38. Connolly HM, Warnes CA. Ebstein’s anoma-
ly: outcome of pregnancy, J Am Coll Cardiol
23:1194–1198, 1994.
39. Donnelly JE, Brown JM, Radford DJ. Preg-
nancy outcome and Ebstein’s anomaly, Br
Heart J 66:368–371, 1991.
40. Drenthen W, Pieper PG, Ploeg M, et al. Risk
of complications during pregnancy after Sen-
ning or Mustard (atrial) repair of complete
transposition of the great arteries, Eur Heart
J 26:2588–2595, 2005.
41. Clarkson PM, Wilson NJ, Neutze JM, et al.
Outcome of pregnancy after the Mustard op-
eration for transposition of the great arteries
with intact ventricular septum, J Am Coll Car-
diol 24:190–193, 1994.
42. Genoni M, Jenni R, Hoerstrup SP, et al. Preg-
nancy after atrial repair for transposition of
the great arteries, Heart 81:276–277, 1999.
43. Guedes A, Mercier LA, Leduc L, et al. Impact
of pregnancy on the systemic right ventricle
after a Mustard operation for transposition
of the great arteries, J Am Coll Cardiol 44:433–
437, 2004.
44. Radford DJ, Stafford G. Pregnancy and the
Rastelli operation, Aust N Z J Obstet Gynaecol
45:243–247, 2005.
45. Tobler D, Fernandes SM, Wald RM, et al.
Pregnancy outcomes in women with transpo-
sition of the great arteries and arterial switch
operation, Am J Cardiol 106:417–420, 2010.
46. Connolly HM, Grogan M, Warnes CA. Preg-
nancy among women with congenitally cor-
rected transposition of great arteries, J Am
Coll Cardiol 33:1692–1695, 1999.
47. Therrien J, Barnes I, Somerville J. Outcome of
pregnancy in patients with congenitally cor-
rected transposition of the great arteries, Am
J Cardiol 84:820–824, 1999.
48. Canobbio MM, Mair DD, van der Velde M,
Koos BJ. Pregnancy outcomes after the Fon-
tan repair, J Am Coll Cardiol 28:763–767,
1996.
49. Drenthen W, Pieper PG, Roos-Hesselink JW,
et al. Pregnancy and delivery in women after
Fontan palliation, Heart 92:1290–1294, 2006.
50. Presbitero P, Somerville J, Stone S, et al. Preg-
nancy in cyanotic congenital heart disease.
Outcome of mother and fetus, Circulation
89:2673–2676, 1994.
51. Gleicher N, Midwall J, Hochberger D, Jaffin
H. Eisenmenger’s syndrome and pregnancy,
Obstet Gynecol Surv 34:721–741, 1979.
52. Weiss BM, Zemp L, Seifert B, Hess OM. Out-
come of pulmonary vascular disease in preg-
nancy: a systematic overview from 1978
through 1996, J Am Coll Cardiol 31:1650–
1657, 1998.
53. Bedard E, Dimopoulos K, Gatzoulis MA. Has
there been any progress made on pregnancy
outcomes among women with pulmonary ar-
terial hypertension? Eur Heart J 30:256–265,
2009.
54. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC guideline for the manage-
ment of patients with valvular heart disease:
executive summary: a report of the American
ch43.indd 1131
03.04.2019 12:17:51
1132 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
College of Cardiology/American Heart Asso-
ciation Task Force on Practice Guidelines,
J Am Coll Cardiol 63:2438–2488, 2014.
55. Lao TT, Sermer M, MaGee L, et al. Congenital
aortic stenosis and pregnancy — a reappraisal,
Am J Obstet Gynecol 169:540–545, 1993.
56. Hameed A, Karaalp IS, Tummala PP, et al.
The effect of valvular heart disease on mater-
nal and fetal outcome of pregnancy, J Am Coll
Cardiol 37:893–899, 2001.
57. Silversides CK, Colman JM, Sermer M, et al.
Early and intermediate-term outcomes of
pregnancy with congenital aortic stenosis, Am
J Cardiol 91:1386–1389, 2003.
58. Yap SC, Drenthen W, Pieper PG, et al. Risk
of complications during pregnancy in women
with congenital aortic stenosis, Int J Cardiol
126:240–246, 2008.
59. Tzemos N, Silversides CK, Colman JM, et al.
Late cardiac outcomes after pregnancy in
women with congenital aortic stenosis, Am
Heart J 157:474–480, 2009.
60. Tzemos N, Harris L, Carasso S, et al. Adverse
left ventricular mechanics in adults with re-
paired tetralogy of Fallot, Am J Cardiol 103:
420–425, 2009.
61. Tzemos N, Silversides CK, Carasso S, et al. Ef-
fect of pregnancy on left ventricular motion
(twist) in women with aortic stenosis, Am J
Cardiol 101:870–873, 2008.
62. Silversides CK, Colman JM, Sermer M, Siu
SC. Cardiac risk in pregnant women with
rheumatic mitral stenosis, Am J Cardiol 91:
1382–1385, 2003.
63. Sawhney H, Aggarwal N, Suri V, et al. Mater-
nal and perinatal outcome in rheumatic heart
disease, Int J Gynaecol Obstet 80:9–14, 2003.
64. Avila WS, Rossi EG, Ramires JA, et al. Preg-
nancy in patients with heart disease: experi-
ence with 1,000 cases, Clin Cardiol 26:135–
142, 2003.
65. Lesniak-Sobelga A, Tracz W, KostKiewicz M,
et al. Clinical and echocardiographic assess-
ment of pregnant women with valvular heart
diseases — maternal and fetal outcome, Int J
Cardiol 94:15–23, 2004.
66. Diao M, Kane A, Ndiaye MB, et al. Pregnancy
in women with heart disease in sub-Saharan
Africa, Arch Cardiovasc Dis 104:370–374, 2011.
67. al Kasab SM, Sabag T, al Zaibag M, et al. Be-
ta-adrenergic receptor blockade in the man-
agement of pregnant women with mitral ste-
nosis, Am J Obstet Gynecol 163:37–40, 1990.
68. Iung B, Cormier B, Elias J, et al. Usefulness of
percutaneous balloon commissurotomy for
mitral stenosis during pregnancy, Am J Car-
diol 73:398–400, 1994.
69. Chan WS, Anand S, Ginsberg JS. Anticoagu-
lation of pregnant women with mechanical
heart valves: a systematic review of the litera-
ture, Arch Intern Med 160:191–196, 2000.
70. Hassouna A, Allam H. Limited dose warfarin
throughout pregnancy in patients with me-
chanical heart valve prosthesis: a meta-analy-
sis, Interact Cardiovasc Thorac Surg 18:797–
806, 2014.
71. McLintock C, McCowan LM, North RA. Ma-
ternal complications and pregnancy outcome
in women with mechanical prosthetic heart
valves treated with enoxaparin, BJOG
116:1585–1592, 2009.
72. Yinon Y, Siu SC, Warshafsky C, et al. Use of
low molecular weight heparin in pregnant
women with mechanical heart valves, Am J
Cardiol 104:1259–1263, 2009.
73. Bates SM, Greer IA, Middeldorp S, et al. VTE,
thrombophilia, antithrombotic therapy, and
pregnancy: antithrombotic therapy and pre-
vention of thrombosis, 9th ed: American Col-
lege of Chest Physicians Evidence-Based
Clinical Practice Guidelines, Chest 141:e691S–
736S, 2012.
74. North RA, Sadler L, Stewart AW, et al. Long-
term survival and valve-related complications
in young women with cardiac valve replace-
ments, Circulation 99:2669–2676, 1999.
75. Immer FF, Bansi AG, Immer-Bansi AS, et al.
Aortic dissection in pregnancy: analysis of
risk factors and outcome, Ann Thorac Surg
76:309–314, 2003.
76. Rossiter JP, Repke JT, Morales AJ, et al. A
prospective longitudinal evaluation of preg-
nancy in the Marfan syndrome, Am J Obstet
Gynecol 173:1599–1606, 1995.
77. Goland S, Elkayam U. Cardiovascular prob-
lems in pregnant women with Marfan syn-
drome, Circulation 119:619–623, 2009.
78. Donnelly RT, Pinto NM, Kocolas I, Yetman
AT. The immediate and long-term impact of
pregnancy on aortic growth rate and mortal-
ity in women with Marfan syndrome, J Am
Coll Cardiol 60:224–229, 2012.
79. Meijboom LJ, Vos FE, Timmermans J, et al.
Pregnancy and aortic root growth in the Mar-
fan syndrome: a prospective study, Eur Heart
J 26:914–920, 2005.
80. Ruys TP, Roos-Hesselink JW, Hall R, et al.
Heart failure in pregnant women with cardiac
disease: data from the ROPAC, Heart 100:231–
238, 2014.
81. Grewal J, Siu SC, Ross HJ, et al. Pregnancy
outcomes in women with dilated cardiomy-
opathy, J Am Coll Cardiol 55:45–52, 2009.
82. Sliwa K, Hilfiker-Kleiner D, Petrie MC, et al.
Current state of knowledge on aetiology, di-
agnosis, management, and therapy of peri-
partum cardiomyopathy: a position state-
ment from the Heart Failure Association of
the European Society of Cardiology Working
Group on peripartum cardiomyopathy, Eur J
Heart Fail 12:767–778, 2010.
83. McNamara DM, Elkayam U, Alharethi R, et
al. Clinical Outcomes for Peripartum Cardio-
myopathy in North America: Results of the
IPAC Study (Investigations of Pregnancy-As-
sociated Cardiomyopathy), J Am Coll Cardiol
66:905–914, 2015.
84. Elkayam U. Clinical characteristics of peri-
partum cardiomyopathy in the United States:
diagnosis, prognosis, and management, J Am
Coll Cardiol 58:659–670, 2011.
85. Sliwa K, Forster O, Libhaber E, et al. Peripar-
tum cardiomyopathy: inflammatory markers
as predictors of outcome in 100 prospectively
studied patients, Eur Heart J 27:441–446,
2006.
86. Sliwa K, Blauwet L, Tibazarwa K, et al. Evalu-
ation of bromocriptine in the treatment of
acute severe peripartum cardiomyopathy: a
proof-of-concept pilot study, Circulation
121:1465–1473, 2010.
87. Elkayam U, Tummala PP, Rao K, et al. Mater-
nal and fetal outcomes of subsequent pregnan-
cies in women with peripartum cardiomyopa-
thy, N Engl J Med 344:1567–1571, 2001.
88. Autore C, Conte MR, Piccininno M, et al.
Risk associated with pregnancy in hypertro-
phic cardiomyopathy, J Am Coll Cardiol
40:1864–1869, 2002.
89. Avila WS, Amaral FM, Ramires JA, et al. In-
fluence of pregnancy on clinical course and
fetal outcome of women with hypertrophic
cardiomyopathy, Arq Bras Cardiol 88:480–
485, 2007.
90. Thaman R, Varnava A, Hamid MS, et al. Preg-
nancy related complications in women with
hypertrophic cardiomyopathy, Heart 89:752–
756, 2003.
91. Pieper PG, Balci A, Aarnoudse JG, et al.
Uteroplacental blood flow, cardiac function,
and pregnancy outcome in women with con-
genital heart disease, Circulation 128:2478–
2487, 2013.
92. Thangaroopan M, Wald RM, Silversides CK,
et al. Incremental diagnostic yield of pediat-
ric cardiac assessment after fetal echocardiog-
raphy in the offspring of women with con-
genital heart disease: a prospective study, Pe-
diatrics 121:e660–665, 2008.
93. Robertson JE, Silversides CK, Mah ML, et al.
A contemporary approach to the obstetric
management of women with heart disease,
J Obstet Gynaecol Can 34:812–819, 2012.
94. Dajani AS, Taubert KA, Wilson W, et al. Pre-
vention of bacterial endocarditis. Recom-
mendations by the American Heart Associa-
tion, JAMA 277:1794–1801, 1997.
95. Reddy VY, Morales G, Ahmed H, et al. Cath-
eter ablation of atrial fibrillation without the
use of fluoroscopy, Heart Rhythm 7:1644–
1653, 2010.
96. Weiss BM, von Segesser LK, Alon E, et al.
Outcome of cardiovascular surgery and preg-
nancy: a systematic review of the period
1984–1996, Am J Obstet Gynecol 179:1643–
1653, 1998.
97. John AS, Gurley F, Schaff HV, et al. Cardio-
pulmonary bypass during pregnancy, Ann
Thorac Surg 91:1191–1196, 2011.
98. Arnoni RT, Arnoni AS, Bonini RC, et al. Risk
factors associated with cardiac surgery during
pregnancy, Ann Thorac Surg 76:1605–1608,
2003.
99. Vered Z, Poler SM, Gibson P, et al. Noninva-
sive detection of the morphologic and hemo-
dynamic changes during normal pregnancy,
Clin Cardiol 14:327–334, 1991.
100. Savu O, Jurcut R, Giusca S, et al. Morpholog-
ical and functional adaptation of the mater-
nal heart during pregnancy, Circ Cardiovasc
Imaging 5:289–297, 2012.
101. Sadaniantz A, Kocheril AG, Emaus SP, et al.
Cardiovascular changes in pregnancy evalu-
ated by two-dimensional and Doppler echo-
cardiography, J Am Soc Echocardiogr 5:253–
258, 1992.
102. Boodhwani M, Andelfinger G, Leipsic J, et al.
Canadian Cardiovascular Society position
statement on the management of thoracic aor-
tic disease, Can J Cardiol 30:577–589, 2014.
103. Hiratzka LF, Bakris GL, Beckman JA, et al.
2010 ACCF/AHA/AATS/ACR/ASA/SCA/AI/
SIR/STS/SVM Guidelines for the diagnosis
and management of patients with thoracic
aortic disease. A Report of the American Col-
lege of Cardiology Foundation/American He-
art Association Task Force on Practice Gui-
delines, American Association for Thoracic
Surgery, American College of Radiology,
American Stroke Association, Society of Car-
diovascular Anesthesiologists, Society for
Cardiovascular Angiography and Interven-
tions, Society of Interventional Radiology,
Society of Thoracic Surgeons, and Society for
Vascular Medicine, J Am Coll Cardiol 55:e27–
129, 2010.
104. Silversides CK, Marelli A, Beauchesne L, et al.
Canadian Cardiovascular Society 2009 Con-
sensus Conference on the management of
adults with congenital heart disease: executive
summary, Can J Cardiol 26:143–150, 2010.
ch43.indd 1132
03.04.2019 12:17:51
1133
44
Врожденные
внутрисердечные шунты
JEANNETTE LIN, MD • JAMIL A. ABOULHOSN, MD
Открытое овальное окно
Анатомия и патофизиология
Визуализация
Тактика лечения
Шунты на уровне предсердий
Анатомия и патофизиология
Тактика лечения
Дефект межпредсердной перегородки
типа ostium secundum
Анатомия и патофизиология
Визуализация
Тактика лечения
Дефект межпредсердной перегородки
типа ostium primum
Анатомия и патофизиология
Визуализация
Тактика лечения
Дефект венозного синуса
Анатомия и патофизиология
Визуализация
Тактика лечения
Дефект крыши коронарного синуса
Анатомия и патофизиология
Визуализация
Тактика лечения
Аномальный дренаж легочных вен
Анатомия и патофизиология
Визуализация
Тактика лечения
Дефект межжелудочковой
перегородки
Патофизиология и номенклатура
Анатомия и визуализация
Тактика лечения
Разрыв аневризмы синуса
Вальсальвы
Анатомия и патофизиология
Визуализация
Тактика лечения
Открытый артериальный проток
Анатомия и патофизиология
Визуализация
Тактика лечения
Фистула коронарной артерии
Анатомия и патофизиология
Визуализация
Тактика лечения
Врожденные пороки сердца (ВПС) встречаются при-
близительно у 1 из 100 взрослых людей. ВПС под-
разделяют на легкие, средние и тяжелые, что соот-
ветствует выраженности клинических проявлений
и уровню смертности (табл. 44 .1) [1].
Для диагностики и лечения ВПС нужны глубо-
кие знания: (1) анатомии и физиологии сердца при
рождении; (2) изменений анатомии и физиологии
сердца по мере развития организма; (3) влияния
особых состояний (например, беременности) и за-
болеваний взрослого человека (например, артери-
альной гипертензии, ишемической болезни сердца)
на физиологию сердца; (4) современных и истори-
ческих методов хирургического лечения каждого из
ВПС; (5) наличия и степени выраженности после-
операционных остаточных явлений, осложнений и
их последствий; (6) эхокардиографической карти-
ны различных типов устройств, используемых для
коррекции ВПС, осложнений и их последствий;
(7) эффективных методов визуализации и оценки
гемодинамики сердца.
Цель специалиста, проводящего эхокардиогра-
фию (ЭхоКГ), — выявить заболевание, определить
наличие либо отсутствие сопутствующих ВПС, оце-
нить остаточные явления или последствия как по-
сле коррекции ВПС, так и при ее отсутствии.
Использование допплерографии облегчает не-
инвазивную оценку функции желудочков и клапа-
нов, давления в полостях сердца и в большинстве
случаев ВПС избавляет от необходимости проведе-
ния катетеризации сердца. ЭхоКГ предоставляет
подробную информацию о размерах и функции же-
лудочков, степени их гипертрофии; размерах пред-
сердий, межпредсердной и внутрипредсердной ана-
томии, соединении устьев легочных и полых вен с
предсердиями. Использование импульсно-волно-
вой и непрерывно-волновой допплерографии и
цветового допплеровского картирования (ЦДК) кро-
вотока в комбинации с визуализацией в 2D-режиме
позволяет локализовать нативные врожденные вну-
трисердечные шунты, выявить остаточное шунти-
рование после коррекции, оценить скорость потока
крови и рассчитать градиенты давления на внутри-
сердечных шунтах.
Трансторакальную эхокардиографию (ТТЭхоКГ)
рекомендуется выполнять при первичном обследо-
вании бессимптомных пациентов с отклонениями
на электрокардиограмме или на рентгенограмме
ch44.indd 1133
03.04.2019 12:18:05
1134 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
грудной клетки при подозрении на наличие струк-
турных изменений в сердце, а также при выслуши-
вании сердечного шума [2]. Всех пациентов со зна-
чительной дилатацией полостей сердца либо дис-
функцией миокарда даже при отсутствии симптомов
следует рассматривать в качестве кандидатов на
оперативное лечение для предотвращения отдален-
ных осложнений из-за постоянной перегрузки объ-
емом или давлением. Все пациенты (оперирован-
ные и неоперированные) должны регулярно про-
ходить осмотр кардиолога и выполнять ЭхоКГ на
протяжении всей жизни, т.к. ВПС могут сопрово-
ждаться поздними осложнениями — остаточным
шунтированием через дефект, аритмией, сердечной
недостаточностью [3]. ЭхоКГ также рекомендуется
в качестве метода визуализации при первичном и
регулярном обследованиях пациентов с признака-
ми правожелудочковой либо левожелудочковой не-
достаточности, легочной гипертензии, предсердных
аритмий, эндокардита.
Чреспищеводная эхокардиография (ЧПЭхоКГ) и
внутрисердечная эхокардиография (ВСЭхоКГ) по-
зволяют улучшить визуализацию клапанов левых
отделов сердца, задней части сердца и предоставля-
ют бесценную информацию для диагностики и пла-
нирования оперативного вмешательства при ВПС.
Если после этих методов визуализации остаются во-
просы (особенно касающиеся внесердечных струк-
тур), для получения дополнительной информации
можно провести магнитно-резонансную томогра-
фию (МРТ) или компьютерную томографию (КТ).
Катетеризацию сердца в диагностических целях
проводят для измерения давления в полостях серд-
ца, легочной артерии, подтверждения степени шун-
тирования и дооперационной оценки коронарных
артерий у пожилых людей.
При клинической оценке внутрисердечных шун-
тов и при оценке с помощью ЭхоКГ рекомендуется
определить, какая полость принимает дополнитель-
ный поток крови через внутрисердечный шунт, т.е.
установить его вид — претрикуспидальный или пост-
трикуспидальный (табл. 44 .2). Претрикуспидаль-
ные шунты приводят к перегрузке объемом правых
отделов сердца и, соответственно, к симптомам и
эхокардиографическим признакам дилатации пра-
вых отделов сердца. Обычно претрикуспидальные
шунты не приводят к значительным изменениям в
малом круге кровообращения. Степень шунтирова-
ния зависит от размера дефекта и относительной
эластичности правого желудочка (ПЖ) и левого же-
лудочка (ЛЖ). Посттрикуспидальные шунты при-
водят к перегрузке давлением ПЖ и перегрузке объ-
емом левого предсердия (ЛП) и ЛЖ.
У пациентов могут быть симптоматика левоже-
лудочковой недостаточности и эхокардиографиче-
ские признаки гипертрофии ПЖ с возможной его
дилатацией и дисфункцией из-за постоянной повы-
шенной постнагрузки и расширения ЛП и ЛЖ
вследствие перегрузки объемом. Степень шунтиро-
вания зависит от размера дефекта и соотношения
системного сосудистого сопротивления и легочного
сосудистого сопротивления (ЛСС).
И претрикуспидальные, и посттрикуспидальные
шунты могут стать причиной правожелудочковой
недостаточности. Нерестриктивные посттрикуспи-
дальные шунты в отсутствие хирургической кор-
рекции в первые годы жизни приводят к прогресси-
рующему возрастанию ЛСС и в конечном итоге —
к изменению направления потока крови (синдрому
Эйзенменгера).
Фистула коронарной артерии обычно имеет не-
большой размер и не приводит к значительной пе-
Легкие
Средние
Тяжелые
ВПС, естественное течение которого не приводит
к ухудшению состояния
Малый ДМПП
Изолированный небольшой ДМЖП
Прооперированный ВПС
Предшествующее закрытие/лигирование ОАП
Прооперированный ДМПП типа ostium secundum,
дефект венозного синуса без остаточного
шунтирования
Прооперированный ДМЖП без остаточного
шунтирования
Полный либо частичный аномальный
дренаж легочных вен
ДМПП типа ostium primum
Открытый артериальный проток
(который не закрывается естествен-
ным путем)
Фистула/аневризма синуса Вальсальвы
Дефект венозного синуса ДМЖП в
сочетании с другими пороками
сердца
Синдром Эйзенменгера
ВПС — врожденный порок сердца; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки;
ОАП — открытый артериальный проток.
[Warnes C, Williams R, Bashore T, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summa-
ry, a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop
Guidelines for the Management of Adults With Congenital Heart Disease) Developed in Collaboration With the American Society of Echocardiog-
raphy, Heart Rhythm Society, International Society for Adult Congenital Heart Disease, Society for Cardiovascular Angiography and Interven-
tions, and Society of Thoracic Surgeons, J Am Coll Cardiol 52:1890–1947, 2008.]
ТАБЛИЦА 44.1 Классификация врожденных пороков сердца
ch44.indd 1134
03.04.2019 12:18:06
1135
44 Врожденные внутрисердечные шунты
регрузке объемом, но может сопровождаться сим-
птомами коронарной недостаточности.
Отношение легочного кровотока (Qp) к систем-
ному (Qs) можно определить неинвазивными мето-
дами с помощью допплерографии, измерив удар-
ный объем в двух точках внутри сердца (рис. 44 .1).
Чаще всего Qp рассчитывают через площадь попе-
речного сечения (cross-sectional area, CSA) легочно-
го ствола и интеграл скорости кровотока (VTI) в
нем, измеренной в месте расчета площади при им-
пульсно-волновой допплерографии, а Qs — через
CSA выходного тракта левого желудочка (ВТЛЖ) и
VTI в ВТЛЖ. Данный метод расчета надежен при хо-
рошем качестве двухмерных изображений, позво-
ляющем точно измерить диаметры ВТЛЖ, выход-
ного тракта правого желудочка (ВТПЖ), легочного
ствола, а также при получении допплеровских сиг-
налов, параллельных потоку. Однако даже неболь-
шие погрешности при измерениях в 2D-режиме мо-
гут привести к неверным расчетам.
При наличии несоответствия между Qp/Qs, вы-
численному по данным ЭхоКГ, и другими эхокар-
диографическими или клиническими признаками
следует провести катетеризацию сердца, а затем рас-
считать Qp и Qs по уравнению Фика.
ОТКРЫТОЕ ОВАЛЬНОЕ ОКНО
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
В большинстве случаев первичная перегородка (sep-
tum primum) и вторичная перегородка (septum se-
cundum) после рождения сливаются. Неполное сли-
яние приводит к остаточному отверстию в области
овальной ямки. По данным аутопсии, открытое
овальное окно (ООО) имели приблизительно 10–
35% людей [4]. У пациентов с аневризмой межпред-
сердной перегородки более вероятно наличие ООО.
В отличие от дефекта межпредсердной перего-
родки (ДМПП), который является истинным отвер-
стием в перегородке, ООО возникает в результате
нарушения слияния первичной и вторичной пере-
городок и выступает в роли функционального вну-
трисердечного шунта, который открывается, когда
давление в правом предсердии (ПП) выше, чем в
ЛП, и закрывается в противоположной ситуации
(рис. 44 .2).
Давление в ПП повышается при легочной гипер-
тензии, обструкции ВТПЖ и трикуспидальной ре-
гургитации. При этих состояниях заслонка ООО
может приоткрываться, что приводит к сбросу кро-
ви справа налево. В других случаях ООО может
Претрикуспидальный шунт
Посттрикуспидальный шунт
Полость, принимающая
дополнительный поток крови
через шунт
Вены большого круга кровообращения (НПВ, ВПВ)
ПП
Коронарный синус
ПЖ
Легочный ствол
Примеры
Шунт на уровне предсердий
ДМПП типа ostium secundum
ДМПП типа ostium primum
Дефект венозного синуса
Дефект крыши коронарного синуса
Дефект предсердно-желудочковой перегородки
Аномальный дренаж легочных вен (частичный
или тотальный)
Разрыв аневризмы синуса Вальсальвы в ПП
ДМЖП
ОАП
Разрыв аневризмы синуса Валь-
сальвы в ПЖ
Гемодинамика
Перегрузка объемом правых отделов сердца
Перегрузка давлением ПЖ
Перегрузка объемом левых
отделов сердца
Эхокардиографические признаки Расширение ПП
Расширение ПЖ
Трикуспидальная регургитация
Умеренное повышение давления в легочной артерии
Уплощение межжелудочковой перегородки во время
диастолы
Гипертрофия ПЖ
Расширение ЛП
Повышение давления в легочной
артерии при массивном сбросе
крови или изменении направле-
ния потока крови через дефект
(синдром Эйзенменгера)
Уплощение межжелудочковой
перегородки во время систолы
и во время диастолы
ВПВ — верхняя полая вена; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки; ЛЖ — ле-
вый желудочек; ЛП — левое предсердие; НПВ — нижняя полая вена; ОАП — открытый артериальный проток; ПЖ — правый желудо-
чек; ПП — правое предсердие.
ТАБЛИЦА 44.2 Сравнительная характеристика претрикуспидальных и посттрикуспидальных шунтов
ch44.indd 1135
03.04.2019 12:18:06
1136 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
«растягиваться», и в межпредсердной перегородке
образуется небольшой, но постоянный внутрисер-
дечный шунт.
Степень шунтирования через ООО редко бывает
гемодинамически значимой. Большинство пациен-
тов не имеют симптомов, в редких случаях могут
быть клинические признаки. У пациентов без зна-
чимой легочной гипертензии может наблюдаться
умеренная гипоксемия в покое или при физической
нагрузке, а также снижение сатурации при переходе
из положения лежа в положение сидя или стоя (та-
кое состояние называют платипноэ-ортодеоксией).
Причина десатурации у этих пациентов неизвестна,
но, возможно, десатурация связана с наличием ев-
стахиевой заслонки или растяжением межпредсерд-
ной перегородки при изменении положения тела.
У пациентов с тяжелой легочной гипертензией и
ООО сброс крови справа налево может усугубить
гипоксемию. Однако в некоторых случаях ООО вы-
ступает в качестве гемодинамически важного для
правых отделов сердца «предохранительного клапа-
на», позволяющего частично снизить перегрузку
объемом и давлением ПЖ за счет сброса крови, в
результате чего возникает цианоз. Закрытие ООО у
пациентов с тяжелой легочной гипертензией может
спровоцировать увеличение деформации миокарда
в правых отделах сердца и ухудшить гемодинамику
и симптоматику.
Рис. 44 .1 Расчет легочного кровотока и системного кровотока. (А) Легочный кровоток (Qp) равен площади поперечного сечения (CSA) легочного ствола
(ЛС) (CSAЛС), умноженной на интеграл скорости кровотока в легочном стволе (VTIЛС), измеренной в том же месте. (Б) Системный кровоток (Qs) равен площади
поперечного сечения выходного тракта левого желудочка (ВТЛЖ) (CSAВТЛЖ), умноженной на интеграл скорости кровотока в выходном тракте левого желудочка
(VTIВТЛЖ).
Допплеровская кривая ЛС
Контрольный объем
Диаметр ЛС
м
/
с
е
к
1
2
VTIЛC
Qp = CSAЛC × VTIЛC
А
Диаметр ВТЛЖ
м
/
с
е
к
1
2
Допплеровская кривая ВТЛЖ
VTIВТЛЖ
Qs = CSAВТЛЖ × VTIВТЛЖ
Б
Рис. 44.2 Шунты на уровне предсердий. (А) Открытое овальное окно (ООО). (Б) Дефект межпредсердной перегородки (ДМПП) типа ostium secundum.
(В) ДМПП типа ostium primum с общим атриовентрикулярным клапаном (ОАВК) и приточным дефектом межжелудочковой перегородки (ДМЖП). МК — митраль-
ный клапан; ТК — трикуспидальный клапан.
ООО
ТК
МК
Приточный
ДМЖП
ДМПП типа
ostium primum
О
А
В
К
ДМПП типа
ostium secundum
А
Б
В
ch44.indd 1136
03.04.2019 12:18:06
1137
44 Врожденные внутрисердечные шунты
ВИЗУАЛИЗАЦИЯ
У взрослых пациентов при ТТЭхоКГ ООО визуали-
зируется редко. Как правило, ООО подозревают у
пациентов с криптогенным инсультом или систем-
ной эмболией, которым следует провести пробу с
пузырьковым контрастированием. Эта проба про-
тивопоказана пациентам со значительным сбросом
крови справа налево (например, при синдроме Эй-
зенменгера) из-за повышенного риска инсульта от
воздушной эмболии.
Пробу с пузырьковым контрастированием вы-
полняют практически повсеместно, но каждая кли-
ника имеет свою методику проведения. Как прави-
ло, 8–9 мл физиологического раствора перемешива-
ют с 1 мл воздуха и быстро проталкивают данную
взвесь через трехпросветный порт двумя шприца-
ми, а затем сразу вводят через периферический ли-
бо центральный венозный доступ. Пробу следует
провести пациенту дважды: один раз — в состоянии
покоя, второй раз — при кашле либо при пробе
Вальсальвы, чтобы временно увеличить давление в
ПП. Следует оценивать видеоизображение, по про-
должительности равное 10 сердечным циклам, за-
пись которого должна начинаться перед полным за-
полнением ПП пузырьками.
Пробу считают положительной (наличие ООО),
если пузырьки появляются в ЛП/ЛЖ через 3–4 уда-
ра сердца после появления пузырьков в ПП либо
прекращения пробы Вальсальвы. Если пузырьки
появляются после 6 ударов сердца, следует предпо-
ложить наличие внутрилегочного шунта или шун-
тирование через ДМПП во время изменения давле-
ния в ЛП и ПП в ходе дыхательного цикла.
Чувствительность пробы с пузырьковым контра-
стированием относительно ООО зависит от доста-
точного количества пузырьков, качества изображе-
ния, соотношения давления в ПП и ЛП в состоянии
покоя и возможности временного повышения дав-
ления в ПП при выполнении пациентом пробы
Вальсальвы или кашле [5]. У пациентов с повышен-
ным давлением в ЛП из-за диастолической дис-
функции ЛЖ или митральной либо аортальной ре-
гургитации чувствительность пробы с пузырьковым
контрастированием существенно ниже.
При подозрении на ООО и отрицательной про-
бе с пузырьковым контрастированием при ТТЭхоКГ
рекомендуется проведение ЧПЭхоКГ. Единых пра-
вил по трактовке этой пробы не существует, хотя
были попытки создать приемлемые алгоритмы [6–
8]. Вариабельность результатов, получаемых разны-
ми исследователями у одного и того же пациента,
до настоящего времени не оценивали, но она имеет
четкую зависимость от качества изображения [5].
ТАКТИКА ЛЕЧЕНИЯ
Благодаря современным технологиям, ООО можно
закрыть транскатетерным методом с минимальным
риском и высокой успешностью. Данный способ
аналогичен закрытию ДМПП типа ostium secundum
(см. далее). Показания к закрытию ООО, а также
клиническая эффективность вмешательства оста-
ются спорными. В главе 40 описана связь ООО с
профилактикой инсульта. В редких случаях функ-
ционирующее ООО приводит к легкому цианозу.
ЧПЭхоКГ и ВСЭхоКГ применяют для позициони-
рования окклюдера, оценки стабильности его поло-
жения и оценки остаточного шунтирования.
ШУНТЫ НА УРОВНЕ ПРЕДСЕРДИЙ
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
ДМПП составляет примерно 10% общего количе-
ства ВПС [9] и встречается у 4 из 100 000 новорож-
денных. На долю ДМПП приходится около 25–30%
всех ВПС, которые диагностируют у взрослых [10].
Существует три распространенных типа дефектов
на уровне предсердий: ДМПП типа ostium secundum,
ДМПП типа ostium primum и дефект венозного си-
нуса (рис. 44 .3). Четвертым типом дефекта является
редкий дефект крыши коронарного синуса.
Степень шунтирования зависит от относитель-
ной эластичности желудочков, которая определяет-
ся постнагрузкой. У новорожденных с ДМПП ПЖ
имеет относительно толстую стенку и низкую эла-
стичность из-за повышенного ЛСС во время эмбри-
онального кровообращения. В результате снижения
ЛСС в первые месяцы жизни происходит регрессия
гипертрофии ПЖ, и он становится более податли-
вым, чем ЛЖ, что приводит к увеличению сброса
крови слева направо.
Пациенты с небольшими дефектами могут не
иметь симптомов до достижения взрослого возрас-
та. С возрастом эластичность ЛЖ снижается, а дав-
ление в ЛП повышается, что приводит к еще боль-
шему сбросу крови слева направо. По прошествии
нескольких десятилетий постоянной перегрузки объ-
емом правых отделов сердца у пациентов может
развиться предсердная аритмия либо правожелу-
дочковая недостаточность. Необъяснимая дилата-
ция ПП и ПЖ при ТТЭхоКГ должна натолкнуть на
мысль о наличии претрикуспидального шунта. При
отсутствии четкой визуализации при ТТЭхоКГ сле-
дует провести ЧПЭхоКГ и/или КТ и МРТ сердца.
Предсердные аритмии редко наблюдаются у па-
циентов моложе 40 лет [11], обычно отмечается ле-
гочная гипертензия легкой или умеренной степени.
Тяжелая легочная гипертензия встречается у 5–10%
пациентов с неоперированным ДМПП, преимуще-
ственно у женщин [12]. Причина тяжелой легочной
гипертензии у данной группы пациентов не уста-
новлена, поскольку степень легочной гипертензии
не связана со степенью шунтирования. Тяжелая ле-
гочная гипертензия может представлять собой соче-
тание идиопатической легочной артериальной ги-
пертензии и шунта на уровне предсердий.
ch44.indd 1137
03.04.2019 12:18:06
1138 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 44.3 Шунты на уровне предсердий (вид спереди). (А) Вид межпредсердной перегородки со стороны правого предсердия. Видны различные типы де-
фекта межпредсердной перегородки (ДМПП). (Б) Края ДМПП типа ostium secundum. АВ
—
атриовентрикулярный; Ао — аорта; ВПВ — верхняя полая вена;
НПВ — нижняя полая вена.
Верхний дефект
венозного синуса
ДМПП типа
ostium primum
Трикуспидальный клапан
Дефект крыши
коронарного синуса
Коронарный синус
Нижний дефект
венозного синуса
ДМПП типа
ostium secundum
Аномально дренирующаяся
правая верхняя легочная вена
ДМПП типа
ostium secundum
Ао
ВПВ
ВПВ
НПВ
Ао
НПВ
Край АВ-клапана
Край позади аорты
Верхний край
Край НПВ
Край ВПВ
Задний край
Аномально дренирующаяся
правая нижняя легочная вена
А
Б
ch44.indd 1138
03.04.2019 12:18:06
1139
44 Врожденные внутрисердечные шунты
ТАКТИКА ЛЕЧЕНИЯ
Пациентам с ДМПП любого типа и наличием сим-
птомов рекомендуется оперативное лечение. Транс-
катетерное закрытие дефекта возможно у большин-
ства пациентов с ДМПП типа ostium secundum. От-
крытую операцию выполняют при отсутствии
возможности закрыть дефект транскатетерным ме-
тодом и всем пациентам с ДМПП типа ostium pri-
mum и дефектом венозного синуса. Бессимптом-
ным пациентам показано оперативное лечение с це-
лью предотвращения поздних осложнений при
увеличении правых отделов сердца, а также при Qp/
Qs > 1,5. Тяжелая легочная гипертензия со сбросом
крови справа налево является противопоказанием к
закрытию ДМПП, однако иногда применение вазо-
дилататоров значимо снижает ЛСС, что позволяет
провести операцию. Описаны необычные наблюде-
ния сброса крови справа налево на уровне предсер-
дий в отсутствие легочной гипертензии: (1) при ме-
диальном направлении струи трикуспидальной ре-
гургитации; (2) при движении потока крови из
нижней полой вены (НПВ) к ДМПП, направляемо-
го евстахиевой заслонкой; (3) при снижении эла-
стичности правых отделов сердца (например, после
коррекции атрезии легочной артерии с интактной
межжелудочковой перегородкой). В таких случаях
следует закрыть ДМПП хирургически, но для пре-
дотвращения последующего повышения давления
в ПП может понадобиться проведение тестов с на-
грузкой объемом либо временной окклюзией де-
фекта баллоном.
Дилатация ПП и ПЖ обычно уменьшается в те-
чение 3–6 месяцев после закрытия ДМПП, но у
взрослых пациентов с большим дефектом может
сохраняться и дольше. При ТТЭхоКГ после опера-
ции следует обратить внимание на размеры поло-
стей, трикуспидальную регургитацию и остаточное
шунтирование. Поздняя послеоперационная реци-
дивирующая дилатация ПП и ПЖ может быть свя-
зана с остаточным шунтированием через окклюдер
либо заплату, а также с утяжелением легочной арте-
риальной гипертензии. Проведение ЭхоКГ до и по-
сле операции с оценкой размеров полостей сердца,
функции желудочков и измерением давления явля-
ется необходимым компонентом лечения ДМПП.
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
ТИПА OSTIUM SECUNDUM
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Наиболее распространенным типом ДМПП являет-
ся дефект типа ostium secundum (75%). Вторичное
отверстие (ostium secundum) — это естественное со-
общение в первичной перегородке (septum primum),
позволяющее крови плода миновать его легкие.
При формировании у эмбриона предсердной пере-
городки вторичное отверстие в норме закрывается
вторичной перегородкой (septum secundum), кото-
рая опускается вниз с крыши общего предсердия в
направлении центра сердца. ДМПП типа ostium se-
cundum возникает в результате атипичного роста
вторичной перегородки, что приводит к сохране-
нию вторичного отверстия и формированию шунта
на уровне предсердий.
ВИЗУАЛИЗАЦИЯ
ДМПП типа ostium secundum варьирует от неболь-
шого размера в области овальной ямки до очень
большого с минимальными краями. Дефект может
быть одиночным или множественным, иметь кру-
глую или овальную форму. Небольшие дефекты,
как правило, не приводят к увеличению размеров
правых отделов сердца или легочной гипертензии и
могут не обнаруживаться при ТТЭхоКГ. Средние и
большие дефекты обычно легко визуализируются.
Поскольку в области овальной ямки эхо-сигналы
часто могут пропадать, наличие шунтирования сле-
дует подтвердить с помощью ЦДК кровотока. Для
оценки направления потока через внутрисердечный
шунт необходимо использовать импульсно-волно-
вую или непрерывно-волновую допплерографию.
Сброс крови может быть слева направо, справа на-
лево и двунаправленным (рис. 44 .4). Субкостальная
позиция оптимальна для визуализации сброса кро-
ви через ДМПП при ЦДК кровотока, т.к. направле-
ние потока параллельно ультразвуковому лучу.
Для подтверждения наличия сброса крови спра-
ва налево через ДМПП, особенно при неопределен-
ных результатах визуализации в 2D-режиме и ЦДК
кровотока, можно провести пробу с пузырьковым
контрастированием. Для дифференциальной диа-
гностики ООО и небольшого ДМПП у взрослых па-
циентов нужно провести ЧПЭхоКГ. Пробу с пу-
зырьковым контрастированием считают отрица-
тельной в случае отсутствия пузырьков около
межпредсердной перегородки вследствие притока
крови без пузырьков. Однако ввиду того что кровь
из верхней полой вены (ВПВ) течет вдоль межпред-
сердной перегородки, результат пробы с пузырько-
вым контрастированием следует интерпретировать
в учетом других данных ЭхоКГ.
ТАКТИКА ЛЕЧЕНИЯ
В настоящее время транскатетерное закрытие ДМПП
типа ostium secundum практически вытеснило тради-
ционные открытые операции. Возможность прове-
дения транскатетерного вмешательства определяет-
ся размером дефекта, наличием оформленных кра-
ев, расположением дефекта относительно клапанов
и легочных вен и наличием сопутствующего ВПС
(например, аномального дренажа легочных вен)
(табл. 44 .3). Все эти данные можно получить при
ЧПЭхоКГ. Врач должен тщательно визуализиро-
вать ДМПП под разными углами, чтобы оценить
ch44.indd 1139
03.04.2019 12:18:07
1140 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
все края дефекта (см. рис. 44 .3). В течение сердечно-
го цикла размер ДМПП изменяется. Для правильно-
го выбора окклюдера необходимо определить мак-
симальный размер дефекта в двух ортогональных
плоскостях. 3D-ЧПЭхоКГ является важным допол-
нением к визуализации в 2D-режиме, поскольку
только при мультипланарной реконструкции мож-
но точно определить размер дефекта [13]. ЧПЭхоКГ
представляет возможность визуализировать ДМПП
в позиции ПП и в позиции ЛП. Для закрытия де-
фекта окклюдером нужно, чтобы ВПВ по отноше-
нию к ПП находилась на 12 часах условного цифер-
блата, а правая верхняя легочная вена по отноше-
нию к ЛП — на 1 часе условного циферблата (рис.
44.5) [14].
В США для транскатетерного закрытия ДМПП
FDA были одобрены несколько моделей окклюде-
ров: Amplatzer Septal Occluder, Gore Helex Septal Oc-
cluder, Gore Cardioform septal Occluder (рис. 44.6).
Ранее транскатетерное закрытие ДМПП выполня-
ли только при размере дефекта < 30 мм и ширине
свободных краев > 5 мм. Со временем стали закры-
вать с минимальным процентом осложнений даже
более крупные дефекты с узкими краями. Возмож-
ные осложнения: аритмия, дислокация или разру-
шение окклюдера, перфорация, гидроперикард,
тромбоэмболия, аллергическая реакция на никеле-
вый сплав, входящий в состав окклюдера. В неран-
домизированном исследовании, в котором сравни-
вали хирургическое закрытие ДМПП открытым
способом (n = 154) с транскатетерным (n = 442), ча-
стота осложнений была ниже после транскатетерно-
го закрытия ДМПП (7%), чем при закрытии дефек-
та открытым способом (25%). Среди осложнений
после транскатетерного закрытия ДМПП отмечали
эмболизацию (0,3%) и транзиторные аритмии (3%),
а после хирургического закрытия — тампонаду
сердца (2%) и транзиторные аритмии (5%) [15].
Рис. 44.4 Дефект межпредсердной перегородки типа ostium secundum. (А) A Парастернальная позиция по короткой оси. (Б) A Апикальная четырех-
камерная позиция. (В) A Субкостальная позиция. (Г) A Субкостальная позиция. При ЦДК кровотока виден сброс крови слева направо. Дефект межпредсерд-
ной перегородки указан звездочкой. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
А
Б
*
ПП
ПЖ
ЛП
ЛП
ПП
ЛЖ
*
ЛЖ
ЛЖ
ПЖ
ПЖ
ЛП
ЛП
ПП
ПП
*
Г
В
ch44.indd 1140
03.04.2019 12:18:07
1141
44 Врожденные внутрисердечные шунты
Анатомические
особенности
Эхокардиографическая
позиция, вид
Показатели/признаки
Тактика лечения
Расширение ПП
ТТЭхоКГ, апикальная
четырехкамерная
Объем ПП (бипланарный
метод Симпсона либо метод
площадь–длина)
Закрытие показано при расшире-
нии правых отделов сердца
Расширение ПЖ
ТТЭхоКГ, парастернальная
по длинной оси
ТТЭхоКГ, парастернальная
по короткой оси
Диаметр ВТПЖ
Проксимальный/дистальный
диаметры ВТПЖ
КДР ПЖ
Закрытие показано при расшире-
нии правых отделов сердца
Функция ПЖ
ТТЭхоКГ, апикальная
четырехкамерная
(с фокусировкой
изображения ПЖ)
Фракция изменения площади
ПЖ
Закрытие показано при расшире-
нии правых отделов сердца
с их вторичной дисфункцией
Трикуспидальная
регургитация
ТТЭхоКГ, апикальная четырех-
камерная (с фокусировкой
изображения ПЖ)
ТТЭхоКГ, апикальная четырех-
камерная (с фокусировкой
изображения приточного
отдела ПЖ)
Размеры фиброзного кольца
клапана
Максимальная скорость струи ТР
Степень ТР
Регургитация
на клапане легоч-
ной артерии
ТТЭхоКГ, парастернальная
по короткой оси (с фокуси-
ровкой изображения отточ-
ного отдела ПЖ)
Время полуспада градиента
давления
Дилатация
легочного ствола
и его ветвей
ТТЭхоКГ, парастернальная
по короткой оси
Диаметр легочного ствола,
диаметр легочных артерий
Давление в ПЖ
ТТЭхоКГ, апикальная четырех-
камерная (с фокусировкой
изображения приточного
отдела ПЖ)
Максимальная скорость струи ТР
для расчета градиента давления
по модифицированному
уравнению Бернулли
Qp/Qs
Qs: ТТЭхоКГ, парастернальная
по длинной оси и апикальная
пятикамерная либо
трехкамерная
Qp: ТТЭхоКГ, парастернальная
по короткой оси
Qs: CSAВТЛЖ × VTIВТЛЖ
Qp: CSAВТПЖ × VTIВТПЖ
Рекомендуется закрытие
при отношении Qp/Qs > 1,5
Наличие ДМПП
ТТЭхоКГ, парастернальная
по короткой оси
ТТЭхоКГ, апикальная
четырехкамерная
ТТЭхоКГ, субкостальная
четырехкамерная
Отсутствие перегородки
в области овальной ямки
Поток через дефект
при ЦДК кровотока
Наличие и размер
края дефекта
ЧПЭхоКГ, мультипланарная
из среднего отдела пищевода
(0–180°)
Размер края дефекта
Взаимное расположение с атрио-
вентрикулярными клапанами,
ВПВ, НПВ, легочными венами
Предпочтительный размер края
дефекта 3–5 мм. Закрытие воз-
можно при размере края < 3 мм,
но увеличивается риск дислока-
ции окклюдера
Форма и размер
ДМПП
ЧПЭхоКГ, мультипланарная
из среднего отдела пищевода
(0–180°)
Максимальный размер
Дефект > 30–32 мм может
превышать размер окклюдера
для закрытия
CSA — площадь поперечного сечения; Qp — легочный кровоток; Qs — системный кровоток; VTI — интеграл скорости кровотока; ВПВ —
верхняя полая вена; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка; ДМПП — дефект меж-
предсердной перегородки; КДР — конечно -диастолический размер; НПВ — нижняя полая вена; ПЖ — правый желудочек; ПП — пра-
вое предсердие; ТР — трикуспидальная регургитация; ТТЭхоКГ — трансторакальная эхокардиография; ЦДК — цветовое допплеровское
картирование; ЧПЭхоКГ— чреспищеводная эхокардиография.
ТАБЛИЦА 44.3 Эхокардиографическая оценка дефекта межпредсердной перегородки типа ostium secundum
ch44.indd 1141
03.04.2019 12:18:07
1142 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 44.5 Оценка краев дефекта межпредсердной перегородки типа ostium secundum. ЧПЭхоКГ из среднего отдела пищевода. (А) A Изображение
(0°) атриовентрикулярного и заднего краев дефекта. (Б) A Изображение (62°) аортального (стрелка) и заднего краев дефекта. (В) A Изображение (91°) верх-
него края дефекта (красная стрелка) и края нижней полой вены (НПВ) (белая стрелка). (Г) A Изображение (117°) края верхней полой вены (ВПВ) (стрелка) и
края нижней полой вены. (Д) A 3D-ЧПЭхоКГ. Межпредсердная перегородка со стороны правого предсердия (ПП) с верхней полой веной между 11 и 12 часами
условного циферблата. (Е) A 3D-ЧПЭхоКГ. Межпредсердная перегородка со стороны левого предсердия (ЛП) с правой верхней легочной веной (ПВЛВ) на 2 ча-
сах условного циферблата. Звездочки указывают место дефекта межпредсердной перегородки. АК — аортальный клапан.
Рис. 44 .6 Окклюдеры для закрытия дефекта межпредсердной перегородки. (А) Amplatzer septal occluder (ASO) (St Jude Medical, St Paul, MN). (Б) A
Интраоперационное измерение баллоном дефекта межпредсердной перегородки. (В) ЧПЭхоКГ, четырехкамерная позиция из среднего отдела пищевода. Вид рас-
крытого окклюдера ASO (стрелка). (Г) Gore Cardioform septal occluder (W.L. Gore & Associates, Newark, DE). (Д) A ВСЭхоКГ во время раскрытия окклюдера. (Е) A
ТТЭхоКГ, апикальная четырехкамерная позиция установленного в межпредсердной перегородке окклюдера. ЛП — левое предсердие; ПП — правое предсердие.
*
ЛП
ПП
АК
*
*
*
*
*
*
ПП
ПП
ПП
ПП
ЛП
ЛП
ЛП
ЛП
АК
АК
НПВ
НПВ
ПВЛВ
ВПВ
ВПВ
А
Б
В
Г
Д
Е
ПП
ПП
ПП
ЛП
ЛП
ЛП
А
Б
В
Г
Д
Е
ch44.indd 1142
03.04.2019 12:18:08
1143
44 Врожденные внутрисердечные шунты
Закрытие ДМПП рекомендуется выполнять под
контролем ЧПЭхоКГ либо ВСЭхоКГ. Преимуще-
ство ВСЭхоКГ заключается в том, что один и тот же
врач может одновременно управлять ультразвуко-
вым катетером и устанавливать окклюдер, пока па-
циент находится в состоянии умеренной седации. К
недостаткам ВСЭхоКГ относят необходимость при-
обретения хирургом навыка позиционирования
ультразвукового катетера, сложность визуализации
всех краев дефекта и устьев легочных вен, а также
ограниченный сектор обзора при закрытии боль-
ших дефектов. При ЧПЭхоКГ необходимы второй
врач, более глубокая седация или общая анестезия в
течение всей процедуры из-за дискомфорта, связан-
ного с применением чреспищеводного зонда. Тем
не менее ЧПЭхоКГ позволяет более детально оце-
нить края большого дефекта.
При транскатетерном закрытии ДМПП выпол-
няют катетеризацию правых отделов сердца для
контроля гемодинамики и сатурации. Под контро-
лем ЧПЭхоКГ, ВСЭхоКГ либо рентгеноскопии про-
водник продвигают по бедренной вене и, минуя де-
фект, вводят в ЛП, а затем — в левую верхнюю ле-
гочную вену. Калибровочный баллон заводят по
проводнику, размещают в дефекте и наполняют
смесью физиологического раствора с йодсодержа-
щим контрастным веществом до момента, пока
кровоток через ДМПП не будет полностью пере-
крыт, а на калибровочном баллоне не появится цир-
кулярное сужение («талия»). Диаметр «талии» соот-
ветствует размеру дефекта в растянутом состоянии.
Размер дефекта в растянутом состоянии обычно на
10–20% больше размера на исходных изображени-
ях. На данном этапе крайне важно не пропустить
остаточное шунтирование.
При сохранении потока через дефект при разду-
том калибровочном баллоне следует попытаться
раздуть его еще больше, чтобы полностью закрыть
ДМПП (либо заподозрить наличие второго дефек-
та). После этого калибровочный баллон медленно
сдувают до появления небольшого потока через де-
фект, затем вновь надувают до закрытия внутрисер-
дечного шунта. «Талию» измеряют при ЧПЭхоКГ и
на рентгенограмме для выбора соответствующего
окклюдера.
Затем через дефект в ЛП вводят по проводнику
систему доставки с окклюдером. Там раскрывают
левопредсердный диск окклюдера, а затем катетер с
ним оттягивают, пока левопредсердный диск не
окажется прижатым к дефекту со стороны ЛП. По-
сле этого раскрывают правопредсердный диск. Пре-
жде чем отсоединить окклюдер от системы достав-
ки, следует оценить корректность его позициониро-
вания. Для этого осматривают все края в 2D-режиме
и при ЦДК кровотока. При ультразвуковой оценке
оператор подтягивает назад или проталкивает впе-
ред катетер с окклюдером для подтверждения его
стабильного положения. После отсоединения ок-
клюдера возможно минимальное остаточное шун-
тирование, что соответствует норме. На первой неде-
ле после операции рекомендуется провести ТТЭхоКГ
для исключения гидроперикарда и оценки положе-
ния окклюдера. В ходе этого исследования проба с
пузырьковым контрастированием может быть по-
ложительной, однако в течение нескольких месяцев
после процедуры остаточное шунтирование обыч-
но исчезает благодаря эндотелизации окклюдера.
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
ТИПА OSTIUM PRIMUM
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
ДМПП типа ostium primum относят к дефектам
предсердно-желудочковой перегородки (ДПЖП),
которые также называют атриовентрикулярным ка-
налом или дефектом эндокардиальной подушки.
ДПЖП возникает из-за недостаточного роста пере-
городки из эмбриональных эндокардиальных поду-
шек и приводит к выраженной мальформации фи-
брозного каркаса соединения стенок четырех поло-
стей сердца. Изолированный ДМПП типа ostium
primum и изолированный приточный дефект меж-
желудочковой перегородки (ДМЖП) относят к ча-
стичным ДПЖП (неполной форме атриовентрику-
лярного канала). Полный ДПЖП (полная форма
атриовентрикулярного канала) характеризуется на-
личием ДМПП типа ostium primum и приточного
ДМЖП. ДПЖП связывают с такими генетическими
дефектами, как трисомия 21 (синдром Дауна), син-
дром ДиДжорджи, синдром Холта-Орама, синдром
Эллиса-Ван-Кривальда. С ДПЖП часто сочетаются
такие аномалии, как ДМПП типа ostium secundum и
добавочная левая ВПВ. В отличие от ДМПП типа os-
tium secundum, который диагностируют во взрослом
возрасте, ДМПП типа ostium primum чаще проявля-
ется на раннем этапе жизни. Это связано с большим
дефектом и сопутствующими мальформациями
атриовентрикулярных клапанов, приводящими к
значительной регургитации на атриовентрикуляр-
ном клапане и развитию сердечной недостаточно-
сти. При отсутствии выраженной регургитации на
атриовентрикулярных клапанах некоторые пациен-
ты не имеют симптомов до взрослого возраста.
ВИЗУАЛИЗАЦИЯ
ДМПП типа ostium primum и место соединения сте-
нок четырех полостей сердца лучше всего визуали-
зируются при ТТЭхоКГ в апикальной четырехка-
мерной позиции. Для постановки диагноза редко
нужна ЧПЭхоКГ, но этот метод визуализации поле-
зен для углубленного обследования атриовентрику-
лярного клапана. При ДПЖП есть общий атриовен-
трикулярный клапан с пятью створками, а не от-
дельные митральный и трикуспидальный клапаны
(рис. 44 .7).
ch44.indd 1143
03.04.2019 12:18:09
1144 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Общий атриовентрикулярный клапан разделен
межпредсердной или межжелудочковой перегород-
кой на левый и правый компоненты (табл. 44 .4).
Общий атриовентрикулярный клапан может иметь
как сбалансированную анатомическую форму, так и
несбалансированную, при которой оба предсердия
изгоняют кровь преимущественно в один нормаль-
но сформированный желудочек, а небольшое коли-
чество крови попадает во второй, гипоплазирован-
ный желудочек. Также для порока характерно ано-
мальное крепление перегородок.
Наличие общего атриовентрикулярного клапана
приводит к смещению аортального клапана кпере-
ди и удлинению ВТЛЖ (рис. 44 .8). Важно отметить,
что такое аномальное строение ВТЛЖ может сопро-
вождаться подклапанным аортальным стенозом. В
данном случае при импульсно-волновой допплеро-
графии будет отмечаться ускорение потока в ВТЛЖ.
Для описания ангиографической картины ВТЛЖ у
пациентов с ДПЖП используют термин «деформа-
ция в виде гусиной шеи».
ТАКТИКА ЛЕЧЕНИЯ
ДМПП типа ostium primum невозможно закрыть
транскатетерным способом, нужна открытая опера-
ция: закрытие дефекта заплатой и пластика атрио-
вентрикулярного клапана в случае регургитации. В
некоторых случаях дополнительно нужно выпол-
нить операцию Конно с целью устранения стеноза
ВТЛЖ.
ДЕФЕКТ ВЕНОЗНОГО СИНУСА
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Дефект венозного синуса обусловлен неполной де-
градацией венозного синуса в эмбриогенезе. В ре-
зультате появляется шунт на уровне предсердий в
области устьев правых легочных вен [16]. Дефект
венозного синуса не считают истинным ДМПП, т.к.
дефект венозного синуса не является дефектом пер-
вичной перегородки (septum primum) или вторич-
ной перегородки (septum secundum). Дефект веноз-
ного синуса часто классифицируют как дефект
межпредсердной перегородки типа sinus venosus, т.к.
Норма
Дефект предсердно-желудочковой перегородки
Трикуспидальный клапан относительно верхушки
сердца располагается ниже, чем митральный клапан
Митральный и трикуспидальный клапаны имеют
собственные фиброзные кольца (фиброзное кольцо
митрального клапана имеет седловидную форму)
Митральный клапан имеет переднюю и заднюю
створки, а трикуспидальный клапан — переднюю,
заднюю и септальную створки
Прикрепление клапанов к перегородке на одном уровне
Общее фиброзное кольцо у левого и правого атриовентрикулярных
клапанов
В левом атриовентрикулярном клапане есть щель между левой
створкой и левой частью верхней мостовидной створки, что приво-
дит к регургитации. Нижняя мостовидная створка служит в каче-
стве задней створки
Правый атриовентрикулярный клапан состоит из части верхней
и нижней мостовидных створок, правой передневерхней и правой
нижней створок
ТАБЛИЦА 44.4 Различие между анатомически нормальными митральным и трикуспидальным клапанами
и атриовентрикулярными клапанами у пациентов с дефектом предсердно-желудочковой перегородки
Рис. 44.7 Дефект предсердно-желудочковой перегородки. Атриовен-
трикулярное соединение со стороны предсердий. (А) Нормальное клиновидное
расположение аортального клапана между митральным и трикуспидальным
клапанами. (Б) Полный дефект предсердно-желудочковой перегородки с при-
точным дефектом межжелудочковой перегородки и дефектом межпредсерд-
ной перегородки типа ostium primum. (В) Частичный ДПЖП — ДМПП типа ostium
primum с отдельными отверстиями клапанов из-за слияния (стрелка) верхней
мостовидной створки с нижней мостовидной створкой и «расщеплением» перед-
ней створки митрального клапана [Shinebourne E, Ho SY. Atrioventricular septal de-
fect. In Gatzoulis M, Webb G, Daubeney P, editors: Diagnosis and management of
adult congenital heart disease, Philadelphia, 2011, Elsevier].
Нижняя
мостовидная
створка
Левая
пристеночная
створка
Нижняя
мостовидная
створка
Правая
нижняя створка
Правая
передневерхняя
створка
Задняя створка
Верхняя
мостовидная
створка
Митральный
клапан
Аортальный
клапан
Передняя створка
Трикуспидальный
клапан
Передняя створка
Задняя створка
Септальная створка
А
Б
В
ch44.indd 1144
03.04.2019 12:18:09
1145
44 Врожденные внутрисердечные шунты
он приводит к шунтированию крови на уровне
предсердий с гемодинамической и клинической
картиной, характерной для ДМПП. В общей класси-
фикации ДМПП типа sinus venosus составляет около
5% всех ДМПП [17]. Верхний дефект венозного си-
нуса встречается чаще, чем нижний. В 95% случа-
ев сопутствующей патологией является частичный
аномальный дренаж легочных вен (ЧАДЛВ) от пра-
вой верхней легочной вены или от обеих правых ле-
гочных вен.
ВИЗУАЛИЗАЦИЯ
Дефект венозного синуса трудно идентифицировать
с помощью ТТЭхоКГ. Верхние дефекты легче все-
го визуализировать в субкостальной позиции. При
ЧПЭхоКГ в бикавальной позиции трудностей с ди-
агностикой порока обычно не возникает (рис. 44 .9).
При недостаточно качественной визуализации ле-
гочных вен рекомендуется выполнить КТ либо
МРТ.
ТАКТИКА ЛЕЧЕНИЯ
Как и в случае с ДМПП типа ostium primum, для кор-
рекции дефекта венозного синуса необходимо от-
крытое оперативное вмешательство. Если аномаль-
ные легочные вены впадают в ПП или устье ВПВ,
то для перенаправления потока по ним в ЛП фор-
мируют туннель. При этом следует избегать об-
струкции потока через ВПВ в ПП. Однако при впа-
дении легочных вен в ВПВ более чем на 2 см выше
места ее соединения с предсердием следует выпол-
нить операцию Вардена. Для этого ВПВ отсекают
над местом впадения легочных вен и реимпланти-
руют ее в ушко ПП. Затем поток из правой легоч-
Рис. 44 .8 Дефект предсердно-желудочковой перегородки. (А) A Парастернальная позиция по длинной оси. Выходной тракт левого желудочка (ВТЛЖ)
удлиненный и узкий, аортальный клапан смещен кпереди (стрелка). (Б) A Парастернальная позиция по длинной оси с ЦДК кровотока. Видны митральная регур-
гитация (МР) и ускоренный поток через выходной тракт левого желудочка. (В) A Апикальная четырехкамерная позиция. Левый и правый атриовентрикулярные
клапаны крепятся к перегородке на одном уровне. Видны малый дефект межпредсердной перегородки типа ostium primum (
*
) с большим приточным дефектом
межжелудочковой перегородки. (Г) A ЦДК кровотока. Виден поток через дефект межпредсердной перегородки (
*
). В данном случае следует обратить внима-
ние на гипертрофию правого желудочка (ПЖ), т.к . у пациента тяжелая легочная гипертензия со сбросом крови справа налево. ЛЖ — левый желудочек; ЛП —
левое предсердие; ПП — правое предсердие.
ЛЖ
ПЖ
ВТЛЖ
ВТЛЖ
МР
ПП
ЛП
**
В
Г
А
Б
ch44.indd 1145
03.04.2019 12:18:09
1146 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ной вены перенаправляют в ЛП, формируя туннель.
При долгосрочном наблюдении пациентов после
операции Вардена следует отслеживать признаки
стеноза легочных вен и синдрома ВПВ, т.к. возмо-
жен стеноз анастомоза между ВПВ и ПП.
ДЕФЕКТ КРЫШИ КОРОНАРНОГО СИНУСА
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Изредка наблюдается дефект крыши коронарного
синуса, при котором также происходит шунтирова-
ние крови. Порок характеризуется присутствием
добавочной левой ВПВ с наличием или отсутствием
вены, соединяющей правую и левую ВПВ (рис.
44.10). Подобно дефекту венозного синуса, данный
порок также не является истинным дефектом пер-
вичной перегородки (septum primum) либо вторич-
ной перегородки (septum secundum), но его часто
классифицируют как ДМПП, поскольку шунтиро-
вание крови происходит на уровне предсердий. Де-
фект крыши коронарного синуса составляет < 1%
всех шунтов на уровне предсердий и обычно связан
с гетеротаксией. Kirklin и Barratt-Boyes описали че-
тыре морфологических типа дефекта крыши коро-
нарного синуса: тип I — крыша отсутствует полно-
стью, есть добавочная левая ВПВ; тип II — полно-
стью отсутствуют крыша и добавочная левая ВПВ;
тип III — частично отсутствует крыша в срединном
отделе коронарного синуса; тип IV — частично от-
сутствует крыша в терминальном отделе коронар-
ного синуса [17].
ВИЗУАЛИЗАЦИЯ
Как правило, большинство дефектов крыши коро-
нарного синуса имеют небольшой размер, но могут
привести к умеренной дилатации правых отделов
сердца. Расширенный коронарный синус хорошо
визуализируется в парастернальной позиции по
длинной оси на задней поверхности ЛП, а также в
апикальной четырехкамерной позиции. В обеих по-
Рис. 44.9 Дефект венозного синуса. Пациент с верхним дефектом венозного синуса, добавочной левой верхней полой веной, впадающей в коронарный си-
нус (КС), частичным аномальным дренажем легочных вен (правая верхняя легочная вена). (А) A Парастернальная позиция по длинной оси. Визуализируется
расширенный коронарный синус. (Б) A Апикальная четырехкамерная позиция. Правое предсердие (ПП) и правый желудочек (ПЖ) значительно расширены, дре-
нирующийся в правое предсердие коронарный синус также расширен. (В) A ЧПЭхоКГ, бикавальная позиция из среднего отдела пищевода. ВПВ расположена
над межпредсердной перегородкой, есть дефект венозного синуса (
*
). Сзади визуализируется расширенная правая легочная артерия. (Г) A ЧПЭхоКГ в бика-
вальной позиции из среднего отдела пищевода с ЦДК кровотока. Видны полые вены и сброс крови слева направо через дефект венозного синуса (
*
).ЛП —ле-
вое предсердие.
ЛП
ЛП
ПП
ПП
*
*
ПЖ
ПЖ
КС
КС
А
Б
Г
В
ch44.indd 1146
03.04.2019 12:18:10
1147
44 Врожденные внутрисердечные шунты
зициях можно заподозрить дефект крыши коронар-
ного синуса, однако порок редко удается хорошо
визуализировать при ТТЭхоКГ. Для точной диагно-
стики следует использовать ЧПЭхоКГ (позиция из
среднего отдела пищевода, угол 100–120°), что по-
зволяет выявить также сопутствующие патологии
(например, атрезию коронарного синуса) [18].
У пациентов с добавочной левой ВПВ без дефек-
та крыши коронарного синуса проба с пузырько-
вым контрастированием через вену левой верхней
конечности приводит к заполнению коронарного
синуса перед поступлением пузырьков в ПП. При
дефекте крыши коронарного синуса с добавочной
левой ВПВ пузырьки визуализируются в ЛП и ко-
ронарном синусе непосредственно перед попадани-
емвПП.
ТАКТИКА ЛЕЧЕНИЯ
При данном пороке не всегда нужно оперативное
вмешательство вследствие незначительного шунти-
рования крови, но пациентам со значительно рас-
ширенными правыми отделами сердца или пара-
доксальной эмболией в анамнезе лечение рекомен-
дуется. Также рекомендуется устранение дефекта
крыши коронарного синуса при обнаружении де-
фекта во время операции по поводу ВПС.
АНОМАЛЬНЫЙ ДРЕНАЖ ЛЕГОЧНЫХ ВЕН
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Аномальный дренаж легочных вен — это ВПС, при
котором нарушается дренирование крови в ЛП по
одной или нескольким легочным венам. В литера-
туре описано множество вариантов аномального
дренажа легочных вен, которые могут впадать в
различные полости сердца на разном уровне, со сте-
нозами и без них. Чаще всего аномальный дренаж
легочных вен характеризуется наличием претрику-
спидального шунта. При тотальном аномальном
дренаже легочных вен (ТАДЛВ) все легочные вены
собираются в венозный коллектор, из которого
кровь оттекает в вертикальную вену.
ТАДЛВ может быть супракардиальным, карди-
альным и инфракардиальным, в зависимости из ме-
ста дренирования относительно сердца (табл. 44 .5).
Данный порок практически всегда проявляется в
раннем детском возрасте. ЧАДЛВ встречается чаще,
чем ТАДЛВ. При ЧАДЛВ одна либо несколько ле-
гочных вен могут впадать в вены большого круга
кровообращения, коронарный синус, ПП (рис.
44.11). ЧАДЛВ обычно диагностируют в более позд-
нем возрасте, чем ТАДЛВ, что обусловлено мень-
шим сбросом крови слева направо. Существует три
основных вида ЧАДЛВ (табл. 44 .6).
Рис. 44 .10 Дефект крыши коронарного синуса. Пациент с атрезией трикуспидального клапана после операции Фонтена (создания анастомоза между пра-
вым предсердием и легочной артерией) и дефектом крыши коронарного синуса (КС). Давление в правом предсердии (ПП) выше, чем в левом предсердии (ЛП),
из-за гемодинамики после операции Фонтена (сброса крови справа налево). (А) A Нормальное расположение устья коронарного синуса (
*
) в правом предсер-
дии. (Б) A Аномальное соединение (стрелка) коронарного синуса с левым предсердием, изображение в 2D-режиме (слева) и при ЦДК кровотока (справа).
*
ПП
КС
КС
КС
ЛП
ЛП
А
Б
Вид
Место дренирования
Эхокардиография
Супракардиальный
Безымянная вена
Непарная вена
Верхняя полая вена
Верхняя парастернальная позиция по короткой оси и ЦДК кровотока
Супрастернальная позиция по короткой оси и ЦДК кровотока
Интракардиальный
Коронарный синус
Полости сердца
Аномальное соединение легочных вен с коронарным синусом можно
диагностировать в парастернальной либо субкостальной позиции
по короткой оси с наклоном датчика кзади
Инфракардиальный
Включение в печеноч-
ный кровоток по нис-
ходящему коллектору
Субкостальная позиция по длинной оси нижней полой вены
для визуализации с помощью цветовой допплерографии потока
по нисходящему коллектору
ЦДК — цветовое допплеровское картирование.
ТАБЛИЦА 44.5 Классификация тотального аномального дренажа легочных вен по месту их дренирования
ch44.indd 1147
03.04.2019 12:18:10
1148 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Место дренирования
Сопутствующая патология
Правые верхние и средние легочные вены впадают в ВПВ или правое предсердие Дефект венозного синуса
Правые легочные вены либо только правые нижние легочные вены впадают в
НПВ через вертикальную вену
Синдром «ятагана»
Гипоплазия правого легкого
Интактная межпредсердная перегородка
Левые легочные вены через вертикальную вену впадают в плечеголовную вену
либо в коронарный синус
ВПВ — верхняя полая вена; НПВ — нижняя полая вена .
ТАБЛИЦА 44.6 Наиболее частые виды частичного аномального дренажа легочных вен
Рис. 44.11 Частичный аномальный дренаж легочных вен. У 50-летней женщины — одышка при физической нагрузке. Все правые легочные вены дрени-
руются в правое предсердие (ПП). (А) Трехмерная реконструкция сердца по данным КТ сердца (вид сзади, легочные вены обозначены красным цветом). Все пра-
вые легочные вены (стрелка) дренируются в общую вертикальную вену, впадающую в правое предсердие. (Б) На рентгенограмме грудной клетки справа отмеча-
ется характерный вид вертикальной вены в виде турецкой сабли (ятагана) (стрелка). (В) A Визуализируется частичный аномальный дренаж легочных вен (ЧАДЛВ)
(*) в правое предсердие. (Г) A Проба с пузырьковым контрастированием, апикальная четырехкамерная позиция. Обратите внимание на отсутствие пузырьков в
месте, где легочные вены дренируются в правое предсердие (
*
). ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек
ПП
ЧАДЛВ
ПП
ЧАДЛВ
ЛП
ЛЖ
ПЖ
*
*
А
Б
Г
В
ВИЗУАЛИЗАЦИЯ
У младенцев и детей при визуализации в супрастер-
нальной позиции обычно видно впадение четырех
легочных вен в ЛП. Отсутствие нормального воз-
врата крови в ЛП должно насторожить врача. Сле-
дует провести доскональное исследование и найти
место впадения легочных вен. При отсутствии
устьев легочных вен в ЛП следует попытаться най-
ти аномально дренирующиеся вены. Клиническая
картина может варьировать от критического состо-
яния у новорожденных из-за резко нарушенного
возврата по легочным венам до симптомов, харак-
терных для массивного шунтирования на уровне
предсердий, у пациентов старшей возрастной груп-
пы с впервые выявленным пороком. У взрослых
при ТТЭхоКГ наблюдается расширение ПП и ПЖ.
На ТТЭхоКГ обычно визуализируется ЧАДЛВ при
впадении вен в сердце (рис. 44 .12). Однако при экс-
ch44.indd 1148
03.04.2019 12:18:11
1149
44 Врожденные внутрисердечные шунты
Рис. 44.12 Перимембранозный дефект межжелудочковой перегородки. (A–В) 20-летняя женщина с бессимптомным рестриктивным перимембранозным
дефектом межжелудочковой перегородки (стрелка). (А) A Парастернальная позиция по короткой оси. Видна аневризматическая септальная створка трикуспи-
дального клапана, частично закрывающая дефект межжелудочковой перегородки. (Б) A Парастернальная позиция по короткой оси и ЦДК кровотока. Поток че-
рез дефект межжелудочковой перегородки направлен в аневризматическую септальную створку трикуспидального клапана. (В) При спектральной допплерогра-
фии регистрируется высокоскоростной поток слева направо через дефект межжелудочковой перегородки с градиентом давления 80 мм рт. ст. между левым же-
лудочком (ЛЖ) и правым желудочком (ПЖ). (Г–Е) 50-летняя женщина с синдромом Дауна, рестриктивным перимембранозным приточным дефектом
межжелудочковой перегородки и двухкамерным правым желудочком. (Г) A Парастернальная позиция по длинной оси с ЦДК кровотока и без него. Обратите
внимание на дефект межжелудочковой перегородки (стрелка) со сбросом крови слева направо и сильной гипертрофией приточного отдела правого желудочка.
(Д) A Парастернальная позиция по короткой оси. Видна гипертрофия проксимальной части приточного отдела правого желудочка с гипертрофированным мы-
шечным пучком (
*
), которая сужает срединную часть желудочка. В области низкого давления в отточном отделе правого желудочка стенка тонкая. (Е) A Пара-
стернальная позиция по короткой оси и ЦДК кровотока. Видны дефект межжелудочковой перегородки и внутриполостной поток из-за обструкции правого желу-
дочка мышечным пучком. Ао — аорта; ЛП — левое предсердие; ПП — правое предсердие.
*
ПЖ
ПЖ
ПЖ
ПЖ
ПЖ
ПЖ
ПП
ПП
ПП
ПП
ЛП
ЛП
ЛП
ЛП
ЛП
ЛП
ЛЖ
ЛЖ
Ао
Ао
Г
Д
Е
А
Б
В
тракардиальных вариантах впадения легочных вен
диагностика зачастую затруднена и нужно проведе-
ние КТ либо МРТ.
ТАКТИКА ЛЕЧЕНИЯ
При установленном диагнозе «тотальный ано-
мальный дренаж легочных вен» оперативное вме-
шательство следует провести в наиболее ранние
сроки, чтобы предотвратить повреждение легоч-
ного сосудистого русла. Новорожденным в крити-
ческом состоянии показана экстренная операция.
Оперативное лечение ЧАДЛВ показано в случае
наличия симптомов перегрузки объемом правых
отделов сердца. При аномальном дренаже одной
легочной вены хирургическое вмешательство про-
водят редко, т.к. аномальный кровоток составляет
лишь 20–25% общего венозного возврата [19]. В
послеоперационном периоде у пациентов необхо-
димо своевременно выявлять признаки и симпто-
мы обструкции легочных вен. Для оценки прохо-
димости хирургических анастомозов и туннелей,
обструкции легочных вен и остаточного шунтиро-
вания после коррекции ЧАДЛВ и ТАДЛВ исполь-
зуют ЧПЭхоКГ, КТ и МРТ.
ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
ПАТОФИЗИОЛОГИЯ И НОМЕНКЛАТУРА
Наиболее частым ВПС детского возраста является
ДМЖП. Частота ДМЖП варьирует, т.к . многие па-
циенты имеют бессимптомную форму заболевания,
а многие мелкие дефекты закрываются спонтанно.
По данным литературы, в США у младенцев еже-
годно диагностируют от 10 000 до 11 000 изолиро-
ванных ДМЖП [20, 21].
Межжелудочковая перегородка — сложная ана-
томическая структура. Существует несколько клас-
сификаций ДМЖП. Представленная в данной главе
классификация основана на Congenital Heart Surgery
Nomenclature and Database Project [22–25]. В аутоп-
сийных исследованиях ДМЖП детально описывают
относительно анатомических ориентиров, с эхокар-
ch44.indd 1149
03.04.2019 12:18:11
1150 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
диографической точки зрения ДМЖП делят на 4 ти-
па: перимембранозный, мышечный, приточный и над-
гребешковый (табл. 44 .7, рис. 44 .13).
Частота перимембранозных ДМЖП составляет
около 80% [26], мышечных — от 5 до 10% [27], при-
точных — около 5%, надгребешковых — от 5 до 7%
общего количества ДМЖП [28].
Небольшой рестриктивный ДМЖП не приводит
к гемодинамически значимому шунтированию кро-
ви. Давление в легочной артерии и размеры левых
отделов сердца остаются в пределах нормы. Такие
дефекты могут закрыться спонтанно еще в детстве.
Хотя большинству пациентов с рестриктивным пе-
римембранозным ДМЖП хирургическое вмеша-
Тип
Анатомия
Альтернативная номенклатура
Перимембранозный Края включают фиброзную ткань мембранозной части
перегородки и мышечную часть перегородки
Мембранозный ДМЖП
Приточный
Мышечная часть перегородки между дефектом
и атриовентрикулярным клапаном отсутствует
Частичный ДПЖП
Неполная форма атриовентрикулярного
канала
Частичный дефект эндокардиальной подушки
Мышечный
Присутствует лишь край мышечной части
перегородки:
• Приточная часть/трабекулярная часть перегородки
• Только трабекулярная часть перегородки
• Инфундибулярная и трабекулярная части
перегородки
Надгребешковый
Локализуется в инфундибулярной части перегородки
Немышечный край сформирован аортальным
клапаном
Подартериальный
Инфундибулярный
Подлегочный
Двуотточный
Околоартериальный
ДМЖП — дефект межжелудочковой перегородки; ДПЖП — дефект предсердно-желудочковой перегородки.
ТАБЛИЦА 44.7 Классификация дефектов межжелудочковой перегородки
Рис. 44.13 Межжелудочковая перегородка и типы дефектов межжелудочковой перегородки. (А) Гладкая область приточной части межжелудочковой
перегородки сверху и сзади крепится к трикуспидальному клапану, далее простирается ниже и кзади к месту прикрепления папиллярных мышц. Трабекулярная
часть перегородки расположена ниже и кпереди от приточной части и характеризуется наличием множества трабекул на стороне правого желудочка. Отточная
часть перегородки отделена от трабекулярной части перегородочно-краевой трабекулой и простирается кпереди и выше к клапану легочной артерии. Мембраноз-
ная часть перегородки представляет собой небольшую полупрозрачную область, ограниченную спереди подаортальной отточной частью перегородки, снизу —
трабекулярной частью перегородки, а сзади — приточной частью. (Б) Варианты локализации дефекта межжелудочковой перегородки (ДМЖП). Могут встречать-
ся сразу несколько типов.
Мембранозная
часть перегородки
Отточная часть
перегородки
Трабекулярная
часть перегородки
Надгребешковый
ДМЖП
Приточный
ДМЖП
Мышечный
ДМЖП
Перимембранозный
ДМЖП
Приточная часть
перегородки
А
Б
ch44.indd 1150
03.04.2019 12:18:12
1151
44 Врожденные внутрисердечные шунты
тельство не показано, всем пациентам периодиче-
ски следует проводить ТТЭхоКГ, поскольку у них
возможно развитие инфекционного эндокардита
трикуспидального клапана и двухкамерного ПЖ и
аортальной регургитации.
Из-за того что септальная створка связана с мем-
бранозной частью перегородки, высокоскоростной
поток через ДМЖП повреждает эту створку, что
может привести к развитию инфекционного эндо-
кардита. При подозрении на инфекционный эндо-
кардит трикуспидального клапана рекомендуется
провести ЧПЭхоКГ. После курса антибиотикотера-
пии следует закрыть ДМЖП хирургическим мето-
дом с одновременной пластикой либо протезиро-
ванием трикуспидального клапана. При тяжелой
трикуспидальной регургитации либо септической
эмболии ветвей легочного ствола оперативное вме-
шательство выполняют в более ранние сроки.
В некоторых случаях интенсивный поток через
ДМЖП повреждает мышечный пучок ПЖ, вызывая
локальное прогрессирующее утолщение и фиброз
стенки желудочка. Со временем гипертрофирован-
ный мышечный пучок может стать причиной об-
струкции полости желудочка, что будет способство-
вать прогрессированию гипертрофии. В результате
ПЖ разделяется на две камеры: приточную камеру
с высоким давлением и толстой стенкой и отточную
камеру с низким давлением и тонкой стенкой [29].
Перимембранозный и надгребешковый ДМЖП
могут ассоциироваться с аортальной регургитаци-
ей, т.к . близость дефекта к аортальному клапану мо-
жет привести к пролапсу его створок в ВТЛЖ (при
перимембранозном ДМЖП) либо непосредственно
в ДМЖП (при надгребешковом ДМЖП). В случае
значимой аортальной регургитации для сохранения
нативного аортального клапана рекомендуется про-
вести хирургическое лечение перимембранозного
или надгребешкового ДМЖП в наиболее ранние
сроки.
У пациентов со средним ДМЖП могут наблю-
даться умеренная легочная гипертензия и расшире-
ние ЛП и ЛЖ. В этом случае следует выполнить ка-
тетеризацию сердца для количественной оценки
сброса крови, измерения давления в легочной арте-
рии и ЛСС, а также провести тесты на обратимость
легочной артериальная гипертензия. Qp/Qs ≥ 1,5 яв-
ляется прямым показанием к закрытию ДМЖП [3].
При большом нерестриктивном ДМЖП может
развиться сердечная недостаточность в раннем воз-
расте из-за перегрузки объемом левых отделов серд-
ца, и понадобится хирургическая коррекция в пер-
вые 6–12 месяцев жизни. Позднее происходят изме-
нения в легочном сосудистом русле. Закрытие ДМЖП
в первые годы жизни возможно, если давление в ле-
гочной артерии и ЛСС составляют < 70% давления
в аорте и системного сосудистого сопротивления
соответственно. Тяжелая легочная гипертензия раз-
вивается у большинства пациентов с нерестриктив-
ным ДМЖП в возрасте 8–10 лет. Закрытие дефекта
пациентам с синдромом Эйзенменгера противопо-
казано. При данном состоянии на допплерограмме
отмечается низкая скорость потока крови справа на-
лево либо двунаправленный сброс крови, также на-
блюдается гипертрофия и дилатация ПЖ.
Вазодилататоры малого круга кровообращения
заметно улучшают прогноз и уменьшают смерт-
ность в данной группе пациентов, снижая ЛСС с по-
следующим улучшением систолической и диастоли-
ческой функций ПЖ.
АНАТОМИЯ И ВИЗУАЛИЗАЦИЯ
ТТЭхоКГ имеет большое значение для диагностики
ДМЖП, определения его локализации и размера, а
также направления и скорости потока через дефект
и наличия сопутствующих пороков. Небольшие де-
фекты трудно визуализировать в 2D-режиме. Ино-
гда поток через ДМЖП может быть эксцентриче-
ским, поэтому его следует оценивать под разными
углами для определения максимальной скорости
потока с целью расчета градиента давления в обла-
сти ДМЖП во время систолы. При отсутствии об-
струкции оттока из ПЖ или ЛЖ давление в ПЖ и,
следовательно, давление в легочной артерии можно
рассчитать, вычитая градиент давления в области
ДМЖП во время систолы из систолического арте-
риального давления. ЧПЭхоКГ полезна в тех случа-
ях, когда визуализация при ТТЭхоКГ недостаточно
качественная и сложно позиционировать катетер
при транскатетерном закрытии ДМЖП.
Перимембранозный ДМЖП локализуется в мем-
бранозной части перегородки, представляющей со-
бой небольшую соединительнотканную мембрану,
расположенную у основания сердца и соприкаса-
ющуюся с фиброзным соединением митрального,
трикуспидального и аортального клапанов.
Мембранозная часть межжелудочковой перего-
родки имеет две зоны: межжелудочковую и атрио-
вентрикулярную, которые разделены септальной
створкой трикуспидального клапана. Атриовентри-
кулярная зона мембранозной части перегородки рас-
полагается между точками соприкосновения ми-
трального и трикуспидального клапанов с перего-
родкой. Поскольку трикуспидальный клапан распо-
лагается ниже фиброзного кольца митрального кла-
пана, то атриовентрикулярная зона мембранозной
части перегородки определяется ПП и ЛЖ [30]. Шунт
между ЛЖ и ПП называют дефектом Гербоде [31].
Межжелудочковая зона мембранозной части пе-
регородки сверху ограничена атриовентрикулярной
зоной мембранозной части перегородки, спереди —
отточной частью, снизу — трабекулярной частью, а
сзади — приточной частью перегородки. Перимем-
бранозный ДМЖП может локализоваться в межже-
лудочковой зоне и лежать ниже и медиальнее аор-
тального клапана и латеральнее септальной створки
трикуспидального клапана.
ch44.indd 1151
03.04.2019 12:18:13
1152 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Перимембранозный ДМЖП лучше всего визуа-
лизируется в парастернальной позиции по длинной
оси под небольшим углом, смещенным медиально.
В парастернальной позиции по короткой оси ниже
аортального клапана перимембранозный ДМЖП
определяется в положении на 9–10 часах условного
циферблата, ниже правой коронарной створки аор-
тального клапана и поблизости от септальной створ-
ки трикуспидального клапана. Необходимо тща-
тельно изучить септальную створку трикуспидаль-
ного клапана, которая может препятствовать потоку
через перимембранозный ДМЖП, уменьшая сброс
крови слева направо, а иногда полностью закрывая
дефект. В последнем случае ДМЖП может остаться
недиагностированным или визуализироваться в ви-
де аневризмы межжелудочковой перегородки.
Мышечный ДМЖП может располагаться в лю-
бой области мышечной части межжелудочковой пе-
регородки. Мышечную часть этой перегородки под-
разделяют на приточный, трабекулярный и инфун-
дибулярный участки.
Часто встречаются несколько мышечных ДМЖП.
Они визуализируются в парастернальной позиции
по длинной оси или апикальной четырехкамерной
позиции, иногда нужно изменить угол наклона дат-
чика в зависимости от расположения дефекта. Не-
большой мышечный дефект в 2D-режиме не визуа-
лизируется, его можно обнаружить лишь при нали-
чии допплеровского потока через ДМЖП. В таких
случаях в середине систолы поток через ДМЖП мо-
жет прекращаться, поскольку утолщенный миокард
временно его закрывает. Малый мышечный ДМЖП
может иметь извитой ход.
Приточный ДМЖП появляется в результате на-
рушения формирования центрального фиброзного
тела (или креста сердца) и связан с общим атрио-
вентрикулярным клапаном (см. «Дефект межпред-
сердной перегородки типа ostium primum»). При-
точная часть перегородки располагается ниже и по-
зади мембранозной части. Базальной и апикальной
границами приточной части перегородки являются
атриовентрикулярные клапаны и места прикрепле-
ния их сухожильных хорд соответственно. Лучше
всего данный дефект визуализируется в апикальной
четырехкамерной позиции и субкостальной пози-
ции.
Надгребешковый ДМЖП локализуется в инфун-
дибулярной части перегородки, которая находится
ниже обоих полулунных клапанов и разделяет ВТПЖ
и ВТЛЖ. С правой стороны перегородки границу ее
инфундибулярной части образуют мембранозная
часть перегородки, папиллярные мышцы конуса и
полулунные клапаны. Надгребешковый ДМЖП ви-
зуализируется по длинной оси под небольшим ме-
диальным углом и по короткой оси в положении
на 2 часах условного циферблата, ниже аортального
клапана и рядом с клапаном легочной артерии. По-
ток через ДМЖП направлен из ВТЛЖ в ВТПЖ.
ТАКТИКА ЛЕЧЕНИЯ
Закрытие малого ДМЖП показано пациентам с уме-
ренной или тяжелой степенью аортальной регур-
гитации, эндокардитом трикуспидального клапана
и двухкамерным ПЖ. Средний и большой дефекты
следует закрывать, когда Qp/Qs > 2,0, а также при
перегрузке объемом ЛЖ. Транскатетерное закрытие
можно выполнить в случаях, когда Qp/Qs > 1,5, а
давление в легочной артерии и сосудистое сопро-
тивление в малом круге кровообращения составля-
ют < 70% артериального давления и сосудистого со-
противления в большом круге кровообращения со-
ответственно. Закрытие ДМЖП противопоказано
пациентам с необратимой тяжелой легочной арте-
риальной гипертензией.
Ввиду близкого расположения приточного и над-
гребешкового ДМЖП к клапанам сердца хирурги-
ческое закрытие дефекта проводят открытым спо-
собом. С развитием катетерных технологий и появ-
лением новых видов окклюдеров транскатетерное
закрытие стало альтернативой открытой хирургии
в лечении мышечного ДМЖП.
Перимембранозный ДМЖП также закрывают с
помощью окклюдера, но этот метод еще не одо-
брен FDA для клинического использования на тер-
ритории США. В крупном международном иссле-
довании (n = 100) закрытие перимембранозного
дефекта с помощью окклюдера Amplatzer Septal
Occluder было успешным в 93% случаев. Времен-
ная полная атриовентрикулярная блокада сердца
наблюдалась в 4% случаев, при этом в 2% случаев
понадобилась имплантация постоянного кардио-
стимулятора [32].
Подобно лечению ДМПП типа ostium secundum,
транскатетерное закрытие ДМЖП можно прово-
дить под контролем ЧПЭхоКГ либо ВСЭхоКГ для
правильного позиционирования окклюдера, оцен-
ки остаточного шунтирования, а также подтвержде-
ния нормального функционирования соседних кла-
панов. После транскатетерной либо открытой кор-
рекции ДМЖП крайне важно в послеоперационном
периоде отслеживать остаточное шунтирование че-
рез окклюдер или заплату.
РАЗРЫВ АНЕВРИЗМЫ СИНУСА ВАЛЬСАЛЬВЫ
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Аневризма синуса Вальсальвы может быть врожден-
ной или приобретенной после инфекции, болезни
соединительной ткани либо операции. Врожденная
аневризма синуса Вальсальвы представляет собой
истонченное очаговое расширение аорты, которое
пролабирует в смежные структуры сердца. Порок
часто описывают как «ветровой конус». Аневризма
некоронарного синуса пролабирует в ПП, левого
коронарного синуса — в ЛП, правого коронарного
синуса — в ПЖ. Таким образом, разрыв аневризмы
синуса Вальсальвы может приводить к сбросу кро-
ch44.indd 1152
03.04.2019 12:18:13
1153
44 Врожденные внутрисердечные шунты
ви как выше, так и ниже трикуспидального клапа-
на. Сброс крови из аорты в ПП выше этого клапана
приводит к перегрузке объемом правых отделов
сердца, в то время как сброс крови из аорты в ПЖ
приводит к перегрузке давлением ПЖ и перегрузке
объемом левых отделов сердца. Сброс крови из аор-
ты в ЛП вызывает перегрузку объемом левых отде-
лов сердца.
ВИЗУАЛИЗАЦИЯ
Диагноз «аневризма синуса Вальсальвы» легко по-
ставить при ТТЭхоКГ по наличию непрерывного
высокоскоростного потока между корнем аорты и
принимающей полостью, поскольку давление в
аорте превышает давление в ПП, ЛП и ПЖ в тече-
ние всего сердечного цикла. Однако скорость пото-
ка может быть значительно уменьшена при сбросе
крови из аорты в ПЖ, при легочной гипертензии
и обструкции оттока из ПЖ. ЭхоКГ в высокой па-
растернальной позиции по короткой оси позволя-
ет визуализировать синусы, аневризму и полость,
принимающую кровь. Диагноз можно подтвердить
в апикальной позиции.ЧПЭхоКГ помогает оценить
расстояния между дефектом и аортальным клапа-
ном, коронарными артериями и принять решение о
транскатетерной коррекции.
ТАКТИКА ЛЕЧЕНИЯ
Коррекцию разрыва аневризмы синуса Вальсальвы
выполняют независимо от ее размера для предот-
вращения развития эндокардита и сердечной недо-
статочности. Коррекцию можно выполнить как от-
крытым, так и транскатетерным способом. Однако
для транскатетерного закрытия необходимо нали-
чие достаточных по размеру краев, чтобы была воз-
можность зафиксировать диски окклюдера и не по-
вредить коронарные артерии и аортальный клапан
(рис. 44 .14).
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Открытый артериальный проток (ОАП) представ-
ляет собой посттрикуспидальный шунт, возник-
ший в результате дефекта между верхней частью
нисходящего отдела аорты и дистальным участком
легочного ствола. ОАП является важным компо-
нентом эмбрионального кровообращения и обыч-
но спонтанно закрывается в течение 1 недели после
рождения. Частота ОАП составляет 56,7 на 100 000
живорожденных детей [21].
Небольшой рестриктивный ОАП приводит к ми-
нимальной перегрузке объемом левых отделов серд-
ца без расширения ЛП и ЛЖ и без повышения дав-
ления в легочной артерии. Средний ОАП вызывает
умеренное повышение давления в легочной артерии
и расширение ЛП и ЛЖ. Большой ОАП приводит к
прогрессирующей сердечной недостаточности в
первые недели жизни из-за увеличения сброса кро-
ви из аорты в легочный ствол по мере уменьшения
Рис. 44 .14 Разрыв аневризмы синуса Вальсальвы. 26-летний мужчина с одышкой при физической нагрузке и диагностированным разрывом аневризмы
синуса Вальсальвы (АСВ). (А) A ЧПЭхоКГ, позиция из среднего отдела пищевода. Разрыв аневризмы синуса Вальсальвы со сбросом крови слева направо из
корня аорты (Ао) в выходной тракт правого желудочка (ВТПЖ). (Б) A На 3D-ЧПЭхоКГ рядом с аортальным клапаном (АК) виден дефект. (В) A Транскатетер-
ная установка окклюдера мышечного дефекта межжелудочковой перегородки. (Г) A Визуализация окклюдера на 3D-ЧПЭхоКГ. ВТЛЖ — выходной тракт левого
желудочка; КЛА — клапан легочной артерии.
КЛА
ВТПЖ
ВТПЖ
ВТЛЖ
АСВ
АСВ
АК
АК
Ао
КЛА
Окклюдер
Окклюдер
А
Б
В
Г
КЛА
ch44.indd 1153
03.04.2019 12:18:13
1154 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ЛСС. В первые годы жизни при большом ОАП зна-
чительно повышается ЛСС, что может привести к
развитию синдрома Эйзенменгера и изменению на-
правления потока через ОАП. У пациентов с синдро-
мом Эйзенменгера вследствие ОАП обнаруживается
характерный симптом, называемый дифференци-
альным цианозом: на верхних конечностях уровень
сатурации практически соответствует норме, т.к . в
них поступает оксигенированная кровь из аорты, в
то время как на нижних конечностях отмечается
умеренный цианоз, обусловленный смешением ве-
нозной крови с артериальной на уровне впадения
ОАП в грудную часть нисходящего отдела аорты.
ВИЗУАЛИЗАЦИЯ
В большинстве случаев малый и средний ОАП слож-
но оценить в 2D-режиме, однако легко обнаружить
при ЦДК кровотока в парастернальной позиции по
короткой оси и визуализации ВТПЖ (рис. 44 .15).
Смещение датчика вверх в верхнюю парастерналь-
ную позицию (на уровне аортального клапана) и
поворот по часовой стрелке дают возможность ви-
зуализировать бифуркацию легочного ствола. При
вращении датчика против часовой стрелки ультра-
звуковой луч отображает ОАП по длинной оси. Ду-
гу аорты можно визуализировать в супрастерналь-
ной позиции. Наклон датчика влево и поворот по
часовой стрелке визуализируют левую легочную ар-
терию и нисходящий отдел аорты в одной плоско-
сти. В этой позиции ОАП обычно хорошо виден.
У пациентов с небольшим или средним ОАП и
умеренно повышенным давлением в легочной арте-
рии при непрерывно-волновой допплерографии
регистрируется поток из аорты в легочный ствол.
Систолическое и диастолическое давление в легоч-
ной артерии можно рассчитать, вычислив соответ-
ствующие градиенты с использованием максималь-
ных скоростей потока и вычтя их из соответствую-
щих значений артериального давления, полученных
неинвазивным методом.
Пациенты с большим ОАП и значительно повы-
шенным ЛСС могут иметь низкоскоростной двуна-
правленный сброс крови либо сброс крови справа
налево через ОАП, поэтому иногда ОАП сложно ди-
агностировать даже с помощью ЦДК кровотока. В
таких случаях следует выполнить пробу с пузырь-
ковым контрастированием. После введения кон-
трастного средства пузырьки появляются в грудной
части нисходящего отдела аорты и отсутствуют в
восходящем отделе аорты.
ТАКТИКА ЛЕЧЕНИЯ
На данный момент транскатетерное закрытие ОАП
успешно выполняют с низкой частотой осложнений
с помощью спиралей и окклюдеров. Закрытие пока-
зано всем пациентам с симптомами сердечной недо-
статочности и эндартериитом в анамнезе. Бессим-
птомное течение порока с расширением ЛП, ЛЖ
также следует лечить в целях профилактики сердеч-
ной недостаточности. При малом, случайно обнару-
женном ОАП у бессимптомных пациентов мнения
специалистов о необходимости лечения неоднознач-
ны, однако большинство рекомендуют закрывать
дефект для профилактики развития эндартериита.
Закрытие противопоказано пациентам с высо-
ким ЛСС, двунаправленным сбросом крови либо
сбросом справа налево. У пациентов с синдромом
Эйзенменгера сердечный выброс из ПЖ часто сни-
Рис. 44 .15 Открытый артериальный проток. Пациент с нерестриктивным дефектом межжелудочковой перегородки, открытым артериальным протоком (ОАП)
и легочной гипертензией. (А) A Верхняя парастернальная позиция. Открытый артериальный проток визуализируется между нисходящим отделом аорты (НАо)
и легочным стволом (ЛС). При ЦДК кровотока виден типичный для порока поток вдоль боковой стенки легочного ствола. (Б) Непрерывно-волновая допплерогра-
фия. На спектрограмме отражается поток через открытый артериальный проток в легочный ствол во время систолы, а также непрерывный поток из аорты в ле-
гочный ствол. Градиент давления между аортой и легочным стволом можно рассчитать по скорости потока через открытый артериальный проток . У данного па-
циента систолическая и диастолическая скорости равны 2,7 м/сек. Градиент давления в аорте и легочном стволе во время диастолы составляет 28 мм рт. ст. Ле-
гочное систолическое и диастолическое давление рассчитывают, вычитая 28 мм рт. ст. из значений неинвазивно измеренного систолического и диастолического
артериального давления соответственно. ВАо — восходящий отдел аорты; ПЛА — правая легочная артерия.
ПЛА
ВАо
НАо
ЛС
ОАП
А
Б
ch44.indd 1154
03.04.2019 12:18:13
1155
44 Врожденные внутрисердечные шунты
жается из-за высокого ЛСС. При некоторых ВПС
ОАП может функционировать как «клапан сброса»,
что позволяет поддерживать сердечный выброс за
счет шунтирования венозной крови из легочного
ствола в нисходящий отдел аорты. Это приводит к
выраженному цианозу. У данных пациентов не ре-
комендуется закрывать ОАП ввиду возможного
ухудшения гемодинамики и функции ПЖ.
ФИСТУЛА КОРОНАРНОЙ АРТЕРИИ
АНАТОМИЯ И ПАТОФИЗИОЛОГИЯ
Фистула коронарной артерии представляет собой
аномальное соединение коронарной артерии с од-
ной полостью сердца или с магистральным сосудом.
Фистула может возникнуть на любом участке коро-
нарного русла, иметь множественные источники и
образовывать сложную сосудистую сеть перед впа-
дением в полость сердца либо сосуд с более низким
давлением. Описаны фистулы, впадающие в ПП,
ПЖ, коронарный синус, ВПВ, легочный ствол, ле-
гочную вену, ЛП и ЛЖ [33]. У пациентов могут
быть симптомы ишемии миокарда из-за феномена
обкрадывания, при котором преимущественный
сброс крови в полость с низким давлением приво-
дит к относительной коронарной недостаточности.
ВИЗУАЛИЗАЦИЯ
Фистулу коронарной артерии обнаруживают, как
правило, случайно во время коронарной ангиогра-
фии, иногда фистула визуализируется при ЭхоКГ,
особенно если она большая либо имеет аневризма-
тическое расширение (рис. 44 .16). При ЦДК крово-
тока отмечается непрерывный поток через фистулу.
ТАКТИКА ЛЕЧЕНИЯ
При наличии феномена обкрадывания, перегрузки
объемом и приемлемой для коррекции анатомии
порока проводят хирургическое лигирование либо
транскатетерное закрытие фистулы коронарной ар-
терии.
Рис. 44 .16 Фистула коронарной артерии. 50-летний мужчина с болью в груди. (А) A Парастернальная позиция выходного тракта правого желудочка (ВТПЖ)
с визуализацией легочного ствола (ЛС) и клапана легочной артерии (КЛА). Над клапаном виден небольшой эхонегативный участок, который представляет собой
аневризматически расширенную коронарную артерию (КА), дренирующуюся через фистулу в легочный ствол. При ЦДК кровотока отмечается непрерывный по-
ток в легочный ствол. (Б) A На коронарной ангиограмме (бипланарное изображение) виден участок стеноза левой передней нисходящей артерии (ЛПНА) с анев-
ризматически расширенной коронарной артерией, расположенной проксимальнее и дистальнее стенозированного участка (мешотчатая аневризма). Изображение
при коронарной ангиографии соответствует изображению, полученному при ЭхоКГ. ЛЖ — левый желудочек; ОА — огибающая артерия.
BIPLANE A RAO 39 CAUD 23
КА
КА
ЛПНА
ЛЖ
ЛС
ОА
ВТПЖ
КЛА
А
Б
Вид шунта
Определение
Эхокардиографические/
допплерографические признаки
Показания
к хирургическому лечению
Открытое овальное
окно
Неполное слияние первичной
перегородки (septum primum)
и вторичной перегородки
(septum secundum)
При ЦДК кровотока: непрерывный либо
прерывистый поток через ООО, пре-
имущественно слева направо. Сброс
крови может быть справа налево при
кашле, пробе Вальсальвы и высоком
давлении в правых отделах сердца
Гипоксемия
Повторная эмболия
в анамнезе
Шунт на уровне
предсердий
Претрикуспидальный шунт,
приводящий к перегрузке
объемом правых отделов
сердца
Расширение ПП/ПЖ, уплощение межже-
лудочковой перегородки во время диа-
столы. При ЦДК кровотока: сброс крови
обычно слева направо. Для расчета
Qp/Qs следует определить CSAВТПЖ
и VTIВТПЖ, CSAВТЛЖ и VTIВТЛЖ
Сердечная недостаточность
Qp/Qs > 1,5
Дилатация ПП/ПЖ
Закрытие противопоказано
при тяжелой ЛАГ,
ЛСС > 7–8 ед. Вуда
СВОДНАЯ ИНФОРМАЦИЯ
Врожденные шунты сердца
ch44.indd 1155
03.04.2019 12:18:14
1156 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Вид шунта
Определение
Эхокардиографические/
допплерографические признаки
Показания
к хирургическому лечению
ДМПП типа ostium
secundum
Дефект в области овальной
ямки
ТТЭхоКГ: субкостальная четырехкамер-
ная позиция для визуализации дефекта
и ЦДК кровотока. Парастернальная
позиция по короткой оси, апикальная
четырехкамерная позиция для оценки
краев дефекта
ЧПЭхоКГ: позиция из среднего отдела
пищевода позволяет увидеть все края
дефекта и оценить возможность транс-
катетерного закрытия
Транскатетерное закрытие
предпочтительно
при краях дефекта > 3 мм,
может рассматриваться
при краях дефекта < 3 мм
Хирургическое закрытие
открытым способом
очень большого дефекта
(> 30 мм) с отсутствием
свободных краев
ДМПП типа ostium
primum
Дефект, затрагивающий центр
сердца, снизу ограничен
АВ-клапанами . Входит
в состав ДПЖП
Лучше всего визуализируется в апикаль-
ной четырехкамерной позиции. Могут
наблюдаться регургитация при расщеп-
лении створки АВ-клапана и обструк-
ция ВТЛЖ
Хирургическое закрытие
открытым способом
Дефект венозного
синуса
Дефект в месте соединения
одной полой вены и ПП.
Часто сочетается с аномаль-
ным дренажем легочных вен
ТТЭхоКГ: визуализируется плохо. Реко-
мендуется ЧПЭхоКГ для оценки дефекта
и венозного возврата от легких
Хирургическое закрытие
открытым способом
Дефект крыши
коронарного
синуса
Дефект, через который идет
сброс крови слева направо
ТТЭхоКГ: могут наблюдаться расширен-
ный КС, добавочная левая ВПВ
ЧПЭхоКГ: позиция из среднего отдела
пищевода (100–110°) позволяет визуа-
лизировать крышу коронарного синуса
Хирургическое закрытие
открытым способом
Аномальный
дренаж легочных
вен
Большая вариабельность
в зависимости от количества
аномально дренирующихся
легочных вен и полостей,
в которые они впадают.
ТАДЛВ обычно диагности-
руют в неонатальном
периоде, а ЧАДЛВ —
в старшем возрасте. Ассоци-
ируется с дефектом веноз-
ного синуса
Расширение ПП/ПЖ, уплощение межже-
лудочковой перегородки
ТТЭхоКГ: может отмечаться дренаж в ПП
либо НПВ
ЧПЭхоКГ используют для диагностики
ЧАДЛВ в ВПВ, ПП, КС
Хирургическое лечение
показано при наличии
симптомов сердечной
недостаточности, расшире-
ния ПП/ПЖ. Обычно
при частичном аномаль-
ном дренаже одной вены
лечение не нужно
Дефект межже-
лудочковой
перегородки
Посттрикуспидальный шунт,
в результате возникает
перегрузка давлением ПЖ
и перегрузка объемом левых
отделов сердца
Гипертрофия ПЖ, расширение ПЖ, дис-
функция ПЖ; подъем систолического
давления в ПЖ/ЛА; расширение
ЛП/ЛЖ. При небольших и средних
дефектах отмечается сброс крови слева
направо. При двунаправленном сбросе
крови либо сбросе справа налево
следует заподозрить тяжелую ЛГ
Закрытие показано при:
• Qp/Qs > 2,0 и расшире-
нии ЛП/ЛЖ;
• при Qp/Qs > 1,5 и давле-
ниивЛА<70%
от системного давления,
ЛСС < 70% ССС;
• наличии систолической/
диастолической левоже-
лудочковой
недостаточности;
• н а ли ч ии двухкамерного
ПЖ, эндокардита, аор-
тальной регургитации
Перимембраноз-
ный ДМЖП
Дефект мембранозной части
межжелудочковой перего-
родки, ближе к основанию
сердца
Парастернальная позиция по длинной
оси сразу ниже аортального клапана,
парастернальная позиция по короткой
оси в положении на 9–10 часах услов-
ного циферблата. Дефект может быть
прикрыт септальной створкой трику-
спидального клапана
Рекомендуется открытое
хирургическое вмешатель-
ство ввиду более низкого
риска АВ-блокады сердца
в сравнении с транскате-
терным методом
СВОДНАЯ ИНФОРМАЦИЯ
продолжение
Врожденные шунты сердца
ch44.indd 1156
03.04.2019 12:18:15
1157
44 Врожденные внутрисердечные шунты
Вид шунта
Определение
Эхокардиографические/
допплерографические признаки
Показания
к хирургическому лечению
Мышечный
ДМЖП
Дефект в мышечной части
перегородки. Бывает
множественным
Парастернальная позиция по длинной
оси и апикальная четырехкамерная
позиция. Небольшой дефект
в 2D-режиме определить сложно,
но возможно при ЦДК кровотока
Транскатетерное закрытие
возможно при достаточном
удалении дефекта от три-
куспидального клапана
и аорты
Приточный
ДМЖП
Дефект с вовлечением центра
сердца, ограниченный
сверху АВ-клапанами.
Входит в состав ДПЖП
Апикальная четырехкамерная позиция
ниже АВ-клапанов. Могут наблюдаться
регургитация при расщеплении створки
АВ-клапана и обструкция ВТЛЖ
Хирургическое закрытие
открытым способом
Надгребешковый
ДМЖП
Дефект в инфундибулярной
части перегородки, ниже
аортального клапана, рядом
с клапаном ЛА
Парастернальная позиция по длинной
оси с наклоном датчика в медиальном
направлении; парастернальная позиция
по короткой оси в положении на 2 часах
условного циферблата
Хирургическое закрытие
открытым способом
Разрыв аневризмы
синуса
Вальсальвы
Обычно рестриктивный шунт
различной локализации:
из правого КС — в ПЖ,
излевогоКС—вЛП,
из некоронарного синуса —
вПП
Парастернальная позиция по короткой
оси сразу над аортальным клапаном.
Высокоскоростной непрерывный сброс
слева направо на протяжении всего
сердечного цикла
Закрытие рекомендуется
при любом размере, т.к .
есть риск увеличения
дефекта. Выбор метода
закрытия (хирургический
либо транскатетерный)
зависит от опыта клиники.
Для транскатетерного
закрытия нужно достаточ-
ное расстояние между
дефектом, коронарными
артериями и аортальным
клапаном
Открытый артери-
альный проток
Шунт между верхней частью
нисходящего отдела аорты
и дистальным участком
легочного ствола
Высокая парастернальная позиция
по короткой оси с поворотом датчика
против часовой стрелки для визуализа-
ции бифуркации ЛС. В супрастерналь-
ной позиции визуализируют дугу
аорты, левую ЛА и нисходящий отдел
аорты
Непрерывный сброс крови слева направо
при малом или среднем ОАП
Низкоскоростной двунаправленный
сброс крови либо сброс крови справа
налево отмечается при тяжелой ЛАГ
(синдром Эйзенменгера)
Закрытие показано
при сбросе крови слева
направо с расширением
ЛП/ЛЖ, ЛАГ либо
симптомов сердечной
недостаточности
Закрытие противопоказано
пациентам с ЛАГ
и сбросом крови справа
налево
Фистула коронар-
ной артерии
Аномальное окончание коро-
нарной артерии. Наблюда-
ется на любом участке коро-
нарного русла, может иметь
несколько источников
и формировать сосудистую
сеть перед впадением
в полость сердца, ВПВ,
ЛСиКС
Может визуализироваться расширенная
коронарная артерия. При ЦДК крово-
тока и импульсно-волновой и непре-
рывно-волновой допплерографии
подтверждается аномальный поток,
который варьирует в зависимости
от размера фистулы и дренирующей
полости
Закрытие показано
при наличии у пациента
клинических признаков
феномена обкрадывания,
а также при анатомическом
варианте, приемлемом
для лигирования либо
эмболизации спиралью
CSA — площадь поперечного сечения; Qp — легочный кровоток; Qs — системный кровоток; VTI — интеграл скорости кровотока; АВ —
атриовентрикулярный; ВПВ — верхняя полая вена; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого же-
лудочка; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки; ДПЖП — дефект предсерд-
но-желудочковой перегородки; КС — коронарный синус; ЛА — легочная артерия; ЛАГ — легочная артериальная гипертензия; ЛЖ —
левый желудочек; ЛП — левое предсердие; ЛС — легочный ствол; ЛСС — легочное сосудистое сопротивление; НПВ — нижняя полая
вена; ОАП — открытый артериальный проток; ООО — открытое овальное окно; ПЖ — правый желудочек; ПП — правое предсердие;
ССС — системное сосудистое сопротивление; ТАДЛВ — тотальный аномальный дренаж легочных вен; ТТЭхоКГ — трансторакальная
эхокардиография; ЦДК — цветовое допплеровское картирование; ЧАДЛВ — частичный аномальный дренаж легочных вен; ЧПЭхоКГ —
чреспищеводная эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Врожденные шунты сердца
ch44.indd 1157
03.04.2019 12:18:15
1158 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ЛИТЕРАТУРА
1. Warnes C, Williams R, Bashore T, et al. ACC/
AHA 2008 Guidelines for the management of
adults with congenital heart disease: executive
summary, a report of the American College
of Cardiology/American Heart Association
Task Force on Practice Guidelines (Writing
Committee to Develop Guidelines for the
Management of Adults With Congenital
Heart Disease) Developed in Collaboration
With the American Society of Echocardiog-
raphy, Heart Rhythm Society, International
Society for Adult Congenital Heart Disease,
Society for Cardiovascular Angiography and
Interventions, and Society of Thoracic Sur-
geons, J Am Coll Cardiol 52:1890–1947, 2008.
2. American College of Cardiology Foundation
Appropriate Use Criteria Task F, American
Society of E, American Heart A, et al. ACCF/
ASE/AHA/ASNC/HFSA/HRS/SCAI/SCCM/
SCCT/SCMR 2011 appropriate use criteria
for echocardiography. A report of the Amer-
ican College of Cardiology Foundation Ap-
propriate Use Criteria Task Force, American
Society of Echocardiography, American
Heart Association, American Society of Nu-
clear Cardiology, Heart Failure Society of
America, Heart Rhythm Society, Society for
Cardiovascular Angiography and Interven-
tions, Society of Critical Care Medicine, Soci-
ety of Cardiovascular Computed Tomogra-
phy, and Society for Cardiovascular Magnet-
ic Resonance Endorsed by the American
College of Chest Physicians, J Am Coll Cardi-
ol 57:1126–1166, 2011.
3. Warnes C, Williams R, Bashore T, et al. ACC/
AHA 2008 guidelines for the management of
adults with congenital heart disease: a report
of the American College of Cardiology/
American Heart Association Task Force on
Practice Guidelines (Writing Committee to
Develop Guidelines on the Management of
Adults With Congenital Heart Disease) De-
veloped in Collaboration With the American
Society of Echocardiography, Heart Rhythm
Society, International Society for Adult Con-
genital Heart Disease, Society for Cardiovas-
cular Angiography and Interventions, and So-
ciety of Thoracic Surgeons, J AM Coll Cardiol
52:e143–e263, 2008.
4. Di Tullio MR. Patent foramen ovale: echocar-
diographic detection and clinical relevance in
stroke, J Am Soc Echocardiogr 23:144–155, 2010.
5. Woods TD, Patel A. A critical review of pat-
ent foramen ovale detection using saline con-
trast echocardiography: when bubbles lie, J
Am Soc Echocardiogr 19:215–222, 2006.
6. Barzilai B, Waggoner AD, Spessert C, et al.
Two-dimensional contrast echocardiography
in the detection and follow-up of congenital
pulmonary arteriovenous malformations, Am
J Cardiol 68:1507–1510, 1991.
7. Lovering AT, Stickland MK, Amann M, et al.
Hyperoxia prevents exercise-induced intrapul-
monary arteriovenous shunt in healthy hu-
mans, J Physiol 586(Pt 18):4559–4565, 2008.
8. La Gerche A, MacIsaac AI, Burns AT, et al.
Pulmonary transit of agitated contrast is as-
sociated with enhanced pulmonary vascular
reserve and right ventricular function during
exercise, J Appl Physiol 109:1307–1317, 2010.
9. Campbell M. Natural history of atrial septal
defect, Br Heart J 32:820–826, 1970.
10. Lindsey JB, Hillis LD. Clinical update: atrial
septal defect in adults, Lancet 369:1244–1246,
2007.
11. Gatzoulis MA, Freeman MA, Siu SC, et al.
Atrial arrhythmia after surgical closure of
atrial septal defects in adults, New Engl J Med
340:839–846, 1999.
12. Steele PM, Fuster V, Cohen M, et al. Isolated
atrial septal defect with pulmonary vascular
obstructive disease—long-term follow-up
and prediction of outcome after surgical cor-
rection, Circulation 76:1037–1042, 1987.
13. Silvestry FE, Cohen MS, Armsby LB, et al.
Guidelines for the echocardiographic assess-
ment of atrial septal defect and patent fora-
men ovale: from the American Society of
Echocardiography and Society for Cardiac
Angiography and Interventions, J Am Soc
Echocardiogr 28:910–958, 2015.
14. Saric M, Perk G, Purgess JR, Kronzon I. Im-
aging atrial septal defects by real-time three-
dimensional transesophageal echocardiogra-
phy: step-by-step approach, J Am Soc Echo-
cardiogr 23:1128–1135, 2010.
15. Du ZD, Koenig P, Cao QL, et al. Comparison
of transcatheter closure of secundum atrial
septal defect using the Amplatzer septal oc-
cluder associated with deficient versus suffi-
cient rims, Am J Cardiol 90:865–869, 2002.
16. Van Praagh S, Carrera ME, Sanders SP, et al.
Sinus venosus defects: unroofing of the right
pulmonary veins—anatomic and echocardio-
graphic findings and surgical treatment, Am
Heart J 128:365–379, 1994.
17. Kirklin JW, Barratt-Boyes BG. Cardiac sur-
gery: morphology, diagnostic criteria, natural
history, techniques, results, and indications,
New York, 1986, Wiley.
18. Sun T, Fei HW, Huang HL, et al. Transesoph-
ageal echocardiography for coronary sinus
imaging in partially unroofed coronary sinus,
Echocardiography 31:74–82, 2014.
19. Tajik AJ, Gau GT, Ritter DG, Schattenberg
TT. Echocardiographic pattern of right ven-
tricular diastolic volume overload in children,
Circulation 46:36–43, 1972.
20. Mitchell SC, Korones SB, Berendes HW. Con-
genital heart disease in 56,109 births. Inci-
dence and natural history, Circulation 43:
323–332, 1971.
21. Hoffman JI, Christianson R. Congenital heart
disease in a cohort of 19,502 births with long-
term follow-up, Am J Cardiol 42:641–647,
1978.
22. Anderson RH, Wilcox BR. The surgical anat-
omy of ventricular septal defect, J Card Surg
7:17–35, 1992.
23. Soto B, Becker AE, Moulaert AJ, et al. Classi-
fication of ventricular septal defects, Br Heart
J 43:332–343, 1980.
24. Van Praagh R, Geva T, Kreutzer J. Ventricular
septal defects: how shall we describe, name
and classify them? J Am Coll Cardiol 14:1298–
1299, 1989.
25. Jacobs JP, Burke RP, Quintessenza JA, Mav-
roudis C. Congenital Heart Surgery Nomen-
clature and Database Project: ventricular sep-
tal defect, Ann Thorac Surg 69(Suppl 4):S25–
S35, 2000.
26. Soto B, Ceballos R, Kirklin JW. Ventricular
septal defects: a surgical viewpoint, J Am Coll
Cardiol 14:1291–1297, 1989.
27. Ramaciotti C, Vetter JM, Bornemeier RA,
Chin AJ. Prevalence, relation to spontaneous
closure, and association of muscular ventric-
ular septal defects with other cardiac defects,
Am J Cardiol 75:61–65, 1995.
28. Lincoln C, Jamieson S, Joseph M, et al.
Transatrial repair of ventricular septal defects
with reference to their anatomic classifica-
tion, J Thorac Cardiovasc Surg 74:183–190,
1977.
29. Wong PC, Sanders SP, Jonas RA, et al. Pul-
monary valve-moderator band distance and
association with development of double-
chambered right ventricle, Am J Cardiol
68:1681–1686, 1991.
30. Ho SY, McCarthy KP, Rigby ML. Morphol-
ogy of perimembranous ventricular septal de-
fects: implications for transcatheter device
closure, J Interv Cardiol 17:99–108, 2004.
31. Gerbode F, Hultgren H, Melrose D, Osborn J.
Syndrome of left ventricular-right atrial
shunt; successful surgical repair of defect in
five cases, with observation of bradycardia on
closure, Ann Surg 148:433–446, 1958.
32. Holzer R, de Giovanni J, Walsh KP, et al.
Transcatheter closure of perimembranous
ventricular septal defects using the amplatzer
membranous VSD occluder: immediate and
midterm results of an international registry,
Catheter Cardiovasc Intervent 68:620–628,
2006.
33. Angelini P. Coronary artery anomalies: an en-
tity in search of an identity, Circulation
115:1296–1305, 2007.
ch44.indd 1158
03.04.2019 12:18:15
1159
45 Аномалии левых отделов сердца
AMI B. BHATT, MD • DOREEN DEFARIA YEH, MD
Трехпредсердное сердце
Врожденная патология
митрального клапана
Расщепление створок
митрального клапана
Надклапанная мембрана
Митральный клапан
с двойным отверстием
Парашютообразный митральный клапан
Врожденные аномалии расположения
папиллярных мышц
Некомпактный миокард
левого желудочка
Врожденная обструкция выходного
тракта левого желудочка
Подклапанный аортальный стеноз
Врожденная патология
аортального клапана
Надклапанный аортальный стеноз
Аномалии дуги аорты
Двойная дуга аорты
Правосторонняя дуга аорты
Шейная дуга аорты
Перерыв дуги аорты
Коарктация аорты
Аномалии коронарных артерий
Аномалии отхождения
коронарных артерий
Фистула коронарной артерии
Синдром гипоплазии левых отделов
сердца
Аномалии левых отделов сердца составляют зна-
чительную часть всех врожденных пороков сердца
(ВПС) у взрослых и могут быть как изолированны-
ми, так и сочетаться с другими патологиями (рис.
45.1). В данной главе рассмотрены некоторые пато-
логии, их анатомические особенности и связанные
с ними данные эхокардиографии (ЭхоКГ), наиболее
частые осложнения, а также применение ЭхоКГ для
длительного регулярного наблюдения и выбора
тактики лечения. В главе рассмотрены врожденные
аномалии левых отделов сердца: левого предсердия
(ЛП), митрального клапана, левого желудочка
(ЛЖ), выходного тракта левого желудочка (ВТЛЖ),
аорты и коронарных артерий. Важно отметить, что
при любом обструктивном поражении ВТЛЖ уве-
личивается риск инфекционного эндокардита, по-
этому необходимы его своевременная профилакти-
ка и диагностика.
ТРЕХПРЕДСЕРДНОЕ СЕРДЦЕ
Трехпредсердное сердце встречается очень редко —
0,4% всех ВПС. Аномалия формируется на 5-й не-
деле гестации, когда общая легочная венозная каме-
ра включается в состав ЛП. Чаще всего порок пред-
ставляет собой тонкую мембрану, которая делит ЛП
на верхнюю камеру, куда впадают легочные вены, и
нижнюю камеру, сообщающуюся с ушком ЛП и
митральным клапаном. В 70% случаев патология
сочетается с открытым овальным окном или дефек-
том межпредсердной перегородки (ДМПП), ано-
мальным дренажем легочных вен, впадением левой
верхней полой вены в коронарный синус, а также
коарктацией аорты. Мембрана может быть сплош-
ной, тогда симптомы появляются в младенчестве,
либо с небольшими отверстиями, которые обеспе-
чивают достаточный венозный возврат в ЛП, тогда
порок впервые выявляют у пациента во взрослом
возрасте (чаще всего случайно). Распространенный
симптом — фибрилляция предсердий. Со временем
фиброз мембраны может привести к развитию хро-
нической легочной венозной гипертензии и в ко-
нечном итоге — к сердечной недостаточности.
Пациенты с постоянно повышенным давлением
в легочных венах склонны к развитию поздней вто-
ричной легочной артериальной гипертензии как
при физических нагрузках, так и в состоянии покоя.
При трансторакальной эхокардиографии (ТТЭхо-
КГ) в 2D-режиме (2D-ТТЭхоКГ) выявляется тонкая
мембрана в ЛП, чрезвычайно редко — в правом
предсердии (ПП) (рис. 45.2). Она визуализируется в
парастернальной позиции по длинной оси в виде
вертикальной линейной структуры внутри ЛП, ко-
торая идет перпендикулярно восходящему отделу
аорты. Однако лучше всего мембрана визуализи-
руется в апикальной четырехкамерной позиции в
виде горизонтальной линейной структуры, отде-
ляющей верхнезаднюю часть предсердия с прито-
ком из легочных вен от нижней части с оттоком
через митральный клапан. Цветовое допплеров-
ское картирование (ЦДК) кровотока используют
для оценки турбулентного диастолического потока
и определения градиента на мембране (в случае его
наличия).
ch45.indd 1159
03.04.2019 12:18:33
1160 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Надклапанная мембрана
Парашютообразный
митральный клапан
Субаортальная мембрана
Аортальный клапан
Коарктация аорты
ПП
ЛП
ПЖ
ЛЖ
Также необходимо оценить все четыре устья ле-
гочных вен, межпредсердную перегородку и размер
коронарного синуса, чтобы выявить аномальное
впадение в него левой верхней полой вены, и визу-
ализировать дугу аорты в супрастернальной пози-
ции для исключения коарктации аорты. Измерение
давления в правом желудочке (ПЖ) и легочного со-
судистого сопротивления составляет важную часть
диагностики. Визуализация в 3D-режиме полезна
при наличии в мембране отверстий.
ВРОЖДЕННАЯ ПАТОЛОГИЯ
МИТРАЛЬНОГО КЛАПАНА
Врожденные патологии митрального клапана на-
блюдаются относительно редко (исключение — про-
лапс митрального клапана), но характеризуются по-
вышенным риском осложнений и летального ис-
хода в случае развития клапанного стеноза и/или
митральной регургитации. Данная группа пороков
обычно сочетается с другими обструктивными по-
ражениями левых отделов сердца, включая комплекс
Шона — врожденный стеноз митрального клапана
(надклапанная мембрана, парашютообразный ми-
тральный клапан), подклапанный (субаортальная
мембрана), клапанный либо надклапанный аорталь-
ный стеноз и коарктация аорты. Визуализация в
3D-режиме позволяет получить дополнительную
информацию о морфологии митрального клапана,
необходимую для планирования хирургического
либо транскатетерного вмешательства [1].
РАСЩЕПЛЕНИЕ СТВОРОК МИТРАЛЬНОГО КЛАПАНА
Расщепление створок митрального клапана чаще
всего наблюдается при дефектах предсердно-желу-
дочковой перегородки (ДПЖП) и обычно приводит
к митральной регургитации. Данный дефект возни-
кает из-за отсутствия слияния обращенных влево
верхушек верхней и нижней эндокардиальных по-
душек и мостовидных створок, причем расщелина
Рис. 45.1 Варианты обструкции левых отделов сердца. Комплекс Шона — это сочетание врожденного стеноза митрального клапана (в виде надклапанной
мембраны или парашютообразного митрального клапана), подклапанного (в виде субаортальной мембраны), клапанного либо надклапанного аортального стено-
за и коарктации аорты. ЛЖ — левый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
ch45.indd 1160
03.04.2019 12:18:33
1161
45 Аномалии левых отделов сердца
направлена на срединную часть межжелудочковой
перегородки и ПЖ (рис. 45.3). Изолированное рас-
щепление створок митрального клапана ассоции-
руется с нормально сформированным фиброзным
кольцом митрального клапана и отсутствием де-
фектов в мышечной и мембранозной частях пред-
сердно-желудочковой перегородки. Такое расще-
пление чаще всего направлено в сторону ВТЛЖ.
Изолированное расщепление иногда сочетается с
дефектом межжелудочковой перегородки (ДМЖП),
тетрадой Фалло. Струя регургитации обычно про-
ходит через расщепление передней створки и на-
правлена к задней стенке предсердий. Кроме того, у
неоперированных пациентов с ДПЖП струя регур-
гитации может попадать в полость ПП через ДМПП
типа ostium primum.
НАДКЛАПАННАЯ МЕМБРАНА
Надклапанная мембрана из соединительной ткани
(или надклапанное митральное кольцо) располага-
ется сразу над фиброзным кольцом митрального
клапана ниже ушка ЛП и приводит к обструкции
притока крови в ЛЖ. Как правило, надклапанная
мембрана не соединяется со створками митрально-
го клапана, имеющего нормальный подклапанный
аппарат. Однако иногда надклапанная мембрана ло-
кализуется внутри митрального клапана и интимно
спаяна со створками, что зачастую приводит к
структурным аномалиям, включая гипоплазию фи-
брозного кольца и наличие единственной папил-
лярной мышцы. Надклапанная мембрана входит в
состав комплекса Шона. В отличие от ревматическо-
го поражения митрального клапана, при надкла-
панной мембране ограничение подвижности ство-
рок наблюдается у их основания, в то время как края
створок ничем не ограничены (рис. 45.4). При ЦДК
кровотока отмечается ускорение потока на уровне
надклапанной мембраны, а не на краях створок, как
это происходит при ревматическом митральном
стенозе. Для всех пациентов с симптомами обструк-
ции следует планировать хирургическое вмеша-
тельство.
Рис. 45.2 Трехпредсердное сердце. (A) A Парастернальная позиция по длинной оси. Визуализируется мембрана (стрелка), делящая левое предсердие на
верхнюю камеру, в которую впадают легочные вены, и нижнюю камеру, сообщающуюся с ушком левого предсердия и митральным клапаном. (Б) A При ЦДК
кровотока выявляется умеренное ускорение потока через мембрану. (В) A Мембрана (стрелка) лучше визуализируется в апикальной четырехкамерной позиции.
(Г) A На 3D-ЧПЭхоКГ в левом предсердии видна тонкая подвижная мембрана с множественными отверстиями.
3D Beats 1
Отверстия
А
Б
Г
В
ch45.indd 1161
03.04.2019 12:18:34
1162 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
МИТРАЛЬНЫЙ КЛАПАН С ДВОЙНЫМ ОТВЕРСТИЕМ
Митральный клапан с двойным отверстием форми-
руется при наличии двух отдельных фиброзных ко-
лец с собственными створками и подклапанным ап-
паратом. Отверстия могут иметь одинаковые или
разные размеры. Данный порок чаще всего наблю-
дается у пациентов с ДПЖП, однако иногда может
быть изолированным. 2D-ЭхоКГ не дает полного
представления о данной патологии, поэтому реко-
мендуется проведение чреспищеводной эхокардио-
графии (ЧПЭхоКГ). Согласно данным крупного ис-
следования, с помощью ТТЭхоКГ поставить пра-
вильный диагноз удалось лишь в 30% всех случаев
митрального клапана с двойным отверстием в соче-
тании с ДПЖП [2]. В 3D-режиме можно получить
дополнительную информацию о размерах и форме
отверстий (рис. 45.5). Оптимальный диагностиче-
ский минимум для подтверждения диагноза вклю-
чает данные, полученные в парастернальной пози-
Рис. 45.3 Расщепление створок митрального клапана. (А) A Парастер-
нальная позиция по короткой оси. Виден митральный клапан с расщеплением
передней створки. (Б) При ЦДК кровотока визуализируется струя митральной
регургитации через расщепление, направленная кзади. (В) A Апикальная че-
тырехкамерная позиция с ЦДК кровотока и без него. Визуализируется дефект
межпредсердной перегородки (ДМПП) типа ostium primum и струя митральной
регургитации, проходящая через этот дефект в полость правого предсердия
(ПП). ЛЖ — левый желудочек; ПЖ — правый желудочек.
Рис. 45.4 Надклапанная мембрана. (А) A ЧПЭхоКГ пациента с врожден-
ным стенозом митрального клапана в виде надклапанной мембраны. Обратите
внимание на ограничение подвижности створок у их основания и нормальную
подвижность краев створок, а также значительное расширение левого пред-
сердия (ЛП). (Б) A При ЦДК кровотока выявляется ускорение потока на уров-
не надклапанной мембраны. ЛЖ — левый желудочек.
Расщепление
ДМПП типа ostium primum
ПП
ПЖ
ЛЖ
А
Б
В
ЛЖ
ЛП
А
Б
ции по длинной оси и в апикальной четырехкамер-
ной позиции.
ПАРАШЮТООБРАЗНЫЙ МИТРАЛЬНЫЙ КЛАПАН
Парашютообразный митральный клапан является
следствием его дисплазии. При этой патологии су-
хожильные хорды обычно прикреплены к одной из
папиллярных мышц (как правило, к заднемедиаль-
ной), что приводит к обструкции на уровне подкла-
панного аппарата. Другая папиллярная мышца обыч-
но не имеет сухожильных хорд, или они аномаль-
ch45.indd 1162
03.04.2019 12:18:35
1163
45 Аномалии левых отделов сердца
ные, или имеют атипичное прикрепление. Из-за
недостаточного пространства между аномальными
папиллярными мышцами может формироваться
парашютообразный митральный клапан [3]. Дан-
ная патология часто сочетается с другими обструк-
тивными поражениями левых отделов сердца, на-
пример коарктацией аорты. Диагноз трудно вери-
фицировать в парастернальной позиции по длинной
оси, но в парастернальной позиции по короткой оси
хорошо видно отверстие митрального клапана, сме-
щенное к папиллярной мышце со сходящимися к
ней сухожильными хордами (рис. 45.6). При такой
эхокардиографической картине следует оценить на-
личие обструкции путей оттока из левого желудоч-
ка на других уровнях, особенно в случае коарктации
аорты.
ВРОЖДЕННЫЕ АНОМАЛИИ РАСПОЛОЖЕНИЯ
ПАПИЛЛЯРНЫХ МЫШЦ
К данной группе относят аномалии расположения
папиллярных мышц из-за разрыхления ткани эндо-
кардиальной подушки в месте присоединения па-
пиллярных мышц, что может приводить к наруше-
ниям формирования подклапанного аппарата в ви-
де утолщения либо укорочения сухожильных хорд.
Крайняя форма — митральная аркада с прикрепле-
нием папиллярных мышц непосредственно к створ-
кам клапана [1].
НЕКОМПАКТНЫЙ МИОКАРД ЛЕВОГО ЖЕЛУДОЧКА
Некомпактный миокард ЛЖ — это врожденная кар-
диомиопатия, которая возникает, вероятно, вслед-
ствие остановки эмбриогенеза миокарда ЛЖ. Впер-
вые синдром был описан в 1984 г., с тех пор коли-
чество новых наблюдений растет, что связывают с
улучшением качества изображений. Синдром ассо-
циируется с желудочковыми аритмиями, тромбо-
Рис. 45.5 A Митральный клапан с двойным отверстием. 3D-ЧПЭхоКГ
демонстрирует митральный клапан с двойным отверстием (большим и малым,
стрелки) у пациента с частичным дефектом предсердно-желудочковой перего-
родки.
3D Beats 1
Рис. 45.6 Парашютообразный митральный клапан. (А) A Парастер-
нальная позиция по длинной оси. Пациент с парашютообразным митральным
клапаном (МК) и нормальной подвижностью его створок. (Б) A Парастерналь-
ная позиция по короткой оси. Изолированная переднелатеральная папилляр-
ная мышца без сухожильных хорд. Все сухожильные хорды обеих створок кре-
пятся к заднемедиальной папиллярной мышце, что приводит к смещению от-
верстия клапана к центру.
Отверстие МК
Папиллярная мышца
без сухожильных хорд
А
Б
эмболическими осложнениями (например, инсуль-
том), прогрессирующей дисфункцией ЛЖ и сим-
птомной сердечной недостаточностью. Генетический
аспект данного синдрома выяснен не полностью,
однако в некоторых исследованиях отмечали семей-
ный характер патологии. Крайне важно отличать
некомпактный миокард от физиологической трабе-
кулярности миокарда, которая может наблюдаться
в норме [4].
К сожалению, существует значительная вариа-
бельность параметров, оцениваемых разными вра-
чами, причем расхождение в диагностике неком-
пактного миокарда ЛЖ составляет 11% [5, 6]. Кор-
ректную диагностику затрудняет низкое качество
изображений, наличие небольшого ЛЖ с нормаль-
ной функцией, аберрантные трабекулы, ложные
хорды и аномальные папиллярные мышцы. Неком-
ch45.indd 1163
03.04.2019 12:18:36
1164 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ны риску стаза с формированием тромбов в углуб-
лениях и кардиоэмболических осложнений.
Проводят количественную оценку толщины слоя
некомпактного миокарда относительно слоя ком-
пактного миокарда (толщину измеряют в парастер-
нальной позиции по короткой оси в конце систо-
лы). Коэффициент > 2 признан диагностически
значимым. Данный метод позволяет отличить не-
компактный миокард от трабекулярности ЛЖ, на-
блюдаемой при дилатационной и гипертензивной
кардиомиопатии [9]. Также важно учитывать, что
выраженная трабекулярность может наблюдаться в
норме при увеличенных трабекулах, аритмогенной
дисплазии ПЖ, эндомиокардиальном фиброэла-
стозе, метастазах в сердце и тромбозе ЛЖ.
Для периодического скрининга подходит ЭхоКГ
с введением контрастного средства в желудочек, од-
нако методом выбора для диагностики и оценки не-
компактного миокарда является МРТ сердца [10],
которая позволяет оценить степень поражения мио-
карда по накоплению гадолиния в фиброзирован-
ных участках и выявить пациентов с риском желу-
дочковых аритмий.
пактный миокард также визуализируется на позд-
них стадиях различных заболеваний ЛЖ, включая
дилатационную и гипертрофическую кардиомио-
патии. В спорных случаях для постановки диагноза
нужно провести контрастную ЭхоКГ, ЧПЭхоКГ в
3D-режиме (3D-ЧПЭхоКГ), магнитно-резонансную
томографию (МРТ) сердца, а также динамическое
наблюдение прогрессирования патологии.
Диагноз ставят с помощью 2D-ЭхоКГ и цветовой
допплерографии. В дистальном отделе желудочка
могут определяться множественные трабекулы с глу-
бокими углублениями между ними (межтрабеку-
лярными пространствами), а при ЦДК кровотока
видны потоки крови через эти углубления [7]. Тра-
бекулярность может быть на нижней и задней стен-
ках ЛЖ и его верхушки (рис. 45.7), реже — у пере-
городки и верхушки ПЖ. Систолическая и диасто-
лическая функции ЛЖ у большинства пациентов
снижены. Участки гипокинезии могут наблюдаться
как в компактном, так и в некомпактном миокарде,
что отражает фоновую патологию, включая нару-
шения микроциркуляции [8]. Пациенты с гипоки-
незией либо акинезией миокарда больше подверже-
Рис. 45.7 Некомпактный миокард левого желудочка. (А) A Апикальная четырехкамерная позиция. Плотная трабекулярность наблюдается в области вер-
хушки и боковой стенки. (Б) A Развитая трабекулярность в области верхушки (позиция по короткой оси). (В) A Апикальная двухкамерная позиция. Трабекуляр-
ность нижней стенки. (Г) A При ЦДК кровотока визуализируются потоки крови (стрелки) в глубоких углублениях между трабекулами.
Компактный
миокард
Некомпактный
миокард
А
Б
Г
В
ch45.indd 1164
03.04.2019 12:18:37
1165
45 Аномалии левых отделов сердца
Данные МРТ сердца о локализации некомпакт-
ного миокарда и степени поражения обычно корре-
лируют с результатами ЭхоКГ. МРТ сердца следует
проводить при плохой визуализации традицион-
ными способами. Анализ различий интенсивности
сигнала МРТ на участках некомпактного миокарда
позволяет идентифицировать субстрат потенциаль-
но летальных аритмий [10]. Следует учитывать, что
эхокардиографические изображения ЛЖ получают
в конце систолы, в то время как ЛЖ на МРТ сердца
визуализируют в конце диастолы.
Прогноз при некомпактном миокарде ЛЖ у взрос-
лых и детей существенно различается и зависит от
стадии на момент выявления патологии. Большой
конечно-диастолический размер ЛЖ, ФК III–IV по
NYHA, фибрилляция предсердий и блокада ножки
пучка Гиса являются предикторами неблагоприят-
ного исхода [8]. Как и при других кардиомиопати-
ях, необходимы скорейшее начало лечения, вклю-
чая лекарственную терапию, консультация электро-
физиолога, рассмотрение вопроса об имплантации
дефибриллятора и оценка возможности трансплан-
тации сердца.
ВРОЖДЕННАЯ ОБСТРУКЦИЯ ВЫХОДНОГО ТРАКТА
ЛЕВОГО ЖЕЛУДОЧКА
ПОДКЛАПАННЫЙ АОРТАЛЬНЫЙ СТЕНОЗ
Подклапанный аортальный стеноз составляет около
6,5% ВПС. Причиной подклапанного аортального
стеноза может быть субаортальная мембрана из со-
единительной ткани или туннелеобразное фиброз-
но-мышечное сужение. Наиболее часто выявляют
субаортальную мембрану (рис. 45.8). Фиброзно-мы-
шечное сужение встречается в 10% случаев и пред-
ставляет собой тяжелый и прогрессирующий вари-
ант подклапанного аортального стеноза. Фиброзно-
мышечная ткань может значительно препятствовать
оттоку из ЛЖ и часто вызывает аортальную регур-
гитацию из-за повреждения аортального клапана
турбулентным подклапанным потоком. Изолиро-
ванный подклапанный аортальный стеноз обычно
развивается в позднем детском либо в зрелом воз-
расте спонтанно или после пластики ДПЖП. После
хирургической резекции подклапанный аортальный
стеноз может развиться вновь, поэтому необходи-
мы регулярные повторные клиническое и эхокар-
диографическое исследования.
Подклапанный аортальный стеноз в 2 раза чаще
встречается у мужчин. В большинстве случаев это
единственная врожденная патология, но иногда ему
сопутствуют ДМЖП, врожденный порок аорталь-
ного клапана, коарктация аорты. При ЭхоКГ может
визуализироваться триада патологий: подклапан-
ный аортальный стеноз, двухстворчатый аорталь-
ный клапан и двухкамерный ПЖ (табл. 45.1).
Показания класса I к хирургической резекции суб-
аортальной мембраны: максимальный мгновенный
градиент давления ≥ 50 мм рт. ст. либо средний гра-
диент давления ≥ 30 мм рт. ст., а также более низкие
градиенты давления с прогрессирующей аорталь-
ной регургитацией и конечно-диастолический раз-
мер ЛЖ > 50 мм. Оперативное вмешательство рас-
сматривают и при меньших градиентах давления,
если есть значительная гипертрофия ЛЖ, заплани-
рована беременность, пациент намерен активно за-
ниматься спортом либо есть дополнительные пока-
зания к операции на левых отделах сердца.
Существует значительная гетерогенность анато-
мии и физиологии подклапанного аортального сте-
ноза, поэтому каждый случай следует рассматри-
вать индивидуально с использованием доступных
Рис. 45.8 Подклапанный аортальный стеноз. (А) A ЧПЭхоКГ пациента
с подклапанным аортальным стенозом. Субаортальная мембрана (САМ) рас-
полагается приблизительно на 1 см ниже фиброзного кольца аортального кла-
пана и идет от базальной передней перегородочной поверхности вокруг вы-
ходного тракта левого желудочка к основанию передней створки митрального
клапана (ПСМК). Сами створки уплотнены и имеют дегенеративные изменения.
(Б) При ЦДК кровотока выявляются ускорение потока в выходном тракте ле-
вого желудочка ниже створок во время систолы и аортальная регургитация во
время диастолы. Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсер-
дие; ПЖ — правый желудочек.
ЛЖ
САМ
ПСМК
ЛП
ПЖ
Ао
А
Б
ch45.indd 1165
03.04.2019 12:18:37
1166 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
к базальной передней перегородочной поверхности
ЛЖ на разном расстоянии ниже аортального клапа-
на. Реже эта мембрана локализуется непосредствен-
но под створками либо прикрепляется к их поверх-
ности, обращенной в ЛЖ. Чаще всего субаорталь-
ная мембрана располагается примерно на 1,0–1,5 см
ниже фиброзного кольца клапана. Она может начи-
наться от основания передней перегородочной по-
верхности ЛЖ и вклиниваться в базальную часть
передней створки митрального клапана, а в очень
редких случаях — формировать в ВТЛЖ полное
кольцо.
ЦДК кровотока в 2D-режиме отражает ускорение
потока в ВТЛЖ на субаортальной мембране ниже
уровня аортального клапана при нормальнойпод-
вижности створок. Ниже субаортальной мембраны
может развиться вторичная гипертрофия перего-
родки ЛЖ, напоминающая гипертрофическую кар-
диомиопатию, но при импульсно-волновой и не-
прерывно-волновой допплерографии пациентов с
субаортальной мембраной, как правило, не наблю-
дается позднего максимального градиента в ВТЛЖ,
характерного для его динамической обструкции.
Может отмечаться высокоскоростной поток через
ВТЛЖ. Поток крови травмирует створки аорталь-
ного клапана, приводя к их деформации, утолще-
нию или пролапсу. В такой ситуации возможно об-
разование тромбов и вегетаций. Часто наблюдается
аортальная регургитация, возникающая в случае
поражения передней створки митрального клапана,
что подчеркивает необходимость его тщательной
оценки. Bharucha и соавт. исследовали 16 пациентов
с подклапанным аортальным стенозом с помощью
трехмерной мультипланарной реконструкции (из
нескольких ЭхоКГ в 2D-режиме в разных позициях)
и выявили поражение створок митрального клапа-
на, атипичное прикрепление сухожильных хорд, па-
тологические мышечные пучки в ЛЖ и увеличен-
ное расстояние между аортой и митральным клапа-
ном [11].
В послеоперационном периоде рекомендуется
выполнять ЧПЭхоКГ для оценки полноты резекции
субаортальной мембраны, состояния и функции
митрального и аортального клапанов, а также меж-
желудочковой перегородки для исключения ятро-
генных ДМЖП.
ВРОЖДЕННАЯ ПАТОЛОГИЯ АОРТАЛЬНОГО КЛАПАНА
Врожденный аортальный стеноз может возникать
на подклапанном, клапанном или надклапанном
уровне, а также на дистальном участке аорты. Врож-
денный аортальный стеноз может быть изолиро-
ванной патологией или сочетаться с другими поро-
ками. В норме аортальный клапан трехстворчатый,
но возможны врожденные аномалии количества
створок аортального клапана: одна, две и четыре.
Наиболее распространенной врожденной анома-
лией сердца является двухстворчатый аортальный
Врожденные
аномалии левых
отделов сердца
Ассоциированные
с аномалией
заболевания
Сопутству-
ющие пороки
сердца
Некомпактный
миокард ЛЖ
Тромбоз, инсульт,
желудочковые
аритмии, сердечная
недостаточность
Аномалия
Эбштейна
(редко)
Субаортальная
мембрана
Подклапанный аор-
тальный стеноз,
аортальная
регургитация
Двухстворча-
тый аорталь-
ный клапан,
надклапанная
мембрана,
коарктация
аорты,
ДМЖП, двух-
камерный ПЖ
Двухстворчатый
аортальный
клапан
Клапанный аорталь-
ный стеноз, аор-
тальная регургита-
ция, расширение
аорты
Коарктация
аорты
Коарктация аорты Рецидивирующая
коарктация аорты,
постстенотическая
дилатация, умень-
шенная дуга аорты
Двухстворча-
тый аорталь-
ный клапан,
коарктация
брюшной
части нисхо-
дящего отдела
аорты, анома-
лии митраль-
ного клапана
ДМЖП — дефект межжелудочковой перегородки; ЛЖ — левый
желудочек; ПЖ — правый желудочек.
ТАБЛИЦА 45.1 Врожденные аномалии левых отделов
сердца и сопутствующие пороки сердца
методов визуализации, поиском сопутствующих па-
тологий, клиническим обследованием и оценкой
риска долгосрочных осложнений. Не рекомендует-
ся проводить транскатетерную баллонную дилата-
цию или стентирование, поскольку прогрессирова-
ние дегенерации аортального клапана из-за нали-
чия турбулентного потока и поражения основания
митрального клапана может привести к необходи-
мости проведения вальвулопластики или протези-
рования этих клапанов.
Потенциальными осложнениями после хирурги-
ческого вмешательства являются полная атриовен-
трикулярная блокада сердца, ДМЖП и эндокардит,
поэтому нужна более тщательная диагностика. При
обследовании взрослых пациентов отмечаются си-
столический шум потока через ВТЛЖ, отсутствие
систолического щелчка и шум аортальной регурги-
тации (табл. 45.2).
При ТТЭхоКГ изолированный подклапанный аор-
тальный стеноз наилучшим образом визуализиру-
ется в парастернальной позиции по длинной оси, а
также в апикальных трех- и пятикамерной позици-
ях. Субаортальная мембрана чаще всего прилегает
ch45.indd 1166
03.04.2019 12:18:38
1167
45 Аномалии левых отделов сердца
Диагноз
Результаты обследования
Эхокардиографические данные
Дополнительная
визуализация
Подклапан-
ный аор-
тальный
стеноз
Систолический шум по левому/правому
верхнему краю грудины, распростране-
ние на сонные артерии, усиленный
верхушечный толчок ЛЖ (может ассо-
циироваться с диастолическим шумом
аорты по нижнему краю грудины)
Ускорение потока начинается ниже аортального
клапана. Нарушений подвижности створок нет.
У базальной передней перегородочной поверх-
ности может наблюдаться субаортальная мем-
брана, которая тянется до основания передней
створки митрального клапана (лучше видна в
парастернальной позиции по длинной оси, апи-
кальной трехкамерной и пятикамерной пози-
циях); аортальная регургитация
ЧПЭхоКГ
Двухствор-
чатый
аорталь-
ный
клапан
Систолический шум с прогрессирующей
задержкой тона, задержкой пульса
на сонных артериях и уменьшением
его наполнения по мере нарастания
тяжести заболевания. Систолический
щелчок уменьшается с увеличением
градиента давления. Может присут-
ствовать аортальная регургитация.
Иногда причиной систолического
шума может быть дилатация корня
аорты
В парастернальной позиции по длинной оси
видны створки куполообразной формы, в пара-
стернальной позиции по короткой оси — две
комиссуры (швы между ними могут отсутство-
вать), асимметрия створок, дилатация синусов
Вальсальвы, стирание границы синотубулярного
соединения, дилатация восходящего отдела
аорты. Следует исключить коарктацию аорты
Надклапан-
ный аор-
тальный
стеноз
Систолический шум по правому верх-
нему краю грудины (часто распростра-
няется на сонные артерии)
Сужение проксимального участка восходящего
отдела аорты на уровне синотубулярного соеди-
нения или сразу над ним; ускорение потока на
этом уровне. Могут наблюдаться стенозы ветвей
легочного ствола
МРТ/КТ сердца
Коарктация
аорты
Задержка пульса между лучевой и
бедренной артериями, сниженный
пульс на нижних конечностях, непре-
рывный шум по левому верхнему
краю грудины либо в межлопаточной
области
Для визуализации дуги аорты и ее ветвей,
а также проксимального участка нисходящего
отдела аорты используют импульсно-волновую
и непрерывно-волновую допплерографию
в супрастернальной позиции. С помощью доп-
плерографии также исследуют брюшную часть
нисходящего отдела аорты для оценки постоян-
ного потока во время диастолы. Импульсно-
волновая допплерография брюшной части нис-
ходящего отдела аорты выявляет замедленный
поток во время систолы и антеградный поток
во время диастолы. Следует провести скрининг
двухстворчатого аортального клапана, ДМЖП,
аномалий митрального клапана
МРТ сердца
ДМЖП — дефект межжелудочковой перегородки; КТ — компьютерная томография; ЛЖ — левый желудочек; МРТ — магнитно -резонанс-
ная томография; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 45.2 Корреляция результатов обследования пациента с аномалией левых отделов сердца
и эхокардиографических данных
клапан (1–2% всей популяции), имеющий множе-
ство морфологических вариантов. Очень редко на-
блюдается четырехстворчатый аортальный клапан,
для которого характерна регургитация.
Врожденные аномалии аортального клапана мо-
гут сопровождаться стенозом либо регургитацией,
а также атипичным строением стенки аорты [12,
13], предрасполагающим к развитию аортопатии с
повышенным риском расширения аорты, образова-
ния аневризмы и расслоения аорты, особенно у па-
циентов старше 50 лет и у пациентов со значитель-
ной дисфункцией клапанов [13, 14]. В связи с этим
пациентам с врожденными патологиями аорталь-
ного клапана необходимо провести тщательное
эхокардиографическое исследование корня аорты и
восходящего отдела аорты. Надо отметить, что па-
тология аорты не связана со степенью повреждения
клапана, поэтому аорту необходимо исследовать
даже при минимальной врожденной дисфункции
клапана. При аускультации у молодых пациентов
могут выслушиваться значительный щелчок изгна-
ния в середине систолы и шум из-за аортального
стеноза либо аортальной регургитации.
При лечении детей и подростков с врожденным
аортальным стенозом без значительной аортальной
регургитации методом выбора является транскате-
терная баллонная вальвулопластика. У взрослых па-
циентов баллонную вальвулопластику рекоменду-
ch45.indd 1167
03.04.2019 12:18:38
1168 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
хоже на замочную скважину либо каплю. Когда
створки смыкаются, минимальная площадь попе-
речного сечения клапана будет между краями ство-
рок, в то время как оптимальную визуализацию в
2D-режиме обеспечивает позиция по короткой оси
ниже этого уровня. Таким образом, стандартный
расчет площади отверстия клапана в поперечном
сечении в парастернальной позиции по короткой
оси может завышать ее фактическое значение, что
следует учитывать. 3D-ЭхоКГ помогает оптималь-
ным образом определить минимальную площадь
отверстия клапана, а планиметрия в 3D-режиме по-
зволяет точно оценить фактическую площадь от-
верстия клапана.
Обычно порок аортального клапана устраняют с
помощью вальвулотомии (в детстве) либо путем
пластики/протезирования клапана (в более позднем
возрасте). Однако существует уникальное хирурги-
ческое вмешательство, называемое операцией Рос-
са, когда клапан легочной артерии транспланти-
ется выполнять при обмороках, одышке, симпто-
мах стенокардии, а также максимальном градиенте
давления > 50 мм рт. ст., выявленном при катетери-
зации сердца. Бессимптомным пациентам транска-
тетерная баллонная вальвулопластика показана при
наличии изменений на электрокардиограмме или
максимальном градиенте давления > 60 мм рт. ст.
Осложнениями после транскатетерной баллонной
вальвулопластики являются значимое увеличение
аортальной регургитации (на 10–30%), инсульт и
другие эмболические события в случае кальцифи-
кации аорты. У пациентов после четвертого или пя-
того десятилетия жизни аортальный клапан может
утолщаться и кальцифицироваться (при аускульта-
ции систолический щелчок отсутствует), следова-
тельно, станет менее податливым для баллонной
вальвулопластики.
В парастернальной позиции по длинной оси ви-
зуализируется асимметричное закрытие створок
двухстворчатого аортального клапана во время диа-
столы. Морфологию такого клапана изучают в па-
растернальной позиции по короткой оси во время
систолы, а комиссуры — во время диастолы. Доп-
плерографию используют во всех случаях врожден-
ных пороков аортального клапана для расчета гра-
диента давления и площади. У всех пациентов с
двухстворчатым аортальным клапаном также сле-
дует тщательно исследовать нисходящий отдел аор-
ты для исключения коарктации аорты. Двухствор-
чатый аортальный клапан может ассоциироваться с
ДМПП, ДМЖП, пролапсом митрального клапана.
3D-ЭхоКГ помогает точно рассчитать размеры фи-
брозного кольца аортального клапана, определить
количество створок, идентифицировать места их
слияния, оценить наличие узелков и разрастаний,
характерных для дисплазии клапана [15]. В литера-
туре описаны наблюдения наследования двухствор-
чатого аортального клапана [16], поэтому рекомен-
дуется проводить скрининг заболевания у родствен-
ников первой степени родства (см. главу 17).
Одностворчатый аортальный клапан характери-
зуется наличием одной комиссуры (между левой
коронарной створкой и некоронарной створкой) и
проявляется стенозом в неонатальном периоде или
детском возрасте и редко — у взрослых, хотя после
чрескожного вмешательства рестеноз может прои-
зойти и в среднем возрасте. Транскатетерная бал-
лонная вальвулопластика у взрослых пациентов не-
эффективна, поэтому не рекомендуется. На ЭхоКГ
створки имеют аномальное строение, деформиро-
ваны, диспластичны, а при визуализации в пара-
стернальной позиции по длинной оси видно, что
створки смыкаются верхушками, приобретая купо-
лообразную форму (рис. 45.9).
В верхней парастернальной позиции по корот-
кой оси визуализируется одна открытая комиссура
между левой коронарной створкой и некоронарной
створкой. Во время систолы отверстие клапана по-
Рис. 45.9 Врожденный одностворчатый аортальный клапан. (А) A Па-
растернальная позиция по длинной оси. Пациент с врожденной аномалией аор-
тального клапана. Видны створки куполообразной формы. (Б) A Парастер-
нальная позиция по короткой оси. Пациент с одностворчатым аортальным кла-
паном. Обратите внимание на открытую комиссуру между некоронарной
створкой и левой коронарной створкой. Отверстие клапана имеет вид замоч-
ной скважины.
Открытая
комиссура
А
Б
ch45.indd 1168
03.04.2019 12:18:38
1169
45 Аномалии левых отделов сердца
руют в позицию аортального клапана с реимплан-
тацией коронарных артерий, а на место клапана
легочной артерии имплантируют аллотрансплантат.
Пациентам с врожденным пороком аортального
клапана, которым может быть выполнена операция
Росса, необходимо провести тщательное эхокардио-
графическое исследование для точного измерения
фиброзных колец аортального клапана и клапана
легочной артерии с оценкой функции последнего
для исключения регургитации или патологических
изменений створок, которые могут привести к ухуд-
шению функции после трансплантации клапана ле-
гочной артерии в позицию аортального клапана. В
отдаленном послеоперационном периоде у пациен-
тов могут наблюдаться аортальная регургитация,
стеноз легочной артерии либо регургитация на ал-
лотрансплантате, а также стенозы в местах анасто-
мозов. У этих пациентов до- и послеоперационная
оценка функции ЛЖ и длительное наблюдение по-
сле операции крайне важны ввиду выполнения ре-
имплантации коронарных артерий [17].
НАДКЛАПАННЫЙ АОРТАЛЬНЫЙ СТЕНОЗ
Надклапанный аортальный стеноз может быть изо-
лированным, входить в состав синдрома Вильямса–
Бейрена либо сочетаться с другими обструктивны-
ми поражениями левых отделов сердца (табл. 45.3).
Синдром Вильямса–Бейрена — редкое аутосомно-
доминантное системное заболевание, характеризу-
ющееся задержкой развития. Надклапанный аор-
тальный стеноз отмечается у 71% пациентов и соче-
тается со стенозом легочной артерии и пролапсом
митрального клапана. Мутация гена эластина на
хромосоме 7q11.23 приводит к уменьшению коли-
чества и дезорганизации эластиновых волокон в ме-
дии аорты. В результате повышается гемодинами-
ческое напряжение в восходящем отделе аорты, что
приводит к гипертрофии гладкомышечных клеток
и повышенному отложению коллагена и в итоге —
надклапанному аортальному стенозу. У данной
группы пациентов также наблюдается вторичная
гипертензия, вероятно, обусловленная увеличением
жесткости стенки аорты вследствие мутации гена
эластина [18–23].
Как правило, транскатетерное лечение взрослых
малоэффективно, поэтому рекомендуется открытая
хирургическая операция. На ТТЭхоКГ отмечается
нормальный размер синусов Вальсальвы с сужени-
ем синотубулярного соединения и проксимального
участка восходящего отдела аорты (рис. 45.10). Доп-
плерография позволяет получить максимальный
мгновенный и средний градиенты давления в об-
ласти стеноза. У взрослых пациентов визуализация
всего восходящего отдела аорты при ТТЭхоКГ бы-
вает затруднена, поэтому рекомендуется проводить
ЧПЭхоКГ. Надклапанному аортальному стенозу в
50% случаев сопутствуют аномалии аортального
клапана, чаще всего наблюдается двухстворчатый
Синдром
Аномалии левых отделов сердца
Сопутствующие сердечно-сосудистые
заболевания
Системные процессы, влияющие
на функцию сердца
Синдром
Вильямса–
Бейрена
Надклапанный аортальный
стеноз
Стеноз устьев коронарных артерий;
стеноз сонных, почечных, подключич-
ных артерий, чревного ствола; стеноз
легочной артерии, пролапс митраль-
ного клапана
Гипертензия (важно оценить
гипертрофию ЛЖ и его диасто-
лическую функцию), удлинен-
ный интервал QT, нарушение
метаболизма глюкозы
Синдром
Тернера
Коарктация аорты, двухстворча-
тый аортальный клапан, анома-
лии митрального клапана,
синдром гипоплазии левых
отделов сердца (редко)
Дилатация аорты, частичный аномаль-
ный дренаж легочных вен, ДМПП,
ДМЖП
Гипертензия, риск разрыва аорты
во время беременности, удлинен-
ный интервал QT
Синдром
делеции
22q11.2
Перерыв дуги аорты типа B,
общий артериальный ствол,
изолированные аномалии дуги
аорты (шейная дуга, правосто-
ронняя дуга аорты, аберрантная
подключичная артерия)
Тетрада Фалло, конусный ДМЖП
Синдром
Дауна
Обструкция ВТЛЖ после опера-
ции при ДПЖП, остаточная
митральная регургитация,
митральный стеноз после кор-
рекции расщепления створки
ДМПП, ДМЖП, ДПЖП, ОАП, тетрада
Фалло, двойное отхождение маги-
стральных сосудов от правого желу-
дочка, пролапс митрального клапана
Диабет, ожирение
ВТЛЖ — выходной тракт левого желудочка; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной пере-
городки; ДПЖП — дефект предсердно-желудочковой перегородки; ЛЖ — левый желудочек; ОАП — открытый артериальный проток.
[Lin AE, Basson CT, Goldmuntz E, et al. Adults with genetic syndromes and cardiovascular abnormalities: clinical history and management. Genet
Med 10:469–494, 2008.]
ТАБЛИЦА 45.3 Синдромы, сочетающиеся с аномалиями левых отделов сердца
ch45.indd 1169
03.04.2019 12:18:38
1170 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
аортальный клапан [23, 24]. Гемодинамическое на-
пряжение и постоянное воздействие давления на
створки аортального клапана из-за сужения области
синотубулярного соединения приводят к утолще-
нию и повреждению створок [25]. Также следует
тщательно визуализировать ветви легочного ствола
для исключения их стеноза. Изредка отмечается сте-
ноз устьев коронарных артерий, который можно
подтвердить с помощью ЦДК кровотока в парастер-
нальной позиции по короткой оси (ультразвуковой
луч должен быть направлен перпендикулярно усть-
ям коронарных артерий).
АНОМАЛИИ ДУГИ АОРТЫ
Врожденные аномалии дуги аорты относятся к ред-
ким патологиям, однако часто наблюдаются у паци-
ентов с ВПС. Аномалии дуги аорты могут обнару-
жить случайно при рентгенографии взрослых па-
циентов без симптомов или с симптомами дисфагии
либо нарушений дыхания.
Дуга аорты начинает развиваться у эмбриона на
4-й неделе гестации из 6 симметричных парных со-
судов дуги и парной дорсальной аорты. Перегруппи-
ровка этих структур приводит к образованию нор-
мальной леворасположенной дуги аорты [26, 27].
Система Эдвардса предполагает наличие у эм-
бриона сначала двойной дуги аорты и двух артери-
альных протоков, которые располагаются симме-
трично относительно друг друга. Из правой дуги
аорты образуются правая сонная артерия и правая
подключичная артерия, а из левой дуги аорты — ле-
вая сонная артерия и левая подключичная артерия.
При нормальном развитии дуги аорты происходят
перерыв дорсального сегмента правой дуги между
правой подключичной артерией и нисходящим от-
делом аорты и последующая регрессия правого ар-
териального протока (рис. 45.11). Перерыв в раз-
личных местах такой системы может объяснить раз-
витие разных аномалий аорты [28].
Полное сосудистое кольцо — это аномалия, при
которой дуга аорты полностью окружает трахею и
пищевод. При данном пороке есть двойная дуга
аорты или правосторонняя/левосторонняя дуга
аорты с аберрантной подключичной артерией и ар-
териальным протоком, замыкающим кольцо. Не-
полное сосудистое кольцо — это аномалия, при ко-
торой дуга аорты частично окружает трахею и пи-
щевод. При данном пороке есть правосторонняя/
левосторонняя дуга аорты с аберрантной подклю-
чичной артерией или безымянной артерией. При
ЭхоКГ бывает сложно оценить все анатомические
особенности аномалии дуги аорты, поэтому «золо-
тым стандартом» диагностики являются контраст-
ная компьютерная томография (КТ) и МРТ сердца.
ДВОЙНАЯ ДУГА АОРТЫ
Двойная дуга аорты представляет собой вариант
полного сосудистого кольца, при котором восходя-
щий отдел аорты разделяется на две дуги: правая
(задняя) лежит за пищеводом, левая (передняя) —
перед пищеводом и трахеей. Эти дуги соединяются
и образуют нисходящий отдел аорты. Как правило,
правая дуга аорты доминирует и лежит более кау-
дально. Данная аномалия редко сочетается с ВПС.
Клинические проявления и тяжесть симптоматики
зависят от размеров полного сосудистого кольца. У
пациентов могут наблюдаться дисфагия, стридор,
рецидивирующие респираторные инфекции в ран-
нем детстве. Эту патологию редко диагностируют у
взрослых пациентов [29].
Рис. 45.10 Надклапанный аортальный стеноз. (А) A Надклапанный аор-
тальный стеноз у пациента с синдромом Вильямса. Обратите внимание на су-
жение просвета непосредственно над синотубулярным соединением (СТС).
(Б) A При ЦДК кровотока отмечается ускорение потока в этой области. АК —
аортальный клапан; ВАо — восходящий отдел аорты; ВТЛЖ — выходной
тракт левого желудочка.
Створка АК
ВТЛЖ
СТС
ВАо
Б
А
ch45.indd 1170
03.04.2019 12:18:38
1171
45 Аномалии левых отделов сердца
ПРАВОСТОРОННЯЯ ДУГА АОРТЫ
Правосторонняя дуга аорты встречается у 0,05%
всей популяции [29] и бывает трех типов:
1. Правосторонняя дуга аорты с зеркальным распо-
ложением магистральных сосудов.
2. Правосторонняя дуга аорты с аберрантной ле-
вой подключичной артерией. Встречается наи-
более часто и является результатом перерыва в
период эмбриогенеза дорсального сегмента ле-
вой дуги аорты между левой общей сонной ар-
терией и левой подключичной артерией с ре-
грессией правого артериального протока. Пер-
вая ветвь, отходящая от аорты, — левая сонная
артерия, затем отходят правая сонная артерия,
правая подключичная артерия и аберрантная
левая подключичная артерия. Нисходящий от-
Пищевод
Трахея
Левая сонная
артерия
Правая сонная
артерия
Левая
подключичная
артерия
Левый
артериальный
проток
Легочный
ствол
Восходящий
отдел аорты
Нисходящий
отдел аорты
Правый
артериальный
проток
Область правой дуги,
регрессирующая в норме
Правая
подключичная
артерия
Рис. 45.11 Эмбриология дуги аорты. Система Эдвардса.
ch45.indd 1171
03.04.2019 12:18:39
1172 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
дел аорты обычно располагается справа от сре-
динной линии тела. Аберрантная левая подклю-
чичная артерия может сформироваться из остат-
ков дорсального сегмента левой дуги аорты.
При расширении дуги аорты может образовать-
ся дивертикул Коммерелля (рис. 45.12Б). При на-
личии дивертикула риск расслоения аорты по-
вышен, поэтому рекомендуется ранняя хирур-
гическая коррекция [30].
3. Правосторонняя дуга аорты с изолированной ле-
вой подключичной артерией. Это самый редкий
тип. В эмбриогенезе изолирование данной арте-
рии происходит в результате перерыва левой ду-
ги аорты на двух уровнях — между левой общей
сонной артерией и левой подключичной артери-
ей, а также дистальнее отхождения левого арте-
риального протока.
ШЕЙНАЯ ДУГА АОРТЫ
Шейная дуга аорты — редкая аномалия, при кото-
рой дуга аорты локализуется над ключицей (см. рис.
45.12А). Данная патология чаще всего изолирован-
ная, но есть описания сочетания ее с коарктацией
аорты. При шейной дуге аорта может быть более
подвержена аневризматическому расширению [31].
Шейная дуга аорты легко диагностируется при по-
зиционировании датчика в яремной вырезке. При
этом между нижней границей дуги аорты и правой
легочной артерией в поперечном сечении обычно
наблюдается расстояние длиной несколько санти-
метров. Может отмечаться ускорение потока в пере-
шейке из-за его перегиба, т.к. при этом происходит
поворот потока почти на 180° от восходящего отде-
ла аорты до проксимального участка нисходящего
отдела.
ПЕРЕРЫВ ДУГИ АОРТЫ
Перерыв дуги аорты — редкая аномалия, которая
характеризуется полным анатомическим разобще-
нием восходящего и нисходящего отделов аорты.
Перерыв дуги аорты отличается от коарктации и
атрезии аорты отсутствием структурной связи меж-
ду отделами аорты. В большинстве случаев перерыв
дуги аорты сочетается с другой патологией сердеч-
но-сосудистой системы [32]. После хирургической
коррекции следует периодически проводить ЭхоКГ
согласно рекомендациям при коарктации аорты.
КОАРКТАЦИЯ АОРТЫ
Коарктация аорты составляет 6–8% всех ВПС и
встречается у 4 из 10 000 новорожденных мужского
и женского пола с соотношением 2 : 1. Порок ана-
томически весьма вариабелен. Это может быть изо-
лированная стриктура вследствие локального утол-
щения стенки либо длинный участок сужения аор-
ты. Независимо от морфологии, у всех пациентов
с коарктацией аорты наблюдается диффузная ар-
териопатия. Сопутствующими патологиями могут
быть двухстворчатый аортальный клапан (50–60%),
поражение митрального клапана, подклапанный
аортальный стеноз, ДМЖП, открытый артериаль-
ный проток, а также аномалии дуги аорты, включая
аберрантную подключичную артерию. Среди паци-
ентов с двухстворчатым аортальным клапаном ко-
арктацию аорты диагностируют реже, но таким па-
циентам крайне важно провести полный скрининг
для выявления признаков коарктации аорты (кли-
ническое обследование и ЭхоКГ в супрастернальной
позиции), поскольку коарктация может быть легко
упущена. У 10% пациентов с коарктацией аорты
Рис. 45.12 Аномалии дуги аорты. (А) Супрастернальная позиция. Пациент с шейной дугой аорты. Обратите внимание на расстояние между правой легочной
артерией (ПЛА) в поперечном сечении и нижним краем дуги аорты. Восходящий отдел аорты (ВАо) делает резкий разворот, в проксимальном участке нисходя-
щего отдела аорты (НАо) визуализируется коарктация аорты. (Б) 3D-КТ с ангиографией пациента с правосторонней дугой и дивертикулом Коммерелля (ДК).
АЛПА — аберрантная левая подключичная артерия; ЛОСА — левая общая сонная артерия; ПОСА — правая общая сонная артерия; ППА — правая подключич-
ная артерия.
ПЛА
ВАо
НАо
ПОСА
ППА
ЛОСА
АЛПА
ВАо
ДК
А
Б
ch45.indd 1172
03.04.2019 12:18:40
1173
45 Аномалии левых отделов сердца
может встречаться аневризма в церебральном вил-
лизиевом круге — аневризма Берри, поэтому следу-
ет всем пациентам исследовать артерии головного
мозга. Осложнения при естественном течении пато-
логии: персистирующая гипертензия и гипертензия
младшего возраста. У некоторых пациентов даже
после хирургической коррекции отмечается изоли-
рованная гипертензия, вызванная физической на-
грузкой. У пациентов с коарктацией аорты без опе-
ративного лечения и у тех, у кого после лечения воз-
ник рестеноз, может отмечаться разное артериальное
давление на верхних и нижних конечностях, увели-
чение задержки пульсовой волны между лучевой и
бедренной артериями, а также систолический щел-
чок двухстворчатого аортального клапана при ау-
скультации. Кроме того, при аускультации может
выслушиваться шум в лопаточной области. При на-
личии аберрантной подключичной артерии артери-
альное давление на верхних конечностях может
быть симметричным (в зависимости от места от-
хождения аномального сосуда относительно коар-
ктации аорты). Пациенты, которым выполнена
пластика лоскутом из подключичной артерии, так-
же могут иметь разное артериальное давление на
верхних конечностях.
К показаниям класса I к вмешательству, которое
может быть хирургическим или транскатетерным в
зависимости от анатомического варианта порока,
сопутствующих патологий и индивидуальных осо-
бенностей пациента, относят максимальный гради-
ент давления > 20 мм рт. ст., градиент давления
< 20 мм рт. ст. при развитой сети коллатералей, а
также иногда постоянную артериальную гипертен-
зию.
Основным методом диагностики коарктации аор-
ты, включая ее визуализацию и оценку гемодина-
мики, является ТТЭхоКГ (табл. 45.4). Лучше всего
анатомия визуализируется в супрастернальной по-
зиции (рис. 45.13) с использованием ЦДК кровото-
ка и непрерывно-волновой допплерографии (оцени-
вают дистальную часть дуги аорты и перешеек). Ге-
модинамически значимая коарктация аорты при
непрерывно-волновой допплерографии имеет ти-
пичную картину: продолжительный антеградный
поток, прекращающийся во время диастолы [33–
35]. Для оценки градиента давления следует внести
в уравнение Бернулли повышенную проксималь-
ную скорость. Направление потока через коаркта-
цию аорты может быть эксцентрическим, в резуль-
тате может быть сложно направить ультразвуковой
луч параллельно направлению потока. У пациентов
после хирургической коррекции коарктации аорты
поток более симметричный. Крайне важно оценить
поток в брюшной части нисходящего отдела аорты.
Отличительной чертой проксимального стеноза яв-
ляется задержка потока во время систолы и наличие
в брюшной части нисходящего отдела аорты турбу-
лентного потока во время диастолы. Также следует
визуализировать восходящий отдел аорты для ис-
ключения его поражений. Дополнительными пре-
дикторами степени коарктации аорты являются ди-
аметр потока в месте коарктации и скорость крово-
тока в суженном участке нисходящего отдела аорты,
располагающемся проксимальнее зоны стеноза.
ВПС, вызывающие обструкцию путей оттока из
ЛЖ (изолированный подклапанный аортальный сте-
ноз, врожденный аортальный стеноз, надклапан-
ный аортальный стеноз, коарктация аорты), приво-
Позиция
Визуализация анатомии
Оценка физиологии
Супрастернальная
Нисходящий отдел аорты в 2D-режиме для
оценки анатомии и наличия турбулентного
потока
Определение градиента давления
с помощью допплерографии
Верхняя парастернальная
Аорта в сагиттальной плоскости
Можно обнаружить постстенотическую
дилатацию
Со стороны брюшной части
нисходящего отдела аорты
Дистальный участок аорты в 2D-режиме
При тяжелой коарктации аорты выявляется
постоянный диастолический поток
в брюшной части нисходящего отдела
аорты
Парастернальная
по длинной оси
Аортальный клапан (оценка морфологии,
степени стеноза и регургитации), корень
аорты, восходящий отдел аорты
Определение степени гипертрофии ЛЖ
и его размеров
Апикальная двухкамерная/
четырехкамерная/
пятикамерная
Аортальный клапан, ВТЛЖ (пятикамерная
позиция)
Оценка систолической и диастолической
функции ЛЖ (четырехкамерная и двухка-
мерная позиции)
ЧПЭхоКГ
Высококачественная визуализация анатомии
в 2D-режиме и 3D-режиме
Неточное измерение градиента давления
с помощью допплерографии из-за неадек-
ватного прилегания датчика
ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; ЧПЭхоКГ — чреспищеводная эхокардиография.
ТАБЛИЦА 45.4 Эхокардиография при коарктации аорты
ch45.indd 1173
03.04.2019 12:18:40
1174 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 45.13 Коарктация аорты. (А) A Супрастернальная позиция. Пациент с удлиненной дугой аорты, коарктацией аорты в проксимальном участке нисходя-
щего отдела аорты. (Б) A ЦДК кровотока отражает обструкцию в проксимальном участке нисходящего отдела аорты и постоянный антеградный поток во время
диастолы. (В) Непрерывно-волновая допплерография в области проксимального участка нисходящего отдела аорты с ускоренным потоком, продолжающимся во
время диастолы. (Г) Непрерывно-волновая допплерография отражает задержку потока во время систолы и турбулентный поток во время диастолы в брюшной
части нисходящего отдела аорты из-за коарктации в проксимальном участке.
А
Б
Г
В
дят к постоянной перегрузке давлением, гипертро-
фии ЛЖ, фиброзу миокарда, диастолической дис-
функции и в итоге — к сердечной недостаточности.
При лечении коарктации аорты полезно оценить
диастолическую функцию и массу ЛЖ. Многие ис-
следования с участием взрослых пациентов показа-
ли, что точно измерить массу ЛЖ возможно при
3D-ЭхоКГ [36]. Подобных исследований с участием
детей существенно меньше, Riele и соавт. продемон-
стрировали четкую корреляцию между массой ЛЖ,
измеренной с помощью 3D-ЭхоКГ и МРТ [37].
Большое значение в настоящее время имеет оценка
диастолических показателей ЛЖ у взрослых паци-
ентов с ВПС ввиду того, что длительная обструкция
левых отделов сердца (в течение нескольких лет)
приводит к задержке расслабления сердца во время
диастолы. При исследовании деформации ЛЖ на-
капливаются данные о диастолической и систоличе-
ской дисфункции ЛЖ у пациентов после хирур-
гического лечения коарктации аорты. У данной
группы пациентов увеличивается жесткость стенки
аорты, что, вероятно, и нарушает диастолическое
расслабление миокарда. Для оценки эластичности
артерий можно использовать эхокардиографиче-
ские методы исследования, однако в настоящее вре-
мя такие подходы в клинической практике доста-
точно редки.
АНОМАЛИИ КОРОНАРНЫХ АРТЕРИЙ
АНОМАЛИИ ОТХОЖДЕНИЯ КОРОНАРНЫХ АРТЕРИЙ
Рекомендуется оценивать места отхождения коро-
нарных артерий у всех пациентов детского и моло-
дого возраста [38], а также у взрослых с ВПС либо с
подозрением на него. В норме правая коронарная
артерия отходит от средней трети правого синуса
Вальсальвы перпендикулярно его стенке, а левая ко-
ронарная артерия отходит от средней трети левого
ch45.indd 1174
03.04.2019 12:18:40
1175
45 Аномалии левых отделов сердца
синуса Вальсальвы перпендикулярно его стенке. Не
все аномалии отхождения коронарных артерий про-
являются клинически; большинство из них обнару-
живают случайно при плановой ЭхоКГ. Места от-
хождения коронарных артерий у взрослых пациен-
тов бывает сложно визуализировать неинвазивными
методами, поэтому для уточнения диагноза иногда
проводят компьютерную томографию с ангиогра-
фией либо МРТ сердца [39].
АНОМАЛЬНОЕ ОТХОЖДЕНИЕ КОРОНАРНОЙ АРТЕРИИ
ОТ ПРОТИВОПОЛОЖНОГО СИНУСА
Аномальное отхождение коронарной артерии от
противоположного синуса — редкая патология, од-
нако она является одной из причин синдрома вне-
запной смерти у клинически здоровых молодых
людей. Если левая коронарная артерия отходит от
правого синуса Вальсальвы, пролегая между аортой
и легочным стволом, то высок риск желудочковой
тахикардии и внезапной смерти. При диагностике
аномального отхождения коронарной артерии от
противоположного синуса необходима хирургиче-
ская коррекция порока [40]. Аномальное отхожде-
ние правой коронарной артерии от левого синуса
Вальсальвы также сопряжено с повышенным ри-
ском синдрома внезапной смерти у молодых паци-
ентов, но такую патологию можно случайно обна-
ружить и у пожилых людей. В отсутствие клиниче-
ских симптомов оперативное вмешательство не
нужно.
Коронарные артерии лучше всего визуализиру-
ются в парастернальной позиции по короткой оси
на уровне аортального клапана. Коронарные арте-
рии видны по ходу атриовентрикулярной борозды
(рис. 45.14), но решающее значение для определе-
ния аномального отхождения имеет четкое просле-
живание хода артерии от места ее визуализации до
корня аорты. Сканирование может быть продолже-
но с целью визуализации аномального сегмента ар-
терии (отходящего от восходящего отдела аорты
более высоко, чем в норме). Парастернальная пози-
ция по длинной оси может помочь определить ано-
мальную коронарную артерию между аортой и ле-
гочным стволом.
Описанные позиции повышают чувствитель-
ность ЭхоКГ относительно аномального отхожде-
ния коронарной артерий от противоположного си-
нуса [41].
Левая огибающая артерия, отходящая от право-
го синуса Вальсальвы и проходящая за аортой, так-
же представляет собой аномальный вариант. Одна-
ко данный порок зачастую выявляется случайно
при скрининге и не сопровождается повышенным
риском внезапной смерти. Визуализацию проводят
в четырехкамерной позиции с отклонением датчи-
ка кзади для визуализации узкой трубчатой струк-
туры, расположенной параллельно левой атриовен-
трикулярной борозде.
АНОМАЛЬНОЕ ОТХОЖДЕНИЕ КОРОНАРНОЙ АРТЕРИИ
ОТ ЛЕГОЧНОГО СТВОЛА
Аномальное отхождение левой или правой коро-
нарной артерии от легочного ствола — редкий по-
рок, особенно у взрослых пациентов. У пациентов с
естественным течением патологии при ЭхоКГ выяв-
ляют дилатацию ЛЖ, нарушения локальной сокра-
тимости, функциональную митральную регургита-
цию и ретроградный поток по коллатеральным со-
судам, снабжаемым кровью из коронарной артерии
с нормальным отхождением.
ФИСТУЛА КОРОНАРНОЙ АРТЕРИИ
Фистула коронарной артерии — редкая врожденная
аномалия, при которой наблюдаются патологиче-
ские сообщения между коронарными артериями и
полостями сердца. Чаще всего фистулу диагности-
руют случайно во время ЭхоКГ, иногда происходит
расширение полости сердца. Подозрение на данный
порок возникает при обнаружении потока крови со
стороны эпикарда в полость ЛЖ либо полость ПЖ
во время диастолы при ЦДК кровотока.
СИНДРОМ ГИПОПЛАЗИИ
ЛЕВЫХ ОТДЕЛОВ СЕРДЦА
При синдроме гипоплазии левых отделов сердца
(СГЛОС) ЛЖ недоразвит и неспособен обеспечивать
кровоток в большом круге кровообращения. Как
правило, объем ЛЖ составляет < 20 мл/м2 площади
поверхности тела. СГЛОС характеризуется высо-
кой смертностью в неонатальном периоде и раннем
детстве. Пренатальная диагностика достоверна в
60–100% случаев [42]. Дифференциальную диагно-
стику СГЛОС проводят со всеми пороками левых
отделов сердца, при которых гемодинамика зави-
сит от наличия открытого артериального протока,
например с критическим аортальным стенозом,
коарктацией аорты и перерывом дуги аорты. Па-
циенты с этими патологиями чаще всего переносят
хирургическое вмешательство в детском возрасте, но
у них во взрослом возрасте существует риск повтор-
ной обструкции левых отделов сердца и развития
миопатии ЛЖ. Тем не менее, согласно данным од-
ного исследования, по мере взросления пациентов
показатели смертности существенно снижаются. У
взрослых пациентов выживаемость составляет 87%
в течение 20-летнего периода наблюдения [43].
Хирургическое лечение поэтапное: (1) устранение
обструкции с обеспечением коронарного и легоч-
ного кровотока, создание нерестриктивного ДМПП
(операция Норвуда); (2) устранение дополнитель-
ных источников легочного кровотока и создание
анастомоза между верхней полой веной и легочной
артерией; (3) перенаправление венозной крови из
нижней полой вены в легочную артерию (операция
Фонтена).
ch45.indd 1175
03.04.2019 12:18:41
1176 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Долгосрочные результаты после операции Фон-
тена — повышение системного венозного давления
[44] и другие сердечные и внесердечные осложне-
ния [45], при которых необходимо периодическое
наблюдение и проведение ЭхоКГ. Долгосрочные
результаты зависят от систолической и диастоли-
ческой функций ЛЖ, степени гипоксемии, степени
дисфункции печени, сопротивления сосудов мало-
го круга кровообращения, наличия предсердной
или желудочковой аритмии и тромбоэмболии в
анамнезе. У пациентов, которым выполнили кор-
рекцию СГЛОС, часто наблюдаются дефекты корня
аорты и аортального клапана, что доказывает необ-
ходимость визуализации этих структур при каждом
осмотре. На это также указывают результаты ис-
следований, в которых 98% пациентов (n = 53) при
средней продолжительности наблюдения 9,2 года
имели прогрессирующую дилатацию корня рекон-
струированной аорты в 2 балла по Z-шкале, а у 50%
пациентов развилась аортальная регургитация [46].
Оценка дуги аорты также необходима, поскольку в
зоне пластики возможны рестеноз, дилатация и об-
разование аневризмы [46].
В связи с этим специалист, проводящий ЭхоКГ
пациентам после операции Фонтена (см. главу 49) с
первичным диагнозом «синдром гипоплазии левых
отделов сердца», должен оценивать систолическую
и диастолическую функции желудочков, степень
расширения корня реконструированной аорты, на-
личие трикуспидальной и аортальной регургитации,
дистальных стенозов или дилатации аорты (более
точную картину дуги аорты позволяют получить
МРТ и КТ), а также исключить тромбообразование
(для этого может понадобиться ЧПЭхоКГ) [47, 48].
Рис. 45.14 Аномальное отхождение правой коронарной артерии. (А) A Парастернальная позиция по короткой оси на уровне аортального клапана. Ано-
мальное отхождение правой коронарной артерии у взрослого пациента. Обратите внимание, что правая коронарная артерия визуализируется в правой атриовен-
трикулярной борозде. Достоверно исключить аномальное отхождение нельзя, т.к . невозможно четко визуализировать синусы аорты. (Б) A При прослеживании
хода коронарной артерии до корня аорты отмечается отхождение левее правой/левой комиссуры. (В) A Апикальная четырехкамерная позиция с наклоном дат-
чика кзади. Визуализируется огибающая артерия, проходящая за аортой. (Г) A В миокарде обнаруживается поток из фистулы коронарной артерии, который дре-
нируется в правый желудочек.
А
Б
Г
В
ch45.indd 1176
03.04.2019 12:18:41
1177
45 Аномалии левых отделов сердца
Таким образом, врожденные аномалии левых
отделов сердца являются гетерогенной группой,
включающей изолированные либо множественные
пороки, при которых, как правило, необходимо на-
блюдение врача в течение всей жизни пациента, т.к.
при естественном течении эти патологии могут про-
грессировать, а после оперативных вмешательств
высок риск развития осложнений. Эхокардиографи-
ческий метод исследования позволяет установить
первичный диагноз, проводить периодический
осмотр пациентов, а также лучше понять патофи-
зиологические изменения и определить сроки как
первичного, так и повторных оперативных вмеша-
тельств.
Аномалия
Описание
Метод исследования
Сопутствующие
пороки
Дополнительная
визуализация
Трехпредсерд-
ное сердце
Тонкая мембрана делит ЛП
на две камеры. Мембрана
может быть цельной
либо перфорированной.
Перфорированная мем-
брана чаще наблюдается
у взрослых
Скорость потока при ЦДК
кровотока отражает
степень обструкции.
Систолическое давление
в ПЖ может отра жать
легочную венозную
гипертензию
ООО, ДМПП, ано-
мальный дренаж
легочных вен, доба-
вочная левая ВПВ,
коарктация аорты
3D-ЭхоКГ — при
наличии в мембране
перфораций
Врожденная
патология
митрального
клапана
Расщепление передней
створки, надклапанная
мембрана, двойное отвер-
стие, парашютообразный
клапан, аномальное рас-
положение папиллярных
мышц
Допплерография для
оценки стеноза/регургита-
ции. Измерение систоли-
ческого давления в ПЖ
для оценки степени легоч-
ной артериальной
гипертензии
Комплекс Шона,
ДПЖП, коарктация
аорты
Некомпакт-
ный миокард
ЛЖ
Множественные трабекулы
в ЛЖ с глубокими углуб-
лениями между ними
При ЦДК кровотока визуа-
лизируется поток через
углубления между
трабекулами
Кардиомиопатия ЛЖ,
тромбы в ЛЖ
Контрастная ЭхоКГ
повышает качество
диагностики
МРТ сердца является
наилучшим методом
визуализации
Врожденный
аортальный
стеноз
Стеноз может быть под-
клапанным, клапанным
или надклапанным
Непрерывно-волновая
допплерография помогает
определить степень
обструкции, ее уровень и
аортальную регургитацию
ДМЖП, коарктация
аорты, двухкамерный
ПЖ, аортопатия
Аномалия
дуги аорты
Полное сосудистое кольцо,
неполное сосудистое
кольцо, правосторонняя
аорта, шейная дуга
аорты, перерыв дуги
аорты
ЦДК кровотока, импульсно-
волновая и непрерывно-
волновая допплерография
позволяют оценить струк-
туру потока
МРТ либо КТ обеспечи-
вает качественную
визуализацию анато-
мии дуги аорты
Коарктация
аорты
Анатомические варианты:
от локализованной стрик-
туры до протяженного
сужения, однако часто
это не видно при ЭхоКГ
Непрерывно-волновая доп-
плерография демонстри-
рует увеличение скорости
потока во время систолы
и продолжительный анте-
градный кровоток во
время диастолы
У пациентов с коаркта-
цией аорты в 50%
случаев наблюдается
двухстворчатый аор-
тальный клапан.
Рекомендуется прове-
сти скрининг анев-
ризмы Берри. Часто
отмечается
гипертензия
Рекомендуется МРТ
либо КТ сердца для
визуализации анато-
мии аорты, локализа-
ции патологии, опре-
деления степени коар-
ктации аорты и
степени ее расширения
СВОДНАЯ ИНФОРМАЦИЯ
Врожденные аномалии левых отделов сердца
ch45.indd 1177
03.04.2019 12:18:41
1178 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ЛИТЕРАТУРА
1. Kutty S, Cohen TM, Smallhorn JF. Three-di-
mensional echocardiography in the assess-
ment of congenital mitral valve disease, JASE
27:142–154, 2014.
2. Sittiwangkul R, Ma RY, McCrindle BW, et al.
Echocardiographic assessment of obstructive
lesions in atrioventricular septal defects, J Am
Coll Cardiol 38:253–261, 2001.
3. Oosthoek PW, Wenink AC, Wisse LJ. Gitten-
berger-de Groot AC: Development of the
papillary muscles of the mitral valve: mor-
phogenetic background of parachute-like
asymmetric mitral valves and other mitral
valve anomalies, J Thorac Cardiovasc Surg
116:36–46, 1998.
4. Carrilho-Ferreira P, Almeida AG, Pinto FJ.
Non-compaction cardiomyopathy: preva-
lence, prognosis, pathoetiology, genetics, and
risk of cardioembolism, Curr Heart Fail Rep
11:393–403, 2014.
5. Sto
llberger C, Gerecke B, Engberding R, et al.
Interobserver agreement of the echocardio-
graphic diagnosis of LV hypertrabeculation/
noncompaction, JACC Cardiovasc Imaging
8:1252–1257, 2015.
6. Pinto FJ. When and how to agree in disagree-
ing on the diagnosis of noncompaction by
echocardiography? JACC Cardiovasc Imaging
8:1258–1259, 2015.
7. Agmon Y, Connolly HM, Olson LJ, et al.
Noncompaction of the ventricular myocardi-
um, J Am Soc Echocardiogr 12:859–863, 1999.
8. Oechslin EN, Attenhofer Jost CH, Rojas JR,
et al. Long-term follow-up of 34 adults with
isolated left ventricular noncompaction: a
distinct cardiomyopathy with poor prognosis,
J Am Coll Cardiol 36:493–500, 2000.
9. Jenni R, Oechslin E, Schneider J, et al. Echo-
cardiographic and pathoanatomical charac-
teristics of isolated left ventricular non-com-
paction: a step towards classification as a dis-
tinct cardiomyopathy, Heart 86:666–671,
2001.
10. Daimon Y, Watanabe S, Takeda S, et al. Two-
layered appearance of noncompaction of the
ventricular myocardium on magnetic reso-
nance imaging, Circ J 66:619–621, 2002.
11. Bharucha T, Ho SY, Vettukattil JJ. Multipla-
nar review analysis of three-dimensional
echocardiographic datasets gives new insights
into the morphology of subaortic stenosis,
Eur J Echocardiogr 9:614–620, 2008.
12. Bauer M, Pasic M, Meyer R, et al. Morpho-
metric analysis of aortic media in patients
with bicuspid and tricuspid aortic valve, Ann
Thorac Surg 74:58–62, 2002.
13. Nataatmadja M, West M, West J, et al. Abnor-
mal extracellularmatrix protein transport as-
sociated with increased apoptosis of vascular
smooth muscle cells in Marfan syndrome and
bicuspid aortic valve thoracic aortic aneu-
rysm, Circulation 108(Suppl 1):II329–II334,
2003.
14. Michelena HI, Khanna AD, Mahoney D, et al.
Incidence of aortic complications in patients
with bicuspid aortic valves, JAMA 306:1104–
1112, 2011.
15. Sadagopan SN, Veldtman GR, Sivaprakasam
MC, et al. Correlations with operative anato-
my of real time three-dimensional echocar-
diographic imaging of congenital aortic val-
var stenosis, Cardiol Young 16:490–494, 2006.
16. Fedak PW, Verma S, David TE, et al. Clinical
and pathophysiological implications of a bi-
cuspid aortic valve, Circulation 106:900–904,
2002.
17. Ross D, Jackson M, Davies J. Pulmonary au-
tograft aortic valve replacement: long-term
results, J Card Surg 6:529–533, 1991.
18. Bruno E, Rossi N, Theur O, et al. Cardiovas-
cular findings, and clinical course, in patients
with Williams syndrome, Cardiol Young 13:
532–536, 2003.
19. Nickerson E, Greenberg F, Keating MT, et al.
Deletions of the elastin gene at 7q11.23 occur
in approximately 90% of patients with Wil-
liams syndrome, Am J Hum Genet 56:1156–
1161, 1995.
20. Ewart AK, Jin W, Atkinson D, et al. Supraval-
vular aortic stenosis associated with a deletion
disrupting the elastin gene, J Clin Invest
93:1071–1077, 1994.
21. Keating MT. Genetic approaches to cardio-
vascular disease. Supravalvular aortic steno-
sis, Williams syndrome, and long-QT syn-
drome, Circulation 92:142–147, 1995.
22. Perou ML. Congenital supravalvular aortic
stenosis: morphological study with attempt at
classification, Arch Pathol Lab Med 71:453–
466, 1961.
23. Tani LY, Minich L, Pagotto L, Shaddy R. Use-
fulness of Doppler echocardiography to deter-
mine the timing of surgery for supravalvar
aortic stenosis, Am J Cardiol 86:114–116, 2000.
24. McElhinney D, Petrossian E, Tworetzky W, et
al. Issues and outcomes in the management of
supravalvar aortic stenosis, Ann Thorac Surg
69:562–567, 2000.
25. Braunstein PW, Sade RM, Crawford FA, Os-
lizlok PC. Repair of supravalvular aortic ste-
nosis: cardiovascular morphometric and he-
modynamic results, Ann Thorac Surg 50:700–
707, 1990.
26. Davies M, Guest PJ. Developmental abnor-
malities of the great vessels of the thorax and
Аномалия
Описание
Метод исследования
Сопутствующие
пороки
Дополнительная
визуализация
Аномалия
коронарной
артерии
Аномальное отхождение
коронарной артерии
от противоположного
синуса, аномальное
отхождение коронарной
артерии от легочного
ствола, фистула коронар-
ной артерии
ЦДК кровотока помогает
определить устье коронар-
ной артерии
Ретроградный поток в
легочном стволе, если
коронарная артерия
отходит от легочного
ствола
Непрерывный поток
из фистулы коронарной
артерии в полость сердца
Стандартный метод диа-
гностики — КТ сердца
с контрастированием.
Также можно провести
коронарную
ангиографию
Синдром
гипоплазии
левых
отделов
сердца
Выживаемость зависит
от паллиативной опера-
ции, выполненной
в раннем детстве.
Взрослые пациенты,
как правило, перенесли
операцию Фонтена
ЦДК кровотока позволяет
оценить центральный
венозный кровоток и
наличие его обструкции,
а также степень регургита-
ции на атриовентрикуляр-
ном клапане
Дисфункция желудоч-
ков, дилатация аорты
Для оценки состояния
кондуита после опера-
ции Фонтена может
понадобиться МРТ
либо КТ сердца
ВПВ — верхняя полая вена; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки; ДПЖП —
дефект предсердно-желудочковой перегородки; КТ — компьютерная томография; ЛЖ — левый желудочек; ЛП — левое предсердие;
МРТ — магнитно -резонансная томография; ООО — открытое овальное окно; ПЖ — правый желудочек; ЦДК — цветовое допплеров-
ское картирование; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Врожденные аномалии левых отделов сердца
ch45.indd 1178
03.04.2019 12:18:42
1179
45 Аномалии левых отделов сердца
their embryological basis, Br J Radiol 76:491,
2003.
27. Licari A, Manca E, Rispoli GA, et al. Congen-
ital vascular rings: a clinical challenge for the
pediatrician, Pediatr Pulmonol 50:511, 2015.
28. Edwards JE. Anomalies of the derivatives of
the aortic arch system, Med Clin North Am
32:925–949, 1948.
29. Stewart JR, Kincaid OW, Edwards JE. An at-
las of vascular rings and related malforma-
tions of the aortic arch system, Springf ield IL,
1964. Double Arch Reference.
30. Kim KM, Cambria RP, Isselbacher EM, et
al. Contemporary surgical approaches and
outcomes in adults with Kommerell diver-
ticulum, Ann Thoracic Surg 98:1347–1354,
2014.
31. Pearson GD, Kan JS, Neill CA, et al. Cervical
aortic arch with aneurysm formation, Am J
Cardiol 79:112–114, 1997.
32. Dillman JR, Yarram SG, D’Amico AR, Her-
nandez RJ. Interrupted aortic arch: spectrum
of MRI findings, AJR Am J Roentgenol 190:
1467–1474, 2008.
33. Child JS. Transthoracic and transesophageal
echocardiographic imaging: anatomic and he-
modynamic assessment. In Perloff JK, Child
JS, editors: Congenital heart disease in adults,
ed 2, Philadelphia, 1998, WB Saunders.
34. Child JS. Echocardiographic evaluation of the
adult with postoperative congenital heart dis-
ease. In Otto CM, editor: The practice of clin-
ical echocardiography, ed 2, Philadelphia,
2002, WB Saunders.
35. Child JS. Echo-Doppler and color-flow imag-
ing in congenital heart disease, Cardiol Clin 8:
289–313, 1990.
36. Armstrong AC, Gidding S, Gjesdal O, et al.
LV mass assessed by echocardiography and
cmr, cardiovascular outcomes, and medical
practice, J Am Coll Cardiol Img 5:837–848,
2012.
37. Riehle TJ, Mahle WT, Parks WJ, et al. Real-
time three-dimensional echocardiographic
acquisition and quantification of left ventric-
ular indices in children and young adults with
congenital heart disease: comparison with
magnetic resonance imaging, J Am Soc Echo-
cardiogr 21:78–83, 2008.
38. Lopez L, Colan SD, Frommelt PC, et al. Rec-
ommendations for quantification methods
during the performance of a pediatric echo-
cardiogram: a report from the Pediatric Mea-
surements Writing Group of the American
Society of Echocardiography Pediatric and
Congenital Heart Disease Council, J Am Soc
Echocardiogr 23:465–495, 2010.
39. Goo HW, Park IS, Ko JK, et al. CT of con-
genital heart disease: normal anatomy and
typical pathologic conditions, Radiographics
23:S147–S165, 2003.
40. Warnes CA, Williams RG, Bashore TM, et al.
ACC/AHA 2008 guidelines for the manage-
ment of adults with congenital heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines, J Am Coll Cardiol
52:e143–e263, 2008.
41. Thankavel PP1, Lemler MS, Ramaciotti C.
Utility and importance of new echocardio-
graphic screening methods in diagnosis of
anomalous coronary origins in the pediatric
population: assessment of quality improve-
ment, Pediatr Cardiol 36:120–125, 2015.
42. Freud LR, Moon-Grady A, Escobar-Diaz MC,
et al. Low rate of prenatal diagnosis among
neonates with critical aortic stenosis: insight
into the natural history in utero, Ultrasound
Obstet Gynecol 45:326–332, 2015.
43. Ono M, Boethig D, Goerler H, et al. Clinical
outcome of patients 20 years after Fontan op-
eration — effect of fenestration on late mor-
bidity, Eur J Cardiothorac Surg 30:923–929,
2006.
44. Driscoll DJ, Offord KP, Feldt RH, et al. Five-
to fifteen-year follow-up after Fontan opera-
tion, Circulation 85:469–496, 1992.
45. Anderson PA, Sleeper LA, Mahony L, et al.
Contemporary outcomes after the Fontan pro-
cedure: a Pediatric Heart Network multicenter
study, J Am Coll Cardiol 52:85–98, 2008.
46. Cohen MS, Marino BS, McElhinney DB, et al.
Neo-aortic root dilation and valve regurgita-
tion up to 21 years after staged reconstruction
for hypoplastic left heart syndrome, J Am Coll
Cardiol 42:533–540, 2003.
47. Balling G, Vogt M, Kaemmerer H, et al. Intra-
cardiac thrombus formation after the Fontan
operation, J Thorac Cardiovasc Surg 119:745–
751, 2000.
48. Walker HA, Gatzoulis MA. Prophylactic an-
ticoagulation following the Fontan operation,
Heart 91:854–856, 2005.
49. Siu S, Sermer M, Colman J, et al. Prospective
multicenter study of pregnancy outcomes in
women with heart disease, Circulation
104:515–521, 2001.
50. Lin AE, Basson CT, Goldmuntz E, et al.
Adults with genetic syndromes and cardio-
vascular abnormalities: clinical history and
management, Genet Med 10:469–494, 2008.
ch45.indd 1179
03.04.2019 12:18:42
ch45.indd 1180
03.04.2019 12:18:42
1181
КЛАПАННЫЙ И ПОДКЛАПАННЫЙ СТЕНОЗ
ЛЕГОЧНОЙ АРТЕРИИ
КЛАПАННЫЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
Клапанный стеноз легочной артерии обычно изо-
лированный. Частота его составляет 8–10% всего
количества врожденных пороков сердца (ВПС). Это
наиболее распространенная форма обструкции пра-
вых отделов сердца [1]. Створки клапана легочной
артерии имеют куполообразную форму во время
систолы, с узким отверстием в центре между ство-
рок. У пожилых людей клапан может кальцифициро-
ваться. Реже наблюдается дисплазия клапана с утол-
щенными, малоподвижными створками без сраста-
ния комиссур. Дисплазия часто ассоциируется с
другими ВПС и аномалиями развития других орга-
нов. Одностворчатый и двухстворчатый клапаны
легочной артерии редко бывают изолированной па-
тологией, чаще им сопутствует сложный ВПС, на-
пример тетрада Фалло. Клапанный стеноз легочной
артерии может сочетаться с генетическими синдро-
мами (Нунан, Алажиля, Вильямса) и врожденной
краснухой [1].
При естественном течении клапанного и подкла-
панного стенозов развивается обструкция выходно-
го тракта правого желудочка (ВТПЖ) с повышени-
ем давления в нем. Поддержание функции правого
желудочка (ПЖ) обеспечивается за счет его про-
грессирующей гипертрофии. Тяжелая гипертрофия
ПЖ приводит к уменьшению эластичности стенки
желудочка, из-за чего увеличивается конечно-диа-
столическое давление в ПЖ и давление в правом
предсердии (ПП). При наличии шунта на уровне
предсердий может наблюдаться сброс крови справа
налево. Легочный ствол часто расширяется, при
46 Аномалии правых отделов сердца
YULI Y. KIM, MD
Клапанный и подклапанный стеноз
легочной артерии
Клапанный стеноз легочной артерии
Подклапанный стеноз легочной артерии
Тетрада Фалло
Морфология и анатомические варианты
Хирургическая коррекция
Клиническая картина и осмотр пациентов
Эхокардиография при тетраде Фалло
Результаты лечения и наблюдение
после коррекции тетрады Фалло
Аномалия Эбштейна
Морфология
Клиническая картина и осмотр пациентов
Эхокардиография при аномалии
Эбштейна
Хирургическое лечение и отдаленные
результаты
этом наблюдается ускорение постстенотического
потока, преимущественно направленного в левую
легочную артерию. Однако степень расширения ле-
гочного ствола не всегда связана с тяжестью клапан-
ного стеноза.
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ И КЛИНИЧЕСКАЯ КАРТИНА
В большинстве случаев умеренный клапанный сте-
ноз легочной артерии редко прогрессирует в возрас-
те старше 3 лет. Согласно исследованию, в котором
изучали естественное течение ВПС, выживаемость
при стенозе правых отделов сердца (независимо от
тактики лечения) не отличается от таковой населе-
ния в целом, причем большинство пациентов сим-
птомов не имеют. Пациентов с градиентом давле-
ния в месте стеноза 25–49 мм рт. ст. оперируют в
20% случаев. При градиенте давления 50 мм рт. ст.
и выше стеноз прогрессирует, поэтому его хирурги-
ческая коррекция обязательна [2]. Тяжелый клапан-
ный стеноз легочной артерии проявляется одыш-
кой при нагрузке, усталостью, болью в груди, серд-
цебиением и обмороками. Ощущение дискомфорта
в области груди во время физической нагрузки мо-
жет быть связано с развитием ишемии ПЖ или на-
личием сопутствующей ишемической болезни серд-
ца. При клапанном стенозе легочной артерии опи-
саны случаи сдавления левой коронарной артерии
аневризматически расширенным легочным ство-
лом [3]. У пациентов могут быть цианоз и пальцы
в виде барабанных палочек из-за наличия шунта на
уровне предсердий и сброса крови справа налево.
Результаты осмотра взрослого пациента с кла-
панным стенозом легочной артерии зависят от сте-
пени стеноза и сопутствующих заболеваний. При
легком стенозе плетизмографические кривые ярем-
ch46.indd 1181
03.04.2019 12:18:56
1182 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ных вен не отличаются от нормы, при пальпации
над областью сердца дрожание грудной клетки от-
сутствует. При аускультации выслушивается систо-
лический шум в области клапана легочной артерии,
шум усиливается при вдохе и обычно заканчивается
в середине систолы. Может выслушиваться тон из-
гнания над легочным стволом, ослабевающий на
вдохе. Тяжелый клапанный стеноз легочной артерии
характеризуется увеличенным давлением в яремных
венах с заметной волной на плетизмограмме. Отме-
чается перегрузка ПЖ, громкий систолический шум
при аускультации, который проводится на спину.
Степень расщепления тона S2 пропорциональна сте-
пени стеноза. При тяжелом стенозе компонент P2
может быть ослаблен либо отсутствовать, что за-
трудняет определение расщепления тона S2. Также
может выслушиваться дополнительный правосто-
ронний тон S4 (ритм галопа).
ЭХОКАРДИОГРАФИЯ ПРИ КЛАПАННОМ СТЕНОЗЕ
ЛЕГОЧНОЙ АРТЕРИИ
Основным методом визуализации и оценки клапан-
ного стеноза легочной артерии считают эхокардио-
графию (ЭхоКГ). Основные задачи ЭхоКГ при кла-
панном стенозе легочной артерии приведены в
табл. 46.1 .
Основные позиции для визуализации клапана
легочной артерии — парастернальная по короткой
Структура
Оценка
Позиция/метод визуализации
Клапан легочной артерии
Морфология: створки купо-
лообразной формы во
время систолы, гипоплазия
либо дисплазия створок
и их подвижность
Парастернальная по длинной оси ВТПЖ, парастернальная
по короткой оси, высокая правая парастернальная для визуали-
зации клапана легочной артерии
Уровень обструкции: под-
клапанный, надклапанный
стеноз, ветви легочного
ствола
Парастернальная по длинной оси ВТПЖ, парастернальная
по короткой оси на уровне основания сердца с использованием
импульсно-волновой и непрерывно-волновой допплерографии
для оценки локализации и степени обструкции
Правая передняя косая субкостальная с поворотом датчика
против часовой стрелки на 45° относительно длинной оси
для визуализации приточного и отточного отделов ПЖ
Функция: степень стеноза,
степень регургитации
Парастернальная по короткой оси на уровне основания сердца
и модифицированная апикальная с наклоном датчика кпереди
и использованием импульсно-волновой и непрерывно-волно -
вой допплерографии
Размер фиброзного кольца Парастернальная по короткой оси на уровне основания сердца
для визуализации клапана легочной артерии и бифуркации
легочного ствола
Правый желудочек
Степень гипертрофии ПЖ,
размеры и функция ПЖ
Субкостальная по длинной оси либо парастернальная
по длинной оси в М-режиме, в 2D-режиме при толщине стенки
ПЖ во время диастолы > 5 мм, что указывает на гипертрофию
ПЖ (см. раздел «Тетрада Фалло»)
Межжелудочковая
перегородка
Снижение амплитуды
движения перегородки
во время систолы из-за
перегрузки давлением ПЖ
Парастернальная по короткой оси на уровне среднего отдела ЛЖ
Трикуспидальный клапан
Степень регургитации
и систолическое давление
вПЖ
Апикальная четырехкамерная, парастернальная по длинной оси
для визуализации приточного отдела ПЖ, парастернальная
по короткой оси на уровне основания сердца для визуализации
трикуспидального клапана
Правое предсердие
Размеры ПП
Апикальная четырехкамерная, с верхней границей нормы 18 см2
Нижняя полая вена
Диаметр и коллабирование
на вдохе для оценки давле-
ниявПП
Субкостальная по длинной оси для измерения диаметра НПВ
в конце выдоха
Межпредсердная
перегородка
ДМПП, открытое овальное
окно, выбухание межпред-
сердной перегородки
Субкостальная по длинной, короткой и «промежуточной» осям,
парастернальная по короткой оси, высокая правая
парастернальная
ВТПЖ — выходной тракт правого желудочка; ДМПП — дефект межпредсердной перегородки; ЛЖ — левый желудочек; НПВ — нижняя
полая вена; ПЖ — правый желудочек; ПП — правое предсердие.
ТАБЛИЦА 46.1 Задачи эхокардиографического исследования клапанного стеноза легочной артерии
ch46.indd 1182
03.04.2019 12:18:56
1183
46 Аномалии правых отделов сердца
ВТПЖ
ЛС
Рис. 46.1 A Клапанный стеноз легочной артерии. Парастернальная по-
зиция по короткой оси. Визуализируются легочный ствол (ЛС) и утолщенный
клапан (стрелка) во время систолы. ВТПЖ — выходной тракт правого желу-
дочка.
оси на уровне основания сердца и парастернальная
по длинной оси ВТПЖ. Створки клапана утолщены
(рис. 46.1), с ограничением движения свободных кра-
ев створок во время систолы, вследствие этого они
приобретают куполообразную форму. Диспластич-
ный клапан легочной артерии утолщен за счет ру-
диментарной неподвижной ткани створок и сочета-
ется с гипоплазией фиброзного кольца и надкла-
панным сужением легочной артерии.
Высокая правая парастернальная позиция при
визуализации клапана легочной артерии дает под-
робную информацию о его морфологии, но данная
позиция трудновыполнима у взрослых пациентов.
Импульсно-волновую и непрерывно-волновую
допплерографию используют для оценки степени
стеноза и уровня обструкции. Для визуализации
клапана легочной артерии и ветвей легочного ство-
ла в дополнение к парастернальной позиции по ко-
роткой оси используют модифицированную апи-
кальную позицию с размещением датчика ближе к
срединной линии тела или субкостальную позицию
с наклоном датчика кпереди, что позволяет полу-
чить изображение для измерения градиентов давле-
ния.
Поток через клапан легочной артерии могут из-
менять разные физиологические состояния, влияя
на точность оценки градиента давления с помощью
модифицированного уравнения Бернулли, которое
наиболее точно при изолированном клапанном сте-
нозе. Например, при выраженной систолической
дисфункции ПЖ и правожелудочковой недостаточ-
ности в ПЖ нет достаточного давления для преодо-
ления сопротивления потоку крови через стенози-
рованный участок, а создается максимальный мгно-
венный градиент давления, который приводит к
недооценке тяжести обструкции. Аналогичным об-
разом сброс крови слева направо через дефект меж-
предсердной перегородки или регургитация на кла-
пане легочной артерии увеличивает поток через
клапан легочной артерии, тем самым повышая гра-
диент давления на клапане, что может привести к
завышению степени стеноза. Стеноз на протяжении
и обструкция на нескольких уровнях (сочетание с
подклапанным и/или надклапанным стенозом) так-
же искажают результат измерения градиента давле-
ния, полученный при допплерографии.
В соответствии с Рекомендациями American Col-
lege of Cardiology/American Heart Association (ACC/
AHA) 2014 г. по ведению пациентов с пороками кла-
панов сердца [4], критерием тяжелого клапанного
стеноза легочной артерии является максимальная
скорость потока > 4 м/сек или максимальный мгно-
венный градиент давления 64 мм рт. ст. и выше
(табл. 46.2). В Рекомендациях ACC/AHA 2008 г. по
ведению взрослых пациентов с ВПС тяжелый кла-
панный стеноз легочной артерии диагностируют
при максимальном мгновенном градиенте давления
> 50 мм рт. ст., умеренный — при показателях от 30
до50ммрт.ст., алегкий—<30ммрт.ст.[5].Со-
гласно рекомендациям, пациентов с максимальным
мгновенным градиентом давления < 30 мм рт. ст.
следует обследовать и проводить им ЭхоКГ каждые
5 лет, а бессимптомным пациентам с максималь-
ным мгновенным градиентом давления > 30 мм
рт. ст. — каждые 2–5 лет [5].
Легкий
стеноз
Умеренный
стеноз
Тяжелый
стеноз
Максимальная скорость потока по данным допплерографии (м/сек)
<3
3–4
>4
Максимальный градиент давления по данным допплерографии (мм рт. ст.)
<36
36–64
>64
Средний градиент давления по данным допплерографии (мм рт. ст.)
>40
Систолическое давление в ПЖ/систолическое давление в ЛЖ (%)
<50
50–74
≥75
ЛЖ — левый желудочек; ПЖ — правый желудочек.
[Cuypers JA, Witsenburg M, van der Linde D, Roos-Hesselink JW. Pulmonary stenosis: update on diagnosis and therapeutic options. Heart 99:339–
347, 2013.]
ТАБЛИЦА 46.2 Выраженность клапанного стеноза легочной артерии
ch46.indd 1183
03.04.2019 12:18:56
1184 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Данные о точности измерения максимального
мгновенного градиента давления в месте клапанно-
го стеноза легочной артерии при ЭхоКГ противоре-
чивы по сравнению с данными, полученными при
катетеризации сердца. Некоторые исследования по-
казали идеальное совпадение результатов измере-
ний с помощью этих методов [6, 7], тогда как в дру-
гих работах максимальный мгновенный градиент
давления превышал межпиковый градиент давле-
ния, но при этом был сравним с максимальным
мгновенным градиентом давления, полученным
при катетеризации сердца [8, 9]. Позже было дока-
зано, что средний градиент давления при допплеро-
графии имеет наилучшую корреляцию с межпико-
вым градиентом давления при оценке изолирован-
ного [10] и сочетанного [11] клапанного стеноза
легочной артерии. Согласно нашему опыту, макси-
мальный мгновенный градиент давления, измерен-
ный с помощью ЭхоКГ, превышает показатель, по-
лученный при катетеризации сердца, причем разни-
ца может увеличиваться вследствие эффекта седации
у пациента. Такие косвенные показатели систоличе-
ского давления в ПЖ, как максимальная скорость
струи трикуспидальной регургитации, снижение
амплитуды движения межжелудочковой перегород-
ки и степень гипертрофии ПЖ, дают дополнитель-
ную информацию о тяжести клапанного стеноза ле-
гочной артерии. Рекомендуется соотносить гради-
ент давления, полученный при допплерографии, с
клинической картиной и симптоматикой.
ПОКАЗАНИЯ К ЧРЕСКОЖНОМУ ВМЕШАТЕЛЬСТВУ
И ЭХОКАРДИОГРАФИЧЕСКАЯ ОЦЕНКА
РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ
Показания к чрескожным вмешательствам при кла-
панном стенозе легочной артерии перечислены в
табл. 46.3 [5]. Первая успешная баллонная валь-
вулопластика была выполнена в 1982 г. Этот метод
лечения до сих пор является методом выбора при
лечении типичного клапанного стеноза легочной
Класс
Показания
Уровень
доказательности
Класс I
Баллонная вальвулотомия показана бессимптомным пациентам со створками
куполообразной формы у клапана легочной артерии во время систолы и максимальным
мгновенным градиентом давления > 60 мм рт. ст. либо средним градиентом давления
> 40 мм рт. ст. по данным допплерографии (в сочетании с легкой/умеренной
регургитацией)
B
Баллонная вальвулотомия показана симптомным пациентам со створками куполообразной
формы у клапана легочной артерии во время систолы и максимальным мгновенным
градиентом давления > 50 мм рт. ст . либо средним градиентом давления > 30 мм рт. ст.
по данным допплерографии (в сочетании с легкой/умеренной регургитацией)
C
Хирургическое лечение показано пациентам с тяжелым клапанным стенозом легочной
артерии и при сочетании его с гипоплазией фиброзного кольца клапана, тяжелой
регургитацией, подклапанным либо надклапанным стенозом. Хирургическая коррекция
также показана в большинстве случаев дисплазии клапанов и при сочетании ее с тяжелой
трикуспидальной регургитацией либо при необходимости проведения операции
«лабиринт»
C
Класс IIb Проведение баллонной вальвулотомии может быть рациональным у бессимптомных
пациентов с дисплазией клапана легочной артерии и максимальным мгновенным
градиентом давления > 60 мм рт. ст. либо средним градиентом давления > 40 мм рт. ст . по
данным допплерографии
C
Проведение баллонной вальвулотомии может быть рациональным у некоторых симптомных
пациентов с дисплазией клапана легочной артерии и максимальным мгновенным
градиентом давления > 50 мм рт. ст. либо средним градиентом давления > 30 мм рт. ст . по
данным допплерографии
C
Класс III Баллонная вальвулотомия не рекомендуется бессимптомным пациентам с максимальным
мгновенным градиентом < 50 мм рт. ст . по данным допплерографии и нормальным
сердечным выбросом
C
Баллонная вальвулотомия не рекомендуется пациентам с симптомами клапанного стеноза
и/или тяжелой регургитацией
C
Баллонная вальвулотомия не рекомендуется пациентам с симптомами и максимальным
мгновенным градиентом < 30 мм рт. ст . по данным допплерографии
C
ACC — American College of Cardiology; AHA — American Heart Association.
[Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 Guidelines for the Management of Adults with Congenital Heart Disease: Executive
Summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to
develop guidelines for the management of adults with congenital heart disease). Circulation 118:2395–2451, 2008.]
ТАБЛИЦА 46.3 Рекомендации ACC/AHA по проведению чрескожных вмешательств при клапанном стенозе легочной артерии
ch46.indd 1184
03.04.2019 12:18:57
1185
46 Аномалии правых отделов сердца
артерии (рис. 46.2) [12]. Процесс заключается в ме-
ханическом воздействии баллона на комиссуры с
целью их разрыва. Процедура имеет отличные ре-
зультаты [13, 14].
Баллонная вальвулопластика также улучшает со-
стояние пациента при дисплазии клапана и являет-
ся методом выбора лечения дисплазии, хотя в этом
случае результаты несколько хуже по сравнению с
результатами при типичном клапанном стенозе ле-
гочной артерии. Результаты большого многоцен-
трового исследования с участием 533 пациентов и
периодом наблюдения после баллонной вальвуло-
пластики в среднем 33 месяца (от 1 месяца до 8,7 го-
да) показали, что у 23% пациентов был остаточный
градиент давления 36 мм рт. ст. или более либо по-
надобилась повторная баллонная вальвулопластика
или открытая вальвулотомия. Предикторы небла-
гоприятного исхода: более раннее проведение вме-
шательства, более высокий остаточный градиент
давления и анатомические особенности клапана ле-
гочной артерии [15].
Отдаленные результаты у 139 пациентов с меди-
аной наблюдения 6 лет (от 0 до 21 года) свидетель-
ствуют о том, что повторное вмешательство пона-
добилось лишь 9,4% пациентов, главным образом
из-за рестеноза. В этом же исследовании проанали-
зированы данные 79 пациентов, которые перенесли
открытую вальвулотомию, с медианой наблюдения
22,5 года (от 0 до 45 лет). В 20,3% случаев понадо-
билось повторное оперативное вмешательство, в
основном из-за регургитации на клапане легочной
артерии [16]. Предыдущие исследования также про-
демонстрировали высокий процент регургитации
после вальвулотомии, что в отдаленном периоде
стало показанием к протезированию клапана [17–
20]. Эти данные свидетельствуют о том, что баллон-
ная вальвулопластика является методом выбора
при лечении пациентов с подходящим анатомиче-
ским вариантом стеноза.
Во время эхокардиографического исследования
пациентов, перенесших баллонную вальвулопла-
стику либо открытую вальвулотомию, необходимо
оценить степень остаточного стеноза, локализацию
и выраженность регургитации на клапане легочной
артерии. После этих вмешательств может наблю-
даться увеличение степени обструкции отточного
отдела ПЖ, однако со временем она снижается по
мере регрессии гипертрофии ПЖ [21, 22]. Регур-
гитация на клапане легочной артерии — достаточ-
но частое явление, особенно после хирургического
вмешательства по поводу клапанного стеноза. Эхо-
кардиографическая оценка регургитации подробно
описана в разделе, посвященном тетраде Фалло. По-
казания к протезированию клапана при тяжелой ре-
гургитации после вальвулотомии не установлены.
ПОДКЛАПАННЫЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
ПЖ состоит из трех отделов: (1) приточного (вход-
ной тракт); (2) синусного (трабекулярная часть с вер-
хушкой ПЖ); (3) отточного, или инфундибулярно-
го (выходной тракт). Подклапанный стеноз легоч-
ной артерии — редкий врожденный порок правых
Рис. 46.2 Баллонная вальвулопластика при клапанном стенозе легочной артерии. (А) Правая вентрикулограмма в боковой проекции. Видны створки
куполообразной формы во время систолы (стрелка). Обратите внимание на дилатацию легочного ствола (ЛС). (Б) Правая вентрикулограмма в боковой проекции
после раздувания баллона. Визуализируется умеренная «талия» баллона на уровне стеноза (стрелка). ВТПЖ — выходной тракт правого желудочка; ПЖ — пра-
вый желудочек; ПП — правое предсердие.
BIPLANE B LAO 90 CRAN 1
BIPLANE B LAO 90 CRAN 1
ПЖ
ВТПЖ
ПП
ЛС
А
Б
ch46.indd 1185
03.04.2019 12:18:57
1186 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Дистальная камера
правого желудочка
Гипертрофированный
мышечный пучок
Проксимальная камера
правого желудочка
Гипертрофированный
мышечный пучок
Рис. 46.3 Двухкамерный правый желудочек. Гипертрофированные мышечные пучки разделяют полость правого желудочка на проксимальную и дистальную
камеры [Loukas M, Housman B, Blaak C, et al. Double-chambered right ventricle: a review. Cardiovasc Pathol 22:417–423, 2013].
отделов сердца, развивающийся либо при обструк-
ции ВТПЖ, или инфундибулярном стенозе, из-за
образования фиброзно-мышечной мембраны, либо
при гипертрофии мышечных пучков и приводя-
щий к разделению ПЖ на две камеры. Инфундибу-
лярный стеноз может быть на любом уровне ВТПЖ
(от начала отточного отдела до клапана легочной
артерии). Обструкция ПЖ разделяет его на прокси-
мальную (синусную) камеру с высоким давлением
и дистальную (инфундибулярную) камеру с низким
давлением (рис. 46.3).
Двухкамерный ПЖ сочетается с дефектом меж-
желудочковой перегородки (ДМЖП) (чаще всего
мембранозным) у 60–90% пациентов, причем обыч-
но наблюдается шунт между левым желудочком
(ЛЖ) и проксимальной камерой с высоким давле-
нием. Клапанный стеноз легочной артерии встреча-
ется примерно в 40% случаев, а дефект межпред-
сердной перегородки — в 17%. Патология также
может быть связана со сложными ВПС, например
двойным отхождением магистральных сосудов от
ПЖ и тетрадой Фалло [23, 24]. В редких случаях воз-
можно сочетание с обструкцией выходного тракта
ЛЖ и подклапанным аортальным стенозом.
МЕХАНИЗМЫ НАРУШЕНИЙ ГЕМОДИНАМИКИ
И КЛИНИЧЕСКАЯ КАРТИНА
Нарушениями гемодинамики при обструкции вы-
ходного тракта ЛЖ и двухкамерном ПЖ являются
повышение давления в проксимальной камере ПЖ
с последующей гипертрофией ПЖ, повышение ко-
нечно-диастолического давления в ПЖ и давления
в ПП. Обструкция при двухкамерном ПЖ прогрес-
сирует из-за гипертрофии мышечных пучков, одна-
ко скорость развития обструкции может варьиро-
вать [25, 26]. Предполагают, что взрослые пациенты
с изолированным и впервые диагностированным
двухкамерным ПЖ могли иметь ДМЖП, который
спонтанно закрылся. При локализации ДМЖП в не-
посредственной близости от места обструкции по-
вышенное давление в ПЖ может снизить сброс кро-
ви слева направо, а в тяжелых случаях даже изме-
нить его направление на противоположное, что
приведет к цианозу.
Клиническая картина подклапанного стеноза ле-
гочной артерии сходна с таковой клапанного стено-
за и зависит от степени обструкции, а также нали-
чия сопутствующего ДМЖП или других пороков
сердца. Данные аускультации при подклапанном
ch46.indd 1186
03.04.2019 12:18:58
1187
46 Аномалии правых отделов сердца
стенозе легочной артерии отличаются от таковых
при клапанном стенозе, т.к. при подклапанном сте-
нозе систолический щелчок отсутствует, а компо-
нент Р2 не расщеплен. Систолический шум с вибра-
цией выслушивается примерно у 25% пациентов с
двухкамерным ПЖ [24].
ЭХОКАРДИОГРАФИЯ ПРИ ПОДКЛАПАННОМ СТЕНОЗЕ
ЛЕГОЧНОЙ АРТЕРИИ
Диагностика подклапанного стеноза легочной арте-
рии с помощью ЭхоКГ у молодых пациентов обыч-
но не вызывает затруднений, но у пожилых людей
сложна, в этом случае может понадобиться чреспи-
щеводная эхокардиография (ЧПЭхоКГ) (рис. 46.4)
[23]. Магнитно-резонансная томография (МРТ) —
еще один метод диагностики, который отлично ви-
зуализирует анатомию и используется все чаще [27,
28]. Задачи ЭхоКГ при подклапанном стенозе и кла-
панном стенозе легочной артерии аналогичны, за
исключением того, что необходимо искать ДМЖП,
оценить его тип, локализацию и градиент давления
на нем. Оценку выходного тракта ЛЖ проводят для
исключения его обструкции.
Как и при оценке клапанного стеноза легочной
артерии, основными позициями при визуализации
подклапанного стеноза являются парастернальная
по короткой оси на уровне основания сердца и па-
растернальная по длинной оси ВТПЖ. В некоторых
случаях в парастернальной позиции по короткой
оси ультразвуковой луч не удается установить пер-
пендикулярно ВТПЖ, поэтому используют моди-
фицированную апикальную позицию, смещая дат-
чик к срединной линии тела и наклоняя датчик кпе-
реди. Это обеспечивает лучшее его прилегание и
визуализацию.
Расположение подклапанного стеноза легочной
артерии относительно трикуспидального клапана и
клапана легочной артерии лучше всего оценивать в
субкостальной позиции, которая также позволяет
измерить градиент давления в ВТПЖ по короткой
оси. Однако зачастую в данной позиции это сделать
сложно у взрослых пациентов.
Повышенное систолическое давление в ПЖ, вы-
явленное по ускоренной струе трикуспидальной ре-
гургитации и выраженной гипертрофии ПЖ при
нормальной анатомии клапана легочной артерии
(рис. 46.5), может приводить к ошибочной диагно-
стике легочной гипертензии, если истинная причи-
на обструкции ВТПЖ так и остается неустановлен-
ной. Большое значение имеют локализация ДМЖП
и его расположения относительно гипертрофиро-
ванных мышечных пучков. Если дефект сообщается
с проксимальной камерой ПЖ с высоким давлени-
ем, то скорость потока через ДМЖП будет относи-
тельно низкой (особенно при существенной об-
струкции ВТПЖ) даже при небольшом ДМЖП.
ПОКАЗАНИЯ К ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ
Лечение изолированного инфундибулярного стено-
за только хирургическое. Оперативное вмешатель-
ство рекомендуется пациентам с двухкамерным ПЖ
и максимальным градиентом давления > 60 мм
рт. ст. в полости желудочка либо средним градиен-
том давления > 40 мм рт. ст. (по данным допплеро-
графии) независимо от наличия или отсутствия
симптомов. Хирургическую коррекцию также мож-
но рассматривать при максимальном градиенте дав-
ления > 50 мм рт. ст. либо при среднем градиенте
давления > 30 мм рт. ст. у пациентов с симптомами,
которые не вызваны другими заболеваниями [5].
ПЖ
ПП
ЛП
ВТЛЖ
ВТПЖ
ПЖ
ЛЖ
Рис. 46.4 A Двухкамерный правый желудочек. Позиция по короткой оси
из среднего отдела пищевода. Визуализируется обструкция правого желудоч-
ка (ПЖ) на уровне отточного отдела (стрелка). ВТЛЖ — выходной тракт лево-
го желудочка; ВТПЖ — выходной тракт правого желудочка; ЛП — левое пред-
сердие; ПП — правое предсердие.
Рис. 46.5 A Двухкамерный правый желудочек. Парастернальная позиция
по короткой оси. Дилатация и выраженная гипертрофия двухкамерного право-
го желудочка (ПЖ) и снижение амплитуды движения D-образной межжелудоч-
ковой перегородки во время систолы. ЛЖ — левый желудочек.
ch46.indd 1187
03.04.2019 12:18:58
1188 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
При двухкамерном ПЖ не рекомендуется отклады-
вать операцию, учитывая прогрессирующий харак-
тер заболевания. Хирургическое лечение характери-
зуется отличными результатами и минимальными
остаточными проявлениями [29, 30].
ТЕТРАДА ФАЛЛО
Тетрада Фалло (ТФ) — наиболее распространенный
цианотический порок сердца. Частота его составляет
0,33 на 1000 живорожденных детей, или 6,7% обще-
го количества ВПС [31, 32]. ТФ относится к порокам
конотрункуса и включает: (1) ДМЖП; (2) аорталь-
ный клапан, «сидящий верхом» на ДМЖП; (3) ин-
фундибулярный стеноз; (4) гипертрофию ПЖ (рис.
46.6). Хотя причина формирования ТФ изучена не
до конца, известен генетический компонент, ассо-
циированный с хромосомными аномалиями, моно-
генными заболеваниями, синдромом Ди Джорджи,
велокардиофациальными синдромами (например,
синдромом делеции 22q11), синдромом Дауна, син-
дромом Алажиля и ассоциацией VATER/VACTERL
(дефекты позвоночника, атрезия ануса, пороки серд-
ца, трахеопищеводная фистула, аномалии почек и
конечностей) [33].
МОРФОЛОГИЯ И АНАТОМИЧЕСКИЕ ВАРИАНТЫ
ДМЖП при ТФ смещен из-за отклонения инфунди-
булярной части межжелудочковой перегородки вы-
ше и вперед от плоскости остальной части перего-
родки. Это приводит к инфундибулярному стенозу,
который может усугубляться аномальными мышеч-
ными пучками, пересекающими ВТПЖ. Клапан ле-
гочной артерии зачастую гипоплазирован, может
быть одно- или двухстворчатым, со стенозом раз-
личной степени. Наиболее тяжелая форма ТФ пред-
ставляет собой атрезию легочной артерии, которая
Рис. 46.6 Тетрада Фалло. (A) Тетрада Фалло с отклонением инфундибулярной (Инф) части перегородки кпереди, инфундибулярным стенозом (ИС), смещен-
ным дефектом межжелудочковой перегородки (ДМЖП), «сидящим верхом» аортальным клапаном (АК) и гипертрофией правого желудочка (ПЖ). (Б) Неопери-
рованная тетрада Фалло. Правая передняя косая субкостальная позиция. Визуализируются смещенная вперед инфундибулярная часть перегородки (стрелка) и
возникающий вследствие этого дефект межжелудочковой перегородки (
*
), «сидящий верхом» аортальный клапан и гипоплазированный клапан легочной арте-
рии (КЛА). В субкостальной позиции по длинной оси после поворота датчика по часовой стрелке на 45° видно углубление между 1 и 2 часами условного цифер-
блата. ЛС — легочный ствол; ПП — правое предсердие; ТК — трикуспидальный клапан; ПКТ — перегородочно-краевая трабекула [А —Srivastava S, Parness IA.
Tetralogy of Fallot. In: Lai WW, Mertens L, Cohen MS, Geva T, eds. Echocardiography in Pediatric and Congenital Heart Disease From Fetus to Adult. Hoboken: Wiley-Black-
well; 2009:362–384].
ЛС
ТК
АК
КЛА
Инф
ИС
ПКТ
ДМЖП
ПЖ
*
КЛА
ПЖ
ПП АК
ЛС
А
Б
ch46.indd 1188
03.04.2019 12:18:59
1189
46 Аномалии правых отделов сердца
характеризуется отсутствием сообщения между ле-
гочной артерией и ПЖ и наличием крупных аорто-
легочных коллатералей, идущих к сегментам лег-
ких. Другими вариантами ТФ являются ТФ с атрио-
вентрикулярным каналом (часто наблюдается при
синдроме Дауна) и ТФ с агенезией клапана легочной
артерии. ТФ ассоциируется и с другими пороками
сердца, которые описаны в табл. 46.4 .
ХИРУРГИЧЕСКАЯ КОРРЕКЦИЯ
Большинство взрослых пациентов с ТФ перенесли
хирургическое лечение в детстве, поэтому результа-
ты эхокардиографического исследования напрямую
зависят от данных анамнеза и информации о том,
какой объем оперативного лечения был выполнен.
Ранее (до использования искусственного кровообра-
щения у новорожденных) коррекцию ТФ проводи-
ли поэтапно. На первом этапе формировали аорто-
легочный анастомоз для увеличения легочного кро-
вотока, на втором этапе при повторной операции
выполняли радикальную коррекцию. Хирургиче-
ское лечение порока за один этап начали успешно
проводить в 1980-х гг ., однако модифицированный
анастомоз по Блелоку–Тауссиг все еще выполняют
у новорожденных с атрезией легочной артерии, у
детей в критическом состоянии и в центрах, не вы-
полняющих радикальную коррекцию порока. В
табл. 46.5 описаны различные виды паллиативных
операций с формированием анастомозов, которые
можно встретить у взрослых пациентов с ТФ.
Радикальная коррекция заключается в закрытии
ДМЖП, устранении обструкции ВТПЖ и ликвида-
ции анастомоза, сформированного ранее (при его
наличии). Обструкцию устраняют различными спо-
собами, включая резекцию мышечных пучков, пла-
стику ВТПЖ заплатой, трансаннулярную пластику
заплатой, вальвулотомию клапана легочной арте-
рии, имплантацию кондуита между ПЖ и легочной
артерией при ее атрезии либо аномальной анатомии
коронарных артерий, которые пересекают ВТПЖ.
Ранее всем пациентам выполняли правостороннюю
вентрикулотомию с трансаннулярной пластикой за-
платой, что уменьшало обструкцию ВТПЖ, но при-
водило к тяжелой регургитации на клапане легоч-
ной артерии, дисфункции и рубцеванию ПЖ.
Послеоперационные остаточные структурные и
функциональные нарушения после коррекции ТФ
считают нормой. Особенно часто наблюдается ре-
гургитация на клапане легочной артерии — наибо-
лее значимая проблема. В табл. 46.6 описаны самые
частые остаточные нарушения после коррекции ТФ.
КЛИНИЧЕСКАЯ КАРТИНА И ОСМОТР ПАЦИЕНТОВ
Зачастую взрослые с ТФ не имеют симптомов, но
после коррекции при наличии остаточных наруше-
ний возможны одышка при нагрузке и сниженная
толерантность к нагрузке. Хотя регургитацию на
клапане легочной артерии считают относительно
доброкачественным состоянием, тяжелая регурги-
тация способствует прогрессированию дилатации и
дисфункции ПЖ, что приводит к непереносимости
физической нагрузки, аритмии, сердечной недоста-
точности и синдрому внезапной смерти [34–37].
Стенозы ветвей легочного ствола могут способство-
вать развитию одышки при нагрузке и усугублять
регургитацию на клапане легочной артерии [38].
Во время обследования при наличии трикуспи-
дальной регургитации отмечаются повышенное дав-
ление в яремных венах и широкие пульсовые волны.
При пальпации может быть усиленный сердечный
толчок из-за гипертрофии ПЖ. Во время аускульта-
ции тон S2 может быть нормальным либо расще-
пленным из-за задержки проводимости, связанной с
расширением ПЖ и блокадой правой ножки пучка
Врожденная аномалия
Примечания
Дефект межпредсердной перегородки
(83%) [109]
Пентада Фалло
Мышечный дефект межжелудочковой
перегородки
Правосторонняя дуга аорты (25%) [33] Часто встречается
при синдроме
делеции 22q11
Добавочная левая верхняя полая вена
(11%) [109]
Коронарная артерия, пересекающая
ВТПЖ (5,4%) [110]
Чаще всего
ЛПНА, которая
идет от ПКА
Двухкамерный правый желудочек
Аномалия Эбштейна
Частичный либо тотальный аномаль-
ный дренаж легочных вен
Дефект венозного синуса
Дефект крыши коронарного синуса
Трехпредсердное сердце
Безымянная вена, проходящая за аортой
Надклапанный митральный стеноз
Расщепление створки митрального
клапана
Двухстворчатый аортальный клапан
Коарктация аорты
Аномалии дуги аорты (двойная дуга,
аномальное отхождение сосудов
от аорты, сосудистые кольца)
Отхождение ветви легочного ствола
(чаще левой легочной артерии)
от аорты
Дефект аортолегочной перегородки
Кроссинг легочных артерий
Эктопия сердца и торакоабдомиальный
дефект при пентаде Кантрелла
ВТПЖ — выходной тракт правого желудочка; ЛПНА — левая пе-
редняя нисходящая артерия; ПКА — правая коронарная артерия.
ТАБЛИЦА 46.4 Врожденные аномалии, которые
сочетаются с тетрадой Фалло
ch46.indd 1189
03.04.2019 12:19:00
1190 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Название
Техника
Примечания
Классический
анастомоз
по Блелоку–Тауссиг
Анастомоз «конец-в-бок» между под-
ключичной артерией и легочной
артерией на той же стороне
Отсутствие пульса на лучевой и плечевой артериях на стороне
анастомоза
Редко возникает чрезмерный легочный кровоток, приводя-
щий к легочной гипертензии
Обычно анастомоз накладывают на противоположной
стороне от дуги аорты
Первая в мире паллиативная кардиохирургическая операция
при цианотических пороках сердца
Модифицированный
анастомоз
по Блелоку–Тауссиг
Протез из синтетического материала
Gore-Tex между подключичной
артерией и легочной артерией
на той же стороне
Диаметр 3,5–4 мм у новорожденных
Лучший контроль легочного кровотока в сравнении с класси-
ческим анастомозом
Может наблюдаться ослабление пульса на лучевой артерии
со стороны анастомоза
Анастомоз
по Ватерстоуну
Анастомоз «бок-в -бок» между восхо-
дящим отделом аорты и правой
легочной артерией
Могут наблюдаться чрезмерный легочный кровоток и легоч-
ная гипертензия
Деформация либо вторичная атрезия легочной артерии
Анастомоз по Поттсу Анастомоз «бок-в -бок» между нисхо-
дящим отделом аорты и левой
легочной артерией
Могут наблюдаться чрезмерный легочный кровоток и легоч-
ная гипертензия
Деформация либо вторичная атрезия легочной артерии
Центральный
анастомоз
Протез из синтетического материала
Gore-Tex между восходящим
отделом аорты и легочной артерией
Возможность избыточного легочного кровотока и легочной
гипертензии
[Babu-Narayan SV, Gatzoulis M. Tetralogy of Fallot. In Gatzoulis M, Webb G, Daubeney PE, editors: Diagnosis and management of adult congenital
heart disease, ed 2, Philadelphia, 2011, Elsevier Saunders.]
ТАБЛИЦА 46.5 Паллиативные операции при тетраде Фалло (системно-легочные анастомозы)
Структурные нарушения
Функциональные нарушения
Связанные с коррекцией порока
Частичная либо полная резекция клапана легочной артерии
Рубец после инфундибулотомии
Резекция ПЖ/инфундибулярных мышечных пучков
Рубец после атриотомии правого предсердия
Заплата на дефекте межжелудочковой перегородки
Остаточные либо повторные нарушения
Обструкция ВТПЖ
Стеноз легочного ствола либо его ветвей
Дефект межжелудочковой перегородки
Дефект межпредсердной перегородки
Вторичные нарушения
Аномалии трикуспидального клапана
Аневризма ВТПЖ
Фиброз ПЖ
Другие
Расширение аорты
Перегрузка объемом ПЖ
Регургитация на клапане легочной артерии
Трикуспидальная регургитация
Сброс крови слева направо через дефект межжелудочковой
перегородки, дефект межпредсердной перегородки либо
по аортолегочным коллатералям
Перегрузка давлением ПЖ
Стеноз ВТПЖ либо легочной артерии
Заболевания сосудов легких
Легочная венозная гипертензия из-за дисфункции ЛЖ
Систолическая и диастолическая дисфункции ПЖ
Дисфункция ЛЖ
ВТПЖ — выходной тракт правого желудочка; ЛЖ — левый желудочек; ПЖ — правый желудочек.
[Geva T. Repaired tetralogy of Fallot: the roles of cardiovascular magnetic resonance in evaluating pathophysiology and for pulmonary valve replace-
ment decision support. J Cardiovasc Magn Reson 13:9, 2011.]
ТАБЛИЦА 46.6 Структурные и функциональные нарушения после коррекции тетрады Фалло
ch46.indd 1190
03.04.2019 12:19:00
1191
46 Аномалии правых отделов сердца
Гиса. Зачастую определяется систолический шум в
области проекции клапана легочной артерии, кото-
рый возникает из-за ускорения потока через ВТПЖ.
В этой же области может выслушиваться убываю-
щий диастолический шум из-за регургитации на
клапане легочной артерии. При наличии регургита-
ции диастолический шум может быть укороченным
из-за быстрого уравнивания диастолических давле-
ний в легочной артерии и ПЖ. Изредка отмечаются
голосистолический шум из-за трикуспидальной ре-
гургитации и правосторонний тон S3.
Пациенты, которым не была выполнена коррек-
ция ТФ, или пациенты, перенесшие только паллиа-
тивный этап в виде наложения аортолегочного ана-
стомоза, могут иметь умеренную десатурацию из-за
сброса крови справа налево через ДМЖП при отно-
сительно сбалансированном кровотоке либо выра-
женный цианоз.
У пациентов после паллиативных операций на-
блюдаются цианоз и пальцы в виде барабанных па-
лочек. При наличии послеоперационного рубца по-
сле торакотомии и отсутствии либо ослаблении
пульса на плечевой и лучевой артериях с этой же
стороны можно сделать вывод, что пациенту ранее
был наложен анастомоз Блелока–Тауссиг. При ау-
скультации определяется непрерывный шум потока
по анастомозу, выслушиваемый в области ключи-
цы или на спине, а также возможны признаки ле-
гочной гипертензии.
ЭХОКАРДИОГРАФИЯ ПРИ ТЕТРАДЕ ФАЛЛО
При эхокардиографическом исследовании перво-
степенное значение имеет информация о проведен-
ной ранее хирургической или катетерной коррек-
ции. Опубликованы рекомендации по эхокардио-
графическому исследованию пациентов с ТФ, где
подчеркивается необходимость регулярного наблю-
дения прооперированных пациентов [39]. Задачи
эхокардиографического исследования при ТФ при-
ведены в табл. 46.7 .
ВЫХОДНОЙ ТРАКТ ПРАВОГО ЖЕЛУДОЧКА
И КЛАПАН ЛЕГОЧНОЙ АРТЕРИИ
Оценка выходного тракта ПЖ и клапана легочной
артерии не отличается от оценки, описанной в раз-
делах, посвященных клапанному и подклапанно-
му стенозу. Следует выявлять остаточную обструк-
цию, определять ее уровень и степень на уровне
отточного отдела ПЖ, фиброзного кольца и легоч-
ного ствола.
Аневризма ВТПЖ характеризуется наличием
большого эхонегативного пространства спереди или
сбоку от выходного тракта и легочного ствола, а так-
же истончением и дискинезией стенки ПЖ на уров-
не ВТПЖ. Перед хирургическим либо чрескожным
вмешательством нужно измерить диаметр кондуи-
та между ПЖ и легочной артерией или фиброзного
кольца клапана легочной артерии. В норме размер
фиброзного кольца составляет 17–26 мм [40]. Как
правило, визуализация кондуита у взрослых паци-
ентов затруднена из-за вариабельной локализации,
особенно при загрудинном положении. Для адек-
ватной оценки локализации кондуита и градиента
давления на нем рекомендуется использовать раз-
личные эхокардиографические позиции, а также
допплерографию.
РЕГУРГИТАЦИЯ НА КЛАПАНЕ ЛЕГОЧНОЙ АРТЕРИИ
Степень регургитации на клапане легочной артерии
зависит от размера отверстия, эластичности ПЖ и
постнагрузки на него [38]. Лучше всего оценивать
ВТПЖ в парастернальной позиции по длинной оси,
а клапан легочной артерии — по короткой оси на
уровне основания сердца. У взрослых с хорошей аку-
стической доступностью лучше визуализировать
клапан и ВТПЖ в апикальной позиции с располо-
жением датчика ближе к срединной линии тела и
наклоном датчика кпереди (рис. 46.7).
ЭхоКГ позволяет качественно оценить степень
регургитации (умеренная или тяжелая). Многие ис-
следователи для получения точных данных прово-
дят МРТ сердца. Ретроградный поток в ветвях ле-
гочного ствола во время диастолы [41, 42] и шири-
на струи регургитации > 70% размера фиброзного
кольца клапана [41, 43] ассоциируются с тяжелой
регургитацией на клапане легочной артерии (рис.
46.8). Согласно одной из классификаций, ширина
струи регургитации ≤ 1/3 размера фиброзного коль-
ца клапана соответствует легкой степени регургита-
ции, от 1/3 до 2/3 — умеренной, ≥ 2/3 — тяжелой
[44].
Время полуспада давления менее 100 мсек корре-
лирует с гемодинамически значимой регургитацией
на клапане легочной артерии [45], однако из-за на-
рушения податливости стенок ПЖ с диастоличе-
ской дисфункцией степень регургитации можно
переоценить из-за быстрого уравнивания конечно-
диастолических давлений в ПЖ и легочной артерии
(рис. 46.9). Другие эхокардиографические показате-
ли имеют вариабельную чувствительность и специ-
фичность либо не были валидированы [46–49].
ВЕТВИ ЛЕГОЧНОГО СТВОЛА
Ключевым компонентом ЭхоКГ пациентов с ТФ яв-
ляется тщательная оценка ветвей легочного ствола,
однако у взрослых пациентов с плохой акустиче-
ской доступностью она может быть затруднена. Вет-
ви легочного ствола визуализируются в парастер-
нальной позиции по короткой оси, но иногда для
определения этих ветвей и анастомоза Блелока–Та-
уссиг используют высокую парастернальную либо
подключичную позицию. Правую легочную арте-
рию на ее протяжении определяют в высокой левой
парастернальной позиции по короткой оси либо су-
прастернальной позиции по короткой оси (рис.
ch46.indd 1191
03.04.2019 12:19:00
1192 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Структура
Оценка
Позиция/метод визуализации
Выходной тракт
правого
желудочка
Аневризма или
обструкция
Парастернальная по длинной оси ВТПЖ и парастернальная по короткой оси
на уровне основания сердца с использованием импульсно-волновой и непре-
рывно-волновой допплерографии для определения локализации и степени
обструкции
Правая передняя косая субкостальная с поворотом датчика против часовой стрелки
на 45° относительно длинной оси для визуализации приточного и отточного
отделов ПЖ
Клапан легоч-
ной артерии
Размер фиброзного
кольца, наличие
остаточной ткани
створок, стеноза
либо регургитации
на клапане легоч-
ной артерии,
оценка кондуита
между ПЖ и легоч-
ной артерией (при
его наличии)
Парастернальная по длинной оси ВТПЖ, парастернальная по короткой оси на
уровне основания сердца, модифицированная апикальная с наклоном датчика
кпереди
Изменение направления потока в ветвях легочного ствола во время диастолы
при оценке регургитации на клапане легочной артерии
Импульсно-волновая и непрерывно-волновая допплерография для оценки макси-
мального и среднего градиентов давления, время полуспада давления, антеградного
диастолического потока при рестриктивных нарушениях ПЖ
Легочный ствол
и его ветви
Диаметр, гипоплазия,
непрерывность,
стенозы, резидуаль-
ные шунты
Парастернальная по короткой оси на уровне основания сердца с фокусировкой
на клапане легочной артерии и бифуркации легочного ствола
Измерения легочного ствола проводят в его среднем отделе во время систолы
Супрастернальная по короткой оси и высокая левая парастернальная для визуализа-
ции легочного ствола и правой легочной артерии, супрастернальная по длинной
оси и высокая левая парастернальная для визуализации левой легочной артерии
Правый
желудочек
Размеры, гипертро-
фия и функция
Субкостальная по длинной оси или парастернальная по длинной оси в М-режиме
либо 2D-режиме, толщина стенки ПЖ > 5 мм во время диастолы соответствует
гипертрофии
Апикальная четырехкамерная, парастернальная по короткой и длинной осям
для оценки размеров и функции приточного и отточного отделов ПЖ
(см. табл. 46.8)
Межжелу-
дочковая
перегородка
Перегрузка объемом
ПЖ (снижение
амплитуды движе-
ния во время диа-
столы), перегрузка
давлением (сниже-
ние амплитуды
движения во время
систолы)
Парастернальная по короткой оси на уровне среднего отдела ЛЖ
Остаточный ДМЖП,
расположение отно-
сительно трикуспи-
дального и аорталь-
ного клапанов
Парастернальная по короткой оси от основания к верхушке, парастернальная по
длинной оси, апикальная четырехкамерная, апикальная пятикамерная с ЦДК кро-
вотока для оценки направления сброса крови и непрерывно-волновой допплеро-
графией для измерения градиента давления в области ДМЖП
При сбросе крови слева направо систолическое давление в ПЖ равно систоличе-
скому давлению в ЛЖ (оценка с помощью манжеты при отсутствии стеноза
ВТЛЖ) минус градиент давления в области ДМЖП
Трикуспидаль-
ный клапан
Степень регургита-
ции и систоличе-
ское давление в ПЖ
Апикальная четырехкамерная, парастернальная по длинной оси для визуализации
приточного отдела ПЖ, парастернальная по короткой оси на уровне основания
сердца и визуализации трикуспидального клапана
Правое
предсердие
Размеры
Апикальная четырехкамерная с верхней границей нормы 18 см2
Нижняя полая
вена
Диаметр и коллапс
на вдохе для оценки
давления в ПП
Субкостальная по длинной оси для измерения диаметра нижней полой вены
в конце выдоха
Межпред-
сердная
перегородка
ДМПП или открытое
овальное окно,
направление
потока, выбухание
межпредсердной
перегородки
Субкостальная по длинной, короткой и «промежуточной» осям, парастернальная
по короткой оси, высокая правая парастернальная
ТАБЛИЦА 46.7 Задачи эхокардиографического исследования при тетраде Фалло
ch46.indd 1192
03.04.2019 12:19:00
1193
46 Аномалии правых отделов сердца
Структура
Оценка
Позиция/метод визуализации
Левый
желудочек
Размеры и функция Апикальная четырехкамерная с тканевой допплерографией латеральной и медиаль-
ной частей фиброзного кольца митрального клапана, апикальная двухкамерная,
апикальная трехкамерная, парастернальная позиция по длинной и короткой осям
Аортальный
клапан
Аортальная
регургитация
Парастернальная по длинной оси, апикальная пятикамерная, апикальная трехкамер-
ная, парастернальная по короткой оси на уровне основания сердца, субкостальная
по короткой оси либо супрастернальная по длинной оси для визуализации нисхо-
дящего отдела аорты и импульсно-волновая допплерография для определения
наличия ретроградного кровотока во время диастолы
Аорта
Дилатации корня
аорты, восходящего
отдела аорты, дуги
аорты, аортолегоч-
ных коллатералей
Парастернальная по длинной оси для оценки корня аорты и диаметра восходящего
отдела аорты, супрастернальная по длинной оси для оценки дуги аорты, супрастер-
нальная по короткой оси для оценки дуги аорты, субкостальная по короткой оси
либо супрастернальная по длинной оси для оценки нисходящего отдела аорты
и импульсно-волновая допплерография для определения наличия ретроградного
кровотока во время диастолы
ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка; ДМЖП — дефект межжелудочковой перего-
родки; ДМПП — дефект межпредсердной перегородки; ЛЖ — левый желудочек; ПЖ — правый желудочек; ПП — правое предсердие;
ЦДК — цветовое допплеровское картирование; ПЛА — правая легочная артерия.
ТАБЛИЦА 46.7
окончание
Задачи эхокардиографического исследования при тетраде Фалло
46.10). Визуализация левой легочной артерии за-
труднена.
РАЗМЕРЫ И ФУНКЦИЯ ПРАВОГО ЖЕЛУДОЧКА
Оценка ПЖ с помощью ЭхоКГ зачастую бывает не-
простой задачей из-за его сложной и вариабельной
геометрии (по сравнению с ЛЖ), а также из-за рас-
положения за грудиной. В силу этих причин наи-
лучшим методом визуализации ПЖ при ТФ счита-
ют МРТ сердца (рис. 46.11) [39, 40]. Тем не менее
ЭхоКГ остается основным методом оценки состоя-
ния ПЖ [5]. Отправной точкой для оценки разме-
ров и функции ПЖ служат критерии нормы, ис-
ключающие ВПС [40, 50]. В табл. 46.8 приведены
параметры и их референсные значения, используе-
мые при обследовании пациентов с ТФ.
При оценке функции ПЖ можно использовать
показатели деформации и скорости деформации
миокарда, но они не относятся к стандартному про-
токолу эхокардиографического исследования при
ВПС, поскольку программное обеспечение позволя-
ет провести такие измерения только для ЛЖ.
Есть небольшое количество исследований, в ко-
торых описан значительный диапазон изменений
продольной деформации миокарда и скорости де-
формации в зависимости от возраста пациента и
ПЖ
ВТПЖ
ЛС
*
Рис. 46.7 A Выходной тракт правого желудочка при тетраде Фалло.
Модифицированная апикальная позиция на уровне выходного тракта правого
желудочка (ВТПЖ) и фиброзного кольца клапана легочной артерии (
*
)сна-
клоном датчика кпереди. Данная позиция обеспечивает идеальные условия
для допплерографии. ЛС —легочный ствол; ПЖ — правый желудочек.
Рис. 46.8 A Тяжелая регургитация на клапане легочной артерии при
тетраде Фалло. Парастернальная позиция по короткой оси на уровне осно-
вания сердца с ЦДК кровотока. Визуализируется тяжелая регургитация на кла-
пане легочной артерии с изменением направления потока в правой легочной
артерии (ПЛА). Обратите внимание, что ширина струи регургитации практиче-
ски равна диаметру фиброзного кольца клапана легочной артерии (
*
). ВТПЖ —
выходной тракт правого желудочка; ЛС — легочный ствол.
ВТПЖ
ЛС
ПЛА
*
ch46.indd 1193
03.04.2019 12:19:00
1194 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Легкая
Умеренная
Тяжелая
ЛБВ
ВПВ
Ао
ЛС
ПЛА
Рис. 46.9 Эхокардиографическая оценка регургитации на клапане легочной артерии. Регургитация на клапане легочной артерии по данным ЦДК кро-
вотока и спектральной допплерографии. Легкая регургитация характеризуется постоянным градиентом давления диастолического потока до конца диастолы, тя-
желая регургитация — ранним уравниванием давления во время диастолы и резким спадом давления (верхний ряд). Обратите внимание на изменение направ-
ления потока в левой легочной артерии во время диастолы (нижний ряд) [Valente AM, Cook S, Festa P, et al. Multimodality imaging guidelines for patients with re-
paired tetralogy of Fallot: a report from the American Society of Echocardiography: developed in collaboration with the Society for Cardiovascular Magnetic Resonance and
the Society for Pediatric Radiology. J Am Soc Echocardiogr 27:111–141 , 2014].
Рис. 46.10 Правая легочная артерия. Супрастернальная позиция по корот-
кой оси. Визуализируется правая легочная артерия (ПЛА) на ее протяжении.
Ао — аорта; ВПВ — верхняя полая вена; ЛБВ — левая безымянная вена;
ЛС — легочный ствол.
степени регургитации на клапане легочной артерии
[51, 52]. Тем не менее максимальная общая дефор-
мация и продольная деформация свободной стенки
ПЖ могут служить маркерами дисфункции желу-
дочка, несмотря на сохранную фракцию выброса
[53], причем продольная деформация миокарда ПЖ
коррелирует с физической работоспособностью па-
циента после коррекции ТФ [54].
При рестриктивных изменениях ПЖ наблюдает-
ся плохая растяжимость (снижение эластичности)
миокарда во время диастолы в результате выражен-
ной гипертрофии ПЖ из-за его постоянной пере-
грузки давлением. К факторам риска относят кор-
рекцию ТФ, проведенную в более старшем возрасте
[55]. Рестриктивные изменения ПЖ могут снижать
степень регургитации на клапане легочной артерии
из-за повышения давления в середине и конце диа-
столы, которое уравнивается с давлением в легоч-
ch46.indd 1194
03.04.2019 12:19:01
1195
46 Аномалии правых отделов сердца
гургитация). Трикуспидальная регургитация также
может возникнуть из-за повреждения трикуспи-
дального клапана заплатой на ДМЖП либо прово-
дником во время катетеризации сердца. Дополни-
тельный поток крови из-за трикуспидальной регур-
гитации усугубляет перегрузку объемом ПЖ, которая
уже есть из-за регургитации на клапане легочной
артерии. Умеренная и тяжелая трикуспидальная ре-
гургитация относится к показаниям класса IIа к
протезированию клапана легочной артерии при на-
личии на нем выраженной регургитации [5].
Оценку степени трикуспидальной регургитации
с помощью ЭхоКГ относят к полуколичественным
методам. Доказано, что струя регургитации шири-
ной > 0,7 см свидетельствует о тяжелой регургита-
ции [58]. Тяжелая трикуспидальная регургитация
ассоциируется с неблагоприятным исходом после
протезирования клапана легочной артерии незави-
ной артерии. При этом в конце диастолы после со-
кращения предсердий может наблюдаться антеград-
ный поток. Рестриктивный ПЖ в конце диастолы
по функции напоминает кондуит между ПП и ле-
гочной артерией во время систолы. Конечно-диа-
столический антеградный поток в норме наблюда-
ется во время вдоха, а при патологии — в течение
всего дыхательного цикла (рис. 46.12). Данные о
взаимосвязи рестриктивных изменений ПЖ с его
размерами и уровнем физической работоспособно-
сти пациента неоднозначные, что, скорее всего, свя-
зано с возрастом пациента и давностью коррекции
ТФ [56, 57].
ТРИКУСПИДАЛЬНАЯ РЕГУРГИТАЦИЯ
У пациентов с ТФ часто наблюдается трикуспидаль-
ная регургитация в результате дилатации ПЖ и
фиброзного кольца клапана (функциональная ре-
Рис. 46.11 A Магнитно-резонансная томография сердца при тетраде Фалло. Визуализация по короткой оси, стоп-кадры с определенным интервалом
времени. Визуализация сердца после коррекции тетрады Фалло. Объем и фракцию выброса правого желудочка рассчитывают после трассировки границы эндо-
карда на каждом срезе в конце систолы и диастолы. Обратите внимание на расширенный правый желудочк и истонченную переднюю стенку правого желудочка
(верхний ряд) в месте пластики.
ch46.indd 1195
03.04.2019 12:19:01
1196 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Параметр
Пороговые значения
(не для ТФ)
Применение показателей при тетраде Фалло
Диаметр основания ПЖ
>4,1см
Конечно-диастолический размер ПЖ, индексированный на
площадь поверхности тела, хорошо коррелирует с данными
МРТ пациентов, которым выполнена коррекция ТФ [112]
Проксимальный диаметр ВТПЖ
в парастернальной позиции
по длинной оси
>3,0см
Фракция изменения площади
< 35%
Фракция изменения площади < 30% с уменьшением фракции
укорочения ВТПЖ < 25% коррелирует с фракцией выброса
ПЖ < 35% согласно данным МРТ взрослых пациентов с ТФ
[113]
Систолическое смещение фиброз-
ного кольца трикуспидального
клапана
<1,7см
Слабая корреляция между систолическим смещением фиброз-
ного кольца трикуспидального клапана и фракцией выброса
ПЖ при ТФ [114, 115]
Максимальная скорость S
(импульсно-волновая
допплерография)
< 9,5 см/сек
Показатель может быть неточным. Лучшая корреляция отмеча-
ется между скоростью S при импульсно-волновой допплеро-
графии и глобальной фракцией выброса ПЖ у пациентов,
имеющих фракцию выброса ≥ 30% в отточном отделе [116,
117]
Максимальная скорость S
(цветовая допплерография)
< 6,0 см/сек
Данных о применении цветовой тканевой допплерографии
для оценки фракции выброса ПЖ при ТФ немного [118]
Индекс Tei (импульсно-волновая
допплерография)
> 0,43
Противоречивые данные о точности и клиническом использова-
нии индекса Tei для оценки функции ПЖ при ТФ [119, 120]
Индекс Tei (тканевая
допплерография)
> 0,54
Противоречивые данные о точности и клиническом использова-
нии индекса Tei для оценки функции ПЖ при ТФ [119, 120]
Фракция выброса ПЖ по данным
3D-ЭхоКГ
< 45%
При оценке объема и функции ПЖ с помощью ЭхоКГ
в 3D-режиме возможно занижение показателей по сравнению
с МРТ, особенно у пациентов с большим ПЖ [121–123]
ВТПЖ — выходной тракт правого желудочка; МРТ — магнитно -резонансная томография; ПЖ — правый желудочек; ТФ — тетрада Фалло;
ЭхоКГ — эхокардиография.
[Portnoy SG, Rudski LG. Echocardiographic evaluation of the right ventricle: a 2014 perspective. Curr Cardiol Rep 17:21, 2015.]
[Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the
American Society of Echocardiography and the European Association of Cardiovascular Imaging, J Am Soc Echocardiogr 28:1–39, 2015.]
ТАБЛИЦА 46.8 Параметры правого желудочка в нормальном сердце, применяемые при диагностике тетрады Фалло
симо от степени трикуспидальной регургитации
после операции [59].
ЛЕВЫЕ ОТДЕЛЫ СЕРДЦА ПРИ ТЕТРАДЕ ФАЛЛО
Оценка левых отделов сердца является частью стан-
дартного протокола эхокардиографического иссле-
дования взрослых пациентов с ТФ. Согласно дан-
ным одного исследования, систолическая дисфунк-
ция ЛЖ определяется примерно у 20% пациентов с
ТФ [60]. На развитие дисфункции ЛЖ влияют такие
факторы, как взаимозависимость желудочков, позд-
ний срок радикальной коррекции порока, гипоксия
тканей, перегрузка объемом и фиброз миокарда
[60–62]. Под взаимозависимостью желудочков пони-
мают физические силы, которые передаются от од-
ного желудочка к другому по общим анатомиче-
ским структурам — мышечным волокнам, межже-
лудочковой перегородке и перикарду. Например,
при ТФ фракция выброса ПЖ коррелирует с фрак-
*
*
*
Рис. 46.12 Рестриктивный правый желудочек. Импульсно-волновая доп-
плерография потока в легочном стволе отражает антеградный кровоток во вре-
мя диастолы при сокращении предсердий (стрелки). Обратите внимание на
проекцию зубца Р (*) на электрокардиограмме.
ch46.indd 1196
03.04.2019 12:19:02
1197
46 Аномалии правых отделов сердца
цией выброса ЛЖ [63]. Другим примером является
дилатация ПЖ из-за перегрузки объемом при нали-
чии регургитации на клапане легочной артерии.
При этом ухудшается наполнение ЛЖ во время ди-
астолы, что не сказывается на систолической функ-
ции, но приводит к снижению фракции выброса
ЛЖ. Аномальная вращательная механика ЛЖ (на-
рушение скручивания и осевого вращения) связана
с дилатацией ПЖ и дисфункцией обоих желудочков
и объясняет влияние размеров ПЖ на наполнение
ЛЖ [64, 65]. Сниженная функция ЛЖ выступает
фактором риска внезапной смерти [66, 67]. Такие
эхокардиографические показатели эффективной
работы ЛЖ, как продольная деформация и систоли-
ческое смещение фиброзного кольца митрального
клапана, также связаны с риском возникновения
аритмии у взрослых с ТФ [68].
Примерно у 50% пациентов с ТФ может отме-
чаться расширение восходящего отдела аорты и ее
корня (в зависимости от используемых диагности-
ческих критериев) [69, 70]. Для ТФ характерна ди-
латация корня аорты с нормализацией ее диаметра
в восходящем отделе. В одном исследовании было
отмечено, что умеренное расширение корня аор-
ты — частое проявление ТФ, выраженная дилата-
ция наблюдается редко. Из 474 пациентов 29% име-
ли, по данным ЭхоКГ, диаметр корня аорты > 4 см,
но только у 2% диаметр превышал 5 см [70]. Уме-
ренная аортальная регургитация наблюдается у
12,5% пациентов с ТФ [69]. К факторам риска отно-
сят старший возраст, мужской пол и делецию 22q11
[70, 71]. Хирургическое вмешательство [72, 73] при
расширении аорты показано в случае увеличения
корня аорты > 5,5 см, но каждый случай должен рас-
сматриваться индивидуально. На данный момент в
литературе описано всего 4 наблюдения расслаива-
ющей аневризмы аорты при ТФ, следовательно,
риск этого осложнения невелик [74–77].
РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ И НАБЛЮДЕНИЕ
ПОСЛЕ КОРРЕКЦИИ ТЕТРАДЫ ФАЛЛО
Отдаленная выживаемость после радикальной кор-
рекции составляет 86% (период наблюдения до 40
лет) [35, 78, 79]. Однако количество осложнений
остается значительным: практически 50% пациен-
тов нужно повторное вмешательство, причем в боль-
шинстве случаев — протезирование клапана легоч-
ной артерии [79]. Размеры и функция ПЖ при на-
личии регургитации на клапане легочной артерии
не только определяют прогноз после коррекции ТФ,
но и помогают определить показания к протезиро-
ванию клапана. Оптимальный метод оценки поро-
говых значений параметров ПЖ (указывающих на
необходимость протезирования клапана) — МРТ.
На данный момент четких критериев нет, но описа-
ны пороговые значения у бессимптомных пациен-
тов при оценке с помощью МРТ [80]:
•
индекс конечно-диастолического объема
ПЖ > 150 мл/м2;
•
отношение конечно-диастолического объема
ПЖ к конечно-диастолическому объему ЛЖ
>2;
•
индекс конечно-систолического объема
ПЖ > 80 мл/м2;
•
фракция выброса ПЖ < 47%;
•
фракция выброса ЛЖ < 55%.
Транскатетерное протезирование клапана легоч-
ной артерии показано пациентам с кондуитом меж-
ду ПЖ и легочной артерией, а также тем, у которых
диаметр ВТПЖ < 22 мм без предшествующей транс-
аннулярной пластики заплатой. В 2010 г. был разра-
ботан протез клапана легочной артерии Medtronic
Melody (Medtronic Inc, Minneapolis, MN) для транс-
катетерной имплантации, а в 2015 г. получено одоб-
рение FDA на его клиническое использование. Сте-
пень уменьшения объема регургитации и объема
ПЖ после транскатетерной имплантации сопоста-
вимы с таковой при открытом хирургическом лече-
нии, однако прямого сравнения двух методов в ран-
домизированных контролируемых исследованиях
не проводили [81, 82]. Повторное оперативное вме-
шательство после транскатетерной имплантации
протеза Medtronic Melody не понадобилось в тече-
ние 5 лет 95% пациентов [83]. На данный момент
есть предварительные данные об эффективности и
безопасности нового протеза Edwards Sapien (Ed-
wards Lifesciences LLC, Irvine, CA) с максимальным
размером 26 мм для имплантации в позицию кла-
пана легочной артерии [84].
Рекомендации относительно показаний к хирур-
гическому лечению остаточных нарушений после ра-
дикальной коррекции ТФ приведены в табл. 46.9 [5].
АНОМАЛИЯ ЭБШТЕЙНА
МОРФОЛОГИЯ
Аномалия Эбштейна трикуспидального клапана —
редкая патология (частота 5,2 случая на 100 000 жи-
ворожденных детей, что составляет < 1% всех ВПС)
[85]. В большинстве наблюдений заболевание спо-
радическое, однако описано влияние генетических,
репродуктивных и экзогенных факторов, включая
прием беременной женщиной препаратов лития
[85, 86]. Порок характеризуется сращением перего-
родочной и задней створок трикуспидального кла-
пана с миокардом ПЖ из-за нарушения их расхож-
дения во время эмбриогенеза, что приводит к сме-
щению линии прикрепления створок [87]. Передняя
створка может быть избыточной длины, иметь пер-
форации, аномальные хорды, но не смещаться (рис.
46.13) [88]. При аномалии Эбштейна происходит
ротационное, направленное вправо и вперед, сме-
щение фиброзного кольца клапана к ВТПЖ (рис.
46.14) [89]. При этом ПЖ анатомически делится на
ch46.indd 1197
03.04.2019 12:19:02
1198 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
диагностируют у плода и в неонатальном периоде,
более легкие формы могут быть обнаружены даже
у взрослых [96]. Патология может протекать бес-
симптомно либо с признаками правожелудочковой
недостаточности, аритмией, парадоксальной эмбо-
лией, также возможна внезапная смерть [91]. При
осмотре может отмечаться цианоз из-за сброса кро-
ви справа налево на уровне предсердий. Во время
аускультации определяется голосистолический шум
из-за трикуспидальной регургитации. Первый тон
сердца громкий, расщепленный, с отсроченным
компонентом Т1. Второй тон сердца также может
иметь расщепление. Из-за движения удлиненной
передней створки возникают систолические щелч-
ки. Несмотря на наличие тяжелой трикуспидальной
регургитации, пульсовой кровоток в яремных ве-
нах отличается отсутствием V-волны из-за эффекта
демпфирования расширенным эластичным ПП.
ЭХОКАРДИОГРАФИЯ ПРИ АНОМАЛИИ ЭБШТЕЙНА
Основным методом диагностики аномалии Эбштей-
на является ЭхоКГ. На основании ее данных осу-
ществляется планирование операции. ЭхоКГ также
проводят интраоперационно. Морфология клапана
атриализованную часть и функционирующую часть.
При тяжелых вариантах аномалии Эбштейна функ-
ционирующая часть ПЖ может быть представлена
только отточным отделом. Фиброзное кольцо три-
куспидального клапана расширено, отмечаются три-
куспидальная регургитация различной степени и
иногда клапанный стеноз либо отсутствие отвер-
стия [90].
Болезни, которые сопутствуют аномалии Эбштей-
на, перечислены в табл. 46.10 [91]. Данная аномалия
иногда наблюдается у пациентов с ТФ и атрезией ле-
гочной артерии с интактной межжелудочковой пе-
регородкой. Артериальный атриовентрикулярный
клапан при врожденной корригированной транспо-
зиции магистральных сосудов соответствует крите-
риям анатомии аномалии Эбштейна в 50% случаев
[92]. При аномалии Эбштейна часто наблюдается
блокада правой ножки пучка Гиса, а у 18–44% паци-
ентов описывают синдром преждевременного воз-
буждения желудочков [93–95].
КЛИНИЧЕСКАЯ КАРТИНА И ОСМОТР ПАЦИЕНТОВ
Выраженность аномалии Эбштейна может широко
варьировать. Тяжелые формы аномалии Эбштейна
Класс
Показания
Уровень
доказательности
Класс I Протезирование клапана легочной артерии показано при наличии тяжелой регургитации
и симптомов снижения толерантности к физической нагрузке
B
Класс IIa Протезирование клапана рекомендуется взрослым пациентам с ТФ, имеющим тяжелую
регургитацию на клапане легочной артерии и одно из следующих состояний:
• Средняя либо тяжелая дисфункция ПЖ
B
• Средняя либо тяжелая дилатация ПЖ
B
• Симптомная или постоянная предсердная и/или желудочковая аритмия
C
• Средняя либо тяжелая трикуспидальная регургитация
C
Хирургическое лечение рекомендуется взрослым пациентам, которым ранее была выполнена
коррекция ТФ и есть остаточная обструкция ВТПЖ и одно из следующих состояний:
• Остаточная обструкция ВТПЖ (клапанная либо подклапанная) с максимальным
мгновенным градиентом давления > 50 мм рт. ст .
C
• Остаточная обструкция ВТПЖ (клапанная либо подклапанная) с отношением давления
вПЖкдавлениювЛЖ>0,7
C
• Остаточная обструкция ВТПЖ (клапанная либо подклапанная) с прогрессирующей
и/или тяжелой дилатацией ПЖ с его дисфункцией
C
• Остаточный сброс крови слева направо > 1,5 через ДМЖП
B
• Тяжелая аортальная регургитация с симптомами умеренной или тяжелой дисфункции ЛЖ C
• Множественные остаточные нарушения (ДМЖП, обструкция ВТПЖ),
приводящие к расширению ПЖ либо снижению его функции
C
ВТПЖ — выходной тракт правого желудочка; ДМЖП — дефект межжелудочковой перегородки; ЛЖ — левый желудочек; ПЖ — правый
желудочек; ТФ — тетрада Фалло.
[Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 guidelines for the management of adults with congenital heart disease: executive sum-
mary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to devel-
op guidelines for the management of adults with congenital heart disease). Circulation 118:2395–2451, 2008.]
ТАБЛИЦА 46.9 Рекомендации ACC/AHA по хирургическому лечению остаточных нарушений
после радикальной коррекции тетрады Фалло
ch46.indd 1198
03.04.2019 12:19:02
1199
46 Аномалии правых отделов сердца
Нормальное положение
трикуспидального
клапана
Типичное положение
трикуспидального
клапана при аномалии
Эбштейна
Направление ротационного движения фиброзного кольца трикуспидального клапана
Рис. 46.14 Анатомические варианты аномалии Эбштейна. Schreiber и соавт. изучили 23 анатомических препарата сердца с аномалией Эбштейна и описа-
ли различное ротационное движение фиброзного кольца трикуспидального клапана [88]. Зеленые эллипсы обозначают варианты углов наклона эффективного
отверстия клапана, а длинная ось эллипсов отражает максимальную ширину отверстия клапана как процент расстояния между атриовентрикулярным соединени-
ем и верхушкой ПЖ, измеренного вдоль острого края сердца [Martinez RM, O ’Leary PW, Anderson RH. Anatomy and echocardiography of the normal and abnormal tri-
cuspid valve. Cardiol Young 16 Suppl 3:4–11 , 2006].
Рис. 46.13 Аномалия Эбштейна. (А) Трикуспидальный клапан (вид снизу). (Б, В) Трикуспидальный клапан развернут, чтобы показать створки в одной проек-
ции. (Б) В норме все створки трикуспидального клапана находятся на одной линии. (В) При аномалии Эбштейна наблюдается смещение перегородочной и задней
створок трикуспидального клапана от центра сердца и схожее смещение перегородочной и задней створок артериального атриовентрикулярного клапана. ПП —
правое предсердие [Anderson KR, Zuberbuhler JR, Anderson RH, et al. Morphologic spectrum of Ebstein’s anomaly of the heart: a review. Mayo Clin Proc 54:174–180,
1979].
Задняя
створка
П
е
р
е
г
о
р
о
д
о
ч
н
а
я
с
т
в
о
р
к
а
ПП
Центр сердца
*
Передняя
створка
Медиальная
сухожильная
хорда
Передняя
створка
Центр сердца
Задняя
створка
Перегородочная
створка
*
А
Б
В
Переднелатеральная
папиллярная мышца
Медиальная
сухожильная
хорда
Передняя
створка
Задняя створка
Перегородочная
створка
Центр сердца
*
ch46.indd 1199
03.04.2019 12:19:02
1200 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Порок
Частота
Шунт на уровне предсердий (открытое
овальное окно либо дефект межпред-
сердной перегородки)
50–89% [93–95]
Дефект межжелудочковой перегородки 3% [94]
Стеноз трикуспидального клапана
Обструкция выходного тракта правого
желудочка (функциональная либо
анатомическая атрезия клапана легоч-
ной артерии)
6% [93]
Пролапс митрального клапана: расщеп-
ление створки, парашютообразный
митральный клапан, митральный
клапан с двойным отверстием
13% [94]
Двухстворчатый аортальный клапан
5% [94]
Нарушения левого желудочка (синдром
некомпактного миокарда, систоличе-
ская и диастолическая дисфункции)
2% [94]
Частичный аномальный дренаж
легочных вен
2% [93]
[Arya P, Beroukhim R. Ebstein anomaly: assessment, management, and
timing of intervention. Curr Treat Options Cardiovasc Med 16:338,
2014.]
ТАБЛИЦА 46.10 Сопутствующие врожденные пороки
сердца при аномалии Эбштейна
и тяжесть порока являются прогностическими кри-
териями физической работоспособности пациента
и летального исхода [96–98]. Задачи эхокардиогра-
фического исследования при аномалии Эбштейна
перечислены в табл. 46.11 [91, 99].
В четырехкамерной позиции смещение перего-
родочной створки к верхушке (относительно перед-
ней створки митрального клапана) более чем на
8 мм/м2 свидетельствует о наличии аномалии Эб-
штейна (рис. 46.15) [97]. Перегородочная створка
может быть гипоплазирована и иметь ограничен-
ную подвижность из-за укорочения сухожильных
хорд. При визуализации приточного отдела ПЖ
видны передняя и задняя створки, а также точки их
прикрепления. Парусообразное движение передней
створки хорошо видно в парастернальной позиции
по короткой оси. При адекватной акустической до-
ступности в субкостальной позиции по короткой
оси видны дистальное прикрепление передней створ-
ки, ее фенестрация и обструкция ВТПЖ. Единствен-
ная позиция трансторакальной ЭхоКГ, когда могут
быть видны все три створки, — субкостальная по-
зиция с поворотом датчика на 30–45° относительно
субкостальной позиции по длинной оси (рис. 46.16).
Чреспищеводная ЭхоКГ в трансгастральной пози-
ции по короткой оси обеспечивает отличную ви-
зуализацию подклапанного пространства, включая
сухожильные хорды и папиллярные мышцы [89].
Прогностическими критериями, которые корре-
лируют с тяжестью патологии, являются размеры и
функция ПЖ. При выраженном смещении фиброз-
ного кольца трикуспидального клапана атриализо-
ванная часть ПЖ увеличивается, а функционирую-
щая часть ПЖ уменьшается.
Тяжесть аномалии Эбштейна описывают как от-
ношение площади функционирующей части ПЖ к
площади ПП, суммированной с площадью атриа-
лизованной части ПЖ. Чем больше атриализован-
ная часть ПЖ либо чем меньше отношение (< 35%),
тем хуже прогноз [96, 97].
Во время ЭхоКГ бывает сложно оценить ЛЖ при
аномалии Эбштейна из-за изменения геометрии ЛЖ,
что обусловлено взаимозависимостью желудочков
[99]. Может отмечаться парадоксальное движение
межжелудочковой перегородки, что уменьшает диа-
столическое наполнение ЛЖ. Межжелудочковая пе-
регородка выбухает в полость ЛЖ, в результате это-
го форма полости ЛЖ становится похожа на полуме-
сяц. По этой причине нужна качественная или
полуколичественная оценка систолической функции
ЛЖ с использованием фракции укорочения [99].
Визуализация аномалии Эбштейна с помощью
трансторакальной ЭхоКГ в 2D-режиме ограничена
тем, что в стандартных позициях видны только две
створки трикуспидального клапана из трех. Также
могут возникать затруднения при оценке анатомии
его комиссур. ЭхоКГ в 3D-режиме позволяет опре-
делить морфологию трикуспидального клапана, а
также степень смещения его фиброзного кольца в
направлении ВТПЖ [100, 101]. Дополнительным
методом визуализации сердца с аномалией Эбштей-
на, особенно при плохой акустической доступности,
является МРТ [102]. МРТ помогает определить ана-
томию клапана и наилучшим образом визуализи-
ровать заднюю створку [102]. С помощью МРТ так-
же можно определить размеры и функцию ПЖ,
трикуспидальную регургитацию и сброс крови че-
рез шунт на уровне предсердий. МРТ позволяет
оценить структуру ткани сердца, включая визуали-
зацию с отсроченным усилением и верификацию
некомпактного миокарда ПЖ.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
Показания к хирургической коррекции представле-
ны в табл. 46.12, однако оптимальные сроки прове-
дения оперативного вмешательства следует опреде-
лять с учетом индивидуальных особенностей паци-
ента.
Операция заключается в пластике либо протези-
ровании трикуспидального клапана для снижения
степени трикуспидальной регургитации, закрытии
шунта на уровне предсердий (при его наличии), хи-
рургической аблации аритмогенных очагов и при
возможности пликации ПЖ [103]. Предпочтитель-
нее выполнять пластику трикуспидального клапана
в случае подходящей анатомии. Пластику должен
проводить хирург с большим опытом лечения ВПС
[5]. Технику вальвулопластики совершенствовали
ch46.indd 1200
03.04.2019 12:19:03
1201
46 Аномалии правых отделов сердца
Структура
Оценка
Позиция/метод визуализации
Трикуспидальный клапан
Анатомия, размер фиброзного кольца
для планирования оперативного
вмешательства
Апикальная четырехкамерная, парастернальная
по длинной оси
Перегородочная и задняя створки:
смещение перегородочной створки,
утолщение, дисплазия, подтягивание
сухожильных хорд, отсутствие пере-
городочной створки при тяжелой
аномалии Эбштейна [125]
Смещение перегородочной створки > 8 мм/м2 визуали-
зируется в апикальной четырехкамерной позиции
и в парастернальной позиции по короткой оси
Задняя створка видна в парастернальной позиции
Передняя створка: удлинение или
избыточность ткани, подвижность,
подтягивание к свободной стенке,
наличие аномальных сухожильных
хорд, обструкция ВТПЖ, фенестра-
ции, смещение (редко) [97]
Апикальная четырехкамерная, парастернальная
по короткой оси. Прикрепление к ВТПЖ видно
в парастернальной позиции ВТПЖ
Объем регургитации, локализация,
патология створок, сухожильных
хорд, vena contracta, систолическое
давление в ПЖ (при тяжелой регур-
гитации обычно недооценивают)
Апикальная четырехкамерная, парастернальная по
длинной оси для визуализации приточного отдела
ПЖ и парастернальная по короткой оси на уровне
основания сердца для визуализации трикуспидаль-
ного клапана
Смыкание створок, эффективная
площадь отверстия регургитации,
ориентация отверстия клапана на
верхушку либо ВТПЖ
Левая передняя косая субкостальная либо субкосталь-
ная с поворотом датчика на 30–45° относительно
субкостальной позиции по длинной оси
Правое предсердие
Анатомическое правое предсердие
и атриализованная часть ПЖ
Апикальная четырехкамерная, парастернальная
по короткой оси
Правый желудочек
Анатомический и физиологический
размеры, функция
Апикальная четырехкамерная, парастернальная
по короткой оси, парастернальная по длинной оси
для визуализации приточного и отточного отделов
ПЖ
Выходной тракт правого
желудочка, клапан легоч-
ной артерии
Обструкция ВТПЖ либо клапанный
стеноз легочной артерии
Парастернальная по длинной оси для визуализации
отточного отдела ПЖ, парастернальная по короткой
оси на уровне основания сердца с фокусировкой
на клапане легочной артерии и бифуркации легоч-
ного ствола
Нижняя полая вена
Диаметр и коллабирование на вдохе
для оценки давления в ПП
Субкостальная по длинной оси для измерения
диаметра НПВ в конце выдоха
Межпредсердная
перегородка
ДМПП либо открытое овальное окно,
локализация и направление сброса
крови, выбухание межпредсердной
перегородки
Субкостальная по длинной, короткой и «промежуточ-
ной» осям, парастернальная по короткой оси, высокая
правая парастернальная
Межжелудочковая
перегородка
ДМЖП, парадоксальное движение
Парастернальная по короткой оси от основания до вер-
хушки ЛЖ, парастернальная по длинной оси, апи-
кальная четырехкамерная позиция и переход на пяти-
камерную с ЦДК кровотока для оценки направления
потока, парастернальная по короткой оси для оценки
парадоксального движения перегородки, септальная
для оценки систолического давления в ПЖ
Левый желудочек
Некомпактный миокард, систоличе-
ская и диастолическая функции
Апикальная четырехкамерная, двухкамерная и трехка-
мерная, парастернальная по длинной и короткой осям
ВТПЖ — выходной тракт правого желудочка; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной пере-
городки; ЛЖ — левый желудочек; НПВ — нижняя полая вена; ПЖ — правый желудочек; ПП — правое предсердие; ЦДК — цветовое
допплеровское картирование.
ТАБЛИЦА 46.11 Задачи эхокардиографического исследования при аномалии Эбштейна
ch46.indd 1201
03.04.2019 12:19:03
1202 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
последние 30 лет. Во время вмешательства умень-
шают размер фиброзного кольца (с аннулопласти-
кой опорным кольцом либо без нее), перемещают
ткани створок для улучшения их коаптации, умень-
шают размеры ПП и атриализованной части ПЖ.
Конусная реконструкция, впервые выполненная
da Silva, представляет собой технически сложную
операцию, в ходе которой создается новый клапан
в форме конуса. Конусная реконструкция имеет от-
личные кратко- и долгосрочные результаты (рис.
46.17) [93, 104]. Другие операции представляют со-
бой пластику одной створки или протезирование
клапана биологическим протезом.
При выраженной дилатации ПЖ, низком сердеч-
ном выбросе и при наличии антеградного кровото-
ка по легочному стволу может понадобиться фор-
мирование двунаправленного кавопульмонального
анастомоза, при котором верхнюю полую вену со-
единяют с ветвью легочного ствола на той же сто-
роне для разгрузки ПЖ. Данное вмешательство но-
сит название «полуторажелудочковая коррекция».
Решающее значение при планировании опера-
тивного вмешательства имеет детальная эхокардио-
графическая оценка аномалии Эбштейна. Иногда
для этого необходимо проведение чреспищеводной
ЭхоКГ. С анатомической точки зрения успешность
хирургической коррекции определяется подвижно-
стью передней створки с наличием у нее свободно-
го края [103]. Пациенты с мышечной передней створ-
кой или гипоплазированной либо отсутствующей
перегородочной створкой не подходят для конус-
ной реконструкции. Также затрудняет коррекцию
наличие нескольких потоков трикуспидальной ре-
гургитации, мышечные мостики, ориентация при-
точного отдела кпереди от отточного отдела [89].
Операции, уменьшающие трикуспидальную ре-
гургитацию, позволяют увеличить толерантность к
Рис. 46.16 Трикуспидальный клапан пациента с аномалией Эбштейна.
(А) A Парастернальная позиция по длинной оси приточного отдела правого
желудочка (ПЖ). Визуализируются передняя створка (ПС) и задняя створка
(ЗС) трикуспидального клапана. (Б) A Парастернальная позиция по длинной
оси приточного отдела правого желудочка. ЦДК кровотока демонстрирует тя-
желую трикуспидальную регургитацию. (В) A Субкостальная позиция. Видны
утолщенная перегородочная створка (
*
), аномальная задняя створка и перед-
няя створка. Обратите внимание на большой дефект смыкания в центре. КС —
коронарный синус; ЛЖ — левый желудочек; ПП — правое предсердие.
физическим нагрузкам [105]. После вмешательства
также может улучшаться систолическая функция
ЛЖ [105, 106]. Есть отдаленные результаты с хоро-
шей выживаемостью и функциональным статусом
после коррекции аномалии Эбштейна, однако даже
после лечения пациенты жалуются на утомляе-
мость, одышку и предсердную аритмию [107].
ПЖ
ПС
ЗС
ЛЖ
*
А
Б
В
ПЖ
ПС
ПП
ПЖ ПС
ЗС
ПП
КС
ПП
ЛП
ЛЖ
ПЖ
Рис. 46.15 A Трикуспидальный клапан пациента с аномалией Эбштей-
на. Апикальная четырехкамерная позиция. Визуализируется смещение пере-
городочной створки трикуспидального клапана (стрелка) к верхушке. Отмеча-
ется эффект подтягивания перегородочной створки и избыточность передней
створки. ЛЖ
—
левый желудочек; ЛП — левое предсердие; ПЖ — правый
желудочек; ПП — правое предсердие.
ch46.indd 1202
03.04.2019 12:19:03
1203
46 Аномалии правых отделов сердца
Класс
Показания
Уровень
доказательности
Класс I
У пациентов с аномалией Эбштейна пластику либо протезирование трикуспидального
клапана с закрытием дефекта межпредсердной перегородки (при его наличии) проводят
при наличии одного из следующих состояний:
• Снижение толерантности к физической нагрузке
B
• Цианоз (уровень сатурации < 90%)
B
• Парадоксальная эмболия в анамнезе
B
• Прогрессирующая кардиомегалия на рентгеновском снимке грудной клетки
B
• Прогрессирующая дилатация правого желудочка либо снижение его систолической
функции
B
Одновременное хирургическое лечение аритмии у пациентов с аномалией Эбштейна прово-
дят при наличии одного из следующих состояний:
• Возникновение/прогрессирование предсердной и/или желудочковой аритмии, которые
невозможно вылечить транскатетерными методами
B
• Неэффективное катетерное вмешательство по поводу синдрома преждевременного воз-
буждения желудочков
B
У взрослых пациентов с аномалией Эбштейна хирургическая коррекция
либо протезирование трикуспидального клапана рекомендуется при наличии одного из сле-
дующих состояний:
• Наличие симптомов, снижение толерантности к физической нагрузке
либо функциональный класс III или IV по NYHA
B
• Тяжелая трикуспидальная регургитация после коррекции с прогрессирующей дилатацией
правого желудочка, снижением систолической функции правого желудочка, возникнове-
нием/прогрессированием предсердной и/или желудочковой аритмии
B
• Дисфункция биологического протеза трикуспидального клапана
с наличием регургитации и стеноза
B
• Преобладание стеноза биологического протеза трикуспидального клапана (средний гради-
ент давления > 12–15 мм рт. ст.) над трикуспидальной регургитацией
B
• Оперативное вмешательство в более ранние сроки следует рассматривать
при меньшей степени стеноза биологического протеза трикуспидального клапана
в случае симптомов снижения толерантности к физической нагрузке
B
[Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 Guidelines for the Management of Adults with Congenital Heart Disease: Executive
Summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to
develop guidelines for the management of adults with congenital heart disease). Circulation 118:2395–2451, 2008.]
ТАБЛИЦА 46.12 Рекомендации ACC/AHA по хирургической коррекции аномалии Эбштейна
Рис. 46.17 Магнитно-резонансная томография сердца пациента с аномалией Эбштейна. (А) A Вид по короткой оси до операции. (Б) A Вид по корот-
кой оси после конусной реконструкции.
А
Б
ch46.indd 1203
03.04.2019 12:19:04
1204 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Структура
Оценка
Позиция/метод визуализации
Правое предсердие Верхняя граница нормы 18 см2 или 25 ±
7мл/м2умужчини21±6мл/м2уженщин
Анатомическое правое предсердие и атриали-
зованная часть ПЖ при аномалии Эбштейна
Апикальная четырехкамерная
Трикуспидальный
клапан
Смещение перегородочной створки > 8 мм/м2
в апикальной четырехкамерной позиции
свидетельствует об аномалии Эбштейна
Патология створок и сухожильных хорд, ано-
малии их прикрепления
Изменение положения перегородочной
створки из-за заплаты, закрывающей дефект
межжелудочковой перегородки
Апикальная четырехкамерная для визуализации перего-
родочной и передней створок, парастернальная по
длинной оси для визуализации приточного отдела ПЖ,
передней и задней створок, парастернальная по корот-
кой оси на уровне основания сердца для визуализации
передней и перегородочной створок, левая передняя
косая субкостальная или субкостальная с поворотом
датчика на 30–45° относительно субкостальной
позиции по длинной оси для визуализации всех трех
створок
Площадь струи регургитации > 10 см2
и ширина vena contracta > 0,7 см свидетель-
ствуют о тяжелой трикуспидальной
регургитации
Расширение фиброзного кольца клапана,
размеры ПП, снижение амплитуды движе-
ния межжелудочковой перегородки во время
диастолы, эффективная площадь отверстия
клапана
Оценка систолического давления в ПЖ
Апикальная четырехкамерная, парастернальная
по длинной оси для визуализации приточного отдела
ПЖ, парастернальная по короткой оси на уровне осно-
вания сердца с фокусировкой на трикуспидальном
клапане, левая передняя косая субкостальная или суб-
костальная с поворотом датчика на 30–45° относи-
тельно субкостальной позиции по длинной оси
Правый желудочек Гипертрофия и размеры: толщина стенки
ПЖ > 5 мм во время диастолы свидетель-
ствует о гипертрофии; диаметр основания
ПЖ > 4,1 см и проксимальный диаметр
ВТПЖ > 3,0 см являются признаками врож-
денной патологии ПЖ
Субкостальная по длинной оси или парастернальная
по длинной оси в М-режиме либо 2D-режиме
для оценки гипертрофии
Апикальная четырехкамерная, парастернальная
по короткой оси, парастернальная по длинной оси
для визуализации приточного и отточного отделов ПЖ
Функция: фракция изменения площади,
систолическое смещение фиброзного кольца
трикуспидального клапана, индекс Tei
Апикальная четырехкамерная, парастернальная
по короткой оси, парастернальная по длинной оси
для визуализации приточного и отточного отделов ПЖ
Тканевая допплерография
ЭхоКГ в 3D-режиме (ограниченное применение)
для оценки функции ПЖ при тетраде Фалло
Правый желудочек ВТПЖ: оценка анатомии и степени обструк-
ции из-за мембраны, мышечных пучков,
мест прикрепления сухожильных хорд
Акинезия передней стенки отточного отдела
ПЖ или трансаннулярная пластика заплатой
Аневризма ВТПЖ с эхо-негативной зоной
Парастернальная по длинной оси ВТПЖ, парастерналь-
ная по короткой оси на уровне основания сердца,
правая передняя косая субкостальная с поворотом
датчика против часовой стрелки на 45° для визуализа-
ции приточного и отточного отделов ПЖ
Клапан легочной
артерии
Оценка морфологии, включая куполообраз-
ную форму створок во время систолы, гипо-
плазию либо дисплазию створок и их
подвижность
Размер фиброзного кольца клапана легочной
артерии в норме 17–26 мм
Парастернальная по длинной оси ВТПЖ, парастерналь-
ная по короткой оси на уровне основания сердца,
высокая правая парастернальная позиция
Функция: максимальный градиент скорости
кровотока > 4 м/сек по данным допплеро-
графии, средний градиент давления > 40 мм
рт. ст. по данным допплерографии, систоли-
ческое давление в ПЖ ≥ 75% систолического
давления в ЛЖ указывают на тяжелый кла-
панный стеноз легочной артерии
Ширина струи регургитации > 70% размера
фиброзного кольца, изменение направления
потока крови в ветвях легочного ствола,
PHT < 100 мсек указывают на наличие
регургитации на клапане легочной артерии
Парастернальная по короткой оси на уровне основания
сердца, модифицированная апикальная с наклоном
датчика кпереди
СВОДНАЯ ИНФОРМАЦИЯ
Врожденные аномалии правых отделов сердца
ch46.indd 1204
03.04.2019 12:19:04
1205
46 Аномалии правых отделов сердца
Структура
Оценка
Позиция/метод визуализации
Легочный ствол
и его ветви
Оценка диаметра, гипоплазии, непрерывно-
сти, стеноза. Легочный ствол измеряют от
центральной точки во время систолы
Оценка потоков через резидуальные шунты
Парастернальная по короткой оси на уровне основания
сердца для визуализации клапана легочной артерии
и бифуркации легочного ствола, супрастернальная
по короткой оси и высокая левая парастернальная
для визуализации легочного ствола и правой легочной
артерии, супрастернальная по длинной оси и высокая
левая парастернальная для визуализации левой легоч-
ной артерии
Межжелудочковая
перегородка
Оценка остаточного ДМЖП либо не подверг-
шегося коррекции: локализация, расположе-
ние относительно трикуспидального и аор-
тального клапанов, клапана легочной
артерии, отточного отдела ПЖ
Парастернальная по короткой оси от основания
к верхушке ЛЖ, парастернальная по длинной оси,
апикальная четырехкамерная с переходом
на пятикамерную
ЦДК кровотока для оценки направления потока и непре-
рывно-волновая допплерография для измерения гра-
диента давления на перегородке
При сбросе крови слева направо систолическое давление
в ПЖ равно систолическому давлению в ЛЖ (оценка
с помощью манжеты при отсутствии стеноза ВТЛЖ)
минус максимальный градиент давления
на перегородке
Нижняя полая вена Диаметр в конце выдоха и коллабирование
на вдохе для оценки давления в ПП
Субкостальная по длинной оси для измерения диаметра
НПВ в конце выдоха
Межпредсердная
перегородка
ДМПП или открытое овальное окно, выбуха-
ние межпредсердной перегородки
Субкостальная по длинной, короткой и «промежуточ-
ной» осям, парастернальная по короткой оси, высокая
правая парастернальная
PHT — время полуспада давления; ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка; ДМЖП —
дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки; ЛЖ — левый желудочек; НПВ — нижняя полая
вена; ПП — правое предсердие; ЦДК — цветовое допплеровское картирование; ЭхоКГ — эхокардиография.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Врожденные аномалии правых отделов сердца
ЛИТЕРАТУРА
1. Prieto LR, Latson LA. Pulmonary stenosis. In
Allen HD, Driscoll DJ, Shaddy RE, Feltes TF,
editors. Moss and Adams’ heart disease in in-
fants, children, and adolescents: including the fe-
tus and young adult, ed 7, vol. 2. Phildadelphia,
PA, 2008, Lippincott Williams & Wilkins.
2. Hayes CJ, Gersony WM, Driscoll DJ, et al.
Second natural history study of congenital
heart defects. Results of treatment of patients
with pulmonary valvar stenosis, Circulation
87(Suppl 2):I28–I37, 1993.
3. Jurado-Roman A, Hernandez-Hernandez F,
Ruiz-Cano MJ, et al. Compression of the left
main coronary artery by a giant pulmonary
artery aneurysm, Circulation 127:1340–1341,
2013.
4. Nishimura RA, Otto CM, Bonow RO, et al.
2014 AHA/ACC Guideline for the Manage-
ment of Patients With Valvular Heart Dis-
ease: executive summary: a report of the
American College of Cardiology/American
Heart Association Task Force on Practice
Guidelines, Circulation 129:2440–2492, 2014.
5. Warnes CA, Williams RG, Bashore TM, et al.
ACC/AHA 2008 Guidelines for the Manage-
ment of Adults with Congenital Heart Dis-
ease: executive Summary: a report of the
American College of Cardiology/American
Heart Association Task Force on Practice
Guidelines (writing committee to develop
guidelines for the management of adults with
congenital heart disease), Circulation 118:
2395–2451, 2008.
6. Lima CO, Sahn DJ, Valdes-Cruz LM, et al.
Noninvasive prediction of transvalvular pres-
sure gradient in patients with pulmonary ste-
nosis by quantitative two-dimensional echo-
cardiographic Doppler studies, Circulation
67:866–871, 1983.
7. Frantz EG, Silverman NH. Doppler ultra-
sound evaluation of valvar pulmonary steno-
sis from multiple transducer positions in chil-
dren requiring pulmonary valvuloplasty, Am
J Cardiol 61:844–849, 1988.
8. Aldousany AW, DiSessa TG, Dubois R, et al.
Doppler estimation of pressure gradient in
pulmonary stenosis: maximal instantaneous
vs peak-to-peak, vs mean catheter gradient,
Pediatr Cardiol 10:145–149, 1989.
9. Currie PJ, Hagler DJ, Seward JB, et al. Instan-
taneous pressure gradient: a simultaneous
Doppler and dual catheter correlative study, J
Am Coll Cardiol 7:800–806, 1986.
10. Silvilairat S, Cabalka AK, Cetta F, et al. Echo-
cardiographic assessment of isolated pulmo-
nary valve stenosis: which outpatient Doppler
gradient has the most clinical validity? J Am
Soc Echocardiogr 18:1137–1142, 2005.
11. Silvilairat S, Cabalka AK, Cetta F, et al. Out-
patient echocardiographic assessment of
complex pulmonary outflow stenosis: Dop-
pler mean gradient is superior to the maxi-
mum instantaneous gradient, J Am Soc Echo-
cardiogr 18:1143–1148, 2005.
12. Kan JS, White Jr. RI, Mitchell SE, Gardner TJ.
Percutaneous balloon valvuloplasty: a new
method for treating congenital pulmonary-
valve stenosis, N Engl J Med 307:540–542,
1982.
13. Chen CR, Cheng TO, Huang T, et al. Percu-
taneous balloon valvuloplasty for pulmonic
stenosis in adolescents and adults, N Engl J
Med 335:21–25, 1996.
14. Ananthakrishna A, Balasubramonium VR,
Thazhath HK, et al. Balloon pulmonary val-
vuloplasty in adults: immediate and long-
term outcomes, J Heart Valve Dis 23:511–515,
2014.
15. McCrindle BW. Independent predictors of
long-term results after balloon pulmonary val-
vuloplasty. Valvuloplasty and Angioplasty of
Congenital Anomalies (VACA) Registry Inves-
tigators, Circulation 89:1751–1759, 1994.
16. Voet A, Rega F, de Bruaene AV, et al. Long-
term outcome after treatment of isolated pul-
monary valve stenosis, Int J Cardiol 156:11–
15, 2012.
17. Earing MG, Connolly HM, Dearani JA, et al.
Long-term follow-up of patients after surgi-
cal treatment for isolated pulmonary valve
stenosis, Mayo Clin Proc 80:871–876, 2005.
ch46.indd 1205
03.04.2019 12:19:04
1206 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
18. O’Connor BK, Beekman RH, Lindauer A,
Rocchini A. Intermediate-term outcome after
pulmonary balloon valvuloplasty: compari-
son with a matched surgical control group,
J Am Coll Cardiol 20:169–173, 1992.
19. Roos-Hesselink JW, Meijboom FJ, Spitaels
SE, et al. Long-term outcome after surgery
for pulmonary stenosis (a longitudinal study
of 22–33 years), Eur Heart J 27: 482–488,
2006.
20. Peterson C, Schilthuis JJ, Dodge-Khatami A,
et al. Comparative long-term results of sur-
gery versus balloon valvuloplasty for pulmo-
nary valve stenosis in infants and children,
Ann Thorac Surg 76:1078–1082, 2003. discus-
sion 1082–1073.
21. Engle MA, Holswade GR, Goldberg HP, et al.
Regression after open valvotomy of infun-
dibular stenosis accompanying severe valvu-
lar pulmonic stenosis, Circulation 17:862–
873, 1958.
22. Ben-Shachar G, Cohen MH, Sivakoff MC, et
al. Development of infundibular obstruction
after percutaneous pulmonary balloon valvu-
loplasty, J Am Coll Cardiol 5:754–756, 1985.
23. Hoffman P, Wojcik AW, Rozanski J, et al.
The role of echocardiography in diagnosing
double chambered right ventricle in adults,
Heart 90:789–793, 2004.
24. Singh MN, McElhinney DB. Double-cham-
bered right ventricle. In Gatzoulis MA, Webb
G, Daubeney PEF, editors: Diagnosis and man-
agement of adult congenital heart disease, ed 2,
Philadelphia, PA, 2011, Elsevier Saunders.
25. Pongiglione G, Freedom RM, Cook D, Rowe
RD. Mechanism of acquired right ventricular
outflow tract obstruction in patients with
ventricular septal defect: an angiocardio-
graphic study, Am J Cardiol 50:776–780, 1982.
26. Oliver JM, Garrido A, Gonzalez A, et al. Rap-
id progression of midventricular obstruction
in adults with double-chambered right ven-
tricle, J Thorac Cardiovasc Surg 126:711–717,
2003.
27. Bashore TM. Adult congenital heart disease:
right ventricular outflow tract lesions, Circu-
lation 115:1933–1947, 2007.
28. Kilner PJ, Geva T, Kaemmerer H, et al. Rec-
ommendations for cardiovascular magnetic
resonance in adults with congenital heart dis-
ease from the respective working groups of
the European Society of Cardiology, Eur
Heart J 31:794–805, 2010.
29. Kahr PC, Alonso-Gonzalez R, Kempny A, et
al. Long-term natural history and postopera-
tive outcome of double-chambered right ven-
tricle — experience from two tertiary adult
congenital heart centres and review of the lit-
erature, Int J Cardiol 174:662–668, 2014.
30. Said SM, Burkhart HM, Dearani JA, et al.
Outcomes of surgical repair of double-cham-
bered right ventricle, Ann Thorac Surg 93:
197–200, 2012.
31. Hoffman JI, Kaplan S. The incidence of con-
genital heart disease, J Am Coll Cardiol
39:1890–1900, 2002.
32. Nies M, Brenner JI. Tetralogy of Fallot: epi-
demiology meets real-world management:
lessons from the Baltimore-Washington In-
fant Study, Cardiol Young 23:867–870, 2013.
33. Siwik ES, Erenberg F, Zahka KG, Goldmuntz
E. Tetralogy of Fallot. In Allen HD, Driscoll
DJ, Shaddy RE, Feltes TF, editors. Moss and
Adams’ heart disease in infants, children, and
adolescents: including the fetus and young
adult, ed 7, vol. 2. Philadelphia, PA, 2008, Lip-
pincott Williams & Wilkins.
34. Gatzoulis MA, Balaji S, Webber SA, et al. Risk
factors for arrhythmia and sudden cardiac
death late after repair of tetralogy of Fallot: a
multicentre study, Lancet 356:975–981, 2000.
35. Nollert G, Fischlein T, Bouterwek S, et al.
Long-term survival in patients with repair of
tetralogy of Fallot: 36-year follow-up of 490
survivors of the first year after surgical repair,
J Am Coll Cardiol 30:1374–1383, 1997.
36. d’Udekem Y, Ovaert C, Grandjean F, et al. Te-
tralogy of Fallot: transannular and right ven-
tricular patching equally affect late function-
al status, Circulation 102 (19 Suppl 3):III116–
III122, 2000.
37. Khairy P, Aboulhosn J, Gurvitz MZ, et al. Ar-
rhythmia burden in adults with surgically re-
paired tetralogy of Fallot: a multi-institution-
al study, Circulation 122:868–875, 2010.
38. Redington AN. Determinants and assessment
of pulmonary regurgitation in tetralogy of
Fallot: practice and pitfalls, Cardiol Clin
24:631–639, 2006. vii.
39. Valente AM, Cook S, Festa P, et al. Multimo-
dality imaging guidelines for patients with re-
paired tetralogy of fallot: a report from the
American Society of Echocardiography: de-
veloped in collaboration with the Society for
Cardiovascular Magnetic Resonance and the
Society for Pediatric Radiology, J Am Soc
Echocardiogr 27:111–141, 2014.
40. Rudski LG, Lai WW, Afilalo J, et al. Guide-
lines for the echocardiographic assessment of
the right heart in adults: a report from the
American Society of Echocardiography en-
dorsed by the European Association of Echo-
cardiography, a registered branch of the Eu-
ropean Society of Cardiology, and the Cana-
dian Society of Echocardiography, J Am Soc
Echocardiogr 23:685–713, 2010. quiz 786–688.
41. Puchalski MD, Askovich B, Sower CT, et al.
Pulmonary regurgitation: determining severity
by echocardiography and magnetic resonance
imaging, Congenit Heart Dis 3:168–175, 2008.
42. Renella P, Aboulhosn J, Lohan DG, et al.
Two-dimensional and Doppler echocardiog-
raphy reliably predict severe pulmonary re-
gurgitation as quantified by cardiac magnetic
resonance, J Am Soc Echocardiogr 23:880–886,
2010.
43. Williams RV, Minich LL, Shaddy RE, et al.
Comparison of Doppler echocardiography
with angiography for determining the sever-
ity of pulmonary regurgitation, Am J Cardiol
89:1438–1441, 2002.
44. Srivastava S, Parness IA. Tetralogy of Fallot.
In Lai WW, Mertens L, Cohen MS, Geva T,
editors. Echocardiography in pediatric and con-
genital heart disease from fetus to adult, Hobo-
ken, NJ, 2009, Wiley-Blackwell.
45. Silversides CK, Veldtman GR, Crossin J, et al.
Pressure half-time predicts hemodynamically
significant pulmonary regurgitation in adult
patients with repaired tetralogy of fallot, J Am
Soc Echocardiogr 16:1057–1062, 2003.
46. Li W, Davlouros PA, Kilner PJ, et al. Doppler-
echocardiographic assessment of pulmonary
regurgitation in adults with repaired tetralogy
of Fallot: comparison with cardiovascular
magnetic resonance imaging, Am Heart J 147:
165–172, 2004.
47. Pothineni KR, Wells BJ, Hsiung MC, et al.
Live/real time three-dimensional transthorac-
ic echocardiographic assessment of pulmo-
nary regurgitation, Echocardiography 25:911–
917, 2008.
48. Mercer-Rosa L, Yang W, Kutty S, et al. Quan-
tifying pulmonary regurgitation and right ven-
tricular function in surgically repaired tetral-
ogy of Fallot: a comparative analysis of echo-
cardiography and magnetic resonance imaging,
Circ Cardiovasc Imaging 5:637–643, 2012.
49. Festa P, Ait-Ali L, Minichilli F, et al. A new
simple method to estimate pulmonary regur-
gitation by echocardiography in operated fal-
lot: comparison with magnetic resonance im-
aging and performance test evaluation, J Am
Soc Echocardiogr 23:496–503, 2010.
50. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
51. Weidemann F, Eyskens B, Mertens L, et al.
Quantification of regional right and left ven-
tricular function by ultrasonic strain rate and
strain indexes after surgical repair of tetralo-
gy of Fallot, Am J Cardiol 90:133–138, 2002.
52. Xie M, Li Y, Cheng TO, et al. The effect of
right ventricular myocardial remodeling on
ventricular function as assessed by two-di-
mensional speckle tracking echocardiography
in patients with tetralogy of Fallot: a single
center experience from China, Int J Cardiol
178:300–307, 2015.
53. Scherptong RW, Mollema SA, Blom NA, et al.
Right ventricular peak systolic longitudinal
strain is a sensitive marker for right ventricu-
lar deterioration in adult patients with tetral-
ogy of Fallot, Int J Cardiovasc Imaging 25:669–
676, 2009.
54. Alghamdi MH, Mertens L, Lee W, et al. Lon-
gitudinal right ventricular function is a better
predictor of right ventricular contribution to
exercise performance than global or outflow
tract ejection fraction in tetralogy of Fallot: a
combined echocardiography and magnetic
resonance study, Eur Heart J Cardiovasc Im-
aging 14:235–239, 2013.
55. Munkhammar P, Cullen S, Jogi P, et al. Early
age at repair prevents restrictive right ventric-
ular (RV) physiology after surgery for tetral-
ogy of Fallot (TOF): diastolic RV function af-
ter TOF repair in infancy, J Am Coll Cardiol
32:1083–1087, 1998.
56. Gatzoulis MA, Clark AL, Cullen S, et al. Right
ventricular diastolic function 15 to 35 years
after repair of tetralogy of Fallot. Restrictive
physiology predicts superior exercise perfor-
mance, Circulation 91:1775–1781, 1995.
57. Samyn MM, Kwon EN, Gorentz JS, et al. Re-
strictive versus nonrestrictive physiology fol-
lowing repair of tetralogy of Fallot: is there a
difference? J Am Soc Echocardiogr 26:746–
755, 2013.
58. Tribouilloy CM, Enriquez-Sarano M, Bailey
KR, et al. Quantification of tricuspid regurgita-
tion by measuring the width of the vena con-
tracta with Doppler color flow imaging: a clini-
cal study, J Am Coll Cardiol 36:472–478, 2000.
59. Bokma JP, Winter MM, Oosterhof T, et al.
Severe tricuspid regurgitation is predictive for
adverse events in tetralogy of Fallot, Heart
101:794–799, 2015.
60. Broberg CS, Aboulhosn J, Mongeon FP, et al.
Prevalence of left ventricular systolic dys-
function in adults with repaired tetralogy of
fallot, Am J Cardiol 107:1215–1220, 2011.
61. Hausdorf G, Hinrichs C, Nienaber CA, et al.
Left ventricular contractile state after surgical
correction of tetralogy of Fallot: risk factors
for late left ventricular dysfunction, Pediatr
Cardiol 11:61–68, 1990.
ch46.indd 1206
03.04.2019 12:19:04
1207
46 Аномалии правых отделов сердца
62. Borow KM, Green LH, Castaneda AR, Keane
JF. Left ventricular function after repair of
tetralogy of fallot and its relationship to age
at surgery, Circulation 61:1150–1158, 1980.
63. Geva T, Sandweiss BM, Gauvreau K, et al.
Factors associated with impaired clinical sta-
tus in long-term survivors of tetralogy of Fal-
lot repair evaluated by magnetic resonance
imaging, J Am Coll Cardiol 43:1068–1074,
2004.
64. Menting ME, Eindhoven JA, van den Bosch
AE, et al. Abnormal left ventricular rotation
and twist in adult patients with corrected te-
tralogy of Fallot, Eur Heart J Cardiovasc Im-
aging 15:566–574, 2014.
65. Dragulescu A, Friedberg MK, Grosse-Wort-
mann L, et al. Effect of chronic right ventric-
ular volume overload on ventricular interac-
tion in patients after tetralogy of Fallot repair,
J Am Soc Echocardiogr 27:896–902, 2014.
66. Ghai A, Silversides C, Harris L, et al. Left ven-
tricular dysfunction is a risk factor for sud-
den cardiac death in adults late after repair of
tetralogy of Fallot, J Am Coll Cardiol 40:1675–
1680, 2002.
67. Valente AM, Gauvreau K, Assenza GE, et al.
Contemporary predictors of death and sus-
tained ventricular tachycardia in patients
with repaired tetralogy of Fallot enrolled in
the INDICATOR cohort, Heart 100:247–253,
2014.
68. Diller GP, Kempny A, Liodakis E, et al. Left
ventricular longitudinal function predicts
life-threatening ventricular arrhythmia and
death in adults with repaired tetralogy of fal-
lot, Circulation 125:2440–2446, 2012.
69. Niwa K, Siu SC, Webb GD, Gatzoulis MA.
Progressive aortic root dilatation in adults late
after repair of tetralogy of Fallot, Circulation
106:1374–1378, 2002.
70. Mongeon FP, Gurvitz MZ, Broberg CS, et al.
Aortic root dilatation in adults with surgical-
ly repaired tetralogy of fallot: a multicenter
cross-sectional study, Circulation 127:172–
179, 2013.
71. John AS, Rychik J, Khan M, et al. 22q11.2 de-
letion syndrome as a risk factor for aortic
root dilation in tetralogy of Fallot, Cardiol
Young 24:303–310, 2014.
72. Stulak JM, Dearani JA, Burkhart HM, et al.
Does the dilated ascending aorta in an adult
with congenital heart disease require inter-
vention? J Thorac Cardiovasc Surg 140(Suppl
6):S52–S57, 2010. discussion S86–91.
73. Silversides CK, Kiess M, Beauchesne L, et al. Ca-
nadian Cardiovascular Society 2009 Consensus
Conference on the management of adults with
congenital heart disease: outflow tract obstruc-
tion, coarctation of the aorta, tetralogy of Fal-
lot, Ebstein anomaly and Marfan’s syndrome,
Can J Cardiol 26:e80–e97, 2010.
74. Kim WH, Seo JW, Kim SJ, et al. Aortic dis-
section late after repair of tetralogy of Fallot,
Int J Cardiol 101:515–516, 2005.
75. Rathi VK, Doyle M, Williams RB, et al. Mas-
sive aortic aneurysm and dissection in re-
paired tetralogy of Fallot; diagnosis by car-
diovascular magnetic resonance imaging, Int
J Cardiol 101:169–170, 2005.
76. Konstantinov IE, Fricke TA: d’Udekem Y,
Robertson T. Aortic dissection and rupture in
adolescents after tetralogy of Fallot repair, J
Thorac Cardiovasc Surg 140:e71–e73, 2010.
77. Wijesekera VA, Kiess MC, Grewal J, et al. Aor-
tic dissection in a patient with a dilated aortic
root following tetralogy of Fallot repair, Int J
Cardiol 174:833–834, 2014.
78. Murphy JG, Gersh BJ, Mair DD, et al. Long-
term outcome in patients undergoing surgical
repair of tetralogy of Fallot, N Engl J Med
329:593–599, 1993.
79. Cuypers JA, Menting ME, Konings EE, et al.
Unnatural history of tetralogy of Fallot: pro-
spective follow-up of 40 years after surgical
correction, Circulation 130:1944–1953, 2014.
80. Geva T. Repaired tetralogy of Fallot: the roles
of cardiovascular magnetic resonance in eval-
uating pathophysiology and for pulmonary
valve replacement decision support, J Cardio-
vasc Magn Reson 13:9, 2011.
81. Zahn EM, Hellenbrand WE, Lock JE, McEl-
hinney DB. Implantation of the melody
transcatheter pulmonary valve in patients
with a dysfunctional right ventricular out-
flow tract conduit early results from the u.s.
Clinical trial, J Am Coll Cardiol 54:1722–1729,
2009.
82. McElhinney DB, Hellenbrand WE, Zahn EM,
et al. Short- and medium-term outcomes af-
ter transcatheter pulmonary valve placement
in the expanded multicenter US melody valve
trial, Circulation 122:507–516, 2010.
83. Fraisse A, Aldebert P, Malekzadeh-Milani S,
et al. Melody (R) transcatheter pulmonary
valve implantation: results from a French reg-
istry, Arch Cardiovasc Dis 107:607–614, 2014.
84. Kenny D, Hijazi ZM, Kar S, et al. Percutaneous
implantation of the Edwards SAPIEN trans-
catheter heart valve for conduit failure in the
pulmonary position: early phase 1 results from
an international multicenter clinical trial, J Am
Coll Cardiol 58:2248–2256, 2011.
85. Correa-Villasenor A, Ferencz C, Neill CA, et
al. Ebstein’s malformation of the tricuspid
valve: genetic and environmental factors. The
Baltimore-Washington Infant Study Group,
Teratology 50:137–147, 1994.
86. Cohen LS, Friedman JM, Jefferson JW, et al.
A reevaluation of risk of in utero exposure to
lithium, JAMA 271:146–150, 1994.
87. Van Mierop LH, Gessner IH. Pathogenetic
mechanisms in congenital cardiovascular
malformations, Prog Cardiovasc Dis 15:67–85,
1972.
88. Schreiber C, Cook A, Ho SY, et al. Morpho-
logic spectrum of Ebstein’s malformation: re-
visitation relative to surgical repair, J Thorac
Cardiovasc Surg 117:148–155, 1999.
89. Martinez RM, O’Leary PW, Anderson RH.
Anatomy and echocardiography of the nor-
mal and abnormal tricuspid valve, Cardiol
Young 16(Suppl 3):4–11, 2006.
90. Anderson KR, Zuberbuhler JR, Anderson
RH, et al. Morphologic spectrum of Ebstein’s
anomaly of the heart: a review, Mayo Clin
Proc 54:174–180, 1979.
91. Arya P, Beroukhim R. Ebstein anomaly: as-
sessment, management, and timing of inter-
vention, Curr Treat Options Cardiovasc Med
16:338, 2014.
92. Attenhofer Jost CH, Connolly HM, Dearani
JA, et al. Ebstein’s anomaly, Circulation 115:
277–285, 2007.
93. Silva JP, Silva Lda F, Moreira LF, et al Cone
reconstruction in Ebstein’s anomaly repair:
early and long-term results. Arq Bras Cardiol
97:199–208.
94. Barbara DW, Edwards WD, Connolly HM,
Dearani JA. Surgical pathology of 104 tricus-
pid valves (2000–2005) with classic right-sid-
ed Ebstein’s malformation, Cardiovasc Pathol
17:166–171, 2008.
95. Attie F, Rosas M, Rijlaarsdam M, et al. The
adult patient with Ebstein anomaly. Outcome
in 72 unoperated patients, Medicine 79:27–36,
2000.
96. Celermajer DS, Bull C, Till JA, et al. Ebstein’s
anomaly: presentation and outcome from fetus
to adult, J Am Coll Cardiol 23:170–176, 1994.
97. Shiina A, Seward JB, Edwards WD, et al. Two-
dimensional echocardiographic spectrum of
Ebstein’s anomaly: detailed anatomic assess-
ment, J Am Coll Cardiol 3(2 Pt 1):356–370, 1984.
98. Trojnarska O, Szyszka A, Gwizdala A, et al.
Adults with Ebstein’s anomaly—cardiopul-
monary exercise testing and BNP levels exer-
cise capacity and BNP in adults with Ebstein’s
anomaly, Int J Cardiol 111:92–97, 2006.
99. Oechslin E, Buchholz S, Jenni R. Ebstein’s
anomaly in adults: Doppler-echocardiographic
evaluation, Thorac Cardiovasc Surg 48: 209–
213, 2000.
100. Muraru D, Badano LP, Sarais C, et al. Evalu-
ation of tricuspid valve morphology and
function by transthoracic three-dimensional
echocardiography, Curr Cardiol Rep 13:242–
249, 2011.
101. Bharucha T, Anderson RH, Lim ZS, Vettukat-
til JJ. Multiplanar review of three-dimension-
al echocardiography gives new insights into
the morphology of Ebstein’s malformation,
Cardiol Young 20:49–53, 2010.
102. Attenhofer Jost CH, Edmister WD, Julsrud
PR, et al. Prospective comparison of echo-
cardiography versus cardiac magnetic reso-
nance imaging in patients with Ebstein’s
anomaly, Int J Cardiovasc Imaging 28:1147–
1159, 2012.
103. Dearani JA, Danielson GK. Surgical manage-
ment of Ebstein’s anomaly in the adult, Semin
Thorac Cardiovasc Surg 17:148–154, 2005.
104. da Silva JP, Baumgratz JF, da Fonseca L, et al.
The cone reconstruction of the tricuspid
valve in Ebstein’s anomaly. The operation:
early and midterm results, J Thorac Cardio-
vasc Surg 133:215–223, 2007.
105. Kuhn A, De Pasquale Meyer G, Muller J, et al.
Tricuspid valve surgery improves cardiac output
and exercise performance in patients with Eb-
stein’s anomaly, Int J Cardiol 166: 494–498, 2013.
106. Brown ML, Dearani JA, Danielson GK, et al.
Effect of operation for Ebstein anomaly on
left ventricular function, Am J Cardiol 102:
1724–1727, 2008.
107. Brown ML, Dearani JA, Danielson GK, et al.
Functional status after operation for Ebstein
anomaly: the Mayo Clinic experience, J Am
Coll Cardiol 52:460–466, 2008.
108. Cuypers JA, Witsenburg M, van der Linde D,
Roos-Hesselink JW. Pulmonary stenosis: up-
date on diagnosis and therapeutic options,
Heart 99:339–347, 2013.
109. Rao BN, Anderson RC, Edwards JE. Anatom-
ic variations in the tetralogy of Fallot, Am
Heart J 81:361–371, 1971.
110. Need LR, Powell AJ, del Nido P, Geva T. Cor-
onary echocardiography in tetralogy of fallot:
diagnostic accuracy, resource utilization and
surgical implications over 13 years, J Am Coll
Cardiol 36:1371–1377, 2000.
111. Babu-Narayan SV, Gatzoulis M. Tetralogy of
Fallot. In Gatzoulis M, Webb G, Daubeney
PE, editors. Diagnosis and management of
adult congenital heart disease, ed 2, Philadel-
phia, 2011, Elsevier Saunders.
112. Greutmann M, Tobler D, Biaggi P, et al. Echo-
cardiography for assessment of right ventric-
ular volumes revisited: a cardiac magnetic res-
onance comparison study in adults with re-
paired tetralogy of Fallot, J Am Soc Echo-
cardiogr 23: 905–911, 2010.
ch46.indd 1207
03.04.2019 12:19:04
1208 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
113. Greutmann M, Tobler D, Biaggi P, et al. Echo-
cardiography for assessment of regional and
global right ventricular systolic function in
adults with repaired tetralogy of Fallot, Int
J Cardiol 157:53–58, 2012.
114. Koestenberger M, Nagel B, Ravekes W, et al.
Tricuspid annular plane systolic excursion
and right ventricular ejection fraction in pe-
diatric and adolescent patients with tetralogy
of Fallot, patients with atrial septal defect,
and age-matched normal subjects, Clin Res
Cardiol 100:67–75, 2011.
115. Mercer-Rosa L, Parnell A, Forfia PR, et al.
Tricuspid annular plane systolic excursion in
the assessment of right ventricular function
in children and adolescents after repair of te-
tralogy of Fallot, J Am Soc Echocardiogr 26:
1322–1329, 2013.
116. Bussadori C, Di Salvo G, Pluchinotta FR, et
al. Evaluation of right ventricular function in
adults with congenital heart defects, Echocar-
diography 32(Suppl 1):S38–S52, 2015.
117. Kutty S, Zhou J, Gauvreau K, et al. Regional
dysfunction of the right ventricular outflow
tract reduces the accuracy of Doppler tissue
imaging assessment of global right ventricular
systolic function in patients with repaired te-
tralogy of Fallot, J Am Soc Echocardiogr 24:
637–643, 2011.
118. Srivastava S, Salem Y, Chatterjee S, et al. Echo-
cardiographic myocardial deformation evalua-
tion of right ventricular function in compari-
son with CMRI in repaired tetralogy of Fallot:
a cross-sectional and longitudinal validation
study, Echocardiography 30:196–202, 2013.
119. Schwerzmann M, Samman AM, Salehian O,
et al. Comparison of echocardiographic and
cardiac magnetic resonance imaging for as-
sessing right ventricular function in adults
with repaired tetralogy of fallot, Am J Cardi-
ol 99:1593–1597, 2007.
120. Koca B, Oztunc F, Eroglu AG, et al. Evalua-
tion of right ventricular function in patients
with tetralogy of Fallot using the myocardial
performance index and isovolumic accelera-
tion: a comparison with cardiac magnetic res-
onance imaging, Cardiol Young 24:422–429,
2014.
121. Shimada YJ, Shiota M, Siegel RJ, Shiota T. Ac-
curacy of right ventricular volumes and func-
tion determined by three-dimensional echo-
cardiography in comparison with magnetic
resonance imaging: a meta-analysis study,
J Am Soc Echocardiogr 23:943–953, 2010.
122. Iriart X, Montaudon M, Lafitte S, et al. Right
ventricle three-dimensional echography in
corrected tetralogy of fallot: accuracy and vari-
ability, Eur J Echocardiogr 10:784–792, 2009.
123. Crean AM, Maredia N, Ballard G, et al. 3D Echo
systematically underestimates right ventricular
volumes compared to cardiovascular magnetic
resonance in adult congenital heart disease pa-
tients with moderate or severe RV dilatation,
J Cardiovasc Magn Reson 13:78, 2011.
124. Portnoy SG, Rudski LG. Echocardiographic
evaluation of the right ventricle: a 2014 per-
spective, Curr Cardiol Rep 17:21, 2015.
125. Rusconi PG, Zuberbuhler JR, Anderson RH,
Rigby ML. Morphologic-echocardiographic
correlates of Ebstein’s malformation, Eur
Heart J 12:784–790, 1991.
ch46.indd 1208
03.04.2019 12:19:04
1209
47 Пороки конотрункуса
ANNE MARIE VALENTE, MD • STEPHEN P. SANDERS, MD
Эмбриональное развитие конотрункуса
Номенклатура врожденных пороков
сердца
Генетические особенности
Аортопатия при пороках конотрункуса
Специфические пороки конотрункуса
Общий артериальный ствол
Двойное отхождение магистральных
сосудов
Врожденная корригированная
транспозиция магистральных сосудов
Дефект аортолегочной перегородки
Заключение
Аномальный эмбриогенез конотрункуса приводит
к дефектам, которые затрагивают выходные тракты
желудочков и магистральные сосуды. Нарушения
формирования конотрункуса могут привести к:
(1) атипичным расположению и соединению желу-
дочков и магистральных сосудов; (2) разделению
отточных отделов желудочков перегородками; (3) ги-
поплазии, стенозу либо атрезии отточных отделов
желудочков [1].
К порокам конотрункуса относят многие дефек-
ты, например тетраду Фалло (ТФ) (см. главу 46),
транспозицию магистральных сосудов (ТМС) (см.
главу 48), перерыв дуги аорты (см. главу 45), анома-
лии полулунных клапанов (см. главы 45, 46). В дан-
ной главе будут рассмотрены наиболее редкие по-
роки конотрункуса, а именно: общий артериальный
ствол (ОАС), двойное отхождение магистральных
сосудов от желудочка, врожденная корригирован-
ная транспозиция магистральных сосудов (КТМС)
и дефект аортолегочной перегородки.
Для планирования оперативного вмешательства
нужна точная диагностика порока конотрункуса, ко-
торая нередко затруднена из-за большой анатоми-
ческой вариабельности порока. Диагноз обычно
ставят в раннем возрасте после полного эхокардио-
графического обследования, включающего субко-
стальный доступ [2, 3]. Эхокардиография (ЭхоКГ) в
2D-режиме в разных позициях является надежным
методом определения анатомии порока, особенно
при последовательном детальном анализе структур
сердца [4]. По мере увеличения возраста пациента
акустическая доступность может становиться более
ограниченной, поэтому на первый план выходят
альтернативные методы визуализации, например
магнитно-резонансная томография (МРТ) [5].
ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ КОНОТРУНКУСА
Врожденные пороки сердца (ВПС) — наиболее рас-
пространенные врожденные аномалии развития, ко-
торые являются основной причиной младенческой
заболеваемости и смертности. Пороки конотрунку-
са составляют до 20% всех ВПС. Визуализация дан-
ных пороков помогает пониманию эмбриологии и
развития сердца. Формирование сердца плода начи-
нается на 3-й неделе гестации и в целом заканчива-
ется к 8-й неделе. Миграция мезодермальных прекар-
диальных клеток приводит к образованию в перед-
ней латеральной мезодерме двух первичных полей
сердца, имеющих форму полумесяца, которые за-
тем объединяются, формируя при образовании вен-
тральной борозды эмбриона линейную первичную
сердечную трубку. Клетки вторичного поля сердца
продолжают пролиферировать вне сердца и в ходе
эмбриогенеза присоединяются к линейной первич-
ной сердечной трубке, что способствует формиро-
ванию предсердий, правого желудочка (ПЖ) и вы-
ходного тракта. Кроме этого, на 5–6 -й неделе в раз-
вивающееся сердце мигрируют клетки нервного
гребня для формирования перегородки в выходном
тракте, образования полулунных клапанов и дуги
аорты. Линейная первичная сердечная трубка после
формирования растет и удлиняется за счет присо
единения к ней клеток из вторичного поля сердца.
Концы линейной первичной сердечной трубки
фиксирует перикардиальный мешок (перикард),
благодаря чему она по мере удлинения изгибается в
виде петли. В большинстве случаев формируется
правая петля (D-петля). Последующее удлинение
первичной сердечной трубки передвигает ее сред-
нюю часть (будущие желудочки) ниже и каудальнее
относительно приточного отдела. В итоге формиру-
ch47.indd 1209
03.04.2019 12:19:20
1210 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ется нормальное взаиморасположение предсердий
и желудочков. Дальнейший рост первичной сердеч-
ной трубки характеризуется смещением выходного
тракта к центру и вращением, что необходимо для
его нормального формирования. В конечном итоге
проксимальная часть выходного тракта включается
в состав ПЖ и на фоне дальнейшего вращения вы-
ходной тракт укорачивается. В ходе такого ремоде-
лирования под влиянием клеток нервного гребня в
выходном тракте образуется перегородка. Ее обра-
зование происходит в направлении от дистальной
части выходного тракта к проксимальной и завер-
шается формированием инфундибулярной части,
которая внедряется в верхнюю эндокардиальную
подушку в месте правой окружности выходного
тракта, создавая выходной тракт из левого желуд-
лочка (ЛЖ) в аорту и из ПЖ — в легочной ствол.
Нарушение любого из этих процессов, включая уд-
линение, вращение, укорочение, формирование пе-
регородки, приводит к развитию порока конотрун-
куса [6, 7].
НОМЕНКЛАТУРА ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА
ВПС — это сложные аномалии, поэтому для их
описания проводят последовательный детальный
анализ структур сердца. Сердце состоит из несколь-
ких структур, каждую из которых анализируют от-
дельно, прежде чем поставить диагноз.
К основным структурам относят предсердия, же-
лудочки и магистральные сосуды. Эти основные
структуры соединяются между собой посредством
атриовентрикулярного канала и инфундибулума.
Сначала определяют расположение основных струк-
тур. В нормально сформированном сердце ПЖ ле-
жит справа (его приточный и отточный отделы рас-
полагаются справа налево), ЛЖ — слева (его при-
точный и отточный отделы располагаются слева
направо). Затем определяют соединения между ос-
новными структурами, т.е. что с чем соединяется. В
норме кровь из правого предсердия (ПП) поступает
в ПЖ, а из ЛЖ — в аорту. Потом оценивают анато-
мические связи структур между собой. В норме ле-
гочный ствол связан с ПЖ инфундибулумом, тогда
как аорта связана с ЛЖ фиброзным контактом меж-
ду аортальным и митральным клапанами.
Соединения и анатомические связи структур —
разные понятия, однако они оба имеют большое
значение, особенно при сложных ВПС. На рис. 47.1
приведены варианты расположения трех основных
структур сердца, их соединений и анатомических
связей при пороках конотрункуса.
ГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ
Пороки конотрункуса часто ассоциируются с неко-
торыми хромосомными аномалиями, в первую оче-
редь с делецией 22q11 (синдром Ди Джорджи). У та-
ких пациентов, помимо порока конотрункуса, на
ЭхоКГ могут отмечаться правосторонняя дуга аор-
ты, аберрантная подключичная артерия, а у младен-
цев — и отсутствие тимуса [8].
Многих взрослых пациентов с пороком коно-
трункуса не тестировали на наличие синдрома Ди
Джорджи, хотя диагностика синдрома Ди Джорджи
является первоочередной задачей, поскольку у па-
циентов с пороком конотрункуса могут быть раз-
личные психические расстройства и нарушения
когнитивных функций, которые следует лечить[9].
У 60 пациентов с пороком конотрункуса при срав-
нительной геномной гибридизации и последую-
щим сопоставлением найденных вариантов копий
ДНК с геномными базами данных в 38% случаев
были выявлены различные генетические аномалии.
Данное исследование подчеркивает важность ана-
лиза генома у пациентов с ВПС [10].
АОРТОПАТИЯ ПРИ ПОРОКАХ КОНОТРУНКУСА
У пациентов с пороком конотрункуса часто выявля-
ют аортопатию, поскольку стенки артерий происхо-
дят из клеток нервного гребня и клеток вторичного
поля сердца, а каждая из этих структур во время эм-
бриогенеза может иметь дефекты [11]. Например, у
пациентов с ТФ с детского возраста отмечаются вы-
раженные патологические изменения при гистоло-
гическом исследовании корня аорты и восходящего
отдела аорты [12].
У взрослых пациентов, которым выполнили
коррекцию ТФ, часто отмечается дилатация аорты
(особенно у пациентов с правосторонней дугой аор-
ты, атрезией клапана легочной артерии либо дефек-
том аортолегочной перегородки в анамнезе) [13].
Фактически до 25% взрослых после лечения ТФ
имеют диаметр корня аорты > 4 см, однако только
у 6,6% из них индексированные значения диаметра
аорты превышают пороговые показатели [14]. Ана-
логичным образом у 50% детей с ТМС типа D
(D-ТМС) происходит дилатация корня аорты через
10 лет после операции артериального переключе-
ния, однако дилатация не прогрессирует [15]. В од-
ноцентровом ретроспективном исследовании 73 из
76 пациентов с ОАС имели расширение его корня
со средним Z-критерием 5,1 ± 2,3 [16]. Несмотря на
высокую частоту дилатации восходящего отдела
аорты у пациентов с пороком конотрункуса, рассло-
ение аорты наблюдается крайне редко [17].
Каждое отделение ЭхоКГ имеет свои протоколы
визуализации аорты, что необходимо учитывать
при сравнении результатов исследований различ-
ных медицинских центров. Существующие руко-
водства по мультимодальной визуализации груд-
ной части нисходящего отдела аорты у взрослых ре-
комендуют измерять корень аорты в конце диастолы
методом «от переднего края до переднего края» [18],
в то время как рекомендации по визуализации в пе-
ch47.indd 1210
03.04.2019 12:19:20
1211
47 Пороки конотрункуса
Инф
Инф
Инф
Инф
Инф
Инф
Right
Left
Posterior
Anterior
Транспозиция
магистральных сосудов
ПЖ
ПП
ПЖ
ПП
ЛЖ
ЛП
ЛЖ
ЛП
Инф
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ЛЖ
ЛП
ПЖ
ПП
ПЖ
ЛП
ЛЖ
ЛП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ЛП
ЛЖ
ПП
ПЖ
ПП
ЛЖ
ЛП
1
Конкордантное
предсердно-желудочковое
соединение
{S, D, S}
{S, D, L}
{S, D, D}
{S, D, D}
{S, D, D}
{I, L, I}
{I, L, L}
{I, L, D}
{I, L, L}
{I, L, L}
{I, D, D}
{I, D, L}
{I, D, L}
{I, D, D}
{S, L, D}
{S, L, L}
{S, L, L}
{S, L, L}
3
Конкордантное
предсердно-желудочковое
соединение
4
Дискордантное
предсердно-желудочковое
соединение
2
Дискордантное
предсердно-желудочковое
соединение
Норма
Ж
е
л
у
д
о
ч
к
о
в
о
-
а
р
т
е
р
и
а
л
ь
н
о
е
с
о
е
д
и
н
е
н
и
е
К
о
н
к
о
р
д
а
н
т
н
о
е
Д
и
с
к
о
р
д
а
н
т
н
о
е
К
о
н
к
о
р
д
а
н
т
н
о
е
Д
в
о
й
н
о
е
о
т
х
о
ж
д
е
н
и
е
м
а
г
и
с
т
р
а
л
ь
н
ы
х
с
о
с
у
д
о
в
К
о
н
ф
и
г
у
р
а
ц
и
я
Н
о
р
м
а
л
ь
н
а
я
А
т
и
п
и
ч
н
а
я
Врожденная
корригированная
транспозиция
магистральных сосудов
От правого желудочка
От левого желудочка
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Инф
Рис. 47 .1 Варианты расположения трех основных структур сердца, их соединений и анатомических связей при пороках конотрункуса. В норме
легочный ствол соединяется с правым желудочком (ПЖ) через инфундибулум (Инф), полностью сформированным из мышечной ткани (полный мышечный ко-
нус), аорта соединяется с левым желудочком (ЛЖ), выходной тракт которого представлен с одной стороны межжелудочковой перегородкой, а с другой — фи-
брозным контактом между аортальным и митральным клапанами (т.е . мышечный конус неполный). При врожденной корригированной транспозиции магистраль-
ных сосудов есть дискордантное соединение предсердий с желудочками и желудочков — с магистральными сосудами, т.е . гемодинамика корригирована. При
этом между аортой и левым желудочком есть мышечный конус, но под легочным стволом он отсутствует. При двойном отхождении магистральных сосудов от
правого желудочка обычно наблюдается двухсторонний подартериальный конус, а при двойном отхождении магистральных сосудов от левого желудочка этот ко-
нус практически отсутствует. Первая буква (расположение отделов сердца): S — (situs) solitus, I — (situs) inversus, A — (situs) ambiguous. Вторая буква (распо-
ложение желудочков): D (dextra) — правая петля; L (levo) — левая петля. Третья буква (положение магистральных сосудов): D (dextra) — D -транспозиция, L (le-
vo) — L -транспозиция, I — (situs) inversus, S — (situs) solitus; ЛП — левое предсердие; ПП — правое предсердие [The atlas of congenital heart disease nomen-
clature: An illustrated guide to the Van Praagh and Anderson approaches to describing congenital cardiac pathology, by David S. Ezon MD, Jason F. Goldberg MD, William
B. Kyle MD. Seattle, WA, 2015, CreateSpace Independent Publishing Platform].
диатрической практике, которые часто используют
при диагностике ВПС с помощью ЭхоКГ, предпи-
сывают измерять корень аорты в середине систолы
с использованием метода «от внутреннего края до
внутреннего края» [19].
СПЕЦИФИЧЕСКИЕ ПОРОКИ КОНОТРУНКУСА
ОБЩИЙ АРТЕРИАЛЬНЫЙ СТВОЛ
ОАС — редкий ВПС. При этом пороке из сердца вы-
ходит единственный артериальный ствол, который
последовательно дает начало коронарным артери-
ch47.indd 1211
03.04.2019 12:19:20
1212 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ям, легочным артериям и артериям большого круга
кровообращения. В большинстве случаев также на-
блюдаются дефект межжелудочковой перегородки
(ДМЖП) и единственный полулунный клапан, ко-
торый называют трункальным клапаном. Такой кла-
пан может иметь две, три, четыре и более створок и
обычно «сидит верхом» над отточным ДМЖП.
В настоящее время есть две классификации ОАС
(рис. 47.2). Более старую классификацию Коллетта
и Эдвардса используют все реже, т.к. в ней нет ва-
рианта «ОАС с перерывом дуги аорты», а есть «ТФ
с атрезией легочной артерии», что сейчас уже не
считают формой ОАС. Классификация Ван Праага
шире классификации Коллетта и Эдвардса и вклю-
чает редкие формы ОАС без ДМЖП [20].
При естественном течении этого порока средняя
продолжительность жизни — 2,5 месяца после рож-
дения, т.е . без хирургического вмешательства 80%
детей умирают в течение первого года жизни [21].
Однако в литературе описаны наблюдения, когда
больной доживал до взрослого возраста без коррек-
ции ОАС [22–24].
В табл. 47.1 перечислены основные параметры и
структуры, которые следует оценить у пациентов с
ОАС до оперативного вмешательства. Эхокардио-
графическое исследование начинают в субкосталь-
ной позиции по длинной (рис. 47.3А) и короткой
осям, что обеспечивает хорошую визуализацию
анатомии сердца. По длинной оси виден корень
ОАС, разделенный на аортальный и легочный ком-
поненты, по короткой оси визуализируется ДМЖП
с расположенным над ним корнем ОАС. Парастер-
нальная позиция (см. рис. 47.3Б) дает представление
о морфологии и функции трункального клапана и
ветвей легочного ствола. В высокой парастерналь-
ной позиции оценивают анатомию дуги аорты (рис.
47.4) и открытый артериальный проток (при его на-
личии).
Хирургическая коррекция заключается в отсече-
нии легочной артерии от ОАС, закрытии ДМЖП за-
Рис. 47 .2 Две классификации общего артериального ствола. (А) Классификация Коллетта и Эдвардса. (Б) Классификация Ван Праага. Обратите внима-
ние на тип А3 по Ван Праагу, при котором одна из легочных артерий может отходить от открытого артериального протока [Lai WW, Mertens LL, Cohen MS, Geva
T, editors. Echocardiography in pediatric and congenital heart disease: from fetus to adult, Oxford, United Kingdom, 2009, Wiley-Blackwell].
I
II
III
IV
A1
A2
A3
A4
А
Б
ch47.indd 1212
03.04.2019 12:19:21
1213
47 Пороки конотрункуса
платой и имплантации кондуита между ПЖ и ле-
гочной артерией. При дисфункции трункального
клапана выполняют его пластику либо протезиро-
вание аллотрансплантатом. Kaza и соавт. исследова-
ли небольшую группу пациентов, перенесших кор-
рекцию трункального клапана, и установили, что
пластика этого клапана является вариантом лече-
ния с хорошими долгосрочными результатами от-
носительно функции клапана, низким процентом
повторных операций и низкой вероятностью необ-
ходимости протезирования клапана [25]. После хи-
рургической коррекции всем пациентам с помощью
ЭхоКГ оценивают функцию кондуита и трункаль-
ного клапана, наличие обструкции ветвей легочно-
го ствола и дилатации корня ОАС (рис. 47.5). В табл.
47.2 перечислены основные параметры, которые
следует оценивать у пациентов после оперативного
лечения ОАС.
ДВОЙНОЕ ОТХОЖДЕНИЕ МАГИСТРАЛЬНЫХ СОСУДОВ
Двойное отхождение магистральных сосудов пред-
ставляет собой нарушение соединения желудочков
с магистральными сосудами. При данном пороке
оба магистральных сосуда полностью либо частич-
но отходят от одного из желудочков либо от отточ-
ной камеры при единственном желудочке [26]. Вто-
рой желудочек может быть нормальным, гипопла-
зированным либо отсутствует. Оба магистральных
сосуда обычно проходимы, однако иногда наблюда-
ется атрезия клапана легочной артерии или аор-
тального клапана. Анатомия и физиология порока,
а также клиническая картина весьма вариабельны.
Тактика лечения определяется в первую очередь
размером ДМЖП, его расположением по отноше-
нию к магистральным сосудам, морфологией мы-
шечного конуса, наличием обструкции выходного
тракта и сопутствующих дефектов сердца и сосудов.
ДВОЙНОЕ ОТХОЖДЕНИЕ МАГИСТРАЛЬНЫХ
СОСУДОВ ОТ ПРАВОГО ЖЕЛУДОЧКА
Двойное отхождение магистральных сосудов от
правого желудочка (ДОСПЖ) представляет собой
порок конотрункуса, при котором оба магистраль-
ных сосуда полностью либо частично отходят от
ПЖ. Некоторые авторы при диагностике предлага-
ют руководствоваться «правилом 50%», однако оно
не имеет клинической значимости [27].
Описано большое количество вариантов ДОСПЖ:
от простых аномалий, похожих на ДМЖП, до слож-
ных аномалий с синдромом гетеротаксии.
Ключевыми анатомическими характеристиками
ДОСПЖ являются наличие ДМЖП, конусной пере-
Тип общего артериального ствола (см. рис. 47.2)
Расположение и диаметр легочного ствола
Отхождение коронарных артерий, их проксимальные
участки
Морфология трункального клапана
Количественная оценка стеноза
Количественная оценка регургитации
Сопутствующий порок
Правосторонняя дуга аорты
Перерыв дуги аорты
Дефект межжелудочковой перегородки
Дефект межпредсердной перегородки
Левая верхняя полая вена
Открытый артериальный проток
ТАБЛИЦА 47.1
Дооперационное эхокардиографическое
исследование пациентов с общим
артериальным стволом
Рис. 47 .3 Общий артериальный ствол. (А) A Новорожденный с общим артериальным стволом. Субкостальная позиция по длинной оси. Видно, что аорта
(Ао) и легочная артерия (ЛА) отходят от корня общего артериального ствола (кОАС). (Б) A Новорожденный с общим артериальным стволом (тип А1 и I по обе-
им классификациям). Косая парастернальная позиция по короткой оси. A — anterior; L — left; L–S
—
left superior; S–P
—
superior posterior; ЛЖ — левый желу-
дочек; ЛЛА — левая легочная артерия; ПЖ — правый желудочек; ПЛА — правая легочная артерия.
S-P
L
A
L-S
ПЖ
кОАС
Ао ЛА
ЛЖ
кОАС
ПЛА
ЛЛА
А
Б
ch47.indd 1213
03.04.2019 12:19:22
1214 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 47 .4 Дуга аорты при общем артериальном стволе. (A) Высокая парастернальная позиция, дуга аорты (Ао) у ребенка с общим артериальным стволом.
(Б) Импульсно-волновая допплерография, дистальный участок дуги аорты. Отмечается пандиастолический ретроградный поток, который возникает из-за отхож-
дения ветвей легочного ствола от корня общего артериального ствола (кОАС). A — anterior; L–S
—
left superior; ЛЛА — левая легочная артерия; НАо — нисхо-
дящий отдел аорты.
Рис. 47 .5 Результаты хирургической коррекции общего артериального ствола. (А) A Апикальная позиция по длинной оси. Дилатация корня общего
артериального ствола (кОАС) у подростка после хирургической коррекции. (Б) ЦДК кровотока отражает умеренную аортальную регургитацию (стрелка). З — за -
плата на дефекте межжелудочковой перегородки; кОАС — корень общего артериального ствола; ЛЖ — левый желудочек; ЛП — левое предсердие.
городки и аномальное расположение устьев маги-
стральных сосудов [28].
Расположение ДМЖП почти всегда одинаково —
в Y-части перегородочно-краевой трабекулы. Рас-
положение ДМЖП относительно корня аорты зави-
сит от ориентации и размера конусной перегородки
и расположения устьев магистральных сосудов (рис.
47.6). На рис. 47.7 представлены взаимоотношения
между ДМЖП и устьями магистральных сосудов
при распространенных вариантах ДОСПЖ. Чаще
всего ДМЖП располагается справа от аорты, т.к. ко-
нусная перегородка крепится к мышечной части пе-
регородки левее и выше ДМЖП, отделяя легочный
ствол от дефекта. В 30% случаев ДМЖП локализу-
ется под легочным стволом, поскольку конусная пе-
регородка смещена вперед и вправо от мышечной
части перегородки, отделяя аорту от дефекта. При
гипоплазии либо отсутствии конусной перегородки
ДМЖП располагается под обоими устьями маги-
стральных сосудов. В редких случаях ДМЖП распо-
лагается далеко от магистральных сосудов и с ними
не связан (это обычно наблюдается при мышечном
либо приточном ДМЖП).
Большую роль также играет расположение маги-
стральных сосудов относительно ДМЖП. Обычно
при подаортальном ДМЖП аорта лежит сзади либо
L-S
A
кОАС
ЛЛА
НАо
Ао
А
Б
кОАС
ЛП
ЛЖ
З
А
Б
ch47.indd 1214
03.04.2019 12:19:22
1215
47 Пороки конотрункуса
«бок о бок» с легочным стволом. При расположении
дефекта под легочным стволом аорта лежит «бок о
бок» с легочным стволом либо перед ним. В редких
случаях аорта находится слева от легочного ствола
(ДОСПЖ {S, D, L}), что делает подлегочный ДМЖП
подаортальным, и наоборот.
Существует 4 самых частых варианта ДОСПЖ,
определяющих клиническую картину и подход к
хирургическому лечению:
1. Вариант ДМЖП: ДОСПЖ с большим подаор-
тальным ДМЖП без стеноза клапана легочной
артерии.
2. Вариант ТФ: ДОСПЖ с подаортальным ДМЖП
и стенозом клапана легочной артерии.
3. Вариант ТМС: ДОСПЖ с подлегочным ДМЖП и
обструкцией аорты или без ее обструкции.
4. Вариант единственного желудочка: ДОСПЖ с
атрезией митрального клапана, дефект предсер-
дно-желудочковой перегородки или другая при-
чина значительной гипоплазии желудочков.
ДОСПЖ с подлегочным ДМЖП, двухсторонней
инфундибулярной частью и, соответственно, от-
хождением легочного ствола от обоих желудочков
называют аномалией Тауссиг–Бинга [29]. Пациентам
с такой аномалией зачастую необходимы повтор-
ные оперативные вмешательства во взрослом воз-
расте для устранения остаточной обструкции в обо-
их выходных трактах [30].
Обструкция выходного тракта при ДОСПЖ воз-
никает в 70% случаев и наиболее часто наблюдается
в легочном стволе [31]. Подклапанный аортальный
стеноз и обструкция дуги аорты встречаются у 50%
пациентов с подлегочным ДМЖП [32]. Наблюдают-
ся также аномалии атриовентрикулярных клапанов,
включающие общий атриовентрикулярный клапан,
«верхом сидящий» атриовентрикулярный клапан и
атрезию одного из атриовентрикулярных клапанов.
Аномалии митрального клапана ассоциируются с
более низкой эффективностью хирургического ле-
чения ДОСПЖ.
Пациентам с ДОСПЖ и атрезией митрального
клапана выполняют паллиативную коррекцию с це-
лью выполнения затем операции Фонтена. ДОСПЖ
также сочетается с дефектом межпредсердной пере-
городки (ДМПП), добавочной верхней полой ве-
ной, атипичным расположением ушек предсердий.
ДОСПЖ широко распространен у пациентов с син-
дромом гетеротаксии с аспленией [33].
Для точной диагностики необходимо углублен-
ное эхокардиографическое исследование структур
сердца. Обычно исследование начинают в субко-
стальной позиции по короткой и длинной осям для
Кондуит между правым желудочком и легочной артерией
Степень стеноза
Степень регургитации
Систолическое давление в правом желудочке
Остаточный дефект межжелудочковой перегородки
Диаметр проксимальных участков ветвей
легочного ствола
Морфология трункального клапана
Степень стеноза
Степень регургитации
Обструкция выходного тракта левого желудочка
Морфология дуги аорты
Размеры и функция желудочков
ТАБЛИЦА 47.2
Послеоперационная эхокардиографическая
оценка пациентов с общим артериальным
стволом
Рис. 47 .6 Анатомическая картина при двойном отхождении магистральных сосудов от правого желудочка. Позиция по короткой оси конусной пере-
городки (КП) при различных вариантах двойного отхождения магистральных сосудов от правого желудочка (ПЖ) и разной локализации дефекта межжелудочко-
вой перегородки (ДМЖП): при подаортальном дефекте (А), при подлегочном дефекте (Б), при локализации дефекта под обоими магистральными сосудами ко-
нусная перегородка отсутствует или гипоплазирована (В). Редкий вариант позиции конусной перегородки при расположении дефекта межжелудочковой перего-
родки далеко от магистральных сосудов представлен на рис. 47.7Г. Ао — аорта; ЛЖ — левый желудочек; ЛС — легочный ствол.
Ао
ЛС
ЛЖ
ПЖ
ЛС
Ао
ЛЖ
ПЖ
КП
ЛЖ
ЛС
Ао
КП
ПЖ
А
Б
В
ДМЖП
ДМЖП
ДМЖП
ch47.indd 1215
03.04.2019 12:19:24
1216 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 47 .7 Расположение дефекта межжелудочковой перегородки и устьев магистральных сосудов при некоторых вариантах двойного отхож-
дения магистральных сосудов от правого желудочка. (А) Подаортальный дефект межжелудочковой перегородки (ДМЖП). (Б) Подлегочный дефект меж-
желудочковой перегородки. (В) Дефект межжелудочковой перегородки под обоими магистральными сосудами. (Г) Дефект межжелудочковой перегородки на уда-
лении от магистральных сосудов. Ао — аорта; КП — конусная перегородка; ЛС — легочный ствол; ПКТ — перегородочно-краевая трабекула; ТК — трикуспи-
дальный клапан [Lopez L: Double outlet ventricles. In Lai WW, Mertens LL, Cohen MS, Geva T, editors. Echocardiography in pediatric and congenital heart disease: from
fetus to adult, 2009, Wiley-Blackwell].
общего обзора анатомии сердца и визуализации со-
единений желудочков с магистральными сосудами
(рис. 47.8) [2]. Дополнительные данные получают в
апикальной позиции (размер и функция атриовен-
трикулярного клапана, наличие мышечного ДМЖП),
парастернальной позиции (полулунный клапан,
анатомия и функция дуги аорты, ветвей легочного
ствола), супрастернальной позиции (дуга аорты, ар-
териальный проток, дополнительные источники
легочного кровотока) [34]. В табл. 47.3 представле-
ны основные анатомические детали, на которые не-
обходимо обратить внимание у пациентов с ДОСПЖ
перед хирургической коррекцией. Важным параме-
тром при подаортальном ДМЖП является расстоя-
КП
ЛС
Ао
ДМЖП
ТК
ПКТ
ЛС
КП ДМЖП
ПКТ
ТК
Ао
ЛС
КП
ЛС
ДМЖП
ДМЖП
ТК
ТК
ПКТ
ПКТ
Ао
Ао
А
Б
Г
В
ch47.indd 1216
03.04.2019 12:19:24
1217
47 Пороки конотрункуса
ние между трикуспидальным клапаном и клапаном
легочной артерии и/или инфундибулярной частью
перегородки, поскольку оно определяет будущий
минимальный диаметр выходного тракта левого
желудочка (ВТЛЖ) после закрытия ДМЖП. От дан-
ного расстояния зависит, удастся ли сконструиро-
вать перегородку между ДМЖП и аортой.
Целью хирургического лечения подаортального
ДМЖП (самого частого варианта ДОСПЖ) является
создание непрерывного соединения ЛЖ и аорты пу-
тем наложения заплаты на ДМЖП. В некоторых
случаях необходимо расширить ДМЖП для созда-
ния адекватного ВТЛЖ [31]. Подклапанный аор-
тальный стеноз может сформироваться в случае,
когда расстояние между трикуспидальным клапа-
ном и клапаном легочной артерии меньше размера
фиброзного кольца аортального клапана, а выход-
ной тракт правого желудочка (ВТПЖ) — в есте-
ственной позиции. При наличии стеноза легочной
артерии обструкцию устраняют путем расширения
ВТПЖ, вальвулотомии либо имплантации кондуи-
та между ПЖ и легочной артерией. Пациентам с
ДОСПЖ и подлегочным ДМЖП выполняют опера-
цию артериального переключения с одновремен-
ным наложением заплаты на ДМЖП и формирова-
нием туннеля. Пациентам с анатомическими ва-
риантами порока, не позволяющими восстановить
функцию обоих желудочков хирургическим путем,
выполняют поэтапную паллиативную операцию
Фонтена [35].
Для достижения долгосрочных результатов лече-
ния пациентов с ДОСПЖ важна эхокардиографиче-
ская оценка остаточных нарушений (табл. 47.4).
Обструкция ВТЛЖ может быть обусловлена не
адекватным закрытием ДМЖП, сужением туннеля,
пролиферацией соединительной ткани в выходном
тракте желудочка, гипоплазией фиброзного кольца
аортального клапана [36, 37]. У пациентов с подаор-
тальным ДМЖП могут наблюдаться остаточные
интрамуральные ДМЖП (рис. 47.9, 47.10). Обычно
они располагаются в трабекулярной части между за-
платой на ДМЖП и свободной стенкой ПЖ, неред-
ко прямо под аортальным клапаном. Такие дефекты
часто не визуализируются сразу после хирургиче-
ской коррекции, но их размеры постепенно увели-
Локализация дефекта межжелудочковой перегородки,
его размер, расположение относительно аортального
клапана и клапана легочной артерии
Морфология конусной перегородки
Расположение магистральных сосудов относительно
друг друга
Сопутствующие пороки сердца
Обструкция выходного тракта
Аномалии атриовентрикулярных клапанов
Гипоплазия желудочков
Отхождение коронарных артерий, их проксимальные
участки
ТАБЛИЦА 47.3
Дооперационная эхокардиографическая
оценка пациентов с двойным
отхождением магистральных
сосудов от правого желудочка
Рис. 47.8 A Двойное отхождение магистральных сосудов от правого желудочка. (А) Субкостальная позиция по длинной оси. Новорожденный с двой-
ным отхождением магистральных сосудов от правого желудочка (ПЖ) и подлегочным дефектом межжелудочковой перегородки (
*
). ДМЖП локализуется напро-
тив легочного ствола (ЛС) из-за смещения конусной перегородки (острие стрелки) кпереди и вправо. (Б) ЦДК кровотока того же пациента. L — left; S–P
—
su-
perior posterior; Ао — аорта; ЛЖ — левый желудочек.
L
S-P
ПЖ
Ао
ЛС
ЛЖ
*
А
Б
ch47.indd 1217
03.04.2019 12:19:24
1218 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Остаточный ДМЖП, включая мышечный (см. рис. 47.9)
Подклапанный аортальный стеноз
Подклапанный стеноз легочной артерии
Регургитация на клапане легочной артерии
Размеры и функция желудочков
Функция атриовентрикулярных клапанов
(особенно после их коррекции)
После реконструкции дуги аорты
Морфология дуги аорты и степень обструкции
После операции артериального переключения
Регургитация на неоаортальном клапане
Подклапанный аортальный стеноз
Расширение корня неоаорты
Подклапанный стеноз легочной артерии либо стеноз
проксимальных участков ветвей легочного ствола
ДМЖП — дефект межжелудочковой перегородки.
ТАБЛИЦА 47.4
Послеоперационная эхокардиографическая
оценка пациентов с двойным
отхождением магистральных сосудов
от правого желудочка
чиваются по мере регресса гипертрофии ПЖ. Такие
межжелудочковые дефекты очень сложно диагно-
стировать любым методом визуализации, поэтому
врачу нужно проявлять высокую степень насторо-
женности. Часто эти дефекты удается закрыть чрес
кожно с помощью окклюдеров, используемых для
устранения сброса крови слева направо. Даже после
успешной хирургической коррекции может пона-
добиться повторное вмешательство для закрепле-
ния передней части заплаты в другом месте [38, 39].
ДВОЙНОЕ ОТХОЖДЕНИЕ МАГИСТРАЛЬНЫХ
СОСУДОВ ОТ ЛЕВОГО ЖЕЛУДОЧКА
Двойное отхождение магистральных сосудов от ЛЖ
(ДОСЛЖ) представляет собой чрезвычайно редкий
порок конотрункуса, при котором аорта и легочный
ствол отходят от ЛЖ. Патология во многом похожа
на ДОСПЖ. До первого описания ДОСЛЖ в 1967 г.
ее существование считали маловероятным [40]. С
тех пор описано не менее 15 различных анатомиче-
ских вариантов [41].
Рис. 47 .9 Интрамуральные дефекты межжелудочковой перегородки. (А) Заплата на дефекте межжелудочковой перегородки, направляющая кровь из
левого желудочка в аорту (Ао), подшита к трабекулярной части стенки правого желудочка. (Б) Кровь может проходить между трабекулами (стрелки) из рекон-
струированного выходного тракта левого желудочка в полость правого желудочка. После хирургической коррекции расстояния между трабекулами небольшие из-
за гипертрофии правого желудочка, но по мере регресса гипертрофии эти расстояния увеличиваются и становятся гемодинамически значимыми. В этом случае
нужна повторная операция. (В) Замена заплаты с перемещением на новое место и надежное подшивание к свободной стенке правого желудочка. ЛС — легоч-
ный ствол [Preminger TJ, Sanders SP, van der Velde ME, et al. “Intramural” residual interventricular defects after repair of conotruncal malformations. Circulation 89:236–
242, 1994].
Заплата
Ао
ЛС
Ао
Ао
А
Б
В
ch47.indd 1218
03.04.2019 12:19:25
1219
47 Пороки конотрункуса
Примерно в 75% случаев ДОСЛЖ есть два нор-
мально сформированных желудочка, а в остальных
случаях наблюдаются атрезия трикуспидального или
митрального клапана, двуприточный ЛЖ либо тя-
желая аномалия Эбштейна. Большинству пациен-
тов с ДОСЛЖ диагноз ставят в детском возрасте, од-
нако описаны наблюдения этой патологии у взрос-
лых, которым не выполнили коррекцию [42].
Наиболее частым видом является ДОСЛЖ {S, D,
D} с подаортальным ДМЖП (рис. 47.11) и стенозом
легочной артерии (тетрадоподобный тип). ДМЖП
в 10% случаев располагается под легочным стволом,
а в 6% случаев— под обоими магистральными со-
судами. Может отмечаться обструкция выходного
тракта: в 25% случаев— подлегочная (физиология
схожа с ТФ), в 4% случаев — подаортальная. Другие
анатомические варианты порока встречаются реже.
При адекватном развитии обоих желудочков па-
тофизиологическая картина зависит от взаимного
расположения ДМЖП и магистральных сосудов, а
ЛЖ
ПЖ
ЛП
ВТЛЖ
Рис. 47 .10 A Интрамуральный дефект межжелудочковой перегород-
ки. На ЧПЭхоКГ виден интрамуральный дефект межжелудочковой перегород-
ки (стрелки) у пациента с двойным отхождением магистральных сосудов от
правого желудочка. ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый
желудочек; ЛП — левое предсердие; ПЖ — правый желудочек.
Рис. 47.11 Двойное отхождение магистральных сосудов от левого желудочка. МРТ сердца в режиме турбо-спин-эхо у ребенка с двойным отхождени-
ем магистральных сосудов от левого желудочка (ЛЖ) и левой верхней полой веной (ЛВПВ), которая дренируется в коронарный синус (КС). Ао — аорта;
ДМЖП — дефект межжелудочковой перегородки; ЛС — легочный ствол; ЛП — левое предсердие; ПЖ — правый желудочек.
ПЖ
ЛЖ
ЛС
КС
ЛС
ЛЖ
ПЖ
ЛП
ЛП
Ао
Ао
ЛВПВ
ДМЖП
ДМЖП
ch47.indd 1219
03.04.2019 12:19:25
1220 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
также наличия либо отсутствия обструкции выход-
ного тракта. Например, у пациентов с ДОСЛЖ {S,
D, D} и подаортальным ДМЖП без обструкции
ВТЛЖ будет отмечаться легкий либо умеренный
цианоз с гиперволемией малого круга кровообра-
щения (как при ТМС с ДМЖП без стеноза легочной
артерии). Напротив, пациенты с подлегочным ДМЖП
обычно имеют нормальную сатурацию, однако у них
развивается сердечная недостаточность из-за боль-
шого сброса крови слева направо. Пациенты с об-
струкцией ВТПЖ имеют цианоз, как при ТФ, а при
обструкции ВТЛЖ либо стенозе дуги аорты возмо-
жен шок в неонатальном периоде из-за неадекват-
ного сердечного выброса.
Диагностика ДОСЛЖ аналогична диагностике
ДОСПЖ. В субкостальной позиции по длинной и
короткой осям визуализируется анатомия сердца и
соединения желудочков с магистральными сосуда-
ми. Дополнительную информацию можно полу-
чить в апикальной, парастернальной и супрастер-
нальной позициях, как при ДОСПЖ.
Хирургические подходы при ДОСЛЖ и ДОСПЖ
также аналогичны и зависят от внутрисердечной
анатомии [43].
Рис. 47 .12 A Врожденная корригированная транспозиция магистральных сосудов. Субкостальная позиция по длинной оси (А) и по короткой оси (Б–
Г). Ребенок с врожденной корригированной транспозицией магистральных сосудов {S, D , L}. Визуализируется длинный подаортальный мышечный конус (крас-
ная стрелка), который разделяет аортальный и митральный клапаны (Б). В данном случае есть два дефекта межжелудочковой перегородки (желтые стрелки): ти-
пичный конусно-желудочковый дефект (В) и передний дефект между подаортальным мышечным конусом и правым желудочком (ПЖ) (Г). L — left; P — poste-
rior; S — superior; S–P
—
superior posterior; Ао — аорта; ЛC — легочный ствол; ЛЖ — левый желудочек.
Хирургические методы коррекции ДОСЛЖ:
1. Закрытие ДМЖП заплатой и имплантация конду-
ита между ПЖ и легочной артерией.
2. Закрытие ДМЖП заплатой со смещением легоч-
ного ствола к ПЖ.
3. Формирование туннеля от ПЖ к легочному ство-
лу через ДМЖП с возможным расширением де-
фекта.
4. Паллиативное вмешательство — одножелудоч-
ковая коррекция (операция Фонтена).
Большую роль в лечении данной группы паци-
ентов в долгосрочном периоде играет послеопера-
ционная ЭхоКГ.
ВРОЖДЕННАЯ КОРРИГИРОВАННАЯ ТРАНСПОЗИЦИЯ
МАГИСТРАЛЬНЫХ СОСУДОВ
Врожденная КТМС — редкий ВПС, при котором на-
блюдается нормальное соединение магистральных
сосудов с желудочками (конкордантное желудочко-
во-артериальное соединение), но есть патологиче-
ские особенности соединений (рис. 47.12, 47.13).
При наиболее частом анатомическом варианте
этого порока — {S, D, L} — легочный ствол отходит
S
P
S
P
S
P
S-P
L
ПЖ
ЛЖ
ЛС
ПЖ
ЛЖ
ПЖ
ЛЖ
ЛЖ
ПЖ
Ао
А
Б
Г
В
ch47.indd 1220
03.04.2019 12:19:26
1221
47 Пороки конотрункуса
Рис. 47 .13 Магнитно-резонансная томография сердца после хирургической коррекции врожденной корригированной транспозиции магистраль-
ных сосудов {S, D, L}. (А) Аксиальная проекция отражает восходящий отдел аорты, расположенной слева и кпереди от бифуркации легочного ствола (ЛС).
(Б) Позиция по короткой оси. Отхождение коронарных артерий от аорты (Ао), которая расположена слева и кпереди от легочного ствола. Обе коронарные арте-
рии отходят от передней поверхности синуса, но правая коронарная артерия (ПКА) проходит кпереди от выходного тракта правого желудочка (ВТПЖ), ограничи-
вая возможности хирургического вмешательства. (В) При трехмерной реконструкции видны суженный выходной тракт правого желудочка, выходной тракт лево-
го желудочка (ВТЛЖ) и подаортальный мышечный конус. ЛКА — левая коронарная артерия; ЛЛА — левая легочная артерия; ПЛА — правая легочная артерия.
от ПЖ, подлегочный мышечный конус недостаточ-
но развит, а аорта отходит от ЛЖ и связана с боль-
шим подаортальным мышечным конусом. Данный
анатомический вариант был впервые упомянут в
1895 г. Теремином, а в 1971 г. подробно описан Ван
Праагом. В крайне редких случаях врожденную
КТМС {S, D, L} без сопутствующих аномалий диа-
гностируют случайно, поскольку нет симптомов
[44]. Зачастую есть ДМЖП и стеноз легочной арте-
рии. Описаны хорошие результаты хирургического
закрытия ДМЖП с устранением стеноза легочной
артерии.
Однако встречается и другой вариант врожден-
ной КТМС {S, L, D}, при котором есть дискордант-
ное предсердно-желудочковое соединение и кон-
кордантное желудочково-артериальное соединение,
что приводит к цианозу, т.к. кровь из полых вен те-
чет в ПП, а затем — в расположенный справа ЛЖ и
в аорту, а кровь из легочных вен попадает в левое
предсердие (ЛП), расположенный слева ПЖ и легоч-
ный ствол. В данном случае необходимо выполнить
операцию предсердного переключения для устране-
ния дискордантного предсердно-желудочкового со-
единения, а также для закрытия ДМЖП и устране-
ния обструкции выходного тракта (при ее нали-
чии).
ЭхоКГ при врожденной КТМС крайне необходи-
мо, т.к. практически при каждом варианте присут-
ствуют два ДМЖП: (1) отточный (в Y-части пере-
городочно-краевой трабекулы); (2) мышечный (вы-
сокий дефект в передней области мышечной части
перегородки между подаортальным мышечным ко-
нусом и ПЖ).
ДЕФЕКТ АОРТОЛЕГОЧНОЙ ПЕРЕГОРОДКИ
Дефект аортолегочной перегородки, или аортоле-
гочное окно, — это редкий ВПС, при котором есть
сообщение между легочным стволом и внутрипери-
кардиальной частью восходящего отдела аорты и
два полулунных клапана — аортальный клапан и
клапан легочной артерии. Примерно в 50% случаев
порок сочетается с правосторонней дугой аорты, пе-
рерывом дуги аорты типа А, аномальным отхожде-
нием коронарной артерии от легочного ствола, ТФ,
ТМС, ДМЖП либо отхождением правой легочной
артерии от аорты. У детей обычно наблюдаются
симптомы сердечной недостаточности и легочной
гипертензии. Дефект аортолегочной перегородки
лучше всего визуализируется в парастернальной
позиции по короткой оси (рис. 47.14), субкосталь-
ной либо супрастернальной позиции. Качественная
ЭхоКГ позволяет провести дифференциальную ди-
агностику дефекта аортолегочной перегородки и
других шунтов между аортой и легочной артерией,
в частности открытого артериального протока, от-
хождения ветви легочного ствола от аорты (геми-
трункус). Для отображения сброса крови слева на-
право через дефект аортолегочной перегородки ис-
пользуют цветовое допплеровское картирование
кровотока. Уже на первом году жизни легочная ги-
пертензия может стать необратимой, поэтому край-
не важна своевременная диагностика. Пациентам с
небольшим дефектом аортолегочной перегородки
его можно закрыть чрескожным методом. Большие
дефекты обычно закрывают при открытом опера-
тивном вмешательстве. Техника хирургического ле-
чения зависит от клиники и опыта хирургов.
Backer и Mavroudis описали 22 наблюдения де-
фекта аортолегочной перегородки за 40 лет работы
в одном центре [45]. Из 16 пациентов, которым вы-
полнили коррекцию дефекта аортолегочной пере-
городки, 5 пациентов умерли в раннем послеопера-
ционном периоде и 1 — в отдаленном периоде из-
за легочной гипертензии (смертность 37%). Среди
6 пациентов, которым дефект закрыли заплатой че-
рез аорту, летальных исходов не было.
В редких случаях дефект аортолегочной перего-
родки диагностируют во взрослом возрасте. Есть
сообщения об успешной коррекции порока у этих
пациентов, но перед оперативным вмешательством
необходимо провести функциональные и фармако-
логические тесты на обратимость высокого легоч-
ного сосудистого сопротивления [46]. Взрослые па-
циенты, которым дефект аортолегочной перегород-
ПЛА
Ао
ЛЛА
ЛС
Ао
ПКА
ЛКА
ВТПЖ
ВТЛЖ
Конус
А
Б
В
ch47.indd 1221
03.04.2019 12:19:26
1222 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ки закрыли в детском возрасте, должны проходить
периодический осмотр для исключения рецидива
порока, стеноза восходящего отдела аорты, стеноза
легочной артерии и легочной гипертензии.
ЗАКЛЮЧЕНИЕ
Пороки конотрункуса зачастую сложно диагности-
ровать, т.к. каждый дефект имеет несколько анато-
Рис. 47 .14 A Дефект аортолегочной перегородки. (А) Парастернальная позиция по короткой оси. Визуализируется дистальное расположение дефекта аор-
толегочной перегородки возле бифуркации легочного ствола (ЛС). (Б) При ЦДК кровотока виден антеградный поток через дефект аортолегочной перегородки в
дистальной части легочного ствола и проксимальном участке его ветвей. Ао — аорта; ЛЛА — левая легочная артерия; ПЛА — правая легочная артерия.
ПЛА
Ао
ЛС
ЛЛА
А
Б
Порок
Эхокардиографическая картина
Послеоперационная эхокардиографическая оценка
Общий артериаль-
ный ствол
Общий артериальный ствол, от него
берут начало коронарные артерии,
легочные артерии и артерии боль-
шого круга кровообращения
Кондуит между ПЖ и легочной артерией
Определение степени стеноза
Определение степени регургитации
Измерение систолического давления в ПЖ
Остаточный ДМЖП
Диаметр проксимальных участков ветвей легочного ствола
Морфология трункального клапана
Степень стеноза трункального клапана
Степень регургитации на трункальном клапане
Обструкция ВТЛЖ
Морфология дуги аорты
Размеры и функция желудочков
СВОДНАЯ ИНФОРМАЦИЯ
Пороки конотрункуса
мических вариантов. Полное эхокардиографиче-
ское исследование имеет большое значение, по-
скольку тактика хирургического лечения зависит от
анатомических особенностей конкретного пациен-
та. Пациенты с пороком конотрункуса должны на-
блюдаться на протяжении всей своей жизни. Важно
контролировать диаметр и функции аорты, т.к. для
данной группы заболеваний характерно развитие
аортопатии.
ch47.indd 1222
03.04.2019 12:19:27
1223
47 Пороки конотрункуса
Порок
Эхокардиографическая картина
Послеоперационная эхокардиографическая оценка
Двойное отхождение
магистральных
сосудов от ПЖ
Оба магистральных сосуда полно-
стью либо частично отходят
от ПЖ
Сопутствующие патологии:
• ДМЖП
• Обструкция выходного тракта
• Аномалии атриовентрикулярных
клапанов
• Синдром гетеротаксии
Остаточные ДМЖП, включая интрамуральные (см. рис. 47 .7)
Подклапанный аортальный стеноз
Подклапанный стеноз легочной артерии
Регургитация на клапане легочной артерии
Размеры и функция желудочков
Функция атриовентрикулярных клапанов (особенно у пациен-
тов после коррекции ДПЖП)
Для пациентов, которые перенесли реконструкцию дуги аорты:
• Морфология дуги аорты и степень обструкции
Для пациентов, которые перенесли коррекцию транспозиции
магистральных сосудов:
• Регургитация на неоаортальном клапане
• Надклапанный аортальный стеноз
Дилатация корня неоаорты
Надклапанный стеноз легочной артерии либо стеноз ветвей
легочного ствола
Двойное отхождение
магистральных
сосудов от ЛЖ
Оба магистральных сосуда полно-
стью либо частично отходят
от ЛЖ
Сопутствующие патологии:
• ДМЖП
• Обструкция выходного тракта
• Аномалии атриовентрикулярных
клапанов
Остаточные ДМЖП, включая интрамуральные (см. рис. 47 .7)
Подклапанный аортальный стеноз
Подклапанный стеноз легочной артерии
Регургитация на клапане легочной артерии
Размеры и функция желудочков
Функция атриовентрикулярных клапанов (особенно у пациен-
тов после коррекции ДПЖП)
Для пациентов, которые перенесли реконструкцию дуги аорты:
• Морфология дуги аорты и степень обструкции
Для пациентов, которые перенесли коррекцию транспозиции
магистральных сосудов:
• Регургитация на неоаортальном клапане
• Надклапанный аортальный стеноз
Дилатация корня неоаорты
Надклапанный стеноз легочной артерии либо стеноз ветвей
легочного ствола
Врожденная корриги-
рованная транспо-
зиция магистраль-
ных сосудов
Магистральные сосуды отходят
от желудочков в правильном
порядке (ЛС — от ПЖ, Ао —
от ЛЖ), однако есть атипичное
соединение с желудочками
(подаортальный мышечный конус,
гипоплазированный или отсут-
ствующий подлегочный мышеч-
ный конус)
Сопутствующие патологии:
• ДМЖП
• Обструкция выходного тракта
• Предсердно-желудочковая
дискордантность
Зависит от вида хирургической коррекции
Остаточные ДМЖП
Размеры и функция желудочков
При операции предсердного переключения:
• Обструкция внутрипредсердных туннелей
• Отсутствие герметичности на уровне внутрипредсердных
туннелей
Дефект аортолегоч-
ной перегородки
Сообщение между ЛС и внутрипе-
рикардиальной частью восходя-
щего отдела аорты с двумя полу-
лунными клапанами
Остаточный дефект
Стеноз восходящего отдела аорты
Стеноз легочной артерии
Легочная гипертензия
Ао — аорта; ВТЛЖ — выходной тракт левого желудочка; ДМЖП — дефект межжелудочковой перегородки; ДПЖП — дефект предсердно-
желудочковой перегородки; ЛЖ — левый желудочек; ЛС — легочный ствол; ПЖ — правый желудочек.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Пороки конотрункуса
ch47.indd 1223
03.04.2019 12:19:28
1224 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ЛИТЕРАТУРА
1. Hutson MR, Kirby ML. Model systems for
the study of heart development and disease.
Cardiac neural crest and conotruncal malfor-
mations, Semin Cell Develop Biol 18:101–110,
2007.
2. Sanders SP, Bierman FZ, Williams RG. Cono-
truncal malformations: diagnosis in infancy us-
ing subxiphoid 2-dimensional echocardiogra-
phy, Am J Cardiol 50:1361–1367, 1982.
3. Johnson TR. Conotruncal cardiac defects: a
clinical imaging perspective, Pediatr Cardiol
31:430–437, 2010.
4. Pasquini L, Sanders SP, Parness I, et al. Echo-
cardiographic and anatomic findings in atrio-
ventricular discordance with ventriculoarterial
concordance, Am J Cardiol 62:1256–1262,
1988.
5. Frank L, Dillman JR, Parish V, et al. Cardio-
vascular MR imaging of conotruncal anoma-
lies, Radiographics 30:1069–1094, 2010.
6. Schleich JM, Abdulla T, Summers R, Houyel
L. An overview of cardiac morphogenesis,
Arch Cardiovasc Dis 106:612–623, 2013.
7. Bajolle F, Zaffran S, Kelly RG, et al. Rota-
tion of the myocardial wall of the outflow
tract is implicated in the normal position-
ing of the great arteries, Circ Res 98:421–
428, 2006.
8. Yeager SB, Sanders SP. Echocardiographic
identification of thymic tissue in neonates
with congenital heart disease, Am Heart J
129:837–839, 1995.
9. Vogels A, Schevenels S, Cayenberghs R, et al.
Presenting symptoms in adults with the
22q11 deletion syndrome, Eur J Med Genet
57:157–162, 2014.
10. de Souza KR, Mergener R, Huber J, et al. Cy-
togenomic evaluation of subjects with syn-
dromic and nonsyndromic conotruncal heart
defects, BioMed Res Int 2015:401941, 2015.
11. Trippel A, Pallivathukal S, Pfammatter JP, et
al. Dimensions of the ascending aorta in
conotruncal heart defects, Pediatr Cardiol
35:831–837, 2014.
12. Tan JL, Davlouros PA, McCarthy KP, et al. In-
trinsic histological abnormalities of aortic
root and ascending aorta in tetralogy of Fal-
lot: evidence of causative mechanism for aor-
tic dilatation and aortopathy, Circulation
112:961–968, 2005.
13. Niwa K, Siu SC, Webb GD, Gatzoulis MA.
Progressive aortic root dilatation in adults late
after repair of tetralogy of Fallot, Circulation
106:1374–1378, 2002.
14. Mongeon FP, Gurvitz MZ, Broberg CS, et al.
Aortic root dilatation in adults with surgical-
ly repaired tetralogy of fallot: a multicenter
cross-sectional study, Circulation 127:172–
179, 2013.
15. Schwartz ML, Gauvreau K, del Nido P, et al.
Long-term predictors of aortic root dilation
and aortic regurgitation after arterial switch
operation, Circulation 110(11 Suppl 1):II128–
II132, 2004.
16. Carlo WF, McKenzie ED, Slesnick TC. Root
dilation in patients with truncus arteriosus,
Congenit Heart Dis 6:228–233, 2011.
17. Frischhertz BP, Shamszad P, Pedroza C, et al.
Thoracic aortic dissection and rupture in
conotruncal cardiac defects: a population-
based study, Int J Cardiol 184:521–527, 2015.
18. Goldstein SA, Evangelista A, Abbara S, et al.
Multimodality imaging of diseases of the tho-
racic aorta in adults: from the American So-
ciety of Echocardiography and the European
Association of Cardiovascular Imaging: en-
dorsed by the Society of Cardiovascular
Computed Tomography and Society for Car-
diovascular Magnetic Resonance, J Am Soc
Echocardiogr 28:119–182, 2015.
19. Lopez L, Colan SD, Frommelt PC, et al. Rec-
ommendations for quantification methods
during the performance of a pediatric echo-
cardiogram: a report from the Pediatric Mea-
surements Writing Group of the American
Society of Echocardiography Pediatric and
Congenital Heart Disease Council, J Am Soc
Echocardiogr 23:465–495, 2010. quiz 576–467.
20. Jacobs ML. Congenital Heart Surgery No-
menclature and Database Project: truncus ar-
teriosus, Annals Thorac Surg 69 (Suppl 4):
S50–S55, 2000.
21. Locatelli G, Alfieri O, Villani M, et al. Surgi-
cal treatment of truncus arteriosus in the 1st
year of life, Chirurgie pediatrique 21:89–94,
1980.
22. Lopes LM, Silva JP, Fonseca L, et al. Atypical
truncus arteriosus operated at 28 years of age:
importance of differential diagnosis, Arquiv-
os Brasileiros Cardiologia 97:e29–e32, 2011.
23. Guenther F, Frydrychowicz A, Bode C, Geibel
A. Cardiovascular flashlight. Persistent trun-
cus arteriosus: a rare finding in adults, Eur
Heart J 30:1154, 2009.
24. Abid D, Daoud E, Kahla SB, et al. Unrepaired
persistent truncus arteriosus in a 38-year-old
woman with an uneventful pregnancy, Car-
diovasc J Afr 26(4):e6–e8, 2015.
25. Kaza AK, Burch PT, Pinto N, et al. Durability
of truncal valve repair, Ann Thorac Surg
90:1307–1312, 2010. discussion 1312.
26. Lev M, Bharati S, Meng CC, et al. A concept
of double-outlet right ventricle, J Thorac Car-
diovasc Surg 64:271–281, 1972.
27. Wilcox BR, Ho SY, Macartney FJ, et al. Sur-
gical anatomy of double-outlet right ventricle
with situs solitus and atrioventricular concor-
dance, J Thorac Cardiovasc Surg 82:405–417,
1981.
28. Anderson RH, Becker AE, Wilcox BR, et al.
Surgical anatomy of double-outlet right ven-
tricle—a reappraisal, Am J Cardiol 52:555–
559, 1983.
29. Van Praagh R. What is the Taussig-Bing mal-
formation? Circulation 38:445–449, 1968.
30. Schwarz F, Blaschczok HC, Sinzobahamvya
N, et al. The Taussig-Bing anomaly: long-
term results, Eur J Cardiothorac Surg 44:821–
827, 2013.
31. Belli E, Serraf A, Lacour-Gayet F, et al. Biven-
tricular repair for double-outlet right ventri-
cle. Results and long-term follow-up, Circu-
lation 98 (Suppl 19):II360–II365, 1998. dis-
cussion II365–367.
32. Takeuchi K, McGowan Jr. FX, Moran AM, et
al. Surgical outcome of double-outlet right
ventricle with subpulmonary VSD, Annals
Thorac Surg 71:49–52, 2001. discussion 52–43.
33. Artrip JH, Sauer H, Campbell DN, et al. Bi-
ventricular repair in double outlet right ven-
tricle: surgical results based on the STS-
EACTS International Nomenclature classifi-
cation, Eur J Cardiothorac Surg 29:545–550,
2006.
34. Hagler DJ, Tajik AJ, Seward JB, et al. Double-
outlet right ventricle: wide-angle two-dimen-
sional echocardiographic observations, Circu-
lation 63:419–428, 1981.
35. Ruzmetov M, Rodefeld MD, Turrentine MW,
Brown JW. Rational approach to surgical
management of complex forms of double
outlet right ventricle with modified Fontan
operation, Congenit Heart Dis 3:397–403,
2008.
36. Aoki M, Forbess JM, Jonas RA, et al. Result
of biventricular repair for double-outlet right
ventricle, J Thorac Cardiovasc Surg 107:338–
349, 1994. discussion 349–350.
37. Chaitman BR, Grondin CM, Theroux P,
Bourassa MG. Late development of left ven-
tricular outflow tract obstruction after repair
of double-outlet right ventricle, J Thorac Car-
diovasc Surg 72:265–268, 1976.
38. Preminger TJ, Sanders SP, van der Velde ME,
et al. “Intramural” residual interventricular
defects after repair of conotruncal malforma-
tions, Circulation 89:236–242, 1994.
39. Patel JK, Glatz AC, Ghosh RM, et al. Intra-
mural ventricular septal defect is a distinct
clinical entity associated with postoperative
morbidity in children after repair of
conotruncal anomalies, Circulation 132:
1387–1394, 2015.
40. Sakakibara STA, Arai T, Hashimoto A, Nogi
M. Both great vessels arising from the left
ventricle (double outlet left ventricle) (origin
of both great vessels from the left ventricle),
Bull Heart Inst Jap 66–86, 1967.
41. Van Praagh R, Weinberg PM, Srebro JP.
Double-outlet left ventricle. In Moss AJ, Ad-
ams FH, Emmanouilides GC, editors: Heart
disease in infants, children, and adolescents, ed
3, Baltimore, MD, 1988, Williams & Wilkins.
42. Karavelioglu Y, Turan B, Karapinar H. Non-
invasive diagnosis of an adult patient with
double-outlet left ventricle, Eur J Cardiotho-
rac Surg 40:e154–e155, 2011.
43. Bharati S, Lev M, Stewart R, et al. The mor-
phologic spectrum of double outlet left ven-
tricle and its surgical significance, Circulation
58(3 Pt 1):558–565, 1978.
44. Blume ED, Chung T, Hoffer FA, Geva T. Im-
ages in cardiovascular medicine. Anatomical-
ly corrected malposition of the great arteries
[S, D, L], Circulation 97:1207, 1998.
45. Backer CL, Mavroudis C. Surgical manage-
ment of aortopulmonary window: a 40-year
experience, Eur J Cardiothorac Surg 21:773–
779, 2002.
46. Aggarwal SK, Mishra J, Sai V, et al. Aortopul-
monary window in adults: diagnosis and
treatment of late-presenting patients, Conge-
nit Heart Dis 3:341–346, 2008.
ch47.indd 1224
03.04.2019 12:19:28
1225
48 Транспозиция
магистральных сосудов
JASON F. DEEN, MD • ERIC V. KRIEGER, MD
Полная транспозиция
магистральных сосудов
Хирургическая тактика
Обследование пациентов после операции
Врожденная корригированная
транспозиция магистральных
сосудов
Анатомия и определение
Отдаленные результаты
и эхокардиографическая оценка
ПОЛНАЯ ТРАНСПОЗИЦИЯ
МАГИСТРАЛЬНЫХ СОСУДОВ
Полная транспозиция магистральных сосудов (ТМС),
или ТМС с D-петлей (D-ТМС), — это довольно рас-
пространенный цианотический врожденный порок
сердца (ВПС), который составляет 5–7% общего ко-
личества ВПС и встречается у 3 детей на 10 000 жи-
ворожденных, чаще у мальчиков. При полной ТМС
есть два разобщенных круга кровообращения: в ма-
лом круге кровообращения циркулирует оксигени-
рованная кровь, а в большом круге — неоксигени-
рованная. При естественном течении порока смерт-
ность в первый год после рождения отмечается
практически в 100% случаев [1].
В большинстве наблюдений полной ТМС у боль-
ных нормальный системный венозный возврат,
правильно расположенные предсердия и атриовен-
трикулярные (АВ) сообщения. Аорта обычно отхо-
дит от морфологически правого желудочка (ПЖ)
спереди и справа от легочного ствола, который от-
ходит от морфологически левого желудочка (ЛЖ).
Приблизительно в 50% случаев у пациентов с
полной ТМС есть сопутствующие пороки, включая
дефект межжелудочковой перегородки (ДМЖП),
обструкцию выходного тракта левого желудочка
(ВТЛЖ) (подлегочный стеноз) и аномалии коро-
нарных артерий (табл. 48.1). На степень хирургиче-
ского риска и на отдаленные результаты лечения
могут повлиять сопутствующие заболевания [2–4].
В этой главе внимание сосредоточено на взрос-
лых пациентах, которые в детстве перенесли кор-
рекцию полной ТМС. Пренатальная эхокардиогра-
фия (ЭхоКГ), неонатальная диагностика, периопе-
рационная эхокардиографическая оценка порока
описаны в других изданиях [5, 6].
ХИРУРГИЧЕСКАЯ ТАКТИКА
Новорожденные с полной ТМС жизнеспособны толь-
ко при условии попадания определенного объема
оксигенированной крови в артерии большого круга
кровообращения. Смешивание крови происходит
на уровне предсердий, поэтому данной группе па-
циентов показана экстренная баллонная атриосеп-
тостомия перед выполнением основного хирурги-
ческого вмешательства.
Цель оперативного лечения заключается в воз-
вращении аорты и легочного ствола в нормальную
анатомическую позицию для создания двух объеди-
ненных кругов кровообращения, одного — для по-
ступления оксигенированной крови в аорту, второ-
го — для поступления неоксигенированной крови в
легочный ствол. В зависимости от сопутствующих
пороков, опыта и предпочтений клиники применя-
ют одну из нескольких техник коррекции полной
ТМС (табл. 48.2).
Операцию предсердного переключения Мастар-
да или Сеннинга широко применяли с 1960-х до на-
чала 1990-х гг ., когда стали активно внедрять опера-
цию артериального переключения [7, 8]. В настоя-
щее время операцию предсердного переключения
у пациентов с полной ТМС не выполняют, однако
на данный момент есть большая когорта взрослых
пациентов, которые перенесли эту операцию в ран-
нем детстве. Суть операции предсердного переклю-
чения состоит в формировании внутрипредсердных
туннелей, перенаправляющих венозную кровь из
большого круга кровообращения налево, к ми-
тральному клапану и ЛЖ, а кровь из легочных
вен — к трикуспидальному клапану и системному
ПЖ (рис. 48.1, 48.2). После данной операции у па-
циентов исчезает цианоз, однако ПЖ и трикуспи-
ch48.indd 1225
03.04.2019 12:19:44
1226 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Тип дефекта
Частота (%) Примечания
ДМЖП
40–45
Чаще всего наблюдается перимембранозный ДМЖП. Мышечный ДМЖП зачастую гемодина-
мически не значим. Приточный ДМЖП может быть обусловлен «верхом сидящим»
атриовентрикулярным клапаном. Смещение ДМЖП кпереди (anterior malalignment) ассоции-
руется с обструкцией ВТПЖ и гипоплазией аорты. Смещение ДМЖП кзади (posterior
malalignment) ассоциируется с обструкцией ВТЛЖ и гипоплазией легочной артерии
Аномалии
коронарных
артерий
35
Наиболее распространено отхождение левой коронарной артерии от левого синуса
Вальсальвы, правой — от правого синуса Вальсальвы. У 14% пациентов огибающая артерия
отходит от правого синуса Вальсальвы. У 8% пациентов есть единственная правая коронар-
ная артерия. Аномалии отхождения коронарных артерий могут создавать технические труд-
ности при их реимплантации во время операции артериального переключения
Обструкция
ВТЛЖ
20–30
К возможным причинам обструкции ВТЛЖ относят наличие подлегочной фиброзно-мышеч -
ной мембраны, смещение ДМЖП кзади (posterior malalignment), аномальное прикрепление
сухожильных хорд митрального клапана к межжелудочковой перегородке, асимметричную
гипертрофию перегородки
Аномалии
дуги аорты,
коарктация
аорты
5
Наиболее характерны для пациентов с двойным отхождением магистральных сосудов
от ПЖ с гемодинамикой транспозиции магистральных сосудов (аномалия Тауссиг–Бинга)
ВТЛЖ — выходной тракт левого желудочка; ВТПЖ — выходной тракт правого желудочка; ДМЖП — дефект межжелудочковой перего-
родки; ПЖ — правый желудочек.
ТАБЛИЦА 48.1 Частота сопутствующих пороков сердца у пациентов с полной транспозицией магистральных сосудов
дальный клапан остаются структурами большого
круга кровообращения, а во внутрипредсердных
туннелях могут сформироваться дефекты либо
участки стеноза, что ограничивает наполнение же-
лудочков во время диастолы. Все это приводит к
увеличению заболеваемости и смертности среди
пациентов, которым провели операцию предсерд-
ного переключения.
Операция артериального переключения была
разработана и впервые выполнена в 1970-х гг., но
не находила широкого применения до 1990-х гг . [9,
10]. Задачи операции предельно просты — реим-
плантация коронарных артерий и мобилизация ле-
гочных артерий, однако техника трудна, поскольку
операцию необходимо провести ребенку в первые
дни после рождения. Отдаленные результаты на-
много превосходят таковые после операции пред-
сердного переключения [11, 12]. Среди осложнений
отмечают коронарную ишемию, надклапанный сте-
ноз легочной артерии, дилатацию корня аорты и
аортальную регургитацию.
Пациентам с полной ТМС, ДМЖП и обструкци-
ей ВТЛЖ нередко выполняют операцию Растелли.
Суть вмешательства заключается в наложении за-
платы на ДМЖП, перенаправляющей оксигениро-
ванную кровь из ЛЖ в аорту через ДМЖП, и им-
плантации кондуита между ПЖ и легочной артери-
ей. Положительные аспекты операции — устранение
цианоза, позиционирование ЛЖ как системного и
отсутствие необходимости реимплантации коро-
нарных артерий. Однако дети растут, и размер кон-
дуита становится недостаточным, а повторные опе-
рации увеличивают риск осложнений после рестер-
нотомии. У взрослых пациентов после операции
Растелли возможна дисфункция кондуита, желу-
дочков и негерметичность заплаты на ДМЖП.
ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ ПОСЛЕ ОПЕРАЦИИ
ОБСЛЕДОВАНИЕ ПОСЛЕ ОПЕРАЦИИ
ПРЕДСЕРДНОГО ПЕРЕКЛЮЧЕНИЯ
Несмотря на недостатки операции предсердного пе-
реключения Мастарда или Сеннинга (ПЖ и трику-
спидальный клапан функционируют в большом
круге кровообращения) и проблемы с внутрипред-
сердными туннелями, ранние и ближайшие отда-
ленные результаты были отличными. В одном ис-
следовании 132 пациентов, которым выполнили опе-
рацию Сеннинга, периоперационная летальность
составила 5% (период наблюдения 10 лет), 95% де-
тей имели нормальную систолическую функцию
ПЖ, включенного в большой круг кровообраще-
ния, и лишь у некоторых отмечалась трикуспидаль-
ная регургитация. Однако после 20 лет большин-
ство пациентов нуждались в повторном оператив-
ном вмешательстве из-за резкого снижения функции
желудочков, особенно у лиц с сопутствующими по-
роками, например ДМЖП или обструкцией ВТЛЖ
(рис. 48.3) [13].
Пациенты, перенесшие операцию предсердного
переключения, имеют склонность к брадиаритмиям
и тахиаритмиям. Дисфункция синусового узла по-
сле хирургической коррекции отмечается более чем
в 50% случаев, что, вероятно, обусловлено рубцами
ch48.indd 1226
03.04.2019 12:19:44
1227
48 Транспозиция магистральных сосудов
ТАБЛИЦА 48.2 Коррекция полной транспозиции магистральных сосудов
Название/эпоним
Описание
Схема
Отдаленные осложнения
Операция предсерд-
ного переключения
(операция Мастарда
или Сеннинга)
Создают внутрипредсердные
туннели для перенаправле-
ния крови из полых вен
через митральный клапан
в ЛЖ, а из легочных вен
через трикуспидальный
клапан в ПЖ
Систолическая дисфункция ПЖ
в большом круге кровообращения
Трикуспидальная регургитация
Негерметичность внутрипредсерд-
ных туннелей
Стеноз внутрипредсердного
туннеля ВПВ
Предсердная аритмия
Внезапная смерть
Операция артериаль-
ного переключения
(операция Жатене,
включая маневр
ЛеКомпта)
Аорту и легочный ствол пере-
секают выше синусов.
Аорту смещают кзади
к клапану легочной артерии,
а легочный ствол соединяют
с корнем аорты. Коронарные
артерии реимплантируют
в корень неоаорты
Окклюзия коронарных артерий,
ишемия миокарда
Дилатация корня неоаорты
Регургитация на неоаортальном
клапане
Надклапанный стеноз легочной
артерии
Надклапанный аортальный стеноз
Стеноз ветвей легочного ствола
Операция Растелли
Выполняют у пациентов
с полным ТМС, ДМЖП
и обструкцией ВТЛЖ
(подлегочным стенозом).
С помощью заплаты на
ДМЖП кровь перенаправ-
ляют в аорту. Клапан легоч-
ной артерии ушивают
и имплантируют кондуит
между ПЖ и легочной
артерией
Стеноз кондуита либо регургитация
на кондуите между ПЖ и легочной
артерией
Гипертензия и дисфункция ПЖ
из-за обструкции кондуита
Повторная имплантация кондуита
Остаточное шунтирование
через заплату на ДМЖП
ВПВ — верхняя полая вена; ВТЛЖ — выходной тракт левого желудочка; ДМЖП — дефект межжелудочковой перегородки; ЛА — левая
артерия; ЛЖ — левый желудочек; ПЖ — правый желудочек; ТМС — транспозиция магистральных сосудов.
Кондуит
между ПЖ и ЛА
Заплата
на ДМЖП
и швами, наложенными на предсердия при форми-
ровании внутрипредсердных туннелей [2, 14, 15].
5–10% пациентов нужна имплантация кардиости-
мулятора, что может оказаться технически слож-
ным или способствовать развитию в дальнейшем
стеноза либо обструкции верхней полой вены
(ВПВ). После операции предсердного переключе-
ния также распространены реципрокные тахиарит-
мии. Пациенты без структурных нарушений сердца
обычно хорошо переносят суправентрикулярную
тахикардию, но у пациентов после операции пред-
сердного переключения наблюдается обратная кар-
тина. Внутрипредсердные туннели, созданные при
операции предсердного переключения, имеют жест-
кую структуру с высоким сопротивлением, что
ограничивает их способность обеспечивать адекват-
ch48.indd 1227
03.04.2019 12:19:44
1228 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ную преднагрузку ПЖ. В результате сердце не мо-
жет увеличить ударный объем во время тахикардии
независимо от сократительной способности мио-
карда [16]. Именно по этой причине реципрокную
предсердную тахикардию у пациентов после опера-
ции предсердного переключения связывают с ри-
ском внезапной смерти [13, 17]. Данной группе па-
циентов рекомендуется периодическое проведение
электрокардиографии и холтеровского суточного
мониторирования в амбулаторных условиях. Нали-
ПЖ
ПЖ
ЛЖ
ЛЖ
Туннель
для крови
из полых вен
Туннель
для крови
из легочных
вен
Туннель для крови
из легочных вен
А
Б
Рис. 48.1 Путь движения венозной крови после операции предсердного переключения (операция Мастарда) у пациента с полной транспозици-
ей магистральных сосудов. (A) A Внутрипредсердный туннель (
*
). (Б) A ЦДК кровотока отражает низкую скорость потока (стрелка) через внутрипредсерд-
ный туннель, характерную для венозного кровотока. КЛА — клапан легочной артерии; ПЖ — правый желудочек (системный); ПП — правое предсердие.
Рис. 48.2 Возврат крови по легочным венам по внутрипредсердному туннелю после операции предсердного переключения у пациента с пол-
ной транспозицией магистральных сосудов. (A) A Апикальная четырехкамерная позиция. (Б) A МРТ сердца. ЛЖ — левый желудочек (подлегочный); ПЖ —
правый желудочек (системный).
ПП
КЛА
ПЖ
А
Б
*
ch48.indd 1228
03.04.2019 12:19:45
1229
48 Транспозиция магистральных сосудов
p < 0,001
100
80
60
40
20
0
0
5
10152025303540
К
у
м
у
л
я
т
и
в
н
а
я
в
ы
ж
и
в
а
е
м
о
с
т
ь
(
%
)
66
23
31
6
71
35
79
58
91
91
Длительность наблюдения (годы)
Выживаемость в популяции Голландии
Выживаемость с ТМС без трансплантации сердца
Выживаемость без событий
Количество пациентов в группе риска
чие в анамнезе предсердной аритмии либо желудоч-
ковой тахикардии связано с неблагоприятным про-
гнозом [18].
Большое значение после коррекции полной ТМС
имеет оценка у пациента толерантности к физиче-
ской нагрузке. У пациентов со сниженной толерант-
ностью прогноз хуже, чем у пациентов без жалоб
[17]. Однако у многих пациентов с ВПС часто на-
блюдается выраженное несоответствие между субъ-
ективным ощущением переносимости физической
нагрузки и функциональным состоянием, выявляе-
мым инструментально [19], т.е . проведение нагру-
зочных тестов позволяет выявить нарушения даже
у пациентов, которые считают себя здоровыми [20].
После операции предсердного переключения воз-
можно нарушение вентиляции легких или ее неэф-
фективность (VE/VCO2 ≥ 35,4) либо снижение аэроб-
ной мощности (максимальное поглощение кисло-
рода < 52%), что свидетельствует о повышенном
риске госпитализации либо летального исхода [21].
ЭхоКГ в послеоперационном периоде проводят с
целью:
1. Определить степень стеноза и герметичности
внутрипредсердных туннелей.
2. Качественно и полуколичественно оценить
систолическую функцию ПЖ, включенного в
большой круг кровообращения.
3. Оценить степень и механизм трикуспидальной
регургитации.
4. Оценить наличие и степень обструкции ВТЛЖ
(подлегочный стеноз).
5. Измерить систолическое давление в ЛЖ
и легочной артерии.
6. Оценить остаточное шунтирование.
Осложнения, связанные
с внутрипредсердным туннелем
Стеноз внутрипредсердного туннеля. После опе-
рации предсердного переключения могут наблю-
даться осложнения, связанные с внутрипредсерд-
ным туннелем, что является наиболее частым пока-
занием к повторному оперативному вмешательству.
Процент осложнений зависит от критериев, ис-
пользуемых для постановки диагноза «стеноз вну-
трипредсердного туннеля». Частичная обструкция
системного венозного кровотока (градиент давле-
ния > 3 мм рт. ст.) встречается более чем в 35% слу-
чаев, причем после операции Мастарда чаще, чем
после операции Сеннинга [2, 22, 23].
К другим факторам риска стеноза внутрипред-
сердного туннеля относят наличие трансвенозных
электродов от кардиостимуляторов или дефибрил-
ляторов [24]. Обструкция внутрипредсердного тун-
неля большого круга кровообращения практически
всегда локализуется в области ВПВ. У пациентов мо-
гут быть признаки синдрома ВПВ, но у многих они
отсутствуют ввиду того, что непарная вена перена-
правляет больший объем крови в сердце через ниж-
нюю полую вену (НПВ). Обструкция кровотока по
легочным венам наблюдается лишь у 5% пациен-
тов. Несмотря на высокую частоту стеноза внутри-
предсердного туннеля ВПВ, в большинстве случаев
достаточно консервативного лечения без повтор-
ных оперативных вмешательств даже при полной
обструкции ВПВ. Однако при наличии клинических
симптомов обструкции внутрипредсердного тунне-
ля рекомендуется хирургическое лечение.
Кроме того, поскольку такой туннель существен-
но ограничивает преднагрузку на сердце, особенно
во время физической нагрузки, стеноз внутрипред-
сердного туннеля может проявляться в виде непере-
носимости физической нагрузки, выраженной ги-
потензии во время нее и даже обморока [25]. Совре-
менные технологии позволяют успешно устранять
большинство стенозов внутрипредсердного тунне-
ля чрескожно: баллонной пластикой и стентирова-
нием. Перед стентированием электроды кардиости-
мулятора извлекают, чтобы предотвратить их по-
вреждение [26, 27].
Стеноз внутрипредсердного туннеля сложно оце-
нить с помощью трансторакальной эхокардиогра-
фии (ТТЭхоКГ), особенно у взрослых пациентов
(чувствительность < 20%) [29, 30]. Обычно исполь-
зуют альтернативные методы визуализации.
Просвет внутрипредсердного туннеля ВПВ дол-
жен быть не менее 0,8 см при оценке в 2D-режиме,
а просвет внутрипредсердного туннеля НПВ — не-
много больше [23, 28]. При диаметре внутрипред-
сердного туннеля < 0,5 см делают заключение о на-
Рис. 48.3 Кривые выживаемости Kaplan-Meier после операции Ма-
старда. Кривая выживаемости без событий отражает пациентов без таких не-
желательных событий, как трансплантация сердца, повторные вмешательства,
клинически значимые аритмии, сердечная недостаточность и смерть. Выжива-
емость без трансплантации сердца сравнивали с выживаемостью в популяции
Голландии. ТМС — транспозиция магистральных сосудов [Cuypers JA, Eind-
hoven JA, Slager MA, et al The natural and unnatural history of the Mustard proce-
dure: long-term outcome up to 40 years. Eur Heart J 35:1666–1674, 2014].
ch48.indd 1229
03.04.2019 12:19:45
1230 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
личии стеноза [23]. ВПВ визуализируют с помощью
ТТЭхоКГ в супрастернальной позиции, а при цвето-
вом допплеровском картировании (ЦДК) кровотока
может определяться ускорение потока (это специ-
фический, но не чувствительный метод диагности-
ки обструкции внутрипредсердного туннеля). Спек-
тральная допплерография позволяет определить
степень обструкции по градиенту давления. Значе-
ния в пределах от 3 до 5 мм рт. ст. являются гемоди-
намически значимыми для венозной системы. При
обструкции ВПВ может определяться ретроградный
поток в непарной вене. Следует учитывать, что
вследствие обструкции ВПВ отток крови от верхней
половины туловища идет через непарную вену, и
градиент определяться не будет. При подозрении на
обструкцию следует провести пробу с пузырьковым
контрастированием, которую считают положитель-
ной при появлении пузырьков в НПВ [6].
Динамическая магнитно-резонансная томогра-
фия (МРТ) сердца помогает диагностировать стеноз
внутрипредсердного туннеля, измерить его диаметр
и провести трехмерную реконструкцию. При оцен-
ке направления потока в непарной вене в качестве
эталона используют нисходящий отдел аорты —
поток по вене является ретроградным, если он про-
тивоположен потоку в аорте. При каудальном на-
правлении потока по непарной вене следует заподо-
зрить стеноз устья ВПВ.
Обструкция путей возврата крови от легких на-
блюдается редко. Место стеноза практически всегда
располагается между правыми легочными венами и
свободной стенкой правого предсердия (ПП) [28].
Обструкция оттока по легочным венам проявляет-
ся в виде легочной гипертензии, отека легких, сни-
жения толерантности к физической нагрузке. В боль-
шинстве случаев нужно открытое оперативное вме-
шательство, однако описаны успешная баллонная
пластика и стентирование [26, 31].
Несостоятельность внутрипредсердного тунне-
ля. Несостоятельность внутрипредсердного тунне-
ля — это наличие дефекта между туннелем, обеспе-
чивающим возврат венозной крови из большого
круга кровообращения, и туннелем, обеспечиваю-
щим возврат артериальной крови по легочным ве-
нам. Направление потока зависит от соотношения
давлений в желудочках. У большинства взрослых
пациентов после операции предсердного переклю-
чения отмечается дилатация ПЖ и его дисфункция,
в результате в ПЖ возникает более высокое диасто-
лическое давление. В данной ситуации происходит
сброс крови из легочных вен в венозную систему
большого круга кровообращения, и цианоз не по-
является. Шунтирование диагностируют с помо-
щью ЦДК кровотока в апикальной четырехкамер-
ной позиции с наклоном датчика кзади. Чаще всего
шунтирование наблюдается на стыке двух внутри-
предсердных туннелей. Для подтверждения нали-
чия шунтирования может понадобиться проба с пу-
зырьковым контрастированием (пузырьки не дол-
жны появиться в ПЖ, включенном в большой круг
кровообращения). Наличие шунта приводит обыч-
но к перегрузке объемом венозного ЛЖ и сниже-
нию сердечного выброса. Важно учитывать, что на-
правление потока через шунт во время физической
нагрузки меняется и это приводит к десатурации.
Наличие эритроцитоза может натолкнуть на мысль
о несостоятельности внутрипредсердного туннеля
[32]. При несостоятельности есть риск парадоксаль-
ной эмболии, особенно у пациентов с электродами
кардиостимулятора, установленными трансвенозно
[33]. Стеноз внутрипредсердного туннеля и/или его
несостоятельность чаще отмечаются в области ВПВ,
чем в области НПВ [26]. Гемодинамически значи-
мые шунты можно устранить с помощью стентов
или специальных устройств — окклюдеров для де-
фекта межпредсердной перегородки [32]. Хирурги-
ческое закрытие дефекта выполняют под контролем
чреспищеводной эхокардиографии (рис. 48.4) или
внутрисердечной эхокардиографии.
Функции правого желудочка
и трикуспидального клапана
У пациентов с полной ТМС после операции пред-
сердного переключения ПЖ выполняет функцию
ЛЖ, качая кровь в аорту. Многие ранние исследова-
ния показали, что даже через 10 лет после операции
предсердного переключения у большинства паци-
ентов функциональное состояние ПЖ остается нор-
мальным. На основании этого были сделаны выво-
ды об эффективности операции [34]. Однако со вре-
Рис. 48.4 A Несостоятельность внутрипредсердного туннеля у паци-
ента с полной транспозицией магистральных сосудов после опера-
ции предсердного переключения. На 3D-ЧПЭхоКГ видны два места негер-
метичности (стрелки) внутрипредсердного туннеля (изображение с венозной
стороны, включенной в большой круг кровообращения). ВПВ — верхняя полая
вена (предоставлено Brian Soriano, MD).
ВПВ
ch48.indd 1230
03.04.2019 12:19:45
1231
48 Транспозиция магистральных сосудов
ПЖ
ЛЖ
Рис. 48.5 A Пациент с полной транспозицией магистральных сосудов
после операции предсердного переключения. Визуализация в парастер-
нальной позиции по короткой оси. Обратите внимание на выбухающую меж-
желудочковую перегородку в результате перегрузки давлением правого желу-
дочка (ПЖ) (системный). ЛЖ — левый желудочек (подлегочный).
менем систолическая функция ПЖ ухудшается, а
к четвертому десятилетию у 25% пациентов после
операции Мастарда развивается сердечная недоста-
точность [2, 13]. В ходе длительного (> 40 лет) на-
блюдения 91 пациента после операции предсердно-
го переключения у большинства из них была обна-
ружена систолическая дисфункция ПЖ. В среднем
возрасте 14 лет 69% пациентов имели нормальную
систолическую функцию ПЖ, но к 36 годам только
у 2% пациентов функция ПЖ оставалась сохран-
ной. В отдаленном периоде у 23% пациентов была
легкая дисфункция ПЖ, у 60% — умеренная, у
15% — тяжелая [2]. Согласно некоторым исследова-
ниям, к факторам риска дисфункции ПЖ также
относят более старший возраст на момент коррек-
ции порока, наличие трикуспидальной регургита-
ции и ДМЖП [2, 13, 35]. По данным некоторых ис-
следователей, сохранность функции ПЖ после опе-
рации Сеннинга несколько выше, но это не было
подтверждено в дальнейшем [13].
Количественная оценка функции ПЖ, включен-
ного в большой круг кровообращения, с помощью
ЭхоКГ достаточно сложна. При выполнении ЭхоКГ
разными специалистами отмечается низкая воспро-
изводимость таких параметров, как фракция выбро-
са (ФВ) ПЖ и фракция укорочения ПЖ, поэтому
данные параметры имеют ограниченное использо-
вание при динамическом наблюдении пациента [36].
Фракция изменения площади плохо коррелирует с
величиной ФВ, полученной при МРТ (r2 = 0,2), дру-
гие показатели имеют еще более слабую корреля-
цию [37]. Трехмерная ЭхоКГ (3D-ЭхоКГ) повышает
точность визуализации, но ее проводят редко, т.к.
необходимо специальное программное обеспечение
и много времени [38].
В клинической практике для эхокардиографиче-
ской оценки функции ПЖ после операции пред-
сердного переключения чаще всего используют ка-
чественные критерии. В парастернальной позиции
по короткой оси отмечаются увеличение и гипер-
трофия ПЖ, а межжелудочковая перегородка неред-
ко выбухает в сторону ЛЖ, что приводит к его сдав-
лению (рис. 48.5). Однако для описания нормаль-
ной функции ПЖ в большом круге кровообращения
стандартные значения функциональных параме-
тров еще не выработаны.
В большом поперечном исследовании взрослых
пациентов после операции Мастарда средняя фрак-
ция изменения площади ПЖ составила 25%, систо-
лическое смещение фиброзного кольца трикуспи-
дального клапана — 1,3 см, средняя скорость s′ —
7,5 см/сек, что совпадает с результатами других
исследований [39, 40]. Обратите внимание: данные
значения ниже границы нормы для ПЖ в обычной
позиции и получены в популяции пациентов, име-
ющих аномальную систолическую функцию ПЖ,
включенного в большой круг кровообращения [2].
В сравнении с остальными количественными пара-
метрами систолическое смещение фиброзного коль-
ца трикуспидального клапана имеет самую сильную
корреляцию с клинической картиной и толерантно-
стью к физической нагрузке [40]. Значения ФВПЖ,
полученные с помощью ЭхоКГ, обычно ниже тех,
которые регистрируются при МРТ сердца [41].
Трикуспидальная регургитация
После операции предсердного переключения три-
куспидальный клапан функционирует как атриовен-
трикулярный (АВ) клапан большого круга крово-
обращения. Так же, как и дисфункция ПЖ, три-
куспидальная регургитация с течением времени
прогрессирует. Тяжелая трикуспидальная регургита-
ция в подростковом периоде наблюдается лишь у 2%
пациентов, в то время как в четвертом десятиле-
тии — уже у 38% пациентов[2]. Появление трику-
спидальной регургитации связано с дисфункцией
ПЖ, но существуют различные мнения о том, явля-
ется трикуспидальная регургитация следствием ди-
латации фиброзного кольца или первичной неспо-
собности трикуспидального клапана функциониро-
вать в условиях высокого давления в большом круге
кровообращения. Дисфункция ПЖ обычно предше-
ствует появлению трикуспидальной регургитации,
т.е. можно сделать вывод, что трикуспидальная ре-
гургитация после операции предсердного переклю-
чения, скорее всего, вторична по отношению к дила-
тации желудочка. Данная ситуация отличается от
ситуации с врожденной корригированной транспо-
зицией магистральных сосудов, при которой исход-
но есть морфологические нарушения трикуспидаль-
ного клапана и первичная трикуспидальная регурги-
тация, которые ускоряют развитие дисфункции ПЖ.
Вероятный механизм появления трикуспидаль-
ной регургитации связан со смещением перегород-
ки влево из-за перегрузки давлением ПЖ. Это
способствует расхождению створок клапана и про-
воцирует регургитацию и правожелудочковую не-
ch48.indd 1231
03.04.2019 12:19:46
1232 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
достаточность. В подобных ситуациях некоторые
центры рекомендуют операцию по дозированному
сужению легочного ствола для увеличения постна-
грузки на ЛЖ и смещения перегородки вправо. Дан-
ная методика у одних пациентов приводила к умень-
шению степени трикуспидальной регургитации и
улучшению функционального статуса пациентов, у
других вмешательство ассоциировалось с высоким
хирургическим риском и приводило к дисфункции
ЛЖ [42, 43]. Таким образом, операция по дозиро-
ванному сужению легочного ствола выступает в
качестве паллиативного вмешательства, и в настоя-
щее время ее выполняют редко.
При оценке трикуспидальной регургитации при-
меняют комплексный подход, включая спектраль-
ную допплерографию и ЦДК кровотока с оценкой
потока по легочным венам. Следует учитывать, что
трикуспидальный клапан выступает в качестве АВ-
клапана большого круга кровообращения, поэтому
скорость потока через клапан нельзя использовать
для оценки давления в легочной артерии.
Обструкция выходного тракта левого желудочка
Обструкция ВТЛЖ наблюдается у пациентов с пол-
ной ТМС часто (20–30%). После операции предсерд-
ного переключения обструкция ВТЛЖ функцио-
нально представляет собой подлегочный стеноз.
Описаны различные механизмы обструкции, вклю-
чая изолированную подлегочную фиброзно-мышеч-
ную мембрану, смещение ДМЖП кзади (posterior
malalignment), аномальное прикрепление сухожиль-
ных хорд митрального клапана к межжелудочковой
перегородке, гипертрофию этой перегородки и па-
радоксальное систолическое движение передней
створки митрального клапана. У некоторых паци-
ентов обструкция ВТЛЖ улучшает клиническое со-
стояние после операции предсердного переключе-
ния, создавая дополнительную постнагрузку на
ЛЖ, поддерживая срединное положение межжелу-
дочковой перегородки и предотвращая развитие
трикуспидальной регургитации [13].
Стеноз ВТЛЖ оценивают с помощью 2D-ЭхоКГ
и допплерографии. Импульсно-волновую доппле-
рографию в апикальной позиции используют для
определения уровня обструкции. Для измерения
максимального мгновенного градиента давления
следует использовать непрерывно-волновую доп-
плерографию. Обратите внимание, что для оценки
систолического давления в легочной артерии при
обструкции ВТЛЖ максимальный мгновенный гра-
диент давления следует вычесть из градиента дав-
ления струи митральной регургитации.
ОБСЛЕДОВАНИЕ ПОСЛЕ ОПЕРАЦИИ
АРТЕРИАЛЬНОГО ПЕРЕКЛЮЧЕНИЯ
При операции артериального переключения аорту
и легочный ствол пересекают над клапанами. Затем
аорту смещают кзади и создают анастомоз с корнем
легочного ствола, который после этого называют
корнем неоаорты. Легочный ствол перемещают кпе-
реди, а его бифуркацию перекидывают через вос-
ходящий отдел аорты (маневр ЛеКомпта) (рис. 48.6),
а затем создают анастомоз между легочным стволом
и корнем аорты (после этого аортальный клапан на-
зывают неолегочным клапаном). С технической точ-
ки зрения наиболее сложной частью операции явля-
ется реимплантация коронарных артерий в корень
неоаорты, что может привести к их травме либо
перегибу.
Операция артериального переключения стала опе-
рацией выбора при полной ТМС в большинстве
хирургических центров с начала 1990-х гг . Предпо-
чтительность операции артериального переключе-
ния перед операцией предсердного переключения
очевидна: ЛЖ и митральный клапан включены в
большой круг кровообращения. Тем не менее опе-
рация является технически сложной из-за необхо-
димости реимплантации коронарных артерий, пе-
ремещения бифуркации легочного ствола, а также
проведения внутрисердечного этапа для устранения
сопутствующих дефектов [10, 44]. По мере накопле-
ния опыта результаты вмешательств улучшились.
В настоящее время периоперационная смертность
составляет < 3% у пациентов без сопутствующих
пороков. Хирургический риск выше у пациентов с
сопутствующими патологиями, аномалиями коро-
нарных артерий, а также у тех, кому необходима
реконструкция дуги аорты [12, 45].
Несмотря на технические трудности, отдаленные
результаты операции артериального переключения
лучше, чем после операций Мастарда и Сеннинга.
Среди 95% пациентов, которые выживают в течение
первого года после операции, отдаленная смертность
ПЛА
Ао
ЛЛА
Рис. 48.6 Маневр ЛеКомпта у пациента с полной транспозицией ма-
гистральных сосудов при операции артериального переключения.
При магнитно-резонансной томографии с контрастированием визуализируется
бифуркация легочного ствола, которая располагается над аортой (Ао) после
маневра ЛеКомпта (этапа операции артериального переключения). Обратите
внимание на стеноз правой легочной артерии (ПЛА). ЛЛА — левая легочная
артерия.
ch48.indd 1232
03.04.2019 12:19:46
1233
48 Транспозиция магистральных сосудов
составляет < 1% [12]. По прошествии 20 лет после
операции артериального переключения практиче-
ски все пациенты имеют сердечную недостаточ-
ность функционального класса (ФК) I по NYHA, в
то время как после операции Мастарда 58% пациен-
тов имеют сердечную недостаточность ФК II или III
по NYHA. Примерно 40% пациентов после опе-
рации предсердного переключения необходима им-
плантация кардиостимулятора, чего не наблюда-
ется после операции артериального переключения
[11, 46].
К сожалению, никто из пациентов со сложным
ВПС не может быть полностью излечен хирургиче-
ским способом. Операция артериального переклю-
чения не является исключением из этого правила.
Существует ряд осложнений, которые могут воз-
никнуть в отдаленном периоде и при которых по-
надобится повторное вмешательство (табл. 48.3).
При ЭхоКГ в послеоперационном периоде оце-
нивают дилатацию корня неоаорты, регургитацию
на неоаортальном клапане, стеноз легочного ствола
и его ветвей, нарушения локальной сократимости,
свидетельствующие об ишемической болезни серд-
ца, и функцию ЛЖ.
Корень неоаорты
После операции артериального переключения ко-
рень неоаорты подвержен риску дилатации под воз-
действием системного артериального давления, по-
скольку стенка легочного ствола не способна выдер-
живать такое давление. В отдаленном периоде у
большинства пациентов после вмешательства отме-
чается умеренное расширение корня неоаорты [47].
Через 15 лет после операции < 50% пациентов име-
ют нормальный диаметр корня неоаорты, лишь у
5% отмечается его расширение > 4 см [48, 49]. Темп
дилатации корня неоаорты у детей достаточно мал:
около 1,6 мм в год, учитывая общесоматический
рост [49]. У взрослых после прекращения роста ско-
рость развития дилатации корня неоаорты снижа-
ется до 0,31 мм в год, лишь у 11% взрослых она со-
ставляет > 1 мм в год. Расширение корня неоаорты
до 5 см отмечается у 5% пациентов. Расслоение и
разрыв неоаорты наблюдаются крайне редко. Суще-
ствует неподтвержденная гипотеза, что расслоение
неоаорты после операции артериального переклю-
чения является менее фатальным событием, т.к . нео-
аорта стабилизирована рубцом и рядами швов в зо-
не анастомоза, что предотвращает ретроградное рас-
пространение расслоения к коронарным артериям
либо сосудам головы и шеи.
Неоаортальный клапан оценивают с помощью
2D-ТТЭхоКГ в парастернальной позиции по длин-
ной оси и в М-режиме [50]. Следует отметить, что в
педиатрической практике в большинстве случаев
аорту измеряют во время систолы, в то время как у
взрослых — во время диастолы, когда результаты
измерений наиболее воспроизводимы. Крайне важ-
но учитывать это при переходе пациента от детско-
го кардиолога к взрослому. Врач должен тщательно
измерить аорту и последовательно сравнить полу-
ченные изображения с предыдущими.
Регургитация на неоаортальном клапане
После операции артериального переключения кла-
пан легочной артерии функционирует в аортальной
позиции, в связи с чем на нем может возникнуть ре-
гургитация. К факторам риска относят наличие ре-
гургитации на момент выписки, ДМЖП, двухствор-
чатого неоаортального клапана, несоответствие ди-
аметров легочного ствола и аорты [10, 49, 51].
Через 15 лет после операции умеренная или тя-
желая регургитация отмечается в 3–25% случаев [49,
51, 52], очень тяжелая регургитация наблюдается
крайне редко. Через 20 лет после операции менее 5%
пациентов нуждаются в повторной операции из-за
дисфункции неоаортального клапана [51].
Регургитацию на неоаортальном клапане оцени-
вают в нескольких позициях, включая парастер-
нальную по короткой и длинной осям, а также в
апикальной позиции. Степень регургитации помо-
гает определить ЦДК кровотока. При спектральной
допплерографии следует оценивать скорость убы-
вания и плотность сигнала, а также обращать вни-
мание на изменение направления потока в нисходя-
щем отделе аорты.
Стеноз легочного ствола и его ветвей
Стеноз легочного ствола после операции артериаль-
ного переключения развивается спустя 20 лет более
чем у 50% пациентов и служит наиболее частой
причиной повторных оперативных вмешательств
[52]. Отмечают две наиболее распространенные
локализации стеноза: (1) в зоне анастомоза легоч-
ного ствола и корня аорты; (2) дистальнее места
бифуркации легочного ствола при натяжении его
ветвей во время маневра ЛеКомпта.
Стеноз легочного ствола может развиться после
удаления коронарных артерий из корня аорты и им-
плантации их в корень неоаорты. Это приводит к
Отдаленные осложнения
Частота (%)
Надклапанный стеноз легочной артерии
10
Надклапанный аортальный стеноз
5
Дилатация корня неоаорты
>75
Регургитация на неоаортальном клапане
≈50
Обструкция коронарных артерий
2–7
[Villafane J, Lantin-Hermoso MR, Bhatt AB, et al. D -transposition of the
great arteries: the current era of the arterial switch operation. J Am Coll
Cardiol 64:498–511, 2014.]
ТАБЛИЦА 48.3 Осложнения после операции
артериального переключения
ch48.indd 1233
03.04.2019 12:19:46
1234 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
сужению неолегочного клапана, особенно при пол-
ной резекции синусов с коронарными артериями. В
этом случае необходима пластика заплатой неоле-
гочного клапана. В случае неполной резекции сину-
сов риск надклапанного стеноза ниже [53, 54]. При
надклапанном стенозе легочного ствола иногда по-
могает баллонная дилатация.
Стеноз ветвей легочного ствола может возникать
из-за проведения маневра ЛеКомпта. Поскольку по-
сле операции бифуркация смещается кпереди, ее
визуализация с помощью ЭхоКГ затруднена. Ветви
можно оценить в верхней парастернальной пози-
ции либо в супрастернальной позиции (рис. 48.7).
При стенозе одной ветви иногда может отмечаться
низкий градиент давления из-за перенаправления
потока в другую ветвь. Периферический стеноз вет-
вей легочного ствола оценивают с помощью других
методов визуализации. При МРТ сердца или радио-
нуклидном исследовании перфузии миокарда мож-
но выявить асимметричную перфузию легких. Ге-
модинамически значимый стеноз одной ветви ле-
гочного ствола приводит к тому, что не менее 70%
кровотока поступает в легкое на противоположной
стороне. Периферический стеноз обычно успешно
устраняют путем имплантации стентов.
При наличии стеноза ветви легочного ствола оп-
ределить давление в дистальном ее участке по ско-
рости трикуспидальной регургитации бывает край-
не сложно.
Осложнения, связанные с реимплантацией
коронарных артерий
Реимплантация коронарных артерий — наиболее
технически сложный этап операции артериального
переключения, особенно у пациентов с аномалиями
коронарных артерий, встречающимися в 35% слу-
чаев. Проблемы, связанные с коронарными артери-
ями, являются одной из наиболее частых причин
ранней послеоперационной летальности (в течение
первого года жизни).
Риск развития поздних и клинически значимых
осложнений, связанных с реимплантацией коро-
нарных артерий, не определен. Стеноз коронарных
артерий после операции артериального переключе-
ния отмечается у 5–7% пациентов [10, 52, 55].
У взрослых пациентов, которые перенесли хи-
рургическую коррекцию в детском возрасте, редко
наблюдаются спонтанные проблемы с коронарны-
ми артериями. В одном исследовании с периодом
наблюдения 20 лет отмечено, что ишемическая бо-
лезнь сердца развилась у 5% оперированных [52,
56]. Практически все осложнения проявляются в
первый год жизни, второй пик симптомов прихо-
дится на подростковый возраст.
Оптимальная тактика наблюдения не определе-
на, большинство центров не проводят коронарную
ангиографию рутинно. Вызвать подозрение о за-
болевании коронарных артерий может нарушение
локальной сократимости миокарда в покое либо
систолическая дисфункция ЛЖ. Большинство кли-
ник проводят функциональные стресс-тесты для
допуска пациентов к участию в спортивных сорев-
нованиях [57]. Стресс-эхокардиография выступает
оптимальным методом диагностики, а при отклоне-
нии ее результатов от нормы следует проводить
катетеризацию сердца либо компьютерную томо-
графическую ангиографию для исключения стеноза
или окклюзии устьев коронарных артерий.
ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ ПОСЛЕ ОПЕРАЦИИ РАСТЕЛЛИ
Операцию Растелли проводят пациентам с полной
ТМС, ДМЖП, а также с обструкцией ВТЛЖ (подле-
гочным стенозом). Заплату накладывают на ДМЖП,
перенаправляя в аорту обогащенную кислородом
Рис. 48.7 ЦДК кровотока и спектральная допплерография после операции артериального переключения у пациента с полной транспозицией
магистральных сосудов. (A) ЦДК кровотока в ветвях легочного ствола, которые располагаются над аортой (Ао) после маневра ЛеКомпта. (Б) Спектральная
допплерография показывает умеренное ускорение потока через правую легочную артерию (ПЛА). ЛЛА — левая легочная артерия.
ПЛА
Ао
ЛЛА
А
Б
ch48.indd 1234
03.04.2019 12:19:46
1235
48 Транспозиция магистральных сосудов
кровь. Нативный клапан легочной артерии ушива-
ют, а для оттока крови из правых отделов сердца
имплантируют кондуит между ПЖ и легочной ар-
терией, который обеспечивает поступление крови в
легкие (см. табл. 48.2), ЛЖ включается в большой
круг кровообращения, а ПЖ — в малый круг кро-
вообращения. После операции у пациентов исчеза-
ет цианоз. К поздним осложнениям, особенно при
необходимости расширения ДМЖП во время опе-
рации, относят дисфункцию кондуита между ПЖ и
легочной артерией, остаточное шунтирование через
ДМЖП и полную АВ-блокаду сердца. В последнее
время все большее количество хирургов предпочи-
тают выполнять операцию Никайдо с реконструк-
цией путей оттока крови из ПЖ для профилактики
обструкции выходного тракта в более позднем пе-
риоде.
У пациентов после операции Растелли дисфунк-
ция кондуита, в частности его стеноз, встречается
часто. Большинству пациентов проводят повтор-
ную операцию до достижения ими взрослого воз-
раста, но 40% пациентов нуждаются в повторном
вмешательстве уже в раннем детстве [58]. При по-
вторных операциях со стернотомией повышается
риск развития спаечной болезни и возможного сра-
стания кондуита с задней поверхностью грудины.
ЭхоКГ кондуита зачастую затруднительна. Как
правило, кондуит сильно смещен кпереди, поэтому
для его визуализации нужно позиционировать дат-
чик под острым углом. При плохой визуализации в
2D-режиме и ЦДК кровотока следует провести не-
прерывно-волновую допплерографию в супрастер-
нальной позиции с помощью датчика Pedoff. В нор-
ме максимальная скорость потока через кондуит
составляет 2–3 м/сек. При скорости > 4 м/сек следу-
ет заподозрить значительный стеноз. Регургитация
на кондуите наблюдается реже, чем стеноз. В боль-
шинстве случаев у взрослых пациентов возможно
лечение чрескожными методами, включая транска-
тетерную имплантацию клапана.
После операции Растелли возможен стеноз ВТЛЖ
из-за недостаточного исходного размера ДМЖП.
При визуализации ВТЛЖ врач должен помнить, что
у данных пациентов аорта расположена кпереди,
поэтому позиция должна быть такой, чтобы можно
было оценить поток крови через ДМЖП в аорту.
ВРОЖДЕННАЯ КОРРИГИРОВАННАЯ
ТРАНСПОЗИЦИЯ МАГИСТРАЛЬНЫХ СОСУДОВ
АНАТОМИЯ И ОПРЕДЕЛЕНИЕ
Врожденная корригированная транспозиция маги-
стральных сосудов (КТМС), или физиологически кор-
ригированная мальпозиция магистральных сосудов,
или ТМС с L-петлей (L-ТМС), является редким ВПС,
при котором наблюдается дискордантное предсер-
дно-желудочковое соединение и дискордантное же-
лудочково-артериальное соединение. Кровь посту-
пает по полым венам в ПП и проходит через ми-
тральный клапан в расположенный справа ЛЖ,
который изгоняет ее в легочный ствол. Кровь из ле-
гочных вен поступает в левое предсердие (ЛП), за-
тем через трикуспидальный клапан — в располо-
женный слева морфологически ПЖ и аорту (рис.
48.8). С физиологической точки зрения кровь цир-
кулирует правильно — деоксигенированная кровь
поступает в легкие, а богатая кислородом — в боль-
шой круг кровообращения, однако из-за инверсии
желудочков ПЖ работает в большом круге крово-
обращения. АВ-клапаны эмбриологически разви-
ваются соответственно желудочкам, поэтому при
врожденной КТМС митральный клапан является
венозным клапаном, а в большом круге кровообра-
щения находится трикуспидальный клапан. Часто
врожденная КТМС сочетается с другими ВПС (табл.
48.4).
Около 10% пациентов с врожденной КТМС име-
ют декстрокардию. Коронарные артерии также рас-
положены с инверсией: левая коронарная артерия
отходит от правого синуса Вальсальвы, а правая —
от левого синуса Вальсальвы. Проводящая система
характеризуется аномальным расположением АВ-
узла и наличием неразветвленного пучка Гиса, вслед-
ствие чего у пациентов с врожденной КТМС часто
наблюдается АВ-блокада сердца.
Клиническая картина при врожденной КТМС за-
висит от наличия сопутствующего порока сердца.
При его отсутствии патология может быть обнару-
жена в более старшем возрасте, а у пациентов с об-
струкцией ВТЛЖ или ДМЖП диагноз ставят пре-
натально либо сразу после рождения. Среди паци-
ентов с врожденной КТМС как с сопутствующим
пороком, так и без него часто наблюдается систоли-
ческая дисфункция ПЖ с развитием хронической
сердечной недостаточности (рис. 48.9) [59]. Первым
симптомом может быть недостаточность желудоч-
ка, нагнетающего кровь в большой круг кровообра-
щения.
ЭПИДЕМИОЛОГИЯ
Врожденная КТМС — редкая патология (около 0,5%
общего количества ВПС). Врожденная КТМС встре-
чается в 10 раз реже, чем полная ТМС. Генетическая
природа врожденной КТМС не установлена, однако
врожденная КТМС часто наблюдается у братьев и
сестер пациентов с врожденной КТМС [60].
ХИРУРГИЧЕСКАЯ КОРРЕКЦИЯ
Новорожденным с врожденной КТМС в отсутствие
сопутствующих пороков хирургическая коррекция
не всегда нужна. Есть два подхода к хирургическо-
му лечению детей с данным пороком (табл. 48.5):
1. Физиологическая коррекция. Устранение сопут-
ствующих пороков, но ПЖ остается в большом
круге кровообращения, а ЛЖ — под легочным
стволом.
ch48.indd 1235
03.04.2019 12:19:47
1236 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ПП
ЛЖ
ЛС
Ао
ЛП
ПЖ
2. Анатомическая коррекция (операция двойного
переключения: предсердного и артериального).
Переориентирование ЛЖ в большой круг крово-
обращения, а ПЖ — в малый круг кровообраще-
ния за счет формирования внутрипредсердных
туннелей и выполнения операции Растелли либо
артериального переключения.
Результаты хирургической коррекции зависят от
возраста пациента и исходной анатомии порока.
Иногда совокупность аномалий исключает возмож-
ность выполнения конкретной хирургической опе-
рации (например, аномалии коронарных артерий
являются противопоказанием к операции артери-
ального переключения, тогда выполняют физиоло-
гическую коррекцию).
Пациенты с изолированной врожденной КТМС
(без сопутствующих пороков) зачастую узнают о
своем диагнозе, обратившись за медицинской по-
мощью во взрослом возрасте с симптомами дис-
функции ПЖ либо АВ-блокады сердца. Если в ран-
Рис. 48.8 Анатомия сердца при врожденной корригированной транспозиции магистральных сосудов. Наблюдается инверсия желудочков и транспо-
зиция магистральных сосудов. С физиологической точки зрения кровоток правильный, однако правый желудочек (ПЖ) обеспечивает движение крови в большом
круге кровообращения, в котором АВ-клапаном является трикуспидальный клапан. Ао — аорта; ЛЖ — левый желудочек; ЛП — левое предсердие; ЛС —легоч-
ный ствол; ПП — правое предсердие.
Сопутствующий
врожденный
порок сердца
Частота (%) Примечания
Дефект межже-
лудочковой
перегородки
60–80
Наиболее часто встреча-
ется перимембраноз-
ный дефект
Стеноз легочной
артерии
30–50
Часто сочетается с дефек-
том межжелудочковой
перегородки. Может
быть клапанным
и подклапанным
Аномалия трику-
спидального
клапана
14–56
Морфология похожа
на аномалию Эбштей-
на. Способствует разви-
тию дисфункции
правого желудочка
ТАБЛИЦА 48.4
Частота сопутствующих врожденных
пороков сердца у пациентов
с врожденной корригированной
транспозицией магистральных сосудов
ch48.indd 1236
03.04.2019 12:19:47
1237
48 Транспозиция магистральных сосудов
0
0,0
0,2
0,4
0,6
0,8
1,0
20
p = 0,0013
Группа I (n = 125)
Группа II (n = 50)
40
60
80
Д
о
л
я
п
а
ц
и
е
н
т
о
в
б
е
з
Х
С
Н
Возраст (лет)
Рис. 48.9 Развитие хронической сердечной недостаточности у паци-
ентов с врожденной корригированной транспозицией магистральных
сосудов. Вероятность отсутствия хронической сердечной недостаточности
(ХСН) в группе I (с сопутствующими пороками) и группе II (без сопутствующих
пороков) снижается с течением времени [Graham TP Jr, Bernard YD, Mellen BG,
et al. Long-term outcome in congenitally corrected transposition of the great arter-
ies: a multiinstitutional study. J Am Coll Cardiol 36: 255–261, 2000].
нем возрасте не провели дозированное сужение ле-
гочного ствола, то в отдаленном периоде операцию
двойного переключения выполнить практически
невозможно, т.к. венозный ЛЖ, постоянно работая
в зоне низкого давления, теряет способность функ-
ционировать в большом круге кровообращения [61,
62]. Промежуточная и долгосрочная летальность
при обоих подходах к хирургической коррекции со-
поставима: общая выживаемость после вмешатель-
ства составляет 87,6% через 10 лет и 83,3% через 25
лет [63 64]. У пациентов, которым выполняли фи-
зиологическую коррекцию, часто возникает регур-
гитация на АВ-клапане большого круга кровооб-
ращения и выраженная систолическая дисфункция
желудочка, включенного в большой круг кровооб-
ращения [63].
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
И ЭХОКАРДИОГРАФИЧЕСКАЯ ОЦЕНКА
ФИЗИОЛОГИЧЕСКАЯ КОРРЕКЦИЯ
ВРОЖДЕННОЙ КОРРИГИРОВАННОЙ ТРАНСПОЗИЦИИ
МАГИСТРАЛЬНЫХ СОСУДОВ
После физиологической коррекции врожденной КТМС
на ТТЭхоКГ визуализируется L-петля желудочков и
L-ТМС (аорта располагается спереди и слева от ле-
гочного ствола). Морфологически ЛЖ и митраль-
ный клапан находятся справа, а морфологически
ПЖ и трикуспидальный клапан — слева. Морфоло-
гически ЛЖ имеет в области верхушки мелкие тра-
бекуляции, а у перегородки поверхность гладкая.
АВ-клапан имеет типичную для митрального кла-
пана морфологию без прикрепления сухожильных
хорд к перегородке. Морфологически ПЖ имеет
множество трабекул и модераторный пучок. АВ-кла-
пан представлен трикуспидальным клапаном с при-
креплением сухожильных хорд к перегородке. Аор-
та отходит от ПЖ, находящегося в большом круге
кровообращения, кпереди и слева от легочного
ствола, который выходит из ЛЖ (рис. 48.10).
При ЭхоКГ особое внимание следует уделить
остаточной обструкции выходного тракта правого
желудочка, наличию остаточного шунтирования в
месте пластики ДМЖП, а также структуре и функ-
ции АВ-клапанов (особенно трикуспидального кла-
пана в большом круге кровообращения). Следует
оценить систолическую функцию ПЖ (см. далее).
У взрослых пациентов с врожденной КТМС часто
плохая акустическая доступность. В случае плохой
визуализации при ТТЭхоКГ следует провести МРТ
сердца [65].
Визуализация в субкостальной позиции у взрос-
лых пациентов часто ограничена. У пациентов с хо-
рошей акустической доступностью по длинной оси
можно определить морфологические особенности
желудочков и взаиморасположение магистральных
сосудов. Аорта идентифицируется как большой со-
суд, от которого отходят коронарные артерии. Вы-
ходные тракты расположены «бок о бок» и не пере-
Сопутствующий порок
Физиологическая коррекция
Анатомическая коррекция
Нет
Коррекция не нужна
Операция двойного переключения
Дефект межжелудочковой
перегородки
Закрытие дефекта межжелудочковой
перегородки
Закрытие дефекта межжелудочковой перегородки,
операция двойного переключения
Дефект межжелудочковой
перегородки со стенозом
либо атрезией легочной
артерии
Закрытие дефекта межжелудочковой
перегородки и имплантация кондуита
между левым желудочком
и легочной артерией
Операция предсердного переключения с операцией
Растелли (имплантация кондуита между правым
желудочком и легочной артерией)
либо
Геми-операция Мастарда с двунаправленным
кавопульмональным анастомозом и операцией
Растелли
ТАБЛИЦА 48.5 Хирургическая тактика при врожденной корригированной транспозиции магистральных сосудов
ch48.indd 1237
03.04.2019 12:19:47
1238 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 48.11 A Врожденная корригированная транспозиция магистраль-
ных сосудов. Апикальная четырехкамерная позиция позволяет определить
ориентацию и морфологию предсердий и желудочков. Обратите внимание на
смещение трикуспидального клапана к верхушке (острие стрелки). ЛЖ — ле-
вый желудочек; ЛП — левое предсердие; ПЖ — правый желудочек; ПП —
правое предсердие.
секаются друг с другом, как при нормальной анато-
мии сердца.
С помощью допплерографии определяют нали-
чие обструкции ВТЛЖ (подлегочного стеноза). По-
зиция по короткой оси позволяет оценить морфо-
логию желудочков, подклапанный аппарат трику-
спидального клапана и прикрепление сухожильных
хорд к перегородке. ЦДК кровотока помогает опре-
делить остаточное шунтирование через ДМЖП, а
ЦДК кровотока и спектральная допплерография —
регургитацию на клапанах и обструкцию ВТЛЖ.
В апикальной позиции можно изучить морфоло-
гию, ориентацию желудочков и их систолическую
функцию (рис. 48.11), а также оценить АВ-клапаны.
Следует обратить внимание на смещение трикуспи-
дального клапана к верхушке. Регургитацию выяв-
ляют с помощью ЦДК кровотока. В апикальной по-
зиции также можно выявить остаточное шунтиро-
вание через ДМЖП и обструкцию выходного тракта
(при их наличии). Наклон датчика кпереди позво-
ляет визуализировать выходные тракты, стеноз ли-
бо регургитацию. Визуализация в парастернальной
позиции по длинной оси при врожденной КТМС за-
труднена из-за отсутствия нормальной переднезад-
ней связи желудочков. Определить расположение вы-
ходных трактов относительно АВ-клапанов сложно
из-за расположения желудочков «бок о бок». Если
ЭхоКГ проводит специалист, который не знаком с
врожденной КТМС, он часто ошибочно восприни-
мает расположенный слева трикуспидальный кла-
пан за митральный и интерпретирует эхокардио-
ЛС
Ао
Рис. 48.10 A Расположение аорты и легочного ствола при врожден-
ной корригированной транспозиции магистральных сосудов. В высо-
кой парастернальной позиции по короткой оси визуализируется смещенная
кпереди и левее аорта (Ао) (L-ТМС). ЛС — легочный ствол.
ЛЖ
ПП
ЛП
ПЖ
Модераторный
пучок
графическую картину как конкордантное желудоч-
ково-артериальное соединение. Чтобы исключить
эту ошибку, ультразвуковой луч следует направить
по длинной оси тела пациента.
Дисфункция правого желудочка
В четвертом и пятом десятилетиях у пациентов раз-
вивается хроническая сердечная недостаточность
из-за дисфункции ПЖ в большом круге кровообра-
щения [59]. Учитывая это, у пациентов с врожден-
ной КТМС после физиологической коррекции и у
пациентов с полной ТМС после операции предсерд-
ного переключения следует в первую очередь оце-
нить систолическую функцию ПЖ. Механизмами
развития систолической дисфункции ПЖ в боль-
шом круге кровообращения являются: (1) морфо-
логические особенности ПЖ, вследствие которых
он не приспособлен для работы в условиях высоко-
го давления; (2) трикуспидальная регургитация как
результат воздействия системного давления на три-
куспидальный клапан (см. далее); (3) снижение кро-
воснабжения миокарда ПЖ в большом круге крово-
обращения при врожденной КТМС [66].
Оценка функции ПЖ при ЭхоКГ крайне сложна.
Из-за изменений геометрии ПЖ и особенностей его
сокращения нельзя рассчитать стандартные параме-
тры, которые оценивают при нормальной анато-
мии. «Золотым стандартом» диагностики стала МРТ
сердца благодаря своей точности и воспроизводи-
ch48.indd 1238
03.04.2019 12:19:47
1239
48 Транспозиция магистральных сосудов
ПЖ
ЛП
Ао
Рис. 48.13 МРТ при врожденной корригированной транспозиции ма-
гистральных сосудов. Визуализируются приточный и отточный отделы пра-
вого желудочка (ПЖ). Правый желудочек выталкивает кровь в аорту (Ао).
ЛП — левое предсердие.
створка трикуспидального клапана в большинстве
случаев развита нормально и не имеет вида паруса,
как при истинной аномалии Эбштейна, а у перего-
родочной и задней створок обычно отсутствуют до-
полнительные прикрепления к стенке ПЖ, которые
при истинной аномалии Эбштейна могут ограни-
чивать движение створок.
Структуру и функцию трикуспидального клапа-
на лучше всего оценивать в апикальной позиции, а
степень смещения — в 2D-режиме. Степень дис-
функции клапана определяют с помощью ЦДК кро-
вотока (рис. 48.14), а механизм дисфункции — в
3D-режиме [72].
У пациентов со значительной трикуспидальной
регургитацией выполняют протезирование трику-
спидального клапана в ранние сроки для предотвра-
щения систолической дисфункции ПЖ. Функция
ПЖ в большом круге кровообращения и функция
трикуспидального клапана между собой взаимосвя-
заны, но степень регургитации может быть не свя-
зана со степенью дисфункции ПЖ [73]. Протези-
рование трикуспидального клапана предпочтитель-
нее, т.к. пластика обеспечивает лишь краткосрочный
эффект [63, 74, 75]. В идеале перед операцией ФВПЖ
должна быть в пределах нормы, т.к. после операции
она в большинстве случаев снижается [76]. Наибо-
лее благоприятные результаты протезирования три-
куспидального клапана описаны при ФВПЖ не ме-
нее 40% и систолическом давлении в ЛЖ < 50 мм
рт. ст. У пациентов с полной АВ-блокадой сердца и
Рис. 48.12 МРТ сердца при врожденной корригированной транспози-
ции магистральных сосудов. Четырехкамерная позиция отражает ориента-
цию предсердий и желудочков. Видно смещение перегородочной створки (
*
)
трикуспидального клапана к верхушке. ЛЖ
—
левый желудочек (подлегоч-
ный); ЛП — левое предсердие; ПЖ — правый желудочек (системный); ПП —
правое предсердие.
ЛЖ
ПП
ЛП
ПЖ
*
мости количественных параметров ПЖ (рис. 48.12,
48.13) [36, 37]. Выявить с помощью ЭхоКГ пациен-
тов со сниженной ФВПЖ (< 50%) можно, используя
следующие параметры: фракцию изменения пло-
щади ПЖ < 33%, dP/dt < 1000 мм рт. ст./сек, индекс
Tei < 0,4–0,53 [37, 68, 69]. Некоторые исследователи
приводят данные, что со сниженной ФВПЖ ассоци-
ируется систолическое смещение фиброзного коль-
ца трикуспидального клапана < 14 мм [36, 37, 68].
Продольная деформация < –14,2% ассоциируется с
нормальной ФВПЖ [68, 70]. Нарушение продоль-
ной деформации коррелирует с повышенным уров-
нем предшественника мозгового натрийуретическо-
го пептида (NT-proBNP) и повышением ФК по NYHA
[71]. Несмотря на все ограничения, ЭхоКГ остается
важным дополнением к МРТ сердца при оценке
функции ПЖ.
Трикуспидальная регургитация
У пациентов с врожденной КТМС дисфункция три-
куспидального клапана связана с развитием право-
желудочковой недостаточности и дисфункцией ПЖ
[59]. У пациентов с врожденной КТМС трикуспи-
дальный клапан зачастую диспластичен и имеет
различную степень смещения к верхушке, поэтому
часто ошибочно ставят диагноз «аномалия Эбштей-
на». Нужна дифференциальная диагностика, чтобы
отличить врожденную КТМС от истинной анома-
лии Эбштейна. При врожденной КТМС передняя
ch48.indd 1239
03.04.2019 12:19:48
1240 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
желудочковую перегородку необходимо визуализи-
ровать в ортогональных плоскостях. С помощью
ЦДК кровотока определяют направление сброса кро-
ви, а максимальную скорость — с помощью спек-
тральной допплерографии в любой позиции, в ко-
торой ультразвуковой луч параллелен направлению
сброса крови.
АНАТОМИЧЕСКАЯ КОРРЕКЦИЯ ВРОЖДЕННОЙ
КОРРИГИРОВАННОЙ ТРАНСПОЗИЦИИ
МАГИСТРАЛЬНЫХ СОСУДОВ
Существуют различные варианты анатомической
коррекции врожденной КТМС, которые зависят от
анатомических особенностей основного порока и
локализации сопутствующих ВПС. Однако все ва-
рианты анатомической коррекции включают пер-
вый этап: формирование внутрипредсердных тун-
нелей для перенаправления крови из легочных вен
в ЛЖ, а из полых вен — в ПЖ (рис. 48.15). После
выполнения первого этапа существует несколько
вариантов соединения желудочков с магистральны-
ми сосудами. Это может быть операция артериаль-
ного переключения (при благоприятной анатомии
коронарных артерий) либо операция Растелли (при
подходящем анатомическом варианте ДМЖП). При
стенозе или атрезии клапана легочной артерии меж-
ду ПЖ и легочной артерией имплантируют конду-
ит. Имплантация кондуита — один из этапов опе-
рации Растелли. Недавно для упрощения процедуры,
предотвращения позднего стеноза внутрипредсерд-
ного туннеля ВПВ и повреждения синусового узла,
а также продления срока службы кондуита между
ПЖ и легочной артерией была предложена новая
методика, которая заключается в формировании
двунаправленного кавопульмонального анастомоза
и создании внутрипредсердного туннеля от НПВ в
направлении трикуспидального клапана [79].
Рис. 48.14 Трикуспидальная регургитация при врожденной корригированной транспозиции магистральных сосудов. (А) A Апикальная четырехка-
мерная позиция. (Б) A При ЦДК кровотока виден поток трикуспидальной регургитации (на АВ-клапане большого круга кровообращения). ЛП — левое предсер-
дие; ПЖ — правый желудочек.
имплантированным кардиостимулятором возмож-
но ухудшение систолической дисфункции ПЖ при
изолированной стимуляции ЛЖ из-за увеличения
размеров ПЖ и снижения его ФВ [77]. В таком слу-
чае следует рассмотреть вопрос о проведении ре-
синхронизирующей терапии, поскольку после нее
возможно уменьшение степени трикуспидальной
регургитации.
Обструкция выходного тракта левого желудочка
После операций на клапане легочной артерии у па-
циентов может наблюдаться клапанный стеноз, ре-
гургитация или комбинация этих нарушений. Для
подтверждения ускоренного потока либо регурги-
тации используют ЦДК кровотока. Спектральную
допплерографию проводят с целью количественной
оценки дисфункции. До внедрения в практику опе-
рации двойного переключения многим пациентам
с врожденной КТМС, атрезией легочной артерии
или ее критическим стенозом имплантировали кон-
дуит между ЛЖ и легочной артерией. Однако со вре-
менем возможно появление дисфункции кондуита
(стеноз либо регургитация), что может привести к
перегрузке давлением венозного ЛЖ. Устранение
причины дисфункции кондуита приводит к смеще-
нию межжелудочковой перегородки в сторону ЛЖ,
в результате сухожильные хорды перегородочной
створки трикуспидального клапана натягиваются,
что может ухудшить его функцию. Со временем на-
рушение функции трикуспидального клапана при-
водит к ухудшению функции ПЖ в большом круге
кровообращения [78].
Остаточное шунтирование через дефект
межжелудочковой перегородки
ДМЖП виден практически при любой акустической
доступности, но для подтверждения дефекта меж-
ЛП
ЛП
ПЖ
ПЖ
А
Б
ch48.indd 1240
03.04.2019 12:19:48
Ао
ЛС
ПЖ
ЛЖ
Двунаправленный
кавопульмональный
анастомоз
Туннель НПВ
(геми-операция Мастарда)
Кондуит
между ПЖ и ЛА
Заплата на ДМЖП
(операция Растелли)
ПЖ
ЛЖ
А
Б
Рис. 48.15 Анатомическая коррекция при врожденной корригированной транспозиции магистральных сосудов. (A) Операция двойного переключе-
ния, включающая операцию Мастарда и артериальное переключение. Внутрипредсердные туннели перенаправляют неоксигенированную кровь в правый желудо-
чек (ПЖ), а оксигенированную — в левый желудочек (ЛЖ). При артериальном переключении магистральные сосуды перемещают, в результате аорта (Ао) отхо-
дит от левого желудочка, а легочный ствол (ЛС) — от правого желудочка. (Б) Операция двойного переключения (геми-операция Мастарда и операция Растелли).
Кровь из нижней полой вены (НПВ) перенаправляют в правый желудочек, который выталкивает ее в кондуит, идущий в легочную артерию (ЛА). Верхнюю полую
вену анастомозируют с правой легочной артерией (двунаправленный кавопульмональный анастомоз). С помощью заплаты на дефекте межжелудочковой перего-
родки (ДМЖП) кровь из левого желудочка перенаправляют в аорту.
ch48.indd 1241
03.04.2019 12:19:49
1242 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Хирургическая
коррекция
Осложнения
Эхокардиография
Интерпретация/показатели
Операция
предсердного
переключения
Стеноз
внутрипредсерд-
ных туннелей
ВПВ визуализируется в супра-
стернальной позиции.
Ускорение скорости потока оце-
нивают с помощью ЦДК крово-
тока. Стеноз внутрипредсерд-
ного туннеля НПВ наблюдается
реже
Диаметр внутрипредсердного туннеля < 0,5 см
свидетельствует о стенозе
При спектральной допплерографии градиент
давления > 3 мм рт. ст.
Ретроградный поток в непарной вене
при наличии стеноза
Негерметичность
внутрипредсерд-
ных туннелей
Лучше всего визуализируется
в апикальной четырехкамерной
позиции с наклоном датчика
кзади. Проба с пузырьковым
контрастированием позволяет
локализировать место остаточ-
ного шунтирования
Обычно остаточное шунтирование происходит
из туннеля легочных вен в туннель полых
вен.
При пробе с пузырьковым контрастированием
пузырьки не должны попадать в ПЖ.
Остаточное шунтирование может вызвать
перегрузку объемом венозного ЛЖ
Обструкция ВТЛЖ
(подлегочный
стеноз)
В парастернальной позиции
по длинной оси визуализиру-
ется механизм обструкции.
Спектральную допплерографию
в апикальной позиции исполь-
зуют для измерения градиента
давления
Тяжелая обструкция ≥ 4,0 м/сек; умеренная
обструкция 3,0–3,9 м/сек; легкая обструкция
< 3 м/сек
Трикуспидальная
регургитация
ЦДК кровотока и спектральная
допплерография в апикальной
четырехкамерной позиции
В большинстве случаев при транспозиции
магистральных артерий трикуспидальный
клапан функционирует в большом круге
кровообращения, поэтому данный клапан
нельзя использовать для оценки давления
в легочной артерии
Систолическая
функция ПЖ
в большом круге
кровообращения
Качественную оценку проводят
в парастернальной позиции
по короткой оси и в четырехка-
мерной позиции
ПЖ часто увеличен и гипертрофирован, меж-
желудочковая перегородка прогибается в ЛЖ
СВОДНАЯ ИНФОРМАЦИЯ
Эхокардиографическое исследование послеоперационных осложнений у пациентов с полной либо врожденной
корригированной транспозицией магистральных сосудов
Интраоперационная летальность достаточно вы-
сокая, но долгосрочные результаты анатомической
коррекции удовлетворительные. Выживаемость в
течение 20 лет после операции двойного переклю-
чения и после операции предсердного переключе-
ния с созданием внутрижелудочкового туннеля со-
ставляет 83,3% и 75,7% соответственно [80].
Результаты модифицированной операции пред-
сердного переключения с двунаправленным каво-
пульмональным анастомозом многообещающие, с
хорошей функцией трикуспидального клапана и
«долговечностью» кондуита между ПЖ и легочной
артерией, поскольку уменьшается нагрузка на кон-
дуит (через него проходит лишь 50% сердечного
выброса). Данную технику следует рассматривать
у пациентов, которым планируют анатомическую
коррекцию с имплантацией кондуита [79].
Одним из самых распространенных осложнений
после анатомической коррекции является поздняя
дисфункция ЛЖ, которая наиболее вероятна в слу-
чае имплантации кардиостимулятора, при удлинен-
ном комплексе QRS и у пациентов более старшего
возраста на момент первичной операции [81, 82].
Поздние осложнения после анатомической кор-
рекции до сих пор полностью не описаны. Это мо-
гут быть проблемы с внутрипредсердными и вну-
трижелудочковым туннелями, а также последствия
операции артериального переключения (механиз-
мы подробно описаны в разделе, посвященном пол-
ной ТМС).
У пациентов, которым выполнен двунаправлен-
ный кавопульмональный анастомоз с модифици-
рованной операцией предсердного переключения,
оценку анастомоза на предмет обструкции прово-
дят в высокой правой парастернальной позиции. На
допплерограмме должен быть виден ламинарный
поток через двунаправленный кавопульмональный
анастомоз. Спектральная допплерография позволя-
ет обнаружить в нестенозированном двунаправлен-
ном кавопульмональном анастомозе низкоскорост-
ной поток венозной крови, который изменяется в
зависимости от фазы дыхательного цикла.
ch48.indd 1242
03.04.2019 12:19:50
1243
48 Транспозиция магистральных сосудов
Хирургическая
коррекция
Осложнения
Эхокардиография
Интерпретация/показатели
Операция
артериального
переключения
Дилатация корня
неоаорты
Корень неоаорты лучше всего
оценивать в парастернальной
позиции по длинной оси
в 2D-режиме и M-режиме
При измерении корня неоаорты и сравнении
показателей с предыдущими необходимо учи-
тывать, что большинство кардиологов прово-
дят измерения у взрослых во время диастолы,
тогда как у детей — во время систолы
Регургитация
на неоаортальном
клапане
ЦДК кровотока и спектральная
допплерография в парастер-
нальной позиции по длинной
и короткой осям
Регургитация часто прогрессирует
Стеноз легочной
артерии (надкла-
панный либо
ветвей легочного
ствола)
Анастомоз легочного ствола
с корнем аорты лучше всего
визуализировать в парастер-
нальной позиции по короткой
оси. После операции артериаль-
ного переключения бифуркация
легочного ствола лежит
кпереди. Ветви лучше всего
визуализировать в верхней
парастернальной либо супра-
стернальной позиции. Оценка
ветвей легочного ствола зача-
стую затруднительна
При маневре ЛеКомпта ветви легочного ствола
позиционируют вокруг восходящего отдела
аорты. Односторонний стеноз может не при-
водить к высокому градиенту давления, т.к.
поток перенаправляется в контралатеральную
легочную артерию
Систолическая
дисфункция ЛЖ
Стандартная оценка систоличе-
ской функции ЛЖ включает
оценку нарушений локальной
сократимости
Систолическая дисфункция ЛЖ либо наруше-
ния локальной сократимости в покое могут
свидетельствовать об обструкции коронарных
артерий, т.к . во время операции артериаль-
ного переключения выполняют их
реимплантацию
Операция
Растелли
Дисфункция
кондуита
Кондуит между ПЖ и легочной
артерией бывает сложно визуа-
лизировать в 2D-режиме. Могут
помочь высокая парастерналь-
ная позиция по короткой оси
с наклоном датчика кпереди
либо апикальная позиция.
Спектральную допплерографию
используют для измерения гра-
диента давления. Непрерывно-
волновую допплерографию
в супрастернальной позиции
проводят с помощью датчика
Pedoff
При нормальной функции кондуита макси-
мальная скорость кровотока составляет
2,0–3,0 м/сек. Скорость > 4,0 м/сек указывает
на тяжелый стеноз кондуита
Обструкция ВТЛЖ Апикальная трехкамерная
позиция отражает взаимораспо-
ложение дефекта межжелудоч-
ковой перегородки и аорты.
Для определения степени
и уровня обструкции необхо-
димы импульсно-волновая
и непрерывно-волновая
допплерография
Тяжелая обструкция — скорость кровотока
≥ 4,0 м/сек; умеренная обструкция —
3,0–3,9 м/сек; легкая обструкция —
2,0–2,9 м/сек
Двунаправленный
кавопульмо-
нальный
анастомоз
Обструкция
Анастомоз визуализируют
в высокой правой парастер-
нальной позиции. Оценить
состояние анастомоза следует
с помощью ЦДК кровотока и
спектральной допплерографии
Поток при ЦДК кровотока должен быть лами-
нарным. В норме при спектральной доппле-
рографии регистрируется низкоскоростной
поток венозной крови, который изменяется
в зависимости от фазы дыхательного цикла
ВПВ — верхняя полая вена; ВТЛЖ — выходной тракт левого желудочка; ЛЖ — левый желудочек; НПВ — нижняя полая вена; ПЖ —
правый желудочек; ЦДК — цветовое допплеровское картирование.
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Эхокардиографическое исследование послеоперационных осложнений у пациентов с полной либо врожденной
корригированной транспозицией магистральных сосудов
ch48.indd 1243
03.04.2019 12:19:50
1244 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ЛИТЕРАТУРА
1. Liebman J, Cullum L, Belloc NB: Natural his-
tory of transposition of the great arteries.
Anatomy and birth and death characteristics,
Circulation 40:237–262, 1969.
2. Cuypers JA, Eindhoven JA, Slager MA, et al.
The natural and unnatural history of the
Mustard procedure: long-term outcome up to
40 years, Eur Heart J 35:1666–1674, 2014.
3. Lange R, Horer J, Kostolny M, et al. Presence
of a ventricular septal defect and the Mustard
operation are risk factors for late mortality
after the atrial switch operation: thirty years
of follow-up in 417 patients at a single center,
Circulation 114:1905–1913, 2006.
4. Pasquali SK, Hasselblad V, Li JS, et al. Coro-
nary artery pattern and outcome of arterial
switch operation for transposition of the
great arteries: a meta-analysis, Circulation
106:2575–2580, 2002.
5. Lai WW: Echocardiography in pediatric and
congenital heart disease: from fetus to adult,
Oxford, 2009, Wiley-Blackwell.
6. Lewin MB, Stout KK: Echocardiography in
congenital heart disease: expert consult, Phila-
delphia, 2012, Elsevier Saunders.
7. Senning A: Surgical correction of transposi-
tion of the great vessels, Surgery 45:966–980,
1959.
8. Mustard WT: Successful two-stage correction
of transposition of the great vessels, Surgery
55:469–472, 1964.
9. Jatene AD, Fontes VF, Paulista PP, et al. Ana-
tomic correction of transposition of the great
vessels, J Thorac Cardiovasc Surg 72:364–370,
1976.
10. Villafane J, Lantin-Hermoso MR, Bhatt AB,
et al. D -transposition of the great arteries: the
current era of the arterial switch operation,
J Am Coll Cardiol 64:498–511, 2014.
11. Junge C, Westhoff-Bleck M, Schoof S, et al.
Comparison of late results of arterial switch
versus atrial switch (mustard procedure) op-
eration for transposition of the great arteries,
Am J Cardiol 111:1505–1509, 2013.
12. Fricke TA, d’Udekem Y, Richardson M, et al.
Outcomes of the arterial switch operation for
transposition of the great arteries: 25 years of
experience, Ann Thorac Surg 94:139–145,
2012.
13. Roubertie F, Thambo JB, Bretonneau A, et al.
Late outcome of 132 Senning procedures af-
ter 20 years of follow-up, Ann Thorac Surg
92:2206–2213, 2011. discussion 2213-2204.
14. Warnes CA: Transposition of the great arter-
ies, Circulation 114:2699–2709, 2006.
15. Dos L, Teruel L, Ferreira IJ, et al. Late out-
come of Senning and Mustard procedures for
correction of transposition of the great arter-
ies, Heart 91:652–656, 2005.
16. Derrick GP, Narang I, White PA, et al. Failure
of stroke volume augmentation during exer-
cise and dobutamine stress is unrelated to
load-independent indexes of right ventricular
performance after the Mustard operation,
Circulation 102(19 Suppl 3):III154–159, 2000.
17. Kammeraad JA, van Deurzen CH, Sreeram N,
et al. Predictors of sudden cardiac death after
Mustard or Senning repair for transposition
of the great arteries, J Am Coll Cardiol
44:1095–1102, 2004.
18. Khairy P, Harris L, Landzberg MJ, et al. Sud-
den death and defibrillators in transposition
of the great arteries with intra-atrial baffles:
a multicenter study, Circ Arrhythm Electro-
physiol 1:250–257, 2008.
19. Oechslin E, Jenni R: 40 years after the first
atrial switch procedure in patients with trans-
position of the great arteries: long-term re-
sults in Toronto and Zurich, Thorac Cardio-
vasc Surg 48:233–237, 2000.
20. Diller GP, Dimopoulos K, Okonko D, et al.
Exercise intolerance in adult congenital heart
disease: comparative severity, correlates, and
prognostic implication, Circulation 112:828–
835, 2005.
21. Giardini A, Hager A, Lammers AE, et al. Ven-
tilatory efficiency and aerobic capacity predict
event-free survival in adults with atrial repair
for complete transposition of the great arter-
ies, J Am Coll Cardiol 53:1548–1555, 2009.
22. Khairy P, Landzberg MJ, Lambert J,
O’Donnell CP: Long-term outcomes after the
atrial switch for surgical correction of trans-
position: a meta-analysis comparing the Mus-
tard and Senning procedures, Cardiol Young
14:284–292, 2004.
23. Bottega NA, Silversides CK, Oechslin EN, et
al. Stenosis of the superior limb of the sys-
temic venous baffle following a Mustard pro-
cedure: an under-recognized problem, Int
J Cardiol 154:32–37, 2012.
24. Chintala K, Forbes TJ, Karpawich PP: Effec-
tiveness of transvenous pacemaker leads
placed through intravascular stents in patients
with congenital heart disease, Am J Cardiol
95:424–427, 2005.
25. Horer J, Karl E, Theodoratou G, et al. Inci-
dence and results of reoperations following
the Senning operation: 27 years of follow-up
in 314 patients at a single center, Eur J Car-
diothorac Surg 33:1061–1067, 2008. discus-
sion 1067-1068.
26. Hill KD, Fleming G, Curt Fudge J, et al. Per-
cutaneous interventions in high-risk patients
following Mustard repair of transposition of
the great arteries, Catheter Cardiovasc Interv
80:905–914, 2012.
27. Brown SC, Eyskens B, Mertens L, et al. Self
expandable stents for relief of venous baffle
obstruction after the Mustard operation,
Heart 79:230–233, 1998.
28. Chin AJ, Sanders SP, Williams RG, et al. Two-
dimensional echocardiographic assessment of
caval and pulmonary venous pathways after
the Senning operation, Am J Cardiol 52:118–
126, 1983.
29. Cook SC, McCarthy M, Daniels CJ, et al. Use-
fulness of multislice computed tomography
angiography to evaluate intravascular stents
and transcatheter occlusion devices in pa-
tients with d-transposition of the great arter-
ies after mustard repair, Am J Cardiol 94:967–
969, 2004.
30. Fogel MA, Hubbard A, Weinberg PM: A sim-
plified approach for assessment of intracar-
diac baffles and extracardiac conduits in con-
genital heart surgery with two- and three-di-
mensional magnetic resonance imaging, Am
Heart J 142:1028–1036, 2001.
31. Parekh DR, Cabrera MS, Ing FF: Simultane-
ous transcatheter implantation of systemic
and pulmonary venous baffle stents after
mustard operation for d-transposition of the
great arteries, Catheter Cardiovasc Interv
86:708–713, 2015.
32. Bentham J, English K, Hares D, et al. Effect
of transcatheter closure of baffle leaks fol-
lowing senning or mustard atrial redirection
surgery on oxygen saturations and polycy-
thaemia, Am J Cardiol 110:1046–1050, 2012.
33. Khairy P, Landzberg MJ, Gatzoulis MA, et al.
Transvenous pacing leads and systemic
thromboemboli in patients with intracardiac
shunts: a multicenter study, Circulation 113:
2391–2397, 2006.
34. Hurwitz RA, Caldwell RL, Girod DA, Brown
J: Right ventricular systolic function in ado-
lescents and young adults after Mustard op-
eration for transposition of the great arteries,
Am J Cardiol 77:294–297, 1996.
35. Kirjavainen M, Happonen JM, Louhimo I:
Late results of Senning operation, J Thorac
Cardiovasc Surg 117:488–495, 1999.
36. Iriart X, Horovitz A, van Geldorp IE, et al.
The role of echocardiography in the assess-
ment of right ventricular systolic function in
patients with transposition of the great arter-
ies and atrial redirection, Arch Cardiovasc Dis
105:432–441, 2012.
37. Khattab K, Schmidheiny P, Wustmann K, et
al. Echocardiogram versus cardiac magnetic
resonance imaging for assessing systolic func-
tion of subaortic right ventricle in adults with
complete transposition of great arteries and
previous atrial switch operation, Am J Cardi-
ol 111:908–913, 2013.
38. Moroseos T, Mitsumori L, Kerwin WS, et al.
Comparison of Simpson’s method and three-
dimensional reconstruction for measurement
of right ventricular volume in patients with
complete or corrected transposition of the
great arteries, Am J Cardiol 105:1603–1609,
2010.
39. Wheeler M, Grigg L, Zentner D: Can we pre-
dict sudden cardiac death in long-term survi-
vors of atrial switch surgery for transposition
of the great arteries? Congenit Heart Dis
9:326–332, 2014.
40. Li W, Hornung TS, Francis DP, et al. Relation
of biventricular function quantified by stress
echocardiography to cardiopulmonary exer-
cise capacity in adults with Mustard (atrial
switch) procedure for transposition of the
great arteries, Circulation 110:1380–1386,
2004.
41. Ho JG, Cohen MD, Ebenroth ES, et al. Com-
parison between transthoracic echocardiogra-
phy and cardiac magnetic resonance imaging
in patients status post atrial switch procedure,
Congenit Heart Dis 7:122–130, 2012.
42. van Son JA, Reddy VM, Silverman NH, Han-
ley FL: Regression of tricuspid regurgitation
after two-stage arterial switch operation for
failing systemic ventricle after atrial inversion
operation, J Thorac Cardiovasc Surg 111:342–
347, 1996.
43. Winlaw DS, McGuirk SP, Balmer C, et al. In-
tention-to-treat analysis of pulmonary artery
banding in conditions with a morphological
right ventricle in the systemic circulation with
a view to anatomic biventricular repair, Cir-
culation 111:405–411, 2005.
44. Karamlou T, Jacobs ML, Pasquali S, et al. Sur-
geon and center volume influence on out-
comes after arterial switch operation: analysis
of the STS Congenital Heart Surgery Data-
base, Ann Thorac Surg 98:904–911, 2014.
45. Stoica S, Carpenter E, Campbell D, et al. Mor-
bidity of the arterial switch operation, Ann
Thorac Surg 93:1977–1983, 2012.
46. Vandekerckhove KD, Blom NA, Lalezari S, et
al. Long-term follow-up of arterial switch op-
eration with an emphasis on function and di-
mensions of left ventricle and aorta, Eur J
Cardiothorac Surg 35:582–587, 2009. discus-
sion 587–588.
47. McMahon CJ, Ravekes WJ, Smith EO, et al.
Risk factors for neo-aortic root enlargement
and aortic regurgitation following arterial
ch48.indd 1244
03.04.2019 12:19:50
1245
48 Транспозиция магистральных сосудов
switch operation, Pediatr Cardiol 25:329–335,
2004.
48. van der Bom T, van der Palen RL, Bouma BJ,
et al. Persistent neo-aortic growth during
adulthood in patients after an arterial switch
operation, Heart 100:1360–1365, 2014.
49. Co-Vu JG, Ginde S, Bartz PJ, et al. Long-term
outcomes of the neoaorta after arterial switch
operation for transposition of the great arter-
ies, Ann Thorac Surg 95:1654–1659, 2013.
50. Lang RM, Badano LP, Mor-Avi V, et al. Rec-
ommendations for cardiac chamber quantifi-
cation by echocardiography in adults: an up-
date from the American Society of Echocar-
diography and the European Association of
Cardiovascular Imaging, J Am Soc Echocar-
diogr 28:1–39, 2015.
51. Lo Rito M, Fittipaldi M, Haththotuwa R, et
al. Long-term fate of the aortic valve after an
arterial switch operation, J Thorac Cardiovasc
Surg 149:1089–1094, 2015.
52. Khairy P, Clair M, Fernandes SM, et al. Car-
diovascular outcomes after the arterial switch
operation for D-transposition of the great ar-
teries, Circulation 127:331–339, 2013.
53. Swartz MF, Sena A, Atallah-Yunes N, et al.
Decreased incidence of supravalvar pulmo-
nary stenosis after arterial switch operation,
Circulation 126(11 Suppl 1):S118–S122, 2012.
54. Moll JJ, Michalak KW, Mludzik K, et al.
Long-term outcome of direct neopulmonary
artery reconstruction during the arterial
switch procedure, Ann Thorac Surg 93:177–
184, 2012.
55. Legendre A, Losay J, Touchot-Kone A, et al.
Coronary events after arterial switch opera-
tion for transposition of the great arteries,
Circulation 108(Suppl 1):II186–II190, 2003.
56. El-Segaier M, Lundin A, Hochbergs P, et al.
Late coronary complications after arterial
switch operation and their treatment, Cathe-
ter Cardiovasc Interv 76:1027–1032, 2010.
57. Warnes CA, Williams RG, Bashore TM, et al.
ACC/AHA 2008 guidelines for the manage-
ment of adults with congenital heart disease:
a report of the American College of Cardiol-
ogy/American Heart Association Task Force
on Practice Guidelines (writing committee to
develop guidelines on the management of
adults with congenital heart disease), Circula-
tion 118:e714–e833, 2008.
58. Brown JW, Ruzmetov M, Huynh D, et al.
Rastelli operation for transposition of the
great arteries with ventricular septal defect
and pulmonary stenosis, Ann Thorac Surg
91:188–193, 2011. discussion 193-184.
59. Graham Jr. TP, Bernard YD, Mellen BG, et al.
Long-term outcome in congenitally corrected
transposition of the great arteries: a multi-in-
stitutional study, J Am Coll Cardiol 36:255–
261, 2000.
60. Piacentini G, Digilio MC, Capolino R, et al.
Familial recurrence of heart defects in sub-
jects with congenitally corrected transposi-
tion of the great arteries, Am J Med Genet A
137:176–180, 2005.
61. Myers PO, del Nido PJ, Geva T, et al. Impact
of age and duration of banding on left ven-
tricular preparation before anatomic repair
for congenitally corrected transposition of
the great arteries, Ann Thorac Surg 96:603–
610, 2013.
62. Quinn DW, McGuirk SP, Metha C, et al. The
morphologic left ventricle that requires train-
ing by means of pulmonary artery banding
before the double-switch procedure for con-
genitally corrected transposition of the great
arteries is at risk of late dysfunction, J Thorac
Cardiovasc Surg 135:1137–1144, 2008.
63. Lim HG, Lee JR, Kim YJ, et al. Outcomes of
biventricular repair for congenitally corrected
transposition of the great arteries, Ann Thorac
Surg 89:159–167, 2010.
64. Murtuza B, Barron DJ, Stumper O, et al. An-
atomic repair for congenitally corrected
transposition of the great arteries: a single-in-
stitution 19-year experience, J Thorac Cardio-
vasc Surg 142:1348–1357, 2011.
65. Caso P, Ascione L, Lange A, et al. Diagnostic
value of transesophageal echocardiography in
the assessment of congenitally corrected
transposition of the great arteries in adult pa-
tients, Am Heart J 135:43–50, 1998.
66. Hauser M, Bengel FM, Hager A, et al. Im-
paired myocardial blood flow and coronary
flow reserve of the anatomical right systemic
ventricle in patients with congenitally cor-
rected transposition of the great arteries,
Heart 89:1231–1235, 2003.
67. Geva T: Is MRI the preferred method for
evaluating right ventricular size and function
in patients with congenital heart disease?:
MRI is the preferred method for evaluating
right ventricular size and function in patients
with congenital heart disease, Circ Cardiovasc
Imaging 7:190–197, 2014.
68. Focardi M, Cameli M, Carbone SF, et al. Tra-
ditional and innovative echocardiographic
parameters for the analysis of right ventricu-
lar performance in comparison with cardiac
magnetic resonance, Eur Heart J Cardiovasc
Imaging 16:47–52, 2015.
69. Salehian O, Schwerzmann M, Merchant N, et
al. Assessment of systemic right ventricular
function in patients with transposition of the
great arteries using the myocardial perfor-
mance index: comparison with cardiac mag-
netic resonance imaging, Circulation
110:3229–3233, 2004.
70. Lipczynska M, Szymanski P, Kumor M, et
al. Global longitudinal strain may identify
preserved systolic function of the systemic
right ventricle, Can J Cardiol 31:760–766,
2015.
71. Eindhoven JA, Menting ME, van den Bosch
AE, et al. Quantitative assessment of systolic
right ventricular function using myocardial
deformation in patients with a systemic right
ventricle, Eur Heart J Cardiovasc Imaging
16:380–388, 2015.
72. Abadir S, Leobon B, Acar P: Assessment of
tricuspid regurgitation mechanism by three-
dimensional echocardiography in an adult
patient with congenitally corrected transposi-
tion of the great arteries, Arch Cardiovasc Dis
102:459–460, 2009.
73. Lewis M, Ginns J, Rosenbaum M: Is systemic
right ventricular function by cardiac MRI re-
lated to the degree of tricuspid regurgitation
in congenitally corrected transposition of the
great arteries? Int J Cardiol 174:586–589, 2014.
74. Hirose K, Nishina T, Kanemitsu N, et al. The
long-term outcomes of physiologic repair for
ccTGA (congenitally corrected transposition
of the great arteries), Gen Thorac Cardiovasc
Surg 63:496–501, 2015.
75. Scherptong RW, Vliegen HW, Winter MM, et
al. Tricuspid valve surgery in adults with a
dysfunctional systemic right ventricle: repair
or replace? Circulation 119:1467–1472, 2009.
76. Mongeon FP, Connolly HM, Dearani JA, et
al. Congenitally corrected transposition of
the great arteries ventricular function at the
time of systemic atrioventricular valve re-
placement predicts long-term ventricular
function, J Am Coll Cardiol 57:2008–2017,
2011.
77. Yeo WT, Jarman JW, Li W, et al. Adverse im-
pact of chronic subpulmonary left ventricu-
lar pacing on systemic right ventricular func-
tion in patients with congenitally corrected
transposition of the great arteries, Int J Car-
diol 171:184–191, 2014.
78. Buber J, McElhinney DB, Valente AM, et al.
Tricuspid valve regurgitation in congenitally
corrected transposition of the great arteries
and a left ventricle to pulmonary artery con-
duit, Ann Thorac Surg 99:1348–1356, 2015.
79. Malhotra SP, Reddy VM, Qiu M, et al. The
hemi-Mustard/bidirectional Glenn atrial
switch procedure in the double-switch opera-
tion for congenitally corrected transposition
of the great arteries: rationale and midterm
results, J Thorac Cardiovasc Surg 141:162–170,
2011.
80. Hiramatsu T, Matsumura G, Konuma T, et al.
Long-term prognosis of double-switch oper-
ation for congenitally corrected transposition
of the great arteries, Eur J Cardiothorac Surg
42:1004–1008, 2012.
81. Bautista-Hernandez V, Marx GR, Gauvreau
K, et al. Determinants of left ventricular dys-
function after anatomic repair of congenital-
ly corrected transposition of the great arter-
ies, Ann Thorac Surg 82:2059–2065, 2006. dis-
cussion 2065-2056.
82. Bautista-Hernandez V, Myers PO, Cecchin F,
et al. Late left ventricular dysfunction after
anatomic repair of congenitally corrected
transposition of the great arteries, J Thorac
Cardiovasc Surg 148:254–258, 2014.
ch48.indd 1245
03.04.2019 12:19:50
ch48.indd 1246
03.04.2019 12:19:50
1247
49 Единственный желудочек сердца
LUKE J. BURCHILL, MBBS, PHD • RACHEL M. WALD, MD • LUC MERTENS, MD, PHD
Основные принципы эхокардиографии
после операции Фонтена
Врожденные пороки сердца
с физиологией единственного
желудочка сердца
Эволюция хирургического лечения
после внедрения операции Фонтена
Функция желудочков до и после
операции Фонтена
Подготовка к эхокардиографии
Последовательный детальный анализ
структур сердца
Терминология
Технические аспекты
Эхокардиографическое
исследование
Оценка гемодинамики
после операции Фонтена
Возврат крови по легочным венам
Функция атриовентрикулярного клапана
Систолическая функция желудочка
Диастолическая функция желудочка
Выходной тракт
Заключение
Патология в виде единственного желудочка серд-
ца — это гетерогенная группа врожденных пороков
сердца (ВПС), при которых есть только один желу-
дочек, обеспечивающий кровообращение как в
большом, так и в малом круге кровообращения. Об-
следование пациентов с такой патологией должны
проводить специалисты функциональной диагно-
стики и кардиологи с большим опытом диагности-
ки ВПС. При диагностике этой редкой патологии
нужен системный подход. Большинству пациентов
выполняют операцию Фонтена: перенаправление
венозной крови в малый круг кровообращения без
участия подлегочного желудочка.
В данной главе рассмотрены ВПС с физиологией
единственного желудочка сердца, эволюция хирур-
гических подходов к лечению после внедрения опе-
рации Фонтена, а также изменения функции желу-
дочка до и после операции Фонтена.
Представлен поэтапный подход к проведению
эхокардиографии (ЭхоКГ) пациентам с единствен-
ным желудочком сердца: (1) оценка анатомических
особенностей сердца; (2) оценка результатов опера-
ции Фонтена. Такое разделение позволит читателям
лучше понять ключевые моменты диагностики. Од-
нако на практике пациентам с единственным желу-
дочком сердца последовательный детальный анализ
структур сердца и состояния анастомозов после
операции Фонтена проводят одновременно.
ОСНОВНЫЕ ПРИНЦИПЫ ЭХОКАРДИОГРАФИИ
ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА С ФИЗИОЛОГИЕЙ
ЕДИНСТВЕННОГО ЖЕЛУДОЧКА СЕРДЦА
Термин единственный желудочек сердца используют
скорее для описания физиологического состояния,
а не анатомии, поскольку действительно единствен-
ный желудочек наблюдается чрезвычайно редко.
Большинство пациентов с физиологией единствен-
ного желудочка сердца (табл. 49.1) на самом деле
имеют два желудочка — большой и маленький [1].
Для оценки функционального состояния желудоч-
ков и определения тактики хирургического лечения
крайне важно иметь представление о расположении
желудочков и других отделов сердца относительно
друг друга. Поскольку атрезия трикуспидального
клапана, синдром гипоплазии левых отделов сердца
(СГЛОС) и двухприточный левый желудочек (ЛЖ)
представляют собой наиболее частые пороки, при-
водящие к формированию единственного желудоч-
ка, им уделяется особое внимание.
В случае атрезии трикуспидального клапана (рис.
49.1) отсутствует сообщение между правым предсер-
дием (ПП) и правым желудочком (ПЖ) из-за отсут-
ствия самого трикуспидального клапана или отвер-
стия в нем. При ЭхоКГ между ПП и ПЖ визуали-
зируется фиброзная перегородка. Порок обычно
ch49.indd 1247
03.04.2019 12:20:02
1248 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
сочетается с дефектом межпредсердной перегород-
ки (ДМПП) и сбросом крови справа налево, умень-
шенным или гипоплазированным ПЖ и дефектом
межжелудочковой перегородки (ДМЖП). В 70%
случаев магистральные сосуды отходят нормально,
в остальных случаях наблюдается их транспозиция
с обструкцией легочного ствола или аорты либо без
обструкции. В случае нормального отхождения ма-
гистральных сосудов легочный ствол отходит от ПЖ,
что часто сочетается с клапанным либо подклапан-
ным стенозом. В случае транспозиции магистраль-
ных сосудов легочный ствол отходит от ЛЖ, что со-
провождается его стенозом, а аорта отходит от ПЖ.
В данной ситуации возможна обструкция оттока
крови по аорте вследствие гипертрофии отточного
отдела либо рестриктивного ДМЖП. Обычно паци-
ентам с атрезией трикуспидального клапана снача-
ла создают анастомоз между подключичной арте-
рией и легочной артерией с помощью сосудистого
протеза (модифицированный анастомоз Блелока–
Тауссиг), затем — двунаправленный кавопульмо-
нальный анастомоз, потом выполняют операцию
Фонтена.
СГЛОС — это гетерогенная группа врожденных
пороков, связанных со значительным недоразвити-
ем левых отделов сердца и дуги аорты. В большин-
стве случаев наблюдается критический стеноз либо
атрезия митрального и аортального клапанов, а так-
же гипоплазия восходящего отдела аорты, которая
сочетается с коарктацией аорты (рис. 49.2). Цель
паллиативного хирургического вмешательства за-
ключается в обеспечении функционирования ПЖ в
большом круге кровообращения с перенаправлени-
ем венозной крови в легкие (операция Фонтена).
Описание тактики лечения детей с СГЛОС выходит
за рамки данной главы, но перечислим три после-
довательных этапа: (1) операция Норвуда в неона-
тальном периоде; (2) формирование двунаправлен-
ного кавопульмонального анастомоза в возрасте
6 мес; (3) операция Фонтена в 2–3 года.
Ключевыми моментами операции Норвуда яв-
ляются иссечение межпредсердной перегородки, ис-
пользование клапана легочной артерии в качестве
неоаортального клапана, соединение гипоплазиро-
ванной аорты и легочного ствола «бок в бок», ре-
конструкция дуги аорты с помощью заплаты. Ле-
гочный ствол отсекают от ПЖ, и легочный кровоток
обеспечивают за счет модифицированного анасто-
моза Блелока–Тауссиг либо кондуита между ПЖ и
легочной артерией (в модификации Сано). Для под-
робного изучения тактики лечения СГЛОС следует
ознакомиться с обзорными статьями [2–4].
Термин двухприточный левый желудочек исполь-
зуют при описании анатомического варианта, при
котором оба предсердия соединены с доминантным
ЛЖ. Наиболее часто данному пороку сопутствует
транспозиция магистральных сосудов, или дискор-
дантное желудочково-артериальное соединение. Ва-
риант двухприточного ЛЖ с нормальным располо-
жением магистральных сосудов называют сердцем
Холмса. Часто этот порок сочетается с ДМЖП, ко-
торый соединяет доминантный ЛЖ с небольшим
гипоплазированным ПЖ. В зависимости от того,
есть транспозиция либо нет, рестриктивный ДМЖП
может привести к обструкции кровотока в большом
или малом круге кровообращения. К сопутствую-
щим порокам также относят клапанный и подкла-
панный стеноз легочной артерии, коарктацию аор-
ты и перерыв дуги аорты (рис. 49.3). Пациентам с
двухприточным ЛЖ и дискордантным желудочко-
во-артериальным соединением выполняют опера-
цию Норвуда в неонатальном периоде, затем созда-
ют двунаправленный кавопульмональный анасто-
моз и проводят операцию Фонтена.
ЭВОЛЮЦИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
ПОСЛЕ ВНЕДРЕНИЯ ОПЕРАЦИИ ФОНТЕНА
Операция Фонтена была впервые описана в 1971 г.
[5]. Ее внедрение способствовало появлению по-
коления детей с единственным желудочком сердца,
которые получили возможность дожить до взросло-
го возраста. В настоящее время операция Фонте-
на — наиболее распространенный метод хирурги-
ческого лечения детей со сложными ВПС, при кото-
рых невозможно выполнить двухжелудочковую
коррекцию [6]. Независимо от исходной анатомии
сердца, цель операции Фонтена состоит том, чтобы
обеспечить адекватный кровоток в большом и ма-
Врожденный порок сердца
Частота* (%)
Атрезия трикуспидального клапана
22
Синдром гипоплазии левых отделов сердца 21
Двухприточный левый желудочек
15
Синдром гетеротаксии
8
Двойное отхождение магистральных сосудов
от правого желудочка
8
Атрезия легочной артерии с интактной
межжелудочковой перегородкой
6
Атрезия митрального клапана
6
Аномалии трикуспидального клапана
4
Дефект предсердно-желудочковой перего-
родки (несбалансированная форма)
4
Другие
7
* У 546 пациентов после операции Фонтена.
[Anderson PA, Sleeper LA, Mahony L, et al. Contemporary outcomes
after the Fontan procedure: a Pediatric Heart Network multicenter
study. J Am Coll Cardiol 52:85–98, 2008.]
ТАБЛИЦА 49.1
Сопутствующие врожденные пороки
сердца при единственном желудочке
ch49.indd 1248
03.04.2019 12:20:02
1249
49 Единственный желудочек сердца
Рис. 49.1 Атрезия трикуспидального клапана. (A) При атрезии трикуспидального клапана (ТК) сообщение между правым предсердием (ПП) и правым же-
лудочком (ПЖ) отсутствует. Венозная кровь из большого круга кровообращения сначала попадает в правое предсердие, потом в левое предсердие (ЛП) через
дефект межпредсердной перегородки (ДМПП). Затем кровь поступает в левый желудочек (ЛЖ) через митральный клапан (МК). Как правило, дефект межжелу-
дочковой перегородки ведет в уменьшенный или гипоплазированный правый желудочек. Желудочково-артериальное соединение в 70% случаев может быть кон-
кордантным (как на рисунке). (Б) 2D-ЭхоКГ, апикальная четырехкамерная позиция. Видны атрезия трикуспидального клапана и толстая мышечная трабекула, раз-
деляющая правое предсердие и правый желудочек. Правый желудочек гипоплазирован, есть дефект межпредсердной перегородки.
Дефект
межпредсердной
перегородки
Открытый
артериальный
проток
Атрезия
ТК
Гипоплази-
рованный ПЖ
Атрезия
трикуспидального
клапана
Гипоплазированный
правый желудочек
ПП
ЛП
ПЖ
ЛЖ
ЛП
ЛЖ
ПП
МК
ДМПП
Дефект
межжелудочковой
перегородки
А
Б
ch49.indd 1249
03.04.2019 12:20:02
1250 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 49.2 Синдром гипоплазии левых отделов сердца. (A) При синдроме гипоплазии левых отделов сердца все структуры левой половины сердца, вклю-
чая аорту и ее дугу, имеют тяжелую степень недоразвития, поэтому не могут участвовать в кровообращении. Зачастую наблюдается стеноз либо атрезия митраль-
ного и аортального клапанов. Размеры левого желудочка (ЛЖ) крайне малы, а диаметр начальной части аорты всего несколько миллиметров. Кровь из легких
возвращается в левое предсердие (ЛП) и проходит через дефект межпредсердной перегородки в правые отделы сердца. Правый желудочек (ПЖ) нагнетает кровь
к легким через легочный ствол (ЛС), а также в большой круг кровообращения через открытый артериальный проток. (Б) 2D-ЭхоКГ, апикальная четырехкамерная
позиция. Пациент с синдромом гипоплазии левых отделов сердца. Визуализируются атрезия митрального клапана и утолщенная мышечная трабекула, разделя-
ющая предсердие и левый желудочек. Левый желудочек гипоплазирован, а правый желудочек является доминантной полостью. После предсердной септэктомии
предсердия представляют собой общую полость. ПП — правое предсердие.
Открытый артериальный проток
Коарктация аорты
Дефект
межпредсердной
перегородки
Стеноз
митрального
клапана
Гипоплазированный
левый желудочек
Гипоплазированный
ЛЖ
Атрезия
митрального клапана
Предсердие
ЛС
ЛП
ПЖ
ПЖ
ПП
Гипоплазия аорты
и атрезия аортального
клапана
А
Б
ch49.indd 1250
03.04.2019 12:20:04
1251
49 Единственный желудочек сердца
ПП
Рис. 49.3 Двухприточный левый желудочек. (A) Оба предсердия соединяются с доминантным левым желудочком (ЛЖ). Правый желудочек гипоплазирован.
Обычно есть дефект межжелудочковой перегородки и желудочково-артериальная дискордантность, возможны коарктация аорты (Ао), подлегочный стеноз, сте-
ноз или атрезия легочной артерии. (Б) 2D-ЭхоКГ, апикальная четырехкамерная позиция. Визуализируются открытые левый и правый атриовентрикулярные (АВ)
клапаны, соединяющиеся с левым желудочком. Гипоплазированный правый желудочек на данном изображении не виден, однако виден небольшой дефект меж-
предсердной перегородки. ЛА — левая артерия; ЛП — левое предсердие; ПП — правое предсердие.
Коарктация аорты
Гипоплазированный
правый желудочек
Стеноз/атрезия ЛА
Левый АВ-клапан
Правый АВ-клапан
Ао
ЛП
ЛЖ
ПП
ЛЖ
ПП
ЛП
А
Б
ch49.indd 1251
03.04.2019 12:20:05
1252 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
лом кругах кровообращения, уменьшив выражен-
ность цианоза и перегрузку объемом желудочка.
При операции Фонтена венозную кровь из боль-
шого круга кровообращения направляют в малый
круг кровообращения (обычно без интерпозиции
ПЖ). При отсутствии подлегочного желудочка дви-
жение крови в легочную артерию происходит пас-
сивно. Движущими силами являются давление ве-
нозной крови, превышающее давление в посткапил-
лярных сосудах легких [7], а также присасывающее
действие грудной клетки во время акта дыхания [8].
Со временем операция Фонтена претерпела мно-
жество модификаций для обеспечения более эффек-
тивного движения венозной крови в малый круг
кровообращения. Первые операции проводили, соз-
давая анастомоз между ПП и легочной артерией
(предсердно-легочный анастомоз Фонтена) (рис. 49.4)
[5, 9]. У некоторых пациентов при создании пред-
сердно-легочного анастомоза Фонтена применяли
дополнительные клапаны и кондуиты, но было об-
наружено, что они препятствовали кровотоку. Мо-
дификация Бьерка заключалась в создании при
атрезии трикуспидального клапана предсердно-
желудочкового анастомоза между ПП и ПЖ (часто
с использованием клапан-содержащего кондуита)
[10].
Увеличение давления в ПП после операции Фон-
тена приводило к прогрессирующему увеличению
размеров предсердия, что способствовало развитию
аритмии, формированию тромбов и обструкции
легочных вен. Хирурги пришли к выводу, что опе-
рацию Фонтена следует выполнять по схеме, в ко-
торой ПП исключено из венозного кровотока. С
1988 г. по настоящее время внутри ПП формируют
из синтетического материала внутрипредсердный
туннель, соединяющий нижнюю полую вену с ле-
гочной артерией, — латеральный туннель (рис. 49.5)
[11, 12]. Такая модификация операции Фонтена так-
Рис. 49.4 Предсердно-легочный анастомоз Фонтена. (A) Правое предсердие (ПП) изолируют путем закрытия дефекта межпредсердной перегородки и от-
верстия трикуспидального клапана (при его наличии). Ушко правого предсердия анастомозируют с правой легочной артерией (ПЛА). (Б) 2D-ЭхоКГ, субкостальная
позиция. У пациента с атрезией трикуспидального клапана после создания предсердно-легочного анастомоза Фонтена видна нижняя полая вена (НПВ), которая
соединяется с правым предсердием. Правое предсердие расширено, правый желудочек гипоплазирован. ВПВ — верхняя полая вена.
ПП
Ушко правого
предсердия
Заплата
на дефекте
межпредсердной
перегородки
Заплата на отверстии
трикуспидального
клапана
ПЛА
ВПВ
ПП
НПВ
НПВ
А
Б
ch49.indd 1252
03.04.2019 12:20:06
1253
49 Единственный желудочек сердца
Рис. 49.5 Латеральный туннель. (A) Поток из нижней полой вены (НПВ) направляется через латеральный туннель, проходящий внутри полости правого пред-
сердия (ПП). Нижняя часть верхней полой вены (ВПВ) анастомозирована напрямую с правой легочной артерией (ПЛА). Верхняя часть верхней полой вены соеди-
нена с верхней поверхностью правой легочной артерии двунаправленным кавопульмональным анастомозом. Бо
́
льшая часть полости правого предсердия прини-
мает кровь из легочных вен. (Б) 2D-ЭхоКГ, апикальная четырехкамерная позиция. Визуализируются латеральный туннель в полости правого предсердия, атрезия
трикуспидального клапана и гипоплазия правого желудочка (ПЖ). (В) 2D-ЭхоКГ и ЦДК кровотока из субкостального доступа. Визуализируется латеральный тун-
нель, направляющий низкоскоростной поток из нижней полой вены к нижней части верхней полой вены. ЛЖ — левый желудочек; ЛП — левое предсердие.
93 bpm
Анастомоз
между ВПВ
и ПЛА
Латеральный
туннель
Латеральный
туннель
Печень
ВПВ
ПЛА
ПП
НПВ
НПВ
ВПВ
ЛП
ЛЖ
ПЖ
Латеральный
туннель
А
Б
В
ch49.indd 1253
03.04.2019 12:20:07
1254 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
же сопровождается повышенным риском развития
предсердных аритмий, поэтому стали создавать экс-
тракардиальный анастомоз, не затрагивающий ПП
[13]: кровь из нижней полой вены проходит по син-
тетическому кондуиту, расположенному снаружи
ПП (рис. 49.6). Данная операция стала методом вы-
бора во многих кардиохирургических клиниках
благодаря технической простоте создания экстра-
кардиального анастомоза, уменьшению количества
швов и отсутствию необходимости пережатия аор-
ты во время операции. Однако выживаемость после
создания экстракардиального анастомоза без арит-
мии ненамного выше, чем при латеральном тунне-
ле [14]. Дискуссии о преимуществах того и другого
вариантов продолжаются до сих пор.
В настоящее время отдается предпочтение по-
этапному подходу: на первом этапе пациенту с един-
ственным желудочком сердца создают системно-ле-
гочный анастомоз либо выполняют дозированное
сужение легочного ствола, на втором этапе создают
двунаправленный кавопульмональный анастомоз
между верхней полой веной и правой легочной ар-
терией. У взрослых пациентов при ЭхоКГ можно
обнаружить классический кавопульмональный ана-
стомоз Гленна (рис. 49.7), в то время как у молодых
пациентов обычно наблюдается двунаправленный
кавопульмональный анастомоз (рис. 49.8).
Классический кавопульмональный анастомоз Глен-
на представляет собой анастомоз, который соединя-
ет верхнюю полую вену с правой легочной артери-
ей (правая и левая легочные артерии между собой
не сообщаются) [15]. После этой операции у паци-
ентов часто обнаруживают легочные артериовеноз-
ные мальформации, которые развиваются, вероят-
но, из-за непоступления венозной крови от печени
в правое легкое. Правильность предположения под-
тверждается тем, что после восстановления поступле-
ния венозной крови в легкое происходит регрессия
легочных артериовенозных мальформаций [16].
Двунаправленный кавопульмональный анастомоз
Рис. 49.6 Модифицированная операция Фонтена: экстракардиальный анастомоз. (A) Поток из нижней полой вены (НПВ) направляют в правую легоч-
ную артерию (ПЛА) с помощью кондуита из синтетического материала, который полностью расположен вне правого предсердия (ПП). Верхнюю полую вену (ВПВ)
соединяют с верхним краем правой легочной артерии (двунаправленный кавопульмональный анастомоз). (Б) 2D-ЭхоКГ, апикальная четырехкамерная позиция.
Экстракардиальный анастомоз. Обратите внимание: кондуит лежит снаружи правого предсердия. При ЦДК кровотока видно, что поток из кондуита идет в правое
предсердие через фенестрацию.
Ушитая
культя ВПВ
Ушитая
культя НПВ
Экстракардиальный кондуит
из синтетического материала
Поток через
фенестрацию
Экстракардиальный кондуит
из синтетического материала
ПП
ПП
НПВ
ВПВ
ПЛА
А
Б
ch49.indd 1254
03.04.2019 12:20:08
1255
49 Единственный желудочек сердца
Рис. 49.7 Классический кавопульмональный анастомоз по Гленну. (A) Анастомоз создают между верхней полой веной (ВПВ) и дистальным концом пе-
ресеченной правой легочной артерии (ПЛА). Правая и левая легочные артерии не сообщаются. Культю верхней полой вены ушивают. (Б) 2D-ЭхоКГ с цветовой
допплерографией в супрастернальной позиции. При ЦДК кровотока виден поток через классический кавопульмональный анастомоз по Гленну (поток венозной
крови из верхней полой вены в правую легочную артерию). ПП — правое предсердие.
58 bpm
ВПВ
ПЛА
ВПВ
ПЛА
ПП
А
Б
ch49.indd 1255
03.04.2019 12:20:09
1256 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 49.8 Двунаправленный кавопульмональный анастомоз. (A) Анастомоз «конец в бок» между верхней полой веной (ВПВ) и правой легочной артерией
(ПЛА). Правую легочную артерию и левую легочную артерию (ЛЛА) не разобщают. У некоторых пациентов кровоток по легочному стволу сохраняют (
*
).
(Б) 2D-ЭхоКГ с ЦДК кровотока в верхней парастернальной позиции. Видны поток через двунаправленный кавопульмональный анастомоз и поток венозной крови
из верхней полой вены в правую и левую легочные артерии.
ВПВ
ВПВ
ПЛА
ПЛА
ПП
ЛЛА
А
Б
*
ch49.indd 1256
03.04.2019 12:20:10
1257
49 Единственный желудочек сердца
представляет собой анастомоз «конец в бок» между
верхней полой веной и правой легочной артерией,
при этом кровь из верхней полой вены поступает
как в правую, так и в левую легочную артерию [17].
Такое соединение обеспечивает пассивный возврат
венозной крови от верхней половины тела в малый
круг кровообращения. Двунаправленный кавопуль-
мональный анастомоз создают у ребенка, начиная с
возраста 4 месяца.
Завершающим этапом выступает операция Фон-
тена (соединение нижней полой вены с правой ле-
гочной артерией), которую выполняют в возрасте
от 2 до 4 лет. Операция Фонтена полностью разоб-
щает венозный кровоток между малым и большим
кругами кровообращения, что приводит к нормаль-
ному насыщению артериальной крови кислородом.
Поток в легочных артериях является пассивным,
что ограничивает любое увеличение сердечного вы-
броса, особенно во время физических нагрузок. В
результате операции происходит уменьшение на-
грузки объемом единственного желудочка за счет
увеличения системного венозного давления.
Дети относительно хорошо переносят операцию
Фонтена, но в отдаленном периоде часто наблюда-
ются осложнения. Гемодинамика после операции
Фонтена предрасполагает к хронической системной
венозной гипертензии, снижению сердечного вы-
броса и ограничению его резерва при физических
нагрузках.
Другими осложнениями могут быть предсердная
аритмия, формирование тромбов в предсердиях,
застой венозной крови в печени, цирроз печени, ас-
цит. У пациентов после операции Фонтена в 4% слу-
чаев отмечается энтеропатия с потерей белка (ЭПБ)
(потеря белка через желудочно-кишечный тракт),
которая проявляется хронической диареей с разви-
тием вторичной гипоальбуминемии, приводящей к
периферическим отекам, гидротораксу, асциту, им-
мунодефициту и увеличению риска смерти [18]. К
редким осложнениям относят пластический брон-
хит, при котором просвет трахеобронхиального де-
рева на всем протяжении блокирован слепками из
желатинообразного вещества.
При операции Фонтена иногда создают фене-
страцию между внутрипредсердным туннелем и ПП,
что позволяет обеспечить сброс крови справа нале-
во, тем самым снизить давление, улучшить предна-
грузку желудочков и увеличить сердечный выброс
(рис. 49.9, см. также рис. 49.6Б). Это особенно ак-
туально в послеоперционном периоде, когда риск
неблагоприятного исхода особенно высок. В более
позднем периоде фенестрацию можно закрыть хи-
рургически для уменьшения цианоза, связанного со
сбросом крови справа налево.
В
Рис. 49.8 окончание (В) Импульсно-волновая допплерография верхней полой вены при классическом кавопульмональном анастомозе по Гленну отражает нор-
мальную низкую скорость венозного потока с изменениями в зависимости от фазы дыхательного цикла. Максимальную и среднюю скорости, а также давление
рассчитывают путем усреднения данных за 5 сердечных сокращений. ПП — правое предсердие.
ch49.indd 1257
03.04.2019 12:20:11
1258 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Рис. 49.9 Фенестрация латерального туннеля. Создание фенестрации в латеральном туннеле (A) либо в экстракардиальном кондуите обеспечивает сброс
крови справа налево. Фенестрация позволяет снизить центральное венозное давление, что предотвращает раннюю декомпенсацию (см. рис. 49.6Б). (Б) При не-
прерывно-волновой допплерографии оценивают поток на фенестрации и измеряют средний градиент давления. Средний градиент давления на фенестрации ра-
вен градиенту давления на клапане легочной артерии, т.к . отражает разницу между центральным венозным давлением и давлением в полости сердца, принима-
ющей кровь от легких. ВПВ — верхняя полая вена; НПВ — нижняя полая вена; ПЛА — правая легочная артерия; ПП — правое предсердие.
ВПВ
ПП
Латеральный туннель
Средний градиент давления 8 мм рт. ст.
Фенестрация
ПЛА
НПВ
А
Б
ch49.indd 1258
03.04.2019 12:20:12
1259
49 Единственный желудочек сердца
ФУНКЦИЯ ЖЕЛУДОЧКОВ
ДО И ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
В эмбриональном периоде доминантный желудочек
обеспечивает движение крови в малом и большом
кругах кровообращения. Параллельная работа на
два круга кровообращения приводит к постоянной
перегрузке объемом доминантного желудочка серд-
ца, его эксцентрическому ремоделированию и рас-
ширению [19].
Двунаправленный кавопульмональный анасто-
моз, который создают у ребенка в возрасте старше
4 месяцев, снижает перегрузку объемом, в результа-
те происходит обратное ремоделирование и норма-
лизация фракции выброса (ФВ) [20]. После опера-
ции Фонтена наблюдается дополнительное сниже-
ние объемной нагрузки при отсутствии изменения
массы миокарда желудочка, что приводит к гипер-
трофии, которая способствует диастолической дис-
функции желудочка [8, 21, 22].
Частота развития сердечной недостаточности с
возрастом увеличивается: около 40% взрослых па-
циентов после операции Фонтена имеют сердечную
недостаточность по Фремингемским критериям [23].
Предикторами сердечной недостаточности высту-
пают повышенное давление в ПП, ЭПБ, доминант-
ный морфологически ПЖ. После постановки диа-
гноза «сердечная недостаточность» смертность вы-
сокая в случае клинического ухудшения течения
аритмии и развития полиорганной недостаточно-
сти. При аритмии всегда следует рассматривать в
качестве ее механизма декомпенсацию гемодинами-
ки и проводить неинвазивную ее оценку [24, 25].
Декомпенсация гемодинамики у пациентов по-
сле операции Фонтена обусловлена несколькими
факторами, включая обструкцию анастомозов, си-
столическую и диастолическую дисфункции, повы-
шенное легочное сосудистое сопротивление. Серь-
езной проблемой остается раннее распознавание
сердечной недостаточности у пациентов после опе-
рации Фонтена, а также определение точных пока-
зателей функции желудочка.
Точность эхокардиографических данных постав-
лена под сомнение, т.к. критерии оценки функций
желудочков, используемые при нормальной анато-
мии сердца, у пациентов с гемодинамикой после опе-
рации Фонтена не применимы. Отдельной пробле-
мой является уменьшение преднагрузки желудочка
после операции Фонтена. Информативность фрак-
ции выброса как параметра функции желудочка, за-
висящего от преднагрузки, в этом случае сомни-
тельна. При ЭхоКГ могут возникнуть проблемы из-
за плохой акустической доступности, деформации
грудной клетки, измененного расположения сердца,
аномальной геометрии полостей сердца. Учитывая
все эти проблемы, для оценки функции сердца у па-
циентов с единственным желудочком в настоящее
время используют несколько методов визуализа-
ции, включая магнитно-резонансную томографию
(МРТ).
ПОДГОТОВКА К ЭХОКАРДИОГРАФИИ
К эхокардиографическому исследованию взрослых
пациентов с ВПС нужны более серьезный подход и
планирование, чем к ЭхоКГ пациентов с приобре-
тенными заболеваниями. Следует тщательно изу-
чить историю болезни пациента, включая протоко-
лы всех оперативных вмешательств. Необходимо
четко определить морфологию желудочка (домини-
рование ПЖ, ЛЖ либо промежуточный вариант),
что влияет на измерения и интерпретацию полу-
ченных данных. Врач должен понимать суть преды-
дущих оперативных вмешательств (табл. 49.2).
Для принятия решения об использовании моди-
фицированных позиций при визуализации анато-
мии сердца пациентов со сложными ВПС врачу сле-
дует изучить предшествующие эхокардиограммы и
определить клинические показания к проведению
исследования.
ПОСЛЕДОВАТЕЛЬНЫЙ ДЕТАЛЬНЫЙ
АНАЛИЗ СТРУКТУР СЕРДЦА
ТЕРМИНОЛОГИЯ
Поскольку большинство взрослых пациентов с един-
ственным желудочком сердца перенесли хирургиче-
ское вмешательство, анатомические особенности их
сердца известны. Следовательно, эхокардиографи-
ческое исследование взрослых пациентов должно
быть направлено на оценку функции желудочков,
клапанов и анастомозов, а не на диагностику пато-
логии. Однако иногда пациент не имеет медицин-
ской документации, и врач лишен возможности оз-
накомиться с анамнезом до обследования. В любом
случае следует применять системный подход к опи-
санию анатомии и функции сердца, который за-
ключается в последовательном детальном анализе
структур сердца и всех анастомозов [26]. Систем-
ный подход минимизирует риск упустить какую-
либо аномалию сердца.
В основе эхокардиографической оценки ВПС ле-
жит поэтапное описание связей между предсердия-
ми, желудочками и магистральными сосудами. При
ВПС наблюдается множество вариантов нарушений
связи между этими анатомическими структурами.
Под конкордантностью понимают ситуацию, когда
анатомическая структура правильно соединяется с
другой анатомической структурой. Например, в слу-
чае конкордантного предсердно-желудочкового со-
единения морфологически ПП сообщается с мор-
фологически ПЖ, а морфологически левое предсер-
дие (ЛП) — с морфологически ЛЖ. Конкордантное
желудочково-артериальное соединение предполага-
ет отхождение легочного ствола от морфологически
ПЖ, а аорты — от морфологически ЛЖ. Дискор-
ch49.indd 1259
03.04.2019 12:20:12
1260 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Хирургическое
вмешательство
Цель
Описание
Доступ
Предсердная
септэктомия
Увеличение сатурации
артериальной крови кис-
лородом у пациентов
с D-ТМС и синдромом
гипоплазии левых
отделов сердца
Иссечение межпредсердной перегородки, чтобы
венозная и артериальная кровь смешивалась
на уровне предсердий
Боковая
торакотомия
Анастомоз Блелока–
Тауссиг (анастомоз
Блелока–Тауссиг–
Томаса)
Повышение сатурации
артериальной крови кис-
лородом путем увеличе-
ния легочного кровотока
При классическом анастомозе Блелока–Тауссиг под-
ключичную артерию непосредственно соединяют
с легочной артерией на той же стороне
При модифицированном анастомозе Блелока–
Тауссиг соединение между этими сосудами создают,
используя сосудистый протез
Боковая
торакотомия
Анастомоз Дамуса–
Кайе–Стенсла
Устранение обструкции
выходного тракта желу-
дочка большого круга
кровообращения у паци-
ентов с транспозицией
магистральных сосудов,
подклапанным аорталь-
ным стенозом, синдро-
мом гипоплазии левых
отделов сердца
с атрезией аорты
Создание анастомоза «бок в бок» между проксималь-
ным участком легочного ствола и восходящим
отделом аорты для обеспечения кровотока
в большом круге кровообращения через клапан
легочной артерии, который становится неоаорталь-
ным. Легочный кровоток осуществляется
без участия подлегочного желудочка, а у пациентов
с двухжелудочковой коррекцией — по кондуиту
между дистальным участком легочного ствола
и правым желудочком
Срединная
стернотомия
Двунаправленный
кавопульмональный
анастомоз
Направление потока
из ВПВ в легкие, увеличе-
ние оксигенации артери-
альной крови
Создание анастомоза между ВПВ и правой легочной
артерией (отличия двунаправленного от классиче-
ского см. в тексте)
Срединная
стернотомия
Операция Кавашима
Направление потока
из ВПВ в легкие, улучше-
ние оксигенации артери-
альной крови
Создание двунаправленного кавопульмонального
анастомоза при отсутствии печеночного сегмента
НПВ. В итоге кровь попадает в легкие из ВПВ
и НПВ, минуя печеночные вены
Срединная
стернотомия
Операция Норвуда
Первый этап до операции
Фонтена у пациентов
с синдромом гипоплазии
левых отделов сердца
Предсердная септэктомия, создание анастомоза
Блелока–Тауссиг и анастомоза Дамуса–Кайе–
Стенсла, закрытие открытого артериального
протока (реконструкция дуги аорты). Первый ана-
стомоз обеспечивает легочный кровоток, второй —
кровоток в большом круге кровообращения
Срединная
стернотомия
Дозированное сужение
легочного ствола
или его ветвей
Достижение сбалансиро-
ванности кровотока
в большом и малом
кругах кровообращения
и снижение риска
развития легочной
гипертензии
Опоясывание ветвей легочного ствола синтетиче-
скими манжетами для уменьшения потока крови
к легким и давления
Срединная
стернотомия,
торакотомия
Анастомоз Поттса
Увеличение оксигенации
артериальной крови
путем увеличения
легочного кровотока
Создание анастомоза между левой легочной артерией
и нисходящим отделом аорты. В настоящее время
этот анастомоз используют редко из-за высокого
риска развития легочной гипертензии
Срединная
стернотомия,
торакотомия
Кондуит Сано
Увеличение сатурации
путем увеличения легоч-
ного кровотока при син-
дроме гипоплазии левых
отделов сердца
Соединение сосудистым протезом свободной стенки
единственного желудочка с легочным стволом
Срединная
стернотомия
Анастомоз Ватерстоуна Увеличение оксигенации
артериальной крови
путем увеличения легоч-
ного кровотока
Создание анастомоза между правой легочной арте-
рией и восходящим отделом аорты. В настоящее
время данный анастомоз используют редко из-за
высокого риска развития легочной гипертензии
Срединная
стернотомия
ВПВ — верхняя полая вена; НПВ — нижняя полая вена; ТМС — транспозиция магистральных сосудов.
ТАБЛИЦА 49.2 Наиболее часто проводимые хирургические вмешательства у пациентов с единственным желудочком сердца
ch49.indd 1260
03.04.2019 12:20:12
1261
49 Единственный желудочек сердца
дантным предсердно-желудочковым соединением
называют связь морфологически ПП с морфологи-
чески ЛЖ, а дискордантным желудочково-артери-
альным соединением — отхождение легочного ство-
ла от морфологически ЛЖ, а аорты — от морфоло-
гически ПЖ.
Перед оценкой анатомических структур сердца
врач должен описать положение сердца в грудной
клетке и расположение внутренних органов тела.
Эти данные несут важную информацию о вероят-
ности сопутствующих ВПС.
Относительно срединной линии тела сердце мо-
жет находиться в левой половине грудной клетки
(нормальное леворасположенное сердце, синистро-
позиция), в правой половине грудной клетки (ано-
мальное праворасположенное сердце, декстропози-
ция) либо по срединной линии тела (мезопозиция).
Леворасположенное сердце отклонено от средин-
ной линии тела влево на 30–45°. Праворасположен-
ное сердце отклонено от срединной линии тела
вправо на 30–45°. Затем описывают положение вер-
хушки сердца: нормально расположенная верхуш-
ка — синистрокардия, верхушка справа — декстро-
кардия.
Термином situs описывают положение внутрен-
них органов тела. Situs solitus — нормальное поло-
жение внутренних органов (справа — правое легкое
и печень, слева — левое легкое, сердце, селезенка и
желудок). Situs inversus (частота 1–2 случая на 10 000
детей) [27] — инверсия положения непарных орга-
нов, включая сердце. Используя данную термино-
логию, нормальное расположение сердца и вну-
тренних органов описывают как синистрокардию с
situs solitus. Если сердце располагается справа, пе-
чень — слева, желудок — справа, то данное состоя-
ние называют декстрокардией с situs inversus.
Причинами декстрокардии могут быть: (1) situs
inversus; (2) гипоплазия или коллапс правого легко-
го, приводящий к смещению средостения; (3) дек-
строверсия, если верхушка не смогла нормально по-
вернуться во время развития плода.
Situs inversus характеризуется тем, что правые и ле-
вые структуры сердца меняют свое положение на
противоположное. При вторичной декстрокардии
из-за смещения средостения либо декстроверсии ПП
и ПЖ будут располагаться справа, а ЛП и ЛЖ — сле-
ва. Большинство людей с декстрокардией и situs in-
versus имеют нормально сформированное сердце. У
пациентов с единственным желудочком сердца наи-
более частым ВПС, ассоциированным с декстрокар-
дией и situs inversus, является врожденная корригиро-
ванная транспозиция магистральных сосудов [28].
Термином situs ambiguous описывают ситуацию,
при которой положение сердца невозможно опреде-
лить четко. Обычно данное состояние сочетается с
предсердным изомеризмом (зеркальным располо-
жением предсердий). Левый предсердный изоме-
ризм сочетается с удвоением морфологически ле-
вых структур: двухсторонними левыми бронхами,
двухсторонними левыми легкими (с двумя доля-
ми), полиспленией. Правый предсердный изоме-
ризм сочетается с удвоением морфологически пра-
вых структур: двухсторонними правыми бронхами,
двухсторонними правыми легкими (с тремя доля-
ми), аспленией.
ТЕХНИЧЕСКИЕ АСПЕКТЫ
Стандартное эхокардиографическое исследование
большинства взрослых начинают в парастерналь-
ной позиции по длинной оси, но исследование па-
циентов с единственным желудочком сердца наибо-
лее информативно в субкостальной позиции. Такая
позиция позволяет оценить расположение сердца и
других органов.
Положение предсердий можно наиболее точно
определить по расположению печени и взаимному
расположению нижней полой вены и брюшной ча-
сти нисходящего отдела аорты. Как правило, распо-
ложение предсердий конкордантно расположению
внутренних органов. В большинстве случаев поло-
жение печени справа свидетельствует о situs solitus и
окончательно подтверждается расположением ма-
гистральных сосудов. В субкостальной позиции ви-
зуализируются аорта, нижняя полая вена и тела по-
звонков (позвонки указывают на срединную линию
тела). Situs solitus констатируют при расположении
аорты слева от срединной линии тела, а нижней по-
лой вены — справа. Сканируя до печени, можно
увидеть впадение нижней полой вены в ПП. Распо-
ложение печени и нижней полой вены с левой сто-
роны свидетельствует о предсердном situs inversus
(ПП находится слева, ЛП — справа). При situs am-
biguous, которое часто наблюдается у пациентов с
синдромом гетеротаксии и предсердным изомериз-
мом, нижняя полая вена и аорта располагаются на
одной стороне от срединной линии тела (рис. 49.10).
При синдроме гетеротаксии обычно наблюдается
перерыв нижней полой вены, когда подпеченочная
часть нижней полой вены соединяется с верхней по-
лой веной через непарную вену. В редких случаях
синдрома гетеротаксии печеночные вены дрениру-
ются непосредственно в ПП.
После уточнения положения сердца и предсер-
дий специалист должен определить морфологию
доминантного желудочка, а также наличие и лока-
лизацию гипоплазированного желудочка. Для этого
используют субкостальную или парастернальную
позицию по короткой оси (рис. 49.11). Небольшой
гипоплазированный желудочек зачастую представ-
лен только отточным отделом. Обычно гипоплази-
рованный желудочек отходит от доминантного (бо-
лее крупного) желудочка. Расположенный кпереди
гипоплазированный желудочек представляет собой
морфологически ПЖ, а доминантный желудочек
имеет морфологию ЛЖ. Расположенный кзади ги-
поплазированный желудочек представляет собой
ch49.indd 1261
03.04.2019 12:20:12
1262 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
морфологически ЛЖ, а доминантный желудочек
имеет морфологию ПЖ. Дополнительными при-
знаками доминантного морфологически ПЖ слу-
жат модераторный пучок и прикрепление структур
подклапанного аппарата атриовентрикулярного кла-
пана к перегородке. В редких случаях при полном
отсутствии гипоплазированного желудочка доми-
нантный желудочек имеет промежуточную морфо-
логию.
После описания расположения предсердий и мор-
фологии желудочков определяют атриовентрику-
лярные соединения, которые могут быть одножелу-
дочковыми (при единственном желудочке) и двух-
желудочковыми (при наличии двух желудочков).
При одножелудочковом атриовентрикулярном
соединении атриовентрикулярное(ые) отверстие(я)
ведет(ут) в доминантный желудочек, который мо-
жет иметь или не иметь сообщение с гипоплазиро-
ванным желудочком. Одножелудочковые атриовен-
трикулярные соединения разделяют на три группы:
двухприточные (наиболее распространены), одно-
приточные или общий атриовентрикулярный кла-
пан. При двухприточном варианте левый и правый
атриовентрикулярные клапаны связаны с морфоло-
гически ЛЖ (см. рис. 49.3). При одноприточном со-
единении один атриовентрикулярный клапан явля-
ется функциональным, второй — атрезированным.
При атрезии правого атриовентрикулярного клапа-
на ставят диагноз атрезия трикуспидального клапа-
на (см. рис. 49.1), а при атрезии левого атриовентри-
кулярного клапана — атрезия митрального клапана
(см. рис. 49.2). Общий атриовентрикулярный кла-
пан является менее распространенным вариантом и
обычно ассоциируется с первичным ДМПП типа
ostium primum либо общим предсердием.
К двухжелудочковому атриовентрикулярному со-
единению относят ВПС, при которых хирургиче-
ское разделение левых и правых полостей невоз-
можно. Анатомическими факторами, которые пре-
пятствуют двухжелудочковой коррекции, являются
«верхом сидящий» либо смещенный атриовентри-
кулярный клапан, большой ДМЖП, синдром гипо-
плазии левых либо правых отделов сердца.
Затем врач оценивает пути оттока, определяя
расположение каждого из магистральных сосудов.
Для визуализации магистральных сосудов лучше
всего подходит субкостальная позиция по длинной
и короткой осям. Также информативным является
исследование в парастернальной позиции по длин-
ной и короткой осям. В норме магистральные сосу-
ды при выходе из сердца перекрещиваются друг с
другом. Применительно к ЭхоКГ это означает, что
если один сосуд виден по длинной оси, то другой
будет виден по короткой оси (рис. 49.12). Например,
в парастернальной позиции по короткой оси аор-
тальный клапан виден по короткой оси, а выходной
тракт ПЖ и легочный ствол — по длинной оси. При
транспозиции магистральных сосудов они распола-
Рис. 49.10 Определение положения сердца и внутренних органов по
расположению нижней полой вены и аорты. (A) A Situs solitus. 2D -ЭхоКГ
с ЦДК кровотока, субкостальная позиция по короткой оси. По центру изобра-
жения видно тело позвонка (
*
). Нижняя полая вена (НПВ) — справа от по-
звонка, аорта (Ао) — слева. (Б) A Situs inversus. 2D -ЭхоКГ с ЦДК кровотока,
субкостальная позиция по короткой оси. Видно измененное расположение
нижней полой вены и аорты: оба сосуда расположены зеркально по сравнению
с нормой. (В) A Синдром гетеротаксии. 2D -ЭхоКГ с ЦДК кровотока, субко-
стальная позиция по короткой оси. Нижняя полая вена и аорта визуализиру-
ются слева от позвонков.
70 bpm
75 bpm
70 bpm
НПВ
Ао
Ао
Ао
НПВ
НПВ
*
*
*
А
Б
В
ch49.indd 1262
03.04.2019 12:20:12
1263
49 Единственный желудочек сердца
гаются параллельно друг другу. Такое расположение
визуализируется в парастернальной позиции как по
короткой, так и по длинной оси. При транспозиции
магистральных сосудов аорта обычно располагается
кпереди слева или справа от легочного ствола.
Магистральные сосуды также оценивают по их
направлению, форме и характеру ветвления. Восхо-
дящий отдел аорты направляется к голове и шее, за-
тем аорта отдает брахиоцефальные артерии и пере-
ходит в дугу аорты и нисходящий отдел аорты. Ле-
гочный ствол представляет собой прямой сосуд,
который направляется кзади и делится на левую и
правую легочные артерии. У взрослых пациентов с
единственным желудочком сердца легочный ствол
после операции Фонтена заканчивается слепой
культей, а его ветви принимают венозную кровь не-
посредственно из полых вен.
Соединения между магистральными сосудами и
желудочками многообразны. Выделяют четыре ос-
новных варианта: (1) дискордантное желудочково-
артериальное соединение (полная транспозиция
магистральных сосудов или врожденная корриги-
рованная транспозиция магистральных сосудов);
(2) конкордантное желудочково-артериальное со-
единение; (3) двойное отхождение магистральных
сосудов от доминантного желудочка; (4) одинарное
отхождение магистрального сосуда от доминантно-
го желудочка. При одинарном отхождении от желу-
дочка отходит один магистральный сосуд — общий
артериальный ствол, который затем разделяется на
аорту и легочные артерии. Одинарное отхождение
также наблюдается при атрезии аорты или легочной
артерии. Восходящий отдел аорты может иметь раз-
личный диаметр, что зависит от интенсивности ан-
теградного потока в аорте. При атрезии аортально-
го клапана может отмечаться гипоплазия восходя-
щего отдела аорты. У пациентов с СГЛОС часто
наблюдается коарктация аорты.
В конце анализа проводят поиск внутрисердеч-
ных шунтов. При наличии ДМПП или ДМЖП сле-
дует исключить рестрикцию потоков через них. Ре-
стриктивный ДМЖП эквивалентен аортальному
стенозу, и может понадобиться оперативное вмеша-
тельство для устранения обструкции оттока.
Ключевые вопросы, на которые необходимо от-
ветить при последовательном детальном анализе
структур сердца, перечислены в табл. 49.3 .
ЭХОКАРДИОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ
ОЦЕНКА ГЕМОДИНАМИКИ ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
Эхокардиографическую оценку гемодинамики по-
сле операции Фонтена проводят в субкостальной
позиции. Задачи исследования пациентов с един-
ственным желудочком сердца, которым была выпол-
нена операция Фонтена, перечислены в табл. 49.4,
а технические детали — в табл. 49.5 .
При визуализации анатомических структур сле-
дует оценить: (1) состояние системного венозного
кровотока; (2) предсердие, принимающее кровь из
легочных вен; (3) функции атриовентрикулярных и
полулунных клапанов; (4) функцию доминантного
желудочка; (5) выходной тракт доминантного желу-
дочка, включая дугу аорты; (6) внутрисердечные
шунты (как правило, на уровне предсердий и/или
желудочков). Рекомендации по визуализации и сро-
кам повторных оперативных вмешательств после
операции Фонтена приведены в табл. 49.6 .
Рис. 49.11 Взаиморасположение доминантного и гипоплазированного желудочков. (A) Единственный желудочек сердца , D -петля желудочков. Кпере-
ди располагается гипоплазированный морфологически правый желудочек (ПЖ), а доминантный желудочек имеет морфологию левого желудочка (ЛЖ). При
D-петле гипоплазированный правый желудочек и аорта (Ао) располагаются кпереди и справа. (Б) Единственный желудочек сердца, L -петля желудочков. Кпереди
располагается гипоплазированный морфологически правый желудочек, а доминантный желудочек имеет морфологию левого желудочка. При L-петле гипоплази-
рованный правый желудочек и аорта располагаются кпереди и слева. (В) Единственный желудочек сердца. Кзади располагается гипоплазированный морфологи-
чески левый желудочек, а доминантный желудочек имеет морфологию правого желудочка. ЛС — легочный ствол.
А
Б
В
Ао
Доминантный
морфологически ЛЖ
ЛС
Ао
ЛС
Ао
Доминантный
морфологически ЛЖ
ЛС
Гипоплазированный
морфологически ПЖ
D-петля
L-петля
Гипоплазированный
морфологически ПЖ
Доминантный
морфологически ПЖ
Гипоплазированный
морфологически ЛЖ
ch49.indd 1263
03.04.2019 12:20:13
1264 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ОЦЕНКА КРОВОТОКА В НИЖНЕЙ ПОЛОЙ ВЕНЕ
ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
Для оценки кровотока в нижней полой вене прово-
дят двухмерную допплерографию в субкостальной
позиции (см. рис. 49.4Б, 49.5В). В норме кровоток
после операции Фонтена ламинарный и низкоско-
ростной (от 20 до 30 см/сек), но изменяется в зави-
симости от фазы дыхательного цикла: во время вдо-
ха ускоряется, во время выдоха замедляется. Для
подтверждения нормального потока используют
цветовое допплеровское картирование (ЦДК) кро-
вотока и импульсно-волновую допплерографию.
Чтобы визуализировать поток при ЦДК кровотока,
необходимо уменьшить предел Найквиста (обычно
ниже 30 см/сек). При импульсно-волновой доппле-
рографии скорость потока уменьшается в зависи-
мости от фазы дыхательного цикла (см. рис. 49.8В).
Ретроградный характер потока либо отсутствие его
изменений во время дыхательного цикла свидетель-
ствует о нарушении (обструкция с тромбозом или
Рис. 49.12 Расположение магистральных сосудов. (A) 2D-ЭхоКГ, парастернальная позиция по короткой оси. Нормальное расположение магистральных со-
судов: аорта (Ао) и легочный ствол (ЛС) располагаются перпендикулярно. Причем когда аорта визуализируется по короткой оси, выходной тракт правого желу-
дочка и легочный ствол визуализируются по длинной оси. (Б) A 2D-ЭхоКГ, парастернальная позиция по короткой оси. D-ТМС: аорта и легочный ствол идут па-
раллельно и видны по короткой оси. В данном случае аорта лежит кпереди и справа от легочного ствола (при l-ТМС аорта лежит слева от легочного ствола).
(В) A 2D-ЭхоКГ, парастернальная позиция по длинной оси. Параллельное расположение аорты (кпереди) и легочного ствола (кзади) при D-ТМС.
Ао
Ао
ЛС
ЛС
А
Б
В
Ао
ЛС
ch49.indd 1264
03.04.2019 12:20:14
1265
49 Единственный желудочек сердца
Объект анализа
Ключевые вопросы
Варианты ответов
Сердце
Как расположено сердце в грудной клетке?
В левой половине грудной клетки
(синистропозиция)
В правой половине грудной клетки
(декстропозиция)
По срединной линии тела (мезопозиция)
Верхушка сердца
Куда направлена верхушка сердца?
Налево (синистрокардия)
Направо (декстрокардия, пояснения
см. в тексте)
По срединной линии тела (мезокардия)
Предсердия
Как расположено морфологически
правое предсердие?
Справа (расположение внутренних органов
situs solitus)
Слева (расположение внутренних органов
situs inversus)
Предсердный изомеризм (расположение
внутренних органов situs ambiguous)
Желудочки
Какова морфология доминантного желудочка?
Есть ли дополнительная камера и каково ее
расположение?
Морфологически левый желудочек
Морфологически правый желудочек
Неопределяемая
Атриовентрикулярное
соединение
Каков тип атриовентрикулярного соединения? Одножелудочковое (пояснения см. в тексте)
Двухжелудочковое (пояснения см. в тексте)
Магистральные сосуды
Как расположена аорта относительно легочного
ствола?
Перекрещивание (норма)
Параллельно (транспозиция магистральных
сосудов)
Желудочково-артериальное
соединение
Каково взаимное расположение желудочков
и магистральных сосудов?
Какой вариант отхождения магистральных
сосудов от единственного желудочка?
Какова анатомия дуги аорты?
Есть ли коарктация аорты?
Конкордантное (пояснения см. в тексте)
Дискордантное (пояснения см. в тексте)
Двойное (пояснения см. в тексте)
Одинарное (пояснения см. в тексте)
Внутрисердечные шунты
Есть ДМПП либо ДМЖП?
Рестриктивный ли он?
ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки.
ТАБЛИЦА 49.3 Последовательный детальный анализ структур сердца при сложных врожденных пороках сердца
без него). При подозрении на обструкцию во время
трансторакальной эхокардиографии (ТТЭхоКГ) и
неясной причине обструкции следует использовать
другие методы визуализации: МРТ, компьютерную
томографию (КТ), чреспищеводную эхокардиогра-
фию (ЧПЭхоКГ). При ТТЭхоКГ тромб можно не уви-
деть, но он хорошо визуализируется при ЧПЭхоКГ
[29]. При ЦДК кровотока можно выявить фенестра-
цию по турбулентному потоку между внутрипред-
сердным туннелем или экстракардиальным конду-
итом и предсердием, принимающим кровь из ле-
гочных вен (см. рис. 49.6Б). Импульсно-волновую
допплерографию используют для оценки градиента
давления на фенестрации. Обычно скорость крово-
тока на ней низкая (< 4 м/сек) [30]. Средний гради-
ент давления на фенестрации равен транспульмо-
нальному градиенту давления, поскольку средний
градиент давления на фенестрации отражает раз-
ность давлений между внутрипредсердным тунне-
лем или экстракардиальным кондуитом и предсер-
дием, принимающим кровь из легочных вен (см.
рис. 49.9Б).
ОЦЕНКА КРОВОТОКА В ВЕРХНЕЙ ПОЛОЙ ВЕНЕ
ПОСЛЕ ОПЕРАЦИИ ФОНТЕНА
Одним из этапов операции Фонтена является созда-
ние кавопульмонального анастомоза (соединение
между верхней полой веной и легочной артерией).
Наличие сообщения между легочными артериями
зависит от типа кавопульмонального анастомоза
(см. табл. 49.2). Визуализацию лучше всего прово-
дить в супрастернальной позиции (см. рис. 49.7,
49.8) либо верхней парастернальной позиции. Так
же, как и в нижней полой вене, скорость кровотока
низкая и зависит от фазы дыхательного цикла (см.
рис. 49.8В) [8]. Если наблюдается ускорение потока,
ch49.indd 1265
03.04.2019 12:20:15
1266 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Задача
Клиническая картина
Оценка системного венозного кровотока
Наличие и размер фенестрации
Сброс крови справа налево происходит из-за увеличения центрального веноз-
ного давления, что приводит к цианозу
Наличие и размеры тромбов
Тромбоз препятствует венозному кровотоку, повышает риск эмболии малого
круга кровообращения, гипертензии и неблагоприятного исхода
Анастомозы между экстракардиальным
кондуитом и нижней полой веной с одной
стороны и легочной артерией с другой
стороны либо внутрипредсердный
туннель, либо предсердно-легочный
анастомоз
Любое нарушение потока (стеноз или обструкция) увеличивает центральное
венозное давление, приводя к застою венозной крови, асциту, предсердным
аритмиям
Ветви легочного ствола
Стеноз ветвей легочного ствола нарушает легочный кровоток и повышает
центральное венозное давление
Оценка полости, принимающей кровь из легочных вен
Межпредсердное сообщение (смешивание
крови)
Обструкция легочных вен
Уменьшение возврата крови по легочным венам снижает наполнение желудочка,
тем самым уменьшая его преднагрузку, что ведет к низкому сердечному
выбросу, непереносимости физической нагрузки и декомпенсации
Оценка функции атриовентрикулярного клапана
Степень регургитации на АВ-клапане
Механизм регургитации на АВ-клапане
Стеноз АВ-клапана (после пластики
или протезирования)
Регургитация на АВ-клапане обычно сочетается с чрезмерной перегрузкой
объемом желудочка и ведет к нарушению гемодинамики после операции
Фонтена
Функция желудочка может ухудшаться после пластики или протезирования
АВ-клапана, что ассоциируется с неблагоприятным исходом
Оценка функции доминантного желудочка
Систолическая функция
Диастолическая функция
Более тяжелая систолическая дисфункция является предиктором неблагоприят-
ного исхода
Оценка выходного тракта доминантного желудочка
Стеноз либо регургитация
на полулунном клапане
Регургитация на полулунном клапане ведет к перегрузке объемом и дисфункции
желудочка
Остаточная либо рецидивирующая
обструкция дуги аорты
Стеноз полулунного клапана и обструкция выходного тракта приводят к посто-
янной перегрузке давлением, гипертрофии, систолической и диастолической
дисфункции желудочка
Остаточная обструкция дуги аорты либо коарктация аорты приводит к артери-
альной гипертензии
АВ — атриовентрикулярный.
ТАБЛИЦА 49.4 Задачи эхокардиографического исследования пациентов с единственным желудочком сердца
после операции Фонтена
то для определения среднего градиента давления ис-
пользуют импульсно-волновую допплерографию.
У пациентов с двухсторонней верхней полой веной
(ВПВ) необходимо проводить визуализацию обоих
кавопульмональных анастомозов.
ОЦЕНКА КРОВОТОКА В ЛЕГОЧНЫХ АРТЕРИЯХ
Легочные артерии лучше всего визуализируются в
супрастернальной позиции либо в высокой пара-
стернальной позиции. В данном случае у пациен-
тов, в отличие от пациентов с патологией сердечно-
сосудистой системы без операции Фонтена, крово-
ток будет иметь малую скорость без пульсации из-за
отсутствия подлегочного желудочка. Признак сте-
ноза легочных артерий — непрерывный характер
потока с повышением среднего градиента давления.
Ретроградный поток наблюдается при повышении
легочного сосудистого сопротивления либо при на-
личии развитой сети аортолегочных коллатералей.
ВОЗВРАТ КРОВИ ПО ЛЕГОЧНЫМ ВЕНАМ
Полостью, принимающей кровь из легочных вен,
чаще всего является большое общее предсердие или
правое и левое предсердия с большим ДМПП. По-
скольку латеральный туннель проходит внутри пред-
сердий, а экстракардиальный — вне предсердий, то
сдавление легочных вен возможно из-за экстракар-
диального кондуита либо при значительной дила-
тации предсердий. При оценке предсердия, прини-
мающего кровь из легочных вен, проводят ЦДК
кровотока в 2D-режиме и импульсно-волновую доп-
плерографию, которые могут помочь исключить
наличие тромба в полости сердца (рис. 49.13) и оце-
нить степень сдавления легочных вен (рис. 49.14).
ch49.indd 1266
03.04.2019 12:20:15
1267
49 Единственный желудочек сердца
Исследование
Первое
описание
Воспроизводимость
Корреляция с данными
магнитно-резонансной томографии
Методы, учитывающие геометрию желудочка
Метод качественной
оценки функции
желудочка
Bellsham-Revell
[20]
Не описана
Результаты качественной оценки
с помощью 2D-ЭхоКГ плохо коррели-
руют с количественной оценкой
с помощью МРТ
Метод качественной оценки для выявле-
ния сниженной функции (ФВ < 50%
при МРТ) характеризуется высокой
чувствительностью и низкой
специфичностью
Margossian [35] Умеренная для морфологически
левого желудочка
Низкая для морфологически
правого желудочка
Низкая корреляция с данными МРТ
Модифицированный
бипланарный метод
Симпсона
Margossian [35] Умеренная
Слабая корреляция между данными
модифицированного бипланарного
метода Симпсона и количественной
оценкой с помощью МРТ
Нельзя достоверно оценить объем
желудочков
Бипланарный метод
Симпсона в 3D-режиме
Soriano [37]
Хорошая
Не определена
Параметры, не зависящие от геометрии желудочка
dP/dt
Rhodes [38]
Высокая
Слабая корреляция с данными МРТ
оФВ
Скорость движения
миокарда
Rhodes [38]
Cкорость s′ имеет высокую воспроиз-
водимость при повторении тем же
исследователем, но среднюю — при
повторении разными
исследователями
Отсутствие корреляции скорости s′
при импульсно-волновой тканевой
допплерографии с ФВ при МРТ
Индекс Tei
Williams [38a]
Не описана
Корреляция с данными МРТ не описана
Наблюдается слабая корреляция между
индексом Tei и конечно-диастоличе-
ским давлением
Bellsham-Revell
[40]
Хорошая
У пациентов с СГЛОС индекс Tei не кор-
релирует с ФВ
Деформация миокарда
Singh [40a]
Параметр неприменим при тахикар-
дии; высокая воспроизводимость
при частоте кадров между 60 и 90
в секунду
Более высокая воспроизводимость
отмечается для базальных сегментов
по сравнению с апикальными
Хорошая корреляция параметра, опреде-
ляемого при 2D-ЭхоКГ, с меченым
миокардом на МРТ
Корреляция лучше при продольной
деформации миокарда, чем при
циркулярной
МРТ — магнитно -резонансная томография; СГЛОС — синдром гипоплазии левых отделов сердца; ФВ — фракция выброса; ЭхоКГ — эхо -
кардиография.
ТАБЛИЦА 49.5 Валидационные эхокардиографические исследования функции желудочка после операции Фонтена
ФУНКЦИЯ АТРИОВЕНТРИКУЛЯРНОГО КЛАПАНА
У пациентов с единственным желудочком сердца
после операции Фонтена регургитация на атриовен-
трикулярном клапане ассоциируется с повышенной
заболеваемостью и смертностью. Атриовентрику-
лярные соединения могут быть одножелудочковые
или двухжелудочковые. Анатомию и функцию кла-
панов оценивают в нескольких позициях, включая
субкостальную, парастернальную по длинной оси,
апикальную четырехкамерную и двухкамерную по-
зиции. Для оценки степени и механизма регургита-
ции используют 2D-режим и ЦДК кровотока.
Распространенной причиной регургитации явля-
ется дисплазия атриовентрикулярного клапана, осо-
бенно при СГЛОС. В этом случае регургитация на
атриовентрикулярном клапане служит предикто-
ch49.indd 1267
03.04.2019 12:20:15
1268 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Класс
Показания
Уровень
доказательности
Рекомендации по визуализации сердца у взрослых пациентов после операции Фонтена
Класс I Всем пациентам после операции Фонтена необходимо проводить эхокардиографию
и/или МРТ, результаты должны интерпретировать врачи с опытом диагностики врожденных
пороков сердца у взрослых
C
Рекомендации по повторной хирургической коррекции у взрослых пациентов после операции Фонтена
Класс I Пациентам с физиологией единственного желудочка сердца, которым была выполнена
операция Фонтена, любое повторное хирургическое вмешательство должны проводить
хирурги с достаточным опытом коррекции врожденных пороков сердца
C
Реоперации после операции Фонтена показаны при:
• Резидуальном ДМПП, из-за которого происходит сброс крови справа налево с симптомами
цианоза и который невозможно устранить транскатетерными методами
C
• Наличии гемодинамически значимого резидуального шунта между артериями большого
и малого кругов кровообращения, резидуального шунта между желудочком и легочной
артерией, которые невозможно устранить транскатетерными методами
C
• Умеренной либо тяжелой регургитации на АВ-клапане
C
• Значимой подаортальной обструкции (максимальный градиент давления > 30 мм рт. ст.)
C
• Обструкции системного венозного кровотока (экстракардиального кондуита
или внутрипредсердного туннеля)
C
• Венозных коллатералях либо легочных артериовенозных мальформациях, которые
невозможно закрыть транскатетерными методами
C
• Обструкции легочных вен
C
• Нарушениях ритма, например полной АВ-блокады сердца либо синдроме слабости
синусового узла, при которых необходима имплантация кардиостимулятора
с эпикардиальными электродами
C
• Создании либо закрытии фенестрации, если это невозможно выполнить транскатетерным
методом
C
Класс IIa Реоперация после операции Фонтена (ревизия предсердно-легочного соединения
при латеральном туннеле, внутрипредсердном кондуите, экстракардиальном кондуите)
может быть показана при фибрилляции либо трепетании предсердий без гемодинамически
значимых анатомических отклонений. Одновременно следует выполнить модифицирован-
ную операцию «лабиринт»
C
Класс IIb При тяжелой дисфункции единственного желудочка либо при энтеропатии с потерей белка
необходима трансплантация сердца
C
АВ — атриовентрикулярный; ДМПП — дефект межпредсердной перегородки; МРТ — магнитно -резонансная томография.
[Warnes CA, Williams RG, Bashore TM, et al. ACC/AHA 2008 Guidelines for the Management of Adults with Congenital Heart Disease: a report of
the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to develop guidelines on
the management of adults with congenital heart disease). Circulation 118:e714–833, 2008.]
ТАБЛИЦА 49.6 Рекомендации по визуализации и срокам повторных оперативных вмешательств после операции Фонтена
ром неблагоприятного исхода [31]. Для определе-
ния степени регургитации следует оценить пло-
щадь, длину и ширину струи регургитации.
Гемодинамически значимыми являются умерен-
ная регургитация и выраженная регургитация, при
которых необходима дополнительная оценка с по-
мощью ЭхоКГ в 3D-режиме [32] и других методов
визуализации. Клапанный стеноз обычно наблюда-
ется после пластики либо протезирования клапана.
Средний градиент давления определяют с помощью
непрерывно-волновой допплерографии в апикаль-
ной четырехкамерной позиции, направив ультра-
звуковой луч параллельно потоку через атриовен-
трикулярный клапан. Также полезно измерить вре-
мя полуспада давления.
СИСТОЛИЧЕСКАЯ ФУНКЦИЯ ЖЕЛУДОЧКА
Анатомию сердца и его структуры оценивают с по-
мощью ЭхоКГ в 2D-режиме. Функцию желудочка
определяют в нескольких позициях, включая субко-
стальную позицию, парастернальную позицию по
длинной оси, апикальную пятикамерную и двухка-
мерную позиции.
Эхокардиографическое исследование желудочков
после операции Фонтена проводят с целью оценки
систолической функции, диастолической функции
и желудочковой диссинхронии. Параметры, кото-
рые используют для оценки воспроизводимости и
надежности эхокардиографической оценки функ-
ции желудочка у пациентов после операции Фонте-
на, перечислены в табл. 49.4.
ch49.indd 1268
03.04.2019 12:20:15
1269
49 Единственный желудочек сердца
ПП
ЛП
Ж
Рис. 49.13 A Спонтанное контрастирование у пациента с предсердно-
легочным анастомозом Фонтена. ЧПЭхоКГ после создания предсердно-
легочного анастомоза Фонтена у пациента с атрезией трикуспидального кла-
пана. Видно расширенное правое предсердие (ПП) со спонтанным контрасти-
рованием, что указывает на низкую скорость потока (высокий риск
образования тромбов). Межпредсердная перегородка смещена вправо, что
свидетельствует о повышенном давлении в правом предсердии. Ж — желу-
дочек; ЛП — левое предсердие.
Рис. 49.14 Сдавление легочных вен при предсердно-легочном анастомозе Фонтена. (A) A 2D-ТТЭхоКГ, апикальная четырехкамерная позиция. Вид-
но значительно расширенное правое предсердие (ПП) после предсердно-легочного анастомоза Фонтена у пациента с атрезией трикуспидального клапана и гипо-
плазией правого желудочка. Расширение правого предсерия привело к сдавлению (стрелка) левого предсердия (ЛП) и правой верхней легочной вены. (Б) A ЦДК
кровотока позволяет оценить потоки в левом предсердии и правой верхней легочной вене. Высокоскоростной поток указывает на сдавление легочных вен. Ж —
желудочек.
ПП
ЛП
Ж
А
Б
КАЧЕСТВЕННАЯ ОЦЕНКА
У пациентов с физиологией единственного желу-
дочка его систолическую функцию оценивают каче-
ственно. Функцию считают нормальной в случае
ФВ > 55%, умеренной — при ФВ от 41 до 55%, сред-
ней — при ФВ от 31 до 40%, сниженной — в случае
ФВ ≤ 30% на основании субъективного восприятия
врача, проводящего исследование. Градация взята
из рекомендаций по эхокардиографической оценке
состояния желудочков у взрослых с приобретенны-
ми болезнями сердца [33]. Следовательно, досто-
верность такой оценки функции единственного же-
лудочка сомнительна.
Качественная оценка функции желудочков пло-
хо коррелирует с данными МРТ сердца — «золото-
го стандарта» оценки единственного желудочка серд-
ца [34, 35]. При принятии в качестве порогового
значения ФВ < 50% (по МРТ) субъективная оценка
сниженной функции желудочка имеет высокую
чувствительность, но низкую специфичность. Ве-
роятно, это происходит вследствие склонности вра-
ча к гипердиагностике, чтобы не пропустить паци-
ента с дисфункцией единственного желудочка серд-
ца [34]. По мере прогрессирования дисфункции
желудочка от умеренной до средней степень субъ-
ективности в оценке различными специалистами
по ультразвуковой диагностике возрастает, что сви-
детельствует о низкой чувствительности качествен-
ной оценки дисфункции желудочка. Наличие дис-
синхронии также затрудняет оценку глобальной
функции желудочка. На качественную оценку си-
столической функции желудочка дополнительно
влияет морфология, при этом результаты оценки
морфологически ПЖ всегда менее воспроизводи-
мы, чем при оценке морфологически ЛЖ [35].
КОЛИЧЕСТВЕННАЯ ОЦЕНКА
Для минимизации погрешностей при качественной
оценке были предложены количественные методы.
С помощью модифицированного бипланарного ме-
тода Симпсона было установлено, что у детей и под-
ростков после операции Фонтена ФВ в среднем со-
ставляет 59 ± 10%. Более высокая ФВ отмечается в
ch49.indd 1269
03.04.2019 12:20:15
1270 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
ентов [21]. Использовать стандартные протоколы
исследования и классификации следует с осторож-
ностью, т.к. они не учитывают у пациентов с един-
ственным желудочком некоторые особенности, в
частности более медленный возврат крови по легоч-
ным венам, вариабельные размеры и функцию атрио
вентрикулярного клапана.
Установлено, что при нормальной анатомии серд-
ца отношение скорости кровотока через митральный
клапан (Е) к скорости смещения его фиброзного
кольца (e′) > 15 часто свидетельствует о повышении
конечно-диастолического давления в желудочке до
уровня более 12 мм рт. ст. [43]. Подобные исследова-
ния у пациентов с единственным желудочком сердца
дали противоречивые результаты: в некоторых ис-
следованиях корреляция между отношением E/e′ и
конечно-диастолическим давлением в желудочке бы-
ла слабой [44], в других — умеренной [42]. В одном
исследовании 32 пациентам с единственным желу-
дочком сердца выполнили ЭхоКГ и катетеризацию
сердца и установили, что отношение E/e′ ≥ 12 имеет
чувствительность 90% и специфичность 75% для ди-
агностики конечно-диастолического давления, пре-
вышающего 10 мм рт. ст. Также полезно определять
наличие ретроградного потока по легочным венам,
поскольку он во время систолы сильнее коррелирует
с конечно-диастолическим давлением, чем отноше-
ние E/e′ (r = 0,77 vs r = 0,44) [42]. С учетом больших
различий в результатах одноцентровых исследова-
ний для внедрения данных показателей с целью
оценки диастолической функции единственного же-
лудочка сердца в повседневную клиническую прак-
тику необходимо предварительно провести много-
центровые исследования.
ВЫХОДНОЙ ТРАКТ
После операции Фонтена выходной тракт соединя-
ет желудочек с аортой. Наиболее распространенная
причина обструкции выходного тракта — подкла-
панный стеноз из-за рестриктивного ДМЖП. Реже
наблюдаются подклапанная мембрана, ложная хор-
да либо обструкция на уровне клапана. Постоян-
ная перегрузка давлением желудочка, включенного
в большой круг кровообращения, несет риск про-
грессирования систолической и диастолической
дисфункций желудочка и нарушения гемодинами-
ки после операции Фонтена. Оценивать выходной
тракт следует в нескольких позициях, включая суб-
костальную, парастернальную по длинной оси и
апикальные.
Для определения ускорения, турбулентности по-
тока, максимального и среднего градиентов давле-
ния используют ЦДК кровотока, импульсно-волно-
вую и непрерывно-волновую допплерографию. Для
точного измерения градиентов давления крайне важ-
но направить ультразвуковой луч параллельно вы-
ходному тракту.
морфологически ЛЖ (около 60%) в сравнении с
морфологически ПЖ (56%) [21]. Модифицирован-
ный бипланарный метод Симпсона дает более вос-
производимые результаты по сравнению с каче-
ственной оценкой, однако корреляция с данными
МРТ остается слабой [35]. Практически у всех паци-
ентов наблюдается дилатация желудочка: средний
диастолический объем единственного желудочка
составляет 79 ± 29 мл/м2 (при морфологически ЛЖ)
и 93 ± 29 мл/м2 (при морфологически ПЖ) [21].
Слабым местом модифицированного бипланар-
ного метода Симпсона является сложность визуали-
зации истинных размеров по короткой и длинной
осям, что приводит к систематической недооценке
объема единственного желудочка. Кроме того, при
модифицированном бипланарном методе Симпсо-
на предполагается, что сердце имеет форму эллип-
соида, однако в случае единственного желудочка
сердца геометрия его полостей может быть гораздо
сложнее. Трехмерная ЭхоКГ (3D-ЭхоКГ) не имеет
геометрических ограничений, поэтому ее результа-
ты значительно ближе к данным МРТ, чем резуль-
таты визуализации в 2D-режиме [36, 37]. Объем же-
лудочка также недооценивается, а результаты огра-
ничены низкой частотой кадров. Визуализация в
3D-режиме может давать более качественные изо-
бражения у детей, а у взрослых, особенно имеющих
ожирение и дилатацию желудочков, проведение ис-
следования затруднено.
ПАРАМЕТРЫ, НЕ ЗАВИСЯЩИЕ ОТ ГЕОМЕТРИИ ЖЕЛУДОЧКА
Существуют параметры, которые не зависят от объ-
емных данных, что позволяет преодолевать многие
ограничения визуализации в 2D- и 3D-режимах. У
пациентов после операции Фонтена оценивают dP/
dt [38], индекс Tei [39], скорость движения миокар-
да [40], соотношение продолжительности систолы
и диастолы [41]. Все эти параметры имеют высокую
воспроизводимость, но они также плохо коррели-
руют с данными МРТ относительно ФВ. В связи с
этим клиническая значимость данных показателей
у пациентов с единственным желудочком сердца не-
однозначна.
ДИАСТОЛИЧЕСКАЯ ФУНКЦИЯ ЖЕЛУДОЧКА
У пациентов после операции Фонтена часто наблю-
дается диастолическая дисфункция желудочка [21].
При этом остается неясным, можно ли использо-
вать стандартные параметры ЭхоКГ (скорость кро-
вотока через атриовентрикулярный клапан, крово-
тока в легочных венах и скорость деформации мио
карда) и границы нормы показателей в отношении
гемодинамики после операции Фонтена [42].
Если к пациентам с единственным желудочком
сердца применить стандартные критерии определе-
ния диастолической дисфункции, то некоторые ее
признаки будут обнаружены более чем у 70% паци-
ch49.indd 1270
03.04.2019 12:20:16
1271
49 Единственный желудочек сердца
Анастомоз Дамуса–Кайе–Стенсла формируют
для устранения системной обструкции выходного
тракта у пациентов с транспозицией магистральных
сосудов, а также в рамках операции Норвуда при ле-
чении пациентов с СГЛОС. Данный анастомоз со-
единяет проксимальный участок легочного ствола с
восходящим отделом аорты, что обеспечивает бес-
препятственный поток крови в большой круг кро-
вообращения через клапан легочной артерии, кото-
рый после операции становится неоаортальным
клапаном. Анастомоз между восходящим отделом
аорты и легочным стволом необходимо визуализи-
ровать для исключения обструкции, которая может
нарушить коронарный кровоток и привести к ише-
мии и дисфункции желудочка. Также следует оце-
нить функцию полулунных клапанов. При транс-
плантации клапана легочной артерии в аортальную
позицию может развиться регургитация. Из-за ана-
стомоза Дамуса–Кайе–Стенсла возможно наруше-
ние подвижности створок, что также приведет к ре-
гургитации.
Важным этапом исследования является оценка
дуги аорты, особенно у пациентов с СГЛОС, кото-
рым необходима реконструкция дуги либо пласти-
ка по поводу коарктации аорты. Дуга аорты лучше
всего визуализируется в супрастернальной позиции
с помощью ЦДК кровотока и непрерывно-волно-
вой допплерографии при определении максималь-
ного градиента давления в дуге и нисходящем отде-
ле аорты. У взрослых визуализировать дугу аорты
бывает трудно, поэтому следует оценивать крово-
ток в брюшной части нисходящего отдела аорты с
помощью импульсно-волновой допплерографии.
Отсутствие антеградного диастолического потока в
брюшной части нисходящего отдела аорты исклю-
чает значительную обструкцию.
ЗАКЛЮЧЕНИЕ
При обследовании взрослых пациентов со сложны-
ми ВПС как в дооперационном, так и в послеопера-
ционном периоде используют все эхокардиографи-
ческие методы. Специалист, оценивающий анато-
мию сердца с единственным желудочком, должен
обладать достаточными знаниями о ВПС, опытом
последовательного детального анализа структур
сердца, включая внутрипредсердный туннель и экс-
тракардиальный кондуит, предсердие, принимаю-
щее кровь из легочных вен, атриовентрикулярный
клапан, желудочки и выходной тракт. Точная оцен-
ка функции желудочков с помощью ТТЭхоКГ зача-
стую затруднена. В настоящее время оптимальным
методом количественного определения объема и
функции желудочков является МРТ. Пациентам с
подозрением на тромбоз либо обструкцию крово-
тока во внутрипредсердном туннеле или экстракар-
диальном кондуите следует выполнять ЧПЭхоКГ,
МРТ либо КТ сердца.
Задача
Анатомическая
структура сердца
Позиция
Метод, цели и параметры
Оценка цен-
трального
венозного
кровотока
Соединение НПВ
с экстракардиаль-
ным кондуитом
Субкостальная
2D-ЭхоКГ: оценка дилатации, спонтанного контрастирования
и тромбоза
Цветовая допплерография: определение низкоскоростного
потока с уменьшением предела Найквиста
Импульсно-волновая допплерография: оценка скорости
потока во время дыхательного цикла
Внутрипредсердный
туннель или экстра-
кардиальный
кондуит
Субкостальная,
парастернальная,
апикальная
2D-ЭхоКГ: оценка дилатации, спонтанного контрастирования
и тромбоза плюс оценка потока через фенестрацию (при ее
наличии)
Импульсно-волновая допплерография: измерение градиента
давления на фенестрации (средний градиент равен транс-
пульмональному градиенту)
Соединение ВПВ
с легочной артерией
(двунаправленный
кавопульмональный
анастомоз)
Супрастернальная
Высокая
парастернальная
2D-ЭхоКГ: определение тромба в ВПВ
Цветовая допплерография: определение низкоскоростного
потока с уменьшением предела Найквиста
Импульсно-волновая допплерография: оценка скорости
потока во время дыхательного цикла
Ветви легочного
ствола
Супрастернальная
2D-ЭхоКГ: оценка стеноза ветвей легочного ствола
Цветовая допплерография: выявление ретроградного потока
при увеличении легочного сосудистого сопротивления либо
при наличии значимых аортолегочных коллатералей
Импульсно-волновая допплерография: выявление постоян-
ного потока с увеличением среднего градиента давления
при стенозе
СВОДНАЯ ИНФОРМАЦИЯ
Практические рекомендации по визуализации сердца у пациентов с единственным желудочком сердца
ch49.indd 1271
03.04.2019 12:20:16
1272 ЧАСТЬ VIII Врожденные пороки сердца у взрослых
Задача
Анатомическая
структура сердца
Позиция
Метод, цели и параметры
Оценка пред-
сердия, при-
нимающего
кровь
из легочных
вен
Соединение легочных
вен с предсердием,
принимающем
кровь
из легочных вен
Апикальная
четырехкамерная
2D-ЭхоКГ: выявление сдавления легочных вен, рестриктив-
ного ДМПП
Цветовая допплерография: определение ускорения потока
в месте сдавления легочных вен, исключение рестриктив-
ного ДМПП
Импульсно-волновая допплерография: оценка увеличения
скорости потока
Оценка
функции
АВ-клапана
Общий АВ-клапан
Митральный клапан
Системный трику-
спидальный клапан
Апикальная
четырехкамерная
Апикальная
двухкамерная
Парастернальная
по длинной и
короткой осям*
2D-ЭхоКГ: оценка структуры и функция клапана, планиме-
трия при клапанном стенозе
Цветовая допплерография: измерение площади, длины
и ширины струи регургитации
Непрерывно-волновая допплерография: оценка максималь-
ного/среднего градиента давления при клапанном стенозе,
времени полуспада давления
Оценка
функции
желудочка
Доминантный
желудочек†
Апикальная
четырехкамерная
Апикальная
двухкамерная
Парастернальная
по длинной
и короткой осям
Субкостальная
Систолическая функция
2D-ЭхоКГ: бипланарный метод Симпсона при отсутствии
нормальной геометрии клапана (низкая надежность)
Параметры, не зависящие от геометрии желудочка: скорость
деформации миокарда, dP/dt, время изоволюметрического
сокращения, индекс Tei, деформация миокарда
Диастолическая функция
Импульсно-волновая допплерография: оценка скорости
потока в приточном отделе желудочка, отношения E/e′
Оценка выход-
ного тракта
Выходной тракт
желудочка
Аортальный клапан
Дуга аорты
и нисходящий отдел
аорты
Парастернальная
по длинной оси
Апикальная
по длинной оси
Субкостальная
Супрастернальная
(при коарктации
аорты)
2D-ЭхоКГ: определение причины обструкции
либо регургитации
Цветовая допплерография: поиск места обструкции,
измерение ширины vena contracta
Импульсно-волновая допплерография: определение локали-
зации максимального градиента давления
Непрерывно-волновая допплерография: оценка максималь-
ного/среднего градиента давления
* Использование различных позиций крайне важно для визуализации струи регургитации в трех плоскостях.
† В большинстве случаев единственного желудочка сердца есть два желудочка, однако лишь у одного функция сохранна (доминантный
желудочек). Второй желудочек отличается малым размером, иногда его называют кодоминантным желудочком или «выпускником».
АВ — атриовентрикулярный; ВПВ — верхняя полая вена; ДМПП — дефект межпредсердной перегородки; НПВ — нижняя полая вена .
СВОДНАЯ ИНФОРМАЦИЯ
окончание
Практические рекомендации по визуализации сердца у пациентов с единственным желудочком сердца
ЛИТЕРАТУРА
1. Cook AC, Anderson RH: The functionally
univentricular circulation: anatomic sub-
strates as related to function, Cardiol Young
15(Suppl 3):7–16, 2005.
2. Barron DJ, Kilby MD, Davies B, et al. Hypo-
plastic left heart syndrome, Lancet 374:551–
564, 2009.
3. Bondy CA: Hypoplastic left heart syndrome,
New Engl J Med 362:2026–2028, 2010.
4. Feinstein JA, Benson DW, Dubin AM, et al.
Hypoplastic left heart syndrome: current
considerations and expectations, J Am Coll
Cardiol 59(1 Suppl):S1–42, 2012.
5. Fontan F, Baudet E: Surgical repair of tricus-
pid atresia, Thorax 26:240–248, 1971.
6. Gersony WM: Fontan operation after 3 de-
cades: what we have learned, Circulation 117:
13–15, 2008.
7. Gewillig M: The Fontan circulation, Heart
91:839–846, 2005.
8. Penny DJ, Redington AN: Doppler echocar-
diographic evaluation of pulmonary blood
flow after the Fontan operation: the role of
the lungs, Br Heart J 66:372–374, 1991.
9. Kreutzer G, Galindez E, Bono H, et al. An op-
eration for the correction of tricuspid atresia,
J Thorac Cardiovasc Surg 66:613–621, 1973.
10. Bjork VO, Olin CL, Bjarke BB, Thoren CA:
Right atrial-right ventricular anastomosis for
correction of tricuspid atresia, J Thorac Car-
diovasc Surg 77:452–458, 1979.
11. Laks H, Ardehali A, Grant PW, et al. Modifi-
cation of the Fontan procedure. Superior ve-
na cava to left pulmonary artery connection
and inferior vena cava to right pulmonary ar-
tery connection with adjustable atrial septal
defect, Circulation 91:2943–2947, 1995.
12. Puga FJ, Chiavarelli M, Hagler DJ: Modifica-
tions of the Fontan operation applicable to
patients with left atrioventricular valve atresia
or single atrioventricular valve, Circulation
76(3 Pt 2):III53–III60, 1987.
13. Marcelletti CF, Hanley FL, Mavroudis C, et al.
Revision of previous Fontan connections to
total extracardiac cavopulmonary anastomo-
sis: a multicenter experience, J Thorac Cardio-
vasc Surg 119:340–346, 2000.
14. Khairy P, Poirier N: Is the extracardiac con-
duit the preferred Fontan approach for pa-
tients with univentricular hearts? The extra-
cardiac conduit is not the preferred Fontan
approach for patients with univentricular
hearts, Circulation 126:2516–2525, 2012.
15. Glenn WW: Circulatory bypass of the right
side of the heart. IV. Shunt between superior
vena cava and distal right pulmonary artery;
report of clinical application, New Engl J Med
259:117–120, 1958.
16. Lee J, Menkis AH, Rosenberg HC: Reversal of
pulmonary arteriovenous malformation after
diversion of anomalous hepatic drainage, An-
nals Thorac Surg 65:848–849, 1998.
17. Haller Jr. JA, Adkins JC, Worthington M,
Rauenhorst J: Experimental studies on per-
ch49.indd 1272
03.04.2019 12:20:16
1273
49 Единственный желудочек сердца
manent bypass of the right heart, Surgery
59:1128–1132, 1966.
18. Mertens L, Hagler DJ, Sauer U, et al. Protein-
losing enteropathy after the Fontan opera-
tion: an international multicenter study. PLE
study group, J Thorac Cardiovasc Surg
115:1063–1073, 1998.
19. Brooks PA, Khoo NS, Mackie AS, Hornberger
LK: Right ventricular function in fetal hypo-
plastic left heart syndrome, J Am Soc Echocar-
diogr 25:1068–1074, 2012.
20. Bellsham-Revell HR, Tibby SM, Bell AJ, et al.
Serial magnetic resonance imaging in hypo-
plastic left heart syndrome gives valuable in-
sight into ventricular and vascular adaptation,
J Am Coll Cardiol 61:561–570, 2013.
21. Anderson PA, Sleeper LA, Mahony L, et al.
Contemporary outcomes after the Fontan
procedure: a Pediatric Heart Network multi-
center study, J Am Coll Cardiol 52:85–98,
2008.
22. Fogel MA, Weinberg PM, Chin AJ, et al. Late
ventricular geometry and performance
changes of functional single ventricle
throughout staged Fontan reconstruction as-
sessed by magnetic resonance imaging, J Am
Coll Cardiol 28:212–221, 1996.
23. Piran S, Veldtman G, Siu S, et al. Heart fail-
ure and ventricular dysfunction in patients
with single or systemic right ventricles, Circu-
lation 105:1189–1194, 2002.
24. Silversides CK, Salehian O, Oechslin E, et al.
Canadian Cardiovascular Society 2009 Con-
sensus Conference on the management of
adults with congenital heart disease: complex
congenital cardiac lesions, Can J Cardiol
26:e98–e117, 2010.
25. Warnes CA, Williams RG, Bashore TM, et al.
ACC/AHA 2008 Guidelines for the Manage-
ment of Adults with Congenital Heart Dis-
ease: a report of the American College of Car-
diology/American Heart Association Task
Force on Practice Guidelines (writing com-
mittee to develop guidelines on the manage-
ment of adults with congenital heart disease),
Circulation 118:e714–e833, 2008.
26. Van Praagh R: Terminology of congenital
heart disease. Glossary and commentary, Cir-
culation 56:139–143, 1977.
27. Moller TH, Neal WA: Heart disease in infancy,
New York, 1978, Appleton-Century-Crofts.
28. Campbell M, Deuchar DC: Dextrocardia and
isolated laevocardia. II . Situs inversus and iso-
lated dextrocardia, Br Heart J 28:472–487,
1966.
29. Fyfe DA, Kline CH, Sade RM, Gillette PC:
Transesophageal echocardiography detects
thrombus formation not identified by transtho-
racic echocardiography after the Fontan opera-
tion, J Am Coll Cardiol 18:1733–1737, 1991.
30. Stumper O, Sutherland GR, Geuskens R, et al.
Transesophageal echocardiography in evalua-
tion and management after a Fontan proce-
dure, J Am Coll Cardiol 17:1152–1160, 1991.
31. Bharucha T, Honjo O, Seller N, et al. Mecha-
nisms of tricuspid valve regurgitation in hy-
poplastic left heart syndrome: a case-matched
echocardiographic-surgical
comparison
study, Eur Heart J Cardiovasc Imaging 14:135–
141, 2013.
32. Takahashi K, Inage A, Rebeyka IM, et al. Re-
al-time 3-dimensional echocardiography pro-
vides new insight into mechanisms of tricus-
pid valve regurgitation in patients with hypo-
plastic left heart syndrome, Circulation
120:1091–1098, 2009.
33. Lang RM, Bierig M, Devereux RB, et al. Rec-
ommendations for chamber quantification: a
report from the American Society of Echo-
cardiography’s Guidelines and Standards
Committee and the Chamber Quantification
Writing Group, developed in conjunction
with the European Association of Echocar-
diography, a branch of the European Society
of Cardiology, J Am Soc Echocardiogr 18:1440–
1463, 2005.
34. Bellsham-Revell HR, Simpson JM, Miller OI,
Bell AJ: Subjective evaluation of right ventric-
ular systolic function in hypoplastic left heart
syndrome: how accurate is it? J Am Soc Echo-
cardiogr 26:52–56, 2013.
35. Margossian R, Schwartz ML, Prakash A, et al.
Comparison of echocardiographic and cardiac
magnetic resonance imaging measurements of
functional single ventricular volumes, mass,
and ejection fraction (from the Pediatric Heart
Network Fontan Cross-Sectional Study), Am J
Cardiol 104:419–428, 2009.
36. Altmann K, Shen Z, Boxt LM, et al. Compar-
ison of three-dimensional echocardiographic
assessment of volume, mass, and function in
children with functionally single left ventri-
cles with two-dimensional echocardiography
and magnetic resonance imaging, Am J Car-
diol 80:1060–1065, 1997.
37. Soriano BD, Hoch M, Ithuralde A, et al. Ma-
trix-array 3-dimensional echocardiographic
assessment of volumes, mass, and ejection
fraction in young pediatric patients with a
functional single ventricle: a comparison
study with cardiac magnetic resonance, Cir-
culation 117:1842–1848, 2008.
38. Rhodes J, Margossian R, Sleeper LA, et al.
Non-geometric echocardiographic indices of
ventricular function in patients with a Fontan
circulation, J Am Soc Echocardiogr 24:1213–
1219, 2011.
38a. Williams RV, Ritter S, Tani LY, et al. Quanti-
tative assessment of ventricular function in
children with single ventricles using the Dop-
pler myocardial performance index, Am J
Cardiol 86:1106–1110, 2000.
39. Cheung MM, Smallhorn JF, Redington AN,
Vogel M: The effects of changes in loading
conditions and modulation of inotropic state
on the myocardial performance index: com-
parison with conductance catheter measure-
ments, Eur Heart J 25:2238–2242, 2004.
40. Bellsham-Revell HR, Tibby SM, Bell AJ, et al.
Tissue Doppler time intervals and derived in-
dices in hypoplastic left heart syndrome, Eur
Heart J Cardiovasc Imaging 13:400–407, 2012.
40a. Singh GK, Cupps B, Pasque M, et al. Accura-
cy and reproducibility of strain by speckle
tracking in pediatric subjects with normal
heart and single ventricular physiology: a
two-dimensional speckle-tracking echocar-
diography and magnetic resonance imaging
correlative study, J Am Soc Echocardiogr
23:1143–1152, 2010.
41. Friedberg MK, Silverman NH: The systolic to
diastolic duration ratio in children with hy-
poplastic left heart syndrome: a novel Dop-
pler index of right ventricular function, J Am
Soc Echocardiogr 20:749–755, 2007.
42. Menon SC, Gray R, Tani LY: Evaluation of
ventricular filling pressures and ventricular
function by Doppler echocardiography in pa-
tients with functional single ventricle: correla-
tion with simultaneous cardiac catheterization,
J Am Soc Echocardiogr 24:1220–1225, 2011.
43. Ommen SR, Nishimura RA, Appleton CP, et
al. Clinical utility of Doppler echocardiogra-
phy and tissue Doppler imaging in the estima-
tion of left ventricular filling pressures: a
comparative simultaneous Doppler-catheter-
ization study, Circulation 102:1788–1794,
2000.
44. Husain N, Gokhale J, Nicholson L, et al. Non-
invasive estimation of ventricular filling pres-
sures in patients with single right ventricles,
J Am Soc Echocardiogr 26:1330–1336, 2013.
ch49.indd 1273
03.04.2019 12:20:16
ch49.indd 1274
03.04.2019 12:20:16
1275
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
А
Аблация
трепетание предсердий, 1071
фибрилляция предсердий, 108
этанолом межжелудочковой перегородки
при гипертрофической кардиомиопатии, 664–666,
669–671
Абсцесс околоклапанный, 524–530, 543
Автоматизированное определение границ, 209
интеллектуальные ультразвуковые системы, 221, 222
классификаторы, 220, 221
методы, 211–220
анализ объекта, 214
оценка структуры, 211–214
популяционная модель, 218–220
правила, 209
сопоставление с образом, 214–216
сравнение, 220–222
трехмерное определение поверхности, 216–219
функциональность, 211
определение границ, 210
перспективы, 221, 222
получение качественного изображения, 210
практические аспекты, 210, 222
проблемы и подводные камни, 209
эхокардиография, 209–211
Автоматизированный анализ изображений, 205, 206
Аденозин, стресс-эхокардиография, 312
Акромегалия, 940–942
Алкоголь-зависимые заболевания печени, 946–949
Амилоидоз
рестриктивная кардиомиопатия, 684–686
у пожилых, 1025, 1026
Анализ
изображений, определение, 205
отношения давление–объем
в перикарде, 706, 707, 709
систолическая функция левого желудочка, 150
отношения напряжение/укорочение, 148, 149
Анастомоз
Ватерстоуна, 1260
Дамус–Кайе–Стансла, 1260
двунаправленный кавопульмональный, 1243, 1248, 1260
Поттса, 1260
Сано, 1260
Ангиография коронарная
с внутрисосудистым ультразвуковым исследованием,
746, 748–750
срочная, оценка необходимости, 234
Аневризма
верхушки, 656, 657, 659
восходящего отдела аорты, 364
грудной части нисходящего отдела аорты,
наследственная, 985
истинная, осложнение острого инфаркта миокарда, 259
межпредсердной перегородки, 1044, 1047
синусов Вальсальвы, 1152, 1153
Анкилозирующий спондилит, 908–910
Аномалия
дуги аорты, 1170–1172, 1177–1178
Эбштейна, 1197–1202
во время беременности, 1117, 1129, 1130
Аномальный дренаж легочных вен, 1147–1149, 1155–1157
Антифосфолипидный синдром первичный, 902, 903
Аорта
артериит, 915, 922–925
гигантоклеточный, 916–918, 920
Такаясу, 915–919
восходящий отдел, оценка, 391, 392
врожденная патология, 1166–1169
грудная часть. См. Грудная часть нисходящего отдела
аорты
данные в норме, 985–987
дилатация при заболеваниях соединительной ткани,
986–988
интрамуральная гематома, 867–868
диагностика, чреспищеводная эхокардиография, 876
коарктация, 1166–1167, 1172–1174, 1177–1178
во время беременности, 1116, 1117, 1129–1130
острый синдром
диагностика, 868–877, 879
компьютерная томография, 868–870
магнитно-резонансная томография, 869, 871
трансторакальная эхокардиография, 870–872
чреспищеводная эхокардиография, 869–879
чреспищеводная эхокардиография, 65–67
расслоение. См. Расслоение аорты
травма, 868, 877
у спортсменов, 960–964
чреспищеводная эхокардиография, 50, 54–56
язва, пенетрирующая, 868
диагностика, чреспищеводная эхокардиография, 877
Аортальная регургитация, 381–402
аортальный стеноз, 339–341
осложнение расслоения аорты, 878–880
острая, 398–400
оценка корня аорты и восходящего отдела аорты, 391
протезы
диагностика и оценка, 587–593
неправильное расположение и нарушение работы
створок, 371–373
размеры и систолическая функция левого желудочка, 391
степень, оценка, 384–390, 401, 402
альтернативные методы, 389, 390
импульсно-волновая допплерография, 387, 401, 402
магнитно-резонансная томография, 390
непрерывно-волновая допплерография, 388, 401, 402
цветовая допплерография, 384–387, 401, 402
хирургическое лечение, 394, 395
лекарственная терапия, 394
In-index_2 колонки.indd 1275
03.04.2019 12:47:33
1276 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
осложнения, 397, 398
показания, 394
результаты и наблюдение, 397, 398
эхокардиография, 396, 397
хроническая, 393, 394, 398
этиология, 381–384
изменения корня аорты, 383, 384
изменения створок, 382, 383
Аортальный клапан
беременность, 1120–1121
визуализация в 3D-режиме, 40, 42–44
кальцификация, степень и локализация, 368
оценка, 332, 355
протезирование
высокие градиенты на протезе, интерпретация, 596–599
имплантация транскатетерная. См. Транскатетерная
имплантация аортального клапана
регургитация. См. Аортальная регургитация
склероз у пожилых, 1011, 1015–1019
транскатетерная имплантация. См. Транскатетерная
имплантация аортального клапана
устройства вспомогательного кровообращения, 770, 772
функция корня аорты, 391, 392
чреспищеводная эхокардиография, 50, 54–57, 68–69
Аортальный стеноз, 325–360
аортальная регургитация, 339, 340
бессимптомный, 346, 348, 350
во время беременности, 1119–1121, 1129–1130
изменения левого желудочка, 339
ишемическая болезнь сердца, 342
кальцификация фиброзного кольца митрального
клапана, митральная регургитация, 341
катетеризация сердца, 342, 343
клинические подходы, 343–346
компьютерная томография, 343
легочная гипертензия, 342
магнитно-резонансная томография, 343
морфология клапанов, 328, 330, 331
надклапанный, 1169–1170
острая боль в груди, 241, 243
пациенты с симптомами, 349, 350
подклапанная обструкция, 340, 341
прогностическая значимость эхокардиографии, 346–349
протезирование аортального клапана, 349–355, 364
низкий градиент давления и сниженная фракция
выброса, 351, 352
низкий градиент давления и сохранная фракция
выброса, 352–355
пациенты без симптомов, 350, 351
пациенты с показаниями к другим хирургическим
вмешательствам, 355
пациенты с симптомами, 349, 350
ревматический, 336
стадии, 327, 329
степень нарушений гемодинамики, 328–335
индекс скорости, 334, 355
индекс ударного объема, 332, 333, 355
планиметрия площади клапана, 335, 336, 355
расчет площади аортального клапана, 332, 355
скорость кровотока, 330, 331, 334, 355
трудности, 335–339
стресс-эхокардиография, 342
Аортит при анкилозирующем спондилите, 908, 909
Аортолегочное окно, 1221, 1222
Аортопатия
во время беременности, 1121–1124, 1129–1130
пороки конотрункуса, 1210–1211
Апноэ во сне обструктивное, 935, 936, 937
Аритмия, диссинхрония и риски развития аритмий, 174,
175
Аритмогенная кардиомиопатия правого желудочка, 974,
975
Артериит
гигантоклеточный, 916–918, 920
Такаясу, 915–919
Асимметричная апикальная гипертрофическая
кардиомиопатия, 655–659, 669–671
Атеросклероз
анкилозирующий спондилит, 910
заболевания соединительной ткани, 914–915
первичный антифосфолипидный синдром, 902–903
полимиозит и дерматомиозит, 914
ревматоидный артрит, 903–908
системная красная волчанка, 885, 901
склеродермия, 910–914
Атрезия трикуспидального клапана, 1247–1249
Атриовентрикулярный канал, 1143–1145
Б
Бактериемия при инфекционном эндокардите, 532
Баллонная аортальная вальвулопластика, 368
Баллонная комиссуротомия
отбор пациентов, осложнения, 510, 511
выбор времени проведения процедуры, 512
выбор процедуры, 511
противопоказания, 511
результаты, 504
ближайшие, 504, 505
молодые пациенты, 509
неэффективность и осложнения, 503, 505
отдаленные, 503, 506, 507, 509
рестеноз после ранее проведенной комиссуротомии,
507, 508, 510
у беременных женщин, 510
у пожилых, 508, 511
эхокардиография, 499–503
во время процедуры, 501, 502
внутрисердечная, 105, 106
до процедуры, 499, 500
после процедуры, 501, 503
последующие наблюдения, 502
Беременность, 1109–1130
баллонная комиссуротомия, 510
возможные риски, 1113–1125, 1129, 1130
аномалия Эбштейна, 1117, 1129, 1130
аортопатия, 1123, 1124, 1129, 1130
внутрисердечные шунты, 1113–1116
гемодинамика после операции Фонтена, 1119, 1129,
1130
искусственные клапаны сердца, 1122, 1123, 1129, 1130
кардиомиопатия, 1124, 1125
коарктация аорты, 1116, 1117, 1129, 1130
поражение аортального клапана, 1120, 1121
поражение митрального клапана, 1121, 1122, 1129, 1130
тетрада Фалло, 1116, 1129, 1130
транспозиция магистральных сосудов, 1118, 1119
цианотические пороки сердца, 1119, 1120
клинические рекомендации по стратификации риска
и тактике лечения заболеваний сердца, 1126–1128
недостатки эхокардиографии, 1128, 1129
фетальные и неонатальные риски, 1114, 1125, 1126
физиологические изменения, 1109, 1110
In-index_2 колонки.indd 1276
03.04.2019 12:47:33
1277
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
эхокардиография во время нормально протекающей
беременности, 1110, 1111
Биологические протезы, 559–561, 563, 564, 566, 567
Биопсия эндомиокардиальная, 743–745, 748
Блокада левой ножки пучка Гиса, 173, 174
Болезнь
Барлоу, 435, 436
Бехчета, 917–925
Гоше, рестриктивная кардиомиопатия, 692
накопления
дифференциальная диагностика с гипертрофической
кардиомиопатией, 642
рестриктивная кардиомиопатия, 690, 693–695
печени, 943–949
алкоголь-зависимая, 946–948
неалкогольная жировая болезнь, 947, 948
трансплантация печени, 87, 944–947
цирротическая кардиомиопатия, 944–946
сердца
артериит Такаясу, 915, 916, 918
болезнь Бехчета, 916, 917
врожденные. См. Врожденные пороки сердца
гигантоклеточный височный артериит, 916, 920
эндокринопатия. См. Эндокринопатия
Фабри
гипертрофическая кардиомиопатия, 643
рестриктивная кардиомиопатия, 692
Боль в груди, эхокардиография, 239. См. также Острая
боль в груди
В
Вазодилататоры, 321
Вазопрессорный стресс у пожилых, 1008, 1009
Вальвулопластика баллонная. См. также Баллонная
комиссуротомия
аортальная, контроль с помощью чреспищеводной
эхокардиографии, 368
митрального клапана, 105, 106
Васкулопатия сердечного аллотрансплантата, 748–752
Вегетации
инфекционный эндокардит, 524–530
тактика, 536–541
клапанные
трансторакальная эхокардиография, 1038, 1054
чреспищеводная эхокардиография, 1037, 1038, 1054
Либмана–Сакса, 885–887, 889–897, 899
Вено-венозная экстракорпоральная мембранная
оксигенация, 86, 92, 93
Визуализация перфузии миокарда, 746, 749–752
Визуализация движения миокарда, 159
Висцеральный перикард, 705
Внутрисердечная эхокардиография, 97, 98, 100, 103, 108
датчик с фазированной решеткой, 98–101, 108
доступные системы, 97
закрытие дефекта межпредсердной перегородки, 100–105
клиническое применение, 98
ограничения, 98
осложнения, 107
оценка правого желудочка, 793, 803
пункция перегородки, 104, 108
стандартные позиции, 98–100
транскатетерная баллонная вальвулопластика
митрального клапана, 105, 107, 108
трехмерная, 98
фибрилляция предсердий, 1067, 1068, 1070
электрофизиологические процедуры, 106
Внутрисердечные массы, транскатетерная имплантация
аортального клапана, 364
Внутрисердечные опухоли. См. Опухоли сердца
Внутрисосудистое ультразвуковое исследование, 746, 748
Возврат крови по легочным венам, 1266, 1269, 1271, 1272
Время изоволюмического расслабления, 183, 184
Врожденная корригированная транспозиция
магистральных сосудов, 1225, 1231, 1235–1240, 1242
анатомическая коррекция, 1240, 1241, 1242
анатомия и определение, 1235, 1236
отдаленные результаты и эхокардиографическая оценка,
1237
Врожденные внутрисердечные шунты, 1133, 1155, 1156
аневризма синуса Вальсальвы, разрыв, 1152
аномальный дренаж легочных вен, 1147, 1148, 1156
дефект
венозного синуса, 1144–1146, 1156
крыши коронарного синуса, 1146, 1147, 1156
межжелудочковой перегородки. См. Дефект,
межжелудочковой перегородки
межпредсердной перегородки типа ostium primum,
1143–1145, 1156
межпредсердной перегородки типа ostium secundum,
1138, 1139, 1140–1143, 1156
классификация, 1134
на уровне предсердий, 1137, 1138
открытое овальное окно. См. Открытое овальное окно
открытый артериальный проток. См. Открытый
артериальный проток
фистула коронарной артерии, 1155, 1157
Врожденные пороки сердца
врожденная корригированная транспозиция
магистральных сосудов, 1225, 1231, 1235, 1236
анатомическая коррекция, 1240–1242
анатомия и определение, 1235, 1236
отдаленные результаты и эхокардиографическая
оценка, 1237
генетические особенности, 1210
легочная гипертензия, 813, 814
пороки конотрункуса, 1209–1211
с физиологией единственного желудочка, 1247, 1248
атрезия трикуспидального клапана, 1247–1249
двухприточный левый желудочек, 1248, 1251
подготовка к эхокардиографии, 1259
синдром гипоплазии левых отделов сердца, 1175, 1176,
1178, 1247, 1248, 1250
эволюция хирургического лечения после внедрения
операции Фонтена, 1248, 1252
чреспищеводная эхокардиография, 66
Вторичное поражение клапана, 437, 438
Вторичный амилоидоз, 686
Выпот перикардиальный. См. Перикардиальная жидкость
Выходной тракт левого желудочка
врожденные аномалии, 1165–1170
диаметр, 332, 355
интраоперационный мониторинг функции желудочков,
73–75
обструкция, гипертрофическая кардиомиопатия, 647,
648, 669, 671
движение створки митрального клапана, 647, 648
митральная регургитация, 649, 651
оценка с помощью допплерографии, 647, 651
патофизиология, 646, 647
сравнительная характеристика методов лечения, 666
стресс-исследования и другие провокационные тесты,
649–655
In-index_2 колонки.indd 1277
03.04.2019 12:47:33
1278 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
тактика ведения, 662, 663, 666
скорость, 331, 332
транспозиция магистральных сосудов, 1232
врожденная корригированная, 1240
чреспищеводная эхокардиография, 50, 53, 54, 60, 61
Выходной тракт правого желудочка
внутрисердечная эхокардиография, 99
давление в легочной артерии, 811, 812
общая функция, 76
тетрада Фалло, 1192
Г
Гемангиомы сердца, 1093
Гематома аорты интрамуральная, 867, 868
диагностика, чреспищеводная эхокардиография, 876
Гемодинамика после операции Фонтена, беременность,
1119, 1129
Гемохроматоз, рестриктивная кардиомиопатия, 690, 691
Гигантоклеточный височный артериит, 916–918, 920
Гидродинамика при регургитации, 551
Гидродинамика клапанов сердца, 547–573
анализ контрольного объема, 550
биологические протезы, 564, 566
бескаркасных, 560–564, 566
каркасных, 559, 561–564, 566
допплеровский градиент, 553, 571
механическая энергия, 548, 549, 571
потери, 556, 571
конверсия и, при стенозах, 551, 552
механизмы, 550–552
параметры, 557
механические протезы, 560, 564, 565
двухстворчатые, 559–561, 563–569
дисковые, 559–561, 563–565
шарикового типа, 560, 561, 563, 564
нативных клапанов сердца, 558, 559
объем регургитации, 555
падение давления, 552, 571
сохранение массы, 547, 548, 571
транскатетерные протезы, 566–571
уравнение Бернулли, 549
эффективная площадь отверстия, 554, 571
Гиперпаратиреоз, болезнь сердца, 941, 942
Гипертензия
легочная. См. Легочная гипертензия
сопутствующая, оценка при аортальном стенозе, 338
Гипертиреоз, болезнь сердца, 940, 941
Гипертрофическая кардиомиопатия, 639–674
аблация этанолом межжелудочковой перегородки,
664–666, 669–671
визуализация деформаций, 661, 662
во время беременности, 1130
гипертрофия межжелудочковой перегородки у пожилых,
644
диагностика, 640–642
дифференциальная диагностика, 642–644, 645
обструкция выходного тракта левого желудочка,
646–649, 669
допплерография, 647, 650
митральная регургитация, 649, 651
патофизиология, 646, 647
систолическое движение створки митрального
клапана, 647–649
сравнительная характеристика методов лечения, 666
стресс-исследования и другие провокационные тесты,
649–655
оценка диастолической функции, 659, 660
подтипы, 655–658
асимметричная апикальная, 655–659
у пожилых, 657, 658
рестриктивная кардиомиопатия и терминальная стадия,
593, 595
семейный скрининг, 640, 642
сердце атлета, 644, 645
трехмерная эхокардиография, 662
у спортсменов, 971–973
хирургическая миоэктомия, 662–664, 669–671
эхокардиографическая оценка, 644, 646
эхокардиографические прогностические факторы, 668
Гипертрофия левого желудочка, 644–646
Гипертрофия перегородки
асимметричная, 439
пожилые пациенты, дифференциальная диагностика
с гипертрофической кардиомиопатией, 642, 644
Гиперэозинофильный синдром, рестриктивная
кардиомиопатия, 688–690
Гиповолемический шок, эхокардиография у постели
больного, 121
Гипотензия недифференцированная, 121
Гипотиреоз при заболеваниях сердца, 940, 941
Гликогеноз
гипертрофическая кардиомиопатия, дифференциальная
диагностика, 644
рестриктивная кардиомиопатия, 692
Глобальная систолическая функция желудочков,
интраоперационная оценка, 73–80
Гомоцистинурия, 981
Грудная часть нисходящего отдела аорты
аневризма наследственная, 985
расслоение, 66, 68, 69
Д
Давление
в легочной артерии, оценка легочной гипертензии,
808–811, 813
в правом предсердии, оценка, 808–811
заклинивания легочной артерии, 182
Двойное отхождение магистральных сосудов, 1213,
1215–1218, 1223
Двухмерная эхокардиография
констриктивный перикардит, 721,727
оценка
геометрии левого желудочка, 141
массы левого желудочка, 137, 138, 142–144
объема левого желудочка, 137, 138, 142–144
рестриктивная кардиомиопатия, 676–680, 682
функции системы визуализации в сравнении
с трехмерной эхокардиографией, 21–24
Двухмерные томографические срезы, 38, 39
Двухприточный левый желудочек, 1248, 1251
Двухстворчатые клапаны, 559–561, 564, 566–569
аортальный клапан, 983–984, 1166–1167
аортальная регургитация, 386
беременность, 1120–1121
транскатетерная имплантация аортального клапана,
362
Дегенеративная митральная регургитация, 471, 472
Дегенеративное поражение, 435, 436
дооперационная чреспищеводная эхокардиография, 450,
451
хирургические техники пластики митрального клапана,
чреспищеводная эхокардиография, 448, 449, 452–456
In-index_2 колонки.indd 1278
03.04.2019 12:47:33
1279
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Дерматомиозит, 914
Дефект
венозного синуса, 1144, 1145, 1146, 1155–1156
крыши коронарного синуса, 1146, 1147, 1155, 1156
межжелудочковой перегородки, 1149, 1150, 1155–1157
во время беременности, 1129–1130
врожденная корригированная транспозиция
магистральных сосудов, 1269
межпредсердной перегородки
алгоритм оценки, 102, 103
во время беременности, 1129–1130
закрытие, внутрисердечная эхокардиография, 100–105,
108
типа ostium primum, 1143–1145, 1155–1157
типа ostium secundum, 1139–1143, 1155–1157
транскатетерная пластика митрального клапана
методом «край в край», 489
эхокардиография, 66, 67, 1043–1052
открытое овальное окно, аневризмы межпредсердной
перегородки, риск инсульта, 1044, 1047
открытое овальное окно, выявление, 1044–1046
профилактика рецидивов эмболии, 1047–1050, 1052,
1053
эндокардиальной подушки. См. Атриовентрикулярный
канал
Дефицит гормона роста, 941, 942
Деформация
визуализация, 160–164
дилатационная кардиомиопатия, 616–618
ишемия миокарда, 171, 172
ограничения, 164–167
острая боль в груди, 230, 232, 234, 235
оценка диастолической функции, 197–199
спекл-трекинг эхокардиография, 162–165, 176, 177
субклиническая дисфункция левого желудочка, 175
тканевая допплерография, 161
Лагранжа, 161
определение, 160, 161
Диастолическая стресс-эхокардиография, 194–197
Диастолическая функция
аортальный стеноз, 338
гипертрофическая кардиомиопатия, 657, 660
дилатационная кардиомиопатия, 616, 620, 634
классификация, 187
левого желудочка, 181–204
влияние старения организма, 182–185, 1007, 1012
во время нормально протекающей беременности, 1110
заболевания соединительной ткани, 989
интраоперационная эхокардиография, 71, 92, 93
основные принципы, 181–185
степень, 193–195
у спортсменов, 959
эхокардиографическая оценка, 183–191
визуализация деформации, 197–199
вращение, 198
гипертрофическая кардиомиопатия, 657, 660
давление наполнения левого желудочка, 188–191
допплерография
поток по легочным венам, 185, 190, 201, 202
тканевая, 183, 186–188, 190, 201, 202
цветовая в M-режиме, 185, 190, 201, 202
клиническая оценка, 193–196
митральная регургитация, 191
митральный кровоток, 183–185, 188, 189, 201, 202
определение давления наполнения левого желудочка,
194–196
острый инфаркт миокарда, 263, 264, 267
синусовая тахикардия, 191
фибрилляция предсердий, 191
легочная гипертензия, 193
правого желудочка, 797, 798, 803
легочная гипертензия, 824
старение организма, сердечная недостаточность, 200
увеличение левого предсердия, 191–193
Дилатационная кардиомиопатия, 609–637
другие заболевания сердца, проявляющиеся подобно,
524–627
классификация, 609
критерии целесообразности эхокардиографии, 611, 613
семейный скрининг, 624
сердечная ресинхронизирующая терапия, 626–633
у спортсменов, 970, 971
шкала риска сердечной недостаточности, 633
эпидемиология, 609–613
эхокардиографические признаки, 611–624, 634
вовлечение правых отделов сердца, 616, 622, 634
диастолическая функция левого желудочка, 616,
619–621, 634
относительная митральная регургитация, 621, 623
систолическая функция левого желудочка, 614, 617–619
сократительный резерв левого желудочка, 622, 634
тканевая допплерография, деформация, скорость
деформации, 616, 618
форма и размер левого желудочка, 619, 634
Дипиридамол, стресс-эхокардиография, 303, 305, 321
Дисковые протезы клапанов, 559, 560–566
Диссинхрония, левый желудочек, 173, 174
дилатационная кардиомиопатия, 629–631
Дисфункция протезированного клапана, 575–604
изменение структуры клапана, 576, 577
несоответствие протез–пациент, 575, 577, 603, 604
околоклапанная регургитация, 374–376
паннус, 575, 576
регургитация, 587–593, 603, 604
аортальная
диагностика и оценка, 587–593
неправильное расположение/нарушение функций,
371–373
митральная, 589, 593–595
на клапане легочной артерии, 596
трикуспидальная, 595, 596
стеноз, 578–587, 603, 604
индекс допплеровской скорости, 579, 580, 585
количественные параметры, 579
морфология и подвижность створок, 578–583
скорость потока и градиент, 579–581, 584
форма потока и время ускорения, 581, 584
эффективная площадь отверстия, 582–586, 588
тромбоз, 575, 576, 598–601, 603, 604
эндокардит, 534–536, 577, 601–603
Добутамин, стресс-эхокардиография, 302, 303, 321
боль в груди, 282
выявление заболеваний коронарных артерий, 316, 318
метод выявления васкулопатий сердечного
аллотрансплантата, 749, 750
оценка жизнеспособности миокарда, 309, 310, 319
у пациентов с низким градиентом давления и сниженной
фракцией выброса, 352
Донорское сердце, оценка, 736
Допплерография
беременность, протекающая в норме, 1110, 1112
гемодинамическая оценка инфаркта миокарда, 253
In-index_2 колонки.indd 1279
03.04.2019 12:47:33
1280 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
констриктивный перикардит, 716
непрерывно-волновая
оценка аортальной регургитации, 388, 401, 402
оценка митральной регургитации, 422, 427–429
оценка систолической функции левого желудочка,
145–151
диастолическая функция, 182–191
митральный кровоток, 183–185, 188, 189, 201, 202
поток по легочным венам, 185, 190, 201, 202
обструкция, гипертрофическая кардиомиопатия, 646,
649
тканевая допплерография, 183, 186–188, 190, 201, 202
цветовая в M-режиме, 185, 190, 201, 202
спектральная при регургитации на протезе аортального
клапана, 591, 592
тампонада, 723, 724
тканевая, 158–160. См. также Тканевая допплерография
цветовая. См. Цветовая допплерография
чреспищеводная, 63
Е
Единственный желудочек, 1247–1272
Ж
Желудочек. См. Единственный желудочек; Левый
желудочек; Правый желудочек
Жир эпикардиальный, 933, 934
З
Заболевания
клапанов, 921, 922
анкилозирующий спондилит, 907–909
болезни соединительной ткани, 914
вторичные, 437–439
первичный антифосфолипидный синдром, 902, 903
полимиозит и дерматомиозит, 914
правые отделы. См. Заболевания, правых отделов
сердца
ревматоидный артрит, 903, 904, 906, 907
системная красная волчанка, 885, 889–892, 894, 895, 898,
899
склеродермия, 914
у спортсменов, 968
легких, отношение легочной гипертензии к, 813, 815
правых отделов сердца, 831
болезни трикуспидального клапана, 831, 832
регургитация на клапане легочной артерии, 853, 854,
855, 857
стеноз легочной артерии, 848, 849, 850, 851, 856
стеноз трикуспидального клапана, 846, 847, 856
трикуспидальная регургитация. См. Трикуспидальная
регургитация
соединительной ткани, 979, 980, 982, 983, 985, 986, 989,
991, 993–997, 993
альтернативные диагностические подходы, 997
виды, 979, 981
гомоцистинурия, 981
двухстворчатый аортальный клапан, 983, 984
наследственная аневризма грудной части
нисходящего отдела аорты и расслоение аорты, 985
синдром Лойеса–Дитца, 982, 983
синдром Марфана, 979, 980
синдром Тернера, 984, 985
синдром Элерса–Данло, 981
фибриллинопатии, 981
возможности оценки, 995
гистопатология, 985
история болезни, 991
методы оценки, 991, 995
терапевтическое лечение, 995
фармакологическое лечение, 995
хирургическое лечение, 996
эхокардиографические признаки, 985, 993, 999
аорта в норме, 985–987
дилатация аорты, 988, 989
левый желудочек, 989
легочная артерия, 990
пролапс митрального клапана, 980, 989, 990
расширение аорты, 980, 986, 988, 989
Закон Старлинга, 135
И
Идиопатическая рестриктивная кардиомиопатия, 688
Измерение фиброзного кольца аортального клапана
перед транскатетерной имплантацией аортального
клапана, 364–367
Изоволюмическое сокращение, физиология левого
желудочка, 168
Иммунно-опосредованное повреждение, системные
заболевания. См. Ревматические заболевания
Иммуноглобулиновый амилоидоз, 683
Имплантированные внутрисердечные устройства
инфицирование, визуализация, 527, 530, 543
исследование пациентов с, 531, 536, 537
Импульсно-волновая допплерография
визуализация скорости движения миокарда, 157–161,
176, 177
оценка аортальной регургитации, 387, 388, 401, 402
оценка митральной регургитации, 420, 421, 427, 428
рестриктивная кардиомиопатия, 677, 680–682
Индекс
Tei, 149
допплеровской скорости, 579, 585–587
Дьюка при стресс-тесте на тредмиле, 286
конечно-систолического объема, 131, 132
массы тела, 929–931
потери энергии, 356
ударного объема, 332, 333, 339, 356
Инсульт
кардиоэмболический, 1031
криптогенный, 1031
открытое овальное окно, 1044, 1047
фибрилляция предсердий, 1063–1066, 1065
Интерпретация изображений, 4, 5, 8, 18
в виде пирамиды, 208, 209
воспроизводимость и вариабельность, 1, 14, 15
обработка, 207–209
эхокардиография, 7
Интрамуральная гематома аорты, 867, 868
диагностика, чреспищеводная эхокардиография, 876
Интубация пищевода при чреспищеводной
эхокардиографии, 48
Инфаркт миокарда
острый. См. Острый инфаркт миокарда
правого желудочка, 250–252, 266
типы, 227, 228
транскатетерная имплантация протеза аортального
клапана, 370
трансторакальная эхокардиография, 1033–1035
трудности диагностики, 227, 228
Инфекционный эндокардит, 523–545
альтернативные методы исследования, 542
In-index_2 колонки.indd 1280
03.04.2019 12:47:33
1281
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
митральный клапан, 435, 436
острая аортальная регургитация, 398–400
чреспищеводная эхокардиография, 64, 65
эхокардиографические методы, 523, 543
альтернативные методы исследования, 542
бактеремия, 532
диагностика, 530–536
использование научных разработок, 541
количественная оценка, 524–530
отдаленный период, 541
потенциальные ограничения и будущие направления,
542
протезированные клапаны, 602, 603
целесообразность лечения, 536–541
Искусственное кровообращение, 79, 82
Ишемическая болезнь сердца 227, 229
Ишемический каскад, 271, 272
Ишемия миокарда, 171–173
вызванная физической нагрузкой, 283
К
Кальцификация
дистрофическая, 438
возрастная, 1005–1006, 1009–1012
фиброзное кольцо митрального клапана, возрастные
изменения, 1013–1019
Канюляция коронарного синуса, интраоперационная
чреспищеводная эхокардиография, 86, 87, 92, 93
Кардиогенная тромбоэмболия у пожилых, 1025
Кардиогенный шок
транскатетерная имплантация аортального клапана, 372
ультразвуковое исследование сердца у постели больного,
120, 121
Кардиологическое отделение, эхокардиография
методы, 247
острый инфаркт миокарда
диагностика осложнений, 252–261, 266, 267
истинная аневризма, 259, 260
острая митральная регургитация, 254
перикардиальная жидкость, 253, 254, 266, 267
псевдоаневризма, 258, 259
разрыв межжелудочковой перегородки, 254–258, 266,
267
разрыв свободной стенки желудочка, 258
тромбоз в левом желудочке, 260, 261, 262
локализация инфаркта, 249, 250, 266, 267
правый желудочек, 250–252, 266, 267
роль диагностики, 248, 266, 267
Кардиомиопатия
алкогольная, 946–949
беременность, 1124, 1125
гипертрофическая. См. Гипертрофическая
кардиомиопатия
дилатационная. См. Дилатационная кардиомиопатия
количественная оценка функции левого желудочка, 131,
137, 138
ожирение, 929–935, 949
рестриктивная. См. Рестриктивная кардиомиопатия
стресс-индуцированная, 625, 626
у спортсменов, 974, 975
цирротическая, 944–946, 949
Кардиоэмболический инсульт, 1031
Каркасные биологические протезы клапанов, 559–561, 563,
564
Катетеризация легочной артерии, интраоперационная
чреспищеводная эхокардиография, 83
Катетерная аблация при лечении фибрилляции
предсердий, 1067, 1068, 1069–1071
Качество оказания медицинской помощи, 3, 18
определение, 3
повышение качества, 11–16
воспроизводимость данных и вариабельность
интерпретации результатов, 14–16
отбор пациентов, критерии целесообразного
использования, 11–13, 18
процесс визуализации, 4, 5–11
реформирование системы здравоохранения, 17
структура диагностического отделения, 4–7, 18
ультразвуковое исследование сердца у постели больного,
124
Киста перикарда, 728
Клапан легочной артерии
заболевание. См. Регургитация на клапане легочной
артерии; Стеноз, клапана легочной артерии
протезы, оценка с помощью допплерографии, 595, 596
чреспищеводная эхокардиография, 57, 68
Коарктация аорты, 1166, 1167, 1172–1174, 1177
беременность, 1116, 1117, 1129, 1130
Колоризация, оптимизация трехмерных изображений, 34
Компьютерная томография
диагностика расслоения аорты, 870–872
исследование при аортальном стенозе, 343
Конечно-диастолический объем, интраоперационная
оценка, 72
Конечно-систолический объем, интраоперационная
оценка, 72
Констриктивный перикардит, 708–718
клинические проявления и лечение, 709, 710
нагрузка, 716, 717
определение и этиология, 708, 709
патология и патофизиология, 709
рестриктивная кардиомиопатия, дифференциальная
диагностика, 694–696, 717–719
транзиторный, 718
экссудативно-констриктивный, 718
эхокардиографическая диагностика, 710–717, 729
M-режим, 715
диагностика в 2D-режиме, 715
изменение скорости потока на митральном клапане
при допплерографии в зависимости
от респираторной вариабельности, 714
нарушение подвижности межжелудочковой
перегородки, 711
нарушения потока по допплерографии, 715, 716
респираторная вариабельность наполнения
печеночных вен, 711–713
скорость движения фиброзного кольца митрального
клапана, 712, 713
Контрольный объем в гидродинамике, 547, 548
анализ энергии, 550
Корень аорты
диаметр, возрастные изменения, 1004, 1005
изменения, 383, 384
оценка при аортальной регургитации, 391, 392
Коронарная недостаточность
аортальный стеноз, 343
диагностика, стресс-эхокардиография, 273–277, 283, 285
острая боль в груди, 229
после операции артериального переключения, 1232
у пожилых, стресс-нагрузки, 1022–1024, 1024, 1023
Коронарное шунтирование
без искусственного кровообращения, мониторинг, 82
In-index_2 колонки.indd 1281
03.04.2019 12:47:33
1282 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
интраоперационная чреспищеводная эхокардиография,
82, 88
инфаркт миокарда, 228
Коронарные артерии
аномалии, 1174, 1176, 1178
фистула, 1155, 1157, 1175, 1176
Криптогенная церебральная ишемия, 1032
Криптогенный инсульт, 1032
Л
Левое предсердие
компрессия, инверсия, коллапс, 722, 723
митральный стеноз, 495, 496, 517, 518
объем, стратификация риска после острого инфаркта
миокарда, 263
протоколы для визуализации в 3D-режиме, 40, 41, 43
размер
гипертрофическая кардиомиопатия, 660
изменения с возрастом, 1005, 1006
исходы, 1020, 1021, 1023
система MitraClip, 478, 485
увеличение и функция, 191–193
Левый желудочек
аортальный стеноз, 338, 339
вращение и скручивание, спекл-трекинг
эхокардиография, 164, 167, 199
выходной тракт. См. Выходной тракт левого желудочка
геометрия, оценка, 137, 138
двухмерная эхокардиография, 141–145
гипертрофия
аортальный стеноз, 339
изменения с возрастом, 1017, 1019
локализация, 644–646
обструкция, 364
перегрузка давлением, количественная оценка
функции левого желудочка, 131
перегрузка объемом, количественная оценка функции
левого желудочка, 131
различные виды, 641–644
у спортсменов, 969–973
давление наполнения
определение, 194–196
оценка, 188–191
двойное отхождение магистральных сосудов, 1218–1220
двухприточный, 1248, 1251
диастолическая функция. См. Диастолическая функция,
левого желудочка
диссинхрония, 173–175
дилатационная кардиомиопатия, 630
дисфункция, после операции, 462
заболевания соединительной ткани, 989, 991
количественная оценка, 129–156
метод интеграла скорости кровотока, 144, 145
ограничения, 151
определения и теоретические соображения, 132–137
систолическая функция, 145–151
отношение давление/объем, 150
отношение напряжение/укорочение, 148, 149
фракция выброса, 146, 147, 151–154
фракция укорочения, 147, 148, 151–154
масса
изменения с возрастом, 1003
оценка, 151
двухмерная эхокардиография, 137, 138, 141–143, 145
эхокардиография в M-режиме, 136–141, 151
оценка объема, 151–154
двухмерная эхокардиография, 137, 138, 141–143, 145,
151–154
эхокардиография в M-режиме, 137, 138
оценка с помощью допплерографии, 145
оценка толщины стенки, одномерная эхокардиография
в M-режиме, 137–141
возрастные изменения, 1003, 1004
протоколы для визуализации в 3D-режиме, 39, 40
размеры и форма при дилатационной кардиомиопатии,
619, 634
размеры, изменения с возрастом, 1005, 1006
ремоделирование, 140, 141
аортальный стеноз, 339
стратификация риска после острого инфаркта
миокарда, 263–265
свободная стенка, разрыв после острого инфаркта
миокарда, 258
систолическая функция, 131
аортальная регургитация, 391, 395
аортальный стеноз, 339
дилатационная кардиомиопатия, 611–615, 618
изменения у пожилых, 1006, 1007
размеры, 391
стратификация риска после острого инфаркта
миокарда, 261, 267
у постели больного, 118
у спортсменов, 958, 959, 960
скручивание. См. Скручивание левого желудочка
транскатетерная пластика митрального клапана методом
«край в край», 478, 479
у спортсменов, 955–959
физиология
диастолическая скорость, 168–171, 176, 177
норма, 167
систолические скорости, 168, 169, 176, 177
функция, влияние блокады левой ножки пучка Гиса, 173
чреспищеводная эхокардиография, 51–53, 55, 68, 71
Легочная артериальная гипертензия, 807, 812–814
Легочная артерия
дисплазия соединительной ткани, 990, 991
дозированное сужение, 1260
интраоперационная эхокардиография, 75, 76
тетрада Фалло, 1194, 1196, 1197
Легочная гипертензия, 807–828, 922–925
аортальный стеноз, 343
диагностический подход, 825, 826
диастолическая дисфункция, 193
измерение давления в легочной артерии, 808–811, 813
остро возникшая, 817, 818
первичный антифосфолипидный синдром, 902, 903
полимиозит и дерматомиозит, 914, 915
правые отделы сердца, 817–823, 827, 828
движение межжелудочковой перегородки, 821–823
диастолическая функция, 821
нагрузка давлением, 817, 818, 820
размеры, 818, 820, 821
систолическая функция, 818, 819, 821–822
причины, 812–817
врожденный порок сердца, 813–815
заболевание легких, 813, 816, 817
легочная артериальная гипертензия, 812–814
общая классификация, 812–814
поражение левых отделов сердца, 813–816
с многофакторными механизмами, 813
хроническая легочная тромбоэмболическая болезнь,
813, 816, 817
In-index_2 колонки.indd 1282
03.04.2019 12:47:34
1283
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
ревматоидный артрит, 907, 908
системная красная волчанка, 901, 902
склеродермия, 912, 913
смешанное заболевание соединительной ткани, 914, 915
стресс-эхокардиография, 824, 825
Легочное сосудистое сопротивление, оценка, 822–824
Легочные вены, аномальный дренаж, 1147–1149, 1155–1157
Лекарственная рестриктивная кардиомиопатия, 693
Лимфома, 1097, 1101
Липома, 1091, 1092
Локальная сократимость миокарда
интраоперационная эхокардиография, 80, 81, 92, 93
нарушения, не связанные с поражением коронарных
артерий, 249
оценка, 261
Лучевой некроз, 438
М
Магнитно-резонансная томография
амилоидоз, 684, 687
оценка аортальной регургитации, 390, 391
расслоение аорты, 869, 870
сердца
аортальный стеноз, 343
боль в груди, 282
у спортсменов, 969, 970
Мезотелиома, 1097
Метаболические и пищевые нарушения, 929–949
болезни печени. См. Болезнь, печени
ожирение. См. Ожирение
сахарный диабет второго типа, 937–940
синдром обструктивного апноэ во сне, 935–937
эндокринопатия. См. Эндокринопатия
Метод
интеграла скорости кровотока, 144, 145
конвергенции потока, 386, 387
оценки площади проксимальной зоны струи
регургитации
аортальная регургитация, 386, 387
митральная регургитация, 418, 419, 428, 429
расчета площади аортального клапана, 331, 332
оценки структуры, 211–214
определения границ, основанный на анализе объекта, 214
определения объемов с помощью допплерографии, 420
Механизм Франка–Старлинга, 135
Механика миокарда, 157–180
механическая дисперсия, 174, 175
нормальная физиология левого желудочка, 166–171
оценка
вращение и скручивание левого желудочка
при спекл-трекинг эхокардиографии, 166, 167, 171
деформация и скорость деформации, 160–164
спекл-трекинг эхокардиография, 162–165, 176, 177
тканевая допплерография, 161, 166, 167, 176, 177
скорость движения миокарда и смещение фиброзного
кольца, 157–161, 176, 177
ограничения, 164–167
синхронность, 173–177
функция правого желудочка, 175, 176
Механическая поддержка кровообращения, 757–783
альтернативные варианты, 778–783
дисфункция, доступы, 764–769, 779–783
изменения скорости, 767, 768
клапанная дисфункция, 766, 767
недостаточное наполнение, 766, 768
переполнение, 765, 766
канюли, 772–774, 777
клиническое применение и результаты, 775, 776
ограничения и перспективы, 776–778
основные принципы, 758–764
оценка перед имплантацией, 762–764, 779–783
рекомендации, 764, 765, 779–783
типы устройств вспомогательного кровообращения,
758–762
имплантируемое, 758–761
искусственное сердце, 759, 761, 762
раскрытие аортального клапана, 771
технические детали, анализ данных, 769–775
Механическая энергия в гидродинамике, 548, 549, 571
потеря, 556, 557, 571
конверсия при стенозах, 551, 552
механизмы, 550, 551
Миксома сердца, 1086, 1089–1091, 1104
Миокард, поражение, 923–925
анкилозирующий спондилит, 910
первичный антифосфолипидный синдром, 899, 900
полимиозит и дерматомиозит, 914
ревматоидный артрит, 905–907
системная красная волчанка, 889, 890, 893, 901
склеродермия, 911
смешанное заболевание соединительной ткани, 914, 915
Миокардит, 625–627
Миоэктомия хирургическая, 662–667, 669–671
Митральная регургитация, 407–432
аортальный стеноз, 340
гипертрофическая кардиомиопатия, 649–651
дегенеративная, 471, 472, 476
диастолическая функция, оценка, 191
дилатационная кардиомиопатия, 620, 621
количественная оценка, 415–423, 427–429
гемодинамические и физиологические факторы, 422
дополнительные данные, 421, 422
импульсно-волновая допплерография, 420, 427–429
трехмерная эхокардиография, 422, 423, 427–429
цветовая допплерография, 416–420, 427–429
измерения ширины vena contracta, 416–418, 427–429
определение площади дистальной зоны струи
регургитации, 416, 417, 427–429
определение площади проксимальной зоны струи
регургитации, 418, 419, 427–429
референсные значения, 420
механизм, 408–415
вторичная митральная регургитация, 412–415
номенклатура и классификация Carpentier, 415
первичная митральная регургитация, 409–414
митральный стеноз, 497, 518
осложнение расслоения аорты, 880, 881
остаточная
послеоперационная оценка, 461
транскатетерная пластика митрального клапана
методом «край в край», 470, 483
острая, осложнение острого инфаркта миокарда, 254
пластика митрального клапана. См. Пластика
митрального клапана, чреспищеводная
эхокардиография
протез, 589, 591, 593–596
смешанная, 472–474, 478
степень, показатели, 474–477, 479
стратификация риска после острого инфаркта миокарда,
265–267
транскатетерная имплантация аортального клапана, 362,
363, 372, 373
In-index_2 колонки.indd 1283
03.04.2019 12:47:34
1284 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
транскатетерная пластика митрального клапана методом
«край в край». См. Транскатетерная пластика
митрального клапана методом «край в край»
функциональная, 472, 477
хирургическое вмешательство, 424–427. См. также
Пластика митрального клапана, чреспищеводная
эхокардиография
время проведения, 424
клинические аспекты, 426
патофизиология, 424
хроническая, 425, 426
чреспищеводная эхокардиография, 63
Митральный клапан
анатомическое строение, 407, 434, 435
метод осевой визуализации из апикального доступа,
441–445
оценка, прогнозирование результатов баллонной
комиссуротомии, 515, 516, 518
стандартная мультипланарная визуализация, 56–58,
439, 444
трехмерная визуализация, 40, 41, 44, 58, 441, 446, 447
папиллярные мышцы, 408, 409
патологии врожденные 1160–1163, 1177–1178
пластика. См. Пластика митрального клапана
поражения, 435–439. См. также Митральная
регургитация; Митральный стеноз
пролапс
заболевания соединительной ткани, 989, 990
митральная регургитация, 409–413
протез, высокий градиент, 598, 599
протоколы для визуализации в 3D-режиме, 40, 41, 44
регургитация. См. Митральная регургитация
с двойным отверстием, 1162, 1163
створки, 408
переднее систолическое движение при обструкции
выходного тракта левого желудочка, 647–649
сухожильные хорды, 408, 409
чреспищеводная эхокардиография. См. Пластика
митрального клапана, чреспищеводная
эхокардиография
эмбриология, 407
Митральный стеноз, 493–518
альтернативные варианты, 517
баллонная комиссуротомия. См. Баллонная
комиссуротомия
во время беременности, 1129, 1130
определение, 493, 494
оценка проблем после лечения, 458
эхокардиография, 494–499
методика, 499
митральная регургитация, 497, 518
научное обоснование исследований, 513–516
оценка анатомического строения клапана, 497, 498, 515,
516, 518
оценка изменений, 495–497
оценка степени тяжести, 494–496, 518
перспективы, 516, 517
постановка диагноза, 494, 495
потенциальные ограничения, 516, 517
протезы клапанов, 577–587
индекс допплеровской скорости, 579, 585–587
количественные параметры, 579
морфология и подвижность створок, 578, 579, 581
оценка скорости потока и градиента на протезе,
579–581, 584
форма потока и время его ускорения, 581
эффективная площадь отверстия, 582–585
сопутствующие поражения, 497, 498
тромбоэмболические осложнения, 498
Молотящая створка, 409, 410–412
М-режим, 22
констриктивный перикардит, 714–717
оценка левого желудочка
массы, 136–141, 151
объема, 137, 138
толщины стенки, 137–141
рестриктивная кардиомиопатия, 676, 682
Н
Надклапанная мембрана, 1161, 1162
Надклапанный аортальный стеноз, 1167, 1169, 1170
после операции артериального переключения, 1233
Наследственная аневризма грудной части нисходящего
отдела аорты и расслоение аорты, 985
Неалкогольная жировая болезнь печени, 947, 948
Некомпактный миокард, 624, 1163–1166, 1177–1178
Неонатальный риск во время беременности, 301–323
Непрерывно-волновая допплерография
аортальная регургитация, 388, 389, 401–402
митральная регургитация, 422, 427–429
Несоответствие протез–пациент, 575, 577, 603, 604
Несостоятельность внутрипредсердного туннеля, 1230,
1242–1243
Несостоятельность протеза при эндокардите, 526, 529
Нижняя полая вена, расширение
констриктивный перикардит, 715
тампонада, 724
О
Обработка цифрового изображения, 205–224
автоматизированное определение границ.
См. Автоматизированное определение границ
автоматизированный анализ, 205, 206
в медицине, 207–209
обрезка трехмерных изображений, 35–37
определение, 205
основые моменты, 4, 5, 8, 11
сжатие, 207
улучшение изображений, 207, 208
управление уровнем яркости, 207
уровни интерпретации изображений, 208, 209
характеристики цифровых изображений, 207
хранение и передача изображений, 206, 207
Обструктивный шок, ультразвуковое исследование сердца
у постели больного, 120
Обструкция
гипертрофия левого желудочка, 364
подаортальная, 1165, 1166
подклапанная, аортальный стеноз, 340, 341
после транскатетерной имплантации протеза
аортального клапана, 370
протеза клапана, 575, 576
средней части желудочка, 656
Общий артериальный ствол, 1211–1214, 1222, 1223
Объем
левого желудочка, интраоперационный мониторинг, 72,
73, 92
циркулирующей крови во время беременности, 1109
Однофотонная эмиссионная компьютерная томография, 12
Ожирение, 929–935
индекс массы тела, 929, 931
кардиомиопатия, 929–932, 949
In-index_2 колонки.indd 1284
03.04.2019 12:47:34
1285
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
клиническое ведение пациентов, 934, 935
эхокардиографические данные, 932-934
Околоклапанная регургитация, 374–376
Операция
артериального переключения, 1232–1234
Кавашима, 1260
Норвуда, 1260
Растелли, 1227, 1234, 1235, 1242, 1243
Фонтена, оценка, 1265–1268, 1271
функция желудочка до и после, 1259
эволюция хирургического лечения, 1248, 1254
Опухоли сердца, 1079–1104
диагностический подход, 1080–1086
дифференциальная диагностика, 1101–1103
доброкачественные, 1086, 1091–1095
гемангиома, 1092–1093
липома и липоматозная гипертрофия, 1091–1092, 1104
миксома сердца, 1086, 1089–1091, 1104
папиллярная фиброэластома, 1082–1089, 1104
параганглиома, 1095, 1096
рабдомиома, 1093–1094, 1104
фиброма, 1094–1095, 1104
злокачественные
метастатические, 1099–1101, 1104
внутрипросветное внутривенное распространение,
1100–1101
гематогенное распространение, 1099–1100
имплантационное прорастание, 1099
лимфогенное распространение, 1100–1101
первичные, 1096–1098, 1104
лимфома, 1097
мезотелиома, 1097
саркома, 1096–1098
классификация, 1080–1082
трансторакальная эхокардиография, 1039, 1054, 1080, 1104
чреспищеводная эхокардиография, 1038–1040, 1054, 1080,
1104
Острая боль в груди, 229, 230, 233
диагностические трудности, 227
коронарная ангиография срочная, 234
сортировка пациентов, 228–230
эхокардиография у постели больного, 239
эхокардиография, 243
боль в груди, клинические алгоритмы, 239
диагностика ишемической болезни сердца, 227, 229
долгосрочные прогнозы, 236, 238
клинические исследования по использованию, 233
контрастирование миокарда, 232, 236
напряжение, 230, 234, 235
ограничения, 242
определение рисков, 236, 237–238
оценка боли неишемического характера, 228, 240, 241
стресс, 232, 236
технические аспекты, 229–234
трансторакальная, критерии целесообразного
использования, 229
укомплектованность кадрами, 242
экономическая эффективность, 240
Острая дыхательная недостаточность, 121, 122
Острая ишемия, эхокардиография и физиология, 228
Острый инфаркт миокарда
диагностика, эхокардиография, 248, 250–251
классификация гемодинамики, допплерография, 253
локализация, 248–251
определение рисков после, 261, 262, 267
осложнения, выявление, 252, 253, 266
истинная аневризма, 259, 260
острая митральная регургитация, 254, 255–256
перикардиальная жидкость, 253, 254, 266
псевдоаневризма, 258, 259, 267
разрыв межжелудочковой перегородки, 254, 256, 257,
267
разрыв свободной стенки желудочка, 258, 267
тромбоз в левом желудочке, 260–262, 267
правый желудочек, 250, 252
спекл-трекинг эхокардиография, 172
Острый коронарный синдром, 274–277
Острый перикардит, 726, 727
Отбор пациентов, 4, 5, 8, 18
критерии целесообразного использования, 12, 13
Открытое овальное окно, 1135–1137, 1155–1157
алгоритм оценки, 103
анатомия и патофизиология, 1136–1139
эхокардиография, 1043–1052, 1137–1139
аневризма межпредсердной перегородки, риск
инсульта, 1044–1047
профилактика рецидивов эмболии, 1047–1052
тактика лечения, 1139
Открытый артериальный проток, 1153–1157
во время беременности, 1129, 1130
Отношение напряжение–укорочение левого желудочка
при оценке его систолической функции, 148, 149
Отношение скоростей, расчет, 334–336
Оценка жизнеспособности миокарда, 308–310, 319, 320
П
Паннус, протез клапана, 575, 576
Папиллярные мышцы, 408, 409
отрыв, 438
пластика митрального клапана под контролем
чреспищеводной эхокардиографии, 454
подготовка к эхокардиографии, 449
Параганглиома сердца, 1095, 1096
Парадоксальное движение фиброзного кольца, 714
Парашютообразный митральный клапан, 1162, 1163
Первичный антифосфолипидный синдром, 902, 903
Переупорядочивание кадров при трехмерной
эхокардиографии, 27
Перикард
анатомия, 705–707
врожденное отсутствие, 727, 728
киста, 728
кривые давление–объем, 706, 721
устройство вспомогательного кровообращения, 771
функция, 705, 706
Перикардиальная жидкость, 719–721, 727
констриктивный перикардит, 714
после инфаркта, 253, 254
тампонада сердца, 370, 371
трансплантация сердца, 742–744
Перикардиоцентез под контролем эхокардиографии, 725
Перикард, поражение, 705–731, 922–925
врожденное отсутствие, 727
заболевания соединительной ткани, 914, 915
киста, 728
констриктивный перикардит. См. Констриктивный
перикардит
острый перикардит, 726, 727
патофизиология, 707–709
перикардиальная жидкость, 719–721, 727
полимиозит и дерматомиозит, 914
ревматоидный артрит, 905–907
In-index_2 колонки.indd 1285
03.04.2019 12:47:34
1286 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
системная красная волчанка, 898–901
склеродермия, 911
тампонада, 720–727
эхокардиографическая оценка, 708, 709
Перикардит
боль в груди, 229, 240, 243
констриктивный. См. Констриктивный перикардит
острый, 726, 727
Перфорация створки при инфекционном эндокардите,
524, 526
Пластика митрального клапана
поражения, 435–439
транскатетерная методом «край в край», 469–471, 473,
475, 490, 491
альтернативные методы визуализации, 488, 491
возможные осложнения во время процедуры, 485, 491
определение степени митральной регургитации, 474
определение этиологии митральной регургитации, 470
отбор пациентов, 470, 490
оценка результатов, 484, 485, 491
рекомендакции к проведению процедуры, 478, 483,
488, 490
эхокардиографические критерии возможности
выполнения, 477
транскатетерная. См. Транскатетерная пластика
митрального клапана методом «край в край»
чреспищеводная эхокардиография, 433, 434, 439, 441,
442, 450, 451, 456, 461
бригадный подход, 433, 434
перед операцией, 442–452
вторичная митральная регургитация, 449, 455
дегенеративное поражение, 435, 436, 450, 451
комбинированное поражение, 449, 452, 457–459
отрыв папиллярной мышцы, 449
ревматическое поражение, 449, 454
эндокардит, 443, 449, 453
после пластики, 456–463
хирургические техники, 452–456
вторичная митральная регургитация, 448, 449,
454–456, 460
дегенеративное поражение, 448, 449, 452–456
отрыв папиллярной мышцы, 454
ревматическое поражение, 448, 449, 454
эндокардит, 448, 449
Подклапанный аортальный стеноз, 1165
Подклапанный стеноз легочной артерии, 1185, 1187
Пожилые. См. также Старение
базальная гипертрофия межжелудочковой перегородки,
1017, 1020
баллонная митральная комиссуротомия, 508, 511
гипертрофическая кардиомиопатия, 657
гипертрофия межжелудочковой перегородки,
дифференциальная диагностика
между гипертрофической кардиомиопатией, 644
чреспищеводная эхокардиография, 1025
Полимиозит, 914
Получение изображений, 4, 5, 7, 8, 18
автоматизированное определение границ, 211, 222
двухмерная эхокардиография, 21–23
трехмерная эхокардиография, 21–23, 29, 43
одного или нескольких, 25, 26
оптимизация, 30, 33, 34
проблемы, 33, 34
протоколы, 39
режимы, 30, 31
цветовая допплерография, 28, 29, 32, 43
эхокардиография в отделении интенсивной терапии
и реанимации, 229, 230
Порок сердца
врожденный, 1167, 1168
изменения с возрастом, 1011, 1014, 1016–1019
Пороки конотрункуса, 1209–1211, 1213, 1218, 1222
аортолегочное окно, 1221–1223
аортопатия, 1210
врожденная корригированная транспозиция
магистральных сосудов, 1220, 1223
врожденный порок сердца. См. Врожденные пороки
сердца
генетические особенности, 1210
двойное отхождение магистральных сосудов, 1213,
1215–1219, 1223
общий артериальный ствол, 1211–1215, 1223
Постнагрузка, определение, 135
Пострадиационная кардиомиопатия, 693–695
Поток по легочным венам
оценка диастолического наполнения, 185, 190
чреспищеводная эхокардиография, 63
Поток через митральный клапан
допплерография при оценке наполнения во время
диастолы, 183–185, 188, 189, 201, 202
скорость при констриктивном перикардите,
респираторная вариабельность, 714
Почечно-клеточный рак, 1101
Правое предсердие, 722, 723
Правый желудочек, 787–803
анатомия, 787–789
двойное отхождение магистральных сосудов, 1213–1218,
1222, 1223
диастолическая функция, 797, 798, 802
дилатационная кардиомиопатия, 616, 618, 624, 634
дисфункция
врожденная корригированная транспозиция
магистральных сосудов, 1238–1240
послеоперационная оценка, 462
клинические показания к трехмерной эхокардиографии,
40, 43, 44
количественная оценка, 793, 794, 795, 796, 797, 803
компрессия, инверсия или коллапс, 722, 723
легочная гипертензия, 817, 827–828
движение межжелудочковой перегородки, 821, 823
диастолическая функция, 821
нагрузка давлением, 817, 818, 819, 820
размеры, 818, 820, 821
систолическая функция, 818, 820, 821, 822
размеры, возрастные изменения, 1005, 1009
систолическая функция
изменения с возрастом, 1006, 1112
оценка, 794,795, 796, 797
у спортсменов, 959, 960
физиология, 789
функция, 176, 177
оценка функции желудочков, 78–80, 91–93
транспозиция магистральных сосудов, 1231
чреспищеводная эхокардиография, 50–52, 55, 68, 69
эхокардиографическая оценка
альтернативные подходы, 801, 802
внутрисердечное изображение, 802
дальнейшие направления, 799–801
клиническое применение, 798–799
отдаленные результаты, 798
потенциальные ограничения, 799
применение результатов, 795, 797, 799
In-index_2 колонки.indd 1286
03.04.2019 12:47:34
1287
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
трансторакальная визуализация, 790, 791, 803
чреспищеводная визуализация, 793, 802
Преднагрузка, определение, 135
Предсердие
левое. См. Левое предсердие
правое. См. Правое предсердие
размер, оценка, 1060–1061
у спортсменов, 960–962
функция, оценка, 1060–1064
чреспищеводная эхокардиография, 53
Применение контрастного средства при острой боли
в груди, 232–234, 309–313
Принципы гидродинамики, 547, 548, 571
Продольная деформация при аортальном стенозе, 339
Пространственная разрешающая способность
при трехмерной эхокардиографии, 23–25, 29
в сравнении с временной, 33
Протез клапана
аортального
высокие градиенты на протезе, интерпретация, 596–599
транскатетерная, имплантация. См. Транскатетерная
имплантация аортального клапана
гидродинамика. См. Гидродинамика клапанов сердца
допплерография, 577–593
временные интервалы проведения, 578
клинические данные, 578
интерпретация, 596–600
митрального, высокие градиенты давления
после протезирования, 596, 597
осложнения и дисфункция. См. Дисфункция
протезированного клапана
оценка in vivo, 557, 558
у беременных, 1122, 1123, 1129, 1130
шарикового типа, 560, 561, 564
чреспищеводная эхокардиография, 62–64
Протезирование аортального клапана, 349–355
низкий градиент и сниженная фракция выброса, 351, 352
низкий градиент и сохранная фракция выброса, 352–355
пациенты без симптомов, 350, 351
пациенты с показаниями к другим хирургическим
вмешательствам, 355
пациенты с симптомами, 349, 350
Псевдоаневризма, осложнение острого инфаркта
миокарда, 258, 259
Пункция перегородки
под контролем внутрисердечной эхокардиографии, 104,
108
транскатетерная пластика митрального клапана методом
«край в край», 477, 485
Р
Рабдомиома, 1093, 1094, 1104
Радиальная линия сканирования, 22, 23
Радионуклидная визуализация при амилоидозе, 688
Размеры полостей сердца
во время беременности, 1110–1112
возрастные изменения, 1004, 1005
Разрешающая способность трехмерной эхокардиографии,
24–29
временная, 25–28
выбор временной и пространственной, 33
пространственная, 23, 25, 26
соотношение между временной и пространственной, 29
Разрыв
межжелудочковой перегородки, осложнение острого
инфаркта миокарда, 254–258
фиброзного кольца, 370, 371
Распределительный шок, ультразвуковое исследование
сердца у постели больного, 121
Расслоение аорты, 861–884
анатомическая классификация, 864, 866–867
анатомия, 863–866
аневризма грудной части нисходящего отдела аорты,
наследственная, 985
давление сдвига, 864–865
диагностика, 868–877
выбор метода визуализации, 867, 869, 870, 879
компьютерная томография, 868–870
магнитно-резонансная томография, 869, 871
трансторакальная эхокардиография, 870–872
чреспищеводная эхокардиография, 869–879
заболевания соединительной ткани, 989
механическое давление, 864–865
наблюдение пациентов после, 880
нисходящего отдела аорты, 66, 68, 69
осложнение, 875–876
осложнения, 867
острая боль в груди, 229, 240–242
острое, тип А, 399, 400
патофизиология, 863–866
рекомендации по эндоваскулярной коррекции, 880
течение заболевания, 867
факторы риска, 865–866
чреспищеводная эхокардиография при лечении
и оценке, 877–880
Расчет легочного кровотока и системного кровотока, 1135
Расщепление створок митрального клапана, 1159, 1160,
1162
Реверсное движение фиброзного кольца, 187, 713, 714
Ревматическая митральная регургитация, 413, 438
дооперационная чреспищеводная эхокардиография, 449,
453–455
пластика митрального клапана под контролем
чреспищеводной эхокардиографии, 448, 449, 452
Ревматический стеноз митрального клапана во время
беременности, 1121, 1122
Ревматоидный артрит, 903–908
Ревматические заболевания, 885–925
анкилозирующий спондилит, 908–910
артериит
гигантоклеточный височный, 916, 917, 920
Такаясу, 915–917, 919
болезнь Бехчета, 916–921
дерматомиозит, 914
первичный антифосфолипидный синдром, 902, 903
полимиозит, 914
поражение сердечно-сосудистой системы, 886–888
ревматическая митральная регургитация, 413, 438
ревматоидный артрит, 903–908
системная красная волчанка. См. Системная красная
волчанка
склеродермия, 910–914
смешанные заболевания соединительной ткани, 914, 915
Регургитация на клапане легочной артерии, 852–857
тетрада Фалло, 1191, 1193
Рестеноз, 507, 508, 510
Рестриктивная кардиомиопатия, 675–703
амилоидоз, 683–688
болезни
накопления, 692
Помпе, 692
Гоше, 692
In-index_2 колонки.indd 1287
03.04.2019 12:47:34
1288 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Фабри, 692, 693
гемохроматоз, 690, 691
гипертрофическая кардиомиопатия, поздние стадии, 695
гиперэозинофильнный синдром, 688–690
дифференциальная диагностика, 694–698, 717–719
идиопатическая, 688
лекарственная, 693
методы диагностики, 679
определение и патофизиология, причины, 675–677
пострадиационная, 693–695
саркоидоз, 690–692
эндомиокардиальный фиброэластоз, 688–690
эхокардиография и допплерография, 676–683, 699–701
M-режим, 676
визуализация в 2D-режиме, 676, 677, 683
спекл-трекинг визуализация, 683
С
Саркоидоз, рестриктивная кардиомиопатия, 690–692
Саркомы, 1096–1098
Сахарный диабет 2-го типа, 937–939, 949
Сглаживание при трехмерной эхокардиографии, 34
Семейный амилоидоз, 685
Сердечная недостаточность
прогнозирование на основании фракции выброса, 131
старение, 200, 1021–1024
эхокардиография, критерии, 613
Сердечная ресинхронизирующая терапия
дилатационная кардиомиопатия, 626, 628, 630, 631, 633
функция перегородки и боковой стенки левого
желудочка, 174
Сердечный выброс
во время беременности, 1110
метод интеграла скорости кровотока, 144, 145
мониторинг функции желудочков во время операции,
73, 92, 93
отключение искусственного кровообращения, 82
Сердце
анатомия, 1259, 1262, 1265
влияние физической нагрузки, 968
донорское, оценка, 736
искусственное, 759, 762
полностью, интраоперационная чреспищеводная
эхокардиография, 85, 86
трансплантация. См. Трансплантация, сердца
функция, старение, 200, 1006, 1009, 1011, 1012
Сжатие изображения, 207
Синдром
Билса, 982
гипоплазии левых отделов сердца, 1175, 1176, 1178, 1247,
1248, 1250
Кушинга при заболеваниях сердца, 941, 942
Лойеса–Дитца, 982, 983
Марфана, 979, 980
во время беременности, 1123, 1124
обструктивного апноэ во сне, 935–937
Тернера, 984, 1169
Элерса–Данло, 981
Синусовая тахикардия, 191
Синхронизация с электрокардиографией, 33
Синхронность сокращения миокарда, 173–176
расстройства, 173–175
Системная красная волчанка, 914
атеросклероз, 894, 901
внутрисердечный тромбоз и тромбоэмболия, 885,
893–898, 923, 924
легочная гипертензия, 901
поражение
клапанов, 885, 889–892, 894, 895, 898, 899, 923, 924
миокарда, 896, 901
перикарда, 898
Системные эмболические осложнения, 1047–1057, 1047
трансторакальная эхокардиография
вегетации, 1035, 1038, 1054
внутрисердечная опухоль. См. Опухоли сердца
дефекты межпредсердной перегородки, 1043
открытое овальное окно, выявление, 1044–1046
профилактика рецидивов эмболии, 1047, 1048–1053
инфаркт миокарда, дисфункция левого желудочка,
тромбоз, 1033–1035
клиническая эффективность и результаты, 1033
показания, 1031–1033
потенциальные ограничения и альтернативные
подходы, 1053
технические особенности, 1032, 1033
ушка левого предсердия, 1064, 1065
чреспищеводная эхокардиография
вегетации, 1035, 1037, 1038, 1054
внутрисердечная опухоль. См. Опухоли сердца
клиническая эффективность и результаты, 1033
патология межпредсердной перегородки, 1043
открытое овальное окно, аневризма межпредсердной
перегородки, риск инсульта, 1044, 1047
открытое овальное окно, выявление, 1044–1046
профилактика рецидивов эмболии, 1047–1050, 1052
показания, 1031–1033
потенциальные ограничения и альтернативные
подходы, 1053
технические аспекты, 1032, 1033
тромбоз в левом предсердии, 1039, 1042, 1043
тромбоз, 1033, 1054
Систолическая функция
беременность в норме, 1110
легочная гипертензия, 818, 820–822
ожирение, 933, 934
определение, 134
оценка, 145
отношение давление/объем, 150
отношение напряжение–укорочение, 148, 149
фракция выброса, 146, 147
фракция укорочения, 147, 150
правого желудочка, 794–797, 802
изменения с возрастом, 1009, 1012
у спортсменов, 956, 959
Склеродермия, 910–914
Скорость
движения миокарда при тканевой допплерографии
импульсно-волновая, 159, 160
ограничения, 164–167
цветовой, 157–159, 176, 177
деформации
визуализация, спекл-трекинг эхокардиография,
162–165, 176, 177
дилатационная кардиомиопатия, 617
расчет, 161
Эйлера, 161
диастолическая, 168
систолическая, 168, 169
скорость потока на протезе, 579–581
Скручивание левого желудочка
определение, 168
спекл-трекинг эхокардиография, 198
In-index_2 колонки.indd 1288
03.04.2019 12:47:34
1289
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Смешанная митральная регургитация, 472–474, 478
Смешанные заболевания соединительной ткани, 914, 915
Сократимость, определение, 134, 136
Сократительная функция, определение, 134
Сократительный резерв левого желудочка, 622, 634
Спекл-трекинг эхокардиография, 157
вращение и скручивание левого желудочка, 164, 166, 171,
176, 177
деформация и скорость деформации, 162–165, 176, 177
ограничения, 164–167
дилатационная кардиомиопатия, 629, 630
оценка диастолической функции, 200
оценка функции желудочков, 77, 78
рестриктивная кардиомиопатия, 677–682
стресс-эхокардиография без физической нагрузки,
315–318
физические основы, 162, 163
Спектральная допплерография, регургитация на протезе
аортального клапана, 590–592
Спондилит анкилозирующий, 908–910, 907–909
Спонтанный инфаркт миокарда, 228
Спортсмены, 953–978
аорта, 962–964
дифференциальная диагностика с гипертрофической
кардиомиопатией, 644, 645, 972
левый желудочек, 955–960
отличие между патологией и спортивным сердцем, 971,
973–975
правый желудочек, 959–960
предсердия, 960–962
сердце, влияния различных типов физической нагрузки,
954–957
стресс-эхокардиография, 967–968
эффекты разгрузки, 964
эхокардиографическое исследование, 975
альтернативные способы визуализации, 968–970
показания, 966–967
Старение, 1003–1029. См. также Пожилые
естественные изменения сердечной структуры, 1003–1006
изменения левого желудочка
гипертрофия, 1017
диастолическая функция, 182–185, 199–202, 1007, 1011,
1012
масса, 1003–1004
размер полости, 1003
размеры, 1005–1009
систолическая функция, 1006–1007
толщина стенок, 1003, 1004
изменения правого желудочка
размеры, 1005, 1008, 1009
систолическая функция, 1008, 1012
изменения функции сердца, 200, 1006–1012
кальцификация клапанов, 1005–1006, 1009–1012
кальцификация фиброзного кольца митрального
клапана, 1013–1019
клинические исходы, 1011–1027
амилоидоз сердца, 1025–1026
базальная гипертрофия межжелудочковой
перегородки, 1017–1020
гипертрофия и масса левого желудочка, 1017
ишемическая болезнь сердца, стресс-тесты 1022–1025
кардиогенная тромбоэмболия, 1025
пороки клапанов сердца, 1011–1019
размеры левого предсердия, 1020–1021
сердечная недостаточность, 200, 1021–1023
чреспищеводная эхокардиография, 1025
ответ сердца на нагрузку
давлением, 1008
физическую, 1011
размер левого предсердия, 1004, 1005, 1007
исходы, 1020–1021
размеры полостей сердца, 1004, 1005
склероз аортального клапана, 1011
увеличение диаметра корня аорты, 1004
Старческий системный амилоидоз, 685
Стеноз
внутрипредсердного туннеля, 1229, 1242–1243
клапана легочной артерии, 847–852, 1181–1185
естественное течение и клиническая картина, 1181, 1182
показания к чрескожному вмешательству, 1184, 1185
реимплантация коронарных артерий, 1234
эхокардиография, 1182–1184
конверсия и потеря механической энергии при стенозах,
552
трикуспидального клапана, 846, 847
Стресс
механическое давление при расслоении аорты, 864
напряжение при расслоении аорты, 864, 865
напряжение, 134
Стресс-индуцированная кардиомиопатия, 625, 626
Стресс-эхокардиография, 271–300
аортальный стеноз, 343
без физической нагрузки, 301–323
боль в груди, 280, 281
в клинической практике, 318
возрастные изменения, заболевания коронарных
артерий, 1022–1025
диагностика ишемической болезни сердца, 301–323
контрастное средство, 312
новые подходы, 314
резерв коронарного кровотока, 314, 315
тканевая допплерография и двухмерная
спекл-трекинг эхокардиография, 315, 317–319
трехмерная стресс-эхокардиография, 314
оценка прогноза, 309
различные варианты оценки миокарда, 308–310
стратификация риска после острого инфаркта
миокарда, 265
с фармакологической нагрузкой и протоколы тестов,
302, 321
дипиридамол, 303–305
добутамин. См. Добутамин, стресс-эхокардиография
эргоновин, 304
возрастные заболевания коронарных артерий, 1022–1025
заболевания коронарных артерий, 273–278, 285, 286
клинико-экономическая эффективность, 278
легочная гипертензия, 824, 825
митральный стеноз
до проведения баллонной комиссуротомии, 499
оборудование, 279, 280
дальнейшие разработки, 294–296
деформация миокарда, 294–296
протоколы, 281
стресс-тесты с физической нагрузкой, 280, 281, 297, 298
трехмерная эхокардиография, 295, 296
обструкция выходного тракта левого желудочка
при гипертрофической кардиомиопатии, 649, 652–654,
657
общие рекомендации, 278, 279
острая боль в груди, 232, 237, 238
оценка результатов
артериальное давление, 283
In-index_2 колонки.indd 1289
03.04.2019 12:47:34
1290 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
индекс Дьюка при стресс-тесте на тредмиле, 286
симптомы, стенокардия и субъективное восприятие
нагрузки, 282, 286
функциональные возможности, 282, 283
частота сердечных сокращений, 282, 297, 298
эхокардиографическая визуализация, 283–287, 291, 292,
297, 298
эхокардиографические изменения, 283, 284, 297, 298
пациент с электрокардиостимулятором, 304
персонал, 279
подготовка пациента, 280
показания, 273–278
прекращение, 288, 293
при лекарственной терапии, 281, 282
прогностическая значимость, 286
противопоказания, 275–277
регургитация протеза клапана, 595
сравнение с другими тестами, 290–295
у спорстменов, 966
физиологические и патофизиологические принципы, 272
цель, 278
Сухожильные хорды, 408, 409
Т
Тампонада сердца, 720–726, 727
после транскатетерной имплантации аортального
клапана, 370, 371
Тетрада Фалло, 1188, 1191, 1197
во время беременности, 1116, 1129, 1130
клиническая картина и осмотр пациентов, 1189
морфология и анатомические формы, 1188–1190
хирургическая коррекция и отаточные осложнения, 1189
хирургическое лечение и его результаты, 1197, 1198
эхокардиография, 1191–1196
Тканевая допплерография, 157
визуализация скорости движения миокарда, 157, 176, 177
импульсно-волновая допплерография, 159–161
ограничения, 164–167
цветовая допплерография, 157–160
деформация и скорость деформации, 161
дилатационная кардиомиопатия, 616–618, 628
интраоперационный мониторинг функции желудочков,
76
оценка диастолической функции, 182, 185–188, 190, 201
рестриктивная кардиомиопатия, 676, 682
стресс-эхокардиография без физической нагрузки,
318–320
физические основы, 157–161
Травма аорты, 868, 877
Транзиторный констриктивный перикардит, 718, 719
Транскатетерная баллонная вальвулопластика митрального
клапана, 105–108
Транскатетерная имплантация аортального клапана,
361–378
дегенерация протеза, 377, 378
краткосрочные и среднесрочные результаты, 373–378
непосредственные осложнения, 370–373
отбор пациентов, 361–364, 378
планирование, 364–368, 378
чреспищеводная эхокардиография, 16, 368–380
Транскатетерная пластика митрального клапана методом
«край в край», 469–474, 490, 491
альтернативные методы визуализации, 488, 490, 491
контроль во время вмешательства, 478–485, 490, 491
определение степени митральной регургитации, 474–477,
479
определение этиологии митральной регургитации,
470–478
отбор пациентов с помощью эхокардиографии, 470, 475,
490, 491
последние достижения и перспективы, 488–490
потенциальные осложнения, оценка, 485, 490, 491
результаты, оценка, 485–488, 490, 491
эхокардиографические критерии, 477–480
Транскатетерное закрытие дефекта межпредсердной
перегородки, 100–104
Транскатетерные клапаны, 566–571
Трансплантация
легких, 87, 92, 93
печени, 87, 944, 947
сердца, 733–756
аллотрансплантат
васкулопатия после трансплантации, 748–753
острое отторжение, 739, 740
строение и функциональное состояние, 737–739
донорское сердце, оценка, 736
мониторинг функции желудочков во время, 87, 92, 93
послеоперационная оценка, 733–737
посттрансплантационный мониторинг, 740, 752, 753
перикардиальная жидкость, 742–744
стандартное последующее наблюдение, 740–742
эндомиокардиальная биопсия под контролем
эхокардиографии, 743, 745–748
риски при сердечной недостаточности, 733–736
структура и функция правых отделов сердца, 739
техника, 737, 738
толщина стенки, систолическая и диастолическая
функции желудочка после, 737, 738
Транспозиция магистральных сосудов
беременность, 1118
врожденная корригированная, 1225, 1235, 1242, 1243
анатомическая коррекция, 1240–1242
анатомия и определение, 1235–1237
отдаленные результаты, 1237–1240
полная, 1225–1234, 1242–1243
обследование после операции, 1226–1235
осложнения, 1229–1231
хирургические подходы, 1225–1228
Трансторакальная эхокардиография
диагностика расслоения аорты, 872
интерпретация, 9
инфекционный эндокардит, 530–534, 543
клиническая оценка диастолической функции левого
желудочка, 193–195
определение давления наполнения левого желудочка,
194–196
острый инфаркт миокарда
диагностика осложнений, 252, 266
перикардиальная жидкость, 253, 254
псевдоаневризма, 258, 259
разрыв межжелудочковой перегородки, 256
разрыв свободной стенки левого желудочка, 258
диагностическая роль, 248, 250
оценка аортальной регургитации, 389, 390
оценка в отделении неотложной кардиологии, 247, 248,
249
оценка правого желудочка, 789–791, 802
системные эмболические осложнения. См. Системные
эмболические осложнения, чреспищеводная
эхокардиография
Трепетание предсердий, эхокардиография
при фибрилляции предсердий, 1060–1063
In-index_2 колонки.indd 1290
03.04.2019 12:47:34
1291
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Трехмерная реконструкция на основе эхокардиографии, 21
Трехмерная эхокардиография, 21–44
анализ, 39–44
аортальная регургитация, 389, 390
аортальный клапан, 40, 42, 44
внутрисердечная, 98
вывод на экран монитора, 35–39
гипертрофическая кардиомиопатия, 661–663
дилатационная кардиомиопатия, 624, 630
использование, 21
левого желудочка
масса, 151
протоколы, 39–44
левого предсердия, 40, 41, 43
митральная регургитация, 423, 427, 428
митрального клапана, 40–42, 44, 57, 441, 446, 447
новые подходы, стресс-эхокардиография, 295, 298, 314
получение данных, 21–23, 29–33, 43, 44
оптимизация, 30, 33, 34
протоколы, 39–44
режим модальности, 31, 32
способы получения, 25, 26
трудности, 33, 34
цветовая допплерография, 32, 33, 39, 43
правого желудочка, 40, 41, 43
разрешающая способность, 24–29
трикуспидального клапана, 40, 42, 44
функция ультразвуковой системы визуализации, 21–24
чреспищеводная, 58–60
Трехпредсердное сердце, 1159, 1161, 1177
Трикуспидальная регургитация, 836, 857, 1204, 1205
клиническая значимость и отдаленные результаты, 837,
842–846
на протезе митрального клапана, 595, 596
основные принципы и диагностика с помощью
эхокардиографии, 832
потенциальные ограничения, 846
причины, определение, 832–836
степень, определение, 837, 839–842
тетрада Фалло, 1196
транспозиция магистральных сосудов, 1231
врожденная корригированная, 1238–1240
Трикуспидальный клапан
анатомия, 787, 788
заболевания, 831, 832. См. также Стеноз,
трикуспидального клапана; Трикуспидальная
регургитация
протоколы для визуализации в 3D-режиме, 40, 42–44
транспозиция магистральных сосудов, 1230, 1231
чреспищеводная эхокардиография, 57–59, 68, 69
Тромбоз
внутрисердечный
первичный антифосфолипидный синдром, 902, 903
системная красная волчанка, 885, 893–897, 899, 923–924
левого желудочка, осложнение острого инфаркта
миокарда, 260–262
левого предсердия, 1039–1041, 1043
протезированного клапана, 575, 576, 603, 604
ведение, допплерография, 575, 576, 598–601
стента, инфаркт миокарда, 228
транскатетерная имплантация аортального клапана, 376
Тромбоэмболия
кальцификация кольца митрального клапана у пожилых,
1015
кардиогенная у пожилых, 1025
первичный антифосфолипидный синдром, 902, 903
системная красная волчанка, 885, 893–897, 899, 923–924
Тромбы
левого желудочка
осложнения острого инфаркта миокарда, 260–262
трансторакальная эхокардиография, 1032, 1034, 1054
левого предсердия, 1039, 1041, 1043, 1044
Турбулентные потери, 551
У
Ударный объем, 76, 77, 153, 154
Ультразвуковое исследование
внутрисосудистое, 746, 748
у постели больного, 112–125
сердца, 111–127
боль в груди, 238, 239
визуализация, 116, 117
дополнение к физикальному осмотру, 118
доступные ультразвуковые системы, 112, 113
использование ультразвука при различных
манипуляциях, 122
медицинские работники, 113, 115
недифференцированная гипотензия, 121
недоступность эхокардиографии, 122
обеспечение качества, 124
обучение, 122
острая дыхательная недостаточность, 121
оценка нарушений сердечно-сосудистой системы, 118,
119
оценка ответа на инфузионную терапию, 121
перспективы, 124
результаты лечения, 123
стационарная ультразвуковая система в сравнении,
112, 114, 118, 119
типы шока, 120
тренинг, 113–116
Уравнение Бернулли, 549
Усиление изображения, 205–208
трехмерной эхокардиографии, 33, 34
Устройство вспомогательного кровообращения желудочка,
758
альтернативные доступы, 778
дисфункция, 765–767, 779–783
изменение, 767, 769
клапанов, 766
недостаточное заполнение, 766, 768
чрезмерное заполнение, 765, 767
имплантация, 758, 760
перипроцедурные рекомендации, 764, 765, 779–783
канюли, 772–774, 777
клиническая значимость и отдаленные результаты, 776
ограничения и перспективы, 776, 777
оптимизация, 774
отключение/отсоединение, 775
открытие аортального клапана, 771
позиционирование, интраоперационная чреспищеводная
эхокардиография, 84, 85, 93
правого желудочка, 85
предварительная оценка, 762, 763, 779–783
технические детали, количественная оценка и анализ,
769, 770
чрескожная установка, 761, 762
Ушко левого предсердия
закрытие, 1071–1073
инсульт и эмболизация, 1064
функция, 100, 101
чреспищеводная эхокардиография, 61, 62, 68, 69
In-index_2 колонки.indd 1291
03.04.2019 12:47:34
1292 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Ф
Феохромоцитома, 941, 943
Фетальный и неонатальный риск во время беременности,
1125, 1126
Фибриллинопатия, 981
Фибрилляция предсердий
диастолическая функция, оценка, 191
инсульт, 1063–1067
кальцификация фиброзного кольца митрального
клапана, возрастные изменения, 1014
распространенность, 1059
ремоделирование предсердий, 1059–1060
с клапанной паталогией и без нее, 1067
чреспищеводная эхокардиография, 60–62
эхокардиография во время процедуры, 1067–1074
аблация при трепетании предсердий, 1071
закрытие ушка левого предсердия, 1071–1073
катетерная аблация, 1067–1071
эхокардиография у пациентов с трепетанием
предсердий, 1060–1063
размеры предсердий, оценка, 1060–1061
функция предсердий, оценка, 1060–1064
Фиброзное кольцо митрального клапана, 407, 408
кальцификация
изменения с возрастом, 1011–1017
митральная регургитация, аортальный стеноз, 341
скорость движения при констриктивном перикардите,
712–714
Фиброма сердца, 1094, 1095, 1104
Фиброэластический дефицит, 435
Фиброэластома папиллярная, 1082–1089, 1104
Фистула
инфекционный эндокардит, 526, 527, 530, 543
тактика лечения, 538
коронарной артерии, 1155, 1157, 1175, 1176
Фракция выброса
гемодинамические детерминанты, 146, 147
интраоперационная оценка подвижности стенок, 76, 92
левого желудочка, 14
болезнь сердца, 131–133
факторы повышения качества, 14, 15
оценка систолической функции левого желудочка, 146,
151–154
Фракция укорочения, 147, 148, 151–154
Функция желудочка
до и после операции Фонтена, 1259
интраоперационная оценка, 71–81, 92, 93
выходной тракт левого желудочка, 73–75
выходной тракт правого желудочка, 76
глобальная систолическая функция, 73–80, 92, 93
диастолическая функция левого желудочка, 71, 72, 92
конечно-диастолический объем, 72, 74
конечно-систолический объем, 72–74
легочный ствол, 75, 76
локальная сократимость миокарда, 80, 81, 92, 93
объем левого желудочка, 72, 74, 92, 93
практические рекомендации, 73
сердечный выброс, 73
спекл-трекинг эхокардиография, 77, 78
тканевая допплерография, 77
ударный объем, 76, 77
фракция выброса, 76, 92, 93
функция правого желудочка, 78–80, 92, 93
Х
Хроническая аортальная регургитация, 393, 394, 398
Хроническая легочная тромбоэмболическая болезнь, 813,
816, 817
Хроническая митральная регургитация, 425, 426
Ц
Цветовая допплерография
M-режим
оценка диастолической функции, 185, 190, 201, 202
рестриктивная кардиомиопатия, 682
амилоидоз, 684, 685, 687
визуализация скорости движения миокарда, 157, 158
количественная оценка митральной регургитации,
415–420, 427–429
измерения ширины vena contracta, 417, 418, 427–429
определение площади дистальной зоны струи
регургитации, 416, 417, 427–429
определение площади проксимальной зоны струи
регургитации, 418, 419, 427–429
референсные значения, 420
регургитация на протезе аортального клапана, 588–591
степень аортальной регургитации, 384–387, 401, 402
трехмерные изображения, 32, 33, 39, 43
Цианотические пороки сердца во время беременности,
1119
Цикл Деминга, 3
Цирротическая кардиомиопатия, 944, 945, 949
Ч
Чрескожное коронарное вмешательство, 228
Чреспищеводная эхокардиография, 45–70
анатомия митрального клапана
метод осевой визуализации, 440, 441, 443–445
стандартная мультипланарная визуализация, 57, 58,
439, 440–442
трехмерное изображение, 40–42, 44, 59, 441, 446, 447
аортальный стеноз, 335, 336, 355
в пожилом возрасте, 1025
врожденный порок сердца, 66
интраоперационная оценка функции желудочков, 71–81,
92, 93. См. также Функция желудочка,
интраоперационная оценка
глобальная систолическая функция, 73–80, 92
диастолическая функция левого желудочка, 71, 92
конечно-диастолический и конечно-систолический
объем, 72–74
локальная сократимость миокарда, 80, 81, 91, 92
послеоперационные результаты и экономическая
эффективность, 71, 88–92
интраоперационная оценка функции сердца, 81–87
имплантация внутрисосудистых устройств, 83–87
искусственное кровообращение, отключение, 78, 82
коронарное шунтирование без искусственного
кровообращения, 82, 83
трансплантация, 87, 92, 93
интраоперационная, 71
интенсивная терапия, 67, 68, 88
пластика митрального клапана. См. Пластика
митрального клапана, чреспищеводная
эхокардиография
интубация пищевода, 48
инфекционный эндокардит, 64, 65, 530–534, 543
критерии целесообразного использования, 11–13
обучение, 46, 47
острый аортальный синдром, 65, 66
острый инфаркт миокарда, 247
выявление осложнений, 254, 266
In-index_2 колонки.indd 1292
03.04.2019 12:47:34
1293
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
закрытие дефекта межжелудочковой перегородки, 257
оценка аортальной регургитации, 389
оценка нативных и протезированных клапанов, 62–64
оценка правого желудочка, 793, 802
перемещения зонда и стандартные позиции
при визуализации, 49, 51
пластика митрального клапана, 433
подготовка пациента, 47
позиционирование зонда, 48, 49, 51
показания, 45, 46
последовательность оценки, 68, 69
противопоказания, 87, 88
расслоение аорты, 882
диагностика, 869, 873, 874, 876–878
лечение и наблюдение в отдаленном периоде, 880
риск осложнений, 47
системные эмболические осложнения. См. Системные
эмболические осложнения, чреспищеводная
эхокардиография
стандартные позиции, 49, 50
аорта и аортальный клапан, 54, 56, 57, 68, 69
левое предсердие и его ушко, 53, 55, 68, 69
левый и правый желудочки, 50, 52, 53, 55, 68, 69
митральный клапан, 56–58, 439, 440–442
трикуспидальный клапан и клапан легочной артерии,
57, 68
транскатетерная имплантация аортального клапана, 16,
368–369
фибрилляция предсердий, 60–62, 1066, 1074
эмболия, 60–62
Ш
Шок, ультразвуковое исследование у постели больного, 120
Шунт
Блелока–Тауссиг, 1260
во время беременности, 1113, 1115
врожденный. См. Врожденные внутрисердечные шунты
на уровне предсердий, 1137–1138
трикуспидальный клапан, 1134, 1135
Э
Экссудативно-констриктивный перикардит, 718
Эмболические осложнения системные. См. Системные
эмболические осложнения
Эмболия
легочной артерии, острая боль в груди, 229, 241–243
сердца, 1031–1032
чреспищеводная эхокардиография, 60–62
Эмбриональное развитие конотрункуса, 1209
Эндокардит
инфекционный. См. Инфекционный эндокардит
кальцификация фиброзного кольца митрального
клапана, 1015
митральный клапан, 411, 412
дооперационная чреспищеводная эхокардиография,
442, 453–455
пластика под контролем эхокардиографии, 448, 449, 458
протезированного клапана, 535, 536, 577, 601–604
транскатетерная имплантация аортального клапана, 376
Эндокринопатия, 940, 941, 949
акромегалия, 940, 941
гиперпаратиреоз 941, 942
гипертиреоз, 940, 941
гипотиреоз, 940, 941
дефицит гормона роста, 941, 942
метаболический синдром, 937, 938
синдром Кушинга, 941, 942
феохромоцитома, 941, 943
Эндомиокардиальная биопсия после трансплантации
сердца, 744, 745
Эндомиокардиальный фиброэластоз, рестриктивная
кардиомиопатия, 688–690
Эпикардиальная и эпиаортальная эхокардиография, 87,
92
Эпикардиальный жир, 933, 934
Эргоновин, стресс-эхокардиография, 304
Эхокардиография
2D. См. Двухмерная эхокардиография
3D. См. Трехмерная эхокардиография
внутрисердечная. См. Внутрисердечная
эхокардиография
деформации миокарда
гипертрофическая кардиомиопатия, 661–663
констриктивный перикардит, 716, 717
оценка диастолической функции, 197–199
стресс-эхокардиография, 294, 295
без физической нагрузки, 316–320
качество оказания медицинской помощи, 3, 18
повышение качества, 11–16
процесс визуализации, 5–11
реформирование системы здравоохранения, 17, 18
структура диагностического отделения, 4, 5, 18
отчетность, 9, 15, 16
при физической нагрузке. См. Стресс-эхокардиография
проведение вне диагностического отделения, 16, 17
степень подготовки, 4, 7
ультразвуковое исследование у постели больного,
сравнение, 112, 114, 118, 119
чреспищеводная. См. Чреспищеводная эхокардиография
Я
Язва аорты, пенетрация, 868, 876
In-index_2 колонки.indd 1293
03.04.2019 12:47:34
Катерина Отто
КЛИНИЧЕСКАЯ ЭХОКАРДИОГРАФИЯ:
практическое руководство
Научное издание
Научное редактирование перевода
М.М. Галагудза, Т.М. Домницкая, Т.Ю. Кулагина,
В.С. Никифоров, В.А . Сандриков
Перевод с английского
О.С . Балакирева, А.К. Барсумян, А.В. Блатун,
О.Л. Гордеев, Т.М. Домницкая, В.Э . Кирилюк,
В.А. Климов, Е.М. Климченко, К.С. Комиссаров,
Е.Е. Лисневская, А.А . Мусатова, Н.В . Назаренко,
Е.В. Никенина, А.Б. Сугак, В.К. Сухов
Редакторы
Л.А . Агадулина, А.Д . Ушакова,
Е.В. Никенина, М.С. Фетисова,
Н.С. Щипкова
Корректор
Е.М. Байкадамова
Верстка
А.А. Баранова
Издательство ООО «Логосфера»
127018, Москва, ул. Двинцев, д. 4
тел.: (495) 980-12 -12
e-mail: mail@logobook.ru
www.logobook.ru
Подписано в печать 25.09.2018 .
Формат 60 × 90/8. Бумага мелованная.
Печать офсетная. Усл. печ. л . 170.
Заказ No 02379/19
In-index_2 колонки.indd 1294
03.04.2019 12:47:34
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
П
Р
А
К
Т
И
Ч
Е
С
К
О
Е
Р
У
К
О
В
О
Д
С
Т
В
О
Отто
Новое издание широко известного практического руководства по клинической
эхокардиографии подготовлено экспертами в области интерпретации
эхокардиографических изображений и данных допплерографии.
• В каждой главе описана определенная патология, приведены
ее эхокардиографические изображения с правильной интерпретацией,
графики и рисунки, раскрывающие патофизиологию, а также рекомендации
по лечению.
• Представлены новые методы диагностики и лечения структурных патологий
сердца, включая транскатетерные методы. В конце каждой главы приведена
таблица сводных данных по получению и интерпретации эхокардиограмм.
• Подчеркивается особая роль эхокардиографии в принятии клинических решений
и прогнозировании клинических исходов.
• Информация, изложенная в книге, будет полезной для всех специалистов,
область профессионального интереса которых — сердечно-сосудистая система,
а не только для тех, кто занимается ее визуализацией.
• Это руководство также будет интересно кардиологам, анестезиологам
и другим специалистам, использующим эхокардиографию в клинической
практике, включая радиологов, интервенционных кардиологов, электрофизиологов,
врачей неотложной медицины и терапевтов, которым приходится лечить пациентов
с сердечно-сосудистыми заболеваниями.
• Много нужной информации найдут в этой книге ординаторы, старший и младший
медицинский персонал, желающие расширить свои знания по эхокардиографии.
• Для научных сотрудников в руководстве содержится подробная информация
о современных методах эхокардиографии.
Катерина Отто
Catherine Otto
К
Л
И
Н
И
Ч
Е
С
К
А
Я
Э
Х
О
К
А
Р
Д
И
О
Г
Р
А
Ф
И
Я
Otto
КЛИНИЧЕСКАЯ
ЭХОКАРДИОГРАФИЯ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
Катерина Отто
Catherine Otto
Данное издание представляет собой перевод c английского
оригинального издания The Practice of Clinical Echocardio-
graphy. Перевод опубликован по контракту с издательством
Elsevier Inc.
www.logobook.ru
Перевод
пятого издания
Перевод пятого издания
Otto Mechanical_rus.indd 1
31.10.2018 14:29:51