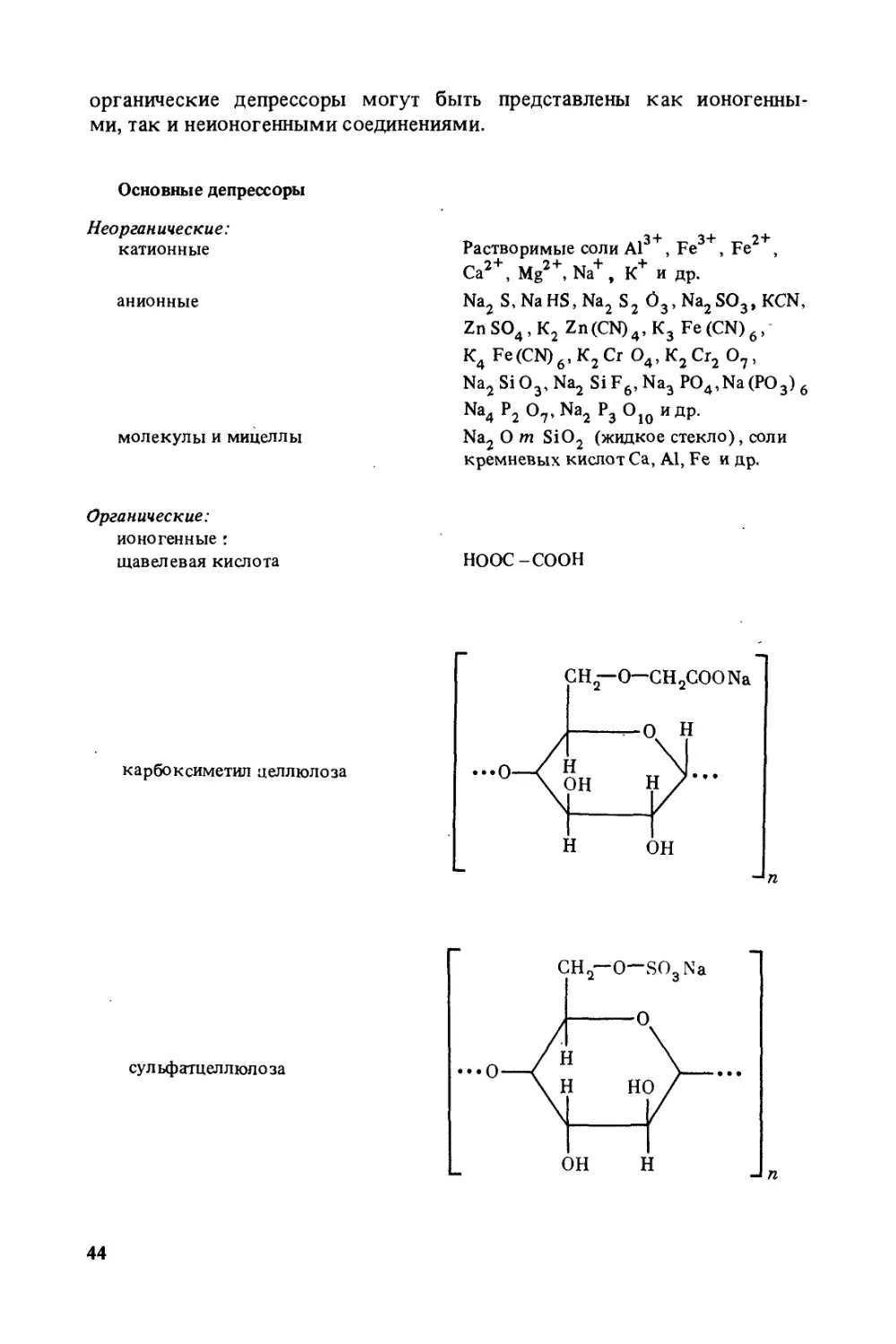
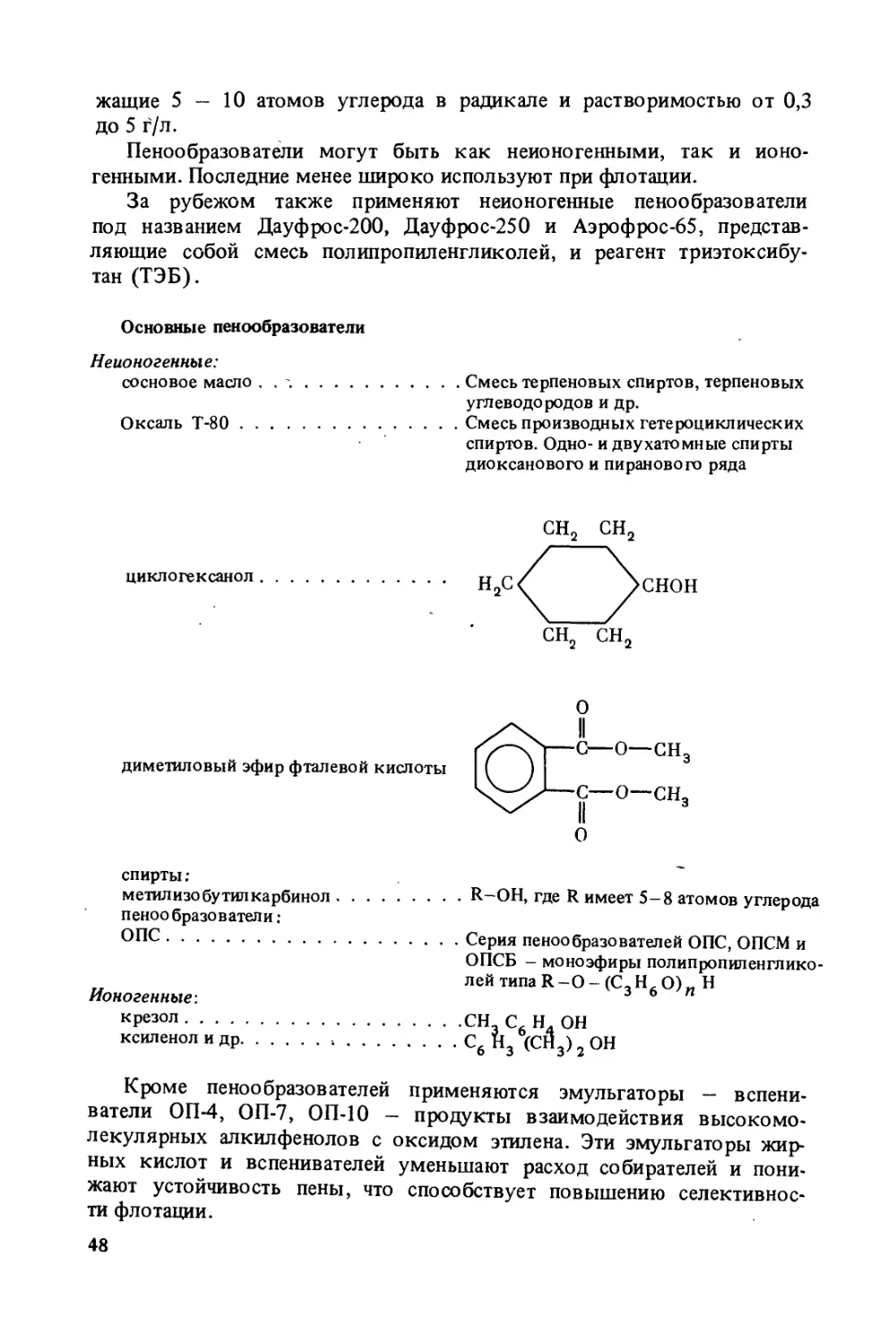
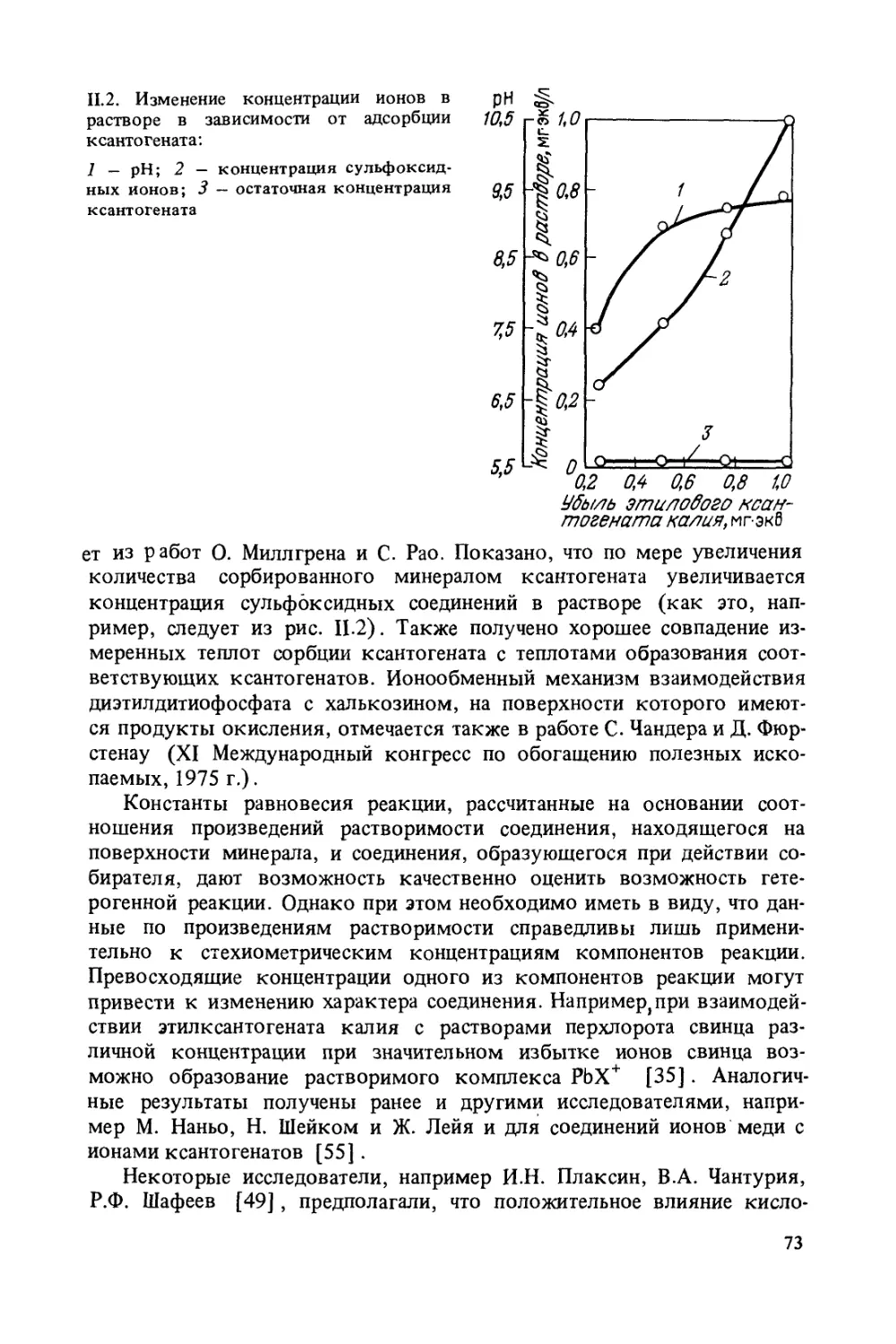
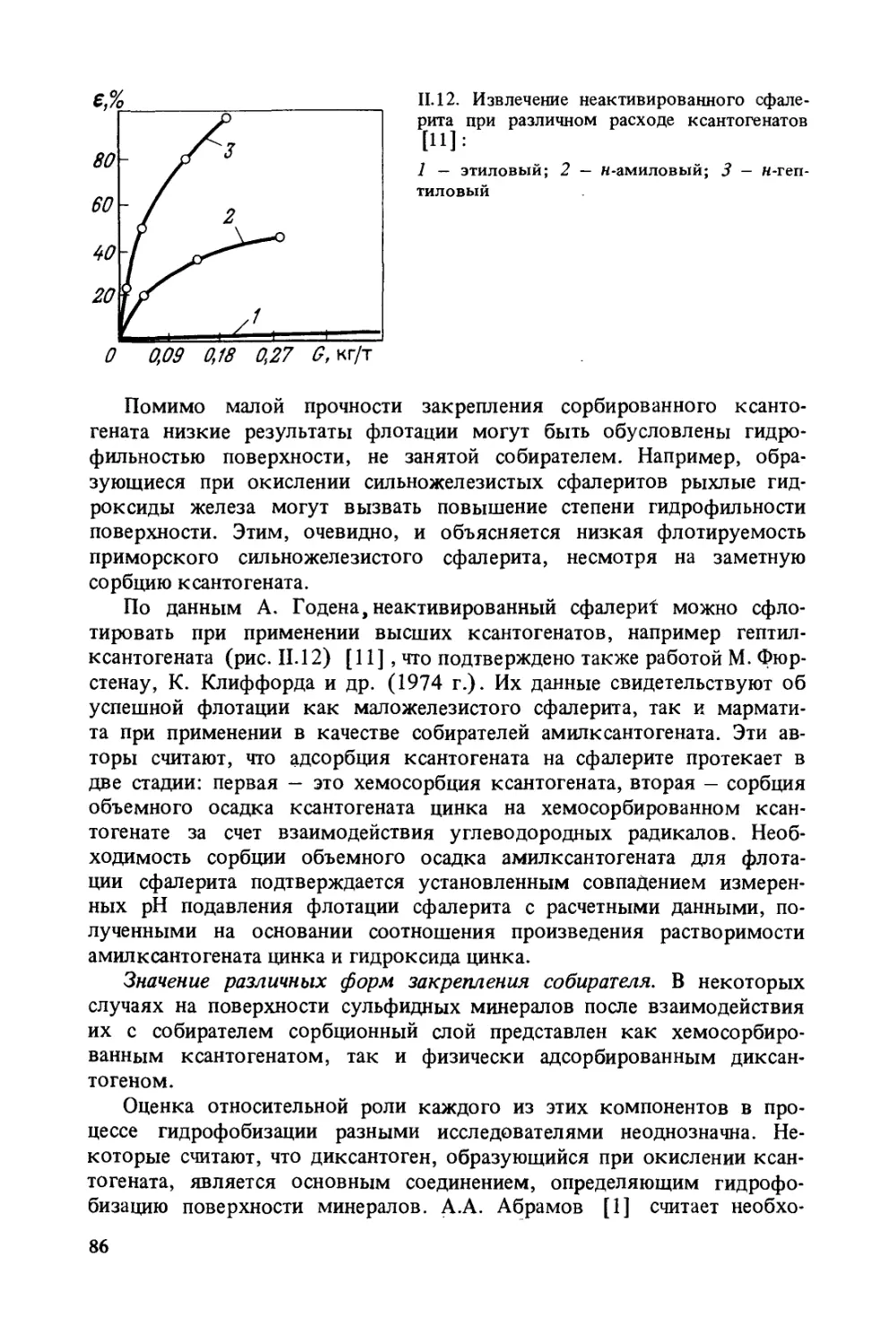
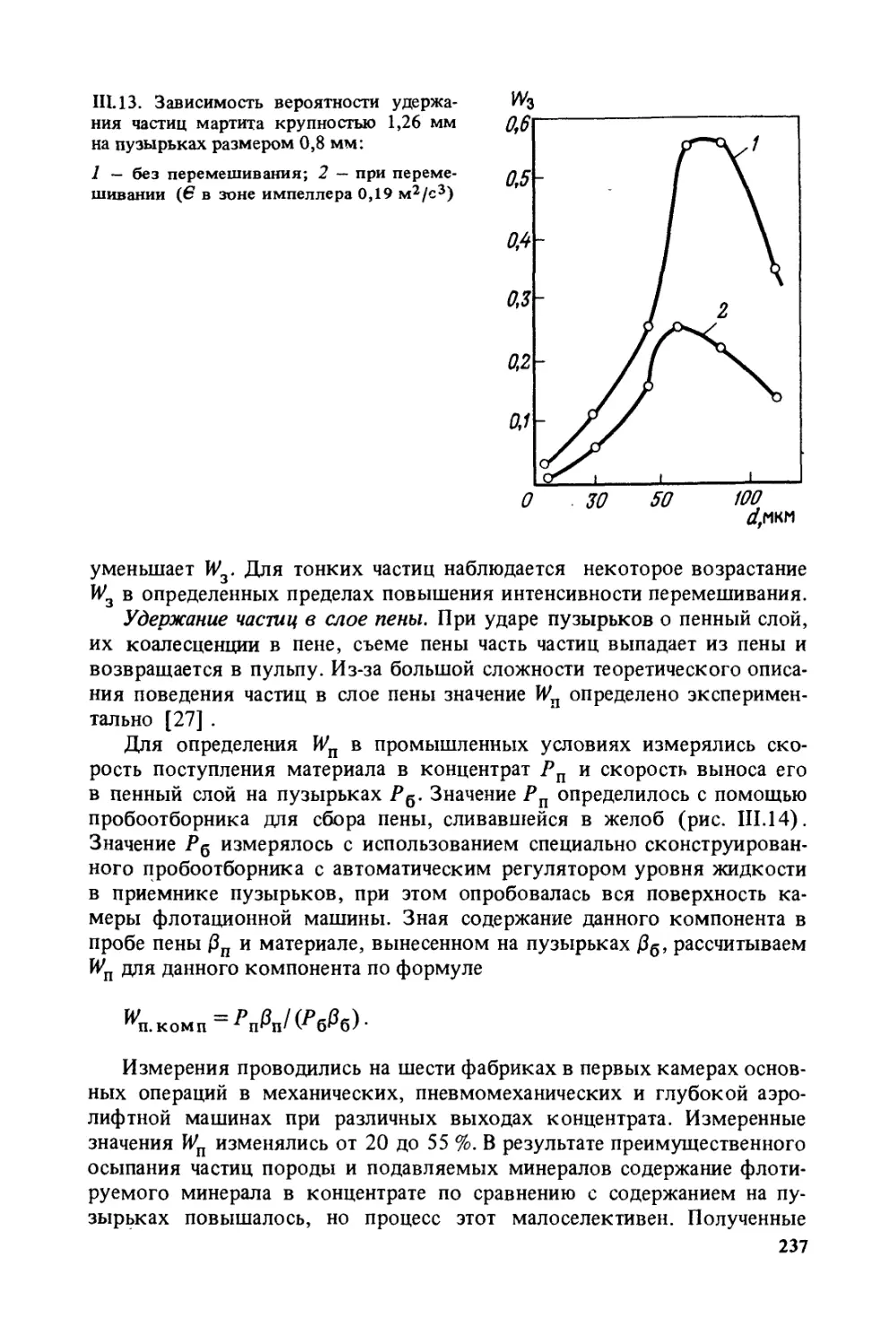
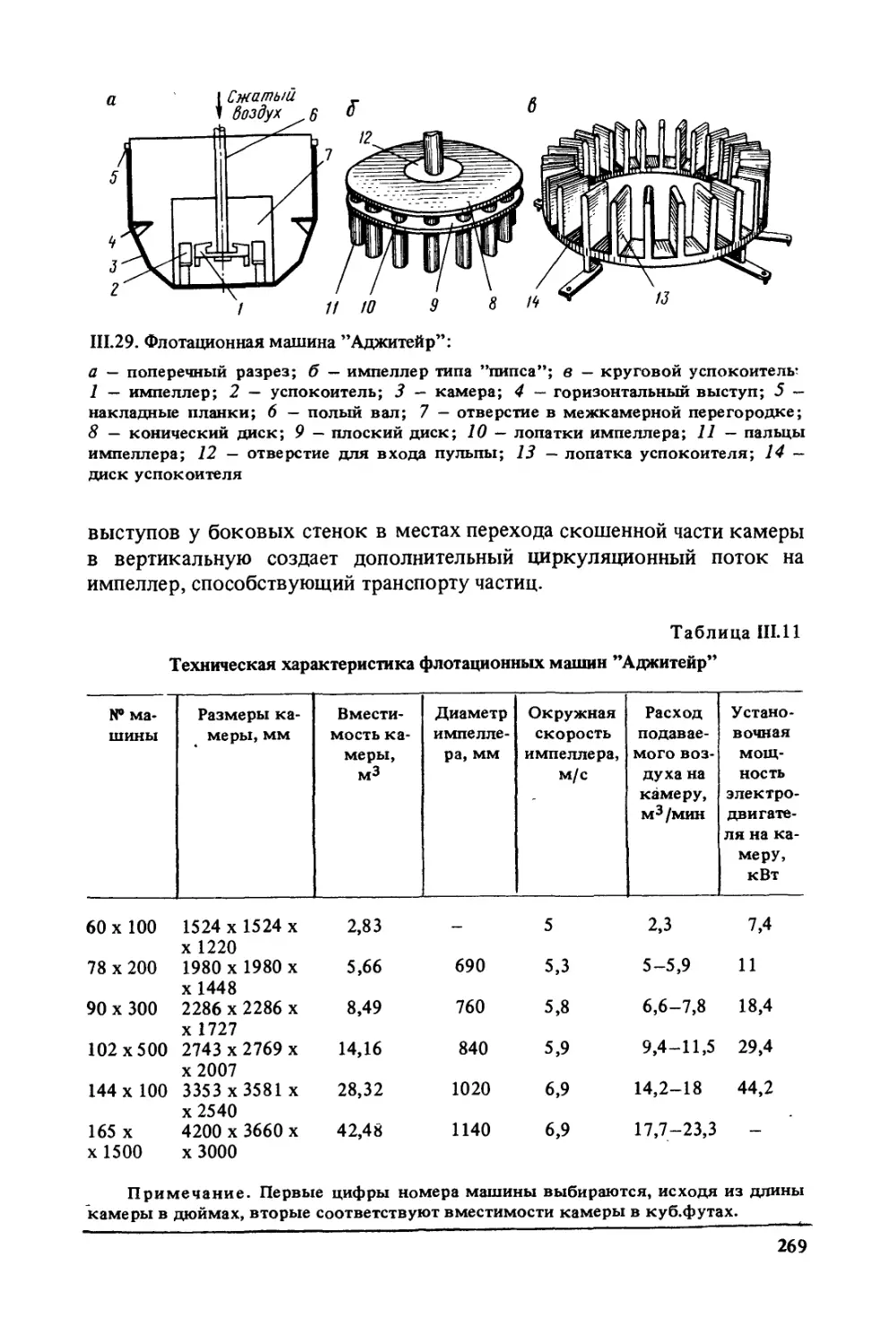
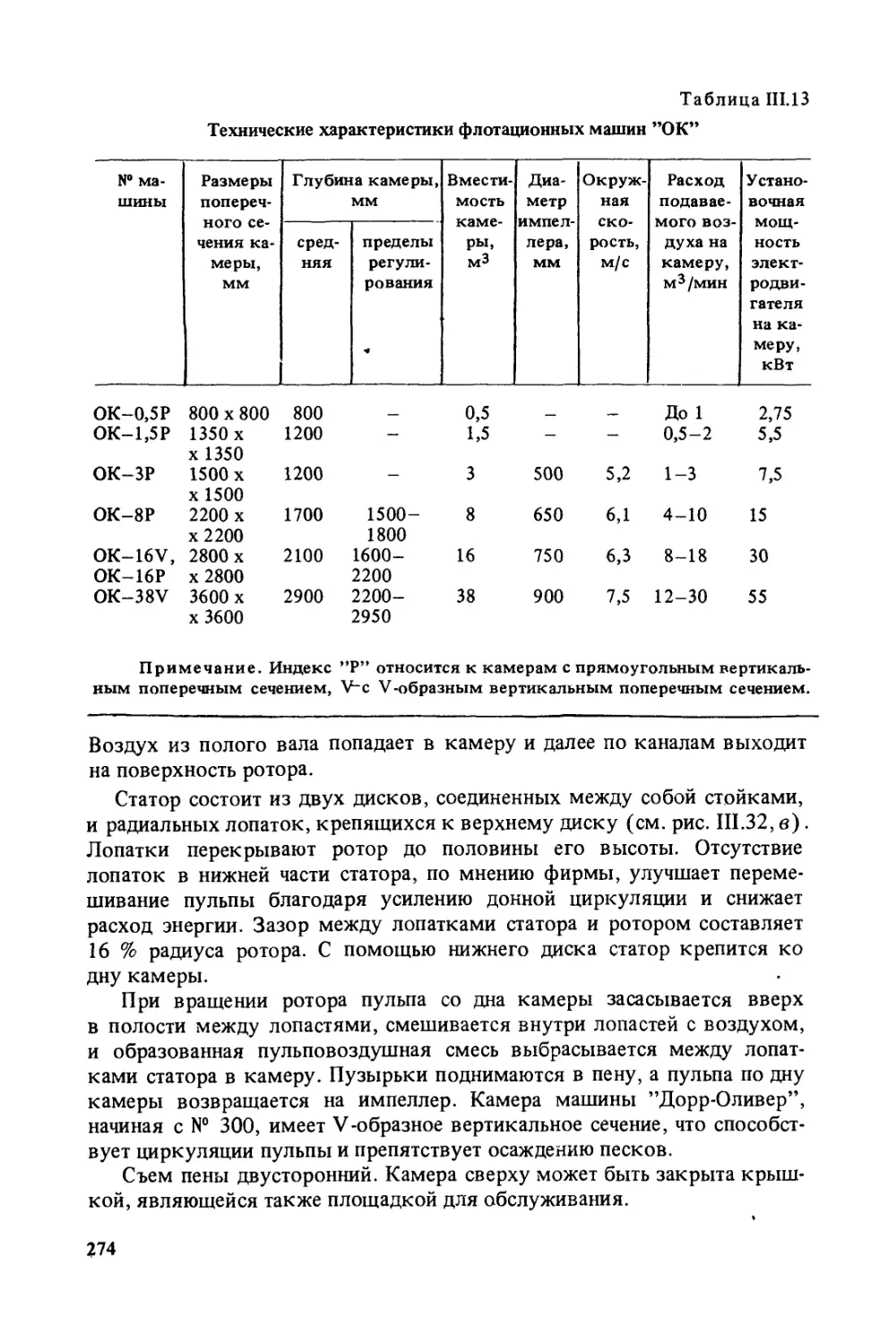
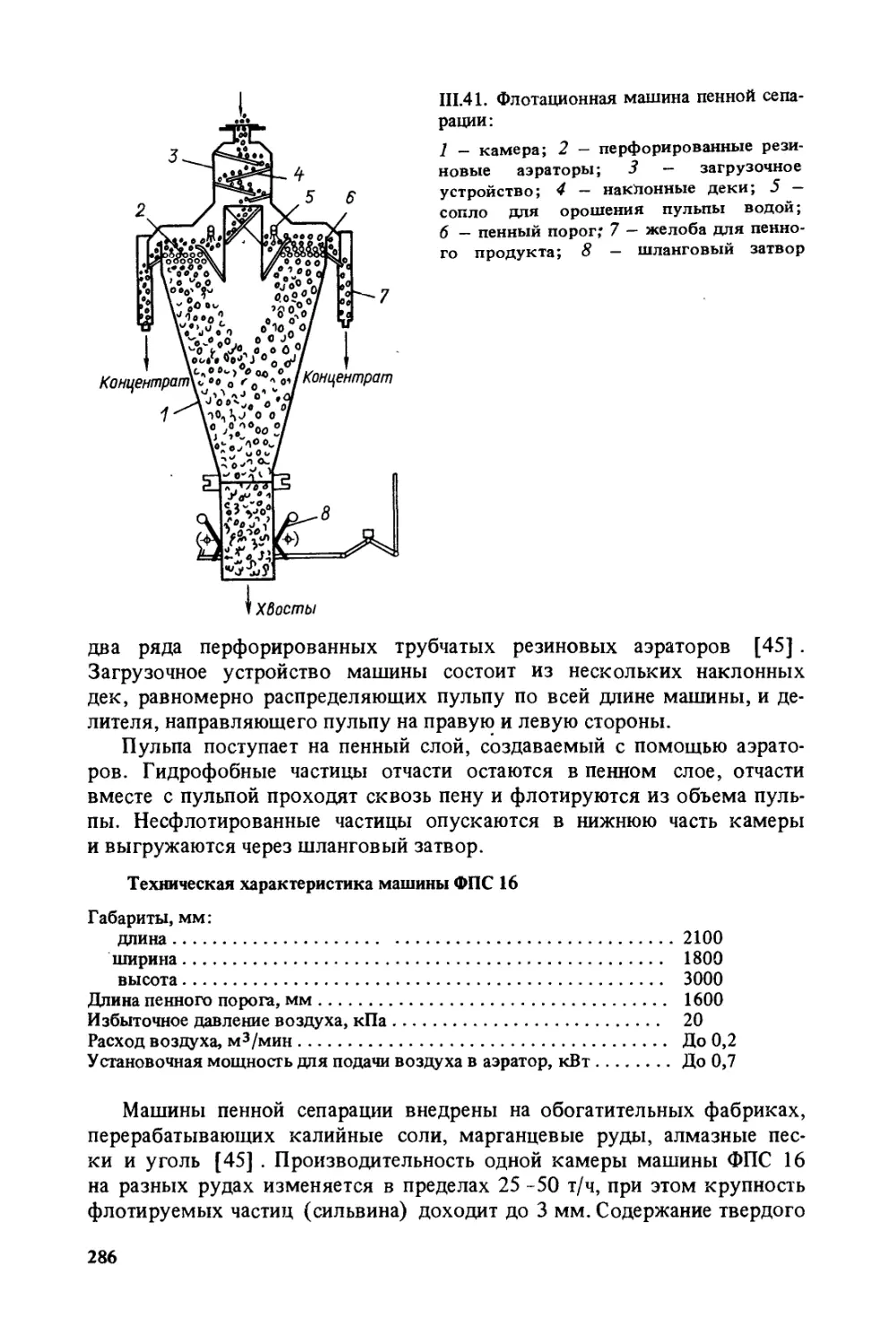
Author: Богданов О.С.
Tags: обогащение минерального сырья горное дело руды науки о земле издательство недра природные ископаемые теория флотации руд
ISBN: 5-247-00449-3
Year: 1990
Text
ТЕОРИЯ
И ТЕХНОЛОГИЯ
ФЛОТАЦИИ
РУД
ТЕОРИЯ
И ТЕХНОЛОГИЯ
ФЛОТАЦИИ
РУД
Под общей редакцией
О.С. БОГДАНОВА
2-е издание,
переработанное и дополненное
МОСКВА ’’НЕДРА” 1990
ББК 33.4
Т 38
УДК 622.765.01
А в т о р ы: О.С. Богданов, д-р техн, наук,
И.И. Максимов, канд. техн, наук, А.К. Поднек,
канд. техн. наук,Я.Л. Янис, канд. техн, наук
Рецензент проф., д-р техн, наук В.И. Тюрникова
2504000000 - 016
Т 043(01) - 90 325 "89
© Издательство ’’Недра”, 1980
ISBN 5-247-00449-3
© Коллектив авторов, 1990
ПРЕДИСЛОВИЕ
Флотационный метод обогащения полезных ископаемых — один
из наиболее распространенных технологических процессов. Он при-
обретает в настоящее время все большее значение в связи с вовлече-
нием в переработку бедных и труднообогатимых руд, а также необ-
ходимостью комплексного и наиболее полного использования руд-
ного сырья.
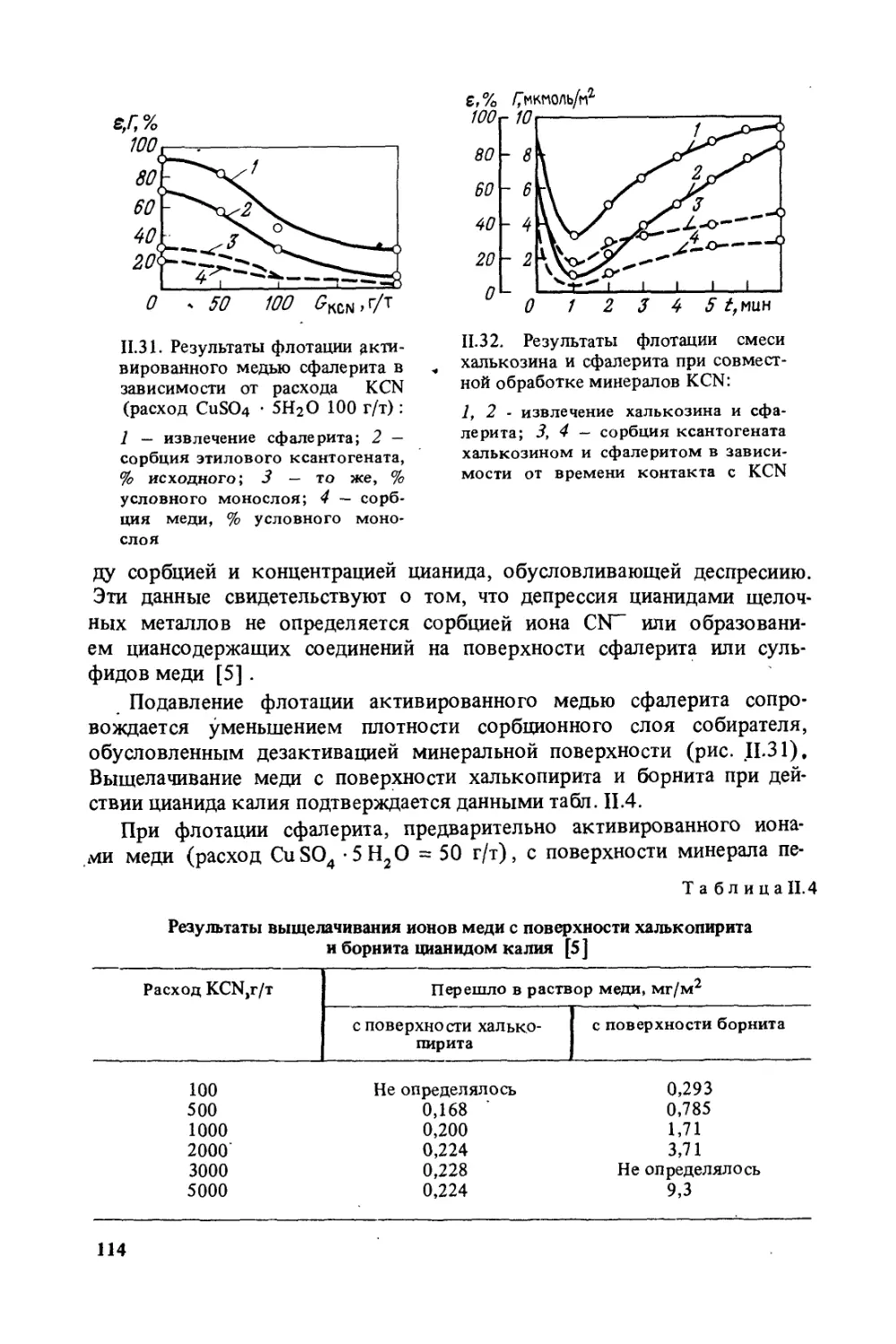
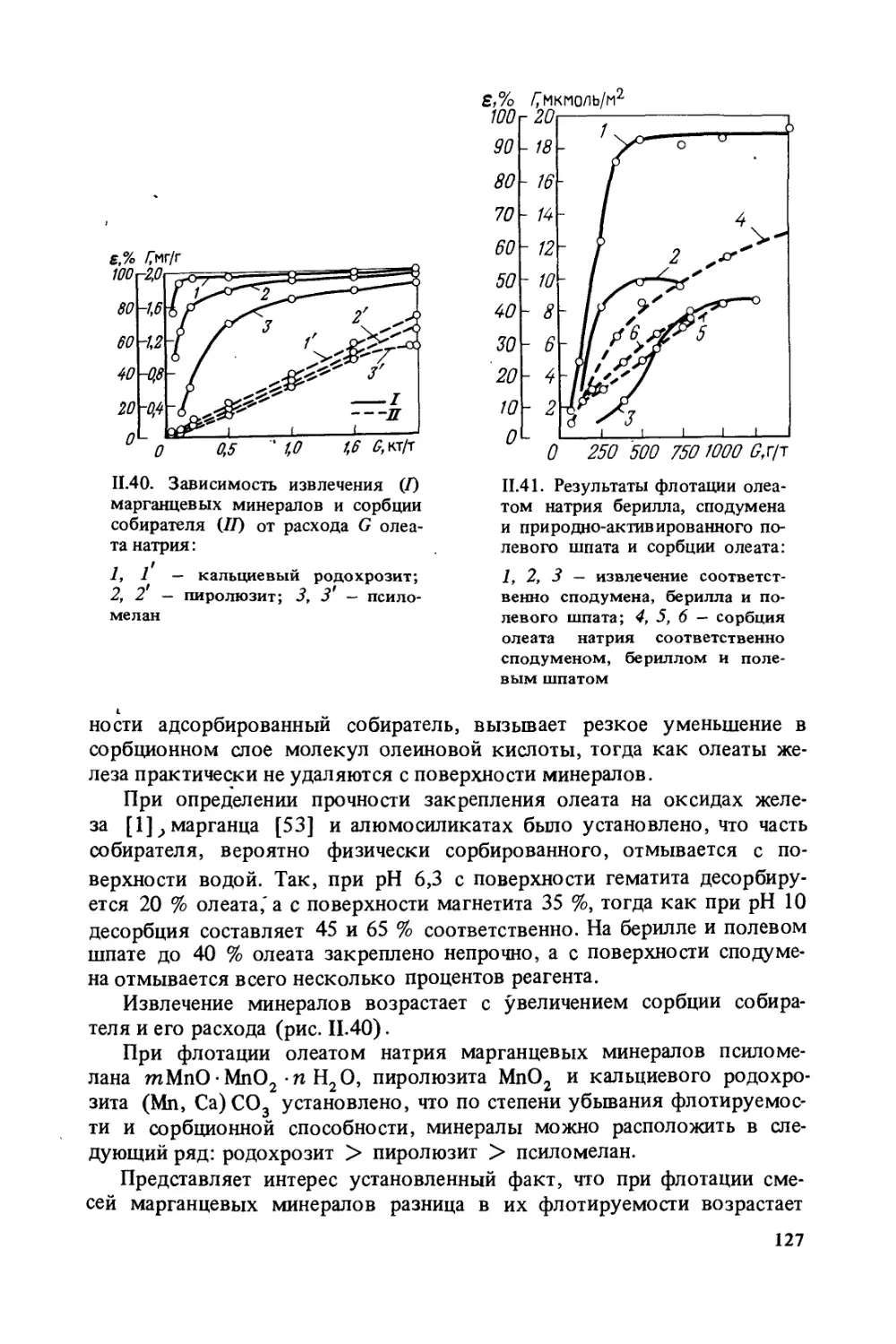
Практика флотации достигла значительных успехов, однако за-
кономерности флотации до настоящего времени далеко не раскры-
ты. Поэтому широкое развитие теоретических работ — основа даль-
нейшего прогресса флотации.
В предлагаемой книге обобщены данные работ, проведенных за
последние десятилетия в институте Механобр. Наряду со своими ра-
ботами авторы сделали попытку проанализировать работы других ис-
следователей, повторив то, что остается незыблемым и дополнив из-
вестные положения новыми данными.
В книге изложены исследования по изучению механизма взаимо-
действия основных флотационных реагентов с минералами. При этом
приведены данные, полученные в последние годы и не нашедшие дол-
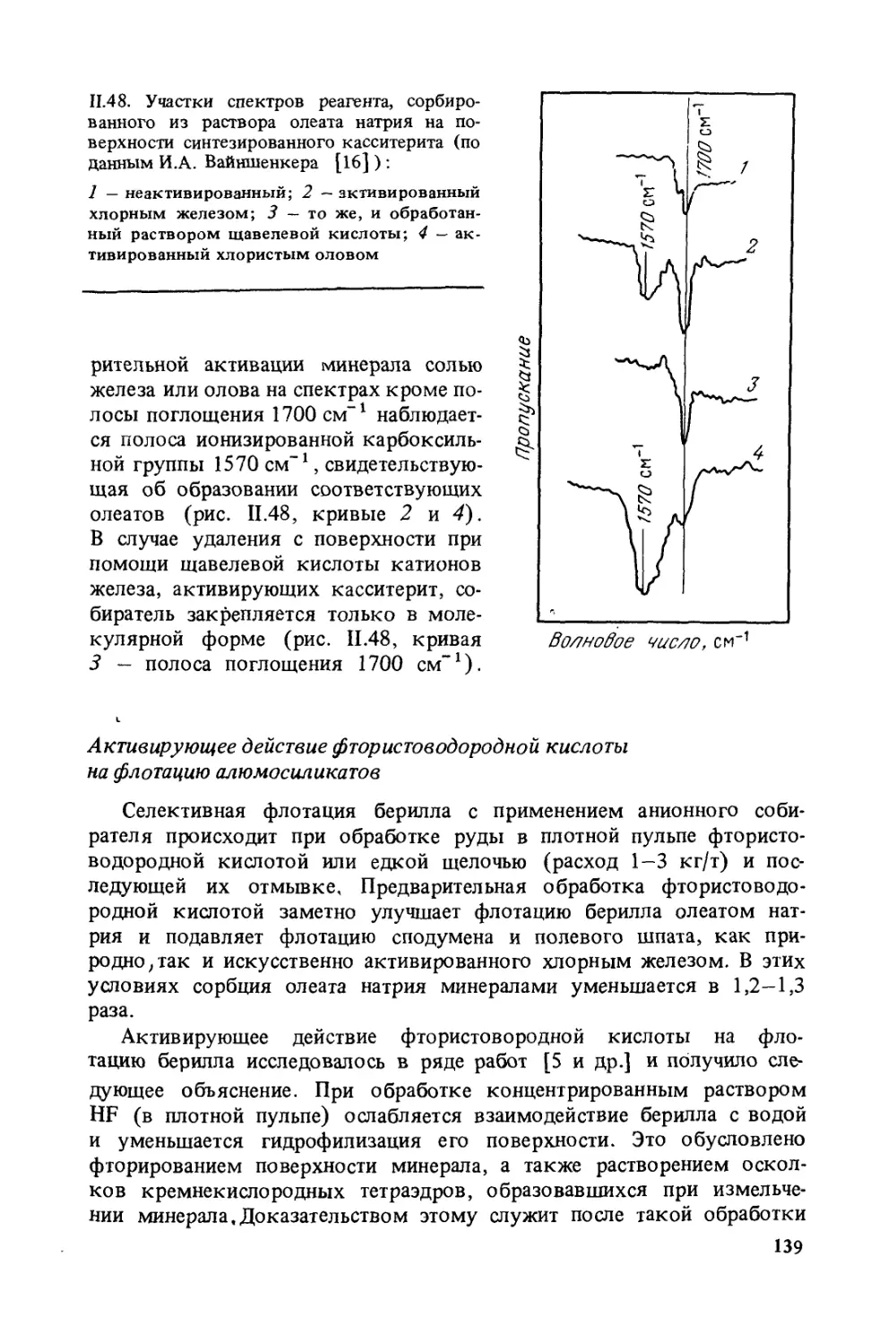
жного отражения в литературе, например действие гидроксамовых
кислот при флотации ряда несульфидных минералов. Расширены раз-
делы по взаимодействию сульфгидрильных (особенно неионоген-
ных) , карбоксильных и катионных собирателей с минералами, а
также по действию используемых при этом модификаторов флота-
ции. Кроме того, рассмотрены основные закономерности флотацион-
ного процесса в машинах периодического и непрерывного действия.
Во второе издание внесены некоторые дополнения, как связанные
с появлением новых сведений, так и по рекомендации наших коллег.
Перераспределен материал по отдельным главам во второй час-
ти. Особо следует отметить существенные изменения, внесенные в третью
часть книги. Наиболее важные из них — включение в книгу рассмот-
рения процесса минерализации пузырьков в условиях перемешива-
ния на базе положений теории изотропной турбулентности Колмого-
рова. Приведенный в конце книги список литературы представляет
лишь малую долю от числа использованных источников. Более пол-
ный список литературы приведен в первом издании книги.
Как известно, флотационный процесс весьма сложен и характери-
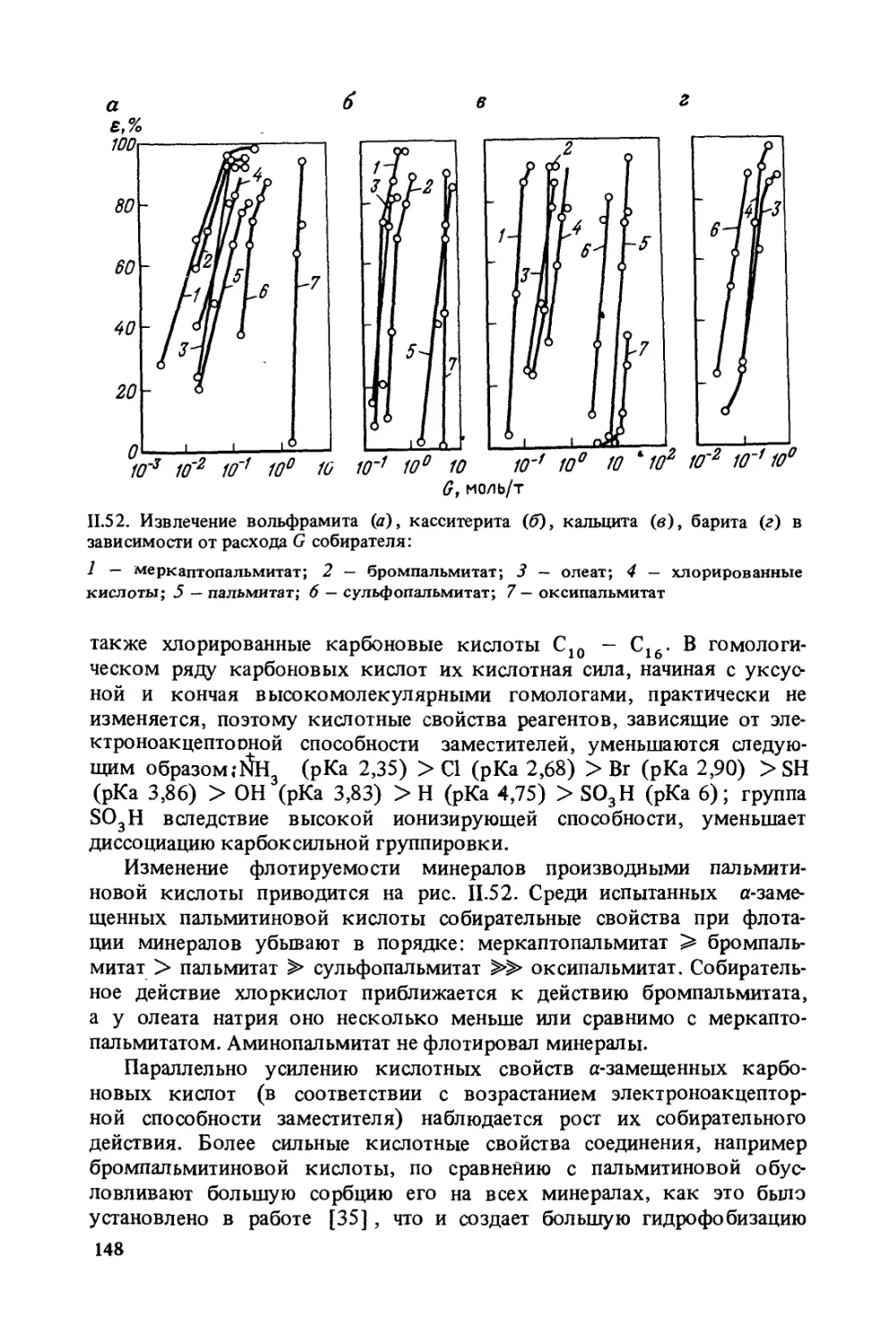
зуется многими переменными факторами. Поэтому по многим воп-
росам, связанным с изложением теоретических основ флотации, имеются
противоречивые взгляды. Некоторые закономерности флотации, обоб-
щенные в виде уравнений и формул, возможно, носят спорный харак-
тер, так как выведены при различных допущениях, исходя из идеа-
лизированной модели флотации. Тем не менее авторы считают, что
развиваемые с разных позиций представления об основах флотации
в конечном итоге позволят создать модель флотационного процесса,
приближающуюся к реальной.
Авторы надеются, что предлагаемая книга окажется полезной для
широкого круга обогатителей.
Разделы, посвященные общим основам флотации (часть I), напи-
саны О.С. Богдановым, механизм действия флотационных реагентов
(часть II) — А.К. Поднек и Н.А. Янис с участием О.С. Богданова, раз-
делы, относящиеся к физическим основам, технологии флотации и
описанию флотационных машин (части III и IV), — И.И. Максимовым
с участием О.С. Богданова.
ЧАСТЬ I
ОБЩИЕ СВЕДЕНИЯ И ОСНОВЫ ПРОЦЕССА ФЛОТАЦИИ
1. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ
Флотационное обогащение — один из обогатительных процессов раз-
деления минералов или отделения одной группы минералов от дру-
гой для дальнейшего экономически целесообразного их применения
в народном хозяйстве. Такое разделение основано на использовании
различия природных или искусственно созданных свойств минералов.
Способы флотации. Флотация как процесс обогащения позволяет
отделить частицы одних минералов от других за счет селективного
прилипания их к поверхности раздела двух фаз — жидкой и газооб-
разной.
В промышленности широко применяется пенная флотация — про-
цесс, основанный на прикреплении менее гидрофильных частиц к пу-
зырькам воздуха, пропускаемого снизу через смесь минеральных час-
тиц с водой (пульпу), и выносе этих частиц на поверхность пульпы,
где образуется пена. Более гидрофильные частицы при этом остают-
ся взвешенными в пульпе.
Разновидность пенной флотации — пенная сепарация, при которой
пульпа подается на поверхность пены. Струя пульпы частично проби-
вает в месте подачи слой пены, однако воздух, проходящий снизу вверх,
селективно удерживает и уносит в пену менее гидрофильные части-
цы, а более гидрофильные, не удерживаясь в пенном и подпенном слоях,
падают вниз.
Находит применение и пленочная флотация, при которой менее
гидрофильные частицы, попадая на поверхность потока пульпы, ос-
таются на ней, образуя пленку, а более гидрофильные тонут.
В настоящее время редко используются процессы масляной флотации
и флотации твердой стенкой. В первом случае менее гидрофильные части-
цы прилипают к каплям масла и всплывают вверх, а более гидрофиль-
ные остаются взвешенными в пульпе, во втором — менее гидрофиль-
ные частицы прилипают к гидрофобной твердой движущейся поверх-
ности, которая выносит их из пульпы.
Флотационный процесс используется также для извлечения тон-
кодисперсных гидрофобных осадков, находящихся в растворе или
образующихся при взаимодействии ионов раствора с добавляемыми
реагентами (ионная флотация).
В настоящей книге рассматривается пенная флотация, имеющая
решающее значение для обогащения руд цветных и черных металлов,
многих видов неметаллического сырья и других полезных ископае-
мых.
Пенная флотация осуществляется во флотационных машинах, в
которых пульпа перемешивается с необходимыми реагентами, при-
чем через пульпу пропускаются воздушные пузырьки. С помощью
пузырьков и происходит разделение минеральных частиц.
Флотационные машины бывают различных типов в зависимости
от способов перемешивания пульпы, засасывания и диспергирования
воздуха.
Назначение флотационных реагентов. Большинство минералов в ес-
тественном виде хорошо смачивается водой и не обладает способностью
к флотации. Вследствие этого главными реагентами, обеспечивающи-
ми флотацию минералов, являются реагенты, гидрофобизирующие по-
верхность минерала. Основное назначение этих реагентов — сорбиро-
ваться на поверхности минеральных частиц и снижать их смачиваемость.
Эти реагенты называются собирателями. Однако, как правило, действие
собирателей недостаточно селективно. Поэтому применяют реагенты,
которые регулируют действие собирателей, усиливая его или ослаб-
ляя. Реагенты, усиливающие действие собирателей, называются акти-
ваторами, а ослабляющие это действие — подавителями (депрессора-
ми) .
В ряде случаев собиратель способен гидрофобизировать поверх-
ность минерала лишь после предварительного воздействия активато-
ра. Действие депрессоров противоположно действию собирателя и зак-
лючается в предотвращении гидрофобизации или даже в повышении
смачиваемости минералов.
Многие специалисты объединяют активаторы и депрессоры в груп-
пу флотореагентов под общим названием — модификаторы флотации.
Для того, чтобы замедлить разрушение комплексов минеральная
частица — пузырек воздуха, когда они достигают поверхности пуль-
пы, применяют стабилизаторы пузырьков воздуха — пенообразова-
тели, сорбируемые в основном на границе газ — жидкость. Роль пено-
образователя заключается также в создании условий для тонкой дис-
пергации вводимого воздуха и предохранения пузырьков от коалес-
ценции в объеме пульпы. По мнению ряда исследователей, пенообра-
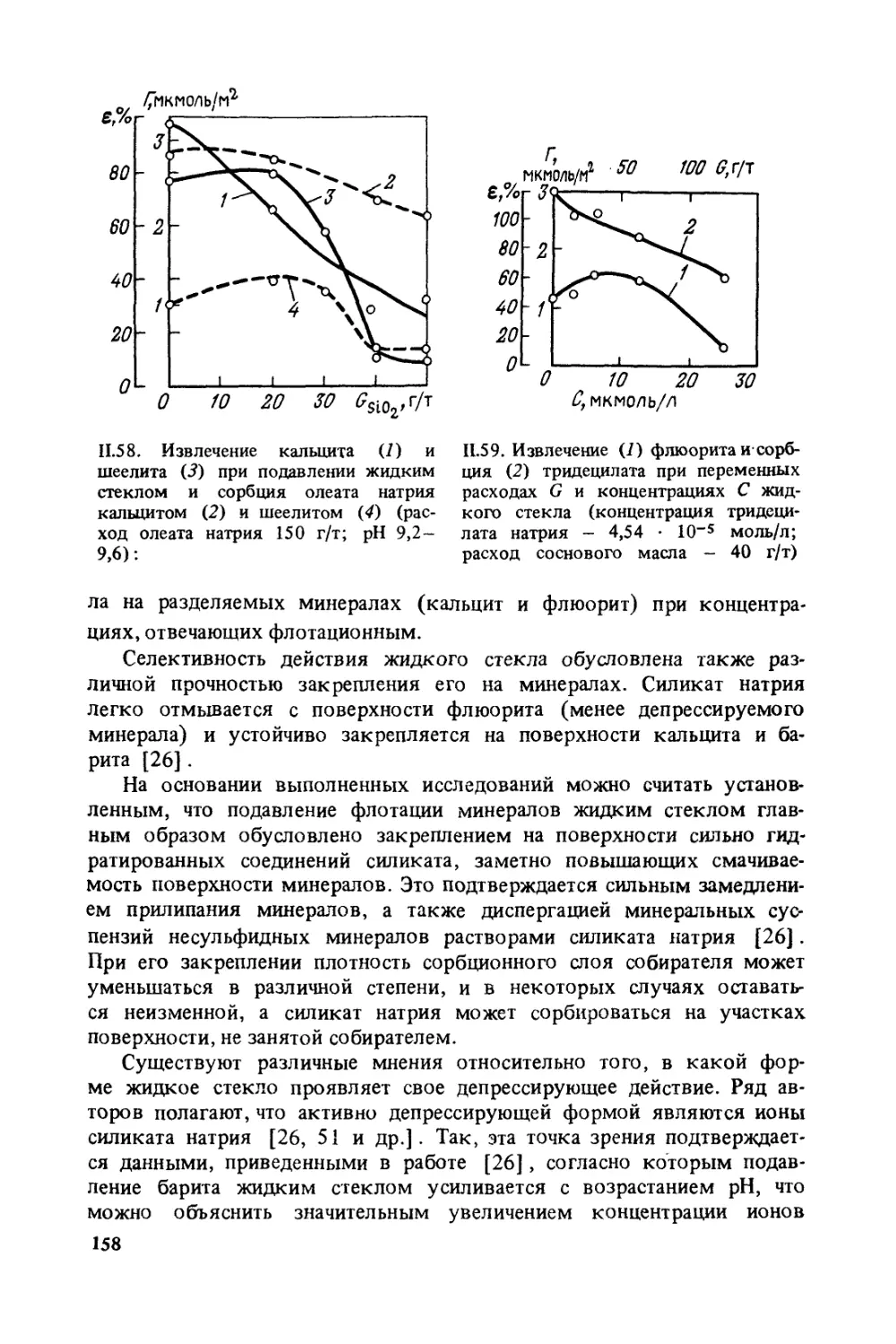
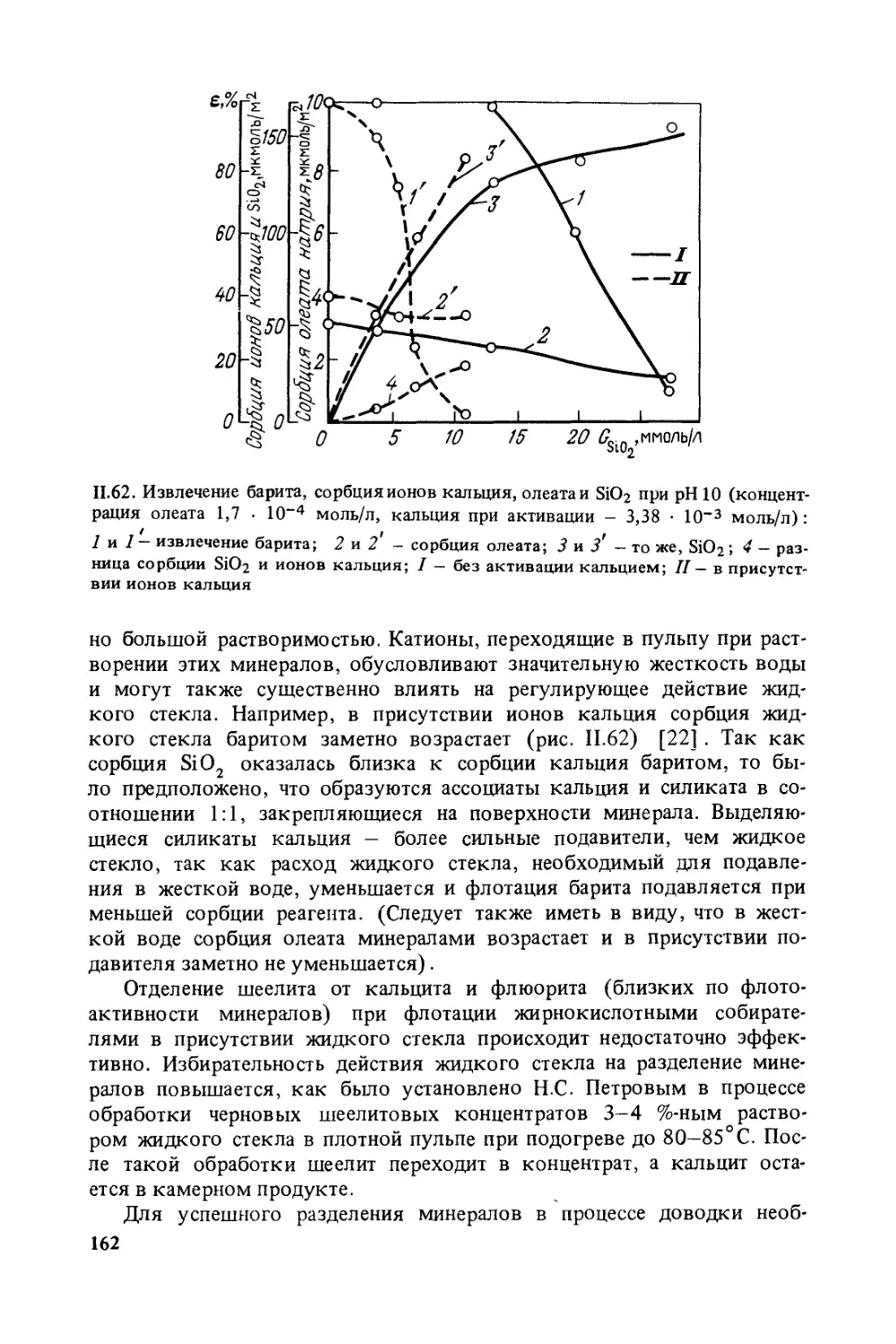
зователи увеличивают прочность контакта комплекса частица — пу-
зырек. Кроме того, важная особенность пенообразователей — сущест-
венное снижение скорости подъема пузырьков в жидкости, установ-
ленная в Механобре.
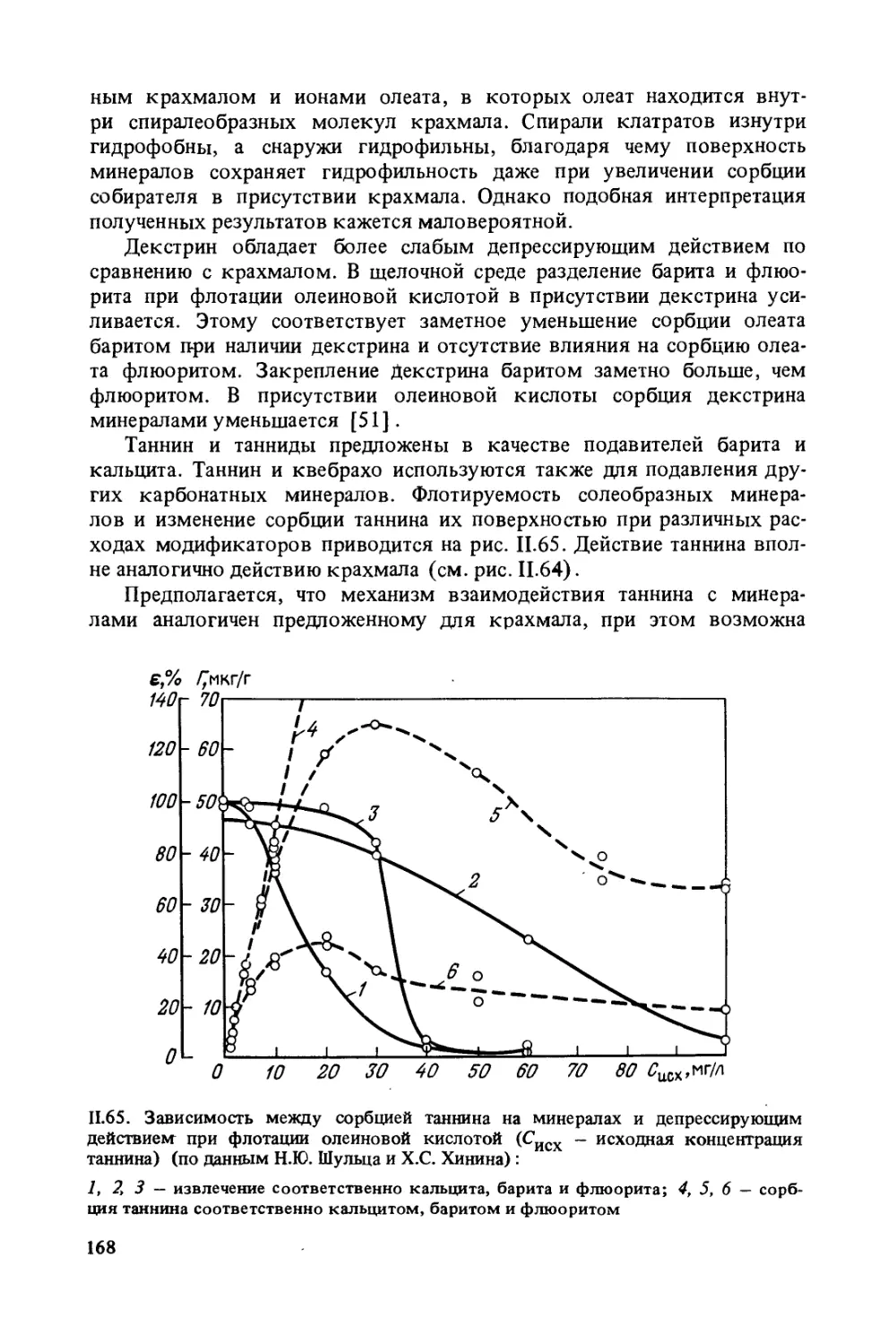
Значительная часть реагентов-собирателей совмещает свойства
собирателей и пенообразователей. Это в некоторых случаях не исклю-
чает подачу в процесс отдельного пенообразователя.
Выделяют группу реагентов-регуляторов pH среды; как правило,
регуляторы среды могут быть также активаторами или депрессора-
ми флотации.
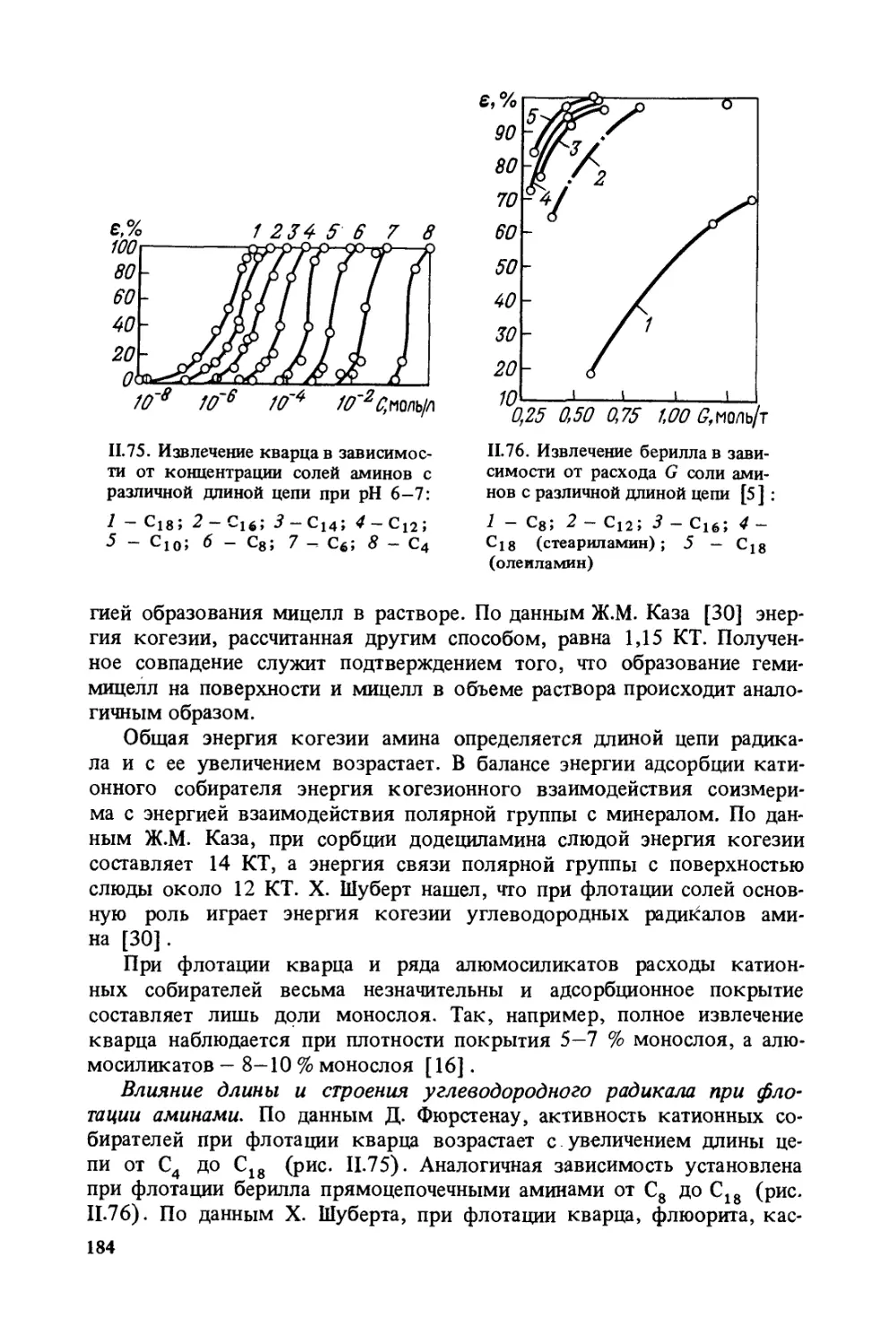
При флотации применяют реагенты, которые способствуют сли-
панию или диспергации частиц. Слипание частиц в зависимости от при-
меняемых реагентов называют флокуляцией, или коагуляцией, а ре-
агенты, вызывающие слипание, — флокулянтами или коагулянтами.
Реагенты, препятствующие слипанию частиц, называют диспергатора-
ми. Собиратели обладают флокулирующим действием. Активато-
ры и депрессоры могут обладать флокулирующим или коагулирую-
щим действием, а также могут быть и диспергаторами частиц.
Естественная флотируемость минералов и их гидратация. При разру-
шении твердого тела происходит разрыв связей между молекулами,
атомами или ионами и на его поверхности появляются ненасыщенные
связи.
Энергия взаимодействия между твердой поверхностью и окружаю-
щими молекулами жидкости определяется характером связей, обна-
жающихся при раскалывании твердого тела, что, в свою очередь, за-
висит от его структуры. Поэтому различия в гидрофильности твер-
дых тел обусловливаются характером этих связей или особенностя-
ми структуры твердого тела, как было показано Г.С. Стрельциным.
Обнажение на поверхности минерала сильных (ионных и некомпен-
сированных ковалентных) связей приводит к полной смачиваемости
поверхности водой, и, наоборот, тела, при раскалывании которых об-
нажаются преимущественно слабые (молекулярные) или сильные, но
взаимно компенсированные связи, смачиваются не полностью и харак-
теризуются естественной флотируемостью.
Характер обнажающихся при раскалывании связей в основном
обусловливает смачиваемость минералов (табл. 1.1.).
Таблица 1.1
Характер ненасыщенных связей поверхности
и естественная флотируемость минералов
Связи, обнажаю- щиеся при раска- лывании Особенности структуры кристаллов Примеры Естественная флотиру- емость
Сильные (ионные, металлические и некомпенсирован- ные ковалентные) Кристаллические решетки могут Барит, каль- Не обладают иметь различную структуру; цит, кварц, элементы кристаллической ре- полевые шетки связаны друг с другом шпаты, слюда ковалентными, ионными или ме- таллическими связями
Взаимно компен- сированные кова- лентные Координационные кристалличес- Галенит, сфа- Слабая кие решетки (типа PbS, ZnS), по- лерит, пирит строены из атомов, связанных ионно-ковалентными связями. На плоскостях раскола (спайнос- ти) соседние атомы взаимно ’’га- сят” свои оборванные связи
7
Продолжение табл. 1.1
Связи, обнажаю- щиеся при раска- лывании Особенности структуры кристаллов Примеры Естественная флотируе- мость
Молекулярные и Кристаллическая решетка пос- Графит, тальк, Обладают
незначительная троена из слоев атомов или ио- молибденит,
доля сильных нов. Атомы, составляющие слои, связаны между собой сильными связями. Слои решетки связаны молекулярными связями, кото- рые в основном обнажаются при раскалывании кристалла. При разламывании слоев решетки возможно частичное обнажение сильных связей, однако их доля незначительна борная кис- лота
Молекулярные В узлах кристаллической решет- ки находятся молекулы, связан- ные между собой слабыми моле- кулярными связями Сера, йод, предельные углеводороды
Естественная флотируемость свойственна многим органическим
соединениям (например, углеводороды) и лишь очень немногим не-
органическим соединениям (сера, йод, графит, молибденит, тальк и
борная кислота).
Различный характер связей, обнажающихся при раскалывании ми-
нералов, обусловливает резкие различия в их гидрофильности и фло-
тационных свойствах. Тальк и слюда имеют сходные кристалличес-
кие структуры. Эти минералы являются слоистыми силикатами, крис-
таллы которых состоят из слоев кремнекислородных тетраэдров; но
тальк обладает естественной флотируемостью, так как слои тетраэд-
ров у этого минерала соединены слабыми молекулярными связями,
а слюда гидрофильна, так как у нее связь между слоями кремнекис-
лородных тетраэдров осуществляется за счет ковалентных и ионных
сил.
Энергия межмолекулярного взаимодействия у различных соеди-
нений неодинакова. Это определяет разную гидрофильность поверх-
ности. При раскалывании кристаллов серы и парафина на поверхнос-
ти обнажаются лишь молекулярные связи, но эти вещества флотиру-
ются различно.
В некоторых случаях, несмотря на то, что при раскалывании об-
нажаются сильные связи, минералы могут обладать естественной фло-
тируемостью. Предполагают, например, что галенит и некоторые дру-
гие сульфиды слабо гидрофильны. Это можно объяснить тем, что в
поверхностном слое минералов происходит ’’замыкание” соседних
оборванных связей металл — сера.
Гидратация твердой поверхности возможна тогда, когда взаим-
8
ное притяжение молекул одной и той же фазы (например, воды) мень-
ше притяжения этих молекул к молекулам другой фазы (в рассмат-
риваемом случае твердого тела). Взаимное притяжение между моле-
кулами одной и той же фазы — это когезия; притяжение молекул од-
ной фазы к молекулам другой фазы — адгезия. Работа когезии и ад-
гезии выражается в джоулях на единицу поверхности.
Гидратация, таким образом, возможна тогда, когда И^/И^ > 1,
где Wa — энергия адгезии твердого тела и воды; WK — энергия когезии
воды. Очевидно, чем больше И^/И^, тем лучше минерал смачивается
водой. Нам неизвестны природные минералы (кроме озокерита), для
которых W /WK < 1. Когда = 1, энергия адгезии равна энергии
когезии.
Молекулы воды могут адсорбироваться на твердой поверхности
в результате притяжения полярных молекул воды электрически за-
ряженными ионами поверхностного слоя минерала и молекулярно-
го взаимодействия между молекулами воды и молекулами .поверх-
ностного слоя минерала, а также образования химических соедине-
ний по типу водородной и координационной связей.
Следует отметить, что чем менее прочны и менее скомпенсиро-
ваны оборванные связи на плоскостях раскола минерала, тем силь-
нее молекула воды притягивается к твердой поверхности, тем более
гидратирована и гидрофильна минеральная поверхность. На хорошо
смачиваемой поверхности молекула воды образует многослойные
покрытия. По аналогии с гидратацией свободных ионов первый слой
молекул воды, прочно удерживаемый твердой поверхностью, мож-
но назвать первичной гидратацией, последующие слои — вторичной.
Прочность притяжения молекул воды зависит от свойств вступаю-
щей во взаимодействие твердой поверхности и механизма сорбции
этих молекул.
Мерой гидрофильности, или смачиваемости, твердой поверхнос-
ти считается значение краевого угла 0 (измеряемого через жидкую
фазу) на границе трех соприкасающихся фаз (твердого тела, жидкос-
ти и газа) в равновесных условиях. Теоретически, когда равновесный
краевой угол в =90°, = 1, т.е., как указано выше, энергия адгезии
минерала и воды равна энергии когезии; при в = 180° < Ff и жид-
кость совершенно не смачивает твердую поверхность. Однако практичес-
ки неизвестны минералы с краевым углом смачивания более 105°. Такой
краевой угол образуется на границе трех фаз — парафина, воды и воз-
духа.
При 0=0 смачиваемость поверхности различных минералов и их
поверхностные свойства могут быть разными.
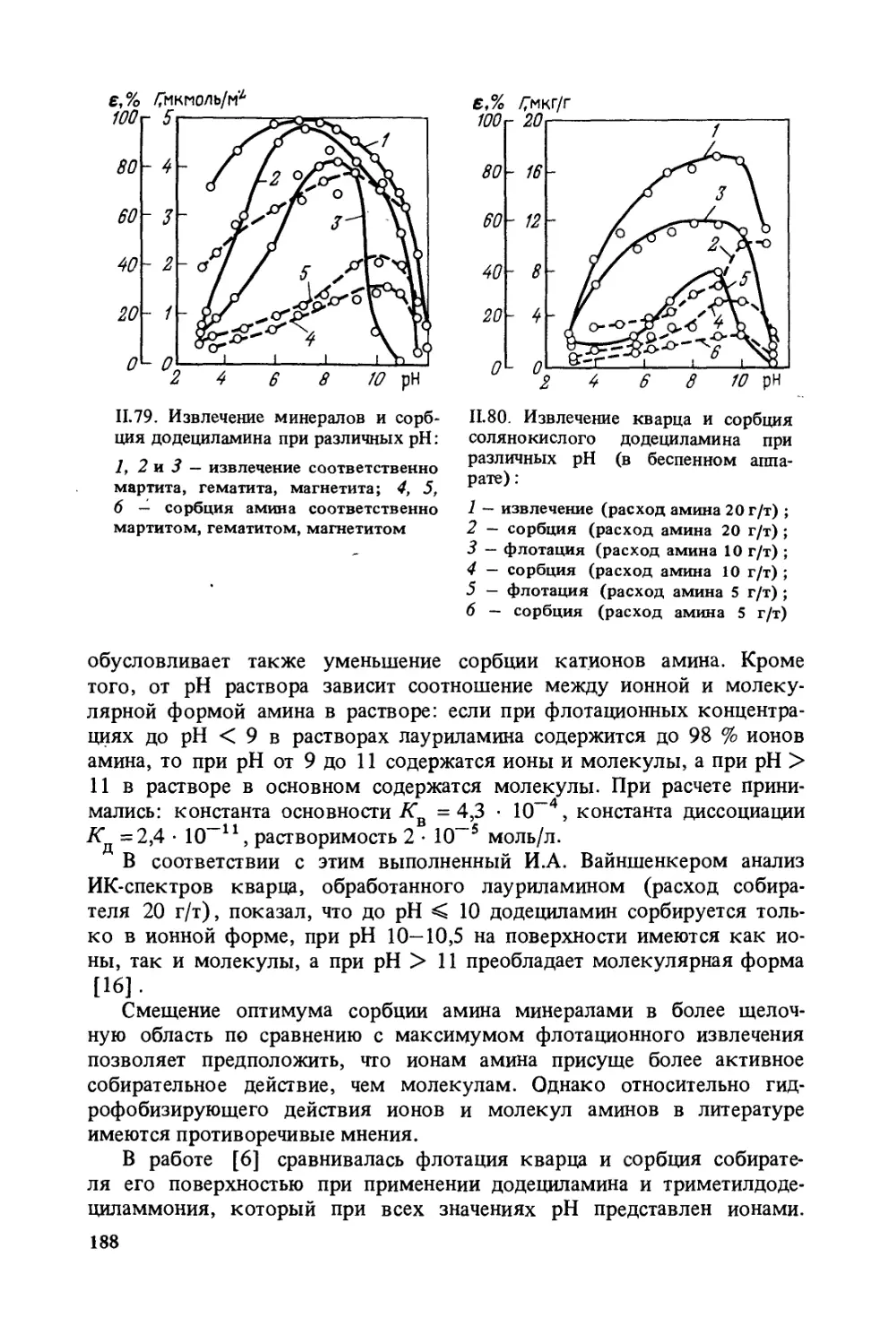
Изотермы адсорбции Г паров воды на минералах (рис. 1.1) пока-
зывают, что в определенной области относительных давлений может
наблюдаться незначительное увеличение абсолютной адсорбции паров
воды. Из исследованных минералов особенно велика эта область на
9
1.1. Изотермы адсорбции паров
воды на минералах:
1 — магнетит; 2 — гематит; 3 —
кварц
1.2. Зависимость извлечения минералов
при флотации от плотности сорбцион-
ного слоя т лауриламина при pH 5,9:
1 — магнетит; 2 — гематит; 3 — кварц
кварце, на котором в диапазоне относительных давлений от 0,2 до 0,8
количество адсорбированной воды остается почти постоянным; ме-
нее заметна эта область на гематите и почти отсутствует на магнети-
те (для измерений использовались минералы крупностью —100+10 мкм).
На кварце, очевидно, в диапазоне указанных давлений образуют-
ся стабильные пленки сорбированной воды, препятствующие даль-
нейшей сорбции воды и, таким образом, обусловливающие меньшую
гидрофильность поверхности кварца по сравнению с магнетитом.
Гематит занимает промежуточное положение. Эти результаты кор-
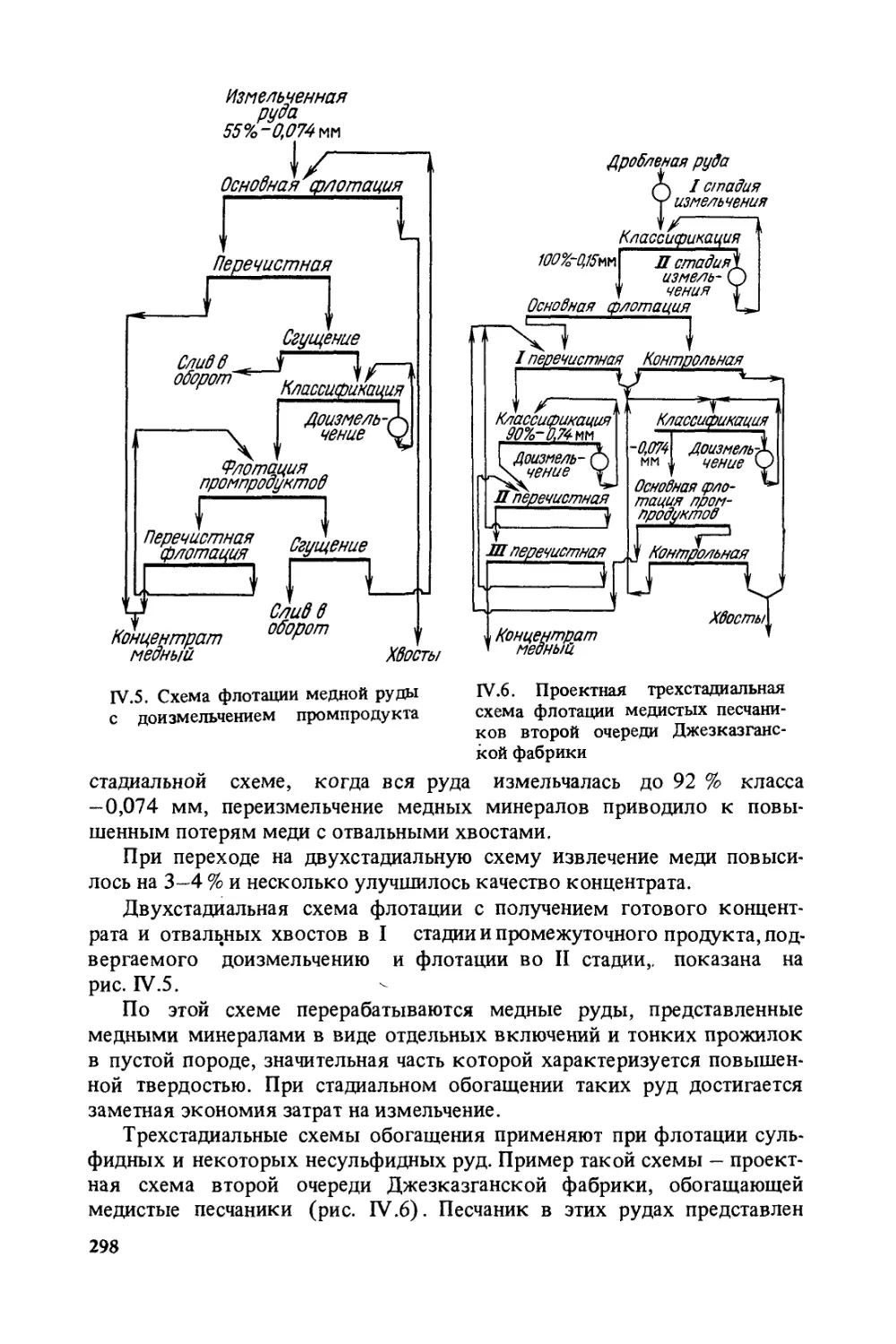
релируют с результатами флотации, приведенными на рис. 1.2, и объяс-
няют, почему для успешной флотации разных минералов требуется
различная плотность сорбированного слоя собирателя1, несмотря на
то, что краевой угол на поверхности этих минералов равен нулю.
Опытами по флотации тех же минералов олеатом натрия показа-
но, что кварц, активированный ионами железа, успешно флотирует-
ся при плотности покрытия 10 %, гематит — 15—20 %, а магнетит —
40 % условного монослоя. Различную гидрофильность поверхностей
железных минералов можно объяснить, изучая поверхности раскола
минералов.
1 При этом, разумеется, не исключается влияние других факторов (неравно-
мерность распределения собирателя, стерические факторы и др.), которые могут
иметь также большое значение.
10
Согласно минералогическим расчетам, плотность распределения
атомов железа по наиболее вероятным плоскостям раскола магнети-
та в 1,5 раза больше, чем гематита. Это обстоятельство, возможно,
обусловливает большую концентрацию поверхностных групп ОН, про-
порционально которой сорбируются молекулы воды. Так, например,
известно, что смачиваемость водой силикагелей возрастает с увеличе-
нием числа поверхностных групп ОН на единицу поверхности.
Г.С. Стрельциным при изучении взаимодействия твердых тел с
водой установлено, что гидрофобные свойства минералов определя-
ются типом и энергией связей, обнажающихся при измельчении час-
тиц. Разрыв на поверхности кристаллов ионных и ковалентных свя-
зей обусловливает гидрофильность, а обнажение дисперсионных свя-
зей — гидрофобность поверхности кристаллов.
Следует отметить, что поверхность большинства несульфидных
минералов в воде гидратирована, а на поверхности сульфидных ми-
нералов в результате окисления увеличивается доля ионных связей,
что приводит к большей гидратации поверхности.
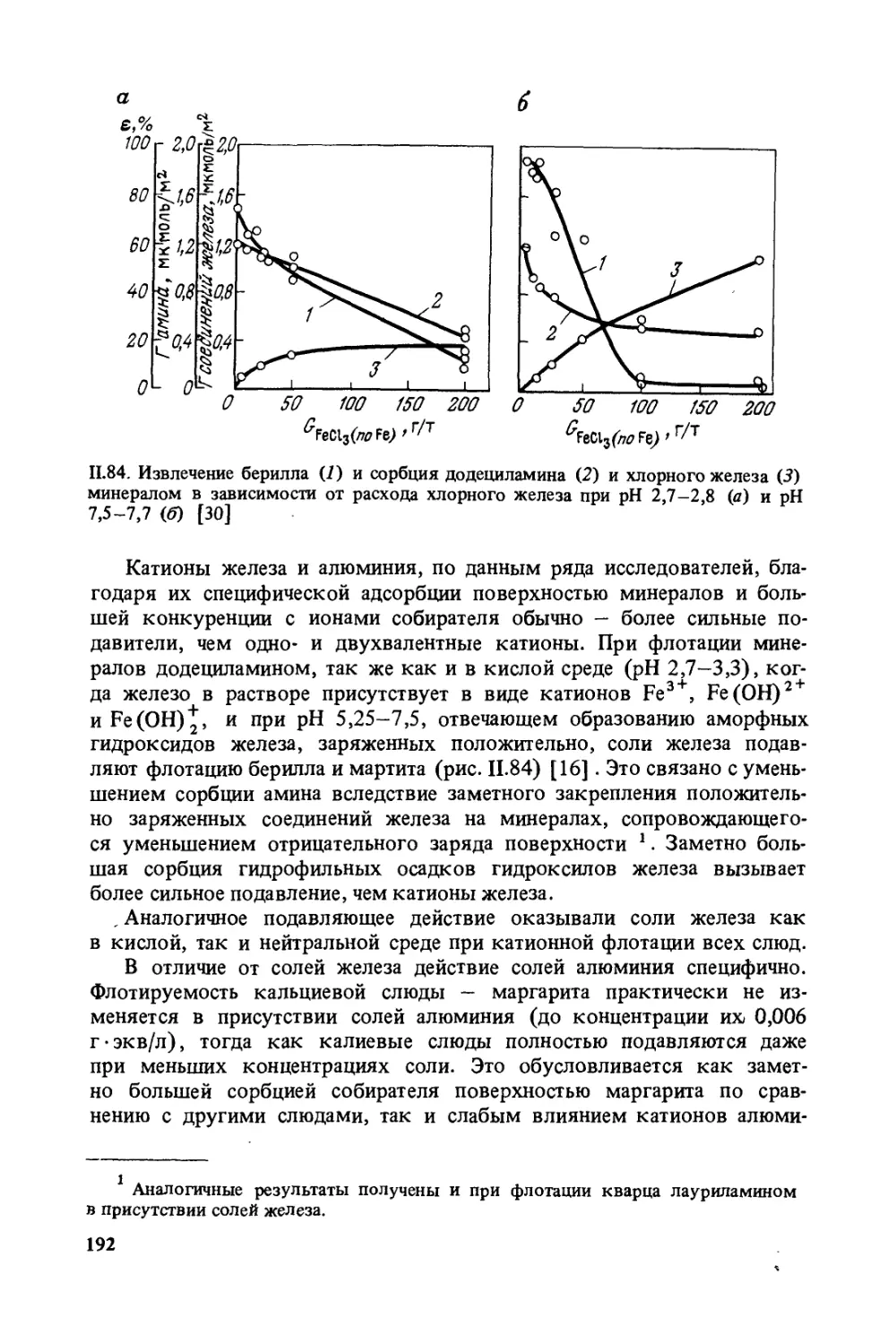
Образование' поверхностного заряда. Обнажающиеся при разру-
шении кристаллов минералов ненасыщенные связи у поверхностных
атомов металлов насыщаются в воде с образованием гидроксидов.
Например, при измельчении в воде кварца по плоскостям спайности
образуются силанольные группы Si—ОН в результате химического
взаимодействия с водой по реакциям:
[Si (-St), О]-+ [Si (-5- )3] + + Н2О-> 2Si (-2-), ОН
\ О z \ ОН\ он
Si Si + Н2 О -* Si^ Si
X \ОХ \ / \ох \
Возможно также образование двух силанольных групп у одного
атома :
. У ОН
SiC
/ \ ОН
Эти гидроксильные группы связаны с атомами кремния прочны-
ми валентными связями.
В случае измельчения алюмосиликатов в воде при атомах крем-
ния образуются поверхностные гидроксильные группы кислотного
характера, а при атомах металлов — основного или амфотерного ха-
рактера. На поверхности оксидов ионы металлов также гидролизу-
ются с образованием гидроксокомплексов.
В зависимости от pH среды поверхностные гидроксильные груп-
пы диссоциируют и поверхность минералов приобретает заряд. В кис-
лой среде поверхностные гидроксильные группы отщепляются, что
И
1.3. Схема двойного электрического
слоя:
1 — внутренняя обкладка двойного
электрического слоя; 2 — плотная
часть внешней обкладки двойного
электрического слоя; 3 — диффуз-
ная часть внешней обкладки
Минерал Раствор
приводит к увеличению заряда поверхности, а в щелочной области они
диссоциируют, что вызывает уменьшение заряда поверхности. Схема-
тично это можно изобразить следующим образом;
+ н+ он~ _
-Ме (Н2°)пов *- “Ме (°Н)пОВ Ме0ПОВ + Н2°
Образование заряда на поверхности минералов имеет значение в
ряде случаев при взаимодействии флотационных реагентов с минера-
лами. В более простых системах, к числу которых относятся соли,
поверхность приобретает заряд вследствие преимущественного раст-
ворения анионов или катионов решетки. Точно так же поверхность
может приобрести заряд в результате неодинаковой адсорбции из раст-
вора катионов или анионов. И на границе раздела твердое тело — раст-
вор образуется двойной электрический слой.
Заряженная поверхность минерала образует внутреннюю обклад-
ку двойного электрического слоя (рис. 1.3,7). Эквивалентное число
ионов противоположного знака (противоионов) концентрируется
у поверхности минерала под действием электростатических сил, об-
разуя внешнюю обкладку двойного электрического слоя. Часть про-
тивоионов (слой Штерна), непосредственно примыкающих к границе
раздела минерал — раствор, находятся в упорядоченном состоянии
(см. рис. 1.3,2), а часть ионов благодаря диффузии распределяются
на большем расстоянии от поверхности минерала, образуя диффузи-
онный слой (см. рис. 1.3,5).
Сумма зарядов плотной (2) и диффузионной (3) частей внешней
обкладки двойного слоя равна заряду внутренней обкладки двойно-
го слоя. При движении твердого тела в жидкости плотный упорядо-
ченный слой Штерна движется вместе с минералом, при этом ионы в
диффузионном слое начинают отставать от поверхности раздела, элек-
тронейтральность нарушается и таким образом измеряется разность
потенциалов, называемая электрокинетическим потенциалом или дзе-
та (О -потенциалом.
12
Полный скачок потенциала между поверхностью минерала и объе-
мом раствора называют электрохимическим потенциалом Нернста,
или электродным потенциалом </?. Ионы, определяющие заряд повер-
хности, являются потенциалопределяющими. Такими ионами, поми-
мо ионов, входящих в состав кристаллической решетки и изоморф-
ных им, являются для силикатных минералов, оксидов и некоторых
солеобразных минералов также ионы Н и ОН~~.
Заряд минералов зависит также от ионов, образующихся при гид-
ролизе ионов, входящих в состав минерала. Например, для кальци-
та потенциалопределяющие ионы: Са2+, СаНСО3, СаОН+, Н+, ОН ,
НСО 3 и СО2- [55]. Эти ионы могут образоваться при растворении
кальцита в воде и адсорбироваться минералом, пропорционально их
концентрации в растворе. Концентрация этих ионов определяется pH
раствора. В случае кальцита при высоких pH в растворе имеется из-
быток отрицательно заряженных ионов НСО3 и СО23 и поверхность
кальцита заряжена отрицательно. При низких pH имеется избыток
положительно заряженных ионов Са2+, СаНСО3 и СаОН+ и поверхность
кальцита заряжена положительно.
Образование заряда на минералах, содержащих более двух ионов
в кристаллической решетке, например на апатите Са5(РО4)3С1, про-
исходит более сложным путем. Так, на изоэлектрическую точку апа-
тита влияют как потенциалопределяющие ионы Са , НРО 4 , Н+ и ОН-,
так и ионы, способные их изоморфно замещать, такие как Si2+, Ва2+,
F и др.
Поверхностный заряд минералов, растворимых в воде, нельзя не-
посредственно измерить с большой точностью. Обычно для характе-
ристики электрических свойств поверхности минерала в растворе из-
меряют электро кинетический потенциал (дзета-потенциал).
Условия равенства дзета-потенциала нулю называют изоэлектри-
ческой точкой поверхности минерала. Изоэлектрическая точка (ИЭТ),
найденная путем измерения дзета-потенциала, может иногда отличать-
ся от точки нулевого заряда, особенно при специфической адсорбции
ионов, например Са2+ кальцитом, или если в процессе определения
дзета-потенциала не установилось термодинамическое равновесие в
системе.
Вышеизложенное позволяет сделать вывод о том, что механизм
образования поверхностного заряда определяется растворимостью
минералов, составом ионов решетки, гидролизом этих ионов как в
объеме пульпы, так и на поверхности, а также зависит от наличия крис-
таллических модификаций и изоморфных замещений в минералах.
2. СМАЧИВАЕМОСТЬ И РАБОТА ПРИЛИПАНИЯ ПУЗЫРЬКА
К ТВЕРДОЙ ПОВЕРХНОСТИ
Краевой угол смачивания в равновесных условиях определяется со-
отношением значений свободной поверхностной энергии (или поверх-
ностного натяжения) трех соприкасающихся фаз:
а = а + о cos 6 , (1.1)
г—т ж-т г-ж ’ v 7
где а — поверхностное натяжение на границе газ — твердое тело;
аж-т ~ поверхностное натяжение на границе жидкость — твердое те-
ло; 0Г_Ж — поверхностное натяжение на границе газ — жидкость; 6 —
краевой угол смачивания.
Из этого уравнения выводится формула Юнга — Неймана:
cos» = (аг_т - ож_т)/ог_ж . (1.2)
Это соотношение должно отвечать второму закону термодинами-
ки, согласно которому свободная поверхностная энергия стремится
к минимуму. Поэтому уравнение (1.2) может быть выведено и тер-
модинамическим путем.
Действие собирателя сводится к понижению разности а — ожт
(т.е. к повышению краевого угла смачивания) и, очевидно, к увели-
чению скорости прилипания. Депрессор действует в противополож-
ном направлении.
Следует отметить, что при флотации существенную роль играет
гистерезис (задержка) смачивания, выражающийся в том, что не сра-
зу образуется равновесный краевой угол. Так, например, при вытес-
нении с поверхности минерала воды воздухом обычно образуется зна-
чительно меньший краевой угол, чем при вытеснении воздуха водой.
По мнению ряда исследователей, гистерезис может зависеть от не-
ровностей твердой поверхности, различной смачиваемости отдельных
ее участков, т.е. от неоднородности физических и химических свойств
твердой поверхности. В уравнениях (1.1) и (1.2) приведен равновес-
ный краевой угол смачивания. Равновесный краевой угол практичес-
ки очень трудно измерить, так как небольшие шероховатости, неод-
нородность поверхности могут значительно влиять на его значение,
и тогда краевой угол будет гистерезисным, а не равновесным.
По поводу влияния гистерезиса на флотацию высказывались про-
тивоположные мнения. Рассмотрим влияние гистерезиса смачивания
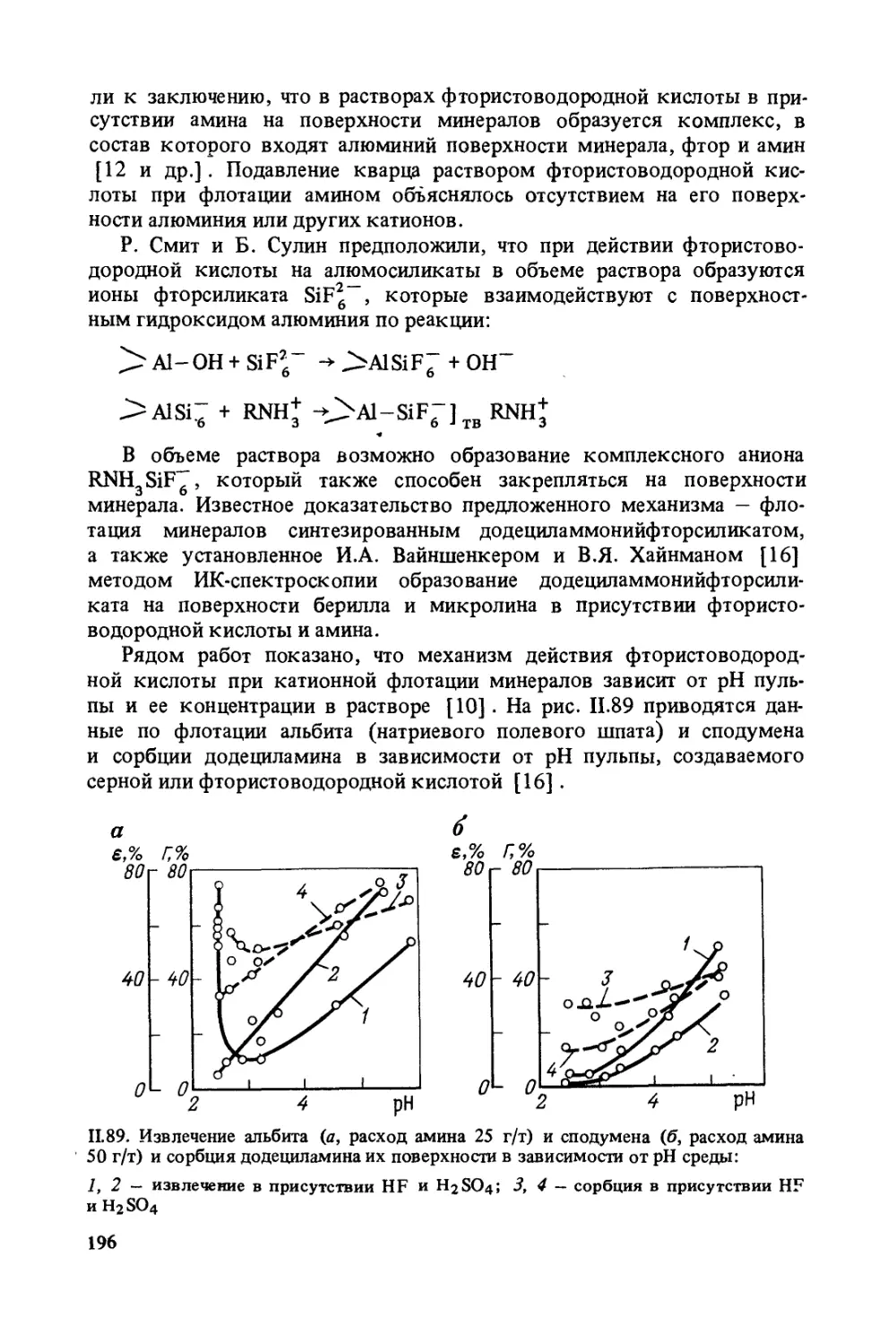
на прилипание частицы к пузырьку и на отрыв частицы от пузырька.
При прилипании пузырька к твердой поверхности воздух частично
вытесняет воду с этой поверхности, а при отрыве пузырька от твер-
дой поверхности вода, наоборот, вытесняет воздух. Оба эти случая
отмечаются как при прилипании пузырька воздуха к наклонной сла-
бо гидрофильной поверхности (рис. 1.4, а), так и при скатывании кап-
ли жидкости с этой поверхности (рис. 1.4, б).
6
1.4. Краевой угол воздушного пузырька (д) и капли (б) на наклонной поверхности
В обоих случаях наступающими краевыми углами будут и0',
а отступающими — 9г и в'2. Эти углы могут изменяться в зависимос-
ти от того, прилипает пузырек к твердой поверхности или капля жид-
кости скатывается с поверхности1.
В обоих случаях все краевые углы будут гистерезисными. При вы-
теснении воздуха водой гистерезисные углы будут м^ьше, чем при
вытеснении воды воздухом, т.е. 0г > 02 и 0* > 02. Качественно это
соответствует двум стадиям элементарного акта флотации: образо-
ванию и разрушению (если такое наступит) комплекса пузырек —
частица.
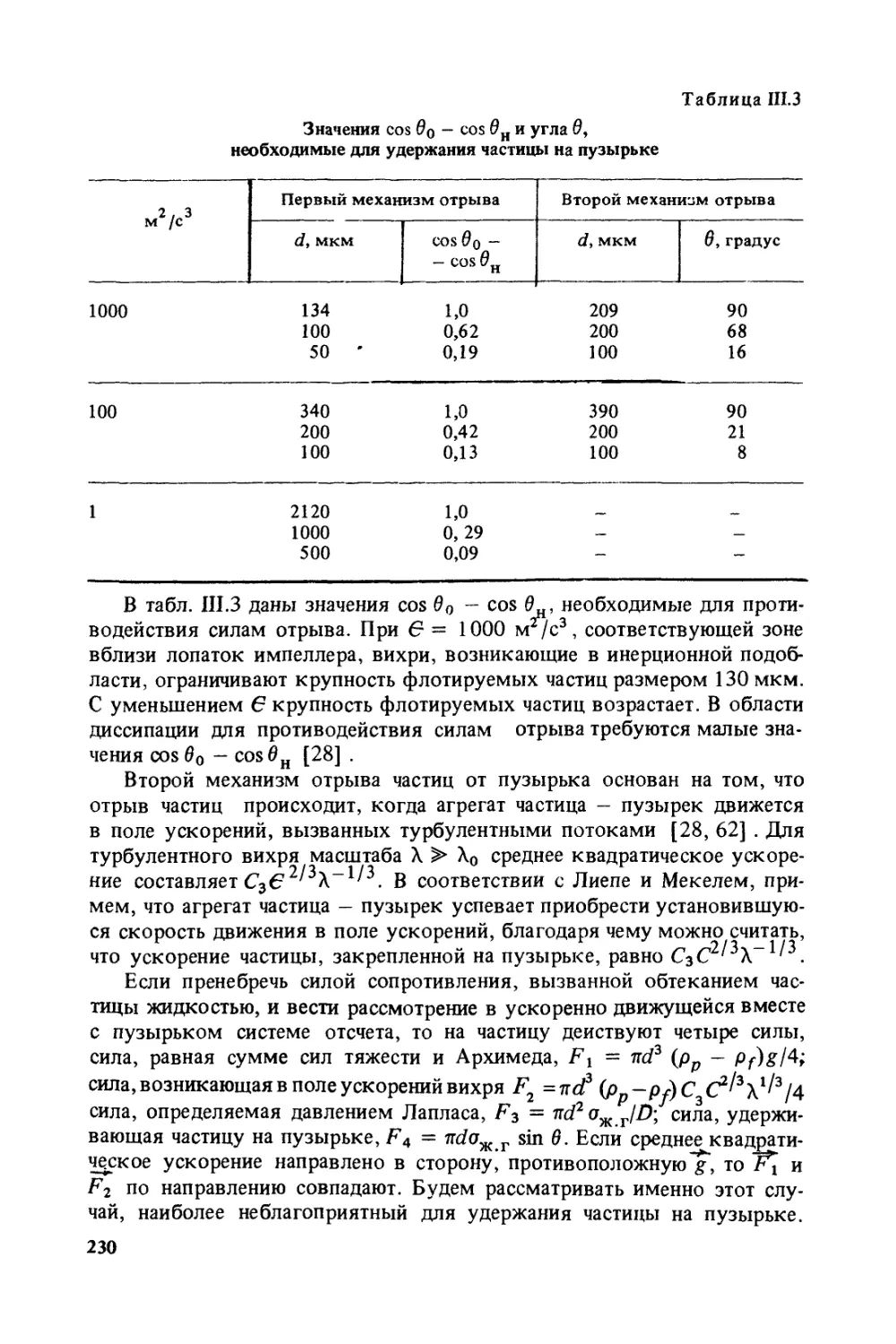
Рассмотрим несколько упрощенную модель — прилипание пузырь-
ка к твердой поверхности в условиях, когда площадь контакта части-
ца — пузырек при равновесном краевом угле смачивания меньше по-
верхности грани частицы, к которой пузырек прлипает. В этом слу-
чае возможны несколько стадий процесса прилипания частицы к пу-
зырьку: начальное положение, когда только образуется начальный
гистерезисный краевой угол (рис. 1.5, а), промежуточное положение
(рис. 1.5, б), когда гистерезисный краевой угол увеличивается, и ко-
нечное положение (рис. 1.5, в), когда гистерезисный краевой угол приб-
лижается к равновесному значению. Очевидно, что < 02 < 03 и соот-
ветственно d1 < d2 < d3, т.е. гистерезис при прилипании пузырька к
частице играет отрицательную роль. Он тормозит образование краево-
го угла, приближающегося к равновесному. Самое прочное прилипа-
ние будет соответствовать равновесному краевому углу, который бу-
дет больше гистерезисного. Также очевидно, что при отрыве пузырь-
ка процесс будет обратным, т.е. при отрыве пузырька от твердой по-
верхности гистерезис смачивания играет положительную роль, тормо-
зя процесс отрыва.
1 Для простоты рассуждений авторы применяют эти названия вместо обыч-
но используемых - угол натекания и угол оттекания. В этом последнем случае
углы 0* и 0* - являются углами натекания, а углы 02 и 02 - углами оттекания.
15
1.5. Стадии прилипания пузырька к
частице
Рассмотрим работу прилипания пузырька к твердой поверхности.
Обозначим общую свободную поверхностную энергию пузырька и твер-
дого тела до их прилипания FQ, тогда
Fo = °г-ж 5о + аж-т 5i ’
где So и Sj - площадь поверхности соответственно пузырька и твер-
дого тела.
После контакта свободная энергия системы
F1 = °Г-Ж So + °г-т S2 + °Ж-Т <S1 - S2>-
где Sq — площадь поверхности раздела газ — жидкость, оставшейся
после прилипания пузырька к твердой поверхности; S2 — площадь
поверхности раздела твердое тело — газ после прилипания пузырька
к твердой поверхности.
Убыль свободной поверхностной энергии системы после прили-
пания пузырька к твердой поверхности на единицу вновь образован-
ной поверхности раздела твердое тело — газ (пузырек) можно выра-
зить следующим уравнением:
&F' = bFI S2 = (Fff—FJ}/S2 =oT_x(S0-S^/S2-
— (°г-ж-°ж-т)- <L3)
Это выражение соответствует работе, затраченной на образование
единицы площади контакта частица — газ, когда эта площадь не огра-
ничена гранями частицы. При этом предполагается, что поверхность
твердого тела однородна по своим физическим и химическим свой-
ствам и горизонтальна, а краевой угол, образуемый при прилипании
пузырька, имеет равновесное значение, тогда можно воспользовать-
ся уравнением (1.1). Сделав соответствующую подстановку в урав-
нении (1.3), получим
Д/?'=»1Ж S»)/S2-COS01- П-4)
Для подсчета отношения ( 50 — S^) / S2 Б.В. Кизевальтером выве-
дена формула, справедливая для указанных выше ограничений,
(50 -S'Q)/S2 =V[4(1 + cos 0) (2 — cos 0)2 -2] / (i -cos0)
« (1 + cos 0) / 2.
16
Подставляя это значение в уравнение (1.4), получаем
А7?'= аг-ж (l-cos0)/2. (1.5)
При ( 50 — Sq)/ S2 « 1 уравнение принимает вид
Д/г'=аг-ж (1-COS0). (1.6)
Это уравнение достаточно точно в случае прилипания частиц, раз-
меры которых малы по сравнению с размерами пузырьков.
Флотационная активность твердой поверхности. Из уравнений (1.5)
и (1.6) следует, что лишь при в > 0 возможно прилипание частиц к по-
верхности раздела газ — жидкость, т.е. когда затрачена работа на обра-
зование единицы поверхности твердое тело — газ при вытеснении жид-
кости воздухом. Для теоретической оценки флотационной активнос-
ти поверхности минерала, измененной или не измененной действием
флотационных реагентов, следует пользоваться уравнением (1.5) в том
случае, когда площадь контакта газ — твердое тело не ограничивается
ребрами частицы, когда нет гистерезиса смачивания и твердая поверх-
ность горизонтальна. В противном случае появляются факторы, ко-
торые трудно учитывать.
Под флотационной активностью поверхности следует понимать
работу, совершенную системой пузырек — частица при образовании
единицы поверхности газ — твердое тело в случае отсутствия гисте-
резиса смачивания (т.е. когда краевой угол смачивания является рав-
новесным) и при условии, что площадь прилипания не ограничена по-
верхностью твердого тела и поверхность горизонтальна. При этом фло-
тационная активность выражается величиной AF' (см. формулу 1.5)
и зависит от равновесного краевого угла смачивания.
Одни исследователи называют гидрофобными такие поверхности,
на которых на границе с водой и воздухом образуется хотя бы неболь-
шой краевой угол, другие считают, что при 9 = 90° на поверхности
твердого тела устанавливается равновесие между жидкой и газооб-
разной фазами. Исходя из этого при 6 < 90° поверхности считаются
гидрофильными, а при в > 90° — гидрофобными. Последняя точка зре-
ния более обоснована, но пользоваться ею при объяснении флотации
неудобно, ибо простые расчеты показывают, что для флотации частиц
обычной флотационной крупности при относительно спокойном дви-
жении пульпы необходимы краевые углы, не превышающие 90°. При
добавке в пульпу собирателей и на минералах естественно гидрофоб-
ных, как правило, 90°, т.е. согласно второму представлению как
флотируемые, так и нефлотируемые частицы гидрофильны. Поэтому
нередко в литературе минеральные частицы, на которых образуется
хотя бы небольшой краевой угол, обеспечивающий успешную фло-
тацию, условно называются гидрофобными.
Работа прилипания большого пузырька к малому, закрепленно-
му на твердой поверхности. В условиях перемешивания пульпы во
2-6926
17
флотационной машине создаются зоны повышенного и пониженно-
го давлений. В зонах повышенного давления воздух, содержащийся
в пульпе в виде пузырьков, растворяется, а в зоне пониженного дав-
ления — выделяется. А.Ф. Таггарт показал, что если в этой зоне име-
ются минеральные частицы, то мелкие пузырьки воздуха будут пре-
имущественно выделяться на поверхности гидрофобных частиц; сог-
ласно исследованиям В.И. Классена, это, очевидно, будет способствовать
прикреплению таких частиц к крупным пузырькам при столкновении.
Представим, что малый пузырек с прилипшей частицей прикрепляется к
большому. Для простоты рассуждений примем, что площадь контак-
та частицы с малым пузырьком ограничена ребрами частицы, тогда
поверхностная энергия до столкновения с большим пузырьком
Fq ~ стг-ж $м + °г-т ‘З’г-т + аж-т ^ж-т + аг-ж —
~ аг-ж (*м + 1 стг-т *^г-т + аж-т $ж-т '
После столкновения
^0 ~ ^г-ж *^г-ж + стг-г *^г-т + стж-т ^ж-т ’
где S м — площадь границы газ — твердое тело для малого пузырька,
прилипшего к твердой частице; Sr_т — площадь границы газ — твер-
дое тело; 5Ж_Т — площадь границы жидкость — твердое тело; SQ —
площадь границы жидкость — газ для большого пузырька; <$г_ж —
площадь границы газ — жидкость вновь образованного после коалес-
ценции пузырька, прилипшего к частице.
Тогда убыль поверхностной энергии после коалесценции пузырь-
ков
^-^0 “’г-ж^м+А-^ж-г) -
Согласно второму закону термодинамики 5м + SQ > 5ж _ г .
Если граница жидкость — газ во флотационной пульпе будет пок-
рыта сорбционным слоем пенообразователя, затрудняющим коалес-
ценцию, то слияние пузырьков замедлится, но все же оно возможно
и лишь при указанном соотношении.
Для случая, когда площадь контакта малого пузырька с твердой
частицей не ограничена ребрами грани, расчет более сложный, но ре-
зультат качественно будет таким же.
Таким образом, мелкие пузырьки, выделившиеся из раствора на
гранях твердых частиц в зонах пульпы пониженного давления, могут
способствовать прилипанию частиц к крупным пузырькам, т.е. будут
активировать их в соответствии с гипотезами, развитыми В.И. Классе-
ном.
3. УСЛОВИЯ ЗАКРЕПЛЕНИЯ ЧАСТИЦЫ
НА ПОВЕРХНОСТИ РАЗДЕЛА ГАЗ - ЖИДКОСТЬ1
Рассмотрим силы, действующие на частицу, закрепленную на грани-
це газ — жидкость в общем случае, т.е. тогда, когда система может
находиться в нестационарном движении. Не будем конкретизировать
вид поверхности газ — жидкость (возможна как горизонтальная по-
верхность, так и поверхность, ограничивающая пузырек воздуха).
Пусть частица обтекается жидкостью, обладающей некоторым распре-
делением скоростей при обтекании поверхности газ — жидкость и по-
верхности частицы (рис. 1.6).
Силы, действующие на частицу, можно разделить на три вида: рас-
пределенные по объему (сила тяжести) X, распределенные по поверх-
ности (сила взаимодействия твердого тела с жидкостью и газом)
и распределенные по линии (сила поверхностного натяжения на гра-
нице газ — жидкость по периметру трехфазного контакта)"4^
Таким образом, уравнение движения частицы будет иметь следую-
щий вид:
Р + F„ + F = т w ,
и К
где т — масса частицы; w — ускорение частицы.
Сила представляет собой сумму сил, приложенных со сторо-
ны жидкости и газа к поверхности тела. На каждой малой площадке
тела можно определить силу Д пропорциональную площади Д5,
причем силу Дг ? можно представить в виде двух составляющих: нор-
мальной Д^ и тангенциальной Дк площадке:
д^=д/ + д^. (1.7)
В соответствии с этим полную силу F $ можно выразить в виде
где Fn — векторная сумма всех сил Д/г п, приложенных ко всей по-
верхности тела (суммарная сила давления); — векторная сумма
всех сил Д/^., приложенных ко всей поверхности тела. (Сила Ft дей-
ствует при обтекании тела вязкой жидкостью).
) Уравнение движения с учетом равенства (1.7) и соотношения
Р = mg принимает вид
mg + Fn + Fs + FK = т w. (1.8)
В общем случае, когда движение частицы нестационарно, решение
уравнения (1.8) представляет собой трудную задачу.
Глава написана М.Ф. Емельяновым.
19
Жидкость
1.6. Силы, действующие на частицу, закреп-
ленную на границе раздела газ — жидкость
При стационарном движении w = 0 и уравнение (1.8) можно запи-
сать в виде
mg + Fn + Ft + FK = 0.
При этом можно считать, что в случае движения частицы, прикреплен-
ной к пузырьку, постоянный вектор скорости движения частицы v
лежит на вертикальной оси, так же как и сила FK и зависящие от ~v
силы W
В статических условиях, когда частица неподвижна относитель-
но жидкости, = 0, и уравнение (1.8) принимает вид
mg + Fn + FK = 0. (1.9)
Это векторное уравнение представляет собой общий вид уравне-
ния равновесия частицы при v = 0.
Для практических целей уравнение (1.9) следует конкретизиро-
вать, выразив входящие в него члены через параметры, определяю-
щие условия задачи, такие, например, как плотность частицы и жид-
кости, размеры частицы и др.
Учитывая, что все входящие в уравнение (1.9) векторы лежат на
вертикальной оси, заменим его уравнением для проекций векторов
на вертикальную ось. Если составляющая вектора направлена вверх,
то будем считать проекцию положительной, а если вниз, то отрицатель-
ной. Поверхность газ — жидкость может быть как плоской горизон-
тальной (рис. 1.7, а), так и принадлежать пузырьку (рис. 1.7, б). Пер-
вый случай соответствует пленочной, второй — пенной флотации.
Рассмотрим общее уравнение для обоих случаев, считая, что час-
тица находится в покое. Условия, обеспечивающие состояние покоя,
будут рассмотрены особо. Будем считать, что частица имеет плотность
рт, превышающую плотность жидкости рж, гистерезисный краевой
угол на контуре контакта вТ < 90°. Пусть частица имеет форму ци-
линдра, диаметр и высота которого равны а, причем'контакт части-
цы с поверхностью газ — жидкость осуществляется по всей верхней
грани частицы.
Сила тяжести Р частицы выражается через ее объем я а3 /4, плотность
рт и ускорение свободного падения g:
20
Р =-4та3 PTg/4.
Суммарная сила давления, которая действует на частицу, окружен-
ную жидкостью со всех сторон, является выталкивающей архимедо-
вой силой Fa и выражается через объем частицы, плотность жидкос-
ти рж и ускорение свободного падения g:
fa = *«*PKgl* •
В рассматриваемом случае верхняя грань частицы находится под
давлением газа, а не жидкости. Давление газа на верхнюю грань час-
тицы будет отличаться от давления жидкости на уровне верхней гра-
ни на величину Ар, обусловленную кривизной поверхности газ - жид-
кость у контура контакта. Давление Ар, называемое обычно Лапласо-
вым, выражается через поверхностное натяжение о на границе газ —
жидкость и главные радиусы Rx и R2 поверхности газ - жидкость у
контура прилипания:
Др =РТ-Рж = <*(1//^ + 1/^2 ),
где рг — давление газа; рж — давление в жидкости в соседних точках,
разделенных поверхностью газ — жидкость (при этом предполагает-
ся, что радиус кривизны положителен, если соответствующая ему вы-
пуклость обращена в жидкую фазу, и отрицателен, если выпуклость
обращена в газообразную фазу).
Таким образом, можно считать, что на поверхность частицы, поми-
мо архимедовой силы Fдействует дополнительная Лапласовая си-
ла давления F^, распределенная по верхней грани частицы:
Fn = — ira2 Ар/4,
где ira2/4 - площадь верхней грани частицы.
1.7. Равновесие частицы, закрепленной на границе раздела газ - жидкость:
а — на горизонтальной поверхности; б — на свободном пузырьке; в — на пузырьке
при наличии упора
21
Наконец, на частицу действует распределенная по трехфазному
контуру контакта (верхнее ребро) капиллярная сила FK:
FK = я а о sin в ,
где ira — длина контура; в — угол, образуемый касательной плоскостью
к поверхности раздела жидкость — газ с горизонталью у контура кон-
такта (вообще в С 0Г и, согласно принятому выше условию, в < 90°).
Условие равновесия частицы приобретает вид
p + fa+Fji+fk = о,
или
— it a3 prg/4 + тта3 рж g/4 — it а2 Ар/4 + тт а о sin 6 =0. (1-Ю)
После упрощения выражения (1.10), получим
sin 0 -a2g(pr - рж)/(4о)~аАр1(4о) = 0. (1.11)
Уравнение (1.11) представляет собой общее уравнение равнове-
сия частицы, закрепленной на границе раздела жидкость - газ. Из урав-
нения (1.11) получаем
sin0 = a2 g(pT -рж)/(4а) + а Ар/(4а). (1.12)
Применим это уравнение к случаю закрепления частицы на гори-
зонтальной поверхности (см. рис. 1.7, а). Равновесие в системе нас-
тупает тогда, когда верхняя грань опускается ниже уровня окружаю-
щей жидкости на величину h . Пренебрегая плотностью газа по срав-
нению с плотностью жидкости, можно принять, что давление газа пос-
тоянно вдоль всей поверхности раздела жидкость - газ и равно pQ.
Давление жидкости на уровне верхней грани частицы, таким образом,
может быть выражено в виде р0 — Ар, где Ар — Лапласово давление,
или в виде pQ —Pxgh, где рж g h — изменение гидростатического дав-
ления на глубине h от уровня плоской поверхности жидкости.
Таким образом
дР=-Рж^Л- (L13)
Подставив уравнение (1.13) в (1.12), получим известную форму-
лу Валентинера
sin0— a2g (р?-рж)/(4о) +apyKgh/(4о) = 0. (1.14)
Тогда формула (1.12) приобретает вид
sin0 = a2 g (рт — Рж) / (4а) — а рж gh / (4а). (1.15)
Можно показать, что всегда первый член правой части формулы
(1.15) по абсолютной величине больше второго. Для грубой оценки
величин углов 0, необходимых для пленочной флотации, можно поль-
22
зоваться только первым членом, тогда рассчитанный угол 0О будет
больше в:
sin0o = a2 g (рт -рж)/(4о). (1.16)
В табл. 1.2 приведены значения угла 0О, рассчитанные по уравне-
нию (1.16).
Некоторыми авторами уравнение (1.16) использовалось для оцен-
ки краевых углов, необходимых для пенной (пузырьковой) флота-
ции; различия между пленочной флотацией, для которой уравнение
(1.16) применимо, и флотацией пузырьками, считались несуществен-
ными.
Установим зависимость величины угла 0 при флотации пузырь-
ками. Трудность задачи состоит в том, что в обычных флотационных
условиях пузырек с прикрепленной к нему частицей движется в жид-
кости и поэтому существенное значение приобретают гидродинами-
ческие силы, действующие как на пузырек, так и на частицу.
Известно, что пузырьки претерпевают при движении деформацию,
а крупные пузырьки, средний диаметр которых более 1 мм, движут-
ся по криволинейным траекториям даже в спокойной жидкости.
При этом форма их также изменяется. Это затрудняет анализ условий
закрепления частиц на пузырьках таких размеров. Поэтому будем
рассматривать только пузырьки, средний диаметр которых не пре-
вышает 1 мм. Неподвижность пузырька может быть обеспечена прик-
реплением частицы снизу пузырька тогда, когда вес частицы равен
выталкивающей силе пузырька, или пузырек удерживается упором -
горизонтальной гидрофильной поверхностью сверху (см. рис. 1.7, в).
Второй способ обладает некоторыми преимуществами, так как не свя-
зан с необходимостью строгого соотношения между размерами пу-
зырька и частицы.
Если принять форму пузырьков почти сферической, то достаточ-
но задать их средний диаметр d или радиус вершины Ъ и считать, что
приблизительно выполнено равенство d = 2b.
Условием слабой деформации является незначительное измене-
ние гидростатического давления в пределах пузырька, приблйзитель-
Таблица 12
Значение угла 0О для пленочной флотации
при рт = 7,5 г/см3
О, мкН/см а, мкм
10 100 1000
700 4,7" / „п 6 50 13°09'
500 6,< 11' 18°34'
300 11 18'15" 32°04'
23
но равное 2рж g b, по сравнению с Лапласовым давлением, равным
2a(b: 2p^.gb < 2o/b.
Тогда
e^pxgb2lo<l. (1.17)
Величина (5 определяет форму пузырька. Строго сферическая фор-
ма соответствует (3 -*0. Равенство (1.17) равносильно условию
Рж#Л2/(4о) «I 1, (1.18)
которое получается из уравнения (1.17) при замене b + d/2. Для пу-
зырьков с d = 1 мм = 0,1 см при а = 700 мкН/см, рж = 1 г/см3, g=980
см/с2 левая часть неравенства 1-980 -0,01/280 = 0,035, т.е. изменение
гидростатического давления составляет примерно 3,5 % Лапласова
давления. Отсюда следует, что пузырьки, диаметр которых d < 1 мм,
можно считать практически сферическими. Нетрудно показать, что
для пузырьков таких размеров изменение Лапласова давления, вы-
зываемое гидрофильным упором, будет невелико. Так, если диаметр
площадки, образуемой в месте соприкосновения пузырька с упором
обозначить dQ, то dQ ~ d2, причем для d = 0,1 см dQ — 0,015 см, т.е.
такой деформацией можно пренебречь.
Рассмотрим ограничения для размера частицы. Одно из этих ог-
раничений следует из требования, по которому комплекс частица —
пузырек должен обладать положительной плавучестью
(рт - Рж) тга3 g/4 < рж ird3 g/6 .
Отсюда
i/з
aid < [2рж/3 (рт-рж)] . (1.19)
Согласно второму ограничению, принимаемому для простоты ана-
лиза, прикрепление частицы должно незначительно изменять давле-
ние внутри пузырька. Это требование выполняется, если размер час-
тицы достаточно мал по сравнению с размером пузырька. Практичес-
ки уже при а = d/2 поправку на изменение Лапласова давления мож-
но не учитывать.
Для рассматриваемых почти сферических пузырьков уравнение
(1.12) показывает, что при а -> 0 Лапласов член а Ар/а) стремится
к нулю медленнее, чем гравитационный (рт — рж) a2g/ (4а). Это означа-
ет, что для достаточно тонких частиц Лапласов член вносит основной
вклад в величину sin в. Этот факт находится в противоречии с распрос-
траненной точкой зрения, согласно которой при а < d можно пренеб-
речь Лапласовым давлением и учитывать только вес частицы в воде.
Запишем условие, при котором Лапласов член значительно боль-
ше гравитационного.
Поскольку Д р 4 а/d, то
24
а Лр1(4а) [al (4a)] (4aId) = a jd
и требуемое условие означает
(рт -Рж)д2 g/(4a)<a/J,
или
(рт ~ Py^ad SK4(J) < 1- (1.20)
Рассмотрим условия закрепления на пузырьке диаметром d = 0,1 см
предельно большой для данного пузырька частицы плотностью р =
= 7,5 г/см3.
Неравенство (1.19) заменяем равенством
aid =[2рж/3(рт-рж)]*/3= [2/(3-6,5)] 1/3.
Отсюда afd =0,468 и a =0,0468 см.
Гравитационный член
(Рт -Рж)д2 £/(4а) = 980 ‘ 2>2 • 1q 3- 6,5/280= 0,05.
Лапласов член akpl(4<j) приблизительно равен afd при этом возмо-
жная относительная погрешность составляет (3 0,035, что соответ-
ствует абсолютной погрешности, равной 0,016.
В этом приближении sin 0 0,468 + 0,05 = 0,518, отсюда в =» 31°.
Следовательно, в этом случае вклад гравитационного члена в sin 0
равен примерно 10 %. При меньших размерах частиц и пузырьков, а
также при плотности частиц <7,5 г/см3 доля гравитационного чле-
на в sin 0 будет еще меньше.
В табл. 1.3 приведены приближенные расчетные значения угла 0
для пузырьков различного размера при относительной погрешнос-
ти определения Лапласова члена, равной (3.
Анализ показывает, что условия равновесия частицы на пузырь-
ке существенно отличаются от условий равновесия на горизонталь-
ной поверхности. Если для пузырька решающее значение имеет ска-
Таблица I .3
Минимальный угол 0 для закрепления частицы
на неподвижном пузырьке при рт =7,5 г/см3
а мкН/см а = ю Д = 100
d, см
0,020 0,0317 0,0502 0,0796 0,020 0,0317 0,0502 0,0796
700 2°52’ 1°49' 1°08' 43' 30>' 18°33', 11°зУ 7°23; 300 2°52' 1°49' 1°08' 43' 30°21' I8°42' 11°48 1 31
25
чок давления Др за счет кривизны поверхности пузырька, то в слу-
чае горизонтальной поверхности более важен член, определяемый ве-
сом частицы в жидкости. В силу этого возникает большая разница меж-
ду краевыми углами, необходимыми для закрепления частиц в этих
двух случаях.
Вычисленные по формуле (1.12) углы 0О и в определены для ци-
линдрических частиц, обладающих наиболее подходящей для флота-
ции формой, причем закрепление происходит наиболее выгодно по
верхней грани. В худших условиях, когда форма частиц округлая,
требуемые углы в будут, вероятно, значительно больше.
Рассмотренные выше условия равновесия частицы на неподвиж-
ном пузырьке не могут быть непосредственно применены к реальным
флотационным условиям, так как в последнем случае на частицу и
пузырек действуют существенные дополнительные силы.
Рассмотрим качественно дополнительные факторы, которые сле-
дует учитывать, исключая последовательно упрощающие предполо-
жения.
Исключим прежде всего ограничение, связанное с неподвижностью
системы частица — пузырек. Будем рассматривать эту систему в сос-
тоянии установившегося движения в спокойной жидкости. Можно
считать, что обтекающая пузырек и частицу жидкость благодаря си-
лам сопротивления уравновешивает плавучесть системы. При этом
Лапласово давление для рассматриваемых достаточно тонких пузырь-
ков не претерпит существенного изменения. Изменение условий рав-
новесия частицы в основном выразится в том, что появится дополни-
тельная сила, направленная вниз. Эта сила обусловлена сопротивле-
нием жидкости, которое тем больше, чем выше скорость движения
частицы в жидкости. Иными словами, чем крупнее пузырек, тем бо-
лее существенна сила сопротивления, действующая на частицу. Поэ-
тому в условиях стационарного движения комплекса частица — пу-
зырек в жидкости для относительно крупных пузырьков требуемые
величины могут быть значительно выше, чем в условиях покоя.
Далее предположим, что жидкость вокруг частицы, как целое, ис-
пытывает некоторое постоянное ускорение и>0. Будем считать, что дви-
жение частицы стационарно в системе, относительно которой ускоре-
ние жидкости равно нулю. При таком предположении условия дви-
жения частицы формально совпадают с условиями равновесия частицы,
стационарно,движущейся в покоящейся жидкости, если произвести заме-
ну g ~*g % • Если । wo । ’то член равенства a2g|g- % I (рт ~ Рж)/
/(4о), аналогичный гравитационному члену в случае покоящейся жид-
кости, может стать достаточно большим и даже более существенным,
чем Лапласов. Кроме того, силы сопротивления, действующие на час-
тицу, тоже будут значительными, так как увеличится скорость части-
цы относительно жидкости. Таким образом, при наличии ускорения
жидкости как целого значения минимальных необходимых углов в
еще выше, чем при движении в неподвижной жидкости.
26
Следующий дополнительный фактор, который мы качественно
попытаемся оценить — возможность нестационарного движения ком-
плекса частица - пузырек, связанная с турбулентностью жидкости.
Дополнительные силы, возникающие в этом случае, будут способство-
вать отрыву частиц от пузырька, так как они вызывают перемеще-
ние частиц по криволинейной поверхности пузырька, а также рывки
скоростей частицы и пузырька. Таким образом, наличие турбулентнос-
ти тоже увеличивает необходимое значение угла в.
Следующее приближение к реальным условиям флотации может
состоять в рассмотрении закрепления частицы на пузырьке как про-
цесса, развивающегося во времени и представляющего собой отдель-
ный этап флотации, следующий за этапом столкновения. Однако в
настоящее время наши знания в этой области еще недостаточны и не
позволяют уверенно объяснить закрепление частицы на пузырьке в
условиях реальной флотации.
4. ОСНОВНЫЕ РЕАГЕНТЫ,
ПРИМЕНЯЕМЫЕ В ПРАКТИКЕ ФЛОТАЦИИ
4.1. Собиратели
Все собиратели по их строению целесообразно подразделить на две
основные группы: гетерополярные и аполярные, хотя последние име-
ют более ограниченное применение. Гетерополярные собиратели, в
свою очередь, подразделяются на анионные, катионные и неионоген-
ные. Гетерополярные собиратели, при диссоциации которых образует-
ся анион, включающий углеводородный радикал, называют анионны-
ми. Анионные собиратели, в состав полярной группы которых вхо-
дит сульфгидрил SH или в случае солей SMe называют сульфгидриль-
ными, если в состав полярной группы входит гидроксил ОН или ОМе, —
оксигидрильными. Гетерополярные собиратели, при диссоциации ко-
торых образуется катион, включающий углеводородный радикал, на-
зывают катионными.
Гетерополярные собиратели, применяющиеся
в практике флотации
Сульфгидрильные анионные:
меркаптаны
меркаптобензотиозол
ксанто-енаты
R - SH (Me)
N=C-SH(Me)
r/ /
S
RO-(У
^SH(Me)
27
алкил- и арилдитиофосфаты (кислые эфиры дитиофосфорных кислот - аэрофлоты) R° S RO'^SH(Me) R S
дитиокарбаматы \n-c^ R/ \SH(Me)
Серосодержащие неионогенные:
дисульфиды сульфгидрильных
собирателей:
диксантогены RO-C-S~S-C-OR II II S S RO S S OR \ II II /
дисульфид диалкилдитиофосфата \ P-S-S-P' ROZ OR RS SR \ II II /
тиурамдисульфиды /N-C-S-S-C-N RZ \R
тионокарбаматы R OC^ \nh-r2 , S
аллиловые эфиры ксантогеновых кислот ROC^
xs-ch2-ch=ch2
минереки ROC-S-C-OR. II
Оксигидрильные анионные: карбоксильные (карбоновые кислоты и их мыла) О R-C-O-H(Me) II О
алкилсульфаты (щелочные соли алкилсерной кислоты) R-O-S^OH (Me) ^0 0
алкилгидроксамовые кислоты и их соли Катионные собиратели: амины: первичные R-C^ 4 NHOH (Me) rnh2 R4
вторичные NH RZ
третичные zR R-N XR
четвертичные аммониевые основания Rx R N-OH RZ 4R
28
Гетерополярные собиратели содержат полярную (функциональ-
ную) группу, определяющую возможность взаимодействия собира-
теля с поверхностью минерала, и аполярный углеводородный ради-
кал, обеспечивающий гидрофобизацию поверхности и тем самым соз-
дающий условия для закрепления пузырька.
Прочность закрепления собирателя на поверхности минерала оп-
ределяется энергией связи функциональной группы с минералом, за-
висящей от ее характера и природы минерала, а также энергией дис-
персионного взаимодействия углеводородных радикалов в адсорбци-
онном слое. Энергия дисперсионного взаимодействия растет по мере
увеличения длины углеводородного радикала. В ряде случаев (кар-
боновые кислоты, амины) влияние дисперсионного взаимодействия
радикалов может играть существенную роль.
Таким образом, эффективность собирателя может быть увеличе-
на путем изменения характера функциональной группы (например,
при замене центрального атома или введении соответствующих заме-
нителей, влияние которых более подробно рассматривается в соответ-
ствующих разделах, либо за счет изменения длины углеводородного
радикала.
Влияние вида центрального атома функциональной группы на со-
бирательное действие можно проследить при сравнении действия ксан-
тогената и дитиофосфата. _ q S
Так как фосфор полярной группы дитиофосфата _ Р/**
-(Г XSMe
является более электроноакцепторным, чем углерод функциональ-
. S
ной группы ксантогената — О—, связь Р—S дитиофосфата — бо-
Х SMe
лее прочная, чем связь С—S ксантогената, а связь S -Me в дитиофос-
фате слабее, чем у ксантогената. Это обусловливает большую раство-
римость дитиофосфатов цветных металлов по сравнению с ксантоге-
натами и соответственно более слабые собирательные свойства.
Другим примером может служить сравнение собирательного дей-
ствия гидроксаматов и карбоксилатов. При наличии более прочновзаи-
0
модействующей с минералами гидроксаматной группировки — N
о Wo-
по сравнению с карбоксильной —С**’’’ достаточное собирательное дей-
\0Н
ствие проявляют алкилгидроксаматы с длиной радикала С7-С8, что
делает их более селективными собирателями, чем жирные кислоты.
Кроме того, следует также учитывать способность полярной группы
к гидратации. Так как полярная группа, входящая в состав карбок-
сильных собирателей, обладает большим сродством к воде, то для гид-
рофилизирующего действия необходимо увеличение длины углево-
дородного радикала.
29
Ксантогенаты, образующие труднорастворимые соединения с ка-
тионами сульфидных минералов, являются эффективными собира-
телями уже при радикале, содержащем 2—5 углеродных атомов, в то
время как низшие карбоновые кислоты с такой же длиной углево-
дородного радикала не флотируют или слабо флотируют эти минера-
лы. Для успешной флотации карбоксильными собирателями требу-
ется значительно большая длина углеводородных радикалов (не ме-
нее 12 атомов углерода).
Таким образом, увеличивая длину углеводородного радикала, мож-
но усилить собирательное действие.
Следует, однако, отметить, что увеличение длины углеводородно-
го радикала, усиливая собирательное действие, приводит к ухудше-
нию селективности собирателей.
С удлинением углеводородного радикала на одну группу СН? для
гомологического ряда ксантогенатов и жирных кислот растворимость
их соединений с катионами уменьшается.
Разветвление углеводородного радикала в молекуле собирателя
увеличивает растворимость органической соли [18], что объясняет-
ся снижением дисперсионного взаимодействия между углеводородны-
ми радикалами. Исключение составляют изопропиловый и изобути-
ловый ксантогенаты, которые дают менее растворимые соли, чем со-
ответствующие прямоцепочечные соли.
Сульфгидрильные собиратели
Меркаптаны являются простейшими представителями сульфгид-
рильных собирателей. Они представляют собой слабые кислоты. Мер-
каптаны слабо растворимы в воде и легко окисляются, образуя ди-
сульфиды.
С катионами тяжелых металлов маркаптаны образуют труднораст-
воримые соединения. Меркаптиды металлов переменной валентнос-
ти, например железа и меди, неустойчивы. Они разлагаются, образуя
дисульфид и меркаптид металла низшей степени окисления. Хотя мер-
каптаны алифатического ряда — самые сильные собиратели сульфид-
ных минералов, применение реагента с коротким углеводородным
радикалом ограничено в связи с их неприятным запахом. Обычно ис-
пользуют более длинноцепочечные меркаптаны или с арильным ради-
калом. Меркаптаны могут быть также использованы при флотации
окисленных медных минералов.
Меркаптобензотиазол применяют обычно в щелочной среде при
флотации медных и цинковых руд. Возможно применение меркапто-
бензотиазола при флотации церуссита без предварительной сульфи-
дизации.
Ксантогенаты. При флотации сульфидных минералов наиболее ши-
рокое применение находят ксантогенаты калия или натрия. Их так-
же применяют при флотации окисленных руд цветных металлов пос-
30
ле предварительной сульфидизации. Ксантогенаты — соли относитель-
но сильной ксантогеновой кислоты (константа диссоциации для раз-
ных членов гомологического ряда, по данным различных авторов,
изменяется в пределах 2,3 10-2 — 3,4 10~2). Ксантогеновые кис-
лоты в воде малорастворимы, их водные растворы неустойчивы.
Ксантогенаты щелочных металлов хорошо растворимы в воде и
в полярных органических растворителях. Устойчивость водных раст-
воров ксантогенатов щелочных металлов зависит от концентрации
и pH. Наиболее устойчивы слабощелочные водные растворы; в кис-
лой среде (при pH < 5) образуется нестойкая ксантогеновая кисло-
та, разлагающаяся на сероуглерод и спирт. Устойчивость водных раст-
воров уменьшается также при повышении температуры.
Важное свойство ксантогенатов как собирателей сульфидных ме-
таллов — способность даже низших гомологов к образованию проч-
ных труднорастворимых соединений с катионами тяжелых цветных
металлов (табл. 1.4).
То обстоятельство, что ксантогенаты не вступают во взаимодей-
ствие с катионами щелочноземельных металлов, обусловливает их
Таблица 1.4
Произведения растворимости различных ксантогенатов
(по данным И.А. Каковского [47] )
Ксантогенат Zn Hg
Этиловый 4,9 • 10"9 2,5 10'38
Пропиловый 3.4 • 10“10 2.8 10“ 39
Бутиловый 3.7 10'11 7,2 • Ю'40
Амиловый 1,5 • 10“12 5,4 • 10~41
Гексиловый 1,2 10'13 —
Гептиловый 1,3 10 14 —
Октиловый 1.5 10 16 -
Продолжение табл. 1.4
Ксантогенат Au Ag Cu(I)
Этиловый 2,5 • 10“33 4,4 • 10'19 3,5 • 10'20
Пропиловый 2,1 10'19 —
Бутиловый 2,0 • 10' 34 4,2 10 20 3,1 • 10“21
Амиловый 4,3 10'36 1,8 • 10'21 —
Гексиловый 1,5 • 10' 35 2,6 • 10~21 —
Гептиловый 4,4 • 10'36 9,8 • 10'21 -
Октиловый - 1,38-10'22 7 • 10~21
31
значительную селективность по сравнению с карбоксильными соби-
рателями при флотации сульфидных руд.
Произведения растворимости этиловых ксантогенатов
некоторых металлов (по данным И.А. Каковского [47])
АиС2 Н5 OCS ......................................
CuC2HsOCS2 .......................................
Hg (С2 н5 OCS2)2 .................................
AgC2H5OCS2 .......................................
Bi (С, Н. OCS,),..................................
Pb(C2 HsOCS2)2 ...................................
Cd(C2 H5 OCS2)2 ..................................
Co(C2 H5 OCS2)2...................................
Ni(C, H OCS,),....................................
Zn(C2 hsocs2)2....................................
Fe (C2 Hs OCS2)2..................................
Fe(C2 Hs OCS2)3...................................
2,5 • IO"30
3,5 • IO-20
2,5 • IO-38
4,4 • 10~19
10“ 39
1,7 • 10“17
8,9 • 10“15
5,6- 10“13
1,4 • 10“12
4,9- 10“9
8 10“8
10“21
Ксантогенаты щелочных металлов относительно легко окисляют-
ся до дисульфида диксантогена по реакции
S ^S S^
2 ROCS " -2e-ROC -S-SCOR
XS
Стандартный окислительный потенциал реакции окисления ксан-
тогенатов Е° = -0,07 - 0,03 (и - 3), где п - число атомов углерода в
радикале [47].
Так как ксантогенаты обладают восстановительными свойствами,
при их взаимодействии с катионами переменной валентности помимо
ксантогената тяжелого металла образуется также диксантоген.
Положительными свойствами ксантогенатов как собирателей яв-
ляются их слабая поверхностная активность на границе жидкость —
газ, а также отсутствие способности к мицеллообразованию. Соби-
рательное действие ксантогенатов увеличивается с ростом длины уг-
леводородного радикала, что согласуется с уменьшением раствори-
мости соответствующих ксантогенатов тяжелых металлов, как это
следует из табл. 1.4.
Алкил- и арилдитиофосфаты (аэрофлоты). Дитиофосфаты также
широко применяют при флотации сульфидных минералов. Диалкил-
дитиофосфаты — кислые эфиры дитиофосфорной кислоты, которая
относится к сильным кислотам (по силе она примерно равна соляной
кислоте).
Дитиофосфаты щелочных металлов хорошо растворимы в воде,
их водные растворы более устойчивы, чем растворы ксантогенатов.
32
Т а б л и ц a 1.5
Произведения растворимости различных дитиофосфатов
(по данным И.А. Каковского [47] )
Дитиофосфат РЬ Ag Zn Си
Метиловый 5 • 10-11 4,5 • 10~16 — 8 • 10~16
Этиловый 7,5 • 10“12 1,4 • 10~16 1,5 • 10~2 1,4 • 10~16
Пропиловый 6 • Ю-14 6,5 • 10“18 - -
Бутиловый 6,1 • 10" 16 5,2 10"19 — 2,2 • 10"18
Изоамиловый 4,2 • Ю“18 3,5 • 10" 20 1•10~3
Фениловый 6,9 • 10~16 7,3 • 10 19 — —
Паракрезиловый 7,7 • 10"18 8 • Ю"20 — 4,1 • 10"19
Ортокрезиловый 1,8 • 10'17 3,3 • 10 19 - —
Метакрезиловый -- 2,1 Ю' 20 — —
Так же, как и ксантогенаты, дитиофосфаты взаимодействуют с кати-
онами тяжелых цветных металлов, образуя труднорастворимые сое-
динения, однако более растворимые, чем ксантогенаты соответствую-
щих металлов, как это видно из табл. 1.5.
Этим, очевидно, и объясняется то, что дитиофосфаты являются
более слабыми собирателями, чем ксантогенаты.
Произведения растворимости диэтилдитиофосфатов
различных металлов (по данным И.А. Каковского [47])
Zn [(С2 н5 o)2ps2]2
№ [(С Н/O)2PS2]2
Cd [(С2 н5 o)2ps2]2
Pb [(C2HsO)2PS2]2
Си [(С2 Hs O)2PS2]
Ag [(С2 Hs O)2PS2]
Hg [(C2 HsO)2PS2]2
1,5 • 10"2
1,7 • 10~4
1,2 • IO"10
7.5 • IO-12
5 • IO"17
1,4 • 10~16
1,3 10~32
По мере увеличения длины углеводородного радикала раствори-
мость дитиофосфатов уменьшается более резко, чем ксантогенатов
(см. табл. 1.5). Это объясняется наличием у дитиофосфатов двух уг-
леводородных радикалов.
Ионы дитиофосфатов окисляются труднее, чем ионы ксантогена-
тов. Стандартный потенциал окисления дитиофосфатов до дисульфи-
дов £° = 0,25 — 0,074 (п — 2), где п - число атомов углерода в ради-
кале дитиофосфата [47]. Дитиофосфаты с разветвленным радикалом
окисляются труднее, чем дитиофосфаты нормального строения.
Работами Гинцветмета установлено, что частичный гидролиз ал-
кил- и арилдитиофосфатов приводит к некоторому улучшению их со-
бирательного действия.
3-6926
33
Дитиокарбаматы. Дитиокарбаматы — производные дитиокарбами-
новой кислоты H2NCS2H. При замещении одного из атомов водорода
углеводородным радикалом получают моноалкилдитиокарбаматы,
а при замещении двух атомов водорода — диалкилдитиокарбаматы.
Дитиокарбаматы щелочных металлов хорошо растворимы в воде.
По своим химическим свойствам они близки к ксантогенатам.
Так как дитиокарбаматы образуют значительно более труднораст-
воримые соединения с катионами тяжелых цветных металлов, чем
ксантогенаты, они обладают и более сильными собирательными дей-
ствиями. Некоторые из дитиокарбаматов могут успешно флотиро-
вать окисленные минералы свинца и меди без предварительной суль-
фидизации. При окислении дитиокарбаматов образуются тиурамди-
сульфиды.
Произведения растворимости диэтилдитиокарбаматов
различных металлов (по данным И.А. Каковского [47] )
Zn[ (С2 Hs)2 NCS2]2....................................8,6 • 1017
Cd [(С2 Hs)2 NCS2]2....................................6,3 • ICT22
Pb [(C2 H5) 2 NCSJ 2...................................1,4-KT23
Hg [(C2 Hs)2NCS2]2................................•• . . 1,4- 10_44
Ag (C2 Hs)2 NCS2 ......................................4,4 • 10 21
Cu (C2 Hs)2 NCS2 ......................................5,0 • 1СГ22
Cu [(C2 H5)2 NCS2]2....................................1,4 • 10~31
Дитиокарбаматы окисляются легче, чем ксантогенаты и дитио-
фосфаты.
Серосодержащие неионогенные собиратели
Диксантогены — продукты окисления ксантогенатов. Они труд-
но растворяются в воде. По данным И.А. Каковского [47], раство-
римость диксантогенов нормальных спиртов в воде выражается урав-
нением: lg Sn = — 5 - 1.257 (п — 2), где п — число атомов углерода
исходного спирта.
Диксантогены в присутствии восстановителей, например сульфид-
ных ионов, при высоком pH восстанавливаются, образуя ион ксан-
тогената.
При взаимодействии с металлами и сульфидными минералами дик-
сантогены образуют ксантогенаты соответствующих металлов. Низ-
кая растворимость диксантогенов в воде при применении их в качест-
ве собирателей обусловливает необходимость более длительного вре-
мени кондиционирования или подачу их в операцию измельчения.
В ряде случаев дисульфиды, в частности диксантоген, могут иметь
некоторые преимущества перед анионным реагентом вследствие то-
го, что дисульфиды более устойчивы в кислой среде, не связывают-
34
ся присутствующими в растворе катионами тяжелых металлов; ди-
сульфиды могут быть использованы при селективной флотации суль-
фидных минералов в присутствии окисленных [47].
Тионокарбаматы. Известным собирателем из класса тионокарбаматов
является реагент Z — 200, имеющий формулу изо—С Н„ ОС
3 7 xnh-c2h5.
Тионокарбаматы в водных растворах существуют в нескольких
таутомерных формах
' S /SH S~
ROC < -ROC< - [ROC< ]+H_O
XNH-Rj XNRX ^NHR/ 2
1 II III
В кислой и нейтральной средах преимущественно существует I фор-
ма, в щелочной — частично II, при высоких pH тионокарбамат перехо-
дит в ионную форму III.
Использование тионокарбаматов в качестве эффективных соби-
рателей при флотации сульфидных руд определяется селективностью
их действия по отношению к пириту.
По силе собирательного действия тионокарбаматы — более слабые
собиратели, чем ксантогенаты.
Аллиловые эфиры ксантогеновой кислоты. В США применяют в
качестве собирателей аллиловый эфир амилксантогеновой кислоты
(S —3302) и аллиловый эфир бутилксантогеновой кислоты (S —3461).
Они оказались эффективными собирателями при флотации медно-мо-
либденовых руд. В СССР из группы аллиловых эфиров ксантогеновой
кислоты Гинцветметом предложен реагент АБ-1.
Оксигидрилъные собиратели
Карбоксильные или жирнокислотные собиратели1 получили боль-
шое распространение в практике флотации несульфидных минералов.
Наиболее широко их применяют при флотации солеобразных мине-
ралов, оксидов и некоторых силикатов.
Жирные кислоты разделяются на предельные и непредельные (с
двойными и тройными связями в радикале). К первым относятся кис-
доты, встречающиеся в природе с 12, 14, 16 и 18 атомами углерода в
радикале. К природным непредельным жирным кислотам относятся
олеиновая, линоленовая и линолевая кислоты с 18 атомами углерода.
Наиболее высокими собирательными свойствами обладают олеиновая
и линоленовая кислоты.
Большинство высших ненасыщенных жирных кислот при нормаль-
ных условиях — жидкости, а соответствующие насыщенные кисло-
1 Карбоксильные собиратели, содержащие алифатический радикал, принято на-
зывать жирнокислотными собирателями.
35
Таблица 1.6
Физико-химические свойства жирных кислот _
Кислота Формула Молеку- лярная масса Темпера- тура плав- ления, С Раствори- мость при 20°С, моль/л
Лауриновая сн3(сн2)10соон 200,32 44,2 1,2 • 10~5
Тридециловая сн3(сн2)п соон 214,34 40,5 8,76 • 10
Миристиновая сн3 (сн2) 12 СООН 228,38 53,9 110° * л 7
Пальмитиновая СН3(СН2)14 соон 256,43 63,1 6-ю
Стеариновая СН3(СН2)16СООН 284,48 .69,6 3 • 10 7
Олеиновая CH (СН ) СН-СН(СН ) соон 27 282,47 - 3,55 • 10-6
Элаидиновая (трансолеиновая) СН3 (СН2) 7 сн-сн (СН ) соон 282,47 - -
Линолевая СН3(СН2)4СН = СНСН2 = = СН(СН2)7 соон 280,43 -5; -5,2
Линоленовая СН3(СН2СН=СН)3 (СН2)7 соон 278,42 -11; -11,3 -
ты — твердые вещества. При флотации их применяют в виде эмуль-
сий в керосине или других органических растворителях, а в случае
использования мыл — в виде водных растворов. Химические форму-
лы, температура плавления и растворимость различных жирных кис-
лот приведены в табл. 1.6. Присутствие двойных связей значительно
Таблица 1.7
ККМ различных карбоновых кислот и их солей
(по данным М. Фюрстенау и Б. Пальмера [55] )
Наименование кислот и солей ККМ, моль/л Температура определения ККМ, °C
Кислота:
лауриновая 5,7 • 10-2 27
миристиновая 1,3 • 10 ~2 27
пальмитиновая 2,8 • 10 3 27
стеариновая 4,5 • 10 4 27
Лаурат натрия 2,6 • 10 2 25
Миристат натрия 6,9- 10~3 25
Пальмитат натрия 2,1 10~3 50
Стеарат натрия 1,8 • 10 3 50
Стеарат калия 4,5 10~4 55
Олеат натрия 2,1 • IO’3 25
Олеат калия 8 10 4 _ 25
Элаидат натрия 1,4 • 10 41
36
превышает растворимость по сравнению с ненасыщенными кислотами.
Высшие жирные кислоты являются слабыми. В воде они диссоци-
ируют по уравнению RCOOH RCOO- + Н+. Константа диссоциации,
или константа кислотности олеиновой кислоты/Са = [RCOO-] [Н+] /
/[RCOOH] 1,08 10-5 и рК^-4,1 при 25°С. У всех карбоновых кис-
лот рК^ изменяется в пределах 4,7 ± 0,5.
Щелочные мыла карбоновых кислот значительно лучше раствори-
мы, чем кислоты. Для жирных кислот и их щелочных мыл характер-
но образование мицелл: ниже определенной концентрации они раство-
ряются в виде молекул или ионов, а выше этой концентрации, называ-
емой критической концентрацией мицеллобразования ККМ, — в виде
коллоидов. В табл. 1.7 приведены ККМ жирных кислот и мыл.
Наиболее полные данные получены Дю Ритцем [53] при опреде-
лении произведения растворимости мыл высших жирных кислот (табл.
1.8). Изменение произведения растворимостей карбоксилатов каль-
ция вследствие изменения дисперсионного взаимодействия углево-
дородной цепи с увеличением ее длины приведено ниже по данным
М. Фюрстенау и Б. Пальмера [55] .
Число атомов
углерода............ 8 9 10 11
Произведение раст-
воримости.......2,69 • 10 7,94 • 10 4.78 • 10 2,6 10
Число атомов -
углерода........... 12 13 14 16 18
Произведение раст- '
воримости.......2,5-10 3 5,01-10 14 2,19-10 3,8-10 2,04 -10 °
Широкое применение в качестве заменителей олеиновой кислоты
в практике флотации нашли талловые масла (сырое и дистиллирован-
ное) и жирные кислоты таллового маета (ректифицированное тал-
ловое масло). В сыром талловом масле содержатся кислоты (%) : оле-
иновая 28 - 43; линолевая 38 — 65; линоленовая 0,5 - 2; пальмитино-
вая 4 — 10 и столько же стеариновой. Кроме того, содержатся при-
меси смоляных и других кислот. Дистиллированное талловое масло
получают дистилляцией сырого таллового масла с целью снижения
содержания смоляных кислот.
Нафтеновые кислоты, содержащиеся в нефтях, являются карбо-
новыми кислотами циклического строения. При взаимодействии неф-
тяных дистиллятов с едкой щелочью происходит омыление и образуется
мылонафт. Устойчивость мыл нафтеновых кислот с катионами металлов
изменяется в следующем ряду: Си > Zn > Ni > Со > Fe > Мп > Mg.
Мылонафт применяется как заменитель олеиновой кислоты при
флотации барита, апатита и других солеобразных минералов, в неко-
торых случаях он йспользуется также в качестве вспенивателя. При
взаимодействии мылонафта с серной кислотой образуется асидол (пред-
37
Произведение растворимости некоторых
Кислота Н+ К+ Ag+
Пальмитиновая 1,58 • 10~13 6,3 • 10'6 6,3 • IO'13
Стеариновая 1,58 • 1014 7,9 • IO"7 7,9 • 1014 '
Олеиновая 5,01 • IO’13 1,99- 10'6 1,26 • 10-11
Кислота v 2 + Fe Ni2 + Мп2 +
Пальмитиновая Стеариновая Олеиновая 1,58 • 10“18 2,5 • Ю-20 3,98 10~16 5,0 • 10"19 3,98 • Ю-20 2 • 10-Х6 3,98 IO’19 2,0 • IO”20 5,01 10~16
ставляющий собой смесь нафтеновых кислот), который также исполь-
зуется при флотации.
Алкилсульфаты и алкилсульфонаты. Для успешной флотации не-
обходимы длинноцепочечные собиратели этого типа с числом атомов
углерода в углеводородном радикале более 10. Это - органические
флотационные реагенты, являющиеся производными серной кисло-
ты, содержащие углеводородный радикал и сернокислотный остаток.
Соединения, имеющие сульфонатную функциональную группировку
9
— S — О — ,относятся к классу сульфоновых кислот, а содержащие суль-
0 0
фатную функциональную группировку —О—^—О— — к классу алкил-
сульфатов или сульфоэфиров. О
В качестве собирателей находят применение натриевые соли алкил-
сульфатов и сульфонатов, содержащие углеводородные радикалы жир-
ного ряда, а также алкилсульфаты, имеющие алкиларильный радикал
общей формулы ^SO3Na.
К ним относятся реагенты ДС (детергент советский),
азолят и мерзолят.
Алкилсульфаты и алкилсульфонаты относятся к сильным кисло-
там, их рКа составляет около 1,5. При действии щелочей на алкилсуль-
фаты и алкилсульфонаты образуются соответствующие соли.
38
Таблица 1.8
мыл жирных кислот при 20 ° С
РЬ2 + Си2 + -7 2 + Zn Cd2 +
1,26 • 10“23 3,98 10“25 1,58 • IO’20 2,51 • 10“22 1 • 10“23 3,98 • IO’19 1,99 10“21 6,3 ю“23 5 • 10“18 6,3 • 10“21
Продолжение табл. 1.8
Са2+ Ва2 + Mg2 + А13+ Fe2+
1 • 10“18 2,5 • 10“20 4«10“16 2,5 • 10“18 1,9 • 10“ 20 1,26 10“15 3,16 • ю“17 2 10“18 1,58 10“14 6,3 10“32 2,5 10“ 34 1 • 1О“30 5 • 10“35 6,31 10“35
Растворимость кальциевых солей сульфонатов
различной молекулярной массы
(по данным М.Фюрстенау и Б. Паль мер а [55] )
Число атбмов углерода в
радйкале................. 10 12 14 16
Произведение раствори-
мости..................... 8,5 10~9 4,67 • 10 11 2,88 • 10“14 1,58 • 10-16
Важной характеристикой этих собирателей является ККМ. С уве-
личением длины углеводородной цепи ККМ алкилсульфатов и алкил-
сульфонатов уменьшается (табл. 1.9).
Эти флотационные реагенты - более слабые собиратели, чем кар-
боновые кислоты, но они более селективны, например, при разделе-
нии барита и кальциевых минералов, нефелина и других алюмосили-
катов, полевого шпата, кварца и др. Они не чувствительны к солям
жесткости и лучше растворимы, чем жирные кислоты. Алкилсуль-
фонаты обладают большими пенообразующими свойствами по срав-
нению с алкилсульфатами. Последние иногда используются в качест-
ве эмульгаторов карбоновых кислот и минеральных масел.
Алкилгидроксамовые кислоты. В практике флотации руд редких
металлов находят применение алкилгидроксамовые кислоты, являю-
щиеся основной частью реагента ИМ-50. Разработанный из доступных
технических продуктов реагент ИМ-50 содержит алкилгидроксамовые
кислоты с С7 - С9.
39
Таблица 1.9
ККМ различных алкилсульфатов и алкилсульфонатов
(по данным М. Фюрстенау и Б. Пальмера [55])
Наименование алкилсульфатов и алкилсульфонатов Молеку- лярная масса ККМ, моль/л Температу- ра опреде- ления ККМ, °C
Октилсульфат натрия 232,2 1,3 • ю-1 25
Децилсульфат натрия 260,3 3,3 10 2 25
Додецилсульфат натрия 288,3 8,2 • 10 3 25
Тетра децил сульфат натрия 316,4 2 • 10 3 25
Гексадецил сульфат натрия 344,4 2,1 • 10 4 25
Октадецилсульфат натрия 372,5 з - ю 4 40
Октил сульфонат натрия 216,2 1,6 • 10 1 25
Децил сульфонат натрия 244,3 4,2 10 2 25
Додецилсульфонат натрия 272,3 9,8 10 3 25
Тетрадецилсульфонат натрия 300,4 2,5 • 10 3 40
Гексадецил сульфонат натрия 328,4 7 • 10 4 50
Октадецилсульфонат натрия 356,5 7,5 • 10 4 57
Додецилбензилсульфонат натрия 348,5 1,2 • 10 3 75
Дибутилнафталинсульфонат натрия 342,4 2,9 • 10 4 —
Гидроксамовые кислоты — довольно устойчивые соединения при
различных концентрациях и в широком ^диапазоне pH (3 — 10).
Растворимость (в %) индивидуальных гидроксамовых кислот,
входящих в состав реагента ИМ-50(по данным В.И. Рябого [47])
Капронгидроксамовая (С6)......................................4,63
Энантгидроксамовая кислота (С7)...............................0,81
Каприлгидроксамовая кислота (С8)..............................0,170
Пеларгонгидроксамовая кислота (С9)............................0,032
Капрингидроксамовая кислота (С1о).............................0,005
Константы диссоциации гидроксамовых кислот (С6 — С8), вхо-
дящих в реагент ИМ-50, равны примерно 2 • 10~10, что указывает на
их слабые кислотные свойства [47].
Произведения растворимости некоторых солей
кайрилгидроксамовой кислоты (по данным Н.Е. Щукиной и др.)
+ 17-3+ т 3+ т„3+ -.4 +
Са Fe La In Ti
0,37 Ю~10 2,46 • 10 15 1,94 • 10-18 1,28 • 1O~20 1 • 10~10
Кроме того, определены произведения
растворимости энантгид-
роксамата (С7) и пеларгонгидроксамата железа (CL), которые при
pH 3 оказались равными соответственно 1,66 • 10~13и 1,38 • 10~ 8.
40
Алкилгидроксамовые кислоты с С6 — С1о обладают сравнитель-
но слабыми поверхностноактивными свойствами. С увеличением дли-
ны углеводородного радикала поверхностноактивные свойства гид-
роксамовых кислот как и других соединений гетерополярного строе-
ния возрастают.
Реагент ИМ-50 содержит (в %): кислоты гидроксамовые 72 - 75;
карбоновые 8—12; влага 10 — 15 и неорганические примеси 2,5 — 4
[30].
Катионные собиратели
К катионным собирателям относятся амины и четвертичные ам-
мониевые основания, причем основное значение при флотации име-
ют амины.
Катионные собиратели нашли промышленное применение при фло-
тации фосфоритов, окисленных минералов тяжелых металлов, слю-
ды, бериллиевых и полевошпатовых руд, при обратной флотации квар-
ца в процессе обогащения железных руд и при обогащении раствори-
мых солей.
По своему строению амины — органические основания. В зависи-
мости от числа углеводородных радикалов, присоединенных к азоту,
N R R
различают первичные R-N^ , вторичные ^N—Н и третичные R—
ХН Rz \ R
амины. Когда к азоту присоединяется четыре углеводородных ради-
R R
кала, образуются четвертичные аммониевые основания типа N— ОН.
R^ \ R
Если азот входит в состав циклического кольца, например пиридина,.
образуются пиридиниевые основания типа
Амины с коротким радикалом хорошо растворяются в воде. С
увеличением длины углеводородного радикала растворимость ами-
нов уменьшается. Растворимость первичных аминов и ККМ их солей в
зависимости от числа атмов углерода в углеводородном радикале привв'
дена в табл. 1.10.
Основность аминов определяется константой основности К
кв = ([RNH3+] [ОН")) / [RNHJ .
Константы основности первичных аминов примерно одинаковы и
составляют приблизительно 4 10~4. Вторичные амины обладают бо-
41
Таблица 1.10
Физико-химические свойства аминов
Число атомов углерода в цепи Растворимость оснований аминов, моль/л ККМ солей аминов, моль/л
10 510“4 3,2 • Ю“2
12 2• 10-5 _ 2 1.3 10
14 1 • ю 6 4,1 10 3
16 — 8,3 • 10 4
18 — 4,0- 10 4
Примечание: ККМ приводятся для случая, когда соли амина присутству-
ют преимущественно в ионной форме при естественном pH.
лее сильными основными свойствами, третичные — более слабыми.
Четвертичные аммониевые основания обладают свойствами более силь-
ных оснований, растворимость их в воде выше и в незначительной сте-
пени зависит от pH раствора, они полностью диссоциируют на ионы.
Будучи органическими основаниями амины и четвертичные аммо-
ниевые основания способны образовывать соли как с минеральными,
так и органическими кислотами. Так как эти соли более растворимы
в воде, чем свободные основания, то при флотации обычно использу-
ют их солянокислые или уксуснокислые соли. Разбавленные раство-
ры солей аминов — истинные растворы: при более высокой концен-
трации образуются коллоидные растворы, содержащие ионные и мо-
лекулярные мицеллы (см. табл. 1.10).
Амины образуют комплексные соли с медью, цинком, кадмием,
никелем, кобальтом и др.
Точные данные о растворимости солей аминов отсутствуют. А.Ф. Таг-
гарт и Н. Арбайтер установили следующий относительный ряд раство-
римостей солей аминов: молибдат, ванадат < силикат < 2,5 • 10“4
моль/л < карбонат, вольфрамат, хромат, фосфат < 7,5-10—4 моль/л <
< тиосульфат < бикарбонат, сульфит, двухосновный арсенат < 12,5 • 10“4
моль/л < сульфат < 25-10 4 моль/л < фторид, борат, хлорид, суль-
фид, одноосновный фосфат > 25 -10 4 моль/л.
В зарубежной практике при флотации железных руд применяют-
ся также диамины, имеющие общую формулу 2 и эфироами-
^NH
ны R-O-(CH2-CH2-O)n-CH2-CH2-NH2 (реагенты Mg-83 и Mg-98).
Mg = 98).
Аполярные собиратели
Молекулы аполярных собирателей не содержат полярной (функ-
циональной) группы. Они представляют собой углеводороды, ко-
торые не способны диссоциировать и практически не растворяют-
42
ся в воде. Эти собиратели сорбируются преимущественно на минера-
лах, поверхность которых плохо смачивается водой, т.е. у которых
О >0. В этом случае капельки аполярных собирателей частично вы-
тесняют воду с поверхности минерала и закрепляются на ней. В ка-
честве аполярных собирателей применяются керосин, соляровое мас-
ло, индустриальные масла, мазут и др. Все они представляют собой
смесь углеводородов.
Аполярные собиратели применяют при флотации минералов, об-
ладающих естественной флотируемостью для уменьшения их смачи-
ваемости (таких как графит, сера, тальк, молибденит и др.) или как
дополнительные собиратели, добавляемые при флотации минералов
собирателями с гетерополярной структурой. При этом, очевидно, апо-
лярные собиратели сорбируются на участках поверхности минералов,
частично гидрофобизированных основным собирателем. Добавки апо-
лярных собирателей, усиливая гидрофобизацию, созданную гетеро-
полярным собирателем, позволяют флотировать более крупные зер-
на минералов и их сростки с депрессируемыми минералами или ми-
нералами пустой породы.
4.2. Модификаторы флотации
Активаторы. Роль активаторов флотации заключается в создании
условий, благоприятствующих закреплению собирателя на поверхнос-
ти минерала. В соответствии с этим при флотации анионным собира-
телем в качестве активаторов используются катионы меди, железа,
кальция, магния и др. При флотации катионным собирателем акти-
ваторами являются такие анионы, как Fe~, SiF2 , S2- и др. Нередко
одни и те же соединения могут быть как активаторами, так и депрес-
сорами, в зависимости от их расхода и условий применения. В отдель-
ных случаях в качестве активаторов применяют реагенты, удаляющие
избыток продуктов окисления с поверхности сульфидных минера-
лов. В то же время частичное окисление сульфидных минералов — не-
обходимое условие для их флотации. В данном случае кислород явля-
ется активатором.
Подавители (депрессоры). Подавление флотации может быть обус-
ловлено вытеснением собирателя с поверхности минерала, гидрофи-
лизацией поверхности сорбированными ионами или молекулами деп-
рессора (без вытеснения собирателя), дезактивацией поверхности вслед-
ствие вытеснения или связывания активирующих ионов. В ряде слу-
чаев могут проявляться различные механизмы депрессии, например
частичное вытеснение собирателя и гидрофилизация поверхности сор-
бированным депрессором.
В практике флотации в качестве депрессоров применяется широ-
кий ассортимент различных неорганических и органических соедине-
ний. Неорганические депрессоры в зависимости от характера депрес-
сирующего иона могут быть подразделены на катионные и анионные;
43
органические депрессоры могут быть представлены как ионогенны-
ми, так и неионогенными соединениями.
Основные депрессоры
Неорганические:
катионные
анионные
молекулы и мицеллы
3+ 3+ 2+
Растворимые соли Al , Fe , Fe ,
Са2+, Mg2+, Na+, К+ и др.
Na2 S,NaHS,Na2 S2 03, Na2 SO3, KCN,
Zn SO4,K2 Zn(CN)4,K3 Fe(CN)6,
K4 Fe(CN)6, K2 Cr O4, K2 Cr2 O? ,
Na0 SiO,,Na, SiF,,Na, POd,Na(POJ ,
2 3 2 о 3 4’ 4 3' о
Na4 P2 O7,Na2 P3 O10 и др.
Na2 О tn SiO2 (жидкое стекло), соли
кремневых кислот Са, Al, Fe и др.
Органические:
ио но генные •.
щавелевая кислота
НООС-СООН
карбоксиметил целлюлоза
сульфатцеллюлоза
44
этан суп ьфонатцелл юло за
танниды (гидролизуемые)1
сульфитные щелока
барда сульфитных щелоков
неионогенные:
Продукт конденсации эфиров глюкозы
и фенолкарбоновых кислот
Кальциевые соли лигносульфоновых
кислот и сахара
То же
Водорастворимый крахмал
крахмал
декстрин
1 За рубежом находят применение также конденсированные танниды, напри-
мер квебрахо, в состав которых входят многоатомные фенолы.
К числу органических депрессоров относятся крахмал и крахмал-
содержащие отходы, декстрин, танниды, квебрахо, карбоксиметил-
целлюлоза или карбоксиэтилцеллюлоза и их производные (сульфо-
эфиры, целлюлозы, комплексные медно-аммиачные соединения цел-
люлозы) , сульфитцеллюлозная барда и др. Эти соединения отно-
сятся к классу высокомолекулярных веществ. В состав их входят силь-
но гидратированные полярные группы такие, как — ОН, СО ОН, —NH2,
—SO3H и др.
Регуляторы ионного состава пульпы, стабилизаторы пены и эмуль-
гаторы. Регуляторы pH среды (кислоты, щелочи и соли), гидролиз
которых вызывает кислую или щелочную реакцию раствора, не толь-
45
ко выполняют роль модификаторов флотации, когда гидроксильные
или водородные ионы являются активаторами или подавителями, но
имеют и самостоятельное значение. Применение их вызвано необходи-
мостью создания оптимального pH среды для действия каждого реа-
гента, используемого при флотации. Это связано с тем, что многие
собиратели, активаторы, подавители и вспениватели в водных раст-
ворах сильно гидролизованы, и соотношение между концентрация-
ми ионов и молекул реагента определяется pH раствора. Некоторые
из этих реагентов, а также и другие электролиты применяются для
связывания различных нежелательных катионов, активирующих фло-
тацию депрессируемых минералов или выводящих из процесса соби-
ратель в виде нерастворимых солей.
Некоторые электролиты влияют на стабилизацию пены, несколь-
ко повышая поверхностное натяжение на границе раздела жидкость —
воздух. На структуру пены и ее устойчивость могут действовать мно-
гие реагенты, способные сорбироваться на границе раздела жидкость —
газ, либо менять ионный состав жидкой фазы пульпы. Эмульгатора-
ми являются реагенты, способствующие образованию стабильных эмуль-
сий флотореагентов, плохо растворимых в воде.
43. Флокулянты и диспергаторы
Различают три способа образования агрегатов: коагуляцию элек-
тролитами, флокуляцию гидрофобизирующими реагентами и поли-
мерами.
Коагуляция частиц осуществляется известью, хлористым кальци-
ем, железным купоросом, хлористым железом, алюмокалиевыми квас-
цами, сульфатом магния, серной кислотой и др.
Флокуляция частиц гидрофобизацией происходит при действии
реагентов-собирателей таких, как ксантогенаты, жирные кислоты и
их мыла, алкилсульфаты, амины и др.
Для флокуляции частиц высокомолекулярными реагентами широ-
ко используются полиакриламид, степень гидролиза амидных групп
которого составляет 30 — 33 %, а молекулярная масса достигает 105.
В общем виде полиакриламид может быть представлен форму-
лой г -I Г ~1
-сн2-сн-
6=0
Ан2
-СН,-СН-
С=О
।
ОН
На базе полиакриламида получают также реагенты типа ’’Полинак”
- сн, -сн - сн_ - сн - сн, - сн-
2 I 2 I 2 I
CN оо & о
nh2 он
46
Флокулирующими свойствами обладают также растворы поливи-
нилового и других высокомолекулярных спиртов, сополимеры ви-
нилацетата с малеиновым ангидридом, продукт конденсации кубо-
вых остатков и дихлорэтана (КОД), продукт конденсации кубовых
остатков дихлорэтана и таллового масла (КОДТ), оксиэтилцеллюло-
за, карбоксиметилцеллюлоза (КМЦ, тцлоза), мочевиноформальде-
гидные смолы, хитозан и др.
Все более широкое применение находит полиэтиленоксид (поли-
окс) [—СН2— СН2— О—] . Наиболее эффективны полиоксы с моле-
кулярной массой (5 4- 7) 106 и более.
Из природных органических соединений, проявляющих флоку-
лирующие свойства, можно назвать крахмал (картофельный, пше-
ничный и др.), глютен (паточный продукт при производстве крахма-
ла), гуартек или калактазол (смола из растений гуар, США), столяр-
ный клей, желатин. Известны рекомендации по использованию муки
из водорослей, картофельной мезги, жмыхов, шротов и др. Эти реа-
генты применяют также в качестве подавителей.
Явление, обратное коагуляции и флокуляции — пептизация (дис-
пергирование или стабилизация суспензии). Пептизация осуществля-
ется в основном введением в пульпу реагентов, способствующих гид-
рофилизации частиц. Таким реагентом в первую очередь является жид-
кое стекло, а иногда едкий натр и сода.
Пептизации способствует снижение концентрации коагулирующе-
го электролита, например промывка осадка, а также механическое
воздействие на пульпу.
Изменение pH среды введением соответствующих реагентов может
способствовать и коагуляции и пептизации частиц.
В процессе обогащения магнетитовых руд после выделения кон-
центрата на магнитных сепараторах наблюдается магнитная флоку-
ляция твердых частиц.
4.4. Пенообразователи
и пенообразующие свойства собирателей
Пенообразователи имеют гетерополярную структуру. При адсор-
бции на границе раздела жидкость — воздух углеводородный ради-
кал ориентируется в воздушную фазу. Полярная группа пенообразо-
вателя взаимодействует с водой и тем самым затрудняет коалесцен-
цию пузырьков при приближении их друг к другу в объеме пульпы
и слое пены. В одном гомологическом ряду по мере увеличения дли-
ны радикала повышается способность пенообразователей к адсорб-
ции на границе раствор — газ, но уменьшается их растворимость. Поэ-
тому нельзя применять как коротко-, так и длинноцепочечные пено-
образователи.
В практике используют пенообразователи, большей частью со дер-
47
жащие 5-10 атомов углерода в радикале и растворимостью от 0,3
до 5 г/л.
Пенообразователи могут быть как неионогенными, так и ионо-
генными. Последние менее широко используют при флотации.
За рубежом также применяют неионогенные пенообразователи
под названием Дауфрос-200, Дауфрос-250 и Аэрофрос-65, представ-
ляющие собой смесь полипропиленгликолей, и реагент триэтоксибу-
тан (ТЭБ).
Основные пенообразователи
Неионогенные:
сосновое масло . . ................Смесь терпеновых спиртов, терпеновых
углеводородов и др.
Оксаль Т-80.........................Смесь производных гетероциклических
спиртов. Одно- и двухатомные спирты
диоксанового и пиранового ряда
циклогексанол....................
диметаловый эфир фталевой кислоты
спирты:
метил изо бутил карбинол............R-ОН, где R имеет 5-8 атомов углерода
пеноо бразователи ;
опс.................................Серия пенообразователей ОПС, ОПСМ и
ОПСБ - моноэфиры полипропиленглико-
лей типа R -О - (С3 Н О) Н
Ионогенные:
крезол.............................СН С, Н ОН
ксиленол и др......................С6 Н3 (СН3) 2 ОН
Кроме пенообразователей применяются эмульгаторы — вспени-
ватели ОП-4, ОП-7, ОП-Ю — продукты взаимодействия высокомо-
лекулярных алкилфенолов с оксидом этилена. Эти эмульгаторы жир-
ных кислот и вспенивателей уменьшают расход собирателей и пони-
жают устойчивость пены, что способствует повышению селективнос-
ти флотации.
48
Многие собиратели сорбируются не только на поверхности разде-
ла жидкость — твердое тело, но и на границе раздела газ — жидкость.-
Это определяется длиной и строением углеводородного радикала,
полярной группы и остаточной концентрацией, зависящей от прочнос-
ти закрепления на поверхности раздела жидкость — твердое тело. Ко-
роткоцепочечные ксантонаты (С2 — С5), прочно закрепляющиеся на:
твердой поверхности, не обладают пенообразующими свойствами. Тог-
да как, например, диэтилдитиофосфат, обладающий двумя радика-
лами и менее прочно, чем этилксантогенат закрепляющийся на твердой
поверхности, является хорошим пенообразователем. Все остальные
применяющиеся в практике собиратели также менее прочно, чем ксан-
тогенаты, сорбирующиеся минералами, и обладающие более развитым
углеводородным радикалом, являются собирателями — пенообразо-
вателями.
5. ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ДЕЙСТВИИ
ФЛОТАЦИОННЫХ РЕАГЕНТОВ
5.1. Виды сорбции флотационных реагентов
Все виды взаимодействия на границе двух фаз вне зависимости от
природы действующих сил могут быть выражены следующим общим
уравнением:
4F° = R Т In К, (1.21)
где AF0 — изменение стандартной свободной энергии; R и Т — газо-
вая постоянная и абсолютная температура; К — константа равнове-
сия химической реакции или константа адсорбционного равновесия.
Под сорбцией понимается процесс поглощения реагентов поверх-
ностью минералов независимо от механизма поглощения (физичес-
кая и химическая адсорбция и гетерогенная химическая реакция).
Сорбция на границе двух фаз может происходить в результате хи-
мических и физических взаимодействий. Разница между ними заклю-
чается в том, что химическое взаимодействие сопровождается пере-
стройкой электронных оболочек связывающихся атомов, тогда как
при физическом взаимодействии атомы в молекулах сохраняют в ос-
новном свою индивидуальную структуру.
Сорбция, обусловленная химическими силами, отличается большей
прочностью, определяемой энергией сорбции, практической необра-
тимостью взаимодействия и избирательностью действия.
Неоднородность минеральной поверхности, возможность различ-
ных форм фиксации одного и того же реагента, наличие в пульпе кон-
курирующих ионов осложняют описание явлений, происходящих при
взаимодействии минералов с реагентами. Тем не менее сорбция фло-
тационных реагентов на поверхности гетерополярных кристаллов,
4—6426
49
к которым относится большинство минералов, может быть рассмот-
рена в следующем порядке:
химическая реакция и хемосорбция неизоморфных ионов;
первичная обменная адсорбция изоморфных ионов во внутренней
обкладке двойного электрического слоя;
потенциале предел яющая (избыточная) адсорбция одного из соб-
ственных ионов во внутренней обкладке двойного электрического
слоя;
вторичная сорбция — обмен ионов во внешней обкладке двойно-
го электрического слоя. При этом возможны неспецифическая адсорб-
ция любого иона и специфическая адсорбция ионов;
адсорбция молекул на границе двух фаз, включая и границу раз-
дела газ — жидкость.
Химическая реакция и хемосорбция неизоморфных ионов. В не-
которых случаях при действии флотационных реагентов на минера-
лы происходит многослойное покрытие минеральной поверхности
продуктами их взаимодействия, т.е. образуется новая твердая фаза.
Условия ее образования будут определяться соотношением произве-
дений растворимости соединений на поверхности до и после взаимодей-
ствия реагентов с минералом, т.е.
а с d b
Kv=LJL2=CxlC2’ (1-22)
где К — константа равновесия; Lx и L2 — произведение растворимос-
ти твердых фаз до и после взаимодействия реагентов с минералами;
Cj и С2 — равновесные концентрации вступающих во взаимодействие
и образующихся ионов (или молекул); a, b, с, d - стехиометричес-
кие коэффициенты гетерогенной химической реакции.
Это уравнение справедливо, если гетерогенная реакция идет в од-
ну стадию. Если же реакция идет в несколько стадий, то предпола-
гается, что равновесная концентрация промежуточных соединений
примерно постоянна, т.е. не зависит от исходных концентраций взаи-
модействующих соединений. Так как гетерогенная химическая реакция
идет в сторону образования более труднорастворимых (или более проч-
ных) соединений, то для того, чтобы реакция была возможна, должно
быть выполнено условие L i > L 2.
Когда химическое взаимодействие флотационного реагента с ми-
нералом ограничено пределами монослоя, то такой процесс представ-
ляет химическую адсорбцию (или сорбцию), сокращенно называемую
в литературе по флотации и в ряде других источников хемосорбцией.
При образовании новой фазы скорость сорбции зависит от скорости
химического взаимодействия и скорости диффузии через слой продук-
тов взаимодействия и определяется скоростью более медленного процес-
са. Естественно, что гетерогенная химическая реакция по сравнению с
хемосорбцией — более длительный процесс, который затормажива-
ется, если продукты взаимодействия не отслаиваются.
50
В результате хемосорбции неизоморфных ионов образуются по-
верхностные соединения, являющиеся как бы зародышем новой твер-
дой фазы. Хемосорбция может происходить при сколь угодно малой
концентрации сорбирующихся ионов, тогда как для гетерогенной хи-
мической реакции необходимо достижение концентраций, отвечаю-
щих произведению растворимости вновь образующегося объемного
соединения.
Помимо представлений, объясняющих хемосорбцию с точки зре-
ния образования обычных стехиометрических соединений, в настоя-
щее время развиваются взгляды, рассматривающие хемосорбцию с
позиций образования поверхностных координационных соединений,
связь в которых осуществляется за счет перекрывания заполненной
молекулярной орбитали донорного атома реагента со свободной ор-
биталью металла минерала. Для образования прочной связи необхо-
дима близость энергий и симметрии молекулярных орбиталей реа-
гента и минерала. С этих позиций считается, что наиболее эффектив-
ным для сульфидных минералов должно быть взаимодействие с S-до-
норными реагентами, т.е. с сульфгидрильными собирателями (ионо-
генными и неионогенными), а для несульфидных (окисленных) ми-
нералов с О-донорными реагентами, например оксигидрильными со-
бирателями [3, 10, 41 и др.] .
При сорбции ионогенных собирателей на поверхности минералов
необходимое условие для сохранения электронейтральности — обмен
с ионами, имеющимися на поверхности минерала. С этой точки зре-
ния понятна необходимость предварительного окисления сульфидных
минералов для сорбции сульфгидрильных собирателей.
Склонность сульфидных минералов к окислению объясняется спо-
собностью заполненных 3sp орбиталей серы перекрываться с вакантны-
ми орбиталями кислорода с образованием a-связи и дативной тг-свя-
зи, что приводит к образованию более полярной связи и благоприятству-
ет последующему обмену с ионогенными собирателями.
Некоторые авторы (например [41] и др.) рассматривают хемосорб-
цию как взаимодействие жестких и мягких кислот и оснований Льюиса.
Согласно этой теории, металлы относятся к кислотам, а реагенты — к
основаниям, и жесткие кислоты взаимодействуют предпочтительно с
жесткими основаниями, а мягкие кислоты — с мягкими основания-
ми. В соответствии с предложенной Р. Пирсоном [2] классифика-
цией катионов наиболее эффективное взаимодействие оксигидриль-
ных собирателей, относящихся к жестким основаниям, должно про-
исходить с минералами, содержащими такие катионы, как Fe3+, Nb5 ,
Та5 + , Ве2 + , Mg , Са2+, относящиеся к жестким кислотам.
Хемосорбция нецзоморфных ионов подчиняется уравнению Фер-
вея — Никольского - общему уравнению для обмена ионов незави-
симо от природы обмена
, llni2
12
(L23)
51
где Г и Г2 — сорбция обменивающихся ионов; пх и п2 — валентнос-
ти ионов.
Это уравнение применимо для однородной поверхности. Если по-
верхность неоднородна, то для каждого ее участка будут свои значе-
ния Г , Г2, С2 и, следовательно, для какого-то z-ro участка урав-
. нение будет иметь вид
1/и., 1/и.,, 1/и.. 1/и.,,
Л-, 11 !ГН “ = KiCi2 'ЧСн 12
Вследствие неоднородности поверхности минералов эксперимен-
тальные данные по хемосорбции неизоморфных ионов редко подчи-
няются уравнению (1.23).
С повышением температуры скорость гетерогенной химической
реакции хемосорбции растет, а количество сорбируемого соединения,
соответствующего равновесию, уменьшается, так как процесс экзо-
термичен. С увеличением исходной концентрации скорость и коли-
чество сорбируемого соединения растут до определенного предела:
для гетерогенной реакции — до насыщения, для хемосорбции — до
монослоя, и если процесс продолжается, то он переходит в гетероген-
ную химическую реакцию.
При флотации могут иметь значение гомогенные реакции с обра-
зованием нового растворимого соединения А + В = С + Д. В этом слу-
чае константа реакции
Кр = СС СД I СА СВ . (1-24)
где К - константа равновесия; СА, Св, Сс и Сд _ равновесные кон-
центрации вступающих в реакцию и образующихся соединений.
Если реакция идет ступенчато, то общее уравнение принимает вид
= *₽>• Kf>--KtP <L25>
где ~ полная константа образования; К , Кр2 • • • > Kpi ~ кон‘
станты равновесия ступенчатого образования.
Возможно также, что в результате взаимодействия реагента с труд-
норастворимым соединением, находящимся на поверхности минера-
ла, образуется растворимый, но устойчивый комплекс. В этом слу-
чае равновесие смещается в сторону образования того из соединений,
в котором соответствующий ион (допустим, катион минерала) свя-
зывается прочнее. Например, если на поверхности минерала имеется
трудно растворимое соединение МА, тогда концентрация катиона ме-
талла в растворе будет определяться произведением растворимости,
точнее произведением активности:
L=[M]'[A] или [М ] ' = L / [А ] .
При образовании устойчивого растворимого комплекса концен-
трация ионов металла в растворе будет определяться константой нес-
52
тонкости комплекса
*h = ОТ" [В]/[МВ] или [М]“ = Кп [МЯ]/[Я]. (1.26)
Если [7И] " < [7И] реакция пойдет в сторону образования раство-
римого, но более прочного комплекса. Если в системе возможно сту-
пенчатое образование нескольких комплексов, то необходимо учи-
тывать их константы нестойкости. Конкретным примером может слу-
жить дезактивация активированного ионами меди сфалерита циани-
дом с образованием растворимого комплекса К/ [Си (CN) 2 ] .
Химическая реакция и хемосорбция играют большую роль при
флотации, поскольку они охватывают область естественных измене-
ний поверхности минералов в процессе подготовки руд к обогаще-
нию (сюда относятся окисление поверхности сульфидных минералов,
приводящее к образованию поверхностных продуктов окисления,
а также образование пленок гидроксидов на поверхности некоторых
минералов, например оксидов железа), и взаимодействие минераль-
ной поверхности с вводимыми в пульпу флотационными реагентами —
собирателями, модификаторами флотации и регуляторами среды.
Первичная обменная адсорбция изоморфных ионов во внутрен-
ней обкладке двойного электрического слоя. Химическая адсорбция
ионов во внутренней обкладке двойного электрического слоя, спо-
собных образовывать с одним из ионов кристаллической решетки ми-
нерала изоморфные соединения, называется первичной, если она ог-
раничивается монослоем. Первичная обменная адсорбция изоморф-
ных ионов требует незначительной энергии активации, практически
не зависит от присутствия других неизоморфных ионов и характе-
ризуется большой скоростью.
При создании условий для диффузии изоморфных ионов в глубь
минерала (например, повышение температуры, высокая концентра-
ция в растворе изоморфных ионов и длительность процесса) могут
образовываться твердые растворы или смешанные кристаллы. Пер-
вичная адсорбция подчиняется уравнению (1.23); при одинаковой
валентности обменивающихся ионов это уравнение принимает вид
rjr2 = KCJC2 . (1.27)
Приняв максимальную адсорбцию равной сумме адсорбции обоих
ионов Гж = Г + Г2, из уравнения (1.27) получим следующее выра-
жение :
С, / Г2 = с21 (К +Cjrx. (1.28)
Когда С2/К = а изменяется незначительно и можно принять а = const,
то выражение (1.28) переходит в уравнение, аналогичное уравнению
Лангмюра
С/Г =а/Г00 + C/Ъ или ^/(1+^ CJ, (1.29)
где Кх = 1/д .
53
Таким образом, это уравнение описывает процесс обмена равно-
валентных ионов, когда изменяется адсорбция лишь одного обмени-
вающегося иона и при условии, что концентрация второго изменяет-
ся в незначительной степени. Этому уравнению, так же как и более
общему уравнению (1.22), подчиняется первичная адсорбция и, как
указывалось выше, адсорбция изоморфных ионов. Примером пер-
вичной адсорбции может служить активация сфалерита ионами меди
в нейтральной среде. Ионы меди только поверхностно изоморфны,
поэтому они сорбируются на поверхности. Экспериментально пока-
зано, что из поверхностного слоя они вытесняют ионы цинка. Менее
распространенный в практике, но еще более убедительный пример —
изоморфное замещение ионами кальция и магния ионов натрия в по-
левых шпатах при их депрессии.
Потенциалопределяющая адсорбция. Первичная адсорбция обус-
ловлена наличием на поверхности минерала некоторого избытка ка-
тионов или анионов, вследствие чего поверхность не является элек-
тронейтрал ьной.
Избыточная адсорбция одного из ионов поверхностного слоя ми-
нерала или изоморфных ионов по сравнению с другими в первичной
обкладке двойного электрического слоя определяет знак и величи-
ну заряда поверхности и называется потенциалопределяющей адсорб-
цией.
Потенциалопределяющая адсорбция описывается уравнением Нерн-
ста
= <pQ + R T/(nF In С), (1.30)
где у — общий скачок потенцила; — стандартный потенциал; F -
число Фарадея; п — валентность; С - концентрация потенциалопреде-
ляющих ионов.
Если принять, что R T[(nF) = b — постоянная величина, зависящая
от температуры и валентности ионов; а — величина адсорбции потен-
циале предел яющих ионов при концентрации (а точнее активности)
их в растворе, равной единице, то из уравнения Нернста можно вы-
вести уравнение сорбции Гп потенциалопределяющих ионов без вы-
теснения других ионов
Гп ± Z7 1nCn. (1.31)
Примером потенциалопределяющей адсорбции может служить ад-
сорбция ионов свинца или сульфатных ионов англезитом.
Вторичная адсорбция ионов во внешней обкладке двойного эле-
ктрического слоя. Вторичная адсорбция представляет собой обмен
ионов в поверхностном слое жидкости во внешней обкладке двой-
ного электрического слоя.
Различают вторичную адсорбцию ионов, обусловленную лишь эле-
ктростатическими силами, и вторичную адсорбцию, обусловленную
54
как электростатическим, так и химическим взаимодействием. Пос-
ледний вид адсорбции иногда называют специфической вторичной сорб-
цией ионов в слое Штерна.
В первом случае адсорбция определяется знаком и величиной за-
ряда поверхности. Она представляет собой сорбцию противоионов,
соответствующую по величине потенциалопределяющей сорбции с про-
тивоположным знаком. Адсорбироваться могут любые ионы со зна-
ком, противоположным знаку заряда поверхности. Поэтому присут-
ствие посторонних ионов того же знака и особенно более высокой
валентности соответственно снижает сорбцию каждого из сорбируе-
мых ионов. Вторичная физическая адсорбция в противоположность
хемосорбции протекает с большой скоростью. С увеличением темпе-
ратуры скорость и адсорбция снижаются. Адсорбция противоионов
в двойном электрическом слое выражается уравнением
Л = Чехр [-В'/<А ОЬ (1.32)
где гг- - радиус адсорбируемого иона; Ц- — концентрация адсорбируе-
мых ионов в объеме раствора; W — работа переноса ионов реагента
из бесконечности (объем раствора) к плоскости Штерна, W = ne£, где
п — валентность иона; е — заряд электрона: f - дзета-потенциал; k —
постоянная Больцмана.
Согласно существующим представлениям, в случае адсорбции во
вторичной обкладке двойного электрического слоя несульфидных
минералов длинноцепочных органических ионов, например алкил-
сульфатов, алкил карбоксилатов или алкиламинов, при определен-
ной плотности сорбционного слоя ионов возможно образование на
поверхности двумерных мицелл путем ассоциации углеводородных
радикалов сорбированных ионов за счет сил Ван-дер-Ваальса. При этом
вследствие более насыщенной концентрации в двойном слое по срав-
нению с объемом раствора ККМ в двойном электрическом слое
наступает раньше, чем в объеме раствора. В этом случае адсорбция
органических ионов будет определяться как электростатической сво-
бодной энергией взаимодействия, так и энергией, когезии органичес-
ких ионов на поверхности раздела и может быть выражена уравнением
Г1 = 2Г Сехр [“(««S' + «’„)/('<’’)] (1-33)
I сдр »»»
где Ф' — энергия когезии ионов, приходящаяся на одну группу СН2;
т — число ассоциирующихся групп СН2.
Специфическую адсорбцию ионов в слое Штерна можно опреде-
лить по уравнению
Г. = ~ri Рехр + <*WOb (1-34)
I I i с лр
где Ф — специфический адсорбционный потенциал.
Уравнение вторичной адсорбции можно также выразить следую-
щим образом. Если в уравнении (1.23) принять Г2 > 1\, а Г2 = const
55
и Cj = const, то после логарифмирования получим
In jTj = а ± Z? In С2, (1.35)
где а — постоянная, зависящая от константы равновесия; Ъ =п1/п2 —
постоянная величина.
Это уравнение описывает вторичную сорбцию ионов во внешней
обкладке двойного электрического слоя и может быть представле-
но в виде
In 1\ = а ± Ъ pH, (1.36)
т.е. оно описывает влияние pH среды на адсорбцию, например иона
кальция на берилле или кварце, активирующего флотацию этих ми-
нералов.
Адсорбция молекул на границе двух фаз. Адсорбция молекул по-
верхностью может происходить вследствие как химических, так и фи-
зических сил взаимодействия. В обоих случаях принято считать, что
адсорбция молекул описывается известным уравнением Лангмюра
(1-29).
Однако, как известно, уравнение Лангмюра имеет три ограниче-
ния (оно справедливо лишь для условий, когда поверхность однород-
на, взаимодействие адсорбируемых молекул друг с другом отсутству-
ет, адсорбция локализована), которые далеко не всегда выполняются.
Особенности адсорбции на границе жидкость - газ. Адсорбция на
поверхности раздела жидкость — газ описывается также взаимосвя-
занными уравнениями Лангмюра, Гиббса и Шишковского. По урав-
нению Гиббса
Г = -Cda/(R TdC), (1.37)
где С — концентрация, или активность, раствора; о — поверхностное
натяжение.
По уравнению Шишковского
Да = 51n (А С + 1), (1.38)
где Да— изменение поверхностного натяжения; А — константа, ха-
рактеризующая поверхностную активность вещества; В — констан-
та, в незначительной степени зависящая от природы вещества и опре-
деляемая предельной адсорбцией
5.2. Влияние плотности сорбционного слоя собирателя
на флотацию минералов
Обычно плотность сорбционного слоя собирателя на поверхнос-
ти минералов выражается в долях условного монослоя. Под услов-
ным монослоем понимается плотная упаковка ионами или молеку-
56
лами собирателя поверхности минерала, подсчитываемая по уравне-
нию
= ll(SN),
где — полный монослой (моль/см); S — площадь поперечного
сечения иона или молекулы собирателя, см2; N — число Авогадро
(6,023 • 1023).
Иногда при подсчете плотности сорбционного слоя принимается,
что сорбируемый ион занимает площадь, приходящуюся в кристал-
лической решетке минерала на ион, связывающий ион собирателя.
Для подсчетов, разумеется, необходимо знать удельную повер-
хность минерала. Такой подсчет плотности сорбционного слоя явля-
ется условным потому, что, во-первых, не всегда полный монослой
соответствует плотной упаковке ионов, во-вторых, сорбируемые
ионы (молекулы) распределяются на поверхности минерала нерав-
номерно. Кроме того, удельная поверхность минерала, обычно опре-
деляемая по сорбции инертных газов, включает поверхность трещин
и пор, часть которых может оказаться недоступной для собирателя1
или, сорбируясь в этих трещинах и порах, ионы собирателя не участ-
вуют в гидрофобизации поверхности минерала. Таким образом, по
этим и другим причинам действительный монослой рассчитать труд-
но.
Экспериментальные данные свидетельствуют о том, что при прак-
тически полном извлечении минералов при флотации степень покры-
тия поверхности минерала собирателем составляет лишь доли услов-
ного монослоя: для разных минералов и собирателей плотность сорб-
ционного слоя колеблется в пределах от 3 до 40 — 45 % условного
монослоя. Очевидно, одной из причин этих колебаний может быть раз-
личная степень смачиваемости естественной поверхности минералов.
Высказываются также и другие предположения, объясняющие вы-
сокое флотационное извлечение минерала при малой плотности сорб-
ционного слоя на его поверхности. Однако не прибегая к рассмотре-
нию этих гипотез, можно считать, что в условиях достаточно сильно-
го перемешивания вероятность столкновения пузырька с тем участ-
ком поверхности частицы, на котором сорбировались ионы собира-
теля значительна.
Необходимая для успешной флотации плотность сорбционного
слоя собирателя зависит от длины углеводородного радикала, с увели-
чением которого до определенного предела (разного для различных
собирателей) гидрофобизация поверхности повышается. Для полу-
чения такого же извлечения при использовании низших гомологов
требуются более высокие расходы собирателя. Эти вопросы более под-
1 В случае, когда ион или молекула собирателя имеет поперечное сечение
больше, чем поперечное сечение молекулы инертного газа.
57
Таблица 1.11
Расход карбоновых кислот и ксантогенатов в зависимости
от длины углеводородного радикала
при практически полном извлечении галенита
Карбоновая кислота Число уг- леводо- родных атомов в радикале Расход, кг/т Ксантогенат Число уг- леводо- родных атомов в радикале Расход, кг/т
Капроновая 5 4 Метиловый 1 Около 0,4
Гептиловая 6 1 Этиловый 2 0,1
Каприловая 7 0,5 Пропиловый 3 0,08
Нониловая 8 0,35 Бутиловый 4 0,06
Каприновая 9 0,15 Амиловый 5 0,04
Ундециловая И 0,1 — — —
робно рассматриваются при описании взаимодействия различных реа-
гентов с минералами.
Сравнивая гидрофобизирующее действие собирателей различных
типов при флотации одного и того же минерала, необходимо учиты-
вать прочность их закрепления; в общем виде это должно определяться
константой равновесия соответствующей реакции. Если сравнивать
гидрофобизирующее действие карбоновых кислот и ксантогенатов,
то для получения одинаковых результатов флотации в случае приме-
нения карбоновых кислот расход будет в несколько раз большим,
чем ксантогенатов, несмотря на большую длину их радикалов (табл.
1.11).
Необходимо также иметь в виду, что в присутствии модификато-
ров флотируемость минерала определяется не только плотностью сорб-
ционного слоя собирателя, но и степенью гидрофилизации, создаваемой
модификаторами, сорбированными на свободных участках поверхнос-
ти минерала.
5.3. Кинетика поглощения флотационных реагентов
минералами из раствора
На основании имеющегося экспериментального материала можно
сделать вывод о том, что в большинстве случаев взаимодействие ми-
нералов с ионогенными флотационными реагентами осуществляется
относительно быстро. Примером может служить сульфидизация не-
которых окисленных минералов тяжелых металлов, когда в течение
нескольких секунд образуется видимая сульфидная пленка, свиде-
тельствующая об образовании многослойного покрытия. По нашим
данным, основная масса ионогенного собирателя поглощается как
58
сульфидными, так и несульфидными минералами в течение первой
минуты взаимодействия [5]. В литературе, однако, имеются сведе-
ния, что сорбция лаурата баритом и искусственными кристаллами суль-
фата бария протекает весьма медленно [11] и равновесие устанавли-
вается за 24 ч.
Кинетика сорбции описывается эмпирическим уравнением
dT/dt = ае~аГ ,
где а и а — константы.
Очевидно, в этих опытах время сорбции определялось до установ-
ления полного равновесия.
По данным С.И. Митрофанова и О.А. Ратниковой, при выяснении
кинетики поглощения реагентов в различных условиях установлено,
что сульфидизация окисленных минералов и поглощение собирате-
лей сульфидными и окисленными минералами подчиняются одному
из следующих уравнений:
1 In
Г= a t или Г = b + a lg t.
Наши исследования кинетики поглощения ксантогената галени-
том и олеата натрия некоторыми несульфидными минералами также
показали, что зависимость сорбции от времени отвечает первому урав-
нению.
При взаимодействии реагентов с минералами ионы реагента преж-
де всего должны продиффундировать к минеральной поверхности че-
рез некоторый относительно неподвижный слой жидкости, окружаю-
щий минеральные зерна. Приблизившиеся к поверхности ионы реа-
гента могут обмениваться с ионами минерала, в результате чего на
поверхности минерала может образоваться моно- или полимолеку-
лярный слой продуктов взаимодействия.
При высоких расходах реагентов продукты взаимодействия зат-
рудняют дальнейшее проникновение ионов реагента к поверхности
минерала, и скорость сорбции будет определяться диффузией через
слой продуктов взаимодействия. При образовании на поверхности
минерала сорбционного покрытия, измеряемого долями монослоя,
скорость сорбции может определяться скоростью конвективной диф-
фузии через слой жидкости, окружающей твердую поверхность, ли-
бо скоростью обмена ионов в зависимости от того, какой из этих про-
цессов является более медленным.
Скорость ионного обмена при незначительной сорбции определя-
ется разностью скоростей двух процессов: обмена ионов А поверх-
ностных соединений минерала на ионы В флотационного реагента, на-
ходящегося в растворе, и обратного процесса обмена сорбированных
на поверхности ионов В на ионы А, находящиеся в растворе.
Рассмотрим случай, когда скорость обмена ионов пропорциональ-
на концентрации реагента в растворе, что является наиболее простым
59
и вероятным при обмене равновалентных ионов. Очевидно, что ско-
рость сорбции будет пропорциональна не только концентрации реа-
гента, находящегося в растворе в данный момент времени, но и по-
верхности минерала, занятой ионами А. Скорость десорбции будет
пропорциональна концентрации ионов А в растворе и поверхности,
занятой сорбированными в данный момент ионами В. Тогда
dr/dr =К\ CBSA - к2 СА SB , (1.39)
где Г - количество реагента, сорбированное единицей поверхности
минерала за время Z; Кх и К2 — постоянные, характеризующие проч-
ность закрепления ионов А и В на поверхности минерала; СА и Св —
концентрации ионов А и В в растворе в момент времени t\ Sи SB —
доли поверхности минерала, занятые ионами А и В, % общей поверх-
ности.
Если сорбируемые ионы закрепляются на минеральной поверх-
ности значительно прочнее, чем вытесняемые ими (К* >ТГ2), то при
всех значениях сорбции, вплоть до близких к равновесным, и при со-
отношениях ионов (СА и Cg), представляющих практический инте-
рес, может быть справедливо неравенство
Л-, св 8а » кг СА SB .
Поэтому при исследовании кинетики сорбции во многих случаях
можно пренебречь вторым членом правой части уравнения (1.39). Ко-
нечно, при равновесии эти два члена правой части уравнения равны друг
другу. Но во многих случаях даже незначительное отклонение от сос-
тояния равновесия делает справедливым указанное выше неравенство
и тогда уравнение (1.39) приобретает вид
dT/dt =Ку Св SA (1.40)
Обмен ионов целесообразно изучать по специальной методике, поз-
воляющей резко сократить интервалы определения сорбции. Нами для
изучения кинетики сорбции использовалась адсорбционная колонка
(рис. 1.8), в которой через слой минерала просасывается значительный
объем раствора реагента заданной концентрации. Адсорбционная ко-
лонка позволяет измерять поглощение реагента за 2 — 3 с и резко умень-
шает влияние ионов, вытесненных с поверхности минерала, на даль-
нейшую сорбцию.
В случае обмена разновалентных ионов уравнение скорости ион-
ного обмена может усложниться. Так, например, при обмене двух-
валентных ионов на одновалентные, если реакция протекает в одну
стадию, можно было бы предположить, что в уравнение (1-40) Св дол-
жна входить во второй степени. Однако в большинстве случаев взаи-
модействие протекает в несколько стадий, наиболее медленная из
которых может определять кинетику процесса, что может привести
к линейной зависимости скорости сорбции от концентрации. Кроме
60
a
Исходный
раствор
1.8. Разрез адсорбционной колонки (а) и схема установки (5) для изучения кине-
тики сорбции:
1 — минерал; 2 — пористые стеклянные фильтры; 3 — сосуд с исходным раство-
ром; 4 — адсорбционная колонка
того, на поверхности минерала при незначительной плотности сорб-
ционного слоя, составляющего лишь доли монослоя, могут выделить-
ся специфические поверхностные соединения, отличающиеся от соеди-
нений, образующихся в объеме раствора.
Из литературных данных следует, что во многих случаях при ге-
терогенном взаимодействии скорость процесса линейно зависит от
концентрации реагента.
При изучении кинетики сорбции в адсорбционной колонке урав-
нение (1-40) может быть применено лишь для бесконечно тонкого
слоя материала, так как каждый последующий тонкий слой обраба-
тывается реагентом уже иной концентрации.
В верхнем слое концентрация реагента равна концентрации его
в исходном растворе, в нижнем слое — концентрации вытекающего
из колонки раствора, внутри слоя минерала концентрация изменя-
ется в зависимости от толщины х слоя минерала, находящегося над
данным элементарным слоем, т.е. является функцией положения пос-
леднего = С (х).
" в
61
Так как концентрация раствора в колонке изменяется в резуль-
тате сорбции реагента минералом, то справедливо соотношение
-v dr dC* = drx dx , (1.41)
в котором левая часть представляет убыль реагента из раствора, про-
шедшего через слой минерала толщиной d;c за время dr (где v — ско-
рость протекания раствора через колонку), а правая — количество реа-
гента, поглощенного элементарным слоем минерала (где d/^ — из-
менение сорбции на минерале данного бесконечно тонкого слоя за
время dr).
Подставив в уравнение (1.41) выражение для d7"’x из уравнения
(1.40), получим распределение концентрации реагентов в слое мине-
рала при обмене равновалентных ионов
-vdC*dt = dr dx = К. С* SA dt dx
D X I if A
ИЛИ
-dCg = (S’, SAlv)C* dx.
Проинтегрировав это уравнение при начальном условии =о =С0
и обозначив Sjv=f} (где по принятому ранее допущению =
= const), получим Сд = Со е~^х, где Cg — концентрация реагента в раст-
воре на глубине х от поверхности минеральной суспензии; (3 — величина,
не зависящая от Со.
Полную скорость сорбции реагента всей навеской минерала нахо-
дим, суммируя скорости сорбции всеми бесконечно тонкими слоя-
ми минерала
dT/dr=f dT/dtdx=S KCoSAdx =
х=о х х=0 1 в А
Х=1
= J К SАсое~(3х dx = со v (1 -е~@х). (1.42)
х=о А
Таким образом, при принятых допущениях скорость сорбции в слу-
чае справедливости уравнения (1.40) пропорциональна исходной кон-
центрации раствора, или, что то же самое, доля CQ v поглощенного ми-
нералом реагента, прошедшего через колонку, не зависит от исходной
концентрации и составляет 1 — е~Рх.
Справедливость уравнения (1.42) подтверждается результатами
опытов обмена ионов цинка сфалерита на ионы меди из разбавленных
растворов медного купороса при условии, что плотность покрытия
поверхности сфалерита ионами меди не превышает 10 % монослоя.
62
Результаты опытов по изучению кинетики сорбции ксантогената
галенитом показывают, что при незначительной плотности сорбцион-
ного слоя зависимость между скоростью сорбции и концентрацией
также весьма близка к линейной и, следовательно,удовлетворяет урав-
нению (1.40).
Если предположить, что скорость сорбции в этих опытах опреде-
ляется скоростью ионного обмена, зависимость dT/dt от концентра-
ции будет линейной при условии, что ион свинца поверхности галени-
та связывает лишь один ион ксантогената, или что подобное соотно-
шение между сорбированными ионами ксантогената и ионами свин-
ца определяет кинетику взаимодействия, если процесс протекает ста-
диально.
На основании электронографических исследований X. Хагихара
[5] можно предположить, что при действии ксантогената на слабо-
окисленный галенит каждый ион свинца связывает лишь один ион ксан-
тогената. Можно допустить также и иное объяснение полученных эк-
спериментальных данных.
Зависимость Г СQt возможна тогда, когда скорость сорбции оп-
ределяется скоростью конвективной диффузии реагента к поверхнос-
ти минеральных частиц через пограничный слой раствора, окружаю-
щий минеральные частицы. Так, по данным Г.А. Аксельруда [5], ско-
рость диффузии пропорциональна концентрации. Автор приводит урав-
нение для определения скорости диффузии растворенного вещества
к поверхности одной изолированной шарообразной частицы, обтека-
емой потоком раствора. Ориентировочно рассчитанные нами по этим
формулам скорости диффузии для бутилового ксантогената оказа-
лись близкими к полученным в наших опытах значениях скоростей
сорбции (коэффициент диффузии ксантогената рассчитывался по урав-
нению Эйнштейна).
Тувинер и Карман [43], изучившие сорбцию ксантогената на халь-
козине, пришли к выводу, что скорость сорбции собирателя опреде-
ляется скоростью диффузии реагента через неподвижную водную прос-
лойку к поверхности минерала. Однако при интенсивном перемеши-
вании или высокой скорости просасывания раствора через тонкий рав-
номерный слой минеральных частиц, вероятно, можно исключить влия-
ние диффузии на скорость сорбции и, таким образом, определить за-
висимость скорости обмена ионов от концентрации реагента. Этот про-
цесс требует дальнейших исследований.
Рассмотрим случай, когда при действии реагента на минеральную
поверхность образуется многослойное покрытие и когда определяющим
кинетику процессом (как более медленным) является диффузия реаги-
рующих веществ через слой продуктов взаимодействия. При этом бу-
дем рассматривать процесс с момента образования сорбционного слоя
на всей поверхности минеральных зерен, когда дальнейшая сорбция
происходит через сорбционный слой, образованный ранее. Для этого
63
1.9. Кинетика сорбции галенитом этилового
ксантогената при его расходе 1 000 г/т (о-о -
экспериментальные точки, нанесенные на рас-
четную кривую)
случая выразим скорость поглощения реагента уравнением скорости
диффузии через пленку
dr/dr =К (СВ-С^)1А, (1.43)
где Св и Св' - концентрация реагента соответственно с одной и с дру-
гой стороны пленки; Д — толщина пленки.
В нашем случае, когда диффузия ксантогената происходит через
сорбционный слой на поверхности минерала, за Св можно принять
концентрацию в растворе в каждый данный момент, а за Св — равно-
весную концентрацию в растворе, которая устанавливается по окон-
чании сорбции. Таким образом, в каждый данный момент разность
— Св будет определять скорость сорбции. Очевидно, что Св — Св «
» Г^ — Г, где Гж — предельное значение сорбции реагента в данных
условиях. Также очевидно, что Д ~ Г. Тогда уравнение (1.43) примет
вид
dr/dr = К' (Г^-П/Г. (1.44)
Преобразовав это уравнение, получим
d(r/roo)/dr = К'Гк [(Г^/Г^-Г/Г^/Г/Г^]
или dr' /dr =К" (1-Г')/Г,' (1.45)
Интегрируя это уравнение при начальных условиях Г = О и Г = О,
получаем
Г = 1//С" [In(1/(1 -Г') -Г' ] . (1.46)
Полученные экспериментальные данные по кинетике сорбции ксан-
тогената при расходе его 1000 г/т подчиняются указанному уравнению,
как это видно из рис. 1.9. Опыты проводились при перемешивании на-
вески галенита с раствором ксантогената при Т : Ж = 1 : 4, т.е. не в ад-
сорбционной колонке.
5.4. Влияние крупности частиц минералов
на сорбцию реагентов
Сорбционная способность минералов по отношению к флотаци-
онным реагентам определяется как природой минерала, так и его удель-
ной поверхностью. Некоторые авторы считают, что по мере изменения
крупности частиц изменяется не только удельная поверхность, но и
сорбционная активность минеральных зерен. В процессе измельчения
увеличивается дефектность кристаллической решетки минеральных
частиц и число активных точек поверхности (число ребер, углов и т.д.),
что повышает сорбционную активность более тонких классов. Одна-
ко основываясь на измерениях удельной поверхности (методом ад-
сорбции паров спирта при комнатной температуре) различных клас-
сов крупности минеральных порошков, можно предположить, что по
мере измельчения минеральные частицы становятся менее шерохова-
тыми, более окатанными и их сорбционная активность на единицу по-
верхности не повышается [5].
Важный показатель, характеризующий поверхность минеральных
частиц,— отношение удельной поверхности SH3M, измеренной тем или
иным способом, к удельной поверхности Spac4, рассчитанной, исходя
из предположения, что минеральные частицы имеют правильную фор-
му (для вычисления 5расч можно было принять, что частицы имеют
и другую форму, тогда значения ^пзм1^расч численно могли бы быть
другими, но общая закономерность изменения этого отношения при
различной крупности частиц остается такой же). Отношение ^нзм/^расч
может изменяться вследствие изменения как формы частиц (напри-
мер, приближения формы зерен к шаровидной или кубической), так
и числа и характера трещин, выступов, ребер и углов.
В табл. 1.12 приведены данные, показывающие изменение удель-
ной поверхности и Sa3MISpac4 в зависимости от крупности, получен-
ные для различных узких классов крупности кварца. Измеренные зна-
чения удельной поверхности различных классов сравнивались с удель-
ной поверхностью, рассчитанной исходя из предположения, что части-
цы кварца имеют кубическую форму и ребро, равное среднему ариф-
метическому из граничных размеров узкого класса.
Как следует из приведенных данных, отношение ^изм/^расч Умень‘
шается с уменьшением размера частиц. Это указывает на то, что ми-
неральные частицы дробятся по наиболее слабым местам (трещинам,
выступам и др.) и в результате измельчения становятся более окатан-
ными. Эти данные хорошо согласуются с результатами исследований,
осуществленных с другими минералами и иными методами.
Для выяснения влияния крупности частиц на сорбционную ем-
кость, приходящуюся на единицу минеральной поверхности, определя-
лось поглощение этилового ксантогената калия и диэтилдитиофосфа-
та натрия галенитом и сфалеритом, различных классов крупности, по-
5-6926
65
Таблица 1.12
Удельная поверхность кварца различных классов
крупности
Класс крупности, мкм Измеренная удельная по- верхность, м2/г “^изм^расч
-3 + 0 4,62 —
-6 + 3 0,853 1,70
-И + 6 0,481 1,81
-22 + 11 0,292 2,13
-44 + 22 0,164 2,45
-52 + 44 0,127 2,70
-74 + 52 0,108 3,00
лученных при дроблении однородных кусков минерала. При иссле-
довании сорбционной активности различных по крупности классов
не рассматривались случаи, когда в месторождении под воздействи-
ем разных геологических агентов образуются участки, в которых одни
и те же рудные минералы обладают различными физическими и хими-
ческими свойствами. В этом случае минералы могут содержать пер-
вичные шламы или участки различной измельчаемости, поэтому при
измельчении неоднородных кусков минерала более тонкие зерна иног-
да отличаются от более крупных по своим физическим и химическим
свойствам. В табл. 1.13 приведены результаты опытов, в которых на
единицу поверхности минерала приходится одинаковое количество
реагента при одной и той же исходной концентрации. Для этого соот-
ветственно удельной поверхности изменялось отношение Т : Ж . Ана-
логичные результаты получены и в опытах со сфалеритом
Таблица!. 13
Поглощение этилового ксантогената калия
и этилдитиофосфата натрия различными классами
крупности галенита ( х 10~6 моль/м2).
Исходная концен- трация, мг/л Класс крупности, мкм
-125 + 10 -125 + 52 -44 + 10 -10
5,0 Этиловый 2,09 ксантогенат калия 2,05 2,07 2,11
12,5 4,85 4,63 4,92 4,74
25,0 9,13 9,12 9,18 9,03
50,0 19,82 — 18,85 18,77
5,0 Диэтилдитиофосфат натрия 0,85 0,80 0,88 0,91
12,5 1,80 1,75 1,78 1,96
25,0 3,09 2,91 3,32 3,18
50,0 4,43 5,55 4,91
66
Во всех случаях поглощение этилового ксантогената и диэтилди-
тиофосфата (на единицу поверхности) приблизительно одинаково
(в пределах погрешности опыта). Практически заметного повыше-
ния сорбционной емкости тонких классов на единицу поверхности
по сравнению с более крупными не наблюдается.
Таким образом, в пределах испытанного диапазона крупности ми-
неральных частиц их сорбционная способность в отношении исследо-
ванных ионогенных собирателей типа этилового ксантогената и диэ-
тилдитиофосфата определяется удельной поверхностью. Что касает-
ся кинетики поглощения собирателей различными по крупности клас-
сами минералов, то исследования С.И. Митрофанова и О.А. Ратнико-
вой показали, что несколько более высокая скорость сорбции (на еди-
ницу поверхности) наблюдается для более крупных классов, хотя сорб-
ционная емкость на единицу поверхности может быть такой же, как
и при сорбции более тонких классов.
Результаты приведенных выше опытов, разумеется, не указыва-
ют на степень неравномерности покрытия поверхности минеральных
зерен собирателем и не раскрывают влияния дефектов кристалличес-
кой решетки, а также трещин, выступов, углов и ребер на сорбцию
реагентов. Эти исследования лишь свидетельствуют о том, что изме-
нение влияния названных факторов при обычном измельчении мине-
ральных зерен невелико.
Все описанное, конечно, относится к частицам флотационной круп-
ности. При переходе к более тонкодисперсным системам возможно
увеличение сорбционной активности по мере увеличения степени дис-
персности.
ЧАСТЬ II
ИССЛЕДОВАНИЕ МЕХАНИЗМА ДЕЙСТВИЯ
ФЛОТАЦИОННЫХ РЕАГЕНТОВ
6. ВЗАИМОДЕЙСТВИЕ СУЛЬФГИДРИЛЬНЫХ СОБИРАТЕЛЕЙ
С СУЛЬФИДНЫМИ МИНЕРАЛАМИ1
6.1. Состояние поверхности сульфидных минералов
При рассмотрении действия флотационных реагентов на сульфид-
ные минералы необходимо учитывать, что уже в операциях, предшест-
вующих флотации, вновь образованная при измельчении поверхность
1 Основной объем исследований взаимодействия сульфгидрильных собира-
телей с сульфидными минералами относится к изучению действия алкилксанто-
генатов и диалкилдитиофосфатов, являющихся наиболее широко применяемы-
ми собирателями при флотации сульфидных минералов.
67
минерала вступает в контакт с водной фазой, содержащей растворен-
ные газы, из которых наиболее важное значение имеют кислород и
углекислый газ. По мере увеличения времени контакта минералов
руды с водной фазой ионный состав ее постепенно усложняется в ре-
зультате растворения некоторых продуктов окисления, гидролиза по-
верхности и т.д. Поверхность минералов после их взаимодействия с
водой, содержащей растворенные газы, уже не может рассматривать-
ся как неизменная. Происшедшие изменения поверхности будут су-
щественно влиять на последующее взаимодействие минералов с фло-
тационными реагентами.
К настоящему времени большое число исследований подтверж-
дают высокую адсорбционную активность сульфидов по отношению
к кислороду. Об этом свидетельствуют определения содержания раст-
воренного кислорода в водной фазе флотационной пульпы сульфид-
ных руд в различных точках промышленного процесса. При этом в
ряде случаев показано полное отсутствие кислорода в растворе при
измельчении, что свидетельствует об интенсивном поглощении кис-
лорода образующейся при измельчении поверхностью сульфидов. Раст-
воренный кислород обнаруживается лишь в дальнейших стадиях фло-
тации, где благодаря аэрации постепенно восстанавливается содержа-
ние кислорода, отвечающее его растворимости в воде при данных ус-
ловиях.
Интенсивность поглощения кислорода, естественно, зависит от ве-
щественного состава руд. Она наиболее высока для пирротина и пир-
ротинсодержащих руд. Имеющиеся в литературе данные об относи-
тельной окисляемости сульфидов тяжелых металлов в ряде случаев
противоречивы, что, очевидно, объясняется наличием примесей дру-
гих минералов в исследуемых образцах минералов и недостаточно
тщательным соблюдением условий эксперимента (постоянство pH,
степени аэрации и др.).
Исследование кинетики окисления сульфидных минералов [20,
47, 54] показало, что скорость окисления пропорциональна парци-
альному давлению кислорода в степени 1/2. Скорость окисления v =
= к S [О2 ] 42 [ОН] 2, где S — поверхность минерала.
Скорости окисления различных сульфидов в зависимости от pH
среды могут существенно отличаться: для исследованных минералов
показатель степени п изменяется от 0,185 до 1. Получен хороший ба-
ланс между количеством поглощенного кислорода и содержанием
сульфоксидных соединений [20]. Обычно окисление протекает в ки-
нетическом режиме, лимитирующей процесс стадией является ско-
рость гетерогенной реакции окисления. Вследствие энергетической
неоднородности поверхности минералов окисление может протекать
неравномерно с образованием островных участков различной степе-
ни окисления.
В литературе встречаются указания на взаимное влияние сульфид-
ных минералов на их окисление. Некоторые исследователи отмечали,
68
что в присутствии пирита галенит, сульфиды меди и сфалерит окисля-
ются во много раз быстрее, чем при окислении мономинеральных сус-
пензий этих минералов [1, 33]. Взаимное влияние сульфидов на их
окисление некоторые авторы объясняют возникновением разности
потенциалов при контакте различных сульфидов, в результате чего
ускоряется окисление более электроотрицательного минерала и тор-
мозится окисление более электроположительного.
Однако исследования И.А. Каковского с сотрудниками показа-
ли, что в присутствии пирита скорость окисления сульфидов меди
и цинка остается такой же, как и каждого сульфида в отдельности;
при этом показано, что поглощение кислорода одинаково как при
условиях контакта между сульфидами, так и при бесконтактном окис-
лении.
В случае, например [19] , совместного окисления сульфидов меди
и сфалерита в результате окисления сульфидов меди в кислой среде
ионы меди, перешедшие в раствор, способны активировать поверх-
ность сфалерита, увеличивая тем самым переход ионов цинка в раст-
вор. Свежеосажденный на поверхности сфалерита сульфид меди отли-
чается более легкой окисляемостью и растворимостью.
Различная склонность сульфидных минералов к окислению ис-
пользуется в практике флотации руд. Так, преимущественная окис-
ляемость сульфидов железа в щелочной среде используется для по-
давления их флотации.
В ряде случаев поглощение кислорода сульфидами железа приво-
дит к столь резкому уменьшению концентрации растворенного кис-
лорода, что его не хватает для частичного окисления сульфидов ме-
ди и поэтому приходится прибегать к дополнительной аэрации пуль-
пы. Для уменьшения избыточного окисления сульфидных минералов
в некоторых случаях требуется введение в процесс реагентов восста-
новителей (S2-, SO2, SO2-, S2O2") или реагентов, переводящих
в раствор избыток окисленных соединений, а также применение азота.
Для оценки характера соединений, образующихся при окислении
сульфидных минералов, некоторые исследователи применяют термо-
динамический метод, используя зависимости между константой рав-
новесия, стандартной свободной энергией и потенциалом реакции.
Так, например, А.А. Абрамов [1] на основании измерений окисли-
тельно-восстановительного потенциала промышленных пульп рассчи-
тал, что в обычных условиях конечными продуктами окисления при
pH 7 — 12 для сульфидов железа являются Fe (ОН)3, для сульфи-
дов меди, не содержащих железа, до pH <9 Си(ОН)2СО3, а при
pH > 9 Си (ОН), для железосодержащих сульфидов меди Си (ОН)2СО3
и Fe (ОН) 3, для сфалерита при pH < 5 Zn СО3, а при pH > 5 Zn (ОН) .
Следует, однако, отметить, что подобные термодинамические расчеты
применимы лишь к равновесным состояниям, а в реальных условиях
большое значение имеют кинетические факторы. Поэтому использо-
69
вание термодинамического подхода не правомочно в тех случаях, ког-
да процесс окисления протекает в кинетическом режиме и стадиаль-
но (через образование промежуточных соединений).
Согласно экспериментальным данным различных авторов, при окис-
лении галенита в нейтральной и щелочной средах обнаружен тиосуль-
фат и сульфат свинца, которые при контакте с углекислотой могут пе-
рейти в карбонат свинца. При окислении халькопирита сера перехо-
дит в раствор в виде сульфита, тиосульфата и сульфата, при окисле-
нии пирита и пирротина — тиосульфата и сульфата, в случае сфалери-
та — сульфита и тиосульфата. В кислой среде сульфидная сера мине-
ралов окисляется лишь до S0.
Перешедшие в раствор и постепенно накапливающиеся продукты
окисления сульфидной серы минералов (ионы SO* , S2O2-, SO* ),
концентрация которых может быть относительно высокой (по дан-
ным В.А. Бочарова, концентрация ионов окисленной серы, например
для медно-цинковых руд различных месторождений, колеблется от
0,6 до 1,5—2 г/л), сами являются модификаторами флотации (SO23 ,
S О23~)’ 410 необходимо учитывать при регулировании флотации,
особенно в случае применения оборотного водоснабжения.
6.2. Влияние окисления на взаимодействие сульфидных минералов
с сульфгидрильными собирателями
В настоящее время существуют убедительные доказательства не-
обходимости частичного окисления поверхности сульфидных мине-
ралов для успешного взаимодействия их с анионными собирателями
типа ксантогенатов и диалкил дитиофосфатов. Невозможность хемо-
сорбционного взаимодействия ксантогенатов с неокисленной поверх-
ностью сульфидных минералов показана термодинамическими рас-
четами и подтверждена экспериментальными данными многих иссле-
дователей. На первый взгляд этот вопрос носит отвлеченный харак-
тер, поскольку в процесс реальной флотации сульфидные минералы
всегда в той или иной степени окислены и в большинстве случаев эф-
фективно флотируются ксантогенатами.
Исследования [5] с галенитом, предварительно сульфидизирован-
ным для удаления окисленных соединений и отмытым обескислоро-
женной водой от избытка сульфидных ионов в условиях, исключаю-
щих контакт с воздухом, показали отсутствие флотации при добавле-
нии ксантогената. Лишь после кратковременного контакта галенита
с воздухом начиналась флотация сульфидизированного галенита. Бо-
лее глубокое окисление растворами Н2 О2 ухудшает флотацию вслед-
ствие образования значительного количества продуктов полного окис-
ления галенита, частично отслаивающихся с поверхности минерала.
Невозможность флотации чистых сульфидов показана в исследо-
ваниях, приведенных в работе С.В. Бессонова и И.Н. Плаксина. По
данным этих авторов, галенит и халькопирит, измельченные и обес-
шламленные в атмосфере азота или аргона, не флотируются ксанто-
70
II. 1. Изотермы сорбции этилового ксан-
тогената различными образцами галени-
та, отличающимися степенью окисления:
1 — образец № 1; 2 — образец № 2;
3 — образец № 3
> мкмоль//!
генатами без предварительного взаимодействия с кислородом воз-
духа. При этом для успешной флотации галенита и халькопирита не-
обходим различный расход кислорода, зависящий от способности суль-
фидного минерала к окислению.
Опыты Н.П. Финкельштейна по определению сорбции ксантогена-
та сульфидными минералами, с поверхности которых удалены про-
дукты окисления, подтвердили отсутствие взаимодействия сульфид-
ных минералов с ксантогенатом в отсутствие кислорода в системе
[54] . Лишь после некоторого окисления поверхности начинается сорб-
ция ксантогената, которая продолжается до тех пор, пока в системе
имеются кислород и ксантогенат.
Катодная поляризация галенита, в результате которой восстанав-
ливаются окисленные соединения и создается чистая сульфидная по-
верхность, также приводит к прекращению флотации [5] . Необходи-
мые для флотации условия создаются лишь при анодной поляриза-
ции поверхности минерала.
Степень окисления поверхности сульфидных минералов определя-
ет сорбционную емкость их по отношению к анионному собирате-
лю. На рис. II. 1 приведены изотермы сорбции Г этилового ксантоге-
ната калия различными образцами галенита, отличающимися степенью
окисления. Если пересчитать количество поглощенного ксантогена-
та на среднюю плотность покрытия, то оказывается, что для сильно
окисленного галенита (образец № 1) число продуктов взаимодействия
отвечает нескольким десяткам условных монослоев [5] .
Аналогично влияет степень окисления поверхности минерала на
поглощение дибутилдитиофосфата галенитом. Взаимодействие соби-
рателя с галенитом продолжается до тех пор, пока не будут исчерпа-
ны поверхностные продукты окисления или пока образовавшиеся
продукты взаимодействия не прекратят диффузию ионов собирате-
ля к минеральной поверхности. При значительном окислении поверх-
ности минерала продукты взаимодействия с ксантогенатом, очевид-
но, могут отслаиваться.
Значительное окисление сульфидов железа, особенно очень легко-
окисляющегося пирротина, ухудшает флотацию при высоких pH, что
объясняется образованием на поверхности минералов пленки гидро-
фильного гидроксида железа.
71
Согласно гипотезе, предложенной Д.А. Шведовым, на поверхнос-
ти сульфидных минералов в начальной стадии окисления образуют-
ся смешанные поверхностные соединения типа ’’сульфидо-сульфатов”,
сульфоксидный анион которых способен обмениваться на ион ксан-
тогената. В результате на поверхности образуются ”сульфидо-ксан-
тогенаты”, обеспечивающие необходимую для флотации гидрофоби-
зацию поверхности по следующей схеме:
— S—Pi —S —Pb —ROCS2
J>SO4 + 2ROCS7^ +SO*"
-S-РЬ — S—Pb —ROCS2
Гипотеза образования смешанных поверхностей соединений, не
теряющих связи с кристаллической решеткой минерала, по своей су-
ти отвечает представлениям, высказанным в свое время И. Уорком
[43], выдвинувшим понятие ’’адсорбционного произведения раство-
римости”, которое должно быть меньше произведения растворимос-
ти соответствующих соединений металла минерала с анионом соби-
рателя, образующихся в растворе.
Обмен сульфоксидных анионов продуктов окисления сульфид-
ных минералов на анионы собирателя при хемосорбционном закреп-
лении последнего экспериментально подтвержден работами многих
авторов. Исследования состава поверхностного покрытия на галени-
те после взаимодействия с этилксантогенатом калия методом ИК-спек-
троскопии, проведенные Ж. Лейя, Л. Литлл и Г. Полингом показали,
что на поверхности галенита при взаимодействии с ксантогенатом ис-
чезают полосы, характерные для S2Q3- иона, а вместо них появляют-
ся полосы, характерные для ксантогената свинца [55] . Интенсивность
этих полос поглощения свидетельствует об образовании многослой-
ного покрытия, отвечающего десяткам монослоев. Отсутствие харак-
терных для диксантогената полос указывает, что в сорбционном слое
нет заметных количеств диксантогената. Некоторое смещение полос,
относящихся к С-О—С связи, интерпретировалось авторами как до-
казательство, того что первый адсорбционный слой отвечает отноше-
нию Pb : X = 1 : 1. Ранее такое предположение было высказано Хаги-
хара Хитоси на основании электронографических исследований.
Исследованиями [5] сорбции ксантогената сульфидизированным
церусситом, после частичного окисления сульфидизированной поверх-
ности также установлено, что сорбция ксантогената сопровождается
вытеснением в раствор сульфоксидных ионов, что подтверждено оп-
ределением ионного состава раствора после взаимодействия с ксан-
тогенатом.
Совпадение теплот сорбции ксантогената на галените с теплотой
реакции образования ксантогената свинца при взаимодействии тио-
сульфата свинца с раствором ксантогената калия также является кос-
венным подтверждением ионообменного механизма, как это следу-
72
I I.2. Изменение концентрации ионов в
растворе в зависимости от адсорбции
ксантогената:
1 - pH; 2 — концентрация сульфоксид-
ных ионов; 3 — остаточная концентрация
ксантогената
Убыль этилового ксан-
тогената калия, мгэкб
ет из работ О. Миллгрена и С. Рао. Показано, что по мере увеличения
количества сорбированного минералом ксантогената увеличивается
концентрация сульфоксидных соединений в растворе (как это, нап-
ример, следует из рис. П.2). Также получено хорошее совпадение из-
меренных теплот сорбции ксантогената с теплотами образования соот-
ветствующих ксантогенатов. Ионообменный механизм взаимодействия
диэтилдитиофосфата с халькозином, на поверхности которого имеют-
ся продукты окисления, отмечается также в работе С. Чандера и Д. Фюр-
стенау (XI Международный конгресс по обогащению полезных иско-
паемых, 1975 г.).
Константы равновесия реакции, рассчитанные на основании соот-
ношения произведений растворимости соединения, находящегося на
поверхности минерала, и соединения, образующегося при действии со-
бирателя, дают возможность качественно оценить возможность гете-
рогенной реакции. Однако при этом необходимо иметь в виду, что дан-
ные по произведениям растворимости справедливы лишь примени-
тельно к стехиометрическим концентрациям компонентов реакции.
Превосходящие концентрации одного из компонентов реакции могут
привести к изменению характера соединения. Например,при взаимодей-
ствии этилксантогената калия с растворами перхлорота свинца раз-
личной концентрации при значительном избытке ионов свинца воз-
можно образование растворимого комплекса РЬХ+ [35]. Аналогич-
ные результаты получены ранее и другими исследователями, напри-
мер М. Наньо, Н. Шейком и Ж. Лейя и для соединений ионов меди с
ионами ксантогенатов [55].
Некоторые исследователи, например И.Н. Плаксин, В.А. Чантурия,
Р.Ф. Шафеев [49], предполагали, что положительное влияние кисло-
73
рода на последующее взаимодействие сульфидов с ксантогенатом зак-
лючается в превращении поверхности минерала из полупроводника
и-типа в p-тип в результате того, что растворенный кислород при ад-
сорбции на поверхности минерала является акцептором электронов
из зоны проводимости. При этом создаются благоприятные условия
для сорбции анионов ксантогената и частичного его окисления в дик-
сантоген.
Однако другие исследователи полагают, что полупроводниковые
свойства сульфидных минералов вряд ли могут заметно влиять на
их взаимодействие с собирателями. Например, как показал И.А. Вайн-
шенкер, отдельные разновидности одних и тех же минералов, отличаю-
щихся типом проводимости, одинаково эффективно взаимодейству-
ют с собирателем и флотируются. В основном возможность хемосорб-
ционного взаимодействия должна определяться термодинамическими
критериями. До сих пор нет убедительных доказательств существен-
ного влияния типа проводимости на действие сульфгидрильных соби-
рателей и незначительные различия в поведении полупроводников раз-
ного типа могут быть обусловлены различием в концентрации и при-
роде примесей в минералах (Р. Вуудс [55]).
Роль кислорода при флотации сульфидных минералов не ограни-
чивается лишь воздействием на минеральную поверхность. Для реа-
гентов типа ксантогенатов и дитиофосфатов необходимо учитывать
их способность к окислению с образованием соответствующих ди-
сульфидов. Гомогенное окисление ксантогенатов в растворе раство-
ренным кислородом — медленный процесс, и в отсутствие сульфид-
ных минералов количество образовавшегося диксантогена ничтожно.
Наличие карбонатных ионов и растворенной СО2 несколько увели-
чивает скорость гомогенного окисления ксантогената.
На основании исследования состава сорбционного слоя на гале-
ните после его взаимодействия с ксантогенатом Ж. Лейя высказана
гипотеза, согласно которой роль кислорода заключается в окислении
ксантогената до диксантогена, обеспечении перехода ионов металла
сульфидного минерала в раствор благодаря его окислению, образо-
вании ксантогенатов тяжелых металлов в растворе и соадсорбции этих
соединений и диксантогена на хемосорбированном ксантогенате.
Анализируя влияние окисления на состояние сульфгидрильных
собирателей • в процессе их взаимодействия с сульфидными минера-
лами, кратко рассмотрим представления об этом процессе с позиций
электрохимических реакций. Такой подход к рассмотрению действия
сульфгидрильных собирателей отражен в работах многих авторов (см.
обзорную статью Р. Вуудса [55]). Согласно этим представлениям,
применяемым при изучении коррозионных процессов на поверхнос-
ти металлов, сульфидные минералы, обладающие электронной прово-
димостью, могут выступать как доноры или акцепторы электронов.
В соответствии с этим на их поверхности могут протекать окислитель-
74
но-восстановительные реакции, такие, например, как:
анодная реакция окисления иона ксантогената до диксантогена
2ROCS~ (ROCS2)2 + 2е,
катодная реакция восстановления кислорода
1/2 О2 +2 .Н++ 2 е -> Н2 О ,
суммарная реакция
2ROCS7+ 1/2 О2 + 2 Н+ -> (ROCS2)2 +Н2О,
В результате этих окислительно-восстановительных реакций воз-
никает так называемый ’’смешанный” потенциал, по которому судят
о возможности образования тех или иных продуктов взаимодействия.
Например, на основании того, что наиболее прочный контакт меж-
ду минералом и пузырьком воздуха отмечен при потенциале, отвечаю-
щем потенциалу реакции окисления ксантогената в диксантоген,
было высказано предположение, что основным продуктом взаимо-
действия, определяющим гидрофобизацию поверхности, является дик-
сантоген.
Электрохимический подход возможен и при объяснении хемосорб-
ционного процесса на поверхности минерала за счет переноса заряда
от иона ксантогената поверхности минерала. Так, например, реакция
PbS + 2ROCS~ + 1/2 О2 + 2 Н+ -> Pb (ROCS2)2 + S° + Н2 О»
включает анодную реакцию
PbS + 2ROCS~ -+ Pb(ROCS2)2 + S° +2е
и катодную реакцию
1/2 О2 + 2Н+ + 2е -> Н2 О ,
Подтверждают такую точку зрения результаты опытов флотации
минералов с контролем потенциала их поверхности. При этом уста-
новлено, что флотация зерен галенита начинается при более отрица-
тельных значениях потенциала, чем потенциал, необходимых для об-
разования диксантогена. На основании чего предполагается, что дос-
таточная для флотации гидрофобизация поверхности галенита обес-
печивается хемосорбцией ксантогената. В случае же пирита флотация
происходит лишь при потенциале, отвечающем потенциалу реакции
2ROCS7 -* (ROCS2)2 + 2е ,
Некоторые исследователи, однако, считают, что применение тео-
рии смешанного потенциала неприменимо для таких сульфидов, как
галенит и сфалерит, содержащих катионы постоянной валентности.
Кроме того, как отмечает Г. Полинг [55], поскольку сульфидные
75
минералы уже при контакте с водой перестают быть электронейтраль-
ными за счет преимущественного перехода катионов металла в раст-
вор в виде аквокомплексов, то частичный перенос электронов должен
происходить в двойном электрическом слое, поэтому нельзя говорить
о применимости теории смешанного потенциала, требующей эквивалент-
ности анодных и катодных реакций.
Основной недостаток электрохимического подхода — игнорирова-
ние того обстоятельства, что к моменту воздействия собирателя по-
верхность сульфидных минералов уже частично окислена и поэтому
при дальнейшем взаимодействии с собирателем принимают участие
именно продукты окисления сульфидов.
6.3. Сорбция сульфгидрильных собирателей
и флотация сульфидных минералов
Галенит. Как в свое время было показано А.М. Годеном [11],со-
бирательное действие ксантогенатов повышается с увеличением дли-
ны углеводородного радикала собирателя (рис. П.З). Аналогично влия-
ние длины углеводородного радикала собирателя на флотируемость
галенита, сфалерита, халькопирита. Согласно данным Е. Вотгена и
Д. Луфта, по мере увеличения длины углеводородного радикала повы-
шается и сорбция ксантогенатов поверхностью галенита.
Для успешной флотации достаточно образования на поверхности
минерала далеко не насыщенного молекулярного покрытия сорби-
рованным собирателем. По нашим данным, для практически полно-
го извлечения галенита в пенный продукт достаточно примерно 35 %
условного слоя этилксантогената (рис. II.4), что согласуется с резуль-
татами других авторов.
Исследования прочности закрепления сорбированного минералом
собирателя при многократном разбавлении равновесного раствора сви-
детельствуют о практической необратимости поглощения ксантогена-
та галенитом: десорбция ксантогената не превышает 2—4 % сорбирован-
ного количества [5] . Высокая прочность закрепления дитиофосфа-
та на поверхности галенита установлена и другими исследователями
[33].
Исследования скорости обмена сорбированных галенитом ионов
ксантогената с ионами ксантогената, находящимися в растворе, по-
казали, что за 10 мин обмен между ионами составляет лишь около
70 % расчетного полного обмена при условии статистического распре-
деления ионов ’’меченого” ксантогената между сорбированными и на-
ходящимися в растворе ионами. Эти данные также подтверждают вы-
сокую прочность закрепления ксантогената на поверхности галенита.
Диалкилдитиофосфаты — более слабые собиратели сульфидных
минералов, чем ксантогенаты. Например, галенит сорбирует значитель-
но большее количество, этилксантогената, чем диэтилдитиофосфата
(рис. II.5 и II.6). Это объясняется как различием в произведениях раст-
76
II.3. Зависимость извлечения гале- п.4. Зависимость извлечения галенита
нита от расхода G алкилксанто- от плотности тп сорбционного слоя
генатов [И]: этилксантогената калия
1—5 — соответственно метил, этил,
пропил-, н-бутил-, изоамилксантоге-
нат
воримости ксантогенатов и дитиофосфатов свинца, так и различием
в величине поперечного сечения сорбируемого иона — по данным
Ж. Симарда и др. поперечное сечение иона диэтилдитифосфата рав-
но 70х10—16 см2, а для этилксантогената — 29х10—16 см2 [И] . Дан-
ные рис. II.6 свидетельствуют о том, что при одной и той же исходной
молярной концентрации собирателей кривые сорбции в пределах от
долей монослоя до примерно двух монослоев совпадают; при более
значительной плотности сорбционного слоя кривая, отвечающая пог-
II.5. Изотермы сорбции этил-
ксантогената калия (/) и диэ-
тилдитиофосфата натрия (2) га-
ленитом (CQCT - остаточная кон-
центрация реагента)
П.6. Зависимость плотности
сорбционного слоя на поверх-
ности галенита от исходной кон-
центрации Сисх собирателя:
1 — этилксантогенат калия;
2 — диэтилдитиофосфат натрия
77
лощению дитиофосфата, начинает отставать от кривой, отвечающей
поглощению этилксантогената. Вероятно, это обусловлено затруднен-
ностью диффузии более крупного иона дитиофосфата.
Для изучения соединений, образующихся на поверхности минера-
лов при действии реагентов типа ксантогенатов, используются различ-
ные методы исследований. Наиболее эффективными оказались спек-
трофотометрические методы, особенно ИК-спектроскопия. Помимо
этого ^применяются электронографические методы, селективно дей-
ствующие растворители, ЭПР, ЯМР и др.
В связи с необходимостью идентификации соединений, образую-
щихся на поверхности минералов, многими авторами исследовались
соединения, образующиеся в водном растворе солей соответствующих
металлов при добавлении ксантогенатов или дитиофосфатов. В иссле-
дованиях, проводившихся в институте Механобр, при изучении продук-
тов взаимодействия ионов свинца и меди с растворами ксантогена-
тов использовались методы как ИК-спектроскопии, так и УФ-спектро-
скопии [35] . При этом изучались водные и водно-спиртовые раство-
ры. Разбавление спиртом расширяет диапазон растворимости ксанто-
генатов тяжелых металлов, как это было показано С.Б. Леоновым
и Б.В. Комогорцевым, что позволяет успешно использовать метод
УФ-спектроскопии.
При титровании водного раствора этилксантогената раствором
перхлората свинца наблюдается образование осадка, отвечающего со-
отношению Pb : X = 1 : 2. При дальнейшем добавлении перхлората свин-
ца осадок ксантогената свинца растворяется, переходя в комплекс
РЬХ+, имеющий максимум поглощения при X = 250 нм. В водно-спир-
товых (1:3) растворах наблюдается поглощение при X = 270 нм, от-
вечающее ксантогенату свинца.
Исследование влияния pH на образование осадка ксантогената свин-
ца показало, что спектр, характерный для ксантогената свинца, наб-
людается при pH 4—8, при pH 2 ксантогенат разрушается, а при pH > 11
в растворе присутствуют лишь ионы ксантогената (X = 301 нм) (рис.
П.7, а) поскольку образование ксантогенатных комплексов свинца
затруднено вследствие образования более устойчивых гидроксоком-
плексов свинца. На основании термодинамических расчетов в этих
условиях можно было ожидать образования смешанных комплексов
типа РЬ (ОН) X, однако не удалось обнаружить появления каких-либо
специфических полос поглощения для этого комплекса.
Для определения состава сорбционного слоя, образовавшегося
на поверхности галенита при действии бутилксантогената калия, ис-
пользовалась обработка минерала после взаимодействия его с ксан-
тогенатом водно-спиртовым раствором или гексаном. При такой об-
работке с поверхности минерала в обоих случаях удаляется основная
часть (80—90 %) сорбированного собирателя, как это показали радио-
метрические определения (см. рис. II.7, б). Сравнение спектров рис.
78
II.7. Уф-спектры водно-спиртовых растворов:
а — бутилксантогената свинца при разных pH; б — собирателя, экстрагированного
с поверхности галенита после взаимодействия с бутилксантогенатом калия
П.7, а и б показывает, что с поверхности отмывался преимуществен-
но ксантогенат свинца.
ИК-спектры пленки возогнанного сульфида свинца, нанесенно-
го на поверхность кристалла германия, служившего оптическим эле-
ментом при записи спектров нарушенного полного внутреннего от-
ражения (НПВО), после обработки раствором бутилксантогената ка-
лия показали, что сорбционный слой представлен в основном ксан-
тогенатом свинца [35]. Во время записи спектров слой сульфида свин-
ца находился в растворе ксантогената, что исключило возможность
изменения поверхностных соединений при обработке их экстраген-
тами и высушивании.
При обработке галенита различными органическими растворите-
лями с поверхности минерала не удается удалить часть сорбирован-
ного реагента, более прочно закрепленного на катионах свинца, не по-
терявших связи с кристаллической решеткой минерала. Отмываемый
органическими растворителями ксантогенат свинца представляет со-
бой продукт взаимодействия ксантогената с продуктами окисления
галенита, очевидно, утратившими связи с решеткой минерала.
Некоторые исследователи считают, что при адсорбции ксантоге-
ната из растворов, содержащих растворенный кислород, сорбцион-
ный слой собирателя представлен несколькими слоями: первый слой —
это прочно закрепленный ксантогенат, не удаляемый с поверхности
даже при промывании минерала органическими растворителями; на
этом первом слое находятся адсорбированные за счет сил Ван-дер-Ва-
альса осадки ксантогената свинца и молекулы диксантогената.
Так как поверхность сульфидных минералов в реальных услови-
ях всегда в той или иной степени покрыта продуктами окисления, вод-
ная фаза пульпы имеет концентрацию катионов металлов, определя-
ющуюся растворимостью поверхностных продуктов окисления и pH
раствора. При добавлении собирателя некоторая часть его может свя-
79
зываться в виде труднорастворимых соединений, например ксанто-
генатов или диалкилдитиофосфатов тяжелых металлов. При относи-
тельно высокой концентрации катионов это может привести к непро-
изводительному расходу собирателя.
В связи с этим представляло интерес выяснить собирательное дей-
ствие ксантогенатов тяжелых металлов [5]. Опыты флотации галени-
та этилксантогенатом свинца показали, что собирательное действие
этилксантогената свинца зависит от степени дисперсности осадка —
наиболее высокие результаты сорбции наблюдались при применении
ксантогената свинца, полученного прибавлением ксантогената калия
к водной вытяжке галенита, когда получался наиболее тонкодисперс-
ный осадок.
Эти данные согласуются с результатами В.А. Глембоцкого и А.Е. Кол-
чемановой, в соответствии с которыми собирательное действие ксан-
тогенатов определяется в основном степенью их дисперсности, а так-
же их относительной растворимостью, т.е., чем более растворим ксан-
тогенат тяжелого металла, тем интенсивнее его собирательное действие.
На основании этого можно сделать вывод, что собирательное дей-
ствие ксантогенатов тяжелых металлов обусловлено сорбцией ионов
собирателя, подаваемых в раствор с учетом растворимости соот-
ветствующего ксантогената тяжелого металла. Поглощение анионов
собирателя минеральной поверхностью сдвигает равновесие в сторо-
ну дальнейшего растворения ксантогената тяжелого металла.
Подобный механизм действия ксантогенатов тяжелых металлов
подтверждается тем, что после взаимодействия ксантогената свинца
с галенитом на поверхности минерала сорбируются лишь ионы ксан-
тогената, в то время как свинец не сорбируется, как показано в опы-
тах М.Д. Хассиалиса с ксантогенатом свинца, содержащим ThB, что оп-
ровергает предположение о возможном ’’налипании” коллоидных осад-
ков ксантогената свинца на поверхность минерала.
Сульфиды меди характеризуются высокой сорбционной активностью
по отношению к сульфгидрильным собирателям, что объясняется вы-
сокой прочностью образующихся соединений при наличии на поверх-
ности продуктов окисления. Характеристикой этого могут служить
произведения растворимости соответствующих соединений меди с иона-
ми собирателей (см. главу IV).
По флотационной способности сульфиды меди можно расположить
в следующий ряд: халькопирит < борнит < ковеллин < халькозин
[38]. Ковеллин и некоторые разности халькозина склонны к шламо-
образованию и легкой окисляемости, вследствие чего в присутствии
этих минералов отмечается повышенная концентрация ионов меди
в жидкой фазе пульпы, приводящая к непроизводительному расхо-
ду собирателя за счет связывания его в объеме раствора. Кроме то-
го, ионы меди в растворе активируют другие сульфидные минералы,
что ухудшает селекцию.
80
II.8. Зависимость извлечения халько-
пирита (1, 2) и сорбции бутилового
ксантогената калия {3, 4) от исход-
ной концентрации последнего:
1, 3 - pH 6,2; 2, 4 - pH 10,1
Исследования различных авторов свидетельствуют о том, что суль-
фиды меди флотируются сульфгидрильными собирателями в широ-
ком диапазоне pH (рис. П.8).
По результатам спектрофотометрического титрования ксантоге-
ната калия раствором перхлората меди точка эквивалентности отве-
чает отношению Си : X = 1 : 2 [35]. При выдержке в течение опреде-
ленного времени раствора, содержащего стехиометрические количест-
ва ксантогената и перхлората меди, наблюдается изменение характе-
ра спектра водно-спиртового (1:3) раствора. Примерно через 30 мин
фиксируется спектр, характерный для диксантогена и ксантогената
одновалентной меди. Это свидетельствует о том, что первоначально
образовавшийся ксантогенат двухвалентной меди переходит посте-
пенно в ксантогенат меди одновалентной и диксантоген, что подтвер-
ждается данными ИК-спектров после экстракции гексаном соедине-
ний, образующихся при взаимодействии ксантогената с ионами меди.
При отмывке гексаном халькопирита, обработанного раствором
бутилксантогената калия, в экстракте оказались значительные коли-
чества диксантогена. Аналогичные результаты получены и другими
исследователями.
При взаимодействии растворов этилксантогената калия с иона-
ми меди установлено, что диксантоген образуется при pH в пределах
4-10. При этом реакция окисления идет со значительной скоростью
[58] . На основании этих результатов предполагается, что диксанто-
ген в кислой среде образуется за счет окисления ионами Си2+, а в ще-
лочной среде - за счет окисления гидроксидом меди. Кроме того, воз-
можно окисление кислородом, адсорбированным поверхностью ми-
нерала.
Изучение устойчивости диксантогена показало, что диэтилдиксан-
тоген устойчив до pH 10. Однако в присутствии халькозина уже при
pH > 8 диксантоген не был обнаружен, и, таким образом, успешная
флотация халькозина при высоких pH обусловлена, очевидно, обра-
зованием ксантогената меди.
6-6926
81
II.9. Извлечение халькозина этил-
ксантогенатом (7), диэтилдитио-
фосфатом (2) и его дисульфидом
С?) при различных pH (расход
этилксантогената 5 ’ 10“5 моль/л;
диэтилдитиофосфата 5 • 10-5 моль/л;
дисульфида 5 • 10-5 моль/л [58]
При флотации халькозина диэтилдитиофосфатом его подавление
отмечается лишь при pH > 12, если же в качестве собирателя исполь-
зуется дисульфид диэтилдитиофосфат, то даже при pH около 14 халь-
козин успешно флотируется [58] (рис. II.9).
В присутствии ионов меди в растворе диэтилдитиофосфат окис-
ляется при pH 6-8, при pH 10 дисульфид не образуется. Это подтвер-
ждается данными по окислению диэтилдитиофосфата в присутствии
халькозина, согласно которым при pH > 8 установлены лишь следы
дисульфида [58] . Очевидно, успешная флотация халькозина при вы-
соких pH обусловлена наличием дитиофосфата меди.
При изучении продуктов взаимодействия флотационных концен-
траций диэтилдитиофосфата с ионами Си2+ в водном растворе Л.Я. Шу-
бовым, И.Б. Залесником и С.И. Митрофановым установлено, что при
pH < 6,5 образуется смесь диэтилдитиофосфата одновалентной меди
и дисульфида, при pH 7,5—9,5 в основном образуется диэтилдитио-
фосфат двухвалентной меди. При взаимодействии диэтил дитиофосфа-
та с халькопиритом, как показали радиометрические исследования,
количество сорбированного собирателя зависит от степени окисле-
ния поверхности халькопирита. УФ-спектры растворов четыреххло-
ристого углерода, использованного для экстракции продуктов реак-
ции с поверхности халькопирита, показали наличие дитиофосфата од-
новалентной меди и дисульфида дитиофосфата. Увеличение степени
окисления халькопирита способствует образованию дитиофосфата
двухвалентной меди. При этом подчеркивается, что наличие дисуль-
фида обусловлено не окислением исходного собирателя, а разложе-
нием дитиофосфата двухвалентной меди на дисульфид и дитиофос-
фат одновалентной меди.
При применении методов магнитной радиоспектроскопии для изу-
чения состава соединений, образующихся на поверхности, П.М. Соло-
женкиным и Н.И. Копиця установили, что на поверхности медьсодер-
жащих сульфидов при взаимодействии их с ксантогенатами и дитио-
фосфатами образуются соответствующие соединения двух- и одно-
валентной меди, а при взаимодействии с дитиокарбаматами — лишь
дитиокарбаматы двухвалентной меди. При этом отмечено, что хелат-
ные комплексы меди в случае соединения двухвалентной меди обес-
82
11.10. Зависимость сорбции этилксантогената
пиритом от pH среды:
1—3 — концентрация собирателя соответственно:
6,24 • 10-6, 6,24 • 10“5, 6,24 • 10~4 моль/л
печивают большую гидрофобизацию поверхности минерала, чем сое-
динения одновалентной меди [30].
Пирит. По данным радиометрического определения, пирит, содер-
жащий продукты окисления, активно сорбирует ксантогенат [11].
Количество сорбированного ксантогената зависит от степени окисле-
ния пирита и pH; так, при pH 8 сорбция ксантогената ухудшается (рис.
11.10). Аналогичные результаты получены и другими исследователя-
ми.
Поскольку ионы железа при взаимодействии с ксантогенатом об-
разуют значительно более легко растворимые соединения, чем ксанто-
генаты других цветных металлов, оставалось неясным, в какой фор-
ме сорбируется ксантогенат поверхностью пирита даже при тех pH,
при которых на его поверхности образуются в результате окисления
такое труднорастворимое соединение, как гидроксид железа.
Применение таких методов исследования, как ИК- и УФ-спект-
роскопия, ЭПР убедительно показало, что основным продуктом взаи-
модействия является диксантоген, физически сорбированный поверх-
ностью пирита.
Образование диксантогена возможно вследствие восстановления
Fe3+ или Fe (ОН)3 по реакциям
2Fe3+ + 2Х~ -> 2Fe2 + + Х2
или
2 Fe (ОН) + 2Х" + 6Н+ -> 2 Fe2 + + Х, + 6Н,О.
Одни исследователи считают, что диксантоген образуется в резуль-
тате окисления ксантогената кислородом, адсорбированным поверх-
ностью пирита:
’/2 о2 (адс) + 2Х- + н2 О - Х2 (адс) + 2 он;
83
Другие установили, что в присутствии ионов железа окисление
ксантогената до диксантогена возможно лишь до pH < 4, в то время
как в присутствии пирита образование диксантогена прекращается
лишь при pH > 11. Т.е. образование диксантогена возможно за счет
кислорода, адсорбированного поверхностью пирита.
При взаимодействии пирита с диэтилдитиофосфатом согласно пред-
ставлениям, развиваемым в работе [58] , флотируемость пирита также
обусловлена образованием соответствующего дисульфида в результа-
те окисления диэтилдитиофосфата адсорбированным на поверхнос-
ти пирита кислородом. Подавление флотации пирита при высоких pH
объясняется неустойчивостью в этих условиях дисульфида диэтилди-
тиофосфата. Определения содержания дисульфида при взаимодействии
диэтил дитиофосфата с пиритом показали, что уже при pH > 6 созда-
ются условия, ухудшающие образование дисульфида [58].
Присутствие пирита в смеси минералов приводит к некоторому
перераспределению различных форм фиксации собирателя между ми-
нералами. Так, например, в присутствии пирита уменьшается сорбция
диксантогена халькопиритом и переход его на поверхность пирита,
в результате чего флотация халькопирита ухудшается, а пирита — улуч-
шается.
Сфалерит. При оценке флотационной активности сфалерита необ-
ходимо иметь в виду, что различные разновидности этого минерала
могут весьма существенно отличаться содержанием железа и других
примесей, а также степенью природной активации ионами меди. В за-
висимости от содержания изоморфного железа различаются мало- (до
10 % железа) сфалериты и сильно железистые (более 10 % железа) мар-
матиты.
В институте Механобр исследовалась флотация четырех различных
образцов сфалерита (рис. II. 11). Параллельно определялась сорбция
этил- и бутилксантогената калия радиометрическим методом [16].
Рациональным анализом установлено, что в акджальском сфале-
рите содержится в виде окисленных соединений 2,4 % цинка, 0,64 %
свинца и 0,013 % меди; в приморском богатом железом сфалерите
содержится 1 % окисленного цинка. Высокое содержание изоморф-
ного железа (14 %) в приморском сфалерите обусловливает его боль-
шую склонность к окислению; этому также способствует наличие тон-
кой вкрапленности пирротина и пирита.
Лишь один из образцов (акджальский) достаточно успешно фло-
тируется как бутиловым, так и этиловым ксантогенатами при относи-
тельно невысоких расходах собирателя. Это, очевидно, объясняется
некоторой природной активацией его поверхности. Для максималь-
ного извлечения образца сфалерита достаточно образования сорбци-
онного слоя этил- и бутилксантогената, отвечающего 15-20 % услов-
ного монослоя.
84
II. 11. Зависимость извлечения образцов сфалерита этиловым и бутиловым ксан-
тогенатом калия (а) и изотермы сорбции этих реагентов (б):
1 — акджальский (этиловый ксантогенат) ; 2 — то же (этиловый ксантогенат) ;
3 — лениногорский и зыряновский (этиловый и бутиловый ксантогенаты);
3' - лениногорский (бутиловый ксантогенат) ; 3" - то же (этиловый ксантоге-
нат) ; 4 — приморский (бутиловый ксантогенат) ; 5 — то же (этиловый ксанто-
генат) ; 6 - зыряновский (бутиловый ксантогенат) ; 7 - то же (этиловый ксан-
тогенат)
Как следует из изотерм сорбции этил- и бутилксантогенатов раз-
личными образцами сфалерита (см. рис. 11.11, б), наиболее высокой
сорбционной емкостью по отношению к обоим собирателям облада-
ют акджальский и приморский сфалериты. Насыщение сорбционной
способности этих образцов отвечает примерно 1,6—2 условным мо-
нослоям. Несмотря на заметную сорбцию ксантогената лениногорс-
ким и зыряновским сфалеритом, оба эти образца плохо флотируют-
ся. По данным И.Н. Плаксина и Г.Н. Хажинской, ксантогенат калия
сорбируется даже химически чистым искусственно приготовленным
сульфидом цинка. Это подтверждается также результатами ИК-спек-
троскопии искусственного сульфида цинка после взаимодействия с
бутилксантогенатом калия [16] : на спектре неактивированного суль-
фида цинка имеются полосы, отвечающие ксантогенату цинка.
Согласно представлениям многих исследователей, низкая флоти-
руемость неактивированного сфалерита объясняется относительно
высокой растворимостью низших ксантогенатов цинка, вследствие
чего на поверхности минерала невозможно образование прочного гид-
рофобного покрытия.
Определение десорбции ксантогената с поверхности сфалерита
при многократном разбавлении равновесного раствора показало, что
за исключением акджальского природноактивированного сфалери-
та с поверхности других образцов десорбируется от 40 до 60 % сор-
бированного ксантогената. Эти данные согласуются с результатами
И.Н. Плаксина и Е.А. Анфимовой, показавшими наличие устойчивой
и неустойчивой форм закрепления низших ксантогенатов на поверх-
ности неактивированного сфалерита.
85
11.12. Извлечение неактивированного сфале-
рита при различном расходе ксантогенатов
[П]:
1 — этиловый; 2 — н-амиловый; 3 — «-геп-
тиловый
Помимо малой прочности закрепления сорбированного ксанто-
гената низкие результаты флотации могут быть обусловлены гидро-
фильностью поверхности, не занятой собирателем. Например, обра-
зующиеся при окислении сильножелезистых сфалеритов рыхлые гид-
роксиды железа могут вызвать повышение степени гидрофильности
поверхности. Этим, очевидно, и объясняется низкая флотируемость
приморского сильножелезистого сфалерита, несмотря на заметную
сорбцию ксантогената.
По данным А. Годена, неактивированный сфалери! можно сфло-
тировать при применении высших ксантогенатов, например гептил-
ксантогената (рис. 11.12) [11], что подтверждено также работой М. Фюр-
стенау, К. Клиффорда и др. (1974 г.). Их данные свидетельствуют об
успешной флотации как маложелезистого сфалерита, так и мармати-
та при применении в качестве собирателей амилксантогената. Эти ав-
торы считают, что адсорбция ксантогената на сфалерите протекает в
две стадии: первая — это хемосорбция ксантогената, вторая — сорбция
объемного осадка ксантогената цинка на хемосорбированном ксан-
тогенате за счет взаимодействия углеводородных радикалов. Необ-
ходимость сорбции объемного осадка амилксантогената для флота-
ции сфалерита подтверждается установленным совпадением измерен-
ных pH подавления флотации сфалерита с расчетными данными, по-
лученными на основании соотношения произведения растворимости
амилксантогената цинка и гидроксида цинка.
Значение различных форм закрепления собирателя. В некоторых
случаях на поверхности сульфидных минералов после взаимодействия
их с собирателем сорбционный слой представлен как хемосорбиро-
ванным ксантогенатом, так и физически адсорбированным диксан-
тогеном.
Оценка относительной роли каждого из этих компонентов в про-
цессе гидрофобизации разными исследователями неоднозначна. Не-
которые считают, что диксантоген, образующийся при окислении ксан-
тогената, является основным соединением, определяющим гидрофо-
бизацию поверхности минералов. А.А. Абрамов [1] считает необхо-
86
димым условием успешной флотации одновременное присутствие на
поверхности минералов как хемосорбированного ксантогената, так
и физически адсорбированного диксантогена. По его данным, отмыв-
ка эфиром диксантогена требует многократного увеличения плотнос-
ти сорбционного слоя для полной флотации галенита.
В настоящее время большинство исследователей приходят к вы-
воду, что в присутствии некоторых минералов образование диксан-
тогена невозможно или весьма незначительно, и поэтому в этих слу-
чаях необходимая для флотации степень гидрофобизации обеспечи-
вается химическим взаимодействием ксантогената с катионами по-
верхностных соединений минерала. Образование дисульфидов сульф-
гидрильных собирателей возможно лишь в присутствии минералов,
катионы которых обладают переменной валентностью.
Это положение подтверждается исследованиями П.М. Соложен-
кина и Н.И. Копиця [30, 47] с применением метода ЭПР, показав-
шими отсутствие диксантогена на поверхности галенита, в то время
как на халькопирите, борните, пирите и активированном ионами ме-
ди сфалерите наряду с ксантогенатами соответствующих металлов
отмечается и диксантоген.
Имеющиеся в литературе данные различных авторов по опреде-
лению содержания диксантогена в сорбционном слое на поверхнос-
ти сульфидных минералов весьма существенно отличаются. Так, нап-
ример, по данным А.А. Абрамова [1], доля диксантогена в сорбци-
онном слое на галените колеблется от 35 до 95 % общей сорбции соби-
рателя (в зависимости от его расхода и pH). По результатам С. Алли-
сона и Н. Финкельштейна содержание диксантогена составляет при-
мерно 1 %, а по данным Н.И. Копиця и П.М. Соложенкина диксанто-
ген не обнаружен.
Возможно, что наблюдаемое расхождение результатов обуслов-
лено недостаточной селективностью применяемых растворителей для
удаления диксантогена. Наши исследования показали, что эфир и диок-
сан не могут быть использованы в качестве селективного растворите-
ля, поскольку они растворяют и свежеобразованный ксантогенат свин-
ца (радиометрический контроль отмываемого эфиром собирателя
показал почти полное удаление сорбированного ксантогената), при
этом он частично разлагается.
Наиболее селективными растворителями диксантогена оказались
СС14 и гексан. По нашим данным, экстракция диксантогена СС14 так-
же ухудшает флотацию галенита [6], правда менее резко, чем при
применении эфира [ 1 ].
При оценке результатов флотации минералов после отмывки дик-
сантогена растворителями следует также учитывать возможность сме-
щения равновесия, нарушение распределения продуктов взаимодей-
ствия. Кроме того, присутствие даже незначительных количеств са-
мого растворителя также может исказить результаты флотации. На-
87
личие даже незначительных включений других минералов или ионов
меди и железа в растворе может привести к повышению содержания
диксантогена в сорбционном слое.
В случае образования дисульфида его присутствие способствует
улучшению флотируемости минерала, увеличивая гидрофобизацию
поверхности. Улучшение флотируемости сульфидных минералов в
случае наличия в сорбционном слое диксантогена объясняется, оче-
видно, так же как и улучшение флотации при добавках аполярных
собирателей, созданием более благоприятных условий для закрепле-
ния минеральных частиц на пузырьках воздуха и упрочением контак-
та с ними.
7. ВЗАИМОДЕЙСТВИЕ
НЕИОНОГЕННЫХ СЕРОСОДЕРЖАЩИХ СОБИРАТЕЛЕЙ
С СУЛЬФИДНЫМИ МИНЕРАЛАМИ
Взаимодействие дисульфидов ксантогената и диалкилдитиофос-
фата с сульфидными минералами. Ранее предполагалось, что собира-
тельное действие таких дисульфидов сульфгидрильных реагентов как
диксантоген обусловлено физической адсорбцией молекул дисуль-
фида.
В настоящее время возможность химического взаимодействия
дисульфидов с поверхностью металлов и сульфидных минералов под-
тверждается как термодинамическими расчетами [47] с использова-
нием потенциалов соответствующих частных реакций, так и экспери-
ментальными данными разных авторов.
При рассмотрении действия дисульфидов необходимо иметь в виду,
что они являются слабыми окислителями и способны восстанавливать-
ся в присутствии сульфидных, гидроксильных и даже тиосульфатных
ионов [47] ~
Наиболее активно дисульфиды сульфгидрильных собирателей реа-
гируют с металлами в соответствии с уравнениями
Me - 2 е = Ме2 +
(ROCS2)2 + 2е = 2ROCS~
Me+(ROCS2)2 = Ме2++ 2ROCS~.
В результате такой реакции возможно образование ксантогената
соответствующего металла. При взаимодействии дисульфидов с суль-
фидными минералами за исключением пирита, который не реагирует
с диксантогеном, в результате восстановления дисульфида до аниона
ROCS2 • на поверхности минерала образуется соответствующий ксан-
тогенат металла. Так при взаимодействии халькозина с диэтилдиксан-
тогеном образуется ксантогенат меди
Cu2 S + (C2HS OCS2)2 = 2 Си C2HS OCS2 + S°
88
Исследования ИК-спектров галенита после его взаимодействия
с этилдиксантогеном, проведенные Г. Полингом [55], показали на-
личие в сорбционном слое этилксантогената свинца, т.е. в этом слу-
чае образуются такие же продукты взаимодействия, как и при приме-
нении этилксантогената калия. Однако взаимодействие с диксанто-
геном не сопровождается вытеснением с поверхности галенита иона
тиосульфата, что свидетельствует об образовании поверхностного ксан-
тогената свинца в результате восстановления диксантогена на поверх-
ности минерала [55] . Сера сульфидного минерала при этом окисля-
ется лишь до элементарной, поскольку оргайические дисульфиды от-
носительно слабые окислители. Образование ксантогената меди на
поверхности халькозина при действии этилдиксантогена установле-
но еще в ранних исследованиях [11].
При флотации сульфидных минералов в отсутствие подавителей
ксантогенат и диксантоген проявляют примерно одинаковое соби-
рательное действие. Необходимо лишь учитывать, что вследствие пло-
хой ‘растворимости диксантогена для успешной флотации необходи-
мо большее время контакта. Различие в собирательном действии ксан-
тогенатов и их дисульфидов больше проявляется в присутствии пода-
вителей. Так, по данным И.А. Каковского и В.М. Арашкевича [30],
при флотации сфалерита при разных pH оба собирателя проявляют
примерно одинаковое действие, так же как и при флотации сфале-
рита в присутствии Na2 S. Флотация галенита в присутствии подавителя
СаО или хромата калия подавляется сильнее при использовании ди-
бутилдиксантогена, что свидетельствует о том, что ионная форма со-
бирателя (ксантогенат) больше способна препятствовать действию деп-
рессора, чем диксантоген.
Взаимодействие тионокарбаматов с сульфидными минералами.
В последнее десятилетие в практике флотации успешно применяют-
ся неионогенные собиратели — тионокарбаматы. Наиболее известный
собиратель этого класса — американский реагент Z-200. Несмотря на
эффективность реагентов этого класса, изучению механизма их дей-
ствия посвящено лишь незначительное число работ. В Гинцветмете
изучалась сорбция реагента НТК (О-изопропил- А^метилтионокарба-
мат), являющегося аналогом Z-200, халькопиритом, молибденитом
и пиритом [9]. При этом установлено, что поверхностью халькопи-
рита и молибденита НТК сорбируется примерно, так же как и ксан-
тогенат; пиритом — весьма незначительно.
Максимальная сорбция НТК на халькопирите отмечается при pH
7,8—8, что, вероятно, обусловлено тем, что в щелочной среде начина-
ется образование ионной формы тионокарбамата. Максимальная сорб-
ция изопропилтионокарбамата на молибдените происходит при pH 8.
На поверхности халькопирита НТК закрепляется относительно проч-
но, в то же время с поверхности пирита НТК очень легко десорбирует-
ся водой.
89
Таблица II. 1
Испытанные тионокарбаматы и их свойства
Т ионокарбамат Формула рКа * а •'max' н«
(9-бутил- N- бензоилтио- нокарбамат (ББТК) с4н 0(^S XNHC-CaHc у 6 5 7,45 +2,34 266
О бутил- N -фенилтио- нокарбамат (БФТК) 0- бутил- N- бензилтио- нокарбамат (БТК) и С.Н. OC-NHC.H, 4 9 „ 6 5 с4и9°с \NHCILCJL _ Z О э 11,05 12,1 +0,6 +0,215 272 246
О-бутил- TV-этилтионо- карбамат (БЭТК) С.Н ОС 4 9 \nhc2h5 12,7 -0,10 243
0-бутил- TV-оксиэтил- тиокарбамат (БОЭТК) С Н Off Xnhc2h4 он 12,7 -0,10 246
Большая селективность в отношении пирита собирателей, содер-
жащих тиоамидную группировку, по сравнению с ксантогенатами объяс-
няется тем, что трехвалентное железо обладает небольшим сродством
к низкомолекулярным лигандам, содержащим алифатический азот.
В то же время наличие в молекуле собирателя помимо азота серы обус-
ловливает эффективное взаимодействие с сульфидами меди.
Собирательные свойства соединений типа тионокарбаматов можно
улучшить, если использовать реагенты с высокой поляризующей спо-
собностью и более кислыми свойствами. Последние два фактора долж-
ны способствовать образованию дативной я-связи.
Для выявления влияния характера заместителя на флотационные
свойства собирателей в институте Механобр синтезированы соедине-
ния, приведенные в табл. II. 1 [61]. В состав первых трех соединений
введены электроноакцепторные заместители, а последних — электро-
нодонорные, что позволило изменить кислотные свойства этих реа-
гентов, как это видно из значений рКа (см. табл. II.1). Их кислотные
свойства зависят от индуктивного эффекта заместителя, определя-
емого значением а* Тафта. Смещение длины волны Хтах первой по-
лосы поглощения в УФ-спектре позволяет судить в первом прибли-
жении о поляризуемости соединений (чем сильнее смещение этой по-
лосы в длинноволновую область, тем больше способность к поляри-
зации) .
Концентрация водородных ионов в растворе заметно влияет на
сорбцию ББТК и БФТК халькопиритом (рис. 11.13, а). В случае бо-
лее кислого соединения — ББТК (рКа = 7,45) максимум сорбции на
90
a
^мкмоль/м1
11.13. Результаты флотации в зависимости от pH среды халькопирита (а, б) и пи-
рита (в) различными тионокарбаматами [61]:
1 - ББТК; 2 - БФТК; 3 - ВТК; 4 - БЭТК; 5 - БОЭТК
халькопирите смещен в более кислую область (pH 6—9), а для БФТК
(рКа = 11,05) максимум сорбции смещен в более щелочную область
(pH 10—11). Дальнейшее повышение pH ухудшает сорбцию на халь-
копирите за счет конкуренции с гидроксильными ионами. Для осталь-
ных тионокарбаматов резко выраженный максимум сорбции отсут-
ствует; для БЭТК наблюдается постепенное уменьшение сорбции с
увеличением pH. • Наиболее слабым собирателем для халькопирита
является БОЭТК (см. рис. 11.13, б), что, вероятно, объясняется мень-
шей прочностью его сорбции, а также некоторым гидрофилизирую-
шим действием ОН-группы.
В щелочной среде (pH около 10) все испытанные тионокарбама-
ты сорбируются пиритом меньше, чем халькопиритом, относительно
лучше сорбируются БФТК и БТК, что согласуется с результатами фло-
тации пирита (см. рис. 11.13, в). БОЭТК не флотирует пирит при всех
испытанных pH. На основании этих данных можно считать, что наи-
более селективен в отношении пирита — БОЭТК и ББТК.
Особенности действия тионокарбаматов можно объяснить разли-
чием в кислотной силе, их поляризуемостью и свойствами функцио-
нальных группировок, присутствующих в молекуле. При взаимодей-
ствии халькопирита с тионокарбаматами может образоваться поверх-
ностное координационное соединение в результате перекрывания за-
полненных орбиталей донорных атомов азота и серы вакантными
орбиталями меди с образованием ковалентной ст-связи, а одна из за-
полненных ^/-орбиталей меди перекрывается со свободной орбиталью
91
серы собирателя (или группировки С =S) и образует дативную я-св язь.
Если в молекуле тионокарбамата имеется электроноакцепторный замес-
титель, повышающий кислотные свойства, то он будет оттягивать не-
поделенную пару электронов азота и уменьшать электронную плот-
ность в области Си - N. Вследствие уменьшения межэлектронного
отталкивания перекрывание — d^ орбиталей меди и серы увеличи-
вается, т.е. возрастает вклад дативной я-связи и соответственно проч-
ность связи.
Это характерно для БВТК и БФТК и, в несколько меньшей сте-
пени, для БТК. Если в реагенте содержится электронодонорный замес-
титель, повышающий электронную плотность на донорном атоме азо-
та, то электронная плотность по a-связи Си — N будет больше, что обус-
ловит меньшее перекрывание d^—d^ орбиталей меди и серы и понизит
прочность связи, как, например, в случае БОЭТК. Увеличение поля-
ризуемости реагента должно способствовать упрочнению связи. Как
видно, высокая поляризуемость ББТК и БФТК будет благоприятство-
вать их прочному закреплению на медных минералах.
Наличие в молекуле собирателя полярных гидрофильных группи-
ровок должно, видимо, способствовать большему растворению не
только исходного реагента, но и поверхностного соединения и гидро-
филизации поверхности, что приводит к менее прочному закреплению
реагента, например, БОЭТК.
Присутствие в молекуле ББТК полярной гидрофильной группи-
ровки (С = О) компенсируется его высокими кислотными свойства-
ми и поляризуемостью, хотя сорбция ББТК на халькопирите по вы-
шеуказанной причине и несколько меньше, чем БЭТК.
Из литературных данных известно, что Fe3+ способно образовы-
вать весьма прочные комплексы с N -донорными реагентами, когда
их неподеленная пара электронов делокализована, как, например, у
дипиридила. Вероятно, по этой причине БФТК и БТК в большей сте-
пени сорбируются и флотируют пирит, чем остальные реагенты. В об-
щем случае можно также ожидать, что чем более основными свойства-
ми в тионокарбамате обладает азот, тем хуже такое соединение долж-
но флотировать пирит.
При изучении методом ИК-спектроскопии характера поверхност-
ных соединений ББТК, БТК, БФТК и БЭТК на медной пленке, халь-
копирите и пирите показано, что во всех случаях наблюдается их хе-
мосорбция с образованием четырех- или пятичленных хелатных цик-
лов типа [61] :
ROC-N=CCJL
If J 6 5
S о
Минерал
RO—С
/\
Минерал
RO-
III S^NH-X
AZ_____
Минерал
92
Форма I характерна для ББТК на поверхности халькопирита при
pH 6-9, форма II для ББТК (pH 10), БФТК (pH 9) и БЭТК на мед-
ной пленке (pH 6,8; 10,2), форма III — для всех остальных случаев,
причем на пирите для ББТК (pH 6,3) и БЭТК (pH 6,3; 10,2) отме-
чено присутствие и молекулярной формы. Для БОЭТК отчетливых
спектров на минералах не удалось получить. Таким образом, данные
ИК-спектроскопии подтверждают донорно-акцепторный механизм хе-
мосорбционного закрепления тионокарбаматов.
Взаимодействие тиоамидов с сульфидными минералами. В качест-
ве собирателей для сульфидных минералов предложены также реаген-
ты из класса тиоамидов, имеющие общую формулу R—
\NH-X
где X — соответствующий заместитель. Исследовано, собирательное
S
действие таких тиамидов, как тиоацетамид СН —и тиобенза-
s ^nh2
мид С6Н5 при флотации сульфидов меди и активированного
>4'NH2
медью сфалерита. Собирательное действие этих реагентов по отноше-
нию к сульфидным минералам обусловлено их способностью к обра-
зованию комплексных соединений с медью, при этом медь восстанав-
ливается до одновалентной.
Определение сорбции этих собирателей показало, что марказит и
неактивированный сфалерит практически не сорбируют тиоамиды,
в то время как активированный сфалерит сорбирует тиоамиды, хотя и
значительно хуже, чем этиловый ксантогенат. Галенит и марказит флоти-
руются тиоамидами значительно хуже, чем ксантогенатом.
В институте Механобр исследовали сорбцию тиовалеранилида
и флотацию халькопирита, пирита и галенита
[35] . При pH 6,4—6,7 как халькопирит, так и пирит сорбируют тиова-
леранилид примерно одинаково. Максимум сорбции тиовалеранилида на
халькопирите наблюдается при pH около 9, а на пирите — при pH 6—9.
При pH > 10 флотация халькопирита и пирита резко подавляется, что
обусловлено ухудшением сорбции тиовалеранилида за счет конкуренции
с ионами гидроксила. Галенит флотируется тиовалеранилидом значитель-
но хуже,чем халькопирит и пирит. Приведенные выше эксперименталь-
ные данные свидетельствуют о том, что тиоациланилиды — сильные соби-
ратели для сульфидов меди; селективность их действия в отношении
пирита примерно такая же, как и ксантогенатов.
Взаимодействие аллиловых эфиров ксантогеновых кислот с суль-
93
a
11.14. Зависимость извлечения минералов (/-У) и сорбции (1-3) аллилового
эфира изопропилксантогеновой кислоты от расхода собирателя (а) и pH среды (б):
1,1— активированный сфалерит; 2,2 - пирит; 3, 3 — халькопирит
фидными минералами. Из этого класса неионогенных собирателей для
сульфидных минералов известен реагент S-3302, являющийся аллиловым
эфиром амилксантогеновой кислоты: Я~СсН,, ОС
5 11 XS-CH2-CH~CH2
Этот реагент применяется в качестве собирателя для сульфидов меди
и молибдена при отделении их от пирита.
Собирательное действие аллиловых эфиров различных ксантоге-
новых кислот исследовалось в Гинцветмете. На рис. 11.14, а приводят-
ся результаты флотации халькопирита, активированного ионами меди
сфалерита и пирита. Изучение влияния pH на флотацию этих минера-
лов (см. рис. 11.14, б) показало, что при повышении pH до 9,5—10 наб-
людается незначительное ухудшение флотации халькопирита и акти-
вированного сфалерита. Пирит флотируется плохо при всех значениях
pH, что обусловлено очень низкой сорбцией аллилового эфира изо-
пропилксантогеновой кислоты, а также незначительной прочностью
закрепления сорбированного реагента. С поверхности пирита при об-
работке его четыреххлористым углеродом после взаимодействия с
собирателем, последний удаляется в неизмененном виде, в то время как
с поверхности халькопирита аллиловый эфир изопропилксантогено-
вой кислоты экстрагируется в виде медного комплекса. Эти данные
свидетельствуют о хемосорбционном закреплении реагента на поверх-
ности халькопирита, а в случае пирита — о физической сорбции.
8. ДЕЙСТВИЕ МОДИФИКАТОРОВ
ПРИ ФЛОТАЦИИ СУЛЬФГИДРИЛЬНЫМИ СОБИРАТЕЛЯМИ
8.1. Влияние концентрации водородных ионов
Концентрация водородных ионов имеет важное значение для фло-
тации сульфидных минералов. Влияние pH может быть обусловлено
конкуренцией ионов Н+ или ОН- с ионами собирателя на поверхнос-
ти минералов, состоянием собирателя и минеральной поверхности,
а также может сказываться на действии модификаторов флотации.
Для каждого сульфидного минерала существует критическое зна-
чение pH, выше которого при данном расходе собирателя невозмож-
но закрепление воздушного пузырька на минеральной поверхности
[43].
Значение критического pH зависит от природы минерала, свойств
собирателя и его расхода и определяется отношением X-/ОН = К,
где К — величина постоянная при данной температуре. Отсюда следу-
ет, что флотация возможна, если Х~/ОН“ > К, и флотация отсутству-
ет, если Х~/ОН— < К. Подобное соотношение, определяющее возмож-
ность флотации или подавления,не позволяет, однако, судить о меха-
низме подавляющего действия при высоких pH. Совпадение экспери-
ментально установленного критического pH с рассчитанным на осно-
ве констант равновесия соответствующих реакций подтверждает хи-
мический характер взаимодействия, т.е. конкуренцию ионов собира-
теля и гидроксила.
Критические значения pH для сульфидных минералов
в растворе этилксантогената (25 мг/л) калия
при комнатной температуре [43]
Сфалерит Пирротин .... 6,0 Халькопирит . . Ковеллин. . . . .. . . 11,8 . . . 13,2
Арсенопирит . . . . . 8,4 Борнит . . 13,8
Г аленит . . . 10,4 Тетраэдрит . . . . . . 13,8
Пирит Марказит .... . . . 10,5 . . . 11,0 Халькозин . . . . . . 14,0
Характерные данные по влиянию концентрации гидроксильных
ионов на сорбцию этилового ксантогената и флотацию галенита при-
ведены на рис. 11.15 [5]. Аналогичные результаты получены други-
ми исследователями при изучении влияния pH на сорбцию ксантоге-
натов и диэтилдитиофосфата для других сульфидных минералов. Во
всех случаях по мере увеличения концентрации ОН-ионов наблюда-
ется уменьшение плотности сорбционного слоя собирателя. Из срав-
нения действия регуляторов кислотности Na,CO3 и Na ОН (рис.
11.15) видно, что определяющее значение имеет лишь концентрация
гидроксильных ионов. Однако в случае применения в качестве регу-
95
П.15. Зависимость извлечения галенита (7)
и сорбции этилового ксантогената (2) от pH
среды (3 — NaOH; 4 - NaiCOg)
П.16. Зависимость извлечения лениногорс-
кого сфалерита и сорбции этилового ксан-
тогената от pH среды (а) и степени активации
при pH 10,7 (б) (расход C11SO4 • $Н2о
100 г/т, этилового ксантогената 48,5 г/т):
1,4 — извлечение; 2, 5 - сорбция сфалерита
активированного; 3 — то же, неактивирован-
ного
б
20 40 60 80 100 120 140 160
Степень активации, % ус-
ловного монослоя ионов меди
лятора pH извести оказывается, что подавление определяется не толь-
ко концентрацией ОН-ионов.
Так, например, при применении в качестве регулятора среды из-
вести подавление флотации пирита наступает при более низких pH,
чем при использовании КОН или К2СО3. Это объясняется дополни-
тельным подавляющим действием ионов кальция, которые, как это
показано радиометрическими определениями, сорбируются поверх-
ностью пирита.
На рис. 11.16, а представлены данные по влиянию pH на сорбцию
ксантогената сфалеритом до и после активации ионами меди [16] .
Для вытеснения ксантогената с поверхности активированного сфале-
рита концентрация гидроксильных ионов должна быть примерно в
30—300 раз больше, чем для вытеснения такого же количества ксан-
тогената с поверхности неактивированного минерала. Значения pH,
обусловливающие ухудшение флотации сфалерита, зависят от степе-
ни активации сфалерита ионами меди. По мере увеличения степени
активации возрастает сорбция ксантогенатов, достигая максималь-
но возможной величины, несмотря на высокую концентрацию ионов
ОН- (pH 10,7), однако извлечение при флотации достигает лишь 58 %
(см. рис. 11.16, б). Это, очевидно, объясняется гидрофилизирующим
96
действием ионов гидроксила, сорбированных незанятыми собирате-
лем участками поверхности (максимальная плотность сорбционного
слоя собирателя в этих условиях составляет около 37 % условного мо-
нослоя) .
Некоторые исследователи, например М. Флеминг, С.Ф. Бессонов,
считают, что при высоких pH ксантогенат свинца разлагается по ре-
акциям
Pb(C Н OCS2) + 4КОН + К PbO, +Н О + 2С,Н OCS,K
^0
С Н5OCS2K + 2KOH^ С2нч ОСс +К.S+H.о
к2 РЬО2 + K2s + 2 Н2о -> PbS + 4КОН .
Образующийся K2S при взаимодействии с плюмбитом дает суль-
фид свинца, не способный к взаимодействию с ксантогенатом.
Спектрофотометрические исследования показали (см. рис. И.7)
что при высоких pH (pH 11—12) ксантогенат свинца разрушается (на
спектрограмме наблюдаются лишь полосы, отвечающие ионам ксанто-
гената) . Таким образом, избыток гидроксильных ионов в растворе
препятствует образованию ксантогената свинца.
При исследовании продуктов взаимодействия галенита и пирита
с ксантогенатом в щелочной среде в присутствии избытка кислорода
П. Харис и Н. Финкельштейн [59] установили, что со временем обра-
зуется растворимый продукт, который идентифицирован как алкил-
0
монотиокарбонат ROC\" . При постоянной исходной концентрации
4 SH
ксантогената и кислорода скорость образования монотиокарбоната
возрастает с повышением pH среды. Для галенита (рис. П.17) скорость
образования монотиокарбоната примерно постоянна, причем с течением
времени (примерно 3 ч) весь сорбированный минералом ксантогенат
переходит в раствор в виде монотиокарбоната; в случае пирита скорость
образования монотиокарбоната уменьшается со временем и количество
сорбированного пиритом ксантогената остается постоянным.
Для объяснения образования монотиокарбоната авторы [59] пос-
тулируют образование на поверхности промежуточного соединения
типа РЬХОН, которое в щелочной среде разлагается по реакции
| РЬХОН + ОН~ -> (PbS + С2 Н5 О2 CS~ + Н2О.
На поверхности пирита авторы предполагают наличие соединения
типа Fe ОНХ2, которое также разлагается в щелочной среде.
При взаимодействии ксантогената с халькозином и сфалеритом
образование монотиокарбоната не обнаружено, что авторы объясня-
ют невозможностью образования соединения типа МеОНХ, поскольку
в халькозине медь одновалентна.
97
7-6926
О 20 40 60 80 WO 120 140 Л HUH
11.17. Изменение содержания ионов ксан-
тогената (7) и монотиокарбоната (2)
в растворе, а также сорбированного га-
ленитом ксантогената (5) при pH 10 в
присутствии избытка кислорода [59]
Гипотеза о механизме образования монотиокарбоната еще не дос-
таточно обоснована, но представленные экспериментальные данные
свидетельствуют о том, что взаимодействие ксантогенатов с сульфид-
ными минералами — сложный процесс, включающий ряд одновремен-
но протекающих реакций. Для практики флотации возможность об-
разования растворимых монотиокарбонатов вряд ли может иметь су-
щественное значение, поскольку для заметного уменьшения необхо-
димой для флотации плотности сорбционного слоя собирателя тре-
буется время, превышающее обычное время пребывания минералов
в процессе флотации.
При применении неионогенныхЛ собирателей, например тионокар-
баматов, влияние высоких pH Может проявляться двояко: с одной сто-
роны, по мере повышения pH в зависимости от кислотности приме-
няемого реагента увеличивается содержание ионной формы, что при-
водит к улучшению сорбции, с другой — при pH > 10—11 начинает ска-
зываться конкуренция с гидроксильными ионами.
8.2. Депрессирующее действие сульфида натрия
Сульфид натрия Na2 S широко применяется при флотации руд,
содержащих сульфидные минералы. Это один из наиболее сильных
подавителей флотации. Его используют для десорбции собирателя с
поверхности коллективных концентратов перед их разделением, для
связывания катионов цветных металлов в объеме раствора и предот-
вращения активации сфалерита и пирита, уменьшения расхода соби-
рателя. Кроме того, Na2S используется для создания восстановитель-
ной среды для снижения избыточного окисления поверхности суль-
фидных минералов.
Подавляющее действие его обычно объясняется тем, что он, ак-
тивно вступая во взаимодействие с продуктами окисления на поверх-
ности минерала, образует пленку сульфида соответствующего метал-
ла, препятствующую взаимодействию с ксантогенатом или аэрофло-
том. Большинство исследователей считают, что сплошная сульфиди-
зация поверхности и наличие сульфидных ионов в растворе исключа-
ют возможность взаимодействия с собирателями, образующими с ка-
тионом минерала более растворимые соединения, чем соответствую-
щие сульфиды.
98
П.18. Извлечение галенита и сорбция этилового ксантогената калия галенитом (а)
и природно-активированным сфалеритом (б) при переменных расходах NaiS:
7 — извлечение; 2 — сорбция (расход этилового ксантогената 50 г/т, соснового
масла — 20 г/т) ; 3, 4 — то же, соответственно (расход этилового ксантогената
47,4 г/т; соснового масла 20 г/т)
Радиометрические определения сорбции ксантогената галенитом
и сфалеритом и параллельные опыты флотации показали, что в при-
сутствии Na2 S поглощение ксантогената и, соответственно флота-
ция резко подавляются (рис. 11.18) [5] . Аналогичные результаты по-
лучены и с другими сульфидными минералами.
При действии Na2 S наблюдается почти полный параллелизм по-
давления флотации и сорбции ксантогената. Это свидетельствует о
наличии в данном случае однозначной зависимости между плотностью
сорбционного слоя собирателя и результатами флотации.
Из соотношения произведений растворимости сульфидов тяжелых
металлов и ксантогенатов соответствующих металлов следует, что
полное вытеснение собирателя должно наступать при небольших кон-
центрациях Na2S. Между тем обычно для полного подавления флота-
ции минерала необходимы относительно высокие расходы Na2S. Так,
подавление флотации слабоокисленного галенита (см. рис. 11.18) про-
исходит лишь при расходе 200 г/т Na2 S, а в случае более окисленно-
го галенита этот расход составляет примерно 1 кг/т.
Относительно высокие расходы Na2 S в значительной степени обус-
ловлены количеством продуктов окисления, находящихся на поверх-
ности минерала или перешедших в раствор. Кроме того, необходимо
учитывать окисляемость сульфидных ионов в условиях аэрации при
флотации. В связи с этим специфическая особенность Na2S как пода-
вителя — быстрое восстановление флотации минералов. По мере окис-
ления сульфидных ионов в пульпе и частично на поверхности мине-
рала, повышается сорбция ксантогената и флотация восстанавлива-
ется (табл. II.2). qq
Таблица II.2
Результаты флотации галенита в зависимости от времени
перемешивания после сульфидизации (расход этил-
ксантогената 50 г/т, соснового масла 20 г/т)
Расход Na2S, г/т Время переме- шивания после загрузки Na2 S, МИН Извлечение, % Сорбция ксантогената
% исходного % условного моно слоя
200 2 8,01 • 36,16 16,9
200 7 92,4 74,41 36,8
210,7 3’ 0 0 0
210,7 6 82,4 62,4 31,1
210,7 10 95,6 69,0 34,2
Благодаря высокой эффективности Na?S как вытеснителя сорби-
рованного ксантогената с поверхности сульфидных минералов, он при-
меняется в технологии коллективной флотации сульфидов перед пос-
ледующим их разделением.
Для повышения эффективности десорбции собирателя в практи-
ке флотации используется активированный уголь, который поглоща-
ет из раствора вытесненные с поверхности сульфидных минералов
ионы ксантогената.
В связи с широким применением сульфида натрия при флотации
представляют интерес результаты исследований устойчивости его раст-
воров при аэрации в присутствии сульфидных минералов, проведен-
ные различными авторами.
Как показали эти исследования, во всех случаях при аэрации в при-
сутствии сульфидных минералов отмечено более заметное уменьше-
ние содержания сульфидных ионов в растворе по сравнению с их окис-
лением в отсутствие минералов в тех же условиях. Убыль сульфидных
ионов из раствора сильно зависит от удельной поверхности минера-
лов, степени их исходного окисления.
С.И. Митрофанов с сотрудниками и другие авторы [33] и более
поздние публикации ускорение убыли сульфидных ионов из раство-
ра объясняют каталитическим действием сульфидных минералов.
И.А. Каковский и Р.Н. Щекалева [21], однако,отрицают каталитичес-
кое влияние сульфидных минералов на окисление сульфидных ионов.
Они считают, что более резкое снижение концентрации сульфидных
ионов в растворе в присутствии сульфидных минералов, содержащих
на поверхности продукты окисления, является результатом параллель-
но последовательных реакций, включающих гомогенное окисление
сульфидных ионов в объеме раствора, обменную гетерогенную реак-
цию сульфидизации продуктов окисления, протекающую в диффу-
100
зионном режиме, окисление вновь образованной сульфидной поверх-
ности, протекающее в кинетическом режиме, и последующую ее суль-
фидизацию.
В случае сильноокисленных пирита и халькопирита показано [21]
наличие трех стадий процесса, отличающихся друг от друга констан-
тами скоростей. При этом установлено, что окисление свежеобразо-
ванной сульфидной поверхности протекает со значительно более вы-
сокой скоростью, чем окисление природных сульфидов. В случае силь-
ноокисленных сульфидных минералов убыль сульфидных ионов из
раствора может отвечать образованию сульфидной пленки толщиной
в десятки и даже сотни монослоев.
Следует отметить, что имеющиеся на данном этапе результаты ис-
следований не позволяют дать однозначное, объяснение механизма про-
цессов, протекающих в такой сложной системе.
Приведенные выше результаты подтверждают необходимость под-
бора условий, предотвращающих непроизводительный расход Na2S
за счет его окисления.
8.3. Активация сульфидом натрия флотации
окисленных минералов
Как известно из практики флотации, окисленные минералы цвет-
ных металлов, такие, как англезит, церуссит, вульфенит, крокоит, ма-
лахит, азурит, смитсонит и другие, плохо флотируются сульфгидриль-
ными собирателями. Например, по данным И.Н. Шоршера, для фло-
тации руд окисленных минералов свинца требуется более чем в 20
раз больший расход собирателя, чем для флотации сульфидных руд,
причем целесообразно применение ксантогенатов, имеющих более длин-
ный углеводородный радикал.
Согласно представлениям Д.А. Шведова и И.Н. Шоршера, плохая
флотация ксантогенатами окисленных минералов объясняется тем,
что образующиеся ксантогенаты свинца или меди отслаиваются с по-
верхности минерала и переходят в раствор, обусловливая необходи-
мость повышенных расходов собирателя. Так, для флотации малахи-
та требуются значительно более высокие расходы собирателя, чем для
церуссита. Объясняется это лучшей растворимостью малахита, его склон-
ностью к шламообразованию и большей способностью к образованию
полных ксантогенатов свинца.
Наиболее эффективное средство улучшения флотируемости окислен-
ных минералов цветных металлов — сульфидизация их поверхности
при применении сульфида натрия. Эффективность сульфидизации окис-
ленных минералов зависит от расхода Na2S, pH раствора и времени суль-
фидизации. Обычно сульфидизация идет очень быстро. При достаточной
концентрации сульфида натрия уже в течение 1 мин образуется сульфид-
ная пленка значительной толщины. На рис. 11.19 представлены данные
101
сита от pH среды при различном времени
контакта:
1—6 — время контакта соответственно
300, 120, 60,40, 20, 10 с
сорбция этилового ксантогената
калия (2) при переменных расхо-
дах Naj S (расход этилового ксан-
тогената - 50 г/т)
Г.А. Осолодкова по влиянию pH и времени взаимодействия на образо-
вание сульфидной пленки на поверхности церуссита. В работах ряда
исследователей отмечается положительное влияние добавки сульфа-
та аммония на сульфидизацию окисленных медных минералов; суль-
фат аммония помимо регулирования pH среды ускоряет рост суль-
фидной пленки.
Сульфидизация окисленных минералов уменьшает их смачивае-
мость водой. Например, по данным И.Н. Шоршера, сульфидизирован-
ный церуссит после удаления равновесного раствора после сульфи-
дизации и промывки удается частично сфлотировать даже без соби-
рателя. Предварительная сульфидизация окисленных минералов сок-
ращает расход ксантогената и обеспечивает условия для его закреп-
ления на поверхности минералов.
Исследования влияния предварительной сульфидизации на фло-
тацию церуссита и сорбцию этилксантогената показывают (рис. 11.20),
что в результате действия Na2 S флотация улучшается. Это обуслов-
лено увеличением сорбции собирателя при небольших расходах сер-
нистого натрия [5] . По мере дальнейшего увеличения концентрации
сульфидных ионов флотация резко ухудшается. При этом наблюда-
ются отчетливый параллелизм результатов флотации и изменения плот-
ности сорбционного слоя ксантогената.
Аналогичные результаты получены другими исследователями при
сульфидизации смитсонита, церуссита, малахита. При небольших рас-
ходах сернистого натрия поверхность окисленного минерала частич-
но сульфидизируется, в результате чего на ней, очевидно, могут об-
102
разовываться поверхностные соединения типа сульфидокарбонатов.
При увеличении расхода сернистого натрия, когда вся поверхность
минерала становится сульфидной и в растворе имеются сульфидные
ионы, сорбция ксантогената полностью подавляется. Однако после
кратковременной аэрации флотация вновь возобновляется, как это
наблюдалось и в случае галенита. Опыты флотации сульфидизиро-
ванного ’’меченым” Na2 S церуссита показали, что поглощение ксан-
тогената после кратковременного контакта минерала с воздухом соп-
ровождается вытеснением сульфоксидных ионов.
Определения остаточной концентрации сульфидных ионов в раст-
воре в процессе сульфидизации церуссита непосредственно в лабора-
торной флотационной камере с применением автоматической запи-
си показаний сульфидсеребряного электрода показали, что основное
количество сульфидных ионов, даже при наиболее высоком из испы-
танных расходов сульфида натрия, удаляется из раствора в течение пер-
вых 10—20 с взаимодействия. Естественно, что помимо поглощения
церусситом, часть сульфидных ионов окисляется вследствие аэрации
[5].
На основании этих данных можно сделать заключение, что в пре-
делах испытанных концентраций Na2S, обеспечивающих успешную
флотацию церуссита, остаточная концентрация сульфидных ионов нич-
тожна.
Представляют интерес исследования возможности селективной
флотации таких окисленных минералов, как церуссит и малахит, про-
веденные в институте Механобр И.Н. Шоршером [50].. Им показано,
что предварительная сульфидизации улучшает сорбцию ксантогена-
та как церусситом, так и малахитом, но в случае малахита наблюда-
ется значительно менее прочное закрепление сорбированного собира-
теля в результате отслаивания сульфидной пленки. Это обстоятель-
ство было использовано для разделения церуссита и малахита. Для
повышения селективности разделения применялось жидкое стекло,
что вызывало не только некоторую гидрофилизацию поверхности ма-
лахита, но и усиливало отслаивание поверхностной сульфидно-ксанто-
генатной пленки.
Извлечение сульфидизированного малахита в пенный продукт мо-
жет быть повышено введением углеводородных масел, что обуслов-
лено помимо дополнительной гидрофобизации поверхности заметным
уменьшением отслаивания сульфидно-ксантогенатных соединений.
Изучение кинетики сульфидизации церуссита и малахита свиде-
тельствует о том, что в случае церуссита на поверхности минерала об-
разуется более плотное покрытие сульфидом свинца, создающее диф-
фузионные затруднения для дальнейшей сульфидизации, в то время
как на поверхности малахита образуется более рыхлое, легко отслаи-
вающееся покрытие. Это, очевидно, объясняется меньшим соответ-
ствием параметров кристаллических решеток сульфида меди и ма-
лахита, чем сульфида свинца и церуссита. Кроме того, высказано пред-
103
положение о возможности отслаивания за счет возникновения сил от-
талкивания между одноименно заряженным минералом и поверхност-
ной пленкой.
8.4. Депрессирующее действие хромата калия
Один из известных методов подавления флотации галенита при
разделении свинцово-медных концентратов — так называемый ’’би-
хроматный метод”. Однако в ряде случаев, особенно при наличии окис-
ленных минералов или вторичных сульфидов меди, не удается дос-
тигнуть высоких результатов разделения. Известно, что галенит, ак-
тивированный ионами меди, не подавляется бихроматом калия и что
применение последнего приводит иногда к частичному подавлению
сульфидов меди.
Относительно механизма подавляющего действия бихромата
К2Сг2О7 и хромата калия К2СгО4 существуют различные точки зре-
ния. В основном эти представления можно разделить на две группы.
Одни исследователи [33] , например, считают, что подавляющее
действие бихромата в основном обусловлено его окисляющим дей-
ствием на минерал и ксантогенат. Однако известно, что ионы хрома-
та СгО4~, являющиеся гораздо более слабыми окислителями, чем
ионы бихромата Сг2О7~, также успешно подавляют галенит. Непос-
редственные определения устойчивости растворов ксантогената при
действии 10-кратного избытка хромата калия показали, что окисли-
тельное действие хромата проявляется лишь в кислой и нейтральной
средах; при pH > 7,5 ксантогенат практически не окисляется хрома-
том [33] .
Другие исследователи подавление галенита хроматом объясняют
образованием труднорастворимого хромата свинца на поверхности
галенита. Некоторые (например, С.И. Митрофанов с сотрудниками)
предполагают, что депрессия обусловлена вытеснением ионов ксан-
тогената с поверхности галенита ионами хромата, что, однако >термо-
динамически мало вероятно.
Исследования, проведенные в институте Механобр [5, 16] с при-
менением радиометрического метода определения сорбции ионов хро-
мата и ксантогената галенитом, показали, что флотация резко подав-
ляется уже при расходе К2СгО4 20—30 г/т, в то время как плотность
сорбционного слоя собирателя остается примерно постоянной в пре-
делах испытанных расходов К2СгО4 (20-50 г/т), обеспечивающих
почти полную депрессию (рис. 11.21, а). Некоторое ухудшение сорб-
ции этилксантогената наблюдается лишь при значительно более вы-
соких расходах подавителя. Полное подавление флотации наступает
при образовании сорбционного слоя депрессора, в среднем примерно
отвечающего условному монослою. Насыщение сорбционной емкос-
104
П.21. Извлечение галенита (7), сорбция бутилового ксантогената при расходе
12,5 г/т (2) и хромата (J) в зависимости от расхода К2Сг2О7 (а) и pH среды
при постоянном расходе К2Сг2О7 50 г/т (ff)
ти галенита ионами хромата отвечает примерно двум условным ью-
нослоям.
Вследствие неравномерного распределения ионов хромата собира-
тель может сорбироваться на незанятых хроматом участках поверх-
ности. Так как ионами хромата занята значительная часть поверхнос-
ти, эффект гидрофилизации может перекрывать гидрофобизацию, соз-
даваемую сорбированным собирателем.
Определения сорбции хромата калия при переменных pH среды
показали,что при pH 6 сорбция хромата заметно ухудшается, что оп-
ределяется конкуренцией ионов СгО^~ и pH-. Эти данные согласу-
ются с результатами, полученными С.М. Митрофановым и В.Г. Куш-
никовой. Данные о влиянии pH на флотацию галенита при постоян-
ных расходах хромата калия и бутилового ксантогената показывают
(см. рис. 11.21, б), что наиболее эффективно флотация подавляется при
pH 5—6. Дальнейшее повышение pH приводит к восстановлению фло-
тации галенита, достигающей максимума при pH около 8, что, очевид-
но, связано с ухудшением сорбции хромата. При pH > 8 флотация га-
ленита вновь ухудшается, вероятно, в этой области помимо подавляю-
щего действия влияния ионов хромата сказывается и влияние ионов
гидроксила.
Опыты флотации сульфидов меди в присутствии хромата калия
(рис 11.22) при pH 5—6 показывают, что во всех случаях наблюдает-
ся некоторое ухудшение флотации, наиболее резко выраженное в слу-
чае халькозина, что подтверждается практикой разделения свинцово-
медных минералов, когда медные минералы представлены халь-
козином. По данным С.И. Митрофанова и В.Г. Кушниковой, ионы
хромата сорбируются халькопиритом примерно в 5—6 раз меньших
количествах, чем галенитом.
105
11.22. Результаты флотации сульфи-
дов меди при переменных расходах
К2СГО4 (расход бутилового ксан-
тогената калия 25 г/т):
1, 2 и 3 — извлечение соответствен-
но борнита, халькопирита и халь-
козина; 4, 5 и б — сорбция ксан-
тогената калия соответственно бор-
нитом, халькопиритом и халько-
зином
Опыты флотации сульфидов меди при разных pH в присутствии
хромата показали, что по мере повышения pH от 5 до 11 флотируе-
мость сульфидов меди ухудшается, что обусловлено ухудшением сорб-
ции хромата. Из приведенных выше данных следует, что разделение
галенита и сульфидов меди должно наиболее эффективно протекать
лишь при высоких pH, когда достигается устойчивое подавление га-
ленита в результате суммарного действия хромата калия и гидрок-
сильных ионов, в то время как сульфиды меди продолжают флоти-
роваться [16].
8.5. Действие фосфата натрия на галенит
и сульфиды меди
Подавляющее действие фосфата натрия на галенит обусловлено
не только ухудшением сорбции собирателя, но и гидрофилизирую-
щим действием сорбированных ионов фосфата [16] . Это следует из
данных по изучению сорбции ксантогената в присутствии Na3PO4,
которые показали, что подавление флотации галенита сопровождает-
ся лишь частичным ухудшением сорбции собирателя (рис., 11.23). Для
полного подавления флотации галенита при расходе ксантогената 12,5
г/т достаточно 0,5 кг/т (в опытах фосфат подавался до ксантогена-
та) , а при расходе ксантогената 25 г/т — свыше 1 кг/т.
Порядок загрузки подавителя и собирателя практически не влияет
на результаты флотации, хотя сорбция каждого из них свидетельству-
ет о частичной конкуренции за поверхность. Это более заметно прояв-
ляется при повышенных расходах реагентов.
Изучение сорбции ионов фосфата показало, что насыщение сорб-
ционной емкости галенита в отношении ионов фосфата (в отсутствие
собирателя) при pH 9,2—10,7, отвечает образованию примерно насы-
щенного условного монослоя (площадь поперечного сечения ионов
фосфата принималась равной 18-10“16 см2). Ионы фосфата сорби-
руются галенитом прочно, о чем свидетельствует практически полное
отсутствие десорбции при многократном разбавлении равновесного
раствора.
106
^3 R
£
0,4 0,6 0,8 1,0
£№зро4,кг/т
а
100г^200
80 -^160
II ! L
?? 60-%120-
«\3 ^3 еС
11.24. Результаты флотации галенита,
сорбции фосфата и бутилового ксан-
тогената калия в присутствии фосфата
при различных pH (расход Na3PO4
500 г/т, бутилового ксантогената калия
12,5 г/т):
11.23. Результаты флотации галенита
и сорбции фосфата и ксантогената
при переменных расходах трехза-
мещенного фосфата натрия:
1, 2 — извлечение при расходе ксан-
тогената соответственно 12,5 и
25 г/т; 3 — сорбция фосфата; 4, 5 —
то же, при расходе ксантогената
соответственно 12,5 и 25 г/т
1,2 — извлечение соответственно в от-
сутствие и присутствии Na3PC>4; 3, 4 —
сорбция соответственно фосфата и бути-
лового ксантогената
При введении в раствор Na3PO4 одновременно протекают два про-
цесса — образование труднорастворимого фосфата свинца и гидролиз
фосфата натрия, в результате которого образуются ионы различной
степени замещения и накапливаются гидроксильные ионы. Послед-
ние могут привести к образованию смешанных соединений типа ос-
новных фосфатов.
В присутствии фосфата флотация галенита подавляется при бо-
лее низких pH, причем сорбция собирателя примерно одинакова как
в присутствии, так и в отсутствие депрессора при относительно неболь-
ших расходах последнего и определяется в основном лишь измене-
нием pH раствора (рис. 11.24). По мере увеличения pH заметно умень
шается сорбция фосфата (в 1,5—2 раза).
На основании констант трехступенчатой диссоциации фосфорной
кислоты можно рассчитать при любом pH’концентрации ионов Н2 РО~
НРО4—, РО4~, способных образовать труднорастворимые соединения
с катионом свинца, концентрация которого может быть определена
из произведений растворимости соединений, существующих на поверх-
ности галенита. На основании таких ориентировочных расчетов мож-
но считать, что при pH около 6—7 должен преимущественно образо-
ваться РЬНРО4, при повышении pH до 9—10 равновесие сдвигается
в сторону образования РЬ3(РО4)2. При дальнейшем повышении pH
должна быть более заметной конкуренция между ионами гидрокси-
ла и фосфата. Этим, очевидно, объясняется наблюдаемое ухудшение
сорбции фосфата при повышении pH до 10. Однако депрессия гале-
107
11.25. Извлечение борнита (7), сорбция фос-
фата (2) и бутилового ксантогената калия
(2) при переменных расходах NajPCU (рас-
ход бутилового ксантогената калия 25 г/т)
нита при повышении pH до 10 увеличивается, очевидно, ₽ результа-
те как повышения концентрации гидроксильных ионов, так и обра-
зования труднорастворимого фосфата свинца, поскольку при этом
плотность сорбционного слоя фосфата на поверхности галенита оста-
ется значительной.
Таким образом, сорбция ксантогената при pH >8,5 снижается вслед-
ствие вытеснения ксантогената гидроксильными ионами. Однако зна-
чительная депрессия галенита при наличии фосфата происходит при
pH около 9,5, а в его отсутствие при pH > 11. На основании этого деп-
рессирующее действие фосфата натрия можно объяснить резкой гид-
рофилизацией поверхности галенита за счет ионов РО4 — и ОН-, обра-
зующихся в результате гидролиза фосфата натрия. При более высо-
ких исходных концентрациях фосфата натрия его подавляющее дей-
ствие связано также с частичным вытеснением ксантогената с поверх-
ности галенита.
При применении Na2HPO4 полная депрессия галенита не наблю-
далась даже при расходе 7 кг/т. Повышение pH > 9 резко увеличи-
вало его депрессирующее действие.
При изучении сорбции фосфата натрия сульфидами меди установ-
лено, что сорбция ионов фосфата в значительной степени зависит от
наличия окисленных соединений на поверхности минералов, сорбция
ионов фосфата сульфидами меди относительно невелика (по сравне-
нию с сорбцией ионов фосфата галенитом) и отвечает для халькопи-
рита и борнита образованию сорбционного покрытия примерно 20 %
условного монослоя. Несколько большая сорбция отмечена для халь-
козина, что, возможно, связано с трудностью удаления продуктов окис-
ления с его поверхности.
Опыты флотации сульфидов меди при различных расходах трех-
замещенного фосфата натрия показали, что даже при высоких расхо-
дах фосфата натрия подавления их флотации не отмечается (рис. 11.25).
Отсутствие подавления флотации сульфидов меди в присутствии фос-
фата натрия, несмотря на наличие сорбции фосфата, объясняется тем,
что в этом случае после воздействия депрессора значительная часть
108
поверхности минерала остается свободной и таким образом создают-
ся условия для успешной сорбции ионов собирателя, что обеспечива-
ет необходимую для флотации гидрофобизацию поверхности.
Сравнение опытов флотации галенита с опытами флотации суль-
фидов меди наглядно свидетельствует о том, что эффективность по-
давляющего действия фосфата натрия определяется соотношением
плотности сорбционного слоя собирателя и депрессора. Изменение
pH раствора (в пределах от 6 до 11) не вызывает изменения флоти-
руемости халькопирита. Приведенные выше данные свидетельству-
ют об отсутствии депрессирующего действия фосфата натрия на. халь-
копирит, борнит и халькозин.
8.6. Активация сфалерита ионами меди
Многие исследователи плохую флотируемость неактивированно-
го сфалерита низшими гомологами ксантогенатов объясняют отно-
сительно высокой растворимостью, например этилксантогената цин-
ка, благодаря чему отсутствуют необходимые условия для прочно-
го закрепления собирателя на поверхности минерала. С этой точки
зрения объяснимо активирующее влияние меди и других катионов
тяжелых металлов, таких, как Ag, Pb, Hg. которые образуют с ксан-
тогенатом более трудно растворимые соединения.
В практике флотации для активации сфалерита обычно применя-
ют сульфат меди Cu SO4-5 Н2О. Со/ласно существующим представ-
лениям, сфалерит активируется ионами меди в результате обмена ка-
тионов цинка на ионы меди, согласно реакции
ZnS^”2 + Cu2 + -> Znsl Cu2 + Zn 2+.
В процессе активации происходит почти эквивалентный обмен ио-
нов цинка и меди: по данным А.М. Годена и Д.В. Фюрстенау отноше-
ние отменивающихся ионов равно 0,8—0,96, что хорошо согласуется
с более поздними результатами других авторов.
В институте Механобр исследовалась активация ионами меди раз-
личных образцов сфалерита, отличающихся содержанием железа и сте-
пенью природной активации [16] (рис. П.26). Сорбция ионов меди
определялась радиометрическим методом при использовании радио-
активного изотопа 6 4 Си. Насыщение сорбционной способности раз-
личных сфалеритов ионами меди отвечает с небольшими отклонения-
ми в отдельных случаях образованию примерно 1 — 1,5 условного мо-
нослоя1 . Это свидетельствует о том, что замещение ионов цинка ре-
шетки сфалерита ионами меди в обычных условиях ограничивается
поверхностным слоем.
1 Плотность сорбционного слоя ионов меди подсчитывалась при допущении,
что адсорбируемый ион меди занимает площадь, приходящуюся на один ион цин-
ка в кристаллической решетке сфалерита (14,7 • 10-16 см2) .
109
а б
£остСи’мкмоль//1
11.26. Изотермы сорбции ионов меди различными образцами сфалерита:
1 — акджальский; 2 — лениногорский; 3 — приморский; 4 — зыряновский
Активация поверхности сфалерита ионами меди подчиняется урав-
нению Лэнгмюра, о чем свидетельствует линейная зависимость С/Г от
С и представляет собой процесс первичной обменной адсорбции.
При исследовании активации сфалерита катионами серебра [И]
было показано, что ионы серебра более активно, чем ионы меди, за-
мещают цинк сфалерита, что особенно заметно после образования мо-
нослоя. Подобное различие объясняется тем, что катионы серебра изо-
морфны ионам цинка и могут диффундировать в объеме минерала,
тогда как ионы меди являются лишь поверхностно-изоморфными.
Отношение количества поглощенных сфалеритом ионов серебра к ко-
личеству вытесненных ионов цинка равно 2:1.
Максимум адсорбции ионов меди отмечается при pH около 6 (рис.
П.27) [33] . В щелочной среде при pH > 6 начинается образование
гидроксидов меди, что снижает концентрации ионов меди в растворе.
Однако нельзя исключить и сорбцию осадка гидроксида меди на по-
верхности сфалерита.
Предварительная активация сфалерита ионами меди вызывает за-
метное увеличение количества сорбированного минералом этилксан-
тогената, что резко улучшает флотацию сфалерита (рис. 11.28) [5] .
Для успешной флотации маложелезистых образцов сфалерита доста-
точно образования на поверхности минерала сорбционного слоя ио-
нов меди порядка 22—25 % условного монослоя (см. рис. П.28). Для
сильножелезистого сфалерита Приморского месторождения даже бо-
лее высокие расходы сульфата меди, несмотря на заметное повыше-
/7мг/г
11.27. Влияние pH на сорбцию
ионов меди сфалеритом [33]
ПО
11.28. Зависимость результатов флота-
ции различных образцов сфалерита
этилового ксантогенатом калия от
плотности сорбционного слоя ионов
меди (расход этилового ксантогената
50 г/т):
1 — акджальский; 2 — лениногорс-
кий и зыряновский; 3 — приморский
Г, % условного монослоя
ние количества сорбированного ксантогената, все же не улучшают фло-
тацию (рис. 11.29). Очевидно, в этом случае необходима значительно
большая плотность сорбционного слоя собирателя, чтобы перекрыть
высокую степень гидрофилизации поверхности. Так, например, при
флотации этого сфалерита при расходе 189,6 г/т бутилового ксанто-
гената и 200—300 г/т медного купороса удается повысить извлечение
до 73 %.
Помимо увеличения сорбции ксантогената активация сфалерита
ионами меди приводит к значительному повышению прочности зак-
репления сорбированного собирателя (табл. П.З).
Как известно, наличие в руде вторичных сульфидов меди и окис-
ленных медных минералов вызывает активацию сфалерита как в са-
мом месторождении, так и в процессе измельчения по мере раскры-
тия минеральных зерен и их окисления. На рис. П.ЗО приводятся дан-
ные по активирующему действию различных медных минералов на
Таблица II. 3
Влияние предварительной активации поверхности
сфалерита ионами меди на прочность закрепления
этилового ксантогената
Отмыто, % сорбированного
Сфалерит Без активации После активации
При разбавлении
в 10 раз в 20 раз в 10 раз в 20 раз
Акджальский (природно-активирован- ный) 22,75 29,38 21,5 24,1
Лениногорский 40,10 60,42 25,69 30,0
Зыряновский 47,0 51,50 10,01 17,6
Приморский (железистый) 58,86 61,45 11,29 26,33
Ш
11.29. Результаты флотации приморского
сфалерита при переменных расходах C11SO4 х
х 5Н2О (расход бутилового ксантогената
189,6 г/т):
1, 3 — сорбция бутилового ксантогената
и ионов меди; 2 — извлечение
11.30. Извлечение зыряновского сфалерита
при флотации (а) и сорбция бутилового
ксантогената (б) в зависимости от содер-
жания С медных минералов: малахита
(7), халькозина (2), отмытого халько-
зина (3), борнита (4) и халькопирита (5)
флотацию нефлотирующихся без активации разностей сфалерита [5] .
Исследования проводились на синтетических смесях сфалерита круп-
ностью — 100+10 мкм с переменным содержанием различных медных
минералов крупностью —297+125 мкм при предварительном переме-
шивании в течение 15 мин. Медные минералы для определения сорб-
ции собирателя взяты большей крупности для того, чтобы их можно
было отделить от сфалерита рассевом продуктов флотации.
Сильную активацию флотации сфалерита, обусловленную увели-
чением сорбции ксантогената, вызывает присутствие в синтетической
смеси малахита и неотмытого от окисленных соединений халькози-
на, в то время как присутствие борнита и халькопирита лишь незна-
чительно сказывается на флотируемости сфалерита. Частичная отмыв-
ка продуктов окисления с поверхности халькозина резко уменьша-
ет его активирующее действие.
В случае сильножелезистого сфалерита наличие малахита вызывает
менее заметную активацию, что согласуется с результатами изложен-
ных выше опытов активации сульфатом меди.
8.7. Действие циансодержащих подавителей
В практике флотации сульфидных руд широко применяются различ-
ные циансодержащие подавители при разделении сульфидов свинца,
цинка, меди и пирита. Наиболее употребительными являются KCN,
Zn (CN) 2, К2 Zn (CN) 4, К Fe (CN) 6 и К4 Fe (CN) 6.
Цианистый калий KCN. Подавляющее действие цианидов щелоч-
ных металлов на флотацию активированного медью сфалерита и суль-
фидов меди большинства исследователей объясняют способностью
цианидов переводить в раствор ионы меди с поверхности минерала
в виде прочного медно-цианистого комплекса. В результате ухудша-
ются условия закрепления анионных собирателей на минеральной
поверхности.
В реальных условиях флотации не удается достигнуть удовлетво-
рительного отделения сфалерита от вторичных сульфидов меди од-
ним лишь изменением расхода цианида. Это, очевидно, объясняется
тем, что при наличии легко окисляющихся вторичных сульфидов ме-
ди поверхность сфалерита значительно активирована и приближает-
ся по своим свойствам к поверхности медных минералов. При этом
значительная часть цианида расходуется на растворение вторичных
сульфидов меди, вследствие чего концентрация ионов CN~ в раст-
воре падает, а концентрация ионов меди, активирующих сфалерит,
возрастает в результате диссоциации медно-цианистого комплекса.
Константа нестойкости этого комплекса 1,6-10-24. При избытке KCN
может образоваться комплекс К3 Cu (CN) 3.
Критические концентрации цианида, необходимые для эффектив-
ного подавления, изменяются для различных минералов в широких
пределах. Согласно представлениям И.А. Каковского [47] , основное
значение при депрессии цианидом калия имеет его способность раство-
рять ксантогенаты тяжелых металлов или предотвращать возможность
их образования. На основании констант равновесия реакций растворе-
ния ксантогенатов тяжелых металлов в цианистых растворах можно
оценить относительную депрессируемость различных минералов.
Некоторые исследователи считают, что депрессия при действии
KCN обусловлена сорбцией ионов цианида [33] или образованием
на поверхности сфалерита труднорастворимых цианидов тяжелых ме-
таллов, препятствующих взаимодействию с собирателем. Однако, как
показали радиометрические определения, сорбция цианида, содержа-
щего радиоактивный изотоп 14 С* сфалеритом и сульфидами меди нич-
тожно мала и составляет 2-3 % количества, необходимого для обра-
зования монослоя. При этом установлено отсутствие корреляции меж-
** При проведении радиометрических определений сорбции цианида были при-
няты предосторожности, исключающие возможность сорбции минералами про-
дуктов разложения цианида калия; несоблюдением этих предосторожностей, оче-
видно, и объясняются имеющиеся в литературе данные о сорбции цианида [33].
113
8-6926
П.31. Результаты флотации акти-
вированного медью сфалерита в
зависимости от расхода KCN
(расход C11SO4 • 5НгО 100 г/т):
1 — извлечение сфалерита; 2 —
сорбция этилового ксантогената,
% исходного; 3 — то же, %
условного монослоя; 4 — сорб-
ция меди, % условного моно-
слоя
11.32. Результаты флотации смеси
халькозина и сфалерита при совмест-
ной обработке минералов KCN:
1, 2 - извлечение халькозина и сфа-
лерита; 3, 4 — сорбция ксантогената
халькозином и сфалеритом в зависи-
мости от времени контакта с KCN
ду сорбцией и концентрацией цианида, обусловливающей деспресиию.
Эти данные свидетельствуют о том, что депрессия цианидами щелоч-
ных металлов не определяется сорбцией иона СЬГ" или образовани-
ем циансодержащих соединений на поверхности сфалерита или суль-
фидов меди [5] .
Подавление флотации активированного медью сфалерита сопро-
вождается уменьшением плотности сорбционного слоя собирателя,
обусловленным дезактивацией минеральной поверхности (рис. 11.31),
Выщелачивание меди с поверхности халькопирита и борнита при дей-
ствии цианида калия подтверждается данными табл. II.4.
При флотации сфалерита, предварительно активированного иона-
ми меди (расход CuS04 -5Н2О = 50 г/т), с поверхности минерала пе-
Таблица П.4
Результаты выщелачивания ионов меди с поверхности халькопирита
и борнита цианидом калия [5]
Расход KCN,r/T Перешло в раствор меди, мг/м2
с поверхности халько- пирита с поверхности борнита
100 Не определялось 0,293
500 0,168 0,785
1000 0,200 1,71
2000 0,224 3,71
3000 0,228 Не определялось
5000 0,224 9,3
114
реводится в раствор около 94 % сорбированного количества меди (рас-
ход KCN 50-200 г/т).
Дезактивация сфалерита при действии KCN протекает очень быстро —
в течение первой минуты взаимодействия с поверхности сфалерита
удаляется свыше 80 % сорбированной меди. Таким образом, эти дан-
ные свидетельствуют, что уменьшение сорбции ксантогената, опреде-
ляющее подавление флотации, не связано с вытеснением собирателя
ионами цианида, а обусловлено выщелачиванием меди с поверхности
минералов.
В случае совместного присутствия сфалерита и вторичных сульфи-
дов меди при применении в качестве подавителя KCN с течением вре-
мени концентрация свободных ионов цианида уменьшается в резуль-
тате растворения меди вторичного сульфида и образования устойчи-
вого медно-цианистого комплекса; в итоге нарушаются условия ус-
тойчивого подавления (рис. П.32).
Подавление флотации пирита цианидами щелочных металлов объ-
ясняется образованием в растворе ионов ферроцианида, которые, всту-
пая во взаимодействие с ионами железа поверхности пирита, образу-
ют трудно растворимый ферроцианид железа Fe4 [Fe(CN)6]3 • хН2О.
K2Zn(CN)4. Обычно при селективной флотации полиметалличес-
ких руд для подавления сфалерита применяется цианид совместно с
сульфатом цинка в различных молярных соотношениях, обеспечиваю-
щих образование труднорастворимого цианида цинка Zn(CN)2 или
в случае избытка KCN — растворимой комплексной соли K2Zn(CN)4
по реакции
Zn2+ + 2CN~ -> Zn(CN)2 Zn(CN)2+ 2CN~<fe Zn(CN)2".
Цианид калия совместно с сульфатом цинка используется и для
подавления медных минералов при разделении свинцово-медных кон-
центратов.
Согласно представлениям И.В. Уорка [43] и И.А. Каковского
[47], более эффективное подавляющее действие смеси KCN и Zn SO4
по сравнению с одним KCN объясняется возможностью поддержания
постоянной концентрации ионов цианида, благодаря чему может быть
достигнута необходимая селективность подавления флотации мине-
ралов.
Некоторые исследователи предполагают, что депрессирующее дей-
ствие. K2Zn(CN)4 обусловлено образованием осадка Zn(CN)2 или
сорбцией комплексного аниона Zn(CN)4~ на поверхности минера-
ла [33].
На рис. 11.33 приводятся данные, характеризующие относительную
эффективность подавляющего действия K2Zn(CN)4, Zn(CN)2 и KCN
на сфалерит (а), халькопирит (б) и борнит (в). Наиболее эффектив-
ный подавитель — K2Zn(CN)4. Экспериментально подтверждено пред-
положение, что K2Zn(CN)4, так же как и KCN, дезактивирует поверх-
115
11.33. Зависимость извлечения сфалерита (а), халькопирита (б) и борнита (в)
от расхода различных циансодержащих подавителей (по KCN) :
1 — KCN; 2 — Zn(CN)2; 3 — K2Zn(CN) (расход бутилового ксантогената калия:
а — 50 г/т; б — 75 г/т; в — 150 г/т)
б 6
150 \-----------
Исходная концентрация Исходная концен- Исходная концен-
(по KCN>, ммоль//! трация (по KCN), трация (по KCN),
ММОЛЬ//! ммоль/л
11.34. Результаты выщелачивания меди с поверхности активированного сфалерита
(а), борнита (б) и халькопирита (в) :
1 - KCN; 2 - K2Zn(CN)4; 3 - Zn(CN)2
11.35. Результаты флотации активированно-
го ионами меди сфалерита при переменных
расходах K2Zn(CN)4 (расход CuSO4 • 5Н2О
100 г/т, этилового ксантогената калия
50 г/т):
1 — извлечение сфалерита; 2 — сорбция
этилового ксантогената, % исходного; 3 —
то же, % условного монослоя; 4 — сорбция
ионов меди, % условного монослоя
ность сфалерита и заметно выщелачивает медь с поверхности борнита
и халькопирита (рис. 11.34). Это обусловливает уменьшение плотнос-
ти сорбционного слоя собирателя на поверхности минерала (рис. 11.35).
Однако, если сравнивать подавляющее действие K2Zn(CN)4 и KCN
по расходу KCN, то оказывается (см. рис. 11.39), что K2Zn(CN)4 обес-
печивает более сильное подавление, несмотря на меньшую степень де-
зактивации поверхности, так как K2Zn(CN)2 переводит медь в раст-
вор в меньших количествах, чем KCN (см. рис. 11.35).
Радиометрические определения сорбции CN~ и Zn2+ при действии
K2Zn(CN)4 показали, что сорбция цианида незначительна на всех ми-
нералах и не превышает нескольких процентов монослоя. Малая сорб-
ция цианида и отсутствие эквивалентности между количествами сор-
бированного цинка и цианида, отвечающими какому-либо циансо-
держащему соединению, свидетельствуют о том, что при действии
K2Zn(CN)4 комплексная соль разрушается [5].
Выщелачивание меди с поверхности халькопирита и вторичных
сульфидов протекает как самотормозящийся процесс, что можно объ-
яснить образованием на поверхности минерала пленки сорбированно-
го цинка. Именно наличием какого-то гидрофильного соединения цин-
ка на поверхности минералов и объясняется большая эффективность
депрессирующего действия K2Zn(CN)4 по сравнению с KCN. Благо-
даря торможению растворения ионов меди с поверхности вторичных
сульфидов в растворе остается достаточное количество K2Zn(CN)4 для
поддержания более устойчивого подавления флотации, чем в случае
применения KCN (см. рис. 11.35 и 11.36) [5] .
Некоторые исследователи, например П.М. Соложенкин, предпола-
гали, что при действии K2Zn(CN)4 на поверхности депрессируемого
минерала может образоваться Zn(CN)2 (что однако, опровергается
приведенными выше данными) или Zn(OH)2.
Цианид цинка Zn(CN)2. При разделении медно-цинковых и свин-
цово-цинковых продуктов часто применяют KCN и ZnSO4, подавае-
мые в отношениях, отвечающих образованию Zn (CN)2 . Согласно пред-
ставлениям, развитым в работах И.В. Уорка и И.А. Каковского, деп-
рессирующее действие Zn(CN)2 так же как и K2Zn(CN)4 обуслов-
лено поддержанием в растворе постоянной концентрации ионов CN~
117
е,°/о /^MKMo/ib/н2,
11.36. Зависимость результатов флотации
смеси халькозина и сфалерита в при-
сутствии K2Zri(CN)4 от времени кон-
такта с собирателем :
1,2 — извлечение халькозина и сфале-
рита; 3, 4 — сорбция ксантогената
халькозином и сфалеритом
Однако исследования Механобра показали, что и в этом случае наб-
людается сорбция значительных количеств цинка на поверхности деп-
рессируемых минералов (рис. 11.37) [5] .
Изучение устойчивости Zn(CN)2 в щелочной среде (pH 7-10),
т.е. в условиях практической флотации, показало, что при pH > 8,5
цианид цинка разрушается и соотношение между CN~ и цинком в раст-
воре отвечает образованию Zn(CN)“ согласно реакции
3Zn(CN)2 + 2 КОН 2KZn(CN)3 + Zn(OH)2
Сорбция CN- сфалеритом и сульфидами меди при действии Zn (CN) 2
очень незначительна. Очевидно, и в этом случае в растворе образует-
ся устойчивый медный комплекс.
Высокая сорбция цинка минералами при действии цианида цинка,
очевидно, объясняется тем, что образующийся при разложении Zn(CN)2
гидроксид цинка поглощается минералами.
Z11SO4, pH 6
£ост,мкмо/1ь//1
118
Из данных, приведенных на рис. II.34д видно, что Zn(CN)2 вытес-
няет медь в раствор менее активно, чем KCN и K2Zn(CN)4.
Таким образом, подавляющее действие Zn(CN)2 в щелочной сре-
де обусловлено дезактивирующим действием комплекса KZn(CN)3
и гидрофилизирующим действием гидроксида цинка. Несколько мень-
шая эффективность подавления флотации обусловлена более слабой
дезактивацией.
Феррацианид калия K3Fe(CN) . Известно применение K3Fe(CN)6
для подавления флотации вторичных сульфидов меди. Подавляющее
действие феррицианида калия большинство исследователей объясня-
ют образованием труднорастворимых феррицианидов тяжелых ме-
таллов. Ферри- и ферроцианиды тяжелых металлов плохо раствори-
мы в воде и их осадки весьма гидрофильны, что подтверждается не-
возможностью получения безводных ферроцианидов тяжелых ме-
таллов. При взаимодействии феррицианидов с ионами тяжелых ме-
таллов обычно получаются соединения переменного состава типа
Ме3 [Fe(CN)6] 2 • (х-1) K3Fe(CN)6 в зависимости от соотношения
концентраций феррицианида и катиона тяжело металла.
Исследования сорбции халькозином феррицианида K3Fe(CN)6,
содержащего в одном случае ’’меченое” железо, а в другом — ’’мече-
ный” углерод, показали, что комплексный анион Fe(CN)3- сорбиру-
ется минералом, не разрушаясь в пределах испытанных значений pH
[5]. Очевидно, в результате действия феррицианида на поверхнос-
ти минерала или в объеме раствора образуется феррицианид соответ-
ствующего металла, который по мере повышения pH разрушается,
согласно реакции:
Cu3 [Fe(CN)6]2 + 6 ОН- -+3Cu(OH)2 + 2Fe(CN)36“
В этом случае концентрация Fe(CN)3 согласно закону действую-
щих масс, должна возрастать пропорционально [Fe (CN) 3-] = К [ОН- ] 3
Однако концентрация Fe (CN) 6- в растворе в присутствии осадка
Си [Fe(CN)6]2 растет пропорционально [ОН-] 0,5. Еще медленнее
увеличивается равновесная концентрация Fe(CN)3- при разрушении
феррицианидов, образующихся на поверхности минерала при высо-
ких расходах феррицианида.
Приведенные на рис. 11.38 данные свидетельствуют о том, что фер-
рицианид успешно депрессирует халькозин (аналогичные результа-
ты получены и с борнитом) в результате сорбции Fe(CN)3-. Установ-
лено, что на сорбцию Fe(CN)3- и эффективность подавления флота-
ции существенно влияет степень окисления минерала: чем выше сте-
пень окисления минерала, тем больше сорбция феррицианида и соот-
ветственно подавление.
Следует отметить, что для успешного подавления вторичных суль-
фидов необходима значительная плотность сорбционного слоя пода-
вителя, отвечающая образованию многослойного покрытия. На халь-
119
£,% 4мкмоль/м2
50г50
-40
'-30
'-20~
'-10 ~
40
30
20
10
0 о
100 1000
^K3Fe(CN)6 >r?ZT
11.38. Результаты флотации халькозина
KsFe(CN)6 (расход бутилового ксантоге-
ната калия 100 г/т):
1,3 — извлечение; 2,4 - сорбция Fe(CN)36~;
1,4 — отмытый халькозин; 2, 3 — окис-
ленный халькозин
копирите, отмытом от основного количества окисленных соединений,
сорбция феррицианида отвечает образованию примерно 1—1,5 услов-
ного монослоя, что и обусловливает меньшее подавление флотации.
На галените, сфалерите и пирите сорбция феррицианида составляет
лишь доли монослоя и не вызывает заметного подавления флотации.
Параллелизм между сорбцией феррицианида и его подавляющим
действием наблюдается и при повышении pH, которое приводит к умень-
шению сорбции феррицианида и некоторому улучшению флотации.
Разрушение феррицианидов тяжелых металлов при высоких pH при-,
водит к образованию менее гидрофильных или хуже закрепляющих-
ся на поверхности минерала соединений. Подавление флотации не соп-
ровождается вытеснением собирателя с поверхности вторичных суль-
фидов меди. Установлено также, что высокие расходы собирателя (200—
400 г/т) ухудшают сорбцию феррицианида, что согласуется с более
высокой прочностью ксантогенатов тяжелых металлов по сравнению
с феррицианидами соответствующих металлов.
Осаждение ферри- и ферроцианидов тяжелых металлов на поверх-
ности минералов подтверждено исследованием спектров отражения
минералов после обработки растворами K3Fe(CN)6, проведенных
В.А. Коневым, В.Ю. Кукушкиным и др.
Приведенные выше результаты экспериментальных исследований
свидетельствуют о том, что подавление флотации сульфидов меди фер-
рицианидом' обусловлено гидрофилизирующим действием последне-
го сорбированного свободными от собирателя участками поверхнос-
ти. При этом, очевидно, на отдельных участках поверхности появля-
ется многослойное покрытие образующимися в растворе коллоидны-
ми частицами феррицианидов тяжелых металлов. Это согласуется с
влиянием степени окисления поверхности минерала на сорбцию фер-
рицианидов: при значительном количестве окисленных соединений
их концентрация в растворе увеличивается и в результате в объеме
раствора увеличивается образование труднорастворимых феррициа-
нидов тяжелых металлов.
Исследование подавляющего действия свежеосажденных тонко-
дисперсных феррицианидов меди и железа показало (рис. 11.39), что
120
11.39. Зависимость извлечения халькозина (а) и борнита (б) от расхода подавите-
лей Cu2Fe(CN)6 (2); Cu3 [Fe(CN)6]2 (2) и Fe3 [Fe(CN)6]2 (3) (вакуумная фло-
тация, расход бутилового ксантогената калия 100 г/т)
наиболее эффективный подавитель халькозина — феррицианид меди,
а борнита - феррицианид железа. Менее эффективно эти соединения
подавляют флотацию халькопирита и не влияют на флотацию галени-
та, сфалерита и пирита.
8.8. Действие сульфата цинка
Для подавления флотации сфалерита в некоторых случаях приме-
няется цинковый купорос обычно в известковой среде. Его подавляю-
щее действие на сфалерит проявляется лишь в щелочной среде, поэ-
тому большинство исследователей объясняют это образованием гид-
роксида цинка. Подавление флотации сфалерита гидроксидом цин-
ка объясняется как ухудшением условий взаимодействия с ксанто-
генатом, так и поглощением ионов меди осадком гидроксида, что умень-
шает активацию поверхности сфалерита. Однако последнее предпо-
ложение опровергнуто исследованиями Л.Б. Дебривной, А.К. Ливши-
ца и Е.М. Идельсон.
В случае применения ZnSO4 в содовой среде предполагалась так-
же возможность образования труднорастворимого карбоната цинка.
На основании констант диссоциации угольной кислоты и произведе-
ний растворимости карбоната и гидроксида цинка можно определить
условия образования соответствующих соединений в зависимости от
pH раствора и расхода ZnS04. Из результатов расчета следует, что при
изменении pH от 7 до 10 и при расходе соды 10 кг/т концентрация
СО3~ в растворе меньше необходимой для образования карбоната
цинка. Таким образом, при применяемых на практике концентраци-
ях соды образование ZnCO3 невозможно и весь цинк должен связы-
ваться в виде Zn (ОН) 2.
Согласно исследованиям Л.И. Гросмана и П.Г. Хаджиева, подав-
ление флотации сфалерита обусловлено закреплением на поверхнос-
121
ти минерала многослойного покрытия, представляющего собой тон-
кодисперсные аморфные осадки гидроксида цинка.
По Н.П. Финкельштейну и С.А. Аллисону [55], предлагается нес-
колько возможных вариантов, объясняющих механизм закрепления
соединений цинка, представленных осадками: 1) образующийся в объе-
ме раствора осадок закрепляется на поверхности физически (агло-
мерация или коагуляция); 2) осадок образуется или переосаждает-
ся на отдельных участках (центрах кристаллизации); 3) образовав-
шийся в объеме раствора осадок закрепляется на монослое хемосор-
бированной поверхностью сфалерита гидроксида; 4) объемный оса-
док хемосорбируется поверхностью.
По нашему мнению, наиболее вероятен третий из предложенных
механизмов закрепления.
Следует отметить, что имеющийся довольно обширный эксперимен-
тальный материал в настоящее время не позволяет прийти к достаточ-
но обоснованным объяснениям селективного закрепления образую-
щихся гидрофильных осадков.
При избытке щелочи (при pH 10,5—12) гидроксид цинка раство-
ряется с образованием цинкатных комплексов Zn(OH)4- и Zn(OH)
Согласно данным работы В.А. Конева и К.А. Разумова, эти комплек-
сы являются для сфалерита более селективными подавителями, чем
K2Zn(CN)4.
Авторы этой работы предполагают возможность закрепления ком-
плексных анионов цинката на поверхности сфалерита за счет образо-
вания связи между тетраэдром кристаллической решетки сфалерита
и тетраэдром цинкат-иона через атом кислорода гидроксильной груп-
пы по схеме
I I н I
S л ОН
I ф
Адсорбции цинкатного иона на поверхности сфалерита, по мнению
авторов, способствуют одинаковая электронная конфигурация и струк-
тура ионов цинката и решетки сфалерита, близкие размеры тетраэдров,
наличие одинаковых центральных атомов.
Определения сорбции цинка из растворов, содержащих цинкатные
комплексы, показали, что цинкатный ион сорбируется сфалеритом и
не сорбируется халькопиритом, борнитом, галенитом и пиритом, что
и определяет селективность действия цинкатов при флотации. Сорб-
122
ция цинка сфалеритом зависит от отношения молярных концентра-
ций Zn SO4 и Na ОН, она происходит лишь в том случае, если [Na ОН] /
[ZnSO4] > 2, т.е. при условии возможности образования заметных
количеств цинката. Максимум сорбции цинка отмечается при [NaOH] /
[ZnSO4] = 7—8, что отвечает полному переходу Zn(OH)2 в цинкат.
8.9. Действие ионов-восстановителей SO2“ и S2O2-
В результате окисления сульфидных минералов в жидкой фазе
пульпы накапливаются продукты окисления сульфидной серы: ионы
сульфита SO2, тиосульфата S2O2-, сульфата SO2-, а также тритио'
ната S3O2 — и высших политионатов SnO6. Наиболее важные для фло-
тации минералов ионы SO2 и S2O2 } влияющие на окислительно-вос-
становительные реакции, протекающие в пульпе. Эти ионы, являющи-
еся сильными восстановителями в нейтральной и особенно щелочной
средах, активно поглощая кислород, предотвращают избыточное окис-
ление сульфидов меди. В результате снижается концентрация ионов
меди и ухудшается активация сфалерита и пирита. Понижение концен-
трации ионов меди обусловлено также способностью ионов SO3- и
S2O2- к образованию устойчивых комплексов с катионами меди.
$ литературе отсутствуют данные систематических исследований
влияния ионов SO2- и S2O2- на флотацию сульфидных минералов.
Отмечается, что в присутствии Na2SO3 несколько улучшается сорб-
ция ксантогената халькопиритом, в то время как на пирите она за-
метно уменьшается [33]. Максимальное подавляющее действие Na2SO3
наблюдается при pH 4—5, при котором более заметно различие во фло-
тируемости халькопирита и сфалерита.
Присутствие Na2S2O3 мало сказывается на флотации галенита,
более заметно им подавляются халькопирит и сфалерит. По данным
В.А. Бочарова и других исследователей, изучавших кинетику флота-
ции пирита и сфалерита в присутствии Na2SO3 и Na2S2O3, пирит по-
давляется при pH > 8, как Na2SO3, так и Na2S2O3, сфалерит подавля-
ется более заметно в присутствии Na3SO3 при pH около 9. По подав-
лению флотации сфалерита испытанные модификаторы располагают-
сявряд:82 > HSO~> SO2 > S2O24~> SO2~> S2O2-.
8.10. Действие сульфита натрия и сульфата железа
Один из возможных методов разделения свинцово-медных кон-
центратов в отсутствие вторичных сульфидов меди — применение сме-
си сульфита натрия и сульфата железа, обеспечивающее подавление
галенита и активацию флотации халькопирита. Согласно исследова-
ниям К.Г. Бакинова, подавление галенита в основном обусловлено
гидрофилизацией его поверхности вследствие закрепления тонкодис-
персных частиц смеси гидроксидов и оксида железа (II). Кроме то-
го, благодаря действию сульфита натрия частично уменьшается сорб-
123
ция ксантогената на поверхности галенита, в то время как флотация
халькопирита несколько активируется.
К.Г. Бакиновым также показано, что при действии одного лишь
сульфита натрия наблюдается недостаточно полное подавление фло-
тации галенита. При применении одного Fe SO4 галенит подавляется
при высоких расходах FeSO4 и лишь при pH 5,5—6,5. При этом нес-
колько ухудшается и флотация халькопирита.
Радиометрическими определениями установлено, что на поверх-
ности галенита сорбируется больше железа, чем на халькопирите; плот-
ность сорбционного слоя собирателя на халькопирите примерно в 2 ра-
за выше, чем на галените. Кроме того, очевидно, сорбция сульфита
на поверхности галенита, которая во много раз больше, чем на халь-
копирите, может также оказывать гидрофилизирующее действие на
галенит. Это предположение подтверждается исследованиями Т. Ши-
моизака, С.Усио и др. [55] , которые полагают, что депрессирующее
действие Na2SO3 обусловлено в основном гидрофилизирующим дей-
ствием сульфита свинца, образующегося на поверхности галенита, со-
держащего продукты окисления.
В.А. Конев на основании исследования состава системы FeSO4 —
Na2 SO3 — Н2 SO4 — Н2 О в зависимости от pH высказал предположение
об образовании в растворе комплексных анионов: дисульфитоферри-
та (II) [Fe(SO3)2] и сульфитосульфатоферрита (II) [FeSO3SO4]
при тех pH, при которых обычно разделяются медно-свинцовые кон-
центраты при применении сульфита натрия и сульфата железа (II) [25].
По убыли из раствора ионов сульфита и железа при взаимодействии
дисульфитоферрита с минералами установлено, что на поверхности
галенита, сфалерита и пирита сорбируются анионы дисульфитоферри-
та, поскольку координационное число железа по сульфиту равно 2
(отношение сорбированных количеств Fe/SO3 = 1/2).
При взаимодействии с халькопиритом наблюдается значительно
большее уменьшение концентрации иона сульфита в растворе, сопро-
вождающееся скачкообразным увеличением окислительно-восстано-
вительного потенциала Eh и понижением pH раствора, в то время как
при контакте раствора дисульфитоферрита с галенитом, сфалеритом и пи-
ритом Eh и pH практически не изменяются. На основании этого предпо-
лагается, что халькопирит, в отличие от других сульфидов, вызывает
окисление сульфитной группы комплекса и его разрушение.
Однако К.Г. Бакинов подвергает сомнению возможность образо-
вания комплексов типа дисульфитоферрита при взаимодействии Na2SO3
и Fe SO4 вследствие легкой окисляемости сульфитных ионов в пуль-
пе, как об этом свидетельствуют анализы состава соответствующих
растворов и жидкой фазы фабричных пульп.
Исследования устойчивости компонентов системы Fe2 — SO2-
показали, что в случае одновременного присутствия Fe2 и SO3~ рез-
ко увеличивается скорость их окисления, зависящая от pH среды.
124
В щелочной среде повышается скорость поглощения кислорода.
Если в слабокислых растворах окисление Fe2+ незначительно, то при-
бавление небольших количеств Na SO3 (10~3 моль/л) приводит к
заметному окислению Fe2+ до Fe? . Образование гидроксида желе-
за отвечает оптимальному для разделения медных минералов и га-
ленита pH, равному 5,5.
На основании большей устойчивости ионов S2O2~ к окислению
более предпочтительно использование тиосульфата натрия вместо суль-
фита натрия при разделении медно-свинцовых концентратов.
Как следует из приведенных выше данных, механизм подавляю-
щего действия при совместном применении сульфита натрия и суль-
фата железа еще недостаточно ясен, что объясняется, очевидно, слож-
ностью исследуемой системы.
9. ВЗАИМОДЕЙСТВИЕ КАРБОКСИЛЬНЫХ СОБИРАТЕЛЕЙ
С ОКСИДАМИ И СИЛИКАТНЫМИ МИНЕРАЛАМИ
9.1. Сорбция карбоксильных собирателей минералами
в отсутствие активирующих катионов
и модификаторов флотации
При флотации силикатных минералов в отсутствие активирую-
щих катионов или после кислотной обработки с целью их дезакти-
вации кварц, полевые шпаты, берилл, касситерит не флотируются или
слабо флотируются жирнокислотными собирателями [6, И, 36]. Ра-
ботами П.А. Ребиндера установлено, что в нейтральной и щелочной
средах олеиновая, гептиловая и другие карбоновые кислоты и мыла
этих кислот почти не влияют на смачиваемость неактивированного
кварца как на границе с воздухом, так и на границе вода — бензол
[37], несмотря на то, что сорбция карбоксильных собирателей по-
верхностями указанных минералов составляет от 15 до 30 % услов-
ного монослоя [6 и др.].
Синтетический химически чистый диоксид олова, имеющий крис-
таллическую структуру и форму зерен касситерита, не флотируется
олеиновой кислотой (подобно неактивированным силикатам), при-
чем сорбция собирателя поверхностью минерала незначительна [44].
Сорбция олеиновой кислоты неактивированным кварцем изуча-
лась путем определения ИК-спектров сорбированного реагента [16] .
При обработке кварца как раствором олеата натрия, так и олеиновой
кислоты в спектре поглощения сорбированного реагента максимум
наблюдался при 1680 см1 и характеризовал сорбцию собирателя в
молекулярной форме. Аналогичные результаты получены при изуче-
нии ИК-спектров собирателя на поверхности после взаимодействия
олеиновой кислоты с синтетическим диоксидом олова или природным
125
касситеритом, очищенным кислотой от поверхностных катионов [16].
Установлено, что собиратель полностью удаляется с поверхности кас-
ситерита при обработке гексаном, в растворе которого была обнару-
жена только молекулярная форма олеиновой кислоты.
Относительно невысокая гидрофобизация поверхности минералов
при закреплении только молекул собирателя, вероятно, обусловлена
неориентированной сорбцией и относительно непрочным закреплени-
ем собирателя. Так, при отмывке водой с поверхности неактивиро-
ванных берилла и кварца удаляется от 65 до 75 % сорбированного
собирателя [5, 51]. Недостаточно прочная связь тридецилата с поверх-
ностью полевого шпата и кварца, не активированных катионами, подт-
верждается также значительным уменьшением сорбции собирателя
при температуре пульпы, равной 80°С.
Сорбция молекул олеиновой кислоты возможна за счет сил Ван-
дер-Ваальса или водородных связей с поверхностными гидроксила-
ми минералов, причем собиратель не изменяет химически своего сос-
тояния. Высказано предположение, что он образует с поверхностью
минерала соединение, аналогичное димерам карбоновых кислот [16]
или адсорбционный комплекс.
9.2. Сорбция карбоксильных собирателей
и флотация оксидов и силикатов, содержащих катионы,
в отсутствие модификаторов флотации
При взаимодействии гематита и лимонита с олеиновой кислотой
или олеатом натрия методом ИК-спектроскопии установлено, что на
поверхности минералов образуются олеаты железа и сорбируются мо-
лекулы олеиновой кислоты. При этом количественно определено, что
собиратель вытесняет с поверхности гематита гидроксил и физически
сорбированную воду по реакциям
—Me —0Н + Н01 -> -МеОН.. . Н01
-МеОН . .. НО1 -> —МеО1 + Н2 О
-Me ОН+01“ ->-МеО1+ОН“
Полученные результаты согласуются с данными многочисленных
исследований, которыми установлено, что в подавляющем большин-
стве случаев на поверхности оксидов и силикатов карбоксильный со-
биратель присутствует как в форме молекул, так и хемосорбирован-
ных ионов [30]. Закрепление молекул собирателя на минералах воз-
можно как в результате соадсорбции с углеводородными радикала-
ми хемосорбированного собирателя, так и за счет водородной или
ван-дер-ваальсовых связей с участками поверхности, не занятыми со-
бирателями.
Обработка спиртом или ацетоном гематита, имеющего в поверх-
126
£,% /7мкмоль/м2
100г 20г-
90-18-
80-
16-
70-
14\-
£,% 4"МГ/Г
WOr-2,0
60-
'-1,6
so
-1,2
60
'-0,8
40
20
-0,4
0,5 ’ 1,0 1,6 6,кт/т
50
40
30
20
10
0
12
10
8
6
4
2
0 250 500 7501000 G,v/t
11.40. Зависимость извлечения (Z)
марганцевых минералов и сорбции
собирателя (1Г) от расхода G олеа-
та натрия:
1,1 — кальциевый родохрозит;
2, 2 - пиролюзит; 3, 3’ - псило-
мелан
11.41. Результаты флотации олеа-
том натрия берилла, сподумена
и природно-активированного по-
левого шпата и сорбции олеата:
1, 2, 3 — извлечение соответст-
венно сподумена, берилла и по-
левого шпата; 4, 5, 6 — сорбция
олеата натрия соответственно
сподуменом, бериллом и поле-
вым шпатом
° о
ности адсорбированный собиратель, вызывает резкое уменьшение в
сорбционном слое молекул олеиновой кислоты, тогда как олеаты же-
леза практически не удаляются с поверхности минералов.
При определении прочности закрепления олеата на оксидах желе-
за [1], марганца [53] и алюмосиликатах было установлено, что часть
собирателя, вероятно физически сорбированного, отмывается с по-
верхности водой. Так, при pH 6,3 с поверхности гематита десорбиру-
ется 20 % олеата,'а с поверхности магнетита 35 %, тогда как при pH 10
десорбция составляет 45 и 65 % соответственно. На берилле и полевом
шпате до 40 % олеата закреплено непрочно, а с поверхности сподуме-
на отмывается всего несколько процентов реагента.
Извлечение минералов возрастает с увеличением сорбции собира-
теля и его расхода (рис. 11.40).
При флотации олеатом натрия марганцевых минералов псиломе-
лана гиМпО • МпО2 -п Н2О, пиролюзита МпО2 и кальциевого родохро-
зита (Мп, Са)СО3 установлено, что по степени убывания флотируемос-
ти и сорбционной способности, минералы можно расположить в сле-
дующий ряд: родохрозит > пиролюзит > псиломелан.
Представляет интерес установленный факт, что при флотации сме-
сей марганцевых минералов разница в их флотируемости возрастает
127
11.42. Извлечение оксидов железа и
сорбция олеата натрия при различ-
ных pH (расход олеата натрия при
флотации гематита 75 г/т, магнетита —
200 г/т):
1 и 2 — извлечение гематита и магне-
тита; 3 и 4 — сорбция олеата натрия
гематитом и магнетитом
по сравнению с флотацией каждого минерала в отдельности. При этом
происходит некоторое перераспределение собирателя и минерал, пере-
ходящий в концентрат, сорбирует значительно больше собирателя, чем
остающийся в камерном продукте. Так, например, кальциевый родо-
хрозит при биминеральной флотации сорбирует олеат в 4,1 раза боль-
ше, чем пиролюзит, и в 4,9 раза больше, чем псиломелан, благодаря
чему возможно их разделение.
Изменение флотируемости и сорбции олеата натрия сподуменом
и природно-активированными катионами бериллом и полевым шпа-
том от расхода собирателя показано на рис. 11.41. В соответствии с
большей сорбционной способностью сподумена и более прочным зак-
реплением собирателя наблюдалась его лучшая флотируемость. Кри-
вые флотации берилла и полевого шпата, сорбции олеата натрия их
поверхностью выполаживаются при расходе последнего более SOO-
TSO г/т, что, видимо, обусловлено их ограниченной природной акти-
вацией катионами. Максимальные сорбция олеата натрия и извлече-
ние гематита и магнетита наблюдаются при pH 6—7 (рис. 11.42), что
отвечает изоточке минералов. Методом ИК-спектроскопии установ-
лено для различных образцов гематита максимальная хемосорбция
олеата также вблизи изоэлектрической точки заряда поверхности. Оп-
тимум флотации марганцевых минералов изменяется в пределах pH
5—9, а максимальная сорбция происходит при 6,5—8.
Э.Д. Кривелева и др. определили состав сорбционной пленки со-
бирателя на берилле и марганцевых минералах при различных pH раст-
вора. Установлено, что при pH 3—3,5 основная часть олеата сорбиру-
ется в молекулярной форме, а по мере возрастания pH увеличивает-
ся доля ионной формы и уменьшается доля молекулярной и при pH > 9
весь реагейт практически сорбируется в ионной форме.
Преобладание в кислой области молекул в адсорбционной плен-
ке связано, с одной стороны, с уменьшением количества катионов в
поверхности минералов за счет обменной сорбции с ионами водоро-
да (что подтверждается возрастанием отрицательного дзета-потенциа-
ла минералов), с другой — с уменьшением концентрации ионов олеа-
128
та за счет гидролиза. Понижение сорбции собирателя и увеличение от-
рицательного значения дзета-потенциала в щелочной области, вероят-
но, обусловлены преимущественной сорбцией в поверхности ионов
ОН- и гидролизом поверхности минерала. На поверхности алюмоси-
ликатов также возможно образование анионов Ве2О2^ и А1О~, что
подтверждается установленным А.Н. Долженковой возрастанием от-
рицательного дзета-потенциала берилла и сподумена в растворе едко-
го натра.
Так как оптимум флотируемости олеатом многих оксидов и алю-
мосиликатов лежит в нейтральной и слабощелочной области, то оче-
видно, что эффективная флотация этих минералов обусловлена сов-
местной гидрофобизацией сорбированных ионов и молекул собира-
теля. Интересные результаты получены Кулкарни и Самосандораном
при исследовании флотации гематита олеатом натрия при различных
pH и параллельном определении изменения поверхности натяжения
d/y/d£ растворов олеата от pH. Наблюдалась полная корелляция меж-
ду изменением указанных величин от pH. Было установлено, что pH
оптимума флотации и dy/dt растворов олеата в нейтральной среде
отвечают области образования в растворах кислых мыл, представляю-
щих комплексы кислота — мыло. Эти мыла имеют высокую поверх-
ностную активность, большую,чем кислота и мыло в отдельности [60].
9.3. Действие модификаторов при флотации силикатов
и оксидов карбоксильными собирателями
Активирующее действие ионов кальция
при флотации силикатов
Как известно, кварц, полевой шпат и берилл, отмытые кислотой
от активирующих катионов, слабо флотируются карбоксильными со-
бирателями и сорбируют собиратель в молекулярной форме.
При активации кварца и других силикатов катионами щелочно-
земельных и тяжелых металлов жирнокислотный собиратель закреп-
ляется преимущественно хемосорбционно с образованием солей соот-
ветствующих металлов, как это было показано методом ИК-спектро-
скопии [16 и др.].
На основании проведенных исследований активирующего действия
различных катионов на кварц М.А. Эйгелес располагает их в следую-
щий ряд по способности вытеснять друг друга с поверхности мине-
ралов: Н+, Fe3+, Al3+, Fe2+, Mg2+, Na+1 [51] . Он считает, что все
катионы могут вступать во взаимный обмен на поверхности минера-
лов, при этом чем сильнее сорбируется катион кварцем, тем более
низкий pH необходим для дезактивации поверхности.
Как показали исследования сорбции меченых ионов кальция бе-
риллом, полевым шпатом и кварцем в пределах изменения концен-
траций от 0,5 до 15 • 10 4 моль/л Са2+ [5] (рис. 11.43), поглощение
9-6926
129
е,% /^мкмоль/и2
^Ca2+ucx ’
11.43. Результаты флотации силикат-
ных минералов олеатом натрия и
сорбции ионов кальция при pH
10,8-11,2 (концентрация олеата нат-
рия 9 • 10-5 моль/л [15]:
1, 2, 3 — извлечение соответственно
берилла, кварца и полевого шпата;
4, 5, 6 — сорбция ионов кальция
соответственно бериллом, кварцем
и полевым шпатом
11.44. Сорбция ионов кальция
бериллом (2) и кварцем (2)
при различных pH (концентра-
ция ионов кальция 6,24 х
х 10-4 моль/л)
ионов кальция минералом увеличивается с ростом концентрации раст-
воров, стремясь к предельному значению. В соответствии с этим воз-
растает извлечение минералов по мере увеличения сорбции ионов каль-
ция. Из-за различной сорбции ионов кальция минералами их активи-
рующее действие на флотацию различно. Кроме того, необходимо так-
же учитывать неодинаковую степень гидрофилизации поверхности
минералов, не занятой собирателем. Ионы кальция сравнительно лег-
ко отмываются с поверхности берилла и кварца, с поверхности поле-
вого шпата отмывается не больше 50 % сорбированного кальция. От-
мывка водой активированных ионами кальция силикатных минера-
лов до подачи собирателя, приводит к подавлению флотации минера-
лов.
При последовательной обработке кварца вначале ионами кальция,
а затем раствором олеата прочность закрепления активирующих ио-
нов заметно возрастает и при разбавлении равновесного раствора во-
дой (имеющей тот же pH, что и первоначальный раствор) с поверх-
ности не десорбируются ни ионы олеата, ни ионы активатора. Отсю-
да следует, что одновременное присутствие ионов активатора и со-
бирателя увеличивает прочность закрепления каждого из них.
Сорбция активирующих катионов силикатами и оксидами зави-
сит как от концентрации активатора, так и pH раствора. Согласно Ку-
ку и Дигре, при активации кварца солями кальция в случае анионной
флотации оптимальное извлечение минерала наблюдается, если в объе-
130
Таблица II.5
Соотношение между сорбцией ионов кальция
и результатами флотации кварца
при различных pH и концентрациях ионов кальция
2 + Концентрация Са 12,6* —4 10 J моль/л 2+ —4 Концентрация Са 6,3 -10 } моль/л
Извлеченйе(% рн 2 + Сорбция Са , 1010 моль/см2 pH 2 + Сорбция Са , 1010 моль/см2
20 9,7 1,87 10,0 1,70
40 10,1 2,3 10,73 2,2
60 10,4 2,7 11,30 2,7
80 10,7 3,3 11,70 3,25
ме раствора соотношение [Са2+]/Н+ > 10е, и отсутствие активации,
если Са2+/Н+ < 105. Оптимальная сорбция ионов кальция, обеспечи-
вающая успешную флотацию кварца олеатом, примерно соответству-
ет вышеуказанным pH.
Зависимость сорбции ионов кальция бериллом и кварцем от pH
раствора, согласно данным работы [5], выражается уравнением (1.36)
(рис. 11.44). Это уравнение — частный случай уравнения обменной сорб-
циц ионов Фервея-Никольского.
При обмене двухвалентных ионов кальция на одновалентные ио-
ны водорода b должно равняться 2, однако для кривых доказанных
на рис. 11.50, b « 0,13 + 0,14. В работе А.М. Годэна, изучавшего сор-
бцию ионов бария кварцем [11] как функцию pH раствора,уста-
новлено, что b « 0,18 4- 0,2, т.е. того же порядка. Отклонение экспе-
риментально определенных констант от теоретической возможно вслед-
ствие более сложного характера обмена.
Например, согласно гипотезе М. Фюрстенау, на поверхности ми-
нералов ионы кальция преимущественно сорбируются в виде одно-
валентных гидроксокомплексов СаОН+ [57]. Необходимо также учи-
тывать конкурирующую сорбцию ионов натрия при высоких pH. По
данным Кука и Лигре, ионы натрия вытесняют ионы кальция с поверх-
ности кварца при концентрациях, в 1000 раз превышающих концентра-
цию ионов кальция, что связано с их значительно менее прочной сорб-
цией поверхностью кварца [5, 11]. Исследования влияния ионов нат-
рия, подаваемых в виде NaCl, на сорбцию кальция кварцем и полевым
шпатом и на флотацию кварца показали, что при концентрации ионов
натрия, в 200 раз превышающей концентрацию кальция в процессе
активации, флотация кварца резко ухудшилась, а сорбция кальция на
обоих минералах уменьшилась примерно в 2 раза.
131
В соответствии с ростом сорбции ионов кальция при увеличении
pH раствора, извлечение минералов при флотации олеатом натрия уве-
личивается. Согласно данным работы [5], одинаковой сорбции ионов
кальция кварцем отвечало равное извлечение минералов олеатом (табл.
II.5) независимо от того, обеспечивалась ли сорбция повышенным рас-
ходом кальция или повышением pH пульпы.
Таким образом, при флотации силикатных минералов, требую-
щих активации поверхности, извлечение прежде всего определяется
плотностью сорбционного слоя активирующих ионов, при которой
сорбция собирателя способна обеспечить достаточную гидрофобиза-
цию поверхности.
В Механобре исследоцдлась флотируемость кварца олеатом нат-
рия в зависимости от pH пульпы в присутствии активирующих ионов
кальция. Согласно этим результатам, увеличение сорбции ионов каль-
ция с ростом pH пульпы приводит к параллельному возрастанию сорб-
ции собирателя.
При определении сорбции ионов кальция и олеата кварцем в ус-
ловиях флотации показано, что соотношение между ионом кальция
и ионом олеата на поверхности примерно равно 1, что может служить
в известной мере подтверждением образования поверхностного сое-
динения типа, предложенного М. Фюрстенау. Аналогичное соотноше-
ние Ва : 01 = 1 : 1 установлено А.М. Годэном при активации кварца
барием и флотации олеатом [11].
Примечательно, что при флотации активированного кальцием квар-
ца увеличение щелочности среды (до pH 13,8) не подавляет флотацию
минерала, а, наоборот, способствует увеличению извлечения с ростом
рн за счет возрастания сорбции ионов кальция. Это свидетельству-
ет о преимущественной сорбции ионов олеата на поверхности акти-
вированного кварца и лишь о незначительном поглощении гидрок-
сильных ионов.
Активирующее действие ионов кальция при флотации оксидов
На флотацию железных руд анионным собирателем в щелочной
среде отрицательно влияют соли жесткости. Как и в случае силикатов,
действие ионов кальция при флотации оксидов железа в значитель-
ной степени определяется pH раствора, регулирующего их сорбцию.
О.С. Богдановым, М.С. Михайловой и др. установлено, что сорбция
ионов кальция мартитом и другими оксидами железа подобно сили-
катам подчиняется уравнению (1.36). В области pH 6,3, оптимальном
для флотации мартита (а также гематита и магнетита), сорбция ио-
нов кальция незначительна и мало сказывается на результатах фло-
тации. Однако при pH 9 флотация минералов подавляется и очень зна-
чительно. Подавляющее действие солей кальция можно уменьшить,
увеличив расход собирателя. Так, например, удовлетворительные ре-
зультаты флотации мартита в присутствии 500 г/т Са2+ имеют место
132
при расходе олеата более 1 кг/т. Высказано предположение, что по-
давляющее действие катионов кальция (и, видимо, магния) обуслов-
лено как связыванием собирателя в объеме раствора, так и гидрофи-
лизацией поверхности в результате заметной сорбции ионов кальция.
При исследовании влияния солей кальция и магния на флотацию
марганцевых минералов установлено, что увеличение жесткости во-
ды до 15 приводит к небольшому понижению флотируемости мине-
ралов. Извлечение марганцевого минерала, содержащего кальций —
(Мп, Са)СО3, уменьшается при этом более значительно, чем оксида
марганца - МпО2. Это, возможно, связано с большей сорбцией ионов
кальция кальциевым родохрозитом, обусловливающей бол$е замет-
ную гидрофилизацию поверхности [ 1 Зр
Активирующее действие ионов железа
при флотации силикатов
Кварц, алюмосиликаты. Из практики флотации известна способ-
ность кварца активироваться ионами железа в процессе мокрого из-
мельчения руды в металлической мельнице. По данным Шумана и Пра-
каша, активирующее действие ионов железа проявляется при ничтож-
ной концентрации ионов Fe3+ в растворе, отвечающей произведению
растворимости Fe(OH)3. Присутствие следов железа в пульпе также
приводит к активации берилла при анионной флотации.
Изучение флотируемости кварца, берилла, полевого шпата и дру-
гих алюмосиликатов показало, что в присутствии солей железа извле-
чение минералов возрастает по мере увеличения сорбции ионов же-
леза, параллельно которой возрастает сорбция собирателя (рис. П.45).
Избыток активирующей соли часто приводит к падению извлечения
в результате связывания собирателя в объеме пульпы в труднораст-
воримые олеаты, обладающие меньшим собирательным действием.
Опытами установлено [5], что в отличие от ионов кальция ионы
железа практически не отмываются водой с поверхности силикатов.
Это обстоятельство объясняет образование более прочного покрытия
собирателя на поверхности минералов, активированных солью желе-
за. При активации кварца и полевого шпата ионами железа наблюда-
ется хемосорбция карбоксильного собирателя с образованием олеа-
тов железа, прочно связанных с поверхностью [ 16 и др.].
Сорбция соединений железа минералами, как и любого катиона
зависит от pH пульпы. Измерениями дзета-потенциала кварца в раст-
ворах хлорного железа различной концентрации было установлено,
что сорбция катионов железа кварцем обусловливает положитель-
ный дзета-потенциал кварца при изменении pH от 2 до 8. При этом
максимальный положительный дзета-потенциал отмечался при pH от
4 до 6, что позволяет предположить преимущественную сорбцию гид-
роксокомплексов Fe(OH)2+ и Fe(OH)2, которые находятся в этих
условиях в растворах в преобладающем количестве по сравнению с
133
11.45. Результаты флотации олеа-
том натрия полевого шпата, акти-
вированного железом, и сорбции
олеата натрия и железа (расход
олеата натрия 500 г/т):
1 — извлечение (I — опыты с ’’ме-
ченым” олеатом натрия и ’’неме-
ченым” железом; II — опыты
с ’’немеченым” олеатом натрия и
’’меченым” железом) ; 2 — сорб-
ция олеата натрия; 3 — то же,
железа
11.46. Результаты флотации ак-
тивированного солью железа
кварца и сорбции ионов и
молекул при различных pH
[39]:
1 — извлечение кварца; 2 —
сорбция общая собирателя; 3 —
то же, ионов олеата; 4 — то
же, молекул олеиновой кисло-
ты
ионами Fe3 . Закрепление их на поверхности возможно как в резуль-
тате электростатического взаимодействия с отрицательно заряженной
поверхностью кварца, так и водородной связью с поверхностными
гидроксилами и за счет специфической адсорбции в слое Штерна. По-
ложительный дзета-потенциал до pH 9, вероятно, обусловлен адсорб-
цией положительно заряженных коллоидных частиц Fe(OH)3, преоб-
ладающих в щелочных растворах.
Исследованиями многих авторов установлено, что в присутствии
солей железа при флотации кварца олеатом натрия оптимальное из-
влечение наблюдается в области pH 8-9. Например, кварц, активи-
рованный железом, успешно флотируется олеатом натрия как в кис-
лой, так и в щелочной средах (рис. 11.46) [6]. При этом извлечение
кварца изменяется параллельно сорбции собирателя. Минимальное
извлечение и сорбция отвечают pH, равному 4,5—5.
С помощью селективных растворителей и ИК-спектроскопии ус-
тановлено, что сорбционный слой в диапазоне pH от 3,5 до 10 пред-
134
ставлен как ионами, так и молекулами олеиновой кислоты, В связи
с этим высказано предположение, что поверхностные олеаты железа
образуются как путем хемосорбции ионов олеата (в слабокислой и
щелочной среде), так и за счет взаимодействия сорбирующихся мо-
лекул (в кислой среде) с поверхностными ионами Fe3 . При pH < 5
сорбция молекул возрастает с понижением pH и уменьшением заряда
кварца при приближении к изоточке при pH 3,5 (хотя недостаточно по-
нятно наличие сорбированных молекул в сильнощелочной области).
Во всем изученном диапазоне pH доля собирателя, закрепившегося
в ионной форме, преобладает над молекулярной, однако несомненно,
что совместное присутствие ионов и молекул собирателя в поверх-
ностной пленке усиливает эффект гидрофобизации. Это объясняет-
ся уменьшением сил отталкивания между сорбированными в поверх-
ности одноименно заряженными полярными группами ионов соби-
рателя, благодаря экранированию адсорбирующимися между ними
молекулами, что также может способствовать большей сорбции ио-
нов собирателя. Физически адсорбированный собиратель действует
подобно аполярным собирателям, способствуя утоньшению прослой-
ки жидкости между частицей и пузырьком [37] .
Железистые силикаты. При флотации железных руд наличие в пус-
той породе железистых силикатов ухудшает разделение минералов
и приводит к снижению качества флотационного концентрата. В свя-
зи с этой проблемой изучались флотационные и сорбционные свой-
ства мономинеральных фракций наиболее распространенных железо-
содержащих силикатов: минералов группы амфиболов - актинолит
Ca^Mg, Fe)5 [Si4On]2 [ОН] 2, куммингтонит Fe7Mg [Si4On]2 [ОН] 2>
роговая обманка Са2 Na (Mg, Fe)4 (Al, Fe) [Si, Al)4On ] 2 (ОН)2игруп-
пы хлоритов — шамозит Fe4Al [AlSi3O10] [OH] • nH2O.
На рис. П.47 приводятся результаты флотации указанных минера-
лов олеатом натрия, причем для сравнения даются результаты фло-
тации оксидов железа. Роговая обманка приближается по своим фло-
тационным свойствам к магнетиту, несколько хуже флотируется ша-
мозит, а извлечение куммингтонита даже при высоких расходах со-
бирателя не превышает 65 %. Актинолит практически не извлекает-
ся в концентрат, тогда как при активации солью трехвалентного же-
леза его извлечение заметно возрастает и флотируемость приближа-
ется к флотируемости роговой обманки.
Различное поведение, железосодержащих силикатов при флота-
ции связано с их химическим составом. Высказано предположение,
что при раскалывании минералов группы амфиболов на образующих-
ся плоскостях обнажаются катионы трехвалентных металлов (Ре3^и
А13+), которые взаимодействуют с собирателем и образуют прочные
олеаты. В актинолите содержится небольшое количество трехвалент-
ного железа (0,1 %) и алюминия (1,04 % А12О3) по сравнению с дру-
гими железистыми силикатами, что и объясняет его флотационную
инертность. Наличие в его кристаллической решетке до 4,6 % Fe2 +
135
11.47. Извлечение оксидов железа и железистых силикатов олеатом натрия при
pH 6,2-8,2 в зависимости от расхода G олеата натрия (а) и плотности т сорб-
ционного слоя олеата натрия (б) :
1 — гематит; 2 — магнетит; 3 — роговая обманка; 4 — ожелезненный актинолит;
5 — шамозит; 6 — куммингтонит; 7 — актинолит
не обеспечивает флотацию, что согласуется с отсутствием активации
кварца солью двухвалентного железа. Определение прочности закреп-
ления олеата актинолитом показало, что с поверхности неактивиро-
ванного минерала десорбируется 43 % собирателя, а с ожелезненно-
го актинолита в этих условиях отмывается всего 3 %. Непрочное зак-
репление собирателя на неактивированном минерале обусловливает
его низкую флотируемость. Наоборот, большое содержание алюми-
ния (18—25 % А13О3) и увеличение содержания Fe3+ до 2 % в соста-
ве роговой обманки и шамозита обеспечивает их заметно лучшую фло-
тируемость. Низкое извлечение куммингтонита связано с малым со-
держанием А12 О3 ( < 1 %).
Оптимум флотации изученных железистых силикатов отвечает pH
5—7 и близок к оптимальной флотации оксидов железа.
Активирующее действие ионов железа, алюминия
и других поливалентных металлов
при флотации оксидов
Оксиды железа. При изучении действия солей трехвалентного же-
леза установлено, что магнетит активируется ионами Fe3+ при невы-
соких рн возможно за счет возрастания сорбции этих ионов поверх-
ностью минерала. При повышенных концентрациях солей железа фло-
тация магнетита подавляется. Флотация гематита, однако, даже в при-
сутствии малых концентраций ионов Fe3+ ухудшается [1]. Сорби-
рующиеся поверхностью гидроксидные ионы железа и гидроксид при
невысоких концентрациях способны активировать минералы, тогда
как при более высоких расходах их поверхность гидрофилизирует-
136
ся. Этот процесс может происходить неодинаково на различных ми-
нералах, обусловливая активацию или их подавление.
Касситерит. Синтетический^так же как и природный касситерит, тща-
тельно отмытый с поверхности от примесных катионов, не флотиру-
ется олеатом натрия. В то же время флотируемость природного кас-
ситерита, содержащего значительные включения оксидов железа, обус-
ловлена наличием в поверхностном слое соединений железа. С.И. Поль-
киным, С.Ф. Лаптевым и др. изучались влияние различных примесей
на флотационные свойства касситерита и механизм взаимодействия
его с олеатом натрия. С этой целью исследовались образцы искусствен-
ного касситерита, полученные при высокотемпературном окислении,
которые активировались различными катионами Sn2+, Fe3 , Си2 ,
Pb2+, Мп2+ и др., а также образцы природного касситерита различных
месторождений, содержащие в своем составе Fe, W, Та, Мп, Ti.
Исследования показали, что изменение флотируемости кассите-
рита в зависимости от активации растворами различных катионов
аналогично изменению флотируемости касситеритов, содержащих в
кристаллической решетке подобные примесные катионы. Наилучшей
флотируемостью при pH 6 обладают образцы касситерита, содержа-
щие примеси тантала, вольфрама, ниобия, железа и хрома, т.е. эле-
менты пятой и шестой группы Периодической системы элементов
Д.И. Менделеева и худшая флотируемость установлена для образцов,
содержащих элементы более низкой валентности, чем олово.
При одновременном присутствии в образцах касситерита, танта-
ла и железа, или вольфрама и железа флотация их резко ухудшает-
ся.v Было установлено, что влияние примесей на флотируемость свя-
зано с изменением растворимости касситерита в воде и кислотах. Наи-
большая растворимость присуща чистому искусственному касситери-
ту, а также касситериту с примесями марганца, меди, скандия. Менее
растворимы образцы касситерита, содержащие примеси тантала, нио-
бия, хрома, вольфрама и железа.
Таким образом, примесные катионы, понижающие растворимость
касситерита, лучше активируют его флотацию. В присутствии приме-
сей, изоморфно замещающих атомы олова или образующих комплек-
сы и самостоятельные включения фаз, изменяются параметры крис-
таллической решетки и степень ионности — ковалентности связей на
плоскостях раскола, обусловливающие изменение флотации. Так, с
увеличением доли ковалентных связей гидрофобность касситерита
возрастает.
В работе [5 и др.] было сделано предположение, что хемосорб-
ция карбоксильных собирателей оксидами и силикатами происходит
в результате образования труднорастворимых соединений с гидроксо-
комплексами металлов, образующихся на поверхности минералов.
Согласно этой гипотезе, в воде происходит растворение минералов
и переходящие в раствор ионы металлов гидролизуются до гидро-
137
ксокомплексов, которые адсорбируются минералом путем водород-
ной связи с кислородсодержащими участками минерала или специ-
фической адсорбцией в слое Штерна.
Минералы флотируются анионными собирателями в области pH,
в которой ионы металлов гидролизуются до первого гидроксоком-
плекса. Этот вывод сделан М. Фюрстенау на основании сравнения ре-
зультатов флотации с диаграммами состояния ионов металлов, вхо-
дящих в состав минералов при различном pH растворов.
В соответствии с гипотезой, предложенной М. Фюрстенау [57], был
сделан вывод (на основании анализа полученных экспериментальных
результатов), что в присутствии катионов поливалентных металлов
и олеата натрия максимальная флотируемость таких минералов, как
касситерит, гематит, турмалин, независимо от их природы, наблюда-
ется вблизи pH гидратообразования поливалентных катионов и отве-
чает области образования пленок основных металлических мыл. Нап-
ример, максимум активирующего действия ионов Си2+ при флота-
ции неактивированным синтетическим диоксидом олова (pH 6—6,5)
совпадает с образованием в объеме раствора и на поверхности мине-
ралов основного олеата меди, близкого по составу стехиометричес-
кому соединению CuOHOl.
Основной олеат меди характеризуется значительной способностью
к структурообразованию, межфазные пленки его на границе раствор —
воздух обладают повышенной механической прочностью. При более
высоких pH на поверхности минералов образуются легко отслаиваю-
щиеся пленки продуктов взаимодействия полигидроксида меди с олеа-
том натрия, что в условиях интенсивного перемешивания в процессе
флотации обусловливает понижение извлечения.
Активация синтетического касситерита катионами носит ионооб-
менный характер и происходит лишь тогда, когда при взаимодействии
диоксида олова с раствором соли раствор подкисляется за счет обме-
нивающихся ионов водорода. Это имеет место при изменении pH от
3 до 5, причем с ростом pH увеличивается сорбция катионов. В слу-
чае поглощения катионов трехвалентных металлов при pH > 3 воз-
можно осаждение гидроксидов этих металлов.
Хемосорбция олеиновой кислоты касситеритом возможна как за
счет взаимодействия с поверхностными включениями посторонней
фазы, главным образом оксидов железа, так и с катионами полива-
лентных металлов, сорбированными поверхностью по реакции ион-
ного обмена [16].
Форма собирателя, закрепленного на синтезированном кассите-
рите, изменяется в зависимости от наличия или отсутствия активи-
рующих катионов [16]. На ИК-спектре собирателя, закрепленного
на поверхности неактивированного касситерита, наблюдается толь-
ко полоса поглощения 1700 см'1, соответствующая сорбции соби-
рателя в молекулярной форме (рис. 11.48, кривая 7). После предва-
138
11.48. Участки спектров реагента, сорбиро-
ванного из раствора олеата натрия на по-
верхности синтезированного касситерита (по
данным И.А. Вайншенкера [16] ) :
1 — неактивированный; 2 — активированный
хлорным железом; 3 — то же, и обработан-
ный раствором щавелевой кислоты; 4 — ак-
тивированный хлористым оловом
ригельной активации минерала солью
железа или олова на спектрах кроме по-
лосы поглощения 1700 см-1 наблюдает-
ся полоса ионизированной карбоксиль-
ной группы 1570 см-1, свидетельствую-
щая об образовании соответствующих
олеатов (рис. 11.48, кривые 2 и 4).
В случае удаления с поверхности при
помощи щавелевой кислоты катионов
железа, активирующих касситерит, со-
биратель закрепляется только в моле-
кулярной форме (рис. 11.48, кривая
3 — полоса поглощения 1700 см-1).
Активирующее действие фтористоводородной кислоты
на флотацию алюмосиликатов
Селективная флотация берилла с применением анионного соби-
рателя происходит при обработке руды в плотной пульпе фтористо-
водородной кислотой или едкой щелочью (расход 1—3 кг/т) и пос-
ледующей их отмывке. Предварительная обработка фтористоводо-
родной кислотой заметно улучшает флотацию берилла олеатом нат-
рия и подавляет флотацию сподумена и полевого шпата, как при-
родою, так и искусственно активированного хлорным железом. В этих
условиях сорбция олеата натрия минералами уменьшается в 1,2—1,3
раза.
Активирующее действие фтористовородной кислоты на фло-
тацию берилла исследовалось в ряде работ [5 и др.] и получило сле-
дующее объяснение. При обработке концентрированным раствором
HF (в плотной пульпе) ослабляется взаимодействие берилла с водой
и уменьшается гидрофилизация его поверхности. Это обусловлено
фторированием поверхности минерала, а также растворением оскол-
ков кремнекислородных тетраэдров, образовавшихся при измельче-
нии минерала,Доказательством этому служит после такой обработки
139
уменьшение интенсивности полос поглощения 1160, 1100, 780 и 425
см-1, связанных с колебаниями поверхностных структур в ИК-спектре
берилла.
Уменьшение гидрофильности поверхности берилла под действием
HF подтвердилось также опытами флотации с лауриламином и изме-
рениями краевых углов смачивания.
Отмечается также уменьшение количества адсорбированной на
поверхности берилла воды, или групп ОН, в этих условиях. Как ус-
тановлено ИК-спектроскопией на измененной под действием кисло-
ты поверхности минерала олеат закрепляется в основном в молеку-
лярной форме даже в щелочной среде, что свидетельствует о перехо-
де значительной части поверхностных катионов в раствор. Тем не ме-
нее, уменьшение гидрофильности поверхности обеспечивает заметную
флотацию берилла молекулярной формой собирателя, а незначитель-
ная активация почти всегда присутствующими в рудной пульпе иона-
ми железа обусловливает закрепление собирателя в ионной форме
и резко улучшает флотацию берилла.
При сравнении действия серной кислоты в условиях обработки
минерала HF установлены значительное уменьшение сорбции соби-
рателя и подавление берилла. В этом случае серная кислота более ак-
тивно способствовала переходу поверхностных катионов в раствор.
Собиратель адсорбировался на поверхности только в молекулярной
форме. Можно также предположить, что при действии серной кисло-
ты поверхность минерала становится более гидрофильной в резуль-
тате образования поверхностной кремневой кислоты. Во всех случа-
ях собиратель закреплялся на поверхности в ионной форме. При оди-
наковой плотности сорбции ионов собирателя наибольшее извлече-
ние получено после обработки HF, уменьшающей степень гидрофи-
лизации поверхности берилла и наименьшее — после сернокислотной
обработки, обусловливающей увеличение степени гидрофилизации
поверхности, по сравнению с опытами флотации в обычных услови-
ях (рис. II.49).
11.49. Извлечение берилла в зависимости от
плотности покрытия олеатом натрия при
активации растворами хлорного железа:
1 — после обработки плавиковой кислотой;
2 — без обработки; 3 — после обработки
серной кислотой
Таблица II. 6
Влияние обработки фтористоводородной кислотой на флотацию кварца
и полевого шпата, активированных ионами железа
(концентрация олеата натрия - 10~4 моль/л;
расход соснового масла - 40 г/т)
Минерал •> Расход Fe3+ Извлече- ние при флота- ции Сорбция ионов железа Расход Нр,г/т
г/т 1010 моль/л 1010 моль/см2 % исход- ного
Кварц 24 0,506 89,04 2,724 75,42 0
25 0,527 0 0,435 12,0 500
25 0,527 0 0,315 8,0 1000
Полевой шпат 40 0,504 96,98 2,317 65,25 0
42 0,527 0 0,124 3,42 1000
Подавление флотации полевого шпата и кварца при обработке
фтористоводородной кислотой обусловлено [5] вытеснением с по-
верхности минерала активирующих катионов в результате сорбции
потенциалопределяющих ионов водорода, что приводит к резкому
уменьшению плотности сорбционного слоя собирателя (табл. II.6)
и закреплению его только в молекулярной форме. Серная или соля-
ная кислота одинаково дезактивирует как берилл, так и силикатные
минералы пустой породы и обусловливает их депрессию.
При выделении коллективного берилло-сподуменового концен-
трата по одной из схем обогащения руды в плотной пульпе обраба-
тывается едким натром, а затем после отмывки избытка щелочи фло-
тируется олеатом натрия. В этих условиях подавляется основная мас-
са кварца и полевого шпата и активируется флотация берилла и спо-
думена. Сорбция собирателя поверхностью берилла и сподумена при
этом изменяется незначительно, а на поверхности полевого шпата за-
метно падает.
Действие едкого натра, вероятно, аналогично влиянию обработки
фтористоводородной кислотой и связано с растворением на поверх-
ности осколков гидрофильных силикатных колец берилла и споду-
мена, что уменьшает степень гидрофилизации их поверхности. В про-
цессе обработки едким натром с поверхности полевого шпата удаля-
ются активирующие минерал соединения железа в виде гидроксидов,
что приводит к подавлению полевого шпата. Следует отметить, что
при действии фтористоводородной кислоты эффект гидрофобизации
флотирующихся полезных минералов и дезактивации минералов пус-
той породы выражен сильнее, чем при использовании едкого натра,
поэтому кислотная схема флотации берилла более эффективна, чем
щелочная.
141
10. ВЗАИМОДЕЙСТВИЕ КАРБОКСИЛЬНЫХ СОБИРАТЕЛЕЙ
С СОЛЕОБРАЗНЫМИ МИНЕРАЛАМИ
10.1. Сорбция карбоксильных собирателей
и флотация солеобразных минералов
К классу малорастворимых солеобразных минералов относят кар-
бонаты, фториды, фосфаты, сульфаты, вольфраматы, бораты и молиб-
даты.
Разделение солеобразных минералов представляет значительные
трудности. Это часто связано с близкими флотационными свойства-
ми разделяемых минералов, обусловленными аналогичным хими-
ческим составом их поверхности. Флотируемость минералов зависит
от их растворимости и гидролиза поверхности и ионов в объеме пуль-
пы, определяющих заряд частиц минералов и состав растворимых сое-
динений в водной фазе. Растворимость минералов может широко из-
меняться при флотации. Так, например, на растворимость минералов
влияет присутствие посторонних ионов: изоморфных, входящих в
состав решетки минерала и переходящих в водную фазу; растворен-
ных соединений других минералов, находящихся в руде; различных
электролитов, добавляемых для создания pH среды, депрессирующих
или активирующих реагентов и др. Поскольку переходящие в раст-
вор с поверхности минералов ионы и молекулы способны взаимодей-
ствовать друг с другом и с добавляемыми флотационными реагента-
ми, то состав водной фазы оказывает значительное влияние на разде-
ление минералов.
Электрохимические свойства поверхности солеобразных мине-
ралов устанавливают измерением электрокинетического потенциа-
ла поверхности. В процессе растворения и гидролиза поверхности ми-
нералов в раствор переходят помимо ионов, составляющих решетку
минералов, более сложные ионы, образующиеся за счет гидролиза ио-
нов решетки. Так, например, в случае кальцита помимо Са2 и СО2~
в растворе содержатся комплексные ионы СаНСО*, СаОН+, НСО~,
концентрация которых зависит от pH раствора. При этом электроки-
нетический потенциал поверхности кальцита будет определяться сос-
тавом ионов, адсорбируемых пропорционально их концентрации в
растворе. Таким образом, изменение электрохимических свойств по-
верхности солеобразных минералов обусловлено протеканием слож-
ных реакций на поверхности минералов и в объеме пульпы.
Взаимодействие жирнокислотных собирателей с большинством
солеобразных минералов в нейтральной и щелочной средах представ-
ляет собой хемосорбцию, при которой обычно происходит образо-
вание соответствующих солей с катионами металлов, находящихся
на поверхности. С помощью метода ИК-спектроскопии установлена
хемосорбция олеиновой кислоты и олеата при взаимодействии с флю-
оритом.
142
А. Бар, M. Клемент и др. [30] с помощью того же метода изуча-
ли строение адсорбционной пленки на флюорите. Они установили, что
ИК-спектры синтетического порошка олеата кальция отличаются от
спектров поверхностной пленки олеата, хемосорбированной на флю-
орите. ИК-спектры флюорита, обработанного более разбавленным вод-
ным раствором олеата натрия [до (2—3) 10 4 моль/л] , имели толь-
ко одну полосу поглощения при 6,45—6,5 мкм. Спектр же минерала,
обработанного более концентрированным раствором олеата натрия
( > 5 • 10”4 моль/л), имел две отчетливые полосы поглощения при
6,35 и 6,5 мкм и был подобен спектру синтезированного олеата каль-
ция. Хемосорбция олеата происходила в соответствии с изотермой
Лэнгмюра до образования монослоя, в котором в среднем на три иона
кальция приходилось два иона олеата, причем на каждый ион олеата
приходилась площадь 1,85 нм2.
По аналогии с результатами, полученными в исследованиях А.Бара
и др., было установлено [35] , что хемосорбционное соединение паль-
митата на кальците, образующееся при обработке кальцита спирто-
вым раствором пальмитиновой кислоты, отличается от пальмитата каль-
ция, осаждающегося в растворе. В изученных условиях возможность
образования пальмитата кальция в объеме раствора маловероятна бла-
годаря низкой растворимости кальцита в спирте.
Образование мыл щелочноземельных металлов в результате хе-
мосорбции жирнокислотных собирателей различными солеобразны-
ми минералами было подтверждено в работах ряда исследователей
[51]. Тем не менее, некоторые авторы считают, что возможны и дру-
гие виды сорбции.
П. Самосандаран на основании измерения дзета-потенциала каль-
цита в растворах олеата натрия при нескольких значениях pH и опре-
деления изотерм адсорбции олеата кальцитом при pH 9,6 предложил
следующий механизм взаимодействия олеата с кальцитом. При поло-
жительном дзета-потенциале кальцита (ниже изоэлектрической точ-
ки поверхности, отвечающей pH 8,2) закрепление ионов олеата поверх-
ностью из сильно разбавленных растворов ( < 10“ 6 моль/л) происхо-
дит под действием кулоновских сил. При возрастании pH поверхность
кальцита перезаряжается до отрицательного дзета-потенциала.при этом
электростатическая сорбция одноименно заряженных ионов невозмож-
на. Но так как с увеличением концентрации олеата натрия сорбция его
продолжает возрастать (рис. 11.50), то возможно только хемосорб-
ционное закрепление собирателя в виде хемомицелл или при взаимо-
действии с поверхностными катионами. Последнее подтверждается
изменением наклона изотермы при концентрации 2-10“5 моль/л. При
концентрации олеата в растворе, отвечающей образованию осадка олеа-
та кальция в объеме раствора (более 4-10“5 моль/л), возможно его
осаждение на минерале.
Можно предположить, что хемосорбция собирателя минералами
143
11.50. Изотерма сорбции олеата натрия на кальците
при естественном pH 9,6 (С—равновесная концентра-
ция олеата натрия)
возможна во всем диапазоне изменения pH, так как она не зависит
от заряда поверхности минералов. Так, например, она происходила
при pH 1,5 при взаимодействии олеата с флюоритом и при pH 3—4 фло-
тации кальцита олеатом.
В работе М. Смани, Р. Блази и Ж. Каза, изучавших флотацию каль-
цита в трубке Халлимонда при переменных концентрациях олеата нат-
рия (от 1 ’ 10“5 до 5 • 10~4 моль/л) при изменении pH от 3 до 12 за-
фиксированы два оптимума флотации — в кислой и щелочной средах.
Адсорбция олеата как в щелочной среде (pH > 7), так и в кислой
(pH 3—5) происходит за счет химической связи с образованием дву-
мерного комплекса анион—поверхностный катион.
Хемосорбция олеата флюоритом, баритом и кальцитом по данным
А. Пика и М. Вадсворда является результатом ионного обмена, при ко-
тором ионы олеата замещают анионы F-, СО^- или SO*-, находящи-
еся в поверхностном слое кристаллической решетки минералов. В соот-
ветствии с этим в присутствии заметных количеств NaF или Na2SO4
и перемешивании суспензии флюорита или барита с олеатом натрия
при pH 8,5 хемосорбция олеата флюоритом и соответственно баритом
значительно уменьшалась, а физическая адсорбция собирателя возрас-
тала.
Предложенный механизм нашел подтверждение в исследованиях
А. Бара и др. [30] . Иной механизм сорбции анионных собирателей
был предложен Е. Зоренсеном. Он предполагает, что поверхностные
атомы фтора фторсодержащих минералов взаимодействуют с поляр-
ной группой жирнокислотного собирателя за счет ионной и водород-
ной свази с кислородом карбоксильной группы. Предложенный меха-
низм основан на подобии геометрических размеров кристаллической
решетки минерала и структуры полярной группы. Однако эта точка
зрения не разделяется большинством исследователей.
Согласно результатам исследований, проведенных различными
авторами, сорбционная способность солеобразных несульфидных ми-
нералов по отношению к карбоксильным собирателям весьма различ-
на. Примером этому могут служить изотермы сорбции тридецилата
натрия, содержащего 14 С, мрамором, флюоритом и ферберитом в ще-
144
лочной среде [5]. Как следует из этих данных на ферберите, в пре-
делах исследовавшихся концентраций, происходит насыщение поверх-
ности при покрытии, отвечающем 1,2 монослоя, на флюорите в этих
условиях сорбируется около двух слоев, а при сорбции мрамором
происходит химическая реакция на такую большую глубину, что да-
же при наличии 13 молекулярных слоев сорбция не достигает предель-
ного значения1.
Согласно представлениям, изложенным в работе [11], при взаи-
модействии несульфидных минералов с карбоксильным собирателем
образуется пленка трудно растворимых продуктов реакции, толщина
которой может достигать 100 молекулярных слоев, т.е. происходит
образование новой фазы. Таким путем образуются пленки олеата каль-
ция на кальците, пальмитата кальция на апатите, олеата меди на ма-
лахите и др. Экспериментально установлена полислойная сорбция кар-
боновых кислот кальциевыми минералами [36, 53]. При десорбции
тридецилата водой с поверхности кальциевых минералов и ферберита,
собиратель лишь частично отмывается при разбавлении равновесного
раствора в 8—16 раз [5] . Это свидетельствует о необратимом харак-
тере сорбции жирнокислотного собирателя изученными минералами.
Зависимость флотируемости минералов от плотности сорбционно-
го слоя собирателя. В отсутствие модификаторов флотации извлече-
ние минерала определяется плотностью сорбционного покрытия со-
бирателя, зависящей от природы минерала. Существовало мнение,
что второй слой собирателя закрепляется в результате взаимодействия
с углеводородными радикалами монослоя, причем полярные груп-
пы, обращенные в водуt обусловливают гидрофилизацию поверхнос-
ти. В этом случае флотация минералов должна ухудшаться. Однако,
согласно исследованиям [36, 51 и др.] при полислойной сорбции час-
то сохраняется гидрофобизация поверхности, что объясняется беспо-
рядочным расположением собирателя во вторичных слоях. При избыт-
ке собирателя происходит сорбция осадков мыл, образующихся в пуль-
пе. Применение растворов собирателя, концентрация которых пре-
вышала ККМ (5 г/л)^ приводило к падению сорбции собирателя и по-
давлению флотации минералов [36], а также увеличению смачивае-
мости флюорита, барита, кварца, каолина, графита и др. в растворах
олеата концентрацией больше 1 г/л [37] . Причина этого — образова-
ние сильно гидратированных коллоидных мицелл типа (Na 01)* (Н2О)^
как в объеме раствора, так и в поверхностном слое.
1 При расчете плотности сорбционного слоя собирателя на кальциевых ми-
нералах принималось, что весь собиратель распределяется равномерно,, причем
площадь поперечного сечения иона*жирной кислоты принималась равной 2210-16
см2. Исходя из размеров элементарной ячейки ферберита, ориентировочно рас-
считали, что на каждый ион Fe или Мп приходится площадь, равная 7610~16
см2, которая соответствует закреплению одного иона собирателя.
10-6926
145
Флотация минералов труднорастворимыми солями собирателя.
Собирательное действие труднорастворимых олеатов различных ме-
таллов при флотации несульфидных минералов было показано М.А. Эй-
гелесом, М.Е. Липец и др. [51]. М.А. Эйгелес,применявший при фло-
тации несульфидных минералов твердые осадки олеатов многовалент-
ных металлов, установил различную гидрофобизирующую способность
этих соединений. Флотация флюорита осадком тридецилата кальция,
содержащего 14С, показала, что извлечение минерала, определяется
степенью дисперсности труднорастворимой соли собирателя. Наилуч-
шие результаты флотации получены с наиболее высокодисперсным
свежеосажденным осадком. Наиболее низкое извлечение флюорита
установлено при использовании заранее высушенного осадка, содер-
жащего более крупные частицы. Гидрофобизирующее действие нераст-
воримых солей жирных кислот можно объяснить как результат адге-
зии тонкодисперсных осадков либо как результат сорбции анионов
жирной кислоты, приводящей к смещению равновесия в сторону даль-
нейшего растворения соли жирной кислоты [5].
Влияние длины и строения углеводородного радикала собирате-
ля при флотации карбоновыми кислотами. Собирательное действие
карбоновых кислот возрастает с увеличением длины углеводород-
ного радикала до определенного предела, а затем при дальнейшем уд-
линении цепи — ухудшается. Так, при флотации кальцита флотаци-
онная активность насыщенных жирных кислот растет с увеличени-
ем длины цепи собирателя от С8 до С12 [36], при флотации гемати-
та — при удлинении цепи от С4 до Сп, по данным В. Кека, а извле-
чение барита повышается с увеличением углеводородного радикала
в гомологическом ряду кислот от С5 до С13 [63].
Собиратели большей молекулярной массы обладают меньшей ак-
тивностью (рис. 11.51). При флотации корунда и касситерита просты-
ми и замещенными карбоновыми кислотами установлено аналогич-
ное увеличение собирательного действия с удлинением цепи радика-
ла до С15 или С17 в соответствии с возрастанием сорбции.
Б.К. Парек и Ф.Ф. Аплан определяли дисперсионные силы жирно-
кислотных собирателей, имевших различную длину углеводородно-
11.51. Извлечение барита Na-н-алкилкарбоксилатами (pH 6-10) [63] :
1 - С5; 2 - С6; 3 - С7; 4 - С8; 5 - С9; 6 - Сп; 7 - С13; 8 - С15; 9 - С17
146
го радикала при взаимодействии с минералами. На основании прове-
денных исследований был сделан вывод, что молекулы жирных кис-
лот с длиной углеводородного радикала С12 — С18 расположены на
поверхности вертикально и этим самым уплотняют сорбционное пок-
рытие поверхностной пленки, а молекулы собирателей с небольшой
длиной углеводородного радикала имеют более слабую дисперсион-
ную связь и расположены в виде отдельных сегментов и частично нак-
лонены или лежат на поверхности.
Изменение флотационных свойств карбоновых кислот введени-
ем в их молекулу а-заместителей. Использование в качестве собира-
теля а-замещенных карбоновых кислот дает несомненные преимущест-
ва по сравнению с применением общепринятых жирнокислотных со-
бирателей [61, 63]. По данным Т.П. Герман и Н.С. Алейниковой/г-суль-
фопальмитиновая и а-сульфостеариновые кислоты - более сильные
и более селективные собиратели апатита и гематита, чем незамещен-
ные кислоты.
И.Н. Плаксиным с сотрудниками при извлечении некоторых мине-
ралов редких земель показано значительное собирательное и селек-
тивное действие а-сульфокарбоновых кислот с длиной углеводород-
ного радикала от С10 до С16. По данным Б.Е. Чистякова, хлориро-
вание высших карбоновых кислот усиливает их собирательное дей-
ствие при флотации апатита и оксидов железа по сравнению с исход-
ными кислотами и делает их менее чувствительными к солям жест-
кости. Н— пентадеканкарбоксилаты изменяют гидрофобизирующее
действие при введении различных a-заместителей в углеводородную
цепь, что влияет на флотацию барита и корунда. X. Шуберт, А. Серра-
но и X. Бальдауф показали, что бром- и дикарбоновые кислоты - бо-
лее сильные собиратели для касситерита и корунда, чем монокарбо-
новые кислоты.
Кислотные свойства жирнокислотных собирателей, в значитель-
ной степени определяющие собирательное действие их, можно легко
изменить путем введения в их молекулу заместителей в а-положение
к карбоксильной группе R—СН-С<^ , где х — заместитель. Благо-
даря введению в молекулу собирателя в d-положении электроноакцеп-
торного заместителя (например ,Br, С1 или SH), обладающего большим
сродством к электрону, электронная плотность на атомах кислоро-
да карбоксильной группы уменьшается, что приводит к ослаблению
связи с протоном карбоксильной группы и, следовательно, усилению
диссоциации, т.е. повышению кислотности реагента.
С целью исследования влияния кислотной силы жирнокислотно-
го собирателя и характера заместителя на флотационные свойства реа-
гента испытывались а- окси-меркапто-, бром-, сульфо- и аминопроиз-
водные пальмитиновой кислоты при флотации вольфрамита, кальци-
та, касситерита и барита [61] . В качестве собирателей применялись
147
б в
г
G, моль/т
11.52. Извлечение вольфрамита (а), касситерита (б), кальцита (в), барита (г) в
зависимости от расхода G собирателя:
1 — меркаптопальмитат; 2 — бромпальмитат; 3 — олеат; 4 — хлорированные
кислоты; 5 — пальмитат; 6 — сульфопальмитат; 7 — оксипальмитат
также хлорированные карбоновые кислоты С10 — С16- В гомологи-
ческом ряду карбоновых кислот их кислотная сила, начиная с уксуо
ной и кончая высокомолекулярными гомологами, практически не
изменяется, поэтому кислотные свойства реагентов, зависящие от эле-
ктроноакцептооной способности заместителей, уменьшаются следую-
щим образом;1^Н (рКа 2,35) > С1 (рКа 2,68) > Вг (рКа 2,90) > SH
(рКа 3,86) > ОН (рКа 3,83) > Н (рКа 4,75) > SO3H (рКа 6); группа
SO3H вследствие высокой ионизирующей способности, уменьшает
диссоциацию карбоксильной группировки.
Изменение флотируемости минералов производными пальмити-
новой кислоты приводится на рис. 11.52. Среди испытанных а-заме-
щенных пальмитиновой кислоты собирательные свойства при флота-
ции минералов убывают в порядке: меркапто пальмитат > бромпаль-
митат > пальмитат > сульфопальмитат » оксипальмитат. Собиратель-
ное действие хлоркислот приближается к действию бромпальмитата,
а у олеата натрия оно несколько меньше или сравнимо с меркапто-
пальмитатом. Аминопальмитат не флотировал минералы.
Параллельно усилению кислотных свойств а-замещенных карбо-
новых кислот (в соответствии с возрастанием электроноакцептор-
ной способности заместителя) наблюдается рост их собирательного
действия. Более сильные кислотные свойства соединения, например
бромпальмитиновой кислоты, по сравнению с пальмитиновой обус-
ловливают большую сорбцию его на всех минералах, как это было
установлено в работе [35], что и создает большую гидрофобизацию
148
минералов. Возрастание кислотных свойств собирателя способству-
ет расширению оптимума сорбции и флотации минералов в более кис-
лой области.
Помимо влияния заместителя на кислотные свойства собирателя
необходимо также учитывать возможность взаимодействия «-замес-
тителя с поверхностью минералов, а также водой. Принимая во вни-
мание данные по флотации минералов, можно полагать, что в том слу-
чае, когда кислотные свойства а-замещенных соединений возрастают,
а замещающие группы взаимодействуют с водой только за счет сла-
бых дисперсионных (С1 или Вт) или очень слабых водородных (SH)
связей, то соединения являются сильными собирателями. К послед-
ним относятся хлор- бром- и меркаптопальмитиновая кислота.
Если заместитель увеличивает гидрофильность соединения и зак-
репление реагента способствует гидрофилизации поверхности мине-
рала (SO3 Н, ОН), то соединение — слабый собиратель. Исключение
составляет флотация барита сульфопальмитиновой кислотой, когда
сульфогруппа принимает участие в образовании дополнительной ко-
валентной связи с поверхностью минерала, как это следует из спек-
тра поверхностного соединения сульфокарбоновой кислоты на бари-
те [63]. Меркаптогруппа, видимо, в ряде случаев способна образо-
вать хелатные соединения с минералами.
Таким образом, эффект полярного влияния a-заместителя в ря-
ду производных карбоновых кислот на их флотационные свойства
весьма значителен. Ряд производных карбоновых кислот по эффек-
тивности действия равен или превосходит олеиновую кислоту. Так,
например, высокие показатели обогащения шеелитовой руды полу-
чены в Механобре при использовании вместо олеата натрия дихлор-
кислот фракции С17 - С20 (табл. II.7).
ТаблицаП.7
Результаты флотации шеелитовой руды дихлоркислотами
фракции С1? - С20
Собиратель Расход, г/т Продукт Выход, % Содержа- ние WO,’ % Извлече- ние WO,, %
Олеат натрия 90 Концентрат Хвосты Исходный 7,4 92,6 100,0 2,58 0,018 0,208 91,4 8,6 100,0
Дихлоркислоты фракции С17 - С20 90 Концентрат Хвосты Исходный 7,3 92,7 100,0 2,62 0,017 0,207 92,4 7,6 100,0
149
10.2. Действие регуляторов pH пульпы при флотации
Солеобразные минералы очень трудно разделить вследствие бли-
зости их флотационных свойств в особенности, если в кристалличес-
кой решетке минералов имеются одинаковые катионы. При этом боль-
шое значение для селективной флотации минералов имеет выбор со-
ответствующего pH. Для большинства солеобразных минералов при
флотации жирнокислотными собирателями необходима слабощелоч-
ная или щелочная среда [11, 51 и др.], а карбонатные минералы, та-
кие, как кальцит и доломит, могут флотироваться как в слабокислой,
так и в щелочной среде.
Концентрация водородных ионов влияет на состояние поверхност-
ного слоя минералов (электрохимический и дзета-потенциал, гидро-
лиз поверхности), гидролиз собирателя и его адсорбцию минералом
и состав соединений, образующихся во флотационной пульпе, а так-
же на ценообразование.
Карбоксилатные ионы RCOO- вступают во взаимодействие с по-
ливалентными ионами металлов как на поверхности минералов, так
и в объеме раствора с образованием труднорастворимых солей. С уве-
личением pH раствора диссоциация жирнокислотного собирателя воз-
растает. Это приводит к увеличению концентрации анионов жирной
кислоты в растворе, что должно способствовать улучшению сорбции
их и флотируемости минералов. В кислой среде происходит обратное.
Однако увеличение pH означает рост концентрации гидроксильных
ионов, конкурирующих с ионами собирателя в отношении адсорб-
ции на тех же центрах поверхности минералов. По этой причине уве-
личение концентрации гидроксильных ионов сверх определенного pH
будет компенсировать влияние повышенной концентрации ионов со-
бирателя и может ухудшить флотацию.
При исследовании зависимости флотации олеатом натрия, гема-
тита, барита, шеелита, кальцита и других минералов от pH установ-
лено, что для каждого минерала существует критический pH, опре-
деляемый соотношением [R~] = К [ОН] , где [R~] — концентра-
ция ионов олеата, Кип— постоянные для каждого минерала. Ана-
логичная зависимость была теоретически выведена М. Шигеру и др. для
сорбции собирателя.
И.Х. Влодавский на примере флотации олеатом натрия минералов
изоморфной группы вольфрамита — ферберита FeWO4 и гюнерита
MnW04 показал, что pH, обусловливающий подавление минералов,
определяется природой катиона кристаллической решетки. Им был
установлен определенный параллелизм между значением pH, вызы-
вающим подавление минералами pH осаждения гидроксида соответ-
ствующего катиона. Так, в случае ферберита флотация ухудшается
при pH > 7, а гюбнерита при pH > 10,2 (рис. 11.53), тогда как pH
начала осаждения Fe(OH)2 равен 5, а Мп(ОН)2 — 9. Следовательно,
150
11.53. Влияние концентрации водородных ио-
нов на извлечение ферберита (7) и гюбне-
рита (2) (концентрация олеата натрия
30 мг/л; расход крезола 30 мг/л; Т:Ж =
= 1:6) [по данным И.Х. Влодавского]
чем менее растворим гидроксид, образуемый катионом решетки, тем
меньше концентрация гидроксильных ионов, необходимая для подав-
ления минерала.
И.Х. Влодавский также показал, что оптимальный pH флотации
минералов зависит как от катиона, входящего в состав решетки, так
и от активирующего минерал катиона. При флотации гюбнерита (рис.
11.54) оптимальное извлечение при pH 9,5-10 обусловлено наличием
ионов Мп2 + в решетке минерала, а при pH 5—6 - активацией гюбне-
рита ионами Fe3 , А13 + или РЬ2+, а при pH 11,2 - активацией иона-
ми Mg2+.
Как указывалось ранее, согласно представлениям М. Фюрстенау
[57 и др.] оптимальное извлечение при флотации минералов связа-
но с оптимальным pH образования первичных гидроксокомплексов
(PbOH+, FeOH+, Fe (ОН) *, MgOH+, МпОН+, СаОН+ и др.), имеющихся на
поверхности минерала, с которыми взаимодействует собиратель. Об-
ласть pH, при которой отсутствует флотация, обусловлена, как по-
лагает М. Фюрстенау, недостаточным количеством гидроксокомплек-
сов указанного состава. Оптимальные извлечения при флотации ми-
нералов группы вольфрамита, найденные И.Х. Влодавским, до неко-
торой степени согласуются с pH, получаемым согласно гипотезе М. Фюр-
стенау.
Подавляющее действие высоких концентраций гидроксильных
ионов может быть обусловлено также изменением состава поверх-
ностного слоя минерала. Согласно данным В.Г. Данилова, гидроксид
11.54. Извлечение гюбнерита в зависи-
мости от pH при активации ионами
(по данным И.Х. Влодавского):
I - Fe3+; 2 - Al3*; 3 - Pb2+; 4 -
Mg2+; 5 — без активации
151
алюминия, образующийся на поверхности минералов алюминия, с уве-
личением pH пульпы превращается в алюминат, что должно привести
к уменьшению обменной сорбции ионов олеата с поверхностными гид-
роксидами и ухудшению флотации, наблюдающемуся на практике.
Известны попытки рассчитать оптимальный pH сорбции анионных
собирателей несульфидными минералами. Авторы таких исследова-
ний рассматривают поверхность большинства несульфидных минера-
лов как обладающую свойствами основания или кислоты (так как
ионы Н+ и ОН- являются для них потенциалопределяющими). В свя-
зи с этим с изменением pH пульпы должно изменяться количество гид-
роксилов или ионов Н+ на их поверхности. Кроме того, pH пульпы
определяет также концентрацию анионов реагента в растворе, зави-
сящую от константы ионизации. Предполагая образование комплекс-
ного соединения при сорбции анионов собирателя поверхностными
катионами минерала, можно рассчитать оптимальный pH раствора,
отвечающий максимальному выходу комплекса в соответствии с сорб-
цией реагента. Такой расчет произведен Ю.Г. Буниным и Ю.А. Быко-
вым для флотации олеиновой кислотой ряда несульфидных минера-
лов.
С этой целью авторы вывели формулу, учитывающую зависимость
оптимального pH сорбции от значения констант ионизации олеиновой
кислоты и гидролиза катиона металла кристаллической решетки ми-
нерала
[И+] опт =V*HR ^МеОН)^.,) (И. 1)
где A"jIR - константа ионизации олеиновой кислоты; ^\меОЮ -
константа гидролиза катиона металла. ' f (п-1)
При расчете авторы использовали оптимальный pH флотации, а
не pH оптимальной сорбции собирателя минерала. Тем не менее они
получили удовлетворительное совпадение расчетных и эксперимен-
тальных данных.
В аналогичных исследованиях [40] была несколько изменена фор-
мула расчета. В.И. Рябой исходит из того, что на поверхности мине-
ралов в результате пространственных затруднений маловероятно об-
разование комплекса катиона с собирателем состава более чем 1:1.
По этой причине основные свойства поверхности минерала будут оп-
ределяться константой нестойкости гидроксокомплекса первой сту-
пени или соответственно, константой основности (Кв) гидроксида
металла. Отсюда оптимальный pH сорбции реагента можно рассчитать
по формуле
(П-2)
152
где /fHR - константа ионизации реагента; -K\feQn _ константа нестой-
кости гидроксокомплекса металла первой ступени; — ионное про-
изведение воды.
По указанной формуле в химии координационных соединений оп-
ределяется максимальный выход комплекса, образующегося в раст-
воре в зависимости от pH среды.
Уравнения (П.1) и (П.2) аналогичны и решение их приводит к оди-
наковым результатам, однако константы гидролиза металлов опре-
делены с меньшей точностью и для меньшего числа металлов, чем кон-
станты нестойкости гидроксокомплексов. В табл. II.8 сравниваются
оптимальные pH сорбции жирной и пеларгонгидроксамовой кислот
на различных несульфидных минералах, рассчитанные по формуле
(II.2) и определенные экспериментально. Во многих случаях полу-
чено удовлетворительное совпадение расчетных и эксперименталь-
ных данных. В том случае, когда на поверхности минералов имеется
несколько катионов, сравнение расчетных и экспериментальных дан-
ных позволяет установить, какой из атомов поверхности определя-
ет сорбцию реагентов. Так. например, в случае сподумена, на поверх-
ности которого находятся атомы лития и алюминия, оптимум сорб-
ции жирной кислоты отвечает pH 9,2. Расчетный оптимальный pH сорб-
ции жирной кислоты атомами алюминия равен 4,94, а атомами лития —
9,3.
Таким образом, активными центрами закрепления анионов жир-
ной кислоты на сподумене являются атомы лития. Аналогично при взаи-
модействии берилла с жирной кислотой сорбция должна иметь мес-
то на атомах бериллия. Указанные результаты соответствуют данным
по сорбции олеатов алюмосиликатами.
Симбатное изменение сорбции карбоксильных собирателей и фло-
тируемости солеобразных минералов в зависимости от pH наблюдает-
ся лишь в некоторых пределах значений pH [5, 22, 51], а для ряда
минералов не было установлено какого-либо соответствия между эти-
ми величинами. Это связано с рядом причин, в том числе с влиянием
pH и реагентов на пенообразование, неоднородностью поверхности
и др.
v На рис. 11.55 и 11.56 приведены извлечения при мономинеральной
флотации и сорбция карбоксильных собирателей флюоритом, кальци-
том и шеелитом при различных pH. Для всех минералов имеется хо-
рошо выраженный оптимум флотации, который для флюорита и шее-
лита наблюдается в нейтральной среде, для кальцита — в щелочной.
Хорошая флотируемость шеелита при pH 6—7, вероятно, связана с
тем, что его поверхность была частично ожелезнена. Сорбция собира-
теля шеелитом и кальцитом в зависимости от pH изменяется парал-
лельно их флотируемости, тогда как при падении извлечения флюори-
та в кислой области сорбция собирателя уменьшается незначительно,
что, возможно, связано с коадсорбцией молекул жирной кислоты.
153
Оптимальный pH сорбции реагентов на минералах, вычисленный
№ п/п Название минерала и его формула Катионы по- верхности К МеОН
1 Кальцит СаСО3 Ca2 + 0,35 • 10"1
2 Барит BaSO4 Ba2+ 0,14
3 Флюорит CaF2 Ca2 + 0,35 10-1
4 Мартит Fe2O3 Fe3+ 0,13 10-11
5 Гюбнерит (Mn2+, Fe2+) WO4 Mn2+ Fe2+ 0,13 • 10~2 0,27 • 10
6 Ферберит FeWO4 Fe2+ 0,27 • 10-S
7 Монацит (Се, La) РО4 La3+ Ce3+ 0,5 • 10~3 0,25 • 10~4
8 Иттросинхизит [Са, La(CO3)2F] La3t Ca2+ 0,5 • 10~3 0,35 • 10 1
9 Берилл Ве3А12(512°6) Be’: Al3 0,33 • 10'J 0,91 • 10
10 Сподумен Li, Al [Si,0,1 u Z о J Li+ Al3+ 0,66 0,91 • 10 s
И Кварц SiO2 H2SiO4 Ka=l,3 • IO'10
Данные флотации.
**
Вычислено из экспериментальных данных с карбоксилатами.
Согласно исследованиям И.Х. Влодавского, извлечение гюбнери-
та олеатом натрия определяется только pH раствора и не зависит от
того, применяется ли в качестве регулятора среды сода или едкий
натр. Хотя в содовых растворах концентрация карбонатных ионов
154
Таблица II. 8
и определенный экспериментально
---------------------------------------была значительно больше
Сорбционный реагент
Жирная кислота К =1,75 • 10“5 а Пеларгонгидроксамо- вая кислота =2,4 • 10-10 [14]
pH расчет- ный pH экспе- рименталь- ный pH расчет- ный pH экспе- рименталь- ный
8,65 8,5-9
[5]
8,96 9-11* — —
[33]
8,7** 8-9 [23]
3,43 7,5 - -
7,94 9,8* 10,4 8 и 10
6,60 9,3 [23]
6,60 6,2* - -
7,72 7 и9 — —
7,08 [36]
— — 10,16 10
- - 11,08 [17]
5,64 5,6
4,84
9,29 9,20
4,84 -
7,3 7,0 9,8 9,5
концентрации гидроксиль-
ных, заметного влияния кар-
бонатные ионы на флотацию
гюбнерита не оказали. В от-
личие от этого при флотации
кальцита, согласно данным
работы [5] , более заметно
падает сорбция тридецилата
в содовой среде, чем в раст-
воре едкого натра при одном
и том же pH. Это можно
объяснить большей адсорб-
цией кальцитом потенциал-
определяющих карбонатных
ионов, чем гидроксильных.
При определении адсорб-
ции карбонатных ионов каль-
цитом и флюоритом из раст-
воров соды, содержащий14 С,
установлено, что поглощение
карбонатных ионов кальци-
том заметно выше, чем флю-
оритом, и подчиняется урав-
нению типа Лэнгмюра. Для
флюорита такой закономер-
ности не наблюдается, так
как ионы карбоната не изо-
морфны ионам решетки ми-
нерала [5] . По данным
А. Бара, М. Клемента и др.
[30], при действии соды на
флюорит в случае превыше-
ния произведения раствори-
мости происходит осаждение
СаСО3. Ими показано, что
кислоты НС1 или H2SO4*
так же как щелочи NaOH
или Са(ОН)25 при одина-
ковых pH различным образом влияют на сорбцию олеата и флота-
цию флюорита. Так, например, сорбция олеата и флотируемость
флюорита в растворах НС1 выше, чем в присутствии H2SO4,
что свидетельствует о влиянии анионов добавляемых кислот
155
4мкмо/1ь/м2
11.55. Извлечение флюорита (7) и
сорбция тридецилата натрия (2)
в зависимости от pH (концентра-
ция тридецилата натрия 4,54 х
х 10-5 моль/л, расход соснового
масла 40 г/т)
£,% /^мкмоль/м2
100г 1,0
4 5 6 7 8 9 10 11 pH
11.56. Извлечение минералов олеа-
том натрия и сорбция последнего
в зависимости от pH:
1 — извлечение кальцита (70 г/т
олеата натрия) ; 2 — сорбция олеа-
та кальцитом; 3 — извлечение
шеелита (50 г/т олеата натрия);
4 — сорбция олеата шеелитом
(рис. 11.57). Было также установлено, что NaOH подавляет флотацию
флюорита только при pH > 13, а Са(ОН)2 — уже при pH > 10 явля-
ется сильным депрессором. Ион ОН- является потенциалобразующим
ионом для флюорита; в растворах щелочей, как было показано А. Ба-
ром [30] и др.,происходит реакция обмена
CaF2TB + 2ОН~ Са(ОН)2 + 2F“
Максимальное сорбированное количество ОН- на поверхности
флюорита отвечает образованию монослоя. На флотацию солеобраз-
ных минералов влияют катионы, находящиеся в объеме пульпы. Часть
из этих катионов образуется за счет растворения кристаллической ре-
шетки минералов, а также при использовании различных модифика-
торов флотации. При обогащении кальцийсодержащих минералов зна-
чительное количество ионов Са2+ переходит в раствор пульпы. При
флотации олеатом натрия П. Шульцем и др. установлено, что перехо-
дящие в раствор ионы Са2+ оказывают сильное активирующее дей-
ствие на флотацию кальцита и депрессируют апатит. Использование
цеолитов для поглощения ионов Са2+ из объема пульпы приводило
к возрастанию извлечения апатита.
При изучении Сома сандараком, Офори и др. взаимного влияния
кальцита и апатита, связанного с их растворимостью, установлено,
что при совместном присутствии их в пульпе происходит превраще-
ние поверхности одного минерала в другой. Так, при перемешивании
одного минерала в водной вытяжке другого наблюдается сдвиг изо-
электрической точки. У кальцита она перемещается в сторону апати-
та, а у апатита в сторону кальцита. Аналогичное влияние оказывают
156
11.57. Извлечение флюорита и сорбция
олеата в зависимости от pH среды [30] :
1 — извлечение в присутствии НС1; 2 —
сорбция олеата в присутствии НС1;
3 — извлечение в присутствии H2SO4;
4 — сорбция олеата в присутствии H2SO4
соли Ca(NO3)2, К2СО3 и К3РО4. Исследователи считают, что селек-
тивная флотация смеси минералов возможна при создании pH, при
котором минералы заряжены разноименно.
10.3. Действие жидкого стекла
при флотации солеобразных минералов
Жидкое стекло — наиболее широко распространенный подавитель
при обогащении солеобразных минералов и оксидов. Оно применяет-
ся как при основной флотации, так и перечистках черновых концен-
тратов. Основной флотацией с помощью жидкого стекла можно раз-
делять несульфидные минералы, резко отличающиеся по своей фло-
тируемости, например шеелит от касситерита, пироксена и граната,
флюорит от фенакита и др.
Жидкое стекло подавляет силикатную пустую породу (кварц, си-
ликаты и алюмосиликаты) при обогащении флюоритовых, карбонат-
ных, баритовых, фосфоритовых и других руд. При этом важное зна-
чение имеет также его диспергирующее действие на шламы. Приме-
нение жидкого стекла при флотации жирнокислотными собирателя-
ми позволяет разделить такие близкие по флотационным свойствам
минералы, как шеелит и кальцит, флюорит и кальцит и силикаты каль-
ция и кальцит.
Подавляющее действие силиката натрия при флотации различных
солеобразных минералов изучалось многими исследователями [22,
46, 5J и др.] . Отмечено, что подавление флотации минералов жидким
стеклом не всегда связано с вытеснением собирателя с поверхности
минералов. Так, например, если при флотации кальцита, шеелита и
флюорита в присутствии силиката натрия сорбция собирателя замет-
но уменьшается (рис. 11.58 и П.59), то при флотации барита сорбция
олеата снижается незначительно. В то же время установлена [26, 51
и др.] заметная сорбция силиката натрия минералами, возрастатаю-
щая с увеличением концентрации растворов силиката (рис. 11.60 и П.61).
При постоянном расходе собирателя минералы подавляются тем силь-
нее, чем больше плотность сорбционного слоя силиката натрия (см.
рис. П.61). Также отмечено селективное закрепление жидкого стек-
157
11.58. Извлечение кальцита (Z) и
шеелита (5) при подавлении жидким
стеклом и сорбция олеата натрия
кальцитом (2) и шеелитом (4) (рас-
ход олеата натрия 150 г/т; pH 9,2-
9,6):
11.59. Извлечение (7) флюорита и-сорб-
ция (2) тридецилата при переменных
расходах G и концентрациях С жид-
кого стекла (концентрация тридеци-
лата натрия - 4,54 • 10-5 моль/л;
расход соснового масла - 40 г/т)
ла на разделяемых минералах (кальцит и флюорит) при концентра-
циях, отвечающих флотационным.
Селективность действия жидкого стекла обусловлена также раз-
личной прочностью закрепления его на минералах. Силикат натрия
легко отмывается с поверхности флюорита (менее депрессируемого
минерала) и устойчиво закрепляется на поверхности кальцита и ба-
рита [26].
На основании выполненных исследований можно считать установ-
ленным, что подавление флотации минералов жидким стеклом глав-
ным образом обусловлено закреплением на поверхности сильно гид-
ратированных соединений силиката, заметно повышающих смачивае-
мость поверхности минералов. Это подтверждается сильным замедлени-
ем прилипания минералов, а также диспергацией минеральных сус-
пензий несульфидных минералов растворами силиката натрия [26].
При его закреплении плотность сорбционного слоя собирателя может
уменьшаться в различной степени, и в некоторых случаях оставать-
ся неизменной, а силикат натрия может сорбироваться на участках
поверхности, не занятой собирателем.
Существуют различные мнения относительно того, в какой фор-
ме жидкое стекло проявляет свое депрессирующее действие. Ряд ав-
торов полагают, что активно депрессирующей формой являются ионы
силиката натрия [26, 51 и др.]. Так, эта точка зрения подтверждает-
ся данными, приведенными в работе [26], согласно которым подав-
ление барита жидким стеклом усиливается с возрастанием pH, что
можно объяснить значительным увеличением концентрации ионов
158
11.61. Извлечение в камерный продукт
флюорита (2) и сорбция SiO2 (2)
при различных концентрациях SiO2
[15] (кривые условны, так как
опыты флотации и измерения сорбции
проводились на образцах флюорита,
имеющих различную удельную поверх-
ность)
П.60. Сорбция силиката натрия апа-
титом [15] при различной остаточной
концентрации SiO2:
1 — из водного раствора; 2 — в при-
сутствии NaOH (0,125 моль/л); 3 -
в присутствии Ма2СОз (0,048 моль/л)
HSiO3 и SiO3 в результате увеличения диссоциации кремневых кис-
лот.
Применение кислых растворов жидкого стекла (pH 1,5) в качест-
ве подавителя кальцита при доводке шеелитовых концентратов, а так-
же в ряде других случаев свидетельствует, что подавительной способ-
ностью обладает также коллоидно-дисперсная кремневая кислота.
Это также подтверждается возрастанием подавляющего действия жид-
кого стекла с повышением его модуля (т.е. увеличением содержания
кремневой кислоты).
Введение в пульпу смесей жидкого стекла с солями поливалент-
ных металлов и применение варки с жидким стеклом, способствую-
щие повышению селекции минералов, также приводит к возрастанию
концентрации кремневой кислоты в пульпе. Таким образом, молеку-
лы или коллоиды кремневой кислоты проявляют активнее депрес-
сирующее действие.
Согласно предположениям Г.С. Стрельцина, частицы силиката
помимо гидрофильности должны обладать достаточной протяженностью.
Они представляют собой ионные мицеллы, имеющие такую же или
даже несколько большую длину, чем ионы карбоксильного собирате-
ля. При закреплении на поверхности минералов они препятствуют гид-
рофо бизации поверхности собирателем, а следовательно, и соприкос-
новению пузырька воздуха с минералом, что приводит к подавлению
флотации минералов.
159
Можно полагать, что в зависимости от pH пульпы, концентрации
и модуля жидкого стекла, ионного состава пульпы, подавление ми-
нералов возможно как силикатными ионами различного состава, так
и молекулами и мицеллами кремневой кислоты.
Наряду с подавляющим действием жидкого стекла при относитель-
но высоких его концентрациях установлено, что при низких концен-
трациях жидкого стекла улучшается флотируемость жирнокислотным
собирателем некоторых несульфидных минералов — флюорита, апа-
тита, барита и др. [5, 22, 51 и др.] (см. рис. 11.51). Это явление мож-
но объяснить улучшением пенообразования в щелочной среде, созда-
ваемой жидким стеклом. Кроме того, силикат натрия способствует
диспергации неселективно сфлотированных частиц минералов, а так-
же адсорбирует присутствующие в пульпе поливалентные катионы,
которые могут активировать флотацию минералов пустой породы,
а также непроизводительно связывать в объеме раствора собиратель
в виде трудно растворимых соединений.
В ряде случаев селективное действие жидкого стекла при разде-
лении солеобразных минералов, имеющих близкие флотационные свой-
ства, благодаря общему катиону решетки минерала, удалось замет-
но повысить при использовании смесей солей поливалентных метал-
лов и жидкого стекла [5, 22] . Применение смеси солей алюминия
с жидким стеклом позволяет весьма успешно разделять флюорит и
кальцит (табл. П.9) [22].
Смеси жидкого стекла с солями алюминия использовались при
флотации чистых минералов и их смесей [51].
Отмечено избирательное подавление кальцита этой смесью при мо-
номинеральной флотации флюорита, барита и кальцита (табл. 11.10).
При определении взаимодействия собирателя и модифицирующих
реагентов с минералами установлена в присутствии соли алюминия
большая сорбция силиката натрия поверхностью кальцита, чем флюо-
рита. При обработке минералов заранее приготовленной смесью соли
алюминия и силиката натрия происходило также большее поглоще-
ние кальцитом продукта взаимодействия смеси. В присутствии моди-
фикаторов не наблюдается заметной и селективной десорбции олеа-
та с поверхности минералов [51].
Смеси солей алюминия и других поливалентных металлов с жид-
ким стеклом применяются в качестве, селективных подавителей при
отделении шеелита от кальцита и апатита. Более значительные подав-
ление и селективность действия отмечены при использовании смесей
солей алюминия, магния, меди и железа с силикатом натрия (по срав-
нению с использованием одного силиката натрия) при флотации флюо-
рита, кальцита, шеелита, апатита. М. Карта, Чиани и др. показано, что
соли Cr2 (SO4)3 пН2О и ZnSO4-7H2O в присутствии жидкого стек-
ла влияют на флотацию различных минералов, включая синтетичес-
кие и природные смеси кальцита с флюоритом.
160
Таблица II.9
Результаты разделения кальцито-флюоритовых руд
с применением в качестве подавителя жидкого стекла
и солей алюминия (без обработки промежуточного продукта)
Исходная руда Содержа- ние CaF2 в концен- трате, % Извлече- ние CaF,, % Исследователь
Содержание, % Соотноше- ние
CaFj СаСО3 CaF-,/ СаСО3
57,8 7,1 8,2 95,1 81,7 Мокроусов
49,7 8,8 5,7 96,8 75,4
32,1 5,7 5,6 96,6 83,5 Князева
26,1 19,0 1,4 95,8 68,8 Лебедев
47,9 39,9 1,2 98,2 66,8 Мокроусов
37,8 49,4 0,8 95,6 — Лебедев
Таблица II. 10
Влияние азотнокислого алюминия
и жидкого стекла (2:1) на флотацию минералов
(крупностью -0,15 + 0,06 мм) олеиновой кислотой
Расход смеси азотно- кислого алюминия и силиката натрия (2:1) (вводятся раздельно) Извлечение минералов, %
Флюорит (30 г/т олеиновой кислоты'! Кальцит (30 г/т олеиновой кислоты) Барит (55 г/т олеи- новой КИСЛОТЬ})
0 93,0 80,4 50,5
50 97,7 19,5 —
100 86,3 0 35,0
250 64,0 0 76,9
1000 0 0 86,8
Таким образом, можно ожидать, что если в начале процесса обогаще-
ния происходит флотация сульфидов, то во флотационной пульпе бу-
дут находиться поливалентные ионы как за счет вводимых реагентов-
модификаторов сульфидных руд - сульфатов меди и цинка, так и об-
разующиеся при растворении присутствующих в рудах оксидов, кар-
бонатов, сульфатов тяжелых металлов. Эти ионы способны взимодей-
ствовать с жидким стеклом, изменяя его свойства при последующем
обогащении несульфидных минералов.
В рудах щелочноземельных металлов обычно присутствуют кар-
бонаты, сульфаты или оксиды, характеризующиеся также относитель-
11.62. Извлечение барита, сорбция ионов кальция, олеата и SiO2 при pH 10 (концент-
рация олеата 1,7 • 10-4 моль/л, кальция при активации - 3,38 • 10~3 моль/л):
1 и 1 — извлечение барита; 2 и 2 - сорбция олеата; 3 и З' — то же, SiO2; 4 — раз-
ница сорбции SiO2 и ионов кальция; I — без активации кальцием; II — в присутст-
вии ионов кальция
но большой растворимостью. Катионы, переходящие в пульпу при раст-
ворении этих минералов, обусловливают значительную жесткость воды
и могут также существенно влиять на регулирующее действие жид-
кого стекла. Например, в присутствии ионов кальция сорбция жид-
кого стекла баритом заметно возрастает (рис. 11.62) [22] . Так как
сорбция SiO2 оказалась близка к сорбции кальция баритом, то бы-
ло предположено, что образуются ассоциаты кальция и силиката в со-
отношении 1:1, закрепляющиеся на поверхности минерала. Выделяю-
щиеся силикаты кальция — более сильные подавители, чем жидкое
стекло, так как расход жидкого стекла, необходимый для подавле-
ния в жесткой воде, уменьшается и флотация барита подавляется при
меньшей сорбции реагента. (Следует также иметь в виду, что в жест-
кой воде сорбция олеата минералами возрастает и в присутствии по-
давителя заметно не уменьшается).
Отделение шеелита от кальцита и флюорита (близких по флото-
активности минералов) при флотации жирнокислотными собирате-
лями в присутствии жидкого стекла происходит недостаточно эффек-
тивно. Избирательность действия жидкого стекла на разделение мине-
ралов повышается, как было установлено Н.С. Петровым в процессе
обработки черновых шеелитовых концентратов 3—4 %-ным раство-
ром жидкого стекла в плотной пульпе при подогреве до 80—85 С. Пос-
ле такой обработки шеелит переходит в концентрат, а кальцит оста-
ется в камерном продукте.
Для успешного разделения минералов в процессе доводки необ-
162
Таблица II. 11
Десорбция собирателя с поверхности шеелита
и кальцита в процессе варки с жидким стеклом
Минерал Извлече- ние в концен- трат, % Количество олеа- та на минерале Десорбция олеата Примечание
мг % мг %
Кальцит 91,91 2,594 100 — — Основная флотация
3,13 0,134 5,2 2,460 94,8 Основная флотация и доводка
Шеелит 95,92 1,974 100 — Основная флотация
72,45 0,551 27,9 1,419 72,1 Основная флотация и доводка
68,01 0,407 20,6 1,563 79,4 То же
ходима надлежащая депрессия их жидким стеклом еще в стадии ос-
новной флотации [46] . Недостаток жидкого стекла при основной фло-
тации приводит к нарушению селективности при доводке.
Для достаточно полного извлечения шеелита из руд необходим боль-
шой расход собирателя, что обусловливает высокое содержание олеи-
новой кислоты на черновом концентрате. На фабричных концентра-
тах содержится до 3 кг/т олеиновой кислоты [46]. С.Д. Суховоль-
ская и Н.А. Янис определили, что только после удаления по способу
Н.С. Петрова избытка собирателя в стадии доводки проявляются свой-
ственные минералам различия, способствующие их последующей се-
лекции. Так, В.И. Коваленко и др. определили, что после перемеши-
вания с реагентом в процессе доводки сорбция силиката натрия на
кальците в 1,3-1,5 выше, чем на шеелите.
Ионы олеата десорбируются с поверхности минералов при пропар-
ке в результате обмена их с силикатными и отслаивания пленок
олеата, благодаря разрушению полимолекулярных слоев, образую-
щихся особенно на кальците. На основании экспериментальных дан-
ных подсчитана десорбция олеата с поверхности шеелита и кальцита
при варке в процессе доводки черновых концентратов (табл. 11.11).
Как следует из приведенных данных, в процессе варки с поверх-
ности кальцита десорбируется 95 % собирателя, а с поверхности ше-
елита - 72-79 %. Так как, по данным В.И. Коваленко, сорбция жид-
кого стекла кальцитом значительно больше, чем шеелитом, то в ре-
зультате доводки шеелит сохраняет свою флотируемость, а кальцит
депрессируется.
В процессе варки, согласно большинству исследователей, сорбция
жидкого стекла кальцитом не возрастает, тогда как В.И. Коваленко
163
11.63. Извлечение кальцита олеатом натрия
и сорбция олеата в присутствии жидкого
стекла с добавками и без добавок соды
(расход олеата натрия - 120 г/т) [5]
1 — извлечение без добавок соды; 2 —
сорбция олеата без добавок соды; 3 —
извлечение с 500 г/т соды; 4 — сорб-
ция олеата с 500 г/т воды
нашел, что при доводке десорбция собирателя сопровождается допол-
нительной адсорбцией депрессора. Видимо, выяснение этого вопроса
требует проведения дальнейших исследований.
Метод, предложенный Н.С. Петровым, был использован также
В.И. Классеном и Л.Д. Ратобыльской для разделения коллективно-
го концентрата на кальцитовый концентрат и кальцийсодержащий си-
ликат. После варки чернового концентрата при перечистке в пенный
продукт переходит кальцит, а силикат остается в камерном продукте.
Совместное действие жидкого стекла и соды, или жидкого стек-
ла и едкого натра при флотации солеобразных минералов. Кальцит
и флюорит способны сорбировать карбонатные ионы из содовых раст-
воров [5] . В присутствии растворов силиката натрия сорбция их ми-
нералами уменьшается. Сорбция силиката поверхностью кальцита,
флюорита и апатита также уменьшается при добавках едкого натра
и особенно соды.
Таким образом, наблюдается взаимное вытеснение силикатных
и карбонатных ионов, сорбируемых кальциевыми минералами, при-
чем вытесняющая способность карбонатных ионов сильнее, чем си-
ликатных.
Активирующее действие щелочей на флотацию кальцита олеа-
том в присутствии жидкого стекла показано на рис. И.63. Согласно
полученным результатам, в присутствии соды десорбирующее дей-
ствие жидкого стекла заметно уменьшается, причем сорбция собира-
теля несколько увеличивается. Замена соды едким натром снижает
результаты флотации, что соответствует большему падению сорбции
силиката в содовых растворах, чем в растворах едкого натра. Заме-
щение силикатных ионов менее гидратированными карбонатными
или гидроксильными, а также большая сорбция собирателя в этих ус-
ловиях улучшают флотируемость минералов.
Полученные экспериментальные данные свидетельствуют о том,
что флотируемость несульфидных минералов определяется как плот-
164
ностью сорбционного слоя собирателя, так и плотностью сорбционно-
го слоя модификаторов, причем подавляющее действие модифика-
торов зависит от их свойств. На основании приведенных данных мож-
но считать установленным, что кроме широко известных свойств
(диспергатора, депрессора, реагента, осаждающего катионы пульпы,
и др.) сода обладает еще одной особенностью — она ослабляет или ус-
траняет депрессирующее действие жидкого стекла на кальциевые ми-
нералы.
10.4. Депрессирующее действие хроматов, фосфатов
и фторидов
Обычно хроматы применяются в качестве селективного подави-
теля барита. Они используются как индивидуально, так и в смеси с
органическими коллоидами. Согласно представлениям А. Юветта, а
также М.А. Эйгелеса, ионы СгО^-- образуют на поверхности барита
труднорастворимый хромат бария, вследствие чего адсорбция жирно-
кислотного собирателя уменьшается. Бихромат калия - более сла-
бый подавитель барита, чем хромат, но сильнее депрессирует каль-
цит. Под действием бихромата теплота смачивания поверхности ми-
нералов водой увеличивается [51].
В качестве подавителей карбонатных минералов применяются фос-
фаты и полифосфаты. Депрессирующее действие динатрийфосфата
на флотацию кальцита слабое, а соли пирофосфорной кислоты замет-
но подавляют кальцит и апатит. Сильное депрессирующее действие
при флотации несульфидных минералов жирными кислотами оказы-
вает гексаметафосфат. Так, например, он применяется при селектив-
ной флотации бокситовых и хромитовых руд.
Высказано предположение, что фосфаты и полифосфаты сорби-
руются во вторичной обкладке двойного электрического слоя мине-
ралов, значительно увеличивая отрицательный заряд поверхности, что
обусловливает понижение адсорбции собирателя. Депрессирующее
действие полифосфатов в процессе разделения магнезита и доломи-
та объясняется селективной адсорбцией полифосфатов поверхностью
доломита, что ухудшает адсорбцию жирнокислотного собирателя. Дис-
пергация шламов доломита с поверхности магнезита под действием
модификаторов также способствует селекции.
Чанжен-Ли и Юнгхин-Лю при изучении механизма действия гек-
саметофосфата и пирофосфата на кальцит, флюорит и шеелит уста-
новили, что депрессирующее действие фосфатов связано не с адсорб-
циеи их минералами, а растворением поверхностных ионов Са ре-
шетки минералов с образованием растворимых комплексов, пере-
ходящих в раствор. При этом ионы кальция легче выщелачиваются
с поверхности кальцита и флюорита, чем шеелита, и гексаметофосфат
сильнее растворяет, чем пирофосфат. В результате выщелачивания
165
ионов кальция увеличивается отрицательный дзета-потенциал поверх-
ности минералов и уменьшается сорбция олеата. В связи с более проч-
ным закреплением ионов Са2+ в решетке шеелита его флотируемость
не изменяется.
По данным М.А. Эйгелеса, добавка фтористого натрия при фло-
тации флюорита и барита олеиновой кислотой активирует флюорит
и практически не влияет на барит. Фтористый натрий подавляет фло-
тацию апатита и силикатов.
10.5. Действие органических подавителей
При флотации жирнокислотными собирателями крахмал исполь-
зуется для разделения кальцита, флюорита и барита, причем он подав-
ляет флотацию кальцита и барита и активирует или не ухудшает фло-
тацию флюорита. Крахмал также применяется для подавления и фло-
куляции карбонатных минералов и в связи с этим используется при
селективной флотации апатита. Применение смеси реагентов, содер-
жащей оксиэтилированные карбоновые кислоты фракции С17-С20
(250 г/т), крахмал (500 г/т), жидкое стекло (400 г/т) и кальцини-
рованную соду (500 г/т), позволило Г.А. Голованову увеличить сте-
пень гидрофилизации поверхности кальцита, форстерита и слюды и
более избирательно флотировать апатит. Автор полагает, что окси-
этилированные соединения образуют комплексы с высокомолеку-
лярными соединениями типа крахмала, которые заметно сорбиру-
ются и гидрофилизируют поверхность подавляемых минералов.
Сорбция крахмала солеобразными минералами изучалась в ряде
работ. На рис. 11.64 показана флотируемость кальцита, барита и флюо-
рита и сорбция ими крахмала (данные Язона и Г. Шефера). Согласно
этим данным, подавление минералов модификатором изменяется в
соответствии с сорбцией крахмала, за исключением флюорита, кото-
рый сохраняет высокую флотируемость олеатом натрия при значи-
тельной сорбции крахмала.
Исследования Н.С. Михайловой и др. сорбции крахмала флюори-
том, кальцитом и апатитом показали, что при естественном pH крах-
11.64. Зависимость между сорбцией крах-
мала на минералах и его депрессирующим
действием при флотации олеиновой кисло-
той:
1, 2, 3 — извлечение соответственно каль-
цита, барита и флюорита; 4, 5, 6 — сорб-
ция соответственно кальцитом, баритом и
флюоритом (Сисх — исходная концентра-
ция крахмала)
166
мал в большей степени сорбируется на кальците и в меньшей — на апа-
тите и флюорите. При этом кальцит в изученной области концентра-
ций поглощает почти 100 % загруженного крахмала, а флюорит и апа-
тит — от 80 до 40—50 % при изменении расхода от 25 до 200 г/т. Так
как для успешной флотации кальцита требуется более значительный
расход карбоксильного собирателя, чем для флюорита, то разделение
смеси флюорита с кальцитом с помощью крахмала — весьма простой
случай по сравнению с селекцией смеси кальцита с апатитом, имею-
щих близкую флотируемость.
Крахмал относительно прочно закрепляется на поверхности ми-
нералов и при отработке водой с поверхности кальцита и флюорита
отмывается не больше 15—20 %. Сорбция крахмала кальцитом, флюо-
ритом и апатитом резко изменяется с изменением pH пульпы и уве-
личением щелочности падает. Количество крахмала, закрепляющего-
ся на кальците,зависит также от концентрации в пульпе ионов Са ,
СаОН , СаНСО3, СО2 , НСО~ и заряде поверхности кальцита.
Результаты исследования взаимного влияния крахмала и олеата
натрия на сорбцию их минералами противоречивы. Согласно экспе-
риментальным данным, сорбция олеата кальцитом и апатитом в при-
сутствии крахмала уменьшалась, а на флюорите оставалась без изме-
нения. Присутствие олеата не влияло на сорбцию крахмала кальци-
том. В отличие от этих данных М.Фюрстенау установлено увеличе-
ние сорбции олеата кальцитом при добавках крахмала, а также воз-
растание сорбции крахмала кальцитом в присутствии олеата.
Предложен ряд гипотез для объяснения механизма действия крах-
мала при флотации минералов. Большая часть авторов (Ю.Н. Бемил-
лер, Н.К. Хозла, Н.С. Михайлова и др.) считает, что происходит спе-
цифическое химическое взаимодействие между крахмалом и поверх-
ностными ионами Са, Ba, Fe на минералах с образованием труднораст-
воримых комплексов, гидрофилизирующих поверхность. Это подт-
верждается данными ИК-спектроскопии и кондуктометрии, а также
установленным уменьшением адсорбции крахмала кальцитом с рос-
том pH, при котором уменьшается поверхностная концентрация по-
ложительных ионов Са2^, СаОН+ и СаНСО*. Это явление связы-
вается также с возможностью электростатического взаимодействия
отрицательно заряженных частиц крахмала с положительно заряжен-
ными поверхностями минералов. Подтверждением этому служит пе-
резарядка частиц кальцита, барита, флюорита в растворах крахмала.
X. Ханна взаимодействие крахмала с минералами объясняет обра-
зованием водородных связей, чем и определяется большая адсорб-
ция крахмала флюоритом по сравнению с кальцитом. Согласно дан-
ным М. Фюрстенау, такая адсорбция должна играть относительно нез-
начительную роль. На основании установленного активирующего влия-
ния крахмала и олеата на сорбцию друг друга высказано предполо-
жение относительно возможной соадсорбции между адсорбирован-
167
ным крахмалом и ионами олеата, в которых олеат находится внут-
ри спиралеобразных молекул крахмала. Спирали клатратов изнутри
гидрофобии, а снаружи гидрофильны, благодаря чему поверхность
минералов сохраняет гидрофильность даже при увеличении сорбции
собирателя в присутствии крахмала. Однако подобная интерпретация
полученных результатов кажется маловероятной.
Декстрин обладает более слабым депрессирующим действием по
сравнению с крахмалом. В щелочной среде разделение барита и флюо-
рита при флотации олеиновой кислотой в присутствии декстрина уси-
ливается. Этому соответствует заметное уменьшение сорбции олеата
баритом при наличии декстрина и отсутствие влияния на сорбцию олеа-
та флюоритом. Закрепление Декстрина баритом заметно больше, чем
флюоритом. В присутствии олеиновой кислоты сорбция декстрина
минералами уменьшается [51].
Таннин и танниды предложены в качестве подавителей барита и
кальцита. Таннин и квебрахо используются также для подавления дру-
гих карбонатных минералов. Флотируемость солеобразных минера-
лов и изменение сорбции таннина их поверхностью при различных рас-
ходах модификаторов приводится на рис. 11.65. Действие таннина впол-
не аналогично действию крахмала (см. рис. 11.64).
Предполагается, что механизм взаимодействия таннина с минера-
лами аналогичен предложенному для крахмала, при этом возможна
11.65. Зависимость между сорбцией таннина на минералах и депрессирующим
действием при флотации олеиновой кислотой (Сисх — исходная концентрация
таннина) (по данным Н.Ю. Шульца и Х.С. Хинина) :
1, 2, 3 — извлечение соответственно кальцита, барита и флюорита; 4, 5, 6 — сорб-
ция таннина соответственно кальцитом, баритом и флюоритом
168
как электростатическая адсорбция таннина, так и закрепление его за
счет образования водородной связи, а также комплексных ионов (тан-
натов щелочноземельных металлов) или таннин-олеат-клатратов.
В отличие от крахмала и таннина депрессирующее действие квеб-
рахо на кальцит Ж. Искра, С. Гутерис объясняют понижением сорб-
ции олеата и сильным гидрофилизирующим действием полифенольных
групп молекул квебрахо.
11. ВЗАИМОДЕЙСТВИЕ АЛКИЛСУЛЬФАТОВ
И АЛКИЛСУЛЬФОНАТОВ С МИНЕРАЛАМИ
11.1. Взаимодействие с оксидами и силикатами
При исследовании адсорбции алкилсульфатов и алкилсульфонатов
различными силикатами и оксидами во многих случаях установлен
электростатический характер взаимодействия этих собирателей с ми-
нералами [5, 55, 67] . Подтверждением данному факту является вы-
сокая флотационная активность указанных собирателей при таких
pH, когда поверхность минералов заряжена положительно (в облас-
ти pH ниже точки нулевого заряда) [67] . Так, например, флотация
берилла, граната и других минералов додецилсульфатом (по данном
Каза) происходила при pH, когда поверхность минералов имела поло-
жительный заряд. То же наблюдалось при флотации гематита, сфена,
пирохлора и циркона додецилсульфатом (по данным Ю. Ивасаки и
С.И. Полькина). Оптимум флотации ильменита, перовскита, ставро-
лита наблюдается также в кислой области (рис. 11.66).
В ряде случаев, однако, происходит не только кулоновское взаи-
модействие алкилсульфатов и алкилсульфонатов с минералами, но
также и специфическая адсорбция их в слое Штерна. Типичным при-
мером этому могут служить установленные в работе [67] зависимости
адсорбции додецилсульфоната корундом и изменение дзета-потенциа-
ла на его поверхности от концентрации собирателя (рис. П.67). Ав-
торы работы полагают, что на участке I кривой сорбции 1 происхо-
дит адсорбция индивидуальных анионов сульфоната (как противои-
онов) за счет притяжения положительно заряженной поверхностью
корунда. Подобная адсорбция происходит при концентрациях соби-
рателя меньших, чем 5 • 10“5 моль/л, она всецело определяется за-
рядом поверхности и выражается уравнением (1.32). Резкое увели-
чение адсорбции додецилсульфоната на участке //кривой адсорбции
объясняется как электростатическим взаимодействием, так и специ-
фической адсорбцией с образованием двумерных мицелл, так назы-
ваемых хемимицелл. Адсорбция сопровождается перезарядкой поверх-
ности минерала, как это видно на кривой 2, при концентрации 3-10~4
моль/л. В этом случае адсорбция ионов собирателя определяется за-
169
11.66. Извлечение минералов алкил-
сульфатом натрия при различных
pH (по данным С.И. Полькина и
ДР-):
1 — ильменит; 2 — перовскит;
3 — ставролит; 4 — эгирин — авгит
11.67. Зависимость адсорбции Г (7)
собирателя и дзета-потенциала (2)
корунда в зависимости от равно-
весной концентрации ^павн Д°Де’
цилсульфоната натрия (pH 7,2; ион-
ная сила 2 . 10“3 моль/л) [6]
рядом поверхности и специфическим адсорбционным потенциалом,
рассчитывается по уравнению (1.33). Участок Шна. кривой характе-
ризует адсорбцию в результате взаимодействия углеводородных ра-
дикалов, адсорбированных частиц на поверхности минерала.
При образовании хемимицелл сульфонатных ионов в слое Штер-
на вторичной обкладки двойного электрического слоя поверхности
корунда по расчетам [67] концентрация адсорбированных анионов
в 100—200 раз выше, чем в объеме раствора. При адсорбции соби-
рателя, равной 0,1 монослоя, адсорбционный потенциал составляет
примерно 2,8 кДж, а в случае монослойного покрытия — примерно
28 кДж. Высшие алкилсульфонаты и алкилсульфаты такие как, нап-
ример, октадецилсульфат, проявляют собирательное действие и в слу-
чае отрицательно заряженной поверхности. Это явление объясняется
специфической адсорбцией их с образованием хемимицелл.
Другой механизм взаимодействия предложен М. Фюрстенау и
Б. Пальмер [55] при флотации алкилсульфонатом таких силикатов^
как кварц, полевой шпат и др. Если неактивированный кварц извле-
кается в пену при pH < 1,8 за счет электростатической адсорбции со-
бирателя, то для его флотации при pH > 1,8 необходима активация
катионами металлов, на которых происходит хемосорбция ионов ал-
килсульфата. Согласно этой гипотезе, адсорбция катионов происхо-
дит в виде первичных гидроксокомплексов. На рис. 11.68 приводят-
ся данные, иллюстрирующие области флотации кварца в растворе
170
11.68. Извлечение кварца при различ-
ных pH в присутствии сульфоната
(1 • 10-4 моль/л) и соли металла
(1 • 10-4 моль/л) [55]
1 • 10~4 моль/л сульфоната при различном pH в присутствии 1 • 10~4
моль/л соли металла [55] . В верхней части рис. 11.68 показаны диа-
пазоны pH образования первичных гидроксокомплексов металлов,
совпадение которых с оптимумом флотации может служить извест-
ным подтверждением предложенной гипотезы.
11.2. Взаимодействие с солеобразными минералами
Значительная часть исследователей рассматривает взаимодействие
алкилсульфатов и алкилсульфонатов с солеобразными минералами
как хемосорбцию с катионами минерала, находящимися в слое Штер-
на. Так, например, химическое взаимодействие додецил сульфата с
флюоритом и баритом было установлено Н. Шергольдом и В. Гуммин-
гом. Значительная сорбция цетилсульфата баритом, кальцитом и до-
ломитом наблюдалась в широком диапазоне pH, включая сильноще-
лочную область, когда поверхность минералов имела отрицательный
заряд.
По данным Р. Новак, Ю. Строек и др.,хемосорбция додецилбен —
зилсульфоната натрия и додецилсульфоната кальцитом и осадками
СаСО3 и Са3(РО4)2 происходит до образования монослоя и сопро-
вождается успешной флотацией.
При изучении ИК-спектров кальцита, обработанного алкилбен-
зилсульфонатом> и флюорита, обработанного додецилсульфатом, наб-
людалось образование на поверхности минералов алкилсульфонатов
и сульфатов кальция [65] , что может служить доказательством хе-
мосор бцио иного механизма. Хемосорбция указанных собирателей
и их флотационная а'ктивность‘возрастают с увеличением длины уг-
леводородного радикала.
Наряду с этим некоторые исследователи (Б. Добиаш, X. Чай, Ф. Са-
леб и др.), изучая сорбцию алкилсульфатов и сульфонатов апатитом,
шеелитом, флюоритом, которая происходит лишь при положительном
заряде поверхности, рассматривают ее как результат действия куло-
новских сил.
171
Таким образом, на основании анализа имеющихся представлений
о механизме действия алкилсульфатов и сульфонатов на солеобраз-
ные минералы, видимо, следует допустить как электростатическое
взаимодействие этих реагентов в кислой области (ниже ТНЗ мине-
ралов), так и химическое - при высоких pH и больших расходах со-
бирателей, особенно при использовании высших гомологов.
12. ВЗАИМОДЕЙСТВИЕ АЛКИЛГИДРОКСАМОВЫХ КИСЛОТ
С МИНЕРАЛАМИ
12.1. Сорбция алкилгидроксамовых кислот
минералами
В связи с успешным применением гидроксамовых кислот при обо-
гащении руд редких металлов (редкоземельных, вольфрамитовых и
касситеритовых), окисленных медных, оксидов железа и др. изуча-
лось взаимодействие солей гидроксамовых кислот с ценными минера-
лами и минералами пустой породы, встречающимися в таких рудах
(табл. 11.42).
Гидроксамовые кислоты являются Д^алкилпроизводными гидро-
ксиламина. Комплексообразующие свойства этих собирателей опре-
деляются наличием в их функциональной группировке двух донор-
ных атомов азота и кислорода, которые обусловливают образование
хелатных циклов с катионами решетки минерала. Ниже приводится
структура I молекулярной формы гидроксамовой кислоты и струк-
тура II металлгидроксамата, образующегося при хемосорбционном
взаимодействии с катионами решетки минерала:
NH-C-R NH-C-R
н‘о (5 6
Me
I II
Гидроксаматные комплексы с различными металлами сильно раз-
личаются по прочности. Наименее прочные комплексы образуются с
катионами щелочноземельных металлов Са2+, Ва2+ и др. У переход-
ных элементов Ti, V, Мп, Zn, Nb, Hf, Та и др, прочность комплексов
увеличивается. Весьма прочные комплексы образуются с редкоземель-
ными элементами и алюминием как высокозарядными катионами
и очень прочные комплексы с Fe3+. Хотя отсутствуют сведения по
комплексообразованию гидроксамовых кислот с Ni5+, Та5 + , Sn4 + ,
можно полагать, что с ними образуются комплексы, которые по проч-
ности не уступают комплексам с Fe3 + . Так, например, константы об-
разования 0g К^) ацетгидроксаматов изменяются следующим об-
172
Таблица И. 12
Применение гидроксамовых собирателей
при флотации различных минералов
(по исследованиям советских и зарубежных авторов) [56]
Минерал Реагент Метод иссле- дования Оптимальный pH флотации сорбции
Гематит Fe2O3 Октилгидроксамат калия флотация Адсорбция 9,0 8,5
Родонит Мп, Fe= Cu SiO3 То же Флотация 9,0
Хризоколла Cu SiO3 2Н2О 6,0
Малахит Си2СО3 (ОН) 2 - - Адсорбция 6-10 плато, 9,5 9,0
Хризоколла Малахит Азурит С6-Сд гидроксаматы Флотация 7,5-8
Пирохлор NaCaNb(CO3)6 ИМ-50 (С7-С9 гидрокса- маты) 6,0
Флюорит CaF2 ИМ-50 Адсорбция 8,5 8,5
Гюбнерит MnWO4 ИМ-50 Флотация Адсорбция 9,0 9,0
Барит BaSO4 Октилгидроксамат калия Флотация Адсорбция 9,5 9,0
Кальцит СаСО3 То же Флотация Адсорбция 9,5 9,5
Бастнезит (Се, La) FCO3 Флотация Адсорбция 5-9 плато 8,5
Кварц Si09 Микроклин К (AlSi3O 8^ Флотация 1,5
Окисленная Zn-Pb руда С6-С8 гидроксаматы -
173
разом: Са2 + - 2,4; Мп2 + - 4; Fe2+ - 4,80; Со2+ - 5,1; Ni2+ - 5,3;
Pb2+ - 6,70; Си2+ - 7,9; La - 5,16; Се3+ - 5,45; А13+ - 7,95; Fe3+ -
11,42 (данные Ц. Шварценбаха и К. Шварценбаха).
Так как гидроксамовые кислоты образуют прочные комплексы
со многими полезными окисленными минералами, а с щелочными
и щелочноземельными минералами пустой породы образуют хела-
ты с низкими константами устойчивости, то при использовании гид-
роксамовых кислот достигаются большие селективность и собиратель-
ное действие, чем при применении жирных кислот.
ИК-спектры минералов, обработанные гидроксаматами, показы-
вают, что гидроксаматы хемосорбируются поверхностью минералов
с образованием соответствующих металлгидроксаматов. Так, на по-
верхностях редкоземельных минералов — иттросинхизите и монаци-
те - образуются гидроксаматы редкоземельных металлов [17] ; на
кальците и флюорите - гидроксаматы кальция [56] , на оксидах же-
леза - тригидроксамат железа. На медных минералах, например, хри-
зоколле зафиксирован гидроксамат меди [57]. На поверхности тур-
малина и касситерита гидроксамовая кислота закрепляется также хе-
мосорбционно при образовании комплексов с катионами решетки.
Хемосорбционный характер закрепления гидроксаматов подтверж-
дается сдвигом изо-электрической точки минералов. Наблюдающееся
возрастание адсорбции гидроксаматов минералами с увеличением тем-
пературы и флотации минералов также типичны для всех хемосорби-
рующихся собирателей. Предложены два механизма адсорбции гид-
роксаматов минералами [56] : 1) хемосорбция при образовании ко-
валентной связи с катионами металла, находящегося в кристалличес-
кой решетке минералов; 2) поверхностная реакция с катионами: а) на-
ходящимися в двойном электрическом слое вне решетки минерала
(в плоскости Штерна), ограничивающаяся монослоем; б) обменная
поверхностная реакция собирателя с образовавшимися гидроксоком-
плексами металлов в двойном электрическом слое минерала. При этом
возможно образование полислоев продуктов реакции за счет водо-
родной связи или взаимодействия углеводородных радикалов.
Исследованиями Н.Е. Щукиной установлено, что сорбция пелар-
гонгидроксамата калия (ПГК) иттросинхизитом Са [Се, Y, La] (СО3)2 F
(являющимся одним из основных редкоземельных минералов неко-
торых месторождений) и кальцитом (основного минерала породы)
при флотационных концентрациях сравнима, что не позволяет осу-
ществить их разделение без применения модификаторов. Характер
же сорбции этими минералами заметно отличается. Так, на иттросин-
хизите сорбция стремится к насыщению, а на кальците она возраста-
ет пропорционально концентрации, что объясняется в этом случае воз-
можностью протекация гетерогенной реакции и закреплением обра-
зующихся в растворе осадков гидроксаматов кальция.
При десорбции собирателя водой путем 10—20-кратного разбав-
174
ления равновесного раствора с поверхности иттросинхизита. Проч-
ность закрепления пеларгонгидроксамата на минералах определяет-
ся Н.Е. Щукиной методом конкурирующего комплексообразования
с олеатом натрия путем вытеснения гидроксамата пятимолярным из-
бытком олеиновой кислоты (по сравнению с закрепленным количест-
вом ПГК). Десорбция ПГК под действием олеиновой кислоты с по-
верхности иттросинхизита не превышает 10—13 %, а с поверхности
кальцита достигает 58 %. Эти опыты свидетельствуют также о менее
прочном закреплении собирателя кальцитом.
При успешной флотации гюбнерита и флюорита, являющегося ши-
роко распространенным минералом породы, сорбция собирателя сос-
тавляет 20—30 % условного монослоя [23]. В отличие от действия
жирнокислотного собирателя сорбция ПГК (пеларгонгидроксамовой
кислоты) поверхностью гюбнерита не достигает равновесного состоя-
ния даже за 1 ч перемешивания. Закрепление ПГК на указанных ми-
нералах также менее прочное, чем жирнокислотного собирателя. При
десорбции водой при pH 7 с поверхности флюорита удаляется пример-
но 90 %, а с поверхности гюбнерита примерно 65 % сорбированного
реагента. Эта разница в прочности сорбции собирателя, вероятно, объяс-
няется большей растворимостью гидроксаматов кальция и железа,
образующихся на поверхности минералов, по сравнению с их олеата-
ми [23 и др.].
При использовании ПГК в качестве собирателя’ установлена близ-
кая флотируемость природного касситерита, касситерита ’’обезжелез-
ненного” (обработка 10 %-ной горячей соляной кислоты) и турмали-
на, особенно при невысоких расходах собирателя. В этих условиях
сорбция собирателя минералами заметно отличается. Присутствие гид-
рофильных пленок гидроксида железа на природном касситерите, ви-
димо, является причиной меньшего извлечения минерала по сравне-
нию с ’’обезжелезненным” касситеритом при большей сорбции на нем
собирателя. Полученные результаты свидетельствуют о невозмож-
ности разделения касситерита и турмалина в отсутствии модифика-
торов.
12.2. Действие модификаторов при флотации минералов
гидр окса матами
Действие регуляторов pH пульпы. При флотации ПГК иттросин-
хизита и кальцита максимальная флотация минералов и сорбция со-
бирателя происходят при pH 9—10 [17]. Оптимумы сорбции и фло-
тации флюорита и гюбнерита ПГК совпадают и наблюдаются при pH
8—9 [23]. При понижении pH пульпы разница во флотируемости и
сорбции собирателя минералами увеличивается (рис. 11.69) и в силь-
нокислой области возможно их разделение. Это объясняется тем, что
в кислой среде на поверхности флюорита не образуется гидроксамат
175
a б в
П.69. Извлечение минералов и сорбция
собирателя при переменном расходе пе-
ларгонгидроксамата калия и различных
pH:
а— в — pH соответственно 2,5; 5, 7: 1, 2 —
извлечение побнерита и флюорита; 3, 4 —
сорбция пеларгонгидроксамата калия гюб-
неритом и флюоритом [23]
11.70. Извлечение хризоколлы при раз-
личном pH:
1 — концентрация гидроксамата 0,33 х
х 10~4 моль/л; 23 °C; 2 — то же, 5 х
х 10-5 моль/л, 49 °C, 3 — то же, 5 х
10~5 моль/л; 22 °C [57]
кальция, который по данным ИК-спектроскопии осаждается в объе-
ме при pH > 7. флотация гюбнерита в сильнокислой области, наобо-
рот, возможна в результате образования поверхностного гидрокса-
мата железа, или комплекса с вольфрамом, являющихся устойчивы-
ми соединениями в кислой среде. Согласно расчетам (см. табл. II.9), об-
разование на гюбнерите гйдроксамата марганца маловероятно.
Влияние pH пульпы и температуры на флотацию хризоколлы ок-
тилгидроксаматом изучалось в работе [57]. Как можно видеть на рис.
11.70 оптимум флотации наблюдался при pH около 6.
Согласно гипотезе Д. Фюрстенау, оптимальные pH при флотации
минералов и адсорбции собирателей определяются pH гидролиза ка-
тионов решетки минерала и ионизации собирателя [56]. В соответ-
ствии с этим успешная флотация хризоколлы происходила при pH
6, отвечающем образованию в заметных количествах ионов СиОН+
Сорбция ионов меди поверхностью хризоколлы подтверждалась сме-
176
щением ТНЗ минерала от pH 2 (в отсутствии соли меди) до pH 6,7
в растворе при концентрации 1 • 10—4 моль/л меди. На поверхности
минерала была также установлена полислойная адсорбция гидрокса-
матов меди.
Другой пример, подтверждающий предложенный механизм,— фло-
тация бастнезита и адсорбция гидроксаматов его поверхностью. Ос-
новными катионами, входящими в состав бастнезита, являются La
и Се. Эти катионы сильно гидролизуются в водных растворах. Сог-
ласно расчетам, при pH от 5 до 9 в растворе преобладают ионы типа
Me3, Me (ОН) j+ и Ме(ОН)2, взаимодействие которых с гидроксама-
том может обусловливать оптимальную флотацию минерала и сорб-
цию собирателя в указанных пределах pH (см. табл. 11.12).
Однако предложенный механизм взаимодействия собирателей с
минералами не является универсальным. Так, например, оптималь-
ная флотируемость минералов, содержащих ионы кальция, при pH 9
не соответствует pH образования гидроксокомплексов кальция, про-
исходящих при pH 13.
Поскольку в поверхностном слое касситерита в рудах обычно при-
сутствуют катионы железа, представляло интерес определить степень
вклада олова и железа при образовании соответствующих гидрокса-
матов в поверхности. Согласно измерениям сорбции ПГК природным
касситеритом и обезжелезненным касситеритом, оптимум сорбции
природным образцом отвечает pH 5,5, а обезжелезненным — pH 7.
По расчетам [40] оптимум сорбции гидроксамовой кислоты касси-
теритом за счет взаимодействия с поверхностными атомами олова
отвечает pH 7,02, а с поверхностными атомами железа — pH 5,85. На
основании полученных результатов сделан вывод, что основной вклад
в закрепление гидроксамовой кислоты на природном касситерите вно-
сят ионы железа, а на обезжелезненном ионы олова и частично остав-
шиеся ионы железа.
Действие солей железа на флотацию минералов гидроксаматом.
Гидроксамовые кислоты образуют ряд прочных комплексов с желе-
зом, заметно отличающихся растворимостью. При pH > 1,5 образу-
ются труднорастворимые гидрофобные комплексы железа с моляр-
ным отношением Fe : Гк = 1:3 - 1:2. При pH > 1,5 труднораствори-
мые комплексы разрушаются, а в воде существуют растворимые комп-
лексы, например, состава
Н2О
Н2О. . о—N—H
*Fe
Н2О* ^О=С—R
Н2О
177
12-6926
Таблица II, 13
Показатели флотации минералов
в кислой среде гидроксаматами калия и железа
Минерал pH Расход собирателя Извлече- ние, %
КГк РеГк*
Обезжелезненный кварц 2,5 400 — 1,3
2,5 — 400 85
Природноожелезненный кварц 2,3 400 — 6
2,3 — 400 20
Микроклин 2,5 400 — 3
2,5 — 400 47
Флюорит 2,3 800 — 7
•« * Расход РеГк дан в расчете на КГк. 2,3 800 85,3
Трудно растворимые гидроксаматы железа могут закрепляться на
минеральной поверхности и обусловливать флотацию минералов, не со-
держащих катионы, способные взаимодействовать с собирателем в
этих условиях, — обезжелезненного кварца, полевого шпата, вероят-
но, других силикатов и алюмосиликатов, а также флюорита (табл.
11.13).
Активация минералов возможна также и путем взаимодействия
гидроксамовой кислоты или ее соли с минералами, на поверхности
которых закрепились катионы железа в процессе образования мине-
ралов или подготовки их к флотации.
Таким образом, катионы железа, как в решетке, так и сорбиро-
ванные из объема раствора в двойном слое, нивелируют разницу по-
верхностных свойств минералов и отделение полезных минералов от
минералов пустой породы является весьма трудной задачей. Необ-
ходимо иметь в виду, что нарушение селекции минералов будет иметь
место при уже незначительных содержаниях железа.
По данным Г.Е. Колтуновой и др., в опытах флотации кварца вве-
дение в пульпу, содержащую гидроксамовые кислоты, 4 г/т железа
(рис. 2,3) увеличивало извлечение кварца с 1,3 до 70 %. В связи с ак-
тивирующим действием гидроксаматов железа в широкой области
изменения pH полезные минералы можно отделить от минералов пус-
той породы только при pH от 1 до 1,5, при котором разлагаются труд-
норастворимые гидроксаматы железа. Так, при pH 1,3 возможна се-
лективная флотация с применением ИМ-50 минералов группы воль-
фрамита из черновых концентратов, содержащих флюорит и кварц;
отделение пирохлора и танталит-кол у бита, содержащих в поверхнос-
ти Nb и Та, от граната и топаза.
178
По данным [44] , возможна селективная флотация перовскита
от диопсида, роговой обманки и оливина, содержащих железо. По-
казана также возможность разделения касситерита от турмалина с
эффективностью 35-40 % при рН> 1,5 при повышенном расходе ИМ-50.
При этом оксиды железа флотируются совместно с касситеритом. Улуч-
шить- отделение касситерита от железосодержащих минералов пустой
породы удается с помощью специфических модификаторов, напри-
мер щавелевой кислоты. Последняя, образуя прочные комплексы с
катионами железа, лучше выщелачивает катионы с поверхности ми-
нералов, чем соляная или серная кислота. Кроме того, она может сор-
бироваться на остающихся в решетке минерала катионах железа, гид-
рофилизируя поверхность и препятствуя закреплению на них ИМ-50.
С.И. Горловским и др. [16] установлено, что щавелевая кисло-
та сорбируется пропорционально содержанию железа на поверхнос-
ти минералов. В этих условиях возможно отделение касситерита от
турмалина и оксидов железа.
С целью улучшения отделения касситерита от железосодержащих
примесей и сркелезненных минералов пустой породы предложено со-
четание кислотного выщелачивания ионов железа с поверхности ми-
нералов с последующей обработкой комплексообразующими соеди-
нениями (низшими гидроксамовыми и фосфоновыми кислотами)
и удаление образовавшихся соединений из объема пульпы обесшлам-
ливанием.
Действие жидкого стекла, соды, кремнефтористого натрия при
флотации гидроксаматами. Применение гидроксамовых кислот как
при флотации жирнокислотным собирателем разделения не происхо-
дит. Большая избирательность действия гидроксамовых кислот обус-
ловлена тем, что разница в прочности гидроксаматов редкоземель-
ных металлов, входящих в состав иттросинхизита и кальция, присут-
ствующего в кальците, значительно больше, чем между прочностью
их карбоксилатов. По расчетам [40] на поверхности иттросинхизи-
та гидроксамат преимущественно взаимодействует с катионами ред-
коземельных металлов (см. табл. 11.12).
Так, при флотации смеси иттросинхизита и кальцита в присутствии
жидкого стекла и олеиновой кислоты разделения не происходило,
а при действии гидроксаматов имела место их селекция (рис. П.71).
Поскольку комплекс гидроксамата с иттросинхизитом обладает боль-
шей прочностью, чем с кальцитом, то жидкое стекло должно десор-
бировать собиратель с поверхности кальцита в большей степени, чем
с иттросинхизита. Н.Е. Щукина (Механобр) установила, что при об-
работке смеси минералов 2 кг/т жидкого стекла с поверхности ит-
тросинхизита десорбируется 25 % собирателя, а с кальцита — 42 %.
Аналогичное уменьшение сорбции происходило при мономинераль-
ной флотации иттросинхизита и кальцита ПГК в присутствии жидко-
го стекла [17] . Более заметное подавление кальцита, видимо, связа-
179
11.71. Результаты флотации смеси
минералов олеатом натрия и пе-
ларгонгидроксаматом (ПГК) калия
при различных расходах G жидкого
стекла (расход пеларгонгидроксама-
та калия 200 г/т; олеата натрия
400 г/т, pH 10) (по данным Н.Е. Щу-
киной) :
1,2 — извлечение иттросинхизита
и кальцита при флотации ПГК;
3, 4 — извлечение иттросинхизита
и кальцита при флотации олеатом
натрия
но с большей сорбцией гидратированных силикатных ионов кальци-
том.
Разница в сорбций гидроксамата иттросинхизитом, и кальцитом
возрастает при нагревании [17]. Так, пропарка при 80—85°С продук-
та, содержащего редкоземельные минералы и кальцит, приводит к
перераспределению собирателя, причем собиратель десорбируется с
поверхности кальцита и переходит на поверхность иттросинхизита, об-
разующего более прочные комплексы. В этих условиях флотация каль-
цита ухудшается, а извлечение иттросинхизита возрастает (табл. 11.14).
В содовой среде десорбция собирателя с поверхности кальцита
усиливается. Наибольшая разница в сорбции собирателя иттросинхи-
зитом и кальцитом установлена при нагревании в присутствии соды
и ОП-7.
С точки зрения предложенного механизма действия гидроксама-
та непонятно отсутствие отделения по разработанному режиму иттро-
синхизита от другого кальциевого минерала — флюорита. Вероятно,
Таблица 11.14
Результаты сорбции пеларгонгидроксамата калия
и флотации минералов (расход П ГК-400 г/т)
при pH 9 при пропарке
Условия опытов Иттросинхизит Кальцит
Сорбция ПГ, % Извлече- ние, % Сорбция, ПГ, % Извлече- ние, %
Перемешивание с ПГК без нагревания 100* 97 100 66,2
То же, с нагреванием при 80-85°С 120,7 — 70,9 —
То же, с нагреванием при 80-85 °C;
300 г/т соды и 1000 г/т ОП-7 120,2 98,4 46,8 23,9
Сорбция пелагонгидроксамата без нагревания принята за 100 %.
180
для разделения важное значение имеет также избирательная сорбция
модификаторов минералами. Исследованиями флотации гюбнерита
и флюорита ПГК (или ИМ-50) в присутствии кремнефтористого нат-
рия установлено, что при pH 5—7 кремнефтористый натрий является
селективным подавителем флюорита [23].
13. ВЗАИМОДЕЙСТВИЕ МИНЕРАЛОВ С КАТИОННЫМИ
СОБИРАТЕЛЯМИ
13.1. Механизм взаимодействия аминов
с несульфидными минералами
Многочисленные работы по изучению действия аминов и солей чет-
вертичных аммониевых оснований на флотацию кварца и других си-
ликатов щелочноземельных металлов, а также проведенные измерения
электрокинетического потенциала и адсорбции показали, что закреп-
ление реагентов в большинстве случаев происходит в двойном элек-
трическом слое кулоновским притяжением положительных ионов
к отрицательно заряженной поверхности минерала.
Значительно реже наблюдается хемосорбция аминов в результа-
те образования донорно-акцепторной связи между атомами азота ами-
на и легкополяризуемыми катионами решетки минералов: Со2+, Ni2+,
Си2 , Zn2 и др. с образованием прочных комплексов.
Возможна также координационная связь с поверхностью минера-
лов, образующихся в объеме раствора ион-молекулярных комплек-
сов аминов и закрепление молекул амина при помощи водородных
связей [47]. При образовании поверхностной пленки амина проис-
ходит дисперсионное взаимодействие между углеводородными цепя-
ми адсорбированных ионов и молекул амина.
Адсорбция кварцем уксуснокислого лауриламина, содержащего 14 С,
в широком диапазоне концентраций (pH 6—7), по данным А. Годэна и
Ф. Блотчера, приведена на рис. II.72. Подобная же изотерма адсорбции
лауриламина была получена на гематите. При концентрациях лаурилами-
на 2-10 4 моль/л и менее кривая IgZ' =/(lg0 для кварца имеет нак-
лон 0,5, т.е. Г = К\/с, а в случае гематита экспериментальные данные
подчиняются уравнению Г = К^~С + К2 С, где К, и К2 - констан-
ты.
Зависимость адсорбции от С1/2 характеризует адсорбцию ионов
амина при относительно невысоких концентрациях, как адсорбцию
противоионов в двойном электрическом слое.
Доказательством электростатической адсорбции ионов амина ми-
нералами служит изменение электрокинетического потенциала мине-
ралов в присутствии соли амина. Сравнение изменения дзета-потен-
циала кварца в растворе соли натрия и соли амина показывает (рис.
181
§
1500
£ wo
§ 50
£ w
1
0,5
Концентрация уксуснокис-
лого лауриламина, моль/л
11.72. Изотерма адсорбции додециламина
кварцем
11.73. Дзета-потенциал кварца в раст-
ворах додециламинацетата и хлорис-
того натрия:
1 — раствор NaCl, pH 10; 2 — NaQ,
pH 7; 3 — до деци л амин, pH 7; 4 —
то же, pH 10; 5 — то же, pH 11
11.73), что в разбавленных растворах ионы амина адсорбируются по-
добно ионам натрия как индивидуальные противоионы в ДЭС. В этом
случае адсорбция ионов амина, определяемая зарядом поверхности
минерала, подчиняется уравнению (1.32). С увеличением концентра-
ции ионов амина резко уменьшается отрицательный дзета-потенци-
ал поверхности кварца и происходит ее перезарядка. Подобного дей-
ствия ионы натрия не оказывают. С ростом pH отрицательный заряд
поверхности кварца увеличивается, что обусловливает большую сорб-
цию амина, приводящую к перезарядке поверхности при меньших кон-
центрациях амина (рис. II. 73, кривая 5).
В системе кварц — уксуснокислый додециламин при концентра-
ции соли амина 4-10—5 моль/л и pH 8,5 резко увеличиваются адсорб-
ция амина, краевой угол на минерале, дзета-потенциала и извлечение,
минерала. Указанные явления свидетельствуют о качественном изме-
нении в этих условиях свойств адсорбированной пленки собирателя.
По расчетам А. Годэна и Д. Фюрстенау, концентрация ионов амина
в двойном слое в данном случае превышала критическую концентра-
цию мицеллообразования в объеме раствора. В связи с этим предло-
жена гипотеза об образовании на поверхности хемимицелл при взаи-
модействии углеводородных радикалов ионов амина за счет диспер-
сионных сил. Ассоциация аполярных групп аминов происходит уже
при небольшой плотности покрытия собирателем и с увеличением сорб-
ции возрастает. При образовании хемимицелл на поверхности, адсорб-
ция амина определяется как электростатической свободной энерги-
ей, так и энергией когезии ионов амина в поверхности раздела и мо-
жет быть выражена уравнением (1.33).
Прочность закрепления амина на минералах. Некоторые исследо-
ватели считают, что адсорбированный амин непрочно закрепляется
182
поверхностью минералов и легко десорбируется при промывании во-
дой. Так, при промывании кварца и гематита даже 2-кратным объе-
мом воды амин полностью отмывается. Кварц после промывки во-
дой перестает флотироваться [12].
Прочность закрепления амина зависит от длины углеводородно-
го радикала. Так, гексадециламин удерживается на поверхности квар-
ца очень прочно, в то время как тетрадециламин отмывается пример-
но на 50 %, а додециламин закреплен еще менее прочно. В более позд-
них исследованиях показано, что в большинстве случаев амин десор-
бируется далеко не полностью, например, с поверхности алюмосили-
катов при промывании десятикратным объемом десорбируется не бо-
лее 70 % амина. С поверхности кварца и гематита десорбция додеци-
ламина при pH 6,0 и pH 11,5 не превышает 60 % [16]. Н.С. Михайло-
вой и др. при исследовании кинетики отмывки с поверхности марти-
та водой при pH 5,6 установлено, что большая часть отмываемого со-
бирателя удаляется в течение первых 2 мин отмывки.
Дальнейшее повышение концентрации соли амина приводит к об-
разованию обратноориентированного второго слоя ионов собирате-
ля благодаря притяжению углеводородных радикалов, что может ухуд-
шить флотацию.
Предложенная А. Годэном и Д. Фюрстенау схема взаимодействия
амина с минералом показана на рис. П.74.
Согласно расчетам Д. Фюрстенау, свободная энергия когезии Ф,
приходящаяся на одну группу СН2 в адсорбционной пленке собира-
теля равна 1,0±0,1 КТ (или 2,5—2,8 КДж/моль), что совпадает с энер-
©-/ <S3~2 QZI-7
11.74. Схема образования двойного электрического слоя (по А.М. Годэну и
Д.В. Фюрстенау):
а — адсорбция индивидуальных ионов; б — образование хемимицелл; в — поли-
слойная адсорбция: 1 — потенциалопределяющие ионы; 2 — ион додециламина;
5 — ион ацетата
183
11.75. Извлечение кварца в зависимос-
ти от концентрации солей аминов с
различной длиной цепи при pH 6—7:
1 ~ С1в; 2 — Cjg; 3 — С14; 4 — С12;
•5 - С10; 6 - С8; 7 - С6; 5 - С4
0,25 0,50 0,75 1,00 £,мо/1ь/т
11.76. Извлечение берилла в зави-
симости от расхода G соли ами-
нов с различной длиной цепи [5 ] :
1 - С8; 2-С12; 3 - С16; 4-
С18 (стеариламин) ; 5 — С18
(олеиламин)
гией образования мицелл в растворе. По данным Ж.М. Каза [30] энер-
гия когезии, рассчитанная другим способом, равна 1,15 КТ. Получен-
ное совпадение служит подтверждением того, что образование геми-
мицелл на поверхности и мицелл в объеме раствора происходит анало-
гичным образом.
Общая энергия когезии амина определяется длиной цепи радика-
ла и с ее увеличением возрастает. В балансе энергии адсорбции кати-
онного собирателя энергия когезионного взаимодействия соизмери-
ма с энергией взаимодействия полярной группы с минералом. По дан-
ным Ж.М. Каза, при сорбции додециламина слюдой энергия когезии
составляет 14 КТ, а энергия связи полярной группы с поверхностью
слюды около 12 КТ. X. Шуберт нашел, что при флотации солей основ-
ную роль играет энергия когезии углеводородных радикалов ами-
на [30].
При флотации кварца и ряда алюмосиликатов расходы катион-
ных собирателей весьма незначительны и адсорбционное покрытие
составляет лишь доли монослоя. Так, например, полное извлечение
кварца наблюдается при плотности покрытия 5—7 % монослоя, а алю-
мосиликатов — 8-10 % монослоя [16].
Влияние длины и строения углеводородного радикала при фло-
тации аминами. По данным Д. Фюрстенау, активность катионных со-
бирателей при флотации кварца возрастает с увеличением длины це-
пи от С4 до С18 (рис. П.75). Аналогичная зависимость установлена
при флотации берилла прямоцепочечными аминами от С8 до С18 (рис.
IL76). По данным X. Шуберта, при флотации кварца, флюорита, кас-
184
П.77. Извлечение кварца в зависимости
от концентрации 1, 3-диаминопропанов
(RNH(CH2)3NH2) [55] :
1,2 — и-додециламинопропан соответст-
венно при pH 8, и 10; 3, 4 — тридецок-
сипропилдиаминопропан при pH 8 и 10)
ситерита и вольфрамита алкилпиридинийбромидом R—С5Н5 NBr со-
бирательная сила также возрастает с увеличением числа углеводород-
ных атомов в радикале от 8 до 16. В то же время при флотации поле-
вого шпата наиболее сильным собирателем является амин сС14, ами-
ны с более высокой молекулярной массой обладают меньшей фло-
тационной активностью. Указанное различие в поведении полевого
шпата не нашло обоснованного объяснения.
Степень ассоциации углеводородных радикалов в слое собирате-
ля на минерале определяется структурой аполярной группы. Наилуч-
шая ассоциация происходит у прямоцепочечных аминов, она умень-
шается при наличии нескольких алкильных групп в молекуле, раз-
ветвленной цепи радикала, ароматических и других колец и т.д. Это
приводит к ухудшению флотируемости минералов соответствующи-
ми собирателями.
При флотации кварца применяются диамины. На рис. 11.77 при-
ведены результаты флотации кварца 1,3-диаминпропанами при pH 8
и 10. И в этом случае В. Росс, А. Смит и др. [55] наблюдали возрас-
тание флотируемости минералов при увеличении длины цепи. Флота-
ция диаминами происходит при более низких концентрациях соби-
рателя, чем моноаминами. Связано ли это с наличием второй амино-
группы или с удлинением цепи — остается неясным. Вполне вероят-
но, что наличие второй аминогруппы обусловливает большую раст-
воримость реагента в воде по сравнению с алифатическими моноами-
нами, содержащими в радикале более С12.
Имеющиеся данные относительно флотации кварца первичными,
вторичными, третичными аминами и четвертичными основаниями ам-
мония [55] свидетельствуют о весьма сложном влиянии структуры
этих собирателей на их собирательные свойства.
Значения рКа первичных, вторичных и третичных н-додецилами-
нов равны 10,63; 11,00 и 10,00 соответственно, т.е. в порядке воз-
185
растания значений рКа эти соединения располагаются в ряд: третич-
ные < первичные < вторичные. Изменение кислотноосновных свойств
этих собирателей качественно объясняет их флотационное поведение.
Так, оптимум флотации кварца третичным амином наблюдается при
pH 9,5, первичным амином — pH 10,5 и вторичным — pH 10,75.
Влияние нейтральных молекул на сорбцию аминов и флотацию
минералов аминами. Исследования показали, что более эффектив-
ным собирательным действием по сравнению с полностью диссоции-
рованными собирателями обладают реагенты, подвергающиеся гид-
ролизу и образующие в растворе наряду с ионами нейтральные мо-
лекулы. В соответствии с этим флотация корунда додециламином про-
исходит при концентрациях, в 10 раз меньших, чем при использова-
нии триметилдодециламмония. Р. Смит на основании измерения кра-
евых углов на кварце в растворах додециламина при различных кон-
центрациях собирателя и различном pH пришел к выводу, что как
молекулы, так и ионы амина поверхностноактивны, и образование
краевых углов зависит от их относительных концентраций.
Согласно одной из гипотез, наличие в молекуле амина постоянного
периферического диполя, положительный заряд которого направлен
к внешнему концу функциональной группы, допускает адсорбцию ее
на отрицательно заряженной поверхности минерала в промежутке меж-
ду сорбированными ионами амина.
По другой гипотезе (М. Букенхем, Ж. Роджерс) молекулы ами-
на адсорбируются за счет водородной связи с гидроксилами поверх-
ности. Закрепление нейтральных молекул амина также возможно в
виде ион-молекулярного комплекса состава 1:1, образующегося в
объеме раствора путем образования координационной связи с поверх-
ностью минерала [47] . Адсорбция молекул, сопровождающаяся ассо-
циацией с углеводородными цепями адсорбированных частиц экра-
нирует силы отталкивания между одинаково заряженными полярны-
ми группами ионов. В этом случае, по данным Р. Смита, увеличивает-
ся общая сорбция собирателя, причем краевой угол возрастает от 36
до 86°. В ряде работ исследовалось влияние добавок неиногенных
гетерополярных и аполярных соединений на флотацию минералов пол-
ностью диссоциированными в растворе собирателями. При этом бы-
ло установлено заметное улучшение флотации корунда триметилдо-
децилам монийхлоридом в присутствии децилового спирта. Добав-
ки спирта не влияли на флотацию в отсутствие собирателя, но снижа-
ли в 10 раз концентрацию собирателя, обеспечивающую эффективную
флотацию минерала, и расширяло диапазон действия pH. Наблюдалось
также заметное увеличение краевых углов на кварце при добавке до-
децилового спирта к растворам додециламина при различном pH.
По данным X. Шуберта и В. Шнейдера [30], добавка «-углеводо-
родов и солей аминов увеличивает сорбцию собирателя и энергию ко-
гезии углеводородных цепей.
186
13.2. Действие модификаторов при флотации
несульфидных минералов катионными собирателями
Влияние pH раствора на флотацию минералов и сорбцию катион-
ных собирателей. Взаимодействие аминов с силикатами рассматрива-
ется как кислотно-основная реакция типа [47] :
Si ОН + H3NR^± SiO“H3N-R + H+
_ + +
SiO + Н3 NR SiO- H3 N- R
На основании рассмотрения кислотных и основных свойств алифа-
тических аминов и кварца оптимум сорбции определен как 9,8 pH. Эк-
спериментально он был определен для кварца, гематита, кальцита,
доломита, барита, берилла и других несульфидных минералов от pH
8 до 10,6.
На рис. 11.78 показаны типичные кривые изменения дзета-по-
тенциала минералов, сорбции собирателя, а также извлечения мине-
ралов в растворах катионных собирателей при различных pH.
Полученные результаты опытов можно объяснить следующим об-
разом. У несульфидных минералов, имеющих точку нулевого заря-
да (ТНЗ) в кислой или нейтральной среде, заряд поверхности, опре-
деляемый концентрацией ионов Н+ и ОН- при pH > ТНЗ отрицате-
лен и с увеличением щелочности раствора увеличивается, достигая
максимума при pH 9—10.
Параллельно росту отрицательного заряда поверхности (и изме-
ряющего его дзета-потенциал) увеличивается сорбция катионов со-
бирателя, что обусловливает уменьшение отрицательного дзета-по-
тенциала (см. рис. П.79). В сильнощелочной области сжатие двойно-
го электрического слоя в результате сорбции катионов щелочи, имею-
щихся в большом избытке, вызывает падение дзета-потенциала, что
11.78. Влияние pH на извлечение берилла
(7), сорбцию додециламина (2) и изме-
нение дзета-потенциала (2) при расхо-
де амина 100 г/т
187
£,7о 4'мкмоль/м''4
100
80
60
40
20
О
П.80. Извлечение кварца и сорбция
солянокислого додециламина при
различных pH (в беспенном аппа-
рате) :
11.79. Извлечение минералов и сорб-
ция додециламина при различных pH:
1, 2 и 3 — извлечение соответственно
мартита, гематита, магнетита; 4, 5,
6 — сорбция амина соответственно
мартитом, гематитом, магнетитом
1 — извлечение (расход амина 20 г/т) ;
2 — сорбция (расход амина 20 г/т) ;
3 — флотация (расход амина 10 г/т) ;
4 — сорбция (расход амина 10 г/т) ;
5 — флотация (расход амина 5 г/т) ;
6 — сорбция (расход амина 5 г/т)
обусловливает также уменьшение сорбции катионов амина. Кроме
того, от pH раствора зависит соотношение между ионной и молеку-
лярной формой амина в растворе: если при флотационных концентра-
циях до pH < 9 в растворах лауриламина содержится до 98 % ионов
амина, то при pH от 9 до 11 содержатся ионы и молекулы, а при pH >
Ив растворе в основном содержатся молекулы. При расчете прини-
мались: константа основности Къ =4,3 • 10~4, константа диссоциации
/С =2,4 • 10—11, растворимость 2 • 10“5 моль/л.
В соответствии с этим выполненный И.А. Вайншенкером анализ
ИК-спектров кварца, обработанного лауриламином (расход собира-
теля 20 г/т), показал, что до pH < 10 додециламин сорбируется толь-
ко в ионной форме, при pH 10—10,5 на поверхности имеются как ио-
ны, так и молекулы, а при pH > 11 преобладает молекулярная форма
[16].
Смещение оптимума сорбции амина минералами в более щелоч-
ную область по сравнению с максимумом флотационного извлечения
позволяет предположить, что ионам амина присуще более активное
собирательное действие, чем молекулам. Однако относительно гид-
рофобизирующего действия ионов и молекул аминов в литературе
имеются противоречивые мнения.
В работе [6] сравнивалась флотация кварца и сорбция собирате-
ля его поверхностью при применении додециламина и триметилдоде-
циламмония, который при всех значениях pH представлен ионами.
188
11.81. Извлечение кварца и сорбция
триметилдодециламмоний хлорида при
различных pH (в бесценном аппарате);
Расход амина 100 г/т: 1 — извлечение;
2 — сорбция
Расход амина 60 г/т: 3 — флотация;
4 — сорбция
2 4 6 3 Ю 12 pH
Полученные результаты показаны на рис. 11.80 и 11.81. Как следует
из этих данных, в случае трйметилдодециламмония (см. рис. 11.81).
оптимум флотации совпадает с максимальной сорбцией ионов ами-
на. При применении додециламина оптимум сорбции на 1—1,5 еди-
ниц pH отличается от оптимума флотации (см. рис. П.81), причем он
смещен в область более высоких pH, когда собиратель в растворе преи-
мущественно представлен молекулами. Уменьшение извлечения квар-
ца при pH > 9, когда сорбция амина минералом продолжает расти (до
pH 10-10,5) в основном за счет молекулярной формы амина, может
свидетельствовать о том, что молекулярная форма менее эффектив-
на для гидрофобизации, чем ионная.
Более высокая поверхностная активность, возможно, присуща
ион-молекулярному комплексу состава 1:1 [47]. При определении
флотируемости сульфидных минералов — галенита, пирита, халько-
пирита и самородного висмута додециламином и измерении сорбции
собирателя было найдено [1], что их извлечение определяется лишь
общей плотностью сорбции собирателя и не зависит от того, обуслов-
лена ли она закреплением ионов или молекул амина. В опытах фло-
тации pH изменяется от 9 до 12, причем соотношение ионной и мо-
лекулярной форм амина в растворе изменялось от 100 до 0,01.
Таким образом, вопрос относительно гидрофобизирующей спо-
собности ионов и молекул амина или их комплексов остается пока
нерешенным.
Влияние различных катионов на флотацию минералов катионны-
ми собирателями. Инообменный характер взаимодействйя аминов с
минералами находит подтверждение при изучении действия подави-
телей и активаторов катионной флотации. В связи с электростатичес-
ким характером адсорбции катионных собирателей можно ожидать,
что она будет уменьшаться в присутствии других катионов вследствие
конкуренции с этими катионами, стремящимися адсорбироваться в
двойном электрическом слое. Адсорбция катионов в этом случае мо-
жет быть определена по уравнению (1.34).
189
Действие катионов на флотацию кварца, полевого шпата и берил-
ла лауриламином проявляется тем заметнее, чем выше заряд конку-
рирующего катиона [12]. При концентрации соли до 1 г/л, одно- и
двухвалентные катионы практически не влияют на флотируемость
кварца и ряда алюмосиликатов. Однако Г. Пуш отмечает, что при оп-
ределенном избытке одно- и двухвалентных ионов, возможно вытес-
нение катионного собирателя из двойного слоя на поверхности квар-
ца и подавления кварца. Д. Хопсток и Г. Агар на основании получен-
ных экспериментальных данных рассчитали специфическую адсорб-
цию на кварце ионов магния, кальция, бария.
Адсорбционные потенциалы (кДж) щелочноземельных ионов*
Магния 16,72
Кальция 50,05
Бария 12,54 х2
Так как ионы натрия не адсорбируются специфично на кварце, у них ад-
сорбционный потенциал отсутствует.
х2
Адсорбционный потенциал бария определен А. Гаудином и Д. Фюрстенау.
В соответствии с полученными значениями адсорбционного потен-
циала при флотации кварца наибольшее подавляющее действие из изу-
ченных одно- и двухвалентных катионов присуще магнию.
Использование катионов калия, натрия, кальция в качестве селек-
тивных подавителей при катионной флотации предложено В.И. Рев-
нивцевым, А.М. Путриным, Н.А. Янис и др. [30] для разделения та-
ких близких по своим поверхностным свойствам минералов, как ка-
лиевые и натриевые полевые шпаты.
Установлено, что специфическое депрессирующее действие ока-
зывают катионы, одноименные или изоморфные ионы решетки по-
давляемого полевого шпата, благодаря избирательному вытеснению
катиона амина с его поверхности. Так, флотацию калиевого полево-
го шпата и сорбцию им амина избирательно подавляют катионы ка-
лия, при этом натриевые полевые шпаты преимущественно перехо-
дят в пенный продукт. Соли натрия и иногда кальция специфически
подавляют натриевые полевые шпаты; в этом случае также более за-
метно вытесняется амин с поверхности натриевых полевых шпатов
(рис. 11.82 и 11.83) [30].
Аналогичные результаты получены в опытах с синтезированными
стеклами, отвечающими чистым разновидностям полевых шпатов сос-
тава Na AlSi3Og; KAlSi3O8 и CaAl2Si2Og. При этом растворы хлорис-
того натрия оказывали подавляющее действие на флотацию стекол
NaAlSi3Og и CaAl,Si2Og, практически не влияя на извлечение стек-
ла KAlSi3Og, а хлористый калий являлся селективным депрессором
стекла KAlSi3Og. Действие СаС12 оказалось наиболее заметным при
190
11.82. Действие хлористого калия на
флотацию полевых шпатов и сорбцию
додециламина поверхностью этих мине-
ралов (расход амина 200 г/т, HF 7,5-
10 кг/т; извлечение минералов и сорб-
ция амина в отсутствии подавителя
приняты за 100 %) [30]:
1, 3 и 5 — извлечение соответственно
альбита, амазонита и микроклина; 2, 4
и 6 — сорбция додециламина соответст-
венно альбитом, амазонитом и микро-
клином
11.83. Действие хлористого натрия на
флотацию полевых шпатов и сорбцию
додециламина поверхностью минера-
лов (расход амина 200 г/т, HF 7,5-
10 кг/т; извлечение минералов и
сорбция амина в отсутствии подави-
теля приняты за 100 %) [30]
1 и 3 — извлечение микроклина и аль-
бита; 2 и 4 — сорбция додецилами-
намикроклином и альбитом
флотации стекла CaAl2Si2Og. Соответственно наибольшее уменьше-
ние сорбции амина стеклами происходило в присутствии специфичес-
кого подавителя. И.В. Шейко при измерении сорбции ионов натрия
и калия полевыми шпатами установил, что ионы калия преимущест-
венно сорбируются калиевым шпатом, а ионы натрия — натриевым
полевым шпатом. Применение фтористоводородной кислоты улуч-
шает разделение полевых шпатов. В этом случае уменьшается расход
подавителя и повышается избирательность его действия.
Специфическое подавляющее действие катионов калия установле-
но А.И. Какориным при флотации калиевых слюд аминов, что позво-
лило разработать технологию отделения их от бериллсодержащей каль-
циевой слюды.
Наличие солей кальция и магния в пульпе ухудшает также фло-
тацию оксидов железа (гематита и мартита), а флотация кварца при
этом практически не изменяется [16]. Это связано с заметно боль-
шей сорбцией щелочноземельных катионов поверхностью оксидов
железа и соответственно их большим вытесняющим действием по от-
ношению к ионам амина.
Действие катионов кальция на флотацию алюмосиликатов так-
же специфично. Они заметно ухудшают флотацию сподумена, так как
значительно сорбируются и вытесняют ионы амина с его поверхнос-
ти и не влияют на флотацию берилла и альбита и сорбцию ими амина
[16].
191
11.84. Извлечение берилла (7) и сорбция додециламина (2) и хлорного железа (3)
минералом в зависимости от расхода хлорного железа при pH 2,7-2,8 (а) и pH
7,5-7,7 (ff) [30]
Катионы железа и алюминия, по данным ряда исследователей, бла-
годаря их специфической адсорбции поверхностью минералов и боль-
шей конкуренции с ионами собирателя обычно — более сильные по-
давители, чем одно- и двухвалентные катионы. При флотации мине-
ралов додециламином, так же как и в кислой среде (pH 2,7—3,3), ког-
да железо в растворе присутствует в виде катионов Fe3+, Fe(OH)2+
и Fe(OH)j, и при pH 5,25—7,5, отвечающем образованию аморфных
гидроксидов железа, заряженных положительно, соли железа подав-
ляют флотацию берилла и мартита (рис. 11.84) [16]. Это связано с умень-
шением сорбции амина вследствие заметного закрепления положитель-
но заряженных соединений железа на минералах, сопровождающего-
ся уменьшением отрицательного заряда поверхности 1. Заметно боль-
шая сорбция гидрофильных осадков гидроксилов железа вызывает
более сильное подавление, чем катионы железа.
, Аналогичное подавляющее действие оказывали соли железа как
в кислой, так и нейтральной среде при катионной флотации всех слюд.
В отличие от солей железа действие солей алюминия специфично.
Флотируемость кальциевой слюды — маргарита практически не из-
меняется в присутствии солей алюминия (до концентрации их 0,006
г-экв/л), тогда как калиевые слюды полностью подавляются даже
при меньших концентрациях соли. Это обусловливается как замет-
но большей сорбцией собирателя поверхностью маргарита по срав-
нению с другими слюдами, так и слабым влиянием катионов алюми-
Аналогичные результаты получены и при флотации кварца лауриламином
в присутствии солей железа.
192
11.85. Влияние концентрации раствори-
мых солей на извлечение смитсонита
додециламином (концентрация амина
4,9 мг/л, pH 11) [1]:
1 — карбоксиметилцеллюлоза; 2 —
Na2SiO3; 3 - /NaPO^; 4 - СаС12;
5 - А1С13; 6 - FeQ3; 7 - РЬ(СН3СО2)2 ;
8- ZnSO4; 9 — CuSO4
ния на закрепление на ней амина. Указанный эффект использован для
разработки технологии отделения калиевых слюд от бериллсодержа-
щей кальциевой слюды при применении в качестве селективного по-
давителя солей алюминия как в кислой, так и в щелочной средах.
При катионной флотации церуссита, каламина, смитсонита наиболь-
шее депрессирующее действие оказывают в слабокислой среде соли
алюминия и железа, а в щелочной — соли меди, свинца и цинка (рис.
11.85) [1]. Предполагается, что подавление катионами в среде обус-
ловлено конкуренцией депрессирующих ионов с ионами собирателя,
а в щелочной среде происходят как сорбция гидрофильных осадков
подавителей, так и связывание собирателя (находящегося в основ-
ном в молекулярной форме) в объеме раствора в виде металл-амин-
ных комплексов типа Me(NH2)”+. Подавление катионами тяжелых
металлов можно предотвратить сернистым натрием, связывающим
катионы в труднорастворимые сульфиды.
Влияние анионов на катионную флотацию минералов. Некоторые
анионы способны активизировать катионную флотацию подобно ак-
тивации минералов катионами при флотации анионными собирателя-
ми. Например, флотация кварца октадециламином и диметиллаурил-
бенаиламмонийхлоридом заметно активировалась в присутствии ли-
монной кислоты (рис. П.86).
Соли бария ослабляют активацию лимонной кислотой. Двузаме-
щенный фосфат натрия и щавелевая кислота также повышают извле-
чение кварца. Авторы объясняют эти результаты специфической ад-
сорбцией кварцем многовалентных анионов — питратного, оксалат-
ного и фосфатного, при которой увеличивается отрицательный заряд
поверхности и сорбция ионов собирателя. Ионы бария, сорбируясь
во внешней обкладке двойного слоя, уменьшают сорбцию катионов
собирателя.
X. Шубертом, А. Серрано и др. установлено, что ряд полярных ор-
ганических соединений — лимонная, винная, тартроновая, галловая кис-
лоты оказывают активирующее действие при флотации флюорита до-
дециламмонийхлоридом (рис. П.87). При этом растет адсорбция до-
дециламмонийхлорида в присутствии некоторых соединений (лимон-
193
13-6926
С, мкмоль/л
11.87. Влияние концентрации полярных
органических соединений на флотацию
флюорита додециламином (концентра-
ция додециламина 6,67 • 10~5 моль/л;
pH 6; крупность флюорита 0,16—
0,20 мм): по данным Шуберта, Сир-
рано и др.]
1 — лимонная кислота; 2 — винная
кислота СООН-СН(ОН) - СН(ОН)-
СООН; 3 — тартроновая кислота
СН (ОН) (СООН) 2; 4 — триоксибен-
зойная кислота С^Нз (СООН) (ОН) з
11.86. Влияние концентрации лимонной
кислоты на флотацию кварца диметил-
лаурилбензиламмонийхлоридом (7) и
октадециламином (2) (концентрация
собирателей 1 • 10-6 м/л; pH 11,
крупность кварца 50-90 мкм)
ной и галловой кислот, конго-рот), причем адсорбция указанных сое-
динений значительно больше, чем собирателя. Авторы полагают, что
гидрофильные органические соединения способны изменять заряд и
состав поверхности таким образом, что увеличивается адсорбция ио-
нов собирателя, имеющих заряд, противоположный заряду поверх-
ности.
Флотация катионным собирателем кварца, полевого шпата и осо-
ленно берилла активируется в присутствии фтористого натрия [12].
Исследования, выполненные с меченым амином, показали, что улуч-
шение флотации кварца, сподумена, биотита и особенно берилла в при-
сутствии фтористого натрия связано с ростом сорбции амина по ме-
ре увеличения расхода фтористого натрия [ 16].
Адсорбция фтористого натрия алюмосиликатами, каолинитом и
монтмориллонитом объяснялась образованием поверхностных коор-
динационных комплексов фтора с алюминием, возможно, вида (A1F6)3
[5]. По аналогии с этим, можно допустить, что при флотации амина-
ми алюмосиликатов в присутствии фторида, ионы фтора замещают
поверхностные гидроксилы и образуют комплексные анионы с катио-
нами решетки минерала, которые способны взаимодействовать с ио-
нами амина. Значительное увеличение отрицательного дзета-потенциа-
ла берилла в растворах фтористого натрия, установленное А.Н. Дол-
женковой, служит доказательством сорбции ионов фтора бериллом.
194
Активация минералов анионами возможна также и тогда, когда
поверхности минералов заряжены положительно, например, при pH <
ТНЗ. В этом случае адсорбция анионов приведет к перезарядке поверх-
ности, что будет способствовать сорбции ионов амина и флотации. Та-
ким образом, объясняется активация корунда, имеющего положитель-
ный заряд при pH < 6 под действием сульфата натрия при флотации
солянокислым додециламином. Измерениями дзета-потенциала ко-
рунда в растворе сульфата натрия была определена перезарядка час-
тиц корунда.
Действие фтористоводородной кислоты при флотации минералов
аминами. В практике обогащения берилловых и полевошпатовых руд
катионным собирателем фтористоводородная кислота применяется в
качестве активатора берилла и полевого шпата для отделения от квар-
ца. В этих условиях флотация кварца подавляется и он остается в ка-
мерном продукте. Влияние HF на флотацию берилла, альбита, споду-
мена и кварца додециламином и сорбцию амина минералами показа-
но на рис. 11.88.
Влияние HF на флотацию зависит от концентрации ее в растворе
при обработке минералов. При относительно невысоких концентрациях
кислоты (60—100 мг/л) флотация всех минералов ухудшается, чему
соответствует уменьшение сорбции амина. При дальнейшем увеличе-
нии концентрации HF, флотация берилла и альбита активируется, кварц
же и сподумен остаются задепрессированными. В этих условиях нез-
начительно увеличивается сорбция амина бериллом, очень в малой
степени альбитом и остается постоянной и небольшой по величине на
кварце и сподумене.
Большинство исследователей, изучавших активацию алюмоси-
ликатов фтористоводородной кислотой при катионной флотации, приш-
6
£,% /Гмкмоль/м2,
2
\ 20
I ППМЬ —ir —Q\_ ।------—।-----1----1----
0 1000 2000 о 1000 2000 3000G^jT
11.88. Извлечение (д) сподумена (7), кварца (2), сорбция амина сподуменом (5),
кварцем (4) и извлечение (б) берилла (7), альбита (2), сорбция амина бериллом
(5), альбитом {4) в зависимости от расхода плавиковой кислоты (расход амина
при флотации сподумена 50 г/т, кварца 25 г/т, берилла 100 г/т и альбита 25 г/т)
195
ли к заключению, что в растворах фтористоводородной кислоты в при-
сутствии амина на поверхности минералов образуется комплекс, в
состав которого входят алюминий поверхности минерала, фтор и амин
[12 и др.]. Подавление кварца раствором фтористоводородной кис-
лоты при флотации амином объяснялось отсутствием на его поверх-
ности алюминия или других катионов.
Р. Смит и Б. Сулин предположили, что при действии фтористово-
дородной кислоты на алюмосиликаты в объеме раствора образуются
ионы фторсиликата SiF2-, которые взаимодействуют с поверхност-
ным гидроксидом алюминия по реакции:
> А1-ОН + SiF2- -> >AlSiF7 + ОН~
> AlSi^ + RNHj -t>Al-SiF~]TB RNHj
В объеме раствора возможно образование комплексного аниона
RNH3SiF~, который также способен закрепляться на поверхности
минерала. Известное доказательство предложенного механизма — фло-
тация минералов синтезированным додециламмонийфторсиликатом,
а также установленное И.А. Вайншенкером и В.Я. Хайнманом [16]
методом ИК-спектроскопии образование додециламмонийфторсили-
ката на поверхности берилла и микролина в присутствии фтористо-
водородной кислоты и амина.
Рядом работ показано, что механизм действия фтористоводород-
ной кислоты при катионной флотации минералов зависит от pH пуль-
пы и ее концентрации в растворе [10] . На рис. 11.89 приводятся дан-
ные по флотации альбита (натриевого полевого шпата) и сподумена
и сорбции додециламина в зависимости от pH пульпы, создаваемого
серной или фтористоводородной кислотой [16].
6
11.89. Извлечение альбита (а, расход амина 25 г/т) и сподумена (б, расход амина
50 г/т) и сорбция додециламина их поверхности в зависимости от pH среды:
1, 2 — извлечение в присутствии HF и H2SO4; 3, 4 — сорбция в присутствии HF
и Н2 SO 4
196
11.90. Извлечение берилла в зависи-
мости от сорбции олеатом натрия
Г1 или лауриламина Гз [55] :
1 — флотация амином при обработке
концентрированной HF; 2 — то же,
обработка 400 г/т HF; 3 — то же,
без обработки HF; 4 — флотация
олеатом и обработка HF; 5 — то же,
без обработки HF
Действие серной и фтористоводородной кислот во всем диапазоне
изменения pH при флотации сподумена и кварца — традиционное —
с понижением pH уменьшаются сорбция амина и извлечение минера-
лов. В отличие от этого действие плавиковой кислоты на альбит и бе-
рилл — специфично: при pH < 3 (расход плавиковой кислоты более
1000 г/л) извлечение минералов заметно увеличивается и не сопро-
вождается значительным возрастанием сорбции амина.
Активирующее действие концентрированных растворов фторис-
товодородной кислоты на алюмосиликаты обусловлено уменьшени-
ем гидрофильности их поверхности за счет фторирования и ’’сглажи-
вает” поверхности благодаря растворению кислотой осколков крем-
некислородных тетраэдров, образовавшихся при извлечении минера-
лов. При фторировании поверхностей алюмосиликатов поверхност-
ные гидроксилы замещаются ионами фтора с образованием Al—F
участков поверхности.
На рис. 11.90 приведены данные флотируемости берилла в зави-
симости от плотности покрытия как олеатом, так и амином при об-
работке HF и без нее. При одинаковой плотности покрытия собира-
телем после обработки плавиковой кислотой, по данным Механоб-
ра, извлечение минерала резко возрастает. Уменьшение гидрофиль-
ности поверхности берилла в указанных условиях подтвердилось из-
мерением краевых углов, а также определением адсорбции паров во-
ды.
Более сильное взаимодействие ионов фтора с алюминием объяс-
няется амфотерным характером алюминия и его повышенной способ-
ностью обменивать гидроксил на анион. Фторирование поверхности
минералов сопровождается уменьшением ее взаимодействия с водой,
что подтверждается данными ИК-спектроскопии.
197
Таким образом, активация алюмосиликатов фтористоводородной
кислотой связана как с формой закрепления собирателя, так и, глав-
ным образом, с гидрофобизацией их поверхности.
Действие крахмала при флотации катионными собирателями. Ка-
тионные собиратели вследствие электростатического характера зак-
репления на минералах, характеризующегося недостаточной прочностью,
менее селективны, чем жирнокислотные собиратели, сорбирующие-
ся хемосорбционно. При флотации аминами обычно минералы разде-
ляются в присутствии селективно действующих подавителей — крах-
мала, декстрина, квебрахо и других. При обратной флотации желез-
ных руд, когда флотируются катионным собирателем силикатные ми-
нералы, а в камерном продукте остаются оксиды железа, применя-
ются крахмал и его заместители для подавления железосодержащих
минералов.
Крахмал относится к классу неионогенных полимеров. Крахмал
и другие соединения этого класса — гидрофильные соединения, в их
составе содержится значительная доля полярных групп — ОН и дру-
гих, прочно удерживающих молекулы воды. При определении степе-
ни гидратации этих соединений установлено, что ОН- группа способ-
на связывать три молекулы воды, и при гидратации крахмала образу-
ется прочный мономолекулярный слой воды. Так как размеры гид-
рофильных молекул полимера значительно больше углеводородных
радикалов собирателя, то они экранируют гидрофобизирующее дей-
ствие собирателя, аналогично тому, как это предположил Г.С. Стрель-
цын для жидкого стекла. Следовательно, закрепление крахмала и дру-
гих полимеров, обусловливающее подавление минералов, приводит
к гидрофилизации поверхности.
Сорбция крахмала селективна [34]. Так, например, при исполь-
зовании крахмала типа ’’British qum” плотность сорбционного слоя
крахмала на кварце была в 10 раз меньше, чем на гематите (рис. 11.91).
Указанные факторы обусловили флотацию кварца и подавление гема-
11.91. Сорбция крахмала гематитом
(7, 2, 3) и кварцем (4, 5, б) в зави-
симости от остаточной концентрации
реагента при различных pH (по дан-
ным С. Балае и Ю. Ивасаки):
1, 4 - pH 7; 2 ~ pH 9; 3 - pH 11;
5 - pH 8,5; 6 - pH 10,6
198
тита. Аналогичные результаты получены при применении обычного
крахмала при флотации кварца и оксидов железа [34]. Сорбция крах-
мала минералами возрастает с уменьшением pH среды. Максимум сорб-
ции крахмала соответствует кислой среде. При pH > 8 крахмал практи-
чески не закрепляется на неактивированном кварце, и в заметном ко-
личестве сорбируется оксидами железа.
Железистые силикаты по своей флотируемости амином в присут-
ствии крахмала и сорбционной способности крахмала занимают про-
межуточное положение между кварцем и магнетитом [34] . Сорбция
крахмала минералами отличается не только по величине, но и по проч-
ности закрепления, так, при pH 8—11 с поверхности неактивированно-
го кварца удаляется 50—80 % сорбированного крахмала, а с поверх-
ности оксидов железа крахмал практически не отмывается.
В отношении взаимного влияния крахмала и амина на сорбцию
минералами имеются различные мнения. Согласно данным С.Р. Балая
и Ю. Ивасаки, сорбция катионами амина в присутствии крахмала
’’British qum”, заряженного отрицательно, возрастает на кварце и нез-
начительно на гематите. Точно так же при наличии амина сорбция это-
го крахмала заметно увеличивается кварцем. Присутствие крахма-
ла вызывает изменение дзета-потенциала кварца в растворе амина.
В связи с этим высказано предположение относительно образования
двойного комплекса амина и крахмала ’’British qum”, сорбируемого
поверхностью минералов.
В других исследованиях [34 и др.] при применении обычного крах-
мала сорбция амина минералами в присутствии крахмала не увели-
чивалась.
Предложены различные объяснения механизма действия крахма-
ла при флотации минералов. Предполагается возможность взаимодей-
ствия крахмала за счет электростатических сил, водородной связи,
а также специфических сил [34]. Электростатический характер ад-
сорбции крахмала поверхностью минералов подтверждается наличи-
ем оптимума сорбции его в кислой среде (когда минералы заряже-
ны положительно, а крахмал отрицательно1);11 уменьшением сорбции
с ростом pH.
Синтезированы катионные крахмалы, заряженные положительно,
адсорбция которых возрастает с увеличением pH, она также выше на
кварце, имеющем больший отрицательный заряд, чем гематит. С.Ба-
лае и Ю. Ивасаки считают, что в области pH, при которых поверхность
минерала и крахмал имеют заряд одного знака, крахмал закрепляет-
ся на поверхности водородными связями между водородом в груп-
пах —ОН, —NH и др. в молекуле крахмала и кислородом поверхност-
ных гидроксидов, серой и фтором поверхности минерала. Одни не-
обычные крахмалы обладают отрицательным зарядом при pH от 3 до 11.
199
следователи полагают, что водородная связь играет основную роль
в закреплении крахмала [16] , другие, наоборот, отводят ей второ-
степенное значение.
Селективность сорбции крахмала минералами и высокая проч-
ность его закрепления на оксидах железа свидетельствуют также о
наличии специфического взаимодействия крахмала с оксидами же-
леза, которое является более прочным, чем электростатические и во-
дородные связи. Подтверждением этому может служить существо-
вание устойчивых комплексов железа с крахмалом [34].
В известной степени специфический характер взаимодействия крах-
мала подтверждается при активации минералов щелочноземельными
катионами. Так, сорбция крахмала кварцем, гематитом и магнетитом,
по данным Н.С. Михайловой, увеличивается в присутствии катионов
кальция и магния и образуется более прочный сорбционный слой крах-
мала. Следовательно, в присутствии катионов кальция и магния селек-
тивность отделения железных минералов от кварца должна уменьшить-
ся.
13.3 Флотация сульфидных минералов катионными
собирателями
Максимальная флотируемость сульфидных минералов аминами
происходит в сильнощелочной среде (pH 10,5-12), когда амин нахо-
дится в растворе в основном в молекулярной форме [I] (рис. 11.92).
Однако диапазон флотируемости их может быть смещен в кислую
область в результате увеличения расхода собирателя, где амин в ос-
новном представлен ионами.
11.92. Флотация сульфидов в зависимости от pH пульпы (а) и потенциала поверх-
ности (б) при постоянной концентрации лауриламина (2 мг/л)
7 — пирит; 2 — халькопирит; 3 — галенит
200
При измерении сорбции амина халькопиритом и пиритом установ-
лена более эффективная сорбция амина в щелочной среде, чем в кис-
лой. На основании изучения изменения при различном pH краевого
угла, электродного потенциала, сорбции амина и флотируемости, ха-
рактеризующих состояние поверхности сульфидных минералов в раст-
ворах лауриламина, предложен различный механизм взаимодействия
аминов с поверхностью сульфидов в кислой и щелочной средах [ 1 ].
Для халькопирита и пирита при низких pH закрепление ионов ами-
на смещает электродный потенциал поверхности минерала в сторону
положительных значений, что свидетельствует об электростатическом
характере сорбции амина. В то же время в щелочной среде сорбция
молекул амина, большая по величине, приводит к возрастанию отри-
цательных значений электродного потенциала, что говорит в пользу
другого механизма взаимодействия амина с минералами [1].
Еще в ранних работах Н. Арбайтера, А. Таггарта и других иссле-
дователей на основании измерения краевых углов было высказано
предположение, что в щелочных растворах амина на поверхности
сульфидов образуются металламинные комплексы общего вида
MeCRNHj)”*, где Me - металл; R - углеводородный радикал отно-
сительно большой молекулярной массы; х и п — небольшие целые
числа. Эти комплексы аналогичны координационным комплексам,
образуемым металлами с аммиаком. Их образование возможно с ми-
нералами, содержащими катионы следующих металлов: Cu, Zn, Ni,
Fe, Со и др. В то же время для катионов металлов Pb, Mg и А1 неиз-
вестны комплексные соединения с аммиаком и, видимо, невозмож-
но их образование и с амином.
* Различный механизм закрепления амина на сульфидах в кислой
и щелочной средах подтверждается результатами опытов по отмыв-
ке собирателя. Установлено, что закрепление собирателя на халько-
пирите в кислой среде значительно менее прочное, чем в щелочной
[1]. Извлечение смитсонита аминами в щелочной среде при подогре-
ве пульпы резко возрастает, что свидетельствует также о хемосорб-
ционном закреплении амина [33]. В кислой среде металламинные
комплексы менее устойчивы, чем комплексный ион RNH^, поэтому
в этих условиях они не образуются. В присутствии сернистого нат-
рия они также разрушаются.
Закрепление молекул амина в щелочной среде, создаваемой сер-
нистым натрием, происходит в результате физической адсорбции за
счет дисперсионных сил. Подобное взаимодействие амина при различ-
ных pH происходит также с галенитом, так как на его поверхности не-
возможно образование металламинного соединения.
13.4. Флотация растворимых солей катионными собирателями
Растворимые соли флотируются аминами из насыщенных раство-
ров этих солей. В подобных условиях растворимость солянокислых
w-алкиламинов весьма незначительна. Растворимость их в насыщен-
ных растворах солей при 22,5°С приведена в табл. 11.15.
При флотации растворимых солей первичными аминами взаимо-
действие амина рассматривалось Д. Фюрстенау и М. Фюрстенау как
электростатическое, носящее обменный характер. При этом флота-
ция соли возможна, если катион амина имеет близкий ионный ради-
ус с обменивающимся ионом минерала.
Для объяснения взаимодействия аминов с растворимыми соля-
ми получила широкое распространение и является наиболее прием-
лемой теория подобия структур собирателя и минерала, выдвинутая
Р. Бахманом и др., а затем дополненная X. Шубертом и др. Согласно
этой теории, минерал способен флотироваться, если имеется подобие
между размером его решетки и решетки амина в кристаллическом
состоянии. Разница в размерах решетки может составлять 20 %. В этом
случае на поверхности минерала адсорбируется монослой собирателя
в виде димерной конденсированной пленки, обладающей заметной ус-
тойчивостью. На нефлотируемых минералах пленки собирателей весь-
ма неустойчивы и отделяются в виде хлопьев. Для образования устой-
чивого покрытия расположение собирателя должно соответствовать
наиболее плотной упаковке его на поверхности флотируемого мине-
рала. Таким образом объяснялась флотация аминов карбонатов маг-
ния, кальция и двухвалентного железа при допущении отклонения
констант решеток минерала и амина от —10 до +25 %.
Более поздними исследованиями показано, что существующее в
кристаллической решетке амина распределение ионов и расстояния
между ними не должны точно соответствовать им в адсорбирован-
ном монослое амина на поверхности минерала. Так, например, по из-
мерению дифракции электронов установили, что в монослоях высших
Таблица 11.15
Растворимость (ммоль/л) н-алкиламинов
в насыщенных растворах солей (по данным X. Шуберта)
Число атомов угле- рода в амине КС1 NaCl NaCl-KCl
С8 36 000-42 000 13 000-17 000 2800
С10 490 80 51
С 16 0,72 0,66
с 14 0,84 Следы 0
202
аминов отсутствует наклон углеводородных цепей в отличие от их
расположения в кристаллах аминов. Следовательно, подобие струк-
тур трактуется как способность пленки собирателя закрепляться на
минерале в пределах ее определенной деформации [64].
Часто наблюдается также расположение пленки, которое подоб-
но расположению в кристаллах амина, этому может способствовать
близость ионных радиусов катиона минерала и иона амина. Однако
имеется много исключений, не укладывающихся в рамки этой гипо-
тезы. Например NaCl, Na2SO4 не флотируются амином, так как струк-
туры этих солей не подобны структуре амина, но AgCl, азоморфный
NaCl, хорошо извлекается амином; лангбейнит KMg(SO4)2 в воде
и органических растворителях флотируется амином, хотя по своей
структуре не должен флотироваться, и т.д.
Согласно другой гипотезе [64], предпосылкой закрепления со-
бирателя должно являться адсорбционное сродство собирателя с ми-
нералом, более сильное, чем взаимодействие минерала с водой. Одна-
ко если пленка собирателя не будет достаточно прочной, то ее могут
вытеснить с поверхности другие ионы раствора. Поэтому, очевидно,
соответствие структур пленки собирателя и поверхности минерала
должно быть одним из важных условий образования прочного зак-
репления собирателя.
При исследовании сорбции гидрохлорида октадециламина на саль-
вине (хлористом калии) из насыщенного раствора хлоридов калия и
натрия методом ИК-спектроскопии Л.А. Отрожденновой установле-
но, что амин сорбируется в виде иона RNH*-
Согласно экспериментальным данным И.Б. Махлянкина, изотер-
ма сорбции амина подчиняется уравнению Г =AcVn. Максимум фло-
тируемости солей отвечает образованию насыщенного монослоя или
более плотного покрытия собирателя на поверхности минералов. Наи-
большей флотационной активностью по отношению к сильвину обла-
дают амины с С16, а к карналлиту - амины С8 — С12.
Адсорбция аминов на солевых и глинистых минералах определя-
ется pH раствора. На сильвине КС1 и карналлите КС1 • MgCl2 х 6Н2О
оптимумы флотации и сорбции амина отвечают pH 2—3. В этой облас-
ти pH скорость флотации наибольшая и наиболее прочное закрепле-
ние амина. Как показали исследования Э.Е. Литвиненко, катионы по-
давляют адсорбцию и флотацию сильвина. Их действие усиливается
в порядке расположения в ряд: Mg < Са < Sr < Ba < Cd < Zn < Hg < Pb.
На нерастворимом остатке и солях натрия амин преимуществен-
но закрепляется в щелочной среде в молекулярной и мицеллярной
формах, причем адсорбируется непрочно и легко отмывается. Вред-
ное влияние глинисто-карбонатных шламов, присутствующих в ка-
лийных рудах, св'язано главным образом с их большой поглощающей
способностью по отношению к аминам благодаря высокоразвитой
поверхности и способности набухать в воде, при которой повышает-
203
11.93. Сорбция амина Армака кристал-
лами КС1 в присутствии нерастворимого
остатка, обработанного различными подави-
телями :
1 — NaKMU + крахмал; 2 — NaKMIJ, + гидро-
лизат; 3 — NaKMLI; 4 — жидкое стекло;
5 — жидкое стекло + крахмал
fC16 , ммоль/л
ся их внутренняя поверхность. Это влияние устраняется применени-
ем высокомолекулярных подавителей, в присутствии которых поверх-
ность шламов гидрофилизуется и уменьшается сорбция катионно-
го собирателя шламами, что приводит к возрастанию сорбции ами-
на солями и улучшению их флотируемости (рис. 11.93). В качестве
таких модифицирующих реагентов предложены карбоксиметил цел-
люлоза и кислая форма жидкого стекла.
Этому вопросу посвящены многочисленные работы, на основании
которых В.А. Арсентьевым и С.И. Горловским предложено примене-
ние катионоактивных полимеров (низкомолекулярных производных
этаноламинов, полибензолтриметиламмонийхлорида и др.), полиак-
риламида и его производных и других реагентов в качестве модифи-
цирующих реагентов при флотации солей.
Л.Я. Сквирским и С.Н. Титковым показана перспективность при-
менения сочетания нескольких модификаторов, одни из которых умень-
шают сорбцию собирателя шламами, а другие подавляют флотацию бла-
годаря гидрофилизации поверхности (например, применение полиак-
риламида и карбоксиметилцеллюлозы).
Введение аполярных добавок углеводородов к аминам увеличи-
вает гидрофобность поверхности и прочность взаимодействия с по-
верхностью флотируемых минералов, а также способствует флота-
ции более крупных зерен.
14. МЕХАНИЗМ ДЕЙСТВИЯ АПОЛЯРНЫХ СОБИРАТЕЛЕЙ
Аполярные собиратели (масла) используются при флотации ми-
нералов, обладающих природной гидрофобностью (уголь, сера, гра-
фит, молибденит, тальк), а также при флотации различных руд сов-
местно с анионными и катионными собирателями для повышения из-
влечения сростков, крупных и тонких частиц. Аполярные собирате-
ли практически не растворимы в воде и для лучшего распределения
в объеме пульпы их подают в процесс в виде водных эмульсий. Оп-
тимальная крупность капель масел составляет 3—5 мкм. В качестве
стабилизаторов эмульсий применяются различные поверхностно-ак-
тивные вещества [22].
Эффективность флотационного действия аполярных масел зави-
сит от химического состава и их физико-химических свойств. По дан-
ным Л.Я. Шубова, А.К. Лившица и А.С. Кузькина, для флотации тон-
ких частиц рекомендуется применять легкие масла плотностью 0,82—
—0,87 г/см3 при 20°С и вязкостью 2—10 мм2/с при 50°С, для флота-
ции крупных частиц и сростков — тяжелые масла плотностью 0,88—0,93
г/см3 и вязкостью 10—50 мм2/с.
Аполярные масла отрицательно влияют на пенообразование, поэ-
тому подбор пенообразователей, особенно при использовании угле-
водородов в качестве единственного собирателя или в сочетании с ксан-
тогенатами, не являющимися поверхностно-активными веществами,
имеет большое значение. В этих случаях из пенообразователей приме-
няются ОПСБ, сосновое масло, терпинеол и Т-80. На зарубежных фаб-
риках, перерабатывающих молибденовые руды, преимущественное
распространение получил реагентный режим, включающий использо-
вание водных эмульсий депарафинизированного нефтяного масла плот-
ностью 0,9 г/см3 и вязкостью 10 мм2/с при 37,8°С, стабилизатора эмуль-
сий — сульфированного глицерида кокосового масла (синтекс Л) и
соснового масла.
По К.А. Разумову, при столкновении с частицами минералов, об-
ладающих природной гидрофобностью, капельки собирателя закреп-
ляются на их поверхности в виде линз. Закрепление осуществляется
в основном за счет дисперсионных сил. Механизм закрепления аполяр-
ных собирателей при использовании их совместно с гетерополярными
состоит, по-видимому, в растекании капелек углеводородов по гидро-
фобизированным участкам поверхности минералов.
Капли углеводородов, сталкиваясь с пузырьками воздуха, расте-
каются по поверхности и так же как молекулы растворимых поверх-
ностно-активных веществ, очевидно, сносятся обтекающими пузырек
струями воды в кормовую часть.
Закрепление омасленных частиц на пузырьках воздуха приводит
к образованию на верхней грани частицы пленки собирателя под пу-
зырьком, причем большая часть масла собирается у трехфазного пе-
риметра контакта [22] .
205
По данным Л.Я. Шубова, А.К. Лившица и А.К. Кузькина, в при-
сутствии аполярных собирателей значительно возрастает скорость при-
липания частиц к пузырьку, что имеет большое значение для закреп-
ления на пузырьках крупных частиц и сростков. Возможно также,
что при наличии каймы аполярного реагента упрочняется контакт
между пузырьком и прилипшей к нему частицей. Это может произой-
ти за счет локального роста поверхностного натяжения, предваритель-
но пониженного углеводородами, на вытягиваемых участках поверх-
ности пузырька при действии на частицу сил отрыва [47].
При введении аполярных масел в пульпу, содержащую природно
гидрофобные или гидрофобизированные тонкие частицы, усиливает-
ся селективная флокуляция тонких частиц между собой и с более круп-
ными частицами того же минерала. Образованные агрегаты имеют боль-
шую скорость флотации по сравнению с разрозненными тонкими час-
тицами, так как вероятность столкновения флокул с пузырьками и
вероятность их закрепления на пузырьках выше, чем несфлокулиро-
ванных тонких частиц. Поэтому применение аполярных собирателей
может улучшать флотацию не только крупных частиц и сростков, но и
тонких частиц.
15. МЕХАНИЗМ ДЕЙСТВИЯ ПЕНООБРАЗОВАТЕЛЕЙ
Пенообразователи существенно влияют на крупность пузырьков
во флотационной машине, скорость их подъема и содержание возду-
ха в пульпе, стабильность пены и прилипание частиц к пузырькам.
Установлено, что небольшой расход пенообразователя приводит
к заметному уменьшению крупности пузырьков, образующихся во
флотационных машинах [11, 22]. Это достигается как путем тонко-
го диспергирования воздуха в момент образования пузырьков, так
и в результате предотвращения их дальнейшей коалесценции в пульпе.
Концентрация различных поверхностно-активных веществ влияет
на средний размер пузырьков воздуха, находящихся во флотационной
машине (рис. 11.94). Увеличение концентрации пенообразователя при-
водит вначале к резкому, а затем к более медленному уменьшению
крупности воздушных пузырьков, причем дальнейшее увеличение кон-
центрации поверхностно-активных веществ не снижает размера пузырь-
ков [11] •
По данным А.Н. Фрумкина и А.В. Городецкой и согласно [5, 11],
пенообразователи существенно влияют на скорость подъема пузырь-
ков в жидкости. Для пузырьков флотационных размеров это влияние
проявляется в диапазоне крупности 0,5—2 мм. В растворах пенооб-
разователей по сравнению с дистиллированной водой скорость дви-
жения пузырьков снижается до скоростей подъема твердых шариков,
рассчитанных по диаграмме Рэлея. Наример, скорость подъема пузырь-
ка диаметром 1,54 мм в дистиллированной воде составляет пример-
206
11.94. Зависимость среднего размера
пузырька воздуха от концентрации по-
верхностно-активных веществ (по
Т.М. Мягковой):
1 — октиловый спирт; 2 — терпинеол;
3 — сосновое масло; 4 — гексиловый
спирт; 5 — амиловый спирт; 6 — крезол,
7 — лауриламин; 8 — олеиновая кисло-
та; 9 — этиловый ксантогенат калия
но 30 см/с, в растворе терпинеола концентрацией 20 м/г — примерно
14 см/с, а скорость подъема твердых шариков по Рэлею — примерно
16 см/с [5].
Снижение скорости подъема пузырьков при том же их размере
влияет на время пребывания пузырьков в пульпе и на содержание воз-
духа во флотационной машине. Последнее следует из уравнения
= Я1(тиъ),
где — объемное содержание воздуха во флотационной машине, до-
ли ед; q — расход воздуха на единицу площади горизонтального се-
чения камеры; и* — скорость нестесненного всплывания генериру-
емых аэратором пузырьков; т — коэффициент, учитывающий стес-
ненность всплывания пузырьков, их коалесценцию, характер переме-
шивания и циркуляцию пульпы.
При уменьшении скорости подъема пузырьков снижается скорость
обтекающих пузырек струй жидкости, что также влияет на условия
столкновения частиц с пузырьками и на время контакта столкнувших-
ся с пузырьками частиц. Форма пузырьков размером менее 1 мм в
растворах пенообразователей близка к сферической.
Основное назначение пенообразователей — создание условий для
образования пены. Флотационные пены, как известно, являются трех-
фазными, однако большое значение имеет стабильность двухфазной
пены в отсутствие твердой фазы.
Двухфазные пены. Характеристикой устойчивости двухфазных
пен служит время существования (жизни) отдельных пузырьков, все-
го объема пены или определенной его доли (например, половины объе-
ма).
Наряду с растворами поверхностно-активных веществ, широко
применяющихся во флотации, пенообразующими свойствами обла-
дают растворы электролитов, коллоидные растворы, а также монослои
нерастворимых поверхностно-активных веществ. По данным П.А. Ребин-
дера и А.А. Трапезникова, в двух последних случаях стабильность пен
207
обусловлена образованием на поверхности раздела жидкость — газ
сорбционных слоев, обладающих механическими свойствами — по-
верхностной вязкостью и прочностью.
Сорбционные слои, образованные в растворах поверхностно-ак-
тивных веществ даже при концентрациях, обеспечивающих макси-
мальную стабильность пен, не обладают механическими свойствами.
Максимум устойчивости пен в этом случае наблюдается, когда на по-
верхности раздела жидкость — газ имеется газообразный, далеко не
насыщенный адсорбционный слой молекул пенообразователя, кото-
рые движутся независимо друг от друга и не связаны между собой.
Устойчивость двухфазных пен в таких растворах большинство иссле-
дователей обычно объясняют эффектами Гиббса и Марангони, учиты-
вающими соответственно статический и динамический факторы, вы-
зывающие стабилизацию пленок.
Поверхностно-активные реагенты — пенообразователи, сорбиру-
ясь на границе раздела жидкость — газ, снижают поверхностное на-
тяжение. При растяжении пленки, образующейся между двумя пу-
зырьками, жидкость из ее объема устремляется в поверхностный слой.
Концентрация пенообразователя в объеме пленки меньше, чем в по-
верхностном слое, и поэтому приток жидкости в поверхностный слой
снижает концентрацию пенообразователя и, следовательно, повыша-
ет поверхностное натяжение. Таким образом, появляется стабилизи-
рующая сила, противодействующая растяжению пленки. Она тем боль-
ше, чем выше градиент концентрации пенообразователя между поверх-
ностным слоем и объемом пленки, что имеет большое значение в не-
равновесных условиях. Эта сила приводит к сокращению поверхност-
ти раздела, поверхность увлекает нижележащие слои жидкости, участ-
вующие в восстановлении первоначальной толщины пленки. Стаби-
лизирующая сила отсутствует, если увеличивать поверхность разде-
ла жидкость — газ в чистой воде.
В более насыщенных растворах пенообразователя при растяжении
поверхностного слоя быстрое пополнение его молекулами пенообра-
зователя мешает увеличению поверхностного натяжения, препятствую-
щего разрыву пузырька.
Трехфазные пены отличаются от двухфазных тем, что на границе
раздела фаз закрепляются твердые частицы, т.е. появляется третья
фаза.
Закрепившись на границе жидкость — газ, частицы существенно
повышают стабильность пены. Это объясняется бронированием пу-
зырьков частицами, наличием капиллярных сил, действующих на гра-
нице трехфазного контакта, и влиянием частиц, уменьшающих ско-
рость истечения воды из межпузырьковых каналов [22].
Бронирование пузырьков частицами заключается в создании плот-
ной пленки твердых частиц. При этом уменьшение поверхности пузырь-
ков, происходящее в результате их коалесценции, сопрово’ждается
208
11.95. Стабилизация поверхности пу-
зырьков воздуха закрепившейся на
них «Истицей
отрывом от пузырьков частиц, т.е. требует затраты энергии. Поэтому
бронирование пузырьков частицами приводит к повышению устойчи-
вости пены.
При закреплении твердых частиц на поверхности пузырьков в плен-
ке жидкости возникают капиллярные силы, направленные на поддер-
жание определенной толщины жидкой прослойки между пузырька-
ми. Отклонение положения участков поверхностей пузырьков в ту
или иную сторону вызовет повышение поверхностной энергии сис-
темы, которое будет стремиться удержать поверхность пузырьков
в прежнем состоянии (рис. 11.95).
Твердые частицы, закрепившиеся на пузырьках, препятствуют вы-
теканию жидкости из пленок, разделяющих пузырьки, и тем самым
повышают стабильность пены [22].
По А.К. Лившицу и СВ. Дуденкову, если частица тонка и очень
гидрофобна, т.е. краевой угол близок к 90°, то закрепление части-
цы на поверхности раздела может способствовать коалесценции пу-
зырьков, так как их поверхности приблизятся на такое весьма малое
расстояние, когда пленка между ними становится неустойчивой. При
большом содержании гидрофобизированных крупных частиц (6 < 90°)
тонкие частицы не могут закрепляться одновременно на поверхнос-
ти двух пузырьков и их разрушающее действие на пену уменьшается.
16. МЕХАНИЗМ АГРЕГИРУЮЩЕГО ДЕЙСТВИЯ РЕАГЕНТОВ
Различают три способа образования агрегатов: коагуляцию элек-
тролитами, флокуляцию гидроф©визирующими реагентами и поли-
мерами.
Коагуляция электролитами. Слипание частиц может происходить
под действием сил Лондона — Ван-дер-Ваальса, которые достигают
значительной величины на малых расстояниях и резко убывают на боль-
ших. Поверхность большинства минералов в нейтральной и щелочной
средах заряжена отрицательно. Поэтому при сближении двух частиц
на такое расстояние, при котором перекрываются их диффузные слои,
возникают силы отталкивания, препятствующие дальнейшему сбли-
209
14-6926
жению частиц. Добавка электролитов уменьшает заряд поверхности
и толщину диффузного слоя, в результате чего частицы могут сбли-
зиться до расстояний, на которых силы притяжения достаточно вели-
ки, чтобы произошла коагуляция.
Флокуляция частиц гидрофобизирующими реагентами происхо-
дит вследствие уменьшения поверхностной энергии частиц при их аг-
регации. При гидрофобизаЦии поверхности частиц силы взаимодей-
ствия между частицами и водой меньше, чем между самими частица-
ми, что и приводит к слипанию частиц. Поэтому собиратели могут вы-
зывать флокуляцию. Флокулирующее действие гетерополярных со-
бирателей значительно усиливается при введении в пульпу аполярных
собирателей.
Флокуляция частиц высокомолекулярными реагентами — поли-
мерами происходит в’ результате образования между частицами мос-
тиков на закрепившихся на их поверхности молекул или мицелл по-
лимеров. Это позволяет агрегировать частицы без снижения заряда
их поверхности и уменьшение толщины диффузного слоя, так как
иэ-за больших размеров мостики могут перекрывать удвоенную тол-
щину двойных электрических слоев и соответственно действие сил
электростатического отталкивания сближающихся частиц. Этому про-
цессу способствует уменьшению заряда частиц за счет сорбции высо-
комолекулярного флокулянта, имеющего заряд, противоположный
заряду частицы, или введения в пульпу неорганических электролитов.
Закрепление неионогенных полимеров на поверхности минералов
обусловлено преимущественно водородными связями. Вследствие боль-
шого числа полярных групп в каждой молекуле полимера, взаимодей-
ствующих с поверхностью минерала, суммарная энергия водородной
связи молекулы получается очень высокой и может обеспечить зак-
репление неионогенных полимеров.
Ионогенные полимеры закрепляются на поверхности минералов
водородными связями в результате химического и электростатичес-
кого взаимодействия.
При флокуляции полимерами характерен невысокий расход реа-
гентов, часто в сотни раз меньший, чем расход коагулянтов. Подбор
оптимального расхода флокулянта необходим, так как при его пре-
вышении эффективность агрегации частиц падает вплоть до их дис-
пергирования.
Действие полимера зависит от исходной концентрации его раст-
вора. В пульпу обычно подают 0,05—0,1 %-ные растворы. Сильное и
длительное перемешивание пульпы с полимерами недопустимо, так
как флокулы могут разрушаться, после чего флокуляция полностью
не восстанавливается. Для уменьшения расхода флокулянта в ряде
случаев применяется дробная загрузка его в пульпу и совместное при-
менение флокулянтов и коагулянтов.
Флокулирующее действие оказывают также и гидроксиды поли-
валентных металлов.
210
Для обогащения тонких частиц разработан процесс, названный се-
лективной флокуляцией. Селективная флокуляция используется при
флотационном разделении тонких частиц и в качестве самостоятель-
ного процесса обогащения. В первом случае могут быть сфлокули-
рованы как частицы флотируемых, так и подавляемых минералов.
При применении селективной флокуляции в качестве самостоя-
тельного процесса обогащения сфлокулированный минерал отделя-
ется от диспергированных частиц другого минерала в аппаратах ти-
па сгустителя или отстойника. Ж. Китченером с сотрудниками про-
ведены исследования по разработке для обогащения весьма шламис-
тых окисленных медных руд развитой технологической схемы, осно-
ванной на использовании только селективной флокуляции.
Примеры применения селективной флокуляции для обогащения
железных и хромистых руд приведены в гл. 20.
ЧАСТЬ III
ФИЗИЧЕСКИЕ ОСНОВЫ МИНЕРАЛИЗАЦИИ
ПУЗЫРЬКОВ В ПУЛЬПЕ.
ФЛОТАЦИОННЫЕ МАШИНЫ
17. КИНЕТИКА ФЛОТАЦИИ1)
Кинетика флотации изучает развитие флотации во времени в зави-
симости от различных параметров.
Извлечение в концентрат основной массы частиц, находящихся в
пульпе, достигается в результате столкновения и закрепления частиц
на пузырьках, удержания на пузырьках при их подъеме в пену и удер-
жания в пене до удаления концентрата. Тонкие частицы, не закрепив-
шиеся на пузырьках, могут попасть в концентрат благодаря механичес-
кому выносу их вместе с жидкостью.
Существуют различные возможности поведения частиц в камере
(прикрепление и отрыв от пузырьков в пульпе и пене, повторные прик-
репления и отрывы и т.д.), заканчивающиеся выходом частиц в концент-
рат либо хвосты. Все эти процессы показаны на диаграмме (рис. III. 1)
в виде переходов частиц внутри камеры флотационной машины между
четырьмя состояниями: 1 — свободные частицы в пульпе; 2 — закреп-
ленные на пузырьках частицы в пульпе; 3 — закрепленные на пузырь-
ках частицы в пене; 4 — свободные частицы в пене [4] .
Вероятность совершения перехода зависит от физических и химичес-
ких свойств частицы — размера, массы, формы, минерального состава,
*) Глава написана М.Ф. Емельяновым и И.И. Максимовым.
211
III.1. Диаграмма переходов частиц из одного состояния в другое в машине непре-
рывного действия
состояния поверхности и т.д. Группу частиц, обладающих одинаковой
вероятностью перехода из одного состояния в другое, назовем классом
флотируемости. Частицы, входящие в один класс флотируемости, долж-
ны обладать близкими размерами, одинаковыми минеральным составом
и состоянием поверхности. В дальнейшем, если это не оговорено особо,
рассматриваются частицы одного класса флотируемости.
17.1. Модели флотации
Модель флотации — комплекс представлений, позволяющих сфор-
мулировать полную систему уравнений, определяющих развитие фло-
тации во времени. Описание флотации для любой модели может быть
дано на основе вероятностного способа,.в котором полная вероятность
выхода частиц в концентрат за время t может быть выражена в виде
решения алгебраической системы уравнений [4].
Математический аппарат, обычно используемый для описания мо-
делей флотации, — обыкновенные дифференциальные уравнения.
Модель четырех состояний, упомянутая выше, описывает поведение
частиц системой четырех уравнений, выражающих баланс частиц, в каж-
дом из состояний на основе предположения о том, что масса частиц,
переходящих из данного состояния в любое другое в единицу времени,
пропорциональна массе частиц, находящихся в данном состоянии в рас-
сматриваемый момент времени t:
dMi/dr =М0 + К2ХМ2 + К4ХМ4 -КХ2МХ-КХ4МХ -KXtMx
dM2/dt =К12МХ +К32М3 К2ХМ2 -К23М2-^ K2tM2
dM3/dt=K23M2 + - К32М3 - К34М3 - К3(М3
( (П1.1)
(ЦИд jdt — Кх 4МХ +К 34М3 — К4 ХМ4 — К4 3М4 — К4сМ4 „
где MQ - масса частиц, поступающих во флотационную машину в единицу
времени; , М3 и М4 - массы частиц в состояниях 1,2, 3, и 4 в мо-
212
мент времени t; Kl2, К\4, K2V K23, K32, K34, К41 и K43 - константы
скоростей переходов, представляющие собой вероятности совершения
переходов из одного состояния в другое в единицу времени; К f иК2 t—
константы скоростей переходов соответственно из состоянии 1 и 2 в
хвосты; К^с и К^с — константы скоростей переходов соответственно
из состояний 3 и 4 в концентрат.
При установившемся непрерывном процессе, когда dMJdt = О,
где i — 1, 2, 3, 4, можно найти Mi и извлечение е, однако получаемые
выражения довольно громоздки и здесь не приводятся.
Основной недостаток модели четырех состояний — ее большая слож-
ность. Даже если принять, что флотация проходит в свободных усло-
виях, т.е. занятость поверхности пузырьков мала и минерализация
пузырьков незначительна, а, следовательно, можно пренебречь осажде-
нием перегруженных пузырьков из пены в пульпу и выносом их в хвос-
ты (&2t = 0 и К32 = 0), то для описания флотации одного класса фло-
тируемости необходимо знать 10 параметров. Поэтому практическое
применение модели четырех состояний затруднительно. Ее теоретичес-
кое значение состоит в том, что она позволяет хотя бы качественно
анализировать некоторые существенные стороны флотации, которые
не учитывались в более простых моделях.
В двухфазной модели флотации, предложенной К. Харрисом и
X. Риммером, пульпа и пена рассматриваются как идеально переме-
шиваемые фазы, в каждой из которых частицы находятся только в од-
ном состоянии. Двухфазная модель может быть получена из модели
четырех состояний, если предположить, что минерализованные пузырь-
ки мгновенно всплывают в пену, а частицы, осыпавшиеся с пузырьков
в пенном слое, мгновенно возвращаются в пульпу. Если в уравнениях
системы (III. 1) заменить состояния 1 и 2 одним состоянием пульпы
р, а состояния 3 и 4 — одним состоянием пены f, то получим систему
уравнений, описывающих кинетику флотации в двухфазной модели:
dMptdt — — KpfMp + А'у-рЛ/у Мр + Мо;
d^/dr =KpfMp-KfpMf-KfcMf.
Практическое применение двухфазной модели также затруднитель-
но, хотя она может быть использована для теоретического анализа
процесса.
Однофазная модель может быть получена из двухфазной, если пред-
положить, что пена весьма быстро удаляется в концентрат.
Для описания процесса во флотационной колонне Д. Фюрстенау
и К. Шастри использовали однофазную модель, включающую два сос-
тояния частиц в пульпе, — свободные частицы и частицы, закрепленные
на пузырьках.
Если считать, что минерализованные пузырьки весьма быстро под-
213
нимаются в пену, то получаем однофазную модель, в которой частицы
находятся только в одном состоянии — свободных частиц в пульпе.
Эта модель развита в работах [5 и др.] и является наиболее распрост-
раненной упрощенной моделью, изучению которой посвящено большое
число экспериментальных исследований.
Из модели четырех состояний ее можно получить при следующих
предположениях:'переходы частиц между состояниями совершаются
мгновенно, т.е. запаздывание при переходах не учитывается (это пред-
положение не имеет значения для установившегося процесса в машинах
непрерывного действия); механический вынос частиц в пену по срав-
нению с выносом частиц на пузырьках мал и им можно пренебречь.
Первое предположение означает, что за время подъема пузырьков
в пену и съема пены концентрация частиц в пульпе изменяется незначи-
тельно. Это предположение оправдано в силу того, что в машинах перио-
дического действия время подъема пузырьков в пену и время съема
пены обычно значительно меньше, чем время флотации.
Второе предположение справедливо для частиц флотируемых мине-
ралов, так как их основная масса, как правило, переходит в концентрат
благодаря столкновению и закреплению на пузырьках. Для тонких
частиц нефлотируемых минералов механическим выносом во многих
случаях пренебречь нельзя [22] .
Извлечение частиц данного класса флотируемости из пульпы в кон-
центрат указанной однофазной модели характеризуется вероятностью
флотации в единицу времени . Эта величина называется также удель-
ной скоростью флотации. Вероятность флотации К\ отражает все основ-
ные этапы флотационного процесса — столкновение частиц с пузырьком,
закрепление на пузырьке, удержание частиц на пузырьках до выхода
в пенный слой и удержание в пене до съема в концентрат.
Столкновение и закрепление частиц на пузырьке происходят под
действием гидродинамических и поверхностных сил. На расстояниях
от пузырька, больших по сравнению с размером частиц, на частицу
действуют гидродинамические силы. На расстояниях, малых по сравне-
нию с размером частицы, превалируют поверхностные силы. Различие
в масштабах действия различных сил позволяет отделить этап столк-
новения от этапа закрепления и условно отнести к этапу столкновения
сближение частицы и пузырька до расстояний, на которых действие
поверхностных сил становится определяющим. Вероятно, такое раз-
деление этапов столкновения и закрепления допустимо при флотации
не очень тонких частиц.
Этапы закрепления и удержания частицы на пузырьке условно можно
разделить, считая, что закрепление заканчивается фиксацией частицы
на пузырьке, а этап удержания — это сохранение комплекса пузырек —
частица до выхода в пенный слой.
В соответствии с такими представлениями было предложено выра-
жать вероятность флотации в единицу времени частиц данного класса
214
флотируемости в виде произведения четырех сомножителей [5 и др.]
^=И/сИ/3И/удИ/п, (Ш.2)
где IVC, IV3, И/уд и % - вероятность соответственно столкновения в
единицу времени частиц с пузырьками, закрепления частиц на пузырь-
ках, удержания закрепившихся на пузырьках частиц до выноса в пену
и удержания частиц в пене:
И/ = d MJMd t’,W.= dM/dMc;
V V z «J O' V z
и'уд = амуд/лц; и/п = <wn/d^B,
dMc, dM3, (1Муд и dMn — масса частиц соответственно столкнувшихся
с пузырьками, закрепившихся на пузырьках, вынесенных в пену, извле-
ченных в концентрат за время df.
Подставляя вероятности отдельных этапов в уравнение (Ш.2),
получаем
Kt = dMJMdt
или ' (Ш.З)
dMc = K1Mdt.
17.2. Анализ однофазной модели
Столкновение частиц с пузырьками. Столкновение частиц с пузырь-
ками в отсутствие перемешивания. При движении во флотационной
пульпе пузырька диаметром D с ним столкнутся все частицы, находя-
щиеся внутри некоторой трубки, имеющей на бесконечном удалении
от пузырька диаметр d (рис. Ш.2). Если диаметр частиц d, то столкнув-
шимися с пузырьками частицами будем считать те, продолжения траек-
торий центра масс которых при движении в потоке жидкости, обтекаю-
щей пузырек, проходят от центра пузырька на‘ минимальном расстоя-
нии r>(Z) + d)/2. Продолжения траекторий частиц, которые удовлет-
воряют условию Z>/2 < г < (D + d)/2, соответствуют столкновениям
в результате эффекта зацепления, т.е. за счет геометрических размеров
частиц. Продолжения траекторий частиц, которые заканчиваются на
поверхности пузырьков, определяются столкновениями в результате
сноса частиц с линий тока жидкости под действием силы тяжести, инер-
ции частиц и других факторов.
Столкновение частиц с пузырьком характеризуется эффективностью
столкновения Е, которая определяется как отношение массы частиц,
встретившихся с пузырьком, к массе частиц, которые попали бы на
215
III. 2. Схема столкновения частиц с пузырьком
в спокойной жидкости:
2 — предельные траектории столкновения,
3 — траектория, разграничивающая снос и зацеп-
ленйе; 4, 5 — линии тока жидкости
поверхность пузырька > если бы они двигались прямолинейно и равно-
мерно. Величина Е представляет собой отношение площади попереч-
ного сечения цилиндра диаметром а к площади поперечного сечения
цилиндра диаметром D + d'.
E = a2/(D + d)2. (Ш.4)
Для расчета Е в отсутствие перемешивания предложены различные
формулы. При выводе формул не учитывалось взаимное влияние час-
тиц и пузырьков при движении в пульпе. Впервые Е была рассчитана
О.С. Богдановым, при этом были учтены эффект сноса в результате
действия силы тяжести и эффект зацепления. К. Сазерленд и А. Годэн
при расчете учитывали только эффект зацепления.
Выражения для Е получены для двух предельных случаев обтека-
ния пузырька идеальной жидкостью (потенциальное обтекание) и бе-
зынерционной вязкой жидкостью при полной заторможенности поверх-
ности пузырька ПАВ (вязкое обтекание). При этом принималось, что
частица и пузырек имеют сферическую форму и движутся относитель-
но жидкости соответственно с постоянными скоростями ир и иь. Ско-
рость движения частицы ир принималась равной скорости осаждения
частицы в неподвижной жидкости, т.е. инерционные свойства частицы
и жидкости не учитывались.
При потенциальном обтекании пузырька формулу для расчета Е
можно представить в следующем виде:
£ = (7/(1 +G) +3а(1 + а + а3/3)/(1 + G).(1 + а)3, (III.5)
где G = Up/ub и а = d/D.
216
При вязком обтекании пузырька, поверхность которого полностью
заторможена, выражение для Е имеет вид
£=(7/(1 + (7) + За2 (1 + 2а/3)/2(1 + (?) (1 + а)3. (III.6)
Из формул (III. 5) и (III.6) видно, что при а = О
£ = (7/(1 + (7) = £0, (П1.7)
т.е. представляет собой эффективность столкновения, учитывающую
столкновения за счет сноса частиц с линий тока жидкости в результате
действия силы тяжести. Как показано Е.Б. Кремером, при принятых
выше допущениях уравнение (Ш.7) выполняется при любом ламинар-
ном законе обтекания пузырька жидкостью.
Эффективности столкновения за счет эффекта зацепления Ег =
= Е — Ео. Если G < 1 и а < 1, то при потенциальном обтекании £\ За,
а при вязком обтекании £1 « За2/2.
Таким образом, на основании вышеизложенного можно получить
для двух предельных случаев обтекания пузырьков — идеальной жид-
костью и вязкой жидкостью при полной заторможенности поверхности
пузырька ПАВ следующие приближенные выражения для расчета £:
£^ (7/(1 + (?) + За; (III.8)
£^ (7/(1+(?) + За2/2. (III.9)
Формулы (Ш.6) и (III.9) можно применять для расчета £ при исполь-
зовании пузырьков соответствующих числу Рейнольдса Re •< 1 (т.е.
£< 0,13 мм). Такие пузырьки движутся как твердые шарики независи-
мо от концентрации ПАВ. Для пузырьков диаметром 0,2 мм (Re =
= 3,3) можно также без большой погрешности применять эти формулы.
При движении пузырьков диаметром 0,8 мм и более (80 < Re < 500)
из-за сноса ПАВ к корме пузырьков поверхность их верхней полусфе-
ры, с которой в основном сталкиваются частицы, по-видимому, не
заторможена ПАВ и гидродинамическое поле около верхней полусфе-
ры пузырька можно приближенно описывать потенциальным течением
идеальной жидкости (по данным В.Г. Левича). В этом случае £ можно
рассчитывать по формулам (III.5) и (III.8).
В переходной области (0,5 < Re < 80) заторможенность поверх-
ности увеличивается с уменьшением Re, однако изменение заторможен-
ности в зависимости от крупности пузырька и закон обтекания неиз-
вестны.
Л. Флинт и В. Ховарт вычисляли значение £ исходя из сноса частиц
с линий тока жидкости силами тяжести и инерцией частиц без учета
эффекта зацепления. Значения £ были получены в виде функции (7 и
217
параметра Стокса Stk:
Stk = p^2^/(9 д£), (ШЛО)
где р- — плотность частицы; р — вязкость жидкости.
При Stk <0,1 силами инерции можно пренебречь и Е в отсутствие
эффекта зацепления для потенциального и вязкого обтекания пузырька
жидкостью выражается формулой (III.7). Это означает, что выраже-
ниями (III.5), (Ш.6), (Ш.8) и (Ш.9) можно пользоваться до значений
Stk =* 0,1. Если Stk > 0,1, то указанные формулы дают заниженные
значения £, так как они не учитывают инерционных свойств частицы.
В.М. Волощук и Т.А. Муйдинова получили приближенное значение
Е, учитывающее эффект зацепления и снос частиц с линий тока жидкости
силами тяжести и инерцией частиц для потенциального обтекания пу-
зырька жидкостью по формуле
£^l + (£f - 1)/(1 + G) (1 +а)3, (Ш.11)
где Е^ — эффективность столкновения при чисто инерционном осажде-
нии частицы на пузырьке, т.е. когда пузырек сталкивается с частицей
только в результате инерции частицы.
Ej является функцией Stk*
Stk* = Stk/ (1 + а) + StkKp,
где StkKp = 0,083 — критическое число Стокса для модели потенциаль-
ного обтекания при чисто инерционном осаждении.
Зависимость £г- от Stk* может быть получена на основании данных
Волощука и Муйдиновой.
На рис. III.3 показана зависимость £ от крупности частиц плотностью
5200 кг/м3 при потенциальном (D = 2 мм) и вязком (D = 0,2 мм)
обтекании пузырька жидкостью, рассчитанная по формулам (Ш.5),
(Ш.6) и (III.11). Для режима потенциального обтекания при крупности
частиц менее 30 мкм Е в основном определяется эффектом зацепления,
вклад которого в Е составляет 83,5—90 %.
С увеличением крупности частиц роль гравитационного сноса и
влияние силы инерции на Е все более возрастают. Так, при крупности
частиц 125 мкм значение Е, определяемое эффектом зацепления, сос-
тавляет 0,15; при дополнительном учете гравитационного сноса Е по-
вышается до 0,26, а с учетом сноса силами инерции £ возрастает до 0,57.
В то же время расчет показывает, что при чисто инерционном осаж-
дении £ для данного случая составляет лишь 0,36, что в 1,6 раза меньше
значения £, определяемого эффектом зацепления и сносом силами
тяжести и инерции.
При вязком обтекании пузырька жидкостью, т.е. при использовании
мелких пузырьков, они сталкиваются в основном в результате гравита-
218
III.3. Зависимость эффективности столкновения от крупности частиц при потен-
циальном (д) и вязком (б) обтекании пузырька жидкостью:
Столкновение за счет: 1 — эффекта зацепления; 2 — зацепления и гравитационного
сноса; 3 — эффекта зацепления, гравитационного сноса и инерционного осаждения
ционного сноса (см. рис. Ш.З, б). Вклад эффекта зацепления не пре-
вышает 25 %. Гравитационный снос имеет очень большое значение для
флотации тонких частиц.
В работе [13] применительно к очистке сточных вод рассмотрено
движение мелкой сферической частицы, имеющей плотность, близкую
к плотности воды, вблизи поверхности поднимающегося пузырька,
при этом на малых расстояниях учитываются силы так называемого
ближнего гидродинамического взаимодействия (БГВ) частицы и пузырь-
ка, определяемые возмущением, которое вносит частица в гидродина-
мическое поле пузырька.
Предполагается, что с уменьшением расстояния между частицей и пу-
зырьком быстро возрастает сила сопротивления, обусловленная вяз-
костью жидкости в прослойке, разделяющей поверхность частицы и
поверхность жидкость — газ. Если за время движения частицы вблизи
поверхности пузырька пленка не достигает критической толщины,
после чего происходит спонтанный разрыв пленки, частица может не
закрепиться на пузырьке. Учет БГВ снижает значение Е, определяемое
эффектом зацепления, в несколько раз.
Применительно к флотации минеральных частиц, имеющих плот-
ность значительно выше плотности воды, при вязком обтекании пу-
зырька жидкостью основной вклад в Е определяется гравитационным
сносом, поэтому при флотации тонких частиц мелкими пузырьками
роль БГВ незначительна. При потенциальном обтекании БГВ может
уменьшить Е. Однако в отличие от флотации нефтяных капель при
водоочистке при флотации минеральных частиц БГВ может быть зна-
219
чительно ослаблено. Минеральные частицы имеют углы, выступы, что
существенно облегчает прорыв пленки между частицей и пузырьком,
как это показано И. Анфрансом и И. Китченером. Кроме того, вероят-
ность закрепления частиц на пузырьках может быть значительно вы-
ше, когда они сталкиваются в результате сноса частиц с линий тока
жидкости и удара о поверхность пузырьков, поэтому с учетом закреп-
ления частиц роль эффекта зацепления может быть ниже, чем гравита-
ционного сноса.
Из рис. Ш. 3 видно, что Е падает с уменьшением крупности частиц.
Согласно приближенным расчетам, выполненным Д. Ри и Д. Рэтклифом,
падение Е происходит до крупности 1 мкм, а затем при дальнейшем
уменьшении размера частиц Е увеличивается. Возрастание Е для суб-
микронных частиц соответствует диффузному режиму столкновения
частиц с пузырьками благодаря броуновскому движению.
Расчеты показывают, что в пределах действия любого из законов
обтекания пузырька жидкостью Е увеличивается с уменьшением разме-
ра пузырька. Однако изменение закона обтекания при снижении круп-
ности пузырьков может уменьшить Е, так как при потенциальном об-
текании Е & первом приближении равна За, а при вязком За2/2. На
рис. III.4 показана зависимость эффективности столкновения от круп-
ности пузырьков для частиц размером 15 и 30 мкм. При переходе от
потенциального обтекания (D = 0,8 мм) к вязкому, которое принято
для пузырьков диаметром 0,2 мм, Е несколько уменьшается для час-
тиц 15 мкм и остается примерно постоянной для частиц 30 мкм. Так
как закон обтекания в переходной области неизвестен, кривые в диа-
пазоне размеров пузырьков 0,2—0,8 мм проведены пунктиром.
Если известна Е, то вероятность столкновения частиц с пузырьками
в единицу времени (т.е. число столкновений, приходящихся на одну
частицу) выразится как
Wc = 3Eq (1 + а)2 (1 + G) / (2D), (III. 12)
где q — поток воздуха, приходящийся на единицу площади горизонталь-
ного сечения камеры.
Результаты расчетов Wc по уравнению (III. 12) в зависимости от круп-
ности частиц при постоянном расходе подаваемого воздуха на единицу
площади камеры, т.е.при q = const показывают (рис. III.5) , что увеличе-
ние крупности частиц существенно повышает IVC. Так, при десятикрат-
ном возрастании крупности частиц Wc увеличивается в 30 раз.
Столкновение частиц с пузырьками в условиях перемешивания.
При перемешивании пульпы импеллером возникает турбулентное дви-
жение. Число Re в импеллерных флотационных машинах велико: в ла-
бораторных машинах имеет порядок 104—10s, в промышленных —
10®. При больших числах Re микроструктура реальных турбулентных
220
III.4. Зависимость эффективности
столкновения от крупности пузырь-
ков:
1,2 — диаметр частиц соответствен-
но 15 и ЭО мкм
III.5. Зависимость вероятности
столкновения W частиц с пузырь-
ком в единицу времени от круп-
ности частиц d (D = 2 мм, q —
= 1/(мин • м3) Др = 5000 кг/м3):
1 — без перемешивания; 2 — при
перемешивании, G = 2 м2/с3
потоков — приблизительно изотропна1 \ хотя поток как целое неи-
зотропен. Поэтому в первом приближении будем считать турбулент-
ность пульпы в импеллерных флотационных машинах локально изо-
тропной и при рассмотрении ее влияния на отдельные процессы элемен-
тарного акта флотации пользоваться представлениями теории локально
изотропной турбулентности А.И. Колмогорова.
В турбулентных потоках на осредненную скорость движения частиц
и пузырьков, которую приблизительно можно рассматривать как ко-
нечную (седиментационную) скорость частиц и пузырьков, наклады-
вается пульсационная скорость. Это приводит к тому, что скорость
сближения частиц и пузырьков (в спокойной жидкости ир + иь) возрас-
тает, в результате чего увеличивается и Wc. Кроме того, турбулентные
пульсации могут также увеличивать Е в результате спрямления траек-
торий движения частиц.
•При турбулентном движении наблюдается спектр пульсаций раз-
личного масштаба X — от максимальных, характеризующихся внешним
масштабом турбулентности L, до минимальных, определяемых внут-
ренним масштабом турбулентности Хо. Величина L обычно значительно
больше диаметра пузырьков и частиц и составляет 0,08 диаметра импел-
лера. Механизм столкновения частиц и пузырьков в значительной мере
определяется соотношением размеров частиц и пузырьков и внутрен-
ним масштабом турбулентности.
Турбулентность является изотропной, если ее статические свойства не
зависят от направления.
221
Величина Ло вычисляется по формуле
\о = (^/01/4, (Ш.13)
где v — кинематическая вязкость жидкости (пульпы); G — диссипа-
ция энергии, представляющая собой мощность, рассеиваемую в единице
массы пульпы.
При данной v значение Ло определяется значением (?, которое весьма
существенно изменяется в зависимости от положения точки в агитацион-
ном чане [66] . Вблизи концов лопастей импеллера, не имеющего стато-
ра, С примерно в 50 раз, превышает среднюю диссипацию энергии € для
чана в целом. Объем этой зоны составляет всего 0,5 % общего объема
чана.
По данным Ф. Лиепе и X. Мекеля, при наличии статора вблизи концов
лопастей импеллера 6 = 3006?. В остальной зоне импеллера, охватываю-
щей область до стенок чада и имеющей объем 9,5 % объема чана, дис-
сипация энергии больше 6? в 5,4 раза. В основной части объема, предс-
тавляющей собой относительно спокойную зону и составляющей 90 %
всего объема чана, € = 0,256?.
В промышленных флотационных машинах в спокойной зоне пульпы
С может достигать 0,5-1, а вблизи лопаток импеллера - 1000 м2/с3.
Соответственно Ло колеблется от 5 до 40 мкм. Таким образом, соот-
ношения между размерами частиц, пузырьков и внутренним масшта-
бом турбулентности в различных зонах флотокамеры существенно
изменяются. Для оценки Wc можно использовать имеющиеся аналити-
ческие решения, позволяющие рассчитать Wc для ряда соотношений
между Ло, d и D.
В зоне максимальной турбулентности, т.е. вблизи лопаток импел-
лера, расчет Wc может быть осуществлен по следующей формуле [52] :
И'с = 1,2Е(1 + a)2qA(a>bf) + + a)2qBIbf), (Ш.14)
где _________________.
А + )/3 exp [-3(vpf + vbf)2/[2(v^+'v'^)] ,
в = { l3(^p/ + + v’2]/3(vpf + vbf)} erf [(Гр/ +
+ v bf)y/3iy/?v'2 + V%],
где v"pj- и v b? — осредненные (конечные) скорости частицы и пузырька
относительно жидкости; v'p nvj - дисперсии пульсационных скорос-
х _ 2
тей частицы и пузырька; erfx = (2/тт) J е у dy - интеграл вероятности.
0
222
Формула (III. 14) справедлива в инерционной подобласти энерге-
тического спектра турбулентности, когда размеры частиц и пузырьков
значительно больше Хо • _
При отсутствии турбулентности, когда ~v •2 = v >2b = 0, первый член,
отражающий в основном влияние турбулентности на процесс столкно-
вения, становится равным нулю, а во втором члене erf(°°) = 1. Тогда
формула (III.14) переходит в (111.12), так как в этом случае ~vpf =
= upHiT6/=u6.
Выражение (III. 14) получено, исходя из того, что при очень сильной
турбулентности сталкивающиеся тела случайно распределены в прост-
ранстве и имеют независимые друг от друга случайные скорости. Сбли-
жение тел рассматривается как их катапультирование навстречу друг
другу из независимо движущихся вихрей.
Условие независимости скоростей сталкивающихся тел выражается
следующим образом [52] •
w>0,85py2g/C, (III. 15)
где и — скорость движения частицы или пузырька в спокойной жидкос-
2
ти; у у — дисперсия пульсационной скорости жидкости.
По данным X. Шуберта и Г. Бишоф-Бергера, вблизи импеллера
составляет 21-28 % линейной скорости импеллера us и может
быть принята в среднем, равной 0,25м$. Это позволяет оценить нижний
предел размеров пузырьков и частиц, удовлетворяющих условию
(Ш.15). Ему отвечают пузырьки D> 0,3 мм и частицыd> 0,1 мм плот-
ностью 5000 кг/м3. Движение таких частиц и пузырьков не подчиняет-
ся закону Стокса. В этом случае F'2 и 1)'ь можно рассчитать, исходя
из следующих соотношений:
= (b2 +12 i//2)/(b2 +Ф2У,
b = 1 ,SpfCD VzHy-/ \d(2pp + pf) ] ;
/ =3py/(2pp + py), v,2f= (f/b)2 + [302 (1-Z)2iT'2/(b2+02);
/ = 2(pp-py)g, 0 = яГу/(2£),
где U'2 - дисперсия пульсационной скорости частицы (или пузырька);
Ср — коэффициент сопротивления жидкости движению тела; —
средняя квадратическая относительная скорость частицы (или пузырь-
ка) ; р и d — соответственно плотность и диаметр частицы (или пузырь-
ка) ; п — частота вращения импеллера.
Так как частица сталкивается с пузырьком вблизи лопаток импел-
223
Таблица III.l
Результаты расчетов Wc по формулам (III. 14) и (III. 12)
Форму- ла Е А, м/с 1.2F (1 + + а)М/ /(^7/,/) В, м/с l.Stfll + + ССГВ! / № bf) Wc, мин 1
(III. 12) 0,7 0 0 0,155 1180 1180
(III. 14) 0,86 1,33 2.036 1,49 2844 4880
лера во вращающейся жидкости, v и 77представляют собой скорос-
ти в поле центробежных сил.
При расчете 77 у Mi>bf принималось, что при значительных ускоре-
ниях поля центробежных сил / (/ > g) частица и пузырек движутся в
радиальном направлении навстречу друг другу. При этом не учиты-
вается движение пузырька и частицы под действием гравитации.
В качестве примера в табл. III. 1 приведены результаты расчета по
формуле (III. 14) вероятности столкновения Wc частиц размером
0,125 мм плотностью 5200 кг/м3 с пузырьками размером 1,26 мм в
единицу времени при q = 1 м3/(мин • м2) и / = 100 м/с2. Для срав-
нения в табл. III. 1 также даны результаты расчета И', по формуле
(III.12) при столкновении частиц и пузырьков такой же крупности в
спокойной жидкости.
Данные табл. III. 1 показывают, что для принятых размеров частиц
и пузырьков в зоне максимальной плотности рассеиваемой энергии
И', возрастает примерно в 4 раза по сравнению с процессом столкновения
в спокойной жидкости. Оба члена вносят приблизительно равный вклад
в повышение Wc. Так как в данном случае Е близка к единице, то нель-
зя ожидать заметного роста Wc за счет увеличения Е до максимального
значения.
В случае низкой диссипации энергии, характерной для относительно
спокойной зоны флотационной машиныz может выполняться условие
Ло > D > d, соответствующее вязкой области, или области диссипации,
энергетического спектра турбулентности. В области диссипации под
действием вязких сил происходит ламинаризация течения жидкости
внутри вихрей. Лиепе и Мекель считают, что область диссипации отве-
чает размерам вихрей Л < 10 -12,5Л0 • Тогда при Ло = 30 4- 40 мкм вихри,
соответствующие этой области, имеют размер Л < 300—500 мкм.
Расчет Wc в спокойной зоне пульпы может быть проведен по следую-
щей формуле
И'с = 2,39.1,3</£ (1 +ау [тд + тр)г (<?» 1/2 +
+ 0» +гр)У/з (1 +a)2e'/(36p)] 1/2/(MjO), (П1.16)
где тр и ть - время релаксации соответственно частицы и пузырька;
гк = ик1^,ик ~ конечная скорость тела в жидкости; к = р,Ь.
224 .
Первый член в квадратных скобках в формуле (III.16) отражает
влияние на столкновение ноля ускорений a вихря, так как в
области диссипации а ~ 1,3(63/р) ^2. Произведение v/<2 (гр +
+ Tjj) представляет собой пульсационную составляющую скорости
сближения частицы и пузырька, обусловленную их неодинаковой инер-
цией при движении в поле ускорений а . Второй член в скобках предс-
тавляет собой составляющую скорости сближения частицы и пузырька,
обусловленную гравитацией. Произведение g(jp + ть) равно ир + иь.
Третий член в скобках отражает влияние градиента скорости ламинар-
ного движения жидкости внутри вихря масштаба X . Величина (6/v)-'2
представляет собой градиент скорости жидкости, который способст-
вует сближению частиц.
В том случае, когда перемешивание отсутствует (С = 0), из (III.16)
получаем
Wc = 1,38^(1 + а)2 (1 + G)ID.
Эта формула отличается от формулы (III. 12) лишь на ~ 9 % вели-
чиной численного коэффициента.
Результаты расчетов Wc по формуле (III.16) для частиц размером
7,5; 15 и 30 мкм и пузырьков диаметром 0,2 мм в зависимости от
6 приведены в табл. Ш.2. Значение Е с учетом возросших за счет турбу-
лентности скоростей частиц и пузырьков вычислялось по формуле
(III.8), так как в этом случае внутри вихрей движение жидкости счи-
тается ламинарным. В табл. Ш.2 приведены также значения Wc, рас-
считанные по формуле (III. 12).
Из табл. III.2 видно, что при (? ~ 0,5-1 м2/с3 Wc, рассчитанная по
формуле (III.16). в 4—7 раз больше значения К'с для спокойной жид-
кости, а при € = 0,01 м2/с3 значения Wc, вычисленные по обеим форму-
лам, примерно равны.
При 6 = 0,1 м2/с3 вклад членов, отражающих влияние неодинако-
вой инерции частиц и пузырьков и градиента скорости жидкости, приб-
лизительно одинаков. При G > 0,1 м2/с3 преобладает первый член, при
G < 0,1 м2 /с3 — второй. Возрастание И7С за счет £ при принятых допу-
щениях практически не происходит.
Для промежуточных случаев средних значений 6? расчеты также
показали увеличение Wc при перемешивании в несколько раз.
Таким образом, в турбулентных потоках 1VC существенно возрастает
с увеличением диссипации энергии, при этом наибольшее увеличение
наблюдается для тонких частиц, благодаря чему зависимость
становится менее крутой (см. рис. Ш.5, кривая 2).
Закрепление частиц на пузырьках. Частица может сталкиваться с
пузырьком в результате действия эффекта сноса частиц с линий тока
жидкости, обтекающей пузырек и эффекта зацепления.
При столкновении за счет эффекта сноса частица ударяется о по-
225
15-6926
Таблица III.2
Результаты расчетов Wc по формулам (III. 12) и (III.16)
Величины Диссипация энергии, м2/с3 Диаметр частиц, мкм 7,5 15
(Tb + Tp)2g2/3,M2/c3 - 9,41 • 10"5 9,85 • 10~5 1,0 3,82 • 10"3 4 • 10~3 0,5 1,35 • 10-3 1,41 • 10-3 \,3{тъ + т^2 (6^/Р)1/2, м2/с3 0,1 1,21 Ю"4 1,26 • 10~4 0,05 4,27 • 10"5 4,46 • 10"5 0,01 3,82 • 10"6 4 • 10"6 1,0 1,2 - 10-3 1,28 • 10"3 0,5 6,0 • 10"4 6,42 • 10"4 Ь2 (1 + а)26/(ЗбР),м2/с3 0,1 1,2 - 10-4 1,28 10"4 0,05 6,0 • 10~5 6,42 • 10"5 0,01 1,2 • 10"6 1,28 • 10"6 1,0 540 2302 0,5 341 1457 Wc, мин 0,1 138 590 расчет по формуле (III. 16) 0,05 106 452 0,01 75,2 320 Wc, мин" - 79,7 339 расчет по формуле (III. 12)
верхность пузырька. Если энергия удара достаточно велика, то поверх-
ность пузырька вдавливается, а затем возвращается в исходное поло-
жение [22] . Если за время контакта жидкая пленка между частицей
и пузырьком не прорвется, то частица может быть отброшена от поверх-
ности пузырька или начнет скользить по ней [5] . Возможность проры-
ва жидкой пленки в значительной степени зависит от гидрофобности
поверхности частицы и энергии удара, в основном определяемой отно-
сительной радиальной скоростью частицы и пузырька.
Согласно [62] , время контакта уменьшается с увеличением отно-
сительной радиальной скорости частицы и пузырька. Как показали
эксперименты, проведенные Ф. Де деком, при большой скорости столк-
новения пузырька с горизонтальной поверхностью твердого тела пу-
зырек не прилипает к ней, даже если тело очень гидрофобно. Вследст-
вие искривления поверхности пузырька между телом и пузырьком
возникают сужения и вода не успевает вытечь из пленки. По этой при-
чине вероятность закрепления крупных частиц на пузырьках, особенно
движущихся с большими скоростями, должна быть низкой.
При ударе нельзя, однако, полностью исключать и другую возмож-
ную причину незакрепления частицы на пузырьке. Если даже прилипа-
ние и произошло, то частица все равно может быть отброшена от по-
226
верхности пузырька, если энергия удара была очень большой, а площадь
контакта частицы с пузырьком незначительной.
Если после удара частица скользит по поверхности пузырька, то
вероятность ее закрепления на пузырьке в значительной степени опре-
деляется временем скольжения. Чем больше путь и меньше тангенциаль-
ная скорость движения частицы, тем выше вероятность закрепления.
Как показали эксперименты П. Уэлана и Д. Брауна по изучению закреп-
ления частиц на поднимающихся пузырьках, при постоянной относи-
тельной радиальной скорости столкновения частиц галенита размером
0,2 мм с пузырьками увеличение тангенциальной скорости резко умень-
шало число закрепившихся на пузырьках частиц. При этом не только
сокращалось время скольжения, но и возрастала сила инерции, отрываю-
щая частицу, движущуюся под действием обтекающих струй жидкости
по пузырьку.
Таким образом, для успешной флотации крупных частиц необходимо
уменьшить скорость их столкновения с пузырьком. Согласно Дадеку,
закрепление частиц на пузырьке возможно, если их относительная ско-
рость менее 17 см/с.
Тонкие частицы сталкиваются с крупными пузырьками в основном
за счет эффекта зацепления. При столкновениях тонких частиц с мел-
кими пузырьками гравитационный снос превалирует над зацеплением,
если плотность частиц превышает 2500 кг/м3. Столкновения в резуль-
тате гравитационного сноса с большей вероятностью приводят к закреп-
лению тонких частиц на пузырьках, чем столкновения, соответствующие
зацеплению. В последнем случае частицы только скользят по поверх-
ности пузырька и могут преодолеть энергетический барьер при сбли-
жении с пузырьком до расстояний, на которых пленка жидкости теряет
устойчивость и прорывается на верхней полусфере за счет составляющей
силы тяжести и, возможно, ”прижимной’? гидродинамической силы [13]
Последняя, по мнению авторов работы [13] , возникает вследствие
того, что выше экваториальной плоскости пузырька радиальная скорость
жидкости больше радиальной скорости частицы, и поэтому радиальное
течение жидкости, обтекающей частицы, прижимает последнюю к пу-
зырьку.
При ударе энергетический барьер преодолевается за счет кинетичес-
кой энергии частицы и пузырька. Поэтому, если при флотации круп-
ных частиц увеличение скорости отрицательно влияет на вероятность
их закрепления на пузырьке, то при флотации тонких частиц увеличе-
ние до некоторой степени скорости их сближения с пузырьком может
оказаться полезным.
На основании вышеизложенного можно предположить, что вероят-
ность закрепления как крупных, так и тонких частиц мала и что наиболь-
шие значения JV3 должны иметь частицы промежуточных размеров,
т.е. зависимость вероятности закрепления от крупности частиц имеет
экстремальный характер.
227
В условиях перемешивания скорости частиц и пузырьков относитель-
но жидкости возрастают. Поэтому увеличивается и скорость сближения
частиц и пузырьков. Из этого следует, что увеличение скоростей движе-
ния частиц и пузырьков в условиях перемешивания должно ухудшать
флотацию крупных частиц и при увеличении перемешивания в опре-
деленных пределах может улучшить флотацию тонких частиц. Послед-
нее особенно важно в условиях, когда частицы и пузырьки заряжены
одноименно и электростатические силы отталкивания препятствуют
закреплению тонких частиц на пузырьке.
Удержание частиц на пузырьках до выноса в пенный слой. Отрыв
закрепившихся частиц от пузырька при его подъеме в пенный слой в
основном обусловлен влиянием турбулентности, возникающей при ра-
боте импеллера. При этом возможны два механизма отрыва.
В работе Мика и Фюрстенау [30] по аналогии с механизмами дроб-
ления капель и разрушения агрегатов частиц (флокул) в инерционной
подобласти спектра турбулентности предполагалось, что в результате
турбулентных пульсаций на противоположных сторонах частицы диа-
метром d, закрепленной на пузырьке, возникает разность флуктуаций
давления p(d). Она является причиной возникновения нескомпенсиро-
ванной силы, приводящей к срезу частицы с пузырьков.
Величину р(д) для данных условий можно выразить следующим
образом [30] :
= c1Pf(6d)2/3, (ш.17)
где Ci = 1,61 -г 2,33 - коэффициент.
В области диссипации определяющими становятся вязкие силы,
возникающие благодаря градиенту скорости внутри вихря размером
Хо. В этом случае силы, действующие на частицу, обязаны касательным
напряжениям. Среднее квадратическое значение касательного напря-
жения Т определяется равенством [66]
т=с2 ute/v)1!2, (ШЛ8)
где С2 — коэффициент, имеет порядок единицы.
Для простоты будем считать, что значения p(d) и Т не изменяются
вплоть до отрыва частицы от пузырька.
На рис. III.6, а схематично изображен отрыв частицы цилиндричес-
кой формы (диаметр основания и высоты равный) от пузырька диамет-
ром D благодаря срезывающим усилиям, обусловленным разностью
давлений р (с?) [28] .
Устойчивость частицы к срезу определяется различием в углах нак-
лона поверхности газ — жидкость к плотности верхней грани частицы.
По аналогии с гистерезисными краевыми углами, будем называть углы,
возникающие при отрыве частицы от пузырька, наступающим 0Н и
отступающим в0 углами.
228
Ш.6. Схема к расчету силы, удерживающей частицу на пузырьке при появлении
срезывающего усилия
Примем для простоты расчета, что на одной половине периметра
контакта угол равен 0К, а на другой половине - 0О (см. рис. III.6, а),
хотя в действительности этот угол изменяется плавно. Исходя из это-
го горизонтальную составляющую сил поверхностного натяжения F на
границе пузырек — частица выразим (см. рис. Ш.6,6) как
7Т/2 7Т/2
Fx = 2 f (d/2) аж г cos 0О cos ах d — 2 J* (d/2) аж г х
О О
х cos0H cos сц d«i = d аж r(cos0o - cos0H).
Сила Fx препятствует срезанию частиц с пузырька и уравновешивает
силы, вызванные разностью давлений p(d) или касательным напряже-
нием Т.
Для инерционной подобласти получаем по порядку величины
Fx = ^d)d\
откуда (для Ci = 2) имеем
cos 0О - cos 0„ « 2d 5/3е2/3 pf/(j
Для области диссипации
Fx= Т ird2 /4,
откуда (для Сг = 1) получаем
cos0o-cos0H « 0,8jud(6’/p)1/2/o)K.r.
229
Таблица Ш.З
Значения cos 0о - cos 0Н и угла О,
необходимые для удержания частицы на пузырьке
2 , 3 м /с Первый механизм отрыва Второй механизм отрыва
d, мкм COS 0Q — — COS 0Н d, мкм в, градус
1000 134 1,0 209 90
100 0,62 200 68
50 ' 0,19 100 16
100 340 1,0 390 90
200 0,42 200 21
100 0,13 100 8
1 2120 1,0
1000 0, 29 — —
500 0,09 — —
В табл. Ш.З даны значения cos 0О — cos ^н- необходимые для проти-
водействия силам отрыва. При 6=1 000 м2/с3, соответствующей зоне
вблизи лопаток импеллера, вихри, возникающие в инерционной подоб-
ласти, ограничивают крупность флотируемых частиц размером 130 мкм.
С уменьшением 6 крупность флотируемых частиц возрастает. В области
диссипации для противодействия силам отрыва требуются малые зна-
чения cos 0О - cos0H [28] .
Второй механизм отрыва частиц от пузырька основан на том, что
отрыв частиц происходит, когда агрегат частица — пузырек движется
в поле ускорений, вызванных турбулентными потоками [28, 62] . Для
турбулентного вихря масштаба X > Хо среднее квадратическое ускоре-
ние составляет С362^3Х-1^3. В соответствии с Лиепе и Мекелем, при-
мем, что агрегат частица — пузырек успевает приобрести установившую-
ся скорость движения в поле ускорений, благодаря чему можно считать,
что ускорение частицы, закрепленной на пузырьке, равно С3С2^3Х-1^3.
Если пренебречь силой сопротивления, вызванной обтеканием час-
тицы жидкостью, и вести рассмотрение в ускоренно движущейся вместе
с пузырьком системе отсчета, то на частицу действуют четыре силы,
сила, равная сумме сил тяжести и Архимеда, — nd3 (рр — Pf)g/4;
сила, возникающая в поле ускорений вихря F2 = 7id3 (pp-pf)C3Cil3\il3 /4
сила, определяемая давлением Лапласа, F3 = ?Г(У2аж r/Z); сила, удержи-
вающая частицу на пузырьке, F4 = т1ож г sin 6. Если среднее квадрати-
ческое ускорение направлено в сторону, противоположную^, то 7^ и
F2 по направлению совпадают. Будем рассматривать именно этот слу-
чай, наиболее неблагоприятный для удержания частицы на пузырьке.
230
III.7. Зависимость вероятности удержа-
ния частиц на пузырьках до выноса
в пенный слой от крупности частиц
при различной диссипации энергии
(C2>Ci)
III.8. Схема колонной бесценной флота-
ционной машины:
1 — трубка для подачи питания; 2 —
трубка для удаления избытка жид-
кости; 3 — приемник сфлотированных
частиц; 4 — мешалка для равномер-
ного распределения питания по сече-
нию камеры; 5 — мешалка для пере-
мешивания материала в камере; 6 —
аэраторы; 7 — приемник несфдоти-
рованных частиц
Тогда баланс сил выражается уравнением
Fi +F2 + F3 = F4.
В табл. Ш.З даны значения 0 для следующих условий флотации:
аж.г = 7 • 10-2 Н/м, g = 9,81м/с2, рр= 5000 кг/м3, С= 2, Ру =
= 1000 кг/м3,£) = 1 мм.
Сравнение данных табл. Ш.З показывает, что оба возможных меха-
низма отрыва дают близкие значения максимальной крупности флоти-
руемых частиц. При одновременном действии указанных механизмов
верхний предел крупности флотируемых частиц может существенно
уменьшиться.
В соответствии с полученными результатами можно предположить,
что вероятность удержания частиц на пузырьках FVya сначала слабо
уменьшается с возрастанием размера частиц, а затем более резко. При
этом с увеличением € наклон кривых становится более крутым
(рис. Ш.7).
231
Экспериментальное изучение процесса минерализации пузырьков
в пульпе. Экспериментальное изучение влияния размера пузырьков и
интенсивности перемешивания на скорость флотации частиц различного
размера проведено на специально сконструированной установке бес-
ценной флотации с противоточным движением частиц и пузырьков
(рис. III.8) [15].
Отличительная особенность установки - получение пузырьков узких
классов крупности в диапазоне 0,1—3 мм и возможность исследовать
действие физико-механических факторов независимо друг от друга,
так что изменение интенсивности перемешивания в широких пределах
не влияет на крупность генерируемых пузырьков.
В тех опытах, когда минерализация пузырька возрастала пропор-
ционально высоте, пройденной пузырьком, результаты оценивали по
коэффициенту минерализации Кн, представляющему собой удельную
скорость флотации Хд, отнесенную к единице расхода воздуха q через
единицу площади горизонтального сечения камеры
Кн зависит только от характеристик пузырьков и частиц и гидро-
динамических условий.
Деминерализация, дефицит свободной поверхности и подъемной
силы пузырьков приводят'к тому, что отношение K\lq начинает сущест-
венно зависеть от геометрических размеров флотационной камеры.
В этом случае KJq можно рассматривать как интегральную характе-
ристику процесса во всем флотационном объеме.
Для оценки флотационной активности пузырьков различных раз-
меров следует учесть ограничения/ налагаемые на значение q, связан-
ные со стесненностью движения пузырьков. Эти ограничения выра-
жаются в том, что для каждой крупности пузырьков существуют мак-
симально возможные плотность потока qm и газосодержание <рт при
условии, что газосодержание в пульпе не может быть выше <рт, а в пе-
не — не может быть ниже <рт.
Для сравнения флотационной активности различных пузырьков
можно воспользоваться параметром Kim = Kuqm. С увеличением раз-
мера пузырька qm возрастает (рис. III .9).
Опыты без перемешивания пульпы показали, что уменьшение круп-
ности пузырьков увеличивает Кн при флотации частиц галенита и пири-
та всех испытанных размеров (—210 + 5 мкм) и мартита крупностью
— 300 + 20 мкм (рис. ШЛО). При этом, однако, для извлечения круп-
ных частиц размер пузырьков должен быть таким, чтобы обеспечить
подъем минерализованного пузырька на поверхность пульпы. Анализ
экспериментальных данных показал, что увеличение Кн с уменьшением
размера пузырьков в основном обусловлено возрастанием Wc. Данные,
подтверждающие большую флотационную активность мелких пузырь-
232
III.9. Зависимость qm и
от крупности пузырьков D
ков, получены также Ю.Б. Рубинштейном, В.И. Тюрниковой, В.Д. Самы-
гиным и др.
При флотации мартита крупностью —20 + 5 мкм Кп имеет мак-
симум в диапазоне крупности пузырьков 0,3—0,5 мм, в то время как
при флотации тонких частиц сульфидов уменьшение размера пузырьков
Ш.10. Зависимость Кн от круп-
ности пузырьков при флотации
без перемешивания:
а — мартит: 1—5 — крупность
соответственно — 300 + 210;
-100 + 74; -40 + 20; -20 +
+ 10; —10 + 5 мкм; б — галенит:
6, 7,9 — крупность соответствен-
но -210 + 150; -20 + 10;
— 10 + 5 мкм; 8 — пирит —10 +
+ 5 мкм
233
III. 11. Зависимость от диссипации энергии в зоне импеллера при флотации
минералов пузырьками различной крупности:
а — галенит; 1---210 + 150 мкм, D = 0,8 мм; 2----210 + 150 мкм, D= 1,26 мм;
3----10 + 5 мкм, D = 0,2 мм; 4-----10 + 5 мкм, D — 0,32 мм; 5-----10 + 5 мкм,
D = 0,5 мм;
б — мартит: 2 — 150 + 100 мкм, D = 0,5 мм; 2 ----74 + 53 мкм, D = 0,5 мм; 3 —
74 + 53 мкм, D = 0,8 мм; 4 — 150 + 100 мкм, D — 0,8 мм; 5 — 40 + 20 мкм, D —
= 0,8 мм; б — —10 + 5 мкм, D = 0,2 мм; 7—10 + 5 мкм, D — 0,32 мм; 8 — 10 +
+ 5 мкм, D = 0,8 мМ
с 2 до 0,2 мм приводит к непрерывному возрастанию Кн, увеличивая
ее значение в 30-50 раз. Такое различие в поведении тонких частиц
мартита и сульфидов можно объяснить электростатическим взаимо-
действием между отрицательно заряженными частицами мартита и
пузырьками воздуха вследствие сорбции ионов олеата, причем это
взаимодействие, по-видимому, тем больше, чем меньше пузырек.
При флотации крупных частиц относительно мелкими пузырьками
(0,5 мм) Кн резко падает при увеличении высоты камеры или повыше-
нии концентрации частиц, так как образуются перегруженные пузырьки.
Добавление более крупных пузырьков (1—2 мм) в этих условиях при-
водит к существенному возрастанию Кн благодаря образованию всплы-
вающих аэрофлокул.
234
В опытах с перемешиванием на основании измерения рассеиваемой
мощности, рассчитаны в соответствии с [66] , средние для камеры и
локальные для зоны импеллера диссипации энергии. Сопоставление
значений € для зоны импеллера с полученными результатами флота-
ции частиц различной крупности позволяет сделать следующие выводы.
1). За исключением флотации тонких частиц увеличение интенсивнос-
ти перемешивания для всех испытанных размеров пузырьков отрица-
тельно влияет на флотируемость частиц (рис. III.11). Так скорость
флотации крупных частиц значительно уменьшается при € = 0,2—
0,25 м/с3, заметное снижение скорости флотации частиц среднего раз-
мера наблюдается в основном при 6= 0,4 4- 0,55 м2 /с3.
2). При 6 = 0,08 -г 0,2 м2/с3 флотируемость тонких частиц мелкими
пузырьками (0,2 мм) улучшается. При увеличении G более 0,5—
0,7 м2/с3 скорость флотации тонких частиц снижается независимо от
размеров пузырьков.
Уменьшение скорости флотации частиц при превышении некоторого
значения диссипации энергии означает, что увеличение Wc с повышением
интенсивности перемешивания перекрывается падением вероятнос-
тей W3 и W
Опыты, проведенные в условиях применения пузырьков заданных
постоянных размеров и изменении интенсивности перемешивания,
показали, что отрицательное влияние турбулентности на флотацию
крупных частиц и частиц среднего размера может быть заметно уменьше-
но за счет увеличения гидрофобности их поверхности, создаваемой по-
вышенными расходами собирателя. Так, при флотации галенита круп-
ностью — 210 + 150 мкм пузырьками размером 1,26 мм повышение
расхода бутилового ксантогената с 2,6 • 10~б до 1,7 • 10-5 моль/м2
привело к меньшему падению Кн при изменении 6 для зоны импел-
лера от нуля до 0,35 м2 /с3. Эти данные подтверждают известное поло-
жение о необходимости создания повышенной плотности адсорбцион-
ного слоя собирателя для флотации крупных частиц, высказанное
В.А. Глембоцким и другими авторами [5, 22] .
На рис. III.12 приведены зависимости К 1т от крупности пузырьков
и интенсивности перемешивания при флотации частиц различных разме-
ров. Эти данные показывают, что К1т имеет максимум, в большинстве
случаев соответствующий диаметру пузырьков 0,5—0,8 мм независимо
от крупности частиц, интенсивности перемешивания и характера обра-
ботки реагентами. Поэтому пузырьки такого размера теоретически
могут считаться наиболее эффективными для флотации. Практически
же при определении сравнительной эффективности пузырьков различ-
ных размеров следует учитывать зависимость плотности потока q от
размера вырабатываемых аэратором пузырьков D, которая может
существенно отличаться от зависимости qm (D) идеального аэратора.
Как показывают эксперименты, отношение q]qm с увеличением D
возрастает, поэтому оптимальная для этих аэраторов крупность пузырь-
ков (1—2 мм) оказывается больше, чем значение D при максимальном
К1т- 235
I п
200 317 502 7У0 1Zb2
III. 12. Зависимость К 1т от крупности пузырьков для различных частиц:
1 — мартит —10+5 мкм, € в зоне импеллера 0,55 м2/с3,2 — мартит —20 + 10 мкм,
6 = 0,026 м2/с3; 3 - галенит -20 + 10 мкм, 6 ~ 0,83 м2/с3; 4 - пирит -20 +
+ 10 мкм, 6= 0,04 м2/с3; 5 - мартит -74 + 53 мкм, 6 = 0; 6 - галенит -210 +
+ 150 мкм, 6=0
Изучение влияния различных факторов на удержание закрепивших-
ся частиц на пузырьках показало, что движение минерализованных
пузырьков в спокойной жидкости не приводит к отрыву частиц от
пузырьков и в этих условиях И'уд = 1 (табл. III.4).
Пузырьки деминерализуются только при определенной интенсивнос-
ти перемешивания. При этом особенно резкое падение Wyn происходит
для крупных частиц, т.е. подтверждается теоретическая зависимость
W от размера зерен.
На основе расчета Wc и определения !Vyn найдены зависимости ве-
роятности закрепления частиц на пузырьках от крупности частиц в
отсутствие и при наличии перемешивания. Эти зависимости, как и пред-
полагалось в результате теоретического анализа, имеют экстремальный
характер (рис. III.13), за исключением флотации тонких частиц (осо-
бенно мартита — 10 + 5 мкм) мелкими пузырьками, перемешивание
Таблица III.4
Зависимость И'уд для частиц галенита
от диссипации энергии в зоне импеллера
Размер час- тиц, мм Размер пу- зырьков, мм W уд
2,3 Диссипация энергии, м /с
0 0,033 0,24 | 0,7
-32 + 20 0,32 1 1 1 0,24
1,26 1 0,9 0,66 0,25
-390 + 210 1,26 1 0,57 0,28 —
236
III. 13. Зависимость вероятности удержа-
ния частиц мартита крупностью 1,26 мм
на пузырьках размером 0,8 мм:
1 — без перемешивания; 2 — при переме-
шивании (€ в зоне импеллера 0,19 м2/с3)
уменьшает W3. Для тонких частиц наблюдается некоторое возрастание
W3 в определенных пределах повышения интенсивности перемешивания.
Удержание частиц в слое пены. При ударе пузырьков о пенный слой,
их коалесценции в пене, съеме пены часть частиц выпадает из пены и
возвращается в пульпу. Из-за большой сложности теоретического описа-
ния поведения частиц в слое пены значение Wn определено эксперимен-
тально [27] .
Для определения Wn в промышленных условиях измерялись ско-
рость поступления материала в концентрат РП и скорость выноса его
в пенный слой на пузырьках Рб. Значение РП определилось с помощью
пробоотборника для сбора пены, сливавшейся в желоб (рис. III. 14).
Значение Рб измерялось с использованием специально сконструирован-
ного пробоотборника с автоматическим регулятором уровня жидкости
в приемнике пузырьков, при этом опробовалась вся поверхность ка-
меры флотационной машины. Зная содержание данного компонента в
пробе пены РП и материале, вынесенном на пузырьках /Зб, рассчитываем
И'п для данного компонента по формуле
^п.комп — ^п^ц/ •
Измерения проводились на шести фабриках в первых камерах основ-
ных операций в механических, пневмомеханических и глубокой аэро-
лифтной машинах при различных выходах концентрата. Измеренные
значения Wn изменялись от 20 до 55 %. В результате преимущественного
осыпания частиц породы и подавляемых минералов содержание флоти-
руемого минерала в концентрате по сравнению с содержанием на пу-
зырьках повышалось, но процесс этот малоселективен. Полученные
237
III. 14. Опробование промышленных флотационных машин для измерения удер-
жания частиц в слое пены:
1 — камера машины; 2 — аэратор; 3 — пробоотборник; 4 — минерализованные
пузырьки; 5 — пеногон; 6 — система автоматического поддержания уровня жид-
кости в пробоотборнике; 7 — точки отбора проб на поверхности камеры
данные и данные других исследований [22] показывают, что в резуль-
тате вторичной концентрации в слое пены содержание полезных компо-
нентов в основном увеличивается в 1,2—1,3 раза и лишь в отдельных
случаях возрастает в 1,6—2,3 раза.
Экспериментально установлено, что Wn в основном определяется
скоростью и полнотой удаления пены и слабо зависит от типа аэратора.
Сокращение времени пребывания пены на поверхности камеры умень-
шает коалесценцию пузырьков в пене и снижает осыпание частиц в
пульпу. Повышение Wn достигается установкой пеноотбойных щитов
Таблица III.5
Зависимость Wn от расхода олеата натрия
при флотации мартита —150 + 10 мкм
Расход соби- рателя, г/т Пенная флотация Беспенная флотация И'п
е, % Ki е,% *1
12,5 4,9 0,051 36,9 0,46 0,11
50 12,4 0,131 57,8 0,863 0,15?
100 51,6 0,725 78,9 1,555 0,465
150 74,1 1,35 82,8 1,760 0,765
200 82,3 1,73 90,2 2,323 0,743
250 81,5 1,686 89,3 2,231 0,755
238
III. 15. Зависимость вероятности удержа-
ния частиц в слое пены от степени мине-
рализации пузырьков:
1, 2 — класс соответственно —74 + 40
и —40 + 10 мкм
0 20 40 60 80 100
Степень минерализа-
ции пузырь нов, %
на задних стенках камер, ликвидацией шпицкастенов и увеличением
скорости пеносъема до определенного предела, при котором не нару-
шается стабильность пены.
Величина Wn возрастает с уменьшением крупности частиц. Отноше-
ние между значениями IVn крупных и тонких частиц зависит от при-
роды разделяемых минералов, реагентного режима, наличия сростков
и других факторов и в исследованных случаях изменяется от 1,5 до 4,6.
Влияние различных факторов на изучалось в лабораторной флота-
ционной машине, позволяющей проводить пенную и беспенную флота-
цию в одних и тех же аэро- и гидродинамических условиях. Это дости-
галось тем, что верхняя часть камеры была съемной и позволяла снимать
образующуюся пену или улавливать минерализованные пузырьки.
Опыты проводились с мартитом различной крупности. В качестве со-
бирателя использовался олеат натрия. Установлено, что увеличение до
определенного предела степени минерализации пузырьков (рис. III. 15),
расхода собирателя (табл. III.5), расходов пенообразователя и пода-
ваемого воздуха повышает величину .
Таким образом, монотонно возрастающая зависимость Wc от круп-
ности частиц, экстремальная зависимость ^(tZ) и убывающие зависи-
мости Ц/уд(б7) и JVn(<y) с увеличением размера зерен определяют экст-
ремальный характер произведения четырех вероятностей от крупности
частиц, что особенно проявляется в условиях перемешивания.
17.3. Условия эффективной флотации частиц различной
крупности
Экстремальная зависимость Кн от крупности зерен означает, что
наибольшую скорость флотации имеют частицы среднего размера, а
крупные и тонкие частицы обладают пониженной флотируемостью.
На основании имеющегося экспериментального материала могут быть
сформулированы условия эффективной флотации частиц различной
крупности.
Выше было показано, что с учетом зависимости qm от D оптимальная
крупность пузырьков, обеспечивающая максимум величины К\т, сос-
тавляет 0,5—0,8 мм независимо от крупности флотируемых частиц.
При флотации крупных частиц рекомендуется также наряду с пузырь-
239
ками 0,5—0,8 мм применять небольшие количества более крупных
’’транспортных пузырьков” размером до 2 мм для выноса в пену пере-
груженных пузырьков 0,5—0,8 мм.
Для эффективной флотации крупных частиц диссипация энергии в
основном объеме камеры флотационных машин должна быть ниже
0,2—0,25 м2/с3. Флотационные машины для тонких частиц должны
обеспечивать перемешивание в основном объеме камеры, соответствую-
щее диссипации энергии при оптимуме 0,1—0,2 м2/с3.
Требование слабого перемешивания в основном объеме камеры
можно совместить с обеспечением равномерного распределения круп-
ных частиц во флотационных машинах с горизонтальным движением
пульпы (например, в многокамерных импеллерных машинах) путем
создания циркуляции, обеспечивающей восходящие потоки пульпы.
Во флотационных машинах для крупных частиц, а также частиц сред-
него размера должны быть созданы условия для быстрого и полного
съема пены.
Отрицательное влияние турбулентности на флотацию крупных частиц
и частиц среднего размера может быть уменьшено за счет увеличения
гидрофобности их поверхности. Это достигается применением собира-
телей с большей длиной углеводородного радикала (высшие ксантоге-
наты, аэрофлоты и меркаптаны), использованием сочетаний собира-
телей (например, ионогенных с неионогенными аполярными), разделе-
нием измельченной руды на пески и шламы и раздельной обработкой
песковой части руды реагентами в плотной пульпе [30] .
Важное условие эффективности флотации частиц всех размеров —
диспергирование пульпы, предотвращающее слипание флотируемых
и депрессируемых минералов и, в частности, препятствующее нали-
панию тонких частиц породы на более крупные частицы флотируемых
минералов.
Для успешной флотации тонких частиц их целесообразно агреги-
ровать до размера, соответствующего максимуму произведения четы-
рех вероятностей. Селективная флокуляция тонких частиц минерала
между собой или с минералом-носителем, в роли которого используют-
ся и более крупные частицы того же минерала, является наиболее перс-
пективным направлением повышения эффективности флотации тон-
ких частиц. Традиционная схема селективной флокуляции включает
предварительное диспергирование всех частиц и последующее селек-
тивное слипание зерен определенных минералов между собой.
Возможна другая схема селективной флокуляции, когда перед
основной флотацией проводится малоселективная флокуляция тонких
частиц, а затем перед перечистками чернового концентрата осуществ-
ляется селективное диспергирование образованных флокул. При се-
лективном диспергировании тонких частиц, извлекаемых в пену ми-
нералов остаются в основном в виде агрегатов, а не подлежащие флота-
ции минералы переходят во фракции, содержащие преимущественно
частицы первичных размеров.
240
Достижение малоселективной флокуляции возможно за счет уси-
ления гидрофобных взаимодействий путем применения способов по-
вышения гидрофобности частиц, указанных выше, и применения соче-
тания собирателей и флокулянтов. Селективное диспергирование мо-
жет быть достигнуто уменьшением гидрофобных взаимодействий, в
частности, за счет селективной десорбции собирателя с поверхности
диспергируемых минералов. Действие флокулянтов может быть ослаб-
лено или нейтрализовано пропаркой чернового концентрата или веде-
нием перечисток в разбавленной пульпе.
17.4. Кинетика флотации в машинах периодического действия
Лабораторные исследования проводятся обычно в машинах перио-
дического действия — однокамерных аппаратах, в которых флотирует-
ся одна порция руды. Кинетика флотации этих машин не осложняется
перемещением частиц с потоком пульпы, и поэтому масса частиц отдель-
ных классов флотируемости в пульпе изменяется только в результате
их извлечения в пену, т.е. в уравнении (Ш.З) dMcz- = — dMz-, где индекс
i означает ьй класс флотируемости.
Подставляя полученное соотношение в уравнение (Ш.З) получаем
-(17Ц- = КЦ Mt dt. (III.19)
Так как — CjV и объем пульпы V в камере поддерживается в ма-
шинах периодического действия постоянным, то уравнение (Ш.19)
будет иметь вид
-dq = Klf Q dr.
В общем случае вероятность флотации KAi в единицу времени —
функция концентрации частиц всех классов флотируемости и времени.
Поэтому Kxi = Кij (Ci, С2, ... , Сп, t). Переходя от концентраций
к извлечениям, получаем
def = КИ (е/0 -ejdt, (Ш.20)
где ej0 — максимально возможное извлечение z-го класса (доля частиц
/-го класса в исходной пульпе).
Уравнения, аналогичные (Ш.20), могут быть записаны для частиц
каждого класса флотируемости. Вместе они составят систему дифферен-
циальных уравнений, полностью описывающих кинетику флотации
данной руды. Для интегрирования этой системы необходимо знать за-
висимость вероятности флотации частиц каждого класса флотируемости
в единицу времени от концентрации частиц всех классов флотируемости
в пульпе и от времени, а также начальное распределение частиц по фло-
тируемости, т.е. значения е10, е2о, • • • , еио- В настоящее время эти
241
16-6926
зависимости могут быть найдены только экспериментальным путем,
а система уравнений проинтегрирована лишь при упрощающих пред-
посылках.
Флотация не влияющих друг на друга частиц различной флотируе-
мости. Если частицы при флотации не влияют друг на друга и свойства
частиц не изменяются во времени, то можно принять, что
дКц /дС\ = дКи/дС2 = ... = дС\ {/дСп = 0 и dK^ldt = 0.
Тогда каждое из уравнений типа (III.20) может быть проинтегри-
ровано при начальном условии ei = 0. После интегрирования получим
е,- (Ш.21)
Если ег- выражено в долях всего флотируемого компонента, то при
наличии дискретных классов флотируемости получим
п
е= S ei0(l-e-x4‘), (Ш.22)
i = 1
а при непрерывном распределении частиц по флотируемости сумма
(Ш.22) превращается в интеграл
e = J F(Ki)(l -е~ (III.23)
о
где е — суммарное извлечение всех классов флотируемости в концент-
рат; Е(Кг) — функция начального распределения частиц по флотируе-
мости. °®
Функция E(Ki) выбирается так, чтобы J E(Kl)dKl = 1. Если все
0
частицы обладают одинаковой флотируемостью, то уравнения (III.22)
и (III.23) превращаются в уравнение К.Ф. Белоглазова
е=1-е~к^. (III.24)
Уравнения (III.22) и (III.23) использовали многие исследователи
для учета различий частиц по флотируемости [39] . Средняя вероят-
ность флотации частиц различных классов флотируемости в единицу
времени (удельная скорость флотации) является функцией времени,
так как в первые минуты флотируются частицы с наибольшим значением
а в последние — с наименьшим. Поэтому среднее значение Kt умень-
шается со временем.
Опыты беспенной флотации апатита и гематита показали, что при
небольшой исходной концентрации флотируемого минерала в пульпе
242
III. 16. Зависимость удельной скорости бес-
пенной флотации мартита крупностью -40 +
+ 10 мкм от его исходной концентрации в
пульпе (расход олеата натрия 0,63 х
х 10“б моль/м2)
(< 0,02 г/см3) уравнение (Ш.22) выполняется, т.е. взаимное влияние
частиц практически не сказывается при закреплении их на пузырьках
и происходит свободная флотация.
Влияние частиц друг на друга при флотации проявляется различным
образом. Так, закрепившиеся на пузырьках частицы занимают часть
их поверхности, уменьшая этим вероятность столкновения других
частиц со свободными участками поверхности пузырьков [5] .
Выполнимость уравнения К.Ф. Белоглазова в опытах беспенной фло-
тации при низкой концентрации флотируемых частиц свидетельствует
о том, что в этих условиях занятость поверхности пузырьков не влияет
на скорость флотации. По-видимому, основная часть частиц закрепляет-
ся при столкновении с верхней полусферой поднимающегося пузырька,
а затем частицы потоками обтекающей пузырек жидкости достаточно
быстро сносятся на его нижнюю полусферу и слабо влияют на столкно-
вение других частиц со свободной поверхностью пузырька [5] . Поэ-
тому степень минерализации пузырьков, определяемая концентрацией
флотируемых частиц в пульпе, начинает снижать скорость флотации
при значениях, превышающих 50 %. На рис. III.16 этот момент, как по-
казали расчеты, приблизительно отвечает концентрации 0,05 г/см3 [27] .
Опыты проводились в беспенной машине с интенсивным перемешива-
нием в зоне минерализации.
Очевидно, в предельном случае полностью нагруженных пузырьков
скорость выноса материала не зависит от концентрации частиц, т.е.
de/dt = const. Это уравнение является уравнением нулевого порядка.
По мере уменьшения концентрации частиц порядок уравнения растет
и при свободной беспенной флотации частиц узкого класса флотируемос-
ти становится равным единице (уравнение К.Ф. Белоглазова).
В условиях реального процесса при наличии частиц различной фло-
тируемости и взаимном их влиянии в пульпе и пене порядок п уравнения
кинетики флотации изменяется от 1 до 6 [5] , если пользоваться фено-
менологическим уравнением
(d e/d t)/(l - е)П = const.
243
Взаимное влияние частиц проявляется также в том, что при флота-
ции крупных частиц и частиц среднего размера тонкие и сильно нагру-
женные пузырьки не могут всплыть на поверхность. В этом случае гру-
зоподъемность пузырьков лимитирует скорость флотации, снижая
вероятность флотации частиц.
Частицы породы, скользя вблизи поверхности пузырька и не зак-
репляясь на нем, могут препятствовать попаданию флотируемых час-
тиц на свободные участки поверхности пузырька, экранируя ее [5] .
Опыты беспенной флотации показали, что при постоянной исходной
концентрации флотируемого минерала 0,03 г/см3 нефлотирующаяся
порода снижает извлечение полезного минерала при Т:Ж = 1:3 [27] .
Существенное влияние на флотацию частиц оказывает флокуляция.
При селективной флокуляции мелких или крупных и мелких частиц
одного и того же флотируемого минерала скорость флотации мелких
частиц может существенно расти, так как образованные агрегаты будут
иметь большую вероятность столкновения и закрепления на пузырь-
ках. По данным В.Д. Самыгина и А.К. Лившица, при добавке крупных
частиц того же минерала к мелким скорость флокуляции возрастает
Ш.17. Зависимость удельной скорости (а), пенной (7) и беспенной (2) флотации
и вероятности удержания частиц в слое пены (б) для мартита крупностью -74 +
+ 40 мкм от концентрации минерала в пульпе (расход олеата натрия 0,63 х
х 10”6 моль/м2):
I— V — навески соответственно ЮО; 75; 16; 10; 7,5 г
244
в 300—400 раз, и извлечение' мелких частиц заметно повышается в срав-
нении с их флотацией без крупных частиц.
Неселективная флокуляция частиц флотируемого и депрессируемо-
го минералов может существенно снизить скорость и селективность
флотации. На флотацию полезного минерала отрицательно влияют шла-
мы породы. Налипая на поверхность флотируемых частиц, шламы вызы-
вают их подавление [8,11] .
Влияние частиц друг на друга наблюдается не только в пульпе, но и
в пенном слое. Так, в зависимости от степени минерализации пузырь-
ков изменяется стабильность пены и вероятность удержания частиц
в пене (рис. III.17).
На рис. III. 17 показано влияние концентрации частиц мартита круп-
ностью — 74 + 40 мкм в пульпе на удельную скорость пенной и бесцен-
ной флотации частиц, а также на Wn [27] . Из рис. III. 17 следует, что
удельная скорость пенной флотации существенно зависит от концент-
рации частиц в пульпе. Ее низкие значения при небольшой концентрации
частиц обусловлены малым значением Wn (см. рис. III.17, б).
Увеличение концентрации частиц в пульпе приводит к резкому воз-
растанию Wn благодаря повышению стабильности пены частицами мар-
тита. Падение удельной скорости пенной флотации при увеличении
концентрации частиц выше определенного предела объясняется сниже-
нием удельной скорости беспенной флотации в результате уменьшения
свободной поверхности пузырьков. Поэтому как при малом, так и при
большом содержании флотируемого минерала в пульпе пенную фло-
тацию, вероятно, нельзя рассматривать как процесс извлечения незави-
симо флотирующихся частиц.
17.5. Кинетика флотации в машинах непрерывного
действия
Основное отличие машины непрерывного действия от машины перио-
дического действия — наличие в первой потока пульпы.
Механизм влияния продольного перемешивания пульпы на время
флотации в машинах непрерывного действия. При движении пульпы
по флотационной машине продольное перемешивание приводит к тому,
что одна часть частиц находится в машине меньше, а другая часть час-
тиц дольше по сравнению со средним временем. Влияние продольного
перемешивания можно охарактеризовать функцией распределения
частиц по времени их нахождения в машине N(t) [27] .
Вероятность выхода частиц в хвосты на промежутке времени (t,
t + d?) в отсутствие флотации равна N(t ) df. Если флотируются частицы,
обладающие одной и той же удельной скоростью флотации/^ , то вероят-
ность выхода частиц в хвосты на этом промежутке времени составит
245
При неограниченном времени наблюдения полная вероятность выхо-
оо
да частиц в хвосты выразится как J e~KltN(t)dt, а вероятность Р
О
выхода частиц в концентрат как
Р = 1 _j e~KifN(t)dt =J (1 — e~Kit)N(t)dt, (Ш.25)
О о
оо
где учтено, что _[ N(t) d? = 1.
О
Зная функцию N(t), можно получить уравнение кинетики флотации.
Для и-камерной импеллерной машины, состоящей из полностью изоли-
рованных камер с идеальным перемешиванием, функция N(t) имеет вид
W) =Q(Qt/V)n ~ 1 e'QtlVIV(n- 1)!,
где Q — объемный поток пульпы.
Подставляя значение ЛГ(г) в уравнение (III.25) и производя необ-
ходимые преобразования, получаем [27]
Р = / Qt!v -е~ K^)dt/[V(n- 1)] ! =
О
= 1 - 1/(1 v/Q)n.
При флотации большого числа частиц доля извлеченных частиц
(извлечение е) по закону больших чисел равна вероятности флотации
каждой частицы, т.е. Р = е. Мы получили известное уравнение
е = 1 — 1/(1+Х’1т)/2, (Ш.26)
где г = VIQ — среднее время пребывания пульпы в камере.
Если все частицы в машине обладают возможностью флотироваться
в течение одного и того же времени Т, то N(t) переходит в дельта-
функцию и из уравнения (III.25) получаем уравнение К.Ф. Белоглазова
р = е= 1 - е~ к'т.
Такой машиной является машина периодического действия. Ее мо-
делью в случае непрерывного процесса может быть машина с идеальным
вытеснением, в которой каждый элемент пульпы движется не размы-
ваясь,вдоль машины, и все элементы пульпы находятся в машине одно
и то же время. В реальных машинах непрерывного действия продоль-
246
Ш.18. Влияние распределения частиц
по времени их пребывания в машине
на извлечение в концентрат
ное перемешивание всегда приводит к распределению частиц по времени
пребывания.
При одном и том же среднем времени прохождения частиц через
машину распределение частиц по времени их пребывания в машине
приводит к потере извлечения. Сравним извлечение одинаковых частиц
в двух случаях: в первом — все частицы находятся в машине одно и то
же время Г; во втором — половина частиц флотируется в течение вре-
мени Т — Д71, другая половина — за время Т + ДГ. При таких условиях
среднее время флотации частиц в обоих случаях одинаково и равно Т.
На рис. Ш.18 извлечение в машине без перемешивания показано
ординатой б(7), а в машине с распределением частиц по времени пре-
бывания е, равной среднему арифметическому из ординат е(Т — Д7)
и е(Т + Д7). Уменьшающаяся крутизна кривой б(?) приводит к тому,
что 6(t) > [е(7' + Д7) + е(Т — Д Т) ] /2, т.е. при одинаковом среднем
времени пребывания частиц в машине распределение по времени пре-
бывания снижает извлечение в концентрат.
Уменьшение времени флотации одних частиц до Г — ДТ приводит
к такому снижению извлечения, которое не компенсируется увеличе-
нием времени флотации других частиц до Т + Д7\ Поэтому в машинах
периодического действия и в машинах с идеальным вытеснением полу-
чают при прочих равных условиях наибольшее извлечение [27] .
Основная характеристика распределения частиц по времени пребы-
вания в машине — дисперсия о2. Чем меньше дисперсия, тем больше
режим работы машины приближается к режиму работы машины без
перемешивания. Рассчитаем дисперсию для «-камерной машины, сос-
тоящей из полностью изолированных камер с идеальным перемешива-
нием. Для нее среднее время флотации t равно nV/Q. Тогда
оо оо
О2 = f (Г - ?W)dr = / (7 - nV/Q)2 X
О о
х [Q(QtlV)n- 1 е~ Galvin- l)!]d? =nV2IQ2. (Ш.27)
247
III.19. Зависимость функции N(t) от
времени пребывания частиц в машине
и числа камер (среднее время флота-
ции пт остается постоянным):
1 — Т = 4 мин; п= I; 2 — Т = 1 мин,
П = 4; 5 — 7 = 0,1 мин, п = 40
Из уравнения (III.27) следует, что при увеличении скорости потока
пульпы и неизменном числе камер дисперсия уменьшается, следова-
тельно, скорость флотации возрастает. Однако это приводит к уменьше-
нию времени флотации и извлечения. При одновременном увеличении
<2 и п в одно и то же число раз дисперсия уменьшается и, хотя среднее
время флотации остается постоянным, извлечение возрастает. При
этом режим работы приближается к режиму работы машины без про-
дольного перемешивания.
На рис. III.19 показана зависимость функции N(t) от времени пре-
бывания в и-камерной машине, состоящей из полностью изолированных
камер с идеальным перемешиванием, и от числа камер. Все три кривые
соответствуют одинаковому среднему времени t = пт = const.
Из рис. III.19 видно, что при одновременном увеличении потока
пульпы и числа камер кривые ’’сжимаются”. Это означает, что диспер-
сия уменьшается. При большом увеличении скорости потока пульпы
и числа камер дисперсия стремится к нулю и и-камерная машина прев-
ращается в машину без продольного перемешивания [27] .
Другой Подход к описанию кинетики непрерывного режима флота-
ции состоит в том, что рассматривается изменение концентрации флоти-
руемых частиц по фронту флотации.
При движении потока пульпы вдоль машины концентрация флоти-
руемого минерала в пульпе по фронту машины зависит от соотношения
скорости флотации минерала и интенсивности перемешивания.
В пневматической машине перемешивание выравнивает концентра-
цию частиц в каждом поперечном сечении, но его недостаточно, чтобы
выравнять концентрацию по всей ванне. Можно предположить, что в
импеллерных машинах имеется идеальное перемешивание в каждой ка-
мере, а концентрация частиц изменяется скачком при переходе от каме-
ры к камере.
Кинетика флотации в пневматической машине. Баланс массы час-
тиц z-ro класса флотируемости, составленный для некоторого произ-
вольного весьма малого элемента объема машины и учитывающий
изменение массы частиц в данном элементе объема благодаря потоку
248
пульпы Q, извлечению частиц в концентрат и переносу частиц вследствие
продольного перемешивания,приводит к следующему уравнению кине-
тики флотации в установившемся режиме работы в пневматической
машине:
d ez- - (dQ/Q) (е,- 0 - ef) = КЧ (ег- 0 - ez) dr +
+ (£>Typ6/u2) (d2e/dr2)dr, - (III.28)
где и — линейная скорость потока пульпы; Z)Typ6 — коэффициент, харак-
теризующий интенсивность перемешивания и не зависящий от потока
пульпы.
Отношение dQJQ - доля объема пульпы, извлеченной в концентрат
при флотации из данного элемента объема в течение времени dr. Если
выход концентрата незначителен и изменением объема пульпы в процес-
се флотации можно пренебречь, т.е. dQfQ = 0, то уравнение (Ш.28)
примет вид
de,. =^,.(e/0^e,.)d/ + (£>Typ6/u2)(d2e/d;2)dr. (Ш.29)
Второй член правой части уравнения (III.29) обычно отрицательный,
он учитывает влияние продольного перемешивания пульпы на кинети-
ку флотации. Из сопоставления уравнений (Ш.29) и (Ш.23) для»маши-
ны периодического действия видно, что продольное перемешивание
уменьшает извлечение в пневматической машине по сравнению с маши-
ной периодического действия.
С увеличением скорости потока пульпы второй член правой части
уравнения (Ш.29) убывает и последнее переходит в уравнение (Ш.20),
т.е. влияние продольного перемешивания исчезает. При недостаточно
большой скорости потока пульпы и прочих равных условиях время
флотации, необходимое для получения заданного извлечения, в машине
непрерывного действия будет больше, чем в машине периодического
действия.
Кинетика флотации в п-камерной импеллерной машине, состоящей
из полностью изолированных камер с идеальным перемешиванием.
Уравнение кинетики флотации z-ro класса в такой машине, как показа-
- ли О.С. Богданов, И.И. Максимов и В.Я. Хайнман, в установившемся
режиме ее работы имеет следующий вид:
п
ef =eiQ [l-l/П (^VKlik/Qk)], (Ш.30)
K=l
где Qk — поток пульпы, выходящий из /с-й камеры; Klik — вероятность
флотации частиц z-ro класса флотируемости в k-й камере в единицу
времени.
249
Если выход концентрата мал, т.е. Qk = Qfn флотируются одинако-
вые частицы, имеющие постоянную вероятность флотации Кх в единицу
времени в течение всего процесса, то система уравнений, аналогичных
(Ш.30) для каждого класса флотируемости, сводится к одному уравне-
нию (Ш.26)
е= 1 — 1/(1 +^7)",
где т= И/<2=£/п; t — общее время флотации.
При большом увеличении числа камер и уменьшении их размера,
что равносильно большому увеличению потока пульпы и соответствую-
щему уменьшению т при постоянном размере камер, уравнение (Ш.26)
переходит в уравнение (III.24), так как lim (1 + к^/л)” = QKlt. Это
п -> оо
означает, что при большом потоке пульпы и соответствующем увеличе-
нии числа камер время флотации в импеллерной машине, состоящей
из полностью изолированных камер с идеальным перемешиванием,
стремится к времени флотации в машине периодического действия.
Таким образом, анализ уравнений кинетики флотации в машинах
непрерывного действия показывает, что с увеличением потока пуль-
пы скорость флотации должна возрастать.
Впервые зависимость между временем флотации и потоком пульпы
была установлена С .И. Митрофановым на специально сконструиро-
ванной лабораторной установке. Исследования, проведенные в промыш-
ленных условиях [29] , подтвердили вывод о том, что с увеличением
потока пульпы через флотационную машину скорость флотации увели-
чивается, т.е. уменьшается время флотации, необходимое для получе-
ния заданного извлечения.
Кинетика флотации в Пгкамерной импеллерной машине, состоящей
из частично изолированных камер с идеальным перемешиванием.
Расчеты, проведенные по уравнениям (Ш.29) и (Ш.26) на основе
уравнения кинетики флотации первого порядка показали, что влияние
потока питания на время флотации оказывается гораздо более слабым,
чем по данным промышленных испытаний [29] . Поэтому в работе
[14] проанализирован этот процесс для л-камерной импеллерной ма-
шины с идеальным перемешиванием на основе уравнения кинетики фло-
тации произвольного порядка при наличии обратных потоков пульпы,
т.е. при частичной изоляции камер. В этом случае уравнение кинетики
флотации имеет вид
Щ. = KpVd^t, (Ш.31)
где Кр — константа; р — порядок кинетики флотации.
Такое рассмотрение кинетики флотации является феноменологи-
ческим и принято для простоты, так как зависимость KXi = Kvi (Сх,
С2 >’• • •, Сп, t) в настоящее время неизвестна.
250
III.20. Схема потоков пульпы между
камерами
а.
В звене, состоящем из п прямоточных камер, между двумя любыми
камерами существует поток питания, представляющий собой разность
прямого Qt и обратного Q- потоков (рис.Ш.2О). Их сумма Q+ + Q_ =
= Сц представляет собой циркуляционный поток. Будем считать, что
выход концентрата мал и потоки не изменяются по фронту машины.
Баланс массы частиц, например, для второй камеры в звене, выразится
следующим уравнением:
^рс?и=с1ен.+с3е.-с2е,-
Тогда
Ci = (1 +Д)-1 [ЬС? +2Сг - (1 -д)С3] ,
где
rQ!Qy, С<СЦ
b = 27СрКа IQ.
Рассматривая подобным образом баланс массы частиц для каж-
дой камеры, получаем систему уравнений
Со = (2а)"1 (Z>Cf + (1 +«)С, - (1 -а)С2]
С, = (1 +а )-• [Z>Cf +2С2 - (1 -а )С3]
> (Ш.32)
CN_2= (1 +«)"* [ЙСР_ ] +2Сдг_ 1 - (1 -а)СЛГ]
CN_l = (^a)-'bC<’N +CN.
Расчет проводился исходя из предположения, что при некотором
Сц = Со и Q — O,5Qo, т.е. при я = 0,5 в 12-камерной машине, состоящей
из двух звеньев по шесть камер, достигается е = 0,9. Считая затем зна-
чения Кр и Со определенными этими условиями, находим е(7) для
двух крайних случаев зависимости обратного потока Q_ от потока
питания Q: 1) Q_ сильно зависит от Q, т.е. Сц = const, 2) Q_ не зависит
от Q.
251
III.21. Зависимость извлечения от времени флотации в цепи прямоточных импел-
лерных камер (р = 4)
На рис. Ш.21 приведены кривые е(Г) для первого случая, исходя
из уравнения кинетики четвертого порядка, при (2Ц = Qq и Q = О,25(7о,
О,5бо и 0,75^0 (кривые 1, 2, 3 соответственно), т.е. при увеличении
потока питания в 3 раза. Кривая Г соответствует Q = 0,25(>о и 2Ц =
= 0, т.е. отсутствуют обратный и циркуляционный потоки из-за полной
изоляции камер. Кривые при Сц = 0 для потоков Q = О,5(7о и О,75()о
не приводятся, так как они близко подходят к аналогичным кривым при
Сц — Qo-
252
Из рис. III.21 следует, что установка перегородок при потоке пита-
ния О,25бо сокращает время флотации на 25,8 %, а при потоке О,750о —
на 3,2 %, в то время как увеличение потока с О,250о до О,750о без
установки перегородок сокращает время флотации на 41,3 %. Расчеты,
проведенные для второго случая, дали близкие результаты.
Аналогичное рассмотрение на основе кинетики первого порядка
показало, что при увеличении потока с О,250о до О,750о время флотации
в отсутствие перегородок сокращается на 27,3 %, т.е. с возрастанием
порядка кинетики флотации зависимость времени флотации от потока
питания усиливается.
Таким образом, теоретический анализ свидетельствует, что увели-
чение степени изоляции камер существенно сокращает время флотации
при работе прямоточных импеллерных флотационных машин на малых
потоках питания, при этом с увеличением потока питания влияние
степени изоляции камер на время флотации уменьшается.
Экспериментальная проверка теоретических положений проведена
на медно-обогатительной фабрике в машинах с камерами вместимостью
12,5 м3, установленных в операциях основной и контрольной флотации.
Увеличение степени изоляции камер с 30 до 90 % уменьшает время
флотации медных минералов, требуемое для получения заданного извле-
чения на потоках питания 4, 6,7, 9,5 м3/мин соответственно на 42, 26
и 15 %. С увеличением потока питания влияние степени изоляции камер
ослабляется, поэтому для интенсификации флотации целесообразно
повышать степень изоляции камер во флотационных машинах при
времени пребывания пульпы в головной камере приблизительно бо-
лее 1 мин.
Экспериментально установлено, что увеличение потока питания
резко повышает скорость флотации медных минералов в машинах
с низкой степенью изоляции камер. Так, увеличение потока с 4 до
12,9 м3/мин уменьшает требуемое время флотации на 71 %, а с 6,7
до 12,9 м3 /мин — на 53 %.
В машинах с высокой степенью изоляции камер влияние потока
питания на скорость флотации слабее — при увеличении потока питания
с 4 и 6,7 до 12,3 м3/мин время флотации уменьшается соответственно
на 57 и 39 %. Наибольшее возрастание скорости флотации отмечено
при подаче во флотационную машину максимально возможного в усло-
виях эксперимента потока питания (18—20 м3 /мин).
Таким образом, показано, что при работе прямоточных импеллер-
ных флотационных машин на относительно небольших потоках пи-
тания (при времени пребывания пульпы в головной камере более 1 мин)
скорость флотации может быть значительно увеличена повышением
степени изоляции камер. Наибольший рост скорости флотации дости-
гается, если имеется возможность увеличить поток питания сокращением
числа ниток. Данные промышленных испытаний лучше соответствуют
зависимостям, полученным на основе уравнений кинетики флотации,
имеющим порядок выше первого.
253
Таблица Ш.6
Зависимость относительного времени флотации Ту
и содержания полезного минерала /3
в концентрате от числа используемык камер N
К TN 0,%
1 4,16 2 2,02 3 1.60 4 1.42 5 1,33 10 1.15 оо I 62,96 69,0 71,72 73,03 73,89 75,67 77,48
Влияние продольного перемешивания на флотацию сказывается
и в том, что при уменьшении числа используемых камер, помимо воз-
растания общего времени флотации до заданного извлечения,изменяет-
ся распределение извлечения частиц различной флотируемости.
С целью оценки такого влияния рассмотрим .следующий качествен-
ный пример. Допустим, что флотируемый материал представлен двумя
компонентами, флотируемыми независимо друг от друга по уравнениям
кинетики первого порядка, — чистым минералом и сростками с содер-
жанием полезного минерала 10 %. Удельная скорость флотации срост-
ков составляет 0,1 скорости флотации чистого минерала и в сростках
находится 10 % этого минерала. Если флотация ведется до извлечения
е = 90 %, то примем, что время флотации в периодическом режиме
равно 1. Тогда содержание полезного минерала в концентрате и время
флотации Ту в этих условных единицах будут изменяться в зависимости
от числа используемых в непрерывном режиме флотации последователь-
ных камер, так, что 7^| = 1. Результаты расчетов даны в табл. Ш.6.
N
Из приведенного анализа можно сделать вывод, что при числе камер
в ряду менее 4 резко увеличивается время флотации и падает качество
концентрата при флотации до заданного извлечения.
18. ФЛОТАЦИОННЫЕ МАШИНЫ
Для ведения флотационного процесса во флотационной машине
должны обеспечиваться: необходимое перемешивание для поддержа-
ния минеральных частиц во взвешенном состоянии; необходимый для
эффективного разделения частиц расход воздуха, его диспергирова-
ние на мелкие пузырьки и равномерное распределение пузырьков по
объему камеры; создание на поверхности пульпы спокойной зоны
254
ценообразования; подача питания и раздельная разгрузка пенного и
камерного продуктов.
По способу перемешивания и аэрации пульпы большинство приме-
няемых в настоящее время флотационных машин разделяются на:
механические, в которых перемешивание пульпы и засасывание возду-
ха осуществляются импеллером; пневмомеханические, в которых пе-
ремешивание пульпы осуществляется импеллером, а воздух подается
от воздуходувки; пневматические, в которых перемешивание и аэра-
ция пульпы осуществляются подачей сжатого воздуха. Возможны комби-
нации этих способов. Так, в некоторых машинах механического типа
осуществляется дополнительная подача воздуха воздуходувкой.
18.1. Механические флотационные машины
Флотационная машина машиностроительного завода им. Котлякова.
Прототипом этой машины, как и многих других конструкций механи-
ческих флотационных машин, является машина ’’Денвер—Фаренволд”.
Аэратор машины завода им. Котлякова (рис. Ш.22) [45] , состоя-
щий из лопастного радиального импеллера и надымпеллерного диска,
по устройству аналогичен низконапорному центробежному насосу, в
котором роль турбинки выполняет импеллер. При вращении импелле-
ра пульпа отбрасывается лопатками к его периферии, в результате чего
в центральной зоне импеллера создается небольшое разрежение. Поэ-
тому пульпа поступает на импеллер практически самотеком, ее дебит
определяется высотой уровня в загрузочном устройстве и пропускной
способностью питающего патрубка. Из-за того, что производительность
III.22 Флотационная машина завода им. Котлякова:
1 — импеллер; 2 — над^мпеллерный диск; 3 — питающая труба; 4 — карман;
5 — центральная труба; 6 — шибер для регулирования уровня пульпы; 7 — цирку-
ляционные отверстия; 8 — пеногон; 9 — радиальные успокоительные ребра; 10 —
труба для промпродукта; 77 — корпус камеры
255
импеллера по пульпе значительно больше поступающего на него потока
пульпы, разрежение полностью не компенсируется и в полость импел-
лера через центральную трубу засасывается воздух. Воздух увлекается
пульпой и концентрируется в областях пониженного давления за ло-
патками вращающегося импеллера, образуя воздушные полости. В хвос-
товой части полостей на границе с жидкостью возникают вихри, отры-
вающие от полостей пузырьки воздуха, которые вместе с пульпой выбра-
сываются в камеру.
Четыре радиальных ребра в камере машины устраняют завихрения
пульпы и способствуют образованию спокойного пенного зеркала.
Съем пены односторонний и осуществляется пеногоном с жестко зак-
репленными лопатками.
Флотационная машина машиностроительного завода им. Котлякова
при работе на грубоизмельченных пульпах не забивается песками, так
как питание поступает на импеллер сверху. Надымпеллерный диск
предохраняет импеллер от заиливания при остановках машины и ее
можно пускать в работу, не выпуская пульпу из камер.
Машина состоит из всасывающих камер. Каждая такая камера
имеет питающий патрубок и разгрузочный карман, снабженный шибе-
ром для регулирования уровня пульпы в камере. Промежуточные про-
дукты, возвращаемые в процесс, могут подаваться в любую камеру
через специально устанавливаемый для этой цели патрубок.
Флотационная машина "Механобр” (рис. III.23) состоит из камер
квадратного сечения со шпицкастеном [45] . Импеллер машины ’’Ме-
ханобр” (см. рис. III.23) представляет собой вогнутый диск с шестью
радиальными лопатками. Статор состоит. из диска с отверстиями и
лопаток, установленных под углом 60° к радиусу по направлению
вектора абсолютной скорости выхода пульпы с импеллера. Централь-
ная труба в нижней части заканчивается расширением, называемым
надымпеллерным стаканом. Надымпеллерный стакан имеет регулируе-
мое отверстие. Это отверстие, так же как и отверстия в статоре, пред-
назначено для подачи на импеллер циркуляционного потока пульпы.
Наличие статора с косо поставленными лопатками и подача на импел-
лер циркуляционного потока пульпы являются отличительными осо-
бенностями машины ’’Механобр” по сравнению с машиной завода
им. Котлякова. Эти особенности позволяют увеличить расход засасывае-
мого воздуха в 1,5—2 раза при том же расходе энергии на камеру.
Расход воздуха существенно зависит от потока пульпы, подаваемой
на импеллер. Для каждого номера машины существуют оптимальные
потоки пульпы, обеспечивающие максимальный расход засасываемого
воздуха. Эти потоки пульпы для машин ФМ 1,2, ФМ 3,2 и ФМ 6,3 сос-
тавляют соответственно 2—3, 5—7, 7—12 м3/мин. Статор и подача на
импеллер оптимального потока пульпы обеспечивают поступление в
машины ’’Механобр” всех размеров, включая машину ФМ 6,3 глубиной
1200 мм, 1 м3/мин воздуха на 1 м3 вместимости камеры без исполь-
256
III.23. Флотационная машина ’’Механобр”:
а — продольный и поперечный размер; б — импеллер и статор; в — блок импелле-
ра: 1 — статор; 2 — импеллер; 3 — центральная труба; 4 — отверстие в централь-
ной трубе для циркулирования пульпы; 5 — заслонка, регулирующая степень
открытия отверстия 4; 6 — питающий трубопровод; 7 — шибер для регулирова-
ния уровня пульпы; 8 — разгрузочный карман; 9 — пеногон; 10 — окно в меж-
камерной перегородке; 11 — успокоитель; 12 — диск импеллера; 13 — лопатки
статора; 14 — диск статора; 15 — лопатки импеллера; 16 — ступица импеллера;
17 — циркуляционное отверстие в диске статора
зования воздуходувки. При этом радиальный зазор между импелле-
ром и лопатками статора должен составлять 5—8 мм, а осевой зазор
между лопатками импеллера и статором — 6—10 мм. Увеличение радиаль-
ного и осевого зазоров приводит к снижению расхода засасываемого
воздуха.
Импеллер и статор гуммируются износостойкой резиной. Привод-
ной механизм и импеллер со статором собраны в единый блок, что
позволяет быстро заменять изношенные импеллер и статор.
Для создания спокойной зоны пенообразования в последней конст-
рукции машин ’’Механобр” предусмотрена установка успокоителя,
257
17-6926
258
Таблица Ш.7
Технические характеристики флотационных машин ’’Механобр”
Параметры ФМ*0,2 ФМ 0,4 | ФМ 1,2 ФМ 3,2 ФМ 6,3
Размеры камеры (длина х ширина х глубина), мм 500 х 500 х 700 х 700 х 1100 х1100 х 1750х1600х 2200 х 2200 х
х550 х 700 х 1000 х 1100 х 1200
Вместимость камеры, м3 0,14 0,38 1,35 3,2 6,3
Диаметр импеллера, мм 200 300 500 600 750
Частота вращения импеллера, мин 1 700 460 300 280(320)** 240 (275 )**
Окружная скорость импеллера, м/с 7,3 7,2 7,8 8,8 (10,1) ** 9,4 (10,8) *2
Производительность по потоку пульпы, м3/мин До 0,25 До 0,6 1,5-2,5 4 3,5-6,0 7-12
Установочная мощность электродвигателя 1,1 2,2 5,5 11 (13) *2 22 (30) *2
на одну камеру, кВт
Мощность, потребляемая электродвигателем 1 2 4,5 9 20
одной камеры для руды плотностью
2700 кг/м3 в пульпе с содержанием
твердого 30 %, кВт
Расход засасываемого воздуха на камеру, 0,2 0,4 1 3 6
м3/мин -
Площадь пола, занимаемая одной камерой 0,58 0,85 2,1 . 3,2 6,5
машины «.без карманов и пенных желобов) . -
* Флотационная машина механическая.
*2 Цифры в скобках относятся к работе на грубоизмельченных рудах, содержащих менее 40 % класса — 0,074 мм.
состоящего из радиальных Г-образных пластин, расположенных вок-
руг статора и крепящихся ко дну камеры. Для направления пены к
сливному порогу задняя стенка камеры в верхней части выполнена
в виде плавной кривой. Съем пены в машине осуществляется пеногоном.
Машина ’’Механобр” собирается из двухкамерных секций и может
состоять из одних всасывающих камер или звеньев, включающих вса-
сывающую и одну или несколько прямоточных камер. Пульпа посту-
пает самотеком из приемного кармана машины (или из промежуточ-
ного кармана) через питающий патрубок на импеллер всасывающей
камеры и проходит по машине через отверстия в межкамерных пере-
городках.
Разгрузка пульпы из последней прямоточной камеры звена осу-
ществляется через карман, снабженный шибером для регулирования
уровня пульпы в звене и песковой заслонкой для регулирования ши-
рины отверстия, через которое загружается крупнозернистый материал.
Шибер приводится в движение от электродвигателя. Промежуточные
продукты могут поступать в любую камеру самотеком через специаль-
но устанавливаемый для этой цели патрубок.
Технические характеристики флотационных машин ’’Механобр”
приведены в табл. Ш.7. Для каждого номера машины целесообразно
выбирать максимальные потоки питания, указанные в табл. Ш.7, для
снижения вредного влияния продольного перемешивания. Подача на
импеллер таких потоков пульпы обеспечивает также максимальный
расход засасываемого воздуха.
Таким образом, при работе на максимальных потоках пульпы в
машинах ’’Механобр” достигается наиболее высокая скорость флота-
ции. При подаче в машину максимальных потоков пульпы во всасываю-
щих камерах отверстия в статоре и надымпеллерном стакане должны
быть закрыты. При меньших потоках питания отверстия в диске статора
должны быть открыты, чтобы общий поток, поступающий на импеллер,
был постоянен. В прямоточных камерах эти потоки на импеллер обес-
печиваются открытием отверстий в диске статора и надымпеллерном ста-
кане и не зависят от подачи питания в машину.
Флотационная машина ’’Механобр” — первая в мире механическая
машина с камерами большой вместимости (6,3 м3) и одним импелле-
ром в камере.
Флотационные машины ’’Механобр” установлены на фабриках разной
производительности, перерабатывающих различные руды.
Флотационная машина ’Денвер Суб-А ” (рис. Ш.24), выпускаемая
фирмой ’’Денвер” (США), создана на основе машины ’’Денвер — Фа-
ренволд” [45] . Вместо надымпеллерного диска в машине ’’Денвер
Суб—А” установлен статор — диск с радиальными лопатками. Статор
увеличивает аэрацию и улучшает распределение воздуха в камере. На
рис. Ш.24, в показана последняя конструкция статора с клиновидными
выемками по периферии диска. Эти выемки служат для направления
выбрасываемой импеллером пульповоздушной смеси к центральной
259
a
б
a — продольный разрез; б — импеллер; в — статор: 1 — импеллер; 2 — статор;
3 — центральная труба; 4 — карман; 5 — шибер для регулирования уровня пуль-
пы; 6 — циркуляционное отверстие для подачи пульпы на импеллер; 7 — отверстие
для прохода крупнозернистого материала; 8 — лопатки импеллера; 9 — диск
импеллера; 10 — лопатки статора
трубе и обеспечивают более равномерное распределение воздуха в
камере.
Импеллер (см. рис. Ш.24, б) представляет собой диск с шестью
лопатками, выступающими за края диска. Импеллер и статор гуммиро-
ваны износостойкой резиной. В тех случаях, когда в качестве реагентов
применяются масла, керосин или жирные кислоты, импеллер и ста-
тор гуммируются неопреном.
Воздух во флотационные машины ’’Денвер Суб—А” засасывается
из атмосферы и подается от воздуходувки. Расход поступающего воз-
духа в машины всех размеров составляет 1,25 м3 /мин на 1 м3 вмести-
мости камеры. Машина ’’Денвер Суб—А” состоит из всасывающих камер
и выпускается с одно- или двусторонним съемом пены. Пена удаляется
пекогоном. Технические характеристики машин ’’Денвер Суб—А” при-
ведены в табл. Ш.8. В настоящее время флотационные машины этого
типа в основном применяются в перечистных операциях и при разделе-
нии коллективных концентратов, так как обеспечивают возврат пром-
продуктов без применения насосов.
Флотационная машина ’’Вемко”, выпускаемая фирмой ’’Вемко”
(США), состоит из квадратных или прямоугольных камер, имеющих
в нижней части по ширине трапецеидальное сечение (рис. Ш.25) [45] .
Разработанный фирмой в 1967—68 гг. аэратор, состоящий из цель-
нолитых ротора и статора, получил название ”1 + 1” (см. рис. Ш.25, б).
260
Таблица Ш.8
Технические характеристики флотационных машин ’’Денвер Суб—А”
№ машины Размеры камеры, мм Вмести- мость ка- меры, м3 Диаметр импеллера, мм Окружная скорость импеллера, м/с Установочная мощность электродви- гателя на одну каме- ру, кВт
8 483х406х х406 0,08 203 9,15 1,1
15 711 хбЮх х 762 0,34 280 9,15 2,2
18 914х813х х 864 0,68 406 9,15 3,7
24 1220 х 1092 х х 1016 1,42 558 6,1 5,5
30 1575 х 1422х х 1220 2,83 685 6,1 7,4
180 1981х1829 х х 1626 5,09 — 6,1 14,7
300 2235 х 2235 х х 1829 8,49 — 6,1 22,1
500 2845 х 2692 х х 1981 14,16 — 6,1 29,4
Примечание. За номер машин до № 30 включительно принят диаметр импел-
лера в дюймах, а начиная с № 180 — вместимость камеры в кубических футах.
III.25. Флотационная машина ’’Вемко”:
а — поперечный разрез; б — ротор и статор конструкции 1 + 1:7- ротор; 2 — ка-
мера; 3 — статор; 4 — центральная труба; 5 — труба для засасывания воздуха;
б — конический перфорированный колпак; 7 — циркуляционная труба; 8 — перфо-
рированное ложное днище; С — зазор между ротором и статором; d — глубина
погружения ротора
261
Звездообразный ротор имеет 6—10 радиальных лопаток, заканчивающих-
ся трапецеидальным утолщением. Статор выполнен в виде цилиндра
с овальными отверстиями, между которыми с внутренней стороны
расположены полуцилиндрические ребра. Ротор и статор целиком из-
готовлены из резины. Между ротором и статором имеется большой
зазор, который для машин № 120 (вместимость камеры 8,49 м3), нап-
ример, составляет 180 мм.
При вращении ротора из атмосферы через центральную трубу заса-
сывается воздух, а снизу — пульпа. Воздух и пульпа смешиваются в по-
лости ротора, и пульповоздушная смесь выбрасывается через отверстия
статора в камеру в радиальном (а не тангенциальном) направлении,
так как благодаря большому зазору турбулентные потоки в значитель-
ной степени гасятся в пространстве между ротором и статором. Радиаль-
ный выброс аэрированной пульпы способствует более равномерному
распределению воздушных пузырьков по объему камеры.
Для создания на поверхности пульпы спокойной зоны пенообра-
зования на центральной трубе установлен конический перфорирован-
ный колпак.
В камерах вместимостью 2,83 м3 и более для усиления циркуляции
пульпы установлено ложное дно, не доходящее до стенок камеры, с
циркуляционной трубой. Пульпа, выброшенная ротором к стенкам
камеры, проходит между настоящим и ложным дном и через циркуля-
ционную трубу засасывается ротором вверх. Такая циркуляция пре-
пятствует осаждению материала на дне камеры, что позволяет увеличить
глубину камеры с 686 (№ 66) до 2667 мм (№ 190) . При этом расстояние
от поверхности пульпы до верхней кромки ротора в камерах большей
глубины по сравнению с мелкими камерами изменяется незначительно.
Так, для камеры вместимостью 28,32 м3 (№164) глубина погружения
ротора составляет в стандартных условиях всего 250 мм. Малая глу-
бина погружения ротора обеспечивает засасывание в машину значитель-
ных объемов воздуха. Фирма указывает, что максимальный расход воз-
духа составляет для машин всех размеров 1 м3/мин на 1 м3 вмести-
мости камеры. Номинальный расход воздуха для больших номеров
машин приблизительно равен 0,5 (№ 120), 0,5 (№ 144) и 0,4 м3/мин
на 1 м3 вместимости камеры (№№ 164, 190), что соответственно сос-
тавляет 0,8—1 м3/мин на 1 м2 сечения камеры.
Съем пены в машинах ’’Вемко” обычно двусторонний и осуществ-
ляется самотеком, однако при необходимости для удаления пены
используется пеногон. Машина состоит из отдельных прямоточных
звеньев, устанавливаемых каскадно (рис. III. 26).
Наибольшее число камер в звене равно шести для машин до № 120
включительно, пяти — для машин № 144 и четырем — для машин №№ 164,
190. Звенья машины соединяют посредством промежуточных карманов.
В конце машины устанавливается разгрузочный карман. Регулирование
уровня пульйы в промежуточных и разгрузочных карманах может быть
ручным и автоматическим. Пульпа поступает в машину самотеком че-
262
Питание
1 — приемный карман; 2 — первое прямоточное звено; 3 — регулятор уровня
пульпы; 4 — промежуточный карман; 5 второе прямоточное звено; 6 — разг-
рузочный карман
рез приемный карман, перетекает из камеры в камеру через отверстия
в межкамерных перегородках и промежуточных карманах и выпускает-
ся через разгрузочный карман. Реагенты и промпродукты могут пода-
ваться в приемный и промежуточные карманы. Промпродукты подаются
насосами.
Технические характеристики машин ’’Вемко” приведены в
табл. III.9.
В последние годы фирма ’’Вемко” разработала конструкцию маши-
ны, в которой вместо воздуха используется азот. Машина получила
название ’’Инертный газ”. Необходимость разработки была вызвана
применением на ряде фабрик при разделении медно-молибденового
концентрата азота вместо воздуха с целью снижения расхода подавите-
ля сульфидов меди — гидросульфида натрия.
В основе конструкции машины ’’Инертный газ” лежит стандартная
машина ’’Вемко”. Она состоит из ряда камер, собранных в единую
установку. Камеры и желоба герметизированы, над ними имеется замк-
нутое пространство. В начальный момент в машину из атмосферы заса-
сывается воздух. В пульпе кислород, содержащийся в воздухе, рас-
ходуется на окисление гидросульфида натрия, а оставшийся почти чис-
тый азот используется в качестве флотационного газа. Частично азот
выделяется из пульпы при разрушении пены и собирается в замкнутом
пространстве над машиной, частично уходит с пенным и камерным
продуктами.
Для извлечения азота из камерного продукта последняя камера
машины превращена в камеру дегазации. В ней вместо блока ’’Вемко”
смонтирован корабельный винт. Частота вращения винта обеспечивает
только взвешивание частиц и позволяет пузырькам азота выделиться
из пульпы и собраться в замкнутом пространстве над машиной. Для
извлечения азота из пенного продукта последний поступает в буферный
чан, а оттуда в дегазатор.
В дегазаторе под действием центробежной силы и вакуума из пен-
ного продукта выделяется азот, направляемый в замкнутое пространст-
263
Таблица III.9
Технические характеристики флотационных машин ’’Вемко”
№ машины Размеры камеры, мм Вместимость камеры, м3 Диаметр ротора, мм Окружная скорость ротора, м/с Установочная мощность электродви- гателя на одну камеру, кВт
18 305 х457 х х 254 0,03 89 4,6 0,4
28 457 x711 х х 305 0,09 140 5,1 0,7-1,1
36 914 х 914 х х406 0,31 178 5,3 2,2
44 1118 х1118 х х508 0,59 216 5,6 3,7
56 1422х1422х х 610 1,13 279 6,2 5,5
66 1676 х 1676 х х686 1,7 324 6,4 7,4
66 Д 1524х1676х х 1194 2,83 406 5,7 11,0
84 1600х2134 х х 1346 4,25 406 6,6 11,0
120 2286 х 3048 х х 1346 8,49 559 6,4 18,4-22,1
144 2743 х 3658 х х 1600 14,16 660 6,6 22,1-29,4
164 3023 х 4166х 28,32 762 7,4 44,2-55,2
х 2362
190 3556х4826 х х 2667 42,^8 889 7,7 73,6-92,0
Примечание. За номер машин принята ширина камеры в дюймах.
во под машиной, а обезгаженный концентрат через буферный чан идет
на дальнейшие операции. Собранный в замкнутом пространстве азот
вновь засасывается в пульпу и таким образом многократно использует-
ся для флотации.
Машина ’’Инертный газ” производит азот из воздуха, ей не требуются
специальные источники азота. Применение машины № 66 на фабрике
Твин—Бьютте в основной молибденовой флотации позволило уменьшить
расход подавителя на 68 %.
Флотационные машины ’’Вемко” применяются при обогащении
медных, медно-молибденовых, свинцово-цинковых, полиметаллических,
железных, фосфатных и других руд на обогатительных фабриках мно-
гих стран. Машины больших размеров установлены на ряде зарубежных
предприятий, реконструированных и построенных в последние годы:
’’Чайно”, ’’Пима”, ’’Магна” и ’’Артур” (США), ’’Квеста” (Канада), ”Эль-
Тениенте” и ’’Чукикамата” (Чили), ’’Кобриза” (Перу) и др.
264
18.2. Пневмомеханические флотационные машины
Отличительной особенностью пневмомеханических флотационных
машин является то, что в этих машинах импеллер вращается с частотой,
необходимой для поддержания частиц во взвешенном состоянии и тон-
кого диспергирования воздуха, а воздух подается в машину от возду-
ходувки, что позволяет по сравнению с механическими флотационными
машинами обеспечить постоянный расход воздуха в машине независимо
от износа аэраторов и осуществить регулирование расхода воздуха по
фронту флотации.
Флотационная пневмомеханическая машина ФПМ (СССР) имеет
квадратные камеры, в каждой из которых расположен аэратор.
В машинах с камерами вместимостью 3,2; 6,3 и 8,5 м3 аэратор
представляет собой перевернутый усеченный конус с отверстием по
нижнему сечению конуса (рис. III.27) [45] . Основанием конуса служит
диск, выступающий за края конуса. На внешней поверхности конуса
расположены нарифления в виде усеченного конуса. Основаниями
нарифления крепятся к диску аэратора, а их концы расположены на
небольшом расстоянии от кромки нижней части аэратора. На диске
имеются радиальные полуцилиндрические выступы. Внутри конуса
проходит воздушный канал, который соединяется с полым валом.
У вращающегося аэратора вследствие различия окружных скоростей
его верхней и нижней частей центробежное действие усиливается снизу
вверх, что приводит к возникновению потока вдоль образующих конуса.
У основания конуса поток делится на части и движется к стенкам каме-
ры, а затем по дну камеры возвращается к аэратору. Воздух по полому
валу в нижнем сечении конуса выходит в камеру, смешивается с пото-
ком пульпы и увлекается вверх, концентрируясь в областях пониженно-
го давления за нарифлениями. Возникающие на границе воздушных
полостей с пульпой вихри диспергируют воздух. Пульповоздушная
смесь при сходе с диска аэратора выбрасывается в камеру.
Машина компонуется из прямоточных звеньев. Звенья могут быть
установлены на одном уровне или каскадно. В последнем случае в голов-
ных камерах прямоточных звеньев устанавливается блок импеллера
механического типа. Механические блоки также позволяют возвращать
промежуточные продукты по принятой схеме без применения насосов.
III.27. Флотационная машина ФПМ с ко-
ническим аэратором:
а — поперечный разрез; б — аэратор: 1 —
корпус камеры; 2 — импеллер; 3 —
полый вал; 4 — лопатки успокоителя;
5 — диск; 6 — нарифления; 7 — радиаль-
ные полуцилиндрические выступы
265
III.28. Флотационная машина ФПМ 12,5:
а — поперечный разрез; б — импеллер; в — импеллер
упрощенной конструкции: 1 — корпус камеры; 2 —
блок импеллера; 3 — привод импеллера; 4 — вентиль;
5 — воздуховод; 6 — пеногон; 7 — крыльчатка; 8 — ко-
нус
Съем пены осуществляется пекогоном.
В машине ФПМ 8,5 с камерой вместимостью 8,5 м3 и глубиной
1,8 м конический аэратор сверху дополнительно снабжен лопастями,
закрытыми диском с отверстием в центре для прохода пульпы. Благо-
даря наличию лопастей достигаются интенсивное перемешивание и рав-
номерное распределение частиц по всему объему камеры.
В машине ФПМ 12,5 с камерой вместимостью 12,5 м3 (рис. Ш.28,д)
установлен лопастной импеллер (см. рис. III.28, б), представляющий
собой ступицу, связанную восемью радиальными лопастями с диском,
в нижней части которого имеется конический раструб. Сверху на сту-
пице закреплен конус, обеспечивающий раздельный подвод верхнего
и нижнего потоков пульпы.
Импеллер крепится на полом валу, над импеллером размещен дис-
пергатор-диск с 24 радиальными лопатками. Диспергатор крепится к
циркуляционной воронке, которая в свою очередь закреплена на цент-
ральной трубе. При вращении импеллера через нижний раструб засасы-
вается пульпа, которая вместе с воздухом, поступающим по полому
валу, идет через окна между радиальными лопастями в зону лопаток,
где воздух диспергируется. Затем пульповоздушная смесь смешивает-
ся с верхним потоком пульпы, поступающим через циркуляционную
воронку, и выбрасывается в камеру через промежутки между лопат-
ками диспергатора, который снижает турбулентность потоков пульпы
в камере, способствует тонкому диспергированию воздуха и обеспечи-
266
вает равномерное распределение воздуха в камере. Импеллер и диспер-
гатор гуммируются.
На рис. III.28, в показан импеллер упрощенной конструкции к маши-
не ФПМ 12,5.
Импеллер флотационной машины ФПМ 25 с вместимостью камеры
25 м3 принципиально не отличается от импеллера, изображенного на
рис. Ш.28, в.
В настоящее время институтом ’’Механобр” создана флотационная
машина ФПМ 40 с камерой вместимостью 40 м3 и бесстаторным аэра-
тором. Машина успешно эксплуатируется на одной из медно-никелевых
фабрик. Промышленные испытания, проведенные на фабрике, перера-
батывающей медно-никелевые руды, показали, что при близких техно-
логических показателях аэратор машины ФПМ 40 потребляет на 30-
35 % меньше электроэнергии, чем аэратор ОК-38. Аэратор такой же
конструкции создан для машины ФПМ 12,5. Успешные испытания этого
аэратора проведены на фабрике, перерабатывающей медно-цинковые
руды.
Технические характеристики машин ФПМ приведены в табл. ШЛО.
Флотационная машина ’’Аджитейр” выпускается в настоящее время
фирмой ’’Вемко” (США). В последние годы широко известная конст-
рукция машины с пальцевым импеллером и квадратным успокоителем
[45] была существенно усовершенствована применительно к боль-
шеобъемным машинам [31] .
Машина состоит из квадратных или прямоугольных камер со ско-
шенными углами, в которых установлены импеллер типа ’’пипса” и
радиальный успокоитель (рис. Ш.29). Нижняя часть импеллера ’’пипса”
(см. рис. Ш.29, б) представляет собой плоский диск с прикрепленными
к нему снизу пальцами. В верхней части импеллера ’’пипса” имеется
конический диск с отверстием в центре для подачи пульпы. Между
коническим и плоским дисками расположены лопатки.
Нижняя часть импеллера работает как обычный пальцевый импел-
лер, создавая донную циркуляцию пульпы и диспергируя воздух. Верх-
няя часть импеллера работает как лопастной импеллер центробежного
типа — пульпа поступает на лопатки через отверстие в центре коничес-
кого диска и выбрасывается к стенкам камеры. Это создает дополни-
тельное перемешивание и циркуляцию пульпы в камере и облегчает
запуск машины после аварийных остановок.
Круговой успокоитель состоит из диска с отверстием под импеллер
и радиальных лопаток. Из-за наличия горизонтального диска эта конст-
рукция обеспечивает достаточно сильную донную циркуляцию. Пульпа,
выброшенная импеллером к стенкам камеры между лопатками успо-
коителя, по дну камеры под диском возвращается снова на импеллер.
Конструкция камеры со скошенными углами препятствует оседанию
песков в углах камеры и придает потокам пульпы и воздушных пузырь-
ков движение в вертикальном направлении, а наличие горизонтальных
267
268
Технические характеристики флотационных машин ФПМ
Таблица III.10
Параметры ФПМ 3,2 ФПМ 6,3 ФПМ 8,5 ФПМ 12,5 ФПМ 25 ФПМ 40
Размеры камеры, мм 1600х 1750 х 2200 х 2200 х 2200 х 2200 х 2600 х 2600 х 2900 х 2900 х 3500 х 3500 х
х 1100 х 1200 х 1850 х 1800 х 2900 хЗЗОО
Вместимость камеры, м3 3,2 6,3 8,5 12,5 25 40
Диаметр импеллера, мм 650 760 760 900 (760) 1000 900
Частота вращения импел- лера, мин-1 200 240 165 190(165) 143 150
Окружная скорость им- пеллера, м/с 6,3 9,4 6,6 8,8(6,3) 7,5 7
Установочная мощность электродвигателя на одну камеру, кВт 7,5 18,5 22 45 (ЗОУ 55 55
Мощность, потребляемая электродвигателем одной камеры для руды плот- ностью 2700 кг/м3 при содержании твердого в пульпе 30 %, кВт 4,4 15,5 13 21,5(16) 33 25
Суммарная потребляемая мощность на одну камеру с учетом мощности на по- дачу воздуха, кВт 5,8 17,6 15,6 27,5 (20,5) 40 35
Расход воздуха на одну камеру, м3/мин 2,3 4,4 4,8 10(7,5) 10 12
Площадь пола, занимаемая одной камерой машины (без карманов и пенных желобов) 3,4 5,5 6,7 8,7 10,5 15,4
Избыточное давление воз- 18-22 . духа, кПа Примечание. Цифры в скобках относятся 18-22 к машине ФПМ 1 25 25 2,5 с бесстаторным аэратором. 40 50
III.29. Флотационная машина ’’Аджитейр”:
а — поперечный разрез; б — импеллер типа ’’пипса”; в — круговой успокоитель?
1 — импеллер; 2 — успокоитель; 3 — камера; 4 — горизонтальный выступ; 5 —
накладные планки; 6 — полый вал; 7 — отверстие в межкамерной перегородке;
8 — конический диск; 9 — плоский диск; 10 — лопатки импеллера; 11 — пальцы
импеллера; 12 — отверстие для входа пульпы; 13 — лопатка успокоителя; 14 —
диск успокоителя
выступов у боковых стенок в местах перехода скошенной части камеры
в вертикальную создает дополнительный циркуляционный поток на
импеллер, способствующий транспорту частиц.
Таблица III.И
Техническая характеристика флотационных машин ’’Аджитейр”
№ ма- шины Размеры ка- меры, мм Вмести- мость ка- меры, м3 Диаметр импелле- ра, мм Окружная скорость импеллера, м/с Расход подавае- мого воз- духа на камеру, м3/мин Устано- вочная мощ- ность электро- двигате- ля на ка- меру, кВт
60 х 100 1524 х 1524 х х 1220 2,83 - 5 2,3 7,4
78 х 200 1980 х1980 х х 1448 5,66 690 5,3 5-5,9 11
90 х 300 2286 х 2286 х х 1727 8,49 760 5,8 6,6-7,8 18,4
102x500 2743 х 2769 х х 2007 14,16 840 5,9 9,4-11,5 29,4
144 х100 3353 х 3581 х х 2540 28,32 1020 6,9 14,2-18 44,2
165 х х 1500 4200 х 3660 х хЗООО 42,48 1140 6,9 17,7—23,3 —
Примечание. Первые цифры номера машины выбираются, исходя из длины
камеры в дюймах, вторые соответствуют вместимости камеры в куб.футах.
269
Ш.30. Флотационная машина ’’Денвер Д-Р”:
а — продольный разрез; б — импеллер: 1 — статор; 2 — импеллер; 3 — криволи-
нейный раструб; 4 — конический стакан; 5 — центральная труба; 6 — труба для
подачи воздуха; 7 - вентиль для регулирования подачи воздуха; 8 - диск импел-
лера; 9 — лопатки импеллера
Благодаря новым разработкам глубина камеры была увеличена
с 762 мм в машинах с малой вместимостью камер до 3000 мм в маши-
нах № 165 х 1500 с вместимостью камеры 42,48 .м3 (табл. III.11).
Съем пены в машине осуществляется самотеком. Выход пенного
продукта регулируется накладными планками.
Машина ’’Аджитейр” — прямоточного типа и состоит из отдельных
звеньев, устанавливаемых каскадно (см. рис. III.29). Уровень пульпы
в машине регулируется автоматически. Для подачи промежуточных
продуктов в различные операции используются специальные насосы.
Технические характеристики флотационных машин ’’Аджитейр” при-
ведены в табл. III. 11.
Флотационная прямоточная машина "Денвер Д-Р" выпускается
фирмой ’’Денвер” для интенсивного ведения основной и контрольной
флотации [45 J .
Машина состоит из камер квадратного или прямоугольного сече-
ния. В отличие от машины ’’Денвер Суб-А” в машине ’’Денвер Д-Р”
пульпа поступает на лопатки импеллера из средней по высоте зоны
камеры через конический стакан, который крепится к статору
(рис. III.30, а). Воздух подводится к лопаткам импеллера от воздухо-
дувки через центральную трубу, заканчивающуюся криволинейным
270
Таблица 111.12
Технические характеристики флотационных машин ’’Денвер Д-Р
№ ма- шины Размеры ка- меры, мм Вмести- мость ка- меры, м3 Диаметр импелле- ра, м/с Окружная скорость импелле- ра, м/с Расход по- даваемого воздуха на каме- ру, м3 /мин Установоч- ная мощ- ность электро- двигателя на камеру, кВт
8 483 х 406 х х 430 0,09 0,2 6,3 0,3 1,1
15 711х 610 х х 762 0,34 0,3 6,4 0,8 2,2
18 914 х 813 х х914 0,71 0,46 6,7 1,4 3,7
24 1220х1092х х 1014 1,42 0,56 6,6 2,4 5,5
100 1575 х 1575 х х 1220 2,83 0,61 6,4 3,6 11,0
180 1829 х1829 х х 1930 5,09 — — 5,1 14,7
300 2235 х 2235 х х 1980 8,49 0,84 7,2 7,6 22,1
500 2692 х 2692 х х 1980 14,16 0,84 7,5 11,3 29,4
1275 4267 х 3531 х х 2590 36,08 1,17 8,0 14,22 55,2
Примечание. За номер машины до № 24 включительно принят диаметр
импеллера в дюймах, а начиная с № 100 — вместимость камеры в куб. футах.
раструбом. Пульпа смешивается с воздухом непосредственно при входе
на лопатки импеллера, что является особенностью машин ’’Денвер Д-Р”.
Пульповоздушная смесь выбрасывается между радиальными лопатками
статора в камеру, где возникают восходящие потоки пульпы. Сочетание
конического стакана с лопастным открытым сверху импеллером обес-
печило в машине ’’Денвер Д-Р” принудительную циркуляцию значитель-
ных объемов пульпы и позволило создать камеры большой вместимос-
ти, имеющие глубину 2590 мм (табл. III. 12).
Импеллер (см. рис. Ш.ЗО, б) представляет собой диск с вырезами
между лопатками. При вращении такого импеллера пульпа со дна ка-
меры через вырезы поступает в полость импеллера, отбрасывается к
стенкам камеры, а затем по дну камеры возвращается на импеллер.
Таким образом, наряду с циркуляцией пульпы через конический ста-
кан в машине ’’Денвер Д-Р” имеется также донная циркуляция, увели-
чивающая перемешивание в нижней части камеры.
271
Подача больших объемов пульпы на импеллер привела к необхо-
димости увеличить число лопаток импеллера с 9 в камерах вмести-
мостью 2,83—8,49 м3 до 12 в камере вместимостью 14,16 м3 и до 18
в камере вместимостью 36,08 м3.
Восходящие потоки обеспечивают хорошее перемешивание, предотв-
ращая расслоение частиц по высоте, и помогают подъему частиц и пу-
зырьков до верхнего среза конического стакана. Необходимо отметить,
что расстояние от верхнего среза стакана до поверхности пульпы даже
для камер большой вместимости незначительно, и минерализованные
пузырьки вне зоны циркуляции должны пройти относительно короткий
путь, чтобы достичь пенного слоя.
Машина ’’Денвер Д-Р” состоит из отдельных звеньев, устанавливае-
мых каскадно (см. рис. Ш.29), что обеспечивает движение пульпы
через машину самотеком.
Съем пенного продукта в машинах ’’Денвер Д-Р” одно- и двусторон-
ний и осуществляется самотеком или пеногоном. Промежуточные про-
дукты подаются в различные операции с помощью насосов.
В табл. III. 12 приведены технические характеристики машин ’’Ден-
вер Д-Р”. Флотационные машины ’’Денвер Д-Р” применяются при обога-
щении различных руд на зарубежных обогатительных фабриках мно-
гих стран.
Флотационная машина ”ОК” выпускается фирмой ’’Оутокумпу Оу”
(Финляндия) [31,45] . Машина состоит из квадратных камер с прямо-
угольным или V -образным вертикальным поперечным сечением
(рис. 111.31, а). В каждой камере имеется аэратор, включающий ротор
и круговой радиальный статор (см. рис. 31, б, в). Ротор представляет
собой диск, к которому снизу симметрично по кругу крепятся десять
элементов. Каждый элемент состоит из двух радиальных лопастей слож-
ного профиля и имеет V-образную форму (см. рис. III.31, в)
III.31. Флотационная машина ”ОК”:
а — поперечный разрез (пунктиром показана камера V-образной формы) ; б —
ротор; в — статор: 1 — ротор; 2 — статор; 3 — камера; 4 — полый вал
272
Лопасти соседних элементов параллельны и между ними имеются
щели, из которых воздух, подаваемый через полый вал, выходит в ка-
меру. При вращении ротора пульпа со дна камеры засасывается вверх
в полость между радиальными лопастями каждого элемента и выходит
в верхней части ротора. Точки выхода пульпы и воздуха из полости
ротора чередуются попеременно по кругу, т.е. осуществляется раздель-
ный выход пульпы и воздуха с лопастей ротора.
Конструкция ротора рассчитана таким образом, что воздух выходит
из полости ротора на всем расстоянии, равном двум третьим высоты
ротора от его верхнего края, а не только в наименее погруженной части
ротора. Возрастание гидростатического давления с увеличением расстоя-
ния от верхнего края ротора компенсируется уменьшением давления,
создаваемого центробежной силой вращающейся жидкости в пространст-
ве между ротором и статором.
На выходе из ротора пульпа и воздух смешиваются, и образованная
пульповоздушная смесь выбрасывается между лопатками статора в
камеру. Пузырьки поднимаются в пену, а пульпа по дну камеры возв-
ращается на импеллер, создавая циркулирующий поток.
Конструкция ротора позволяет запускать машину после остановок
без выпуска пульпы из камеры. Ротор и статор гуммируются износо-
стойкой резиной.
В камере V-образной формы происходит более слабое осаждение
песков, и она имеет меньшую массу, чем камера с прямоугольным
вертикальным сечением.
Съем пены в машине ”ОК” двусторонний, но возможна и односторон-
няя разгрузка. Машина сверху закрыта крышкой, которая одновремен-
но является площадкой для обслуживания. В крышку вставляется тру-
ба, через которую отсасывается отработанный воздух, выходящий из
пены.
Технические характеристики машин ”ОК” приведены в табл. Ш.13.
В настоящее время создана машины ОК-60 с камерой вместимостью
60 м3.
Машина ”ОК” компонуется из двухкамерных секций, устанавливае-
мых каскадно. Уровень пульпы в машине поддерживается автоматически.
Флотационные машины ”ОК” установлены на фабриках Финляндии,
на отечественных предприятиях, на фабриках Канады, Швеции, Филип-
пин, Бразилии, Замбии и других стран.
Флотационная машина ’Дорр-Оливер”, выпускаемая фирмой ’’Дорр-
Оливер” (США), состоит из квадратных или прямоугольных камер,
имеющих в основном V-образное вертикальное поперечное сечение
(рис. III.32, а) [31] . В камере установлен аэратор, включающий ротор
и круговой радиальный статор. Ротор состоит из диска и шести лопастей,
которые крепятся к диску снизу (см. рис. Ш.32, б). Лопасти имеют
профиль, аналогичный профилю лопастей ротора машины ”ОК”. Две
соседние лопасти образуют полость V-образной формы. В центре ротора
имеется камера, которая соединяется с каждой из полостей каналами.
273
18-6926
Таблица III. 13
Технические характеристики флотационных машин ”0К”
№ ма- шины Размеры попереч- ного се- чения ка- меры, мм Глубина камеры, мм Вмести- мость каме- ры, м3 Диа- метр импел- лера, мм Окруж- ная ско- рость, м/с Расход подавае- мого воз- духа на камеру, м3/мин Устано- вочная мощ- ность элект- родви- гателя на ка- меру, кВт
сред- няя пределы регули- рования
ОК—0,5 Р 800 х 800 800 0,5 До 1 2,75
ОК-1,5Р 1350 х х 1350 1200 — 1,5 — — 0,5-2 5,5
ОК-ЗР 1500 х х 1500 1200 — 3 500 5,2 1-3 7,5
ОК-8Р 2200 х х 2200 1700 1500— 1800 8 650 6,1 4-10 15
OK-16V, ОК-16Р 2800 х х 2800 2100 1600- 2200 16 750 6,3 8-18 30
OK-38V 3600 х х 3600 2900 2200- 2950 38 900 7,5 12-30 55
Примечание. Индекс ”Р” относится к камерам с прямоугольным вертикаль-
ным поперечным сечением, V~c V-образным вертикальным поперечным сечением.
Воздух из полого вала попадает в камеру и далее по каналам выходит
на поверхность ротора.
Статор состоит из двух дисков, соединенных между собой стойками,
и радиальных лопаток, крепящихся к верхнему диску (см. рис. III.32, в).
Лопатки перекрывают ротор до половины его высоты. Отсутствие
лопаток в нижней части статора, по мнению фирмы, улучшает переме-
шивание пульпы благодаря усилению донной циркуляции и снижает
расход энергии. Зазор между лопатками статора и ротором составляет
16 % радиуса ротора. С помощью нижнего диска статор крепится ко
дну камеры.
При вращении ротора пульпа со дна камеры засасывается вверх
в полости между лопастями, смешивается внутри лопастей с воздухом,
и образованная пульповоздушная смесь выбрасывается между лопат-
ками статора в камеру. Пузырьки поднимаются в пену, а пульпа по дну
камеры возвращается на импеллер. Камера машины ”Дорр-Оливер”,
начиная с № 300, имеет V-образное вертикальное сечение, что способст-
вует циркуляции пульпы и препятствует осаждению песков.
Съем пены двусторонний. Камера сверху может быть закрыта крыш-
кой, являющейся также площадкой для обслуживания.
274
в
Ш.32. Флотационная машина ’’Дорр-
Оливер”:
а — поперечный разрез; б — ротор;
в — статор; 1 — ротор; 2 — статор;
3 — камера; 4 — полый вал; 5 — ка-
мера для воздуха в роторе
Машина ”Дорр-Оливер” компонуется из двухкамерных секций.
Уровень пульпы в машине поддерживается вручную и автоматически.
Технические характеристики машин ”Дорр-Оливер” приведены в
табл. Ш.14.
Флотационная машина ’’Акер”, выпускаемая фирмой ’’Акер Трон-
делег А/С” (Норвегия) состоит из квадратных камер, имеющих прямо-
угольное вертикальное поперечное сечение [31] . В камере установлен
аэратор, включающий ротор и круговой радиальный статор (рис. Ш.ЗЗ).
Звездообразный ротор имеет восемь лопаток, скошенных с одной сторо-
ны от диагонали книзу.
Воздух по полому валу и через отверстия в роторе, расположенные
у задних поверхностей лопаток, где при вращении создаются зоны по-
ниженного давления, поступает в камеру. При вращении ротора пульпа
поступает в полости между лопатками сверху, смешивается с воздухом
и образованная пульповоздушная смесь выбрасывается между лопат-
ками статора в камеру.
В среднем расход диспергируемого воздуха, по данным фирмы,
составляет 1 м3/мин на 1 м3 вместимости камеры. Ротор выполнен
полностью из полиуретана, что позволяет из-за гибкости лопаток легко
запускать машину после остановок, не выпуская пульпу из камер.
Машина ’’Акер” в основном компонуется из двух- и четырехка-
мерных секций. Уровень пульпы в машине регулируется вручную и
автоматически. Технические характеристики машины ’’Акер” приве-
дены в табл. III. 15.
275
Таблица Ш.14
Технические характеристики флотационных машин ”Дорр-Оливер”
№ ма- шины Размеры камеры, мм Вмести- мость камеры, м1 * 3 Диаметр импелле- ра, мм Окружная скорость импелле- ра, м/с Расход подавае- мого воз- духа на камеру, м3/мин Устано- вочная мощ- ность электро- двигате- ля на камеру, кВт
DO-100 1524х1524х х 1220 3 500 4,5 4,2 7,5
DO-300 2286 х 2286 х х 1880 8,5 650 5,5 7,8 15
DO-600' 2946х2692х х 2464 17 750 5,4 15,6 30
DO-1000 3353 х 3353 х х 2896 28,3 750 7,2 25,5 40
DO-1350 3810 х 3581 х х 3226 38 900 6,5 34 50
DO-1550 3962 х 3962 х х 3226 44 750 7,5 39,6 60
DO-2500 4572х4572х х 3962 70 1100 8,1 56,6 75
Флотационная машина ’’Максвелл" была сконструирована в Канаде
и впервые установлена на медной фабрике ’’Опемиска” [45] . Маши-
на представляет собой чан (рис. III.34), диаметр которого равен высоте.
Ш.33. Аэратор флотационной маши-
ны ’’Акер”:
1 — статор; 2 — скошенная часть ло-
патки ротора; 3 — целая часть лопат-
ки ротора; 4 — отверстия в роторе;
5 — полый вал
276
Таблица Ш.15
Технические характеристики флотационных машин ’’Акер”
Параметр Номер машины
1 2 3 5 10 20 40
Вместимость камеры, м3 0,75 2 3 5 , 10 20 40
Диаметр импеллера, мм 230 310 350 425 510 610 790
Окружная скорость импеллера, м/с 6,7 6,6 6,5 6,9 6,5 6,5 6,0
Потребляемая мощность на камеру, кВт 1,9 5 7,5 10 15 22 45
Пульпа перемешивается шестилопастным импеллером. Воздух подво-
дится в камеру через трубу с обратным резиновым клапаном. Пульпа
загружается в машину сверху или сбоку, а разгружается через желоб
и отверстие в стенке камеры. Нижний конец разгрузочного желоба
расположен на расстоянии 1/3 высоты от поверхности камеры. Уровень
пульпы в камере регулируется вручную с помощью шибера. Пенный
желоб расположен внутри камеры и закреплен на четырех успокои-
тельных пластинах (на рис. III.34 показана одна пластина). Пена сли-
вается в желоб с обеих сторон и разгружается через трубу в стенке
камеры. При последовательном соединении машины ’’Максвелл” уста-
навливаются каскадно.
В табл. III. 16 приведены технические характеристики машин ’’Макс-
велл”.
Флотационные машины ’’Максвелл” установлены на ряде зарубежных
фабрик, перерабатывающих медные, медно-цинковые, медно-никеле-
III. 34. Флотационная машина ’’Макс-
велл”:
1 — клапан для подачи воздуха; 2 —
импеллер; 3 — камера; 4 — успокои-
тельная пластина; 5 — пенный желоб;
б — труба для подачи питания; 7 —
желоб для разгрузки хвостов; 8 —
отверстие для выпуска хвостов
Питание
277
Таблица III.16
Технические характеристики флотационных машин ’’Максвелл”
Номер машины Размер камеры, мм Вмести- мость камеры, м3 Диаметр импелле- ра, мм Окружная скорость импелле- ра, м/с Расход подавае- мого воз- духа, м3/мин Установоч- ная мощ- ность электро- двигателя, кВт
МХ-6 1830х1830 4,25 457 6,6 1,41 3,7
МХ-8 2440 х 2440 9,9 609 6,6 2,12 7,4
МХ-10 3050 х 3050 19,8 762 6,6 4,24 14,7
МХ-12 3660 х 3660 34,0 914 6,7 5,66 22,0
МХ-14 4270x4270 56,6 1068 6,7 8,49 30,0
Примечание. Цифра в номере машины обозначает диаметр камеры в футах.
вые и полиметаллические руды. Обычно их устанавливают в виде мо-
нокамер в начале основной флотации для удаления легко флотирую-
щихся частиц полезных минералов (фабрики ’’Насименто”, ’’Фокс”,
’’Руттен”, ’’Блэк Эйнжел”) или для доизвлечения полезных компо-
нентов из хвостов основных операций (фабрика ’’Менибридж”). На
фабрике ’’Мэгмонт” при высоком содержании свинца в руде машина
’’Максвелл” используется для доизвлечения галенита из хвостов свин-
цово-медной флотации, а при высоком содержании цинка в руде —
для флотации сфалерита. На фабрике ’’Опемиска” флотационные маши-
ны ’’Максвелл” используются во всех операциях [45] .
18.3. Пневматические флотационные машины
В пневматических флотационных машинах пульпа перемешивается
подводимым воздухом; съем пены — двусторонний и часто осуществ-
ляется самотеком.
Флотационная машина с неподвижным пористым днищем ’’Келлоу”,
машина ”Мак-Интош” с одним или двумя вращающимися у дна ро-
торами, покрытыми пористой тканью или перфорированной резиной,
мелкие аэролифтные машины ’’Форрестер” и ’’Саусвестерн” широко
применялись в 30—40-х годах. В настоящее время эти машины редко
устанавливаются на обогатительных фабриках. К их недостаткам отно-
сятся забивание пор (особенно при использовании извести) в машинах
’’Келлоу” и ”Мак-Интош”, забивание воздухоподводящих трубок пес-
ками при отключении воздуха в мелких аэролифтных машинах, труд-
ности при переработке грубозернистого материала, чувствительность
к колебаниям плотности пульпы и гранулометрического состава руды.
Глубокая аэролифтная машина АФМ 2,5 разработана в СССР и отли-
278
Д-Д
11
12
III. 35. Флотационная машина
АФМ 2,5:
1 — щелевые аэраторы; 2 — ван-
на; 3 — аэролифтная камера;
4 — накладные планки; 5 —
трубка для подачи воздуха;
6 — приемный карман; 7 —
воздушный коллектор; 8 —
шибер; 9 — разгрузочный кар-
ман ; Ю — направляющие щиты
для воздуха; 11 — отбойник;
12 — вертикальные перегородки
чается от других конструкцией глубоких аэролифтных машин двусто-
ронним щелевым подводом воздуха (рис. Ш.35) [45] . Щелевые аэра-
торы представляют собой пустотелые металлические коробки, закан-
чивающиеся сбоку щелевидным обратным клапаном, образованным
стенкой коробки и резиновой накладкой и предохраняющим аэратор
от забивания. Аэраторы подводят воздух к центральному отсеку (аэро-
279
П1.36. Колонная флотационная машина:
1, 3, 6 — расходомер соответственно для
исходной пульпы, промывной воды и
сжатого воздуха; 2 — автоматический
клапан; 4 — устройство для подачи про1-
мывной воды; 5 — пенный слой; 7 —
ручной клапан; 8 — аэратор
лифтной камере) равномерно по всей длине машины. В результате
плотность пульпы в центральном отсеке по сравнению с боковыми отсе-
ками снижается, пульпа из боковых отсеков поступает в центральный
отсек, смешивается с воздухом и выбрасывается вверх.
Отбойник над центральным отсеком направляет пульпу вниз, и она
вместе с мелкими и минерализованными пузырьками под вертикаль-
ными перегородками поступает в боковые отсеки. При этом транс-
портный воздух выходит через отверстия в системе направляющих
щитов. Минерализованные пузырьки поднимаются вверх и образуют
на поверхности боковых отсеков пену, удаляемую самотеком.
Аэролифт машины АФМ 2,5 имеет высокую производительность и
обеспечивает интенсивное перемешивание и аэрацию пульпы. Коэф-
фициент использования воздуха по сравнению с мелкими аэролифт-
ными машинами увеличен с 5-10 до 25 %.
Машина компонуется из отдельных секций длиной 3 м. Глубина
ванны 2 м, ширина 2,5 м. Расход воздуха составляет 5-7 м3/мин на
1 м машины при избыточном давлении 25—30 кПА. Выход пенного про-
дукта регулируется накладными планками. Пульпа поступает в маши-
ну через приемный карман и разгружается через хвостовой карман,
снабженный шибером для регулирования уровня пульпы в ванне.
Промышленные испытания машины АФМ 2,5 и машины ’’Саусвес-
терн” на старой Кафанской фабрике, перерабатывающей медно-пирит-
ную руду, показали экономические преимущества машины АФМ 2,5,
на основании чего машина АФМ 2,5 была установлена на новой Кафанс-
кой фабрике.
Колонная флотационная машина выпускается фирмой ’’Колэм
Флотейшн” (Канада) [31] . Она состоит из трех частей: верхней, цент-
ральной и нижней (рис. III.36). Обработанная реагентами пульпа пос-
тупает в центральную часть колонны и движется навстречу воздушным
пузырькам, поднимающимся снизу из специального диспергатора
воздуха.
280
В качестве диспергатора воздуха, расположенного в нижней части
колонны, используются рукава из перфорированной резины или тка-
ни. Срок службы трубок составляет не менее 0,5 г. Расход воздуха
1,35 м3/мин на 1 м2 сечения машины. В верхнюю часть колонны подает-
ся чистая вода. Поток воды отмывает механически увлеченные при дви-
жении пузырька частицы и способствует получению высококачественных
концентратов. Это — важное технологическое достоинство колонной
машины. Пульпа разгружается через трубу, снабженную клапаном, с
помощью которого автоматически регулируется уровень пульпы в
машине.
На фабрике ’’Гаспе” (Канада) в перечистках молибденового кон-
центрата установлены три колонные машины сечением 1,8 х 1,8, 0,9 х
х 0,9, 0,45 х 0,45 м и глубиной 12 м. Три перечистки в колоннах заме-
нили 13 операций, которые проводились в машинах ’’Денвер Д-Р”.
Сокращение числа операций достигнуто благодаря лучшему разделению
минералов в колонных машинах, при этом извлечение молибдена воз-
росло на 11 %.
Колонные машины установлены также на канадских фабриках
’’Гибралтар”, ’’Лорнекс”, ’’Хаймонт”, ’’Айленд Коппер” в молибденовых
перечистках цикла медно-молибденового разделения, на фабрике
’’Гибралтар”, кроме того, — в перечистках медно-молибденового кон-
центрата, на фабрике ’’Полярис” — в перечистках свинцового и цин-
кового концентратов.
В СССР ИОТТ, Гинцветметом и Госгорхимпроектом разработаны
оригинальные конструкции колонных машин [38] . Колонные машины,
сконструированные институтом ИОТТ, успешно применяются на фаб-
риках в перечистках сурьмяного концентрата и для доизвлечения цинка
из хвостов разделения свинцово-цинкового концентрата. Конструкции
колонных машин предложены в США, Великобритании, Польше, Индии
и других странах [44].
Флотационные машины чанового типа разработаны в СССР (рис.
III.37) [45] . Камера машины имеет верхнюю цилиндрическую и ниж-
нюю коническую части. В камере расположены два аэратора — основ-
ной и вспомогательный. Основной аэратор представляет собой металли-
ческий каркас с закрепленными на нем перфорированными резиновыми
трубками. Вспомогательный аэратор имеет коническую форму и сос-
тоит из металлического каркаса с закрепленными на нем резиновыми
кольцами. Он предназначен для пуска машины с питанием за счет пода-
чи в него сжатого воздуха.
Пульпа подается в машину в верхней части камеры через централь-
ную трубу и по периферии и движется навстречу пузырькам, образо-
ванным при пропускании воздуха через основной аэратор. Пенный про-
дукт разгружается самотеком в кольцевой желоб, камерный продукт —
через карман с шибером.
Технические характеристики пневматических машин чанового типа
приведены в табл. III. 17.
281
III.37. Флотационная пневматическая
флотомашина чанового типа:
1 — корпус; 2 — ввод питания; 3 —
разгрузка хвостов; 4 — основной
аэратор; 5 — вспомогательный аэра-
тор; 6 — пенный желоб; 7 — люк
для осмотра машины; 8 — пеноот-
бойник
Флотационная машина ’Давкра” (рис. Ш.38) разработана фирмой
’’Зинк Корпорейшн” (Австралия) . В сопло под напором подается пульпа
и одновременно засасывается воздух. При выходе из отверстия сопла
воздушная струя диспергируется потоком пульпы. Пульповоздушная
смесь ударяется о перегородку. Минерализованные пузырьки всплывают
вверх, образуя пену, а несфлотированные частицы через трубу удаляются
из камеры.
Флотационные машины ’’Давкра” установлены на фабриках Австра-
лии и в перечистках медного концентрата на фабрике ’’Бугенвиль”
( Папуа — Новая Гвинея) .
Таблица III. 17
Технические характеристики пневматических машин
чанового типа
Параметр ФП 10 ФП40 ФП 80 ФП 100
Диаметр, м 2 3,4 3,4 3,4
Глубина, м 5,2 5,2 11 13
Вместимость, м3 10 40 80 100
Производительность по потоку пульпы, м3/мин 3 8 8 8
Максимальный расход воздуха, м3/мин 7,5 15 30 40
Избыточное давление воздуха на входе в аэратор, мПА 0,15 0,15 0,16 0,18
Мощность, затрачиваемая на подачу максимального расхода воздуха, кВт 19 40,5 81 108
282
III.38. Флотационная машина ”Давк-
ра”:
1 — труба для разгрузки хвостов;
2 — перегородка; 3 — сопло; 4 — ка-
мера
Новая пневматическая флотационная машина создана в ФРГ (рис.
Ш.39) [31] . Первая особенность машины состоит в том, что дисперги-
рование воздуха и минерализация пузырькбв предварительно подготов-
ленными к флотации частицами осуществляются в специальном аэра-
ционном реакторе, а отделение минерализованных пузырьков от пуль-
пы, образование пены и удаление концентрата и хвостов происходят
во флотационной камере. Другая особенность машины заключается в
условиях диспергирования воздуха и минерализации пузырьков в аэра-
ционном реакторе.
Воздух подается через пористую среду поперек направлению движе-
ния пульпы, при этом ширина слоя пульпы, в котором эффективно
минерализуются пузырьки, не превышает нескольких сантиметров.
Размер генерируемых в таком слое пузырьков составляет менее 0,5 мм.
Минерализованные пузырьки уносятся пульпой во флотокамеру.
На рис. Ш.39, б приведена одна из применяемых конструкций аэра-
ционного реактора. Аэратор в виде трубок изготовлен из полиэтилена
низкого давления. Трубки имеют диаметр пор 15 мкм и порозность
40 %. Воздух подводится в трубки с двух сторон. Скорость движения
пульпы составляет 9,5 м/с.
Поток пульпы, поступающий на флотацию, делится на части, каж-
дая из которых обрабатывается в одном аэрационном реакторе и раз-
дельно вводится во флотационную машину. Камера представляет собой
конусообразную емкость с цилиндрической верхней частью. Пульпа
поступает в камеру из аэрационных реакторов горизонтально и почти
тангенциально или снизу (см. рис. Ш.39, л). Минерализованные пузырь-
ки всплывают вверх, образуя пену, которая разгружается в центральной
части камеры, а несфдотированные частицы разгружаются снизу.
Пневматическая флотационная машина испытана в полупромыш-
ленных условиях на угле, железной, магнезитовой, апатитовой рудах
и тонких шламах свинцово-цинковой руды. В промышленной эксплуа-
тации находятся камера производительностью 1,7 м3/мин в которой
флотируется апатитовая руда, и камеры вместимостью 27 и 40 м3
283
III.39. Пневматическая машина (ФРГ) :
а — общая схема; б — аэрационный реактор: 1 — воздушный коллектор; 2 — кол-
лектор пульпы; 3 - аэрационный реактор; 4 — регулятор уровня пульпы; 5 —
устройство для выпуска хвостов; 6 — устройство для ввода пульповоздушной
смеси во флотационную камеру; 7 — флотационная камера; 8 — разгрузка пенно-
го продукта; 9 - пенный желоб; 10 - воздухопровод для подачи воздуха в аэра-
ционный реактор
производительностью соответственно 8,3 и 16,7 м3/мин, обрабатываю-
щие воды после промывки угля с содержанием твердого 30—70 г/л.
Машина характеризуется высокой скоростью и селективностью
флотации, в том числе труднофлотируемых частиц размером +200 и
— 10 мкм, низкими энергетическими затратами (в 3—4 раза меньшими,
чем в механических флотационных машинах). Расход воздуха составляет
0,2—1,3 м3/мин на 1 м3 потока пульпы.
Конечные результаты достигаются в машине при обогащении обычно
в одну стадию, лишь при обогащении сложных руд требуются две опе-
рации флотации. Срок службы аэраторов не указывается. Отмечается,
что наряду с аэраторами из пористых материалов в машине применяют-
ся также щелевые аэраторы.
18.4. Флотационные машины для крупнозернистой флотации
Для обогащения крупновкрапленных руд в СССР разработаны флота-
ционная машина с кипящим слоем и пневматическая флотационная
машина пенной сепарации.
Флотационная машина с кипящим слоем (машина КС) (рис. III.40)
создана на основе машины ’’Механобр” [31] . В камере на расстоянии
450—550 мм от дна установлена решетка с живым сечением, равным
15—20 %, и отверстиями 6—8 мм. В последней конструкции машины
КС вместо аэратора машины ’’Механобр” использован турбоцентробеж-
ный импеллер.
На передней стенке камеры смонтирован желоб, из которого пуль-
па поступает на импеллер. При этом возникают восходящие потоки
пульпы, в которых частицы минералов взвешиваются с образованием
кипящего слоя. Пузырьки минерализуются при их прохождении через
кипящий слой в восходящих потоках пульпы в условиях пониженной
турбулентности, что повышает крупность флотируемых частиц.
Исходная пульпа поступает на решетку или на пенный слой. В пос-
леднем случае в машине используется принцип пенной сепарации. Так,
при флотации калийных солей в зоне подачи пульпы на пенный слой
циклонными аэраторами в результате падения струй маточного раст-
вора создается повышенная аэрация, что интенсифицирует флотацию
сильвина.
Машины КС прямоточные и компонуются из двухкамерных секций.
Флотомашины КС установлены на фабриках, перерабатывающих ка-
лийные соли и фосфатные руды.
Флотационная машина пенной сепарации (рис. Ш.41) представляет
собой пирамидальную камеру, в верхней части которой установлены
Ш.40. Флотационная машина с кипя-
щим слоем:
1 — камера; 2 — импеллер; 3 — ре-
шетка; 4 — центральная труба;
3 — вал импеллера; 6 — рециркуля-
ционный желоб; 7 — питающий
патрубок
285
III.41. Флотационная машина пенной сепа-
рации:
1 — камера; 2 — перфорированные рези-
новые аэраторы; 3 — загрузочное
устройство; 4 — наклонные деки; 5 —
сопло для орошения пульпы водой;
6 — пенный порог; 7 — желоба для пенно-
го продукта; 8 - шланговый затвор
два ряда перфорированных трубчатых резиновых аэраторов [45] .
Загрузочное устройство машины состоит из нескольких наклонных
дек, равномерно распределяющих пульпу по всей длине машины, и де-
лителя, направляющего пульпу на правую и левую стороны.
Пульпа поступает на пенный слой, создаваемый с помощью аэрато-
ров. Гидрофобные частицы отчасти остаются в пенном слое, отчасти
вместе с пульпой проходят сквозь пену и флотируются из объема пуль-
пы. Несфлотированные частицы опускаются в нижнюю часть камеры
и выгружаются через шланговый затвор.
Техническая характеристика машины ФПС 16
Габариты, мм:
длина.....................................................2100
ширина................................................... 1800
высота.................................................. 3000
Длина пенного порога, мм................................... 1600
Избыточное давление воздуха, кПа........................... 20
Расход воздуха, м3/мин..................................... До 0,2
Установочная мощность для подачи воздуха в аэратор, кВт....До 0,7
Машины пенной сепарации внедрены на обогатительных фабриках,
перерабатывающих калийные соли, марганцевые руды, алмазные пес-
ки и уголь [45] . Производительность одной камеры машины ФПС 16
на разных рудах изменяется в пределах 25 -50 т/ч, при этом крупность
флотируемых частиц (сильвина) доходит до 3 мм. Содержание твердого
286
в питании машины составляет 40—70 %. Машина ФПС 16 устанавливает-
ся каска дно или требует применения насосов. Поэтому были разрабо-
таны многокамерные машины пенной сепарации ФП 1,6 и ФП 6,3.
18.5. Практика применения флотационных машин
различных типов
Импеллерные машины. В СССР широкое распространение получили
механические флотационные машины ’’Механобр”, ФМ 1,2,ФМ 3,2 и
ФМ 6,3. К преимуществам этих машин относятся: возможность работы
на рудах с широким диапазоном крупности частиц, содержащих 40 %
и выше класса менее 0,074 мм; отсутствие воздуходувного хозяйства
и насосов для возврата промпродуктов; установка машин на одном
уровне. Недостатки машин’’Механобр”— сравнительно быстрый износ
аэратора и снижение по этой причине объема засасываемого воздуха,
а также относительно высокая энергоемкость.
Исходя из вышеизложенного наиболее целесообразные области при-
менения механических машин — все операции, включая хмежцикловую
флотацию, на фабриках малой производительности, не имеющих воз-
духодувного хозяйства; перечистные операции и операции разделения
коллективных концентратов на фабриках большой производитель-
ности [29] .
В настоящее время в нашей стране все более широко применяются
пневмомеханические флотационные машины, которые стали основным
типом машин на обогатительных фабриках. Эти машины имеют большую
скорость флотации, меньший расход электроэнергии и более просты
по конструкции, чем механические машины. На основе аэратора пневмо-
механического типа возможно создание большеобъемных машин, харак-
теризующихся высокими технологическими качествами и низкой энер-
гоемкостью.
Однако для пневмомеханических флотационных машин необходимо
воздуходувное хозяйство, а для перекачки промпродуктов — насосы
или специальные пульпоподъемные камеры. Для регулирования уров-
ня пульпы пневмомеханические машины устанавливаются каскадно.
Отечественные пневмомеханические флотационные машины типа
ФПМ в зависимости от размера имеют различную конструкцию и со-
ответственно разные области применения.
Флотомашины ФПМ 3,2 и ФПМ 6,3 с глубиной камеры до 1300 мм,
ранее оснащавшиеся пальцевыми импеллерами и радиальными успо-
коителями, в настоящее время выпускаются с коническими импелле-
рами. Испытаниями и промышленной эксплуатацией указанных машин
установлено, что скорость флотации в них в среднем на 25 % выше,
а расход электроэнергии на 20—45 % ниже, чем в механических машинах.
Эти машины чувствительны к крупности перерабатываемого материа-
ла и рассчитаны для работы на пульпах с содержанием класса -0,074 мм
60 % и выше. Их целесообразно применять в основной и контрольной
287
флотации на фабриках малой производительности и в перечистных
операциях на фабриках малой и средней производительности при не-
большом числе операций перечисток.
Флотомашина ФПМ 8,5 снабжена коническим импеллером, имеющим
повышенную перемешивающую способность. Флотомашины ФПМ 12,5
и ФПМ 25 оснащены импеллером с радиальными лопастями, обеспе-
чивающими интенсивную придонную циркуляцию пульпы. В машинах
ФПМ 12,5 и ФПМ 25 имеется направляющий конус для создания вер-
тикальных циркуляционных потоков в камере. Флотомашина ФПМ 40
оснащена новым бесстаторным аэратором, об!еспечивающим эффектив-
ное перемешивание пульпы и диспергирование воздуха. На основе раз-
работанной конструкции бесстаторного аэратора намечено модерни-
зировать все имеющиеся механические и пневмомеханические флото-
машины, создав единый размерный ряд машин.
Большеобъемные пневмомеханические флотационные машины
имеют камеры вместимостью 8,5-40 м3 и глубиной 1800—3500 мм.
Промышленные испытания машин ФПМ 8,5, ФПМ 12,5, ФПМ 25 и
ФПМ 40 на ряде фабрик показали, что за счет лучшей организации пото-
ков пульпы в камере и, возможно, большей глубины камер скорость
флотации в этих машинах на 50 % выше, чем в механических машинах.
Наличие эффективного перемешивания, особенно в машинах ФПМ 12,5,
ФПМ 25 и ФПМ 40, позволяет применять их при флотации материала
с содержанием класса - 0,074 м,м 40 % и выше.
Все пневмомеханические флотационные машины — прямоточные, ха-
рактеризуются высокой пропускной способностью, более простой конст-
рукцией, удобны в эксплуатации, так как в них легко заменяются и мень-
ше изнашиваются блоки импеллера и проще регулируется уровень пуль-
пы, особенно в основной и контрольной флотации. Поэтому прямоточные
машины имеют доминирующее значение в этих операциях при обога-
щении руд всех типов.
Однако прямоточные машины имеют недостаток, заключающийся
в том, что в машине возникает обратный поток пульпы, который значи-
тельно усиливает разброс частиц по времени пребывания в камере и тем
самым снижает скорость флотации. Обратный поток может быть умень-
шен за счет увеличения подачи прямого потока и повышения степени
изоляции камер установкой междукамерных перегородок.
Как отмечалось в разд. 17, при работе на малых потоках, соответст-
вующих времени пребывания пульпы в головной камере более 1 мин,
в прямоточных машинах необходимо устанавливать междукамерные
перегородки с высокой (~ 90 %) степенью изоляции камер, благодаря
чему уменьшается чувствительность машин к влиянию потока пульпы
на кинетику флотации. Этот факт имеет важное значение для больше-
объемных флотационных машин, так как позволяет использовать их не
только на больших, но и на малых потоках пульпы.
Исходя из вышеизложенного большеобъемные флотационные маши-
ны могут применяться на фабриках различной производительности в
288
межцикловой, основной и контрольной флотации и в операциях пере-
чисток на фабриках большой производительности.
За рубежом, несмотря на наличие импеллерных машин различных
конструкций, в основной и контрольной флотации наиболее широко
применяются прямоточные машины ’’Денвер Д-Р”, ’’Аджитейр”, ”ОК”
пневмомеханического типа и ’’Вемко” механического типа. В пере-
чистных операциях и при разделении концентратов, когда большое зна-
чение имеет возможность возвращения промпродуктов без применения
насосов, чаще используются машины ’’Денвер Суб-А”. В этих операциях
устанавливаются также пневмомеханические машины ’’Аджитейр” и
’’Денвер Д-Р”, в которых (по сравнению с машиной ’’Вемко”) можно
регулировать также выход пенного продукта в каждой камере изме-
нением подачи воздуха.
Несмотря на указанные преимущества машин тех или иных конст-
рукций, в некоторых случаях целесообразно применять один тип машин
во всех операциях.
В последнее время из-за необходимости переработки бедных руд
резко возросла производительность обогатительных фабрик. Это при-
вело к созданию крупного обогатительного оборудования, в том числе
и флотационных машин.
Большинство новых отечественных и зарубежных фабрик оснащает-
ся в настоящее время флотационными машинами с камерами большой
вместимости, так как применение таких камер сокращает капитальные
вложения и эксплуатационные расходы.
Пневматические машины. Область применения пневматических ма-
шин прежде всего определяется возможностью получения тех же тех-
нологических показателей, которые характерны для машин импеллер-
ного типа.
При одинаковых технолшических показателях преимущества пнев-
матических машин — простота конструкции, низкая стоимость ремонта,
относительно высокая производительность. Недостатки машин — нена-
дежность аэраторов, чувствительность к изменению плотности пульпы
и крупности измельченной руды, трудности при флотации крупного и
тяжелого материала из-за недостаточного перемешивания. В глубоких
аэролифтных машинах интенсивность перемешивания пульпы более
высокая, чем в других пневматических машинах.
Вследствие указанных недостатков • пневматические машины как
старых, так и новых конструкций, в том числе машины чанового типа,
’’Давкра” и другие,не получили в настоящее времй широкого распрост-
ранения и применяются на небольшом числе фабрик.
19-6926
18.6. Выбор тала, размера
и числа камер импеллерных флотационных машин
Суммарный объем пульпы, поступающей на флотацию,
W=M(R + 1/5)/1440,
где М — масса твердого, поступающего на основную и контрольную фло-
тацию, т/сут; R — массовое отношение жидкого к твердому в пульпе;
5 — плотность руды, т/м3.
Число параллельных ниток (или рядов) флотационных машин опре-
деляется соотношением JV = W/Q, где Q — поток пульпы, перерабатывае-
мой каждой ниткой флотационных машин, м3/мин.
Как было показано выше, для импеллерных флотационных машин
следует принимать максимально возможные потоки пульпы в соот-
ветствии с техническими характеристиками машин. По принятым зна-
чениям Q для всех выбранных для сравнения типов и размеров машин
рассчитывается время пребывания пульпы в головной камере т — VnIQ,
где Кп — полезная вместимость камеры флотационной машины, равная
0,8—0,85 геометрического объема камеры.
Лабораторные исследования обычно проводятся в механических
машинах периодического действия конструкции ’’Механобр”. Для
расчета времени флотации в промышленных флотационных машинах
по данным лабораторных опытов необходимо знать коэффициент пере-
хода Кп от времени флотации в лабораторной машине периодического
действия к времени флотации в промышленной флотационной машине
непрерывного действия, работающей при определенном времени пре-
бывания пульпы в головной камере.
На рис. Ш.42 приведены зависимости Кп от времени пребывания
пульпы в головной камере промышленных механических и пневмоме-
ханических флотационных машин различных размеров [29] . Эти данные
получены по результатам испытаний машин на рудах цветных и редких
металлов в операциях межцикловой, основной и контрольной флотации.
Сплошные части кривых отражают данные более 50 промышленных испы-
таний. Пунктирные части кривых построены по результатам отдельных
испытаний экстраполяцией и в настоящее время уточняются. Кривые
отражают влияние потока пульпы на скорость флотации в машинах с
изолирующими перегородками и без перегородок и различия в скорос-
ти флотации машин в зависимости от их конструкции, изложенные в
предыдущем параграфе.
С учетом коэффициента перехода время флотации t, необходимое
для получения заданного извлечения в промышленной флотационной
машине,
— ^i/л’
где tл — время флотации в лабораторной машине.
290
III.42. Зависимость коэффициента перехода Кп от времени пребывания пульпы
в головной камере:
I, 1 —ФПМ 25 — ФПМ 40 прямоточное исполнение с перегородками; 2 —ФПМ 8,5 —
ФПМ 12,5 — ФПМ 16 прямоточное исполнение с перегородками; 3 — ФПМ 8,5 —
ФПМ 12,5 — прямоточное исполнение без перегородок; 4 — ФПМ 1,2 — ФПМ 6,3
прямоточное исполнение без перегородок; 5 — ФМ 1,2 — ФМ 6,3 — камерное ис-
полнение; 6 — ФМ 1,2 — ФМ 6,3 прямоточное исполнение
При малом выходе концентрата необходимое к установке число
камер п в нитке флотационных машин рассчитывается по формуле
В случае большого выхода концентрата следует рассчитать число
камер в нитке с учетом выхода концентрата.
На основании имеющихся практических данных и проведенных рас-
четов (см. табл. III.6) число камер в нитке в основной и контрольной
флотации должно быть не менее четырех, чтобы избежать проскока
частиц в хвосты.
Зная число камер в нитке и число ниток, можно определить для
выбранного типоразмера флотационной машины общую установочную
и потребляемую мощность, занимаемую площадь. Сравнение различных
вариантов позволяет выбрать для данной фабрики оптимальный вариант
установки флотационных машин.
В качестве примера в табл. Ш.18 приведены результаты расчета
требуемого числа камер флотационных машин различных типов, уста-
навливаемых в основной и контрольной флотации на фабрике произво-
дительностью 1,5 млн. т руды в год или 4412 т/сут. Плотность руды
2700 кг/м3, содержание твердого в пульпе 30 %, общий объем пульпы,
поступающей на флотацию, 8,3 м3/мин, содержание класса —0,074 мм
в питании операции 65 %, время флотации, необходимое для получения
291
Сравнение возможных вариантов установки
производительностью
Типо- размер машины Исполнение машины Число ниток Поток пульпы на нитку, м3/мин Т, мин *п
ФМ 3,2 Прямоточное без перегородок 2 4,15 0,65 2,7
ФПМ 3,2 То же 2 4,15 0,65 2,0
ФПМ 6,3 1 8,3 0,64 1,95
ФПМ 8,5 1 8,3 0,87 1,8
ФПМ 12,5 Прямоточное с перегородками 1 8,3 1,28 2,2
ФПМ 25 То же 1 8,3 2,57 2
ФПМ 40 1 8,3 4,1 2,2
Примечание. Цифры в скобках относятся к машине ФПМ 12,5 с бесстатор-
заданного извлечения в лабораторной машине периодического дейст-
вия, 5 мин.
Данные табл. III. 18 показывают, что по всем показателям оптималь-
ными являются варианты установки на фабрике флотационных машин
ФПМ 25 и ФПМ 40. В данном случае следует предпочесть установку
флотационных машин ФПМ 25, так как в этом случае объем здания
получается в 1,5 раза меньше, чем при установке машин ФПМ 40.
ЧАСТЬ IV
ТЕХНОЛОГИЯ ФЛОТАЦИИ
19. СХЕМЫ ФЛОТАЦИИ
Многообразие и сложность технологических схем флотации в основ-
ном обусловлены различиями в составе и структуре обогащаемых
РУД (151•
Схемы различаются по методу флотации (селективная или коллек-
292
Таблица Ш.18
флотационных машин для фабрики
1,5 млн. т/год
Время флотации t, мин Число камер Общий гео- метричес- кий объем камер, м3 Общая мощность, кВт Общая площадь, занимае- мая ма- шинами, м?
в нитке общее устано- вочная потреб- ляемая с учетом подачи воздуха
13,5 21 42 135 462 ' 378 135
10 16 32 103 240 208 109
9,8 16 16 101 296 282 88
9 11 11 94 242 143 69
11 9 9 ИЗ 405 248 79
(270) (185)
10 4 4 100 220 160 42
И 4 4 160 220 130 62
ным аэратором.
тивная) и числу стадий обогащения * (одно-, двух- или многостадиаль-
ные), причем схемы с одинаковым числом стадий могут различаться
порядком и расположением технологических операций внутри каждой
стадии.
При наличии в схеме операций контрольной флотации и перечисток
концентрата число этих операций зависит от требований к качеству
концентрата, содержания полезного минерала в руде и флотационных
свойств составляющих руду минералов.
При относительно невысоких требованиях к качеству концентрата
и сравнительно богатых или труднофлотируемых рудах схемы харак-
теризуются развитием контрольных операций и малым развитием (или
отсутствием) перечисток концентрата. Если кондиции на концентрат
высокие, то схемы дополняются перечистками концентрата, при этом
число их увеличивается, когда обогащаются относительно бедные руды,
например молибденовые.
* Под стадией обогащения понимается совокупность операций измельчения,
классификации и флотации, в результате которых получается один или несколько
конечных продуктов обогащения (концентраты, хвосты).
293
Если минералы пустой породы практически не флотируются, то при
достаточно высокой флотационной активности полезных минералов
может быть достигнута высокая чистота разделения уже в I стадии
обогащения. В этом случае число перечисток чернового концентрата
минимальное. При богатых рудах, содержащих нефлотирующуюся
вмещающую породу, схемы обычно имеют лишь одну-две контроль-
ные флотации.
Точки возврата промпродуктов в процесс при развернутых схемах
могут находиться в разных местах схемы. В том случае, когда к качест-
ву концентрата не предъявляются высокие требования, промпродукты
целесообразно направлять в предшествующие операции.
При выборе в схеме места возврата промпродуктов нередко стре-
мятся присоединить их к потокам пульпы с примерно таким же ми-
неральным составом. Возврат промпродуктов в начало процесса поз-
воляет сократить расход пенообразователя.
Когда продукт представлен большой массой сростков, его доизмель-
чают в отдельной мельнице или основных мельницах. В обоих случаях
целесообразно обезвоживать продукты в гидроциклоне, классифика-
торе или сгустителе. При этом слив гидроциклона или классификатора
часто направляют в классификацию стадии измельчения, что существен-
но снижает обводнение процесса.
Слив сгустителя обычно используют в качестве оборотной воды.
При доизмельчении промпродуктов одновременно происходит ’’об-
дирка” граней его границ.
В ряде случаев, когда для обогащения промпродукта требуется
технологический режим, отличный от режима основных операций, или
когда присутствие промпродукта ухудшает флотируемость поступаю-
щей в процесс руды, промпродукт флотируется в отдельном цикле.
За рубежом, например, получили распространение схемы, включающие
операции ’’cleaner — scavenger” (первая перечистка — контрольная фло-
тация хвостов перечистки) . В этих схемах промпродукт — хвосты первой
перечистки и часто концентрат контрольной флотации флотируются в
отдельном цикле с получением отвальных хвостов и пенного продукта,
направляемого на первую перечистку или в основную флотацию, и,
таким образом, основная флотация проводится в открытом цикле либо
масса промпродуктов, направляемых в эту операцию, резко сокращает-
ся. Это позволяет стабилизировать основную флотацию*.
В ряде случаев целесообразна раздельная флотация шламов и песков
или раздельная обработка их флотореагентами.
Одностадиальные схемы. Руды с относительно равномерной вкрап-
ленностью, не превышающей 0,25—0,3 мм, и мало шламующиеся при
измельчении, обычно обогащают в одну стадию. По схеме одностадиаль-
* В схемах следует предусматривать оборотное водоснабжение там, где не
нарушается технология процесса.
294
Дробленая руда
хИзмельчение и
(^классификация
Основная флотация
I перечистная Контрольная
Н перечистная
Ш перечистная .
Концентрат
апатитовый
Хвосты
IV. 1. Одностадиальная схема флотации
апатитовой руды
IV.2. Зависимость содержания минерала
С в концентрате (7) и потерь Я его с
хвостами (2) от крупности измельчения
d при агрегатном включении тонких
частиц минералов во вмещающей породе
ной флотации обогащается, например, апатитовая руда Кольского по-
луострова (рис. IV.1). В связи с тем, что содержание апатита в руде
высокое и требования, предъявляемые к качеству концентрата, также
высокие, схема включает контрольную флотацию и две или три пере-
чистки концентрата.
По одностадиальной схеме обогащают богатые медные, шеелитовые,
флюоритовые, баритовые, берилловые и сподуменовые руды ряда
месторождений. Схемы обогащения этих руд имеют различное число
операций перечистки концентрата и контрольной флотации.
Многостадиальные схемы. Число стадий обогащения определяется
размером и характером вкрапленности минералов, а также склонностью
руды к ошламованию.
Осуществление двухстадиальной схемы обогащения возможно
по трем вариантам: 1) выделение после относительно грубого измель-
чения в I стадии готовых хвостов и бедного концентрата, подвергае-
мого доизмельчению и флотации во II стадии; 2) выделение после
относительно грубого измельчения в I стадии готового или достаточно
богатого концентрата и богатых хвостов с доизмельчением и флотацией
их во П стадии; 3) выделение после предварительного измельчения в
I стадии готового (по крупности) концентрата, бедных хвостов и пром-
продукта, который доизмельчается и подвергается последующей фло-
тации во II стадии.
Применяются и трехстадиальные схемы, включающие доизмельче-
ние промпродукта и хвостов или концентрата, полученных в I стадии.
Сложные схемы с доизмельчением продуктов флотации (т.е. с нес-
колькими стадиями обогащения) основываются на принципе ”не измель-
чать ничего лишнего”. Такие схемы имеют технологические (снижение
ошламования и его вредного влияния) и экономические • (снижение
стоимости переработки) преимущества.
295
Если полезные минералы тонко вкраплены друг в друга, а их агре-
гаты представляют собой крупные включения во вмещающей породе
(некоторые медно-пиритные и полиметаллические руды) или полез-
ные минералы входят в состав агрегатов с другими минералами, ко-
торые при грубом измельчении легко отделяются от остальной части
вмещающей породы (многие молибденовые и графитовые руды), то
измельчать такие руды сразу до конечной крупности, необходимой для
раскрытия всех полезных минералов, может оказаться нерациональным.
При очень тонком измельчении потери с хвостами увеличиваются,
а содержание в концентрате падает за счет вредного влияния шламов
(рис. IV.2). Минимальные потери с хвостами наблюдаются при относи-
тельно грубом измельчении. В подобных случаях, очевидно, рациональ-
но применить схему двухстадиальной флотации с получением в I стадии
отвальных хвостов и с последующим доизмельчением и флотацией
концентрата.
В том случае, когда наряду с крупной вкрапленностью имеются
тонкие включения полезного минерала во всей массе вмещающей по-
роды, рационально при грубом измельчении выделить флотацией часть
готового богатого концентрата, хвосты доизмельчить и подвергнуть
флотации с выделением оставшейся части полезного минерала.
В ряде случаев при относительно грубом измельчении можно вы-
делить готовый концентрат, отвальные бедные хвосты и промпродукт,
содержащий сростки полезного минерала с вмещающей породой (или
с другим полезным минералом).
При очень сложном характере вкрапленности, когда, например,
полезные минералы представлены в виде весьма неравномерных вклю-
чений и образуют друг с другом или с некоторыми компонентами вме-
щающей породы флотирующиеся агрегаты, может оказаться рацио-
нальным применение трехстадиальной схемы обогащения.
Чем сложнее характер вкрапленности полезных минералов и чем
более склонны они к ошламованию, тем сложнее должны быть схе-
мы обогащения. Наоборот, если вкрапленность полезного минерала
более или менее равномерная и минерал не переизмельчается, приме-
няются простые схемы обогащения.
Примером двухстадиальной схемы флотации с выделением в I стадии
отвальных хвостов и доизмельчением во II стадии концентрата может
служить схема фабрики, перерабатывающей сульфидные вкрапленные
руды (рис. IV.3). В результате внедрения этой схемы (доизмельчение
медного концентрата для разрушения сростков медных минералов с
минералами пустой породы) содержание меди в концентрате повыси-
лось с 15—16 до 21—22 %, а извлечение металла сохранилось примерно
на том же уровне, что и при одностадиальной схеме.
На молибденовых фабриках применяются схемы с доизмельчением
черновых концентратов, что обусловлено высокими кондициями на
молибденовые концентраты.
296
Дробленая руда
I стадия гх
измельчения^
Классификация
П стадия rf
измельчения^
____ Классификация
Слив классификатора
I стадии измельчения
Межцикловая флотация
Основная флотация
Классификация
Хперечистная Контрольная
Очистная
флотация
* I
Сгущение
Сли& Классификация
И перечистная
Ш перечистная промпродуктов
Хвосты
Концентрат
' медный
П стадия
измельчения
Классификация
| 92%~0,074мм
Контактирование
/ основная флотация
П основная флотация
стная Контрольная
Концентрат
медный
Хвосты
(пирит-
ный про-
дукт)
IV.3. Схема двухстадиальной флота-
ции вкрапленной медной сульфид-
ной руды
ГУЛ. Схема флотации медных кол-
чеданных руд
Примером двухстадиальной схемы флотации с получением в I ста-
дии готового концентрата и доизмельчением хвостов во II стадии могут
служить схемы фабрик, перерабатывающих медно-никелевые и ме-
дистые пириты.
На медно-никелевой фабрике в I стадии флотации, осуществляе-
мой в цикле измельчения, извлекается 60 % меди и 40 % никеля. На
фабрике, обрабатывающей медистые пириты, внедрена стадиальная схе-
ма, включающая в цикле I стадии измельчения операцию флотации
(рис. IV.4). Ранее на этой фабрике применялась одностадиальная схема
флотации. Внедрение этой схемы позволило извлекать до 25 % меди в
готовый концентрат при крупности измельчения руды до 55—60 %
класса —0,074 мм, тогда как хвосты перед последующей контрольной
флотацией измельчались до 92 % класса —0,074 мм. В руде содержа-
лось 60 % меди в виде вторичных сульфидов, которые быстро переиз-
мельчались, в особенности ковеллин.
Несмотря на то, что в питании межцикловой флотации (см. рис. IV.4)
содержалось 55—60 % класса —0,074 мм, концентрат этой флотации
был представлен на 98 % частицами —0,074 мм. При флотации по одно-
297
Измельченная
руда
55%~0,074 мм
Основная флотация
Дробленая руда
А I стадия
Y измельчения
Перечистная
Классификация
П стадия^
измель- С
чения |
Основная флотация L
100%-0,15wn
Сгущение
Сливв
оборот
Л
Флотация п
промпродуктов
Классификация
Доизмель-ру
чение
I перечистная Контрольная
। yj v
Классификация
907о-0,74 мм
Классификация
Концентрат
медный
Слив в
оборот
Хвосты
907а~0,74мм —|----------1
Г Л -0,0741 Доизмель-\
УЛние \ мм| чение ¥
* Основная фло- ***
П перечистная тация пром-
| । продуктов
Ш перечистная
Концентрат
медный.
Контрольная
Хвосты\
Т
IV.5. Схема флотации медной руды
с доизмельчением промпродукта
IV.6. Проектная трехстадиальная
схема флотации медистых песчани-
ков второй очереди Джезказганс-
кой фабрики
стадиальной схеме, когда вся руда измельчалась до 92 % класса
—0,074 мм, переизмельчение медных минералов приводило к повы-
шенным потерям меди с отвальными хвостами.
При переходе на двухстадиальную схему извлечение меди повыси-
лось на 3—4 % и несколько улучшилось качество концентрата.
Двухстадиальная схема флотации с получением готового концент-
рата и отвальных хвостов в I стадии и промежуточного продукта, под-
вергаемого доизмельчению и флотации во II стадии,, показана на
рис. IV.5.
По этой схеме перерабатываются медные руды, представленные
медными минералами в виде отдельных включений и тонких прожилок
в пустой породе, значительная часть которой характеризуется повышен-
ной твердостью. При стадиальном обогащении таких руд достигается
заметная экономия затрат на измельчение.
Трехстадиальные схемы обогащения применяют при флотации суль-
фидных и некоторых несульфидных руд. Пример такой схемы — проект-
ная схема второй очереди Джезказганской фабрики, обогащающей
медистые песчаники (рис. IV.6). Песчаник в этих рудах представлен
298
отдельными частицами, которые сцементированы сульфидами, глав-
ным образом борнитом и халькопиритом.
Размеры частиц полевого шпата, роговика и других минералов,
составляющих песчаник, колеблются в пределах от 0,1 до 1 мм. Таким
образом, часть медных минералов, цементирующих крупные частицы
песчаника, может быть освобождена уже при относительно грубом
измельчении.
При измельчении до —0,15 мм освобождается значительная доля
медных минералов, однако в концентрат основной флотации извле-
каются также сростки, которые после первой перечистки чернового
концентрата распределяются между пенным продуктом и хвостами
первой перечистки. Последние вместе с пенным продуктом контроль-
ной флотации доизмельчаются до крупности —0,074 мм. Концентрат
первой перечистки также доизмельчается почти до такой же крупности,
но режим его измельчения и флотации существенно отличается от ре-
жима измельчения и флотации промпродуктов.
Схемы с раздельной флотацией песков и шламов. Некоторые руды
содержат значительную долю первичных шламов или быстро шламуют-
ся при измельчении. Состав и физические свойства шламов и зернистой
части таких руд различны.
В шламах концентрируются главным образом окисленные соедине-
ния (если руда сульфидная) и растворимые соли. При большом выходе
тонких шламов разделение рудных и нерудных минералов затруднено,
особенно если их флотационные свойства близки. Поэтому при измель-
чении и классификации руду и разделяют на зернистую и шламовую
части, которые флотируются раздельно, или перед флотацией шламы
отделяют и направляют в отвал. Такие варианты применяют при обога-
щении фосфоритов, марганцевых и некоторых редкометалльных руд.
Вариант схемы с раздельной флотацией шламов и песков внедрен
на Джезказганской фабрике. Руда, измельченная в две стадии до 60—
65 % класса —0,074 мм, классифицируется в гидроциклонах. Слив
крупностью 75—80 % класса —0,074 мм флотируется при обычном ре-
жиме ксантогенатом и сосновым маслом. В пески гидроциклона до-
бавляют углеводородные масла для интенсификации флотации сростков.
Промежуточные продукты (хвосты перечистки концентрата и кон-
центраты контрольной флотации песков и шламов) после доизмельче-
ния до 95—100 % класса —0,074 мм направляют на флотацию вместе с
песками после их доизмельчения. Установлено, что при этом ошламо-
ванные частицы рудных минералов, аккумулирующиеся в промежуточ-
ных продуктах, флотируются более активно. Это объясняется тем, что
крупные частицы рудных минералов и их сростки с породой, кондицио-
нированные с углеводородами, являются ’’носителем” для ошламован-
ных частиц.
В некоторых случаях аналогичные или даже лучшие результаты (по
сравнению с раздельной флотацией шламов и песков) могут быть полу-
чены по схеме, при которой хвосты контрольной флотации рудного
299
a
в
Дробленая руда
Хвосты
Х\Измельчение и
у классификация
Коллективная флотация
трех минералов
РуДоизмельчение и ],
у классификация
Селективная флотация
первого минерала
Т Селективная флота-
Концентрат 1 ция второго минерала
I I
Концентрат2 Концентрат 3
Дроблёная руда
А Измельчение и
у классификация
Селективная флотация
первого минерала
f
1 Коллективная флота-
Концентрат! ^я д^х минералов
Селективная Хвосты
флотация
Концентрат2 |
Концентрат 3
Дробленая руда
д' Измельчение
Q и классифи-
Y нация .
Коллективная флота-
ция трех минералов
А Дризмельчение
у и классификация
Флотация двух 1'
минералов Хвосты
Селективная Флотация трех
флотация минералов
т — -------1 f-------------1
Концентрат 1 | Концентрате Хвосты
Концентрате
г Дробленая руда
А Измельчение и
у классификация
Коллективная флота-
ция двух минералов
f-----
Селективная Флотация треть-
флотация его минерала
| Концентрате1 Хвосты
Концентрат / Концентрат 3
IV.7. Схема коллективной флотации с последующим разделением коллективного
концентрата
цикла классифицируются на пески и шламы. Шламы являются отваль-
ным продуктом, а пески (без доизмельчения или после него) посту-
пают на флотацию. Для лучшей флотации сростков могут использоваться
углеводороды. Если пески не доизмельчаются, то обычно измельчается
черновой концентрат. Конечный концентрат дофлотации песков при-
соединяется к концентрату основного цикла.
Эта схема с большим эффектом внедрена при обогащении медных
И ме дно-ник елевых вкрапленных руд на некоторых фабриках. При
этом на одной фабрике для доизмельчения из песковой фракции хвос-
тов крупнозернистого пирротина и магнетита, с которыми обычно
связано некоторое количество никеля и платиноидов, вместо флотации
была применена магнитная сепарация.
Схемы коллективной и селективной флотации. При значительном
содержании в руде вмещающей породы, в особенности если после отно-
сительно грубого измельчения можно получить отвальные хвосты, при-
меняют схемы коллективной флотации с последующей селекцией.
На рис. IV.7 показаны варианты принципиальных схем коллективной
флотации с последующим разделением коллективного концентрата
при обогащении трехкомпонентной руды.
При наличии в руде двух модификаций одного и того же минерала,
имеющих разную флотируемость и вкрапленность, рациональны схемы
коллективно-селективной флотации, применяемые при обогащении
300
IV.8. Схема коллективно-селективной
флотации полиметаллических руд в два
приема
Слив классификатора
50°/в-0,074 мм
I
I коллективная
флотация
Измельчение и (*) |
классификациях Л коллективная
75%-0Д74мн 1 флотация
I селективная
флотация
Л селективная
флотация
Хвосты
Концентрат Концентрат
цинковый пиритный
медно-цинковых пиритсодержащих руд (рис. IV.8). В этих рудах сфа-
лерит представлен двумя разновидностями,, одна из которых флотирует-
ся легко, а другая — лишь при добавке активатора (медного купороса) .
Многие полиметаллические руды содержат четыре компонента (нап-
ример, свинец, медь, цинк, пирит), которые выделяют в отдельные
концентраты или в три концентрата. Один из этих концентратов, напри-
мер свинцово-медный, — коллективный. Такие руды на ряде фабрик
СССР флотируют по схемам, показанным на рис. IV.9.
а
Дробленая руда
г>Мзме/7ьчение и
уклассификация
Коллективная флотация
сульфидов свинца и меди
т ‘ 7 \
Селективная
флотация
Концент- Концент-
рат свин- рат мед-
цовый ныи
Селективная фло-
тация сульфидов цинка
в
Флотация пирита
Хвосты
Дробленая руда
(^Измельчение и
^^классификация
Коллективная флотация
сульфидов свинца и меди
Коллективная
флотациясуль-
фидов цинка
и железа
Селективная
флотация
t
Концентрат
медный
Концентрат пиритный
цинковый
Дробленая руда
('''Мзмельчение и
уклассификация
Коллективная флотация
ХкДоизмельчение и I--------
У классификация
Селективная флотация
суль фидов свинца и меди
f ’1
Селективная фло-
тация сульфидов
свинца
j I
Концент- Концен-
рат свин- трат
цовый медный
6
Концен-
трат
свинцо-
вый
селектив-
ная фло-
тация^
Хвосты
Концент- Концент-
рат цин- рат пи-
ковый ритный
1
Селективная фло-
тация сульфидов
цинка
Флотация
пирита 1
Концент- Хвосты
рат пи-
ритный
1
Концент-
рат цин-
ковый
IV.9. Схема флотации полиметаллических руд, содержащих четыре компонента
301
Хвосты молибде-
новой флотации
♦
Перемешивание
Основная шеелитовая
флотация
Ч Г , л
/ перечистка шеели- I контрольная
тового концентрата флотация
IV. 10. Комбинированная схема обогаще-
ния шеелито-молибденовой руды с полу-
чением флотационного шеелитового кон-
центрата, содержащего около 3 % WO3, с
последующей его переработкой автоклав-
ным процессом
Пперечистка шеели-
тового концентрата
П контрольная
флотация
i 1
1сты
Шеелитовый
концентрат
(~37oW3)
обогащении сплошных
сульфидных полиметаллических руд
с низким содержанием пустой породы (менее 20 -25 %), как правило,
применяют схемы прямой селективной флотации с последовательным
выделением свинцового концентрата (или свинцово-медного, когда
в руде имеется медь), цинкового, а затем пиритного.
Схемы прямой селективной флотации целесообразно применять на
фабриках малой производительности, даже при большом содержании
пустой породы в руде, когда схема с коллективной флотацией всех
сульфидов в начале процесса не дает явных технологических и эконо-
мических преимуществ.
Комбинированные схемы. Для эффективного обогащения руд может
оказаться рациональной комбинация флотации с химической обработ-
кой продуктов или электромагнитными и гравитационными методами.
Для обогащения бедных шеелитовых руд разработана комбиниро-
ванная схема (рис. IV.10), включающая получение флотацией бедного
чернового шеелитового концентрата (без доводки по методу Петрова)
и его гидрометаллургическую доводку высокотемпературным содовым
выщелачиванием шеелита в автоклаве. По сравнению с флотационной
схемой, по которой доводку чернового концентрата осуществляли по
методу Петрова (см. разд. 10.3), комбинированная схема позволяет
повысить извлечение триоксида вольфрама примерно на 10 %.
Примером комбинированных схем, включающих химическую пере-
работку, могут служить схемы обогащения медных окисленных и сме-
шанных руд с выщелачиванием и цементацией окисленной и флотацией
цементной и сульфидной меди [45] . Эти схемы разработаны в СССР
(В.Я. Мостовичем) и США и внедрены на ряде фабрик.
Комбинированные схемы, включающие электромагнитное обогаще-
ние и флотацию, применяют при обогащении медных руд, содержащих
магнетит, и медно-никелевых руд, содержащих магнитный пирротин.
Они рациональны при обогащении смешанных железных руд, содержа-
щих магнитные и тонковкрапленные немагнитные железные минералы.
Магнитное и гравитационное обогащение совместно с флотацией
применяют также для доводки гравитационных вольфрамовых, оловян-
ных и некоторых других концентратов при наличии в этих концентратах
302
сульфидов, апатита, магнетита и некоторых других железных минералов.
Если из руд, обогащаемых флотационным способом, после сред-
него или мелкого дробления может быть выделена значительная доля
(больше 30 % массы руды) пустой породы с отвальным содержанием
полезных компонентов, то такие руды целесообразно обогащать по
комбинированной схеме, включающей обогащение в тяжелых суспен-
зиях (для удаления пустой породы после дробления) или радиометри-
ческую сепарацию и флотационное обогащение грубого концентрата
после измельчения.
Комбинированные схемы с обогащением в тяжелых суспензиях
для удаления легкой фракции в отвал разработаны применительно к
обогащению некоторых полиметаллических руд. В последние годы
применяют схемы с радиометрической сепарацией для предконцентрации
преимущественно для редкометалльных жильных и штокверковых руд.
Пример комбинированной схемы с применением гравитационных
процессов — схема обогащения сплошных сульфидных медно-никеле-
вых руд, принятая в проекте обогатительной фабрики № 2 Норильского
горно-металлургического комбината.
Эта схема включает промывку руды, обогащение класса —100 + 5 мм
в тяжелой суспензии, селективную флотацию тяжелой фракции с по-
лучением медного, никелевого и пирротинового концентратов и кол-
лективную флотацию сульфидов из легкой фракции с последующим
разделением коллективного концентрата.
Хотя в данном случае легкая фракция не является отвальной, тем
не менее такая схема имеет существенные преимущества перед схемой
селективной флотации руды. Эти преимущества заключаются в том,
что в легкую фракцию удаляется бетон, попадающий в руду из закладки
и значительно осложняющий селекцию (при коллективной флотации
сульфидов из легкой фракции присутствие бетона не имеет большого
значения). Кроме того, при данной схеме основная масса материала,
поступающего на селективную флотацию, представлена тяжелой фрак-
цией относительно стабильного состава с чистой поверхностью минера-
лов, не подвергавшейся воздействию реагентов, что облегчает селекцию.
Комбинированные схемы, объединяющие разделение в тяжелых
суспензиях с получением готового концентрата и флотацию доизмель-
ченного мелкого класса, оказались целесообразными для обогащения
руд ряда месторождений, в том числе флюоритовых.
Марганцевые руды обогащаются примерно по такой же схеме, но
содержащей, кроме того, электромагнитное обогащение и другие опе-
рации.
Гравитация используется при флотационном обогащении медных,
медно-цинковых и полиметаллических руд для выделения золота, се-
ребра и самородной меди в цикле измельчения в отсадочных машинах.
20. РЕЖИМЫ ФЛОТАЦИИ
Прежде чем приступить к краткому изложению режимов флотации
руд, следует отметить, что многие руды содержат различные металлы,
применение которых входит в компетенцию разных отраслевых орга-
низаций, что приводит нередко к некомплексному использованию
руд различных месторождений. Например, из некоторых никелевых
руд северных месторождений СССР не извлекается магнетит; с хвос-
тами апатитовой флотации идут в отвал так называемые темноцветные
минералы и существенная часть нефелина и т.д.
Накопленные хвосты обогащения за те годы, когда руды имели более
высокое содержание ценных компонентов, в настоящее время являются
потенциальным рудным сырьем, т.е. содержание в них металлов приб-
лижается к тому их содержанию, которое имеют обрабатываемые в нас-
тоящее время руды. И.Ш. Сатаев и В.А. Конев (Механобр) отмечают,
что 77 % хвостов из отрабатываемых в настоящее время малосернистых
руд пригодны для производства ячеистого бетона, керамической плит-
ки, кирпича и других строительных материалов. Например, налажено
производство силикатного кирпича из- хвостов Сорского комбината.
Часть хвостов обогатительных фабрик Джезказганского, Зыряновс-
кого, Лениногорского, Ачисайского и ряда других комбинатов исполь-
зуется для закладки подземных выработок.
Используя режимы флотации различных руд следует, когда это эко-
номически выгодно, выделять различные не основные компоненты руд,
включая так называемую пустую породу, для применения в промыш-
ленности и народном хозяйстве.
Во всех случаях на обогатительных фабриках следует внедрять
оборотное водоснабжение или, когда это затруднительно, очищать сточ-
ные воды.
20.1. Медные руды
Медные руды по относительному содержанию окисленной меди
делят на сульфидные, в которых содержание окисленной меди не пре-
вышает 10—15 % общего содержания меди; смешанные, в которых
доля окисленной меди составляет от 10—15 до 50—75 %, и окисленные,
в которых доля окисленной меди составляет более 50-75 %.
Сульфидные руды подразделяют на вкрапленные и сплошные. Основ-
ную часть вкрапленных руд составляют минералы породы (кварц,
полевой шпат, серицит, биотит, каолин). Сплошные руды в основном
состоят из пирита и пирротина.
Запасы вкрапленных сульфидных руд главным образом сосредо-
точены в медно-порфировых рудах и медистых песчаниках. Кроме то-
го, выделяют жильные и медно-колчеданные вкрапленные руды.
Основные рудные минералы медистых песчаников - борнит, халь-
304
козин и халькопирит; медно-колчеданных руд — халькопирит и пирит.
Кроме того, в некоторых рудах присутствует самородная медь. В зонах
окисления месторождений вкрапленных руд медные минералы предс-
тавлены помимо сульфидов малахитом, азуритом, брошантитом, антле-
ритом, купритом,хризоколлой и др.
Главный медный рудный минерал сплошных медно-колчеданных
руд — халькопирит. Кроме того, медь представлена вторичными мед-
ными минералами — борнитом, халькозином, ковеллином, теннантитом,
тетраэдритом.
Медные сульфидные руды
Вкрапленные руды. На большинстве фабрик, перерабатывающих
вкрапленные медные руды, отвальные хвосты получают при измельче-
нии до 45—65 % класса —0,074 мм. Во многих случаях чернотой кон-
центрат и промпродукты доизмельчают до крупности 80—95 % класса
—0,074 мм и тоньше. Применяют различные схемы — от очень простых,
включающих основную флотацию и несколько перечисток концентрата,
до сложных трехстадиальных с отдельным промпродуктовым цикйом.
Получают все большее распространение схемы с раздельной флота-
цией песков и шламов и схемы ’’cleaner — scavenger” (см. разд. 19).
При обогащении вкрапленных руд обычно необходимо отделить
минералы меди от пирита и минералов породы. Для подавления пирита
применяют известь, которую подают в одну или несколько следующих
точек: рудные мельницы, мельницы доизмельчения чернового кон-
центрата, операции перечистки. Значение pH в основной флотации из-
меняется от 8,5 до 11,5 и зависит от содержания пирита в руде и эффек-
тивности применяемого собирателя.
В ряде»случаев при обогащении халькопиритных медно-порфировых
руд создание pH 10—10,5 известью также способствует повышению
извлечения меди и золота. В операциях перечисток концентрата pH
составляет 11—12. Иногда в эти операции для лучшего подавления пири-
та добавляют небольшое количество цианида.
Если содержание пирита в рудах незначительно, как, например, в
медистых песчаниках, то известь не применяют.
На большинстве фабрик, перерабатывающих медные вкрапленные
руды, специальные подавители минералов породы не используют. Одна-
ко, если в пульпе, поступающей на флотадию, доля тонких шламов
пустой породы значительна, в основную флотацию и перечистку кон-
центрата подают жидкое стекло.
Для подавления флотации тонких шламов используют также орга-
нические высокомолекулярные реагенты — декстрин, реагент 633 [45] .
При на'личии в рудах окисленной меди в мельницы и с питанием фло-
тации в небольших количествах подается сернистый натрий.
В качестве собирателей медных минералов применяют ксантогенаты
(этиловый, изопропиловый, бутиловый, амиловый)', дитиофосфаты
(аэрофлоты) (прямоцепочечные, изостроения и с арильным радика-
лом) , меркаптобензотиазол. 305
При флотации медных руд за рубежом применяется реагент Z-200,
который более селективен по отношению к пириту.
На многих фабриках используется сочетание собирателей. При этом
часто комбинируют слабый собиратель с сильным. В качестве слабых
собирателей применяют аэрофлоты, короткоцепочечные ксантогенаты
и реагент Z-200. Эти реагенты загружают в операцию измельчения или
подают вместе с питанием флотации. В качестве сильных собирателей
обычно используют изопропиловый, бутиловый и амиловый ксанто-
генаты, которые подают в середину и конец основной флотации и конт-
рольную флотацию. В ряде случаев применяют сочетание ксантогенатов
с углеводородными маслами.
Из пенообразователей используют Т-80, МИБК, сосновое масло,
Дауфрос 250, Аэрофрос 65, ТЭБ.
Нередко применяется сочетание реагентов, при этом спиртовые
пенообразователи дозируют в процесс совместно с пенообразователями,
состоящими из эфиров полипропиленглико лей. Так, для получения
более стабильной и пышной пены МИБК используют в смеси с Аэро-
фросом 65 (расход соответственно 65—70 и 25—30 %) [55] .
Содержание пирита во вкрапленных рудах часто бывает достаточно
высокое (более 5—7 %) для рентабельного получения пиритного кон-
центрата. Последний выделяется по схеме селективной или коллектив-
ной флотации.
По схеме селективной флотации сначала флотируют медные мине-
ралы, подавляя пирит известью, либо известью с цианидом, или циа-
нидом и цинковым купоросом. В некоторых случаях цианид удается
исключить при введении аэрации измельченной руды. Концентрация
свободной СаО при флотации составляет 400—800 г/м3.
Хвосты медной флотации обычно сгущаются. Для активации пирита
используют соду, железный купорос или серную кислоту. Для этой
цели могут быть также применены углекислый газ, кремнефтористый
натрий и другие реагенты, понижающие pH пульпы. Сода и углекислый
газ связывают известь, образуя плохо растворимый карбонат кальция,
другие предложенные реагенты активируют флотацию пирита, снижая
pH до 5—7. В качестве собирателя при флотации пирита обычно исполь-
зуют бутиловый или амиловый ксантогенаты.
По коллективной схеме медно-пиритную флотацию проводят при
pH 7,5—8 (концентрация свободной СаО в пульпе 20—50 г/м3), при
этом отвальные хвосты получают при измельчении до крупности 60—
70 % класса —0,074 мм. Коллективный концентрат разделяют после
раскрытия сростков медных минералов и пирита при pH 12—12,5 и по-
давления пирита известью (концентрация свободной СаО 400—500 г/м3
и выше) и цианидом. Пиритный концентрат в этом случае получают в
виде камерного продукта.
В некоторых рудах наряду с медными минералами в значительных
количествах содержится магнетит. Руды, содержащие менее 30—40 %
306
железа и более 0,5 % меди, обычно обогащаются по схемам, включаю-
щим медную флотацию и магнитную сепарацию хвостов медной фло-
тации с получением магнетитового концентрата. Руды, содержащие
более 40 % железа и 0,2-0,3 % меди, сначала подвергают магнитной се-
парации, а затем флотируют для получения медного концентрата.
При обогащении медьсодержащих руд в некоторых случаях воз-
никает проблема отделения медных минералов от арсенопирита. Нап-
ример, при переработке сульфидно-оловянных руд медные минералы
(халькопирит, борнит, халькозин, ковеллин, малахит), а также арсено-
пирит и пирит сначала извлекают в коллективный концентрат, из кото-
рого затем получают медный концентрат. Разработанная в Механобре
бесцианидная технология получения медного концентрата основана
на подавлении арсенопирита и пирита при перемешивании коллектив-
ного концентрата с известью и активированным углем (pH 12,5-12,8)
и длительной аэрации (до 60—120 мин).
Сплошные руды. При обогащении сплошных медно-колчеданных руд
необходимо отделить медные минералы от пирита и пирротина.
Селективная флотация таких руд осложняется тем, что сульфиды
меди и железа обычно имеют более тонкое прорастание между собой,
чем с минералами породы, а флотационные свойства сульфидов меди
и активированных сульфидов железа близки. Наличие вторичных суль-
фидов меди еще больше затрудняет задачу разделения, особенно если в
руде содержится быстро шламующийся ’’сажистый” ковеллин.
Черновой медный концентрат получают при измельчении руды до
крупности 70—80 % класса —0,074 мм. Для подавления сульфидов
железа концентрация свободной СаО при измельчении поддерживается
в пределах 400—800 г/м3, а при свободной флотации — 500—1000 г/м3.
В качестве собирателя используют бутиловый ксантогенат и его сочета-
ние с бутиловым аэрофлотом.
Черновой концентрат доизмельчается до крупности 90-95 % класса
-0,074 мм и перечищается при концентрации свободной СаО 500-
1000 г/м3. Если содержание пустой породы в рудах не превышает 10-
15 %, то хвосты медной флотации — готовый пиритный концентрат.
При более высоком содержании пустой породы из хвостов медной
флотации после их сгущения флотируют пирит по реагентным режи-
мам, указанным выше.
Медные смешанные и окисленные руды
Основные медные окисленные минералы - малахит Си2 [СО3] (ОН)2,
азурит Сиз [СОз] 2(ОН)2, брошантит CU4 [S04] (ОН)6, атакамит
Си2(ОН)3С1, хризоколла CuSiO3 • иН2 О, куприт Си2О, тенорит СиО.
Смешанные и окисленные руды перерабатываются флотационными,
комбинированными и гидрометаллургическими методами.
Способность медных окисленных минералов к флотации опреде-
ляется их растворением в цианиде. Карбонаты, сульфаты,, хлориды
307
и оксиды меди растворяются в цианиде, и руды, содержащие эти ми-
нералы, обычно обогащаются флотацией.
Труднофдотируемые окисленные медные минералы (силикаты,
фосфаты меди) переходят в сернокислотную вытяжку. При значитель-
ном содержании этих минералов руды относят к категории упорных
и обогащают комбинированным или гидрометаллургическим мето-
дами [45] .
Флотацию обычно проводят ксантогенатами после предварительной
сульфидизации. Последняя осуществляется с помощью сернистого
или гидросернистого натрия- при нормальной температуре в течение
короткого времени (0,5-1 мин). Расход сульфидизатора не должен
быть избыточным, так как в противном случае сульфидизация идет
на большую глубину с образованием видимой сульфидной пленки и
ксантогенат не сорбируется на поверхности минералов. С другой сто-
роны, со временем сульфидные пленки отслаиваются или окисляются,
и поэтому сульфидизатор необходимо загружать в несколько приемов.
Собиратель подают также дробно после введения сульфидизатора.
Окисленные медные минералы флотируются совместно с сульфид-
ными минералами либо после флотации сульфидных минералов. В пер-
вом случае сульфидизатор загружается совместно с питанием флотации
и в камеры флотационных машин. Если сначала флотируются сульфид-
ные минералы, то с питанием флотаций иногда также подают небольшое
количество сернистого натрия для связывания в объеме пульпы ионов
тяжелых металлов. Расход сульфидизатора при флотации смешанных
и окисленных руд составляет 0,3—2 кг/т.
В качестве собирателя чаще всего применяют бутиловый и амило-
вый ксантогенаты (100-300 г/т), иногда в сочетании с аэрофлотами
и машинным маслом. В некоторых случаях (также после предваритель-
ной сульфидизации) используют меркаптобензотиазол как единственный
собиратель, а также в сочетании с амиловым ксантогенатом.
Значение pH при флотации смешанных и окисленных руд обычно
находится в пределах 9—11. Для подавления пирита или при недостатке
щелочности, создаваемой сульфидизатором, в мельницы загружают
известь.
В зарубежной практике для флотации окисленных медных минера-
лов, кроме сульфгидрильных собирателей, применяют также оксигид-
рильные, в частности жирно-кислотные. При обогащении смешанных
руд, содержащих медные минералы — халькозин, халькопирит, малахит,
куприт, тенорит, азурит, силикатную породу и доломит, жирные кисло-
ты загружают с хвостами сульфидной флотации, которую проводят с
использованием ксантогенатов. Перед подачей жирных кислот проводят
сульфидизацию гидросернистым натрием. Жирные кислоты (пальмовое
масло) применяют в смеси с газойлем или дизельным топливом.
При обогащении окисленных руд, содержащих малахит и силикат-
ную породу, в качестве собирателя используют эмульсию пальмового
масла, гидролизованного до 75 % кислотности, в смеси с газойлем в
308
отношении 3:1 с небольшими (3—5 %) добавками таллового масла и
соды. Расход пальмового масла составляет 0,8—1,2 кг/т. Флотацию
проводят в содовой среде. В качестве подавителя и диспергатора породы
используют жидкое стекло (0,4—0,6 кг/т).
При переработке смешанных и окисленных руд комбинированны-
ми методами наибольшее распространение получил метод В.Я. Мосто-
вича. Метод включает выщелачивание окисленной меди серной кисло-
той, осаждение (цементацию) меди, перешедшей в раствор, металли-
ческим железом и флотацию цементной меди. За рубежом этот процесс
называется LPF.
Расход серной кислоты для выщелачивания определяется составом
руды и изменяется от нескольких килограммов до 40 кг/т руды, про-
должительность выщелачивания составляет 10—60 мин. В качестве
осадителя используются измельченное губчатое железо, чугунная струж-
ка, железный скрап. Расход осадителя также колеблется в широких
пределах — от нескольких килограммов до 20 кг/т руды, время цемен-
тации равно 5—20 мин. В качестве собирателя для цементной меди при-
меняют бутиловый и изопропиловый гидролизованные аэрофлоты
(калиевая или натриевая соли смесей диалкил- и диарилмонотиофос-
форных и диалкил- и диарилдитиофосфорных кислот). Расход собира-
теля 150—200 г/т. За рубежом для флотации цементной меди приме-
няют Минереки (смешанные тиоангидриды ксантогеновыхи алкилуголь-
ных кислот). Цементную медь обычно флотируют при pH 4—5, регули-
руемом известью.
По другому комбинированному методу обогащения окисленных
медных руд пульпа после выщелачивания (pH 2) поступает в специаль-
ный реактор, в котором через нее пропускают сероводород. При этом
находящаяся в растворе медь осаждается в виде искусственного ковел-
лина. Из реакторов пульпа поступает на флотацию, которая проводится
при pH 4 с использованием в качестве собирателя Минерека А и алли-
лового эфира изоамилксантогеновой кислоты [55] .
Применяется также комбинированный метод переработки трудно-
обогатимых окисленных руд, называемый процессом сегрегации. Сна-
чала проводится восстановительный обжиг измельченной руды в при-
сутствии кокса и поваренной соли при температуре 700—800 °C в пе-
чах кипящего слоя. При этом медь восстанавливается до металла и ее
зерна укрупняются. Полученный продукт охлаждается и флотирует-
ся в щелочной среде ксантогенатами.
В окисленных упорных рудах наряду с силикатами, фосфатами
и другими труднофлотируемыми минералами обычно содержатся суль-
фиды и легкофлотируемые окисленные минералы. Тогда в большинст-
ве случаев сначала флотируют сульфиды и легкофлотируемые окислен-
ные минералы (последние с предварительной сульфидизацией). Однако
сульфиды могут извлекаться из хвостов флотации цементной меди
или после выщелачивания окисленных минералов.
309
В последнее время при обогащении окисленных упорных руд все
большее применение получает схема, по которой после грубого измель-
чения выделяют шламы, в основном содержащие окисленные трудно-
флотируемые медные минералы, которые перерабатывают комбиниро-
ванным методом, и пески, преимущественно содержащие сульфиды
и легкофлотируемые окисленные минералы, которые после доизмельче-
ния обогащают флотацией [45] .
Для переработки окисленных упорных руд применяют также гид-
рометаллургические методы.
20.2. Молибденовые руды
Основной полезный минерал молибденовых руд — молибденит.
В зоне окисления молибденовых месторождений часто встречаются
повеллит СаМоО4, ферримолибдит Fe2 [МоО4] 3 • 7Н2О и молибдено-
вые охры. Промышленное значение из окисленных минералов имеет
повеллит.
Помимо молибденовых руд, молибденит и окисленные молибденовые
минералы содержатся в вольфрамовых шеелитсодержащих и медно-
порфировых рудах. Из вольфрамовых руд молибденит флотируется в
первую очередь, шеелит извлекается из хвостов молибденовой флота-
ции. Из медно-порфировых руд молибденит флотируется совместно с
медными минералами в коллективный концентрат, который затем
разделяется на медный и молибденовый. Получение молибдена из вольф-
рамовых и медно-порфировых руд имеет важное промышленное
значение.
При переработке молибденовых и вольфрамовых руд отвальные
по молибдену хвосты получают при крупности измельчения 40-60 %
класса -0,074 мм. Концентрат основной флотации после одной - трех
перечисток направляют в цикл селекции. В ряде случаев концентрат
основной флотации или первой перечистки доизмельчается.
При обогащении медно-порфировых руд медно-молибденовая фло-
тация нередко проводится при крупности 60—70 % класса —0,074 мм,
так как вкрапленность медных минералов обычно более тонкая, чем
молибденита в молибденовых и вольфрамовых рудах. Обычно схемы
цикла медно-молибденовой флотации более развиты, чем при получении
чернового концентрата из молибденовых и вольфрамовых руд. Схемы
включают межцикловую флотацию, доизмельчение концентрата основ-
ной флотации или первой перечистки, доизмельчение промпродукта,
промпродуктовый цикл, в том числе операции ’’cleaner — scavenger”.
Применяют схемы с разделением грубоизмельченной руды на пески
и шламы, измельчением песков до требуемой крупности (60—70 %
класса -0,074 мм) и раздельной флотацией песков и шламов. В пос-
ледние годы используют схемы с доизвлечением меди и молибдена из
песковой фракции хвостов контрольной флотации [55] .
310
При обогащении молибденовых и вольфрамовых руд, содержащих
незначительное количество попутно извлекаемых сульфидов (в основ-
ном медных минералов), в основной и контрольной флотации приме-
няют только собиратели для молибдена — углеводородные масла или
последние совместно с бутиловым ксантогенатом при небольшом его
расходе (2—5 г/т). При большем содержании медных минералов расход
ксантогената увеличивается до нескольких десятков граммов на 1 т.
В качестве углеводородных собирателей применяют керосин и транс-
форматорное масло, а за рубежом — депарафинированное нефтяное
масло плотностью 0,9 и вязкостью 10 мм2/с при 37,8 °C. Углеводороды
подают в измельчение и во флотацию, их расход зависит от содержания
молибдена в руде, крупности измельчения, наличия сростков и изме-
няется в широких пределах (от 10 до 400 г/т). Углеводородные соби-
ратели обычно подают в виде водной эмульсии. В качестве стабилизато-
ра эмульсии на зарубежных фабриках часто используют Арктик Син-
текс Л (или просто Синтекс Л), представляющий собой сульфированный
глицерид коксового масла [55].
Из пенообразователей часто применяют сосновое масло, терпинеол,
ОПСБ, Т-80, МИБК, а также их сочетания. Расход пенообразователей
составляет 10—50 г/т.
Флотация молибденита ведется в щелочной среде (pH 8—9,5), созда-
ваемой известью или содой. Известь не только поддерживает необходи-
мый для флотации молибденита pH, но также подавляет пирит и спо-
собствует образованию пены [55] .
При наличии в руде окисленных медных минералов и выделении
медного концентрата с питанием флотации в операцию добавляется
сернистый натрий.
Для подавления и диспергирования минералов пустой породы при-
меняют жидкое стекло и метасиликат натрия, расходы которых сос-
тавляют 50—200 г/т. Подавление пирита достигается, помимо извести,
цианидом, смесью цианида и цинкового купороса. При большом содер-
жании пирита операция перечистки чернового концентрата проводится
с добавлением извести до pH 9,5—11.
Если сульфидные концентраты попутно не выделяются и необходи-
мо получить высококачественный молибденовый концентрат с незначи-
тельным содержанием (не более 0,1 %) примесей меди и свинца, халько-
пирит и галенит начинают подавлять в основной флотации. За рубежом
для этой цели используется реагент Нокса, получаемый при взаимодейст-
вии пятисернистого фосфора с едким натром в соотношении 1:1,5 ч-
Ч- 1:2 [55] .
При обогащении медно-порфировых руд реагентный режим кол-
лективной медно-молибденовой флотации во многом совпадает с ре-
жимом флотации руд этого типа, не содержащих молибдена.
Однако на ряде зарубежных фабрик в коллективной флотации
применяют Минереки А, 898, 1661, 2030 и реагент ТЗО-Ю, представ-
ляющий собой смесь Минерека А (60 %), МИБК (10 %) и бензина (30%).
311
Различие заключается также в том, что при медно-молибденовой флота-
ции наряду с собирателями медных минералов применяют также соби-
ратели молибденита — керосин, углеводородные масла и аллиловый
эфир изоамилксантогеновой кислоты. Кроме того, так как известь
депрессирует молибденит, ее расход в ряде случаев уменьшают по срав-
нению с расходом, требуемым для подавления пирита.
На фабриках предприятия ”Эль-Тенйенте” (Чили) основную флота-
цию проводят в кислой среде (pH ~ 4), а операции перечистки — в
щелочной (pH 11).
Для активации молибденита в операции перечистки коллективного
концентрата иногда в небольших количествах загружают медный
купорос.
В качестве пенообразователей также применяют Шелл-10 (спирто-
вая фракция более тяжелая, чем МИБК [45]), Дауфрос 1012, смесь
МИБК с крезолом.
Схемы разделения чернового молибденового и медно-молибдено-
вого концентратов включают стадиальное доизмельчение и флотацию.
Для удаления избытка реагентов медно-молибденовые концентраты
перед разделением обычно сгущаются.
При доизмельчении в качестве измельчающей среды используют
шары и рудную галю. Число стадий доизмельчения составляет 1—3,
число перечисток 6—8, но иногда достигает 10—11. Концентраты обычно
доизмельчают до крупности —0,074 мм, но в некоторых случаях значи-
тельно тоньше — до 80 % класса — 20 мкм.
Иногда наряду с циклом разделения чернового молибденового кон-
центрата используют очень развитый промпродуктовый цикл, вклю-
чающий доизмельчение и перечистки промпродукта [55] . Это связано
с наличием труднофлотируемой разновидности молибденита, боль-
шим содержанием высокоактивных шламов породы и загрязняющих
концентрат сульфидов, вследствие чего осложняется получение доста-
точно богатого концентрата промпродуктового цикла, который можно
направить в цикл селекции чернового концентрата.
В большинстве случаев разделение черновых концентратов осу-
ществляется подавлением сульфидов и минералов породы при фло-
тации молибденита.
Для разделения молибденита и сульфидов часто применяют сер-
нистый или гидросернистый натрий. Последний используют на мно-
гих зарубежных фабриках для разделения медно-молибденовых кон-
центратов, в которых медные минералы представлены в основном
халькопиритом, хотя в ряде случаев гидросернистый натрий применяют
при обогащении руд, содержащих вторичные сульфиды меди.
Для снижения расхода сернистого натрия до последнего времени
применяли подогрев и пропарку с подавителем перед флотацией и сов-
мещенйе пропарки с флотацией, когда пульпа непосредственно во флота-
ционных машинах подогревается острым паром до 70—80 °C [45] .
312
При повышенной температуре вследствие снижения концентрации кис-
лорода в пульпе уменьшается окисление сернистых и гидросернистых
ионов и увеличиваются десорбция ксантогената с поверхности сульфи-
дов и его разрушение.
В последние годы на ряде фабрик Канады, Перу и Чили при разде-
лении медно-молибденовых концентратов с использованием гидросер-
нистого натрия вместо воздуха стали применять азот. Это привело к
сокращению расхода подавителя в несколько раз. Так, на фабрике
’’Гибралтар” (Канада) расход гидро сернистого натрия уменьшили
с 7,6 до 1,8 кг/т коллективного концентрата. При этом во флотацию
поступает также диоксид углерода, получаемый в генераторе азота в
качестве побочного продукта. Это позволило отказаться от серной
кислоты, применяемой для снижения pH пульпы при флотации.
В нашей стране Механобром ,Гинцветметом, Армнипроцветметом
проведены исследования, показавшие перспективность использования
азота вместо воздуха при обогащении медно-молибденовых руд. Тех-
нология обогащения с использованием азота при флотации внедряется
на ряде фабрик.
Для усиления подавления халькопирита и пирита совместно с сер-
нистым и гидросернистым натрием применяют цианид. На одной из
отечественных фабрик Гинцветметом для подавления халькопирита
и пирита предложено использовать реагент МФТК-Э, представляющий
собой о-этил-ТУ-сульфофенилтионокарбамат.
На зарубежных фабриках для подавления халькопирита, галенита
и пирита применяют также реагент Нокса в известковой среде и в со-
четании с цианидом и тиосульфатом натрия, а также пропарку с реаген-
том Нокса. Для подавления халькозина используют ферроцианид как
после пропарки чернового концентрата, так и без нее. В операцию пере-
чистки молибденового концентрата может подаваться реагент Нокса.
Ферроцианид применяют в сочетании с окислителями — гипохлоритом
при pH 7—8,6 или перекисью водорода при pH 7,5-7,8; pH регулируют
серной кислотой.
Реагенты-окислители используют для окисления ксантогената, по-
верхности сульфидов и ферроцианида, чтобы превратить последний в
феррицианид, являющийся более сильным подавителем. Для подавления
халькозина на зарубежных фабриках применяют также тиоарсенат
натрия (Анимол Д).
Для разделения медно-молибденового концентрата, содержащего
вторичные сульфиды меди и халькопирит, используется пропарка с
известью, при этом в последние операции перечистки загружается сер-
нистый натрий.
На зарубежных фабриках при разделении коллективных концент-
ратов, содержащих халькопирит, пирит и вторичные сульфиды меди,
применяют комбинации способов, указанных выше.
Для подавления минералов пустой породы при доводке черновых
концентратов обычно используют жидкое стекло и метасиликат натрия.
Их расход изменяется от 0,15 до 1,5 кг/т концентрата.
Для удаления оталькованных и глинистых минералов черновой кон-
центрат (после подавления сульфидов гидросернистым натрием) обра-
батывают лигносульфонатом в известковой среде (pH 11,9), после
чего флотируют минералы породы, а молибденовый концентрат полу-
чают в виде камерного продукта.
Для флотации молибденита в цикле разделения чернового концент-
рата обычно используют те же собиратели, что и в цикле основной фло-
тации, — керосин и углеводородные масла. Из вспенивателей приме-
няют терпинеол, сосновое масло, ОПСБ, МИБК, Дауфрос 250.
В связи с жесткими требованиями, предъявляемыми за рубежом
к содержанию вредных примесей в молибденовых концентратах, пос-
ледние выщелачивают цианидом (для удаления меди) и горячими раст-
ворами хлоридов кальция и железа (для удаления меди, железа, крем-
незема) .
При наличии в рудах медных минералов из хвостов доводки молиб-
деновых концентратов выделяют медные концентраты. Иногда хвосты
доводки представляют собой медный концентрат. Однако в большинстве
случаев проводится флотация медных минералов бутиловым ксанто-
генатом и вспенивателем (ОПСБ, Т-80). Если при этом подавление пи-
рита устойчивое, то депрессоры не добавляют. В противном случае при-
меняют известь (pH 11 — 12,5) и сернистый натрий (концентрация в пуль-
пе до 1 г/л) [45] .
В некоторых случаях коллективные медно-молибденовые концент-
раты разделяют подавлением молибденита и флотацией медных мине-
ралов и минералов породы [55] . Коллективный концентрат переме-
шивают с декстрином, подавляющим молибденит и минералы породы,
после чего медные минералы флотируют этиловым ксантогенатом и
метилизобутилкарбинолом. (МИБК). Камерный продукт обжигается
при температуре 246—290 °C в течение 30 мин. В результате обжига
разрушается пленка реагентов, сорбированных на минералах, окисляет-
ся поверхность сульфидов меди и железа и активируется поверхность
минералов породы — талька и слюды. Затем проводится флотация
талька и слюды с использованием МИБК при pH 7, создаваемом из-
вестью. В этот продукт также частично переходят сульфиды меди, и поэ-
тому он присоединяется к медному концентрату. В дальнейших опера-
циях схемы с использованием топливного масла и МИБК проводится
флотация молибденита, при этом сульфиды меди и железа подавляют
реагентом Нокса и известью (pH 10-11), а оставшиеся в концентрате
минералы породы — жидким стеклом. В результате получают высоко-
качественный молибденовый концентрат, камерный продукт присое-
диняется к медному концентрату.
При наличии в молибденовых рудах повеллита его извлекают из
хвостов молибденовой флотации с использованием жирнокислотных
собирателей. Например, на одной из фабрик применяют олеат натрия
(100—200 г/т) в сочетании с алкилсульфатом (10-20 г/т). Черновой
314
концентрат пропаривают с жидким стеклом для подавления минералов
породы, трижды перечищают и вновь пропаривают с сернистым натрием,
а затем направляют в цикл доводки молибденитового концентрата [45] .
20.3. Медно-цинковые руды
Медно-цинковые руды делятся на сплошные, в которых содержа-
ние сульфидов составляет 50—90 %, и вкрапленные, в которых обычно
содержится от 20 до 50 % сульфидных минералов. Основные минералы
медно-цинковых руд — халькопирит, сфалерит и пирит. Кроме того,
медные минералы представлены борнитом, халькозином, ковеллином,
таннантитом, тетраэдритом, малахитом, азуритом, хризоколлой, из
сульфидов железа нередко в значительных количествах присутствует
пирротин.
Медно-цинковые руды обогащают по различным схемам. При фло-
тации вкрапленных медно-цинковых руд в некоторых случаях приме-
няется схема коллективной флотации всех сульфидов с последующим
доизмельчением и разделением коллективного концентрата на медный,
цинковый и пиритный. Применение такой схемы целесообразно, нап-
ример, когда сульфидные агрегаты можно отделить от породы при
грубом измельчении, а раскрытие сростков сульфидов требует тонкого
измельчения. Эту схему используют также в тех случаях, когда наличие
в рудах сульфидов и вторичных сульфидов меди вызывает активацию
ионами меди сульфидов цинка и железа и затрудняет подавление пос-
ледних при прямой селективной флотации [45] .
Во многих сплошных медно-цинковых рудах зерна сульфидов меди
и цинка имеют меньший размер, чем значительная часть зерен пирита.
Такие руды обогащают по схеме, включающей флотацию медных мине-
ралов, сфалерита и части пирита в коллективный концентрат и выделе-
ние основной части пирита в хвосты при измельчении 85—90 % класса
—0,074 мм. Полученный концентрат затем доизмельчается до 85—90 %
класса —0,044 мм и разделяется. Пиритсодержащие хвосты коллектив-
ной флотации при незначительном содержании минералов породы в руде
(~ 10 %) являются пиритным концентратом, при значительном содер-
жании хвосты перефлотируются для получения пиритного концентрата.
Помимо указанных схем, при обогащении вкрапленных и сплош-
ных медно-цинковых руд широкое распространение получили также
схема прямой селективной флотации с последовательным выделением
медного, цинкового и пиритного концентратов [45] .
Коллективная флотация сульфидов из вкрапленных руд проводит-
ся при измельчении руды до крупности 55—70 % класса —0,074 мм
в слабокислой (pH 6—6,5), нейтральной или слабощелочной (pH 7—8)
среде, создаваемой соответственно серной кислотой или известью.
В качестве собирателей используют этиловый и бутиловый ксантогенаты,
аэрофлоты, в качестве вспенивателей — Т-80, сосновое масло. В неко-
315
торых случаях для полного извлечения сфалерита в коллективную фло-
тацию добавляют медный купорос [44,45] .
При наличии в рудах двух разновидностей сфалерита коллективную
флотацию проводят в два приема — сначала флотируют медные мине-
ралы и природно активированный ионами меди сфалерит, а затем с
добавками медного купороса — сфалерит, обладающий слабой природ-
ной флотируемостью. Концентрат второй коллективной флотации может
направляться прямо в цинковую флотацию [44, 45] .
В ряде случаев из коллективного концентрата, получаемого из
вкрапленных руд, перед разделением медных и цинковых минералов
предварительно удаляется основная часть пирита. Для этого концент-
рат доизмельчается до крупности 80—90 % класса —0,074 мм и флоти-
руется собирателем при небольших его загрузках. Пирит подавляется
известью, загружаемой в доизмельчение (концентрация свободной
СаО 500 г/м3).
Коллективная флотация сульфидов из сплошных руд обычно про-
водится при измельчении руды до крупности 85—90 % класса —0,074 мм
в известковой среде (концентрация свободной СаО 200—500 г/м3),
создаваемой для подавления свободных зерен пирита. В качестве со-
бирателя применяют бутиловый ксантогенат, сочетания бутилового
ксантогената с изопропиловым и бутиловым аэрофлотом. Расход соби-
рателей составляет 150—200 г/т. Для активации сфалерита применяют
медный купорос (расход 70-150 г/т). Коллективный концентрат пере-
чищается при концентрации свободной СаО 500-600 г/м3, а в некоторых
случаях коллективный концентрат перед селекцией доизмельчается.
Медные и цинковые минералы разделяют по цианидному и бесциа-
нидному способам. Цианидное разделение осуществляется обычно с
использованием сочетания цианида с цинковым купоросом.
На отечественных фабриках проводят бесцианидное разделение,
при котором из процесса исключается высокотоксичный реагент —
цианид и сокращаются затраты на реагенты и очистку сточных вод.
Бесцианидное разделение основано на подавлении сфалерита сернистым
натрием и цинковым купоросом в известковой среде, при этом также
подавляется пирит. В некоторых случаях к указанным реагентам добав-
ляется сульфит натрия. Этот реагентный режим разработан Механоб-
ром, Уралмеханобром, Унипромедью и Гинцветметом.
Перед разделением обычно проводят десорбцию собирателя. Для
этого используют сернистый натрий или сернистый натрий совместно
с активированным углем. Реагенты загружают в контактный чан или
в мельницу доизмельчения коллективного концентрата. В случае необ-
ходимости после десорбции производится сгущение, чтобы удалить
в слив десорбированный собиратель и избыток вспенивателя. Расходы
сернистого натрия и активированного угля при операции десорбции
изменяются в широких пределах и составляют соответственно 0,2—3
и 0,1—0,3 кг/т руды.
316
Сернистый натрий, цинковый купорос и известь загружают в доиз-
мельчение коллективного концентрата.
Известь может дополнительно подаваться в медную флотацию.
Сульфит натрия загружают в доизмельчение или медную флотацию.
Расход реагентов составляет, кг/т руды: сернистого натрия 0,1—0,2;
цинкового купороса 0,3—0,5; сульфита натрия — 0,2. Щелочность пульпы
в операциях доизмельчения и медной флотации изменяется в широких
пределах: доизмельчение — от 15—30 до 500 г/м3 свободной СаО; мед-
ная флотация — от 100—200 до 500—700 г/м3 свободной СаО.
Коллективный концентрат доизмельчается до крупности 90 % клас-
са —0,074 мм и 90 % класса —0,044 мм. Медная флотация проводится
с использованием бутилового ксантогената и пенообразователя при
небольщих их расходах. При перечистках медного концентрата обычно
используются сернистый натрий, цинковый купорос и известь. Указан-
ная технология обеспечивает устойчивое подавление сфалерита и пирита.
Хвосты медной флотации перемешиваются с медным купоросом
(100—300 г/т руды) для активации сфалерита и известью (концентрация
800—1000 г/м3 свободной СаО) для подавления пирита. В некоторых
случаях при перемешивании пульпа подогревается до 35—40 °C и аэри-
руется для лучшего подавления пирита.
Цинковая флотация проводится с использованием бутилового ксан-
тогената и Т-80. Черновой цинковый концентрат может доизмельчаться
до 90 % класса —0,044 мм. Его перечистки осуществляются в высоко-
щелочной среде (концентрация свободной СаО до 1100 г/м3).
В некоторых случаях разделение коллективного концентрата ведут
в несколько стадий. Сначала с использованием сернистого натрия (40—
140 г/т руды), цинкового купороса (300—400 г/т) и извести (до 30 г/м3
свободной СаО в операциях доизмельчения коллективного концентрата
и до 150—200 г/м3 в медной флотации) депрессируются малоактивные
сфалерит и пирит и флотируются медные минералы и высокоактивные
сфалерит и пирит. Затем пенный продукт обрабатывается сернистым
натрием (600—800 г/т руды) для десорбции собирателя, сгущается и
перемешивается с цинковым купоросом, после чего проводится медная
флотация при pH 7,4—7,8. Камерный продукт присоединяется к цинко-
вому концентрату, полученному из хвостов первой медной флотации
с использованием медного купороса и извести.
При наличии в руде высокоактивного пирита коллективный кон-
центрат после десорбции собирателя сернистым натрием и доизмельче-
ния перемешивается с цинковым купоросом, дозируемым в слив гид-
роциклона, и поступает на медно-пиритную флотацию, которая прово-
дится при pH 8—9. В качестве собирателя используется изопропиловый
ксантогенат, в качестве вспенивателя — Т-80. При этом из-за перехода
значительной части пирита в пенный продукт для получения кондицион-
ного медного концентрата содержание меди в коллективном концентра-
те выдерживается в заданных пределах. Цинковый концентрат получают
в виде камерного продукта [44] .
317
На японских фабриках применяют другие бесцианидные методы
разделения коллективного концентрата. Сфалерит пирит подавляют
сернистым газом.
Пиритсодержащие хвосты цинковой флотации объединяют с пирит-
ным продуктом, выделенным из коллективного концентрата перед
медной флотацией при обогащении вкрапленных руд, или хвостами
коллективной флотации при обогащении сплошных руд. В зависимости
от содержания пустой породы объединенный продукт является пирит-
ным концентратом или подвергается дальнейшей переработке. В не-
которых случаях пиритный концентрат получают после обесшламлива-
ния в гидроциклонах, так как в шламы в основном уходят минералы
породы.
По схеме прямой селективной флотации перерабатывают многие
вкрапленные и сплошные руды. Медную флотацию проводят по ме-
ре раскрытия сростков медных минералов. Схемы включают флотацию
в цикле измельчения и операции межцикловой флотации. Так, в некото-
рых случаях флотации подвергают продукты разгрузки как стержневой,
так и шаровой мельниц. Крупность измельчения руды перед основной
медной флотацией изменяется в широких пределах (от 60 до 90 %
класса —0,074 мм). Цинковую флотацию проводят при той же тонине
измельчения руды, что и медную. Схемы медного и цинкового циклов
включают доизмельчение черновых концентратов и промпродуктов
(иногда до крупности —0,044 мм), промпродуктовую флотацию спере-
чистками промпродукта.
Применяют различные реагентные режимы. На одной из отечествен-
ных фабрик сфалерит и пирит подавляют по описанной выше бесциа-
нидной технологии [44] . Цинковую флотацию проводят по обычному
режиму, основанному на активации сфалерита медным купоросом и
подавлении пирита известью. Хвосты цинковой флотации — это пирит-
ный концентрат.
Цинковый концентрат, содержащий 37—40 % цинка, поступает на
доводку по методу Л.Б. Дебривной. После десорбции собирателя сер-
нистым натрием и отмывки в сгустителях концентрат доизмельчается
и перемешивается с содой и цинковым купоросом при pH 7—8, регули-
руемым подачей железного купороса. После чего с использованием
бутилового ксантогената и пенообразователя флотируются медные
минералы и пирит, а сфалерит остается в хвостах, при этом содержание
цинка в цинковом концентрате повышается до кондиционного.
На зарубежных фабриках сфалерит и пирит обычно подавляют в
известковой среде с помощью сульфита натрия, цианида и сочетаний
цианида с цинковым купоросом, сульфидом натрия, сернистым газом.
Расходы реагентов составляют 10—100 г/т.
В некоторых случаях в качестве регулятора среды применяется сода
(pH основной флотации 9—9,5). Сфалерит подавляется с помощью
сернистого газа (300 г/т), подаваемого в операцию перечистки медного
318
концентрата (pH 7,5-5). Для подавления пирита и пустой породы ис-
пользуется гуарова смола (5 г/т).
Реагенты загружают в мельницу или в кондиционеры перед медной
флотацией. Для лучшего подавления сульфидов железа — пирита и
пирротина пульпа аэрируется перед флотацией и в специальных аэра-
торах — классификаторах в цикле измельчения.
В качестве собирателей используют этиловый, изопропиловый и
изобутиловый аэрофлоты, меркаптобензотиазол. Нередко применяют
сочетания собирателей. Расход собирателей составляет 20—120 г/т.
Распространена дробная загрузка собирателей в четыре-пять точек,
например в I и II стадии измельчения, межцикловую, основную и конт-
рольную медную флотацию, при этом процесс ведется ”на голодном”
режиме, чтобы получить более высокую селективность. Из пенообразо-
вателей широко применяют МИБК и ТЭБ.
Флотация сфалерита из хвостов медного цикла, как правило, про-
водится с использованием медного купороса и извести после предва-
рительного кондиционирования с этими реагентами. Для усиления
подавления сульфидов железа кондиционирование совмещается с аэра-
цией. Из собирателей применяют различные ксантогенаты, реагент Z-200
и в редких случаях — аэрофлот и меркаптобензотиазол. Из пенообра-
зователей используются ТЭБ, МИБК, сосновое масло, Дауфрос 250.
На одной из японских фабрик, перерабатывающих руды с большим
содержанием пирротина, который частично представлен сильномаг-
нитной модификацией, перед цинковой флотацией проводится магнит-
ная сепарация.
На некоторых фабриках для получения высококачественного цин-
кового концентрата черновой цинковый концентрат подвергается спе-
циальной доводке. На одной из финских фабрик черновой цинковый
концентрат сначала нагревается до кипения с загрузкой извести для
десорбции собирателя, затем перемешивается с цинковым купоросом
для подавления сфалерита и серной кислотой для создания pH, необхо-
димого для успешной флотации пирита, и флотируется изопропиловым
ксантогенатом и пенообразователем ТЭБ. В пенный продукт извлекают-
ся сульфиды меди и железа, а в камерном продукте остается сфалерит.
На одной из норвежских фабрик сгущенный черновой цинковый
концентрат пропаривается при температуре 85—90 °C с гидросульфитом
натрия в течение 20 мин, затем разбавляется холодной водой до содер-
жания твердого 40 % и температуры 50 °C и флотируется. В пенный
продукт переходят пирит, халькопирит и сростки пирита со сфалери-
том, а в камерном продукте остается сфалерит.
Из хвостов цинковой флотации при необходимости выделяют пирит-
ный концентрат. Хвосты обычно после сгущения в гидроциклонах
перемешиваются с серной кислотой до pH 4—6,5 и флотируются различ-
ными ксантогенатами.
319
20.4. Медно-никелевые руды
Медно-никелевые руды делятся на вкрапленные и сплошные. В
сплошных рудах содержание сульфидов превышает 70%.
Основные никелевые минералы медно-никелевых руд— пентландит
(Fe, Ni)9S8, никеленосный пирротин и миллерит NiS. Основные мед-
ные минералы — халькопирит, кубанит CuFe2S3, талнахит Cu9Fe8S16,
моихукит Cu9Fe9Si6, борнит. Кроме никеля и меди ценными компо-
нентами медно-никелевых руд являются металлы платиновой группы,
золото, серебро и кобальт.
Пирротин — основной рудный минерал. Его никеленосность прояв-
ляется в виде твердого раствора сульфида никеля и мелких включений
или эмульсионной вкрапленности пентландита в пирротине. Пирротин
бывает сильно- и слабомагнитным. Значительная часть никеля (до 20—
25 %) во вкрапленных рудах является неизвлекаемой. К этой категории
относится силикатный никель, представленный эмульсионной вкраплен-
ностью пентландита в силикатах и никелем, изоморфно связанным с
силикатами (оливином, серпентином, пироксеном) [45] .
Вкрапленные руды часто обогащают по схеме коллективной флота-
ции сульфидов. В этом случае основные трудности связаны с отделе-
нием флотоактивных силикатов (талька, хлорита, серицита) и извле-
чением никеленосного пирротина. Учитывая быструю окисляемость пос-
леднего, вызывающую понижение флотируемости, схемы строятся
таким образом, чтобы как раскрытые, так и сфлотированные сульфиды
возможно быстрее выводились из процесса. Так, если позволяет харак-
тер вкрапленности, проводится межцикловая флотация или флотация
в цикле измельчения; число и объем циркулирующих продуктов сводят-
ся к минимуму и основная флотация проводится в открытом цикле.
Схема в ряде случаев включает промпродуктовый цикл, концентрат
которого направляется в последнюю перечистку объединенного кон-
центрата межцикловой и основной флотации [44,45] .
Крупность измельчения руды, поступающей в межцикловую флота-
цию, составляет 40—50 % класса —0,074 мм, в основную флотацию -
60—80 % этого класса, промпродукты нередко доизмельчаются до круп-
ности 100 % класса - 0,044 мм.
Основная флотация проводится в щелочной среде (pH 9—10). Щелоч-
ная среда создается обычно содой. Иногда регуляторы среды не при-
меняют. В качестве собирателя используют бутиловый или амиловый
ксантогенаты, а также сочетание амилового и изопропилового ксанто-
генатов, бутилового ксантогената и аэрофлота, вторичного бутилового
ксантогената и производных меркаптобензотиазола. Ксантогенат часто
загружают в мельницу, чтобы обеспечить взаимодействие собирателя
со свежеобнаженной, неокислившейся поверхностью пирротина.
Расход собирателей составляет обычно 70—200 г/т. Из пенообразо-
вателей используют Т-80 ССК, сосновое масло, МИБК, ТЭБ. При необ-
320
ходимости применяют медный купорос как активатор пирротина (35—
50 г/т).
Минералы породы, главным образом флотоактивные силикаты,
подавляют жидкихм стеклом, карбоксиметилцеллюлозой (УМЦ), гуар-
теком, гуаровой смолой. Следует отметить, что КМЦ вместо жидкого
стекла как более эффективный подавитель силикатов была впервые
использована для медно-никелевых руд Кольского полуострова И.И. Ва-
неевым, С.И. Горловским и Н.В. Зашихиным и в настоящее время
широко применяется для этой цели на зарубежных фабриках. В неко-
торых случаях жидкое стекло используется в основном для диспер-
гирования пульпы.
Однако не всегда удается подавить флотоактивные силикаты в
щелочной среде, и тогда флотация проводится в кислой среде при pH
3—5,5. Среда создается серной кислотой или сернистым газом. Кроме
того, применяют подавители — КМЦ, КМЦ в сочетании с жидким стек-
лом, маисовую муку. Флотация проводится этиловым или амиловым
ксантогенатом.
Для более полного извлечения полезных минералов и особенно
пирротина применяют схему с раздельной флотацией песков и шламов.
Раздельная флотация может проводиться как в голове процесса (после
измельчения руды до необходимой крупности), так и после основной
флотации, когда применяется флотация песковой фракции хвостов.
В зависимости от отношения содержаний меди и никеля коллектив-
ный концентрат разделяют на медный и никелевый (при отношении
менее двух) либо подвергают плавке на файнштейн и разделяют пос-
ледний по методу И.Н. Масленицкою (при отношении более двух) [45] .
Коллективный медно-никелевый концентрат разделяется флотацией
медных и подавлением никельсодержащих минералов. Депрессия дости-
гается известью, загружаемой до pH 11 — 12, декстрином, пропаркой с
известью, сочетаниеги извести и цианида при повышенной (до 35 °C)
температуре пульпы в перечистках, сочетанием извести и декстрина,
извести и сульфита натрия. Коллективный концентрат перед селекцией
или после первого приема медной флотации часто доизмельчается.
Если коллективный концентрат необходимо разделять, коллектив-
ная флотация проводится без подачи медного купороса, так как пос-
ледний активирует никелевые минералы и затрудняет последующую
селекцию. В этом случае обычно в коллективный концентрат, получае-
мый в известковой среде, извлекают халькопирит и пентландит. Известь
применяется для подавления пирротина, который затем активируется
загрузками медного купороса и флотируется в пирротиновый концент-
рат. Пирротиновый концентрат объединяется с никелевым концентра-
том либо поступает на металлургическую переработку для извлечения
из него железа, серы, никеля.
Если пирротин обладает магнитными свойствами, то его выделяют
магнитной сепарацией. Используются различные схемы выделения маг-
нитного пирротина.
321
21-6926
Пирротин может извлекаться магнитной сепарацией в цикле дроб-
ления или из измельченной руды перед флотацией. В ряде случаев сна-
чала проводится коллективная флотация халькопирита и основной
части пентландита, затем магнитной сепарацией выделяется пирротино-
вый продукт, а из хвостов магнитной сепарации с использованием мед-
ного купороса дофлотируются остатки пентландита и Пирротина.
Часть фабрик работает по схеме, в которой предусмотрены коллек-
тивная флотация халькопирита и части пентландита, извлечение из хвос-
тов пентландита и пирротина флотацией с подачей медного купороса
и получение отвальных хвостов, выделение пирротина из флотационного
пирротин-пентландитового концентрата магнитной сепарацией.
Магнитный пирротиновый продукт обычно содержит халькопирит
и пентландит. Последние отделяются от пирротина флотацией, при этом
пирротин депрессируется известью (pH 9). При необходимости пирроти-
новый продукт перед флотацией доизмельчают. Для лучшего отделения
халькопирита и пентландита от пирротина схема может включать не-
сколько операций магнитной сепарации и флотации.
На одной из отечественных фабрик пирротин доизвлекается из от-
вальных хвостов после их обесшламливания по магнитно-флотацион-
ной схеме, разработанной Механобром. Сростки пирротина с магне-
титом переходят в магнитную фракцию. Магнитная фракция доизмель-
чается и флотируется с использованием небольших расходов медного
купороса, бутилового ксантогената и бутилового аэрофлота. Пенный
продукт направляется в перечистки основного цикла [45].
Сплошные руды, в которых сульфиды в основном представлены
халькопиритом, пентландитом и пирротином, а отношение содержания
меди к содержанию никеля в руде не превышает единицы, обогащают-
ся по таким же схемам, как и вкрапленные руды.
Значительно бблыпую сложность представляет обогащение сплош-
ных руд, содержащих наряду с халькопиритом такие сульфиды меди,
как талнахит, кубанит, моихукит, и имеющих отношение содержаний
меди и никеля в руде больше единицы. Для переработки таких руд
Механобром и Норильским ГМК разработана технологическая схема,
включающая предварительное обогащение крупной руды в тяжелых
суспензиях, а мелкий класс присоединяется к тяжелой фракции (см.
разд. 19). Из легкой фракции после ее измельчения до 80 % класса
—0,074 мм и флотации с использованием бутилового ксантогената и
пенообразователя Т-80 получают коллективный концентрат и отваль-
ные хвосты. Коллективный концентрат после пропарки с известью и
доизмельчения разделяют на медный (пенный продукт) и бедный ни-
келевый концентраты.
Тяжелая фракция обогащается по схеме прямой селективной фло-
тации с последовательным выделением медного, никелевого и пирро-
тинового концентратов.
Тяжелая фракция измельчается до крупности 85—90 % класса
322
—0,044 мм. Затем пульпа аэрируется в течение 15—25 мин и флотирует-
ся собирателем. В качестве собирателя используется бутиловый аэро-
флот, который загружается в процессе аэрации, пенообразователя —
МИБК, активатора медных минералов — сульфита натрия.
Из хвостов медной флотации после их сгущения получают богатый
никелевый концентрат, в который извлекается основная часть пент-
ландита. Флотация проводится сочетанием бутилового ксантогената
(50-70 г/т) и МИБК (до 10 г/т).
Пирротин извлекается флотацией из хвостов никелевого цикла
применением бутилового ксантогената и МИБК, расходы которых
значительно выше, чем в никелевой флотации (соответственно 200
и 40 г/т).
Содержащиеся в медно-никелевых рудах кобальт, элементы плати-
новой группы, золото и серебро извлекаются в основном в медный, ни-
келевый и пирротиновый концентраты.
20.5. Полиметаллические руды
Основные полезные минералы полиметаллических руд — галенит,
сфалерит, сульфиды меди и пирит. В зонах окисления месторождений
полиметаллических руд распространены церуссит РЬСО3, англезит
PbS04, смитсонит ZnCO3, каламин Zn4 [Si2O7] (ОН)2 • Н2О, окислен-
ные медные минералы, оксиды и карбонаты железа.
Основной процесс обогащения полиметаллических руд в настоящее
время — флотация. Однако, если вкрапленность полезных минералов
благоприятна, осуществляется предварительное гравитационное обога-
щение этих руд, позволяющее в некоторых случаях выделить значитель-
ную часть (до 30—35 %) минералов породы после сравнительно круп-
ного дробления. Наиболее распространенный гравитационный процесс -
обогащение в тяжелых суспензиях.
Схемы, применяемые в большинстве случаев при обогащении поли-
металлических руд, показаны на рис. IV.9. Кроме того, на некоторых
фабриках используется также схема прямой селективной флотации
руд, содержащих медные минералы.
Схема коллективной флотации с последующим разделением кол-
лективного концентрата, как показано А.С. Коневым и Л.Б. Дебривной,
особенно эффективна в тех случаях, когда при грубом измельчении
всей руды можно выделить отвальные хвосты и коллективный концент-
рат с небольшим выходом, требующий для селекции более тонкого
измельчения. По данным М.А. Фишмана и Д.С. Соболева, эта схема
применяется также при наличии в рудах природно-активированного
сфалерита, подавление которого затруднено, или карбонатов железа
и марганца, препятствующих подавлению сфалерита цинковым купо-
росом и цианидом. При коллективной флотации карбонаты остаются
в хвостах и не мешают разделению концентрата.
323
Коллективная флотация проводится при измельчении руды до круп-
ности 45—55 % класса —0,074 мм. При неравномерной вкрапленности
сульфидов коллективная флотация осуществляется в две стадии и
отвальные хвосты выделяются при крупности измельчения 80—85 %
класса —0,074 мм.
Обычно сульфиды флотируют в содовой среде при pH 8—9,5 с исполь-
зованием в качестве собирателя ксантогенатов (бутилового, изопро-
пилового и др.). В ряде случаев флотацию ведут при pH 7—7,5. При
необходимости для активации сфалерита применяют медный купорос,
а при наличии в руде окисленных минералов свинца и меди — сернистый
натрий. Из пенообразователей в коллективной флотации применяют
Т-80, Э-1, сосновое масло, МИБК.
Если сфалерит представлен двумя разновидностями, то сначала,
совместно с другими сульфидами извлекают хорошо флотируемый
сфалерит, а затем с добавками медного купороса получают цинковый
продукт, который направляется в цинковый цикл либо присоединяется
к цинковому концентрату.
При большом содержании пирита в руде коллективная флотация
проводится в высокощелочной среде, при этом значительная часть пи-
рита подавляется. Из хвостов коллективной флотации доизвлекают
цинк, направляя полученный цинковый продукт в цинковый цикл,
а затем флотируют пирит.
Наличие в руде первичных шламов отрицательно влияет на флота-
цию. Поэтому первичные шламы выделяют перед дроблением руды
оттиркой или промывкой на грохотах и флотируют в отдельном цикле.
Коллективный шламовый концентрат затем объединяют с коллектив-
ным концентратом, полученным из руды.
Для разделения коллективного концентрата необходимо десорби-
ровать собиратель с поверхности сульфидов, извлеченных в коллек-
тивный концентрат. От полноты осуществления десорбции во многом
зависит эффективность применения схемы коллективной флотации.
В Механобре А.С. Коневым и Л.Б. Дебривной предложен способ
десорбции собирателя сернистым натрием с последующей отмывкой
реагентов, находящихся в жидкой фазе пульпы, внедренный на ряде
фабрик. Степень отмывки реагентов, рассчитываемая как отношение
оставшегося количества реагентов в жидкой фазе пульпы к количеству
реагентов, имевшихся в пульпе после десорбции, составляет 1:3—1:10.
Из других методов десорбции собирателя с поверхности сульфидов
применяют сгущение и фильтрование коллективного концентрата;
десорбции) сернистым натрием и активированным углем без отмывки
реагентов, а также пропарку коллективного концентрата в щелочной
среде.
Коллективный концентрат, полученный при грубом измельчении
руды, перед разделением обычно доизмельчается до крупности 85—
90 % класса —0,074 мм. Если коллективная флотация проводилась
324
стадиально и отвальные хвосты выделялись при тонком измельчении,
то при разделении концентрата сначала извлекают свободные зерна
флотируемого минерала, затем хвосты разделительной флотации доиз-
мельчают для раскрытия сростков и снова ведут разделение. В неко-
торых случаях концентрат доизмедьчается в рудно-галечных мельни-
цах [44, 45].
В зависимости от вещественного состава, вкрапленности и флоти-
руемости основных компонентов концентрат разделяют по одной из
схем, показанных на рис. IV.9. Эти схемы аналогичны схемам селектив-
ной флотации полезных минералов непосредственно из руды. Так,
сначала флотируют галенит, а при наличии в руде сульфидов меди —
галенит совместно с сульфидами меди. В дальнейшем свинцово-медный
концентрат разделяют на свинцовый и медный. Из хвостов свинцовой
флотации последовательно флотируют сфалерит и пирит. Иногда прово-
дится цинково-пиритная флотация с последующим получением цинко-
вого и пиритного концентратов. Реагентные режимы, применяемые
при разделении коллективного концентрата и флотации минералов
из руды, также аналогичны и рассматриваются ниже.
Схемы включают флотацию в цикле измельчения или межцикловую
флотацию свинцовых и медных минералов при крупности 35-55 %
класса — 0,074 мм, основную и контрольную флотацию при крупности
измельчения 55—90 % класса —0,074 мм, доизмельчение чернового
концентрата и промпродуктов; флотацию промпродуктов в отдельном
цикле. Практикуется отмывка первичных шламов перед дроблением,
их сгущение и флотация в отдельном цикле с направлением концентрата
в свинцово-медную флотацию руды [44, 45] .
Если свинцовая или свинцово-медная флотация проводится из кол-
лективных концентратов, когда порода в основном отсутствует, а срост-
ки сульфидов преимущественно раскрыты, то схема включает основ-
ную и контрольную флотации и перечистки концентрата.
При наличии в руде талька, загрязняющего сульфидные концентра-
ты, его можно флотировать перед сульфидами в голове процесса одним
вспенивателем при небольшом расходе подавителей сульфидов.
Свинцовая или свинцово-медная флотация обычно осуществляется
в известковой или содовой среде при pH 7—10,5. Иногда pH создается
гидроксидом натрия. Для подавления сфалерита и пирита применяют
цианид, цинковый купорос, сульфит натрия, сочетания цианида с цин-
ковым купоросом и сульфитом натрия или сернистым газом. Реагенты
загружают в мельницу или подают с питанием флотации.
В качестве собирателя используют различные ксантогенаты (этило-
вый, изопропиловый, бутиловый и изобутиловый, амиловый и изо-
амиловый), аэрофлоты, сочетания низших и высших ксантогенатов,
аэрофлотов и ксантогенатов. Из вспенивателей применяют Т-80, цикло-
гексанол, МИБК, ТЭВ, Дауфрос 250.
На некоторых японских фабриках пульпа сначала перемешивается
325
Таблица IV.l
Методы разделения свинцово-медных концентратов1
Группа методов
Реагенты, обеспечивающие разделение
Бихроматные (подавление
галенита)
Цианидные (подавление
халькопирита)
Сульфоксидные (подавление
галенита)
Фосфатные (подавление
галенита)
Комбинированные (цианид-
но-бихроматный и бихромат-
но-цианидный)
Отделение галенита от халькопирита
Бихроматы калия и натрия
Бихромат натрия и силикат натрия в соотноше-
нии 1:1, активированный уголь
Цианиды натрия и калия
Цианид совместно с жидким стеклом
Цианид совместно с крахмалом
Цианид совместно с восстановителями (суль-
фитом и сульфидом натрия)
Цианид совместно с сульфатом цинка
Сернистая кислота (сернистый газ) и органи-
ческие соединения (крахмал, декстрин, гуа-
ров а смола) без подогрева и с подогревом
пульпы
Сернистая кислота (сернистый газ) и бихро-
мат (последовательная загрузка)
Сернистая кислота (сернистый газ), бихро-
мат, крахмал, pH 4,5-5
Сульфит натрия и цинковый купорос2
Сульфит натрия и железный купорос
Тиосульфат натрия и железный купорос
(или хлорное железо)
Серная кислота до pH 5 (при наличии сульфи-
дов железа) 3
Растворимые фосфаты — ортофосфорная
кислота, дигидрофосфаты натрия и кальция
Комбинация загрузок цианидов и бихроматов
Отделение галенита от борнита и халькозина
Цианистые (подавление
медных минералов)
Сода, цинковый купорос и цианид (цинк-
цианистый метод)
Реагент 675 Zn(CN)2 • I8NH3 фирмы ’Циа-
намид”
Цианид натрия, оксид цинка и сульфат аммо-
ния
Гексацианоферрат калия
Отделение галенита от халькопирита, ковеллина,
теннантита, тетраэдрита, борнита и халькозина
о
Пропарка острым паром при температуре 70 Св течение 10 мин при pH 5,5 без
загрузки реагентов (подавление галенита)4
1 По данным К.Г. Бакинова, Булатовича и Вислоужила, В. Вентера, Л.А. Гла-
зунова и И.С. Томовой.
326
с сернистым газом при pH 4 в течение 5 мин, затем такое же время —
при pH 5,5, создаваемом известью, при этом подавляются сфалерит
и пирит. Свинцово-медная флотация проводится с использованием
аэрофлота 208 (нейтрализованная содой смесь (1:1) диэтил-и вторично-
бутилдитиофосфорных кислот) и соснового масла.
На одной из фабрик для удаления пирита из чернового свинцового
концентрата последний перемешивается с известью при pH 9—9,5, затем
пульпа подкисляется сернокислым аммонием до pH 8,3—8,8 и прово-
дятся перечистки [45] .
Свинцово-медный концентрат разделяется различными методами
(табл. IV.1). В некоторых случаях перед разделением проводится де-
сорбция собирателя сернистым натрием или активированным углем,
либо их сочетанием без отмывки реагентов.
При разделении свинцово-медного концентрата, содержащего бор-
нит и халькозин, цинк-цианистым методом, разработанным Ю.И. Ероп-
киным (табл. IV.1), в операцию десорбции совместно с сернистым
натрием и активированным углем загружают соду. После перемешива-
ния подают цинковый купорос, а затем цианид. При обратном порядке
загрузки цианида и цинкового купороса разделение нарушается.
В качестве собирателя при свинцово-медном разделении независимо
от того, какие минералы флотируются, применяют этиловый и бутило-
вый ксантогенаты и аэрофлоты. Кроме того, при флотации медных ми-
нералов применяют реагенты Z-200 и аэрофлот 3501 (вторичный дибу-
тилдитиофосфат натрия или калия).
Свинцовый и медный концентраты в некоторых случаях загрязне-
ны сфалеритом. Обесцинкование свинцовых концентратов осуществляет-
ся подавлением галенита известью, загружаемой до pH И—12, и флота-
цией сфалерита после активации медным купоросом с использованием
ксантогенатов и пенообразователя. Для более активной флотации сфа-
лерита пульпа иногда подогревается до 38—43 °C [45] .
На одной из фабрик обесцинкование медного концентрата проводит-
ся в две стадии. Сначала после перемешивания концентрата с сернистым
газом и цинковым купоросом частично флотируют медные минералы
при pH 11,5—11,8. Хвосты сгущаются, пропариваются при температуре
50 °C в присутствии медного купороса и перефлотируются с получением
цинкового пенного продукта и камерного медного, последний объеди-
няется с медным концентратом I стадии флотации.
Из хвостов свинцовой или свинцово-медной флотации проводится
цинковая или цинково-пиритная флотация. При необходимости перед
2 Метод предложен для разделения тетраэдрита и галенита.
3 Метод дает положительный результат в тех случаях, когда при pH 5 в жид-
кую фазу пульпы переходит достаточное количество железа и сульфоксидных
ионов.
4 Свинцово-медная флотация проводится в слабокислой среде при pH 5,5 с
использованием аэрофлота 208 в качестве собирателя.
327
цинковой флотацией руда доизмельчается. В некоторых случаях цинко-
вой флотации предшествует сгущение.
Схемы цинкового цикла включают основную и контрольную флота-
ции, две—четыре перечистки концентрата, доизмельчение чернового
концентрата и промпродукта, промпродуктовую флотацию [44, 45] .
При выделении цинкового концентрата из коллективного в схеме
предусмотрены основная, контрольная флотация и перечистки.
Перед цинковой флотацией обычно проводится кондиционирование
с известью, загружаемой до pH 9—12, и медным купоросом. Для уси-
ления подавления пирита применяется аэрация, а для интенсификации
флотации сфалерита - подогрев пульпы до 30—40 °C.
В качестве собирателя используют различные ксантогенаты (этило-
вый, изопропиловый, бутиловый, амиловый), реагент Z-200, сочетания
низших и высших ксантогенатов и ксантогенатов и аэрофлотов. Из пено-
образователей используют Т-80, МИБК, Дауфрос 250. Для подавления
сульфидов железа при перечистке иногда добавляется цианид [44, 45] .
При малом содержании пирита в руде сфалерит флотируют после
активации медным купоросом, ксантогенатами или реагентом Z-200
без применения извести. При перечистке концентрата используют цин-
ковый купорос, цианид и бихромат натрия для подавления пирита и
галенита [45].
При необходимости проводится пиритная флотация из хвостов
цинкового цикла. Ее реагентный режим такой же, как при обогащении
медных и медно-цинковых руд.
Как указывалось выше, в некоторых случаях осуществляется сов-
местная флотация сфалерита и пирита с последующим разделением
цинково-пиритного концентрата. Такая схема оказывается целесообраз-
ной, когда сростки сфалерита и пирита можно отделить от минералов
породы при той же крупности измельчения при которой велась свинцо-
во-медная флотация, а разделение сфалерита и пирита требует более
тонкого измельчения. Кроме того, по такой схеме активация сфалерита
медным купоросом осуществляется без извести при pH 6—8, когда
этот процесс идет весьма эффективно. В результате скорость флотации
сфалерита возрастает и сокращается необходимый фронт флотации.
Однако последующее разделение сфалерита и пирита затрудняется,
что является недостатком этой схемы. Селекция проводится при pH
11-12,5, создаваемом известью. Иногда дополнительно подается мед-
ный купорос [45] .
На ряде фабрик проводится доводка цинкового концентрата удале-
нием из него галенита, медных минералов и пирита. Обессвинцевание
осуществляется флотацией галенита и депрессией сфалерита цианидом
или цианидом и цинковым купоросом. Флотация галенита проводится
цианидом или цианидом при pH 8—9,5, иногда с добавками извести или
сернистого натрия. Перед флотацией для десорбции собирателя пульпу
фильтруют и разбавляют свежей водой. Обезмеживание иобезжелез-
328
некие цинкового концентрата ведут по способу, разработанному
Л.Б. Де брив ной.
На одной канадской фабрике для удаления пирита цинковый кон-
центрат перемешивается с сернистым газом (pH 5—5,2), а затем пульпа
подогревается до 80 °C и пирит флотируется этиловым ксантогенатом.
Гак как в пиритный продукт переходят сростки пирита со сфалеритом,
то пиритный продукт сгущается, доизмельчается и в известковой среде
(pH 10,8—11,2) проводится дофлотация сфалерита. Полученный цинко-
вый продукт направляется на перечистку в цинковый цикл.
Выше были рассмотрены коллективная, коллективно-селективная
и прямая селективная (при отсутствии медных минералов) схемы
обогащения полиметаллических руд. Кроме этих схем в некоторых слу-
чаях применяется также схема прямой селективной флотации руд,
содержащих сульфиды меди.
На одной канадской фабрике из руды, измельченной до крупности
70—75 % класса —0,044 мм, сначала выделяется медный концентрат.
Подавление сульфидов свинца, цинка и железа достигается с помощью
сернистого газа и аэрации пульпы в специальных кондиционерах. Мед-
ная флотация проводится с использованием изобутилового ксантогена-
та и пенообразователя Дауфрос 250. В I перечистке медного концентрата
используется известь.
Из хвостов медной флотации после перемешивания с содой аэроф-
лотом 208 и МИБК выделяют свинцовый концентрат, а из хвостов
свинцовой флотации — цинковый концентрат.
20.6. Окисленные свинцовые и цинковые руды
Основные окисленные минералы свинца — церуссит РЬСО3, англе-
зит PbS04, пироморфит РЬ5 [РО4]3С1, крокоит РЬСгО4, миметезит
Pb5 [AsO4] 3С1, вульфенит РЬМоО4, ванадинит Pb5[VO4]3Cl, плюм-
боярозит PbFe6 [SO4] 4(ОН)12 • Основные окисленные минералы цин-
ка — смитсонит ZnCO3, каламин Zn4 [Si2O7](ОН)2 • Н2О, гидроцин-
кит Zns [СО3]2(ОН)6.
В смешанных и окисленных свинцово-цинковых рудах содержатся
также галенит и сфалерит. Другие рудные минералы представлены
сульфидами и оксидами меди, карбонатами, оксидами и гидроксидами
железа и марганца, баритом. Из нерудных минералов в смешанных
и окисленных свинцово-цинковых рудах присутствуют кварц, силикаты,
кальцит, доломит.
Окисленные свинцовые минералы флотируются сульфгидрильными
собирателями после предварительной сульфидизации сернистым или
гидросернистым натрием.
В отличие от малахита для успешной флотации церуссита желательна
глубокая сульфидизация, необходимая для создания на его поверхнос-
ти сульфидной пленки определенной толщины, при этом отслаивания
пленки не наблюдается [21, 33] . Такая пленка образуется при довольно
329
больших расходах сернистого натрия (200—300 г/т и выше) . По данным
Г.И. Шоршера и С.И. Горловского, дальнейшее увеличение расхода
сульфидизатора приводит (вследствие снижения скорости диффузии
сульфидных ионов через пленку) к возрастанию концентрации сульфид-
ных ионов в пульпе и подавлению церуссита.
Сульфидизация проводится при обычной температуре в контакт-
ных чанах или непосредственно во флотационных машинах, иногда
требуется длительное время перемешивания с сульфидизатором. В не-
которых случаях сульфидизатор загружается в мельницы.
Из окисленных свинцовых минералов лучшей флотируемостью
обладает церуссит; англезит и вульфенит флотируются хуже; осталь-
ные минералы извлечь еще труднее, хотя при флотации руды, содер-
жащей миметезит, НИ. Кудряковой и В.И. Копатиловым были получе-
ны достаточно высокие результаты. Плюмбоярозит — самый трудно-
флотируемый окисленный минерал свинца, проблема его селективной
флотации в настоящее время не решена.
Результаты обогащения окисленных и смешанных свинцовых руд
в большой степени зависят не только от состава окисленных свинцо-
вых минералов, но и от вещественного состава руды. Легче всего обо-
гащаются руды, в которых порода представлена силикатными минера-
лами, хуже — руды с карбонатной породой (доломитизированными
известняками), наибольшую трудность представляет обогащение руд,
содержащих значительное количество гидроксидов железа, с которы-
ми связана основная часть свинца. Поэтому, если возможно, применяет-
ся предварительное гравитационное обогащение в тяжелых суспензиях,
отсадкой и винтовых сепараторах, позволяющее выделить часть породы
в отвальные хвосты перед флотацией [45] .
При обогащении смешанных и окисленных свинцовых руд совмест-
но с сернистым натрием обычно используется жидкое стекло, диспер-
гирующее шламы и подавляющее флотацию минералов породы. Пред-
полагается, что сернистый натрий при загрузке в пульпу сначала выпол-
няет роль диспергатора, а затем — сульфидизатора. Поэтому жидкое
стекло частично заменяет сернистый натрий.
Применяется флотация окисленных минералов свинца совместно
с галенитом и после извлечения галенита. Последующие сульфидиза-
ция и окисленная флотация позволяют избежать подавляющего дейст-
вия сернистого натрия на галенит.
При неравномерной вкрапленности минералов проводится совмест-
ная стадиальная флотация. Сульфидизатор загружается в каждую стадию
флотации. В некоторых случаях удается выделить отвальные хвосты
при измельчении 95—100 % класса —0,074 мм [44, 45] .
В качестве собирателя окисленных минералов свинца используют
различные ксантогенаты (этиловый, бутиловый амиловый), аэрофлоты
и их сочетания. Из пенообразователей применяют Т-80, Дауфрос 250,
МИБК. Пирит подавляется цианидом и известью.
330
При наличии в рудах сфалерита применяют следующие схемы:
1) коллективная флотация галенита и окисленных свинцовых минера-
лов при депрессии сфалерита цинковым купоросом, цианидом и сернис-
тым натрием, а затем флотация сфалерита после активации медным
купоросом; 2) прямая селективная флотация с последовательным вы-
делением галенита, окисленных свинцовых минералов и сфалерита;
3) прямая селективная флотация галенита, сфалерита, при необходимос-
ти — пирита, окисленных свинцовых минералов [33, 44] .
В некоторых рудах наряду с окисленными минералами свинца со-
держатся окисленные медные минералы. В Механобре Г.И. Шоршером
для обогащения окисленных руд одного из месторождений, основными
рудными минералами которого являются церуссит и малахит, разра-
ботана гравитационно-флотационная схема. Порода представлена квар-
цем, глинистыми минералами, карбонатами.
Флотация церуссита проводится после предварительного выделения
крупнозернистого церуссита отсадкой и отмывки глинистых минералов.
Сульфидизация осуществляется сернистым натрием. Малахит депрес-
сируется жидким стеклом, вводимым перед сульфидизацией.
В качестве собирателя церуссита используется этиловый ксантоге-
нат. Хвосты свинцовой флотации обесшламливаются, и затем в три
приема проводится медная флотация с подачей перед каждым приемом
сернистого натрия и собирателя - изоамилового ксантогената. В ка-
честве пенообразователя в обоих циклах применяется сосновое масло.
Окисленные цинковые минералы флотируют после извлечения
сульфидов и окисленных свинцовых минералов.
Для флотации окисленных цинковых минералов разработаны два
метода — Р. Дэвиса — А.И. Андреевой и М. Рея [5, 45] .
По первому методу окисленные цинковые минералы сульфидизи-
руются при температуре 40—60 °C в течение 20—25 мин, активируются
медным купоросом и флотируются сульфгидрильными собирателями.
На одной из фабрик флотация осуществлялась амиловым ксантогенатом
при pH 7-7,5.
По второму методу окисленные минералы цинка флотируются
высшими первичными алифатическими аминами, содержащими 12—
18 атомов углерода, после предварительной сульфидизации при обычной
температуре. При флотации вредное влияние оказывают шламы и гли-
нистые минералы, поглощающие амин. Поэтому перед флотацией пульпу
обесшламливают. В некоторых случаях перед сульфидизацией пульпа
перемешивается с содой и жидким стеклом. Загрузка сульфидизатора
и собирателя может быть дробной или единовременной. Флотация про-
водится при pH 10—11,5, расход амина составляет 80—170 г/т. В ка-
честве пенообразователя используется сосновое масло.
20.7. Золотосодержащие руды
Самородное золото в рудах ассоциирует со многими минералами,
чаще всего с кварцем и сульфидами, особенно пиритом и арсенопиритом.
По данным В.И. Зеленова, крупное золото (+70 мкм) обычно находится
в свободном виде и легко улавливается гравитационными аппаратами,
установленными в цикле измельчения. Мелкое золото (—70 + 1 мкм)
частично находится в сростках с минералами и хуже обогащается гра-
витацией. Оно, так же как и тонкодисперсное золото (— 1 мкм), в ос-
новном заключенное в минералах, лучше извлекается цианированием
и флотацией.
При обогащении золотых руд основная задача флотации заключает-
ся в получении отвальных хвостов и концентрировании золота в ма-
териале, перерабатываемом в дальнейшем металлургическими методами.
Флотация золота основана на способности его сорбировать сульф-
гидрильные собиратели. Флотация проводится при pH 7—9 различными
ксантогенатами, аэрофлотами или их сочетаниями. При этом также
флотируются золотосодержащие сульфиды. Щелочная среда часто соз-
дается содой, дозируемой в измельчение. При обогащении пиритных и
арсенопиритных золотосодержащих руд в качестве активатора сульфи-
дов применяется медный купорос.
В некоторых случаях цианированию подвергается исходная руда,
а флотация применяется для извлечения золотосодержащих сульфидов
и теллуридов золота из хвостов цианирования.
При обогащении медных и полиметаллических золотосодержащих
руд крупное золото улавливается в циклах измельчения гравитацион-
ными методами, а мелкое и тонкодисперсное золото стремятся мак-
симально извлечь в свинцовые и медные концентраты, из которых
при металлургическом переделе оно хорошо извлекается. Так как
цианиды растворяют золото, рекомендуется применять бесцианидные
методы флотации.
20.8. Вольфрамовые руды
Основные минералы вольфрамовых руд - минералы группы шее-
лита и вольфрамита. К первым относится шеелит CaWO4 и молибдо-
шеелит Ca(W, Мо)О4. Минералы группы вольфрамита представляют
собой изоморфный ряд вольфраматов железа и марганца от ферберита
FeW04 до гюбнерита MnW04.
Шеелитовые руды обогащаются в основном флотацией. При этом
наиболее трудная задача — отделение шеелита от других кальцийсодер-
жащих минералов (кальцита, флюорита, апатита, волластонита). Мине-
ралы группы шеелита хорошо флотируются жирно-кислотными соби-
рателями, например олеиновой кислотой, жирно-кислотной фракцией
таллового масла и их мылами.
332
Флотация шеелитовых руд осуществляется в две стадии: сначала
получают черновой концентрат, а затем доводят его до кондиционного.
При наличии сульфидов шеелитовая флотация проводится из хвостов
сульфидной флотации. Для подавления силикатов перед собирателем
подается жидкое стекло, pH флотации 9—10 и создается содой. В черно-
вой концентрат вместе с шеелитом переходят и другие кальцийсодер-
жащие минералы. Доводка чернового концентрата осуществляется по
методу Петрова.
Черновой концентрат сгущают до 50—60 % твердого и пропаривают
в 2,5—4 %-ном растворе жидкого стекла при температуре 80—90 °C
в течение 50—60 мин. Далее продукт разбавляют свежей водой, снижая
температуру пульпы до 20—35 °C и содержания твердого до 25—30 %,
перечищают несколько раз без реагентов. При этом основная масса
кальцита и флотоактивных силикатов депрессируется, а шеелит и мо-
либдошеелит на 90—95 % переходят в пенный продукт, содержащий
40—45 % триоксида вольфрама и пригодный для гидрометаллургичес-
кой переработки. Для повышения качества концентрата до содержания
50—65 % триоксида вольфрама его вторично пропаривают и дважды-
трижды перечищают. В операциях доводки флюорит и апатит депресси-
руются недостаточно эффективно. При значительном содержании апати-
та шеелитовые концентраты обрабатывают соляной кислотой [44, 45] .
В последние годы для переработки шеелитовых руд была разрабо-
тана комбинированная флотационно-гидрометаллургическая техноло-
гия, включающая получение чернового концентрата флотацией и со-
довое выщелачивание шеелита из чернового концентрата в автоклавах
(см. рис. IV.10). По сравнению с флотационной технологией комбини-
рованная позволяет существенно повысить извлечение триоксида вольф-
рама.
Для руды одного из отечественных месторождений, содержащей
наряду с шеелитом небольшое количество вольфрамита, в Механобре
разработана технология с использованием в качестве собирателя эмуль-
сии раствора жирно-кислотного собирателя и ИМ-50 в керосине. Фло-
тация проводится в содовой среде с жидким стеклом. Предусмотрена
как гидрометаллургическая переработка чернового флотационного
концентрата, так и комбинация доводки чернового концентрата по
методу Петрова с гидрометаллургией.
На зарубежных флотационных фабриках, перерабатывающих шее-
литовые руды, наряду с жирно-кислотными собирателями применяют
сочетание нафтеновых и жирных кислот. Полученные черновые кон-
центраты во многих случаях поступают на гидрометаллургическую
переработку.
Вольфрамитовые руды обогащаются в основном гравитационными
методами, однако имеются случаи переработки вольфрамитовых руд
флотацией. В качестве примера можно привести введенную в эксплуа-
тацию в 1982 г. фабрику ’’Маунт Плезант” (Канада). Хвосты сульфидной
333
флотации обесшламливают по классу 10 мкм и кондиционируют с
кремнефтористоводородной кислотой, а затем с собирателем — фос-
форорганической кислотой. Флотационный концентрат подвергают
сернокислотному выщелачиванию и магнитной сепарации.
Флотацию применяют также в отдельных случаях для извлечения
частиц крупностью —74 мкм из шламов гравитации.
На одной из отечественных фабрик внедрена следующая разработан-
ная И.Н. Плаксиным и Г.А. Мясниковой технология обогащения гра-
витационных шламов, содержащих сульфиды, кварц, полевой шпат,
серицит, флюорит, эпидот-цоизит, апатит и вольфрамовые минералы —
гюбнерит и шеелит в отношении 3:1. После флотации сульфидов про-
водится флотация с использованием жирно-кислотного собирателя
вольфрамовых минералов при pH 10, создаваемо^ содой. Пенный про-
дукт перечищается без добавок реагентов и поступает на концентра-
ционные столы. Концентрат столов, содержащий до 45 % триоксида
вольфрама, является товарным продуктом.
Предложена также флотационно-гравитационная доводка чернового
концентрата. Она включает три пропарки с кремнефтористым натрием
с последующими перечистками, четвертую пропарку с жидким стеклом
для подавления вольфрамовых минералов и доф дотацию сульфидов,
обогащение промпродуктов на концентрационных столах. В резуль-
тате из шламов, содержащих 0,45—0,65 % триоксида вольфрама, полу-
чают промпродукт с содержанием 17—20 % при извлечении 51—57 %.
В Механобре Т.Е. Колтуновой разработана технология обогащения
вольфрамсодержащих гравитационных шламов с применением реагента
ИМ-50. При наличии в шламах значительных количеств флюорита и
эпидота-цоизита основная флотация проводится с ИМ-50 в нейтральной
или слабокислой среде, а при наличии силикатной породы и гидрокси-
дов железа — при pH 8—10. Кремнефтористый натрий и ОП-Ю в ряде
случаев позволяют заметно повысить качество черновых концентратов.
Для уменьшения пенообразования применяются высшие спирты.
Черновые концентраты доводятся перефлотацией при pH 1,3—1,5, созда-
ваемом серной кислотой, с загрузками ИМ-50. Из шламов, содержащих
0,17 и 0,43 % триоксида вольфрама, получены промпродукты с содер-
жанием триоксида вольфрама 30—50 % при извлечении 65—74 %.
Весьма перспективна флотационно-гравитационная схема обогаще-
ния вольфрамсодержащих шламов флотацией с ИМ-50 или с эмульсией
раствора жирно-кислотного собирателя и ИМ-50 в керосине с получе-
нием бедных отвальных хвостов и доводкой чернового концентрата,
а также обогащением промпродуктов на концентрационных столах.
На китайских фабриках для флотационного извлечения вольфрами-
та из шламов гравитации применяются следующие схемы. При обо-
гащении простых по минеральному составу руд вольфрамит флотируют
после удаления сульфидов в слабощелочной или нейтральной среде с
использованием в качестве собирателя олеиновой, толиларсоновой
или бензоэтиленфосфоновой кислот. Возможно применение сочетаний
334
указанных кислот. Из модификаторов используют жидкое стекло,
кремнефтористый натрий, азотнокислый свинец.
При обогащении более сложных руд сначала жирно-кислотным
собирателем в содовой среде с жидким стеклом флотируют сульфи-
ды и вольфрамит. Затем из коллективного концентрата ксантогенатом
в кислой среде извлекают сульфиды, подавляют вольфрамит жидким стею
лом и кремнефтористым натрием: Вольфрамит флотируют из хвостов
сульфидной флотации сочетанием олеиновой и толиларсоновой кис-
лот в керосине.
Из весьма труднообогатимых руд флотацию вольфрамита ведут
после удаления сульфидов при pH 2—4 сочетанием олеиновой и толи-
ларсоновой кислот в керосине, модификатор — кремнефтористый
натрий.
20.9. Оловянные руды
Главные оловянные минералы в оловянных рудах — касситерит
SnO2 и в меньшей степени станнин Cu2FeSnS4. Оловянные руды обога-
щают в основном гравитационными методами. Однако вследствие тон-
кой вкрапленности касситерита в руде и его склонности к ошламова-
нию значительная часть касситерита переходит в шламы гравитации,
для обогащения которых в последние годы все чаще используют
флотацию.
Обычно перед флотацией касситерита шламы сгущают, из них уда-
ляют частицы тоньше 10—15 мкм и проводят сульфидную флотацию.
При обогащении шламов простого минерального состава, в которых
порода состоит преимущественно из кварца, флотация касситерита
может осуществляться жирно-кислотными собирателями или Аспара-
лом-Ф (производной аспарагиновой кислоты). Так, на одной из отечест-
венных фабрик при извлечении касситерита из кварц-хлоритовых шла-
мов в качестве собирателя используется Аспарал-Ф. Основная флота-
ция проводится при pH 5, перечистки при pH 4,2—4,7, среда создается
серной кислотой. Технология разработана С.Ф. Лаптевым в ЦНИИолово.
Для обогащения шламов сложного состава со значительным содер-
жанием турмалина и гидроксидов железа в Механобре разработана
технология, основанная на применении реагента ИМ-50. Технология
включает основную и контрольную касситеритовую флотации с реаген-
том ИМ-50 при pH 5,5, две перечистки концентрата при pH 3,5 и довод-
ку концентрата на концентрационном столе. Среда создается серной
кислотой. Подавление турмалина и гидроксидов железа усиливается
подачей в основную флотацию и перечистки щавелевой кислоты. Для
уменьшения пенообразования, вызываемого образующимися в кислой
среде гидроксаматами железа, возможно применение высших спиртов
или эмульсии растворов ИМ-50 в углеводородах.
В нашей стране для флотации касситерита предложен собиратель
флотол-7,9 (смесь 1-оксиалкилиден-1,1-дифосфоновых кислот). Фло-
335
тация флотолом-7,9 проводится при pH 5,5 после тщательного уда-
ления частиц тоньше 10—15 мкм и при подогреве пульпы до 30 °C.
В качестве модификатора используется кремнефтористый или фторис-
тый натрий.
За рубежом для флотации касситерита применяют производные
сульфо янтарной (сульфосукцинаты), арсоновой и фосфоновой кислот.
Флотация касситерита паратолиларсоновой кислотой (РТАА) про-
водится при pH 5, создаваемом серной кислотой. Для депрессии со-
путствующих минералов в пульпу подают жидкое стекло и фтористый
натрий.
Флотация касситерита сульфосукцинатами проводится при pH 2,3—3.
Черновой концентрат перечищается при pH 1,5—2. В некоторых случаях
для связывания ионов железа добавляется лимонная кислота, а для
подавления железосодержащих минералов — кремнефтористый натрий.
Перспективный собиратель касситерита — стиролфосфоновая кис-
лота (СФК), предложенная в ГДР. Флотация СФК проводится при pH
5,5—6 с использованием в качестве модификатора кремнефтористого
натрия.
По данным Д. Булу, на фабрике Руйберг (ЮАР) РТАА была заменена
СФК. Расход собирателя составляет 0,35 кг/т. В качестве депрессора
породы и диспергатора используется жидкое стекло (0,4 кг/т). Флота-
ция ведется при pH 5. Из шламов, имеющих крупность —44 + 6 мкм
и содержащих 0,78 % олова, в концентрат с содержанием 20 % извлекает-
ся 70 % металла.
20.10. Титановые руды
Основные титановые минералы — рутил ТЮг, ильменит FeTiO3,
ильменорутил Fe^Tij „ 3x(Nb, Та)2хО$, сфен CaTi[SiO4]O и перовскит
CaTiO3, в состав которого входят также редкоземельные элементы,
замещающие кальций, тантал и ниобий, замещающие титан.
В промышленности флотация в основном применяется для извле-
чения тонковкрапленного ильменита из магнетитоильменитовых руд.
Предварительно из руды магнитной сепарацией выделяют магнетит.
Питание ильменитовой флотации сгущается и при наличии сульфидов
проводится их флотация. Ильменит флотируется жирно-кислотными
собирателями (например, талловым маслом, растворенным в керосине)
при pH 6,2—6,8, создаваемом серной кислотой. Перечистки проводятся
при pH 4,8—6. При наличии в руде граната и апатита для их подавления
используется фтористый натрий [45] .
В настоящее время флотация сфена совместно с апатитом, эгирином
осуществляется при обогащении апатито-нефелиновых руд из хвостов
апатитовой флотации для получения нефелинового концентрата (см.
разд. 19).
Рутил может быть сфлотирован жирно-кислотными собирателями
при pH 6-8. Если в руде присутствуют ильменит и циркон, то они так-
336
же переходят в концентрат в этих условиях. Выделение ильменита из
коллективного концентрата проводится магнитной сепарацией. Немаг-
нитный продукт обрабатывают кремнефтористым натрием для деп-
рессии циркона и флотируют жирно-кислотным собирателем в слабо-
кислой среде.
По другому способу рутил и ильменит депрессируют жидким стеклом
в содовой среде, а циркон флотируют жирно-кислотным собирателем.
Затем из хвостов цирконовой флотации извлекают рутил в нейтраль-
ной среде, создаваемой добавками серной кислоты [45] .
Для обогащения руды крупного месторождения, содержащей 15-
28 % перовскита, 2—10 % кальцита, 50—60 % ожелезненных силикатов
и -несколько процентов титано-магнетита, Т.Б. Найфоновым с’сотруд-
никами предложена и проверена в промышленном масштабе магнитно-
флотационная схема, в которой предусмотрены магнитная сепарация
в слабом поле для выделения титаномагнетита, обесшламливание по
классу 30 мкм, флотация перовскита реагентом ИМ-50 при pH 7-8
и несколько перечисток пенного продукта при pH 5,5—6,5, создаваемом
серной кислотой. В последнюю перечистку рекомендуется загружать
КМЦ для лучшей депрессии силикатов. При этом могут быть получены
концентраты, содержащие 48 % диоксида титана, с извлечением от исход-
ной руды свыше 60 %.
С.И. Горловским и И.Д. Устиновым предложена схема флотации
перовскитовых руд с использованием только одного собирателя -
реагента ИМ-50. Сначала щелочной формой реагента ИМ-50 (расход
40—50 г/т) при pH 12 флотируется кальцит. Камерный продукт каль-
цитовой флотации после сгущения направляется на перовскитовую
флотацию с использованием в качестве собирателя эмульсии раствора
реагента ИМ-50 в керосине. Указанная схема позволяет организовать
оборотное водоснабжение и снизить удельные расходы ИМ-50.
20.11. Тантало-ниобиевые руды
Основные тантало-ниобиевые минералы — колумбит (Fe, Мп) (Nb,
Та)2О6, танталит (Мп, Fe) (Та, Nb)2O6, пирохлор NaCaNb2O6F, микро-
лит NaCaTa2O6(O, ОН, F), лопарит (Na, Се, Ca)(Nb Т1)Оз, эвксенит
Y(Nb,Ta, Ti)2(O, ОН)б.
Пары минералов колумбит — танталит и пирохлор — микролит
являются крайними представителями двух изоморфных рядов, в кото-
рых от одного конца ряда к другому содержание ниобия уменьшается,
а содержание тантала увеличивается.
Основные источники получения тантала и ниобия — танталит-микро-
литовые, пегматитовые и карбонатитовые пирохлоровые, лопаритовые
и эвксенитовые руды.
Тантало-ниобиевые руды, за исключением карбонатитовых пиро-
хлоровых, обогащают в основном гравитационными методами. Флота-
цию используют в комбинированных схемах доводки гравитационных
337
22-6926
концентратов. Кроме того, флотация предложена для доизвлечения
тантала и ниобия из шламов и хвостов гравитационного обогащения.
При переработке карбонатитовых пирохлоровых руд флотация являет-
ся главным процессом обогащения.
На одной из отечественных фабрик, перерабатывающих тантало-
ниобиевые руды, для доводки чернового гравитационного концентрата,
содержащего колумбит — танталит, пирохлор — микролит, сульфиды,
ильменит, оксиды железа, силикаты и алюмосиликаты, С.И. Горловским
и Н.П. Хоботовой внедрена простая технология, основанная на примене-
нии реагента ИМ-50. По этой технологии после флотации сульфидов
и удаления магнитных минералов магнитной сепарацией проводится
флотация тантало-ниобиевых минералов ИМ-50 при pH 1—1,5, создавае-
мом соляной кислотой. По сравнению со старой, весьма сложной тех-
нологией, основанной на подавлении тантало-ниобиевых минералов
за счет длительной кислотной обработки при температуре 80—90 °C
и флотации силикатов и алюмосиликатов, новая технология, кроме
резкого упрощения схемы, позволила также на 6 % повысить извле-
чения тантала.
Для обогащения тонковкрапленных пегматитовых пирохлоровых
руд и хвостов их гравитационного обогащения С.И. Горловским и
Н.П. Хоботовой предложена технология, включающая сульфидно-каль-
цитовую флотацию с использованием ксантогената и жирно-кислотного
собирателя при депрессии ниобийсодержащих минералов жидким стек-
лом, обесшламливание хвостов, флотацию пирохлора, ильменорутила
и других ниобийсодержащих минералов реагентов ИМ-50 в присутствии
жидкого стекла при pH 5,5—6,5 (после ИМ-50 загружается серная или
соляная кислота до pH 4,2—4,7, а затем сода — до pH 5,5—6,5) ; перечист-
ки чернового ниобиевого концентрата при pH 1,8—2, создаваемом серной
или соляной кислотами.
По данным Р. Бурта, на одной из канадских фабрик внедрена флота-
ционно-гравитационная технология извлечения танталовых минералов
вуджинита MgTa2O6, симпсонита А14Та3О13ОН и микролита из шламов
гравитации. Исходные шламы последовательно обесшламливаются в
гидроциклонах Кребса диаметром 150 мм и Мозли диаметром 50 мм
по классу 5 мкм и затем обезвоживаются в сгустителе Ламелла. Со-
держание оксида тантала (V) в питании флотации составляет 0,1 %.
Основная флотация проводится с собирателем сульфосукцинатно-
го типа Прокол СА540 (0,4—0,5 кг/т) при pH 2,4—2,6, создаваемом
серной кислотой. В качестве модификатора используется лимонная
кислота (0,1 кг/т). Черновой флотационный концентрат поступает на
стол Холмана для выделения крупных частиц танталовых минералов.
Концентрат стола перечищается в концентраторе Бартлес—Кросбелт,
где получают концентрат с содержанием оксида тантала (V) 26 % при
извлечении от питания флотации 54 %. Хвосты стола Холмана дважды
перечищаются при pH 1,5—1,9 с кремнефтористым натрием. Флотацион-
338
ный концентрат поступает на доводку в концентратор Бартлес — Крос-
белт, где получают концентрат с содержанием оксида тантала (V) 34 %
при извлечении 14 %. Суммарный концентрат содержит 27 % оксида
тантала (V) при извлечении 68 % питания флотации.
Для извлечения лопарита из хвостов гравитационного обогащения
лопаритовых руд наиболее перспективна магнитофлотационная техно-
логия. По технологии, предложенной в Гиредмете, магнитной сепарацией
в слабом и сильном полях выделяют магнитный продукт, в который
в основном переходят лопарит, эгирин и отвальные хвосты. Лопарит
и эгирит затем разделяют с использованием в качестве собирателя лопа-
рита стиролфосфоновой кислоты. Депрессором эгирина является
кремнефтористый натрий.
По технологии, разработанной в Механобре, сначала высокогра-
диентной сепарацией в магнитный продукт выделяют эгирин. Из немаг-
нитной фракции жирно-кислотным собирателем флотируют апатит,
а из хвостов апатитовой флотации с использованием реагента ИМ-50
и кислого жидкого стекла получают лопаритовый концентрат. Обе тех-
нологии проходят опытно-промышленную проверку.
При обогащении карбонатитовых пирохлоровых руд на зарубеж-
ных фабриках применяют схемы, в которых флотация является основ-
ным процессом. Схемы основаны на прямой флотации пирохлора либо
на предварительном флотационном выделении карбонатной породы
и последующей флотации пирохлора.
По первой схеме на одной из канадских фабрик руда, измельченная
до крупности —0,35 мм, тщательно обесшламливается и после суль-
фидной флотации и удаления магнитных минералов магнитной сепара-
цией поступает на пирохлоровую флотацию. В качестве собирателя
используются амины. В пенный продукт переходят пирохлор, силикаты
и апатит, а в камерном — остается кальцит. Перечистки чернового кон-
центрата проводятся с использованием плавиковой кислоты, подавляю-
щей флотацию силикатов.
Для удаления слюды из пирохлорового концентрата его перечищают
на столах, а для удаления сульфидов, апатита и силикатов сначала про-
водится сульфидная флотация при депрессии пирохлора жидким стек-
лом, затем — промывка серной кислотой на столах и повторная фло-
тация сульфидов и силикатов.
На новой бразильской фабрике ’’Аракса” перерабатывается руда,
где основным полезным минералом является барийсодержащий пиро-
хлор-пандаит. Из рудных минералов присутствуют также магнетит,
лимонит, ильменит и монацит. Минералы породы представлены в основ-
ном баритом, кварцем и горцекситом. Руда измельчается до крупности
45 % класса —37 мкм, затем подвергается магнитной сепарации для
удаления магнетита, тщательно обесшламливается по 5 мкм и делится
на пески и шламы, которые флотируются раздельно. В качестве соби-
рателя используется амин, в качестве активатора пирохлора — крем-
нефтористый натрий. Применяется также подавитель породы.
339
Пульпа перед флотацией перемешивается с реагентами в течение
15 мин. Флотация проводится при pH 2,5—3,5, создаваемом соляной
кислотой. Черновой концентрат песковой флотации сгущается до 25 %
твердого, кондиционируется с собирателем и активатором и четыреж-
ды перечищается. Черновой концентрат шламовой флотации подвергает-
ся двукратной перечистке. Суммарный концентрат, содержащий 55—
60 % оксида ниобия (V), поступает на гидрометаллургическую обра-
ботку для удаления фосфора, серы и свинца.
По второй схеме руда, измельченная до —0,2 мм, обесшламливает-
ся по классу 10 мкм и поступает на карбонатную флотацию. Флотация
проводится в слабощелочной среде эмульсией катионного реагента с
поверхностно-активным веществом с использованием щавелевой кисло-
ты в качестве подавителя пирохлора, при этом пески и шламы флоти-
руются раздельно. В пенный продукт переходит 35 % карбонатной по-
роды. Камерный продукт карбонатной флотации после обесшламли-
вания и удаления магнитных минералов магнитной сепарацией посту-
пает на пирохлоровую флотацию.
По данным Р. Бисса, в качестве собирателя используется ацетат
М-таллеил-1,2-пропандиамина. Величина pH пульпы составляет в основ-
ной флотации 6—6,4, в I перечистке — 5,5—5,8, во II — 5—5,2, в III —
4,3—4,5, в IV — 3,7—3,9, в V — 3,3—3,5, в VI — 2,9—3,1 и создается в
V и VI перечистках щавелевой кислотой, а в остальных операциях —
кремнеф тористов о дородной.
Постепенное понижение pH позволяет последовательно выделять
в хвосты операций различные минералы: карбонаты и небольшую долю
биотита в основной флотации, карбонаты, биотит и апатит в I перечистке,
карбонаты, биотит, апатит, калиевый полевой шпат, пирит и гематит во
II перечистке, карбонаты, биотит, калиевый и натриевый полевые шпаты,
биотит и гематит в III перечистке, натриевый и калиевый полевые шпаты,
биотит и гематит в IV перечистке, натриевый и калиевый полевые шпаты,
гарматит и пирит в V и VI перечистках. Точный автоматический контроль
pH в сочетании с применением крахмала и жидкого стекла позволяет
повысить содержание оксида ниобия (V) с 1 до 37 % при извлечении
86 % питания пирохлоровой флотации. Из пирохлорового концентрата
флотацией удаляют сульфиды, а выщелачиванием соляной кислотой —
фосфор.
20.12. Редкоземельные руды
Основные редкоземельные (РЗ) минералы - монацит (Се, La)PO4,
бастнезит (Се, La)CO3F,ксенотим УРО4, лопарит (Na, Се, Са) (Ti, Nb)O
и ттросинхизит Ca(Y, Се, La)_ [CO_]_F,, эвксенит Y(Nb, Та, Ti) Ю,
ОН)6. 2
РЗ минералы содержатся в рудах и россыпях. Россыпи, содержащие
наряду с ильменитом, рутилом, цирконом и касситеритом монацит,
эвксенит, ксенотим, обогащаются по комбинированным схемам, вклю-
340
чающим гравитационные методы, магнитную и электрическую сепара-
цию. Лопаритовые руды, содержащие РЗ элементы, обогащаются по
аналогичным схемам.
Оксиды РЗ элементов и РЗ концентраты получают также в виде
попутной продукции при обогащении урановых и некоторых других
руд. Так, на фабрике Клаймакс (США) получают монацитовый кон-
центрат из хвостов молибденовой флотации. Рудные минералы сначала
отделяют от породы гравитационными методами, флотацией извле-
кают пирит. Затем в кислой среде проводится флотация монацита с
использованием в качестве собирателя амина и в качестве подавителя
гюбнерита, касситерита и других минералов крахмала.
Однако на некоторых фабриках флотация является основным обо-
гатительным процессом при переработке РЗ руд.
На одной отечественной фабрике для обогащения бедных РЗ руд,
в которых РЗ минералы представлены РЗ фторкарбонатами, ксеноти-
мом, монацитом, сотрудниками комбината и Механобра внедрена сле-
дующая технология. Она включает флотацию сульфидов, магнитную
сепарацию для удаления магнетита, РЗ флотацию с использованием в
качестве собирателя реагента ИМ-50 и в качестве модификаторов соды
и жидкого стекла, сгущение, пропарку и перечистки пропаренного чер-
нового концентрата.
На фабрике ”Маунтин-Пасс” (США) перерабатывают богатые руды
с содержанием суммы оксидов РЗ элементов 7—8 %. Основной РЗ мине-
рал в этих рудах — бастнезит. Минералы породы представлены баритом,
карбонатами, кварцем. Руда измельчается до крупности 96 % класса
—0,15 мм, нагревается до температуры 93 °C и пропаривается в при-
сутствии жирно-кислотного собирателя Эмерсола 300 и подавителей
пустой породы — Орзана А (лигносульфонат аммония) и жидкого
стекла.
Затем путем разбавления водой температуру пульпы доводят до
54 °C и проводят флотацию бастнезита. Концентрат после пяти перечис-
ток содержит 60 % суммы оксидов РЗ элементов при извлечении 60—
65 %. Для удаления карбонатов концентрат обрабатывают соляной кис-
лотой, что повышает содержание суммы редких земель до 70 %. Пос-
ледующий обжиг повышает содержание суммы оксидов РЗ элементов
до 90 % благодаря удалению диоксида углерода.
Исследования, выполненные в последнее время Д. Фюрстенау с
сотрудниками на рудах, перерабатываемых фабрикой ”Маунтин-Пасс”,
показали значительные преимущества алкилгидроксамовых кислот
перед жирно-кислотным собирателем. К такому же выводу пришли
Луо и Чен при обогащении комплексной руды, содержащей редкие
земли, одного из месторождений Китая. Указанные данные свидетельст-
вуют о том, что впервые примененные в нашей стране для флотации
редкоземельных руд алкил гидроксамовые кислоты являются более
эффективным собирателем для этих руд, чем жирные кислоты.
341
20.13. Ртутные и сурьмяные руды
Основными минералами ртути и сурьмы, имеющими промышленное
значение, являются соответственно киноварь HgS, антимонит Sb2S3
и тетраэдрит Cu3SbS3.
При наличии крупной вкрапленности полезных минералов ртут-
ные и сурьмяные руды обогащаются гравитационными методами, мел-
кие классы и тонковкрапленные руды - флотацией [44, 45] .
По данным П.М. Соложенкина, киноварь обычно флотируется ксанто-
генатами при pH 6—8. Активация солями свинца и,меди улучшает фло-
тируемость киновари. Антимонит может флотироваться одним вспени-
вателем или с добавками углеводородов, однако в промышленной
практике флотация этого минерала, как правило, проводится ксанто-
генатами после активации солями свинца и меди при pH, близком к
нейтральному. Для флотации тетраэдрита применяют аэрофлоты и
ксантогенаты.
При обогащении золотосурьмяных руд, в которых золото связано
с арсенопиритом и пиритом, применяют схемы коллективно-селектив-
ной флотации. По первой схеме все сульфиды извлекают в концентрат,
при этом для активации пирита и арсенопирита используют медный
купорос, а для аквивации антимонита дополнительно применяют нит-
рат или ацетат свинца.
Разделение концентрата в основном проводится при подавлении
антимонита едким натром при pH > 9 и флотации золотосодержащих
сульфидов с небольшими добавками медного купороса. По второй
схеме сначала либо флотируют пирит и арсенопирит при подавлении
антимонита едким натром, а затем из хвостов извлекают антимонит,
либо в слабокислой среде, создаваемой серной кислотой, одним вспе-
нивателем ведут флотацию антимонита, а потом с использованием мед-
ного купороса и ксантогената флотируют золотосодержащие сульфиды.
20.14. Алюмосодержащие руды
Флотация бокситов и алунитовых руд. Бокситы представляют собой
породу, в которой наряду с полезными минералами — гиббситом
А1(0Н)3, бемитом А1ООН и диаспором АЮОН встречаются также крем-
неземсодержащие минералы — каолинит, кварц, шамозит, оксиды и
гидроксиды железа, сидерит, ильменит, рутил, сульфиды и др.
Трудности обогащения бокситов обусловлены весьма тонким про-
растанием разделяемых минералов. В ряде случаев удается удалить
каолинит промывкой, а тяжелые и магнитные минералы — гравитацион-
ными методами и магнитной сепарацией.
Флотация для обогащения бокситов применяется редко. Разработан-
ные режимы предусматривают как извлечение полезных минералов
анионными жирно-кислотными собирателями, так и флотацию кремне-
земсодержащих минералов катионными собирателями. При тонком
342
измельчении бокситов в пульпе содержится до 50 % частиц — 5 мкм. Поэ-
тому для успешного проведения флотации пульпа должна быть пред-
варительно диспергирована.
По данным В.П. Кузнецова, М.Л. Воловой и В.Е. Лифиренко, лучшие
результаты флотации жирно-кислотными собирателями получены при
использовании в качестве диспергатора и депрессора, гексаметафосфата
натрия при pH 7,5—9,5, создаваемом едким натром. Отмечено положи-
тельное влияние реагента ОП-7.
Флотация кремнеземсодержащих минералов катионными собирате-
лями, например типа АПН, дает лучшие результаты после предвари-
тельного обесшламливания пульпы. В качестве диспергатора использует-
ся жидкое стекло.
Алунит КА13 [SO4] 2(ОН)6 флотируется жирно-кислотными собира-
телями при pH 9,5—10, создаваемом содой или едким натром. Для по-
давления пустой породы — кварца, халцедона, глинистых минералов —
применяется жидкое стекло [45] .
Флотация силикатов алюминия. Минералы этой группы представле-
ны кианитом, силлиманитом, андалузитом, которые являются поли-
морфными модификациями Al2SiOs. Исследования в основном прово-
дились на кианитовых и силлиманитовых рудах.
Для переработки крупновкрапленных кианитовых руд разработаны
схемы, включающие обогащение крупных классов в тяжелых суспен-
зиях с выделением в хвосты кварца и слюды. Мелкие классы и тонко-
вкрапленные руды обогащают флотацией [45] . При наличии в рудах
сульфидов и слюды сначала флотируют сульфиды сульфгидрильными
собирателями, а затем слюду — аминами. Для удаления растворимых
солей перед флотацией кианита пульпу обесшламливают.
В качестве собирателя при флотации кианита используют жирные
кислоты при pH 6—8 и нефтяные сульфонаты при pH 3—3,5. Кислая сре-
да создается серной кислотой, щелочная — содой. Для подавления ми-
нералов породы применяют жидкое стекло и полифосфаты натрия.
Магнетит, рутил, ильменит и другие магнитные минералы выделяют
из кианитового концентрата магнитной сепарацией в слабом и силь-
ном поле.
Силлиманитовые руды обогащают по схемам, аналогичным приме-
няемым при переработке кианитовых руд. Флотацию силлиманита про-
водят жирно-кислотным собирателем в щелочной среде, создаваемой
содой или едким натром, с использованием в качестве депрессора ми-
нералов пустой породы, жидкого стекла и пирофосфорного натрия [45] .
Флотация нефелина. Для флотации нефелина KNa3 [AlSiO4]4 пред-
ложено два способа: прямая флотация и обратная флотация, когда фло-
тируется основная часть минералов, содержащихся в руде, а нефелин
остается в камерном продукте [45] .
Прямая флотация нефелина может осуществляться как жирно-
кислотными собирателями в щелочной среде (pH 11), создаваемой
343
едким натром, при активации нефелина ионами кальция, так и амина-
ми — в кислой среде (pH 4,5) в присутствии фтор-иона.
Обратная флотация нефелина осуществляется жирно-кислотными
собирателями в щелочной среде (pH И), создаваемой едким натром.
20.15. Бериллиевые руды
Основным бериллиевым минералом является берилл Ве3 Al2[Si6O18].
Тонковкрапленные бериллиевые руды обогащаются флотацией. При
наличии в рудах сульфидов и слюды сначала флотируют сульфиды
ксантогенатом, а затем слюду — катионным собирателем в сернокислой
среде при pH 3. Флотация берилла проводится по кислотной и щелочной
схемам [45] .
По кислотной коллективной схеме пульпа обрабатывается смесью
плавиковой и серной кислот и осуществляется берилло-полевошпато-
вая флотация катионным собирателем с выделением в хвосты кварца.
После тщательной отмывки реагентов коллективный концентрат пе-
рефлотируют с использованием жирно-кислотного собирателя, при
этом берилл переходит в пенный продукт, и дезактивированный в ре-
зультате кислотной обработки полевой шпат остается в хвостах.
По другому способу коллективный берилло-полевошпатовый кон-
центрат перемешивается с гипохлоритом кальция в плотной пульпе,
затем реагенты отмываются и проводится флотация берилла в сернокис-
лой среде нефтяным сульфонатом, имеющим молекулярную массу
350-430.
Кислотная коллективная схема позволяет получать наряду с берил-
ловым полевошпатовый и кварцевый концентраты.
По кислотной селективной схеме целесообразно обогащать берил-
лиевые руды с относительно высоким содержанием весьма разрушен-
ного полевого шпата. По этой схеме хвосты слюдяной флотации обраба-
тываются плавиковой кислотой, затем остатки катионного собирателя
и кислоты отмываются и проводится флотация берилла жирно-кислот-
ным собирателем в щелочной среде с выделением в хвосты кварца и
полевого шпата. Берилловый концентрат перечищается без реагентов
или с использованием катионного собирателя (иногда после перемеши-
вания с плавиковой кислотой). При необходимости проводится доводка
берилловых концентратов, включающая пропарку с содой, жидким стек-
лом или сернистым натрием и перечистку.
По щелочной схеме пульпа обрабатывается едким натром, затем
отмывается от щелочи до pH 8—8,5 и проводится флотация берилла
жирно-кислотными собирателями. В случае необходимости черновой
концентрат подвергается двукратной пропарке с содой или с содой и
сернистым натрием и перефлотируется для очистки от кварца, полево-
го шпата, биотита и других минералов породы.
344
20.16. Литиевые руды
Важнейший промышленный минерал лития — сподумен LiAl [Sis О6 ] <>
Крупновкрапленные сподуменовые руды обогащаются в тяжелых сус-
пензиях, а мелкие классы руды и тонковкрапленные руды — флота-
цией. Применяется прямая и обратная флотация сподуменовых руд [45],
Прямая флотация сподуменовых руд основана на обработке руды
едким натром в плотной пульпе с последующей отмывкой шламов
и продуктов взаимодействия минералов со щелочью. При этом сподумен
активизируется, по-видимому, за счет выщелачивания с его поверхности
кремнезема, а минералы породы депрессируются в результате удаления
с их поверхности активирующих катионов (железа и др.), которые свя-
зываются в труднорастворимые соединения.
После отмывки проводится флотация сподумена жирно-кислотным
собирателем. Для лучшего подавления породы в перечистки загружают
жидкое стекло и квебрахо или молочную кислоту.
При обратной флотации пульпа перемешивается с известью и декст-
рином и проводится флотация минералов породы — кварца, полевого
шпата и слюды катионным собирателем при pH 10,5—11. Для получе-
ния сподуменового концентрата камерный продукт, в который также
переходят железосодержащие минералы, сгущается, перемешивается
с плавиковой кислотой, жирно-кислотным собирателем — омыленными
смоляными кислотами и перефлотируется. Камерный продукт является
конечным сподуменовым концентратом.
20.17. Баритовые руды
Барит BaSO4 получают из баритовых и сульфидно-баритовых руд.
На отечественных фабриках барит извлекают в основном из полиме-
таллических сульфидных руд после флотации сульфидов. В качестве
собирателя барита применяют жирные кислоты алкилсульфаты, суль-
фосукцинаты и сочетания жирных кислот с алкилсульфатами и суль-
фосукцинатами. Флотация обычно ведется в щелочной среде при pH
8—10. Если барит флотируется из хвостов сульфидного цикла, то pH
часто определяется pH сульфидной флотации, однако в ряде случаев
в баритовый цикл дополнительно загружается сода. Для подавления
минералов породы используется жидкое стекло [45] .
При наличии в рудах значительных количеств кальцита и доломита
в качестве собирателя барита применяют алкилсульфаты.
Исследования, проведенные в Механобре, показали, что эффектив-
ным собирателем барита являются алкилсульфаты Cj6—С2о- Их ис-
пользование позволяет осуществить полный водооборот при обога-
щении полиметаллических руд.
Режим обогащения флюорито-баритовых руд рассмотрен ниже.
345
20.18. Флюоритовые руды
Источником получения флюорита CaF2 являются флюоритовые
и сульфидно-флюоритовые руды.
При переработке флюоритовых руд применяют ручную и автома-
тическую сортировку, гравитационные методы (отсадка и обогащение
в тяжелых суспензиях) и флотацию. Флотация — основной метод обо-
гащения тонковкрапленных флюоритовых руд, мелких классов круп-
новкрапленных руд, а также используется при доводке черновых гра-
витационных концентратов [44,45].
При обогащении флюоритовых руд, содержащих сульфиды, пос-
ледние извлекаются сульфгидрильными собирателями перед флота-
цией флюорита. При наличии в рудах углистых сланцев их флотируют
в ’’голове” процесса аполярными собирателями.
Флотация флюорита, как правило, осуществляется жирными кис-
лотами при pH 8—11, создаваемом содой, и температуре пульпы выше
25 °C. При перечистках пульпа подогревается до 60—80 °C.
Наиболее простые по минеральному составу кварцево-флюоритовые
руды обогащаются по схемам, включающим основную и контрольную
флотацию и перечистку. В качестве подавителя пустой породы исполь-
зуют жидкое стекло.
Кальцито-флюоритовые руды вследствие близости флотационных
свойств флюорита и кальцита обогащаются с применением более слож-
ных схем и реагентных режимов. Так, в некоторых случаях схема вклю-
чает развитый промпродуктовый цикл с весьма тонким доизмельчением
промпродуктов (до 80 % класса —0,02 мм). Для подавления кальцита
наряду с жидким стеклом используются сернистый натрий и сернокис-
лый алюминий [45,51] .
В ряде случаев черновой концентрат перед перечистками пропари-
вается при температуре 50—60 °C с жидким стеклом и сернокислым
алюминием.
По данным X. Валдауфа, X. Шуберта и В. Крамера, эффективное
разделение флюорита и кальцита было достигнуто с использованием
в качестве собирателя олеилсаркозида натрия и модификаторов жид-
кого стекла и квебрахо при pH 8,1—8,5.
При обогащении флюорито-баритовых руд разработано несколько
вариантов схем. Наибольшее распространение получила схема прямой
селективной флотации флюорита и барита. По этой схеме сначала жир-
ными кислотами флотируется флюорит, а барит подавляется декстри-
ном, крахмалом, хромпиком, лигносульфонатами или сочетанием пос-
ледних с фтористым натрием. Затем жирно-кислотным собирателем
флотируется барит, при этом в качестве активатора барита может при-
меняться хлористый барий, а в качестве подавителя несфдотировав-
шегося флюорита — лимонная кислота.
По другой схеме принят обратный порядок флотации указанных
минералов. Из руды алкилсульфатами флотируется барит, а флюорит
346
подавляется жидким стеклом и лимонной кислотой, затем жирно-
кислотным собирателем флотируется флюорит, а неизвлеченный барит
подавляется с помощью крахмала, декстрина, лигносульфоната. Воз-
можна также коллективная флотация флюорита и барита с разделе-
нием концентрата, например, флотацией флюорита и подавлением бари-
та жидким стеклом или флотацией флюорита при pH 4,6—4,8, темпера-
туре 45 °C и подавлением барита лигносульфонатами [45, 51] .
20.19. Фосфатные руды
Промышленное значение имеют апатитовые и фосфоритовые руды.
Апатитовые руды. Апатит представляет собой фосфат кальция пере-
менного состава с общей формулой Cas [Р04] з (F, С1, ОН, СО3).
Основные запасы апатита заключены в апатито-нефелиновых и апа-
титсодержащих железных рудах. Апатит извлекается из руд флотацией
с использованием жирно-кислотных собирателей в щелочной среде. При
переработке «отечественных апатито-нефелиновых руд в качестве соби-
рателя используется омыленная смесь, состоящая из дистиллирован-
ного таллового масла (18 %), сырого таллового масла (35 %), вторич-
ного масляного гудрона (30 %), окисленного петролатума (7 %) и
технических жирных кислот (10 %). Расход собирателя составляет
200—220 г/т. Флотация проводится при pH 8,5—10. Среда создается
едким натром, подаваемым в начало флотации. Для подавления сили-
катов и алюмосиликатов используется жидкое стекло (50—70 г/т)
[44,45] .
По данным Н.А. Алейникова и Г.А. Голованова, при переработке
разрушенных (окисленных) руд с повышенным содержанием шламов
улучшение результатов флотации достигается при использовании реа-
гента ОП-4 (5—15 г/т). Схема апатитового цикла показана на рис. IV. 1.
Из хвостов апатитовой флотации после их классификации и сгуще-
ния Проводятся магнитная сепарация для удаления титаномагнетита
и флотация темноцветных минералов (эгирина, сфена) и остатков
апатита. Камерный продукт представляет собой нефелиновый концент-
рат. Флотация проводится омыленным сырым талловым маслом при
pH 10,5—11, создаваемой едким натром [44] .
В Механобре разработана и внедрена на одной из фабрик технология
извлечения апатита из хвостов магнитной сепарации апатитсодержащих
железных руд, в состав пустой породы которых входят кальцит и доло-
мит. Технология включает доизмельчение хвостов магнитной сепарации,
обесшламливание и сгущение измельченного продукта, перемешивание
с содой и жидким стеклом, подавляющих карбонаты, и флотацию апа-
тита омыленным дистиллированным талловым маслом с загрузками
реагента ОП-4 [44] .
Фосфоритовые руды. Фосфориты — это порода, фосфатный мате-
риал которой представлен переходными разностями, объединяемыми
общим названием фторкарбонатапатит. В желваковых и плитообразных
347
фосфоритах фосфат играет роль цемента, скрепляющего кварц, глинис-
тые минералы, глауконит, известняк. У зернистых или ракушечных
фосфоритов фосфат сцементирован глинисто-железистыми или карбо-
натными минералами.
Для обогащения фосфоритов крупностью +0,5 мм в основном при-
меняют промывку, флотацию и флотогравитацию, класс —0,5 мм обо-
гащают флотацией [44,45].
Флотация фосфоритов, в которых минералы породы представлены
преимущественно кварцем, осуществляется по режимам с анионными
и катионными собирателями. При анионной флотации в пенный продукт
переходит фосфат, при катионной — кварц и другие примесные ми-
нералы.
Из анионных собирателей применяют жирные кислоты, обычно в
сочетании с углеводородами. Флотацию проводят при pH 8—10, созда-
ваемом содой, едким натром или аммиаком, после обесшламливания
пульпы. В качестве подавителя кварца используют жидкое стекло,
загружаемое в измельчение. Перемешивание с собирателями стремятся
проводить в плотной пульпе с содержанием твердого 60—70 %.
На одной из отечественных фабрик на флотацию поступает обес-
шламленная фосфоритовая руда, измельченная до крупности 30—40 %
класса +0,18 мм. Флотация ведется сочетанием омыленного сырого
таллового масла и тракторного керосина. Необходимый pH среды (9—
9,5) создается содой. Подавление минералов породы достигается жид-
ким стеклом.
Катионная флотация фосфоритовых руд проводится с использова-
нием в качестве собирателя длинноцепочечных аминов. На одной оте-
чественной фабрике собирателем служит катионный реагент АНП-2.
В пенный продукт удаляются кварц, полевой шпат и сланец. Камерный
продукт является фосфоритовым концентратом. Схема фабрики пре-
дусматривает выделение тонких шламов и раздельную флотацию пес-
ков и шламов. Последние (после флотации или без нее) присоединяют-
ся к концентрату [45] .
На большинстве фабрик США, перерабатывающих фосфоритовые
руды, применяется технология, по которой фосфоритовый концентрат,
полученный с применением анионного собирателя, подвергается доводке
с катионным собирателем после десорбции анионного собирателя с по-
верхности сфлотированных минералов. Обычно питание флотации обесш-
ламливается по крупности 0,1 мм, делится на классы —1,17 (0,83)
+0,41 и —0,41 + 0,1 мм, каждый из которых поступает на анионную
флотацию. Концентраты грубой и тонкой анионной флотации объеди-
няются, обезвоживаются, обрабатываются серной кислотой (4—4,5 кг/т
концентрата) в скрубберах для разрушения карбоксилатов кальция
и обдирки образовавшихся жирных кислот с поверхности минералов.
После чего в гидроциклонах и спиральных классификаторах произ-
водятся отмывка собирателя и дополнительное обесшламливание.
348
Катионная флотация проводится сочетанием аминов и углеводородов
при pH, близком к нейтральному. Камерный продукт является ко-
нечным фосфоритовым концентратом [55] .
Обогащение фосфоритов с карбонатной породой (преимуществен-
но доломитом) очень трудный процесс. Предложены две схемы их пере-
работки: последовательная селективная флотация доломита и фосфата
и коллективная флотация с последующей флотацией доломита. Обе
схемы основаны на разделении доломита и фосфата жирно-кислотными
собирателями при pH 4,5—5, создаваемом фосфорной кислотой.
На одной из отечественных фабрик применяется первая схема. Расход
жирно-кислотного собирателя в карбонатной флотации составляет
2 кг/т, фосфорной кислоты — 7 кг/т. Фосфатная флотация проводится
сочетанием жирно-кислотного собирателя (0,2 кг/т) и керосина
(0,75 кг/т) в присутствии соды (1 кг/т) и жидкого стекла (1 кг/т)
[45].
20.20. Полевошпатовые руды
Полевые шпаты — алюмосиликаты К, Na, Са и некоторых катионов,
изоморфных кальцию. Наиболее ценным полевошпатовым сырьем
является калиевый полевой шпат. В качестве примесных минералов в
полевошпатовых рудах содержатся кварц, слюды, кальпит, флюорит,
гидроксиды железа, гранат, турмалин, эгирин.
Полевошпатовые руды обогащаются магнитной и электрической
сепарацией и флотацией. Руда измельчается в стержневых мельницах
до 0,5—0 8 мм, обесшламливается и поступает на слюдяную флотацию.
Флотация слюды проводится катионным собирателем в кислой (pH 3)
или щелочной (pH 8—10) средах, иногда с добавками углеводородов.
Возможно применение сочетаний катионного и анионного собирателей.
Из хвостов слюдяной флотации извлекают железосодержащие минералы.
Для этой цели применяют нефтяные сульфонаты при pH 3-4, создавае-
мом серной кислотой. Флотация железосодержащих, а также кальцие-
вых минералов может проводиться и в щелочной среде жирно-кислот-
ным собирателем.
Отделение полевого шпата от кварца осуществляется с использова-
нием катионного собирателя в сочетании с углеводородами при pH
2,5—3,5, создаваемом плавиковой кислотой. В этих условиях флоти-
руются полевые шпаты, а кварц остается в камерном продукте.
Если черновой полевошпатовый концентрат представлен смесью
различных полевых шпатов, из него можно извлечь калиевый или натрие-
вый полевой шпат при помощи соответствующих селективно действую-
щих подавителей. Такими подавителями являются для натриевого поле-
вого шпата соли натрия, для калиевого полевого шпата — соли калия,
для натриево-кальциево-бариевого полевого шпата — соли кальция,
бария, магния. В качестве собирателя применяется прямоцепочечный
амин. Для повышения селективности разделения из пульпы предвари-
тельно удаляется избыток плавиковой кислоты (45]. 349
20.21. Железные руды
Основные минералы железных руд эксплуатируемых месторож-
дений — магнетит, гематит, мартит, гидроксиды и карбонаты железа.
Минералы породы представлены кварцем, амфиболом, пироксенами,
хлоритом, слюдами, карбонатами.
Магнетитовые руды обогащаются магнитной сепарацией. Флотация
может быть применена при обогащении тонковкрапленных гематитовых
и мартитовых руд, для доизвлечения слабомагнитных железных ми-
нералов из хвостов магнитной сепарации и гравитации, а также для
получения высококачественных концентратов с содержанием железа
более 70 % из магнетитовых концентратов.
Известны три способа флотации железных руд: прямая анионная,
обратная анионная и обратная катионная.
Прямая флотация железных руд проводятся жирно-кислотными
• собирателями, из которых наиболее часто применяются талловое масло
и сульфатное мыло. В качестве подавителей минералов пустой породы
используются жидкое стекло, сернокислый алюминий и кремнефторис-
ный натрий. Обычно флотация ведется в слабокислой среде при pH
5,5—6,5, создаваемом серной кислотой. При наличии в руде карбонатов
щелочная среда создается содой (pH 10). Пульпа перемешивается с
собирателем при содержании твердого 50—65 %. Для повышения качест-
ва концентрата и крупности флотируемых зерен применяются эмульсии
жирнокислотных собирателей с углеводородами.
Как правило, при прямой флотации анионным собирателем тре-
буется предварительное обесшламливание руды. При существенном
содержании в руде гидроксидов железа это приводит к значительным
потерям железа.
Полупромышленные и промышленные испытания, проведенные в
СССР на криворожских рудах, содержащих 33—35 % железа, показали
возможность получения концентрата с содержанием 59—63 % железа
при извлечении лишь 55—68 % из-за больших потерь со шламами, обус-
ловленных высоким содержанием гидроксидов железа в руде. Тонина
измельчения руды в этих испытаниях достигла 90 % класса —0,074 мм,
обесшламливание проводилось по классу 20 мкм.
На одной из фабрик США прямой анионной флотацией обогащаются
гематитовые руды. Руда, измельченная до 0,3 мм, обесшламливается
по классу 20 мкм, при этом из-за меньшего содержания гидроксидов
и более крупной вкрапленности гематита по сравнению с криворожс-
кими рудами потери железа в шламах относительно малы. Флотация
проводится талловым маслом при pH, близком к нейтральному. Чер-
новой концентрат доизмельчается до 80 % класса —0,044 мм и переф-
лотируется при температуре пульпы 90—95 °C. Из руды, содержащей
36—39 % железа, получают концентрат с содержанием железа более
65 % при извлечении 84 %.
350
Сточные воды при прямой анионной флотации могут очищаться
оксидом кальция и железным купоросом и после отстаивания использо-
ваться при флотации.
Обратная анионная флотация, при которой в пену переходят минера-
лы породы, проводится жирно-кислотным собирателем (например,
талловым маслом) с использованием извести в качестве активатора
породы. Для создания необходимой концентрации ионов кальция и
pH пульпы 11—11,5, при которых наиболее эффективно достигается
активация минералов породы, известь применяется совместно с едким
натром или содой. В последнем случае также снижается жесткость воды
и уменьшается связывание собирателя в объеме пульпы. В качестве
подавителя железных минералов используется крахмал или его замени-
тели, например барда сульфитных щелоков.
По сравнению с прямой обратная анионная флотация обладает рядом
преимуществ: 1) наличие шламов меньше влияет на процесс и поэтому
можно исключить обесшламливание перед флотацией и значительно
уменьшить потери железа с хвостами; 2) процесс более устойчив при
изменении соотношений различных минералов железа, так как они
остаются в камерном продукте, за исключением тех случаев, когда
содержатся силикаты железа, которые снижают качество концентратов;
3) флотация успешно проводится и при жесткости воды до 25 мг • экв,
тогда как при прямой флотации и такой жесткости активируется флота-
ция минералов пустой породы и снижается содержание железа в концент-
рате. С применением обратной анионной флотации из криворожских
руд могут быть получены концентраты, содержащие до 60—63 % железа
при извлечении 78-83 %. Однако при содержании в руде значительных
количеств железа в виде силикатов результаты прямой флотации могут
оказаться выше.
Основным недостатком обратной анионной флотации считают пло-
хую фильтруемость концентрата, что в случае последующего окомко-
вания может вызвать существенные трудности.
Для очистки сточных вод при обратной анионной флотации рекомен-
дуется применять оксид кальция и полиакриламид. После очистки вода
может быть использована для оборота.
Обратная катионная флотация проводится аминами (например,
реагентом АНП-2) при pH 7,5—9, создаваемом известью или содой,
в качестве депрессора железных минералов применяются крахмал,
отходы мукомольного производства, арабогалактан.
Обратная катионная флотация по сравнению с другими способами
флотации железных руд характеризуется более высокой селективностью
и скоростью флотации и нечувствительна к солям жесткости. Ее недос-
татки — дороговизна и токсичность собирателя, дефицитность пода-
вителя, большая, чем при анионной флотации, чувствительность к шла-
мам. Поэтому в СССР исследования по обратной катионной флотации
351
железных руд проводились лишь в лабораторном масштабе и преиму-
щественно для доводки магнетитовых концентратов.
За рубежом обратная катионная флотация является основным про-
цессом, применяемым для обогащения тонковкрапленных окислен-
ных таконитов1 и доводки магнетитовых концентратов. Резкое сокра-
щение потерь железа со шламами может быть достигнуто благодаря
использованию селективной флокуляции. Она включает диспергирование
пульпы, селективную флокуляцию железных минералов, осаждающих-
ся в виде флокул, и дешламацию, при которой в слив в основном уда-
ляются тонкие частицы пустой породы. В качестве диспергатора приме-
няются жидкое стекло, полифосфаты натрия, лигносульфонаты, в ка-
честве флокулянтов — крахмал и другие полимеры, которые также
являются депрессорами железных минералов. Этот процесс применен
на одной из фабрик США. При селективной флокуляции pH поддержи-
вается равным 11 подачей едкого натра. Сгущенный продукт затем
подвергается обратной катионной флотации для удаления оставшихся
минералов пустой породы [45] .
20.22. Марганцевые руды
Основные марганцевые минералы — пиролюзит МпО2, псиломелан
mMnO • МпО2 • лН2Ои карбонаты марганца родохрозит МпСО3, ман-
ганокальцит (Са, Мп)СО3 и олигонит (Мп, Fe)CO3.
Крупные классы марганцевых руд обогащаются промывкой, отсад-
кой и магнитной сепарацией, флотация применяется для обогащения
шламов [45] .
При флотации марганцевых шламов могут быть использованы те
же способы, что и при флотации железных руд, однако наибольшее
применение нашла прямая анионная флотация по коллективной или
селективной схеме.
Флотация проводится жирно-кислотным собирателем после пред-
варительного обесшламливания при pH 7—9, создаваемом содой. В оте-
чественной практике в качестве собирателя используется в основном
сырое и дистиллированное талловое масло в виде мыла и эмульсий с
поверхностно-активными веществами и другими жирно-кислотными
собирателями обычно в сочетании с углеводородами [45]. В качестве
подавителя пустой породы (кварца, полевого шпата, карбонатов), а
также оксидов марганца при селективной схеме используется жидкое
стекло.
По коллективной схеме оксиды и карбонаты марганца флотируют-
ся вместе: по селективной схеме сначала при небольших расходах со-
1 Окисленные такониты - кремнисто-глинистые породы с тонкой вкраплен-
ностью немагнитных оксидов железа.
352
бирателя (до 0,05 кг/т) в присутствии жидкого стекла флотируются
карбонаты, затем при повышенной подаче собирателя (до 3 кг/т) фло-
тируются оксидные марганцевые минералы [45] .
Разработаны условия обратной флотации анионным собирателем
руд, в котором пустая порода представлена карбонатами, а марган-
цевые минералы — оксидами. Относительно невысокими дробными
загрузками собирателя (общий расход 0,3—0,5 кг/т) флотируют кар-
бонаты, а в хвостах остаются оксиды марганца, флотация проводится
при pH 9—10, создаваемом содой или едким натром [45] .
На одной из отечественных фабрик внедрена пенная сепарация зер-
нистых фракций марганцевых шламов [44, 45] . Из шламов крупностью
— 1 + 0,04 мм получают концентрат с содержанием марганца 22-23 %
и оксидный концентрат с содержанием 34—38 %. Извлечение марганца
из обесшламленного продукта, поступающего в пенную сепарацию,
достигает 80—90 %.
Расход реагентов составляет, кг/т: жидкое стекло 0,4—0,7; омылен-
ное сырое талловое масло 0,7—0,9 в карбонатный цикл и 2,5—3 в оксид-
ный; соответственно расход солярового масла 0,6—0,9 и 1,6—2.
20.23. Хромитовые руды
Основные минералы хрома — магнохромит (Mg, Fe)Cr2O4, хром-
пикотит (Mg, FeXCr, Al)z O4 и алюмохромит Fe(Cr, Д1)2О4.
Хромитовые руды обогащают в основном гравитационными и маг-
нитными методами. Флотация находит применение при обогащении
тонковкрапленных россыпных руд, а также промпродуктов и шламов
гравитации [45].
Разработанные режимы включают прямую флотацию хромитов
анионным собирателем при pH 6—7 и обратную флотацию катионным
собирателем при pH 8 после предварительного удаления тонких частиц.
Из анионных собирателей применяются жирные кислоты и нефтяные
сульфонаты, из катионных — амины с углеводородным радикалом,
имеющим 16—18 атомов углерода.
Слабокислая среда при анионной флотации создается серной кис-
лотой, что обеспечивает подавление минералов пустой породы, предс-
тавленных в основном серпентином и оливином. В ряде случаев фло-
тация проводится при естественном pH, а минералы породы депресси-
руются лигносульфонатами, при перечистках добавляются серная кис-
лота и фтористый натрий.
На одной фабрике в Родезии технология обогащения россыпных
руд включает выделение магнетита магнитной сепарацией, обдирку
и обесшламливание по классу 60 мкм, перемешивание с реагентами
в плотной пульпе при содержании 65—70 % твердого и флотацию хро-
мита после разбавления до 35 % твердого. Флотация проводится соче-
танием жирно-кислотного собирателя и нефтяного сульфоната при
353
23-6926
pH 6, создаваемом серной кислотой. По указанной технологии из руды,
содержащей 15 % Сг2О3, получают концентрат с содержанием оксида
хрома 54 % при извлечении 55 %.
В Югославии для обогащения первичных руд, требующих в ряде
случаев измельчения до крупности 70 % класса —0,074 мм и содержа-
щих значительную долю хромита в тонких классах, была разработана
технология без предварительного обесшламливания руды. Она вклю-
чает диспергирование пульпы жидким стеклом (1,5 кг/т) при pH
11—11,5, создаваемом едким натром, селективную флотацию мине-
ралов породы и гидрофилизацию их поверхности карбоксиметил цел-
люлозой (0,12—0,25 кг/т) и флотацию хромита жирно-кислотным соби-
рателем (например, талловым маслом при расходе 0,5—1,5 кг/т). При
этом из руды, содержащей 18—22 % оксида хрома, был получен концент-
рат с содержанием оксида хрома 50—52 % при извлечении 80—81,5 %.
20.24. Аполярные минераль!
К аполярным минералам относятся сера, графит, алмаз и уголь.
Ниже рассматриваются данные по флотации серы и графита.
Серные руды. Флотация серы ведется аполярными собирателями —
керосином, трансформаторным маслом (расход 0,6—1,2 кг/т) и пено-
образователями (сосновым маслом, Т-80) при расходах 0,1—0,4 кг/т.
Для подавления минералов породы (глины, кальцита и др.) приме-
няются жидкое стекло, пирофосфат натрия. Флотация серы малочувст-
вительна к pH.
На одной из отечественных фабрик из руды, содержащей 22—23,5 %
серы, получают концентрат с содержанием серы 65—70 % при извлечении
более 90 %.
Графитовые руды. Естественная флотируемость графита зависит
от структуры и степени его окисления. Флотация графита обычно про-
водится керосином и пенообразователем (например, Т-80). Среда мо-
жет быть щелочная (pH 8—10) или кислая (pH 4—5) и создается содой,
известью или серной кислотой. Для подавления минералов породы
применяется жидкое стекло. При наличии слюды в руде для ее подав-
ления при перечистке используется фтористый натрий. Флотационная
схема состоит из основной флотации, двух—шести перечисток и вклю-
чает доизмельчение (иногда двухкратное) чернового концентрата.
На одной отечественной фабрике из руды, содержащей 7 % угле-
рода, выделяются концентраты с содержанием углерода 90—91 % при
извлечении 92 % [44,45] .
20.25. Растворимые соли
В промышленности флотационному обогащению подвергаются
следующие растворимые в воде минералы: сильвин КС1, галит NaCl,
лангбейнит 2MgSO4 • K2SO4, полигалит 2CaSO4 • MgSO4 K2SO4 2H2O.
карналлит КС1 • MgCI2 • 6H2 О, каинит КС1 • MgSO4 • ЗН2 О, бораты и др.
Особенностью флотации растворимых солей является то, что она
ведется в их насыщенных растворах. Раствор должен полностью исполь-
зоваться для оборота с целью максимального снижения потерь раство-
римых минералов. Для этого сгущают и фильтруют как хвосты, так и
концентрат. Вязкость раствора превышает вязкость воды в несколько
раз, поверхностное натяжение достигает 8-9 мкДж/см2.
На практике для флотации сильвина в отсутствие сернокислых
солей применяют амины; для флотации сильвина и калиевых сульфат-
ных солей — жирные кислоты. Собиратель не должен образовывать
трудно растворимых солей с ионами раствора. Поэтому из жирных
кислот хорошими собирателями могут быть только короткоцепочеч-
ные с числом атомов углерода 7—9. Эти собиратели не образуют трудно-
растворимых солей и не высаливаются из раствора [45] .
В качестве собирателя сильвина применяют прямоцепочечные на-
сыщенные амины с углеводородным радикалом, имеющим 16—20 ато-
мов углерода. Амины с разветвленными радикалами не являются со-
бирателем для сильвина.
Температура применяемого раствора амина не должна быть ниже
температуры, при которой коагулируется амин. Она зависит от длины
его радикала.
Более активны собиратели в ионной форме, поэтому растворимые
соли флотируют аминами в кислой или слабощелочной среде, а жирно-
кислотными собирателями при pH > 6.
Температура коагуляции 0,01 М раствора амина
в зависимости от длины углеводородного радикала
Длина углеводородного
радикала................Ci2 C'i4 Ci$ Cis C2o C22 Cig:
C18 —
o =1:1
Температура, C.......... 23 25-30 40-50 55-60 70-75 95 45-50
Глинистые и другие нерастворимые шламы сильно сорбируют соби-
ратель, особенно амины, повышая его расход, затрудняют флотацию
солей и загрязняют концентраты. Поэтому перед флотацией солей обыч-
но проводят обесшламливание - флотационное, механическое с удале-
нием частиц —0,074 мм или механическое в сочетании с флотационным.
При флотационном удалении шламов их предварительно флокулируют
полиакриламидом или крахмалом, а затем флотируют жирно-кислот-
ным собирателем в сочетании с углеводородами (например, окисленным
уайт-спиритом и керосином, оксиэтилированными жирными кислотами).
355
Вместо обесшламливания на практике также применяют реагенты,
гидрофилизирующие шламы и препятствующие закреплению амина
на их поверхности. К таким реагентам относятся карбоксиметилцеллю-
лоза, крахмал, полиакриламид, лигносульфонаты [45] . Высокомоле-
кулярные депрессоры одновременно подавляют и флотацию галита.
В СССР разработана технология флотации крупнозернистого (—3 +
+ 0,8 мм) сильвина. В качестве собирателя применяют сочетание ами-
на с соляровым маслом и мазутом. Флотация ведется во флотомашинах
пенной сепарации и с кипящим слоем (см. разд. 18).
На отечественных фабриках из сильвинитовых руд, содержащих
20—30 % оксида калия, получают сильвиновый концентрат с содержа-
нием 90—95 % К2О при извлечении 85—90 % [44, 45] .
На одной отечественной фабрике обогащают сернокислые калийно-
магниевые руды. Калиевые минералы представлены полигалитом, каи-
нитом, лангбейнитом, сильвином. В руде также содержатся галит и
минералы пустой породы. Флотация калийно-магниевых солей прово-
дится жирными кислотами С7-С9 (400 г/т) при pH 6,5—7. Галит и ми-
нералы пустой породы подавляются полиакриламидом и кремниевой
кислотой (1500 г/т) [45] .
СПИСОК ЛИТЕРАТУРЫ
1. Абрамов А.А. Теоретические основы оптимизации селективной флотации
сульфидных руд. М., Недра, 1978.
2. Басоло Ф., Пирсон Р. Механизмы неорганических реакций. М., Мир, 1971.
3. Берсукер Б.И. Координационная химическая связь и некоторые вопросы
катализа. - В кн.: Комплексообразование в катализе. М., 1968, с. 7-35.
4. Богданов О.С., Емельянов М.Ф. О вероятностном способе описания про-
цесса флотации. - Обогащение руд, 1970, № 1-2, с. 63-66.
5. Вопросы теории и технологии флотации /О.С. Богданов, А.К. Поднек,
Н.А. Янис и др. - Труды ин-та Механобр. Л., 1959, вып. 124.
6. Гидрофобизирующее действие ионов и молекул собирателей при флота-
ции /О.С. Богданов, И.А. Вайншенкер, В.И. Мелик-Гайказян и др. - В кн.: IX Меж-
дународный конгресс по обогащению полезных ископаемых. Прага, 1970, с. 149-
156.
7. Глембоцкий ВА. Физико-химия флотационных процессов. М., Недра, 1972.
8. Глембоцкий А.В., Классен В.И. Флотационные методы обогащения. М.,
Недра, 1981.
9. Глембоцкий А.В., Лившиц AJC., Сологуб Д.Б. Изучение некоторых особен-
ностей взаимодействия диалкилтионокарбоматов с сульфидными минералами. -
Изв. вузов. Цветная металлургия, 1971, № 1, с. 11-15.
10. Глембоцкий А.В., Фролов Ю.Г. О механизме закрепления собирателей
на поверхности минералов в процессе флотации. — Цветные металлы, 1978, № 8,
с. 110-114.
11. Годэн А.М. Флотация. Пер. с англ. М., Металлуртмздат, 1959.
12. Данилова Е.В. О некоторых особенностях флотации кварца катионными
реагентами. - В кн.: Обогащение полезных ископаемых. Л., 1952, вып. 1, с. 70-84.
13. Дерягин Б.В., Духин С.С., Рулев Н.Н. Кинетическая теория флотации
мелких частиц. - Успехи'химии, 1982, т. 60, № 1, с. 92-118.
14. Емельянов М.Ф. Теоретическая оценка отрицательного влияния переме-
шивания на время флотации и пути ее снижения. - Обогащение руд, 1985, № 2,
с. 10-13.
15. Емельянов М.Ф., Максимов И.И. Изучение условий минерализации пузырь-
ков и требования к флотомашинам для частиц различной крупности. - В кн.:
Исследования по разработке новых флотационных машин и усовершенствованию
существующих конструкций. Л., Механобр, 1983, с. 12-29.
16. Исследования действия флотационных реагентов. - Труды ин-та Меха-
нобр. Л., 1965, вып. 135.
17. Исследование механизма действия алкилгидроксамовых кислот при фло-
тации иттросинхизита и кальцита /В.И. Кочкин, О.С. Богданов, В.И. Рябой и др. -
Обогащение руд, 1972, № 3, с. 14-17.
18. Каковский И.А. Анионные собиратели при флотации. - В кн.: Роль газов
и реагентов в процессах флотации. М., 1950, с. 106-126.
357
19. Каковский И.А. К вопросу о кинетике окисления смесей сульфидных
минералов кислородом в водных растворах. - Обогащение руд, 1980, № 3, с. 15-18.
20. Каковский И.А., Косиков Е.М. Изучение кинетики окисления некоторых
сульфидных минералов. - Обогащение руд, 1975, № 3, с. 18-21.
21. Каковский ИА., Щекалева Р.Н. О поведении сульфида натрия во флота-
ционной пулыте. - Обогащение руд, 1984, № 1, с. 20-24.
22. Классен В.И., Мокроусов В.А. Введение в теорию флотации. М., Госгор-
техиздат, 1959.
23. Колтунова Т.Е., Богданов О.С. Изучение флотации гюбнерита и флюорита
щелочной солью гидроксамовой кислоты и сорбции ее на этих минералах. - Обо-
гащение руд, 1971, № 2, с. 7-10.
24. Колтунова Т.Е., Богданов О.С., Порошина А.Н. Влияние солей железа
на флотацию кварца гидроксамовыми кислотами и их солями. - Обогащение руд,
1978, №3, с. 12-16.
25. Конев В А. О механизме действия сульфидных комплексов железа при
флотации. — Обогащение руд, 1966, № 2, с. 17-22.
26. Логинов Г.М., Янис НА. Исследование механизма действия жидкого
стекла при разделении барита и кварца в жесткой воде. - Обогащение руд, 1976,
№ 2, с. 20-23.
27. Максимов И.И. Основные закономерности флотации частиц различной
крупности и их использование для повышения извлечения полезных компонентов
из руд. Дисс. на соиск. учен, степени д-ра техн. наук. Л., 1984.
28. Максимов И.И., Емельянов М.Ф. Влияние турбулентности на процесс
отрыва частиц от пузырьков во флотационной пульпе. - Обогащение руд, 1983,
№ 2, с. 16-19.
29. Методические указания по выбору типа, размера и количества камер
флотационных машин /О.С. Богданов, М.Ф* Емельянов, Э.Н. Корниенко и др.
Л., Механобр, 1985.
30. VIII Международный конгресс по обогащению полезных ископаемых.
Л., Недра, 1969.
31. Мещеряков Н.Д. Новое флотационное и аэрационное оборудование. ЦНИИ-
цветметэкономики и информации. М., 1984, выл. 1.
32. Мещеряков Н.Д. Флотационные машины и аппараты. М., Недра, 1982.
33. Митрофанов С.И. Селективная флотация. М., Недра, 1967.
34. Михайлова Н.С. Исследование взаимодействия крахмала с некоторыми
окиспами и силикатами. - Обогащение руд, 1972, № 6, с. 20-23.
35. Обогащение руд цветных металлов. 4.1. Исследования по теории и техно-
логии обогащения руд цветных металлов. Труды ин-та Механобр, 1974, вып. 141.
36. Полькин С.И. Обогащение руд и россыпей редких и благородных металлов.
М„ Недра, 1987.
37. Ребиндер ПА. Физико-химия флотационных процессов. М., Металлург-
издат, 1933.
38. Рубинштейн Ю.Б. Противоточные пневматические флотомашины. ЦНИИ-
цветметэкономики и информации, М., 1979, вып. 4.
39. Рубинштейн Ю.Б., Филиппов ЮА. Кинетика флотации. М., Недра, 1980.
358
40. Рябой В.И. Расчет зависимости между pH и оптимумом сорбции реагентов
на несульфидных минералах и его использование для изучения механизма действия
реагентов. - Обогащение руд, 1975, № 6, с. 20—24.
41. Рябой В.И., Богданов О.С., Зуев В.В. Хемосорбция реагентов на минералах
как процесс образования поверхностных соединений с координационной связью
(гипотезы о механизме действия флотореагентов). Труды ин-та Механобр. Л.,
1977, вып. 145, с. 59-89.
42. Рябой В.И., Шендерович В.А., Щукина Н.Е. О кислотных свойствах флото-
реагентов - алкилгидроксамовых кислот и тионокарбаматов. - Ж. прикладной
химии, 1973, №5, с. 1095-1098.
43. Сазерленд К.Л., Уорк И.В. Принципы флотации. Пер. с англ. М., Метал-
лургиздат, 1958.
44. Справочник по обогащению руд. Обогатительные фабрики. М., Недра,
1984.
45. Справочник по обогащению руд. Основные процессы. М., Недра, 1983.
46. Суховольская С.Д. Факторы, вызывающие депрессию при флотации. Труды
ин-та Механобр. Л., 1960, вып. 125, с. 5-34.
47. Физико-химические основы флотации /О.С. Богданов, А.М. Гольман,
И.А. Каковский и др. М., Наука, 1983.
48. Формирование ионного состава жидкой фазы и флотируемость сульфид-
ных минералов в присутствии серосодержащих модификаторов. — Цветные ме-
таллы, 1981, № 9, с. 99-103.
49. Чантурия В.А., Шафеев Р.Ш. Химия поверхностных явлений при флотации.
М., Недра, 1977.
50. Шоршер И.Н. Селективная флотация окисленных свинцово-медных руд. -
Обогащение руд, 1975, № 2, с. 8-11.
51. Эйгелес М.А. Основы флотации несульфидных минералов. М., Недра, 1964.
52. Abrahamson I. Collision Rates of small Particles in a vigorously turbulent Fluid. -
Chem. Engng. Sci., 1975, v. 30, N 11, p. 1371-1379.
53. Eleventh International Mineral Processing Congress, Cagliari, 1975.
54. Finkelstein N. Quantitative Aspects of the Role of Oxygen in the Interaction
between Xanthate and Galena. - Separ. Sci, 1970, 5(3), p. 227-256.
55. Flotation (A. Gaudin Memorial Volume), N.Y., Am. Inst, of Min. Met. and
Petrol. Eng., 1976.
56. Fuerstenau D. Reagents in Mineral Industry, the Jnst. Min. Metall., 1984 (Lon-
don M. J. Jones and R. Oblatt).
57. Fuerstenau M. Role of Metal Ion Hydrolysis in Oxide and Silicate Flotation
Systems. - AICHE Symposium Series, 1975, v. 71, N 150, p. 16-23.
58. Fuerstenau M., Huiatti J., Kuhn M. Dithiophosphate vs. Xanthate Flotation of
Chalcocite and Pyrite. - Trans. Soc. Min. Eng., AIME, 1971, v. 250, N 3, p. 227-231.
59. Harris P., Finkelstein N. Interactions between Sulphide Minelals and Xanthate,
I, The Formation of Monothiocarbonate at Galena and Pyrite Surfaces. - Int. J. Min.,
1975, 2, p. 77-100.
60. Kulkami B„ Somasundaran P. Kinetics of Oleate Adsorption at the liqued/air
Interface and its Role in Hematite Flotation. AIChE Simp, ser., 1975, v. 71, N 150,
61. Reagents Chemisorption on Minerals as a Process of Formation of Surface Com-
pounds with a Coordination Bond./Bogdanov O.S., Podnek A.K., Rjaboy V.I., Ja-
nis N.AA. - XII Intern. Mineral Process. Congr., San Paulo, Brazil, 1977, meet. 7, pa-
per 2.
62. Schulze H. Physikalisch-chemische Elementvorgange des Flotations prozesses. —
Berlin, VEB Deutscher Verlag der Wissenschaften, 1981.
63. Siebert B. Uber die Sammlereigenschaften von n-Alkankarbonsauren und 0-
substituierten n-Pentakarbonsauren, — Freiberger Forsch. H., 1971, A. 487.
64. Singewald A. Zur Frage der Stellung von der Salzmineralien - Flotationst-
heotie. — Chem. Ing. Techn., 1961, N 5, Mai, S. 376—397.
65. Somasundaran P. Adsorption of Starch and Oleate and Interaction between
them on Calcite in Aqueous Solutions. - J. Colloid Interface Sci., N.Y., 1969, v. 31,
N 4, p. 557-565.
66. Tomi D., Bagster D. The behavior of Aggregates in stirred Vessels, - Trahs.
Inst. Chem. Engng., 1978, v. 56, N 1, p. 1-18.
67. Wakamatsu T., Fuerstenau D. Effect of alkyl Sulfonates on the Wettability of
Alumina. — Trans. AAME, 1973, 254, N 2, p. 123—126.
ОГЛАВЛЕНИЕ
Предисловие.........................................................3
Часть I. Общие сведения и основы процесса флотации..................$
1. Основные представления...........................................5
2. Смачиваемость и работа прилипания пузырька к твердой поверхности .... 14
3. Условия закрепления частицы на поверхности раздела газ - жидкость .... 19
4. Основные реагенты, применяемые в практике флотации..............27
4.1. Собиратели..................................................27
4.2. Модификаторы флотации.......................................43
4.3. Флокулянты и диспергаторы...................................46
4.4. Пенообразователи и пенообразующие свойства собирателей .....47
5. Общие представления о действии флотационных реагентов...........49
5.1. Виды сорбции флотационных реагентов.........................49
5.2. Влияние плотности сорбционного слоя собирателя на флотацию ми-
нералов .........................................................56
5.3. Кинетика поглощения флотационных реагентов минералами из раст-
вора ............................................................58
5.4. Влияние крупности частиц минералов на сорбцию реагентов.....65
Часть II. Исследование механизма действия флотационных реагентов ...67
6. Взаимодействие сульфгидрильных собирателей с сульфидными минералами
6.1. Состояние поверхности сульфидных минералов..................&
6.2. Влияние окисления на взаимодействие сульфидных минералов с сульф-
гидрильными собирателями.........................................70
6.3. Сорбция сульфгидрильных собирателей и флотация сульфидных
минералов........................................................76
7. Взаимодействие неионогенных серосодержащих собирателей с сульфид-
ными минералами.....................................................gg
8. Действие модификаторов при флотации сульф гидрильными собирателями . 95
8.1. Влияние концентрации водородных ионов ......................95
8.2. Депрессирующее действие сульфида натрия.....................98
8.3. Активация сульфидом натрия флотации окисленных минералов....дц
8.4. Депрессирующее действие хромата калия.......................104
8.5. Действие фосфата натрия на галенит и сульфиды меди..........Юб
8.6. Активация сфалерита ионами меди.............................Ю9
8.7. Действие циансодержащих подавителей.........................цз
8.8. Действие сульфата цинка.....................................121
8.9. Действие ионов-восстановителей SOj- н S2 Of"................123
8.10. Действие сульфита натрия и сульфата железа.................123
9. Взаимодействие карбоксильных собирателей с оксидами и силикатными
минералами..........................................................125
9.1. Сорбция карбоксильных собирателей минералами в отсутствие акти-
вирующих катионов и модификаторов флотации.......................125
361
9.2. Сорбция карбоксильных собирателей и флотация оксидов и силика-
тов, содержащих катионы, в отсутствие модификаторов флотации.....126
9.3. Действие модификаторов при флотации силикатов и оксидов карбо-
ксильными собирателями...........................................129
10. Взаимодействие карбоксильных собирателей с солеобразными минера-
лами ...............................................................142
10.1. Сорбция карбоксильных собирателей и флотация солеобразных
минералов........................................................142
10.2. Действие регуляторов pH пульпы при флотации................150
10.3. Действие жидкого стекла при флотации солеобразных минералов ... 157
10.4. Депрессирующее действие хроматов, фосфатов и фторидов......165
10.5. Действие органических подавителей .........................166
11. Взаимодействие алкил сульфатов и алкилсульфонатов с минералами.169
11.1. Взаимодействие с оксидами и силикатами.....................169
11.2. Взаимодействие с солеобразными минералами..................171
12. Взаимодействие алкилгидроксамовых кислот с минералами..........172
12.1. Сорбция алкилгидроксамовых кислот минералами...............172
12.2. Действие модификаторов при флотации минералов гидроксаматами . 175
13. Взаимодействие минералов с катионными собирателями..............181
13.1. Механизм взаимодействия аминов с несульфидными минералами . . . 181
13.2. Действие модификаторов при флотации несульфидных минералов
катионными собирателями......................................... 187
13.3. Флотация сульфидных минералов катионными собирателями......200
13.4. Флотация растворимых солей катионными собирателями.........202
14. Механизм действия аполярных собирателей........................205
15. Механизм действия пенообразователей............................206
16. Механизм агрегирующего действия реагентов......................209
Часть I1L Физические основы минерализации пузырьков в пульпе. Флотацион-
ные машины..........................................................211
17. Кинетика флотации..............................................211
17.1. Модели флотации............................................212
17.2. Анализ однофазной модели...................................215
17.3. Условия эффективной флотации частиц различной крупности....239
17.4. Кинетика флотации в машинах периодического действия........241
17.5. Кинетика флотации в машинах непрерывного действия .........245
18. Флотационные машины........................................... 254
18.1. Механические флотационные машины.......................... 255
18.2. Пневмомеханичекие флотационные машины..................... 265
18.3. Пневматические флотационные машины........................ 278
18.4. Флотационные машины для крупнозернистой флотации.......... 285
183. Практика применения флотационных машин различных типов ...... 287
18.6. Выбор типа, размера и числа камер импеллерных флотационных
машин........................................................... 290
362
Часть IV. Технология флотации......................................292
19. Схемы флотации.................................................292
20. Режимы флотации.............................................. 304
20.1. Медные руды.............................................. 304
20.2. Молибденовые руды........................................ 310
20.3. Медно-цинковые руды . . . .'............................. 315
20.4. Медно-никелевые руды .................................... 320
20.5. Полиметаллические руды................................... 323
20.6. Окисленные свинцовые и цинковые руды..................... 329
20.7. Золотосодержащие руды ................................... 332
20.8. Вольфрамовые руды........................................ 332
20.9. Оловянные руды........................................... 335
20.10. Титановые руды.......................................... 336
20.11. Тантало-ниобиевые руды.................................. 337
20.12. Редкоземельные руды .................................... 340
20.13. Ртутные и сурьмяные руды................................ 342
20.14. Алюмо содержащие руды................................... 342
20.15. Бериллиевые руды ....................................... 344
20.16. Литиевые руды........................................... 345
20.17. Баритовые руды.......................................... 345
20.18. Флюоритовые руды........................................ 346
20.19. Фосфатные руды.......................................... 347
20.20. Полевошпатовые руды..................................... 349
20.21. Железные руды........................................... 350
20.22. Марганцевые руды........................................ 352
20.23. Хромитовые руды......................................... 353
20.24. Аполярные минералы...................................... 354
20.25. Растворимые соли........................................ 355
Список литературы................................................. 357
Оглавление
361
Теория и технология флотации руд/О.С. Богданов, И.И. Мак-
Т 38 симов, А.К. Поднек, Н.А. Янис: Под общей ред. О.С. Богдано-
ва. - 2-е изд., перераб. и доп. - М.: Недра, 1990. - 363 с.: ил.
ISBN 5-247-00449-3
Изложены основные представления о процессе флотации. Рассмотрены
теория флотации, механизм действия флотационных реагентов, кинети-
ка флотации. Во втором издании (1-е изд. - 1980) более полно осве-
щены процессы диспергирования и флокуляции частиц, влияние турбу-
лентности пульпы и размера частиц на их флотацию. Описаны конструк-
ции наиболее распространенных отечественных и зарубежных флотацион-
ных машин, приведены их технические характеристики. Рассмотрены реа-
гентные режимы и схемы флотации руд цветных, редких и черных метал-
лов, а также неметаллических полезных ископаемых.
Для инженерно-технических работников обогатительных фабрик и
научно-исследовательских институтов.
2504000000 - 016
043 (01) -90
ББК 33.4
ПРОИЗВОДСТВЕННОЕ (ПРАКТИЧЕСКОЕ) ИЗДАНИЕ
Богданов Орест Сергеевич
Максимов Исаак Исорович
Поднек Аустра Карловна
Янис Нина Александровна
ТЕОРИЯ И ТЕХНОЛОГИЯ ФЛОТАЦИИ РУД
Заведующий редакцией О.И. Паркани
Редактор издательства Т.Д. Новикова
Переплет художника В.П. Христинина
Художественный редактор Г.Н. Юрчевская
Технический редактор Н.С. Анашкина
Корректор ЕЛ. Одабашян
Операторы Ю.А. Савельева, И.А. Налейкина
ИБ № 6602
Подписано в печать с репродуцируемого оригинал-макета 08.12.89. Т- 18434.
Формат 60Х881/16- Бум. офсетная № 2. Гарнитура Пресс-роман. Печать офсет-
ная. Усл. печ. л. 22,54. Усл. кр.-отт. 22,78. Уч .-изд. л. 26,72. Тираж 2000 экз.
Зак. № 6926/797-9. Цена 1 руб. 70 к.
Набор выполнен на наборно-пишущей машине
Ордена ’’Знак Почета” издательство ’’Недра”.
125047 Москва, пл. Белорусского вокзала, 3.
Ордена Октябрьской революции и ордена Трудового Красного Знамени МПО
’’Первая Образцовая типография” Государственного комитета СССР по печати
113054 Москва, Валовая, 28