Author: Хелдт Г.В.
Tags: биология биохимия физиология растений сельское хозяйство агрономия
ISBN: 978-5-94774-795-5
Year: 2011
Text
Оглавление
Предисловие к английскому изданию.........5
Благодарности...............................6
Предисловие к русскому изданию............7
Введение.................................17
1. Органеллы растительных клеток................19
1.1. Клеточная стенка обеспечивает механическую
прочность растительной клетки......................21
Клеточная стенка растительной клетки
состоит преимущественно из углеводов
(полисахаридов) и белков.....................21
Плазмодесмы соединяют соседние клетки
и способствуют межклеточным
взаимодействиям..............................24
1.2. Функции вакуолей.............................26
1.3. Пластиды - эволюционные потомки
цианобактерий................................27
1.4. Митохондрии также произошли путем
эндосимбиоза.................................31
1.5. В пероксисомах проходят реакции с образованием
токсичных продуктов-интермедиатов............33
1.6. Эндоплазматический ретикулум и аппарат
Гольджи образуют пространственную
трехмерную сеть, отвечающую за распределение
продуктов биосинтеза.........................34
1.7. Препаративное выделение функционально
активных органелл растительных клеток..............37
1.8. Различные транспортные процессы обеспечивают
обмен метаболитами между компартментами
растительной клетки...............................38
1.9. Переносчики-транслокаторы обеспечивают
избирательный транспорт продуктов метаболизма
и молекул-субстратов..............................40
Все белки-транслокаторы имеют сходное
строение.....................................43
Аквапорины облегчают транспорт воды
через мембрану...............................44
1.10. Высокая пропускная способность ионных каналов.46
1.11. Для белков-поринов характерна р-складчатая
структура......................................49
Дополнительная дитература......................53
2. Использование энергии солнечного света
в процессе фотосинтеза - основа жизни
на Земле...................................55
2.1. Как возник фотосинтез?.....................55
2.2. Пигменты поглощают энергию солнечного света.56
Энергия световой волны зависит
от ее длины................................56
Хлорофилл — основной пигмент
фотосинтеза................................58
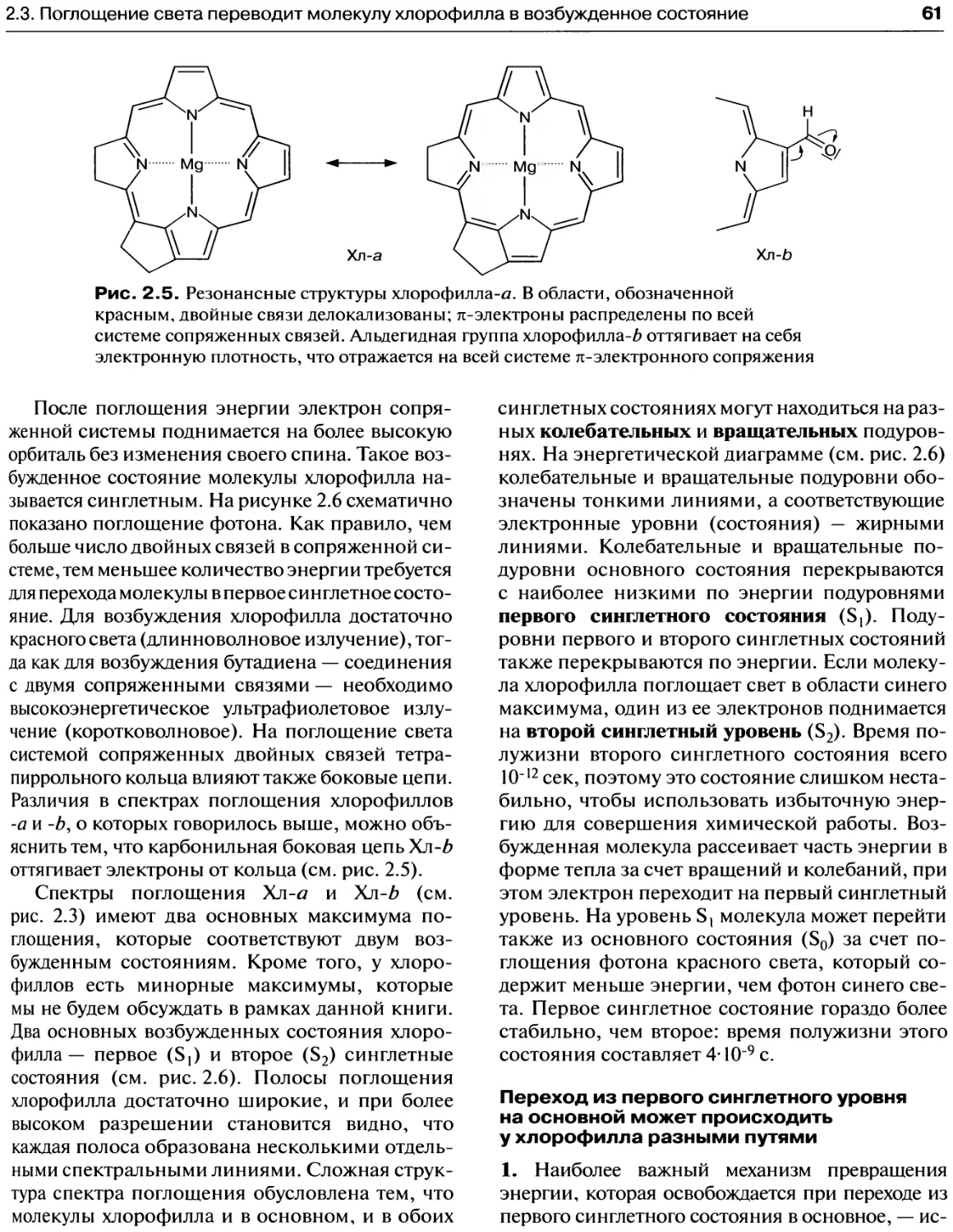
2.3. Поглощение света переводит молекулу
хлорофилла в возбужденное состояние........60
Переход из первого синглетного уровня
на основной может происходить
у хлорофилла разными путями................61
2.4. Антенна служит для сбора света.............64
Каким образом энергия фотонов,
поглощенная антенной,передается
в реакционный центр?.......................65
Функции антенны на примере антенны
ФС II.......................................66
Фикобилисомы позволяют
цианобактериям и красным водорослям
фотосинтезировать даже при слабом
свете......................................69
Дополнительная литература..................72
3. Транспорт электронов в процессе
фотосинтеза.....................................73
3.1. Фотосинтетический аппарат имеет
модульную организацию...........................73
3.2. В процессе фотосинтеза образуются окислитель
и восстановитель................................76
3.3. Основная структура фотосинтетического
реакционного центра была расшифрована
с помощью рентгено-структурного анализа.........77
Рентгеновская структура
фотосинтетического реакционного
центра.....................................78
Реакционный центр Rhodopseudomonas
viridis имеет симметричную структуру.......80
3.4. Как функционирует реакционный центр........81
3.5. У водорослей и растений два фотосинтетических
реакционных центра функционируют в тандеме.83
10
Оглавление
3.6. Окисление воды происходит в фотосистеме II.86
Комплекс фотосистемы II очень сходен
с реакционным центром пурпурных
бактерий..................................89
Механизированное сельское хозяйство
обычно требует применения гербицидов......91
3.7. Цитохрохром-Ь6 /7-комплекс обеспечивает транспорт
электрона между фотосистемами..................92
Атомы железа в составе цитохромов
и железосерных центров выполняет важнейшую
функцию передачи электрона................92
Электронный транспорт
в цитохром-/>6//-комплексе сопряжен
с транспортом протонов....................94
Число протонов, перекаченных через
цитохром-£6//-комплекс, может быть
удвоено в результате работы Q-цикла.......95
3.8. Фотосистема I восстанавливает НАДФ........97
При циклическом транспорте электрона
в ФС I энергия света используется
только для синтеза АТФ....................99
3.9. В отсутствие других акцепторов электроны
могут передаваться с фотосистемы I на кислород.... 101
3.10. Регуляторные механизмы контролируют
распределение поглощенных фотонов между
двумя фотосистемами...........................104
Избыточная энергия диссипируется в тепло.... 106
Дополнительная литература..................107
4. В процессе фотосинтеза образуется АТФ.. 109
4.1. Протон-движущая сила является промежуточной
формой запасания энергии в процессе
синтеза АТФ...................................109
4.2. Электрохимический протонный градиент может
быть диссипирован в тепло с помощью
разобщителей..................................111
Хемиосмотическая гипотеза была
доказана экспериментально................113
4.3. Н+-АТФ-синтазы бактерий, хлоропластов
и митохондрий имеют сходную структуру..........114
Рентгеноструктурный анализ F] части
АТФ-синтазы позволил изучить
механизм синтеза АТФ.....................115
4.4. Синтез АТФ происходит за счет изменения
конформации белка..............................116
В фотосинтетической электрон-
транспортной цепи стехиометрия
синтезированных НАДФН/АТФ все еще
является предметом дискуссий.............119
Н+-АТФ-синтаза хлоропластов
регулируется светом......................119
V-АТФаза родственна F-АТФ-синтазе........120
Дополнительная литература................120
5. Митохондрии — энергетические станции
клетки.........................................122
5.1. Биологическое окисление происходит за счет
разложения субстратов с образованием водорода
иСО2...........................................122
5.2. В митохондриях локализовано клеточное дыхание.... 123
Митохондрии образуют отдельный
метаболический компартмент.....................124
5.3. Расщепление субстрата для биологического
окисления происходит в матриксе................124
Пируват окисляется мультиферментным
комплексом................................126
Ацетат полностью окисляется в цикле
трикарбоновых кислот......................127
Отток интермедиатов цикла
три карбоновых кислот возмещается
за счет анаплеротических реакций..........129
5.4. Сколько энергии может быть запасено
в результате окисления НАДН?...................130
5.5. Дыхательная цепь митохондрий имеет много
общего с электрон-транспортной цепью
фотосинтеза....................................131
Комплексы митохондриальной
дыхательной цепи..........................131
5.6. Транспорт электронов в дыхательной цепи сопряжен
с синтезом АТФ через транспорт протонов........135
Митохондриальный электронный
транспорт приводит к образованию
мембранного потенциала ...................137
Синтез АТФ в митохондриях служит для
удовлетворения потребностей цитозоля
в энергии ................................137
5.7. У растительных митохондрий есть особые
метаболические функции.........................138
Митохондрии могут окислять НАДН
без образования АТФ.......................139
НАДН и НАДФН из цитозоля могут
окисляться в дыхательной цепи
растительных митохондрий..................140
5.8. Для компартментации митохондриального
метаболизма необходимы специальные
мембранные переносчики ........................140
Дополнительная литература.................142
6. В цикле Кальвина происходит
фотосинтетическая ассимиляция СО2..............143
6.1. Ассимиляция С02 происходит в темновых
реакциях фотосинтеза...........................143
6.2. Рибулозобисфосфаткарбоксилаза катализирует
реакцию фиксации С02...........................144
Оксигеназная реакция RubisCO:
дорогостоящая побочная реакция............147
Оглавление
11
Рибулозобисфосфаткарбоксилаза/
оксигеназа: особые свойства...............148
Активация RubisCO.........................148
6.3. При восстановлении 3-фосфоглицерата
образуется триозофосфат........................149
6.4. Рибулозобисфосфат регенерирует
из триозофосфата...............................150
6.5. Кроме восстановительного пентозофосфатного
пути есть также окислительный пентозофосфатный
путь...........................................156
6.6. Восстановительный и окислительный
пентозофосфатные пути регулируются.............157
Восстановленные тиоредоксины
передают «сигнал об освещении»
ферментным белкам.........................160
Активация хлоропластных ферментов
тиоредоксином происходит благодаря
встроенному регуляторному домену..........161
Многоуровневая регуляция обеспечивает
согласованность разных этапов
восстановительного пентозофосфатного
пути......................................162
Дополнительная литература.................163
7. При фотодыхании происходит
рециклирование фосфогликолата,
образовавшегося в результате
оксигеназной активности RubisCO .................165
7.1. Рибулозо-1,5-бисфосфат регенерирует
из 2-фосфогликолата..............................165
7.2. NH4+, который выделяется в процессе
фотодыхания, затем вновь фиксируется
в хлоропластах..................................170
7.3. Для восстановления гидроксипирувата
необходима поставка восстановительных
эквивалентов в пероксисомы......................171
Восстановительные эквиваленты
вносятся в пероксисомы через малат-
оксалоацетатный челнок.....................172
«Малатный кран» контролирует экспорт
восстановительных эквивалентов
из хлоропластов............................174
7.4. Матрикс пероксисом - специализированный
компартмент для утилизации токсичных отходов.....174
7.5. Насколько дорого обходится растениям
оксигеназная активность RubisCO?.................174
7.6. В точке углекислотной компенсации
суммарная фиксация СО2 равна нулю................176
7.7. Хотя фотодыхание требует затрат энергии,
этот метаболический путь может быть полезен
растению........................................177
Дополнительная литература...................177
8. Фотосинтез сопряжен с потерями воды.....178
8.1. Поступление СО2 в ткани листа
сопровождается испарением воды................178
8.2. Устьица регулируют газообмен листа.......179
Малат играет важную роль в метаболизме
замыкающих клеток........................179
Степень открытости устьиц сложным
образом регулируется.....................181
8.3. Поступление СО2 в растительную
клетку путем диффузии....................183
8.4. С4-растения ассимилируют СО2 с меньшими
затратами воды, чем С3-растения .........185
Концентрирование СО2 у С4-растений.......186
С4-метаболизм у растений
НАДФ-малатдегидрогеназного типа .........192
С4-метаболизм НАД-малатдегидро-
геназного типа...........................192
С4-метаболизм ФЕП-карбоксикиназного
типа.....................................192
Кранц-анатомия со специализацией клеток
на мезофилл и обкладку не является
необходимой для С4-метаболизма...........194
Ферменты С4-метаболизма регулируются
светом...................................194
Продукты С4-метаболизма могут быть
идентифицированы с помощью
масс-спектрометрии.......................194
К С4-растениям относятся как
сельскохозяйственные культуры,
так и сорняки............................195
8.5. Метаболизм по типу толстянковых (САМ)
позволяет растениям выживать в условиях засухи ... 195
СО2 фиксируется ночью и запасается
в форме яблочной кислоты (малата).............196
Фотосинтез происходит при закрытых
устьицах.................................197
С4-метаболизм, как и САМ, возникал
неоднократно в процессе эволюции.........199
Дополнительная литература................199
9. Полисахариды как запасные
и транспортные формы углеводов,
образованных в процессе фотосинтеза .... 201
Крахмал и сахароза — основные продукты
ассимиляции СО2 у многих растений........202
9.1. Большие количества углеводов могут запасаться
в клетках в виде крахмала.....................202
Синтез крахмала осуществляется через
стадию образования АДФ-глюкозы...........206
Деградация крахмала происходит двумя
различными путями........................206
Избыточные продукты фотосинтеза могут
временно запасаться в хлоропластах
посредством синтеза крахмала.............207
12
Оглавление
9.2. Синтез сахарозы происходит в цитозоле.......210
9.3. Утилизация триозофосфата, продукта
фотосинтеза, строго регулируется...............211
Фруктозо-1,6-бисфосфатаза регулирует
поступление углеводов в процесс
биосинтеза сахарозы.........................211
Сахарозофосфатсинтаза регулируется
не только метаболитами, но также
ковалентной модификацией....................214
Распределение ассимилятов между
сахарозой и крахмалом обусловлено
взаимодействием нескольких
регуляторных механизмов.....................215
9.4. У некоторых растений ассимиляты из листьев
экспортируются как сахароспирты
или олигосахариды семейства раффинозы .........216
9.5. Фруктаны как запасные вещества
откладываютсяв вакуоли ........................216
9.6. Целлюлоза синтезируется ферментами,
локализованными на плазматической мембране ....220
Синтез каллозы часто индуцируется
механическим повреждением ..................220
Полисахариды клеточной стенки
синтезируются также в аппарате Гольджи......222
Дополнительная литература...................222
10. Ассимиляция нитратов крайне важна
для синтеза органического вещества.............224
10.1. Существуют два последовательных этапа
восстановления нитрата до NH4+.................224
Нитрат восстанавливается до нитрита
в цитозоле..................................226
Восстановление нитрита до аммония
происходит в пластидах......................227
Фиксация NH4+ осуществляется
с помощью некоторых ферментов,
участвующих в фотодыхании ..................228
10.2. Ассимиляция нитрата происходит также в корнях ....230
Окислительный пентозофосфатный путь
производит восстановительные
эквиваленты для восстановления
нитрита в лейкопластах.........................230
10.3. Ассимиляция нитрата строго контролируется .231
Синтез белка нитратредуктазы
регулируется на уровне экспрессии гена......231
Нитратредуктаза также регулируется
обратимой ковалентной модификацией..........232
14-3-3-белки являются важными
метаболическими регуляторами...............233
В регуляции нитратредуктазы
и сахарозофосфатсинтазы много общего.......233
10.4. Конечным продуктом ассимиляции нитрата
является целый спектр аминокислот .............234
В процессе ассимиляции СО2
производятся углеродные скелеты
для синтеза конечных продуктов
ассимиляции нитрата .....................234
Для синтеза глутамата требуется участие
митохондриального метаболизма ...........237
Биосинтез пролина и аргинина.............237
Аспартат как предшественник пяти
аминокислот..............................239
Ацетолактатсинтаза участвует в синтезе
гидрофобных аминокислот..................241
Шикиматный путь синтеза ароматических
аминокислот .............................243
Глифосат действует как гербицид..........245
Существенная часть общей биомассы
растений образуется через шикиматный
путь.....................................245
10.5. Глутамат служит предшественником для синтеза
хлорофиллов и цитохромов......................246
Протопорфирин является также
предшественником синтеза гема............249
Дополнительная литература................249
11. Симбиотическая азотфиксация позволяет
растениям использовать азот воздуха...........251
11.1. Бобовые образуют симбиоз с клубеньковыми
бактериями....................................252
Образование клубеньков обусловлено
регулируемым взаимодействием
экспрессии специфических бактерий
и генов растения ........................254
Обмен метаболическими продуктами
между бактероидами и клетками
расте ния-хозяина........................254
Редуктаза нитрогеназы поставляет
электроны для нитрогеназной реакции......255
N2, как и Н+, восстанавливаются
нитрогеназой одновременно................256
11.2. Азотфиксация может осуществляться лишь
при очень низких концентрациях кислорода......257
11.3. Затраты энергии для использования N2 в качестве
источника азота значительно выше, чем для
использования N03"............................259
11.4. Растения улучшают свое питание
путем симбиоза с грибами......................259
Арбускулярная микориза широко
распространена...........................260
Эктомикориза снабжает деревья
элементами минерального питания..........261
11.5. Симбиоз с образование клубеньков, возможно,
эволюционировал на основе физиологических
механизмов, регулирующих формирование
арбускулярной микоризы........................261
Дополнительная литература................262
Оглавление
13
12. Ассимиляция сульфата
и синтезсеросодержащих веществ................263
12.1. Фотосинтез обеспечивает энергией
и восстановителями ассимиляцию сульфата.......263
Сходство процессов ассимиляции
сульфата и нитрата.......................263
Активация сульфата перед
восстановлением..........................264
Сходство сульфит-редуктазы
с нитрит-редуктазой......................266
Фиксация H2S в форме цистеина............266
12.2. Глутатион как антиоксидант и средство
детоксикации посторонних вредных веществ......267
Детоксикация ксенобиотиков с помощью
конъюгации...............................268
Фитохелатины и защита растений
от тяжелых металлов......................269
12.3. Синтез метионина из цистеина............269
S-аденозилметионин — универсальный
метилирующий реагент.....................269
12.4. Избыточные концентрации диоксида серы
в атмосфере токсичны для растений.............271
Дополнительная литература................271
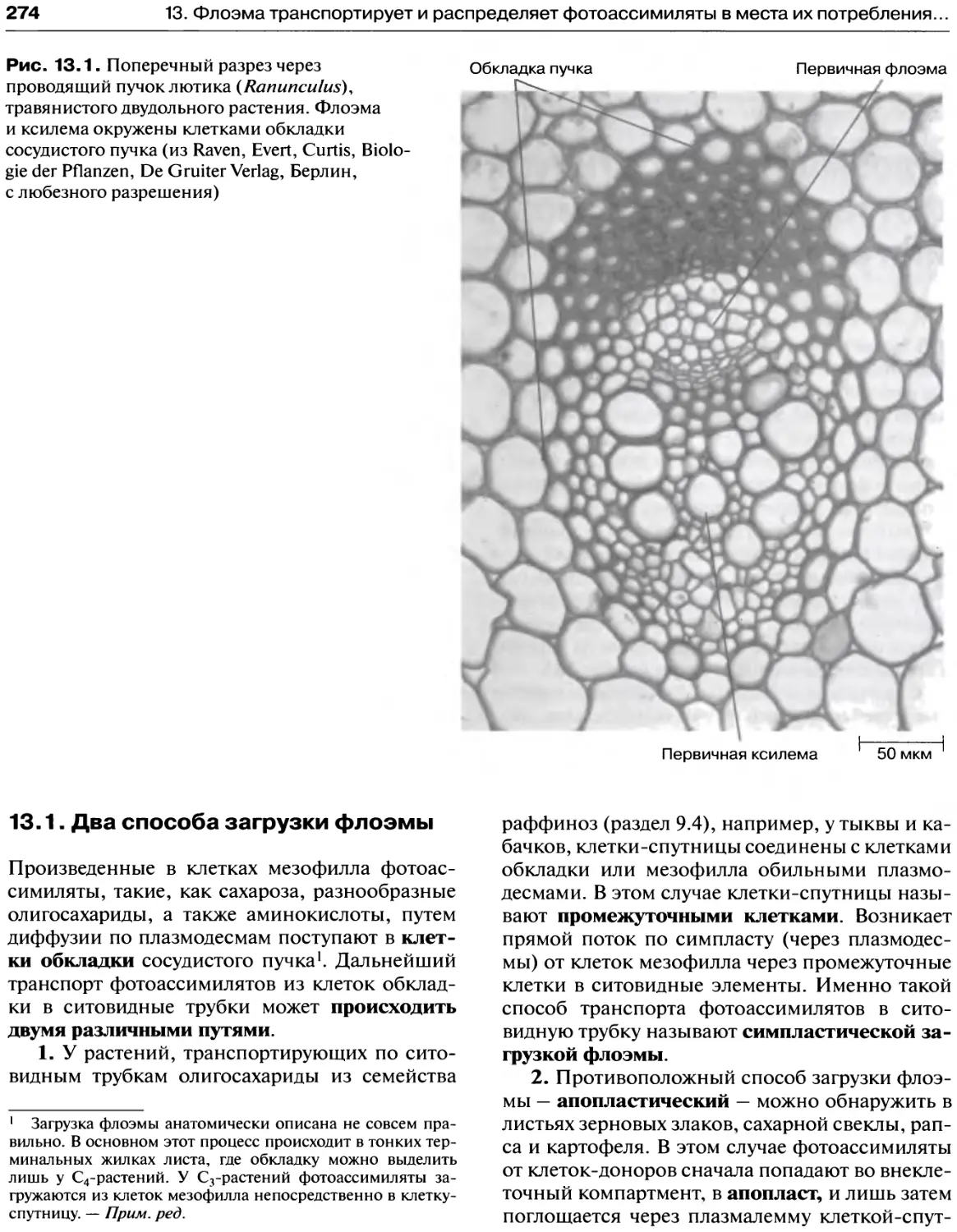
13. Флоэма транспортирует и распределяет
фотоассимиляты в места их потребления
или запасания.................................273
13.1. Два способа загрузки флоэмы.............274
13.2. Транспорт по флоэме происходит
за счет массового тока...................276
13.3. Ткани-акцепторы снабжаются фотоассимилятами
путем разгрузки флоэмы........................277
Крахмал откладывается в пластидах........278
Гликолиз является центральным
метаболическим путем расхода углеводов...278
Дополнительная литература................265
14. Продукты ассимляции нитратов
откладываются в растении в виде
запасных белков...............................283
14.1. Глобулины являются наиболее распространенными
запасными белками.............................284
14.2. Проламины образуются как запасные белки злаков.. 284
14.3. 25-Белки присутствуют в семенах
двудольных растений......................285
14.4. Особые белки защищают семена
от поедания животными.........................285
14.5. Синтез запасных белков осуществляется
в шероховатом эндоплазматическом ретикулуме...285
14.6. Протеиназы позволяют использовать аминокислоты,
отложенные в составе запасных белков..........288
Дополнительная литература................288
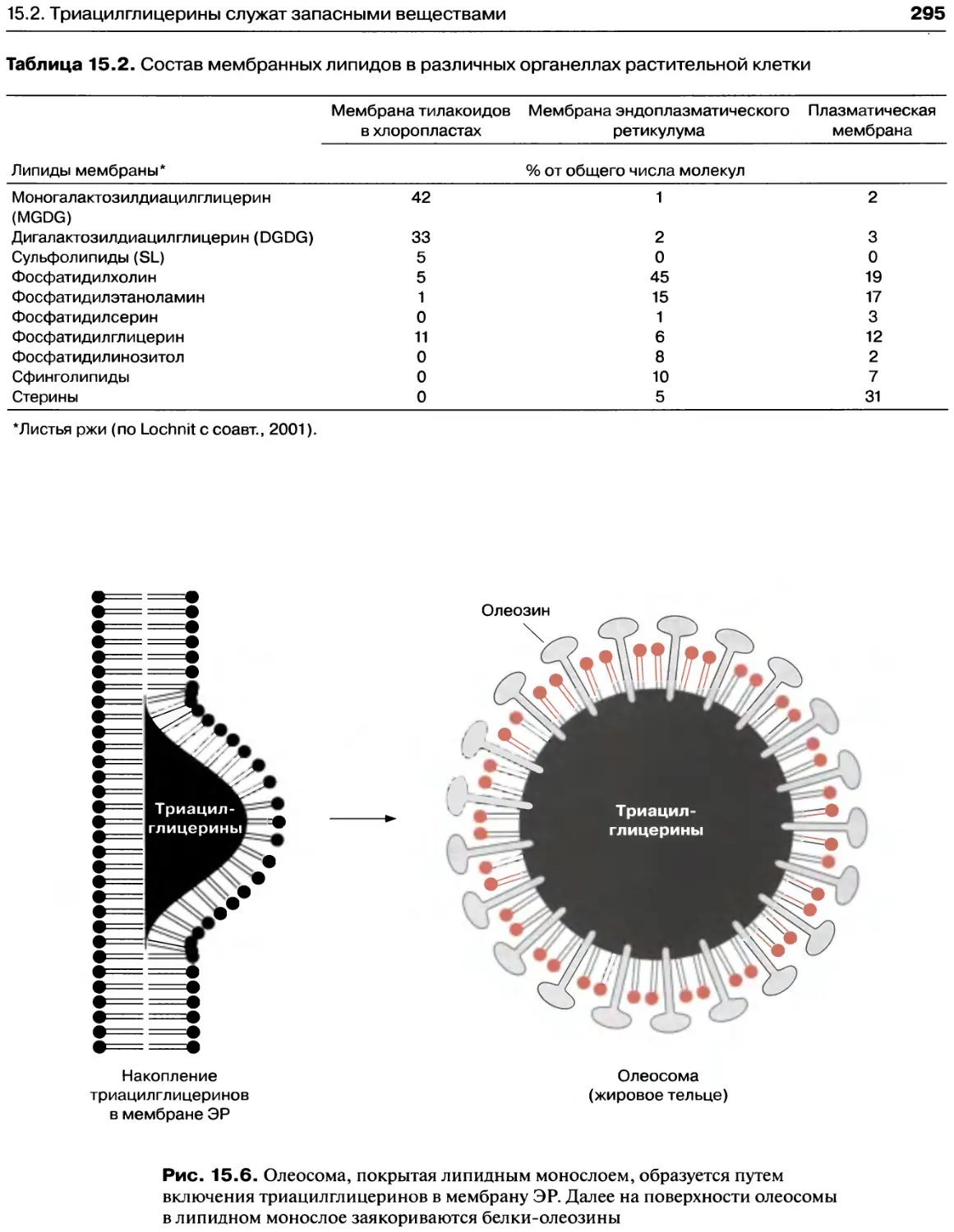
15. Глицеролипиды являются компонентами
мембраны и служат запасом углерода............289
15.1. Полярные глицеролипиды - важные
компоненты мембраны...........................289
Текучесть мембраны зависит от доли
ненасыщенных жирных кислот
и содержания стеринов...................292
Мембранные липиды содержат
разнообразные гидрофильные группы ......292
15.2. Триацилглицерины служат запасными
веществами...................................294
15.3. Синтез жирных кислот de novo происходит
в пластидах..................................294
Ацетилкоэнзим А — предшественник
в биосинтезе жирных кислот..............296
Ацетил-КоА-карбоксилаза — начальный
фермент биосинтеза жирных кислот........297
Дальнейшие этапы биосинтеза жирных
кислот происходят также при помощи
мультиэнзимных комплексов...............300
Первая двойная связь в новообразованную
жирную кислоту внедряется растворимой
десатуразой.............................301
Ацил-АПБ (продукт синтеза жирных
кислот в пластидах) может использоваться
двумя путями............................303
15.4. Глицерин-З-фосфат является предшественником
в синтезе глицеролипидов.....................304
Мембрана ЭР является местом
удлинения жирных кислот и введения
дополнительных двойных связей...........307
Некоторые из липидов пластидной
мембраны образуются
по эукариотическому пути................308
15.5. Триацилглицерины образуются в мембранах
эндоплазматического ретикулума...............308
Растительное масло находит применение
как продукт питания, а также
для технических целей...................309
Свойства растительных жиров можно
улучшить методами генной инженерии......311
15.6. Во время прорастания семян запасные липиды
мобилизуются в пероксисомах для синтеза
углеводов....................................312
Глиоксилатный никл позволяет
растениям синтезировать гексозы
из ацетил -Ко А.........................315
В пероксисомах протекают реакции
с образованием токсичных интермедиатов..315
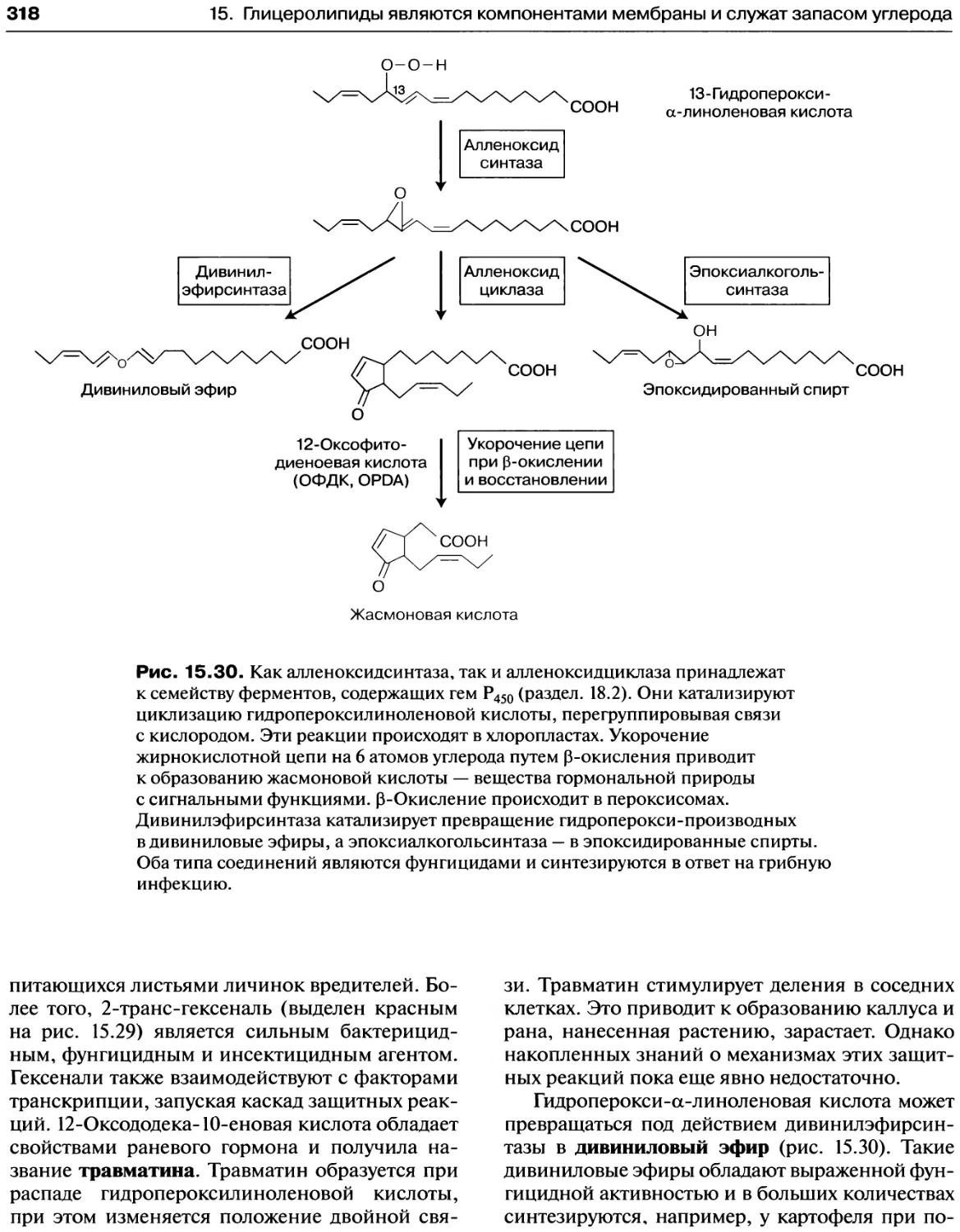
15.7. Липоксигеназа участвует в синтезе оксилипинов,
играющих роль сигнальных и защитных
соединений...................................316
Дополнительная литература................320
14
Оглавление
16. Вторичные метаболиты выполняют
в растениях прежде всего экологические
функции.......................................322
16.1. Вторичные метаболиты защищают растения
от патогенных микроорганизмов и травоядных....322
Микроорганизмы — потенциальные
патогены.................................322
В ответ на поражение патогенными
микроорганизмами растения
синтезируют фитоалексины.................323
Некоторые вторичные метаболиты
могут быть опасны для человека...........324
16.2. Алкалоиды объединяют обширную группу
вторичных метаболитов на основе гетероциклов..324
16.3. Некоторые растения для защиты от животных
используют синильную кислоту..................326
16.4. Некоторые растения при повреждении
выделяют летучие горчичные масла..............327
16.5. Синтез непротеиногенных аминокислот - еще один
способ защиты растений от травоядных..........328
Дополнительная литература................328
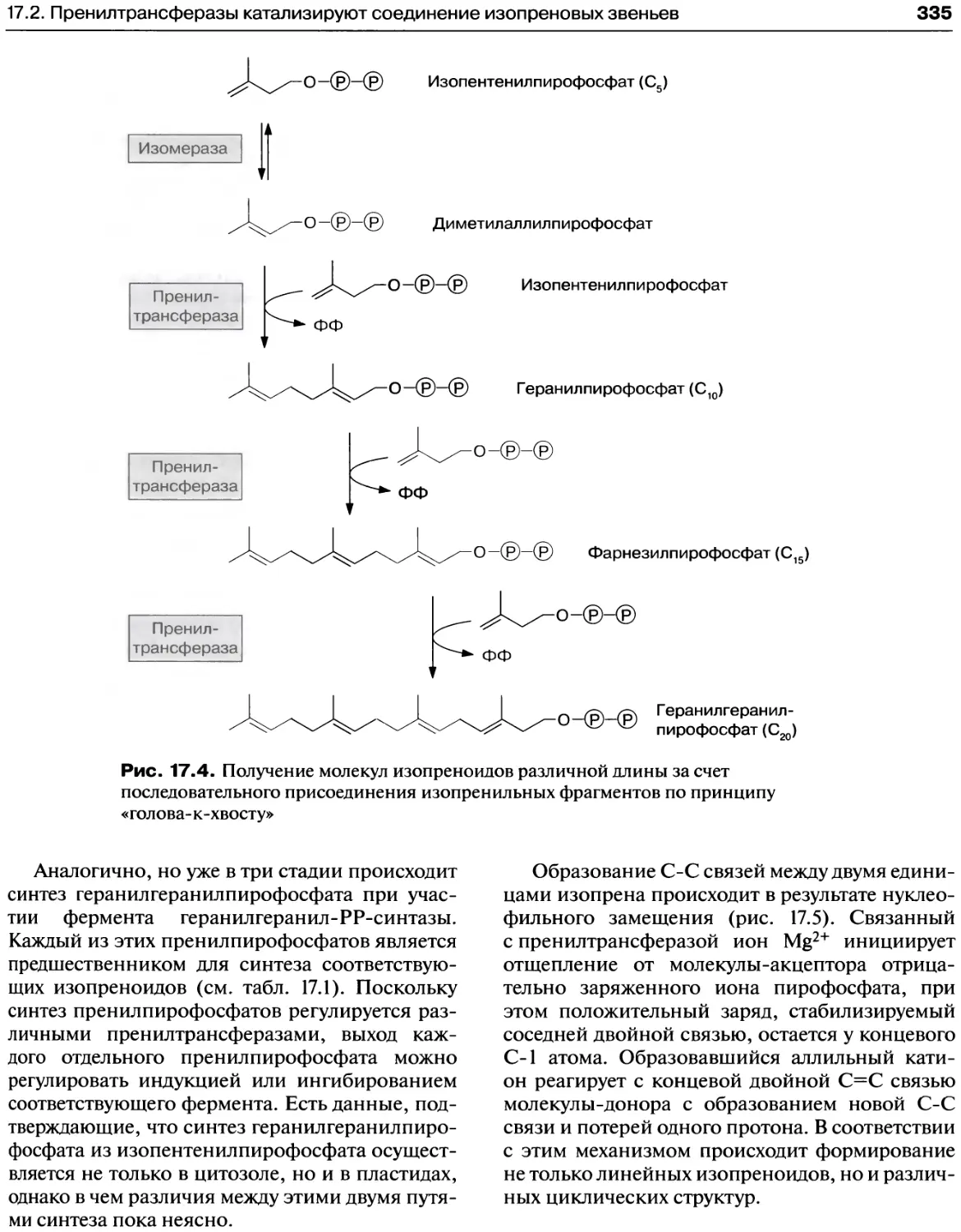
17. Изопреноиды — обширная группа
вторичных метаболитов растений,
обладающих широким спектром
биологической активности......................330
17.1. Два различных пути биосинтеза изопреноидов
у высших растений.............................332
Ацетил-СоА — предшественник синтеза
изопреноидов в цитозоле..................332
Пируват и D-глицеральдегид-З-фосфат —
предшественники биосинтеза
изопентенил-пирофосфата в пластидах......332
17.2. Пренилтрансферазы катализируют соединение
изопреновых звеньев...........................334
17.3. Некоторые растения выделяют газообразный
изопрен.......................................336
17.4. Многие соединения, входящие в состав эфирных
масел, являются производными
геранилпирофосфата............................337
17.5. Фарнезилпирофосфат - предшественник
биосинтеза сесквитерпенов.....................338
Фарнезилпирофосфат — предшественник
синтеза стероидов........................339
17.6. Геранил геранилпирофосфат - предшественник
биосинтеза фитогормонов, каротиноидов
и вторичных метаболитов, выполняющих
защитные функции..............................340
Интенсивное смолообразование — эффективное
средство защиты деревьев
от вредителей............................340
Каротиноиды — пигменты растений
и источник витамина А для животных......341
17.7. Пренильные группы позволяют веществам
проявлять липофильные свойства...............343
Белки могут заякориваться на мембране
путем пренилирования....................343
Долихолы — важные посреднки в процессе
гликозилирования белков.................344
17.8. Регуляция синтеза изопреноидов.........344
17.9. Изопреноиды отличаются высокой
стабильностью и устойчивостью.................345
Дополнительная литература...............345
18. Фенилпропаноиды - компоненты клеточной
стенки и предшественники вторичных
метаболитов ароматической природы............347
18.1. Исходная стадия биосинтеза фенилпропаноидов -
дезаминирование фенилаланина при участии
фермента фенилаланинаммиаклиазы...............347
18.2. Биосинтез фенолов с участием
монооксигеназ.................................349
18.3. Полимеризация фенилпропаноидов.........351
Защитные функции лигнанов...............353
Лигнин образуется при
свободнорадикальной полимеризации
производных фенилпропаноидов ...........353
Суберин и кутин формируют газо-
и водонепроницаемые слои на поверхности
клеточных стенок........................355
18.4. Флавоноиды и стильбены - фенольные
соединения с двумя ароматическими кольцами....356
Стильбены — природные фунгициды.........357
18.5. Функции флавоноидов в растительном организме.... 357
18.6. Защитные функции пигментов антоцианов..358
18.7. Таннины прочно связываются с белками,
что обусловливает их защитные функции.........359
Дополнительная литература...............361
19. Комплексная регуляция роста, развития
и приспособления к окружающей среде
растительного организма.................362
19.1. Цепи передачи сигналов, обнаруженные
у животных организмов, действуют и в растении.362
G-белки играют роль молекулярных
выключателей............................362
Регуляторные функции малых G-белков.....363
Са2+ как мессенджер в цепи передачи
сигналов................................364
Фосфатидил-инозитольная система открывания
Са2+-каналов............................364
Кальмодулин — посредник при работе
ионов кальция...........................365
Оглавление
15
Роль фосфорилирования белков
при передаче сигнала......................367
19.2. Основные классы фитогормонов.............369
19.3. Ауксин стимулирует рост растяжением......369
19.4. Гиббереллины регулируют удлинение стебля.372
19.5. Цитокинины стимулируют деление клеток....374
19.6. Абсцизовая кислота контролирует водный баланс
растений.....................................376
19.7. Этилен и созревание плодов...............378
19.8. Стероидные и пептидные гормоны растений..378
Брассиностероиды и контроль развития
растений..................................379
Полипептидные гормоны.....................380
Системин и защита от животных,
поедающих растения........................380
Фитосульфокины регулируют деление
клеток....................................380
19.9. Взаимодействие нескольких сигналов
при защитных реакциях........................381
19.10. Рецепторы света и регуляция роста
и развития растений..........................382
Дополнительная литература.................385
20. Три генома растительной клетки..............388
20.1. Организация генетической информации в ядре.388
Секвенирование и анализ ДНК ядерного
генома в двудольных и однодольных
растениях...................................391
20.2. Транскрипция ДНК ядерного генома
РНК-полимеразами..............................391
Регуляция транскрипции структурных
генов.....................................392
Элементы, регулирующие транскрипцию.
Промотор..................................392
Регуляция транскрипции гена...............393
Микро-РНК и ингибирование экспрессии
генов.....................................393
Транскрипция структурных генов............394
Созревание мРНК...........................397
Синтез рРНК и тРНК........................398
20.3. Полиморфизм ДНК и генетические маркеры
при скрещивании растений.....................398
Полиморфизм длин рестрикционных
фрагментов как метод характеристики
индивидуальных различий ..................399
Метод RAPD при исследовании
Д Н К-полиморфизма........................401
Полиморфизм микросателлитной ДНК
как генетический маркер...................402
20.4. Мобильные элементы ДНК...................404
20.5. Вирусы растительных клеток...............405
Ретротранспозоны и ретровирусы............407
20.6. Кольцевой геном пластид..................408
Сходство пластидного транскрипционного
аппарата с бактериальным..................410
20.7. Митохондриальный геном растения..........411
Пост-транскрипционное редактирование
мтРНК.....................................414
Мужская стерильность растений — важный
инструмент при выведении гибридов.........415
Дополнительная литература.................417
21. Биосинтез белков..........................419
21.1. Синтез белков на рибосомах...............419
Синтез пептидной цепочки..................421
Специфические ингибиторы трансляции
рибосом разного типа......................422
Регуляция трансляции......................425
21.2. Формирование трехмерной структуры белков.425
Многостадийный процесс сворачивания
белков....................................425
Защита белков в процессе сворачивания....426
Белки теплового шока и защита
от температурных повреждений..............426
Взаимодействие шаперонов
с несвернутыми белками....................426
21.3. Белки, кодируемые в ядре, распределяются
по разным компартментам клетки...............428
Транспорт белков в митохондрии............429
Транспорт белков в хлоропласты............431
Транспорт белков в пероксисомы............433
21.4. Протеасомная деградация белков...........434
Дополнительная литература.................436
22. Применение генно-инженерных технологий
в сельском хозяйстве, пищевой
промышленностии индустрии....................437
22.1. Выделение гена...........................437
Использование для выделения гена генетических
библиотек.................................437
Хранение генных библиотек в фагах.........439
Хранение геномных библиотек
в плазмидах...............................440
Поиск нужного гена в генной
библиотеке................................441
Идентификация клона с помощью
антител к нужному белку...................442
Идентификация клона с помощью
проб ДНК..................................443
Выделение генов, кодирующих
неизвестные белки.........................444
Идентификация генов с помощью
транспозонов или Т-ДНК....................444
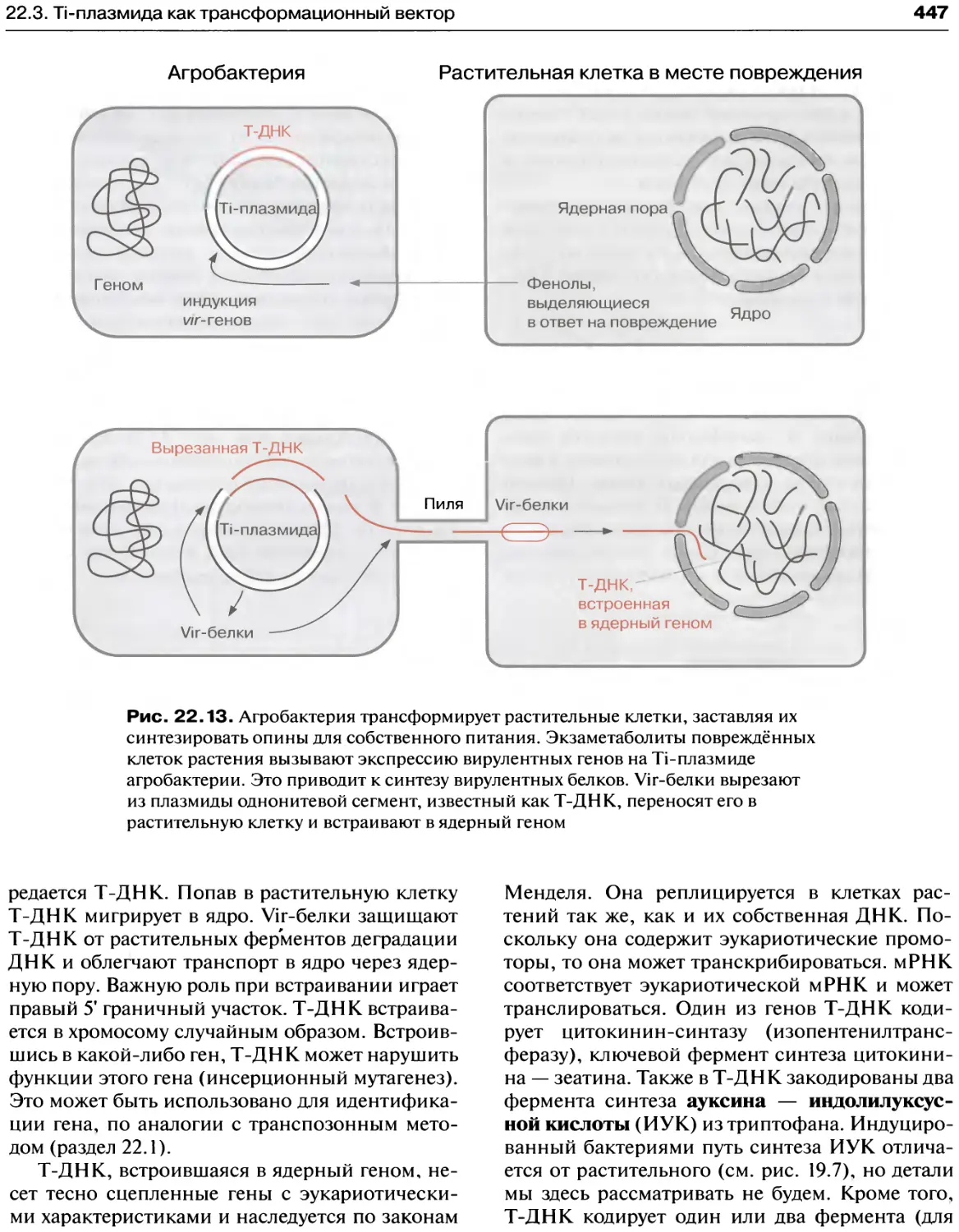
22.2. Агробактериальная трансформация
растительных клеток..........................445
Генетическая информация Ti-плазмиды.......446
16
Оглавление
22.3. Ti-плазмида как трансформационный вектор.448
Регенерация растений
из трансформированных клеток листа......450
Биобаллистический метод трансформации.....452
Трансформация протопластов..............452
Трансформация пластид...................452
22.4. Выбор подходящего промотора............455
Транспорт продуктов гена в различные
компартменты клетки с помощью
сигнальных последовательностей..........456
22.5. Выключение генов с помощью трансформации.456
22.6. Применение генной инженерии
растений очень разнообразно.............458
Защита растений от насекомых
с помощью БТ-токсина....................458
Защита растений от вирусов с помощью
генных технологий.......................459
Получение растений, устойчивых
к грибным инфекциям...................460
Получение растений, устойчивых
к гербицидам..........................460
Повышение качества и урожайности
сельскохозяйственных культур..........461
Использование трансгенных растений
для получения сырья в промышленности
и фармакологии........................461
Повышение устойчивости растений
к стрессовым воздействиям методами
генной инженерии......................461
Возможные риски при культивировании
трансгенных растений..................462
Дополнительная литература.............462
Предметный указатель.......................464
Введение
Биохимия растений изучает молекулярные про-
цессы, происходящие в растительном организ-
ме. Центральное место среди этих процессов
занимает фотосинтез, происходящий в основ-
ном в листьях у высших растений. Преобразуя
солнечную энергию, фотосинтез обеспечивает
потребности растений в углеводах и аминокис-
лотах, которые образуются из двуокиси углеро-
да, воды, нитратов и сульфатов. По проводящей
системе большая часть продуктов фотосинтеза
транспортируется из листьев по стеблю далее в
те части растения, где фотоассимиляты необ-
ходимы (например, в корни, чтобы снабдить их
энергией). Поэтому листья принято называть
донорами, а корни — акцепторами фотоасси-
милятов. Запасные ткани семян также являются
важными акцепторами. В зависимости от вида
растений в них откладываются углероды, белки
или жиры, что позволяет людям получать раз-
нообразные продукты питания из сельскохозяй-
ственных растений.
В противоположность большинству живот-
ных площадь поверхности растений очень вели-
ка, а листья приобретают небольшую толщину
для того, чтобы уменьшить до минимума рас-
стояние для диффузии СО2 и уловить настолько
много квантов света, насколько это возможно.
Многочисленные тонкие корневые волоски
позволяют растениям эффективно поглощать
воду и минеральные вещества из почвы. Вся
эта огромная площадь поверхности тела делает
растения особенно уязвимыми по отношению
к таким неблагоприятным фактором, как за-
суха, жара, охлаждение или даже замерзание, а
также избыток солнечного света. Смена дня и
ночи заставляет клетки листа переключаться с
фотосинтетических процессов в световое время
на окислительный метаболизм в темноте. Рас-
тения быстро приспосабливаются к этим рез-
ким изменениям внешних условий при помощи
удивительно гибких перестроек метаболизма,
которые были бы невозможны без множества
регуляторных процессов. Поскольку растения в
силу неподвижного образа жизни не могут убе-
жать от своих врагов, они разработали широкий
«арсенал» соединений, защищающих их от по-
едания.
Сельское хозяйство является основой для
обеспечения человечества продуктами питания.
Генно-инженерные технологии с применением
растений (которые можно рассматривать как
один из разделов биохимии или молекулярной
биологии растений) уже вносят свой вклад в
решение глобальной продовольственной про-
блемы, которая возникает в результате роста
населения земного шара. Приобрело большое
экономическое значение использование эко-
логически безопасных гербицидов, защита рас-
тений от вирусных и грибковых заболеваний с
помощью генной инженерии. Достижения мо-
лекулярной генетики растений стали важным
инструментом для оценки результатов скрещи-
вания и для создания новых особенно продук-
тивных сортов сельскохозяйственных растений.
Растения являются источником разнообраз-
ного сырья для промышленного производства,
такого, как техническое масло, крахмал. На
основе растительного сырья производят так-
же многочисленные лекарственные препараты.
Как ожидают, в ближайшем будущем развитие
генно-инженерных технологий приведёт к даль-
нейшему расширению использования растений
в различных отраслях промышленности и меди-
цины.
Это краткое перечисление областей приме-
нения растений призвано показать, что биохи-
мия и молекулярная биология растений — это
не просто важные фундаментальные науки,
объясняющие функции молекул в растениях.
Они имеют громадное практическое значение
18
Введение
и в настоящий момент переживают пору свое-
го революционного развития, вносят свой вклад
в решение важных экономических проблем.
Чтобы достичь решения практических задач,
потребуется тесная кооперация и интеграция
всех знаний о растительном организме, нако-
пленных такими отраслями наук о растениях,
как биоэнергетика, биохимия первичного и
вторичного метаболизма, молекулярная биоло-
гия, физиология растений, клеточная биология.
Только путём интеграции результатов и методов
работы в рамках различных наук можно достичь
понимания того, как функционирует раститель-
ный организм, и применить накопленные зна-
ния для получения экономического эффекта.
В книге приведены лишь некоторые примеры
того, каким образом этого можно достичь.
К настоящему времени издано много учеб-
ников по обшей биохимии, элементарные био-
химические понятия здесь не рассматриваются,
поскольку читатель может почерпнуть эти зна-
ния из других книг.
Органеллы растительных клеток
У высших растений фотосинтез осуществля-
ется преимущественно в мезофилле — важ-
нейшей ткани листа, содержащей хлоропласты.
На рисунке 1.1 представлена электронная
микрофотография клеток мезофилла листа, а
на рис. 1.2 — схема строения клетки мезофилла.
От внешней среды клеточное содержимое от-
делено плазматической мембраной (плазма-
леммой) и жесткой клеточной стенкой. Вну-
триклеточное пространство подразделяется на
компартменты — органеллы. В зависимости от
типа клетки, органеллы выполняют различные
Рис. 1.1. Электронная микрофотография губчатого мезофилла табака. У многих
клеток видна крупная центральная вакуоль (v). Клетки рыхло связаны между собой,
есть большие межклетники (ig). (с) — хлоропласты, (cw) — клеточная стенка, (п) —
ядро, (т) — митохондрия (по D.G. Robinson, Гейдельберг)
20
1. Органеллы растительных клеток
Хлоропласт
Пероксисома
Митохондрия
Ядрышко
Плазмодесма
Ядерная оболочка
Ядро
Гладкий (агранулярный)
эндоплазматический ретикулум (ЭР)
Шероховатый (гранулярный) ЭР
Аппарат Гольджи
Срединная пластинка
Клеточная стенка
Плазматическая мембрана (плазмалемма)
Рис. 1.2. Схема строения клетки мезофилла листа
специфические функции, которые будут обсуж-
даться более подробно в последующих главах
(табл. 1.1).
Органеллы погружены в цитоплазму, суще-
ственную часть которой составляет цитозоль.
Самая большая органелла клетки — вакуоль.
Она заполняет 80% от общего клеточного объ-
ема. К крупным органеллам относят также хло-
ропласты. Остальной объем клетки приходится
на цитозоль, митохондрии, пероксисомы, ядро,
эндоплазматический ретикулум (ЭР), аппарат
Гольджи. В цитоплазме некоторых раститель-
ных клеток (например, в семенах или тканях
корневых клубеньков) содержатся сферические
липидные капли (олеосомы), которые форми-
руются в ЭР за счет накопления молекул триа-
цилглицеридов.
Содержимое ядра клетки окружает ядерная
оболочка, состоящая из двух мембран, возника-
ющих в телофазе из мембран ЭР. Пространство
между мембранами называют перинуклеарным
пространством. Ядерная оболочка пронизана
ядерными порами диаметром около 50 нм. В
ядре клетки содержится хроматин, который со-
стоит из двойных спиралей ДНК, связанных с
комплексами белков — основных гистонов, про-
являющих щелочные свойства. Совокупность
генов, локализованных в ядре, составляет ядер-
ный геном. В ядре также расположено ядрышко,
где при транскрипции ДНК происходит синтез
РНК рибосомальных субъединиц (рРНК). Эти
рибосомальные субъединицы и матричные РНК
(мРНК) мигрируют через ядерные поры в цито-
золь к рибосомам, осуществляющим биосинтез
белков. Синтезированные белки распределяют-
ся между различными компартментами клетки в
соответствии с их конечным назначением.
Заполненное цитозолем внутриклеточное
пространство пронизано трехмерной сетью из
белковых нитей — цитоскелетом, который пред-
ставляет собой совокупность микротрубочек и
микрофиламентов, построенных из особых
глобулярных белков. Микротрубочки образуют-
ся путем сборки двух глобулярных мономеров
а- и р-тубулина. Микротрубочки связаны с раз-
личными моторными белками и осуществляют
транспорт органелл в присутствии АТР. Микро-
филаменты образованы цепочками белка акти-
1.1. Клеточная стенка обеспечивает механическую прочность растительной клетки
21
Таблица 1.1. Внутриклеточные органеллы клеток мезофилла* и некоторые их функции
Процент
от общего объема Функции
клетки
Вакуоль 79 Поддержание тургора клетки, накопление запасных и токсичных ве- ществ
Хлоропласты 16 Фотосинтез, синтез липидов и крахмала
Цитозоль 3 Осуществление процессов внутриклеточного метаболизма, синтез сахарозы
Митохондрии 0,5 Дыхание клетки
Ядро Пероксисомы Эндоплазматический ретикулум (ЭР) Олеосомы Аппарат Гольджи 0,3 Хранение генетической информации клетки (генома) Место синтеза нуклеиновых кислот (репликация, транскрипция) Осуществление метаболических реакций с образованием и распадом активных форм кислорода Запасание ионов Са2+, синтез и транспорт белков в вакуоль, экспорт белков из клетки Запасание триацилглицеридов Модификация, сортировка и транспорт белков в вакуоль, экспорт белков из клетки
* На примере клетки мезофилла шпината (по Winter, Robinson, Helt, 1994)
на (сходного по строению с мышечным акти-
ном), который при взаимодействии с миозином
также способствует внутриклеточному движе-
нию. Цитоскелет формирует пространственную
опорно-двигательную систему клетки, осущест-
вляет взаимосвязь и перемещение внутрикле-
точных структур, отчасти обеспечивает термо-
стойкость клетки, а также участвует в клеточном
делении и межклеточных взаимодействиях.
1.1. Клеточная стенка обеспечивает
механическую прочность
растительной клетки1
Одно из основных отличий растительных кле-
ток от животных — наличие жесткой полисаха-
ридной клеточной стенки, защищающей содер-
жимое клетки и поддерживающей ее размер и
форму. Под давлением пассивно поступающей
1 Это лишь одна из функций клеточной стенки (достаточ-
но важная). Кроме того, клеточная стенка обладает опреде-
ленными ионообменными свойствами, служит источником
сигнальных молекул (олигосахаринов), содержит различные
ферменты и т.д. — Прим. ред.
в клетку воды плазмалемма прижимается к вну-
тренней поверхности эластично растягиваю-
щейся клеточной стенки, создавая внутреннее
тургорное давление, препятствующее дальней-
шему осмотическому проникновению воды и
разрыву клетки.
Клеточная стенка растительной клетки
состоит преимущественно из углеводов
(полисахаридов) и белков
Клеточная стенка высших растений почти на
90% состоит из полисахаридов и только на
10% из белков. Одним из основных углевод-
ных компонентов клеточной стенки является
целлюлоза, представляющая собой линей-
ную цепь остатков D-глюкозы, соединенных
между собой (р-(1—>4))-гликозидными связя-
ми (рис. 1.3л), при этом каждый последующий
глюкозный остаток повернут на 180° относи-
тельно предыдущего. Такая структура позволяет
образовывать длинные полимерные цепочки,
содержащие от 2000 до 25000 глюкозных остат-
ков. Отдельные макромолекулы целлюлозы
соединяются между собой водородными свя-
22
1. Органеллы растительных клеток
Р-1,4-D-глюкан
а (Целлюлоза)
L-арабиноза
о-ксилоза D-ксилоза
б D-галактоза
I
D-фукоза
Ксилогликан (Гемицеллюлоза)
(К ДЭе
Н ОН Н ОН
поли-р-1,4-0-галактуроновая кислота, основная структурная единица пектина
Рис. 1.3. Основные структурные компоненты клеточной стенки: (а) целлюлоза,
(б) гемицеллюлоза, (в) строение пектинов
зями с образованием пространственных пара-
кристаллических структур — микрофибрилл.
У высших растений каждая микрофибрилла в
поперечном сечении состоит примерно из 36
цепочек целлюлозы. Микрофибриллы целлю-
лозы нерастворимы в воде, обладают повышен-
ной механической прочностью, чрезвычайно
устойчивы к химическому и ферментативному
(энзиматическому) гидролизу. Тем не менее
целлюлоза может разрушаться под действием
гидролитических ферментов (целлюлаз) неко-
торых грибов и бактерий. Такие ферменты вы-
деляют симбиотические бактерии, составляю-
щие микрофлору желудочно-кишечного тракта
некоторых травоядных животных (например,
жвачных), что позволяет им эффективно пере-
варивать траву и солому.
Еще один важнейший компонент клеточной
стенки — гемицеллюлозы, представляющие
собой гибкие полисахаридные структуры, под-
дающиеся экстракции щелочными раствора-
ми. Первоначально гемицеллюлозы ошибочно
считали предшественниками целлюлозы, впо-
следствии название сохранилось1. Гемицеллю-
лозы представляют собой обширную гетероген-
1 В биохимии растений термин «гемицеллюлоза» все чаще
заменяют на «сшивочные гликаны». — Прим. ред.
1.1. Клеточная стенка обеспечивает механическую прочность растительной клетки 23
ную группу полисахаридов, которые помимо
D-глюкозы содержат в своем составе остатки
гексоз (D-маннозы, D-галактозы, D-фукозы)
и пентоз (D-ксилозы и L-арабинозы). На
рис. 1.3# в качестве примера показана струк-
тура полимерной молекулы ксилоглюкана.
Основой ксилоглюканов является линейная
цепочка р-1,4-О-глюкана, к которой (al—>6)-
гликозидными связями присоединены остатки
D-ксилозы, связанные в свою очередь с остат-
ками D-галактозы и D-фукозы. Кроме того, по
2-ОН-группам к остаткам глюкозы может при-
соединяться L-арабиноза.
Помимо целлюлозы и гемицеллюлоз в состав
клеточной стенки входят пектины, представ-
ляющие собой смесь кислых полисахаридов,
основу полимерной цепи которых составляют
остатки D-галактуроновой кислоты, связанные
([И—>4)-гликозидным и связями (рис. 1.3в). При
метилировании карбоксильных групп возмож-
но образование метоксилированных пектинов.
Свободные карбоксильные группы соседних
макромолекул полигалактуроновых кислот спо-
собны взаимодействовать с ионами Са2+ и Mg2+,
что приводит к сшиванию отдельных полимер-
ных цепочек в единую пространственную сеть,
которая формирует аморфный гель, способный
к набуханию (рис. 1.4). В отсутствие ионов Са2+ и
Mg2+ пектин превращается в растворимое веще-
ство. Благодаря этим свойствам пектин широко
используется в пищевой промышленности.
Разветвленные цепочки полисахаридов свя-
заны гликозидными «мостиками» с некоторыми
структурными белками клеточной стенки, обра-
зуя гликопротеины, от 50 до 90% массы которых
составляют углеводы. В клеточной стенке также
могут содержаться воска (глава 15), кутин и су-
берин (глава 18).
Снижение прочности клеточной стенки
и ослабление связи между компонентами ма-
трикса приводит к тому, что клеточная стенка
растягивается, при этом происходит рост клет-
ки. В процессе растяжения участвуют белки
экспансины, чья функция, по-видимому, со-
стоит в разрушении водородных связей между
микрофибриллами целлюлозы и связующими
полисахаридами. Экспансины обязательно при-
сутствуют в растущих тканях всех цветковых
растений.
Клеточные стенки делят на два типа — пер-
вичную и вторичную. Первичная клеточная
стенка формируется на заключительных эта-
пах роста клетки. Она проницаема для молекул
воды. У однодольных растений первичная кле-
точная стенка «среднестатистической» клетки
на 20—30% состоит из целлюлозы, 25% — геми-
целлюлозы, 30% — пектина и на 5—10% из струк-
турных белков. В первичной клеточной стенке
пектины, гемицеллюлозы и гликопротеины об-
разуют несколько пространственных сетей, в
которые встроены микрофибриллы целлюлозы.
Вторичная клеточная стенка образуется при
достижении клеткой окончательного размера за
счет отложения новых слоев целлюлозы с вну-
тренней стороны первичной клеточной стен-
ки. При этом микрофибриллы целлюлозы рас-
полагаются под разными углами, что приводит
к созданию сложной многослойной структуры
(рис. 1.5).
Образование вторичной клеточной стенки
и прекращение роста у некоторых клеток совпа-
дает с началом синтеза лигнина, образующего-
Рис. 1.4. Сшивание отдельных макромолекул полигалактуроновых кислот
ионами Са2+ и Mg2+
24
1. Органеллы растительных клеток
Рис. 1.5. Клеточная стенка зеленой морской водоросли Oocystis solitaria.
Микрофибриллы целлюлозы ориентированы под различными углами, формируя
многослойную сетчатую структуру. Снимок получен методом замораживания /
скалывания (по D.G. Robinson, Гейдельберг)
ся при полимеризации фенилпропаноидов —
кумарового, кониферилового и синапового
спиртов (этот процесс подробно описывается
в разделе 18.3). Лигнификация (или одревесне-
ние) клеточных стенок приводит к образованию
жесткой и прочной структуры, которая позво-
ляет дифференцированным клеткам и после
отмирания выполнять функцию своеобразного
опорного скелета (например, при ветвлении или
формировании стеблей травянистых растений).
Лигнин — одно из самых распространенных
веществ в природе после целлюлозы. Так, сухая
древесина состоит из 30% лигнина, 40% — цел-
люлозы и 30% — гемицеллюлоз.
Плазмодесмы соединяют соседние
клетки и способствуют межклеточным
взаимодействиям
Межклеточное взаимодействие осуществля-
ется по плазмодесмам, пронизывающим кле-
точную стенку. Через плазмодесмы могут про-
никать небольшие молекулы с молекулярной
массой 800—900 Да, например такие продукты
метаболизма, как растворимые сахара, амино-
кислоты и свободные нуклеотиды1. Отдельная
растительная клетка может содержать от 1000
до 10000 плазмодесм1 2. Плазмодесмы соединяют
цитоплазму клеток в единый протяженный ком-
партмент — симпласт, по которому из клетки в
клетку могут диффундировать различные веще-
ства (рис. 1.6). Контактирующие между собой
клеточные стенки соседних клеток с межклет-
никами формируют апопласт (см. рис. 1.2).
Схема строения плазмодесмы показана на
рис. 1.7. Каждая плазмодесма представляет со-
бой канал (трубку), выстланный плазмалем-
мой, которая непрерывно переходит из клетки
в клетку. В центральной части канала распола-
гается десмотрубочка, связывающая эндоплаз-
1 По современным данным через плазмодесмы селективно
могут проходить и более крупные молекулы (белки, рибону-
клеопротеиновые комплексы). — Прим. ред.
2 Не все клетки имеют плазмодесмы. — Прим. ред.
1.1. Клеточная стенка обеспечивает механическую прочность растительной клетки
25
Рис. 1.6. Плазмодесмы соединяют
цитоплазму смежных клеток в единую
систему — симпласт. Контактирующие
между собой клеточные стенки соседних
клеток с межклетниками формируют
апопласт. На рисунке представлено
схематическое изображение такой системы.
В действительности каждый участок
контактирующих клеточных стенок
содержит не одну, а множество плазмодесм
Рис. 1.7. Схема строения плазмодесмы.
Плазмодесма представляет собой канал,
выстланный плазмалеммой, непрерывно
переходящей из клетки в клетку. В центре
канала расположена десмотрубочка —
мембранная структура, являющаяся
частью ЭР соседних клеток. Пространство
между плазмалеммой и мембраной ЭР
заполнено спирально расположенными
белковыми субъединицами, расстояние
между которыми определяет пропускную
способность плазмодесмы:
(а) продольный срез, (б) поперечный срез
Плазмалемма
б
26
1. Органеллы растительных клеток
магический ретикулум (ЭР) смежных клеток в
единую систему. По пространству между плаз-
малеммой и десмотрубочкой осуществляется
диффузия веществ между цитоплазматически-
ми компартментами соседних клеток. Белковые
частицы прикреплены к наружной мембране
плазмодесмы и к мембране десмотрубочки, и
при этом соединены друг с другом с помощью
сократимых белков. Предполагают, что благода-
ря изменению свободного пространства между
белковыми частицами регулируется пропуск-
ная способность плазмодесм. Многочисленные
вирусы растений, включая вирус табачной мо-
заики (ВТМ), синтезируют особые белки, от-
ветственные за перемещение вируса из клетки в
клетку (virus movement proteins). Эти белки из-
меняют проницаемость плазмодесм настолько,
что вирусная нуклеиновая кислота, связанная с
транспортирующим белком, может проникать
через плазмодесму. Таким образом, после зара-
жения одной клетки вирус распространяется по
всему пространству симпласта. Оказалось, что в
расширении плазмодесм при помощи вирусных
белков, заметную роль играет цитоскелет. Су-
ществует также естественный механизм обмена
макромолекулами (РНК, белками) по плазмо-
десмам между соседними клетками. Подобный
механизм могут использовать вирусы при рас-
пространении по растению. Вероятно, есть соб-
ственные транспортные белки растений, кото-
рые переносят макромолекулы с затратой АТФ.
По этому пути по симпласту могут распростра-
няться сигнальные молекулы, например, транс-
крипционные факторы.
Клеточная стенка растительных клеток может
разрушаться (лизироваться) под действием ги-
дролитических ферментов грибов и микроорга-
низмов — целлюлаз и пектиназ. Клетки, лишен-
ные клеточной стенки (например, в результате
инкубации растительной ткани с соответствую-
щими ферментами), называют протопластами.
У протопластов нарушена регуляция водообме-
на, поэтому они стабильны только в изотониче-
ских средах, осмотическое давление которых
соответствует осмотическому давлению вну-
триклеточной жидкости. Если поместить изо-
лированный протопласт в чистую воду, он будет
увеличиваться в объеме за счет осмотического
поступления воды до полного разрушения. При
культивировании на специально подобранных
питательных средах протопласты некоторых
растений способны вновь синтезировать кле-
точную стенку, делиться, образовывать каллус и
регенерировать целое растение.
1.2. Функции вакуолей
Вакуоль растительной клетки представляет со-
бой органеллу, заполненную жидкостью и окру-
женную мембраной — тонопластом. В клетках
растений разных видов вакуоли значительно
отличаются по форме и размерам. Как правило,
молодые клетки содержат много маленьких ва-
куолей, занимающих небольшую часть клеточ-
ного объема. По мере роста и развития клетки
мелкие вакуоли сливаются в несколько крупных
или в одну центральную вакуоль (см. рис. 1.1 и
1.2). За счет увеличения размера вакуолярного
компартмента происходит растяжение и увели-
чение размеров самой клетки. В клетках запа-
сающих и эпидермальных тканей вакуоль мо-
жет занимать практически все внутриклеточное
пространство.
Одна из важнейших функций вакуоли — под-
держание тургора клетки. За счет транспорти-
руемых через тонопласт солей органических и
неорганических кислот содержимое вакуоли
обладает высоким осмотическим потенциа-
лом. Вода за счет осмоса поступает в вакуоль,
которая при этом увеличивается в объеме и
оказывает давление на сравнительно жесткую
клеточную стенку. Именно тургорное давление
поддерживает стебли и листья травянистых рас-
тений в вертикальном положении и придает им
упругость. При недостатке воды тургорное дав-
ление падает, и растение увядает.
Важная функция вакуолей — разрушение
и реутилизация тех клеточных структур, кото-
рые повреждены или не нужны в данный мо-
мент. Некоторые вакуоли содержат различные
гидролитические ферменты — гидролазы, ко-
торые способствуют расщеплению различных
метаболитов — белков, нуклеиновых кислот,
полисахаридов, а также участвуют в утилизации
структурных компонентов клетки. В процессе
эндоцитоза клеточные органеллы (например,
митохондрии) включаются в литическую ва-
куоль и подвергаются деградации. Аминокис-
лоты и углеводы, образующиеся в результате
действия ферментов, транспортируются из ва-
1.3. Пластиды — эволюционные потомки цианобактерий
27
куоли в клетку и вторично используются в про-
цессах клеточного метаболизма. Рециклизация
веществ особенно актуальна во время запро-
граммированного старения клеток и тканей
(раздел 19.5), когда перед листопадом из листьев
выводятся метаболически важные соединения,
которые в дальнейшем используются при фор-
мировании семян.
Еще одна важная функция вакуолей — обез-
вреживание ядовитых соединений, которые
изолируются в вакуолярных системах и таким
образом исключаются из обмена веществ клет-
ки. Например, так происходит накопление ток-
сичных продуктов клеточного метаболизма (за
исключением газообразных метаболитов), а
также различных ксенобиотиков в вакуолях ли-
ста (глава 12).
Кроме того, вакуоли растительных клеток
используются для запасания различных ве-
ществ. В вакуолярных системах хранится запас
нитратов и фосфатов, в вакуолях клеток листа
накапливается яблочная кислота (раздел 8.5),
в вакуолях запасающих тканей откладываются
углеводы (раздел 13.3) и запасные белки (гла-
ва 14). Многие растительные клетки одновре-
менно содержат и литические, и запасающие
вакуолярные системы, изолированные друг от
друга.
Благодаря запасающим свойствам вакуолей,
растения можно использовать как природные
«фабрики» белков. Современные методы ген-
ной инженерии позволяют создавать транс-
генные растения-продуценты с повышенным
содержанием экономически ценных типов бел-
ков, например, специфичных антител, которые
будут в значительных количествах накапливать-
ся в запасающих вакуолях растительных клеток.
Отработка методов культивирования таких рас-
тений позволит значительно снизить затраты на
получение подобных веществ.
1.3. Пластиды - эволюционные
потомки цианобактерий
Пластиды — органеллы, которые характерны
только для растительных клеток. Они способны
к интенсивному делению, наследование пла-
стид происходит чаще всего через яйцеклетку
(материнское наследование). Предшествен-
никами всех типов пластид являются пропла-
стиды, которые в процессе дифференциации
клетки могут превращаться в зеленые фотосин-
тезирующие хлоропласты, в хромопласты,
содержащие цветные пигменты (желтые, оран-
жевые или красные каротиноиды) или в бесц-
ветные лейкопласты. Для пластид характерно
наличие пластидного генома (пластома), ор-
ганизация которого напоминает структуру ге-
нома прокариот, например — цианобактерий.
Все пластиды обладают собственной кольцевой
ДНК и набором ферментов, которые отвечают
за дупликацию и экспрессию генов1, а также
совместно с ядерным геномом контролируют
синтез пластидных белков, причем ядерными
генами кодируется большая их часть. В пла-
стидном геноме чаще всего кодируются белки
электрон-транспортной цепи фотосинтетиче-
ского аппарата и некоторые субъединицы АТФ-
синтазного комплекса.
В 1883 г. ботаник Андреас Шимпер выдвинул
гипотезу об эндосимбиотическом происхожде-
нии пластид1 2. В соответствии с этой теорией
пластиды образовались в результате симбиоза
прокариот (например, цианобактерий) с пер-
вичными эукариотическими клетками. Клетки
бактерий могли попадать в клетку-хозяина за
счет фагоцитоза (рис. 1.8), в процессе форми-
рования новой составной клеточной системы
часть генетической информации эндосимби-
онта могла изменяться и переноситься в ядро.
В результате такого перемещения большей ча-
сти прокариотических генов пластиды попада-
ли под контроль клеточного ядра, теряя способ-
ность к самостоятельной жизнедеятельности.
Так, например, проведенный сравнительный
анализ последовательностей ДНК, кодирующих
некоторые белки хлоропластов с одной сторо-
ны, и первичных форм цианобактерий с другой,
показал, что все хлоропласты растений скорее
всего произошли в результате одного симбиоти-
ческого события, что также служит веским аргу-
ментом в пользу эндосимбиотической теории.
1 Функция редупликации генома пластид находится под
ядерным контролем (собственных ферментов нет). Экс-
прессия части генома происходит при участии РНК-по-
лимеразы фагового типа, транспортирующейся в пласти-
ды из цитороля, хотя имеется и собственная пластидная
РНК-полимераза. — Прим. ред.
2 Приоритет на самом деле принадлежит русскому учено-
му М. Д. Мережковскому. — Прим. ред.
28
1. Органеллы растительных клеток
Рис. 1.8. Симбиоз цианобактерии и клетки-хозяина
Пропластиды (рис. 1.9а) — небольшие не-
дифференцированные сферические органел-
лы диаметром 1 — 1,5 мкм. Они являются пред-
шественниками всех пластид и содержатся в
основном в меристематических клетках (в кор-
нях, молодых побегах). Как и у других типов
пластид, содержимое пропластид отделено от
цитоплазмы двумя мембранами. В соответствии
с эндосимбиотической теорией считается, что
внутренняя мембрана была сформирована плаз-
малеммой прокариота-симбионта, а внешняя —
плазматической мембраной клетки-хозяина.
Хлоропласты (рис. 1.90 дифференцируют-
ся из пропластид (рис. 1.10). Количество хло-
ропластов в клетках не одинаково, например,
клетки мезофилла листа могут содержать около
50 хлоропластов. От остальных типов пластид
хлоропласты отличаются наличием зеленого
пигмента хлорофилла, зеленый цвет которо-
го может маскироваться содержанием других
пигментов (например, у бурых и красных во-
дорослей). Хлоропласты имеют линзовидную
форму, длина хлоропластов высших растений
составляет 3—10 мкм; они могут изменять свое
местоположение в клетке так, чтобы улавли-
вать оптимальное количество света. Двойная
мембранная оболочка хлоропластов ограничи-
вает внутренний матрикс — строму, содержа-
щую разветвленную систему мембран, которая
образуется при дифференциации хлоропластов
за счет тесно соприкасающихся друг с другом
складок (инвагинаций) внутренней мембраны
оболочки — тилакоидов (термин «тилакоид»
предложен Вильгельмом Менке в 1960 г. от греч.
«похожий на мешок») (рис. 1.11). Соединенные
между собой и уложенные в стопки группы
тилакоидов формируют граны, которые видны
в световой микроскоп как небольшие уплотне-
ния во внутреннем пространстве хлоропластов
(тилакоиды граны). Соседние граны могут быть
связаны между собой одиночными тилакоида-
ми (тилакоиды стромы). В результате в хлоро-
пластах образуется единое внутритилакоидное
пространство. В мембранах тилакоидов содер-
жатся функциональные белковые комплексы
фотосинтетического аппарата растительной
клетки (глава 3).
Хлоропласт можно разделить на три
компартмента: 1) межмембранное простран-
ство между внешней и внутренней мембрана-
ми оболочки; 2) пространство стромы между
внутренней мембраной и мембранами тила-
коидов: 3) внутритилакоидный люмен, пред-
ставляющий собой пространство, окружен-
ное тилакоидными мембранами. Внутренняя
мембрана оболочки обладает высокой избира-
тельной проницаемостью по отношению к ме-
таболитам, которые пересекают ее только при
помощи специализированных переносчиков
(раздел 1.9). Внешняя мембрана оболочки со-
держит неспецифичные поровые белки пори-
ны, образующие поры, позволяющие свободно
диффундировать веществам с молекулярной
массой до 10000 Да, но не пропускающие ма-
кромолекулы (белки, нуклеиновые кислоты)
(раздел 1.11). Благодаря сложной организации,
тилакоидная мембрана образует барьер между
метаболическими компартментами хлороплас-
та — стромой и люменом, который играет роль
внешнего пространства по отношению к стро-
ме и служит для накопления протонов при соз-
дании протонного градиента (глава 3).
1.3. Пластиды - эволюционные потомки цианобактерий
Рис. 1.9. Различные типы пластид:
(а) пропластида из клеток молодых листьев Cucurbita pepo (цуккини);
(б) хлоропласт из клеток мезофилла листьев табака, зафиксированный в конце
ночи;
(в) амилопласт из клеток корня Cestrum auranticum;
(г) хромопласт из клеток лепестка Cestrum auranticum
(по D. G. Robinson, Гейдельберг)
30
1. Органеллы растительных клеток
Пропластида
Строма
Межмембранное пространство
Рис. 1.10. Схема дифференциации пропластиды в хлоропласт
Рис. 1.11. Уложенные в стопки тилакоиды
гран и связывающие их между собой одиночные
тилакоиды стромы формируют единое
тилакоидное пространство (люмен) (по Weier,
Stocking, 1963)
1.4. Митохондрии также произошли путем эндосимбиоза
31
Строма хлоропласта содержит крахмальные
зерна. Крахмал служит хранилищем углеводов,
накопленных в дневное время в результате ин-
тенсивного фотосинтеза. Запасенные углеводы
становятся источником энергии для процес-
сов жизнедеятельности клетки в ночное время,
о чем можно судить по уменьшению размеров
крахмальных зерен (раздел 9.1). Образование
крахмала в растительных клетках всегда проис-
ходит именно в пластидах.
В строме пластид также присутствуют пла-
стоглобулы — осмиофильные безмембранные
образования, содержащие помимо других ве-
ществ резервный пул липидов и пластохинонов.
Максимальное количество пластоглобул в хло-
ропластах наблюдается в период осеннего отми-
рания листьев. По-видимому, в этих структурах
накапливаются продукты деградации мембран
тилакоидов стареющих хлоропластов.
Кроме того, в строме присутствует пластид-
ный геном (может быть от 10 до 100 идентичных
копий), который локализован в особой обла-
сти — нуклеоиде. Присутствующие в хлоропла-
сте рибосомы либо свободно расположены в
стромальном пространстве, либо связаны с по-
верхностью тилакоидных мембран.
В листьях растений, выращенных в темноте
(этиолированные растения), образуются бледно-
желтые этиопласты. Этиопласты формируются
из пропластид и считаются промежуточной ста-
дией развития хлоропластов. В этиопластах от-
сутствует хлорофилл, а также некоторые из хло-
ропластных белков. Во внутреннем пространстве
этиопластов расположена рельефная мембран-
ная структура — проламеллярное тело, образо-
ванное липидами, которые обычно составляют
внутренние мембраны хлоропластов.
Лейкопласты (см. рис. 1.9в) представляют
собой целую группу неокрашенных (бесцвет-
ных) пластид, выполняющих различные функ-
ции. К ним относят амилопласты1, которые
содержат гранулы крахмала и встречаются в за-
пасающих тканях и органах растений, например
в корнях, семенах и клубнях (глава 9). В лейко-
пластах бесхлорофилльных тканей также осу-
ществляется биосинтез липидов. У некоторых
1 Амилопласты часто выделяют в отдельный тип пластид.
Существуют также лейкопласты, специализированные на
синтезе изопреноидов. — Прим. ред.
видов растений промежуточная стадия ассими-
ляции нитратов — восстановление нитритов до
аммония (глава 10) — происходит в лейкопла-
стах клеток корня.
Хромопласты (рис. 1.9г) — пластиды, кото-
рые содержат каротиноиды и в зависимости от
комбинаций пигментов (рис. 2.9) могут быть
желтого, оранжевого или красного цвета. Раз-
меры хромопластов схожи с размерами хлоро-
пластов. Хромопласты ответственны за окраску
цветков и плодов растений (например, красный
цвет томатов), про их метаболические функции
достоверно ничего неизвестно.
1.4. Митохондрии также произошли
путем эндосимбиоза
Митохондрии отвечают за процесс клеточного
дыхания и содержат системы окислительного
фосфорилирования, обеспечивающие энерге-
тические потребности клеток (глава 5). Как и
пластиды, новые митохондрии могут образовы-
ваться за счет деления уже существующих мито-
хондрий. Митохондрии наследуются, как пра-
вило, через яйцеклетку. Митохондрии обладают
собственным геномом (митохондриальный ге-
ном растительных клеток помимо крупных
кольцевых молекул ДНК, содержит некоторое
количество кольцевых и линейных молекул
меньшего размера), а также собственными си-
стемами биосинтеза белка, редупликации и
экспрессии генов, причем геном митохондрий
кодирует лишь незначительную часть митохон-
дриальных белков (табл. 20.6), а большая часть
кодируется ядерным геномом. Митохондрии,
как и пластиды, имеют эндосимбиотическое
происхождение, что подтверждается исследо-
ваниями последовательностей ДНК. Считает-
ся, что митохондрии образовались в результате
симбиоза предковой протеобактерии и анаэ-
робной бактерии (например, архебактерии).
Эндосимбиотическое происхождение (см.
рис. 1.8) объясняет наличие двух мембран, от-
деляющих содержимое митохондрий от ци-
топлазмы (рис. 1.12). Подобно мембранам
хлоропласта, внешняя мембрана оболочки
митохондрий содержит белки-порины и про-
ницаема для небольших молекул метаболитов
размером 4000—6000 Да. Внутренняя мембрана
обладает избирательной проницаемостью по
32
1. Органеллы растительных клеток
Рис. 1.12. Строение
митохондрии
отношению к этим соединениям; большинство
веществ транспортируется через внутреннюю
мембрану при помощи белков-переносчиков
и специализированных каналов. Особенности
строения внешней и внутренней мембран ми-
тохондриальной оболочки позволяют рассма-
тривать межмембранное пространство как
отдельный компартмент, функционально соот-
ветствующий внутритилакоидному простран-
ству (люмену) хлоропластов.
Внутреннее содержимое митохондрий, огра-
ниченное внутренней мембраной, называют
митохондриальным матриксом. Внутренняя
мембрана оболочки образует инвагинации
(складки) различной формы — митохондриаль-
ные кристы (рис. 1.13), которые глубоко вне-
дряются в матрикс и значительно увеличивают
поверхность мембраны. Структура таких мем-
бранных складок напоминает тилакоиды хло-
ропластов, однако, в отличие от тилакоидов,
систему крист нельзя рассматривать как отдель-
ный компартмент. Во внутренней мембране ти-
лакоидов локализованы компоненты электрон-
транспортной цепи дыхания, а также системы,
отвечающие за формирование на этой мембра-
не протонного градиента.
Рис. 1.13. Внутренняя
мембрана оболочки образует
складки различной формы,
которые глубоко внедряются
в матрикс и значительно
увеличивают поверхность
мембраны. На фотографии
показаны митохондрии клеток
алейронового слоя ячменя
(по D. G. Robinson, Гейдельберг)
1.5. В пероксисомах проходят реакции с образованием токсичных продуктов-интермедиатов
33
1.5. В пероксисомах проходят
реакции с образованием
токсичных продуктов-
интермедиатов
Пероксисомы (один из типов микротелец) —
небольшие сферические органеллы эука-
риотических клеток диаметром 0,5—1,5 мкм
(рис. 1.14). В отличие от пластид и митохондрий
они ограничены мембраной и не обладают соб-
ственным генетическим аппаратом. Матрикс
пероксисом представляет собой специализи-
рованный компартмент, в котором содержатся
различные ферменты, катализирующие реак-
ции, проходящие с образованием токсичных
продуктов-интермедиатов. Так, например, при
работе окислительных ферментов в перокси-
сомах образуется перекись водорода, кото-
рая немедленно разлагается присутствующей в
этих же органеллах каталазой (раздел 7.4). Пе-
роксисомы характерны практически для всех
эукариотических клеток. В клетках растений
Рис. 1.14. Пероксисомы:
(А) Пероксисомы клеток мезофилла листа табака. Близкое расположение
пероксисом (Р), митохондрий (М) и хлоропластов (С) способствует быстрому
обмену метаболитами между этими органеллами в процессе фотодыхания (глава 7);
(Б) глиоксисомы семядолей проростков Cucurbitapepo (цуккини). Для
эффективного превращения запасенных липидов в сахара в ходе глиоксплатного
цикла (раздел 15.6) необходимо тесное взаимодействие между липидными каплями
(L), глиоксисомами (G) и митохондриями (М) (по D. G. Robinson, Гейдельберг)
34
1. Органеллы растительных клеток
выделяют два основных типа микротелец — пе-
роксисомы листьев (рис. 1.14А), участвующие
в процессах фотодыхания (глава 7), и глиок-
сисомы (рис. 1.14Б), содержащие ферменты
глиоксилатного цикла и [3-окисления жирных
кислот. Глиоксисомы присутствуют в прорас-
тающих семенах масличных растений и отвеча-
ют за превращение жирных кислот в углеводы
(раздел 15.6). Механизм формирования новых
пероксисом до сих пор неясен. Считается, что
пероксисомы либо возникают de novo из скла-
док мембран эндоплазматического ретикулума,
либо, подобно пластидам и митохондриям, об-
разуются при делении предсуществующих орга-
нелл1. Собственного генетического аппарата в
пероксисомах нет. Сравнение аминокислотных
могли иметь общего предка. Был ли это эндо-
симбионт, как в случае митохондрий и хлоро-
пластов, который в процессе эволюции утратил
свой геном, до сих пор неясно.
1.6. Эндоплазматический
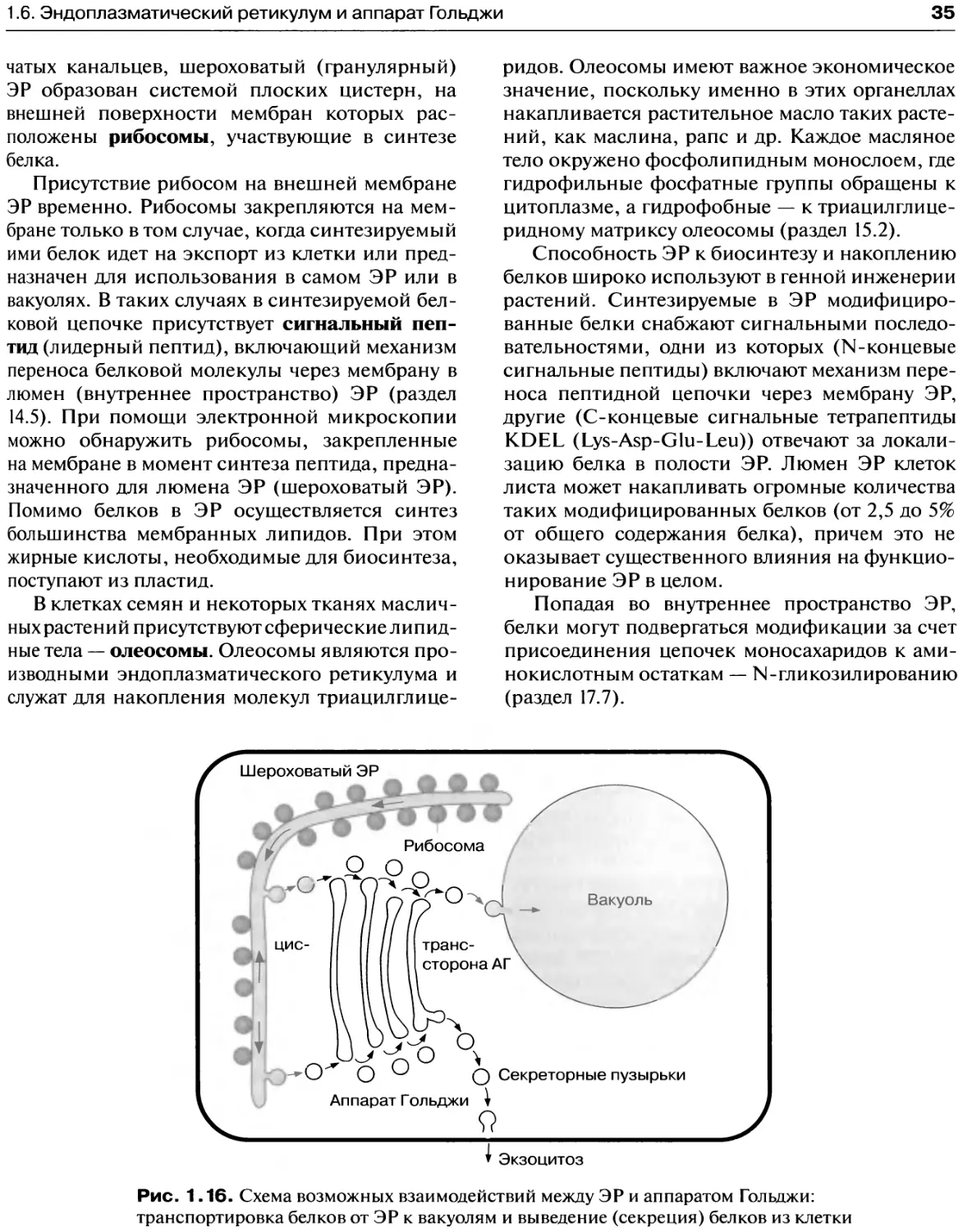
ретикулум и аппарат Гольджи
образуют пространственную
трехмерную сеть, отвечающую
за распределение продуктов
биосинтеза
На фотографии электронной микроскопии эн-
доплазматический ретикулум (ЭР) выглядит
своеобразным лабиринтом, пронизывающим
Рис. 1.15. Шероховатый эндоплазматический ретикулум. Видны пересекающие
клетку вытянутые полости ЭР (узкие стрелки), а также тангенциально
расположенные цистерны (широкие стрелки). Комплексы из нескольких рибосом,
ассоциированных с одной молекулой мРНК, называются полисомами. Полисомы
могут быть свободными или закреплёнными на мембране ЭР. На фотографии
показан участок клетки семядолей созревающих семян гороха (по D. G. Robinson,
Гейдельберг)
последовательностей ферментов, содержащих-
ся в пероксисомах растений, животных и гри-
бов, позволяет предположить, что пероксисомы
1 В настоящее время окончательно доказано, что новые
пероксисомы образуются только путём деления старых. —
Прим. ред.
внутриклеточное пространство (рис. 1.15). ЭР
представляет собой непрерывную систему, об-
разованную канальцами, цистернами и пу-
зырьками, которые ограничены одинарной
мембраной. Обычно выделяют два типа ЭР —
шероховатый и гладкий ЭР. Гладкий (аграну-
лярный) ЭР состоит преимущественно из труб-
1.6. Эндоплазматический ретикулум и аппарат Гольджи
35
чатых канальцев, шероховатый (гранулярный)
ЭР образован системой плоских цистерн, на
внешней поверхности мембран которых рас-
положены рибосомы, участвующие в синтезе
белка.
Присутствие рибосом на внешней мембране
ЭР временно. Рибосомы закрепляются на мем-
бране только в том случае, когда синтезируемый
ими белок идет на экспорт из клетки или пред-
назначен для использования в самом ЭР или в
вакуолях. В таких случаях в синтезируемой бел-
ковой цепочке присутствует сигнальный пеп-
тид (лидерный пептид), включающий механизм
переноса белковой молекулы через мембрану в
люмен (внутреннее пространство) ЭР (раздел
14.5). При помощи электронной микроскопии
можно обнаружить рибосомы, закрепленные
на мембране в момент синтеза пептида, предна-
значенного для люмена ЭР (шероховатый ЭР).
Помимо белков в ЭР осуществляется синтез
большинства мембранных липидов. При этом
жирные кислоты, необходимые для биосинтеза,
поступают из пластид.
В клетках семян и некоторых тканях маслич-
ных растений присутствуют сферические липид-
ные тела — олеосомы. Олеосомы являются про-
изводными эндоплазматического ретикулума и
служат для накопления молекул триацилглице-
ридов. Олеосомы имеют важное экономическое
значение, поскольку именно в этих органеллах
накапливается растительное масло таких расте-
ний, как маслина, рапс и др. Каждое масляное
тело окружено фосфолипидным монослоем, где
гидрофильные фосфатные группы обращены к
цитоплазме, а гидрофобные — к триацилглице-
ридному матриксу олеосомы (раздел 15.2).
Способность ЭР к биосинтезу и накоплению
белков широко используют в генной инженерии
растений. Синтезируемые в ЭР модифициро-
ванные белки снабжают сигнальными последо-
вательностями, одни из которых (N-концевые
сигнальные пептиды) включают механизм пере-
носа пептидной цепочки через мембрану ЭР,
другие (С-концевые сигнальные тетрапептиды
KDEL (Lys-Asp-Glu-Leu)) отвечают за локали-
зацию белка в полости ЭР. Люмен ЭР клеток
листа может накапливать огромные количества
таких модифицированных белков (от 2,5 до 5%
от общего содержания белка), причем это не
оказывает существенного влияния на функцио-
нирование ЭР в целом.
Попадая во внутреннее пространство ЭР,
белки могут подвергаться модификации за счет
присоединения цепочек моносахаридов к ами-
нокислотным остаткам — N-гликозилированию
(раздел 17.7).
Экзоцитоз
Рис. 1.16. Схема возможных взаимодействий между ЭР и аппаратом Гольджи:
транспортировка белков от ЭР к вакуолям и выведение (секреция) белков из клетки
36
1. Органеллы растительных клеток
Рис. 1.17. Диктиосома аппарата Гольджи в клетках зеленой водоросли
Chlamydomonas reinhardii. С — цис-компартмент, t — транс-компартмент. Транс-
компартмент расширяется и образует трубчатый ретикулум — транс- Гольджи -
сеть (широкие стрелки). Шероховатый ЭР типичен для этого типа клеток. На
поверхности мембран ЭР (кроме тех областей, где отпочковываются транспортные
везикулы) видны рибосомы (по D. G. Robinson, Гейдельберг)
Из люмена ЭР вновь синтезированные белки
при помощи транспортных пузырьков (везикул)
переносятся к аппарату Гольджи и сливают-
ся с цис-поверхностью ближайшей цистерны
(рис. 1.16). Транспортные пузырьки отпочковы-
ваются от мембран ЭР и несут на поверхности
специальные белки оболочки — СОР (от англ.
coat protein), состоящие из 6—7 субъединиц.
Белки СОР необходимы для направленного
транспорта пузырька (targeting) в нужный ком-
партмент.
Аппарат Гольджи (АГ) был открыт при по-
мощи световой микроскопии в 1898 году итальян-
цем Камилло Гольджи. Функциональная единица
аппарата Гольджи может содержать до 20 диско-
образных уплощенных цистерн Гольджи или дик-
тиосом, которые расположены параллельно друг
другу и собраны в стопки. Каждая диктиосома
окружена гладкой мембраной, не несущей рибо-
сом на поверхности (рис. 1.17). В стопках всегда
различают цпс-компартмент (проксимальный или
формирующийся), промежуточный компартмент
и дирянс-компартмент (дистальный или зрелый).
При прохождении через компартменты АГ неко-
торые белки подвергаются О-гликозилированию
за счет присоединении цепочек из моносахаридов
к аминокислотным остаткам, главным образом
серину и треонину.
Цистерны АГ всегда ассоциированы с мно-
жеством мелких мембранных пузырьков, кото-
рые группируются по периферии диктиосом и
участвуют в транспорте продуктов биосинтеза.
Предполагают, что существуют два основных
механизма транспорта веществ через аппарат
Гольджи.
1. По модели везикулярного челнока (vesicle
shuttle) везикулы отпочковываются от мембран
ЭР и АГ и транспортируют белки между цистер-
нами, при этом каждая цистерна в стопке имеет
четко фиксированное положение (см. рис. 1.16).
2. Согласно модели образования цистерн
(cisternae progression) транспортные везикулы
сливаются на цис-стороне диктиосомы с обра-
зованием новой цистерны, которая перемеща-
ется в промежуточное положение, и затем — на
дирянс-стороне в свою очередь распадаются и
формируют новые везикулы для дальнейшего
транспорта белков. Полученные в последнее
время данные указывают на то, что эти процес-
сы могут происходить в клетке параллельно.
Аппарат Гольджи осуществляет перенос син-
тезированных белков в соответствии с их функ-
1.7. Препаративное выделение функционально активных органелл растительных клеток
37
Рис. 1.18. Структура клатриновой оболочки везикулы:
(а) при ассоциации трех а- и трех р-субъединиц клатрина образуется тример
в форме трискелиона; (б) при полимеризации клатрин формирует замкнутую
трехмерную сеть в виде гексагональной решетки, окружающей везикулу — (в)
(из Kleinig, Sitte)
циями либо к поверхности клетки (секреция),
либо к запасающим и литическим вакуолям (раз-
дел 1.2), причем распределение белков между ва-
куолярными компартментами регулируется сиг-
нальными последовательностями. Транспорт к
литическим вакуолям осуществляется клатрин-
окаймленными везикулами. Клатрин — особый
белок, состоящий из двух различных субъеди-
ниц (а-субъединица 180000Да, [3-субъединица
35000—40000 Да). При ассоциации трех а- и
трех р-субъединиц клатрина образуется три-
мер в форме трискелиона. При полимеризации
клатрин формирует замкнутую трехмерную сеть
в виде гексагональной решетки, окружающей
везикулу (рис. 1.18). «Простые» везикулы (без
клатриновой оболочки) транспортируют белки
к запасающим вакуолям. Белки, несущие толь-
ко один сигнальный пептид для ЭР, переносятся
секреторными везикулами (пузырьками) по се-
креторному пути к плазмалемме и выводятся из
клетки при помощи экзоцитоза.
Совокупность мембранных структур — мем-
браны ЭР, аппарата Гольджи, транспортные ве-
зикулы и ядерную оболочку — называют эндо-
мембранной системой растительной клетки.
1.7. Препаративное выделение
функционально активных
органелл растительных клеток
Для выделения органелл необходимо нарушить
целостность клетки и разрушить ее на отдель-
ные фрагменты, при этом клеточные органел-
лы попадают в среду выделения и образуют
клеточный гомогенат. Чтобы предотвратить
набухание и разрушение клеточных органелл
при гомогенизации, используют изотониче-
ские среды выделения, осмотическое давление
которых (за счет присутствия осмотиков, на-
пример — сахарозы) соответствует осмотиче-
скому давлению жидкой фазы внутри самих ор-
ганелл. Обычно используют среды, содержащие
0,3 моль/л сахарозы или сорбита.
На рисунке 1.19 в качестве примера пред-
ставлена схема получения суспензии хлоро-
пластов. Кусочки листовой пластинки по-
мещают в гомогенизатор и измельчают при
высоких скоростях вращения в течение не-
скольких секунд. Время гомогенизации долж-
но быть непродолжительным, иначе выде-
ляющиеся в среду органеллы также могут
разрушиться. Следует отметить, что такой
метод гомогенизации пригоден только для тех
видов растений, клетки тканей листа которых
обладают достаточно хрупкой клеточной стен-
кой (например, для шпината). В тех случаях,
когда клеточная стенка растительной клетки
оказывается слишком прочной (например, у
различных видов злаковых), из фрагментов
листовой пластинки сначала выделяют прото-
пласты по описанной в п. 1.1 методике; затем
изолированные протопласты протирают через
сито с размером ячеек меньшим, чем размеры
самих протопластов.
Необходимые органеллы можно отделить от
гомогената при помощи дифференциального
центрифугирования или центрифугирования
в градиенте плотности.
38
1. Органеллы растительных клеток
Схема выделения хлоропластов из листьев
(все операции проводят при температуре О °C)
Кусочки листовой пластинки
в среде выделения
Гомогенизация в миксере
3 сек
Г омогенат
Фильтрация суспензии через
несколько слоев марли для
удаления крупных фрагментов
ткани и клеточных стенок
Фильтрат
Центрифугирование 1 мин
при 4000 д,
у отделение супернатанта
Осадок ресуспендирован
в среде выделения
Промывка
Центрифугирование 1 мин
при 4000 д,
отделение супернатанта
Осадок ресуспендирован
в среде выделения -
СУСПЕНЗИЯ
ХЛОРОПЛАСТОВ
Рис. 1.19. Методика выделения функционально
активных хлоропластов
Для дифференциального центрифугирова-
ния используют среды, плотность которых мень-
ше плотности гомогената, при этом скорость
осаждения компонентов клеточного экстракта
при ускорении, созданном в центрифуге, будет
зависеть в основном от размера содержащихся
в гомогенате частиц (крупные частицы оседают
быстрее мелких). (Важен не только размер, но
и плотность органелл. — Прим, ред.) Как пока-
зано на рис. 1.19, достаточно чистую суспензию
изолированных хлоропластов можно получить в
течение короткого времени за счет центрифуги-
рования в несколько этапов с последовательным
увеличением скорости вращения. (На рисунке
это не показано, поэтому при данной методике
в суспензию хлоропластов попадают также ядра.
Это не так важно при изучении фотосинтетиче-
ских процессов, но недопустимо при выделении
хлоропластной ДНК. — Прим, ред.)
При необходимости более точного разделе-
ния фракций клеточного экстракта используют
центрифугирование, формируя градиент плот-
ности (рис. 1.20). Для этого в центрифужную
пробирку наслаивают среды таким образом,
чтобы плотность раствора уменьшалась в на-
правлении от дна пробирки. Чтобы предотвра-
тить изменения осмотических концентраций
среды, для достижения высоких плотностей
обычно используют «тяжелые» макромолекулы
(например, Percoll). Поверх приготовленной
Суспензия-гомогенат
Г радиент
плотности
Рис. 1.20. Разделение частиц различной плотности при помощи центрифугирования
в градиенте плотности
1.8. Различные транспортные процессы обеспечивают обмен метаболитами
39
таким образом среды наносят исследуемый об-
разец и центрифугируют до тех пор, пока ком-
поненты гомогената не опустятся в те слои
раствора, плотность которых равна их собствен-
ной. Поскольку центрифугирование в градиенте
плотности требует более длительного времени и
более высоких скоростей, данный метод обычно
применяют после предварительного дифферен-
циального центрифугирования для окончатель-
ной очистки экстрактов.
Совмещая методы фракционирования, мож-
но получать функционально активные препара-
ты выделенных хлоропластов, митохондрий, пе-
роксисом и мембран вакуолей высокой степени
очистки для проведения дальнейших исследова-
ний метаболических процессов.
1.8. Различные транспортные
процессы обеспечивают
обмен метаболитами между
компартментами растительной
клетки
Каждая из упомянутых в предыдущих главах
органелл играет свою четко определенную роль
в клеточном метаболизме. Для обеспечения
взаимосвязи метаболических процессов, про-
текающих в различных компартментах клетки,
необходимо наличие развитой системы транс-
порта веществ через мембраны клеток и орга-
нелл. Транспорт соединений может осущест-
вляться различными способами: при помощи
специфических белков-переносчиков, через
ионные каналы, поры, за счет везикулярного
транспорта, а в некоторых случаях — для моле-
кул СО2 или О2 — за счет пассивной диффузии
через мембраны. Транспорт через плазмодесмы
и везикулярный транспорт уже рассматривался
в предыдущих главах.
На рисунке 1.21 показаны схемы основных
транспортных процессов. Перенос веществ че-
рез мембрану может осуществляться нескольки-
ми способами. При унипорте через мембрану
переносится единичная молекула или ион; при
антипорте вещества переносятся через мем-
брану в противоположных направлениях; при
симпорте через мембрану в одном направле-
нии одновременно переносятся два соедине-
ния. Транспортные процессы, проходящие по
той же схеме, но с одновременным переносом
заряда, носят название электрогенных. На-
правленный (векторный) транспорт против
градиента электрохимического потенциала с
затратой энергии фотонов или энергии хими-
в
Первичный активный
транспорт
Вторичный активный
транспорт
Рис. 1.21. Классификация мембранных транспортных процессов
40
1. Органеллы растительных клеток
ческих связей называют активным или пер-
вичным активным транспортом. Примером
активного транспорта может служить транспорт
протонов за счет энергии переноса электронов
в электрон-транспортной цепи при фотосин-
тетических реакциях (глава 3), в дыхательной
цепи (глава 5) или за счет использования энер-
гии АТФ (рис. 1.21 в). Транспорт протонов, без-
условно, является электрогенным транспортом,
поскольку перенос положительно заряженных
ионов ведет к образованию мембранного потен-
циала. Другим примером первичного активного
транспорта является АТФ-зависимый транспорт
конъюгатов глутатиона в вакуоль (раздел 12.2).
Вторичным активным транспортом назы-
вают процесс переноса веществ через мембрану
за счет электрохимического потенциала. Так,
в случае электроген ного ун и порта, мембран-
ный потенциал обеспечивает перенос молекул
субстрата против градиента его концентрации.
Примером такого транспорта является про-
цесс накопления малата в вакуолях (глава 8,
рис. 1.21в). Еще один пример вторичного ак-
тивного транспорта — процесс накопления са-
харозы в результате симпорта сахарозы и Н+ за
счет протонного градиента, образующегося при
участии первичного активного транспорта (см.
рис. 1.21 в). Эти транспортные процессы играют
важную роль при накоплении сахарозы в сито-
видных элементах флоэмы (глава 13).
1.9. Переносчики-транслокаторы
обеспечивают избирательный
транспорт продуктов
метаболизма
и молекул-субстратов
В клеточных мембранах присутствуют специали-
зированные транспортные белки, осуществляю-
щие избирательный транспорт веществ через
мембрану. Еще совсем недавно считалось, что
эти белки действуют как переносчики, — свя-
зываясь с молекулой субстрата с одной стороны
мембраны, они перемещаются через мембрану,
чтобы освободиться от молекулы субстрата с
другой стороны. В настоящее время существуют
доказательства в пользу совершенно иного меха-
низма. Молекулы субстрата перемещаются через
специальную структуру — пору с избирательной
способностью. Транспортные белки, форми-
рующие поровую структуру1, называют транс-
локаторами. Для того чтобы понять структуру
и принцип действия таких белков, здесь и далее
рассмотрим в качестве примера работу фос-
фат/триозофосфатного транслокатора хлоро-
пластов— одного из самых распространенных
транспортных белков растений. Этот транс-
портер отвечает за экспорт фотоассимилятов
из хлоропластов, обеспечивая распределение и
взаимообмен фосфатов и триозофосфатов (ди-
гидроксиацетонфосфата или 3-фосфоглицери-
нового альдегида.
Для того чтобы наиболее точно количественно
оценить транспорт субстратов в хлоропласты или
другие клеточные органеллы, используют метод
центрифугирования с фильтрацией через слой
силиконового масла (рис. 1.22). Соответствую-
щий субстрат добавляют в суспензию выделенных
хлоропластов и проводят центрифугирование с
одновременной фильтрацией через слой силико-
нового масла для осаждения хлоропластов из су-
спензии. Затем рассчитывают количество субстра-
та, поглощенного выделенными хлоропластами.
Изучая зависимость скорости поглощения
фосфата хлоропластами от исходных концентра-
ций фосфата в растворе можно получить гипер-
болическую кривую, подобную кривым кине-
тики насыщения для реакций, катализируемых
ферментами (рис. 1.23). При низких концентра-
циях фосфата в среде скорость его поглощения
растет пропорционально росту концентрации.
Однако при высоких концентрациях фосфата
наблюдаемая скорость его поглощения замед-
ляется, и при достижении некоторой величины
максимальной скорости поглощения (Vmax)
кривая выходит на плато. По аналогии с фер-
ментативным катализом, где субстрат (S) связы-
вается с ферментом (Е) с последующим образо-
ванием продукта (Р) и его освобождением:
Е + S ES катализ ЕР Е + Р
процесс переноса субстрата специфическим
белком-транслокатором происходит по сходной
схеме:
S + Т —> ST —> транспорт —> TS —> Т + S
1 Важно отметить, что пора у транслокаторов попеременно
открывается то с одной, то с другой стороны мембраны при
изменении конформации белка. У каналов пора сквозная,
может быть одновременно открыта с обеих сторон (см. да-
лее). — Прим. ред.
1.9. Переносчики-транслокаторы обеспечивают избирательный транспорт продуктов метаболизма... 41
Молекула субстрата взаимодействует со спец-
ифическим участком — сайтом связывания —
белка-транслокатора (Т), транспортируется че-
рез мембрану и освобождается от переносчика.
Максимальная скорость поглощения (Vmax) со-
ответствует состоянию полного насыщения всех
сайтов связывания белков-транслокаторов суб-
стратом. Также по аналогии с ферментативными
реакциями, Км для белков-транслокаторов соот-
ветствует концентрации субстрата, при которой
достигается */2 максимальной скорости поглоще-
ния. Подобно ферментам, белки-транслокаторы
обладают высокой избирательной способностью
(селективностью или специфичностью) по отно-
шению к транспортируемым молекулам субстра-
та. Так, фосфат/триозофосфатный транслокатор
хлоропластов С3 растений (раздел 9.1) может
транспортировать ортофосфат, дигидроксиаце-
тонфосфат (ДГАФ), 3-фосфоглицериновый аль-
дегид (3-ФГА) или 3-фосфоглицерат (3-ФГК),
но не 2-фосфоглицерат. Кроме того, различные
субстраты могут конкурировать между собой
за сайты связывания переносчиков. Например,
фосфат будет конкурирующим ингибитором
транспорта 3-фосфоглицерата. Поскольку фос-
фат/триозофосфатный транслокатор работает
Шпатель
Исследуемый субстрат
О
Суспензия
выделенных
хлоропластов
©° ©
О о
°о°о®
@ @
О О
Супернатант
Центрифугирование
Слой
силиконового
масла
Перхлорная
кислота
Осадок, содержащий
денатурированные
хлоропласты
Рис. 1.22. Метод центрифугирования с использованием фильтрации через
слой силиконового масла: оценка степени поглощения субстрата выделенными
хлоропластами. Для проведения эксперимента на дно центрифужной пробирки
наливают перхлорную кислоту, на которую наслаивают силиконовое масло.
На слой силикона помешают суспензию хлоропластов. В суспензию при
помощи небольшого шпателя добавляют некоторое количество исследуемого
субстрата. Для упрощения идентификации обычно используют соединения с
радиоизотопными метками (32Р или |4С). При скоростном центрифугировании
хлоропласты в течение нескольких секунд проходят через слой силиконового
масла и попадают в перхлорную кислоту, где подвергаются денатурации. Измеряя
радиоактивность осевшей фракции можно рассчитать количество поглощенного
вещества. Не поглощенный хлоропластами субстрат в основном остается в
супернатанте, однако за счет неспецифического переноса через силиконовый
слой (на внешней поверхности пластид или в межмембранном пространстве)
некоторое количество не поглощенного субстрата может также оказаться в
осевшей фракции. Для того, чтобы исключить возможную ошибку, проводят
контрольный эксперименте использованием субстратов (например, сахарозы),
не способных проникнуть через внутреннюю мембрану исследуемых пластид
42
1. Органеллы растительных клеток
Скорость поглощения
Рис. 1.23. Скорость поглощения как функция
концентрации переносимого вещества.
Анализируя ход кривой кинетики поглощения
вещества, можно определить механизм транспорта
субстрата — неспецифическая (пассивная)
диффузия через мембрану (а) или специфический
(селективный) транспорт (б)
а Пинг-понг-механизм
б Параллельный перенос
Рис. 1.24. Две модели транспорта в
режиме анти порта двух молекул субстрата
(А и Б): (а) пинг-понг-механизм: один
белок-транслокатор обеспечивает
последовательный перенос через мембрану
в противоположных направлениях двух
молекул субстрата (А и Б);
(б) параллельный перенос: два связанных
между собой транслокатора одновременно
транспортируют через мембрану в
противоположных направлениях две
молекулы субстрата (А и Б)
1.9. Переносчики-транслокаторы обеспечивают избирательный транспорт продуктов метаболизма... 43
в режиме антипорта, молекулы одного из суб-
стратов (например, фосфата) будут транспорти-
роваться в хлоропласт в обмен на транспорти-
руемые из пластиды молекулы другого субстрата
(дигидроксиацетонфосфата).
На рисунке 1.24 показана схема такого транс-
портного процесса. Фосфат/триозофосфатные
транслокаторы хлоропластов, а также белки-
транслокаторы митохондрий и других компар-
тментов (пластид), как правило, состоят из двух
субъединиц и образуют поровую структуру, дей-
ствующую по принципу воротного механизма.
Субъединицы образуют единый сайт связыва-
ния, который может быть доступен для субстрата
как с внешней, так и с внутренней стороны мем-
браны в зависимости от конформации белка-
транслокатора. Молекула субстрата (А) взаи-
модействует с сайтом связывания на внешней
стороне мембраны, переносится на внутреннюю
сторону за счет обратимых изменений конфор-
мации субъединиц и освобождается. Свободный
сайт связывания связывает молекулу субстата (Б)
и по той же схеме переносит ее на внешнюю сто-
рону мембраны. Активация системы переноса и
изменение конформации белка-транслокатора
происходит только после взаимодействия сай-
та связывания и молекулы субстрата. Подобная
модель транспорта в режиме антипорта получи-
ла название пинг-понг механизма (рис. 1.24я).
В частности, фосфат/триозофосфатные транс-
локаторы хлоропластов работают именно по
этому механизму. Кроме того, существует модель
параллельного (одновременного) антипорта двух
субстратов — параллельный (одновременный)
перенос (рис. 1.246). В соответствии с этой схе-
мой два транслокатора связаны между собой та-
ким образом, что изменение конформации про-
исходит только в том случае, когда одновременно
оба сайта связывания заняты (или не заняты)
молекулами транспортируемого субстрата. По
такому механизму действуют митохондриальные
белки-транслокаторы.
Все белки-транслокаторы имеют
сходное строение
Транслокаторы — это интегральные мембран-
ные белки. Они погружены в липидый бислой
мембраны и имеют вид а-спиралей с гидро-
фобными боковыми радикалами, состоящими
из гидрофобных аминокислот: аланина, вали-
на, лейцина, изолейцина или фенилаланина.
Благодаря высокой гидрофобности мембран-
ные интегральные белки не растворимы в воде.
Для выделения таких белков применяют мягкие
неионогенные детергенты, например— октил-
гликозид (рис. 1.25). Гидрофобные участки белка
связываются гидрофобными остатками октанола
детергента, и за счет свободных глюкозных остат-
ков образующийся агрегат (мицелла) становится
водорастворимым. При удалении детергента вы-
деленные белковые агрегаты склеиваются и пре-
вращаются в нерастворимую вязкую массу.
При помощи этой методики был выделен це-
лый ряд транспортных белков-транслокаторов,
что позволило проанализировать их амино-
кислотную последовательность. По результа-
там анализа гидрофобности аминокислотных
остатков в пептиде можно предсказать, какие
именно участки белковой цепочки будут обра-
зовывать трансмембранные спирали (hydropathy
analysis). Так, в частности, было выявлено, что
в активном (функциональном) состоянии фос-
фат/триозофосфатный транслокатор хлоропла-
стов состоит из двух идентичных субъединиц,
каждая из которых сформирована пептидом
из 324 аминокислотных остатков. Этот пептид
образует 6 трансмембранных спиралей (рис.
1.26) длиной около 6 нм (что приблизительно
равно толщине мембраны), каждая из кото-
рых содержит по 20 аминокислотных остатков.
Сравнение результатов сиквенса аминокислот-
ных последовательностей различных белков-
транспортеров показало, что практически все
белки-транслокаторы бактерий, растительных
и животных клеток имеют сходное строение
Н2СОН
Рис. 1.25. Октилгликозид — гликозид,
состоящий из остатков а-D-глюкозы и
октилового спирта (октанола). Мягкий
неионогенный детергент, позволяющий
выделять мембранные белки без
нарушения структуры (без денатурации)
н/н
н6\он
/ОК /ОК /ОК
о-сн2 сн2 сн2 сн2
н он
Октилгликозид
СК
44
1. Органеллы растительных клеток
Рис. 1.26. Фосфат/триозофосфатный транслокатор шпината образует
6 трансмембранных спиралей. Аминокислоты условно обозначены кругами.
Схема расположения трансмембранных спиралей была получена при анализе
гидрофобности отдельных аминокислотных остатков. Отмеченные знаком «+»
аминокислоты, несушие положительный заряд (спираль 5) — это аргинин и лизин.
Возможно, эти аминокислотные остатки образуют анионные сайты связывания
фосфата и триозофосфата (по данным Fliigge et al., 1989)
и состоят либо из димера, где каждый мономер
образует по 6 трансмембранных спиралей, либо
из мономера, образующего 12 трансмембранных
спиралей. Совсем недавно при помощи рентге-
ноструктурного анализа (см. описание метода
в разделе 3.3) была получена модель трехмер-
ной структуры митохондриального АТФ/АДФ-
транслокатора, мономер которого формирует
поровую структуру, также состоящую из 6 транс-
мембранных спиралей.
Аквапорины облегчают транспорт воды
через мембрану
Сравнивая осмотическое поведение различных
клеток и клеточных органелл, можно сделать
вывод, что их мембраны значительно отлича-
ются по водопроницаемости. Водопроницае-
мость самого липидного бислоя достаточно
низкая. В 2003 г. Петер Агре из Университета
Джона Хопкинса в Балтиморе был удостоен
Нобелевской премии по химии за выделение
и идентификацию в эритроцитах и клетках
почечной ткани специфических мембранных
белков — аквапоринов. Он открыл, что эти
белки формируют каналы облегченного по-
ступления воды через клеточные мембраны.
Позже аквапорины были обнаружены также
и в растительных клетках, в основном в плаз-
малемме и в тонопласте. Следует подчеркнуть,
что именно эти мембранные структуры играют
главную роль в регуляции водного обмена рас-
тительной клетки.
1.9. Переносчики-транслокаторы обеспечивают избирательный транспорт продуктов метаболизма... 45
Растительная клетка может содержать множе-
ство изоформ белков-аквапоринов. Например, у
Arabidopsis thaliana (раздел 20.1) было идентифи-
цировано около 30 различных генов, кодирующих
белки аквапоринов. Контроль за изменением водо-
проницаемости мембран растительной клетки осу-
ществляется за счет регуляции экспрессии генов, а
также за счет регуляции транспортной активности
аквапоринов в мембранах (механизм не ясен до сих
пор)1. Такая система позволяет растительному ор-
ганизму эффективно приспосабливаться к измене-
ниям условий окружающей среды.
Рентгеноструктурный анализ и электронная
криомикроскопия показали, что полипептид-
ная цепочка каждой субъединицы аквапорина
также образует 6 трансмембранных а-спиралей
(раздел 3.3). В мембране 4 субъединицы аква-
порина объединены в тетрамерную структуру,
где каждый мономер формирует узкий канал,
способный транспортировать от 109 до 10й мо-
лекул воды в секунду. Каждый водный канал
содержит сайты связывания для 4 молекул воды
и действует как гидрофобная пора, где сай-
ты связывания выполняют роль селективного
фильтра для специфического водного транспор-
та. Предполагается, что по ряду энергетических
причин эти водные каналы практически непро-
ницаемы для протонов. Кроме того, недавно по-
лучены данные о том, что аквапорины плазма-
леммы табака помимо молекул воды могут также
транспортировать СО2. Возможно, аквапорины
играют роль дополнительных транспортеров-
переносчиков СО2 в растениях.
Интересно отметить, что термин аквапорин
не совсем удачен, поскольку строение аквапори-
нов значительно отличается от структуры белков-
поринов, речь о которых пойдет в разделе 1.11.
Аквапорины, также как и белки-транслокаторы
и ионные каналы, формируют трансмембранные
спиралевидные структуры, тогда как порины об-
разуют р-складчатые структуры.
1.10. Высокая пропускная
способность ионных каналов
Пропускная способность упомянутого выше
фосфат/триозофосфатного транслокатора хло-
1 Показано, что проницаемость аквапоринов регулируется
путём фосфорицирования. — Прим. ред.
ропластов составляет около 80 с1 при 25 °C. Это
означает, что данный белок-транслокатор спо-
собен транспортировать 80 молекул субстрата в
секунду. Пропускная способность других транс-
локаторов может варьировать в интервале от 10
до 1000 с1. Однако клеточные мембраны содер-
жат также группы белковых комплексов — ион-
ные каналы, — которые способны распозна-
вать и достаточно селективно транспортировать
различные ионы с гораздо большей скоростью,
чем транслокаторы (106—108 ионов в секунду).
Ионный канал представляет собой специаль-
ную структуру — пору, которая в отличие от
транслокаторов может быть открыта одновре-
менно с обеих сторон клеточной мембраны.
Интенсивность перемещения ионов по каналу
настолько высока, что позволяет определять
пропускную способность одиночного ионного
канала путем измерения проводимости тока.
Такая методика регистрации ионного транс-
порта была впервые разработана немецкими
учеными Эрвином Нейером и Бертом Сакманом
и получила название пэтч-кламп метода (patch-
clamp). За это открытие в 1991 г. Э. Нейеру и
Б. Сакману была присуждена Нобелевская пре-
мия по медицине и физиологии. Для проведения
эксперимента необходима стеклянная пипетка
со встроенным микроэлектродом, заполненная
электролитом (см. рис. 1.27). При определенных
условиях может формироваться плотный кон-
такт между кончиком пипетки (диаметром око-
ло 1 мкм) и исследуемым участком клеточной
мембраны. Количество ионов, транспортируе-
мых через изолированный участок мембраны в
единицу времени, можно оценить, регистрируя
ионные токи [обозначают как проводимость в
Сименсах (S)]. На рисунке 1.28 в качестве при-
мера представлены результаты измерения токов
через одиночные ионные каналы плазмалеммы
замыкающих клеток устьиц бобовых. По изме-
нению величины электрического тока можно
определить периоды открытия и закрытия кана-
ла. Такая способность обратимо переходить из
открытого (активного, проводящего) состояния
в закрытое (неактивное, непроницаемое) явля-
ется особенностью функционирования ионных
каналов. Проводимость различных каналов в
открытом состоянии варьирует от нескольких
pS до нескольких сотен pS, а периоды открытия
и закрытия могут длиться от нескольких милли-
46
1. Органеллы растительных клеток
4 Электролит
\ / Наконечник пипетки
Протопласт Схема для
Измерение для целой клетки
в условиях плотного контакта,
внешняя часть мембраны
обращена наружу
Измерение ионных токов
на изолированном участке
мембраны, внешняя поверхность
которой обращена внутрь пипетки
Рис. 1.27. Способы измерения ионных токов пэтч-кламп методом.
Стеклянная пипетка с диаметром кончика около I мкм содержит встроенный
микроэлектрод и заполнена электролитом. При создании небольшого разряжения
внутри пипетки создается плотный контакт между кончиком пипетки и фрагментом
исследуемой мембраны протопласта или клеточной органеллы (например, вакуоли).
При увеличении отрицательного давления мембранный фрагмент под пипеткой
разрушается и между микроэлектродом и клеточным содержимым устанавливается
изолированный от внешней среды прямой проводящий путь. Таким образом можно
измерить токи для всех ионных каналов в мембране (измерение для целой клетки в
условиях плотного контакта, внешняя часть мембраны обращена наружу). Еще один
вариант — измерение ионных токов на изолированном участке мембраны, внешняя
поверхность которой обращена внутрь пипетки. Поскольку контакт мембраны со
стеклом механически очень прочен, находящийся под кончиком пипетки фрагмент
можно вырвать из целой мембраны и изолировать. В этом случае можно измерить
проводимость только для тех каналов, которые находятся в изолированном
фрагменте
секунд до нескольких секунд в зависимости от
типа канала. Очевидно, что пропускная способ-
ность ионного канала в единицу времени будет
зависеть от проводимости канала в открытом
состоянии, а также от продолжительности ак-
тивного (открытого) периода.
Ионные каналы различают по селективности
к различным ионам (ионной специфичности).
Мембраны растительных клеток содержат высо-
коспецифичные катионные каналы для транс-
порта К+, Н+ и Са2+, а также высокоспецифич-
ные анионные каналы для СГ и дикарбоновых
кислот (например, малата). В отличие от живот-
ных клеток специфичные Na+-каналы в расте-
ниях пока не обнаружены. Поскольку открытие
и закрытие большинства ионных каналов, как
правило, стимулируется мембранным потен-
циалом, мембранные структуры играют важную
роль в регуляции ионных потоков. Так, напри-
мер, в замыкающих клетках устьиц (раздел 8.1)
1.10. Высокая пропускная способность каналов
47
400 мс
Канал
открыт
Канал
закрыт
Рис. 1.28. Результаты измерений токов через одиночный К+-выходной канал
изолированного фрагмента плазмалеммы замыкающих клеток устьиц Vicia faba
(концентрация К+ во внешней среде 50 мМ, в цитоплазме 200 мМ, напряжение
+35 мВ) (данные проф. G. Thiel, Дармштадт)
гиперполяризация плазмалеммы (>—100 мВ)
активирует каналы, обеспечивающие приток
ионов калия в клетку (К+-входные каналы),
тогда как деполяризация открывает каналы, по
которым идет отток ионов калия из внутрикле-
точного пространства (К+-выходные каналы).
Открытие ионных каналов может также регули-
роваться Са2+-ионами, протонами или фосфо-
рилированием полипептидов, формирующих
канал. Такая система позволяет контролировать
активность каналов при помощи сигнальных
молекул и продуктов различных метаболиче-
ских процессов (глава 19).
В настоящее время уже выяснены амино-
кислотные последовательности полипептидов
многих ионных каналов. Интересно, что одно-
типные каналы имеют очень близкое строение
(например, К+-каналы животных и раститель-
ных клеток, а также бактерий). Родерику Мак-
Киннону с коллегами (Университет Рокфеллера,
Нью-Йорк) при помощи рентгеноструктурного
анализа удалось воссоздать трехмерную струк-
туру К+-канала бактерии Streptomyces lividans
(раздел 3.3). Это открытие, за которое Р. Мак-
Киннон был награжден Нобелевской премией
по химии в 2003 г., позволило впервые предста-
вить молекулярный механизм работы ионных
каналов. Долгое время считалось, что структура
ионного канала сформирована двумя идентич-
ными белковыми субъединицами, каждая из
которых состоит их двух трансмембранных спи-
ралей, соединенных петлей из 30 аминокис-
лотных остатков (рис. 1.29я). Также было из-
вестно, что эта петлеобразная структура отвечает
за ионную селективность канала. Проведенный
структурный анализ показал, что в реальности
К+-канал представляет собой тетрамер из 4 та-
ких белковых комплексов (рис. 1.29 6, в). Одна
из спиралей (наружная) каждой субъединицы
контактирует с липидным бислоем, другая (вну-
тренняя) — выстилает внутреннюю поверхность
ионного канала (поры). Внутренняя полость
поры заполнена водой и отделена от внешне-
го пространства так называемым селективным
фильтром, который образован пептидными пет-
лями четырех субъединиц (см. выше). Это самая
узкая часть канала, и для проникновения через
поровое отверстие ионы К+ подвергаются деги-
дратации на одном из участков поры. На этом
участке присутствует кольцеобразная область из
атомов кислорода, которые замещают молекулы
воды, разрушая гидратную оболочку ионов, и
образуют комплексы с ионами К+, компенсируя
затраты энергии на дегидратацию. Пора в цен-
тре канала также несет множество фиксирован-
ных отрицательных зарядов и имеет множество
сайтов связывания для катионов. Входящие че-
рез устье поры ионы К+ облегчают вытеснение
дегидратированных ионов на другую сторону
фильтра за счет электростатического отталки-
вания. Такое строение селективного фильтра
определяет специфичность К+-канала и препят-
ствует транспорту остальных ионов, например,
Na+, которые слишком малы для того, чтобы об-
разовать комплекс и «освободиться» от гидрат-
ной оболочки. Следует отметить, что формиро-
вание селективных фильтров петлеобразными
пептидными фрагментами, соединяющими
трансмембранные спирали, характерно для всех
К+-каналов микроорганизмов, животных и рас-
тительных клеток. Исследования К+1каналов
растений показали, что К+-избирательность
селективных фильтров обусловлена наличием
в четырех «петлях» глициновых остатков. Сход-
ные результаты были получены при изучении
трехмерной структуры хлоридных каналов бак-
48
1. Органеллы растительных клеток
1.11. Для белков-поринов характерна [^складчатая структура
49
терий Salmonella и Е. coll (Cl-каналы относят к
семейству анионных каналов прокариот и эука-
риот). Эти каналы также сформированы транс-
мембранными а-спиралями, которые связаны
между собой пептидными петлями, образующи-
ми селективный фильтр и связывающими хло-
ридный анион за счет электростатического взаи-
модействия. Вполне вероятно, что приведенная
выше модель работы К+-канала Streptomyces яв-
ляется общей для всех ионных каналов.
В структуре ионных каналов и транслокато-
ров есть определенное сходство. Исследования
показывают, что при помощи определенных
химических реакций можно превратить транс-
локатор (например, фосфат/триозофосфатный
транслокатор хлоропластов) в канал, открытый
одновременно по обе стороны мембраны, и
его транспортная способность будет аналогич-
ной проводимости ионных каналов. Основное
функциональное отличие транслокаторов от
ионных каналов заключается в том, что цен-
тры связывания транслокатора могут быть до-
ступны для субстрата только с одной из сторон
мембраны, а сам транспорт осуществляется за
счет конформационных изменений белковых
субъединиц, тогда как заполненная водой пора
открытого ионного канала может быть открыта
с обеих сторон мембраны. Такая разница в ме-
ханизме действия обусловлена особенностями
строения полипептидных цепочек.
1.11. Для белков-поринов
характерна [3-складчатая
структура
Как уже было отмечено, благодаря присутствию
порообразующих белков — поринов — внеш-
ние мембраны митохондрий и хлоропластов об-
ладают неспецифической проницаемостью по
отношению к некоторым клеточным метаболи-
там, в частности — к нуклеотидам и фосфатам
сахаров.
Разработана методика по определению раз-
меров поры и пропускной способности пори-
нов с применением искусственной мембраны,
основанная на фиксации изменений величины
тока в системе (рис. 1.30). Две емкости, запол-
ненные электролитом, разделяют перегородкой
с небольшим отверстием. На отверстие наносят
некоторое количество мембранных липидов,
которые образуют двойной слой и формируют
искусственную мембрану. Растворенные в де-
тергенте мембранные белки-порины добавля-
ют в электролит одной из емкостей. Благодаря
своей гидрофобности, молекулы полипептидов
постепенно встраиваются в липидный бислой
с образованием новых пор, что отражается на
проводимости системы. Каждый «скачок» в
увеличении проводимости тока соответствует
проводимости единичной поры. При помощи
этого метода было установлено, что для пори-
4 Рис. 1.29. Модель структуры К+-канала бактерии Streptomyces lividans\
(а) предполагаемая укладка полипептида одной из субъединиц К+-канала в мембране.
Два трансмембранных спиральных сегмента соединены между собой при помощи
«порового» петлевидного фрагмента пептида. В составе петли есть еще одна спираль,
которая, тем не менее, не выступает за пределы мембраны в нативной конформации;
(б) двойное стереоизображение К+-канала — вид сверху (с внешней стороны
мембраны). К+-канал представляет собой тетрамер из 4 белковых субъединиц
(обозначены черным и серым цветом). Одна из спиралей (наружная) каждой
субъединицы контактирует с липидным бислоем, другая (внутренняя) — выстилает
внутреннюю поверхность ионного канала (поры). Черный шарик в центре поры —
ион К+;
(в) двойное стереоизображение К+-канала — вид сбоку. Восемь трансмембранных
спиралей и петлевидные фрагменты формируют канал с селективным фильтром (по
результатам рентгеноструктурного анализа, Doyle et al., 1998).
Как увидеть объемную картинку: вы смотрите на изображение, но глаза сфокусированы
не на самой картинке, а на точке, расположенной позади рисунка. Например, подойдите
к окну и сфокусируйте взгляд на какой-либо удаленной точке. Не меняя фокусировки,
быстро поместите перед глазами картинку. Вы увидите три изображения вместо двух и
центральное будет иметь стереоэффект
50
1. Органеллы растительных клеток
Измерение
величины тока
о
Встраивание поринов
в мембрану
I
I
1 Проводимость
? единичной
J поры
Время
Рис. 1.30. Определение пропускной способности поринов.
Две ёмкости, заполненные электролитом и содержащие встроенные электроды,
разделены перегородкой с небольшим отверстием. На отверстие наносят некоторое
количество мембранных липидов, которые образуют двойной слой и формируют
искусственную мембрану. Растворенные в детергенте мембранные белки поринов
добавляют в электролит одной из емкостей. Благодаря своей гидрофобности,
молекулы полипептидов постепенно встраиваются в липидный бислой с
образованием новых пор, что отражается на проводимости системы. Каждый
«скачок» в увеличении проводимости тока соответствует проводимости единичной
поры
Рис. 1.31. Если пептид принимает конформацию
P-слоя (складчатая структура), радикалы
аминокислот располагаются сверху и снизу
относительно поверхности слоя
1.11. Для белков-пори нов характерна ^складчатая структура
51
б
p-слой порина
Рис. 1.32. Схема строения мембранной поры, образованной поринами:
(а) вид сверху;
(6) строение поры в продольном разрезе. 16 p-слоев молекул поринов, каждый из
которых состоит из 13 аминокислот, формируют пору в мембране. Аминокислотные
остатки, обращенные к мембранной стороне поры, обладают гидрофобными
свойствами, а те, которые обращены к водной фазе в центре поры, гидрофильны
р-слой порина
нов внешней мембраны митохондрий диаметр
пор в среднем составляет 1,7 нм, а для хлоропла-
стов — 3 нм.
Порины впервые были выделены из наруж-
ных мембран грамотрицательных бактерий
Escherichia coli. В настоящее время известно
несколько типов поринов, отличающихся по
своим свойствам. Чаще всего порины образуют
неспецифические диффузионные поры, кото-
рые представляют собой цилиндрические на-
полненные водой каналы. Порины этого типа
сформированы субъединицами с молекуляр-
52
1. Органеллы растительных клеток
ной массой около 30 кДа. В мембранах они су-
ществуют в виде тримеров, где каждый из трех
идентичных мономеров формирует отдельную
пору. В отличие от транслокаторов порины
не способны образовывать трансмембранные
а-спирали, поскольку в полипептидах поринов
отсутствуют ответственные за формирование
подобных структур сплошные гидрофобные об-
ласти, образованные аминокислотными после-
довательностями. При помощи рентгенострук-
турного анализа (раздел 3.8) было установлено,
что диффузионные поры в бактериальных пори-
нах представляют собой цилиндрические обра-
зования из 16 р-складчатых структур (тяжей),
связанных водородными связями (рис. 1.31).
Каждая такая структура, как правило, состоит
из 13 чередующихся гидрофильных и гидро-
фобных аминокислотных остатков (рис. 1.32б/).
Гидрофобные остатки располагаются с одной
стороны p-слоя и контактируют с липидной фа-
зой мембраны, тогда как гидрофильные остат-
ки расположены с противоположной стороны
P-слоя и формируют в наполненный водой по-
ровый канал (рис. 1.326). В целом строение по-
ринов напоминает бочку, где p-слои выполняют
роль отдельных досок (планок). По сравнению с
ионными каналами, порины имеют более эко-
номичную структуру — молекулярная масса
белковой молекулы порина в два раза меньше,
чем у пептидов ионных каналов, однако при
этом она формирует транспортный канал гораз-
до большего размера.
Еще один тип поринов — порины, образую-
щие селективные поры и содержащие сайты
связывания для различных ионов и неионоген-
ных молекул (например, углеводов). Пример
поринов такого типа — порины Escherichia coli
для транспорта мальтодекстринов. Они так-
же состоят из 16 р-складчатых структур, сайты
связывания мальтодекстрина расположены на
соединяющих р-тяжи участках полипептидной
цепи белка, так называемых петлях, погружен-
ных в полость поры.
Аналогичную р-складчатую структуру име-
ют и митохондриальные порины. Изучение
свойств митохондриальных поринов при помо-
щи искусственных мембран (см. рис. 1.30) пока-
зало, что в открытом состоянии их поры имеют
анионную специфичность, однако воздействие
слабого напряжения порядка 30 мВ приводит
к сужению (закрытию) канала, и порин прояв-
ляет чувствительность к катионам. Благодаря
этой особенности митохондриальные порины
получили название селективных потенциал-
зависимых анионных каналов (voltage-dependent
anion selective channel — VDAC). Физиологиче-
ские функции такой регуляции открытия и за-
крытия пор пока остаются под вопросом.
Во внешней мембране оболочки хлороплас-
тов был обнаружен порин с молекулярной мас-
сой 24 кДа (outer envelope protein — ОЕР24),
образующий неспецифичную диффузионную
пору. Его свойства весьма сходны со свойства-
ми VDAC, несмотря на отсутствие гомологии
последовательностей. В открытом состоянии
ОЕР24 способен пропускать различные метабо-
литы.
Кроме того, внешняя мембрана оболочки
хлоропластов содержит также порин с молеку-
лярной массой 21 кДа (ОЕР21), который фор-
мирует селективный анионный канал, специали-
зирующийся на транспорте фосфорилированных
метаболитов (например, 3-фосфоглицерата или
дигидроксиацетонфосфата). Переключение это-
го канала регулируется процессами связывания
и освобождения субстратов. До сих пор не ясно,
зависит ли поток метаболитов через внешнюю
мембрану оболочки хлоропластов от работы
ОЕР24 и ОЕР21, и в какой степени.
Еще один порообразующий белок локализо-
ван в мембране пероксисом (раздел 7.4).
Дополнительная дитература
Aaziz, R., Dinant, S., Epel, В. L. Plasmodesmata and
plant cytoskeleton. Trends Plant Sci 6, 326—330 (2001).
Benz, R. Permeation of hydrophilic solutes through
mitochondrial porins. Biochim Biophys Acta 1197,
167-196(1994).
Blatt, M. R. Plant potassium channels double up. Trends
Plant Sci 2, 244-246 (1997).
Cavalier-Smith, T. Membrane heredity and early
chloroplast evolution. Trends Plant Sci 5, 174—182
(2000).
Choi, D., Lee, Yi., Cho, H.-Т., Kende, H. Regulation
of expansin gene expression affects growth and
development in transgenic rice plants. Plant Cell 15,
1386-1398 (2003).
Doyle, D. A., Cabrai, J. M., Pfuetzner, R. A., Kuo, A.,
Gulbis, J. M., Cohen, S. L., Chait, В. T., MacKinnon,
R. The structure of the potassium channel: Molecular
Дополнительная литература
53
basis of К+ conduction and selectivity. Science 280,
69-77(1998).
Dutzler, R., Campbell, E. B., Cadene, M., Chait, В. T.,
MacKinnon, R. Xray structure of a CIC chloride channel
at 3.0 A reveals the molecular basis of anion selectivity.
Nature 415, 287-294 (2002).
Fliigge, U.-L, Fischer, K., Gross, A., Sebald, W.,
Lottspeich, F., Eckerskorn, C. The triose phosphate-3-
phosphoglycerate-phosphate translocator from spinach
chloroplasts: Nucleotide sequence of a full-length cDNA
cloneand import of the in vitro synthesized precursor
protein into chloroplasts. EM BO J 8, 39—46 (1989).
Fliigge, U.-L Transport in and out of plastids: Does the
outer envelope membrane control the flow? Trends
Plant Sci 5, 135-137 (2000).
Fliigge, U.-l. Phosphate translocators in plastids. Annu
Rev Plant Physiol Plant Mol Biol 50, 27—45 (1999).
Frandsen, G. I., Mundy, J., Tzen, J. T. C. Oil bodies
and their associated proteins, oleosins and caleosin.
Physiologia Plantarum 112, 301—307 (2001).
Gunning, D. E. S., Steer, M.W. Ultrastructure and the
biology of plant cells. Edward Arnold, London (1975).
Jackson, D. Opening up the communication channels:
Recent insights into plasmodesmal function. Curr Opin
Plant Biol 3, 394-399 (2000).
Kjellbom, P., Larsson, C., Johansson, L, Karlsson, M.,
Johanson, U. Aquaporins and water homeostasis in
plants. Trends Plant Sci 4, 308—314 (1999).
Kramer, R. Functional principles of solute transport
systems: Concepts and perspectives. Biochim Biophys
Acta 1185, 1-34(1994).
Kuo, A., Gulbis, J. M., Antcliff, J. F., Rahman, T.,
Lowe, E. D., Zimmer, J., Cuthbertson, J., Ashc-
roft, F. M., Ezaki, T., Doyle, D. A. Crystal structure
of the potassium channel KirBacl.l in the closed state.
Science 300, 1922-1926 (2003).
Li, X., Franceschi, V. R., Okita, T. W. Segregation of
storage protein mRNAs on the rough endoplasmatic
reticulum membranes of rice endosperm cells. Cell 72,
869-879 (2001).
Lucas, W. J., Wolf, S. Connections between virus
movement, macromolecular signaling and assimilate
allocation. Curr Opin Plant Biol 2, 192—197 (1999).
Maathius, F. J. M., Ichida, A. M., Sanders, D., Schroeder,
J. I. Roles of higher plant K+ channels. Plant Physiol
114, 1141-1149(1997).
Maeser, P., Hosoo, Y., Goshima, S., Horie, T.,
Eckelman, B., Yamada, K., Yoshida, K., Bakker, E. P.,
Shinmyo, A., Oiki, S., Schroeder J. L, Uozumi N.
Glycine residues in potassium channel-like selectivity
filters determine potassium selectivity in four-loop-per-
subunit HKT transporters from plants. Proc Natl Acad
Sci USA 99, 6428-6433 (2002).
Moreira, D., Le Guyader, H., Philippe, H. The origin of
red algae and the evolution of chloroplasts, Nature 405,
69-72 (2000).
Murata, K., Mitsuoka, K., Hirai, T., Walz, T., Agre, P.,
Heymann, J. B., Engel, A., Fujiyoshi, Y. Structural
determinants of water permeation through aquaporin-1.
Nature 407, 599-605, (2000).
Murphy, D. J., Herandez-Pinzon, L, Patel, K. Role of
lipid body proteins in seeds and other tissues. J Plant
Physiol 158,471-478 (2001).
Nebenfuhr, A., Staehelin, L. A. Mobile factories: Golgi
dynamics in plant cells. Trends Plant Sci 6, 160—167
(2001).
Overall, R. L., Blackman, L. M. A model on the
macromolecular structure of plasmodesmata. Trends
Plant Sci 307-311 (1996).
Pebay-Peyroula, E., Dahout-Gonzalez, C., Kahn, R.,
Trezeguet, V., Lauquin, G.-J.-M., Brandolin, G.
Structure of mitochondrial ATP/ADP carrier in complex
with carboxyatractyloside. Nature 426, 39—44 (2003),
Pennell, R. Cell walls: Structures and signals. Curr Opin
Plant Biol 1,504-510(1998).
Pohlmeyer, K., Soil, J., Grimm, R., Hill, K.,Wagner, R.
A high-conductance solute channel in the chloroplastic
outer envelope from pea. Plant Cell 10, 1207—1216
(1998).
Reiter, W. D. The molecular analysis of cell wall
components. Trends Plant Sci 3, 27—32 (1998).
Robinson, D. G. Plant membranes. John Wiley and Sons,
New York (1985).
Robinson, D. G. ed. The Golgi apparatus and the plant
secretory pathway. Blackwell, Oxford, UK (2003).
Santoni, V., Gerbeau, P., Javot, H., Maurel, C. The high
diversity of aquaporins reveals novel facets of plant
membrane functions. Curr Opin Plant Biol 3, 476—481
(2000).
Sul, H., Han, B.-G., Lee, J. K., Wallan, P., Jap, В. K.
Structural basis of water-specific transport through the
AQP1 water channel. Nature 414, 872—878 (2001).
Tanner, W, Carpari, T. Membrane transport carriers.
Annu Rev Plant Physiol Plant Mol Biol 47, 595—626
(1996).
Uehlein, N., Lovisolo, C., Siefritz, F., Kaldenhoff, R.
The tobacco aquaporin NtAQPl is a membrane CO2
pore with physiological functions. Nature 425, 734—737
(2003).
54
1. Органеллы растительных клеток
Very, A.-A., Sentenac, Н. Molecular mechanism and
regulation of K+ transport in higher plants. Annu Rev
Plant Biol 54, 575-602 (2002).
Wandelt, С. I., Kahn, M. R. I., Craig, S., Schroeder, H. E.,
Spencer, D. E., Higgins, T. J. V. Vicilin with carboxy-
terminal KDEL is retained in the endoplasmatic
reticulum and accumulates to high levels in leaves of
transgenic plants. Plant J 2, 181 — 192(1992).
Ward, J. M. Patch-clamping and other molecular
approaches for the study of plasma membrane
transporters demystified. Plant Physiol 114, 1151 — 1159
(1997).
Winter, H., Robinson, D. G., Heldt, H.W. Subcellular
volumes and metabolite concentrations in spinach
leaves. Planta 193, 530-535 (1994).
Zhou, Y., Morais-Cabral, J. H., Kaufmann, A.,
MacKinnon, R. Chemistry of ion coordination and
hydration revealed by a K+ channel-Fab complex at 2.0
A resolution. Nature 414, 4348 (2001).
Использование энергии солнечного света
в процессе фотосинтеза - основа
жизни на Земле
Растения и цианобактерии поглощают сол-
нечный свет и используют его энергию для
синтеза органических соединений из неоргани-
ческих молекул и ионов, таких, как СО2, нитрат
и сульфат. Эти организмы относятся к фото-
автотрофам. Образующиеся соединения могут
использоваться для синтеза различных клеточ-
ных компонентов. В процессе фотосинтеза при
использовании энергии фотонов происходит
окисление воды с образованием кислорода и
водорода, который, в конце концов, оказывает-
(СН2О)п + пО2
Углеводы
Гетеротрофные
организмы,
в т.ч. животные
ся связанным в молекуле НАДФН1. Этот про-
цесс называют световой стадией фотосинтеза.
Преобразование энергии фотонов происходит в
реакционных центрах фотосистем, встроенных
в тилакоидную мембрану. В дальнейшем про-
исходит транспорт электронов, сопряженный
с синтезом АТФ. НАДФН и АТФ расходуют-
ся в так называемых темновых реакциях для
синтеза углеводов из СО2 (рис. 2.1). В результа-
те фотосинтеза растений и цианобактерий на
Земле образовались органические вещества, в
том числе запасы нефти и газа, а также атмос-
ферный кислород. Жизнь животных зависит от
поступления углеводов и других органических
веществ с пищей, поэтому их относят к гете-
ротрофам. Энергию, необходимую для жизне-
деятельности, они получают путем окисления
органических веществ, синтезированных рас-
тениями, при этом потребляя кислород и выде-
ляя углекислый газ. Следовательно, солнечный
свет, использованный растениями, служит так-
же источником энергии для жизненных процес-
сов в организмах животных.
2.1. Как возник фотосинтез?
При изучении радиоизотопного состава древ-
нейших пород было установлено, что планета
Земля образовалась около 4,6 млрд лет назад.
Наиболее ранние свидетельства жизни — это
остатки бактериоподобных структур, возраст
которых примерно 3,5 млрд лет. Когда на Земле
появилась первая жизнь, в атмосфере не было
кислорода. Этот вывод был сделан на основа-
нии того, что в очень древних осадочных по-
Рис. 2.1. Жизнь на Земле связана с циклом СО2
1 На самом деле в результате окисления воды образуются
кислород, протоны и электроны, которые восстанавливают
НАДФ+ до НАДФН. — Прим. ред.
56
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
родах железо присутствует в форме Fe2+. В при-
сутствие кислорода железо в составе минералов
окисляется1. По современным представлениям,
изначально атмосфера Земли содержала угле-
кислый газ, молекулярный водород, метан, ам-
моний, синильную кислоту и пары воды.
В 1922 г. русский ученый Александр Опарин
предложил интересную гипотезу о самопроиз-
вольном синтезе органических веществ в ат-
мосфере ранней Земли за счет энергии ультра-
фиолетового излучения (защитного озонового
слоя тогда не было), электрических разрядов
(молнии), а также тепловой энергии вулкани-
ческих извержений. Он предположил, что орга-
нические вещества постепенно накапливались
в первичном океане и затем стали компонента-
ми первых форм жизни. В 1953 г. американские
ученые Стэнли Миллер и Гарольд Юри под-
твердили гипотезу Опарина, осуществив «пред-
жизненный» синтез органических веществ. Они
воссоздали состав первичной атмосферы Земли,
смешав Н2О, СН4, NH3 и Н2, и пропускали че-
рез эту смесь электрические разряды при 80 °C
в течение недели. В результате эксперимента
были синтезированы аминокислоты, такие, как
глицин и аланин, а также другие органические
кислоты: муравьиная, уксусная, молочная и ян-
тарная. Другие экспериментаторы добавляли
в газовую смесь дополнительные компоненты,
такие, как СО, HCN и формальдегид, и в этих
работах были получены данные о том, что мно-
гие компоненты живых клеток (например, угле-
воды, жирные кислоты, тетрапирролы, а также
азотистые основания аденин, гуанин, цитозин и
урацил) могут самопроизвольно образовывать-
ся в «первичной атмосфере» при участии элек-
трической или тепловой энергии.
Предполагают, что органические вещества,
образованные таким образом, т. е. абиотиче-
ски, накапливались в древних морях, озерах
и лужах задолго до появления первой жизни.
В отсутствие атмосферного кислорода и живых
организмов органически вещества не окисля-
лись и не разлагались. Опарин говорил об оке-
1 Геохимические данные изложены не совсем верно. В при-
сутствие кислорода Fe2+ окисляется до Fe3+. Гидроксид же-
леза (III) малорастворим, поэтому усиливается образование
осадочных пород, содержащих железо. При дальнейшей ме-
таморфизации степень окисления железа в минералах может
вновь становиться равной +2. — Прим. ред. .
ане того времени как о «первичном бульоне»,
в котором накапливался материал для возник-
новения жизни. Поскольку в то время на Зем-
ле не было кислорода, первые организмы были
анаэробами.
В настоящее время считается, что первые
организмы на Земле по типу энергетического
метаболизма относились к хемолитотрофам.
Например, они могли получать энергию за счет
реакции
FeS + H2S -> FeS2 + Н2 (AG° = - 42 кДж/моль)
Вполне возможно, что уже на самой ранней
ступени эволюции катализ этой реакции был
сопряжен с генерацией на клеточной мембра-
не протон-движущей силы (раздел 4.1), кото-
рая обеспечивала энергией синтез АТФ с уча-
стием примитивного варианта АТФ-синтазы
(раздел 4.3). За счет этой реакции могут синте-
зировать АТФ архебактерии (археи) — ныне
живущие организмы, способные существовать
в анаэробных условиях при экстремальных
температурах (например, вблизи горячих ис-
точников на дне океана). В настоящий момент
архебактерии рассматриваются как ближайшие
родственники первых организмов. Вероятно,
способность использовать энергию солнечного
света для синтеза органических молекул появи-
лась достаточно рано, и ее появление стало на-
стоящим прорывом в эволюции жизни на Зем-
ле. Пурпурные бактерии и зеленые серные
бактерии, широко распространенные в настоя-
щее время, рассматривают как реликты раннего
этапа эволюции фотосинтеза.
Прежде чем перейти к рассмотрению про-
цесса фотосинтеза в главе 3, мы обсудим, как
растения улавливают свет и как световая энер-
гия передается в фотосинтетическом аппарате.
2.2. Пигменты поглощают энергию
солнечного света
Энергия световой волны зависит
от ее длины
В начале XX века в Берлине нобелевские лау-
реаты Макс Планк и Альберт Эйнштейн про-
вели знаменитые опыты, в ходе которых была
доказана двойственная природа света. С одной
стороны, свет — это электромагнитная волна,
с другой стороны — это поток частиц, которые
2.2. Пигменты поглощают энергию солнечного света
57
называют квантами света, или фотонами.
Энергия фотона пропорциональна частоте ко-
лебаний световой волны
E = h v =h -г-, (2-1)
л
где h — постоянная Планка (6,6-10-34 Джс), с —
скорость света (З Ю8 м-с-1), X — длина световой
волны.
Моль — величина, которая выражает коли-
чество молекул или фотонов. За 1 моль приня-
то 6 1023 молекул или фотонов (число Авогадро
Na). Энергия одного моля фотонов рассчитыва-
ется как
E=h^NA
(2.2)
С точки зрения термодинамики, чтобы энер-
гия фотона могла быть использована в фотохи-
мической реакции, она должна быть, по край-
ней мере, равна свободной энергии Гиббса для
данной реакции. [На самом деле значительная
доля энергии теряется в процессе перехода из
одной формы в другую (раздел 3.4), и из этого
следует, что энергия фотона должна быть боль-
ше, чем энергия Гиббса для соответствующей
реакции.] Мы можем приравнять энергию Гиб-
бса к энергии фотона:
\G = E = h^-NA (2.3)
Л
Подставляя численные значения констант,
получаем:
Л4 4 1П~34 /П \ 3 • 1О8(М) 1 6 • 1023 /П Д\
ЛС7 = 6,6-10 (Джс)--(Е) x^O’O^) (24)
\G=
119,000
Х(нм)
[кДж/моль фотонов] (2.5)
Для описания фотосинтетических окисли-
тельно-восстановительных реакций, которые
будут разобраны в главе 3, необходимо исполь-
зовать величину электрического потенциала
(Д£), который можно выразить через энергию
Гиббса:
F
(2.6)
где F — количество зарядов в 1 моле, которое
равно 96,480 Амп с моль-1. Подставляя это зна-
чение, получаем
\Е=- [Вольт (2.7)
гл(нм) л(нм)
Из широкого спектра электромагнитных
волн человеческий глаз воспринимает лишь
узкий диапазон с длиной волны между 400 и
700 нм (рис. 2.2). У поверхности Земли интен-
сивность солнечного излучения в этом диапазо-
не наиболее высока. Видимая часть спектра ис-
Рис. 2,2, Спектр электромагнитного излучения. Снизу приведена видимая
часть спектра. (' По другим данным видимая часть спектра шире — от 360 до
760 нм. — Прим, ред.)
58
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Таблица 2.1. Содержание энергии для фотонов разных длин волн
и рассчитанная исходя из формулы (2.7) разность электрохимических потенциалов
Длина волны, нм Цвет Содержание энергии, кДж/моль фотонов ДЕ, эВ
700 красный 170 1,76
650 красно-оранжевый 183 1,90
600 жёлтый 199 2,06
500 сине-зелёный 238 2,47
440 синий 271 2,80
400 фиолетовый 298 3,09
пользуется растениями в процессе фотосинтеза.
В процессе бактериального фотосинтеза, кроме
видимого света, используется также свет в ин-
фракрасной области.
В соответствии с формулой 2.3 энергия све-
та обратно пропорциональна длине волны.
В таблице 2.1 представлены значения энергии
для моля фотонов разных длин волн. Напри-
мер, фиолетовый свет имеет энергию примерно
300 кДж/моль фотонов. Красный свет с мак-
симальной длиной волны, которая может быть
использована в фотосинтезе (700 нм), содержит
170 кДж/моль фотонов, т.е. примерно в 2 раза
меньше, чем фиолетовый свет.
Хлорофилл — основной пигмент
фотосинтеза
В фотосинтезе зеленых растений функцию
«сбора света» выполняют преимущественно
хлорофиллы — пигменты, которые поглоща-
ют свет с длинами волн меньше 480 нм и в диа-
пазоне 650—700 нм (данные для хлорофилла а,
см. рис. 2.3). Когда белый (дневной) свет пада-
ет на слой молекул хлорофилла, зеленый свет
с длинами волн 480—650 нм не поглощается, а
проходит сквозь него. Поэтому хлорофилл, со-
держащийся в листе, и весь лист целиком, име-
ют зеленый цвет.
Эксперименты, проведенные в 1905—1913 го-
дах в Цюрихе и Берлине Ричардом Вильштет-
тером и его коллегами, привели к открытию
структурной формулы зеленого пигмента листа
хлорофилла — весьма значительному событию
в истории химии. Это открытие было настолько
грандиозным, что Ричард Вилыптеттер был на-
гражден Нобелевской премией по химии почти
сразу — в 1915 г.
Существует несколько хлорофиллов. На ри-
сунке 2.4 представлена структурная формула
хлорофиллов а и b (Хл-я, Хл-Л). Основой струк-
туры хлорофилла является кольцо, состоящее из
четырех пиррольных циклов, тетрапиррол, ко-
торый также называют порфирином. Mg2+ рас-
положен внутри кольца в качестве центрального
атома: с двумя атомами азота тетрапиррола он
связан ковалентно, с двумя другими — коорди-
национно. Пятое циклопентановое кольцо при-
креплено к кольцу с. В кольце d остаток про-
пионовой кислоты образует эфир со спиртом
фитолом. Фитол представляет собой длинную
углеводородную цепочку с одной двойной С=С
связью. Он является изопреноидом из 4 изопре-
новых единиц (раздел 17.7). Длинный гидро-
фобный хвост фитола делает хлорофилл хоро-
шо растворимым в неполярных растворителях,
и, таким образом, обеспечивает его внедрение
в липидную фракцию в искусственных систе-
мах. Однако в живых организмах хлорофилл
всегда находится в связи с белками. В кольце b
хлорофилл-Z) содержит формальдегидную груп-
пу, а хлорофилл-б/ — метильный остаток. Это
небольшое отличие приводит к значительному
изменению спектра поглощения. На рисунке 2.3
видны различия в спектрах поглощения Хл-я и
Хл-/>.
У растений отношение Хл\-а/Хл-Ь составляет
примерно 3:1. Только Хл-я является основным
компонентом реакционных центров фотосистем
(разделы 3.6 и 3.8), поэтому его считают основ-
ным пигментом фотосинтеза. Однако на боль-
шом участке видимого спектра Хл\-а не поглоща-
ет. Этот участок называют «зеленым провалом» в
спектре поглощения. Эта область становится уже
за счет поглощения Хл-Z?: его первый максимум
2.2. Пигменты поглощают энергию солнечного света
59
Рис. 2.3. Спектры поглощения хлорофилла-67 (Хл-я), хлорофилла-/? (Хл-/>)
и ксантофилла лютеина в ацетоне. Для сравнения приведена интенсивность
солнечного излучения при разных длинах волн
расположен в более длинноволновой области, а
второй — в более коротковолновой области по
сравнению с соответствующими максимумами
Хл-67. Как будет сказано в разделе 2.4, световая
энергия, поглощенная Хл-/>, может с высокой
эффективностью быть передана на Хл-а. Таким
образом, Хл-b используется растениями для бо-
лее эффективного использования солнечной
энергии.
Структура хлорофиллов в процессе эволюции
оставалась на удивление консервативной. Пур-
пурные бактерии, которые возникли, предполо-
жительно, более 3 млрд лет назад, содержат фото-
синтетический пигмент бактериохлорофилл-б/,
который отличается от хлорофилла-^, изобра-
женного на рис. 2.4, только одной боковой цепью
и отсутствием одной двойной связи. Однако это
небольшое отличие обеспечивает сдвиг одно-
го максимума поглощения из красной области
в инфракрасную, а второго — из синей в более
коротковолновую часть спектра. Это приводит к
расширению участка спектра, на котором погло-
щение бактериохлорофилла незначительно.
В процессе эволюции тетрапиррольное коль-
цо не только осталось почти без изменений во
всех хлорофиллах, но также обеспечило вы-
полнение различных функций, не связанных с
фотосинтезом. Тетрапиррольная структура с Ni
в качестве центрального атома участвует в об-
разовании метана у бактерий. С центральным
атомом Со та же структура образует кобаламин
(витамин В12), который в качестве кофактора
участвует в реакциях переноса водорода и ор-
ганических групп. Когда центральным атомом
становится Fe, тетрапиррольное кольцо образу-
ет базовую структуру гемов (рис. 3.24), которые,
с одной стороны, функционируют как редокс-
кофакторы в цепи переноса электрона (цитохро-
мы) (разделы 3.7 и 5.5), а, с другой стороны, за-
пасают и переносят кислород в тканях аэробных
организмов (гемоглобин, миоглобин). Тетрапир-
рольное кольцо гема в гемоглобине животных
60
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Рис. 2.4. Структурная формула хлорофилла-67. У хлорофилла-/? метильная группа
в кольце b заменена альдегидной группой (обозначена цветом). Фитольный «хвост»
гидрофобен и обеспечивает заякоривание в белковых комплексах липидной
мембраны
незначительно отличается от тетрапиррольного
кольца хлорофилла-^ (см. рис. 2.4).
Удивительно, что соединение, приспосо-
бленное в процессе эволюции для выполнения
определенной функции, после незначительных
структурных изменений может выполнять со-
вершенно иную функцию. Причина многофунк-
циональности таких соединений, как хлорофилл
и гем, заключается в том, что их активность в
значительной степени контролируется белками,
с которыми они связаны.
Молекулы хлорофилла в клетке связаны со
специальными белками. Спектр поглощения
хлорофилл-белкового комплекса может сильно
отличаться от спектра поглощения свободно-
го хлорофилла. То же самое можно сказать и о
других соединениях, поглощающих свет, таких,
как каротиноиды, ксантофиллы и фикобили-
ны, которые также находятся в комплексах с
белками. Эти соединения будут рассмотрены в
следующих разделах. Далее в тексте вещества,
поглощающие свет в видимой области будут на-
зываться хромофоры (от греческого «цвет» и
«нести»), а хромофоры в комплексе с белками
будут называться пигментами. Пигменты часто
называют по длине волны максимума поглоще-
ния (например, Хл-я700 означает хлорофилл-^
с максимумом поглощения 700 нм). Еще одно
распространенное сокращение — Р700 (от pig-
ment) — не содержит информации о структуре
хромофорной группы.
2.3. Поглощение света переводит
молекулу хлорофилла
в возбужденное состояние
Что происходит, когда хромофор поглощает фо-
тон? При возбуждении фотоном определенной
энергии молекулы хромофора, которая погло-
щает свет данной длины волны, энергия фотона
передается электронам, и они переходят на более
высокий энергетический уровень. В соответствии
с законом сохранения энергии (первый закон тер-
модинамики) энергия хромофора увеличивается
за счет энергии поглощенного фотона, и молеку-
ла хромофора переходит в возбужденное состо-
яние. Этот процесс происходит по принципу «все
или ничего». Энергия может поглощаться только
дискретно (квантами), энергетические уровни
также дискретны. Количество энергии, которая
необходима для возбуждения хромофора, зависит
от структуры хромофорной группы. Общее свой-
ство хромофорных групп заключается в том, что
они содержат большое количество сопряженных
двойных связей (десять в случае тетрапирроль-
ного кольца Хл-я). Электроны этих двойных свя-
зей делокализованы. На рисунке 2.5 изображены
две возможные резонансные формы.
2.3. Поглощение света переводит молекулу хлорофилла в возбужденное состояние
61
Рис. 2.5. Резонансные структуры хлорофилла-я. В области, обозначенной
красным, двойные связи делокализованы; л-электроны распределены по всей
системе сопряженных связей. Альдегидная группа хлорофилла-/? оттягивает на себя
электронную плотность, что отражается на всей системе л-электронного сопряжения
После поглощения энергии электрон сопря-
женной системы поднимается на более высокую
орбиталь без изменения своего спина. Такое воз-
бужденное состояние молекулы хлорофилла на-
зывается синглетным. На рисунке 2.6 схематично
показано поглощение фотона. Как правило, чем
больше число двойных связей в сопряженной си-
стеме, тем меньшее количество энергии требуется
для перехода молекулы в первое синглетное состо-
яние. Для возбуждения хлорофилла достаточно
красного света (длинноволновое излучение), тог-
да как для возбуждения бутадиена — соединения
с двумя сопряженными связями — необходимо
высокоэнергетическое ультрафиолетовое излу-
чение (коротковолновое). На поглощение света
системой сопряженных двойных связей тетра-
пиррольного кольца влияют также боковые цепи.
Различия в спектрах поглощения хлорофиллов
-а и -/?, о которых говорилось выше, можно объ-
яснить тем, что карбонильная боковая цепьХл-/?
оттягивает электроны от кольца (см. рис. 2.5).
Спектры поглощения Хл-я и Хл-/> (см.
рис. 2.3) имеют два основных максимума по-
глощения, которые соответствуют двум воз-
бужденным состояниям. Кроме того, у хлоро-
филлов есть минорные максимумы, которые
мы не будем обсуждать в рамках данной книги.
Два основных возбужденных состояния хлоро-
филла — первое (S0 и второе (S2) синглетные
состояния (см. рис. 2.6). Полосы поглощения
хлорофилла достаточно широкие, и при более
высоком разрешении становится видно, что
каждая полоса образована несколькими отдель-
ными спектральными линиями. Сложная струк-
тура спектра поглощения обусловлена тем, что
молекулы хлорофилла и в основном, и в обоих
синглетных состояниях могут находиться на раз-
ных колебательных и вращательных подуров-
нях. На энергетической диаграмме (см. рис. 2.6)
колебательные и вращательные подуровни обо-
значены тонкими линиями, а соответствующие
электронные уровни (состояния) — жирными
линиями. Колебательные и вращательные по-
дуровни основного состояния перекрываются
с наиболее низкими по энергии подуровнями
первого синглетного состояния (SJ. Поду-
ровни первого и второго синглетных состояний
также перекрываются по энергии. Если молеку-
ла хлорофилла поглощает свет в области синего
максимума, один из ее электронов поднимается
на второй синглетный уровень (S2). Время по-
лужизни второго синглетного состояния всего
10-12 сек, поэтому это состояние слишком неста-
бильно, чтобы использовать избыточную энер-
гию для совершения химической работы. Воз-
бужденная молекула рассеивает часть энергии в
форме тепла за счет вращений и колебаний, при
этом электрон переходит на первый синглетный
уровень. На уровень S| молекула может перейти
также из основного состояния (So) за счет по-
глощения фотона красного света, который со-
держит меньше энергии, чем фотон синего све-
та. Первое синглетное состояние гораздо более
стабильно, чем второе: время полужизни этого
состояния составляет 4-10-9 с.
Переход из первого синглетного уровня
на основной может происходить
у хлорофилла разными путями
1. Наиболее важный механизм превращения
энергии, которая освобождается при переходе из
первого синглетного состояния в основное, — ис-
62
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Второе возбужденное состояние
(второй синглет, S2)
Первое возбужденное состояние
(первый синглет, SJ
Основное состояние, So
Рис. 2.6. Схема возбужденных состояний хлорофилла-я и его возвращения
в основное состояние, в процессе которого высвобожденная энергия
возбуждения превращается в фотохимическую работу, свет флуоресценции или
фосфоресценции, или рассеивается в виде тепла. На этой упрощенной схеме
показаны только возбужденные состояния, соответствующие двум основным
максимумам поглощения хлорофиллов
2.3. Поглощение света переводит молекулу хлорофилла в возбуждённое состояние
63
пользование ее для совершения химической ра-
боты по переносу Н+ против градиента концен-
трации и созданию ДцН+ на мембране1. Молекула
хлорофилла передает возбужденный электрон с
первого синглетного уровня Sj акцептору; при
этом образуется положительно заряженный хло-
рофилл (радикал Хл+е). Это происходит потому,
что возбужденный электрон связан с молекулой
хромофора слабее, чем электрон в основном со-
стоянии So. В разделе 3.5 детально описано, как
электрон может возвращаться обратно с акцепто-
ра на Хл+* через электрон-транспортную цепь, в
результате чего молекула хлорофилла вновь пере-
ходит в основное состояние, а свободная энергия
используется для создания ДцН+ на мембране.
В другом случае дефицит электрона в радикале
Хл+е может восполняться за счет донора электро-
на [например, волы (раздел 3.6)].
2. Возбужденный хлорофилл может вернуть-
ся в основное состояние So, расходуя энергию
на излучение света. Это явление носит название
флуоресценции. В связи с колебанием и вра-
щением групп атомов в молекуле часть энергии
возбуждения обычно успевает рассеяться в фор-
ме теплового излучения, поэтому кванты света
при флуоресценции несут меньше энергии, чем
было затрачено для перехода на первый синглет-
ный уровень (а значит, имеют большую длину
волны, чем возбуждающий свет) (рис. 2.7).
3. Возможен возврат с первого синглетного
уровня Sj на основной So путем постепенного
Поглощение Флуоресценция
Рис. 2.7. Спектр флуоресценции обычно сдвинут
в более длинноволновую область, по сравнению
с возбуждающим светом
1 Эта энергия, в конце концов, запасается в виде энергии
химических связей. Процесс преобразования энергии осу-
ществляется через ряд промежуточных стадий (см. далее). —
Прим. ред.
перехода через различные колебательные и вра-
щательные уровни. При этом вся энергия дис-
сипирует в тепло.
4. Диссипируя часть энергии в тепло, моле-
кула хлорофилла может перейти на возбужден-
ный уровень с более низкой энергией, который
называется первым триплетным уровнем (Tj).
Молекула не может перейти в триплетное со-
стояние непосредственно из основного за счет
поглощения света. При переходе в триплетное
состояние спин возбужденного электрона ме-
няется на противоположный. Так как вероят-
ность обращения спина невелика, триплетное
состояние возникает редко, но при достаточ-
но высоком уровне поглощения квантов света
часть молекул хлорофилла все же переходит в
это состояние. Молекула может перейти из три-
плетного состояния Tj в основное, испуская так
называемый свет фосфоресценции. Свет фос-
форесценции имеет меньшую энергию, чем та,
которая была затрачена для перехода молекулы
в первое синглетное состояние. Возврат элек-
трона с триплетного уровня на основной тре-
бует обращения спина. Поскольку вероятность
этого мала, первое триплетное состояние (Т0,
по сравнению с первым синглетным, отличает-
ся большим временем полужизни: 10~4—10~2 с.
Хлорофилл втриплетном состоянии не участвует
в выполнении фотосинтетической функции как
таковой. Однако триплетный хлорофилл может
передать энергию на кислород и перевести его,
таким образом, в возбужденное синглетное со-
стояние, после чего кислород становится очень
реакционноспособным и может вызвать разру-
шение клеточных компонентов. В разделе 3.10
описано, как растение противостоит разруши-
тельному действию синглетного кислорода.
5. Возврат в основное состояние может быть
сопряжен с возбуждением соседней молекулы
хромофора (процесс миграции энергии). Переда-
ча возбуждения — функция антенных пигментов.
Она будет рассмотрена в следующем разделе.
2.4. Антенна служит для сбора света
Для того чтобы передать возбуждение на пиг-
мент реакционного центра, фотон определен-
ной энергии должен возбудить молекулу хло-
рофилла в реакционном центре. Вероятность
того, что фотон не только несет определенную
64
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
энергию, но и столкнется именно с той моле-
кулой хлорофилла, которая находится в реак-
ционном центре, очень невелика. Поэтому эф-
фективный фотосинтез возможен лишь тогда,
когда энергия фотонов разных длин волн захва-
тывается, так называемой антенной (рис. 2.8).
Фотосинтез, подобно радио и телевидению, не
мог бы функционировать в отсутствие антенны.
Антенны растений состоят из многих моле-
кул хлорофилла, связанных с белком, которые
поглощают фотоны и передают их энергию в ре-
акционный центр. Если произвести усреднен-
ный расчет для всей поверхности листа, то ока-
жется, что в состав реакционных центров входят
всего несколько тысяч молекул хлорофилла.
Остальные сотни тысяч молекул хлорофилла
расположены в антенных комплексах. Наблюде-
ния, сделанные Робертом Эмерсоном и Уилья-
мом Арнольдом в США в 1932 году, показали,
что абсолютное большинство молекул хлоро-
филла не входит в состав реакционных центров.
Исследователи освещали суспензию зеленой
водоросли Chlorella импульсами света длитель-
ностью 10 мкс с интервалами 20 мс. Интенсив-
ность выделения кислорода использовали как
количественный показатель фотосинтеза. Им-
пульсы света были так коротки, что хлорофилл
мог перейти в возбужденное состояние только
один раз, а интенсивность света была настоль-
ко высокая, что выделение кислорода достигало
своего максимума. Таким образом, фотосинте-
тический аппарат оказывался насыщен фотона-
ми. Анализ содержания хлорофилла в суспензии
водорослей показал, что при насыщающей ин-
тенсивности света на 2400 молекул хлорофилла
образуется лишь одна молекула О2.
В последующие годы Эмерсон уточнил эти дан-
ные: он показал, что при освещении импульсами
очень низкой интенсивности количество выделен-
ного кислорода увеличивалось пропорционально
интенсивности света. Отсюда было рассчитано,
что выделение одной молекулы кислорода требу-
ет поглощения как минимум восьми фотонов.
Эти результаты положили начало длительному
научному диспуту с Отто Варбургом, который на
основании своих экспериментов заключил, что
для формирования одной молекулы О2 требуется
лишь четыре фотона.
Результаты Эмерсона и Арнольда привели к
заключению, что потребность в квантах для вы-
деления одной молекулы кислорода составляет
восемь фотонов, причем два реакционных цен-
тра, как было показано позже, используют по
4 фотона каждый. С одним реакционным цен-
тром ассоциировано около 300 молекул хлоро-
филла. Эти молекулы входят в состав антенны.
Антенны комплексы водорослей и высших
растений содержат дополнительные пигменты
для использования фотонов, длины волн которых
лежат в области «зеленого провала», между мак-
симумами поглощения хлорофилла. У высших
растений это каротиноиды, преимущественно
ксантофиллы, включая лютеин и сходный с ним
по структуре виолаксантин, а также каротины
Рис. 2.8. Фотоны собираются с помощью антенны, и их энергия передается в
реакционный центр. На этой схеме квадратами обозначены молекулы хлорофилла.
Возбуждение, переданное в реакционный центр, вызывает разделение зарядов
(раздел 3.4)
2.4. Антенна служит для сбора света
65
р-Каротин
(каротин)
Лютеин
(ксантофилл)
Виолаксантин
(ксантофилл)
Рис. 2.9. Структурные формулы каротина (Р-каротин) и двух ксантофиллов
(лютеина и виолаксантина). Благодаря сопряженным связям в изопреноидной цепи
эти молекулы поглощают свет. Каротиноиды — гидрофобные соединения
(преимущественно, p-каротин) (рис. 2.9). Кро-
ме сбора света, каротиноиды в составе антенны
выполняют еще одну важную функцию: они за-
бирают на себя энергию от опасного для клетки
триплетного состояния хлорофилла (TJ, которое
упоминалось выше (раздел 3.10).
Важными компонентами антенны у циано-
бактерий являются фикобилины, которые бу-
дут рассмотрены в конце этого раздела.
Каким образом энергия фотонов,
поглощенная антенной,
передается в реакционный центр?
Можно было бы предположить, что энергия
мигрирует по антенне за счет передачи элек-
трона от одного хромофора к другому в се-
рии окислительно-восстановительных реакций,
подобно тому, как это происходит в электрон-
транспортных цепях фотосинтеза и дыхания
(которые будут рассмотрены ниже). Такой элект-
ронный транспорт должен был бы иметь замет-
ную энергию активации. Но было установлено,
что поток энергии возбуждения в антенне про-
исходит даже при температуре 1°К. При столь
низкой температуре поглощение света и флуо-
ресценция все еще могут происходить, в то вре-
мя как химические процессы, катализируемые
ферментами, полностью блокированы. Очевид-
но, передача энергии в антенне происходит по
механизму, сходному с механизмом поглощения
света и флуоресценции.
Когда хромофоры расположены очень близ-
ко друг к другу, возможна передача энергии фо-
тона от одного хромофора к другому. Подобно
тому, как квант световой энергии называется
фотоном, квант энергии возбуждения, пере-
данной от одной молекулы к другой, называется
экситоном1. Обязательным условием передачи
экситонов является определенное расположение
хромофоров, участвующих в передаче, которое
достигается за счет их взаимной ориентации на
молекуле белка. Поэтому хромофоры антенны
всегда входят в состав пигмент-белковых ком-
плексов.
Антенны растений состоят из внутренней и
внешней частей (рис. 2.10). Внешняя часть, об-
разованная светособирающими комплексами
(ССК), поглощает свет. Внутренняя часть антен-
ны, состоящая из коровых комплексов, ассоци-
ирована с реакционным центром; она поглоща-
1 В немецкой традиции преподавания фотосинтеза при-
нято говорить только об экситонном механизме передачи
энергии и чётко различать квант света и экситон. Однако су-
ществуют и другие механизмы передачи энергии в антенных
комплексах: индуктивный резонанс, излучение кванта света
с последующим поглощением, полупроводниковые токи,
позволяющие обмен электронами без участия ферментов.
Термин «экситон» в нашей научной литературе использует-
ся ограниченно. — Прим. ред.
66
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Тилакоидная
мембрана
Рис. 2.10. Обобщенная схема строения антенны
ет свет, а также передает экситоны, собранные
внешней антенной, в реакционный центр.
ССК состоят из полипептидов, с которыми
связаны Хл-<7, Хл-/), ксантофиллы и каротины.
Эти белки, которые называют полипептидами
ССК, кодируются в ядре. У растений было об-
наружено много различных полипептидов ССК.
Например, у томата найдено как минимум 19
сходных между собой генов, кодирующих поли-
пептиды ССК. Эти гены гомологичны, так как
в процессе эволюции они возникли от общей
предковой формы, и образуют мультигенное се-
мейство.
У растений есть два типа реакционных цен-
тров, определенным образом расположенных
в тилакоидной мембране: реакционный центр
фотосистемы II (ФС II), который имеет макси-
мум поглощения 680 нм, и реакционный центр
фотосистемы I (ФС I) с максимумом поглоще-
ния 700 нм. Функции этих реакционных цен-
тров будут рассмотрены в разделах 3.6 и 3.8.
Функции антенны на примере антенны ФС II
Антенна реакционного центра ФС II содер-
жит 4 основных ССК, названных ССК-П а—d.
Главный компонент — ССК-П-/); на нем рас-
положено 67% всего хлорофилла антенны
ФС II. ССК-П-/) — белок, наиболее широ-
ко представленный в тилакоидной мембране,
поэтому он был детально изучен. Скорее все-
го, он находится в мембране в форме тримера.
Мономер (табл. 2.2) состоит из полипептида, с
которым соединены две молекулы лютеина (см
рис. 2.9). Полипептид содержит остаток треони-
на, который может быть фосфорилирован про-
теинкиназой с использованием АТФ. Фосфо-
рилированием регулируется активность ССК-П
(раздел 3.10).
Прорыв в расшифровке трехмерной струк-
туры ССК-П-/) был совершен при исследова-
нии кристаллических слоев тримеров ССК-П-/)
методом электронной криомикроскопии при
температуре 4 °К (рис. 2.П). Пептид ССК-П-/)
образует три трансмембранных спирали. Две
молекулы лютеина располагаются в толще мем-
браны крест-накрест. Молекулы Хл-/), у кото-
рых красный максимум поглощения находится
в более коротковолновой области спектра, чем у
Хл-я, расположены в наружной части комплек-
сов. Всего одна молекула Хл-я расположена в
периферической части; остальные расположены
в центральной части. На рисунке 2.12 схематич-
но изображена вертикальная проекция мономе-
ров, образующих тример. Хл-я, расположенный
в периферической части, обеспечивает передачу
энергии в соседний тример или в реакционный
центр. Другие пептиды ССК-П (a, cf d) очень
похожи на пептид ССК-П-/); они отличаются
лишь 5% аминокислотной последовательности
и, соответственно, по трехмерной структуре
тоже очень сходны. Соотношение Хл-а/Хл-Ь
значительно выше вССК-П-я и вССК-П-с, чем
в ССК-П-/?. Вероятно, ССК-П-я и ССК-П-с
расположены между ССК-П-/) и реакционным
центром.
2.4. Антенна служит для сбора света
67
Таблица 2,2, Состав мономера ССК-11-b
Пептид 232 аминокислоты
Липиды 1 фосфатидил гл и церин, 1 диацилглицерин
Хромофоры 7 Хл-а, 5 Хл-Ь, 2 лютеина
(Kuhlbrandt, 1994)
На рисунке 2.13 приведена гипотетическая
схема организации антенного комплекса ФС II.
Наружные комплексы, состоящие из тримеров
ССК-П-/?, находятся на периферии антенны.
Экситоны с хлорофилла-/? в ССК-П-/?, пере-
даются на Хл-# в центральной части мономера
ССК-П-/? и далее через контактирующие моле-
кулы Хл-я соседних тримеров — во внутренний
антенный комплекс. Внутренние комплексы
связаны маленькими хлорофилл-содержашими
субъединицами с коровым комплексом. Он со-
стоит из антенных белков СР 43 и СР 47, тесно
связанных с реакционным центром (рис. 3.22),
каждый из которых содержит 15 молекул Хл-я.
Тилакоидная
мембрана
Рис, 2.11. Пространственное расположение мономера ССК-П-/? в тилакоидной
мембране, вид сбоку. Три а-спирали белка пронизывают мембрану. Хлорофилл-#
(черный) и хлорофилл-/? (красный) ориентированы почти перпендикулярно к
поверхности мембраны. Две молекулы лютеина (черные) в центре комплекса
функционируют в качестве внутренней крестообразной распорки (с любезного
разрешения W. Kuhlbrandt, Гейдельберг)
68
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Рис. 2.12. Тример CCK-II-/? в тилакоидной мембране, вид сверху со стороны
стромы. В каждом мономере центральная пара спиралей образует левозакрученную
суперспираль, которая окружена молекулами хлорофилла. Молекулы Хл-/>
(красные) расположены на периферии мономеров (С любезного разрешения
W. Kiihlbrandt, Гейдельберг)
Поскольку максимум поглощения Хл-b рас-
положен в более коротковолновой области, чем
у Хл-я, передача экситонов от Хл-b к Хл-а со-
провождается потерями энергии в виде тепла.
Это обеспечивает ток экситонов с периферии
к реакционному центру. Связь между внешни-
ми ССК (ССК-П-£) и ФСП нарушается при
фосфорилировании ССК-П-£. Таким образом,
общий размер антенн комплексов может быть
адаптирован к интенсивности освещения (раз-
дел 3.10).
Фотосистема I содержит меньше ССК, чем
фотосистема II (раздел 3.8), так как ее коровая
антенна больше, чем у ФСП. ССК ФС1 сходны
с ССК ФСП. Анализ аминокислотной последо-
вательности показал, что ССК-I и ССК-П эво-
люционировали из одной предковой формы.
Предположительно, в фосфорилированном со-
стоянии ССК-П-£ может также функциониро-
вать как антенна ФС I (подвижная антенна —
см. раздел 3.10).
Механизм миграции экситонов в антенне еще
не полностью установлен. Экситон может быть
делокализован путем распределения по целой
группе хромофорных молекул. С другой сторо-
ны, экситон может в определенный момент на-
ходиться в какой-то конкретной хромофорной
молекуле и быть передан другой молекуле. Такая
передача экситона была названа механизмом
Фёрстера. Передача экситонов между очень
2.4. Антенна служит для сбора света
69
Тилакоидная
мембрана
Свет
Коровая антенна
Рис. 2.13. Схема расположения светособирающих комплексов в антенне
фотосистемы II (вид на мембрану тилакоида сверху) (по Thornber). а обозначает
ССК-П-я, b — ССК-П-£, и т.п. Комплексы внутренней антенны связаны
мономерами CCK-II-я и ССК-П-сс коровым комплексом. Функции CCK-II-J
и ССК-1 I-е ещё не до конца выяснены1
близко расположенными молекулами хлоро-
филла внутри ССК, скорее всего, происходит
путем делокализации электронов, а передача
от ССК в реакционный центр — по механизму
Фёрстера. Измерения поглощения с помощью
ультраскоростной лазерной техники показали,
что передача экситона между двумя молекула-
ми хлорофилла происходит за 0,1 пс (10-13 с).
Таким образом, скорость передачи экситона в
антенне гораздо выше, чем разделение зарядов
в реакционном центре (3,5 пс), которое будет
рассмотрено в разделе 3.4. Реакционный центр
функционирует как энергетическая ловушка
для экситонов, которые мигрируют по антенне.
1 На рисунке показаны устаревшие сведения. По современ-
ным рентгеноструктурным данным белок СР 43 находится в
непосредственном контакте с реакционным центром, и не
контактирует с СР 47. — Прим. ред.
Фикобилисомы позволяют
цианобактериям и красным водорослям
фотосинтезировать даже при слабом свете
У цианобактерий и красных водорослей имеются
антенные структуры, которые могут собирать свет
при очень низкой интенсивности освещения. Эти
антенны представляют собой частицы, располо-
женные на мембране рядом с реакционными цен-
трами фотосистемы II (рис. 2.14). Эти частицы,
названные фикобилисомами, состоят из белков
(фикобилипротецдов), ковалентно связанных с
хромофорами фикобилинами. Фикобилины — те-
трапирролы с открытой цепью, т.е. соединения, по
структуре родственные хлорофиллам. Тетрапир-
ролы с открытой цепью также содержатся в желчи
(bile), отсюда и название — фикобилины. Фикоби-
лины связаны с белком тиоэфирной связью, обра-
зованной SH-группой белка и винильной боковой
цепью хромофора. Белок фикоэритрин связан с
хромофором фикоэритробилином, а белки фи-
70
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
Рис. 2.14. Схема структуры фикобилисомы, вид сбоку. Каждая из показанных на
рисунке единиц состоит из трех а- и трех р-субъединиц (по Bryanth)
Белок
I
SH
Фикоцианин
(Фикоэритрин)
Рис. 2.15. Структурная формула фи кобил и протеидов, входящих в состав
фикобилисом: фикоцианина (черный) и фикоэритрина (отличия от фикоэритрина
показаны красным). Соответствующие хромофоры фикоцианобилин и
фикоэритробилин ковалентно связаны с белками тиоэфирой связью, образованной
SH-группой цистеинового остатка белка и винильной группой хромофора.
Сопряженные двойные связи (обозначены красным) придают молекуле
хромофорные свойства
2.4. Антенна служит для сбора света
71
Длина волны (нм)
Рис. 2.16. Спектры поглощения фи кобил и протеидов фикоэритрина,
фикоцианина и аллофикоцианина, а также хлорофилла-# (для сравнения)
коцианин й аллофикоцианин — с хромофором
фикоцианобилином (рис. 2.15). Базовая структура
фикобилипротеидов — гетеродимер (а, 0). Каждая
из субъединиц содержит 1-4 молекулы фикобили-
на. Гетеродимеры агрегируются, образуя тримеры
(а, ₽)3 — «кирпичи», из которых строится фикоби-
лисома. Так называемые линкерные (связующие)
полипептиды служат «цементом», сцепляющим
«кирпичи».
На рисунке 2.14 представлена структура фи-
кобилисомы. Она прикреплена к мембране с
помощью заякоривающих белков. Три агрегата
из 4—5 (а, ₽)3 «кирпичей» образуют ядро, со-
держащее пигмент аллофикоцианин (АР). КАР
прикреплены цилиндрические стержневидные
структуры, каждая из которых состоит из 4—6
«кирпичей». «Кирпичи», обращенные к ядру,
содержат преимущественно фикоцианин (PC),
а внешние — фикоэритрин (РЕ). Функциональ-
ное значение такой структурной организации
обусловлено спектрами поглощения различных
фикобилипротеидов, представленными на ри-
сунке 2.16. Коротковолновый свет поглощается
на периферии стержня фикоэритрином, а длин-
новолновый свет поглощается фикоцианином
в подлежащих слоях. Пигменты ядра передают
экситоны в реакционный центр. Неравномерное
пространственное распределение длинновол-
новых и коротковолновых пигментов в антенне
ФС II было показано в предыдущем разделе на
примере высших растений.
Благодаря фикобилипротеидам фикобили-
сомы могут весьма эффективно поглощать зе-
леный свет (см. рис. 2.16), что позволяет циано-
бактериям и красным водорослям жить в воде на
большой глубине. Практически весь видимый
свет, кроме зеленого (см. рис. 2.3), поглощается
зелеными водорослями, живущими в поверх-
ностном слое воды, и на глубину доходит лишь
зеленый свет. Поэтому водоросли, живущие на
глубине, чтобы осуществлять фотосинтез при
такой низкой интенсивности света, вынуждены
72
2. Использование энергии солнечного света в процессе фотосинтеза — основа жизни на Земле
тратить значительную часть строительного ма-
териала клеток на образование фикобилисом.
Фикобилипротеиды у водорослей составляют до
40% от общей белковой массы. Эти организмы
расходуют столько белкового материала, чтобы
собрать необходимое для выживания количе-
ство света.
Дополнительная литература
Bada, J. L., Lazcano, A. Prebiotic soup—revisiting the
Miller experiment. Science 300, 74—746 (2003).
Cerullo, G., Polli, D., Lanzani, G., De Silverstri, S.,
Hashimoto, H., Cogdell, R. J. Photosynthetic light
harvesting by carotenoids: Detection of an intermediate
excited state. Science 298, 2395—2398 (2002).
Emerson, R. The quantum yield of photosynthesis. Annu
Rev Plant Physiol 9, 1—24 (1958).
Glazer, A. N. Photosynthetic accessory proteins with bilin
prosthetic groups. The Biochemistry of Plants, Vol.
8 (eds. M. D. Hatch, N. K. Boardman), pp. 51—96.
Academic Press, New York (1981).
Govindjee, Knox, R. S., Amesz, J. (eds.) Photosynthetic
unit: Antenna and reaction centers. Photosynth Res 48,
1-319(1996).
Kuhlbrandt, W. Structure and function of the plant light
harvesting complex, LHC-П. CurrBiol 4, 519—528
(1994).
Nilsson, A., Stys, D., Drakenberg, T., Spangfort, M. D.,
Forsen, S., Allen, J. F. Phosphorylation controls the
three-dimensional structure of plant light harvesting
complex II. J Biol Chem TH, 18350-18357 (1997).
Ruban, A. V., Wentworth, M., Yakushevska, A. E.,
Andersson, J., Lee, P. J., Keegstra W., Dekker, J. P.,
Boekema, E. J., Jansson, S., Horton, P. Plants lacking
the main light-harvesting complex retain photosystem II
macroorganization. Nature 42, 648—652 (2003).
Scheer, H., Chlorophylls. CRC. Boca Raton, Fla. (1991).
Turconi, S., Weber, N., Schweitzer, G., Strotmann, H.,
Holzwarth, A. R. Energy charge separation kinetics
in photosystem I. 2. Picosecond fluorescence study
of various PSI particles and light-harvesting complex
isolated from higher plants. Biochim Biophys Acta,
1187, 324-334(1994).
Vogelmann, T. C., Nishio, J. N., Smith, W. K. Leavesand
light capture light propagation and gradients of carbon
fixation in leaves. Trends Plant Sci 1, 65—70 (1996).
Xiong, J., Fischer, W. M., Inoue, K., Nakahara, M.,
Bauer, С. E. Molecular evidence for the early evolution
of photosynthesis. Science 289, 1724—1730 (2000).
3___________________________________
Транспорт электронов в процессе фотосинтеза
В предыдущей главе говорилось о том, как
фотоны захватываются антенной и пере-
даются в виде экситонов на реакционные цен-
тры. В этой главе речь пойдет о функциони-
ровании реакционных центров и о том, как
энергия фотонов превращается в химическую
энергию, которая используется клеткой для
различных энергоемких процессов. Как было
сказано в главе 2, фотосинтез растений, ско-
рее всего, эволюционировал из бактериального
фотосинтеза, поскольку основные механизмы
фотосинтетических реакций сходны у растений
и бактерий. Бактерии — удобные объекты для
изучения основных процессов фотосинтеза,
потому что их реакционные центры устроены
проще, чем у растений, и их легче выделять. По
этой причине мы рассмотрим сначала бактери-
альный фотосинтез, а затем поговорим о том,
как фотосинтез происходит у растений.
3.1. Фотосинтетический аппарат
имеет модульную организацию
Фотосинтетический аппарат бактерий состо-
ит из комплексов, которые похожи на компо-
ненты фотосинтетического аппарата расте-
ний. Как будет описано в главе 5, некоторые
из этих комплексов аналогичны компонентам
электрон-транспортной цепи митохондрий.
Эти комплексы можно рассматривать как мо-
дули, сформировавшиеся на ранних этапах
эволюции, которые могут различным образом
комбинироваться для выполнения конкретных
функций. Для удобства рассмотрения основ-
ных функции этих модулей они будут сначала
описаны как «черные ящики»; детализация их
структуры и функций будет дана ниже.
Фотосинтетические реакционные центры
и главные компоненты электрон-транспортной
цепи всегда расположены на мембране. У пур-
пурных бактерий есть только один реакцион-
ный центр (рис. 3.1). В нем энергия поглощен-
ного фотона возбуждает электрон, при этом
молекула хромофора приобретает отрицатель-
ный редокс-потенциал (становится восстано-
вителем). Возбужденный электрон переходит
на первичный акцептор и далее возвращается
к реакционному центру в результате его пере-
дачи по цепи переносчиков, расположенных в
цитохром-A/cj-комплексе. Запасание энергии
происходит за счет сопряжения электронного
транспорта с переносом протонов через мем-
брану. При этом энергия возбужденного элек-
трона переходит в энергию электрохимического
протонного градиента на мембране.
При участии АТФ-синтазы энергия протон-
ного градиента используется для синтеза АТФ
из АДФ и фосфата. В форме АТФ энергия, ко-
торая высвобождается в процессе электронного
транспорта, в дальнейшем используется для син-
теза органических веществ (белков и углеводов).
Так как возбужденный электрон у пурпурных
бактерий всегда возвращается обратно в реак-
ционный центр, электронный транспорт в этом
случае называется циклическим. У пурпурных
бактерий протонный градиент, помимо синтеза
АТФ, используется также для восстановления
НАД+ при участии НАДН-дегидрогеназного
комплекса (см. рис. 3.1). При его работе в дан-
ном случае электроны передаются от восстанов-
ленного соединения (например, органических
кислот или сероводорода) на НАД+. Расход
энергии протонного градиента позволяет сдви-
нуть равновесие в сторону образования восста-
новленного НАДН.
АТФ и НАДН, образованные в результате
бактериального фотосинтеза, используются для
синтеза органических веществ; особенно вели-
ко значение синтеза углеводов из СО2 в цикле
Кальвина (глава 6).
74
3. Транспорт электронов в процессе фотосинтеза
Е
Рис. 3.1. Схема фотосинтетического аппарата пурпурных бактерий. Энергия
поглощенного кванта света (экситона) в реакционном центре переводит
электрон на возбужденный энергетический уровень, что позволяет сдвинуть
редокс-потенциал бактериохлорофилла в более электроотрицательную область.
Электрон возвращается в основное состояние через электрон-транспортную цепь,
включающую цитохром-^/cj-комплекс и цитохром-с. Свободная энергия, которая
высвобождается при этом, запасается в форме электрохимического потенциала
протонов (АцН+), который используется как для синтеза АТФ, так и для передачи
электронов от доноров (например, H2S) на НАДН. У многих пурпурных бактерий
при этом образуются гранулы свободной серы, которые могут далее окисляться до
серной кислоты
НАДН
НАД®+Н®
АТФ
АДФ+Ф
Реакционный центр зеленых серных бак-
терий (рис. 3.2) в общих чертах похож на ре-
акционный центр пурпурных бактерий, что
указывает на возможное происхождение этих
групп организмов от общего предка1. У зеленых
серных бактерий АТФ также образуется в ре-
зультате циклического транспорта электронов.
Электрон-транспортная цепь и АТФ-синтаза,
которые участвуют в этом процессе, также сход-
ны с комплексами пурпурных бактерий. Одна-
ко, в отличие от пурпурных, у зеленых серных
бактерий НАДН образуется в процессе неци-
клического транспорта электронов. В этом
случае возбужденные электроны передаются на
ферредоксин-НАД-редуктазный комплекс,
который восстанавливает НАД+ до НАДН. По-
скольку возбужденные электроны в нецикли-
1 Проблема дискуссионна. Общепринято, что есть два раз-
личных типа реакционных центров, причём у пурпурных и
зелёных серных бактерий они существенно различаются.
Часто считают, что эти реакционные центры имеют различ-
ное эволюционное происхождение. — Прим. ред.
ческом пути не возвращаются в реакционный
центр, возникает дефицит электронов, который
восполняется за счет донора — H2S, который
окисляется до элементарной серы и далее — до
сульфата.
Цианобактерии и растения в качестве доно-
ра электронов в процессе фотосинтеза исполь-
зуют воду (рис. 3.3). При этом образуется моле-
кулярный кислород, поэтому такой фотосинтез
был назван оксигенным. Две фотосистемы (I
и II) в этом случае образуют функциональный
тандем. Фотосинтетический аппарат при окси-
генном фотосинтезе составлен из тех же моду-
лей, которые были описаны для бактериального
фотосинтеза. Реакционные центры ФС II и ФС
I сходны по структуре с реакционными центра-
ми пурпурных бактерий и зеленых серных бак-
терий, соответственно. Ферменты АТФ-синтаза
и ферредоксин-НАДФ-редуктаза также весьма
сходны у растений и фотосинтезирующих бак-
терий. Электрон-транспортная цепь цитохром-
д6/Лкомплекса хлоропластов имеет в прин-
H2s H2so4
Рис. 3.2. Схема фотосинтетического аппарата зеленых серных бактерий. В отличие
от схемы на рис. 3.1, часть электронов, поднявшихся на возбужденный уровень,
передается через электрон-транспортную цепь (ферредоксин-НАД редуктазу) на НАД,
и при этом образуется НАДН. Дефицит электрона, образующийся в реакционном
центре, восполняется за счет доноров электронов, таких как H2S. Как и у пурпурных
серных бактерий, сначала образуются гранулы элементарной серы, которые могут
окисляться до серной кислоты
Ч
н2° 72°2 + 2Н®
Рис. 3.3. В фотосинтетическом аппарате цианобактерий и растений два
реакционных центра, соответствующие по своим функциям фотосинтетическим
реакционным центрам пурпурных и зелёных серных бактерий (рис. 3.1 и 3.2),
расположены последовательно
76
3. Транспорт электронов в процессе фотосинтеза
ципе примерно такую же структуру, как цепь
цитохром-d/c/-комплекса бактерий.
Для энергетического обеспечения процесса
окисления одной молекулы воды при оксиген-
ном фотосинтезе необходимо четыре экситона:
Н2О + НАДФ+ + 4 экситона */2 О2 + НАДФН + Н+
В процессе нециклического транспорта элек-
троны передаются на НАДФ+, а протоны транс-
портируются через мембрану. При этом генери-
руется протонный градиент, необходимый для
синтеза АТФ. Таким образом, при образовании
одной молекулы НАДФН в процессе оксиген-
ного фотосинтеза одновременно могут синте-
зироваться от 1 до 2 молекул АТФ (раздел 4.4).
Большая часть образующихся АТФ и НАДФН
используется при ассимиляции СО2 и неорга-
нических соединений азота для дальнейшего
синтеза углеводов и аминокислот. Оксигенный
фотосинтез у растений происходит в хлоропла-
стах — клеточных органеллах, относящихся к
пластидам (раздел 1.3).
3.2. В процессе фотосинтеза
образуются окислитель
и восстановитель
В 1920-е годы Отто Варбург предположил, что
энергия света передается на СО2 и углекислый
газ, активированный таким образом, реагирует
с водой с образованием углеводов и выделени-
ем кислорода. В соответствии с этой гипотезой
кислород, выделяющийся при фотосинтезе, об-
разуется из СО2. В 1931 году эта гипотеза была
оспорена Корнелиусом ван Нилем, который
утверждал, что в процессе фотосинтеза образу-
ется восстановитель, который затем реагиру-
ет с СО2. Так называемое уравнение ван Ниля
описывает фотосинтез следующим образом:
СО2 + 2Н2А CUel- [СН2О] + Н2О + 2А
([СН2О] — углеводы).
Ван Ниль предположил, что вещество Н2А
разлагается за счет энергии света на восста-
навливающую компоненту (Н) и окисляющую
компоненту (А). Для оксигенного фотосинтеза у
цианобактерий и растений это уравнение может
быть представлено как:
свет
СО2 + 2Н2О-----► [СН2О] + О2
В соответствии с этим уравнением кислород,
выделяющийся в процессе фотосинтеза, образу-
ется из воды.
В 1937 году Роберт Хилл в Кембридже доказал,
что при фотосинтезе образуется восстановитель.
Он впервые успешно выделил хлоропласты, об-
ладающие частичной фотосинтетической ак-
тивностью, но лишенные интактной наружной
оболочки и содержащие только тилакоидные
мембраны. Когда эти хлоропласты освещали в
присутствии ([Fe(CN)6]3 ), выделение кислорода
сопровождалось восстановлением Fe3+ до Fe2+.
Н2О + 2Fe3+ Свет» 2Н+ + уО2 + 2Fe2+
Поскольку СО2 не участвовал в «реакции
Хилла», этот эксперимент доказывал, что фото-
химическое разложение воды может быть отде-
лено от восстановления СО2. Таким образом,
суммарную реакцию фотосинтетической асси-
миляции СО2 можно подразделить на две реак-
ции.
1, Так называемая световая реакция, в кото-
рой вода окисляется за счет энергии фотона
с образованием сильного восстановителя (в
форме НАДФН) и запасанием химической
энергии (в форме АТФ).
2. Так называемая темновая реакция (глава 6),
в которой происходит ассимиляция СО2 с
использованием восстановительной силы
(НАДФН) и АТФ.
В 1952 году голландский ученый Луис Дюй-
зенс сделал важное наблюдение, которое по-
могло объяснить механизм фотосинтеза. При
освещении изолированных мембран пурпур-
ных бактерий Rhodospirillum rubum короткими
вспышками происходило снижение поглоще-
ния света при 890 нм, но оно немедленно вос-
станавливалось при помещении бактерий в тем-
ноту. Аналогичный эффект «выцветания» при
870 нм был обнаружен у пурпурных бактерий
Rhodobacter sphaeroides. Позже Бессил Кок в
США и Хорст Витт в Германии также обнару-
жили выцветание пигментов при 700 и 680 нм
в хлоропластах. Эффект выцветания был соот-
несен с первичной реакцией фотосинтеза, а со-
ответствующие пигменты реакционных центров
были названы Р870 (у Rh. sphaeroides), Р680 и Р700
(в хлоропластах). При добавлении окислителя
(например, [Fe(CN)6]3 ) эффект выцветания
достигался не только на свету, но и в темноте.
3.3. Основная структура фотосинтетического реакционного центра
77
Эти результаты показали, что изменения в по-
глощении пигментов были обусловлены ре-
акцией восстановления. Так было впервые
показано, что хлорофилл может быть окислен.
Измерения электронного парамагнитного ре-
зонанса выявили образование радикалов при
«выцветании». «Выцветание» наблюдается даже
при очень низких температурах — при 1 °К. Это
свидетельствует о том, что участники реакции,
приводящей к формированию радикалов, рас-
положены настолько близко, что тепловые ко-
лебания, которые обычно имеют большое зна-
чение для химической реакции, в этом случае не
являются необходимым условием окислительно-
восстановительного процесса. Спектральные
измерения показали, что участники первичной
окислительно-восстановительной реакции —
пара близко расположенных молекул хлорофил-
ла, которые получили название «специальной
пары».
3.3. Основная структура
фотосинтетического
реакционного центра была
расшифрована с помощью
рентгено-структурного анализа
Реакционные центры пурпурных бактерий
оказались чрезвычайно удобными объектами
для изучения структуры и функции фотосин-
тетического аппарата. Важный этап в изучении
фотосинтеза ознаменовала разработка амери-
канским ученым Родериком Клейтоном в 1970
году метода выделения реакционных центров
пурпурных бактерий. Анализ компонентов ре-
акционных центров различных пурпурных
бактерий (в табл. 3.1 приведены данные для
бактерии Rh. sphaeroides) показал, что реакци-
онные центры всех исследованных видов имеют
одну и ту же базовую структуру. Минимальная
структура включает в себя три субъединицы: L,
Таблица 3.1. Состав реакционного центра Rhodobacter sphaeroides (Р870)
1 субъединица L
1 субъединица М
1 субъединица Н
4 бактериохлорофилла-а
2 бактериофеофитина-а
2 убихинона
1 белок, содержащий негеминовое железо
1 каротиноид
Молекулярная масса
21 кДа
24 кДа
28 кДа
Рис. 3.4. Бактериохлорофилл-а
78
3. Транспорт электронов в процессе фотосинтеза
Рис. 3.5. Убихинон. Длинная изопреноидная цепь придает веществу липофильные
свойства
М и Н (light, medium, heavy). Субъединицы L
и М — гомологичные пептиды со сходной ами-
нокислотной последовательностью. Реакци-
онный центр Rh. sphaeroides содержит четыре
бактериохлорофилла-я (Бхл-я, рис. 3.4) и два
бактериофеофитина-я (Бфео-я). Феофитины
отличаются от хлорофиллов отсутствием цен-
трального атома магния. Реакционный центр
содержит также атом железа, который не вхо-
дит в состав гема, и поэтому называется неге-
миновым железом, и две молекулы убихино-
на (рис. 3.5), которые обозначают как QA и QB.
Убихинон Qa прочно связан с реакционным
центром, тогда как QB лишь слабо ассоцииро-
ван с ним.
Рентгеновская структура
фотосинтетического реакционного центра
В случае если из белка могут быть получены
упорядоченные кристаллы, пространственную
структуру белковой молекулы можно изучать с
помощью рентгеноструктурного анализа. [Про-
странственная структура кристаллических мо-
лекулярных слоев может быть также изучена ме-
тодом электронной криомикроскопии (раздел
2.4), но использование этого метода требует зна-
чительных материальных затрат.] При исполь-
зовании рентгеноструктурного анализа образец
облучают рентгеновскими лучами. Электроны
в атомах молекул вызывают рассеяние рентге-
новских лучей. Когда лучи проходят через регу-
лярно повторяющуюся структуру, наблюдается
дифракция лучей. Суммарная дифракционная
картина фиксируется на рентгеновской пленке,
помещенной позади кристалла, или регистриру-
ется каким-либо другим детектором. Принцип
метода представлен на рис. 3.6. Для того чтобы
получить максимальное количество изображе-
ний с разных сторон, кристалл, помещенный в
капилляр, вращают. Для получения одного на-
бора данных необходимо от нескольких десятков
до нескольких сотен облучений, в зависимости
от формы кристалла и размера решетки кристал-
ла. Для установления ранее неизвестной струк-
туры белка требуется несколько наборов данных,
в том числе белка со связанным или встроенным
Пленка
Источник
рентгеновских
лучей
Кристалл белка
в капилляре
Вращение
Проявление
Рис. 3.6. Метод рентгеноструктурного анализа белкового кристалла. Капилляр,
содержащий кристалл, медленно вращается, а дифракционная картина фиксируется
на рентгеновской пленке. В настоящее время вместо пленок используются более
современные регистрирующие системы. Дифракционная картина, представленная
здесь, была получена в результате структурного анализа реакционного центра Rh.
sphaeroides (с любезного разрешения Н. Michel, Франкфурт)
3.3. Основная структура фотосинтетического реакционного центра
79
Рис. 3.7. Детергент N,N-ди мети л додецил амин- СН3
N] ОкГСИП О ' ® ^*СН2\ ^*СН2\ ^СН2\ ^СН2\ .xCHq
IN-оксид Q_N_CH/" 2^СН2^ СН£^ 2 СН^ 2 СН2^ СН< 3
СНз
Л/,Л/-диметилдодециламин-Л/-оксид
в белковую молекулу ионом тяжелого металла.
С помощью специальных компьютерных про-
грамм, исходя из правил рассеяния рентгенов-
ских лучей атомами с различной электронной
плотностью, реконструируют пространственную
структуру изучаемого белка.
Рентгеноструктурный анализ требует значи-
тельных технических возможностей и временных
затрат, но обычно ограничивающим фактором
в установлении пространственной структуры
становится получение образцов кристаллов, при-
годных для анализа. До 1980 года считалось, что
кристаллы, пригодные для рентгеноструктурного
анализа, невозможно приготовить из гидрофоб-
ных мембранных белков. Применение детергента
^ЬГ-диметилдодециламин-ТЧ-оксида (рис. 3.7)
позволило решить эту проблему. Этот детергент
образует растворимые в воде мицеллы, содержа-
щие искомый белок, которые могут быть кристал-
лизованы при добавлении сульфата аммония или
полиэтиленгликоля. Мицеллы образуют регуляр-
ные решетки в кристаллах (рис. 3.8). Белок в кри-
сталле остается в своем нативном состоянии, так
как его гидрофобные участки, которые обычно
граничат с гидрофобной мембраной, покрыты
гидрофобными цепями детергента.
Мембранный белок
Кристаллизация
Рис. 3.8. Мицеллы образуются
после солюбилизации1 детергентом
мембранного белка. Гидрофобный
участок мембранного белка, а также
липиды мембраны и детергент
обозначены черным, гидрофильные
участки — красным. Кристаллические
структуры могут быть образованы
за счет ассоциации гидрофильных
областей мицелл детергента. (’ Мицеллы
из белка и детергента не образуют
истинного раствора в воде, поэтому
переведение в водную фракцию
называют солюбилизацией (от solution —
раствор}. — Прим, ред.}
Кристаллическая структура мицелл с детергентом
80
3. Транспорт электронов в процессе фотосинтеза
Используя этот метод, Хармут Михель из
Мюнхена успешно получил кристаллы реак-
ционного центра пурпурной бактерии Rho-
dopseudomonas viridis и совместно со своим
коллегой Иоганном Дайзенхофером из отдела
Роберта Хубера провел рентгеноструктурный
анализ этих кристаллов. Можно представить,
насколько трудоемкими были эти исследования,
если учесть тот факт, что только обработка по-
лученных данных заняла два с половиной года.
Так впервые была получена трехмерная струк-
тура мембранного белка. За эту работу Михель,
Дайзенхофер и Хубер получили Нобелевскую
премию по химии в 1988 г. Этим же методом был
изучен реакционный центр Rh. sphaeroides, и
оказалось, что принципиальные структуры ре-
акционных центров у этих бактерий на удивле-
ние сходны.
Реакционный центр Rhodopseudomonas
viridis имеет симметричную структуру
На рисунке 3.9 изображена трехмерная струк-
тура реакционного центра пурпурной бактерии
Rhodopseudomonas viridis. Он имеет цилиндри-
ческую форму и достигает в длину примерно
8 нм. Гомологичные субъединицы L (изображе-
на красным цветом) и М (изображена черным)
расположены симметрично и включают моле-
кулы бактериохлорофилла и бактериофеофити-
на. Субъединица Н прикреплена как крышка к
нижней части цилиндра.
На рисунке 3.10 показано расположение
хромофоров в реакционном центре; белковый
комплекс показан в той же проекции, что и на
рис. 3.9. Все хромофоры расположены парами,
разделенными осью симметрии. Две молекулы
Бхл-л (Dm, Dl) расположены в верхней части
комплекса. Два тетрапиррольных кольца на-
столько сближены (0,3 нм), что в возбужденном
состоянии их орбитали перекрываются. Этот
факт подтвердил гипотезу о существовании «спе-
циальной пары» молекул бактериохлорофилла,
в которой происходят первичные окислитель-
но-восстановительные процессы фотосинтеза.
Гипотеза была выдвинута на основании спек-
троскопических исследований. Хромофоры, ко-
Рис. 3-9- Стереопара трехмерной структуры реакционного центра Rh. viridis.
Пептидная цепь субъединицы L обозначена красным, субъединицы Н — белым,
а субъединицы М — черным. Полипептидные цепи изображены в форме лент, а
хромофоры (бактериохлорофиллы, бактериофеофитины) и хиноны изображены
в виде проволочных моделей. Верхняя часть реакционного центра граничит с
периплазматическим компартментом, а нижняя — с цитоплазмой
(с любезного разрешения Н. Michel и R.C.R.D. Lancaster, Франкфурт). О том, как
рассматривать стереоизображение, см. подпись к рис. 1.29)
3.4. Как функционирует реакционный центр
81
Рис. 3.10. Стереопара трехмерного расположения хромофоров и хинонов
в реакционном центре Rh. viridis. Проекция относится к структуре, представленной
на рис. 3.9. Пара БХл-д DMDL (см. в тексте) изображена красным цветом
(с любезного разрешения Н. Michael и R.C.R.D. Lancaster, Frankfun. Изображения
для рис. 3.9 и 3.10 были подготовлены Р. Kraulis, Uppsala, с помощью программы
MOLSCROPT)
торые могут участвовать в передаче электрона от
специальной пары, образуют две практически
идентичные ветви, каждая из которых включает
в себя мономер Бхл-д (ВА, Вв) и Бфео (ФА, Фв).
В то время как пара бактериохлорофиллов (DM,
Dl) связана с обеими субъединицами L и М,
бактериохлорофилл ВА и бактериофеофитин ФА
связаны с субъединицей L, а Вв и Фв — с субъе-
диницей М. Хинонное кольцо QA связано водо-
родными связями и гидрофобными взаимодей-
ствиями с субъединицей М, а слабо связанный
QB ассоциирован с субъединицей L.
3.4. Как функционирует
реакционный центр
Анализ структуры фотосинтетического аппара-
та и изучения кинетики фотосинтеза позволили
детально описать функционирование бактери-
ального реакционного центра. Исследование ки-
нетики включало спектроскопические измерения
поглощения и флуоресценции после вспышек
света длительностью менее 1013 с, а также изме-
рения ядерного магнитного и электронного пара-
магнитного резонансов. Хотя реакционный центр
имеет симметричное строение с практически
идентичными ветвями хромофоров, транспорт
электронов идет только по одной из ветвей (пра-
вой на рис. 3.10) — расположенной на субъедини-
це L. Мономер бактериохлорофилла (Вв) на сто-
роне М находится в тесном контакте с молекулой
каротиноида, которая обезвреживает опасные
триплетные состояния бактериохлорофилла ре-
акционного центра (разделы 2.3 и 3.7). Функции
бактериофеофитина Фв и негеминового железа
на субъединице М пока не до конца ясны.
На рисунке 3.11 приведена схема реакци-
онного центра, на которой участники реакции
расположены в соответствии со своим электро-
химическим потенциалом. В результате первич-
ной реакции с участием экситона, приходящего
с антенны (раздел 2.4), пара бактериохлорофил-
лов переходит в возбужденное состояние. Пер-
вичное возбужденное состояние (S0 имеет
очень короткое время полужизни, очень быстро
происходит разделение зарядов и затем, благо-
даря большому перепаду электрохимического
потенциала, электрон за несколько пикосекунд
передается на бактериофеофитин, который при
этом восстанавливается.
(Бхл)2 + 1 экситон (Бхл)*
(Бхл)*+ Бфео (Бхл)2+* + Бфео-*.
Возможно, электрон сначала передается на мо-
номер бактериохлорофилла (ВА), а затем на фео-
фитин (ФА). Процесс второй передачи электрона
происходит за 0,9 пс, т.е. примерно в четыре раза
быстрее, чем передача на ВА. Радикал бакте-
риофеофитина имеет тенденцию возвращаться
в основное состояние (So), отдавая полученный
электрон обратно на ВА. Чтобы предотвратить
82
3. Транспорт электронов в процессе фотосинтеза
Рис, 3-11 - Схема циклического электронного транспорта в процессе фотосинтеза
Rh. sphaeroides. Возбужденное состояние, обозначенное звездочкой, приводит
к разделению зарядов; электрон передается через бактериофеофитин, хиноны
Qa и Qb и цитохром-Ь/сх-комплекс к положительно заряженному радикалу
бактериохлорофилла. Q — хинон, Q-* — семихинон-радикал, QH2— гидрохинон
это, в течение 200 пс электрон передается с ради-
кала бактериофеофитина на хинон (QA) с боль-
шим перепадом потенциала (см. рис. З.П). При
этом образуется радикал семихинона, который
передает электрон дальше по градиенту потен-
циала слабо связанному убихинону QB. В резуль-
тате образуется убисемихинон; после передачи
второго электрона образуется убигидрохинон
(рис. 3.12). В отличие от лабильных интермедиа-
тов радикальной природы, описанных выше,
убигидрохинон — стабильный переносчик. Но
эта стабильность дорого обходится: при передаче
электрона от первичного возбужденного состоя-
ния бактриохлорофилла до стабильного убиги-
дрохинона более половины энергии экситона
рассеивается в виде тепла.
Наличие в молекуле убихинона (см. рис. 3.5)
гидрофобной изопреноидной боковой цепи де-
лает его хорошо растворимым в липидной фазе
фотосинтетической мембраны. Изопреноидная
цепь в молекуле бактериохлорофилла взаимо-
действует с гидрофобными радикалами амино-
кислот, входящих в состав белковых субъединиц
реакционного центра (раздел 2.2). В отличие от
бактериохлорофилла, бактериофеофитина и QA,
прочно связанных с белками, убихинон рвлишь
3.4. Как функционирует реакционный центр
83
Семихинон-
радикал
(Q®)
Гидрохинон
(QH2)
Рис. 3-12- Одноэлектронное восстановление
хинона приводит к образованию семихинон-
радикала. При дальнейшем восстановлении
образуется гидрохинон
Экситон
Рис- 3-13- Циклический транспорт электрона при
фотосинтезе (аналогия электрической цепи)
слабо ассоциирован с реакционным центром и
может заменяться другим убихиноном. Убиги-
дрохинон, оставаясь в липидной фазе, может
быстро диффундировать в мембране, поэтому он
выполняет функцию мобильного окислительно-
восстановительного агента. Он передает элек-
троны на цитохром-£/С]-комплекс, который
также расположен в мембране; затем электро-
ны передаются обратно в реакционный центр
через цитохром-с. Энергия, высвобожденная в
процессе транспорта электронов, запасается в
форме протонного градиента (раздел 4.1), кото-
рый используется для синтеза АТФ. Структура
и механизм работы цитохром-/?/<?!-комплекса и
АТФ-синтазы будет описан в разделе 3.7 и в гла-
ве 4, соответственно.
В целом циклический электронный транс-
порт у пурпурных бактерий можно рассматри-
вать как простую электрическую схему, изобра-
женную на рис. 3.13. Пара бактериохлорофиллов
и бактериофеофитин, между которыми электрон
передается с затратой энергии света, могут быть
рассмотрены как две пластинки конденсато-
ра, между которыми генерируется напряжение,
движущая сила тока электронов. Значительная
часть энергии электрона рассеивается в тепло
при падении напряжения в резисторе. Генера-
тор использует оставшееся напряжение для пре-
образования в химическую форму энергии.
3.5. У водорослей и растений два
фотосинтетических реакционных
центра функционируют в тандеме
Квантовая затрата (количество поглощенных
фотонов на молекулу О2), равная примерно
восьми, была определена для фотосинтетиче-
ского окисления воды у зеленых водорослей
(раздел 2.4). В настоящее время вместо кван-
товой затраты обычно используют обратную
величину — квантовый выход (количество
молекул на поглощенный фотон). Исследова-
ния зависимости квантового выхода от длины
волны света облучения (спектр действия) пока-
зали, что квантовый выход очень резко падает,
когда водоросли освещают красным светом с
длиной волны более 680 нм (рис. 3.14). Сначала
этот эффект, получивший название «красного
падения», оставался необъясненным, так как
водоросли содержат хлорофилл, полощающий
свет при 700 нм. Роберт Эмерсон и его коллеги
решили эту проблему в 1957 г., когда они на-
блюдали резкое возрастание квантового выхода
на участке спектра с длиной волны более 680 нм
при одновременном облучении оранжевым све-
84
3. Транспорт электронов в процессе фотосинтеза
Рис. 3.14. Квантовый выход выделения О2
у зелёной водоросли (Chlorella) в зависимости от
длины волны действующего света. Верхняя кривая
при дополнительном освещении светом с длиной
волны 650 нм (по Emerson и Rabinowitch)
том (650 нм). Квантовый выход был выше, чем
сумма квантовых выходов при облучении све-
том разных длин по отдельности.
Открытие эффекта Эмерсона привело уче-
ных к заключению, что у зеленых водорослей
(а также у цианобактерий и высших растений)
в процесс фотосинтеза вовлечены два различ-
ных реакционных центра. В I960 г. Роберт Хилл
и Фэй Бендалл предложили схему реакций
(рис. 3.15), в которой два реакционных центра
функционируют в тандеме и связаны электрон-
транспортной цепью, включающей цитохромы-/>6
и -f (цитохром-/— это цитохром с-типа; см. раз-
дел 3.7). Диаграмма, на которой переносчики
электронов расположены в соответствии со сво-
им окислительно-восстановительным потенциа-
лом, имеет форму зигзага и поэтому получила
название Z-схемы. Нумерация фотосистем от-
ражает порядок их отрытия. Фотосистема II
(ФС II) может использовать свет с длиной волны
не более 680 нм, тогда как фотосистема I (ФС I)
может использовать свет с длиной волны до
700 нм. Фотосистема II образует очень сильный
окислитель, который необходим для окисления
воды, а фотосистема I образует сильный вос-
становитель, который восстанавливает НАДФ+
(см. рис. 3.3).
На рисунке 3.16 представлен путь транспорта
электрона через фотосинтетические комплек-
сы; переносчики электронов расположены по
Рис. 3.15. Z -схема фотосинтеза растений. Электроны передаются двумя
фотосистемами, функционирующими в тандеме, от воды к НАДФ+, и в результате
электронного транспорта синтезируется АТФ. Количество образующейся АТФ
точно неизвестно, но предположительно оно составляет между 2 и 3 молекулами на
4 экситона, захваченные в каждом из реакционных центров (раздел 4.4)
3.5. У водорослей и растений два фотосинтетических реакционных центра функционируют в тандеме 85
Вольт
2НАДФ®+2Н®
воссту
2 НАДФН
ОКИСЛ
Фотосистема II
Рис, 3-16- Схема нециклического электронного транспорта у растений.
Редокс-компоненты расположены в соответствии со своим окислительно-
восстановительным потенциалом и местом в том или ином комплексе,
участвующем в электронном транспорте. Звездочка обозначает возбужденное
состояние. Поглощение 4 экситонов происходит последовательно (по одному).
Электронный транспорт между комплексом фотосистемы II и цит-^/^комплексом
осуществляется пластогидрохиноном (PQH2), который окисляется цит-^/f-
комплексом до пластохинона (PQ). Электроны передаются с цит-^/^комплекса в
фотосистему I через пластоцианин (Пц). От возбужденного Р700 электрон поступает
на филлохион через хлорофилл а695 (на схеме не показан). Та же последовательность
реакций имеет место и у цианобактерий, только вместо пластоцианина второй
перенос электрона между комплексами осуществляет цитохром-с. Подробности см.
на рис. 3.18 и 3.31
градиенту электрохимического потенциала, как
на рис. З.П. На рисунке 3.17 показано, каким
образом фотосинтетические комплексы рас-
положены в тилакоидной мембране. Разность
потенциалов между реакциями окисления воды
и восстановления НАДФ+ составляет примерно
1,2 В. Суммарная энергия, которая достигается
при поглощении двух фотонов (680 и 700 нм),
эквивалентна разности потенциалов 3,45 В (раз-
дел 2.2, уравнение 2.7). Таким образом, лишь
около трети энергии фотонов, поглощенных
двумя фотосистемами, используется для пере-
носа электронов от воды к НАДФ+. Кроме того,
около 1/8 части световой энергии, поглощен-
ной фотосистемами, запасается за счет пере-
носа протонов в люмен тилакоидов при участии
фотосистемы II и цитохром-£6/Лкомплекса (см.
рис. 3.17). Этот процесс приводит к формиро-
ванию протонного градиента между люменом
и стромой. АТФ-синтаза, также расположенная
в тилакоидной мембране, использует энергию
протонного градиента для синтеза АТФ.
Таким образом, примерно половина энергии
света, поглощенного двумя фотосистемами, не
используется для совершения химической рабо-
ты, а рассеивается в тепло. Значение тепловых
86
3. Транспорт электронов в процессе фотосинтеза
Рис. 3.17. Схема расположения фотосинтетических комплексов и Н+-АТФ-
синтазы в тилакоидной мембране. Электронный транспорт между комплексом
фотосистемы II и цит-£6/Лкомплексом осуществляется пластогидрохиноном
(PQH2), а между цит-^/^комплексом и ФС I — пластоцианином (Пц). Окисление
воды происходит на люменальной стороне мембраны, а образование НАДФН
и АТФ — на стромальной стороне. Электрохимический градиент протонов,
накопленных в люмене, является движущей силой синтеза АТФ. Количество
протонов, переносимых в люмен в процессе электронного транспорта и затраты
протонов на синтез АТФ пока точно неизвестны (раздел 4.4)
потерь энергии при фотосинтетическом элек-
тронном транспорте было обсуждено в преды-
дущем разделе.
3.6. Окисление воды происходит
в фотосистеме II
Несколько лет назад группы ученых под руко-
водством Норста Витта и Вольфганга Сэнжера в
Берлине исследовали трехмерную структуру ФС
II, проводя рентгеноструктурный анализ кри-
сталлов ФС II термофильной цианобактерии
Synechococcus elongatis. В результате этой рабо-
ты было установлено, что ФС II построена по
тем же принципам, что и реакционные центры
пурпурных бактерий (раздел 3.4). Эти данные,
вместе с результатами анализа аминокислотной
последовательности, указывают на наличие
общей предковой формы. ФС II также содер-
жит пару молекул Хл-я, хотя расстояние между
ними настолько велико, что, вероятно, в реак-
цию в экситоном вступает лишь одна из них.
3.6. Разложение воды происходит в фотосистеме II
87
Две ветви, каждая из которых включает Хл-я и
феофитин, связаны с центральной парой так
же, как у пурпурных бактерий (см. рис. 3.10). У
цианобактерий, по-видимому, также лишь одна
из двух ветвей участвует в транспорте электро-
нов.
При возбуждении Р680 электрон передается
через мономер Хл-я на феофитин, а оттуда — на
прочно связанный пластохинон (QA) с образо-
ванием семихинон-радикала (рис. 3.18). Далее
этот электрон передается на слабо связанный
пластохинон (QB). Пластохинон (PQ) (рис. 3.19)
принимает два электрона и два протона один
за другим, и при этом восстанавливается до ги-
дрохинона (PQH2). Гидрохинон освобождается
из фотосинтетического комплекса и может рас-
сматриваться как конечный продукт фотосисте-
мы II. Эта последовательность событий, вклю-
чающая передачу отдельного электрона между
(Хл-я)2 и QA и транспорт двух электронов между
Qa и Qb> соответствует последовательности ре-
акций, установленной для Rh. sphaeroides (см.
рис. 3.11). Единственное различие заключается
в том, что хиноны бактерий относятся к убихи-
нонам и менахинонам, а хиноны фотосистемы
II — к пластохинонам.
Как бы то ни было, сходство реакционных
центров ФС II и фотосистемы пурпурных бак-
терий относится только к акцепторной части.
Функции донора электронов в ФС II карди-
нально отличаются от таковых у пурпурных
бактерий. Дефицит электрона в паре (Хл-я)2+в,
образовавшийся в процессе нециклического
электронного транспорта, компенсируется за
Рис. 3-18- Схема фотосинтетического электронного транспорта в комплексе
фотосистемы 11. Возбуждение при поглощении фотона приводит к передаче по цепи
одного электрона. Образующийся при этом радикал хлорофилла с положительным
зарядом восстанавливается за счет остатка тирозина, а тот, в свою очередь,
за счет четырех атомов марганца, участвующих в окислении воды (рис. 3.20).
Отрицательный заряд хлорофилла передается далее на феофитин (Фео) и хинон QA,
на пластохинон QB
88
3. Транспорт электронов в процессе фотосинтеза
Пластохинон
Рис, 3-19- Пластохинон
счет электронов, полученных при окислении
воды. Катионы марганца и остатки тирозина
участвуют в транспорте электронов от воды к
хлорофиллу. Радикал (Хл-я)2+* с окислительно-
восстановительным потенциалом примерно
+ 1,1 В является настолько сильным окислите-
лем, что он способен отнять электрон у остатка
тирозина в составе белка реакционного центра;
при этом образуется радикал тирозина. Обыч-
но тирозин, участвующий в этой реакции, обо-
значают как Z. Дефицит электрона в радикале
тирозина компенсируется за счет окисления
ионов марганца (рис. 3.20). Комплекс ФС II со-
держит четыре иона марганца, расположенных
близко друг к другу. Эта группа ионов марган-
ца получила название марганцевого класте-
ра. Марганцевый кластер представляет собой
редокс-систему, которая может отдавать после-
довательно четыре электрона акцептору и за-
тем отбирать их у донора. При этом ионы Мп,
очевидно, могут находиться в состояниях Мп3+
и Мп4+.
Чтобы образовать в процессе окисления воды
одну молекулу О2, реакционный центр должен
передать четыре электрона, а значит, получить
четыре экситона. Временной промежуток между
захватами отдельных экситонов реакционным
центром зависит от интенсивности освещения.
Если бы окисление воды проходило ступенчато,
возможно было бы образование в качестве про-
межуточных продуктов радикальных форм кис-
лорода, особенно при низких интенсивностях
света. Радикальные формы кислорода разрушают
биомолекулы, такие, как липиды и белки (раз-
дел 3.10). Механизм разложения воды в Мп кла-
стере минимизирует образование кислородных
радикалов, снабжая реакционный центр через
тирозин четырьмя электронами один за другим
(см. рис. 3.20). Марганцевый кластер в процессе
перехода к основному состоянию (So) проходит
четыре последовательных редокс-состояния (ко-
торые обозначаются, соответственно, как S]_4).
Эксперименты Пьера Джолиота и Вессела
Кока доказали, что система окисления воды мо-
жет находиться в пяти состояниях, включая So
(рис. 3.21). Когда хлоропласты, которые держали
в темноте, затем освещали серией вспышек све-
та, наблюдали колебания выделения кислорода.
После первых двух вспышек выделения кис-
лорода практически не происходило, оно было
максимальным после трех вспышек, затем после
следующих четырех вспышек, и т. д. При возрас-
тании количества вспышек, однако, происходило
Рис- 3.20. Механизм окисления
воды в фотосистеме 11.
М означает кластер, состоящий из
четырех атомов марганца. Атомы
марганца находятся в разных
состояниях (которые обозначаются,
соответственно, как So и Sj_4).
Кластер функционирует как редокс-
единица и поставляет один за другим
четыре электрона в реакционный
центр ФС 11. Дефицит четырех
электронов восполняется за счет
разложения 2 Н2О до О2 и 4 Н+.
М означает (4 Мп)п+, М+ означает
(4 Мп)(п+1)+, и т. д.
3.6. Разложение воды происходит в фотосистеме II
89
Рис. 3.21. Количество кислорода, выделенное
хлоропластами в зависимости от числа вспышек
света. Хлоропласты, прединкубированные
в темноте, освещали импульсами длительностью
2 мкс с перерывом 0,3 с (по Forbush, Kok
и McGoild, I97l)
12 16 20
Число вспышек
все большее сглаживание колебаний. Это можно
объяснить тем, что не все вспышки возбужда-
ют реакционные центры, поэтому происходит
десинхронизация осцилляций. В хлоропластах,
выдержанных в темноте, водоокисляющий ком-
плекс переходит в Sj состояние. После того, как
система достигает четвертого редокс-состояния,
высвобождается молекула О2, и система воз-
вращается в основное состояние (So). Протоны,
высвобождающиеся при окислении воды, посту-
пают в люмен тилакоидов. Эту реакцию можно
записать так:
2 Н2О-> 4Н++ 2О2
2О2 + М4МО2+ М
Образно говоря, четыре электрона, необхо-
димые реакционному центру, берутся «взаймы»
у Mn-кластера и затем разом возвращаются к
ионам марганца при окислении воды до кисло-
рода. Таким образом Mn-кластер минимизирует
вероятность образования кислородных радика-
лов в фотосистеме II. Несмотря на эту «систему
безопасности», в ФС II, по-видимому, образу-
ется достаточно радикалов, чтобы повреждать
белки комплекса; последствия этого процесса
будут описаны в разделе 3.10.
Комплекс фотосистемы II очень сходен
с реакционным центром пурпурных
бактерий
Фотосистема II — комплекс, состоящий
как минимум из 17 различных субъединиц
(табл. 3.2), из которых только две непосред-
ственно входят в состав реакционного цен-
тра. Функции нескольких субъединиц до сих
пор не установлены. На рис. 3.22 изображены
только те субъединицы, функции которых из-
вестны. Комплекс ФС II окружен антенной,
состоящий из светособирающих комплексов
(см. рис. 2.13).
В центре комплекса ФС II находится гетеро-
димер, состоящий из двух белковых субъединиц
Dj и D2. С этими белками связаны шесть Хл-я,
два феофитина, два пластохинона и одна или
две молекулы p-каротин. Белки D] и D2 гомоло-
гичны друг другу и белкам L и М реакционного
центра пурпурных бактерий (раздел 3.4). Как и
у бактерий, только та из молекул феофитина,
которая связана с белком Dh участвует в транс-
порте электрона. С другой стороны, QA в ФС II
связан с белком D2, a QB — с белком Dr Мар-
ганцевый кластер, очевидно, связан с обоими
белками. Тирозин Z, который участвует в пере-
даче электрона, входит в состав белка DP Субъе-
диница MSP (Manganese stabilizing protein) ста-
билизирует Mn-кластер. Внутреннюю антенну,
изображенную на рис. 2.10, образуют СР 43 и
СР 47 (СР значит chlorophyll protein). С каждой
из субъединиц связано примерно 15 молекул
хлорофилла, которые образуют СР 43 и СР 47 с
двух сторон окружают комплекс Dj-D2. Цитох-
ром /?559, по-видимому, не участвует в транспор-
те электрона в ФС II; возможно, его функции
связаны с защитой комплекса ФС II от фотоде-
струкции.
90 3. Транспорт электронов в процессе фотосинтеза
Таблица 3.2. Белки фотосистемы II (неполный список)
Белок Молекулярная масса, кДа Локализация Кодирование Функция
D, 32 в мембране хлоропласт связывание Р680, Фео, QB, Туг, Мп- кластера
d2 34 -//- -//- связывание Р680, Фео, QA, Мп- кластера
СР47 47 -//- -Ц- коровая антенна, контакт с перифе- рической антенной ССК
СР43 43 -н- —п— -п—п-
ЦИТ-Ь559а 9 -п- -п- связывание гема, защита ФС II от повреждений светом
ЦиТ-ЬзБдр 4 —п— —п— -//-
Марганец- стабилизирующий белок 33 перифери- ческая (в люмене) ядро стабилизация Мп-кластера
Р 23 —//— -//- ?
Q 16 —и— -//- ?
R 10 периферичес- кая: строма -п- ?
(noVermaas, 1993)
Комплекс фотосистемы II
Рис. 3.22. Схематическое изображение комплекса фотосистемы II. Схема построена
на основании данных структурного анализа, проведенного сотрудничающими
группами Witt и Saenger (Берлин), а также на исследованиях связывания хинона с
субъединицами D1 и D2, которые гомологичны субъединицам L и М пурпурных
бактерий. Оказалось, что в структуре ФС II и реакционного центра пурпурных
бактерий много общего. См. также табл. 3.2. Две коровые антенны СР43 и СР47
фланкируют D1-D2 комплекс (не показано на рисунке)1
Р Приведены устаревшие данные о строении комплекса фотосистемы II. См.
примечание к рис. 2.13. — Прим, ред.]
3.6. Разложение воды происходит в фотосистеме II
91
Белок D] комплекса ФС II имеет высокую
скорость оборота; он постоянно обновляется
(время его полужизни составляет около 30 ми-
нут). Очевидно, этот белок быстро выходит из
строя из-за повреждающего действия кислород-
ных радикалов, которые образуются, несмотря
на защитные механизмы. Показано, что Dj за-
меняется после 106—107 каталитических циклов
в реакционном центре ФС II.
Некоторые соединения, по структуре сход-
ные с пластохинонами, могут блокировать сайт
связывания пластохинонов белка Db вызывая
остановку транспорта электронов при фотосин-
тезе. Такие соединения используют как герби-
циды. Прежде чем детально разбирать эффект
этих веществ, мы рассмотрим некоторые общие
вопросы, связанные с применением гербици-
дов.
Механизированное сельское хозяйство
обычно требует применения гербицидов
На гербициды расходуется примерно половина
средств, которые тратятся в мире на вещества
для зашиты растений. Высокая стоимость тру-
да — одна из основных причин использования
гербицидов в сельском хозяйстве. Проше и де-
шевле избавляться от сорняков, обрабатывая
поля гербицидами, чем использовать для этой
цели ручной труд. Контроль за сорными рас-
тениями необходим не только потому, что уро-
жай снижается из-за конкуренции культурных
растений с сорняками, но также потому, что
сорняки затрудняют механизированный сбор
урожая. Поля, лишенные сорняков, — необхо-
димое условие механизированного земледелия.
В качестве гербицидов используют вещества,
малотоксичные для человека и животных, но
блокирующие реакции, необходимые для жиз-
ни растений. Большое количество гербицидов
(конкретные примеры будут даны в конце этого
раздела) ингибируют ФС II, являясь антагони-
стами пластохинонов. Молекулы гербицидов
должны связаться с большей частью реакцион-
ных центров каждого растения. Для эффектив-
ного воздействия используют от 125 до 4000 г
гербицида на гектар.
С целью уменьшить количество гербицидов,
необходимое для эффективной обработки, были
разработаны новые гербициды, блокирующие
определенные биосинтетические процессы, на-
пример, синтез жирных кислот, определенных
аминокислот, каротиноидов, хлорофилла. Есть
также гербициды, действующие подобно фито-
гормонам или ингибиторам митоза. Некоторые
из них эффективно действуют в количестве 5 г
на гектар.
Одни гербициды поступают в растение толь-
ко через корни, другие — через листья. Напри-
мер, чтобы освободить железнодорожные пути
от сорняков, применяют неселективные герби-
циды, которые уничтожают любую раститель-
ность. Для таких целей часто используют герби-
циды, которые не разлагаются и накапливаются
в корнях или в молодых побегах. Неселективные
гербициды также используют в сельском хозяй-
стве (например, для уничтожения сорняков на
плантации цитрусовых), но в этом случае герби-
циды проникают только в листья травянистых
растений, но не в листья цитрусовых, покрытые
толстой кутикулой. В этом случае гербициды
распыляют на уровне земли.
Особенный интерес представляют селектив-
ные гербициды, которые уничтожают только
сорные растения и затрагивают жизнедеятель-
ность культурных растений лишь в минималь-
ной степени (разделы 12.2 и 15.3). Селективность
может быть обусловлена несколькими причина-
ми, такими, как различия в поступлении гер-
бицидов в ткани растения, в чувствительности
метаболизма разных растений к этим соедине-
ниям, в способности растений к детоксикации
гербицида. Важнейший механизм детоксикации
растениями гербицидов и других инородных
веществ (ксенобиотиков) — включение в них
гидрокисильной группы при участии фермента
Р-450-монооксигеназы и образование глутатио-
новых конъюгатов (раздел 12.2). Селективные
гербициды имеют важное преимущество перед
неселективными: их можно использовать тогда,
когда посевы уже взошли, и высохшие сорняки
образуют мульчирующий слой, который сохра-
няет воду в почве и защищает ее от эрозии.
В некоторых случаях применение герби-
цидов привело к появлению среди растений
гербицид-устойчивых мутантов (раздел 10.4).
В программах гибридизации с использованием
этих мутантов были получены сорта, устойчи-
вые к гербицидам. Однако эти результаты полу-
чены благодаря случайности; сейчас гербицид-
устойчивые сорта можно получить методом
92
3. Транспорт электронов в процессе фотосинтеза
генной инженерии. Это позволяет использовать
гербициды, которые быстро разлагаются и мо-
гут эффективно использоваться в маленьких до-
зах. Примеры будут рассмотрены в разделах 10.1
и 10.4.
Большое количество гербицидов ингибиру-
ют фотосинтез: производное мочевины DCML
(Диурон, производимый фирмой «Дюпон»),
триазин Атразин (ранее Циба Гейджи), Бентазон
(BASF) (рис. 3.23) и другие аналогичные соеди-
нения используют как гербициды. Эти вещества
связываются с сайтом связывания пластохинона
на белке Dj и таким образом блокируют фото-
синтетический электронный транспорт. В на-
стоящее время DCMU используется в сельском
хозяйстве довольно редко, потому что эффек-
тивен в высоких дозах и медленно разлагается,
однако это соединение довольно часто исполь-
зуется в лабораторных исследованиях как ин-
гибитор фотосинтеза (например, в листе или в
суспензии выделенных хлоропластов). Атразин
действует селективно: растения кукурузы до-
вольно устойчивы к этому гербициду, потому
что обладают способностью к его эффективной
детоксикации (раздел 12.2). Однако он медленно
разлагается в почве, поэтому применение атра-
зина запрещено в ряде стран. На территориях,
Диурон (DuPont)
3-(3,4-дихлорфенил)-
1,1 -диметилмочевина
(DCMU)
Атразин
(Ciba Geigy)
Рис. 3.23. Ингибиторы фотосистемы II, которые
применяются как гербициды
где определенные гербициды использовались
много лет подряд, сорняки приобрели устойчи-
вость к этим соединениям. В некоторых случаях
оказывается, что эта устойчивость обусловлена
точечной мутацией: заменой отдельной амино-
кислоты в D] белке. Это изменение не оказывает
значительного влияния на фотосинтез сорного
растения, но заметно ослабляет связывание гер-
бицида с D1 белком.
3.7. Цитохрохром-Ь6/^-комплекс
обеспечивает транспорт
электрона между
фотосистемами
Атомы железа в составе цитохромов
и железосерных центров выполняет
важнейшую функцию передачи электрона
Цитохромы — белки, с которыми связано одно
или два тетрапиррольных кольца, — обнаруже-
ны во всех организмах, кроме облигатных анаэ-
робов. Тетрапирролы цитохромов очень сход-
ны с хромофорными группами хлорофиллов.
Однако хлорофиллы содержат в качестве цен-
трального атома Mg2+, а цитохромы — железо
(рис. 3.24). Тетрапиррольное кольцо цитохрома
с центральным атомом железа носит название
гема. Связанный атом железа может менять
степень окисления с Fe3+ на Fe2+, поэтому
цитохромы работают как переносчики одно-
го электрона, в отличие от хинонов, НАД(Ф) и
ФАД, которые переносят два электрона вместе
с протонами.
Цитохромы подразделяются на три основ-
ные группы: цитохромы-я, -Ь и -с, содержа-
щие, соответственно, гемы-л, -Ь и -с. Гем-/?
можно рассматривать как исходную структуру
(см. рис. 3.24). У гема-с SH2 группа цистеи-
на добавляется к каждой из двух винильных
групп гема-/?. Таким образом, гем-с ковалент-
но связан сульфидными мостиками с белком
цитохрома. Такая разновидность ковалент-
ной связи уже была описана на примере фи-
коцианина (см. рис. 2.15). В соответствующих
апопротеинах есть определенная последо-
вательность аминокислот, ответственная за
связывание гемов. В геме-я (не показан) изо-
преноидная боковая цепь из трех звеньев при-
креплена к одной из винильных групп гема-/?.
Эта боковая цепь выполняет функцию гидро-
3.7. Цитохрохром-Ьб/f комплекс обеспечивает транспорт электрона между фотосистемами
93
Гем-Ь
Н
R-i, R2 С—СН2
Гем-с
Н
R-|, R2 С СНд
S Cys Protein
Рис. 3.24. Гем-6 и гем-с — простетические группы цитохромов. Гем-с ковалентно
связан с апопротеином цитохрома через два остатка цистеина апопротеина и две
вин ильные группы гема-6
фобного «мембранного якоря»1, как у хино-
нов (см. рис. 3.5 и 3.19). Гем-я упомянут здесь
только для полноты картины. Он не участвует
в фотосинтезе, однако вовлечен в электронный
транспорт в митохондриях (раздел 5.5).
Атом железа в составе гема может образо-
вывать шесть координационных связей. Четы-
ре из них связывают железо с атомами азота
тетрапиррольного кольца, имеющего плоскую
структуру. Две оставшиеся связи соединяют
атом Fe с двумя гистидиновыми остатками,
которые расположены перпендикулярно пло-
скости кольца (рис. 3.25). Цитохром-/ (/зна-
чит foliar, т.е. присутствующий в листьях)
содержит, как и цитохром-с, один гем-с, и по-
этому относится к с-типу цитохромов. У ЦИТ-/
атом Fe связан одной координационной свя-
зью с терминальной аминогруппой белка, а
другой — с остатком гистидина.
Железосерные центры — универсальные пе-
реносчики электронов, которые также присутству-
ют в фотосинтетической электрон-транспортной
цепи. Остатки цистеина в составе белка, образу-
ющие железосерные центры (рис. 3.26), связаны
координационными или ковалентными связями
с атомами Fe. (В некоторых белках с атомами Fe
1 Гемы, как и хлорофиллы, всегда находятся в комплексах
с белками. Гидрофобный «мембранный якорь» взаимодей-
ствует с гидрофобными аминокислотами в белках, а не с ли-
пидами. — Прим. ред.
могут быть связаны остатки гистидина.) Атомы
железа связаны друг с другом S-мостиками. При
помещении белков в кислую среду сера, располо-
женная между атомами Fe, высвобождается в виде
H2S, поэтому она получила название лабильной
Гем-Ь
Fe
Цитохром-Ь
Гем-с
Н
Prot— N
I
Н
Fe
СН2—Prot
, His
Цитохром-/"
Рис. 3.25. Осевые лиганды атомов железа
в гемовой группе цитохромов-6 и -/ Из шести
возможных координационных связей атома
Fe в геме четыре заняты N-атомами плоского
тетрапиррольного кольца. Две оставшиеся связи
образуются либо с двумя гистидиновыми остатками
белка, расположенными перпендикулярно к
плоскости тетрапиррола, либо с терминальной
аминогруппой и одним гистидиновым остатком
белка. Prot — белок
94
3. Транспорт электронов в процессе фотосинтеза
Рис. 3.26. Структура металл-содержащих кластеров
железосерных белков
серы. Железосерные центры обычно имеют со-
став 2Fe-2S или 4Fe-4S. Атомы Fe в этих центрах
присутствуют в двух степенях окисления: Fe3+ и
Fe2+. Независимо от числа атомов Fe в составе
центра, окисленное и восстановленное состоя-
ние центра отличается лишь на единичный заряд.
Поэтому железосерные центры могут принимать
и отдавать только один электрон. Различные же-
лезосерные центры могут сильно отличаться по
значению редокс-потенциала, которое зависит от
белкового окружения.
Электронный транспорт
в цитохром-b6/f-комплексе сопряжен
с транспортом протонов
Пластогидрохинон (PQH2), образовавшийся
в ФС II, диффундирует в липидной фазе тила-
коидной мембраны и передает электроны на
цитохром-bjf-комплекс (см. рис. 3.17). Этот
комплекс, в свою очередь, передает электроны
на пластоцианин, который при этом восста-
навливается. Поэтому цитохром-bjf-комплекс
также называют пластохинон-пластоцианин
оксидоредуктазой. Пластоцианин — белок с
молекулярной массой 10,5 кДа, содержащий
атом меди, который координационно связан с
цистеиновым, метиониновым и двумя гистиди-
новыми остатками в составе белка (рис. 3.27).
Этот атом меди может менять степень окисления
между Си+ и Си2+, поэтому он функционирует
как одноэлектронный переносчик Пластоциа-
нин растворим в воде и располагается в люмене
тилакоидов.
Транспорт электрона в цитохром-^/Лкомп-
лексе происходит по градиенту потенциала. Раз-
ность потенциалов между PQH2 и пластоциани-
ном составляет примерно 0,4 В (см. рис. 3.16).
Энергия, которая высвобождается при перено-
се электрона по градиенту редокс-потенциала,
запасается за счет сопряженного транспорта
протонов в люмен против электрохимического
градиента (ДцН+). Цитохром-^/Лкомплекс —
мембранный белковый комплекс, состоящий
из многих субъединиц: цит-/?6, цит-/, железо-
серный белок, названный белком Риске в честь
ученого, который его обнаружил, и субъединица
IV. Кроме этих основных субъединиц, в состав
комплекса входят более мелкие пептиды, а так-
же хлорофилл и каротиноид, функции которых
неизвестны. Белок Риске содержит 2Fe-2S центр
с высоким положительным редокс-потенциалом
(+0,3 В), который не характерен для железосер-
ных центров. Возможно, положительный потен-
циал обусловлен связью 2Fe-2S центра с остат-
ками гистидина.
Цитохром-bjf-комплекс имеет асимме-
тричную структуру (рис. 3.28). Цит-/?6, со-
держащий две молекулы гема-/?, пронизывает
—Cys—S Си S—Met—
I I I
Рис. 3.27. Пластоцианин. Два гистидиновых, один
метиониновый и один цистеиновый остатки этого
белка связаны с одним атомом Си, который меняет
степень окисления между Си+ и Си2+ (отдает или
принимает электрон)
3.7. Цитохрохром-Ьб/f комплекс обеспечивает транспорт электрона между фотосистемами
95
мембрану, как и субъединица IV. В цитохром-
/?6/Лкомплексе две молекулы гема расположе-
ны одна над другой, и таким образом образу-
ют редокс-цепь, соединяющую две стороны
мембраны. Одна аминокислотная цепь пит-/
внедряется в мембрану, образуя якорь. Гем-с
(функциональная группа цит-/) расположен на
периферии мембраны со стороны люмена. На
той же стороне расположен и белок Риске, кото-
рый лишь слегка утоплен в мембране.
Цитохром-bjf-комплекс по своей структуре
является аналогом цитохром-Л/cj-комплекса
бактерий и митохондрий (раздел 5.5). В табли-
це 3.3 суммированы функции этих комплексов.
Они сходны по структуре и функциям. Амино-
кислотная последовательность цит-Z? в цито-
xpoM-A/cj-комплексе бактерий и митохондрий
соответствует суммарной последовательности
цит-/?6 и субъединицы IV цитохром-/^//'-комп-
лекса. По-видимому, в процессе эволюции
произошло разделение гена цит-/? на два гена:
цит-/>6 и субъединицы IV. В то время как
цитохром-bfjf-комплекс растений восстанав-
ливает пластоцианин, цитохром-Ь/сх-комплекс
бактерий и митохондрий восстанавливает
цит-с. Цит-с — очень маленький белок, кото-
рый растворим в воде и подобно пластоциа-
нину переносит электроны в водной фазе от
цитохром-/)/^-комплекса к следующему ком-
плексу цепи. У цианобактерий, у которых так-
же есть цитохром-Л/с,-комплекс, электроны от
этого комплекса передаются на фотосистему I
через цит-с (вместо пластоцианина). Значитель-
ное сходство между цитохром-/>6//'-комплексом
растений и цитохром-/)/^-комплексом бак-
терий и митохондрий указывает на то, что эти
комплексы выполняют сходные функции в фо-
тосинтезе и дыхании: они представляют собой
транслокаторы протонов, которые работают за
счет гидрохинон-пластоцианин (или цит-с) ре-
дуктазной активности.
Рис. 3.28. Структура цитохром-/^//-комплекса.
Схема основана на молекулярной структуре,
предсказанной на основании аминокислотной
последовательности (по Hauska)
Перенос протонов из стромы в люмен тила-
коидов осуществляется при окислении и вос-
становлении хинонов, поскольку эти процес-
сы происходят на разных сторонах мембраны.
Протоны, необходимые для восстановления
пластохинона в комплексе ФС II, берутся со
стромальной стороны, а окисление пластоги-
дрохинона, которое сопровождается выделе-
нием протонов, происходит на люменальной
стороне цитохром-/^//-комплекса (рис. 3.29).
Таким образом, после получения комплексом
ФС II четырех экситонов из стромы в люмен
переносятся четыре протона. Кроме того, че-
тыре протона высвобождаются в люмен при
окислении воды в ФС II.
Таблица 3.3. Функции цитохром-Ь/с-комплексов
Пурпурные бактерии Cyt-Ь/С! восстановление цит-с протонная помпа
Зелёные серные бактерии Cyt-Ь/С! -//- -//-
Митохондрии Cyt-Ь/С! —и— -//-
Цианобактерии Cyt-be/f -п- —и—
Хлоропласты Cyt-bf/f восстановление пластоцианина —Ц—
96
3. Транспорт электронов в процессе фотосинтеза
Число протонов, перенесенных через
цитохром-Ь6/7-комплекс, может быть
удвоено в результате работы Q-цикла
Исследования работы электрон-транспортной
цепи митохондрий показали, что в процес-
се электронного транспорта в цитохром-/?/^ -
комплексе число перенесенных протонов в рас-
чете на один электрон больше, чем показано на
рис. 3.29. Питер Митчелл, который разработал
хемиосмотическую гипотезу запасания энер-
окисляется железосерным центром белка Риске в
л юменальном сайте связывания. Благодаря своему
высокому положительному потенциалу белок Ри-
ске отнимает один электрон у пластогидрохинона.
Поскольку образовавшийся семихинон облада-
ет очень низким отрицательным потенциалом, и
поэтому нестабилен, он передает свой электрон
первому гему-/? цит-/?6 (/?L), с которого он пере-
ходит на второй гем-/? (Ьн)*. При этом потенциал
гема-/?ь составляет примерно - 0,1 В. Только одна
Рис. 3.29. Протонный транспорт сопряжен с электронным транспортом в ФС
II и цит-/?6//-комплексе в отсутствие Q-цикла. Схема основана на данных о том,
что окисление воды в ФС II и окисление пластогидрохинона (PQH2) цит-/?6//:
комплексом происходит на люменальной стороне тилакоидной мембраны
гии (раздел 4.1), предложил так называемый
Q-цикл, за счет которого количество протонов,
перенесенных через цитохром-/?/С|-комплекс
при транспорте одного электрона, удваивается.
Позже выяснилось, что Q-цикл функционирует
и в электрон-транспортной цепи фотосинтеза.
На рисунке 3.30 показан принцип работы
Q-цикла в хлоропластах. Цитохром-/?6/Лкомплекс
содержит два сайта связывания хинонов: один
расположен на стромальной, а другой — на люме-
нальной стороне тилакоидной мембраны. Пла-
стогидрохинон (PQH2), образовавшийся в ФС II,
из двух образованных молекул пластохинона (PQ)
возвращается в комплекс ФС II. Вторая молекула
PQ диффундирует в липидной фазе мембраны к
сайту связывания на стромальной стороне и по-
следовательно восстанавливается в нем за счет
гема-/?£, который обладает сравнительно высоким
потенциалом относительно пары семихинон/ги-
1 bL означает низкопотенциальную форму, а Ьи — высо-
копотенциальную (от англ. L — low — низкий; Н — high —
высокий). Электрон как отрицательно заряженная частица
движется от bL к £н. — Прим. ред.
3.8. Фотосистема I восстанавливает НАДФ
97
н©
н©
СТРОМА
Сайт связывания
PQ/PQH2
на стромальной
стороне
Сайт связывания
PQ/PQH2
на люменальной
стороне
Рис. 3.30. Число протонов, которое высвобождается из цит-/>6//-комплекса
в люмен, удваивается в результате Q-цикла. В основе функционирования цикла
лежит тот факт, что окислительно-восстановительные реакции с участием PQ и
PQH2 протекают в двух сайтах связывания, один на стромальной, другой — на
люменальной стороне тилакоидной мембраны. Функционирование цикла описано
в тексте
ЛЮМЕН
дрохинон. Эта реакция сопровождается поглоще-
нием двух протонов из стромы. Образовавшийся
гидрохинон в дальнейшем окисляется на люме-
нальной стороне, и т. д. Суммарно число пере-
несенных протонов удваивается в Q-цикле (1/2 +
+ 1/4 + 1/8 + 1/16 + . . . + l/n = 1). Когда Q-цикл
работает в полную силу, транспорт четырех элек-
тронов через цитохром-bjf-комплекс приводит к
переносу восьми протонов из стромы в люмен.
Функции Q-цикла в цепи дыхания в мито-
хондриях сейчас приняты бесспорно. В случае
фотосинтетического электронного транспорта его
функции до сих пор обсуждаются. По аналогии с
цитохром-/)/<?!-комплексом предполагается, что
Q-цикл, связанный с цитохром-/?6/Лкомплексом,
играет важную роль в хлоропластах. Однако пока
функционирование Q-цикла у растений наблюда-
ли в основном в условиях низкой освещенности.
Предположительно, Q-цикл подавляется высоким
протонным градиентом на тилакоидной мембра-
не, который формируется, например, при высо-
ких интенсивностях света. Таким образом, поток
электронов может быть адаптирован к потребно-
стям растительной клетки через Q-цикл.
3.8. Фотосистема I
восстанавливает НАДФ
Пластоцианин, восстановленный в цитохром-
/>6//-комплексе, диффундирует в люмене тила-
коидов и связывается с положительно заряжен-
ным сайтом связывания на комплексе ФС I. Он
передает электрон в ФС I, и затем диффундиру-
ет обратно к цитохром-/)6//-комплексу в окис-
ленной форме (рис. 3.31).
Реакционный центр ФС I с максимумом по-
глощения 700 нм также содержит пару хлорофил-
лов (Хл-я)2 (рис. 3.31). Как и вФС II, поглощение
98
3. Транспорт электронов в процессе фотосинтеза
1/2НАДФ® + Н® 1/2 НАДФН
Ферредоксин-
НАДФ редуктаза
Рис. 3.31. Схема электронного транспорта в фотосистеме I. Образовавшийся
после возбуждения специальной пары хлорофилл с высокоэлектроотрицательным
редокс-потенциалом, вызывает восстановление НАДФ+ путем последовательной
передачи электрона через Хл-я, филлохинон и три железосерных белка. Дефицит
электрона в положительно заряженном радикале хлорофилла компенсируется за
счет электронов пластоцианина
фотона приводит к разделению зарядов, т.е. к об-
разованию (Хл-а)+, который затем восстанав-
ливается за счет пластоцианина. Предположи-
тельно (Хл-я)2 передает электрон мономеру Хл-а
(АД который, в свою очередь, передает его на
прочно связанный филлохинон (Aj) (рис. 3.32).
Филлохинон выполняет функции, аналогичные
Qa в фотосистеме II. От филлохинона в форме
семихинона электрон передается на железосер-
ный центр, получивший название Fx.
3.8. Фотосистема I восстанавливает НАДФ
99
Таблица 3.4. Белки фотосистемы I (неполный список)
Белок Молекулярная масса (кДа) Локализация Кодирова- ние Функция
А 83 в мембране хлоропласт связывание Р700, Хл-а, Ао, Av Q, Fx,
антенная функция
В 82 -//- -п-
С 9 периферическая: -н- связывание FA, FB, ферредоксина
в строме
D 17 -п- ядро
Е 10 -п- -п-
F 18 периферическая: люмен -п- связывание пластоцианина
Н 10 периферическая: строма ядро связывание фосфорилированного CCKII
1 5 в мембране хлоропласт ?
J 5 -п- -II- ?
Рис. 3.32. Филлохинон
Fx — это 4Fe-4S центр с очень низким отри-
цательным окислительно-восстановительным
потенциалом. Он передает один электрон на
два следующих 4Fe-4S центра (FA, FB), кото-
рые, в свою очередь, восстанавливают ферре-
доксин — белок с молекулярной массой 11 кДа,
в состав которого входит 2Fe-2S центр. Фер-
редоксин принимает и передает только один
электрон. Восстановление происходит на стро-
мальной стороне тилакоидной мембраны. Для
этого ферредоксин связывается с положитель-
но заряженным сайтом на субъединице С ФС I
(рис. 3.33). В результате восстановления НАДФ
с участием ферредоксина, которое катализиру-
ется ферредоксин-НАДФ-редуктазой, обра-
зуется НАДФН — конечный продукт фотосин-
тетического транспорта электронов.
Комплекс ФС I состоит минимум из 11 раз-
личных субъединиц (табл. 3.4). Центральная
часть комплекса ФС I (как и ФС II) представля-
ет собой гетеродимер, состоящий из субъеди-
ниц А и В (см. рис. 3.33). Молекулярные массы
каждой из субъединиц А и В (82—83 кДа) соот-
ветствуют примерно сумме молекулярных масс
белков D] и СР43 и D2 и СР47, соответственно, в
ФС II (см. табл. 3.2).
Подобно D] и D2 в ФС II, с субъединицами А
и В связаны хромофоры Р700 (Хл-я)2 и перенос-
чики электронов (филлохинон, Fex) реакцион-
ного центра. Кроме того, в их состав входят при-
мерно 100 молекул Хл-я, антенных пигментов.
Таким образом, гетеродимер, состоящий из А и
В, включает в себя реакционный центр и вну-
треннюю антенну. Несколько лет назад группы
Сэнджера и Витта в Берлине методом рентге-
ноструктурного анализа получили трехмерную
структуру фотосистемы I термофильной циано-
бактерии Synechococcus elongatus с разрешени-
ем 2,5 А. Было обнаружено, что базовая струк-
тура фотосистемы I, с двумя молекулами Хл-а
в центральной части и двумя системами транс-
порта электронов, по две молекулы хлорофилла
Хл-я695 в каждой, очень похожа на фотосистему
II и бактериальную фотосистему, представлен-
ную на рис. ЗЛО1. Пока не установлено, одна или
обе ветви участвуют в транспорте электрона.
Считают, что FeS-центры FA и FB расположе-
ны на субъединице С, а субъединица F является
сайтом связывания пластоцианина.
1 Представленная точка зрения дискуссионна. Более рас-
пространено мнение, что ФС II похожа на реакционный
центр пурпурных бактерий, а ФС I — на реакционный центр
зелёных серных бактерий. — Прим. ред.
100
3. Транспорт электронов в процессе фотосинтеза
Рис. 3.33. Схема расположения положительно заряженных доменов в белках
цит-^/Лкомплекса и фотосистемы I (обозначено как +++). Эти участки служат
для связывания (doking) небольших белков, несущих отрицательный заряд (—):
пластоцианина и ферредоксина
При циклическом транспорте электрона
в ФС I энергия света используется только
для синтеза АТФ
Помимо нециклического транспорта, который
обсуждался до сих пор, есть и циклический транс-
порт, при котором электроны от возбужденной
фотосистемы I транспортируются по цепи, но
тем не менее возвращаются в основное состоя-
ние в той же фотосистеме. Циклический транс-
порт, предположительно, происходит при участии
цитохром-^/Лкомплекса (рис. 3.34). Энергия,
которая высвобождается при этом, используется
только для синтеза АТФ, а НАДФН не образу-
ется. Этот процесс получил название цикличе-
ского фотофосфорилирования. В интактных
листьях, и даже в изолированных интактных хло-
ропластах, довольно трудно бывает эксперимен-
тально различить циклическое и нециклическое
фотофосфорилирование. Долгое время остава-
лось неясным, происходит ли циклическое фос-
форилирование в нормальных физиологических
условиях, и если да, то в какой степени. Недавние
измерения стехиометрии протонов при фотофос-
форилировании (раздел 4.4) показали, что выход
АТФ в нециклическом электронном транспорте
не может удовлетворить потребности процесса
ассимиляции СО2, и поэтому циклическое фос-
форилирование необходимо. Более того, цикли-
ческое фотофосфорилирование должно происхо-
дить с высокой скоростью в хлоропластах клеток
обкладки некоторых С4-растений (раздел 8.4).
Эти клетки имеют большую потребность в АТФ,
и характеризуются высокой активностью ФС I и
низкой активностью ФС II. По всей вероятно-
сти, циклический поток электронов регулируется
редокс-состоянием акцептора фотосистемы I та-
ким образом, что при повышении восстановлен-
ное™ пула НАДФ и ферредоксина повышается
доля электронов, транспортируемых по цикличе-
скому пути. Функция циклического транспорта
3.9. В отсутствие других акцепторов электроны могут передаваться с фотосистемы I на кислород 101
Фотосистема I
Цит-Ь6//-комплекс
Рис. 3.34. Циклический транспорт электронов с участием фотосистемы I
и uwr-bjf-комплекса. Путь электронов из возбужденной ФС I к \iwr-bh/f-комплексу
остается неясным
электронов, по-видимому, состоит в приведении
скоростей образования АТФ и НАДФН в соот-
ветствие с потребностями клетки, а также в защи-
те электрон-транспортной цепи от избыточного
восстановления.
Несмотря на интенсивное изучение, пути
передачи электрона из ФС I в цитохром-/>6//’-
комплекс при циклическом электронном транс-
порте пока не выяснены. Предположительно,
циклический транспорт структурно отделен от
цепи линейной передачи электрона. Большин-
ство экспериментов по изучению циклического
электронного транспорта были проведены на
изолированных тилакоидных мембранах, в ко-
торых при добавлении таких посредников, как
ферредоксин или флавинаденинмононуклеотид
(ФМН, рис. 5.16) происходит только цикличе-
ский транспорт. Циклический транспорт элек-
тронов ингибируется антибиотиком анти ми ци-
ном А. Пока неясно, с каким сайтом связывается
этот ингибитор. Антимицин А не подавляет не-
циклический электронный транспорт. Удиви-
тельно то, что белки НАДН-дегидрогеназного
комплекса дыхательной цепи митохондрий
(раздел 5.5) были обнаружены в тилакоидной
мембране хлоропластов. Функции этих белков в
хлоропластах остаются невыясненными. Белки
этого комплекса очень часто встречаются в хло-
ропластах из клеток обкладки С4-растений, в ко-
торых невелико содержание ФС II, но высока ак-
тивность циклического фотофосфорилирования
(раздел 8.4). Эти наблюдения позволили пред-
полагать, что циклический поток электронов от
НАДФН или ферредоксина к пулу пластохино-
нов происходит с участием комплекса, сходного
с митохондриальным НАДН-дегидрогеназным
комплексом. Как будет показано в разделе 5.5,
митохондриальный НАДН-дегидрогеназный ком-
плекс передает электроны от НАДН на убихи-
нон. У цианобактерий было показано участие
НАДФ-дегидрогеназного комплекса, сходного
с митохондриальным НАДН-дегидрогеназным
комплексом, в циклическом электронном тран-
спорте.
102
3. Транспорт электронов в процессе фотосинтеза
3.9. В отсутствие других акцепторов
электроны могут передаваться
с фотосистемы I на кислород
Когда пул ферредоксина перевосстановлен, ста-
новится возможной передача электронов от
ФС I на кислород с образованием супероксид-
радикала (’Of) (рис. 3.35). Этот процесс по-
лучил название реакции Мелера. Супероксид-
радикал может восстанавливать ионы металлов,
такие, как Fe3+ и Си2+ (Мп+):
•О2 -+ Мп+—> О2 + м(п-,)+
Супероксиддисмутаза катализирует дис-
мутацию • О2_ с использованием двух протонов,
в результате которой образуются Н2О2 и О2:
2-О2 + 2Н+—>О2 + Н2О2
•О2_, Н2О2 и *ОН называют активными
формами кислорода (АФК). Ионы металлов,
восстановленные супероксидом, реагируют с
перекисью водорода с образованием гидроксил-
радикала:
Н2О2 + М(п ,)+ -> • он + мп+
Гидроксил-радикал (• ОН) представляет из
себя очень реакционноспособное соединение,
повреждающее ферменты и липиды путем их
окисления. Растительная клеткалишена каких бы
то ни было защитных ферментов для ликвидации
• ОН. Поэтому, чтобы не допустить восстановле-
ния ионов металлов, происходит быстрая элими-
нация *О2_ при участии супероксиддисмутазы.
Но перекись водорода также может повреждать
многие ферменты. Чтобы предотвратить это по-
вреждение, перекись разрушается при участии
аскорбатпероксидазы, которая локализована в
тилакоидной мембране. Аскорбат, важнейший
антиоксидант в растительной клетке (рис. 3.36),
окисляется этим ферментом до радикала моно-
дегидроаскорбата, который самопроизвольно
превращается в аскорбат за счет ферредоксина,
восстановленного в фотосистеме I. Монодеги-
дроаскорбат может быть также восстановлен до
аскорбата НАД(Ф)Н-зависимой монодегидроа-
скорбатредуктазой в строме хлоропластов и в ци-
тозоле.
В качестве альтернативы последней реакции,
две молекулы монодегидроаскорбата могут дис-
Рис. 3.35. Схема реакции Мелера. Когда пул ферредоксина в значительной мере восстановлен,
электроны передаются в реакции Мелера на кислород, и при этом образуется супероксид-радикал.
Удаление этого агрессивного радикала включает реакции, катализируемые супероксиддисмутазой
и аскорбатпероксидазой
3.9. В отсутствие других акцепторов электроны могут передаваться с фотосистемы I на кислород 103
Аскорбат
Радикал моно-
дегидроаскорбата
Дегидроаскорбат
Рис. 3.36. Окисление аскорбата происходит через образование радикала
монодегидроаскорбата
2 Монодегидро-
аскорбат
само-
Аскорбат
произвольно
Дегидро-
аскорбат
.2 GSH GSSG
Глутатион-
редуктаза
НАДФН® НАДФН+Н®
Рис. 3.37. Дегидроаскорбат может
восстанавливаться с образованием аскорбата
с участием глутатиона и глутатионредуктазы
тиона. Восстановление GSSG катализируется
глутатионредуктазой, использующей НАД(Ф)
Н в качестве восстановителя (см. рис. 3.37).
Главная функция Мелер-аскорбат-перокси-
дазного цикла — диссипация в тепло избыточ-
ной энергии возбуждения фотосистемы I. По-
глощение восьми экситонов ФС I приводит
к образованию двух супероксид-радикалов и
двух молекул восстановленного ферредоксина,
который в дальнейшем используется в каче-
стве восстановителя для разложения Н2О2 (см.
рис. 3.35). В каком-то смысле передачу электро-
нов на кислород в реакции Мелера можно рас-
сматривать как процесс, обратный окислению
воды в ФС II. Как будет сказано в следующем
разделе, реакция Мелера происходит в ситуа-
ции, когда пул ферредоксина перевосстановлен.
При этом генерируется протонный градиент,
так как электроны транспортируются в фото-
системе II и цитохром-£6//’-комплексе. При на-
личии АДФ протонный градиент может быть
использован для синтеза АТФ. Но обычно при
тех условиях, при которых идет реакция Меле-
ра, наблюдается дефицит АДФ, поэтому про-
мутировать с образованием аскорбата и деги-
дроаскорбата. Дегидроаскорбат превращается в
аскорбат за счет восстановленного глутатиона
в реакции, катализируемой дегидроаскорба-
тредуктазой в строме хлоропластов (рис. 3.37).
Глутатион (GSH) — универсальный анти-
оксидант в клетках растений (раздел 12.2). Он
представляет из себя трипептид, состоящий из
аминокислот глутамата, цистеина и глицина
(рис. 3.38). Окисление GSH происходит с об-
разованием дисульфидного мостика (GSSG)
между остатками цистеина двух молекул глута-
Glu—Cys—Gly
SH
SH
I
Glu—Cys—Gly
Восстановленный
глутатион
(GSH)
2 e®+ 2 H®
Glu—Cys—Gly
S
I
Glu—Cys—Gly
Окисленный
глутатион
(GSSG)
Рис. 3.38. Окисление и восстановление глутатиона
104
3. Транспорт электронов в процессе фотосинтеза
Метилвиологен
(паракват)
Рис. 3.39. Метилвиологен, гербицид, который также называют паракватом, при
передаче электрона от возбужденной ФС I восстанавливается с образованием
радикала. Радикал передает электрон на кислород с образованием агрессивного
супероксид-радикала. Паракват продается компанией ICI под торговым названием
Грамоксон
тонный градиент может достигать значительной
величины. Циклический транспорт электрона и
реакция Мелера имеют общее свойство: они не
служат для образования НАДФН за счет восста-
новления НАДФ. Поэтому электронный транс-
порт, приводящий к реакции Мелера, получил
название псевдоциклического электронного
транспорта.
Не так давно у растений была обнаружена
еще одна группа антиоксидантов: это так на-
зываемые пероксиредоксины. Эти белки, в
состав которых в качестве редокс-агентов вхо-
дят SH группы, были ранее открыты в клетках
животных. У модельного растения Arabidopsis
было идентифицировано 10 различных генов
пероксиредоксинов. Эти белки присутствуют в
хлоропластах и других компартментах клетки
и отличаются от рассмотренных ранее антиок-
сидантов глутатиона и аскорбата тем, что они
могут восстанавливать широкий спектр перок-
сидов, включая Н2О2, алкилпероксиды и пе-
роксинитриты. В хлоропластах окисленные
пероксиредоксины восстанавливаются за счет
фотосинтетического электронного транспорта в
фотосистеме 1; в качестве интермедиатов высту-
пают ферредоксин или тиоредоксин.
Вместо ферредоксина ФС I может восста-
навливать метилвиологен. Метилвиологен, ко-
торый также называют паракват, производит-
ся в промышленных масштабах и используется
как гербицид (рис. 3.39). Его гербицидный эф-
фект обусловлен восстановлением кислорода до
супероксид-радикала за счет восстановленного
параквата. Кроме того, паракват конкурирует с
дегидроаскорбатом за восстановительные экви-
валенты, образующиеся в фотосистеме I.
Таким образом, в присутствии параквата
аскорбат не может регенерировать из дегидроа-
скорбата и реакция, катализируемая аскорбат-
пероксидазой, останавливается из-за отсутствия
субстрата. Повышение продукции супероксида
и прекращение процесса детоксикации переки-
си водорода в присутствие параквата вызывает
серьезные окислительные повреждения клеток
мезофилла, которые проявляются в обесцвечи-
вании листьев. Ранее паракват использовался
для уничтожения полей конопли.
3.10. Регуляторные механизмы
контролируют распределение
поглощенных фотонов между
двумя фотосистемами
Нециклический транспорт электронов с уча-
стием двух фотосистем требует равномерного
распределения поглощенных экситонов между
ними. Как говорилось в разделе 2.4, экситоны
преимущественно транспортируются к тому
3.10. Регуляторные механизмы контролируют распределение поглощенных фотонов
105
Рис. 3.40. Распределение фотосинтетических белковых комплексов между
спаренными и неспаренными участками тилакоидной мембраны. Стыковка
мембран, предположительно, обеспечивается светособирающими комплексами II
(ССК II). PS I - ФС I; PS II - ФС II; LHC II - ССК II
хромофору, который требует меньше энергии
для возбуждения. Для возбуждения фотосисте-
мы I (Р7оо) требуется меньше энергии, чем для
ФС II (Р680), а значит, при свободной конкурен-
ции между фотосистемами экситоны преимуще-
ственно передавались бы в ФС I. Поэтому рас-
пределение экситонов регулируется, в том числе,
за счет пространственного разделения двух фо-
тосистем и их антенн в тилакоидной мембране.
Тилакоидные мембраны хлоропластов подраз-
деляются на спаренные (stacked) и неспаренные
(unstacked) мембраны. Наружная поверхность
неспаренных мембран обращена к пространству
стромы; эти мембраны называются ламеллами
стромы (рис. 3.40). В спаренных мембранах со-
седние тилакоидные мембраны находятся в пря-
мом контакте друг с другом. Эти стопки мембран
в световой микроскоп видны как зерна (граны), и
поэтому получили название ламеллы гран.
АТФ-синтаза и комплекс ФС I (включая све-
тособирающие комплексы) расположены либо в
ламеллах стромы, либо на внешней поверхности
ламмелл гран. Таким образом, эти белки име-
ют свободный доступ к АДФ и НАДФ стромы.
Комплекс ФС II, наоборот, располагается преи-
мущественно в ламеллах гран. Периферические
субъединицы комплекса ФС II (раздел 2.4) мо-
гут взаимодействовать с субъединицей ССК II,
локализованного на спаренной мембране, вы-
зывая слипание мембран. Кроме ФС II и ССК
II, в спаренных мембранах находится цитохром-
/>6//’-комплекс. Поскольку белки ФС I и F-АТФ-
синтазы выдаются в пространство стромы, они
не помещаются в зазоре между спаренными
мембранами. Таким образом, комплексы ФС II
в спаренных мембранах пространственно отде-
лены от комлексов ФС I, расположенных в не-
спаренных мембранах. Предположительно, это
предотвращает неконтролируемый «перелив
экситонов» из ФС II в ФС 1.
Как бы то ни было, существует простран-
ственное разделение двух фотосистем. Кроме
того, существует специальный механизм, регу-
лирующий перелив экситонов с ФС II на ФС I.
Если возбуждение ФС II больше, чем в ФС I, это
приводит к накоплению пластогидрохинонов,
106
3. Транспорт электронов в процессе фотосинтеза
Деэпоксидаза
Люмен тилакоида
pH 5,0
Эпоксидаза
Строма
Рис. 3.41. Виолаксантиновый цикл (по Demming — Adams)
которые ФС I через цитохром-^/Х’-комплекс не
может окислить достаточно быстро. В этих усло-
виях активируется протеинкиназа, которая ка-
тализирует фосфорилирование гидрокисльных
групп треониновых остатков периферических
субъединиц ССК II, вызывая изменение их кон-
формации. В результате этой реакции сродство
ССК II к ФС II снижается, и он отсоединяется
от комплекса ФС II. С другой стороны, благо-
даря изменению конформации субъединицы
ССК II приобретают способность связываться
с ФС I. Это повышает долю экситонов, уходя-
щих с ССК II на ФС I. Таким образом, нако-
пление восстановленного пластохинона может
снизить возбуждение ФС II в пользу ФС I. Про-
теинфосфатаза осуществляет обратную регу-
ляторную реакцию. Этот процесс, описанный
здесь в упрощенном виде, позволяет растениям
оптимально распределять поглощенные фото-
ны между двумя фотосистемами, независимо от
спектрального состава поглощенного света.
Избыточная энергия диссипируется в тепло
Растения достаточно часто сталкиваются с тем,
что интенсивность освещения чересчур велика
по сравнению запросами фотосинтетического
метаболизма на НАДФН и АТФ. Это проис-
ходит в том случае, когда скорость метаболиз-
ма не соответствует высокой интенсивности
света. Такая ситуация наблюдается, например,
при низкой температуре, когда метаболизм за-
медляется из-за снижения ферментативной
активности (холодовой стресс) или при высо-
кой температуре, когда устьица закрываются,
чтобы предотвратить потерю влаги. Избыточ-
ное возбуждение фотосистем могло бы приве-
сти к перевосстановлению компонентов фото-
синтетической электрон-транспортной цепи.
Избыточное возбуждение фотосистемы II, ко-
торое определяют по накоплению пластоги-
дрохинонов, приводит к повреждению фото-
синтетического аппарата, которое называется
фотоингибированием. Основная причина этих
Дополнительная литература
107
повреждений — перевозбуждение реакцион-
ного центра, за счет которого молекулы хлоро-
филла переходят в триплетное состояние, и это
приводит к образованию агрессивного синглет-
ного кислорода (раздел 2.3). Повреждающий
эффект триплетного хлорофилла можно на-
блюдать, поместив небольшое количество хло-
рофилла под кожу человека; освещение вызовет
острое повреждение тканей. Этот фотодинами-
ческий принцип используется в медицине для
местного лечения рака кожи.
Каротиноиды (например, р-каротин,
рис. 2.9) способны переводить триплетный
хлорофилл и синглетный кислород в основное
состояние за счет образования триплетного
каротиноида, который диссипирует энергию в
тепло. Таким образом, каротиноиды выполняют
важнейшую защитную функцию. Однако ино-
гда каротиноидная защита не может справить-
ся с избыточным возбуждением ФС II, и тогда
синглетный кислород повреждает комплекс ФС
II. Наиболее вероятный объект повреждения —
белок D] реакционного центра ФС II, который
даже в нормальных условиях фотосинтеза име-
ет высокую скорость оборота (раздел 3.6). Ког-
да скорость разрушения белка Dj превышает
скорость его ресинтеза, скорость фотосинтеза
падает; другими словами, происходит фотоин-
гибирование.
У растений выработалось несколько меха-
низмов для защиты фотосинтетического аппа-
рата от повреждения светом. Один механизм за-
ключается в перераспределении хлоропластов
внутри клетки: при высокой интенсивности све-
та хлоропласты перемещаются с поверхности
клеток, обращенной к свету, к боковым стенкам
клетки. Другой механизм состоит в рассеива-
нии энергии избыточных экситонов в форме
тепла. Этот процесс называют нефотохимиче-
ским тушением энергии экситонов. Хотя ин-
формация об этом процессе еще неполна, не-
сомненно, важную роль в этом процессе играет
зеаксантин. Зеаксантин вызывает тепловую
диссипацию энергии экситонов за счет взаи-
модействия с хлорофилл-связывающим белком
(СР 22) фотосистемы II. Зеаксантин образуется
путем восстановления диэпоксида виолаксанти-
на. В качестве восстановителя выступает аскор-
бат, помежуточным продуктом реакции явля-
ется моноэпоксид антераксантин. Зеаксантин
может превратиться обратно в виолаксантин
в реакции эпоксидации, требующей НАДФН
и О2 (рис. 3.41). Образование зеаксантина, ка-
тализируемое деэпоксидазой, происходит на
люменальной стороне тилакоидной мембраны
и имеет оптимум pH 5,0, тогда как регенерация
виолаксантина с участием эпоксидазы проис-
ходит на стромальной стороне при pH 7,6. Та-
ким образом, для образования зеаксантина
требуется высокий градиент pH на тилакоидной
мембране. Как уже обсуждалось в связи с реак-
цией Мелера (раздел 3.9), высокий градиент pH
может служить признаком высокой степени воз-
буждения фотосистемы II. Когда поток квантов
света больше, чем нужно, рост градиента pH
инициирует синтез зеаксантина, который рас-
сеивает избыточную энергию комплекса ФС II
в тепло. На ярком солнечном свету растения от
50 до 70% энергии поглощенных фотонов рас-
сеивают в форме тепла. Нефотохимическое ту-
шение энергии экситонов — главный защитный
механизм растений от избыточного освещения.
Для сравнения, реакция Мелера (раздел 3.9) и
фотодыхание (раздел 7.7) почти что при любых
условиях играют минорную роль в рассеивании
избыточной энергии возбуждения.
Дополнительная литература
Allen, J. Е Cyclic, pseudocyclic and non cyclic
photophosphorylation: new links in the chain. Trends
Plant Sci 8, 5-19(2003).
Asada, K. The water-water cycle in chloroplasts:
Scavenging of active oxygens and dissipation of excess
photons. Annu Rev Plant Physiol Plant Mol Biol 50,
601-639(1999).
Chitnis, P. R. Photosystem 1: Function and physiology.
Annu Rev Plant Physiol Plant Mol Biol 52, 593—626
(2001).
Deiner, B. A., Rappaport, E Structure, dynamics, and
energetics of the primary photochemistry of photosystem
11 of oxygenic photosynthesis. Annu Rev Plant Biol 53,
551-580(2002).
Deisenhofer, J., Michel, H. Nobel Lecture: The
photosynthetic reaction center from the purple bacterium
Rhodopseudomonas viridis. EM BO J 8, 2149—2169
(1989).
Demmig-Adams, B., Adams III, W. W. The role of the
xanthophyll cycle carotenoids in the protection of
photosynthesis. Trends Plant Sci 1, 21—26 (1996).
108
3. Транспорт электронов в процессе фотосинтеза
Depege, N., Bellafiore, S., Rochaix, J.-D. Role of
chloroplast protein kinase Stt7 in LHC11 phosphorylation
and state transition in Chlamydomonas. Science 299,
1572-1575 (2003).
Dietz, K.-J. Plant peroxiredoxins. Annu Rev Plant Biol
54, 93-107 (2003).
Ermler, (J., Fritzsch, G., Buchanan, S.K., Michel, H.
Structure of the photosynthetic reaction center from
Rhodobacter sphaeroides at 2.65 A resolution:
Cofactors and protein-cofactor interactions. Structure
2, 925-936(1994).
Govindjee. A role for a light-harvesting antenna complex
of photosystem 11 in photoprotection. Plant Cell 14,
1663-1668 (2002).
Govindjee, Gest, H. (eds.). Historical highlights of
photosynthesis research 1. Photosynth Res 73, 1—308
(2002).
Govindjee, Gest, H. (eds.). Historical highlights of
photosynthesis research II. Photosynth Res 79, 1—450
(2003).
Heller, B. A., Holten, D., Kirmaier, C. Control of electron
transfer between the L- and M-sides of photosynthetic
reaction centers. Science 269, 940—945 (1995).
Horton, P., Ruban, A. V., Walters, R. G. Regulation of
light harvesting in green plants. Annu Rev Plant Physiol
Plant Mol Biol 47, 655-684 (1996).
Kasahara, M., Kagawa, T., Oikawa, K., Suetsugu, N.,
Miyao, M., Wada, M. Chloroplast avoidance movement
reduces photodamage in plants. Nature 420, 829—832
(2002).
Konig, J., Baier, M., Horling, E, Kahmannm, U.,
Harris, G., Schurmann, P. The plant-specific function
of 2-Cys peroxiredoxin-mediated detoxification of
peroxides in the redox-hierarchy of photosynthetic
electron flux. Proc Natl Acad Sci USA 99, 5738—5743
(2002).
Joliot, P., Joliot, A. Cyclic electron transfer in plant leaf.
Proc Natl Acad Sci USA 99, 10209-10214 (2002).
Jordan, P., Fromme, P., Witt, H. T., Klukas, O.,
Saenger, W., Kraub, N. Three-dimensional structure of
cyanobacterial photosystem 1 at 2.5 A resolution. Nature
411,909-917 (2001)
Li, X.-P., Bjorkman, O., Shih, C., Grossman, A. R.,
Rosenquist, M., Jansson, S., Niyogi, К. K. A pigment-
binding protein essential for regulation of photosynthetic
light harvesting. Nature 403, 391—395 (2000).
Lunde, C., Jensen, P. E., Haldrup, A., Knoetzel, J.,
Scheller, H. V. The PS1-H subunit of photosystem I is
essential for state transitions in plant photosynthesis.
Nature,408, 613-615 (2000).
Melis, A. Photosystem-II damage and repair cycle in
chloroplasts: What modulates the rate of photodamage
in vivo? Trends Plant Sci 4, 1130—135 (1999).
Mittler, R. Oxidative stress, antioxidants and stress
tolerance. Trends Plant Sci 7, 405—410 (2002).
Niyogi, К. K. Safety valves for photosynthesis. CurrOpin
Plant Biol 3, 455-460 (2000).
Ort, D. R., Yocum, С. E (eds.). Oxygenic photosynthesis:
The light reactions. (Advances in Photosynthesis).
Kluwer Academic Publishers, Dordrecht, The
Netherlands (1996).
Orr, L., Govindjee. Photosynthesis and the web: 2001.
Photosynth Res 68, 1—28 (2001).
Osmond, B., Badger, M., Bjorkman, O., Leegood, R. Too
many photons: Photorespiration, photoinhibition and
photooxidation. Trends Plant Sci 2, 119—121 (1997).
Powles, S. B., Holtum, J. A. M. Herbicide resistance in
plants. Lewis Publishers, Boca Raton, Ann Arbor,
(1994).
Roy, C., Lancaster, D., Michel, H. The coupling of
light-induced electron transfer and proton uptake as
derived from crystal structures of reaction centers from
Rhodopseudomonas viridis modified at the binding site
of the secondary quinone, QB. Structure 5, 1339—1359
(1997).
Schubert, W.-D., Klukas, O., Saenger, W., Witt, H. T.,
Fromme, P., Kraub, N. A common ancestor for oxygenic
and anoxygenic photosynthetic systems: A comparison
based on the structural model of photosystem 1. J Mol
Biol 280, 297-314(1998).
Vener, A. V., Ohad, L, Andersson, B. Protein
phosphorylation and redox sensing in chloroplast
thylakoids. Plant Biol 1, 217-223 (1998).
Wada, M., Kagawa, T., Sato, Y. Chloroplast movement.
Annu Rev Plant Biol 54, 455-468 (2003).
Werck-Reich hart, D., Hehn, A., Didieijean, L.
Cytochromes P450 for engineering herbicide tolerance.
Trends Plant Sci 5, 116—123 (2000).
Zouni, A., Witt, H. T., Kern, J., Fromme, P., Kraub, N.,
Saenger, W., Orth, P. Crystal structure of photosystem
11 from Synechococcus elongatus at 3.8 A revolution.
Nature 409, 739-743 (2001).
В процессе фотосинтеза образуется АТФ!
В главе 3 мы обсуждали перенос протонов
через тилакоидную мембрану в процессе
фотосинтетического электронного транспор-
та и то, каким образом при этом генерируется
протонный градиент. В этой главе речь пойдет
об использовании протонного градиента для
синтеза АТФ.
В 1954 г. Даниэль Арнон (Беркли) обнару-
жил, что при освещении суспензии тилакоид-
ных мембран из АДФ и неорганического фос-
фата образуется АТФ. Этот процесс называют
фотофосфорилированием. В дальнейших экс-
периментах было установлено, что фотофосфо-
рилирование сопряжено с синтезом НАДФН.
Это был неожиданный результат, ведь в то время
считали, что в хлоропластах, как и в митохон-
дриях, синтез АТФ сопряжен с транспортом
электронов с НАДФН на кислород. Вскоре ста-
ло ясно, что механизм фотофосфорилирования,
сопряженного с фотосинтетическим электрон-
ным транспортом, очень сходен с механизмом
синтеза АТФ, сопряженного с транспортом
электронов в митохондриях, который называет-
ся окислительным фосфорилированием (раз-
дел 5.6).
В 1961 г. Питер Митчелл (Эдинбург) выдви-
нул свою хемиосмотическую гипотезу, которая
заключалась в том, что в процессе синтеза АТФ,
сопряженного с электронным транспортом, об-
разуется протонный градиент, и что именно
протон-движущая сила этого градиента обе-
спечивает синтез АТФ. Первое время многие
ученые, работавшие в этой области, возражали
против революционной теории Митчелла, од-
нако со временем экспериментальные данные,
полученные разными авторами, подтвердили хе-
миосмотическую гипотезу, которая в настоящее
время стала общепринятой. В 1978 г. за разработ-
ку этой гипотезы Питер Митчелл был награжден
Нобелевской премией по химии.
4.1. Протон-движущая сила является
промежуточной формой
запасания энергии в процессе
синтеза АТФ
Рассчитаем для начала, сколько энергии на са-
мом деле нужно, чтобы синтезировать АТФ.
Свободную энергию, необходимую для синтеза
АТФ из АДФ и фосфата, можно рассчитать по
уравнению Вант Гоффа:
ag=ag’ + '!’'I"(AWpI ,4|>
Стандартная свободная энергия1 синтеза
АТФ составляет:
AG0 = 4-30,5 кДж/моль.
Концентрации АТФ, АДФ и фосфата в стро-
ме хлоропластов в значительной степени зави-
сят от метаболизма. По приблизительной оцен-
ке концентрации могут составлять:
АТФ = 2,5- 10-3 М;
АДФ = 0,5- IO 3 М;
Ф = 5- 10-3М.1 2
Подставляя эти значения в уравнение 4.1
(R=8,32 Дж/моль-К, Т = 298 °К), получаем
энергию, необходимую для синтеза АТФ в этих
условиях:
AG = + 47,8 кДж/моль.
Эта величина, конечно, варьирует, так как
она зависит от метаболических условий. В даль-
нейших рассуждениях мы будем оперировать
средним значением 50 кДж/моль, которое и обо-
значим как А(7атф.
1 В данном случае - стандартная свободная энергия при
pH = 7. — Прим. ред.
2 Для точной оценки необходимо знать не концентрации, а
активности участников реакции. В биологических системах
активность определить очень сложно. — Прим. ред.
110
4. В процессе фотосинтеза образуется АТФ
а Мембрана проницаема
для противоиона
можно измерить как разность напряжений на
мембране. Величину ДТ принято считать поло-
жительной, если катион переносится в направ-
лении более положительного заряда. Разность
потенциалов и свободная энергия связаны сле-
дующим уравнением:
= (4.3)
б Мембрана непроницаема
для противиона
- Н®
0
где т — заряд иона (в случае протона равен 1), а
F— число Фарадея, равное 96480 Дж/моль К.
Транспорт протонов через биологическую
мембрану приводит к образованию протонного
концентрационного градиента и мембранного
потенциала. Таким образом, свободная энергия
для транспорта протона из А в Б рассчитывается
как сумма свободных энергий, затраченных на
генерацию концентрационного градиента Н+ и
потенциала на мембране:
Дб=/?Пп
[Н1В
[Н+]А
+ /АТ
(4.4)
О
Рис- 4-1 - а. Транспорт протонов через мембрану,
проницаемую для противоионов, таких как хлорид,
приводит к формированию концентрационного
градиента протонов; б. когда мембрана
непроницаема для противоиона, транспорт
протонов приводит к формированию мембранного
электрического потенциала
Транспорт протонов через мембрану может
иметь различные последствия. Если мембрана
проницаема для противоионов протона [напри-
мер, хлорид-ионов (рис. 4.1 а)], заряд протонов
будет скомпенсирован, так как вслед за каждым
перенесенным протоном будет устремляться
хлорид-ион. При этом будет генерироваться
концентрационный градиент протонов. Сво-
бодная энергия транспорта протонов из ком-
партмента А в компартмент Б составляет:
Д<7=/?Пп7^ [Дж/моль] (4.2)
L*i 1а
Если мембрана непроницаема для противо-
ионов (рис. 4.1 (б)), компенсация заряда пере-
несенного протона оказывается невозможной.
В этом случае перенос всего лишь нескольких
протонов через мембрану приводит к формиро-
ванию мембранного потенциала Д^Р, который
В хлоропластах энергия, которая запасается
в форме протонного градиента, соответствует
изменению свободной энергии в процессе пере-
носа протонов из люмена в строму:
Д(7= ЛПпЩ+U+77ДЧ/, (4.5)
Щ 11
где S = строма, L = люмен, а ДТ = электриче-
ская разность потенциалов между люменом
и стромой.
Переходя к десятичному логарифму, полу-
чаем:
Д(7= 2,3 • /?71og + /AH'
[П JL
(4.6)
Дробь под логарифмом — обратная разность
между pH люмена и стромы:
log[H+]s — log[H+]L = — ДрН
После преобразования получаем:
ДG = —2,3 RT • ДрН + ГДУ (4.7)
При 25 °C: 2,3 • RT = 5700 Дж/моль
Отсюда: Д6’= —5700ДрН+ Ш [Дж/моль] (4.8)
Величина AG/F называется протон-движущей
силой (обозначим ее как proton motive force —
PMF). Она выражается в вольтах:
.А2 = РМР = -^|!^ДрН + ДЧ' [В] (4.9)
4.2. Электрохимический протонный градиент может быть диссипирован в тепло
111
2,3/?Т „
При 25 °C: —р— = 0,059 В
Отсюда: PMF = -0,059 • АрН + АТ [В] (4.10)
Уравнение 4.10 универсально и может быть
использовано для оценки величины химиче-
ской работы при синтезе АТФ, сопряженном с
электронным транспортом. При окислитель-
ном фосфорилировании в митохондриях PMF
в основном образуется за счет мембранного по-
тенциала. В хлоропластах, наоборот, мембран-
ный потенциал не вносит заметного вклада в
величину РМЕ В этом случае PMF почти пол-
ностью образуется за счет концентрационного
градиента протонов на тилакоидной мембране.
В хлоропластах на свету АрН на тилакоидной
мембране составляет около 2,5. Подставляя эту
величину в уравнение 4.8, получаем:
АС = —14,3 кДж/моль
Сравнение этой величины с АС образования
АТФ (50 кДж/моль) показывает, что перенос как
минимум четырех протонов необходим для син-
теза одной молекулы АТФ из АДФ и фосфата.
4.2. Электрохимический
протонный градиент может
быть диссипирован в тепло
с помощью разобщителей
Фотосинтетический транспорт электронов от
воды к НАДФ сопряжен с фотофосфорилиро-
ванием. Электронный транспорт происходит
в норме в том случае, если есть субстраты для
синтеза АТФ: АДФ и фосфат. При добавлении
разобщителя электронный транспорт идет с
высокой скоростью в отсутствие АДФ; в этом
случае он не сопряжен с синтезом АТФ. В при-
сутствии разобщителя синтез АТФ нарушается.
Хемиосмотическая гипотеза объясняет эф-
фект разобщителей (рис. 4.2). Разобщители —
амфифильные вещества, растворимые в воде
и липидах. Они способны входить в липидную
фазу мембраны путем диффузии и при этом пе-
реносить протон или ион щелочного металла,
снимая протонный градиент или мембранный
потенциал, соответственно. В присутствие ра-
зобщителя из-за отсутствия протонного гради-
ента АТФ-синтаза способна переносить прото-
ны из стромы в люмен тилакоида с потреблением
АТФ, который при этом гидролизуется до АДФ
и фосфата. По этой причине разобщители вы-
зывают гидролиз АТФ (АТФ-синтаза проявляет
АТФазную активность).
На рисунке 4.2# показан эффект разобщи-
теля карбонилцианид-пара-трифторметокси-
фенилгидразона (FCCP), который является
слабой кислотой. FCCP диффундирует в недис-
социированной (протонированной) форме из
компартмента с высокой концентрацией прото-
нов (слева на рис. 4.2#) через мембрану в ком-
партмент с низкой концентрацией протонов,
где диссоциирует с образованием протона и
аниона FCCP. Протон остается в этом компарт-
менте, а анион возвращается в другой компарт-
мент, где снова протонируется. Присутствие
FCCP в концентрации всего 710-8 М вызывает
полную диссипацию протонного градиента. Ве-
щество SF6847 (3,5-ди-(длредл-бутил)-4-гидро-
ксибензилдималононитрил) (рис. 4.3) обладает
еще более ярко выраженным разобщающим эф-
фектом. Разобщители, которые переносят про-
тоны через мембрану, как FCCP и SF6847, на-
зываются протонофорами.
Кроме протонофоров, есть и другой класс
разобщителей — ионофоры, которые могут
переносить через мембрану катионы щелоч-
ных металлов и таким образом уменьшать мем-
бранный потенциал. Валиномицин, антибио-
тик из Streptomyces, относится к ионофорам
(рис. 4.26). Валиномицин представляет собой
циклическую молекулу, содержащую последо-
вательность (Е-лактат)-(Ь-валин)-(О-гидро-
ксиизовалерианат)-(В-валин), повторяющуюся
трижды. Благодаря своей гидрофобной наруж-
ной поверхности валиномицин может диффун-
дировать через мембрану. Атомы кислорода,
ориентированные внутрь молекулы, образуют
сайт связывания и замещают воду в гидратной
оболочке катионов и ионов Rb+ и К+. Ионы Na+
связываются валиномицином весьма непрочно.
Добавление валиномицина к суспензии в при-
сутствии ионов К+ приводит к исчезновению
мембранного потенциала. Ионофор грамици-
дин, который мы не будем здесь подробно об-
суждать, тоже представляет из себя полипептид.
Грамицидин встраивается в мембраны, образуя
трансмембранный ионный канал, по которому
катионы щелочных металлов и протоны могут
диффундировать через мембрану.
112
4. В процессе фотосинтеза образуется АТФ
Н®
Карбонилцианид-
лара-трифтормето-
ксифенилгидразон
(FCCP)
Н3С сн3 Н3С сн3
Валиномицин
Рис. 4.2. Протондвижущая сила протонного градиента снимается разобщителями.
а. Гидрофобность FCCP позволяет ему диффундировать через мембрану как
в протонированной, так и в депротонированной форме. Этот разобщитель
может диссипировать протонный градиент за счет опосредованного протонного
транспорта.
б. Валиномицин, антибиотик с циклической структурой, сворачивается в
сферическую гидрофобную молекулу, во внутренней части которой связывается К+.
Валиномицин, связавший ионы К+, может диффундировать через мембрану.
Таким образом, валиномицин снимает мембранный потенциал, перенося ионы К+
через мембрану
4.2. Электрохимический протонный градиент может быть диссипирован в тепло
113 000
SF6847
Рис. 4.3. 3,5 -ди-(трет)-бутил)-4-гидро-
ксибензилиден-малонитрил (SF6847) — очень
эффективный разобщитель. В концентрации всего
лишь Ю-9 М он вызывает полную диссипацию
протонного градиента на мембране. Как и в
случае FCCP (рис. 4.2А), разобщающее действие
SF6847 основано на проницаемости мембраны для
протонированной и депротонированной формы
этого вещества
Хемиосмотическая гипотеза
была доказана экспериментально
В 1966 г. американский ученый Андре Яген-
дорф представил окончательное доказательство
справедливости хемиосмотической гипотезы
для фотофосфорилирования в хлоропластах
(рис. 4.4). Он инкубировал тилакоидные мем-
браны в кислой среде (при pH 4), чтобы повы-
сить кислотность в люмене тилакоидов путем
неспецифического переноса протонов. Он до-
бавил в суспензию тилакоидов неорганический
фосфат и АДФ, и затем повысил pH среды до 8,
добавляя в нее щелочный компонент буфера.
Это привело к внезапному возникновению про-
тонного градиента АрН = 4, и некоторое время
в суспензии происходил синтез АТФ. Посколь-
ку эксперимент проводили в темноте, было до-
казано, что синтез АТФ в хлоропластах может
идти без освещения только за счет градиента
pH на тилакоидной мембране.
Суспензия тилакоидных
мембран
pH среды 4
pH среды 4
pH в люмене 4
pH среды 8
pH в люмене 4
Рис. 4.4. Тилакоидные мембраны могут синтезировать АТФ в темноте за счет
искусственного протонного градиента. В суспензии тилакоидных мембран pH
среды снижается до 4,0 путем добавления янтарной кислоты (а). После 30-минут-
ной инкубации pH в люмене тилакоидов уравновешивается с pH среды за счет
медленной утечки протонов через мембрану (б). На следующем этапе в суспензию
добавляют АДФ и фосфат, меченый изотопом 32Р (в). После этого pH среды
повышают до 8.0, добавляя КОН (г). Таким образом между люменом тилакоидов
и внешней средой образуется градиент АрН = 4,0, и этот градиент используется
для синтеза АТФ из АДФ и фосфата. После короткой инкубации (д) реакцию
прекращают путем добавления в суспензию хлорной кислоты (НСЮ4), которая
вызывает денатурацию белков, и затем определяют количество меченого АТФ
(по Jagendorf, 1966)
114
4. В процессе фотосинтеза образуется АТФ
4.3. Н+-АТФ-синтазы бактерий,
хлоропластов и митохондрий
имеют сходную структуру
Каким образом энергия протонного градиен-
та используется для синтеза АТФ? Работающая
с переносом протонов АТФ-синтаза (Н+-АТФ-
синтаза) есть не только в хлоропластах. Эта си-
стема сформировалась в эволюции довольно
рано и обнаружена в мембранах бактерий, хло-
ропластов и митохондрий. У бактерий этот фер-
мент катализирует не только синтез АТФ за счет
энергии протонного градиента, но и обратную
реакцию транспорта протонов против концен-
трационного градиента с затратами АТФ. Пред-
положительно, эта функция была первична для
фермента. У некоторых бактерий АТФаза, гомо-
логичная Н+-АТФ-синтазе, функционирует как
АТФ-зависимый №+-транспортер.
Современные представления о структуре
и функциях Н+-АТФ-синтазы основаны на из-
Мочевина
F^: нет АТФазной активности,
связывает олигомицин
Рис. 4.5. Везикулы, полученные при
ультразвуковом разрушении митохондрий, содержат
функционально интактную Н+-АТФ-синтазу.
Растворимый фактор Fh обладающий
АТФазной активностью, удаляется при обработке
мочевиной. Олигомицин-связывающий фактор Fo
остается в мембране
Fp АТФазная активность,
не чувствительны
к олигомицину
учении митохондрий, хлоропластов и бактерий.
К I960 г. развитие электронной микроскопии
привело к обнаружению маленьких частиц, ко-
торые прикреплены с помощью ножек ко вну-
тренней мембране митохондрий и к тилакоид-
ной мембране хлоропластов (грибовидные тела).
Эти частицы есть только на стороне, обращен-
ной в матрикс в митохондриях или в строму в
хлоропластах, соответственно. Эфраим Рэкер
с сотрудниками из Корнельского Университета
успешно отделили эти частицы от митохондри-
альных мембран с помощью мочевины. Эти ча-
стицы катализировали гидролиз АТФ до АДФ и
фосфата. Рэкер назвал их F]-АТФаза. Мордехай
Аврон из Реховота, Израиль, показал, что соот-
ветствующие частицы из мембран хлоропластов
также проявляют АТФазную активность.
Везикулы, содержащие частицы, можно при-
готовить из внутренней мембраны митохондрий.
В этих везикулах может происходить дыхание, со-
пряженное с синтезом АТФ. Как и в интактных
митохондриях (раздел 5.6), добавление разобщи-
телей приводит к повышению АТФазной актив-
ности. Гидролиз АТФ, индуцированный разоб-
щителем, как и синтез АТФ, происходящий в этих
везикулах, ингибируется антибиотиком олигоми-
цином. Митохондриальные везикулы, из которых
были удалены F]-частицы, не проявляли АТФаз-
ной активности, но обладали высокой проницае-
мостью для протонов. Эта проницаемость пода-
влялась в присутствии олигомицина. АТФазная
активность изолированных F]-частиц, напротив,
не изменялась под действием олигомицина. Эти
и другие эксперименты показали, что Н+-АТФ-
синтаза митохондрий состоит из двух частей.
1. Растворимый фактор (F0, который в со-
ставе комплекса осуществляет синтез АТФ.
2. Мембрано-связанный фактор, обеспе-
чивающий перенос протонов через мембрану,
с которым связывается олигомицин.
Рэкер назвал этот фактор Fo (О, олигомицин)
(рис. 4.5). В целом такой же результат был полу-
чен для Н+-АТФ-синтаз хлоропластов и бакте-
рий, с той лишь разницей, что Н+-АТФ-синтаза
хлоропластов не чувствительна к олигомицину.
Тем не менее мембранная часть хлоропласт-
ной Н+-АТФ-синтазы также обозначается Fo.
Н+-АТФ-синтазы хлоропластов, митохондрий
и бактерий, как и Н+- и №+-АТФазы бактерий,
называются F-АТФ-синтазы и F-АТФазы. Та-
4.3. Н+-АТФ-синтазы бактерий, хлоропластов и митохондрий имеют сходную структуру
115
Таблица 4.1. Состав F-АТФ-синтазы хлоропластов. Номенклатура как для F-АТФсинтазы Е. coli.
Субъединицы Количество на один комплекс FgFi Молекулярная масса (кДа) Кодирование
а 3 55 Пластидный геном
р 3 54 Пластидный геном
У 1 36 Пластидный геном
6 1 21 Ядерный геном
£ 1 15 Пластидный геном
F0:a 1 27 Пластидный геном
b 1 16 Ядерный геном
Ь’ 1 21 Пластидный геном
с 12* 8 Пластидный геном
* Число субъединиц с в составе комплекса может варьировать. — Прим. ред.
кие обозначения, как FoFj-АТФ-синтаза и FoFr
АТФаза, также употребляются.
Fh после отсоединения от мембраны, пред-
ставляет собой растворимый олигомерный бе-
лок, имеющий состав а3р3уб£ (табл. 4.1). Этот
состав был показан для хлоропластов, бактерий
и митохондрий. Fo — сильно гидрофобный бел-
ковый комплекс, который может быть выделен
из мембраны только с помощью детергентов.
Дициклогексилкарбодиимид (DCCD) (рис. 4.6)
связывается с Fo, встроенным в мембрану, и за-
крывает протонный канал. В хлоропластах че-
тыре различных субъединицы были охарактери-
зованы как главные составляющие Fo. Они были
названы а, Ь, Ь’ и с. Субъединица с, предполо-
жительно представленная в Fo хлоропластов в
12 копиях, содержит две трансмембранные спи-
рали и сайт связывания DCCD. Субъединицы
с образуют цилиндр, который проходит сквозь
мембрану. С наружной стороны цилиндра в
мембране расположены субъединицы а, Ь, и Ь’,
причем b и Ь’ контактируют с Fj через субъеди-
ницу 6. Субъединицы у и £ образуют централь-
ную связь между F] и Fo.
Хотя структура Fo, представленная на рис. 4.7,
еще в какой-то мере гипотетична, структура
F] уже изучена весьма тщательно. Частицы Fj
так малы, что детали их структуры не видны на
электронной микрофотографии. Как бы то ни
было, более подробную информацию о строе-
нии комплекса можно получить в том случае,
если огромное количество электронных микро-
фотографий Fj проанализировать с помощью
компьютерного анализа изображений. На
рисунке 4.8 представлен усредненный снимок
F-АТФ-синтазы хлоропластов. В боковой про-
екции видна ножка, соединяющая Fj с мембра-
ной. С использованием более сложного анализа
изображения недавно между Fj и Fo были обна-
ружены две ножки: толстая и тонкая (на рисунке
не показаны). В вертикальной проекции видна
гексагональная структура, соответствующая че-
редующимся а- и р-субъединицам. Исследова-
ния изолированного белкового комплекса Fj
показали, что он имеет три каталитических сай-
та связывания АТФ или АДФ. Один из них занят
прочно связанной АТФ, которая высвобождает-
ся только тогда, когда белок использует энергию,
полученную в форме протонного градиента.
Дициклогексил-
карбодиимид
(DCCD)
Рис. 4.6. Дициклогексилкарбодиимид (DCCD),
ингибитор Fo части F-АТФ-синтазы
Рентгеноструктурный анализ части
АТФ-синтазы позволил изучить механизм
синтеза АТФ
В 1994 г. группа ученых под руководством Джона
Уокера в Кэмбридже (Великобритания) успеш-
но проанализировала трехмерную структуру Fj
части АТФ-синтазы. Для этого были исполь-
зованы кристаллы Fj из митохондрий сердца
116
4. В процессе фотосинтеза образуется АТФ
Рис. 4.7. Структура F-АТФ-синтазы. Структура
р! субъединицы приведена по результатам
рентгеноструктурного анализа, которые
обсуждаются в тексте (по Junge)
быка. Перед кристаллизацией препарат Fl был
насыщен смесью АДФ и аналога АТФ (5'-аде-
нилил-имидодифосфата, АМФ-PNP). Этот ана-
лог отличается от АТФ последними двумя фос-
фатными остатками, связанными через атом
азота. Он связывается с сайтом связывания АТФ
так же, как АТФ, но не гидролизуется АТФазой.
Структурный анализ подтвердил чередующееся
расположение субъединиц аир (рис. 4.7 и 4.9).
Одна а- и одна Р-субъединица образуют функ-
циональную единицу, содержащую сайт связы-
вания адениннуклеотида. В катализ синтеза АТФ
вовлечена субъединица р. В изученном кристал-
ле F] одна (ар)-единица содержала одну моле-
кулу АДФ, вторая — аналог АТФ, а третья была
свободна. Эти различия в связывании нуклеоти-
дов сопровождались различиями в конформации
трех р-субъединиц, как схематически показано
на рис. 4.9. Субъединица у расположена асим-
метрично: проходит через центр F] и изгибается
в сторону около (ар)-единицы, в которой нахо-
Рис. 4.8. Усредненное по 483 электронномикроскопическим фотографиям
изображение F-АТФ-синтазы хлоропластов шпината. А. Вертикальная проекция
Fj части. Гексамерная структура отражает чередующиеся (ар)-субъединицы.
Б. Боковая проекция, на которой видна ножка, соединяющая F! часть с мембраной
(Р. Graeber, Штутгарт)
4.4. Синтез АТФ происходит за счет изменения конформации белка
117
Рис. 4.9. Схематичное изображение вертикальной
проекции р! части F-АТФ-синтазы. Фермент
содержит три сайта связывания нуклеотидов, каждый
сайт состоит из одной а и одной р субъединицы.
Все три р-субъединицы находятся в разных
конформационных состояниях, у-субъединица,
расположенная в центре, вертикально по
отношению к наблюдателю, крепится кайр
субъединицам, в активном сайте которых находится
АДФ. Это представление основано на результатах
рентгеноструктурного анализа, проведенного Walker
с сотрудниками, которое упоминалось в тексте
дится АДФ (рис. 4.7 и 4.9). Эта асимметрия име-
ет важное значение для функционирования р!
части АТФ-синтазы. Нужно сделать несколько
общих предположений о АТФ-синтазе прежде,
чем разбирать более детально этот вопрос.
4.4. Синтез АТФ происходит за счет
изменения конформации белка
Для реакции:
АТФ + Н2О АДФ + Фосфат
стандартная свободная энергия составляет:
AG0’ = —30,5 кДж/моль.
Из-за высокой свободной энергии гидроли-
за АТФ считается энергетически богатым веще-
ством. Следует заметить, однако, что стандартное
значение АС?0’ определено для водного раствора,
в котором концентрация АТФ, АДФ и фосфата
составляет 1 М, соответственно, концентрация
воды составляет приблизительно 55 М. Если бы
концентрация воды была равна 10 М, А(7° для ги-
дролиза АТФ составляло бы + 2,2 кДж/моль. Это
означает, что при очень низких концентрациях
воды равновесие химической реакци смещено
в сторону самопроизвольного синтеза АТФ. Та-
ким образом, в отсутствие воды синтез АТФ не
требует затрат энергии.
В каталитическом центре фермента может об-
разовываться безводная среда. Такие сайты обыч-
но расположены в гидрофобной части фермент-
ного белка, и субстраты в этих сайтах реагируют
друг с другом в отсутствие воды. Поэтому когда
АДФ и фосфат прочно связаны с ферментом,
синтез АТФ может происходить самопроизволь-
но без затрат энергии (рис. 4.10). Это положение
было доказано для Н+-АТФ-синтазы. Поскольку
сам по себе синтез АТФ происходит без затрат
энергии, то количество энергии, которое необхо-
димо для образования АТФ из АДФ и фосфата,
потребляется каким-то другим способом, напри-
мер, для удаления прочно связанной новооб-
разованной молекулы АТФ из каталитического
центра. Это может происходить путем энергоза-
висимого изменения конформации белка.
АДФ+Ф
Фермент
АТФ
^^AG~0 ?
(АДФ+ ф)
Фермент
AG-0
( АТФ )
Фермент
Фермент
Рис. 4.10. В отсутствие Н2О синтез АТФ может
происходить без затрат энергии. В этом случае
энергия, необходимая для синтеза АТФ в водном
растворе, расходуется на связывание АДФ и фосфата
и/или на высвобождение вновь образованной
АТФ. По последним данным, реализуется вторая
возможность
118
4. В процессе фотосинтеза образуется АТФ
В 1977 г. Пол Бойер (США) выдвинул гипо-
тезу о том, что три идентичных сайта связы-
вания в белке Ft последовательно изменяют
свои связывающие свойства (рис. 4.П). Один
из сайтов связывания находится в L форме, т.е.
непрочно связывает АДФ и фосфат и не про-
являет каталитической активности (loose —
свободный). Второй сайт, Т, прочно связывает
АДФ и АТФ и проявляет каталитическую актив-
ность (tight — плотно закрытый). Третий сайт,
О, открыт, связывает АДФ и АТФ непрочно
и каталитически неактивен (open — открытый).
В соответствии с ротационной гипотезой, син-
тез АТФ происходит циклически. Сначала АДФ
и фосфат непрочно связываются с L-сайтом.
Конформационные изменения в Fj белке пре-
вращают свободный L-сайт в закрытый Т-сайт,
в котором АТФ синтезируется из АДФ и фос-
фата в безводном окружении. Молекула АТФ,
которая при этом образуется, прочно связана с
белком. Еще один конформационный поворот
превращает закрытый сайт в открытый (О), и
синтезированная молекула АТФ освобождается
в окружающую среду. Основное положение ги-
потезы заключалось в том, что с конформацион-
ным изменением в белке Fj, которое происходит
за счет энергии протонного градиента, конфор-
мация трех сайтов меняется одновременно на
следующую по схеме
(L-э Т, Т-э О, О-э L).
Результаты рентгеноструктурного анализа,
приведенные выше, подтверждают ротацион-
ную гипотезу. Четко видно три субъединицы F]i
одна свободна, вторая загружена АДФ, третья —
негидролизуемым аналогом АТФ — АМФ-PNP.
Эти субъединицы находятся в разных конфор-
мационных состояниях. Пол Бойер и Джон Уо-
кер получили Нобелевскую премию в 1997 г.
Дальнейшие исследования показали, что
центральная субъединица у вращается. Субъе-
диницы у и с белка Fj вместе с двенадцатью
субъединицами с комплекса Fo образуют ротор
(выделен цветом на рис. 4.7). В статоре, образо-
ванном субъединицами (оф)3, 5, а, b и Ь*, ротор
вращается, и при этом изменяется конформа-
ция каждого из каталитических центров, пока-
занных на рис. 4.П. Скорость вращения F-АТФ-
синтазы в хлоропластах оценивается примерно
в 160 оборотов в секунду. Все еще не до конца
ясно, каким образом транспорт протонов запу-
скает вращение ротора. Данные недавнего ана-
лиза структуры фермента указывают на то, что
вращение является результатом взаимодействия
между субъединицей а, которая является ча-
стью статора, и субъединицей с, относящейся
к ротору. В соответствии с предварительной мо-
делью, в составе субъединицы а есть протонный
канал, который открыт со стороны люмена, но
перекрыт в середине мембраны. Предполагают,
что через протонный канал протоны из люме-
Рис. 4.11. Синтез АТФ по механизму изменения конформации сайтов связывания,
предложенному Бойером. Главной особенностью предложенного механизма
является то, что синтез АТФ происходит в F! комплексе с тремя сайтами связывания
нуклеотидов, которые находятся в трех различных состояниях: сайт в конформации
L непрочно связывает АДФ и Ф, сайт в конформации Т прочно связывает АДФ и Ф
и катализирует образование АТФ; образовавшаяся молекула АТФ также прочно
связана. В открытой конформации (О) образовавшаяся молекула АТФ выходит
из сайта. Ток протонов через F-АТФ-синтазу, возникающий под действием протон-
движущей силы, приводит к согласованному конформационному изменению трёх
сайтов связывания в процессе вращения
4.4. Синтез АТФ происходит за счет изменения конформации белка
119
на тилакоидов достигают сайта связывания,
расположенного на субъединице с (возможно,
карбоксильной группы остатка аспарагиновой
кислоты). Поворот ротора на один шаг пододви-
гает сайт связывания с протоном к протонному
каналу, который открывается с другой сторо-
ны, выпуская протон на стромальную сторону.
В соответствии с этой моделью перенос про-
тонов из люмена в строму вызывает прогрес-
сивное вращение ротора на один шаг (на одну
с-субъединицу). Протонный градиент между
люменом и стромой обеспечивает необрати-
мость вращения.
Как было упомянуто выше, у некоторых бак-
терий была обнаружена F-АТФ-синтаза, ко-
торая использует для вращения Na+ градиент.
Модель ротора, работающего на протонном гра-
диенте, рассмотренная выше, объясняет работу
этого фермента, если допустить, что субъединица
с в №+-АТФ-синтазе связывает ионы Na+, а две
половины канала проницаемы для Na+.
Еще не до конца ясно, сколько с-субъединиц
входит в состав ротора. К настоящему момен-
ту количество с-субъединиц в одной F-АТФ-
синтазе оценивают как 12 —14 в хлоропластах,
Ю — в митохондриях, 12 — у Е. coli. Однако эти
данные не окончательные. Изучение Е. coli пока-
зало, что число с-субъединиц на один ротор мо-
жет варьировать в зависимости от метаболизма
даже у одного организма. В связи с этим общие
заключения о количестве субъединиц следует де-
лать с осторожностью.
В фотосинтетической электрон-
транспортной цепи стехиометрия
синтезированных НАДФН/АТФ все еще
является предметом дискуссий
В соответствии с моделью, которая обсуждалась
выше, в роторе F-АТФ-синтазы хлоропластов
12—14 с-субъединиц, значит, полный оборот
требует переноса 12—14 протонов. Поскольку
при полном обороте образуются 3 молекулы
АТФ, получаем стехиометрию Н+/АТФ = 4,7.
Независимые измерения показали, что в хло-
ропластах для синтеза одной молекулы АТФ
необходим перенос, по крайней мере, 4 про-
тонов, что вполне согласуется со стехиометри-
ей роторной модели. Не совсем ясно, какой
вклад вносит Q-цикл в транспорт протонов.
При нециклическом электронном транспорте
на каждую молекулу НАДФН через мембра-
ну без участия Q-цикла переносится 4 протона
(ФС II: 2Н+, Цит-/?6//'-комплекс: 2Н+), а с уча-
стием Q-цикла — 6 протонов (Цит-^//1 комп-
лекс: 4Н+) (раздел 3.7). При стехиометрии
Н+/АТФ = 4,7 в нециклическом транспор-
те с функционирующим Q-циклом на каж-
дую молекулу НАДФН будет синтезироваться
1,3 АТФ, а в отсутствие Q-цикла — всего 0,9.
Если эти стехиометрические соотношения со-
блюдаются, нециклического фотофосфорили-
рования не будет достаточно для удовлетворе-
ния нужд ассимиляции СО2 в цикле Кальвина
(АТФ/НАДФН = 1,5 — см. главу 6) и цикличе-
ское фотофосфорилирование (раздел 3.8) также
будет необходимо. Окончательный ответ на во-
прос о стехиометрии фотофосфорилирования
до сих пор не найден. Скорее всего, в живой
клетке стехиометрия очень изменчива и нахо-
дится под регуляторным контролем.
Н+-АГФ-синтаза хлоропластов
регулируется светом
Н+-АТФ -синтаза катализирует реакцию, ко-
торая в принципе обратима. В хлоропластах
градиент pH на тилакоидной мембране гене-
рируется только на свету. В темноте, поскольку
синтез АТФ обратим, можно было бы ожидать,
что АТФ-синтаза начнет катализировать обрат-
ную реакцию с переносом протонов в люмен и
затратой АТФ. Чтобы избежать такого неэконо-
мичного обращения химической реакции, ак-
тивность АТФ-синтазы находится под жестким
контролем. Есть два основных регуляторных
механизма. Если градиент pH на тилакоидной
мембране снижается до некоторого порогово-
го уровня, каталитические сайты р-субъединиц
мгновенно выключаются. Они включаются сно-
ва в тот момент, когда градиент pH восстанавли-
вается на свету. Механизм этого процесса еще не
до конца изучен. Кроме того, АТФ-синтаза хло-
ропластов регулируется путем тиольной модуля-
ции (раздел 6.6). При этом дисульфидная связь
у-субъединицы F] восстанавливается на свету
ферредоксином до двух SH-групп. Восстановле-
ние происходит опосредованно через тиоредок-
син. Восстановление у-субъединицы активирует
каталитические центры р-субъединиц. Таким
образом свет включает F-АТФ-синтазу. В тем-
ноте две SH-группы окисляются кислородом
120
4. В процессе фотосинтеза образуется АТФ
воздуха до дисульфида, вследствие чего катали-
тические центры р-субъединиц оказываются вы-
ключенными. Одновременное действие двух ре-
гуляторных механизмов позволяет эффективно
контролировать активность АТФ-синтазы в хло-
ропластах.
V-АТФаза родственна F-АТФ-синтазе
Помимо F-АТФаз, в растительной клетке на
мембранах существует еще ряд АТФаз, кото-
рые не могут синтезировать АТФ. Эти АТФазы
за счет энергии гидролиза АТФ могут создавать
протонный градиент. Примером может служить
V-АТФаза тонопласта.
V-АТФаза — консервативна у всех эукариот.
У растений V-АТФазы расположены не толь-
ко на тонопласте (вакуолярной мембране, в
честь которой они и были названы), но также
на плазмалемме, мембранах ЭПР и аппарата
Гольджи. У Arabidopsis thaliana были иденти-
фицированы гены как минимум 12 различных
субъединиц этого фермента. Основные функ-
ции этой АТФазы — закисление вакуоли и ге-
нерация на мембранах протонных градиентов,
которые могли бы служить движущей силой для
транспорта ионов. V-АТФаза также участвует
в закрывании устьиц. По структуре V-АТФаза
сходна с F-АТФ-синтазой, но устроена несколь-
ко сложнее. Она состоит из нескольких белков,
погруженных в мембрану (аналогично Fo части
F-АТФ-синтазы), к которым с помощью нож-
ки крепится сферическая часть, выдающаяся в
цитозоль (аналогично Fj)1. Сферическая часть
состоит из трех А- и трех В-субъединиц, кото-
рые чередуются подобно (оф)-субъединицам
F-АТФ-синтазы. F-АТФ-синтаза и V-АТФаза1 2
эволюционировали от общей предковой фор-
мы. V-АТФаза переносит два протона на каж-
дую гидролизованную молекулу АТФ и может
генерировать протонный градиент, который из-
меряют экспериментально (концентрация Н+ в
вакуолях составляет 1,4 моль/л, см. раздел 8.5).
Вакуолярные мембраны также содержат фер-
мент Н+-пирофосфатазу, которая за счет гидро-
1 По аналогии части V-АТФазы обозначают как Vo и V,. —
Прим. ред.
2 Вопрос о происхождении F- и V-АТФаз является дис-
куссионным. V-АТФаза растений отличается от F-АТФазы
многочисленными аминокислотными заменами. F-АТФаза
типична для бактерий. — Прим. ред.
лиза одной молекулы пирофосфата до фосфата
переносит в вакуоль один протон, но не гене-
рирует такой высокий градиент, как V-АТФаза.
Н+-пирофосфатаза, предположительно, состоит
из единственного белка с 16 трансмембранными
спиралями. Вклад каждой из транспортных си-
стем в суммарный перенос протонов в вакуоль
еще не выяснен. Остается загадкой, зачем нужны
два фермента, транспортирующих протоны че-
рез тонопласт. Плазмалемма содержит еще одну
Н+-АТФазу, переносящую протоны Р-АТФазу,
которая будет рассмотрена в разделе 8.2.
Дополнительная литература
Abrahams, J. Р., Leslie, A. G. W., Latter, R., Walker, J. Е.
Structure at 2.8 E resolution of F|-ATPase from bovine
heart mitochondria. Nature 370, 621—628 (1994).
Boekema, E. J., van Heel, M., Graber, P. Structure of
the ATP synthase from chloroplasts studied by electron
microscopy and image processing. Biochim Biophys
Acta 933,365-371 (1988).
Boyer, P. D. The binding change mechanism for ATP
synthase—Some probabilities and possibilities. Biochim
Biophys Acta 1149, 215-250 (1993).
Dimroth, P. Wirkung des Fo-Motors der ATP-Synthase.
Biospektrum 5, 374—380 (1999).
Drozdowicz, Y. M., Rea, P. A. Vacuolar H+
pyrophosphatases: from the evolutionary backwaters into
the mainstream. Trends Plant Sci 6, 206—211 (2001).
Junge, W., Panke, O, Chrepanov, A, Gumbiowski, K,
Engelbrecht, S. Intersubunit rotation and elastic power
transmission in F0F]-ATPase. FEBS Lett 504, 152—160
(2001).
Kramer, D. M., Cruz, J. A., Kanazawa, A. Balancing the
central roles of the thylakoid proton gradient. Trends
Plant Sci 8, 27-32 (2003).
Leigh, R. A., Gordon-Weeks. R., Steele, S. H.,
Korenkov, V. D. The H+- pumping inorganic
pyrophosphatase of the vacuolar membrane of higher
plants. In Blatt, M. R., Leigh, R. A., Sanders, D. (eds.).
Membranes for Experimental Biology, Cambridge
University Press, Cambridge, pp. 61—74 (1994).
Luttge, U., Ratajczak, R. The physiology, biochemistry
and molecular biology of the plant vacuolar ATPase.
In R. A. Leigh, D. Sanders (eds.). The Plant Vacuole,
Advances in Botanical Research 25, Academic Press,
New York, pp. 253-296 (1997).
Noji, H., Yasuda, R., Yoshida, M., Kinosita Jr., K. Direct
observation of the rotation of F|-ATPase. Nature 386,
299-302(1997).
Дополнительная литература
121
Rastogi, V. К., Girvin, М. Е. Structural changes linked to
proton translocation by subunit c of the ATP synthase.
Nature 402, 263-268 (1999).
Sambongi, Y., Iko, Y., Tanabe, M., Omote, H., Iwamoto-
Kihara, A., Ueda, I., Yanagida, T.,Wada, Y, Futai, M.
Mechanical rotation of the c subunit oligomer in ATP
synthase (FoF^: Direct observation. Science 286, 1722—
1724(1999).
Seelert, H., Poetsch, A., Dencher, N. A., Engel, A., Stahl-
berg, H., Muller, D. J. Proton-powered turbine of a plant
motor. Nature 405,418-419 (2000).
Stock, D., Leslie, A. G.W.,Walker, J. E. Molecular
architecture of the rotary motor in ATP synthase.
Science 286, 1700-1705(1999).
Sze, H., Schumacher, K., Mueller, M. L., Padmanaban, S.,
Taiz, L. A simple nomenclature for a complex proton pump:
VHA genes encode the vacuolar H+-ATPase. Trends Plant
Sci 7, 157-161 (2002).
Митохондрии — энергетические станции клетки
В процессе биологического окисления суб-
страты, такие как углеводы, постепенно
разлагаются с образованием воды и СО2. Био-
логическое окисление можно рассматривать
как обращение процесса фотосинтеза. Эво-
люционно этот процесс окончательно сфор-
мировался только после того, как в результате
фотосинтеза в атмосфере накопился кислород1.
И биологическое окисление, и фотосинтез слу-
жат для генерации энергии в форме АТФ. Био-
логическое окисление включает транспорт
электронов по митохондриальной электрон-
транспортной цепи, которая частично сходна
с фотосинтетической электрон-транспортной
цепью, рассмотренной в главе 3. В данной гла-
ве мы покажем, что аппарат митохондриаль-
ного электронного транспорта также имеет
модульную организацию. Из трех комплексов,
входящих в состав электрон-транспортной
цепи, центральный имеет структуру, сходную с
цитохром-£6//'-комплексом хлоропластов. Как
и при фотосинтезе, электронный транспорт в
дыхательной цепи и синтез АТФ сопряжены че-
рез образование протонного градиента. Синтез
АТФ осуществляется с участием F-АТФ-син-
тазы, похожей по структуре на АТФ-синтазу
хлоропластов, которая была описана в главе 4.
5.1. Биологическое окисление
происходит за счет разложения
субстратов с образованием
водорода и СО2
Суммарная реакция биологического окисления
эквивалентна реакции горения. Но, в отличие
1 Такое представление слишком упрощенно и схематично.
На самом деле процессы окисления происходили до возник-
новения оксигенного фотосинтеза. Выделение кислорода
в атмосферу позволило использовать О2 в окислительно-
восстановительных реакциях, резко повысив их энергетиче-
ский выход. — Прим. ред.
от горения, биологическое окисление проис-
ходит в последовательных частичных реакциях,
которые позволяют запасать большую часть вы-
свобождаемой энергии для синтеза АТФ.
Принципиальная схема биологического окис-
ления была сформулирована в 1932 году лауреа-
том Нобелевской премии Генрихом Виландом
хн2 + у2о2 —> х + н2о
Сначала от субстрата ХН2 отнимается водо-
род, который затем окисляется до воды. Таким
образом, в процессе окисления углеводы [СН2О]П
сначала расщепляются в реакции с водой с об-
разованием СО2 и связанного водорода [Н], а
последний в дальнейшем окисляется до воды:
[СН2О] + Н2О----> СО2 + 4[Н]
4[Н] + О2---> 2Н2О
В 1934 году Отто Варбург (лауреат Нобелев-
ской премии по медицине 1931 г.) показал, что
перенос водорода от субстрата к месту окисле-
ния происходит в форме «связанного водорода»
в молекуле НАДН. На основании эксперимен-
тов с гомогенатом летательной мышцы голубя в
1937 г. Ганс Кребс открыл цикл трикарбоновых
кислот (также называемый циклом Кребса)
как механизм расщепления субстрата, произ-
водящий восстановительные эквиваленты для
восстановления кислорода в процессе биологи-
ческого окисления. В 1935 г. он был награжден
Нобелевской премией по медицине за это от-
крытие. Функционирование цикла трикарбо-
новых кислот (ЦТК) будет рассмотрено в раз-
деле 5.3.
5.2. В митохондриях локализовано
клеточное дыхание
Исследования многих типов клеток с помощью
светового микроскопа показали, что клетки со-
5.2. В митохондриях локализовано клеточное дыхание
123
держат небольшие органеллы, внешне похожие
на бактерий. В начале прошлого века ботаник
К. Бенда назвал эти органеллы митохондриями,
что значит «нитевидные тельца». Однако долгое
время функции митохондрий оставались неизу-
ченными.
Но уже в 1913 г. Отто Варбург понял, что кле-
точное дыхание — одна из функций этих органелл
клетки. Он успешно выделил из дрожжей белок,
который назвал «дыхательным ферментом». Этот
фермент катализировал окисление субстрата
кислородом. Варбург также показал, что в этом
катализе участвуют атомы железа. В 1925 г. Дэвид
Кейлин из Кэмбрижда (Великобритания) открыл
цитохромы и показал их участие в клеточном ды-
хании. Используя спектроскоп с ручным управ-
лением, он идентифицировал цитохромы а, а3, b
и с (см. рис. 3.24).
В 1928 г. Отто Варбург показал, что в со-
став его «дыхательного фермента» входит
цитохром-а3. Следующим важным событием
для выяснения механизма клеточного дыха-
ния было открытие Германа Калкара, кото-
рый в 1937 г. обнаружил, что образование АТФ
в аэробных системах зависит от потребления
кислорода. Взаимосвязь клеточного дыхания
и синтеза АТФ в процессе окислительного
фосфорилирования теперь стала очевидной.
В 1948 г. Юджин Кеннеди и Альберт Ленинджер
показали, что митохондрии содержат ферменты
цикла трикарбоновых кислот и окислительного
фосфорилирования. Это открытие указывало
на роль митохондрий в клетке: они выполняют
функции «энергетических станций».
Митохондрии образуют
отдельный метаболический компартмент
Как и пластиды, митохондрии являются органел-
лами с отдельным внутренним метаболическим
компартментом. Структура митохондрий обсуж-
далась в разделе 1.4. На рисунке 5.1 представле-
на общая схема энергетического окислительного
метаболизма митохондрий. Расщепление суб-
стратов до СО2 и водорода (который связывается
с НАДН) происходит в матриксе митохондрий.
Образовавшийся в цикле Кребса НАДН диф-
фундирует к внутренней мембране митохондрий
и там окисляется в дыхательной цепи. В дыха-
тельной цепи происходит ряд последовательных
окислительно-восстановительных реакций, в
результате которых электроны передаются от
НАДН на кислород. Как и при фотосинтетиче-
Рис- 5-1 - Схема энергетического метаболизма митохондрий
124
5. Митохондрии — энергетические станции клетки
ском электронном транспорте, высвобождаемая
энергия используется для генерации протонно-
го градиента, который, в свою очередь, является
движущей силой для синтеза АТФ. АТФ, образу-
ющаяся в результате работы цепи, выносится из
митохондрий и используется для нужд клеточно-
го метаболизма. Энергетическая функция мито-
хондрий универсальна для всех эукариотических
клеток.
5.3. Расщепление субстрата для
биологического окисления
происходит в матриксе
Пируват (пировиноградная кислота, ПВК), ко-
торый образуется в процессе гликолитического
катаболизма углеводов в цитозоле, является тем
первичным субстратом, который подвергается
дальнейшему расщеплению в ЦТК (рис. 5;2).
СООе
I
с=о
I
СН3
соое
I
СН3
2 н2О + н®
2 СО2
Пируват Ацетат
Рис. 5.2. Суммарная реакция окисления пирувата митохондриями. Ацетат образуется в
форме ацетил-кофермента А. [Н] обозначает связанный водород в форме НАДН и ФАДН2
Малат
Пируват
Г лутамат
Малат
НАД-малик-
энзим
МАТРИКС МИТОХОНДРИИ
Пируват
НАД©
НАДН + Н©
Глутамат
НАД© НАДН + Н©
+ со2
KoA-SH
Пируват-
дегидрогеназа
дегидрогеназа
I дегидрогеназа л
Оксалоацетат
НАДН + Н©
НАД©
---► Малат
Фумараза
ФАД
Сукцинат-
дегидрогеназа
Фумарат
ФАДН,
СО
Ацетил-КоА KoA-SH
Цитрат
Цитрат-
синтаза
Сукцинат
+ NH®
4
а-Кетоглутарат
Аконитаза
СО
Изоцитрат
НАД© Изоцитрат- I
НАДН + Н© । дегидрогеназа I
а-Кетоглутарат
KoA-SH НАД©
СО2НАДН + Н®
дегидрогеназа
АТФ
АДФ + Ф
Сукцинил-КоА
рукцинаттио
киназа
Рис. 5.3. Цикл Кребса (ЦТК). Ферменты цикла локализованы в матриксе
митохондрий, за исключением сукцинатдегидрогеназы, которая расположена во
внутренней митохондриальной мембране. Особенностью растительных митохондрий
является наличие в их матриксе НАД-зависимого маликэнзима. Поэтому
растительные митохондрии могут окислять малат в цикле Кребса даже в отсутствие
пирувата. Глутаматде гидрогеназа позволяет им также окислять глутамат
5.3. Расщепление субстрата для биологического окисления происходит в матриксе
125
Сначала пируват окисляется до ацетата (в фор-
ме ацетил-кофермента А), который затем пол-
ностью расщепляется до СО2 в ЦТК с образова-
нием Ю восстановительных эквивалентов [Н],
которые затем будут окисляться в дыхательной
цепи для синтеза АТФ. На рисунке 5.3 показа-
ны реакции ЦТК.
Пируват окисляется
мультиферментным комплексом
Окисление пирувата катализирует пируват-
дегидрогеназный комплекс (ПДК), мультифер-
ментный комплекс, расположенный в матрик-
се митохондрий. Он состоит из трех различных
катал итичес ких субъед и ниц: пируватдегидро-
геназы, дигидролипоилтрансацетилазы и
дигидролипоилдегидрогеназы (рис. 5.4). Пи-
Рис. 5.4.
Окисление пирувата
пируватдегидрогеназным
комплексом, состоящим
из субъединиц:
пируватдегидрогеназы
(простетическая
группа —
тиаминпирософосфат),
дигидролипоилтранс-
ацетилазы
(простетическая
группа — липоевая
кислота)
и дигидролипоилдегидро-
геназы (простетическая
группа — ФАД). Реакции
цикла описаны в тексте
°\ I®
/ Q У?
I Резонанс । H®N—С- Тиаминпирофосфат
126
5. Митохондрии — энергетические станции клетки
а Тиаминпирофосфат
Тиазольное кольцо
Рис. 5.5. Группы, участвующие
в окислении пирувата:
a — тиаминпирофосфат;
б— амид липоевой кислоты;
в — кофермент А
Карбоанион
б
I гл Липоевая кислота
NH U
I ^СН2\ /СН2\ /СН2\ /СН2\
н—с—СН2 СН2 IM СН2 СН2 CH —S
I н /
q=C Лизин Н2С\
I CH2-S
Белковая цепь
В Кофермент А
О О н сн3
II II I I
HS— СН2— СН2— N— с— СН2— сн2— N— С— С— С—
Н Н I I
но сн3
руват дегидрогеназа содержит в качестве про-
стетической группы тиаминпирофосфат (ТРР,
рис. 5.5a) Активным участком молекулы ТРР
является тиазольное кольцо. Благодаря присут-
ствию положительно заряженного атома азота
тиазольное кольцо содержит С-атом, придаю-
щий гетероциклу свойства кислоты. После дис-
социации протона образуется карбоанион, кото-
рый способен связывать карбонильную группу
пирувата. Положительно заряженный N-атом
тиазольного кольца облегчает декарбоксилиро-
вание пирувата с образованием гидроксиэтил-
ТРР (см. рис. 5.4). Гидроксиэтильная группа за-
тем передается на липоевую кислоту.
Липоевая кислота является простетиче-
ской группой дигидролипоилтрансацетилазы.
Карбоксильная группа липоевой кислоты кова-
лентно связана с остатком лизина ферментного
белка через амидную связь (рис. 5.56). Остаток
липоевой кислоты фактически связан с белком
длинной цепью и поэтому может реагировать с
различными сайтами мультиферментного ком-
плекса. Липоевая кислота содержит два атома
серы, связанных дисульфидной связью. Когда
гидроксиэтиловый остаток передается на оста-
ток липоевой кислоты, она восстанавливается
до дигидролипоевой кислоты, а гидроксиэтиль-
ный осаток окисляется до ацетильного остатка.
Последний присоединяется к дигидролипоевой
кислоте через тиоэфирную связь. Таким обра-
зом, энергия, высвобожденная при окислении
карбонильной группы, запасается в богатой
энергией тиоэфирной связи. После этого аце-
тильный остаток передается дигидролипоил-
трансацетилазой на сульфгидрильную группу
кофермента А (рис. 5.56) с образованием ацетил
кофермента А. Ацетил-КоА — его еще называ-
ют активной уксусной кислотой — был открыт
5.3. Расщепление субстрата для биологического окисления происходит в матриксе
127
Ацетил-КоА
Цитратсинтаза
СК S-KoA
Р'
н-с-н
Н
О\ .S-KoA
I
н н-с-н
Н2О KoA-SH q. о + н
" с
Резонанс
н с н
о=с-соо°
I
сн2
соое
ео-с-соое
I
сн2
соое
НО-С-СОСУ
сн2
соое
Оксалоацетат Цитрат
Рис. 5.6. Конденсация ацетил-КоА с оксалоацетатом с образованием цитрата
Теодором Линеном из Мюнхена (Нобелевская
премия по медицине 1984 г.). Дигидролипоевая
кислота окисляется обратно в липоевую кисло-
ту с помощью дигидролипоилдегидрогеназы.
При этом НАД+ восстанавливается до НАДН
через ФАД (рис. 5.16). Заметим, что пируват был
найден также в хлоропластах, но его функции в
метаболизме липидов будут обсуждаться в раз-
деле 15.3.
Ацетат полностью окисляется в цикле
трикарбоновых кислот
Ацетил-кофермент А входит в цикл Кребса
и реагирует с оксалоацетатом с образованием
цитрата (рис. 5.6). Эта реакция катализирует-
ся ферментом цитратсинтазой. Тиоэфирная
группа отнимает протон у ацетильного остатка,
и образующийся при этом карбоанион связы-
вается с углеродом карбонильной группы окса-
лоацетата. Последующее освобождение KoA-SH
делает реакцию необратимой. Фермент акони-
таза (рис. 5.7) катализирует обратимую изо-
меризацию цитрата до изоцитрата. В этой
реакции выделяется первая молекула воды, а
^wc-аконитат остается связанным с ферментом
и преобразуется в изоцитрат при участии воды.
Кроме митохондриальной аконитазы, есть так-
же изоферментная форма аконитазы в цитозоле
растительной клетки.
Окисление изоцитрата до а-кето глутарата
НАД-изоцитратдегидрогеназой (рис. 5.8) при-
водит к образованию НАДН. Оксалосукцинат об-
разуется как промежуточный продукт, который,
будучипрочносвязаннымсферментом,декарбок-
силируется с образованием а-кетоглутарата (его
также называют 2-оксоглутарат). Это декарбок-
силирование делает окисление изоцитрата необ-
ратимым. Кроме НАД-изонитратдегидрогеназы
в митохондриях есть и НАДФ-зависимый фер-
мент. НАДФ-изоцитратдегидрогеназа присут-
ствует также в строме хлоропластов и в цитозоле.
Функции этого фермента в этих компартментах
будут рассмотрены в разделе Ю.4.
Окисление а-кетоглутарата до сукцинил-КоА
(см. рис. 5.8) катализируется а-кетоглутарат-
дегидрогеназным мультиферментным ком-
Аконитаза
СОО0
I
н-с-н
но-с-соо0
I
н-с-н
I
соое
н2о
соо°
I
н-с-н
с-соо0
II
с-н
I
соо°
Н2О
соо°
I
н-с-н
н-с-соо0
I
но-с-н
соо°
Цитрат
цис-Аконитат
Изоцитрат
Рис. 5.7. Изомеризация цитрата до изоцитрата
128
5. Митохондрии — энергетические станции клетки
НАД-изоцитрат-
дегидрогеназа
а-Кетоглутарат-
дегидрогеназа
соое
I
СН2
н-с-соо0
I
НО-С-Н
I
соо0
НАД НАДН + Н
соо0
I
сн2
н-с-соо0
I
с=о
I
соое
COO0
I
СН2
СН2
с=о
I
СООе
KoA-SH
соо0
I
СН2
СН2
с=о
S-KoA
Изоцитрат
Оксалосукцинат
а-Кетоглутарат
Сукцинил-КоА
Рис. 5.8. Окисление изоцитрата с образованием сукцинил-КоА
плексом, в состав которого входят тиамин-
пирофосфат, липоевая кислота и ФАД, аналогично
рассмотренному выше комплексу, окисляющему
пируват до ацетил КоА.
Тиоэфирная связь сукцинил-КоА богата
энергией. В сукцинат-тиокиназной реакции
свободная энергия, высвобождаемая при ги-
дролизе этого тиоэфира, запасается в форме
АТФ (рис. 5.9). Следует отметить, что в мета-
болизме животных клеток в митохондриаль-
ной сукцинат-тиокиназной реакции образует-
ся ГТФ. Сукцинат, который образуется в этой
реакции, окисляется сукцинатдегидрогеназой
до фумарата. Сукцинатдегидрогеназа — един-
ственный фермент ЦТК, расположенный не в
матриксе, а на внутренней митохондриальной
мембране так, что сайт связывания сукцина-
та доступен со стороны матрикса (раздел 5.5).
Восстановительные эквиваленты, полученные
при окислении сукцината, передаются на уби-
хинон. В реакции, катализируемой фумаразой,
вода реагирует с двойной С=С связью фумарата
путем лиряяс-присоединения с образованием
L-малата. Эта реакция обратима (см. рис. 5.9).
Окисление малата малатдегидрогеназой, в
результате которого образуется оксалоацетат и
НАДН, является последней реакцией ЦТК (см.
рис. 5.9). Равновесие реакции сильно сдвинуто в
сторону образования малата.
[НАДН] • [оксалоацетат]
[НАд+] [Малат] = 2,8 • 10 (pH 7)
Сукцинат-
тиокиназа
Сукцинат-
дегидрогеназа
Малат-
дегидрогеназа
соо®
I
сн2
сн2
с=о
S-KoA
АДФ АТФ
+ Ф + KoA-SH
СОО®
I
сн2
сн2
соо®
ФДД фадн2
соо®
I
сн
II
НС
соо®
Фумараза
соо®
I
сн2
н-с-он
соо®
НАД1 НАДН+ Н‘
СОО®
I
сн2
с=о
соо®
Сукцинил-
КоА
Сукцинат
Фумарат
L-Малат
Оксалоацетат
Рис. 5.9. Превращение сукцинил-КоА в оксалоацетат
5.3. Расщепление субстрата для биологического окисления происходит в матриксе
129
Поскольку эта реакция равновесная, для
функционирования ЦТК особенно важно, что-
бы реакция цитратсинтазы была необратимой.
С помощью цитратсинтазной реакции окса-
лоацетат удаляется из равновесной системы
малатдегидрогеназы, и равновесие сдвигается
в сторону образования оксалоацетата. Изофер-
менты малатдегидрогеназы также есть вне мито-
хондрий. В цитозоле и в матриксе пероксисом
найдены НАД-малатдегидрогеназы, а в строме
хлоро пластов — Н АДФ-малатдегидрогеназа.
Эти ферменты будут рассмотрены в главе 7.
Отток интермедиатов цикла трикарбоновых
кислот возмещается
за счет анаплеротических реакций
ЦТК может функционировать только в том слу-
чае, если оксалоацетат, необходимый в качестве
акцептора для ацетильного остатка, полностью
регенерируется. В разделе Ю.4 описывается,
как цитрат и а-кетоглутарат выходят из ЦТК
для синтеза аминокислот в процессе ассими-
ляции нитрата. Таким образом, необходимо
восполнять недостаток интермедиатов цикла
за счет анаплеротических реакций (от греч.
anaplero — восполнять, доводить до полно-
го числа). В отличие от митохондрий клеток
животных, растительные митохондрии могут
транспортировать оксалоацетат с помощью
специального транслокатора на их внутрен-
ней мембране (раздел 5.8). Так что ЦТК может
поддерживаться за счет притока оксалоацетата,
который образуется фосфоенолпируваткарбок-
силазой в цитозоле (раздел 8.2)1. Оксалоацетат
может также получаться путем окисления мала-
та в митохондриях. Малат запасается и хранит-
ся в вакуоли (разделы 1.2, 8.2 и 8.5) и является
важным субстратом для митохондриального
дыхания. Особенностью растительных мито-
хондрий является их способность окислять ма-
лат до пирувата с восстановлением НАД и вы-
свобождением СО2. Эту реакцию катализирует
фермент НАД-маликэнзим, локализованный
в матриксе (рис. 5.10). Таким образом, актив-
1 На самом деле транспорт оксалоацетата из цитозоля име-
ет минорное значение. Гораздо большую роль играет посту-
пление малата через малат/фосфатный антипортер (малат
образуется в цитозоле при восстановлении оксалоацетата).
Есть также обмен оксалоацетата на малат или цитрат в экви-
толярных соотношениях, но этот транспортный процесс не
столь важен для поддержания ЦТК. — Прим. ред.
соо°
I
сн2
н-с-он
соо°
L-Малат
НАД-маликэнзим
СН3
с=о
соо°
Пируват
Рис. 5.10. Окислительное декарбоксилирование
малата с образованием пирувата
ность малатдегидрогеназы и НАД-маликэнзима
позволяет образовать цитрат из малата без
прохождения полного цикла (рис. 5.3). Сле-
дует отметить, что НАДФ-зависимый мали-
кэнзим есть также в хлоропластах, особенно у
С4-растений (раздел 8.4).
Еще один важный субстрат митохондриаль-
ного окисления — глутамат, который являет-
ся одним из основных продуктов ассимиляции
нитрата (раздел ЮЛ). Во многих растительных
клетках глутамат — второе органическое веще-
ство после сахарозы по концентрации в цито-
золе. Окисление глутамата, сопровождающееся
образованием НАДН, катализируется глутамат-
дегидрогеназой, расположенной в матриксе ми-
тохондрий (рис. 5.П). Существует изоформа это-
го фермента, которая также реагирует с НАДФ.
Активность НАДФ-глутаматдегидрогеназы так-
же обнаружена в пластидах, хотя функция фер-
мента в этом компартменте неясна.
Глицин — главный субстрат дыхания в мито-
хондриях клеток мезофилла в листьях на свету.
Окисление глицина является частью метаболи-
Г лутаматдегидрогеназа
L-Глутамат
Рис. 5.11. Окисление глутамата
СОО°
I
сн2
сн2
с=о
I
соо°
а-Кетоглутарат
130
5. Митохондрии — энергетические станции клетки
ческого пути фотодыхания, который мы рассмо-
трим в разделе 7.1.
5.4. Сколько энергии может быть
запасено в результате окисления
НАДН?
Сначала зададимся вопросом: сколько энергии
выделяется в процессе митохондриального ды-
хания или, точнее, насколько велика разность
свободных энергий субстратов и продуктов
окислительно-восстановительной реакции в
митохондриях? Чтобы ответить на этот вопрос,
надо знать разности редокс-потенциала в па-
рах, задействованных в процессе. Эта разность
потенциалов может быть рассчитана по уравне-
нию Нернста:
г r^RT У
Е= Е +— In
nF
[окисленное вещество]
[восстановленное вещество]
где ЕУ — стандартный потенциал при pH 7,
25 °C; R (универсальная газовая постоянная) =
= 8,31 Дж/(К моль); Т= 298 К; п — число пере-
данных электронов; F (константа Фарадея) =
= 96480 (Дж с)/(В моль).
Стандартный потенциал для редокс-пары
НАД+/НАДН составляет
= -0,32 В.
(5.1)
При определенных метаболических услови-
ях соотношение НАД+/НАДН в митохондриях
листа равно 3. Подставляя это значении в (5.1),
получаем
Д1АД+/НАДН = -0,320 1пЗ = -0,306 В
Стандартный потенциал для пары Н2О/О2
составляет
= +0,815 В ([Н2О] в воде составляет 55 М)
Парциальное давление кислорода в воздухе
можно подставить в уравнение в качестве актив-
ности для газообразного [О2].
Ен2о/о2 = 0,8! 5 + InVp О2 (5.2)
Парциальное давление кислорода в воздухе
(рО2) равно 0,2. Подставляя это значение в вы-
ражение (5.3), получаем
£н2о/о2 = 0,815 В (5.3)
Разность потенциалов составляет
= ^Н2О/О2_ ^НАД+/НАДН = 1 1 В
Свободная энергия (ДО связана с \Е следу-
ющим соотношением:
\G=-nFbE (5.4)
В этой реакции передаются два электрона.
Выражение для &Е из (5.5) демонстрирует, что
изменение свободной энергии при окислении
НАДН вдыхательной цепи равно
&G= —214 кДж/моль (5.5)
Сколько энергии требуется для образования
АТФ? В разделе 4.1 мы подсчитали, что синтез
АТФ в хлоропластах требует изменения свобод-
ной энергии AG « +50 кДж/моль. Эта величи-
на также относится к молекулам АТФ, которые
синтезируются в митохондриях для экспорта в
цитозоль.
Таким образом, свободная энергия, которая
выделяется при окислении НАДН, была бы до-
статочна для синтеза четырех молекул АТФ, но
на самом деле количество АТФ, который син-
тезируется при окислении НАДН, значительно
меньше (раздел 5.6).
5.5. Дыхательная цепь митохондрий
имеет много общего с
электрон-транспортной цепью
фотосинтеза
Фотосинтез цианобактерий привел к накопле-
нию кислорода в ранней атмосфере и, таким об-
разом, сформировал основу для окислительного
метаболизма митохондрий. Многие цианобак-
терии могут удовлетворять свою потребность в
АТФ как за счет фотосинтеза, так и за счет окис-
лительного метаболизма. Цианобактерии содер-
жат фотосинтетическую электрон-транспортрую
цепь, которая состоит из трех модулей (ком-
плексов), а именно: фотосистемы II, цит-7>6//-
комплекса и фотосистемы I (глава 3; рис. 5.12).
Эти комплексы расположены во внутренней
мембране цианобактерий — там же, где и фер-
менты дыхательной электрон-транспортной
цепи. Эта дыхательная цепь также состоит
из трех модулей: НАДН-дегидрогеназного
комплекса, в котором происходит окисление
НАДН, того же цит-Л6//'-комплекса, который
5.5. Дыхательная цепь митохондрий имеет много общего с ЭТЦ фотосинтеза
131
Свет
Свет
Н2О
1/2О2 + 2Н®
НАДН
НАД® + Н®
Рис. 5.12. Схема фотосинтетического и окислительного электронного транспорта
у цианобактерий. В обеих электрон-транспортных цепях цитохром-bjf-комплекс
функционирует как центральный комплекс переносчиков
является компонентом фотосинтетической цепи,
и цит-а/а3-комплекса, в котором происходит
восстановление кислорода до воды. Пластохи-
нон отдает электроны на цит-/?6//'-комплекс не
только при фотосинтезе (раздел 3.7), но и в ды-
хательной цепи цианобактерий. Аналогично,
цитохром-с обеспечивает передачу электрона от
um-bjf-комплекса как на фотосистему I, так и
на цит-я/я3-комплекс. Взаимосвязь фотосинте-
тического и окислительного электронного транс-
порта у цианобактерий вполне очевидна; обе
электрон-транспортные цепи имеют один и тот
же центральный модуль — цит-^/Лкомплекс.
В разделе 3.7 описано, как в цит-/?6//'-комплексе
энергия, выделяющаяся при переносе электро-
на, используется для создания протонного гра-
диента. Участие цит-£6//'-комплекса в дыхании
и фотосинтезе свидетельствует о том, что фото-
синтетический и окислительный электронный
транспорт построены по одному принципу.
Митохондриальная дыхательная цепь ана-
логична дыхательной цепи цианобактерий
(рис. 5.13), но вместо убихинонов в качестве
переносчика электронов функционирует пла-
стохиноны; имеются также незначительные
отличия в структуре цитохромов. Вместо цит-
НАДН
Н® + НАД®
Сукцинат Фумарат
1/2О2 + 2Н®
Н2О
Комлекс I Комплекс III
Комплекс IV
Рис. 5.13. Схема электронного транспорта в митохондриях. Дыхательная
цепь состоит из четырёх комплексов; центральный цитохром-6/cj-комплекс
соответствует цитохром-bjf-комплексу цианобактерий и хлоропластов
132
5. Митохондрии — энергетические станции клетки
£6/Лкомплекса в митохондриях функционирует
сходный с ним цит-£/С]-комплекс. И цит-с, и
цит-/содержат гем-с.
На рисунке 5.13 в качестве примера еше одно-
го участка в митохондриальной дыхательной
цепи приведена сукцинатдегидрогеназа. Этот
фермент (его историческое название — ком-
плекс II) катализирует окисление сукцината до
фумарата и передает электроны на пул убихино-
нов. Эта реакция является частью никла Кребса
(см. рис. 5.9).
Комплексы митохондриальной
дыхательной цепи
Подразделение дыхательной цепи на несколько
комплексов восходит к Ёссефу Хатефи, кото-
рый в 1962 г., работая с митохондриями сердца
быка, успешно выделил четыре различных ком-
плекса, которые и назвал комплексами I—IV.
Недавно было показано, что в митохондриях
растений комплексы I и III могут быть объеди-
нены в суперкомплекс. В комплексах I, III и IV
перенос электрона сопровождается снижением
редокс-потенциала (рис. 5.14); энергия, которая
выделяется при этом, используется для форми-
рования протонного градиента.
НАДН-дегидрогеназый комплекс (ком-
плекс I) (рис. 5.15) снабжает дыхательную цепь
электронами от НАДН, который образуется при
окислении субстратов в матриксе. Электроны
передаются на убихинон через флавинмоно-
нуклеотид (ФМН) и несколько железосерных
центров. Комплекс I имеет наиболее сложную
структуру из всех митохондриальных электрон-
транспортных комплексов. Он состоит из более
40 различных субъединиц (из них от 7 до 9, в
зависимости от организма, кодируются в мито-
хондриальном геноме). Одна часть комплекса
погружена в мембрану (мембранная часть), а
другая (периферическая) выступает в матрикс.
Периферическая часть содержит сайт связыва-
ния НАДН, связанный ФМН (рис. 5.16) и, по
меньшей мере, три Fe-S-центра (см. рис. 3.26).
Мембранная часть содержит еше один Fe-S-
центр, а также сайт связывания убихинона.
Транспорт электрона ингибируется рядом ядов
растительного и бактериального происхожде-
ния, таких, как ротенон (который защищает
Вольт
-0.4-
0-
0.4-
0.8-
НАДН
Н® 4- НАД®
Сукцинат
Фумарат
н2о
72О2 + 2Н®
Рис. 5.14. Схема комплексовдыхательной цепи, которые расположены
в соответствии с их редокс-потенциалом. Обозначения: НАДН-ДГ —
НАДН-дегидрогеназный комплекс, Сукц-ДГ — сукцинатдегидрогеназный комплекс
5.5. Дыхательная цепь митохондрий имеет много общего с ЭТЦ фотосинтеза
133
НАДН-
дегидрогеназный
комплекс
(Комплекс I)
Цит-Ь/сг
комплекс
(Комплекс III)
Цит-а/а3-
комплекс
(Комплекс IV)
2
Ингибиторы: Ротенон
Пиерицидин
Амитал
Антимицин А
Миксотиазол
KCN
СО
Рис. 5.15. Схема расположения комплексов I, III и IV дыхательной цепи во
внутренней мембране митохондрий
растения от поедания травоядными животны-
ми); антибиотик пиерицидин А и барбитурат
амитал. Электронный транспорт, который ка-
тализируется комплексом I, обратим: возможна
передача электронов от убихинона к НАД+ за
счет протон-движущей силы протонного гради-
ента. За счет подобного процесса в гомологич-
ном НАДН-дегидрогеназном комплексе пур-
пурные бактерии обеспечивают себя НАДН (см.
рис. 3.1).
Сукцинатдегидрогеназа (комплекс II) (см.
рис. 5.9) из растительных митохондрий состоит
из семи субъединиц. В качестве акцептора элек-
тронов она содержит флавинадениндинуклеотид
(ФАД, рис. 5.16); в качестве переносчиков элек-
тронов — несколько Fe-S-центров (рис. 3.26), а
также цитохром-Z?, функция которого неизвест-
на. Перенос электронов на убихинон с участием
сукцинатдегидрогеназы происходит без значи-
тельного снижения редокс-потенциала, поэтому
в процессе транспорта электрона с сукцината на
убихинон запасания энергии не происходит.
Убихинон, восстановленный НАДН-дегидро-
геназой или сукцинатдегидрогеназой, окисляет-
ся цит-Ь/сх-комплексом (комплексом III) (см.
рис. 5.15). В митохондриях этот комплекс состоит
из Н субъединиц, и только одна из них (цит-/?)
кодируется в геноме митохондрий. По структуре
и функциям цит-/?/С]-комплекс очень сходен с
цит-/?6//'-комплексом хлоропластов (раздел 3.7).
Электроны в этом комплексе передаются на
цит-с, который связан с наружной поверхностью
мембраны. Несколько антибиотиков, таких, как
антимицин А и миксотиазол, ингибируют элек-
тронный транспорт в цит-/?/С] комплексе.
После получения электрона восстановлен-
ный цит-с приобретает «отрицательный» за-
ряд и диффундирует вдоль положительно за-
ряженной поверхности внутренней мембраны
к цит-я/я3-комплексу (см. рис. 5.15), который
также называют комплексом IV, или цитох-
’ Число субъединиц всех комплексов ЭТЦ может варьиро-
вать у различных организмов. — Прим. ред.
134
5. Митохондрии — энергетические станции клетки
R
Окисленный флавин
R
Семихинонная форма
Восстановленный флавин
R: | Флавин-
СН2 мононуклеотид
н-с-он <ФМН>
I
н-с-он
I
н-с-он о
1 11 А
н-с—о—р—ое
R: | Флавин-
СН2 адениндинуклеотид
н-с-он (фАД)
I
н-с-он
Н-С—О—Р—О—P-О—Рибоза-аденин
I L ।
н ое ое
Рис. 5.16. ФМН и ФАД, окисленные и восстановленные формы
Гем-а
Цитохром-а
His Cys Met
Glu Cys His
Рис. 5.17. В медь-серном кластере
цитохром-я/я3-комплекса, который обозначают
как CuA, Си2+ и Си+ ионы соединены двумя
цистеиновыми остатками белковой молекулы,
а также связаны с белком через два гистидина, один
глутамат и один метионин. СиА, предположительно,
переносит один электрон. Структура этого
редокс-кластера была установлена с помощью
рентгеноструктурного анализа цитохром-а/аъ-комп-
лекса, который был одновременно произведен во
Франкфурте (Германия; Iwata et al., 1995) и в Осаке
(Япония; Tsukihara et al., 1995)
Гем-а
Fe
Цитохром-а3
Рис. 5.18. Осевые лиганды атомов железа
в гемовых группах цитохромов -а и -ау. Из шести
координационных связей, которые образует атом
Fe в центре гема, четыре заняты N-атомами,
которые входят в состав плоского тетрапиррольного
кольца. В то время как в цитохроме-я две
оставшиеся координационные связи Fe-атома
оказываются занятыми гистидиновыми группами
белка, расположенными с обеих сторон от
тетрапиррольного кольца, в цитохроме-я3 одна из
связей свободна и работает как сайт связывания
молекулы О2. Обозначения: Prot — белковая цепь
5.6. Транспорт электронов в дыхательной цепи сопряжен с синтезом АТФ через транспорт протонов 135
ромоксидазой. Этот комплекс состоит из 13
различных субъединиц1, три из которых ко-
дирует митохондриальный геном. Недавно
трехмерная структура комплекса была изуче-
на с помощью рентгеноструктурного анали-
за комплексов из митохондрий сердца быка и
Paracoccus denitrifleans. Комплекс имеет боль-
шой гидрофильный участок, который выступа-
ет в межмембранное пространство и содержит
сайт связывания цит-с. При окислении цит-с
электроны передаются на медь-серный кла-
стер, содержащий два атома Си, который обо-
значают СиА. Эти два атома Си связаны двумя
S-атомами боковых цепей цистеина (рис. 5.17).
Медь-серный кластер, предположительно, за-
бирает один электрон и передает его на цит-я
биядерного центра, состоящего из цит-я3
и атома Си (Сив), связанного с гистидином.
Биядерный центр функционирует как единая
редокс-единица, в которой атом Fe гема цит-я3
вместе с Сив, переносят два электрона.
[Fe3+ • CuB+] + 2е -> [Fe2+ • CuB]
В отличие от цит-я и других цитохромов
дыхательной цепи, в геме цит-я3 шесть коор-
динационных связей Fe-атома не насыщены
аминокислотными остатками белка (рис. 5.18).
Свободные координационные связи, как и Сив,
являются сайтами связывания молекулы кис-
лорода, которая четырьмя последовательно по-
Рис. 5.19. Регистрация потребления кислорода
выделенными митохондриями. Фосфат и
малат последовательно добавляют к суспензии
митохондрий в буфере с осмотиком.
При добавлении АДФ скорость дыхания
повышается. Последующее снижение потребления
кислорода означает, что весь добавленный АДФ
превратился в АТФ. После добавления разобщителя
высокая скорость дыхания достигается без
добавления АДФ: теперь дыхание разобщено с
синтезом АТФ
лученными электронами восстанавливается до
воды:
О2 + 4е” -> 2СУ + 4Н+ -> 2Н2О
Скорее всего, Сив играет важную роль в пе-
реносе протонов, который будет обсуждаться в
следующем разделе. Вместо О2 со свободными
координационными связями цит-я3 могут очень
прочно связываться СО или CN-, что приводит
к ингибированию дыхания. Поэтому угарный
газ и синильная кислота (HCN) являются силь-
нейшими ядами.
5.6. Транспорт электронов
в дыхательной цепи сопряжен
с синтезом АТФ через транспорт
протонов
Электронный транспорт в дыхательной цепи со-
пряжен с образованием АТФ. Эту связь иллю-
стрирует эксперимент, показанный на рис. 5.19,
в котором скорость дыхания в суспензии мито-
хондрий определяли по снижению концентрации
кислорода в среде. Добавление субстрата (напри-
мер, малата) вызывало незначительное усиление
дыхания. Последующее добавление ограничен-
ного количества АДФ приводило к значитель-
ному усилению дыхания. Через некоторое время
136
5. Митохондрии — энергетические станции клетки
скорость дыхания снижалась до уровня, который
был до добавления АДФ, потому что весь добав-
ленный АДФ превратился в АТФ. Дыхание в при-
сутствии АДФ называют активным дыханием,
дыхание после того, как АДФ израсходован, на-
зывают контролируемым дыханием. Посколь-
ку весь добавленный в суспензию АДФ превра-
щается в АТФ, количество АТФ, образованного
при окислении определенного субстрата, может
быть определено по отношению добавленного
АДФ к потребленному кислороду (АДФ/О). Для
субстратов, при окислении которых образуется
НАДН (например, для малата), этот показатель
имеет величину, близкую к 2,5, а для сукцината,
от которого электроны передаются непосред-
ственно на убихинон — 1,6. Проблема стехиоме-
трии АТФ в процессе дыхания будет рассмотрена
в конце раздела.
Как и фотосинтетический электронный транс-
порт (глава 4), электронный транспорт в дыхатель-
ной цепи сопровождается образованием протон-
движущей силы (см. рис. 5.15), которая, в свою
очередь, обеспечивает синтез АТФ (рис. 5.20). По-
этому такие вещества, как FCCP (рис. 4.2), дей-
ствуют как разобщители и в фотосинтетическом,
и в окислительном (дыхательном) электронном
транспорте. На рисунке 5.19 показано, что до-
бавление разобщителя FCCP приводит к сильной
стимуляции поглощения О2. Как обсуждалось в
разделе 4.2, разобщающее действие FCCP обу-
словлено с пассивным переносом протонов через
мембрану, который приводит к снятию протонно-
го градиента. В этом случае дыхание становится
разобщенным с синтезом АТФ и свободная энер-
гия, которая выделяется в процессе электронного
транспорта, рассеивается в тепло.
МАТРИКС
пН® -
МЕЖМЕМБРАННОЕ
ПРОСТРАНСТВО
n Н©
Дыхательная
цепь
ДУ
n Н©
АТФ40
Рис- 5.20. Для синтеза АТФ в митохондрии
требуется поступление фосфата (через фосфатный
переносчик в обмен на ОН- ионы), и АДФ
(который осуществляется АДФ/АТФ переносчиком).
Поскольку за счет транспорта электронов
по дыхательной цепи на митохондриальной
мембране генерируется мембранный потенциал,
АДФ, которая находится в виде АДФ3-,
предпочтительно транспортируется вовнутрь,
а АТФ (в форме АТФ4 ) — наружу, и, как следствие,
отношение АТФ/АДФ в цитозоле выше,
чем в матриксе. АТФ/АДФ транспорт ингибируется
карбоксиатрактилозидом (связывается снаружи)
и бонгкрековой кислотой (связывается
со стороны матрикса). F-АТФ-синтаза митохондрий
ингибируется олигомицином
5.6. Транспорт электронов в дыхательной цепи сопряжен с синтезом АТФ через транспорт протонов 137
Чтобы координировать скорость дыхания
и потребности клетки в энергии, дыхание ре-
гулируется с помощью двух различных меха-
низмов. Классический механизм дыхательного
контроля основан на том факте, что когда от-
ношение АТФ/АДФ повышается, замедляется
синтез АТФ, поэтому увеличивается протонный
градиент, что, в свою очередь, вызывает сниже-
ние скорости электронного транспорта в дыха-
тельной цепи. Кроме того, было обнаружено,
что АТФ аллостерически подавляет электрон-
ный транспорт путем связывания с одной из
субъединиц нитохромоксидазы, что приводит к
снижению активности всего комплекса IV.
Митохондриальный электронный
транспорт приводит к образованию
мембранного потенциала
В отличие от хлоропластов, у митохондрий нет
замкнутого тилакоидного пространства для об-
разования протонного градиента. Вместо этого
в процессе электронного транспорта в митохон-
дриях протоны переносятся из матрикса в меж-
мембранное пространство, которое сообщается
с цитолозем через поры, образованные пори-
нами (см. рис. 1.30). Образование протонного
градиента АрН = 2,5 на мембране хлоропластов
приводит к снижению pH в люмене тилакои-
дов с 7,5 до 5,0. Если бы в случае митохондрий
такое сильное закисление происходило в цито-
золе, это бы имело нежелательные последствия
для активности цитозольных ферментов. На
самом деле в процессе контролируемого дыха-
ния в митохондриях разность значений pH на
внутренней мембране составляет всего 0,2. Это
связано с тем, что митохондриальный протон-
ный транспорт приводит преимущественно к
формированию электрического мембранного
потенциала (АТ ® 200 мВ). Митохондрии не мо-
гут генерировать больший протонный градиент,
потому что их внутренняя мембрана непрони-
цаема для анионов, таких как хлорид. Как пока-
зано на рис. 4.1, концентрационный протонный
градиент может быть образован только в том
случае, если заряд переносимых протонов ком-
пенсируется за счет диффузии противоиона.
Наши представления о механизме сопряже-
ния митохондриального электронного транспор-
та и переноса протонов до сих пор еще неполны,
несмотря на интенсивное изучение этой про-
блемы в течение 30 лет. Четыре протона, пред-
положительно, берутся из матрикса при переда-
че двух электронов от НАДН-дегидрогеназного
комплекса на убихинон, а затем высвобож-
даются в межмембранное пространство при
окислении убихинона на цит-^/^-комплексе
(см. рис. 5.15). Считается, что в митохондри-
ях цит-^/с*!-комплекс катализирует Q-цикл
(рис. 3.30), в котором передаются два электро-
на и два дополнительных протона переносятся
из матрикса в межмембранное пространство
(2Н+ + 2Н+ = 4Н+). Комплекс цит-я/я3 пере-
носит два протона на два электрона. Недавно
полученная трехмерная структура цит-я/я3-
комплекса показала, что биядерный центр,
включающий цитохром-я3 и Сив, участвует в
переносе протонов. Если приведенная стехио-
метрия верна, при окислении НАДН суммарно
переносятся Ю протонов, а при окислении сук-
цината — всего 6.
Синтез АТФ в митохондриях служит
для удовлетворения потребностей
цитозоля в энергии
Энергия протонного градиента в митохондри-
ях используется для синтеза АТФ с помощью
F-АТФ-синтазы (рис. 5.20), структура которой
весьма сходна со структурой F-АТФ-синтазы
хлоропластов (раздел 4.3). Однако между этими
ферментами есть и существенные отличия, на-
пример, чувствительность к олигомицину, анти-
биотику Streptomyces. В то время как активность
митохондриальной F-АТФ-синтазы очень сильно
ингибируется олигомицином из-за присутствия
в составе фермента олигомицин-связывающего
белка, хлоропластный фермент к ингибитору
нечувствителен. Несмотря на это отличие, ме-
ханизмы синтеза АТФ обоими ферментами, по-
видимому, не отличаются. Протонная стехио-
метрия митохондриального синтеза АТФ также
окончательно не установлена. Если принять, что
ротор F-АТФ-синтазы в митохондриях состоит из
Ю с-субъединиц, то в соответствии с механизмом,
который обсуждался в разделе 4.4, для синтеза
I моля АТФ необходимо 3,3 протона. Эта цифра
более или менее согласуется с экспериментальны-
ми данными, полученными в независимых экспе-
риментах.
В отличие от хлоропластов, которые синтези-
руют АТФ исключительно для внутреннего по-
138
5. Митохондрии — энергетические станции клетки
требления, в митохондриях АТФ синтезируется
в основном для экспорта в цитозоль. Это требу-
ет пополнения митохондриального пула АДФ и
фосфата из цитозоля и выноса синтезированно-
го АТФ. Фосфат поступает в митохондрии с по-
мощью фосфатного транслокатора в обмен на
ОН- ионы, в то время как поступление АДФ и
вынос АТФ обеспечивается АТФ/АДФ транс-
локатором (см. рис. 5.20). АТФ/АДФ транс-
локатор митохондрий ингибируется карбок-
сиатрактилозидом, глюкозидом из растений
Atractylis gumnifeга, и бонгкрековой кислотой,
антибиотиком бактерий Cocovenerans, которые
живут на кокосовых орехах. Оба вещества смер-
тельно ядовиты.
АТФ/АДФ транслокатор катализирует обмен
субстратами, или антипорт. На каждую моле-
кулу АТФ или АДФ, вынесенную из митохон-
дрии, АДФ или АТФ, соответственно, входит в
хлоропласт из цитозоля. Поскольку АТФ несет
на один отрицательный заряд больше, чем АДФ,
транспорт является электрогенным. Благодаря
тому, что в процессе протонного транспорта в
дыхательной цепи на мембране образуется вы-
сокий электрический потенциал, энергетически
более выгодно транспортировать АДФ внутрь
митохондрий, а АТФ — наружу. В результате
этого асимметричного транспорта соотношение
АТФ/АДФ снаружи митохондрий гораздо выше,
чем в матриксе. Таким образом, синтез АТФ в
митохондриях поддерживает высокое отношение
АТФ/АДФ в цитозоле. При обмене АДФ на АТФ
один отрицательный заряд выносится из матрик-
са наружу, что, в свою очередь, компенсируется
за счет переноса протона. Поэтому протоны,
формирующие протонный градиент, нужны не
только для синтеза АТФ, но и для экспорта син-
тезированной АТФ из митохондрии.
Вернемся к стехиометрии транспортирован-
ных протонов и АТФ, образовавшейся в про-
цессе дыхания. Принято говорить о трех местах
сопряжения дыхательной цепи, которые соот-
ветствуют комплексам I, III и IV. В учебниках
обычно пишут, что при окислении НАДН в ды-
хательной цепи одна молекула АТФ образуется
на каждом сайте сопряжения, и в результате со-
отношение АДФ/О при окислении НАДН со-
ставляет три, а при окислении сукцината — два.
Однако в экспериментах с изолированными ми-
тохондриями были получены гораздо более низ-
кие значения. Была сделана попытка объяснить
это несоответствие теории и эксперимента утеч-
кой протонов через мембрану изолированных
митохондрий. Но сейчас мы приходим к выво-
ду, что эти теоретические значения ошибочны
сами по себе. Предположительно, при окисле-
нии НАДН через мембрану переносятся Ю про-
тонов. Считая, что для образования молекулы
АТФ нужно 3,3 протона, и еше один необходим
для ее экспорта из митохондрии, получим ре-
зультирующее отношение АДФ/О = 2,3. В экс-
периментах с изолированными митохондриями
отношение АДФ/О достигало 2,5.
В начале главы мы подсчитали, что измене-
ние свободной энергии в процессе окисления
НАДН составляет —214 кДж/моль, а для синтеза
АТФ — примерно +50 кДж/моль. Соотноше-
ние АДФ/О, равное 2,3 при окислении НАДН,
означает, что примерно 54% свободной энер-
гии, которая выделяется в процессе окисления,
используется для синтеза АТФ. Тем не менее эти
теоретически рассчитанные значения, следует
интерпретировать с большой осторожностью.
5.7. У растительных митохондрий
есть особые метаболические
функции
Функция митохондрий как энергетических
станций клетки, которая обсуждалась до сих
пор, относится к митохондриям всех организ-
мов, от одноклеточных до высших растений и
животных. В фотосинтезирующих раститель-
ных клетках роль митохондрий как источников
энергии относится не только к темному време-
ни суток; митохондрии обеспечивают цитозоль
молекулами АТФ и во время фотосинтеза.
К тому же растительные митохондрии вы-
полняют некоторые специфические функции.
Матрикс митохондрий содержит ферменты,
окисляющие глицин до серина, т.е. катализи-
рующие важный участок фотодыхательного ме-
таболического пути (раздел 7.1):
2 глицин + НАД+ + Н2О---> серин + НАДН
+ СО2+ NH3
НАДН, который генерируется при окисле-
нии глицина, является важным исходным суб-
стратом для генерации АТФ в митохондриях во
время фотосинтеза. Еще одна важная роль рас-
5.7. У растительных митохондрий есть особые метаболические функции
139
тительных митохондрий — реакция оксалоаце-
тата и пирувата с образованием цитрата, пред-
шественника синтеза а-кетоглутарата. Этот
важный путь образования углеродных скелетов
для синтеза аминокислот при ассимиляции ни-
трата (см. рис. Ю.П).
Митохондрии могут окислять НАДН
без образования АТФ
В митохондриальном электронном транспор-
те участие флавинов, убисемихинонов и других
электронных переносчиков приводит к образова-
нию в качестве побочных продуктов супероксид-
радикалов, Н2О2 и гидоксил-радикалов (все эти
продукты называют АФК, активные формы
кислорода). Эти побочные продукты могут вызы-
вать серьезные повреждения в клетке. Поскольку
много АФК образуется в том случае, если компо-
ненты дыхательной цепи восстановлены, необхо-
димо избегать перевосстановления цепи. С другой
стороны, для растений необходимо, чтобы гли-
цин, который образуется в больших количествах
в фотодыхательном цикле (раздел 7.1), окислялся
в митохондриях, даже когда клетка не нуждается
в АТФ. У растительных митохондрий есть запас-
ные пути, которые позволяют окислить НАДН
без синтеза АТФ, с тем чтобы предотвратить пе-
ревосстановленное состояние дыхательной цепи
(рис. 5.21). Во внутренней митохондриальной
мембране со стороны матрикса есть альтерна-
тивная НАДН-дегидрогеназа, которая пере-
носит электроны от НАДН на убихинон без со-
пряжения с протонным транспортом. Этот путь
не ингибируется ротеноном. Однако окисление
НАДН по ротенон-нечувствительному пути идет
только тогда, когда соотношение НАДН/НАД+ в
матриксе чрезвычайно велико. Кроме того, сто-
рона внутренней митохондриальной мембраны,
обращенная в матрикс, содержит альтернативную
НАДФН-дегидрогеназу, которая не показана на
рис. 5.21.
МАТРИКС
НАДФ АДФ© НАДН НАД© ПРОСТРАНСТВО
+ Н© + Н©
Рис, 5,21, Кроме ротенон-чувствительной НАДН-дегидрогеназы (НАДН-ДГ
комплекс I), вдыхательной цепи растений есть дегидрогеназы, которые передают
электроны на убихинон без сопряженного протонного транспорта. Две из них —
альтернативная НАДН-ДГ,П и НАДФН-ДГ,П (на рисунке не показаны) — находятся на
стороне мембраны, обращённой к матриксу. Две другие — НАДН-ДГО1П и НАДФН-
ДГОШ — находятся на наружной стороне внутренней мембраны митохондрий.
Альтернативная оксидаза окисляет убигидрохинон (UQH2). Этот путь нечувствителен
к ингибиторам антимицину А и KCN, но ингибируется салицил гидроксамовой
кислотой (SHAM)
140
5. Митохондрии — энергетические станции клетки
Более того, в растительных митохондриях есть
альтернативная оксидаза, которая может пере-
давать электроны непосредственно с убихинона
на кислород; этот путь не сопряжен с протонным
транспортом. Альтернативное окисление нечув-
ствительно к антимицину-А и KCN (ингиби-
торам комплексов III и II, соответственно), но
ингибируется салицилгидроксамовой кисло-
той (SHAM). Недавние исследования показали,
что альтернативная оксидаза — мембранный бе-
лок, состоящий из двух одинаковых субъединиц
(по 36 кДа каждая). Исходя из аминокислотной
последовательности предполагают, что каждая
субъединица образует две трансмембранные
спирали. Вместе две субъединицы образуют
2-Ее-оксо-центр (как у десатуразы жирных кис-
лот, рис. 15.16), который катализирует окисление
убихинона кислородом.
Электронный транспорт с участием альтер-
нативной оксидазы можно рассматривать как
сокращенный путь, он используется тогда, ког-
да пул убихинонов сильно восстановлен. Когда
метаболиты в митохондрии в избытке, участие
альтернативной НАДН-дегидрогеназы и альтер-
нативной оксидазы приводит к их окислению
без сопутствующего синтеза АТФ, и вся высво-
божденная энергия рассеивается в форме тепла1.
Активность альтернативной оксидазы в митохон-
дриях из разных тканей растений различается и
зависит от стадии развития. Особенно высокая
активность альтернативной оксидазы была за-
регистрирована в початке Sauromatum guttatum,
растения из семейства ароидных, которое ис-
пользует альтернативную оксидазу для разогрева
соцветия. Из-за высокой температуры с его по-
верхности испаряются летучие азотистые соеди-
нения, которые пахнут падалью или фекалиями.
Сильный запах распространяется на большие
расстояния и привлекает насекомых. Образова-
ние альтернативной оксидазы в этих початках со-
пряжено с началом цветения.
НАДН и НАДФН из цитозоля могут
окисляться в дыхательной цепи
растительных митохондрий
В отличие от митохондрий из тканей живот-
ных растительные митохондрии могут окис-
1 Функции альтернативной оксидазы шире. Они включа-
ют детоксикацию активных форм кислорода, дыхание при
стрессах и др. — Прим. ред.
лять цитозольный НАДН, и в некоторых слу-
чаях НАДФН. Окисление наружных НАДН и
НАДФН обеспечивается двумя специальными
дегидрогеназами внутренней мембраны. Сайт
связывания субстрата у этих ферментов направ-
лен к межмембранному пространству. Как и в
случае сукцинатдегидрогеназы электроны от
наружных НАДН- и НАДФН-дегидрогеназ вхо-
дят в дыхательную цепь через пул убихинонов,
поэтому этот путь не ингибируется ротеноном.
Поскольку в окислении цитозольных НАДН и
НАДФН (как и сукцината) не участвует ком-
плекс I (см. рис. 5.21), при окислении цито-
зольных пиридиннуклеотидов выход АТФ
ниже, чем при окислении НАДН, находящего-
ся в матриксе. Окисление наружными НАДН-
дегидрогеназами происходит только тогда, ког-
да цитозольный пул НАД перевосстановлен.
Наружные НАДН-дегидрогеназы можно также
рассматривать как один из запасных путей, ко-
торый начинает действовать только когда в ци-
тозоле слишком много восстановленного НАДН.
Как обсуждалось в разделе 3.10, в некоторых си-
туациях фотосинтез может производить избы-
ток восстановительных эквивалентов, создавая
опасность для клетки. Но у растительной клетки
есть возможность удалять избыточные восстано-
вители, окисляя их в митохондриях с помощью
альтернативных дегидрогеназ и альтернативной
оксидазы2.
5.8. Для компартментации
митохондриального
метаболизма необходимы
специальные мембранные
переносчики
Внутренняя мембрана митохондрий непрони-
цаема для многих метаболитов. Специфичные
переносчики обеспечивают транспорт метабо-
литов между матриксом и цитозолем по обмен-
ному механизму (рис. 5.22).
Роль АТФ/АДФ транслокатора и фосфатно-
го транслокатора (рис. 5.20) обсуждалась в раз-
деле 5.6. Малат и сукцинат транспортируются
2 Поскольку мембрана хлоропластов непроницаема для
НАДФ+/НАДФН, предложенная схема является дискус-
сионной. Скорее всего, происходит челночный вынос вос-
становительных эквивалентов в цитозоль, а цитозольный
НАДН оказывается доступным для альтернативных ДГ. —
Прим. ред.
5.8. Для компартментации митохондриального метаболизма необходимы специальные...
141
Рис, 5.22. Важные переносчики
внутренней мембраны митохондрий.
Фосфатный и АТФ/АДФ переносчики
уже были представлены на рис. 5.20
в митохондрии в антипорте с фосфатом дикар-
боксилатным транслокатором (обменник ди-
карбоновых кислот). Этот транспорт ингибиру-
ется бутилмалонатом. а-Кетоглутарат, цитрат
и оксалоацетат транспортируются в антипорте
с малатом. Эти переносчики поставляют мета-
болиты, которые могут входить в цикл Кребса.
Глутамат переносится в антипорте с аспартатом,
а пируват — с ионами ОН-. Хотя все эти перенос-
чики присутствуют в растительных митохондри-
ях, наши знания все еще основаны на изучении
митохондрий из тканей животных. Сравнение
аминокислотных последовательностей, которые
известны для АТФ/АДФ, фосфатного, цитрат-
ного и глутамат/аспартатного обменников, пока-
зывает, что они в большой степени гомологичны.
Белки этих переносчиков являются представи-
телями одного семейства, развившимися в про-
цессе эволюции из одной предковой формы. Как
было упомянуто в разделе 1.9, все эти переносчи-
ки состоят из двух субъединиц, в каждой из кото-
рых есть 6 трансмембранных спиралей.
Наличие малат-оксалоацетатного обмен-
ника является особенностью растительных
митохондрий. Он выполняет важную функ-
цию в малат-оксалоацетатном цикле, описан-
ном в разделе 7.3. Он также переносит цитрат
и участвует в поставке углеродных скелетов
для ассимиляции азота (рис. Ю.П). Оксалоа-
цетатный обменник и, в меньшей степени,
а-кето глутаратный обменник ингибируются
дикарбоновой кислотой фталонатом. Транс-
порт глицина и серина, которые участвуют
в фотодыхательном пути (раздел 7.1), еще не
охарактеризован. Хотя это окончательно не до-
казано, считается, что этот транспорт обеспе-
чивают один или два митохондриальных пере-
носчика.
Дополнительная литература
Atkin, О. К., Millar, А. Н., Gardestrom, Р., Day, D. А.
Photosynthesis, carbohydrate metabolism and respira-
tion in leaves of higher plants. In Photosynthesis: Physi-
ology and Metabolism. R. C. Leegood, T. D. Sharkey, S.
von Caemmerer (eds.), pp. 153—175. Kluwer Academic
Publishers, Dordrecht, The Netherlands (2000).
Calhoun, M. W., Thomas, J., Gennis, R. B. The
cytochrome oxidase superfamily of redox-driven proton
pumps Trends Biol Sci 19, 325—330 (1994).
Eubel, H., Jaensch, L., Braun, H.-P. New insights into the
respiratory chain of plant mitochondria. Supercomplexes
and a unique composition of complex II. Plant Physiol
133, 274-286 (2003).
Iwata, S., Ostermeier, C., Ludwig, B., Michel, H.
Structure at 2.8 A resolution of cytochrome C oxidase
from Paracoccus denitrificans. Nature 376, 660—669
(1995).
Kadenbach, B., Arnold, A. A second mechanism of
respiratory control. FEBS Lett 447, 131 — 134(1999).
Kramer, R., Palmieri, E Metabolite carriers in mitochondria in
L. Emster (ed.). Molecular Mechanisms in Bioenergetics, pp.
359—384. Elsevier, Amsterdam (1992).
Kromer, S. Respiration during photosynthesis. Annu Rev
Plant Physiol Plant Mol Biol 46, 45-70 (1995).
Laloi, M. Plant mitochondrial carriers: An overview.
Cellular and Molecular Life Sciences. Birkhauser Verlag,
Basel, 56, pp. 918-944 (1999).
Lambers, H., van der Plaas, L. H. W. Molecular,
Biochemical and Physiological Aspects of Plant
Respiration. SPB Academic Publishing, Den Haag, The
Netherlands (1992).
McIntosh, L. Molecular biology of the alternative oxidase.
Plant Physiol 105, 781-786 (1994).
Millenaar, F. F., Lambers, H. The alternative oxidase: In
vivo regulation and function. Plant Biol 5, 2—15 (2003).
Moller I. M., Gardestrom, P., Glimelius, K., Glaser, K.
(Hrsg.) Plant Mitochondria from Gene to Function.
Backhuys Publishers, Leiden, The Netherlands (1998).
Moller 1. M. Plant mitochondria and oxidative stress:
electron transport, NAD PH turnover, and metabolism
of reactive oxygen species. Annu Rev Plant Physiol Plant
Mol Biol 52, 561-591 (2001).
Moller I. M. A new dawn for plant mitochondrial NAD(P)
H dehydrogenases. Trends Plant Sci 7, 235—237 (2002).
Pebay-Peyroula, E., Dahout-Gonzalez, C., Kahn, R.,
Trezeguet, V, Lauquin, G. J.-M., Brandolin, G.
Structure of mitochondrial ATP/ADP carrier in complex
with carboxyatractyloside. Nature 426, 39—44 (2003).
Raghavendra, A. S., Padmasree, K. Beneficial interaction
of mitochondrial metabolism with photosynthetic car-
bon assimilation. Trends Plant Sci 8, 546-553 (2003).
Saraste, Matti. Oxidative phosphorylation at the fin de
siecle. Science 283, 1488—1493 (1999).
Vanlerberghe, G. C.. Ordog, S. H. Alternative oxidase:
Integrating carbon metabolism and electron transport
in plant respiration. In: С. H. Foyer and G. Noctor
(eds.). Advances in Photosynthesis: Photosynthetic
Assimilation and Associated Carbon Metabolism, pp.
173—191. Kluwer Academic Publishers, Dordrecht, The
Netherlands (2002).
Verkhovsky, M. L, Jassaitis, A., Verkhovskaya, M. L.,
Morgan, J. E., Wikstrom. M. Proton translocation by
cytochrome c oxidase. Nature 400, 480—483 (1999).
Xia, D., Yu, C.-A., Kim, H., Xia, J. Z., Kachurin, A. M.,
Zhang, L., Yu, L., Deisenhofer, J. Crystal structure of the
cytochrome be 1 complex from bovine heart mitochondria.
Science 277, 60—66 (1997).
Yoshikawa, S., Shinzawa-Ito, K., Nakashima, R.,
Yaono, R., Yamashita, E., Inoue, N., Yao, M., Jie Fei,
M., Peters Libeu, C., Mizushima, T., Yamaguchi, H.,
Tomizaki, T., Tsukihara, T. Redox-coupled crystal
structural changes in bovine heart cytochrome c oxidase.
Science 280, 1723-1729 (1998).
Zhang, Z., Huang, L., Shulmeister, V. M., Chi, Y.-L,
Kim, К. K., Hung, L.-W., Crofts, A. R., Berry, E. A.,
Kim, S. H. Electron transfer by domain movement in
cytochrome bc\. Nature 392, 677—684 (1998).
6
В цикле Кальвина происходит
фотосинтетическая ассимиляция СО2
В главах 3 и 4 мы говорили о том, как
электрон-транспортная цепь и АТФ-син-
таза тилакоидной мембраны используют энер-
гию света для продукции восстановительных
эквивалентов в форме НАДФН и химической
энергии в форме АТФ. В этой главе мы обсудим
то, как образовавшиеся в процессе фотосинтеза
НАДФН и АТФ используются для ассимиляции
СО2.
9 АТФ 8АДФ+8Ф Н
\ + н-с-он
3 со2 -----------------► с=о
/ \ Н-С-О-РОз2
6 НАДФН 6 НАДФ Н
+ 6 Н + 3 Н2О
Дигидрокси-
ацетонфосфат
(триозофосфат)
6.1. Ассимиляция СО2 происходит
в темновых реакциях
фотосинтеза
Выделить из листа хлоропласты с интактной
наружной мембраной сравнительно просто (см.
раздел 1.7). Когда эти хлоропласты переносят в
изотоническую среду, содержащую осмотик и
бикарбонатный или фосфатный буфер, и вклю-
чают свет, можно наблюдать выделение кисло-
рода. Вода разлагается с выделением кислорода
в световой стадии, описанной в главе 3, а вос-
становительные эквиваленты, которые образу-
ются на свету, используются для ассимиляции
СО2 (рис. 6.1). Если хлоропласты интактны (не
повреждены), кислород не выделяется в от-
Фосфат
Триозофосфат
Рис. 6.1. Общая схема фотосинтеза в хлоропласте
Рис. 6.2. Суммарная реакция фотосинтетической
фиксации СО2
сутствие СО2 или фосфата. Это доказывает со-
пряжение световых реакций в интактных хло-
ропластах с ассимиляцией СО2 и показывает,
что в состав конечного продукта ассимиляции
входит фосфат. Главный продукт ассимиляции
в хлоропластах — дигидроксиацетонфосфат,
т.е. триозофосфат. На рисунке 6.2 показано,
что синтез триозофосфата из СО2 требует за-
трат энергии в форме АТФ и восстановитель-
ных эквивалентов в форме НАДФН, которые
образуются в световых реакциях фотосинте-
за. Последовательность реакций образования
триозофосфата из СО2, АТФ и НАДФН раньше
называли темновой стадией фотосинтеза, по-
скольку эти реакции сами по себе не требуют
освещения и теоретически могли бы происхо-
дить в темноте. Однако в темное время суток в
листе эти реакции не идут, потому что некото-
рые ключевые ферменты в цепи реакций био-
синтеза регулируются светом и могут работать
только при освещении (раздел 6.6).
В 1946—1953 годы Мелвин Кальвин и его
сотрудники, Эндрю Бенсон и Эндрю Бэссхем
в Беркли, Калифорния, расшифровали меха-
низм фотосинтетической ассимиляции СО2.
В 1961 году за это фундаментальное открытие
Кальвин был награжден Нобелевской премией
144
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
СТРОМА ХЛОРОПЛАСТА ЦИТОЗОЛЬ
Рис- 6.3. Общая схема реакций цикла Кальвина без учета стехиометрии
по химии. Важной предпосылкой для расшиф-
ровки пути фиксации СО2 было открытие в 1940
году радиоактивного изотопа 14С. Как побочный
продукт ядерной реакции, радиоактивный угле-
род был доступен после 1945 г. в США в боль-
ших количествах. В качестве объекта своих ис-
следований Кальвин выбрал зеленую водоросль
Chlorella. Он добавлял СО2, меченый изотопом
14С, в освещаемые суспензии водорослей, после
короткого периода инкубации убивал клетки,
добавляя горячий этанол и затем, используя бу-
мажную хроматографию, анализировал мече-
ные радиоактивным изотопом продукты фикса-
ции СО2.
Постепенно сокращая время инкубации, ему
удалось показать, что 3-фосфоглицерат является
первым стабильным продуктом фиксации СО2.
Более детальное исследование этого вопроса
показало, что фиксация СО2 происходит в ци-
клическом процессе, который получил название
цикла Кальвина. В этой книге будет встречать-
ся и другое его название: восстановительный
пентозофосфатный путь. Это название отра-
жает тот факт, что в цикле Кальвина происходит
восстановление и образование пентоз.
Цикл Кальвина принято подразделять на три
этапа:
1. Карбоксилирование пятиуглеродного
(С5) сахара рибулозо-1,5-бисфосфата, приводя-
щее к образованию двух молекул фосфоглице-
риновой кислоты(С3).
2. Восстановление 3-фосфоглицериновой
кислоты (ФГК) до ФГА триозофосфата;
3. Регенерация акцептора СО2 рибулозо-1,5-
бисфосфата из триозофосфата (рис. 6.3).
Конечный продукт фотосинтеза, триозо-
фосфат, экспортируется из хлоропластов с по-
мощью специфичных транспортных систем.
Однако большая часть образовавшихся молекул
триозофосфата остается в хлоропласте и прини-
мает участие в регенерации акцептора. Эти ре-
акции будут детально рассмотрены в следующих
разделах.
6.2. Рибулозобисфосфаткарбоксил аза
катализирует реакцию
фиксации СО2
Ключевая реакция фотосинтетической асси-
миляции СО2 — реакция связывания углекис-
Рис. 6.4. Рибулозобисфосфаткарбо-
ксилаза оксигеназа (RubisCO) может
катализировать две реакции
с РуБФ: карбоксилирование, которое
является фактически фиксацией
СО2, и оксигенирование — побочную
реакцию
Карбоксилазная активность
Н
Н-С-О-РОзе
О=С
I
н-с-он
I
н-с-он
H-C-O-POfe
н
н-с-он
Н-С-О-РО32е
н
З-Фосфоглицерат
Оксигеназная активность
О. /О
ХС
I
н-с-он
Н-С-О-РО^е
н
О. /Ое
хс
н-C-о-POf°
н
З-Фосфо-
глицерат
2-Фосфо-
гл и кол ат
Н
I
1 н—с-о—©
2 О=С
I
з н-с-он
I
4 Н-С-ОН
5 Н-С-О-©
Н
Кето-енольная
изомеризация
Рибулозо-1,5-
бисфосфат
Н
""Wo
НО-С • CSq
с-он
I
н-с-он
Н-С-О-®
н
Ендиол
Конденсация
Н
Н-С-О—®
I
но-с—ссо
с=о
I
н-с-он
I
Н-С-О-®
н
2-Карбокси-
3-кетоарабин итол -
1,5-бисфосфат
З-Фосфоглицерат
Н2О
Н
н-с-о-©
I
НО-С-ССо
н
Оч /Ое
хс
I
н-с-он
н-с-о-®
н
З-Фосфоглицерат
Н
н-с-о-©
I
ноё?-ССо
но-с-о-н
I
н-с-он
н-с-о-®
н
Г идратированная
форма
Рис. 6.5. Реакция карбоксилирования РуБФ ферментом RubisCO.
Для простоты —РО32- обозначена как —Р. Ендиол, образованный в результате
кето-енольной изомеризации карбонильной группы РуБФ (а), делает возможной
нуклеофильную реакцию СО2 с С-2 атомом РуБФ. В результате образуется
3-карбокси-3-кетоарабинитол-1,5-бисфосфат (б). После гидратации (в) связь между
С-2 и С-3 разрывается и образуются две молекулы 3-фосфоглицерата (г)
146
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
н-с-о-©
но-с >0=0
||^
с-он
I
н-с-он
н-с-о-©
н
Ендиольная форма
рибулозо-
1,5-бисфосфата
н
н-с-о-©
но-с-о-о
I
0=0
I
н-с-он
н-с-о-©
н
Пероксидный
интермедиат
(гипотетический)
н-с-о-®
О^ О
2-Фосфогликолат
О. /О *
ХС
I
н-с-он
н-с-о-®
н
З-Фосфоглицерат
Рис. 6.6. Часть последовательности оксигеназных реакций, катализируемых RubisCO
лого газа атмосферы с акцептором рибулозо-
1,5-бисфосфатом (РуБФ) с образованием двух
молекул 3-фосфоглицерата. Эта реакция экзэр-
гоническая, она идет с высвобождением большо-
го количества энергии (Д(70 = —35 кДж/моль) и
поэтому практически необратима. Ее катализи-
рует фермент рибулозобисфосфаткарбоксилаза/
оксигеназа (сокращенно РБФК или RubisCO),
названный так потому, что этот же фермент ка-
тализирует конкурирующую реакцию, в которой
рибулозобисфосфат реагирует с О2 (рис. 6.4).
На рисунке 6.5 показан механизм карбок-
силазной реакций. Кето-енольная изомери-
зация РуБФ приводит к образованию ендио-
ла, который реагирует с СО2 с образованием
и нтермедиата 2 - карбокси - 3 - кетоараби н итол -
1,5-бисфосфата, который распадается на две
молекулы 3-фосфоглицерата. В оксигеназной
реакции кислород предположительно реаги-
рует, как и СО2, с ендиольной формой РуБФ.
При этом образуется пероксидный интермеди-
ат. При последующем распаде этого нестойкого
соединения один атом молекулы О2 освобожда-
ется в форме воды, а другой встраивается в кар-
бонильную группу 2-фосфогликолата (рис. 6.6).
В результате оксигеназной реакции образуются
2-фосфогликолат и 3-фосфоглицерат.
RubisCO — основной фермент1, который
осуществляет фиксацию атмосферного СО2
для формирования биомассы. Поэтому суще-
1 Первичная фиксация углекислоты у С4- и САМ- растений
происходит при помощи фосфоенолпируваткарбоксилазы
(ФЕПК), но запускаемый этим ферментом цикл не при-
водит к синтезу сахаров (глава 8). Минорное значение для
биосферы имеют ферменты цикла Арнона у некоторых бак-
терий, в котором также фиксируется СО2. — Прим. ред.
ствование этого фермента — необходимое усло-
вие существования жизни на Земле.
У растений и цианобактерий белок RubisCO
состоит из 8 одинаковых больших субъединиц
(с молекулярной массой от 51 до 58 кДа у разных
видов) и восьми одинаковых малых субъединиц
(12—18 кДа). Таким образом, RubisCO состо-
ит из 16 субъединиц и является одним из са-
мых крупных ферментов в природе. У растений
большая субъединица кодируется хлоропластным
геномом, а малая — ядром. Каждая из больших
субъединиц содержит один каталитический центр.
Функции малых субъединиц еще не до конца
установлены. Предполагается, что малые субъе-
диницы стабилизируют комплекс, образованный
большими субъединицами. Присутствие малых
субъединиц не является необходимым для про-
цесса фиксации СО2 как такового. У некоторых
пурпурных бактерий RubisCO представляет собой
димер из больших субъединиц, но каталитические
функции соответствующего фермента не имеют
принципиальных отличий от таковых у растений.
Единственное отличие бактериальных фер-
ментов, состоящих из двух больших субъеди-
ниц, от ферментов растений, состоящих из
8 больших и 8 малых субъединиц, заключается
в соотношении оксигеназной и карбоксилазной
активностей: оксигеназная активность выше
у бактериального фермента.
Оксигеназная реакция RubisCO:
дорогостоящая побочная реакция
Хотя концентрация СО2, необходимая для по-
лунасыщения фермента RubisCO (Км [СО2]) го-
раздо ниже, чем О2 (Км [О2]) (табл. 6.1), скорость
6.2. Рибулозобисфосфаткарбоксилаза катализирует реакцию фиксации СО2
147
Таблица 6.1. Кинетические свойства рибулозобисфосфаткарбоксилазы/оксигеназы (RubisCO) при 25°C
Концентрации субстрата при полунасыщении фермента
Км [СО2] : 9 мкмоль/л *
Км [О2] : 535мкмоль/л *
Км (РуБФ): 28 мкмоль/л
Максимальное число оборотов (для одной субъединицы)
Kcat [СО2] 3.3 с-1
Kcat [О2] 2.4 с-’ Xcat[CO2] / Kcat[O2]
СО2/О2 специфичность = -^у/ = 82
* Для сравнения:
В равновесии с воздухом (0,035% = 350 ppm СО2, 21% О2) концентрации в воде при 25 °C
СО2 : 11 мкмоль/л
О2 : 253 мкмоль/л
(по данным Woodrow, Berry, 1988)
оксигеназной реакции очень высока, поскольку
концентрация О2 в атмосфере составляет 21%,
а СО2 — всего лишь 0,035%. Более того, кон-
центрация СО2 в воздушных полостях листьев
может быть значительно ниже, чем в окружаю-
щем воздухе. По этим причинам соотношение
оксигеназной и карбоксилазной активности в
процессе фотосинтеза в листе при 25 °C обыч-
но находится в пределах 1:4 — 1:2. Это значит,
что приблизительно каждая третья-пятая моле-
кула рибулозо-1,5-бисфосфата вступает в по-
бочную реакцию. С повышением температуры
специфичность фермента СО2/О2 падает1 (см.
табл. 6.1), и, следовательно, отношение оксиге-
назной активности к карбоксилазной возраста-
ет. С другой стороны, повышение концентрации
СО2 в атмосфере снижает уровень оксигеназной
активности, что во многих случаях ведет к усиле-
нию роста высших растений.
В главе 7 будет показано, что рециклирова-
ние побочного продукта активности RubisCO
2-фосфоглицерата, который образуется при
фотосинтезе в больших количествах, потребля-
ет значительную долю энергетических ресурсов
растений.
Этот процесс включает метаболическую це-
почку более 10 ферментативных реакций, кото-
рые локализованы в трех органеллах (хлоропла-
стах, пероксисомах, митохондриях) и требуют
1 При повышении температуры растворимость газов в воде
падает, что приводит к резкому снижению концентрации
СО2 в хдоропластах, в то время как концентрация О2 снижа-
ется незначительно. — Прим. ред.
значительных энергетических ресурсов. В раз-
деле 7.5 будет рассчитано, что примерно треть
фотонов, поглощенных в процессе фотосин-
теза целого листа, тратятся на исправление «по-
следствий оксигеназной реакции».
Очевидно в процессе эволюции дорогостоя-
щая побочная реакция RubisCO не была элими-
нирована. По сравнению с цианобактериями у
высших растений соотношение карбоксилазной
и оксигеназной активностей RubisCO возросло
менее чем вдвое. Похоже, что перед нами при-
мер, когда оптимизация ключевых жизненных
процессов в процессе эволюции достигла преде-
ла, определяемого химизмом реакции. Возмож-
но, это связано с тем, что RubisCO появилась
в эволюции тогда, когда в атмосфере не было
кислорода. Сравнение белков RubisCO из раз-
ных организмов приводит к заключению, что
RubisCO уже существовала 3,5 млрд лет назад,
когда эволюционировали первые хемолито-
трофные бактерии. Когда спустя 1,5 млрд лет
благодаря фотосинтезу кислород появился в ат-
мосфере в достаточно высоких концентрациях,
сложность белка RubisCO, по-видимому, поме-
шала изменению каталитического центра для
устранения оксигеназной активности. Экспери-
ментальные данные подтверждают эту гипотезу.
В генноинженерных конструкциях, в которых в
аминокислотную последовательность активно-
го центра были внесены изменения с помощью
точечных мутаций, не удалось добиться опти-
мизации соотношения между карбоксилазной
и оксигеназной активностью RubisCO. Един-
148
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
ственная возможность снизить оксигеназную
активность методами генной инженерии заклю-
чается в одновременном изменении нескольких
аминокислот в каталитическом сайте связыва-
ния RubisCO, но вероятность такой перестрой-
ки в эволюции крайне мала. В разделе 7.7 мы
поговорим о том, как растения делают это «не-
избежное зло» полезным и используют энерго-
емкую оксигеназную реакцию для расходования
избыточных НАДФН и АТФ, образовавшихся в
световых реакциях.
Рибулозобисфосфаткарбоксилаза/
оксигеназа: особые свойства
Реакция карбоксилирования РуБФ с участи-
ем RubisCO имеет очень низкую скорость (см.
табл. 6.1): число оборотов для каждой субъеди-
ницы составляет всего лишь 3,3 с-1. Это значит,
что при насыщении фермента субстратом только
около трех молекул РуБФ в секунду реагируют в
каждом каталитическом центре RubisCO. Для
сравнения, для дегидрогеназ и карбоангидраз
число оборотов составляет порядка 103 и 105 с-1
соответственно. Из-за низкой скорости реакции
для обеспечения нужд фотосинтеза требуется
огромное количество фермента. RubisCO состав-
ляет до 50% всех растворимых белков листьев.
В связи с преобладанием биомассы растений в
биосфере RubisCO является наиболее широко
представленным белком на Земле. Концентра-
ция больших каталитических субъединиц в стро-
ме достигает 4- Ю 3 М. Сравнение этого значения
с концентрацией СО2 в воде, находящейся в рав-
новесии с воздухом (при 25 °C около 11-10-6 М),
показывает соотношение, совершенно не ти-
пичное для ферментативных реакций: концен-
трация фермента почти в 1000 раз больше, чем
субстрата СО2 и примерно равна концентрации
субстрата РуБФ.
Активация RubisCO
Все большие субъединицы RubisCO содержат
в своей последовательности из 470 аминокислот
лизин в положении 201. Фермент RubisCO ак-
тивен только в том случае, если 8-аминогруппа
этого лизина реагирует с СО2 с образованием
карбамата (амида угольной кислоты), с кото-
рым связывается Mg2+ (рис. 6.7). Активация
происходит при изменении конформации белка
большой субъединицы. Активная конформация
стабилизируется за счет образования комплек-
са с Mg2+. Это является обязательным условием
активности для всех изученных белков RubisCO
из разных организмов. Следует отметить, что
молекула СО2, связанная в форме карбамата, не
является субстратом реакции карбоксилирова-
ния РуБФ.
Для активации RubisCO необходима АТФ,
этот процесс катализируется специальным фер-
ментом — активазой RubisCO. Неактивная (не
образовавшая карбамат) форма RubisCO очень
прочно связывает РуБФ, что приводит к бло-
кировке работы фермента. Используя энергию
АТФ, активаза высвобождает прочно связанный
РуБФ и, таким образом, делает возможным об-
разования карбаматного комплекса в 201 по-
ложении (лизин). Регуляция активазы RubisCO
будет рассмотрена в разделе 6.6.
RubisCO ингибируется несколькими гексо-
зофосфатами и 3-фосфоглицератом. Все эти ве-
щества связываются с активным центром фер-
мента вместо РуБФ. Очень сильный ингибитор
RubisCO — 2-карбоксиарабинитол-1-фосфат
(СА1Р) (рис. 6.8). Это вещество имеет структу-
ру, сходную с 2-карбокси-З-кетоарабинитол-
1,5-бисфосфатом (см. рис. 6.5), который являет-
ся интермедиатом реакции карбоксилирования.
Сродство сайта связывания РуБФ RubisCO
к СА1Р в 1000 раз выше, чем к РуБФ. У неко-
Е- Lys-NH®
о
//
Е— Lys—N С
н О'
//Ч
Е—Lys-N-C Мд
Н V
Карбамат
(неактивен)
Комплекс
карбамата с Мд2®
(активен)
Рис. 6.7. RubisCO активируется за счет образования комплекса карбамата с Mg2+
в остатке лизина
6.3. При восстановлении 3-фосфо гл и церата образуется триозофосфат
149
Н
Н-С-О-РО32е
1 ^О
но-с-С<ое
н-с-он
I
н-с-он
I
н-с-он
I
н
2-Карбоксиара-
бинитол-1 -фосфат
Рис. 6.8. 2-карбоксиарабинитол-1 -фосфат,
ингибитор RubisCO
торых видов СА1Р накапливается в листьях
ночью, блокируя значительную часть сайтов
связывания RubisCO и, таким образом, инак-
тивируя фермент. Днем СА1Р высвобождается
активазой RubisCO и деградирует с участием
специфичных фосфатаз, которые гидролизуют
связь остатка фосфорной кислоты с остальной
молекулой СА1Р, нейтрализуя, таким образом,
его действие как ингибитора RubisCO. СА1Р
синтезируется из фруктозо-1,6-бисфосфата с
образованием таких гексозофосфа^ных проме-
жуточных продуктов, как гамамелозобисфосфат
и гамамелозомонофосфат. Поскольку СА1Р об-
разуется не у всех растений, его универсальная
роль в регуляции активности RubisCO до сих
пор ставится под сомнение.
6.3. При восстановлении
3-фосфоглицерата образуется
триозофосфат
Для синтеза ди гидроксиацетонфосфата продукт
карбоксилирования 3-фосфоглииерат фосфори-
лируется ферментом фосфоглицераткиназой.
В этой реакции, которая идет с затратой АТФ,
между новым остатком фосфорной кислоты и
карбоксильной группой образуется смешанный
ангидрид (рис. 6.9). Поскольку свободная энер-
гия гидролиза этого ангидрида примерно та-
кая же, как у фосфатного ангидрида в молекуле
АТФ, реакция фосфоглицераткиназы обратима.
У хлоропластной фосфоглицераткиназы есть
цитоплазматическая изоферментная форма, ко-
торая участвует в гликолизе: она катализирует
образование АТФ из АДФ и 1,3-дифосфоглице-
рата.
Восстановление 1,3-дифосфоглицерата до
D-глицеральдегид-З-фосфата катализирует фер-
мент глицеральдегидфосфатдегидрогеназа
(см. рис. 6.9). На промежуточном этапе реак-
ции при замещении фосфатного остатка на кар-
боксильной группе SH-группой цистеинового
остатка активного центра фермента образуется
тиоэфир (рис. 6.10). Свободная энергия гидро-
лиза этого тиоэфира почти так же велика, как
ангидрида (макроэргическая связь). При восста-
новлении тиоэфира образуется тио-семиацеталь,
свободная энергия гидролиза которого низка.
Фосфогл и церат -
киназа
НАДФ-глицер-
альдегидфосфат-
дегидрогеназа
Триозофосфат-
изомераза
О. /О
хс
I
н-с-он
н-C-о-POje
н
АТФ АДФ
/О-РО2е
^с 3
I
н-с-он
H-C-O-POje
н
НАДФН+Н НАДФ'
О. /Н
хс
I
н-с-он
н—с-о—РО3е
н
н
I
н-с-он
I
с=о
Н-С-О-POfe
н
3-фосфо-
1,3-дифосфо-
гл и церат
глицерат
D-Глицеральдегид-
3-фосфат
Ди гидроксиацетон -
фосфат
T риозофосфаты
Рис. 6.9. Восстановление 3-фосфоглицерата до триозофосфатов
150
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
В реакции, катализируемой глицеральде-
гидфосфатдегидрогеназой и фосфоглиператки-
назой, большая разность энергии химического
потенциала между альдегидной и карбоксиль-
ной группами компенсируется за счет гидролиза
АТФ, поэтому она обратима. Глицеральдегид-
фосфатдегидрогеназа в цитозоле катализирует
превращение глицеральдегидфосфата в 1,3-ди-
фосфоглицерат. В отличие от цитозольного
фермента, который в основном катализирует
окисление глицеральдегидфосфата и в качестве
акцептора водорода использует НАД+, хлоро-
пластный фермент использует НАДФН в каче-
стве донора водорода.
Это пример того, насколько разные роли си-
стемы НАДН/НАД+ и НАДФН/НАДФ+ играют
в метаболизме эукариотической клетки. В то
время как система НАДН в основном служит для
сбора и накопления восстановительных эквива-
лентов, которые затем используются для образо-
вания АТФ, система НАДФН преимущественно
накапливает восстановительные эквиваленты
для большинства процессов биосинтеза. Об-
разно говоря, систему НАДН можно сравнить с
магистралью низкого давления, через которую
восстановительные эквиваленты идут на окис-
ление с генерацией запасов энергии, а НАДФН
систему — с магистралью высокого давления,
через которую восстановительные эквиваленты
направляются в синтетические процессы.
Фосфоангидрид
карбоксильной группы
Тиоэфир
О\ ^S-Фермент
ХС
I
-с-
I
НАДФН + Н'
ИД ПгГ>Ф
СК /Н
ч
I
-с-
I
Альдегид
HS-Фермент
ОН
I
Н—С—S—Фермент
—с—
I
Тио-семиаиеталь
Рис. 6.10. Механизм реакции, катлизируемой гли-
церальдегидфосфатдегидрогеназой. Н-S-фермент
обозначает сульфгидрильную группу цистеинового
остатка в активном центре фермента
Обычно соотношение восстановленных и
окисленных пиридиннуклеотидов для НАДФН
примерно в 100 раз выше, чем для НАДН. Срав-
нительно высокий уровень восстановленное™
НАДФН системы в хлоропластах (примерно
50—60% восстановленных) позволяет очень эф-
фективно восстанавливаеть 1,3-дифосфоглице-
рат до глицеральдегид-3-фосфата.
Триозофосфатизомераза катализирует изо-
меризацию глицеральдегид-3-фосфата до диги-
дроксиацетонфосфата. Промежуточный продукт
этого превращения альдозы в кетозу — 1,2-ен-
диол. В целом реакция триозофосфатизоме-
разы сходна с реакцией, которую катализирует
рибозофосфатизомераза. Равновесие реакции
сдвинуто в сторону образования кетозы. Трио-
зофосфаты — общий термин, обозначающий
оба вещества, участвующих в реакции, при этом
соотношение между ними следующее: 96% ди-
гидроксиацетонфосфата и всего лишь 4% гли-
церальдегидфосфата.
6.4. Рибулозобисфосфат
регенерирует из триозофосфата
В результате фиксации трех молекул СО2 в ци-
кле Кальвина образуются шесть молекул фос-
фоглицерата, которые затем превращаются
в шесть молекул триозофосфата* 1 (рис. 6.11).
Только одна из них выходит из цикла и вступа-
ет в дальнейшие биосинтетические процессы.
Остальные пять молекул триозофосфата необ-
ходимы для регенерации трех молекул рибуло-
зобисфосфата, которые вновь вступают в цикл.
На рисунке 6.12 показаны метаболические пути
превращения триозофосфатов (обозначены бе-
лыми прямоугольниками) в три пентозофосфа-
та (красные прямоугольники).
Две триозы — дигидроксиацетонфосфат и
глицеральдегид-3-фосфат — конденсируются в
обратимой реакции, катализируемой альдола-
1 Здесь и далее — теоретический расчет стехиометрии цик-
ла Кальвина, который предполагает, что каждая из молекул
превращается в промежуточные продукты. На самом деле
концентрации веществ—участников цикла Кальвина изме-
няются при переходе от темноты к свету и обратно. При не-
достатке РуБФ доля молекул триозофосфатов, выходящих из
цикла, сокращается. Для биосинтеза могут использоваться
промежуточные продукты регенерации: фруктозо-6-фосфат
(синтез крахмала), рибозо-5-фосфат (синтез РНК и ДНК
хлоропластов) и т. д. К указанным соотношениям нужно от-
нестись с осторожностью. — Прим. ред.
6.4. Рибулозобисфосфат регенерирует из триозофосфата
151
Рис. 6.11. Пять из шести молекул триозофосфатов,
образованных в процессе фотосинтеза, необходимы
для регенерации рибулозо-1,5-бисфосфата. Одна
молекула триозофосфата представляет собой
конечный продукт ассимиляции углерода и может
использоваться в хлоропласте или экспортироваться
3 Рибулозо-1,5- 6 З-Фосфо-
хлоропласта
Г лицеральдегид-З-Ф
Дигидроксиацетон-Ф
Седогептулозо-1,7-бисфосфат
Седогептулозо-7-Ф
Ксилулозо-5-Ф
Рис. 6.12. Последовательность реакций превращения пяти молекул
триозофосфатов в три молекулы пентозофосфата
5
152
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
Альдолаза
Дигидроксиацетон-
фосфат
Н
н-с-о-®
с=о
I
I
н-с-он
н-с-о-®
н
D-Глицеральдегид-
3-фосфат
С=О
I
но-с-н
I
I
н-с-он
I
н-с-он
н-с-о-©
н
Эритрозо-
4-фосфат
н-с-о-®
с=о
I
но-с-н
I
н-с-он
I
н-с-он
н-с-о-®
н
Фруктозе-1,6-
бисфосфат
н-с-о-®
с=о
I
но-с-н
I
н-с-он
I
н-с-он
I
н-с-он
н-с-о-®
н
Седогептулозо-
1,7-бисфосфат
Рис. 6.13. Альдолаза катализирует конденсацию
дигидроксиацетонфосфата с альдозой глицеральдегид-
3-фосфатом или эритрозо-4-фосфатом
зой (рис. 6.13). На рисунке 6.14 показан механизм
этой реакции. При взаимодействии остатка ли-
зина активного центра фермента с кетогруппой
дигидроксиацетонфосфата образуется промежу-
точный продукт — Шиффово основание. Обра-
зование этой структуры облегчает отщепление
протона из С-3 положения и делает возможной
нуклеофильную реакцию с С-атомом альдегид-
ной группы дигидроксиацетонфосфата.
Фруктозо-1,6-бисфосфат гидролизуется до
фруктозо-6-фосфата в необратимой реакции, ка-
тализируемой фруктозо-1,6-бисфосфатазой
(рис. 6.15).
Фермент транскетолаза переносит угле-
водный остаток с двумя атомами углерода с
фруктозо-6-фосфата на глицеральдегид-3-фос-
фат. Продуктами этой обратимой реакции явля-
ются ксилулозо-5-фосфат и эритрозо-4-фосфат
(рис. 6.16). В качестве простетической группы в
реакции принимает участие тиаминпирофосфат
(рис. 6.17), который обсуждался в связи с окис-
лением пирувата (раздел 5.3).
Альдолаза (см. рис. 6.13) вновь катализиру-
ет конденсацию: на этот раз эритрозо-4-фосфат
конденсируется с дигидроксиацетонфосфатом
с образованием седогептулозо-1,7-бисфосфата.
Затем седогептулозо-1,7-бисфосфатаза ката-
лизирует необратимый гидролиз седогептулозо-
1,7-бисфосфата. Эта реакция сходна с реакцией
гидролиза фруктозо-1,6-бисфосфата, хотя ката-
лизируется другим ферментом. Снова углеводный
остаток с двумя атомами С передается транске-
толазой с седогептулозо-7-фосфата на дигидрок-
сиацетонфосфат. При этом образуются рибозо-
5-фосфат и ксилулозо-5-фосфат (рис. 6.16).
Три образовавшихся пентозофосфата теперь
преобразуются в рибулозо-5-фосфат (рис. 6.18).
Превращение ксилулозо-5-фосфата катализиру-
ется рибулозофосфатэпимеразой: эта реакция
идет через кето-енольную изомеризацию. Про-
межуточным продуктом является 2,3-ендиол.
Превращение альдозы рибозо-5-фосфата в
кетозу рибулозо-5-фосфат катализируется ри-
бозофосфатизомеразой. Реакция также идет
с образованием промежуточного ендиольного
продукта, хотя в этом случае в положении 1—2.
Три молекулы рибулозо-5-фосфата, которые
образуются в этой реакции, превращаются в ак-
цептор СО2 рибулозо-1,5-бисфосфат в реакции,
катализируемой рибулозофосфаткиназой; ре-
акция идет с затратой АТФ (рис. 6.19). Эта ки-
назная реакция необратима, потому что фосфат
переносится из макроэргической ангидридной
связи в молекуле АТФ в эфирную связь с низкой
свободной энергией гидролиза.
Рисунок 6.20 дает представление обо всей со-
вокупности реакций цикла Кальвина. В цикле
есть четыре необратимые стадии, обозначен-
ные жирными стрелками: карбоксилирование,
гидролиз фруктозобисфосфата, гидролиз се-
догептулозобисфосфата и фосфорилирование
рибулозо-5-фосфата. Фиксация одной молеку-
лы СО2 требует суммарно двух молекул НАДФН
и трех молекул АТФ.
6.4. Рибулозобисфосфат регенерирует из триозофосфата
153
Фруктозо-1,6-бисфосфат
или седогептулозо-1,7-бисфосфат
Дигидроксиацетонфосфат
Н
।
Н-С-О-®
I ®
С=О + Н3М-Фермент
I
но-с-н
I
н
н
I
Н-С-О-®
I ф
С=о + H3N-Фермент
I
но-с-н
I
н-с-он
I
-с-
I
—с—
I
Образование
Шиффова
основания
Карбанион
Г идролиз
Шиффова
основания
Н
I
Н-С-О-®
I Н
С=М-Фермент
I ®
ю-с-н
। Резонанс
Н 1
н-с=о
I
-с-
I
—с—
I
н
I
Н-С-О-®
I Н
С=М-Фермент
I ®
|Q_p__|_|
е Конденсация
Н® =►
® ©
н-с-о
I
-с-
I
-с-
I
Н
I Z
н-с-о-®
I Н
С=М-Фермент
I ®
но-с-н
I
н-с-он
I
-с-
I
—с—
I
D-глицеральдегид-З-фосфат
или эритрозо-4-фосфат
Рис. 6.14. Механизм альдолазных реакций. Ди гидроксиацетонфосфат образует
Шиффово основание с терминальной аминогруппой лизинового остатка
фермента. Положительный заряд на атоме азота облегчает отщепление протона
от С-3, и в результате образуется карбанион. В одной из резонансных форм
глицеральдегидфосфата С-1-атом альдегидной группы несет положительный заряд.
Это облегчает конденсацию С-1-атома с отрицательно заряженным С-З-атомом
ди гидроксиацетонфосфата. После конденсации Шиффово основание снова
распадается и образуется фруктозо-1,6-бисфосфат. Седогептулозо-1,7-бисфосфат
образуется тем же ферментом в реакции с эритрозо-4-фосфатом. Альдолазная
реакция обратима
Фруктозо-1,6-бисфосфатаза
Рис. 6.15. Гидролиз фруктозо-1,6-бисфосфата
фруктозо- 1,6-бисфосфатазой
Н
I
С=О
I
но—с—н
I
н-с-он
I
н-с-он
Н-С-О-РОз®
н
Фруктозо-1,6-
бисфосфат
Н2О
HOPOf
Н
I
н-с-он
I
с=о
I
но-с-н
I
н-с-он
I
н-с-он
Н-С-О- РОзе
н
Фруктозо-6-
фосфат
Транскетолаза
п I н-с-он I с=о / I но-с-н I н-с-он + нЛ /О с^ I н-с-он h —► Г К с^ I н-с-он +
н-с-он н-с-о-® н н-с-о-© н Г Г н-с-он н-с-о-© н
Фруктозо- D-Глицеральдегид- Эритрозо-
6-фосфат 3-фосфат 4-фосфат
Н
I
Н-С-ОН
I
с=о
I
но-с-н
I
н-с-он
н-с-о-®
н
Ксилулозо-
5-фосфат
Н
I
Н-С-ОН
с=о X I но-с-н Н?^ /О с' I
н-с-он + I н-с-он I н-с-он н-с-о-© н—С-он
н-с-о—© н
Седо- D-Глицеральдегид-
гептулозо- 3-фосфат
7-фосфат
Н.
С^
I
н-с-он +
I
н-с-он
I
н-с-он
н-с-о-©
н
Рибозо-
5-фосфат
H
I
н-с-он
I
с=о
I
но-с-н
I
н-с-он
н-с-о-©
н
Ксилулозо-
5-фосфат
Рис. 6.16. Транскетолаза катализирует перенос С2-фрагментов с кетоз на альдозы
I
-c-
I Резонанс
O=C ◄--------►
I
н-с-он
I
Ri
Фруктозо-
6-фосфат
(седогептулозо-
7-фосфат)
Тиамин-
пирофосфат
(ТРР)
I
—с—
I
о=с
I
н-с-он
I
r2
Ксилулозо-
5-фосфат
Передача -фрагмента,
связанного с ТРР
I
—с—
I
но-с----
I
н-с-он
I
Ri
ТРР-связанная форма
I /N— С
но—с—||
I
—с—
I
но-с---
I
н-с-он
I
н-с-он
I
Ri
н-с-он
R2
r2
ТРР-связанная форма
Эритрозо-
4-фосфат
(рибозо-
5-фосфат)
Н. /О
С^
I
R2
D - Гл и це рал ьде ги д-
3-фосфат
Рис. 6.17. Механизм транскетолазной реакции.
В качестве простетической группы фермент содержит
тиаминпирофосфат (ТРР). Активная группировка ТРР — тиазольное кольцо,
положительный заряд N-атома в котором облегчает отщепление протона
от соседнего С-атома. Это приводит к появлению отрицательно
заряженного С-атома (карбаниона), с которым связывается
С-атом кетогруппы субстрата, имеющий частичный
положительный заряд. Положительно заряженный
N-атом тиазола способствует расщеплению углеродной цепи,
и С-атом в положении 2 становится карбанионом.
Механизм реакции в целом такой же, как в альдолазной реакции
на рис. 6.14. С2-углеводный фрагмент, связанный с тиазолом,
передается в С-l положение гл и церал ьде гид-3-фосфата
Н
I
Рибулозофосфат -
эпимераза
н-с-он
I
с=о
I
но-с-н
I
н-с-он
н-с-о-®
н
I
-с-
I
с-он
II
с-он
I
2,3-Ендиол
Н
I
н-с-он
I
с=о
I
н-с-он
I
н-с-он
н-с-о-®
н
^Рис. 6.18. Превращение ксилулозо-5-фосфата и
рибозо-5-фосфата в рибулозо-5-фосфат. В обоих
случаях на промежуточном этапе реакции образуется
цис-ендиол
Ксилулозо-5-фосфат
Рибулозо-5-фосфат
Рибулозофосфат-
киназа
I
н-с-он
I
н-с-он
I
н-с-он
н-с-о-®
н
Рибозо-5-фосфат
Рибозофосфат-
изомераза
Н\ ОН с II С-ОН 1 Н I н-с-он I со
1,2-Ендиол н-с-он I 1-1—Г4—он
П V/ VJil н-с-о-®
н
Рибулозо-5-фосфат
Н
I
Н-С-ОН АТФ АДФ
с=о \ /
н-с-он ——►
I
н-с-он
Н-С-О-РО^е
н
Н-С-О-РОз
с=о
I
н-с-он
I
н-с-он
Н-С-О-РОзе
н
Рибулозо-5-фосфат Рибулозо-1,5-бисфосфат
Рис. 6.19. Рибулозофосфаткиназа катализирует
необратимое образование рибулозо-1,5-бисфосфата
2 АДФ
2х
З-фосфоглицерат^ 2 АТФ
Рис. 6.20. Цикл Кальвина (восстановительный пентозофосфатный путь). Ф — фосфат
6.6. Восстановительный и окислительный пентозофосфатные пути регулируются
157
6.5. Кроме восстановительного
пентозофосфатного пути
есть также окислительный
пентозофосфатный путь
Кроме восстановительного пентозофосфатного
пути (цикла Кальвина), который обсуждался в
предыдущих разделах, в хлоропластах содер-
жатся также ферменты окислительного пен-
тозофосфатного пути. В этом пути, который
есть как у растений, так и у животных, гексо-
зофосфат окисляется до пентозофосфата с
высвобождением одной молекулы СО2 (Окис-
лительный пентозофосфатный цикл идет как в
пластидах, так и в цитозоле, где его часто рас-
сматривают как путь дыхания, альтернативный
гликолизу. — Прим. ред.).
Этот путь обеспечивает НАДФН для «маги-
страли высокого давления», т.е. для биосинтетиче-
ских процессов. Последовательность реакций изо-
бражена на рис. 6.21. Сначала глюкозо-6-фосфат
окисляется до 6-фосфоглюконолактона с участи-
ем фермента глюкозо-6-фосфатдегидрогеназы
(рис. 6.22). Эта реакция сильно экзэргониче-
ская и практически необратима. 6-Фосфоглю-
конолактон, внутримолекулярный эфир, ги-
дролизуется лактоназой. Глюконат-6-фосфат,
который образуется в этой реакции, затем окис-
ляется до рибулозо-5-фосфата с участием фер-
мента глюконат-6-фосфатдегидрогеназы. Эта
реакция идет с выделением СО2 и образованием
НАДФН.
В окислительном пентозофосфатном пути
ксилулозо-5-фосфат образуется из рибулозо-5-
Глюкозо-6-фосфат
НАДФ®
НАДФН +Н®
6-фосфоглюконолактон
Глюконат-6-Ф
НАДФ^
НАДФН
Рис. 6.21. Окислительный
пентозофосфатный путь
Г люкозо-6-фосфат-
дегидрогеназа
Лактоназа
Гл юконат-6-фосфат-
дегидрогеназа
НАДФ® НАДФН + Н® Н2О Н®
но-с-н о
I
н-с-он
I
н-с-----
Н-С-О—®
НО-С-Н О
I
н-с-он
I
н-с-----
н-с-о-®
н н
НАДФ® НАДФН
со2
/О
^с н
I I
н-с-он н-с-он
I I
но-с-н с=о
I I
н-с-он н-с-он
I I
н-с-он н-с-он
н-с-о-® н-с-о-®
н н
Глюкозо-
6-фосфат
6-Фосфоглю-
конолактон
Глюконат-
6-фосфат
Рибулозо-
5-фосфат
Рис. 6.22. Две окислительные реакции пентозофосфатного пути
Н
I
н-с-он
I
с=о
I
но-с-н
I
н-с-он
I
н-с-он
I --------►
н-с-он
I
н-с-о-®
I
н
Седогептулозо-
7-фосфат
Н. ^о
С^
I
н-с-он +
I
н-с-он
н-с-о-©
н
Н
I
н-с-он
I
с=о
I
но-с-н
I
н-с-он
I
н-с-он
I
н-с-о-©
н
Эритрозо-
4-фосфат
Фруктозо-
6-фосфат
Рис. 6.23. Трансальдолаза катализирует перенос С3-фрагмент с кетона на
альдегид. Реакция обратима. Механизм реакции такой же, как и с альдолазой,
с тем отличием, что после разрыва С—С связи С3-фрагмент остается связанным
с ферментом и высвобождается только после переноса на глицеральдегидфосфат
6.6. Восстановительный и окислительный пентозофосфатные пути регулируются
159
фосфатас помощью фермента рибулозофосфат-
эп и мер азы, а из рибозо-5-фосфата — с помощью
рибозофосфатизомеразы.
Эти два продукта дальше превращаются в
седогептулозо-7-фосфат и глицеральдегид-3-
фосфат под действием транскетолазы. Эта
последовательность реакций является обраще-
нием восстановительного пентозофосфатного
пути. Дальнейшая последовательность реакций
специфична для окислительного пути: транс-
альдолазный перенос нефосфорилирован-
ного С3-остатка с седогептулозо-7-фосфата
на глицеральдегид-3-фосфат с образованием
фруктозо-6-фосфата и эритрозо-4-фосфата
(рис. 6.23). Механизм реакции в целом такой же,
как в альдолазной реакции (см. рис. 6.13), раз-
личие лишь в том, что после разрыва С-С свя-
зи оставшийся С3-остаток связан с ферментом
через Шиффово основание до тех пор, пока он
не будет перенесен. Эритрозо-4-фосфат реаги-
рует с другой молекулой ксилулозо-5-фосфата
в транскетолазной реакции с образовани-
ем глицеральдегид-3-фосфата и фруктозо-6-
фосфата. Таким образом, два гексозофосфата и
один триозофосфат образуются из трех пенто-
зофосфатов:
ЗС5—Р#2С6— Р+ 1 С3—Р
Эта цепь реакций обратима, что позволяет
клетке производить рибозо-5-фосфат для био-
синтеза нуклеотидов даже тогда, когда нет по-
требности НАДФН.
В окислительном пути при окислении
глюкозо-6-фосфата образуются две молекулы
НАДФН и выделяется одна молекула СО2, в то
время как в восстановительном пути фиксация
молекулы СО2 требует не только двух молекул
НАДФН, но и трех молекул АТФ (рис. 6.24).
Такой расход энергии позволяет восстанови-
тельному пентозофосфатному пути идти в на-
правлении, противоположном окислительному
пути, с очень высокой скоростью.
Рис. 6.24. Одновременное протекание восстановительного и окислительного
пентозофосфатных путей привело бы к бесполезной растрате АТФ
160
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
6.6. Восстановительный
и окислительный
пентозофосфатные пути
регулируются
Ферменты и восстановительного, и окисли-
тельного путей локализованы в строме хлоро-
пластов (см. рис. 6.24). Одновременное функ-
ционирование обоих метаболических путей, в
одном из которых молекула СО2 восстанавли-
вается до углеводного остатка за счет гидроли-
за трех молекул АТФ и двух НАДФН, а в другом
углеводный остаток вновь окисляется до СО2,
и при этом образуются две молекулы НАДФН,
представляло бы из себя бесполезный цикл, при
каждом обороте которого впустую растрачива-
ются три молекулы АТФ. Такую ситуацию пре-
дотвращает метаболическая регуляция, которая
обеспечивает работу основных ферментов вос-
становительного пути только при освещении и
их инактивацию в темноте, тогда как основные
ферменты окислительного пути активны только
в темноте.
Восстановленные тиоредоксины
передают «сигнал об освещении»
ферментным белкам
Важный сигнал о том, что клетка получает поток
света, достаточный для фотосинтеза, передается
от фотосинтетической электронтранспортной
цепи в форме восстановленного тиоредокси-
на (рис. 6.25). Электроны переносятся с ферре-
доксина на тиоредоксин с помощью фермента
ферредоксин-тиоредоксинредуктазы, которая
представляет собой железосерный белок 4Fe-4S
типа.
Тиоредоксины — семейство маленьких бел-
ков, состоящих примерно из 100 аминокислот,
активная группировка которых образована по-
следовательностью Cys-Gly-Pro-Cys, располо-
женной на периферии белка. Благодаря близ-
кому расположению цистеиновых остатков,
тиоредоксин может находиться в двух редокс-
состояниях: восстановленный тиоредоксин с
двумя SH-группами (дитиольная форма) и
окисленный тиоредоксин, у которого два ци-
стеина связнаны дисульфидной связью (S-S-
мостик).
Свет
— S
I
— S
Неактивный
(активный)
фермент
Активный
(неактивный)
фермент
Рис. 6.25. Регуляция активности белков
хлоропластов светом опосредована
восстановленным тиоредоксином
6.6. Восстановительный и окислительный пентозофосфатные пути регулируются
161
Тиоредоксины были найдены у всех живых
организмов от археабактерий до растений и
животных. Они функционируют как оксидо-
редуктазы дисульфидной связи в белках, т.е.
восстанавливают дисульфидные связи в белках-
мишенях до SH-формы или окисляют их обрат-
но до S-S формы. Несмотря на свой маленький
размер, эти белки имеют довольно высокую
субстратную специфичность. Тиоредоксины в
качестве электронных переносчиков принима-
ют участие в восстановлении как высоко-, так и
низкомолекулярных веществ (например, в вос-
становлении рибонуклеотидов до дезоксирибо-
нуклеотидов, восстановлении сульфата, которое
происходит в клетках растений и у микроорга-
низмов (раздел 12.1); а также в восстановитель-
ной активации белков семян при прорастании).
Известно большое число самых разнообраз-
ных процессов, в которых тиоредоксины играют
важную роль, например, сборка бактериофагов
и действие гормонов на свертываемость крови у
животных. Участие тиоредоксинов в регуляции
хлоропластных ферментов светом можно рас-
сматривать как специализированную функцию,
которую они выполняют помимо универсаль-
ных метаболических функций.
Хлоропластные ферменты рибулозофосфат-
киназа, седогептулозе-1,7-бисфосфатаза и
хлоропластная изоформа фруктозо-1,6-бисфос-
фатазы переводятся из неактивного состояния
в активное при помощи восстановленного тио-
редоксина, и, таким образом, активируются при
освещении. Это также относится к ряду других
хлоропластных ферментов, таких, как НАДФ-
малатдегидрогеназа (раздел 7.3) и F-АТФаза
(раздел 4.4). Восстановленный тиоредоксин так-
же участвует в переводе активазы RubisCO
(раздел 6.2) и НАДФ-глицеральдегидфосфат-
дегидрогеназы, содержащихся в хлоропластах,
из менее активного состояния в более активное.
С другой стороны, восстановленный тиоредоксин
инактивирует глюкозо-6-фосфатдегидрогеназу,
первый фермент окислительного пентозофосфат-
ного пути.
Активация хлоропластных ферментов
тиоредоксином происходит благодаря
встроенному регуляторному домену
Важная информация о механизмах действия
тиоредоксина на хлоропластные ферменты была
получена при их сравнении с соответствующими
изоферментами из других клеточных компар-
тментов. Изоферментные формы фруктозо-1,6-
бисфосфатазы и малатдегидрогеназы в цитозоле
не регулируются тиоредоксином. Это также от-
носится к F-АТФазе митохондрий. Сравнение
аминокислотной последовательности показало,
что, по крайней мере в некоторых случаях, у хло-
ропластных изоферментов есть дополнитель-
ные участки (домены), содержащие два цисте-
иновых остатка, на конце или в средней части
аминокислотной последовательности (рис. 6.26).
SH-группы этих цистеиновых остатков могут
при окислении превращаться в дисульфид и,
таким образом, становятся субстратом для дис-
ульфидоксидоредуктазной активности тиоредо-
ксина.
Изоферменты, которые не регулируются
тиоредоксином и, соответственно, не содержат
этих дополнительных последовательностей, ча-
сто имеют более высокую активность, чем те,
которые регулируются тиоредоксином. Заме-
на цистеиновых остатков, вовлеченных в регу-
ляторный процесс, на другие аминокислоты с
помощью генетической инженерии (глава 22)
приводило к постоянной активности фермен-
тов (даже в отсутствие восстановленного тиоре-
доксина). В окисленном состоянии ферменты,
регулируемые тиоредоксином, за счет образо-
। .Ж....................... zz
Фруктозо-1,6-бисфосфатаза
НАДФ-малатдегидрогеназа
I И
F-АТФаза (у-субъединица)
О 100 200 300 400
Номера аминокислот
в последовательности полипептида
Рис. 6.26. В отличие от непластидных
изоферментов, некоторые хлоропластные
белки, регулируемые тиоредоксином, содержат
в аминокислотной последовательности
дополнительные участки-домены (обозначены
красным), в которых расположены два остатка
цистеина (по Scheibe, 1990)
162
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
вания дисульфидного мостика принимают кон-
формацию, в которой каталитический центр
инактивирован. Восстановление этого мостика
тиоредоксином снимает блок, и фермент при-
нимает конформацию, в которой каталитиче-
ский центр активен.
Активация ферментов светом, которая обсуж-
далась до сих пор, не относится к эффектам типа
«все или ничего». Активность ферментов опре-
деляется равновесием между восстановлением
ферментного белка тиоредоксином и его после-
дующим окислением. Уровень активации фер-
мента зависит от уровня восстановленное™, а он
определяется не только уровнем восстановленно-
сти тиоредоксина (а значит, уровнем восстанов-
ленное™ ферредоксина), но также присутствием
различных метаболитов1. Так, например, вос-
становительная активация фруктозо- и седогеп-
тулозобисфосфатаз усиливается в присутствии
соответствующих бисфосфатов. Эти эффекто-
ры вызывают снижение редокс-потенциала SH-
групп соответствующих белков, а это усиливает
восстановление дисульфидных групп тиоредок-
сином. Таким образом, активность этих фермен-
тов повышается, когда повышается концентрация
субстрата. С другой стороны, восстановительная
активация НАДФ-малатдегидрогеназы снижается
в присутствии НАДФ+. Это приводит к тому, что
фермент активен только при высоком соотноше-
нии НАДФН/НАДФ+. Окислительная активация
глюкозо-6-фосфатдегидрогеназы, наоборот, уси-
ливается в присутствии НАДФ+, а значит, актив-
ность окислительного пентозофосфатного пути
увеличивается, когда клетка ощущает недостаток
НАДФН.
Многоуровневая регуляция обеспечивает
согласованность разных этапов
восстановительного пентозофосфатного
пути
Дополнительная световая регуляция цикла Каль-
вина основана на влиянии светозависимых изме-
нений концентрации протонов и Mg2+ в строме
на активность хлоропластных ферментов. При
освещении изолированных хлоропластов закисле-
ние тилакоидного пространства (глава 3) сопрово-
1 Важную роль играет соотношение активной и неактив-
ной форм фермента, скорость синтеза и деградации соот-
ветствующего белка, а также наличие нескольких сайтов
регуляции ферментативной активности (аллостерическая
регуляция). — Прим. ред.
ждается защелачиванием и повышением концен-
трации Mg2+ в строме. При переносе из темноты
на свет pH в строме может измениться с 7,2 до 8,0.
Фиксация СО2 в выделенных хлоропластах име-
ет оптимум при pH 8,0 с резким снижением при
переходе в более кислую область. Почти такая же
pH-зависимость была обнаружена у светозависи-
мых ферментов фруктозо- 1,6-бисфосфатазы и
седогептулозо-1,7-бисфосфатазы. Более того,
каталитическая активность этих двух ферментов
повышалась при светозависимом повышении кон-
центрации Mg2+ в строме. Активация этих фер-
ментов на свету через тиоредоксиновую систему
вместе с повышением ферментативной активно-
сти за счет светозависимых сдвигов pH и концен-
трации Mg2+ в строме представляет собой очень
эффективную систему для включения и выключе-
ния ферментов в зависимости от внутренних за-
просов клетки и внешних условий (освещение).
Активностьнекоторыхстромальныхферментов
также регулируется концентрациями метаболи-
тов. Хлоропластная фруктозо-1,6-бисфосфатаза
и седогептулозо-1,7-бисфосфатаза ингибиру-
ются соответствующими продуктами: фруктозо-
б-фосфатом и седогептулозо-7-фосфатом. Это
может уменьшать активность ферментов в том
случае, если их продукты накапливаются. Рибу-
лозофосфаткиназа ингибируется 3-фосфоглице-
риновой кислотой, а также АДФ. Ингибирование
в присутствии АДФ важно для координирования
двух киназных реакций восстановительного пен-
тозофосфатного пути. В то время как рибулозо-
фосфаткиназа катализирует необратимую реак-
цию, реакция фосфоглицераткиназы обратима.
Если бы обе реакции конкурировали за АТФ без
какой бы то ни было внешней регуляции, то в
случае дефицита АТФ необратимая реакция фос-
форилирования рибулозо-5-фосфата имела бы
преимущество, что привело бы к разбалансировке
цикла Кальвина. Снижение активности рибуло-
зофосфаткиназы при повышении уровня АДФ2
предотвращает это нарушение.
Наконец, сильное ингибирование фрук-
тозо- 1,6-бисфосфатазы и седогептулозо- 1,7-
бисфосфатазы происходит при повышении
концентрации глицерата. Как будет показано
в разделе 7.1, глицерат — важный интермеди-
2 А также при сдвиге равновесия фосфоглицераткиназной
реакции в пользу исходного субстрата — 3-фосфоглицера-
та. — Прим. ред.
Дополнительная литература
163
НАДФ®
НАДФН
TR В
АТФ Б
З-Фосфоглицерат Б
Рибулозо-5-фосфат
СО2
Глюконат-
6-фосфат
НАДФН+Н®
TR Б
нАДФ®а
НАДФ®
Глюкозо-
6-фосфат
Глюкозо-
6-фосфат-
дегидрогеназа
RubisCO
АТФ И
TR В
2х
АТФ Ш
З-Фосфоглицерат Б
ХрН □ Мд2® В
Рибулозо-1,5-бисфосфат
АДФ
АТФ
Рибулозо-
фосфат-
киназа
^Седогептулозо-
( 7-фосфат
Седогептулозо-
бис-
Ф \ I фосфатаза
Г 4
- Седогептулозо-
1,7-бисфосфат
TR □
АрН Б
Мд2® □
Г|ИцератБ
Фруктозо-
6-фосфат
З-Фосфоглицерат
2 АТФ
2 АДФ
2х 1,3-Бисфосфоглицерат
2 НАДФН
TR В
►2НАДФ®+2Ф
Глицеральде-
гидфосфат-
дегидрогеназа
2х Триозофосфат
Фруктозо-
1,6-бисфосфат
Фруктозо-
бис-
фосфатаза
Ф
TR В
В ДРН □
1 Мд20 В
Глицерат Б
Рис. 6.27. Регуляция восстановительного и окислительного пентозофосфатного
путей. Оба пути представлены в упрощенном виде. Обозначены лишь те ферменты,
регуляция которых описана в тексте. [+) повышение и [-] снижение относятся к
изменениям активности, которые вызываются действием факторов, отмеченных
красным, таких, как тиоредоксин (TR), светозависимое защелачивание стромы
(АрН), повышение концентрации Mg2+ в строме и присутствие метаболитов.
Регуляция RubisCO опосредована регуляцией активазы RubisCO
ат рециклирования фосфогликолата, который
образуется за счет оксигеназной активности
RubisCO. Эта регуляторная петля позволяет в
условиях накопления глицерата замедлить реге-
нерацию РуБФ и его карбоксилирование, а зна-
чит, и сопутствующее ему образование гликола-
та, предшественника глицерата.
Кроме того, RubisCO сама по себе является
объектом регуляции. Эксперименты с целыми
листьями показали, что уровень активности
RubisCO коррелирует с интенсивностью осве-
щения и скоростью фотосинтеза. Активное со-
стояние RubisCO обеспечивается регуляцией
активазы RubisCO (раздел 6.2). Активность
этого фермента регулируется тиоредоксином и
зависит от соотношения АТФ/АДФ. Когда это
отношение в строме поднимается, активность
активазы также возрастает. Считают, что таким
образом активность RubisCO подстраивается к
потребностям световых реакций фотосинтеза.
Как бы то ни было, многие наблюдения ука-
зывают на то, что этот механизм не может быть
единственным механизмом регуляции RubisCO
светом. Предположительно, активаза RubisCO
регулируется светозависимым протонным гра-
диентом на тилакоидной мембране. Кроме того,
активность RubisCO ингибируется продуктом ее
реакции — 3-фосфоглицератом. Таким образом,
активность RubisCO может быть уменьшена при
накоплении продукта реакции.
На рисунке 6.27 приведена схема влияния
различных факторов на активность ферментов
восстановительного и окислительного пентозо-
фосфатных путей. Широкое разнообразие регу-
164
6. В цикле Кальвина происходит фотосинтетическая ассимиляция СО2
ляторных процессов обеспечивает подстройку
этих двух путей к нуждам клетки на разных ста-
диях метаболизма.
Дополнительная литература
Allen, D. J., Ort, D. Impact of chilling temperature on
photosynthesis in warm-climate plants. Trends Plant Sci
6, 36-42 (2002).
Andralojc, P. J., Keys, A. J., Kossmann, J., Parry, M. A.
J. Elucidating the biosynthesis of 2-carboxyarabinitol
I -phosphate through reduced expression of chloroplastic
fructose l.6-bisphosphate phosphatase and radiotracer
studies with l4CO2. Proc Natl Acad Sci USA 99, 4742—
4747 (2002).
Balmer, Y., Koller, A., del Vai, G., Manieri, W.,
Schuermann, P., Buchanan, В. B. Proteomics gives
insight into the regulatory function of chloroplast
thioredoxins. Proc Natl Acad Sci USA 7, 370—375
(2003).
Dai, S., Schwendtmayer, C., Schiirmann, P., Ramaswamy,
S., Eklund H. Redox signaling in chloroplasts: cleavage
of disulfides by an iron-sulfur cluster. Science 287, 655—
658 (2000).
Edwards, G., Walker, D. A. C3, C4; Mechanisms
and Cellular and Environmental Regulation of
Photosynthesis. Blackwell Scientific Publications,
Oxford, UK(l983).
Furbank, R. T., Taylor. W. C. Regulation of photosynthesis
in C3 and C4 plants. Plant Cell 7, 797—807 (1995).
Fliigge, U.-L Phosphate translocators in plastids. Annu
Rev Plant Physiol Plant Mol Biol 50, 27—46 (1999).
Gutteridge, S., Gatenby, A. RubisCO synthesis, assembly,
mechanism and regulation. Plant Cell 7, 809—819
(1995).
Kelly, G., J. Photosynthesis: carbon metabolism from
DNA to deoxyribose. Prog Bot 62, 238—265 (2001).
Roy, H., Andrews, T. J. RubisCO: Assemblyandmechanism.
In Photosynthesis: Physiology and Metabolism. R. C.
Leegood, T. D. Sharkey, S. von Caemmerer (eds.), pp.
53—83. Kluwer Academic Publishers, Dordrecht, The
Netherlands (2000).
Ruelland, E., Miginiac-Maslow, M. Regulation of
chloroplast enzyme activities by thioredoxins: Activation
or relief from inhibition? Trends Plant Sci 4, 136—141
(1999).
Schnarrenberger, C., Flechner, A., Martin, W. Enzymatic
evidence for a complete oxidative pentose pathway in
chloroplasts and an incomplete pathway in the cytosol
of spinach leaves. Plant Physiol 108, 609—614 (1995).
Schiirmann P., Jacquot, J.-P. Plant thioredoxin systems
revisited. Annu Rev Plant Physiol Plant Mol Biol 51,
371-400 (2000).
Spreitzer,R. J., Salvucci, M. E. RubisCO: structure,
regulatory interactions and possibilities for a better
enzyme. Annu Rev Plant Biol 53, 449—475 (2002).
Stitt, M. Metabolic regulation of photosynthesis. In:
Advances in Photosynthesis, Vol. 5. Environmental
Stress and Photosynthesis. N. Baker (eds.), pp. 151 — 190.
Academic Press, New York (1997).
Von Caemmerer, S., Quick, W. P. RubisCO: Physiology in
vivo. In Photosynthesis: Physiology and Metabolism. R.
C. Leegood, T. D. Sharkey, S. von Caemmerer (eds.),
pp. 85—113. Kluwer Academic Publishers, Dordrecht,
The Netherlands (2000).
Zhang, N., Kallis, R. P. Ewy, R. G., Portis, A. R. Light
modulation of RubisCO in Arabidopsis requires a ca-
pacity for redox regulation of the larger RubisCO acti-
vase isoform. Proc Natl Acad Sci USA 5, 3330—3334
(2002).
При фотодыхании происходит рециклирование
фосфогликолата, образовавшегося
в результате оксигеназной активности RubisCO
В разделе 6.2 мы говорили о том, что зна-
чительные количества 2-фосфогликолата
образуются как побочный продукт при фикса-
ции СО2 в результате оксигеназной активности
RubisCO. В процессе фотодыхания, открытом в
1972 году американским ученым Эдвардом Тол-
бертом, побочный продукт 2-фосфогликолат
рециклируется до рибулозо- 1,5-бисфосфата.
Термин «фотодыхание» указывает на то, что в
результате фотодыхания на свету наблюдается
поглощение кислорода, которое сопровожда-
ется выделением углекислого газа. Но если при
митохондриальном дыхании (клеточное дыха-
ние, глава 5) окисление субстратов до СО2 слу-
жит для получения АТФ, то в процессе фотоды-
хания, напротив, происходит гидролиз АТФ.
7-1 - Рибулозо-1,5-бисфосфат
регенерирует из 2-фосфогликолата
На рисунке 7.1 представлена общая схема реак-
ций фотодыхания и их локализация в клетке.
Рециклирование 2-фосфогликолата начинает-
ся с отщепления фосфорного остатка, которое
катализирует фосфогликолатфосфатаза, ло-
кализованная в строме хлоропластов (рис. 7.2).
Продукт этой реакции — гликолат — выносится
из хлоропластов с помощью специфического
транспортера, расположенного во внутренней
мембране, и поступает в пероксисомы через не-
специфические поры в их мембранах, которые,
предположительно, образованы порином (раз-
дел 1.11).
В пероксисомах спиртовая группа гликолата
окисляется до карбонильной группы в необра-
тимой реакции, катализируемой гликолатокси-
дазой. В результате реакции образуется глиок-
силат. Электроны передаются на молекулярный
кислород с образованием Н2О2 (см. рис. 7.2).
Как и другие оксидазы, образующие перекись
водорода, гликолатоксидаза содержит кофак-
тор флавинмононуклеотид (ФМН, рис. 5.16),
который функционирует как редокс-посредник
между гликолатом и кислородом. Н2О2, образо-
вавшаяся в этой реакции, разлагается до кис-
лорода и воды ферментом каталазой, которая
находится в пероксисомах. Суммарно для окис-
ления одного моля гликолата до глиоксилата
потребляется 0,5 моля О2.
Образовавшийся глиоксилат превращается в
аминокислоту глицин в двух реакциях, происхо-
дящих в пероксисоме одновременно в соотноше-
нии 1:1. Фермент глутамат-глиоксилатамино-
трансфераза катализирует перенос аминогруппы
от донора (глутамата) на акцептор — глиоксилат.
Этот фермент также может использовать в каче-
стве донора аминогруппы аланин. В другой реак-
ци и фермент сери н - гл иоксил атам и нотрансфераза
катализирует переаминирование глиоксилата се-
рином. Эти два фермента, как и другие амино-
трансферазы (например, глутамат-оксалоацетат-
аминотрансфераза, раздел 10.4), содержит
связанный пиридоксальфосфат с активной аль-
дегидной группировкой (рис. 7.3). Механизм ре-
акций изображен на рис. 7.4.
Аминированный продукт — глицин — вы-
ходит из пероксисом через поры и транспор-
тируется в митохондрии. Хотя механизм это-
го транспорта еще детально не исследован,
предполагают, что он происходит с участием
специфического переносчика. В митохондри-
ях две молекулы глицина окисляются с об-
разованием одной молекулы серина и вы-
делением СО2 и NH4+. При этом происходит
восстановление НАД+ (рис. 7.5). Окисление гли-
цина катализируется глициндекарбоксилазо-
166
7. При фотодыхании происходит рециклирование фосфогликолата...
ХЛОРОПЛАСТ
NH3
2 Ферредоксин 2 Ферредоксин
восстановленный окисленный
АТФ АДФ + Ф
Рибулозо-
АДФ
АТФ
НАДФ®
АДФ + Ф
НАДФН +Н©
гликолат глицерат
АТФ
АДФ
^^АТФ
2 Гликолат
Глицерат
НАД©
НАДН + Н®
2Н2О-»-2Н2О2'*Л,
+ ^2 2Глиоксилат
Г идрокси пируват
2 Глицин Серин
МИТОХОНДРИЯ
НАД® НАДН
СО2 + NH®
Рис. 7.1. Компартментация фотодыхания. На схеме не показаны наружные
мембраны хлоропластов и митохондрий, которые неспецифически проницаемы
для метаболитов благодаря наличию поринов. Т — переносчик. Переносчики для
глицина и серина ешё не идентифицированы. Токсичные продукты пероксисом
выделены цветом
серингидроксиметилтрансферазным ком-
плексом. Этот мультиферментный комплекс
состоит из четырех различных субъединиц
(рис. 7.7), которые имеют значительное сход-
ство с пируватдегидрогеназным комплексом,
описанным в разделе 5.3. Н-белок представ-
7.1. Рибулозо-1,5-бисфосфат регенерирует из 2-фосфогликолата
167
Глутамат-глиоксил ат-
аминотрансфераза
Фосфогликолат-
фосфатаза
Гликолат-
оксидаза
Серин-глиоксилат-
аминотрансфераза
СООе
н-С-о-РО32е
н
2-фосфогликолат
Глутамат а-Кетоглутарат или
или серин гидроксипируват
СООе
I
н-с-он
I
н
Гликолат
Рис. 7.2. Последовательность превращений 2-фосфогликолата, приводящих
к образованию глицина
ляет собой центр глициндекарбоксилазного
комплекса, его простетическая группа — амид
липоевой кислоты (см. рис. 5.5). Вокруг это-
го центра расположены Р-белок, содержащий
пиридоксальфосфат, Т-белок, содержащий те-
трагидрофолат (рис. 7.6), и L-белок (который
также называют дигидролипоилдегидрогена-
зой), идентичный дигидролипоилдегидрогена-
зе пируват- и а-кетоглутаратдегидрогеназных
комплексов (см. рис. 5.4 и 5.8). Поскольку дис-
ульфидная группа амида липоевой кислоты в
Н-белке расположена на конце подвижной по-
липептидной цепи (см. рис. 5.4), она может реа-
гировать с тремя другими субъединицами. На
рисунке 7.7 показана последовательность реак-
ций. Фермент серингидроксиметилтрансфера-
за, который находится в непосредственной бли-
зости от глициндекарбоксилазного комплекса,
катализирует перенос формильного остатка на
другую молекулу глицина, в результате чего об-
разуется серин.
НАДН, который образуется при окислении
глицина, может быть окислен в дыхательной
цепи митохондрий с образованием АТФ, или
экспортироваться из митохондрий за счет чел-
ночных механизмов в другие клеточные ком-
партменты, как будет обсуждаться в разделе 7.3.
Растительные митохондрии способны окислять
глицин в огромных количествах. Глициндекар-
боксилазный комплекс митохондрий может со-
ставлять до 30—50% всех растворимых белков
митохондрий в зеленых тканях. Однако в ми-
тохондриях нефотосинтезирующих клеток рас-
тений белки окисления глицина присутствуют
лишь в очень небольших количествах или вовсе
отсутствуют.
Серин, скорее всего, выходит из митохон-
дрий с участием специфического переносчи-
ка, возможно, того же самого, который обе-
спечивает поступление глицина. После того,
как серин входит в пероксисомы через поры в
мембране, он превращается в гидроксипиру-
ват с участием фермента серин-глиоксилат-
аминотрансферазы, которая уже упоминалась
ранее (рис. 7.8).
Рис. 7.3. Пиридоксальфосфат
168
7. При фотодыхании происходит рециклирование фосфогликолата...
а-Аминокислота
СООе
н—C-NH3 +
Пиридоксаль-
фосфат
Н
। х-X
О=с—(Руг)
а-Кетокислота
СООе
I
с=о +
I
Пиридоксамин-
фосфат
Н
ф I
H3N—С—(Руг)
Н
Образование
Шиффова Н2О
основания
Гидролиз
Н2О Шиффова
основания
СООе Н
I е I
Н— C-N=C—(Ру?
I Н
Миграция двойной связи
СООе Н
C=N—С
। Н |
Рис. 7.4. Механизм аминотрансферазной реакции. Альдегидная группа
пиридоксальфосфата образует с а-аминогруппой аминокислоты (в случае глутамата
или серина) Шиффово основание (а), которое затем превращается в изомерную
форму (б) путем миграции протона. Гидролиз изомерного Шиффова основания
приводит к образованию а-кетокислоты (а-кетоглутарата или гидрокси пирувата), а
пиридоксамин остается (в). Аминогруппа пиридоксамина затем образует Шиффово
основание с другой а-кетокислотой (в данном случае с глиоксил атом), и при
обращении шагов а, би а образуется глицин. Пиридоксаль при этом регенерирует и
оказывается готов к следующему реакционному циклу
Глициндекарбоксилазо-серингидрокси-
метилтрансферазный комплекс
соое
I ф
H-C-NH3
н
соо°
I ф
H-C-NH3
Н
2 Глицин
соое
I ffi
H-C-NH3
н-с-он
I
н
Серин
Рис. 7.5. Суммарное уравнение реакции
превращения двух молекул глицина с образованием
одной молекулы серина, катализируемой
глициндекарбоксилазным комплексом
Тетрагидрофолат
О
II
С — N—
Н
\ ^СН2
(пара-Амино-
Д бензойная
' 2 кислота)
(Птеридин)
А/5, Л/10-Метилентетрагидрофолат
Рис. 7.6. Тетрагидрофолат и его метилированная
форма
соое
I
с- н
I
сн2
сн2
соое
(Глутамат)
соое соое
I ф I ф
н—с—NH3 н— с—NH®
Н Н— С—ОН
Глицин Н Серин
Рис. 7.7. Механизм образования молекулы серина из двух молекул глицина. Сначала
аминогруппа глицина реагирует с альдегидной группой пиридоксаля Р-белка с образованием
Шиффова основания (а). Остаток глицина затем декарбоксилируется и передается с Р-белка на
остаток липоевой кислоты Н-белка (б). Затем С] остаток окисляется до формильной группы,
а остаток липоевой кислоты восстанавливается додигидролипоевой кислоты. Замещенная
дигидролипоевая кислота, в свою очередь, реагирует с Т-белком, формильный остаток передается
на тетрагидрофолат, а остаток дигидролипоевой кислоты остается (в). Дигидролипоевая кислота
окисляется до липоевой кислоты с помощью L-белка (дигидролипоилдегидрогеназы), и при этом
НАД4 восстанавливается до НАДН (г). Затем может начаться следующий цикл. Формильный
остаток, связанный с тетрагидрофолатом, передается на вторую молекулу глицина серин-
гидроксиметилтрансферазой, и при этом образуется конечный продукт — серин (д)
170
7. При фотодыхании происходит рециклирование фосфогликолата...
Серинглиоксилат-
аминотрансфераза
Гидроксипируват-
редуктаза
Серин
Гидроксипируват
D-глицерат
Глицерат-
киназа
АТФ АДФ
соо°
I
н-с-он
Н-с-о- РОз°
З-Фосфоглицерат
Рис. 7.8. Последовательность реакций образования 3-фосфогл и церата из серина
За счет окисления НАДН гидроксипируват
восстанавливается гидроксипируватредукта-
зой до глицерата, который выходит из перокси-
сом и импортируется в хлоропласты.
Вход глицерата в хлоропласты осуществляется с
участием того же переносчика, который обеспечи-
вает выход из хлоропластов гликолата (гликолат-
глицератный переносчик). Этот переносчик осу-
ществляет обмен гликолата на глицерат, а также
котранспорт гликолата с протоном. Таким обра-
зом, этот переносчик делает возможным экспорт
двух молекул гликолата в обмен на импорт одной
молекулы глицерата. Глицерат фосфорилирует-
ся глицераткиназой, локализованной в строме
хлоропластов, с использованием АТФ. При этом
образуется 3-фосфоглицерат, который затем пре-
вращается в рибулозо-1,5-бисфосфат в восстано-
вительном пентозофосфатном пути (разделы 6.3,
6.4). Этими реакциями завершается рециклирова-
ние 2-фосфогликолата.
7.2. NH4+j который выделяется
в процессе фотодыхания,
затем вновь фиксируется
в хлоропластах
Азот является важным элементом питания, ко-
торый часто лимитирует рост растений. Поэтому
для экономичного растительного метаболизма
важно, чтобы весь аммоний, который в больших
количествах выделяется в фотодыхательном пути
при окислении глицина, вновь фиксировался.
Процесс повторной фиксации происходит в хло-
ропластах и катализируется теми же ферментами,
которые участвуют в ассимиляции нитрата (гла-
ва 10). Тем не менее скорость повторной фикса-
ции аммония в фотодыхательном пути в 5—10 раз
выше, чем скорость его фиксации в процессе ас-
симиляции нитрата.
В растительной клетке хлоропласты и ми-
тохондрии обычно расположены близко друг
к другу. NH4+, образованный при окислении
глицина, проходит через внутреннюю мембра-
ну митохондрий и хлоропластов. Происходит
ли это просто за счет диффузии, осуществляет-
ся ли транспорт с помощью переносчиков или
через каналы, пока еще не выяснено. Фермент
глутаминсинтетаза, который присутствует
в строме хлоропластов, катализирует переда-
чу иона аммония на 5-карбоксильную группу
глутамата (рис. 7.9) с образованием глутамина.
Эта реакция происходит за счет гидролиза
одной молекулы АТФ до АДФ и фосфата. На
промежуточном этапе 5-карбоксильная группа
активируется, реагируя с АТФ с образованием
карбокси -фосфатного ан гидрида. Гл утам и н -
синтетаза имеет высокое сродство к NH4+ и ре-
акция, которую она катализирует, практически
необратима. Этот фермент играет ключевую
роль в фиксации NH4+ не только у растений, но
также у бактерий и животных.
Азот, который фиксируется в форме амида в
молекуле глутамина, передается на а-кетоглутарат
путем восстановительного трансаминирования
(см. рис. 7.9). В этой реакции, которая катализи-
руется глутаматсинтазой1, образуются две мо-
лекулы глутамата. Восстановление происходит с
участием двух восстановленных ферредоксинов,
которые образовались в фотосинтетическом
1 По современной номенклатуре ГОГАТ : глутаминоксо-
глутаратаминотрансфераза. — Прим. ред.
7.3. Для восстановления гидрокси пирувата необходимы восстановительные эквиваленты
171
Глутаматсинтаза
/О° /Ое
а-Кетоглутарат С С Глутамат
С=О H-C-NH3
н-с-н н-с-н
I I
Рис. 7.9. Последовательность реакций при фиксации аммония с последующим
образованием глутамата из а-кетоглутарата
электронном транспорте (см. раздел 3.8). В зеле-
ных клетках растений глутаматсинтаза располо-
жена исключительно в хлоропластах.
Из двух молекул глутамата, которые образу-
ются при трансаминировании, одна молекула
может экспортироваться из хлоропластов с по-
мощью глутамат-малатного переносчика в об-
мен на малат и затем, войдя в пероксисомы, стать
субстратом в реакции трансаминирования глиок-
силата. Образующийся при этом а-кетоглутарат
может вновь переноситься из пероксисом в хло-
ропласты с участием малат-а-кетоглутаратного
переносчика в обмен на малат.
7.3. Для восстановления
гидроксипирувата необходима
поставка восстановительных
эквивалентов в пероксисомы
НАДН — восстановитель, необходимый для
конверсии гидроксипрувата в глицерат, которая
происходит в пероксисомах. Поскольку в клет-
ках листа пероксисомы лишены метаболиче-
ского пути, который обеспечивал бы поставку
НАДН в необходимом количестве, они зависят
от поставки восстановительных эквивалентов,
синтезированных в других компартментах.
172
7. При фотодыхании происходит рециклирование фосфогликолата...
Восстановительные эквиваленты
вносятся в пероксисомы через
малат-оксалоацетатный челнок
Обычно цитозольный пул НАДН окислен в та-
кой мере (НАДН/НАД+=Ю-3), что концентрация
НАДН в цитозоле составляет примерно Ю 6 М.
Столь низкая концентрация не позволила бы
поддерживать градиент, обеспечивающий интен-
сивные диффузионные токи НАДН в перокси-
сомы. Поэтому восстановительные эквиваленты
вносятся в пероксисомы косвенно, путем обмена
малата на оксалоацетат (так называемый малат-
оксалоацетатный челнок) (рис. 7.Ю).
Малатдегидрогеназа (см. рис. 5.9), которая
катализирует обратимую реакцию окисления
малата до оксалоацетата, играет ключевую роль
в челночном обмене восстановительными экви-
валентами. Высокая активность малатдегидроге-
назы обнаружена в цитозоле, хлоропластах, мито-
хондриях и пероксисомах. Малатде гидрогеназы в
разных клеточных компартментах являются изо-
ферментами. У них есть различия в структуре и
они кодируются различными, но гомологичными
генами. Очевидно, это родственные белки, ко-
торые возникли в процессе эволюции от общей
предковой формы. Однако малатдегидрогеназы
в цитозоле, митохондриях и пероксисомах ис-
пользуют НАДН, а хлоропластный изофермент
реагирует с НАДФН.
Рис. 7.10. Схема челночного переноса восстановительных эквивалентов из
хлоропластов и митохондрий в пероксисомы. МДГ — малатдегидрогеназа
7.3. Для восстановления гидрокси пирувата необходимы восстановительные эквиваленты
173
СТРОМА ХЛОРОПЛАСТА
ЦИТОЗОЛЬ
З-Фосфоглицерат
З-Фосфоглицерат
Фосфо-
гл и церат-
киназа
НАДФ® -
Глицераль-
дегидфосфат-
дегидрогеназа
Триозо-
фосфат-
изомераза
Фосфо-
гл и церат-
киназа
НАД® -Глицер-
альдегид-
фосфат-
дегидрогеназа
Триозо-
фосфат-
изомераза
Дигидроксиацетонфосфат
Дигидроксиацетонфосфат
Рис. 7.11. Триозофосфат-З-фосфоглицератный челнок, работающий между
стромой хлоропластов и цитозолем. В строме хлоропластов триозофосфат
образуется из 3-фосфогл и церата с затратой АТФ и НАДФН. Триозофосфат
транспортируется через триозофосфатный переносчик через внутреннюю
мембрану в обмен на 3-фосфоглицерат. В цитозоле триозофосфат превращается
обратно в 3-фосфоглицерат, при этом образуются НАДН и АТФ
Восстановительные эквиваленты
экспортируются из митохондрий через
малат-оксалоацетатный челнок
В отличие от митохондрий клеток живот-
ных, внутренняя мембрана которых непро-
ницаема для оксалоацетата, в мембране рас-
тительных митохондрий есть специфический
малат-оксалоацетатный переносчик, который
обменивает малат на оксалоацетат. Посколь-
ку активность малатдегидрогеназы в матриксе
митохондрий очень высока, НАДН, образую-
щийся в митохондриях при окислении глици-
на, может быть использован для восстановле-
ния оксалоацетата до малата с последующим
его экспортом через малат-оксалоацетатный
челнок. Пропускная способность этого челноч-
ного механизма очень велика. Как можно ви-
деть на рис. 7.1, количество НАДН, генерируе-
мого в митохондриях при окислении глицина,
равно количеству НАДН, которое необходимо
для восстановления гидрокси пирувата в перок-
сисомах. Если все молекулы оксалоацетата, об-
разовавшиеся в пероксисомах, окажутся в мито-
хондриях, весь НАДН, который генерируется в
реакции окисления глицина, будет затрачен на
образование малата и больше не будет исполь-
зоваться для образования АТФ в дыхательной
цепи. Однако синтез АТФ в митохондриях во
время фотосинтеза необходим для энергоснаб-
жения цитозоля клеток мезофилла. На самом
деле митохондрии поставляют только полови-
ну восстановительных эквивалентов, необхо-
димых для восстановления гидроксипирувата в
пероксисомах. Другую половину обеспечивают
хлоропласты (рис. 7.Ю). Таким образом, только
половина НАДН, образовавшегося при окис-
лении глицина, отправляется на экспорт через
малат-оксалоацетатный челнок, оставшаяся
часть НАДН окисляется в дыхательной цепи с
образованием АТФ1.
1 Приведенное рассуждение стоит считать лишь одним из
вариантов реальной картины метаболизма. На самом деле
сценариев может быть несколько. Например, в мембране
митохондрий есть специальный малатный транспортер, ко-
торый обеспечивает поступление малата в обмен на фосфат.
В этом случае «подпитка» цикла Кребса позволяет более
полно использовать НАДН митохондрий. Малат (наряду с
пируватом) является одним из продуктов гликолиза расти-
тельных клеток. — Прим. ред.
174
7. При фотодыхании происходит рециклирование фосфогликолата...
«Малатный кран» контролирует экспорт
восстановительных эквивалентов из
хлоропластов
Хлоропласты также способны экспортировать
восстановительные эквиваленты через малат-
оксалоанетатный челнок. Малат и оксалоацетат
транспортируются через внутреннюю мембрану
хлоропласта с помощью специфического пере-
носчика, который работает в режиме антипорта.
Несмотря на высокую активность хлоропласт-
ного малат-оксалоацетатного челнока, между
хлоропластным и цитозольными пулами восста-
новительных эквивалентов существует резкий
градиент: соотношение НАДФН/НАДФ+ в хло-
ропластах более чем в сто раз выше, чем соотно-
шение НАДН/НАД+ в цитозоле. Хотя малатде-
гидрогеназы обычно катализируют обратимую
равновесную реакцию, восстановление окса-
лоацетата хлоропластной малатдегидрогеназой
практически необратимо и не достигает равно-
весия. Это связано с регуляцией хлоропластного
фермента.
В разделе 6.6 мы рассказали о том, что хло-
ропластная малатдегидрогеназа активируется
тиоредоксином и поэтому активна только на
свету. Кроме того, повышение концентрации
НАДФ+ ингибирует восстановительную акти-
вацию фермента тиоредоксином. НАДФ+ по-
вышает восстановительный потенциал регуля-
торных SH-групп малатдегидрогеназы и, как
следствие, восстановительная активация этого
фермента тиоредоксином тормозится. Наобо-
рот, снижение концентрации НАДФ+, которое
означает повышение уровня восстановленно-
сти пула НАДФН/НАДФ+, включает хлоро-
пластную малатдегидрогеназу. Это позволяет
ферменту функционировать подобно «крану»,
через который избыток восстановительных
эквивалентов может быть вынесен из хлоро-
пластов, предотвращая, таким образом, опас-
ную перевосстановленность переносчиков фо-
тосинтетической электрон-транспортной цепи.
В то же время, этот «кран» позволяет хлоропла-
стам обеспечивать восстановительными экви-
валентами реакцию восстановления гидрок-
сипирувата в пероксисомах и другие процессы
[например, восстановление нитрата в цитозоле
(раздел ЮЛ)].
Альтернативным путем экспорта восстано-
вительных эквивалентов из хлоропластов в цито-
зол ь я вл яется триозофосфат- 3 - фосфогл и церат-
ный челнок (рис. 7.И). С помощью этого челнока
в цитозольный компартмент поставляется не толь-
ко НАДН, но и АТФ.
7.4. Матрикс пероксисом —
специализированный
компартмент для утилизации
токсичных отходов
Возникает вопрос, почему кроме хлоропластов,
в рециклирование 2-фосфогликолата вовлечены
еще две органеллы? Преимущество восстановле-
ния глицина до серина в митохондриях заключа-
ется в том, что дыхательная цепь помогает ути-
лизировать образующийся НАДН для синтеза
АТФ. В процессе превращения гликолата в гли-
цин образуются два токсичных промежуточных
продукта: глиоксилат и Н2О2. При добавлении
низких концентраций перекиси водорода или
глиоксилата в суспензию выделенных хлоропла-
стов фотосинтез полностью ингибируется. Ин-
гибирующий эффект перекиси связан с окис-
лением SH-групп ферментов цикла Кальвина,
активируемых тиоредоксином (раздел 6.6), и их
инактивацией. Глиоксилат, очень реакционно-
способное карбонильное соединение, также
оказывает сильный ингибирующий эффект на
тиоредоксин-зависимые белки, за счет окисле-
ния их SH-групп. Глиоксилат также ингибирует
RubisCO. Компартментация превращения гли-
колата в глицин в пероксисомах вызвана необхо-
димостью переработки токсичных промежуточ-
ных продуктов глиоксилата и Н2О2 — в местах
их образования, чтобы они не выходили в другие
клеточные компартменты.
Как возможна такая компартментация? Ком-
партментация метаболических процессов в дру-
гих клеточных компартментах (например, в стро-
ме хлоропластов или в матриксе митохондрий)
осуществляется благодаря наличию мембран,
которые содержат специфические переносчики
для транспорта определенных метаболитов, но
непроницаемы для промежуточных продуктов.
Как бы то ни было, этот принцип не действует в
случае окисления гликолата, поскольку мембра-
ны обычно проницаемы как для Н2О2, так и для
глиоксилата. Поэтому мембрана сама по себе не
могла бы предотвратить утечку этих веществ из
пероксисом.
7.5. Насколько дорого обходится растениям оксигеназная активность RubisCO?
175
Высокая эффективность компартментации
превращения гликолата в глицин, а серина — в
глицерат связана с особыми свойствами матрик-
са пероксисом. Когда пограничная мембрана
хлоропластов и митохондрий повреждается (на-
пример, при кратковременном суспендировании
органелл в чистой воде, т.е. в условиях осмоти-
ческого шока), растворимые белки стромы и ма-
трикса, соответственно, выходят из органеллы,
чья целостность была нарушена. После повреж-
дения мембраны, отграничивающей перокси-
сому от других компартментов, белки матрикса
остаются агрегированными в форме крупных ча-
стиц, и компартментация пероксисомных реак-
ций поддерживается даже в такой стрессовой си-
туации. Глиоксилат, Н2О2 и гидроксипируват,
образующиеся в процессе окисления гликолата,
не выходят из частиц, полученных при удалении
мембраны пероксисом. Ферменты фотодыхатель-
ного пути собраны в пероксисомном матриксе в
мультиферментный комплекс, поэтому продукт
одной ферментативной реакции тут же связыва-
ется с ферментом следующей реакции и не может
диффундировать из комплекса.
Этот процесс, который называют метаболит-
ное туннелирование, скорее всего, имеет место
не только в матриксе пероксисом. Таким же об-
разом могут быть упорядочены и другие метабо-
лические пути [например, цикл Кальвина в стро-
ме хлоропластов (глава 6)]. Однако у пероксисом
есть и особое свойство: такой сложный мульти-
ферментный комплекс остается интактным по-
сле нарушения окружающей мембраны. Это мо-
жет быть защитным механизмом, необходимым
для того, чтобы гликолатоксидаза не оказалась в
цитозоле в случае повреждения пероксисомной
мембраны. Выход гликолатоксидазы привел бы
к окислению гликолата за пределами пероксисо-
мы и, как следствие, к отравлению клетки из-за
накопления продуктов реакции — глиоксилата и
Н2О2 — в цитозоле.
На случай утечки из пероксисом глиоксилата
и перекиси, которая может произойти, несмотря
на туннелирование, в цитозоле есть защитные
ферменты, которые используют НАДФН для
превращения глиоксилата в гликолат (НАДФН-
глиоксилатредуктаза) и гидроксипируват в гли-
церат (НАД ФН-гидроксипируватредуктаза).
Кроме того, глиоксилат может быть переработан
НАДФН-глиоксилат-редуктазой, которая есть в
хлоропластах.
7.5. Насколько дорого обходится
растениям оксигеназная
активность RubisCO?
Затраты АТФ и НАДФН (который является эк-
вивалентом двух восстановленных ферредокси-
Таблица 7.1. Затраты АТФ и НАДФН на карбоксилирование рибулозо-1,5-бисфосфата
(ассимиляцию СО2) и на оксигеназную реакцию RubisCO
Затраты (моль)
АТФ НАДФН или 2 восстанов- ленных ферредоксина
Карбоксилирование: Фиксация 1 моля СО2 1 СО2 -^0,33 триозофосфата 3 2
Оксигеназная реакция: 2 рибулозо-1,5-бисфосфат + 2О2 2 [3-фосфоглицерата] + 2 [2-фосфогликолата] 2 [2-фосфогликолата] 3-фосфо гл и церат + 1 СО2 2 1
1 СО2 0,33 триозофосфат 3 2
3 [3-фосфоглицерата] 3 триозофосфата 3 3
3,33 триозофосфата -> 2 рибулозо-1,5-бисфосфата 2
X 10 Х6
Оксигеназная реакция на 1 моль О2 5 3
176
7. При фотодыхании происходит рециклирование фосфогликолата...
Таблица 7.2. Дополнительные затраты на оксигеназную реакцию с участием
рибулозо-1,5-бисфосфата в отношении к затратам на фиксацию СО2
Отношение
Карбоксилирование/оксигенирование
2
4
Дополнительные затраты
АТФ НАДФН
83% 75%
42% 38%
нов) на оксигеназную и карбоксилазную реак-
ции RubisCO, вычисленные на основе схем на
рис. 6.20 и 7.1, представлены в табл. 7.1. Данные
показывают, что количество АТФ и НАДФН,
необходимое для компенсации последствий ок-
сигеназной реакции, гораздо больше, чем в слу-
чае карбоксилирования. При фиксации СО2 для
превращения СО2 в триозофосфат требуется три
молекулы АТФ и две молекулы НАДФН, а ок-
сигеназная реакция требует пяти молекул АТФ
и трех молекул НАДФН в расчете на одну моле-
кулу О2. В таблице 7.2 отражен дополнительный
расход АТФ и НАДФН при разных соотноше-
ниях карбоксилазной и оксигеназной реакций.
В листе, где это соотношение обычно составля-
ет от двух до четырех карбоксилазных реакций
на одну оксигеназную, дополнительный расход
НАДФН и АТФ для компенсации оксигеназной
реакции составляет более чем 50% от затрат на
фиксацию СО2. Таким образом, побочная ок-
сигеназная реакция RubisCO стоит растени-
ям более чем трети перенесенных через ти-
лакоидную мембрану протонов.
7.6. В точке углекислотной
компенсации суммарная
фиксация СО2 равна нулю
При соотношении карбоксилазной и оксиге-
назной реакций 1:2 суммарная фиксация СО2
равна нулю, поскольку количество углекислого
газа, зафиксированного в реакции карбокси-
лирования, равно количеству, которое выделя-
ется в процессе фотодыхания. Такую ситуацию
можно создать в эксперимменте, освещая рас-
тение в герметично замкнутой камере. Из-за
фотосинтеза количество СО2 в атмосфере сни-
жается до концентрации, при которой фикса-
ция и выделение СО2 уравновешиваются. Это
состояние получило название точки углекис-
лотной компенсации1. Хотя СО2 выделяет-
ся не только в фотодыхательном пути, но и в
других реакциях (например, в цикле Кребса в
митохондриях), его количества пренебрежимо
малы в сравнении с количеством углекисло-
го газа, которое выделяется при фотодыхании.
Растения, которые мы обсуждали до сих пор,
называют С3-растениями (этот термин отра-
жает тот факт, что первый продукт карбокси-
лирования — содержащий три атома углерода
3-фосфоглицерат). Концентрация СО2, при
которой С3-растения достигают точки углекис-
лотной компенсации, варьирует в пределах 35—
70 ppm 1 2 *, что соответствует примерно 10—20%
от средней концентрации СО2 в атмосфере.
В водной фазе, где находится RubisCO, это со-
ответствует концентрации СО2 1—210 6М при
25 °C. Для С4-растений, которые будут обсуж-
даться в разделе 8.4, концентрация СО2 в точке
углекислотной компенсации всего лишь 5 ppm.
Как этим растениям удается иметь столь низ-
кую точку углекислотной компенсации по срав-
нению с С3-растениями, мы подробно расска-
жем в разделе 8.4.
Когда растение находится в замкнутой си-
стеме, можно понизить концентрацию СО2 до
величины ниже точки углекислотной компен-
сации, например, захватывая его КОН. В этом
случае при освещении оксигеназная реакция
RubisCO и сопровождающее ее фотодыхание
приводит к суммарному высвобождению СО2 за
счет органических веществ растительной ткани,
которые разлагаются, чтобы обеспечить углево-
ды для регенерации рибулозо-1,5-бисфосфата.
1 Кроме того, есть точка световой компенсации, опреде-
ляемая как интенсивность потока квантов света, при кото-
рой уравновешены скорость фотосинтеза и клеточного ды-
хания (не путать с фотодыханием!). — Прим. ред.
2 Единица измерения ppm (pars pro million) — одна милли-
онная часть; 0,0001%. — Прим. ред.
7.7. Хотя фотодыхание требует затрат энергии, этот метаболический путь может быть полезен
177
В такой ситуации освещение растения вызывает
выделение СО2.
7.7. Хотя фотодыхание требует
затрат энергии, этот
метаболический путь может быть
полезен растению
Из-за значительных затрат АТФ и НАДФН
в процессе фотодыхания, в точке углекислот-
ной компенсации фотосинтетический мета-
болизм происходит с высокой скоростью, хотя
суммарной фиксации СО2 не происходит. Такая
ситуация наблюдается в том случае, если листья
находятся на ярком свету, а устьица закрыты
из-за недостатка влаги (раздел 8.1), и клетки не
могут поглощать СО2. Перевосстановленность
и избыточная энергия переносчиков фото-
синтетической электрон-транспортной цепи
может вызывать разрушение различных струк-
тур в хлоропластах (раздел 3.10). Растение ис-
пользует энергозатратный путь фотодыхания
для утилизации АТФ и НАДФН, которые об-
разовались в световых реакциях, но не могут
быть использованы для фиксации СО2. Фото-
дыхание, неизбежная побочная реакция фото-
синтеза, используется растением для защиты
фотосинтетического аппарата. Поэтому вполне
вероятно, что снижение оксигеназной актив-
ности RubisCO методами генной инженерии
(глава 22), которое пытались (пока безуспешно)
осуществить многие ученые, приведет не только
к более эффективному использованию энергии
растениями, но и к повышению их чувствитель-
ности к избыточному освещению в условиях не-
достатка влаги (Сомнительное предположение:
снижение оксигеназной активности приведет к
смещению точки углекислотной компенсации
в область более низких значений. Фотодыхание
все равно будет преобладать над фотосинтезом,
но с некоторой задержкой относительно обыч-
ных растений. — Прим, ред.) (глава 8).
Дополнительная литература
Baker, A., Graham, I. A. eds. Plant Peroxisomes. Kluwer
Academic Publishers, Dordrecht, The Netherlands
(2002).
Douce, R., Heldt, H. W. Photorespiration. In
Photosynthesis: Physiology and Metabolism. R. C.
Leegood, T. D. Sharkey, S., von Caemmerer (eds.), pp.
115—136. Kluwer Academic Publishers, Dordrecht, The
Netherlands (2000).
Douce, R., Bourrguignon, J., Neuburger, M., Rebeille,
E The glycine decarboxylase system: A fascinating
complex. Trends Plant Sci 6, 167—176 (2001).
Givan, С. V., Kleczkowski, L. A. The enzymic reduction
of glyoxylate and hydroxypyruvate in leaves of higher
plants. Plant Physiol 100, 552-556 (1992).
Husic, D. W., Husic H. D., Tolbert, N. E. The oxidative
photosynthetic carbon cycle or C2 cycle. CRC Critical
Reviews in Plant Sciences, Vol. 1, pp. 45—100, CRC
Press, Boca Raton (1987).
Husic, D. W., Husic H. D. The oxidative photosynthetic
carbon (C2) cycle: An update of unanswered questions.
Rev Plant Biochem and Biotechnol. 1, 33—56 (2002).
Kozaki, A., Takeba, G. Photorespiration protects C3 plants
from photooxidation. Nature 384, 557—560 (1996).
Reumann, S., Maier, E., Benz, R., Heldt, H. W. The
membrane of leaf peroxisomes contains a porin-like
channel. J Biol Chem 270, 17559-17565 (1995).
Reumann, S. The structural properties of plant peroxisomes
and their metabolic significance. Biol Chem 381, 639—
648 (2000).
Tolbert, N. E. Microbodies—peroxisomesandglyoxysomes.
In The Biochemistry of Plants, P. K. Stumpf and E. E.
Conn (eds.), Vol. 1, pp. 359—388, Academic Press, New
York (1980).
8
Фотосинтез сопряжен с потерями воды
Фотосинтез наземных растений неизбеж-
но связан с заметными потерями влаги,
поэтому он часто бывает лимитирован доступ-
ностью воды. В этой главе описываются био-
химические механизмы, которые позволяют
снизить потребность растений в воде, и таким
образом обеспечивают выживание некоторых
видов растений в условиях жаркого и засушли-
вого климата.
8.1. Поступление СО2 в ткани листа
сопровождается испарением воды
Потеря воды при фотосинтезе неизбежна, по-
тому что поступление СО2 в листья требует от-
крывания специальных образований на их по-
верхности, которые называются устьицами.
Открывание устьиц позволяет СО2 из атмосфе-
ры диффундировать в воздушные пространства
внутри листа, но в то же время через открытые
устьица происходит испарение воды (рис. 8.1).
Поскольку концентрация водяного пара в воз-
душном пространстве внутри листа находится в
равновесии с водой в клетках (31000 ppm, 25 °C),
т.е. она на два порядка выше, чем концентрация
СО2 в воздухе (350 ppm), большие потери воды
во время поступления СО2 неизбежны.
Сз-растениям, произрастающим в умерен-
ном климате, требуется от 700 до 1300 моль
НгО для фиксации 1 моля СО2. При этом доля
воды, необходимой для фотосинтетического
окисления, в количественном отношении пре-
небрежимо мала. Такая большая потребность в
воде объясняется тем, что вода, испаряющая-
Рис. 8.1. Схема среза листа. Устьица
обычно расположены на нижней
стороне листа. СО2 диффундирует через
устьица в межклеточное воздушное
пространство и достигает клеток
мезофилла, в которых происходит
фотосинтез. При этом вода испаряется
с поверхности клеток и в виде пара
диффундирует из межклетников
в атмосферу. На схеме не учтено,
что на самом деле лист, как правило,
образован несколькими слоями клеток,
а межклеточное воздушное
пространство гораздо меньше
8.2. Устьица регулируют газообмен листа
179
ся из листьев, должна быть восполнена за счет
воды, которую всасывают корни из почвы. Та-
ким образом, во время фотосинтеза по рас-
тению идет непрерывный ток воды по сосудам
ксилемы из корней в листья, который называет-
ся током транспирации1.
Чтобы уменьшить потери воды, открывание
устьиц регулируется. Таким образом, при повы-
шении концентрации СО2 в воздухе растениям
требуется меньше воды. Открывание и закры-
вание устьиц вызывается специальными био-
химическими процессами и будет обсуждаться в
следующем разделе.
Даже при достаточном водоснабжении рас-
тения открывают устьица ровно настолько,
насколько необходимо, чтобы обеспечить до-
статочно СО2 для фотосинтеза. При водном де-
фиците растения предотвращают высыхание,
закрывая устьица частично или полностью, что
приводит к замедлению или даже прекращению
ассимиляции СО2. Поэтому водный дефицит
часто становится фактором, лимитирующим
рост, особенно на жарких засушливых террито-
риях, где у многих растений в процессе эволю-
ции выработалась стратегия снижения потерь
влаги при фотосинтезе. При фиксации СО2 у
большинства растений первым продуктом яв-
ляется трехуглеродное соединение — 3-фосфо-
глицерат, отсюда название этих растений — С3
(раздел 6.2). У некоторых растений засушливого
климата сначала образуется четырехуглеродное
соединение — оксалоацетат, поэтому такие рас-
тения называются С4.
8.2. Устьица регулируют
газообмен листа
Устьице состоит из двух замыкающих клеток,
которые часто окружены так называемыми по-
бочными клетками. На рисунках 8.2 и 8.3 изо-
бражено закрытое и открытое устьице. Устьице
открывается при повышении осмотического
давления в замыкающих клетках, которое при-
водит к поступлению в них воды. Сопутствую-
щее увеличение клеточного объема приводит к
набуханию замыкающих клеток и расшире-
нию устьичной щели.
1 Термин «восходящий ток» более адекватен для движения
по ксилеме вверх: часть воды возвращается обратно в корень
по флоэме, т.е. не весь ксилемный ток расходуется на транс-
пирацию. — Прим. ред.
Для изучения механизма открывания устьица,
замыкающие клетки выделяют из листа. Биохи-
мические и физиологические исследования это-
го объекта представляют большую сложность,
поскольку замыкающие клетки имеют малый
размер, и при их выделении выход очень низкий.
Хотя замыкающие клетки являются одними из
наиболее подробно исследованных раститель-
ных клеток, наши знания о процессе закрывания
устьиц все еще неполны.
Малат играет важную роль в метаболизме
замыкающих клеток
Повышение осмотического давления в замыка-
ющих клетках при открывании устьиц в основ-
ном обусловлено накоплением солей калия.
В качестве сопутствующего аниона обычно вы-
ступает малат, а у некоторых видов — хлорид.
На рисунке 8.4 представлена схема метаболиче-
ских реакций, которые происходят при откры-
вании устьиц, если главным анионом выступает
малат. Н+-Р-АТФаза переносит протоны че-
рез плазмалемму в межклеточное пространство.
Эта помпа, которая устроена совершенно ина-
че, чем F-АТФаза и V-АТФаза (разделы 4.3, 4.4),
принадлежит к тому же типу, что и Na+/K+-
АТФаза в клетках животных. Остаток аспартата
в белке Р-АТФазы фосфорилируется в процессе
переноса иона (отсюда название: Р-АТФаза или
Н+-АТФаза P-типа). Разность потенциалов,
которая генерируется Н+-Р-АТФазой, служит
движущей силой для ионов К+, которые входят
в замыкающие клетки через К+-канал. Этот
канал открыт только при отрицательных зна-
чениях мембранного потенциала (раздел 1.10) и
может служить только для входного потока, по-
этому он называется входной К+-канал (inward
channel). Большая часть ионов К+, входящих
в клетку, транспортируется в вакуоль, но ме-
ханизм этого транспорта остается невыяснен-
ным. Возможно, в этом участвует вакуолярная
Н+-АТФаза (V-АТФаза, раздел 4.4), которая
переносит в вакуоль протоны против градиента
концентрации, которые затем могут выходить
в обмен на ионы К+.
Накопление катионов в вакуоли приводит
к формированию разности потенциалов на
вакуолярной мембране, которая служит дви-
жущей силой для входа малата через канал,
специфичный для органических анионов. Ма-
180
8. Фотосинтез сопряжен с потерями воды
Рис. 8.2. Фотографии устьиц нижнего эпидермиса листьев орешника, полученные
на сканирующем электронном микроскопе, в (а) закрытом и (б) открытом
состоянии. (Фото R. S. Harrison-Murray и С. М. Clay, Веллесбурн.) (в) Срез пары
замыкающих клеток из листа табака. Видна крупная центральная вакуоль и
устьичная щель. (Фото D. G. Robinson, Гейдельберг.)
8.2. Устьица регулируют газообмен листа
181
Рис. 8.3. Схема устьица,
образованного двумя замыкающими
клетками, (а) в закрытом и (б)
в открытом состоянии
лат образуется при гликолитическом расще-
плении крахмала, запасаемого в хлоропластах.
Как будет описано в разделе 9.1, в результате
этого расщепления образуются триозофосфа-
ты, которые выносятся из хлоропластов в цито-
золь в обмен на неорганический фосфат через
триозофосфат-фосфатный переносчик (раз-
дел 1.9) и затем превращаются в фосфоенол пи-
руват (ФЕП, рис. 10.11). ФЕП реагируете НСОз
с образованием оксалоацетата. В реакции, ко-
торая катализируется фосфоенолпируваткар-
боксилазой (ФЕП-карбоксилазой) (рис. 8.5),
разрушается высокоэнергетическая эфирная
связь, что делает реакцию необратимой. Обра-
зовавшийся при этом оксалоацетат с помощью
специфичного переносчика транспортируется в
хлоропласты, где восстанавливается до малата
с участием НАДФ-малатдегидрогеназы (см.
рис. 8.4). Малат выходит в цитозоль, возможно,
с участием того же переносчика, который транс-
портирует оксалоацетат1.
При закрывании устьиц большая часть ма-
лата выходит из устьичных клеток. Посколь-
ку активность RubisCO в замыкающих клетках
очень низка, они не способны фиксировать СО2
в заметных количествах. Крахмал синтезирует-
ся из глюкозы, которая поступает в замыкаю-
щие клетки из соседних клеток1 2. В отличие от
хлоропластов клеток мезофилла, хлоропласты
замыкающих клеток содержат глюкозо-6-фос-
фат-фосфатный переносчик, который пере-
носит не только глюкозо-6-фосфат и фосфат, но
также триозофосфат и 3-фосфоглицерат. Этот
1 Рассмотрен лишь один из возможных путей образования
малата. Синтез малата происходит также в цитозоле и в ми-
тохондриях. — Прим. ред.
2 Более вероятно, что в замыкающие клетки по апопласту
поступает сахароза, которая затем служит источником глю-
козы для образования крахмала. — Прим. ред.
переносчик также был найден в пластидах ге-
теротрофных тканей, например, тканей корня
(раздел 13.3).
Степень открытости устьиц сложным
образом регулируется
Известно несколько параметров, влияющих
на открывание устьиц. Открывание регулиру-
ется светом с участием рецептора синего света
(раздел 19.9). Важным фактором является так-
же концентрация СО2 в межклеточном про-
странстве, хотя природа сенсора СО2 неизвест-
на. Закрывание устьиц вызывается действием
абсцизовой кислоты (АБК) в микромоляр-
ных концентрациях (раздел 19.6). Если из-за
водного дефицита водный потенциал снижа-
ется ниже критической отметки, начинается
усиленный синтез АБК. Эффект АБК на за-
крывание устьиц зависит от внутриклеточной
концентрации СО2 и присутствия сигнального
соединения — оксида азота (NO) (раздел 19.9).
Связывание АБК с рецептором на мембране
запускает один или несколько сигнальных ка-
скадов, приводящих к изменению активности
ионных каналов. Существуют убедительные до-
казательства того, что в сигнальных каскадах
участвуют протеин киназы, циклическая АДФ-
рибоза и инозитолтрифосфат, и в результате
происходит открывание Са2+-каналов плазма-
леммы и внутриклеточных Са2+ депо, таких,
как эндоплазматический ретикулум. Попадаю-
щие в цитозоль ионы Са2+ служат вторичными
мессенджерами (раздел 19.6). Посредством сиг-
нальных каскадов АБК активирует анионные
каналы замыкающих клеток, что приводит к
выходу анионов. В результате происходит де-
поляризация плазматической мембраны и, как
следствие, активация выходных К+-каналов
(outward channel) (раздел 1.10). NO регулирует
182
8. Фотосинтез сопряжен с потерями воды
Рис. 8.4. Схема процессов, происходящих при открывании устьиц, если
в качестве основного аниона выступает малат. Перенос протонов Н+-Р-АТФазой
плазматической мембраны (1) замыкающих клеток приводит к повышению
протонного потенциала и гиперполяризации. При этом открываются потенциал-
зависимые входные К+-каналы (2) и за счет энергии протонного градиента через
этот канал в клетку входят ионы калия. Одновременно в хлоропластах происходит
гидролиз крахмала с образованием триозофосфата, который затем выходит из
хлоропластов через триозофосфат-фосфатный переносчик (3) и в цитозоле
превращается в оксалоацетат. Оксалоацетат транспортируется в хлоропласты
(4) и восстанавливается до малата. Малат выносится из хлоропластов в цитозоль
возможно через тот же переносчик, который обеспечивает вход оксалоацетата (5).
Механизм накопления калия и малата в вакуолях замыкающих клеток до сих пор
в деталях не изучен. Протоны переносятся в вакуоль (6) с помощью Н+-У-АТФазы,
и затем обмениваются на ионы калия (7). Разность электрических потенциалов,
образованная Н+-У-АТФазой, служит движущей силой для входа ионов малата
через малатный канал (8). Накопление калия и малата повышает осмотический
потенициал в вакуоли и приводит к входу воды. Для ресинтеза крахмала
в замыкающие клетки в симпорте с протоном поступает глюкоза (9). (Более
вероятно — сахароза. — Прим, ред.) В цитозоле глюкоза превращается в глюкозо-
6-фосфат, который транспортируется в хлоропласт через глюкозо-6-фосфат-
фосфатный переносчик (3).
8.3. Поступление СО2 в растительную клетку путем диффузии
183
Рис. 8.5. Фосфоенолпируваткарбоксилаза
(ФЕП-карбоксилаза)
ФЕП-карбоксилаза
СООе
С-О-РО32е
II 3
сн2
соое
I
с=о
I
сн2
соо
Фосфоенолпируват
Оксалоацетат
активность Са2+-чувствительных ионных кана-
лов, вызывая повышение концентрации Са2+
в цитозоле за счет выхода Са2+ из внутрикле-
точных депо. Это приводит к выходу из замыка-
ющих клеток К+, малата2- и С1-. Таким образом,
действуя вместе, АБК и NO снижают осмоти-
ческое давление в замыкающих клетках, что,
в свою очередь, приводит к снижению клеточ-
ного объема и закрыванию устьиц. Примене-
ние метода пэтч-кламп (раздел 1.10) позволило
по-новому взглянуть на роль отдельных ионных
каналов в процессе открывания и закрывания
устьиц. NO, предположительно, образуется
с помощью фермента NO-синтазы (раздел 19.9)
или при восстановлении нитрита (NO2-), ко-
торое катализируется нитратредуктазой1 (раз-
дел 10.1). В замыкающих клетках нитратредук-
таза индуцируется АБК. Очевидно, что АБК и
NO сложным образом взаимодействуют в про-
цессе регуляции открывания устьиц.
8.3. Поступление СО2 в растительную
клетку путем диффузии
Перемещение СО2 из атмосферы в каталитиче-
ский центр RubisCO — через устьица, межкле-
точное воздушное пространство, плазматиче-
скую мембрану, оболочку и строму хлоропласта
происходит путем диффузии.
В соответствии с простым следствием из за-
кона Фика, диффузионный ток на определенном
расстоянии равен: I = &C/R, где / определяется
как количество вещества, диффундирующего
в единицу времени через единицу площади; АС,
диффузионный градиент, есть разность концен-
траций между начальной и конечной точкой,
1 Как следует из названия фермента, основная его актив-
ность — восстановление нитрата. Восстановление нитрита —
побочный процесс, который идет в клетке с низкой эффек-
тивностью. — Прим. ред.
R — диффузионное сопротивление, которое для
СО2 у воды в 104 раза выше, чем у воздуха.
Модель, представленная на рис. 8.6л, ил-
люстрирует диффузионный ток СО2 в листе
С3-растения с ограниченным водоснабжением.
Контроль ширины устьичной щели приводит
к появлению устьичного диффузионного со-
противления, за счет которого поддерживается
диффузионный градиент в 100 ppm2. Резуль-
тирующая концентрация СО2 в межклеточном
воздушном пространстве (250 ppm) находится
в равновесии с концентрацией СО2 в водном
растворе, равной 8*10-6 М (8 мкмоль). В воде,
насыщенной воздухом, содержащим 350 ppm
СО2, равновесная концентрация растворенного
СО2 равна 11,5 мкмоль при 25 °C.
Поскольку хлоропласты клеток мезофил-
ла часто расположены у плазмалеммы (см.
рис. 1.1), в этом случае наибольшее расстояние
на пути диффузии СО2 до реакционного цен-
тра RubisCO требуется пройти через строму
хлоропласта. Чтобы облегчить ток диффузии,
в строме активно работает фермент карбоанги-
драза3. Этот фермент позволяет СО2, входяще-
му через мембраны в строму хлоропласта, бы-
стро уравновешиваться с НСОз (рис. 8.7). При
pH 8,0, 8 мкмоль СО2 находится в равновесии
с 400 мкмоль НСОз (25 °C). Поэтому в присут-
ствие карбоангидразы градиент для диффузи-
онного движения НСОз в 50 раз выше, чем для
СО2. Благодаря присутствию карбоангидразы
в строме диффузионный ток СО2 из межкле-
точного воздушного пространства к месту свя-
зывания СО2 реакционным центром RubisCO
приводит к снижению концентрации СО2 всего
2 Здесь и далее — усредненные величины, которые могут
варьировать в зависимости от степени водного дефицита и
вида растений. — Прим. ред.
3 Кроме того, изоформы и карбоангидразы присутствуют
также в цитозоле и в люмене тилакоидов. — Прим. ред.
184
8. Фотосинтез сопряжен с потерями воды
а С3-растение
Устьице
Клетка мезофилла
со2
со2
СО2------► RubisCO
Потребности
ассимиляции:
моль потребленной воды
моль фиксированного СО2
700-1300
н2о
н2о
СО2: 350 ppm
250 ppm
СО2 8 мкмоль СО2 6 мкмоль
Л 100 ppm
б С4-растение
Клетка
СО2:
Л 200 ppm
мезофилла
Клетка обкладки
СО2: 5 мкмоль
СО2. 70мкмоль
400-600
Рис. 8.6. Схема реакций поступления СО2 в клетки С3- (а) и С4- (б) растений.
На схеме показано типичные значения устьичного сопротивления для С3- и С4-
растений. Концентрации СО2 вблизи RubisCO взяты из работ von Caemmerer
и Evans (С3-растения) и Hatch (С4-растения)
ХЛОРОПЛАСТ
со2
со2
RubisCO
Карбо-
ангидраза
HCOf
HCOf
НСО? 50
pH 8:---2- =--
СО2 1
Рис. 8.7. Карбоангидраза катализирует быстрое уравновешивание СО2
и НСО3_, повышая диффузионный градиент и, следовательно, диффузионный
ток неорганического углерода через строму хлоропластов. Теоретический расчет,
основанный надопушении, что величина pH равна 8,0. Константа диссоциации
[НСО3-] • [Н+] / [СО2] =5 • IO 7
8.4. Сд-растения ассимилируют СО2 с меньшими затратами воды, чем С3-растения
185
на 2 мкмоль. Концентрация СО2, измеренная
в сайте связывания RubisCO, приблизитель-
но равна 6 мкмоль. В равновесии с воздухом
концентрация СО2 в сайте карбоксилирования
составляет 250 мкмоль1. При таких условиях
отношение карбоксилазной активности к окси-
геназной равно примерно 2,5.
Вернемся к рисунку 8.6. Поскольку СО2 и О2
конкурируют за реакционный центр RubisCO,
а концентрация СО2 в атмосфере очень низ-
ка в сравнении с концентрацией О2, снижение
концентрации СО2 в диффузионном потоке из
атмосферы к активному сайту карбоксилиро-
вания является фактором, лимитирующим эф-
фективную фиксацию СО2 с участием RubisCO.
Это также может быть причиной высокой кон-
центрации RubisCO в строме (раздел 6.2). На
самом деле сопротивление устьиц могло бы
быть уменьшено за счет увеличения устьичной
щели (например, в 2 раза). В этом случае с та-
ким же диффузионным током концентрация
СО2 в межклеточном воздушном пространстве
поднялась бы с 250 до 300 ppm, и соотношение
карбоксилазной и оксигеназной активностей
RubisCO поднялось бы соответственно. Однако
ценой такого снижения устьичного сопротивле-
ния было бы удвоение потерь воды. Поскольку
диффузия водяного пара из листьев пропорцио-
нальна диффузионному градиенту, влажность
воздуха является также важным фактором,
определяющим потери воды при транспирации.
Эти соображения демонстрируют важную роль
устьиц в газообмене листьев. Регуляция шири-
ны устьичной щели определяет, насколько вы-
сокой может быть скорость ассимиляции СО2
без того, чтобы растение теряло слишком много
драгоценной влаги.
8.4. С4-растения ассимилируют СО2
с меньшими затратами воды,
чем С3-растения
В равновесии с жидкой водой плотность водя-
ного пара при увеличении температуры возрас-
тает экспоненциально. Повышение температуры
с 20 до 30 °C приводит практически к удвоению
1 По более распространенной точке зрения роль НСО3_
как в цитозоле, так и в строме хлоропластов — буфер-
ная, т.е. восполнение СО2, расходуемого при фотосинтезе
(рис. 8.7). — Прим. ред.
плотности водяного пара2. Поэтому при высоких
температурах потеря воды при ассимиляции СО2
становится очень серьезной проблемой для расте-
ний. С4-растения нашли способ значительно сни-
зить потери воды. При температуре около 25 °C
эти растения используют всего 400—600 моль
Н2О для фиксации одного моля СО2, что состав-
ляет примерно половину от затрат С3-растений,
и эта разница становится все больше с повыше-
нием температуры. С4-растения растут в основ-
ном в районах с теплым, часто засушливым кли-
матом. К С4-растениям относятся такие важные
сельскохозяйственные культуры, как кукуруза,
сахарный тростник и просо. Принцип, который
помогает С4-растениям сохранять воду, может
быть продемонстрирован при сравнении схемы
поступления СО2 у С3-и С4-растений на рис. 8.6.
Увеличивая устьичное сопротивление вдвое по
сравнению с С3-растениями, С4-растения могут
снизить диффузию водяного пара на 50%.
Чтобы поддерживать такой же диффузион-
ный ток СО2, как у С3-растений, при большем
устьичном сопротивлении, в соответствии с за-
коном Фика диффузионный градиент должен
увеличиться в два раза. Это означает, что при
концентрации СО2 в воздухе 350 ppm концен-
трация в межклеточном воздушном простран-
стве будет всего 150 ppm (равновесная концен-
трация СО2 в воде 5 мкмоль). При таких низких
концентрациях С3-растения достигли бы точки
углекислотной компенсации (раздел 7.6), и, та-
ким образом, скорость суммарной фиксации
СО2 RubisCO была бы очень низка.
При таких условиях важнейшим приспосо-
блением для поддержания ассимиляции СО2
у С4-растений является механизм нагнетания,
который поднимает концентрацию СО2 в сай-
те карбоксилирования RubisCO с 5 мкмоль до
примерно 70 мкмоль. Для осуществления этого
нагнетания необходимо наличие двух компарт-
ментов3 и затраты энергии. Как бы то ни было,
затраты окупаются, так как при высоких концен-
2 Это соответствует увеличению парциального давления
паров воды и является показателем увеличения термоди-
намической активности воды, т.е. она быстрее испаряет-
ся, возрастает скорость химических реакций с участием
воды. — Прим. ред.
3 Утверждение справедливо для классических вариантов
С4. В последнее время обнаружены С4-растения, у которых
механизм «нагнетания» СО2 работает без кранц-анатомии,
см. далее. — Прим. ред.
186
8. Фотосинтез сопряжен с потерями воды
трациях СО2 в сайте кабоксилирования оксиге-
назная реакция в значительной мере подавлена,
и потери энергии в фотодыхании значительно
снижены (раздел 7.5). Поэтому С4-метаболизм
не обязательно требует больших энергозатрат;
на самом деле при повышенных температурах
С4-фотосинтез энергетически более выгоден,
чем С3-фотосинтез. Это связано с тем, что ок-
сигеназная активность RubisCO с повышением
температуры возрастает сильнее, чем карбокси-
лазная. Поэтому в условиях теплого климата
Срас тения, у которых не только снижена
потребность в водоснабжении, но и подавле-
но фотодыхание, имеют значительное преи-
мущество по сравнению с С3-растениями.
Открытие С4-метаболизма началось с «не-
объяснимых» результатов, полученных в экс-
перименте. После того, как Мелвин Кальвин и
Эндю Бенсон установили, что 3-фосфоглице-
рат является первичным продуктом ассимиля-
ции СО2 растениями, Хьюго Корчак с коллега-
ми изучали включение радиоактивно меченого
СО2 в процессе фотосинтеза в Институте са-
харного тростника на Гавайях. Результат был
неожиданным. Первым продуктом фиксации
оказался не 3-фосфоглицерат, как ожидалось,
а С4-соединения: малат и аспартат. Этот ре-
зультат ставил вопрос о том, универсален ли
путь ассимиляции СО2, открытый Кальвином.
Возможно, Корчак не хотел поднимать этот во-
прос, и его результаты оставались неопублико-
ванными почти 10 лет. Интересно отметить, что
за это время Юрий Карпилов в бывшем СССР,
не знавший о работе Корчака, получил сходные
результаты в опытах с ассимиляцией меченого
СО2 на растениях кукурузы.
Вскоре после публикации этих интригующих
результатов австралийские ученые Хэл Хэтч и
Роджер Слэк решили разгадать загадку и на-
чали систематические исследования. Они об-
наружили, что включение СО2 в малат предше-
ствовало фиксации СО2 в цикле Кальвина и что
это первое карбоксилирование было частью си-
стемы концентрирования СО2, работа которой
была окончательно выяснена этими учеными к
1970 году. Раньше принято было называть этот
процесс циклом Хэтча-Слэка, однако авторы
называли его путь С4-дикарбоновых кислот, а
сокращенно — С4-путь фотосинтеза.
Концентрирование СО2 у С4-растений
Разделение двух компартментов для нагнетания
СО2 из области низкой концентрации в область
Устьице
Рис. 8.8. Характерная анатомия листа С4-растения (схема). L — проводящий пучок, MS —
клетки мезофилла, BS — клетки обкладки
8.4. Сд-растения ассимилируют СО2 с меньшими затратами воды, чем Сз-растения
187
КЛЕТКА МЕЗОФИЛЛА
КЛЕТКА ОБКЛАДКИ
Межклеточное
пространство
Оксало-
ацетат ----► Малат------► Малат
Фосфоенол- ◄— Пируват* Пируват
пируват
Рис. 8.9. Принципиальная схема С4-метаболизма
высокой концентрации отражено в особой ана-
томии листа С4-растений, которую называют
кранц-анатомией (рис. 8.8). Проводящие пуч-
ки, содержащие ситовидные трубки и сосуды
ксилемы, окружены клетками обкладки, ко-
торые, в свою очередь, окружены клетками
мезофилла. Мезофилл находится в контакте с
межклеточным воздушным пространством ли-
ста. В 1884 году немецкий ботаник Густав Ха-
берланд в своем учебнике «Физиологическая
анатомия растений» писал, что у некоторых
растений, включая сахарный тростник и про-
со, ассимиляторные клетки организованы по
кранц-типу (от нем. Kranz — венок). Он сделал
весьма дальновидное предположение о том, что
эта анатомия может свидетельствовать о разде-
лении труда между хлоропластами мезофилла и
клеток обкладки.
Клетки мезофилла и клетки обкладки раз-
делены клеточными стенками, которые в неко-
торых случаях содержат слой суберина (пред-
положительно, непроницаемый для газов).
Суберин — полимер гидроксижирных кислот
с возможным участием фенольных соединений,
пропитанный восками (раздел 18.3). Граница
между клетками мезофилла и обкладки пере-
сечена большим количеством плазмодесм (раз-
дел 1.1), которые облегчают интенсивный обмен
метаболитами между клетками.
Нагнетание СО2 в С4-метаболизме обуслов-
лено не свойствами мембранного переносчика,
а предварительной фиксацией СО2. После обра-
зования НСОз в клетках мезофилла происходит
реакция с фосфоенолпируватом с образованием
оксалоацетата. Далее оксалоацетат превращает-
ся в малат, а малат диффундирует через плазмо-
десмы в клетки обкладки, где происходит вы-
свобождение СО2 и его ассимиляция с участием
RubisCO. На рисунке 8.9 показана упрощенная
схема этого процесса. Образование градиен-
та СО2 между двумя компартментами связано
с тем, что предварительная фиксация СО2 и его
последующее высвобождение катализируются
разными ферментами, и одна из реакций прак-
СОО®
I
н-с-он
I
СН2
СОО ’
Малик-
энзим
соое
I
с=о
I
СН3
Малат Пируват
СОО°
I
с=о
I
сн2
СООс
ФЕП-
карбоксикиназа
соо®
С-О-РОзе
II
сн2
Оксалоацетат
ФЕП
Рис. 8.10. Реакции, благодаря которым СО2,
предварительно зафиксированный в клетках
мезофилла, может высвобождаться в клетках обкладки
188
8. Фотосинтез сопряжен с потерями воды
тически необратима1. Ключевой особенностью
С4-растений является то, что RubisCO локали-
зована только в хлоропластах клеток обкладки.
Реакцию НСО3 с ФЕП катализирует фермент
ФЕП-карбоксилаза. Этот фермент уже обсуж-
дался в связи с метаболизмом замыкающих клеток
устьиц (см. рис. 8.4 и 8.5). В результате этой реак-
ции выделяется много энергии, поэтому она не-
обратима. Поскольку сродство фермента к НСО3
достаточно высоко (Кт = 0,1 —0,4 мМоль), эффек-
тивно фиксируются даже сравнительно низкие
концентрации НСО3. Образование НСО3 из СО2
происходит с участием карбоангидразы, которая
локализована в цитозоле клеток мезофилла. Вы-
свобождение СО2 в клетках обкладки может про-
исходить тремя различными путями (рис. 8.10).
У большинства С4-растений декарбоксилирова-
ние малата с сопутствующим окислением пиру-
вата катализируется малик-энзимом (декарбок-
силирующей малатдегидрогеназой). У растений
одной группы высвобождение СО2 происходит в
хлоропластах клеток обкладки, окисление мала-
та до пирувата сопровождается восстановлением
НАДФ+ (этот тип С4-метаболизма получил назва-
ние НАДФ-малатдегидрогеназного, НАДФ-
МДГ С4). У растений другой группы вместо
НАДФ+ восстанавливается НАД+, а соответству-
ющий малик-энзим локализован в митохондриях
клеток обкладки (НАД-малатдегидрогеназный
тип С4-метаболизма, НАД-МД Г С4). У растений
третьей группы оксалоацетат декарбоксилируется
в цитозоле клеток обкладки при участии фермен-
та ФЕП-карбоксикиназы с образованием ФЕП
(ФЕП-карбоксикиназный тип С4-метаболизма,
ФЕПКК С4). Для этой реакции необходим АТФ.
Мы подробнее остановимся на этих типах
С4-метаболизма и его компартментации.
С4-метаболизм у растений НАДФ-
малатдегидрогеназного типа
В эту группу растений входят такие важные
сельскохозяйственные культуры, как кукуруза
и сахарный тростник. На рисунке 8.11 показана
последовательность реакций и их компартмен-
тация. Оксалоацетат, который образуется в ре-
зультате карбоксилирования ФЕП, с помощью
1 Анатомической предпосылкой нагнетания СО2 является
большее число клеток мезофилла (примерно 5—7 на одну клет-
ку обкладки). Таким образом, СО2, предварительно зафиксиро-
ванный в пяти клетках, попадает в одну. — Прим. ред.
специфичного переносчика транспортируется
в хлоропласты, где восстанавливается НАДФ-
малатдегидрогеназой до малата. Образовавший-
ся малат выносится в цитозоль (восстановление
оксалоацетата в хлоропластах было рассмотре-
но в разделе 7.3 в связи с фотодыханием). Малат
диффундирует из клеток мезофилла в клетки
обкладки через плазмодесмы. Диффузионный
ток малата между двумя клетками требует на-
личия диффузионного градиента величиной
примерно в 210-3 М. Малик-энзим, который
локализован в хлоропластах клеток обкладки,
катализирует конверсию малата в пируват с вы-
делением СО2, который фиксируется RubisCO.
Образовавшийся пируват с участием спец-
ифичного переносчика экспортируется из хло-
ропластов клеток обкладки и диффундирует
через плазмодесмы в клетки мезофилла, где он
с помощью другого переносчика входит в хло-
ропласты. Фермент пируватфосфатдикиназа
в хлоропластах клеток мезофилла превращает
пируват в ФЕП в ходе довольно необычной ре-
акции (рис. 8.12). Название «дикиназа» обозна-
чает фермент, который катализирует двукрат-
ное фосфорилирование. В обратимой реакции
один фосфатный остаток передается с АТФ на
пируват, а второй — на фосфат, в результате чего
образуется пирофосфат. Пирофосфатаза, лока-
лизованная в строме хлоропластов, мгновенно
гидролизует вновь образовавшийся пирофос-
фат, что делает реакцию необратимой. Таким
образом, пируват необратимо преобразуется
в ФЕП с потреблением двух богатых энергией
фосфатных групп АТФ (который превращается
в АМФ). ФЕП экспортируется из хлоропластов
в цитозоль в обмен на неорганический фосфат
(ФЕП-фосфатный переносчик).
В связи с наличием высокого градиента СО2
между клетками обкладки и мезофилла воз-
никает вопрос, почему большая часть СО2 не
покидает клетки обкладки до того, как зафик-
сируется RubisCO? Поскольку хлоропласты
клеток обкладки, в отличие от хлоропластов
клеток мезофилла, не содержат карбоангидра-
зы, диффузия СО2 в строме клеток обкладки
происходит медленнее, чем в клетках мезофил-
ла1. Субериновый слой между клетками об-
1 Медленнее достигается равновесие в реакции СО2 +
+ Н2О # Н+ + НСО3~. — Прим. ред.
8.4. С4-растения ассимилируют СО2 с меньшими затратами воды, чем С3-растения
189
Рис. 8.11. Механизм концентрирования СО2 в растениях НАДФ-малат-
дегидрогеназного типа (например, кукурузы). В цитозоле клеток мезофилла
НСО3_ фиксируется в реакции с ФЕП, и образующийся оксалоацетат
восстанавливается в хлоропластах до малата. После выхода из хлоропластов
малат диффундирует в клетки обкладки, где он подвергается окислительному
декарбоксилированию с образованием пирувата, СО2 и НАДФН. Образовавшийся
пируват фосфорилируется до ФЕП в хлоропластах клеток мезофилла. Транспорт
через мембраны хлоропластов осуществляется специфичными переносчиками.
Диффузионный ток между клетками мезофилла и клетками обкладки происходит
по плазмодесмам. Транспорт оксалоацетата в хлоропласты клеток мезофилла
и последующий выход малата, предположительно, осуществляется одним
переносчиком. Сокращение: Т — переносчик
кладки и мезофилла у некоторых растений, ве-
роятно, затрудняет утечку СО2 через клеточные
стенки, так что остается только возможность
утечки через плазмодесмы. Долю СО2, кото-
рый был сконцентрирован в клетках обкладки,
но вследствие утечки диффундировал обратно
в клетки мезофилла, оценивают как 10—30%
для разных видов.
В листьях кукурузы хлоропласты клеток
мезофилла отличаются по структуре от хлоро-
пластов клеток обкладки. Хлоропласты клеток
мезофилла имеют много гран, в то время как
хлоропласты клеток обкладки содержат преиму-
щественно ламеллы стромы и малое количество
гранальных стопок с низкой активностью фото-
системы 11 (раздел 3.10). Главная функция хло-
соое
I
с=о
I
СНз
Пируват
Пируват-
фосфат-
дикиназа
АТФ АМФ
СООе
C-O-POf°
сн2
ФЕП
Рис. 8.12. Пируватфосфатдикиназа. В этой
реакции один фосфатный остаток передается
с АТФ на неорганический фосфат, что приводит
к образованию пирофосфата, а второй
остаток передается на гистидиновый остаток
каталитического центра фермента (E-His). Таким
образом, в качестве промежуточного продукта
образуется фосфорный амид (R-H-N-PO32-), и тогда
этот фосфорный остаток передается на пируват, что
приводит к образованию ФЕП
Пирофосфатаза
Ф + Ф
<изм реакции
+ АТФ + Ф « ►
- ф + пируват * ►
E-His-Ф + АМФ+ ФФ
E-His + ФЕП
Рис. 8.13. С4-метаболизм у кукурузы. Непрямой перенос НАДФН и АТФ из
хлоропластов клеток мезофилла в хлоропласты клеток обкладки через триозофосфат-
3-фосфоглицератный челнок. В хлоропластах клеток мезофилла 3-фосфоглицерат
восстанавливается до триозофосфата за счет АТФ и НАДФН. В хлоропластах клеток
обкладки триозофосфат превращается обратно в фосфоглицерат с образованием АТФ
и НАДФН. Перенос через хлоропластные мембраны осуществляется по механизму
антипорта с участием триозофосфат-фосфатного переносчика
8.4. С4-растения ассимилируют СОг с меньшими затратами воды, чем Сз-растения
1
КЛЕТКА МЕЗОФИЛЛА
Аспартат
МИТОХОНДРИЯ
Аспартат
a-KG
Glu
КЛЕТКА ОБКЛАДКИ
ХЛОРОПЛАСТ
Аланин ◄-------------------------
Оксалоацетат
НАДН + Н© НАД® Малат
Триозофосфат
Аланин
З-Фосфо-
гл и церат
ЦИКЛ
КАЛЬВИНА
Пируват
Glu
Пируват
a-KG
Рис. 8.14. Схема концентрирования СО2 у С4-растений НАД-
малатдегидрогеназного типа. В отличие от С4-метаболизма, показанного на
рис. 8.11, в данном случае оксалоацетат в цитозоле переаминируется в аспартат.
После диффузии через плазмодесмы аспартат входит в митохондрии клеток
обкладки через специфичный переносчик и там превращается в оксалоацетат,
который затем восстанавливается до малата. В митохондриях малат окисляется
НАД-зависимым малик-энзимом, в результате реакции образуются пируват
и СО2. В цитозоле пируват переаминируется в аланин, который затем диффундирует
в клетки мезофилла. СО2, который выделяется в митохондриях, диффундирует
в хлоропласты клеток обкладки, которые находятся в тесном контакте
с митохондриями. В хлоропластах СО2 служит субстратом для RubisCO.
Сокращения: Glu — глутмат; a-KG — a-кетоглутарат; Т — переносчик
192
8. Фотосинтез сопряжен с потерями воды
ропластов клеток обкладки — выработка АТФ,
которая происходит в результате циклического
фосфорилирования при участии фотосисте-
мы I. НАДФН, необходимый для цикла Каль-
вина, обеспечивается в основном за счет неци-
клического электронного транспорта в клетках
мезофилла. Этот НАДФН поставляется к месту
использования частично за счет окислитель-
ного декарбоксилирования малата (НАДФ-
малик-энзимом). Этот восстановительный эк-
вивалент обеспечен клетками мезофилла при
восстановлении оксалоацетата. Другая часть не-
обходимого НАДФН вместе с АТФ поставляется
из хлоропластов клеток мезофилла в хлоропла-
сты клетки обкладки с помощью триозофосфат-
3-фосфоглицератного челночного механизма,
через триозофосфат-фосфатный переносчик
внутренней мембраны соответствующих хлоро-
пластов (рис. 8.13).
С4-метабол изм
НАД-малатдегидрогеназного типа
С4-метаболизм НАД-малатдегидрогеназного типа,
проиллюстрированный метаболической схемой
на рис. 8.14, обнаружен у большинства видов,
включая просо. В этом случае оксалоацетат, ко-
торый образуется в реакции ФЕП-карбоксилазы,
превращается в аспартат путем переамини-
рования, которое катализируется глутамат-
аспартатаминотрансферазой. Поскольку кон-
центрация оксалоацетата в клетке меньше, чем
10-3 М, оксалоацетат не может образовать доста-
точно большой диффузионный градиент, что-
бы обеспечить интенсивный ток соединения в
клетки. В то же время концентрация глутамата в
клетке велика, и в результате переаминирования
оксалоацетата концентрация аспартата достига-
ет значений 510-3М. Поэтому аспартат удобен
для поддержания диффузионного тока между
клетками мезофилла и обкладки.
После диффузии в клетки обкладки аспартат
специфичным переносчиком транспортируется в
митохондрии. Митохондриальная изофермент-
ная форма глутамат-аспартатаминотрансферазы
катализирует превращение аспартата в оксалоа-
цетат, который затем восстанавливается НАД-
малатдегидрогеназой до малата. Малат декарбок-
силируется НАД-малик-энзимом с образованием
пирувата, а НАД+, образовавшийся в реакции
восстановления оксалоацетата, вновь восстанав-
ливается до НАДН. Образовавшийся в реакции
СО2 диффундирует в хлороплдсты, где ассими-
лируется с участием RubisCO. Пируват выходит
из митохондрий через специфичный переносчик
и в цитозоле превращается в аланин с участи-
ем аланин-глутаматаминотрансферазы. По-
скольку эта реакция равновесная, а концентрация
аланина гораздо выше, чем пирувата, возникает
интенсивный диффузионный ток аланина в клет-
ки мезофилла. В клетках мезофилла аланин пре-
вращается в пируват с участием изофермента
аминотрансферазы, которая упоминалась выше.
Пируват транспортируется в хлоропласты, где
превращается в ФЕП с участием пируватфосфат-
дикиназы так же, как это происходит в хлоропла-
стах НАДФ-малатдегидрогеназного типа.
Все молекулы НАДН, образованные малик-
энзимом в митохондриях, используются для
восстановления оксалоацетата, поэтому не
остается восстановительных эквивалентов для
окисления в дыхательной цепи (см. рис. 8.14).
Чтобы сделать возможным образование АТФ
в результате окислительного фосфорилирова-
ния в митохондриях, некоторые молекулы окса-
лоацетата, образованные в клетках мезофилла
с помощью фермента ФЕП-карбоксилазы, вос-
станавливаются в хлоропластах клеток ме-
зофилла до малата, как и в С4-метаболизме
НАДФ-малатдегидрогеназного типа. Образовав-
шийся малат диффундирует в клетки обкладки и
входит в митохондрии, где окисляется с помощью
малик-энзима с образованием НАДН. НАДН за-
тем окисляется вдыхательной цепи с образовани-
ем АТФ. Этот путь функционирует также в случае
С4-метаболизма ФЕП-карбоксикиназного типа,
который будет описан ниже.
Сд-метаболизм
ФЕП-карбоксикиназного типа
Этот тип метаболизма обнаружен у нескольких
быстро растущих тропических злаков, которые
используются в качестве кормовых культур. На
рисунке 8.15 представлена схема метаболиз-
ма этого типа. Как и в С4-метаболизме НАД-
малатдегидрогеназного типа, оксалоацетат пре-
вращается в аспартат в клетках мезофилла.
Аспартат диффундирует в клетки обкладки, где
с участием аминотрансферазы, локализован-
ной в цитозоле, происходит регенерация окса-
лоацетата. В цитозоле под действием фермента
КЛЕТКА МЕЗОФИЛЛА
КЛЕТКА ОБКЛАДКИ
Аспартат ----------------------------► --------------►Аспартат
т
Рис. 8.15. Схема концентрирования СО2 у растений С4-ФЕП-карбоксикиназного
типа. В отличие от С4-метаболизма, представленного на рис. 8.14, оксалоацетат
образуется из аспартата в цитозоле клеток обкладки, а затем декарбоксилируется
до ФЕП и СО2 ферментом ФЕП-карбоксикиназой. ФЕП диффундирует обратно
в клетки мезофилла. В то же время как на рис. 8.П, некоторая часть малата,
образованного в клетках мезофилла, диффундирует обратно в клетки обкладки
и там окисляется митохондриальным НАД-маликэнзимом. Образовавшийся при
этом НАДН служит субстратом для образования АТФ в процессе митохондриального
окислительного фосфорилирования. АТФ транспортируется в цитозоль, чтобы он
мог быть использован в реакции ФЕП-карбоксикиназы. СО2, выделившийся в этой
реакции в цитозоле, служит субстратом для RubisCO в хлоропластах клеток обкладки.
Сокращения: Glu — глутмат; a-KG — а-кетоглутарат; Т — переносчик
194
8. Фотосинтез сопряжен с потерями воды
ФЕП-карбоксикиназы оксалоацетат превра-
щается в ФЕП с затратой АТФ. Выделившийся
в реакции СО2 диффундирует в хлоропласты, а
ФЕП диффундирует обратно в клетки мезофилла.
У растений этого типа затраты АТФ на накачива-
ние СО2 в клетки обкладки связаны исключитель-
но с потреблением АТФ ФЕП-карбоксикиназой
(см. рис. 8.Ю). Митохондрии обеспечивают эту
реакцию необходимым количеством АТФ, окис-
ляя малат при участии НАД-малик-энзима.
Источником малата, как и в случае НАДФ-
малатдегидрогеназного типа, являются клетки ме-
зофилла (рис. 8.15, нижняя часть). Таким образом,
в метаболизме С4-ФЕП-карбоксикиназного типа
лишь небольшая часть СО2 высвобождается в ми-
тохондриях, а большая часть — в цитозоле1.
Кранц-анатомия со специализацией клеток
на мезофилл и обкладку не является
необходимой для С4-метаболизма
В некоторых случаях пространственная сегре-
гация предварительной фиксации СО2 ФЕП-
карбоксилазой и окончательной фиксации СО2
RubisCO может осуществляться и иначе. Для не-
которых видов Chenopodiacae недавно было пока-
зано, что у них С4-метаболизм происходит в удли-
ненных клетках однотипного строения, в которых
цитоплазма на периферическом конце обогащена
ФЕП-карбоксилазой, а на проксимальном конце
расположены хлоропласты, содержащие RubisCO.
Хотя это особый случай, он иллюстрирует разноо-
бразие С4-метаболизма
Ферменты С4-метаболизма
регулируются светом
ФЕП-карбоксилаза, ключевой фермент ^-мета-
болизма, имеет сложную систему регуляции.
Когда лист находится в темноте, активность это-
го фермента низкая. В этом случае сродство фер-
мента к субстрату, ФЕП, очень низкое; процесс
также ингибируется низкими концентрациями
малата. Поэтому в темное время суток фермент
в листе практически неактивен. При освещении
листа активируется сериновая протеинкиназа
1 Приведенная схема не учитывает стехиометрию перено-
са фосфорных соединений между клетками мезофилла и
обкладки. Судя по описанию процесса, клетка мезофилла
отдает больше атомов фосфора, чем получает, а клетки об-
кладки обедняются по фосфату. Это привело бы к остановке
С4-цикла. Поток ФЕП должен быть компенсирован проти-
вотоком фосфата. — Прим. ред.
(см. рис. 9.18 и 10.9), которая фосфорилирует ги-
дроксильную группу серинового остатка в белке
ФЕП-карбоксилазы. Фермент вновь может быть
инактивирован в случае удаления фосфатной
группы сериновой фосфатазой. Активированный
(фосфорилированный) фермент также ингиби-
руется малатом, но в этом случае для достижения
эффекта необходимы более высокие концентра-
ции малата. Таким образом, для поддержания
определенной концентрации малата в клетках ме-
зофилла скорость необратимого карбоксилирова-
ния ФЕП регулируется малатом по типу обратной
связи. Пока неизвестно, какой сигнал включает
активность протеинкиназ при освещении листа.
НАДФ-малатдегидрогеназа активируется
светом за счет восстановления тиоредоксином,
как было описано в разделе 6.6.
Пируватфосфатдикиназа (см. рис. 8.12) так-
же является светозависимым ферментом. Он
инактивируется в темноте за счет фосфорилиро-
вания по остатку треонина. Это фосфорилиро-
вание довольно необычно, поскольку в качестве
донора фосфатной группы используется предпо-
чтительно АДФ, а не АТФ. Фермент активирует-
ся светом при отщеплении фосфатной группы от
треонина. Таким образом, регуляция пируват-
фосфатдикиназы происходит совершенно иначе,
нежели регуляция ФЕП-карбоксилазы.
Продукты С4-метаболизма могут быть
идентифицированы с помощью
масс-спектрометрии
Измерение распределения изотопов 12С и 13С
в продуктах фотосинтеза (например, в сахарозе)
может показать, были ли они образованы в ре-
зультате С3- или С4-метаболизма. 12С и 13С явля-
ются природными изотопами углерода, которые
в СО2 воздуха составляют 98,89 и 1,11%, соответ-
ственно. RubisCO реагирует с 12СО2 быстрее, чем
с 13СО2. Это связано с кинетическим изотопным
эффектом. По этой причине отношение 13С/12С
в продуктах фотосинтеза ниже, чем в атмосфере.
Это отношение может быть определено методом
масс-спектрометрии и выражено через величину
513С2.
1 -f 13С/12С растение ]
8 С[%о] [|3С/.2С атмосфера IJxlOOO
2 Величина 513С отражает уровень дискриминации изо-
топа 13С. Чем меньше абсолютное значение, тем больше 13С
в пробе. Единица измерения — промилле (pro mille) — одна
тысячная часть. \%с = 0,1%. — Прим. ред.
8.5. Метаболизм по типу толстянковых (САМ) позволяет растениям выживать в условиях засухи
195
В качестве стандарта используют распреде-
ление двух изотопов в известняке. В продуктах
С3-фотосинтеза величина 513С составляет 28%о.
В ФЕП-карбоксилазной реакции преимуще-
ство 12С над 13С менее выражено. Поскольку у
С4-растений практически весь СО2, который
был предварительно зафиксирован ФЕП-кар-
боксилазой, реагирует дальше с RubisCO в хло-
ропластах клеток обкладки, фотосинтез ^-рас-
тений характеризуется величиной 513С, равной
всего лишь 14%о. Поэтому с помощью масс-
спектрометрического анализа отношения 13С/12С,
можно, например, определить, была ли сахароза
образована сахарной свеклой (С3-метаболизм)
или сахарным тростником (С4-метаболизм).
К С4-растениям относятся как
сельскохозяйственные культуры,
так и сорняки
В С4-метаболизме концентрирование СО2
в клетках обкладки происходит с затратой АТФ.
Это предотвращает потерю энергии на фото-
дыхание, которая есть у С3-растений. Соот-
ношение оксигеназной и карбоксилазной ак-
тивностей RubisCO возрастает с повышением
температуры (раздел 6.2). При низкой темпе-
ратуре, а значит, при низкой фотодыхательной
активности, у С3-растений есть преимуще-
ство. При таких обстоятельствах С4-растения
оказываются в проигрыше, и очень неболь-
шое число дикорастущих С4-растений обитает
в умеренном климате. Как бы то ни было, при
температурах выше 25 °C С4-растения имеют
преимущество, поскольку при этих температу-
рах потребление энергии на С4-фотосинтез (из-
меренное как количество квантов на фиксацию
молекулы СО2) у них ниже, чем у С3-растений.
Как было сказано, это связано в значительной
степени с усилением фотодыхания у С3-рас-
тений из-за повышения оксигеназной актив-
ности RubisCO у С3-растений. Еще одно преи-
мущество С4-растений заключается в том, что
благодаря высокой концентрации СО2 в клетках
обкладки им нужно меньше RubisCO. Посколь-
ку RubisCO является основным белком листьев,
С4-растениям для роста требуется меньше азо-
та, чем С3-растениям. И наконец, С4-растениям
требуется меньше воды. В условиях жаркого
климата и умеренной засухи эти преимущества
делают С4-растения очень удобными сельскохо-
зяйственными культурами. Из 12 наиболее бы-
стро растущих пищевых и кормовых культур 11
относятся к С4-растениям. Вклад С4-растений
в мировой фотосинтез наземных растений оце-
нивают в 20%. Однако у С4-растений есть и не-
достаток: большинство сельскохозяйственных
культур с С4-метаболизмом, таких, как куку-
руза, просо и сахарный тростник, очень чув-
ствительны к холоду, и это ограничивает их
распространение. К С4-растениям относятся и
наиболее устойчивые сорняки, включая 8 из 10
самых злостных сорняков, например, свинорой
пальчатый (Cynodon dactylon) и куриное просо
(Echinochloa crusgalli).
8.5. Метаболизм по типу толстянковых
(САМ) позволяет растениям
выживать в условиях засухи
Многие растения, живущие на очень сухих
и часто жарких территориях, выработали стра-
тегию не только для выживания в периоды су-
ровой засухи, но и для фотосинтеза в этих усло-
виях. Суккулентное декоративное растение
каланхоэ и кактусы являются примерами таких
растений, так же, как и эпифиты тропических
лесов, к которым относится примерно поло-
вина представителей семейства орхидных. Эти
растения решили проблему потери воды при
фотосинтезе тем, что они открывают устьица
только ночью, когда воздух прохладный и срав-
нительно влажный. Через открытые устьица но-
чью СО2 входит и фиксируется в форме кисло-
ты, которая хранится до следующего дня, когда
она распадается с образованием СО2 Этот СО2
вступает в цикл Кальвина, который теперь мо-
жет работать при закрытых устьицах. На ри-
сунке 8.16 представлена принципиальная схема
этого процесса. Обратите внимание на схожесть
этой схемы со схемой на рисунке 8.9. Она отли-
чается от схемы С4-метаболизма только тем, что
карбоксилирование и декарбоксилирование
разделены во времени, а не в пространстве.
Поскольку этот тип метаболизма был впервые
обнаружен в семействе Crassulaceae (толстян-
ковые) и включает в себя этап запасания кисло-
ты, он был назван САМ1.
1 Читается [КАМ] (crassulacean acid metabolism), или ме-
таболизм по типу толстянковых. К важным сельскохозяй-
ственным культурам относятся такие CAM-растения, как
ананас и мексиканская агава — источник натуральных во-
локон. — Прим. ред.
196
8. Фотосинтез сопряжен с потерями воды
СООН
н-с-он
Яблочная кислота i
Н-С-Н
ВАКУОЛЬ
СООН
Малат
Оксалоацетат
ФЕП
НОЧЬ
Малат
Пируват
СО2—► RubisCO
ДЕНЬ
Рис. 8.16. Приципиальная схема САМ-метаболизма
Первые наблюдения, связанные с САМ-
метаболизмом, были сделаны в начале XIX сто-
летия. В 1804 г. французский ученый де Соссюр
наблюдал выделение кислорода стеблями какту-
са Opuntia на свету в отсутствие СО2. Он заклю-
чил, что эти растения расходуют свои собствен-
ные органические вещества для получения СО2
который далее ассимилируется. Английский
джентльмен Бенджамин Хейн заметил в своем
саду в Индии, что листья популярного декора-
тивного растения Bryophyllwn calycinum имеют
травяной вкус вечером, в то время как утром они
кислые, как щавель. Он нашел свое наблюдение
столь любопытным, что после возвращения в
Англию в 1813 году изложил его в письме в Лин-
неевское Королевское Общество.
СО2 фиксируется ночью и запасается
в форме яблочной кислоты (малата)
Ночная фиксация СО2 происходит в реакции
с ФЕП, катализируемой ФЕП-карбоксилазой,
так же, как это происходит в С4-метаболизме
и в замыкающих клетках устьиц. У многих
CAM-растений необходимый для этой реакции
ФЕП образуется при гликолитическом распа-
де крахмала, но у других растений источником
углерода также могут служить растворимые угле-
воды, такие, как сахароза (раздел 9.2) и фрукта-
ны (раздел 9.5). На рисунке 8.17 представлена
схема CAM-метаболизма, где углерод запасен
в форме крахмала. Крахмал, локализованный
в хлоропластах, деградирует до триозофосфата
(раздел 9.1), который затем экспортируется с по-
мощью триозофосфат-фосфатного переносчика
в цитозоль и там превращается в ФЕП.
Оксалоацетат, образующийся при предвари-
тельной фиксации СО2, восстанавливается до
малата НАД-малатдегидрогеназой в цитозоле.
НАДН, который требуется для этой реакции, обе-
спечивается за счет окисления триозофосфата
в цитозоле. Малат с затратами энергии транс-
формируется в вакуоли. Как было описано для
замыкающих клеток устьиц (раздел 8.2), энерго-
зависимый этап этого процесса — транспорт про-
тонов с помощью Н+-У-АТФазы (раздел 4.4), рас-
положенной на вакуолярной мембране. В отличие
от замыкающих клеток, перенесенные протоны
не обмениваются на ионы калия. Малат благо-
даря градиенту протонов переносится в вакуоль
через малатный канал и в течение ночи хранится
там в форме яблочной кислоты. К утру pH вакуо-
лярного содержимого может снижаться до 3. Две
карбоксильные группы яблочной кислоты имеют
величины рК 3,4 и 5,1, поэтому при pH 3 яблочная
кислота в значительной степени недиссоциирова-
на и осмотическое давление, вызванное присут-
ствием яблочной кислоты, составляет всего треть
от осмотического давления, обусловленного на-
коплением полностью диссоциированного малата
калия (2К+ + Mai2 ) в замыкающих клетках. Дру-
гими словами, при одном и том же осмотическом
8.5. Метаболизм по типу толстянковых (САМ) позволяет растениям выживать в условиях засухи
197
НСО
ФЕП
НОЧЬ
ВАКУОЛЬ
Малат Н2 (Яблочная кислота)
Малат2"
Оксалоацетат
f НАДН + Н® НАД®
3-Фосфо гл и церат
Малат АТФ
2 Н®
АДФ + Ф
С
ХЛОРОПЛАСТ
АТФ
АДФ
1,3-Дифосфоглицерат
Триозофосфат
Триозофосфат
Крахмал
Рис- 8-17. CAM-метаболизм ночью. В результате гидролиза крахмала в
хлоропластах образуются триозофосфаты, которые превращаются
в фосфоенол пируват, акцептор для НСО3-, и при этом генерируется АТФ
и НАДН. Оксалоацетат восстанавливается в цитозоле до малата. Н+-У-АТФаза
на вакуолярной мембране обеспечивает аккумуляцию анионов малата в вакуоли,
где они ханятся в форме яблочной кислоты.
Сокращения: Т — переносчик, К — канал
давлении яблочной кислоты может запасаться
в три раза больше, чем малата калия. Чтобы до-
стичь максимального запасания, большинство
CAM-растений имеют необыкновенно большие
вакуоли и являются суккулентами. АТФ, необ-
ходимая для CAM-метаболизма, генерируется
в процессе окислительного фосфорилирования
в митохондриях при окислении малата.
САМ-фотосинтез происходит
при закрытых устьицах
Малат, который ночью хранится в вакуолях, днем
высвобождается в процессе контролируемого вы-
хода через малатный канал. У CAM-растений, как
и у С4-растений, СО2 может высвобождаться раз-
личными путями в зависимости от вида растения:
с помошью НАДФ-маликэнзима, НАД-ма-
ликэнзима или ФЕП-карбоксикиназы.
CAM-метаболизм НАДФ-маликэнзимного
типа изображен на рис. 8.18. Специфичный
переносчик вносит малат в хлоропласты, где он
декарбоксилируется с образованием пирувата,
НАДФН и СО2. Образовавшийся углекислый
газ выступает в качестве субстрата RubisCO,
а пируват с помощью пируватфосфатдики-
назы превращается в ФЕП (см. рис. 8.11, 8.12,
8.14 и 8.15). Поскольку пластиды, как правило,
не могут превращать ФЕП в 3-фосфоглицерат
(для хлоропластов САМ-растений это еще не
установлено), ФЕП экспортируется в обмен
198
8. Фотосинтез сопряжен с потерями воды
на 3-фосфоглицерат (предположительно, с по-
мощью двух различных переносчиков), как это
показано на рис. 8.18. Как у С4-растений, хло-
ропласты CAM-растений кроме триозофосфат-
фосфатного переносчика (который работает
как обменник и транспортирует триозофосфат,
фосфат и 3-фосфоглицерат) содержат ФЕП-фос-
фатный переносчик (который обменивает ФЕП
на фосфат). 3-фосфоглицерат, который посту-
пает в хлоропласты, вступает в цикл Кальвина.
Триозофосфаты, которые при этом образуются,
в основном используются для ресинтеза крах-
мала, израсходованного за прошедшую ночь.
Лишь небольшой избыток триозофосфата оста-
ДЕНЬ
Рис. 8-18- САМ-метаболизм днём. Малат и сопутствующие протоны выходят
из вакуоли с помощью неисследованного механизма. В приведенном примере
малат окисляется в хлоропластах до пирувата, и при этом образуется СО2, который
фиксируется RubisCO. Пируват превращается в ФЕП с участием пируват -
фосфатдикиназы. Пируват, предположительно, превращается в 3-фосфоглицерат
в цитозоле. После входа в хлоропласты 3-фосфоглицерат превращается
в триозофосфат, который главным образом используется для регенерации крахмала.
Транспорт ФЕП, 3-фосфогл и церата, триозофосфата и фосфата происходит
с участием триозофосфат-фосфатного переносчика.
Сокращения: Т — переносчик, К — канал
Дополнительная литература
19)
ется и является «чистой прибылью» САМ-фото-
синтеза.
Поскольку САМ-фотосинтез происходит при
закрытых устьицах, потребление воды на асси-
миляцию СО2 (сравните с рис. 8.6) составляет
лишь 5—10% от того количества, которое тре-
буется для фотосинтеза С3-растений. Посколь-
ку возможности хранения малата ограниче-
ны, прирост биомассы CAM-растений обычно
очень низок. Поэтому рост растений, которые
используют исключительно САМ-метаболизм,
сильно ограничен.
Довольно часто растения используют САМ
как стратегию выживания в особо засушли-
вые периоды. Некоторые растения (например,
Mesembryanthemum crystallinuni) используют
нормальный С3-фотосинтез, когда воды доста-
точно, но в период засухи или в условиях со-
левого стресса могут переключиться на САМ,
активируя соответствующие ферменты. Опреде-
лить, использует факультативное САМ-растение
САМ или С3-фотосинтез, можно с помощью
масс-спектрометрического анализа соотноше-
ния 13С/12С (раздел 8.4). В период острой засухи
кактусы могут жить довольно долго, не откры-
вая устьица даже ночью. В этих условиях они
могут сохранять углерод, вновь фиксируя в про-
цессе САМ-фотосинтеза тот СО2, который вы-
деляется при дыхании.
С4-метаболизм, как и САМ, возникал
неоднократно в процессе эволюции
С4- и САМ-фотосинтез обнаружены у многих
однодольных и двудольных растений, принадле-
жащих к различным семействам и не родствен-
ных между собой. Это значит, что в процессе
эволюции оба типа метаболизма несколько раз
независимо возникали из С3. Известно более
30 исходных форм для эволюции С4-пути. По-
скольку структурные элементы и ферменты
С4- и САМ-метаболизма также присутствуют у
С3-растений (например, в замыкающих клет-
ках устьиц), превращение С3-растений в С4 и
САМ — процесс несложный с эволюционной
точки зрения.
Дополнительная литература
Assmann,S. M.,Wang,X.-Q. From millisecondsto millions
of years: Guard cells and environmental responses. Curr
Opin Plant Biol 4, 421-428 (2001).
Badger, M. R., Price, D. G. The role of carbonic anhydrase
in photosynthesis. Annu Rev Plant Physiol Plant Mol
Biol 45,369-392(1995).
Barkla, B.J., Pantoja, O. Physiology of ion transport across
the tonoplast of higher plants. Annu Rev Plant Physiol
Plant Mol Biol 47, 159-184 (1996).
Blatt, M. R. Ca2+ signaling and control of guard-cell
volume in stomatai movements. Curr Opin Plant Biol 3,
196-204 (2000).
Borland, A. M., Maxwell, K., Griffith, H. Ecophysiology
of plants with crassulacean acid metabolism. In
Photosynthesis: Physiology and Metabolism. R. C.
Leegood, T. D. Sharkey, S. von Caemmerer (eds.),
pp. 583—605. Academic Publishers, Dordrecht, The
Netherlands (2000).
Chollet, R., Vidal J., O’Leary, M. H. Phosphoenolpyruvate
carboxylase: a ubiquitous, highly regulated enzyme in
plants. Annu Rev Plant Physiol Plant Mol Biol 47, 273—
298 (1996).
Desikan R., Griffiths, R., Hancock, J., Neill, S. A new role
for an old enzyme: Nitrate reductase-mediated nitric
oxide generation is required for abscisic acid-induced
stomatai closure in Arabidopsis thaliana. Proc Natl
Acad Sci USA 99, 16314-16318 (2002).
Edwards, G., Walker, D. A. C3, C4: Mechanisms and Cel-
lular and Environmental Regulation of Photosynthe-
sis. Blackwell Scientific Publications, Oxford, London
(1983).
Edwards, G. E., Furbank, R. T., Hatch, M. D., Osmond,
С. B. What does it take to be C4? Lessons from the
evolution of C4 photosynthesis. Plant Physiol 125, 46—
49 (2001).
Evans, J. R., Loreto, F. Acquisition and diffusion of CO2
in higher plants. In Photosynthesis: Physiology and
Metabolism. R. C. Leegood, T. D. Sharkey, S. von
Caemmerer (eds.), pp. 321—351. Academic Publishers,
Dordrecht, The Netherlands (2000).
Fischer, K., Kammerer, B., Gutensohn, M., Arbinger,
B., Weber, A., Hausler, R. E., Fliigge, U.-L A new class
of plastidic phosphate translocators: A putative link
between primary and secondary metabolism by the
phosphoenolpyruvate/phosphate antiporter. Plant Cell 9,
453-462(1997).
Freitag, H., Stichler, W. Bienertia cycloptera Bunge ex
Boiss., Chenopodiaceae, another C4 plant without
Kranz tissues. Plant Biol 4, 121 — 132 (2002).
Furbank, R. T., Hatch, M. D., Jenkins, C. L. D. C4
Photosynthesis: Mechanism and regulation. In
Photosynthesis: Physiology and Metabolism. R. C.
Leegood, T. D. Sharkey, S. von Caemmerer (eds.),
200
8. Фотосинтез сопряжен с потерями воды
рр. 435—457. Academic Publishers, Dordrecht, The
Netherlands (2000).
Garcia-Mata, C., Gay, R., Sokolovski, S., Hills, A., La-
mattina, L., Blatt, M. R. Nitric oxide regulates K+ and
Cl- channels in guard cells through a subset of abscisic
acid-evoked signaling pathways. Proc Natl Acad Sci
USA 100, 1116-11121 (2003).
Hatch, M. D. C4 Photosynthesis: An unlikely process full
of surprises. Plant Cell Physiol 33, 333—342 (1992).
Kramer, P. J., Boyer, J. S. Water Relations of Plants and
Soils. Academic Press, New York (1995).
Leegood, R. C. Transport during C4 photosynthesis. In
Photosynthesis: Physiology and Metabolism. R. C.
Leegood, T. D. Sharkey, S. von Caemmerer (eds.),
pp. 459—469. Academic Publishers, Dordrecht, The
Netherlands (2000).
Mellilo, J. M., McGuire, A. D., Kicklighter, D. W., Moore
III, B., Vorosmarty, C. J., Schloss, A. L. Global climate
change and terrestrial net primary production. Nature
363,234-240(1993).
Mott, K. A., Buckley, T. N. Patchy stomatai conductance:
emergent collective behavior of stomata. Trends Plant
Sci 5, 258-262 (2000).
Nimmo, H. G. The regulation of phosphoenolpyruvate
carboxylase in CAM plants. Trends Plant Sci 5, 75—80
(2000).
Sage, R. E Environmental and evolutionary preconditions
for the origin and diversification of the C4 photosynthetic
syndrome. Plant Biol 3, 202-213 (2001).
Schroeder, J. L, Allen G. J., Hugouvieux, V., Kwak, J. M.,
Waner, D. Guard cell signal transduction. Annu Rev
Plant Physiol Plant Mol Biol 52, 627-658 (2001).
Thiel, G., Wolf, A. H. Operation of K+-channels in stomatai
movement. Trends Plant Sci 2, 339—345 (1997).
Von Caemmerer, S., Evans, J. R. Determination of the
average partial pressure of CO2 in the leaves of several
C3 plants. Australian J Plant Physiol 18, 287—305
(1991).
Vidal, J., Bakrim, N., Hodges, M. The regulation of
plant phosphoenolpyruvate carboxylase by reversible
phosphorylation. In С. H. Foyer and G. Noctor (eds.).
Advances in Photosynthesis: Photosynthetic Assimilation
and Associated Carbon Metabolism, pp. 135—150. Kluwer
Academic Publishers, Dordrecht, The Netherlands (2002).
Voznesenskaya, E. V, Franceschi, V. R., Kiirats, O., Fre-
itag, H., Edwards, G. E. Kranz anatomy is not essen-
tial for terrestrial C4 plant photosynthesis. Nature 414,
543-546 (2001).
9
Полисахариды как запасные и транспортные
формы углеводов, образованных
в процессе фотосинтеза
У высших растений при фотосинтезе обра-
зуются углеводы, которые используются
в различных гетеротрофных тканей растений
(например, для корней). Доставленные из ли-
стьев субстраты могут быть использованы как
для конструктивного, так и для энергетического
метаболизма.
Различные части растений снабжаются угле-
водами через ситовидные трубки (глава 13).
Основной транспортной формой служит дис-
ахарид сахароза, но у некоторых растений ис-
пользуются также три- и тетрасахариды или
сахароспирты. Поскольку синтез углеводов
в листьях при фотосинтезе осуществляется
только днем, эти углеводы должны запасаться,
чтобы обеспечивать остальные части растения
ночью или при неблагоприятных погодных
условиях. Более того, растениям приходится на-
капливать запасы углеводов, чтобы хранить их
зимой или в сухие периоды, а также как резерв
в семенах для роста следующего поколения.
Для этой цели углеводы первично запасаются
в форме полисахаридов с большим молекуляр-
ным весом, в частности в виде крахмала или
Рис- 9-1 - Триозофосфаты, продукты фотосинтетической фиксации СО2, или
превращаются в хлоропластах в крахмал, или же после транспорта из хлоропластов
превращаются в сахарозу и в этой форме экспортируются из клеток мезофилла
202
9. Полисахариды как запасные и транспортные формы углеводов...
фруктанов, а также и в форме олигосахаридов
с низким молекулярным весом.
Крахмал и сахароза — основные продукты
ассимиляции СО2 у многих растений
У большинства культурных растений (например,
зерновых, картофеля, сахарной свеклы, рапса)
углеводы запасаются в листьях в виде крахмала,
а в другие части растения, такие как корни или
растущие семена, они переносятся в виде саха-
розы. Ассимиляция СО2 в хлоропластах постав-
ляет триозофосфаты, которые транспортируются
триозофосфатфосфатным переносчиком (раз-
дел 1.9) в обмен на фосфат в цитозоль, где эти
углеводы затем превращаются в сахарозу, что со-
провождается освобождением неорганического
фосфата (рис. 9.1). Возвращение фосфата очень
важно, так как если в хлоропластах возникает
дефицит фосфата, то фотосинтез может прекра-
титься. Часть триозофосфатов, образующихся
при фотосинтезе, превращается в хлоропластах
в крахмал и служит резервом для последующего
ночного периода.
9.1. Большие количества углеводов
могут запасаться в клетках
в виде крахмала
Глюкоза — сравнительно нестабильное соеди-
нение. Поэтому она практически не использу-
ется как углевод, пригодный для длительного
хранения. Более того, в связи с осмотически-
ми явлениями в клетке запасание моносаха-
ридов ограничено определенными пределами.
При полимеризации с образованием осмоти-
чески инертного крахмала большие количества
остатков глюкозы могут запасаться в клетке, не
оказывая влияния на осмотический потенци-
ал. Это можно проиллюстрировать следующим
примером: в конце дня содержание крахмала в
листьях картофеля способно достигать вели-
чин до КУ4 молей в расчете на число глюкозных
остатков на мг хлорофилла. Если бы это коли-
чество было растворено в водной фазе клеток
мезофилла как свободная глюкоза, то концен-
трация глюкозы составила бы 0,25 моль/л. Та-
кое накопление глюкозы привело бы к повыше-
нию осмотического давления более чем на 50%.
Молекулы глюкозы в крахмале первично сое-
динены (al—>4) гликозидными связями (рис. 9.2).
Эти связи защищают альдегидные группы моле-
кул глюкозы от окисления; не защищена лишь
первая молекула глюкозы, обозначенная крас-
ным на рис. 9.2 (редуцирующий конец поли-
мера). Таким образом формируются длинные
глюкозные цепи, которые могут разветвляться
посредством (al 6) гликозидных связей. Раз-
ветвленные молекулы крахмала содержат много
терминальных глюкозных остатков, по которым
молекула крахмала может увеличиваться.
а-(1—4)-гликозидная связь
Рис. 9.2. Молекулы глюкозы в крахмале ковалентно соединены (al —> 4)
гликозидными связями и (al —> 6) гликозидными связями, образуя полиглюкан.
Лишь глюкозный остаток, выделенный красным цветом, содержит редуцирующую
группу (восстанавливающий конец полимера, где возможно образование
альдегидной группы в результате изомеризации)
9.1. Большие количества углеводов могут запасаться в клетках в виде крахмала
203
Рис. 9.3. Транзиторный крахмал в хлоропласте клетки листового мезофилла
табака в конце дня. Крахмальное зерно в хлоропласте выглядит большим
электронно-прозрачным (белым) пятном (по D.G. Robinson, Гейдельберг)
В растениях образование крахмала проис-
ходит в пластидах (раздел 1.3), а именно в хло-
ропластах листьев и зеленых плодов и в ами-
лопластах гетеротрофных тканей. Крахмал
откладывается в пластидах в форме крахмаль-
ных зерен (рис. 9.3). Крахмальные зерна в ли-
сте могут достигать очень большой величины
к концу дня и обычно значительно деградиру-
ют в течение последующей ночи. Этот крахмал
называется транзиторным, или быстроисче-
зающим крахмалом. В отличие от него крахмал
в запасающих органа^(например, в семенах или
клубнях) откладывается на длительные периоды
и потому называется резервным крахмалом.
У хлебных злаков резервный крахмал часто со-
ставляет от 65 до 75%, а в клубнях картофеля
даже 80% от сухого веса.
Таблица 9.1. Компоненты растительного крахмала
Крахмальные зерна состоят прежде всего из
амилопектина, амилозы, а в некоторых случа-
ях из фитогликогена (табл. 9.1). Крахмальные
зерна содержат ферменты для синтеза и разло-
жения крахмала. Эти ферменты представлены
несколькими изоформами, некоторые из них
связаны с крахмальными зернами, в то вре-
мя как другие растворимы. Амилоза состоит
преимущественно из неразветвленных цепей,
включающих около 1000 молекул глюкозы. Мо-
лекулы амилопектина, содержащие от 104 до
105 молекул глюкозы, значительно крупнее мо-
лекул амилозы и имеют точки разветвления у
каждого 20—25-го глюкозного остатка (рис. 9.4).
Результаты рентгеноструктурного анализа (раз-
дел 3.3) показывают, что крахмальные зерна
составлены из концентрических слоев, вклю-
Количество глюкозных Количество глюкозных
остатков остатков между разветвлениями
Максимум поглощения
глюкан-йодного комплекса
Амилоза
Амилопектин
Фитогликоген
103
104-105
105
разветвлений нет
20-25
10-15
660 нм
530-550 нм
430-450 нм
204
9. Полисахариды как запасные и транспортные формы углеводов...
Рис. 9.4. Полиглюкановые цепи в амилопектине
содержат точки разветвления у каждого 20—25-го
глюкозного остатка. Новообразованные цепи имеют
упорядоченную структуру. Глюкозный остаток
в начале цепи, выделенный цветом, содержит
редуцирующую группу (восстанавливающий конец).
Группы на концах ветвей являются акцепторами
для присоединения следующих глюкозных остатков
крахмален нтазой
чающих попеременно амилопектин и амилозу.
Молекулы амилопектина расположены ради-
ально (рис. 9.5). Редуцирующая глюкоза (пока-
зана красным на рис. 9.2 и рис. 9.4) направлена
внутрь, а глюкозные остатки на концах ветвей
(окрашены черным) направлены наружу. Но-
вообразованные ветви амилопектина образуют
двойные спирали, которые упакованы в квази-
кристаллическую структуру. В отличие от него
амилоза существует, по всей вероятности, в
аморфном состоянии. Некоторые крахмальные
зерна содержат фитогликоген (особенно обиль-
но разветвленный крахмал).
Крахмальные зерна обычно содержат от 20 до
30% амилозы, от 70 до 80% амилопектина и в не-
которых случаях до 20% фитогликогена. В мор-
щинистых семенах гороха, который Грегор Мен-
дель использовал в своих классических опытах
по скрещиванию, содержание амилозы достигает
80%. У так называемых восковых мутантов куку-
рузы крахмальные зерна состоят почти полно-
стью из амилопектина. С другой стороны, у куку-
рузы разновидности amylomays крахмал на 50%
состоит из амилозы. Были получены трансген-
ные растения картофеля, в клубнях которых име-
ется только амилопектин. Однородность состава
крахмала в клубнях картофеля важна для исполь-
зования крахмала в качестве сырья во многих об-
ластях химической промышленности.
Амилоза, амилопектин и фитогликоген обра-
зуют с молекулами йода комплексы, окрашенные
в цвета от синего до фиолетового (см. табл. 9.1).
Это позволяет очень легко обнаружить крахмал в
листе простой йодной пробой.
Рис. 9.5. В крахмальных зернах молекулы амилопектина и амилозы расположены
чередующимися слоями (сравн. с рис. 9.4)
9.1. Большие количества углеводов могут запасаться в клетках в виде крахмала
205
Рис. 9.6. Превращение
фруктозо-6-фосфата
в глюкозо-1 -фосфат.
В реакции с
гексозофосфатизомеразой
в качестве промежуточного
продукта образуется
Д4ис-ендиол
Фосфоглюко-
мутаза
Гексозофосфат-
изомераза
6СН2ОРОзе СНгОН
Фруктозо-6-фосфат
н он
Глюкозо-1 -фосфат
Н
I
н-с-он
I
с=о
I
—с—
I
н
I
с-он
II
с-он
I
—с—
I
Н. Л)
С^
___ I
н-с-он
I
-с—
I
cis-Ендиол
чг
Рис. 9.7. Биосинтез
крахмала. Глюкозо-
1 -фосфат реагирует с
АТФ, образуя АДФ-
глюкозу. Образующийся
пирофосфат гидролизуется
пирофосфатазой, и в итоге
образование АДФ-глюкозы
оказывается необратимым.
Глюкоза, активированная
АТФ, переносится
крахмалсинтазой на
терминальный остаток
глюкозы в глюкановой цепи
а-1,4-Глюкан
206
9. Полисахариды как запасные и транспортные формы углеводов...
Синтез крахмала осуществляется
через стадию образования АДФ-глюкозы
Фруктозо-6-фосфат, промежуточный продукт
цикла Кальвина, является предшественником
синтеза крахмала в хлоропластах (рис. 9.6).
Фруктозо-6-фосфат превращается гексозофос-
фатизомеразой в глюкозо-6-фосфат, и образу-
ется 4{«с-ендиол как промежуточный продукт
этой реакции. Фосфоглюкомутаза переносит
фосфатный остаток из 6-положения на глюкозе
в 1-положение.
Решающим этапом для синтеза крахмала
является активация глюкозо-1 -фосфата в реак-
ции с АТФ в АДФ-глюкозу, сопровождаемой
освобождением пирофосфата. Эта реакция, ка-
тализируемая ферментом АДФ-глюкозопиро-
фосфорилазой (рис. 9.7), обратима. Однако
высокая активность пирофосфатазы позволяет,
образующийся пирофосфат немедленно гидро-
лизовать до фосфата и таким образом удалить
его из равновесия химической реакции. Следо-
вательно, образование АДФ-глюкозы — необ-
ратимый процесс, очень удобный для регуля-
ции синтеза крахмала. Американский биохимик
Джек Прейсс, детально изучивший свойства
АДФ-глюкозопирофосфорилазы, обнаружил, что
этот фермент аллостерически активируется
3-фосфоглицериновой кислотой и ингибиру-
ется фосфатом. Значение этой регуляции будет
обсуждаться в конце данного раздела. Глюкоз-
ный остаток переносится крахмалсинтазой
с АДФ-глюкозы на ОН-группу в 4-положении
терминальной молекулы глюкозы в полисаха-
ридной цепи крахмала (см. рис. 9.7). Присоеди-
нение новых глюкозных остатков в крахмаль-
ном зерне осуществляется при взаимодействии
нескольких изоферментов крахмалсинтазы.
Разветвления формируются разветвляю-
щим ферментом. При достижении определен-
ной длины полисахаридная цепь расщепляется
по (al 4) гликозидной связи (рис. 9.8), и от-
деленный таким образом фрагмент цепи при-
соединяется к соседней цепи посредством вновь
образующейся (al -> 6) связи. Эти цепи удлиня-
ются далее крахмалсинтазой, пока не образует-
ся новая ветвь. Степень разветвления крахмала
может также уменьшаться снимающим вет-
вление ферментом, действие которого будет
обсуждаться несколько ниже. Уже упоминавши-
еся морщинистые семена гороха с высоким со-
держанием амилозы формируются в результате
снижения активности "разветвляющего фермен-
та в этих растениях, приводящего к снижению
содержания крахмала в целом.
Деградация крахмала происходит
двумя различными путями
Деградация крахмала происходит посредством
двух различающихся в своей основе реакций
(рис. 9.9). Амилазы катализируют гидролитиче-
ское расщепление (al -> 4) гликозидных связей.
Различные амилазы атакуют различные участ-
ки молекулы крахмала (рис. 9.10). Экзоамила-
зы гидролизуют крахмал на конце молекулы.
Р-амилаза — это важная амилаза, которая отде-
ляет два глюкозных остатка в форме дисахарида
мальтозы с конца молекулы крахмала (рис. 9.11).
Фермент получил обозначение р по его продук-
ту — р-мальтозе, у которой ОН-группа в положе-
нии 1 присутствует в p-конфигурации. Амилазы,
которые гидролизуют крахмал внутри глюкано-
вой цепи (эндоамилазы), образуют продукты
расщепления, у которых ОН-группа в положе-
нии 1 присутствует в a-конфигурации и поэтому
называются a-амилазами. Гликозидные связи
(al 6) в точках разветвления гидролизуются
снимающими ветвление ферментами.
Старт
Ветвящий фермент
Рис. 9.8. В глюкановой цепи (al —> 4) связь
разрывается ветвящим ферментом, и отделенный
фрагмент цепи присоединяется к соседней цепи
при помощи (al —> 6) гликозидной связи
9.1. Большие количества углеводов могут запасаться в клетках в виде крахмала
207
Амилаза
+ НОН
Гидролиз
Рис. 9.9. В молекуле крахмала (al —> 4) связь может разрываться как путем
гидролиза, так и при помощи фосфоролиза
Фосфорилазы (см. рис. 9.9) разрывают
(al 4) связи путем фосфоролиза, вследствие
чего образуется глюкозо-1 -фосфат. Этот продукт
более энергизован, чем глюкоза, образованная
при гидролизе амилазой. Поскольку энергия
гликозидной связи используется здесь для обра-
зования фосфорного эфира, то при дальнейшем
гликолизе лишь одна молекула АТФ расходуется
для активации глюкозного остатка, в то время
как при мобилизации крахмала амилазой требу-
ются две молекулы АТФ.
Мобилизация транзиторного крахмала в хло-
ропластах включает как фосфоролитическую,
таки гидролитическую деградацию. Фосфорила-
зы сами по себе не способны разрушить большие
разветвленные молекулы крахмала. Деградация
транзиторного крахмала начинается с расще-
пления a-амилазами больших молекул крахмала
на меньшие фрагменты, которые затем подвер-
гаются разрушению не только амилазами, но и
фосфорилазами. В растительных тканях недав-
но была обнаружена а-глюкан-Н2О-дикиназа,
с участием которой глюкозные остатки в моле-
кулах крахмала фосфорилируются за счет АТФ.
Фосфорилирование осуществляется по типу ди-
киназной реакции (см. рис. 8.12), согласно кото-
рому три субстрата, a-полиглюкан, АТФ и Н2О,
превращаются в три продукта, а-полиглюкан-
фосфат, АМФ и фосфат.
a-полиглюкан + АТР + Н2О
а-глюкан-НэО-дикиназа . А >
-------------> a-полиглюкан-Ф + АМФ + Ф
Этот фермент, вероятно, играет важную роль
в деградации крахмала. У мутантов Arabidopsis,
лишенных этого фермента, деградация крахма-
ла ослаблена. Конкретные связи между фосфо-
рилированием и деградацией крахмала до конца
не изучены.
Фосфорилазы присутствуют также в цито-
золе. Вероятно, что небольшие олигосахариды,
208
9. Полисахариды как запасные и транспортные формы углеводов...
Снимающий
ветвление
фермент
р-Мальтоза
Рис. 9.10. Гликозидные связи (al —> 4) в молекуле
крахмала связь гидролизуются а-амилазами.
Снимающий ветвление фермент гидролизует связи
(al 6). a-Амилазы освобождают дисахарид
Р-мальтозу гидролизом связей (al —> 4), действуя
последовательно с концов молекул крахмала
Р-Мальтоза
Рис. 9.11. В дисахариде р-мальтозе ОН-группа
в положении I находится в Р-конфигурации
продукты гидролитической деградации крахма-
ла, выходят из хлоропласта в цитозоль, чтобы
быть полностью разрушенными имеющимися
там фосфорилазами.
Избыточные продукты фотосинтеза могут
временно запасаться в хлоропластах
посредством синтеза крахмала
На рисунке 9.12 представлена общая схема син-
теза и деградации крахмала в хлоропластах. Ре-
гуляция работы АДФ-глюкозопирофосфорилазы
3-фосфоглицериновой кислотой (3-ФГК) и
фосфатом (Ф), упомянутая выше, позволяет
регулировать поток углеводов, направленный
на образование крахмала. Активность фермен-
та определяется соотношением концентраций
3-ФГК/Ф. 3-ФГК является основным метабо-
литом в строме хлоропласта. Вследствие равно-
весия реакций, катализируемых ферментами
фосфоглицераткиназой и глицеральдегидфосфат-
дегидрогеназой (раздел 6.3), концентрация стро-
мальной ФГА гораздо выше, чем концентрация
триозофосфата. Поскольку в строме хлоропласта
общее количество фосфата и фосфорилирован-
ных промежуточных продуктов цикла Кальвина
поддерживается фактически постоянным в ре-
зультате работы триозофосфат-фосфатного пере-
носчика (раздел 1.9), то возрастание концентра-
ции 3-ФГК приводит к снижению концентрации
фосфата и наоборот. Таким образом, соотноше-
ние 3-ФГК/Ф является весьма чувствительным
индикатором метаболитического статуса в стро-
ме хлоропласта. Когда снижение интенсивности
синтеза сахарозы приводит к уменьшению вы-
свобождения фосфата в цитозоле, хлоропласты
испытывают дефицит фосфата, который ограни-
чивает их фотосинтез (см. рис. 9.1). В подобной
ситуации отношение ФГК/Ф возрастает, что, в
свою очередь, ведет к интенсификации синтеза
крахмала, причем освобождается фосфат, созда-
вая предпосылку для продолжения фотосинтеза.
Крахмал выполняет в данном случае буферную
функцию. Ассимиляты, которые не используют-
ся для синтеза сахарозы или других соединений,
временно откладываются в хлоропластах в форме
транзиторного крахмала. Более того, синтез крах-
мала запрограммирован таким образом, что крах-
мал откладывается каждый день, чтобы использо-
ваться последующей ночью (механизм, лежащий
в основе этого явления, неизвестен).
9.1. Большие количества углеводов могут запасаться в клетках в виде крахмала
209
ХЛОРОПЛАСТ
ЦИТОЗОЛЬ
Рибулозо-1,5- 2х 3-фосфоглицериновая -
бисфосфат v кислота
# о НАДФН + Н©
7 2х АТФ
2х НАДФ®
АДФ + Ф \
2х Триозофосфат
ЦИКЛ КАЛЬВИНА Л
Глюкозо-
6-фосфат
Рис. 9.12. Синтез и распад крахмала в хлоропласте (уточнение к схеме —
см. Прим. ред. на следующей странице)
Переносчик
глюкозы
210
9. Полисахариды как запасные и транспортные формы углеводов...
До сих пор немногое известно о регуляции
деградации транзиторного крахмала. Возможно,
она стимулируется возрастанием концентрации
стромального фосфата, но механизм еще до конца
не ясен. Увеличение концентрации стромального
фосфата служит признаком дефицита углеводных
субстратов. Глюкоза, появляющаяся в результате
гидролитической деградации крахмала, экс-
портируется из хлоропластов с помощью пере-
носчика глюкозы (рис. 9.12). Эта глюкоза, прежде
чем будет вынесена в цитозоль, фосфорилируется
за счет АТФ с образованием глюкозо-6-фосфата
через посредство гексокиназы, связанной с внеш-
ней мембраной хлоропласта1.
Глюкозо-1-фосфат, полученный при фосфо-
ролитической деградации крахмала, при обра-
щении процесса синтеза крахмала превращается
в фруктозо-6-фосфат, а затем в фруктозо-1,6-
бисфосфат фруктозо-6-фосфаткиназой. Триозо-
фосфат, образованный из фруктозо-1,6-бис-
фосфата альдолазой, выносится из хлоропластов
через триозофосфат-фосфатный переносчик.
Часть триозофосфата окисляется внутри хло-
ропластов до 3-фосфоглицериновой кислоты и
впоследствии экспортируется также при участии
триозофосфат-фосфатного переносчика. Этот
переносчик, как и переносчик глюкозы, вклю-
чается, таким образом, в мобилизацию транзи-
торного крахмала в хлоропластах.
9.2. Синтез сахарозы происходит
в цитозоле
Синтез сахарозы, дисахарида глюкозы и фрук-
тозы (рис. 9.13), происходит в цитозоле клеток
мезофилла. Как и при синтезе крахмала, глю-
козный остаток активируется при образовании
нуклеозиддифосфатглюкозы, но в этом случае с
участием УДФ-глюкозопирофосфорилазы:
глюкозо-1-фосфат + УТФ -э-
УДФ-глюкозопирофосфорилаза _
< ...> УДФ-глюкоза + ФФ
В отличие от стромы хлоропласта, цитозоль
клеток мезофилла не содержит пирофосфатазы,
чтобы удалять пирофосфат из равновесия, и поэ-
1 В последнее время установлено, что механизм иной. Сиг-
налом для мобилизации крахмала является его фосфорилиро-
вание за счет глюкан-Н2О-дикиназ, затем он гидролизуется до
мальтозы, которая выходит в цитороль через специфичный пе-
реносчик МЕХ 1. Это происходит ночью, когда триозофосфат-
ные транспортёры практически не активны. — Прим. ред.
тому реакция с УДФ-глюкозопирофосфорилазой
обратима. Сахарозофосфатсинтаза (сокра-
щенно СФС, рис. 9.13) катализирует пере-
нос глюкозного остатка от УДФ-глюкозы на
фруктозо-6-фосфат2, образуя сахарозо-6-фосфат.
Сахарозофосфатфосфатаза, образуя фермент-
ный комплекс с СФС, гидролизует сахарозо-6-
фосфат, таким образом, удаляя его из равновесия
реакции с сахарозофосфатсинтазой. В итоге об-
щая реакция синтеза сахарозы является необра-
тимым процессом.
В дополнение к сахарозофосфатсинтазе рас-
тения содержат также сахарозосинтазу:
сахароза + УДФ #
сахаросинтаза. ,
< • УДФ-глюкоза + фруктоза
Эта реакция обратима. Она включена не
в синтез сахарозы, но в ее утилизацию путем ка-
тализа образования УДФ-глюкозы и фруктозы
из УДФ и сахарозы. Этот фермент обнаружи-
вается, прежде всего, в нефотосинтезирующих
тканях. Он участвует в расщеплении сахарозы
для синтеза крахмала в амилопластах запасаю-
щих тканей, таких, как ткани клубней карто-
феля (раздел 13.3), а также для гликолиза. Изо-
ферментные формы сахарозосинтазы играют
также определенную роль в синтезе целлюло-
зы и каллозы, будучи мембранно-связанными
(раздел 9.6), в то время как в других случаях при-
сутствуют также растворимые изоферментные
формы.
9.3. Утилизация триозофосфата,
продукта фотосинтеза, строго
регулируется
Как показано на рис. 6.11, пять шестых трио-
зофосфатов, образованных в цикле Кальвина,
употребляются для регенерации рибулозобис-
фосфата, акцептора СО2. Поэтому максимум 1/6
образованных молекул триозофосфата доступна
для экспорта из хлоропластов. В действительно-
сти вследствие фотодыхания (глава?) доля до-
ступного триозофосфата составляет лишь око-
ло 1/8 от всех триозофосфатов, образованных
в хлоропластах. Если из цикла Кальвина будет
выноситься больше молекул триозофосфата, то
акцептор СО2 — рибулозобисфосфат — более не
сможет регенерировать, и цикл Кальвина будет
2 Экзэргоническая необратимая реакция. — Прим. ред.
9.3. Утилизация триозофосфата, продукта фотосинтеза, строго регулируется
211
УДФ-Глюкоза
Рис. 9.13. Синтез сахарозы. Глюкоза, активированная УДФ, переносится на
фруктозо-6-фосфат. Суммарная реакция становится необратимой благодаря
гидролизу образованного сахарозо-6-фосфата
Сахароза
(глюкозо-( 1 а—20)-фруктоза
остановлен. Следовательно, для функциониро-
вания цикла Кальвина необходимо, чтобы вы-
носимая доля триозофосфатов не превышала
этот лимит. С другой стороны, фотосинтез хло-
ропласта может продолжаться лишь при усло-
вии, что его продукт — триозофосфат — утили-
зируется (например, для синтеза сахарозы) и что
его фосфат высвобождается1. Следствием недо-
1 Это справедливо при рассмотрении клетки как замкну-
той системы. Фосфат может поступать в клетку извне. —
Прим. ред.
статка фосфата было бы снижение уровня или
даже полное прекращение фотосинтеза. Поэто-
му для растения важно, чтобы при возрастании
интенсивности фотосинтеза (например, при яр-
ком солнечном свете), увеличение образования
продуктов фотоассимиляции сопровождалось
соответствующим увеличением уровня их ути-
лизации.
Поэтому утилизация триозофосфатов, об-
разованных при фотосинтезе, должна регули-
роваться таким образом, чтобы их избыток,
212
9. Полисахариды как запасные и транспортные формы углеводов...
превышающий определенный лимит для реге-
нерации рибулозобисфосфата, как можно пол-
нее утилизировался.
Фруктозо-1,6-бисфосфатаза регулирует
поступление углеводов в процесс
биосинтеза сахарозы
В клетках мезофилла синтез сахарозы в нор-
ме является основным потребителем триозо-
фосфатов, образованных при фиксации СО2.
Вынос триозофосфатов из хлоропласта для
синтеза сахарозы не регулируется на стадии
транслокации. Вследствие гидролиза фруктозо-
1,6-бисфосфата и сахарозо-6-фосфата общая
реакция синтеза сахарозы (рис. 9.14) является
необратимым процессом, который эффективен
благодаря высокой активности соответствую-
щих ферментов. Синтез сахарозы должен строго
регулироваться, чтобы гарантировать вынос не
более дозволенного количества триозофосфата
(см. предыдущую главу) из цикла Кальвина.
Первая необратимая стадия синтеза саха-
розы катализируется цитозольной фрукто-
зо- 1,6-бисфосфатазой. Эта реакция представ-
ляет собой важный пункт контроля метаболизма
и регулирует поступление триозофосфатов для
синтеза сахарозы. Рисунок 9.15 показывает,
как функционирует этот регуляторный ме-
ханизм. Важная роль принадлежит здесь
фруктозо-2,6-бисфосфату (Фр-2,6-БФ), ре-
гуляторному соединению, которое отличается
от метаболического фруктозо-1,6-бисфосфата
лишь положением одной фосфатной группы
(рис. 9.16).
Рис. 9.14. Превращение триозофосфатов в сахарозу. Пунктирные линии
показывают регуляцию отдельных реакций метаболитами, (—) означает
ингибирование, (+) означает активацию. Действие регуляторного соединения
фруктозо-2,6-бисфосфата более подробно показано на рис. 9.15
9.3. Утилизация триозофосфата, продукта фотосинтеза, строго регулируется
213
Фруктозо-1,6-бисфосфат
Фруктозо-2,6-
бисфосфат
АДФ АТФ
Фруктозо-
6-фосфат-
2-киназа
Активируется:
Фосфатом
Фруктозо-6-
фосфатом
Ингибируется:
Дигидроацетонфосфатом
Фруктозо-6-фосфат
Фруктозо-6-
фосфат
З-Фосфоглицератом
Фруктозо-2,6-
бисфосфатаза
Ингибируется:
Фосфатом
Фруктозо-6-фосфатом
Рис. 9.15. Фруктозо-1,6-бисфосфат представляет собой исходное соединение
для превращения продукта ассимиляции СО2 в сахарозу. Фермент ингибируется
регуляторным соединением фруктозо-2,6-бисфосфатом (Фр-2,6-БФ). Пирофосфат-
зависимая фруктозо-6-фосфаткиназа, которая синтезирует фруктозо-1,6-бисфосфат
из фруктозо-6-фосфата, используя пирофосфат, активна лишь в присутствии
регуляторного соединения Фр-2,6-БФ. Концентрация Фр-2,6-БФ поддерживается
его постоянным синтезом и распадом. Ферменты, катализирующие синтез и
распад Фр-2,6-БФ, регулируются метаболитами. Присутствие триозофосфата
и 3-фосфоглицериновой кислоты снижает концентрацию Фр-2,6-БФ и,
следовательно, возрастает активность фруктозо-1,6-бисфосфатазы
Было установлено, что Фр-2,6-БФ является
сильным активатором АТФ-зависимой фрукго-
зо-6-фосфаткиназы и ингибитором фруктозо-
1,6-бисфосфатазы в печени. Позднее выяс-
нилось, что основная функция Фр-2,6-БФ
состоит в регуляции гликолиза и глюконеогенеза
у растений, животных и грибов. Он служит мощ-
ным регулятором цитозольной фруктозо-1,6-
бисфосфатазы в клетках мезофилла, и именно
та микромолярная концентрация Фр-2,6-БФ,
которая может существовать в цитозоле клеток
мезофилла, вызывает значительное ослабление
сродства фермента к его субстрату, фруктозо-
1,6-бисфосфату. С другой стороны, Фр-2,6-БФ
активирует пирофосфат-зависимую фрукто-
зо-6-фосфаткиназу, найденную в цитозоле рас-
тительных клеток. Без Фр-2,6-БФ этот фермент
неактивен. Пирофосфат-зависимая фруктозо-6-
фосфаткиназа может использовать пирофосфат,
который образуется в реакции с УДФ-глюкозо-
пирофосфорилазой.
Фр-2,6-БФ образуется из фруктозо-6-фосфата
специфической киназой (фруктозо-6-фосфат-
2-киназой) и вновь разрушается гидролити-
чески специфической фосфатазой (фруктозо-
2,6-бисфосфатазой) до фруктозо-6-фосфата.
Уровень регуляторного соединения Фр-2,6-БФ
корректируется регуляцией относительных ско-
ростей его синтеза и распада. Триозофосфат
и 3-фосфоглицериновая кислота ингибируют
синтез Фр-2,6-БФ, в то время как фруктозо-
6-фосфат и фосфат стимулирут его синтез и
Рис. 9.16. Регуляторное соединение фрукто-
зо-2,6-бисфосфат (Фр-2,6-БФ) отличается от
метаболита фруктозо- 1,6-бисфосфата (Фр- 1,6-БФ)
лишь положением одной фосфатной группы
СН2ОРо|° ОН
он н
Фруктозо-1,6-бисфосфат,
метаболит
Фруктозо-2,6-бисфосфат,
регуляторное соединение
214
9. Полисахариды как запасные и транспортные формы углеводов...
Концентрация триозофосфатов
Рис. 9.17. Цитозольная фруктозо-1,6-бисфосфатаза
действует как регулятор синтеза сахарозы,
чувствительный к поступлению триозофосфатов.
Увеличение концентрации триозофосфатов под
действием альдолазы приводит к увеличению
количества субстрата фруктозо-1,6-бисфосфата
(см. рис. 9.14) и одновременно (см. рис. 9.15)
к уменьшению концентрации регуляторного
соединения фруктозо-2,6-бисфосфата. Как
следствие этих двух синергических эффектов,
активность фруктозо- 1,6-бисфосфатазы
с увеличением концентрации триозофосфата
возрастает сигмоидально. Фермент становится
активным лишь после того, как концентрация
триозофосфатов достигает порогового уровня,
и лишь затем изменяется активность в ответ на
повышение концентрации триозофосфатов
снижают гидролиз. Таким образом, повыше-
ние концентрации триозофосфата приводит
к снижению уровня Фр-2,6-БФ и, следова-
тельно, к увеличению сродства цитозольной
фруктозо- 1,6-бисфосфатазы к ее субстрату фрук-
тозо-1,6-бисфосфату. Более того, повышение
концентрации триозофосфата обусловленное
равновесием, катализируемым цитозольной
альдолазой, приводит к увеличению концентра-
ции фруктозо-1,6-бисфосфата. Одновременное
повышение концентрации субстрата и сродства
фермента к нему приводит к тому, что скорость
синтеза сахарозы с увеличением концентра-
ции триозофосфатов возрастает сигмоидально
(рис. 9.17). Таким образом, скорость синтеза са-
харозы может эффективно регулироваться по-
ступлением триозофосфата.
Принцип регуляции можно сравнить с пере-
ливом воды через клапан. Если определенная
пороговая концентрация триозофосфата не до-
стигнута, фруктозо-1,6-бисфосфатаза не актив-
на, и нет существенного оттока метаболитов на
синтез сахарозы. Это гарантирует, что уровень
триозофосфата в хлоропластах не опустится
ниже минимума, необходимого для функциони-
рования цикла Кальвина. Если этот порог пре-
вышается, то дальнейшее накопление триозо-
фосфата приведет к значительному повышению
активности фермента, при этом избыток трио-
зофосфатов может очень эффективно направ-
ляться на синтез сахарозы.
Активность цитозольной фруктозо-1,6-бис-
фосфатазы регулируется, как показано выше,
не только поступлением субстрата, но также
потребностью в ее продукте. С увеличением
количества фруктозо-6-фосфата уровень регу-
ляторного соединения Фр-2,6-БФ возрастает
вследствие стимуляции фруктозо-б-фосфат-2-ки-
назы и одновременного ингибирования фруктозо-
2,6-бисфосфатазы, причем активность цитозоль-
ной фруктозо-1,6-бисфосфатазы снижается (см.
рис. 9.15).
Сахарозофосфатсинтаза регулируется
не только метаболитами, но также
ковалентной модификацией
Сахарозофосфатсинтаза (см. рис. 9.14) также на-
ходится под строгим метаболическим контролем.
Этот фермент активируется глюкозо-6-фосфатом
и ингибируется фосфатом. Гексозофосфатизо-
мераза обеспечивает равновесие активатора
(глюкозо-6-фосфата) с фруктозо-6-фосфатом.
В этом равновесии концентрация глюкозо-6-фос-
фата значительно превышает концентрацию суб-
страта (фруктозо-6-фосфата). Следовательно, в
равновесии изменение концентрации субстрата
приводит к значительно большему изменению
концентрации активатора. Таким образом, актив-
ность фермента эффективно регулируется посту-
плением субстрата.
Более того, активность сахарозофосфатсин-
тазы изменяется ковалентной модификацией
фермента. Фермент содержит в положении 158
остаток серина, ОН-группа которого фосфо-
рилируется специфической протеинкиназой,
называемой киназой сахарозофосфатсинтазы
(СФС-киназой) и дефосфорилируется соответ-
ствующей СФС-фосфатазой (рис. 9.18). СФС-
фосфатаза ингибируется окадаевой кислотой,
ингибитором протеинфосфатаз так называемо-
9.3. Утилизация триозофосфата, продукта фотосинтеза, строго регулируется
215
________________ синтез _____________________Ф
СФС-фосфатаза белка ? СФС-фосфатаза
менее активна
' Ингибируется:
окадаевой кислотой
Свет
Рис. 9.18. Сахарозофосфатсинтаза (сокращенно СФС) переходит в менее
активную форму в результате фосфорилирования серинового остатка в положении
158 специальной протеинкиназой (СФС-киназой). Гидролиз фосфатного остатка
СФС-фосфатазой приводит к повышению активности фермента. Активность
СФС-фосфатазы увеличивается при освещении, вероятно, за счет синтеза белка
фермента de novo (по Huber, 1996)
го 2А-типа (здесь детально не обсуждается). Ак-
тивность СФС-киназы, вероятно, регулируется
метаболитами, такими, как глюкозо-6-фосфат.
Фосфорилированная форма сахарозофосфат-
синтазы менее активна, чем дефосфорил ирован-
ная форма. Активность фермента регулируется
относительными скоростями фосфорилирова-
ния и дефосфорилирования. Освещение листа
повышает активность СФС-фосфатазы и таким
образом сахарозофосфатсинтаза превращается в
более активную форму. Механизм этого явления
еще не вполне известен. Обсуждается вопрос,
обусловлено ли снижение активности СФС-
фосфатазы, наблюдаемое в темноте, пониженной
скоростью синтеза СФС-фосфатазы. В положе-
нии 424 сахарозофосфатсинтаза содержит вто-
рой остаток серина, который фосфорилируется
другой протеинкиназой (активируемой осмо-
тическим стрессом), в результате чего сахарозо-
фосфатсинтаза активируется. Это демонстрирует
сложность регуляции СФС. Фосфорилирование
одного серинового остатка соответствующей
протеинкиназой вызывает ингибирование, в то
время как фосфорилирование второго серино-
вого остатка другой протеинкиназой приводит
к активации. Более того, СФС имеет третий сайт
фосфорилирования, с которым может связы-
ваться 14-3-3 белок (сходно с регуляцией ни-
тратредуктазы, раздел 10.3). Физиологическое зна-
чение этого связывания еще предстоит выяснить.
Распределение ассимилятов между
сахарозой и крахмалом обусловлено
взаимодействием нескольких
регуляторных механизмов
В предыдущем разделе обсуждались различные
регуляторные процессы, участвующие в регуля-
ции синтеза сахарозы. Метаболиты, действую-
щие как активаторы или ингибиторы фермента,
могут регулировать скорость синтеза сахарозы,
быстро адаптируя ее уровень к метаболическим
условиям, преобладающим в клетке. Такая мгно-
венная реакция называется тонким контролем.
Ковалентная модификация ферментов, проис-
ходящая под действием факторов, изменяющих-
ся в течение дня, а также, вероятно, фитогормо-
216
9. Полисахариды как запасные и транспортные формы углеводов...
нов (глава 19), определяет общую регуляцию
метаболизма соответственно метаболическим
потребностям растения. Сюда относится в част-
ности распределение ассимилятов между са-
харозой, крахмалом и аминокислотами (глава
10). Следовательно, замедление синтеза сахаро-
зы, которое приводит к увеличению количества
триозофосфатов, а также 3-фосфоглицериновой
кислоты, может вызывать повышение скорости
синтеза крахмала (см. рис. 9.12). Как уже об-
суждалось, в течение дня большая часть фотоас-
симилятов временно откладываются в хлоропла-
стах листьев в форме транзиторного крахмала,
чтобы в течение следующей ночи превращаться
в сахарозу и доставляться в другие части рас-
тения. Однако у некоторых растений, таких,
как ячмень, в течение дня большие количества
фотоассимилятов запасаются в листьях в фор-
ме сахарозы. Следовательно, в темноте скорость
синтеза сахарозы различается в листьях разных
растений.
9.4. У некоторых растений ассимиляты
из листьев экспортируются
в форме сахароспиртов или
олигосахаридов семейства
раффинозы
Не у всех растений основной транспортной
формой для перемещения ассимилятов из ли-
стьев в другие части растения служит сахароза.
У некоторых растений фотоассимиляты вы-
носятся в форме сахароспиртов. У Rosaceae
(включая большинство плодовых деревьев в
регионах с умеренным климатом) ассимиля-
ты переносятся из листьев в форме сорбита
(рис. 9.19). У других растений, таких как тык-
ва, некоторые листопадные деревья (например,
лайм, орешник, вяз) и оливы, по ситовидным
трубкам переносятся олигосахариды семейства
раффинозы, у которых сахароза связана глико-
зидной связью с одной или несколькими моле-
кулами галактозы (рис. 9.20). Олигосахариды
семейства раффинозы включают раффинозу с
одним, стахиозу с двумя, и вербаскозу с тре-
мя галактозными остатками (см. рис. 9.20). Они
также выполняют функции запасных соеди-
нений и, например, в семенах гороха и фасоли
н
I
н-с-он
I
н-с-он
I
но-с—н
I
н-с-он
I
н—с—он
н-с-он
I
н
D-сорбит
Рис. 9-19- У некоторых растений продуктом
ассимиляции СО2 является сахароспирт сорбит,
который экспортируется из листьев
составлют от 5 до 15% сухого вещества. У чело-
века нет пищеварительных ферментов, катали-
зирующих гидролиз сс-галактозидов, поэтому
олигосахариды семейства раффинозы в орга-
низме человека не перевариваются. Если эти
сахара попадают с пищей, то они разлагаются
в последнем отделе кишечника анаэробными
бактериями с образованием газов.
Галактоза, необходимая для синтеза раффи-
нозы, образуется эпимеризацией УДФ-глюкозы
(рис. 9.21). УДФ-глюкозоэпимераза ката-
лизирует окисление ОН-группы в положении
4 в молекуле глюкозы, осуществляемое НАД+,
который прочно связан с ферментом. В резуль-
тате последующей восстановительной реакции
образуются как глюкозные, так и галактозные
остатки. Устанавливается равновесие в реакции,
катализируемой эпимеразой. Галактозный оста-
ток переносится трансферазой на циклический
спирт мио-инозит с образованием галактино-
ла. Мио-инозитгалактозилтрансфераза ката-
лизирует перенос галактозного остатка с галак-
тинола на сахарозу с образованием раффинозы
и далее — соответственно стахиозы и вербаско-
зы, т. е.
Сахароза + галактинол -> раффиноза + мио-инозит
Раффиноза + галактинол стахиоза + мио-инозит
Стахиоза + галактинол вербаскоза + мио-инозит
9.5. Фруктаны как запасные вещества откладываются в вакуоли
217
Раффиноза
Гал-(1а—6)-Гпк-(1а— 20)-Фр
Гал-(1а—6)-Гал-(1а—6)-Глк-(1а—20)-Фр
Вербаскоза
Гал-( 1а—6)-Гал-( 1а—6)-Гал-( 1а—6)-Глк-( 1а— 20 )-Фр
Рис. 9.20. В олигосахаридах семейства раффинозы один из трех галактозных
остатков связан с глюкозным остатком сахарозы в положении 6.
Сокращения: Гал — галактоза; Глк — глюкоза; Фр — фруктоза
218
9. Полисахариды как запасные и транспортные формы углеводов...
УДФ-Глюкоза
УДФ-глюкозо-
эпимераза
УДФ-Галактоза
УД Ф- га лактоза -
-мио-инозит-
галактозилтрансфераза
Рис. 9.21. Синтез галактинола как предшественника синтеза раффинозы из УДФ-
глюкозы и мио-инозита. Эпимеризация УДФ-глюкозы в УДФ-галактозу происходит
путем образования кето-группы в положении 4
9.5. Фруктаны как запасные вещества
откладываются в вакуоли
Многие растения в качестве запасных угеводов
используют в дополнение к крахмалу фруктаны.
Если крахмал является нерастворимым полиме-
ром глюкозы, образуемым в пластидах, то фрук-
таны — это растворимые полимеры фруктозы,
которые синтезируются и запасаются в вакуоли.
Впервые они были обнаружены в клубнях декора-
тивных растений, таких как георгины. У многих
злаков умеренного климата, таких как пшеница
и ячмень, фруктаны часто запасаются в листьях
и стеблях. Фруктаны являются также основны-
ми углеводами, найденными в луковицах у видов
рода Allium. У людей они, как и раффинозные
сахара, не перевариваются. Из-за своего сладко-
го вкуса фруктаны используются как природные
низкокалорийные подсластители. Фруктаны при-
меняются в пищевой промышленности.
9.5. Фруктаны как запасные вещества откладываются в вакуоли
219
Предшественником полисахаридной цепи
фрукганов служит молекула сахарозы, к кото-
рой гликозидными связями присоединяются
дополнительные молекулы фруктозы. Основная
структура фруктана, в которой сахароза соедине-
на с одной дополнительной молекулой фруктозы
в трисахарид, называется кестозой. На рисун-
ке 9.22 изображены три основных типа фрукта-
нов.
У фруктанов 6-кестозного типа фруктозный
остаток сахарозы в положении 6 соединен глико-
зидной связью с другой фруктозой в положении
2р. Цепи различной длины (Ю—200 фруктозных
остатков) образуются посредством связей (6 2р)
с дополнительными фруктозными остатками. Эти
фруктаны называются также фруктанами лева-
нового типа и часто встречаются у трав.
Фруктозные остатки у фруктанов 1-кестоз-
ного типа связаны с молекулой сахарозы и друг
с другом гликозидными связями (1 -> 2р). Эти
фруктаны, именуемые также фруктанами ину-
линового типа, содержат до 50 фруктозных мо-
лекул. Инулин содержится в клубнях георгин.
У фруктанов неокестозного типа две поли-
фруктозные цепи соединены с сахарозой, одна
по типу 1-кестозы (1 —> 2р) гликозидной связью
Сахароза Фр-(6—2р)-Фр
Фр-(1 —2р)-Фр
СН2ОН
ОН
Рис. 9.22. Фруктаны являются производными кестоз. Они образуются путем
связывания фруктозных остатков с молекулой сахарозы. У фруктанов неокестозного
типа число остатков фруктозы пит менее 10. У фруктанов 6-кестозного типа п от 10
до 200, а у фруктанов 1-кестозного типа п менее 50
СН2ОН
он
Фр-(1 —2Р)-Фр
220
9. Полисахариды как запасные и транспортные формы углеводов...
с фруктозной составляющей, а другая (6 20)
гликозидной связью с глюкозным остатком саха-
розной молекулы. Фруктаны неокестозного типа
имеют наименьшие размеры среди фруктанов,
насчитывая лишь от 5 до 10 фруктозных остатков.
Разветвленные фруктаны, у которых молекулы
фруктозы соединены как (1 20), так и (6 -> 20)
гликозидными связями, были найдены в пшени-
це и ячмене и названы граминанами.
Хотя фруктаны, вероятно, играют важную
роль в метаболизме многих растений, но наши
знания об их функции и метаболизме еще фраг-
ментарны. Синтез фруктанов происходит в ва-
куолях, и их предшественником является са-
хароза. Фруктозная составляющая сахарозной
молекулы переносится сахарозосахарозоф-
руктозилтрансферазой на вторую сахарозную
молекулу, вследствие чего образуется 1-кесто-
за и остается молекула глюкозы (рис. 9.23я).
Дополнительные фруктозные остатки пере-
носятся для удлинения кестозной цепи не
от другой сахарозной молекулы, а от другой
кестозной молекулы (рис. 9.23d). Фермент
фруктанфруктан-1 -фруктозилтрансфераза
переносит преимущественно фруктозный оста-
ток с трисахарида на кестозу с более длинной
цепью. Соответственно, образование 6-кестоз
катализируется фруктанфруктан-6-фруктоз-
илтрансферазой. Для образования неокестоз
фруктозный остаток переносится 6-глюкозо-
фруктозилтрансферазойс 1 -кестозы на глюкоз-
ный остаток сахарозной молекулы (рис. 9.23в).
Образованный таким способом трисахарид слу-
жит предшественником для последующего уд-
линения цепи, как показано на рис. 9.23d.
Деградация фруктанов осуществляется пу-
тем последовательного гидролиза фруктозных
остатков экзогидролитическими ферментами
начиная с конца фруктановой цепи.
У многих трав фруктаны накапливаются
в определенные периоды времени в листьях
и стеблях. Они могут составлять до 30% сухого
вещества. Часто углеводы в форме фруктанов
накапливаются перед началом цветения как ре-
зерв для последующего роста семян. Растения
в экстремальных местообитаниях, где периоды
положительного баланса СО2 сменяются перио-
дами, когда невозможен нормальный фотосин-
тез, используют фруктаны как резерв, чтобы пе-
режить неблагоприятные условия. Так, у многих
растений фруктаны образуются при действии
водного или холодового стресса.
Сахарозо-сахарозо-
фруктозилтрансфераза
Глк-Фр +
Сахароза
б
Глк-Фр-фр +
1-Кестоза
Глк - Фр
Сахароза
Глк-Фр-фр + Глк
1 - Кестоза Гл юкоза
Фруктанфруктан-6-
фруктозилтрансфераза
Глк-(Фр)п -------► Глк —(Фр)^ —Фр + Глк-Фр
1 -Кестозный тип 1 -Кестозный тип Сахароза
В
6- Гл юкозофруктози л -
трансфераза
Глк-Фр-фр
1-Кестоза
Глк - Фр
Сахароза
Фр
i
Глк- Фр
Неокестоза
Глк - Фр
Сахароза
Рис. 9.23. Сахароза является предшественником синтеза кестоз. Показаны три
основные реакции биосинтеза кестоз, происходящие в вакуоли
9.6. Целлюлоза синтезируется ферментами, локализованными в плазматической мембране
221
ХЛОРОПЛАСТ
6СО?
Глюкоза
Гексокиназа
АТФ
,>АДФ
ВАКУОЛЬ
Фруктан -
синтаза
Крахмал
2-Триозо-
фосфат
Н—-► 2-Триозо-
\ фосфат
Р
Глюкозо-6-
фосфат
Глюкозо-1-
фосфат
mi^-утф
ФФ
Фруктозо-6-
фосфат
УДФ-глюкоза
Рис, 9.24. Превращение фотоассимилятов во фруктан. Фруктозо-6-фосфат,
образованный в цитозоле как продукт фотосинтеза, сначала превращается
в сахарозу. Необходимая для этого глюкоза получается как побочный продукт
синтеза фруктана в вакуоли (см. рис. 9.23). Фосфорилирование катализируется
гексокиназой, находящейся в цитозоле. Поступление сахарозы в вакуоль и выход
глюкозы облегчаются различными переносчиками
Растения, которые накапливают фруктаны,
обычно запасают в листьях также сахарозу и
крахмал. Фруктаны, таким образом, составляют
дополнительный запас углеводов. Рисунок 9.24
представляет упрощенную схему образования
фруктанов как альтернативных запасных соеди-
нений в листе. Для синтеза фруктанов сначала в
цитозоле синтезируется сахароза (детали см. на
рис. 9.14). Требующаяся для этого УДФ-глюкоза
образуется из молекулы глюкозы, выходящей из
вакуоли в процессе синтеза фруктана и фосфо-
рилируемой гексокиназой. Таким образом, для
превращения образованного при фотосинтезе
фруктозо-6-фосфата в фруктан требуется в целом
две молекулы АТФ на один остаток гексозы.
Большие размеры вакуолей в клетках листа,
часто занимающих около 80% всего объема клет-
ки, обеспечивают растению весьма полезную
способность запасать углеводы в форме фрук-
танов. Таким образом, в листе при максимуме
дневного запасания углеводов в форме транзи-
торного крахмала и сахарозы может сохраняться
дополнительный резерв углеводов в форме фрук-
танов для таких целей, как образование семян
или устойчивость к неблагоприятным условиям.
9.6. Целлюлоза синтезируется
ферментами, локализованными
в плазматической мембране
Целлюлоза, важный компонент клеточной стен-
ки (раздел 1.1), представляет собой глюкан, в ко-
тором глюкозные остатки соединены (01 -> 4)
гликозидными связями, образуя очень длинную
цепь (рис. 9.25). Синтез целлюлозы катализи-
руется целлюлозосинтазой, локализованной в
клеточной мембране. Требующиеся для этого мо-
лекулы глюкозы доставляются из цитозоля в фор-
ме УДФ-глюкозы, а вновь синтезированная
целлюлозная цепь оказывается во внеклеточном
222
9. Полисахариды как запасные и транспортные формы углеводов...
р-1,3-глюкан: каллоза
Рис. 9.25. Целлюлоза и каллоза
компартменте (рис. 9.26). На клетках хлопчатни-
ка, образующих волокна (удобная система для
изучения синтеза целлюлозы) было показано, что
УДФ-глюкоза образуется мембранно-связанной
изоформой сахарозосинтазы (раздел 9.2) из са-
харозы, находящейся в цитозоле. Образовавшаяся
УДФ-глюкоза переносится непосредственно на
целлюлозосинтазу. Согласно результатам совре-
менных исследований, синтез целлюлозы начи-
нается с переноса глюкозного остатка с УДФ-
глюкозы на ситостерин (см. рис. 15.3), стероид
плазматической мембраны. Глюкозный остаток
соединяется с гидроксильной группой ситостери-
на гликозидной связью и действует как затравка
для синтеза целлюлозы, заякоривая, таким об-
разом, растущую целлюлозную цепь на мембра-
не. Целлюлоза никогда не бывает представлена
одиночными цепями, всегда множество ее це-
пей составляет квазикристалл ические структу-
ры, называемые микрофибриллами (раздел 1.1).
Предполагают, что вследствие наличия в мем-
бране множества близко расположенных целлю-
лозосинтазных комплексов все 0-1,4-глюкановые
цепи микрофибриллы синтезируются одновре-
менно и самопроизвольно формируют микрофи-
бриллу.
Синтез каллозы часто индуцируется
механическим повреждением
Каллоза — это 0-1,3-глюкан (см. рис. 9.25)
с длинной неразветвленной спирально закручен-
ной цепью. Каллоза самостоятельно формирует
очень компактные структуры и функционирует
как универсальный изолирующий материал
в растении. Очень большие количества каллозы
могут синтезироваться на плазматической мем-
бране как ответная реакция на поранение клет-
ки. Согласно результатам современных исследо-
ваний, ее синтез происходит сходно с синтезом
целлюлозы (показано на рис. 9.26). Вероятно,
мембранно-связанная сахарозосинтаза также об-
разует УЦФ-глюкозу для синтеза каллозы. Пред-
полагают, что каллоза и целлюлоза синтезиру-
ются тем же ферментом, но это еше не доказано
окончательно. Синтез каллозы стимулируется по-
вышением концентрации кальция в цитозоле.
Поранение индуцирует синтез каллозы как изо-
лирующего материала. Плазмодесмы поврежден-
ных клеток закупориваются отложением каллозы,
чтобы предотвратить повреждение других клеток
Целлюлоза
р-1,4-Глюкан
ВНЕКЛЕТОЧНОЕ
Сахароза Фруктоза
Рис. 9.26. Синтез 0-1,4-глюкановых цепей мембранно-связанной
целлюлозосинтазой. Требующаяся для этого УДФ-глюкоза образуется из сахарозы
мембранно-связанной формой сахарозосинтазы
Дополнительная литература
223
симпласта (раздел 1.1). Кроме того, каллоза слу-
жит заполняющим материалом для закупорки по-
врежденных ситовидных трубок (раздел 13.2).
Полисахариды клеточной стенки
синтезируются также в аппарате Гольджи
В отличие от синтеза каллозы и целлюлозы, ло-
кализованного на плазматической мембране,
синтез других полисахаридов клеточной стенки
(гемицеллюлоз и пектинов) происходит в аппара-
те Гольджи. Для этих синтезов некоторые гексозы
активируются как производные ГДФ (например,
ГДФ-манноза и ГДФ-фукоза). Перенос поли-
сахаридов, образованных в аппарате Гольджи, к
клеточной стенке осуществляется путем везику-
лярного транспорта и последующего экзоцитоза.
Дополнительная литература
Arioli, Т., Peng, L., Betzner, A. S., Burn, J., Wittke, W.,
Herth, W., Camilleri, C., Hofte, H., Jacek, P., Birch, R.,
Cork, A., Glover, J., Redmond, J., Williamson, R.
E. Molecular analysis of cellulose biosynthesis in
Arabidopsis. Science 279, 717—720 (1998).
Ball, S. G., Mrell, M. From bacterial glycogen to starch:
Understanding of the biogenesis of the plant starch
granule. Annu Rev Plant Biol 54, 207-233 (2003).
Blennow, A., Engelsen, S. B., Nielson, T. H., Baunsgaard, L.,
Mikkelsen, R. Starch phosphorylation: A new front line in
starch research. Trends Plant Sci 7, 445—449 (2002).
Brown, R. M., Saxena, I. M., Kuklicka, K. Cellulose biosynthesis
in higher plants. Trends Plant Sci 1, 149—156 (1996).
Calvert, P. The structure of starch. Nature 389, 338—339
(1997).
Cairns, A. J., Pollock, C. J. Gallagher, J. A., Harrison, J.
Fructans: Synthesis and regulation. In Photosynthesis:
Physiology and Metabolism. R. C. Leagued, T. D. Sharkey,
S. von Caemmerer (eds.), pp. 301—351. Kluwer Academic
Publishers, Dordrecht, The Netherlands (2000).
Delmer, D. P. Cellulose biosynthesis: Exciting times for a
difficult field of study. Annu Rev Plant Physiol Plant Mol
Biol 50, 245-276(1999).
Fischer, K., Weber, A. Transport of carbon in non-green
plastids. Trends Plant Sci 7, 345—351 (2002).
Kammerer, B., Fischer, K., Hilpert, B., Schubert, S.,
Gutensohn, M.,Weber, A., Fliigge, U.-L Molecular
characterization of a carbon transporter in plastids from
heterotrophic tissues: The glucose 6-phosphate antiponer.
Plant Cell 10, 105-117(1998).
Mendel, G. Versuche Uber Pflanzen-Hybriden Verh.
Naturforscher-Verein Briinn 4, 3—47 (1865).
Myers, A. M., Morell, M. K., James, M. G., Ball, S. G.
Recent progress toward understanding biosynthesis of the
amylopectin crystal. Plant Physiol 122, 989—997 (2000).
Peng, L., Kawagoe, Y., Hogan, P., Delmer, D. Sitosterol-
p-glucoside as primer for cellulose synthesis in plants.
Science 295, 147-150(2002).
Preiss, J. Biology and molecular biology of starch synthesis
and its regulation. In Oxford Surveys of Plant Molecular
and Cell Biology, B. J. Miflin, (ed.), 7, 59-114 (1991).
Read, S. M., Bacic, T. Prime times for cellulose. Science
295, 59-60 (2002).
Reid, J. S. G. Cementing the wall: Cell wall polysaccharide
synthesizing enzymes. Curr Opin Plant Biol 3, 512—516
(2000).
Ritte, G., Lloyd, J. R., Eckermann, N., Rottmann, A.,
Kossmann, J., Steup, M. The starch-related R1 protein is
an a-glucan, water dikinase. Proc Natl Acad Sci USA 99,
7166-7171 (2002).
Saxena, I. M., Brown Jr, R. M. Cellulose synthases and
related enzymes. Curr Opin Plant Biol 3, 523—531 (2000).
Slattery, C. J., Kavakli, I. H., Okita, T. W Engineering
starch for increased quantity and quality. Trends Plant Sci
5, 291-298 (2000).
Smith A. M. Making starch. Curr Opin Plant Biol 2, 223—
229(1999).
Stitt, M. Metabolic regulation of photosynthesis. In
Advance in Photosynthesis, Vol. 5. Environmental Stress
and Photosynthesis, N. Baker, (ed.). Academic Press,
New York, 151-190(1997).
Taylor, N. G., Howells, R. M., Huttly, A. K.,Vickers, K.,
Turner, S. R. Interactions among three distinct CesA
proteins essential for cellulose synthesis. Proc Natl Acad
Sci USA 100 1450-1455 (2003).
Toroser, D., Huber, S. C. Protein phosphorylation as a
mechanism for osmotic-stress activation of sucrose-
phosphate synthase in spinach leaves. Plant Physiol 114,
947-955(1997).
Wiese, A., Groner, E, Sonnewald, U., Deppner, H.,
Lerchl. J., Hebbeker, U., Fliigge, U.-L,Weber, A. Spinach
hexokinase I is located in the outer envelope membrane of
plastids. FEBS Lett 461, 13-18 (1999).
Williamson, R. E., Bum, J. E., Hocart, С. H. Towards the
mechanism of cellulose synthesis. Trends Plant Sci 7,
461-467 (2002).
Winter, H., Huber, S. C. Regulation of sucrose metabolism
in higher plants: Localization and regulation of activity of
key enzymes. Crit Rev Plant Sci 19, 31—67 (2000).
Zimmermann, M. H., Ziegler, H. List of sugars and sugar
alcohols in sievetube exudates. In (Zimmermann, M.H.;
Milbum, J.A. (eds.)) Encyclopedia of Plant Physiology,
Springer Verlag, Heidelberg, Vol. 1, 480—503 (1975).
Ассимиляция нитратов крайне важна
для синтеза органического вещества
Живая материя содержит большое количес-
тво азота, включенного в белки, нуклеи-
новые кислоты и многие другие биомолекулы.
Этот органический азот представлен степенью
окисления —III (как в NH3). При автотрофном
росте потребность в азоте для образования ве-
ществ клетки удовлетворяется двумя альтерна-
тивными путями:
1. Фиксация молекулярного азота из воздуха.
2. Ассимиляция нитрата или аммония, содер-
жащихся в воде или в почве.
Лишь некоторые бактерии, включая циано-
бактерий, способны фиксировать N2 из воздуха.
Некоторые растения вступают в симбиоз с азот-
фиксирующими бактериями, снабжающими их
азотом, включенным в органические вещества.
В главе 11 это рассмотрено более подробно. Од-
нако около 99% органического азота биосферы
получены в результате ассимиляции нитрата.
NH^ образуется как конечный продукт дегра-
дации органического вещества, прежде всего в
процессах метаболизма животных и бактерий,
и вновь окисляется до нитрата нитрифицирую-
щими бактериями почвы. Таким образом, суще-
ствует постоянный круговорот между нитратом
почвы и органическим азотом растений, произ-
растающих на ней. NH^ накапливается только
в плохо аэрируемых и недостаточно дрениро-
ванных почвах, где существование нитрифици-
рующих бактерий затруднено из-за недостатка
кислорода. В местностях с интенсивным живот-
новодством в почву может попадать много ам-
миака как из навоза, так и из воздуха. При его
доступности многие растения способны также
использовать NH^ вместо нитрата в качестве
источника азота.
10.1. Существуют два
последовательных этапа
восстановления нитрата до NH^
Нитрат может ассимилироваться как в листьях,
так и в корнях. У большинства взрослых тра-
вянистых растений ассимиляции нитрата про-
исходит прежде всего в листьях, хотя ассими-
ляция нитрата в корнях у этих растений часто
играет основную роль на ранних стадиях роста.
У многих деревьев и кустарников ассимиляция
нитрата идет преимущественно в корнях.
Транспорт нитрата в клетки корней осу-
ществляется в симпорте с двумя протонами
(рис. 10.1). Протонный градиент на плазматиче-
ской мембране, генерируемый Н+-Р-АТФазой
(раздел 8.2), обеспечивает поглощение нитрата
против градиента концентрации. АТФ, требуе-
мая для создания протонного градиента, обра-
зуется преимущественно за счет митохондри-
ального дыхания. Если митохондриальный
синтез АТФ в корнях подавить ингибитором или
разобщителем дыхания, то поглощение нитра-
та обычно прекращается. На плазматической
мембране клеток корней содержатся несколь-
ко переносчиков нитрата; среди них имеются
переносчик со сравнительно низким сродством
(полунасыщение >500 мкмоль нитрата) и пере-
носчик с очень высоким сродством (полуна-
сыщение 20—100 мкмоль нитрата), причем по-
следний индуцируется лишь в том случае, когда
это обусловлено потребностями метаболизма.
Таким образом, интенсивность поглощения
нитрата корнями зависит от внешних условий.
Эффективность системы поглощения нитрата
делает возможным рост растений даже при очень
низкой концентрации нитрата — до 10 мкмоль.
10.1. Существуют два последовательных этапа восстановления нитрата до NH4
225
Рис. 10.1. Ассимиляция нитрата в корнях и листьях растения. Нитрат поглощается
из почвы клетками корней. Он может запасаться в вакуолях этих клеток
или ассимилироваться в клетках коры корня. Избыток нитрата переносится
по сосудам ксилемы в клетки мезофилла, где нитрат может временно запасаться
в вакуолях. Нитрат в клетках мезофилла восстанавливается до нитрита, а затем
нитрит в хлоропластах восстанавливается далее до NH4+, используемого в синтезе
аминокислот. Перенос Н+ из цитозоля клеток корней и мезофилла осуществляется
при помощи Н+-Р-АТФазы
226
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
а
НАДН + Н®
НАД®
NO®
NO®
Последовательность аминокислот:
НООС -| 1 ФАД [ 1 Гем | 1~МоКо [- NH2
Домен Домен Домен
Рис. 10.2. (а) Нитратредуктаза переносит электроны от НАД(Ф)Н к нитрату.
(б) Фермент содержит три домена, в нем объединены ФАД, гем и молибденовый
кофактор (МоКо)
Нитрат, поглощенный клетками корней, мо-
жет временно запасаться там в вакуолях. Как по-
казано в разделе Ю.2, NO3 восстанавливается
до NH4+ в клетках корня. Этот NH4+ в основном
используется для образования транспортных
форм: глутамина и аспарагина (обозначены
общим названием амиды на рис. ЮЛ). Эти две
аминокислоты могут транспортироваться в ли-
стья по сосудам ксилемы. Однако если способ-
ность корней к ассимиляции нитрата исчерпы-
вается, то нитрат поступает из корней в сосуды
ксилемы и переносится с восходящим током в
листья1. Там нитрат поглощается клетками ме-
зофилла, возможно, также путем протонного
симпорта. Большие количества нитрата могут
запасаться в листе, накапливаясь в вакуолях.
Иногда этот вакуолярный запас потребляется
вследствие ассимиляции нитрата в течение дня
и восстанавливается ночью. Так, например,
в листьях шпината самое высокое содержание
нитрата обнаруживается рано утром.
Нитрат в клетках мезофилла восстанавлива-
ется до нитрита нитратредуктазой, присутству-
ющей в цитозоле, а затем до NH4+ нитритре-
дуктазой в хлоропластах (см. рис. 10.1).
Нитрат восстанавливается до нитрита
в цитозоле
При восстановлении нитрата в качестве вос-
станавителя используется в большинстве слу-
1 Распределение восстановления нитрата между надзем-
ными и подземными органами зависит от вида растения. —
Прим. ред.
чаев НАДН, но некоторые растения содержат
нитратредуктазу, реагирующую с НАДФН так
же успешно, как и с НАДН. Нитратредуктаза
высших растений состоит из двух идентичных
субъединиц. Молекулярная масса каждой субъ-
единицы варьирует от 99 до 104 кДа в зависимо-
сти от вида растения. Каждая субъединица со-
держит электронтранспортную цепь (рис. 10.2),
состоящую из одной молекулы флавинаденин-
динуклеотида (ФАД), одного гема в составе
цитохрома b (цит Ь551) и одного кофактора, со-
держащего молибден (рис. 10.3). Этот кофактор
является птерином с боковой цепью, с которой
ковалентно связан молибден при помощи двух
атомов серы, и называется молибденовым ко-
фактором, сокращенно МоКо. Связанный атом
Мо, вероятно, изменяет состояния окисления от
+IV до +VI. Каждый из трех редокс-переносчиков
нитратредуктазы ковалентно связан с субъеди-
ницей фермента. Белковую цепь субъединицы
можно разделить ограниченным протеолизом на
три домена, каждый из которых содержит толь-
Птерин
Рис. 10.3. Молибденовый кофактор (МоКо)
10.1. Существуют два последовательных этапа восстановления нитрата до NH4
227
Свет
NH® + 2 Н2О
NO® + 8 Н®
Рис. 10.4. Нитритредуктаза в хлоропластах переносит электроны от ферредоксина
к нитриту. Восстановление ферредоксина фотосистемой I показано на рис. 3.16
ко один из редокс-переносчиков. Эти раздель-
ные домены, как и целый фермент, способны
при помощи своих редокс-переносчиков ката-
лизировать транспорт электронов к искусствен-
ным акцепторам электронов [например, от
НАДФН к ионам Fe3+ посредством домена ФАД
или от восстановленного метилвиологена (см.
рис. 3.39) к нитрату посредством Мо-домена].
Нитратредуктаза также способна в небольшом
количестве восстанавливать нитрит до оксида
азота (NO), который является важным сигналь-
ным соединением в сигнальных каскадах (раз-
дел 8.2, 19.1). Более того, нитратредуктаза вос-
станавливает хлорат (СЮ3-) в хлорит (СЮ2-).
Последний представляет собой очень сильный
окислитель и поэтому чрезвычайно токсичен
для растительных клеток. В прошлом хлорат
использовали в качестве недорогого неизбира-
тельного гербицида для уничтожения сорной
растительности на железнодорожных путях.
Восстановление нитрита до аммония
происходит в пластидах
Для восстановления нитрита до аммония не-
обходимо шесть электронов. Эта реакция ка-
тализируется единственным ферментом, ни-
тритредуктазой (рис. Ю.4), локализованным
исключительно в пластидах. Этот фермент ис-
пользует в качестве донора электронов восста-
новленный ферредоксин, который образуется
фотосистемой I как продукт нециклического
транспорта электронов (см. рис. 3.31). В значи-
тельно меньшей степени ферредоксин, необ-
ходимый для восстановления нитрита в листе,
может также продуцироваться в темноте путем
восстановления с участием НАДФН, который
генерируется в окислительном пентозофосфат-
ном пути, происходящем в хлоропластах и дру-
гих пластидах (рис. 6.21 и 10.8).
Нитритредуктаза содержит ковалентно свя-
занный 4Fe-4S кластер (см. рис. 3.26), одну мо-
лекулу ФАД и один сирогем. Сирогем (рис. 10.5)
представляет собой циклический тетрапиррол
с атомом Fe в центре. Его структура отличается
от гема тем, что содержит добавочный ацетиль-
ный и пропионильный остатки, образовавшие-
ся при синтезе пиррола (раздел 10.5).
Кластер 4Fe-4S, ФАД и сирогем образуют
цепь электронного транспорта, по которой
электроны переносятся от ферредоксина на ни-
трит. Нитритредуктаза обладает очень высоким
сродством к нитриту. Способность к восста-
новлению нитрита в хлоропластах значительно
выше, чем способность к восстановлению ни-
трата в цитозоле. Следовательно, весь нитрит,
образованный нитратредуктазой, может быть
полностью превращен в аммоний. Это очень
важно, поскольку нитрит токсичен для клетки.
Он образует диазосоединения с аминогруппами
азотистых оснований (R-NH2), которые пре-
вращаются в спирты с высвобождением азота.
R - NH2 + NO2- [R-N=N-OH + ОН-]
-> R-OH + N2 + OH-
Так, например, цитозин может превращаться
в урацил. Эта реакция может привести к мута-
циям в нуклеиновых кислотах. Весьма эффек-
тивное восстановление нитрита в хлоропластах
нитритредуктазой предотвращает накопление
нитрита в клетках.
228
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
СООН
СООН
Сирогем
Рис. 10.5. Сирогем
Фиксация NH4+ осуществляется
с помощью некоторых ферментов,
участвующих в фотодыхании
Глутаминсинтетаза в хлоропластах перено-
сит вновь образованный NH4+ за счет АТФ на
глутамат с образованием глутамина (рис. 10.6).
Активность глутаминсинтетазы и ее сродство
к NH4+ (Атп ~ 5-10'6 моль/л) настолько высоки,
что NH4+, произведенный нитритредуктазой,
полностью потребляется. В той же реакции фик-
сируется также NH4+, выделившийся в процессе
фотодыхания (см. рис. 7.9). Вследствие высокой
интенсивности фотодыхания количество NH4+,
полученного путем окисления глицина, при-
близительно в 5—10 раз больше, чем количество
NH4+, образованного при ассимиляции нитрата.
Таким образом, в ассимиляцию нитрата реально
включается лишь незначительная часть синтеза
глутамина в листьях. В листьях содержится также
цитозольная изоферментная форма глутамин-
синтетазы.
Глуфосинат (рис. 10.7), субстратный ана-
лог глутамата, ингибирует синтез глутамина.
В растениях, у которых добавление глуфосина-
та ингибирует синтез глутамина, накапливает-
ся аммоний до токсических уровней, вызывая
их отмирание. Глуфосинат аммония распро-
странен в качестве гербицида (раздел 3.6) под
торговым названием Liberty (фирма «Aventis»).
Его преимуществом является то, что он быстро
разлагается в почве, не оставляя токсических
продуктов деградации. В последнее время пу-
тем генетической инженерии выведены сель-
скохозяйственные растения, устойчивые к глу-
фосинату, что дает возможность использовать
его как избирательный гербицид для уничтоже-
ния сорняков среди культурных растений (раз-
дел 22.6).
Глутамин, образуемый в хлоропластах, всту-
пает в реакцию с а-кетоглутаратом, катализи-
руемую глутаматсинтазой (называемой также
глутаминоксо глутаратаминотрансферазой, или
сокращенно ГОГАТ), где восстановителем слу-
жит ферредоксин и получаются две молекулы
глутамата (см. рис. 7.9). Некоторые хлоропла-
сты и лейкопласты содержат также НАДФН-за-
висимую глутаматсинтазу. Глутаматсинтазы ин-
гибируются субстратным аналогом азасерином
(рис. 10.7), который токсичен для растений.
а-Кетоглутарат, расходующийся в глутамат-
синтазной реакции, транспортируется в хлоро-
пласты специфическим переносчиком в обмен
на малат, перемещаемый в противоположном
направлении (см. рис. 10.6). Другой переносчик
10.1. Существуют два последовательных этапа восстановления нитрата до NH4
229
ХЛОРОПЛАСТ
ЦИТОЗОЛЬ
Нитрит-
редуктаза
NH® -------------
Нитрат-
редуктаза
NO®
NO®
Глутамин-
синтетаза
Глутамат-
синтаза
Основные продукты
ассимиляции нитрата
Г идроксипируват
Рис. 10.6. Компартментация отдельных реакций ассимиляции нитрата
и пути фотодыхания в клетках мезофилла. NH^-, образовавшийся в процессе
фотодыхания, обозначен черным цветом, a NH4+, полученный при ассимиляции
нитрата, обозначен красным цветом. Основные продукты ассимиляции нитрата
отмечены красными стрелками
Рис. 10.7. Глуфосинат (называемый также
фосфинотрицином) является субстратным
аналогом глутамата и сильным ингибитором
глутаминсинтетазы. Аммонийная соль глуфосината
используется как гербицид (Liberty, фирма «Aventis»).
Азасерин является субстратным аналогом глутамата
и ингибитором глутаматсинтазы
СООе
H-C-NH®
СН2
СН2
СН3-Р-ОН
II
О
Глуфосинат
соо®
H-C-NH®
СН2
О
I
с=о
CH2-N= NH®
Азасерин
230
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
в оболочке хлоропласта транспортирует глута-
мин в обмен на глутамат, осуществляя вынос
глутамина из хлоропластов.
10.2. Ассимиляция нитрата
происходит также в корнях
Как уже отмечалось, ассимиляция нитрата осу-
ществляется частично, а у некоторых видов пре-
имущественно, в корнях. NH4+, поглощенный
из почвы, обычно фиксируется в корнях. Вос-
становление нитрата и нитрита, а также и фик-
сация NH4+ происходят в клетках корней анало-
гично процессам, имеющим место в мезофилле.
Однако в клетках корней необходимые восста-
новительные эквиваленты образуются исклю-
чительно при окислении углеводов. Восстанов-
ление нитрита и соответственно фиксация NH4+
(рис. 10.8) осуществляются в специализирован-
ных пластидах (раздел 1.3).
Окислительный пентозофосфатный
путь производит восстановительные
эквиваленты для восстановления нитрита
в лейкопластах
Восстановительные эквиваленты, необходимые
для восстановления нитрита и образования глу-
тамата, производятся в лейкопластах при окис-
лении глюкозо-6-фосфата в реакциях окисли-
тельного пентозофосфатного пути, описанного
в разделе 6.5 (рис. 10.8). Поглощение глюкозо-
6-фосфата происходит посредством обмена на
противоположное перемещение триозофосфа-
та. Глюкозо-6-фосфат-фосфатный транс-
Рис. 10.8. Окислительный пентозофосфатный путь поставляет
восстановительные эквиваленты для восстановления нитрита в пластидах
(лейкопластах) нефотосинтезирующих тканей. В некоторых пластидах глюкозо-1-
фосфат переносится в обмен на триозофосфат или фосфат. Фд — ферредоксин
10.3. Ассимиляция нитрата строго контролируется
231
локатор лейкопластов отличается от триозо-
фосфат-фосфатного переносчика хлоропластов
тем, что он способен переносить глюкозо-6-
фосфат в дополнение к фосфату, триозофос-
фату и 3-фосфоглицерату. В ходе окислитель-
ного пентозофосфатного пути три молекулы
глюкозо-6-фосфата превращаются в три молеку-
лы рибулозо-5-фосфата с выделением трех мо-
лекул СО2, при этом образуются шесть молекул
НАДФН.
Для восстановления нитрита в лейкопла-
стах, как и в хлоропластах, также требуется
восстановленный ферредоксин в качестве вос-
становителя. В лейкопластах ферредоксин вос-
станавливается при помощи НАДФН, который
генерируется в ходе окислительного пентозо-
фосфатного пути. АТФ, расходуемая при синте-
зе глутамина в лейкопластах, может образовы-
ваться в митохондриях и транспортироваться
в лейкопласты пластидным переносчиком АТФ
в обмен на АДФ. Глутаматсинтаза лейкопластов
также использует восстановленный ферредок-
син в качестве источника электронов, хотя не-
которые лейкопласты могут содержать глута-
матсинтазу, которая использует НАДФН или
НАДН непосредственно как восстановитель.
При восстановлении нитрата в корнях побег
снабжается в основном такими органическими
соединениями азота, как глутамин и аспара-
гин, переносимыми восходящим током по со-
судам ксилемы. Это относится и к тем случаям,
когда источником азота в почве является NH4+.
10.3. Ассимиляция нитрата
строго контролируется
При фотосинтезе ассимиляция СО2 и ассими-
ляция нитрата должны происходить согласо-
ванно. Ассимиляция нитрата может протекать
лишь в том случае, когда благодаря ассимиля-
ции СО2 формируются углеродные скелеты для
аминокислот. Кроме того, ассимиляция ни-
трата должна регулироваться таким образом,
чтобы образование аминокислот не превыша-
ло потребности в них. Наконец, важно, чтобы
восстановление нитрата шло не быстрее, чем
восстановление нитрита, поскольку в против-
ном случае в клетках могли бы накапливаться
заметные количества нитрита вплоть до ток-
сического уровня (раздел 10.1). Впрочем, при
определенных обстоятельствах такое опасное
накопление нитрита может происходить, на-
пример, в корнях, если по причине повышен-
ной влажности в почве создаются анаэробные
условия. Затопленные корни способны выде-
лять нитрит в воду, тем самым избегая возрас-
тания его уровня до токсического. Но подоб-
ный путь сбрасывания излишков недоступен
для листьев, поэтому там особенно важен стро-
гий контроль восстановления нитрата.
НАДН, необходимый для восстановления
нитрата в цитозоле, может образовываться и
в темноте (например, при гликолизе). Однако
восстановление нитрата и фиксация N Н4+ в хло-
ропластах существенно зависят от производи-
мых в процессе фотосинтеза восстановительных
эквивалентов (Фдвосст) и АТФ. Окислительный
пентозофосфатный путь в темноте способен
производить лишь весьма ограниченные коли-
чества восстановительных эквивалентов. Сле-
довательно, в темноте восстановление нитрата
в листьях должно замедлиться или даже прекра-
титься, чтобы предотвратить накопление нитри-
та1. Это показывает, насколько существенна для
растения регуляция активности нитратредукта-
зы, т.е. начальной стадии ассимиляции нитрата.
Синтез белка нитратредуктазы
регулируется на уровне экспрессии гена
Нитратредуктаза является исключительно корот-
коживущим белком. Период его полуобновления
составляет лишь несколько часов. Следовательно,
скорость синтеза этого фермента de novo очень
высока. Поэтому, регулируя синтез нитратре-
дуктазы, можно добиться изменения активности
фермента через несколько часов.
Различные факторы контролируют синтез
этого фермента на уровне генной экспрессии.
Нитрат и свет стимулируют синтез фермента.
Не решенным окончательно остается вопрос,
участвует ли в данном регуляторном процессе
рецептор красного света фитохром или рецеп-
тор синего света криптохром (глава 19). Синтез
белка нитратредуктазы стимулируется глюкозой
и другими углеводами и ингибируется NH4+, глу-
тамином и другими аминокислотами (рис. 10.9).
1 Пентозофосфатный шунт в темноте может работать до-
статочно активно. Поэтому существуют и другие причины
снижения ассимиляции нитрата в ночное время. — Прим,
ред.
232
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
Вероятно, в клетке имеются сенсоры, которые
путем регуляции генной экспрессии корректи-
руют скорость синтеза нитратредуктазы, согла-
суя между собой потребность как в аминокисло-
тах, так и доступных углеродных скелетов для их
синтеза, полученных в результате ассимиляции
СО2.
Нитратредуктаза также регулируется
обратимой ковалентной модификацией
Регуляция синтеза нитратредуктазы (HP) de novo
позволяет регулировать активность фермента в
течение временного интервала в несколько ча-
сов. Этого недостаточно, чтобы предотвратить
накопление нитрита в растении при внезапном
снижении уровня освещенности. Быстрая инак-
тивация нитратредуктазы в минутные временные
интервалы происходит путем фосфорилирова-
ния нитратредуктазы (см. рис. 10.9). При затем-
нении остаток серина, расположенный в белке
нитратредуктазы между гемом и доменом МоСо,
фосфорилируется специфической протеинкина-
зой, называемой киназой нитратредуктазы. Эта
протеинкиназа ингибируется продуктом фото-
другие стимулы Свет
; Фотосинтез
; Триозофосфат и
t другие фосфорные
Са2+ эфиры
Глюкоза Свет
(и другие аминокислоты) Окадаевая кислота
Рис. 10.9. Регуляция активности нитратредуктазы (HP). Синтез белка HP
стимулируется углеводами (вероятно, глюкозой или продуктами ее метаболизма)
и светом [+] и ингибируется глутамином и другими аминокислотами [—].
Вновь образованный белок HP разрушается в течение нескольких часов.
Нитратредуктаза ингибируется фосфорилированием серинового остатка и
последуюшим взаимодействием с белком-ингибитором (14-3-3 белок). После
гидролитического отделения фосфатного остатка протеинфосфатазой ингибитор
диссоциирует, и нитратредуктаза вновь обретает полную активность. Активность
киназы нитратредуктазы ингибируется триозофосфатом и другими фосфорными
эфирами — продуктами фотосинтеза при освещении — и таким образом
обеспечивается активность нитратредуктазы на свету. Посредством влияния
Са2+ на киназу нитратредуктазы другие, еще не идентифицированные, факторы
могут модулировать активность нитратредуктазы. Окадаевая кислота, ингибитор
протеинфосфатаз, противодействует активации фосфатазы нитратредуктазы
(по Huber et al., 1996)
10.3. Ассимиляция нитрата строго контролируется
233
синтеза триозофосфатом и другими фосфорны-
ми эфирами и стимулируется ионами Са2+, слу-
жащего мессенджером многих сигнальных цепей
(раздел 19.1). Фосфорилированная нитратредук-
таза связывает белок-ингибитор (14-3-3 белок).
Этим прерывается транспорт электронов между
цитохромом Ь551 и доменом МоКо (см. рис. 10.2)
и таким образом нитратредуктаза ингибирует-
ся. Фосфатаза нитратредуктазы гидролизует
фосфорилированный серин фермента (дефосфо-
рилирование), что приводит к отделению белка-
ингибитора от фермента, поэтому нитратре-
дуктаза вновь обретает активность. Окадаевая
кислота ингибирует фосфатазу нитратредуктазы
и таким образом также ингибирует реактивацию
нитратредуктазы. Еще не выяснено, какие эф-
фекторы передают сигнал об уровне освещен-
ности к киназе и фосфатазе нитратредуктазы.
Ингибирование киназы нитратредуктазы трио-
зофосфатом и другими фосфорными эфирами
показывает, что нитратредуктаза активна лишь
тогда, когда фиксация СО2 функционирует в ре-
жиме образования углеродных скелетов для син-
теза аминокислот, что обсуждается в следующем
разделе.
14-3-3-белки являются важными
метаболическими регуляторами
Было обнаружено, что белок-ингибитор нитра-
тредуктазы принадлежит к семейству регуля-
торных белков, называемых 14-3-3-белками,
которые широко распространены в животном и
растительном царствах. 14-3-3-белки связываются
специальным связывающим сайтом — с шестью
аминокислотами белка-мишени, содержащим
фосфорилированный серин в положении 4. Это
было проверено для нитратредуктазы в опыте, в
котором серин в связывающем 14-3-3-белок сай-
те нитратредуктазы был заменен путем мутаге-
неза на аргинин: измененная нитратредуктаза не
могла более инактивироваться фосфорилирова-
нием. 14-3-3-белки могут связываться с многими
белками, регулируя их активность. Они образуют
большое семейство мультифункциональных ре-
гуляторных белков, многие изоформы которых
присутствуют лишь у отдельных растений. Таким
образом, 14-3-3-белки регулируют у растений
активность Н+-Р-АТФазы (раздел 8.2) плазма-
тической мембраны. 14-3-3-Белки регулируют
функцию факторов транскрипции (раздел 20.2)
и транспорт белка в хлоропласты (раздел 21.3).
Имеются указания на то, что 14-3-3-белки уча-
ствуют в регуляции трансдукции сигнала (раздел
19.1), так как они связываются с различными ки-
назами белков, а также играют некоторую роль
в защитных процессах при биотических и абио-
тических стрессах. Выяснение этих различных
функций 14-3-3-белков в настоящее время пред-
ставляет собой весьма актуальную тему исследо-
ваний.
Эта важная функция 14-3-3-белков в метабо-
лической регуляции используется патогенным
грибом Fusicoccum при нападении на расте-
ния. Этот гриб вырабатывает соединение фу-
зикокцин, которое специфически связывается
с 14-3-3-белком, занимая сайты различных бел-
ков1, и таким образом подавляет регуляторную
функцию 14-3-3-белков. Это может нарушить
метаболизм до такой степени, что растение,
в конечном счете, погибает. Подобное нападе-
ние разыгрывается весьма изощренно. Когда,
например, Fusicoccum amygdalis инфицирует
персиковые или миндальные деревья, снача-
ла он поражает лишь немногие листья. В этих
листьях гриб выделяет фузикокцин в апопласт,
откуда это вещество распространяется с током
воды по остальным частям растения. В конце
концов фузикокцин достигает устьичных кле-
ток, где он активирует сигнальную цепь, удер-
живающую устьица постоянно открытыми. Это
приводит к очень большой потере воды; в итоге
листья увядают, дерево отмирает и становится
источником питания для гриба.
В регуляции нитратредуктазы
и сахарозофосфатсинтазы много общего
Описанный механизм регуляции восстановления
нитрата путем фосфорилирования серинового
остатка нитратредуктазы специфическими про-
теинкиназами и протеинфосфатазами имеет уди-
вительное сходство с регуляцией сахарозофос-
фатсинтазы, обсуждаемой в главе 9 (см. рис. 9.18).
В темноте оба фермента инактивируются по-
средством фосфорилирования, которое в слу-
чае нитратредуктазы требует также связывания
белка-ингибитора. Оба фермента вновь активи-
руются протеинфосфатазами, которые ингибиру-
1 Основной мишенью фузикокцина считается Н+-АТФаза
плазмалеммы. — Прим. ред.
234
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
ются окадаевой кислотой. Сахарозофосфатсинта-
за также имеет сайт связывания с 14-3-3-белком,
однако его значение для регуляции еще неясно.
Хотя многие детали еще неизвестны, но очевид-
но, что основные механизмы быстрой регуляции
светом сходны у сахарозофосфатсинтазы и ни-
тратредуктазы.
10.4. Конечным продуктом
ассимиляции нитрата является
целый спектр аминокислот
Как будет показано в главе 13, углеводы об-
разуются как продукты ассимиляция СО2 и
транспортируются из листьев по ситовидным
трубкам в другие части растения лишь в виде
определенных транспортных форм, таких как
сахароза, сахароспирты (например, сорбит) или
раффиноза вербаскоза и стахиоза, в зависимо-
сти от вида. Для продуктов ассимиляции нитра-
та подобных специальных транспортных форм
нет. Все аминокислоты, имеющиеся в клетках
мезофилла, экспортируются по ситовидным
трубкам. Поэтому вся совокупность амино-
кислот может рассматриваться как конечный
продукт ассимиляции нитрата. (Следует под-
черкнуть, что первичными продуктами ассими-
ляции нитрата являются только глутамин и глу-
тамат. — Прим, ред.) Синтез этих аминокислот
имеет место преимущественно в хлоропластах.
Набор синтезируемых аминокислот широко
варьирует в зависимости от вида растения и
направленности метаболизма. В большинстве
случаев основную часть синтезируемых амино-
кислот составляют глутамат и глутамин. Глу-
тамат экспортируется из хлоропластов в обмен
на малат, а глутамин — в обмен на глутамат (см.
рис. 10.6). Значительную часть общего количе-
ства аминокислот, присутствующих в клетках
мезофилла, составляют также серин и глицин,
образующиеся как промежуточные продукты
в процессе фотодыхания. У С4-растений часто
образуются большие количества аланина.
В процессе ассимиляции СО2 производятся
углеродные скелеты для синтеза конечных
продуктов ассимиляции нитрата
При ассимиляции СО2 образуются углеродные
скелеты, требующиеся для синтеза различных
аминокислот. На рисунке 10.10 схематически
Рибозо- Фосфо-
5-фосфат гликолат
Фосфо- Эритрозо-
енолпируват 4-фосфат
Про Иле
Лиз
Мет
Рис. 10.10. Происхождение углеродных скелетов для различных аминокислот
Гис Гли
Сер -► Цис
10.4. Конечным продуктом ассимиляции нитрата является целый спектр аминокислот
235
Рис. 10.11. Углеродные скелеты для синтеза аминокислот образуются в процессе
фотосинтеза. Важные предшественники синтеза аминокислот выделены цветом
представлено происхождение углеродных ске-
летов для отдельных аминокислот.
3-фосфоглицерат — наиболее важный угле-
родный предшественник синтеза аминокислот.
Он образуется в цикле Кальвина и экспортиру-
ется из хлоропластов в цитозоль триозофосфат-
фосфатным переносчиком в обмен на фосфат
(рис. Ю.Н). В цитозоле 3-фосфоглицерат пре-
вращается фосфоглицератмутазой и енолазой
в фосфоенолпируват (ФЕП). От ФЕП идет раз-
ветвление на два метаболических пути: реакция,
посредством пируваткиназы приводящая к пи-
рувату, и с участием ФЕП-карбоксилазы, даю-
щая оксалоацетат. Кроме того, ФЕП совместно
с эритрозо-4-фосфатом служит предшественни-
ком для синтеза ароматических аминокислот че-
рез шикиматный путь, рассматриваемый далее
в этой главе. Поскольку шикиматный путь ло-
кализован в хлоропластах1, необходимый ФЕП
транспортируется в хлоропласты специфиче-
ским ФЕП-фосфатным-транслокатором (пе-
реносчиком).
ФЕП-карбоксилазная реакция уже обсужда-
лась в связи с метаболизмом устьичных клеток
(раздел 8.2) и С4- и САМ-метаболизмом (раз-
делы 8.4 и 8.5). Оксалоацетат, образуемый при
участии ФЕП-карбоксилазы, несет две функ-
ции в ассимиляции нитрата:
1 У некоторых растений обнаружены изоформы отдельных
ферментов шикиматного пути, локализованные в цитозоле.
Однако их активность ниже, чем у пластидных изоформ.
Наличие полного шикиматного пути в цитозоле является
предметом дискуссии. — Прим. ред.
236
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
сн2
сн2
соо®
соое
H-C-NH
НАДФН НАДФ®
АТФ АДФ
сн2
сн2
О>С"ОРОз
Глутамил-
q фосфат
сн2
сн2
н-с=о
н2О
соое
H-C-NH
н2с---сн2
НС\ нс-соо®
^N^
НАДФН НАДФ®
н2с---сн2
н2с нс-соо®
^n®
Н2
Глутамат
KoA-SH
СООе
K0A-S-C-CH3
Глутамат-
семиальдегид
Д-Пирролин-
5-карбоксилат
Пирролин-5-
карбоксилат-
редуктаза
Пролин
о
АТФ АДФ
соое
Н-с—N-C-CH3
I н
сн2
сн2
соо®
Н-с—N-C-CH
I н
сн2
сн2
о*с"оро|®
о
НАДФН НАДФ®
СООе
о
Н-С—N-С-СНз
I н 3
сн2
сн2
н-с=о
Л/-Ацетил -
глутамат
Н-с—N-C-CH
I н
сн2
сн2
I
h2c-nh®
СООе
Л/-Ацетил-
глутамил-
фосфат
Л/-Ацетил-
глутамил-
семиальдегид
Глутамат
а-Кетоглутарат
АТФ АМФ
+ ФФ
/Оро^®
о=с
'nh2
сн2
сн2
h2c-nh?
Фумарат
соо®
I
H-C-NH®
сн2
сн2
I 4
h2c-n-c
н 'nh2
NH®
Л/-Ацетил -
орнитин
Орнитин
Аргинин
Рис. 10.12. Пути образования аминокислот из глутамата
10.4. Конечным продуктом ассимиляции нитрата является целый спектр аминокислот
237
1. Он превращается путем трансаминирования
в аспартат, который является предшествен-
ником синтеза пяти других аминокислот
(аспарагина, треонина, изолейцина, лизина
и метионина).
2. Совместно с пируватом он служит пред-
шественником для образования а-кетоглута-
рата, который превращается путем трансами-
нирования в глутамат, являющийся в свою
очередь предшественником трех других ами-
нокислот (глутамина, аргинина и пролина).
Гликолат, образованный при фотодыхании,
служит предшественником для образования
глицина и серина (см. рис. 7.1), из последнего
образуется цистеин (глава 12). В нефотосинте-
зирующих клетках серин и глицин могут также
образовываться из 3-фосфоглицерата. Детали
этого процесса здесь не обсуждаются. Рибо-
зо-5-фосфат является предшественником для
синтеза гистидина. Этот путь в растениях еще
не полностью известен.
Для синтеза глутамата требуется участие
митохондриального метаболизма
На рисунке 10.6 показано, что глутамат обра-
зуется из а-кетоглутарата, который может по-
ставляться при неполном протекании митохон-
дриального цикла Кребса (лимонной кислоты)
(см. рис. 10.11). Пируват и оксалоацетат транс-
портируются из цитозоля в митохондрии спец-
ифическими переносчиками. Пируват окисля-
ется пируватдегидрогеназой (см. рис. 5.4), и
полученный таким образом ацетил-КоА кон-
денсируется с оксалоацетатом, образуя цитрат
(см. рис. 5.6). Этот цитрат может подвергаться
превращению в изоцитрат с помощью акони-
тазы (см. рис. 5.7), окисляясь далее НАД-изо-
цитратдегидрогеназой (см. рис. 5.8), а по-
лученный в результате а-кетоглутарат может
транспортироваться в цитозоль специфическим
переносчиком. Но часто основная часть цитрата,
образованного в митохондриях, экспортируется
в цитозоль и там превращается в а-кетоглутарат
цитозольными изоферментными формами ако-
нитазы и НАДФ-изоцитратдегидрогеназы. В этом
случае лишь короткий отрезок цикла Креб-
са (лимонной кислоты) включается в синтез
а-кетоглутарата из пирувата и оксалоацетата.
Цитрат выносится из митохондрий специфиче-
ским переносчиком в обмен на оксалоацетат.
Биосинтез пролина и аргинина
Глутамат является предшественником синтеза
пролина (рис. 10.12). Его 5-карбоксильная груп-
па сначала превращается глутаматкиназой в
богатый энергией смешанный ангидрид с фос-
форной кислотой и затем с помощью НАДФН
восстанавливается до альдегида. Сопутствую-
щий гидролиз богатой энергией фосфоэфирной
связи делает реакцию необратимой. Кольцо об-
разуется конденсацией карбонильной группы
с а-аминогруппой. Результатом восстановления
с участием НАДФН является образование про-
лина.
Пролин не только является составляющим
элементом белков, но помимо этого несет осо-
бую функцию в листьях как вещество, защи-
щающее от повреждений при обезвоживании.
В условиях сухости или высокого содержания
солей в почве (и то и другое приводит к водно-
му стрессу) многие растения накапливают очень
большие количества пролина в листьях, в неко-
торых случаях превышающие суммарные коли-
чества всех других аминокислот. Предполагают,
что накопление пролина при водном стрессе
вызывается индукцией синтеза белка фермента
пиррол ин - 5 - карбокси л атредуктазы.
Пролин предохраняет растения от обезво-
живания, так как он, в отличие от минеральных
солей, не оказывает ингибирующего действия
на ферменты даже в очень высоких концентра-
циях. Поэтому пролин классифицируют как
совместимое соединение. Другие совмести-
мые соединения, образуемые в определенных
растениях в ответ на водный стресс, — это са-
хароспирты, такие как маннит (рис. 10.13), и
бетаины, состоящие из аминокислот, таких
как пролин, глицин и аланин, аминогруппы
которых метилированы. Последние называ-
ются пролин-, глицин- и аланинбетаинами.
Накопление таких совместимых соединений,
особенно в цитозоле, хлоропластах и мито-
хондриях, значительно уменьшает в этих ком-
партментах повреждающее действие водного
дефицита и защищает растения от обезвожива-
ния. Но кроме того эти соединения как анти-
оксиданты принимают участие в ликвидации
активных форм кислорода (АФК) (раздел 3.9).
238
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
СООе
I
н-с-н
CH3-N-CH3
СНз
Глицинбетаин
Н
I
н-с-он
I
но-с-н
I
но-с-н
I
н-с-он
I
н-с-он
I
н-с-он
I
н
D-Маннит
Рис. 10.13. Два совместимых соединения, которые,
подобно пролину, накапливаются в растениях как
агенты, предохраняющие их от обезвоживания
и высокого содержания солей в почве
Водный дефицит и высокое содержание солей
в почве приводят к ингибированию ассимиля-
ции СО2, и в результате к перевосстановлению
переносчиков, участвующих в фотосинтетиче-
ском транспорте электронов, что в свою оче-
редь ведет к возрастанию образования АФК.
На первом этапе синтеза аргинина а-амино-
группа глутамата ацетилируется путем реакции
с ацетил-КоА и таким образом становится защи-
щенной. Затем 5-карбоксильная группа фосфо-
рилируется и восстанавливается до семиальдеги-
да в реакции, примерно такой же, как при синтезе
пролина. Здесь а-аминогруппа защищена и об-
разование кольца невозможно. Путем трансами-
нирования с глутаматом альдегидная группа пре-
вращается в аминогруппу, и после отщепления
ацетильного остатка образуется орнитин. Пре-
вращение орнитина в аргинин (на рис. 10.12 по-
казано лишь суммарно) осуществляется таким
же образом, что и в цикле мочевины у животных,
конденсацией с карбамоилфосфатом в цитрул-
лин. Аминогруппа переносится с аспартата на
цитруллин, вследствие чего образуются аргинин
и фумарат.
Аспартат как предшественник
пяти аминокислот
Аспартат образуется путем трансаминиро-
вания с глутаматом при участии глутамат-
оксалоацетатаминотрансферазы (рис. 10.14).
Для синтеза аспарагина из аспартата требуется
временное фосфорилирование терминальной
карбоксильной группы посредством АТФ, как
при синтезе глутамина. Однако в противополож-
ность синтезу глутамина, донором аминогруппы
при синтезе аспарагина обычно служит не NH4+,
а амидная группа глутамина. Следовательно, за-
трата энергии для амидирования аспартата вдвое
выше, чем для амидирования глутамата. Аспара-
гин образуется большей частью в корнях (раз-
дел 10.2), особенно в том случае, когда источни-
ком азота в почве является NH4+. Роль листьев в
синтезе аспарагина часто весьма незначительна.
При синтезе лизина, изолейцина, треони-
на и метионина первые два этапа в принципе
те же, что и при синтезе пролина: после фосфо-
рилирования киназой у-карбоксильная группа
восстанавливается до семиальдегида. Для син-
теза лизина (на рис. 10.14 детально не показа-
но) семиальдегид конденсируется с пируватом,
и в результате шести последовательных реак-
ций, включающих восстановление с участием
НАДФН и трансаминирование с глутаматом,
образуется жезо-2,6-диаминопимелат, декар-
боксилирование которого дает лизин.
Для синтеза треонина семиальдегид далее
восстанавливается, превращаясь в гомосерин.
После фосфорилирования гомосеринкиназой
карбоксильной группы и дальнейшей изомери-
зации гидроксильной группы, сопровождаемой
удалением фосфата, образуется треонин. Синтез
изолейцина из треонина будет обсуждаться в сле-
дующем параграфе, а синтез метионина в связи
с метаболизмом серы изложен в главе 12.
Синтез аминокислот из аспартата подчиня-
ется строгому контролю своими же конечны-
ми продуктами через отрицательную обратную
связь (рис. 10.15). Аспартаткиназа, начальный
фермент пути синтеза, присутствует в двух изо-
формах. Одна из них ингибируется треонином,
а другая — лизином. Кроме того, образование
аспартат-семиальдегида в точках разветвления
обоих путей синтеза ингибируются соответству-
ющими конечными продуктами.
10.4. Конечным продуктом ассимиляции нитрата является целый спектр аминокислот
239
а-Кето-
глутарат
Глутамин Глутамат
СООе
I
с=о
I
сн2
соое
Оксало-
ацетат
Глутамат
Глутамат-
оксалоацетат
амино-
трансфераза
СОО°
H-C-NH®
СН2
СООе
Аспартат
СОО®
H-C-NH®
СН2
о nh2
Аспарагин
СОО®
H-C-NH®
СН2
О*С'ОРОз®
Аспартил-
фосфат
СОО°
H-C-NH®
I —>—>—► -
сн2
сн3
Аспартат- I
семиальдегид С=о
соо°
соо®
H-C-NH®
сн2
сн2
сн2
H-C-NH®
соо°
соо®
H-C-NH®
сн2
сн2
сн2
I
h2c-nh®
Гомосерин-
дегидрогеназа
Пируват
мезо -2,6- Лизин
Диаминопимелат
СООе
H-C-NH®
СН2
н2с-он
АТФ АДФ
соо®
H-C-NH®
сн2
Н2С-ОРОз®
СОО®
H-C-NH®
н-с-он
I
сн3
Гомосерин
о-Фосфо-
гомосерин
Треонин
Метионин
Рис. 10.14. Пути синтеза аминокислот из аспартата
240
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
Аспартат
АТФ
АДФ
АТФ
_ - ►
АДФ
Аспартилфосфат
Аспартат-
киназы
Рис. 10.15. Ингибирование
конечными продуктами через
отрицательную обратную связь
регулирует ключевой фермент
синтеза аминокислот из аспартата
соответственно потребности
в аминокислотах. [—] означает
ингибирование. Аспартаткиназа
существует в двух изоформах
Ацетолактатсинтаза участвует в синтезе
гидрофобных аминокислот
Пируват может превращаться путем транса-
минирования в аланин (рис. 10.16я). Эта ре-
акция играет особую роль в С4-метаболизме
(см. рис. 8.14 и 8.15).
Синтез валина и лейцина начинается с об-
разования ацетолактата из двух молекул пирува-
та. Ацетолактатсинтаза, катализирующая эту
реакцию, содержит тиаминпирофосфат (ТПФ)
как простатическую группу. Реакция ТПФ с пи-
руватом дает гидроксиэтил-ТПФ и СО2, таким
же образом, что и в реакции с пируватдеги-
дрогеназой (см. рис. 5.4). Гидроксиэтильный
остаток переносится на вторую молекулу пи-
рувата, и образуется ацетолактат. Его восста-
новление и перегруппировка с последующим
отщеплением воды приводят к образованию
а-кетоизовалерата, а следующее за этим транса-
минирование дает валин.
Образование лейцина из а-кетоизовалерата
осуществляется в принципе той же последователь-
ностью реакций, что и при образовании глутамата
из оксалоацетата, показанном на рис. 5.3. Сначала
ацетил-СоА конденсируется с а-кетоизовалератом
(аналогично образованию цитрата), и про-
дукт реакции а-изопропилмалат изомеризуется
(аналогично образованию изоцитрата), а по-
лученный таким образом р-изопропилмалат
окисляется НАД+ с выделением СО2, превраща-
ясь в а-кетоизокапронат (аналогично синтезу
а-кетоглутарата с участием изоцитратдегидроге-
назы). В заключение аналогично синтезу глутама-
та а-кетоизокапронат путем трансаминирования
превращается в лейцин.
При синтезе изолейцина из треонина по-
следний сначала превращается дезаминазой
в а-кетобутират (рис. 10.166). Ацетолактатсин-
таза конденсирует а-кетобутират с пируватом
в реакции, аналогичной образованию ацето-
лактата из двух молекул пирувата (рис. 10.16я).
10.4. Конечным продуктом ассимиляции нитрата является целый спектр аминокислот
241
а-Кето-
Глутамат глутарат
соое \ / соое
С=О Ч t H-C-NH?
I I
сн3 сн3
Пируват Аланин
соо°
соое
с=о
СН3
Ацетолактат-
синтаза
ТПФ
с=о
сн3
сн3-с-он
с=о
соо
НАДФН
+ Н® НАДФ®
н-с-он
Н2О
соо
сн3-с-он
с=о
соо
а-Кето-
Глутамат глутарат
соо®
H-C-NH®
СН3-С-Н
СН3
СН3-С-Н
СНз
Валин
2 Пируват
сн3
СНз
о
а-Кетоизовалерат
®оос
со2
а-Ацетолактат
сн2
соо®
H-C-NHf
сн3-с-н
СНз
сн3-с-н
СНз
сн3-с-н
СНз
р-Изопропилмалат
а-Кетоизокапронат
сн3-с-н
СНз
а-Изопропилмалат
Лейцин
Рис. 10.16а. Пути синтеза аминокислот из пирувата
Дальнейшие реакции синтеза изолейцина соот-
ветствуют последовательности реакций синтеза
валина.
Синтез лейцина, валина и изолейцина также
подвергается контролю конечными продукта-
ми через отрицательную обратную связь. Изо-
пропилмалатсинтаза ингибируется лейцином
(рис. 10.17), а треониндезаминаза ингибируется
изолейцином (см. рис. 10.15). Первый фермент,
ацетолактатсинтаза (АЛС), ингибируется ва-
лином и лейцином. Производные сульфонил-
мочевины (например, хлорсульфурон) и имида-
золиноны (например, имазетапир) (рис. 10.18)
являются очень сильными ингибиторами АЛС,
так как они связываются с ее пируватсвязываю-
щим сайтом. Столь низкой концентрации хлор-
сульфурона, как 10-9 моль/л, достаточно, что-
бы ингибировать АЛС на 50%. Поскольку путь
образования валина, лейцина и изолейцина
представлен только у растений и микроорганиз-
мов, то вышеназванные ингибиторы пригодны
для специфического уничтожения растений и
поэтому используются в качестве гербицидов
(раздел 3.6). Хлорсульфурон (коммерческое на-
звание Glean, фирма «DuPont») применяется
как избирательный гербицид при выращивании
злаков, а имазетапир (Pursuit, фирма «American
Cyanamide Со.») используется для защиты сои.
Вследствие применения этих гербицидов есте-
ственным путем возникли мутанты кукурузы,
сои, рапса и пшеницы, устойчивые к произво-
дным сульфонилмочевины и имидазолинонам
или даже к обеим группам гербицидов. В обоих
случаях в гене ацетолактатсинтазы была обна-
ружена мутация, делающая фермент нечувстви-
тельным к гербицидам без влияния на фермен-
242
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
соо® H-C-NH? ——► Треонин- дезаминаза а-Кето- бутират ООО® 1 Ацетолактат- синтаза ООО® 1
соо® 1 ф c=nh2 - 1 —► сн3-сн
X X U —U V / \ 1 \ 12 J 1
I \ н-с-он \ н-с-н / \ н-с-н с=о 1
I X сн3 51 н2о Треонин СН3 * в СН3 Н2О nh4® е соое 1 с=о 1 СНз Пируват со2 с ;н3 НАДФН + Н® , НАДФ® , Н2О
Глутамат
а-Кетоглутарат
б
соо°
H-C-NH®
СН3-С-Н
сн2
СН3
Изолейцин
Рис. 10.166. Пути синтеза изолейцина из треонина и пирувата
2 Пируват
Ацетолактат-
синтаза
Ацетолактат
Хлорсульфурон
Имазетапир
(Гербициды)
Лейцин
Рис. 10.17. Синтез валина и лейцина
в соответствии с потребностями клеточного
метаболизма регулируется путем ингибирующего
действия этих аминокислот на ацетолактатсинтазу,
а также ингибированием изопропилмалатсинтазы
лейцином. Гербициды хлорсульфурон и имазетапир
ингибируют ацетолактатсинтазу. [—] означает
ингибирование
10.4. Конечным продуктом ассимиляции нитрата является целый спектр аминокислот
243
тативную активность. Путем скрещивания этих
мутантов с другими линиями были выведены
устойчивые к гербицидам сорта, которые уже
частично возделываются в коммерческих целях.
Шикиматный путь синтеза
ароматических аминокислот
Предшественниками образования ароматических
аминокислот являются эритрозо-4-фосфат и фос-
фоенолпируват. Эти два соединения конденсиру-
ются с формированием циклического дегидрохи-
ната, что сопровождается освобождением обеих
фосфатных групп (рис. 10.19). После отщепления
воды и восстановления карбонильной группы об-
разуется шикимат. Далее З’-гидроксильная груп-
па защищается посредством фосфорилирования,
а 5’-гидроксильная группа шикимата реагирует с
фосфоенолпируватом, что дает енольный эфир
5’-енолпирувилшикимат-3-фосфат (ЕПШФ),
а из него в результате отщепления фосфата обра-
зуется хоризмат. Хоризмат может далее использо-
ваться в двух путях биосинтза.
1. Триптофан образуется при помощи четырех
последовательных реакций, которые здесь
детально не обсуждаются.
2. Префенат образуется посредством перегруп-
пировки, в которой боковая цепь переносит-
ся в 1-положение кольца, и после трансами-
нирования кето-группы образуется арогенат.
В результате отщепления воды возникает
третья двойная связь и путем декарбокси-
лирования образуется фенилаланин. Окис-
ление арогената с участием НАД+, сопрово-
ждаемое декарбоксилированием, приводит к
образованию тирозина. Согласно современ-
ным данным, ферменты шикиматного пути
локализованы исключительно в пластидах1.
Синтез ароматических аминокислот также
контролируется конечными продуктами на
некоторых участках пути (рис. 10.20).
Глифосат действует как гербицид
Глифосат (рис. 10.18), структурный аналог
фосфоенолпирувата, является очень сильным
1 На сегодня доказано существование также и цитозольных
форм ряда ферментов шикиматного пути: шикиматдегидро-
геназы, атранилатсинтазы, хоризматмутазы и некоторых
других. Однако цитозольная ветвь шикиматного пути не мо-
жет восполнять дефекты в пластидной ветви, что говорит об
их разной физиологической нагрузке. — Прим. ред.
О
Q II
еО — Р — СН2— N—СН2—СООН
ео н
Глифосат
Рис. 10.18. Гербициды хлорсульфурон -
производное сульфонилмочевины, (коммерческое
название Glean, DuPont) и имазетапир или
имидозолинон (коммерческое название Pursuit,
фирма АСС) ингибируют ацетолактатсинтазу
(рис. 10.16я). Глифосат (коммерческое название
Roundup, фирма Monsanto) ингибирует
ЕПШФ-синтазу (рис. 10.19)
ингибитором ЕПШФ-синтазы. Глифосат
специфично ингибирует синтез ароматических
аминокислот, но оказывает лишь слабое дей-
ствие на другие ферменты, метаболизирующие
фосфоенолпируват (например, пируваткиназу
или ФЕП-карбоксикиназу). Блокирование ши-
киматного пути глифосатом оказывает на рас-
тения летальное действие. Поскольку у живот-
ных отсутствует шикиматный путь, глифосат
(под коммерческим названием Roundup, фирма
Monsanto) используется в качестве гербицида
(раздел 3.6). Имея простую структуру, глифо-
сат сравнительно быстро разлагается почвен-
ными бактериями. Глифосат является наиболее
широко и повсеместно продаваемым герби-
цидом. Методами генной инженерии успешно
создаются устойчивые к глифосату культурные
растения (раздел 22.6). Это позволяет очень
244
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
Фосфоенол-
пируват
СОО
I
усх
©-о ^сн?
®-о-сн2 Н
Х=о
НО^ ^СН
I
ОН
Эритрозо-4-фосфат
соо°
НАДФН НАДС^
соо соое
Н2О
ОН
он
З'-Дегидрохинат
но
он
соо
Глутамин
Глутамат
Фосфорибозил-
пирофосфат
ОН
Хоризмат
СН2
11 А
о-с-соо®
Ф
Антранилат
Шикимат-З-фосфат
5'-Енолпирувилшикимат-
3-фосфат (ЕПШФ)
Сери
еоос сн2-с-соо‘
ОН
а-Кето- г
Глутамат глутарат |1 I
NH^
°оосч „сн2-с-соое
н со2 + н2о
NH?
сн2-с-соое
Фенилаланин
NH®
ОН
СО2
Глицер-
альдегид-
3-фосфат
сн2-сн-соо®
Префенат
Арогенат
НАДН
NH?
I
сн2-с-соое
НАД®
Н
Триптофан
ОН
Тирозин
О
Рис. 10.19. Шикиматный путь синтеза ароматических аминокислот.
ФЕП — фосфоенолпируват
эффективно бороться с сорняками на полях,
засеянных такими трансгенными культурными
растениями.
Существенная часть общей биомассы
растений образуется через
шикиматный путь
Функция шикиматного пути не ограничива-
ется получением аминокислот для биосинтеза
белков. Он также поставляет предшественники
для очень разнообразного ряда других соедине-
ний (рис. 10.21), синтезируемых растениями в
больших количествах, особенно фенилпропа-
ноидов, флавоноидов и лигнинов (глава 18).
Так как суммарное количество этих продуктов
может составлять большую долю от общей кле-
точной массы (у некоторых растений до 50%
сухого вещества), шикиматный путь можно
Рис. 10.20. Ключевые этапы
синтеза ароматических аминокислот
регулируются конечными продуктами
через обратную связь. Таким образом
устанавливается скорость синтеза
аминокислот в соответствии
с потребностями клетки. Триптофан
стимулирует синтез тирозина
и фенилаланина [+]. Гербицид глифосат
ингибирует ЕПШФ-синтазу [—]
Эритрозо-
4-фосфат
ФЕП
ФЕП + эритрозо-4-фосфат
Шикиматный
путь
Фолиевая
кислота
Убихинон
Флавоноиды Алкалоиды цианогенные Гликозиды
Кумарин Пластохиноны
Лигнин Токоферол
Рис. 10.21. Многие вторичные
метаболиты синтезируются через
шикиматный путь
246
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
считать одним из основных биосинтетических
путей растений.
10.5. Глутамат служит
предшественником
для синтеза хлорофиллов
и цитохромов
Содержание хлорофилла составляет от 1 до
2% сухого вещества листьев. Его синтез про-
исходит в пластидах. Как показано на рис. 2.4,
хлорофилл состоит из тетрапиррольного коль-
ца, центральным атомом которого является
магний. К кольцу присоединен остаток фито-
ла (дитерпеноидный спирт) для заякоривания
в пигмент-белковых комплексах мембраны.
Гем также является тетрапирролом, но содер-
жит железо в качестве центрального атома. Гем
служит составной частью цитохромов, каталазы
и ряда других ферментов.
Порфобилиноген, предшественник синтеза
тетрапирролов, образуется конденсацией двух
молекул 5-аминолевулината (5-аминолеву-
линовой кислоты, 5-АЛК). 5-Аминолевулинат
синтезируется у животных, дрожжей и некоторых
бактерий изсукцинил-КоАи глицина, что сопро-
вождается выделением KoA-SH и СО2. В проти-
воположность этому, синтез 5-аминолевулината
в пластидах, у цианобактерий и многих эубак-
терий осуществляется путем восстановления
глутамата. Как обсуждается в разделе 6.3, раз-
личие окислительно-восстановительных по-
тенциалов между карбоксилатом и альдегидом
так велико, что восстановление карбоксильной
группы НАДФН возможно лишь в том случае,
если карбоксильная группа предварительно
активирована [например, как у тиоэфира (см.
рис. 6.10) или как у смешанного ангидрида фос-
форной кислоты (см. рис. 10.12)]. При синтезе
5-аминолевулината в пластидах глутамат акти-
вируется весьма необычным способом, обра-
Глутамат-
семиальдегид-
аминотрансфераза
Глутамил-тРНК-
синтетаза
Глутамат + тРНК
Глутамил-тРНК-
редуктаза
СООе Кофактор
। Пиридоксаль-
СН2 фосфат
СН2 ---------►
H-C-NH?
Н-С=О
Глутамат-
-семиальдегид
соо®
I
сн2
сн2
с=о
H-C-NH?
н
5-Амино-
левулинат
соое
соо° сн2
СН2 + сн2
сн2 с=о
I I
,С = О /СН2
СН2 NH®
I d
NH®
5-Аминолевулинат-
дегидрогеназа
2 х 5-Аминолевулинат
соо®
Порфобилиноген
Рис. 10.22. В хлоропластах глутамат является предшественником синтеза
5-аминолевулината (5-АЛК), который конденсируется в порфобилиноген
10.5 . Глутамат служит предшественником для синтеза хлорофиллов и цитохромов
247
АР АРАР АР
|| || || || Гидрокси метил-
1! 1 J* J* билан
НО—СН2 N СН2 N СН2 N СН2 N
Н Н Н Н
СН2 СН3
СН2
соое
Протопорфирин IX
Рис. 10.23. Синтез протопорфирина IX
248
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
Глутамат
регуляция светом |
5-Аминолевулинат
I
Фитил-ФФ
Хлорофилл-
си нтаза
Хлорофилл
Рис. 10.24. Обобщенная схема синтеза хлорофилла и гема в хлоропластах.
Пунктирные линии обозначают ингибирование фермента конечными продуктами
биосинтеза. Ферменты биосинтетической цепи от протопорфирина IX до цитохрома
присутствуют и в митохондриях; однако эти белки отличаются от таковых в
хлоропластах
зуя ковалентную связь с транспортной РНК
(рис. 10.22). Эта тРНК кодируется в пластидах
и там включается в синтез 8-аминолевулината, а
также в биосинтез белка. Как и при биосинтезе
белка (см. рис. 21.1), связывание карбоксильной
группы глутамата с тРНК происходит с потре-
блением АТФ. При восстановлении глутамата
тРНК с помощью глутамил-РНК-редуктазы
тРНК высвобождается, и реакция становит-
ся необратимой. Глутамат-1-семиальдегид,
образованный таким способом, превращает-
ся в 5-аминолевулинат аминотрансферазой,
содержащей пиридоксальфосфат в качестве
простетической группы. Эта реакция осущест-
вляется посредством того же механизма, что и
аминотрансферазная реакция, изображенная
на рис. 7.4, с тем лишь отличием, что здесь ами-
ногруппа (как амино-донор) и кетогруппа (как
амино-акцептор) присутствуют в одной и той же
молекуле.
Две молекулы 5-аминолевулината конден-
сируются, образуя порфобилиноген (см.
рис. 10.22). Гидроксиметилбилан, тетрапиррол
с открытой цепью, формируется из четырех мо-
лекул порфобилиногена при участии порфо-
билиногендезаминазы (рис. 10.23). Фермент
содержит в качестве кофактора дипиррол, ко-
торый он сам и образует. Уропорфириноген III
образуется после замены двух боковых цепей на
кольцо d и замыкания цепи. Впоследствии пу-
тем реакций с декарбоксилазами и оксидазами
образуется протопорфирин IX (детально не по-
Дополнительная литература
249
казано). Mg2+ включается в тетрапиррольное
кольцо магний-хелатазой, и полученный при
этом Mg-протопорфирин IX превращается тре-
мя последующими ферментами в протохлоро-
филлид. Тетрапиррольное кольцо протохлоро-
филлида содержит такое же количество двойных
связей, что и протопорфирин IX. Восстанов-
ление одной двойной связи в кольце d за счет
НАДФН приводит к образованию хлорофил-
лида. Протохлорофиллидредуктаза, катали-
зирующая эту реакцию, активна лишь тогда,
когда протохлорофилл ид активируется погло-
щением света. Перенос фитольного фрагмента,
активированного пирофосфатом, посредством
пренилтрансферазы, называемой хлорофилл-
синтетазой (раздел 17.7), завершает синтез хло-
рофилла.
Из-за того, что активность протохлорофил-
лидредуктазы зависит от света, побеги приоб-
ретают зеленую окраску лишь при достаточном
освещении. Синтез хлорофилл-связывающих
белков светособирающего комплекса также за-
висит от света. Исключениями являются неко-
торые голосеменные (например, сосна), у кото-
рых как восстановление протохлорофиллида,
так и синтез хлорофилл-связывающих белков
происходят в темноте. Порфирины могут фото-
окисляться на свету, что приводит к фотохими-
ческому повреждению клеток1.
Поэтому важно, чтобы предшественники
биосинтеза хлорофилла в свободном состоянии
не накапливались. Для предотвращения этого
синтез 5-аминолевулината светозависим, но ме-
ханизм такой регуляции еще не выяснен. Более
того, синтез 5-аминолевулината ингибируется
через обратную связь Mg-протопорфирином
IX и гемом. Конечные продукты — протох-
лорофиллид и хлорофиллид — ингибируют
магний-хелатазу (см. рис. 10.24). Более того,
промежуточные продукты синтеза хлорофилла
контролируют синтез белков светособирающего
комплекса (раздел 2.4) путем регуляции генной
экспрессии.
1 Порфирины поглощают кванты света, переходят в си-
глетное возбужденное состояние (Sj) и далее при опреде-
лённых условиях — в триплетное (Tj). Именно Тгсостояние
может передавать энергию на молекулу О2 с образованием
синглетного (возбужденного) кислорода. Далее происходит
либо окисление самого порфирина, либо образование дол-
гоживущих форм активного кислорода, вызывающих по-
вреждение. — Прим. ред.
Протопорфирин является также
предшественником синтеза гема
Включение атома железа в протопорфирин IX
феррохелатазой приводит к формированию
гема. Хлоропласты способны синтезировать
свои собственные цитохромы путем сборки
гема с апопротеинами. Митохондрии также
обладают ферментами для синтеза своих ци-
тохромов из протопорфирина IX, но белки со-
ответствующих митохондриальных ферментов
отличаются от таковых в хлоропластах. Пред-
шественник протопорфирин IX доставляется из
пластид в митохондрии, возможно, при участии
переносчиков порфирина в обеих органеллах.
Таким образом, одна из важнейших функций
хлоропластов — синтез тетрапиррольных сое-
динений в растении.
Дополнительная литература
Brusslau, J. A., Peterson, М. Р. Tetrapyrrol regulation of
nuclear gene expression. Photosynth Res 71, 185—194
(2002).
Campbell, W. H. Nitrate reductase, structure, function
and regulation: bridging the gap between biochemistry
and physiology. Annu Rev Plant Physiol Plant Mol Biol
50, 277-303 (1999).
Cornah, J. E., Terry,M. J., Smith, A. G. Green or red:What
stops the traffic in the tetrapyrrole pathway? Trends
Plant Sci 8, 224-230 (2003).
De Boer, B. Fusicoccin—a key to multiple 14-3-3 locks?
Trends Plant Sci 2, 60-66 (1997).
Forde, B. G. Local and long-range signaling pathways
regulating plant responses to nitrate. Annu Rev Plant
Biol 53, 203-224 (2002).
Galili, G. Regulation of lysine and threonine synthesis.
Plant Cell 7, 899-906(1995).
Grimm, B. Novel insights in the control of tetrapyrrole
metabolism of higher plants. Plant Biol 1,245—250 (1998).
Hasegawa, P. M., Bressan, R. A., Zhu, J.-K., Bohnert, H.
J. Plant cellular and molecular responses to high salinity.
Annu Rev Plant Physiol Plant Mol Biol 51, 463—499
(2000).
Hermann, К. M., Weaver, L. M. The Shikimate pathway. Annu
Rev Plant Physiol Plant Mol Biol 50,473-503 (1999).
Hirel, B., Lea, P. J. The biochemistry, molecular
biology and genetic manipulation of primary ammonia
assimilation. In: С. H. Foyer and G. Noctor (eds.),
Advances in Photosynthesis: Photosynthetic assimilation
and associated carbon metabolism, 239—263. Kluwer
Academic Publishers, Dordrecht, Netherlands (2002).
250
10. Ассимиляция нитратов крайне важна для синтеза органического вещества
Huber, S. С., Bachmann, М., Huber, J. L. Post-
translational regulation of nitrate reductase activity: A
role for Ca+ and 14-3-3 proteins. Trends Plant Sci 1,
432-438(1996).
Kaiser,W. M., Stoimenova, M., Man, H.-M. What
limits nitrogen reduction in leaves. In: С. H. Foyer
and G. Noctor (eds.), Advances in Photosynthesis:
Photosynthetic assimilation and associated carbon
metabolism, pp. 63—70. Kluwer Academic Publishers,
Dordrecht, Netherlands (2002).
Kumar, A. M., Schaub, U., Soil, D., Ujwal, M.L.
Glutamyl-transfer RNA: At the crossroad between
chlorophyll and protein biosynthesis. Trends Plant Sci
1,371-376(1996).
Lancien, M., Gadal, P., Hodges, M. Enzyme redundancy
and the importance of 2-oxoglutarate in higher plant
ammonium assimilation. Plant Physiol 123, 817—824
(2000).
MacKintosh, C. Regulation of cytosolic enzymes in
primary metabolism by reversible protein phos-
phorylation. Plant Biol 1,224-229 (1998).
McNiel, S. D., Nuccio, M. L., Hanson, A. D. Betaines
and related osmoprotectants. Targets for metabolic
engineering of stress resistance. Plant Physiol 120,
945-949(1999).
Roberts, M. R. Regulatory 14-3-3 protein-protein
interactions in plant cells. Curr Opin Plant Biol 3,
400-405 (2000).
Roberts, M. R. 14-3-3 proteins find new partners in plant
cell signalling. Trends Plant Sci 8, 218—223 (2003).
Schultz, G. Assimilation of non-carbohydrate compounds.
In: Photosynthesis: A Comprehensive Treatise,
Raghavendra, A. S. Hrsg, Cambridge University Press,
Cambridge, England, pp. 183—196 (1998).
Singh, В. K., Shaner, D. L. Biosynthesis of branched
chain amino acids: From test tube to field. Plant Cell 7,
935-944(1995).
Stitt, M. Nitrate regulation of metabolism and growth.
Curr Opin Plant Biol 2, 178-186 (1999).
Streatfield,S.J.,Weber,A.,Kinsman,E.A.,Hausler, R. E.,
Li, J., Post-Breitmiller, D., Kaiser,W. M., Pyke, K. A.,
Fliigge, U.-L, Chory, J. The phosphoenolpyruvate/
phosphate translocator is required for phenolic
metabolism, palisade cell development, and plastid-
dependent nuclear gene expression. Plant Cell 11,
1609-1621 (1999).
Thomashow, M. F. Plant cold acclimation: Freezing
tolerance genes and regulatory mechanisms. Annu Rev
Plant Physiol Plant Mol Biol 50, 571—599 (1999).
von Wettstein, D., Gough, S., Kannagara, C. G.
Chlorophyll biosynthesis. Plant Cell, 7, 1039—1057
(1995).
Williams, L. E., Miller, A. J. Transporters responsible for
the uptake and partitioning of nitrogenous solutes. Annu
Rev Plant Physiol Plant Mol Biol 52, 659—688 (2001).
Симбиотическая азотфиксация позволяет
растениям использовать азот воздуха
В закрытой экологической системе нитрат,
требующийся для роста растений, образу-
ется вследствие деградации биомассы. В проти-
воположность другим соединениям, необходи-
мым для питания растений (например, фосфату
или сульфату), нитрат не образуется при выве-
тривании горных пород. Небольшие количества
нитрата образуются при грозовых разрядах и по-
падают в почву с дождевой водой (в районах уме-
ренного климата около 5 кг/га азота в год). При
интенсификации хозяйственной деятельности в
процессе развития цивилизации (например, ав-
томобильное движение, массовое животновод-
ство и т. д.) количество нитрата, других окислов
азота и аммония, вносимых в почву с дождем,
может достигать 15—70 кг/га азота в год. Для
производства сельскохозяйственной продукции
важно вносить удобрения для компенсации по-
тери азота, выносимого при уборке урожая. При
возделывании кукурузы, например, требуется
внесение удобрений в форме нитрата или аммо-
ния в количествах около 70 кг/га азота в год. Ам-
моний, исходный продукт для синтеза нитрат-
ных удобрений, в промышленности получают
из азота и водорода в соответствии с процессом
Габера—Боша1:
ЗН2 + N2 -> 2NH3 (AH = -92,6 кДж/моль)
Из-за высокой прочности тройной связи
N = N этот синтез требует высокой энергии ак-
тивации и поэтому, несмотря на присутствие ка-
тализатора, осуществляется при давлении в не-
сколько сотен атмосфер и температурах от 400
до 500 °C. Таким образом, он нуждается в очень
1 Разработан в Германии в годы 1 Мировой войны изна-
чально для получения взрывчатых веществ, и лишь затем
получивший мирное применение. — Прим. ред.
больших энергетических затратах. Например,
при культивировании кукурузы синтез азотных
удобрений потребляет почти треть общих затрат
на выращивание растений. Без промышленного
производства азотных удобрений значительная
часть населения Земли лишилась бы пропита-
ния. Земледелие с применением естественного
«органического цикла» азота позволяет гектару
земли прокормить приблизительно 10 человек, в
то время как использование азотных удобрений
увеличивает урожай в четыре раза2.
Большинство цианобактерий и некоторые
другие бактерии способны синтезировать аммо-
ний из азота воздуха. Есть растения, живущие
в симбиозе с азотфиксирующими бактериями,
которые снабжают растение органическим азо-
том. В свою очередь растения обеспечивают эти
бактерии метаболитами для их питания. Симби-
оз бобовых растений с клубеньковыми бакте-
риями (ризобиями) широко распространен и
очень важен для сельского хозяйства. Бобовые
(Leguminosae) образуют обширное семейство,
включающее около 20000 видов, среди кото-
рых соя, чечевица, горох, клевер, люпин и дру-
гие, пищевые и кормовые растения. Показано,
что большинство бобовых образуют симбиоз
с ризобиями. В странах с умеренным клима-
том возделывание бобовых может обеспечивать
фиксацию N2 от 100 до 400 кг/га в год. Поэтому
бобовые культуры являются ценным зеленым
удобрением; в севообороте они используются
как недорогая альтернатива искусственным удо-
брениям. Симбиоз водного папоротника Azolla
2 Применение минеральных удобрений имело большое
историческое и социальное значение. Высвободилась ра-
бочая сила, занятая в сельскохозяйственном производстве,
что способствовало развитию промышленности и урбаниза-
ции. — Прим. ред.
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
ианобактерией Nostoc снабжает рисовые
[я азотом. Азотфиксируюшие актиномице-
рода Frankia образуют симбиоз с древесны-
растениями, такими как ольха или австра-
тская казуарина. Последняя появляется как
тение-пионер на бедных азотом почвах.
. 1. Бобовые образуют симбиоз
с клубеньковыми бактериями
iee полагали, что образование клубеньков
обовых (рис. П.1) вызывается заболевани-
растений, пока в 1888 г. Г. Гельригелем и
^ильфартом не была выявлена их роль в фик-
;ии N2. Эти исследователи показали, что бо-
ъте, имеющие такие клубеньки, способны
ти без азотных удобрений.
Клубеньковые бактерии включают роды
izobium, Bradyrhizobium и Azorhizobium на-
c. 11.1. Корневая система Phaseolus vulgaris
июли) с обильным формированием клубеньков
:ле инфицирования Rhizobium (по Р. Vinuesa-
ishmann & D. Werner, Марбург)
ряду с другими родами и именуются обшим на-
званием ризобии. Ризобии — строго аэробные
грамотрипательные палочки, живущие в почве
и растущие гетеротрофно в присутствии орга-
нических соединений. Некоторые виды (Bra-
dyrhizobium) способны также расти автотрофно
в присутствии Н2, хотя и с меньшей скоростью.
Внедрение ризобий в растение-хозяина пред-
ставляет собой контролируемую инфекцию.
Молекулярные основы специфичности и распо-
знавания в настоящее время активно изучаются.
Ризобии образуют видоспецифичные факторы
образования клубеньков (Nod-факторы). Это
липохитоолигосахариды, которые приобретают
высокую структурную специфичность (напри-
мер, при ацилировании, ацетилировании, суль-
фатировании). Они подобны ключу со многими
выступами и «открывают дом» специфичного
хозяина, с которым ризобии образуют ассо-
циацию. Nod-факторы связываются со специ-
фичными рецепторными киназами хозяина,
которые являются частью цепей трансдукции
сигнала (раздел 19.1). Таким образом «ключ»
индуцирует скручивание корневого волоска и
деление клеток коры корня хозяина, что при-
водит к формированию клубенькового при-
мордия. После того, как ризобии проникают в
корневой волосок, образуется инфекционная
нить (рис. 11.2), которая распространяется в
кору корня, разветвляется там и инфицирует
клетки клубенькового примордия. Таким об-
разом, клубенек развивается из инфекционной
нити. Морфогенез клубенька характеризуется
такой же высокой степенью сложности, как и
у любого другого органа растения, например,
корня или побега. Клубеньки соединяются с
корнем посредством сосудистых тканей, ко-
торые снабжают их веществами, образуемыми
при фотосинтезе. Бактерии, которые включа-
ются в растительную клетку, окружаются пери-
бактероидной мембраной (называемой также
симбиосомной мембраной), формируемой рас-
тением. Таким образом бактерии оказываются
включенными в цитоплазму растительной клет-
ки в так называемой симбиосоме (рис. 11.3).
В симбиосоме ризобии дифференцируются в
бактероиды1. Объем этих бактероидов может в
1 У бактериоидов исчезает клеточная стенка, остается на-
ружная мембрана клетки, теряется форма, характерная для
свободноживущих бактерий. — Прим. ред.
Перибактероидная
мембрана
Рис. 11.2. Контролируемое инфицирование клетки хозяина ризобиями начинается
при взаимодействии с корневыми волосками. Ризобии индуцируют формирование
инфекционной нити, которая образуется путем инвагинации клеточной стенки
корневого волоска и выпячивается в клетки коры корня. Таким способом ризобии
проникают в клетку хозяина, где они отделяются перибактероидной мембраной
от цитозоля растительной клетки. Ризобии растут и дифференцируются в крупные
бактероиды
Рис. 11.3. Электронномикроскопическая фотография поперечного среза через
клубенек Glycine maxcv. «Caloria» (сои), инфицированной Bradyrhizobium japoni-
сит. В верхней большой инфицированной клетке видны интактные симбиосомы
(С) с одним или двумя бактероидами на симбиосому. В нижней части среза можно
видеть три неинфицированные клетки с ядром (Я), центральной вакуолью (В),
амилопластом (А) и пероксисомами (П) (по Е. Mnrschel & D.Werner, Марбург)
254
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
10 раз превышать объем отдельных бактерий.
Перибактероидная мембрана может окружать
не один, а несколько бактероидов.
У ризобий имеется дыхательная цепь, ком-
плексы которой соответствуют основным белко-
вым комплексам митохондриальной дыхатель-
ной цепи (см. рис. 5.15). У вида Bradyrhizobium
в процессе дифференциации свободноживущих
бактерий в бактероиды формируется дополни-
тельный путь транспорта электронов. Этот путь
ответвляется в точке цитохром-^/^-комплекса
дыхательной цепи и переносит электроны к
другой терминальной оксидазе, что содействует
повышению интенсивности дыхания. Соответ-
ствующий ген находится в pSym-плазмиде, кон-
тролирующими образование симбиоза.
Образование клубеньков обусловлено
регулируемым взаимодействием
экспрессии специфических бактерий
и генов растения
Ризобии, способные вступать в симбиоз, со-
держат большое количество генов, которые
«отключены» у свободноживущих бактерий и
активируются лишь после вступления во взаи-
модействие с хозяином, чтобы внести вклад в
формирование азотфиксирующего клубенька.
Бактериальные гены, которые кодируют белки,
необходимые для фиксации N2, называются nif
и fix генами, а гены, индуцирующие формиро-
вание азотфиксирующего клубенька — nod ге-
нами.
Сигналом о готовности растения-хозяина
образовывать клубеньки служит выделение
определенных флавоноидов (раздел 18.5) в ка-
честве сигнальных соединений. Эти флаво-
ноиды связываются с бактериальным белком,
который кодируется конститутивным (т. е. по-
стоянно экспрессируемым) nod геном («oJD).
Белок, с которым флавоноид связывается, ак-
тивирует транскрипцию других nod генов. Бел-
ки, кодируемые этими nod генами, включены в
синтез вышеупомянутых Nod-факторов. Четыре
так называемых «общих» nod гена присутствуют
у всех ризобий (nod\ — nodTJ). Кроме того, из-
вестны более 20 других nod генов, ответствен-
ных за специфичность узнавания хозяина.
Те белки, которые особенно нужны для фор-
мирования клубеньков и которые синтезируют-
ся растением-хозяином в ходе формирования
клубенька, называются нодулинами. В число
нодулинов входят леггемоглобин (раздел 11.2),
ферменты, разлагающие углеводы [включая
сахарозосинтазу (раздел 9.2)], ферменты цикла
лимонной кислоты (цикла Кребса — см. раз-
дел 5.3) и синтеза глутамина и аспарагина, а так-
же синтеза уреидов в определенных случаях. К
ним относят и аквапорин перибактероидной
мембраны. Растительные гены, кодирующие
эти белки, называются нодулиновыми гена-
ми. Их подразделяют на «ранние» и «поздние»
нодулины. Ранние нодулины включаются при
инфицировании и формировании клубеньков,
где экспрессия соответствующих генов индуци-
руется частично сигнальными соединениями,
выделяемыми ризобиями. «Поздние» нодулины
синтезируются лишь после формирования клу-
беньков. Во многих случаях нодулины являются
изоформами белков, обнаруживаемых в других
растительных тканях.
Обмен метаболическими продуктами
между бактероидами и клетками
растения-хозяина
Основным субстратом, которым клетки рас-
тения-хозяина снабжают бактероиды, служит
Сахароза
I КЛЕТКА
I ХОЗЯИНА
Малат
NH®
Глутамин----► Аспарагин
Рис, 11 -4, Общая схема метаболизма
инфицированных клеток в корневом клубеньке.
Глутамин и аспарагин образуются как основные
продукты азотфиксации (см. рис. П.5)
11.1. Бобовые образуют симбиоз с клубеньковыми бактериями
255
Фосфорибозилфосфат
2 Г глутамина 1 Аспартат
1 Глицин ЗАТФ
Биосинтез пурина
Рибоза-Ф
Инозинмонофосфат
Ксантин
Н2О + О2 Н2О2
Ксантин-
оксидаза
Мочевая кислота
NH2 СОО nh2
I I I
/Ск /Ск /Ск
N^| N
н н н
Н2О
Аллантоиназа
Уриказа
Аллантоин
Аллантоат
Рис, 11,5- У большинства бобовых (например, сои и вигны) в качестве
транспортных продуктов азотфиксации образуются аллантоин и аллантоиновая
кислота, которые поступают через корни по ксилеме в надземную часть. Образование
уреидов осуществляется сначала через формирование инозинмонофосфата
в процессе синтеза пурина. Инозинмонофосфат окисляется до ксантинов и далее
до мочевой кислоты. Путем гидролиза и раскрывания гетероциклического кольца
образуются аллантоин и аллантоиновая кислота
малат (рис. П.4), образуемый из сахарозы, по-
ставляемой в клубенек по флоэме. Сахароза
метаболизируется сахарозосинтазой (рис. 13.5),
разлагается в процессе гликолиза до фосфо-
енолпирувата, который карбоксилируется в ок-
салоацетат (см. рис. lO.ll), и последний вос-
станавливается в малат. Клетки клубеньков
обладают высокой фосфоенолпируваткарбок-
силазной активностью. NH4+ как продукт азот-
фиксации поставляется в клетку хозяина, где он
затем превращается главным образом в глута-
мин (рис. 7.9) и аспарагин (рис. 10.14), а далее
транспортируется по ксилемным сосудам в дру-
гие части растения. Недавно было показано,
что из бактерий может также экспортироваться
аланин.
Из клубеньков некоторых бобовых (напри-
мер, сои) фиксированный азот экспортируется
в виде уреидов (продуктов деградации мочеви-
ны)1, главным образом аллантоина и аллан-
тоиновой кислоты (рис. 11.5). В этих соедине-
ниях особенно велико отношение азот/углерод.
Для образования уреидов в клетках растения-
хозяина требуется сложный путь синтеза. Сна-
чала синтезируется инозинмонофосфат в про-
цессе синтеза пурина, который имеется во всех
клетках для синтеза АМФ и ГМФ, а затем он
разлагается через образование ксантина и моче-
вой кислоты до указанных выше уреидов.
Малат, поступающий в бактероиды, окис-
ляется в цикле Кребса (лимонной кислоты)
(рис. 5.3). Генерируемые таким образом вос-
становительные эквиваленты служат «горючим»
для азотфиксации.
1 В данном случае мочевина не образуется и не может де-
градировать. Правильнее: мочевая кислота. Терминология
заимствована из биохимии животных. — Прим. ред.
256
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
Редуктаза нитрогеназы поставляет
электроны для нитрогеназной реакции
Азотфиксация катализируется нитрогеназным
комплексом, очень сложной системой, главны-
ми компонентами которой являются редуктаза
нитрогеназы и нитрогеназа (рис. 11.6). Этот ком-
плекс в высокой степени консервативен и нахо-
дится в цитоплазме бактероидов.
От НАДН, образуемого в цикле Кребса (ли-
монной кислоты), электроны переносятся по-
средством растворимого ферредоксина на ре-
дуктазу нитрогеназы. Последняя представляет
собой одноэлектронный переносчик, состоя-
щий из двух идентичных субъединиц, которые
совместно формируют 4Fe-4S кластер (см.
рис. 3.26) и содержат два сайта связывания АТФ.
После восстановления редуктазы нитрогеназы
две молекулы АТФ связываются с ней, вызывая
конформационное изменение белка, вследствие
чего редокс потенциал 4Fe-4S кластера возраста-
ет от —0,25 до —0,40 В. После переноса электрона
на нитрогеназу две молекулы АТФ, связанные с
белком, гидролизуются с образованием АДФ и
фосфата и затем высвобождаются из белка. В ре-
зультате восстанавливается конформация с бо-
лее низким редокс-потенциалом, и белок вновь
готов принять электрон от ферредоксина. Таким
образом, один электрон переносится редуктазой
нитрогеназы от НАДН на нитрогеназу с затратой
двух молекул АТФ.
N2, как и Н+, восстанавливаются
нитрогеназой одновременно
Нитрогеназа является тетрамером а2р2. Субъе-
диницы аир имеют сходные размеры и имеют
сходную конформацию. Тетрамер содержит два
каталитических центра, возможно, реагирую-
щих независимо один от другого. В каждом из
них содержится так называемый P-кластер, со-
стоящий из двух 4Fe-4S кластеров и железо-
молибденовый кофактор (FeMoKo). FeMoKo —
это большой редокс-центр, состоящий из Fe4S3
и Fe3MoS3, которые связаны друг с другом при
помощи трех неорганических сульфидных мо-
стиков (рис. 11.7). Следующей составляющей
кофактора является гомоцитрат, который свя-
зан с молибденом через кислородные атомы
гидроксильной и карбоксильной групп. Дру-
гим лигандом молибдена служит имидазольное
кольцо гистидинового остатка белка. Функция
атома Мо еще неясна. Известны альтернатив-
ные нитрогеназы, в которых молибден замещен
ванадием или железом, но эти нитрогеназы го-
раздо менее стабильны, чем нитрогеназа, содер-
2АДФ + 2Ф
Рис. 11.6. Нитрогеназный комплекс состоит из нитрогеназы и редуктазы
нитрогеназы. Их структура и функции описаны в тексте. Восстановление одной
молекулы N2 сопровождается восстановлением по меньшей мере двух протонов
с образованием молекулярного водорода
11.2. Азотфиксация может осуществляться лишь при очень низких концентрациях кислорода 257
Гис
----NH
Н XS-----------?Fe Fe----7SX
°x ''' / \
4C-O—-Mo-------S Fe^HM=N^Fe S----------Fe
-COC-СН,—c-O^' S'' Fc s •f8F^S-/
r CH, H s
Гомо- ।
цитрат CH2 Fe3MoS3 f Fe4S3
COOe
Три неорганических S-мостика
Рис. 11.7. Железо-молибденовый кофактор состоит из фрагментов Fe4S3
и Fe3MoS3, которые связаны друг с другом посредством трех неорганических
сульфидных мостиков. Кроме того, молибден образует комплекс с гомопитратом
и гистидиновой группой белка. Кофактор связывает одну молекулу N2
и восстанавливает ее, дополнительно поглощая электроны, с образованием двух
молекул NH3. Как именно молекула N2 связана в кофакторе, до настоящего
времени в эксперименте не показано (по Karlin 1993)
жащая FeMoKo. Возможно, наличие атома Мо
создает более выгодную геометрию и электрон-
ную структуру центра. Неизвестно, как азот
реагирует с железо-молибденовым кофакто-
ром. По одной из гипотез, молекула N2 связы-
вается в белковом кармане FeMoKo центра (см.
рис. 11.7), и электроны, необходимые для фик-
сации N2, переносятся P-кластером к FeMoKo-
центру.
Кроме N2, нитрогеназа способна восстанав-
ливать и другие субстраты, (например, прото-
ны, которые восстанавливаются до молекуляр-
ного водорода):
2Н+ + 2е~ H^°~>H2
В процессе азотфиксации на одну молекулу
восстановленного N2 образуется по меньшей
мере одна молекула водорода:
8Н+ + 8е- + N2 НитРогеназа > 2NH3 + Н2
Следовательно, общий баланс азотфиксации
по меньшей мере таков:
N2 + 4НАДН + 4Н+ + 16АТФ------------> 2NH3 +
+ Н2 + 4НАД+ + 16АДФ + 16ФН
В присутствии достаточно высокой концен-
трации ацетилена восстанавливается только он.
При этом образуется этилен:
НС=СН + 2е + 2Н+ НитР°геназа > Н2С=СН2
Эта реакция используется для измерения ак-
тивности нитрогеназы. Еще неизвестно, почему
при азотфиксации выделяется Н2. Это может
быть частью каталитического механизма, или
побочной реакцией, или реакцией, защищаю-
щей активный центр от ингибиторного дей-
ствия кислорода. Показано, что молекулярный
водород выделяется в заметных количествах
в процессе азотфиксации в условиях in vivo на
клеверном поле.
Однако у некоторых бактероидов имеются
гидрогеназы, которые повторно окисляют Н2
при участии электрон-транспортной цепи:
2Н2 + О2 -2Н2О
Но остается недостаточно изученным вопрос
о том, сопряжена ли эта реакция в бактероидах
с синтезом АТФ.
11.2. Азотфиксация может
осуществляться лишь
при очень низких
концентрациях кислорода
Нитрогеназа чрезвычайно чувствительна к кис-
лороду. Поэтому азотфиксация может проис-
ходить лишь при очень низких концентрациях
кислорода. Внутри клубеньков образуется анаэ-
робный компартмент. Поскольку азотфиксация
258
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
мембрана клетки хозяина
Рис. 11.8. Азотфиксация в бактероидах. В результате полного окисления малата
в цикле Кребса (лимонной кислоты) образуются пять НАДН и один ФАДН2
(см. рис. 5.3). Для образования двух NH3 из N2 и сопутствующего восстановления
2Н+ до Н2 требуется по меньшей мере 16 молекул АТФ. При синтезе такого
количества АТФ в дыхательной цепи, локализованной в бактероидной мембране,
требуется окисление не менее восьми молекул НАДН. Следовательно, на каждую
молекулу фиксированного N2 потребляется по меньшей мере четыре молекулы О2
для окисления НАДН вдыхательной цепи бактероидной мембраны
Оболочка
клубенька
О2 20%
N2 80%
зависит от поглощения азота из воздуха, возни-
кает вопрос: каким образом фермент защищен
от кислорода, присутствующего в воздухе? Ока-
зывается кислород, диффундирующий вместе с
азотом в клубеньки, потребляется дыхательной
цепью, присутствующей в бактероидной мем-
бране. Вследствие очень высокого сродства бак-
тероидного цитохром-я/я3-комплекса к кисло-
роду дыхание возможно даже при столь низкой
концентрации О2 как Ю-9 моль/л. Как указано
выше, для фиксации одной молекулы N2 тре-
буется по меньшей мере 16 молекул АТФ. При
окислении одной молекулы НАДН митохон-
дриальной дыхательной цепью синтезируются
приблизительно 2,5 молекулы АТФ (раздел 5.6).
В бактериальной дыхательной цепи, которая,
как правило, отличается от митохондриальной
более низкой степенью сопряжения на одну
молекулу НАДН при окислении, могут образо-
ваться лишь около двух молекул АТФ. Следова-
тельно, около четырех молекул О2 потребляют-
ся для образования 16 молекул АТФ (рис. 11.8).
Если в бактероидах присутствует гидрогеназа,
то вследствие окисления Н2, образовавшегося в
11.3. Затраты энергии для использования N2 в качестве источника азота значительно выше
259
процессе азотфиксации, потребление кислоро-
да далее возрастает на половину моля О2. Таким
образом, в процессе азотфиксации на каждый
моль усвоенного N2 потребляется, по меньшей
мере, четыре моля О2 за счет бактериального
дыхания (O2/N2 > 4). В противоположность это-
му, в воздухе отношение O2/N2 равно прибли-
зительно 0,25. Это сопоставление показывает,
что воздух, используемый для азотфиксации,
содержит очень мало кислорода по отношению
к азоту.
Внешний слой клубенька является диффу-
зионым барьером для проникновения возду-
ха. Сопротивление диффузии столь высоко, что
дыхание бактероида ограничено поступлением
кислорода. Это приводит к поразительной си-
туации, когда азотфиксация лимитируется по-
ступлением О2 для образования необходимого
АТФ. Это было доказано опытами австралий-
ского ученого Фрезера Бергерсена. Он наблю-
дал в опытах с клубеньками сои, что повышение
содержания О2 в два раза (при соответствующем
снижении содержания N2) приводит к удвоению
интенсивности азотфиксации.
Поскольку бактериальная дыхательная цепь
локализована в мембране, а нитрогеназа — вну-
три бактероидов, О2 остается на безопасном рас-
стоянии от нитрогеназы. Высокое сопротивление
диффузии для О2, которое, как показано в экс-
перименте, может ограничивать азотфиксацию,
обеспечивает удаление кислорода от нитроге-
назного комплекса даже при низких температу-
рах, при которых интенсивность азотфиксации и
бактериального дыхания снижаются.
Клетки, инфицированные ризобиями, об-
разуют лег-гемоглобин (легоглобин), очень
сходный с миоглобином животных, но его
сродство к кислороду в 10 раз выше. Концен-
трация кислорода, необходимая для полуна-
сыщения лег-гемоглобина, составляет лишь
10—20 х Ю-9 моль/л. Лег-гемоглобин локали-
зован в цитозоле клетки хозяина — снаружи от
перибактероидной мембраны и представлен
там в необычайно высоких концентрациях (на-
пример, в сое 3 х Ю-3 моль/л). Лег-гемоглобин
может составлять до 25% общего количества
растворимых белков клубенька и придает клу-
бенькам красноватый цвет. Предполагают, что
лег гемоглобин играет некую роль в транспор-
те кислорода в клубеньки. Однако более веро-
ятным представляется предположение, что он
служит кислородным буфером для обеспече-
ния непрерывного электронного транспорта в
бактероидах при очень низкой преобладающей
концентрации О2 в клубеньках.
11.3. Затраты энергии для
использования N2 в качестве
источника азота значительно
выше, чем для использования
NO3-
Как показано на рис. П.8, по меньшей мере,
шесть молекул НАДН потребляются для об-
разования одной молекулы NH4+ из моле-
кулярного азота. В отличие от этого, для ас-
симиляции нитрата требуются лишь четыре
восстановительных эквивалента НАД(Ф)Н для
образования NH4+ (см. рис. 10.1). Кроме того,
затрачивается много метаболической энергии
для образования клубеньков. Поэтому для рас-
тения, которое потенциально способно к азот-
фиксации с помощью симбионтов, гораздо
экономичнее для удовлетворения своих потреб-
ностей в азоте ассимилировать нитрат. По этой
причине формирование клубеньков тонко ре-
гулируется. Клубеньки образуются лишь в слу-
чае дефицита нитрата в почве. Преимуществом
этого симбиоза является то, что бобовые и ак-
тиноризные растения могут расти на почвах с
очень низким содержанием азота, где у других
растений нет шансов выжить.
11.4. Растения улучшают свое
питание путем симбиоза
с грибами
Часто рост растений ограничен поступлением
не азота, а каких-то других жизненно важных
элементов (например, фосфора). Из-за низкой
растворимости солей фосфорной кислоты, для
поглощения фосфатов корнями из почвы не-
обходимы эффективные системы трансмем-
бранного транспорта. Именно поэтому в кор-
нях растений присутствуют высокоаффинные
транспортеры (Км от 1 до 5 мкмоль фосфата),
в которых перенос фосфата в клетку идет за
счет симпорта с протоном (используется энер-
гия протонного градиента на мембране, как в
случае с нитратом — см. раздел 10.1). Для уси-
260
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
ления снабжения фосфатом, а также другими
минеральными веществами (в частности, азо-
том и калием), большинство растений вступает
в симбиоз с грибами. Грибы способны к обра-
зованию очень тонких нитей мицелия, диаметр
которых меньше, чем у корневых волосков. Это
способствует проникновению гиф мицелия в
почвенные частицы и мобилизации элементов
минерального питания. Симбиотические гри-
бы (микросимбионты) передают эти вещества
растениям (макросимбионтам) и получают от
них, в свою очередь, органические вещества
для поддержания метаболизма. Таким обра-
зом, симбиоз с грибами предполагает большой
расход фотоассимилятов растениями. Поэто-
му установление симбиотических отношений у
большинства растений зависит от доступности
почвенных фосфатов. При высоких концентра-
циях фосфатов в почвенном растворе растение
воспринимает гриб как патоген, и включается
иммунная реакция, направленная против гриб-
ных инфекций (глава 16).
Арбускулярная микориза
широко распространена
Арбускулярная микориза обнаружена более
чем у 80% от всех исследованных видов рас-
тений. В этом типе симбиоза гифы гриба про-
никают в кору корня, образуя сеть. Кроме того,
гифы внедряются в клетки коры, и образуются
разветвленные инвагинации, которые называ-
ются арбускулами (рис. 11.9).
Иногда образуются кольца из гиф, охва-
тывающие отдельные клетки корня. При этом
наружная мембрана как грибной, так и расти-
тельной клетки остается интактной. Арбускульт
позволяют создать большую площадь контак-
та между симбионтами, что облегчает эффек-
тивный обмен веществами между грибом и
растением-хозяином. Гифы гриба поставляют
фосфаты, соединения азота, ионы К+ и воду
в обмен на углеводы, поступающие от расте-
ния-хозяина. Отдельная арбускула функциони-
рует не более двух недель и в дальнейшем дегра-
дирует, что, впрочем, не вызывает повреждения
Плазматическая
мембрана
растения
(плазмалемма)
Рис- 11 -9. Схема строения арбускулы. Гифа гриба растет вдоль поверхности
клетки коры и проникает все дальше в межклеточное пространство корня. Боковое
ответвление гифы дает арбускулу: мембрана клетки-хозяина образует сильно
разветвленную инвагинацию. Как клеточные стенки (на рисунке не показаны), так
и плазматические мембраны обоих партнеров по симбиозу остаются интактными.
Образуется большая поверхность контакта между хозяином и микросимбионтом,
что позволяет им эффективно обмениваться веществами.
11.5. Симбиоз с образование клубеньков, возможно, эволюционировал
261
соответствующей клетки растения-хозяина.
Таким образом, чтобы поддерживать симбио-
тические отношения гриб вынужден постоян-
но образовывать все новые и новые арбускулы.
Арбускулярная микориза возникла в процессе
эволюции наземных растений примерно 450
млн лет назад. Хотя число видов растений, обра-
зующих арбускулярную микоризу, очень велико
(более 80% от всех наземных растений), среди
грибов микросимбионтами являются предста-
вители всего лишь шести родов. Таким образом,
этот тип симбиоза не является специфичным.
Эктомикориза снабжает деревья
элементами минерального питания
Многие деревья в холодном и умеренном климате
вступают в симбиоз с грибами, который называ-
ют эктомикоризой. В этом случае гифы гриба не
проникают в клетки коры корня, а колонизируют
корень с поверхности, заходя также в межкле-
точное пространство коры. (Сеть поверхностных
гиф иногда называют сетью Хартига, Hartig
net.) В почве гифы гриба образуют довольно про-
тяженный мицелий. В качестве микросимбионта
в случае эктомиоризы могут выступать как аско-
мицеты, так и базидиальные грибы, принадлежа-
щие более чем к 60 родам. Их плодовые тела часто
собирают и используют в пищу. Корни, колони-
зованные гифами гриба, не образуют корневых
волосков и утолщаются. Функция поглощения
минеральных веществ и воды полностью пере-
ходит к грибному партнеру, который взамен по-
лучает органические субстраты для поддержания
метаболизма. Обмен веществами, как и в слу-
чае арбускулярной микоризы, происходит через
плотно контактирующие мембраны гриба и рас-
тения. Эктомикориза может соединять гифами
гриба несколько растений, показана возможность
перемещения фотоассимилятов от одного рас-
тения к другому через эктомикоризу. Образова-
ние эктомикоризы очень важно для успешного
роста деревьев, таких как береза, дуб или сосна,
поскольку поглощение фосфатов из почвы при
этом возрастает в 3—5 раз. Показано, что экто-
микориза намного хуже образуется при высоком
содержании азота в почве. Это объясняет те на-
рушения, которые вызывает промышленное за-
грязнение воздуха окислами азота или аммиаком:
попадая в лесную почву, соединения азота нару-
шают эктомикоризу.
Другие формы микоризы (например, эндо-
микориза с представителями семейств Orchi-
daceae и Ericaceae) здесь не обсуждаются.
11.5. Симбиоз с образованием
клубеньков, возможно,
эволюционировал на основе
физиологических механизмов,
регулирующих формирование
арбускулярной микоризы
Существует некоторое сходство между установ-
лением симбиотических отношений с арбуску-
лярной микоризой и с клубеньковыми бакте-
риями. В обоих случаях рецептороподобные
киназы (RLK, раздел 19.1) запускают сигналь-
ные каскады, что приводит к индукции синтеза
белков, необходимых для контролируемой ин-
фекции. Эти сигнальные каскады включают
G-белки, MAP-киназы и ионы Са2+ в качестве
вторичных мессенджеров (раздел 19.1). Для не-
скольких видов бобовых известны одиночные
мутации, при которых утрачивается способ-
ность вступать в симбиоз, как с клубеньковы-
ми бактериями, так и с арбускулярной мико-
ризой. Один из генов, повреждение которого
столь важно для установления симбиозов, был
охарактеризован как рецепторподобная киназа
(RLK), что указывает на важную роль RLK как
при образовании клубеньков, так и при обра-
зовании микоризы. И грибы, и бактерии, не-
смотря на их большие различия, вызывают при
контакте одни и те же изменения в экспрессии
генома у растений.
Молекулярные филогенетические исследо-
вания показали, что все растения, способные
формировать азотфиксирующие клубеньки (как
с ризобиями, так и с актиномицетами), принад-
лежат к одной кладе, а именно — к Эурозидам I
(Eurosids I). По-видимому, все они имеют обще-
го предка, хотя далеко не все потомки проявляют
способность вступать в специфический симбиоз.
По-видимому, этот эволюционный предок уже
приобрел определенные механизмы, на основе
которых могли развиться симбиотические отно-
шения с бактериями. Пересечение сигнальных
путей указывает, что эти механизмы связаны с
установлением симбиозов с грибами. Основы-
ваясь на этих предположениях можно заклю-
чить, что корневые клубеньки с азотфиксато-
262
11. Симбиотическая азотфиксация позволяет растениям использовать азот воздуха
рами появились около 50 млн лет назад, однако
не в результате одного эволюционного события.
По-видимому, симбиоз мог возникать в процес-
се эволюции в этой кладе параллельно и неза-
висимо примерно 8 раз! Для того чтобы генно-
инженерными методами перенести способность
к образованию азотофиксирующих клубеньков
к таким важным сельскохозяйственным рас-
тениям, как рис, кукуруза или пшеница (одно-
дольные), необходимо на молекулярном уровне
досконально выяснить, какие свойства предста-
вителей клады Эурозид I позволили им в процес-
се эволюции вступить в симбиоз с бактериями.
Дополнительная литература
Christiansen, J., Dean, D. R. Mechanistic feature of the
Mo-containing nitrogenase. Annu Rev Plant Physiol
Mol Biol 52, 269-295 (2002).
Cohn, J., Day, R. B., Stacey, G. Legume nodule
organogenesis. Trends Plant Sci 3, 105—110 (1998).
Harrison, M. J. Molecular and cellular aspects of the
arbuscular mycorrhizal symbiosis. Annu Rev Plant
Physiol Mol Biol 50, 361-389 (1999).
Hirsch, A. M., Lum, M. R., Downie, J. A. What makes the
rhizobia-legume symbiosis so special? Plant Physiol 127,
1484-1492 (2001).
Karlin, K. D. Metalloenzymes, structural motifs and
inorganic models. Science, 701—708 (1993).
Kistner, C., Pamiske, M. Evolution of signal transduction
in intracellular symbiosis. Trends Plant Sci 7, 511—517
(2002).
Lang, S. R. Genes and signals in the Rhizobium-iegume
symbiosis. Plant Physiol 125, 69—72 (2001).
Limpens, E., Franken, C., Smit, P., Willemse, J.,
Bisseling, T., Geurts, R. LysM domain receptor kinases
regulating rhizobial Nod factor-induced infection.
Science 302, 630-633 (2003).
Mithofer, A. Suppression of plant defence in Rhizobia-
legume symbiosis. Trends Plant Sci 7, 440— (2002).
Mylona, P., Pawlowski, K., Bisseling, T. Symbiotic
nitrogen fixation. Plant Cell 7, 869—885 (1995).
Ndakidemi, P. A, Dakota, E D. Legume seed flavonoids
and nitrogenous metabolites as signals and protectants
in early seedling development. Funct Plant Biol 30,
729-745 (2003).
Parniske, M., Downie, J. A. Locks, keys and symbioses.
Nature 425, 569-570 (2003).
Radutolu, S., Madsen, L. H., Madsen, E. B., Felle, H. H.,
Gronlund, M., Sato, S., Nakamura, Y., Tabata, S., Sandal,
N., Stougaard, J. Plant recognition of symbiotic bacteria
requires two LysM receptor-like kinases. Nature 425, 585—
591 (2003).
Sanders, I. R. Preference, specificity and cheating in the
arbuscular mycorrhizal symbiosis. Trends Plant Sci 8,
143-145 (2003).
Smil, V. Enriching the earth: Fritz Haber, Carl Bosch,
and the transformation of world food. Massachussets
Institute of Technology Press, Boston (2001).
Smith, P. M. C., Atkins, C. A. Purine biosynthesis. Big in
cell division, even bigger in nitrogen assimilation. Plant
Physiol 128, 793-802 (2002).
Triplett, E. W. (ed.) Prokaryotic nitrogen fixation. Horizon
Scientific Press Wymondham, Norfolk, England
(2000).
Zhu, Y.-G., Miller R. M. Carbon cycling by arbuscular
mycorrhizal fungi in soil-plant systems. Trends Plant Sci
8, 407-409 (2003).
Ассимиляция сульфата
и синтез серосодержащих веществ
Сульфат является важным компонентом
живой материи. В степени окисления -II
он содержится в двух аминокислотах (цистеине
и метионине), в глутатионе, в железо-серных
кластерах белков, в пероксиредоксинах и в тио-
редоксинах. Растения, бактерии и грибы могут
синтезировать эти вещества путем ассимиляции
сульфата, поглощаемого из окружающей среды.
Метаболизм животных зависит от наличия ами-
нокислот, содержащих серу, в их пише. Таким
образом, ассимиляция сульфата растениями
является важной предпосылкой для существо-
вания животных, так же, как и рассмотренная
выше ассимиляция нитрата и углерода.
Растения используют нитрат для синтеза
только после его восстановления. Сера является
важным элементом для биосинтезов не только
в восстановленной форме, но также и в форме
сульфата. Сульфат содержится в сульфолипидах,
которые составляют около 5% липидов тилако-
идной мембраны (глава 15). В них сера находит-
ся в виде сульфоновой кислоты, которая через
С-S связь присоединяется к углеводному остат-
ку липида. Пути биосинтеза этой сульфоновой
группы, к сожалению, пока неизвестны.
12.1. Фотосинтез обеспечивает
энергией и восстановителями
ассимиляцию сульфата
Ассимиляция сульфата в растениях происходит,
в основном, в хлоропластах и таким образом,
тесно взаимосвязана с процессом фотосинтеза.
Она также идет в пластидах корней. Однако
скорость ассимиляции сульфата относительно
низка. Она составляет только около 5% скоро-
сти ассимиляции нитрата и только 0,1—0,2%
скорости ассимиляции СО2. Активность фер-
ментов, участвующих в ассимиляции сульфа-
та, невелика, что создает серьезные трудности
для изучения происходящих реакций. Поэтому
наши знания об ассимиляции сульфата все еще
довольно фрагментарны.
Сходство процессов ассимиляции
сульфата и нитрата
Растения поглощают сульфат с помощью спе-
циальных транспортеров в корнях, подоб-
но тому, как поглощается нитрат (глава 10).
С восходящим током по сосудам ксилемы
сульфат поступает в листья. Здесь его захваты-
вает специфический переносчик клеток мезо-
филла, возможно, с симпортом трех протонов
(рис. 12.1). Избыток сульфата транспортируется
в вакуоль и запасается там.
Основные схемы ассимиляции сульфата
и нитрата в клетках мезофилла в основных чер-
тах совпадают. Сульфат восстанавливается до
сульфита с затратой двух электронов, а затем до
сероводорода, с затратой шести электронов:
SO42-+ 2е-+ 2Н+ -> SO32“+ Н2О
SO32- + бе- + 8Н+ -> H2S + ЗН2О
В то время как NH3, образующийся при вос-
становлении нитрата, усваивается, встраиваясь
в аминокислоту глутамин (см. рис. 10.6), серо-
водород, появляющийся при восстановлении
сульфита, встраивается в аминокислоту цисте-
ин. Основным различием между ассимиляцией
нитрата и сульфата является то, что для суль-
фата необходимо гораздо больше энергии. Это
показано на общей схеме (см. рис. 12.1). Восста-
новление сульфата до сульфита, которое, в от-
личие от восстановления нитрата, происходит
в пластидах, требует в сумме расщепления двух
энергетически богатых фосфатных ангидридных
связей; фиксация сероводорода в форме цисте-
ина — еще двух. Поэтому потребление АТФ при
ассимиляции сульфата в четыре раза выше, чем
264
12. Ассимиляция сульфата и синтез серосодержащих веществ
Рис. 12.1. Метаболизм сульфата в листе. Сульфат переносится с восходящим
током в листья и транспортируется в клетки мезофилла. После переноса
в хлоропласт через фосфатный переносчик сульфат восстанавливается здесь
до H2S и затем превращается в цистеин. Сульфат может также запасаться в вакуоли.
Упрощённая схема. На самом деле серин активируется в виде ацетилсерина
(см. рис. 12.4)
при ассимиляции нитрата. Теперь рассмотрим
химизм отдельных реакций.
Активация сульфата
перед восстановлением
Сульфат, возможно, проникает в хлоропласт че-
рез переносчик, обменивающий его на фосфат.
Сульфат не может быть напрямую восстанов-
лен в хлоропластах, поскольку окислительно-
восстановительный потенциал редокс пары
SO32-/SO42- (А£°’=—517мВ) слишком высок.
В хлоропласте нет восстановителей, способных
осуществить восстановление SO42- до SO32- за
один шаг. Чтобы облегчить восстановление суль-
фата, разность оксилительно-восстановительных
потенциалов с сульфитом снижается с помощью
активации сульфата перед восстановлением.
Как показано на рис. 12.2, сульфат активи-
руется через образование ангидридной связи с
фосфатным остатком АМФ. Сульфат при уча-
стии фермента АТФ-сульфурилазы обменива-
ется с пирофосфатным остатком АТФ, образует-
12.1. Фотосинтез обеспечивает энергией и восстановителями ассимиляцию сульфата
265
Сульфат
Пирофосфа-
таза
АФС
(АМФ-сульфат)
► 2Ф
ОН ОН
АФС-
редуктаза
Рис. 12.2. Восстановление сульфата до сульфита
Свет
H2s + зн2о
SO320 + 8 Н®
Рис. 12.3. Восстановление сульфитредуктазой сульфита до сероводорода
в хлоропластах. Восстановительные эквиваленты находятся в форме ферредоксина,
образующегося при работе фотосистемы I (нециклический поток электронов)
266
12. Ассимиляция сульфата и синтез серосодержащих веществ
ся АМФ-сульфат (АФС). Поскольку свободная
энергия гидролиза сульфат-фосфатной анги-
дридной связи (AG0’ = —71 кДж/моль) значи-
тельно выше, чем у фосфат-фосфатной анги-
дридной связи в АТФ (AG0’ = —31 кДж/моль),
равновесие реакции сильно сдвинуто в сторону
АТФ. Эта реакция может идти только благодаря
тому, что пирофосфат постоянно удаляется из
реакции благодаря высокой активности пирос-
фосфатазы в хлоропластах.
Сульфат, присутствующий в форме АФС,
восстанавливается глутатионом (рис. 12.5, 3.38)
до сульфита. АФС-редуктаза, участвующая в
этой реакции, катализирует не только восста-
новление, но также и последующее высвобож-
дение сульфита из АМФ. Разность окислитель-
но-восстановительных потенциалов сульфата и
сульфита снижается, поскольку восстановление
сульфата происходит при гидролизе сульфитной
ангидридной связи, которая очень богата энер-
гией. Механизм действия АФС-редуктазы оста-
ется невыясненным.
Сходство сульфитредуктазы
с нитрит-редуктазой
Как и при восстановлении нитрита, для вос-
становления сульфита в хлоропластах требуется
шесть молекул восстановленного ферредокси-
на (рис. 12.3). Сульфитредуктаза гомологична
нитритредуктазе, она также содержит сирогем
(см. рис. 10.5) и 4Fe-4S кластер. Концентрация
сульфита, необходимая для полунасыщения фер-
мента, находится в пределах 10-6 моль/л, и этого
достаточно для эффективного восстановления
новообразующегося сульфита в сероводород.
Ферредоксин, необходимый для работы сульфи-
тредуктазы, как и в случае нитритредуктазы (см.
рис. 10.1), может быть получен восстановлением
НАДФН. Этот процесс позволяет восстанавли-
вать сульфит также и в гетеротрофных тканях.
Фиксация H2S в форме цистеина
Фиксация образующегося H2S требует активации
серина. Для этого гидроксильная группа ацети-
лируется серин-трансацетилазой с помощью
ацетил-КоА (рис. 12.4). Последний синтезирует-
ся из ацетата и КоА с затратой АТФ (которая пре-
вращается в АМФ) с участием фермента ацетил-
КоА-синтазы. Образующийся в этой реакции
пирофосфат гидролизуется пирофосфатазой, ко-
торая присутствует в хлоропластах. В сумме акти-
вация серина «обходится» хлоропластам в две ма-
кроэргические связи между остатками фосфатов.
Фиксация H2S катализируется ферментом
О-ацетилсерин(тиол)-лиазой. Он содержит в
качестве простетической группы пиридоксаль-
фосфат и имеет высокую аффинность к H2S и
ацетилсерину. Встраивание SH-группы фор-
мально можно рассматривать как расщепление
эфирной связи при помощи H-S-H. Таким
соое
।
Серин H-C-NH®
Н2С-ОН
Серин-
трансацетилаза
АМФ
+ фф АТФ
Ацетил-СоА-
синтетаза
Ацетат + CoASH
СООе
О-Ацетил- H-C-NH®
серин Н2С-О- С-СН3
2 II 3
О
О-Ацетилсерин
(тиол)-лиаза
СООе
H-C-NH?
H2C-SH
Цистеин
Рис. 12.4. Сероводород, образующийся при восстановлении сульфита,
встраивается в цистеин
12.2. Глутатион как антиоксидант и средство детоксикации посторонних вредных веществ
267
образом, конечным продуктом ассимиляции
сульфата оказывается цистеин.
Цистеин играет важную роль в поддержании
третичной и четвертичной структуры и в ката-
литических центрах ферментов, и поэтому не
может быть заменен в них другими аминокис-
лотами. Кроме того, цистеиновые остатки уча-
ствуют в образовании железо-серных кластеров
(см. рис. 3.26) и являются компонентами тиоре-
доксина (см. рис. 6.25).
12.2. Глутатион как антиоксидант
и средство детоксикации
посторонних вредных веществ
Относительно большая доля цистеина, об-
разующегося в растениях, используется для
синтеза трипептида глутатиона (рис. 12.5).
Синтез глутатиона осуществляется в два этапа.
Во-первых, образование аминной связи между
у-карбоксильной группой глутамата с амино-
группой цистеина осуществляется у-глутамил-
цистеинсинтазой, что требует гидролиза
АТФ. Во-вторых, пептидная связь между кар-
боксильной группой цистеина и аминогруп-
пой глицина образуется при работе глутати-
онсинтазы, снова с затратой АТФ. Глутатион,
сокращенно TSH, присутствует в растительных
клетках в довольно высоких концентрациях и
выполняет различные функции. Функция глу-
татиона как восстанавливающего агента об-
суждалась ранее. Являясь антиоксидантом, он
защищает компоненты клетки от окисления.
Вместе с аскорбатом он удаляет кислородные
радикалы, которые образуются как побочные
продукты фотосинтеза (раздел 3.9). Глутатион
играет защитную роль в растениях, образуя
конъюгаты с ксенобиотиками, а также являясь
предшественником фитохелатинов, которые
участвуют в детоксикации тяжелых металлов.
Кроме того, глутатион служит резервом орга-
нической серы. В случае необходимости ци-
стеин высвобождается из глутатиона при его
ферментативной деградации.
Детоксикация ксенобиотиков
с помощью конъюгации
Токсические вещества, образующиеся в рас-
тениях, или поглощаемые ими (ксенобиотики)
могут обезвреживаться в результате взаимодей-
ствия с глутатионом. Процесс катализируется
глутатион-8-трансферазой. Активная SH-rpyn-
па глутатиона образует тиоэфирную связь, реа-
гируя с двойными связями между углеродами,
карбонильными группами и другими реактив-
ными группами. Образующиеся таким способом
конъюгаты глутатиона (рис. 12.6) транспорти-
руются в вакуоль специфическим переносчи-
ком глутатиона против градиента концентра-
ции. В отличие от транспортных процессов, в
которых перенос метаболитов против градиен-
та концентрации обеспечивается вторичным
активным транспортом, поглощение конъюга-
тов глутатиона в вакуоль обеспечивается АТФ-
зависимым первичным активным транспортом
(см. рис. 1.20). Этот переносчик принадлежит
к суперсемейству АВС-транспортеров (АТР-
binding cassette — АТФ-связывающая кассета),
широко распространенных в растениях и жи-
вотных, а также в бактериях. В вакуолярной
мембране находится много АВС-транспортеров
с различной специфичностью. Поглощающиеся
Глутатион-
синтетаза
у- Глутамил
-цистеин -
синтаза
Цистеин
Глутамат
АТФ АТФ + Ф
Глицин
СООе
Н—С—NH®
СН2
I н
SH
I
сн2
.. I н
Н2С—С—N—С—С—N—СН2—СООе
II I II
О но
АТФ АДФ + Ф
у-глу-цис-глу
Глутатион
Рис. 12.5. Биосинтез глутатиона
268
12. Ассимиляция сульфата и синтез серосодержащих веществ
Гербицид
TSH —'
Рис. 12.6. Детоксикация гербицида. Глутатион
(FSH) образует конъюгат с гербицидом, который
активно транспортируется в вакуоль специфическим
глутатионовым переносчиком. Здесь накапливаются
продукты деградации гербицида
конъюгаты часто модифицируются (например,
путем деградации до конъюгатов цистеина) и
в такой форме накапливаются. Таким спосо-
бом растения могут снижать токсический эф-
фект гербицидов. Устойчивость к гербицидам
(например, устойчивость кукурузы к атразину)
может быть следствием активности специфи-
ческой глутатион-8-трансферазы. В попытке
разработать гербициды, которые бы выбороч-
но действовали на сорняки, а не на культур-
ные растения, для промышленной защиты
растений разработаны вещества, которые уве-
личивают устойчивость культурных растений
к определенным гербицидам. Такие защитные
вещества называются антидотами. Они, как и
другие ксенобиотики, стимулируют увеличение
экспрессии глутатион-8-трансферазы и пере-
носчика глутатиона в вакуоль. Таким образом,
гербициды, поглощающиеся культурными рас-
тениями, подвергаются детоксикации значи-
тельно быстрее. Образование конъюгатов глу-
татиона и их перенос в вакуоль также может
вносить вклад в накопление пигментов, содер-
жащихся в цветках (раздел 18.6).
Глутатион
SH
I
Н О СН2
©I II I н
HoN-C-CHo-CHo-C-N-C-C-N-CHo-COO0
I Н I II
соое н о
Глутатион
SH
I
сн2
I н
Н О СН2
© I II I Н
+ H3N-C-CH2-CH2-C-N-C-C-N-CH2-COOe
СООе
Н I II
н о
у-Глу-Цис-Гпи
Фитохелатин-
синтаза
у-Глу-Цис-Глу
активируется
тяжелыми металлами
(например Cd2®, Ад®, РЬ2®,
Cu2a, Hg2i, Zn2®)
Гл и
(у-Глу-Цис^ -Гли
I
1
(у-Глу-Цис)п-Гли (п = 2-11)
Фитохелатин
Рис. 12.7. Синтез фитохелатина. Фитохелатинсинтаза (транспептидаза)
расщепляет пептидную связь между цистеином и глицином в молекуле глутатиона
и переносит «-аминогруппу остатка глутамата второй молекулы глутатиона на
высвободившуюся карбоксильную группу цистеина. При повторении этой реакции
образуется длинная цепочка фитохелатина
12.3. Синтез метионина из цистеина
269
Фитохелатины и защита растений
от тяжелых металлов
Глутатион является предшественником при син-
тезе фитохелатинов (рис. 12.7). Фитохелатин-
синтаза (относится к транспептидазам) пере-
носит аминогруппу глутамата на карбоксильную
группу цистеина второй молекулы глутатиона,
что сопровождается высвобождением одной мо-
лекулы глицина. Повторение этого процесса
приводит к образованию цепочек, содержащих
до 11 последовательно соединенных остатков
глутамата и цистеина. Фитохелатины обнаруже-
ны во всех исследованных к настоящему време-
ни растениях, хотя иногда в модифицированной
форме «зо-фитохелатинов, где глицин заменен
на серин, глутамат или Р-аланин.
Фитохелатины защищают растения от ток-
сичного действия тяжелых металлов; с их по-
мощью запасаются Си2+ и Zn2+. С участием тио-
ловых групп цистеиновых остатков образуются
прочные комплексы с ионами металлов, таких
как Cd2+, Ag+, Pb2+, Cu2+, Hg2+ и Zn2+, а также
с неметаллом As3+ (рис. 12.8). Фитохелатин-
синтаза, находящаяся в цитозоле, активируется
ионами, по меньшей мере, одного из тяжелых
металлов приведенного выше списка. Поэто-
му при действии тяжелых металлов на растение
за очень короткое время из глутатиона de novo
синтезируются необходимые для детоксикации
фитохелатины. Присутствие тяжелых металлов
может приводть к серьезному снижению запасов
глутатиона в клетке. Фитохелатины в комплексе
с тяжелыми металлами транспортируются в ва-
куоли с затратой АТФ, так же, как и конъюгаты
глутатиона. Благодаря кислой среде в вакуоли
тяжелые металлы высвобождаются из фитохела-
тинов и запасаются здесь в виде сульфидов. Фи-
тохелатины необходимы для зашиты растения
от отравления тяжелыми металлами. Обнару-
жены мутанты Arabidopsis с дефектом в фитохе-
латинсинтазы, которые обладают повышенной
чувствительностью к Cd2+.
Способность растений накапливать в без-
опасной форме ионы тяжелых металлов, свя-
зывая их с фитохелатинами, в последнее время
используется для очистки почв, загрязненных
тяжелыми металлами. На таких почвах выра-
щивают растения, которые (в результате скре-
щивания или генно-инженерных манипуляций)
обладают высокой способностью к поглощению
-Глу-Цис-Глу-Цис-
HS.. S
.Cd.
S SH
I I
-Глу-Цис-Глу-Цис-
Рис. 12.8. Детоксикация тяжелых металлов
с помощью фитохелатинов: тяжелые металлы
образуют комплексы с тиоловыми группами
цистеина и таким образом становятся безопасными
тяжелых металлов корнями, к биосинтезу фито-
хелатинов, и таким образом, могут очищать по-
чву от тяжелых металлов.
Этот метод называется фиторемедиацией.
Он может иметь большое будущее, поскольку
его стоимость значительно ниже стоимости дру-
гих методов восстановления загрязненных тя-
желыми металлами почв.
12.3. Синтез метионина из цистеина
Цистеин является предшественником метио-
нина, другой серосодержащей аминокислоты.
О-фосфогомосерин, который уже упоминался
как промежуточный продукт синтеза треонина
(см. рис. 10.14), реагирует с цистеином, при этом
фосфатная группа высвобождается, и образу-
ется цистатионин (рис. 12.9). Тиоэфирная связь
расщепляется цистатионин-[3-лиазой, образу-
ет гомоцистеин и нестабильный енамин, кото-
рый самопроизвольно разлагается на пируват и
NH4+. Сульфгидрильная группа гомоцистеина
метилируется метилтетрагидрофолатом (метил-
ТГФ) (см. рис. 7.6) и в конце концов образуется
метионин1.
S-аденозилметионин —
универсальный метилирующий реагент
При реакциях метилирования источниками ме-
тильных групп могут быть тетрагидрофолие-
вая кислота (ТГФ) или S-аденозилметионин
(SAM). Происхождение метильной группы,
поставляемой тетрагидрофолиевой кислотой,
1 Метионин является первой аминокислотой, с которой
начинается синтез белка (рис. 21.2, 21.3). При снижении
концентрации метионина скорость синтеза всех белков в
клетке также падает. Концентрация метионина (и других ор-
ганических соединений серы) особенно высока в растущих
тканях. — Прим. ред.
270
12. Ассимиляция сульфата и синтез серосодержащих веществ
Цистеин СООе
Н— с- NH®
НгС-SH
СОО®
H-C-NH®
СН2
- I
Н2С-ОРОзе
О-фосфо-
гомосерин
Цистатионин-
у-синтаза
СООе
I ф
СООе H-C-NH?
H-C-NH® СН2
Н2С---S---СН2
Цистатионин
СООе
C-NHf
II 3
сн2
СООе
I _
I ”
сн3
Пируват
Метилтетра-
гидрофолат
соо®
H-C-NHf
СН2
Н2С—SH Гомоцистеин
Тетрагидро-
фол ат
Метил-
трансфераза
СООе
H-C-NHf
СН2
Метионин Н2С—S—СН3
Рис. 12.9. Биосинтез метионина из цистеина
неясно. Возможно, что она появляется от мо-
лекулы муравьиной кислоты, взаимодействую-
щей в АТФ-зависимой реакции с ТГФ, образуя
формил-ТГФ, который восстанавливается с за-
тратой двух молекул НАДФН до метил-ТГФ.
Метил-ТГФ, однако, имеет довольно низкую
способность переноса метила. Гораздо более
серьезную роль в качестве донора метильных
групп играет S-аденозилметионин. Он участву-
ет в метилировании нуклеиновых кислот, бел-
ков, углеводов, мембранных липидов и многих
других веществ и, следовательно, может рассма-
триваться как универсальный метилирующий
агент клетки.
S-аденозилметионин образуется при переносе
аденозильного остатка АТФ на атом серы в мети-
онине; при этом высвобождается фосфат и пиро-
фосфат (рис. 12.10). Метильная группа, с которой
связан положительно заряженный S-атом, акти-
вируется, и втаком виде можетбытьперенесенасо-
ответствующими метилтрансферазами на другие
акцепторы. Оставшийся S-аденозилгомоцистеин
12.4. Избыточные концентрации диоксида серы в атмосфере токсичны для растений
271
соое
Н—С—NH®
СН2
Н2С-S—сн3
S-аденозил-
метионин-
синтаза
RCH3
RH + Н®
СООе
I
Н—С—NHJ
СН2
S-аденозил-
метионин
Рис. 12.10. S-аденозилметионин образуется из метионина и АТФ и является
метилирующим агентом
ОН он
S-аденозил-
гомоцистеин
Метионин
гидролизуется до аденозина и гомоцистеина. Из
последнего при восстановлении с метилтетра-
гидрофолатом (см. рис. 12.9) снова образуется
метионин. S-аденозилметионин также является
предшественником в синтезе фитогормона эти-
лена (раздел 19.7).
12.4. Избыточные концентрации
диоксида серы в атмосфере
токсичны для растений
Диоксид серы в воздухе, который образуется
в довольно больших количествах металлурги-
ческой промышленности при плавлении руд,
содержащих серу, при сжигании ископаемого
топлива, может обеспечить общие потребно-
сти растения в сере. В высоких концентрациях
диоксид серы, однако, вызывает серьезные по-
вреждения растений. Газообразный SO2 прони-
кает через устьица в листья, где преобразуется
в сульфит:
SO2+Н2О-—> SO32-+2Н+
Растения обладают защитными механизма-
ми ликвидации сульфита, который образуется
в листьях. В одном из них сульфит преобразует-
ся сульфитредуктазой (раздел 12.1) в сероводо-
род, а затем в цистеин. Цистеин, образующийся
в избыточных количествах, может перерабаты-
ваться и запасаться в форме глутатиона. Поэто-
му часто наблюдается накопление глутатиона
в листьях растений, находящихся в условиях вы-
сокого загрязнении SO2. Избыток сероводорода
может выводиться из листьев через устьица, но
в довольно небольших количествах. Кроме того,
сульфит может быть окислен, возможно, перок-
сидазами листа, до сульфата. Сульфат, как пра-
вило, не может быть удален из листьев, и в ито-
ге он запасается в вакуолях клеток листа в виде
сульфата калия или магния. Когда возможности
запасания исчерпаны, листья опадают. Это,
в частности, объясняет токсическое влияние
SO2 на сосновые деревья. Ранняя потеря хвои у
сосен при загрязнении воздуха промышленным
SO2 происходит, в основном, из-за того, что ис-
черпаны возможности вакуолей для запасания
сульфата. На катион-дефицитных почвах вы-
сокие потребности в катионах для запасания
сульфата могут приводить к серьезной калий-
ной или магниевой недостаточности в листьях.
Побеление сосновой хвои, часто наблюдаемое
при SO2 загрязнении часто, приписывают сни-
женной доступности ионов Mg2+.
Дополнительная литература
Clemens, S., Palmgren, М. G., Kraemer, С. A long way
ahead: Understanding and engineering plant metal
accumulation. Trends Plant Sci 7, 309—315 (2002).
Cobbett, C., Goldsbrough, P. Phytochelatins and
metallothioneins: Roles in heavy metal detoxification and
homeostasis. Annu Rev Plant Biol 53, 159—182 (2002).
Cole, J. O. D., Blake-Kalff, M. M. A., Davies, T. G.E.
Detoxification of xenobiotics by plants: Chemical
272
12. Ассимиляция сульфата и синтез серосодержащих веществ
modification and vacuolar compartmentation. Trends
Plant Sci 2, 144-151 (1997).
Dixon, D. P., Cummins, I., Cole. D. J., Edwards, R.
Glutathione-mediated detoxification systems in plants.
Plant Biol 1,258-266(1998).
Foyer, С. H., Theodoulou, E L., Delrot, S. The functions
of inter- and intra-cellular glutathione transport systems
in plants. Trends Plant Sci 6, 486—492 (2001).
Heber, U., Kaiser, W., Luwe, M., Kindermann, G.,
Veljovic-Iovanovic, S., Yin, Z-H., Pfanz, H., Slovik, S.
Air pollution, photosynthesis and forest decline. Ecol
Stud 100, 279-296 (1994).
Hesse, H., Hoefgen, R. Molecular aspects of methionine
biosynthesis. Trends Plant Sci 8, 259—262 (2003).
Higgins, С. E, Linton, K. J. The xyz of ABC transporters.
Science 293, 1782-1784 (2001).
Howden, R., Goldsbrough, C. R., Anderson, C. R., Cob-
bett, C. S. Cadmium-sensitive, cadi mutants of Ara-
bidopsis thaliana are phytochelalin deficient. Plant
Physiol 107, 1059-1066 (1995).
Hung, L.-W., Wang, I. X., Nikaido, K., Liu, P.-Q.,
Ames, G. Е-L., Kim, S.-H. Crystal structure of the
ATP-binding subunit of an ABC transporter. Nature
396, 703-707(1998).
Kreuz, K., Tommasini, R., Martinoia, E. Old enzymes
for a new job: Herbicide detoxification in plants. Plant
Physiol 111,349-353(1996).
Leustek, T, Martin, M. N., Bick, J.-A., Davies, J. P.
Pathways and regulation of sulfur metabolism revealed
through molecular and genetic studies. Annu Rev Plant
Physiol Plant Mol Biol 51, 141-165 (2000).
Ma, L. Q., Komart, К. M., Tu, C., Zhang, W., Cai, Y,
Kennelley, E. D. A fern that hyperacculmulates arsenic.
Nature 409, 579 (2001).
Saito, K. Regulation of sulfate transport and synthesis of
sulfur-containing amino acids. Curr Opin Plant Biol 3,
188-195 (2000).
Zenk, M. H. Heavy metal detoxification in higher plants.
Gene 179,21-30(1996).
Флоэма транспортирует и распределяет
фотоассимиляты в места их потребления
или запасания
В этой главе будет рассмотрен экспорт фо-
тоассимилятов из листьев в другие орга-
ны растения. Кроме ксилемы, которая является
одной из систем дальнего транспорта, обеспе-
чивающей поток веществ из корней в листья,
у растений есть вторая система дальнего транс-
порта — флоэма, которая экспортирует фотоас-
симиляты из листьев к органам, нуждающимся
в продуктах фотосинтеза. Ксилема и флоэма
вместе с паренхиматическими клетками образу-
ют проводящий пучок (рис. 13.1). Ксилема (от
греч. xylon — древесина) состоит из лигнифици-
рованных сосудов1, по которым перемещаются
вода и растворенные в ней вещества из корней
в листья с восходящим потоком (раздел 8.1).
Ситовидные элементы, обычно расположен-
ные в стебле снаружи от участков ксилемы, об-
разуют флоэму (от греч. phloios — луб). Флоэма
транспортирует фотоассимиляты от точек син-
теза (доноры, например клетки мезофилла ли-
ста) к местам потребления (акцепторы, напри-
мер корни, клубни, плоды, растущие органы).
Таким образом, доноры и акцепторы соединены
между собой при помощи флоэмы.
Флоэма содержит удлиненные клетки, между
которыми диагонально расположены утолщен-
ные клеточные стенки с многочисленными от-
верстиями (порами) — ситовидные пластинки.
Отдельные клетки такого типа называют си-
товидными элементами, а несколько соеди-
ненных в ряд ситовидных элементов образуют
ситовидную трубку (рис. 13.2). Поры ситовид-
ных пластинок являются расширенными плаз-
модесмами, которые окружены каллозой (раз-
дел 9.6). Ситовидный элемент представляет
1 Имеются в виду типичные цветковые растения. — Прим,
ред.
собой живую клетку, у которой утрачено ядро,
есть лишь незначительное число митохондрий и
пластид, немного цитоплазмы и развитая вакуо-
лярная система.
Отсутствие большинства клеточных струк-
тур, в норме имеющихся у живых клеток, мож-
но рассматривать как признак специализации
ситовидных элементов для дальнего транспорта
углеводов, азотсодержащих метаболитов и раз-
нообразных неорганических и органических
веществ. У многих растений сахароза являет-
ся основной транспортной формой углеводов,
однако у других по флоэме транспортируются
олигосахариды из семейства раффиноз или са-
хароспирты (раздел 9.4). Азот транспортируется
в ситовидных элементах обычно в форме ами-
нокислот. Органические кислоты, нуклеотиды,
белки и фитогормоны присутствуют во флоэм-
ном соке в низких концентрациях. Кроме пере-
численных органических веществ, ситовидные
трубки транспортируют неорганические ионы
(в основном это ионы К+).
У покрытосеменных растений к ситовидным
элементам плотно прилегают клетки-спут-
ницы, у которых есть полный набор органелл,
характерный для живых клеток, включая ядро
и многочисленные митохондрии. Ситовидный
элемент и клетка-спутница в процессе разви-
тия образуются путем деления одной общей
клетки-предшественницы и в дальнейшем оста-
ются соединенными друг с другом при помо-
щи многочисленных плазмодесм (раздел 1.1).
Клетки-спутницы играют ключевую роль в про-
цессе загрузки флоэмы. В зависимости от спо-
соба загрузки флоэмы клетки-спутницы бывают
разных типов передаточные клетки (transfer
cells) или промежуточные клетки (intermedi-
ary cells).
274
13. Флоэма транспортирует и распределяет фотоассимиляты в места их потребления...
Рис. 13.1. Поперечный разрез через
проводящий пучок лютика {Ranunculus),
травянистого двудольного растения. Флоэма
и ксилема окружены клетками обкладки
сосудистого пучка (из Raven, Evert, Curtis, Biolo-
gic der Pflanzen, De Gruiter Verlag, Берлин,
с любезного разрешения)
Обкладка пучка
Первичная флоэма
13.1. Два способа загрузки флоэмы
Произведенные в клетках мезофилла фотоас-
симиляты, такие, как сахароза, разнообразные
олигосахариды, а также аминокислоты, путем
диффузии по плазмодесмам поступают в клет-
ки обкладки сосудистого пучка1. Дальнейший
транспорт фотоассимилятов из клеток обклад-
ки в ситовидные трубки может происходить
двумя различными путями.
1. У растений, транспортирующих по сито-
видным трубкам олигосахариды из семейства
1 Загрузка флоэмы анатомически описана не совсем пра-
вильно. В основном этот процесс происходит в тонких тер-
минальных жилках листа, где обкладку можно выделить
лишь у С4-растений. У С3-растений фотоассимиляты за-
гружаются из клеток мезофилла непосредственно в клетку-
спутницу. — Прим. ред.
раффиноз (раздел 9.4), например, у тыквы и ка-
бачков, клетки-спутницы соединены с клетками
обкладки или мезофилла обильными плазмо-
десмами. В этом случае клетки-спутницы назы-
вают промежуточными клетками. Возникает
прямой поток по симпласту (через плазмодес-
мы) от клеток мезофилла через промежуточные
клетки в ситовидные элементы. Именно такой
способ транспорта фотоассимилятов в сито-
видную трубку называют симпластической за-
грузкой флоэмы.
2. Противоположный способ загрузки флоэ-
мы — апопластический — можно обнаружить в
листьях зерновых злаков, сахарной свеклы, рап-
са и картофеля. В этом случае фотоассимиляты
от клеток-доноров сначала попадают во внекле-
точный компартмент, в апопласт, и лишь затем
поглощается через плазмалемму клеткой-спут-
13.1. Два способа загрузки флоэмы
275
ДОНОР
ЗАГРУЗКА ФЛОЭМЫ
АКЦЕПТОР
РАЗГРУЗКА ФЛОЭМЫ
Рис. 13.2. Схема ситовидной трубки и процессов её загрузки и разгрузки двумя
путями: симпластическим и апопластическим. Плазмодесмы, показанные
двойными линиями, обеспечивают диффузию смеси сахаров и аминокислот.
Структуры клетки изображены без соблюдения пропорций. Клетки-спутницы,
участвующие в апопластической загрузке, называются передаточными клетками
(transfer cells). Промежуточные клетки (intermediary cells) — это клетки-спутницы,
специализированные на симпластической загрузке.
ницей и попадает в транспортный компартмент
ситовидного элемента (рис. 13.3). Переносчики,
осуществляющие экспорт из клеток обкладки
или мезофилла в апопласт, до сих пор не охарак-
теризованы. Поскольку концентрация сахарозы
и аминокислот в фотосинтезирующих клетках-
донорах гораздо выше, чем в окружающем меж-
клеточном пространстве апопласта, трансмем-
бранный транспорт не требует затрат энергии.
Клетки-спутницы, участвующие в апопласти-
ческой загрузке флоэмы, называют передаточ-
ными клетками. В них сахароза и аминокис-
лоты попадают из апопласта за счет симпорта с
протоном (см. рис. 13.3). Основной движущей
силой в загрузке флоэмы является протонный
градиент, возникающий между апопластом и
объединенным цитозолем клетки-спутницы и
ситовидного элемента. Протонный градиент
образуется за счет работы Н+-АТФазы (раз-
дел 8.2), которая находится на плазмалемме.
АТФ, необходимая для поддержания протон-
ного градиента, образуется в митохондриях в
процессе дыхания. Н+-сахарозный переносчик
(симпортер), участвующий в загрузке флоэмы,
был выделен и охарактеризован у нескольких
растений. Используя антитела, специфичные к
Н+-сахарозным переносчикам на примере со-
судистых пучков подорожника (Plantago major),
удалось показать, что эти переносчики располо-
жены на плазматической мембране передаточ-
ных клеток (см. рис. 13.3). В другой модельной
системе Н+-сахарозные переносчики были об-
наружены на мембране ситовидных элементов
(в листьях картофеля). Субстратом для мито-
хондриального дыхания является поступающая
в клетки-спутницы сахароза, которая вначале
276
13. Флоэма транспортирует и распределяет фотоассимиляты в места их потребления...
КЛЕТКА ОБКЛАДКИ
ИЛИ МЕЗОФИЛЛА
АПОПЛАСТ
ПЕРЕДАТОЧНАЯ КЛЕТКА 1Й
ЭЛЕМЕНТ
Рис- 13-3- Апопластическая загрузка флоэмы. Транспорт фотоассимилятов из
клетки обкладки в ситовидный элемент. Множество наблюдений показывают, что
активная загрузка происходит на плазматической мембране передаточной клетки.
Последующее поступление веществ в ситовидный элемент идет путем диффузии
по плазмодесмам. Недавние исследования позволяют предположить, что часть
ассимилятов попадает в ситовидный элемент непосредственно через его мембрану
с участием сахарозосинтазы распадается на две
гексозы (см. рис. 13.5), которые затем вступают
в гликолиз. Другим субстратом для дыхания мо-
жет служить глутамат (раздел 5.3), поскольку у
многих растений эта аминокислота присутству-
ет во флоэмном соке в сравнительно высоких
концентрациях.
По мере исследования растений с апопласти-
ческой загрузкой флоэмы выяснилось, что основ-
ной транспортной формой сахаров у них являет-
ся сахароза (гексозы не транспортируются), но
нет преимущественной аминокислоты, в форме
которой транспортируется органический азот.
В принципе все протеиногенные аминокислоты
могут транспортироваться. При этом соотноше-
ние аминокислот в клетках-донорах и во флоэм-
ном соке приблизительно одинаково. Наиболь-
шая доля среди всех аминокислот во флоэмном
соке у глутамата и глутамина, затем — у аспарта-
та, хотя аланин также присутствует в заметных
количествах у некоторых растений. Несколько
аминокислотных переносчиков с широкой спец-
ифичностью к разнообразным аминокислотам,
обнаруженные в последнее время, как полагают,
могут участвовать в загрузке флоэмы.
13.2. Транспорт по флоэме
происходит за счет
массового тока
Симпорт протона с фотоассимилятами, вторич-
но использующий энергию протонного гради-
ента на плазмалемме, позволяет достичь очень
высоких концентраций сахарозы и аминокис-
лот в ситовидных трубках. В зависимости от
вида растений и от внешних условий концен-
трация сахарозы во флоэмном соке составля-
ет 0,6—1,5 моль/л, а суммарная концентрация
аминокислот варьирует от 0,05 до 0,5 моль/л.
Известные вредители сельскохозяйственных
растений — тли — оказались удобным инстру-
ментом для получения флоэмного сока с целью
дальнейшего анализа1.
Тля после нескольких попыток может вонзить
свой ротовой аппарат (стилет) непосредственно
в ситовидную трубку. Поскольку флоэмный сок
течет под высоким давлением, он через просвет
стилета попадает в организм тли и служит ис-
1 Так называемая афидная методика (от греч. aphid —
тля). — Прим. ред.
13.3. Ткан и-акцепторы снабжаются фотоассимилятами путем разгрузки флоэмы
277
Ксилема Ситовидные трубки
Рис. 13.4. Инстинкт позволяет тлям безошибочно
вонзать свой ротовой аппарат (стилет) точно
в ситовидную трубку. Это позволяет им питаться
флоэмным соком. (Рисунок A.F.G.D. Dixon, из Ency-
clopedia of Plant Physiology, vol.I, Springer-Verlag,
с любезного разрешения.)
точником питания (рис. 13.4). Однако тля полу-
чает слишком много сахарозы и не в состоянии
полностью ее утилизировать, поэтому не пере-
варенный избыток выделяется в виде «медвяной
росы», образующей липкий сахаристый налет на
листьях растений, пораженных тлями. Когда сти-
лет хотят использовать для получения флоэмного
сока, питающуюся тлю удаляют, и сок вытекает
из ситовидной трубки наружу через основание
стилета. Хотя количества флоэмного сока, полу-
ченного этим методом, очень невелики (от 0,05
до 0,1 х 10"6 л/час), тем не менее современные
возможности количественного анализа позволя-
ют изучить состав флоэмного сока.
У фотосинтезирующих растений, которые на
время помещали в атмосферу с радиоактивным
СО2, меченая сахароза распространяется по
флоэме со скоростью от 30 до 150 см/час. Столь
быстрый транспортный процесс массового
тока приводится в движение с одной стороны
очень эффективным механизмом концентри-
рования сахарозы и аминокислот в ситовидных
трубках, а с другой стороны — быстрым выхо-
дом этих веществ в местах потребления. Таким
образом, массовый ток веществ по флоэме ре-
гулируется создающимся продольным гради-
ентом осмотического потенциала. С массовым
током веществ по флоэме могут распростра-
няться вещества, присутствующие в очень низ-
ких концентрациях (такие, как фитогормоны)1.
Направление массового тока регулируется в
первую очередь интенсивностью использования
веществ флоэмного сока. Чтобы удовлетворить
текущие потребности в фотоассимилятах, фло-
эмный транспорт может направляться как вверх
по растению (например, от зрелых листьев к
растущей меристеме побега или к цветкам), так
и вниз (к корням или подземным запасающим
органам). Поскольку флоэмный сок находится
под давлением, а флоэма сильно разветвлена,
любое повреждение могло бы привести к «ис-
течению» флоэмным соком. Чтобы этого не
происходило, у растений существуют защитные
механизмы. Благодаря наличию субстратов во
флоэмном соке, сахарозосинтаза и каллозосин-
таза (которые, скорее всего, связаны с мембра-
ной) в случае повреждения ситовидной трубки
закупоривают поры ситовидной пластинки,
синтезируя каллозу (раздел 9.6). Таким образом,
поврежденная ситовидная трубка в дальнейшем
не используется.
13.3. Ткани-акцепторы снабжаются
фотоассимилятами путем
разгрузки флоэмы
Доставляемые фотоассимиляты в тканях-
акцепторах используются для поддержания ме-
таболизма, но возможно и запасание этих ве-
ществ (преимущественно в форме крахмала).
При разгрузке (как и при загрузке) могут быть
задействованы два пути (рис. 13.2). Симпласти-
ческая разгрузка предполагает, что сахароза и
аминокислоты покидают ситовидный элемент и
проникают в органы-акцепторы по плазмодес-
мам. При апопластической разгрузке веще-
ства сначала транспортируются из ситовидного
элемента во внеклеточный компартмент (апо-
пласт), и лишь затем поглощаются клетками
органа-акцептора с использованием механизмов
трансмембранного транспорта. Электронно-
1 Обсуждают также перемещение по флоэме высокомоле-
кулярных регуляторных веществ: факторов транскрипции
(белки) и разнообразных РНК. — Прим. ред.
278
13. Флоэма транспортирует и распределяет фотоассимиляты в места их потребления...
микроскопические исследования числа плаз-
модесм на единицу площади межклеточного
контакта показали, что в растущих вегетатив-
ных тканях (корнях, побегах) разгрузка флоэмы
происходит в основном симпластически, тогда
как в запасающих тканях часто (но не всегда) ис-
пользуются апопластическая разгрузка.
Крахмал откладывается в пластидах
В запасающих тканях поступающие углеводы
в основном преобразуются в крахмал, который
служит запасной формой. При апопластической
разгрузке флоэмы могут работать два альтерна-
тивных механизма поглощения углеводов. На
рисунке 13.5 красным выделен путь, в котором
сахароза непосредственно поступает из апопла-
ста в запасающую клетку и с помощью сахаро-
зосинтазы и УДФ-глюкозопирофосфорилазы
превращается во фруктозу и глюкозо-1-фосфат.
В этой реакции расходуется пирофосфат и обра-
зуется УТФ. До сих пор неизвестно, каким обра-
зом в клетке синтезируется большое количество
необходимого пирофосфата. Альтернативный
путь происходит с участием апопластной формы
инвертазы, которая сначала гидролизует саха-
розу до глюкозы и фруктозы, и лишь затем эти
гексозы транспортируются в клетку. Этот путь
на рис. 13.5 обозначен черным. Фруктокиназа
и гексокиназа (фосфорилирующая с одинако-
вой эффективностью и глюкозу, и маннозу) ка-
тализируют образование соответствующих гек-
созофосфатов. Глюкозо-6-фосфат с помощью
глюкозо-6-фосфат/фосфатного переносчика
(раздел 8.2) переносится в амилопласт в обмен
на фосфат. Далее в амилопласте происходит
синтез крахмала с промежуточным образовани-
ем АДФ-глюкозы (раздел 9.1). У некоторых рас-
тений амилопласты способны транспортировать
глюкозо-1 -фосфат в обмен на фосфат. В клубнях
картофеля образование крахмала происходит,
очевидно, с участием сахарозосинтазы. В кор-
неплодах сахарной свеклы углеводы запасаются
в вакуолях в форме сахарозы. В некоторых пло-
дах (например, у винограда) углеводы накапли-
ваются в вакуолях в форме глюкозы.
Гликолиз является центральным
метаболическим путем расхода углеводов
Углеводы, поступающие по флоэме в клет-
ки тканей-акцепторов, являются источником
энергии для метаболизма, а также источником
углерода для синтеза разнообразных веществ
клетки. Гликолиз, в том или ином виде обнару-
женный почти у всех живых организмов, игра-
ет важнейшую роль в переработке углеводов.
Ферменты этого метаболического пути есть не
только в тканях-акцепторах, но и во всех клет-
ках растений. В каждой клетке есть два набора
ферментов гликолиза: цитозольные и пла-
стидные изоформы. Некоторые из пластид-
ных ферментов гликолиза вовлечены в реакции
цикла Кальвина, что уже обсуждалось в главе 6.
У некоторых растений в пластидах гликолиз
происходит не полностью, поскольку один или
два фермента отсутствуют. Соответствующие
друг другу цитозольные и пластидные изофор-
мы ферментов гликолиза кодируются разными
генами.
На рисунке 13.6 показан ход реакций гли-
колиза в цитозоле. Глюкозо-6-фосфат, обра-
зующийся либо путем распада сахарозы (см.
рис. 13.5), либо при распаде крахмала (см.
рис. 9.12), в ходе обратимой реакции превраща-
ется во фруктозо-6-фосфат при участии гексо-
зофосфатизомеразы. Механизм реакции ана-
логичен изомеризации рибозо-5-фосфата (см.
рис. 6.18). Далее фруктозо-6-фосфат фосфо-
рилируется при помощи АТФ с участием АТФ-
фосфофруктокиназы. Существует и альтернати-
ва: фосфорилирование за счет неорганического
пирофосфата пирофосфатфосфофруктокина-
зой. Этот фермент не обнаружен в пластидах, и
его физиологическая роль пока еще недостаточ-
но ясна. Поскольку энергия, выделяющаяся при
гидролизе дифосфатной (ангидридной) связи
намного превышает энергию образующейся
фосфоэфирной связи, в целом процесс обра-
зования фруктозо- 1,6-бифосфата необратим.
По этой причине преобразование фруктозо-
1,6-бисфосфатаза во фруктозо-6-фосфат про-
исходит по иному механизму, чем прямая
реакция: удаление фосфатной группы катализи-
рует фруктозо-1,6-бисфосфата (рис. 6.15; 9.13).
Фруктозо- 1,6-бисфосфат расщепляется аль-
долазой на 3-фосфоглицериновый альдегид и
дигидроксиацетонфосфат, причем эта реакция
обратима (см. рис. 6.14). Дигидроксиацетонфос-
фат превращается в 3-фосфоглицериновый аль-
дегид при помощи триозоизомеразы. Механизм
реакции аналогичен изомеризации рибозо-5-
фосфата (см. рис. 6.18).
13.3. Ткани-акцепторы снабжаются фотоассимилятами путем разгрузки флоэмы
279
Инвертаза
АПОПЛАСТ
Сахароза
Сахароза
Глюкоза
Фруктоза
СИТОВИДНАЯ ТРУБКА
Рис. 13.5. Апопластическая разгрузка флоэмы и синтез крахмала. В некоторых
случаях запасающие клетки поглощают сахарозу, тогда как в других — глюкозу
и фруктозу, образующиеся инвертазой при гидролизе сахарозы в апопласте. Пока
еще не выяснено, транспортируются ли глюкоза и фруктоза через один общий
или через два разных переносчика (более подробно см. в разделе 9.1). У некоторых
растений амилопласты способны обменивать глюкозо-1-фосфат на фосфат
280
13. Флоэма транспортирует и распределяет фотоассимиляты в места их потребления...
САХАРОЗА
I
I
Рибозо-
5-фосфат
Окислительный
пентозофосфатный путь
Глюкозо-6-фосфат
Нуклеиновые
кислоты
Фруктозо-6-фосфат
Фруктозо-1,6-бисфосфат
Липиды
НАД® НАДН
/ Дигидрокси-
Глицерин- УУ ацетон-
3-фосфат фосфат
З-Фосфо-
глицериновый
альдегид
НАД®+ Ф
НАДН
2x1,3-дифосфоглицериновая кислота
2х
АДФ
АТФ
3-фосфоглицериновая кислота
2 х 2-фосфоглицериновая кислота
Этанол
Молочная кислота
Электрон-транспортная цепь
дыхания, синтез АТФ
Рис. 13.6. Схема гликолиза, происходящего в цитозоле растительных клеток и его
связь с другими метаболическими процессами
13.3. Ткани-акцепторы снабжаются фотоассимилятами путем разгрузки флоэмы
281
В только что рассмотренной последователь-
ности реакций гликолиза происходит подготов-
ка гексозофосфатов к окислению с образова-
нием восстановительных эквивалентов и АТФ.
3-фосфоглицериновый альдегид окисляется в
ходе обратимой реакции при помощи глице-
ральдегидфосфатдегидрогеназы с образовани-
ем 1,3-дифосфоглицериновой кислоты и вос-
становлением НАД+. Эту реакцию (идущую в
противоположном направлении) мы уже об-
суждали: она является частью цикла Кальвина
(см. рис. 6.9 и 6.10). При окислении выделяется
энергия, которая запасается в форме макроэр-
гической связи с фосфатом. В дальнейшем эта
энергия используется для синтеза АТФ при по-
мощи фосфоглицераткиназы, которая катали-
зирует обратимое превращение 1,3-дифосфо-
глицериновой кислоты в 3-фосфоглицерат (см.
рис. 6.9). Чтобы подготовить оставшуюся фос-
фатную группу к синтезу АТФ, 3-фосфоглице-
риновая кислота превращается в 2-фосфоглице-
риновую кислоту фосфоглицератмутазой (здесь
есть аналогия с механизмом фосфоглюкому-
тазной реакции, см. рис. 9.6). Катализируемая
енолазой обратимая реакция отсоединения Н2О
приводит к образованию фосфоенолпирувата.
Таким образом, фосфатный эфир превращает-
ся в фосфоенольный эфир, у которого свобод-
ная энергия гидролиза с отделением фосфорной
группы заметно больше, чем энергия гидроли-
за АТФ. По этой причине следующая реакция
превращения фосфоенолпирувата в пируват с
образованием АТФ является необратимой. Это
превращение катализирует пируваткиназа. Воз-
можен и альтернативный путь: в цитозоле фос-
фоенолпируват с помощью ФЕП-карбоксилазы
(см. рис. 8.5) превращается в оксалоацетат, кото-
рый далее может восстанавливаться до малата при
участии малатдегидрогеназы (см. рис. 5.9). Малат
под действием малик-энзима превращается в пи-
руват, как показано на рис. 8.10. Как пируват, так
и малат являются субстратами для цикла трикар-
боновых кислот (цикла Кребса) в митохондриях.
Окисление этих субстратов в цикле Кребса и со-
пряженная работа электрон-транспортной цепи
дыхания приводят к синтезу АТФ.
В обычных аэробных условиях гликолиз дает
лишь малую долю энергии в общее энергообеспе-
чение клетки. Преобразование глюкозо-6-фос-
фата в пируват позволяет получить всего лишь
три молекулы АТФ. Окисление пирувата в
митохондриях и дальнейшее окисление обра-
зовавшегося НАДН, напротив, идет с большим
выигрышем в энергии: образуется 25 молекул
АТФ (на каждую исходную молекулу глюкозо-
6-фосфата) — см. раздел 5.6. Но при недостатке
кислорода, который наблюдается при затопле-
нии корней или при набухании семян в воде,
образование АТФ в ходе гликолиза оказывается
жизненно необходимым для поддержания ми-
нимума метаболических функций. В таких усло-
виях НАДН, образовавшийся при гликолизе,
должен вновь окисляться, что происходит при
восстановлении пирувата до молочной кислоты
при помощи лактатдегидрогеназы. В корнях и
прорастающих семенах этот фермент индуциру-
ется недостатком кислорода. Образовавшаяся
молочная кислота выделяется из клетки. Дру-
гая возможность окисления НАДН реализуется
при брожении у дрожжей. Сначала пируват де-
карбоксилируется пируватдекарбоксилазой до
ацетальдегида. Фермент содержит тиаминпи-
рофосфат в качестве кофактора (см. рис. 5.4).
В дальнейшем алкогольдегидрогеназа восста-
навливает ацетальдегид до этанола, который
выводится из клетки. У растений активность ал-
когольдегидрогеназы значительно возрастает в
ответ на недостаток кислорода. У большинства
растений преобладающим является спиртовое
брожение. Молочнокислое брожение практиче-
ски отсутствует, при этом образуется лишь не-
большое количество молочной кислоты.
Кроме образования АТФ гликолитический путь
поставляет предшественники для синтеза раз-
нообразных веществ клетки. Вот лишь несколько
примеров. В окислительном пентозофосфатном
пути (см. рис. 6.21) образуется рибозо-5-фосфат,
который используется как предшественник для
биосинтеза нуклеотидов и нуклеиновых кислот.
Восстановление дигидроксиацетонфосфата до гли-
церин-3-фосфата при помощи глицеринфосфат-
дегидрогеназы дает важный предшественник в
биосинтезе липидов. Фосфоенолпируват служит
предшественником для целого ряда аминокислот
(например, фенилаланин) и далее — для синтеза
фенилпропаноидов, лигнинов (см. рис. 18.9), тан-
нинов (см. рис. 18.16) и других веществ. Пируват
через промежуточное образование ацетил-КоА
является субстратом для синтеза жирных кислот
(рис. 15.7) и, соответственно, для синтеза липидов.
282
13. Флоэма транспортирует и распределяет фотоассимиляты в места их потребления...
Гликолиз находится под контролем очень
сложных регуляторных процессов, причем ре-
гуляция гликолиза в цитозоле и в пластидах
различается. Однако в обоих компартментах
АТФ-фосфофруктокиназа, фосфорилирующая
фруктозо-6-фосфат, ингибируется фосфоенол-
пируватом, т.е. в контроле гликолиза имеется
отрицательная обратная связь. Регуляторное со-
единение фруктозо-2,6-бисфосфат активирует
фосфорилирование при помощи пирофосфат-
зависимой фосфофруктокиназы, и одновре-
менно ингибирует обратную реакцию — гидролиз
фруктозо-1,6-бисфосфата фруктозобисфосфа-
тазой (см. рис. 9.15).
Дополнительная литература
Eschrich, W. Funktionelle Pflanzenanatomie. Springer-
Verlag, Berlin-Heidelberg (1995).
Fischer, W. N., Andre, B., Reutsch, D., Krolkiewicz, S.,
Tegeder, M., Breitkreuz, K., Frommer, W. B. Amino
acid transport in plants. Trends Plant Sci 3, 188—195
(1998).
Givan, С. V. Evolving concepts in plant glycolysis: Two
centuries of progress. Biol Rev (Cambridge) 74, 277—
309(1999).
Herschbach C., Rennenberg, H. Significance of phloem-
translocated organic sulfur compounds for the regulation
of sulfur nutrition. Prog Bot 62, 177—193 (2001).
Knop, C., Voitsekhovskaja, O., Lohaus, G. Sucrose
transporters in two members of the Scrophulariaceae
with different types of transport sugar. Planta 213, 80—91
(2001).
Kuhn, C., Barber L., Burkle, L., Frommer, W.-B. Update
on sucrose transport in higher plants. J Exp Bot 50,
935-953(1999).
Kuehn, C. A comparison of the sucrose transporter systems
of different plant species. Plant Biol 5 215—232 (2003).
Lohaus, G., Winter, H., Riens, B., Heldt, H. W. Further
studies of the phloem loading process in leaves of
barley and spinach. The comparison of metabolite
concentrations in the apoplastic compartment with
those in the cytosolic compartment and in the sieve
tubes. Botanica Acta 108, 270—275 (1995).
Lohaus, G., Fischer, K. Intracellular and intercellular
transport of nitrogen and carbon. In: С. H. Foyer
and G. Noctor (eds.) Advances in Photosynthesis:
Photosynthetic assimilation and associated carbon
metabolism, pp. 239—263, Kluwer Academic Publishers,
Dordrecht, The Netherlands, (2002).
Oparka, K. J., Santa Cruz, S. The great escape: Phloem
transport and unloading of macromolecules. Annu Rev
Plant Physiol Plant Mol Biol 51, 323-347 (2000).
Plaxton, W. C. The organization and regulation of plant
glycolysis. Annu Rev Plant Physiol Plant Mol Biol 47,
185-214(1996).
Ruiz-Medrano, R., Xoconostle-Cazares, B., Lucas, W. J.
The phloem as a conduit for inter-organ communica-
tion. Curr Opin Plant Biol 4, 202—209 (2001).
Sjolund, R. D. The phloem sieve element: A river runs
through it. Plant Cell 9, 1137-1146 (1997).
Stadler, R., Brandner, J., Schulz, A., Gahrtz, M., Sauer,
N. Phloem loading by the PmSUC2 sucrose carrier from
Plantago major occurs in companion cells. Plant Cell 7,
1545-1554(1995).
Stitt, M. Manipulation of carbohydrate partitioning. Curr
Biol 5, 137-143(1994).
Thompson, G. A., Schulz, A. Macromolecular trafficking
in the phloem. Trends Plant Sci 4, 354—360 (1999).
Turgeon, R. Phloem loading and plasmodesmata. Trends
Plant Sci 1,418-423(1996).
van Bel, A. J. E., Ehlers, K., Knoblauch, M. Sieve elements
caught in the act. Trends Plant Sci 7, 126—132 (2002).
Williams, L. E., Lemoine, R., Sauer N. Sugar transporters
in higher plants — a diversity of roles and complex
regulation. Trends Plant Sci 5, 283—290 (2000).
Zimmermann, M. H., Milburn, J. A. (eds.). Phloem
Transport. Encyclopaedia of Plant Physiology, Vol. 1,
Springer-Verlag, Berlin—Heidelberg, (1975).
Продукты ассимляции нитратов могут
откладываться в растении
в виде запасных белков
Вто время как продукты ассимиляция СО2
запасаются в растениях в форме олиго- и
полисахаридов (как описано в главе 13), амино-
кислоты, образованные как продукты ассими-
ляции азота, включаются в состав белков. Часто
это специальные запасные белки, которые не
обладают ферментативной активностью и от-
кладываются в клетках в белковых телах. Бел-
ковые тела окружены одинарной мембраной и
образуются из эндомембранной системы эндо-
плазматического ретикулума и аппарата Голь-
джи или вакуолей. В клубнях картофеля запас-
ные белки содержатся также в вакуолях.
Запасные белки могут откладываться в раз-
личных органах растений, таких как листья, стеб-
ли и корни. Они запасаются в семенах и клубнях,
а также в камбии стволов деревьев в зимний пе-
риод, обеспечивая быстрое образование листьев
при прорастании семян или при развитии по-
бегов из почек. Запасные белки локализованы
в эндосперме семян злаков и в семядолях семян
большинства бобовых. В то время как у злаков
содержание белков составляет от 10 до 15% сухого
веса, у некоторых бобовых (например, сои) оно
достигает величин от 40 до 50%. Около 85% этих
белков являются запасными.
В глобальном масштабе около 70% потреб-
ности человечества в белках покрываются за
счет семян, или при непосредственном упо-
треблении в пищу, или опосредованно путем
скармливания их животным для производства
мяса. Следовательно, запасные белки расте-
ний служат основой питания людей. Однако во
многих растительных запасных белках слишком
низко содержание определенных аминокислот,
незаменимых для питания людей и животных.
В запасных белках хлебных злаков, например,
наблюдается дефицит треонина, триптофана
и особенно лизина, в то время как в бобовых
недостает метионина. Так как эти аминокис-
лоты не могут синтезироваться в человеческом
организме, то люди зависят от поступления
этих вешеств с пишей. У людей, соблюдающих
полностью вегетарианскую диету, дефицит этих
аминокислот может привести к непоправимым
физическим и умственным нарушениям, осо-
бенно у детей. Это может быть также серьезной
проблемой при составлении кормов для свиней
и домашней птицы. Одной из целей генной ин-
женерии растений является улучшение амино-
кислотного состава запасных белков зерновых
продуктов.
Таблица 14,1. Некоторые примеры растительных запасных белков
Растение Глобулины Проламины (включая глутелины) 2 S-белок
Рапс Горох, бобы Легумин, вицилин Пшеница, рожь Кукуруза Картофель Пататин Напин* Глиадин, глютенин Зеин
Белок структурно близкий к проламинам, которые за определенное поведение в растворах,
причисляют к глобулинам.
284
14. Продукты ассимиляции нитратов могут откладываться в растении в виде запасных белков
Растительные белки давно вызывали интерес
ученых. К 1745 г. итальянец Дж. Беккари уже вы-
делил белки из пшеницы. В 1924 г. Т. Б. Осборн
классифицировал растительные белки соответ-
ственно их растворимости. Он разделил расти-
тельные белки на альбумины (растворимые в
чистой воде), глобулины (растворимые в раз-
бавленных солевых растворах), глютелины
(растворимые в разбавленных растворах ще-
лочей и кислот) и проламины (растворимые в
водных растворах этанола). Позже, когда были
установлены структуры этих белков, оказалось,
что глютелины и проламины структурно тесно
связаны. Поэтому в современной литературе
глютелины рассматриваются как представители
группы проламинов. В таблице 14.1 приведены
некоторые примеры различных растительных
запасных белков.
14.1. Глобулины являются наиболее
распространенными
запасными белками
Запасные глобулины встречаются практически
во всех растениях в разных количествах. Наи-
более важные глобулины относятся к группам
легумина и вицилина. Обе группы глобулинов
кодируются мультигенным семейством. Эти
мультигенные семейства в процессе эволюции
вероятно возникли из одной предковой формы
гена. Легумин служит основным запасным бел-
ком семян бобовых. Например, в кормовых бо-
бах 75% общего количества запасных белков со-
ставляет легумин. Легумин является гексамером
с молекулярной массой от 300 до 400 кДа. Моно-
меры содержат две различные пептидные цепи
(а, р), соединенные дисульфидными мостиками.
Большая a-цепь обычно имеет молекулярную
массу приблизительно от 35 до 40 кДа, а моле-
кулярная масса малой p-цепи составляет око-
ло 20 кДа. Гексамеры могут быть составлены из
различных (а, Р) мономеров. Некоторые из них
содержат метионин, в то время как другие почти
не содержат его. Белковые молекулы в гексаме-
ре высокоупорядочены в регулярную упаковку и
только в этой форме могут откладываться в бел-
ковых телах. Гексамеры белков, в которых неко-
торые из белковых цепей расположены непра-
вильно, непригодны для регулярной упаковки
и разрушаются пептидазами. Хотя в настоящее
время сравнительно легко заменить аминокисло-
ты в белке методами генной инженерии, в случае
запасных белков возникли сложности при прак-
тическом применении, потому что при таких за-
менах могут исказиться и взаимное расположе-
ние белков, и трехмерная структура комплекса.
Современный прогресс в получении кристаллов
позволил проанализировать трехмерную струк-
туру белков как для предшественников, так и
для зрелых запасных белков. Эти исследования
показали, что устойчивость запасных белков по
отношению к протеазам в запасающих вакуолях
обусловлена тем, что возможные сайты протео-
литической атаки ферментами спрятаны в глу-
бине структуры белка, и, таким образом, запас-
ные белки защищены от протеолиза.
У вицилина обнаруживается сходство с легу-
мином по аминокислотной последовательности,
но вицилин присутствует в большинстве случаев
как тример, мономеры которого состоят лишь
из одной пептидной цепи. Из-за отсутствия
цистеина мономеры вицилина неспособны об-
разовывать S-S мостики. В отличие от легуми-
нов, вицилины часто гликозилированы, они со-
держат углеводные остатки, такие как манноза,
глюкоза, а также N-аиетилглюкозамин.
14.2. Проламины образуются
как запасные белки злаков
Проламины содержатся у представителей се-
мейства Gramineae, таких, как зерновые зла-
ки. Они присутствуют в виде полиморфных
смесей многих различных субъединиц от 30 до
90 кДа каждая. Некоторые из этих субъединиц
содержат остатки цистеина и связаны S-S мо-
стиками. Так, в глютенине зерновок пшеницы
и ржи мономеры связаны S-S мостиками. Мо-
лекулы глютенина различаются по размерам.
Пригодность муки для хлебопечения зависит
от содержания высокомолекулярных глюте-
нинов. Именно по этой причине мука из овса,
ячменя и кукурузы, не содержащая глютени-
нов, не подходит для изготовления хлеба. По-
скольку содержание глютенина служит решаю-
щим фактором в определении хлебопекарных
качеств зерна, ведутся интенсивные исследо-
вания по увеличению содержания глютенина
в зерне хлебных злаков методами генной ин-
женерии.
14.5. Синтез запасных белков осуществляется в шероховатом эндоплазматическом ретикулуме
285
14.3. 28-Белки присутствуют
в семенах двудольных
растений
25-белки — также широко распространенные
запасные белки. Они представлены гетероген-
ной группой белков, единственной отличи-
тельной чертой которых является коэффициент
седиментации около 2 единиц Сведберга (S).
Исследования структуры показали, что боль-
шинство 25-белков имеет похожую структуру
и, вероятно, в процессе эволюции произошли,
наряду с проламинами, от общего предково-
го белка. Примером 25-белка является напин,
преобладающий запасной белок рапса. Этот
белок имеет существенное экономическое зна-
чение, так как после извлечения масла из семян
рапса жмых (остатки семян) используют как
корм для скота. Напин и другие родственные
ему 25-белки состоят из двух сравнительно не-
больших полипептидных цепей 9 кДа и 12 кДа,
связанных S-S мостиками. До сих пор мало из-
вестно об упаковке проламинов и 25-белков в
белковых телах.
14.4. Особые белки защищают
семена от поедания животными
Белковые тела некоторых семян содержат дру-
гие белки, которые наряду с функциями за-
пасных белков также защищают семена от по-
едания. Запасной белок вицилин выполняет
защитную функцию, поскольку может связы-
ваться с хитином грибов1 и насекомых. У неко-
торых насекомых это нарушает развитие личи-
нок. В семенах некоторых бобовых содержатся
лектины, которые связываются с углеводными
остатками, независимо от того, свободные ли
это сахара (полисахариды) или составляющие
гликолипидов или гликопротеинов. Когда эти
семена попадают в пищеварительный тракт жи-
вотных, лектины связываются с поверхностны-
ми гликопротеидами клеток эпителия кишеч-
ника и таким образом препятствуют усвоению
пищи. В семенах некоторых бобовых и других
растений содержатся также ингибиторы про-
теиназ, которые блокируют усвоение белков,
ингибируя протеиназы в пищеварительном
тракте животного. Поскольку многие бобовые
и другие растительные продукты содержат лек-
тины и ингибиторы протеиназ, они пригодны
для питания людей только после денатурации
защитных белков в процессе варки. Это одна из
причин, по которой древние люди научились
варить пищу. Семена клещевины, из которых
добывают касторовое масло, содержат чрезвы-
чайно токсичный белок рицин, несколько мил-
лиграммов которого способны убить человека2.
В семенах бобовых имеются также ингибиторы
амилаз, которые специфически ингибируют
гидролиз крахмала амилазами в пищеваритель-
ном тракте некоторых насекомых. Использо-
вание методов генной инженерии позволило
успешно воспроизвести экспрессию ингибито-
ров а-амилазы из фасоли в семенах гороха. При
хранении гороха личинки горохового слоника
обычно причиняют большие потери, но полу-
ченные путем генной инженерии растения го-
роха от таких потерь защищены.
14.5. Синтез запасных белков
осуществляется в шероховатом
эндоплазматическом
ретикулуме
Запасные белки семян образуются рибосомами
шероховатого эндоплазматического ретикулума
(ЭР) (рис. 14.1). Вновь синтезированные белки
сначала оказываются в просветах ЭР, и в ко-
нечном счете запасные белки откладываются
в белковых телах. В случае 25-белков и про-
ламинов белковые тела формируются посред-
ством отпочковывания от мембран ЭР. Глобу-
лины в основном перемещаются из ЭР путем
везикулярного переноса через аппарат Гольджи
(раздел 1.6), сначала в вакуоль, из которой в
результате образуются белковые тела. Имеется
также путь, при котором определенные белки
(например, глобулины в эндосперме пшеницы)
транспортируются непосредственно везикуляр-
ным переносом из мембран ЭР в вакуоль, ми-
нуя аппарат Гольджи.
Рисунок 14.2 детально показывает образова-
ние легумина. Белок, образованный рибосомой,
1 Хитин при этом становится более прочным. Гифы гриба
в присутствии вицилина не могут расти, поскольку клеточ-
ная стенка теряет способность к растяжению. — Прим. ред.
2 Рицин не попадает в касторовое масло, а остается в жмы-
хе. — Прим. ред.
286
14. Продукты ассимиляции нитратов могут откладываться в растении в виде запасных белков
Рис. 14.1. Существуют три пути
отложения запасных белков в белковых
телах.
а. При образовании проламинов
в зерновках хлебных злаков проламины
накапливаются в просвете ЭР,
и белковые тела образуются путем
отпочковывания от мембран ЭР.
б. Белки, появляющиеся в просвете
ЭР, переносятся посредством аппарата
Гольджи в вакуоль. Белковые тела
формируются путем фрагментации
вакуоли. Возможно, это самый
обычный путь.
в. Белки, появляющиеся в просвете ЭР,
переносятся прямо в вакуоль в обход
аппарата Гольджи
Глобулины
содержит на N-конце полипептидной цепи ги-
дрофобный участок, называемый сигнальной
последовательностью. После синтеза этой сиг-
нальной последовательности трансляция оста-
навливается, и сигнальная последовательность
образует комплекс с тремя другими компонен-
тами:
1. Частица, распознающая сигнал (signal rec-
ognition particle).
2. Связывающий белок, локализованный на
мембране ЭР.
3. Поровый белок, присутствующий в мембра-
не ЭР.
Образование этого комплекса приводит к
открыванию поры в мембране ЭР; трансляция
продолжается, и вновь образованная белко-
вая цепь (например, пре-пролегумин) дости-
гает просвета ЭР и заякоривает рибосому на
мембране ЭР для продолжения синтеза белка.
Сразу после того, как белковая цепь поступает
в просвет, сигнальная последовательность уда-
ляется сигнальной пептидазой, локализованной
на мембране ЭР. Остающийся полипептид, на-
зываемый пролегумин, содержит будущие а- и
P-цепи легумина. Связь S-S в молекуле про-
легумина образуется уже внутри просвета ЭР.
Три молекулы пролегумина образуют тример,
формирование которого происходит с участием
шаперонов (раздел 21.2). В процессе ассоциации
тримеров осуществляется «контроль качества»:
тримеры с неправильной конформацией разру-
шаются протеазами. Далее тримеры транспор-
тируются через аппарат Гольджи в вакуоли, где
а- и p-цепи отделяются друг от друга специфи-
14.5. Синтез запасных белков осуществляется в шероховатом эндоплазматическом ретикулуме
287
Рибосома
РНК
Связывающий
белок
Частица,
распознающая
сигнал
Синтезированный
белок
Сигнальная
последовательность
Поровый
белок
ЦИТОЗОЛЬ
пептидаза
Пролегумин
f Сигнальная
АППАРАТ ГОЛЬДЖИ
ВАКУОЛЬ,
ЗАПАСАЮЩАЯ БЕЛОК
Легумин
Гексамер
Рис. 14.2. Синтез легумина. Процессинг предшественника легумина
(пре-пролегумина), синтезированного на рибосоме, осуществляется сначала
в просвете ЭР, а затем в вакуоли, давая конечный продукт
ческой пептидазой. Субъединицы легуминов
собираются в гексамеры и откладываются в этой
форме. Белковые тела, конечные компартменты
для запасания легуминов, образуются в резуль-
тате фрагментации вакуоли. Углеводные цепи
гликозилированных вицилинов (например, фа-
зеолинов из фасоли, Phaseolus vulgaris) синте-
зируются в аппарате Гольджи.
Предшественники вновь синтезированных
28-белков и проламинов, находящиеся в про-
светах ЭР, также содержат сигнальные последо-
вательности. Завершение и сборка этих белков
288
14. Продукты ассимиляции нитратов могут откладываться в растении в виде запасных белков
происходят в просветах ЭР, из которого в даль-
нейшем путем почкования образуются белко-
вые тела.
14.6. Протеиназы позволяют
использовать аминокислоты,
отложенные в составе
запасных белков
Наши знания о мобилизации аминокислот из
запасных белков получены в основном благо-
даря исследованиям процессов прорастания
семян. В большинстве случаев прорастание ин-
дуцируется поглощением воды, приводящим к
образованию крупных вакуолей. Гидролиз за-
пасных белков катализируется протеиназами,
которые частично запасаются в неактивной
форме совместно с запасными белками в бел-
ковых телах. Другие протеиназы синтезируют-
ся de novo и переносятся через просветы ЭР и
аппарат Гольджи в вакуоли (см. рис. 14.2). Эти
ферменты синтезируются исходно в виде не-
активных предшественников. Активация этих
пре-протеиназ происходит при помощи огра-
ниченного протеолиза, при котором часть
последовательности аминокислот удаляется
специфической пептидазой. Оставшаяся часть
полипептида представляет собой активную про-
теиназу.
Деградация запасных белков также иниции-
руется ограниченным протеолизом. Специфи-
ческая протеиназа сначала удаляет небольшие
части белковой последовательности, в резуль-
тате чего изменяется конформация запасного
белка. В зернах злаков S-S мостики запасных
белков расщепляются восстановленным тиоре-
доксином (раздел 6.6). В этой форме запасной
белок становится восприимчивым к гидролизу
различными протеиназами: например, экзо-
пептидазами, которые отщепляют одну за дру-
гой аминокислоты с конца белковой молекулы,
и эндопептидазами, которые расщепляют моле-
кулу изнутри. Таким образом, запасные белки
полностью разлагаются в вакуоли, и освободив-
шиеся аминокислоты используются как строи-
тельный материал для прорастающего расте-
ния.
Дополнительная литература
Adachi, М., Takenaka, Y., Gidamis, А. В., Mikami, В.,
Utsumi, S. Crystal structure of soybean proglycinin
AlaBlb homotrimer. J Mol Biol 305, 291-305 (2001).
Bethke, P. C., Jones, R. L. Vacuoles and prevacuolar
compartments. Curr Opin Plant Biol 3, 469—475
(2000).
Hadlington, J. L., Denecke, J. Sorting of soluble proteins
in the secretory pathway of plants. Curr Opin Plant Biol
3,461-468 (2000).
Hillmer, S., Movafeghi, A., Robinson, D. G., Hinz, G.
Vacuolar storage proteins are sorted in the c£s-Cisternae
of the pea cotyledon Golgi apparatus. J Cell Biol 152,
41-50 (2001).
Matsuoka, K., Neuhaus, J.-M. CZs-elements of protein
transport to the plant vacuoles. J Exp Bot 50, 165—174
(1999).
Morton, R. L., Schroeder, H. E., Bateman, K. S.,
Chrispeels, M. J., Armstrong, E. Bean a-amylase
inhibitor 1 in transgenic peas (Pisum sativum) provides
complete protection from pea weevil (Bruch uspisorum)
under field conditions. PNAS 97, 3820-3825 (2000).
Muntz, K. Deposition of storage proteins. Plant Mol Biol
38,77-99 (1998).
Muentz, K., Shutov, A. D. Legumains and their functions
in plants. Trends Plant Sci 7, 340—344 (2002).
Penmans,W. J., van Damme, E. J.M. Lectins as plant de-
fense proteins. Plant Physiol. 109, 247—352 (1995).
Robinson, D. G., Hinz, G. Golgi-mediated transport of
seed storage proteins. Seed Sci Res 9, 267—283 (1999).
Shewry, P. R., Napier, J. A., Tatham, A. S. Seed storage
proteins: Structures and biosynthesis. Plant Cell 7, 945—
956(1995).
Somerville, C. R., Bonetta, D. Plants as factories for
technical materials. Plant Physiol 125, 168—171 (2001).
Vitale, A., Galili. G. The endomembrane system and the
problem of protein sorting. Plant Physiol 125, 115—118
(2001).
15
Глицеролипиды являются компонентами
мембраны и служат запасом углерода
Глицеролипиды являются сложными эфира-
ми жирных кислот и глицерина (рис. 15.1).
Триацилглицерины (которые также называют
триглициридами) состоят из молекулы глицери-
на. этерифицированной тремя жирными кисло-
тами. Если у животных триацилглицерины слу-
жат в основном запасом энергии, то у растений
их функция — запасание органического углеро-
да в некоторых семенах, из которых получают
растительное масло. В полярных глицероли-
пидах глицирин связан лишь с двумя молеку-
лами жирных кислот, а к третьей —ОН группе
присоединена какая-либо гидрофильная груп-
па. Мембрана состоит в основном из полярных
липидов.
15.1. Полярные глицеролипиды —
важные компоненты мембраны
Полярные глицеролипиды являются амфи-
фильными молекулами, состоящими из ги-
дрофильной головки и гидрофобных хвостов.
Это свойство позволяет им формировать ли-
пидные бислои, в которых углеводные хвосты
контактируют друг с другом благодаря гидро-
фобным взаимодействиям, а гидрофильные
головки обращены к водной фазе. Таким
образом, формируется основная структура
мембраны (рис. 15.2). Поскольку в полярных
глицерол и пидах центральный атом углерода
в глицерине оказывается асимметрично заме-
T риацилглицерин
(запасной липид)
Диацилглицерин
(компонент мембраны)
Рис, 15-1 - Триацилглицерины содержат три остатка жирных кислот и
являются соединениями неполярной природы. Полярные липиды, напротив,
амфифильны, поскольку кроме гидрофобных хвостов двух жирных кислот содержат
гидрофильную полярную группу (головку)
290
15. Глицерол и пиды являются компонентами мембраны и служат запасом углерода
Рис. 15.2. Мембранные липиды с полностью
насыщенными жирными кислотами образуют
липидный бислой с очень упорядоченной
структурой. Изгибы углеводородной цепи,
вызванные двойными цис-связями в ненасыщенных
жирных кислотах, приводят к нарушению
регулярной укладки липидов. Это увеличивает
текучесть мембраны
Стигмастерин
Ситостерин
Кампестерин
Холестерин
Полярная группа (головка)
Рис. 15.3. В состав мембраны входят холестерин
и родственные ему стерины (у них показан лишь
боковой заместитель). Холестерин входит в состав
мембран животных клеток, а у растений практически
не встречается
щенным, принято различать неравнозначные
С-1 и С-3 положения.
Кроме полярных глицеролипидов в состав
мембраны у растений входят и другие гидрофоб-
ные вещества. Сфинголипиды (рис. 15.5в) —
важные компоненты плазматической мембра-
ны. Стерины, показанные на рис. 15.3, также
амфифильны: гидроксильные группы образуют
гидрофильную головку, а циклопентанперги-
дрофенантрен с боковыми заместителями играет
роль гидрофобного хвоста. Кроме представлен-
ных на рис. 15.3 стеринов у растений в мембра-
нах обнаружены некоторые другие стерины. Они
содержатся, прежде всего, в наружной мембране
митохондрий, мембранах эндоплазматического
ретикулума и в составе плазмалеммы. Стерины
в большой мере определяют свойства этих мем-
бран (см. далее)1.
Полярные глицеролипиды в основном со-
держат жирные кислоты с 16 или 18 атомами
углерода (С16- и С18-кислоты) (рис. 15.4). Боль-
шинство1 2 из этих жирных кислот являются не-
насыщенными и содержат от одной до трех
двойных связей. Эти двойные связи почти всегда
находятся в цис-конфигурации, и крайне редко
присутствуют в лирпис-конфигурации. Двойные
связи жирных кислот в норме не сопряженные.
На рисунке 15.4 показаны основные принци-
пы номенклатуры и краткого цифрового обозна-
чения жирных кислот. На первом месте ставят
число атомов углерода, затем через двоеточие
указывают число двойных связей. За символом
А, показывающем наличие хотя бы одной двой-
ной связи, в надстрочном индексе пишут номе-
ра первого атома, от которого отходит двойная
связь. Конфигурация двойной связи обозначена
буквами с (цис) или t (транс).
1 Модифицированные стероиды (гликозилированные,
ацилгликозилированные) широко встречаются у растений,
но они не являются компонентами мембраны. Помимо гли-
церолипидов и стеринов в составе внутренней мембраны
митохондрий и тилакоидных мембранах важными функцио-
нальными компонентами служат изопреноиды и их произ-
водные, в частности убихиноны, пластохиноны, каротинои-
ды (раздел 2.4; 3.6 и 5.5). — Прим. ред.
2 Примерно половина жирных кислот является ненасы-
щенными. — Прим. ред.
15.1. Полярные глицеролипиды — важные компоненты мембраны
291
Рис. 15.4. Формулы и сокращенные
обозначения для некоторых жирных
кислот, входящих в состав мембранных
липидов (У растений арахидоновая
кислота практически не встречается. —
Прим, ред.)
Жирные кислоты
Пальмитиновая
кислота
(16:0)
СО—
Стеариновая
кислота
(18:0)
Олеиновая
кислота
(18:1, Д9с)
Линолевая
кислота
(18:2, дэ,12с)
а-Линоленовая
кислота
(18:3, Д9-12 15с)
у-Линоленовая
кислота
(18:3, Д6.Э.12С)
О
Арахидоновая
кислота
(20:4, Д5.8,11.14с)
Таблица 15.1. Влияние длины углеводородной цепи и числа двойных связей
на температуру плавления жирных кислот
Жирная кислота Длина цепи: число двойных связей Температура плавления
лавровая 12:0 40 °C
стеариновая 18:0 70 °C
олеиновая 18:1 13 °C
линолевая 18:2 -5 °C
линоленовая 18:3 -11 °C
В составе запасных липидов у растений ча-
сто встречаются необычные жирные кислоты,
например, с сопряженными двойными связя-
ми, с тройными связями, гидрокси-, кето-, или
эпокси-группами, связанными с углеродным ске-
летом. К настоящему времени известно более 500
необычных жирных кислот. Обнаружены также
липиды, в которых углеводородная цепь связана
с глицерином простыми эфирными связями.
Текучесть мембраны зависит от доли
ненасыщенных жирных кислот
и содержания стеринов
Углеводородные цепи насыщенных жирных
кислот могут формировать бислой с плот-
ной упаковкой и регулярной структурой (см.
рис. 15.2). У ненасыщенных жирных кислот
плотная упаковка нарушается изгибами угле-
родной цепи, возникающими при образовании
292
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
двойных связей в цис-конфигурации, что ве-
дет к увеличению текучести липидного бислоя.
Это особенно заметно при сравнении темпе-
ратуры плавления различных жирных кислот
(табл. 15.1). Температура плавления увеличива-
ется по мере удлинения углеводородной цепи,
поскольку увеличивается сила гидрофобных
взаимодействий и плотность упаковки. Темпе-
ратура плавления, наоборот, понижается при
увеличении числа двойных связей. Эта законо-
мерность характерна также и для липидов, в со-
став которых входят соответствующие жирные
кислоты. Масло кокосового ореха, например,
состоит в основном из насыщенных жирных
кислот и при комнатной температуре твердое.
Подсолнечное, оливковое и льняное масла со-
держат много ненасыщенных жирных кислот и
при комнатной температуре являются жидко-
стями.
Скорее всего, текучесть мембран в клетке
регулируется путем изменения пропорции меж-
ду насыщенными и ненасыщенными жирными
кислотами в составе липидов. Именно поэтому
у некоторых растений, если их выращивать при
низких температурах, степень ненасыщенности
жирных кислот в составе мембраны растет для
того, чтобы компенсировать снижение текуче-
сти, вызванной охлаждением. Недавно удалось
получить генетически модифицированные рас-
тения табака с повышенной устойчивостью к
низким температурам вследствие увеличения
доли ненасыщенных жирных кислот в составе
мембранных липидов. Стерины (см. рис. 15.3)
могут снижать текучесть мембран и, возможно,
также играют роль в адаптации мембран к высо-
ким температурам. Генно-инженерное сниже-
ние доли ненасыщенных жирных кислот в со-
ставе липидов тилакоидных мембран позволило
получить растения табака, более устойчивые к
высоким температурам.
Мембранные липиды содержат
разнообразные гидрофильные группы
В качестве гидрофильных головок в полярных
глицеролипидах у растений могут выступать
разнообразные заместители. Тем не менее все
они придают молекуле липида частичные ги-
дрофильные свойства (рис. 15.5).
У фосфолипидов роль полярной головки
выполняет фосфат, который этерифицирован
веществами со спиртовыми группами (напри-
мер, этаноламином, холином, серином, глице-
рином или инозитом). Фосфатидная кислота
(неэтерифицированный фосфолипид) содер-
жится в мембране в ничтожно малом количе-
стве, но играет важную роль как вторичный мес-
сенджер в сигнальных путях (раздел 19.1).
Вышеупомянутые фосфолипиды входят в со-
став мембран, как у растений, так и у живот-
ных и бактерий. Специфической особенностью
растений и цианобактерий является наличие
галактолипидов: моногалактозилдиацилглице-
рина (MGDG) и дигалактозилдиацилглицерина
(DGDG), а также сульфолипида сульфохиново-
зилдиацилглицерина (SL) в дополнение к обыч-
ным фосфолипидам мембран. Указанный суль-
фолипид содержит остаток глюкозы, к которому
присоединена группа сульфоновой кислоты в
С-6 положении. Эта часть молекулы липида слу-
жит полярной головкой (рис. 15.56).
Существуют большие различия в липидном
составе различных мембран растительной клет-
ки (табл. 15.2). Хлоропласты содержат галакто-
липиды, которые являются основными компо-
нентами тилакоидных мембран, но встречаются
также и во внешней мембране. Мембраны эн-
доплазматического ретикулума и митохондрий
не содержат галактолипидов, а состоят в основ-
ном из фосфолипидов. Кардиолипин является
специфическим компонентом внутренней ми-
тохондриальной мембраны как у животных, так
и у растений.
В фотосинтезирующих клетках растений от
70 до 80% от всех мембранных липидов входят
в состав тилакоидных мембран. Поскольку био-
масса растений в биосфере преобладает, галак-
толипиды (в частности, MGDG и DGDG) яв-
ляются самыми распространенными липидами
на Земле. Рост растений может быть ограничен
содержанием фосфатов в почве. Возможно, что
синтез основной массы липидов, в состав кото-
рых не входит фосфор, дал некоторые эволюци-
онные преимущества растениям.
Сфинголипиды можно обнаружить в составе
эндоплазматического ретикулума и плазмалем-
мы (рис. 15.5в). Сфинголипиды содержат ато-
мы азота, а поэтому обладают слабощелочными
свойствами. В частности, к углеводородной цепи,
содержащей двойные связи, присоединена ами-
ногруппа в С-2 положении, и, кроме того, две или
Рис. 15.5.
А. Гидрофильные группы мембранных
фосфолипидов: фосфат и его эфиры
Б. Гидрофильные группы других мембранных
липидов (гексозы)
В. Гидрофильные группы мембранных липидов:
сфинголипиды
А ое
Диацил- _ । _
глицерин ц
О
Б сн2он
НО
О— Диацил гл и церин
ОН
Моногалактозил-
диацилглицерин
(MGDG)
Сульфохиновозил-
ОН
В
Церамид
Фосфатидная
кислота
Фосфатидил -
этаноламин
Ое
- О-Р-О-СН2- СН2-NH3
II
О
о° сн3
— О —Р —О —СН2—СН2—N—СН3 о сн3 Фосфатидил хол и н (лецитин)
о° I
- о-р-о-сн,-сн—соо® II I ф О NH3~ Фосфатидилсерин
0° НН
I I I -О-Р-О-СН2-С—с-н II I I о он он Фосфатидил - глицерин
ОН
о°
Диацил- глицерин -О-Р-О-С II I :н2
о Н( о® :-он I
Диацил- гл и церин I —О—Р—О—( :н2
О
Фосфатидил-
инозитол
Дифосфатидил -
глицерин
(кардиолипин)
Г люкозилцерамид
Глюкоза
294
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
три гидроксильные группы в положениях 1, 3 и 4.
Этот заместитель, обладающий слабощелочны-
ми свойствами, присоединяется амидной связью
к жирной кислоте (С16—С24), которая содержит
не более двух двойных связей. Как пример одно-
го из множества сфинголипидов можно привести
церамид со сфинганином в качестве основания
(рис. 15.5в). В гликозилсфинголипидах С-1 ги-
дроксильная группа связана с остатком глюкозы,
а в фосфорилсфинголипидах (на рис. 15.5в не
показаны) эта группа этерифицированна либо
фосфатом, либо холинфосфатом.
Как известно, сфинголипиды играют важную
роль в передаче сигналов у животных и дрожжей.
Исследование функций сфинголипидов у расте-
ний пока еще находится на начальном этапе. По
последним данным сфинганин-1-фосфат дей-
ствует как Са2+-мобилизующий мессенджер,
который высвобождается в результате действия
абсцизовой кислоты (АБК) (разделы 8.2 и
19.6). У растений продукты метаболизма сфин-
голипидов, возможно, вовлечены в сигналы
программированной гибели клеток.
15.2. Триацилглицерины служат
запасными веществами
Триацилглицерины содержатся преимуще-
ственно в семенах, реже — в мезокарпе плодов,
таких, как маслины и авокадо1.
В плодах триацилглицерины важны для при-
влечения животных, распространяющих семе-
на. Триацилглицерины семян служат запасом
органического углерода и при прорастании обе-
спечивают биосинтетические процессы. Триа-
цилглицерины в качестве запасающих веществ
имеют то преимущество перед углеродами,
что соотношение между массой и содержани-
ем углерода в этих липидах намного ниже. Это
легко подтвердить расчетами. Так, в крахмале
один глюкозный остаток, содержащий 6 атомов
углерода, имеет молекулярную массу 162 Да. На
один атом запасенного углерода приходится око-
ло 27 Да вещества. На самом деле эта величина
еще больше, поскольку крахмал гидратирован
и всегда содержит дополнительные молекулы
воды. Триацилглицерин с тремя пальмитатными
1 В вегетативных органах триацилглицерины, как правило,
не накапливаются. Исключение — клубни Cyperus esculen-
ta. — Прим. ред.
остатками содержит 51 атом углерода, и при этом
его молекулярная масса равна 807 Да. Таким об-
разом, на один запасенный атом углерода при-
ходится всего 16 Да. К тому же, триацилглицери-
ны не гидратированы (в отличие от крахмала),
и для хранения такого же количества органиче-
ского углерода в форме нейтральных липидов
нужно примерно вдвое меньше биомассы, чем
при хранении в форме крахмала. Снижение веса
семян способствует их распространению.
Триацилглицерины запасаются в олеосо-
мах, которые иногда называют липидными или
жирными тельцами (рис. 15.6). Они состоят из
капель масла, окруженных монослоем полярных
липидов. Белки, которые имеют общее название
олеозинов, заякорены в липидном монослое на
поверхности олеосомы и способствуют мобили-
зации жирных кислот из триацилглицеринов в
процессе прорастания семян (раздел 15.6). Оле-
озины можно обнаружить только в олеосомах
эндосперма, семядолей или зародышевых тка-
ней семени. Жировые тельца в перикарпе мас-
лин и авокадо, в которых триацилглицерины не
используются как запасные вещества, а служат
лишь для привлечения животных, не содержат
олеозинов. В этом случае диаметр жировых ка-
пель составляет от 10 до 20 мкм, что намного
больше по сравнению с олеосомами запасаю-
щих тканей (0,5—2 мкм в диаметре). Как будет
показано в разделе 15.5, триацилглицерины син-
тезируются в мембранах эндоплазматического
ретикулума. Предполагают, что вновь синтези-
рованные триацилглицерины накапливаются в
толще липидного бислоя мембраны ЭР до тех
пор, пока не будет достигнут окончательный
размер олеосомы (рис. 15.6). Затем окруженная
фосфолипидным монослоем олеосома отпочко-
вывается от мембраны ЭР.
15.3. Синтез жирных кислот de novo
происходит в пластидах
Органический углерод, зафиксированный в фор-
ме СО2 в хлоропластах, является предшествен-
ником не только для сахаров и аминокислот, но
также и для синтеза жирных кислот и разноо-
бразных вторичных метаболитов, которые будут
рассмотрены в главах 16—18. Если образование
углеводов предназначено прежде всего для экс-
порта в другие части растения, синтез жирных
15.2. Триацилглицерины служат запасными веществами
295
Таблица 15.2. Состав мембранных липидов в различных органеллах растительной клетки
Мембрана тилакоидов в хлоропластах Мембрана эндоплазматического ретикулума Плазматическая мембрана
Липиды мембраны* % от общего числа молекул
Моногалактозилдиацилглицерин 42 1 2
(MGDG)
Дигалактозилдиацилглицерин (DGDG) 33 2 3
Сульфолипиды (SL) 5 0 0
Фосфатид и л хол и н 5 45 19
Фосфатидилэтаноламин 1 15 17
Фосфатидилсерин 0 1 3
Фосфатидилглицерин 11 6 12
Фосфатидилинозитол 0 8 2
Сфинголипиды 0 10 7
Стерины 0 5 31
*Листья ржи (по Lochnit с соавт., 2001).
Накопление
триацилглицеринов
в мембране ЭР
Олеосома
(жировое тельце)
Рис. 15.6. Олеосома, покрытая липидным монослоем, образуется путем
включения триацилглицеринов в мембрану ЭР. Далее на поверхности олеосомы
в липидном монослое заякориваются белки-олеозины
296
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
кислот обеспечивает прежде всего собственные
потребности фотосинтезирующей клетки (ис-
ключение составляют семена и плоды, запасаю-
щие растительное масло— см. выше). У рас-
тений невозможен дальний транспорт жирных
кислот. Однако каждая клетка растительного
организма содержит жирные кислоты в составе
мембранных липидов, а это означает, что в каж-
дой клетке должны быть ферменты биосинтеза
как липидов, так и жирных кислот.
У растений синтез жирных кислот de novo
всегда происходит в пластидах: в хлоропластах
зеленых клеток или в лейкопластах и хромопла-
стах у незеленых клеток. Хотя ферменты, ката-
лизирующие реакции с липидами, можно встре-
тить и на эндоплазматическом ретикулуме1, в
этом случае происходит лишь модификация
жирных кислот, которые ранее были синтезиро-
ваны в пластидах. Эти модификации в ЭР вклю-
чают удлинение углеводородной цепи жирных
кислот при помощи элонгаз, а также внедрение
дополнительных двойных связей десатуразами
(рис. 15.15<?).
Ацетилкоэнзим А - предшественник
в биосинтезе жирных кислот
В пластидах, как и в митохондриях (см. рис. 5.4),
содержится пируватдегидрогеназа, которая
окисляет пируват до ацетил-КоА, что сопрово-
ждается восстановлением НАД+ (рис. 15.7).
Ацетил -КоА-
синтетаза
—►Жирные кислоты
Пируват-
дегидрогеназа
Рис. 15.7. Ацетилкоэнзим А может образоваться
двумя путями
1 По последним данным значительное количество фермен-
тов липидного обмена находится в плазмалемме. — Прим,
ред.
В хлоропластах в процессе фотосинтеза об-
разуется довольно много НАДФН, необходи-
мого для синтеза жирных кислот. Однако до сих
пор неясно, как из продуктов фиксации СО2
образуется ацетил-КоА. Хотя это и зависит от
стадии развития клетки, в целом активность пи-
руватдегидрогеназы в хлоропластах довольно
низкая. При этом в хлоропластах высока актив-
ность ацетил-КоА-синтетазы, которая превра-
щает ацетат в ацетил-КоА с использованием
АТФ. Если к суспензии хлоропластов добавить
радиоактивно-меченый ацетат, метка очень бы-
стро включается в состав жирных кислот. У мно-
гих растений ацетат является основным пред-
шественником при образовании ацетил-КоА
в хлоропластах и лейкопластах. Однако до сих
пор не выяснено, синтезируется ли ацетат в этих
пластидах. Предполагают, что он может также
образовываться в митохондриях при гидролизе
ацетил-КоА, который в свою очередь образо-
вался при окислении пирувата митохондриаль-
ной пируватде гидрогеназой.
В лейкопластах восстановительные эквива-
ленты, необходимые для синтеза жирных кис-
лот, образуются при окислении глюкозо-6-фос-
фата, который транспортируется в пластиды
через глюкозофосфатный переносчик (см.
рис. 13.5). Окисление глюкозо-6-фосфата идет
по окислительному пентозофосфатному пути
(см. рис. 6.21) и обеспечивает синтез НАДФН,
который в дальнейшем используется при обра-
зовании жирных кислот.
Биосинтез жирных кислот начинается с кар-
боксилирования ацетил-КоА при помощи
ацетил-КоА-карбоксилазы. При этом с затра-
той АТФ образуется малонил-КоА (рис. 15.8).
В следующей реакции коэнзим А замещается
ацилпереносящим белком (АПБ) (рис. 15.9).
В состав АПБ входит серин, с которым через
фосфатную группу ковалентно связан остаток
пантетеина. Поскольку пантетеин входит в со-
став коэнзима А, АПБ можно рассматривать
как КоА, ковалентно связанный с белком. Далее
Р-кетоацил-АПБ-синтаза III катализирует
конденсацию ацетил-КоА и малонил-АПБ. Из-
за высвобождения СО2 эта реакция необратима.
Образовавшийся ацетоацетат остается присое-
диненным тиоэфирной связью к АПБ. НАДФН
восстанавливает ацетоацетил-АП Б до p-D-гидро-
ксиацил-АПБ. Последующая дегидратация при-
15.3. Синтез жирных кислот de novo происходит в пластидах
297
Рис. 15.8. Последовательность
реакций биосинтеза жирных кислот:
активация, конденсация, восстановление,
высвобождение воды (дегидратация), еще
одна реакция восстановления. В результате
образуется жирная кислота, удлиненная на
два атома углерода
Ацетил -КоА-
карбоксилаза
НСО3 +АТФ АДФ + Ф
CH3-C-S-KoA
СН2- С-S—КоА
ООО Малой ил-КоА
Ацетил-КоА /Г Н8 4АПБ|
О о 4 KoA-SH
||>'' II ______
CH3-C-S-C0A СН?-С-34АПБ| Малонил-АПБ
СОО
О О
II II _________
сн3- с- сн2- с- S 4АПБ
НАДФН + Н’
НАДФ ’
Н О
I II ________
сн3- с-сн2- с-з4апб|
он
н2о
н о
I II _________
сня-с=с-с-з4апб|
н
НАДФН +Н1
НАДФ *
О
II ,_______
сн3- сн2- сн2- с - S 4АПБ
0-Кетоацил-АПБ-
синтаза III
р-Кетоацил-АП Б
0-Кетоацил-АПБ-
редуктаза
P-D-Г идроксиациацил-АПБ
P-D-Г идроксиациацил-АПБ-
дегидратаза
транс-Д2 - Еноил-АП Б
Еноил-АПБ-
редуктаза
Ацил-АП Б
водит к образованию двойной связи между
атомами углерода, которая восстанавливается с
участием еще одной молекулы НАДФН до ацил-
АПБ. Продуктом является жирная кислота, ко-
торая может вступить в новый цикл элонгации и
удлинить цепь еще на два углеродных атома (см.
рис. 15.8).
Ацетил-КоА-карбоксилаза - начальный
фермент биосинтеза жирных кислот
При карбоксилировании ацетил-КоА биотин
выполняет функцию переноса «активирован-
ного СО2» (рис. 15.10). Биотин через собствен-
ную карбоксильную группу ковалентно связан
с е-аминогруппой остатка лизина, входящего
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
О Пантетеин О Н СН3
II II I I
0е
H-S-CH2-CH2-N-C-CH2-CH2-N-C-C-C-CH2--O-P-O- Серин АПБ
н н I | II
АПБ
ОН СН3
Рис. 15.9. Ацилпереносящий белок (АПБ) содержит пантетеин — ту же самую
функциональную группу, что и коэнзим А
о
в состав биотинового карбоксилперенося-
щего белка. Одна из NH-групп биотина может
образовывать карбамат, присоединяя НСО3_
(рис. 15.11). Эта реакция сопровождается гидро-
лизом АТФ. Таким образом, карбоксилирова-
ние ацетил-КоА состоит из двух этапов.
1. Биотин карбоксилируется с расходом АТФ
при помощи биотинкарбоксилазы.
2. Бикарбонат переносится на ацетил-КоА
с участием карбоксилтрансферазы.
Все три фермента — биотиновый карбок-
силпереносящий белок, биотинкарбоксила-
за и карбоксилтрансфераза — входят в состав
единого комплекса. Поскольку биотин присо-
единен к переносящему белку длинной гибкой
цепью, при изменении конформации биотин
реагирует либо с карбоксилазой, либо с карбок-
силтрансферазой мультиэнзимного комплекса
(см. рис. 15.11).
Ацетил-КоА-карбоксилазный мультиэнзим-
ный комплекс в строме пластид состоит из не-
скольких субъединиц, похожих на соответствую-
щие субъединицы ацетил- КоА-карбоксилазы
цианобактерий и других бактерий. Состоящий из
отдельных субъединиц комплекс можно назвать
прокариотической формой ацетил- КоА-кар-
боксилазы. Вне пластид, скорее всего, в цитозо-
ле, также обнаружена ацетил-КоА-карбоксилаза.
Здесь малонил-КоА образуется для удлинения
цепи жирных кислот и как предшественник в
биосинтезе флавоноидов (раздел 18.5). Ацетил-
КоА-карбоксилаза, находящаяся вне пластид,
в отличие от прокариотической формы состоит
из одного большого многофункционального
белка, в котором биотиновый переносчик кар-
боксильной группы, биотинкарбоксилаза и кар-
боксилтрансфераза являются крупными доме-
нами в единой полипептидной цепи. Поскольку
hi\KC^nh
I I
нс-----сн
I I 1-1
Н2С. /сн2, /СН2
S сн2 сн2 с
II
о
Биотин
I
NH
н I
N СН2 СН2—С—Н
сн2 сн2 I
с=о
I
Остаток лизина
биотинового
карбоксилпереносящего
белка
Рис. 15.10. Биотин, связываясь с остатком лизина, образует биотиновый
карбоксилпереносящий белок
15.3. Синтез жирных кислот de novo происходит в пластидах
299
3 Мультиэнзимный
комплекс, состоящий
из отдельных субъединиц
б Многофункциональный
белок
Карбоксил- прокариотическая
трансфераза форма
Биотин-
карбоксилаза
Биотиновый карбоксил-
переносящий белок
Биотин- карбоксилаза Биотиновый карбоксил- переносящий белок Карбоксил- трансфераза
Рис. 15.11. Карбоксилирование ацетил-КоА. Биотин, связанный с биотиновым
карбоксилпереносящим белком по очереди реагирует с биотин карбоксилазой и
карбоксилтрансферазой. Круговое вращение показано лишь для наглядности, но на
самом деле происходит изгибание цепи, несущей биотин. Эукариотическая ацетил-
КоА-карбоксилаза представляет собой единый многофункциональный белок
аналогичные многофункциональные белки об-
наружены в цитозоле у дрожжей и животных,
ацетил-КоА-карбоксилазы этого типа относятся
к эукариотической форме. Тем не менее важно
отметить, что и эукариотическая, и прокариоти-
ческая ацетил-КоА-карбоксилазы у растений ко-
дируются ядерным геномом. Возможно, что толь-
ко один из белков мультиэнзимного комплекса
прокариотической ацетил - КоА- карбоксилазы
закодирован в пластидном геноме1.
У семейства злаковых (Gramineae), к ко-
торым отсносятся разнообразные зерновые
культуры, прокариотическая форма фермента
отсутствует. У этих растений многофункциональ-
ный белок эукариотической ацетил-КоА-кар-
боксилазы локализован как в цитоплазме, так
и в пластидах. Эукариотическая ацетил-Ко А-
карбоксилаза ингибируется различными про-
изводными феноксипропионовой кислоты
1 Имеется в виду продукт гена accD. Этот ген обнаружен у
многих растений в хлоропластном геноме. — Прим. ред.
с ароматическими заместителями, например,
диклофопметилом (рис. 15.12). Поскольку
у злаков ключевым ферментом синтеза жир-
ных кислот de novo является эукариотичес-
кая ацетил-КоА-карбоксилаза, расположенная
в пластидах, диклофопметил сильно нарушает
биосинтез липидов у представителей семейства
Gramineae. Это позволяет использовать ди-
Диклофопметил
Рис. 15.12. Диклофопметил (селективный
гербицид против сорных злаков, торговая
марка Hoe-Grass, фирма Aventis) ингибирует
эукариотическую ацетил-КоА-карбоксилазу,
представленную единым многофункциональным
белком
300
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
R
сн2
но-с-н
|апб
|АПБ
р-Кетоацил-
АПБ-синтаза I
Н2О
S
о
о
НАДФН+Н®
р-Гидроксиацил-
АП Б-дегидратаза
р-Кетоацил-
АП Б-редуктаза
НАДФ®
сн2
НАДФ®
НАДФН
+ Н®
АПБ
SH
АПБ|
S-с-СН2— СН2— СН2— R
|апб
Еноил-АПБ-
редуктаза
HS-KoA
СК .S—КоА
С^
сн2-соо®
Рис. 15.13. Взаимодействие ферментов при биосинтезе жирных кислот.
Ацилпереносящий белок (АПБ), расположенный в центре, несет жирнокислотный
остаток, связанный тиоэфирной связью. В результате конформационных
изменений в АПБ, остаток жирной кислоты перемещается от одного фермента
к другому. Круговое движение изображено для наглядности, оно не отражает
реальные изменения конформации
R— СН2—С-СН2- С-S
S-с-СН=СН-сн2- R
S-C—СН2—СН2—СН2—R
Малонил-КоА-
АП Б-трансацилаза
R— СН2- С + СН2— С- S
S СОО®
клофопметил (торговая марка Hoe-Grass, фир-
ма Aventis) и аналогичные вещества как селек-
тивные гербициды (раздел 3.6) для уничтожения
таких сорняков, как пырей, свинорой, куриное
просо в посадках двудольных растений1.
Ацетил-КоА-карбоксилаза является началь-
ным ферментом в биосинтезе жирных кислот,
поэтому скорость его работы определяет ско-
рость синтеза липидов в целом. В хлоропла-
стах активность ацетил- КоА-карбоксилазы
регулируется светом: при хорошем освещении
фермент активен, а в темноте активность силь-
1 Фирма Aventis рекомендует применение диклофопметила
в том числе и в посадках ячменя, озимой и яровой пшеницы
(сем. Злаковые). — Прим. ред.
но подавлена. Таким образом, синтез жирных
кислот происходит в течение дня, когда в ходе
фотосинтеза образуется необходимый НАДФН.
Механизм активации светом ацетил-КоА-
карбоксилазы и ферментов цикла Кальвина
(раздел 6.6) очень похожи: при восстановлении
S - S - мостиков тиоредокси ном ацетил - КоА-
карбоксилаза активируется и в дальнейшем уси-
ливает свою работу при повышении pH и кон-
центрации Mg2+ в строме.
Дальнейшие этапы биосинтеза
жирных кислот происходят также
при помощи мультиэнзимных комплексов
Р-Кетоацил-АПБ образуется при конденса-
ции ацетил-КоА и малонил-АПБ (см. рис. 15.8).
15.3. Синтез жирных кислот de novo происходит в пластидах
301
Дальнейшее восстановление с участием НАДФН
до p-D-гидроксиацетил-АПБ, дегидратация
с образованием двойной связи в еноил-АПБ
и второе восстановление с помощью НАДФН
приводят к образованию ацил-АПБ. Эта по-
следовательность реакций похожа на образова-
ние оксалоацетата из сукцината в цикле Кребса
(если рассматривать его в обратном порядке —
см. рис. 5.3). Синтез жирных кислот происходит
на мультиэнзимном комплексе. Рисунок 15.13
в некоторой мере отражает взаимодействие раз-
личных субъединиц. АПБ с присоединенным
тиоэфирной связью ацильным радикалом рас-
положен в центре комплекса. Поскольку ациль-
ный остаток соединен гибкой цепью, он может
смещаться от одного фермента комплекса к дру-
гому в результате конформационных изменений.
Удлинение углеродной цепи жирной кис-
лоты начинается с переноса ацильного остатка
на новый АПБ. Далее происходит конденсация
ацил-АПБ и малонил-АПБ. Катализирующая
эту реакцию р-кетоацил-АПБ-синтаза I по-
зволяет синтезировать жирные кислоты, не пре-
вышающие С16 по длине. Чтобы получить цепь
с 18 атомами углерода, необходима р-кетоацил-
АПБ-синтаза II (рис. 15.14).
Следует отметить, что у животных и грибов
ферменты биосинтеза жирных кислот, показан-
ные на рис. 15.13, организованы в виде крупных
Синтазы
жирных кислот
Ацил-АПБ (16:0)
р-Кетоацил-
АПБ-синтаза II
Малонил-АПБ
АПБ + СО2
р-Кетоацил-АП Б
Ацил-АПБ (18:0)
Рис. 15.14. Удлинение углеводородной цепи
жирных кислот в пластидах
доменов в один или два многофункциональных
белка, образующих комплекс (эукариотиче-
ский комплекс синтеза жирных кислот).
Поскольку комплекс синтеза жирных кислот
в пластидах состоит из отдельных субъединиц,
обладающих соответствующей ферментативной
активностью и похожих у пластид и бактерий,
его называют прокариотическим комплексом
синтеза жирных кислот.
Первая двойная связь
в новообразованную жирную кислоту
внедряется растворимой десатуразой
Образованный в строме пластид стеарил-АПБ
(18:0) способен превращаться в ненасыщенный
олеил-АПБ (18:1) (рис. 15.1567). Эту реакцию
можно назвать монооксигенированием (раз-
дел 18.2), поскольку один из кислородных атомов
молекулы О2 восстанавливается до воды, а вто-
рой внедряется в углеводородную цепь жирной
кислоты в форме гидроксила. Образование двой-
ной связи между атомами углерода происходит
при последующем высвобождении воды (анало-
гично реакции, катализируемой р-гидроксиацил-
АЛБ-дегидратазой — см. рис. 15.8). Важное
отличие состоит в том, что при удлинении
углеродной цепи продукт дегидратации обра-
зуется в гарянс-форме, а при десатурации воз-
никает Д4«с-конфигурация. При монооксигени-
ровании расходуются два электрона, которые
поступают от НАДФН через восстановленный
ферредоксин. Монооксигеназы широко рас-
пространены у бактерий, растений и животных.
В большинстве случаев кислород (О2) активиру-
ется особым цитохромом (цитохром Р450). Одна-
ко стеарил-АПБ-десатураза активирует молеку-
лу О2 при помощи кластера, состоящего из двух
атомов железа, связанных координационными
связями с атомами кислорода карбоксильных
групп (так называемой 2 Fe-оксокластер —
рис. 5.16). В предыдущих разделах мы рассма-
тривали железо-серные кластеры как перенос-
чики электронов, в которых атомы Fe связаны
с белком через остатки цистеина (см. рис. 3.26).
2Ре-оксокластер десатуразы образован двумя
атомами железа и карбоксильными группами
глутаминовой и аспарагиновой кислоты, входя-
щими в состав белка. Атомы железа могут изме-
нять степень окисления, находясь в состоянии
302
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
Стеарил-АПБ
НАДФН+Н®
НАДФ®
2 Ферредоксин
I
Н-С-Н
I
н-с-н
I
+ Ор
I
н-с-н
I
н-с-он
I
Олеил-АПБ
I
Н-С
II
н-с
I
+ о2
Н2О
Рис. 15.15а. Стеарил-АПБ-десатураза, локализованная в пластидах,
катализирует реакцию превращения стеарил-АПБ в ненасыщенный олеил-АПБ.
Эту реакцию можно рассматривать как монооксигенирование с последующим
отщеплением воды
Ациллипид
оксидоредуктаза
Рис. 15.155. Ациллипиддесатураза, интегральный белок мембраны ЭР,
катализирует образование ненасыщенных жирных кислот, которые входят в состав
фосфолипидов. Здесь, как и на рис. 15.15я, реакцию можно рассматривать как
монооксигенирование с последующим выделеним воды (детали процесса
не показаны). Перенос электронов с НАДФН на десатуразу происходит с участием
двух дополнительных белков: НАДФН-цитохром Ь5-оксидоредукгазы
и цитохрома Ь5
+IV, +III или +11. Молекула О2 активируется,
связываясь с двумя атомами Fe.
Стеарил-АПБ-десатураза является раствори-
мым белком, локализованным в хлоропластах
или других пластидах. Этот фермент настоль-
ко активен, что практически весь новообра-
зованный стеарил-АПБ (18:0) превращается в
олеил-АПБ (18:1) (рис. 15.17). Эта растворимая
десатураза может внедрить в молекулу жирной
кислоты лишь одну двойную связь. Введение
дополнительных двойных связей происходит
при помощи других десатураз, которые явля-
ются интегральными белками мембран ЭР1 и
реагируют только с радикалами жирных кис-
лот, включенными в состав мембранных липи-
дов. В соответствии с субстратом эти фермен-
ты называют ациллипиддесатуразами. Эти
мембрано-связанные десатуразы также нужда-
ются в О2 и восстановительных эквивалентах в
форме НАДФН, как и ранее упомянутые АПБ-
десатуразы, однако путь передачи электронов
1 В плазмалемме также обнаружены десатуразы. — Прим,
ред.
15.3. Синтез жирных кислот de novo происходит в пластидах
303
Глу
Рис. 15.16. В 2Бе-оксокластере два атома железа
связаны с глутаматом и аспартатом, а также
гистидином, входящими в состав полипептида
(по Karlin, 1993)
несколько отличается (см. рис. 15.156). Восста-
новительные эквиваленты с НАДФН передаются
на ФАД, входящий в состав НАДФН-цитохром
65-оксидоредуктазы, и далее — на цитохром 65,
а с него — собственно на десатуразу, которая со-
держит два атома железа, очевидно, связанных
с гистидином в молекуле белка. Ациллипидде-
сатуразы принадлежат к обширному семейству
ферментов. Представители этого семейства мо-
гут также катализировать внедрение в углерод-
ную цепь жирных кислот гидроксильных групп
(гидроксилазы), эпокси-групп (эпоксигеназы),
сопряженных двойных связей (конъюгазы),
тройных связей (ацетиленазы).
Ацил-АПБ (продукт синтеза жирных кислот
в пластидах) может использоваться
двумя путями
У ацил-АПБ, образованного в пластидах, есть
две важные функции.
1. Он играет роль донора ацильных радика-
лов при биосинтезе мембранных липидов в пла-
стидах. Ферменты синтеза глицеролипидов
локализованы частично во внутренней, а ча-
стично — во внешней мембране пластид. Таким
образом, существует «разделение труда» между
этими двумя мембранами. Однако в дальнейшем
изложении пути биосинтеза липидов внешней
и внутренней мембраны пластид будут рассмо-
трены в едином контексте (чтобы избежать из-
лишней детализации).
Рис. 15.17. Ацил-АПБ-тиоэстеразы высвобождают в основном 16:0 и 18:1 жирные
кислоты и лишь небольшое количество 18:0 жирных кислот. Как только жирные
кислоты покидают строму пластид и оказываются в цитозоле, они немедленно
превращаются в ацил-КоА
304
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
2, Для биосинтеза липидов, входящих в со-
став остальных мембран клетки (кроме пластид),
ацил-АПБ гидролизуется ацил-АПБ-тиоэсте-
разами с образованием свободных жирных
кислот, которые затем покидают пластиды (см.
рис. 15.17). До сих пор невыяснено, происходит
ли транспорт жирных кислот при помощи специ-
фичного переносчика, или жирные кислоты по-
кидают пластиду путем неспецифической диф-
фузии. Как только свободные жирные кислоты
оказываются снаружи от внешней мембраны
пластиды, под действием ацил-КоА-синтетаз
они немедленно превращаются вацил-КоА
(с сопутствующим гидролизом АТФ). Посколь-
ку тиоэстеразы в пластидах работают преиму-
щественно с 16:0-ацил-АПБ и 18:1-ацил-АПБ,
и в меньшей мере с 18:0-ацил-АПБ, пластиды
снабжают остальные компартменты клетки в
основном тиоэфирами КоА с 18:1- и 16:0-ациль-
ными заместителями (а также очень небольшим
количеством 18:0-ацил-КоА).
15.4. Глицерин-З-фосфат является
предшественником в синтезе
глицеролипидов
Глицерин-З-фосфат образуется из дигидроксиа-
цетонфосфата с использованием НАДН в каче-
стве восстановителя (рис. 15.18). Дигидроксиаце-
тонфосфатредуктазы присутствуют как в строме
пластид, так и в цитозоле. Если синтез липидов
Пластидный компартмент: прокариотический путь биосинтеза
Дигидрокси-
ацетонфосфат
редуктаза
18 : 1
(16:0)
Ацил-АПБ-глицерин-З-фосфат
ацилтрансфераза
16:0
Н2С-ОН
I
с=о о
1 11 е
Н2С—О—Р—О®
о®
НАДН
+ Не НАД®
Н2С-ОН
I
но-с-н о
1 11 0
НгС-о-Р—О®
о®
Ацил-АПБ АПБ
Н2С—OAcyl
но-с-н о
1 11 о
Н2С—о- р- о®
о®
Ацил-АПБ АПБ
Ди гидрокси -
ацетонфосфат
Глицерин-З-фосфат
Л изофосфати дная
кислота
18 : 1
Н2С—OAcyl (16:0)
АсуЮ-С-Н О 16:0
1 11 о
Н2С—О— Р— О®
О®
Фосфатидная
кислота
Эндоплазматический ретикулум: эукариотический путь биосинтеза
но—
Ацил-АПБ-глицерин-З-фосфат
ацилтрансфераза
18 : 1
(16:0)
Ацил-КоА
КоА
1|— ОН
но—
18 : 1
Ацил-КоА КоА
—ОАцил
АцилО—
18 : 1
—ОАцил (16:0)
18 : 1
з1—ф
— Ф
— Ф
Рис- 15.18. Мембранные липиды, синтезированные на мембранах ЭР
и в пластидах, имеют различный состав жирных кислот
15.4. Глицерин-З-фосфат является предшественником в синтезе глицеролипидов
305
ЦТФ
СНз
НО—сн2—сн2— N—СН3
Фосфохолин
Цитидин-О—Р— О—Р—О—Р—О
I I I
О О О'
ео— р- о—СН2—СН2— N- СН3
Ое СН3
Рис. 15. 19. Образование ЦДФ-холина
Холин
происходит в пластидах, остатки жирных кислот
переносятся на глицерин-3-фосфат непосред-
ственно с ацил-АП Б. Первое ацилирование в
этом случае предполагает этерификацию 18:1-,
реже — 16:0-, и еще реже 18:0-ацильным остат-
ком в первом положении глицерин-3-фосфата.
Тем не менее второе положение практически
всегда этерифицируется 16:0-жирной кислотой.
Поскольку именно такой порядок образования
глицеролипидов обнаружен также у цианобакте-
рий, этот путь биосинтеза липидов назван про-
кариотическим.
Для синтеза глицеролипидов ЭР характер-
но, что донором ацильного радикала является
Ацил —
— Gal - Gal
— Ацил
DGDG
Фосфатидная кислота
Фосфатидилхолин (лецитин)
Рис. 15.20. Общая схема синтеза мембранных липидов
306
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
ацил-КоА. Здесь, как и в пластидах, гидроксиль-
ная группа при С-1 атоме этерифицируется 18:1-
, 16:0- или 18:0-ацильным заместителем. Однако
в позиции С-2 находится в той или иной мере
ненасыщенная 18:п — жирная кислота. Путь
синтеза глицеролипидов эндоплазматичесого
ретикулума называют эукариотическим.
Присоединение полярной гидрофильной го-
ловки к диацилглицерину происходит в основ-
ном путем активации гидрофильной группы,
хотя в некоторых случаях активируется гидро-
фобный диацилглицерин. Холин и этаноламин
активируются путем фосфорилирования специ-
фическими киназами, а затем с помощью цити-
дилтрансфераз, реагируя с ЦТФ, превращаются
в ИДФ-холин и ЦДФ-этаноламин (рис. 15.19).
Галактозная группа галактолипидов активируется
при образовании УДФ-галактозы (рис. 15.20).
Сначала из глюкозо-1-фосфата и УТФ син-
тезируется УДФ-глюкоза (при помощи УДФ-
глюкозопирофосфорилазы — см. раздел 9.2).
Далее УДФ-глюкозоэпимераза (рис. 9.21) пре-
СТРОМА
ЦИТОЗОЛЬ
МЕМБРАНА ЭР
Пул ацил-КоА
22 : 1
22:1
КоА + АТФ
АМФ + ФФ
20 : 1
Ацил-КоА
20:1
Элонгаза
Ацил-КоА 18 : 1 (16 : 0)
16:0
(18:0)
18: 1
1 г- 18: 1(16:0)
2- 18:1 ---►
3 *-- Фосфохолин
Десатуразы
г- 18:2(16:0)
- 18:2 ---►
L- Фосфохолин
г- 18:3(16:0)
18:3
Фосфохолин
18 : 3
также 18 2
Ацил-КоА18 : 1
Ацил-КоА 18 : 3
Обмен ацильным
радикалом
г- 18:3(16:0)
- 18:1
L- Фосфохолин
Фосфатид и лхол ин
Рис. 15.21. В цитозоле постоянно присутствует некоторый пул ацил-КоА
с различной длинной углеводородной цепи и степени ненасыщенности.
Остатки жирных кислот, поступающие из пластид, удлиняются при помощи
элонгаз, локализованных в эндоплазматическом ретикулуме. После включения
фосфатидилхолина 18:1 -ацильные остатки в дальнейшем десатурируются до
18:2 и 18:3 жирных кислот под действием соответствующих десатураз ЭР. Еще
более ненасыщенные жирные кислоты (в позиции С-2) могут образоваться при
трансацилировании с 18:1-ацил-КоА. Таким образом, в составе цитозольных
липидов могут образоваться 18:2- и 18:3-жирные кислоты (в составе тиоэфира
с КоА)
15.4. Глицерин-З-фосфат является предшественником в синтезе глицеролипидов
307
вращает УДФ-глюкозу в УДФ-галактозу. Для
синтеза дигалактозилдиацилглицерина (DGDG)
из моногалактозилдиацилглицерина (MGDG)
еще один остаток галактозы должен поступить
из УДФ-галактозы. Сульфохиновоза также акти-
вируется в форме УДФ-производного, но синтез
этого вещества для краткости мы не будем обсуж-
дать. Акцептором активизированной гидрофиль-
ной группы является диацил глицерин, который
образуется из фосфатидной кислоты при гидро-
литическом отщеплении фосфатной группы.
Мембрана ЭР является местом удлинения
жирных кислот и введения
дополнительных двойных связей
Как показано на рис. 15.17, в пластидах синте-
зируются 16:0-, 18:1- и (в меньшем количестве)
18:0- ацильные группы. Тем не менее некоторые
Рис- 15.22. Липиды
тилакодной мембраны
частично синтезируются
по эукариотическому пути
(выделено красным), в
то время как остальная
часть образуется по
прокариотическому пути
(показано черным)
308
15. Глицерол и пиды являются компонентами мембраны и служат запасом углерода
запасные липиды содержат жирные кислоты с
более длинной углеводородной цепью. То же
самое можно сказать и о растительных восках,
в состав которых входят эфиры С2о-С24 жирных
кислот, а также спирты с очень длинной углево-
дородной цепью (С24-С32). Удлинение цепи для
жирных кислот, превышающих С18, происходит
при участии элонгаз, которые локализованы в
мембранах ЭР (рис. 15.21). Удлинение углево-
дородной цепи в этом случае происходит прак-
тически по тем же механизмам, как и синтез
жирных кислот, с тем отличием, что в биосинтез
вовлечены другие ферменты, а активация ациль-
ного и малонильного радикалов происходит при
образовании соответствующих тиоэфиров с ко-
энзимом А.
В мембране ЭР также может происходить
дальнейшая десатурация ацильных остатков.
Для этого ацильная группа вначале включается
в фосфолипиды, например в фосфатидилхолин
(см. рис. 15.21). Десатуразы, которые входят в
состав мембраны ЭР, превращают остаток ли-
нолевой кислоты (18:1) в остаток линоленовой
(18:2), и далее — линолеиновой (18:3). Жирно-
кислотные остатки 18:2- и 18:3-, замещающие
С-2-положение глицерина, в дальнейшем могут
обмениваться на 18:1 ацильный радикал с по-
следующим введением новых двойных связей.
Взаимодействие десатураз в пластидах и в ЭР
позволяет создать пул ацил-КоА для того, что-
бы обеспечить основные потребности клетки.
Жирные кислоты с составом 16:0; 18:0 и 18:1 по-
ступают из пластид, тогда как жирнокислотные
остатки с большей длиной (или степенью нена-
сыщенности) образуются в эндоплазматическом
ретикулуме1.
Некоторые из липидов пластидной
мембраны образуются по
эукариотическому пути
Синтез глицеролипидов, предназначенных для
мембран тилакоидов, происходит на внутренних
мембранах этих органелл. Кроме прокариотиче-
ского пути, в котором ацильный остаток перено-
сится с ацил-АПБ непосредственно в молекулу
липида, есть глицеролипиды, синтезируемые по
1 По последним данным образование ненасыщенных жир-
ных кислот может также происходить на плазмалемме. —
Прим. ред.
эукариотическому пути. Десатуразы мембран ЭР
снабжают пластидные мембраны ненасыщенны-
ми жирными кислотами с двумя двойными свя-
зями. Предшественником таких липидов может
служить, например, фосфатидилхолин с двумя
двойными связями остатков жирных кислот, ко-
торый образуется в мембране ЭР (см. рис. 15.21).
Фосфатидилхолин, попадая в мембраны обо-
лочки пластид, гидролизуется с образованием
диацилглицерина (рис. 15.22). В большинстве
случаев к нему далее присоединяется полярная
головка из одной или двух молекул галактозы.
Ацильные радикалы могут затем дополнительно
десатурироваться до состояния 18:3 при помощи
десатуразы, присутствующей в оболочке пласти-
ды.
Некоторые десатуразы мембран пластидной
оболочки могут внедрять двойные связи в остат-
ки жирных кислот 18:1 и 16:0, которые включе-
ны в состав липидов. Сравнительный анализ
ацильных радикалов в С-2 положении глицери-
на (где и должна стоять 16:0 жирная кислота при
прокариотическом или 18:п жирная кислота при
эукариотическом пути синтеза) показывает, тем
не менее, что большая доля полиненасыщенных
галактолипидов в пластидах образуется по эука-
риотическому пути синтеза. Скорее всего, мем-
бранные липиды, присутствующие в наружной
мембране пластид, транспортируются в тилако-
идные мембраны при помощи специализирован-
ного белка-переносчика.
15.5. Триацилглицерины
образуются в мембранах
эндоплазматического
ретикулума
Обычно содержание липидов в зрелых семенах
может достигать 45% от сухого веса, но в неко-
торых случаях (например, у клещевины) — даже
до 85%! Предшественником синтеза триацил-
глицеринов является упоминавшийся ранее
глицерин-3-фосфат. Обнаружены по крайней
мере четыре пути биосинтеза, приводящие к
неполярным липидам, однако наиболее значи-
мыми оказались лишь два из них (рис. 15.23).
1. Фосфатидная кислота образуется путем
ацилирования гидроксильных групп в С-1 и С-2
положениях глицерин-3-фосфата, и после ги-
дролитического отщепления фосфатной группы,
308
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
запасные липиды содержат жирные кислоты с
более длинной углеводородной цепью. То же
самое можно сказать и о растительных восках,
в состав которых входят эфиры С2о-С24 жирных
кислот, а также спирты с очень длинной углево-
дородной цепью (С24-С32). Удлинение цепи для
жирных кислот, превышающих С18, происходит
при участии элонгаз, которые локализованы в
мембранах ЭР (рис. 15.21). Удлинение углево-
дородной цепи в этом случае происходит прак-
тически по тем же механизмам, как и синтез
жирных кислот, с тем отличием, что в биосинтез
вовлечены другие ферменты, а активация ациль-
ного и малонильного радикалов происходит при
образовании соответствующих тиоэфиров с ко-
энзимом А.
В мембране ЭР также может происходить
дальнейшая десатурация ацильных остатков.
Для этого ацильная группа вначале включается
в фосфолипиды, например в фосфатидилхолин
(см. рис. 15.21). Десатуразы, которые входят в
состав мембраны ЭР, превращают остаток ли-
нолевой кислоты (18:1) в остаток линоленовой
(18:2), и далее — линолеиновой (18:3). Жирно-
кислотные остатки 18:2- и 18:3-, замещающие
С-2-положение глицерина, в дальнейшем могут
обмениваться на 18:1 ацильный радикал с по-
следующим введением новых двойных связей.
Взаимодействие десатураз в пластидах и в ЭР
позволяет создать пул ацил-КоА для того, что-
бы обеспечить основные потребности клетки.
Жирные кислоты с составом 16:0; 18:0 и 18:1 по-
ступают из пластид, тогда как жирнокислотные
остатки с большей длиной (или степенью нена-
сыщенности) образуются в эндоплазматическом
ретикулуме1.
Некоторые из липидов пластидной
мембраны образуются по
эукариотическому пути
Синтез глицеролипидов, предназначенных для
мембран тилакоидов, происходит на внутренних
мембранах этих органелл. Кроме прокариотиче-
ского пути, в котором ацильный остаток перено-
сится с ацил-АПБ непосредственно в молекулу
липида, есть глицеролипиды, синтезируемые по
1 По последним данным образование ненасыщенных жир-
ных кислот может также происходить на плазмалемме. —
Прим. ред.
эукариотическому пути. Десатуразы мембран ЭР
снабжают пластидные мембраны ненасыщенны-
ми жирными кислотами с двумя двойными свя-
зями. Предшественником таких липидов может
служить, например, фосфатидилхолин с двумя
двойными связями остатков жирных кислот, ко-
торый образуется в мембране ЭР (см. рис. 15.21).
Фосфатидилхолин, попадая в мембраны обо-
лочки пластид, гидролизуется с образованием
диацилглицерина (рис. 15.22). В большинстве
случаев к нему далее присоединяется полярная
головка из одной или двух молекул галактозы.
Ацильные радикалы могут затем дополнительно
десатурироваться до состояния 18:3 при помощи
десатуразы, присутствующей в оболочке пласти-
ды.
Некоторые десатуразы мембран пластидной
оболочки могут внедрять двойные связи в остат-
ки жирных кислот 18:1 и 16:0, которые включе-
ны в состав липидов. Сравнительный анализ
ацильных радикалов в С-2 положении глицери-
на (где и должна стоять 16:0 жирная кислота при
прокариотическом или 18:п жирная кислота при
эукариотическом пути синтеза) показывает, тем
не менее, что большая доля полиненасыщенных
галактолипидов в пластидах образуется по эука-
риотическому пути синтеза. Скорее всего, мем-
бранные липиды, присутствующие в наружной
мембране пластид, транспортируются в тилако-
идные мембраны при помощи специализирован-
ного белка-переносчика.
15.5. Триацилглицерины
образуются в мембранах
эндоплазматического
ретикулума
Обычно содержание липидов в зрелых семенах
может достигать 45% от сухого веса, но в неко-
торых случаях (например, у клещевины) — даже
до 85%! Предшественником синтеза триацил-
глицеринов является упоминавшийся ранее
глицерин-3-фосфат. Обнаружены по крайней
мере четыре пути биосинтеза, приводящие к
неполярным липидам, однако наиболее значи-
мыми оказались лишь два из них (рис. 15.23).
1. Фосфатидная кислота образуется путем
ацилирования гидроксильных групп в С-1 и С-2
положениях глицерин-3-фосфата, и после ги-
дролитического отщепления фосфатной группы,
15.5. Триацилглицерины образуются в мембранах эндоплазматического ретикулума
309
Ацил-КоА
Ацил-КоА
]- X: п
- 18: п
-X: п
МЕМБРАНА ЭПР
Десатуразы
г 18 : 2(3)
- 18:2(3)
- X: п
г18:1
- 18:1
- Ф
г 18 : 1
- 18:1 ------►
I- Фосфохолин
ЦДФ- ЦМФ
холин
г 18:2(3)
18:2(3)
18 : 2(3)
ОН
Ацил-КоА
► ЦМФ ЦДФ-
холин
Рис. 15.23. Обобщенная схема синтеза триацил глицеринов в мембранах ЭР.
Синтез происходит либо путем прямого ацилирования глицерин-3-фосфата
(показано черным), либо с образованием фосфолипидов как промежуточных
продуктов (выделено красным). Во втором пути может происходить внедрение
дополнительных двойных связей при помощи десатураз ЭР
в С-3 положении также происходит ацилирова-
ние. Источником ацильных радикалов служит
цитозольный пул ацил-КоА. Поскольку биосин-
тез поисходит по эукариотическому пути, во вто-
ром положении обычно находится С18-ацильный
остаток (см. рис. 15.21).
2. Фосфатидилхолин синтезируется пер-
вым, затем его ацильные радикалы становятся
ненасыщенными при помощи дасатураз ЭР.
Холинфосфатная группа отделяется от липида
и переносится на ЦМФ, а оставшийся диацил-
глицерин этерифицируется третьей жирной
кислотой. По этому пути идет биосинтез поли-
ненасыщенных триацилглицеринов.
Эти пути биосинтеза могут пересекаться, но
для упрощения общей картины на рисунке 15.23
точки пересечения не изображены.
Растительное масло находит применение
как продукт питания, а также для
технических целей
В развитых странах около 20% энергии, по-
ступающей с пищей в организм человека, при-
ходится на долю жиров растительного проис-
хождения. Растительное масло содержит более
высокий процент ненасыщенных жирных кис-
лот по сравнению с животными жирами. Для
полноценного метаболизма в организм челове-
ка должны поступать ненасыщенные жирные
кислоты с двумя или более двойными связями.
Внедрение дополнительных двойных связей в
12 и 15 положение жирных кислот в организме
человека не происходит. Именно поэтому ли-
нолевая и линоленовая кислоты (см. рис. 15.4)
являются незаменимыми жирными кислотами,
абсолютно необходимым компонентом пита-
ния людей.
Около 2% от мировой продукции раститель-
ного масла служит сырьем в промышленности.
В некоторых странах метиловые эфиры жирных
кислот, получаемые из рапсового масла, исполь-
зуют как автомобильное топливо («биодизель»).
Как показано в табл. 15.3, жирнокислотный
состав растительного масла варьирует в зависи-
мости от вида растений. В некоторых случаях
триацилглицерины содержат довольно много
310
15. Глицерол и пиды являются компонентами мембраны и служат запасом углерода
Таблица 15-3. Жирнокислотный состав наиболее используемых жиров растительного происхождения
Соевое масло Пальмовое масло Рапсовое масло Подсолнеч- ное масло Арахисовое масло
16:0 11 42 4 5 10
18:0 3 5 1 1 3
18:1 22 41 60 15 50
18:2 55 10 20 79 30
18:3 8 0 9 0 0
20:1 0 0 2 0 3
другие 1 0 2 0 0
мировая продукция на 1994 год (х 106 куб. м/год) 18,6 14,7 10,3 7,9 4,2
Сорта без эруковой кислоты, по Бауманну с соавт., 1998.
Topfer International, статистическая информация.
Таблица 15.4. Промышленное использование жирных кислот, входящих в состав растительного масла
Основной источник Применение
Лавровая кислота (12:0) Масличная пальма, кокосовая пальма Мыло, детергенты, косметика
Линолевая кислота (18:3) Лён Лаки, краски
Рициноленовая кислота (18:1, А9- 12-°н) Клещевина Смазка, защита поверхностей
Эруковая кислота Рапс Промышленный пеногаситель для растворов детергентов, смазка, синтез искусственных волокон
редких жирных кислот, которые в дальнейшем
используют для промышленной переработки
(табл. 15.4). Масло из початков масличной паль-
мы, например, содержит много лавровой кис-
лоты с короткой углеводородной цепью (12:0),
которую используют для синтеза поверхностно-
активных веществ для моющих средств и косме-
тики. Обширные плантации масличной пальмы
в юго-восточной Азии обеспечивают потребно-
сти химической промышленности. Линолено-
вая кислота из выращиваемого в Европе льна
используется в лакокрасочной промышленно-
сти для производства льняной олифы. Рицино-
леновая кислота, которая относится к редким
жирным кислотам с гидроксильной группой в
С-12-положении, составляет около 90% касторо-
вого масла из семян клещевины, которое находит
применение в медицине, а также как смазочный
материал, снижающий механическую нагрузку
на трущиеся поверхности. Эруковая кислота
используется для технических целей. Изначально
сорта рапса содержали высокую долю эруковой
кислоты в составе триацилглицеринов, поэто-
му рапсовое масло нельзя было употреблять в
пищу1. Около 40 лет назад одним из достижений
обширных селекционных программ стало полу-
чение сортов рапса, у которых содержание эру-
ковой кислоты крайне низкое, поэтому рапсовое
масло начали широко использовать как продукт
питания. В таблице 15.3 приведены данные для
сортов, широко культивируемых повсеместно в
1 Эруковая кислота в составе рапсового масла придает горь-
кий вкус и является токсичным соединением. — Прим. ред.
15.5. Триацилглицерины образуются в мембранах эндоплазматического ретикулума
311
пищевых целях. Однако в последние годы возрос
интерес и к сортам, содержащим много эруковой
кислоты, которые возделывают для промышлен-
ных целей.
Свойства растительных жиров можно
улучшить методами генной инженерии
Прогресс в области генно-инженерных тех-
нологий сейчас позволяет изменять свойства
растительных жиров в нужную сторону, изме-
няя профиль ферментной активности в клетке.
Конкретно способы введения новых ферментов
или снижения активности уже имеющихся фер-
ментов в клетке будут описаны далее в главе 22.
Здесь ограничимся отдельными примерами из-
менения свойств масличных растений с помо-
щью генной инженерии.
1. Лавровая кислота (12:0) присутствует в по-
чатках масличной пальмы и в кокосовом масле.
Она является важным сырьем для производства
мыла, моющих средств и косметики. Трансфор-
мируя растения рапса, удалось добиться высо-
кого содержания лавровой кислоты (до 66%) в
рапсовом масле. Синтез жирных кислот завер-
шается гидролизом ацил-АПБ (см. рис. 15.17).
Из семян Urnbellaria californica (дерево, ра-
стущее вдоль берега моря), которые содержат
необычайно много лавровой кислоты в составе
запасных липидов, был выделен и клонирован
ген ацил-АПБ-тиоэстеразы, специфично гид-
ролизующей лаурил-АПБ. Перенос этого гена
в геном рапса привел к тому, что в развиваю-
щихся семенах биосинтез жирных кислот оста-
навливался, как только длина цепи достигала
12 атомов углерода, далее высвобождалась лав-
ровая кислота и затем включалась в состав три-
глицеридов рапсового масла. Полевые опыты
показали, что генетически модифицированный
рапс может нормально расти и дает приемлемый
урожай1.
2. Сравнительно высокое содержание стеа-
риновой кислоты (18:0) повышает температуру
плавления, при жарке накапливается меньше
вредных продуктов окисления. Такое масло мож-
но также использовать в производстве маргари-
на. У рапса удалось повысить содержание стеа-
риновой кислоты в запасных липидах с 1—2 до
40% путем снижения активности стеарил-АПБ-
десатуразы, вводя генно-инженерную конструк-
цию с антисмысловой последовательностью
соответствующего гена (раздел 22.5). С другой
стороны, степень ненасыщенности жирных кис-
лот можно повысить методами генной инженерии
(например, у того же рапса). Это необходимо для
того, чтобы увеличить пищевую ценность мас-
ла. У сои доля дважды ненасыщенных жирных
кислот может быть повышена до 30%. Диетоло-
ги обнаружили, что полиненасыщенные жирные
кислоты с длинной углеводородной цепью (20:4;
20:5; 22:6) очень полезны для здоровья человека.
Естественным источником этих жирных кислот
является рыбий жир. Генные инженеры пред-
принимают попытки создать трансгенный рапс
с высоконенасыщенными С-20 жирными кис-
лотами в составе масла. Таким образом, генно-
инженерные технологии можно применять для
получения «здоровых продуктов» со сбалансиро-
ванным липидным составом.
3. Эруковая кислота (рис. 15.24) является
ценным сырьем для промышленности, напри-
мер, для производства синтетических волокон
или для контроля пенообразования в растворах
детергентов. В настоящее время использование
эруковой кислоты ограничено, поскольку тради-
ционные методы селекции не позволяют повы-
сить содержание эруковой кислоты в рапсовом
масле более 50%. Стоимость очистки эруковой
кислоты от сопутствующих других жирных кис-
лот настолько высока, что для многих технологий
использование масла современных сортов рапса
как источника эруковой кислоты оказывается не-
рентабельным. Предприняты попытки дальней-
шего увеличения содержания эруковой кислоты
в семенах рапса. Возможно, этого удастся до-
1 Предлагаемая технология позволит получать относитель-
но дешевое масло с лавровой кислотой в холодном климате
(рапс — холодостойкая культура). Плантационное выращи-
вание масличной пальмы ограничено тропическим клима-
том, а заложенные плантации дают урожай через 10—15 лет.
Это обуславливает высокую стоимость пальмового масла.
Рапс дает урожай за один вегетационный сезон. — Прим,
ред.
i /С00е
Эруковая кислота (22:1, Д13-цис)
Рис. 15.24. Эруковая кислота — ценное
промышленное сырье
312
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
стичь гиперэкспрессией генов соответствующих
элонгаз жирных кислот, а также направленным
изменением генов, кодирующих ферменты, ко-
торые специфично встраивают эруковую кисло-
ту в С-2-положение триацилглицерина. Если это
удастся, современный нефтехимический способ
получения эруковой кислоты можно будет заме-
нить на ее добычу из рапсового масла, которое
(в отличие от нефти) является возобновляемым
ресурсом.
15.6. Во время прорастания семян
запасные липиды
мобилизуются в пероксисомах
для синтеза углеводов
В начале прорастания семян запасные белки
(глава 14) распадаются до свободных аминокис-
лот, из которых в дальнейшем образуются фер-
менты, необходимые для мобилизации запас-
ных липидов. В число этих ферментов входят
липазы, которые катализируют гидролиз триа-
цилглицеринов до глицерина и жирных кислот.
Липазы связываются с белками-олеозинами,
расположенными на поверхности олеосом (раз-
дел 15.2). Глицерин, образовавшийся при ги-
дролизе триацилглицерина, после фосфорили-
рования с образованием глицерин-3-фосфата
и последующего окисления до дигидроксиа-
цетонфосфата может далее непосредственно
участвовать в глюконеогенезе (глава 9). Сво-
бодные жирные кислоты сначала активиру-
ются, образуя тиоэфиры с коэнзимом А, а затем
распадаются до двухуглеродных фрагментов
в виде ацетил-КоА. Этот процесс называют
Р-окислением (рис. 15.25). Он происходит в
н н о
I I II
R-CH2-C-C-C-S-K0A
I I
Ацил-КоА Н Н
Каталаза
Ацил-Ко А-
оксидаза
Н2О2
о2
н о
I II
R-CH2-C=C-C-S-KoA
транс-А2 - Еноил-КоА
НО Н О
Еноил-КоА-
гидратаза
р-Кетоацил-КоА
R-CH2-C-C-C-S-KoA
p-L-Г идроксиацил-КоА
НАД
р-Гидроксиацил-
КоА-дегидрогеназа
R-CH2-C-CH2-C-S-KoA
KoA-SH
р-Кетоацил-КоА-
тиолиаза
R—СН2—С— S-KoA + СН3—С—S—КоА
Ацил-КоА Ацетил-КоА
Рис. 15.25. Р-окисление жирных кислот
в глиоксисомах. В начале жирные кислоты
активируются, превращаясь в тиоэфиры
с КоА. Затем образуется ацетил-КоА,
из-за чего цепь жирной кислоты становится
короче на 2 атома углерода. р-Окисление
состоит из первой дегидрогенизации
с участием ФАД-зависимой дегидрогеназы,
присоединения воды, второй
дегидрогенизации (при помощи НАД+)
и тиолиза посредством реакции с KoA-SH
15.6. Во время прорастания семян запасные липиды мобилизуются в пероксисомах
313
Рис. 15.26. Промежуточные продукты
0-окисления ненасыщенных жирных кислот
обязательно должны изомеризоваться, чтобы
получились обычные интермедиаты 0-окисления
А3-цис-Еноил-КоА
Изомераза
А2- транс-Еноил - КоА
О
11 2
б R С—S— КоА А -цис-Еноил-КоА
Еноил-КоА-
гидратаза
С—S—КоА 0-D-Гидроксиацил-КоА
ОН
Дегидратаза
О
11
С—S—КоА А -транс-Еноил-КоА
специализированных органеллах, одной из раз-
новидностей пероксисом — в глиоксисомах.
Хотя в принципе 0-окисление представляет
собой последовательность реакций, обратных
синтезу жирных кислот (см. рис. 15.8), между
этими двумя процессами есть строгие разли-
чия, что позволяет тонко регулировать мета-
болические потоки, идущие в двух противопо-
ложных направлениях. Между 0-окислением и
синтезом жирных кислот есть следующие раз-
личия.
1. При дегидрогенизации ацил-КоА водород
через ФАД-зависимую оксидазу поступает на
кислород с образованием Н2О2. Каталаза необ-
ратимо разрушает токсичную перекись водоро-
да непосредственно в месте ее образования, при
этом образуется вода и кислород (раздел 7.1).
2. После гидратации еноил-КоА образуется
0-Ь-гидроксиацил-КоА, тогда как при синтезе
возникает не L, а D-энантиомер 0-гидроксиацил-
КоА.
3. Атомы водорода во время еще одной де-
гидрогенизации переходят на НАД+, восста-
навливая его. В норме НАД+/НАДН система
в клетке находится в высокоокисленном состоя-
нии (раздел 7.3), что позволяет реакции течь в
направлении окисления гидроксиацил-КоА.
Неизвестно в ходе каких процессов НАДН, об-
разованный в глиоксисомах, вновь окисляется.
4. В необратимой реакции тиолиза с уча-
стием KoA-SH происходит разрыв углеродной
цепи в 0-кетоацил-КоА с образованием одной
молекулы ацетил-КоА и одной молекулы ацил-
КоА, но теперь уже укороченной на два атома
углерода.
При распаде ненасыщенных жирных кис-
лот промежуточные продукты не могут мета-
болизироваться ферментами, участвующими в
0-окислении. А3-1<ш>еноил-КоА (рис. 15.26л),
который образуется из линоленовой кислоты, при
помощи изомеразы, изменяющей положение
двойной связи, превращается в транс-ено-
314
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
АТФ —
АДФ
СО2
глюконеогенез
Фосфоенолпируват
Г ексозы
Рис. 15.27. Мобилизация запасных липидов для синтеза гексоз во время
прорастания семян. Гидролиз триацилглицеринов, присутствующих в олеосомах,
катализируется липазами, связанными с белками-олеозинами. При этом
образуются свободные жирные кислоты, которые активируются, превращаясь
в тиоэфиры с КоА, что способствует их дальнейшему 0-окислению до ацетил-КоА
В одном «обороте» глиоксилатного цикла из двух молекул ацетил-КоА образуется
одна молекула сукцината, которая далее в митохондриях за счет окислительных
реакций цикла Кребса превращается в оксалоацетат. В цитозоле из оксалоацетата
образуется фосфоенолпируват — предшественник синтеза гексоз в процессе
глюконеогенеза
15.6. Во время прорастания семян запасные липиды мобилизуются в пероксисомах для синтеза
315
ил-КоА (т.е. в один из промежуточных продук-
тов р-окисления). При р-окислении линолевой
или линоленовой кислоты вторая двойная связь
в промежуточном продукте занимает правильное
положение, однако находится в «неправильной»
^wc-конфигурации. При гидратации с участи-
ем еноил-КоА-гидратазы как промежуточный
продукт образуется p-D-гидроксиацил-КоА
(рис. 15.266). В дальнейшем дегидратаза превра-
щает его в Д2-лирянс-еноил-КоА, который легко
вступает в р-окисление.
Глиоксилатный цикл позволяет растениям
синтезировать гексозы из ацетил-КоА
В отличие от животных, которые не способны
синтезировать глюкозу из ацетил-КоА, расте-
ния могут осуществлять глюконеогенез из ли-
пидов, поскольку у них есть ферменты глиокси-
латного цикла (рис. 15.27). Как и р-окисление,
глиоксилатный цикл происходит в глиоксисо-
мах (эти микротельца были названы по проте-
кающему в них циклу). Две начальные реакции
глиоксилатного цикла и цикла Кребса полно-
стью совпадают (см. рис. 5.3). Ацетил-КоА кон-
денсируется с оксалоацетатом, образуя цитрат
(реакцию катализирует цитратсинтаза). Сле-
дующая реакция идет при участии аконитазы:
цитрат превращается в изоцитрат. В следующей
реакции проявляется специфика глиоксилатно-
го цикла: изоцитратлиаза расщепляет изоци-
трат на сукцинат и глиоксилат (рис. 15.28). Ма-
латсинтаза, еще один характерный фермент
глиоксилатного цикла, вызывает быструю кон-
денсацию глиоксилата и ацетил-КоА, что при-
водит к образованию малата. Гидролиз тиоэ-
фирной связи в ацетил-КоА делает эту реакцию
необратимой. Как и в цикле Кребса, в глиок-
силатном цикле малат окисляется малатдеги-
дрогеназой до оксалоацетата, завершая, таким
образом, цикл. В итоге из двух молекул ацетил-
КоА образуется одна молекула сукцината, кото-
рая выходит из глиоксилатного цикла. Сукци-
нат далее транспортируется в митохондрии, где
окисляется при помощи части ферментов цик-
ла Кребса до оксалоацетата. Оксалоацетат через
оксалоацетатный переносчик покидает мито-
хондрию и в цитозоле превращается в фосфое-
нолпируват при участии фосфоенолпируваткар-
боксикиназы (см. рис. 8.10). Фосфоенолпируват
является предшественником для синтеза гексоз
соо
I
но-с-н
н-с-соое
I
н-с-н
соое
Изоцитрат-
лиаза
Изоцитрат
СОО
_ I
О-С-Н Глиоксилат
Н
н-с-соое
I
Н-С-Н
СООе
Сукцинат
Ацетил-КоА
/S-KoA
С
I
н-с-н
I
н
н-с=о
соо}
Глиоксилат
Малат-
синтаза
KoA-SH
СООе
I
н-с-н
I
н-с-он
I
соо4
Малат
Рис. 15.28. Ключевые реакции глиоксилатного
цикла
в процессе глюконеогенеза, а также для других
биосинтетических процессов.
В пероксисомах протекают реакции
с образованием токсичных интермедиатов
Есть довольно простое объяснение тому факту,
что р-окисление жирных кислот и тесно с ним
связанный глиоксилатный цикл происходит
в глиоксисомах (специализированных перок-
сисомах). В процессе фотодыхания (в котором
пероксисомы также участвуют — см. раздел 7.1)
образуются токсичные вещества: перекись во-
дорода и глиоксилат. Оказывается, эти же
интермедиаты образуются при превращении
жирных кислот в сукцинат. Компартментация
в пероксисомах и глиоксисомах не позволя-
ет токсичным веществам выходить в цитозоль
(раздел 7.4). р-Окисление происходит также и
в пероксисомах листа, хотя в гораздо меньшем
объеме. Здесь р-окисление позволяет реутили-
зировать жирные кислоты, которые в данный
момент не нужны, либо повреждены. Реутили-
зация липидов играет важную роль при листо-
паде (старении листа), когда углеводы синте-
зируются из продуктов деградации мембранных
316
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
липидов в желтеющем листе, а затем углеводы
транспортируются по флоэме в стебель и да-
лее (раздел 19.7). Во время старения можно на-
блюдать дифференцировку пероксисом листа
в глиоксисомы (иногда их называют геронто-
сомами). Гидрофобные аминокислоты, такие
как лейцин и валин, также перерабатываются
в пероксисомах.
15.7. Липоксигеназа участвует
в синтезе оксилипинов,
играющих роль сигнальных
и защитных соединений
К оксилипинам, которые образуются из продук-
тов окисления ненасыщенных жирных кислот
кислородом, относят множество разнообразных
сигнальных веществ, широко распространен-
ных как среди растений, так и в животном мире.
У животных оксилипины представлены проста-
гландинами, лейкотриенами и тромбоксанами,
для которых базовые функции в регуляции фи-
зиологических процессов хорошо изучены. Так
и у растений: оксилипины представлены очень
большим числом соединений, в основном замет-
но отличающихся от животных оксилипинов.
Они вовлечены в защитные реакции (т.е. явля-
ются сигнальными веществами, регулирующими
каскады защитных реакций). Среди оксилипи-
нов есть фунгициды, бактерицидные вещества,
инсектициды, а также вещества, привлекающие
хищных и паразитических насекомых, которые
питаются насекомыми-вредителями. Более того,
оксилипины участвуют в заживлении ран, регу-
лируют вегетативный рост, вызывают старение.
Наши знания об этих важных веществах все еще
достаточно фрагментарны.
У растений оксилипины синтезируются
в основном при помощи липоксигеназ. Эти фер-
менты относят к классу диоксигеназ, поскольку
они катализируют внедрение обоих атомов мо-
лекулы кислорода в молекулу жирной кислоты (в
противоположность монооксигеназам, включаю-
щим лишь один из атомов молекулы О2 в органи-
ческие вещества—см. раздел 15.3). Липоксигеназы
представлены семейством ферментов с диоксиге-
назной активностью, использующих в качестве
субстрата полиненасыщенные жирные кислоты,
такие как линолевая и линоленовая кислоты, в
которых есть цис, цис-Х,4-пентадиеновый фраг-
мент молекулы (на рис. 15.29 выделен красным).
Кислород присоединяется к концу этой харак-
терной последовательности, образуя гидроперок-
сидную группу, причем соседняя двойная связь
перемешается ближе ко второй двойной связи,
приобретая лирянс-конфигурацию. Гидропе-
роксидлиаза катализирует разрыв углеродного
скелета гидропероксилиноленовой кислоты с об-
разованием 12-оксокислоты и З-^д/с-гексеналя.
Еще большее разнообразие гексеналей возникает
при перемещении положения двойной связи, а
их дальнейшее восстановление приводит к обра-
зованию гексенолов (см. рис. 15.29). Аналогично
из гидропероксилинолевой кислоты получаются
гексаналь и, после восстановления, гексанол.
Гексаналь, гексанол, гексенали и гексено-
лы — летучие вещества, обладающие запахом,
которые придают аромат и вкус многим фрук-
там и овощам. В зависимости от композиции
летучие оксилипины могут создавать фрукто-
вый, сладкий, пряный или травянистый запах.
Ведутся работы по усилению вкуса и запаха то-
матов, у которых содержание гексенолов было
бы повышено методами генной инженерии.
Качество оливкового масла, кстати, также за-
висит от содержания гексеналей и гексенолов.
Гексенали ответственны за характерный аромат
черного чая. Свежие листья чая при переработке
сначала подвергают ферментации (нарушается
целостность мембран, усиливается активность
липоксигеназ и гидропероксидлиаз). Затем при
нагревании гексенали конденсируются, с об-
разованием веществ, придающих вкус и аромат
конечному продукту — черному чаю. Большое
количество гексеналей и гексенолов синтезиру-
ют искусственно, используя их как ароматиза-
торы в пищевой промышленности и для изго-
товления парфюмерии.
Характерный запах свежескошенной тра-
вы возникает благодаря выделению гексеналей
и гексенолов, что указывает на значительное
возрастание активности липоксигеназ и гидро-
пероксидлиаз при повреждении тканей. Это —
одна из защитных реакций растений. Когда
лист поврежден питающимися личинками на-
секомых, он привлекает естественных врагов
этих личинок, выделяя летучие вещества ок-
силипиновой природы. Например, поражение
растений кукурузы или хлопчатника привлекает
наездников, которые откладывают яйца в тело
15.7. Липоксигеназа участвует в синтезе оксилипинов
317
а-Линоленовая кислота
СООН
цис, цис-Д ,4-Пентадиеновая группировка
13-Гидроперокси- х
а-линоленовая кислота
Липоксигеназа
13
СООН
Гексенолы
Гексенали
Алкоголь
дегидрогеназа
Г идропероксид-
лиаза
2-транс-Гексеналь
Бактерицид
Фунгицид
Инсектицид
12-Оксододека-10-еновая кислота
Травматин
(раневой гормон)
Рис. 15.29. Используя кислород (О2) в качестве одного из субстратов,
липоксигеназа катализирует введение гидроксипероксидной группы в характерную
цис, цис-1,4-пентадиеновую последовательность двойных связей (показана
красным). Гидропероксидлиаза разрывает связь между 12 и 13 атомами углерода.
Получившийся в результате гексеналь далее изомеризуется из-за перемещения
положения двойной связи (предполагают, что с участием специфических
ферментов). Алкогольдегидрогеназа восстанавливает гексенали до соответствующих
гексенолов. 12-Оксододекаеновая кислота является вторым продуктом липазной
реакции, который изомеризуется в травматин, с перемещением двойной связи
в С-10 положение. Существуют также липоксигеназы, внедряющие перокси-группу
в позицию 9
318
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
СООН
Укорочение цепи
при р-окислении
и восстановлении
12-Оксофито-
диеноевая кислота
(ОФДК, OPDA)
13-Гидроперокси-
а-линоленовая кислота
СООН
Эпоксидированный спирт
Жасмоновая кислота
Рис. 15.30. Как алленоксидсинтаза, так и алленоксидциклаза принадлежат
к семейству ферментов, содержащих гем Р450 (раздел. 18.2). Они катализируют
циклизацию гидропероксилиноленовой кислоты, перегруппировывая связи
с кислородом. Эти реакции происходят в хлоропластах. Укорочение
жирнокислотной цепи на 6 атомов углерода путем р-окисления приводит
к образованию жасмоновой кислоты — вещества гормональной природы
с сигнальными функциями. р-Окисление происходит в пероксисомах.
Дивинилэфирсинтаза катализирует превращение гидроперокси-производных
в дивиниловые эфиры, а эпоксиалкогольсинтаза — в эпоксидированные спирты.
Оба типа соединений являются фунгицидами и синтезируются в ответ на грибную
инфекцию.
питающихся листьями личинок вредителей. Бо-
лее того, 2-транс-гексеналь (выделен красным
на рис. 15.29) является сильным бактерицид-
ным, фунгицидным и инсектицидным агентом.
Гексенали также взаимодействуют с факторами
транскрипции, запуская каскад защитных реак-
ций. 12-Оксододека-10-еновая кислота обладает
свойствами раневого гормона и получила на-
звание травматина. Травматин образуется при
распаде гидропероксилиноленовой кислоты,
при этом изменяется положение двойной свя-
зи. Травматин стимулирует деления в соседних
клетках. Это приводит к образованию каллуса и
рана, нанесенная растению, зарастает. Однако
накопленных знаний о механизмах этих защит-
ных реакций пока еще явно недостаточно.
Гидроперокси-а-линоленовая кислота может
превращаться под действием дивинилэфирсин-
тазы в дивиниловый эфир (рис. 15.30). Такие
дивиниловые эфиры обладают выраженной фун-
гицидной активностью и в больших количествах
синтезируются, например, у картофеля при по-
320
15. Глицеролипиды являются компонентами мембраны и служат запасом углерода
ражении грибом Phytophtora infestans. Действуя
последовательно, алленоксидсинтаза и циклаза
вызывают циклизацию 13-гидроперокси-а-ли-
ноленовой кислоты (рис. 15.30). Укорочение
углеводородной цепи путем р-окисления (см.
рис. 15.25) циклизованного продукта приводит к
образованию жасмоновой кислоты. У растений
обнаружены многочисленные производные жас-
моновой кислоты включая сульфатированные со-
единения и метиловые эфиры, которые получили
сборное название жасмонатов. Жасмонаты об-
ладают выраженными гормональными свойства-
ми. По приблизительным оценкам жасмонаты в
целом регулируют экспрессию нескольких сотен
генов. Например, они играют важную роль в по-
вышении устойчивости растений к насекомым и
заболеваниям, в образовании цветков, плодов и
семян; в инициации старения (раздел 19.9).
Недавно было показано, что липоксигена-
зы могут участвовать в мобилизации запасных
липидов в олеосомах. Липидный монослой, по-
крывающий олеосому снаружи, в числе прочих
белков содержит липоксигеназы. Эти фермен-
ты вводят пероксидные группы в остатки по-
линенасыщенных жирных кислот, входящих в
состав триацилглицеринов (рис. 15.31). Только
после перекисного окисления эти триацилгли-
церины гидролизуются липазами, которые так-
же находятся на поверхности олеосомы. После
восстановления перокси-производных жирных
кислот до гидроксижирных кислот, они могут
далее поступать в глиоксисомы, где подвергают-
ся р-окислению до ацетил-КоА (см. рис. 15.25).
Этот путь мобилизации запасных липидов суще-
ствует параллельно основному «классическому»
пути мобилизации, запускаемому активацией
липаз олеосомы (как было рассмотрено ранее).
Похоже, что вклад этих двух путей в мобилиза-
цию липидов зависит от вида растений. Обра-
зующийся в конечном итоге ацетил-КоА служит
субстратом для глиоксилатного цикла и после-
дующего глюконеогенеза (см. рис. 15.27).
Дополнительная литература
Blee, Е. Impact of phyto-oxylipins in plant defense. Trends
Plant Sci 7, 315-321 (2002).
Gaboon, E. B., Ripp, K. G., Hall, S. E., Kinney, A. J.
Formation of conjugated D8, DIO double bonds by
delta 12-oleic acid desaturase related enzymes. J Biol
Chem 276, 2083-2087 (2001).
Chasan, R. Engineering of fatty acids: The long and short
of it. Plant Cell 7, 235-237 (1995).
Dormann, P., Benning, C. Galactolipids rule in seed
plants. Trends Plant Sci 7, 112-117 (2002).
Eastmond P. J., Graham, I. A. Re-examining the role
of the glyoxylate cycle in oilseeds. Trends Plant Sci 6,
72-77(2001).
Feussner, I., Kuhn, H., Wasternack, C. Lipoxygenase-
dependent degradation of storage lipids. Trends Plant
Sci 6, 1360-1385 (2001).
Feussner, I., Wasternack, C. The lipoxygenase pathway.
Annu Rev Plant Physiol Plant Mol Biol 53, 275—297
(2002).
Hatanaka, A. The biogeneration of green odour by green
leaves. Phytochemistry 34, 1201 — 1218 (1993).
Huang, A. H. C. Oleosin and oil bodies in seeds and other
organs. Plant Physiol 110, 1055-1062 (1996).
Kader, J.-C. Lipid-transfer proteins: A puzzling family of
plant proteins. Trends Plant Sci 2, 66—70 (1997).
Murakami, Y., Tsuyama, M., Kobayashi, Y, Kodama, H.,
Ida, K. Trienoic fatty acids and plant tolerance of high
temperature. Science 287, 476—479, (2000).
Ohlrogge, J. B., Browse, J. Lipid biosynthesis. Plant Cell,
7, 957-970 (1995). Pare, P. W., Tumlinson, J. H. Plant
volatiles as a defense against insect herbivores. Plant
Physiol 121, 325-333 (1999).
Porta, H., Rocha-Sosa, M. Plant lipoxygenases.
Physiological and molecular features. Plant Physiol 130,
15-21 (2002).
Reumann, S., Bettermann, M., Benz, R., Heldt, H.W.
Evidence for the presence of a porin in the membrane of
glyoxysomes of castor bean. Plant Physiol 115, 891—899
(1997).
Ross, J. H. E., Sanchez, J., Millan, F, Murphy, D. J.
Differential presence of oleosins in oleogenic seed and
mesocarp tissue in olive (Olea europea) and avocado
(Persea americana). Plant Sci 93, 203—210 (1993).
Schaller, H. The role of sterols in plant growth. Prog Lipid
Res 42, 163-175 (2003).
Shanklin, J., Cahoon, E. B. Desaturation and related
modifications of fatty acids. Annu Rev Plant Physiol
Plant Mol Biol 49, 611-641 (1998).
Spassieva, S., Hille, J. Plant Sphingolipids today—are they
still enigmatic? Plant Biol 5, 125—136 (2003).
Sperling, P., Heinz, E. Plant sphingolipids: Structural
diversity, biosynthesis, first genes and functions.
Biochim Biophys Acta 1632, 1—5 (2003).
15.7. Липоксигеназа участвует в синтезе оксилипинов
321
Sperling, Р., Temes, Р., Zank, Т. К., Heinz, Е. The evolution
of desaturases. Prostaglandins, Leukomens, Essential Fatty
Acids 68,73-95 (2003).
Stumpf, P. K. (ed.) Lipids: Structure and Function.
The Biochemistry of Plants, Vol. 9, Academic Press,
Orlando, San Diego, New York, (1987).
Voelker, T., Kinney, A. J. Variations in the biosynthesis of
seed-storage lipids. Annu Rev Plant Physiol Plant Mol
Biol 52, 335-361 (2001).
Weber, H. Fatty acid derived signals in plants. Trends Plant
Sci 7,217-224(2002).
Weber, S., Zarhloul, K., Friedl,W. Modification of oilseed
quality by genetic transformation. Prog Bot 62, 140—174
(2001).
Worrall, D., Ng, C. K.-J., Hetherington, A. M.
Sphingolipids, new players in plant signalling. Trends
Plant Sci 8, 317-320 (2003).
Yalovsky, S., Rodriguez-Concepcion, M., Gruissem, W.
Lipid modifications of proteins — slipping in and out of
membranes. Trends Plant Sci 4, 439—445 (1999).
Вторичные метаболиты выполняют в растениях
прежде всего экологические функции1
Помимо первичных метаболитов — углеводов,
аминокислот, жирных кислот, цитохромов,
хлорофиллов, соединений-интермедиатов раз-
личных ассимиляционных и катаболических
реакций — растения содержат огромное коли-
чество веществ, не участвующих в основном
клеточном обмене. Эти соединения принято на-
зывать вторичными метаболитами. В отличие
от первичных метаболитов, присутствующих во
всех растительных клетках, вторичные метабо-
литы могут быть специфичны для одного или
нескольких отдельных видов растений, выпол-
няя особые экологические функции, например,
принимая участие в размножении (вещества-
аттрактанты, привлекающие насекомых-опыли-
телей или животных для распространения
семян) и защите (природные пестициды) рас-
тительных организмов.
16.1. Вторичные метаболиты
защищают растения
от патогенных
микроорганизмов и травоядных
Растения содержат большое количество белков
и углеводов и являются ценным источником пи-
тания для многих видов животных — насекомых,
крупных травоядных, улиток. Поскольку расти-
тельные организмы не могут убежать от опасно-
сти, им приходится использовать различные за-
щитные системы, в результате действия которых
растения становятся несъедобными или ядови-
1 В данной главе приведены некоторые классы вторичных
метаболитов, содержащих азот. Вторичные метаболиты изо-
преноидной природы рассматриваются в главе 17, а вторич-
ные метаболиты фенольной природы — в главе 18. В книге
не рассмотрены беталаины, необычные липиды, полиаце-
тилены, аллицины и многие другие классы вторичных ме-
таболитов.
тыми, что спасает их от уничтожения. Многие
виды растений синтезируют токсичные белки
(например, лектины или ингибиторы амилаз и
протеиназ), которые действуют на пищевари-
тельную систему травоядных (раздел 14.4). При
нападении гусениц кукуруза накапливает про-
теазу, нарушающую работу кишечника. Среди
различных групп вторичных метаболитов, о ко-
торых пойдет речь, — алкалоидов (глава 16), изо-
преноидов (глава 17), фенилпропаноидов (гла-
ва 18) — встречаются соединения, выполняющие
также роль природных пестицидов, защищаю-
щих растительные организмы от патогенных
микроорганизмов и травоядных. У некоторых
видов растений содержание этих веществ состав-
ляет до 10% от сухого веса.
Вторичные метаболиты, предназначенные
для защиты от травоядных, постоянно присут-
ствующие в тканях и органах растительного ор-
ганизма относят к конститутивным защитным
соединениям. Однако растения могут также
образовывать защитные соединения в ответ на
соответствующее воздействие — механическое
повреждение, ощипывание листьев и т. д. Такие
защитные вещества называют индуцибельны-
ми. Так, например, при объедании листьев не-
которые виды акации начинают синтезировать
большие количества танинов, что делает ли-
стья несъедобными (раздел 18.7). Другие расте-
ния для защиты от гусениц применяют летучие
соединения (эфирные масла), привлекающие
наездников-паразитов (отряд перепончатокры-
лые). Наездники откладывают яйца в гусениц,
и гусеницы погибают.
Микроорганизмы —
потенциальные патогены
К фитопатогенам относят некоторые виды гри-
бов и бактерий, которые используют ресурсы
16.1. Вторичные метаболиты защищают растения от патогенных микроорганизмов и травоядных 323
растительного организма для поддержания соб-
ственной жизнедеятельности. Чаше всего такие
взаимоотношения приводит к повреждению, ин-
фицированию и гибели растения-хозяина. Па-
тогены воздействуют на растительный организм
с помощью гидролитических ферментов, раз-
рушающих компоненты клеточных стенок, или
токсинов, повреждающих ткани. К таким ток-
синам относят, например, токсин фузикокцин,
синтезируемый грибом Fusicoccum amygdalis
(раздел 10.3). Способность патогена к синтезу
патотоксинов определяется присутствием ге-
нов вирулентности и авирулентности. В свою
очередь растения обладают обширным набором
генов устойчивости, которые регулируют синтез
защитных соединений с антибиотической ак-
тивностью1. Взаимодействие генов устойчиво-
сти у растения и генов вирулентности у патогена
определяет тип инфекции и возможность (или
невозможность) поражения растительного орга-
низма.
Если растение восприимчиво, а патоген,
в свою очередь, агрессивен, это приводит к за-
болеванию растения. Микроорганизм в этом
случае называют вирулентным. Если расти-
тельный организм обладает высокой устойчиво-
стью и способен подавлять развитие паразита,
говорят об иммунной реакции растения. Часто
степень устойчивости или восприимчивости
растения-хозяина может зависеть всего лишь от
одного гена.
В ответ на поражение патогенными
микроорганизмами растения синтезируют
фитоалексины
Фитоалексины (от греч. alekein — защи-
щать) — индуцибельные защитные вещества с
антибиотической активностью, которые расте-
ния синтезируют при инфицировании в ответ на
поражение патогенными грибами. Фитоалек-
синами могут быть различные классы вторич-
ных метаболитов — изопреноиды, флавоноиды,
1 Генетические механизмы патогенеза на самом деле слож-
нее. Гены авирулентности могут кодировать белки (необя-
зательно токсины), важные для жизнедеятельности микро-
организма. Продукты генов авирулентности распознаются
рецепторами растений. Именно эти рецепторы являются
продуктами генов устойчивости растений, определяющи-
ми специфическое распознавание и иммунную реакцию на
внедрение патогена. — Прим. ред.
стильбены. Вследствие разнообразия растений
и фитопатогенов спектр защитного действия
этих соединений очень обширен. Защитные
механизмы растения включают также актив-
ные формы кислорода (например, супероксид-
радикалы (*О2_) и Н2О2), моноксид азота NO
(раздел 19.9), различные типы ферментов, таких
как р-глюканазы, хитиназы, протеиназы, разру-
шающие клеточные стенки грибов и бактерий.
Синтез этих защитных соединений запускает-
ся при взаимодействии растительной клетки с
элиситорами — экзометаболитами патогенного
организма. Элиситоры могут иметь различную
химическую природу. К ним относят белки-
токсины, ферменты, выделяемые патогеном для
разрушения растительной клеточной стенки,
полисахаридные фрагменты клеточной стенки
растения-хозяина. Элиситорами также могут
служить фрагменты полимеров клеточной стен-
ки самого патогена, которые образуются при
действии защитных ферментов растения. Свя-
зывание элиситоров с соответствующими специ-
фическими рецепторами на внешней поверхно-
сти плазмалеммы растительной клетки включает
работу ряда сигнальных каскадных систем при
участии различных протеинкиназ (раздел 19.1)
с образованием сигнальных молекул, прежде
всего салициловой (раздел 18.2) и жасмоновой
(раздел 15.7) кислот2. Сигнальные соединения в
свою очередь способствуют образованию актив-
ных форм кислорода и активируют транскрип-
цию генов, отвечающих за синтез фитоалекси-
нов, защитных ферментов (раздел 19.9).
Образование комплексов элиситор-рецептор
также может вызывать у растения реакцию
сверхчувствительности — быструю програм-
мируемую гибель инфицированных клеток, а
также клеток, расположенных рядом с погиб-
шими. Образующиеся в результате инфицирова-
ния и отмирания клеток токсичные фенольные
соединения способствуют дальнейшему раз-
витию некроза ткани. В клетках, окружающих
некротический участок, происходит усиленная
лигнификация клеточных стенок, что создает
дополнительный барьер на пути дальнейшего
развития патогена.
2 Важную сигнальную роль также играют олигосахари-
ны и короткие пептиды, которые обеспечивают системную
устойчивость к патогенам. — Прим. ред.
324
16. Вторичные метаболиты выполняют в растениях прежде всего экологические функции
Некоторые вторичные метаболиты
могут быть опасны для человека
Соединения, токсичные для животных орга-
низмов, в большинстве случаев также токсичны
и для человека. Благодаря искусственному от-
бору, количество токсичных или несъедобных
вторичных метаболитов в сельскохозяйственных
растениях снижено до минимума. Однако при
этом культурные сорта в отличие от диких видов
часто обладают пониженной устойчивостью к
действию фитопатогенов, что обусловливает не-
обходимость жесткого контроля за распростра-
нением инфекций с применением различных
химикатов. Попытки создать более устойчивые
сорта при помощи скрещивания с дикорасту-
щими формами не всегда приводят к успешным
результатам. Так, один из новых выведенных со-
ртов картофеля с повышенной устойчивостью
против насекомых-паразитов оказался совер-
шенно не пригодным к употреблению в пищу
вследствие повышенного содержания токсично-
го алкалоида соланина (см. следующую главу), и
его пришлось изъять из обращения. Десятикрат-
ное превышение содержания псоралена у нового
устойчивого сорта сельдерея, культивируемого
в США, явилось причиной развития серьезных
повреждений кожи у сборщиков урожая. Эти
примеры показывают, что использование при-
родных механизмов защиты для повышения
устойчивости культурных растений к воздей-
ствию патогенов также небезопасно.
Некоторые опасные для человека вторичные
метаболиты (например, цианогенные гликози-
ды или глюкозинолаты, о которых пойдет речь
в этой главе), белковые соединения, такие как
лектины, ингибиторы амилаз и протеиназ, раз-
лагаются при повышенных температурах (при
жарении или варке). Однако большинство рас-
тительных метаболитов нельзя нейтрализовать
таким способом. В повышенных концентраци-
ях многие вторичные метаболиты становятся
канцерогенными. Установлено, что в развитых
странах более 99% всех канцерогенных веществ,
попадающих в организм человека, составляют
естественные вторичные метаболиты раститель-
ного происхождения, регулярно употребляемые
в пищу. Правда, как показывает опыт, организм
человека обладает значительной устойчивостью
к воздействию этих вредных веществ.
16.2. Алкалоиды объединяют
обширную группу вторичных
метаболитов на основе
гетероциклов
Алкалоиды принадлежат к группе вторичных
метаболитов, которые синтезируются из ами-
нокислот и содержат в составе образующегося
гетероцикла один или несколько атомов азота1.
Алкалоиды используются растением для защи-
ты от животных и микроорганизмов. Поскольку
большинство алкалоидов являются основания-
ми, они обычно запасаются в протонированной
форме, что особенно актуально при хранении в
вакуолях. Экстракты алкалоидов на протяжении
столетий использовались человеком в качестве
ядов, стимуляторов, наркотиков и медикамен-
тов. Еще в 1806 г. помощник аптекаря Фридрих
Вильгельм Сертюрнер выделил из мака мор-
фин, но лишь 146 лет спустя в 1952 г. удалось
окончательно установить его структурную фор-
мулу. В настоящее время известно более 10000
различных алкалоидов. Пути их образования
чрезвычайно разнообразны, а для целого ряда
алкалоидов схема синтеза не ясна до сих пор.
Алкалоиды классифицируют в зависимости
от химической структуры гетероциклического
кольца. На рисунке 16.1 представлены струк-
турные формулы некоторых известных алкало-
идов. Кониин относят к группе пиперидиновых
алкалоидов, это сильнейший яд, синтезируе-
мый болиголовом пятнистым. Именно от этого
яда умер Сократ1 2. Никотин содержит в своем
составе пиридиновое и пироллидиновое коль-
цо. Этот алкалоид синтезируется в корнях та-
бака и транспортируется по ксилеме к побегам
и листьям. Никотин чрезвычайно токсичен, а
сульфат никотина — побочный продукт табач-
ного производства — используется в качестве
мощного инсектицида (например, для обра-
1 В данном случае имеется в виду группа истинных алка-
лоидов, синтезирующихся из аминокислот. Помимо нее к
алкалоидам принято относить протоалкалоиды, у которых
азот не входит в состав гетероцикла, и псевдоалкалоиды,
синтез некоторых происходит не из аминокислот. — Прим,
ред.
2 Предполагают, что кроме кониина из болиголова пятни-
стого в кубок Сократа мог входить цикутотоксин из веха бо-
лотного. — Прим. ред.
16.2. Алкалоиды объединяют обширную группу вторичных метаболитов на основе гетероциклов
325
Лизин
Кониин
(пиперидин)
Орнитин
Аспартат
Никотин
(пиридин,
пирролидин)
Орнитин
Кокаин
(тропан)
Триптофан
Хинин
(хинолин)
Тирозин
Морфин
(изохинолин)
Пурин
(Аспартат,
Глицин, Глутамин)
Кофеин
(пурин)
Рис. 16.1. Некоторые алкалоиды и аминокислоты, из которых они синтезируются.
Гетероциклические структуры, по которым проводят химическую классификацию
алкалоидов, выделены цветом, а название соответствующего гетероцикла
дано в скобках. Для кониина описан также биосинтез из ацетил-КоА. Пурины
синтезируются из аспартата, глицина и глутамина.
ботки теплиц и оранжерей). Пока еще не най-
дено ни одного вида насекомых, устойчивых
к действию никотина. В структуру алкалоида
кокаина — широко известного наркотика —
входит тропан, где атом N принадлежит сразу
двум циклам. Еще один известный тропановый
алкалоид — токсин атропин — содержится в
белладонне (Atropa belladonna). Поскольку
в малых дозах атропин вызывает расширение
зрачков, он широко применяется в медицине
(офтальмологии) при обследовании глаз. Ин-
тересно, что это свойство атропина известно
326
16. Вторичные метаболиты выполняют в растениях прежде всего экологические функции
со времен Клеопатры, которая использовала
экстракты, содержащие атропин, для того что-
бы расширить зрачки и придать глазам при-
влекательный блеск. При помощи хинина,
хинолинового алкалоида из коры Cinchona of-
ficinalis. произрастающего в Южной Америке,
испанские завоеватели лечили малярию1. Изо-
хинолиновый алкалоид морфин используется
в качестве сильного обезболивающего, кроме
того, он является предшественником синтеза
героина. В структуру алкалоида кофеина, син-
тезируемого растением кофе и обладающего
стимулирующими и возбуждающими свойства-
ми, входит пуриновое кольцо.
В настоящее время, с целью создания новых
лекарственных средств, проводятся многочис-
ленные систематические исследования вторич-
ных метаболитов, синтезируемых различными
видами растений. Так, в тисе Taxus brevifolia
был обнаружен и выделен таксол1 2, обладающий
противоопухолевыми свойствами. Препараты
на основе производных алкалоида камтотеци-
на из китайского «дерева счастья» Camptotheca
acuminate прошли клинические испытания и
используются в противораковой терапии. Про-
должаются поиски эффективных препаратов
против возбудителей малярии и различных ви-
русных инфекций. К сожалению, содержание
вторичных метаболитов в растениях различных
видов очень незначительно. Для увеличения
выхода продуктов вторичного метаболизма ис-
пользуют методы генной инженерии растений
(для повышения синтеза биологически актив-
ных соединений). Кроме того, предпринима-
ются попытки по переносу соответствующих
растительных генов в микроорганизмы с целью
разработки технологии получения вторичных
метаболитов.
16.3. Некоторые растения
для защиты от животных
используют синильную кислоту
Поскольку синильная кислота (HCN) пода-
вляет действие цитохромоксидазы на конечной
стадии дыхательной цепи и является мощным
ядом (раздел 5.5), около 10%всех раститель-
ных организмов используют именно этот ток-
син для защиты3. Так, употребление в пищу
ядер горького миндаля или персиковых косто-
чек может иметь фатальные последствия для
человека4. Как и у животных, в дыхательной
цепи растений также есть комплексы, ингиби-
руемые цианидом, и поэтому в растительной
клетке синильная кислота запасается в связан-
ной нетоксичной форме в виде цианогенных
гликозидов, чтобы не вызывать самоотравле-
ния организма. Примером такого цианогенно-
го гликозида является амигдалин из косточек
и корней персика (рис. 16.2).
Цианогенные гликозиды являются ста-
бильными соединениями и накапливаются в
вакуолях. Специфическая гликозидаза, ката-
лизирующая гидролиз гликозидов, локализо-
вана в другом компартменте. При нарушении
целостности клетки или ткани за счет прямого
поражения животными или насекомыми ком-
партментация нарушается, и фермент вступает
во взаимодействие с субстратом5. В результа-
те гидролиза отщепляется углеводный остаток
и образуется цианогидрин, который является
нестабильным соединением и в свою очередь
распадается на синильную кислоту и альдегид.
Процесс разложения цианогидрина идет бы-
стрее в присутствии фермента гидроксини-
триллиазы. Образующиеся в результате гидро-
лиза цианогенных гликозидов альдегиды также
1 Фраза содержит ряд неточностей. Лекарственные свой-
ства отвара коры хинного дерева были известны южноаме-
риканским индейцам задолго до испанского завоевания.
Испанцам в течение длительного времени не был известен
секрет приготовления противомалярийного отвара. В чи-
стом виде хинин был выделен и внедрен в медицинскую
практику в Европе. — Прим. ред.
2 Таксол не является истинным алкалоидом. Это дитерпе-
ноид, у которого при модификации молекулы включен атом
азота. — Прим. ред.
3 Это предварительная оценка, поскольку с точки зрения
вторичного метаболизма исследовано не более 20% всех ви-
дов. Синтез цианогенных гликозидов характерен для сем.
Rosaceae. — Прим. ред.
4 Летальная доза для взрослого человека — около 60 ядер
горького миндаля, ребенка - 5—6 ядер. Съесть такое коли-
чество невозможно из-за невыносимого горького вкуса. —
Прим. ред.
5 Такой механизм защиты называют полуиндуцибельным,
так как непосредственный предшественник ядовитого сое-
динения и фермент постоянно присутствуют в разных ком-
партментах клетки. Образование активных веществ проис-
ходит при повреждениях — Прим. ред.
16.4. Некоторые растения при повреждении выделяют летучие горчичные масла
327
R
I
Сахар—О-С—R
I
Цианогенный
гликозид
Гликозидаза
Н2О
Сахар
R
I
H-O-C-R
I
C=N
Цианогидрин
Г идроксинитриллиаза
HCN
R
I
О=С—R
Синильная
кислота
Рис. 16.2. а. Амигдалин, цианогенный гликозид, содержащийся в косточках
(семенах) некоторых фруктов, б. В результате гидролиза от цианогенного гликозида
отщепляется углеводный фрагмент и образуется цианогидрин, который в свою
очередь распадается на синильную кислоту и соединение с карбонильной группой
чрезвычайно токсичны, и провести детоксика-
цию после отравления этой группой соединений
порой гораздо сложнее, чем после воздействия
синильной кислоты. Благодаря возможности
образования сразу двух токсичных соединений,
защитная система с использованием цианоген-
ных гликозидов весьма эффективна.
16.4. Некоторые растения
при повреждении выделяют
летучие горчичные масла
Глюкозинолаты — гликозиды горчичных масел—
также применяются для защиты от травоядных.
Эти метаболиты характерны, например, для ре-
диса, капусты и видов горчицы. Капуста содер-
н он
б R
Сахар—s—C= №0—80® Глюкозинолат
T иоглюкозидаза
самопроизвольный
переход
R
HS-C= N-0-SOf
R—N = С= S Изоцианат
(горчичное масло)
Рис.16.3. а. Глюкобрассицин, глюкозинолат капусты, б. Гидролиз гликозида
тиоглюкозидазой приводит к образованию нестабильного продукта,
самопроизвольно разлагающегося на сульфат и изоцианат
328
16. Вторичные метаболиты выполняют в растениях прежде всего экологические функции
жит гликозид глюкобрассицин (рис. 16.3), пред-
шественником которого является триптофан.
При гидролизе глюкобрассицина тиоглюкози-
дазой образуется крайне нестабильный продукт,
который в свою очередь после перегруппировки
и отделения сульфатного фрагмента превраща-
ется в изоцианат— основной компонент гор-
чичных масел.
Горчичные масла токсичны в высоких кон-
центрациях.
Механизм действия глюкозинолатов весь-
ма сходен с действием цианогенных гликозидов.
Глюкозинолаты и гидролизирующий фермент
мирозиназа располагаются в разных компартмен-
тах. Фермент может вступать во взаимодействие
с субстратом только при нарушении компар-
тментации. При повреждении растений, содер-
жащих глюкозинолаты (например, у сорванного
редиса), можно отчетливо различить резкий за-
пах летучих горчичных масел. Из-за высокого со-
держания глюкозинолатов в первых сортах рапса
жмых, который оставался после отжима масла из
семян, было невозможно использовать как корм
для сельскохозяйственных животных. В наши дни
в результате тщательного отбора и селекции были
получены новые сорта рапса, почти не содержа-
щие глюкозинолатов.
16.5. Синтез непротеиногенных
аминокислот - еще один
способ защиты растений
от травоядных
Многие растения содержат непротеиногенные
аминокислоты, сходные по строению с обыч-
ными, входящими в состав белков. Так, на-
пример, канаванин из канавалии мечевидной
(Canavalia ensiformis) является структурным
аналогом аргинина (рис. 16.4). Попадая в ор-
ганизм травоядных вместе с кормом, канава-
нин может быть весьма токсичен. У животных
аминоацил-т-РНК-синтетаза, осуществляющая
перенос аргинина на т-РНК, не может отличить
непротеиногенную аминокислоту от аргини-
на и включает канаванин в белок вместо арги-
нина. В результате такой замены искажается
пространственная структура белковой молеку-
лы, что в свою очередь ведет к частичной или
полной потере ее биологической активности.
Интересно отметить, что для самих растений
СООН
Н-С-NH2
СН2
СН2
О
HN-C-NH2
СООН
I
н—с—nh2
сн2
СН2
сн2
HN-C-NH2
II
NH
Канаванин
Аргинин
Рис. 16.4. Канаванин — структурный аналог
аргинина
канаванин безвреден, поскольку растительная
т-РНК с ним не взаимодействует. Сходный за-
щитный механизм используют некоторые на-
секомые, поедающие листья растений, синте-
зирующих непротеиногенные аминокислоты1.
В настоящее время известно большое число по-
добных соединений, действующих по аналогии
с канаванином.
Дополнительная литература
Ames, В. N., Gold, L. S. Pesticides, risk and applesauce.
Science 244, 755-757 (1989).
Anurag, A. A. Overcompensation of plants in response to
herbivory and the by-product benefits of mutualism.
Trends Plant Sci 5, 309-313 (2000).
Asai, T., Tena, G., Plotnikova, J., Willmann, M. R., Chiu,
W.-L., Gomez-Gomez, L., Boiler, T., Ausubel, F. M.,
Sheen, J. MAP kinase signaling cascade in Arabidopsis
innate immunity. Nature 415, 977-983 (2002).
Beers, E. P., McDowell, J. M. Regulation and execution
of programmed cell death in response to pathogens,
stress and developmental cues. Curr Opin Plant Biol 4,
561-567 (2001).
Dangi, J. L., Jones, J.D.G. Plant pathogens and integrated
defense responses to infection. Nature 411, 826—833
(2001).
1 Канаванин поступает с пищей и накапливается в теле на-
секомого, не нанося ему вреда. В результате оно становится
ядовитым для насекомоядных птиц. — Прим. ред.
Дополнительная литература
329
De Luca, V, St Pierre, В. The cell and developmental
biology of alkaloid biosynthesis. Trends Plant Sci 5,
168-173 (2000).
Facchini, P. J. Alkaloid biosynthesis in plants:
Biochemistry, cell biology, molecular regulation, and
metabolic engineering applications. Annu Rev Plant
Physiol Plant Mol Biol 52, 29-66 (2001).
Grant, J. J., Loake, G. J. Role of reactive oxygen
intermediates and cognate redox signaling in disease
resistance. Plant Physiol 124, 21—29 (2000).
Halkier, B. A., Du, L. The biosynthesis of glucosinolates.
Trends Plant Sci 2, 425-431 (1997).
Jones, A. M. Programmed cell death in development and
defense. Plant Physiol 125, 94—97 (2001).
Kessler, A., Baldwin, I. T. Plant responses to insect
herbivory: The emerging molecular analysis. Annu Rev
Plant Biol 53, 299-328 (2002)
Kutchan, T. M. Alkaloid biosynthesis. The basis for
metabolic engineering of medicinal plants. Plant Cell 7,
1059-1070(1995)
Maleck, K., Dietrich, R. A. Defense on multiple fronts:
How do plants cope with diverse enemies? Trends Plant
Sci 4,215-219(1999).
Niirnberger, T., Scheel,D. Signal transmission in the plant
immune response. Trends Plant Sci 6, 372—379 (2001).
Paul, N. D., Hatcher, P. E. Taylor, J. E. Coping with multiple
enemies: An integration of molecular and ecological
perspectives. Trends Plant Sci 5, 220—225 (2000).
Pechan, T., Cohen, A.,Williams,W. P., Luthe, D. S. Insect
feeding mobilizes a unique plant protease that disrupts
the peritrophic matrix of caterpillars. Proc Natl Acad Sci
USA 99,13319-13323 (2002).
Romeis, T. Protein kinases in the plant defense response.
Curr Opin Plant Biol 4, 407-414 (2001).
Somssich, I. E., Hahlbrock, K. Pathogen defense in
plants — a paradigm of biological complexity. Trends
Plant Sci 3,86-90(1998).
Southon, I. W., Buckingham, J. (eds.). Dictionary of
Alkaloids. London, Chapman & Hall (1989).
Stahl, E. A. Bishop, J. G. Plant-pathogen arms races at
the molecular level. Curr Opin Plant Biol 3, 299—304
(2000).
Veronese, P., Ruiz, M. T., Coco, M. A., Hernandez-Lo-
pez, A., Lee, H., Ibeas, J. I., Damsz, B., Pardo, J. M.,
Hasegawa, P. M., Bressan, R. A., Narasimhan, K. L.
In defense against pathogens. Both plant sentinels and
foot soldiers need to know the enemy. Plant Physiol 131,
1580-1590, (2003).
Zhnag, S., Kiessig, D. F. МАРК cascades in plant defense
signaling. Trends Plant Sci 6, 520—527 (2001).
Изопреноиды — обширная группа вторичных
метаболитов растений, обладающих широким
спектром биологической активности
Изопреноиды присутствуют практически
во всех живых организмах, но особенно
широко данный класс метаболитов представ-
лен в растениях. К 1997 г. уже было выделено
и идентифицировано более 23000 раститель-
ных изопреноидов, и новые соединения про-
должают открывать до сих пор. (К 2007 г. их
число увеличилось до 35000. — Прим, ред.)
Функции изопреноидов чрезвычайно разноо-
бразны (табл. 17.1). В первичном метаболизме
изопреноиды выполняют роль фотосинтети-
ческих пигментов, переносчиков электронов,
гормонов и стимуляторов роста, а также входят
в состав мембран. Они могут принимать уча-
стие в реакциях гликозилирования (в качестве
переносчиков гликозила) и в регуляции роста
клеток. Кроме того, в качестве вторичных мета-
болитов изопреноиды помогают растительному
организму решать различные «экологические»
задачи: большинство этих соединений присут-
Таблица 17.1. Изопреноиды высших растений
Предшественник Класс Пример Свойства
С5: диметилаллил-РР Гемитерпен Изопрен Защита фотосинтетического аппа-
изопентенил-РР С10: геранил-РР Монотерпен Боковая цепь цитокинина Пинен рата от воздействия повышенных температур** Регулятор роста Защитное соединение
С15: фарнезил-РР Сесквитерпен Линалоол Капсидиол Аттрактант Фитоалексин
С20: геранилгеранил-РР Дитерпен Гиббереллин Фитогормон
С30: 2-фарнезил-РР Тритерпен Форбол Касбен Холестерин Защитное соединение Фитоалексин Структурные компоненты мембраны
С40: 2-геранилгеранил-РР Тетратерпен Ситостерин Каротиноиды Фотосинтетический пигмент
геранилгеранил-РР или фарнезил-РР Полипренол* Пренилированные (модифици- рованные) белки с С15 или С20 Пренилирование пластохино- нов, убихинонов, хлорофиллов, цитохром а Долихолы Каучуки Регуляторы роста Заякоривание в мембранных ком- плексах фотосинтетических пигмен- тов; переносчики электронов Переносчики гликозила
* Истинными полипренолами являются каучук, гутта и чикл.
Убихиноны и пластохиноны содержат от 4 до 10 изопреновых фрагментов. — Прим. ред.
** По другой точке зрения синтез изопрена является защитой фотосинтетического аппарата
от перевосстановления (избытка НАДФН). — Прим. ред.
Изопреноиды — обширная группа вторичных метаболитов растений...
331
Рис. 17.1. Структурные формулы некоторых
изопреноидов
Изопрен
Лимонен
(монотерпен)
Каучук
(политерпен)
ствует в составе латексов, смол, восков и эфир-
ных масел, благодаря токсичным свойствам
которых растение защищается от травоядных и
вредителей. Изопреноиды могут функциониро-
вать как антибиотики, предохраняя растение от
патогенных микроорганизмов (бактерий, гри-
бов), причем многие из них образуются только
в ответ на инфицирование. Некоторые расте-
ния синтезируют соединения, которые подавля-
ют рост и развитие конкурирующих видов. Су-
ществуют изопреноиды, которые обеспечивают
аромат и яркую окраску цветков и плодов, при-
влекая распространителей семян и пыльцы.
Растительные изопреноиды имеют обшир-
ное коммерческое применение. Их используют
как ароматизаторы для производства продуктов
питания, алкогольных и безалкогольных напит-
ков, косметики, а также в качестве источников
витаминов (A, D и Е), природных инсектици-
дов (пиретрин), растворителей (скипидар). На-
туральный каучук и гуттаперча также являются
изопреноидами. Изопреноиды широко приме-
няют в фармацевтической промышленности при
производстве различных лекарственных препа-
ратов или их предшественников. В настоящее
время проводятся многочисленные исследования
в области генной инженерии с целью получения
генетически модифицированных растений с по-
вышенным синтезом изопреноидов.
Второе название изопреноидов — терпенои-
ды. Химики всегда интересовались раститель-
ными эфирными маслами. Основные цикли-
ческие соединения, содержащие 10, 15, 20 или
большее число атомов углерода, были перво-
начально выделены из очищенного скипидара
(нем. Terpentin. — Прим, ред.), представляю-
щего собой смесь легких изопреноидов. В даль-
нейшем похожие вещества были обнаружены
у многих растений в составе эфирного масла и
получили общее название терпены. На рисун-
ке 17.1 показаны структурные формулы некото-
рых терпенов. Лимонен, летучее соединение из
лимонного масла, содержит 10 атомов С и отно-
сится к монотерпенам. Каротин состоит из 40
атомов С и является, соответственно, тетратер-
пеном. Политерпеноид каучук, получаемый из
млечного сока каучуконоса Hevea brasiliensis,
может содержать до 1500 атомов С.
Изопреноиды или терпены — соединения,
состоящие из нескольких изопреновых единиц.
Первым структуру терпенов описал Отто Вал-
лах (Бонн, Геттинген), в 1910 г. он был удостоен
Нобелевской премии по химии за достижения в
области развития органической химии, в частно-
сти — за то, что он первым осуществил работу в
области алициклических соединений. Исследо-
вания Отто Валлаха были продолжены Леополь-
дом Ружичкой (Цюрих), который был также на-
332
17. Изопреноиды — обширная группа вторичных метаболитов растений...
гражден Нобелевской премией по химии в 1939 г.
Он установил, что изопрен является универсаль-
ной структурной единицей для синтеза большин-
ства природных соединений, включая стероиды.
Кроме того, Леопольд Ружичка выдвинул тео-
рию, в соответствии с которой все терпеноиды
(производные терпенов) должны синтезировать-
ся из некоего гипотетического предшественника,
названного им активным изопреном. Это пред-
положение подтвердил Феодор Линен (Мюних,
Нобелевская премия по медицине и физиологии
в 1964 г.), установив, что этим «активным изо-
преном» является изопентенилпирофосфат.
17.1. Два различных пути биосинтеза
изопреноидов у высших
растений
В клетках высших растений и некоторых видов
водорослей ферменты, отвечающие за синтез
изопреноидов, локализуются не только в цито-
золе, но и в пластидах. Пути образования изо-
пентенилпирофосфата в этих компартментах
различны.
Ацетил-СоА - предшественник синтеза
изопреноидов в цитозоле
В основу теории синтеза изопреноидов в цитозо-
ле легло открытие Конрада Блоха (США, лауре-
ат Нобелевской премии по медицине в 1964 г.),
который установил, что ацетил-КоА является
предшественником биосинтеза стероидов. На
рисунке 17.2 показана схема образования про-
межуточного продукта изопентенилпирофосфа-
та. При взаимодействии двух молекул ацетил-
КоА образуется ацетоацетил-КоА, который в
свою очередь реагирует с еще одной молекулой
ацетил-КоА с образованием р-гидрокси-0-ме-
тилглутарил-КоА (HMG-KoA). В отличие от
животных клеток и дрожжей, где эти реакции
катализируются двумя различными фермента-
ми, в растительных клетках обе реакции идут
при участии одного-единственного фермента —
HMG-KoA-синтазы. Две молекулы НАДФН
восстанавливают эстерифицированную карбок-
сильную группу HMG-KoA до гидроксильной,
параллельно идет гидролиз макроэргической
тиоэфирной связи. В результате этой необрати-
мой реакции образуется мевалонат. Считает-
ся, что у животных клеток процесс образования
мевалоната из HMG-KoA является ключевой
стадией биосинтеза изопреноидов, насколь-
ко это предположение верно для растительных
клеток— пока неясно. Две последовательные
реакции фосфорилирования мевалоната, ката-
лизируемые двумя различными киназами, при-
водят к формированию пирофосфатного эфи-
ра. При участии третьей молекулы АТФ и через
промежуточную стадию образования фосфатно-
го эфира пирофосфатный эфир превращается
в изопентенилпирофосфат за счет образования
двойной углерод-углеродной связи и отщепле-
ния карбоксильной группы. Этот путь синтеза
изопентенилпирофосфата локализован в цито-
золе и носит название мевалонатного пути. По
мевалонатному пути происходит синтез стерои-
дов, некоторых сесквитерпенов и боковых цепей
убихинонов.
Пируват и D-глицеральдегид-З-фосфат -
предшественники биосинтеза изопентенил
пирофосфата в пластидах
Мевалонатный путь блокируется мевиноли-
ном — специфичным ингибитором HMG-
KoA-редуктазы. Эксперименты с растениями
показали, что мевинолин ингибирует только
цитозольный биосинтез изопреноидов. Полу-
ченные данные позволили сделать вывод, что
схема биосинтеза изопентенилпирофосфата
в пластидах отличается от пути синтеза в ци-
тозоле (рис. 17.3). Предшественниками пла-
стидного пути биосинтеза являются пируват и
D-глицеральдегид-З-фосфат. По аналогии с
пируватдегидрогеназой (см. рис. 5.4), пируват
декарбоксилируется при участии тиаминпиро-
фосфата (ТРР) и D-глицеральдегид-З-фосфата
с последующим образованием 1-дезокси-D-кси-
лулозо-5-фосфата (DOXP) (см. реакцию с
транскетолазой, рис. 6.17). За счет перегруппи-
ровки и последующей реакции восстановления
DOXP превращается в 2-С-метил-П-эритри-
ол-4-фосфат, который в свою очередь последо-
вательно подвергается двум дополнительным
реакциями восстановления, реакциям дегидра-
тации и фосфорилирования с образованием
изопентенилпирофосфата. Следует отметить,
что точные подробности прохождения цепи ре-
акций превращения DOXP в изопентенилпи-
рофосфат до сих пор неясны. Путь биосинтеза
изопреноидов при участии DOXP-синтазы
17.1. Два различных пути биосинтеза изопреноидов у высших растений
333
CH3-C-S-K0A + CH3-C-S-K0A
Ацетил-КоА
HMG-KoA-
синтаза
KoA-SH
CH3-C-CH2-C-S-KoA
HMG-KoA-
синтаза
KoA-SH
Ацетоацетил - КоА
ОН О
I И
еООС- СН2-С - СН2- С - S - КоА
СН3
Р-гидрокси-
Р-метилглутарил-КоА
(HMG-KoA)
HMG-KoA-
редуктаза
2 НАДФН + Н
2 НАДФН *
v + KoA-SH
ОН
еоос-сн2-с -СН2-СН2-ОН
СН3
Мевалонат
Мевалонат-
киназа
АТФ
АДФ
ОН О
®ООС-СН2-С-СН2-СН2-О—Р—Ое
СН3
5-Фосфомевалонат
Мевалонат-
фосфат-
киназа
АТФ
^-АДФ
еООС-СН2-С-СН2-СН2-О—p-О— Р-Ое
I I I
СН3 Q© Q©
5-Пирофосфомевалонат
Пирофосфо-
мевалонат-
декарбоксилаза
АТФ
АДФ + Ф
+ Н2О
о о
II II
сн2=с-сн2-сн2-о—p-о—Р-Ое
сн3 о© о©
Изопентенилпирофосфат
Рис- 17-2- Синтез изопентенил пирофосфата в цитозоле происходит
по мевалонатному пути
334
17. Изопреноиды — обширная группа вторичных метаболитов растений...
DOXP-синтаза
Пируват
сн3
I
с=о
I
соо
ТРР
СН3
трр-с-он
1 -Дезокси-О-ксилулозо-
б-фосфат(ООХР)
сн3
со2
н
н-с-он
I Z-S
н-с-о-©
ТРР
н—с=о
но-с-н
с=о
н-с-он
н-с-о-®
н
н
D-глицеральдегид-
3-фосфат
Редуктазы,
дегидратазы,
киназы
(не известны)
Рис- 17.3. Биосинтез
изолентенилпирофосфата в пластидах
(альтернативный или 1-дезокси-Б-
ксилулозо-5-фосфатный (DOXP)
путь)
СН2
II
н3с-с
сн2
СН2-О-®-®
Изопентенилпирофосфат
(немевалонатный или альтернативный путь)
характерен для ряда бактерий, хлоропластов во-
дорослей и пластид растений, в клетках живот-
ных все изопреноиды синтезируются по клас-
сическому мевалонатному пути. Большинство
растительных изопреноидов, включая изопрен,
монотерпены пинен и лимонен, дитерпены
(фитол, гиббереллин, абиетиновая кислота —
компонент смолы живицы), а также тетратер-
пены (каротиноиды) синтезируются именно по
альтернативному пластидному пути. По этому
же пути идет образование боковых цепей хло-
рофилла и пластохинона. Пока неизвестно,
существует ли взаимообмен между пулами изо-
пентенилпирофосфата в цитозоле и в пласти-
дах, также под вопросом взаимодействие пулов
других пренилпирофосфатов (рис. 17.4).
17.2. Пренилтрансферазы
катализируют соединение
изопреновых звеньев
При изомеризации изопентенилпирофосфа-
та образуется диметилаллилпирофосфат (см.
рис. 17.4), к которому по двойной связи при-
соединяется новая молекула изопентенилпиро-
фосфата с образованием геранилпирофосфата
и высвобождением пирофосфатного остатка.
Наращивание длины формирующейся изопре-
ноидной цепи продолжается за счет дальнейше-
го присоединения новых молекул изопетенил-
пирофосфата по принципу «голова-к-хвосту»,
в результате конденсации последовательно об-
разуются фарнезилпирофосфат и геранилгера-
нилпирофосфат.
Конденсация изопентениловых остатков
катал изируется пренилтрансферазами. П од
обобщенным термином «изопренильный фраг-
мент» подразумевают изопреновые или по-
лиизопреновые остатки. Совсем недавно было
установлено, что каждый тип структуры изопре-
нилпирофосфата формируется своей специфи-
ческой пренилтрансферазой. Так, например,
пренилтрансфераза геранил-РР-синтаза ка-
тализирует синтез только геранилпирофосфата.
Интересно, что синтез фарнезилпирофосфата
при участии фарнезил-РР-синтазы протекает
в две стадии: сначала из диметилаллилпирофос-
фата и изопентенилпирофосфата в присутствии
фермента образуется геранилпирофосфат, ко-
торый, оставаясь в комплексе с ферментом,
реагирует с очередной молекулой изопентенил-
пирофосфата с образованием фарнезилпиро-
фосфата.
17.2. Пренилтрансферазы катализируют соединение изопреновых звеньев
335
Изопентенилпирофосфат (С5)
Изомераза
Диметилаллилпирофосфат
Пренил-
трансфераза
Изопентенилпирофосфат
Геранилпирофосфат (С10)
Пренил-
трансфераза
Фарнезилпирофосфат (С15)
Пренил-
трансфераза
Г еранилгеранил-
пирофосфат (С20)
Рис. 17.4. Получение молекул изопреноидов различной длины за счет
последовательного присоединения изопренильных фрагментов по принципу
«голова-к-хвосту»
Аналогично, но уже в три стадии происходит
синтез геранилгеранилпирофосфата при учас-
тии фермента геранилгеранил-РР-синтазы.
Каждый из этих пренилпирофосфатов является
предшественником для синтеза соответствую-
щих изопреноидов (см. табл. 17.1). Поскольку
синтез пренилпирофосфатов регулируется раз-
личными пренилтрансферазами, выход каж-
дого отдельного пренилпирофосфата можно
регулировать индукцией или ингибированием
соответствующего фермента. Есть данные, под-
тверждающие, что синтез геранилгеранилпиро-
фосфата из изопентенилпирофосфата осущест-
вляется не только в цитозоле, но и в пластидах,
однако в чем различия между этими двумя путя-
ми синтеза пока неясно.
Образование С-С связей между двумя едини-
цами изопрена происходит в результате нуклео-
фильного замещения (рис. 17.5). Связанный
с пренилтрансферазой ион Mg2+ инициирует
отщепление от молекулы-акцептора отрица-
тельно заряженного иона пирофосфата, при
этом положительный заряд, стабилизируемый
соседней двойной связью, остается у концевого
С-1 атома. Образовавшийся аллильный кати-
он реагирует с концевой двойной С=С связью
молекулы-донора с образованием новой С-С
связи и потерей одного протона. В соответствии
с этим механизмом происходит формирование
не только линейных изопреноидов, но и различ-
ных циклических структур.
336
17. Изопреноиды — обширная группа вторичных метаболитов растений...
С
I
н
Рис- 17-5- Схема присоединения двух
пренил фосфатов по типу «голова-к-хвосту»
при участии пренилтрансферазы в ходе реакции
нуклеофильного замещения (SN 1 механизм):
а) отщепление пирофосфата от молекулы-акцептора
и образование аллильного катиона;
б) аллильный катион взаимодействует с двойной
связью молекулы-донора с образованием новой
С-С связи;
в) при отщеплении одного протона
восстанавливается двойная связь, смещаясь
на один атом углерода.
Схема реакции приведена в упрошенном виде
Благодаря большому разнообразию предшест-
венников-пренилпирофосфатов возможен син-
тез изопреноидов совершенно различных типов
и структур (гемитерпенов, монотерпенов, се-
сквитерпенов и т.д.) (см. табл. 17.1).
17.3. Некоторые растения выделяют
газообразный изопрен
Действие фермента изопренсинтазы на диме-
тилаллилпирофосфат приводит к отщеплению
пирофосфата и образованию изопрена — ге-
митерпена, присутствующего во многих расте-
Диметилаллил-
пирофосфат
Рис. 17.6. В листьях некоторых растений при
участии фермента изопренсинтазы образуется
изопрен. Это летучее соединение, которое легко
переходит в газообразную форму
Изопрен-
синтаза
ФФ + Н®
Изопрен
ниях (рис. 17.6). Изопрен является летучим со-
единением (температура кипения 30 °C) и легко
переходит в газообразную форму. Так, в днев-
ные часы при температуре 30 °C — 40 °C многие
древесные растения (дуб, платан, тополь, ива)
выделяют газообразный изопрен. При таких
повышенных температурах листья дуба могут
выделить в виде изопрена до 5% от всего асси-
милированного в результате фотосинтеза угле-
рода. До 20% от всего связанного углерода те-
ряет с изопреном многолетняя лиана Pueraria
lobota (kudzu), которую культивируют в Азии в
качестве кормового растения. В жаркую пого-
ду над лесными массивами можно наблюдать
голубоватую дымку, которая образуется за счет
изопрена, а также монотерпенов и некоторых
других летучих соединений, выделяемых расте-
ниями.
Изопрен синтезируется в хлоропластах из
диметилаллилпирофосфата по немевалонатно-
му пути (см. рис. 17.3). Интересно, что содержа-
щаяся в листьях изопренсинтаза активируется
только под воздействием повышенной темпера-
туры окружающей среды.
Физиологическая роль изопрена в жизни рас-
тительного организма до сих пор находится под
вопросом. Некоторые данные указывают на то,
что при воздействии повышенных температур
изопрен в малых концентрациях способен ста-
билизировать фотосинтетические мембраны.
Глобальное выделение изопрена растениями в
масштабах биосферы сопоставимо по величине
с выделением метана метаногенными организ-
мами. Однако по сравнению с метаном изопрен
разлагается в атмосфере гораздо быстрее1.
1 Обсуждается в связи с парниковым эффектом и глобаль-
ными изменениями климата. — Прим. ред.
17.4. Многие соединения из эфирных масел — производные геранилпирофосфата
337
17.4. Многие соединения, входящие
в состав эфирных масел,
являются производными
геранилпирофосфата
Монотерпены представляют собой достаточ-
но обширную группу линейных и циклических
изопреноидов, большинство из которых, как
правило, являются легкоиспаряющимися жид-
костями с характерным, часто приятным за-
пахом. Они составляют основу разнообразных
эфирных масел, например, тимьяна, лаванды,
различных хвойных, лилейных и розоцветных.
В качестве аттрактантов монотерпены могут
использоваться растениями для привлече-
ния насекомых-опылителей, однако основная
функция этих соединений — защищать расти-
тельный организм от повреждения, отпугивая
вредителей.
Ментол
Гераниол
Линалоол
Рис. 17.7. Ментол, компонент мятного масла;
гераниол, компонент розового масла и эфирных
масел герани; линалоол, компонент различных
эфирных масел представителей семейства
Compositae
Исходным соединением для синтеза всех мо-
нотерпенов является геранилпирофосфат. Ги-
дролиз геранилпирофосфата приводит к обра-
зованию спирта гераниола (рис. 17.7), основного
компонента розового масла. Гераниол обладает
характерным запахом свежесрезанной герани.
Если реакция гидролиза сопровождается изоме-
ризацией гераниола, образуется линалоол (см.
рис. 17.7), также входящий в состав эфирных ма-
сел различных растений, например, представи-
телей семейства сложноцветных (Compositae),
у которых биосинтез линалоола локализован в
лепестках и начинается одновременно с цвете-
нием.
Механизм формирования монотерпенов с
циклической структурой из геранилпирофосфа-
та (циклизация) в целом аналогичен механизму
образования линейных изопреноидов с участием
пренилтрансферазы. Основное отличие заклю-
чается в том, что все превращения происходят
в пределах одной и той же молекулы. Такое вну-
тримолекулярное пренилирование часто сопро-
вождается изомеризацией углеродного скелета
исходного соединения. На рисунке 17.8 в качестве
примера показана схема синтеза лимонена при
участии фермента лимоненсинтазы. Выход ли-
монена в этой реакции может достигать 94%. Ин-
тересно, что помимо образования лимонена при
работе того же фермента образуются незначитель-
ные количества других монотерпенов — мирцена
(2%), а-пинена (2%) и р-пинена (2%). Эти четыре
соединения являются основными компонентами
смолы хвойных. Они выполняют защитные функ-
Рис. 17.8. Пример формирования
циклической молекулы монотерпена
при участии одной из циклаз.
В результате работы фермента
лимоненсинтазы образуется лимонен
(выход 94%), а также мирцен (2%),
а-пинен (2%) и р-пинен (2%) в качестве
минорных продуктов
а-Пинен р-Пинен
338
17. Изопреноиды — обширная группа вторичных метаболитов растений...
Рис. 17.9. Один из вариантов
циклизации фарнезилпирофосфата.
При отсутствии внутримолекулярных
перегруппировок двойных связей
взаимодействие С-1 углеродного атома с
одной из двойных связей фарнезильной
цепи может привести к образованию
четырех различных продуктов
ции, так как токсичны для большинства травояд-
ных и насекомых-вредителей. Так, при нападении
жуков-короедов, у хвойных отмечается резкое
возрастание активности соответствующей цикла-
зы с последующим повышением интенсивности
смолообразования. Лимонен также присутствует
в листьях и цедре лимона. Еще один монотерпен
ментол — основной компонент мятного масла —
также служит для отпугивания насекомых.
17.5. Фарнезилпирофосфат —
предшественник биосинтеза
сесквитерпенов
Механизм образования циклических структур
из фарнезилпирофосфата аналогичен механиз-
му циклизации геранилпирофосфата, однако
спектр образующихся при этом соединений на-
много шире (рис. 17.9). Так, при внутримолеку-
лярном взаимодействии С-l углеродного атома
(в форме стабилизированного карбокатиона
после отщепления пирофосфатного остатка) с
одной из двух двойных связей фарнезильной
цепи могут образоваться сразу четыре различ-
ных продукта. С учетом внутримолекулярных
специфических перегруппировок двойных свя-
зей количество возможных конечных продуктов
возрастет многократно. Сесквитерпены пред-
ставляют собой самую обширную группу среди
всех терпеноидов, к ним относят соединения,
имеющие в основе более 200 различных кольце-
вых углеродных скелетов, в частности — веще-
ства, входящие в состав различных эфирных ма-
сел, например, эвкалипта и хмеля. Фитоалексин
(раздел 16.1) капсидиол (рис. 17.10), синтезируе-
мый различными видами красного перца и таба-
ка, также является сесквитерпеном.
Рис. 17.10. Капсидиол, фитоалексин красного
перца и табака
17.5. Фарнезилпирофосфат — предшественник биосинтеза сесквитерпенов
339
Рис. 17.11. Схема образования холестерина
а. Образование тритерпена сквалена в результате НАДФН-зависимой восстановительной
конденсации двух молекул фарнезилпирофосфата по типу «голова-к-голове».
б. Присоединение к сквалену ОН-группы при участии фермента монооксигеназы
и циклизация полученного соединения
Фарнезилпирофосфат - предшественник
синтеза стероидов
Предшественником биосинтеза большинства
стероидных соединений растительного организ-
ма является тритерпен сквален, образующийся в
результате НАДФН-зависимой восстановитель-
ной конденсации двух молекул фарнезилпиро-
фосфата по типу «голова-к-голове» (рис. I7.ll).
Из сквалена синтезируются в частности раз-
личные мембранные компоненты растительной
клетки (например, ситостерин), а также брасси-
ностероиды, выполняющие функции фитогор-
монов (раздел 19.8).
Одна из самых обширных групп стероидных
соединений — гликозилированные стероиды —
носит название сапонины1 благодаря способ-
ности при растворении в воде образовывать
стойкую пену (от лат. sapo — мыло, Saponaria —
мыльнянка) (рис. 17.12). У большинства сапони-
нов углеводная часть представлена разветвлен-
ным олигосахаридом, в состав которого обычно
входят остатки глюкозы, галактозы, ксилозы и
некоторых других гексоз. Наличие гидрофиль-
ного полисахаридного остатка и гидрофобного
стероидного ядра определяет поверхностную
активность стероидных гликозидов и позволяет
1 Сапонины — устаревший термин. Большинство глико-
зилированных стероидов водорастворимо и не обладает
поверхностно-активными свойствами. — Прим. ред.
340
17. Изопреноиды — обширная группа вторичных метаболитов растений...
Рис. 17.12. Ямонин, сапонин ямса (Diosc ore а)
использовать их в качестве природных детер-
гентов. Кроме того, сапонины обладают гемо-
литической активностью, вызывая разрушение
эритроцитов млекопитающих, а также способ-
ны сорбироваться на поверхности плазмалеммы
грибов. Благодаря этим свойствам сапонины
успешно используются растениями для защиты
от повреждения вредителями. Ямонин, сапонин
ямса (D iosco red), широко применяется в фарма-
цевтической промышленности в качестве ис-
ходного сырья для синтеза прогестерона, основ-
ного компонента противозачаточных средств1.
Гликозилированными стероидами являются
также сердечные гликозиды или карденолиды,
токсическое действие которых связано с инги-
бированием работы натрий-калиевого насоса
у животных. Одними из самых известных кар-
денолидов являются гликозиды на основе агли-
кона дигитоксигенина — токсина, синтезируе-
мого наперстянкой (формула не представлена)1 2.
Интересно, что личинки некоторых бабочек
могут поглощать и накапливать в своем орга-
низме карденолиды, эффективно используя эти
соединения против своих врагов (например,
птиц). В малых концентрациях карденолиды
применяются в кардиологии при лечении за-
болеваний сердца. Еще одна группа защитных
стероидов — фитоэкдистероиды. Их строение
напоминает структуру гормонов насекомых —
1 В настоящее время для синтеза горомональных препа-
ратов используется мало. Сегодня для этой цели использу-
ются фитостерины, вырабатываемые определенными штам-
мами микроорганизмов. — Прим. ред.
2 От латинского названия наперстянки — Digitalis. —
Прим. ред.
экдистероидов (например, экдизона), контро-
лирующих превращение личинки в куколку.
Поедание насекомыми-вредителями растений
с повышенным синтезом фитоэкдистероидов
приводит к нарушению процесса окукливания и
гибели личинок.
17.6. Геранилгеранилпирофосфат —
предшественник биосинтеза
фитогормонов, каротиноидов
и вторичных метаболитов,
выполняющих защитные
функции
Геранилгеранилпирофосфат является предше-
ственником биосинтеза не только каротиноидов
и фитогормонов, например, гиббереллинов (раз-
дел 19.4), но и различных вторичных метаболитов
изопреноидной природы, выполняющих защит-
ные функции. Так, в частности, прямая цикли-
зация геранилгеранилпирофосфата приводит к
образованию дитерпена касбена — фитоалекси-
на клещевины обыкновенной (рис. 17.13). Если
циклизация сопровождается реакциями гидрок-
силирования — возможно образование дитерпе-
на форбола, присутствующего в виде сложных
эфиров в млечном соке растений семейства мо-
лочайных (Euphorbiaceae). Форбол при контак-
те с кожей может вызывать сильнейшие ожоги,
кроме того, он является мощным токсином и ис-
пользуется растениями для защиты от поедания
травоядными. Способность форболовых эфиров
вызывать рост опухолей широко используется в
различных медицинских исследованиях. Гера-
нилгеранилпирофосфат также является пред-
шественником для биосинтеза гиббереллинов —
одной из групп фитогормонов (раздел 19.4).
Интенсивное смолообразование —
эффективное средство защиты деревьев
от вредителей
В лесах умеренных широт широко распростра-
нены голосеменные (ель, сосна, пихта, др.).
Примечательно, что возраст деревьев отдель-
ных хвойных пород может достигать 1000 и бо-
лее лет. Подобное долголетие свидетельствует о
наличии эффективных природных механизмов
защиты от вредителей.
Наибольший ущерб наносят жуки-короеды,
которые не только повреждают ткани растений,
17.6. Геранилгеранилпирофосфат — предшественник биосинтеза фитогормонов, каротиноидов
341
Рис. 17.13. Прямая циклизация геранилгеранилпирофосфата приводит к
образованию фитоалексина касбена. Если циклизация сопровождается реакциями
гидроксилирования при участии ферментов монооксигеназ — возможно
образование дитерпена форбола. Еще один изопреноид, образующееся при
циклизации геранилгеранилпирофосфата, — абиетиновая кислота, главный
компонент смол у голосеменных
но и нарушают целостность наружных покровов,
что служит входными воротами для последующих
грибных заболеваний. Для зашиты деревья выде-
ляют смолу, которая заполняет место поврежде-
ния, уничтожая и грибные гифы, и насекомых.
Смола хвойных деревьев представляет собой
сложную смесь терпеноидов. Примерно полови-
ну от общего содержания веществ в смоле состав-
ляет летучая фракция в основном из монотрпенов
и частично сесквитерпенов (скипидар), а вторая
половина представлена нелетучими дитерпена-
ми (канифоль). Фракция скипидара содержит
целый набор веществ, токсичных для грибов и
насекомых, например, лимонен (см. рис. 17.5).
Фракция канифоли содержит смоляные кисло-
ты с абиетовой кислотой в качестве главного
компонента (см. рис. 17.13). Абиетовая кислота —
от лат. abies — пихта. При повреждении дерева
смола, накопленная в смоляных ходах, вытекает
наружу или синтезируется непосредственно в
месте повреждения. Сейчас проводятся интен-
сивные исследования токсических свойств от-
дельных веществ смолы в отношении различных
насекомых и грибов. Можно надеяться, что такие
знания позволят в будущем с помощью генной
инженерии усилить устойчивость к паразитам у
деревьев, растущих в лесных массивах.
Каротиноиды - пигменты растений
и источник витамина А для животных
Каротиноиды — обширная группа разнообраз-
ных пигментов, выполняющих ряд важнейших
функций в растительном организме. В частно-
сти, роль каротиноидов в процессе фотосинтеза
была подробно рассмотрена в главах 2 и 3.
По аналогии с синтезом сквалена, биосинтез
каротиноидов идет с участием геранилгеранил-
пирофосфата. В результате конденсации двух мо-
лекул геранилгеранилпирофосфата по принципу
«голова-к-голове» (рис. 17.14) при последователь-
ном отщеплении двух пирофосфатов и формиро-
вании сопряженных двойных С-С связей между
342
17. Изопреноиды — обширная группа вторичных метаболитов растений...
Ликопин
Рис. 17.14. Схема биосинтеза каротиноидов. Конденсация двух молекул
геранил геранил пирофосфата по принципу «голова-к-голове» при участии
фитоенсинтазы приводит к образованию молекулы фитоена. Фитоен, в свою
очередь, под воздействием десатураз превращается в ликопин через стадию
образования продукта-интермедиата нейроспорена (на схеме не показан). При
циклизации ликопина в зависимости от типа фермента циклазы формируются
а- или p-каротины. Ксантофилл зеаксантин образуется путем гидроксилирования
Р-каротина
р-Каротин
Зеаксантин
пренильными остатками образуется молекула
фитоена. Под воздействием фермента фитоенде-
сатуразы фитоен подвергается последовательным
реакциям дегидрогенирования и превращается
в ликопин. Некоторые данные указывают на то,
что выделяющиеся при десатурации атомы Н при
участии ФАД переносятся на О2. При циклизации
ликопина в зависимости от типа фермента цикла-
зы формируются а- или p-каротины. Ксантофилл
зеаксантин образуется путем гидроксилирования
Р-каротина. На рисунке 3.41 была показана схема
превращения зеаксантина в ксантофилл виолак-
сантин.
В организме животных р-каротин — пред-
шественник хромофора зрительного пигмента
родопсина. В организме человека p-каротин не
синтезируется, однако в качестве провитами-
на А является одним из важнейших компонен-
тов питания. Недостаток или отсутствие про-
витамина А в пище приводит к авитаминозам
и серьезным функциональным нарушениям,
в частности — к ухудшению зрения и слепоте.
Дефицит провитамина А особенно характерен
для жителей некоторых стран Азии, где осно-
вой ежедневного пищевого рациона традици-
онно является рис, не содержащий р-каротин1.
1 У риса есть собственные гены, ответственные за био-
синтез каротиноидов в зелёных листьях, но они находятся
под контролем развития и при формирования эндосперма
не экспрессируются. — Прим. ред.
Х7.7. Пренильные группы позволяют веществам проявлять липофильные свойства
343
Г еранилгеранил-
пирофосфат
•о—©—©
Фитилпирофосфат
Рис- 17.15. Синтез фитилпирофосфата из геранил геранил пирофосфата
Благодаря последним достижениям генной
инженерии в эндосперме зерновок риса уда-
лось экспрессировать гены, кодирующие фер-
менты, которые участвуют в процессе синтеза
Р-каротина из геранилгеранилпирофосфата.
Получены трансгенные линии, производящие
так называемый «золотой рис» — зерна жел-
товатого цвета, богатые p-каротином. Неком-
мерческие благотворительные организации
предоставили линии трансгенного риса в рас-
поряжение многих селекционных станций в
азиатских странах. В настоящее время линии
«золотого риса» скрещивают с местными сор-
тами с целью акклиматизации. Внедрение «зо-
лотого риса» в сельское хозяйство поможет ре-
шить проблему дефицита провитамина А для
большей части населения нашей планеты.
17.7. Пренильные группы позволяют
веществам проявлять
липофильные свойства
Убихиноны (см. рис. 3.5), пластохиноны (см.
рис. 3.19) проявляют липофильные свойства,
а гем цитохрома а (см. рис. 3.24) закрепляется
в мембранных комплексах благодаря изопрено-
идным радикалам различной длины. При био-
синтезе этих веществ, участвующих в транспорте
электронов, пренильные группы вводятся в со-
став молекулы из пренилпирофосфатов в реакци-
ях, сходных с реакциями, осуществляемыми пре-
нилтрансферазами. Хлорофилл (см. рис. 2.4),
токоферолы и филлохинон (см. рис. 3.32) содер-
жат фитол в качестве бокового радикала. Фитоль-
ная группа образуется из геранигеранилпирофос-
фата путем восстановления с помощью НАДФН
и далее встраивается в молекулу (рис. 17.15).
Белки могут заякориваться на мембране
путем пренилирования
Не так давно, у дрожжей и животных было об-
наружено большое число белков, у которых ци-
стеиновый остаток вблизи С-конца способен
образовывать тиоэфирную связь с остатком фар-
незила или геранила (рис. 17.16). Образование
этой связи катализирует специфическая пре-
нилтрансфераза. Во многих случаях С-концевой
О
_________, II
Белок |~ Cys—АК— АК— С- Ое
SH
Фарнезилпирофосфат
ФФ
Пренил-
трансфераза
| Метилирование |
О
_________. II
Белок |— Cys—С— О — СН3
Рис- 17-16- Реакция пренилирования белка.
Остаток фарнезила преносится на SH-rpynny
цистеина в белке с помощью пренилтрансферазы.
После гидролитического отщепления терминальных
аминокислот (АК) карбоксильная группа цистеина
метилируется. Пренильный остаток служит
мембранным якорем для белка
344
17. Изопреноиды — обширная группа вторичных метаболитов растений...
участок из нескольких аминокислот, связанный
с цистеином, удаляется после пренилирования
пептидазой, а карбоксильная группа самого ци-
стеина метилируется. Таким образом, белок ста-
новится липид-ассоциированными и прочно
заякоривается на мембране. По последним дан-
ным пренилирование белков у растений вероят-
но играет столь же важную роль.
Долихолы — важные посреднки
в процессе гликозилирования белков
Долихолы (рис. 17.17) — это изопреноиды
с очень длинными углеродными цепями, кото-
рые встречаются в липидной фракции мембран
эндоплазматического ритикулума и аппарата
Гольджи. Они играют важную роль в процессе
переноса олигосахаридов. Многие мембран-
ные и секретируемые белки гликозилированы
Рис. 17.17. Долихол — один из полипренолов
по атому N, причем олигосахаридная цепочка,
как правило, разветвлена. Гликозилирование
происходит в эндоплазматическом ретикулуме
при участии долихолов (рис. 17.18).
Долихол служит затравкой для синтеза слож-
ной олигосахаридной структуры, и только по-
сле окончания биосинтеза она переносится на
тот остаток аспарагина в белке, который должен
быть гликозилирован. Последующая модифика-
ция в аппарате Гольджи, при которой добавля-
ются новые точки ветвления и новые углеводы
входят в состав цепи, позволяет создать большое
разнообразие олигосахаридных структур.
17.8. Регуляция синтеза
изопреноидов
В зависимости от типа и специфики изопренои-
дов их биосинтез может протекать в различных
участках клеток, органов или тканей раститель-
ного организма. Так, к примеру, гидрофобные
изопреноиды некоторых растений синтезируют-
ся в специализированных структурах — желези-
стых волосках (ментол) или лепестках (линало-
ол). Формирование структуры изопреноидов из
предшественников — пренилпирофосфатов —
Долихол-Ф
УДФ-GIcNAc
УМФ
Долихол-ФФ- GIcNAc
УДФ-GlcNAc
+ 3 УДФ-С1с+ 9 ГДФ-Мап
4 УДФ+ 9 ГДФ
Дол ихол-ФФ-( GIcNAc)?-Man— Man— Man— Man— (Glc)3
Man—Man—Man
Белок
I
Man—Man
Долихол-ФФ
Белок-Asn- (GIcNAc)?— Man—Man—Man—Man—(Glc)3
Man—Man—Man
I
Man—Man
Рис. 17.18. Долихол служит затравкой для синтеза
сложной олигосахаридной структуры. После
окончания биосинтеза разветвленная структура
переносится на тот остаток аспарагина в белке,
который должен быть гликозилирован Сокращения:
GIcNAc — N-ацетилглюкозамин, Man — манноза,
Glc — глюкоза, Asn — аспарагин
Дополнительная литература
345
катализируется набором ферментов с высокой
степенью специфичности. Ферменты обычно
локализованы в пластидах, цитоплазме и ми-
тохондриях, сам процесс синтеза четко сплани-
рован и проходит в строго определенных ком-
партментах; кроме того, синтез и накопление
изопреноидов чаше всего пространственно раз-
общены. Например, фитогормон гибберелло-
вая кислота синтезируется в пластидах, а затем
транспортируется в цитоплазму1. Как упомина-
лось в разделе 17.2, различные пренилпирофос-
фаты, из которых образуются все остальные изо-
преноиды, синтезируется разными ферментами.
Благодаря строгой организации процесс
биосинтеза изопреноидов можно эффективно
контролировать, изменяя активность соответ-
ствующих ферментов. Пути биосинтеза регули-
руются экспрессией соответствующих генов под
воздействием элиситоров1 2. Эта способность дает
возможность растительному организму быстро
изменять характер изопреноидного метаболиз-
ма в ответ на повреждение вредителями или при
инфицировании (раздел 16.1). В таких случаях
может возникать конкуренция между различны-
ми путями биосинтеза вторичных метаболитов.
У растений табака, например, активный синтез
фитоалексинов, индуцированный экзометабо-
литами патогенных грибов, блокирует синтез
стероидных соединений, т.е. при возникновении
угрозы жизнедеятельности доминируют процес-
сы, направленные на защиту растительного ор-
ганизма.
17.9. Изопреноиды отличаются
высокой стабильностью
и устойчивостью
О катаболизме изопреноидов в растениях из-
вестно очень мало. В результате реакций гли-
козилирования или за счет образования допол-
нительных гидроксильных групп биологически
активные производные изопреноидов (в част-
1 В пластидах синтез идет только до гидрофобного пред-
шественника гиббереловых кислот — эяди-каурена. Энт-
каурен в дальнейшем окисляется в ЭПР. Само образование
гиббереловой кислоты происходит в цитозоле. — Прим,
ред.
2 Основная роль в регуляции биосинтеза изопреноидов
принадлежит внутренним (эндогенным) факторам. — Прим,
ред.
ности — фитогормоны) переходят в неактивную
форму и откладываются в вакуолях. До сих пор
остается под вопросом возможность реутилиза-
ции изопреноидов в растительном организме,
поскольку некоторые структуры отличаются по-
вышенной стабильностью. Большое количество
изопреноидов можно обнаружить в остатках
древних организмов практически во всех оса-
дочных породах, а также в сырой нефти3. У ар-
хебактерий плазматическая мембрана содержит
глицериновые эфиры с изопреноидными ради-
калами (вместо эфиров глицерина с жирными
кислотами). Это свидетельствует о том, что изо-
преноиды были важными компонентами мета-
болизма у самых ранних живых организмов.
Дополнительная литература
Bartley, G. Е., Scolnik, Р. A. Plant carotenoids: Pigments
for photoprotection, visual attraction and human health.
Plant Cell 7, 1027-1038 (1995).
Canae, D. E. (Ed.) Comprehensive natural products.
Chemistry 2, Isoprenoids including carotenoids and
steroids. Pergamon/Elsevier, Amsterdam (1999).
Chappel, J. Biochemistry and molecular biology of the
isoprenoid biosynthetic pathway in plants. Annu Rev
Plant Physiol Plant Mol Biol 45, 521-547 (1995).
Connolly, J. D., Hill R. A. Dictionary of Terpenoids.
Chapman & Hall, London (1991).
Dudareva, N., Pichersky, E. Biochemical and molecular
genetic aspects of floral scents. Plant Physiol 122, 627—
633 (2000).
Eisenreich, W., Rohdich, E, Bacher, A. Deoxyxylulose
phosphate pathway. Trends Plant Sci 6, 78—84 (2001).
Giuliano, G., Aquilani, R., Dharmapuri, S. Metabolic
engineering of plant carotenoids. Trends Plant Sci 5,
406-409 (2000).
Hirschberg, J. Carotenoid biosynthesis in flowering plants.
Curr Opin Plant Biol 4, 210-218 (2001).
Laule, O., Fuerholz, A., Chang, H.-S., Zhu, T., Wang, X.,
Heifetz, P. B., Gruissem, W., Lange, В. M. Crosstalk
between cytosolic and plastidial pathways of isoprenoid
biosynthesis in Arabidopsis thaliana. Proc Natl Acad
Sci USA 100, 6866-6871 (2003).
Lichtenthaler, H. K. The 1-deoxy-D-xylulose-5-phosphate
pathway of isoprenoid biosynthesis in plants. Annu Rev
Plant Physiol Plant Mol Biol 50, 47-65 (1999).
3 В частности, по наличию изопреноидов в ископаемых
можно достоверно судить об их биотической природе. —
Прим. ред.
346
17. Изопреноиды — обширная группа вторичных метаболитов растений...
Logan, В. A., Anchordoquy, Т. J., Monson, R. К., Pan,
R. S. The effects of isoprene on the properties of spinach
thylakoids and phosphatidylcholine liposomes. Plant
Biol 1,602-606(1999).
Logan, B. A., Monson, R. K., Potosnak, M. J. Biochemistry
and physiology of foliar isoprene production. Trends
Plant Sci 5, 477-481 (2000).
Mahmoud, S. S., Croteau, R. B. Strategies for transgenic
manipulation of monoterpene biosynthesis in plants.
Trends Plant Sci 7, 366-373 (2002).
McGarvey, D. J., Croteau, R. Terpenoid metabolism.
Plant Cell 7, 1015-1026 (1995).
Osbourn, A. Saponins and plant defense—a soap story.
Trends Plant Sci 1, 4-9 (1996).
Sacchettini, J. C., Poulter, C. D. Creating isoprenoid
diversity. Science 277, 1788-1789 (1997).
Sharkey, T. T., Yeh, S. Isoprene emission from plants.
Annu Rev Plant Physiol Plant Mol Biol 52, 408—436
(2001).
Trapp, S., Croteau, R. Defensive resin biosynthesis in
conifers. Annu Rev Plant Physiol Plant Mol Biol 52,
689-724 (2001).
Ye, X., Al-Babili, S., Kloeti, A., Zhang, J., Lucca, P.,
Beyer, P., Potrykus, I. Engineering the provitamin A
(P-carotene) biosynthetic pathway into (carotenoid-
free) rice endosperm. Science 287, 303—305 (2000).
18
Фенилпропаноиды — компоненты клеточной
стенки и предшественники
вторичных метаболитов ароматической природы
В растениях синтезируется огромное коли-
чество разнообразных фенольных соеди-
нений — помимо простых фенолов в эту группу
входят флавоноиды, стильбены, таннины, лиг-
наны и лигнин1 (рис. 18.1). Вместе с длинно-
цепочечными дикарбоновыми кислотами фе-
нольные соединения могут быть компонентами
суберина. Спектр действия растительных фено-
лов чрезвычайно разнообразен — фенольные
производные могут защищать растительный
организм от воздействия ультрафиолетового
(UV) излучения, выполнять функции природ-
ных антибиотиков, пестицидов, сигнальных
молекул при симбиотических взаимодействи-
ях с бактериями из рода Rhizobium, аттрактан-
тов для привлечения насекомых-опылителей.
Кроме того, фенолы укрепляют и изолируют
клеточную стенку, уменьшая ее газо- и водо-
проницаемость и увеличивая механическую
прочность (табл. 18.1). Основным предшествен-
ником синтеза фенольных соединений явля-
ется фенилаланин, в ряде случаев — тирозин.
Формирование ароматического кольца пред-
шественников идет по шикиматному пути
(через шикимовую кислоту) (раздел 10.4). Об-
разующиеся в результате синтеза соединения
С6-С3-ряда (ароматическое кольцо + боковая
цепочка из 3 дополнительных атомов углерода)
носят название фенилпропаноидов. Флавоно-
иды (включая флавоны, антоцианидины и др.)
и изофлавоноиды содержат в структуре помимо
фенилпропановой единицы дополнительное
ароматическое кольцо, образованное тремя мо-
1 Кроме того, в группу фенольных соединений входят
ксантоны, нафтохиноны, антраценовые производные и др.
метаболиты (всего более 10 000 соединений). — Прим. ред.
Таблица 18.1. Функции фенилпропаноидов
Кумарины Антибиотики, токсины для защиты от травоядных
Лигнан Антибиотики, токсины для защиты от травоядных
Лигнин Компоненты клеточной стенки
Суберин Компоненты газо- и водонепрони- цаемого слоя клеточной стенки
Стильбены Антибиотики, в частности — фунги- циды
Флавоноиды Защита растительного организма от воздействия ультрафиолетового (UV) излучения, антибиотики, сигнальные молекулы при симбиотических взаи- модействиях с Rhizobium, пигменты цветков
Таннины Фунгициды, защита от травоядных
лекулами малонил-СоА (соединения С6-С3-С6-
ряда) (см. рис. 18.1). К фенольным соединениям
с двумя ароматическими кольцами относят так-
же стильбены, в структуре которых два кольца
соединены цепочкой из двух атомов углерода
(соединения С6-С2-С6-ряда).
18.1. Исходная стадия биосинтеза
фенилпропаноидов -
дезаминирование
фенилаланина при
участии фермента
фенилаланинаммиаклиазы
Дезаминирование фенилаланина происходит
под воздействием фермента фенилаланин-
аммиаклиазы (PAL) (рис. 18.2). Отщепление
ГМН2-группы и формирование двойной С-Ссвя-
348
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
Шикиматный
путь биосинтеза
Фенилаланин
+ жирные кислоты
+ гидроксижирные кислоты
+ спирты - производные жирных кислот
+ ди карбоновые кислоты
- флавоны
- флавонолы
- изофлавоны
- антоцианидины
Рис- 18-1- Продукты метаболизма фенилпропаноидов. Предшественником
синтеза большинства фенилпропаноидов является коричная кислота, которая
образуется при дезаминировании фенилаланина при участии фермента
фенилаланинаммиаклиазы (PAL). 4-гидроксикоричная кислота синтезируется
из тирозина в ходе аналогичных реакций (схема не представлена). Дополнительное
ароматическое кольцо флавоноидов или стильбенов формируется из трех молекул
малонил-КоА под воздействием хал кон- или стильбенсинтазы соответственно
18.2. Биосинтез фенолов с участием монооксигеназ
349
СООН
I
h-c-nh2
Фенилаланин-
аммиаклиаза
(PAL)
СООН
I
Фенилаланин
транс-Коричная кислота
Рис. 18.2. Схема синтеза АлрдА/с-коричной кислоты
зи приводит к образованию транс-коричной
кислоты и выделению NH3, который, возмож-
но, в дальнейшем связывается в ходе реакций
ассимиляции аммония, катализируемых глута-
минсинтетазой (раздел 10.1). По аналогичной
схеме проходит превращение тирозина в4-ги-
дроксикоричную кислоту при участии тирози-
наммиаклиазы.
СООН
Аминоксифенил-
пропионовая
кислота
Рис. 18.3. Аминоксифенилпропионовая кислота —
структурный аналог фенилаланина, ингибитор PAL
Фенилаланинаммиаклиаза (PAL) представля-
ет собой тетрамер из 4 субъединиц массой от 77
до 83 кДа. Действие фермента ингибируется об-
разующейся Алрдяс-коричной кислотой, а также
аналогом фенилаланина — аминоксифенилпро-
пионовой кислотой (см. рис. 18.3). Инфициро-
вание растительного организма индуцирует ак-
тивацию PAL, что приводит к быстрому синтезу
фитоалексинов фенольной природы. В настоя-
щее время фенилаланинаммиаклиаза является
одним из наиболее интенсивно изучаемых фер-
ментов вторичного метаболизма растений.
дроксилирование, рис. 18.4) осуществляют мо-
нооксигеназы при участии гема цитохрома Р450
в качестве сайта связывания О2:
НАДФН + Н+ + R-CH3 + О2 ->
-> НАДФ+ + R-CH2-OH + Н2О
В ходе реакции электроны переносятся от
НАДФН через ФАД (см. рис. 5.16) к гему цито-
хрома Р450 (пигмент с максимумом поглощения
450 нм) и далее на О2. Один из атомов кислорода
молекулы О2 идет на образование одной гидрок-
сильной группы (отсюда название фермента
реакции — монооксигеназа), другой - на об-
разование Н2О. По аналогии с цитохромом а3
(цит-а3) цитохром Р450 может связываться также
с СО, поэтому СО является мощным ингибито-
ром Р450-монооксигеназ.
Р450-монооксигеназы широко распростра-
ненные ферменты как среди животных, так и
среди растительных организмов. Проведенный
анализ генома показал, что у Arabidopsis thali-
апа имеется около 300 различных генов, коди-
рующих белки цитохрома Р450. По-видимому,
это самая обширная группа растительных генов.
Большая часть изоферментов цитохрома уча-
ствует в образовании гидроксильных групп при
биосинтезе фитогормонов и вторичных метабо-
литов, однако, ряд изоформ цитохрома Р450 так-
же играет важную роль в процессах детоксика-
ции (например, при детоксикации гербицидов)
(раздел 3.6).
Подобно всем Р450-монооксигеназам, ги-
дроксилазы коричной кислоты ассоциированы
с мембранами эндоплазматического ретикулума.
Образующаяся при участии гидроксилазы пара-
кумаровая кислота может далее гидроксилиро-
ваться по С-3 и С-5 атомам1. Присоединенные
ОН-группы под действием О-метилтрансфераз
вступают в реакции метилирования (донор
метильных групп — 5'-аденозилметионин)
(см. рис. 2.10) с образованием феруловой и си-
наповой кислот — предшественников синтеза
лигнина (раздел 18.3).
18.2. Биосинтез фенолов
с участием монооксигеназ
Присоединение гидроксильной группы к аро-
матическому кольцу коричной кислоты (ги-
1 Существует определенный порядок введения гидроксиль-
ных групп в ароматическое кольцо: сначала по положению
С-3, затем происходит его метоксилирование, и лишь затем
вводится гидроксил в положение С-5. Оксикоричные кисло-
ты с тремя свободными гидроксильными группами в расте-
ниях не найдены. — Прим. ред.
350
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
СООН
I
транс-Коричная кислота
НАДФН + Н®
+ О2
НАДФ®
+ Н2О
4-Гидроксилаза
коричной кислоты
(Р450-монооксигеназа)
Гидрокси- лаза О-метил- трансфераза
Гидроксикоричная кислота
СООН СООН
Феруловая кислота
Синаповая кислота
лара-Кумаровая кислота
Рис. 18.4. Схема биосинтеза различных гидрокси коричных кислот
из транс-коричной кислоты
При отщеплении от фенилпропаноидов
С2-фрагмента образуются производные бен-
зойной кислоты, в частности — салициловая
кислота, а также производное бензальдеги-
да — ванилин (вещество, придающее аромат
ванили) (рис. 18.5). Ацетилсалициловая кислота
(торговое название «аспирин») широко приме-
няется в медицине при лечении различных за-
СООН
Салициловая кислота
Ванилин
Рис. 18.5. Производные фенилпропаноидов—
салициловая кислота и ванилин
болеваний как болеутоляющее и жаропонижаю-
щее средство. Название салициловая кислота
происходит от Salix, латинского названия ивы.
Впервые салициловая кислота была выделена из
коры ивы, где она содержится в значительных
количествах1. Целебные свойства ивовой коры
известны с древних времен. Еще в IV веке до н.
э. Гиппократ использовал ивовую кору как обе-
зболивающее средство при родах. Американ-
ские индейцы также использовали отвар ивовой
коры как обезболивающее.
Салициловая кислота играет важную роль
в метаболизме растительного организма. Для
многих растений отмечается повышение со-
держания салициловой кислоты при инфекции,
а также под воздействием UV-излучения и озо-
на. Салициловая кислота выполняет функции
сигнальной молекулы, которая активирует фер-
менты синтеза защитных соединений широкого
спектра действия (антимикробных, фунгицид-
1 В коре различных видов ивы содержание свободной са-
лициловой кислоты не превышает долей процента, тогда как
содержание гликозидов салицилового спирта и салициловой
кислоты может достигать 10% и более. — Прим. ред.
18.2. Биосинтез фенолов с участием монооксигеназ
351
лара-Кумаровая кислота
Умбеллиферон
(7-гидроксикумарин)
Рис. 18-6- Умбеллиферон — предшественник синтеза псоралена — образуется
в результате гидроксилирования илрл-кумаровой кислоты и ее дальнейшей
этерификации с формированием сложного внутримолекулярного эфира — лактона
ных, антивирусных) (разделы 16.1 и 19.9). Ис-
следования показали, что обработка растений
табака аспирином или салициловой кислотой
повышает их устойчивость к поражению виру-
сом табачной мозаики. Мутанты Arabidopsis,
у которых были повреждены пути синтеза са-
лициловой кислоты, были чрезвычайно под-
вержены инфекции. Способность салициловой
кислоты повышать устойчивость растительного
организма к действию патогенов имеет широкое
коммерческое применение. Например, препа-
раты на основе салициловой кислоты (торговое
название Bion, фирма Syngenta) используют для
обработки пшеницы от ложномучнистой росы.
Действие салициловой кислоты не ограни-
чивается защитными функциями. Салицило-
вая кислота может индуцировать цветение не-
которых видов растений (Lemna). Активируя
митохондриальную альтернативную оксидазу
(раздел 5.7), салициловая кислота стимулирует
термогенез у соцветий-початков «шаманской
лилии» (Sauromatum), испускающих при цвете-
нии неприятный запах гниющего мяса.
7-гидроксикумарин или умбеллиферон
образуется в результате гидроксилирования
пара-кумаровой кислоты и ее дальнейшей эте-
рификации с формированием сложного вну-
тримолекулярного эфира — лактона (рис. 18.6).
Присоединение С2-группы к умбеллиферону
приводит к образованию фуранокумарина
псоралена, который под воздействием UV пре-
вращается в токсичное соединение. Возбужден-
ная форма псоралена вступает во взаимодей-
ствие с пиримидиновыми основаниями ДНК,
блокируя механизмы транскрипции и вызывая
гибель клетки1. Как уже упоминалось в разде-
ле 16.1, повышенное содержание псоралена у
некоторых сортов сельдерея явилось причиной
развития серьезных ожогов кожи у сборщиков
урожая. Большинство фуранокумаринов явля-
ются мощными природными антибиотиками.
Фуранокумарины могут постоянно присутство-
вать в растительном организме (конститутивная
защита) либо по аналогии с фитоалексинами
синтезироваться из предшественников в ответ
на повреждение или инфекцию.
18.3. Полимеризация
фенилпропаноидов
Как уже упоминалось в главе 1.1, лигнин одно
из самых распространенных природных со-
единений на Земле (после целлюлозы). Лиг-
1 Такое действие псоралена является предметом дискус-
сии. Основным свойством псоралена является фотосенси-
билизирующее действие при ультрафиолетом облучении. —
Прим. ред.
СООН
Н-С
с-н
Гидроксициннамат-
КоА-лигаза
о
C-S-KoA
н—с
АТФ АМФ + ФФ с— н
Циннамоил-КоА-
НАДФН-
оксидоредуктаза
НАДФН
+ Н® НАДФ®
Н—с=о
н-с
с-н
KoA-SH
KoA-SH
он
он
он
пара-Кумаровая кислота
Дегидрогеназа
коричной кислоты
НАДФН
+ Н® НАДФ®
лара-Кумаровый
спирт
Катализируется теми же ферментами
Феруловая
кислота
Синаповая
кислота
Синаповый спирт
Конифериловый спирт
Рис. 18-7- Схема биосинтеза монолигнолов за счет восстановления
соответствующих гидроксикоричных кислот
окисление
Лигнан
Малогнол
Рис- 18-8- а. Схема образования лигнана при димеризации монолигнолов.
б. Примеры структурных формул лигнанов
18.3. Полимеризация фенилпропаноидов
353
нин синтезируется из монолигнолов — пара-
кумарового, синапового и кониферилового
спиртов (рис. 18.7). Образование монолигнолов
происходит за счет восстановления карбоксиль-
ных групп соответствуюших кислот до спиртов.
Восстановление карбоксильной группы пара-
кумаровой кислоты НАДФН (см. рис. 18.7)
происходит аналогично реакции с глицераль-
дегидфосфатдегидрогеназой (раздел 6.3) через
промежуточную стадию образования тиоэфира
с КоА. Выделяющаяся при расщеплении тиоэ-
фирной связи энергия активирует процесс вос-
становления карбоксильной группы до альдеги-
да. Дальнейшее восстановление до спирта также
протекает с участием НАДФН в качестве восста-
новителя. Ферменты, катализирующие процесс
образования ияря-кумарового спирта, могут
участвовать в биосинтезе синапового и кони-
ферилового спиртов из синаповой и феруловой
кислот. Синаповый и конифериловый спир-
ты можно также получить из ияря-кумарового
спирта при помощи последовательных реакций
гидроксилирования и метилирования (рис. 18.4).
Защитные функции лигнанов
Точный механизм синтеза лигнанов до сих пор
не ясен. Считается, что лигнаны образуются при
димеризации монолигнолов (рис. 18.8) за счет
формирования одинарных связей между С-8-
атомами углерода боковых цепочек либо при
конденсации двух фенольных колец. Возможно,
этот процесс идет с участием свободных ради-
калов (см. следующий раздел). В растениях лиг-
наны могут образовывать димеры, олигомеры
и полимеры.
Чаще всего лигнаны используются в ка-
честве защитных соединений. Лигнан пино-
резинол входит в состав смолы форзиции и
вырабатывается в ответ на повреждение рас-
тительного организма. Его токсичность по от-
ношению к патогенным микроорганизмам обу-
словлена способностью ингибировать действие
ц-АМФ-фосфодиэстеразы, которая играет роль
сигнальной молекулы во многих метаболиче-
ских процессах (раздел 19.1). Малогнол пода-
вляет рост бактерий и грибов.
Некоторые лигнаны обладают фармаколо-
гическим действием. Способность подофилло-
токсина {Podophyllum, семейство Berberidaceae)
подавлять митозы широко используется в онко-
логии для противоопухолевой терапии. Арктиге-
нин и трахеологин (лигнаны тропических лиан)
предлагают применять в качестве противовирус-
ных препаратов при лечении СПИДа.
Лигнин образуется при
свободнорадикальной полимеризации
производных фенилпропаноидов
Лигнин образуется при полимеризации трех
монолигнолов — идрд-кумарового, синапово-
го и кониферилового спиртов. Считается, что
биосинтез проходит вне клетки (в клеточной
стенке), причем механизм экспорта монолигно-
лов из клетки до сих пор неизвестен. Предпо-
лагается, что монолигнолы транспортируются к
месту синтеза в форме гликозидов, где подвер-
гаются гидролизу под действием глюкозидаз.
Дальнейшая полимеризация монолигнолов,
возможно, проходит при участии лакказ1 и пе-
роксидаз. Лакказа — это монофенолоксидаза,
которая катализирует окисление фенольной
группы и участвует в процессе переноса атома
водорода фермент-связанным ионом Си2+ на
молекулярный кислород О2. Впервые лакказа
была выделена из сока сумаха лаконосного (lac
tree, Rhus vermicifera, Япония), отсюда назва-
ние фермента. Окисление фенольной единицы
при помощи Н2О2 в присутствии пероксидаз
приводит к образованию радикалов монолиг-
нолов. Свободные фенольные радикалы диме-
ризуются и полимеризуются в различных ком-
бинациях (рис. 18.9, а и б) за счет образования
С-С и С-О-С связей, формируя высокоразвет-
вленную полимерную структуру лигнина. В бо-
ковых цепях лигнина часто присутствуют сво-
бодные гидроксильные группы, которые могут
окисляться до альдегидов и карбоксилов.
Точный механизм биосинтеза лигнина до
сих пор неясен. Еще совсем недавно счита-
лось, что формирование аморфной полимер-
ной структуры происходит за счет случайного
взаимодействия радикалов мономеров, димеров
и олигомеров лигнолов. В настоящее время есть
некоторые данные о том, что синтез лигнина ре-
гулируется внеклеточными гликопротеинами,
которые получили название «дирижирующих
1 По последним данным роль лакказ в формировании лиг-
нинов незначительна. Основную роль в этом процессе игра-
ют пероксидазы. — Прим. ред.
354
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
а
1/4О2 1/2Н2О
Лакказа
Пероксидаза
72 Н2О2 Н2О
Н2С—ОН
Н2С—ОН
С
I
-с
I
с-
Рис. 18.9. а. Окисление монолигнола при участии лакказ и пероксидаз приводит
к образованию фенольного радикала, стабильность которого обусловлена
делокализацией неспаренного электрона и его сопряжением с другими связями
монолигнола. б. Монолигнолы способны димеризоваться и полимеризоваться,
формируя аморфный полимер разветвленной структуры — лигнин
белков», которые способствуют образованию
различных полимерных структур, отклады-
вающихся в строго определенных участках
клеточной стенки.
Структура полимера лигнина варьирует
у различных видов растений. К примеру, у хвой-
ных преобладает конифериловая составляю-
щая, тогда как у злаковых больше кумариловых
единиц. В клеточной стенке лигнин в процессе
полимеризации заполняет промежутки между
углеводными полимерами (целлюлозой, геми-
целлюлозой, пектином). Лигнифицированные
клеточные стенки можно сравнить с железо-
бетоном, где лигнин — это бетон, а фибриллы
целлюлозы выполняют роль арматурных пру-
тьев. Механическая прочность и специфиче-
ский химический состав лигнифицированных
растительных тканей (например, сосудов ксиле-
мы стебля) служат дополнительной защитой от
травоядных.
Кроме того, лигнин обладает способностью
ингибировать рост патогенных микроорганиз-
мов и синтезируется в ответ на повреждение или
инфекцию. Лишь некоторые микроорганизмы
обладают способностью расщеплять лигнин, в
частности грибы, которые вызывают серцевин-
ную гниль древесины.
Сухая древесина на одну треть состоит из
лигнина. Делигнификация, которая использует-
ся при производстве бумаги и целлюлозы, очень
дорогостоящий процесс, поэтому проводятся
активные исследования с использованием ме-
тодов генной инженерии для снижения уровня
синтеза лигнина у древесных растений.
18.3. Полимеризация фенилпропаноидов
355
Рис. 18.10. По аналогии с полимерной структурой лигнина, входящие в состав
суберина фенилпропаноиды соединяются С-С и С-О-С связями, однако 9’-ОН
группы в этих связях не участвуют, образуя эфиры с дикарбоновыми кислотами.
Чаще всего полимеризация фенольных единиц происходит за счет образования
эфирных связей через карбоксильные группы
Суберин и кутин формирует газо-
и водонепроницаемые слои
на поверхности клеточных стенок
Суберин — это сополимер фенилпропанои-
дов, дикарбоновых кислот (С14—С20), а также
длинноцепочечных жирных кислот и их спир-
тов (С18—Сзо) (рис. 18.10)1. По аналогии с поли-
мерной структурой лигнина, входящие в состав
суберина фенилпропаноиды соединяются С-С
и С-О-С связями, однако 9'-ОН группы в этих
связях не участвуют, поскольку образуют эфиры
1 Многие данные указывают на то, что суберин имеет бо-
лее сложную структуру. Часто он состоит из двух самостоя-
тельных доменов: полиароматического (представленного
полимерами оксикоричных кислот) и полиалифатического
(представленного полимерами гидроксилированных дикар-
боновых жирных кислот). Структура суберина варьирует
в зависимости от вида растений. — Прим. ред.
с жирными кислотами. Чаще всего полимериза-
ция фенольных единиц происходит за счет об-
разования эфирных связей через карбоксильные
группы. Жирные и гидроксижирные кислоты
также способны образовывать эфиры между со-
бой. Считается, что в процессе биосинтеза субе-
рина участвуют пероксидазы.
Суберин является матриксом специального
газо- и водонепроницаемого слоя на поверх-
ности клеточных стенок. Суберинизированные
стенки клеток эндодермы корня с поясками
Каспари создают для воды и диффундирующих
растворенных веществ непроницаемый барьер,
изолирующий апопласт коры корня от цен-
трального цилиндра. У многих С4-растений су-
берин присутствует на границе между клетками
обкладки и клетками мезофилла. Больше всего
суберина содержится в пробковой ткани, кото-
356
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
рая состоит преимущественно из суберинизи-
рованных оболочек мертвых клеток (пример —
пробковые клетки перидермы). Пробковая
ткань обеспечивает защиту растений от обезво-
живания, инфекции, воздействия высоких тем-
ператур (благодаря этому свойству некоторые
растения выживают даже после пожаров).
Кутин является основным компонентом ку-
тикулы надземных органов растительного орга-
низма (глава 8). Суберин и кутин имеют сходную
полимерную структуру, однако в составе кутина
присутствуют в основном гидроксижирные кис-
лоты (С16—С18), связанные сложноэфирными
связями. Второе отличие — относительное низ-
кое содержание фенилпропаноидов и дикарбо-
новых кислот.
Матрикс, образованный кутином обычно
пропитывается и покрывается сверху кутику-
лярными восками.
18.4. Флавоноиды и стильбены -
фенольные соединения с двумя
ароматическими кольцами
Флавоноиды — наиболее многочисленная груп-
па фенольных соединений С6-С3-С6 ряда, где
присоединение второго ароматического коль-
ца идет по 9'-С атому фенилпропанового ядра
(производного от оксикоричной кислоты). Пред-
шественником синтеза флавоноидов являет-
ся хал кон, который синтезируется из пара-
кумарил-КоА и трех молекул малонил-КоА под
действием фермента халконсинтазы (CHS).
В ходе реакции выделяются три молекулы СО2
и четыре молекулы КоА (рис. 18.И). Этот путь
формирования второго кольца в структуре
флавоноидов из трех ацетатных остатков на-
зывают ацетатно-малонатным. Фермент хал-
консинтаза, катализирующий первую стадию
процесса биосинтеза флавоноидов, достаточно
хорошо изучен. Вероятно, вследствие низкой
каталитической активности, халконсинтаза
(CHS) является одним из самых распространен-
ных ферментов метаболизма фенилпропанои-
дов в растительных клетках. У некоторых видов
растений можно встретить до 9 различных изо-
форм халконсинтазы. По аналогии с фенила-
ланинаммиаклиазой (раздел 18.1), синтез CHS
de novo находится под сложным генетическим
контролем и активируется под влиянием мно-
гочисленных внутренних и внешних факторов,
в частности — под воздействием элиситоров.
Тетрагидроксихалкон
(халкон, флавоноид)
Резвератрол
(стильбен)
Рис. 18-11 - Формирование второго ароматического кольца халконсинтазой
и стильбенсинтазой
18.4. Флавоноиды и стильбены - фенольные соединения с двумя ароматическими кольцами
357
Стильбены - природные фунгициды
Стильбены образуются из ияря-кумарил-КоА
и трех молекул малонил-КоА при участии фер-
мента стильбенсинтазы, который присутствует
у некоторых растений (сосна, виноград, арахис).
В отличие от реакций с CHS, под действием
стильбенсинтазы 9'-С атом молекулы фенил-
пропаноида отщепляется и выделяется в виде
СО2 (рис. 18.11), что приводит к формированию
соединений С6-С2-С6 ряда, где два аромати-
ческих кольца соединяются цепочкой из двух
атомов углерода. К группе стильбенов относят
фитоалексин резвератрол. Некоторые при-
родные фунгициды также являются произво-
дными стильбенов, в частности — виниферин
(рис. 18.12).
Виниферин ОН
Рис. 18.12. Природный фунгицид винограда —
виниферин
Расшифровка пути биосинтеза стильбенов
открыла новые возможности в борьбе с грибны-
ми инфекциями растений. Благодаря современ-
ным возможностям генной инженерии удалось
получить трансгенные растения табака, содер-
жащие ген, ответственный за синтез резвера-
трола, и обладающие повышенной устойчиво-
стью к действию гриба-возбудителя серой гнили
(Botrytis cinerea).
18.5. Функции флавоноидов
в растительном организме
Под действием халконизомеразы халкон пре-
вращается в флаванон, который является пред-
шественником синтеза многих флавоноидов
(рис. 18.13). Дополнительная кольцевая струк-
тура образуется при взаимодействии феноль-
ной гидроксильной группы с двойной связью
углеродной цепочки, соединяющей два арома-
тических кольца. Халконизомераза — еще один
ключевой фермент биосинтеза флавоноидов.
Аналогично PAL и CHS, синтез халконизоме-
разы индуцируется элиситорами в результате
работы сигнальных систем клетки и строго кон-
тролируется.
Большинство флавоноидов используется
растительными организмами в качестве ток-
сичных соединений (для зашиты от травоядных
животных) и фитоалексинов. Так, например,
в листьях некоторых тропических бобовых со-
держится ядовитое вещество ротенон — димер
изофлавона. Ротенон обладает способностью
ингибировать дыхательную цепь (раздел 5.5),
и этим свойством успешно пользуются абори-
гены Южной Америки, бросая листья этих бо-
бовых в воду при ловле рыбы. Еще один изо-
флавон медикарпин, выделенный из люцерны,
является мощным фитоалексином (рис. 18.14).
Некоторые флавоны и флавонолы могут вы-
полнять функции сигнальных соединений при
симбиотических взаимодействиях у бобовых
и Rhizobum (раздел 11.1).
Поскольку максимум поглощения флаво-
нов и флавонолов лежит в ультрафиолетовой
области, эти соединения в качестве защитных
пигментов способны эффективно предохра-
нять растительный организм от воздействия
ультрафиолетового излучения. Показано, что
при УФ-облучении в листьях наблюдается рез-
кое повышение синтеза флавоноидов. Мутан-
ты Arabidopsis thaНапа, у которых отсутствуют
халконсинтаза и халконизомераза, не способ-
ны синтезировать флавоны и, вследствие это-
го, чрезвычайно чувствительны к действию
УФ. У некоторых растительных видов роль
пигментов, защищающих от воздействия УФ-
излучения, выполняют сложные эфиры жирных
кислот и синаповой кислоты (раздел 18.2).
Препараты на основе различных флаво-
ноидов активно используются в медицине как
антиоксиданты для профилактики сердечно-
сосудистых и онкологических заболеваний.
Особенно полезны для здоровья продукты с вы-
соким содержанием флавоноидов — зеленый
чай, соевый соус, красное вино.
В последнее время повышенное внимание
уделяется изофлавонам некоторых растений
358
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
Флавонол
Антоцианидин
Рис. 18.13. Халкон — предшественник синтеза большинства флавоноидов
семейства бобовых. Неоднократно отмечались
случаи нарушения репродуктивной функции
у овец, в корме которых преобладали бобовые.
В результате проведенных исследований было
Медикарпин
Рис. 18.14. Изофлавон медикарпин, выделенный
из люцерны
выявлено, что эти кормовые растения синтезиру-
ют изофлавоны, действие которых на животных
и человека сходно с действием эстрогенов. Груп-
пу природных соединений, обладающих функ-
циями эстрогенов, назвали фитоэстрогенами.
Самым эффективным считается фитоэстроген
генистеин (см. рис. 18.3).
18.6. Защитные функции
пигментов антоцианов
В предыдущих главах подробно обсуждались
функции желтых и оранжевых пигментов — ка-
ротиноидов (раздел 17.6). Помимо каротино-
идов к пигментам также относят желтые халко-
18.7. Таннины прочно связываются с белками, что обуславливает их защитные функции
359
ОН
Пеларгонидин
(антоцианидин)
б ^О-| Сахар | Пеларгонин (антоциан)
Антоцианидин Структура Цвет*
Пеларгонидин — Красно-оранжевый
Цианидин З'-ОН Красный
Пеонидин З'-ОСНз Розовый
Дельфинидин З'-ОН, 5-ОН Голубовато-фиолетовый
Петунидин З'-ОСНз, 5’-ОН Пурпурный
Мальвидин З'-ОСНз, 5'-ОСНз Красно-пурпурный
* Зависит от pH среды и ряда других факторов. — Прим. ред.
Рис- 18.15. а. Антоцианидин пеларгонидин
содержится в лепестках в форме гликозида
пеларгонина
б. Присоединение ОН-групп по З'-С и 5'-С атомам
и дальнейшее их метилирование приводит к
образованию различных пигментов цветка
ны, светло-желтые флавоны, красные и синие
антоцианы. Антоцианы представляют собой
гликозиды антоцианидинов (рис. 18.15), где
представленная остатками гексоз углеводная
составляющая связана с ОН-группой кольца.
Считается, что антоцианы накапливаются пре-
имущественно в вакуолях, куда они транспор-
тируются глутатион-переносчиками в форме
конъюгатов глутатиона (раздел 12.2). На рисун-
ке 18.15 представлена структурная формула ан-
тоциана пеларгонина, содержащего в качестве
хромофора пеларгонидин. Присоединение к ан-
тоциану двух ОН-групп по З'-С и 5'-С атомам
фенольного кольца под действием Р450-моно-
оксигеназ (раздел 18.2) и их дальнейшее ме-
тилирование приводят к формированию пяти
пигментов различного цвета. Производные
пеларгонидина, а также комплекс генов, коди-
рующих их синтез, впервые были выделены из
петунии. За счет дополнительных модификаций
молекулы-предшественника можно получить
большое число пигментов с разнообразными
структурами.
Пигменты способны изменять окраску при
изменении pH или при образовании комплексов
с ионами металлов. Так, например, при взаимо-
действии с А13+ и Fe3+ оранжево-красный цвет
пеларгонина меняется на голубой. Богатство
и разнообразие оттенков лепестков достигается
благодаря сочетаниям различных пигментов.
Антоцианы не только обеспечивают окра-
ску цветков, привлекающую насекомых-опы-
лителей, они также выполняют функции защит-
ных пигментов, которые при необходимости
экранируют клетки мезофилла листа от воздей-
ствия солнечного света. Характерно, что у рас-
тений в условиях стресса (дефицит фосфора,
засоление почвы, переохлаждение) часто на-
блюдается красная окраска листьев вследствие
повышенного содержания антоцианов. Стрес-
совые условия приводят к снижению скоро-
сти утилизации НАДФН и АТФ, образованных
в ходе световых реакций фотосинтеза. Увели-
чение синтеза антоцианов в клетках мезофилла
помогает растению избежать накопления избы-
точного количества продуктов с высоким энер-
гетическим и восстановительным потенциалом
вследствие понижения общей биосинтетиче-
ской активности листа (раздел 3.10).
18.7. Таннины прочно связываются
с белками, что обусловливает
их защитные функции
Таннины — сборное название для большого
числа растительных полифенолов, которые ис-
пользуют в кожевенной промышленности для
дубления кож. Таннины широко распростра-
нены среди разных видов видов растений. Осо-
бенно высокое содержание таннинов в коре
(перидерме) некоторых деревьев, например,
дуба, и в галлах, вызванных повреждением ли-
стьев насекомыми. Различают два типа тан-
нинов: конденсированные и гидролизуемые
(рис. 18.16). Конденсированные таннины яв-
ляются полимерами флавоноидов и образуются
как продукты фенилпропаноидного метаболиз-
ма. В их синтез вовлечены по всей вероятности
свободнорадикальные реакции, однако лишь
немногие детали этого процесса на сегодня из-
360
18. Фенилпропаноиды — компоненты клеточной стенки и предшественники вторичных...
Рис. 18.16. а. Общая формула конденсированных таннинов (n = 1 —10).
Терминальные фенольные остатки могут также содержать по 3 гидроксильные
группы, б. Пример гидролизуемых таннинов. Гидроксильные группы гексозы
этерифицированы галловой кислотой. В качестве примера приведен таннин
из дерева кешью (Anacardiutn)
вестны. Гкдролизуемые таннины состоят из
остатков галловой кислоты, которые в основ-
ном связаны с молекулами гексоз. Галловые
кислоты у растений образуются преимуще-
ственно по шикиматному пути (см. рис. 10.19).
Фенольные группы таннинов образуют на-
столько прочные водородные связи с NH-груп-
пами белков, что их невозможно разорвать
с помощью пищеварительных ферментов.
В процессе дубления таннины связываются
Дополнительная литература
361
с коллагеном (основной белок шкуры живот-
ных) и получается кожа, устойчивая к разру-
шению микроорганизмами. Таннины имеют
выраженный неприятный вяжущий вкус (при-
меры — вкус коры плода граната или недозре-
лой хурмы). Вяжущий вкус обусловлен тем,
что таннины прочно ассоциируются с белками
слизистой оболочки и слюны («сводит скулы»).
По этой причине животные предпочитают не
использовать в пищу растения, богатые танни-
нами. Кроме того, пережевывая растительную
пищу, животные вызывают высвобождение
дополнительных порций таннинов, которые
связываются с растительными белками и пре-
пятствуют их перевариванию. Таннины также
связываются с пищеварительными белками
травоядных животных, нарушая процесс пи-
щеварения. Таким образом, таннины — эф-
фективное средство защиты листьев и других
частей растения от поедания животными. В ка-
честве примера можно привести африканские
виды акаций, которые являются основной пи-
щей антилопы куду.
В листьях содержатся таннины, но в столь
малых количествах, что это не снижает пищевой
ценности листьев акации. У деревьев, которые
были повреждены травоядными, выделяется га-
зообразный этилен (раздел 19.5), это уже через
30 минут вызывает усиление синтеза таннинов
не только у поврежденного, но и у соседних
деревьев акации. Если животные повредили
слишком много листьев акации, содержание
таннинов возрастает до летальной концентра-
ции, и антилопы куду могут умереть, продолжая
питаться листвой того же дерева.
Таким образом, акации защищаются от пол-
ной потери листьев при помощи своеобразной
системы «коллективного оповещения». В на-
стоящее время ведутся исследования, направ-
ленные на снижение уровня таннинов у акаций
генно-инженерными методами, что позволит
решить проблему кормов в засушливом климате
африканских саванн.
Таннины также защищают растения от атаки
грибами и бактериями. Как правило, инфекция
начинается с секреции литических ферментов,
разрушающих клеточную стенку. Эти агрессив-
ные ферменты инактивируются, когда с ними
связываются таннины.
Дополнительная литература
Boeijan, W., Ralph, J., Baucher, M. Lignin biosynthesis.
Annu Rev Plant Biol 54, 519-546 (2003).
Boudet, A.-M. A new view of lignification. Trends Plant
Sci 3, 67-71 (1998).
Davin, L. B., Lewis, N. G. Phenylpropanoid metabolism:
Biosynthesis of monolignols, lignans and neolignans, lignins
and suberins. In Phenolic Metabolism in Plants, H. A.
Stafford, R. K. Ibrahim (eds.). Plenum Press, New York,
pp. 325-375(1992).
Dixon, R. A., Paiva, N. L. Stress-induced phenylpropanoid
metabolism. Plant Cell 7,1085-1097 (1995).
Dixon, R. A., Steele, C. L. Flavonoids and isoflavonoids —
a gold mine for metabolic engineering. Trends Plant Sci 4,
394-400 (1999).
Douglas, C. J. Phenylpropanoid metabolism and lignin
biosynthesis: From weeds to trees. Trends Plant Sci 1,
171-178(1996).
Durner, J., Shah, J., Kiessig, D. F. Salicylic acid and
disease resistance in plants. Trends Plant Sci 2, 266—274
(1997).
Hatfield, R., Vermeris, W. Lignin formation in plants.
The dilemma of linkage specifity. Plant Physiol 126,
1351-1357 (2001).
Holton, T. A., Cornish, E. C. Genetics and biochemistry
of anthocyanin biosynthesis. Plant Cell 7, 1071 — 1083
(1995).
Humphreys, J. M., Chappie, C. Molecular “pharming”
with plant P450s. Trends Plant Scie 5, 271—273 (2000).
Lewis, N. G. A 20th century roller coaster ride: A short
account of lignification. Curr Opin Plant Biol 2,
153-162(1999).
Lois, R., Buchanan, В. B. Severe sensitivity to ultraviolet
radiation in Arabidopsis mutants deficient in flavonoid
accumulation: Planta 194, 504—509 (1994).
Lynn, D. G., Chang, M. Phenolic signals in cohabitation:
Implications for plant development. Annu Rev Plant
Physiol Plant MolBiol 41, 497-526 (1990).
Murphy, A. M., Chivasa, S., Singh, D. P., Carr, J. P. Sali-
cylic acid-induced resistance to viruses and other patho-
gens: A parting of the ways? Trends Plant Sci 4, 155—160
(1999).
Schuler, M. A., Werck-Reichart, D. Functional genomics
of P450. Annu Rev Plant Biol 54, 629-667 (2003).
Shirley, B. W. Flavonoid biosynthesis: New functions for an old
pathway. Trends Plant Sci 1,377—382 (1996).
Strid, A., Chow, W.S., Anderson, J. M. UV-B damage and
protection at the molecular level in plants. Photosynth
Res 39,475-489(1994).
19
Комплексная регуляция роста,
развития и приспособления к окружающей среде
растительного организма
У многоклеточных животных и раститель-
ных организмов метаболизм, рост и раз-
витие различных органов координируются
сложной системой внутренних сигналов. У жи-
вотных такими сигналами являются гормоны,
которые секретируются железистыми клетка-
ми. Различают паракринные гормоны, которые
действуют на соседние клетки, и эндокринные,
вызывающие ответ у клеток, находящихся дале-
ко от них (например, при передаче сигнала по
кровеносной системе). Также и у растений: сиг-
нальные вещества, которые образуются в одних
органах, могут оказывать влияние на соседние
клетки, а могут быть сигналами дальнего дей-
ствия, передаваясь по ксилеме или флоэме. Все
подобные вещества называются фитогормона-
ми1. Некоторые из фитогормонов (например,
брассиностероиды) по структуре очень похожи
на гормоны животных, а другие значительно от
них отличаются. Как и у животных, у растений
гормоны выполняют сигнальные функции. Они
контролируют процессы приспособления мета-
болизма растения к условиям окружающей сре-
ды: влажности, температуре, длине дня, а также
регулируют развитие организма в целом. Рост и
развитие растений контролируются также усло-
виями освещения: интенсивностью красной,
синей и ультрафиолетовой (УФ) составляющих.
Основными световыми рецепторами являют-
ся фитохромы, криптохромы и фототропины.
Фитохромы воспринимают красный и даль-
ний красный свет, а криптохромы и фото-
тропины — синий. Одной из важных функций
фоторецепторов является контроль циркадного
1 На самом деле критерии гормонов более сложные. Здесь
приводится не определение гормона, а аналогия с животны-
ми. — Прим. ред.
ритма животных и растений, контролируя су-
точные циклы организмов.
В настоящее время для животных гормо-
нов хорошо известны цепи передачи сигналов,
начинающиеся со связывания определенного
гормона с соответствующим рецептором и за-
канчивающиеся действием на транскрипцию
генов и активность ферментов. Однако цепи
передачи сигналов от фитогормонов и фото-
рецепторов до конца не выяснены. Некоторые
результаты показывают, что основные компо-
ненты этих цепей могут оказаться сходными с
сигнальными цепями животных. Кроме того,
цепи фитогормональных и фоторецепторных
сигналов пересекаются друг с другом, образуя
сигнальную сеть.
19.1. Цепи передачи сигналов,
обнаруженные у животных
организмов, действуют
и в растении
G-белки играют роль
молекулярных выключателей
Как у животных, так и у растений широко рас-
пространены представители семейства ГТФ/
ГДФ-связывающих белков (G-белки), кото-
рые могут находиться в двух конформационных
состояниях. Гетеротримерные G-белки, кото-
рые будут рассмотрены далее, взаимодействуют
с рецепторами плазматической мембраны. На
внешней стороне мембраны рецепторы име-
ют сайт связывания с сигнальными вещества-
ми, а на цитоплазматической стороне — сайт
связывания с G-белками. Эта система позво-
ляет передать внешний сигнал внутрь клетки.
Основные сведения о G-белках были получе-
19.1. Цепи передачи сигналов, обнаруженные у животных организмов, действуют и в растении
363
Рис. 19-1 - Схема работы G-белка. Вместо ГМФ-циклазы могут быть активированы
другие ферменты (АМФ-циклаза, фосфолипаза С)
ны, преимущественно, из исследований на жи-
вотных. Гетеротримерные G-белки состоят
из трех различных субъединиц: Ga (молекуляр-
ная масса 45—55 кДа), Gp (35 кДа), Gy (8 кДа)
(рис. 19.1). Субъединица Ga содержит сайт свя-
зывания, который может быть занят ГТФ или
ГДФ. У животных связывание гетеротримера
с рецептором (например, адреналиновым ре-
цептором, активированным адреналином) при-
водит к обмену ГДФ, связанной с Ga, на ГТФ.
Связывание ГТФ приводит к конформа-
ционным изменениям Ga- субъединицы. Она
диссоциирует от триммера. Свободная Ga,
ассоциированная с ГТФ, затем активирует фер-
менты, которые участвуют в дальнейшей пере-
даче сигнала. Это может быть ГМФ-циклаза
(гуанилатциклаза), образующая из ГТФ сиг-
нальную молекулу цГМФ (циклическую
ГМФ, гуанозин-3'-5'-монофосфат) (рис. 19.2).
Она встречается как у животных, так и у рас-
тений. Са-ГТФ активирует фосфолипазу С
(рис. 19.4). В следующем разделе эта реакция об-
суждается в связи с высвобождением Са2+ (важ-
ного иона, участвующего в передаче сигнала) из
запасающих компартментов (депо). У грибов
и животных Са-ГТФ активирует АМФ-циклазу
и этим вызывает синтез еще одного мессенджера:
аденозин-3'-5'-монофосфата (цАМФ) из АМФ.
В ранних работах считали, что в растительном
метаболизме цАМФ не играет особой роли. Од-
нако в последнее время получены данные, ука-
зывающие, что цАМФ также принимает участие
в регуляции метаболизма у растений.
Время полураспада Оа-ГТФ составляет всего
несколько минут. Связанная ГТФ гидролизу-
ется до ГДФ благодаря внутренней ГТФ-азной
активности. Происходят конформационные из-
менения, в результате которых Ga теряет свои
активирующие способности. В конце концов
Оа-субъединица снова связывается с оставшим-
ся димером, образуется тример, и цикл начина-
ется снова. Небольшое время существования
комплекса Са-ГТФ делает весьма эффективной
передачу сигнала с помощью G-белков.
Регуляторные функции малых G-белков
Все эукариоты содержат малые G-белки, име-
ющие только одну субъединицу. Она сходна с
a-субъединицей гетеротримерных G-белков,
описанных в предыдущем разделе. Все малые
G-белки принадлежат суперсемейству Ras-
белков. Они находятся в цитозоле, имеют домен
связывания с ГТФ/ГДФ и эффекторный домен.
При получении сигнала малый G-белок взаимо-
действует с фактором, который переводит ГДФ-
связанную неактивную форму в активную ГТФ-
форму путем замены ГДФ на ГТФ. Активная
ГТФ-форма через эффекторный домен взаи-
модействует с рабочими белками по аналогии
364
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Рис. 19.2. цГМФ образуется из ГТФ
с помощью ГМФ-циклазы и снова
превращается в ГМФ в результате работы
диэстеразы
с Са-ГТФ. Анализ генома Arabidopsis показал,
что в нем закодировано 93 малых G-белка. Они
выполняют различные функции (например: ре-
гуляция защитных реакций, ответ на АБК, вези-
кулярный транспорт, обеспечение полярности
клеток, рост пыльцевых трубок и корневых воло-
сков). Однако сведений о роли малых G-белков в
растительном организме пока еще очень мало.
Са2+ как мессенджер
в цепи передачи сигналов
Как в животных, так и в растительных клетках
концентрация Са2+ в цитозоле в обычном со-
стоянии крайне мала — ниже, чем IO-7 М. Столь
низкое содержание Са2+ поддерживается с по-
мощью АТФ-зависимых насосов (Са2+-АТФазы
P-типа, раздел 8.2). Они выносят Са2+ в полость
эндоплазматического ретикулума и в вакуоль
или транспортируют Са2+ через плазматиче-
скую мембрану во внеклеточный компартмент
(рис. 19.3). Са2+ может также поступать в ми-
тохондрии в антипорте с Н+. Поступивший
сигнал вызывает кратковременное открывание
Са2+-каналов на мембранах внутриклеточных
депо. Это приводит к быстрому увеличению
цитозольной концентрации свободного Са2+.
Почти во всех клетках Са2+ активирует различ-
ные регуляторные ферменты, в том числе про-
теинкиназы.
Фосфатидил-инозитольная система
открывания Са2+-каналов
Кальциевые каналы регулируются в числе про-
чего фосфатидил-инозитольным каскадом пере-
19.1. Цепи передачи сигналов, обнаруженные у животных организмов, действуют и в растении
365
Рис. 19.3. У растений
эндоплазматический ретикулум
и вакуоль (обозначенные здесь
как внутриклеточное депо Са2+)
содержат в мембранах Са2+-АТФазы
P-типа (раздел 8.2). Эти насосы
переносят Са2+ в пространство
ЭР или в вакуоль. Отсюда Са2+
высвобождается в цитозоль
в результате открывания
ИФ3-зависимого Са2+-канала
Внутриклеточное
Са2® депо
дачи сигнала (рис. 19.4). Вначале этот путь был
исследован на животных, а затем обнаружен в
растениях. Фосфатидил-инозитол постоянно
присутствует в мембранах клетки, хотя и в очень
небольших количествах. В животных клетках в
его состав входят обычно две жирные кислоты:
стеариновая и арахидоновая. Инозитольный
остаток фосфорилируется киназой по гидрок-
сильным группам в 4’ и 5’ положении. Фосфо-
липаза С, активированная G-белком, расще-
пляет липид на инозитол-1,4,5-трифосфат
(ИФ3) и диацилглицерин (ДАТ). Высвобожде-
ние ИФ3 приводит к увеличению цитозольной
концентрации Са2+, а диацилглицерин у живот-
ных активирует Са2+-зависимые протеинкина-
зы. По всей вероятности, у растений диацил-
глицерин не играет важной роли в регуляции
метаболизма. Однако непрямым способом —
через фосфорилирование диацилглицерина и
образование фосфатидной кислоты (см. рис.
15.5) — диацилглицерин оказывает влияние на
протеинкиназы и ионные каналы1.
Метод patch-clump (раздел 1.10) показал, что
у растений ИФ3 приводит к открыванию Са2+-
каналов в вакуолях и других депо кальция (та-
ких, как ЭР). Быстрый вход Са2+ в цитозоль
ограничен очень коротким временем жизни
ИФ3 (менее одной секунды). Затем ИФ3 быстро
ликвидируется либо с помощью фосфорилиро-
1 Фосфатидная кислота обычно образуется при расщепле-
нии липидов фосфолипазой D. — Прим. ред.
вания ИФ3, либо путем гидролиза с удалением
фосфатной группы фосфатазой. Краткое время
жизни ИФ3 обеспечивает очень эффективную
регуляцию передачи сигнала.
Фосфатидил-инозитольный каскад играет
важную роль в растительном организме. С его
помощью в клетку из окружающей среды пере-
даются разнообразные сигналы (например,
при устьичных движениях в ответ на условия
водного дефицита). У растений обнаружена
специфическая киназа, которая катализиру-
ет фосфорилирование фосфатидил-инозитола
до фосфатидил-инозитол-3-фосфата. Такой
модифицированный мембранный липид дей-
ствует как сигнал для везикулярного транспорта
(см. рис. 1.16), например, при доставке гидроли-
тических ферментов из ЭР в вакуоль.
Кальмодулин — посредник при работе
ионов кальция
Довольно часто Са2+ работает, передавая сигнал
не напрямую, а через кальмодулин. Кальмоду-
лин — это растворимый белок (молекулярная
масса 17 кДа), обнаруженный как у животных,
так и у растений. Это высококонсервативный
белок, сходство аминокислотных последова-
тельностей кальмодулинов у пшеницы и быка
составляет 91%. В основном кальмодулин на-
ходится в цитозоле. Он состоит из гибкой спи-
рали, содержащий на обеих концах по две
петли, каждая из которых имеет сайт связыва-
ния с ионом Са2+. Эти петли содержат глута-
366
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
сн2-сн—сн2________________сн2—сн—сн2__________________________сн2-сн-сн2
Инозитол-
1,4.5-трифосфат
!Рз
Инозитол
(неактивен)
Рис. 19.4. Инозитол-1,4,5-фосфат (ИФ3) — участник цепи передачи сигнала.
Две гидроксильные группы инозитольного остатка мембранного фосфолипида
фосфорилируются киназой. Образовавшийся ИФ3 высвобождается с помощью
(Са-ГТФ)-зависимой фосфолипазы С. ИФ3 передаёт сигнал и расщепляется
фосфатазами
19.1. Цепи передачи сигналов, обнаруженные у животных организмов, действуют и в растении
367
Неактивная
протеинкиназа
Активная
протеинкиназа
Рис. 19.5. Белок кальмодулин содержит две пары Са2+-связывающих доменов
(EF-руки), которые соединяются гибкой а-спиралью. Комплекс Са2+-кальмодулин
активирует определённые протеинкиназы
мат (Е) и фенилаланин (F), поэтому называ-
ются EF-руками (рис. 19.5). Когда все четыре
EF-руки связаны с кальцием, в кальмодулине
происходят конформационные изменения и
открывается его гидрофобный домен. Он вза-
имодействует с определенными протеинкина-
зами (кальмодулин-связывающие киназы,
calmodulin binding kinases, СВК) и активиру-
ет их. Протеинкиназа СВК II после активации
вначале катализирует автофосфорилирование,
после чего приобретает полную активность.
Она сохраняет ее даже после диссоциации каль-
модулина до тех пор, пока не гидролизуется
остаток фосфата. Са2+-кальмодулин также свя-
зывается и изменяет активность многих других
белков. Все это делает кальмодулин важным
компонентом цепи передачи сигнала.
Кроме того, в растениях содержатся бел-
ки семейства протеинкиназ, также имею-
щих EF-руки в своем составе. Они называются
Са2+-зависимыми протеинкиназами (Са2+-
dependent protein kinases, CDPK). В растени-
ях обнаружено множество протеинкиназ этого
типа. В Arabidopsis найдено 34 гена семейства
CDPK, хотя конкретные функции известны
не для всех белков. Например CDPK участвуют
в фосфорилировании сахарозофосфатсинта-
зы (рис. 9.18) и нитратредуктазы (см. рис. 10.9),
в реакциях защиты от патогенов и в ответе на
различные абиотические стрессы.
Существуют также белки с кальмодулино-
вым доменом, так называемые кальмодулин-
родственные белки (calmodulin-relatedprotein,
CRP), функции которых также в большинстве
своем неизвестны.
Роль фосфорилирования белков
при передаче сигнала
Протеинкиназы, некоторые из которых уже
обсуждались выше, и протеинфосфатазы —
являются важными элементами регуляции вну-
триклеточных процессов. При фосфорилиро-
вании и дефосфорилировании белки меняют
свои конформационные состояния. Протеин-
киназы также активируются или инактивиру-
ются при фосфорилировании. Они объединены
в своеобразную сеть «переключателей процес-
сов» в клетке и работают подобно микросхе-
мам компьютера. Так осуществляется контроль
над дифференцировкой, метаболизмом, за-
щитой от патогенов и над многими другими
процессами в клетке. По некоторым оценкам,
от 1 до 3% функциональных генов у эукариот
кодируют протеинкиназы. Изначально проте-
инкиназы исследовали в основном на дрожжах
и животных. Но в последнее время у растений
идентифицировано несколько сотен генов, ко-
дирующих различные протеинкиназы. Однако
функции большинства из них остаются неиз-
вестными. Исследования роли протеинкиназ —
это бурно развивающаяся область биохимии
растений.
Большинство протеинкиназ эукариот (гри-
бы, животные, растения) содержит 12 консерва-
тивных участков. Это протеинкиназы, в основ-
ном, фосфорилируют гидроксильные группы
серина и/или треонина, иногда тирозина. По-
скольку все эти протеинкиназы гомологичны и,
по-видимому, происходят от общего эволюци-
онного предка, то их объединяют в суперсемей-
ство эукариотических протеинкиназ. В таб-
368
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Таблица 19.1. Некоторые представители суперсемейства эукариотических протеинкиназ
Регулирующее вещество
Протеинкиназа А цАМФ
Протеинкиназа G цГМФ
Са2+-зависимые протеинкиназы (CDPK) Са2+
Кальмодулин-связывающие киназы (СВК) Са2+-кальмодулин
Рецептор-подобные протеинкиназы (RLK) например, фитогормон
Циклин-зависимые протеинкиназы (CDK) Циклин
Митоген-активируемые киназы (МАРК) Митоген
Киназы МАРК (МАРКК) МАРККК
Киназы МАРКК (МАРККК) другие киназы
лице 19.1 приведены некоторые члены этого
семейства. Выделяют семейство протеинкиназ,
которые регулируются цГМФ (протеинкина-
зы G). Существование в растениях протеинки-
наз А, регулируемых цАМФ, все еще является
предметом дискуссий. Уже упоминались проте-
инкиназы, регулируемые Са2+-кальмодулином
(СВК), а также Са2+-зависимые протеинкина-
зы (CDPK). Кроме того, в это суперсемейство
входят рецептор-подобные протеинкиназы
(receptor-like protein kinases, RLK). В основном
они локализованы на плазмалемме. В состав их
входит экстраклеточный домен с рецепторной
функцией (например, для взаимодействия с фи-
тогормоном). Взаимодействие с сигналом при-
водит к активации протеинкиназного домена на
цитоплазматической стороне мембраны, кото-
рый фосфорилирует клеточные белки. Секве-
нирование генома позволило выявить более 400
генов RLK в геноме Arabidopsis.
Суперсемейство эукариотических протеин-
киназ также включает циклинзависимые про-
теинкиназы (CDK). Циклины — это белки,
которые присутствуют во всех эукариотических
клетках, поскольку играют важнейшую роль
в клеточном цикле. CDK активируют множество
белков, участвующих в процессе митоза. В су-
персемейство входят митоген-активируемые
киназы (МАРК). Митоген — это общее на-
звание для веществ (природа многих из них
еще неизвестна), которые стимулируют митоз в
клеточном цикле, а также вызывают другие ре-
акции. Митогенами могут выступать G-белки
и фитогормоны. МАРК играет ключевую роль
в протеинкиназном каскаде, где одни протеин-
киназы регулируются через фосфорилирование
другими протеинкиназами. В этом каскаде, на-
пример, G-белок активирует киназу киназы
MAP-киназы (МАРККК), которая фосфо-
рилирует и активирует киназу МАР киназы
(МАРКК), которая в свою очередь активирует
MAP-киназу (МАРК). MAP-киназа в дальней-
шем фосфорилирует другие белки. Например,
она фосфорилирует ряд транскрипционных
факторов (раздел 20.2) и регулирует тем самым
экспрессию различных генов. МАР-киназный
каскад выполняет важную регуляторную функ-
цию в процессе развития и дифференцировки
клетки. Кроме того, MAP-киназная система
также участвует в сигнальном каскаде системы
защиты от патогенов. Эта система включается
в ответ на элиситоры (раздел 16.1) и на абиоти-
ческий стресс. Секвенирование генома Arabi-
dopsis показало наличие в нем 10 генов МАРК,
20 генов МАРКК и 60 генов МАРККК.
Недавно у растений были найдены протеин-
киназы, фосфорилирующие белки по остаткам
гистидина и аспартата, которые не принадле-
жат описанному выше суперсемейству. Как бу-
дет показано в разделе 19.7, гистидиновые про-
теинкиназы участвуют в рецепции этилена и
цитокининов.
У эукариот есть также суперсемейство про-
теинфосфатаз, подразделяемое на классы
серин-треониновых и тирозиновых фосфатаз.
Многие из них регулируются также, как и проте-
инкиназы (Са2+-кальмодулином или фосфори-
лированием). Они тоже играют активную роль
в каскадах передачи сигналов. Но в этой области
исследования начались совсем недавно.
19.3. Ауксин стимулирует рост растяжением
369
19.2. Основные классы фитогормонов
Фитогормоны (рис. 19.6) имеют очень разноо-
бразную химическую природу и выполняют
различные функции. Здесь будут описаны толь-
ко некоторые из этих функций. Индолилук-
сусная кислота (один из ауксинов, в котором
основной структурный элемент — индол) вы-
зывает рост клеток. Гйббереллины, произво-
дные гибберреллана (дитерпеноид), вызывают
вставочный рост междоузлий. Зеатин — цито-
кинин, представляющий собой пренилирован-
ный аденин, — стимулирует деление клеток.
Абсцизовая кислота, синтезирующаяся из ка-
ротиноидов, регулирует водный обмен. Этилен
и жасмоновая кислота (образующаяся из жир-
ных кислот, раздел 15.7) вызывают старение.
Брассиностероиды играют ключевую роль
в регуляции развития клетки. Пептидные гор-
моны регулируют развитие растения, и вместе
с жасмоновой и салициловой кислотами уча-
ствуют в защите от патогенов. Во многих случа-
ях работа гормональной системы растений опо-
средована действием гормонов-антагонистов.
Так, абсцизовая кислота вызывает покой семян,
а гибберелловая кислота выводит семена из это-
го состояния. Теперь рассмотрим фитогормоны
более подробно.
19.3. Ауксин стимулирует рост
растяжением
Чарлз Дарвин и его сын Френсис еще в 1880 году
обратили внимание, что проростки растений
наклоняются в сторону света. На проростках
канареечной травы (Phalaris canadensis) они
выяснили, что наклон проростков вызывает-
ся освещением его верхушки. Поскольку зона
роста находилась в нескольких миллиметрах от
верхушки, они сделали вывод, что от апекса к
зоне роста передается некий сигнал. В 1926 г.
голландский исследователь Фриц Вент выделил
из верхушек проростков овса экстракт, который
содержал неизвестное вещество, стимулирующее
рост. Это вещество он назвал ауксином. Позже
Индолил-З-уксусная
кислота — ауксин
ГК! — гиббереллин
Зеатин — цитокинин
Абсцизовая кислота
Рис. 19.6. Важнейшие
фитогормоны
Н2С=СН2 Этилен
Жасмоновая кислота
370
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Трансаминаза
триптофана
Аминокислота СО2
Индол ил-3-ацетальдегид
И ндол и л ацетал ьдегид-
дегидрогеназа
НАД® + Н2О
НАДН
+ Н®
Индолил-З-уксусная кислота (ИУК), ауксин
Рис. 19.7. Два биосинтетических пути синтеза индолил-3-уксусной кислоты из триптофана
СН2-СООН
Фенилуксусная кислота
О-СН2-СООН
2,4-дихлорфеноксиуксусная
кислота (2,4-D)
Cl
Рис. 19.8. Фенилуксусная кислота, один из
примеров естественных метаболитов со свойствами
ауксина, и 2,4-D — синтетический аналог ауксина,
который может действовать как гербицид
19.3. Ауксин стимулирует рост растяжением
371
было установлено, что оно представляет собой
индолилуксусную кислоту (ИУК, indoleacetic
acid, IAA). Синтез ИУК в разных растениях идет
разными путями. На рисунке 19.7 показаны два
пути, берущие начало от триптофана. Предше-
ственники синтеза триптофана (см. рис. 10.19)
могут также быть предшественниками синте-
за ИУК. Кроме ИУК известны и другие веще-
ства, имеющие свойства ауксинов (например,
фенилуксусная кислота) (рис. 19.8). В качестве
гербицида используется синтетический ауксин
2,4-Дихлорфеноксиуксусная кислота (2,4-D,
Rohm&Haas). Он уничтожает растения, действуя
как особенно сильная форма ауксина, что вызы-
вает нарушения в морфогенезе и увеличенный
синтез этилена. Последний приводит к прежде-
временному старению листьев. Под названи-
ем «Agent Orange» он использовался при войне
во Вьетнаме, чтобы вызывать опадение листьев
в лесах1. 2,4-D — это селективный гербицид, он
действует на двудольные растения. Однодоль-
ные малочувствительны к 2,4-D, они способны
инактвировать и удалять его. Поэтому 2,4-D ис-
пользуется для уничтожения двудольных сорня-
ков в посадках злаковых растений1 2.
Ауксины имеют много других функций. В те-
чение раннего эмбриогенеза ауксины управля-
ют формированием главной оси полярности, с
меристемой побега на верхушке зародыша и кор-
невой меристемой на противоположном полюсе.
Ауксины влияют на деление и дифференциацию
клеток. Один из эффектов ауксинов — рост кле-
ток растяжением (см. ниже). Наиболее высокие
концентрации ИУК наблюдаются в основных
зонах роста побега. Однако образуется ИУК в
апексе побега. Отсюда ауксин транспортируется
от клетки к клетке с помощью активного поляр-
ного транспорта, требующего затрат энергии.
Транспорт ауксина от клетки к клетке происходит
через специальные входные (influx) и выходные
(efflux) переносчики в плазматической мем-
бране. Полярность транспорта обеспечивается
асимметричным распределением этих перенос-
1 Применение американскими войсками «Agent Orange»
для борьбы с партизанами имело катастрофические эколо-
гические последствия на юге Вьетнама. Классический при-
мер экологической войны. — Прим. ред.
2 Сегодня 2,4-D часто заменяют менее токсичными веще-
ствами, имеющими меньший срок биодеградации. — Прим,
ред.
чиков. Белки выходных переносчиков, которые
связаны с мембранами, перемешаются при об-
мене участками мембран. Такой обмен осущест-
вляется с помощью везикулярного транспорта
при участии аппарата Гольджи. В результате вы-
ходные переносчики могут быстро перемещаться
от одной части плазмалеммы к другой, что облег-
чает изменение направления полярного транс-
порта3. При изгибе колеоптиля4 ИУК транспор-
тируется к одной стороне проростка. Клетки,
находящиеся на этой стороне, усиливают свой
рост, что приводит к изгибанию проростка. ИУК
также транспортируется через флоэму от листьев
к другим органам растения.
Влияние ИУК на рост клеток побега можно
проследить по двум эффектам.
1. Через несколько минут после добавления
ИУК к вырезанной ткани, наблюдается по-
теря обычной жесткости клеточной стенки.
Причина этого еще достаточно точно не уста-
новлена. Предполагается, что ауксин активи-
рует Н+-Р-АТФазу в плазматической мембра-
не через цепь трансдукции сигнала, в которую
включены 14-3-3 белок (раздел 10.3) и, воз-
можно, некоторые протеинкиназы. Это приво-
дит к закислению клеточной стенки, что в свою
очередь активирует ферменты, приводящие к ее
размягчению. Затем клетка увеличивается в раз-
мерах под действием тургорного давления.
2. Примерно час спустя после добавления
ИУК начинают синтезироваться белки, необхо-
димые для роста. Это свидетельствует о влиянии
ауксина на экспрессию генов — известно, что
ауксин индуцирует или репрессирует экспрес-
сию определенного набора генов.
ИУК оказывает различное действие на ряд
тканей. ИУК стимулирует деление клеток кам-
бия; вызывает апикальное доминирование,
подавляя рост боковых почек; контролирует
развитие эмбриона. Кроме того, ИУК предот-
вращает образование отделительного слоя
3 Данный механизм является предметом дискуссии. Вход
ИУК в клетку может происходить пассивно. В протони-
рованной форме ИУК сравнительно легко пересекает ли-
пидный бислой. Мембранные переносчики увеличивают
скорость диффузии в цитозоль с мембранным рецептором
АВР1. — Прим. ред.
4 Колеоптиль — колпачковидная структура, закрывающая
почечку и молодые листья при прорастании злаков. Наи-
более подробно транспорт ауксина изучен именно у злаков
(канареечная трава, овес — см. выше). — Прим. ред.
372
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
в листьях и плодах, и является, таким образом,
антагонистом этилена (см. рис. 19.7). С другой
стороны, повышенные концентрации ИУК мо-
гут индуцировать синтез этилена.
Кроме того, ауксин вызывает образование
плодов1. Обычно семена производят ИУК толь-
ко после оплодотворения. С помощью генной
инженерии были созданы трансформированные
баклажаны, которые экспрессировали бактери-
альные ферменты синтеза ИУК в неоплодотво-
ренном семязачатке. Дисбаланс синтеза ИУК
предотвращал образование семян, что приво-
дило к формированию бессемянных баклажа-
нов. Размер плодов при этом в 4 раза превышал
обычный. Этот впечатляющий пример показы-
вает важность ауксина для роста плодов и де-
монстрирует возможности получения генетиче-
ски модифицированных овощей.
Несмотря на интенсивные исследования,
все еще довольно мало известно о цепях пере-
дачи сигналов при различных воздействиях
ауксина. Недавно идентифицирован ауксин-
связывающий белок (auxin-binding protein,
АВР1). Возможно, он является ауксиновым ре-
цептором, хотя еще до сих пор точно не опреде-
лены ни его локализация в клетке, ни его связи
с другими компонентами цепей передачи сигна-
ла. На другом конце пока еще неизвестной цепи
передачи ауксинового сигнала находятся так на-
зываемые Aux/IAA-белки1 2. В геноме Arabidopsis
обнаружены 25 генов этих белков. Это репрес-
сорные белки, которые связываются с другими
регуляторными белками, факторами отве-
та на ауксин (auxin-responsive factors, ARF).
ARF в геноме Arabidopsis представлены 20 ге-
нами. ARF в свободном состоянии усиливают
транскрипцию многих генов (но не в комплек-
се с Aux/IAA-репрессором!). Действие ауксина
приводит к тому, что Aux/IAA-репрессоры свя-
зываются с убиквитином. Убиквитин помеча-
ет их для дальнейшей деградации в протеасоме
(раздел 21.4)3. Таким образом, ауксин усиливает
1 Правильнее — рост неоплодотворенных завязей. — Прим,
ред.
2 Показано, что АВР1 не связан сигнальным каскадом с си-
стемой Aux/IAA. — Прим. ред.
3 По последним данным Aux/IAA-penpeccop становится мише-
нью для убиквитинирования только в том случае, когда в ком-
плекс убиквитин-лигазы входит внутриядерный рецептор TIR1,
связанный с ауксином. Сегодня считается, что у растений не
один, а множество рецепторов для ауксина. — Прим. ред.
экспрессию генов, высвобождая сдерживаемые
репрессией механизмы.
19.4. Гиббереллины регулируют
удлинение стебля
Открытие гиббереллинов произошло благода-
ря изучению заболеваний растений. Заражение
риса грибом Gibbelrella fujikuroi приводило к
образованию чрезмерно высоких растений, ко-
торые полегали и не давали семян. В Японии
эту болезнь назвали «болезнью бешеных про-
ростков». В 1926 г. Эйичи Куросава с сотрудни-
ками в Японии выделили из этого гриба веще-
ство, которое вызывало неестественный рост.
Его назвали гиббереллином. На Западе эти ре-
зультаты стали известны после Второй мировой
войны. Был проведен структурный анализ гиб-
береллина. В дальнейшем было показано, что
существует много различных веществ сходной
структуры, которые присутствуют и в растениях
и действуют в качестве фитогормонов.
Гиббереллины образуются из углеводорода
эши-каурена (рис. 19.9). К настоящему времени
у растений известно более сотни гиббереллинов,
которые нумеруются в историческом порядке их
обнаружения. Поэтому нумерация не дает ин-
формации об их структурных взаимоотношени-
ях и функциях. Многие из этих гиббереллинов
являются промежуточными или побочными
продуктами биосинтетического пути. Только
некоторые из них могут действовать как фито-
гормоны. Неизвестно, имеют ли другие гиббе-
реллины физиологическую функцию. Самые
энт-Гиббереллан
Рис. 19.9. Углеводород (изопреноид),
представляющий структурную основу всех
гиббереллинов
19.4. Гиббереллины регулируют удлинение стебля
373
Гиббереллин ГК1
Рис. 19.10. а. Синтез гиббереллина ГК).
б. Цикоцел, ретардант, который снижает рост
стеблей пшеницы и других злаков, ингибирует
синтез эяАИ-каурена и, как следствие, синтез
гиббереллинов
СН3
CI-CH2-CH2-N-CH3 Cle
СНз
2-Хлороэтилтриметиламмоний-
хлорид (Цикоцел, BASF)
важные гиббереллины — это ГК)1 (рис. 19.10(7)
и ГК4(не показан). Синтез ГК) осуществляется
через изопреноид геранилгеранилпирофосфат
и включает 13 этапов, при этом промежуточным
веществом является энди-каурен. В некоторых
случаях синтез гиббереллинов контролируется
светом через фитохромы (раздел 19.10).
Подобно ИУК, гиббереллины стимулиру-
ют удлинение побега, особенно в междоузлиях
стеблей. Известным эффектом гиббереллина
является его влияние на розеточные растения
(например, шпинат или салат-латук), у которых
он индуцирует образование цветков. Таким об-
разом, гиббереллин — один из регуляторов цве-
тения. Кроме того, гиббереллины выполняют
множество других функций, таких так образова-
ние плодов и стимуляция их роста. Гиббереллин
выводит семена из состояния покоя, возможно
способствуя размягчению семенной кожуры,
облегчает прорастание семян, вызывая экспрес-
сию генов необходимых ферментов (например,
амилаз).
Применение гиббереллина имеет экономи-
ческое значение для выращивания бессемян-
ных сортов винограда2. У них ГК) приводит не
только к растяжению клеток, но и к партено-
карпии (образованию плодов без опыления).
Кроме того, при производстве ячменного соло-
да в пивоварении гиббереллины добавляют для
того, чтобы индуцировать а-амилазу ячменных
зерен. Для этих целей, в основном, исполь-
зуется гиббереллин ГК3, образуемый грибом
Gibbelrella fujikuroi. Ингибиторы биосинтеза
гиббереллинов также являются коммерчески
ценными продуктами — ретардантами (за-
медляют рост). Вещества, которые ингибируют
синтез предшественника гиббереллинов энт-
каурена, такие как хлороэтилтриметиламмо-
нийхлорид (промышленное название Цикоцел,
BASF) (рис. 19.106) распыляют на полях зерно-
вых, чтобы снизить рост стеблей. Это укрепля-
ет стебли злаков и увеличивает пропорцию об-
щей биомассы семян. Медленно разлагающиеся
1 Большинство гиббереллинов имеют кислотную группу,
и поэтому их называют гибберелловыми кислотами (сокра-
щенно — ГК с соответствующим индексом). — Прим. ред.
2 Без применения гиббереллина ягоды винограда у бессе-
мянных сортов бывают очень мелкими, урожай низкий. —
Прим. ред.
374
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
ингибиторы синтеза гиббереллина используют в
садоводстве, чтобы вырастить карликовые ком-
натные растения.
Гиббереллины влияют на экспрессию генов.
Наши знания о цепи передачи гиббереллино-
вого сигнала все еше довольно фрагментарны.
В плазматической мембране находятся гиббе-
реллиновые рецепторы неизвестной приро-
ды. Передача сигнала от рецептора к гену, воз-
можно, включает гетеротримерный G-белок
(см. рис. 19.1), цГМФ, ионы кальция, кальмо-
дулин (см. рис. 19.5) и каскад протеинкиназ, воз-
можно, МАРКи CDPK-типов (раздел 19.1). Это
приводит к модификации транскрипционных
факторов различных генов. Один из эффектов
ГК — снижение действия репрессорных белков,
которые называются DELLA-белки, которые
подавляют рост. Недавно обнаружилось, что
в результате ГК-зависимого протеинкиназно-
го каскада DELLA-белки убиквитинируются,
что способствует их протеасомной деградации
с участием убиквитина (раздел 21.4). Таким об-
разом, ГК усиливает рост через освобождение
от ингибирования (раздел 19.3).
Мутанты, у которых синтез ГК или влияние
ГК на рост нарушены, очень важны для сельского
хозяйства. Резкое увеличение урожайности зла-
ковых культур, достигнутое после 1950-х, часто
называют зеленой революцией, которая стала
возможной в том числе из-за получения новых
карликовых сортов пшеницы. В 1950-х годах по-
пытки увеличить урожайность обычных сортов
пшеницы внесением повышенных доз азотных
удобрений, не достигли успеха, поскольку при
этом образовывалось больше соломы, но не
увеличивался выход зерна. Это затруднение уда-
лось преодолеть, создав разновидности пшени-
цы со сниженным ростом стеблей, у которых
доля зерна в общей биомассе (индекс урожайно-
сти) значительно повышалась. Выяснилось, что
причиной сниженного роста этих разновидно-
стей были мутации генов, кодирующих транс-
крипционные факторы цепи передачи гиббе-
реллинового сигнала. У пшеницы мутантные
гены называются Rht (сниженный рост, reduced
height). У одного из мутантов ингибировалась
убиквитин-зависимая деградация репрессор-
ных белков (см. выше) и, таким образом, сти-
муляции удлинения побега под действием гиб-
береллинов не происходило. Аналогичные гены
были обнаружены у других растений, таких как
кукуруза и рис. Были получены соответствую-
щие мутанты со сниженным ростом стебля, что
позволило создать сорта с увеличенным индек-
сом урожайности.
19.5. Цитокинины стимулируют
деление клеток
Цитокинины представляют собой пренили-
рованные производные аденина. У зеатина,
наиболее широко распространенного цитоки-
нина, аминогруппа аденина связана с остат-
ком изопрена, гидроксилированным в транс-
положении (рис. 19.11). Цитокинины усиливают
рост растений, стимулируя деление клеток
и развитие боковых почек. Поскольку цитоки-
нины подавляют апикальное доминирование,
в этом их действие противоположно действию
ауксина (ИУК). Цитокинины задерживают
старение, проявляя антагонизм с фитогормо-
ном этиленом (раздел 19.7). Личинки некоторых
бабочек (например, Stigmella, которая повреж-
дает буковые деревья) используют это свойство
для своего питания. Они выделяют цитокинин
со слюной, и это предотвращает старение ли-
стьев, на которых они кормятся. В итоге на
желтеющих осенних листьях остаются зеленые
участки интактных тканей листа, которые и
после окончания вегетационного периода снаб-
жают гусениц питательными веществами, необ-
ходимыми для окукливания.
Зрелые (т.е. дифференцированные) клетки
растений обычно прекращают делиться. Добав-
ляя цитокинин и ауксин, дифференцированные
клетки можно заставить снова вступить в цикл
деления. Когда часть листа или других органов
растения (эксплант) помещают на агаризован-
ную питательную среду, содержащую ауксин
и цитокинин, начинается процесс дедифферен-
цирования клеток с последующим делением. Это
приводит к образованию каллуса, который раз-
растается (культура ткани). Если добавлять цито-
кинин и ауксин в определенных соотношениях,
из единственной клетки каллуса можно регене-
рировать целое растение1. Использование куль-
1 Это свойство называют тотипотеннтностью. Теорети-
чески из любой живой клетки растения можно получить
целый организм, хотя на практике этого удается добиться
не всегда. — Прим. ред.
19.5. Цитокинины стимулируют деление клеток
375
Д чметилаллилпирофосфат
Н СН3
С=С
©-©- О-сн2 сн3
Цитокинин-
си нтаза
Г идроксилаза
Зеатин
Рис. 19.11. Синтез цитокинина зеатина
Рибоза
тур тканей для получения трансгенных растений
будет описано в разделе 22.3.
Некоторые бактерии и грибы синтезируют
ауксин и цитокинин, чтобы вызвать неогра-
ниченные клеточные деления, приводящие
к опухолевому росту у растений. Образова-
ние корончатых галлов, которое вызывается
Agrobacterium tumefaciens (раздел 33.3), про-
исходит из-за усиленной продукции цитокини-
на и ауксина в опухолевой ткани. Бактерии не
производят эти фитогормоны сами, но перено-
сят гены биосинтеза цитокининов и ауксинов из
Ti-плазмиды бактерии в геном растений.
Зеатин образуется из АМФ и диметилал-
лилпирофосфата (см. рис. I9.ll). Изопреновый
остаток переносится цитокинин-синтазой
(пренилтрансфераза, раздел 17.2) на аминогруп-
пу АМФ и затем гидроксилируется. Синтез ци-
токинина происходит, в основном, в меристема-
тических тканях (преимущественно в корнях).
Получены трансгенные растения табака, в ко-
торых увеличена активность цитокининсинтазы
в листьях. Листья этих растений живут значи-
тельно дольше, чем нормальные, поскольку их
старение подавлено путем увеличения биосин-
теза цитокининов1.
Рецепторы цитокинина, как и этиленовые
рецепторы, представляют собой димерные ги-
стидинкиназы. Они находятся на плазматиче-
ской мембране, при этом рецепторный участок
направлен во внеклеточный компартмент, а ки-
назный — в цитоплазму. Киназная часть димера
содержит два гистидиновых и два аспартатных
остатка. При связывании с цитокинином два
гистидиновых остатка взаимно фосфорилируют
друг друга, процесс называется автофосфори-
лированием.
1 Имеется в виду экспрессия гена цитокининсинтазы под
промоторами генов, включающихся при старении. Уровень
цитокинина возрастает только тогда, когда лист собирается
пожелтеть. Экспрессия цитокининсинтазы под конститу-
тивным промотором (например, под 358-промотором —
см. разделы 20.5 и 22.4) вызывает образование адвентивных
почек и побегов прямо на листьях. — Прим. ред.
376
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Затем фосфатные группы передаются на ги-
стидиновый или аспартатный остаток белков-
переносчиков. Эти белки перемещаются в ядро,
где работают как транскрипционные факторы,
и таким образом регулируют экспрессию мно-
гих генов.
19.6. Абсцизовая кислота
контролирует водный баланс
растений
Абсцизовая кислота (АБК) была открыта во
время поиска веществ, которые вызывают опа-
дение листьев и плодов1, и была соответствен-
ное названа {abscission — опадение). Позднее
АБК предотвращает живорождение, или виви-
парию2 (т.е. прорастание семян прямо на ма-
теринском растении внутри плода). Получены
мутанты томатов с дефицитом АБК, у которых,
из-за нарушений водного баланса, быстро завя-
дают листья и плоды. У таких мутантов незре-
лые семена прорастают в плодах томатов еще
в то время, пока они находятся на материнском
растении.
АБК — продукт метаболизма изопреноидов.
Синтез АБК происходит при окислении виолак-
сантина (рис. 19.12, см. рис. 3.41). Синтез АБК
идет в листьях и в корнях, что позволяет непо-
средственно контролировать состояние водного
баланса. АБК может транспортироваться с вос-
две молекулы геранилгеранилпирофосфата
Абсцизовая кислота
Рис. 19.12. Синтез абсцизовой кислоты путём окислительной деградации
виолаксантина состоит из нескольких этапов
выяснилось, что образование отделительного
слоя при опадении листьев и плодов индуци-
руется, в основном, этиленом (описываемом в
следующем разделе). Важной функцией фито-
гормона АБК является, однако, индукция со-
стояния покоя семян и почек. Кроме того, АБК
играет основную роль при регуляции водного
баланса растений. Она через оксид азота (NO)
вызывает закрывание устьиц при недостаточ-
ном снабжении водой (раздел 8.2). Вдобавок
1 Абсцизовая кислота открыта в связи с исследованием
физиологии опадения листьев, созревания, растрескивания
и опадения плодов хлопчатника, что имеет важное эконо-
мическое значение. — Прим. ред.
ходящим током по сосудам ксилемы из корней
в листья, где она вызывает закрывание устьиц
(раздел 8.2).
АБК вызывает изменения в метаболизме,
поскольку влияет на экспрессию генов. Цепь
передачи сигнала от АБК включает G-белки,
протеинкиназы, протеинфосфатазы и син-
тез мессенджера циклической АДФ-рибозы
2 На самом деле АБК способствует переходу зародыша
семени в состояние покоя. Многие вивипарные виды, у ко-
торых вместо семян образуются укороченные побеги, тем не
менее обладают нормальным уровнем АБК. Наиболее изве-
стен чеснок и мятлик луковичный с воздушными лукович-
ками вместо семян. — Прим. ред.
19.6. Абсцизовая кислота контролирует водный баланс растений
377
Рис. 19.13. Циклическая АДФ-
рибоза, недавно открытый вторичный
мессенджер у растений, вызывает
высвобождение ионов кальция в
цитозоль. Это вещество по-видимому
широко распространено в царствах
растений и животных. При образовании
циклической АДФ-рибозы (цАДФР)
из НАД+ с участием АДФР-циклазы,
рибозный остаток на левой стороне
рисунка вместо положительно
заряженного N-атома пиридинового
кольца присоединяется к N-атому
аденинового кольца, приобретающему
при этом положительный заряд
Аминоциклопропанкарбоновая
S-Аденозилметионин
Рис. 19.14. Синтез этилена
Этилен
Н2С=СН2
+ СО2
+ HCN
+ Н2О
(цАДФР) (рис. 19.13). Ранние исследования
животных систем позволили предположить,
что цАДФР, так же как и инозитолтрифосфат,
работает, передавая сигнал для высвобождения
ионов кальция. Эта функция четко подтвержде-
на для растения Arabidopsis. Существует также
и другая цепь передачи сигнала при действии
АБК, в которой высвобождение ионов кальция
происходит через фосфатидилинозитольный
путь, который опосредуется фосфолипазой С
(см. рис. 19.4). Увеличение в цитозоле уровня
кальция, которое вызвано или образованием
цАДФР, или высвобождением инозитолтри-
фосфата1, приводит к активации ионных кана-
лов, участвующих в закрывании устьиц и также
в модификации транскрипционных факторов,
через протеинкиназный каскад (например,
МАРК-типа).
1 Тип сигнального каскада, по-видимому, зависит от кон-
кретного вида растений или тканей. Все приведенные дан-
ные получены для замыкающих клеток устьиц. Обнаружены
также внутриядерные рецепторы для АБК. — Прим. ред.
378
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
19.7. Этилен и созревание плодов
Как упоминалось в предыдущем разделе, эти-
лен участвует в индукции старения. При старе-
нии начинается распад органических веществ
в листьях. Белки разлагаются до аминокислот,
которые вместе с определенными ионами (на-
пример, Mg2+) уходят из стареющих листьев по
флоэме для повторного использования. У мно-
голетних растений эти вещества запасаются
в стеблях или в корнях, а у однолетних исполь-
зуются для повышения семенной продуктив-
ности. Этилен индуцирует защитные реакции
после инфицирования грибами или при поеда-
нии животными. Например, индукция этиле-
ном синтеза танинов у акаций в ответ на поеда-
ние антилопами рассмотрено в разделе 18.7.
Кроме стимуляции опадения плодов, этилен
играет важную роль при созревании плодов. Со-
зревание плодов можно рассматривать как осо-
бенную форму старения. Влияние газообразного
этилена можно продемонстрировать следующим
опытом. Если поместить зрелое яблоко и зеленый
томат вместе в пластиковый пакет, этилен, вы-
деляемый яблоком, ускорит созревание томата.
Бананы собирают недозрелыми, а затем транс-
портируют через полмира в условиях, которые по-
давляют синтез этилена (при низкой температуре,
в атмосфере СО2). Перед продажей у этих бананов
ускоряют созревание, обрабатывая их этиленом.
Точно так же и томаты часто непосредственно
перед продажей обрабатывают этиленом, чтобы
придать им товарный вид (спелость).
S-аденозилметионин (см. рис. 12.10) яв-
ляется предшественником синтеза этилена
(рис. 19.14). Положительный заряд атома серы
в S-аденозилметионине облегчает его расще-
пление и образование циклопропанового коль-
ца. Эта реакция катализируется аминоцикло-
пропанкарбоксилатсинтазой (АЦК-синтазой).
Затем АЦК-оксидаза катализирует окисление
аминоциклопропанкарбоновой кислоты (АЦК)
с образованием этилена, СО2, HCN и воды. HCN
немедленно удаляется, превращаясь в нетоксич-
ный р-цианоаланин (реакция не показана).
Генная инженерия позволяет подавлять син-
тез этилена в томатах двумя различными спосо-
бами.
1. Снижение активности АЦК-синтазы
^^^ИК-оксидазы введением комплиментарной
^^цысловой) копии гена (раздел 22.5).
2. Введение в растение бактериального гена,
в результате экспрессии которого накапливается
фермент, настолько быстро разрушающий АЦК
в плодах томатов, что она не успевает преобра-
зоваться в этилен АЦК-оксидазой.
Целью этих генно-инженерных разработок
является получение томатов, которые будут луч-
ше храниться при транспортировке. Кроме того,
также созданы трансгенные растения томатов,
у которых срок хранения собранных плодов зна-
чительно увеличен с помощью антисмысловой
супрессии полигалактуронидазы — фермента,
лизирующего клеточную стенку.
Этилен вызывает изменение экспрессии мно-
жества различных генов. Поскольку этилен, как
и другие фитогормоны, может оказывать влия-
ние в очень низких концентрациях (10-8 моль/л),
рецепторы этилена обладают очень высокой
аффинностью. Так же, как и цитокининовые
рецепторы, они представляют собой димеры
и принадлежат семейству гистидиновых ре-
цепторных киназ. Каждая из субъединиц со-
держит гистидиновый остаток, который после
автофосфорилирования переносит фосфатную
группу на гистидиновый или аспартатный оста-
ток белка-мишени. При связывании этилена
с рецептором (в процессе участвует также медь-
содержащий кофактор) киназная активность
снижается, и автофосфорилирование прекра-
щается. В зависимости от состояния фосфори-
лированности этиленового рецептора сигнал
передается через каскад протеинкиназ, в кото-
рых участвуют МАРКК и МАРК (раздел 19.1),
на транскрипционные факторы, контролирую-
щие экспрессию определенных генов. Стоит за-
метить, что гистидинкиназы обнаружены у рас-
тений, дрожжей и бактерий, но не у животных.
19.8. Стероидные и пептидные
гормоны растений
Ранее1 считалось, что стероидные и пептидные
гормоны, которые выполняют множество раз-
личных функций у животных, не играют осо-
бой роли у растений. Недавние исследования
ясно показали, что это не так. Стероиды, так же
как и пептиды, выполняют у растений важные
гормональные функции.
1 До 1979 г., когда были открыты первые фитогормоны
стероидной природы — брассиностероиды. — Прим. ред.
19.8. Стероидные и пептидные гормоны растений
379
Брассиностероиды и контроль
развития растений
Стероидные фитогормоны растений также на-
зывают брассиностероидами. Наиболее эф-
фективным из брассиностероидов является
брассинолид (рис. 19.15). Брассиностероиды
синтезируются из кампестерина (мембранно-
го липида, рис. 15.3). Брассиностероиды регу-
лируют развитие растений. Кроме того, они
стимулируют рост побегов, разворачивание ли-
стьев и дифференциацию ксилемы. Они замед-
ляют рост корней и образование антоцианов.
Поскольку аналогичные эффекты могут на-
блюдаться при взаимодействии «классических»
гормонов (ауксина, цитокинина, гиббереллина,
этилена и АБК), то долгое время были серьез-
ные сомнения, считать ли брассиностероиды
фитогормонами.
Впервые брассиностероиды были выделены
из пыльцы. Стало известно, что пыльца содер-
жит фактор роста. В 1979 г. ученые из Министер-
ства сельского хозяйства США из 40 кг пыльцы
рапса, собранной пчелами, выделили 4 мкг ве-
щества, которое потом было идентифицировано
и получило название брассинолида1. Позднее, с
использованием очень чувствительных мето-
дов анализа, было показано, что практически
все растения содержат брассинолид или другие
брассиностероиды. Функция брассиностерои-
дов как важных гормонов была установлена при
изучении мутантов Arabidopsis с дефектами раз-
вития, такими как карликовый рост, снижен-
ное апикальное доминирование, пониженная
фертильность. Анализ генов, ответственных за
эти нарушения, показал, что эти мутации по-
вреждают ферменты синтеза брассиностерои-
дов. Путь биосинтеза брассинолидов оказался
очень похожим на синтез животных стероидных
гормонов. Было показано, что полученные де-
фекты развития невозможно предотвратить до-
бавлением «классических» фитогормонов. Фе-
нотип мутантов восстанавливался только при
обработке небольшими дозами брассинолида,
в концентрациях, содержащихся в нормальном
растении. Эти результаты показали важную
роль брассиностероидов для роста и развития
растений.
1 От бинарного названия рапса — Brassica napus. — Прим. ред.
Сквален
Рис. 19.15. Брассинолид образуется из
мембранного липида кампестерина через цепь
биосинтеза, включающую цитохром-
Р450-зависимые гидроксилазы, редуктазы и др.
Этот путь похож на соответствующий путь синтеза
стероидных гормонов у животных
В животных клетках стероидные гормоны
воспринимаются через связывание со специаль-
ными стероидными рецепторами, которые на-
ходятся в цитоплазме. Будучи активированным
добавлением стероидов, гормон-рецепторный
комплекс переносится в ядро и стимулирует или
подавляет экспрессию определенных генов. Рас-
тительные стероиды работают по другому пути,
поскольку у них нет гомологов стероидных ре-
цепторов животных. Показано, что рецептор
брассинолида в растениях является рецептор-
подобной киназой (RLK, раздел 19.1), который,
возможно, связан с MAP-киназным каскадом,
регулирующим деятельность транскрипцион-
ных факторов. Исследования брассиностерои-
дов находятся еще на начальных этапах, и на
многие вопросы ответ еще неизвестен.
380
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Полипептидные гормоны
После открытия полипептидного гормона ин-
сулина у животных было обнаружено большое
количество полипептидных гормонов с разноо-
бразными функциями. Установлено, что расте-
ния также образуют полипептидные гормоны.
Исследования этого безусловно очень важного
направления находятся еще в зачаточном со-
стоянии. Из-за небольшого размера молекул до
сегодняшнего дня у растений идентифицирова-
но лишь несколько функциональных пептидов.
Дальше приведены только три примера из боль-
шого числа полипептидных фитогормонов.
Системин и защита от животных,
поедающих растения
Многие растения отвечают на нападение на-
секомых, накапливая ингибиторы протеиназ,
которые токсичны для насекомых, поскольку
при их действии нарушается расщепление бел-
ков. Для растений томатов показано, что поли-
пептид системин, состоящий из 18 аминокис-
лот, участвует в защитных реакциях1. В ответ
на нападение насекомых синтезируется белко-
вый предшественник системина, который за-
тем расщепляется эндопротеазами до актив-
ного полипептида. Системин воспринимается
мембрано-связанным рецептором с очень вы-
сокой аффинностью. Концентрации системина
в 10_,° моль/л достаточно для полунасыщения
рецептора. Рецептор был идентифицирован; он
представляет собой рецептор-подобную кина-
зу (RLK) (раздел 19.1). Это часть сигнального
каскада, генерируемого жасмоновой кисло-
той (раздел 15.7), является ключевым сигналом
при активации транскрипции генов, связанных
с защитой (например, при синтезе ингибиторов
протеиназ) (см. следующий раздел). Следует
заметить, что эффект системина видоспеци-
фичен. Системин из томатов может оказывать
влияние на картофель и красный перец, однако
не влияет на столь же близкий по систематиче-
скому положению табак и другие растения. Рас-
тения табака могут синтезировать системин-
подобные полипептиды, структура которых
сходна со структурой системина томатов и об-
ладают аналогичным эффектом. Вопрос о том,
1 В настоящее время системины рассматривают не как
фитогормоны, а как вторичные мессенджены. Обнаружено
несколько различных системинов. — Прим. ред.
участвуют ли системин-подобные полипептид-
ные фитогормоны в защитных реакциях других
растений, пока еще недостаточно изучен.
Одним из эффектов добавления системин-
подобных полипептидов в суспензию культуры
клеток табака было защелачивание среды куль-
тивирования. В частности, полипетид из 49 ами-
нокислот вызывал быстрое защелачивание сре-
ды (rapid alkalization) и был назван RALF2. Его
гомологи были найдены у многих видов расте-
ний. У Arabidopsis обнаружено 9 генов RALF,
которые экспрессируются в различных органах
растений. Частота встречаемости полипептидов
RALF предполагает, что они выполняют важную
функцию у растений, которую пока еще пред-
стоит установить. Недавние наблюдения пока-
зывают, что RALF ингибирует деление клеток
в тканях корня.
Фитосульфокины регулируют деление
клеток
В среде культивирования суспензии клеток
был обнаружен фактор, усиливающий их деле-
ние. Он был идентифицирован как смесь двух
небольших полипептидов, которые назвали
фитосульфокинами (PSKa и PSKp), каждый
из которых содержал по два тирозиновых остат-
ка, обе гидроксильные группы которых этери-
фицированы сульфатом.
PSKa: Тир(8О3Н)-Иле-Тир(8О3Н)-Тре-Глн
PSKp: Тир(8О3Н)-Иле-Тир(8О3Н)-Тре
Фитосульфокины с идентичными структу-
рами присутствуют у многих растений и ока-
зывают, как и ауксин с цитокинином, важное
регуляторное влияние на дедифференциацию
клеток. Растительные клетки обладают тотипо-
тентностью. Это означает, что они могут дедиф-
ференцироваться, т.е. вернуться в клеточный
цикл и далее из них может регенерировать новое
растение. Для фитосульфокинов идентифици-
рован их рецептор — рецептор-подобная про-
теинкиназа (RLK). Она, возможно, действует
через сигнальный каскад на транскрипционные
факторы, регулирующие гены, которые отвеча-
ют за дедифференциацию и пролиферацию.
2 Rapid Alkalization Factor. — Прим. ред.
19.9. Взаимодействие нескольких сигналов при защитных реакциях
381
19.9. Взаимодействие нескольких
сигналов при защитных
реакциях
Как обсуждалось в разделе 16.1, растениях могут
защитить себя от патогенных бактерий и гри-
бов с помощью синтеза фитоалексинов. В не-
которых случаях наблюдается реакция сверх-
чувствительности — процесс, включающий
программируемую клеточную гибель, который
приводит к локализации очага заболевания.
Животные, которые питаются растениями, мо-
гут также стимулировать образование защит-
ных веществ, которые делают биомассу расте-
ния ядовитой или неперевариваемой.
Эти разнообразные защитные реакции на-
чинаются в результате взаимодействия раз-
личных сигнальных веществ. После нападения
патогенов или в ответ на абиотические стрессы
запускаются сигнальные каскады, в том чис-
ле фосфоинозитольный (раздел 19.1), которые
приводят к увеличению концентрации Са2+
в цитозоле. Это активирует Са2+-зависимые
протеинкиназы (CDK). Они, в свою очередь,
активируют протеинкиназный каскад, кото-
рый модулирует экспрессию генов через транс-
крипционные факторы (раздел 19.1). Крометого,
при раннем ответе появляются АФК (активные
формы кислорода): супероксид анион-радикал
(•О2_) и/или Н2О2. Они образуются в резуль-
тате действия НАДФН-оксидазы, находящейся
на плазматической мембране. АФК — это хими-
ческое оружие для направленной атаки на пато-
генов. Но они также являются мессенджерами,
индуцирующими сигнальные каскады, которые
вызывают синтез других защитных веществ.
Н2О2 участвует в процессе лигнификации (раз-
дел 18.3), что играет важную роль в укреплении
клеточной стенки против патогенов. Другим
ранним ответом на нападение патогенов явля-
ется образование оксида азота (NO). Это из-
вестный мессенджер у животных и растений, он
образуется при окислении аргинина. Реакция
катализируется синтазой оксида азота (II).
Аргинин + О2+НАДФН-----> Цитруллин +
+ НАДФ+ +NO
Кроме того, NO может образовываться из
нитрата, являясь побочным продуктом работы
нитратредуктазы (раздел 10.1).
NO2-+HA4^)H+H+ —> no+h2o
В настоящее время неизвестно, какой из этих
двух путей играет основную роль при синтезе
NO, и как этот синтез регулируется. У растений
NO — важный мессенджер при передаче сигна-
лов и в защитных реакциях. Он стимулирует вы-
свобождение кальция из внутриклеточных депо,
при этом увеличивается цитоплазматическая
концентрация кальция и активируются сиг-
нальные каскады. NO индуцирует открывание
устьиц, вместе с абсцизовой кислотой регулируя
ширину устьичной щели (раздел 8.2). NO уча-
ствует в запуске процессов программируемой
клеточной смерти и образовании фитоалекси-
нов. Он также индуцирует синтез салициловой
кислоты (см. рис. 18.5).
Салициловая кислота играет основную роль
при защите от патогенов. Трансгенные рас-
тения табака, в которых нарушен синтез сали-
циловой кислоты, были весьма уязвимы к бак-
териальным или грибным инфекциям. Среди
ферментов, индуцируемых салициловой кисло-
той,— р-1,3-глюканаза, которая частично ги-
дролизует клеточную стенку грибов, и липокси-
геназа, ключевой фермент синтеза жасмонатов
(см. рис. 15.29 и 15.30).
Образование жасмонатов (например, ин-
дуцируемое системином) регулируется сиг-
нальным каскадом, в котором участвуют ионы
кальция и MAP-киназы. Также при восприя-
тии сигнала от жасмонатов МАР-киназный
каскад регулирует участвующие в этом про-
цессе транскрипционные факторы. Жасмонат
и ее метиловый эфир, так же как и их предше-
ственник — 12-оксо-фитодиеновая кисло-
та (OPDA) — играют центральную роль в за-
щитных реакциях. В ответ на заражение грибом
жасмонаты индуцируют синтез фениламмиа-
клиазы (PAL) (см. рис. 18.2), первого фермен-
та фенилпропаноидного биосинтеза, а также
халконсинтазы (CS) (рис. 18.11), ключевого
фермента биосинтеза флавоноидов. Как уже
обсуждалось в главе 18, многие защитные ве-
щества происходят из фенольных соединений.
Например, в ответ на повреждение животными
жасмонаты стимулируют в растениях синтез ин-
гибиторов протеиназ. В ответ на механический
стресс (например, от ветра) жасмонаты вызы-
1 Имеется в виду горох (Pisum sativum). — Прим. ред.
382
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
вают усиленное утолщение стебля и усиков1,
что улучшает стабильность положения расте-
ния. Кроме того, у некоторых растений жасмо-
наты регулируют развитие пыльцы. Мутанты
Arabidopsis, неспособные к синтезу жасмона-
тов, не могут образовывать фертильную пыль-
цу, таким образом у них наблюдается мужская
стерильность. Жасмонаты, так же как ауксины
и гиббереллины (раздел 19.3 и 19.4), действуют
через убиквитин-протеасомную систему (раз-
дел 21.4), контролируя экспрессию генов через
деградацию белков-ингибиторов.
Поранение животными во многих случаях
вызывает защитные реакции не только в по-
врежденных листьях, но также и в более удален-
ных органах растения (системная реакция). Для
этого необходим дальний транспорт сигнальных
веществ в растении. Недавние результаты пока-
зали, что жасмонаты и системин могут быть
таким системным сигналом поранения.
19.10. Рецепторы света и регуляция
роста и развития растений
Свет различными путями контролирует мно-
гие этапы развития растений: от прорастания
до образования цветков. Важными рецепто-
рами света в этих процессах являются фитох-
ромы, воспринимающие красный свет. Фи-
тохромы участвуют в процессах инициации
прорастания под действием света и позелене-
ния проростка (деэтиоляция), а также в при-
способлении фотосинтетического аппарата
листьев к полному освещению или к темноте.
Для адаптации к полному спектру солнечного
света у растений есть фоторецепторы синего и,
вероятно, УФ-света1. К настоящему времени
в качестве рецепторов синего света идентифи-
цированы три белка: криптохромы 1 и 2 (каж-
дый из них содержит флавин (см. рис. 5.16) и
птерин (см. рис. 10.3)), а также фототропин1 2,
содержащий один флавин как пигмент для по-
глощения синего света. Возможно, он является
одним из сенсоров УФ-света, которые до сих
1 Рецептор ультрафиолетового света у растений до сих пор
является гипотетическим. УФ запускает ряд специфических
защитных реакций, что говорит о наличии соответствующих
рецепторов. — Прим. ред.
2 К настоящему времени показано, что фототропинов так-
же два (1 и 2). — Прим. ред.
Рис. 19.16. Хромофор фитохрома состоит
из незамкнутого тетрапиррола, который связан
тиоэфирной связью с апопротеином.
Поглощение кванта красного света приводит
к цис-транс-изомеризации двойной связи,
в результате изменяется положение одного
пиррольного кольца (показано красным)
пор еще не идентифицированы. Цепь пере-
дачи сигнала от криптохромов и фототропина
пока неизвестна. Фототропин является рецеп-
торной киназой. При действии синего света он
автофосфорилируется в результате собственной
протеинкиназной активности. Криптохромы
под действием синего света также подвергаются
светозависимому фосфорилированию. Все эти
фоторецепторы, возможно, влияют на актив-
ность транскрипционных факторов через цепь
передачи сигнала, включающую изменение
концентраций цитоплазматического Са2+ и ак-
тивность протеинкиназ. Таким образом регули-
руется экспрессия генов.
Поскольку структура и функции фитохромов
хорошо изучены, то они могут служить приме-
ром для более детального обсуждения проблем
передачи светового сигнала в растениях. Фито-
хромы — это растворимые димерные белки, ко-
торые функционируют, не будучи связанными
с мембраной. Мономер состоит из апопротеина
19.10. Рецепторы света и регуляция роста и развития растений
383
(молекулярная масса 120—130 кДа), в котором
сульфгидрильная группа цистеинового остатка
связана с незамкнутым тетрапирролом — хро-
мофором (рис. 19.16). Автокаталитическое свя-
зывание тетрапиррола с апопротеином приво-
дит к образованию фитохрома Фк (к=красный)
с максимумом поглощения около 660 нм (крас-
ный свет) (рис. 19.17). Поглощение такого света
приводит к изменениям в хромофоре. Двойная
связь между двумя пиррольными кольцами из-
меняется с транс- на цмс-конформацию (по-
мечено красным на рис. 19.16). Это вызывает
изменения конформации белка. В новой кон-
формации фитохром имеет максимум погло-
щения около 730 нм (дальний красный свет —
ДК) и в этом состоянии он обозначается Фдк.
Фдк — это активная форма фитохрома. Фдк пере-
ходит в Фк при поглощении дальнего красного
света. Поскольку спектры поглощения Фдк и Фк
перекрываются (см. рис. 19.17) в зависимости
от спектра окружающего освещения, то дости-
гается обратимое равновесие между ними. Так,
при свете 660 нм 88% фитохромов присутству-
ет в форме Фдк, а при 720 нм — только 3%. При
ярком свете, когда красный компонент значи-
тельно сильнее, чем дальний красный, фито-
красный
660 нм
Рис. 19.17. Спектры поглощения двух форм
фитохрома В: Фк и Фдк
хром присутствует в основном в виде Фдк, и это
сигнализирует о состоянии хорошей освещен-
ности. Всего в изученном модельном растении
Arabidopsis thaliana (раздел 20.1) обнаружено
5 различных фитохромов (А—Е). Фитохром А
воспринимает свет дальнего красного участка
спектра, в то время как фитохром В — красный
свет1. В зависимости от условий освещения оба
фитохрома участвуют в морфогенезе растений.
Фитохромы С, D и Е выполняют специальные
функции, которые во всех подробностях еще
не изучены.
В то время как неактивная форма фитохрома
(Фк) имеет длительный период жизни (около 100
часов), у активной формы (Фдк) этот период зна-
чительно меньше — от 30 до 60 минут. Пул Фдк
может быть пополнен снова из Фк в результате
обратимости превращений (рис. 19.18). В случае
фитохрома А, однако, при переносе растения
из темноты на свет происходит конъюгация Фк
с убиквитином, что отправляет часть фитохрома
А на протеолитическую деградацию протеасом-
ным путем (раздел 21.4).
Показано, что у Arabidopsis фитохром А вли-
яет на транскрипицю 10% всех генов. Действие
фитохромов может изменяться в зависимости
от уровня фитогормонов, таких как цитокини-
ны или брассиностероиды, а также при актива-
ции сигнальных каскадов защиты от патогенов.
Таким образом, рецепторы света, фитогормоны
и защитные реакции образуют широкую сеть
взаимодействий. Активный фитохром Фдк вли-
яет на экспрессию генов через транскрипцион-
ные факторы. Поскольку фитогормоны кон-
тролируют экспрессию такого большого числа
генов, стоит ожидать, что в это вовлечены раз-
личные цепи передачи сигнала. Исследования,
проведенные к настоящему времени, подтверж-
дают это предположение.
1. Недавно было показано, что фитохром
А, также как и фитохром В, которые находятся
в цитозоле, после их превращения в активную
Фдк-форму перемещаются в ядро. Здесь каждый
из них связывается с фактором взаимодействия
1 В силу особенностей спектра поглощения красной фор-
мы фитохром А переходит в активную форму как при крас-
ном, так и при интенсивном дальнем красном освещении
Фитохром В при красном освещении переходит в активную
форму, а при дальнем красном — в неактивную. — Прим,
ред.
384
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
Рис. 19.18. Прямое влияние фитохромов А и В на экспрессию генов. Фитохром
под действием красного света превращается в активную Фдк-форму, а под действием
дальнего красного света снова возвращается к неактивной форме Фк. Активный
Фдк перемещается в ядро, где связывается с транскрипционным фактором PIF3.
После этого PIF3 регулирует экспрессию генов, непосредственно взаимодействуя
с промоторными участками ДНК. В случае фитохрома А Фдк может необратимо
деградировать путем протеолиза. Функции PIF3 остаются предметом серьёзных
дебатов
Рис. 19.19. Предполагаемые пути передачи сигнала от фитохромов, влияющие
на экспрессию генов
Дополнительная литература
385
с фитохромами (PIF3, phytochrome Interacting
factor) (рис. 19.18). Установлено, что комплекс
PIF3 и Фдк связывается с премоторным участ-
ком гена и таким образом регулирует его экс-
прессию. Хотя для выяснения подробностей
необходимы дальнейшие исследования, эти от-
крытия помогут дать первичное описание одной
из цепей передачи сигнала от рецептора к гену.
Стоит заметить, что столь короткая цепь переда-
чи сигнала не включает вторичные мессендже-
ры или протеинкиназы.
2. Протеинкиназная активность обнару-
жена у фитохрома А определенных растений.
Это позволяет предполагать, что фитохромы
связаны с протеинкиназным каскадом, регули-
рующим деятельность транскрипционных фак-
торов.
3. Есть доказательства в пользу существования
другой цепи передачи сигнала. Важным объектом
для этих исследований явились клетки мутантов
томатов, которые из-за недостатка фитохрома,
не могли зеленеть. Микроинъекции ионов каль-
ция и кальмодулина в единичные клетки этих
мутантов могли заменить действие фитохромов
при индукции синтеза светособирающих ком-
плексов. Эти результаты показали, что кальций
может быть одним из мессенджеров в путях пере-
дачи сигнала от фитохромов (рис. 19.19). Фитох-
ромы также индуцируют фермент халконсинтазу
(см. рис. 18.11). В уже упоминавшихся клетках
мутантов такая индукция халконсинтазы может
быть вызвана инъекцией цГМФ (см. рис. 19.2).
Это приводит к выводу, что цГМФ является дру-
гим мессенджером в Фдк-индуцируемой цепи пе-
редачи сигнала к Са2+. Дальнейшие исследования
показали, что в обеих цепях участвует G-белок.
Для проверки выдвинутых гипотез о цепях пере-
дачи сигнала необходимы дальнейшие исследо-
вания.
В настоящее время ведутся интенсивные ис-
следования цепей передачи сигнала от рецепто-
ров света. Стоит ожидать, что ближайшие годы
внесут больше определенности в наши знания
о действии соответствующих сигнальных путей.
Дополнительная литература
Bishop, G. J., Koncz, С. Brassinosteroids and plant steroid
hormone signaling. Plant Cell, Supplement, 97—110
(2002).
Chang, C. Ethylene signaling: The МАРК module has
finally landed. Trends Plant Sci 8, 365—368 (2003).
Cheng, S.-H., Willmann, M. R., Chen, H.-С., Sheen,
J. Calcium signaling through protein kinases. The
Arabidopsis calcium-dependent protein kinase gene
family. Plant Physiol 129, 469-485 (2002).
Cohen, J. D., Slovin, J. P., Hendrickson, A. M. Two
genetically discrete pathways convert tryptophan to
auxin: More redundancy in auxin biosynthesis. Trends
Plant Sci 8, 197-199(2003).
Finkelstein, R. R., Gampala S. S. L., Rock, C. D. Abscisic
acid signaling in seeds and seedlings. Plant Cell,
Supplement, 15—45 (2002).
Friml, J., Vieten, A., Sauer, M., Weijers, D., Schwarz, H.,
Hamann, T, Offringa, R., Juergens, G. Efflux-
dependent auxin gradients establish the apical-basal axis
of Arabidopsis. Nature 426, 147—153 (2003).
Frohnmeyer, H., Staiger, D. Ultraviolet-В radiation-
mediated responses in plants. Balancing damage and
protection. Plant Physiol 133, 1420—1428 (2003).
Fujioka, S., Yokota, T. Biosynthesis and metabolism of
brassinosteroids. Annu Rev Plant Biol 54, 137—164
(2003).
Garcia-Martinez, J. L., Huq, E., Quail, H. Direct
targeting of light signals to a promoter element-bound
transcription factor. Science 288, 859—862 (2000).
Geldner, N., Frimi, J., Stierhof, Y. D., Juergens, G.,
Palme, K. Auxin transport inhibitors block PIN 1 cycling
and vesicle trafficking. Nature 413, 425—428 (2001).
Grossmann, K. Mode of action of auxin herbicides: A new
ending to a long, drawn out story. Trends Plant Sci 5,
506-508 (2000).
Guillaume, T, Asai, T, Chiu, W.-L., Sheen, J. Plant
mitogen-activated protein kinase signaling cascades.
Curr Opin Plant Biol 4, 329-400 (2001).
Guo, F.-Q., Okamoto, M., Crawford, N. M. Identification
of a plant nitric oxide synthase gene involved in hormonal
signaling. Science 302, 100—103 (2003).
Hardie, D. G. Plant protein serine/threonine kinases:
Classification and functions. Annu Rev Plant Physiol
Plant Mol Biol 50, 97-131 (1999).
Harmon, A. C, Gribskov, M., Harper, J. F. CDPKs —
a kinase for every Ca2+ signal? Trends Plant Sci 5, 154—
159 (2000).
Itoh, H., Matsuoka, M., Steber, M. Arolefortheubiquitin-
26S-proteasome pathway in gibberellin signaling. Trends
Plant Sci 8, 492-497 (2003).
Kakimoto, T. Perception and signal transduction of
cytokinins. Annu Rev Plant Biol 54, 605—627 (2003).
386
19. Комплексная регуляция роста, развития и приспособления к окружающей среде...
King, R. W., Evans, L. Т. Gibberellins and flowering of
grasses and cereals: Prizing open the lid of the ’’florigen"
black box. Annu Rev Plant Biol 54, 307—328 (2003).
Lamattina, L., Garcia-Mata, C., Graziano, M., Pagnussat,
G. Nitric oxide: The versatility of an extensive signal
molecule. Annu Rev Plant Biol 54, 109—135 (2003).
Lee, J., Rudd, J. J. Calcium-dependent protein kinases:
Versatile plant signalling components necessary
for pathogen defence. Trends Plant Sci 7, 97—99
(2002).
Leyser, O. Auxin signalling: The beginning, the middle
and the end. Curr Opin Plant Biol 4, 382—386 (2001).
Li, J., Nam, К. H. Regulation of brassinosteroid signaling
by a GSK3/SHAGGY-like kinase. Science 295, 1299—
1301 (2002).
Lin, C., Shalitin D. Cryptochrome structure and signal
transduction. Annu Rev Plant Biol 54, 469—496
(2003).
Liscum, E., Hodgson, D. W., Campbell, T. J. Blue light
signaling through the cryptochromes and phototropins.
So that's what the blues is all about. Plant Physiol 133,
1429-1436 (2003).
Lovegrove, A., Hooley, R. Gibberellin and abscisic acid
signaling in aleurone. Trends Plant Sci 5, 102—110
(2000).
МАРК Group (Ichimura, K. et aL). Mitogen-activated
protein kinase cascades in plants: A new nomenclature.
Trends Plant Sci 7, 301-308 (2002).
Matsubayashi, Y., Ogawa, M., Morita, A., Sakagami,
Y. An LRR receptor kinase involved in perception of
a peptide plant hormone, phytosulfokine. Science 296,
1470-1472 (2002).
Meijer, H. J. G., Munnik, T. Phospholipid-based signaling
in plants. Annu Rev Plant Biol 54, 265—306 (2003).
Mok, D. W. S., Mok, M. C. Cytokinin metabolism and
action. Annu Rev Plant Physiol Plant Mol Biol 52,
89—118(2001).
Meller, S. G., Kim, Y.-S., Kunkel, T., Chua, N.-H.
PP7 is a positive regulator of blue light signaling in
Arabidopsis. Plant Cell 15, 1111-1119(2003).
Muday, G. K., Peer, W. A., Murphy, A. S. Vesicular cycling
mechanisms that control auxin transport polarity. Trends
Plant Sci 8, 301-304 (2003).
Munnik, T. Phosphatidic acid: An emerging plant lipid
second messenger. Trends Plant Sci 6, 227—233 (2001).
Nagy, E., Schafer, E. Control of nuclear import and
phytochromes. Curr Opin Plant Biol 3,450—454 (2000).
Olszewski, N., Sun, Т.-P., Gubler, F. Gibberellin signaling.
Biosynthesis, catabolism, and response pathways. Plant
Cell, Supplement, 61—80 (2002).
Parks, В. M. The red side of photomorphogenesis. Plant
Physiol 133,1437-1444(2003).
Reed, J. W. Roles and activities of Aux/IAA proteins
in Arabidopsis. Trends Plant Sci 6, 420—425 (2001).
Richards, D. E., King, К. E., Ait-ali, T, Harberd, N. P.
How Gibberellin regulates plant growth: A molecular
genetic analysis of gibberellin signaling. Annu Rev Plant
Physiol Plant Mol Biol 52, 67-88 (2001).
Ross, J., O'Neill, D. New interactions between classical
plant hormones. Trends Plant Sci 6, 2—4 (2001).
Ryan, C A., Pearce, G. Polypeptide hormones. Plant
Physiol 125,65-68 (2001).
Ryan, C. A., Pearce, G., Scheer, J., Moura, D. S. Polypeptide
hormones. Plant Cell, Supplement 251—264 (2002).
Sanders, D., Pelloux, J., Brownlee, C., Harper, J. E
Calcium at the crossroads of signaling. Plant Cell,
Supplement, 401—417 (2002).
Sasaki, A., Itoh, H., Gomi, K., Ueguchi-Tanaka, M.,
Ishiyama, K., Kobayashi, M., Jeong, D.-H., An, G.,
Kitano, H., Ashikari, M., Matsuoka, M. Accumulation
of phosphorylated repressor for gibberellin signaling in
an F-box mutant. Science 299, 1896—1898 (2003).
Scheel, D., Wasternack, C. (eds.). Plant signal transduction.
Oxford University Press, Oxford, UK (2002).
Seo, M., Koshiba, T. Complex regulation of AB A biosynthesis
in plants. Trends Plant Sci 1,41—48 (2002).
Silverstone, A. L., Sun, T-P. Gibberellins and the green
revolution. Trends Plant Sci 5, 1—2 (2000).
Stepanova, A. N., Ecker, J. R. Ethylene signaling: From
mutants to molecules. Curr Opin Plant Biol 3, 353—360
(2000).
Stevenson, J. M., Perera, I. Y., Heilmann, 1., Person, S.,
Boss, W. F. Inositol signaling and plant growth. Trends
Plant Sci 5, 252-258 (2000).
Stoelzle, S., Kagawa, T., Wada, M., Hedrich, R., Dietrich,
P. Blue light activates calcium-permeable channels
in Arabidopsis mesophyll cells via the phototropin
signaling pathway. Proc Natl Acad Sci USA 100,
1456-1461 (2003).
Stratmann, J. W. Long distance run in the wound
response — jasmonic acid is pulling ahead. Trends Plant
Sci 8, 247-250 (2003).
Tichtinsky, G., Vanoosthuyse, V, Cock, J. M., Gaude, T.
Making inroads into plant receptor kinase signalling
pathways. Trends Plant Sci 8, 231—237 (2003).
Timpte, C. Auxin binding protein: Curiouserand curiouser.
Trends Plant Sci 6, 586—590 (2001).
Torii, K. U. Receptor kinase activation and signal
transduction in plants: An emerging picture. Curr Opin
Plant Biol 3, 361-367 (2000).
Дополнительная литература
387
Turner, J. G., Ellis, C., Devoto, A. The jasmonate signal
pathway. Plant Cell, Supplement, 153—164 (2002).
Wang, H., Deng, X. W. Dissecting the phytochrome
А-dependent signaling network in higher plants. Trends
Plant Sci 8, 172-178 (2003).
Wu, Y., Kuzma, J., Marechai, E., Graeff, R., Lee, H. C.,
Foster, R., Chua N.-H. Abscisic acid signaling through
cyclic ADP-ribose in plants. Science 278, 2126—2130
(1997).
Xiong, L., Zhu, J.-K. Regulation of abscisic acid
biosynthesis. Plant Physiol 133, 29—36 (2003).
Yang, Z. Small GTPases: Versatile signaling switches
in plants. Plant Cell, Supplement, 375—388 (2002).
Zhao, Y., Dai, X., Blackwell, H. E., Schreiber, S. L.,
Chory, J. SIR1, an upstream component in auxin
signalling identified by chemical genetics. Science 301,
1107-1110(2003).
Zhang, L., Lu, Y.-T. Calmodulin-binding protein kinases
in plants. Trends Plant Sci 8, 123—127 (2003).
Zhang, S., Kiessig, D. E МАРК cascades in plant defense
signaling. Trends Plant Sci 6, 520—527 (2001).
Три генома растительной клетки
В растительной клетке три органеллы име-
ют геном: ядро, митохондрии и пласти-
ды. Размеры этих геномов у трех растительных
видов (в парах оснований, п.о.) приведены
в табл. 20.1, для сравнения указаны размеры
ядерного и митохондриального геномов чело-
века. Как обсуждалось в главе 1, генетическая
информация митохондрий и пластид содержит-
ся в одной кольцевой двунитевой ДНК (иногда
в нескольких), при этом в каждой органелле
присутствует множество копий. При размноже-
нии органелл путем деления эти копии случай-
ным образом распределяются по дочерним ор-
ганеллам. Случайным же образом по дочерним
клеткам распределяется при делении клеток
множество содержащихся в них митохондрий
и пластид. Генетическая информация мито-
хондрий и пластид наследуется, как правило,
по материнской линии от поколения к поколе-
нию, при этом большое число наследуемых ген-
ных копий помогает компенсировать мутации
в генетическом материале. Структуре и функ-
циям пластидного и митохондриального гено-
мов посвящены разделы 20.6 и 20.7.
20.1. Организация генетической
информации в ядре
В течение почти всего цикла развития у цветко-
вых растений эукариотические клетки дипло-
идны, т. е. содержат двойной набор хромосом:
материнский и отцовский. Только небольшая
часть цикла приходится на гаплофазу (зароды-
шевый мешок и пыльцу). Гаметы (яйцеклетки
и спермии) гаплоидны, содержат только один
хромосомный набор. Геномная ДНК удваива-
ется в интерфазе митотического цикла, образуя
четыре хромосомных набора. В анафазе хромо-
сомы с помощью веретена деления расходят-
ся к двум противоположным полюсам клетки.
Каждая дочерняя клетка снова будет содержать
двойной хромосомный набор. Колхицином
(алкалоидом безвременника — Colchicum) мож-
но ингибировать работу веретена деления,
при этом нарушится распределение хромосом
в анафазе. В этом случае все хромосомы могут
собраться только в одной дочерней клетке, ко-
торая станет тетраплоидной. Нередко тетра-
пл оидность появляется спонтанно при наруше-
нии митотических функций.
Таблица 20.1. Размер геномов растений и человека
Arabidopsis thaliana
(резуховидка)
Zea mays
(кукуруза)
Vicia faba
(бобы)
Homo sapiens
(человек)
Количество пар оснований в одной копии
Ядро (гаплоидный хромосомный набор) 7 х 107 390 х 107 1450 х 107 280 х 107
Пластиды 156 х 103 136 х 103 120 х 103
Митохондрии 370 х 103 570 х 103 290 х 103 17 х 103
20.1. Организация генетической информации в ядре
389
Таблица 20.2. Число хромосом
п: плоидность гл: число хромосом в гаплоидном наборе n*m
А Двудольные Arabidopsis thaliana (резуховидка) Vicia faba (бобы) Glycine max (соя) Brassica napus (рапс) Beta vulgaris (сахарная свёкла) Solanum tuberosum (картофель) Nicotiana tabacum (табак) Б Однодольные Zea mays (кукуруза) Hordeum vulgare (ячмень) Triticum aestivum (пшеница) Oryza sativa (рис) 2*5 2*6 2*20 2*19 6*19 4*12 4*12 2*10 2*7 6*7 2*12
Тетраплоидность зачастую оказывается ста-
бильной и наследуется в последующих поколе-
ниях через соматические клетки1. Скрещивая
тетраплоиды с диплоидами, можно получить
триплоидные стерильные растения, хотя успеш-
ность таких опытов невелика. Для восстанов-
ления фертильности триплоиды обрабатывают
колхицином и таким образом получают гекса-
плоидные растения. Тетра- и гексаплоиды (по-
липлоиды) часто имеют более высокую скорость
роста, поэтому многие высокоурожайные рас-
тения полиплоидны. Полиплоидные растения
(соматические гибриды двух различных линий)
можно получить слиянием протопластов. Ди-
плоидные гибриды двух разных видов растений
часто оказываются стерильными из-за отсут-
ствия пар гомологичных хромосом в хромосом-
ном наборе1 2, а полиплоидные гибриды, в основ-
ном, фертил ьны.
1 По-видимому, здесь имеется в виду вегетативное размно-
жение. Если проводить опыление между тетраплоидами, то
число наборов хромосом у потомков также не изменится. —
Прим. ред.
2 Пару хромосом называют гомологичной в том случае,
когда хромосомы близки по размеру, составу и порядку
следования генных локусов. При образовании гамет про-
исходит кроссинговер: обмен гомологичными участками
ДНК. В случае, когда нет пар гомологов, и хромосомы лишь
частично гомологичны друг другу, при кроссинговере воз-
никают продукты без центросом и с двумя центросомами.
Это приводит к нерасхождению или разрывам хромосом при
мейозе, следовательно, к стерильности. — Прим. ред.
Хромосомные числа различных растений
приведены в табл. 20.2. Arabidopsis thaliana,
или резуховидка Таля, незаметный сорняк се-
мейства крестоцветных, растущий вдоль до-
рог Центральной Европы3 * *, имеет только 2x5
хромосом, содержащих 7 х 107 пар оснований
(табл. 20.1). Arabidopsis по своему строению
представляет собой типичное двудольное рас-
тение (см. рис. 20.1), а жизненный цикл про-
ходит примерно за шесть недель. Выведение в
1943 году определенной линии Arabidopsis бота-
ником Е Laibach (Франкфурт) положило начало
широкому использованию этого растения в ка-
честве модельного при исследовании функцио-
нирования растительного организма. В 1965 г.
в Гёттингене, Германия, под председатель-
ством G. Roebbelen был проведен международ-
ный симпозиум по исследованиям Arabidopsis.
Arabidopsis thaliana (резуховидка) и Oriza sativa
(рис) были первыми растениями, для которых
стала известной полная последовательность ну-
клеотидов в геноме (сиквенс).
Иногда увеличенное число хромосом явля-
ется результатом близкородственного скрещи-
вания и полиплоидизации. Так, рапс (Brassica
napus) с 2 х 19 хромосомами, получен скрещи-
3 Ареал Arabidopsis thaliana шире: он охватывает Россию,
страны Средиземноморья, локально распространен в Но-
вом свете. — Прим. ред.
390
20. Три генома растительной клетки
Рис. 20.1. Arabidopsis thaliana, незаметный
маленький сорняк, растущий вдоль дорог
Центральной Европы, из семейства Brassicaceae
(капустные или крестоцветные), благодаря своему
небольшому геному стал самым важным модельным
растением во всём мире. В теплице, при постоянных
условиях освещения, время его жизни «от семени
до семени» составляет всего около шести недель.
В высоту растение достигает от 30 до 40 см.
Каждый стручок содержит около 20 семян
(с разрешения М. A. Estelle и С. R. Sommerville)
ванием репы {Brassica rapd) (2 х 10 хромосом)
и капусты {Brassica oleracea) (2x9 хромосом)
(см. табл. 20.2). В этом случае диплоидный ге-
ном был результатом скрещивания. Успешное
скрещивание трех форм пшениц позволило по-
лучить гексаплоидное растение. А именно, при
скрещивании пшеницы-однозернянки и эги-
лопса (2x7 хромосом каждая) появилась твер-
дая пшеница (4x7 хромосом). При ее после-
дующем скрещивании с другим дикорастущим
видом эгилопса возникла пшеница {Triticum
aestivum) с 6 X 7 хромосомами, которая сейчас
и выращивается повсеместно. Таким же об-
разом, при скрещивании двух видов Nicotiana
tomentosiformis и TV. sylvestris (2 х 12 хромосом
в каждом) получен табак {Nicotiana tabacum).
Ядерный геном бобов (14,5 х 109 п.о.) со-
держит в 200 раз больше ДНК, чем Arabidopsis.
Однако это не означает, что этот геном содер-
жит в 200 раз больше генов, кодирующих бел-
ки (структурных). Вероятно, количество струк-
турных генов в обоих растениях различается не
более, чем в два-три раза. Различие в размерах
геномов объясняется существованием идентич-
ных последовательностей ДНК разного разме-
ра, объединенных вместе. Они называются по-
вторяющейся ДНК. Большая ее часть может не
нести кодирующей функции. В бобах, напри-
мер, 85% ДНК приходится на повторяющиеся
последовательности. Они включают в себя боль-
шое количество тандемных повторов (иногда
до нескольких тысяч) одинаковых повторяю-
щихся последовательностей ДНК (размером
по 170—180 п.о., иногда 350 п.о.). Тандемные
повторы разбросаны по всей хромосоме, ча-
сто объединены в блоки, особенно в концевых
участках, иногда и во внутренних. Такая высо-
коповторяющаяся ДНК называется сателлит-
ной. Она также включает микросателлитную
ДНК, рассматриваемую в разделе 20.3. Эти по-
следовательности родо- и видоспецифичны. Из
сателлитной ДНК состоит более чем 15% общего
ядерного генома некоторых растений. Ее функ-
ции пока еще до конца неизвестны. Возмож-
но, она играет роль при видообразовании. При
получении соматических гибридов слиянием
20.2. Транскрипция ДНК ядерного генома РНК-полимеразами
391
протопластов последовательность сателлитной
ДНК может быть использована как видоспеци-
фичный маркер для проверки эффективности
слияния.
Гены рибосомальной РНК также содержат-
ся в виде повторяющихся последовательностей
и вместе с генами для некоторых транспортных
РНК присутствуют в ядерном геноме в несколь-
ких тысячах копий.
В отличие от них структурные гены обыч-
но присутствуют только в нескольких копиях,
иногда только в одной (однокопийные гены).
Структурные гены, кодирующие структурно и
функционально родственные белки, часто объ-
единяются в семейства генов. Такое семейство
генов существует, например, для генов, коди-
рующих малую единицу рибулозобисфосфат-
карбоксилазы (RBC S). Гены этого семейства
несколько отличаются друг от друга и присут-
ствуют в ядерном геноме в нескольких копиях
(например, у томата пять генов). Также в тома-
тах идентифицированы 14 членов семейства ге-
нов светособирающего комплекса (раздел 2.4).
Зеин, запасной белок зерен кукурузы (глава 14),
кодируется семейством, состоящим примерно
из 100 генов. Почти 40% белков, кодируемых
в геноме Arabidopsis, принадлежат семействам,
содержащим более пяти генов. Белки Р450, на-
пример, кодируется 300 генами (раздел 18.2).
Секвенирование и анализ ДНК
ядерного генома двудольных
и однодольных растений
В 2000 году произошел серьезный научный про-
рыв — полностью был секвенирован ядерный
геном Arabidopsis. Данные секвенирования по-
казали, что он состоит из 25 тысяч структур-
ных генов, в два раза больше, чем геном дро-
зофилы. Сравнение с известными животными
последовательностями ДНК показали, что
специфичными для растений являются около
трети генов Arabidopsis. Вторым был секвени-
рован геном риса, содержащий около 50 тысяч
структурных генов.
Функции многих из этих генов остаются не-
известными. Выяснение этих функций — очень
большая и сложная задача. Один из подходов
к решению этой проблемы представляет собой
сравнение средствами биоинформатики полу-
ченных данных с известными последовательно-
стями микроорганизмов, животных, растений,
содержащимися в специальных банках дан-
ных. Другим способом является выключение
определенного гена с помощью мутации и ис-
следование влияния этой мутации на организм.
Функционирование гена можно нарушить
случайными мутациями (например, при инер-
ции Т-ДНК Ti-плазмид) (раздел 22.5) (Т-ДНК-
инсерционные мутанты), но в этом случае необ-
ходимо затем идентифицировать измененный
ген. Некоторые гены можно изменить РНК-
методиками, как описано в разделе 22.5. Эти ис-
следования требуют огромных технологических
мощностей. Проект Arabidopsis (США) и его не-
мецкая программа-партнер AFGN (Arabidopsis
functional genomics network) ставят своей целью
полное выяснение функций генома Arabidopsis.
20.2. Транскрипция ДНК ядерного
генома РНК-полимеразами
Из двух нитей ДНК транскрибируется только
одна — матричная (рис. 20.2). Нить, компле-
ментарная матричной, называется кодирую-
щей. Она содержит ту же последовательность,
что и транскрибирующаяся РНК, за исключе-
нием того, что содержит тимин вместо урацила.
ДНК ядерного генома транскрибируется тремя
специализированными РНК-полимеразами
(1, II, III) (табл. 20.3). «Разделение труда» между
ними, многие детали структуры генов и принци-
пы генной регуляции характерны для всех эука-
Рис. 20.2. Транскрипция матричной нити
ДНК
392
20. Три генома растительной клетки
Таблица 20.3. Три РНК-полимеразы
РНК-полимераза Продукт транскрипции Ингибирование а-аманитином
I Рибосомальная РНК (5.8S, 18S, 25S) Нет
II Информационная РНК-предшественник, малые РНК(мяРНК) В концентрации 10-8 М
III Транспортные РНК, рибосомальная РНК (5S) Только при высоких концентрациях (10-6 М)
риотических клеток. РНК-полимераза II ката-
лизирует транскрипцию структурных генов и
ингибируется а-аманитином в низких концен-
трациях (108 М). а-аманитин — это смертельно
опасный для людей яд гриба Amanita phalloides
(бледная поганка).
Регуляция транскрипции
структурных генов
В растении, содержащем 25—50 тысяч струк-
турных генов, большинство генов находится
в выключенном состоянии и работает толь-
ко в определенных органах или даже только
в определенных клетках. Кроме того, многие
гены активируются только в определенное вре-
мя (например, гены синтеза фитоалексинов
при заражении патогенами) (раздел 16.1). Сле-
довательно, транскрипция большинства струк-
турных генов должна регулироваться сложным
и специфичным образом. Чаще транскриби-
руются гены ферментов метаболизма или био-
синтеза белков, происходящих во всех клетках.
Такие гены, необходимые каждой клетке для
выполнения ее основных функций, не завися-
щих от специализации, называются генами до-
машнего хозяйства.
Элементы, регулирующие транскрипцию.
Промотор
На рисунке 20.3 показаны основные детали
строения структурного гена. Часть ДНК, нахо-
дящаяся слева от точки начала транскрипции,
обозначается как 5’-участок (участок до этой
точки, upstream), справа — 3’ (участок после
этой точки, downstream). Кодирующая часть
гена может быть распределена по нескольким
экзонам, которые разделяются интронами.
За 25 пар оснований до точки начала транс-
крипции находится промоторный элемент —
участок, в котором РНК-полимераза II связы-
вается с ДНК. Его последовательность может
сильно отличаться у разных генов и у разных
видов, однако можно вывести консенсусную
последовательность. (Консенсусная последо-
вательность — это некоторая идеальная после-
довательность, пары оснований которой встре-
чаются в большинстве промоторов. При этом
большинство элементов промотора отличается
от нее лишь одним-двумя основаниями). В дан-
ном случае эта последовательность называется
ТАТА-бокс (рис. 20.4). За 80—110 пар основа-
ний до точки начала транскрипции обнаруже-
на другая консенсусная последовательность,
Точка начала
транскрипции
3’
-110 -80
Энхансер, сайленсер
-25 0
Пары
оснований
Рис. 20.3. Структурные элементы эукариотического гена. Числами отмечены
расстояния в парах оснований от точки начала транскрипции
20.2. Транскрипция ДНК ядерного генома РНК-полимеразами
393
х-х
/ \
X X
I I
X X
I I
X X
I I
X X
I I
X X
Х^СК
I Zn X
Х^ / \ /
Cys His—X
/ \
-х-х х-х-
Цинковый палец
Рис. 20.4. Консенсусные последовательности двух
промоторных элементов эукариотического гена
(см. рис. 20.3)
СААТ-бокс, влияющая на скорость транс-
крипции (см. рис. 20.4). Ранее упоминавшиеся
гены домашнего хозяйства вместо нее зачастую
содержат участок, богатый цитозином. Кроме
того, более чем за 1000 пар оснований до точ-
ки начала транскприпции, могут находиться
несколько последовательностей, называемых
энхансерами и сайленсерами, чья роль заклю-
чается в усилении или ослаблении действия ре-
гуляторных элементов соответственно.
Регуляция транскрипции гена
Регуляторные элементы содержат сайты связы-
вания для факторов транскрипции — белков,
изменяющих скорость транскрипции. Установ-
лено, что в геноме Arabidopsis закодировано
1500 белков, регулирующих экспрессию генов.
Различные факторы транскрипции часто имеют
сходную структуру. Один из типов таких струк-
тур содержит пептидную цепочку, содержащую
два цистеиновых остатка и два остатка гисти-
дина, отделенных от них 12 аминокислотами
(рис. 20.5). Два остатка цистеина ковалентно
связывают атом цинка, который образует еще
две координационые связи с имидазольными
кольцами двух гистидиновых остатков, фор-
мируя так называемый цинковый палец. Он
связывается с триплетом оснований в ДНК.
Фактор транскрипции типа «цинковый палец»
содержит обычно несколько таких структур
(до 9), что обеспечивает прочное сцепление
с определенными участками ДНК.
Другой тип факторов транскрипции состоит
из димера ДНК-связывающих белков. Каждый
их мономер содержит ДНК-связывающий до-
мен и а-спираль с 3-9 лейциновыми остатками
(рис. 20.6). Гидрофобные остатки лейцина обе-
их спиралей находятся строго друг напротив
Рис. 20.5. Многие транскрипционные
факторы имеют структуру цинковых пальцев.
Их аминокислотная последовательность
(X — некоторая аминокислота) содержит
2 цистеиновых остатка, разделённых 2—4 другими
аминокислотами. Затем через 12 аминокислотных
остатков находятся 2 остатка гистидина, разделённых
3—4 аминокислотами. Ион цинка располагается
между остатками цистеина и гистидина.
Транскрипционный фактор содержит от 3 до 9 таких
«пальцев», каждый из которых связывается
с последовательностью из трёх пар оснований ДНК
друга и прочно связаны гидрофобными взаимо-
действиями, подобно застежке-молнии. Такой
тип структуры получил название лейциновой
молнии1. Активность факторов транскрипции
в свою очередь, обычно регулируется сигналь-
ными цепями передачи сигналов, связанными
с рецепцией фитогормонов или других стимулов
(раздел 19).
Микро-РНК и ингибирование
экспрессии генов
Существует и другой путь регулирования экс-
прессии генов в растениях. Совсем недавно — в
2002 году — выяснилось, что в растениях со-
держатся так называемые микроРНК. Они
представляют собой некодирующую РНК, со-
стоящую из 21—22 высококонсервативных ну-
1 Перечислены далеко не все типы факторов транскрип-
ции. К наиболее известным из них у растений относятся
также MADS-белки (регулируют программы развития),
НОМЕОВОХ-содержащие белки (контроль развития),
EREB-белки (ответ на гормон), спираль—поворот—спираль
(множественные функции) и др. — Прим. ред.
394
20. Три генома растительной клетки
Рис. 20.6. Частым структурным элементом
транскрипционных факторов является лейциновая
молния (lencine zipper). Она состоит из двух
полипептидных цепочек, каждая из которых
сворачивается в а-спираль. Цепочки содержат
лейциновые остатки приблизительно в каждом
седьмом положении. Остатки лейцина, находящиеся
по одну сторону а-спирали, связывают обе спирали
вместе благодаря гидрофобным взаимодействиям
подобно застежке-молнии. Два домена содержат
основные аминокислоты, способные связываться
с ДНК. Упрощённая схема
клеотидов, и обнаружены также и в животных
клетках. МикроРНК ингибируют экспрессию ге-
нов, связываясь с комплементарными участками
мРНК (например, с такими, которые кодируют
ключевые для развития растения белки). Свя-
зывание инактивирует мРНК и помечает ее для
последующей деградации рибонуклеазой. Таким
образом, микроРНК работают как негативный
регулятор при контроле таких процессов, как
дифференцировка клеток меристемы, поляр-
ность органа и др. В растениях уже идентифици-
ровано множество микроРНК и ожидается, что
их количество будет возрастать по мере дальней-
ших исследований.
Транскрипция структурных генов
РНК-полимераза II состоит из 8—14 субъединиц.
Сама по себе она не способна начать транскрип-
цию. Чтобы направить фермент в точку начала
транскрипции необходим транскрипционный
фактор. Центральную роль в этом процессе выпол-
няет ТАТА-связывающий белок, распознающий
ТАТА-бокс и связывающийся с ним (рис. 20.7).
Взаимодействие ТАТА-связывающего белка с
РНК-полимеразой требует дополнительных фак-
торов транскрипции (обозначенных на рисунке
как А, В, F, Е и Н). Все они необходимы для транс-
крипции и называются основными факторами.
Вокруг сложного комплекса белков транс-
крипционного аппарата укладывается сверну-
тая в петлю нить ДНК. В результате регулятор-
ные элементы, находящиеся довольно далеко
от кодируещей части гена, приобретают спо-
собность оказывать влияние на активность
РНК-полимеразы. Скорость транскрипции оп-
ределяется такими факторами, как активаторы
и репрессоры. Они связываются с регулятор-
ными элементами, расположенными на участ-
ках до кодирующего участка гена (энхансерами
и сайленсерами, рис. 20.3).
Эти транскрипционные факторы с помощью
нескольких ко-активаторов взаимодействуют
с ТАТА-связывающим белком и изменяют его
способность влиять на РНК-полимеразу. Раз-
личные комбинации активаторов и репрессоров
приводят либо к усилению, либо к подавлению
транскрипции гена. Схема аппарата транскрип-
ции, приведенная на рис. 20.7, вначале была раз-
работана в исследованиях на животных. Резуль-
таты, полученный на растениях, показали, что
здесь регуляция транскрипции осуществляется
похожим способом.
Для генетической инженерии растений очень
важны точные знания последовательностей
промотора и энхансеров/сайленсеров (глава 22).
Однако не всегда необходимо детально знать все
эти регуляторные элементы. Для практических
20.2. Транскрипция ДНК ядерного генома РНК-полимеразами
395
Активаторы.
Связывают энхансерные элементы.
Контролируют включение гена и
увеличение скорости транскрипции
Репрессоры.
Связывают сайленсерные элементы,
затрудняют действие активаторов и
снижают тем самым скорость транскрипции
ТАТА-бокс
Промотор
Ко-активаторы.
Адаптерные молекулы, суммирующие сигналы
от активаторов и, возможно, от репрессоров,
и «сообщающие» результат основным факторам
Основные факторы.
В ответ на сигналы от активаторов помещают
РНК-полимеразу в точку начала транскрипции
Рис. 20.7. Эукариотический аппарат транскрипции млекопитающих,
предположительно сходный с растительным аппаратом. Основные факторы
(ТАТА-связывающий белок, пептиды А-Н, помеченные красным цветом) являются
обязательными, но они не способны ни усилить, ни замедлить процесс. Эти функции
выполняют регуляторные молекулы, активаторы и репрессоры, при этом
для разных генов нужны их различные комбинации. Они связываются
с регуляторными последовательностями в ДНК (энхансерами и сайленсерами),
расстояние от которых до точки начала транскрипции может быть довольно
большим. Активаторы (возможно, и репрессоры) взаимодействуют с основными
факторами через ко-активаторы, формируя прочные комплексы
с ТАТА-связывающим белком. Вначале такой комплекс связывается с промотором,
регуляторным участком рядом с кодирующей частью гена. Ко-активаторы
обозначены согласно их молекулярной массе (в кДа) (Из Tijan R., Spektrum
der Wissenchaft, 4, 1995, с разрешения)
396
20. Три генома растительной клетки
целей зачастую достаточно знать, идентифици-
рована ли та часть ДНК, которая находится до
структурного гена и каким образом она влияет
на транскрипцию. В эукариотических клетках
обычно весь регуляторный участок называют
просто промотором. Так, выделены премотор-
ные последовательности, которые обеспечивают
транскрипцию гена в листьях, при этом только
ДНК
(транзитный)
пептид мРНК
Кэп
А—А —(А)п п = 200 -250
участок
Некодирующий
Начало
Некодирующий
Остановка участок
трансляции
трансляции
Рис. 20.8. Транскрипционные и посттранскрипционные процессы у эукариот
Из первичного транскрипта, образованного в результате работы РНК-полимеразы
II, сплайсингом удаляются интроны (рис. 20.10 и 20.11). Зрелая м PH К формируется
при добавлении кэпа (рис. 20.9) к 5’-концу и полиаденилатной последовательности
к З’-концу. На З’-конце мРНК находится сайт отщепления, помеченный сигналами
полиаденилированния
Рис. 20.9. Кэп состоит из 7-метилгуанозинтрифосфата, связанного с 5’-концом
мРНК. Рибозные остатки двух следующих нуклеотидов мРНК часто могут быть
метилированы по 2’-положению
20.2. Транскрипция ДНК ядерного генома РНК-полимеразами
397
в клетках мезофилла или устьицах, или клуб-
нях картофеля, причем только в запасающих
клетках. В таких случаях специфичность экс-
прессии генов объясняется влиянием клеточно-
специфичных транскрипционных факторов на
соответствующие промоторы.
Созревание мРНК
РНК-полимераза II в ядре транскрибирует
ДНК, образуя первичный транскрипт (пре-
мРНК, рис. 20.8), который затем в ядре пре-
вращается в зрелую мРНК. При транскрипции
специальная молекула ГТФ связывается с 5’-ОН
группой на конце РНК 5’-5’ дифосфатным мо-
стиком (рис. 20.9). Кроме того, гуанозин и вто-
рая рибоза (иногда также третья, что не показа-
но на рисунке) метилируется с использованием
S-аденозилметионина (донора метильного ра-
дикала) (см. рис. 12.10). Такая модифициро-
ванная ГТФ в начале РНК называется кэпом
и обнаруживается только в мРНК. Он служит
сайтом связывания при формировании иници-
аторного комплекса синтеза белка на рибосомах
(раздел 21.1) и, возможно, обеспечивает защиту
от деградации экзорибонуклеазами.
При дальнейшем созревании (процессин-
ге) пре-мРНК удаляются интроны. Их размер
варьирует от 50 до 10 000 нуклеотидов. Начало
и конец интрона характеризуются определен-
ными последовательностями. Последние два
основания экзона, в основном, AG, а первые
основания интрона — GU (рис. 20.10). Заканчи-
вается интрон основаниями AG. За 20—50 осно-
ваний от З’-конца интрона находится адениль-
ный остаток — точка ветвления.
Вырезание интронов (сплайсинг) катали-
зируется рибопротеиновыми комплексами,
Продукт
сплайсинга
Рис. 20.11. В сайте сплайсинга несколько РНК
и белков объединяются в сплайсосому. Фосфат на
5’-конце интрона образует эфирную связь с 2’-ОН
группой аденина в точке ветвления. Цепочка РНК
разрывается после соединения интрона с экзоном I.
З’-конен экзона I образует новую эфирную связь
с фосфатом на 5’-конце экзона 2, высвобождая
интрон в виде лассо
Экзон 1 Интрон Экзон 2
5' 3'
AG -GU-------------'ЧА- А ---------AG -
Точка
ветвления
Рис. 20.10. Начало интрона часто содержит
последовательности AG/GU, а конец —
последовательность AG. За 20—50 оснований
до конца интрона находится консенсусная
последовательность из 7 нуклеотидов, содержащих
аденин, образующих точку ветвления для сплайсинга
(см. рис. 20.11)
состоящими из РНК и белков. В этом процессе
принимают участие пять различных РНК (ма-
лые ядерные РНК, или мяРНК), содержащих
398
20. Три генома растительной клетки
Сигнал для полиаденилирования
5'
д АТА А(1-з)
3’
Рис. 20.12. Консенсусная последовательность
сигнала для полиаденилирования
100—190 оснований. Вместе с белками и РНК,
которая подвергается сплайсингу, мяРНК об-
разует сплайсосому (рис. 20.11). Вначале 2’-ОН
группа рибозы аденильного остатка в точке
ветвления связывается с фосфатным остатком,
который соединяет конец экзона 1 с началом
интрона. Эфирная связь между экзоном 1 и ин-
троном разрывается. Затем формируется вторая
эфирная связь между З’-ОН группой экзона 1 и
фосфатным остатком на 5’-ОН конце экзона 2.
Это сопровождается разрушением эфирной свя-
зи с фосфатом интрона, что завершает процесс
сплайсинга. Интрон остается замкнутым в фор-
ме лассо и позднее уничтожается рибонуклеа-
зами.
Следующим шагом при созревании РНК яв-
ляется отщепление эндонуклеазами З’-конца пре-
мРНК, расположенного после сигналов полиа-
денилирования (рис. 20.12) и добавление к концу
транскрипта полиаденилатной последователь-
ности длиной до 250 нуклеотидов. Полученная
зрелая мРНК связывается со специальными бел-
ками и выходит из ядра в виде РНК-белкового
комплекса.
Синтез рРНК и тРНК
Эукариотические рибосомы растений содер-
жат четыре различных молекул рРНК: 5S; 5,8S;
18S и 25S-pPHK (обозначаемых так соглас-
но их коэффициентам седиментации). Гены
для 5S рРНК находятся в определенных частях
хромосом в виде тандемов в большом количе-
стве копий. Транскрипция этих генов и генов
тРНК осуществляется РНК-полимеразой III.
Три остальные рибосомальные РНК кодируют-
ся единой последовательностью, также в виде
тандемов и в большом количестве копий. Они
транскрибируются РНК-полимеразой I. Со-
зревание первичного транскрипта заключается
в метилировании —ОН групп рибозных остат-
ков, и расщеплении РНК на зрелые 18S; 5,8S
и 25S рРНК (рис. 20.13). Находящиеся между
ними РНК-спейсеры деградируют. Сравни-
тельный анализ последовательностей спейсер-
ных участков из-за их быстрой эволюции может
быть использован для филогенетической клас-
сификации растительных видов внутри родов.
20.3. Полиморфизм ДНК
и генетические маркеры
при скрещивании растений
Строение всех организмов определяется после-
довательностью оснований ДНК в их геноме.
Различия
морфизм
в последовательностях ДНК (поли-
ДНК) существуют не только между
ДНК
РНК-полимераза I
Спейсер
Спейсер Сп.
Сп.
Первичный
транскрипт
Созревание (процессинг)
18S
25S
рРНК
Рис. 20.13. Три из четырех рРНК транскрибируются полииистронно.
При созревании удаляются спейсеры
20.3. Полиморфизм ДНК и генетические маркеры при скрещивании растений
399
видами, но и в некоторой степени между инди-
видуумами одного и того же вида. Структурные
гены двух разновидностей одного сельскохозяй-
ственного сорта могут различаться по 0,1 — 1%
оснований, в основном, по составу интронов.
Обычно растения для скрещивания выбира-
ются по внешним признакам (например, по уро-
жайности или устойчивости к определенным
заболеваниям). Но в основе всех этих характе-
ристик лежит различие в последовательностях
структурных генов. Выбор растений для скре-
щивания мог бы быть значительно легче, если
бы не было необходимости ждать очевидного
проявления генотипа. Вместо этого можно было
бы напрямую проанализировать соответствую-
щие последовательности ДНК. Однако полный
сравнительный анализ этих генов сейчас не
практикуется, поскольку еще неизвестны боль-
шинство из генов, которые определяют тот или
иной фенотип. Кроме того, секвенирование
ДНК требует больших затрат, как денежных,
так и временных. Сейчас доступны более легкие
и дешевые методики.
Полиморфизм длин рестрикционных
фрагментов как метод характеристики
индивидуальных различий
Различия между генами двух индивидуумов
одного вида можно установить и без детального
сравнения последовательностей ДНК, исполь-
зуя другие методы. Один из таких методов —
анализ полиморфизма длин рестрикционных
фрагментов (restriction fragment length poly-
morphism — RFLP). Он основан на использова-
нии бактериальных эндонуклеаз рестрикции.
Они расщепляют ДНК, узнавая палиндром-
ные последовательности, которые называются
сайтами рестрикции (рис. 20.14). Различные
рестрикционные эндонуклеазы имеют свои
специфичные сайты, состоящие из 4—8 п.о.
Поскольку эти сайты располагаются в ДНК
случайным образом, то последовательности из
4 пар оснований встречаются гораздо чаще, чем
из 8. Одной конкретной эндонуклеазой (обыч-
но имеющей рестрикционный сайт длиной
в 6 п.о.) можно разрезать ДНК растительного
генома на тысячи определенных фрагментов.
Изменение одного основания в ДНК может
устранить или добавить сайт рестрикции, что
приведет к изменениям в наборе рестрикцион-
ных фрагментов.
Разрезание геномной ДНК рестрикцион-
ными ферментами приводит к образованию
огромного количества фрагментов. Для того
чтобы пометить фрагмент определенной ча-
сти генома, используют меченые пробы ДНК.
Приготовление таких проб требует сначала
определения ДНК-участка хромосомы разме-
ром в 10—20 тыс. п.о. Он должен находиться как
можно ближе к гену, ответственному за инте-
3’ ▼
— С Т ТA AG
-------------G А А Т Т С
5’ | 3’
3’ ▼ 5’
----------- С Т А Т A G ----------
---------G А Т А Т С--------------
5' | 3'
EcoRI
EcoRV
-------С Т Т A A G -------
-------------------------------------G А А Т Т С -
-----СТА TAG -----
----- GAT АТС------
Рис. 20.14. Рестрикционные эндонуклеазы типа II расщепляют ДНК по сайтам
рестрикции, содержащим распознаваемые палиндромные последовательности.
Приведён пример сайта рестрикции для двух ферментов из штамма Escherichia
coli. а. Рестрикционная эндонуклеаза Есо RI делает ступенчатый разрез двух нитей
ДНК, оставляя по четыре неспаренных нуклеотида с каждой стороны. Такие
неспаренный концы называются липкими, поскольку могут образовывать пары
как друг с другом, так и с комплементарными липкими концами другого фрагмента
ДНК. б. В отличие от предыдущей рестрикционная эндонуклеаза
Есо RV разрезает ДНК с образованием «тупых» концов
400
20. Три генома растительной клетки
Электрофорез
фрагментов ДНК в
агарозном геле
Перенос разделенных
фрагментов ДНК из
геля на
нитроцеллюлозную
мембрану
Стопка салфеток
Буфера
Нитроцеллюлозная
мембрана
Гель
Бумага
Нитроцеллюлозная
мембрана с
фрагментами ДНК
Гибридизация с
радиоактивно
мечеными пробами ДНК
Радиоавтограф полос
гибридизованной ДНК
на рентгеновской пленке
Рис. 20.15. Методика Саузерн-блота (ДНК-ДНК гибридизация)
ресующий признак, возможно, даже являться
частью этого гена. Этот участок ДНК вводят
в бактерию (в основном, Escherichia coli), с ис-
пользованием плазмид или бактериофагов в
качестве векторов и присходит наработка век-
торной ДНК со вставкой (глава 22). Плазмиды
или бактериофаги затем выделяют из суспензии
бактерий, участки растительной ДНК снова вы-
резают, выделяют и затем метят радиоактивной
или флуоресцентной меткой. Пробы, подго-
товленные для этих целей, называются RFLP-
маркерами.
Анализ фрагментов рестрикции ДНК с по-
мощью меченых проб, описанных выше, про-
водится методом Саузерн-блота, разработан-
ным в 1975 г. Эдвардом Саузерном. Сначала
рестрикционные фрагменты разделяются по
длине электрофорезом в агарозном геле (корот-
кие фрагменты продвигаются дальше, чем длин-
ные). Разделенные фрагменты затем переносят
на нитроцеллюлозную или нейлоновую мембра-
ну следующим образом. Мембрану помещают
на гель и покрывают стопкой салфеток. Буфер
из раствора проходит через гель и нитроцеллю-
лозу, вымывая фрагменты ДНК и перенося их
на мембрану. При этом буфер способствует раз-
делению ДНК на одиночные нити1 (рис. 20.15).
Добавленная меченая проба ДНК гибридизу-
ется с комплементарной последовательностью
ДНК на мембране. Затем при отмывке удаляют-
ся не связавшиеся молекулы пробы. Результат
получают в виде радиоавтографов (если исполь-
зовалась радиоактивная проба) или измерением
флюоресценции. Полоса на блоте находится там
же, где должен находиться интересующий фраг-
мент ДНК, и соответствует его размеру.
Рисунок 20.16 поясняет принципы RFLP. На
рисунке 20.16, а обозначена (1) часть гена с тремя
1 Денатурирующие условия. При этом используют буфер
с высокой ионной силой. В методике пропущен этап фикса-
ции ДНК на мембране (либо при высокой температуре, либо
с помощью УФ-облучения). Без этого при отмывке исходная
ДНК могла бы также перейти в раствор. — Прим. ред.
20.3. Полиморфизм ДНК и генетические маркёры при скрещивании растений
401
R1 R2 R3
V V V
Зонд
w -х-►
р-----------------------------------Точечная мутация р
V I V
◄-----------:-----Y----------------►
„ „ Вставка „
R1 R2 I R3
v v Л>_у
-*--------w------------------z-----►
Рис. 20.16. Полиморфизм длин рестрикционных фрагментов (RFLP)
на молекулярном уровне, а. Рестрикционные сайты для эндонуклеаз в генотипах
I, 2, 3 обозначены как Rb R2 и R3. Проба, с помощью которой идентифицируются
фрагменты, окрашена в красный цвет. б. (I) Результаты электрофореза помеченных
пробой фрагментов W и X. (2) Из-за точечной мутации в сайте рестрикции этот сайт
исчезает и в результате наблюдается только один фрагмент Y, большего размера,
чем W и X и проходящий меньшее расстояние при электрофорезе.
(3) Фрагмент X увеличивается в результате вставки ДНК (Z)
сайтами рестрикции (Rb R2 и R3). Так как про-
ба связывается только с участком ДНК между R!
и R2, то после обработки рестрикционными эн-
донуклеазами будут видны два фрагмента (W и
X). Поскольку они имеют разную длину, то при
электрофорезе они будут разделены и дадут сиг-
нал при гибридизации с пробой (см. рис. 20.166
(1)). Если произошла мутация в одном основа-
нии (точечная мутация) (2), сайт рестрикиции
R2 исчезнет, и будет виден только один меченый
рестрикционный фрагменту, который при гель-
электрофорезе из-за большого размера пройдет
меньшее расстояние, чем фрагменты W и X (2).
Если же между сайтами R2 и R3 (3) будет нахо-
диться вставка ДНК, то соответствующий фраг-
мент Z будет длиннее, чем X.
Метод RFLP предоставляет набор генети-
ческих маркёров, которые наследуются по за-
конам Менделя. С помощью маркеров мож-
но охарактеризовать вариабельность особей.
Обычно при анализе одновременно используют
несколько проб. Этот метод также применялся
в систематике растений для построения фило-
генетических деревьев, но теперь заменен более
информативными методами. Некоторые ре-
стрикционные фрагменты могут использовать-
ся в качестве маркеров для локализации генов
на хромосомах. Этим методом впервые были
получены хромосомные карты нескольких ви-
дов растений (например, Arabidopsis, картофе-
ля, томата, кукурузы).
Метод RAPD при исследовании
ДНК-полиморфизма
Другим методом при анализе различий между
последовательностями ДНК индивидуумов и
разновидностей внутри вида является ампли-
фикация случайно полученных фрагментов
ДНК (RAPD, random amplified polymorphic
DNA). Он используется с 1990 г. и требует го-
раздо меньше труда и времени по сравнению с
RFLP, что обеспечило ему широкое и быстрое
распространение.
Метод RAPD основан на полимеразной
цепной реакции (ПЦР). Он позволяет выде-
лить фрагменты ДНК длиной до 2—3 тыс. п.о. и
размножить (амплифицировать) их с помощью
ДНК-полимеразы. Для этого требуются олиго-
нуклеотидные праймеры, которые связыва-
ются с интересующей комплиментарной после-
довательностью ДНК, задавая начало синтеза
дочерней нити ДНК на матрице материнской
402
20. Три генома растительной клетки
нити. Для полимеразной цепной реакции необ-
ходимы два праймера (А, Б) определяющие на-
чало и конец того участка ДНК, который необхо-
димо размножить. На рисунке 20.17 рассмотрен
принцип этой реакции. На первом шаге при на-
гревании до 95 °C двунитевая ДНК разделяется
на одинарные нити. Затем следует охлаждение,
во время которого праймеры гибридизуются с
этими нитями. Это позволяет на третьем шаге,
при средней температуре, провести синтез ДНК
из дезоксинуклеозидтрифосфатов. Обычно ис-
пользуется ДНК-полимераза, выделенная из
Thermus aquaticus — термофильной бактерии
горячих источников (Taq-полимераза), по-
скольку ее фермент не теряет активность при
предшествующем нагревании. После этого но-
вая двунитевая ДНК снова разделяется на оди-
ночные нити нагреванием до 95 °C, снова при
охлаждении с ними связываются праймеры,
и вслед за этим проходит новый цикл синтеза
ДНК с помощью Taq-полимеразы. Эти реакции
повторяются 30—40 раз, при этом ДНК в каждом
цикле удваивается. В первом цикле длина новой
нити ДНК еще не ограничена с одного конца.
Во втором цикле праймеры снова связываются
с комплиментарными последовательностями
новой ДНК, и при следующем цикле синтези-
руется продукт, ограниченный с обоих концов.
С увеличением количества циклов умножает-
ся количество фрагментов ДНК определенной
длины. Поскольку при полимеразной цепной
реакции число молекул ДНК с каждым циклом
увеличивается экспоненциально (например,
после 25 циклов в 34 х 106 раз), то даже очень
небольшие количества ДНК (вплоть до един-
ственной молекулы) могут быть размножены до
любого необходимого уровня1.
В методиках RAPD для полимеразной цепной
реакции используется геномная ДНК и только
один олигонуклеотидный праймер, обычно со-
стоящий из 10 п.о. Поскольку вероятность свя-
зывания всех 10 оснований с геномной ДНК
крайне невелика, то праймеры связываются
только в очень небольшом количестве точек.
Свойства ДНК-полимеразы, используемой для
амплификации, требуют, чтобы расстояние меж-
ду двумя связанными праймерами не превыша-
1 Метод очень чувствителен к случайным примесям ДНК, —
Прим. ред.
ло 2—3 тыс. п.о. Следовательно, с помощью по-
лимеразной цепной реакции будет размножено
только несколько участков генома и при этом нет
необходимости в дальнейшем отборе фрагмен-
тов с помощью проб. В результате амплифика-
ции накапливается так много одинаковых фраг-
ментов ДНК, что их можно увидеть. Для этого
их разделяют с помощью гель-электрофореза
и окрашивают бромистым этидием. При этом
каждый фрагмент заметен в ультрафиолетовом
свете (УФ) в виде флуоресцирующей полосы. То-
чечные мутации, при которых удаляются сайты
связывания праймеров, или формируются но-
вые, делеции или инсерции, каждая из которых
влияет на размер и количество ПЦР-продукта,
могут изменить набор фрагментов ДН К таким же
образом, как и RFLP-методики (см. рис. 20.16).
Изменяя последовательность праймеров, можно
получать различные фрагменты ДНК. Праймеры
из 10 оснований доступны во многих вариантах
в коммерческой продаже. При RAPD-методике
используют разные праймеры до тех пор, пока
полосы фрагментов ДНК случайно не окажутся
связаны с исследуемым признаком. Метод RAPD
требует гораздо меньше труда, чем RFLP, по-
скольку не нуждается ни в приготовлении спе-
циальных проб, ни в требующих долгого време-
ни процедурах Саузерн-блоттинга. Еще одним
его преимуществом является то, что он требует
очень маленьких количеств ДНК (достаточно,
например, количеств, которые можно выделить
из эмбриона растения). Правда, при этом невоз-
можно определить, какой ген представлен этим
фрагментом. Но поскольку метод RAPD позво-
ляет различить разновидности внутри одного
вида, он стал важным инструментом в работах по
скрещиванию растений.
Полиморфизм микросателлитной ДНК
как генетический маркер
Недавно важным инструментом для иденти-
фикации растительных линий стала микроса-
теллитная ДНК (раздел 20.1). Она содержит
последовательность из 1, 2 иногда от 3 до 6 пар
оснований, которые находятся в 10—50 по-
вторностях на определенных участках генома.
Они находятся, например, в интронах, непо-
средственно перед геном или после него, при
этом количество повторов сильно отличается.
Для детекции этих последовательностей так-
20.3. Полиморфизм ДНК и генетические маркёры при скрещивании растений
403
Двойная нить ДНК
Цикл 1 j Разделение нитей \ Связывание праймеров ( )
А В
Taq-полимераза Синтез комплементарной г нити ДНК
А В
Цикл 2 Разделение нитей Связывание праймеров г Taq-полимераза
А В г ' А В
Цикл 3 См. выше
Рис. 20.17. Принцип полимеразной цепной реакции
404
20. Три генома растительной клетки
же используется метод ПЦР. Микросателлит-
ный полиморфизм применяется не только при
идентификации конкретных людей (например,
в криминалистике), но может использоваться
и как генетический маркёр при скрещивании
растений.
20.4. Мобильные элементы ДНК1
Иногда зерна в початках кукурузы имеют нео-
бычную пигментацию: белые полосы на крас-
ном фоне. Это говорит о том, что при формиро-
вании зерновки с высокой частотой происходят
мутации. У львиного зева красные цветки, но
иногда потомство случайно мутировавших кле-
ток не имеет красной окраски, что также при-
водит к появлению белых полос и штрихов на
лепестках. В других случаях дефектные клетки
могут снова возвращать себе способность син-
тезировать красный пигмент, и развиваются бе-
лые цветки с красными полосами.
Барбара МакКлинток (США) много лет за-
нималась этим явлением на кукурузе, используя
методы классической генетики. Она обнаружила
в геноме кукурузы мобильные элементы ДНК,
которые могут «перепрыгивать» в структурный
ген и инактивировать его. Чаще всего этот мо-
бильный элемент не остается здесь постоянно,
но рано или поздно перемещается в другой ген.
При этом функция первого гена в большинстве
случаев восстанавливается1 2. За эти важные от-
крытия Барбара МакКлинток получила в 1983 г.
Нобелевскую премию в области медицины.
Позже стало ясно, что мобильные элементы, ко-
торые получили название транспозонов, свой-
ственны не только растениям. Они были также
обнаружены у бактерий, грибов и животных.
На рисунке 20.18 показана структура транс-
позона Ас (автономного элемента) из кукурузы,
состоящего из двунитевой ДНК с 4600 п.о. Оба
конца содержат длинные инвертированные по-
вторяющиеся последовательности из 15 п.о. (IRA,
IRB). Внутри транспозона находится структурный
1 В данном разделе речь идёт только об одном типе транс-
позонов (ДНК-транспозонах с нереплекативной транспо-
зицией). Ретротранспозоны рассмотрены в разделе 20.5. —
Прим. ред.
2 Это происходит только в случаях, когда транспозон слу-
чайно попал в премоторный участок. Фенотип: красные по-
лосы и штрихи на белом фоне. — Прим. ред.
ген, кодирующий транспозазу, фермент, кото-
рый катализирует перенос мобильного элемента.
Этот фермент связывается с фланкирующими
инвертированными повторами и катализирует
перенос транспозона в другое место. Может слу-
читься так, что вырезание транспозона окажется
неточным, и оставшийся ген будет иметь изме-
ненную последовательность, что приведет к дли-
тельно сохраняющейся мутации3.
В кукурузе помимо транспозона Ас (авто-
номного) найден также транспозон Ds (неав-
тономный), в котором поврежден ген транспо-
зазы. Такой транспозон может перемещаться
только в присутствии транспозона Ас, кото-
рый кодирует необходимую для перемещения
транспозазу.
Транспозон, таким образом, может быть оха-
рактеризован как автономная единица, кодиру-
ющая белки, необходимые ей для перемещения.
Существуют несколько противоположных мне-
ний об их происхождении и функциях. Боль-
шинство рассматривают транспозоны как вид
паразитической ДНК, сходной с вирусами, ко-
торый использует клетку для собственного раз-
множения4. Другая точка зрения предполагает,
что транспозон дает клетке преимущества при
естественном отборе, способствуя возрастанию
количества мутаций. Это увеличивает адаптив-
ные возможности для приспособления к изме-
няющимся условиям окружающей среды.
Транспозоны представляют особый интерес
для биотехнологов, поскольку могут быть ис-
пользованы для идентификации генов. Как
уже обсуждалось, вставка транспозона в струк-
турный ген приводит к потере его функции5.
Например, вставка транспозона в ген синтеза
3 Инвертированные повторы несут последовательности,
характерные для интронов (см. рис. 20.10). При случайном
попадании в кодирующую часть гена танспозон вырезается
в ходе процессинга м-РНК по механизму, изображенному
на рис. 20.10. При транспозиции из кодирующей части за-
хватывается несколько соседних нуклеотидов (мутация).
Фенотип: белые полосы на красном фоне. — Прим. ред.
4 Приведенное сравнение касается ретровирусов (одна
из групп вирусов) и ретротранспозонов (в разделе 20.4 не
описаны). Многие вирусы не встраиваются в геном хозяи-
на, а в приведенном примере Ас не размножается в геноме,
число копий этого транспозона более-менее постоянно. —
Прим. ред.
5 Верно только в случае вставки транспозона в премотор-
ный участок. В целом вставка транспозона приводит к ха-
рактерной нестабильности. — Прим. ред.
20.4. Мобильные элементы ДНК
405
Транспозон
Хромосома
Инвертированный Ген транспозазы Инвертированный
повтор IR
повторIR
Транспозаза
Хромосома
Рис. 20.18. Транспозон характеризуется наличием инвертированных повторов
по обоим концам. В его состав входит структурный ген транспозазы.
Когда транспозон вырезается из хромосомы, два инвертированных
повтора связываются друг с другом, а образовавшийся разрыв в хромосоме
восстанавливается. Тем же способом транспозон встраивается в хромосому
в другом месте
антоцианов у львиного зева приводит к выклю-
чению синтеза красного пигмента. Транспозон,
который привел к нарушению этого гена, может
быть использован как ДНК-маркер, позволяю-
щий выделить и охарактеризовать один из ге-
нов биосинтеза антоцианов. Похожие методики
описаны в разделе 22.1.
20.5. Вирусы растительных клеток
Все клетки растения, вероятно, за исключением
меристематических, обычно заражены вирусами.
В большинстве случаев вирусы не уничтожают
своих хозяев, поскольку их воспроизводство за-
висит от метаболизма растения хозяина. Вирусы
кодируют лишь несколько специальных белков,
используют энергетический метаболизм и био-
синтетические возможности клеток хозяина для
того, чтобы размножаться. Зачастую это осла-
бляет растение-хозяина и снижает урожайность
сортов, зараженных вирусами. Заражение неко-
торыми вирусами может привести к гибели всего
урожая. Например, дыни и кабачки чрезвычай-
но подвержены заражению вирусом* огуречной
мозаики. В некоторых провинциях Бразилии
за 12 лет вирусом Tristeza было уничтожено 75%
апельсиновых деревьев.
В предыдущем разделе уже упоминалось
о сходстве между вирусами и транспозонами.
Оба этих элемента могут сами встраиваться в ге-
ном хозяина и также самостоятельно покидать
его, оба могут кодировать ферменты, необхо-
димые для этого процесса1. Основное различие
между транспозоном и вирусом заключается
в том, что вирус на поздней стадии своего жиз-
ненного цикла заключается в белковую оболоч-
ку, капсид, который позволяет вирусу существо-
вать без хозяина.
Геном вирусов состоит из РНК или ДНК,
окруженных белковой оболочкой. У большин-
ства растительных вирусов геном состоит из од-
нонитевой РНК, называемой плюс-нитью РНК.
У некоторых вирусов (например, вируса мо-
заки костра, который поражает определенные
злаки), плюс-нить РНК имеет свойства мРНК
и транслируется хозяином. У других вирусов
(например, у вируса табачной мозаики, TMV
или ВТМ) с плюс-нити РНК вначале транскри-
бируется комплементарная минус-нить РНК,
которая затем и служит матрицей для синтеза
м PH К (рис. 20.19). Продуктами трансляции этих
1 Верно только для ретровирусов, но не для других виру-
сов, описанных в этом разделе. — Прим. ред.
3’
Геномная плюс-РНК
5’
5’
РНК-полимераза,
кодируемая вирусом
-РНК
3’
Рис. 20.19. С однонитевой геномной РНК многих
вирусов вначале транскрибируется минус-нить РНК,
и лишь затем — мРНК для синтеза белков
РНК-полимераза,
кодируемая вирусом
3’
мРНК
5’
Синтез белков
Вирусные белки
Геном вируса
Вирус мозаики цветной
капусты (CaMV)
РАСТИТЕЛЬНАЯ КЛЕТКА
а-нить
ДНК
Мини-хромосома
(Хроматин)
РНК-полимераза II
РНК ------------------
Обратная транскриптаза
(кодируется вирусом) ,
Разрезание(процессинг)
Несколько
мелких мРНК
Репликаза
Синтез белков
DNA
Новый вирус
Вирусные белки,
включая белки оболочки
Рис. 20.20. Заражение растительной клетки вирусом мозаики цветной капусты (CaMV)
20.5. Вирусы растительных клеток
407
мРНК являются репликазы, катализирующие
репликацию плюс- и минус-нитей РНК, а также
белки, которые способствуют распространению
вируса от клетки к клетке (раздел 1.1) и белки
оболочки для упаковки вирусов. Обычно вирус
попадает в клетку через рану, которую наносят,
например, насекомые, такие, как тли, кормя-
щиеся на растениях (раздел 13.2). Когда вирусы
проникли в клетку, то его двигательные белки
увеличивают проницаемость плазмодесм, сое-
диняющие отдельные клетки, чтобы позволить
вирусам пройти через них и распространиться
по всему симпласту.
Геном ретровирусов также состоит из одно-
нитевой РНК, но в этом случае при заражении
клетки РНК транскрибируется с помощью об-
ратной транскриптазы в ДНК, которая частич-
но интегрируется в ядерный геном. Ретровирус-
ные инфекции известны только для животных.
Вирус мозаики цветной капусты (Cauli-
flower mosaic virus, CaMV), вызывающий пато-
генные изменения в листьях цветной капусты
и родственных ей растений, имеет черты сход-
ства с ретровирусами. Геном CaMV состоит из
двунитевой ДНК из 8 тыс. п.о., с разрывами в
ней (рис. 20.20). Заражая растительную клетку,
вирус теряет свою белковую оболочку. Разры-
вы в ДНК заполняются с помощью ферментов
репарации хозяина. Геном вируса приобретает
структуру двойной спирали и образует в ядре
хроматин-подобные агрегаты с гистонами. Это
позволяет вирусному геному оставаться в ядре
в виде мини-хромосомы. Геном вируса содер-
жит промоторную последовательность, сходную
с промоторами ядерных генов. Она содержит
как ТАТА и СААТ-боксы, так и энхансерные
элементы. Промотор вируса распознается РНК-
полимеразой II клетки хозяина и начинает
транскрибироваться с большой скоростью. За-
тем транскрипт разрезается на отдельные мРНК,
которые кодируют синтез шести вирусных бел-
ков, включая белки оболочки и обратной транс-
криптазы. Сильный 35S CaMV-промотор часто
используется для экспрессии чужеродных генов
в трансгенных растениях (глава 22).
Молекула, полученная с помощью РНК-
полимеразы II, снова транскрибируется в ДНК
обратной транскриптазой (кодируется виру-
сом). После синтеза комплиментарной нити
ДНК упаковывается в виде двунитевого генома
в белковую оболочку. Вирус теперь готов зара-
жать другие клетки.
Ретротранспозоны и ретровирусы
Помимо ДНК-транспозонов, описанных в пред-
ыдущем разделе, существует другой класс мо-
бильных элементов, вероятно, произошедших
ДНК Ретротранспозон Хромосома
__________________________________________
....... ьг
РНК-полимераза
хозяина
РНК I
Обратная транскриптаза
(кодируется вирусом)
кДНК I —~1
Рис. 20.21. Ретротранспозон состоит из
последовательности ДНК, интегрированной
в хромосому. Граничные последовательности
содержат сигнал для распознавания и
транскрипции ДНК РНК-полимеразой
хозяйской клетки. РНК транскрибируется
в кДНК (комплементарную ДНК) обратной
транскриптазой, которая кодируется
ретротранспозоном, и встраивается в другой
участок генома
Интеграция
в хромосому
Хромосома
Ретротранспозон
1.^
408
20. Три генома растительной клетки
от ретровирусов. Они не могут «выпрыгивать»
из участка ДНК, как ДНК-транспозоны, но мо-
гут размножаться. Ретротранспозоны имеют
последовательности, которые несут сигналы для
транскрипции ДНК. Транскрипция ДНК ретро-
транспозона осуществляется РНК-полимеразой
хозяйской клетки. РНК ретротранспозона ко-
дирует единый полипептид, который разрезает-
ся протеиназным доменом на несколько белков,
среди которых нет белков оболочки. Важней-
шим ферментом ретротранспозонов является
обратная транкриптаза, которая гомологична
ферменту ретровирусов и транскрибирует РНК
ретротранспозона в ДНК (рис. 20.21). Эта ДНК
затем встраивается в другие участки генома.
Логично предположить, что ретротранспозоны
представляют собой ретровирусы, потерявшие
способность синтезировать белковую оболочку.
У Arabidopsis обнаружено несколько различных
ретротранспозонов, содержащих все элементы
для размножения. Однако вставку ретротран-
спозона в ген Arabidopsis наблюдать пока еще
не удалось. Около 0,1% генома Arabidopsis со-
стоит из таких ретротранспозонов, что позволя-
ет предположить, что они размножаются, хотя
и с очень медленной скоростью.
20.6. Кольцевой геном пластид
Существует множество аргументов, говорящих
в пользу теории происхождения пластид от про-
кариотических эндосимбионтов (раздел 1.3).
Строение пластидного генома — дополнитель-
ное тому подтверждение. Кольцевой геном
пластид сходен с геномом цианобактерий, хотя
и гораздо меньше по размерам. ДНК пластид-
ного генома называется хлДНК (хлоропласт-
ной) или птДНК (пластидной). У большин-
ства исследованных растений кольцевой геном
хлоропластов имеет размеры от 120 до 160 тыс.
п.о., что в зависимости от растения, составля-
ет 0,001—0,1% ядерного генома (см. табл. 20.1).
Однако в клетках находится множество копий
пластидного генома. Во-первых, несколько ко-
пий хлДНК находится в каждой пластиде. Так,
в молодых листьях содержится около 100 моле-
кул хлДНК на хлоропласт, в старых — 15—20.
Во-вторых, клетки содержат большое коли-
Таблица 20.4. Идентифицированные гены хлоропластного генома кукурузы
Название гена Продукт гена (белок или РНК)
Фотосинтетический аппарат rbcL atpk, -В, -Е atpF, -Н, -1 psak, В, С psbA, -В, -С, -D psbE, -F, -G, -Н, -1 RubisCO, большая субъединица F-АТФ-синтаза, субъединицы а, р, е F-АТФ-синтаза, субъединицы I, III, IV Фотосистема I, субъединицы A1f А2, 9-кДа белок Фотосистема II, субъединицы D1f 51-кДа, 44-кДа, О2 Фотосистема II, субъединицы цит. Ь559-9-кДа, -4кДа, G, 10Pi, l-белок
petk, -В, -D nd/?A, -В, -С, -D ndhE, -F Синтез белка Цит-Ь6/Т- комплекс: цит. f, цит. Ь6, субъединица IV НАДН-дегидрогеназа (ND): субъединицы 1,2, 3, 4 НАДН-дегидрогеназа (ND): субъединицы ND4L, 5
РДНК trn rps2,-3,-4,-7,-8,-11 rps12,-14,-15,-16, -18,-19 rpl2, -14, -16, -20, -22 rp/23, -33, -36 /л/А Транскрипция генов Рибосомные РНК (16S, 23S, 4.5S, 5S) Транспортные РНК (30 генов) 30S- рибосомальные белки (CS) 2, 3, 4, 7, 8, 11 30S- рибосомальные белки (CS) 12, 14, 15, 16, 18, 19 50S- рибосомальные белки (CL) 2, 14, 16, 20, 22 50S- рибосомальные белки (CL) 23, 33, 36 Фактор инициации 1
rpok, -В, -С ssb РНК-полимераза-а, -р, -р' белок, связывающий одноцепочечную ДНК
20.6. Кольцевой геном пластид
409
Малый однокопийный участок
Малый однокопийный участок
Рис. 20.22. а. Карта генов хлоропластного генома табака, по Shinozaki
с сотрудниками. Отдельные гены перечислены в табл. 20.4, где расшифровываются
приведённые здесь аббревиатуры, б и в. Схема строения хлоропластного генома
других растений. Бобы и горох не содержат инвертированных повторов. rbcL
кодирует большую субъединицу RubisCO, psbA — белок D, фотосистемы П
чество пластид (20—50 на клетку мезофилла).
Поэтому, несмотря на небольшой размер гено-
ма, пластидная ДНК составляет 5—10% от всей
ДНК клетки.
Первое полное секвенирование пластидно-
го генома было проведено в 1986 г. для хлоро-
пластов табака группой Katzuo Shinozaki, На-
гоя, и группой Kanji Ohyama, Киото, а также
410
20. Три генома растительной клетки
Вал- 16S Иле-
тРНК рРНК тРНК
Ала-
тРНК
23S
рРНК
4,5S—5S
рРНК
Рис. 20.23. В пластидах кукурузы все четыре рибосомные рРНК и две тРНК
транскрибируются полицистронно, одной транскрипционной единицей
для хлоропластов печеночного мха маршанции
(Marschantia polymorpha). Хотя эти два расте-
ния эволюционно очень далеки друг от друга, их
пластидный геном оказался сходным по составу
и расположению генов. Очевидно, геном пла-
стид мало изменялся в течение эволюции. Это
подтверждается секвенированием пластидной
ДНК многих других растений.
На рисунке 20.22# представлена полная гене-
тическая карта хлоропластного генома табака.
Он содержит так называемые инвертированные
повторы (IR), которые разделяют остальной ге-
ном на большой и малый однокопийные участ-
ки. Каждый из повторов (IRA и IRB) у разных
растений состоит из 20—50 тыс. п.о. и содержит
гены четырех рРНК, а также несколько генов
тРНК (рис. 20.226). Такие повторы не найдены
в пластидных геномах гороха, бобов и других
бобовых (рис. 20.22#). Возможно, инвертиро-
ванные повторы в них исчезли в ходе эволюции.
Гены в оставшемся участке обычно присутству-
ют в единственной копии.
Секвенирование хлДНК табака показало,
что она содержит 122 гена (146 с учетом удвоения
генов в инвертированных повторах) (табл. 20.4).
В большом однокопийном участке находится,
например, ген большой субъединицы рибулозо-
бисфосфаткарбоксилазы/оксигеназы (RubisCO,
раздел 6.2), в то время как ген малой субъеди-
ницы входит в состав ядерного генома. Одно-
копийный участок пластидного генома также
кодирует шесть субъединиц F-АТФ-синтазы
(остальные ее гены кодируются в ядре), некото-
рые субъединицы фотосистем I и II, цитохром-
66/Лкомплекса, НАДН-дегидрогеназы (также
присутствующей в митохондриях, см. разде-
лы 3.8 и 5.5), ферменты для синтеза пластидных
белков и транскрипции ДНК. Некоторые из
этих структурных генов содержат интроны. Кро-
ме того, есть гены с так называемой открытой
рамкой считывания (open reading frame, ORF),
кодирующие части которых, как и у остальных
генов, ограничены старт- и стоп-кодоном, но
еще неизвестно, какие именно функциональ-
ные белки они кодируют. В пластидном геноме
кодируется только часть хлоропластных белков,
информация о большинстве других белков со-
держится в ядре. Возможно, что многие гены
исходного эндосимбионта переместились в ядро
в течение эволюции. Также есть доказательства
в пользу гипотезы переноса генов между пласти-
дами и митохондриями (раздел 20.7).
В пластидном геноме кодируются все четы-
ре рРНК, из которых состоит рибосома хлоро-
пласта (4,5S; 5S; 16S и 23S). Размер у рибосо-
мы пластид (коэффициент седиментации 70S)
меньше, чем у цитозольной эукариотической
(80S), и более свойственен бактериальным ри-
босомам. Как и у бактерий, эти четыре рРНК
содержатся в одной транскрипционной единице
(рис. 20.23). Между 16S и 23S рРНК находится
большой спейсер. В нем содержится последо-
вательность, кодирующая одну или две тРНК.
Всего в геноме пластид кодируется 30 тРНК.
Сходство пластидного транскрипционного
аппарата с бактериальным
В пластидах работают два типа РНК-
полимераз, одна из которых кодируется хлоро-
пластным геномом, а другая — ядерным.
1. РНК-полимераза, кодируемая в пласти-
дах, обеспечивает транскрипцию генов субъе-
диниц фотосинтетических комплексов. Она
представляет собой комплекс из нескольких
субъединиц, сходный с бактериальным. Од-
нако, в отличие от последнего, хлоропластный
РНК-полимеразный комплекс нечувствителен
к рифампицину (синтетическому производно-
му антибиотика из Streptomyces).
2. РНК-полимераза, кодируемая в ядре,
произошла при дупликации митохондриаль-
ной РНК-полимеразы. Эта «импортированная»
РНК-полимеразагомологичнаРНК-полимеразе
бактериофагов. Она транскрибирует так назы-
20.7. Митохондриальный геном растений
411
ваемые гены домашнего хозяйства хлоропластов
(house-keeping), которые выполняют основные
функции метаболизма, такие как синтез рРНК
или тРНК.
Многие пластидные гены, подобно бактери-
альным, за 10 п.о. до точки начала транскрипции
содержат бокс с консенсусной последователь-
ностью ТАТААТ, и за 35 п.о. — другой консен-
сусный промоторный участок TTGACA. Неко-
торые структурные гены полицистронны — это
означает, что они транскрибируются все вместе
одним крупным первичным транскриптом, как
это свойственно бактериальным генам. В не-
которых случаях первичный транскрипт затем
разрезается эндонуклеазами, но этот процесс
еще во многом остается невыясненным.
20.7. Митохондриальный геном
растений
Растения имеют очень большой митохондри-
альный геном по сравнению с животными.
У Arabidopsis он в 20 раз больше по размеру,
чем у человека, а у дыни — в 140 раз (табл. 20.5).
Он также содержит больше генетической ин-
формации: количество закодированных в нем
генов в 7 раз выше, чем у человека.
Размер митохондриального генома заметно
варьирует даже в пределах одного семейства.
Так, в семействе тыквенных (Cucurbitaceae) его
размер составляет 330 тыс. п.о. у арбуза (Citrul-
lus lanatus), 850 тыс. п.о. — у тыквы (Cucurbita
pepo) и 2400 тыс. п.о. — у дыни (Cucumis melo)
(см. табл. 20.5). Размер же хлоропластного ге-
нома у растений обычно более постоянный,
120—160 тыс. п.о.
Митохондриальный геном растений часто
состоит из одной крупной молекулы ДНК и
нескольких мелких. У некоторых видов такое
строение постоянно, но в большинстве случае
фрагментация мт-генома возникает из-за го-
мологичной рекомбинации прямых повторов
(например, у кукурузы таких повторов шесть).
На рисунке 20.24 показано, каким образом вза-
имодействие двух прямых повторов вследствие
гомологичной рекомбинации приводит к по-
явлению двух фрагментов ДНК. Митохондри-
альный геном кукурузы, размером в 570 тыс.
п.о., теоретически может находиться как в виде
крупного основного кольца (master circle), так
и в виде четырех субгеномных колец (subcircles)
(рис. 20.25). Рекомбинация молекул ДНК может
также приводить к образованию более крупных
единиц, чем, возможно, и объясняется высокая
вариабельность размеров митохондриального
генома растений.
Количество митохондрий в растительной
клетке колеблется от 50 до 2000, при этом каж-
дая митохондрия содержит от 1 до 100 геномов.
Поэтому при каждом делении клетки митохон-
дриальный геном наследуется во множестве ко-
пий.
Животные и дрожжи обычно имеют кольцевую
мтДНК, подобную бактериальной. Возможно, что
и растительная мтДНК имеет кольцевое строе-
ние. Это точно известно для небольших молекул
мтДНК (субгеномных колец, рис. 20.25), однако
остается неясным, имеет ли такое же строение и
основная мтДНК. Существуют данные в пользу
того, что основной геном представляет собой не-
замкнутую нить.
На рисунке 20.26 показана полная генетиче-
ская карта митохондриального генома Arabidop-
sis tha liana, а в табл. 20.6 отражен примерный ге-
нетический состав мт-генома высших растений.
Если сравнить эти цифры с количеством генов
пластидного генома (см. табл. 20.4), то видно,
что митохондриальный геном хотя и имеет зна-
Таблица 20.5. Размер митохондриальной ДНК (мтДНК) растений по сравнению с мтДНК человека
Организм Размер мтДНК (тыс. п.о.)
Arabidopsis thaliana (резуховидка) Vicia faba (бобы) Zea mays (кукуруза) Citrullus lanatus (арбуз) Cucurbita pepo (тыква) Cucumis melo (дыня) Marschantia polymorpha (маршанция), печёночный мох Homo sapiens (человек) 367 290 570 330 850 2400 170 17
412
20. Три генома растительной клетки
Рис. 20.24. Путём обратимой гомологичной рекомбинации двух прямых повторов
из основного кольца митохондриального генома образуются
два субгеномных кольца
Гомологичная
рекомбинация
Субгеномные
кольца
Митохондриальный геном кукурузы
Основное кольцо
Субгеномные кольца
Рис. 20.25. Благодаря гомологичной рекомбинации митохондриальный геном
кукурузы может находиться как в виде одного большого кольца, так и в виде
нескольких субгеномных колец. Большинство митохондриальных геномов растений
существует только в виде субгеномных колец
чительно больший размер, чем пластидный,
содержит меньше генетической информации.
Такое соотношение возникает благодаря боль-
шому количеству повторяющихся последова-
тельностей. Митохондриальный геном содержит
большое количество ДНК, чьи функции еще
неизвестны. Некоторые исследователи счита-
ют, что это — «мусорная» ДНК, накопившаяся
здесь в ходе эволюции, часть которой происхо-
дит из пластидной, а часть — из ядерной ДНК1.
1 Концепация митохондриального генома как «рекомбина-
ционной помойки». — Прим. ред.
Очевидно, что митохондриальный геном, как и
ядерный, может содержать большие количества
бессмысленных последовательностей и пере-
давать их будущим поколениям. Интересно,
что большая часть мтДНК транскрибируется, в
частности 30% митохондриального генома репы
Brassica гара (218 тыс. п.о.) транскрипционно
активны. То же самое показано для генома ды-
ни Cucumis melo, который в шесть раз больше
(2400 тыс. п.о.). Почему образуется такое боль-
шое количество транскриптов, остается неяс-
ным, учитывая, что в этих двух митохондриаль-
ных геномах общее число кодируемых единиц:
белков, тРНК и рРНК — всего около 60.
20.7. Митохондриальный геном растения
413
Таблица 20.6. Гены, идентифицированные в геноме растительных митохондрий
Аппарат трансляции 5S, 18S, 26S рРНК 10 рибосомных белков 16 транспортных РНК
НАДН-дегидрогеназа Сукцинатдегидрогеназа Цитохром-Ь/Ст -комплекс Цитохром-а/а3-комплекс F-АТФ-синтаза Биогенез цитохрома с Консервативная открытая рамка считывания с неизвестным продуктом 9 субъединиц 1 —3 субъединицы 1 субъединица 3 субъединицы 4 субъединицы > 3 генов > 10 генов
Из Schuster и Brennicke
366.924/0
Рис. 20.26. Генетическая карта митохондриального генома Arabidopsis
thaliana, основанная на анализе ДНК, проведённом Unseld et al. (1997)
(с любезного разрешения A. Brennicke)
414
20. Три генома растительной клетки
Митохондриальный геном кодирует часть
трансляционного аппарата, включая 3 рРНК,
около 15 тРНК и около Ю рибосомных белков.
В митохондриальном геноме также кодируются
различные гидрофобные мембранные белки,
как, например, некоторые субъединицы ком-
плексов дыхательной цепи (раздел 5.5), АТФ-
синтазы (раздел 4.3), а также, по меньшей мере,
три фермента синтеза цитохрома с (раздел Ю.5).
Около 95% митохондриальных белков, включая
большинство субъединиц дыхательной цепи,
АТФ-синтазы, а также некоторые тРНК коди-
руются в ядре. Предполагая, что митохондрии
произошли от эндосимбионтов, можно сделать
вывод, что большинство генетической инфор-
мации их генома было передано в ядро. Такой
перенос генов часто наблюдается в растениях,
а состав генов митохондрий у разных видов мо-
жет отличаться. Очевидно также, что существует
перенос генов из пластид в митохондрии1. Так,
если судить по нуклеотидной последовательно-
сти, из пластидного генома в митохондриаль-
ный перешли гены нескольких тРНК.
Промоторы генов растительных митохон-
дрий гетерогенны. Различаются сигнальные
последовательности для начала и окончания
транскрипции, причем даже для генов одного и
того же митохондриального генома. Вероятно,
что растительные митохондрии содержат не-
сколько мтРНК-полимераз, как и пластиды. Но
соответствующие факторы транскрипции еще
недостаточно охарактеризованы. Большинство
митохондриальных генов транскрибируются
моноцистронно.
Пост-транскрипционное редактирование
мтРНК
При сравнении аминокислотных последова-
тельностей белков, синтезированных в ми-
тохондрии, с соответствующими последова-
тельностями нуклеотидов кодирующего гена
обнаруживаются странные расхождения и не-
соответствия правилам генетического кода.
На том месте, где в триплетах должен находить-
ся цитозин, обнаруживается тимин, а иногда
1 У кукурузы в митохондриальном геноме обнаружена по-
следовательность около 12 тыс. п.о., полностью идентичная
хлоропластной, однако в митохондриях она не транскриби-
руется. — Прим. ред.
наоборот. Более подробные исследования по-
казали, что с мтДНК транскрибируется мРНК,
которая содержит неверную информацию
о синтезируемом затем белке. И удивительным
было открытие, что мРНК в митохондриях за-
тем подвергается коррекции: цитозин превра-
щается в урацил (или урацил в цитозин) до тех
пор, пока не будет создана матрица для синтеза
соответствующего белка. Этот процесс называ-
ется редактированием РНК.
Такое редактирование первоначально не-
правильной мРНК не является исключением,
свойственным только некоторым экзотическим
генам, но, наоборот, широко распространено
среди митохондриальных мРНК высших расте-
ний. В некоторых мРНК митохондрий в процес-
се редактирования на урацил заменяется до 40%
цитозина. Этим же способом редактируются
митохондриальные тРНК. Редактирование РНК
обнаружено в митохондриях всех исследован-
ных высших растений. Возникает вопрос, воз-
можно ли, чтобы в результате редактирования
транслировались другие белки. Все чаще обна-
руживаются митохондриальные белки, которые
транслируются лишь с частично отредактиро-
ванной РНК. Поскольку такие белки обычно
нефункциональны, то они, скорее всего, быстро
уничтожаются.
Редактирование РНК впервые обнаружено
в митохондриях трипаносом, одноклеточных
простейших, вызывающих сонную болезнь. Ре-
дактирование происходит также в митохондриях
животных, а в некоторых случаях оно отмечено
и в пластидах.
С 1989 г., когда впервые стало известно о суще-
ствовании редактирования РНК в митохондриях
растений, осталось еше множество нерешенных
вопросов. Каков механизм редактирования? Как
именно изменяются основания? Нерешенным
остается вопрос о его физиологической роли. Мо-
жет ли быть, что таким способом нивелируется вы-
сокая скорость мутирования митохондриального
генома, наследуемого по материнской линии? От-
куда берется информация о правильной структуре
мРНК? Предоставляется ли она ядром или также
содержится в митохондриальном геноме? Может
ли быть так, что очень крупный митохондриаль-
ный геном содержит, кроме структурных генов,
еще и одиночные фрагменты, транскрипты с ко-
торых используются для исправления мРНК, как
20.7. Митохондриальный геном растения
415
это действительно наблюдается в митохондриях
трипаносом?
Мужская стерильность растений — важный
инструмент при выведении гибридов
При скрещивании двух чистых линий, гибрид,
полученный в первом поколении (гибриды
Ft), обычно обладает большей энергией роста,
и его урожайность выше, чем у родительских
растений. Этот эффект, называемый гетеро-
зисом, наблюдался еще до переоткрытия за-
конов наследования Менделя и впервые был
практически использован в 1906 году при вы-
ведении гибридной кукурузы Георгом Шуллем
в лаборатории Cold Spring Harbor (США). Успех
этих исследований произвел целую револю-
цию в сельском хозяйстве. Основываясь на ре-
зультатах Шулля, частные компании, произво-
дящие семена, получали гибриды Fj с гораздо
большей урожайностью, чем продажные сорта.
В 1965 году 95% кукурузы, выращиваемой в зер-
новом поясе США, была гибридной. Именно
в результате использования гибридов перво-
го поколения (F]) урожай кукурузы с единицы
площади за 1940—1980 годы в США увеличился
в 3,5 раза.
Гибриды F] нельзя размножать дальше, по-
скольку, согласно законам Менделя, потомство
второго поколения будет гетерогенным. Эффект
гетерозиса в ряду поколений падает, что снижает
урожайность. Поэтому каждый год фермеры вы-
нуждены покупать семена гибридов у произво-
дителей, которые начинают играть большую роль
в экономике. Теперь гибриды F] широко исполь-
зуются при выращивании многих сельскохозяй-
ственных растений. Рассматривая кукурузу в ка-
честве примера, опишем принципы и проблемы
массового получения гибридов FP
Для того чтобы получить гибридные семе-
на F] (рис. 20.27), пыльцу отцовской линии А
переносят на пестики материнской линии Б.
На семена собирают только урожай линии Б.
Скрещивания в основном проводятся в поле-
вых условиях. Растения линий А и Б выращи-
вают раздельно, но в соседних рядах, поэтому
пыльца от А может ветром переноситься к Б.
Чтобы предотвратить опыление линии Б своей
же пыльцой, растения линии Б кастрируют. Так
как у кукурузы мужские цветки, вырабатываю-
щие пыльцу, расположены в метелке отдельно
от женских цветков, то срезанием их можно лег-
ко удалить. Однако чтобы получить таким обра-
зом гибридные семена в коммерчески выгодных
количествах, требуется огромная ручная работа.
Кроме того, такой метод не пригоден на прак-
тике для таких растений, как рожь, где мужские
и женские органы находятся в одном цветке.
Большой удачей для выращивания гибри-
дов F] оказалась находка мутантов кукурузы со
стерильной пыльцой. В этих растениях с муж-
ской стерильностью женские органы сохраняют
фертильность, их можно оплодотворить пыль-
цой других линий. Мужская стерильность на-
следуется по материнской линии и кодируется
в митохондриальном геноме. Сейчас известно
несколько мутантов кукурузы и других растений
с мужской стерильностью, являющейся след-
ствием мутации митохондриальных генов.
Связь между мутацией митохондриального
гена и мужской стерильностью растений была
предметно исследована на кукурузе с техасским
типом мужской стерильности Т (Texas). Мито-
хондрии этого мутанта содержат ген, обозна-
чаемый T-wa/13, кодирующий белок размером
13 кДа. Скорее всего, этот ген является результа-
том сложной рекомбинации. Этот белок не ока-
зывает явного влияния на метаболизм митохон-
дрий при вегетативном росте, и мутанты имеют
нормальный фенотип. Белок (еще неизвестным
образом) нарушает только формирование пыль-
цы. Одно из возможных объяснений — необыч-
ный избыток митохондрий в клетках тапетума
(слой тканей пыльника, который участвует в
обеспечении развивающейся пыльцы питатель-
ными веществами, и видимо, сильно зависит от
митохондриального метаболизма).
Успешное использование этих мутантов
с мужской стерильностью для скрещивания
основывается на втором открытии: обнаруже-
ны линии кукурузы, содержащие в ядре так на-
зываемые гены восстановители фертильности
(restorer of fertility, Rf). Кодируемые ими белки
подавляют экспрессию Т-ш/13 гена в митохон-
дриях (рис. 20.28). Скрещивание отцовского
растения А, содержащего такие /^f-гены, с мате-
ринским растением Б, несущим гены мужской
стерильности, приводит к появлению поколе-
ния Fb в котором фертильность пыльцы восста-
навливается и образуются нормальные початки
кукурузы.
416
20. Три генома растительной клетки
Рис. 20.27. Принцип получения гибридов Fj показан на примере кукурузы.
Линии А и Б — чистые (инбредные), но дающие относительно небольшой урожай.
Потомство первого поколения Fj от их скрещивания оказывается более сильным и
урожайным. Семена получают от линии Б, опылённой пыльцой линии А. Мужские
цветки линии Б срезают, чтобы предотвратить самоопыление (из Patricia Nevers,
Pflanzenziichtung aus der Nahe gesehen, Max Plank Institute fur Ziichtungsforschung,
Koln, с разрешения)
20.7. Митохондриальный геном растения
417
Линия А
Линия Б
fif-гены
Белки
T-urf13
13 кДа-белок
I
Мужская
стерильность
Рис, 20.28. Мутант кукурузы Т (обозначенный
как линия Б) в митохондриальном геноме содержит
ген Т-ш/13. Его продукт, 13 кДа-белок, нарушает
созревание пыльцы, что вызывает мужскую
стерильность растения. Другая линия кукурузы
(А) содержит в ядре один или несколько fif-генов
таких белков, которые подавляют экспрессию
T-wa/13 в митохондриях. После скрещивания
линии А с линией Б пыльца снова восстанавливает
фертильность
Скрещивание кукурузной линии Т, характе-
ризующейся мужской стерильностью, с линией,
содержащей fif-гены, способствует эффектив-
ному производству гибридов F]. К несчастью,
13 кДа-белок, кодируемый геном Т-ш/13, увели-
чивает чувствительность растения ктоксину гри-
ба Bipolaris maydis Т, который вызывает очень
опасную болезнь, уничтожившую в 1971 году
большую часть урожая кукурузы. 13 кДа-белок,
взаимодействуя с токсином гриба, нарушает
протонный градиент на внутренней митохон-
дриальной мембране. При этом резко снижает-
ся синтез АТФ. Чтобы сохранить производство
гибридных семян, пришлось снова вернуться
к ручному удалению мужских цветков. Линии
с мужской стерильностью известны не только
у кукурузы, но и у многих других растений, где
стерильность вызывается белками, кодируемы-
ми в митохондриальном геноме. Известны так-
же и линии, где синтез этих белков подавляется
другими генными продуктами, которые коди-
руются в ядре. Эти линии сегодня используют-
ся для получения фертильных семян гибридов
Fp Возможно, что влияние белков, кодируемых
ядром, на экспрессию митохондриальных генов,
таких как Т-ш/13, — это нормальная реакция
митохондриального метаболизма в растениях
и, после получения соответствующих мутантов,
может использоваться различным образом в ра-
ботах с получением мужской стерильности.
К настоящему моменту в мире проводятся
интенсивный поиск способов получения муж-
ской стерильности методами генной инженерии
и достигнуты заметные успехи. У табака и рапса
были получены трансгенные растения с экспрес-
сией рибонуклеазы бактерии Bacillus amyloli-
quefaciens (barnase) под специфическим промо-
тором, активным только в клетках тапетума. Эта
рибонуклеаза уничтожает мРНК, синтезирую-
щуюся в клетках тапетума, что предотвращает
развитие пыльцы. На другие части растения она
не действует, и растение развивается нормаль-
но. Для получения T^f-линии в клетках тапетума
экспрессируют ген ингибитора рибонуклеазы
из той же бактерии (barstar). Большим преиму-
ществом таких систем являются возможности
широкого их применения. Мужская стериль-
ность может быть получена на видах, у которых
нельзя удалять вручную тычинки и не известны
стерильные мутанты. Сейчас в США широко
распространены генно-инженерные гибриды
F] рапса. Ожидается, что производство генно-
инженерных растений с мужской стерильно-
стью и использование гибридных семян может
привести к повышению урожайности многих
культур.
Дополнительная литература
Arabidopsis Genome: A milestone in plant biology. Special
Issue. Plant Physiol 124, 1449—1865 (2000).
Arabidopsis functional genomics. Special Issue. Plant
Physiol 129, 389-925(2002).
Bachmann, K. Molecular markers in plant ecology. New
Phytologist 126, 403-418 (1994).
Backert, S., Nielsen, B. L., Borner, T. The mystery of
the rings: Structure and replication of mitochondrial
genomes from higher plants. Trends Plant Sci 2, 477—
483 (1997).
Bartel, B., Bartel, D. P. MicroRNAs: At the root of plant
development? Plant Physiol 132, 709—717 (2003).
Brennicke, A., Kuck, U. (eds.). Plant mitochondria with
emphasis on RNA editing and cytoplasmic male sterility.
Verlag Chemie, Weinheim (1993).
Chrispeels, M. J., Sadava, D. E. Plants, Genes and
Agriculture. Jones and Bartlett, Boston, London (1994).
418
20. Три генома растительной клетки
Fosket, D. Е. Plant Growth and Development. A Molecular
Approach. Academic Press, San Diego, New York (1994).
Goff, S. A., et al. A draft sequence of the rice genome {Oryza
sativa L. ssp. indica) Science 296, 92—100 (2002).
Marienfeld, J., Unseld, M., Brennicke, A. The
mitochondrial genome of Arabidopsis is composed of
both native and immigrant information. Trends Plant
Sci 4, 495-502(1999).
Mayfield, S. P., Yohn, С. B., Cohen, A., Danon, A.
Regulation of chloroplast gene expression. Annu Rev
Plant Physiol Plant Mol Biol 46, 147-166 (1995).
Meyerowitz, E. M. Prehistory and history of Arabidopsis
research. Plant Physiol 125, 15—19 (2001).
Moore, G. Cereal chromosome structure, evolution, and
pairing. Annu Rev Plant Physiol Plant Mol Biol 51,
195-222 (2000).
Ohyama, K., Fukuzuwa, H., Kochi, T., et al. Chloroplast
gene organization deduced from the complete sequence
of liverwort Marschantia polymorpha chloroplast
DNA. Nature 322, 572-574 (1986).
Rochaix, J.-D. Chloroplast reverse genetics: New insights
into the function of plastid genes. Trends Plant Sci 2,
419-425(1997).
Saedler, H., Gierl, A. Transposable Elements. Current
Topics in Microbiology and Immunology 204 Springer-
Verlag, Heidelberg (1996).
Schnable, P. S., Wise, R. P. The molecular basis of
cytoplasmic male sterility and fertility restoration.
Trends Plant Sci 3, 175-180 (1998).
Shimamoto, K., Kyozuka, J. Rice as model for comparative
genetics in plants. Annu Rev Plant Biol 53, 399—420
(2002).
Shinozyki, K., Ohme, M., Wakasugi, T., etal. The complete
nucleotide sequence of the chloroplast genome: Its gene
organization and expression. EM BO J 9, 2043—2049
(1986).
Stern, D. B., Higgs, D. C., Yang, J. Transcription and
translation in chloroplasts. Trends Plant Sci 2, 308—315
(1997).
Sundaresan, V. Horizontal spread of transposon
mutagenesis: New uses of old elements. Trends Plant Sci
1, 184-190(1996).
The Arabidopsis genome initiative. Analysis of the genome
sequence of the flowering plant Arabidopsis tha liana.
Nature 408, 796-815 (2000).
The rice full-length cDNA consortium, Kikuchi, S. et
al. Collection, mapping and annotation of over 28,000
cDNA clones fromJaponica rice. Science 301, 376—379
(2003).
Unseld, M., Marienfeld, J. R., Brandt, P., Brennicke, A.
The mitochondrial genome of Arabidopsis thaliana
contains 57 genes in 366,924 nucleotides. Nat Genet 15,
57-61 (1997).
Westhoff, P. Molecular Plant Development. Oxford
University Press. Oxford, UK (1998).
Zdravko, J. L.,Wieczorek Kirk, D. A., Lambemon, M. H. L.,
Flipowicz,W. Pre-mRNA splicing in higher plants. Trends
Plant Sci 5, 160-167 (2000).
Yamada, K., et al (69). Empirical analysis of transcrip-
tional activity in the Arabidopsis genome. Science 302,
842-846 (2003).
Yu, J., et al. A draft sequence of the rice genome {Oryza
sativa L. ssp. indica) Science 296, 79—92 (2002).
21
Биосинтез белков
При биосинтезе белков последовательность
аминокислот определяется последователь-
ностью нуклеотидов в мРНК. Посредника-
ми служат транспортные рибонуклеиновые
кислоты (тРНК) — небольшие РНК из 75—85
нуклеотидов. Они имеют характерную структу-
ру стремя петлями-шпильками. Центральная
петля содержит антикодон, комплементарный
кодону мРНК. Каждой аминокислоте соответ-
ствует одна или несколько тРНК. Ковалентное
связывание аминокислоты с соответствую-
щей тРНК обеспечивается специфической
аминоацил-тРНК-синтетазой. При этом не-
обходима АТФ. В качестве промежуточного
соединения образуется смешанный ангидрид
аминоацил-АМФ (рис. 21.1).
В растительной клетке синтез белков может
идти в трех компартментах. Трансляция ядер-
ной мРНК происходит в цитозоле. Трансляция
мРНК, кодируемой в пластидном и митохондри-
альном геномах, осуществляется, соответствен-
но, в строме пластид и матриксе митохондрий.
21.1. Синтез белков на рибосомах
Рибосома — это крупный рибопротеиновый
комплекс, содержащий 3—4 различных рРНК и
большое количество белков. В интервале между
Аминоацил-тРНК-синтетаза
nh2
R-C-H
I
СООН
+ АТФ
Рис. 21.1. С помощью специфической аминоацил-тРНК-синтетазы тРНК
связывается с соответствующей аминокислотой. В этом процессе принимает
участие АТФ. Промежуточным соединением является аминоацил-АМФ
420
21. Биоситнтез белков
Таблица 21.1. Состав рибосом цитозоля, стромы хлоропластов и митохондриального
матрикса растений
Рибосома в целом Субъединицы рибосом Компоненты рРНК Число белков
Цитозоль (эукариотическая рибосома растений) 80S Малая 40S Большая 60S 18S-pPHK 5S-pPHK 5,8S-pPHK 25S-pPHK около 30 около 50
Хлоропласт (прокариотическая рибосома) 70S Малая 30S Большая 50S 16S-pPHK 4,5S-pPHK 5S-pPHK 23S-pPHK около 24 около 35
Митохондрия (прокариотическая рибосома) 78S Малая -30S Большая -50S 18S-pPHK 5S-pPHK 26S-pPHK около 33 около 35
5' | Кэп |-------AUG
3’ мРНК
| Кэп
| Кэп
3’
е1Р2-ГДФ
и другие факторы инициации
808-инициаторный комплекс
Рис. 21.2. Образование инициаторного комплекса эукариотической (80S) рибосомы
21.1. Синтез белков на рибосомах
421
трансляциями она диссоциирует на две субъе-
диницы. Рибосомы цитозоля, пластид и ми-
тохондрий различаются по составу и размеру
(табл. 21.1). Цитозольные (эукариотические)
рибосомы с коэффициентом седиментации
80S, диссоциируют на малую (40S) и большую
(60S) субъединицы. Митохондриальные и пла-
стидные рибосомы меньше по размеру. Размер
митохондриальных рибосом — 78S, при этом
он меняется от вида к виду. Пластидные ри-
босомы имеют коэффициент седиментации
70S, как и рибосомы бактерии Escherichia coli.
Поскольку рибосомы митохондрий и пластид
схожи с бактериальными, то их относят к про-
кариотическому типу рибосом.
В начале трансляции мРНК образует ком-
плекс инициации с рибосомой (см. рис. 21.2).
В этом процессе участвует много факторов
инициации. Вначале рассмотрим, что про-
исходит во время трансляции в цитозоле. Во-
первых, эукариотический фактор инициации 2
(eIF2) вместе с ГТФ и транспортной РНК, несу-
щей метионин, образует инициаторную транс-
портную РНК. С помощью других факторов
инициации она затем связывается с малой 40S
субъединицей. Фактор инициации eIF4F состо-
ит из нескольких белков и известен также как
кэп-связывающий белок. При участии АТФ он
способствует связыванию малой 40S субъеди-
ницы, несущей инициаторную транспортную
РНК, с кэпом на 5’-конне мРНК (см. рис. 20.9).
Благодаря гидролизу АТФ субъединица 40S про-
двигается от 5’ к 3’ концу, пока ей не встретит-
ся стартовый кодон AUG. Обычно, хотя и не
всегда, распознается один первый стартовый
триплет AUG. Для некоторых мРНК трансля-
ция начинается со следующего триплета AUG.
Какой конкретно из триплетов AUG будет рас-
познаваться как стартовый кодон, определяется
окружающими последовательностями мРНК.
Затем большая субъединица 60S связывается
с 40Б-субъединицей, что сопровождается дис-
социацией нескольких факторов инициации
и ГДФ. Теперь формирование инициаторного
комплекса полностью завершено и рибосома
готова начать трансляцию.
В митохондриальной и пластидной мРНК
нет кэпа. Пластидная мРНК имеет специаль-
ный сайт для начального связывания с малой
субъединицей рибосомы. Эта пурин-богатая
последовательность примерно из Ю оснований
называется последовательностью Шайн-
Дальгарно. Она связывается с 16S рРНК малой
рибосомной субъединицы. Последовательность
Шайн-Дальгарно также найдена в бактериаль-
ных мРНК. Однако неизвестно, играет ли она ту
же роль в митохондриях. В митохондриях, пла-
стидах и бактериях инициаторная тРНК связы-
вается с N-формилметионином (вместо метио-
нина в цитозоле). После образования пептида от
метионина отщепляется формильный остаток.
Синтез пептидной цепочки
Рибосома, собранная в результате процес-
са инициации, содержит два сайта, в кото-
рых тРНК может связываться с мРНК. Пеп-
тидильный сайт (Р) позволяет связывать
инициаторную тРНК со стартовым кодоном
AUG (рис. 21.3). Аминоацильный сайт (А) за-
крывает второй кодон и вначале ни с чем не
связан. С другой стороны от сайта Р находит-
ся сайт выхода (Е, exit), где высвобождается
свободная тРНК. Элонгация начинается в тот
момент, когда соответствующая аминоацил-
тРНК занимает сайт А, образуя комплимен-
тарные водородные связи со вторым кодоном.
В этом участвуют два фактора элонгации. Эу-
кариотический фактор элонгации eEFla свя-
зывается с АТФ и доставляет соответствующую
аминоацил-тРНК к сайту А, при этом ГТФ ги-
дролизуется до ГДФ и фосфата. Расщепление
энергетически богатой связи в ГТФ дает воз-
можность аминоацил-тРНК связаться с ко-
доном в сайте А. После этого ГДФ, все еще
связанная с eEFla, заменяется на ГТФ, при
непосредственном участии фактора eEFiPy.
Теперь комплекс eEFla-ГТФ подготовлен для
следующего цикла.
Вслед за этим образуется пептидная связь
между карбоксильной группой метионина и
аминогруппой той аминокислоты, которая на-
ходится на тРНК, связанной с сайтом А. Пеп-
тидилтрансфераза, катализирующая этот про-
цесс, — это сложный фермент, состоящий из
нескольких рибосомальных белков. Решающую
роль при катализе играет 25S-pPHK. Происхо-
дит N-нуклеофильная атака на карбоксильную
группу во время формирования пептидной свя-
зи. Результатом является формирование дипеп-
тида, связанного с тРНК в сайте А (рис. 2l.4a).
422
21. Биоситнтез белков
Рис. 21.3. Элонгационный цикл биосинтеза
белков. После связывания соответствующей
аминоацил-тРНК с сайтом А с помощью пептидил-
трансферазы образуется пептидная связь. При
последующем передвижении оставшаяся свободной
тРНК передвигается к сайту Е и выходит из
рибосомы. тРНК, несущая на себе пептидную
цепочку занимает в это время сайт Р. После цикла
элонгации происходит связывание новой тРНК
с сайтом А. Сокращение: Ак — аминокислота
Благодаря гидролизу одной молекулы ГТФ
до ГДФ и фосфата, фактор элонгации eEF2 об-
легчает передвижение (транслокацию) рибо-
сомы по мРНК к следующим трем основаниям
(см. рис. 21.3). Таким образом, свободная тРНК
оказывается на сайте Е, после чего она выходит,
и сайт Р занимает тРНК, несущая пептид. С ва-
кантным теперь сайтом А связывается третья
аминоацил-тРНК и цикл повторяется вновь.
После нескольких циклов элонгации 5’-ко-
нец мРНК больше ни с чем не связан и мо-
жет участвовать в формировании нового ини-
циаторного комплекса. мРНК, одновременно
транслирующаяся несколькими рибосомами,
называется полисомой (рис. 21.5).
Заканчивается трансляция в тот момент,
когда сайт А свяжется со стоп-кодоном (UGA,
UAG, UAA) (рис. 21.46). Эти стоп-кодоны могут
образовывать связь с release-фактором (eRF),
что сопровождается гидролизом ГТФ до ГДФ и
фосфата. Связывание eRF со стоп-кодоном из-
меняет специфичность пептидилтрансферазы.
Акцептором пептидной цепочки вместо амино-
кислоты становится молекула воды. Синтезиро-
ванный белок освобождается от тРНК.
Специфические ингибиторы трансляции
рибосом разного типа
На прокариотических рибосомах элонгация,
транслокация и терминация происходят точно
также, за исключением небольших деталей. На-
пример, при терминации не требуется ГТФ. Од-
нако эукариотические и прокариотические ри-
босомы по-разному реагируют на определенные
антибиотики (рис. 21.6, табл. 21.2). Пуромицин,
аналог тРНК, — это основной ингибитор бел-
кового синтеза независимо от типа рибосом.
Циклогексимид ингибирует синтез белков
только на эукариотических хромосомах. Хло-
рамфеникол, тетрациклин и стрептомицин —
в основном являются ингибиторами прока-
риотических рибосом. Эти ингибиторы могут
быть использованы для того, чтобы определить,
кодируется белок в ядре или в геноме пластид и
митохондрий. Относительно простой метод на-
блюдения синтеза белков заключается в изме-
рении встраивания в белки радиоактивно мече-
ной аминокислоты (например, 358-метионина).
Если это встраивание ингибируется циклогек-
симидом, то белок кодируется в ядре. Точно так
21.1. Синтез белков на рибосомах
423
а
Пептидилтрансфераза
nh2
I
R^C-H
C = O
I
HN
I
r2-c-h
o = c
I
о
nh2 nh2
R.-C-H R2-C-H
I I
o=c o=c
I I
о о
| P сайт j
| А сайт|
Р
I
NH
I
R -С-Н
I
о = с
I
ОН
P (пептид)
I
NH
I
R -C-H
I HOH
0 = 0
7 Терминация транскрипции
О ОН
Releasing-
| Рсайт] А сайт | Рсайт]
Рис. 21.4. а. Образование пептидной связи с помощью пептидилтрансферазы.
б. Терминация транскрипции пептида. Связывание releasing-фактора (eRF)
со стоп-кодоном в сайте А. Пептид переходит с молекулы тРНК на молекулу Н2О
Рис. 21.5. Несколько рибосом, одновременно транслирующих одну и ту же нить
мРНК, образуют полисому
424
21. Биоситнтез белков
Пуромицин
Тетрациклин
I
С=О
I
H-C-R
I
nh2
Аминоацил-тРНК
CI
I
H-C-CI
I
о=с Н2СОН
H-N----с-н
I
но-с-н
Циклогексимид
no2
Хлорамфеникол
Стрептомицин
Рис. 21.6. Антибиотики, ингибирующие синтез белка. Механизм их действия
описан в табл. 21.2. Для сравнения дана формула аминоацил-тРНК
Таблица 21.2. Антибиотики — ингибиторы белкового синтеза. Все антибиотики, приведённые в списке,
синтезируются стрептомицетами
Антибиотик Ингибиторное действие
Пуромицин Связывается с сайтом А как аналог аминоацил-тРНК и участвует во всех шагах элонгации, но не может образовывать пептидную связь. Это прекращает синтез белка на рибосомах как прокарио- тических, так и эукариотических.
Циклогексимид Хлорамфеникол Тетрациклин Ингибирует пептидилтрансферазу на эукариотических рибосомах. Ингибирует пептидилтрансферазу на прокариотических рибосомах. Связывается с 30S-субъединицей и предотвращает связывание аминоацил-тРНК с рибосомой. На прокариотические рибосомы действует сильнее, чем на эукариотические.
Стрептомицин Взаимодействует с 708-рибосомами и приводит к неверному распознаванию последовательно- стей мРНК. На прокариотических рибосомах, таким образом, ингибируется инициация
21.1. Синтез белков на рибосомах
42
же ингибирование хлорамфениколом говорит
о том, что соответствующий белок кодируется
геномом пластид или митохондрий.
Регуляция трансляции
Синтез многих белков специфически регули-
руется на уровне трансляции. Эта регуляция
может осуществляться за счет работы протеин-
киназ, с помощью которых фосфорилируют-
ся белки, участвующие в трансляции. Этапом,
лимитирующим скорость при трансляции, яв-
ляется, в основном, инициация. Поэтому эта
стадия лучше всего подходит для осуществле-
ния регуляции. У животных фактор инициации
eIF2 инактивируется фосфорилированием, при
этом инициация ингибируется. Но о регуляции
трансляции у растений известно мало.
21.2. Формирование трехмерной
структуры белков
Полипептид, получающийся в результате син-
теза на рибосомах — это еще не завершенный
белок. Его еще нужно перевести (если это не-
обходимо, отрезав некоторые участки) в био-
логически активную форму нативного белка.
Это делается с помощью специфического сво-
рачивания (фолдинга). Трехмерная структура
нативного белка представляет собой особое со-
стояние молекулы и определяется, в основном,
последовательностью аминокислот.
Многостадийный процесс
сворачивания белков
Для пептида, содержащего 100 аминокис-
лот (а это небольшой белок весом всего около
11 кДа) теоретически возможны Ю100 конфор-
маций. Переориентация одной связи занимает
10'13 секунд. Перебор всех возможных конфор-
маций, таким образом, занял бы 1087 секунд.
Для сравнения, возраст Земли составляет око-
ло 1,6* 1017 секунд. В реальности, однако, белки
принимают свою нативную форму в течение
нескольких секунд или минут. Очевидно, что
сворачивание молекулы проходит в несколь-
ко стадий. Вначале формируются вторичные
структуры: а-спирали и/или p-слои. Они со-
стоят из 8—15 аминокислотных остатков, кото-
рые соединяются или разъединяются за милли-
секунды (рис. 21.7). Вторичные структуры затем
а-спираль
Рис. 21.7. Сворачивание белков — это ступенчатый
иерархический процесс. Сначала образуются
вторичные структуры, которые соединяются друг
с другом. Процесс идет до тех пор, пока (после
небольших исправлений) не образуется третичная
конформация нативного белка
постепенно объединяются друг с другом в более
крупные ассоциаты и стабилизируют участки
молекулы, не имеющие вторичной структуры.
Движущей силой этого процесса являются ги-
дрофобные взаимодействия1. При дальнейших
конформационных изменениях в результате ко-
оперативных процессов сворачивания доволь-
но быстро формируется правильная трехмер-
ная структура молекулы. Если белок состоит из
1 Значительную роль в сворачивании белков также играют
и другие механизмы, в частности образование S-S-связей.
Существуют ферменты, которые «исправляют» неправильно
образованные связи. — Прим. ред.
426
21. Биоситнтез белков
нескольких субъединиц, то его составляющие
объединяются в четвертичную структуру.
Защита белков в процессе сворачивания
Процесс сворачивания может быть сильно на-
рушен, если вторичные структуры будут сое-
диняться неправильным образом, или станут
связываться с частями другой молекулы в не-
желательные агрегаты (гидрофобный коллапс).
Риск этого особенно высок при синтезе белка,
когда незавершенный белок еще соединен с ри-
босомой (см. рис. 21.5), или во время транспор-
та развернутого белка через мембрану, в мо-
мент, когда только часть пептидной цепочки
перемещена на другую сторону. Вероятность
неправильных межмолекулярных взаимодей-
ствий повышается при повышенной концен-
трации только что синтезированных белков,
что бывает в люмене шероховатого эндоплазма-
тического ретикулума (глава 14).
Чтобы предотвратить неправильное свора-
чивание, в различных компартментах клетки
находятся белки, выделяемые в особое семей-
ство. Они помогают синтезирующимся белкам
принять правильную конформацию и избежать
ошибок при сворачивании. Такие белки назы-
ваются шаперонами.
Белки теплового шока и защита
от температурных повреждений
Шапероны играют роль не только при образо-
вании белков. Они также защищают белки от
денатурации и слипания при действии высо-
ких температур, помогают сохранению и вос-
становлению их нативной конформации. Бак-
териальные, животные и растительные клетки
реагируют на подъем температуры на 10° выше
оптимального очень быстрым синтезом так на-
зываемых белков теплового шока, большин-
ство из которых является шаперонами. При ле-
тально высоких температурах многие растения
могут выжить, если их вначале подвергнуть не-
большому нагреванию, которое приведет к син-
тезу белков теплового шока. Это явление назы-
вается приобретенной термоустойчивостью.
Исследования на растениях сои показали, что
термоустойчивость действительно совпадает с
увеличением количества таких белков. Однако
многие из белков теплового шока в небольших
количествах синтезируется постоянно, видимо,
из-за того, что в нормальных условиях они так-
же участвуют в фолдинге белков.
Взаимодействие шаперонов
с несвернутыми белками
Поскольку шапероны впервые были охарак-
теризованы как белки теплового шока, они в
основном обозначаются аббревиатурой БТШ
(или HSP — heat shock protein) с указанием
молекулярной массы в килодальтонах (не все
БТШ являются шаперонами).
Шапероны семейства БТШ70 обнаруже-
ны в бактериях, митохондриях, хлоропластах,
цитозоле эукариот и эндоплазматическом ре-
тикулуме. Это высококонсервативные белки.
В БТШ70 есть сайты связывания аденино-
вых нуклеотидов, в которых могут находиться
АТФ или АДФ. Если в сайте находится АДФ,
то БТШ70 вместе с БТШ40 образует прочный
комплекс с несвернутым сегментом белка, при
этом с нативным белком они не связываются
(рис. 21.8). АДФ, связанная с БТШ70, заменяет-
ся на АТФ. Комплекс АТФ-БТШ70 имеет более
низкую аффинность связывания и легко дис-
социирует от белка. Последующим гидролизом
АТФ до АДФ, БТШ70 подготавливается к ново-
му связыванию с несвернутым сегментом белка.
Таким образом, БТШ70 лишь короткое время
связан с белком, быстро диссоциирует от него,
а затем, при необходимости, связывается снова.
Это стабилизирует синтезируемый белок, при
этом не нарушается его способность правиль-
но сворачиваться. Механизм АДФ-зависимого
связывания БТШ70 с пептидами, опосредуемый
БТШ40, сохранялся постоянным в течение эво-
люции. У человека и Е. coli 50% аминокислот
в последовательности БТШ70 оказались одина-
ковыми.
Белки семейства БТШ60, содержащиеся
в бактериях, пластидах и митохондриях, также
связываются с несвернутыми белками. Первы-
ми были идентифицированы фактор GroEL
в Е. coli и RubisCO-связывающийся белок
в хлоропластах. Затем было доказано, что эти
белки гомологичны и действуют как шапероны.
В связывании с шаперонами БТШ60 участвует
фактор GroES, в митохондриях и хлоропластах
обозначаемый как БТШ10. У бактерий 14 мо-
лекул GroEL и 7 GroES объединяются в су-
першаперонный комплекс, образуя большую
21.2. Формирование трехмерной структуры белков
427
Рис. 21.8. Шаперон БТШ70 содержит сайт связывания для АТФ и гидролизует
АТФ до АДФ. БТШ70, содержащий АДФ, вместе с БТШ40 прочно соединяется
с несвёрнутым сегментом белка. АДФ, связанный с БТШ, заменяется на АТФ.
БТШ70, содержащий АТФ, имеет низкую аффинность связывания с белком, что
приводит к диссоциации комплекса. Новая связь с белком возможна только после
гидролиза АТФ. На рисунке представлена упрощенная схема, в ней не указаны
переходные состояния и не отражена реальная структура комплекса
АДФ
АДФ АДФ
GroEL-
(БТШ 60)
Несвёрнутый
белок
' АТФ
АТФ АТФ
АТФ АТФ
Нативный
белок
Рис. 21.9. Поперечный срез супершаперонного комплекса прокариот, состоящего
из 14 молекул GroEL (БТШ60) и 7 молекул GroES (БТШ 10). Мо-лекулы шаперонов,
содержащие АДФ, связываются с несвернутым сегментом синтезирующегося белка.
АТФ постоянно замещает АДФ в супершаперонном комплексе, что приводит
к повторяющимся актам присоединения/отсоединения несвернутых участков белка
к БТШ (см. предыдущий рисунок). Это дает возможность белку сворачиваться.
При завершении свертывания белок больше не может связываться с шаперонами
и выходит в нативном виде
428
21. Биоситнтез белков
(БТШ 60)
Супер-
шаперонный
комплекс
7 GroEL
7 GroES (БТШ 10)
Нативный
белок
Рис. 21.10. Сворачивание белков у прокариот,
в пластидах и митохондриях. Несвернутый белок
защищен, если находится в связи с шапероном
БТШ70, несущим АДФ. Он сворачивается
в нативную форму в полости супершаперонного
комплекса, состоящего из молекул GroEL (БТШ60)
и GroES (БТШЮ). Реакция идёт с затратой АТФ
полость, в которой и находятся несвернутые
белки (рис. 21.9, 21.10). Белки в полости крат-
ковременно связываются с молекулами БТШ60,
аналогично тому, как они связываются с БТШ70
(см. рис. 21.8). Правильное сворачивание на-
тивного белка достигается в нескольких циклах,
сопровождающихся гидролизом АТФ, которые
включают диссоциацию и новое связывание
с белковым сегментом. Несвернутый белок мо-
жет таким образом приобретать естественную
конформацию, избегая слипания с другими бел-
ками.
БТШ70, как БТШ60 и БТШЮ, участвует
в сворачивании пластидных и митохондриаль-
ных белков (см. рис. 21.10). БТШ70 защищает
сегмент растущей пептидной цепочки в тече-
ние синтеза, а супершаперонный комплекс
из БТШ60 и БТШЮ способствует окончатель-
ному сворачиванию целого белка.
В цитозоле эукариот шаперон БТШ90 об-
наруживается в очень высоких концентрациях.
Его количество превышает количество других
белков. Он играет центральную роль при сво-
рачивании и сборке цитозольных белков. В ци-
тозоле эукариот также обнаружены шапероны
ССТ (цитозольный комплекс Т), напоминаю-
щие прокариотические БТШ60. Они образуют
олигомерные шаперонные комплексы, сходные
с супершаперонными комплексами БТШ60—
БТШЮ (см. рис. 21.10).
Существуют также ферменты, отвечающие
за другие процессы при сворачивании белков.
Такими процессами являются образование ди-
сульфидных мостиков, изомеризация
пептидных связей с участием пролина, которые
самостоятельно не вращаются. Пристальное из-
учение шаперонов началось только в последние
годы, поэтому на многие вопросы об их структу-
ре и функциях ответы еще неизвестны.
21.3. Белки, кодируемые в ядре,
распределяются по разным
компартментам клетки
Рибосомы цитозоля синтезируют белки, пред-
назначенные для транспорта во все клеточные
органеллы: пластиды, митохондрии, перокси-
сомы, вакуоли, а также белки, секретируемые
из клетки. Чтобы достичь места функциони-
рования, белки должны специфично распреде-
ляться и транспортироваться через различные
мембраны.
Белки, предназначенные для вакуоли или
для секреции из клетки во время синтеза транс-
лируются в люмен ЭР (раздел 14.5). Это дости-
21.2. Формирование трехмерной структуры белков
429
гается благодаря наличию сигнальной после-
довательности на конце синтезируемого белка.
Она с помощью сигнал-распознающей части-
цы связывается с белком мембранной поры в
ЭР, и в результате белок направляется в люмен
ЭР. Рибосома ассоциируется с мембраной ЭР,
и белки попадают в люмене ЭР по мере синте-
за (см. рис. 14.2). Этот процесс называется ко-
трансляционным транспортом белка. Затем
такие белки через аппарат Гольджи с помощью
везикулярного транспорта переносятся в вакуо-
ли или экспортируются в секреторных пузырь-
ках наружу.
В противоположность этому белки пластид,
митохондрий и пероксисом практически всег-
да доставляются в них пост-трансляционным
транспортом. Это означает, что через мембрану
белки транспортируются только после полно-
го синтеза и высвобождения их из рибосомы1.
Лучше всего изучен транспорт в митохондрии,
поэтому вначале мы рассмотрим его.
Транспорт белков в митохондрии
Более 95% митохондриальных белков растений
кодируются в ядре и транспортируются через
цитозоля. Подробности импорта в митохон-
дрии в основном изучены на дрожжах. Чтобы
попасть в митохондрию, белок должен иметь
специальный направляющий сигнал (target-
ing signal). Некоторые белки, предназначенные
для внутренней мембраны митохондрий или
межмембранного пространства, как и белки на-
ружной мембраны, имеют внутренние сигналы,
которые еще не идентифицированы. Другие
белки митохондриальной внутренней мембра-
ны и большинство белков митохондриально-
го матрикса синтезируются в цитозоле в виде
предшественников, содержащих сигнальную
последовательность из 12—70 аминокислот на
N-конце (так называемый пресиквене). Обыч-
но такие последовательности удаляются после
импорта и называются сигнальными (тран-
зиторными) пептидами. Эти последователь-
ности содержат много положительно заряжен-
ных аминокислот, которые могут образовывать
1 Таким образом, белки секреторного пути (транспорт
в вакуоль или секреция) синтезируются на рибосомах шеро-
ховатого ЭР, а белки цитозольного пути (цитозоль, транс-
порт в митохондрии, пластиды, ядро, перексиомы) — на ри-
босомах, не связанных с ЭР. — Прим. ред.
а-спирали, в которых одна сторона заряжена
положительно, а другая гидрофобна. Направ-
ляющим сигналом является, скорее, не опреде-
ленная аминокислотная последовательность,
а именно трехмерная структура амфифильной
а-спирали. Если чужеродный белок, напри-
мер, дигидрофолатредуктазу мыши снабдить
направляющим транзитным пептидом, чуже-
родный белок начинает транспортироваться
в митохондриальный матрикс. Это доказывает,
что для транспорта в митохондрии необходим
определенный направляющий сигнал (лидер-
ная последовательность).
Для импорта белка в матрикс ему необходимо
пройти внутреннюю и внешнюю мембраны (см.
рис. 1.12). Перенос белка осуществляется в так
называемых сайтах транслокации, в которых
обе мембраны находятся близко друг к другу.
Каждая из них содержит собственный аппарат
транслокации, который переносит белок в раз-
вернутом состоянии.
Белок-предшественник синтезируется на
рибосомах и далее ассоциируется с шаперо-
нами (например, с цтБТШ70, цт — цитозоль-
ный). Шапероны предотвращают ошибки сво-
рачивания или слипание с другими, зачастую
гидрофобными белками-предшественниками.
Связывание с цтБТШ70 сопровождается ги-
дролизом АТФ (см. рис. 21.8). Транспорт через
внешнюю мембрану осуществляется ТОМ-
комплексом (translocase of the outer mitochondrial
membrane), который состоит, по меньшей мере,
из 8 различных белков. Субъединицы ТОМ20
и ТОМ22, возможно, участвуют в распознава-
нии направляющей сигнальной (лидерной) по-
следовательности. Возможно, в специфическое
распознавание сигнала включены электроста-
тические взаимодействия между положительно
заряженной стороной а-спирали сигнальной
последовательности и отрицательно заряжен-
ной поверхностью ТОМ22. ТОМ20 и ТОМ22
затем принимают участие при передаче поли-
пептидной цепочки в транслокационную пору.
Еще одним участником транспорта белков в ми-
тохондрии является ТОМ70. Он опосредует про-
никновение белка АТФ/АДФ-транслокатора
и других бел ков-перенося и ков внутренней
мембраны. Такие белки содержат внутреннюю
сигнальную последовательность, а не лидер-
ную N-концевую (пресиквене). Возможно, что
430
21. Биоситнтез белков
БТШ 60
БТШ 10
АДФ
Супершаперонный
комплекс
Нативный белок
Рис. 21.11. Импорт белков в митохондрии (по Lili и Neupert). Структура
белка-предшественника, синтезирующегося на рибосоме в цитозоле, при неполном
сворачивании стабилизируется цитозольным шапероном цтБТШ70. Положительно
заряженная сигнальная последовательность (пресиквенс) связывается
с субъединицами ТОМ20 и ТОМ22. С помощью этой начальной последовательности
белок-предшественник проходит через транслокационную пору во внешней
и внутренней мембранах. Митохондриальные шапероны БТШ70 связываются
с пептидной цепочкой, входящей в матрикс, помогая белку проходить через пору.
Начальная (лидерная) последовательность отрезается пептидазой матрикса.
После этого белок принимает свою нативную форму в супершаперонном комплексе
21.3. Белки, кодируемые в ядре, распределяются по разным компартментам клетки
431
в формировании транслокационной поры при-
нимают участие также белок ТОМ40 и мелкие
субъединицы ТОМ5, 6, 7 (на рис. 2l.ll не пока-
заны).
Последующий транспорт через внутреннюю
мембрану происходит с участием комплекса
TIM (translocase of the inner mitochondrial mem-
brane). Он состоит из белков TIM 17, 23, 44 и не-
которых других, еще не идентифицированных
субъединиц. Для транспорта белков через вну-
треннюю мембрану нужно еще одно дополни-
тельное условие: мембранный потенциал ЛТ
(раздел 5.6). Видимо, положительный заряд ли-
дерной последовательности (пресиквенса) и от-
рицательный заряд со стороны матрикса на вну-
тренней мембране способствуют прохождению
пептида через транслокационную пору. Пептид-
ная цепочка попадает в матрикс, где она вначале
связывается с TIM44. После этого она связыва-
ется с шапероном мтБТШ70, что сопровождает-
ся гидролизом АТФ, и с другими шаперонами,
которые здесь не упоминаются. Проникновение
пептидной цепочки через транслокационную
пору происходит в результате теплового дви-
жения. Немедленное связывание со внутрен-
ним мтБТШ70 предотвращает обратный выход
белка. Предполагают, что повторное связыва-
ние БТШ70 переводит случайные колебания
белковой цепи в транслокационном канале в
однонаправленное движение. Согласно модели
молекулярного храповика (molecular ratchet),
АТФ, необходимая для обратимого связыва-
ния мтБТШ70, нужна не для того, чтобы про-
толкнуть поли пептидную цепь через пору. Она
нужна, чтобы превратить свободные колебания
полипеитидной цепи в двух транслокационных
порах в однонаправленное движение. Выдвинута
также и альтернативная гипотеза, согласно кото-
рой белок, входящий в пору, проходит в матрикс
благодаря АТФ-зависимым конформационным
изменениям связанного с ним мтБТШ70.
Когда пептидная цепь полностью переходит
в матрикс, N-концевая направляющая последо-
вательность (пресиквенс) немедленно отрезает-
ся специальной пептидазой, осуществляющей
процессинг белка (рис. 21.11). Сворачивание
белков матрикса происходит с помощью су-
першаперонного комплекса БТШ60 и БТШЮ
(см. рис. 21.9 и 21.10). Белки, предназначенные
для наружной митохондриальной мембраны,
могут встраиваться в нее сразу после связы-
вания с рецепторными субъединицами ТОМ-
комплекса.
В большинстве случаев после транспорта
через внешнюю мембрану белки, предназна-
ченные для внутренней митохондриальной
мембраны, встраиваются в нее сразу из меж-
мембранного пространства. Но в некоторых
случаях белки могут содержать сигнальную по-
следовательность, которая вначале направляет
их в пространство матрикса. После удаления
этого пресиквенса пептидазами такие белки
встраиваются со стороны матрикса во внутрен-
нюю мембрану с помощью второго сигнального
пептида.
Транспорт белков в хлоропласты
Большинство хлоропластных белков также ко-
дируется в ядре. Хотя об импорте их в хлоропла-
сты известно гораздо меньше, чем о транспорте
в митохондрии, очевидны и сходства, и разли-
чия этих процессов. Транспорт в хлоропласты
осуществляется пост-трансляционно. Белок-
предшественник, синтезирующийся в цитозоле,
имеет на N-конце направляющую сигнальную
последовательность (сигнальный, или тран-
зиторный пептид), размером в 30—100 амино-
кислот. Как и в митохондриях, он выполняет
свои функции благодаря не столько конкретной
аминокислотной последовательности, сколько
благодаря своей вторичной структуре. Находясь
в цитозоле, белок-предшественник стабилизи-
рован шапероном БТШ70.
Чтобы проникнуть в строму, белок должен
пересечь две мембраны (рис. 21.12). Трансло-
кационный аппарат наружной хлоропластной
мембраны содержит TOC-комплекс (translo-
case of the outer chloroplast membrane). По моле-
кулярным массам белки комплекса обознача-
ют ТОС34, 64, 70, 75 и 160. Взятые вместе, они
составляют 30% от общего количества белков
внешней мембраны хлоропластов. ТОС75, по
всей видимости, образует транслокационную
пору для прохождения развернутой сигнальной
последовательности. ТОС160 действует как ре-
цептор для белка-предшественника. В последу-
ющий транспорт через внутреннюю мембрану
вовлечены как минимум пять белков.
В отличие от транспорта в митохондрии,
транспорт в строму хлоропластов не требует по-
Рис. 21.12. Упрошенная схема импорта белков в хлоропластах (по Soil, 1995).
Белок люмена тилакоидов синтезируется в цитозоле и содержит два сигнальных
пептида на N-конце. Первая последовательность (на рисунке обозначена красным
цветом) связывается с рецептором ТОС160 транслокационного аппарата на внешней
мембране. Транспорт через нее, видимо, регу-лируется с помошью ГТФ. Белок
мембраны ТОС75, по всей вероятности, образует канал для транслокации
полипептида. Пора внутренней мембраны содержит, по меньшей мере, пять белков
с молекулярными массами 20, 22, 40, 55 и ПО кДа. Для взаимодействия с шапероном
БТШ70 необходима АТФ (см. рис. 21.8). Пептидная цепь, попадающая в строму,
связывается с несколькими шаперонами БТШ70, что облегчает прохождение
развёрнутой цепи через пору для транслокации. Отщепляется первая сигнальная
последо-вательность (обозначена красным цветом). Вторая последовательность
(чёрная) служит направляющим сигналом для транспорта через тилакоидную
мембрану. Она удаляется мембран-связанной тилакоидной пептидазой
21.3. Белки, кодируемые в ядре, распределяются по разным компартментам клетки
433
тенциала АТ на мембране. Однако для него ну-
жен достаточно высокий уровень стромальной
АТФ. Транспорт белка регулируется с помощью
связывания ГТФ с ТОС160 и ТОС34, и в этом
состоит существенное отличие транслокацион-
ного аппарата хлоропластов от митохондриаль-
ного. Однако и здесь упорядоченное движение
пептидной цепи через транслокационную пору
осуществляется с помощью шаперонов БТШ70
и гидролиза АТФ, согласно модели «молекуляр-
ного храповика».
После того как пептидная цепь попадает
в строму, сигнальный пептид удаляется стро-
мальной пептидазой. Белок приобретает натив-
ную конформацию, возможно, с помощью су-
першаперонного комплекса БТШ60—БТШ10,
и высвобождается. Таким способом в строму по-
падает малая субъединица RubisCO (раздел 6.2),
и здесь она объединяется с большой субъедини-
цей, кодируемой в хлоропластах, в один фер-
мент.
Белки тилакоидной мембраны вначале до-
ставляются в строму, а затем с помощью внутрен-
них сигнальных последовательностей направля-
ются к месту назначения. Некоторые белки этой
мембраны, например, белки водоокисляющего
комплекса, транспортируются вначале в тилако-
идное пространство. Для этого существуют три
сигнальные системы. Белок-предшественник
пластоцианина (белка тилакоидного простран-
ства — люмена) содержит две сигнальные после-
довательности. Первая из них направляет белок
в строму и отрезается стромальной пептидазой.
Вторая сигнальная последовательность необхо-
дима для транспорта через мембрану тилакоидов
и отрезается тилакоидной мембран-связанной
пептидазой. Транспорт пластоцианина и не-
скольких белков комплекса разложения воды
требует гидролиза АТФ. Поскольку такой тип
транспорта наблюдается у цианобактерий, его
называют прокариотическим путем. Другие бел-
ки водоокисляющего комплекса вначале с помо-
щью градиента pH доставляются в люмен тила-
коидов, а затем уже встраиваются в тилакоидную
мембрану.
Транспорт белков в пероксисомы
Пероксисомы, в отличие от митохондрий и хло-
ропластов, не содержат собственного генома.
Все их белки кодируются в ядре. Вопрос о раз-
множении пероксисом изучен недостаточно.
Показано, что они размножаются делением,
как митохондрии и хлоропласты, и могут на-
Рис. 21.13. Импорт белка
в пероксисомы. Белок синтезируется
в цитозоле. Для того чтобы направиться
в пероксисомы, он должен иметь
сигнальную последовательность PTS1
или PTS2. В цитозоле он связывается
с соответствующими растворимыми
рецепторными белками Рех5 или Рех7.
Рецепторы соединяют его с доковым
комплексом, с помощью которого
белок в свернутом виде проходит через
мембрану пероксисом. После импорта
пептидаза отщепляет сигнальную
последовательность PTS2, тогда как PTS1
сохраняется и остаётся частью зрелого
белка
ПЕРОКСИСОМНЫЙ
МАТРИКС
PTS2
Пептидаза
434
21. Биоситнтез белков
следоваться по материнской линии. В то же вре-
мя наблюдался синтез de novo пероксисомных
мембран, берущих начало от мембран эндоплаз-
матического ретикулума. Существует несколько
сигнальных последовательностей, с помощью
которых белки пероксисом встраиваются в опре-
деленные части мембран эндоплазматического
ретикулума. Потом эти мембраны обособляют-
ся в виде пузырьков-везикул, называемых пре-
пероксисомами. Эти везикулы сливаются с уже
существующими пероксисомами.
Пероксисомам необходимо импортировать
свои белки, которые кодируются в ядре и син-
тезируются в цитозоле (рис. 21.13). Для этого
известны две различные сигнальные последо-
вательности PTS1 и PTS2 (peroxisomal targeting
signals). PTS1 содержит на С-конце консенсус-
ную серин-лизин-лейциновую последователь-
ность (SKL), которая не отрезается при транс-
порте в пероксисомы. PTS2 представляет собой
последовательность из 9 аминокислот рядом
с N-концом белка и удаляется после импорта
белка. Белки, направляемые одним из этих двух
сигналов, взаимодействуют с соответствующи-
ми растворимыми рецепторными белками
Рех5 и Рех7 (peroxisomal biogenesis factor). Ре-
цепторы связывают импортируемые белки с ап-
паратом транслокации (доковый комплекс),
состоящим из нескольких мембранных белков.
Импортируемый белок отсоединяется от рецеп-
тора и с затратой АТФ транспортируется через
мембрану в матрикс пероксисомы. Детали этого
процесса еще не ясны окончательно. Известно,
что в отличие от митохондрий и хлоропластов,
белки транспортируются в пероксисомы в свер-
нутом состоянии. Таким образом, транспорт
белка в пероксисомы значительно отличается от
транспорта в ЭР, митохондрии и пластиды.
21.4. Протеасомная деградация
белков
В эукариотической клетке содержание белков
регулируется не только их синтезом, но и дегра-
дацией. Эукариоты характеризуются наличием
высококонсервативного аппарата для контро-
лируемой деградации белков. Он представляет
собой мультиферментный комплекс, называе-
мый протеасомой. Его выдающаяся роль в жиз-
ни растений подчеркивается тем фактом, что
более 5% всех структурных генов Arabidopsis
принимают участие в процессе деградации бел-
ков. Чтобы гидролизовать белок таким спосо-
бом, его необходимо предварительно пометить
ковалентным присоединением к нему молекул
убиквитина. Убиквитин — это очень высоко-
консервативный белок всех эукариот. Во всех
растениях он имеет идентичную последователь-
ность из 76 аминокислот. На карбоксильном
конце молекулы находится глициновый оста-
ток, при этом терминальная карбоксильная
группа обращена наружу. Белки, предназначен-
ные для деградации, связываются с убиквити-
ном через так называемую изопептидную связь
между вышеупомянутой карбоксильной груп-
пой убиквитина и аминогруппой лизинового
остатка разрушаемого белка.
Присоединение убиквитина требует взаимо-
действия трех различных белков (рис. 21.14л).
Убиквитин-активирующий фермент (El) с зат-
ратой АТФ соединяется убиквитином, об-
разуя тиоэфирную связь с его SH-группами.
Затем убиквитин передается на убиквитин-
конъюгирующий белок (Е2). После этого
целевой белок и убиквитин, связанный с Е2,
взаимодействуют со специфической убиквитин-
протеинлигазой (ЕЗ), и между ними образуется
е-изопептидная связь. При дальнейшем убик-
витинировании новые молекулы убиквитинов
соединяются либо с еще не занятыми лизино-
выми остатками уже присоединенных убикви-
тинов, либо с лизиновыми остатками целевого
белка. Таким образом, белок оказывается по-
мечен либо цепочкой убиквитиновых молекул,
либо несколькими убиквитинами в разных ме-
стах. Анализ генома Arabidopsis показал, что он
содержит 2 гена для El, 24 — для Е2 и 1200 (!)
генов для ЕЗ. Очевидно, что специфичность
деградации белков обеспечивается именно раз-
личными ЕЗ-лигазами1.
Протеолиз помеченного целевого белка про-
исходит в протеасомах. В составе этого муль-
тиферментного комплекса выделяют коровую
протеазную частицу (core protease, СР), со-
стоящую из 14 субъединиц, и две регуляторных
(regulatory particle, RP), каждая из которых со-
стоит из 20 субъединиц. Коровая протеаза име-
1 Рецепторы как минимум трех классов фитогормонов
(ауксинов, гиббереллинов и жасмонатов) являются компо-
нентами ЕЗ-лигаз. — Прим. ред.
ATP ФФ
Ubi —с—о-
/°
> Ubi — с— амф
а
Е1
Рис. 21.14. а. Гидролиз белка с помощью протеасом. Белок, предназначенный
для деградации (целевой белок) помечается через связывание с убиквитином (Ubi).
Убиквитин реагирует с АТФ, образуя ацил-АМФ. Затем он соединяется
с убиквитин-активирующим ферментом Е1 через тиоэфирную связь с цистеиновым
остатком фермента. После этого убиквитин передается на цистеиновый остаток
убиквитин-конъюгирующего фермента (Е2). Специфическая убиквитин-протеин-
лигаза (ЕЗ) опосредует перенос убиквитина на лизиновый остаток целевого белка,
образуется с-изопептидная связь. Процесс повторяется несколько раз. В результате
этого несколько молекул убиквитина последовательно присоединяются или
к лизиновым остаткам уже присоединенного убиквитина, образуя цепочку,
или к свободным лизиновым остаткам целевого белка. Таким образом, целевой
белок оказывается помечен несколькими молекулами убиквитина
б. Схема работы протеасомы. Этот
мультиферментный комплекс состоит из коровой
протеазной частицы (СР, 14 субъединиц) в
форме бочонка, ограниченного с обеих сторон
регуляторными частицами (RP, 20 субъединиц),
подобно крышкам. Помеченный убиквитином
белок связывается с RP. Связь с убиквитином
гидролизуется, молекулы убиквитина
высвобождаются. Целевой белок теряет нативную
конформацию (АТФ-зависимый процесс) и
полипептидная цепь проходит внутрь СР, где
разрезается протеолитическими ферментами
б
Коровая
протеазная
частица
Регуляторная
частица
436
21. Биоситнтез белков
ет форму бочонка, внутри которого находятся
каталитические протеазные сайты. Отверстия
по обеим сторонам бочонка закрыты регулятор-
ными частицами (рис. 21.146). Регуляторная ча-
стица распознает белок, меченый убиквитином,
и катализирует гидролитическое отщепление
убиквитиновой молекулы, которая затем мо-
жет снова использоваться для мечения белков.
Целевой белок связывается с субъединицей RP
и теряет нативную конформацию (этот про-
цесс проходит с участием АТФ). Только после
этого пептидная цепочка может пройти внутрь
«бочонка», где расщепляется внутренними про-
теолитическими субъединицами на пептиды по
7—9 аминокислотных остатков, которые затем
выходят из протеасомы и в дальнейшем разреза-
ются цитозольными пептидазами.
Контролируемый гидролиз белков в про-
теасоме играет определенную роль при передаче
сигналов от фитогормонов, как, например, аук-
сина и гиббереллина. Эти фитогормоны через
цепь передачи сигнала вызывают деградацию
репрессоров транскрипции, и, таким образом,
усиливают экспрессию генов (разделы 19.3 и
19.4). Протеасомы также задействованы при де-
градации активированного фитохрома А (раз-
дел 19.10).
Убиквитин-зависимыйпротеасомныйпуть —
не единственный способ гидролиза клеточных
белков. При старении белки цитоплазмы или
органелл окружаются мембранами и образуют
автофагосомы. Везикулы сливаются друг с дру-
гом, образуя литические вакуоли, в которых
белки подвергаются протеолизу1.
Дополнительная литература
Ban, N., Nissen, Р., Hansen, J., Moore, P. В., Steitz, T. A.
The complete atomic structure of the large ribosomal
subunit at 2.4 A resolution. Science 289, 905—930
(2000).
Fuks, B., Schnell, D. J. Mechanism of protein transport
across the chloroplast envelope. Plant Physiol 114,405—
410(1997).
Cech, T., R. The ribosome is a ribozyme. Science 289,
878-879, (2000).
Glaser, E., Sjoling, S., Tanudji, M., Whelan, J.
Mitochondrial protein import in plants: Signals, sorting,
targeting, processing and regulation. Plant Mol Biol 38,
311-338 (1998).
Gutierrez, R. A., Macintosh, G. C., Green, P. Current
perspectives on mRNA stability in plants: Multiple
levels and mechanisms of control. Trends Plant Sci 4,
429-438(1999).
Johnson, T. L., Olsen, L. J. Building new models for
peroxisome biogenesis. Plant Physiol 127, 731—739
(2001).
Keegstra, K, Cline, K. Protein import and routing systems
of chloroplasts. Plant Cell 11, 557-570 (1999).
Mogk, A., Mayer, M. P., Deuerling, E. Mechanismus
der Proteinfaltung. Molekulare Chaperone und ihr
biotechnologisches Potential. Biologie in unserer Zeit 3,
182-192 (2001).
Mullen, R. T., Flynn, C. R., Trelease, R. N. How are
peroxisomes formed? The role of the endoplasmic
reticulum and peroxins. Trends Plant Sci 23, 68—73
(1998).
Netzer, W. J., Hartl, F. U. Protein folding in the cytosol:
Chaperonindependent and -independent mechanisms.
Trends Plant Sci 6, 256-261 (2001).
Pfanner, N., Douglas, M. G., Endo, T., Hogenraad, N. J.,
Jensen, R. E., Meijer, M., Neupert,W., Schatz, G.,
Schmitz, U. K., Shore, G. C. Uniform nomenclature
for the protein transport machinery of the mitochondrial
membranes. Trends Biochem Sci 21, 51—52 (1996).
Robinson, C., Hynds, P. J., Robinson, D., Mant, A.
Multiple pathways for the targeting of thylakoid proteins
in chloroplasts. Plant Mol Biol 38, 209—221 (1998).
Schatz, G., Dobberstein, B. Common principles of
protein translocation across membranes. Science 271,
1519-1526(1996).
Schleiff, E. Signals and receptors — The translocation
machinery on the mitochondrial surface. J Bioenergetics
and Biomembranes 32, 55—66 (2000).
Vierstra, R. D. The ubiquitin/26S proteasome pathway, the
complex last chapter in in the life of many plant proteins.
Trends Plant Sci 8. 136-142 (2003).
Vothknecht, U. C., Soli, J. Protein import: The hitchhikers
guide into chloroplasts. Biol Chem 381, 887-897
(2000).
Wiedemann, N., Kozjak, V., Chacinska, A., Schoenfisch,
B., Rospert, S., Ryan, M. T., Pfanner, N., Meisinger,
C. Machinery for protein sorting and assembly in the
mitochondrial outer membrane. Nature 424, 565—571
(2003).
1 Этот способ образования литических вакуолей не явля-
ется основным. — Прим. ред.
22
Применение генно-инженерных технологий
в сельском хозяйстве, пищевой промышленности
и индустрии
Исследования последних лет позволили раз-
работать много новых идей о применении
генно-инженерных технологий для практиче-
ских нужд. В 1984 г. группа Марка ван Монтагю
и Джеффа Шелла в Генте и Кёльне, одновре-
менно с группой Роберта Хорча и сотрудни-
ков Monsanto Company в Сент Луисе, Миссури
(США), опубликовали методику переноса чуже-
родной ДНК в геном растений с использовани-
ем Ti-плазмид Agrobacterium tumefaciens (по
новой номенклатуре Rhizobium radiobacter).
Этот метод позволяет изменять белковый со-
став растений определенным образом. Напри-
мер, можно получать растения, устойчивые к
вредителям и гербицидам, качественно и коли-
чественно увеличивать продуктивность сель-
скохозяйственных культур, изменять растения
таким образом, чтобы получать из них каче-
ственное сырье для химической промышлен-
ности.
Вряд ли какое-то другое ботаническое от-
крытие в истории имело столь далеко идущие
следствия за столь короткое время. В 2003 г. 80%
сои, 70% хлопка и 38% кукурузы, выращенные
в Соединенных Штатах, пришлось на генети-
чески модифицированные линии, полученные
с использованием Agrobacterium tumefaciens.
Здесь мы воочию наблюдаем случай, когда ре-
зультаты фундаментальных исследований на до-
вольно экзотическую тему (такую как формиро-
вание корончатых галлов у растений) привели к
методу, совершившему революцию в сельском
хозяйстве.
В этом разделе описано, каким образом с по-
мощью методов генной инженерии можно из-
менить растение. Поскольку конкретных мето-
дик очень много, то здесь будут описаны только
принципы самых распространенных методов,
без деталей и усложнения в целях краткости. Бу-
дут приведены некоторые примеры технологий,
с использованием генетически модифициро-
ванных сельскохозяйственных растений1.
22.1. Выделение гена
Рассмотрим случай получения трансгенно-
го растения А, которое должно синтезировать
чужеродный белок из другого растения Б. Для
этого вначале необходимо из растения Б выде-
лить ген, кодирующий этот белок. Поскольку
растение содержит от 25 до 50 тыс. структурных
генов, то выделение одного гена из этого мно-
жества — довольно трудная задача.
Использование для выделения гена
генетических библиотек
Чтобы выделить нужный ген из множества ге-
нов растительного генома, выгодно сделать его
доступным в виде генных библиотек ДНК. Су-
ществуют два вида таких библиотек.
Чтобы приготовить библиотеку геномной
ДНК, весь геном организма разрезают рестрик-
ционными эндонуклеазами (раздел 20.3) на
фрагменты от 15 до нескольких сотен тыс. п.о.
В результате образуется множество фрагментов
ДНК, которые зачастую содержат только части
генов. Эти фрагменты вставляют в вектор (плаз-
миду или бактериофаг) и затем каждый фраг-
1 Утверждения автора о революции в сельском хозяйстве
слишком категоричны. Активно дискутируется вопрос о
безопасности генно-модифицированных растений, осо-
бенно предназначенных для употребления в пищу. — Прим,
ред.
438 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
Смесь РНК, выделенная из тканей
тРНК, рРНК, мРНК-АААА
и удаление мРНК-АААА
с током растворителя Т Т Т Т
Выход
Буфер
мРНК -АААА
(Полиаденилированная мРНК)
Рис- 22-1 - Выделение мРНК из смеси РНК
методом хроматографии на колонке с поли-дТ
последовательностями, пришитыми к частицам
наполнителя
мент размножается клонированием, например,
в бактериях.
Чтобы приготовить библиотеку кДНК, вна-
чале выделяют молекулы мРНК, присутствую-
щие в особых тканях, которые затем с помощью
обратной транскриптазы транскрибируют в
соответствующую кДНК (раздел 20.5). мРНК
выделяют из таких тканий, где соответствующий
ген активно экспрессируется. кДНК вставляют
в вектор и размножают с помощью клонирова-
ния. Поскольку кДНК не имеет промоторных
участков, то в этом случае кДНК нужно соеди-
нить с каким-либо прокариотическим промото-
ром. В отличие от фрагментов геномных библи-
отек, кДНК содержит целые гены без интронов
и, таким образом, после трансформации может
экспрессироваться под соответствующим про-
кариотическим промотором в бактериях, что
позволяет синтезировать белок.
Чтобы приготовить кДНК, скажем, из ткани
листа, необходимо из нее выделить всю РНК, в
которой мРНК составляет лишь около 2%. Чтобы
выделить мРНК из смеси других РНК, используют
такое важное свойство эукариотической мРНК,
как «полиаденилатный хвост» на З'-конце (см.
рис. 20.8). Это позволяет выделить мРНК с по-
мощью аффинной хроматографии. Наполнитель
колонки состоит из твердых частиц целлюлозы
или других веществ, к которым ковалентно при-
соединяют полидезокситимидиновые олигону-
клеотиды (поли-дТ). Когда смесь РНК, выделен-
ную из листьев, наносят на колонку, то молекулы
мРНК связываются с колонкой, гибридизуя свой
«полиаденилатный хвост» с полидезокситими-
диновыми фрагментами, иммобилизованными
на колонке. Остальные РНК не задерживаются и
выходят из колонки в процессе элюции (рис. 22.1).
Связанная РНК может элюироваться с колонки
только при помощи специального буфера.
мРНК 5’ [
Полидезокси-
тимидиновый
(поли-дТ)
праймер
Обратная
транскриптаза
мРНК
кДНК
Частичное удаление мРНК
РНКазой-Н
кДНК
ДНК-полимераза I
ДНК-лигаза Е. СоН
Двойная
нить кДНК
Рис. 22.2. Обратная транскрипция мРНК
в двунитевую кДНК
22.1. Выделение гена
439
Для синтеза с помощью обратной транскрип-
тазы нити кДНК, комплементарной мРНК, в
качестве праймера используется полидезокси-
тимидиновый олигонуклеотид (рис. 22.2). Затем
мРНК гидролизуется рибонуклеазой, полностью
или, как показано на рисунке, лишь частично.
Преимуществом второго способа является то,
что фрагменты мРНК могут послужить затрав-
кой для синтеза второй нити кДНК с помощью
ДНК-полимеразы. ДНК-полимераза I успеш-
но заменяет эти фрагменты мРНК на ДНК-
фрагменты, а ДНК-лигаза связывает их друг с
другом. При этом на конце второй нити кДНК
остается небольшой участок РНК, который не
может быть заменен. Но это не так важно, пото-
му что большинство мРНК на 5’-конце содержат
некодирующие участки (см. рис. 20.8).
Двунитевые молекулы кДНК, полученные из
молекул мРНК, размножаются путем клониро-
вания. В качестве векторов для клонирования
могут быть использованы плазмиды или бак-
териофаги. В настоящее время существует мно-
жество коммерчески доступных искусственных
фагов и плазмид, которые могут использоваться
для самых разнообразных целей. Разработаны
векторы, которые могут только амплифициро-
вать ДНК, и экспрессионные векторы, которые
обеспечивают еще и синтез белков с клониро-
ванных генов.
Хранение генных библиотек в фагах
На рисунке 22.3 показана вставка кДНК в ДНК
фага X. В этом примере ДНК фага имеет сайт
расщепления рестрикционной эндонуклеазой
EcoRI (раздел 20.3). Чтобы защитить сайты ре-
стрикции EcoRI в двунитевой кДНК, ее вначале
метилируют EcoRI-метилазой по этим сайтам
рестрикции. Затем, чтобы связать химически
синтезированный двунитевой олигонуклеотид
вставки с разрезанными сайтами рестрикции
кДНК
3’
5'
СН
Метилаза EcoRI
Линкер
СН3
ДНК-лигаза фага T4
EcoRI
GAATTCj
CTTAAGi
EcoRI t
линкер
ДНК фага X
(инсерционный вектор)
GAATTC
CTTAAG
GAATTC
CTTAAG
EcoRI
ДНК-лигаза фага Т4
Липкий
конец
GJ
СТТАА
Рис. 22.3. Встраивание кДНК в инсерционный вектор фага X
440 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
(в данном случае, полученными при помощи
EcoRI), используется ДНК-лигаза. Она при-
шивает олигонуклеотиды (линкеры) к обоим
концам двунитевой кДНК. Эндонуклеаза ре-
стрикции EcoRI также легко расщепляет этот
линкер, как расщепляет ДНК фага X. В резуль-
тате образуются липкие концы, по которым
можно соединить комплементарные пары осно-
ваний кДНК и фаговой ДНК. Нить ДНК сши-
вается ДНК-лигазой. кДНК теперь встроена в
вектор.
Фаговая ДНК вместе со вставкой кДНК упа-
ковывается in vitro в белки фаговой оболочки
(рис. 22.4). Для этого используют экстракт с эти-
ми белками, полученный из бактерий, заражен-
ных фагами. Таким образом, можно получить
библиотеку генов. В ней каждая кДНК, полу-
ченная из множества различных мРНК тканей
листа, упакована в фаговую частицу. После того,
как этим фагом будет заражена бактерия, любую
кДНК можно размножить по желанию экспери-
ментатора.
Бактерии заражают фагами и высевают на
агаризованные питательные среды на чашки
Петри. Сначала бактерии, растущие на агаре,
образуют сплошной газон. Но затем часть из
них начинает лизироваться размножающимися
фагами. На месте лизированных колоний появ-
ляются прозрачные пятна — бляшки. Они со-
держат новые фаговые частицы, которые можно
размножить далее. Полученные таким способом
библиотеки кДНК обычно занимают 10—20 ча-
шек. В идеале каждая из этих бляшек содержит
только один клон. Клон может быть выделен с
применением специфических проб, как описа-
но далее.
Хранение геномных библиотек в плазмидах
Для того чтобы получить библиотеку генов
в плазмидах, кДНК встраивают в плазмиду по
сайтам рестрикции примерно тем же спосо-
бом, что и в ДНК фага (рис. 22.5). Затем плаз-
мидой трансформируют клетки Е. coli. Транс-
формация происходит при обработке клеток
раствором СаС12, который делает мембрану
более проницаемой для плазмид. Затем клетки
смешивают с плазмидной ДНК и подвергают
короткому тепловому шоку. Чтобы выделить
трансформированные клетки из множества
^трансформированных, плазмиду снабжают
специальным генетическим маркером. Плаз-
мид ный вектор содержит ген устойчивости к
антибиотикам, который обеспечивает выжи-
вание бактерии на определенном антибиотике,
таком как ампициллин или тетрациклин. Если
соответствующий антибиотик добавить в пита-
тельную среду, то выживут и будут образовы-
вать колонии только клетки, содержащие плаз-
миды, а все остальные погибнут. При посеве на
агар развиваются колонии, которые видны не-
вооруженным глазом.
Чтобы можно было проверить, действи-
тельно ли плазмида несет вставку нужной
ДНК, плазмидный вектор конструируют так,
чтобы сайт рестрикции для вставки чужерод-
Упаковка
в фаги in vitro
Рекомбинантная
ДНК фага
Заражение
бактерии Е. coii
Бактериальный
газон
Фаговые бляшки
Рис. 22.4. Рекомбинантная ДНК фага, упакованная в вирусную частицу. Клетки
Е. coli заражают этими фагами и высевают на чашки с агаром. Клетки заражённых
колоний лизируются, что можно наблюдать в виде пятен (бляшек) на сплошном
бактериальном газоне
22.1. Выделение гена
441
Вставка ДНК
Плазмида
Т рансформация
Ген устойчивости
к антибиотику
Колонии, каждая из которых
представляет собой клон
Высевание на агар
с антибиотиком
Рост в присутствии антибиотиков
(вырастают только колонии
трансформированных бактерий)
Рис. 22.5. кДНК размножают в Е. coli с помощью плазмидного вектора.
Ген устойчивости к антибиотику позволяет провести селекцию
трансформированных клеток
Рис. 22.6. Чтобы проверить, содержит ли
плазмида бактериальной колонии вставку
ДНК, сайт рестрикции встраивают в ген
Р-галактозидазы плазмидного вектора.
Колонии с интактным геном (не несущим
вставки) гидролизуют бесцветный субстрат
X-Gal (5-бромо-4-хлоро-3-индолил-р-
галактопиранозид). Субстрат разлагается
Р-галактозидазой на галактозу и индоксильное
производное, которое и окисляется в
окрашенный димер. Ко-лонии приобретают
ярко-синий цвет. В том случае, если работа
гена нарушена вставкой ДНК, продукт гена
отсутствует и соответствующие колонии
остаются неокрашенными. X обозначает 5-бром-
4-хлор-З-индол
б Вставка чужеродной ДНК
в ген р-галактозидазы
нарушает его работу
а Ген р-галактозидазы
с сайтом рестрикции
XGal----------► X + Gal
Синие колонии
Бесцветные колонии
ной ДНК находился внутри гена, кодирующе-
го фермент р-галактозидазу (рис. 22.6). Этот
фермент гидролизует бесцветный субстрат
X-Gal, при этом образуется нерастворимый
продукт синего цвета. При добавлении X-Gal
в питательную среду все колонии, не содержа-
щие вставки ДНК (и сохранившие нетронутым
ген р-галактозидазы) приобретут синий цвет.
Если же участок ДНК встроился в соответ-
ствующий сайт рестрикции в гене, то функция
р-галактозидазы будет нарушена. Ген больше
не сможет кодировать полноценный фермент.
Поэтому соответствующие колонии не будут
окрашены в синий цвет, а останутся белыми
(сине-белая селекция).
Поиск нужного гена в генной библиотеке
Для поиска желаемого гена (скрининга) в би-
блиотеке из бактериальных колоний или фа-
говых бляшек используются специфические
пробы. На агаризованную среду с колониями
помещают нейлоновую или нитроцеллюлозную
мембрану и делают отпечаток (рис. 22.7). На
мембране остаются несколько фагов или бакте-
рий. Затем можно использовать два типа проб.
1. Специфические антитела к белку, который
является продуктом нужного гена (Вестерн-
блот анализ).
2. Меченые специфические пробы ДНК
к кДНК искомого гена (Саузерн-блот гибри-
дизация).
442 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
Выделение и
размножение
Отпечаток на нейлоновой
мембране
а. Радиоактивная проба ДНК
или
б. 1. Специфические антитела.
2. Меченые вторичные антитела
Снимок на рентгеновской плёнке
Рис. 22.7. Для скрининга библиотеки генов
получают отпечаток колоний, выросших на
агаризованной среде, на нейлоновой или
нитроцеллюлозной мембране. Нужная ДНК
определяется с помощью меченых проб
(а — проба ДНК, б — проба антител). Меченая
ДНК или соответствующий генный продукт
виден либо как тёмное пятно на рентгеновской
пленке, либо как люминесцирующее пятно.
Затем сравнивают положение пятен на
отпечатке и чашке. Соответствующий клон
можно пересадить на свежую среду для
дальнейшего размножения
Идентификация клона с помощью антител
к нужному белку
Для определения гена с помощью Вестерн-
блота необходимы антитела к определенному
белку. Этот метод требует достаточных коли-
честв соответствующего белка. Поликлональ-
ные антитела к белку получают с помощью
иммунизации животных. Для этого белок дол-
жен быть предварительно выделен и очищен.
Если для идентификации продукта гена ис-
пользуются антитела, то для получения библио-
теки кДНК нужно встраивать в специальный
экспрессионный вектор, т.е. вектор должен
обеспечивать последующую транскрипцию
встроенной молекулы ДНК. Для этого в векто-
ре должны быть промоторная последователь-
ность, контролирующая инициацию и транс-
крипцию гена, а также последовательность для
терминации транскрипции (сайт терминации
транскрипции используют часто, но не всегда).
Полученная мРНК затем должна транслиро-
ваться в соответствующий белок, который будет
распознаваться антителами. Эти белки нараба-
тываются в бактерии.
Бактерии, связанные с мембраной, разру-
шают. Высвободившиеся бактериальные белки
фиксируют на мембране. Когда в качестве век-
торов используют фаги, то дополнительное раз-
рушение клеток не требуется, поскольку фаги
сами лизируют их. Но и в этом случае белки не-
обходимо фиксировать. Затем добавляют анти-
тела, которые специфически связываются с ис-
комым белком. После этого антитела отмывают
со всех остальных частей мебраны. Чтобы уви-
деть связанные антитела, используют вторичные
антитела, распознающие первичные (рис. 22.8).
Раньше их предварительно метили радиоактив-
ным йодом-125. Сейчас чаще используются лю-
Белок
Люминесценция
Специфичное
антитело
Вторичное антитело,
меченое
пероксидазой
пероксидаза
+ Люминол
+ Н2О2
Мембрана
Рис. 22.8. Антитело связывается с иммобилизованным белком. Затем оно
распознаётся вторичным антителом, с которым ковалентно связана пероксидаза.
Пероксидаза катализирует окисление люминола перекисью водорода. Это вызывает
люминесценцию, которую можно увидеть, снимая ее на рентгеновскую пленку
22.1. Выделение гена
443
минесцентные ECL-технологии (enchaced lu-
minescence). Для этого с вторичным антителом
ковалентно связывают пероксидазу из хрена.
Она катализирует окисление добавляемого лю-
минола (гидразид 3-аминофталевой кислоты)
перекисью водорода, что сопровождается голу-
бым люминесцентным свечением. Используя
усилитель люминесценции, можно повысить
интенсивность свечения в 1000 раз. После ин-
кубации со вторичными антителами мембрану
снова отмывают. К ней добавляют перекись во-
дорода, люминол и усилитель люминесценции.
Затем ее плотно прикладывают к рентгеновской
пленке (1 час экспозиции). Положительные сиг-
налы видны как темные пятна на авторадио-
грамме (см. рис. 22.7). Сравнивают положение
пятна на мембране и клонов на чашке, и выби-
рают нужный клон. Однако, определенная по-
сле первого просмотра колония из-за большой
плотности бактерий может содержать несколько
клонов. Поэтому колонии, при помощи сте-
рильной зубочистки вновь высевают на агари-
зированную среду (повторное клонирование).
Всю процедуру повторяют заново (рескрининг)
и выделяют единичные чистые клоны. Положи-
тельные фаговые бляшки для получения чистых
клонов повторно выращивают на бактериаль-
ном газоне.
Идентификация клона с помощью проб ДНК
В этом случае фаги и бактерии на мембра-
не блота вначале лизируют, удаляя при этом
белки. Остающуюся ДНК фиксируют и под-
вергают денатурации. При этом ДНК раз-
деляется на одинарные нити, которые проч-
но связаны с мембраной. В качестве проб
используются комплементарные последователь-
ности ДНК, которые метят радиоактивными
32Р-дезоксинуклеотидами. Пробы гибридизуют
с нужной кДНК на мембране блота1. Иденти-
фикацию положительных сигналов и дальней-
ший отбор клонов осуществляют с помощью
радиоавтографии, так же, как это было описано
в предыдущем разделе.
В качестве проб ДНК также используют хи-
мически синтезированные олигонуклеотиды
(около 20 п.о.). Их метят 32Р-фосфатом на 5’-кон-
1 Здесь необходима отмывка от ДН К-зонда, не связавшего-
ся с ДНК на блоте. — Прим. ред.
Трп Лиз Ала Мет Асн Иле
UGG.AAA.GCU.AUG.AAU.AUU
G С ОС
А А
G
Рис. 22.9. Смесь олигонуклеотидов содержит все
теоретически возможные последовательности
для кодирования каждой аминокислоты
це. Такие пробы применяют в тех случаях, когда
доступны только очень небольшие количества
очищенного белка, и невозможно получить анти-
тела к нему. Однако, даже имея очень небольшие
количества белка, с помощью микросеквени-
рования можно определить часть N-концевой
аминокислотной последовательности белка.
Определив ее и используя правила генетическо-
го кода, можно предположить какая последова-
тельность ДНК кодирует исходный белок. После
этого можно химически синтезировать олиго-
нуклеотидную пробу. Однако генетический код
вырожден, и аминокислоты могут кодировать-
ся не одним триплетом нуклеотидов (рис. 22.9).
Это необходимо учитывать, рассчитывая состав
олигонуклеотидов. Например, третье основание
триплета, кодирующего лизин, может быть А или
G. В этом случае для пришивания третьего осно-
вания этого триплета к олигомеру в синтезатор
добавляется смесь обоих нуклеотидов. Чтобы
ввести третье основание аланинового трипле-
та, добавляют смесь всех четырех нуклеотидов.
Таким образом из-за вырожденности генетиче-
ского кода приходится получать смесь олигону-
клеотидов, которая изображена на рисунке 22.9,
и состоит, таким образом, из 48 различных оли-
гонуклеотидов, только один из которых содержит
правильную последовательность искомого гена.
Иногда белок, который кодируется желаемым
геном, вообще невозможно очистить и выде-
лить. Тогда для получения пробы иногда исполь-
зуют соответствующие участки генов из других
родственных организмов. В ферментах и дру-
гих белках (например, в белках-транспортерах)
часто оказываются консервативными домены
со специфическими аминокислотными после-
довательностями. Сходство наблюдается даже
у дальнородственных растений. Такие домены
кодируются соответственно сходными (гомоло-
гичными) последовательностями генов.
После того как успешно выделена кДНК,
следующим шагом обычно является определе-
444 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
ние последовательности ее оснований. Это де-
лают с помощью автоматических секвенаторов
(здесь не описывается).
Выделение генов,
кодирующих неизвестные белки
В некоторых случаях можно выделить кДНК
неизвестного белка, опираясь на его функцию.
Библиотека кДНК из листьев
в клетках дрожжей (Saccharomyces)
Выделение
плазмидной ДНК
Отсутствие роста
рансформация
клеток дрожжей
(мутантов,
неспособных
’' к транспорту
сахарозы)
Культиви-
рование
на среде
с сахарозой
Переносчик
Сахароза
сахарозы
Выделение клона
Размножение
Выделение
плазмидной ДНК
Вырезание
эндонуклеазами
рестрикции
Ген переносчика сахарозы
из клеток листа
Рис. 22.10. Идентификация гена растений
с помощью мутанта дрожжей, неспособного
поглощать сахарозу
Один из методов идентификации генов таких
белков — восстановление фенотипа бактери-
альных или дрожжевых мутантов с поврежде-
нием какой-либо функции (так называемые
дефицитные мутанты, deficiency nutants) при
трансформации плазмидами из библиотек кДНК
(рис. 22.10). Обычно в качестве векторов кло-
нирования для экспрессии кодируемого белка
используют плазмиды, которые могут быть раз-
множены как в Е. со1ц так и в дрожжах. Таким
способом были идентифицированы некоторые
гены переносчиков, например, переносчик са-
харозы, работающий при загрузке флоэмы (раз-
дел 13.1). Чтобы идентифицировать ген перенос-
чика сахарозы, использовали дрожжевой мутант.
Этот мутант не мог поглощать сахарозу из пи-
тательной среды и использовать ее в качестве
источника питания. Он был трансформирован
плазмидой из библиотеки растительных кДНК.
Плазмида содержала промотор, позволявший
экспрессировать плазмидную ДНК в клетках
дрожжей. После помещения трансформирован-
ных клеток дрожжей на среду с сахарозой в ка-
честве единственного источника углеводов, был
обнаружен клон, способный расти на такой сре-
де. Трансформация плазмидой, содержащей со-
ответствующий ген, из библиотек растительных
кДНК привела к появлению клеток дрожжей,
которые продуцируют растительный переносчик
сахарозы и встраивают его в собственную кле-
точную мембрану. После этого отобранный клон
был размножен, из него выделена и секвениро-
вана плазмидная кДНК. По последовательности
кДНК удалось установить аминокислотную по-
следовательность переносчика сахарозы, до того
неизвестного.
Идентификация генов с помощью
транспозонов или Т-ДНК
Другой возможностью, не связанной с функци-
ей белковых продуктов гена, является использо-
вание транспозонов. Транспозоны представля-
ют собой последовательности ДНК, способные
«прыгать» по геному растения, что иногда приво-
дит к потере функции генов (раздел 20.4). К при-
меру, такой функцией может быть способность
синтезировать окрашенный пигмент в лепестках
цветков. Для идентификации в этом случае ис-
пользуют пробу с известной последовательностью
ДНК транспозона. Проводят гибридизацию ДНК
22.2. Агробактериальная трансформация растительных клеток
445
с участком генома, в который встроился транс-
позон. Ген (в нашем случае ген синтеза пигмента
цветков) можно выявить, используя вышеописан-
ные процедуры клонирования и скрининга. За-
тем с помощью анализа последовательности ДНК
определяют аминокислотную последовательность
соответствующего фермента. Поиск генов с по-
мощью вставки транспозона в англоязычной ли-
тературе называется gene tagging.
Альтернативным методом, который заме-
нил транспозонные методики, является встав-
ка Т-ДНК, описываемая в следующем разделе.
Вставка Т-ДНК в геном приводит к появлению
случайных мутаций (Т-ДНК-инсерционные му-
танты). С помощью комплиментарной пробы
определяют локус, в который встроилась Т-ДНК,
затем с помощью секвенирования — последова-
тельность этого локуса. После этого определяется
полная последовательность мутированного гена,
обычно при сравнении соответствующего участка
гена с базами данных известных последователь-
ностей Т-ДНК-инсерционных мутантов. Так,
например, фирма Syngenta предоставляет банк
данных с последовательностями около 100000.
Т-Д Н К-инсерционных мутантов Arabidopsis.
22.2. Агробактериальная
трансформация растительных
клеток
Грам-положительная почвенная бактерия Agro-
bacterium tumefaciens (по новой номенклатуре
Rhizobium radiobacter) у многих растений вы-
зывает рост опухолей в поврежденных местах,
чаше всего на стебле. Это приводит к форми-
рованию так называемых корончатых галлов.
Из опухолевой ткани таких галлов можно полу-
чить культуру клеток, которая будет расти, даже
если в среду не добавлены фитогормоны. Как
описано в разделах 19.3 и 19.5 зрелые диффе-
ренцированные клетки растений, в нормальном
состоянии уже не способные делиться, можно
вернуть к состоянию неограниченного роста.
Для этого в среду культивирования добавляют
фитогормоны ауксины и цитокинины. Зара-
женное растение вырабатывает ауксины и ци-
токинины в высоких концентрациях, что при-
водит к пролиферации растительных тканей
и росту опухоли. Поскольку способность к син-
тезу повышенных количеств фитогормонов
передается по наследству клеткам-потомкам
в результате клеточных делений, то каллусная
культура корончатых галлов может расти без до-
полнительного добавления фитогормонов.
Клетки корончатых галлов приобретают и
другую способность. Они могут синтезировать
вещества, которые называются опинами. Опи-
ны образуются при конденсации аминокислот
и а-кетокислот или аминокислот и сахаров.
Опины образуются в больших количествах и
экскретируются из клеток опухоли. На рисун-
ке 22.11 в качестве примеров опинов приведе-
ны октопин, лизопин, нопалин и агропин.
Каждый агробактериальный штамм синтези-
а
соо®
।
с=о
I
сн3
соо®
H3N- С-Н
сн2
сн2
сн2
nh2
h2n^ ^nh2
НАДФН
+ Н® НАДФ®
Н2О
соо° соо®
I ф I
н-с—N-C-H
I Н2 I
сн3 сн2
сн2
I
сн2
nh2
h2n^ nh2
Пируват + Аргинин
Октопин
О=С^ ^СН2
I | Глутамат
N----ОН
/ \
Н2С\ /С=О
НС----О
I
нс-он
I Гексоза
НС-ОН
I
нс-он
I
н2с- он
Аналогично: Пируват + Лизин
а-Кетоглутарат + Аргинин
Лизопин
Нопалин
Агропин
Рис. 22.11. Опины образуются из аминокислот и кетокислот (а) или аминокислот
и гексоз (б).
446 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
рует только один опин. Синтез первых трех из
упомянутых опинов происходит с образовани-
ем Шиффова основания с последующим вос-
становлением при помощи НАДФН. Опины
настолько стабильны, что не могут перераба-
тываться большинством почвенных бактерий1.
На использовании опинов специализируются
только штаммы Agrobacterium tumefaciens. При
этом конкретный опин может быть использо-
ван только одним штаммом — тем, который и
вызвал его синтез. Растение, таким образом,
оказывается способным синтезировать источ-
ник питания только для одного конкретного
штамма агробактерий.
Превращение дифференцированных рас-
тительных клеток в опин-продуцирующую
опухоль не требует прямого внедрения агро-
бактерий в клетку. Перепрограммирование
метаболизма клетки растения происходит бла-
годаря переносу функциональных генов из
бактерии в геном хозяина. В ходе эволюции
агробактерии приобрели способность транс-
формировать клетки растений для того, чтобы
использовать их как фабрику по производству
собственного питания. Джефф Шелл назвал
такой способ паразитизма «генетической коло-
низацией».
Генетическая информация Ti-плазмиды
Фитопатогенная функция A. tumefaciens обе-
спечивается Ti-плазмидой (tumor-inducing),
размером примерно в 200 тыс. п.о. (рис. 22.12).
Агробактериальные штаммы без этой плазмиды
не способны вызывать формирование коронча-
тых галлов у растений.
Растения заражаются бактериями в местах
поранения, что чаще всего бывает в основании
стебля. При поранении растений начинает выде-
лять в среду фенольные вещества для защиты от
патогенов (глава 18). Эти фенолы являются для
агробактерий сигналом для начала атаки. Фено-
лы стимулируют экспрессию примерно 11 генов
вирулентности (у/г-генов) Ti-плазмиды. Эти
гены кодируют вирулентные белки, которые
переносят гены, индуцирующие опухоль, из
бактерий в растение-хозяина. В плазмиде есть
участок из 12—25 тыс. п.о., называемый Т-ДНК
1 Дело не в стабильности, а в отсутствии соответствующих
ферментов катаболизма опинов. — Прим. ред.
Рис. 22.12. Схема строения Ti-плазмиды (не
в масштабе). Т-ДНК, которая переносится в геном
растения, составляет от 7 до 13% Ti-плазмиды.
Она вырезается полевой и правой граничным
последовательностям. Т-ДНК содержит гены,
которые кодируют ферменты для синтеза
фитогормонов: цитокининов и ауксинов, а также
специфических опинов. Т-ДНК транскрибируется
и транслируется только в растительной клетке.
Остальная часть плазмиды транскрибируется
и транслируется в бактерии. В ней находятся
несколько специальных vzr-генов, а также один или
несколько генов катаболизма опинов. Участок ori
представляет собой начальную точку для репликации
(по Glick и Pasternak)
(Т — transfer). Из него vir-нуклеазой2 вырезается
однонитевая ДНК. Сайт вырезания определяет-
ся граничными последовательностями3 на обо-
их концах Т-ДНК.
Перенос однонитевой Т-ДНК из бактерии
в ядро растительной клетки (рис. 22.13) проис-
ходит подобно конъюгации (форма полового
процесса у бактерий). Чтобы соединить бак-
терию с клеткой растений, Vir-белки образуют
нитевидный вырост — пилю, через который пе-
2 Двухкомпонентный комплекс из белков Vir-Dl и Vir-D2.
После разрезания на 5'-конце однонитевой ДНК остается
белок Vir-D2, связанный с нею ковалентно. — Прим. ред.
3 Прямые повторы около 25 п.о. — Прим. ред.
22.3. Ti-плазмида как трансформационный вектор
447
Агробактерия
Растительная клетка в месте повреждения
Фенолы,
Ядерная пора
выделяющиеся
в ответ на повреждение Д|ЭО
Рис. 22.13. Агробактерия трансформирует растительные клетки, заставляя их
синтезировать опины для собственного питания. Экзаметаболиты повреждённых
клеток растения вызывают экспрессию вирулентных генов на Ti-плазмиде
агробактерии. Это приводит к синтезу вирулентных белков. Vir-белки вырезают
из плазмиды однонитевой сегмент, известный как Т-ДНК, переносят его в
растительную клетку и встраивают в ядерный геном
Vir-белки
редается Т-ДНК. Попав в растительную клетку
Т-ДНК мигрирует в ядро. Vir-белки защищают
Т-ДНК от растительных ферментов деградации
ДНК и облегчают транспорт в ядро через ядер-
ную пору. Важную роль при встраивании играет
правый 5’ граничный участок. Т-ДНК встраива-
ется в хромосому случайным образом. Встроив-
шись в какой-либо ген, Т-ДНК может нарушить
функции этого гена (инсерционный мутагенез).
Это может быть использовано для идентифика-
ции гена, по аналогии с транспозонным мето-
дом (раздел 22.1).
Т-ДНК, встроившаяся в ядерный геном, не-
сет тесно сцепленные гены с эукариотически-
ми характеристиками и наследуется по законам
Менделя. Она реплицируется в клетках рас-
тений так же, как и их собственная ДНК. По-
скольку она содержит эукариотические промо-
торы, то она может транскрибироваться. мРНК
соответствует эукариотической мРНК и может
транслироваться. Один из генов Т-ДНК коди-
рует цитокинин-синтазу (изопентенилтранс-
феразу), ключевой фермент синтеза цитокини-
на — зеатина. Также в Т-ДНК закодированы два
фермента синтеза ауксина — индолилуксус-
ной кислоты (ИУК) из триптофана. Индуциро-
ванный бактериями путь синтеза ИУК отлича-
ется от растительного (см. рис. 19.7), но детали
мы здесь рассматривать не будем. Кроме того,
Т-ДНК кодирует один или два фермента (для
448 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
каждого штамма свои) для синтеза определен-
ных опинов. Таким образом, Т-ДНК, встраи-
вающаяся в растительный геном, несет генети-
ческую информацию для синтеза цитокининов
и ауксинов, чтобы вызвать развитие опухоли, и
информацию для синтеза опинов.
Ферменты, нужные для катаболизма соот-
ветствующего опина, закодированы в той части
Ti-плазмиды, которая остается в бактерии. Они
синтезируются когда бактерия поселяется в об-
разовавшейся опухоли.
22.3. Ti-плазмида как
трансформационный вектор
Благодаря своей способности к трансформа-
ции растений A. tumefaciens является пре-
красным инструментом для встраивания в рас-
тительный геном чужеродных генов. Однако
перед тем, как использовать Ti-плазмиду в ка-
честве вектора, необходимо ее предварительно
модифицировать. Для начала нужно удалить
гены синтеза ауксинов и цитокининов, чтобы
не вызвать рост опухоли. Также удаляют гены
синтеза опинов, поскольку растению они не
нужны, и могут повредить его метаболизму.
Т-ДНК определяется только своими граничны-
ми последовательностями, а не генами, входя-
щими в ее состав. Чтобы вставить чужеродный
ген между граничными последовательностями
в Т-ДНК для удобства работы встраивают та-
кую последовательность, которая содержала
бы несколько сайтов для работы эндонуклеаз
рестрикции (полилинкерная последователь-
ность или сайт множественного клонирова-
ния). Теперь Ti-плазмиду можно разрезать в
точно известном участке Т-ДНК конкретными
рестриктазами. В сайт рестрикции вставляется
чужеродная ДНК, вырезанная теми же самы-
ми рестриктазами (см. рис. 22.3). Поскольку
полилинкерная последовательность содержит
сайты для нескольких рестриктаз, то в Т-ДНК
можно вставить несколько фрагментов ДНК.
На рисунке 22.14 промотор, вызывающий экс-
прессию встроенной ДНК в хозяйской клетке,
находится слева от сайта рестрикции.
Конструкция
Е coli-
ori
Сайт рестрикции Селективный маркер для
трансформации растений.
Например, ген устойчивости к канамицину
(с растительным промотором)
Последовательность
промотора
Точка начала A.tumefaciens-ori
репликации (ori)
Исходный вектор
Селективный маркер
для трансформации Е. coli
и A. tumefaciens.
Например, ген устойчивости
к ампицилину
Вектор, несущий генно-инженерную
конструкцию Т-ДНК
(с бактериальным промотором)
Рис. 22.14. Бинарный вектор клонирования Т-ДНК, сконструированный
для трансформации растительных клеток (хелперная плазмида не показана)
22.3. Ti-плазмида как трансформационный вектор
449
Т-ДНК
со встроеннымии генами
Геном
| Трансформация
Рис. 22.15. Трансформация растительной клетки с помощью бинарной системы
клонирования. После бактериальной трансформации Т-ДНК-вектор, содержащий
встроенную чужеродную ДНК, размножается в Е. coli, далее его выделяют
и переносят в агробактерию. Плазмида-помощник, которая уже присутствует
в агробактерии, кодируют Vir-белки, необходимые для трансформации
растительных клеток
450 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
В современных системах для трансформации
векторы, полученные на основе Ti-плазмид, не
содержат никаких vzr-генов и не могут сами по
себе трансформировать растения1.
Для трансформации необходима вторая
плазмида-помощник (helper plasmid). Эта
плазмида содержит vzr-гены, но не содержит
Т-ДНК и также не способна сама по себе транс-
формировать растительную клетку. Поскольку
для полноценной трансформации необходимы
оба вектора, то используемую методику назвали
бинарной системой. Сейчас уже создано мно-
жество таких векторов для разнообразных спе-
циальных целей, которые находятся в коммер-
ческом доступе.
Чтобы трансформировать растение, необхо-
димо наличие достаточного количества векторов,
содержащих нужный ген. Поэтому вначале вектор
аплифицируют, клонируя их в Е. coli (рис. 22.15).
Поскольку Е. coli не может распознавать точ-
ку начала репликации обычной Ti-плазмиды
(A. tumefaciens-ori), то в нее встраивают вторую
точку начала репликации (Е. coli-ori).
Плазмиду также снабжают селективным мар-
кером, чтобы выделить только те клетки Е. coli,
которые трансформированы Ti-плазмидой. Для
этого часто используется ген неомицинфосфо-
трансферазы. Этот фермент разлагает антибио-
тик канамицин, делая клетки устойчивыми к
нему. Канамицин очень редко используется в
медицине, что является важным аспектом его
применения по отношению к трансгенным рас-
тениями, содержащим ген устойчивости1 2. Ген
устойчивости к канамицину находится под бак-
териальным промотором3. После трансформа-
ции вектора он может экспрессироваться в клет-
1 Плазмиды, содержащие vir-область, слишком велики и
неудобны для препаративной работы с ДНК. — Прим. ред.
2 В сельском хозяйстве есть законодательные ограничения
применения антибиотиков, используемых в медицине. —
Прим. ред.
3 На самом деле ген неомицинфосфотрансферазы нахо-
дится под двумя промоторами: эукариотическим и прока-
риотическим, что позволяет использовать канамицин для
селекции как бактерий, так и трансформированных расти-
тельных клеток. Более специализированным генетическим
маркером служит устойчивость к ампициллину и другим
антибиотикам пенициллинового ряда (ген р-лактамазы),
которую широко используют в векторах под прокариотиче-
скими промоторами. Плазмида-помошник также несет мар-
кер — ген устойчивости к рифампицину. В экспериментах
бактерий отбирают на средах с двумя-тремя антибиотика-
ми. — Прим. ред.
ках Е. coli. При добавлении канамицина в среду
культивирования выживают только трансфор-
мированные бактерии, защищенные от антибио-
тика геном устойчивости, который находится в
векторе.
В методике также используются агробак-
териальные штаммы, содержащие не полные
Ti-плазмиды, а только ранее упоминавшуюся
плазмиду-помошник. Она кодирует Vir-белки,
необходимые для переноса Т-ДНК из бинарного
вектора в растительный геном (см. рис. 22.15).
Регенерация растений из
трансформированных клеток листа
Из большого числа нетрансформированных
клеток растения нужно выделить несколько
трансформированных. Это осуществляется с
помощью другого селективного маркера, со-
держащегося в Т-ДНК-векторе. В основном
для этого тоже используется описанный выше
ген устойчивости к канамицину. Но в этом
случае он снабжен растительным промотором.
Во введении к этой главе упоминалось, что
A. tumefaciens заражает растения в местах по-
вреждения. Прекрасной мишенью для зара-
жения являются диски, вырезанные из тканей
листа (рис. 22.16). Листовые диски помещают
в суспензию трансформированных агробакте-
риальных клеток. Через некоторое время диски
переносят на агаризованную среду культивиро-
вания. В этой среде, кроме питательных веществ,
должны содержаться фитогормоны цитокинин
и ауксин, которые способствуют росту каллус-
ной ткани на основе тканей листа. Добавление
канамицина приведет к гибели всех клеток, кро-
ме трансформированных, защищенных от анти-
биотика геном устойчивости. Оставшиеся агро-
бактерии также уничтожаются специфичным
антибиотиком. Каллусная ткань развивается по
краям листовых дисков. При подходящих кон-
центрациях цитокинина и ауксина каллусная
ткань может почти неограниченно разрастаться
на питательной агаризованной среде. Поэтому
трансформированные клетки в таком виде мож-
но хранить и размножать в течение довольно
длительного периода.4 При необходимости из
них можно вырастить целое растение.
4 Длительное культивирование нежелательно из-за сниже-
ния морфогенетического потенциала клеток. — Прим. ред.
22.3. Ti-плазмида как трансформационный вектор
451
Листовые диски
Агаризованная среда культивирования
Суспензия
трансформированных
A. tumefaciens
+ Ауксин и цитокинин (индукция формирования каллуса)
+ Канамицин (селекция трансформантов)
+ Другой антибиотик (уничтожение агробактерий)
Образование каллуса
из трансформированных клеток растений
Размножение
каплусной
культуры /
Культура тканей для размножения
и поддержания клонов
трансформированных клеток
Перенос в почву
для выращивания
Регенерация
растений на
агаризованной
среде
Рис. 22.16. Получение трансгенного растения с помощью агробактериальной
трансформации. Шаг с ведением каллусной культуры может быть пропущен (см. текст)
452 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
Чтобы регенерировать растение целиком,
клетки каллусной культуры переносят на среду,
содержащую цитокинин в большем количестве,
чем ауксин. Это вызывает формирование по-
бегов на каллусной ткани. Затем стимулируют
рост корней: для этого побеги переносят на сре-
ду, в которой ауксина больше, чем цитокинина.
После того как у проростков сформировались
корни, и они немного подросли, их переносят в
почву. В большинстве случаев они развиваются
в нормальное растение, способное цвести и да-
вать семена1.
Простой метод переноса чужеродных генов
в клетки высших растений с помощью агро-
бактериальной трансформации был разработан
Джеффом Шеллом, Марком ван Монтагю, Па-
трисией Замбрыски, Робертом Хорчем и други-
ми сотрудниками. Сейчас даже обычный студент
без особого труда может получить несколько со-
тен трансгенных растений табака.
С помощью этого метода было успешно
трансформировано более 100 видов растений.
Однако с помощью A. tumefaciens очень труд-
но или даже невозможно трансформировать
однодольные растения. Недавно этот метод был
улучшен, что позволило успешно проводить
трансформацию таких растений, как рис.
Другим способом трансформации является
физический перенос генов. Одна из наиболее
эффективных методик — бомбардировка ми-
крочастицами.
Биобаллистический метод трансформации
Этот метод был разработан в 1985 г. Микрочас-
тицы — это крошечные шарики из вольфра-
ма или золота, диаметром 1—4 мкм, покрытые
ДНК. Для доставки этих «пуль» в растительную
клетку используется специальная пушка (gene
gun). Вначале для «обстрела» в пулях действи-
тельно использовали порох, но сейчас выстре-
лы производят с помощью сжатого воздуха,
гелия и других газов1 2. В качестве объектов ис-
пользуют каллусные и эмбриональные ткани, а
1 Использование для генетической трансформации реге-
нерации растений через каллус крайне нежелательно, из-за
опасности получения сомаклональных вариантов. — Прим,
ред.
2 Из-за токсичности пороховых газов, ухудшающих резуль-
тат трансформации. — Прим. ред.
также листья. Чтобы пробить клеточную стен-
ку эпидермиса и клеток мезофилла микроча-
стицы должны обладать огромной скоростью
/около 1500 км/ч). Клетки, находящиеся точно
на «линии огня» при такой стрельбе могут по-
вреждаться. Однако частицы достаточно малы,
чтобы клетки во всем поле обстрела выживали.
ДНК, перенесенная этими частицами в клет-
ки, может встроиться не только в ядерный, но и
в митхондриальный и хлоропластный геномы.
Это дает возможность трансформировать ми-
тохондрии и хлоропласты. В некоторых случаях
метод бомбардировки довольно эффективен.
Например, при бомбардировке клеток эмбрио-
генного каллуса сахарного тростника за один
выстрел обычно получают 10—20 трансформи-
рованных линий (рис. 22.17).
Трансформация протопластов
Еще одним способом доставки чужеродной ДНК
в клетки является трансформация протопластов.
Их можно получить из растительной ткани, раз-
рушив клеточную стенку (раздел 1.1). В присут-
ствии СаС12 и полиэтиленгликоля протопласты
способны поглощать ДНК. Зачастую при этом
ДНК интегрируется в геном. Этот метод анало-
гичен трансформации бактерий плазмидами.
Вместе с целевым геном в конструкции находит-
ся и селективный маркер, несущий устойчивость
к антибиотикам. После добавления антибио-
тиков выживают только трансформированные
протопласты. Так можно трансформировать
протопласты любых растений, отсутствует ви-
доспецифичность, свойственная агробактери-
альной трансформации. Однако использование
этого метода также ограничено несколькими
растительными видами, которые способны реге-
нерировать из протопласта интактное фертиль-
ное растение. Получение протопластов успеш-
но применяют для трансформации кукурузы
и риса.
Трансформация пластид
Все большую важность в последнее время при-
обретает трансформация хлоропластов. Транс-
генные растения с трансформированным (напри-
мер, с помощью Ti-плазмид) ядерным геномом
могут передавать генетическую информацию
дальше. Передача происходит через опыление,
при этом могут быть опылены сорта на соседних
22.3. Ti-плазмида как трансформационный вектор
453
Игла
Фильтровальная бумага
Рис. 22.17. Трансформация растений с помощью генной пушки. Золотые
или вольфрамовые частицы в растворе СаС12 покрывают тонким слоем ДНК.
Микрочастицы помещают на переднюю часть пластикового патрона в дуло пушки.
Пушка и мишень находятся в вакуумном корпусе. При выстреле пластиковый
патрон направляется к останавливающей пластинке. Проходя через отверстия
в ней, микрочастицы по инерции с высокой скоростью проникают в клетки
растительной ткани. ДНК, которая попадает в клетки, должна, кроме целевого
гена, содержать ген устойчивости к антибиотикам (например, ген устойчивости
к канамицину). С помощью этого маркера, так же, как и в случае A. tumefaciens,
отбирают трансформированные клетки. Затем их размножают через каллусную
культуру, и из них можно регенерировать целое растение (по Hess, Biotechnologie
der Pflanze, Verlag Ulmer, Stuttgart, 1992)
полях или даже дикие растения1. Это может при-
вести к нежелательным перекрестным скрещива-
ниям и к появлению гербицид-устойчивых сор-
няков рядом с гербицид-устойчивыми сортами
(проблема «утечки генов»). Эту проблему можно
решить, если поместить генетическую информа-
цию в пластидный геном растения. Поскольку в
большинстве случаев геном хлоропластов насле-
дуется по материнской линии, то случайноерае-
1 Речь идет о диких видах — предках культурных растений,
обитающих на той же^Вритории. — Прим. ред.
пространение новых генетических признаков при
опылении маловероятно.
Для трансформации хлоропластов обыч-
но используют баллистический метод. Чуже-
родная ДНК, которую нужно встроить в геном
пластид, на обоих концах несет последователь-
ности, идентичные с последовательностями
хлоропластного генома (рис. 22.18). После того,
как ДНК с помощью пушки попала в пластиды,
она может быть встроена в пластидный геном.
Встраивание происходит путем гомологичной
рекомбинации по сайтам, которые определя-
454 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
А Чужеродная ДНК Б
Рис. 22.18. Трансформация пластидного генома. ДНК попадает в пластиды
с помощью пушки. На обоих концах ДНК находятся последовательности А и
Б, готологичные последовательностям пластидного генома. Чужеродная ДНК
встраивается в пластидный геном благодаря гомологичной рекомбинации.
Происходит обмен участков встраиваемой ДНК с участками пластидной ДНК,
ограниченной последовательностями А и Б
ются концевыми последовательностями. Для
ядерного генома гомологичная рекомбинация
является значительно более редким событием1.
Значительно снижается вероятность случайных
мутаций (которая высока при использовании
Ti-плазмид).
Однако в каждой клетке содержится много
пластид, каждая с 10—100 геномами. Поэтому,
чтобы получить трансгенную линию, в которой
все пластидные геномы содержали бы вставку
ДНК, требуются несколько циклов отбора и ре-
генерации. Затем выращивают растения, каж-
дая клетка которых содержит много сотен копий
чужеродной ДНК. Преимуществом этого метода
является то, что растения могут синтезировать
в больших количествах чужеродный белок (до
46% растворимого белка)2.
Трансформацию пластид планируют исполь-
зовать в тех случаях, когда растения генетически
модифицируют для получения защитных ве-
ществ или лекарств.
Другим преимуществом трансформации пла-
стид является то, что гены пластид могут транс-
крибироваться полицистронно. Ядерная ДНК
обьцщо транскрибируется в моноцистроЯНМЬ
Активно происходит только при мейозе. — Прим. ред.
2 При этом в конструкции используют промотор гена
большой субъединицы RubisCO (раздел. 6.2). — Прим. ред.
22.3. Ti-плазмида как трансформационный вектор
455
мРНК. которые затем транслируются с образо-
ванием только одного белка. Большинство же
пластидных генов транскрибируется в полици-
стронную мРНК, которая кодирует несколько
белков, и в некоторых случаях может быть раз-
резана на одиночные, способные к трансляции,
мРНК. Это свойство значительно облегчает
вставку нескольких чужеродных генов (напри-
мер, генов целого биосинтетического пути),
транскрипция которых теперь может проис-
ходить за один шаг. Правда, этого же результа-
та иногда можно достичь и при трансформации
ядерного генома.
Еще одним преимуществом пластидной
трансформации является возможность обра-
зования белков с дисульфидными мостиками
(что трудно получить в цитозоле). Как описыва-
лось ранее (см. рис. 6.25) ферменты хлоропла-
стов регулируются через окисление SH-rpynn.
Поэтому такой компартмент, как пластиды,
прекрасно подходит для того, чтобы получать
в них животные белки (такие, как антитела или
съедобные вакцины), которые должны образо-
вать дисульфидные мостики для правильного
сворачивания1.
Сейчас трансформация пластид как биотех-
нологический метод только начинает развивать-
ся. Однако она имеет большое будущее. Транс-
форманты, полученные этим способом, лучше
совместимы с окружающей средой, не могут
распространять чужеродные гены через опыле-
ние других растений и дают очень высокие ко-
личества чужеродного белка.
22.4. Выбор подходящего промотора
Любой чужеродный ген, перенесенный в рас-
тение, может экспрессироваться в нем только в
том случае, если он снабжен подходящей про-
моторной последовательностью (раздел 20.2).
Выбор промотора определяет где, как, сколь-
ко и в каких условиях будет экспрессироваться
нужный ген. Векторы, поступающие в продажу,
обычно уже содержат различные промоторы
(см. рис. 22.14).
Чгобы получить высокую экспрессию встро-
енного чужеродного гена во всех частях растения,
1 Точка зрения автора о преимуществе пластид для полу-
чения подобных белков дискуссиона поскольку дисульфид-
ные мостики образуются также в ЭПР. — Прим. ред.
часто используется CaMV-358-промотор из ви-
руса мозаики цветной капусты (раздел 20.5). Он
содержит энхансеры транскрипции, обеспечи-
вающие ее высокий уровень в различных тканях
многих видов растений. В качестве неспецифи-
ческого промотора также часто используется nos-
промотор Ti-плазмиды A. tumefaciens, обычно
регулирующий ген синтеза нопалина.
ДНК-последовательности специфических рас-
тительных промоторов изучают путем анализа
генов из специальных геномных библиотек (раз-
дел 22.1). Так, например был выделен промотор
для специфической экспрессии генов в клубнях
картофеля, принадлежащий гену пататина — за-
пасающего белка картофеля (глава 14).
Является ли выделенная промоторная по-
следовательность тканеспецифичной, можно
определить с помощью репортерных генов. Ре-
портерные гены кодируют белки, которые легко
можно выявить в растении. Например, это зеле-
ный флуоресцирующий белок (GFP — green
fluorescent protein) медузы Aequorea victoria.
Его можно наблюдать в интактных растениях
с помощью конфокального микроскопа.
Очень часто в качестве репортерного гена ис-
пользуется фермент p-глюкуронидаза (GUS) из
Е. coli (см. рис. 22.19). Он похож на р-галактозидазу
(упоминавшуюся в разделе 22.1) и обычно не
встречается в растениях. Этот фермент гидро-
лизует синтетический Х-глюкуронид. При этом
образуется синий продукт, видимый под микро-
скопом. Растения картофеля можно трансформи-
ровать репортерным геном GUS под контролем
упоминавшегося ранее пататинового промото-
ра. После добавления Х-глюкуронида на срезах
клубней (и только в них!) будет видна яркая синяя
окраска. Это доказывает, что пататиновый про-
мотор работает как промотор, специфически кон-
Репортерный ген
Промотор p-Глюкуронидаза (GUS)
Рис. 22.19. Чтобы проверить функционирование
промотора, создают конструкцию, в которой он
связан с репортерным геном. На рисунке приведен
пример, где репортёрный ген кодирует фермент
Р-глюкуронидазу (GUS) из Е. coli. Этот фермент
гидролизует Х-глюкуронид. При этом образуется
окращрдный в синий цвет продукт, как и в случае
с р-галактозидазной реакцией (см. рис. 22.6)
456 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
тролирующий экспрессию генов только в клубнях
картофеля.
Сейчас выделено множество промоторов, ак-
тивных только в определенных органах и тканях:
листьях, корнях, флоэме, цветках, семенах и т.д.
Кроме того, известны промоторы, контроли-
рующие экспрессию только при определенных
внешних воздействиях: на свету, при высоких
температурах, водном дефиците, при атаке па-
тогенов. Часто промоторы одних видов расте-
ний активны в других видах, хотя паттерны их
экспрессии могут различаться.
Транспорт продуктов гена в различные
компартменты клетки с помощью
сигнальных последовательностей
Экспрессия чужеродного гена в трансгенном
растении при использовании определенного
промотора может быть ограничена определен-
ной тканью или типом клеток. Кроме того, бел-
ки, кодируемые чужеродными генами, могут
быть направлены в различные клеточные ком-
партменты (например, в строму хлоропластов
или в вакуоль). Этого можно добиться с помо-
щью специальных аминокислотных сигналь-
ных последовательностей. Они служат для
переноса белков с использованием различных
систем транспорта, находящихся на мембранах
клетки (разделы 14.5, 21.3). Сейчас известно
множество сигнальных последовательностей,
позволяющих направить нужный белок в опре-
деленный компартмент.
22.5. Выключение генов
с помощью трансформации
С помощью переноса и экспрессии генов мож-
но не только получать растения, обладающие
новыми свойствами. Огромный интерес пред-
ставляют также возможность снизить или
убрать определенные свойства (например,
устранить активность переносчика или фер-
мента) путем ингибирования экспрессии соот-
ветствующего гена. Выключение гена и изуче-
ние последствий, проявляющихся при этом в
метаболизме растений, позволяет установить
функции гена.
В прокариотических геномах (включая мито-
хондриальные и пластидные), как и в ядерных
геномах животных, часто наблюдается гомоло-
гичная рекомбинация. Это свойство часто ис-
пользуют при работе с животными для наруше-
ния функции определенного гена при получении
так называемых «нокаутных» мутантов. При
этом участок гена выделяют, клонируют и из-
меняют с помощью методов генной инженерии.
Затем его снова встраивают в ядро, где с помо-
щью гомологичной рекомбинации он встраива-
ется, замещая интересующий ген, что приводит
к нарушению работы этого гена. В растениях,
однако, такой метод мало применим, поскольку
в ядерном геноме растений гомологичная реком-
бинация — явление очень редкое. Для них нуж-
ны другие методы. Снижение экспрессии гена
может быть получено с помощью инактивации
кодирующей мРНК через синтез комплементар-
ных РНК — антисмысловых РНК (рис. 22.20).
Обычно мРНК находится в однонитевой форме.
В присутствии комплементарной нити РНК она
образует двунитевую РНК, которая нестабильна
и быстро разрушается рибонуклеазами. Поэто-
му в присутствии антисмысловой РНК матрич-
ная РНК теряет возможность транслироваться,
образуя белки.
Чтобы добиться синтеза антисмысловой
РНК, вначале методами, описанными ранее,
выделяют соответствующий ген. Затем этот ген
вставляют в виде кДНК в вектор трансформа-
ции, но в обратной ориентации. Благодаря об-
ратной ориентации (промотор находится на
другой стороне) его транскрипция приведет
к формированию антисмысловой РНК. Анти-
смысловая супрессия стала очень важным ин-
струментом в генной инженерии растений для
получения специфически сниженного уровня
экспрессии определенного гена. Но этот метод
не всегда приводит к желаемым результатам. Во
многих случаях невозможно понизить уровень
белка (фермента, транслокатора и др.) более чем
на 90%, а иногда активность оставшегося белка
даже повышается в результате дополнительных
методов регуляции.
Другим способом снизить активность гена
является ко-супрессия. При этом с помощью
трансформации встраивают дополнительную
копию имеющегося гена. Гиперэкспрессия это-
го же или сходного гена часто приводит к сни-
жению активности не только встроенного, но
и уже существующего гена. Механизм этого
явления понятен далеко не полностью. Ко-
22.5. Выключение генов с помощью трансформации
457
Ген
Промотор
Транскриптаза
Рис. 22.20. Снижение экспрессии гена с помощью антисмысловой РНК.
На основе мРНК в результате обратной транскрипции образуется двунитевая кДНК
(см. рис. 22.2). Затем кДНК встраивают в обратной ориентации в вектор
(см. рис. 22.14) для трансформации растений. Теперь трансформированное растение
содержит в своем геноме, помимо обычного гена, ещё и второй, антисмысловой.
Активность промотора вызывает транскрипцию второй нити ДНК, обычно
некодирующей. Транскрипция обоих генов приводит к появлению (в результате
комплементарного спаривания) двунитевой мРНК, которая затем гидролизуется
и не может транслироваться
458 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
супрессия может быть более эффективной, чем
антисмысловая супрессия, однако работает этот
метод только в некоторых случаях.
Новой и очень эффективной методикой для
снижения экспрессии определенного гена яв-
ляется метод интерференции РНК (RNAi —
RNA-mediated interference). При этом син-
тезируются специальные РНК: небольшие
двунитевые фрагменты РНК1, которые способ-
ны инактивировать соответствующие мРНК.
Обнаружено, что присутствие таких двунитевых
фрагментов РНК приводит к резкому ингиби-
рованию трансляции мРНК и к ее гидролизу
клеточными нуклеазами. Следовательно, можно
трансформировать растение ДНК, которая ко-
дирует обе нити двунитевых фрагментов РНК,
что приведет к резкому снижению экспрессии
нужного гена. Метод интерференции РНК име-
ет определенные преимущества по сравнению
с антисмысловыми, и сейчас широко распро-
странен.
Для многих растений простейший способ на-
рушения функции гена случайным образом — это
трансформация с помощью A. tumefaciens (гла-
ва 20.1). Растения встраивают Т-ДНК Ti-плаз-
миды в геном случайным образом. Ген при
встраивании в него Т-ДНК изменяется и теряет
свою функцию. Такие Т-ДНК-инсерционные
мутанты затем можно идентифицировать с по-
мощью зонда к используемой Т-ДНК.
22.6. Применение генной инженерии
растений очень разнообразно
Использование агробактерий в генетической
инженерии произвело революцию как в фунда-
ментальной, так и в прикладной науке. В фун-
даментальной науке за очень короткое время
были идентифицированы и охарактеризованы
многие новые белки, ферменты и переносчики.
При исследовании функций белков в растениях
важную роль сыграла возможность повышать
или снижать экспрессию соответствующих ге-
нов методами трансформации (см. предыдущий
раздел). Изучая эффекты этих изменений, мож-
1 В геном под сильным промотором встраивают два фраг-
мента подряд: в прямой и в обратной ориентации. После
синтеза РНК происходит образование двунитевой структу-
ры, соединённой короткой шпилькой. — Прим. ред.
но делать выводы о роли, которую соответству-
ющий белок играет в метаболизме.
В сельском хозяйстве генная инженерия рас-
тений используется во многих проектах. С ее
помощью можно усилить защиту растений от
паразитов, увеличить качество и количество
урожая, получить подходящее сырье для про-
мышленных целей. К настоящему времени во
всем мире, особенно в Северной Америке, Юж-
ной Америке и Китае, широко распространены
трансгенные (генетически модифицированные)
сорта сельскохозяйственных. В Европе же из-за
организованного негативного общественного
мнения сейчас разрешено выращивать только
один трансгенный вид (БТ-кукуруза, см ниже).
Основная масса трансгенных растений в мире
получена в целях борьбы с паразитами и сорня-
ками, повышения устойчивости к насекомым и
гербицидам (раздел 10.4). Чтобы повысить уро-
жайность, получают гибриды Fj с участием ге-
нетически модифицированных растений с муж-
ской стерильностью (например рапс). Также
трансформанты используются для повышения
качества конечного продукта. Например, полу-
чены томаты со свойствами, обеспечивающие
долгое хранение (раздел 19.5), или рапс с улуч-
шенным составом жирных кислот (раздел 20.7).
Защита растений от насекомых
с помощью БТ-токсина
На сельскохозяйственные растения часто напа-
дают различные насекомые-вредители. Можно
привести несколько примеров.
1. Колорадский жук, родом из Северной
Америки, может полностью уничтожить листья
на полях картофеля.
2. Личинки кукурузного сверлильщика, про-
никая в побеги кукурузы, выедают их изнутри, что
может привести к крупным потерям урожая.
3. Этим же способом (выедая изнутри) свер-
лильщик хлопчатника нарушает образование
его цветков.
Установлено, что насекомые уничтожают
примерно 1/6 всего урожая растений. У ферме-
ров часто нет других доступных способов эф-
фективной защиты, кроме химических. Ранее
в качестве довольно эффективного средства ис-
пользовали хлорированные углеводороды (ДДТ
или Алдрин). Но эти вещества очень медленно
разлагаются. Накапливаясь, они могут нанес-
22.6. Применение генной инженерии растений очень разнообразно
459
ти серьезный вред окружающей среде, поэто-
му сейчас их использование во многих странах
ограничено или полностью запрещено. Сегодня
в качестве инсектицидов используют, в основ-
ном, фосфоорганические вещества, например,
ингибиторы фосфоэстераз, нарушающие пере-
дачу нервных импульсов в синапсах (нервно-
паралетические вещества). Такие вещества быст-
ро разлагаются, но могут уничтожить не только
вредных, но и полезных насекомых, таких, как
пчелы. Они ядовиты и для человеческого орга-
низма. Опасность представляют не остатки пе-
стицида в конечном продукте, опасен он прежде
всего для сельскохозяйственных рабочих, кото-
рые обрабатывают инсектицидами растения.
Более 30 лет в качестве альтернативного био-
логического инсектицида использовали пре-
параты из Bacillus thuringiensis. Эта бактерия
синтезирует токсический пептид (БТ-токсин),
который связывается с белками-мишенями на
стенках кишечника определенных насекомых,
что ухудшает усвоение ими пищи. Нарушение
пищеварения приводит к тому, что насекомое
голодает и умирает. Сейчас известно более сотни
бактериальных штаммов, образующих различные
БТ-токсины с относительно специфическими
ядовитыми свойствами для определенных видов
насекомых. Токсикологические исследования
показали, что БТ-токсины безопасны для лю-
дей. Вот уже много лет опрыскивание суспензией
бактерий с БТ-токсинами применяют для защи-
ты урожая от насекомых. К несчастью, такие пре-
параты стоят дорого и легко смываются с листьев
дождями. Опрыскивание имеет тот недостаток,
что невозможно уничтожить вредителей внутри
растительных побегов (сверлильщиков кукурузы
и хлопчатника).
Были выделены и клонированы гены раз-
личных БТ-токсинов. Затем их использовали
для трансформации растений. Хотя трансгенное
растение производит очень небольшие количе-
ства БТ-токсинов (0,1% от общего белка), этого
более чем достаточно, чтобы предотвратить по-
едание растений насекомыми. БТ-токсины раз-
лагаются в почве и перевариваются в кишечном
тракте человека так же, как и другие белки. Поэ-
тому сейчас устойчивые к насекомым линии ку-
курузы, сои и хлопчатника широко распростра-
нены в Соединенных Штатах. Их выращивание
помогло снизить использование инсектицидов,
которые способны нанести вред широкому
спектру видов животных. Поэтому использова-
ние таких растений вносит свой вклад в защиту
окружающей среды.
Другим путем защиты растений от насекомых
является вставка методами генетической инже-
нерии генов, кодирующих ингибиторы протеи-
наз (раздел 14.4). При поранении насекомыми
или при грибной заражении растение синте-
зирует ингибиторы некоторых специфических
протеиназ животных и микроорганизмов. Пи-
тающиеся на таких растениях насекомые поеда-
ют ингибитор, которые нарушает пищеварение.
Насекомое голодает, а затем умирает. Синтез
ингибитора не ограничивается только местом
поранения, но часто идет и в других органах
растения, что защищает его от дальнейших атак
(возникает системная устойчивость). Вставка
соответствующего гена под сильным промото-
ром в томаты, люцерну и табак приводила к вы-
сокой экспрессии ингибиторов протеиназ, эф-
фективно защищая такие растения от поедания
насекомыми. Эта стратегия защиты растений
имеет то преимущество, что она неспецифична
к определенным группам насекомых. Ингибито-
ры протеиназ содержатся в большом количестве
в обычной пище человека, но они инактивиру-
ются при термической обработке.
Еше одним примером зашиты растений от
повреждения насекомыми с помощью методов
генной инженерии является экспрессия инги-
битора амилазы в семенах гороха. Это помогло
предотвратить потери урожая от личинок неко-
торых видов жуков (раздел 14.4).
Защита растений от вирусов
с помощью генных технологий
К катастрофическим потерям урожаев могут
приводить и вирусные заболевания, от кото-
рых страдают многие сельскохозяйственные со-
рта. Заражение вирусом мозаики огурца может
привести к полному уничтожению урожая тыкв,
огурцов, дынь и кабачков. Ризомания — вирус-
ное заболевание сахарной свеклы — может погу-
бить до 60% урожая. В отличие от насекомых или
паразитических грибов, вирусы нельзя прямо
уничтожить с помощью химикатов. Стандарт-
ные процедуры, например, снижение размно-
жения вирусов с помощью севооборота культур,
не всегда успешны. Одним из способов борьбы
460 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
с вирусами является уничтожение насекомых-
переносчиков вируса, особенно тлей, с помо-
щью пестицидов.
Давно известно, что при заражении слабой
формой патогенного штамма определенного ви-
руса растение приобретает устойчивость к более
агрессивным его формам. Это явление успешно
используют при биологической защите тыквен-
ных растений. Предположили, что устойчивость
вызывается некими молекулярными компонен-
тами вирусов. Это предположение было прове-
рено молекулярно-биологическими методами
на вирусе табачной мозаики (ВТМ). Ген бел-
ка оболочки ВТМ был встроен в геном табака,
и растение приобрело устойчивость к этому ви-
русу. Затем это было подтверждено для многих
других вирусов. Если ген белка оболочки опре-
деленного вируса эффективно экспрессировал-
ся в растении, то растение становилось устойчи-
вым к заражению этим патогеном. В США уже
разрешены к выращиванию генетически моди-
фицированные сорта тыквенных устойчивые
к вирусу мозаики огурца. В Германии этот метод
использовался для получения сахарной свеклы,
устойчивой кризомании (Planta, Einbeck).
Получение растений,
устойчивых к грибным инфекциям
Генно-инженерные технологии получения рас-
тений, устойчивых к заражению грибами, на-
ходятся еще на ранних стадиях разработки.
Уже была предпринята попытка использования
естественных защитных механизмов растений.
Так, некоторые растения защищаются от гри-
бов, разрушая их клеточную стенку. Клеточная
стенка у большинства грибов содержит хитин,
полимер, состоящий из остатков N-ацетил-
D-глюкозамина, отсутствующий в растениях.
Некоторые растения содержат в семенах хи-
тиназы, которые лизируют клеточную стенку
грибов1. Сорта растений, трансформированные
геном хитиназы из бобов, обладают повышен-
ной устойчивостью к заражению определен-
ными грибами. Другая стратегия предполагает
экспрессию ферментов для синтеза фунгицид-
1 Полного разрушения клеточной стенки гриба не проис-
ходит. При действии хитиназ образуются фрагменты хитина,
которые являются сигналом для запуска иммунных реакций
в растениях. — Прим. ред.
ных фитоалексинов (например, стильбенов)
(раздел 18.4). Однако чтобы подготовить для
широкого культивирования сорта устойчивых
к грибам растений, необходимо еще некоторое
время.
Получение растений,
устойчивых к гербицидам
Необходимость гербицидов для защиты растений
рассмотрена в разделе 3.6. Примеры действия
различных гербицидов приведены в разделах 3.6,
10.4 и 15.3. Самым экономически успешным гер-
бицидом признан глифосат (торговое название
Раундап — Round Up, Monsanto) (см. рис. 10.18).
Он специфически ингибирует синтез аромати-
ческих аминокислот через шикиматный путь на
уровне енолпирувилшикиматфосфат(ЕПШФ)-
синтазы (см. рис. 10.19). Поскольку у животных
шикиматный путь синтеза отсутствует, то на их
метаболизм глифосат почти не влияет. Благода-
ря простой структуре он относительно быстро
разлагается почвенными бактериями. Его мож-
но использовать, просто опрыскивая листья.
Глифосат неселективен, поэтому его можно ис-
пользовать против многих очень устойчивых
сорняков. Например, он широко используется
для уничтожения растительности вдоль железно-
дорожных путей, против сорняков на плодовых
и виноградных плантациях, для уничтожения
сорняков перед посадкой сельскохозяйственных
культур. А для того, чтобы можно было приме-
нять этот мощный гербицид и после прорас-
тания семян культурных растений, методами
генной инженерии получили несколько линий
устойчивых к нему генетически модифициро-
ванных растений. Для этого из бактерий выде-
лили ген ЕПШФ-синтазы, менее чувствитель-
ной к глифосату, чем растительный фермент.
Растения, трансформированные им, оказывают-
ся более устойчивыми к этому гербициду. К на-
стоящему моменту в культуру введены глифосат-
устойчивые растения хлопчатника, рапса и сои.
Таким же образом получены растения, устойчи-
вые к гербициду глуфосинату (торговое название
Либерти — Liberty, фирма Aventis) (см. рис. 10.7).
Такие растения экспрессируют бактериальные
ферменты, разрушающие этот гербицид.
22.6. Применение генной инженерии растений очень разнообразно
461
Повышение качества и урожайности
сельскохозяйственных культур
Для получения растений, устойчивых к парази-
там или гербицидам обычно достаточно встра-
ивания одного гена. Для улучшения качества и
количества выращиваемого продукта часто не-
обходимо встраивание нескольких генов, что
увеличивает сложность получения генетически
модифицированных растений.
Многообещающим путем представляется
получение гибридов F| с использованием гене-
тически измененных растений с мужской сте-
рильностью. Этот метод описан в разделе 20.7.
Другой стратегией повышения урожайности
является изменение соотношения биомассы
между хозяйственно-важными и не важными
органами растения. Так, получены трансгенные
растения картофеля, у которых повышена отно-
сительная масса клубней (раздел 13.3). Однако
этот результат еще необходимо подтвердить по-
левыми испытаниями.
Генная инженерия используется также для
улучшения пищевых и кормовых свойств про-
дукции. В качестве примеров можно назвать
рапс, масло семян которого содержит повы-
шенное количество ненасыщенных жирных
кислот, рис с провитамином А («золотой рис»,
раздел 17.5), соя с увеличенным содержанием
метионина (раздел 14.3).
Использование трансгенных растений
для получения сырья в промышленности
и фармакологии
С помощью генетической инженерии можно
вырастить растения, которые будут являться
ценным промышленным сырьем. В разделе 15.5
рассматривались трансгенные растения, ис-
пользуемые в качестве источника жиров, в ко-
торых повышено содержание ценных веществ.
Жирные кислоты с короткой цепью нужны для
производства детергентов и в косметической
промышленности; эруковая кислота использу-
ется для получения синтетических материалов.
Генетически модифицированные растения кар-
тофеля, крахмал которых состоит только из ко-
роткоцепочечной а-амилозы (раздел 9.1), пред-
ставляют интерес как сырье для производства
пластика. Эфиры амилозы имеют полимерные
свойства, близкие к свойствам полиэтилена, но
быстрее разлагаются биологическим путем (ми-
кроорганизмами).
Трансгенные растения, особенно пластид-
ные трансформанты, хорошо подходят для по-
лучения пептидов и белков (например, бычьего
сывороточного альбумина или интерферона).
Некоторых успехов удалось добиться при попыт-
ке использования растений для получения чело-
веческих моноклональных антител (используе-
мых, например, для лечения рака кишечника).
В растениях легко получить антитела к бактери-
ям, вызывающим кариес, и эти антитела можно
добавлять в зубную пасту. При производстве
антител важно получать очень большие коли-
чества белка с низкой себестоимостью. В этом
плане выращивание генетически модифици-
рованных растений может оказаться экономи-
чески выгодным. Достигнуты определенные
успехи при получении трансгенных растений
для производства съедобных вакцин. Кормовое
растение люцерна была трансформирована для
получения съедобной вакцины против заболе-
ваний ног и ротовой полости1. Съедобную вак-
цину против вируса гепатита В синтезируют в
картофеле и люпине, вакцину от бешенства — в
томатах. Хотя эти эксперименты находятся еще
на начальных фазах, они открывают широкие
возможности вакцинации с помощью простого
употребления растительной пищи (кормовых
культур для животных и плодоовощных — для
людей).
Повышение устойчивости растений
к стрессовым воздействиям методами
генной инженерии
В различных главах этой книги описаны меха-
низмы, с помощью которых растения адаптиру-
ется к стрессовым воздействиям окружающей
среды, таких, как жара (раздел 21.2), холод (раз-
делы 3.10 и 15.1), засуха и засоление (глава 8 и
раздел 10.4), загрязнение вредными вещества-
ми и тяжелыми металлами (раздел 12.2), обра-
зование активных форм кислорода (разделы 3.9
и 3.10). Генная инженерия открывает широкие
возможности для повышения устойчивости
культивируемых растений к стрессам. Это-
го можно достичь путем усиления экспрессии
белков, участвующих в механизмах ответа на
стрессовые воздействия. Так, увеличение числа
двойных связей в жирных кислотах мембран-
1 По-видимому, для использования в ветеринарной прак-
тике. — Прим. ред.
462 22. Применение генно-инженерных технологий в сельском хозяйстве, пищевой промышленности ...
ных липидов с помощью методов генной ин-
женерии введением генов десатураз повысило
холодостойкость растений табака (раздел 15.1).
В будущем может получить широкое распро-
странение выращивание растений, накапли-
вающих тяжелые металлы (ртуть и кадмий), для
детоксикации почв (раздел 12.2).
С ростом мирового населения достаточное
увеличение площади пахотных земель станет
серьезной проблемой. Из-за высокого засоле-
ния, которое часто вызывается неправильным
орошением, большие площади выходят из сель-
скохозяйственного использования. В 1990 году
20% мировых сельскохозяйственных земель
(включая 50% искусственно орошаемых) были
классифицированы как засоленные. Сейчас
идут активные исследования по получению со-
леустойчивых растений как с усиленным син-
тезом осмотиков: маннита, бетаина, пролина
(раздел 10.4), так и с экспрессией ферментов,
участвующих в инактивации активных форм
кислорода (АФК) (разделы 3.9 и 3.10). АФК —
это серьезный повреждающий фактор при за-
сухе и солевом стрессе. Однако доведение этих
идей до практического использования требует
еше довольно долгого времени. Если попытки
получения солеустойчивых растений окажутся
успешными, это будет важным вкладом в реше-
ние мировых продовольственных проблем.
Возможные риски при культивировании
трансгенных растений
В настоящее время возможности растительной
генной инженерии порождают как большие
ожидания, так и серьезные опасения. Существу-
ет большое количество требований, которым
должно удовлетворять генетически модифици-
рованное растение при введении его в культу-
ру. Необходимо, подходя с четкими научными
критериями, проанализировать всевозможные
риски, связанные с угрозой как окружающей
среде, так и здоровью людей. В частности, нуж-
но оценить возможности скрещивания между
трансформантами и родственными им дикими
растениями, а также потенциальные послед-
ствия этого. Например, трансгенный рапс мо-
жет скрещиваться с другими крестоцветными,
например, дикорастущей сурепкой. Этот риск
можно предотвратить с помощью хлоропласт-
ных трансформантов (раздел 22.5). Кроме того,
трансгенные растения и сами по себе могут
одичать. И создание гербицид-устойчивых сор-
тов может привести к появлению гербицид-
устойчивых сорняков. С другой стороны, нуж-
но заметить, что при постоянном применении
гербицидов такие сорняки отбираются и путем
естественного отбора (см. раздел 10.4). Для ана-
лиза подобных рисков нужны не только лабора-
торные, но и хорошо контролируемые полевые
эксперименты. Мы не будем рассматривать в
этой книге все проблемы подбора критериев
лицензирования растений и оценки рисков,
связанных с введением в культуру трансген-
ных сортов. При соблюдении должного уров-
ня ответственности генная инженерия расте-
ний может внести крупный вклад в увеличение
урожайности культур, их пищевой ценности,
а также в снабжение промышленности каче-
ственным сырьем. И если защита растений с
помощью методов генной инженерии даже про-
сто приведет к тому, что меньше химикатов бу-
дет попадать на поля, то это уже послужит оздо-
ровлению окружающей среды1.
Дополнительная литература
Allen, D. J., Ort, D. R. Impacts of chilling temperatures
on photosynthesis in warm-climate-plants. Trends Plant
Sci 6, 36-42 (2001).
Brandt, P. Zukunft der Gentechnik. Birkhauser-Verlag,
Basel (1997).
Chrispeels, M. J., Sadava, D. E. Plant Genes and Agriculture.
Jones and Bartlett, Boston, London (1994).
Chilton, M.-D. Agro bacterium. A memoir. Plant Physiol
125,9-14(2001).
Daniell, H., Streatfield, S. J., Wycoff, K. Medical molecular
farming: Production of antibodies, biopharmaceuticals
and edible vaccines in plants. Trends Plant Sci 5, 219—
226 (2001).
Daniell, H., Khan, M. S., Allison, L. Milestones in
chloroplast genetic engineering: An environmentally
friendly era in biotechnology. Trends Plant Sci 7, 84—91
(2002).
De Block, M., Herrera-Estrella, L., Van Montagu, M.,
Schell, J. Expression of foreign genes in regenerated
plants and their progeny. EMBO J 3, 1681 — 1689(1984).
1 Особенно велика опасность применения генетически-
модифицированных растений для пищевых целей. — Прим,
ред.
Дополнительная литература
463
Dale, М. Е В., Bradshaw, J. Е. Progress in improving
processing attributes in potato. Trends Plant Sci 8, 310—
312 (2003).
Groot, A. T., Dicke, M. Insect-resistant transgenic plants
in a multi-trophic context. Plant J 31, 387—406 (2002).
Grusak, M. A. Improving the nutrient composition of
plants to enhance human nutrition and health. Annu
Rev Plant Physiol Plant Mol Biol 50, 133—136(1999).
Hansen, G., Wright, M. S. Recent advances in the
transformation of plants. Trends Plant Sci 4, 226—231
(1999).
Hellens, R., Mullineaux, P., Klee, H. A guide to
Agrobacterium binary Ti vectors. Trends Plant Sci 5,
446-451 (2000).
Iba, K. Acclimative response to temperature stress in higher
plants: Approaches of gene engineering for temperature
tolerance Annu Rev Plant Biol 53, 225—246 (2002).
Horsch, R. B., Fraley, R. T., Rogers, S. G., Sanders, P. R.,
Lloyd, A., Hoffman, N. Inheritance of functional foreign
genes in plants. Science 223, 496—498 (1984).
Kappeli, O., Auberson, L. How safe enough is plant genetic
engineering? Trends Plant Sci 3, 276—281 (1998).
Miflin, B. J. Crop biotechnology, where now? Plant Physiol
123, 17-27 (2000).
Moffat, A. S. Exploring transgenic plants as a new vaccine
source. Science 268, 658—660 (1995).
Nap. J.-R, Metz, P. L. J., Escaler, M., Conner, A. J.
The release of genetically modified crops into the
environment Plant J 33, 1 — 18 (2003).
Pilon-Smits, E., Pilon M. Breeding mercury-breathing
plants for environmental cleanup. Trends Plant Sci 5,
235-236 (2000).
Plant biotechnology: Food, feed- Special Issue. Science
285,289-484(1999).
Poppy, G. GM crops: Environmental risks and non-target
effects. Trends Plant Sci 5, 4—6 (2000).
Pray, С. E., Huang, J., Hu, R., Rozelle, S. Five years of
Bt cotton in China — the benefits continue. Plant J 31,
423-430 (2002).
Sarhan, F, Danyluk, J. Engineering cold-tolerant
crops — throwing the master switch. Trends Plant
Sci 3, 289-290 (1998).
Sommerville, C. R., Bonetta, D. Plants as factories for technical
materials. Plant Physiol 125, 168—171 (2001).
Straughan R. Moral and ethical issues in plant biotechnology.
Curr Opin Plant Biol 3, 163-165 (2000).
The Royal Society. An open review of the science relevant
to GM crops and food based on interests and concerns
of the public. The Royal Society, London (2004).
Thomashow M. E. So what’s new in the field of plant cold
acclimation? Lots! Plant Physiol 125, 89—93 (2001).
Tinland, B. The integration ofT-DNA into plant genomes.
Trends Plant Sci 1, 178—184 (1996).
Tzfira, T., Citowsky, V. The agrobacterium-plant cell
interaction. Taking biology lessons from a bug. Plant
Physiol 133, 943-947 (2003).
Ward, D. V., Zupan, J. R., Zambryski, P. C. Agrobacterium
VirE2 gets the VIPl treatment in plant nuclear import.
Trends Plant Sci 7, 1—3 (2002).
Wilkinson, M. J., Sweet, J., Poppy, G. M. Risk assessment
of GM plants: Avoiding gridlock? Trends Plant Sci 8,
208-212 (2003).
Willmitzer, L. Transgenic plants. In: H. J. Rehm, G.
Reed, A. Piihler, P. Stadler (eds.): Biotechnology, A
Multi-Volume Comprehensive Treatise. Band 2, 627—659
(1993). Verlag Chemie, Weinheim.
Ye, X., Al-Babili, S., Kloti, A., Zhang, J., Lucca, P., Beyer, P.,
Potrykus, I. Engineering the provitamin A (P-carotene)
biosynthetic pathway into (carotenoid-free) rice
endosperm. Science 287, 303—305 (2000).
Zhu, J.-K. Plant salt tolerance. Trends Plant Sci 6, 66—71
(2001).
Указатель
14-3-3 белок 215,232,233,371
2,4-дихлорфеноксиуксусная кислота (2,4-D) 371
28-белки 285
а-кетоглутарат (оксоглутарат) 127, 237
а-кетоглутаратдегидрогеназа 127
а-спирали 425
Р-галактозидаза 441
Р-глюкуронидаза (GUS) 455
Р-окисление 313
Р-слои 425
А
абиетиновая кислота 334, 341
абсцизовая кислота (АБК) 181, 369, 376
автофагосомы 436
АДФ-глюкоза 206
АДФ-глюкозопирофосфорилаза 206, 208
аквапорины 44
аконитаза 127
активаза RubisCO 148, 161, 163
активные формы кислорода (АФК) 102, 139, 323, 381, 462
активный транспорт 40
актин 20
аланин 241
алкалоиды 324
алкогольдегидрогеназа 281
аллантоин 255
алленоксидсинтаза 320
аллофикоцианин 71
альбумины 284
альдолаза 152
альтернативная оксидаза 140,351
альтернативные НАДН-дегидрогеназы 139
амигдалин 326
амилазы 206, 373
амилоза 203
амилопектин 203
амилопласты 203
аминоацил-тРНК-синтетаза 419
аминоацильный сайт 421
аминолевулиновая кислота (5-АЛК) 245
аминотрансферазы 165
АМФ-циклаза 363
анаплеротические реакции 129
анаэробы 56
антенна 64, 65, 69, 89, 99
антибиотики 422, 424, 440
антикодон 419
антиоксидант 267
антипорт 39,138
антоцианидины 359
антоцианы 359
апикальное доминирование 371
апопласт 24, 25, 274
аппарат Гольджи 20, 36, 223, 429, 344
арахидоновая кислота 365
арбускулы 260
аргинин 328
архебактерии (археи) 56
аскорбат 102, 103, 107
аскорбатпероксидаза 102
аспарагин 226,231,255
аспартат 186
атропин 325
АТФ-синтаза F-типа 105, 111, 114, 117—120, 137,410
АТ Ф/А Д Ф трансл окатор 13 8
АТФ-сульфурилаза 264
ауксины 369, 436, 445
АФС-редуктаза 266
аффинная хроматография 438
ацетил-КоА 297
ацетил-КоА-карбоксилаза 298
ацил-КоА 305, 309
ациллипиддесатуразы 303
ацилпереносящий белок (АПБ) 298
АЦК-оксидаза 378
АЦК-синтаза 378
Б
бактериофаги 410,439
бактериофеофитин 78, 80
бактериохлорофилл 59, 78, 80
баллистический метод 452, 453
белки оболочки 407
белки теплового шока (БТШ) 426
белковые тела 285
белок Риске 94, 95, 96
бензойная кислота 350
бетаины 238
библиотека кДНК 438
биотин 299, 298
биядерный центр 135
Бобовые (Leguminosae) 251
брассинолид 379
брассиностероиды 340, 362, 369, 378
БТ-токсин 458
Указатель
4
В
вакуоль 20,26,218,226,428
ванилин 350
везикулы 37
вербаскоза 216
Вестерн-блот 442
виниферин 357
вирус мозаики огурца 459
виолаксантин 64, 107
вирус мозаики цветной капусты (CaMV) 407
вирус табачной мозаики (ВТМ) 26, 351, 459
вирусы 26,405
вицилин 284
возбужденное состояние 60
водный дефицит 179
восстановительный пентозофосфатный путь (цикл Каль-
вина) 144, 156, 157, 170
восстановители фертильности (Rf) 415
вторичная клеточная стенка 23
вторичные мессенджеры 292
вторичные метаболиты 322
Г
галактинол 216
галактолипиды 292, 305
галловая кислота 360
гаплоиды 388
гиперполяризация 47
гексокиназа 278
гексенали 318
гексенолы 318
гем 59, 92, 93, 245, 226, 249, 343
гемитерпен 336
гемицеллюлоза 22, 223
генная инженерия 92
гены домашнего хозяйства 392, 411
генетические маркеры 401
генетический код 443
генистеин 358
геранилгеранилпирофосфат 340, 373
геранилпирофосфат 334
гераниол 337
гербициды 91, 245, 242, 268, 300, 371, 437, 460
геронтосомы 316
гетерозис 415
гетеротримерные G-белки 363
гетеротрофы 55
гиббереллин 334, 340, 372, 369, 436
гибберелловая кислота 345
гибриды Fj 415
гидроксил-радикал 102, 139
гидроксинитриллиазы 326
гидропероксидлиаза 318
гидроксипируватредуктаза 170
гидрохинон 87
гликозидаза 326
гликолат 165, 174
гликолатоксидаза 165
гликолиз 255, 278
глиоксилат 165,174,316
глиоксилатный цикл 314,315
глиоксисомы 34,313,314,320
глифосат 245, 460
глицераткиназа 170
глицерин-3-фосфат 304
глицеральдегид-3-фосфат (ФГА) 150, 332
глицеральдегидфосфатдегидрогеназа 149, 161, 208
глицеролипиды 289, 304
глицин 165
глобулины 284
глутамат 165, 228, 234, 237, 246, 269, 276
глутаматдегидрогеназа 129
глутамин 170, 231, 234, 226, 228, 255, 276
глутаминоксоглутаратаминотрансфераза 228
глутаминсинтетаза 170
глутаматсинтаза 170, 228, 231
глутатион 103,269,267,359
глутатионредуктаза 103
глюкоза 202
глуфосинат 228, 229
глюкобрассицин 328
глюкозинолаты 324, 327
глюкозо-6-фосфатдегидрогеназа 161, 157
глюконат-6-фосфатдегидрогеназа 157
глюконеогенез 314, 312
глютелины 284
глютенины 284
ГМФ-циклаза (гуанилатциклаза) 363
ГОГАТ 228
гормоны 362
горчичные масла 328
граны 28, 189
граминаны 220
ГТФ/ГДФ-связывающие белки (G-белки) 362
гуттаперча 331
д
дальний красный свет 383
дезокси-В-ксилулозо-5-фосфатный (DOXP) путь 334
десатуразы 296, 302, 302, 308, 461
десмотрубочка 24, 25
детергенты 340
деэтиоляция 382
диацилглицерин (ДАГ) 365
дигидроксиацетонфосфат (ДГАФ) 143, 150,304
дигидролипоилдегидрогеназа 167
дигитоксигенин 340
дикарбоксилатный транслокатор 140
диктиосома 36
диметилаллилпирофосфат 334, 336, 375
диплоиды 388
дирижирующие белки 353
дисульфидная связь (S-S-мостик) 160
ДНК-лигаза 439
ДНК-полимеразы 439
долихол 343, 344
466
Указатель
дубильные вещества 360
дыхательная электрон-транспортная цепь 130
Ж
жасмонаты 320,369,380,381
железистые волоски 345
железо-молибденовый кофактор 256
железо-серные центры «кластеры» 93, 94, 132, 227, 267
жирная кислота 299, 313, 310, 296, 304, 357
3
замыкающие клетки устьиц 179
зеаксантин 107,342
зеатин 369, 375
зеленые водоросли 83
зеленый флуоресцирующий белок (GFP) 455
золотой рис 461
И
изопентенилпирофосфат 332
изопрен 332, 334,336
изопреноиды 330
изопренсинтазы 336
изотонические среды 26
изофлавоны 357, 358
изохинолиновые алкалоиды 326
изоцианат 328
изоцитратдегидрогеназа 127
изоцитратлиаза 314
иммунная реакция 323
инвертазы 278
инвертированные повторы 404
ингибиторы амилаз 285, 324, 459
ингибиторы протеиназ 285, 380, 459
индолилуксусная кислота (ИУК) 369, 371
инозитол-1,4,5-трифосфат (ИФ3) 365
инсерционные мутанты 391
интерференция РНК (RNAi) 456
интроны 392
инфекционная нить 252
ионные каналы 45, 46
ионофоры 111
К
калиевый канал 179, 181
каллоза 210,222,273,277
каллус 26, 320,375, 450
кальмодулин 365
кальмодулин-связывающие киназы 367
канаванин 328
канифоль 341
капсидиол 339
карбоангидраза 183, 184
карбоксилирование 144
карденолиды 340
кардиолипины 292
каротиноиды 31, 64, 107, 81, 334, 341
каротины 64, 342
касбен 340
каталаза 33, 165,313
каучук 331
квантовый выход 83
кестозы 219,220
киназа нитратредуктазы 232
клатрин 37
клетки обкладки 187, 189, 274, 355
клетки-спутницы 273, 274
клеточная стенка 21, 19
клубенек 252
клубеньковые бактерии (ризобии) 251, 252
кобаламин 59
кодон 419
кокаин 325
кониин 324
конифериловый спирт 353
коровые комплексы 65
корончатые галлы 375, 437, 445
ко-супрессия 456
кофеин 326
кофермент А 126
кранц-анатомия 187
красный свет 383
крахмал 31,202,209,216,278
крахмалсинтаза 206
крахмальные зерна 203
криптохромы 362, 382
кристы 32
ксантофиллы 64
ксенобиотики 267
ксилема 226, 273
кутикула 356
кутикулярные воска 356
кутин 356
кэп 396,397,421
Л
лавровая кислота 310, 311
лакказы 353
лактатдегидрогеназа 281
лактоназа 157
ламеллы 105
лег-гемоглобин (легоглобин) 259
легумин 284
лейкопласты 27,31, 231
лектины 285, 324
лигнаны 353
лигнин 349,351,354
лидерный пептид 35
ликопин 342
лимонен 334, 337, 341
лимоненсинтаза 337
линалоол 337
линкеры 440
линолевая кислота 310, 317
линоленовая кислота 310, 317
липазы 320,312
липидные бислои 289
липкие концы 440
Указатель
467
липоевая кислота 128, 126, 167
липоксигеназы 317,320,381
литические вакуоли 436
листопад 316
люмен 28
лютеин 64
М
малат 179,186,196,181,255
малатдегидрогеназа 128, 129, 172, 173, 174, 188, 181,316
малатсинтаза 314
малатоксалоацетатный обменник (челнок) 141, 172, 173,
174
малик-энзим 188
малогнол 353
малые G-белки 363
малые ядерные РНК 398
мальтоза 206
маннит 238
марганцевый кластер 88
массовый ток 277
масс-спектрометрия 194
матрикс 32, 123
мевалонатный путь 332, 333
медикарпин 357
медь-серный кластер 135
мезофилл 19, 187, 189
межмембранное пространство 28, 32
ментол 338
метаболизм по типу толстянковых (САМ) 195
метаболитное туннелирование 175
метилвиологен 104
метилирование 398
метионин 269
миграция энергии 63
микориза 260
микроРНК 393
микросателлитная ДНК 402, 390
микрофибриллы 22, 23, 222
микрофиламенты 20
мини-хромосомы 407
миозин 21
л/мо-инозитгалактозилтрансфераза 216
мирозиназа 328
мирцен 337
митоген 368
митоген-активируемые киназы (МАР-киназы) 368, 381
митохондриальный геном 31
митохондрии 20, 31, 123, 165, 166, 292, 388, 426
мобильные элементы 404
молибденовый кофактор 226
молочная кислота 281
монолигнолы 353
монооксигеназы 302, 349, 359
монотерпены 337
морфин 324, 326
мужская стерильность 382
Н
НАДН-дегидрогеназый комплекс (комплекс I) 73, 101,
130, 132,410
НАД-малатдегидрогеназа 196
НАД-малик-энзим 192
НАДФ-малатдегидрогеназа 161, 188, 194
напин 285
немевалонатный путь 334
неомицинфосфотрансфераза 450
непротеиногенные аминокислоты 328
нециклический транспорт электронов 74, 85, 87
никотин 324
нитрат 224, 226, 230
нитратредуктаза 231, 226, 232, 233, 381
нитрит 227, 230, 231
нитритредуктаза 226, 227
нитрифицирующие бактерии 224
нитрогеназа 256
нодулины 254
«нокаутные» мутанты 456
нуклеоид 31
О
обратная транкриптаза 408, 407,438
однокопийные гены 391
окислительное фосфорилирование 109, 123
окислительный пентозофосфатный путь 157, 227, 230,
231,298
оксалоацетат 235
оксид азота (NO) 227, 381
оксилипины 316
олеозины 296
олеосома 35,295,296,315,320
олигосахариды 344
опины 445
осмотики 37
основное кольцо (master circle) 411
открытая рамка считывания 410
П
паракват 104
ияря-кумаровая кислота 349
ияря-кумаровый спирт 353
пектины 23, 223
пеларгонидин 359
пептидаза 431
пептидилтрансфераза 421
пептидильный сайт 421
первичная клеточная стенка 23
переаминирование 165, 192
передаточные клетки (transfer cells) 273, 275
перекись водорода 102, 104, 174, 313, 316
перибактероидная мембрана 252, 254
перидерма 359,356
перинуклеарное пространство 20
пероксидазы 353
пероксисомы 20, 34, 33, 166, 170, 174, 175, 165, 171,433
пестициды 322, 458
468
Указатель
пинен 334
пинорезинол 353
пиперидиновые алкалоиды 324
пиретрин 331
пиридиновое кольцо 324
пироллидиновое кольцо 324
пирофосфатаза 188
пируват 235, 241, 332
пируватдегидрогеназа 296
пируватдекарбоксилаза 281
пируватфосфатдикиназа 188, 190, 194, 192, 197
плазматическая мембрана (плазмалемма) 19, 292
плазмида 440, 439
плазмида-помощник 450
плазмодесмы 25, 26, 187, 222, 273, 407
пластидный геном (пластом) 27, 31,408
пластиды 27, 388, 426
пластогидрохинон 96
пластоглобулы 31
пластохинон 87, 88, 96, 106, 131, 334, 343
пластоцианин 94, 98, 433
подофил л отоксин 353
полиаденилатный хвост 438
полилинкерная последовательность 448
полимеразная цепная реакция (ПЦР) 401
полиморфизм длин рестрикционных фрагментов (RFLP)
399
полипептидные гормоны 380
полиплоиды 389
полисомы 422
полифенолы 359
порины 49, 28, 31
порфирины 58
порфобилиноген 246
последовательность Шайн-Дальгарно 421
пояски Каспари 355
праймеры 401
пренилпирофосфаты 343
пренилтрансферазы 344, 334, 344
пробковая ткань 355
проводящий пучок 273
провитамин А 342,461
проламеллярное тело 31
проламины 284
пролегумин 286
пролин 237
промежуточные клетки (intermediary cells) 273, 274
пропластиды 27, 28, 26
протеасомы 434
протеиназа 288, 324
протеинкиназы 367
протеинфосфатазы 368, 367
протеолитическая деградация 383
протон-движущая сила 109, 110, 112
протонный градиент 32
протонофоры 111
протопорфирин IX 246
протопласты 452
протохлорофиллид 248
прямые повторы 411
псевдоциклический электронный транспорт 104
псорален 324,351
птерин 382
пуриновое кольцо 326
пурпурные бактерии 56, 59, 80, 73, 77, 83
пэтч-кламп метод 45, 183
Р
разветвляющий фермент 206
разделение зарядов 81
разобщитель 111, 112, 136
раффинозы 216,273,274
реакционные центры 63, 66, 77, 73, 99, 81, 107, 146, 163,
176
реакция сверхчувствительности 323, 381
реакция Хилла 76
редактирование РНК 414
редуктаза нитрогеназы 256
редуцирующий конец 202
резвератрол 357
резервный крахмал 203
рекомбинация прямых повторов 411
рентгеноструктурный анализ 78
репликазы 407
репортерные гены 455
ретарданты 373
ретровирусы 407, 408
ретротранспозоны 408
рецептор-подобная киназа (RLK) 368, 379, 380
рибозофосфатизомераза 152, 159
рибосома 35,410,421
рибосомальная РНК 391
рибулозобисфосфаткарбоксилаза/оксигеназа (RubisCO)
146, 148, 163, 176, 391,410
рибулозофосфаткиназа 161, 162, 152
рибулозофосфатэпимераза 152, 159
ризобии 252
ризомания 459
рицин 285
рициноленовая кислота 310
РНК-полимеразы 410,391
родопсин 342
ротенон 357
С
сайленсеры 393
сайты рестрикции 399
сайты транслокации 429
салициловая кислота 350,369,381
сапонины 340
Саузерн-блот 400
сахароза 201, 202, 210, 216, 273, 275
сахарозосинтаза 210,222,278
сахарозофосфатсинтаза 210,214,233
сахарозофосфатфосфатаза 210
сахароспирты 216
световые реакции фотосинтеза 76, 143
светособирающие комплексы (ССК) 65,89, 105
Указатель
469
седогептулозо-1,7-бисфосфатаза 152, 161, 162 семейства генов 391 семихинон 82, 96 серные бактерии 56, 74 сесквитерпены 332, 339, 338 сигнальная последовательность 285, 429, 456 сигнальный пептид 35 симбиоз 28,27,31,260,261 симбиосома 252 симпласт 24, 25, 407 симпорт 39 синаповая кислота 349, 357 синаповый спирт 353 синглетное состояние 61 синглетный кислород 63 синильная кислота 326 сирогем 227, 228, 266 системин 380 ситовидные пластинки 273 ситовидные трубки 223 ситовидные элементы 273, 275 ситостерин 340 сквален 339 скипидар 331,341 смола хвойных деревьев 338, 341 снимающй ветвление фермент 206 соланин 324 сорбит 216 спейсер 398,410, специальная пара 77, 80 сплайсинг 397 сплайсосома 398 стахиоза 216 стеариновая кислота 312,365 стерины 290 стероиды 332 стильбенсинтаза 357 стильбены 357, 460 стоп-кодон 422 стром 28 структурные гены 391 субгеномные кольца 411 суберин 187,355 сукцинатдегидрогеназа (комплекс II) 128, 131, 133 сульфат 263,271 сульфит 271 сульфитредуктаза 266 сульфолипиды 292 сульфохиновоза 307 супероксиддисмутаза 102 супероксид-радикал 102, 104, 139 супершаперонный комплекс 426 сфинголипиды 290, 292 Т-ДНК 446 Т-ДНК-инсерционные мутанты 458 темновая стадия фотосинтеза 76, 143 термогенез 351 терпеноиды 331 тетрагидрофолиевая кислота 269 тетрапиррол 58, 69, 92 тетраплоиды 388 тиаминпирофосфат (ТРР) 126, 128, 152, 155 тилакоиды 28, 433 тиоглюкозидаза 328 тиоредоксин 104, 119, 160, 161, 174, 194, 267, 288 тиоэфирная связь 126,128,267 тирозин 347 тирозинаммиаклиаза 349 токоферолы 344 тонопласт 26, 120 точка углекислотной компенсации 176, 177, 185 травматин 320 транзиторный крахмал 203, 207, 216 трансаминирование 170 трансгенные (генетически модифицированные) сорта 458 транскетолаза 152, 159 дирянокоричная кислота 349 транскрипционный фактор 394 транслокатор 41,43,40 трансляция 421 транспирация 179 транспозаза 404 транспозоны 404, 444 транспортные РНК 391 триацилглицерин 294, 309, 315, 289, 294 триозофосфат 143,150,202 триозофосфатизомераза 150 триозофосфат-фосфатный челнок (переносчик) 181, 202 триозофосфат-фосфоглицератный челнок (переносчик) 174, 190, 192,202 триплет нуклеотидов 443 триплетное состояние 63, 81, 107 триплоиды 389 триптофан 371 тритерпен 339 тропан 325 тургор 26 тяжелые металлы 269 У убигидрохинон 82 убиквитин 434 убиквитин-активирующий фермент (Е1) 434 убиквитин-конъюгирующий белок (Е2) 434 убиквитин-протеинлигаза (ЕЗ) 434
Т таксол 326 тандемные повторы 390 танины 322,359,361 тапетум 415 убисемихинон 82 убихинон 78, 128, 131, 132, 133, 140, 332, 343 УДФ-галактоза 305 УДФ-глюкозопирофосфорилаза 210, 278 УДФ-глюкозоэпимераза 216 УДФ-глюкоза 222, 305
470
Указатель
умбеллиферон 351
унипорт 39
устьица 179,181,376
у рейды 255
уропорфириноген III 246
Ф
фактор GroEL 426
фактор элонгации 421
факторы инициации 421
факторы транскрипции 393
фарнезилпирофосфат 334, 338
фенилаланин 347
фенилаланинаммиаклиаза (PAL) 381, 347
фенилпропаноиды 245, 347, 355
фенольные соединения 347, 381
феофитин 87, 89
ферредоксин 99, 104, 119, 160, 170,227,228,231,256,
266, 302
ферредоксин-НАДФ-редуктаза 74, 99
феруловая кислота 349
ФЕП-карбоксикиназа 192, 316
фибриллы 354
фикобилины 65, 69
фикобилипротеиды 69
фикобилисома 71, 69
фикоцианин 71
фикоцианобилин 71
фикоэритрин 69
фикоэритробилин 69
филлохинон 98, 99, 344
фитоалексины 323, 339, 340, 345, 349, 357, 381,460
фитогликоген 203
фитогормоны 345, 362, 369, 436, 445, 450
фитоен 342
фитоендесатураза 342
фитол 58, 245, 334, 344
фитопатогены 322
фиторемедиация 269
фитосульфокины 380
фитохелатины 267, 269
фитохромы 382, 362, 436
фитоэкдистероиды 340
фитоэстрогены 358
флаванон 357
флавин 382
флавинадениндинуклеотид (ФАД) 133, 226, 227
флавинмононуклеотид (ФМН) 132,165
флавоноиды 245,254,357,356,381
флавонолы 357
флавоны 357, 359
флоэма 273
флуоресценция 63
фолдинг 425
форбол 340
фосфат 143
фосфоглицерат 235
фосфатаза нитратредуктазы 233
фосфатидилинозитол 365
фосфатидилхолин 309
фосфатидная кислота 292, 309, 365
фосфатный транслокатор 138
фосфогликолат 165
фосфогликолатфосфатаза 165
фосфоглицераткиназа 149,208
фосфоенолпируват (ФЕП) 243
фосфоенолпируваткарбоксикиназа 192, 316
фосфоенолпируваткарбоксилаза (ФЕП-карбоксилаза)
129, 181, 188, 192, 196, 235
фосфолипаза С 363, 365
фосфолипиды 292
фосфоресценция 63
фосфорилаза 207
фотоавтотрофы 55
фотодыхание 130, 165, 166, 170, 176, 177,228,234
фотоингибирование 107, 106
фотосинтетическая электрон-транспортная цепь 130
фотосистема I (ФС I) 66, 84, 97, 99, 189,410
фотосистема II (ФС II) 84, 87, 89, 106, 227, 410
фототропин 362, 382
фотофосфорилирование 109
фруктаны 218,219
фруктаны инулинового типа 219
фруктаны леванового типа 219
фруктаны неокестозного типа 219
фруктозо-1,6-бисфосфатаза 152, 161, 162,212
фруктозо-2,6-бисфосфат 212
фруктозо-6-фосфаткиназа 213
фруктокиназа 278
фузикокцин 233,323
фумараза 128
фуранокумарины 351
X
халкон 356, 358
халконизомераза 357
халконсинтаза 356,381
хемиосмотическая гипотеза 96, 113, 109
хемолитотрофы 56
хинин 326
хинолиновые алкалоиды 326
хиноны 96
хитиназа 460
хлоропласты 20, 27, 28, 166, 203, 231, 292
хлорофиллы 58, 245, 248, 334, 344
хлорофиллид 248
холестерин 339
хромопласты 27, 31
хромофоры 60, 92
ц
целлюлоза 21,22,210,221,354
целлюлозосинтаза 221
цианобактерии 69, 74, 130, 224, 408
цианогенные гликозиды 324, 326
цикл Кальвина 144, 162, 156, 189, 206, 210
цикл Кребса (цикл трикарбоновых кислот) 122, 132, 237,
316
Указатель
471
цикл Хэтча-Слэка 186
циклаза 320
циклизация 337
циклинзависимые протеинкиназы (CDK) 368
циклины 368
циклическая АДФ-рибоза (цАДФР) 376
циклический электронный транспорт 83, 100
циклическое фотофосфорилирование 100, 189
цинковый палец 393
циркадный ритм 362
цитозоль 20
цитокинины 369, 375, 445
цитоплазма 20
цитоскелет 26
цитохром-а/а3-комплекс (комплекс IV) 131, 133
цитохром-b/Cj-комплекс (комплекс III) 133, 137
цитохром-Ь6/Ё-комплекс 94, 105, 131,410
цитохромоксидаза 133,326
цитохромы 92, 123,249
цитратсинтаза 127, 314
Ш
шапероны 226, 426, 486
шероховатый эндоплазматический ретикулум 426
шикиматный путь 235, 243, 347
э
экдистероиды 340
экзоамилазы 206
экзоны 392
экзоцитоз 37
экситон 65
экспансины 23
эктомикориза 261
элиситоры 323, 345, 356, 368
элонгазы 296, 308
элонгация 421
эндоамилазы 206
эндодерма 355
эндомембранная система 37
эндонуклеазы 411
эндонуклеазы рестрикции 399
эндоплазматический ретикулум (ЭР) 20, 34, 292, 344
эндосимбионты 408,414
энергетическая ловушка 69
энга-каурен 372
энхансеры 393
эритрозо-4-фосфат 243
эруковая кислота 310, 312, 461
эстрогены 358
этилен 271,361,377,369
этиопласты 31
эфирные масла 337
эффект Эмерсона 84
Я
ядерная оболочка 20
ядерные поры 20
ядро 20, 388
ямонин 339, 340
А
АВС-транспортеры 267
С
С3-растения 176, 185, 183, 184
С4-растения 176, 186, 188, 184, 185
С4-метаболизм НАД-малатдегидрогеназного типа 192
С4-метаболизм НАДФ-маликэнзимного типа 197
С4-метаболизм ФЕП-карбоксиназного типа 188
Са2+-каналы 181
Са2+-зависимые протеинкиназы (CDK) 367, 381
САМ-метаболизм 196, 197
D
DELLA-белки 374
Н
Н+-пирофосфатаза 120
Н+-АТФаза 275
Н+-Е-АТФаза 114, 161
Н+-Р-АТФаза 120,179,224,233,371
Н+-У-АТФаза 196
Е
EF-руки 367
G
G-белок 363, 385
Q
Q-цикл 96, 97, 137
N
Nod-факторы 252
Р
Р-450-монооксигеназы 91
S
S-аденозилметионин (SAM) 269, 349, 378, 397
Т
Taq-полимераза 402
Ti-плазмида 437, 450
V
vir-гены 446
Z
Z-схема фотосинтеза 84