Author: Третьяков Н.Н. Кошкин Е.И. Макрушин Н.М.
Tags: физиология растений полеводство полевые культуры и их производство общее растениеводство биохимия агрономия
ISBN: 5-10-002915-3
Text
УЧЕБНИК
ФИЗИОЛОГИЯ
И БИОХИМИЯ
СЕЛЬСКО*
ХОЗЯЙСТВЕННЫХ
РАСТЕНИЙ
УДК 581.1:633(075.8)
ББК41.2я73
Ф50
Авторы: проф. Н. Н. Третьяков — «Введение», главы 7
(совместно с А. С. Лосевой и проф. Н. М. Макрушиным), 8
(совместно с А. С. Лосевой), 10; проф. Е. И. Кошкин — главы 2 (совместно
с Н. В. Пилыциковой), 3; проф. Н. Н. Новиков — главы 6, 9;
доцент Т. В. Карнаухова — глава 1; доцент Н. В. Пилыцикова—
главы 4, 5.
Редактор А. С. Максимова
Рецензент доктор сельскохозяйственных наук, профессор М. К. Литвинова
(Мичуринский государственный педагогический институт)
Физиология и биохимия сельскохозяйственных растений
Ф50 /Н. Н. Третьяков, Е. И. Кошкин, Н. М. Макрушин и др.;
под ред. Н. Н. Третьякова. — М.: Колос, 2000 — 640 с: ил. —
(Учебники и учеб. пособия для студентов высш. учеб.
заведений).
5-10-002915-3. г
Рассмотрены физиологические функции растений на примере
основных сельскохозяйственных культур. Большое внимание уделено
современным представлениям о водном обмене растений, их минеральному
питанию, регуляторным механизмам роста и развития растений, адаптации
растений к экологическим факторам среды.
Изложены физиология и биохимия формирования качества урожая
сельскохозяйственных культур.
Для студентов сельскохозяйственных вузов по агрономическим
специальностям.
I5ВN 5-10-002915-3
УДК 581.1:633(075.8)
ББК 41.2я73
Издательство «Колос», 1998
ВВЕДЕНИЕ
Предмет и задачи физиологии растений. Физиология
растений — наука, которая изучает процессы жизнедеятельности и
функции растительного организма на всем протяжении его
онтогенеза при всех возможных условиях внешней среды; наука об
организации, управлении и интеграции функциональных систем
в растительном организме; наука о функциональной активности
растительных организмов.
Биохимия растений изучает химический состав и превращение
веществ у растений.
Объектом изучения физиологии и биохимии растений служит
громадный и разнообразный мир растений. Предметом
физиологии являются функции растений, функциональные системы,
обеспечивающие реализацию генетической программы роста и
развития. Функции зеленого автотрофного растения: питание
(воздушное — фотосинтез, почвенное — минеральное и водное);
дыхание; рост и развитие; размножение и др. Функции зеленого
автотрофного растения можно объединить в четыре группы
жизненных явлений: процессы превращения веществ, превращения
энергии, изменения формы, управления и информации
растительных организмов.
; Взаимная координация этих процессов обеспечивает
существование растений в непрерывно изменяющихся условиях
внешней среды, продуктивность ценозов и агрофитоценозов. Поэтому
необходимо исследование функций целого растения и функций
посева как единой системы. Урожай сельскохозяйственной
культуры является результатом взаимосвязанных физиологических
процессов растений, составляющих ценоз, определяется
особенностями конкретного вида и сорта растения, условиями, в
которых оно выращивается.
{& задачи физиологии растений входят раскрытие сущности
процессов, протекающих в растении, установление их взаимной
связи, изменения под влиянием среды механизмов их регуляции^
Главная задача физиологии растений — раскрытие сущности
процессов жизнедеятельности растительного организма в онтогенезе
в различных условиях среды с целью управления ходом роста и
развития растений, формированием урожая и его качеством.
Управление качеством является особо важной задачей биохимии
растений.
По мнению К. А. Тимирязева, «цель стремлений физиологии
растений заключается в том, чтобы изучить и объяснить
жизненные явления растительного организма и не только изучить и
объяснить их, но путем этого изучения и объяснения вполне
подчинить их разумной воле человека так, чтобы он мог по
произволу видоизменять, прекращать или вызывать эти
явления». Конечная цель физиологических исследований — разработка
приемов управления обменом веществ конкретных видов и
сортов растений путем активного вмешательства в деятельность
функциональных систем, определяющих рост и развитие
растений, их конечную продуктивность и качество урожая.
Глубокое изучение биохимических превращений веществ
позволяет установить их связь с физиологическими процессами.
Зная общие закономерности жизнедеятельности растительного
организма, агроном может средствами агротехники создавать
благоприятные условия для получения устойчивых урожаев
зерна, кормовых, технических и других сельскохозяйственных
культур, наивысшей их продуктивности. Особая задача
физиологии — создание новых скороспелых, высокопродуктивных и
устойчивых сортов сельскохозяйственных растений. Учитывая
ухудшающуюся экологическую обстановку, система
агрономических мероприятий, обеспечивая высокую продуктивность
растениеводства, должна одновременно способствовать охране
природы. В этом также немалая роль физиологии растений.
2, Место физиологии растений в системе биологических
дисциплин. Физиология растений относится к биологическим,
теоретическим наукам, является отраслью экспериментальной ботаники,
которая в XIX в. выделилась в самостоятельную науку. В разное
время на базе физиологии растений сформировались
вирусология (1902 г.), агрохимия (1910 г.), химия гербицидов и
стимуляторов роста (1925 г.), микробиология (1930 г.), биохимия
(1930 г.). Физиология растений тесно связана с биохимией,
биофизикой, микробиологией, цитологией, генетикой,
молекулярной биологией, химией, физикой, использует современные
методы химии, физики, математики, кибернетики. Успешное
развитие биохимии способствует изучению обмена веществ и энергии
растений на субклеточном и молекулярном уровнях. Трудно
установить границы между отдельными биологическими науками,
науками о жизни. Однако прежде всего физиология растений
обеспечивает необходимую интеграцию всех биологических
знаний на уровне целого растения и ценоза, в этом ее особая роль
в системе биологических наук.
3 Физиология растений как фундаментальная основа
агрономических наук. К. А. Тимирязев неоднократно указывал, что
физиология растений является теоретической основой
рационального земледелия. Изучая основные закономерности жизнедея-
Г
I
тельности растений, раскрывая зависимость функций растений
от условий внешней среды, физиология растений является
фундаментальной основой всех агрономических наук (земледелие,
растениеводство, овощеводство и др.), создает теоретическую
основу агротехнических систем, направленных на повышение
урожайности и качества продукции сельскохозяйственных культур.
Фундаментальную основу современного научного земледелия и
агротехники сельскохозяйственных культур составляют
результаты исследований и рекомендации в области:
теории фотосинтетической продуктивности посевов,
разработки методов повышения использования растениями солнечной
энергии, позволяющих довести использование ФАР до 3—5 %
(вместо 0,5—1,5 %);
разработки физиологических основ и способов применения
минеральных удобрений под сельскохозяйственные культуры,
позволяющие более эффективно использовать минеральные
удобрения без вредных экологических последствий;
раскрытия механизмов и повышения уровня биологической
фиксации азота атмосферы бобовыми растениями;
выяснения составляющих водного баланса растений и
разработки приемов более продуктивного использования осадков,
оросительной воды, внедрения капельного и импульсного
орошения, автоматизированных оросительных систем;
раскрытия природы механизмов устойчивости растений к
неблагоприятным факторам внешней среды, приемов,
позволяющих растению в экстремальных условиях не только выжить, но и
обеспечить достаточно высокую продуктивность (приемы
повышения морозоустойчивости, холодостойкости, солеустойчи-
вости и др.);
физиологии иммунитета растений, механизмов и условий,
повышающих устойчивость сельскохозяйственных растений к
болезням и вредителям;
познания регуляторных систем и механизмов,
обеспечивающих упорядоченность и регуляцию физиологических процессов,
способность растений к адаптации в широком диапазоне
меняющихся условий среды;
использования фитогормонов и синтетических регуляторов
роста, позволяющих направленно влиять на ход формирования
урожая и его качество в технологиях сельскохозяйственных
культур;
использования специальных методов и технических средств
диагностики функционального состояния растений в полевых
условиях, в селекционном процессе, в закрытом грунте для
успешного «диалога» с ним с целью оптимизации условий
выращивания, борьбы с болезнями и вредителями, оценки засухо-,
морозо-, солеустойчивости (показатели газообмена,
биоэлектрические потенциалы, градиенты температур, скорость водного
тока и др.);
теоретических физиологических и биохимических основ
хранения урожая, снижения его потерь с использованием инертных
газов, полупроницаемых мембран, консервантов и др.;
изучения потребности оптимальных режимов и способов
облучения отдельных видов и сортов растений в сооружениях
защищенного грунта в овощеводстве, в селекционном процессе;
изучения процессов и механизмов распределения ассимилятов
в онтогенезе растений в целях направленного формирования
урожаев.
Как фундаментальная область знаний физиология растений
служит также теоретической основой биотехнологии и
биоинженерии растений.
Применение минеральных удобрений, гербицидов,
физиологически активных веществ, химических препаратов для защиты
растений от болезней и вредителей требует дальнейшего
глубокого и всестороннего изучения их влияния на рост и обмен
веществ растительных организмов с целью значительного
повышения продуктивности сельскохозяйственных растений. В
селекционном процессе, при разработке агротехнических приемов и
осуществлении технологий сельскохозяйственных культур
необходимо основываться на достигнутом уровне знаний физиологии
конкретной сельскохозяйственной культуры.
'Главнейшие этапы развития физиологии растений как науки.
Физиология растений зародилась в XVII—XVIII вв. Датой ее
рождения как науки считают 1800 г., когда был издан
пятитомный труд швейцарского ботаника Ж. Сенебье «Физиология
растений». Этот ученый предложил термин «физиология растений»,
сформулировал основные задачи новой науки.
Основоположниками физиологии растений в России являются Андрей Сергеевич
Фаминцын (1835—1918) и Климент Аркадиевич Тимирязев
(1843—1920). А. С. Фаминцын, академик Российской академии
наук, в 1867 г. организовал в Санкт-Петербургском университете
первую в России кафедру физиологии растений, а в системе
Академии наук — лабораторию анатомии и физиологии
растений, прообраз современного Института физиологии растений
АН России (ИФР). Он автор книги «Обмен веществ и
превращение энергии в растениях» (1883 г.) и первого отечественного
учебника по физиологии растений (1887 г.). Среди учеников
А. С. Фаминцына Д. И. Ивановский, открывший вирусы
(1892 г.), М. С. Цвет, разработавший принципы адсорбционно-
хроматографического анализа (1903 г.), О. В. Баранецкий,
С. Н. Виноградский, В. А. Ротерт, А. А. Рихтер и другие
известные ученые.
Ж. А. Тимирязев — профессор Петровской земледельческой и
лесной, академии (ныне Московская сельскохозяйственная
академия имени К. А. Тимирязева) и Московского государственного
университета, академик Российской академии наук. Основные
исследования К. А. Тимирязева посвящены процессу
фотосинтеза. Им опубликованы труды «Жизнь растения» (1878), «Чарльз
Дарвин и его учение» (1883), «Борьба растений с засухой» (1891),
«Земледелие и физиология растений» (1906) и др?7
Условно выделяют три этапа развития физиологии растений.
Первый этап — разработка основ корневого питания, второй
этап — разработка ' проблемы превращения энергии, третий
этап — современный период. Физиология растений сначала
развивалась как наука о почвенном питании.
Для первого этапа характерен повышенный интерес к
основам почвенного корневого питания растений, эта проблема
занимала центральное место. Голландец Ван-Гельмонт (1579—
1644) ошибочно считал воду единственным питательным
веществом для растения (водная теория питания растений).
А. Теер утверждал, что органическое вещество растения берут
непосредственно из почвы (гумусовая теория питания растений);
Ю. Либих доказывал необходимость полного возвращения в
почву всех элементов, в том числе кремния, кроме азота,
вынесенных с урожаем. По его мнению, азот в виде аммиака в
достаточном количестве содержится в воздухе. Ж. Бусенго,
Г. Гельригель и М. С. Воронин в середине прошлого века
(1866 г.) показали роль бобовых в фиксации азота. Русский
ботаник М. С. Воронин в 1866 г. доказал образование клубеньков на
корнях бобовых из паренхимных тканей, наличие в клубеньках
клубеньковых бактерий. Огромный вклад в изучение проблемы
минерального питания внес Д. Н. Прянишников (1865—1948),
который всесторонне изучил азотный обмен и другие вопросы
минерального питания сельскохозяйственных растений.
Дальнейшее развитие учение о минеральном питании получило в
работах Д. А. Сабинина, Я. В. Пейве и др.
Второй этап — разработка проблемы превращения
энергии. М. В. Ломоносов (1711—1765) впервые высказал мысль, что
растение строит свое тело с помощью листьев за счет окружающей
атмосферы. В 1772—1782 гг. Д. Пристли, Я. Ингенхауз и Ж.
Сенебье, дополняя друг друга, открыли явление фотосинтеза, т. е.
способность зеленых растений усваивать СОг из воздуха с
использованием солнечного света. На экспериментальное изучение
поставлена новая категория явлений жизни растений — проблема
превращения энергии, началось изучение фотосинтеза как энерге-
тического процесса. (_К. А. Тимирязев доказал применимость
закона сохранения энергии к процессу фотосинтеза"?Много
сделали для развития этого направления отечественные ученые
В. И. Палладии, В. Н. Любименко, Е. Ф. Вотчал, М. А. Монте-
верде, Н. М. Гайдуков, А. А. Красновский, А. Н. Теренин,
А. А. Ничипорович, Т. Н. Годнев, А. Т. Мокроносов и др.
Дыхание, энергетическая роль его свойственны всем живым
организмам. Первые исследования дыхания растений были
проведены в конце XVIII в. (А. Лавуазье и др.). В раскрытии
химизма дыхания ведущая роль принадлежит русским ученым
А. Н. Баху, В. И. Палладину, С. П. Костычеву, немецкому
ученому О. Варбургу, американцу Д. Кейлину и др.
В XIX в. окончательно сложились основные разделы
современной физиологии растений: фотосинтез (Ж. Бусенго, Ю. Сакс,
А. С. Фаминцын, К. А. Тимирязев, М. С. Цвет, М. Ненцкий и
Л. Мархлевский, А. Н. Бах), дыхание (А. С. Фаминцын, Л. Пас-
тер, А. Н. Бах, Г. Э. Бертран), водный режим (Г. Дютроше,
Г. Де Фриз, Ю. Сакс), минеральное питание (Ю. Либих, Ж- Бу-
сёнго, Г. Гельригель, И. Кноп, С. Н. Виноградский, М. В. Чэейе-
ринк, Д. Н. Прянишников), транспорт веществ (В. Пфеффер,
Е. Ф. Вотчал), рост и развитие (Ю. Сакс, А. С. Фаминцын,
О. В. Баранецкий, А. Ф. Баталии, Н. Ф. Леваковский, Г. Фехтинг,
Г. Клебс), движение (Т. Найт, Ю. Сакс, Ч. Дарвин, Ю. Визнер,
В. А. Ротерт, В. Пфеффер), раздражимость (Б. Сандерсон, Ч.
Дарвин, Н. Ф. Леваковский), устойчивость растений (Д. И.
Ивановский, К. А. Тимирязев, Г. Молиш). Возникла эволюционная
физиология растений, устанавливающая приспособительный к
внешним условиям характер функциональных особенностей растений
(Ч. Дарвин, К. Бернар, А. С. Фаминцын, К. А. Тимирязев).
В первой половине XX в. ведущим направлением физиологии
растений становится изучение биохимии дыхания (В. И. Палладии,
Г. Виланд, С. П. Костычев, О. Варбург, Д. Кейлин, Т. Тунберг,
Г* Кребс, А. Корнберг и др.) и фотосинтеза (Р. Вильштетер,
К. Б. Ван-Ниль, К. Хилл, М. Кальвин, Д. И. Арнон и др.),
развиваются фитоэнзимология, физиология растительной клетки и
экологическая физиология растений. Основоположником
экологической физиологии растений является Н. А. Максимов (1880—1952).
Им и его учениками (И. И. Туманов, Ф. Д. Сказкин, В. И.
Разумов, Б. С. Мошков, Л. И. Джапаридзе, В. Г. Александров,
А. Ф. Клешнин, В. М. Леман, И. В. Красовская и др.) выполнены
классические работы по морозоустойчивости, засухоустойчивости,
росту и развитию, светокультуре растений. Важнейшим событием
явилось открытие эндогенных регуляторов роста и развития
растений — фитогормонов (Д. Н. Нелюбов, Н. Г. Холодный, Ф. Вент,
Ф. Кегль, И. Д. Куросава и Т. Ябута, Ф. Скуг и др.), создание гор-
8
I
мональной теории роста и развития растений (Н. Г. Холодный,
М. X. Чайлахян).
Для третьего этапа физиологии растений второй
половины XX в. характерны ее слияние, интеграция и
взаимопроникновение с биохимией и молекулярной биологией,
биофизикой, цитологией, анатомией и генетикой растений. Нынешний
этап наряду с углублением исследований на субклеточном и
молекулярном уровнях отличается интересом к изучению систем
регуляции, обеспечивающих целостность растительного
организма (А. Л. Курсанов, М. X. Чайлахян, И. И. Гунар, В. В.
Полевой, В. И. Кефели и др.), а также дальнейшей разработкой
теоретических проблем физиологии, направленных на решение
практических задач сельского хозяйства. Большое внимание
физиологи растений уделяют изучению механизмов реализации
наследственной информации, роли мембран в системах регуляции,
механизмам действия фитогормонов, электрофизиологии
растений, адаптивных реакций растений к стрессовым воздействиям.
Развитию этих исследований способствуют успехи в разработке и
использовании методов культуры органов, тканей и клеток,
успехи новой науки — биотехнологии (Р. Г. Бутенко, В. Е. Семенен-
ко, В. С. Шевелуха и др.). В сельском хозяйстве все более
широкое применение находят достижения и идеи физиологии
растений — теория минерального питания и водного обмена,
химические регуляторы роста растений, гербициды и др.
Характерной чертой развития физиологии растений современного
периода являются ее тесная связь с практикой, научным
земледелием и растениеводством, обоснование и разработка новых
приемов возделывания сельскохозяйственных культур, участие в
практической селекции сортов.
Биохимия растений как наука зародилась в России. В 1814 г.
академик Российской академии наук Г. К. Кирхгоф описал
гидролиз крахмала под действием прорастающих семян ячменя.
Выдающийся вклад в биохимию растений внесли русские ученые
А. С. Фаминцын (труд «Обмен веществ и превращения энергии
в растениях», 1883), А. Н. Бах, В. И. Палладии и С. П.
Костычев (механизм спиртового брожения и дыхания), Д. Н.
Прянишников (превращение азота при прорастании семян), Н. Н.
Иванов и др. Под руководством академика А. Н. Баха в России была
создана техническая биохимия: производство лимонной кислоты
(С. П. Костычев, В. С. Буткевич), производство чая (А. Л. Кур-
санов), усовершенствованы виноделие (А. И. Опарин),
хлебопечение (В. Л. Кретович), ферментация табака (А. И. Смирнов),
получение витаминов из растительного сырья (В. Н. Букин) и
т. л. В настоящее время биохимия растений во многих вопросах
успешно интегрируется с физиологией растений.
:9
Основные направления современной физиологам растений. Базу
отечественной физиологии растений и ее мировую славу в
прошлом создали работы А. С. Фаминцына, К. А. Тимирязева,
М. С. Цвета, Н. А. Максимова, Т. Н. Годнева, Д. А. Сабинина,
Д. Н. Прянишникова, Н. Г. Холодного, В. Н. Любименко,
А. Л. Курсанова. Они заложили и основные направления этой
науки. В современной физиологии растений различают шесть
принципиально важных направлений (А. Л. Курсанов, 1973):
биохимическое, биофизическое, онтогенетическое,
эволюционное, экологическое, синтетическое (кибернетическое).
Биохимическое направление исследует
функциональную роль различных органических веществ, образующихся в
растениях, закономерности минерального питания, пути биосинтеза
органических соединений, роль минеральных веществ как
регуляторов состояния клеточных коллоидов, биокатализаторов
процессов метаболизма, центров электрических явлений в клетке.
Биофизическое направление исследует биофизические
основы физиологических функций и функциональных систем,
вопросы энергетики, электрофизиологии, физико-химические
закономерности фотосинтеза и дыхания, водного режима,
корневого питания, роста и развития, раздражения растений.
Онтогенетическое направление исследует возрастные
закономерности развития растений, морфогенез, приемы
управления развитием растений (фотопериодизм, светокультура,
закаливание растений и др.).
Эволюционное (сравнительное) направление исследует
физиологические особенности филогенеза конкретных видов,
особей растений, особенности онтогенеза растений при
определенных внешних условиях, изучает онтогенез как функцию
генотипа и внешних условий.
Экологическое направление исследует зависимость
физиологических функций растений от экологических факторов
среды, участвует в разработке эффективных приемов управления
ростом и развитием растений в производственных условиях
(оптимизация условий минерального питания, водного режима,
приемы повышения белковости, сахаристости урожая,
повышение устойчивости растений к неблагоприятным внешним
условиям и др.).
Синтетическое (кибернетическое) направление
исследует общие закономерности роста растений, энергетики и кине^
тики взаимосвязанных физиологических процессов в системе це~
лого растения, разрабатывает способы регуляции и управления
процессами в биологических системах.
В дополнение к названным целесообразно выделить
прикладное (частная физиология) направление. Оно исследует физиоло-
10
\)
гию конкретных видов и сортов сельскохозяйственных культур с
целью совершенствования их агротехники, получения
максимально возможных и устойчивых урожаев, разрабатывает
физиологические паспорта и модели сортов основных
сельскохозяйственных культур применительно к региональным почвенно-кли-
матическим условиям страны, разрабатывает методы и приборы
диагностики физиологического состояния и оценки
устойчивости растений.
В биохимии растений также существуют различные
направления: аналитическое, физиологическое, прикладное,
генетическое, молекулярное и квантовое. Большое будущее принадлежит
биохимической генетике.
Для фундаментальных исследований процессов
жизнедеятельности растений все направления физиологии и биохимии
растений важны и взаимосвязаны. Теоретическая физиология
растений и ее влияние на практику будут развиваться по пяти
основным направлениям, объективно вытекающим из мировых
тенденций развития науки и практики (А. Т. Мокроносов, 1988).
Первое направление развития физиологии растений —
организация, регуляция и интеграция функциональных систем в
растительном организме на разном уровне организации (от моле-
кулярно-биологического до ценотического). На молекулярно-
биологическом уровне это организация и экспрессия генома, его
регуляция, исследование мембранных структур и клеточных ор-
ганелл, взаимодействие компартментов в клетках, исследование
потоков веществ, энергии и информации в различных системах
клетки. На надклеточном уровне — исследование плазмодесм и
других канализированных путей передачи сигнала, информации,
энергии в этих специализированных многоклеточных
композициях. На уровне целого растения — изучение систем дальнего
транспорта, донорно-акцепторных отношений, физиологии
запасающих органов, аттрагирующих систем. И наконец,
исследования на уровне ценозов в практических целях в связи с
проблемами регуляции и оптимизации природных и агросистем.
Второе направление развития физиологии растений — мо-
лекулярно-генетические и физиологические основы онтогенеза
растений. Проводятся исследования проблем организации,
координации и кооперации всех геномов клетки — ядерного, плас-
тидного, митохондриального и даже вирусного, взаимодействие
которых обеспечивает рост, специализацию, морфогенез,
развитие, сексуализацию растительного организма в онтогенезе. Это
направление связано с ролью фитогормонов и других природных
регуляторов гормонально-ингибиторной природы в реализации
генетической программы онтогенеза растений, включает разра-
11
ботку приемов вмешательства в процессы жизнедеятельности
растений в практических целях.
Третье направление развития физиологии растений —
фотосинтез и продукционный процесс. Исследуются принципы
структурной организации фотосинтетического аппарата как
системы первичной трансформации и запасания световой энергии;
физиолого-генетические и энергетические составляющие
фотосинтетической продуктивности в онтогенезе растения, ядерно-
пластидные генетические отношения, фотосинтетический
метаболизм углерода и азота, организация донорно-акцепторных
систем фотосинтеза на клеточном, субклеточном и организменном
уровнях; оптимизация фотосинтетической деятельности агрофи-
тоценозов; разработка принципов управления
фотосинтетической продуктивностью и продукционным процессом в
биотехнологических, промышленных и биорегенерационных системах,
промышленная фитотроника, создание высокоэффективных
систем культуры растений в закрытом грунте, где растение
соединено с управляющей ЭВМ, создание систем жизнеобеспечения для
наземных и космических целей.
Четвертое направление развития физиологии растений —
это физиолого-биохимические и молекулярные основы
устойчивости растений к неблагоприятным условиям температуры,
водного режима, избытка солей, гипо- и аноксии, радиации,
устойчивости к биологическим патогенам и другим факторам.
Проблема адаптации растений к стрессовым условиям, иммунитета к
биологическим патогенам — ключевая для земледелия.
Изучаются защитные системы на клеточном структурно-метаболическом
уровне, включающие индукцию синтеза протекторных
соединений, сопряженность всех последовательных процессов, начиная
с восприятия сигнала клеточными рецепторами, индукции
экспрессии генома, синтеза адаптивных белков, изменения липид-
ного и белкового комплекса мембран, далее следуют морфо-
структурные изменения растений.
Пятое направление развития физиологии растений —
фотосинтез и продуктивность как фактор сбалансированности
биосферных процессов на земле исследует биосферные процессы,
начиная от состояния озонового экрана, включая процесс
снижения гумуса в почвах.
Помимо названных фундаментальных проблем развития
физиологии растений эта наука решает значительный комплекс
практических задач в условиях природных экосистем
(количественное исследование энерго-, массообмена, экология растений,
защита генофонда), в условиях полевого земледелия
(неблагоприятное воздействие на экологическую среду, резкое ухудшение
качества растительной продукции — загрязнение нитратами и
12
I
I
I
1
нитритами, повышенный мутагенный фон, загрязнение среды
пестицидами и другие проблемы адаптивного земледелия), в
условиях фитотрона (проблемы промышленной фитотроники,
реализация биологического потенциала растения, методы
оптимального поиска и оптимизации среды с помощью специальных
датчиков растений и ЭВМ).
Особенно важны для нашей страны разработка научных основ
адаптивного земледелия, гарантирующего получение устойчивых
урожаев независимо от погодных условий, основ экологического
земледелия, создание энерго- и ресурсосберегающих технологий
в растениеводстве, обеспечение высокого качества
растениеводческой продукции. В решении этих вопросов большая роль
принадлежит физиологии и биохимии растений. Влияние
физиологии растений на селекционный процесс должно быть более
эффективным. Необходимо помнить слова академика Н. И. Вавилова
о том, что «генетика и селекция ждут от физиолога разработки
частной физиологии отдельных культур, сортовой физиологии,
физиологической систематики сортов. Создание такой
«физиологической систематики» оплодотворит всю работу селекции и
упростит ее». Ставится задача вывести, интенсивные,
отзывчивые на высокий фон, имеющие комплексную устойчивость
сорта и гибриды сельскохозяйственных культур, создать
оптимальные физиологические модели сортов для различных зон
страны. Реализация указанной программы исследований имеет
большое значение для ускорения научно-технического
прогресса в земледелии. Раскрывая зависимость биологических
процессов, происходящих в растениях, от условий внешней
среды, физиология растений создает теоретическую основу для
системы приемов, направленных на повышение
продуктивности растений, улучшение качества сельскохозяйственной
продукции.
Методы физиологии, растений и уровни исследований. Физио-
, логия растений — наука экспериментальная. Основной метод
познания функций, процессов и явлений жизнедеятельности
растений в физиологии — эксперимент, опыт. Для изучения физико-
химической, биохимической и биологической сущности
функций, процессов в физиологии растений применяют лабора-
торно-аналитический, вегетационный и полевой методы
исследований, методы меченых атомов, световой и электронной
микроскопии, электрофореза, хроматографического анализа,
ультрафиолетовой и люминесцентной микроскопии, спектрометрии,
иммунологии, кристаллографии, математики и кибернетики.
Физиологические исследования проводят в фитотронах и
лабораториях искусственного климата, где растения выращивают в кон-
13
тролируемых, заданных экспериментатором условиях
(температура, режим освещения, состав воздуха и др.)- ^
Современная физиология растений все больше сближается с
физико-химической биологией. Вместе с тем она имеет
специфические, свойственные только этой науке методы
исследований: методы водных и песчаных культур, биотестов,
исследования фотопериодизма, системы красный — дальний красный,
культуры клеток и тканей и др. Изолированная клетка —
незаменимый объект исследований фундаментальных основ
физиологии растений, а также клеточной биотехнологии и биоинженерии
растений. Господствующим принципом физиологических
исследований является принцип причинности, используются
аналитический и синтетический подходы в познании явлений жизни
растения. Физиологи разрабатывают математические модели
физиологических процессов, которые экспериментально
проверяются. Многие физиологи в работах применяют диалектический
метод, исторический подход к изучению функций растительного
организма.
С помощью всех этих методов физиологи исследуют процессы
жизнедеятельности растений на различных уровнях организации,
начиная от молекулярно-биологического, биохимического и
клеточного уровней и кончая биогеохимическим. На молекулярном
уровне изучают функции нуклеиновых кислот, белков и других
веществ, на клеточном и субклеточном — функции клеток и ее
органелл, на органном — функции листа, стебля, корня и т. д.,
на организменном — функции целого интактного растения, на
популятивном — функции вида и сорта растений, на полевом
(ценотическом) — функции фито- и агрофитоценозов, на
биогеохимическом — системы растение — почва и глобальные
процессы в биосфере Земли.
Глава 1
ФИЗИОЛОГИЯ И БИОХИМИЯ
РАСТИТЕЛЬНОЙ КЛЕТКИ
1.1. СТРУКТУРА И ФУНКЦИИ РАСТИТЕЛЬНОЙ КЛЕТКИ
1.1.1. ОСНОВНЫЕ ПРИНЦИПЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ
РАСТИТЕЛЬНОЙ КЛЕТКИ
Ц {Миллиарды лет эволюции привели к появлению на нашей
планете организмов, различия между которыми достигают
колоссальных размеров. В то же время у животных и растений, у
мельчайших бактерий ч*~1!тоат1тсгого"жргга^екввй№ есть общее
свойство — все они состоят из клеток. Более того, именно эта
структурная единица всего живого претерпела наименьшие
изменения с момента ее возникновения до наших дней.
Совершенство внутренней структуры обеспечивает выполнение клеткой
практически всех функций организма. Таким образом, клетка
является не только его структурной, но и функциональной
единицей^.
Живая клетка состоит из тех же химических элементов, что и
неживая природа. Процессы, происходящие в клетке,
подчиняются общим законам физики и химии. Согласно первому закону
термодинамики энергия для клеточной работы не может
создаваться из ничего и исчезать бесследно. Как вся природа, клетка
подчиняется и второму закону термодинамики — в ней
последовательно возрастает энтропия и происходит «разупорядочеиие»
структуры. Однако в функционировании и самом существовании
живых систем есть уникальные особенности: по сравнению с
неживыми структурами скорость возрастания у них энтропии
минимальная. Можно сказать, что жизнь — это способность
поддерживать упорядоченное состояние в течение длительного
времени. По мнению американского ученого А. Ленинджера (1976),
«клетка способна сохранять прекрасную в своей сложности
хрупкую структуру благодаря непрерывному потреблению энергии;
как только поступление энергии прекращается, структура клетки
распадается». Другими словами, поддержание совершенной
клеточной структуры — энергозависимый процесс.
Главная особенность живых организмов заключается в том,
что они представляют собой открытые системы, которые
обмениваются с окружающей средой энергией, веществом и
информацией (рис. 1).
Фотосинтезирующие клетки растений потребляют солнечную
энергию и превращают ее в химическую форму. Универсальной
15
Среда
Энергия солнца
Вещество
Информация
Внешние
раздражители
Растительная клетка
Фотосинтез
Свет
^ Механическая
у? работа
АТФ *•" Активный
"*" ч. транспорт
4 ч веществ
Теплота
Биопотенциалы
Биохеми- / Биосинтез
люминесценция веществ
I .>
Дыхание - '
Поглощение
-♦- Биохимические структуры
Выделение
Отходы
жизнедеятельности
Живые
структуры
♦
■ Распад
Сигналы
Сигналы
Возбуждение
Изменение структур и функций
Рис. 1. Обмен растительной клетки со средой энергией, веществом и
информацией (по Т. В. Карнауховой, 1991)
клеточной «валютой» служат молекулы АТФ, обеспечивающие
важнейшие процессы жизнедеятельности и прежде всего
биосинтез соединений, являющихся необходимыми компонентами
структур и участниками функций клетки — белков, липидов,
углеводов, нуклеиновых кислот и т. д. Часть энергии АТФ
затрачивается на механическую работу (например, движение
цитоплазмы), другая часть идет на активный транспорт веществ
против физико-химических градиентов. Большую роль играют в
клетке механизмы, обеспечивающие сигналы о быстрых измене*1
ниях окружающей среды. При этом часть энергии АТФ
превращается в электрическую (биопотенциалы) или световую (биохе-
милюминесценция), которые вновь высвобождаются в среду.
Образованные при фотосинтезе органические вещества
участвуют в другом важнейшем процессе — дыхании. Окислительный
распад дыхательных субстратов приводит к освобождению за-
16
ключенной в них энергии — часть ее вновь локализуется в
универсальных аккумуляторах — молекулах АТФ — и может затем
использоваться по указанным направлениям. Более половины
энергии окисления превращается в теплоту и в этой форме
выделяется в окружающую среду. Таким образом осуществляется
обмен энергией между клеткой и средой.
Обмен веществом включает процесс поглощения из
окружающей среды диоксида углерода, воды, минеральных веществ,
участвующих в клетке в многочисленных биохимических реакциях.
В результате этих процессов клетка строит и поддерживает свои
структуры, а продукты распада и отходы жизнедеятельности
выходят в окружающую среду, где они подвергаются
превращениям.
Обмен информацией начинается с восприятия клеткой
сигналов от внешних раздражителей. Возникающее в клетке
возбуждение приводит к изменению функциональной активности клетки.
Сигналы о происшедших переменах клетка посылает в
окружающую среду.
Таким образом, способность жить, т. е. длительное время
находиться в упорядоченном, энергетически насыщенном
состоянии, обусловливается постоянным обменом клетки и среды
веществом, энергией и информацией. Основные проявления
жизни — обмен веществ, рост и размножение — обеспечиваются
ртроиной системой структурно и функционально связанных
элементов клетки.
1.1.2. НЕКОТОРЫЕ МЕТОДЫ ИЗУЧЕНИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ
К настоящему моменту структура растительной клетки
достаточно хорошо изучена. Это оказалось возможным благодаря
современным методам исследования и развитию техники.
Рассмотрим кратко некоторые способы изучения клетки.
В световом микроскопе наблюдаемый объект освещается
относительно длинными волнами видимого света (400—700 нм),
что не позволяет получить увеличение более чем в 1000 раз. С
середины XX в. в биологии стали широко использовать
электронный микроскоп, где вместо светового луча применяется поток
электронов, источником которого является раскаленная
металлическая нить в электрическом поле. Благодаря этому
разрешающая способность электронного микроскопа превышает
способность светового в десятки, сотни и тысячи раз.
Электронно-микроскопическая техника требует использования чрезвычайно
тонких срезов (около 0,1 мкм). Прежде чем сделать такой срез,
объект необходимо фиксировать (например, глутаровым
альдегидом), контрастировать с помощью металла (например, четырех-
окисью осмия) и обезводить. Срез делают с помощью алмазных
17
или стеклянных ножей. Наиболее эффективным считается метод
замораживания—скалывания—травления, который позволяет
изучать глубокую внутреннюю структуру клеточных образований
(органелл, мембран). Суть его в том, что с быстро
замороженного жидким азотом объекта, сохраняющего свою прижизненную
структуру, охлажденным ножом под вакуумом делаются сколы.
Следующий этап работы — травление, т. е. возгонка части воды;
поверхность скола напыляют тонким слоем углерода, а затем
металла. Так получается реплика. Органические вещества клеток
растворяют в кислотах, а реплику исследуют с помощью
электронного микроскопа, получая фотографии тонкого строения
объекта.
Для изучения химического состава и функций отдельных
клеточных частиц с успехом применяется метод дифференциального
центрифугирования. Специальные приборы (гомогенизаторы)
позволяют (при нейтральном рН, охлаждении, присутствии саха-
ров) получить однородную клеточную массу — гомогенат.
Последний подвергается центрифугированию. При небольших
ускорениях оседают крупные клеточные частицы, при большей
скорости вращения — мелкие. Современные центрифуги
позволяют очень тонко дифференцировать структуры клетки. Так, при
ускорении, равном 1—3 тыс. §, выделяются ядра; увеличивая
последовательно ускорение, добиваются выхода хлоропластов,
митохондрий и самых легких компонентов — при 50 тыс. §
оседают микросомы, мембранные элементы.
Электронно-микроскопический контроль позволяет убедиться в чистоте полученной
фракции, которая может быть подвергнута дальнейшей очистке и
химическому исследованию.
Заслуживают внимания и другие способы изучения клетки.
Микрохирургия позволяет оперировать с конкретным
компонентом клетки под микроскопом; цитохимические методы основаны
на применении красителей или реактивов, с помощью которых
удается определить размеры, внешнее и внутреннее строение
органелл и локализацию в клетке различных химических
веществ.
1.1.3. СТРОЕНИЕ И ФУНКЦИИ КОМПОНЕНТОВ КЛЕТКИ
Основными частями любой клетки являются ядро и
цитоплазма, составляющие вместе протопласт. Однако в отличие от
животной растительная клетка имеет особенности, связанные с
автотрофным питанием и специфическим образом жизни. К
числу таких отличий относятся клеточная стенка, большая
центральная вакуоль, пластиды, плазмодесмы.
Особое образование на поверхности протопласта, продукт его
деятельности — клеточная стенка. Под микроскопом в ней
можно обнаружить два компонента — более или менее однород-
18
Рис. 2. Микростроение клеточной стенки корешка гороха:
/ — участок плазмодесмы (по Ж.-К. Ролану и др., 1978)
ный рыхлый матрикс и прочную арматуру в нем (рис. 2).
Расположение арматурных элементов имеет свои особенности: в
ближней к протопласту зоне оно отражает ориентацию
специфических клеточных элементов — микротрубочек, в более удаленных
слоях арматурные элементы располагаются хаотично.
10бразование клеточной стенки начинается в метафазе клеточ-
19
ного деления^В экваториальной зоне возникает срединная
пластинка, состоящая из пектата кальция, которая, нарастая от
центра к периферии, отделяет одну новообразованную клетку от
другой] Срединная пластинка с той и другой стороны покрывается
первичной клеточной стенкой. Рост в толщину происходит за
счет наложения новых слоев со стороны содержимого каждой
клетки (аппозиция). Рост в длину начинается с разрыхления
матрикса. В этом процессе важную роль играют фитогормоны. В
образовавшиеся полости поступают новые порции материала, из
которого строится клеточная стенка (интусусцепция). Синтез и
транспорт этих веществ осуществляются главным образом
вакуолями аппарата Гольджи.
[Основой химического состава клеточной стенки являются
полисахариды. Средний состав первичной клеточной стенки
высших растений таков: целлюлоза — 25 % от сухой массы,
пектиновые вещества — 30, гемицеллюлозы — 40, белки и другие
вещества — 5 %.
Целлюлоза — основное вещество арматуры — представляет
собой высокомолекулярный полимер (3-глюкозы, молекулы
которой соединены между собой 1—4-гликозидными связями со
степенью полимеризации 8—12 тыс. Около 100 молекул целлюлозы
ассоциируются в мицеллы, мицеллы формируют «веревочки» —
микрофибриллы, а последние «канаты» — фибриллы.
Матрикс состоит из пектиновых веществ и гемицеллюлоз.
Пектиновые вещества — это главным образом полимеры галакту-
роновой кислоты. Особую роль в связывании этих молекул
играет кальций, взаимодействующий с их карбоксильными группами.
Гемицеллюлозы — сложные полимеры различных
моносахаридов: арабинозы, маннозы, ксилозы и др. Если пектиновые
вещества придают матриксу высокие гидрофильные свойства, то
гемицеллюлозы, связываясь с целлюлозными структурами,
закрепляют их специфическую организацию. В клеточной стенке
присутствуют белки: во-первых, это ферменты, участвующие в ее
синтезе, во-вторых, белки, защищающие клетку от инфекции
путем разрушения оболочки и самой клетки патогена (хитиназы,
протеазы). Для клеточной оболочки специфичен белок экстен-
зин, богатый аминокислотой пролином.?
Некоторые клетки формируют вторичную клеточную стенку.
Она превосходит первичную по плотности и отличается по
химическому составу. В зависимости от функций клеток
конкретных тканей (проводящей, защитной, механической) доля
целлюлозы может возрастать до 60 % и более. Кроме того, во вторич..-_
ной клеточной стенке могут находиться вещества, усиливающие
ее изолирующие свойства и прочность, — лигнин, суберин,
минеральные соли.
I Химический состав и структура клеточной стенки определяют
[ ее важнейшие свойства — прочность, эластичность, высокую
20
гидрофильность. Фу_нкдии_клеточной^стенки, знадательны и раз-
^^ообразны.
Опорная, благодаря ей клетка поддерживает свою форму и
размеры.
Защитная, препятствующая проникновению в протопласт
частиц, способных его повредить, а также патогенных
микроорганизмов.
Буферная по отношению к воде. В полисахаридной оболочке
может сосредоточиваться до 30 % ее содержания в клетке; при
водном дефиците она может использоваться протопластом.
Транспортная, осуществляющая диффузионное передвижение
гидрофильных веществ по насыщенному водой матриксу. Кроме
клеточных стенок в диффузионном движении воды и
растворенных в ней веществ участвуют межклетники. Клеточные стенки и
межклетники вместе образуют так называемое свободное про-
) странство — апопласт, составляющее 10—15 % объема
растительной ткани. Часть этого пространства способна адсорбировать
различные ионы за счет электростатических взаимодействий
последних с компонентами клеточных стенок. Этот объем
называется доннанбвским свободным пространством. Адсорбция ионов
клеточной стенкой облегчает их дальнейшее движение в клетку.
В общей массе растения клеточным стенкам принадлежит
основная доля. Это отражается в химическом составе целого
растения. Так, в зрелом растении кукурузы углеводы составляют
83,3 % сухой массы, белки — 8,7, липиды — 2,3, а зола — 5,7 %.
Углеводы клеточных стенок служат ценным питательным
веществом для сельскохозяйственных животных. Кроме того,
целлюлоза является важным сырьем для промышленной переработки.
Доля целлюлозы в клеточных стенках хозяйственно полезных
растений различна, что и определяет то или иное их
использование. Так, в волосках коробочек хлопчатника целлюлозы
содержится 90 %, в древесине ее около 50 %. Прочность,
эластичность, энергетическая значимость позволяют использовать это
ценное вещество в производстве ткани, бумаги, спирта и даже
взрывчатых веществ.
Протопласты всех клеток растения связаны в единую
целостную систему — симпласт. Таким образом происходят
взаимодействие отдельных клеток и частей многоклеточного организма и
регулирование его жизнедеятельности. Межклеточные связи
осуществляются через поры в клеточной стенке с помощью
специфичных для растений достаточно сложно^ устроенных цитоплазма-
тических образований — плазмодвсм\ Плазмодесма представляет
собой канал диаметром 40—50 нм, выстланный плазмалеммой,
которая, переходя из клетки в клетку, образует непрерывную
внешнюю мембрану. В канале имеется центральный стержень,
окруженный десмотрубочкой, в свою очередь, состоящей из
нескольких трубчатых элементов. Вся полость канала заполнена ци-
21
топлазмой (рис. 3). Со стороны каждой клетки к плазмодесмам
вплотную подходят (а иногда и входят внутрь) элементы эндо-
плазматической сети, что обеспечивает еще более тесные
контакты между клетками. Число и размеры плазмодесм варьируют в
соответствии с типом ткани и ее функциональной нагрузкой. В
листовой пластинке пшеницы, где осуществляется транспорт ас-
симилятов, на 1 см2 поверхности приходится 2108 плазмодесм. В
среднем площадь плазмодесм составляет от 0,02 до 8 %
поверхности клеток.
Плазмодесмы выполняют ряд важных функций, среди
которых главными можно считать следующие:
транспорт органических и минеральных веществ,
транспорт веществ-регуляторов (фитогормонов),
передача электрических сигналов.
Однако весьма тонкая и сложная структура плазмодесм
позволяет предположить возможность их участия в других пока не
известных процессах.
Прежде чем охарактеризовать отдельные составные части про-
500 А
Рис. 3. Схема электронно-микроскопического строения плазмодесмы вторичной
древесины ивы (по А. Л. Курсанову, 1976):
ЦС — центральный стержень; Дт — десмотрубочка; ЭР — эндоплазматический ретикулум;
Пл — плазмалемма; Пл' — плазмалемма в канале плазмодесмы; ВП— внутренняя полость
плазмодесмы; КС — клеточная стенка
22
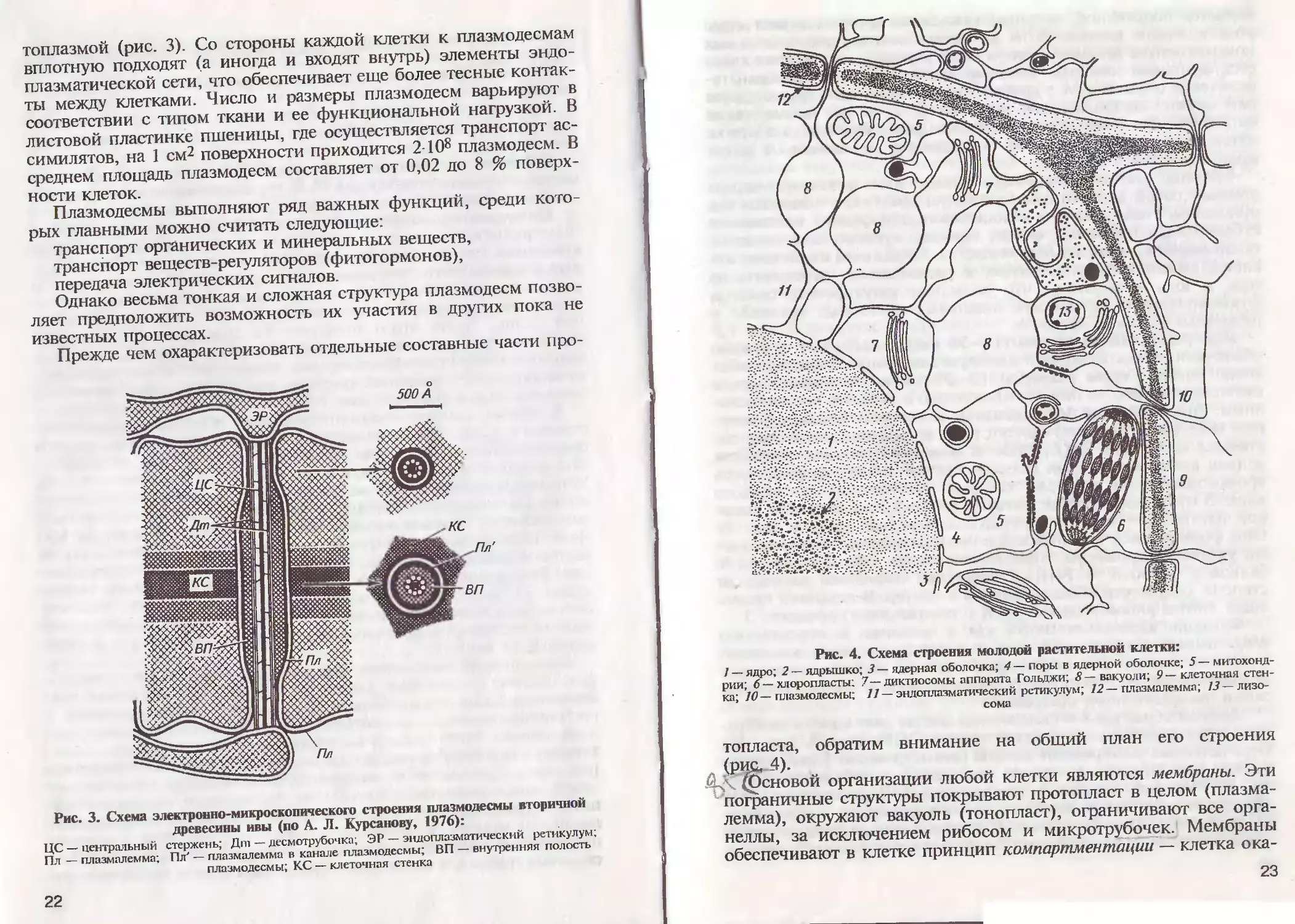
Рис. 4. Схема строения молодой растительной клетки:
/ — ядро; 2 — ядрышко; 3 — ядерная оболочка; 4 — поры в ядерной оболочке; 5 —
митохондрии; 6— хлоропласта; 7— диктиосомы аппарата Гольджи; 8—вакуоли; 9—клеточная
стенка; 10 — плазмодесмы; // — эндоплазматический ретикулум; 12 — плазмалемма; 13— лизо-
сома
топласта, обратим внимание на общий план его строения
Й4)
^ сновой организации любой клетки являются мембраны. Эти
пограничные структуры покрывают протопласт в целом
(плазмалемма), окружают вакуоль (тонопласт), ограничивают все орга-
неллы, за исключением рибосом и микротрубочек. \ Мембраны
обеспечивают в клетке принцип компартментации~~—-'клетка ока-
23
зывается поделенной на зоны, каждая из которых играет свою
роль в жизни клетки. В то же время деятельность отдельных
компартментов взаимосвязана и интегрирована, и это тоже
является функцией мембран. Большая часть клеточных мембран
генетически связана друг с другом, то есть возникает друг от друга
или служит продолжением друг другар В то же время такие
органеллы, как хлоропласты и митохондрии, образуются в клетке
путем деления. Их мембраны, по-видимому, не связаны в своем
происхождении с другими.
Матрикс цитоплазмы — гиалоплазма, или цитозоль, —
представляет собой внутреннюю клеточную среду, где находятся все
органеллы. Гиалоплазма — относительно однородная коллоидная
субстанция, содержащая белки, липиды, нуклеиновые кислоты,
полисахариды, минеральные вещества. Ее важным свойством
является способность уплотняться и разжижаться (переходить из
геля в золь и обратно), что позволяет регулировать связь и
функциональную активность отдельных клеточных органелл в
различных условиях среды.
Ядро растительной клетки (10—30 мкм в диаметре) окружено
оболочкой, представляющей двойную мембрану. В ядерной
оболочке имеются поры размером 10—20 нм, связывающие ядро с
цитоплазмой (рис. 4, поз. 4). Количество и диаметр пор
непостоянны: они зависят от функциональной активности ядра. В
ядерном соке (нуклеоплазме) присутствует хроматин — вещество,
состоящее из белков, ДНК, РНК. В нем сосредоточена
наследственная информация. При делении клетки из него формируются
хромосомы, число и форма которых специфичны для каждого
вида. В нуклеоплазме присутствуют внутриядерные тельца
высокой плотности — одно или несколько ядрышек (рис. 4, поз. 2).
Они формируются в телофазе клеточного деления
определенными участками хромосом. Химический состав ядрышек: 80—85 %
белков и около 5 % РНК. Содержание последней зависит от
степени активности обмена веществ в клетке. В ядрышке
происходят синтез рибосомальной РНК и образование рибосом.
Функции ядра заключаются как в хранении и передаче
наследственной информации, так и в регуляции всей
жизнедеятельности клетки. Это достигается главным образом путем
последовательной экспрессии и репрессии генов в процессе
реализации наследственной программы.
Ядерная оболочка в определенных местах дает начало
мембранам эндоплазматического ретикулума — ЭПР (рис. 4, поз. 11).
Ограниченные мембранами каналы (диаметр около 5 нм)
пронизывают всю цитоплазму, иногда расширяясь в небольшие
вакуоли. ЭПР бывает гладким и шероховатым. Шероховатость ЭПР
зависит от того, что на внешней стороне мембраны
сосредоточены рибосомы. Функции этого ЭПР: транспорт веществ и
сигналов в клетке и между клетками (связь с плазмодесмами); органи-
24
зация белоксинтезирующей системы; синтез некоторых веществ
для клеточной стенки. На гладком ЭПР рибосом нет; его
функции связывают с синтезом веществ липидной природы.
С мембранами ЭПР, а следовательно, и с ядерной мембраной
генетически связан аппарат Гольджи — АГ (рис. 4, поз. 7). В
паренхимной клетке кукурузы около 30 таких органелл. Число их
в клетках, выполняющих секреторные функции, возрастает до
сотен. АГ состоит из диктиосом (цистерн) й везикул (пузырьков,
маленьких вакуолек). В диктиосомах происходит синтез веществ,
преимущественно полисахаридов, а также белков и липидов.
Отделяющиеся от диктиосом секреторные пузырьки, богатые
полисахаридами, транспортируются к плазмалемме, сливаются с ней,
а вещества углеводной природы используются для строительства
клеточной стенки. Таким образом, АГ играет двойную роль,
участвуя как в организации плазмалеммы, так и в образовании и
росте клеточной стенки.
Лизосомы (рис. 4, поз. 13) представляют собой пузырьки (0,2—
0,4 мкм в диаметре), окруженные мембраной, генетически
связанной с ЭПР. Их внутреннее содержимое богато
гидролитическими ферментами. Функции лизосом связаны с
«перевариванием» выполнивших свою роль компонентов клетки или запасных
питательных веществ. Наличие поверхностной мембраны
ограничивает разрушительную деятельность гидролаз. Возможно,
автолиз определенных участков цитоплазмы с помощью лизосом
является также необходимым элементом в формировании
вакуолей растительных клеток.
Пероксисомы — небольшие вакуоли (0,3—1,5 мкм) — также
тесно связаны с ЭПР. Они содержат
окислительно-восстановительные ферменты. Их роль в растении заключается в том, что
они участвуют в фотодыхании — процессе, в котором часть
синтезированных при фотосинтезе веществ при необходимости
окисляется, что может приводить к существенным потерям — до
30—40 % образованных органических веществ.
Сферосомы также образуются из элементов ЭПР. Они
представляют собой пузырьки (100—150 нм в диаметре) и содержат
большое количество липидов и ферменты, связанные с синтезом
и распадом жиров. Особо важную роль играют сферосомы у
масличных культур — при прорастании семян в этих органеллах
осуществляется активная утилизация запасных жиров.
Самой большой частью системы, связанной с мембранами
ядра и ЭПР. является центральная вакуоль. Подобно клеточной
стенке и плазмодесмам, она специфически принадлежит только
растительной клетке. Образуется вакуоль за счет слияния
расширенных участков ЭПР; иногда в нее включаются и участки гиа-
лоплазмы, которые подвергаются ферментативной деградации.
Образовавшийся объем окружен мембраной -41 тонопластом, ре-
гулирующим^оступление и_ выделение веществ. Центральная ва-
. "•"""■———■""- _ 25
куоль взрослой растительной клетки занимает 90 % объема
последней и содержит почти 75 % всей клеточной воды.
В вакуолярном соке содержатся различные вещества: сахара,
органические и аминокислоты, белки, ферменты, пигменты,
другие органические соединения, а также катионы и анионы
минеральных солей и кислот. Вакуоль выполняет в клетке важные
функции. Прежде всего она является осмотическим резервуаром:
концентрация клеточного сока создает необходимый градиент
для поступления воды в клетку. Таким образом, благодаря
вакуоли клетка находится в тургесцентном состоянии. Во-вторых,
вакуоль играет экскрективную роль. В ней накапливаются
продукты обмена веществ, от которых освобождается цитоплазма:
полифенолы, алкалоиды, гликозиды. Один из гликозидов, пигмент
антоциан, придает красивую окраску цветам и плодам, что
обеспечивает нормальное опыление, оплодотворение и
распространение семян. Есть данные, что антоциан косвенно участвует в
энергетическом обмене в хлоропластах. Некоторые вещества,
взаимодействуя друг с другом, образуют в вакуолярном соке
кристаллы — таким способом откладывается щавелевокислый
кальций. Отработанные компоненты могут подвергаться в
вакуоли лизису. Специфические соединения из клеточного сока
используют в промышленности для производства табака (никотин),
чая (танин, катехин), лекарств (кофеин).
Третья важнейшая функция вакуоли — это то, что она служит
депо, в котором хранится резерв ценных питательных веществ;
при необходимости они могут быть израсходованы на нужды
клетки. Главным запасным веществом вакуолей являются
растворимые сахара, первое место среди которых занимает сахароза;
из моносахаридов чаще других встречаются глюкоза и фруктоза.
Человек с успехом использует эти запасы. С помощью селекции
получены сорта овощных, плодовых и ягодных культур с
высоким содержанием ценных веществ в хозяйственно полезных
частях растений. Так, в клеточном соке корнеплодов сахарной
свеклы содержится 18—20 % Сахаров, столовой — около 10,
моркови — 7 %. Ценные питательные и вкусовые качества плодов и
ягод связаны не только с сахарами, но и с органическими
кислотами, растворенными в вакуолярном соке клеток,
преимущественно яблочной, лимонной, щавелевой, винной (табл. 1).
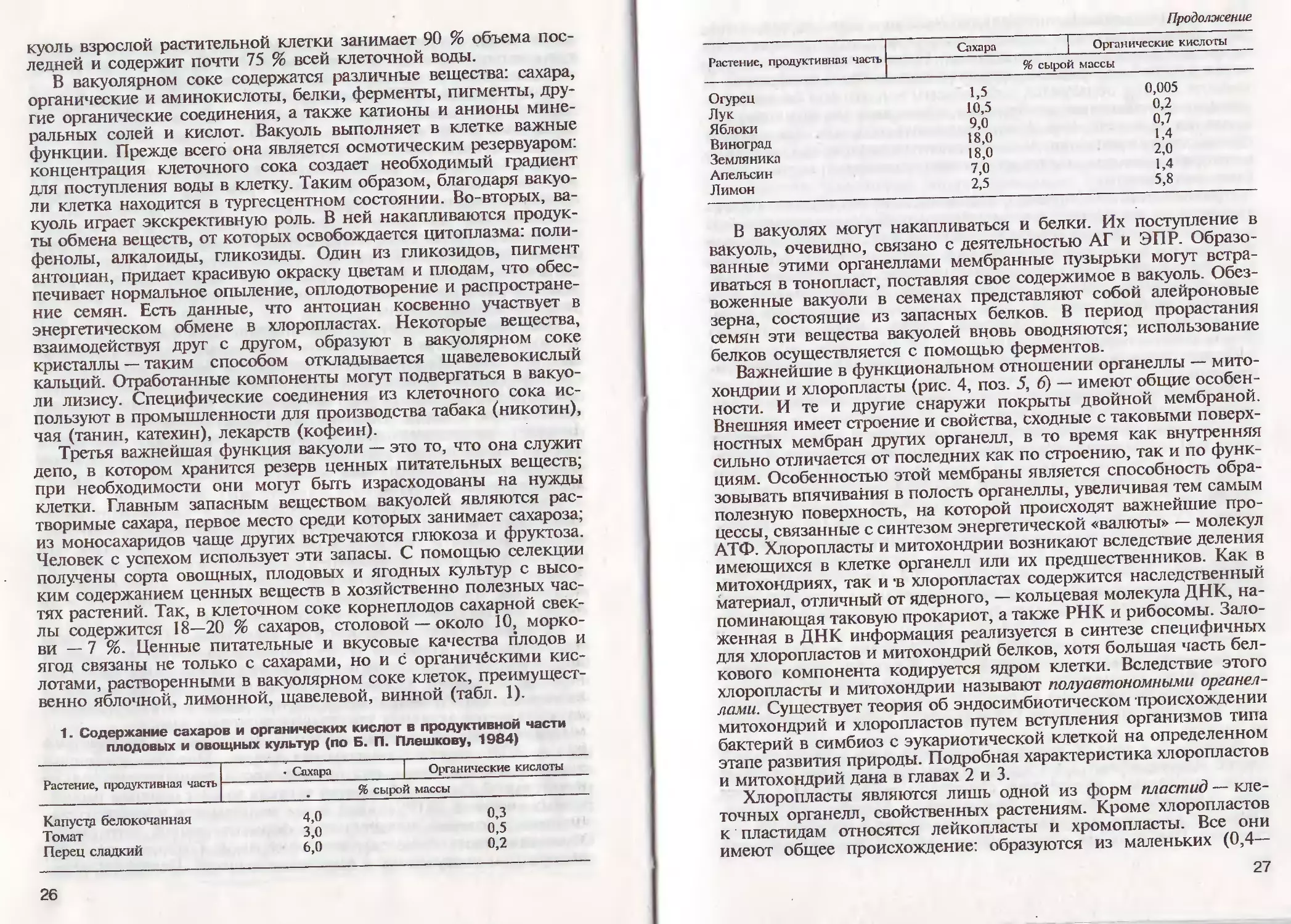
1. Содержание Сахаров и органических
плодовых и овощных культур (по
Растение, продуктивная часть
Капусту белокочанная
Томат
Перец сладкий
• Сахара
4,0
3,0
- 6,0
кислот в продуктивной части
Б. П. Плешкову, 1984)
Органические кислоты
% сырой массы
0,3
0,5
0,2
26
Продолжение
Огурец
Лук
Яблоки
Виноград
Земляника
Апельсин
Лимон
Сахара
1,5
10,5
9,0
18,0
18,0
7,0
2,5
Органические кислоты
% сырой массы
0,005
0,2
0,7
1,4
2,0
1,4
5,8
В вакуолях могут накапливаться и белки. Их поступление в
вакуоль, очевидно, связано с деятельностью АГ и ЭПР.
Образованные этими органеллами мембранные пузырьки могут
встраиваться в тонопласт, поставляя свое содержимое в вакуоль.
Обезвоженные вакуоли в семенах представляют собой алейроновые
зерна, состоящие из запасных белков. В период прорастания
семян эти вещества вакуолей вновь оводняются; использование
белков осуществляется с помощью ферментов.
Важнейшие в функциональном отношении органеллы —
митохондрии и хлоропласта (рис. 4, поз. 5, 6) — имеют общие
особенности. И те и другие снаружи покрыты двойной мембраной.
Внешняя имеет строение и свойства, сходные с таковыми
поверхностных мембран других органелл, в то время как внутренняя
сильно отличается от последних как по строению, так и по
функциям. Особенностью этой мембраны является способность
образовывать впячивания в полость органеллы, увеличивая тем самым
полезную поверхность, на которой происходят важнейшие
процессы, связанные с синтезом энергетической «валюты» — молекул
АТФ. Хлоропласта и митохондрии возникают вследствие деления
имеющихся в клетке органелл или их предшественников. Как в
митохондриях, так и -в хлоропластах содержится наследственный
материал, отличный от ядерного, — кольцевая молекула ДНК,
напоминающая таковую прокариот, а также РНК и рибосомы.
Заложенная в ДНК информация реализуется в синтезе специфичных
для хлоропластов и митохондрий белков, хотя большая часть
белкового компонента кодируется ядром клетки. Вследствие этого
хлоропласта и митохондрии называют полуавтономными
органеллами. Существует теория об эндосимбиотическом происхождении
митохондрий и хлоропластов путем вступления организмов типа
бактерий в симбиоз с эукариотической клеткой на определенном
этапе развития природы. Подробная характеристика хлоропластов
и митохондрий дана в главах 2 и 3.
Хлоропласта являются лишь одной из форм пластид —
клеточных органелл, свойственных растениям. Кроме хлоропластов
к пластидам относятся лейкопласты и хромопласты. Все они
имеют общее происхождение: образуются из маленьких (0,4—
27
1,0 мкм) бесцветных инициальных частиц — пропластид,
которые обнаруживаются в меристематических клетках; увеличение
их числа происходит за счет деления. Пропластиды имеют
достаточно плотное содержимое, ограниченное двойной мембраной. В
темноте из них образуются лейкопласты — пластиды со
слаборазвитыми внутренними мембранами, выполняющие функцию
накопления крахмала или других запасных веществ. На свету в
пропластидах происходит мощное развитие внутренних мембран,
в которые включается зеленый пигмент хлорофилл, — так
возникают хлоропласты.
Хромопласты, как правило, образуются из хлоропластов и
отличаются от последних главным образом набором пигментов — в
них преимущественно содержатся желтые каротиноиды, которые
не встроены в мембраны, а находятся непосредственно в матрик-
се в виде капель или кристаллов. Значение хромопластов
главным образом связано с окраской плодов. В эстетическом
восприятии человека хромопласты играют не последнюю роль:
вспомним золотую осень, красные грозди рябин, аппетитные
плоды томата, перца и т. д.
Далее остановимся на органеллах, не имеющих мембранной
природы.
Важнейшую функцию в клетке выполняют рибосомы: в них
происходит заключительный этап биосинтеза белков —
трансляция. Как уже известно, рибосомы образуются в ядре (точнее, в
ядрышке), а затем через поры ядерной оболочки выходят в
цитоплазму. Они состоят из белка и рибосомальной РНК (примерно
по 50 % того и другого). Рибосомы — очень маленькие частицы
(20—30 нм), образованные из двух субъединиц, которые
характеризуются с помощью коэффициента седиментации (5) —.
скорости осаждения при центрифугировании. В цитоплазме
растительных клеток присутствуют 805 рибосомы, состоящие из 405 и 605
субъединиц. Рибосомы хлоропластов — 705, митохондрий — 70—
805. В рабочем состоянии субъединицы рибосом ассоциируются
друг с другом, что происходит только в присутствии ионов
магния.
Рибосомы могут находиться непосредственно в гиалоплазме
или ассоциироваться с мембраной ЭПР. В синтезе одного белка,
как правило, принимают участие несколько рибосом
(полисомы), объединенные одной молекулой информационной
(матричной) РНК. Это способствует более высокой активности
белкового синтеза.
Интересна и еще до конца не выяснена роль в растительной
клетке микротрубочек. Они представляют собой тонкие длинные
полые цилиндры с внутренним диаметром около 15 нм. Стенки
этих трубочек состоят из глобулярных белков — тубулинов.
Сборка и разборка микротрубочек происходят в цитоплазме
постоянно. При делении клетки микротрубочки формируют нить
28
веретена. Сеть микротрубочек образует в гиалоплазме
своеобразные канальца. Аналогия в расположении арматурных элементов
клеточной стенки и близко расположенных микротрубочек
предполагает участие последних в формировании структуры
клеточной стенки.
Другие фибриллярные образования гиалоплазмы — микрофила-
менты, имеющие в основе сократительный белок типа актина, —
обеспечивают движение цитоплазмы и ее органелл внутри клетки.
Рассмотрим кратко изменение структуры растительной клетки
при действии патогенных микроорганизмов. Учитывая огромный
ущерб, который болезни растений наносят сельскому хозяйству,
агроном должен четко представлять, что происходит в
растительном организме на всех уровнях его организации при
заболевании. Знание ответных реакций на действие патогена поможет
правильно оценить степень заболевания, своевременно
применить нужные агротехнические меры и, наконец, выявить
иммунные формы, сорта и индивидуальные растения, необходимые при
селекции на устойчивость к болезням.
Влияние инфекции на клеточные структуры значительно и
разнообразно. Однако клетка устойчивого организма способна
преодолевать пагубное действие инфекции, выздоравливать, и
это выражается в сохранении и новообразовании клеточных
структур и восстановлении их функций. В таблице 2 дается
представление о типичных изменениях в клетках иммунных и
неиммунных форм растений при действии инфекции.
2. Действие инфекции на структуры и свойства Клетки
Структура, свойство клетки
Неиммунные формы
Иммунные формы
Проницаемость цитоплаз- Сильно возрастает
мы
Гидрофильность цито- Уменьшается
плазмы
Ядро
Уменьшается в размерах
Пластиды
Митохондрии
Рибосомы
Набухают, внутренние
мембранные структуры
разрушаются
Набухают, кристы
исчезают
Новых нет
Изменяется мало
Слабо меняется
Сначала уменьшается,
затем увеличивается
Структура сохраняется
Структура сохраняется
Новообразуются
В заключение важно подчеркнуть следующее.
1. Живая клетка представляет собой целостную открытую
систему, обменивающуюся с окружающей средой веществом,
энергией и информацией.
2. Основой структуры клетки являются биологические
мембраны, осуществляющие компартментацию и взаимодействие ее
отдельных частей.
29
3. Все функции, обеспечивающие жизнь, выполняются за счет
взаимосвязанной работы ядра, цитоплазмы и клеточных органелл.
4. По сравнению с клеткой животных растительная клетка
имеет ряд оригинальных структур — полисахаридную клеточную
стенку, большую центральную вакуоль, пластиды, плазмодесмы;
все это обеспечивает автотрофный тип питания и свойственный
растениям специфический образ жизни.
1.2. ПРИРОДА И ФУНКЦИИ ОСНОВНЫХ ХИМИЧЕСКИХ
КОМПОНЕНТОВ РАСТИТЕЛЬНОЙ КЛЕТКИ
1.2.1. ХИМИЧЕСКИЙ СОСТАВ РАСТИТЕЛЬНОЙ КЛЕТКИ
Сравнивая химический состав клеток самых разных
организмов, нельзя не обратить внимания на строгий отбор, который
осуществила природа при создании живой материи.
Конкуренция между организмами началась лишь после конкуренции
между молекулами. Из 100 известных химических элементов в
составе живых клеток постоянно обнаруживается чуть более 20,
а обязательными для выполнения жизненных функций можно
считать всего 16. В то же время с помощью этого ограниченного
набора элементов построено огромное множество разнообразных
веществ. Так, одних только белков у маленькой бактерии Езспе-
псЫа соН 3 тыс., а у человека их 5 млн. Очевидно, что в
процессе отбора выделились именно те элементы, которые оказались
способными создать соединения с наиболее важными
биологическими свойствами.
Большую часть массы живых клеток составляет вода (около
80 %). Воду не зря называют матрицей жизни — она
обеспечивает прижизненную структуру макромолекул и клеточных
органелл, участвует в химических реакциях, транспортных процессах
и терморегуляции, поддерживает форму и размеры клетки. О
соотношении органических веществ дает представление анализ
цитоплазмы клеток листьев капусты: белки составляют 63,11 %
сухой массы, липиды — 20,75, другие органические вещества —
9,69, а зола — 6,46 % сухой массы. Химический состав активно
функционирующих растительных клеток весьма сходен (табл. 3).
3. Средний химический состав цитоплазмы и органелл растительной
клетки, %
Часть клетки
Белки
Липиды
Нуклеиновые
кислоты
Цитоплазма в целом
Ядро
Хлоропласты
Митохондрии
60-70
70
60-70
55-60
15-20
8
20-25
25-35
5
20
1-3
1-3
30
Оставшаяся доля в сухом веществе цитоплазмы принадлежит
другим органическим веществам — углеводам, пигментам и пр., а
также минеральному компоненту (около 5 %). В клетках,
выполняющих сугубо специфические функции, химический состав
несколько иной. Это касается, например, клеток семян или других
продуктивных частей растений, где хранятся запасные вещества,
ради которых и возделывают сельскохозяйственные культуры.
Так, в составе клеток семени пшеницы содержится 78 %
углеводов, 16 — белков, 2 — жиров и 2 % золы.
Таким образом, белки, липиды и нуклеиновые кислоты
служат химической основой жизненных процессов. Постараемся
выяснить, каким образом состав, структура и свойства этих
молекул позволяют им выполнять важнейшие биологические
функции.
1.2.2. БЕЛКИ И ИХ ФУНКЦИИ В КЛЕТКЕ
Белки представляют собой полимеры, то есть вещества,
состоящие из небольших, сходных по свойствам молекул, связанных друг
с другом ковалентными связями. Биологическая роль полимеров
велика. Это объясняется, по крайней мере, двумя причинами. Во-
первых, объединение мономеров в одну молекулу многократно
усиливает их свойства. Во-вторых, образующаяся полимерная
цепочка укладывается в пространстве в оригинальные структуры,
специфичность которых обусловливает их конкретные функции в
клетке. Существуют гомо- и гетерополимеры. У веществ первой
группы все мономеры идентичны — к таковым относится,
например, целлюлоза, мономером которой является (3-глкжоза, и
важнейший запасной полисахарид крахмал (мономер — а-глюкоза).
Наибольшую ценность в биологическом отношении представляют
гетерополимеры, в молекулы которых объединяются мономеры,
обладающие некоторыми общими свойствами, но не идентичные
Друг другу. К гетерополимерам относятся нуклеиновые кислоты (4
разных мономера) и белки; в состав последних могут входить до 20
различных аминокислот. Аминокислоты, образующие белки,
называются протеиногенными.
Протеиногенные аминокислоты. Молекула каждой
аминокислоты имеет две части: неспецифическую (—СН—СООН), общую
2
для всех, и специфический для каждой радикал (К.):
I Я-СН-СООН
>]н2
Неспецифическая часть придает всем аминокислотам общие
31
амфотерные свойства — они способны диссоциировать и как
кислоты, и как основания.
к-сн-соон
1 К—СН—СОО +Н кислотная диссоциация
I
+н2о|| -н2о
К—СН-СООН + ОН основная диссоциация.
Вследствие этого в водной среде аминокислоты всегда несут и
положительный, и отрицательный заряды. Преобладающий заряд
зависит от рН среды: кислая среда стимулирует основную
диссоциацию, в результате которой амфолит приобретает
положительный заряд; в щелочной среде — обратная картина: степень
кислотной диссоциации больше, чем основной, и амфолит
заряжается преимущественно отрицательно. При определенном
значении рН степень кислотной и основной диссоциации
уравнивается и аминокислота становится электронейтральной.
Это значение рН называется изоэлектрическои точкой (ИЭТ).
Заряженность аминокислот, а следовательно, и белков является
важным условием ассоциирования их с другими молекулами и
интегрирования в различные клеточные структуры.
Специфический радикал аминокислот придает им самые
разнообразные свойства, которые обогащают структурные и
функциональные возможности белков.
По природе радикала протеиногенные аминокислоты можно
разделить на несколько групп.
1. Алифатические (глицин, аланин, валин, лейцин, изолей-
цин).
СНз—СН—СООН
аланин
Специфический радикал этих аминокислот имеет
углеводородную природу и придает им гидрофобные свойства.
2. Оксиаминокислоты (серии, треонин).
сн-сн-соон
он ын2
серии
Группа ОН обеспечивает их гидрофильность.
32
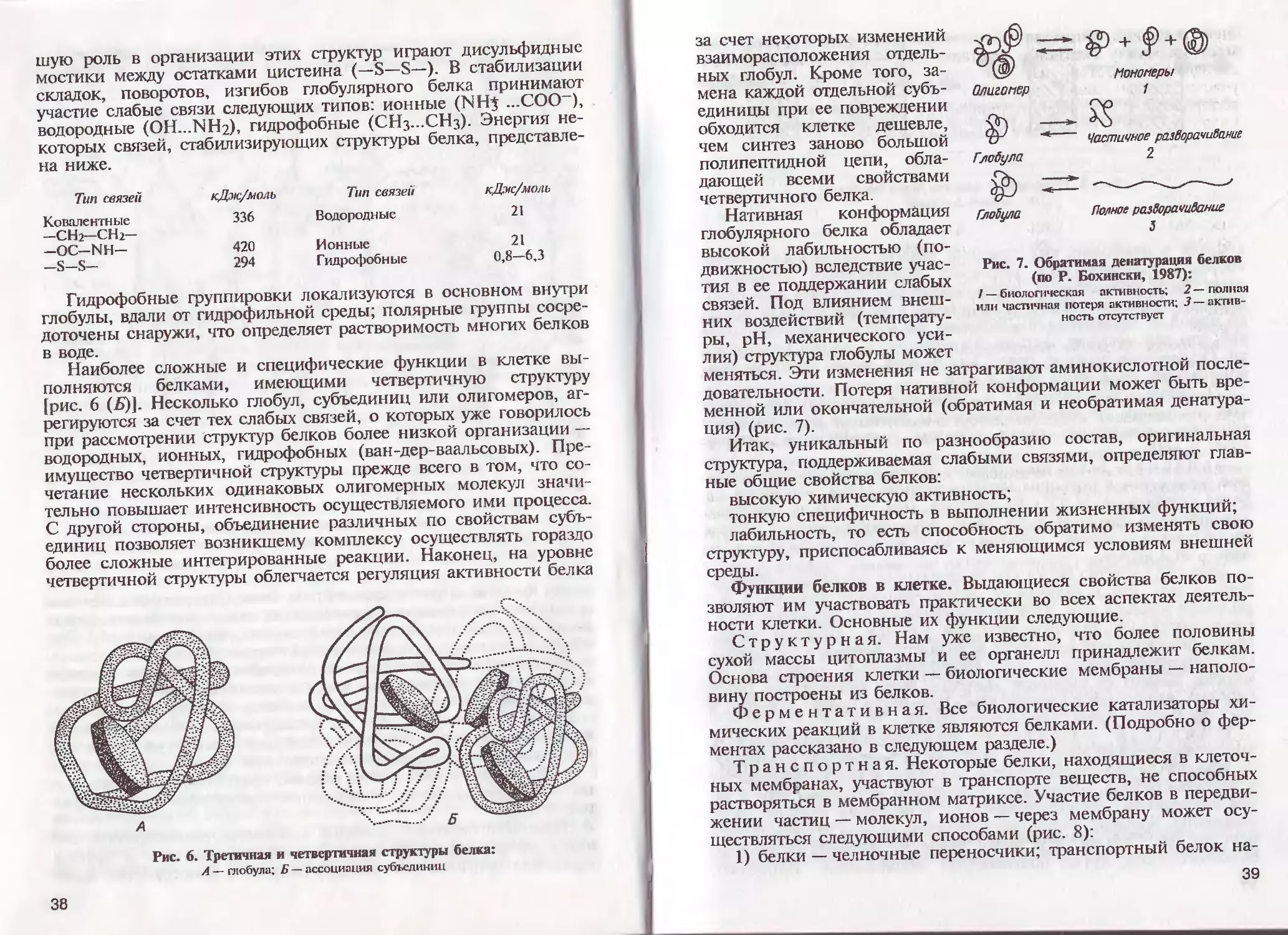
3. Серосодержащие (цистеин, метионин).
Сульфгидрильные группы двух молекул цистеина могут
окисляться с образованием дисульфидных мостиков (—3—8—),
которые играют важную роль в стабилизации третичной структуры
белка
СН;
1
ЗН
5Н
1
СН
,-сн-соон
NН2 ^
КН2 +2Н"
1 /
2-СН-СООН /
СН2-СН-СООН
1 |
1
3
1
А
1
СН
цистеин '
дисульфидный
мостик
1
NН2
ЫН2
2-сн-соон
цистин
4. Моноаминодикарбоновые (аспарагиновая, глутаминовая) —
кислые.
СООН-СНг—СН-СООН
1ЧН2
аспарагиновая кислота
Вторая карбоксильная группа придает этим аминокислотам
высокую химическую активность, гидрофильность,
дополнительный отрицательный заряд.
5. Диаминомонокарбоновые (лизин, аргинин) — основные.
Благодаря дополнительной аминогруппе эти аминокислоты
представляют собой депо азота в клетке.
СН2-СН2-СН2-СН2-СН-СООН
N«2
«1Н2
Величина ИЭТ белков отражает соотношение в них основных
и кислых аминокислот. Если ИЭТ имеет низкое значение —
белок богат кислыми аминокислотами; высокое значение ИЭТ
говорит о существенном содержании основных аминокислот.
Для определения ИЭТ используют цитохимический метод,
основанный на взаимодействии амфолита с основными и
кислыми красителями.
Установлено, что ИЭТ цитоплазмы растительных клеток
лежит в кислой зоне рН. Следовательно, белки цитоплазмы
содержат много дикарбоновых аминокислот. ИЭТ ядра имеет более
высокое значение, так как в ядерных белках содержится много
основных аминокислот. Удалось также выяснить, что значение
33
ИЭТ может характеризовать функциональную активность
клетки. Как правило, активные периоды в жизни растений (молодой
возраст, выход из состояния покоя, подготовка к образованию
репродуктивных органов) сопровождаются «подкислением»
цитоплазмы — ИЭТ снижается.
Динамика ИЭТ цитоплазмы у озимых в период подготовки к
зиме позволяет различить зимостойкие и слабозимостойкие
сорта. Последние характеризуются быстрым прохождением
этапов органогенеза, возобновлением роста в периоды зимнего
потепления, что влечет за собой их гибель. У таких сортов
снижение ИЭТ (до 2,8—3,0) происходит быстро, уже к середине
второго этапа органогенеза. !
6. Ароматические аминокислоты (фенилаланин, тирозин).
^"с- сн2-сн-соон
фенилаланин
Ароматическая группировка определяет гидрофобность этих
соединений.
7. Гетероциклические (триптофан, гистидин).
но
х
с- сн2-сн-соон
н н
триптофан
Эти аминокислоты также имеют в себе большой запас азота..
8. Иминокислоты (пролин, оксипролин).
н2с —сн2
■II
Н2Сч. •СН-СООН
I ■ .'
н
пролин
При образовании циклической структуры из линейной исчет
зает группа гШг и возникает иминная группа N11.
Таким образом, 20 различных аминокислот, участвуя в
образовании белков, придают им разнообразные и противоречивые
34
свойства — гидрофильность и гидрофобность, заражённость и
нейтральность, кислотность и основность, способность
окисляться и восстанавливаться. Учитывая, что в молекуле белка
могут соединяться от 50 до нескольких сотен мономеров, так что
их свойства многократно умножаются, можно понять, какими
огромными функциональными возможностями обладают эти
уникальные соединения.
Несколько слов о питательной ценности аминокислот,
входящих в состав белков. С этой точки зрения их можно разделить
на две группы — заменимые и незаменимые. Последние не
способны синтезироваться в организме человека и животных. К ним
относят валин, лейцин, изолейцин, треонин, метионин, лизин,
аргинин, фенилаланин, триптофан, гистидин. Наличие
достаточного количества этих аминокислот в пищевой и кормовой
продукции значительно повышает ее качество (табл. 4).
4. Состав белков различных семян (г на 100 г белка)
(по Б. Йиргенсонсу, 1965)
Аминокислота
Глицин
Серии
Валин
Метионин
Пролин
Триптофан
Гистидин
Лизин
Глутаминовая
Глиадин
пшеницы
1,0
4,8
2,6
1,6
13,2
0,0
■2,3
1,2
47,0
Зеин
кукурузы
0,0
7,8
3,0
2,8
10,5
0,0
1,7
0,0
27,0
Аминокислота
Алании
Треонин
Лейцин
Цисте и н
Фенилаланин
Тирозин
Аргинин
Аспара готовая
Глиадин
пшеницы
2,0
2,1
5,1
2,5
6,3
3,3
2,7
3,6
Зеин
кукурузы
11,5
3,0
7,4
1.0
6,5
5,3
1,8
5,7
Особенно ценны незаменимые аминокислоты, содержащие
много азота, — лизин, аргинин, триптофан. Ученые всего мира
работают над проблемой селекции зерновых культур с высоким
содержанием лизина в белках. Особенно остро эта проблема
стоит в отношении кукурузы, в семенах которой меньше белков,
чем у других зерновых; к тому же эти белки содержат мало
лизина и триптофана. Тридцать лет назад был открыт мутантный
ген опейк-2, ответственный за содержание лизина в зерне
кукурузы. Его успешно используют в селекции. Однако проблема в
том, что увеличение содержания лизина сопровождается, как
правило, снижением урожайности. Тем не менее удалось
выделить несколько гибридов, где оптимально сочетаются
урожайность зерна и его белковые качества: Краснодарский 1.8 ВЛ дает
до 7 т/га зерна с содержанием белка около 10 % и лизина
0,398 % (против стандартных значений 8,81 и 0,272 %
соответственно).
35
Структура белков. Отдельные аминокислоты соединяются друг
с другом в молекуле белка с помощью пептидной связи:
СН3-СН-СООН + Н^-СН-СН2ОН
I I
мн2 соои
алпнин серии
пептидная связь
+н2о
1МН2 СООН
дипептид алашшсерин
Так создается первичная структура белка, которая
определяется:
природой входящих в молекулу аминокислот;
относительным количеством каждой аминокислоты;
строго определенной аминокислотной последовательностью
полипептидной цепи.
Природу и количество аминокислот устанавливают,
расщепляя белок с помощью кислотного гидролиза и затем анализируя
эту смесь. Последовательность аминокислот определяют путем
ступенчатого отщепления аминокислот с помощью ферментов.
Именно аминокислотный состав и их последовательность
обусловливают не только химические свойства, но и высшие уровни
структуры каждой молекулы.
Реально белок никогда не существует в виде линейной
структуры. В полипептидной цепи вокруг связей, соединяющих ос-уг-
леродные атомы, происходит свободное вращение, в то время
как вращение вокруг оси С—N (более жесткая пептидная связь)
затруднено. В результате этого аминокислотная цепь
закручивается в правую спираль, так называемую ос-структуру [рис. 5 (а)].
Каждый виток ее составляет 3,6 аминокислотного остатка. Таким
образом возникает вторичная структура. Она стабилизируется
слабыми водородными связями: каждая карбонильная группа СО
пептидной связи взаимодействует с группой N14, входящей в
четвертую от СО пептидную связь.
Только в тех местах, где присутствует пролин, ос-спираль
имеет характерные изгибы, так как в пептидных связях,
образованных этой аминокислотой, отсутствует водород (СО—И) и в
этих местах водородная связь образоваться не может. В
образовании вторичной структуры принимают участие все
карбонильные и аминные группы. Это определяет однообразность,
неспецифичность ос-спирали самых разных белков, ос-спираль
наиболее характерна для глобулярных белков. Вторичная структура
36
/
М-конец\
н к н
он к н
С Г N
Л\ / Л /
он
II *
я
И
/ \ / \ / С-конец
с N с си
II / \ I II / V"" I
О Н К Н О Н К Н Водород-
е 1 1 = ные связи
н к н о- н к н о
I V/ II I \ У II
N С С - N С . С
/ \ / \■ л; \ / \ / Л 7 \
С НС С N С V, - НР1.
У. II I ;/ \ II ,| ./ЛМк°Нец
К Н О Н К Н О Н К Н
(У а
Рис. 5. Вторичная структура белка:
« — «-спираль; б — складчатая структура (по Р. Бохински, 1987)
может быть и другого, складчатого типа (р-структура). В этом
случае межмолекулярные водородные связи возникают между
двумя или большим числом параллельных цепей [рис. 5 (б)}. Так
образуются главным образом фибриллярные белки.
Специфическая деятельность разнообразных белков в живой
клетке осуществляется ими лишь в состоянии нативной
(прижизненной) структуры, которая является трехмерной —
третичной или четвертичной. Для ее расшифровки используют метод
рентгеноструктурного анализа. Впервые третичную структуру
белка миоглобина определили английские ученые Дж. Кендрыо
и М. Ф. Перутц в 1960 г. Они образно представили эту структуру
как «толстую колбасу, чрезвычайно причудливо скрученную»
[рис. 6 {А)].
Наличие в белковой молекуле множества разнообразных
боковых цепей, стремящихся к взаимодействию друг с другом,
определяет оригинальную укладку спирали в пространстве. Боль-
37
шую роль в организации этих структур играют дисульфидные
мостики между остатками цистеина (—8—5—). В стабилизации
складок, поворотов, изгибов глобулярного белка принимают
участие слабые связи следующих типов: ионные (Т*Ш$ ...СОО~),
водородные (ОН...МН2), гидрофобные (СН3...СН3). Энергия
некоторых связей, стабилизирующих структуры белка,
представлена ниже.
Тип связей
Ковапентные
-СН2-СН2-
-ОС-ЫН-
-8-8-
кДж/моль
336
420
294
Тип связей
Водородные
Ионные
Гидрофобные
кДж/моль
21
21
0,8-6,3
Гидрофобные группировки локализуются в основном внутри
глобулы, вдали от гидрофильной среды; полярные группы
сосредоточены снаружи, что определяет растворимость многих белков
в воде.
Наиболее сложные и специфические функции в клетке
выполняются белками, имеющими четвертичную структуру
[рис. 6 (Б)}. Несколько глобул, субъединиц или олигомеров,
агрегируются за счет тех слабых связей, о которых уже говорилось
при рассмотрении структур белков более низкой организации —
водородных, ионных, гидрофобных (ван-дер-ваальсовых).
Преимущество четвертичной структуры прежде всего в том, что
сочетание нескольких одинаковых олигомерных молекул
значительно повышает интенсивность осуществляемого ими процесса.
С другой стороны, объединение различных по свойствам
субъединиц позволяет возникшему комплексу осуществлять гораздо
более сложные интегрированные реакции. Наконец, на уровне
четвертичной структуры облегчается регуляция активности белка
Рис. 6. Третичная и четвертичная структуры белка:
А — глобула; Б — ассоциация субъединиц
38
Олигапер
Глобула
Мономеры
1
Глобула
Частичное разворачивание
2
Полное разворачивание
5 о
Рис. 7. Обратимая денатурация белков
(по Р. Бохински, 1987):
/ — биологическая активность; 2—полная
или частичная потеря активности; 3 —
активность отсутствует
за счет некоторых изменении
взаиморасположения
отдельных глобул. Кроме того,
замена каждой отдельной
субъединицы при ее повреждении
обходится клетке дешевле,
чем синтез заново большой
полипептидной цепи,
обладающей всеми свойствами
четвертичного белка.
Нативная конформация
глобулярного белка обладает
высокой лабильностью
(подвижностью) вследствие
участия в ее поддержании слабых
связей. Под влиянием
внешних воздействий
(температуры, рН, механического
усилия) структура глобулы может
меняться. Эти изменения не затрагивают аминокислотной
последовательности. Потеря нативной конформации может быть
временной или окончательной (обратимая и необратимая
денатурация) (рис. 7).
Итак, уникальный по разнообразию состав, оригинальная
структура, поддерживаемая слабыми связями, определяют
главные общие свойства белков:
Щ высокую химическую активность;
?;' тонкую специфичность в выполнении жизненных функций;
лабильность, то есть способность обратимо изменять свою
структуру, приспосабливаясь к меняющимся условиям внешней
среды.
Функции белков в клетке. Выдающиеся свойства белков
позволяют им участвовать практически во всех аспектах
деятельности клетки. Основные их функции следующие.
Структурная. Нам уже известно, что более половины
сухой массы цитоплазмы и ее органелл принадлежит белкам.
Основа строения клетки — биологические мембраны —
наполовину построены из белков.
т Ферментативная. Все биологические катализаторы
химических реакций в клетке являются белками. (Подробно о
ферментах рассказано в следующем разделе.)
Транспортная. Некоторые белки, находящиеся в
клеточных мембранах, участвуют в транспорте веществ, не способных
растворяться в мембранном матриксе. Участие белков в
передвижении частиц — молекул, ионов — через мембрану может
осуществляться следующими способами (рис. 8):
1) белки — челночные переносчики; транспортный белок на-
39
Рис. В. Переносчики веществ через мембрану:
а — челнок; о — канал
ходится в мембране; ему присущи важные особенности —
способность специфически связывать переносимый элемент и
структурная подвижность, позволяющая ему изменять свое
положение в толще мембраны. Соединяясь с молекулой или ионом
на одной из поверхностей мембраны, он меняет свое положение
так, что переносимая частица оказывается на другой
поверхности. Осуществив перенос, белок, как челнок, вновь занимает
первоначальное положение [рис. 8 (а)];
2) белки •— организаторы в мембране специальных
участков — каналов, по которым способны двигаться гидрофильные
вещества, минующие таким образом гидрофобный матрикс
[рис. 8 (б)].
Запасная. Белок представляет собой высоковосстановлен-
ное соединение с большим запасом энергии. При окислении 1 г
белка освобождается 23 кДж энергии. Для сравнения приведем
калорийность других веществ, также откладывающихся в запас в
растительных клетках: глюкоза — 15,5 кДж/г, крахмал — 17,6,
жир — 38,2 кДж/г.
Высокое качество белка как питательного материала
обусловлено и тем, что в отличие от других запасных веществ в его
молекуле имеется азот. При прорастании семян запасные белки
распадаются на аминокислоты, из которых строятся новые
белки, необходимые для роста и развития молодого организма.
От содержания белка в сельскохозяйственной продукции во
многом зависит ее кормовое значение. Так, вегетативная масса
бобовых, являющаяся прекрасным кормом для скота, содержит в
3—5 раз больше азота, чем солома злаков.
Иммунная (защитная). Известно, что роль белков в
защите растений от инфекции велика и разнообразна. Различные
по иммунным свойствам объекты отличаются как по количеству
и качеству белков, имеющихся в здоровом организме, так и по
тем изменениям, которые происходят в белковом спектре после
заражения. Большая питательная ценность белков отчасти
объясняет тот факт, что часто растения, имеющие большое количество
белкового азота, лучше противостоят заболеваниям. Например,
40
при хранении сельскохозяйственной продукции потери у таких
сортов ниже, чем у тех, которые содержат меньше белка
(табл. 5).
5, Распределение форм азота (% общего азота) в листьях хранящихся
кочанов капусты (по Б. А. Рубину, Е. В. Арциховской,
В. А. Аксеновой, 1975)
Сорт
Дата
Белковый азот
Аминный азот
Амагер (устойчивый
к Во1гу115 стегса)
Номер первый
(неустойчивый)
03.12
13.04
03.12
13.04
47,0
37,5
39,4
10,2
32,7
42,3
39,0
58,3
I
В качественном отношении белки устойчивых форм часто
имеют в своем составе много аминокислот, плохо переносимых
тем или иным патогеном. Например, фитофтора «не любит»
белки с большим содержанием аргинина. В то же время легко
заболевающие антракнозом сорта винограда отличаются
повышенным содержанием аспарагина по сравнению с устойчивыми.
Интересно, что не только состав, но и структура белков
устойчивых и не устойчивых к инфекции форм различна. Ученый
Д. В. Липсиц обнаружил в клетках картофеля, устойчивого к
раку, белки с необыкновенно плотной, жесткой глобулой.
Наиболее активно противостоят инфекции так называемые
антиферменты, способные ингибировать ферменты паразита: из
семян злаков выделены ингибиторы а-амилаз грибов; ферменты
глюконазы, хитиназы вызывают мацерацию мицелия многих
грибов-паразитов.
Чрезвычайно интересны белки-лектины, обладающие
агглютинирующими, склеивающими свойствами по отношению к
многим веществам углеводной природы, в том числе гликопроте-
инам патогенных грибов и бактерий. Эти белки находятся на
поверхности клеточной мембраны и даже проникают в
клеточную стенку. Они очень специфичны в отношении различных
видов инфекции: в листьях яблони есть белки, «узнающие» даже
отдельные штаммы бактерий. Лектины специфически связывают
патогенные бактерии, образуя при этом как бы тромб,
предотвращающий дальнейшее распространение болезни. Известна
способность белков из зародышей пшеницы, специфичных к
олигомерам хитина, связывать споры и кончики гиф 2у§о-,
Азсо-, ВазЫютусегез. Лектины из бобов сои и арахиса
специфически связывают РепюШштп и А$рег§Ши8, препятствуя
растяжению их мицелия.
С момента заражения в клетках растений начинается синтез
новых иммунных белков. Об этом говорят опыты по включению
41
в белки зараженных растений капусты и огурца меченой по
углероду (14С) аминокислоты лейцина по сравнению с
контрольными, незараженными растениями (табл. 6).
6. Включение 14С-лейцина в белки здоровых и зараженных растений
(по Б. А. Рубину, Е. В. Арциховской и В. А. Аксеновой, 1975)
Растение
Сорт, устойчивость
Включение |4С-лейцина, %
от незараженных растений
Капуста, зараженная
ВИ апегеа
Огурцы, зараженные
ЕтуарЬе сосЬогасеагшп
Амагер, устойчивый
Номер первый,
неустойчивый
Дальневосточный,
устойчивый
Неросимый,
неустойчивый
140
114
131
86
Из таблицы 6 видно, что интенсивность новообразования
белков в ответ на инфекцию соответствует степени устойчивости
сорта. Происхождение этих новых белков может быть связано с
экспрессией соответствующих генов в ответ на действие патогена.
Роль белков трудно переоценить и в «реакции
сверхчувствительности». Эта реакция состоит в том, что при инфицировании
определенного участка растительной ткани в нем начинаются
процессы некроза. Ведущую роль при этом играют
белки-ферменты хозяина. Продукты распада отравляют клетки патогена;
деструктивные изменения в клетках предотвращают
распространение инфекции. Ценой потери определенного объема своей
ткани растительный организм избавляется от патогена,
выздоравливает и сохраняется.
Набор белков, ответственных за иммунные свойства,
изменяется в процессе эволюции организмов. Это происходит в ответ
на появление у патогенов новых белков, причиняющих вред
растению. Таким образом, происходит параллельное развитие
свойств вирулентности у патогена и устойчивости у растения,
обусловленных главным образом спецификой их белков.
1.2.3. БИОЛОГИЧЕСКАЯ РОЛЬ ФЕРМЕНТОВ
В основе всех функций организма лежат химические реакции.
В живой клетке их скорость регулируется ферментами —
биологическими катализаторами. В результате многочисленных
исследований в 30-е годы стало известно, что все ферменты являются
белками. За последние 50 лет удалось открыть более 2500
ферментов; многие из них выделены в кристаллическом виде.
Принцип действия ферментов основан на их способности
временно связываться с субстратами, участвующими в реакции,
По окончании реакции фермент освобождается из комплекса с
42
субстратом и может вновь взаимодействовать со следующей его
молекулой.
Любая химическая реакция происходит потому, что некоторая
часть молекул какого-нибудь вещества обладает большей
энергией, чем другие, то есть находится в активированном
состоянии. Только эти молекулы могут вступать в реакцию. Энергией
активации называют такое количество энергии, которое
необходимо затратить на то, чтобы привести все молекулы 1 моль
вещества в активированное состояние. Увеличить скорость
реакции можно путем внесения извне какого-то количества энергии,
например, путем нагревания. Это позволяет молекулам двигаться
быстрее, чаще сталкиваться и легче преодолевать энергетический
барьер. Ферменты действуют иначе. Они не привносят
дополнительной энергии. В комплексе с субстратом фермент как бы
изменяет путь химической реакции, направляя ее по
энергетически более выгодному руслу, тем самым снижая уровень
энергии активации (рис. 9). Это достигается за счет поляризации
связей, смещения электронной плотности в молекулах субстрата.
Кроме того, реагирующие молекулы ориентируются по
отношению друг к другу так, что их взаимодействие становится более
эффективным.
Главные качества белков обеспечивают следующие основные
свойства ферментов:
чрезвычайно высокую активность по сравнению с
катализаторами другой природы. Для примера возьмем реакцию разложения
перекиси водорода на кислород и воду. С помощью 1 моль_ ж>нов
железа в качестве катализатора за 1 мин разлагается 10 моль
Н2О2; 1 моль фермента каталазы в тех же условиях за то же время
разлагает 10 моль перекиси водорода. Большинство реакций в
клетке осуществляется с участием ферментов в 1 млн и более раз
быстрее, чем без них;
очень высокую специфичность в отношении субстратов
реакций. Специфичность
ферментов может проявляться на
разных уровнях, начиная с
абсолютной, когда фермент
способен катализировать всего лишь
одну-единственную реакцию, а
иногда лишь реакцию только с
одним стереоизомером.
Причина столь тонкой
специфичности заключается в строгой
упорядоченности структуры
белка, связывающего
определенным своим участком лишь
один конкретный ' субстрат.
Относительная специфичность
1
[А...В]
Ход реакции
Рис. 9. Энергия активации реакции
взаимодействия двух веществ (А и В)
с ферментом ( ) и без фермента
()
43
выражается в способности ферментов катализировать
однотипные реакции с несколькими структурно подобными субстратами.
Это обусловлено главным образом определенной конформацион-
ной^. подвижностью белка.
—'"Специфичность ферментов лежит в основе их международной
классификации. Самыми крупными группами ферментов
являются классы.
Оксидоредуктазы. Они осуществляют окисление и
восстановление субстратов; принимают активнейшее участие в
фотосинтезе, дыхании, энергетическом обмене.
Трансферазы. Эти ферменты катализируют перенос
отдельных групп между молекулами. Очень важную роль играют
фосфокиназы, переносящие остатки фосфорной кислоты от
энергетической «валюты» — молекул АТФ, что необходимо для
активации жизненных процессов: синтезов, активного
транспорта ионов, направленного потока ассимилятов и др.
Гидролазы. Участвуют в расщеплении сложных веществ
(углеводов, жиров, белков) до простых с участием воды. Играют
огромную роль при мобилизации запасных питательных веществ
в процессе прорастания семян. Могут действовать и в обратном
направлении, синтезируя сложные вещества из их компонентов.
Л и а з ы. Отщепляют от субстратов определенные группы без
участия воды с образованием двойной связи. Могут действовать
и в противоположном направлении — присоединять группу к
двойной связи. В качестве примера приведем один из важных
ферментов углеводного обмена — альдолазу. В процессе дыхания
с его помощью происходит расщепление глюкозы на две триозы,
что облегчает окисление дыхательного субстрата. При
фотосинтезе этот же фермент соединяет две триозы с образованием
гексозы.
Изомеразы. Осуществляют изомеризацию — перенос
отдельных групп внутри одной молекулы. Важную роль играют,
например, в углеводном обмене, превращая кетосахара в
альдегидные формы и обратно.
Синтетазы. Эти ферменты участвуют в синтезах,
требующих затрат энергии. С их помощью образуются амиды — аспара-
гин и глутамин — из соответствующих аминокислот путем
присоединения к ним аммиака; большую роль играют синтетазы в
биосинтезе белка, других энергетически значимых веществ,!
Активность фермента прежде всего связана с его структурой.
По строению все ферменты делятся на две группы — однокомпо-
нентные и двухкомпонентные. Ферменты первой группы состоят
только из одного компонента — белка; в его молекуле имеется
активный центр, вступающий в химическое взаимодействие с
субстратом. Однокомпонентными ферментами являются
гидролазы. Двухкомпонентные состоят из двух частей — белковой
(апофермент) и небелковой (простетическая группа, кофермент).
44
I
Специфичность фермента по отношению к конкретному
субстрату связана с белковой частью, а непосредственный механизм
реакции осуществляется с участием простетической группы (ко-
фермента).
Природа коферментов весьма разнообразна. Многие из них
представляют собой витамины.
Витамины — относительно низкомолекулярные вещества
различной химической природы, совершенно необходимые для
нормального функционирования любого живого организма в очень
малых количествах. Витамины подразделяют на жирорастворимые
(А, Т>, Е, К) и водорастворимые (Вь Щ, Вб, В^, РР, С, липоевая
и пантотеновая кислоты). Уникальные функции витаминов
определяются тем, что они, как правило, являются коферментами
основных каталитических белков или непосредственно участвуют в
важнейших биохимических реакциях. Так, витамин С
(аскорбиновая кислота) необходим для осуществления
окислительно-восстановительных процессов. Роль этого витамина многократно
возрастает при заболеваниях растения, животного, человека,
когда возникает необходимость активно окислять ядовитые
продукты — результаты воздействия патогена на хсивой организм. К
сожалению, человек (как и обезьяна, и морская свинка) не
способен самостоятельно синтезировать аскорбиновую кислоту.
Главными источниками витаминов для человека служат
растительные продукты — зеленые части, зародыши растений, а
также дрожжи и микроорганизмы. Из животных объектов богаты
витаминами внутренние органы — печень, почки, сердце. В
таблице 7 представлены некоторые органические соединения,
выступающие в качестве простетических групп ферментов, многие
из которых являются витаминами, специфическое значение
которых связано с их ферментативной функцией. О других
витаминах будет сказано при рассмотрении соответствующих функций
растительного организма.
7. Простетические группы некоторых ферментов
Химическая природа
Ароматические —
кофермент <2 (убихинон)
Н8-соединения:
пантотеновая кислота
липоевая кислота
Гетероциклические:
цитохромы
тиаминпирофосфат
пиридоксальфосфат
Нуклеотиды:
никотинамидаденин-
динуклеотид (НАД)
1 Витамин
Пантотеновая кислота
Липоевая кислота
—
в6
РР
| Ферментативная функция
Перенос атомов водорода
Перенос ацильных групп
То же
Перенос электронов
Декарбоксилирование
Перенос аминогрупп
Перенос атомов водорода
45
Продолжение
Химическая природа
Витамин
Ферментативная функция
никотинамидаденин-
динуклеотидфосфат
(НАДФ)
флавинадениндинук-
леотид (ФАД)
флавинмононуклео-
тид (ФМН)
РР
В2
в2
То же
Ферментативная активность во многом зависит от
неорганических кофакторов, прежде всего ионов металлов, роль
которых проявляется различным образом. Некоторые из них
поддерживают нативную структуру белка (кальций, магний). Другие
осуществляют связь фермента с субстратом (например,
марганец в фосфорилазах). Наконец, такие, как железо, медь,
молибден, цинк, марганец, непосредственно участвуют в реакции,
перенося электроны. Эти ионы являются микроэлементами.
Они абсолютно необходимы растению из-за обязательного
участия в работе ферментов, хотя требуются в чрезвычайно малых
количествах. Их отсутствие нарушает важнейшие функции
растительного организма. Так, без молибдена, участвующего в
работе нитратредуктазы — ключевого фермента азотного
обмена, — невозможно включение в метаболизм нитратной формы
азота. Агроном должен знать потребности сельскохозяйственных
культур в микроэлементах и своевременно обеспечивать ими
растение. ,
Кинетика (скорость) ферментативной реакции. Сущность
ферментативной реакции сводится к тому, что фермент (энзим — Е)
связывается с субстратом (5) с образованием
фермент-субстратного комплекса (Е5), который затем распадается с образованием
продукта (или продуктов) реакции (Р) и свободного фермента
(Е):
Е + 5
Е + Р.
Кинетические параметры ферментативной реакции,
отражающие механизм действия фермента, были изучены Л. Михаэлисом
и М. Ментен (1913). Зависимость скорости ферментативной
реакции от концентрации субстрата (при постоянном количестве
фермента) может быть выражена графически (рис. 10). С
увеличением количества субстрата (5) скорость реакции (V) растет, так
как все большее число молекул фермента взаимодействует с
молекулами субстрата, осуществляя катализ. Когда все молекулы
фермента вовлечены в реакцию, дальнейшее повышение
концентрации субстрата уже не будет влиять на скорость
ферментативной реакции; лимитирующим фактором в такой ситуации
46
1
в 5,НМ№
Рис. 10. Кинетика ферментативной
реакции
является уже не субстрат, а
фермент. Таким образом,
скорость реакции достигает
максимального значения (Ктах)
при определенной
концентрации субстрата ([5]).
Концентрация субстрата, при которой
скорость реакции равна
половине максимальной, носит
название константы Михаэлиса
Зная максимальную
скорость реакции и величину
константы Михаэлиса, можно
рассчитать скорость
ферментативной реакции при данной
концентрации субстрата, используя упрощенное уравнение
Михаэлиса—Ментен: ■■-.:■■
где у— скорость реакции; Ипах — максимальная скорость реакции; Кт —
константа Михаэлиса; [5] — концентрация субстрата.
Кттх и кт являются важными кинетическими
характеристиками фермента. Максимальная скорость отражает эффективность
действия фермента в стандартных условиях. Ее можно выразить
числом оборотов, то есть количеством молей субстрата,
реагирующих с 1 моль фермента за единицу времени (1 мин). Одним из
наиболее эффективно действующих ферментов является,
например, карбоангидраза, разлагающая угольную кислоту на диоксид
углерода и воду и обеспечивающая диоксидом углерода
первичные реакции темновой фазы фотосинтеза: 1 моль этого фермента
катализирует превращение 36-Ю6 моль субстрата в 1 мин.
Константа Михаэлиса характеризует степень сродства
фермента к субстрату. Чем меньшее количество субстрата
необходимо для связывания половины имеющегося фермента (ниже Кт)^
тем больше сродство фермента к этому субстрату. Причиной
различной специфичности фермента к субстратам может быть
более или менее эффективное связывание в
фермент-субстратном комплексе (Е$), а также различное по эффективности
превращение комплекса Е в продукты реакции.
Сродство фермента к субстрату имеет решающее значение в
осуществлении различных физиологических функций. Для
примера обратимся к фотосинтезу. Известно, что высокая
продуктивность некоторых сельскохозяйственных растений (сорго, ку-
47
куруза, просо, сахарный тростник) во многом определяется
особым типом фотосинтеза (так называемый кооперативный
фотосинтез). Ключевым ферментом связывания диоксида углерода у
этих растений является фосфоенолпируваткарбоксилаза (ФЕПК).
У большинства других растений (пшеница, рожь, картофель) эту
функцию выполняет другой фермент — рибулозобисфосфаткар-
боксилаза (РБФК). Константа Михаэлиса в реакции связывания
С(>2 у ФЕПК значительно ниже, чем у РБФК. Таким образом,
одной из причин более эффективного усвоения СОг
высокопродуктивными растениями является большее сродство ключевого
фермента к субстрату.
На скорость ферментативной реакции в значительной степени
влияют внешние факторы. Зависимость скорости реакции от
температуры выражается одновершинной кривой. В ее
восходящей части при повышении температуры на 10 °С скорость
ферментативной реакции увеличивается в 1,4—2,0 раза (<2ю = 1,4 —
2,0), что объясняется возрастанием кинетической энергии
молекул. Оптимум ферментативной реакции т уИто приходится на
55—60 "С (в живых организмах значительно ниже), после чего
начинается быстрый спад, связанный с денатурационньгми
изменениями, нарушением специфичности и снижением активности
фермента.
Большинство ферментов (хотя и не все) проявляют
максимальную активность в близкой к нейтральной или слабокислой
среде (характерной для цитоплазмы растительных клеток).
Снижение или повышение рН вызывает сдвиг в диссоциации групп,
участвующих в стабилизации нативной структуры. Нарушение
электростатических взаимодействий приводит к изменению кон-
формации фермента и потере каталитических свойств.
Регуляция ферментативной деятельности. Одним из
важнейших различий живых и неживых систем является способность
первых к саморегуляции. Поскольку в основе жизнедеятельности
лежит ферментативная активность, особое значение приобретает
познание принципов ее регуляции.
Существуют два основных пути регуляции ферментативной
деятельности в клетке. Первый осуществляется за счет
новообразования белковых молекул, второй — за счет активации или ин-
гибирования деятельности уже имеющихся в клетке ферментов.
Первый способ требует более длительного времени и больших
энергетических затрат («грубая настройка»), второй происходит
чрезвычайно бьгстро («тонкая настройка»). Образование новых
белков связано с экспрессией соответствующих генов. В
результате этого, с одной стороны, может регулироваться количество
молекул ферментов, уже работающих в клетке; с другой — могут
появляться белки с новыми ферментативными функциями. В
частности, это могут быть ферменты, необходимые для борьбы с
проникшей в организм инфекцией, или так называемые белки
48
теплового шока, возникающие в ответ на быстрое повышение
температуры. На уровне синтеза регулируется соотношение в
клетке изоферментов — молекулярных форм, отличающихся
некоторыми химическими или структурными особенностями,
выполняющих одну и ту же функцию, но с разной
эффективностью. Соотношение этих форм влияет на активность данной
реакции.
Регуляция активности может происходить следующими
способами.
1. Конкурентное ингибирование. Этот тип
регуляции состоит в том, что к одному и тому же активному центру
ферментативного белка способен присоединиться не только
субстрат реакции, но и структурно подобный ему ингибитор. Эти
молекулы конкурируют друг с другом за активный центр: при
снижении концентрации субстрата все большее число молекул
фермента связывается с ингибитором, и скорость реакции
снижается. Ускорить реакцию можно, увеличив количество
субстрата, молекулы которого при этом будут вытеснять ингибитор, —
реакция пойдет быстрее. Классическим примером конкурентного
ингибитора является малоновая кислота в одной из реакций
цикла Кребса — окислении янтарной кислоты ферментом сукци-
натдегидрогеназой до фумаровой.
СН2СООН
1
1
СН2СООН
сукцинат
/
"Т-йГ
СН2СООН
1
1
соон
малонат
сн соон
II
II
сн соон
фумарат
По этому типу действуют сульфамидные препараты, ингиби-
руя жизненно важные для болезнетворных микроорганизмов
ферментативные реакции. В качестве конкурентного ингибитора
может выступать и сам продукт реакции. В этом случае
«перепроизводство» вещества прекращает его образование. После его
частичного расходования реакция вновь активизируется.
2. Аллостерическая (неконкурентная)
регуляция. Аллостерический («алло» — разный) фермент имеет в
белковой структуре несколько центров, с одним из которых
связывается субстрат, а к другим могут присоединяться ингибиторы
или активаторы реакции. Присоединение регулятора приводит к
изменению конформации белка, что отражается на активности
фермент-субстратного комплекса (рис. 11). В качестве
регуляторов, действующих в' аллостерических центрах, могут выступать
различные органические молекулы — продукты обмена, физио-
49
Центр ввязывания
/ эдхре/стора
/>п »■■• "\.
ЯШ. \
Субстратный
центр
Субстратный ^а*
центр
Активное состояние Неактивное состояние
Субстрат
-,".■■'■■■ -::--:Ру • Л±
Продукты
Нет сродства
к субстрату
> Инеибирование
Малоактивный комплекс
Рис. 11. Аллостерическая регуляция ферментативной активности (по Я. Мусил
и др., 1981)
логически активные вещества. В частности, один из фитогормо-
нов (стимуляторов роста) — цитокинин — является,
по-видимому, активатором РНК-полимеразы, что в конечном итоге
приводит к усилению синтеза белка. Некоторые ингибиторы, вступая
во взаимодействие с аллостерическим центром, необратимо
изменяют конформацию белка и полностью выводят фермент из
строя. На этом основано терапевтическое действие пенициллина,
который выключает один из ферментов, необходимых бактериям
для образования клеточной стенки. Наконец, возможно кова-
лентное взаимодействие фермента с какими-либо химическими
группами (например, фосфорилирование), что приводит к
превращению неактивной или слабоактивной формы в интенсивно
действующую.
50
Направленность и последовательность действия ферментов в
осуществлении какой-либо функции достигается их
специфической локализацией в клетке и образованием мулыпиферментных
комплексов, осуществляющих одну многостадийную реакцию:
Еъ
Начальный субстрат А с помощью последовательно
действующих ферментов Е\, Е^ и 2?з превращается через промежуточные
продукты В и С в конечный — Д который непосредственно
участвует в конкретной функции. Ферменты объединены в
комплекс не только функционально, но и структурно: они
локализуются в цитоплазме близко друг к другу, что обеспечивает
сопряженность и экономичность их действия.
Большую роль в организации мультиферментных комплексов
играют органеллы, а также мембраны, способствующие
упорядочению ферментных белков. В связи с этим даже незначительные
изменения в структуре мембран серьезно влияют на
функциональное состояние клетки. Особенно чутко реагируют на
состояние мембран митохондрий и хлоропластов наиболее
энергетически важные процессы, связанные с синтезом АТФ и
осуществляющиеся сложными, многоступенчатыми мультиферментными
комплексами. При резких, быстрых колебаниях внешних
условий ферменты могут утратить связь с мембранами. Их свободное
положение в цитозоле часто приводит к противоположному
эффекту. Так, резкое иссушающее действие суховея, вызывающее
так называемые запалы, захваты, приводит к делокализации
ферментов и стимулирует реакции гидролиза (вместо синтеза). Это
приводит к образованию щуплого зерна.
1.2.4. НУКЛЕИНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИИ
В образном выражении, что белки все могут, но ничего не
знают, а нуклеиновые кислоты все знают, но ничего не могут,
заключен глубокий смысл. Действительно, как уже известно,
гетерополимерное строение и специфическая лабильная
структура позволяют белкам участвовать практически во всех
жизненных функциях. Что же касается нуклеиновых кислот, то именно
эти молекулы содержат и реализуют информацию о всех белках
в клетке.
Как и белки, нуклеиновые кислоты (НК) представляют гете-
рополимеры, мономерами которых являются нуклеотиды. Нукле-
отид состоит из азотистого основания, связанного с ним пятиуг-
леродного сахара и остатка ортофосфорной кислоты (Р). В НК
51
присутствуют азотистые основания двух типов — производные
пурина (пуриновые) и производные пиримидина (пиримидино-
вые). К пуриновым основаниям относятся аденин (А), гуанин
(Г), к пиримидиновым — цитозин (Ц), урацил (У) и тимин (Т).
гуанин
Каждый нуклеотид получает название по входящему в него
азотистому основанию, например адениловая кислота (или аде-
нозинмонофосфат — АМФ): аденин — рибоза — Р.
АМФ может фосфорилироваться с образованием аденозинди-
фосфата — АДФ (аденин—рибоза—Р ~ Р); фосфорилирование
последнего приводит к образованию аденозинтрифосфата (АТФ):
0
0
о
НО-Р-0-Р-О-Р-О-СН,
III \у
ОН ОН ОН с Н
фосфатные остатки
СН аденин
^сс
Н I I Н
ОН ОН
рибоза
АТФ
При гидролитическом отщеплении остатка фосфорной
кислоты от АМФ высвобождается 12,6 кДж, гидролиз же второй или
третьей фосфатной связи в АТФ дает около 33,6 кДж.
Универсальным энергетическим аккумулятором в клетке является АТФ.
Присоединение остатка фосфорной кислоты к АДФ с
использованием энергии окисления (при дыхании) или света (при
фотосинтезе) представляет «зарядку». Отщепление фосфата от АТФ с
образованием АДФ сопровождается выходом энергии — «разрядка»:
АДФ + Фнеорг + энергия -> АТФ + НгО — «зарядка»;
АТФ + НгО -» АДФ + Фнеорг + энергия — «разрядка».
52
Энергия макроэргической связи АТФ расходуется в клетке на
самые разные виды работ.
Не только АТФ, но и другие трифосфатнуклеотиды (ГТФ,
ЦТФ, УТФ, ТТФ) являются макроэргическими соединениями,
способными при гидролизе концевой фосфатной связи
освобождать большое количество энергии.
При образовании НК нуклеотиды соединяются друг с другом с
помощью фосфорно-эфирной связи, возникающей между
остатком фосфорной кислоты у пятого атома рибозы или дезоксирибо-
зы и гидроксилом третьего атома сахара следующего нуклеотида:
з'
5'
А - о о оод>Р
Г - о о ооо^-Р
Ц - о о о оо^.Р
У-ооооо-Р
о о о о о - рибоза
Образующаяся полинуклеотидная цепочка имеет два конца —
5', где расположена несвязанная фосфатная группа, и 3', у
которой находится свободная группа ОН при третьем атоме пентозы.
НК подразделяют на рибонуклеиновые (РНК) и дезоксирибо-
нуклеиновые (ДНК). Их состав различен. В РНК входят
нуклеотиды с А, Г, Ц, У, сахар — рибоза. ДНК содержит А, Г, Ц, Т,
сахар — дезоксирибоза. Последовательность нуклеотидов
определяет первичную структуру НК.
Как и белки, НК имеют сложную специфическую структуру,
в основе которой лежит принцип комплементарности. Компле-
ментарность проявляется в том, что азотистые основания
взаимодействуют друг с другом посредством образования водородных
связей строго попарно -Ас Т или У, а Г с Ц. Между
комплементарными основаниями возникают две или три водородные
связи ( ):
А : : : : : Т (У)
Г : : : : : Ц
В 1953 г. американским ученым Д. Уотсоном и англичанином
Ф. Криком было сделано открытие века — описана трехмерная
структура ядерной ДНК. Она представляет собой двойную
спираль: две правозакрученные спирали переплетены друг с другом,
при этом 3' — конец одной из них соответствует 5' — концу
другой. Структура двойной спирали стабилизируется водородными
связями между комплементарными нуклеотидами. Молекула
ДНК хлоропластов и митохондрий (как и ДНК прокариот)
замкнута в кольцо.
В интерфазе клеточного деления ДНК входит в состав особого
ядерного вещества — хроматина, в котором также присутствуют
53
белки — основные (гистоны) и неосновные, а также небольшое
количество РНК и липидов. Основой структуры хроматина
являются нуклеосомы, которые представляют собой белковые диски
из 8 молекул гистонов, по окружности которых намотана часть
ДНК (140 пар оснований). Нуклеосомы соединяются участками
ДНК (линкерами), состоящими приблизительно из 60 нуклео-
тидных пар (рис. 12). Нуклеосомная укладка ДНК способствует
ее компактизации, степень которой увеличивается в митотичес-
ком ядре. В период митоза хроматин формирует хромосомы,
число и форма которых являются важнейшим критерием вида.
При образовании хромосомы 8—10 нуклеосом объединяются в
виде глобул. В дальнейшем уплотненная таким образом
структура образует петли. Сближаясь между собой, они формируют
толстые (0,1—0,2 мкм) хромосомные нити (хромонемы),
которые, в свою очередь, образуют видимые в микроскоп хромосомы.
Все это обеспечивает концентрацию в небольшом ядре
огромного количества наследственной информации, а также облегчает
абсолютно точное ее распределение между дочерними клетками.
Структура молекул РНК достаточно разнообразна, что
связано с многообразием их функций. Так, матричная
(информационная) РНК представляет собой одинарную спираль, для
транспортной РНК характерно сочетание одинарных и
спаренных участков, рибосомальная РНК имеет более сложную
структуру.
Функции РНК. Все функции НК обеспечиваются принципами
комплементарности и матричного воспроизводства. Роль ДНК
состоит в хранении, передаче и реализации
наследственной информации.
Наследственная информация определяется
последовательностью нуклеотидов в молекуле
ДНК. Отдельный участок ДНК, содержащий
определенную нуклеотидную
последовательность, отвечает за синтез одного белка и
называется геном. Каждые три нуклеотида в этой
последовательности (триплет) определяют
одну аминокислоту в данном белке. Код ДНК
универсален практически для всех организмов
и является вырожденным: одна и та же
аминокислота может определяться несколькими
триплетами. Совокупность всех генов в ДНК
составляет генотип организма. Важнейшим
условием передачи потенциальных возможностей
от родителей к детям является удвоение моле-
Рис. 12. Схема строения нуклеосомы (по Ю. С. Ченцову,
1984):
/—молекула ДНК; 2 — октомер гистонов; 3 — линкер
54
Старая
цепь
Старая
цепь
кулы ДНК (репликация),
происходящее в интерфазе
клеточного деления. Под действием
фермента ДНК-полимеразы
двойная спираль постепенно
раскручивается, и на каждой
из освободившихся от
взаимодействия нитей строится
вторая, комплементарная ей
нить — при этом
восстанавливаются водородные связи
между комплементарными
основаниями (рис. 13). Вместо
одной молекулы ДНК в клетке
образуются две идентичные
двойные спирали. В результате
митоза каждая молекула
попадает в одну из
новообразованных клеток. Таким образом,
все клетки одного организма
имеют одинаковый набор
генов и потому являются то-
типотентными.
Тотипотентность успешно
используют в биотехнологии.
Культивируя на определенных
средах, при различной
комбинации фитогормонов и других
факторов изолированные
клетки или ткани, можно добиться
их развития и регенерации
целого растения, обладающего
генотипом исходного организма.
Культуру клеток и тканей
современная биотехнология
использует в
сельскохозяйственных и промышленных целях, в
частности для получения из
группы незараженных клеток
апекса обеззараженного
посадочного материала (земляника,
картофель). Выращивание большой массы недифференцированной
ткани (каллус), клетки которой содержат ценные вещества,
позволяет эффективно применять их в парфюмерии, медицине (женьшень,
наперстянка).
Клеточные культуры используют также в целях селекции на
важные хозяйственные признаки. Во Всероссийском институте
55
Старая
цепь
Новая
цепь
Новая
цепь
Старая
цепь
Рис. 13. Репликация ДНК
(по Д. Уотсону, 1969)
кормов успешно работают над проблемой повышения
устойчивости к засолению люцерны, клевера и других растений с
помощью отбора групп клеток из суспензионной культуры,
подвергающейся засолению, и последующего получения из них
устойчивых регенерантов.
Методы современной генетики и молекулярной биологии
позволяют не только обнаружить наличие в геноме растения генов,
ответственных за хозяйственно полезные признаки (качество
белка, устойчивость к болезням), но и выделить их в чистом виде.
Это открывает перспективы для искусственного создания новых
генотипов путем включения в состав ДНК генов,
обеспечивающих те или иные качества. Этим занимается генная инженерия —
новая, интенсивно развивающаяся отрасль биотехнологии.
Выщепленные с помощью ферментов рестриктаз из ДНК
участки, несущие нужную информацию, встраиваются в
кольцевую молекулу бактерий (плазмиду). Бактерия проникает в клетку
растения, доставляя туда новую информацию, которая затем
реализуется белоксинтезирующей системой и обеспечивает новые
свойства. В настоящее время выделено несколько десятков
генов, ответственных за некоторые важные ферменты, например
а-амилазу ячменя, а также гены, контролирующие запасные
белки сои, гороха, кукурузы; выделены и гены устойчивости к
антибиотикам. В клетки подсолнечника был доставлен ген
запасного белка фасоли — фазеолина. Полученные путем регенерации
из каллуса растения, обладающие наследуемой способностью к
синтезу этого белка, получили название «санбин» (от английских
слов подсолнечник — зипйошег и бобы — Ьееп). Следует, однако,
отметить, что практическое значение подобных опытов пока еще
невелико, хотя имеются хорошие перспективы. В то же время
нельзя забывать, что насильственное вмешательство в святая
святых природы — наследственность — при недостаточно
серьезном отношении к этой проблеме может повлечь
катастрофические последствия, связанные с исчезновением старых и
появлением новых видов, что способно нарушить экологическое
равновесие на планете.
Если репликация ДНК обеспечивает генетическую
стабильность, то генетическую изменчивость — главный двигатель
эволюции — осуществляют рекомбинация и транспозиция.
Рекомбинация — это взаимодействие и обмен участками двух
различных молекул ДНК, приводящие к образованию молекулы,
отличающейся от исходных. При этом возникает разрыв цепей
ДНК с последующим их сшиванием. В наиболее типичном случае
это происходит в момент кроссинговера при мейозе (рис. 14).
Транспозиция — процесс перемещения генов по хромосоме
или даже между разными хромосомами, в основе которого, как и
во время всей другой деятельности ДНК, лежит взаимодействие
между комплементарными основаниями («прыгающие гены»).
56
V
Рис. 14. Генетическая рекомбинация
ДНК:
1 — две молекулы ДНК; 2 — образование
разрывов; 3 — перекрест; 4 — сшивание
Рис. 15. Транскрипция РНК:
1 — РНК-полимераза; 2 — растущая цепь
РНК
Известно, что именно транспозицией объясняется быстрое
эволюционирование бактериальных штаммов, приобретающих ре-
зистентность к антибиотикам.
Неизменность наследственной информации ДНК
поддерживается посредством репарации, в ходе которой с помощью
ферментов поврежденные участки «вырезаются» и заменяются
нормальными. Ошибка в работе систем репарации приводит к
мутациям — наследуемым изменениям в генетическом материале.
, Реализация наследственной информации ДНК
осуществляется посредством процесса транскрипции мРНК, что служит
начальным этапом в биосинтезе клеточных белков. При
транскрипции фермент РНК-полимераза раскручивает двойную
спираль ДНК; на одной из нитей («значащей») происходит
комплементарный синтез мРНК, в котором участвуют АТФ,
ГТФ, ЦТФ, УТФ. В отличие от репликации при транскрипции
РНК синтезируется ДНК лишь на отдельном участке,
отвечающем за образование конкретного белка (рис. 15). Образующаяся
молекула матричной РНК состоит из кодонов — триплетов,
комплементарных таковым ДНК. Каждый кодон шифрует
определенную аминокислоту.
После завершения транскрипции РНК претерпевает процес-
синг (дозревание). В ходе этого процесса происходит
сплайсинг — удаление участков, не содержащих информацию (ин-
тронов), с последующим сшиванием полинуклеотидной
цепочки. Кроме того, для стабилизации новообразованной молекулы
57
РНК, облегчения ее транспорта и продления времени жизни
в цитоплазме осуществляются кэпирование — присоединение
специальной нуклеотидной последовательности на 5'-конце (сар
по-английски — шапочка), а также присоединение нескольких
остатков адениловой кислоты к З'-концу (полиаденилирование).
Образованная мРНК окружается белками, выходит из ядра
через поры в его оболочке и в виде информосомы достигает
рибосомы, где заключенная в ней информация реализуется на
синтез белка.
1.2.5. БИОСИНТЕЗ БЕЛКА
Этот сложный процесс, требующий значительного количества
энергии, состоит из нескольких этапов.
1. Активация аминокислот в цитоплазме за счет энергии АТФ:
Аминокислота +АТФ —- аминоацил-АМФ + ФФ (пирофосфат)
2. Взаимодействие активированной аминокислоты с
транспортной РНК (тРНК).
тРНК представляет собой относительно небольшую молекулу
(73—93 нуклеотида; М.М ~ 25 тыс.) с характерной структурой,
напоминающей клеверный лист (рис. 16). Один из участков
имеет неспецифическую для всех тРНК последовательность нук-
леотидов — ЦЦА. К этому триплету присоединяется аминоа-
цил — АМФ. Зато другой участок строго специфичен для разных
тРНК — там находится триплет антикодон, комплементарный
какому-нибудь кодону на мРНК.
Специфический фермент осуществляет взаимодействие строго
определенной активированной аминокислоты с конкретной
тРНК:
аминоацил-АМФ + тРНК
аминоацил-тРНК-синтетаза
аминоацил-тРНК + АМФ.
Таким образом, каждая тРНК может переносить только
определенную аминокислоту. Богатый энергией комплекс
аминокислоты с тРНК перемещается в цитоплазме и достигает рибосомы.
3. В рибосоме происходит главный этап белкового синтеза —
трансляция, в основе которого лежит «узнавание» антикодоном
тРНК комплементарного кодона мРНК, обеспечивающее
специфическую последовательность аминокислот в синтезируемом
белке (рис. 17).
Начальный этап трансляции — инициация — требует энергии в
58
Рис. 16. Схема строения
транспортной РНК аминокислоты
глицин:
АЦЦ — амин'оацильный конец;
ГГА — антикодон
форме ГТФ. Инициирующий кодон
мРНК (АУГ) комплементируется с
антикодоном тРНК, несущей
аминокислоту метионин (после
завершения синтеза эта аминокислота
отщепляется от полипептида).
Образующийся комплекс обладает
способностью взаимодействовать
сразу с обеими субъединицами
рибосомы. В результате этого мРНК
оказывается между этими
субъединицами, что обусловливает начало
считывания информации.
Следующий за инициацией
этап — элонгация — также требует
энергии ГТФ. По мере реализации
наследственной информации мРНК
как бы «продергивается» через
рибосому. В результате
последовательного «узнавания» антикодона-
ми тРНК кодонов мРНК достигает-
>а ся необходимое расположение
аминоацил—тРНК, за которым следует образование пептидной
связи между этими аминокислотами, после чего освободившиеся
тРНК могут вновь присоединять и переносить новые молекулы
соответствующих аминокислот.
« В осуществлении необходимого расположения в рибосоме
тРНК, мРНК, а также в образовании пептидной связи участвуют
рибосомальная РНК и белки рибосом.
Завершающим этапом трансляции является терминация.
Терминирующие кодоны УАА, УАГУУГА, попадая в пределы
рибосомы, служат сигналом окончания синтеза полипептида, так как
этим триплетам не соответствует никакая тРНК. В соответствии
с созданной в рибосоме первичной структурой в цитоплазме
формируются вторичная, третичная и четвертичная, характерные
для каждого белка, и он оказывается способным выполнять свои
специфические функции.
Регуляция синтеза белка. Молекула ДНК каждой клетки несет
информацию о десятках и сотнях тысяч белков. Однако эти
потенциальные возможности никогда не реализуются
одновременно. Нам уже известно, что бездействующие в клетке гены
«просыпаются» и начинают реализовывать заключенную в них
информацию на синтез белков, необходимых для активации
ферментативной деятельности, борьбы с инфекцией или
противодействия различным стрессовым факторам. В процессе развития
организма в клетках постоянно происходит качественная смена
белков. Следовательно, существует тонкая и четкая система
59
Пептидильный участок
Аминоацильный участок
Сер
фМет Ала
Сигнал инициации
цепи
Пептидильный участок
Ц»Но
>уац цги / У ,/
ГЦЩУЦЦУАУГУЦУУ У ГЦУУЦУУАЦ-* „пщг
I I I / I I I | I < I I I III I Г Т 1 ^ I | I I МГП1\
-"1 2 "У "1" "Г" "У ^~Т "Т"
Аминоацильный участок
Тир
Вал
АУГ(ГЦЦУЦЦ)УАУГУЦУУУ ГЦУ
Сигнал инициации
цепи
у у -2 3 4 5 6 7 8
фМет —Ала
«*- Антикодон
/ И /АГИ АТГ \ У -1
Аугги,|^уцц уау)гуцууу гцу уцууац-^
.. мРНК
1 2 '3 4 5 6 7 8
фМет — Ала — Сер — 7ир — йол ч
уцц уау гуцууудгцу уцу/уац-3 мРНК
Т "~з" "Т ЧГ "б^^^-^Т" ч '
Направление считывания мРНК
Рис. 17. Синтез белка на рибосоме
включения и выключения отдельных генов в ДНК,
обеспечивающая внутренние условия для выполнения наследственной
программы.
Французские ученые Ф. Жакоб и Ж. Моно в 1961 г. впервые
высказали предположение, что механизм экспрессии и
репрессии генов связан со структурой самой молекулы ДНК. Они
предложили схему регуляции белкового синтеза, разработанную
для бактерии ЕзспепсЫа соИ. В дальнейшем в эту схему были
внесены некоторые изменения и дополнения, касающиеся в
основном эукариот. Согласно современным представлениям
деятельность структурного гена (ответственного за специфический
белок, фермент, функцию) контролируется с помощью особого
регуляторного гена, отделенного по расположению в ДНК от
структурного. Регуляторный ген определяет синтез белков — реп-
рессоров или активаторов деятельности структурного гена.
Связываясь с промотором — особым участком структурного гена,
который предшествует триплетам, кодирующим специфический
белок, репрессор препятствует взаимодействию РНК-полимеразы
с ДНК. Вследствие этого транскрипция оказывается
невозможной. Активатор, напротив, облегчает присоединение
РНК-полимеразы, что повышает транскрипционную способность
структурного гена.
Экспрессия заторможенного гена может быть вызвана
индуктором — веществом, связывающим или разлагающим репрессор.
РНК-полимераза получает возможность контактировать с ДНК;
начинается транскрипция, за которой следует синтез белка,
ответственного за необходимую функцию. В качестве индукторов,
по-видимому, могут выступать различные метаболиты, белки,
фитогормоны.
Биологическое значение экспрессии-репрессии как системы
контроля заключается в том, что она позволяет организму
приспосабливаться к изменению внешней среды. Велико
экономическое значение этого механизма: клетка не затрачивает энергию
на синтез тех белков, в которых не нуждается в данный момент
и в данных условиях.
1.2.6. УГЛЕВОДЫ РАСТЕНИЙ
По сравнению с белками, ферментами, нуклеиновыми
кислотами молекулы углеводов устроены значительно проще Их
химический состав суммарно может быть выражен так: (СН2О)л- »
зависимости от числа мономеров в строении углеводов их
подразделяют на моно-, ди-, олиго- и полисахариды.
К моносахаридам (монозам) относятся простые углеводы
имеющие 3 (триозы), 4 (тетрозы), 5 (пептозы), 6 (гексозы), /
(гептозы) углеродных атомов. В молекулах моноз имеется лиоо
61
альдегидная группа (альдозы), либо кетонная (кетозы).
Простейшей альдозой является глицериновый альдегид (ГА), кетозой —
дигидроацетон (ДА). Начиная с ГА все моносахариды (кроме
ДА) имеют асимметричные углеродные атомы (*). Это значит,
что могут существовать различные стереоизомеры каждого
соединения:
В природе преобладают Э-формы моносахаридов.
Установлено, что помимо линейной структуры простые сахара
могут иметь и циклическую (пиранозную — шестичленную или
фуранозную — пятичленную) структуру. При этом возникают
еще два изомера — аир:
СН2ОН
.О *^ л Г*1
IV «и
онт V он
1 1
н он
а-О-глюкоза
н
1
с=о
1
н-с-он ^
но-с-н **
[
н-с-он
1
н-с-он
СН2ОН
О-глюкоза
СН2ОН
н ,1 п он
он^ у н
н он
В-О-глюкоза
сн,он
1 1-о^ он
сн онс
IV с/\
Н ? С\ СН2'
1
он н
Р-О-фруктоза
он
Моносахариды, прежде всего триозы и гексозы, играют
большую роль в важнейших метаболических превращениях. (Их
участие в фотосинтезе и дыхании будет рассмотрено в других главах.)
Пентозы — рибоза и дезоксирибоза, как указывалось ранее,
являются неотъемлемыми компонентами АТФ, нуклеиновых
кислот, многих ферментов. В некоторых растительных объектах
(плоды, ягоды) моносахариды — глюкоза, фруктоза — служат
запасными веществами.
Молекулы моносахаридов могут взаимодействовать друг с
другом с выделением воды. Из двух моноз образуются дисахариды,
62
из трех и четырех — олигосахариды (соответственно три- и тетра-
сахариды). Если в состав молекулы входит большое число
остатков простых Сахаров, то возникают полисахариды.
Важнейшим дисахаридом, состоящим из остатков ос-О-глюко-
зы и р-В-фруктозы, является сахароза.
СН2ОН
о
II
н-с*-он
1
СН2ОН
О-глицериновый
альдегид
О
II
но-с*-н
1
СН2ОН
Ь-глицериновый
альдегид
СН2ОН
1
с=о
1
1
СН2ОН
О-гидроацетон
н н
сахароза
Сахароза служит запасным питательным веществом в
корнеплодах, сочных плодах, сахарном тростнике. Другим
замечательным свойством этого дисахарида (так же, как и некоторых оли-
госахаридов, — стахиозы, рафинозы, вербаскозы) является ее
транспортная роль. Именно в этой форме фотосинтезированные
в листьях ассимиляты передвигаются в разные части растения.
Полисахариды выполняют в растении в основном две
функции — структурную и запасную. Главное запасное вещество
растений — крахмал — представляет собой смесь двух полимерных
молекул, каждая из которых состоит из многочисленных
остатков а-Б-глюкозы. В молекуле одного из них — амилозы — глю-
козные остатки соединены друг с другом только посредством
связей между 1-ми 4-м углеродными атомами, вследствие чего
амилоза представляет собой линейную структуру. При
образовании амилопектина между молекулами глюкозы образуются не
только 1—4-связи, но и связи между 1-м и 6-м углеродными
атомами соседних молекул, в результате чего возникает
разветвленная структура.
сн,он
о
(4)
СН2ОН
-о
СН2ОН
I
о
О
(1)
СН2ОН
-о
Оч(6)
сн.
(4)
О
О
амилопектин
Соотношение амилозы и амилопектина в крахмале из разных
объектов неодинаково: крахмал яблок почти целиком состоит из
амилозы, в то время как в кукурузном крахмале до 80 %
приходится на амилопектин. Крахмал находится в клетках растений в
со
63
виде крахмальных зерен, форма, размеры и структура которых в
значительной степени определяются генотипически. При
определении качества муки это позволяет выявлять примеси.
В некоторых растениях роль основного запасного
полисахарида выполняет полифруктозан инулин, как, например, в клубнях
земляной груши.
1.2.7. ЛИПИДЫ РАСТИТЕЛЬНОЙ КЛЕТКИ
Общее свойство всех веществ этой группы — высокая гидро-
фобность. Липиды растворяются в эфире, бензине, бензоле. Это
обусловлено наличием в их молекулах большого количества
неполярных углеводородных радикалов.
Липиды можно разделить на следующие группы.
Собственно жиры. Они являются сложными эфирами
трехатомного спирта глицерина и высших карбоновых кислот.
Высокомолекулярные жирные кислоты представляют собой
длинные углеводородные цепочки с насыщенными или
ненасыщенными связями. От степени насыщенности
жирных кислот зависит консистенция жира: чем
больше степень ненасыщенности, тем более
жидким при нормальных условиях является жир
(масло). В жирах растений чаще других
встречаются такие ненасыщенные кислоты, как
олеиновая (С17Н33СООН), линолевая (С17Н31СООН),
линоленовая (С17Н29СООН), среди
насыщенных — стеариновая (С17Н35СООН) и
пальмитиновая (С[5НззСООН). Собственно жиры
отличаются очень высокой калорийностью: 1 г жира
дает 38 кДж (больше, чем углеводы и белки). Это определяет
основную функцию жиров — запасную. Главное место их
локализации — семена. Насыщенность жирами семян масличных
культур делает их ценнейшим сырьем для производства масел,
использующихся в пищевых и промышленных целях.
Содержание масла в семенах масличных культур (по П. П. Вавилову и др.,
1979)
О
СН2-О-С-К,
о
сн-о-с-к2
о
сн2-о-с-к3
Культура
Подсолнечник
Сафлор
Горчица сизая
Рапс озимый
Рыжик
Клещевина
Содержание масла, 9>
абсолютно сухого
вещества
29-37
25-37
35-47
45-49
25-46
47-58
о Культура
Кунжут
Перилла
Ляллеманция
Арахис
Соя
Лен масличный
Содержание масла,
абсолютно сухого
вещества
48-63
26-49
29-37
41-55
15-24
30-49
64
Следует отметить еще одну полезную особенность жиров. При
их окислении высвобождается больше воды, чем при окислении
других запасных веществ (так называемая метаболическая вода).
Это обстоятельство может иметь решающее значение для
выживания растительного организма в условиях водного стресса.
Воска. Это наиболее гидрофобные вещества из всех липидов.
Они представляют собой сложные эфиры одноатомных
высокомолекулярных спиртов (от 22 до 32 атомов углерода) и высших
жирных кислот с числом углеродных атомов от 24 до 36. В
качестве спирта в растительных восках часто встречается цетило-
вый — (СН2)нСН2ОН. Помимо эфиров в состав восков могут
входить и молекулы свободных высокомолекулярных спиртов,
кислот и углеводородов.
Воска образуются в цитоплазме и накапливаются в виде
отдельных пластинок в клеточной стенке эпидермальных клеток,
откуда они выступают на поверхность в виде гранул, палочек,
ячеек. Образовавшаяся таким образом кутикула защищает
листья, стебли и плоды растений от высыхания при недостатке
влаги и вымокания в период длительных дождей. Восковой налет
служит существенной преградой для проникновения в растение
патогенных грибов и бактерий, а также ряда вредных насекомых.
Листья некоторых растений, например свечного дерева (Еирпог-
Ыа ап115урЫ1Шса), выделяют так много воска, что его используют
на выделку свечей.
Стероиды. Относятся к терпеноидам. В основе их строения
лежат конденсированные структуры из четырех углеводородных
циклов, представляющих собой высокомолекулярные спирты
или их сложные эфиры. Эти гидрофобные вещества играют
определенную роль в структуре клеточных мембран, а также
являются витаминами группы Е> (эргостерол). Стероиды выделены из
таких растительных объектов, как зародыши пшеницы и
кукурузы, зеленые листья. Наиболее богаты этой группой липидов
дрожжи и плесневые грибы.
Липофильные пигменты. К этой группе относятся
растворимые в органических растворителях пигменты — хлорофиллы и
каротиноиды. (Их химическая природа, свойства и функции
рассматриваются в главе «Фотосинтез»).
Амфипатические липиды. Основное отличие этой группы
заключается в том, что они обладают двойственными свойствами:
как гидрофобностью, так и гидрофильностью. Последнее
обеспечивается тем, что с одной из спиртовых групп глицерина
взаимодействует соединение с гидрофильными свойствами. Поэтому,
если собственно жиры схематично изображают в виде символа
Ш, то амфипатические липиды напоминают камертон — ЦЛ; две
его ветви, символизирующие радикалы с гидрофобными
свойствами, обращены в одну сторону, а третья, с противоположными
гидрофильными свойствами, — в другую.
Наиболее часто в растениях встречаются фосфолипиды, гли-
колипиды и сульфолипиды.
Фосфолипиды. В их молекулах с одним из гидроксилов
глицерина взаимодействует ортофосфорная кислота, к которой
присоединяется какое-либо гидрофильное соединение:
о
Н2с—о-с-к,
-К2
1А2^— \У ^ 1
нс-о-с-г
о
Н2С-О-С-К,
о
нс-о-с-к2
о
Н2С-О-Р~О-СН2-Н-СН3 Н2С-О-Р-О-СН2-СН2-МН2
он холин он
этаноламин
о
н2с-о-с-к,
нс-о-с-я
I °
Н,С-О-Р-О-СН,-СН-
соон
он
:ын2
серии
Гликолипиды. В качестве гидрофильного компонента
содержат остаток галактозы:
Н2С-О-С-К1
—о-с-к.
НС
Н2С-0
Н2СОН
он н\
н он
66
Сульфолипиды. В растительных липидах этого типа галактоза
взаимодействует с серной кислотой следующим образом:
он н2с-о-
-я,
0=8=0
I
Н2С
он>1
I /
(1/он н
н с с н
н он
н2с-р
Соотношение различных форм амфипатических липидов
можно представить по анализу их содержания в листьях
сахарной свеклы.
Содержание различшлх форм лилидов в листьях сахарной свеклы (по Дж.
Боннеру, 1968)
Тип липидов
Фосфолипиды:
фосфатидилхолин
фосфатидилэтаноламин
фосфатидилинозит
фосфатидилглицерин
Гликолипиды
Сульфолипиды
Мкмоль/г сырой массы
4,7
2,2
1,1
0,5
3,7
0,9
Роль амфипатических липидов в живой клетке уникальна: они
являются основой всех биологических мембран.
1.3. СТРУКТУРА И ФУНКЦИИ МЕМБРАН
Способность живых клеток поддерживать постоянство
внутренней среды (гомеостаз) известна очень давно. В этом легко
убедиться, сравнивая химический состав клеток и окружающей
их среды: содержание в клетке калия, кальция, натрия, хлора и
других элементов в десятки и сотни раз превышает таковое в
среде. Установлено, что способность регулировать свой состав
утрачивается с гибелью клетки. Все эти данные уже 100 лет назад
позволили предположить, что на поверхности клетки имеются
структуры, ответственные за регуляцию поглощения и выделения
веществ, существование которых обеспечивается процессами
67
жизнедеятельности. Однако лишь к середине XX в. с помощью
электронной микроскопии удалось достоверно зафиксировать
наличие на поверхности клетки и ее органелл сходных по
строению трехслойных образований — мембран.
Изучением мембран занимается специальная наука — мембра-
нология. Путем дифференциального центрифугирования удается
выделить мембранную фракцию и определить ее состав.
Основными химическими компонентами мембран являются белки у
липиды. Соотношение белков и липидов в различных клеточных
мембранах связано со спецификой \функций, этих > мембран/
(табл. 8). Те из них, которые выполняют только защитную
функцию (например, оболочка нерва), насыщены липидами; высокая
ферментативная и энергетическая активность (внутренняя
мембрана митохондрий) может осуществляться лишь при большом
содержании белков.
8. Количество белков и липидов в разных мембранах, %
Мембрана
Белки
Липиды
Миелин (оболочка нерва)
Внешняя мембрана
митохондрий
Внутренняя мембрана
митохондрий
Тилакоиды хлоропластов
Оболочка ядра
20
55-65
75-85
50-60
43-52
80
35-45
15-25
40—60
38-47
Белки мембраны можно разделить на три группы:
структурные, транспортные и ферментативные. Липиды представлены
главным образом амфипатическими, хотя в мембранах всегда
имеется некоторое количество собственно жиров. Соотношение
в мембранах различных форм липидов непостоянно. В
частности, достоверно установлено, что в стрессовых условиях (засуха,
мороз) доля амфипатических липидов возрастает. Кроме того, в
этих неблагоприятных условиях в липидах повышается
содержание непредельных жирных кислот, что делает мембранный мат-
рикс более жидким и подвижным. С помощью этих изменений в
химическом составе мембран удается идентифицировать
различия в зимостойкости сортов озимых культур. Работами Г. В.
Новицкой в Институте физиологии растений показано, что в
результате закаливания в растениях устойчивого к морозу сорта
озимой ржи Харьковская 55 содержание фосфатидилхолина
повысилось по сравнению с незакаленными растениями в 6,7 раза,
в то время как этот показатель для неморозостойких растений
сорта Харьковская 70 увеличился лишь в 2,5 раза.
Помимо белков и липидов в мембранах есть и другие
химические вещества. Это прежде всего вода, содержание которой
может достигать 30 % массы мембраны. Вода играет важную
68
роль в ориентировании отдельных структурных компонентов, а
также облегчает транспорт через мембрану гидрофильных
веществ. Обязательным компонентом мембран являются
полисахариды, взаимодействующие с белками преимущественно на
поверхности. Среди минеральных веществ мембран особо следует
выделить кальций, способствующий взаимодействию друг с
другом мембранных компонентов.
Вопрос о строении мембран возник вместе с самим
предположением об их существовании. Прежде всего выяснилось, что
организация мембран обусловлена свойствами самих
амфипатических липидов. Уже в 20-х годах текущего столетия было
обнаружено, что липиды, экстрагированные из эритроцитов и
разлитые на поверхности воды, занимают там площадь, вдвое
большую, чем поверхность эритроцитов. Из этого было сделано
заключение, что липиды располагаются на поверхности клеток
двойным слоем, в котором гидрофобными радикалами они
обращены друг к другу, а гидрофильными группировками — к
окружающей водной среде и содержимому клетки. В дальнейшем
модельные опыты показали, что поверхностное натяжение
искусственной мембраны — липидной пленки и мембраны живой
клетки существенно различаются. Когда к липидам добавили
белок, пограничные свойства мембран сохранились, а
поверхностное натяжение уменьшилось. На основании этих результатов
было высказано предположение о наличии белков в клеточных
мембранах.
В начале 30-х годов Г. Даусон и Д. Даниелли предложили
свою гипотезу о строении элементарной клеточной мембраны
(рис. 18), согласно которой она представляет собой двойной ли-
пидный слой, с двух сторон покрытый белками. Описанная
структура напоминает двойной бутерброд — сэндвич. Основными
силами, стабилизирующими мембрану, являются слабые
водородные взаимодействия между гидрофильными радикалами
белков и амфипатических липидов, а также гидрофобные связи
Ван-дер-Ваальса в зоне углеводородных радикалов
высокомолекулярных жирных кислот. В дальнейшем было высказано
предположение о наличии в
мембранах «пор», представляющих
собой участки с
гидрофильными свойствами.
Н-сВязи
Связи >П
ОО
оо
ОО
Предложенная Д. Даниелли Ван-/ер-Вашш\\ (Г И II ^~ I) [} [)'
и Г. Даусоном модель
элементарной (унитарной) клеточной
мембраны в течение
последующих лет неоднократно
подтверждалась прямыми
исследованиями ее структуры и
функций и до сих пор остается ос-
/"ООООООООО/
н-сбти
Рис. 18. Схема строения
элементарной мембраны («сэндвич») (по Г. Дау-
сону и Д. Даниелли, 1935):
/ — белок; 2 — липиды; 3 — «пора»
69
1
Рис. 19. Современная схема строения элементарной клеточной мембраны
(по Д. Кларксону, 1978):
/ — периферические белки; 2— глобулы интегральных белков; 3 — двойной липидный
слой; 4 — липидная мицелла; 5— молекулы неполярных липидов
новой современных мембранных схем. Однако развитие науки и
экспериментальной техники позволило к настоящему времени
сформировать представление о мембранах как о более
разнокачественных и динамичных образованиях как в структурном, так и
в функциональном отношении. Примеров такой динамичности
немало. Так, в результате активного встраивания в мембрану
новых элементов поверхность быстрорастущих клеток в
тычиночных нитях злаков за 1 ч увеличивается в 65 раз, т. е. каждую
минуту плазмалемма нарастает на свою первоначальную
величину. Структурная лабильность объясняет и такие явления, как
быстрое изменение периметра плазмалеммы и тонопласта при
плазмолизе и деплазмолизе и образование выростов мембраны во
время пиноцитоза.
Огромную роль в современных представлениях о структуре
мембран сыграл прогресс электронно-микроскопической
техники. В настоящее время модель клеточной мембраны можно
представить себе следующим образом (рис. 19).
Основой мембраны являются амфипатические липиды. Их
организация в бимолекулярный слой объясняется
физико-химическими свойствами самих молекул. В результате возникает
внутренняя гидрофобная зона — полужидкий матрикс,
обладающий высокими изолирующими свойствами в отношении гидро-
70
фильной среды. Стабильность этого слоя увеличивается
присутствующими в нем неполярными молекулами жиров.
Помимо бислоя липиды в мембране организованы в
глобулярные структуры — мицеллы, внутренняя часть которых образована
гидрофобными остатками жирных кислот, а наружная —
гидрофильными компонентами амфипатических липидов. Липидные
мицеллы уменьшают стабильность мембраны, но дают ей
возможность изменять конфигурацию. Кроме того, вокруг
периферической гидрофильной зоны липидных мицелл возникают гид-
ратные оболочки, облегчающие движение воды и растворенных в
ней молекул.
По современным данным, диффузия воды через липидный
матрикс может осуществляться также с помощью кинкизомеров.
Что же это такое? Длинные углеводородные цепочки остатков
высших карбоновых кислот в жидком матриксе мембраны
находятся в постоянном тепловом движении. Если вокруг какой-либо
С—С-связи в прямой углеводородной цепи произойдет поворот
на 120°, то соседняя с ней С—С-связь также повернется на 120°,
но в противоположном направлении. При этом образуется
«излом», ограничивающий небольшой пустой объем, который не
остается на месте, а перемещается вдоль цепи. В этом объеме,
как в пакете, через мембрану могут проходить молекулы воды и
некоторые растворенные вещества.
Поверхностное положение в мембране белков подтверждается
как результатами электронно-микроскопических исследований,
так и данными модельных опытов. В то же время метод
замораживания — скалывания позволил зарегистрировать в самой
толще мембраны очень крупные глобулы, иногда
пронизывающие всю мембрану насквозь и, по-видимому, лабильно
взаимодействующие с другими компонентами мембраны как
гидрофильно, так и гидрофобно. Эти крупные образования
представляют собой молекулы белков, имеющие непосредственное
отношение к активному транспорту веществ через мембрану:
плотность распределения этих элементов часто коррелирует с
транспортной активностью мембран.
Таким образом, современная модель мембраны отражает
лабильность, динамичность, разнокачественность ее структуры и
способность осуществлять многообразные функции. Значение
мембран трудно переоценить. С их помощью в клетке
осуществляются важнейшие принципы экономичности, скорости,
направленности и сопряженности всех процессов.
1. Мембраны — это пограничные структуры, обеспечивающие
диалектическое единство разделения и связи клеточных
компонентов.
2. С помощью мембран поддерживается гомеостаз —
постоянство среды в каждом компартменте клетки.
71
3. Через мембраны происходит обмен веществ, энергии и
информации между клеткой и окружающей средой.
4. Мембраны связаны с важнейшими биохимическими
процессами, так как в них локализованы ферменты,
осуществляющие синтез, гидролиз, окисление, перенос и т. д.
5. На мембранах хлоропластов и митохондрий происходят
сложные процессы биоэнергетики (фотосинтетическое и
окислительное фосфорилирование), снабжающие клетку энергией.
6. Мембраны выполняют рецепторную функцию,
воспринимая внешние раздражения и передавая сигналы о них организму
в целом.
1.3.1. ПРОБЛЕМА МЕМБРАННОЙ ПРОНИЦАЕМОСТИ
Способность веществ преодолевать мембранный барьер
зависит прежде всего от их химической природы. Еще на заре XX в.
английский ученый Дж. Овертон показал, что вещества,
имеющие сродство к жирам (липофильные), легко проходят в клетку.
Теперь мы знаем, что это объясняется их сродством к
мембранному матриксу, состоящему из липидов. Гидрофильные же
вещества, в первую очередь вода, по-видимому, «протискиваются»
через мембранные поры. Поэтому для их проникновения
существенное значение имеют размеры молекулы. Само понятие
«поры» скорее всего является не структурным, а
функциональным. Иными словами, пора — это не отверстие в мембране, а
участок, обладающий гидрофильными свойствами и способный
проводить гидрофильные вещества. В среднем размер такой
поры 0,3—0,5 нм. Лабильность структуры мембраны,
обусловленная слабыми связями между ее компонентами, приводит к
тому, что поры могут менять расположение и размеры. Это
объясняет изменчивость пропускной способности мембраны.
Особое значение для живой клетки имеет поступление в нее
минеральных элементов, без которых не обходится ни один
функционально важный процесс. Так как минеральные вещества
находятся в окружающей среде (почве) в растворенном
состоянии и поступают в клетку в виде ионов, то мембрану должны
преодолевать гидратированные в той или иной степени частицы.
Молекулы воды, как известно, являются диполями и вследствие
этого ориентируются вокруг положительно или отрицательно
заряженных ионов соответствующими полюсами. Размеры гидра-
тируемых частиц сильно увеличиваются, что препятствует их
проникновению через поры мембраны. Степень гидратации
ионов зависит от их заряда и размеров атомного ядра. Гидрата-
ционное число так увеличивается в ряду катионов: калий — 4,
натрий — 5, кальций — 10, магний — 13, алюминий —21. Чем
более гидратирован ион, тем труднее ему преодолеть мембрану.
72
Движение ионов через мембраны связывают со специальными
молекулами-переносчиками — ионофорами. Действие ионофоров
можно представить на примере функционирования
антибиотиков — веществ, вырабатываемых некоторыми грибами и
бактериями и действующих в очень низких концентрациях (10"11 —
10~6 М). Антибиотик, продуцируемый бактериями ЗиерЮтусез
ГиМззшшз, — валиномицин — представляет собой циклический
полипептид, почти не растворимый в воде. Сродство валиноми-
цина к мембранному матриксу обеспечивается гидрофобными
радикалами, расположенными на поверхности молекулы, в то
время как на внутренней ее части имеются карбоксильные
группы, с атомами кислорода которых ион калия образует
координационные связи (рис. 20, А). Благодаря неполярному «чехлу» он
благополучно преодолевает мембрану. Переносчик при этом
может быть уподоблен челноку, курсирующему от одной
поверхности мембраны к другой. Внутренний размер «молекулярного
мешка» обеспечивает высокую избирательность к определенному
иону. Так, валиномицин связывает и транспортирует ион калия
в 1000 раз эффективнее, чем ион натрия.
Другой антибиотик — грамицидин — представляет собой
линейный полипептид, две молекулы которого образуют
спиралевидный канал, в котором гидрофильные группы обращены
внутрь, а гидрофобные — к мембранному матриксу. По
гидрофильному каналу происходит передвижение через мембрану
ионов (рис. 20, Б).
Способность антибиотиков наводить каналы ионной
проводимости обусловливает их медицинское значение, так как является
мощным средством ионного опустошения клеток патогенных
микроорганизмов. Вследствие сильного повышения
проницаемости («продырявливания») клеточных мембран под действием
антибиотиков происходит быстрая утечка калия и других важных
элементов из клеток возбудителей болезней, в связи с чем насту-
Рис. 20. Переносчики ионов через мембрану:
- комплекс валиномицина с ионом калия; 5— грамицидиновая «пора»
73
Рис. 21. Механизмы движения веществ через мембрану:
/—пассивный транспорт: / — диффузия и осмос; 2 — электрофорез; //—активный
транспорт: 3 — ионный насос
пает их гибель. На этом основан терапевтический эффект
антибиотиков в борьбе с инфекционными заболеваниями.
Фитопатогенные грибы способны вырабатывать весьма
специфические вещества, с помощью которых они воздействуют на
поражаемые растения, увеличивая проницаемость клеточных
мембран, чем причиняют растительному организму
непоправимый вред. Идентификация мембранных переносчиков растений
и изучение их действия для ученых-биологов — важная задача,
решение которой в дальнейшем может иметь практическое
значение в управлении ионным транспортом.
До сих пор рассматривался вопрос о том, каким образом
различные по природе и свойствам вещества способны
преодолевать мембранный барьер. Не менее важно и то, какие силы
направляют вещества в клетку или из нее.
Все известные механизмы, обеспечивающие передвижение
атомов, ионов или молекул между клеткой и средой, можно
разделить на две категории. К первой относятся процессы,
происходящие по законам физики и химии, общим как для живой,
так и неживой природы. Направление движения молекул и
ионов в этом случае определяется градиентами, существующими
между клеткой и окружающей ее средой. Живая клетка не
затрачивает на транспорт веществ собственной энергии,
вырабатываемой ею в процессе жизнедеятельности. Такой тип транспорта
называется пассивным. Пассивный транспорт — это движение
веществ по физико-химическим градиентам без затраты клеткой
метаболической энергии. Подобное движение происходит как в
живой, так и в неживой природе.
Другая категория процессов транспорта веществ — активный
транспорт — присуща только живым организмам, которые
способны осуществлять передвижение молекул и ионов против фи-
74
зико-химических градиентов. Для того чтобы «повернуть вспять»
движущиеся частицы, клетке необходимо затратить какую-то
часть выработанной ею в процессе обмена веществ энергии,
запасенной чаще всего в молекулах АТФ (рис. 21, II).
Энергетические затраты клетки на активный транспорт веществ очень
велики — они могут достигать 40 % всей энергии дыхания.
Рассмотрим возможные механизмы пассивного и активного
транспорта веществ.
Пассивный транспорт. Важнейшим механизмом передвижения
веществ является диффузия. В газах и жидкостях молекулы и
ионы находятся в постоянном движении благодаря кинетической
энергии, которой обладают эти частицы. По второму закону
термодинамики каждая система стремится уменьшить свою
внутреннюю энергию и увеличить энтропию. Поэтому в
сообщающихся растворах разных концентраций частицы растворенного
вещества будут перемещаться из более концентрированного
раствора в менее концентрированный (рис. 21, /). Одновременно из
второго сосуда в первый на том же основании будут
передвигаться молекулы растворителя. Процесс направленного
передвижения молекул продолжится до тех пор, пока концентрация
растворенного вещества в обеих частях системы не станет одинаковой.
При этом энергия движущихся частиц в любой единице объема
Данной системы уравнивается — химический потенциал будет
одинаков. Таким образом, движущей силой диффузии,
происходящей за счет тепловой энергии, является градиент
концентрации (Ас) или химического потенциала (Дц.) данного вещества.
Количество вещества, диффундирующего в единицу времени
через единицу поверхности, пропорционально градиенту
концентрации и зависит от природы диффундирующего вещества
(коэффициента диффузии). Это выражается уравнением Фика:
Ё1
Л
с1х'
где — — число частиц, диффундирующих за единицу времени (скорость
диффузии); 1> — коэффициент диффузии; <? —площадь поверхности диффузии; — —
градиент концентрации между двумя системами.
Если объемы с различными концентрациями не сообщаются,
а разделены перегородкой, проницаемой для растворителя, но не
проницаемой для растворенного вещества, то выравнивание
концентраций будет происходить лишь за счет перемещения
молекул растворителя. Такие перегородки называют
полупроницаемыми, а движение частиц через них — осмосом.
Таким образом, осмос — это одностороннее движение
растворителя через полупроницаемую мембрану по градиенту
концентрации (химического потенциала). Поскольку почвенный раствор
75
всегда сильнее разбавлен, чем водный раствор веществ в клетке
(химический потенциал воды выше в почвенном растворе), вода
поступает в клетку по законам осмоса.
Одной из форм пассивного транспорта является
электрофорез — движение заряженных частиц за счет электрической
энергии по градиенту электрического потенциала (рис. 21, 2).
Предположим, что две системы, содержащие раствор электролита,
разделены мембраной, проницаемой для ионов. Поверхность
мембраны, обращенная к первой системе, заряжена
отрицательно по отношению к той ее стороне, которая обращена ко второй
системе. В результате этого под действием электродвижущей
силы в обеих системах возникает направленный ток заряженных
частиц — из первой системы во вторую будут перемещаться
анионы, из второй в первую — катионы.
Известно, что на клеточных мембранах генерируется и
поддерживается электрический потенциал определенной величины —
мембранный потенциал (МП). Внешняя мембрана растительной
клетки — плазмалемма — имеет потенциал, равный в среднем
— 120...—150 мВ; МП тонопласта составляет —90...—120 мВ, хло-
ропластов —50...—70, митохондрий —120...—170 мВ; клеточная
оболочка также имеет свой потенциал —50...—70 мВ. Знак
«минус» перед цифрой, выражающей значение мембранного
потенциала, означает, что содержимое нормально
функционирующей растительной клетки и ее органелл заряжено отрицательно
по отношению к внешней среде.
Электрический градиент на мембране обусловлен рядом
причин. Его составляющими являются диффузионный потенциал,
доннановский потенциал и активность электрогенных насосов в
клетке. Первый компонент обеспечивает 30—40 % значения МП,
второй—10—15 %. За счет активных механизмов (протонной
помпы) достигается 45—50 % этой величины. Диффузионный
потенциал возникает в результате различной проницаемости
ионов через мембрану и, как следствие, градиента их активности
между клеткой и средой. Доннановский потенциал образуется за
счет фиксированных зарядов, присущих находящимся в клетке
молекулам белков, нуклеиновых кислот, пектиновых и других
веществ. Об активных механизмах генерации МП с затратой
метаболической энергии будет сказано дальше.
Итак, направление и скорость движения заряженных частиц
определяются совместным действием концентрационного и
электрического градиентов. Другими словами, реальной
движущей силой ионов является градиент электрохимического
потенциала, который выражается в джоулях на моль.
Активный транспорт. Известно, что основные макро- и
микроэлементы в нормальных условиях жизнедеятельности
находятся в клетке в концентрациях, значительно превышающих их
содержание в окружающей среде. Так как со стороны цитоплаз-
76
мы мембрана заряжена отрицательно, совершенно очевидно, что
анионы не способны поступать в клетку пассивно, поскольку и
концентрационный, и электрический компоненты
электродвижущей силы направлены не в клетку, а из нее. Тем не менее клетка
поглощает N63", Б^РО^, 8О|~, С1~ и другие анионы.
Следовательно, их транспорт в клетку представляет собой активный
процесс, требующий затрат энергии.
Что касается катионов, то, хотя концентрационный градиент,
как правило, направляет их движение из клетки в окружающую
среду, электрическая составляющая движущей силы действует в
противоположном направлении: отрицательный заряд на
клеточной мембране заставляет катионы устремляться внутрь клетки. В
каждом конкретном случае направление пассивного тока
катионов будет определяться соотношением двух сил — химической и
электрической.
Для того чтобы решить, активно или пассивно движется
ион и каково направление его движения — в клетку или из
нее при конкретном соотношении концентраций иона в клетке
и окружающей среде, используют упрощенное уравнение Нерн-
ста:
где -Е> — потенциал Нернста (мембранный потенциал), абсолютное значение; п —
валентность и заряд иона; с, — внутренняя концентрация иона; с„ — внешняя
концентрация иона.
Зная величину мембранного потенциала, можно рассчитать,
каким должно быть соотношение внутренней и внешней
концентрации данного иона при пассивном его перемещении за счет
электрохимического градиента. Если реально найденное
соотношение внутренней и внешней концентраций отличается от
расчетного, значит, клетка затрачивает метаболическую энергию на
поглощение или на выделение данного иона, то есть
осуществляет его активный транспорт.
На практике мембранный потенциал клетки (МП) измеряют
с помощью электродов, представляющих собой тончайшие
капилляры, заполненные 3 М КС1 и открытые на концах. Один
из капилляров погружен в окружающий раствор, а другой
вводят в цитоплазму клетки с помощью микроманипулятора под
микроскопом. С другой стороны эти электроды через хлорсе-
ребряный или каломельный электрод присоединяют к высоко-
омному вольтметру, который и показывает величину МП.
Концентрацию иона в окружающей среде измеряют стандартными
методами. Для определения внутриклеточной концентрации
либо получают экстракт из убитых тканей, либо при помощи
центрифугирования выделяют из крупных клеток тонопласты с
77
вакуолярным соком. В экстрактах или выделенных вакуолях
концентрацию исследуемого иона измеряют обычными
методами.
Приведем несколько примеров использования уравнения Нернста как
критерия активного транспорта.
Предварительно прямыми определениями установлено, что мембранный
потенциал клетки Ея составляет 116 мВ, соотношение — для К+ равно 120, для
со
№+ — 20, а для СГ — 140. При п = 1 (для ионов Йа+ и К+) из уравнения
Нернста получаем:
Нб - ^ Ъ*; ^Щ =2 = 1ё100; «- = 100.
1 °сй со 58 со
Таким образом, при МП, равном 116 мВ, за счет пассивного транспорта
содержание калия в клетке должно поддерживаться на уровне в 100 раз выше,
чем в среде. Реально же было установлено, что калия в клетке в 120 раз больше,
чем вне ее. Уравнение Нернста позволяет сделать следующий вывод: для
поддержания реальной концентрации калия в клетке электрохимического потенциала
недостаточно, на поступление калия затрачивается вырабатываемая клеткой
энергия. За счет пассивных механизмов в клетке, обладающей мембранным
потенциалом в 116 мВ, концентрация № также должна быть выше, чем снаружи, в 100
раз. Однако реально, как было установлено, натрия в клетке только в 20 раз
больше, чем в среде. Следовательно, существующее соотношение между
внутренней и внешней средой активно поддерживается самой клеткой: она выкачивает
наружу ионы натрия, используя для этого энергию метаболических процессов.
При п = — 1 (для ионов хлора) уравнение Нернста будет выглядеть
следующим образом:
58. с,
116
1§0,01; — = 0,01.
со
Для аниона хлора складывается противоположная ситуация: МП в 116 мВ
обеспечивает такое равновесие между клеткой и средой, при котором
концентрация этого иона в окружающей среде в 100 раз выше клеточной. Реально же
определено, что в клетке хлора в 140 раз больше, чем снаружи. Как легко было
предположить, отрицательно заряженные ионы поглощаются клеткой против
электрохимического градиента с затратой собственных энергетических ресурсов.
В качестве критерия активности и пассивности ионного
транс порта может быть использована его зависимость от уровня
метаболизма клетки. Первые представления об активном
транспорте веществ связаны с именами американского ученого Д.
Хогланда и вьщающегося отечественного физиолога Д. А.
Сабинина.
Доказано, что движение ионов против электрохимического
градиента стимулируется теми факторами, которые
положительно влияют на дыхание и фотосинтез. Последние, как известно,
являются источниками АТФ в живой клетке. К числу
активаторов транспорта ионов относятся свет, температура,
содержание в среде кислорода, а в растении — углеводов (субстратов
дыхания). С другой стороны, воздействие на растение
дыхательных ядов сильно тормозит поглощение минеральных
веществ. Все это подтверждает активный характер поглощения
клеткой ионов.
78
"Вопрос о механизмах
активного транспорта весьма
сложный. Системы,
отвечающие за передвижение ионов
против электрохимического
градиента, по-видимому,
должны иметь сродство к
мембранному матриксу; быть
достаточно структурно
лабильными, чтобы
осуществлять передвижение какого-
либо вещества; иметь участки,
ответственные за
специфическое присоединение какого-
либо иона (молекулы);
обладать АТФ-'азной активностью,
то есть способностью гидро-
лизовать молекулу АТФ до
АДФ и неорганического
фосфата с высвобождением
энергии макроэргической связи,
которая и обеспечивает
транспорт иона. Современные
исследования мембран, как
отмечалось ранее, позволяют
выявить в них крупные
глобулярные образования, которые
представляют собой белки,
часто имеющие четвертичную
структуру. Активный
транспорт веществ через мембраны
связывают именно с этими
белковыми молекулами. Так
как ионы активно
«накачиваются» или «выкачиваются»
АТ4>
.АТФ
Рис. 22. Схема работы натриево-калие-
вого насоса:
А — ионофорная субъединица; Б — АТФ-
азная субъединица: / — центр присоединения
№+; 2— центр присоединения К+; 3— центр
взаимодействия с АТФ
клеткой, механизмы активного транспорта принято называть
ионными насосами, помпами. В живой клетке функционируют
насосы двух типов — электронейтральные и электрогенные.
Принцип работы электронейтрального насоса заключается в том,
что он переносит через мембрану два иона одинакового заряда в
противоположных направлениях. Поэтому в результате действия
такого насоса заряд на мембране не изменяется. Механизмом
подобного типа является натриево-калиевый насос. Одна из схем
работы этого насоса выглядит следующим образом (рис. 22).
Белок, отвечающий за .транспорт натрия и калия, состоит из двух
структурных компонентов. Первая субъединица (А) пронизывает
матрикс мембраны, образуя в ней ионный канал, по которому
79
могут передвигаться ионы из клетки в среду и обратно. Во
второй субъединице (Б), находящейся на внутренней
поверхности мембраны, имеются участки, способные связывать натрий (1),
калий (2) и АТФ (5).
В результате гидролиза АТФ высвобождается энергия, за
счет которой происходит поворот глобулы таким образом, что
№+ оказывается в канале, сообщающемся с окружающей
средой. В этот момент переносчик теряет способность связывать
какие-либо ионы. Иа+ выходит наружу, а К+ поступает в
клетку. Далее белок возвращается в исходное, наиболее
термодинамически выгодное состояние. В этом положении к
ионному каналу оказывается обращенным участок глобулы,
специфически связывающий калий, поступающий из окружающей
среды. Исходное конформационное состояние глобулы
обеспечивает присоединение к ней новых молекулы АТФ и иона
натрия в соответствующих центрах. Начинается следующий
цикл работы ионного насоса — в результате гидролиза АТФ
высвобождается энергия, обеспечивающая поворот глобулы.
Ион натрия обращается к каналу, а ион калия — к цитоплазме;
потеря способности удерживать эти ионы приводит вновь к
высвобождению натрия в среду, а калия — в цитоплазму.
Электрический заряд на* мембране при этом не меняется.
Ма+/К+ АТФ-аза обнаружена в мембранах клеток многих
животных организмов. Что касается растений, то все более очевидно
присутствие в их мембранах подобных насосов. Профессором
Д. Б. Вахмистровым достоверно показана работа №+/К+ помпы в
клетках галофитов — растений, приспособленных к жизни в
условиях засоления, что, вероятно, связано с необходимостью
откачивать из клеток избыток натрия. Возможно, Ка+/К+ АТФ-аза
активируется растительными клетками и в других крайних условиях,
когда подавляется деятельность активных механизмов другого
рода.
Работа электрогенного насоса заключается в том, что он
переносит ион определенного заряда только в одну сторону,
поэтому за счет его работы происходит генерация
электрического потенциала на мембране. Образующаяся таким образом
электродвижущая сила обеспечивает перемещение ионов путем
электрофореза. Универсальным для всех клеток механизмом
подобного рода является протонная помпа (рис. 23).
Встроенный в плазмалемму (и другие мембраны) белок, состоящий из
нескольких субъединиц, осуществляет выброс протонов
водорода за счет энергии гидролизуемой АТФ — первично активный
транспорт. В результате этого на мембране генерируется
градиент электрического (Ду) и концентрационного (А рН)
потенциалов. Электрический градиент обеспечивает движение в
клетку катионов. Концентрационный градиент протонов
определяет их осмотический отток в клетку с помощью перенос-
80
Кат.*
АТФ
АДФ
АрН
Кат.*
Н+
Н* Органические
вещества.
Рис. 23. Роль протонного насоса в транспорте веществ через мембрану:
ично активный транспорт: 1 — протонный насос; вторично активный транспорт: 2 —
симпорт; 3 — антипорт; 4 — котранспорт органических веществ
чиков. Этот обратный ток протонов может быть сопряжен с
однонаправленным транспортом анионов {симпорт),
противоположно направленным током катионов {антипорт), а также
совместным движением органических молекул {котранспорт).
Таким образом, потоки ионов и молекул в клетке опосредованы
деятельностью протонной помпы и поэтому могут считаться
вторично активным транспортом.
■ 1.4. РАЗДРАЖИМОСТЬ И РЕАКЦИЯ КЛЕТКИ
НА ПОВРЕЖДАЮЩЕЕ ВОЗДЕЙСТВИЕ
Мы рассмотрели молекулярные, структурные и
физиологические основы жизнедеятельности ' растительной клетки. Жизнь
клетки протекает в постоянном взаимодействии с окружающей
средой, изменения в которой не могут не отражаться на
функциональном состоянии клетки. В определенном диапазоне действия
внешнего фактора уровень клеточных функций меняется
градуально. Если же изменения превышают обычную норму, то
внешний агент становится раздражителем. Раздражитель — это
внешнее воздействие, достигшее пороговой силы. Способность живых
структур отвечать на действие раздражителя называется
раздражимостью.
В качестве раздражителей может выступать любой вид
энергии — механическая, химическая, электрическая, световая, теп-
81
ловая. Сила ответной реакции, эффект раздражения,
определяется количеством раздражения — произведением силы
раздражителя на время его действия. Таким образом, слабый агент,
если он действует достаточно долго, может оказывать такое же
действие, как и сильный. Другим важным свойством
раздражимости является суммация раздражения. Отдельные внешние
воздействия различной напряженности могут суммироваться,
достигая порогового значения. Демонстрирует суммацию
раздражения следующее простое явление. Усик вьющегося
растения совершает в воздухе колебательные движения. Если
подвести к нему палочку, то вначале он, столкнувшись с ней,
отталкивается несколько раз. Когда в результате столкновений
происходит суммация раздражения и достигается пороговая
сила, возникает ответная реакция и усик обвивается вокруг
опоры.
Явления суммации раздражения имеет большое
приспособительное значение. Если бы каждое слабое воздействие вызывало
ответную реакцию, то этих реакций было бы бесчисленное
множество и организм тратил бы слишком много энергии
непроизводительно. Суммация раздражения позволяет экономно
расходовать энергию, затрачивая ее лишь в ответ на раздражитель
достаточной силы.
Русский физиолог Н. В. Введенский впервые отметил
единство признаков возбуждения и повреждения (1901). В
дальнейшем эта мысль была развита учеными Д. Н. Насоновым и
В. Я. Александровым, и их исследования приобрели широкую
известность. Ими было установлено, что в ответ на
раздражители и повреждающие агенты в клетке возникают
неспецифические (не зависящие от природы действующего агента)
изменения, которые проявляются рядом ответных реакций. Реакции
эти следующие.
Уменьшение степени дисперсности цитоплазмы («оструктурива-
ние»). Рассматривая в световой микроскоп растительную клетку
при малом и среднем увеличениях, мы не' видим цитоплазмы
из-за высокой степени дисперсности последней. Стоит, однако,
чем-либо подействовать на клетку — уколоть, добавить
гипертонический раствор, подействовать электрическим током, как
цитоплазма сразу станет заметной, так как размеры составляющих
ее частиц увеличатся.
Увеличение общей проницаемости. При повреждающем
воздействии из клетки в окружающую среду выходят самые
разнообразные вещества, которые в неповрежденной клетке прочно
удерживаются: чем сильнее увеличивается проницаемость, тем
больше степень повреждения. На этом основаны методы диагностики
устойчивости к морозу, засухе и другим неблагоприятным
факторам среды (табл. 9).
82
9. Экзосмос электролитов из тканей узлов кущения растений озимой
пшеницы, различающихся по морозоустойчивости (по Э. А. Барашковой
и др., 1983)
Сорт
Морозоустойчивость
по методу прямого
промораживания
Экзосмос электролитов после
промораживания (% от экзосмоса из непро-
мороженных растений)
Тормовчанка
Лютесценс 1060/10
Московская озимая
РПГ 51/49
Безостая 1
Лада
Гектор
Выше средней
То же
»
Средняя
»
Слабая
»
264
367
378
579
500
501
603
Подвергнутые воздействию повреждающего агента
растительные ткани погружают в бидистиллированную воду, после чего
анализируют состав образовавшегося раствора.
Повышение у цитоплазмы и ядра сродства к витальным
(прижизненным) красителям. На этом показателе основан способ
определения жизнеспособности семян.
Неспецифичность ответных реакций на раздражители и
повреждающие агенты разного рода связана с общими
изменениями в структуре клеточных белков. Любой из внешних факторов,
достигших пороговой силы, нарушает слабые связи,
поддерживающие специфическую конформацию молекул. Упрощение
структуры, «развертывание» глобулы представляет собой
денатурацию, которая может быть обратимой или необратимой
(коагуляция). Раскручивание белковых глобул приводит к уменьшению
дисперсности цитоплазмы, повышению вязкости, сродства к
красителям, дестабилизации мембран. Последнее обстоятельство
ярко проявляется еще в одной неспецифической реакции клетки:
при действии раздражителя и повреждающего фактора МП
падает. Как нам уже известно, МП генерируется и поддерживается
прижизненными структурными и функциональными свойствами
клетки и обеспечивается непрерывной выработкой
метаболической энергии. При достижении внешним агентом пороговой силы
МП начинает снижаться, иногда происходит перезарядка
мембраны — поверхность клетки негативируется. Падение МП —
хороший показатель повреждения. Так, при действии ядом
цианидом на колеоптили овса МП упал с —119 до —42 мВ; в отсутствие
кислорода МП гипокотиля вигны составил лишь —40 мВ, тогда
как в контрольных условиях он был равен —111 мВ.
В ответ на сильное раздражение (механическое, химическое,
температурное, электрическое, фото- и радиостимулы) может
возникнуть другая биоэлектрическая реакция — потенциалы
действия (ПД). Они зарегистрированы у растений тыквы, гороха,
фасоли, кукурузы, подсолнечника, свеклы и др. Суть этого явле-
83
ЮмВ
Рис. 24. Потенциалы действия при
раздражении ОДМ КС1 базипетальной
( ) и акропетальной ( ) частей
стебля подсолнечника (но И. И. Гуна-
ру и др., 1970)
12 3 4
Время температурного
деист бия,ч
Рис. 25. Динамика выделения
веществ, вязкости цитоплазмы и
движения сферосом в клетках колеоптилей
ячменя при температуре 40 °С (по
П. С. Беликову и др., 1964):
I — выделение веществ; 2 — вязкость
цитоплазмы; 3 — движение сферосом
ния в следующем. При резком изменении какого-либо фактора
увеличивается ионная проводимость мембраны; за счет
входящего в клетку кальция происходит деполяризация мембраны, при
этом внешняя поверхность может стать отрицательной по
отношению к внутренней. Затем за счет выходящего ионного тока
калия потенциал возвращается к исходному уровню.
Возбужденный участок мембраны сам становится источником возбуждения
для соседнего участка, где повторяются уже описанные
двухфазные изменения. Потенциалы как бы бегут вдоль мембраны
(рис. 24). Так возникает и распространяется ПД, с помощью
которого по растению передаются сигналы о происходящих во
внешней среде изменениях. После достижения ПД какого-либо
органа наступает ответная физиологическая реакция. Особенно
хорошо она проявляется у «чувствительных» растений.
Например, у мимозы вслед за механическим раздражением листа
регистрируется ПД, который, достигая листовой подушечки, вызыва-
84
ет в ней изменения тургора, что, в свою очередь, приводит к
опусканию листочков. Но не только у подобных растений ПД
вызывает физиологический эффект. В Московской
сельскохозяйственной академии им. К. А. Тимирязева профессором
П. С. Беликовым (1964) было показано, что раздражение корней
растений пшеницы концентрированными солями или высокой
температурой генерируют ПД, который, распространяясь,
достигает листа. Этот сигнал вызывает изменения фотосинтетической
активности.
Не только биопотенциалы, но и другие показатели при
действии раздражителей изменяются волнообразно, двухфазно. Так,
сразу же после начала теплового воздействия вязкость
цитоплазмы сначала уменьшается, а уже затем увеличивается; скорость
движения цитоплазмы сначала возрастает, а потом снижается;
выход веществ из клетки изменяется волнообразно (рис. 25).
Колебательный характер ответных реакций объясняется тем,
что при действии на клетку раздражителя в ней одновременно
наблюдается несколько функциональных состояний
(альтераций) — повреждение, возбуждение, закалка, репарация.
Повреждение выражается в нарушении структуры и функций клетки.
Возбуждение приводит к активации
клеточной деятельности, в
результате чего возникает закалка —
действие раздражителя
воспринимается в меньшей степени. На фоне
закалки происходит восстановление
исходных структур и функций —
репарация. Клетка адаптируется к
данному уровню внешнего
фактора. Перечисленные процессы
имеют разную направленность и
противоречивый характер. В
результате их взаимодействия переход
клетки из одного состояния в
другое не бывает плавным, а
представляет собой колебательный процесс.
Характерными особенностями
временного хода колебательного
процесса являются время
наступления ответной реакции, амплитуда и
длина волны. Уровень каждого из
Рис. 26. Биоэлектрические реакции
проростков озимой пшеницы на температурное
раздражение корня (по И. И. Гунару и др.,
1972):
/— при 60 "С (10 с); II— при 2 "С (непрерывно);
/ — Улъяновка; 2 — Безостая 1
этих параметров может служить критерием силы повреждения.
Эти параметры могут быть использованы для диагностики
устойчивости к различным воздействиям. Чем раньше наступает
ответная реакция и больше ее амплитуда, тем более уязвим объект.
В качестве примера приведем данные профессора И. И. Гунара
(1972) — одного из первых исследователей биоэлектрических
явлений у растений в нашей стране. Исследовали
биоэлектрическую реакцию растений морозоустойчивого сорта озимой
пшеницы Ульяновка и слабоустойчивого к морозу сорта Безостая 1.
Оказалось, что под воздействием резких колебаний температуры
у неустойчивого сорта возникают быстрые и резкие колебания
потенциалов; устойчивый сорт реагирует слабее (рис. 26).
В этом разделе мы сосредоточили свое внимание на
неспецифических реакциях растительной клетки. В то же время в
растительном организме проявляется множество специфических
изменений на стрессоры различной природы. Об этих специфических
реакциях будет рассказано при рассмотрении вопросов
устойчивости растений к неблагоприятным факторам среды.
Итак, все живые системы обладают свойством
раздражимости, которое позволяет им воспринимать изменения во внешней
среде и реагировать на них структурными и функциональными
перестройками. Под действием раздражителей в клетке в первую
очередь возникают изменения в нативной структуре белков и
состоянии биологических мембран. Уровень ответных реакций и
характер их временного хода может использоваться для
диагностики функционального состояния растений и их устойчивости к
стрессорам.
1.5. ПРИНЦИПЫ РЕГУЛИРОВАНИЯ ФИЗИОЛОГИЧЕСКИХ
ПРОЦЕССОВ
Живая клетка, как и организм в целом, состоит из тех же
химических элементов и подчиняется тем же общим законам,
что и неживая природа. Однако живые структуры отличаются от
неживых уникальными особенностями своего существования.
Одним из важнейших условий, обеспечивающих жизнь, является
способность к внутренней регуляции клеточных процессов.
Существует несколько систем регулирования. Их совместная
деятельность приводит к быстрым, направленным и экономичным
перестройкам, обеспечивающим поддержание гомеостаза и
оптимальный уровень функций в условиях непостоянной внешней
среды при выполнении наследственной программы.
Системы эти следующие.
Генетическая. Обеспечивает включение и выключение
отдельных генов, ответственных за синтез специфических белков, и
86
осуществляется за счет уникальной структуры ДНК и
саморегуляции ее деятельности (см. 1.2.5.).
Трофическая. Реализуется с помощью химических веществ,
продуктов метаболизма. Они могут использоваться как
источники для синтетического и энергетического обмена, а также
выполнять в клетке «тонкую настройку», выступая как регуляторы
ферментативной активности (см. 1.2.З.).
Энергетическая. Выполняется системами, ответственными за
новообразование энергоемких молекул, прежде всего АТФ
(см. 1.2.4.), способных снабжать энергией все виды работ в
клетке.
Гормональная регуляция — один из самых тонких механизмов
структурных и функциональных изменений. О специфических
веществах — гормонах — и принципах гормонального
регулирования процессов жизнедеятельности будет рассказано в разделе
«Рост и развитие растений».
Все регуляторные системы работают не только в отдельной
клетке, но и на уровне многоклеточного организма, обеспечивая
динамическое взаимодействие частей, надежность и целостность
сложной живой системы.
Контрольные вопросы и задания
1. Как осуществляется обмен растительной клетки с окружающей средой
веществом, энергией и информацией? 2. Что является структурной основой
любой клетки? Каковы отличия растительной клетки от животной? 3. Каков
средний химический состав цитоплазмы растительных клеток? Какие важнейшие
в структурном и функциональном отношении вещества относятся к полимерам?
4. Какие основные свойства клеточных белков обеспечивают им приоритетное
участие в главных функциях? 5. В чем состоит принцип действия ферментов?
Чем определяется их высокая активность, специфичность и лабильность?
6. Каким образом регулируется уровень ферментативной деятельности в клетке?
7. Назовите главнейшие принципы, обеспечивающие функции нуклеиновых кис-
лот.'8. Как используется тотипотентность всех клеток организма в
биотехнологических целях? Что такое генная инженерия? 9. Каковы основные этапы
биосинтеза белка и принципы регуляции этого процесса? 10. В чем состоят современные
представления о структуре биологических мембран? 11. На чем основаны
механизмы пассивного и активного транспорта веществ в клетке? 12. Как
используется клеточная проницаемость для диагностики состояния растения? 13.
Перечислите общие (неспецифические) реакции клетки на повреждающие воздействия.
14. Как можно использовать биоэлектрические явления для оценки устойчивости
растения к стрессорам?
Глава 2
ФОТОСИНТЕЗ
2.1. ФОТОСИНТЕЗ КАК ОСНОВА ЭНЕРГЕТИКИ БИОСФЕРЫ
2.1.1. ПЛАНЕТАРНАЯ РОЛЬ ФОТОСИНТЕЗА
Фотосинтез, возникнув на первых этапах эволюции жизни,
остается важнейшим процессом биосферы. Человечество все
больше осознает истину, впервые установленную К. А.
Тимирязевым и В. И. Вернадским, что именно зеленые растения
посредством фотосинтеза обеспечивают космическую связь жизни
на Земле с Вселенной и определяют экологическое благополучие
биосферы вплоть до возможности существования человеческой
цивилизации. Фотосинтез — это не только источник пищевых
ресурсов и полезных ископаемых, но и фактор
сбалансированности биосферных процессов на Земле, включая постоянство
содержания кислорода и диоксида углерода в атмосфере,
состояние озонового экрана, содержание гумуса в почве, парниковый
эффект и т. д.
Глобальная чистая продуктивность фотосинтеза составляет
78-108 т углерода в год, из которых 7 % непосредственно
используют на питание, топливо и строительные материалы. В
настоящее время потребление ископаемого топлива приблизительно
сравнялось с образованием биомассы на планете. Ежегодно в
ходе фотосинтеза в атмосферу поступает 70—120 млрд т
кислорода, обеспечивающего дыхание всех организмов. Одним из
важнейших последствий выделения кислорода является образование
озонового экрана в верхних слоях атмосферы на высоте 25 км.
Озон (Оз) образуется в результате фотодиссоциации молекул Ог
под действием солнечной радиации и задерживает большую
часть ультрафиолетовых лучей, губительно действующих на все
живое.
Существенным фактором фотосинтеза является также
стабилизация содержания СОг в атмосфере. В настоящее время
содержание СОг составляет 0,03 % по объему воздуха, или 711 млрд т
в пересчете на углерод. Дыхание организмов, Мировой океан, в
водах которого растворено в 60 раз больше СО2, чем находится в
атмосфере, производственная деятельность людей, с одной
стороны, фотосинтез — с другой, поддерживают относительно
постоянный уровень СОг в атмосфере. Диоксид углерода в
атмосфере, а также вода поглощают инфракрасные лучи и сохраняют
значительное количество теплоты на Земле, обеспечивая
необходимые условия жизнедеятельности.
88
:1 Однако за последние десятилетия из-за возрастающего
сжигания человеком ископаемого топлива, вырубки лесов и
разложения гумуса сложилась ситуация, когда технический прогресс
сделал баланс атмосферных явлений отрицательным. Положение
усугубляется и демографическими проблемами: каждые сутки на
Земле рождается 200 тыс. человек, которых нужно обеспечить
жизненными ресурсами. Эти обстоятельства ставят изучение
фотосинтеза во всех его проявлениях, от молекулярной
организации процесса до биосферных явлений, в ранг ведущих проблем
современного естествознания. Важнейшие задачи — повышение
фотосинтетической продуктивности сельскохозяйственных
посевов и насаждений, а также создание эффективных
биотехнологий фототрофных синтезов.
2.1.2. ФИЗИКО-ХИМИЧЕСКАЯ СУЩНОСТЬ ФОТОСИНТЕЗА
И ГЛАВНЫЕ ЭТАПЫ ЕГО ИЗУЧЕНИЯ
Процесс фотосинтеза выражают суммарным уравнением
СО2 + Н,0
1 1
свет
хлорофилл
*~ {СН2О} + О2,
1 1
в котором выражена суть явления, состоящая в том, что на свету
в зеленом растении из предельно окисленных веществ —
диоксида углерода и воды образуются органические вещества и высво- ~
бождается молекулярный кислород. Фотосинтез — это процесс"
трансформации поглощенной энергии света в химическую энер—-
гию органических соединений. Причем в процессе фотосинтеза
восстанавливаются не только СО2, но и нитраты или сульфаты,
а энергия может быть направлена на различные эндергонические
процессы, в том числе на транспорт веществ.
С древних времен растение привлекало внимание человека.
Догадка о существовании фотосинтеза намного опередила его
экспериментальное изучение. Так, еще: в 1727 г. английский
ботаник Стивен Гейлес высказал предположение, что на свету
растения усваивают пищу из воздуха. Сходную идею о воздушном
питании растений высказал несколько позже М. В. Ломоносов
(1753).
Начало экспериментального изучения фотосинтеза принято
датировать 1771 г. и связывать с именем английского химика
Джозефа Пристли, который обнаружил, что зеленое растение
мяты способно поддерживать горение свечи или дыхание мыши
под стеклянным колпаком. В то время еще не был известен
состав воздуха, но этими опытами было четко показано, что в
зеленом растении идет процесс, обратный дыханию или
горению. Несколько позже был открыт кислород. Однако феномен
89
«исправления» воздуха зеленым растением не всегда
воспроизводился в опытах самого Пристли и других исследователей. В
1779 г. голландский врач Ян Ингенхауз, который работал в
Австрии, показал, что все зависит от света. Зеленые растения
выделяют кислород только на ярком свету. В темноте они, "как" и
животные, поглощают кислород.
Крупный вклад в изучение фотосинтеза сделали швейцарские
естествоиспытатели. В 1782 г. Жан Сенебье показал, что
выделение СС>2 происходит лишь в случае, если растение поглощает
СО2- Необходимость участия воды в фотосинтезе была
установлена в 1804 г. Т. Соссюрой.
Французские химики П. Ж. Пельтье и Ж. Каванту в 1817 г.
выделили из листьев зеленый пигмент и назвали его
хлорофиллом (от греч. сЫогоз — зеленый и рпуНоп — лист), который, как
выяснилось позднее, находится в хлоропластах. В 1865 г.
немецкий физиолог растений Юлиус Сакс продемонстрировал, что в
листьях на свету образуется крахмал, который локализуется в
хлоропластах.
Роль света начали изучать с середины XIX в. Великий
русский естествоиспытатель К. А. Тимирязев в 1875 г.
сформулировал учение о космической роли зеленого растения: лист —
уникальный орган, в котором солнечная энергия улавливается и
остается на Земле, трансформируясь в другие формы энергии;
процесс подчиняется закону сохранения и превращения энергии;
интенсивность ассимиляции СО2 максимальна при освещении
листа красным светом, который в наибольшей степени
поглощается хлорофиллом; хлорофилл служит фотосенсибилизатором, он
непосредственно участвует в окислительно-восстановительных
превращениях. Только в 1877 г. немецким физиологом Пфеффе-
ром этот процесс был назван «фотосинтез», т. е. с начала
изучения до его названия прошло более 100 лет, а простое суммарное
уравнение фотосинтеза явилось плодом коллективного труда,
работы нескольких поколений ученых разных стран. Тем не.менее
суммарное уравнение, выражая суть процесса, оставляет
неясным многие вопросы механизма трансформации солнечной
энергии в химическую. Потребовалось еще столетие, чтобы
приблизиться к пониманию этого процесса. Экспериментальные
доказательства того, что кислород при фотосинтезе освобождается
из воды, а не из диоксида углерода, были получены в 1941 г.
независимо в СССР и США. А. П. Виноградов и Р. В. Тейс с
помощью масс-спектрометрического анализа показали, что
отношение 16О:18О в кислороде, выделяющемся при фотосинтезе,
соответствует соотношению этих изотопов в воде.
В опытах с мигающим светом, проведенных в России
(А. А. Рихтер, 1914) и США (Р. Эмерсон и У. Арнольд, 1932,
1941), установлено существование двух фаз фотосинтеза.
Оптимальное время световой вспышки оказалось 10""5 с, темнового
90
периода — 0,04—0,06 с. Эффективность импульсного света
объясняется наличием в фотосинтезе темновых энзиматических
реакций, которые идут более медленно, чем фотохимические
процессы. Об этом свидетельствует и тот факт, что для
интенсивности фотосинтеза при оптимальном освещении и температуре
15—25. °С величина @Ю равна 2,0-2,5, т. е. соответствует энзи-
матическим процессам. Следовательно, интенсивность
фотосинтеза определяется скоростью его химических (темновых)
реакций. , ,
Окончательно вопрос о двухэтапности фотосинтеза оыл
решен американским физиологом и биохимиком Д. Арноном. В
1954—1958 гг. на хлоропластах листьев шпината было показано,
что под действием света в гранах происходит восстановление
НАДФ и образование АТФ, в строме эти соединения
используются в темновых реакциях для восстановления СОг- Этот
уровень знаний процесса фотосинтеза можно представить
следующей схемой:
Свет
хлорофилл
Н2О
со,
световая фаза
АТФ НАДФ'Н
темновая фаза
1/2 О2
{СН2О}
Детальное изучение световой и темновой фаз, их структурной
"и функциональной организации, регулирования в растении и
зависимости от факторов среды лежит в основе разработки
способов управления продукционным процессом.
2.2. ЛИСТ КАК ОРГАН ФОТОСИНТЕЗА
В процессе эволюции растений сформировался
специализированный орган фотосинтеза — лист. Приспособление его к
фотосинтезу шло в двух направлениях: возможны более полное
поглощение и запасание лучистой энергии и эффективный
газообмен с атмосферой.
Рассмотрим, как складывается энергетический баланс листа в
умеренной зоне (рис. 27). В летний полдень приход солнечной
радиации составляет около 30-105 Дж/(м2ч). В среднем листья
. 91
10%
Теплообмен
СЙоздухам
30%
Пропускание
Рис. 27. Энергетический баланс листа растений
поглощают 80—85 %
энергии фотосинтети-
чески активной
радиации (ФАР), которой
является видимая часть
спектра
электромагнитного излучения с
длиной волны 400—
700 нм, и 25 % энергии
инфракрасных лучей,
что составляет около
55 % энергии общей
радиации, или
16,5 105 дж/(м2-ч). Лист
отражает 10 % ФАР и
45 % инфракрасных
лучей и пропускает
соответственно 5 и 30 %.
На фотосинтез
используется 1,5—2 %
поглощенной фото-
синтетически активной
радиации, остальная
поглощенная энергия
расходуется в основном на испарение воды — транспирацию (95—
98 %), возможен также и теплообмен с атмосферой.
Лист имеет ограниченный рост и характерное для данного
вида и сорта строение. Как орган, осуществляющий
ассимиляцию и испарение, он отличается плоской структурой и
небольшой толщиной, измеряемой долями миллиметра. Благодаря
этому при малых затратах строительного материала создается
значительная общая поглощающая поверхность листьев. Так,
сухая масса 1 м2 листовых пластинок составляет 30—40 г. Тонкая
листовая пластинка лучше просвечивается, что способствует пол-
_ неценной работе всех клеток листа.
( Толщина листа тесно коррелирует с интенсивностью света,
/ при которой он развивается. При ограниченном освещении тол-
I щина листовой пластинки меньше. При детальном рассмотрении
I поверхность листа выглядит волнистой, что увеличивает полноту
Vулавливания солнечных лучей.
Листовая поверхность достигает значительных размеров и
превосходит площадь почвы, которую занимает растение. Для
характеристики размеров фотосинтетического аппарата
используют индекс листовой поверхности (Ь), который рассчитывают как
площадь листьев (м2), приходящуюся на 1 м2 почвы. Для
сельскохозяйственных растений умеренной зоны средние значения
листового индекса 3—5, в южных широтах с влажным климатом
92
Верхняя кожица
Столбчатая паренхима
Губчатая паренхима Устьица Жилка
Рис. 28. Поперечный разрез листа подсолнечника
до 8—10. Например, поверхность листьев 1 га посевов зерновых
культур в фазе цветения достигает 20—40 тыс. м2, у низкорослых
яблонь во время вегетации площадь листьев составляет 25—
30 тыс. м2/га.
Благодаря большой поверхности и определенному
размещению листьев в пространстве растение может использовать как
прямой, так и рассеянный свет, падающий под различными
углами. Большое значение для эффективного улавливания света
имеет архитектоника растений, под которой понимают
пространственное расположение органов. У высокопродуктивных
зерновых культур листья на стебле снизу вверх располагаются
под все уменьшающимся углом и не затеняют друг друга. Свекла
отличается от своих диких предков воронковидным
расположением листьев, для нее листовой индекс может достигать 6, у
дикорастущих форм с распластанными на поверхности почвы
листьями — 1—2. Оптимизация листовой поверхности посева или
насаждения — важный способ управления продукционным
процессом.
В зависимости от вида растений и условий их произрастания
листья отличаются большим разнообразием. Однако можно
выделить общие анатомические особенности, обеспечивающие
возможность эффективного фотосинтеза (рис. 28).
1. Наличие покровной ткани — эпидермиса, защищающего
93
лист от излишней потери воды. Клетки нижнего и верхнего
эпидермиса лишены хлоропластов, имеют крупные вакуоли,
которые, подобно линзам, фокусируют свет на расположенную
глубже хлорофиллоносную ткань. Деятельность клеток
мезофилла основана не только на их хорошем освещении, она зависит
также от поступления СОг- Нижний эпидермис, реже и верхний,
имеют большое количество устьиц. Щели открытых устьиц
занимают примерно 1 % площади листовой пластинки, диффузия
СОг внутрь листа идет через них сравнительно быстро.
Отдельное устьице позволяет за I с поступить в лист 2500 млрд молекул
СО2- Поверхность листа поглощает СОг только в 1,5—2 раза
меньше, чем открытая поверхность щелей той же площади, хотя
открытые устьица составляют лишь сотую часть поверхности.
Такая высокая скорость связана с особенностями диффузии
газов через мелкие отверстия, находящиеся на значительном
расстоянии друг от друга, за счет краевого эффекта. (Подробнее
вопросы функционирования устьиц рассмотрены в разделе
«Водообмен растений».)
2. Наличие специализированной фотосинтетической ткани —
хлоренхимы. Основная хлорофиллоносная ткань — палисадная
паренхима — расположена обычно на освещаемой части листа.
Вытянутость клеток и перпендикулярное расположение их к
эпидермису обеспечивают увеличение поверхности, вдоль
которой могут располагаться хлоропласты, не затеняя друг друга, а
также облегчают отток ассимилятов. В каждой клетке полисад-
ной паренхимы находится 30—40 хлоропластов. Губчатая ткань
характеризуется меньшим содержанием хлоропластов (примерно
20 на клетку) и сильно развитой системой межклетников. Объем
межклетников составляет 15—20 % общего объема листа и
образует внутреннюю газовую среду, которая при помощи устьичных
щелей сообщается с атмосферой. За счет межклетников
значительно возрастает внутренняя рабочая поверхность, через
которую каждой клеткой паренхимы поглощается СО2- Она в 8—12
раз больше, чем наружная поверхность листа. Хлоропласты как
основные светоулавливающие органеллы еще в большей степени
увеличивают светопоглощающую поверхность листа. На 1 см2
листа приходится примерно 200 см2 поверхности хлоропластов.
1 га посева -» 5 га площадь листьев -» 50 га поверхность
межклетников —> 1000 га поверхность хлоропластов.
Таким образом, 1 га посева, который испаряет воды не
больше, чем открытая водная поверхность такой же площади, имеет
50 га поверхности, поглощающей СОг, и 1000 га светоулавли-
вающей поверхности хлоропластов. Это является выражением
общебиологической особенности организации — создание
больших внутренних рабочих поверхностей при сравнительно малых
наружных испаряющих площадях за счет, как было отмечено,
затрат небольших количеств материала.
94
3. Наличие сильно развитой густой системы жилок —
проводящих путей, что обеспечивает быстрый отток ассимилятов и
снабжение фотосинтезирующих клеток водой и необходимыми
минеральными веществами.
В зависимости от внешних условий, при которых происходят
формирование и функционирование листьев, анатомическое
строение их может существенно различаться. Листья,
формирующиеся в условиях недостаточной влагообеспеченности, имеют
ксероморфную структуру. В зависимости от освещения меняется
соотношение между полисадной и губчатой паренхимой в
мезофилле. Имеются и другие приспособления для
функционирования листа в определенных условиях. Еще более существенные
отклонения от типичного строения листа связаны с физиологе -
биохимическими особенностями фиксации СОг у С4-растений, к
которым относятся кукуруза, сахарный тростник, ряд злостных
сорняков наших полей.
2,3. ХЛОРОПЛАСТЫ, ИХ СОСТАВ, СТРОЕНИЕ И ФУНКЦИИ
Лист растения — орган, обеспечивающий условия для
протекания фотосинтетического процесса. Функционально же
фотосинтез приурочен к специализированным органеллам — хлоро-
пластам. Хлоропласты высших растений имеют форму
двояковыпуклой линзы (диска), которая наиболее удобна для поглощения
солнечных лучей. Их размеры, количество, расположение в
клетке также полностью отвечают назначению: как можно
эффективнее поглощать солнечную энергию, как можно полнее усваивать
углерод. На различных сельскохозяйственных объектах
установлено, что количество хлоропластов в клетке измеряется
десятками. Это обеспечивает высокое содержание этих органелл на
единицу поверхности листа. Так, на 1 мм2 листа фасоли приходится
283 тыс. хлоропластов, у подсолнечника — 465 тыс. Диаметр
хлоропластов в среднем 0,5—2 мкм, длина 5—10 мкм, объем 30—
40 мкм3. Малый размер хлоропластов и большое количество их в
одной клетке обусловливают громадную общую суммарную
рабочую поверхность.
Хлоропласты способны к активным движениям — изменению
ориентации тела и перемещению в пространстве. Скорость
движения хлоропластов около 0,12 мкм/с. Их передвижения
вызываются физическими и химическими факторами. Например, под
влиянием яркого света хлоропласты поворачиваются узкой
стороной диска к падающим лучам и перемещаются на боковые
стенки клеток. Хлоропластам присуща также хемотаксическая
чувствительность — они передвигаются в направлении более
высокой концентрации СОг в клетке. Установлен и эндогенный
95
суточный ритм движения хлоропластов: днем они обычно
выстраиваются вдоль стенок, ночью опускаются на дно клетки.
Состав хлоропластов. Изучение химического состава
хлоропластов стало возможным благодаря методу дифференциального
центрифугирования, позволяющему выделить из гомогената
ткани фракции определенных органелл. Величина центробежной
силы, необходимая для осаждения, зависит от массы частиц.
Хлоропласты из экстракта протопластов осаждаются при 250 § в
течение 1 мин. Большое значение имеет состав среды выделения.
Использование для этих целей забуференного раствора сорбита
предотвращает вымывание водорастворимых белков и позволяет
сохранить нативную структуру, состав и функциональную
активность хлоропластов.
Химический состав хлоропластов достаточно сложен и
характеризуется высоким содержанием воды (75 %). Около 75—80 %
общего количества сухих веществ приходится на долю различных
органических соединений, 20—25 % — на долю минеральных
веществ. Структурной основой хлоропластов являются белки,
содержание которых достигает 50—55 % сухой массы, примерно
половину из них составляют водорастворимые белки. Такое
высокое содержание белков объясняется их многообразными
функциями в составе хлоропластов. Это структурные белки,
являющиеся основой мембран, белки-ферменты, транспортные белки,
поддерживающие определенный ионный состав, отличающийся
от цитозоля, сократительные белки, подобные актомиозину
мышц, которые обеспечивают двигательную активность
хлоропластов. Белки выполняют также рецепторную функцию,
принимая участие в регуляции интенсивности фотосинтеза в
меняющихся условиях внутренней и внешней среды.
Важнейшей составной частью хлоропластов являются липиды,
содержание которых колеблется от 30 до 40 % сухой массы.
Липиды хлоропластов представлены тремя группами соединений.
1. Структурные компоненты мембран, которые представлены
амфипатичными липоидами и отличаются высоким содержанием
(более 50 %) галактолипидов и сульфолипидов. Фосфолипидный
состав характеризуется отсутствием фосфатидилэтаноламина и
высоким содержанием фосфатидилглицерина (более 20 %).
Свыше 60 % состава жирных кислот "приходится на линолевую
кислоту.
2. Фотосинтетические пигменты. В отличие от
водорастворимых пигментов клеточного сока пигменты хлоропластов
характеризуются повышенным сродством к гидрофобным растворителям
и относятся к липоидам. Высшие растения содержат две формы
зеленых пигментов: хлорофилл а и хлорофилл Ъ и две формы
желтых пигментов: каротины и ксантофиллы (каротиноиды).
Ведущую роль в фотосинтезе — фотосенсибилизацию — выполняет
хлорофилл а, другие пигменты расширяют спектр действия фо-
96
тосинтеза за счет более полного поглощения ФАР, каротиноиды
защищают хлорофилл от фотоокисления, участвуют в транспорте
кислорода, образующегося при фотолизе воды.
3. Жирорастворимые витамины — эргостерол (провитамин П),
витамины Е, К сосредоточены практически целиком в хлоро-
пластах, где участвуют в преобразовании световой энергии в
химическую. В цитозоле клеток листа в основном находятся
водорастворимые витамины. Так, у шпината содержание аскор- .
биновой кислоты в хлоропластах в 4—5 раз меньше, чем в
листьях.
Н. М. Сисакян обнаружил в хлоропластах листьев сахарной
свеклы значительные количества нуклеиновых кислот, причем
наряду с РНК им впервые установлено присутствие в
хлоропластах ДНК. По современным данным, нуклеиновые кислоты
составляют примерно 1 % сухой массы хлоропластов (РНК —
0,75 %, ДНК — 0,01—0,02 %). Таким образом, хлоропласты
имеют собственную белоксинтезирующую систему. Его геном
представлен кольцевой молекулой ДНК длиной 40 мкм с
молекулярной массой 108, кодирующей 100—150 белков средних
размеров. Рибосомы хлоропластов составляют от 20 до 50 % общей
популяции рибосом клетки. Они относятся к 70 5-типу с
субъединицами 50 и 30 /51.
Под контролем ДНК хлоропласта синтезируются большая
субъединица ключевого фермента темновой фазы фотосинтеза —
рибулезодифосфаткарбоксилазы, три из пяти субъединиц
фактора, сопрягающего поток электронов с синтезом АТФ, цитохром
/, около 12 мембранных белков и 80 растворимых белков,
выполняющих в основном ферментативную функцию. Однако для
нормального функционирования хлоропластов необходимо
взаимодействие ядерного и хлоропластного геномов. Например, у
ячменя обнаружено 86 различных ядерных генов,
контролирующих определенные звенья развития хлоропластов. Ключевой
фермент фотосинтеза РДФ-карбоксилаза синтезируется под
двойным контролем — ДНК ядра и хлоропласта.
Углеводы не являются конституционными веществами
хлоропласта. В очень небольших количествах фосфорные эфиры саха-
ров участвуют в восстановительном цикле углерода, в основном
же это продукты фотосинтеза. Поэтому содержание углеводов в
хлоропластах значительно колеблется (от 5 до 50 %). Я активно
функционирующих хлоропластах углеводы обычно не
накапливаются, происходит их быстрый отток. При уменьшении
потребности в продуктах фотосинтеза в хлоропластах образуются
крупные крахмальные зерна. В этом случае содержание крахмала
может возрасти до 50 % сухой массы и активность хлоропластов
снизится.
Необходимо обратить внимание также на высокое
содержание в хлоропластах минеральных веществ. Сами хлоропласты
97
Образование
внутренней
лапешрной
системы
Стропа
ВтчиВание
внутренней
мембраны
.Свет
Инициальная частица
1мкп
Пропластида
Крахмальное зерно
Темнота
Ламе/та
стропы
Пузырьки,
образующиеся
из бпячиваний
внутренней
мембраны
'проламеллярное
тело
Образование
ламелл
■ капля жира ^ 11 "^ *
5мкм
Полностью развитый хлоропласт
Рис. 29. Онтогенез хлоропластов:
слева — при развитии хлоропластов на свету происходит нормальное образование ламелл
стромы; справа — в темноте образуется проламеллярное тело. (Модифицировано по Фрей
Висслингу и Мюлеталеру.)
составляют 25—30 % массы листа, но в них сосредоточено до
80 % железа, 70—72 — магния и цинка, около 50 — меди, 60 %
кальция, содержащихся в тканях листа. Эти данные хорошо
согласуются с высокой и разнообразной ферментативной
активностью хлоропластов. Минеральные элементы выступают в
роли простетических групп и кофакторов деятельности
ферментов. Магний входит в состав хлорофилла. Важная роль
кальция состоит в стабилизации мембранных структур
хлоропластов.
Возникновение и развитие хлоропластов. Хлоропласты
образуются в меристематических клетках из инициальных частиц
или зачаточных пластид (рис. 29). Инициальная частица со-
98
стоит из амебоидной стромы, окруженной двухмембранной
оболочкой. По мере роста клетки инициальные частицы
увеличиваются в размере и приобретают форму двояковыпуклой линзы,
в строме появляются небольшие крахмальные зерна.
Одновременно внутренняя мембрана начинает разрастаться, образуя
складки (впячивания), от которых отшнуровываются пузырьки
и трубочки. Такие образования называют пропластидами. Для
дальнейшего их развития необходим свет. В темноте же
формируются этиопласты, в которых образуется мембранная
решетчатая структура — проламеллярное тело. На свету
внутренние мембраны пропластид и этиопластов образуют гранальную
систему. Одновременно с этим также на свету в граны
встраиваются вновь образованные молекулы хлорофилла и других
пигментов. Таким образом, структуры, которые
подготавливаются к функционированию на свету, появляются и развиваются
только при его наличии.
Наряду с хлоропластами имеется ряд других пластид, которые
образуются либо непосредственно из пропластид, либо одна из
другой путем взаимных превращений (рис. 30). К ним относятся
накапливающие крахмал амилопласты (лейкопласты) и
хромопласты, содержащие каротиноиды. В цветках и плодах
хромопласты возникают на ранних стадиях развития пропластид.
Хромопласты осенней листвы представляют собой продукты
деградации хлоропластов, в которых в качестве структур — носителей
каротиноидов выступают пластоглобулы.
Строение хлоропластов. Строение хлоропласта,
обнаруживаемое с помощью электронного микроскопа, весьма сложное.
Подобно ядру и митохондриям хлоропласт окружен оболочкой,
состоящей из двух липопротеидных мембран. Внутреннюю среду
представляет относительно однородная субстанция — матрикс,
или строма, которую
пронизывают , мембраны — ламеллы
(рис. 31). Ламеллы,
соединенные друг с другом, образуют
пузырьки — тилакоиды.
Плотно прилегая друг к другу,
тилакоиды образуют граны,
которые различают даже под
световым микроскопом. В свою
очередь, граны в одном или
нескольких местах объединены
друг с другом с помощью меж-
гранных тяжей — тилакоидов
стромы. Пигменты
хлоропласта, участвующие в улавливании
световой энергии, а также
ферменты, необходимые для
Ле
йкопласты
чилопласть^
А
и
Хромопласт
Пропластиды
свет
. .1
I ►
х
^
^Т темнота
Этиопласты
г свет
Хлоропласты
^ 1
Рис. 30. Схема взаимных
превращений пластид
99
Рис. 31. Строение фрагмента хлоропласта:
/ — тилакоид стромы; 2 — тилакоид фаны; 3 — ламелла; 4— строма; 5-
■ грана
световой фазы фотосинтеза, вмонтированы в мембраны тилако-
идов.
Ферменты, которые катализируют многочисленные реакции
восстановительного цикла углерода (темновой фазы
фотосинтеза), а также разнообразные биосинтезы, в том числе биосинтезы
белков, липидов, крахмала, присутствуют главным образом в
строме, часть из них является периферическими белками ламелл.
Строение зрелых хлоропластов одинаково у всех высших
растений, так же как в клетках разных органов одного растения
(листьях, зеленеющих корнях, коре, плодах). В зависимости от
функциональной нагрузки клеток, физиологического состояния
хлоропластов, их возраста различают степень их внутренней
структурированности: размеры, количество гран, связь между
ними. Так, в замыкающих клетках устьиц основная функция
хлоропластов — фоторегуляция устьичных движений, энергией
этот процесс обеспечивается высокоструктурированными
митохондриями. Хлоропласты не имеют строгой гранальной
структуры, содержат крупные крахмальные зерна, набухшие тилакоиды,
липофильные глобулы. Все это свидетельствует об их низкой
энергетической нагрузке. Другая картина наблюдается при
электронно-микроскопическом изучении хлоропластов зеленых
плодов томата. Наличие хорошо развитой гранальной системы
свидетельствует о высокой функциональной нагрузке этих органелл
и вероятном существенном вкладе фотосинтеза при
формировании плодов.
100
С возрастом строение хлоропластов существенно меняется.
Молодые хлоропласты характеризуются ламеллярной структурой,
в таком состоянии хлоропласты способны размножаться путем
деления. В зрелых хлоропластах хорошо выражена система гран.
В стареющих хлоропластах происходит разрыв тилакоидов
стромы, связь между гранами уменьшается, в дальнейшем
наблюдаются распад хлорофилла и деструкция гран. В осенней листве
деградация хлоропластов приводит к образованию хромопластов,
в которых каротиноиды сосредоточены в пластоглобулах.
При выращивании сельскохозяйственных растений следует
иметь в виду, что на структуру хлоропластов, а следовательно, и их
функциональную активность большое влияние оказывает режим
минерального питания растений. При недостатке азота
хлоропласты становятся в 1,5—2 раза мельче, дефицит фосфора и серы
нарушает нормальную структуру ламелл и гран, одновременная
нехватка азота и калия приводит к переполнению хлоропластов
крахмалом из-за нарушения нормального оттока ассимилятов. При
недостатке кальция нарушается структура наружной мембраны
хлоропласта. Для поддержания структуры хлоропласта также
необходим свет. В темноте идет постепенное разрушение тилакоидов фан
и стромы. Таким образом, структура хлоропластов лабильна и
динамична, в ней отражаются все условия жизни растения.
2.4. ПИГМЕНТЫ ХЛОРОПЛАСТОВ
Фотосинтез связан с избирательным поглощением
пигментами света в видимой части солнечного спектра.
Фотосинтетические пигменты составляют 10—15 % сухой массы хлоропластов.
Они характеризуются большим разнообразием и по химической
природе делятся на две группы — хлорофиллы и каротиноиды.
2.4.1. ХЛОРОФИЛЛЫ
{^Состав и структура. В настоящее время известно несколько
различных форм хлорофилла, которые обозначают латинскими
буквами. Хлоропласты высших растений содержат хлорофилл а и
хлорофилл Ь. Они были идентифицированы русским ученым
М. С. Цветом (1906) с помощью разработанного им метода
хроматографии. Структурная формула хлорофилла, предложенная
Г. Фишером (1939), получила окончательное подтверждение в
1960 г. в результате двух независимо проведенных работ в США
и ФРГ по искусственному синтезу хлорофилла а.
^Хлорофилл — сложный эфир дикарбоновой кислоты хлоро-
филлина, у которой одна карбоксильная группа этерифицирова-
101
на остатком метилового спирта (СНзОН), а другая — остатком
одноатомного непредельного спирта фитола (С20Н39ОН):
соо сн3
М8И4ОН30С32
\
хлорофилл ин
соо с20н39
остатки
спиртов
На рисунке 32, а дана структурная формула хлорофилла а.
Четыре пиррольных кольца (I—IV) соединены между собой ме-
тиновыми мостиками (а, |3, у, е), образуя порфириновое ядро.
Атомы азота пиррольных колец четырьмя координационными
связями взаимодействуют с атомом М§. В структуре порфирино-
вого ядра есть также циклопентановое кольцо, содержащее
химически активную карбонильную группу. Структура, состоящая
из тетрапиррольного и циклопентанового колец, получила
название форбина.
Порфириновое кольцо представляет собой систему из девяти
пар чередующихся двойных и одинарных, т. е. конъюгирован-
ных, связей с 18 делокализованными л-электронами. Хлорофилл
Ь отличается от хлорофилла а тем, что у третьего углерода
второго пиррольного кольца вместо метильной находится альдегидная
группа. Структура хлорофилла, лишенная фитола, называется
хлорофиллидом. При замещении атома магния протонами
водорода образуется феофитин.
Биосинтез. Существенные сведения о биосинтезе хлорофил-
лов в растении были получены благодаря использованию
изотопного метода (14С, 151^) и сравнительного изучения мутант-
ных растений. Эти исследования позволили установить, что
хлорофиллы и близкие к ним по химическим свойствам ци-
тохромы (Ре-порфирины) характеризуются единым процессом
синтеза (см. схему на с. 104).
• Первый этап биосинтеза хлорофиллов у высших растений —
образование 8-аминолевулиновой кислоты (АЛК) из С5-дикарбо-
новых кислот. Циклизация двух молекул АЛК приводит к
образованию пиррольного соединения — порфобилиногена. Из
четырех пиррольных колец формируется уропорфириноген, который
превращается в протопорфирин IX. Дальнейший путь
превращений протопорфирина может быть различным. С участием железа
образуется гем, входящий в состав цитохромов и ряда
окислительно-восстановительных ферментов. Если в молекулу
протопорфирина включается магний, карбоксильная группа у Сю эте-
рифицируется метильной группой и замыкается циклопентано-
102
вое кольцо, то* формируется
протохлорофиллид.
Последующие превращения про-
тохлорофиллида у высших
растений происходят только
на свету.
Решающей предпосылкой
для светоиндуцированного
превращения протохлоро-
филлида IX в хлорофиллид
является его объединение с
белками в проюхлорофил-
лидбелковый комплекс.
Существенным компонентом
этого комплекса является
протохлорофиллид-оксидоре-
дуктаза — фермент, который
катализирует восстановление
протохлорофиллида в
хлорофиллид в результате
гидрирования двойной связи у С-]—Се
в IV пиррольном кольце. В
качестве источника
активированного водорода служит
восстановленный НАДФ.
Хлорофиллид обладает теми
же спектральными
свойствами, что и хлорофилл.
Последний этап в
формировании молекулы
хлорофилла а — этерификация фи-
толом, который, как и все
полиизопреновые
соединения, синтезируется из
ацетил ~ ЗКоА через меволоно-
вую кислоту. Этерификация
приводит к поляризации
молекул пигмента, что
позволяет им стать важнейшими
структурными компонентами
тилакоидов.
Процесс биосинтеза
хлорофилла, начиная с
образования АЛК, осуществляется
н2с=сн
н
НзС~С
нс
/
X
-К1 к-
/ II I
Н3С-С IV с С И1 С-СН3
/ ч / ч ^ч ^ 3
Н
ч
С
с
ч
н
сн2 нс-
I I
сн2 со
с=о о-сн3
о
4.
1 Остаток
\ метилового
спирта
I
о
Г
о
I
н2сч
СН
Н2С
У
с-сн3
[2^\
:сн,
Н2С
НС-СН3
Ч„,.
н2сч
нс-сн3
хн,
Н2С\
нс-сн3
н3с
Рис. 32. Структурная формула
хлорофилла:
а — хлорофилл о; Ь — особенности
хлорофилла Ь
в хлоропластах. По данным
А. А. Шлыка с соавторами (1965), синтез хлорофилла (совместно
с образованием каротиноидов) происходит в отдельных центрах
мембраны тилакоидов. Особенно богатыми «молодыми» молеку-
103
лами пигментов оказываются «легкие частицы», получаемые в
результате обработки детергентами и фракционированием.
Образование хлорофилла Ь происходит в тех же центрах биосинтеза
из хлорофилла а путем замещения метильной группы третьего
углеродного атома II пиррольного кольца альдегидной
группировкой.
Первые признаки зеленения выращенных в темноте
этиолированных растений наблюдаются через 2—4 ч после начала
освещения. Оптимальным для синтеза хлорофилла является
освещение 200 Вт/м . При сильном повышении интенсивности света
биосинтез хлорофилла начинает замедляться. Поэтому световые
Основные этапы биосинтеза хлорофилла у высших растений (по ШаПег,
1984, с изменениями)
Глутамат (С5)
а-кетоглутарат (С5)
у-6-диоксовалериат
8-аминолевулиновая кислота
| СН3
Протохлорофиллид
к— (йу + НАДФ-Н)
Хлорофиллид
и— фитол
Хлорофилл а
О
■ё -
сн,
Хлорофилл Ь
104
листья имеют меньшую концентрацию хлорофилла, чем темно-
вые (эффект Шталя).
В опытах В. Н. Любименко показан нижний предел
освещенности для образования хлорофилла. У проростков ячменя и овса
таким пределом было освещение лампой накаливания
мощностью 10 Вт. При исследованиях было выявлено, что образование
хлорофилла идет интенсивнее на прерывистом свете. Это
подтверждает двухфазность процесса, причем световая фаза
(восстановление протохлорофиллида) идет значительно быстрее, чем
тешщвые реакции.
^Образование хлорофилла зависит от температуры.
Оптимальной температурой для накопления хлорофилла является 20—
25 °С, причем особое значение температура имеет для темновых
реакций синтеза предшественников хлорофилла. Поэтому
растения ранней весной часто не зеленеют и остаются
этиолированными до тех пор, пока температура не превысит 10 °С. На
скорость образования хлорофилла и особенно его
предшественников оказывает влияние оводненность тканей. При недостаточной
водообеспеченности биосинтез хлорофилла затормаживается и
наблюдается его распад. Пожелтение листьев при сильных
засухах — обычное внешнее проявление водного дефицита.
Важное значение для образования хлорофилла имеют условия
минерального питания. Растениям прежде всего необходимо
хорошее обеспечение азотом и магнием, которые входят в состав
хлорофилла. При недостатке этих элементов наблюдается
хлороз — утрата зеленой окраски листьев. Причиной хлороза может
быть и дефицит железа. Железо входит в состав ферментов,
катализирующих важнейшие звенья биосинтеза хлорофилла, —
образование о-аминолевулиновой кислоты и протопорфирина.
При недостатке меди хлорофилл легко разрушается, так как
нарушаются комплексы между хлорофиллом и соответствующими
бЗ
уг}а общий ход биосинтеза хлорофилла влияет возраст листьев
и растения в целом. В молодых листьях биосинтез хлорофилла
идет в 10—15 раз быстрее, чем в старых. Молекулы хлорофилла
не могут служить неограниченно долго. Часть их постепенно
разрушается, заменяясь вновь синтезированными. «Молодые»
молекулы хлорофилла в химическом отношении тождественны
«старым», но имеют иную связь с белками и работают более
активно. Таким образом, биосинтез и распад хлорофилла
представляют сложный комплекс биохимических реакций,
находящихся под контролем как генетических факторов, так и условий
произрастания растениЩ
Общее количество хлорофилла в фитоценозах довольно
значительно. В посевах сельскохозяйственных растений среднее
количество хлорофилла составляет 1,5 г/м , или 15 кг/га.
Спектральные характеристики посевов позволяют по аэрофотосъемкам
105
Хлорофилл Ь
Хлорофилла
Л
/ \
500 600
Длина волны, нм
Рис. 33. Спектры поглощения пигментов хлоропластов
700
и снимкам, сделанным из космоса, оценивать их состояние и
определять урожай на больших территориях с точностью до 20 %.
Оптические свойства. Согласно закону Гротгуса — одному из
фундаментальных законов светохимии фотохимически деятельны
только поглощенные лучи. Поэтому [изучение спектров
поглощения пигментов, и в первую очередь Хлорофилла, является
решающим для понимания механизма фотосинтеза и разработки
путетйг его регуляции. Не случайно этой ключевой проблеме
посвящен классический труд К. А. Тимирязева «Об усвоении света
растениями».
Отличительной особенностью всех пигментов является
наличие в их составе системы слабо удерживаемых делокализованных
электронов, возбуждаемых квантами видимой части солнечного
спектра. Это лежит в основе их свойства — избирательного
поглощения света. Резко выраженные максимумы поглощения хло-
рофиллов находятся в сине-фиолетовой и красной частях
спектра (рис. 33). Максимумы поглощения раствора хлорофилла а в
этиловом спирте — 428—430 и 660—663 нм соответственно,
хлорофилла Ь — 452—455 и 642—644 нм. Хлорофиллы очень слабо
поглощают оранжевые и желтые лучи и совсем не поглощают
зеленые и инфракрасные. Поэтому раствор хлорофилла а имеет
сине-зеленый цвет, хлорофилла Ъ — желто-зеленый.
Поглощение в сине-фиолетовой части спектра обусловлено
системой конъюгированных 9 пар одинарных и двойных связей
порфиринового ядра молекулы хлорофилла с 18 делбкализован-
ными я-электронами, которые возбуждаются квантами с энергией
106
4,5-10~19 Дж, соответствующей этим лучам. Поглощение в
красной области спектра (энергия кванта 310~19 Дж) связано с
гидрированием двойной связи у С7—Си в IV пиррольном кольце (при
восстановлении протохлорофиллида до хлорофиллида),
присутствием магния в порфириновом ядре и наличием циклопентанового
кольца (V). Эти же особенности структуры способствуют
снижению поглощения в желтой и зеленой частях спектра.
Необходимо отметить, что даже небольшое изменение в
строении молекул приводит к значительным различиям в
положении максимумов поглощения. Так, у хлорофилла Ь,
отличающегося от хлорофилла а заменой метильной группы на
альдегидную, максимумы поглощения света оказываются более
сближенными за счет смещения сине-фиолетового в
длинноволновую, а красного — в коротковолновую области. Кроме
того, хлорофилл Ь более полно использует сине-фиолетовый
свет, чем хлорофилл а; в красных лучах преимущества имеет
хлорофилл а. Замещение магния протонами при обработке
хлорофилла кислотой приводит к образованию феофитина,
имеющего ослабленный красный максимум поглощения света и
буро-зеленый цвет. Удаление остатков фитола и метилового
спирта путем щелочного гидролиза слабо сказывается на
оптических свойствах хлорофилла.
Существенное влияние на положение максимумов спектра
поглощения оказывают природа растворителя и взаимодействие
молекул хлорофилла друг с другом, а также с другими
пигментами, белками и липидами в составе хлоропластов. У
агрегированных молекул хлорофилла, взаимодействующих с белками,
красный максимум поглощения сдвинут в более длинноволновую
часть спектра. Степень связывания определяет точный максимум
поглощения света.
Раствор хлорофилла обладает яркой вишнево-красной
флуоресценцией — излучением поглощенных квантов света. В
соответствии с правилом Стокса флуоресценция сдвинута в более
длинноволновую часть по сравнению с поглощением света, максимум
флуоресценции 650—668 нм. Хлорофилл в живом листе
флуоресцирует слабо. Это связано с тем, что энергия поглощенных
квантов в основном преобразуется в химическую, причем по
степени флуоресценции листа можно судить об эффективности
фотосинтеза. Чем интенсивнее флуоресценция, тем ниже КПД
использования поглощенной энергии.
Механизмы избирательного поглощения света и
флуоресценции изучены достаточно хорошо. Поглощение кванта света
сопровождается переходом в более богатое энергией короткоживу-
щее возбужденное состояние, связанное с переходом электрона
,- свет
на более удаленную от ядра орбиталь (хлорофилл —>
хлорофилл*). Электронные орбитали атомов характеризуются опреде-
107
300
200
Рис. 34. Энергетические состояния молекулы хлорофилла и различные пути
использования энергии электронного возбуждения. (Цифры указывают время жизни
каждого из состояний молекулы.)
ленными энергетическими уровнями, возрастающими по мере
удаления от ядра. Те кванты света, энергия которых
соответствует разности энергий между двумя орбиталями, поглощаются с
переходом электрона на более дальнюю орбиталь. Поэтому могут
поглощаться только кванты света с совершенно определенной
длиной волны. В отличие от атома возможные энергетические
состояния молекул нельзя описать точно фиксированными
энергетическими уровнями, они характеризуются широкими
полосами в спектрах поглощения (рис. 34).
В органических молекулах почти все электроны спарены, т. е.
находятся в одном и том же энергетическом состоянии, обладая
противоположными спинами (основное синглетное
энергетическое состояние — 5о). Поглощение молекулой хлорофилла кванта
красного света с энергией 170 кДж/моль квантов приводит к пер-
I вому синглетному электронно-возбужденному состоянию — .5^
\ время существования которого примерно 10~9 с. Возбужденная
молекула хлорофилла переходит в стабильное состояние путем
возвращения электрона на исходную орбиталь. Поглощенная
энергия при этом может расходоваться различными способами:
рассеиванием теплоты; потерей в виде излучения; возбуждением
соседних молекул пигментов (перенос энергии к фотохимическим
центрам); совершением фотохимической работы. Возможны
также потеря части энергии в виде теплоты и переход молекулы из
синглетного в метастабильное триплетное возбужденное
состояние (с обращением спина электрона). Триплетное состояние
длится гораздо дольше (> 10~4 с). Из триплетного состояния
молекула может вернуться в основное за счет более длительного, чем
108
флуоресценция, слабого длинноволнового свечения —
фосфоресценции или направив энергию на фотохимические реакции.
Поглощение кванта в сине-фиолетовой области спектра
(содержание энергии 300 кДж/моль квантов) приводит к
возникновению исключительно краткого (< 10 п с) второго
возбужденного синглетного состояния (^). За счет выделения части
энергии в виде теплоты молекула переходит в ^, и дальнейшие
события соответствуют возбуждению красным светом. Поэтому
поглощение света в синей и красной областях дает одинаковый
спектр флуоресценции (красный), а также равные количества
фотохимической работы, несмотря на неодинаковое содержание
энергии у поглощенных квантов. Этим объясняется более
высокая эффективность красных участков солнечного спектра, о
которой писал еще К. А. Тимирязев.
Он предположил, что хлорофилл способен к окислительно-
восстановительному превращению. Впервые реакция
фотовосстановления хлорофилла была осуществлена в 1948 г. А. А. Крас-
новским в модельных опытах. В качестве донора электронов
использована аскорбиновая кислота. После выключения света
реакция идет в обратном направлении:
Хлорофилл + АV —► хлорофилл*—► хлорофилл + АН ~^* хлорофилл" + АН+
Фотовосстановленный ион-радикал хлорофилл, в свою
очередь, может восстанавливать различные акцепторы электронов.
Донор электронов
| /IV
_^> хлорофилл
акцептор электронов.
В таких условиях хлорофилл действует как
фотосенсибилизатор. Эти реакции получили название реакций Красновского.
Таким образом, молекула хлорофилла благодаря структурным
изменениям и физико-химическим особенностям способна
выполнять три важнейшие функции: избирательно поглощать
энергию света; трансформировать ее в энергию электронного
возбуждения (или запасать ее в виде энергии электронного
возбуждения); фотохимически преобразовать энергию возбужденного
состояния в химическую энергию. Для функционирования
молекулы хлорофилла существенное значение имеет ее
пространственная организация. Магний-порфириновое кольцо молекулы
представляет собой почти плоскую пластинку толщиной 0,42 нм
и площадью 1 нм2. Это гидрофильная фотоактивная часть
молекулы хлорофилла. Длинный (2 нм) алифатический остаток фито-
109
ла, образующий угол с порфириновым кольцом, — ее
гидрофобный полюс, необходимый для взаимодействия молекулы
хлорофилла с гидрофобными участками мембранных белков и липидов.
2.4.2. КАРОТИНОИДЫ
Каротиноиды — жирорастворимые пигменты желтого, оран-
< жевого и красного цветов. Они входят в состав хлоропластов и
хромопластов незеленых частей растений (цветков, плодов,
корнеплодов). В зеленых листьях их окраска маскируется
хлорофиллом. С его более ранним разрушением осенью или при
неблагоприятных условиях связано пожелтение листьев.
Структура и свойства. Каротиноиды являются тетратерпенои-
дами (8 остатков изопрена, Сад). Каротиноиды могут быть
ациклическими (алифатическими), моно- и бициклическими. Циклы
на концах молекул каротиноидов — производные ионона.
Каротины представляют собой углеводороды с формулой С4оН5б- В
хлоропластах высших растений содержатся а- и р-каротины. р-ка-
ротин (рис. 35) имеет два р-иононовых кольца (двойная связь
между С5 и Сб). При гидролизе р-каротина по центральной
двойной связи образуются две молекулы витамина А (ретинола). а-Ка-
ротин отличается от р-каротина тем, что у него одно кольцо р-ио-
ноновое, а второе е-иононовое (двойная связь между С4 и С5).
Ксантофиллы являются кислородсодержащими производными
каротина. Ксантофилл лютеин — производное сс-каротина, а зе-
аксантин — р-каротина. Они имеют по одной гидроксильной
группе в каждом иононовом кольце — (С40Н56О2Х
Дополнительное включение в молекулу зеаксантина двух атомов кислорода по
двойным связям С5—Се (эпоксидные группы) приводит к
образованию виолаксантина (С40Н56О4), при включении эпоксидных
групп в лютеин образуется неоксантин. Синтез каротиноидов
начинается с ацетил ~8КоА через мевалоновую кислоту до лико-
пина — ациклического каротина, который является
предшественником всех других каротиноидов. Синтез каротиноидов не
требует света.; Спектры поглощения каротиноидов характеризуются
двумя полосами в фиолетово-синей и синей частях спектра от
400 до 500 нм и определяются системой конъюгированных
связей. При увеличении числа таких связей максимумы поглощения
смещаются в длинноволновую область спектра. Подобно хлоро-
филлам, каротиноиды нековалентно связаны с белками и
липоидами мембран и тилакоидов^!
Физиологическая роль каротиноидов. Каротиноиды являются
обязательными компонентами пигментных систем. Они
выполняют роль дополнительных пигментов, которые передают
энергию поглощенных квантов хлорофиллу а для совершения
фотохимической работы. Особенно возрастает их значение как свето-
улавливающих систем в сине-фиолетовой и синей частях спектра
110
Н3С СН3 нзс
а = к
СН3
Зеаксантин
н,с сн3
сн3 н3с сн3
Иононовое кольцо
* Н3С" СН3
Виолаксантин
Рис. 35. Структурные формулы каротиноидов и последовательность их
превращений
в затененных местах, т. е. когда преобладает рассеянная
радиация.
Имеются доказательства, что каротиноиды выполняют
защитную функцию, предохраняя хлорофилл от фотоокисления. Еще в
1913 г. Д. И. Ивановский установил, что в пробирках,
выставленных на прямой солнечный свет, степень разрушения
хлорофилла зависела от концентрации каротиноидов в растворе.
У дефектных по каротиноидам мутантов кукурузы и
подсолнечника, а также при экспериментально нарушенном
образовании каротиноидов наблюдается быстрое фотоокисление
хлорофилла.
Высказывается также предположение о прямом участии
каротиноидов в расщеплении воды и кислородном обмене при
фотосинтезе. Особое значение придается виолаксантиновому циклу:
■*»■'
4Н >. х- Виолаксантин
У Свет
,О-*А*- Зеаксантин
2О2 + 4Н
* При освещении в зеленых листьях происходит превращение
диэпоксидксантофилла виолаксантина в безэпоксидный
ксантофилл зеаксантин. В независимой от света реакции благодаря
включению кислорода происходит обратное превращение
зеаксантина в виолаксантин. Возможно, этот цикл служит для
удаления излишков кислорода, образующихся при фотолизе воды.
В верхушках побегов растений каротиноиды обеспечивают
определение направления света и их ориентацию к световому
потоку за счет фототропизма.
111
2.5. СВЕТОВАЯ ФАЗА ФОТОСИНТЕЗА
Сущность световой фазы фотосинтеза состоит в поглощении
лучистой энергии и ее трансформации в ассимиляционную силу
(АТФ и НАДФН), необходимую для восстановления углерода в
темновых реакциях. Сложность процессов преобразования
световой энергии в химическую требует их строгой мембранной
организации. Световая фаза фотосинтеза происходит в гранах
хлоропласта.
В состав фотохимически активных мембран хлоропластов
входят пять согласованно функционирующих многокомпонентых
белковых комплексов: светособирающий комплекс, фотосистемы
I и II, цитохромный комплекс (цитохромы Ь^ и Д участвующий
в транспорте электронов, и АТФ-азный комплекс,
обеспечивающий синтез АТФ. Рассмотрим функционирование этих систем на
основе современных достижений науки.
2.5.1. ОРГАНИЗАЦИЯ И ФУНКЦИОНИРОВАНИЕ ПИГМЕНТНЫХ СИСТЕМ
Пигменты хлоропластов объединены в функциональные
комплексы — пигментные системы, в которых реакционный центр —
хлорофилл а, осуществляющий фотосенсибилизацию, связан
процессами переноса энергии с антенной, состоящей из светосо-
бирающих пигментов. Современная схема фотосинтеза высших
растений включает две фотохимические реакции,
осуществляемые с участием двух различных фотосистем. Предположение об
их существовании было высказано Р. Эмерсоном в 1957 г. на
основании обнаруженного им эффекта усиления действия
длинноволнового красного света (700 нм) совместным освещением
более коротковолновыми лучами (650 нм).
Впоследствии с помощью обработки ультразвуком и
поверхностно-активными веществами и использования
дифференциального центрифугирования в градиенте плотности сахарозы
удалось получить легкие фрагменты хлоропластов, обогащенные
фракцией фотосистемы I, и более тяжелые фрагменты,
содержащие фракцию фотосистемы И. Установлено, что фотосистема II
(ФСП) поглощает более коротковолновые лучи по сравнению с
ФС1. Фотосинтез идет эффективно только при их совместном
функционировании, что объясняет эффект усиления Эмерсона.
В состав ФС1 в качестве реакционного центра входит димер
хлорофилла а с максимумом поглощения света 700 нм (Рюо), а
также хлорофиллы О675—695, играющие роль антенного
компонента. Первичным акцептором электронов в этой системе является
мономерная форма хлорофилла «695, вторичными акцепторами —
железосерные белки (—Ре8). Комплекс ФС1 под действием света
112
восстанавливает железосодержащий белок — ферредоксин (Фд) и
окисляет медьсодержащий белок — пластоцианин (Пц).
ФСН включает реакционный центр, содержащий хлорофилл а
(Рб8о) и антенные пигменты — хлорофиллы Яб70—683- Первичным
акцептором электронов является феофитин (Фф), передающий
электроны на пластохинон. В состав ФСП входит также
белковый комплекс ^-системы, окисляющий воду, и переносчик
электронов 2. Этот комплекс функционирует с участием марганца,
хлора и магния. ФСП восстанавливает пластохинон (Р(2) и
окисляет воду с выделением О2 и протонов.
Связующим звеном между ФСН и ФО служат фонд пласто-
хинонов, белковый цитохромный комплекс (Ь^, /) и
пластоцианин.
В хлоропластах растений на каждый реакционный центр
приходится примерно 300 молекул пигментов, которые входят в
состав антенных или светособирающих комплексов. Из ламелл
хлоропластов выделен светособирающий белковый комплекс,
содержащий хлорофиллы а и Ь и каротиноиды (ССК), тесно
связанный с ФСН, и антенные комплексы, непосредственно
входящие в состав ФС1 и ФСН (фокусирующие антенные компоненты
фотосистем). Половина белка тилакоидов и около 60 %
хлорофилла локализованы в ССК. В каждом ССК содержится от 120
до 240 молекул хлорофилла.
Антенный белковый комплекс ФС1 содержит ПО молекул
хлорофиллов «680—695 на один /^(хь из них 60 молекул —
компоненты антенного комплекса, который можно рассматривать как
ССК ФС1. Антенный комплекс ФС1 также содержит р-каротин.
Антенный белковый комплекс ФСП содержит 40 молекул
хлорофиллов а с максимумом поглощения 670—683 нм на один
Р680 и |3-каротин.
Хромопротеины антенных комплексов не обладают
фотохимической активностью. Их роль состоит в поглощении и
передаче энергии квантов на небольшое количество молекул
реакционных центров Р700 и ^68О> каждая из которых связана с цепью
транспорта электронов и осуществляет фотохимическую
реакцию. Организация электронно-транспортных цепей (ЭТЦ) при
всех молекулах хлорофилла нерациональна, так как даже на
прямом солнечном свету на молекулу пигмента кванты света
попадают не чаще одного раза за 0,1 с.
Передача энергии в светособирающих комплексах и
фотосистемах происходит путем индуктивного резонанса. Условиями
для резонансного переноса энергии служат сближенное
расположение и перекрытие частот осциллирующих электронных
систем у двух взаимодействующих молекул. Причем миграция
энергии осуществляется от коротковолновых пигментов -к более
длинноволновым. Квант света мигрирует в фотосистеме, пока
не попадет в стоковую молекулу (ловушку) — пигмент реакци-
113
онного центра, который является самым длинноволновым и
поэтому неспособным возбуждать соседние молекулы. Энергия
возбужденного пигмента реакционного центра расходуется на
фотохимическую работу. Квант света обычно передается на
стоковую молекулу через несколько сотен передач, каждая
передача осуществляется за 10~12 с, 100 передач —
соответственно за 10~'° с. Экспериментально установлено, что 90 %
энергии возбуждения хлорофилла а может быть передано на
Р700 менее чем за 10~9 с.
2.5.2. ЦИКЛИЧЕСКОЕ И НЕЦИКЛИЧЕСКОЕ ФОТОСИНТЕТИЧЕСКОЕ
ФОСФОРИЛИРОВАНИЕ
Фотосинтетическое фосфорилирование, т. е. образование АТФ
в хлоропластах в ходе реакций, активируемых светом, может
осуществляться циклическим и нециклическим путями.
Циклическое фотофосфорилирование является более простым
и эволюционно более древним. При циклическом фотофосфори-
лировании функционирует только ФС1 и ее единственным
продуктом является АТФ.
Циклическое фотофосфорилирование было открыто в 1954 г.
Арноном, Алленом и Френкелем на изолированных хлоропластах
шпината.
Сущность циклического фотофосфорилирования заключается
в следующем (рис. 36).
При поглощении кванта света
один их электронов пигмента
реакционного центра (Р700)
переходит на более высокий
энергетический уровень. В этом
состоянии он захватывается белком,
содержащим железо и серу (Ре —
8-центр), а затем передается на
железосодержащий белок ферри-
доксин. Дальнейший путь
электрона — поэтапный, его
транспорт обратно к Р700 через ряд
промежуточных переносчиков,
среди которых имеются флаво-
протеиды и цитохромы. По мере
транспорта электрона его
энергия высвобождается и
используется на присоединение Фн к
АДФ с образованием АТФ.
Число молекул АТФ,
образующихся при переносе одного
электрона, до сих пор не установле-
+081 -
Рис. 36. Схема циклического
транспорта электронов при фотосинтезе
114
Е'о,В
-1,0
-0,6
-0,4
о
0,2
0,4
0,6
48
1,0
1,2
Антенный
комплекс ФСП
Рис. 37. Схема нециклического транспорта электронов при фотосинтезе
но. Причина в том, что из двух необходимых величин
относительно легко измерить только количество АТФ, синтезированное
за определенное время, тогда как оценить число электронов,
перенесенных по циклической цепи за тот же промежуток
времени, не представляется возможным.
Итак, при циклическом фотофосфорилировании энергия
света расходуется на перенос электрона на высоковосстановлен-
ное соединение, т. е. против градиента ОВ-потенциала, а затем
электрон «скатывается с горки», образованной переносчиками с
убывающим уровнем восстановленности, и, обедненный
энергией, возвращается на ФС1. Механизмы сопряжения (АТФ-
азный комплекс) обеспечивают на этом отрезке пути запасание
энергии в виде АТФ. У простейших автотрофов — бактерий —
это единственный путь фотофосфорилирования.
У высших растений в процессе эволюции появился более
сложный путь, который осуществляется при участии двух
фотосистем и обеспечивает восстановление НАДФ за счет
фотоокисления воды. Причем восстановление НАДФ осуществляет ФС1, а
фотоокисление воды — ФСП. Эти две системы функционируют
одновременно и взаимосвязанно. Р. Хиллом и Ф. Бендаллом
(1960) разработана схема последовательности реакций, которая
115
получила название схемы нециклического транспорта электронов,
или ^-схемы. Рассмотрим ее основные моменты (рис. 37).
При возбуждении .Р700 в реакционном центре ФС1 электрон
захватывается мономерной формой хлорофилла а и затем
последовательно передается через железосерные белки, ферридоксин,
флавопротеиды на восстановление НАДФ. Р-юо, не получив
электрона обратно, как в случае циклического фосфорилирования,
приобретает положительный заряд, который компенсируется
электроном ФСП.
В ФСП /*68О, возбужденный квантом света, передает электрон
феофитину. От феофитина электрон, теряя энергию,
последовательно передается на пластохиноны, железосерный белок, цитох-
ром/, пластоцианин и, наконец, на /^оо ФС1. Энергия,
освобождающаяся при транспорте электрона от возбужденной ФСП на
ФС1, используется для синтеза АТФ из АДФ и Фн, т. е. здесь
имеет место фотофосфорилирование.
7*6805 оставшись без электрона, приобретает способность
получать электрон от воды. Несмотря на активное исследование,
детально механизм процесса фотоокисления воды не установлен.
Показано участие белкового комплекса и переносчика
электронов 2,, для функционирования которых необходимы Мп, С1 и Са.
Таким образом, при нециклическом пути происходит
линейный или открытый, т. е. не замкнутый по циклу, транспорт
электронов. Донором электронов является вода, конечным
акцептором — НАДФ. Причем происходит одновременно двухэлек-
тронный транспорт. Передача электронов осуществляется при
участии двух фотосистем, поэтому для переноса каждого
электрона расходуются два кванта света. На участке между ФСП и
ФС1 транспорт электрона идет по убывающему градиенту
окислительно-восстановительного потенциала с высвобождением
энергии и запасанием ее в АТФ. (Подробно механизмы
фосфорилирования, сопряженные с транспортом электронов,
рассмотрены в разделе 3.)
Наряду с нециклическим в мембранах хлоропластов высших
растений функционирует циклический транспорт электронов.
Причем ферридоксин выполняет роль регулятора потока
электронов. При возрастании потребности в АТФ часть электронов
от ферридоксина через систему цитохромов возвращается к Р700
с образованием АТФ. Восстановление НАДФ в этом случае не
идет, и фотоокисления воды при участии ФСП не требуется.
Белковые комплексы, участвующие в фотохимических
реакциях фотосинтеза, в мембранах хлоропластов распределены
неравномерно. Наибольшие различия наблюдаются между теми
мембранами, которые плотно состыкованы друг с другом в
гранах, и теми участками мембран, которые контактируют со стро-
мой, — закругленные участки тилакоидов гран и мембраны тила-
коидов стромы (рис. 38).
116
Рис. 38. Локализация электрон- и протонтранспортных реакций в мембране тила-
коида
Светособирающий комплекс и ФСП находятся в основном в
плотносостыкованных мембранах гран. ФС1 со своим светособи-
рающим комплексом и АТФ-азный комплекс находятся на несо-
стыкованных участках мембран. Взаимодействие между ними
осуществляется с помощью легкоподвижного в липидной фазе
пластохинона, а также благодаря перемещению
водорастворимого пластоцианина вдоль внутренних поверхностей ламелл и
водорастворимого ферридоксина вдоль наружных поверхностей.
К латеральным перемещениям способны и пигментбелковые
комплексы. Например, восстановление в избыточных
количествах пластохинона ФСП способствует перемещению ССК в стро-
мальную область мембраны и возрастанию миграции
поглощенной энергии света с ФС1. Возросшая фотохимическая активность
ФС1 усиливает окисление пластохинона, что приводит к
обратному перемещению ССК. Таким образом, система взаимной
регуляции активности ФС1 и ФСП включает латеральный
транспорт белковых комплексов в мембранах хлоропластов.
2.6. МЕТАБОЛИЗМ УГЛЕРОДА ПРИ ФОТОСИНТЕЗЕ
(ТЕМНОВАЯ ФАЗА)
Продукты световой фазы фотосинтеза АТФ и НАДФ-Н
используются в темновой фазе для восстановления СОг до уровня
углеводов. Реакции восстановления происходят настолько
быстро, что с помощью обычных методов химического анализа
чрезвычайно трудно обнаружить промежуточные продукты и
117
практически невозможно установить последовательность их
превращений. Только использование радиоактивных изотопов, в
первую очередь С, в качестве метки, хроматографии и
электрофореза позволило установить последовательность реакций при
фотосинтезе, множественность путей метаболизма углерода. В
настоящее время известны С3- и С4-пути фиксации СОг,
фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание.
2.6.1. Сз-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ КАЛЬВИНА)
Этот способ ассимиляции СО2, присущий всем растениям,
был расшифрован американскими исследователями во главе с
Мэльвином Кальвиным. Схема последовательности реакций
получила название цикла Кальвина. Характерной особенностью
фотосинтетического восстановления СС>2 являются цикличность
и разветвленность этого процесса. Цикличность обеспечивает
высокую производительность, саморегуляцию и непрерывность
образования углеводов. Разветвленность — образование
разнообразных продуктов, дублирование путей регенерации акцептора
СОг- Цикл состоит из трех этапов: карбоксилирования,
восстановления и регенерации акцептора СОг (рис. 39).
Карбоксилирование. Первой реакцией, вводящей СОг в цикл
Кальвина, является карбоксилирование рибулезо-1,5-дифосфата
(1,5-РДФ) с участием фермента рибулезодифосфаткарбоксилазы
(РДФ-карбоксилазы). Образующееся при этом нестойкое шести-
углеродное соединение быстро распадается на триозы — две
молекулы 3-фосфоглицериновой кислоты (3-ФГК). Поэтому 3-ФГК
можно считать первичным продуктом фотосинтеза.
Фаза восстановления. Восстановление 3-фосфоглицериновой
кислоты (3-ФГК) до 3-фосфоглицеринового альдегида (3-ФГА)
происходит в два этапа. Сначала при участии АТФ и фосфогли-
цераткиназы 3-ФГК присоединяет остаток фосфорной кислоты с
образованием 1,3-дифосфоглицериновой кислоты (1,3-дФГК).
Этим достигается повышение реакционной способности
соединения и возможность его восстановления с помощью НАДФН
до 3-ФГА. Это единственная восстановительная реакция цикла,
фосфоглицериновый альдегид по уровню восстановленности
углерода соответствует углеводу с общей формулой (СНгО)з. Фаза
восстановления является центральным звеном цикла. Именно
здесь скрещиваются световая и темновая фазы фотосинтеза. Все
остальные превращения идут на уровне Сахаров, одинаковых по
степени восстановленности.
Фаза регенерации первичного акцептора СО2 и синтеза
конечных продуктов фотосинтеза. В результате рассмотренных ранее
реакций при фиксации трех молекул СОг образуются 6 молекул
восстановленных 3-фосфотриоз, пять из них используются затем
118
С02 из атмосщры
РДФ-кар6оксилаза2(
Рибулозовисроссрат,
АВР
Конденсации
и перестройки
кислота . ,„ реакций
\ /ЫАВР-Н
ЫАОР*
Фосцзогшцеринобый
'ьдешд
Конечный
продукт
Гексозомоносросфат
Крахмал и сахароза
и С7- сахародхюратоВ
Рис. 39. Упрощенная схема цикла Кальвина
для регенерации рибулезодифосфата, а одна — для синтеза
глюкозы. Это достигается следующей последовательностью реакций.
Часть молекул 3-ФГА под действием триозофосфатизомеразы
превращается в фосфодиоксиацетон (ФДА). Затем два изомера
(ФГА и ФДА) подвергаются конденсации при участии фермента
альдолазы, образуя фруктозо-1,6-дифосфат, у которого затем
отщепляется один фосфат. В дальнейших реакциях, связанных с
регенерацией акцептора СОг, возникает цепь фосфорных эфиров
Сахаров, содержащих в своем составе 4, 5 или 7 атомов углерода.
В этих реакциях последовательно принимают участие транскето-
лазы и альдолазы. Транскетолаза катализирует перенос двухугле-
родной группировки от фруктозо-гб-фосфата на 3-ФГА, при этом
образуются эритрозо-4-фосфат (С4) и ксилулозо-5-фосфат (С5).
Затем альдолаза осуществляет перенос трехуглеродного остатка
ФДА на эритро-4-фосфат, в результате чего синтезируется седо-
гептулозо-1,7-дифосфат (С7). От последнего отщепляется один
остаток фосфорной кислоты и под действием транскетолазы из
него и 3-ФГА образуются ксилулозо-5-фосфат (С5) и рибозо-5-
фосфат (С5). Две молекулы ксилулозо-5-фосфата путем эпимери-
зации и одна молекула рибозо-5-фосфата за счет изомеризации
превращаются в три молекулы рибулозо-5-фосфата (С5). Это
соединение подвергается фосфорилированию за счет АТФ, кото-
119
рую поставляет световая фаза фотосинтеза, с образованием рибу-
лозо-1,5-дифосфата. Цикл при этом замыкается.
Из оставшейся неиспользованной шестой молекулы 3-ФГА
при повторении цикла под действием альдолазы синтезируется
фруктозо-1,6-дифосфат, из которого могут образоваться глюкоза,
сахароза или крахмал:
фруктозо 1,6-дифосфат
фруктозо-6-фосфаТ
сахароза
глюкоза-^— глюкозо-6-фосфат ^-УДФД-глюкоза
\ +УТФ
глюкозо-1 -фосфат г—>- крахмал
Таким образом, для синтеза одной молекулы глюкозы ($)
должно произойти шесть оборотов цикла. В каждом обороте
цикла используются три молекулы АТФ (две для активирования
двух молекул ФГК и одна при регенерации акцептора СОг 1,5-
РДФ) и две молекулы НАДФН для восстановления ФГК до
ФГА. Поэтому для синтеза одной молекулы глюкозы в цикле
Кальвина необходимо 12 НАДФН и 18 АТФ. Таков
энергетический вклад световой фазы в темновую фиксацию СОг-
В цикле Кальвина первичными продуктами включения СОг в
органические вещества и восстановления являются трехуглерод-
ные соединения (3-ФГК, 3-ФГА, ФДА). Поэтому этот способ
фиксации СОг носит название Сз-пути фотосинтеза.
Большинство растений, особенно произрастающих в умеренной зоне,
используют именно этот путь восстановления СОг и называются
Сз-растениями.
2.6.2. С4-ПУТЬ ФОТОСИНТЕЗА (ЦИКЛ ХЕТЧА И СЛЭКА)
Путь усвоения СОг, установленный М. Кальвиным, является
основным. Но существует большая группа растений,
включающая более 500 видов покрытосеменных, у которых первичными
продуктами фиксации СОг и восстановления являются четырех-
углеродные соединения. Их называют С4-растениями. Основы
для биохимического исследования фотосинтеза у С4-растений
были заложены в работах Л. А. Незговоровой (1956—1957),
Ю. С. Карпилова и И. А. Тарчевского (1960—1963), а также
австралийских ученых Хетча и Слэка. В 1966 г. Хетч и Слэк пред-
120
дожили законченную схему цикла темновых реакций у С4-расте-
ний, которая получила название цикла Хетча и Слэка.
К С4-растениям относится ряд культурных растений
преимущественно тропического и субтропического происхождения —
кукуруза, просо, сорго, сахарный тростник и многие злостные
сорняки — свинорой, сыть округлая, ежовник крестьянский,
просо куриное, просо крупное, гумай (сорго алепское), щирица,
щетинник и др. Как правило, это высокопродуктивные растения,
устойчиво осуществляющие фотосинтез при значительных
повышениях температуры и в засушливых условиях.
Для листьев (^-растений характерно анатомическое строение
кранц-типа (от нем. Кгапг — венок, корона), т. е. наличие явно
отличающихся друг от друга фотосинтезирующих клеток двух
типов, которые располагаются концентрическими кругами: ради-
ально расположенные вокруг проводящих пучков клетки
обкладки и основной мезофилл (рис. 40).
Клетки обкладки проводящего пучка содержат крупные,
лишенные гран (агранальные) хлоропласты. В клетках мезофилла
находятся более мелкие гранальные хлоропласты. Эти два типа
клеток физиологически не равноценны и специализируются на
выполнении разных звеньев фотосинтеза. С4-ЦИЮ1 можно
разделить на две стадии: карбоксилирование, происходящее в клетках
мезофилла, и декарбоксилирование и синтез углеводов, идущие в
клетках обкладки проводящих пучков. Общим для всех С4-расте-
ний является то, что карбоксилированию подвергается фосфо-
енолпировиноградная кислота (ФЕП) при участии ФЕП-карбок-
силазы и образуется щавелевоуксусная кислота (ЩУК), которая
восстанавливается до яблочной кислоты или аминируется с
образованием аспарагиновой кислоты.
соон
I
сн2
I
СНОН + Н3РО4
сн
соон
I
сн2
I
со
I
соон
ЩУК
соон
яблочная кислота
(малат)
соон
аспарагиновая
кислота
121
Щавелевоуксусная, яблочная
и аспарагиновая кислоты
являются четырехуглеродными
соединениями.
По способу декарбоксилиро-
вания при участии НАДФН
или НАД-малатдегидрогеназы
(МДГ, называемой также малик-
энзимом и яблочным
ферментом) или ФЭП — карбоксики-
назы (ФЕП-КК) у С4-растений
можно выделить три группы:
НАДФ-МДГ, НАД-МДГ и
ФЕП-КК-типы соответственно.
У НАДФ-МДГ-растений
главными метаболитами,
вовлеченными в обмен между клетками,
являются малат и пируват (ПВК), у НАД-МДГ-растений —
аспартат и аланин и у ФЕП-КК-растений — аспартат и ФЕП.
Важнейшие сельскохозяйственные культуры — кукуруза, сорго,
сахарный тростник и такие распространенные сорняки, как сыть,
ежовник, щетинник, гумай, относятся к НАДФ-МДГ-типу.
Рассмотрим С4-цикл восстановления СО2 на примере этих
растений (рис. 41). СОг, поступающий в лист через устьица,
попадает в цитоплазму клеток мезофилла, где при участии ФЕП-
карбоксилазы вступает в реакцию с ФЕП, образуя щавелевоук-
сусную кислоту (оксалоацетат). Затем уже в хлоропластах оксало-
ацетат восстанавливается до яблочной кислоты (малата) за счет
НАДФН, образующегося в ходе световой фазы фотосинтеза;
Рис. 40. Структурные особенности С4-
растений: поперечный разрез листа
кукурузы (по В. Я. Александрову, 1961):
/—эпидермис; 2— межклетники; 3—
мезофилл; 4— проводящий пучок; 5—
клетки обкладки
Мезофилл
обкладка сосудистого пучка
СО,
Рис. 41. Схема кооперативного действия клеток мезофилла и обкладки
сосудистого пучка у С4-растений
122
ЩУК в присутствии МЩ может превращаться также в аспартат.
Опыты с радиоактивной меткой (14С) показали, что после
освещения растений в течение 1 с более 90 % радиоактивности
обнаруживается в составе С4-кислот.
Затем малат переносится в хлоропласты клеток обкладки
сосудистого пучка, где он подвергается окислительному декарбо-
ксилированию, продуктом которого является пировиноградная
кислота (ПВК). Последняя снова диффундирует в мезофилл, где
при участии АТФ, образованной в световой фазе, происходит
регенерация ФЕП, после чего цикл карбоксилирования
повторяется с участием новой молекулы СО2- Образовавшиеся в
результате окислительного декарбоксилирования малата СОг и
НАДФН поступают в цикл Кальвина, что приводит к
образованию ФГК и других продуктов, свойственных Сз-растениям.
Следовательно, именно клетки обкладки выполняют роль основной
ассимилирующей ткани, поставляющей сахара в проводящую
систему. Клетки мезофилла выполняют вспомогательную
функцию — подкачку СО2 для цикла Кальвина. Таким образом, С4-
путь обеспечивает более полное усвоение СОг, что особенно
важно для тропических растений, где основным лимитирующим
фактором фотосинтеза является концентрация СОг-
Эффективность усвоения СО2 С4-растениями увеличивается также за счет
подачи НАДФН в хлоропласты клеток обкладки. Эти
хлоропласты имеют агранальное строение и специализируются на темно-
вой фазе фотосинтеза, здесь практически не происходит
нециклическое фотофосфорилирование. На один агранальный
хлоропласт в среднем приходится 8—10 гранальных хлоропластов,
осуществляющих первичную фиксацию СОг и нециклическое
фотофосфорилирование. Такая компартментация процессов и
кооперация функционирования тканей обеспечивают повышение
продуктивности растений и позволяют накапливать СОг в
органических кислотах для осуществления фотосинтеза даже при
закрытых устьицах в наиболее жаркое время дня. Это сокращает
потери воды на транспирацию. Эффективность использования
воды С4-растениями вдвое выше, чем у Сз-растений. Физиолого-
биохимические различия между Сз- и С4-растениями
систематизированы в таблице 10.
10. Сравнительная характеристика Сз- и С4-растений
Признак
Сз-растения
С4-растения
Происхождение и
основное местообитание
Мезофилл
Умеренная зона
Дифференцирован на
столбчатую и губчатую
ткань
Тропическая и
субтропическая зона
Дифференцирован на
основной мезофилл и
клетки обкладки сосудистого
пучка
123
Продолжение
Признак
Сз-растения
С4-растения
Хлоропласты
Гранальные
Первичные продукты фо- ФГК, ФГА (трехуглерод-
тосинтеза ные соединения)
Первичный акцептор СОг Рибулезодифосфат
Ключевой фермент РДФ-карбоксилаза
СОг-компенсационный 0,003—0,01 %
пункт
Световое насыщение
фотосинтеза
Наблюдаемое
фотодыхание
Отток ассимилятов
Продуктивность
При средней
освещенности
Есть
Медленный
Средняя (20—30 т/га)
Гранальные и аграналь-
ные
ЩУК, аспартат, малат
(четырехуглеродные
соединения)
Фосфоенолпи руват
ФЕП-карбоксилаза
0-0,0005 %
Не достигается даже на
полном солнечном свете
Нет
Быстрый
Высокая (80 т/га)
2.6.3. ФОТОСИНТЕЗ ПО ТИПУ ТОЛСТЯНКОВЫХ (САМ-МЕТАБОЛИЗМ)
Цикл Хетча и Слэка обнаружен также у растений-суккулентов
(из родов Сга88и1а, ВгуорпуЦшп и др.)- Но если у С4~растений
кооперация достигнута за счет пространственного разделения
двух циклов (включение СО2 в органические кислоты в
мезофилле, восстановление в обкладке), то у суккулентов эти
процессы разделены во времени. Для них не характерны структурные
особенности С^растений, а существует суточный цикл
метаболизма С4-кислот с образованием яблочной кислоты ночью. В
соответствии с английским выражением Сгаз8и1асеап асШ те1а-
ЬоНзт (САМ) этот тип фиксации СС>2 называют САМ-метабо-
лизмом (рис. 42).
Устьица у этих растений открываются ночью, что уменьшает
гМалат
ночь
(устьица (
открыты) ииг.
дет
закрыты)
Сахара
Рис. 42. Метаболизм органических кислот по типу толстянковых
124
потери воды растениями. СО2, поступающий из атмосферы и
освобождающийся в процессе дыхания, при участии ФЕП-кар-
боксилазы взаимодействует с фосфоенолпируватом, образуя ща-
велевоуксусную кислоту. Последняя восстанавливается до мала-
та, который накапливается в вакуолях клеток листа. Это
приводит к подкислению клеточного сока в ночное время. Днем при
закрытых устьицах в условиях недостатка влаги малат
транспортируется в цитоплазму и там декарбоксилируется с образованием
СОг, который включается в цикл Кальвина, участвуя в синтезе
Сахаров. Такой метаболизм СО2 не может обеспечить высокой
продуктивности растений, но позволяет им существовать в
засушливых местообитаниях.
2.6.4. ФОТОДЫХАНИЕ И МЕТАБОЛИЗМ ГЛИКОЛЕВОЙ КИСЛОТЫ
Фотодыхание — это индуцированное светом поглощение
кислорода и выделение СО2, которое наблюдается только в
растительных клетках, содержащих хлоропласты. Химизм этого
процесса значительно отличается от «темнового» дыхания
митохондрий. Первичным продуктом фотодыхания является гликолевая
кислота, поэтому такой путь окисления получил название глико-
латного.
Фотодыхание осуществляется в результате взаимодействия
трех органелл — хлоропластов, пероксисом и митохондрий
(рис. 43). В основе фотодыхания лежит способность ключевого
фермента цикла Кальвина РДФ-карбоксилазы в условиях
высокого парциального давления кислорода выполнять оксигеназную
функцию, т. е. катализировать окислительное расщепление рибу-
лозо-1,5-дифосфата на 3-фосфоглицериновую кислоту и 2-фос-
фогликолевую кислоту, содержащую два атома углерода. 3-ФГК
поступает в цикл Кальвина, а 2-фосфогликолевая кислота
подвергается дефосфорилированию с образованием гликолата. Гли-
колат из хлоропласта поступает в пероксисому — органеллу
овальной формы, окруженную одинарной мембраной. Здесь гли-
колат под действием гликолатоксидазы окисляется до глиоксила-
та. Образующаяся при этом перекись водорода расщепляется при
участии фермента каталазы. Глиоксилат затем превращается в
аминокислоту глицин в результате реакции трансаминирования.
В качестве донора аминогруппы функционирует глутаминовая
кислота.
Глицин транспортируется в митохондрию. Там из двух
молекул глицина образуется серин и освобождается СО2. Таким
образом, часть углерода, фиксированного в цикле Кальвина, теряется
растением. Поэтому при интенсивном фотодыхании
продуктивность фотосинтеза снижается. Серин может использоваться в
белковом синтезе или поступает в пероксисому и там передает
аминогруппу на пируват. При этом из пирувата образуется ала-
125
:•'.'■'. НООу ' ■'. \-0- .'■ . Цитоплазма...- : '».' • :.■'.'.■■
'. '-'.'.со, '.'■ '■ :' \ ■■.":■' '-■'■.■.".■ •"•'."• ■'/•'.'•^Ч•■'.•'.'.'
СНцОН-СООН \
колац V
ЗФГК I Гливксилат
пероксисома СНО-СООН
Глицин
ш
Клеточная
=>9<х стенка
■ ■■ ■'.■'.■'.••. :•■•!\:.:'. : •'. Сахароза/
Рис. 43. Схема процесса фотодыхания
нин, из серина — гидроксипируват, который восстанавливается в
глицерат. Глицерат может снова попасть в хлоропласты и
включиться в цикл Кальвина.
Митохондриальное («темновое») дыхание на свету обычно
затормаживается. У Сз-растений при хорошей освещенности
фотодыхание в 1,3—3 раза активнее, чем «темновое» дыхание. Сз-рас-
тения в результате фотодыхания теряют 30—35 %, а иногда до
половины всего углерода, ассимилированного в процессе
фотосинтеза. У С4-растений СОг, выделяющийся в результате
фотодыхания, включается в клетках мезофилла 6 оксалоацетат и
малат и благодаря этому реассимилируется растением. Расход на
фотодыхание продуктов ассимиляции снижается до 0—6 %, это
обеспечивает их более высокую продуктивность.
Некоторые исследователи видят в снижении фотодыхания
резерв для увеличения урожайности сельскохозяйственных культур.
Однако работа в этом направлении пока не увенчалась успехом.
При испытании многочисленных химических ингибиторов
снижение фотодыхания обычно сопровождается подавлением и
самого фотосинтеза. Положительный эффект высокой концент-
126
рации СО2 сохраняется обычно только в течение 5—10 сут. Для
поиска растений с низким фотодыханием было обследовано
значительное число видов и сортов, получены мутанты. Однако, как
правило, образцы растений с пониженным фотодыханием имели
низкий уровень фотосинтеза и продуктивности, поэтому не
получили практического применения.
Установлено также, что подавление фотодыхания сои в
условиях пониженной концентрации Ог (5 %) сопровождалось
увеличением накопления вегетативной массы без формирования семян.
Все это свидетельствует о фотодыхании как о необходимом и
полезном процессе. Преимущества С4-растений не в отсутствии
фотодыхания, а в способности реассимилировать СОг- В связи с
этим некоторый интерес представляет идея модификации
фотосинтеза Сз-растений путем введения в клетки мезофилла листа
механизма «накачки» СОг внутрь хлоропластов, свойственного
С4-растениям. Известно, что у Сз-растений имеются все
ферменты С4-метаболизма углерода кроме пируватдикиназы,
ответственной за регенерацию акцептора СОг — ФЕП. С4-тип,
по-видимому, эволюционно возник из Сз-типа как результат
приспособления к аридному климату, и есть перспектива методами генной
инженерии создать формы Сз-растений с высокой активностью
ФЕП-системы для концентрирования СОг в хлоропластах.
В настоящее время нет общепризнанных представлений о
физиологической роли фотодыхания, однако многие исследователи
склоняются к мнению, что оно выполняет роль поставщика
более широкого ассортимента образующихся в ходе фотосинтеза
продуктов. Необходимо вспомнить, что гликолатный путь
приводит к синтезу аминокислот — глицина и серина. В
многочисленных опытах прослеживается связь фотодыхания с азотным
обменом листа. Условия, приводящие к снижению фотодыхания и
ослаблению фотосинтетического потока углерода через
гликолатный путь (снижение концентрации кислорода и повышение
СОг), вызывают уменьшение включения СОг в аминокислоты
и усиление образования углеводов. При усилении азотного
питания (особенно нитратной формой) активность ферментов глико-
латного пути возрастает. Кроме того, фотодыхание поставляет
энергетически ценные продукты — восстановленный НАДФ,
обсуждается также возможность синтеза АТФ в процессе
образования серина.
Одна из концепций значения фотодыхания предполагает его
защитную роль. Сброс избыточной энергии позволяет
предотвратить деструкцию фотосистем, избежать прекращения
фотохимических процессов при высокой освещенности и недостатке СОг
(при закрытых в условиях водного дефицита устьицах и высокой
температуре). Фотодыхание обеспечивает сбалансированность
световой и темновой фаз фотосинтеза, их зависимость от
потребности в продуктах фотосинтеза. Показано стимулирование фото-
127
дыхания при торможении оттока ассимилятов, например, при
удалении плодов, клубней картофеля. Фотодыхание, наоборот,
снижается при увеличении нагрузки на хлоропласт. Таким
образом, фотодыхание выполняет роль отводного канала в общем
русле энергообеспечения растений.
2.7. ИНТЕНСИВНОСТЬ ФОТОСИНТЕЗА
И МЕТОДЫ ЕГО ОПРЕДЕЛЕНИЯ
Под интенсивностью фотосинтеза (ИФ) понимают количество
)
г усваиваемое единицей листовой поверхности за единицу
времени. ИФ измеряется преимущественно в мг СОг/(дм -ч) или
в мкмоль* СОг/(м с). Реже для характеристики активности
фотосинтеза используют количество О2, выделяемое единицей
листовой поверхности за единицу времени.
Наиболее распространенным методом определения ИФ как в
лабораторных, так и в полевых условиях является
газометрический. Это самый производительный и точный метод учета
поглощения СОг, основанный на инфракрасном анализе содержания
диоксида углерода в токе воздуха. Измерение поглощения СОг
имеет ряд важных преимуществ перед определением динамики
накопления сухой массы. Прежде всего данный метод применим
в любое время, не приводит к уничтожению растения и
позволяет оценить прибавку сухой массы за короткий интервал времени
(за минуты, часы или дни). Кроме того, он дает возможность
изучать каждый лист в отдельности и соответственно оценить
вклад каждого яруса в фотосинтетическую деятельность
растения, отделяя прибыль углерода за счет фотосинтеза от потерь за
счет дыхания.
В большинстве исследований газообмена СОг используется
метод, основанный на помещении листа, растения или группы
растений в прозрачную камеру. ИФ таких объектов определяют с
помощью инфракрасных газоанализаторов по изменению
концентрации СОг в потоке воздуха, протекающем через камеру.
Обмен СОг больших участков, например, поля, можно измерить
с помощью микрометеорологического метода. При этом ИФ
посевов определяют с помощью параллельных измерений
концентрации СО2 и движения воздуха над посевом. Поскольку растения
поглощают СОг, то его концентрация в воздухе непосредственно
над растениями и вокруг них будет снижаться. Изменения
концентрации СОг на различной высоте над полем будут вызваны
соотношением между скоростью ассимиляции СОг растениями и
движением воздуха, благодаря чему восполняется необходимый
уровень СОг-
Радиометрический метод определения ИФ предполагает
введение метки по 14С в виде СОг- С этой целью лист (целое
растение) экспонируется с 14СОг в течение короткого (менее 60 с), но
точно измеренного периода времени. Затем лист срезают,
фиксируют в жидком азоте и определяют содержание в нем С,
которое прямо пропорционально ИФ. Метод широко используется
для полевого измерения. Однако появившиеся недавно
портативные ИК-газоанализаторы на СО2 начали вытеснять
радиометрический метод при работе в поле, поскольку последний имеет
два существенных недостатка. Во-первых, он приводит к гибели
растения, во-вторых, может систематически завышать ИФ,
особенно у Сз-растений, обладающих в сравнении с С4-растениями
значительным фотодыханием.
Фотосинтез интактных листьев обычно исследуют при
помощи инфракрасного газоанализатора. Однако полярографическое
определение кислорода при помощи электрода, прикладываемого
к листовой высечке, является в этом случае более дешевым
альтернативным методом. Он может дать дополнительную
информацию, например, о том, что отношение между
выделившимся Ог и поглощенной СОг не всегда равно 1. Электрод для
листовой высечки можно использовать для измерения
максимальных скоростей фотосинтеза в условиях насыщения СОг-
Этим же способом удобно проводить измерение скорости
фотосинтеза в зависимости от освещенности.
Фотосинтетическую активность изолированных хлоропластов
трудно определить при помощи ИК-газоанализатора.
Радиометрический метод может дать ценную информацию относительно
продуктов фотосинтеза, однако при этом измерения нельзя
проводить непрерывно. Поэтому используют обычный метод
измерения ИФ при помощи кислородного электрода, дающий
возможность определять изменения содержания кислорода в суспензии
порядка 0,01 мкмоль.
2.8. ЭНДОГЕННЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ
ФОТОСИНТЕЗА
Проводимость листа. Одним из основных факторов
эндогенной регуляции фотосинтеза является проводимость* листа для
молекул СОг, тесно коррелирующая с ИФ. Различают устьичную
и остаточную проводимость. Последняя представлена главным
1 мкмоль СО2/(м2с)=1,58 мгСОг/(дм2ч).
* Проводимость 1 см/с примерно равна 400 ммоль СОг/(м с) при 25 "С.
128
129
образом проводимостью мезофилла. Проводимость — это
величина, обратная сопротивлению. Она измеряется в сантиметрах в
секунду. Устьичная проводимость (УП), или проводимость в
газовой фазе, у растений колеблется от 1 см/с, когда устьица
широко открыты, до 0,02 см/с при закрытых устьицах.
Проводимость мезофилла (МП), или проводимость молекул СОг в
жидкой фазе, при их прохождении через клеточные стенки,
мембраны, цитозоль и двойную мембрану хлоропласта к местам
карбоксилирования в строме определяется прежде всего
активностью карбоксилирующих ферментов фотосинтеза. МП имеет
значения 0,1—0,5 см/с у Сз-растений и более 0,5 см/с у С4-рас-
тений. Более высокая МП у Севидов объясняется главным
образом незначительным фотодыханием. УП у Севидов, напротив,
ниже, чем у Сз-видов, что обусловлено как меньшим числом
устьиц на единицу площади листьев, так и меньшими размерами
• устьичных щелей.
Однако суммарная проводимость листа для молекул СОг в
целом выше для С4-растений, что определяет преимущество
последних по ИФ. Относительную роль устьиц в регуляции
фотосинтеза можно оценить, вычисляя отношение сопротивления устьиц
к суммарному сопротивлению листа для молекул СОг. Чем выше
это отношение, тем сильнее сказывается относительное
лимитирование поглощения СОг за счет диффузии через устьица. Эта
величина обычно равна 0,6—0,8 для Сз-видов и 0,2—0,4 для С4-
видов, что указывает на доминирующую роль устьиц у Сз-видов.
Фотохимическое лимитирование фотосинтеза. Скорость
фотосинтетического метаболизма часто ограничивается поступлением
энергии в форме АТФ и НАДФН, образующихся в мембранах
хлоропластов за счёт энергии поглощенного света. Считается,
что звено, ограничивающее скорость транспорта электронов,
находится между ФС1 и ФСП. При этом существует корреляция
между транспортом электронов и количеством цитохромов Ь- и
/-типов, пластохинона и сопрягающего фактора, связанного с
мембранами.
Возникает вопрос: что лимитирует скорость фиксации СОг
при оптимальных условиях — световые или темновые реакции?
В исследованиях, выполненных на кафедре физиологии
растений ТСХА на растениях кукурузы, показано, что при
нормальных физиологических условиях скорости этих двух процессов
сравнимы и, следовательно, каждый в отдельности не может
рассматриваться как фактор первого лимитирования. При этом
различия в активности ЭТЦ не сказываются на ИФ. Это можно
понять, если принять во внимание, что фотосинтез —
иерархический процесс, пространственная шкала организации которого
простирается от 10~27 до 105 м3, а временная — от 10~15
(первичные фотохимические процессы) до 10 с (первичная
продуктивность в полевых условиях).
130
В силу значительной буферности и множественных
взаимодействий изменение в каком-либо звене фотосинтеза далеко не
всегда может привести к ожидаемому ответу всей системы.
Поэтому при определении фотосинтеза в полевых условиях
информация о процессе, идущем на молекулярном уровне, например
скорости транспорта электронов, может оказаться мало полезной
для интерпретации колебаний ИФ. Таким образом, чем большее
число эндогенных факторов вводится в общую систему
регуляции фотосинтеза, тем меньше возможностей для того, чтобы
улучшение организации на низших уровнях привело к
повышению интегрального фотосинтеза.
Биохимическое лимитирование фотосинтеза. Реакции,
катализируемые РДФ-карбоксилазой/оксигеназой, — наиболее
вероятное звено лимитирования скорости ассимиляции СОг. Скорость
реакции карбоксилирования является функцией количества
фермента, присутствующего в хлоропласте; концентрации
субстратов (СОг, Ог и РДФ) вблизи фермента; степени активации
фермента. Содержание карбоксилазы в листьях Сз-растений
2,0—3,5 г/м2, что достаточно для обеспечения довольно
высокой скорости фотосинтеза. Белок РДФ-карбоксилазы
представляет большую часть растворимого белка листьев у Сз-видов,
чем у С4-ВИДОВ.
Карбоксилирующий фермент, как правило, содержится в
листьях в избыточном для поддержания текущего фотосинтеза
количестве и поэтому вряд ли ограничивает ассимиляцию СОг-
Скорость ферментативной реакции скорее всего лимитируется
снабжением субстратом рибулозодифосфатом, особенно если
недостаточна скорость поступления энергии из световой фазы.
Несмотря на то что у С4-ВИДОВ первым ферментом
карбоксилирования является ФЭП-карбоксилаза, а не РДФ-карбоксилаза,
как у Сз", так и у С4-ВИДОВ существует очень тесная корреляция
между ИФ и активностью РДФ-карбоксилазы. При этом
преимущество С4-цикла состоит в том, что благодаря
концентрированию СОг в клетках обкладки проводящих пучков фотодыхание и
связанное с ним потребление энергии снижаются до очень
низкого уровня. Однако энергия, сэкономленная за счет подавления
фотодыхания, примерно равна энергии, затраченной на
концентрирование СОг- Поэтому основным преимуществом С4-Цикла
можно считать то, что РДФ-карбоксилаза у С4-ВИДОВ
функционирует в условиях насыщающих концентраций СОг.
Гормональный эффект. Из донорного листа наряду с ассими-
лятами экспортируются синтезируемые в хлоропластах вещества
гормональной природы, в том числе абсцизовая кислота (АБК).
При торможении экспорта ассимилятов, например, путем
удаления бобов у сои устьичная проводимость и ИФ резко
снижаются. Одновременно содержание АБК в листе в сравнении с
контролем возрастает в 10 раз. Это приводило к закрыванию устьиц
131
и торможению фотосинтеза. Частичное удаление корней, где
синтезируется цитокинин, транспортируемый по ксилеме
водным током, также подавляло фотосинтез листьев. Так, после
декапитации корней у молодых растений фасоли ИФ резко
снижалась. Избыточного накопления углеводов в листьях при этом
не установлено, что указывает на важную роль фитогормонов в
эндогенной регуляции фотосинтеза.
Донорно-акцепторные отношения. ИФ листа (донор) сильно
зависит от запроса на ассимиляты со стороны потребляющих
органов (акцептор). Так, удаление клубней с растений
картофеля или плодоэлементов у томата подавляло фотосинтез, а
увеличение спроса на ассимиляты или усиление «силы»
акцептора, напротив, стимулировало ассимиляцию СО2 листьями.
Например, частичная дефолиация молодых растений яблони
или кукурузы резко увеличила ИФ оставшихся листьев для
того, чтобы удовлетворить запрос акцепторов на ассимиляты.
Удаление колоса у пшеницы снизило ИФ флагового листа на
40 %, а последующее затенение нижних листьев практически
восстановило ИФ на прежнем уровне, поскольку флаговый лист
остался единственным источником ассимилятов. Изменение
ИФ в онтогенезе растения также можно объяснить изменением
запроса на ассимиляты. Так, в период роста плодоэлементов
у растений гороха, пшеницы, яблони и других культур высокая
г?1—I»-
1111
1111
. I I I 1
1111
16 18 20 22 2Ь 28 28 30 О П 16 18 20 22 2<+ 26 28 30
Дни после всходод
Рис. 44. Динамика фотосинтетических параметров в ходе старения второго листа
пшеницы (по Р. Сашр, 1982):
/ — транспорт электронов; 2 — содержание хлорофилла; 3 — интенсивность фотосинтеза;
4 — РБФ-карбоксилаза; 5 — водорастворимый белок
132
и
о
(00
0,15
%№
0,25
* • #
Ч*:\
ч.
25 50 75 100
Дни после Всходов
5
125
ИФ отмечена у листьев, обес- ^ 120
печивающих прежде всего §
рост и развитие плодов. 11~Е^
Накопление углеводов. В =з ^
многочисленных эксперимен- ^ ^ ВО
тах повышенная концентра- з^
ция сахарозы или крахмала в Й ^ 30
листе рассматривалась как В
один из важных факторов,
обусловливающих снижение
ИФ. Однако в последние годы
появились данные, которые
не позволяют однозначно
интерпретировать влияние
высокой концентрации углеводов
на фотосинтез листа. Так, в
опытах Г. Торн и Н. Коллер
(1974) на сое полностью были
затенены бобы, стебли,
листья, за исключением одного
листа, чтобы усилить
фотосинтез последнего. Через
неделю после затенения ИФ
возросла на 50 %,
одновременно резко увеличилась ме-
зофильная проводимость при
неизменной проводимости
устьиц, снизилось содержание крахмала, увеличилось содержание
сахарозы и РДФК в донорном листе. Таким образом, множество
параметров могли влиять на повышение фотосинтеза, в том
числе вещества гормональной природы, которые в данном случае
не были идентифицированы. Поэтому увязывать высокую ИФ
только с низким содержанием крахмала в донорном листе или
наоборот нет оснований, хотя избыточная концентрация
крахмала, по данным А. Т. Мокроносова (1982), может вызвать
серьезные нарушения фотосинтетических процессов.
Возраст листа (растения). ИФ, как правило, быстро возрастает
в период интенсивного роста листовой пластинки, достигая
наибольших значений у завершившего рост листа. Затем начинается
постепенное снижение ИФ, которое обусловлено параллельным
уменьшением проводимости устьиц и мезофилла для молекул
СО2- Одной из причин снижения МП является уменьшение
содержания хлорофилла в результате деградации хлоропластов по
мере старения листа (рис. 44). Скорость транспорта электронов
по ЭТЦ и активность ключевого фермента фотосинтеза РДФК,
снижаясь одновременно с содержанием хлорофилла, тесно
коррелируют с ним. Следовательно, снижение скорости реакций ни
133
Рис. 45. Скорость газообмена (а) и
коэффициент эффективности роста (КЭР)
(б) в онтогенезе посева пшеницы (по
Р. СеЬгаий, 1982):
/ — фотосинтез; 2 — дыхание
световой, ни темновой фазы в отдельности не может определять
уменьшение фотосинтеза в ходе старения листа.
ИФ целого растения или участка посева достигает максимума
в фазе цветения—бутонизации и затем постепенно снижается,
достигая наименьших значений перед созреванием
репродуктивного органа (рис. 45). Подобный колоколообразный ход ИФ
объясняется формированием определенного индекса листовой
поверхности (ИЛП) в онтогенезе растения в посеве. При
определенном значении ИЛП, специфичном для каждой культуры,
относительное постоянство ИФ растения будет поддерживаться на
постоянном уровне до тех пор, пока старение и отмирание
старых листьев компенсируются вновь образующимся листовым
аппаратом. Вслед за прекращением роста листьев начинается
снижение ИФ посева в результате уменьшения площади листьев и
увеличения вклада дыхания в суммарный СО2 обмен посева по
мере формирования репродуктивного органа.
2.9. ЗАВИСИМОСТЬ ФОТОСИНТЕЗА
ОТ ФАКТОРОВ ВНЕШНЕЙ СРЕДЫ
Интенсивность света. Непосредственно в ходе процесса
фотосинтеза используется лишь 1—3 % поглощенной солнечной
энергии (ФАР), измеряемой в соответствии с международными
системами единиц в мкмоль фотонов/(м2-с). На дневном солнечном
свету в безоблачный день 1 мкмоль/(м2-с) ФАР = 0,22 Вт/м2 =
= 0,32 • 10~3 кал/(см2мин) при условии, что ФАР составляет
42 % общей радиации. Что касается общей радиации, то 1 кило-
люкс (клк) = 10 Вт/м2 = 14,3 • 10~3 кал/(см2мин).
Ответная реакция фотосинтеза на поток фотонов выражается
световой кривой по типу параболы, состоящей из двух фаз
(рис. 46). Первая фаза представляет собой линейную
зависимость интенсивности фотосинтеза от потока квантов со
световым компенсационным пунктом (СКП) в точке пересечения
линии указанной зависимости с осью х. Вторая фаза —
постепенное уменьшение наклона кривой по мере возрастания потока
квантов и ее выход на плато, когда ИФ максимальна при ее
насыщении светом. В линейной фазе световой кривой ИФ
ограничивается активностью РДФ-карбоксилазы, а на плато
фотосинтеза — скоростью регенерации РДФ.
Фотосинтез у большинства культурных Сз-растений
насыщается при освещенностях значительно ниже, чем полный солнечный
свет, равный 2200 мкмоль/(м2-с). Однако в посевах с высоким
листовым индексом многие листья находятся в условиях
недостаточного освещения из-за взаимного затенения. В результате у
посевов в отличие от листьев линейная фаза световой кривой
длится гораздо дольше и светового насыщения видимого фото-
134
-10
20 АО 60 80
Освещенность,
% от полной солнечной
синтеза не наблюдается. Не
установлено светового насыщения
фотоассимиляции СОг листьями
и у С4-ВИД0В. Максимальный
фотосинтез у С4-растений оказался
значительно выше, чем у Сз-
видов, при нормальной
температуре (рис. 47) и был равен или
ниже при низких положительных
температурах. Максимальный
фотосинтез сильно различается как
между Сз- и С4-типом
фотосинтеза, так и в пределах каждого
типа метаболизма углерода. Так, у
травянистых С4-растений он
колебался в пределах 32—66 мкмоль
СО2/(м2-с). Сорта
сельскохозяйственных культур (пшеница,
кукуруза, хлопчатник и др.), не
различаясь достоверно по
интенсивности текущего фотосинтеза,
имели разный максимальный
фотосинтез. Кроме текущего и максимального различают
потенциальный фотосинтез, т. е. ассимиляцию СО2 при насыщающей
освещенности и концентрации СО2-С4-растения, как правило,
превосходят Сз-виды по этому показателю.
Радиация, соответствующая точке изгиба световой кривой,
названа X. Г. Тоомингом (1977) радиацией приспособления
(РП). КПД фотосинтеза при РП достигает максимальных значе-
25...35-С
Рис. 46. Идеализированные
световые кривые фотосинтеза различных
видов:
А — кукуруза, сорго, сахарный тростник;
В— соя, хлопчатник, люцерна; В —
табак, клевер луговой, ежа сборная; 1 —
комнатные растения
15 20 25 30 35
Температура,"С
а
Облученность
6
Рис 47. Типичные кривые температурной зависимости фотоассимиляции СОг, Сз;
и С4-растений (а) и световые кривые фотосинтеза Сз- и С^растении при разной
температуре (б). Стрелкой показана максимальная солнечная радиация (по Ь. ьа-
гагаз и Б. \Уа1кег, 1983)
135
ний. Сорта с меньшей РП предпочтительнее, чем сорта с
высокой РП, в посевах с высоким индексом листовой поверхности.
По мнению Ю. Л. Цельникер (1982), диапазон интенсивнос-
тей света при выращивании растений можно разбить на два
участка — физиологический и стрессовый (недостаток или
избыток света). В пределах первого процесс адаптации направлен на
сохранение состояния гомеостаза в отношении прироста
органического вещества при изменении прихода ФАР. Это достигается
за счет того, что теневые листья, имея большую в сравнении со
световыми поверхность, используют ФАР на фотосинтез с более
высоким КПД. Действительно, при умеренном свете (10—50 %
среднедневной интенсивности) образуются наиболее крупные
листья с большими размерами клеток. В результате у листа
теневой структуры внутренняя поверхность клеток превышает
поверхность листа в 16—20 раз, а у светового листа — в 40—65 раз.
Количество фан, тилакоидов в гранах и межгранных ламелл
наиболее высокое у крупных теневых хлоропластов и меньшее —
у световых. Число хлоропластов, приходящихся на единицу
поверхности листа, а также соотношение хлорофиллов а : Ь,
напротив, значительно выше у светового листа. Повышение
интенсивности света в диапазоне слабого освещения ведет к увеличению
хлоропластов, но число их в клетке не меняется. По достижении
пороговой интенсивности размеры хлоропластов становятся
максимальными. Дальнейшее увеличение интенсивности света при
выращивании растений способствует увеличению числа
хлоропластов в клетке и уменьшению их размеров. Для
продуктивности растений наименее благоприятна периодичность смены
интенсивности света в 1—10 мин, тогда как периодичность смены
в долях секунды, например мелькание бликов в посеве,
повышает продуктивность.
В стрессовом диапазоне ФАР, например, около СКП
фотосинтетическая продуктивность будет меньше расхода
органического вещества, используемого на дыхание за сутки. В этом
режиме растения не смогут длительно существовать даже в условиях
одиночного выращивания. При освещенности ниже СКП
наблюдается высокое дыхание растений в результате переключения с
фотофосфорилирования на окислительное фосфорилирование
для синтеза энергетических эквивалентов. Интересными
представляются попытки вести отбор форм культурных растений в
посеве на низкую величину СКП, коррелирующую с
устойчивостью растений к высокой плотности посева. Подобный отбор
возможен даже среди С^-культур — облигатных светолюбов,
имеющих, как правило, более высокие в сравнении с Сз-расте-
ниями значения СКП.
; Спектральный состав света. ИФ сильно зависит от качества
ёвета. Поскольку максимумы поглощения хлорофиллом квантов
света находятся в синей и красной областях спектра, рассмотрим
136
1
влияние именно этих лучей на фотосинтез и его составляющие.
Согласно квантовой теории 1 Дж красных лучей содержит в 1,5
раза больше квантов, чем 1 Дж сине-фиолетовых лучей. При
выравнивании синего и красного света по падающим квантам
ИФ оказывается выше на красном свету (КС), чем на синем
(СС) и белом (БС). Однако на насыщающем свету преимущество
переходит к СС. У растений, выращенных на СС, насыщение
фотосинтеза происходит при более высокой освещенности и они
эффективнее используют более мощные лучистые потоки, чем
растения, выращенные на КС.
Качество света не влияет на число и размеры хлоропластов в
завершившем рост листе, поэтому различия по ИФ обусловлены
главным образом активностью единичного хлоропласта, которая
выше у растений на СС. Это объясняется тем, что СС
активирует деятельность белоксинтезирующей системы клетки и
хлоропласта, значительно повышая активность РДФ- и ФЭП-карбок-
силазы. Кроме того, скорость транспорта электронов и
фотофосфорилирования также выше на СС,, чем на КС и БС, что
является необходимым энергетическим условием активного
фотосинтеза. В основе подобной реакции листа на качество света
лежит изменение его гормонального статуса. КС положительно
влияет на содержание и состав гиббереллинов и цитокининов, а
СС — цитокининов.
Выращивание на СС стимулирует включение продуктов
фотосинтеза в белки и липиды, а на КС — растворимые углеводы и
крахмал. Эти различия отмечены у Сз~ и С4-растений, одно- и
двудольных растений в широком диапазоне концентраций СОг и
интенсивностей света. Эффект добавления даже 20 % синего
света к красному подобен эффекту монохроматического СС. Это
явление можно использовать в теплицах, где применяют
искусственные источники освещения. Так, лампа ДРИ-2000-6 с
высокой долей сине-фиолетовых лучей в спектре значительно
активирует фотосинтез и накопление биомассы у кукурузы. Однако
реакция растений, особенно закрытого грунта, на качество света
видо- и даже сортоспецифична, что следует учитывать при
подборе необходимых источников облучения в теплицах.
Концентрация СОг и Ог- С середины прошлого века по
настоящее время концентрация СОг в атмосфере возросла с 0,029 до
0,033 %, и при сохранении темпов прироста к 2025 г. она может
удвоиться. Зависимость ИФ от концентрации СОг в воздухе
выражается углекислотной кривой фотосинтеза, имеющей вид
прямоугольной гиперболы для С4-растений и
непрямоугольной — для Сз-растений. Углекислотное насыщение фотосинтеза
у С4-растений, имеющих механизм концентрирования СОг,
происходит при содержании двуокиси углерода, близком к
естественному. Его дальнейшее повышение, как правило, не
увеличивает ИФ в отличие от Сз-видов, у которых ИФ значительно
137
возрастает. В результате Сз-виды, уступая С4-видам по ИФ в
нормальных условиях, превосходят их при высокой
концентрации СОг, например при 0,1 %.
Углекислотный компенсационный пункт (УКП) или
концентрация СОг, ПРИ которой фотосинтез и дыхание листа
уравновешивают друг друга, значительно ниже для С4- (0,0005 %), чем
для Сз-видов (0,005 %). Поэтому при совместном выращивании
в замкнутом объеме в результате постепенного снижения
содержания СОг Сз-растения погибают раньше, чем С4-растения. Это
объясняется более высоким сродством ФЭП-карбоксилазы,
первичного карбоксилирующего фермента у С4-растений, к
субстрату (СОг), чем РДФ-карбоксилазы у Сз-растений. Этот подход
может оказаться весьма полезным в селекции при отборе линий
и форм сельскохозяйственных культур с низким УКП,
способных «выедать» из воздуха минимальные концентрации СОг.
С увеличением концентрации Ог выше атмосферной ИФ
подавляется в результате активации фотодыхания (рис. 48), а при
снижении содержания кислорода, наоборот, ИФ возрастает.
Измерение скорости видимого фотосинтеза при нормальном
содержании СОг и Ог и при 3 % Ог часто используют для оценки
скорости фотодыхания.
Наиболее однозначной реакцией растений на длительное
выращивание при повышенной концентрации СОг являются
увеличение площади листьев, уменьшение листовой обеспеченности
биомассы, возрастание чистой продуктивности фотосинтеза
(ЧПФ). Это сопровождается существенной структурной и
функциональной перестройкой фотосинтетического аппарата:
увеличением толщины листовых пластинок за счет возрастания
размеров клеток столбчатой и губчатой паренхимы, снижением
содержания хлорофилла, а также отношения хлорофилла а к
хлорофиллу Ь.
Существенное увеличение ИФ обусловлено в основном
увеличением проводимости мезофилла, активности
РДФ-карбоксилазы и снижением УКП. Однако
длительное (несколько недель)
выращивание растений в
атмосфере повышенной
концентрации СОг снижало
эффект этого приема, что
выражалось в ингибировании
фотосинтеза. Размеры как
начальной стимуляции
фотосинтеза, так и последующего его
подавления носят сортоспеци-
фический характер. Так,
недетерминированные сорта сои с
большим числом точек роста
60
50
!*-»
■1%0о
ЮО 200 300 Ш 500
Концентрация С02, п 0.
Рис. 48. Скорость газообмена сои при
различающихся концентрациях СО? и
О2 (по \У. НМг, 1978)
138
лучше реагируют на повышение содержания СО2, чем
детерминированные. Эффект повышенной концентрации СО2
увеличивается также при низкой освещенности, например в теплицах
зимой. Это объясняется снижением СКП, что увеличивает
период чистого накопления углерода, особенно для самых нижних
листьев в посеве. Кроме того, при недостатке света в растении
возникает повышенный спрос на ассимиляты, что
удовлетворяется за счет усиления фотосинтеза при увеличении
концентрации СОг-
Бобовые культуры наиболее отзывчивы на обогащение
атмосферы СОг, особенно при достаточной облученности. Это
объясняется тем, что симбиотическая азотфиксация перехватывает
значительное количество ассимилятов, предназначенных для
ростовых процессов. В условиях постепенного иссушения почвы
и повышенной концентрации СОг среди 13 Сз-видов
наибольшее увеличение площади листьев отмечено у люцерны (в 1,75
раза) и пшеницы (в 1,68 раза), наименьшее — у клевера
ползучего (в 1,36 раза), имеющего строго детерминированный рост, и
С4-ВИД0В (кукурузы, сорго и амаранта).
Разная реакция Сз- и С4-ВИД0В на повышенную
концентрацию СОг исключительно важна для их конкурентоспособности в
агрофитоценозах. Так, в искусственном ценозе Сз-растения сои
при обогащении СОг превосходили С4-сорняк 8ог§пшп пакрепзе
Ь. по накоплению биомассы, но уступали ему при нормальной
концентрации СОг- При повышении содержания СОг в
атмосфере меняется также характер конкуренции между Сз-видами в
ценозе. Так, клевер, уступающий райграсу в травосмеси по
накоплению биомассы в нормальных условиях, значительно
опережал его при обогащении СОг-
Однако наиболее пристального внимания заслуживает
конкуренция Сз- и С4-культурных и сорных растений в посеве при
повышенном содержании СОг- Среди 15 наиболее важных
сельскохозяйственных культур 12 относятся к растениям с Сз-цик-
лом. С другой стороны, 14 из 18 наиболее злостных сорняков в
мире представлено С4-видами. Среди них свинорой, сыть
округлая, гумай, куриное просо, щетинник и др. В то же время 19 из
38 типичных сорняков кукурузы — С4-вида — имеют Сз-цикл
метаболизма углерода.
Несмотря на то что прямой физиологический эффект
обогащения СОг благоприятствует больше Сз-культурным
растениям, учет взаимодействия основных факторов в конечном итоге
может дать преимущество посевам С4-культур, особенно если
принять во внимание повышение температуры и увеличение
вероятности наступления засухи при повышении содержания
СОг в атмосфере. "В этих условиях конкурентное равновесие
между Сз-культурными растениями и Сз-сорняками в посеве,
а также между С4-сельскохозяйственными культурами и С4-со-
139
рняками может сдвинуться в сторону сорных растений
вследствие лучшей адаптации последних к неблагоприятным
условиям выращивания и снижения эффективности использования
гербицидов.
Известно, что температура, влажность почвы и воздуха могут
существенно влиять на действие гербицидов. Антитранспирант-
ное действие высокой концентрации СО2 тормозит поглощение
корнями, дальний транспорт и последующую метаболизацию
системных гербицидов, внесенных в почву, а изменения в
анатомии и поверхности листьев (опушенность, восковой налет и др.)
снижают некорневое поглощение гербицидов листьями при
опрыскивании посевов и. создают опасность повреждения
культурных растений. Химическая борьба с сорняками, особенно
многолетними, затрудняется также из-за формирования мощной
корневой системы в результате перераспределения большей доли
ассимилятов к корням в условиях повышенной концентрации
СС>2. Таким образом, повышение устойчивости к
неблагоприятным факторам среды, изменение структуры и видового состава
агрофитоценозов в результате конкуренции, выведение сортов,
адаптированных к высоким концентрациям СО2, производство
новых гербицидов — все это необходимо принимать во внимание
при разработке технологии в условиях постепенного повышения
концентрации СОг в атмосфере.
Температура. Влияние температуры на фотосинтез бывает
обратимым и необратимым. В
первом случае указанное влияние не
выходит за пределы устойчивости
отдельных звеньев фотосинтеза,
определяемых генотипом и
предысторией формирования
листа. Для большинства
растений обратимое влияние на
фотосинтез наблюдается в
диапазоне температур от 5 до 35 °С
(рис. 49), где скорость реакций
световой фазы независима от
температуры, а скорость реакций
темновой фазы, напротив,
отличается высокой температурной
чувствительностью с бю 2—3.
При температурах за пределами
устойчивости физиологических
систем листа наблюдается
необратимая потеря
фотосинтетической активности. В этом случае
скорость некоторых реакций,
например синтеза АТФ и НАДФН
~20 30
Температура, °С
Рис. 49. Зависимость фотосинтеза и
дыхания листьев пшеницы от
температуры (по Р. Сапшег, 1985):
/ — истинный фотосинтез; 2 —
видимый фотосинтез; 3— дыхание
140
в мембранах хлоропластов, снижается и становится
лимитирующей.
Зависимость активности отдельных звеньев фотосинтеза от
температуры определяется условиями выращивания. Так, при
повышенной концентрации СО2 более резко проявляется
температурная зависимость активности РДФ-карбоксилазы, а
фотодыхание сильно подавлено. Температурный оптимум фотосинтеза
зависит также от уровня радиации при выращивании: с
уменьшением освещенности снижается температурный оптимум
фотосинтеза.
Температурная зависимость С3- и С^-цикла метаболизма
углерода существенно различается, ^-растения, например кукуруза,
способны поддерживать более высокую скорость фотосинтеза
при повышенной температуре, чем пшеница (Сз-растение).
Вместе с тем Сз- и С^-растения, произрастающие в теплом
климате, имеют более высокий температурный оптимум, и их
фотосинтез не очень сильно ингибируется при повышенных
температурах по сравнению с фотосинтезом видов, адаптированных к
холоду.
При низкой температуре виды, адаптированные к холоду,
наоборот, имеют более высокую скорость поглощения СО2, чем те
же виды, адаптированные к теплу. Это объясняется тем, что
виды, адаптированные к холоду, содержат больше растворимых
ферментов и компонентов мембран, катализирующих важные
реакции метаболизма углерода. Так, у кукурузы по сравнению с
пшеницей при субоптимальных температурах фотосинтез
сильнее лимитируется недостаточной активностью
РДФ-карбоксилазы. Свойства определенных компонентов хлоропластов также
оказывают влияние на диапазон устойчивости
фотосинтетического процесса. Так, температуры выше температурного
максимума фотосинтеза влияют на организацию мембранных белков
хлоропластов (хлорофилл-белковые комплексы, белки реакционных
центров и система выделения кислорода), входящих в ФСП. При
этом флюоресценция хлорофилла резко возрастает в результате
нарушения связей между хлорофилл-белковыми комплексами и
фотохимическими центрами ФСИ. Изменение флюоресценции
используют в качестве быстрого способа выявления различий в
устойчивости растений к тепловому стрессу.
В отличие от действия высокой температуры нарушения
фотосинтетических процессов в листьях при низких температурах
обычно происходят лишь после длительного воздействия.
Понижение температуры в сочетании с ярким освещением
оказывает более негативное действие, чем одно только понижение
температуры. Это можно объяснить нарушением встраивания
хлорофилла в мембрану хлоропласта, различием в действии этих
температур на скорости реакций, ответственных за синтез ком-
141
понентов мембран. Среди последних важное место занимает
повышение вязкости мембран.
Водный режим. Несмотря на то что при фотосинтезе
используется лишь около 1 % поглощенной воды, дефицит последней
сильно влияет на фотосинтез. Закрытие устьиц в результате
водного дефицита вызывает снижение транспирации и поглощения
СС>2 листьями. Последнее объясняется наряду с повышением
устьичного сопротивления и снижением содержания хлорофилла
тем, что водный дефицит может непосредственно изменять
эффективность отдельных звеньев фотосинтеза. Так, транспорт
электронов и фотофосфорилирование в листьях подсолнечника,
не испытывавшего ранее водного стресса, ингибируется при
давлении примерно —1,1 МПа и снижается до нуля при —1,7 МПа.
Потеря способности к фотофосфорилированию связана с
разобщением транспорта электронов и фосфорилирования в связи с
изменением конформации тилакоидных мембран и
непосредственно сопрягающего фактора. В результате нарушается
сопряжение скоростей транспорта электронов и ассимиляции СО2-
Одновременно ингибируется активность РДФ-карбоксилазы.
Прямое отрицательное действие водного стресса на скорость
световых, темновых реакций и на ИФ в целом может быть
опосредовано влиянием фитогормонов. Если абсцизовая кислота
вызывает закрывание устьиц, то цитокинины, наоборот,
обусловливают их открывание, а также активируют фотосинтез путем
стимулирования синтеза хлорофилла и ферментов. Снижение
поступления цитокининов из корней в листья при водном
дефиците снимает стимулирующие эффекты.
Реакция фотосинтеза на снижение влагообеспеченности
строго видо- и сортоспецифична и обусловлена засухоустойчивостью
объекта. Например, активность РДФ-карбоксилазы в листьях
пшеницы и ячменя при уменьшении водного потенциала до
—3,3 МПа снижалась в 2 раза, что заметнее, чем у фасоли. Сорт
кукурузы старой селекции Воронежская 47, отличающийся
засухоустойчивостью, имел более высокую активность РДФ- и ФЭП-
карбоксилазы при дефиците влаги, чем гибрид современной
селекции КВС 701.
Фотодыхание, хотя и снижается по мере усиления водного
дефицита, менее чувствительно к водному стрессу, чем
ассимиляция СОг- В результате, как показал Дж. Бойер (1970), на целом
ряде культур отношение скорости фотодыхания к скорости
истинной ассимиляции СО2 увеличивается по мере снижения
водного потенциала. Это обусловливает повышение межклеточной
концентрации СО2 и углекислотного компенсационного пункта,
что свидетельствует о снижении видимого фотосинтеза. В
данном случае фотодыхание используется как клапан для сброса
избыточной фотохимической энергии, не полностью
используемой в цикле Кальвина в результате его подавления. Если бы у
142
Сз-растений фотодыхание было сопряжено с генерацией
энергии, то выигрыш в сухой массе перевешивался бы потерей этой
защиты. У С4-растений, обладающих незначительным
фотодыханием, в качестве потребителя избыточной фотохимической
энергии может служить обмен метаболитами между клетками
мезофилла и обкладкой проводящих пучков.
В основе регуляторной системы, координирующей
фотосинтетическую способность листа и устьичную проводимость при
дефиците влаги, лежит принцип компромисса между ассимиляцией
СОг и испарением воды. Основная роль устьиц в этом процессе
состоит в том, чтобы поддерживать такую межклеточную
концентрацию СОг, которая обеспечила бы фотосинтез в зоне изгиба
углекислотной кривой фотосинтеза. Именно в этой зоне
достигается максимальная эффективность транспирируемой воды, т. е.
на каждый грамм воды поглощается максимально возможное
количество СОг. При этом устьица регулируют свою открытость
таким образом, чтобы поддерживать соотношение межклеточной
и атмосферной концентрации СОг относительно постоянным
(0,6—0,7 и 0,3—0,4 для С4- и Сз-растений соответственно).
Реакция фотосинтеза на дефицит влаги зависит от множества
сопутствующих факторов: возраста листа, донорно-акцепторных
отношений, предыдущих условий и скорости наступления
стресса. Фотосинтез листа наиболее чувствителен к дефициту влаги,
как правило, в период роста. С завершением роста и по мере
постепенного старения листа устойчивость ассимиляции СОг
возрастает. Последняя прямо коррелирует с напряженностью
донорно-акцепторных отношений. Так, например, чем больше
плодов на растении томата, тем устойчивее к дефициту влаги
фотосинтез листьев, непосредственно обеспечивающих плоды
ассимилятами. Устойчивость фотосинтеза к водному стрессу
повышается с увеличением концентрации СОг в воздухе и при
пдвторном наступлении стресса. Это следует учитывать в
современных технологиях в связи с постепенным повышением
концентрации СОг в атмосфере.
Чувствительность ассимиляции СОг к недостатку влаги
сказывается также на дневном ходе фотосинтеза. При оптимальном
водоснабжении ИФ в течение дня, как правило, достигает
максимума в полдень, следуя за ходом радиации, а затем постепенно
снижается. Дефицит влаги вызывает дневную депрессию
фотосинтеза и при этом тем глубже и раньше, чем сильнее недостаток
влага, испытываемый растениями, и ниже засухоустойчивость
вида. Степень и длительность полуденной депрессии
фотосинтеза часто используют для диагностики засухоустойчивости сортов
сельскохозяйственных культур.
Минеральное питание. Элементы минерального питания (14,
Р, К, Ре и др.) могут- влиять на ИФ прямо или косвенно, через
обмен веществ и рост. Прямое действие на фотосинтез связано с
143
тем, что минеральные вещества входят в состав ферментов и
пигментов или непосредственно участвуют в процессе
фотосинтеза в качестве активаторов. Например, марганец служит
активатором фотолиза, калий имеет отношение к переносу протонов
через мембраны тилакоидов, железо, кобальт, медь содержатся в
различных ферментах, фосфат — в нуклеотидах.
Недостаток минеральных веществ или нарушенное
соотношение между поглощаемыми элементами может повлиять на
содержание хлорофилла и на число, размеры и ультраструктуру хлоро-
пластов, даже если данные элементы не входят в состав
молекулы хлорофилла, как, например, железо. При недостатке железа
возникают хлорозы, приводящие к тому, что поглощение СОг,
например у сахарной свеклы, снижается более чем втрое.
Аналогичные прследствия наблюдаются и при недостатке магния. При
хлорозе растения ведут себя как типично теневые и не могут
использовать интенсивный свет; сильно сокращается также
продолжительность жизни листьев, они, как правило, бывают
мелкими.
Особое место среди элементов питания занимает азот. До
65 % белка находится в хлоропластах, в том числе около 50 % в
РДФ-карбоксилазе. Азот влияет на размеры и ультраструктуру
хлоропластов, усиливая их гранальность; повышает содержание
белков — переносчиков ЭТЦ фотосинтеза, увеличивает ИФ и
КПД ФАР. Низкая ИФ листьев при дефиците азота обусловлена
главным образом повышением сопротивления мезофилла потоку
СС>2 вследствие недостаточной активности РДФ-карбоксилазы и
снижения скорости регенерации РДФ.
В нормальных условиях питания количество данного
фермента в листе избыточно, в результате чего ИФ нередко не реагирует
на дополнительное внесение азотных удобрений, несмотря на
увеличение количества хлорофилла и РДФ-карбоксилазы. Это
объясняется тем, что часть молекул фермента может быть
неактивна и служит лишь в качестве буфера для компенсации
отрицательного влияния возможного дефицита азота на фотосинтез.
По данным Г. Ламберса с сотрудниками (1989),
эффективность использования азота (ЭИА), измеряемая количеством СОг,
поглощенным единицей массы азота за единицу времени,
увеличивается с повышением содержания N в листе до 2—2,5 %. По
мере дальнейшего его повышения ЭИА постепенно снижается.
ЭИА у С4-ВИД0В выше, чем у Сз-видов, что объясняется более
высокой удельной активностью ФЭП-карбоксилазы С^растений
по сравнению с РДФ-карбоксилазой Сз-растений. Высокие
величины ЭИА у С4-растений дают им преимущество над Сз-вида-
ми при конкуренции на низком агрофоне и при высокой
температуре. Это следует учитывать при планировании мер борьбы с
сорняками в посеве, поскольку многие из злостных сорняков
имеют С4-ЦИЮ1 метаболизма углерода.
144
Однако роль азота не ограничивается его влиянием только на
формирование фотосинтетического аппарата и
функционирование отдельных его звеньев. Активный метаболизм азота в
листе — основа лабильности фотосинтетического аппарата, т. е.
его успешной адаптации к быстрым изменениям освещенности и
других факторов внешней среды (рис. 50). Именно это присуще
современным высокопродуктивным сортам, что позволяет им
при более активном по сравнению со старыми сортами росте
достичь высокой продуктивности.
При недостатке фосфора сопротивление мезофилла
поглощению СОг листьями пшеницы и хлопчатника увеличивалось
задолго до появления устьичных эффектов. При этом особенно
сильно подавлялась скорость световых реакций фотосинтеза, что
значительно ингибировало фотоассимиляцию СОг.
Важная роль калия в функционировании замыкающих клеток
устьиц хорошо известна. У люцерны и сахарной свеклы при
недостатке калия увеличивается сначала мезофильное
сопротивление поглощению СОг, а затем устьичное. Основную роль в
снижении фотосинтеза при недостатке калия играет ингибирова-
ние карбоксилазной активности, но не лимитирование
транспорта электронов.
Болезни растений. Грибные патогены, такие, как ржавчина и
мучнистая роса, не приводят к быстрой гибели
растения-хозяина, так как их развитие возможно только на живой ткани. ИФ
больных растений зерновых культур значительно ниже по
сравнению со здоровыми (рис. 51). Это объясняется скорее
нарушением структуры фотосинтетического аппарата, чем реакцией
устьиц. Так, на фоне
незначительного увеличения устьичного
сопротивления листьев овса и ячменя,
пораженных ржавчиной, особенно
заметно резкое падение числа
хлоропластов на единицу площади
листа, объема хлоропласта,
концентрации хлорофилла и
соотношения хлорофиллов а \\ Ь ъ
пределах отдельной пустулы.
Нарушения пигментного
аппарата патогеном, в свою очередь,
блокируют нециклический
транспорт электронов и процессы фото-
фосфорилирования, что
обусловлено нарушением функционирования
отдельных компонентов ЭТЦ, в
частности снижением количества
цитохромов. Аналогичная
тенденция наблюдалась также на листьях
14
-2
Рис. 50. Световая кривая
фотосинтеза листьев райграса на
высоком (/) и низком (2) фоне азота
(по М. КоЬзоп, А. Рагеоп, 1978)
145
сахарной свеклы, пораженных
мучнистой росой, и конских бобов,
инфицированных ржавчиной.
Одновременно происходило резкое
снижение как количества, так и
активности РДФ-карбоксилазы,
связанное с нарушением
метаболизма нуклеиновых кислот в хлоро-
пластах.
Отрицательное влияние
бактериальных инфекций на фотосинтез
связано прежде всего с
интенсивным разрушением структуры
хлоропласта, что обусловлено активным
выделением бактериями токсинов в
ткань растения-хозяина. Например,
табтоксин, образуемый Рзеиёо-
топаз 1аЬас1, подавляет активность
РДФ-карбоксилазы в листьях
табака. Б. Буханан с сотрудниками
(1981) выделил два типа влияний
вирусов на фотосинтез. В первом
случае, как на тыкве, вирусная
инфекция снижает число хлороплас-
тов, но оказывает незначительное
влияние на ИФ; во втором, как на
китайской капусте, — резко
подавляет фотофосфорилирование и
фотосинтез, не оказывая заметного
влияния на мезоструктуру листа.
Следует заметить, что реакция
фотодыхания определяется спецификой взаимодействия патогена и
растения-хозяина: отмечено как снижение, так и увеличение
скорости фотодыхания.
Взаимодействие факторов при фотосинтезе. В естественных
условиях факторы внешней среды действуют совместно. Поэтому
газообмен растения отражает взаимодействие всех внутренних и
внешних факторов. Согласно концепции лимитирующих
факторов Г. Блэкмана (1962), ИФ лимитируется тем фактором или
процессом, который в данных условиях протекает с наименьшей
скоростью, однако некоторое влияние оказывают и остальные
факторы. Например, с повышением освещенности оптимальная
и максимальная температуры видимого фотосинтеза повышаются
на несколько градусов. Для растений это выгодно, так как
сильное освещение всегда связано с нагревом листа. Если оно в
конце концов приводит к перегреву (или к затруднению
водоснабжения), то свет уже перестает быть фактором, определяю-
146
1+56 7
Дни. после заражения
Рис. 51. Влияние заражения
листьев ячменя мучнистой росой на
нетто-фотосинтез (Р„), дыхание
(К) и фотодыхание (Г).
Контроль — неокрашенные символы
(по Р. С. Аугез, 1979)
щим фотосинтез, и ИФ снижается. Поэтому в естественных
условиях в дневных ходах фотосинтеза получаются не кривые
светового насыщения, как в лабораторных опытах, а кривые с
оптимумом.
Аналогичным образом взаимодействуют свет и СОг- При
повышении концентрации последнего радиация, при которой КПД
фотосинтеза достигает максимума, также должна увеличиться,
что следует иметь в виду при обогащении воздуха СО2 в
теплицах в зимний период. Хотя концепция лимитирующих факторов
полезна в качестве первого приближения к решению вопроса, в
природе обычно наблюдается взаимодействие факторов среды,
не учитываемое этой концепцией. Например, стрессовые
факторы (засуха, жара или холод) в сочетании с варьирующей
концентрацией СО2 и О2 могут'влиять на скорость фотосинтеза при
интенсивностях света, сильно лимитирующих фотосинтез. Это
явно противоречит теории лимитирующих факторов, так как в
данном случае.фотосинтез уже сильно ограничен светом.
Подобный тип взаимодействия можно понять, принимая во внимание,
что ИФ при лимитирующей освещенности определяется не
только пропускной способностью самого медленного этапа, но и его
эффективностью.
2.10. ПОСЕВЫ И НАСАЖДЕНИЯ
КАК Ф0Т0СИНТЕЗИРУЮЩИЕ СИСТЕМЫ
2.10.1. ИНДЕКС ЛИСТОВОЙ ПОВЕРХНОСТИ (ИЛП)
Различают критическое и оптимальное значения ИЛП.
Первое характеризует минимальную величину ИЛП, при которой
поглощается максимально возможное в данных условиях (90—
95 %) количество падающей радиации (рис. 52) и достигается
наибольшая скорость накопления биомассы (рис. 53). Однако
после достижения критического значения ИЛП дальнейшее
увеличение площади листьев не приводит к существенному
увеличению скорости роста посева (СРП), а в посевах,
характеризующихся формированием оптимального ИЛП, она даже снижается.
Таким образом, зависимость скорости накопления биомассы
посева от ИЛП в первом случае характеризуется параболой с
выходом на плато при критическом значении ИЛП, а во втором —
колоколообразной кривой с максимумом при оптимальном
значении ИЛП.
Критическое значение ИЛП, равное 4—7, характерно для
посевов зерновых, зернобобовых культур, сахарной свеклы и
других, причем более высокие значения отмечены для посевов с
эректоидным расположением верхних листьев в благоприятных
147
ИЛП
Рис. 52. Поглощение ФАР посевами картофеля при разном ИЛП (по 8. КЬигапа
и 3. Мс.1лгеп, 1982)
20 «7 60 80 100 120
после Всходов
Рис. 53. Связь между ИЛП,
поглощенной радиацией и скоростью роста
посева в онтогенезе растений:
/ — поглощенная радиация; 2 — индекс
листовой поверхности (ИЛП); 3 — чистая
продуктивность фотосинтеза (ЧПФ); 4—
скорость роста посева (СРП); 5— накопленная
биомасса
148
условиях выращивания.
Оптимальный ИЛП достигается
в посевах капусты кормовой,
некоторых трав.
Основной причиной
различной зависимости скорости
накопления биомассы в
посеве от ИЛП в указанных
случаях являются особенности
изменения дыхания посевов
по мере увеличения площади
листьев. В первом случае оно
увеличивается только до
определенного значения ИЛП,
равного критическому, а
затем, как и видимый
фотосинтез посева, выходит на
плато. Во втором случае
дыхание возрастает по мере
увеличения листового индекса
линейно.
При хороших условиях
выращивания величина
оптимального ИЛП того или иного
сорта определяется его
приспособленностью к режиму
VI VII VIII IX
Рис. 54. Сезонный ход
среднедневной радиации и ИЛП посевов
картофеля (по 5. МоогЬу и N. МИ-
(Ьогре, 1975):
1 — среднедневная радиация; 2 — ИЛП
ФАР данной территории. Если
формирование оптимального
значения ИЛП совпадает по времени
с максимальными значениями
приходящей на посев ФАР,
достигается наивысшая
фотосинтетическая продуктивность и
эффективность использования ФАР. В
противном случае значительное
количество солнечной энергии
расходуется неэффективно
(рис. 54). Поскольку при этом
формирование урожая
лимитируется каким-либо фактором,
вопрос об оптимальном ИЛП
должен решаться опытным путем.
Так, для селекции яровой пшеницы в степной части
Поволжья В. А. Кумаков (1975) обосновал вывод о бесперспективности
увеличения ИЛП в сравнении с районированными сортами. Для
каждого комплекса условий у одного и того же сорта и вида
растений может быть свой оптимальный график формирования
площади листьев. С площадью листьев у ряда культур наиболее
тесно коррелирует урожайность. Однако отмечены случаи
отсутствия корреляций между указанными параметрами, особенно
при сильном загущении посевов и избыточных дозах азотных
удобрений. Это объясняется тем, что урожайность растет не
всегда наравне с увеличением площади листьев и биомассы, а только
при увеличении их до определенных величин, после чего рост ее
прекращается. Вместе с тем высокоинтенсивный сорт Безостая 1
не снижает выхода зерна при накоплении биомассы 16—18 т/га,
а у менее продуктивных сортов выход зерна снижается уже при
накоплении биомассы около 10 т/га.
2.10.2. ФОТОСИНТЕТИЧЕСКИЙ ПОТЕНЦИАЛ
Продуктивность посевов определяется наряду с ИФ и ИЛП
длительностью функционирования фотосинтетического
аппарата, характеризуемого показателем фотосинтетический потенциал
(ФП) посева. Фотосинтетический потенциал — это число
«рабочих дней» листовой поверхности посева, рассчитываемое как
произведение полусуммы площадей листьев за два последующих
определения на длительность периода между этими
определениями в днях. ФП посева теснЪ коррелирует как с биологической,
так и с хозяйственной продуктивностью растений и составляет в
Нечерноземной зоне в оптимальных условиях 2,5—3,0 для
зерновых и 1,5—2,0 млн м дней/га для картофеля. По многолетним
149
данным И. С. Шатилова с сотрудниками (1987), каждые 1000 ед.
фотосинтетического потенциала посевов формируют 2—3 кг
зерна, 5—7 кг картофеля. На избыточном агрофоне эти
величины уменьшаются, что свидетельствует об ухудшении баланса
углерода в результате снижения показателей фотосинтеза.
По данным В. А. Кумакова (1975), рост урожайности
селекционных сортов яровой пшеницы обусловлен
преимущественно увеличением ИЛП и ФП, главным образом верхних
листьев, а также доли ФП, приходящейся на период
колошение — спелость. Эванс с сотрудниками (1975) установил, что
колебания зерновой продуктивности наполовину объясняются
вариациями ФП. Наряду с листьями значительный вклад в ФП
растения и соответственно ассимиляцию СОг вносят стебли,
листовые влагалища, шюдоэлементы, причем у таких культур,
как овес и ячмень, вклад метелки (колоса у ячменя) и листьев
примерно одинаков и составляет 35—40 %. Поэтому сохранение
здоровых плодоэлементов у этих культур при защитных
мероприятиях — непременное условие устойчивого урожая. У ржи,
наоборот, ведущая роль принадлежит стеблю (50—55 %) и
значительно уступают ему листья (20 %). Видимо, поэтому
селекционерам до сих пор не удается вывести короткостебельные
сорта ржи. У пшеницы основной вклад в ассимиляцию СОг
вносят листья (57 %), особенно флаговый, и лишь затем колос
(12 %).
Указанные данные позволили польскому исследователю
Е. Нальборчику условно отнести к листовому типу пшеницу,
стеблевому — рожь, листо-колосовому — овес и ячмень. К
стеблевому типу относятся также выведенные за последнее
десятилетие в бывш. СССР и за рубежом сорта зернобобовых культур
(горох, люпин, кормовые бобы) с сильно редуцированными
листовыми пластинками. Они отличаются высокой устойчивостью к
загущению, неполегаемостью, а также экономным
использованием ассимилированного углерода, который не выделяется в виде
СОг в атмосферу в результате дыхания, а повторно используется
на фотосинтез стебля. Зерновая продуктивность этих форм в
расчете на одно растение ниже, чем у облиственных форм, а с
единицы площади — выше благодаря большей густоте посева.
Принадлежность культуры к определенному типу необходимо
учитывать при разработке агротехники, обработке посевов
регуляторами роста и гербицидами.
2.10.3. ЧИСТАЯ ПРОДУКТИВНОСТЬ ФОТОСИНТЕЗА
Накопление биомассы единицей площади листа за единицу
времени называется чистой продуктивностью фотосинтеза
(ЧПФ). Она, как правило, измеряется в граммах сухой массы на
150
1 м2 за сутки, варьируя в зависимости от условий в широком
диапазоне [7—20 г/(м сут)]. ЧПФ характеризует среднюю
эффективность фотосинтеза листьев в посеве, но, как и ИФ, слабо
коррелирует с конечным урожаем. Она максимальна при низких
величинах ИЛП, когда большинство листьев хорошо освещены
(см. рис. 53). С увеличением ИЛП и соответственно усилением
взаимного затенения листьев в посеве, как и при избыточном
азотном питании, значения ЧПФ снижаются. ЧПФ не включает
фотосинтез нелистовых органов (стеблей, влагалищ листьев,
колосковых чешуи и др.), который в определенных условиях,
например при дефиците влаги, может вносить существенный вклад
в формирование урожая. ЧПФ представляет собой комплексный
параметр, определяемый интенсивностью не только фотосинтеза,
но и дыхания. При одинаковой скорости этих процессов у двух
сортов ЧПФ будет выше у того, у которого больше вклад
надземных (фотосинтезирующих) органов в массу целого растения.
Произведение ЧПФ на индекс листовой поверхности равно
скорости роста посева (СРП). Максимальная СРП, по данным
Б. И. Гуляева (1989), составила 30—35 и 50—60 г/(м2сут)
соответственно для Сз- и С4-ВИДОВ.
По мере увеличения периода, в течение которого сохраняются
максимальные величины СРП, возрастает также биологическая
продуктивность посевов. Эффективность работы
фотосинтетического аппарата в посеве, характеризуемая КПД ФАР, достигает
в этот период 6—8 %. Однако у большинства важнейших
сельскохозяйственных культур период высокоэффективной работы
ценоза весьма непродолжительный. У зерновых культур велики
потери углерода на темновое дыхание, а у таких культур, как
сахарная свекла, картофель, — на отмирание ботвы. Поэтому
потенциальный урожай и значения КПД ФАР за теплый период
года у них значительно ниже оптимальных и составляют в
пересчете на хозяйственный урожай для кукурузы при урожае 10 т/га
1,1 %, для пшеницы при урожае зерна 5 т/га около 0,5 %, для
сахарной свеклы при урожае сухой массы корнеплодов 17,5 т/га
1,9 %. Средняя в мире урожайность пшеницы составляет 2 т/га,
кукурузы — 3,5 т/га, что соответствует значениям КПД ФАР
соответственно 0,2 и 0,4 %.
Посевы по их средним значениям КПД ФАР подразделяют на
низкие — 0,5—1,5 %, средние — 1,5—3,0 и высокие — 3,0—5,0 %.
Значения КПД ФАР являются основным показателем
продуктивности и урожайности сельскохозяйственных культур. Поэтому
повышение значения КПД ФАР в результате применения
прогрессивных технологий и максимального использования
продуктов фотосинтеза на формирование урожая представляет собой
главную задачу растениеводства и селекции.
151
2.10.4. РАДИАЦИОННЫЙ РЕЖИМ И СТРУКТУРА ПОСЕВА
Верхние листья в посеве поглощают как прямую, так и
рассеянную радиацию, в то время как самые нижние получают лишь
небольшую долю прямой радиации в виде солнечных бликов.
Кроме того, нижние листья поглощают радиацию, отраженную
от поверхности растения и почвы, а также пропущенную через
верхние листья. От верхних к нижним листьям изменяется не
только мощность солнечного потока, но и качество света в
пользу главным образом инфракрасных лучей. Ослабление радиации
в посеве рассчитывается по уравнению, предложенному
М. Монси и Т. Саеки (1953):
где /,■ — ФАР ниже /-го слоя листьев; /0 — фотосинтетически активная радиация
над посевом; е — основание натурального логарифма (е = 2,71828); ^ —
коэффициент экстинкции посева; I — индекс листовой поверхности (ИЛП) /-го слоя
листьев.
Таким образом, основными факторами, определяющими
поглощение радиации посевом, служат ИЛП и характер
листорасположения, главным образом угол отклонения от стебля,
характеризуемый коэффициентом экстинкции.
Рассмотрим два типа архитектуры посева, наиболее
распространенных среди сельскохозяйственных культур, в данном
случае райграса однолетнего и клевера (рис. 55). Эректоидные
листья верхнего яруса у райграса, занимающие лишь небольшую
долю от общей площади листьев, способствуют проникновению
ФАР к нижним ярусам листьевв посеве и их активному
фотосинтезу. У клевера, наоборот, большая доля листьев находится в
верхнем ярусе, и они
практически горизонтальны, улавливая
значительную часть радиации. В
результате нижние листья в
посеве не фотосинтезируют или
даже используют на дыхание
синтезированные верхними
листьями ассимиляты. Для
зерновых культур более
предпочтителен первый тип архитектуры
посева, когда верхние листья
близки к эректоидным, а листья
среднего яруса, вносящего
наибольший вклад в
фотосинтетический потенциал растения,
расположены почти горизонтально.
/в
Г
Рис. 55. ИЛП и угол отклонения
листьев от стебля (ос) по профилю
посева травосмеси райграса (I) и
клевера (/7) (по \У. ХУПзоп, 1959)
152
Накопление
биомассы
Фотосинтез
посева
Фотосинтез
листа
Поглощенная
радиация
Темновое
дыхание
Фотодыхание
Угол
листа
Распределение
листьев
Количество
радиации
Рис. 56. Роль отдельных элементов продукционного процесса в накоплении
биомассы. Площади фигур пропорциональны относительному вкладу каждого
фактора в накопление биомассы (по Р. СагЛпег, 1985):
А — поглощение радиации нелистовыми органами; Б — поглощение радиации листьями;
В — распределение листьев по растению; Г— размещение растений в посеве
Последнее присуще наряду с клевером также посевам
подсолнечника, кормовых бобов, огурца и других культур.
Однако архитектура посева может меняться в онтогенезе
растения и зависеть от условий облученности. Так, например, после
всходов, когда ИЛП мал, наиболее предпочтительно
горизонтальное, а не вертикальное листорасположение. По мере
увеличения ИЛП происходит постепенный переход к более
вертикальному расположению верхних листьев и КПД ФАР увеличивается.
Критическое значение ИЛП меньше для посевов с
горизонтальными листьями (клевер), чем с вертикальными (райграс). В
результате максимальная скорость накопления биомассы
посевом клевера достигается при ИЛП = 3, а посевом райграса —
при ИЛП = 4. Однако преимущества эректоидного типа
листорасположения достоверны главным образом в южных широтах. В
153
умеренной зоне у сортов пшеницы, отличающихся углом
наклона верхних листьев, разницы в фотосинтетической деятельности
и урожайности не обнаружено.
Наиболее важной в регуляции структуры листового покрова в
этих условиях является борьба с полеганием, существенно
снижающим (на 25 %) КПД ФАР. Из других особенностей
структуры посева, влияющих на поглощение ФАР и на урожай, можно
отметить генотипические различия в коэффициентах отражения
и пропускания ФАР листьями, частоту образования солнечных
бликов по профилю посева, удельное распределение площади
или массы листьев в единице объема посева, ориентацию
листьев в рядках, гелиотропные движения листьев по направлению
к солнцу или от него (рис. 56). По сравнению с углом наклона
листьев каждая из этих особенностей имеет небольшое значение.
Одновременное объединение указанных преимуществ структуры
посева могло бы дать ощутимый выигрыш в урожайности, что и
лежит в основе представлений об идеатипе растений. Однако
создание идеатипа для конкретного региона представляет собой
трудновыполнимую задачу ввиду того, что положительные и
отрицательные особенности сугубо индивидуальны для каждой
ситуации и часто компенсируют друг друга.
2.10.5. ПАРАМЕТРЫ ОПТИМАЛЬНОГО ПОСЕВА
Оптимальным считается фотосинтез, адаптирующийся к
использованию с максимальной эффективностью тех условий,
которые складываются в посеве или создаются человеком с целью
повышения продуктивности. Компонентами этой системы
должны быть растения, формирующие фитоценоз с наивысшей для
данных условий фотосинтетической продуктивностью, сохраняя
и даже улучшая свои свойства (высокие значения Кхоз, высокое
качество урожая, устойчивость к болезням, полеганию).
Наилучшим можно считать фотосинтетический аппарат,
способный быстро достигать оптимальных размеров (ИЛП = 5—8) и
сохранять их, как и максимальные приросты, в течение
возможно длительного периода времени, синхронизируя свою работу с
генетически контролируемой программой онтогенеза. Однако
ИФ в указанных условиях в результате усиления конкуренции за
СО2 и свет будет значительно ниже, чем при ИЛП = 2—3, т. е.
основными факторами повышения продуктивности хорошо
обеспеченных посевов являются усиление ростовых процессов и
увеличение ИЛП (экстенсивные признаки), но не увеличение ИФ
(интенсивный признак). Именно поэтому биологическая
продуктивность в этих условиях тесно коррелирует с ФП посева и
отрицательно со средней ИФ. Вместе с тем при низких величи-
154
нах ИЛП биологическая продуктивность, наоборот, теснее
коррелирует именно с ИФ.
Изменение соотношений между размерами
фотосинтетического аппарата и ИФ по мере оптимизации факторов плодородия
и увеличения ИЛП направлено на повышение КПД ФАР в
условиях ухудшения режима радиации в посеве и соответственно
снижения средней ИФ. Хорошая согласованность процессов
роста с успешной адаптацией фотосинтетического аппарата
посевов к меняющемуся радиационному режиму приводит к
высоким значениям КПД приходящей ФАР —5—6 % в среднем за
вегетацию. '
По мнению А. А. Ничипоровича (1982), эти значения при
оптимизации условий выращивания можно повысить до 7—8 и
даже 10 % (10—15 т/га зерновых), что почти в 2 раза ниже
теоретически возможного предела КПД ФАР (22 %). Это значит,
что в районах, где приход ФАР за период вегетации составляет
2—3 млрд ккал/га, урожаи зерна пшеницы могут достигать 10—
15 т/га. О реальности таких урожаев свидетельствует создание
низкорослых сортов пшеницы интенсивного типа, дающих
10 т/га и выше. Однако на практике КПД ФАР значительно
ниже оптимальных величин и составляет для биомассы 0,2—
0,3 %.
Для получения реального урожая зерна 6 т/га, что
равнозначно получению биологического урожая 15 т/га при Кхоз = 0,4,
необходимо усвоение посевом 30—33 т/га СО2. Это
исключительно сложная задача, так как в период наиболее интенсивного
роста максимальные суточные приросты достигают 400—600, а
иногда 1000 кг/га биомассы. Такие приросты реальны в посевах
с ИЛП = 5—8 и величинах ЧПФ = 4—8 г/(м-сут) или средней
ИФ = 8-16 мг СО2/(дм2ч).
Для получения подобных приростов растения должны
усваивать до 2000 кг/га СО2. В толще посева в это время находится
всего 5—6 кг СО2, т. е. в 150—300 раз меньше требуемого
количества. Растения справляются с этой задачей, поскольку за 16-
часовой летний день в результате турбулентного перемешивания
происходит около 1500—3000 смен воздуха в толще посева. Тем
не менее концентрация СО2 в посеве (0,025—0,027 %)
оказывается ниже, чем над посевом (0,030—0,032 %), и соответственно
лимитирует, как и пониженная освещенность, фотосинтез.
Преодоление этого лимитирования на физиологическом,
агрохимическом и селекционно-генетическом уровнях является
важной задачей повышения урожаев, поскольку оптимальное
сочетание показателей для достижения указанных максимальных
приростов биомассы наблюдается редко. Если, например, при
некоторой обеспеченности водой и питанием в посевах
развивается недостаточная площадь листьев (ИЛП = 2—3), урожай
снижается даже при достаточно хороших показателях ЧПФ и Кхоз-
155
При этом имеет значение выведение сортов с повышенной
устойчивостью ростовой функции, определяющей рост листьев и
плодоэлементов в неблагоприятных условиях.
Фотосинтетический аппарат таких сортов должен быстро и
успешно адаптироваться к изменениям основных параметров
фотосинтетической деятельности в широком диапазоне их проявлений.
В процессе эволюции появились разнообразные биотипы и
генотипы с фотосинтетическим аппаратом, приспособленным для
эффективной работы в различных условиях. Так, в регионах с высокими
температурами у растений, формирующих плотные посевы с
неблагоприятным углекислотным режимом, преимущество могут иметь
растения С^типа (кукуруза, сорго, сахарный тростник) и другие
теплолюбивые и жаростойкие формы с соответствующими
температурными оптимумами фотосинтеза. В умеренных широтах с
более низкими температурами и в условиях, формирующих хорошо
вентилируемые посевы, не менее продуктивными могут быть и
Сз-растения (свекла, подсолнечник и др.) с относительно низкими
температурными оптимумами фотосинтеза.
2.10.6. ПУТИ ОПТИМИЗАЦИИ ФОТОСИНТЕТИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ
ПОСЕВОВ
Формирование урожая сельскохозяйственных культур —
сложный процесс, результат которого определяется взаимодействием
растений с условиями внешней среды. Ведущее место среди
последних занимает обеспечение растений ФАР, водой,
теплотой, СС>2, элементами минерального питания. Среди них только
влагообеспеченность и уровень почвенного питания поддаются
непосредственному регулированию. Совершенствование
технологии возделывания сельскохозяйственных культур путем
оптимизации внешних условий и соответственно фотосинтетической
деятельности посевов для получения высокого и стабильного
урожая является задачей программирования урожая. По мнению
И. С. Шатилова, важнейшую роль при этом играют правильное
применение законов растениеводства и земледелия, а также
комплексный учет агрометеорологического, агрофизического и
агротехнического факторов.
Первым шагом на пути программирования урожая является
выяснение приспособленности гибрида или сорта к режиму ФАР
и температуре данного региона. Эта задача решается при
помощи сопоставления потребности растений в ФАР и теплоте с их
ресурсами на данной территории. Так, например, суммарный
приход ФАР за период вегетации озимой пшеницы в
Московской области составляет 105 кДж/см .
На втором этапе, по мнению X. Г. Тооминга, необходимо
установление потенциально возможного урожая (ПВУ) и реального,
или действительно возможного, урожая (ДВУ). Для характеристи-
156
ки ПВУ используется биологический или потенциальный урожай,
величина которого определяется потенциальным КПД ФАР и
реальным приходом ФАР при оптимальных значениях других
климатических факторов. ДВУ рассчитывается с учетом
потенциального КПД ФАР при реальных климатических параметрах и
высокой агротехнике. ДВУ, как правило, ниже ПВУ, но разницу между
ними можно существенно сократить путем оптимизации условий
выращивания. Биологический урожай
Убиол = Тоо?
Где д_ количество ФАР за период вегетации культуры; А^ —заданный КПД
ФАР посевов, %; д — теплотворная способность единицы урожая, кДж/кг.
Для расчета урожая зерна при стандартной влажности
используют соотношение
у. ЮОУбиол
где Ух — урожайность зерна или другой продукции при стандартной влажности,
тда; „, _ стандартная влажность по ГОСТу, %: для зерновых культур — 14,
клубней картофеля —80 и ботвы — 85, многолетних трав на сено—16; а — сумма
частей в соотношении основной продукции к побочной в общем Урожае
биомассы (для озимой пшеницы — 1:1,5 или 2,5 части; овса — 1:1,2; картофеля — 1:0,7;
свеклы кормовой — 1:0,4).
Потенциальный урожай зерна и другой основной продукции
УПУ= 1Ъ\Кп^,
где Упу— урожайность зерна или другой продукции при стандартной влажности,
т/га; т| — КПД ФАР, %; Кт — коэффициент хозяйственной эффективности
урожая или доли зерна (клубней, корнеплодов) в общей биомассе (0,4 — для озимой
пшеницы); Ъ<2 — суммарный за вегетационный период приход ФАР; д —
теплотворная способность.
Основные показатели, которые учитывают при расчете ДВУ
по фитометрическим параметрам, это средняя (Ьср) и
максимальная (1тах) площадь листьев, длина вегетационного периода
(Ту\, ФП, запланированный выход биомассы и зерна на 1000 ед.
ФП (Мфп), а также средний выход зерна с одного колоса или
початка. Поскольку 1000 ед. ФП формируют 2—3 кг зерна, при
программировании урожаев, например, озимой пшеницы в 5 т/га
зерна (У3) за период ее вегетации 100 дней {Ту- 100)
суммарный ФП должен составить 2,5 млн м2/(га-дн):
ФП = 103(У3:Мфп);
ФП = 103 тыс. м-дн/га • (5 т/га : 2 кг) = 2,5 млн м-дн/га.
157
Зная ФП и Ту, можно определить средний размер площади
листьев:
Ьср = ФП : Ту = 25 тыс. м2/га.
К фазе колошения такой посев должен иметь Ьтах
= 25 000 м2/га ■ 1,83 = 45 800 м2/га. Однако решающими при
этом являются условия питания и влагообеспеченности.
Поэтому следующим, третьим этапом программирования является
обеспечение посевов оптимальным количеством воды и ИРК.
Оптимизация питания путем внесения расчетных доз удобрений
при достаточной водообеспеченности в 1,5—1,7 раза повышает
поглощение СОг и ФАР во все фазы развития растений в
посеве при существенном увеличении ФП. Удобрения
оказывают прямое и опосредованное влияние на фотосинтез и
фотосинтетическую продуктивность посевов.
На посевах, где режим ФАР не входит в число лимитирующих
факторов (изреженные посевы), с ростом дозы минеральных
удобрений отмечается увеличение ИФ в расчете как на единицу
площади листа, так и посева. В нормально развитых посевах
режим ФАР становится лимитирующим фактором, что при
интенсивном накоплении фитомассы приводит к снижению ИФ
единицы площади листа. Однако фотосинтез единицы площади
посева за счет роста ИЛП возрастает. КПД приходящей ФАР
при внесении оптимальных доз минеральных удобрений под
кукурузу на черноземах, по данным Б. И. Гуляева, в 1,57—1,64 раза
выше контроля, а КПД поглощенной ФАР — в 1,35—1,38 раза.
Максимальное значение КПД приходящей ФАР, равное 6,7—
7,5 %, наблюдалось в период цветения метелки — цветения
початка при внесении оптимальной дозы удобрений — М^оРад-
При недостатке влаги внесение удобрений практически не
влияет на значения КПД ФАР. Для нормального фотосинтеза
содержание воды в листьях должно составлять 75—80 % с
некоторыми вариациями для отдельных культур: 81—83 % для
сахарной свеклы, 76—78 % для кукурузы. Ухудшение режима
влагообеспеченности может существенно снизить (вплоть до нуля)
ИФ и фотосинтетическую продуктивность. При этом реакция
листьев разных ярусов в посеве, например, кукурузы заметно
различается. Так, нижние листья фотосинтезируют лучше, чем
при орошении, что свидетельствует о смещении зоны высокой
фотосинтетической активности от верхних к нижним листьям,
наиболее устойчивым к неблагоприятным условиям.
Если при орошении растений дневной ход ИФ следует за
ходом радиации, то при дефиците влаги в почве наблюдается
полуденная депрессия фотосинтеза, причем тем сильнее, чем
хуже влагообеспеченность. Особенно вредно сочетание
почвенной и воздушной засух, характеризуемое водным дефицитом
158
листьев. По данным X. Н. Починка (1965), у кукурузы заметное
снижение ИФ наступает при водном дефиците, равном 7 %, а
компенсационный пункт — при 17 %. Таким образом, при
определении расчетных доз удобрений при программировании
урожаев важно учитывать не только потребность растений и почвенное
плодородие, но и зависимость эффективности удобрений от
условий влагообеспеченности.
Существенным средством оптимизации фотосинтетической
деятельности посевов, позволяющим косвенно влиять на фито-
климат посевов, и в особенности на радиационный режим,
является, структура посева, характеризующаяся густотой, шириной
междурядий, способом расположения растений в рядках. Так, в
современных технологиях озимой пшеницы используют
узкорядный посев с шириной междурядий 7,5 см, сплошной —
15 см, а в семеноводческих хозяйствах, кроме того, ленточный
трехрядный с расстоянием между лентами 45 см, а в ленте —
15 см.
Урожай зерна и количество поглощенной ФАР оказались
максимальными при сплошном посеве, наименьшими — при
ленточном, хотя эффективность использования ФАР в
последнем случае была максимальной: для получения 1 ц зерна
пшеницы ленточный посев расходует 10,2 МДж/м2, сплошной —
11,1 и узкорядный — 12 МДж/м2 энергии. Это обусловлено тем,
что растения ленточного посева, хотя и фотосинтезируют на
40—60 % интенсивнее, чем растения узкорядного посева,
значительно уступают последнему по густоте продуктивного стебля.
Вместе с тем при узкорядном посеве только 10—14 % ФАР
поступает в нижнюю часть растительного покрова, в то время
как в ленточном посеве — до 35 %. Вследствие этого диаметр
соломины (3,1—3,7 мм) в нижнем междоузлии у растений
узкорядного способа посева на 30—40 % меньше, чем при
ленточном способе, что определяет слабую устойчивость
узкорядных , посевов к полеганию и соответственно меньший КПД
поглощенной ФАР.
Кроме того, увеличению поглощения солнечной радиации
посевами и соответственно урожая способствует также возможно
ранний посев с целью быстрого формирования оптимального
ИЛП, совпадающего по времени с максимальным развитием
листового покрова и наибольшим среднедневным, приходом
солнечной радиации (см. рис. 54).
2.10.7. ФОТОСИНТЕЗ И УРОЖАЙ
Прежде всего необходимо обсудить возможность регуляции
фотосинтеза через множество составляющих его звеньев, в
частности мощность пигментного аппарата растений. Несмотря на
159
многочисленные попытки, не установлено тесной связи между
ИФ листа и содержанием в нем хлорофилла как у сортов
культурных растений (пшеница, ячмень), так и у исходных
видов разной плоидности вплоть до современных гексаплоид-
ных форм. Даже у мутантных форм, дефицитных по
хлорофиллу, низкое содержание последнего мало или совсем не
отражалось на ИФ.
Сходная динамика указанных параметров в онтогенезе не
доказывает причинной связи между ними, так как значения других
показателей, например РДФ-карбоксилазы, при этом тоже
изменяются. Только Б. Баттери и Р. Базель, работавшие с 48
нормальными и 20 дефицитными по хлорофиллу линиями пшеницы,
нашли соответствие между содержанием хлорофилла и ИФ, но
исключительно на насыщающем свету. При этом обнаружена
удовлетворительная корреляция между ИФ и активностью РДФ-
карбоксилазы, а также урожаем зерна. Авторы считают наиболее
предпочтительным отбор форм по высокой удельной активности
карбоксилазы в расчете на единицу белка фермента, но не на
единицу площади или массы листа. Однако при этом следует
учитывать оксигеназную функцию данного фермента, тесно
коррелирующую со скоростью фотодыхания.
Интерес к проблеме снижения фотодыхания заметно возрос
после получения данных, согласно которым Сз-виды,
помещенные в атмосферу с 1—2 % кислорода, растут гораздо
быстрее, чем в обычной атмосфере. И. Зелитч и П. Дэй (1968,
1973) отобрали формы табака с низким уровнем фотодыхания
и с высокой ИФ, но закрепить эти свойства в популяции при
дальнейших циклах самоопыления и отбора не удалось. Это
объясняется положительной корреляцией между ИФ и
интенсивностью фотодыхания. Именно поэтому попытки
химического ингибирования фотодыхания с целью повышения
фотосинтеза потерпели неудачу. Фотодыхание играет также важную
роль в азотном метаболизме зеленых клеток, и подавление
фотодыхания неизбежно привело бы к нарушению обмена
аминокислот.
Крайне важна проблема повышения ИФ
селекционно-генетическим путем. Повышенной ИФ отличаются скороспелые
сорта, но у них низка продуктивность. По мере перехода от
ди- и тетра- к гексашюидным пшеницам происходило
параллельное увеличение площади листьев и особенно флагового
листа, Кхоз и зерновой продуктивности (рйс. 57). Последнее
было обусловлено главным образом увеличением площади
листьев.
По мнению английского исследователя Р. Остина (1980), ИФ
при этом не только не повысилась, но нередко даже снижалась,
т. е. отрицательно коррелировала с площадью листьев. Таким
образом, высокая урожайность сортов не всегда означает их вы-
160
сокую ИФ, что доказывает
сложный характер связи между этими
параметрами. Частично это
обусловлено тем, что ИФ наследуется
как полигенный признак,
определяемый более чем 500 генами,
причем в скрещиваниях чаще
доминирует ее низкое значение.
Однако это не исключает
возможностей селекционного улучшения
фотосинтетических признаков.
Установлена положительная
корреляция между ИФ и массой
единицы площади листа, называемой
удельной поверхностной
плотностью (УПП). Отмечено также
положительное влияние эректоидности
листьев в посеве на освещенность
нижних листьев и продуктивность
посевов риса, ячменя, кукурузы,
сахарной свеклы и других культур,
особенно на низких широтах. При
этом ИФ посевов достоверно
возрастала.
В. А. Кумаков считает, что
повышение ИФ должно быть
сопряжено с изменением
морфологической структуры или ритмов
роста и развития растений.
Наряду с повышением УПП это
интенсивный рост корневой
системы, особенно в засушливых
условиях, создание значительных
пластических резервов в узле кущения
и в соломине для последующего
использования при наливе зерна. Кроме того, необходим
умеренный рост всех вегетативных органов при неполном
использовании потенциальных возможностей фотосинтеза с
последующим повышением его активности в ответ на запрос мощного
колоса. При этом не только фотосинтез стимулирует рост
растения, но и рост интенсифицирует фотосинтез, регулируя рост,
развитие и старение листьев, устьичную проводимость и кар-
боксилирование. Нецелесообразно улучшать фотосинтез, если
активные потребители ассимилятов (аттрагирующие центры) не
соответствуют увеличенному потоку ассимилятов. Исходным
условием успешного отбора на высокую ИФ является такая
система, в которой аттрагирующие центры сильно лимитируются
161
0,4
1890г.
тог.
Рис. 57. Надземная масса,
урожайность и Ахоз сортов озимой
пшеницы разных лет селекции
(по К. Аш(ш, 1980)
источниками продуктов фотосинтеза. Как считает О. Д. Быков
(1982), наиболее перспективен дифференцированный подход в
селекции, при котором в зависимости от особенностей
физиологии культуры и места ее возделывания предлагается
конкретная программа улучшения ее фотосинтетических признаков.
Например, для кормовых культур, хозяйственно полезными
частями которых является вегетативная масса, предпочтительно
увеличение площади листьев, пусть даже сопряженное с
некоторым снижением ИФ. Напротив, для зерновых культур,
особенно в засушливых районах, целесообразно выведение форм
с умеренной листовой поверхностью и высокой ИФ. Для
районов с пониженной инсоляцией северо-западной части России
и Дальнего Востока будут иметь преимущество формы,
обладающие фотосинтетическим аппаратом с повышенной
теневыносливостью.. Теневыносливые сорта более устойчивы к
повышению густоты посевов — важному элементу прогрессивной
технологии. Отбор на теневыносливость особо перспективен в
| селекции овощных культур (томат, огурец и др.) закрытого
грунта в связи с необходимостью экономии энергии.
2.11. СВЕТОКУЛЬТУРА СЕЛЬСКОХОЗЯЙСТВЕННЫХ
РАСТЕНИЙ
2.11.1. ИСТОЧНИКИ ОБЛУЧЕНИЯ
Светокультура растений изучает теоретические основы и
методы выращивания растений с помощью искусственного
облучения. В этом случае растения не создают новых запасов энергии
на земле, как в природе, а лишь трансформируют лучистую
энергию ламп в химическую энергию растений.
Искусственное облучение широко применяется в тепличных
хозяйствах, особенно в северных регионах страны, для
выращивания овощей, а также для ускорения выведения новых сортов,
теоретических исследований по биологическим наукам и других
целей. Источниками излучения в светокультуре растений служат
электрические лампы различных типов. Они должны
удовлетворять следующим требованиям.
1. Спектральный состав излучения ламп должен в наибольшей
степени способствовать осуществлению основных
физиологических процессов. Для этого необходимо, чтобы в спектре были все
участки видимого излучения с преобладанием красных, синих и
фиолетовых лучей, а также небольшая доля длинного
ультрафиолетового (УФ) и короткого инфракрасного (И К) излучения.
Излучение с длиной волны менее 290 нм не должно попадать на
растения.
2. Лампы не должны излучать большое количество теплоты,
162
так как это нарушает нормальный обмен веществ в растениях,
приводит к преждевременному цветению, плодоношению и, как
правило, снижению урожая.
3. Лампы должны быть экономичными, т. е. создавать
достаточную фотосинтетическую облученность при возможно
меньшем потреблении электроэнергии и выдерживать
продолжительную эксплуатацию.
В настоящее время наиболее широкое применение нашли
газоразрядные лампы и в меньшей степени — лампы
накаливания. Источник лучистой энергии в газоразрядных лампах —
излучение газов или паров металлов, возникающее при газовом
разряде. В лампах накаливания, отличающихся невысокой
стоимостью, простотой в обращении и высокой мощностью
лучистого потока, источником излучения служит раскаленная
вольфрамовая нить.
Ксеноновые лампы (ДКСТ-5000, ДКСТВ-6000,
ДКСТ-2000О) из производимых промышленностью
газоразрядных источников искусственного света по спектральной
характеристике в области ФАР наиболее близки к солнечному
спектру. Растения разных видов, выращенные с применением этих
типов ксеноновых ламп, имели при коротком вегетационном
периоде продуктивность значительно выше, чем в поле. Однако
низкий КПД этих источников (12—13 %) и сложность
эксплуатации препятствуют их широкому применению в светокультуре
растений.
При этом установлены следующие соотношения между
единицами измерения световых характеристик (табл. 11). Например,
для лампы ДКСТ-5000 отношение общей освещенности в люксах
(лк) к фотосинтетически активной радиации в мкмоль/(м2с) или
ФАР(к) равно 74,2, отношение ФАР(к) к суммарной
облученности в Вт/м (СР) — 3,16 и отношение ФАР(к) к ФАР, выраженной
в Вт/м2, или ФАР(э) — 4,46. Таким образом, измерив
освещенность в люксах, можно легко рассчитать облученность в Вт/м
(ФАР или общую) или поток квантов в области ФАР в
мкмольДм с).
11. Световые характеристики основных типов ламп (Н. Н. Протасова,
Дж. М. Уеллс, М. В. Добровольский, Л. Н Цоглин, 1990)
Тип лампы
ДКСТ-5000
ДРЛФ-400
ДНаТ-400
ДМ4-6000
ДРИ-2000-6
ДРОТ-2000
лк
ФАР(к)
74,2
76,7
116
118
84,1
108
ФАР(к)
СР
3,16
3,03
2,90
2,45
2,90
2,69
ФАР(к)
ФАР(э)
4,46
4,54
3,72
3,00
4,11
3,37
12—13
12
28-30
28—30
29-30
25
163
ДРЛФ-400 — дуговые ртутно-люминесцентные фитолампы
мощностью 400 Вт. Из-за отсутствия в спектре этих ламп излучения в
красной (640—680 нм) области спектра они непригодны для
выращивания растений при полном искусственном освещении:
наблюдается пустозерница у зерновых, плохо растут плодоносящие томат,
перец и другие овощные. Досвечивание лампами ДИаТ-400 может
существенно «улучшить» спектр. Вместе с тем лампы ДРЛФ-400
также используют для досвечивания рассады огурца и томатов в
теплицах как источник сине-фиолетовой радиации, которой
недостаточно в солнечном спектре в зимнее время.
ДНаТ-400— натриевые лампы высокого давления мощностью
400 Вт. Лампы имеют высокий КПД ФАР, но неполноценный
по спектру. Для его «исправления» необходимо добавить
излучение в синей области и в красном спектральном диапазоне 660—
680 нм. Эти лампы эффективны при досвечивании рассады, но
менее приемлемы в генеративной фазе при полном
искусственном освещении.
Металлогалогенные лампы (МГЛ). Выпускаются
с добавками йодидов металлов, более перспективны в сравнении
с вышеперечисленными лампами, так как обладают высоким
КПД (25—30 %) и относительно полным спектром.
ДМ4-6000 — это трехфазная МГЛ мощностью 6 кВт с
наполнением йодидом натрия и скандия и с достаточно длительным
сроком службы. Основной недостаток лампы — неполноценность
спектра, обусловленная снижением доли излучения в синей и
красной областях.
ДРИ-2000-6 — МГЛ мощностью 2 кВт с наполнением
йодидом натрия и скандия. По КПД и спектральным
характеристикам эта лампа является лучшей среди МГЛ, применяемых для
выращивания растений.
ДРФ-1000— МГЛ-светильник мощностью 1 кВт с йодидом
натрия и скандия в качестве наполнителей, широко применяют
для выращивания рассады огурца и томата. Для «улучшения»
спектрального состава света необходимо добавить излучение в
красной области — 650—680 нм.
Хороший результат по «исправлению» спектрального состава
света при выращивании растений дает комбинирование этих
источников с люминесцентными лампами красного света ЛК-65
или сочетание последних с лампами накаливания с отношением
мощностей 3—4:1.
2.11.2. ВЛИЯНИЕ ИСКУССТВЕННОГО ОБЛУЧЕНИЯ
НА АНАТОМО-ФИЗИОЛОГИЧЕСКУЮ ХАРАКТЕРИСТИКУ РАСТЕНИЙ
Анатомическое строение листьев и стеблей служит важным
биологическим показателем условий облучения, выращивания
и физиологического состояния растений. Так, палисадная и
164
губчатая паренхима наиболее развита у листьев под
люминесцентными и ксеноновыми лампами, в результате чего удельная
поверхностная плотность оказывается больше, чем под другими
типами ламп. По анатомическим характеристикам листья под
люминесцентными лампами можно отнести к группе световых,
а под лампами накаливания, неоновыми, ртутными или не
облучавшиеся дополнительно зимой в теплице — к группе
теневых.
При длинноволновом излучении под лампами накаливания и
ксеноновыми стебли обычно вытягиваются; при
коротковолновом под люминесцентными лампами и лампами ДРЛ, наоборот,
наблюдается сильное сокращение междоузлий. В последнем
случае лучше дифференцируются проводящие пучки, хорошо
развиваются механические ткани и образуется наибольшее количество
камбиальных клеток.
Хорошо развитый пигментный аппарат листьев под этими
лампами приводит к длительному сохранению
фотосинтетической функции и соответственно к существенному увеличению
урожая у овощных и других культур. При облучении растений
неоновыми, ртутными и ртутно-вольфрамовыми лампами ИФ
значительно ниже, а дыхание — выше, что снижает
продуктивность растений в сравнении с люминесцентными лампами, ДРЛ
и ДРИ.
Помимо фотосинтеза и дыхания важное значение в
продукционном процессе имеют процессы фотоморфогенеза, т. е.
изменение форм, размеров растений, а также динамика прохождения
отдельных этапов органогенеза под влиянием излучения разного
качества и разной интенсивности. Например, ускорение
развития растений томата при выращивании их под ксеноновыми
лампами по сравнению с люминесцентными происходит за счет
более быстрого прохождения II этапа — образования кисти;
условия выращивания растений в конце II — начале IV этапа
определяют число цветков в кисти.
Таким образом, анатомическая структура листьев, накопление
пигментов, усвоение лучистой энергии, фотосинтез и
фотоморфогенез — лабильные физиологические процессы. Основным
фактором, вызывающим изменчивость указанных процессов при
прочих равных условиях, является спектральный состав
излучения ламп.
Контрольные вопросы и задания
1. Что общего в составе и строении наружной и внутренней мембран
хлоропласта? Укажите различия между этими мембранами и их связь с выполняемыми
функциями. 2. Назовите возможные причины того, что у мутантных растений
гороха с пониженным содержанием каротиноидов фотосинтез протекает менее
165
интенсивно. 3. Какие соединения, образующиеся в световых реакциях
фотосинтеза, используются для восстановления СОг? 4. Чем объяснить, что квантовый
выход фотосинтеза можно увеличить, если вместо непрерывного освещения
давать свет короткими вспышками с более длительными тещговыми
промежутками? 5. Если зеленый лист освещать в отсутствие СОг, то он будет
флуоресцировать. Введение СОг немедленно вызывает прекращение флуоресценции. Как это
объяснить? 6. Опишите реакции, в которых участвуют ферменты РДФ-карбокси-
лаза и ФЕП-карбоксилаза. Укажите локализацию этих ферментов в листе и
охарактеризуйте их функциональные взаимосвязи. 7. Влияет ли свет на
интенсивность дыхания? Поясните свой ответ. 8. Чем фотосинтез у суккулентов
отличается от фотосинтеза у мезофитов Сз- и С4-типа? 9. Как изменились размеры
светособирающего комплекса и его число на единицу площади мембран хлоро-
пластов в процессе селекционного улучшения сельскохозяйственных культур?
10. Почему сорта с относительно тонкими листьями в посевах более
предпочтительны, чем сорта с большей удельной поверхностной плотностью? 11. Чем
преимущественно ограничена урожайность современных сортов
сельскохозяйственных культур: недостаточной активностью донора или акцептора ассимилятов?
Ответ обоснуйте. 12. Назовите фотосинтетический потенциал обеспеченных
посевов основных культур в центральных регионах России. 13. Почему карликовые и
полукарликовые сорта существенно снижают урожайность в засушливые годы?
14. Приведите известные вам примеры использования на практике
теневыносливых сортов. В чем их преимущество? 15. От каких параметров зависит чистая
продуктивность фотосинтеза? 16. В чем основная причина снижения фотосинтеза
при стационарном и прогрессирующем дефиците влаги? 17. Назовите
агротехнические приемы, способствующие увеличению КПД ФАР посевов. 18. В чем
состоят основные причины снижения интенсивности фотосинтеза по мере
старения растений?
Глава 3
ДЫХАНИЕ РАСТЕНИЙ
3.1. ИСТОРИЯ ИЗУЧЕНИЯ ДЫХАНИЯ
Дыхание присуще всем живым организмам. Оно представляет
собой окислительный распад органических веществ,
синтезированных в процессе фотосинтеза, протекающий с потреблением
кислорода и выделением диоксида углерода. А. С. Фаминцын
рассматривал фотосинтез и дыхание как две последовательные
фазы питания растений: фотосинтез готовит углеводы, дыхание
перерабатывает их в структурную биомассу растения, образуя в
процессе ступенчатого окисления реакционноспособные
вещества и освобождая энергию, необходимую для их превращения и
процессов жизнедеятельности в целом. Суммарное уравнение
дыхания имеет вид:
6О2 -» 6СО2 + 6НгО + 2875 кДж.
%
д Из этого уравнения становится ясно, почему именно скорость
газообмена исполЬзуютгДля оценки ^интенсивности дыхания; Оно
было предложено в 1912 г. В. Й. Палладиным, который считал,
что дыхание состоит из двух фаз — анаэробной и аэробной. На
анаэробном этапе дыхания, идущем в отсутствие кислорода,
глюкоза окисляется за счет отнятия водорода (дегидрирования),
который, по мнению ученого, передается на дыхательный фермент.
Последний при этом восстанавливается. На аэробном этапе
происходит регенерация дыхательного фермента в окислительную
форму. В. И. Палладии впервые показал, что окисление сахара
идет не за счет непосредственного окисления его кислородом
воздуха, поскольку кислород не встречается с углеродом
дыхательного субстрата, а связано с его дегидрированием.
Этот вывод опроверг теорию А. Л. Лавуазье, предложенную в
конце XVIII в., о тождестве дыхания и горения. К этому
заключению он пришел на основании того, что при дыхании, как и
при горении, поглощается Ог и выделяются СОг и теплота.
Поэтому Лавуазье ошибочно предположил, что дыхание — это
медленно текущее горение питательных веществ в живом
организме, сопровождаемое присоединением кислорода к
окисляемому субстрату. Кроме того, он не мог знать, что в отличие от
сжигания топлива в топке в клетке энергия окисления, как
правило, не выделяется в виде теплоты, а связывается в молекуле
АТФ. Последнее было открыто только в 1941 г. Ф. Липманом и
Г. Калькаром.
167
Существенный вклад в изучение сути окислительных
процессов и химизма процесса дыхания внесли как отечественные
(И. П. Бородин, А. Н. Бах, С. П. Костычев, В. И. Палладии), так и
зарубежные (А. Л. Лавуазье, Г. Виланд, Г. Кребс) исследователи.
Число работ, посвященных изучению дыхания, значительно
меньше, чем по фотосинтезу. Однако в последнее десятилетие
внимание, уделяемое исследованию дыхания, заметно усилилось.
Это обусловлено тем, что жизнь любого организма неразрывно
связана с непрерывным использованием свободной энергии,
генерируемой при дыхании. Неудивительно, что изучению роли
дыхания в жизни растения в последнее время отводят
центральное место в физиологии растений. При этом дыхание
рассматривается не только как специальный процесс для генерации АТФ и
восстановителя, а как одна из сторон метаболизма, при котором
образуются промежуточные соединения для синтеза всех
компонентов структурной биомассы растения.
3.2. МЕТОДЫ УЧЕТА ДЫХАНИЯ
Дыхание растений измеряют двумя способами: на интактных
растениях и органах в токе воздуха или на отделенных органах в
замкнутой камере. Первый способ лежит в основе ряда
технических решений, использующих главным образом принципы
инфракрасного (ИК) газового анализа и калориметрии, второй —
манометрии (измерение давления) и волюмометрии (измерение
объема).
Рассмотрим приборы, предназначенные для измерения
газообмена у отделенных от растения органов в замкнутой камере.
Использование замкнутой камеры позволяет судить об
интенсивности обмена С>2 и СС>2 по изменению объема газовой фазы, что
упрощает аппаратуру, повышает ее чувствительность и точность.
К недостаткам таких приборов относятся необходимость
расчленения растений, помещение их в атмосферу замкнутой камеры,
инерционность измерительных систем и относительно
небольшая производительность.
В приборах, работающих на принципах манометрии, как,
например, в аппарате Варбурга, количество поглощенного
растением С>2 или выделенного СО2 может быть определено лишь, когда
известен объем газовой и жидкой фаз в приемнике для объекта.
Возможность одновременно изучать обмен двух газов, их
динамику и высокая чувствительность приборов выделяют этот
метод особо даже в сравнении с ИК-газометрией и
полярографическим анализом. Однако использование малых навесок и
сложность проведения измерений ограничивают его массовое
применение при изучении экологии дыхания.
В волюмометрии газообмен измеряется при постоянном дав-
168
1
лении, вследствие чего отпадает необходимость учитывать объем
жидкой и газовой фаз. Расчетная формула имеет вид:
ДК=Р(С1 - С2),
где Д V— изменение объема газа в сосуде; р — цена деления шкалы; С\ и Сг —
отсчеты соответственно в начале и конце экспозиции.
Для точного измерения дыхания на приборах, работающих на
принципе волюмометрии или манометрии, необходима
стабилизация температуры, что осуществляют путем термостатирования
приемника с образцом.
3.3. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ МИТОХОНДРИЙ
'Митохондрия окружена двойной мембраной — наружной и
внутренней. Последняя образует выросты — кристы,
увеличивающие внутреннюю поверхность митохондрий. Внутреннее
пространство митохондрии заполнено матриксом, состоящим
наполовину из белка, Именно здесь локализованы ферменты цикла
Кребса, ферменты, катализирующие окисление жирных кислот,
а также РНК и ДНК для биосинтеза белка.
Митохондриальные мембраны представляют собой ряд
ферментных комплексов, связанных со структурными белками и
липидами. В белках внешней мембраны 50 % составляет
структурный белок и 50 % — ферментативные белки. В белках
внутренней мембраны 60 % приходится на структурный белок,
20 % — на белок ферментов дегидрогеназного комплекса и
20 % — на белки компонентов цепи переноса электронов
(ЭТЦ).
Наружная мембрана митохондрий проницаема для малых
молекул и ионов. Это позволяет многим органическим молекулам,
в Частности пирувату — продукту гликолиза, протекающего в ги-
алоплазме, проходить через эту мембрану и окисляться до СОг и
Н2О в серии ферментативных реакций цикла Кребса. Таким
образом устанавливается связь между отдельными этапами
окисления глюкозы, локализованными в разных компартментах
клетки. Во внутренней мембране митохондрий локализована ЭТЦ.
Энергия трансмембранного потенциала, возникающая между
двумя сторонами внутренней мембраны в результате переноса
электронов по ЭТЦ от НАДН на кислород, используется для
образования АТФ из АДФ и Рн. Образовавшаяся в процессе
фосфорилирования молекула АТФ может выходить через
внутреннюю мембрану в матрикс. Таким образом реализуется
(основная функция митохондрий — обеспечение энергетических
потребностей клеткйл Поэтому митохондрии часто называют
«силовыми станциями» клетки.
169
3.4. ОСНОВНЫЕ ПУТИ ОКИСЛЕНИЯ
ДЫХАТЕЛЬНОГО СУБСТРАТА
3.4.1. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
В процессе дыхания участвует сложная цепь окислительно-
восстановительных превращений углеводов и жиров. Под
окислением какого-либо соединения понимают процесс потери им
электрона (протона), под восстановлением — их присоединения,
протекающие по одному из следующих путей.
Непосредственное присоединение к веществу кислорода,
например, в процессе образования воды:
2Н2 + О2 -> 2Н2О.
Нередко процесс отдачи электрона может происходить без
участия кислорода:
+ _ окисление 2+ _
11 е восстановление е'
Одновалентная медь служит донором электрона и окисляется
до Си2 . В обратной реакции Си2+ — акцептор электронов
восстанавливается до Си .
Перенос электронов во многих
окислительно-восстановительных реакциях сопровождается одновременным переносом
протонов, как при окислении янтарной кислоты в фумаровую:
соон
СН2 -2Н -2ё
СН,
СООН
янтарная
кислота
сукцинатдегидрогеназа
СООН
*- СН +ФАДН2
II
СН
I
СООН
фумаровая
кислота
Для непрерывного протекания этой реакции необходимо
наличие в системе акцептора водорода.
Способность вещества к окислению сильно возрастает, если
оно предварительно гидратируется:
О
Н
К - С - Н + Н2О -* К - С - ОН -> Я - С -ОН + 2Н + 2е"
ОН
170
В живых системах окисление одного соединения всегда
сопряжено с восстановлением другого. Любая
окислительно-восстановительная система может функционировать как окислитель или как
восстановитель в зависимости от соотношения величины ее
собственного потенциала и потенциала системы, с которой она
взаимодействует. Максимальную величину потенциала в клетке имеет
кислород, благодаря чему он служит универсальным окислителем.
3.4.2. ОКСИДОРЕДУКТАЗЫ
Ферменты, катализирующие окислительно-восстановительные
реакции, называют оксидоредуктазами. Класс оксидоредуктаз
представлен дегидрогеназами и оксидазами.
Дегидрогеназы. Основная их функция — активирование
водорода в молекуле дыхательного субстрата и отделение его от
окисляемого вещества, или дегидрирование. Реакция дегидрирования
лежит в основе ряда процессов биологического окисления.
Представление об активации водорода как важнейшей основе
дыхания было впервые дано В. И. Палладиным в 1908 г. и в
дальнейшем подтверждено работами Г. Виланда.
В общем виде схема действия дегидрогеназ заключается в том,
что активированный или лабильный водород дыхательного
материала АНг переносится на акцептор В, имеющий более высокую
степень сродства к водороду:
+ дегидрогеназа + В -»А + ВН2 + дегидрогеназа.
Вопрос о том, какое соединение является первым акцептором
водорода метаболита, важен с точки зрения классификации
дегидрогеназ. По этому признаку дегидрогеназы делят на аэробные
и анаэробные. Аэробные дегидрогеназы передают
активированный водород непосредственно на кислород, а анаэробные —
лишь на промежуточный переносчик.
Аэробные дегидрогеназы представляют собой двухкомпонент-
ные ферменты, куда наряду с белком в качестве простетической
группы входит рибофлавин — производное витамина Вг-
Наиболее распространенными коферментами этой группы являются
ФАД (флавинадениндинуклеотид) и ФМН (флавинмононуклео-
тид), что дало основание называть аэробные дегидрогеназы фла-
виновыми. Сюда входят лактатдегидрогеназа,
сукцинатдегидрогеназа, а-глицерофосфатдегидрогеназа и др. Донорами электронов
для аэробных дегидрогеназ служат анаэробные дегидрогеназы, а
акцепторами — цитохромы, кислород.
Анаэробные дегидрогеназы — это двухкомпонентные ферменты,
коферментами которых являются НАД+ или НАДФ+. Оба кофер-
мента имеют сходную структуру, за исключением того, что в
НАДФ+ на один остаток фосфорной кислоты больше. Оба кофер-
мента дают после гидролиза рибозу, аденин, никотинамид и фос-
171
форную кислоту. Поскольку в состав кофермента входят
пиридиновые основания, анаэробные дегидрогеназы называют также
пиридиновыми. К ним относят ферменты, катализирующие
окислительно-восстановительные превращения в процессах спиртового и
молочнокислого брожения, например алкогольдегидрогеназу, а
также ферменты дегидрирования соединений, образующихся в
процессе аэробного окисления пировиноградной кислоты (ПВК)
(дегидрогеназа цис-аконитовой, изолимонной, янтарной, яблочной
кислот и др.). В основе действия пиридиновых дегидрогеназ лежит
способность к обратимому дегидрированию и гидрированию
пиридинового ядра, входящего в состав коферментов этих дегидрогеназ
в виде амида никотиновой кислоты.
Оксидазы. Активируют молекулярный кислород, т. е.
катализируют заключительные этапы окисления. Водород окисляемого
субстрата соединяется с кислородом воздуха с образованием
воды или перекиси водорода. В зависимости от природы металла
оксидазы могут быть разделены на две группы: железопротеиды
(Ре-протеиды) и медьпротеиды (Си-протеиды). Об активности
оксидаз можно судить, с одной стороны, по количеству
потребленного кислорода, с другой — по количеству окисленного
субстрата. К группе Ре-протеидов относятся гемин, цитохромокси-
даза, каталаза, пероксидаза, а к группе Си-протеидов — полифе-
нолоксидаза и аскорбатоксидаза.
Среди оксидаз важную роль играют железосодержащие
ферменты и переносчики, относящиеся к цитохромной системе, в
частности цитохромы и цитохромоксидаза. Все компоненты
цитохромной системы содержат железопорфириновую простетичес-
кую группу:
Г1
СН3
сн=сн—
СН3
Н3С
соон
\
Обратимое окисление и восстановление цитохромов путем
отдачи и присоединения электрона связаны с изменением
валентности железа фермента в коферменте. Благодаря этому
цитохромы являются переносчиками электронов, а цитохромоксидаза
играет роль последнего звена, способствующего их переносу на
кислород воздуха.
Каталаза ускоряет реакцию разложения перекиси водорода на
воду и кислород по уравнению
2Щ0 _пероксидаза_^ 2ЩО + ^
Пероксидаза с помощью перекиси водорода может окислять
различные соединения, например полифенолы, с образованием
хинона и воды.
Полифенрлоксидаза катализирует перенос в и Н от ряда
фенолов (гидрохинон, пирокатехин и др.) на молекулярный кислород:
но-
-ОН + 1/2О2
полифенолоксидаза
+ н2о
Аскорбатоксидаза окисляет аскорбиновую кислоту (АК) в де-
гидроаскорбиновую (ДАК):
о
II
с-
I
С-ОН
о
С-ОН I + 1/2О2
аскорбатоксидаза
О
II
С-
с=о
II
С=О I + Н,О
о
I
но-с-н
СН2ОН
аскорбиновая
кислота
I
но-с-н
I
СН2ОН
дегидроаскорбиновая
кислота
172
3.5. ХИМИЗМ ДЫХАНИЯ
3.5.1. ГЛИКОЛИЗ, ЕГО РЕГУЛЯЦИЯ И ЭНЕРГЕТИКА
Гликолиз, или цикл Эмбдена—Мейерхофа—Парнаса,
представляет собой доминирующий путь окисления углеводов в
растении. Гликолитический цикл или нечто подобное представлено
во всех формах жизни, предшествуя всем типам дыхания, что
173
свидетельствует о его раннем происхождении в эволюции жизни.
Слово «гликолиз» означает расщепление сахара; при этом глюкоза
и фруктоза являются главными моносахаридами,
трансформируемыми в ходе гликолиза. Поэтому их можно рассматривать как
самые первые продукты, вступающие в этот процесс. Пул гексоз
(гексозофосфатов), куда входят глюкоза и фруктоза, находится в
цитозоле и представлен глюкозо-1-фосфатом, глюкозо-6-фосфатом
и фруктозо-6-фосфатом. Гексозы поступают в зону локализации
«своего» фермента путем диффузии в жидкой фазе цитозоля.
Глюкоза и фруктоза в растительных клетках могут образовываться
путем расщепления сахарозы на глюкозу и фруктозу ферментом
инвертазой в ходе необратимой реакции. Аналогичные продукты
образуются также при обратимом ферментативном расщеплении
сахарозы ферментом сахарозосинтетазой на УДФ-глюкозу, важный
предшественник пблисахаридов клеточной стенки, и фруктозу:
Сахароза + УДФ о УДФ-глюкоза + фруктоза.
Это весьма важная с энергетической точки зрения реакция,
так как УДФ-глюкозу можно затем превратить в
глюкозо-1-фосфат без потребления энергии АТФ, обычно используемой при
фосфорилировании свободной глюкозы:
УДФ-глюкоза + пирофосфат —> глюкозо-1-фосфат + УТФ.
Хотя пирофосфат, образуемый в результате отщепления двух
фосфатных групп от АТФ, потребляется в этой реакции, УТФ
образуется из УДФ. Глюкозо-1-фосфат и глюкозо-6-фосфат вза-
имопревращаемы в реакции, идущей без затрат энергии АТФ и
катализируемой фосфоглюкомутазой.
Таким образом, исключается первая энергопотребляющая
реакция гликолиза. В отсутствие сахарозосинтетазы первая
молекула АТФ, используемая в цикле дыхания, потребляется именно на
фосфорилирование глюкозы (рис. 58):
НСОН
I
НСОН
!
носн
I
НСОН
НС
АТФ
АДФ
СН2ОН
глюкоза
СН2О - Р
глюкозЪ-6-фосфат
Гликолиз
г °6
Глюкоза
Крахмал
Глюкозо-6-фосфат
Стадия 1
(АТФ потребляется)
Фруктозо-6-фосфат
АДФ
АТФ-
7|^
Стадия 2
(Расщепление)
Фруктозо-1,6-дифосфат
Диоксиацетонфосфат
Глицеральдегид-3-фосфат
Стадия 3
(АТФ образуется)
1,3-дифосфоглице-
риновая кислота
Н2РО,
3-фосфоглицериновая кислота
(2 ^/р) Фосфоенол-
3 ^^-' пировино-
градная кислота
2-фосфоглицериновая
^ кислота
Пировиноградная кислота
В цикл
Кребса
Брожение
С2+С,
Ацетальдегид + СО2
НАДН+Н
Этанол
НАДН+Н
►НАД+
174
Молочная кислота
НАД+
Рис. 58. Гликолиз и брожение
Для этой реакции необходимы катион магния и фермент гек-
сокиназа, функционирующий в нескольких формах. Одна- из
форм фермента может быть связана с любой органеллой и фос-
форилирует кроме глюкозы также фруктозу и другие гексозы.
Другая форма фермента прикреплена к наружной мембране
митохондрий и фосфорилирует главным образом глюкозу в ходе
необратимой реакции. Глюкозо-6-фосфат с помощью фермента
глюкозо-6-фосфатизомеразы обратимо превращается во фрукто-
зо-6-фосфат, который затем трансформируется в ходе реакции
фосфорилирования во фруктозо-1,6-дифосфат. АТФ как фосфо-
рилирующему агенту этой реакции также требуется катион
магния.
Далее молекула фруктозо-1,6-дифосфата под влиянием
фермента альдолазы обратимо расщепляется на две трехуглеродные
молекулы (дихотомический путь): фосфодиоксиацетон и 3-фое-
фоглицериновый альдегид (ФГА). Эти два сахара, являющиеся
также промежуточными продуктами фотосинтеза, свободно
могут трансформироваться друг в друга в реакции изомеризации.
В результате превращения фосфодиоксиацетона в ФГА
образуются две молекулы ФГА. Эта реакция рассматривается как
завершающая первый этап гликолиза, в ходе которого использованы
две молекулы АТФ для расщепления молекулы глюкозы на две
триозы.
В ходе второго этапа гликолиза из АДФ образуется АТФ, т. е.
клетка пополняет свой фонд энергии. Первой стадией на этом
пути является превращение 3-ФГА в 1,3-фосфоглицериновую
кислоту (ФГК) с участием НАД-зависимой дегидрогеназы. Эта
реакция протекает с потреблением НАД (НАД+), Рн и
завершается образованием НАДН (НАДН+Н+). По существу, это первая
реакция гликолиза, протекающая не с затратой, а с накоплением
энергии в результате восстановления нуклеотида НАД. Затем
фермент фосфоглицераткиназа катализирует превращение 1,3-
ФГК в 3-ФГК. В ходе этой реакции происходит фосфорилирова-
ние АДФ с образованием АТФ в процессе субстратного
фосфорилирования. Эта реакция высокоэкзоэргоническая и,
следовательно, необратимая. Термин «субстратное фосфорилирование»
говорит о том, что непосредственно субстраты реакции
участвуют в фосфорилировании АДФ (в данном случае один остаток
фосфорной кислоты от 1,3-фосфоглицерата переносится на
АДФ). В то же время окислительное фосфорилирование,
протекающее в митохондриях, не предусматривает прямого участия
субстратов дыхания.
В дальнейшем фермент фосфоглицератмутаза обратимо
катализирует превращение 3-ФГК, которая затем превращается в
ФЭП под действием фермента энолазы в М§-зависимой
реакции, а ФЭП трансформируется в энолпируват. Последняя
реакция включает субстратное фосфорилирование АДФ, в результате
176
чего образуется АТФ. Затем энолпируват превращается в пиру-
ват, чем и завершается второй этап гликолиза. В целом на
преобразование одной молекулы глюкозы в две молекулы ПВК
необходимо затратить две молекулы АТФ. При этом образуются
четыре молекулы АТФ и две молекулы НАДН. Одна молекула
НДДН, окисляясь, образует три молекулы АТФ, а всего — шесть
молекул АТФ. Следовательно, чистый выход энергии в ходе
гликолиза составляет восемь молекул АТФ.
Гликолиз — это процесс генерации энергии в клетке,
происходящий без поглощения О2 и выделения СОг- Поэтому его
скорость трудно измерить. Основной функцией гликолиза наряду с
образованием энергии служит активирование гексоз, достаточно
инертных, малореакционноспособных. В результате
синтезируются активные молекулы кислоты, подвергающиеся дальнейшим
преобразованиям. Кроме того, при гликолизе образуются интер-
медиаты, необходимые для синтетических процессов в клетке
(например, из ФЭП образуются фенольные соединения и
лигнин). Важную роль гликолиз играет также при расщеплении
крахмала хлоропластов до экспортных продуктов — триоз.
Вместе с тем отдельные реакции гликолиза выступают в линейной
последовательности. Это значит, что они менее саморегулируемы
из-за отсутствия обратной связи по сравнению, например, с
циклом Кребса. Тем не менее гликолиз находится под
постоянным контролем регуляторной системы клетки. Если, например,
энергетические потребности клетки возрастают, то концентрация
Рн в результате гидролиза АТФ увеличивается. Это активирует
ферменты гликолиза и одновременно ингибирует активность
ферментов пентозофосфатного цикла. При дефиците Рн,
наоборот, подавляется гликолиз и активируется пентозофосфатный
цикл. Подобная регуляция скорости гликолиза возможна также
на других участках цепи реакций.
3.5.2. ЦИКЛ ДИ- И ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)
Субстратом цикла трикарбоновых кислот (ТКК) служит ПВК,
окисляющаяся в аэробных условиях в строме митохондрий до
СОг и НгО (рис. 59). По существу, цикл представляет собой
окислительное декарбоксилирование ПВК в ходе ряда реакций,
названных в совокупности циклом Кребса (по имени
английского биохимика Г. А. Кребса, предложившего данную схему
распада ПВК в 1937 г.). ПВК перед вступлением в цикл подвергается
окислительному декарбоксилированию с участием дегидрогеназы
ПВК митохондриального происхождения. ПВК импортируется
или из цитозоля как продукт гликолиза, или образуется из
яблочной кислоты. Коферменты А и НАД также вступают в эту
177
Кофермент А
(СоА-ЗН)
СООН
С=О
I
сн,
| Пировиноградная кислота |
-НАД* Д
*НАДН+Н+-
1СО,
Щавелевоуксусная
кислота
Лимонная
кислота
цис- аконитовая
кислота
СООН
н-с-он
1
СН,
СООН
сн,
Н—С-СООН
н—с-он
I
СООН
| Изолимонная кислота|
на;;
| Щавелевоянтарная кислота]
АДФ+РН
Суммарный
результат
окисления
пирувата
в цикле
Кребса
Пируват-
Рис. 59. Цикл Кребса
реакцию, в результате чего образуются ацетил-КоА с
высокоэнергетической тиоэфирной связью, НАДН и СО2-
Для успешного протекания данной реакции необходимы
также другие кофакторы, включая ФАД, липоевую кислоту,
тиамин пирофосфат и двухвалентные катионы. В дальнейшем
фермент цитратсинтаза катализирует реакцию конденсаций ацетил-
КоА, ЩУК и воды с образованием лимонной кислоты и
комплекса КоА-8Н. Эта реакция ответственна за вхождение углерода
в цикл Кребса и, следовательно, контролирует его прохождение
по циклу.
В следующей реакции фермент аконитаза превращает
лимонную кислоту в цис-аконитовую, которая затем трансформируется
в изолимонную кислоту. Последняя под воздействием НАД-за-
висимой изоцитратдегидрогеназы окисляется в нестойкое
соединение — щавелевую кислоту, которая сразу же декарбоксилиру-
ется с образованием а-кетоглутаровой кислоты. При этом
образуется НАДН, а также первая в цикле и вторая после начала
метаболизации ПВК молекула СОг.
В ходе последующего окислительного декарбоксилирования
а-кетоглутаровой кислоты с помощью а-кетоглутаратдегидроге-
назного комплекса образуются НАДН, сукцинил-КоА и
выделяется СО2- Сукцинил-КоА в присутствии Рн и АДФ, в свою
очередь, превращается в сукцинат (янтарная кислота), что
сопровождается образованием АТФ в процессе субстратного фосфори-
лирования. Сукцинатдегидрогеназа, коферментом которой
служит ФАД, катализирует обратимое превращение янтарной
кислоты в фумаровую с образованием ФАДНг во время реакции.
Фумаровая кислота, реагируя с водой в присутствии фумарат-
гидратазы, образует яблочную кислоту (малат), которая затем с
помощью НАД-зависимой малатдегидрогеназы окисляется в
ЩУК. При этом образуется НАДН, а ЩУК может принимать
участие в дальнейших реакциях цикла Кребса. Центральную роль
в регуляции цикла Кребса играет отношение [НАДН]/[НАД+].
Расходование ацетил-КоА на метаболические потребности
клетки, например на синтез жирных кислот, также может
контролировать вход углерода в цикл Кребса.
В ходе реакции цикла потребляются одна молекула ПВК,
четыре НАД, одна АДФ, одна ФАД, две молекулы воды и
синтезируются четыре молекулы НАДН, одна АТФ, одна ФАДНг, Две
молекулы воды и выделяются три молекулы СО2. При этом от
компонентов цикла отщепляется пять пар атомов водорода
(электронов). Поскольку на каждую расщепляющуюся молекулу
глюкозы приходятся два оборота цикла Кребса (если промежу-
' точные продукты не извлекаются из гликолиза и цикла ТКК на
другие метаболические нужды), соответственно указанный
энергетический выход также удваивается.
Электроны НАДН и ФАДНг, образованные в цикле Кребса,
179
. могут передаваться по ЭТЦ, образуя АТФ из АДФ и Рн при
окислительном фосфорилировании. Окисление каждой молекулы
НАДН или НАДФ(Н) дает три молекулы АТФ, а окисление
ФАДНг — две АТФ. Следовательно, при полном окислении ПВК
образуются 15 молекул АТФ и 30 АТФ при двух оборотах цикла
(табл. 12).
12. Вклад различных механизмов накопления энергии в образование
АТФ при аэробном окислении глюкозы
Тип механизма,
участвующего в накоплении энергии
Реакция
Выход АТФ на
одну молекулу
глюкозы
Субстратный (гликоли-
тический)
Субстратный
(дыхательный)
Фосфорилирование в
дыхательной цепи (ко-
ферментное
фосфорилирование)
Итого
За вычетом
энергозатрат при гликолизе
(-2АТФ)
ФГА+НАД+ -» ФГК+НАДН
ФГК -» ПВК (пируват)
ПВК+НАД+ -> цитрат+НАДН
а-кетоглутарат -> янтарная кислота
НАДН -> ФП
цитохром Ь -> цитохром с
цитохром с -> О2
2
2
0
2
10
12
12
40
38
Если сюда добавить 8 АТФ, образованных в ходе гликолиза,
получается 38 АТФ, синтезированных при полном окислении
молекулы глюкозы. Принято считать, что энергия третьей слож-
ноэфирной фосфатной связи АТФ равняется примерно
42 кДж/моль (10 ккал/моль). Отсюда следует, что при полном
окислении глюкозы до СО2 и Н26 образуется 1591 кДж/моль
(380 ккал/моль) энергии, в то время как изменение свободной
энергии составляет 2872 кДж/моль (686 ккал/моль). Таким обра-
зом эффективность использования энергии составляет т^ЮО =
ооо
= 55 %.
Однако подобная эффективность отмечена лишь в
стандартных условиях, т. е. при температуре 25 °С, давлении 1 Па и
концентрации реагирующих веществ 1 М. Вместе с тем
большинство реакций в растениях протекает в условиях, далеких от
равновесия. Поэтому эффективность, равная 55 %, не отражает
реальной эффективности дыхания в интактных клетках растения.
3.5.3. ОКИСЛИТЕЛЬНЫЙ ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ
Глюкозо-6-фосфат, образованный в начале гликолиза в
результате фосфорилирования глюкозы, может подвергаться
дальнейшим преобразованиям в окислительном пентозофосфатном
цикле (нельзя смешивать с восстановительным пентозофосфат-
180
ным циклом при фотосинтезе). Пентозофосфатный цикл, или
гексозомонофосфатный шунт, часто называют апотомическим
окислением в отличие от гликолитического цикла, называемого
дихотомическим (распад гексозы на две триозы). Цикл условно
можно разделить на две фазы: непосредственно окислительную и
регенерации. Первая включает превращение глюкозо-6-фосфата
и двух молекул НАДФ в рибулозо-5-фосфат, две молекулы
НАДФН и СО2 (рис. 60). Вначале глюкозо-6-фосфат окисляется
дегидрогеназой, в результате чего образуются НАДФН и 6-фос-
фоглюконовая кислота:
СбНцОб(Н2РО4) + НАДФ + Н2О = СбНцОб(Н2РО4) + НАДФН,
которая затем подвергается декарбоксилированию с
образованием пятиуглеродных фосфорилированных Сахаров (рибозо-5-фос-
фат) и СО2:
СбНпОб(Н2РО4) + НАДФ = С5Н9О4(Н2РО4) + НАДФН + СО2.
Рибозо-5-фосфат способен переходить в ходе реакции
изомеризации в кетоформу рибулозо-5-фосфат. Эти сахара выполняют
в клетке разные функции: они включаются в полимеры
клеточной стенки (пентозаны), расщепляются при обмене веществ с
образованием СОг, НгО и АТФ, включаются в нуклеотиды РНК
и ДНК или участвуют в синтезе высокоэнергетических
соединений, таких, как АТФ.
В фазе регенерации участвуют только фосфорные эфиры саха-
ров, причем те же, что и в фотосинтетическом цикле Кальвина.
В ходе процесса образуются седогептулозо-7-фосфат, эритрозо-4-
фосфат, фруктозо-6-фосфат и ФГА. Наличие общих
промежуточных продуктов в цикле Кальвина и ОПЦ свидетельствует о
тбм, что эти соединения могут переходить в случае
необходимости из одного цикла в другой. Совокупность реакций ОПЦ
заключается в том, что из шести молекул глюкозо-6-фосфата одна
молекула окисляется до СОг, а остальные пять регенерируют
вновь и выходят из цикла. При этом восстанавливаются 12
молекул НАДФ. Суммарное уравнение ОПЦ выглядит так:
6 глюкозо-6-фосфат + 12НАДФ+ + 7Н2О ->
5 глюкозо-6-фосфат + 6СО2 + 12НАДФН + 12Н+ + Н3РО4.
ОПЦ представляет собой анаэробное окисление,
сопровождаемое в отличие от гликолиза выделением СОг- Этот процесс,
так же как и гликолиз, локализован в цитоплазме, но частично
происходит и в пластидах. В цикле восстанавливаются 12 моле-
181
6 НАД
СН2О®
глнжозо-6-фосфат
(пиранозная форма)
СН2О©
6-фосфо-
глкжонолактон а
СООН
СКОН
I
носн
6 СНОН |3 |
с нон
сн2о© .
6-фосфоглкжоновая
кислота
77)
сн,он
с=о
СНОН
снон
СН2О®
рибулозо-5-
фосфат
и I хн
СНОН
СНОН
СНОН
СН2О©
рибозо-5-
фосфат
СН2ОН
с=о ..
носн
СНОН
2 I
СНОН
СНОН
СН2О®
Т\
СН2ОН
с=о
2 носн
СНОН
СН2О®
ксилулозо-5-
фосфат
СНОН
СН2О®
3-фосфо-
глицери-
новый
альдегид
?с
СНОН
I _
СН2О®
3-фосфо-
глицери-
новый
СН2О®
С=О
НОСН
СНОН
СНОН
СН2О©
фруктозо-1,6-
дифосфат
2 СНОН
СН2О©
ксилулозо-5-
фосфат
/ О
СНОН
НОСН
СНОН
СНОН
СН2О®
глнжозо-6-
^ фосфат
СН2ОН
с=о
носн
СНОН
2 I
СНОН
СН2О®
СНОН
СН2О®
фруктозо-6-
фосфат
С=О
СН2ОН
3-фосфоди-
оксиацетон
сн;
,он
1
с=о
носн
СНОН
СНОН
СН2О®
фруктозо-6-
фосфат
Рис. 60. Пентозофосфатный цикл:
/ — глюкозо-6-фосфатдегидрогеназа; 2 — глюконолактоназа; 3 — фосфоглюконатдегидроге-
наза; 4 — фосфопентоэпимераза; 5 — фосфопентоизомераза; 6, 8 — транскетолаза; 7—транс-
альдолаза; Р—триозофосфатизомераза; 10— альдолаза; // — фосфатаза; 12 — гексофосфати-
зомераза
кул НАДФ, и в результате транспорта электронов от НАДФН по
дыхательной цепи митохондрий синтезируется 12 • 3 = 36
молекул АТФ. Чистый выход энергии за вычетом молекулы АТФ,
потраченной на фосфорилирование глюкозы, составит 35
молекул АТФ. Однако наибольшее значение этот цикл имеет как ■*
источник водорода из НАДФН, необходимого для
восстановительного синтеза аминокислот, жирных кислот и других
соединений. Эритрозо-4-фосфат — промежуточный продукт цикла —
принимает непосредственное участие в образовании шикимовой
кислоты, необходимой для синтеза фенолов, ауксинов и других
ароматических физиологически активных соединений.
В регуляции скорости пентозофосфатного цикла наряду с
концентрацией Рн, контролирующего также гликолиз, важную
роль играет содержание НАДФ+, которое тесно коррелирует со
скоростью ОПЦ. Так, например, восстановительное аминирова-
ние кетокислот, как и другие биосинтезы, протекающие с
использованием НАДФН и соответственно увеличением НАДФ+,
активирует ОПЦ. Важную роль в переключении с гликолиза на
ОПЦ играет эритрозо-4-фосфат.
3.6. АНАЭРОБНОЕ И АЭРОБНОЕ ДЫХАНИЕ
Еще в начале прошлого века было установлено, что ткани
высших растений, лишенные кислорода, находясь в атмосфере
чистого азота или водорода, продолжают выделять СО2- Такое
дыхание было названо интрамолекулярным
(внутримолекулярным) исходя из предположения, что оно осуществляется за счет
кислорода самого субстрата. Позднее было показано, что этот
тип дыхания, как и нормальный, связан с участием
дегидрирующих ферментов, а также коферментов, переносчиков фосфатных
групп и т. д.
В соответствии с современными представлениями процесс
дыхания состоит из двух этапов. В ходе первого этапа, которому
кислород не нужен, дыхательный субстрат, например глюкоза,
распадается до ПВК, которая в ходе второго этапа может
окисляться в присутствии О2 до СО2 и воды. Если же процесс
превращения ПВК осуществляется в анаэробных условиях,
протекает брожение с образованием СОг-
Л. Пастер (1860) первый, кто показал, что брожение есть
проявление жизнедеятельности дрожжей, необходимое для
поддержания их существования в бескислородной среде. Распад и
окисление углеводов до стадии ПВК совершаются тождественными
путями как в процессе брожения, так и аэробного дыхания. В
этом заключается генетическая связь этих процессов. Вместе с
тем химизм брожения более простой, чем химизм нормального
кислородного дыхания. При брожении происходит лишь расщеп-
183
ление дыхательного материала, тогда как при дыхании идет
расщепление, связанное с окислением. Так, при спиртовом
брожении организмы, сбраживающие углеводы (дрожжевые клетки),
обладают активной в анаэробных условиях декарбоксилазой
ПВК. Под действием этого фермента от ПВК отщепляется СО2
и образуется уксусный альдегид, выступающий в качестве
акцептора водорода от восстановленного НАД:
сн3сосоон
пировиноградная
кислота
декарбоксилаза
-СО, '
СН3СНО
СО2
сн,
С=О +НАДН + Н
I
н
уксусный
альдегид
алкогольдегидрогеназа
уксусный
альдегид
СН3
I
*■ СН2ОН + НАД
этиловый
спирт
При молочнокислом брожении, осуществляемом
молочнокислыми бактериями, ПВК не декарбоксилируется, а
непосредственно восстанавливается с участием специфического фермента
лактатдегидрогеназы. Донором водорода для этой реакции
является восстановленный НАД:
лактатдегидрогеназа +
СН3СОСООН + НАДН2 ^ СН3СНОНСООН + НАД
Этот тип брожения часто встречается в клубнях картофеля,
корнеплодах моркови и свеклы, прорастающих семенах. Если
ПВК подвергается окислительному декарбоксилированию,
образуется уксусная кислота:
СНзСО СООН
пировиноградная
кислота
СНзСООН + СО2.
уксусная кислота
Уксусная кислота путем конденсации превращается в ацето-
уксусную, которая, восстанавливаясь, дает масляную кислоту
сн3сн2сн2соон.
Указанные реакции представляют собой возможные
химические пути превращения ПВК в анаэробных условиях. Однако в
ходе брожения высвобождается мало энергии, поскольку
конечные продукты реакций обладают большим запасом
нереализованной химической энергии. Так, 1 моль глюкозы со свободной
энергией 2872,14 кДж высвобождает энергию при спиртовом
184
брожении 118,07, при молочнокислом — около 41,87, при масля-
нокислом — около 62,80 кДж. Таким образом, энергетическая
эффективность брожения довольно низкая.
Анаэробный и аэробный пути превращения дыхательного
субстрата являются двумя сторонами единого дыхательного
процесса. В отсутствие кислорода основным источником энергии в
клетке служат гликолиз и брожение, а в аэробных условиях —
окислительное расщепление дыхательных субстратов. О связи
процессов брожения и дыхания свидетельствует также то, что в
растениях выявлены те же промежуточные продукты и
ферменты, что и при спиртовом брожении, даже в тканях растений,
нормально снабжающихся кислородом.
3.7. ЭЛЕКТРОННО-ТРАНСПОРТНАЯ ЦЕПЬ ДЫХАНИЯ
И ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Электронно-транспортная цепь дыхания. В рассмотренных
реакциях цикла Кребса и при гликолизе молекулярный кислород
не участвует. Потребность в кислороде возникает при окислении
восстановленных переносчиков НАДН и ФАДНг, в которых
заключена значительная энергия. Процесс высвобождения
энергии, осуществляемый постепенно, заключается в передаче
электронов от НАДН и ФАДНг по ЭТЦ на свободный кислород,
который, таким образом, служит терминальным акцептором
электронов (рис. 61). ЭТЦ растений состоит из четырех мульти-
белковых комплексов и двух небольших компонентов — убихи-
нона и цитохрома с, расположенных как на внутренней
мембране митохондрий, так и внутри нее. Комплексы I, III и IV
представляют собой пункты сопряжения транспорта электронов с
фосфорилированием. Компоненты дыхательной цепи
(переносчики электронов) в определенной мере мобильны, поскольку
они как бы представляют собой составную часть жидкого липид-
ного бислоя и, по данным Б. Чанса и др. (1956), расположены в
порядке, указанном на рисунке 61.
Следовательно, ЭТЦ представляет сложное образование,
состоящее из нескольких десятков белковых молекул и лежащее
между метаболитами цикла ТКК с одной стороны и кислородом
воздуха с другой. Белки выполняют в основном структурную
функцию, входят в состав сопрягающего фактора, а также
являются переносчиками электронов. Простетическими группами
белков-переносчиков служит, как отмечалось, наряду с флави-
' ном и гемом железо, имеющее переменную валентность и,
следовательно, легко переходящее из одной формы в другую.
Например, в гемсодержащих цитохромах поступающие к ним по
ЭТЦ электроны восстанавливают железо, переводя его из окис-
ной формы (Ре ) в закисную (Ре ). Каждый такой переносчик
185
НАДН
(мощный донор
электронов)
ФАДН2
(мощный донор
ектронов)
Н20
Рис. 61. Передача энергии по цепи переносчиков электронов в митохондриальной
мембране
находится на несколько более низком уровне восстановленности,
чем его предшественник, и в соответствии с этим содержит
меньше энергии. Зная окислительно-восстановительный
потенциал отдельных компонентов ЭТЦ, их можно расположить в
порядке его убывания — от —0,32 у дыхательного субстрата до
+0,82 у кислорода.
Электроны скатываются с этой «энергетической» горки
благодаря разности потенциалов не сразу, а постепенно, что
позволяет, во-первых, избежать неэффективного выброса энергии и,
во-вторых, связать энергию в форме химических связей АТФ,
образуемых из АДФ и Рн. В этом, по существу, и заключается
физиологический смысл транспорта электронов.
На каждую молекулу НАДН, передающую свои электроны в
ЭТЦ, синтезируются три молекулы АТФ, а на каждую молекулу
ФАДН2 — две. Процесс фосфорилирования АДФ с образованием
АТФ, сопряженный с транспортом электронов от дыхательного
субстрата к О2, получил название окислительного
фосфорилирования. Этот процесс является основным источником энергии
АТФ в клетке в нормальных физиологических условиях,
требующим достаточно сложной структуры как ЭТЦ дыхания, так и
186
самих митохондрий. Нарушение в любой точке цепи переноса
электронов при стрессе полностью блокирует транспорт
электронов. Так, дыхательные яды (цианид, окись углерода) могут
соединиться с железом цитохромов, вследствие чего Ре не
переходит в Ре . В этом случае функция энергообеспечения клетки
переходит к гликолизу как к более надежному и
филогенетически относительно старому механизму и к окислительному пенто-
зофосфатному циклу, который не блокируется при обработке
динитрофенолом. Не случайно активность ОПЦ заметно
возрастает при дефиците питания, влаги, света, а также при старении.
Окислительное фосфорилирование. Главной особенностью
внутренней мембраны митохондрии является присутствие в ней
белков — переносчиков электронов. Эта мембрана непроницаема для
ионов водорода, поэтому перенос последних через мембрану
осуществляется с помощью специфических переносчиков. Так,
например, в мембране локализована система цитохромоксидазы,
включающая цитохром с, локализованный вблизи внешней поверхности
мембраны, цитохром а, расположенный в центре мембранного мат-
рикса, и цитохром а^, примыкающий к ее внутренней поверхности.
По мнению П. Митчелла (1961), именно особенности
структуры внутренней мембраны, локализации в ней переносчиков и
функционирования ферментных белков обеспечивают
разделение зарядов атома водорода: протонов на внешней, а
электронов — на внутренней поверхности мембраны (рис. 62).
Вследствие этого на внутренней митохондриальной мембране возникает
протонный градиент АцЯ, поддерживаемый непроницаемостью
мембраны для протонов. Большая его часть приходится на
градиент электрического заряда (Д\|/), меньшая — на градиент
концентрации (АрН). Если же применять ядовитые вещества,
образующие протонные каналы через мембрану, то происходит
«утечка» ионов водорода, и протонный градиент исчезает.
В мембране имеются три петли, организованные белками —
переносчиками электронов, «прошивающими» мембрану
насквозь при переносе ё от НАДН на кислород. В результате этого
электроны трижды выносятся на внутреннюю поверхность, а
протоны остаются снаружи, что и создает между сторонами
мембраны протонный градиент ДцЯ. При этом с внутренней
стороны митохондриальная мембрана оказывается более щелочной, а
с наружной — более кислой.
Кроме этой в мембране имеются еще несколько систем,
генерирующих мембранный потенциал. Например, АТФ-аза создает
на мембране АцЯ за счет гидролиза макроэргической связи АТФ
И/активного переноса протона на внешнюю поверхность
мембраны. Энергетическая емкость сопрягающих мембран невелика,
что не дает возможности запасать большое количество энергии в
форме А\1Н. Поэтому последняя превращается в более стабиль-
187
Электрический
потенциал
Низкая концентрация
протонов
Грибовидный вырост
{фактор сопряжения)
Рис. 62. Образование АТФ в митохондриях с точки зрения хемиосмотической
теории. (С изменениями по Р. С. Шпк1е и К. Е. МсСагШу, 1978.)
ную и универсальную химическую форму макроэргических
связей в молекулах АТФ -в ходе окислительного фосфорилирования.
Суть его заключается в образовании молекулы АТФ из АДФ и
неорганического фосфата Рн. Суммарный заряд молекулы АДФ
равен -6, а продукта реакции АТФ -4. Поэтому превращение
АДФ в АТФ требует двух положительных зарядов:
АДФ"6 + Рн + 2Н+ -> АТФ"4 + НгО.
Эти два протона переносятся по каналам, имеющимся в
грибовидных выростах с внешней поверхности мембраны, за
счет Д|1#, в результате чего с помощью встроенной в мембрану
АТФ-синтетазы образуется АТФ. Поскольку движение
протонов, АДФ и Рн через мембрану происходит по градиенту
концентрации (осмотически), теория окислительного
фосфорилирования получила название хемиосмотической. АТФ — молекула,
богатая энергией, поскольку ее трифосфатный компонент
содержит две фосфоангидридные связи. Образующаяся при
гидролизе молекулы АТФ энергия может быть использована на
синтез веществ, активный транспорт против электрического
градиента, всякого рода движения, сократительную деятельность
белков, генерацию заряда на мембране, биохемилюминесцен-
цию. АТФ является главным донором свободной энергии в
растении, а не формой ее запасания. АТФ в клетке
используется в течение минуты после ее образования, т. е. оборот
АТФ очень высок.
188
Альтернативный путь дыхания. Наряду с широко
распространенным цитохромным путем переноса электронов по ЭТЦ в
растениях может функционировать альтернативный, устойчивый
к действию цианида транспорт электронов. В этом случае поток
электронов может обходить комплексы III и IV переносчиков
ЭТЦ, где транспорт электронов сопряжен с активным
транспортом протонов и фосфорилированием. В результате отношение
Р:О и, следовательно, эффективность дыхания значительно
снижаются. Альтернативный путь дыхания характерен практически
для всех видов растений. Доля этого пути в общем поглощении
02 может доходить до 50 %, причем она выше в корнях, чем в
листьях. Физиологическая роль этого пути не вполне ясна.
По мнению Г. Ламберса (1985), альтернативный путь служит в
качестве «клапана» сброса избытка энергии в растении, особенно
для тех органов, куда поступают ассимиляты с высоким
отношением С:И и где невозможно хранение избыточных количеств
углеводов, например, в корнях. Так, в молодых корнях моркови
и сахарной свеклы вклад альтернативного пути в общее дыхание
составил 50 %, а в зрелых корнеплодах — лишь 25 %.
Альтернативный путь может также способствовать окислению НАД-Н при
высоком содержании АТФ, обеспечивая таким образом быстрое
функционирование гликолиза и цикла ТКК в отсутствие ингиби-
рования избытком НАД-Н. Альтернативный путь действует тогда,
когда предложение ассимилятов превышает спрос и скорость
переноса электронов на убихинон превосходит способность ци-
тохромного пути транспорта электронов или последний
насыщен.
Однако оценить вклад альтернативного пути в общее дыхание
достаточно сложно, поскольку установлены факты переключения
переноса электронов с альтернативного на цитохромный путь и
обратно. Механизмы, регулирующие переключение, пока не
выявлены. Задача усложняется тем, что вклад альтернативного пути
в значительной мере определяется условиями выращивания
культур.
3.8. ВЗАИМОСВЯЗЬ РАЗЛИЧНЫХ ТИПОВ
ЭНЕРГЕТИЧЕСКОГО ОБМЕНА В РАСТЕНИИ
Каждый механизм накопления энергии вносит определенный,
но неравнозначный вклад в общий фонд образования АТФ в
клетке. Разные пункты сопряженного фосфорилирования в ЭТЦ
также неравноценны с точки зрения энергетической
эффективности. При величине Р:О=3 около 2/з всего количества АТФ,
образуемого при аэробном дыхании, должно поставляться вторым
и третьим фосфорилированием дыхательной цепи, т. е. переносом
электронов, связанным с цитохромной системой. Из основных
189
субстратов только янтарная кислота и ацетил-КоА окисляются,
минуя НАД4" и первую точку фосфорилирования в ЭТЦ.
За счет субстратного фосфорилирования в цикле Кребса
образуются только две молекулы АТФ, за счет коферментного — 34.
В ходе гликолитического фосфорилирования за вычетом затрат
на запуск гликолиза образуются две молекулы АТФ, за счет
коферментного — 34. Хотя вклад гликолиза как анаэробной фазы
в общий фонд энергии клетки ниже, чем вклад аэробной фазы,
гликолиз является одним из важных поставщиков энергии при
дефиците кислорода в ткани. Кроме того, факторы, нарушающие
фосфорилирование в митохондриях, не затрагивают гликолити-
ческой энергетической системы.
Роль гликоза в синтезе АТФ возрастает и тогда, когда энергия
ЭТЦ дыхания используется не для фосфорилирования, а на эн-
дэргонические функции митохондрий (активный транспорт
ионов, конформационные изменения митохондрий и др.).
Значение гликолиза как поставщика энергии заключается еще в том,
что биосинтетические процессы, локализованные в цитоплазме,
легче используют АТФ, образующуюся в гликолитическом фос-
форилировании непосредственно в цитоплазме.
Таким образом, гликолиз, как и субстратное
фосфорилирование, не требует высокой степени структурной организации фос-
форилирующих механизмов, которые необходимы сопряженному
фосфорилированию в ЭТЦ. Поэтому они не нарушаются при
повреждении структуры митохондрий. Кроме того, субстратное
фосфорилирование нечувствительно к ДНФ и другим факторам,
угнетающим коферментное фосфорилирование, например, при
разрушении митохондрий. Вышесказанное позволяет считать
гликолиз и субстратное фосфорилирование более надежными
источниками энергии в клетке, особенно в неблагоприятных
условиях выращивания. Однако для оптимального
функционирования клетки важны все механизмы образования макроэргов,
поскольку растительные организмы произрастают в изменяющихся
условиях среды. Например, существенные изменения в
соотношении между отдельными путями дыхания наступают у растений
под влиянием фотопериодического воздействия. Так, длинный
день активирует аэробные превращения дыхательного субстрата,
а короткий день — гликолитические процессы и пентозофосфат-
ный цикл. В период роста листа растяжением скорость
гликолиза и цитохромного пути снижалась, а скорость альтернативного
пути оставалась постоянной.
3.9. РОЛЬ ДЫХАНИЯ В БИОСИНТЕТИЧЕСКИХ ПРОЦЕССАХ
Тесная связь дыхания с биосинтетическими функциями
клетки не ограничивается использованием реализуемой в ходе
окислительных процессов химической энергии дыхательного субстра-
190
та. Промежуточные продукты дыхания могут использоваться в
процессах новообразования компонентов протоплазмы (рис. 63).
Например, аминирование а-кетоглутаровой кислоты приводит к
образованию глутаминовой кислоты:
соон
I
о=с
■ I +^
Н2С
I
Н2С
I ■•
соон
СООН
+ НАД(Ф) • Н + Н
I
сн2
I
сн2
■Л г
соон
НАД(Ф)
К аминированию путем непосредственного присоединения
аммиака способны также ПВК и ЩУК. Так, прямое
аминирование ПВК приводит к образованию аланина:
сн3сосоон +
пировиноградная
кислота
НАДФ'Н
•- сн3снсоон
В процессах восстановительного биосинтеза используется
почти исключительно НАДФ-Н, тогда как НАД Н потребляется
преимущественно для генерирования АТФ.
С окислительными превращениями трикарбоновых кислот в
цикле Кребса тесно связаны процессы биосинтеза жиров.
Конденсация двух молекул уксусной кислоты при участии КоА
приводит к образованию ацетоуксусной кислоты, при
восстановлении которой получается масляная кислота:
СН3СОСН2СООН
ацетоуксусная кислота
СНЗСН2СН2СООН
масляная кислота
Путем последовательного присоединения ацетильных
радикалов, активируемых КоА, и происходит наращивание углеродной
цепи — синтез жирных кислот в организме. ■
В ходе гексозомонофосфатного дыхания образуются активные
формы пентоз, участвующие в построении важнейших
соединений клетки. У гетеротрофных организмов гексозомонофосфатное
дыхание представляет единственный путь в образовании пентоз.
Таким образом, промежуточные продукты дыхания могут дать
начало всем основным компонентам растительной клетки, и
дыхание в этом случае выполняет функции, которые по своему
191
Гексоза■
Гликолиз
Глицерин
Пировиноградная ■
кислота
Пентозный
шунт
Полимеры клеточной
<г стенки
^-*-Ную1еотиды ,^
N. \ кислоты
АроматическиеЧ цИТОкинины
аминоки (гормоны)
аминокислоты
Фенольные
соединения
Индолилуксусная
кислота (гормон)
Переаминирование
(NN3)
Ацетил-СоА
Алании
,икл
Щавелевоуксусная
кислота
V ■
Аспарагановая
кислота
/(Ш3)
ЮЯN.
Жирные кислоты
Терпеноиды
Стероиды
Изопреноиды
Гибберелловая
кислота
Абсцизовая кислота
Белки
гы,/
в- /
Прочие
нокислоты,
образовавшиеся путем
переаминиро-
вания, в том
числе и серу-
содержащий
метионин
♦
Этилен
а- кетоглутаровая
кислота
!\У
(1МН3)
Тлутаминовая кислота
Прочие аминокислоты,
образовавшиеся путем
переаминирования
Рис. 63. Промежуточные продукты превращений,
происходящих при окислении углеводов в процессе дыхания
значению для синтетической функции клетки не уступают
фотосинтезу. Далее эритрозо-4-фосфат, образующийся на одном из
этапов пентозофосфатного цикла, образует в результате
взаимодействия с ФЭП циклическое соединение — шикимовую
кислоту. Последняя составляет материальную основу для синтеза всех
ароматических аминокислот и в их числе триптофана, который,
в свою очередь, является предшественником гетероауксина —
основного ростактивирующего гормона растительной ткани.
Шикимовая кислота после ряда превращений может дать
начало ароматическим аминокислотам — фенилаланину и
тирозину, последующее дезаминирование которых приводит к образо-
192
ванию веществ вторичного происхождения — коричных кислот и
кумаринов. С синтезом последних, в свою очередь, связано
образование полифенолов. При декарбоксилировании аминокислот
образуются амины, являющиеся предшественниками алкалоидов.
Важная роль принадлежит дыханию в биосинтезе зеленых
пигментов листа, что свидетельствует о тесной связи фотосинтеза и
дыхания.
Из изложенного видно, что окислительные превращения
дыхательного субстрата занимают важное место в процессах
биосинтеза не только белков, жиров и углеводов, но и регуляторов
процессов обмена — ферментов и коферментов, веществ
вторичного происхождения и гормонов.
3.10. СВЯЗЬ ДЫХАНИЯ И ФОТОСИНТЕЗА
Взаимосвязь дыхания и фотосинтеза — одна из важных и
вместе с тем сложных проблем физиологии растений. Хотя при
фотосинтезе растение использует конечные продукты дыхания, а
субстратами дыхания служат продукты фотосинтеза, эти два
процесса в течение длительного периода рассматривали как
диаметрально противоположные. Действительно, при фотосинтезе
происходит синтез органического вещества, при дыхании — его
распад, при фотосинтезе осуществляется восстановление, а при
дыхании — окисление вещества. АТФ, образуемый в
митохондриях, ^Используется практически на все внутриклеточные
процессы, а АТФ хлоропластов — главным образом на процессы
ассимиляции СО2- Кроме того, при дыхании укорочение углеродной
цепи происходит в результате декарбоксилирования веществ, а
при фотосинтезе — карбоксилирования.
Однако, несмотря на все различия, фотосинтез и дыхание
тесно связаны. Например, если рассматривать на молекулярном
уровне одинаковые начальные и конечные этапы цикла
Кальвина и пентозофосфатного пути, многие промежуточные продукты
и каталитические системы тождественны. Промежуточные
продукты обоих процессов широко используются в различных
биосинтезах. Основными функциями как митохондрий, так и
хлоропластов являются транспорт электронов и сопряженные с
переносом электронов процессы связывания энергии в виде АТФ
при фосфорилировании.
При фотосинтезе активирование электрона происходит за
счет энергии кванта света, при дыхании — за счет энергии
химических связей, сосредоточенной в молекуле дыхательного
субстрата. Однако свободная энергия любого органического
соединения генетически связана с фотосинтезом. Следовательно, как
при фотосинтезе, так и при дыхании источник образования
активного электрона — это электромагнитная энергия кванта света.
193
Много общего обнаруживают компоненты ЭТЦ митохондрий
и хлоропластов. Последнее позволяет считать, что при
формировании каталитических систем аэробного дыхания, возникших в
эволюционном отношении вслед за фотосинтезом, были широко
использованы важнейшие компоненты ЭТЦ фотосинтеза.
Ультраструктура и химический состав органелл не только
принципиально близки, но и во многих отношениях общие. Обе
органеллы способны самостоятельно осуществлять синтез
белков. Это свидетельствует о большой автономности этих органелл
и способности к самовоспроизведению, подтверждает идею об их
происхождении от общего предшественника — пропластиды.
Кроме того, практически все продукты процесса гликолиза,
цикла Кребса и гексозомонофосфатного пути обычно
обнаруживаются в группе соединений, относящихся к самым ранним
продуктам фотосинтеза.
Все это свидетельствует о несостоятельности попыток
противопоставить дыхание фотосинтезу с общебиологической точки
зрения. Как отмечал П. С. Беликов (1980), гликолиз —
анаэробное дыхание — филогенетически, вероятно, был первым
поставщиком энергии для клетки. Фотосинтез, появившийся в
эволюции позднее, обогатил атмосферу кислородом, в результате чего
стало возможным аэробное дыхание. Пентозофосфатный цикл,
проходящий в условиях высокого содержания кислорода, мог
возникнуть еще позднее.
Тесная связь между фотосинтезом и дыханием сохраняется
также на уровне целого растения. С тех пор как П. Бойсен-Йе-
нсен (1932) ввел понятие «нетто-ассимиляция», а А. Я. Кокин
составил известное уравнение: «Прирост = фотосинтез —
дыхание», последнее стало рассматриваться главным образом как
растрата ассимилятов (цит. по О. А. Семихатовой, 1987). В этот
период считалось, что уменьшение дыхания приводит к
повышению продуктивности растения.
Концепция «медленное дыхание — высокая продуктивность»
обязана своим происхождением обнаруженной среди зерновых
культур отрицательной корреляции между интенсивностью
дыхания корней и скоростью роста при дефиците влаги. Сорта с
низкой ИД корней имели, как правило, более высокую
продуктивность при одинаковой ИФ. Однако позже было отмечено, что
высокая активность дыхания может компенсироваться
увеличением фотосинтеза, а также ускорением роста и развития
растений. Подобная неоднозначная оценка роли дыхания
подтверждает высказывание В. А. Бриллиант о том, что вопрос о
соотношении фотосинтеза и дыхания в процессе создания урожая выходит
далеко за рамки простого сопоставления функций синтеза и
распада органических соединений растения.
Действительно, скорость как дыхания, так и фотосинтеза
может служить показателем функциональной стойкости расте-
194
Рис. 64. Зависимость скорости
газообмена посевов от ИЛП (по К. I.
МсСгее, I. Н. ТпищМоп, 1966):
Р% — гросс-фотосинтез; Р„ — нетто-фото-
синтез; К — дыхание
ний, и их измерение позволяет
выявить причины изменений
продуктивности в конкретных
условиях среды. По мнению
О. В. Заленского (1977), в ряде
случаев по изменениям
фотосинтеза и дыхания можно
предсказать не только направление
изменений продуктивности
растений, но и ее величину.
В конце 60-х годов для
посевов многих
сельскохозяйственных культур (пшеница, рис,
люцерна, хлопчатник и др.) было
установлено, что дыхание
возрастает не прямо
пропорционально увеличению листового
индекса или сырой массы
растения, как считали ранее. При
определенной величине листового индекса кривая дыхания, как и
фотосинтеза, выходит (или почти выходит) на плато (рис. 64).
Скорость накопления биомассы также не имеет максимума и,
следовательно, нет оптимального ИЛП. Эти данные привели
исследователей к мысли о тесной связи фотосинтеза и дыхания
посева, что количественно было впервые выражено голландским
ученым Мак Кри в 1970 г.:
К= аРч+ ЬЩ
где Аи Рд — соответственно скорость дыхания и суммарный фотосинтез единицы
площади посева, г СО2/(м2сут); IV— сухая биомасса, г, выраженная в
эквивалентах СОг; а и Ь — коэффициенты дыхания соответственно на рост и на
поддержание.
Таким образом, дыхание посева состоит из дыхания на рост
Рд) и дыхания на поддержание {ЬЩ.
Коэффициент дыхания на рост изменяется в небольших
пределах (0,2—0,3), гораздо шире изменяется коэффициент дыхания
на поддержание — 0,01—0,04, имеющий размерность скорости —
г/(гсут). Величины коэффициентов указывают на то, что в
суточном балансе углерода от 20 до 30 % гросс-фотосинтеза
тратится на дыхание роста и 1—4 % уже накопленной биомассы —
на дыхание поддержания. Дыхание на рост обеспечивает
энергией синтез новой биомассы, т. е. превращение продуктов
фотосинтеза, например глюкозы, в белки, жиры, липиды и углеводы.
Круг процессов, именуемых термином «поддержание», четко
не очерчен. В целом они связаны с энергией, затрачиваемой на
ресинтез ферментативных и структурных белков, липидов, РНК
195
и ДНК, обновляющихся в ходе обмена веществ; поддержание в
клетках необходимой концентрации ионов и величины рН;
сохранение внутриклеточного фонда метаболитов;
физиологическую адаптацию, обеспечивающую функционально активное
состояние структур.
Количественное разделение дыхания на компоненты и оценка
их величин с физиологических позиций позволяют выявить
особенности использования ассимилятов растениями в зависимости
от условий произрастания. Это хорошо видно на следующей
схеме:
Д.У»
Гросс-фотосинтез растения (Рч), суммированный в течение
фотопериода, формирует определенное количество субстрата
(Л^У), часть которого (А$т) используется для генерации энергии
и углеродного скелета, необходимого для поддержания статус-
кво клетки. Иными словами, А5т-ЬЖ Остальная часть
субстрата (А5д) расходуется на процессы роста массы (А.Щ и
связанное с последним дыхание, называемое дыханием роста
(А5д или аРд). Разделение на дыхание роста и дыхание
поддержания только количественное, так как обе компоненты имеют
одинаковую биохимическую основу. Принципиальная разница
между ними в том, что дыхание роста не зависит от
температуры, но сильно зависит от обеспеченности дыхания
субстратом, в то время как дыхание поддержания сильно зависит от
температуры, но не зависит непосредственно от поступления
субстрата.
3.11. ЗАВИСИМОСТЬ ДЫХАНИЯ ОТ ВНУТРЕННИХ
ФАКТОРОВ
Субстраты дыхания и дыхательный коэффициент. Субстратом
для дыхания в растении могут служить не только глюкоза или
другие гексозы, но также липиды и белки. Стехиометрия СОг- и
Ог.обмена зависит от типа субстрата. Отношение объема
выделившегося СОг к объему поглощенного Ог получило название
дыхательного коэффициента (ДК). При полном окислении
глюкозы ДК=1,0, т. е. 1 моль глюкозы окисляется с поглощением
196
6 молей Ог, и при этом выделяется 6 молей
из суммарного уравнения дыхания:
, что вытекает
+ 6О2 -» 6Ш0 + 6С0г ДК = 6СО2/6О2 = 1,0.
При полном окислении липидов, белков и других соединений
с высокой степенью восстановленности ДК оказывается меньше
единицы, например:
+ 2602 -» 18СО2 + 18ШО; ДК = 18СОг/26О2 = 0,7.
стеариновая
кислота
Если в качестве субстрата служат более окисленные, чем
сахара, соединения, ДК превышает единицу:
2С4Н4О5 + 502 -> 8СО2 + 4ШО;
щавелевоуксусная
кислота
ДК = 8СО2/5О2 = 1,6.
Таким образом, ДК выступает как мера окисленности
субстрата. Однако на ДК кроме типа субстрата влияет целый ряд
факторов, в частности полнота окисления субстрата или условия
выращивания. Так, частичное окисление Сахаров до ПВК
сопровождается поглощением О2, но без выделения СО2- Вместе с тем
при последующем декарбоксилировании с образованием ацетил-
КоА, используемого для синтеза жирных кислот, наоборот,
выделяется СОг, но поглощения Ог не происходит. Аналогично
повышение концентрации СО2 тормозит реакции декарбоксили-
рования и активность сукцинатдегидрогеназы. При этом
выделение СОг и ДК уменьшаются. Так, при низком парциальном
давлении кислорода в среде ДК возрастает в результате главным
образом сильного подавления поглощения О2, а выделение СОг
снижается лишь незначительно.
Этот пример наглядно свидетельствует о том, что эти два
процесса протекают независимо один от другого, так как
катализируются разными ферментами. Величина ДК возрастает со
снижением влажности ткани и температуры окружающей среды, но
заметно уменьшается при механических повреждениях, в
частности при повреждении корне- и клубнеплодов в ходе уборки. В
последнем случае поглощение 02 может возрасти до 10 раз в
сравнении с неповрежденными клубнями, что может
существенно увеличить потери органического вещества при хранении.
""" "Насто ИД выражается количеством поглощенного кислорода
[мг ОгДгч)]. Чтобы превратить это значение в количество
выделившегося СОг, необходимо определить величину ДК. Если
ДК=1, то для превращения количества поглощенного Ог в коли-
197
чество выделившегося СО2 первое необходимо умножить на
1,375, равное отношению молекулярных масс СО2 и О2.
Содержание углеводов. Как правило, содержание углеводов,
главным образом растворимых Сахаров, достаточно тесно
коррелирует с ИД, что было установлено на листьях огурца,
томата, кормовых бобов, пшеницы и других культур. Однако
встречаются исключения. Так, ИД листьев сахарной свеклы,
ячменя, райграса, сои не зависела от содержания углеводов.
Анализ показал, что тесная корреляция между указанными
параметрами наблюдается при низкой концентрации Сахаров,
а слабая — при высокой. В последнем случае ИД определяется
уже не фондом углеводов, а иными факторами, например
потребностью в АТФ или наличием АДФ для окислительного
фосфорилирования.
Тесная корреляция между содержанием углеводов и ИД
сохраняется обычно в том случае, если в суммарном дыхании
доминирует дыхание роста, что происходит в активно растущих
тканях или листьях, непосредственно снабжающих плодоэлемен-
ты ассимилятами при усиленном спросе со стороны акцептора.
После завершения роста и в стареющих тканях, дыхание которых
представлено главным образом дыханием поддержания,
корреляция между указанными параметрами быстро ослабевает.
Донорно-акцепторные отношения. В механизме связи между
донором, проводящей системой и акцептором важное место
занимает дыхание. Активность фотосинтетического аппарата
(донор ассимилятов) определяется аттрагирующей способностью
растущих органов (акцептор). Так, скорость роста корней при
дефиците влаги, как и их вклад в общую биомассу растения,
выше у сортов, устойчивых к засухе, чем у более чувствительных.
Это обусловлено импортом в корни растений устойчивых сортов
большего количества ассимилятов, используемых как на рост,
так и на более активное дыхание.
Сильная аттрагирующая способность корней, в свою очередь,
обусловливает более высокую ИФ и скорость дыхания
поддержания листьев у устойчивого сорта. Тесная связь между ИФ и
дыханием поддержания листьев объясняется тем, что последнее
обеспечивает энергией обновление «отработавших»
фотосинтетических структур и способствует сохранению более активного
фотосинтетического аппарата у устойчивого сорта при дефиците
влаги. Таким образом, характер регуляции дыхания определяется
соотношением роста и фотосинтеза растения или связями между
акцепторными и донорными тканями в конкретных условиях
выращивания. Потребности акцептора (роста) являются при
этом доминирующими.
Проводящая система играет активную роль в транспорте
ассимилятов от донора к акцептору, что подтверждается ее высокой
ИД. До 5 % транспортируемого по флоэме углерода затрачивает-
198
ся на процессы дыхания, а 95 % поступают к акцептору. Около
трети от указанных затрат (1,5—1,7 %) приходится на загрузку
флоэмных окончаний сахарозой в донорной ткани.
Дыхание также обеспечивает энергией компартментацию
ассимилятов в фондах временного депонирования и их
последующее использование. Так, на передвижение из органа-депонента
(стебель у пшеницы) к акцептору (колос) 1 мг азота необходимо
около 2,7 мг сухого вещества, затрачиваемого на дыхание.
С возрастанием ИД аттрагирующих органов, например бобов
сои, усиливаются приток к ним ассимилятов и рост. При этом
аттрагирующая способность органов зависит не только от
использования самих ассимилятов на рост, но и от того, насколько
сильное дыхание сопровождает этот процесс. Поэтому по ИД
роста можно судить о скорости роста аттрагирующего органа или
всего растения.
Растение (орган), его возрастное состояние. Жизненный цикл
у большинства растений начинается с прорастания семени.
Сухие семена обычно поглощают мало кислорода. Однако по
мере набухания скорость поглощения 02 (выделения СО2)
семенами увеличивается, достигая наибольших значений в период
интенсивного роста зародыша.
В опытах, проведенных в ТСХА на фасоли, органы
располагались в следующей последовательности в порядке убывания ИД:
цветки, листья, корни, прорастающие семена, стебли, сухие
семена. ИД крайних членов ряда различалась в 80 раз в пользу цветков
и составляла соответственно 16 и 0,2 мг СОгДг-ч) (Е. И. Кошкин,
М. В. Моторина, 1981).
ИД листьев, максимальная в
молодом возрасте, снижается по
мере уменьшения скорости
роста (рис. 65). Так,
закончившие рост листья ячменя
использовали на дыхание за сутки
сухую массу, равную 3 % их
начальной массы, растущие
листья — 20—25 %. При старении
листьев на растениях часто
наблюдается временное
увеличение ИД, хотя и менее
выраженное в сравнении с
климактерической активацией дыхания у
сочных плодов. Одновременно в
этот период усиливается
выделение этилена листьями, что
указывает на связь между этими
процессами.
Активация дыхания в период.
50
I
О 1 1
Интенсивность
Рис. 65. Связь интенсивности
дыхания листа райграса со скоростью его
растяжения (по Ь. Мокег, 1982)
199
старения может быть следствием разобщения окисления с фос-
форилированием или усиления метаболизма для обеспечения
энергией процессов реутилизации углерода и азота из
вегетативных органов и их транспорта в развивающиеся плодоэлементы.
ИД корней, как и листьев, по мере старения растений
уменьшается, а в расчете на целый орган быстро увеличивается в фазе
вегетативного роста, остается постоянной от цветения до начала
налива зерна, а затем снижается к фазе уборочной спелости.
Динамика дыхания корня в онтогенезе растения аналогична
динамике фотосинтеза целого растения, имеющей форму колоко-
лообразной кривой с максимумом в фазе цветения генеративных
органов.
В среднем за вегетацию к корням поступает 30—35 % ассими-
лятов, образованных в листьях при фотосинтезе. Около 2/з этого
количества затрачивается на дыхание корней, а остальное — на
рост. Интенсивность дыхания в расчете на единицу массы целого
растения уменьшается по мере старения, что объясняется как
снижением дыхания роста в результате уменьшения скорости
роста, так и уменьшением дыхания поддержания. Вклад дыхания
плодоэлементов у сои, пшеницы, кукурузы составляет 50—70 %
дыхания побега в фазе цветения и 20—25 % — в фазе уборочной
спелости.
3.12. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ ДЫХАНИЯ
Содержание воды. Дефицит влаги оказывает разнообразное
влияние на физиологические процессы в растении. По данным
Дж. Бойера (1970), полученным на подсолнечнике, кукурузе и
сое, с усилением дефицита влаги прежде всего подавлялся рост,
затем фотосинтез и в последнюю очередь дыхание. При
достаточно низком водном потенциале почв (—1,2 МПа) ИД
снизилась по сравнению с контролем в 2 раза, а ИФ — в 5 раз.
Степень ингибирования дыхания при этом определялась
устойчивостью генотипа к недостатку влаги в почве. По данным ТСХА,
дыхание сильнее подавлялось у менее засухоустойчивого
современного гибрида кукурузы КВС 701, чем у относительно
устойчивого сорта старой селекции Воронежская 76.
Реакция дыхания растений на дефицит влаги зависит также от
скорости снижения влажности почвы. При быстром падении
влагообеспеченности, по данным X. А. Молдау (1980), ИД может
даже возрастать. Это объясняется главным образом увеличением
коэффициента дыхания поддержания при относительном
постоянстве коэффициента на рост. В результате отношение дыхания
к фотосинтезу растения резко возрастает и углеродный баланс
ухудшается. При постепенном нарастании дефицита влаги, что
наблюдается, например, в полевых условиях, ИД уменьшается
параллельно снижению скорости роста и ИФ. При этом содер-
200
жание углеводов в тканях уменьшается значительно медленнее,
чем ИД. Поэтому основной причиной снижения ИД является
торможение роста, а не дефицит субстрата дыхания. Этим же
объясняется более сильное ингибирование ИД молодых,
растущих органов по сравнению с закончившими рост.
По данным Б. И. Гуляева с сотрудниками (1989), наиболее
чувствительным к усилению дефицита влаги в почве оказалось
дыхание стеблей, затем листьев и колосьев пшеницы. При этом
суммарные дыхательные затраты растения за вегетационный
период, приходящиеся на 1 г образованного зерна, а также
отношение дыхания к фотосинтезу растения были значительно выше,
чем в условиях оптимальной влагообеспеченности. Вместе с тем
при выращивании растений в условиях стационарного дефицита
влаги в течение всего вегетационного периода эти показатели у
контрольных и опытных растений существенно не отличались.
ИД зерна существенно зависит от его влажности, имея
минимальные значения при критической влажности. Это необходимо
учитывать при хранении зерна.
Азотное питание. Восстановление азота может происходить
как в корнях за счет энергии дыхания, так и в листьях на свету
преимущественно путем использования фото восстановителей.
Особенно велики энергетические затраты корней, включающие
наряду с восстановлением нитратов также их поглощение. По
данным Н. Сасакава и Т. Лурье (1986), они составляют 2—3 г С/г N.
Значительно выше энергетические затраты на связывание
атмосферного азота клубеньками бобовых — 3—4 г С/г N. Пейт с
сотрудниками (1979) показал, что нодулированные (с
клубеньками) корни сои перед началом активной фиксации N
использовали на дыхание 33 % ассимилятов, поступивших в корни, а во
время фиксации — до 50 % и выше. ИД клубеньков во много раз
выше, чем корней. Вследствие этого от 50 до 70 % дыхания
корней с клубеньками приходится на дыхание самих клубеньков,
которое сильно зависит от ИФ.
По данным австралийских ученых, ИД корней с клубеньками
у бобовых культур (соя, бобы и люпин) более чем в 2 раза, а
количество СО2, выделенное целым растением, на 11—13 %
выше, чем у тех же видов, выращенных на высоком азотном
фоне. В результате в углеводном балансе растений, растущих
только за счет симбиотически фиксированного азота, доля
дыхательных затрат углерода выше, а накопление биомассы меньше,
чем при выращивании на высоком фоне нитратного азота.
Растениям, использующим в качестве источника азота
исключительно ионы аммония, для ассимиляции необходимо гораздо
меньше энергии дыхания, чем при выращивании на
фиксированном или нитратном азоте. Однако масса этих растений, как
правило, не выше, чем в последних вариантах. Это можно объ-
201
яснить токсичным влиянием избыточного количества аммония
на метаболизм растения.
ИД тесно коррелирует с содержанием азота (белка) в тканях
вегетативных органов, особенно в области низких концентраций
N (0,5—2,5 ммоль И/г сухой массы). При этом наблюдается
постоянство ИД в расчете на единицу массы азота в тканях
[ммоль СО2/(моль Ыс)]. Подобный характер связи объясняется
тем, что затраты на функционирование белка, особенно
ферментативного, достаточно велики.
Возрастание ИД тканей по мере увеличения содержания белка
в этом диапазоне обусловлено также их высокой метаболической
активностью, в частности большей скоростью роста. При этом
интенсивный рост приводит к импорту дополнительного
количества азотистых соединений и соответственно к обороту большего
количества белка, сопровождаемому усиленной тратой
дыхательной энергии.
При концентрациях N выше 2,5—3,0 ммоль 1Ч/г корреляция
между ИД и содержанием азота снижается. Это объясняется тем,
что значительная доля N0^, накапливаемая в запасных компарт-
ментах, активно не используется и, следовательно, не требует
большого количества энергии для своего поддержания. Поэтому
ИД единицы массы азота в тканях при этом значительно ниже,
чем в диапазоне низких концентраций азота. С увеличением
содержания белка в тканях возрастают коэффициенты дыхания
как на рост, так и на поддержание.
Однако пропорциональность между содержанием белка и
дыханием поддержания сохраняется до тех пор, пока существует
тесная корреляция между содержанием белка и скоростью его
оборота. Это объясняется тем, что на обеспечение оборота белка
затрачивается от 50 до 70 % энергии дыхания поддержания. Это
особенно заметно в загущенных посевах в условиях избытка
азота, когда наблюдаются дефицит углеводов и относительный
избыток белков в листьях нижних ярусов. С одной стороны,
повышенное содержание белка увеличивает затраты на дыхание
поддержания, с другой — снижает ИД биомассы и, как
следствие, уменьшает ее адаптационные возможности. Это ухудшает
баланс углерода посева, снижает его устойчивость, в том числе к
полеганию, и в результате ограничивает продуктивность.
Считается (И. А. Куперман, Е. В. Хитрово, 1977), что дыхание
определяется уровнем азотного питания и оказывает прямое действие
на продуктивность посева, изменяя ЧПФ, и опосредованное,
влияя на устойчивость посева и Кхоз.
Посев интенсивного типа, способный эффективно
использовать высокие дозы азота, должен сочетать активное дыхание
роста шгодоэлементов (для обеспечения их высоких приростов)
со сниженным суммарным дыханием. Для зерновых это могут
202
быть сорта, у которых нижние листья отмирают, как только их
газообмен опустится до компенсационной точки. Дело в том, что
при их дыхании могут использоваться предшественники веществ,
с помощью которых формируются клеточные стенки. Вследствие
этого механические свойства стебля ухудшаются и возникает
опасность полегания растений. Для кормовых культур, например
кукурузы, чем больше белка накапливает посев, тем выше
дыхание поддержания и меньше ЧПФ. Поэтому, накопив
определенное количество белка, посев в дальнейшем накапливает в
основном углеводы, что снижает кормовую ценность зеленой массы.
Эта проблема решается путем периодического скашивания
культур. В этом случае выход белка с единицы площади вследствие
экономии дыхательного субстрата оказывается выше. Таким
образом, создание интенсивных посевов — это поиск оптимального
соотношения между ЧПФ, Кхоз, устойчивостью к полеганию и
качеством продукции. Дыхание оказывает влияние на каждый из
этих элементов через содержание белка в ткани.
Температура. Влияние температуры на ИД подчиняется
правилу Вант-Гоффа: с повышением температуры дыхательная
активность экспоненциально возрастает. Ускорение дыхания при
повышении температуры на 10 °С выражают посредством
температурного коэффициента (Ою):
где Тг —Т\— температурный интервал; Кг и К\ — соответствующие скорости
дыхания.
Если 0ю равен 1, температура не оказывает влияния на
дыхание; при (?ю, равном 2, ИД при увеличении температуры на
10 °С удваивается. Это типично для многих культур в
физиологическом диапазоне действия температур. При температурах
ниже биологического минимума, например меньше 8—10 °С у
кукурузы, С?ю скачкообразно возрастает, а выше 35 °С — у
большинства растений уменьшается до 1,5 и ниже. При очень
высоких температурах биохимические процессы протекают так
быстро, что снабжение субстратом и метаболитами не может
поспевать за обменом веществ и ИД быстро падает. Величина 0ю
непостоянна и зависит от фазы развития растения (органа) и
физиологического состояния.
Холодо- и жаростойкость растений при прочих равных
условиях являются главными факторами, определяющими реакцию
дыхания на экстремальные температуры. Так, при выращивании
проростков пшеницы и кукурузы при 2 °С обнаружены более
значительное снижение ИД проростков кукурузы в сравнении с
растениями, выращиваемыми при 25 °С, и большее ингибирование
роста, чем у пшеницы. Относительно сильное торможение роста у
кукурузы не связано непосредственно с пониженным дыханием, а
203
обусловлено ингибированием транспорта ассимилятов. При
выращивании этих культур при повышенных температурах (выше
40 °С) ИД пшеницы начинала снижаться, а у кукурузы все еще
возрастала, хотя и неэкспоненциально, при этом отмечены более
низкие величины 0К) у корней, чем у побегов. Температурная
зависимость ИД обусловлена главным образом сильной
зависимостью дыхания поддержания (бю^ 1,7 — 2,2), но не дыхания
роста от температуры (если она неэкстремальна). Это объясняется
тем, что скорость ферментативных превращений и оборота белка
в значительной мере зависит от температуры.
Фотосинтез и дыхание, определяющие углеродный баланс и
соответственно продуктивность растения, как и другие процессы
в растении, характеризуются разной температурной
зависимостью. Например, суммарный, или гросс-фотосинтез, у многих
культур сильно тормозится при низких положительных
температурах (минимум) и температурах выше 40 °С (максимум) с
оптимумом в диапазоне 20—35 °С. ИД при температуре ниже 20 °С,
наоборот, снижается до очень низких величин, а при более
высоких температурах она сильно возрастает, вплоть до
компенсационной температуры, при которой скорости
гросс-фотосинтеза и дыхания уравниваются и, следовательно, нетто-фотосинтез
равен нулю. В результате получается колоколообразная кривая
температурной зависимости нетто-фотосинтеза, идентичная
таковой у роста.
Приведем температурные коэффициенты ((?ю) некоторых
физиологических процессов в растении в диапазоне температур 0—
30 °С (по А. Фиттер, Р. Хей, 1981):
Процесс
Диффузия небольших молекул
в воде
Транспорт воды через оболочку
семени плодов арахиса
Поступление воды в
набухающие семена
Реакции гидролиза,
катализируемые ферментами
Дыхание
Фотосинтез:
световые реакции
темновые реакции
Поглощение калия
проростками кукурузы
1,2-1,5
1,3-1,6
1,5-1,8
1,5-2,3
2,0-2,6
-1,0
2—3
2 5
Характер влияния температуры на ИД зависит также от овод-
ненности клетки. При низкой влажности ткани б] о значительно
ниже, чем при высокой. Именно поэтому зерно хранят при
влажности не выше 12—14 %, что сводит к минимуму потери
органического вещества, даже при непостоянных и достаточно
204
высоких температурах. Хранение сочноплодной продукции,
напротив, наиболее эффективно при низких положительных
температурах.
Концентрация СОг и О%. По теоретическим расчетам Р. Джи-
форда (1982), удвоение содержания СО2 в воздухе может
увеличить урожайность сельскохозяйственных культур на 30—40 %.
Это объясняется повышением ИФ, содержания углеводов в
листе, скорости роста при одновременном снижении ИД. Инги-
бирующее влияние повышенной концентрации СО2 на дыхание
наиболее заметно при низком содержании углеводов в листе.
Обогащение атмосферы СО2 влияет на дыхание не только
надземных органов, но и корней, которое у одних культур
(пшеница) падает, а у других (подсолнечник) — возрастает на фоне
стимуляции накопления биомассы. Повышенная концентрация СО2
ингибирует также дыхание плодоэлементов.
Этот принцип используют при длительном хранении плодов и
овощей в регулируемой газовой среде, где важную роль играет
также содержание Ог- При этом поглощение С>2 заметно ингиби-
руется в области как очень высоких (100 %), так и низких (3 %
и ниже) концентраций кислорода. В последнем случае скорость
выделения СО2 снижается гораздо меньше, чем поглощение Ог,
в результате чего ДК возрастает, в тканях накапливается спирт.
Подобное явление наблюдается также при избыточном
переувлажнении, затоплении, выпревании посевов и образовании
ледяной корки. В возникающих при этом условиях анаэробиоза
растения нередко сильно истощаются или даже погибают из-за
дефицита энергии, поскольку эффективность дыхания резко
снижена, а также в результате повреждения мембран продуктами
жизнедеятельности и недостатка промежуточных продуктов
цикла Кребса.
Дыхание больного растения. ИД обычно повышается в
результате инфицирования растения патогеном. Это может сочетаться
с нарушением сопряженного с окислением процесса фосфорили-
рования из-за ингибирующего действия продуктов
жизнедеятельности патогена, а также с высокой долей анаэробного дыхания.
В результате снижается эффективность дыхания клеток
растения-хозяина и усиливаются гидролитические процессы,
особенно у неиммунных сортов. Одной из причин этого считают
индуцируемое вирусом набухание митохондрий, вследствие чего
увеличиваются проницаемость мембран и выход АТФ из
митохондрий. Отмечено также отрицательное влияние патогена
на ферментативный аппарат, но оно не прямое, а
опосредованное действием метаболитов патогена.
У иммунных сортов, наоборот, инфекция индуцирует
образование не только специфических ферментативных белков, но
также митохондрий и рибосом. В результате этого растения
способны противостоять негативному влиянию токсина и сохранять,
205
а нередко и повышать эффективность запасания энергии
дыхания. По мнению Б. А. Рубина с сотрудниками (1974), в реакции
иммунитета связаны воедино следующие звенья: активирование
дыхания и усиление процессов окислительного фосфорилирова-
ния, использование дополнительной энергии на синтез
ферментативного и структурного белка, а последний, в свою очередь,
вызывает дальнейшую активацию дыхания.
Стимуляция дыхания обусловлена главным образом вкладом
дыхания самого растения и в меньшей мере — дыхания патогена.
При этом активность окислительного пентозофосфатного цикла
пораженной ткани возрастает в большей мере, чем скорость
гликолиза. По данным С. Фаррар и Н. Райнс (1987), стимуляция
дыхания листьев ячменя, пораженных мучнистой росой, на 55 %
была обусловлена увеличением активности цитохромного пути и
на 40 % — альтернативного пути. У устойчивых к мучнистой
росе сортов ячменя активности альтернативного пути не
обнаружено.
Значительный урон наряду с болезнями растениям наносят
вредители, что обусловлено как прямым поеданием биомассы,
так и существенной стимуляцией дыхания. Так, поражение
листьев гороха, сои, бобов тлями значительно усиливало дыхание и
в меньшей мере фотосинтез листьев, вследствие чего отношение
дыхания к фотосинтезу целого растения возрастало. Повышение
дыхания листьев объясняется возрастанием энергетических
затрат на загрузку флоэмных окончаний, компенсацией того
количества сахарозы, что было потреблено тлями, а также
увеличением затрат на поддержание клеток пораженной ткани.
Инфицирование корней сои нематодами, не влияя на
дыхание стеблей и листьев, существенно стимулировало дыхание кбр-
ней. При этом рост всех органов растения подавлялся.
Усиление дыхания при поражении растений вредителями и
болезнями обусловлено преимущественно возрастанием дыхания
на поддержание. Последнее следует рассматривать не как
следствие снижения эффективности дыхания, а как «плату» растений
за выживание и успешную адаптацию к неблагоприятным
условиям выращивания.
3.13. РОЛЬ ДЫХАНИЯ В УПРАВЛЕНИИ
ПРОДУКЦИОННЫМ ПРОЦЕССОМ
Большое значение для исследования дыхания как фактора
продуктивности имело количественное разделение дыхания на
две составляющие: дыхание на рост и дыхание на поддержание.
Уровень современных знаний не позволяет ставить вопрос об
управлении дыханием роста с целью оптимизации дыхательных
затрат посева. Что касается дыхания поддержания, то не все
206
О!
-*■■
350
300
1^250
Ч
^200
Ф
ъ'50
!
| по
I 50
ч
1°
г
г Л
в
А
121
113
ш
107
№
н
107
ш
П
91
п
109
ж
109 г
■"■' ■
1
157
И
109
1
10 17 24 31 7 1Ь 21 28 5 12 19 2В
Май Июнь ♦ Июль
Фаза колошения
Рис. 66. Гросс-фотосинтез (АГ), дыхание поддержания (БВ), дыхание роста
(ВТ) и нетто-фотосинтез (АБ) посевов ячменя (по Р. Вюсое, 1975") (Цифры над
столбиками — суммарная радиация за неделю, МДж/м .)
исследователи признают целесообразность снижения его
интенсивности с целью повышения продуктивности растений, хотя
около 50 % всех дыхательных затрат за период вегетации
приходится именно на дыхание поддержания (рис. 66).
Согласно Мак Кри (1987), уменьшение компоненты
поддержания было бы выгодно растению в том случае, если бы оно
отражало бесполезное, а не истинное дыхание поддержания,
свойственное растению в здоровом состоянии. Пенинг де Вриз
(1989), напротив, рассматривает снижение дыхания
поддержания посредством уменьшения скорости оборота белка как один
из путей экономии дыхательных затрат растения. Приведенные
мнения представляют крайние точки зрения по данному
вопросу.
Во всяком случае, попытка регулировать дыхание
поддержания может вызвать неизбежные осложнения, привести к замене
одних растительных структур другими, поскольку величина
дыхания активной биомассы положительно коррелирует с
устойчивостью функционирования растительного организма. Если бы
это даже удалось сделать, то потребовалось бы увеличение внеш-
207
них энергетических затрат для создания дополнительных
компенсирующих условий. Кроме того, из-за уменьшения скорости
оборота белка в листьях может снизиться фотосинтез. Отсюда
понятно, почему среди большого разнообразия сортов и
гибридов пока не удалось найти формы, обладающие слабым
дыханием поддержания, за исключением линий райграса.
Однако в последнем случае биохимическая основа разницы в
скорости дыхания поддержания между линиями не ясна. Не
известна также природа генов, контролирующих эту разницу, и
они в настоящее время не являются предметом генетического
улучшения. Поэтому использование биотехнологических
подходов для повышения продуктивности растений путем снижения
ИД остается проблематичным. Кроме того, при контролируемых
генетических манипуляциях с дыханием, и особенно с
митохондриями, может быть нарушен согласованный метаболизм в цито-
золе, митохондриях и даже хлоропластах. Отсутствие в
современных программах по генной инженерии задач по воздействию на
дыхание подтверждает сложность этой проблемы.
Среди аспектов проблемы продуктивности растений важное
место занимает оценка количественного соотношения дыхания и
фотосинтеза. Оптимальный баланс углерода является одним из
критериев приспособленности растений к условиям
местообитания, поэтому определение указанного соотношения дыхания и
фотосинтеза широко практикуется в эколого-физиологических
исследованиях. В благоприятных условиях ИД листа не
превышает 5—15 % ИФ. Определение соотношения дыхания и
фотосинтеза целого растения на протяжении жизненного цикла
позволяет выявить основные закономерности в продуцировании
биомассы.
Поскольку интенсивность истинного фотосинтеза не может
быть измерена прямыми методами (из-за сложности разделения
фотосинтетического и дыхательного газообмена на свету), то
гросс-фотосинтез (Рд) обычно рассчитывают как сумму
среднесуточного прироста биомассы (ДЖ) и дыхательных затрат (К).
Отношение К/Рд тесно связано с коэффициентом эффективности
роста (КЭР), показывающим долю продуктов фотосинтеза,
пошедших на накопление биомассы растений:
К/Рд = 1 - КЭР или
Величина КЭР у разных культур (15 видов) варьирует от 0,3
до 0,8 (АтИгог, 1989). Интересно отметить, что она ниже у
культур, накапливающих белки и липиды, по сравнению с теми,
которые запасают крахмал или другие углеводы. Как
установлено, величина КЭР заметно снижается в онтогенезе, что
обусловлено увеличением доли дыхания поддержания в общем дыхании
растения.
208
Чем выше значение коэффициента дыхания на рост, тем
ниже эффективность превращения субстрата в структурную
биомассу.
На основании данных о биохимических путях синтеза был
рассчитан выход основных соединений биомассы из единицы
субстрата (глюкозы). Этот показатель получил название
продукционной величины (РУ). По смыслу она идентична коэффициенту
истинной эффективности роста (Уд), но относится к синтезу
отдельных веществ биомассы (табл. 13).
13. Значения продукционной величины для основных соединений
биомассы (Ат№ог, 1989)
Органическое соединение
Углеводы
Липиды
Лигнин
Органические кислоты
Органические
азотсодержащие соединения
источник азота: N03
г продукта
г глюкозы
0,83
0,33
0,46
' 1,10
'0,40
0,62
г С продукта
г глюкозы
0,92
0,63
0,80
—
0,54
0,82
Указанные значения РУ можно использовать для подсчета
примерного количества субстрата, необходимого для синтеза
биомассы известного состава. По теоретическим расчетам из
единицы субстрата (углеводов) синтезируется примерно 0,75—
0,85 единицы вегетативной массы. Экспериментальные значения
для целых растений варьируют от 0,65 до 0,85.
По данным А. Танака (1968), культуры располагаются по
эффективности роста в следующий ряд: рис > кукуруза =
картофель = сахарная свекла > пшеница > соя. Некоторые растения,
например картофель, накапливают в репродуктивный период
значительное количество запасных веществ в виде крахмала.
Высокая эффективность синтеза вещества клубней (1^=0,96),
составляющих 60—80 % общей биомассы, позволяет отнести
картофель к наиболее экономичным культурам. Величина Уд
зависит также от химического состава синтезируемой биомассы и от
того, происходит ли восстановление нитратов за счет
фотосинтеза в листьях или этот процесс обеспечивается за счет энергии
окисления глюкозы. Чем выше содержание белка и липидов в
биомассе и чем больше глюкозы используется для
восстановления нитратов, тем ниже эффективность роста.
Эти данные можно также использовать для расчета
дыхательных затрат на формирование 1 г зерна любой культуры, зная его
химический состав. При превращении единицы ассимилятов
(глюкозы) в биомассу по крайней мере 25 % их затрачивается на
209
дыхание. На поддержание функциональной активности уже
сформировавшейся единицы биомассы ежесуточно требуется
1,5—4,0 % ассимилятов. Если рассматривать приведенные
данные с позиций изложенных представлений, то у большинства
исследованных растений, у которых К/Ра равняется 45—50 %,
дыхание на поддержание ниже или равно дыханию роста. При
соотношении больше 50 % доля дыхания поддержания,
по-видимому, больше. Так, у клевера в период массового цветения
указанное соотношение достигало 70—80 %, при этом доля дыхания
на поддержание от общих дыхательных затрат за вегетацию более
чем вдвое превышала затраты ассимилятов на дыхание роста.
Количество СОг, выделившееся при синтезе единицы массы
разных органов растений (Рептпд бе Упез, 1979)
Орган растения*
Листья (25; 66,5; 2,5; 4,2)
Стебли (125; 74; 2,5; 8,2)
Семена бобов (35; 55; 5; 2; 3)
Зерна риса (5; 90; 2; 1; 2)
г СОуг сухой массы органа
0,33
0,28
0,42
0,19
*Цифры в скобках — содержание в % сухой массы соответственно азотистых
компонентов, углеводов, липидов, лигнина и минеральных веществ.
Заметное влияние на величину К/Ра оказывает температура.
Так, у растений клевера, выращиваемых при 12 и 24 °С, оно
составило за вегетацию соответственно 60 и 72 %. Общее
количество образованных в процессе фотосинтеза ассимилятов
практически не различалось, но конечная биомасса растений при
24 °С была несколько ниже за счет более высоких затрат
дыхательного субстрата. У ячменя К/Ра весной и летом достигало
50 %, а зимой, в фитотроне, — только 35 %.
По мере обезвоживания растений интенсивность фотосинтеза,
как правило, начинает снижаться значительно раньше, чем
дыхание. При этом соотношение К/Рд может значительно
увеличиваться, главным образом за счет уменьшения нетто-продуктив-
ности.
При избыточном азотном питании дыхательный газообмен
усиливается, чистая продуктивность фотосинтеза уменьшается.
Так, при внесении 180 кг азота на 1 га выход зерна озимой
пшеницы повышался на 78 %, а затраты на дыхание — в 3 раза.
У сортов, способных к усвоению высоких доз азота, дыхание
изменяется меньше.
При сильном облучении (95—130 Вт/м2) у растений мятлика
величина Я/Рд была почти вдвое больше, чем при слабом (25—
45 Вт/м ). Длительность светового периода меньше влияла на эту
величину, чем уровень освещенности. Соотношение дыхания и
фотосинтеза практически не изменялось в диапазоне
концентраций СОг 100—300 мкл/л, а при 1500 мкл/л уменьшалось.
210
Величина К/Ра у молодых растений, как правило, ниже (около
30 %), чем у взрослых, что, по-видимому, объясняется, с одной
стороны, возрастанием доли гетеротрофных тканей в биомассе
растений, а с другой — постепенным снижением
фотосинтетической активности вследствие ценотического эффекта.
Таким образом, в углеродном балансе целого растения
затраты ассимилятов на дыхание в благоприятных для роста и
развития условиях составляют от 30 до 60 %, т. е. на накопление
биомассы расходуется лишь около половины ассимилированного
углерода. Остальная часть окисляется в процессе дыхания.
Образовавшиеся при этом энергетические эквиваленты и метаболиты
используются в процессах, связанных с образованием биомассы
растения и поддержанием ее структурной и функциональной
целостности.
Контрольные вопросы и задания
1. Назовите агротехнический прием, использование которого может
способствовать накоплению биомассы кукурузы в период роста с прохладными ночами и
низкой скоростью дыхания. 2. Проанализируйте, исходя из представлений о роли
дыхания в продукционном процессе, две концепции: «низкое дыхание — высокая
продуктивность» и «высокое дыхание — высокая продуктивность». 3. В каких
случаях оценка расходной статьи баланса углерода растения на основании учета
только выделения СОг может быть ошибочной? 4. Рассмотрите возможные
причинные связи между низкой скоростью дыхания поддержания, с одной стороны,
и недостаточной устойчивостью к действию неблагоприятных факторов среды и
низкой питательной ценностью зеленой массы — с другой. 5. Проследите пути
биосинтеза этилена из промежуточных продуктов дыхания. Какова роль этилена
в климактерическом подъеме дыхания и при хранении плодов и овощей? 6. Как
можно использовать разную температурную зависимость фотосинтеза и дыхания
для эффективного выращивания овощных культур в закрытом грунте? 7. На
какие цели может быть использована энергия трансмембранного потенциала
митохондрий в растительной клетке? 8. Расположите фотосинтез, дыхание и рост
в порядке возрастания чувствительности к неблагоприятным факторам среды.
9. Проанализируйте на основании анализа взаимосвязи фотосинтеза, дыхания и
роста возможные последствия внесения избыточных доз азота в загущенном
посеве. 10. В чем состоит прямое и косвенное воздействие химических регулято-
рйв роста на дыхание?
Глава 4
ВОДНЫЙ ОБМЕН РАСТЕНИЙ
4.1. ВОДА: СТРУКТУРА, СОСТОЯНИЕ
В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ И ЗНАЧЕНИЕ
В ЖИЗНЕДЕЯТЕЛЬНОСТИ РАСТИТЕЛЬНОГО ОРГАНИЗМА
В жизни растений, как и всех других организмов нашей
планеты, воде принадлежит исключительная роль. По
справедливому утверждению А. Сент-Дьёрди, все проявления жизни
неразрывно связаны с водой. Жизнь зародилась в воде, развилась в
воде и возможна лишь при ее участии.
Вода является основным компонентом живого, составляя в
среднем 80—90 % массы растения. Содержание воды зависит от
типа и возраста органов, их функционального состояния.
Особенно богаты водой сочные плоды (80—95 % сырой массы),
молодые корни (70—90 %) и молодые листья (80—90 %).
Наиболее бедны водой зрелые семена. В воздушно-сухом состоянии
они содержат 5—15 % воды. Активное проявление
жизнедеятельности без воды вообще невозможно. Высушенные семена и
споры находятся в состоянии анабиоза, когда метаболические
процессы сведены к минимуму и практически не улавливаются
доступными для измерения методами.
Сделана попытка определить пороговое содержание в тканях
воды, ниже которого растение уже не в состоянии поддерживать
основные физиологические функции, повреждается и погибает.
Эта вода получила название гомеостатической. Оказалось, что
содержание гомеостатической воды неодинаково у растений
разных экологических групп: у гигрофитов — 65—70 % сырой
массы, мезофитов — 45—60, ксерофитов — 25—27 %. Эти
величины, тесно коррелирующие с устойчивостью растений к
обезвоживанию, весьма высоки. Возникает вполне закономерный
вопрос: зачем нужна вода растению в таком большом количестве?
Прежде всего необходимо отметить, что в биохимических
превращениях (фотосинтезе, дыхании, гидролитических и других
процессах) принимает участие не более 1 % содержащейся в
растении воды. Столь же широкое распространение и
биологическая роль воды во многом обусловлены строением и физико-
химическими свойствами этого замечательного природного
соединения.
Структура и свойства воды. Вода может находиться в трех
агрегатных состояниях — газообразном, жидком и твердом. В
каждом из них структура воды неодинакова. Но в основе любой
структурной организации лежит молекулярное строение воды. Мо-
212
Рис. 67. Взаимодействие молекул воды с четырьмя
другими:
молекулы 1 п 2 находятся в плоскости чертежа; 3 — над
плоскостью; 4 — под плоскостью
н
н
н
1
о
Н
лекула \воды обладает большим дипольным
моментом за счет смещения электронов к
кислороду и способностью образовывать
водородные связи с соседними молекулами
(рис. 67). Водородная связь осуществляется за
счет электростатического взаимодействия по
донорно-акцепторному механизму, ее
энергия составляет 16—20 кДж/моль. Эта величина позволяет
создавать динамичную, лабильную, но в то же время достаточно
прочН (Н2О)х. Наименьший
б
(4)0
Н
Н " Н
0(3) 0(2)
ч I
н н
ную надмолекулярную структуру:
угол между отрезками, соединяющими молекулу воды с
ближайшими соседями, из-за направленного характера водородных
связей должен быть равен 104,5 °С, т. е. валентному углу при атоме
кислорода. Только при таком условии водородные связи могут
быть линейными. Отсюда следует, что конструкции из молекул
воды представляют не плотные упаковки шаров, а имеют форму
тетраэдров, для которых угол между связями центра с
вершинами равен 109,2°.
Согласно современным представлениям, в основе
надмолекулярной организации воды лежит сочетание упорядоченной
структуры с размытым тепловым движением состоянием части
молекул. В модели О. Я. Самойлова (1957) основой
упорядоченной решетки воды является кристаллическая структура льда, в
которой реализуются все четыре возможности молекул воды
образовывать водородные связи, за счет этого формируется
ажурная гексагональная решетка, пустоты которой в 2 раза
превосходят размеры молекул воды (рис. 68). При плавлении льда с
повышением температуры кристаллическая решетка частично
разрушается, пустоты увеличиваются и заполняются молекулами
воды, находящимися на более близком расстоянии друг от друга.
Эти плотно упакованные молекулы имеют меньшее количество
водородных связей или вообще не имеют их.
Зарубежные авторы при описании структуры воды используют
гипотезу X. Франка и В. Вена (1957), впоследствии развитую
Г. Немети и X. Шерага (1962). Согласно этой гипотезе в воде
имеются скопления (рои) молекул, объединенных друг с другом
водородными связями (рис. 69). Время жизни молекул в роях
составляет 10~10—10"11 с. Затем структура воды разрушается
вследствие теплового движения и возникает новая, с иным
распределением роев. Отсюда названия «мерцающие скопления»,
«текучие кластеры», «рои». Предполагается, что в образовании
213
Водородная
I бодорова | кислорода
Рис. 68. Гексагональная структура льда (О. Я. Самойлов, 1957)
роев участвует до 2/з всех молекул воды, которые находятся в
равновесии с окружающими их молекулами.
Таким образом, обе группы гипотез предполагают
возможность существования двух структур воды: упорядоченной,
обусловленной большим количеством водородных связей (льдопо-
добная или «мерцающие рои»); без правильной ориентации
молекул (плотно упакованные, мономерные молекулы). Различие
моделей состоит в том, что, по О. Я. Самойлову, плотно
упакованная модификация заполняет полость каркаса, тогда как, по
214
Рис. 69. Модель кластерной структуры жидкой воды (С №те№у, Н. А. 8сЬе-
га8а, 1962)
X. Франку и В. Вену, мономерные молекулы находятся вне
кластеров. Пока еще нет убедительных данных, подтверждающих ту
или иную модель. Однако вполне определенно можно утверждать
динамичность структуры воды, под которой следует понимать
пространственное расположение ее молекул, определяемое
межмолекулярным взаимодействием и кооперативными свойствами
системы.
Структурированностью объясняются уникальные
физико-химические свойства, выделяющие воду среди жидкостей: сжатие
при плавлении, увеличение плотности с повышением
температуры до 4 °С и последующее уменьшение ее; понижение
теплоемкости при повышении температуры до 36 °С и последующее
увеличение ее; высокие температуры плавления и кипения.
Установлены резкие изменения свойств воды и происходящих в ней
биологических процессов при температурах 0, 15, 30, 45, 60 °С.
Предполагается, что при этих температурах происходит
структурная перестройка воды. В середине третьей фазы (между 30 и
45 °С) структура воды наиболее благоприятна для гидратации
органических молекул, в частности белка.
Роль свойств воды в биологических процессах и явлениях
/ Свойства воды
Высокая теплоемкость и скрытая
теплота парообразования
Высокое поверхностное натяжение
■!;
Значение
Поддержание теплового баланса растений
Определяея передвижение воды по
капиллярам, обусловливает большое
значение поверхностных явлений в водных
системах, в том числе биологических
215
Высокая растворяющая способность Важна для корневого питания растений,
передвижения продуктов фотосинтеза,
транспорта Ог и СОг
Структурированность, обусловлен- Обусловливает аномальные свойства во-
ная водородными связями ды, делает воду структурным
компонентом цитоплазмы, играет роль в
процессах анестезии
Взаимодействие с биополимерами Влияет на конформацию биополимеров
и активность ферментов, определяет
степень устойчивости растения к
неблагоприятным условиям
Диссоциация на высокоактивные Участвует в химических реакциях
(фотоионы синтез, дыхание, гидролиз)
2Н2О = ШО+ + ОН"
К= КГ14
Поглощает инфракрасную радиа- Обеспечивает способность водных расте-
цию, сравнительно прозрачна для ний поглощать фотосинтетически актив-
видимой части спектра ную радиацию (ФАР), прозрачные
клетки эпидермиса наземных растений
пропускают ФАР к мезофиллу и в какой-то
мере предотвращают его перегрев
-"" 1 Состояние и роль воды в растении. /Для функционирования
живых организмов важна не только их "общая оводненность, но
и состояние, в котором находится содержащаяся в них вода, —
ее концентрация, энергетический уровень, подвижность,
реакционная способность и т. д. Состояние воды характеризуется ее
структурой, соотношением свободной (с неизмененными физико-
химическими свойствами) и связанной (с измененными физико-
химическими свойствами вследствие взаимодействия с
неводными компонентами) воды. Ведь вода не может сохранять в
неизменном виде все свои свойства, находясь в такой сложнейшей
гетерогенной среде, как клетка, где неизбежны самые
разнообразные взаимодействия с ионами, молекулами других веществ,
где действуют векторные факторы внутриклеточных полей, вдоль
силовых линий которых могут ориентироваться диполи воды.
Вода в биологических объектах существует в таких условиях,
которые пока невозможно корректно и полностью воспроизвести
вне клетки^
С введением физических методов исследования: ядерного
магнитного резонанса (ЯМР), электронного парамагнитного
резонанса (ЭПР), диэлектрической спектроскопии (ДС),
инфракрасной спектроскопии (ИКС) — появилась возможность
характеризовать состояние воды подвижностью ее молекул
(трансляционной, вращательно-колебательной), энергией и числом
водородных связей. Для лучшего представления рассмотрим
разные уровни изменения состояния воды в клетке.
Влияние ионов на состояние воды. При взаимодействии ионов
с молекулами воды происходит ориентация диполей воды в
электрическом поле иона. Исследованиями О. Я. Самойлова
(1957) было показано, что одни ионы понижают трансляционное
216
движение воды, другие, наоборот, его усиливают. В первом
случае говорят о положительной гидратации, во втором — об
отрицательной. Положительную гидратацию вызывают ионы М§ ,
СаГ+, П+, №+, 5С>4~, отрицательную — ионы К+, С8+, N1^, СГ,
Г,' N0^
Катионы взаимодействуют с отрицательно заряженными
атомами кислорода молекул воды, тогда как анионы — с
положительными зарядами диполя воды. Электрические взаимодействия
между ионами и молекулами воды экранируют локальные
электрические поля, образуемые ионами, и позволяют им оставаться в
растворе. Воду, связанную ионами и низкомолекулярными
соединениями, называют осмотически связанной.
Уровень макромолекул. Взаимодействие высокополимерных
веществ с водой включает следующие способы: гидратацию
ионизированных и полярных групп; стабилизацию структуры воды
около неполярных групп («гидрофобная гидратация»);
иммобилизацию воды.
Гидратация ионизированных (—г^Нз, -СОСГ) и гетерополярных
О
групп (-СООН, -ОН, -С-Н, > С = 0, > N11, -NN2, -С(ЖН2,
—5Н) состоит в электростатическом притяжении молекул воды.
Между этими двумя видами гидратации существуют только
количественные различия. Степень гидратации зависит от количества
этих групп на поверхности макромолекул, характера их
расположения и соответствия структуре воды. Этим определяется связь
степени гидратации с конформационными изменениями
макромолекул. Гидратная вода располагается около гидрофильных
радикалов в виде сферы, состоящей из нескольких слоев молекул.
В основе полимолекулярной гидратации лежит кооперативный
характер образования водородных связей.
Определенная ориентация монослоя молекул воды около
полярных групп макромолекул создает благоприятные условия для
возникновения других водородных связей с соседними
молекулами воды, вследствие чего ее структура упрочняется в более
широкой области. Данные ЯМР и ЭПР показывают, что
существуют 2—3 слоя воды с ограниченной подвижностью около
поверхности макромолекулы, помимо воды, непосредственно
взаимодействующей с полярными группами. Различают две
категории связанной воды: невращательно связанная — монослой
гидратной оболочки, где подвижность молекул по сравнению с
чистой водой снижена на 3—4 порядка; менее прочно связанная
вода двух следующих слоев молекул, где подвижность воды
снижена на 2 порядка. Для сравнения отметим, что у льда
подвижность воды снижена на 6 порядков.
217
Количество гидратной воды у белков составляет около 0,3 г на
1 г белка. В пересчете на молярные соотношения эта величина
означает, что одной молекулой белка связывается 850—1000
молекул воды, т. е. в среднем менее 1 моль на аминокислотный
остаток. На гидратацию высокополимерных веществ большое влияние
оказывает рН среды, который предопределяет количество
ионизированных групп. В изоэлектрической точке степень гидратации
будет наименьшей. Отнятие у белков связанной воды
сопровождается изменениями третичной структуры макромолекул,
определяющей индивидуальность и функционирование белка. Более
чувствительны к дегидратации белки с высокоразвитой третичной
структурой, т. е. ферменты и другие активные белки мембран.
Взаимодействие гидрофобных групп белка, например остатков
аланина (—СНз), валина (—С3Н7), фенилаланина (—С7Н7),
сопровождается ослаблением их взаимодействия с водой. Молекулы
воды как бы выталкиваются из той сферы, в которой возникает
сближение неполярных частей полипептидных цепочек, что
также стабилизирует структуру воды и называется гидрофобной
гидратацией.
Особое положение занимает иммобилизованная
макромолекулами вода. Иммобилизация представляет собой механический
захват воды при конформационных изменениях макромолекул
или их комплексов. При этом вода оказывается заключенной в
замкнутом пространстве внутри макромолекулы или между
макромолекулами. Количество иммобилизованной воды не
поддается точному учету. Считается, что белки могут иммобилизовать
воды в 30 раз больше, чем весят сами.
Уровень мембран. Возможности взаимодействия воды с
неводными компонентами расширяются при переходе к более
сложным структурам. Мембраны содержат 25—30 % воды, причем
она связана не только с белками, но и с полярными частями
липоидов. Не вызывает сомнения структурообразующая роль
воды в формировании мембран, так как строго ориентированные
липоидные мицеллы образуются только в ее присутствии в
результате гидрофобных взаимодействий неполярных частей
молекул. Существует модель строения мембраны, где поверхностный
слой представлен структурированной водой (рис. 70). При
обезвоживании происходят изменение структуры мембраны,
закрывание гидрофильных пор и снижение проницаемости.
(Клеточный уровень. Все сказанное ранее относится и к клетке
в целом. В зрелой растительной клетке можно выделить три
основных компартмента, различающихся по состоянию воды:
клеточные стенки, протоплазма, вакуоль. Клеточные стенки
составляют около 13 %, объем воды в них примерно 10 % объема
ткани. Состояние воды в клеточных стенках неодинаковое.
Примерно третья часть ее гидратирует вещества и имеет сниженную
подвижность, остальная представляет воду с такой же подвиж-
218
Обезвоживание
Рис. 70. Схема фрагментов оводненной (а) и обезвоженной (б) мембран:
1 — липидные компоненты мембраны; 2 — интегральные белки; 3, — структурированная
вода; 4— свободная вода; 5— гидрофильная пора
ностью молекул, как у обычной воды. Это наиболее лабильная,
легкообмениваемая вода клетки. Протоплазма занимает около
10 % объема клетки, оводненность органелл составляет 65 %,
гиалоплазмы — 95—98 %. На долю протопласта приходится
около 8 % внутриклеточной воды. Это в основном коллоидно
связанная вода. Причем в ядре содержится 20—30 %, в хлоро-
пластах — 14—20, в митохондриях — 5—7 % воды протоплазмы.
Автономность водообмена органелл клетки давно является
установленным фактом. Убедительно показаны набухание
митохондрий при нарушении окислительного фосфорилирования,
при снижении оводненности клеток узлов кущения озимых во
время второй фазы закаливания, набухание хлоропластов при
обезвоживании клеток листа. Большая часть объема клетки (80—
90 %) занята вакуолью с клеточным соком и представлена
осмотически связанной водой.
Водоудерживающую способность, определяемую путем
отнятия воды осмотическими агентами, долгое время использовали в
качестве характеристики соотношения свободной и связанной
воды в клетке. Развитие мембранологии существенно изменило
эти представления, так как выявило значительное влияние
проницаемости клеточных мембран на водообмен. Установлено, что
проницаемость мембран для воды составляет 10~4 см/с, т. е. в
100 000 раз меньше скорости диффузии молекул' воды через
водный слой толщиной 7 нм.
Сопротивление движению воды зависит в значительной
степени от характеристики липидного бислоя, конфигурации белковых
компонентов. Для прохождения воды через мембрану значение
имеют также ее структурные переходы — жидкий кристалл= гель
и деформация липидной фракции мембраны. Известно, что
мембраны в живых и мертвых клетках существенно различаются по
проницаемости для воды. Мембраны живых клеток контролируют
219
поток воды; при повреждении эта функция нарушается, и
проницаемость увеличивается.
В многочисленных опытах с мембраноактивными веществами
(соли свинца, пипольфен, нистатин, вазопрессин) показано
увеличение проницаемости клеток для воды. Пипольфен, вытесняя
Са из плазмалеммы, разрыхляет ее, увеличивая проницаемость
как для воды, так и для ионов. Нистатин индуцирует
образование специфических водных каналов. Вазопрессин (гормон
гипофиза, регулирующий деятельность мочевого пузыря) в
растительных клетках так же, как и в животных, в значительно большей
степени увеличивает проницаемость для воды, чем для ионов.
Ингибирование АТФ-аз плазмалеммы строфантином К снижает
выход воды из клеток, т\_е._вддоудерживающая способность
зависит не столько от подвижности воды в клетке, сколько от
проницаемости мембран. Кроме того, на выход воды из клетки
влияет и ее иммобилизация макромолекулами. Следовательно,
оставшуюся в клетках после воздействия гипертонического
раствора воду нельзя считать «связанной» в. точном физическом
смысле, т. е. водой, взаимодействующей с неводными
компонентами и вследствие этого имеющей пониженную подвижность
молекул. Тем не менее водоудерживающую способность можно
использовать как физиологическую характеристику подвижности
воды: ее способность выходить за пределы определенных,
разграниченных мембранами компартментов, участвовать в физиолого-
биохимических процессах за пределами этого пространства.
Обширный экспериментальный материал, накопленный к
настоящему времени, свидетельствует о тесной связи между
интенсивностью и направленностью физиологических процессов и
оводненностью растительных тканей. Убедительно показана
зависимость активности ферментов дыхания, фотосинтеза,
азотного и фосфорного обмена от содержания и состояния воды. С
оводненностью тканей также связана устойчивость растений к
различным неблагоприятным факторам: морозу, жаре, засухе,
засолению и т. д. А. М. Алексеев (1969) ввел понятие о
протоплазме как целостной системе, структура которой определяется
взаимодействием находящихся в ней воды и белков. Эти
компоненты протоплазмы взаимосвязаны и взаимообусловлены, так
что нарушение одного из них вызывает нарушение структуры
всей системы. Тидратная вода влияет на активность
белков-ферментов, состояние мембран, их устойчивость.
Несмотря на важную роль связанной воды, количество ее не
так велико. Согласно современным данным гидратная вода
составляет 0,13—0,55 г/г сухого вещества, что не превышает 10—
15 % водного запаса листа.
Уровень целостного растения. Вода в растении существует в
форме конституционной (химически связанной), гидратационной,
резервной, заполняющей водосборные полости в вакуолях и дру-
220
гих клеточных компартментах, и в форме интерстициалъной,
которая выполняет транспортные функции в апопласте и
проводящих путях.
Роль воды в растительном организме заключается в
следующем. 1
1. Вода — структурообразователь протоплазмы.
Макромолекулы белков, нуклеиновых кислот, мембраны могут сохранять свою
структуру и функциональную активность только при наличии
водородных связей с водным матриксом. При повышении
температуры водородные связи рвутся и стабилизирующее действие
воды на структуру протоплазмы снижается. Поэтому жизнь
может существовать в относительно узких пределах температур.
2. Вода — растворитель разнообразных веществ, обеспечивает
транспорт минеральных, органических веществ и газов (СО2, О2)
по растению.
3. Вода — активный участник биохимических превращений.
Принимает участие в фотосинтезе, дыхании, гидролитических
процессах.
4. Способствует стабилизации температуры растений.
5. Поддерживает тургесцентное состояние растений, что
обеспечивает сохранение формы травянистых растений,
определенную ориентацию органов в пространстве.
6. Обеспечивает связь органов друг с другом. Пронизывая все
тело растения, вода создает в нем непрерывную фазу и
осуществляет координацию деятельности органов в целостном растении.
4.2. ТЕРМОДИНАМИЧЕСКИЕ ОСНОВЫ
ВОДООБМЕНА РАСТЕНИЙ
Введение в физиологию растений понятий термодинамики
дало возможность математически описать и объяснить причины,
вызывающие как водообмен клеток, так и транспорт воды в
системе почва — растение — атмосфера. Важнейшим
термодинамическим показателем состояния воды в системе является
водный потенциал. Это производная величина от двух других
термодинамических показателей — активности и химического
потенциала воды.
Активность воды (а„). Характеризует ту эффективную
(реальную) концентрацию, соответственно которой вода участвует в
различных процессах. Всякие межмолекулярные и иные
взаимодействия, уменьшающие подвижность и рассеиваемость молекул
(прежде всего гидратация), снижают активность воды.
Активность чистой воды равна единице. В растворе и в клетке
активность воды всегда меньше единицы.
Химический потенциал воды (ц„,). Величина, производная от
активности. Она выражает максимальное количество внутренней
221
энергии молекул воды, которое может быть превращено в
работу, имеет размерность Дж-моль"1 и рассчитывается по уравнению
где р.» — химический потенциал чистой воды (принят равным нулю); Л — газовая
постоянная; Г—абсолютная температура; ап — активность воды в системе.
Водный потенциал (\|/). Выражает способность воды в данной
системе совершить работу по сравнению с той работой, которую
при тех же условиях совершила бы чистая вода. Рассчитывается
по уравнению
где |1„> и ц% — химические потенциалы воды в системе и чистой воды; У„ —
парциальный мольный объем воды (для чистой воды и разбавленных растворов
принимают равным 18 см моль ').
Водный потенциал, являясь фактически мерой активности
воды, определяет термодинамически возможное направление ее
транспорта. Молекулы воды всегда перемещаются от более
высокого водного потенциала к более низкому, подобно тому как вода
течет вниз, переходя на все более низкий энергетический уровень.
Когда система находится в равновесии с чистой водой, \|/=0. В
почве, растении, атмосфере активность воды и способность
совершать работу ниже, чем у чистой воды, поэтому \|/ обычно
отрицателен. Водный потенциал имеет размерность энергии,
деленной на объем, что позволяет выражать его в атмосферах,
барах или паскалях (1 атм = 1,013 бар = 105 Па; 103 Па = 1 кПа,
106 Па = 1 МПа).
Водный потенциал растения является алгебраической суммой
следующих четырех составляющих:
= Ук +
+
где щ — осмотический, щп — матричный, ур — гидростатический,
ционный потенциалы.
—
гравитаСоотношение между ними и вклад в водный потенциал
сильно различаются в-зависимости от объекта и окружающих
условий.
Гравитационный потенциал (у^). Отражает влияние на
активность воды силы тяжести и заметно сказывается только при
поднятии воды на относительно большую высоту. Он составляет
примерно 0,01 МПа-м , т. е. при перемещении воды
вертикально вверх на 10 м гравитационный вклад в водный потенциал
составляет 0,1 МПа. Это незначительная величина для сельско-
222
хозяйственных растений, в том числе и плодовых культур,
поэтому обычно она не, учитывается.
Рассмотрим более подробно, как складываются соотношения
водного потенциала и его основных составляющих.
Осмотический потенциал (\|/ге). Компонент водного
потенциала, характеризующий снижение активности воды частицами
растворенного вещества. Поэтому осмотический потенциал всегда
является величиной отрицательной:
\|% = -КТа,
где Л — газовая постоянная; Г— абсолютная температура; с — концентрация
раствора в молях; ( — изотонический коэффициент, равный 1+а(л—1), где а —
степень электролитической диссоциации; п — количество ионов, на которое
распадается молекула электролита.
Для веществ, не диссоциирующих на ионы, ос=0 и /=1.
Степень диссоциации электролита, как известно, зависит от
концентрации раствора, физиологическое значение имеют 0,1 —
0,5 М растворы солей, для которых I составляет 0,7—0,8.
С увеличением количества частиц растворенного вещества как
за счет повышения концентрации раствора, так и за счет
диссоциации веществ уменьшается активность воды и снижается
осмотический потенциал. При температуре 20 °С величина КТ
равна 2,44 МПа. Для 1 М раствора любого недиссоциирующего
вещества осмотический потенциал равен —2,44 МПа, для 0,5 и
2 М растворов соответственно —1,22 и —4,88 МПа. Диссоциация
растворенных веществ на ионы усиливает депрессию
осмотического потенциала. Осмотический потенциал 0,5 М раствора К1ЧОз
составляет —2,1 МПа (/=1,7),
для 0,5 М раствора Са(>Юз)2
он равен -2,9 МПа (/=2,4).
Когда раствор отделен от
воды полупроницаемой
мембраной (рис. 71), которая
пропускает только
растворитель и непроницаема для
растворенных веществ,
возникает односторонний ток воды
по градиенту ее активности в
направлении раствора. Этот
процесс называется осмосом,
а дополнительное давление,
которое должно быть
приложено к раствору, чтобы
воспрепятствовать
одностороннему току воды, —
осмотическим давлением {%).
Рис. 71, Осмотическая система:
два компартмента, разделенные
полупроницаемой мембраной (У); 2—не проникающие
через поры частицы растворенного вещества;
3— проникающие частицы растворителя
(воды); стрелкой показано направление
движения воды
223
Таким образом, осмотический потенциал раствора,
отделенного полупроницаемой мембраной от чистого растворителя,
реализуется в равном по величине и обратном по знаку
осмотическом давлении. Растворы с одинаковым давлением называются
изотоническими, между ними нет направленного водообмена.
Раствор, имеющий большее осмотическое давление, называется
гипертоническим, меньшее — гипотоническим. При разделении
полупроницаемой мембраной транспорт воды идет по
направлению к гипертоническому раствору.
Клетка, а также все органеллы, окруженные мембранами
(хлоропласты, митохондрии и др.), представляют собой
осмотические системы. Поскольку мембраны обладают избирательной
проницаемостью и вода проходит через них значительно легче,
чем растворенные вещества, допускают, что мембраны
полупроницаемы, т. е. проницаемы только для воды. Всю цитоплазму
обычно рассматривают как единый полупроницаемый барьер.
В зрелых растительных клетках главным «осмотическим
пространством» является вакуоль. Именно клеточный сок,
содержащий растворенные в воде различные соли, сахара, органические
кислоты, аминокислоты и другие соединения, представляет
собой осмотический актив клетки. Суммарная .концентрация
растворенных веществ в клеточном соке варьирует от 0,2 до
0,8 М. Осмотический потенциал клеточного сока измеряется
сотнями и достигает тысяч кПа.
Растительные клетки отличаются от идеальных осмотических
систем тем, что мембраны в некоторой степени проницаемы и
для растворенных веществ. Это снижает осмотический градиент
и возможность поступления воды. Отличие от идеального
поведения можно выразить с помощью коэффициента
селективности, или отражения (а). В случае абсолютной селективности
растворенное вещество «отражается» от мембраны, т. е. совершенно
не проникает через нее (а=1). Если мембрана в одинаковой
степени проницаема и для воды, и для растворенного вещества,
с становится равным 0, осмотического поступления воды нет.
Коэффициент отражения зависит от свойств мембран и природы
веществ. Так, для корней кукурузы получены следующие
значения о: этанол 0,27, маннитол 0,74, сахароза 0,54, полиэтиленгли-
коль 0,82, N301 0,64, К1МОз 0,6, которые фактически
характеризуют эффективность мембранного барьера в поддержании
осмотического градиента. В качестве осмотически активных
веществ при определении термодинамических параметров
растительных тканей необходимо использовать соединения со
значением а, близким к 1, например полиэтиленгликоль.
Матричный потенциал (цт). Характеризует снижение
активности воды за счет гидратации коллоидных веществ и
адсорбции на границе раздела фаз. Матричное связывание воды
сопровождается увеличением объема и называется набуханием. В
224
протоплазме преобладает набухание за счет гидратации белков,
нуклеиновых кислот, углеводов; в клеточной стенке
наблюдаются капиллярный эффект (вода между микрофибриллами и в
межмицеллярных пространствах) и гидратация полисахаридов,
среди которых по способности к набуханию выделяются
пектиновые вещества, содержащие диссоциированные
карбоксильные группы.
Состояние набухания протоплазмы имеет решающее значение
для интенсивности и направленности обмена веществ. В
некоторых частях растений поглощение воды происходит
исключительно путем набухания, например у семян, меристематических
тканей, клетки которых еще не вакуолизированы. При набухании
семян может развиваться давление, измеряемое десятками МПа.
Особенно сильной способностью к набуханию отличаются
семена бобовых культур с высоким содержанием белков.
Между осмосом и набуханием существует аналогия.
Осмотическое и матричное связывание снижает активность воды; поэтому
щ и \|/от всегда меньше нуля. Чем более отрицательное значение
они имеют, тем выше способность клеток и тканей поглощать
воду. Осмотическому давлению л соответствует давление набухания
х. Сухое набухающее тело обладает потенциальным давлением
набухания, которое так же, как и потенциальное осмотическое
давление, характеризует максимальную способность поглощать воду.
Гидростатический потенциал, или потенциал давления (\|/р).
Компонент водного потенциала, обусловленный
внутриклеточным давлением. При погружении растительной ткани, имеющей
зрелые сильно вакуолизированные клетки, в гипотонический
раствор наблюдается эндоосмос. При отсутствии противодавления
клеточной стенки поступление воды в клетку определяется ее
водным потенциалом (\|/), в начальный момент времени равным
осмотическому потенциалу (уж) раствора, заполняющего вакуоль,
вклад матричных сил очень незначительный, и им можно
пренебречь. Однако по мере поступления воды в вакуоль ее объем
увеличивается, цитоплазма прижимается к клеточной стенке и
возникает тургорное давление, а вместе с ним и равное ему по
величине противодавление стенки на клеточное содержимое.
Таким образом, осмотическое поглощение воды ведет к
созданию гидростатического давления. Под давлением активность
воды возрастает, поэтому гидростатический потенциал имеет
положительное значение. При полном насыщении клетки водой
(достижении максимального тургора) положительный потенциал
давления полностью уравновешивает отрицательный
осмотический потенциал и клетка перестает поглощать воду. В таком
состоянии ее водный потенциал равен нулю.
В любой момент времени водный потенциал вакуолизирован-
ной клетки определяется соотношением осмотического потен-
225
Рис. 72. Возможные уровни водного потенциала вакуолизированной клетки:
А — при завядании растений; Б — при частичном восстановлении тургесцентности; В —
при полном восстановлении тургора; Г— гидростатическое давление больше осмотического
циала и потенциала давления: \|/ = уп + л\гр. При завядании
растений гидростатическое давление равно нулю, у = Ур (рис. 72, А).
Восстановление тургесцентности сопровождается
возникновением и возрастанием гидростатического давления. Водный
потенциал имеет отрицательную величину, когда осмотический
потенциал еще не полностью реализован в гидростатическом
давлении и клетка способна поглощать воду (рис. 72, Б). Водный
потенциал равен нулю, когда потенциал давления полностью
компенсирует осмотические силы (рис. 72, В). Величина будет
положительной, если гидростатическое давление превосходит эти
силы (рис. 72, Г). Такая ситуация наблюдается в клетках,
прилегающих к сосудам ксилемы и подающих туда воду.
Необходимо также обратить внимание на то, что в соседних
клетках соотношения осмотического и гидростатического
потенциалов могут быть разными. У клеток с более низким
осмотическим потенциалом возможен более высокий потенциал
давления в результате большей насыщенности водой. Поэтому ее
водный потенциал окажется выше, чем в соседней клетке, и
транспорт воды осуществляется против осмотического градиента.
Этим растительные клетки существенно отличаются от
классического осмометра, где в результате неограниченного увеличения
объема нет гидростатического потенциала и поступление воды
идет только по осмотическому градиенту.
В клетках, которые поглощают воду в основном за счет
матричных сил, также возникает гидростатическое давление.
Протоплазма не может достичь состояния максимального набухания,
так как гидростатическое давление, которое проявляется вследст-
226
вие обусловленного набуханием притока воды, противодействует
этому. Способность /таких клеток поглощать воду зависит от
соотношения матричных сил и потенциала давления:
V = Ут + МУ
Таким образом, осмотический и матричный потенциалы
определяют максимальную поглотительную способность, реальная
же возможность поглощать воду в данный момент
характеризуется водным потенциалом, составляющим которого является
гидростатический потенциал, зависящий от степени
насыщенности клеток водой.
4.3. ЗНАЧЕНИЕ ТРАНСПОРТА ВОДЫ И ПУТЬ ВОДНОГО
ТОКА В РАСТЕНИИ
Подавляющая часть мощного водного тока, непрерывно
проходящего через растение, непосредственно в биохимических
превращениях не участвует. В фотосинтезе, дыхании,
гидролитических и других реакциях используется не более 1 % поглощенной
воды. Согласно одному из основных положений общей биологии
активное проявление жизнедеятельности возможно только в
водной среде, которая должна постоянно циркулировать по
организму. За счет циркуляции вода доставляет клеткам необходимые
для их функционирования вещества и одновременно удаляет
продукты жизнедеятельности, в том числе токсические отбросы.
Именно благодаря такой циркуляции осуществляется
взаимосвязь между отдельными частями клеток, между отдельными
клетками в пределах ткани, между различными тканями в
пределах органа, наконец, между различными органами и тем самым
обеспечиваются взаимосвязь физиологических процессов,
поддержание гомеостаза и функционирование организма как
единого целого.
Исходя из первостепенного значения для жизнедеятельности
растения транспортной функции воды необходимо учитывать
следующее. Во-первых, морфологическую и функциональную
взаимосвязь между восходящим и нисходящим водными токами,
образующими единую гидродинамическую систему. Во-вторых,
участие клеток в регуляции водного тока в растении нельзя
сводить только к пассивному движению по градиенту водного
потенциала в системе почва — растение — атмосфера благодаря
непрерывности водной фазы в растении.
Транспорт воды является важнейшей физиологической
функцией, в регулировании которой самое непосредственное участие
принимают не только внешние, но и главным образом
внутренние факторы. Концевые двигатели восходящего тока — нижний
(корневое давление) и верхний (присасывающее действие транс-
пирации) взаимосвязаны, а также имеют связь с другими процес-
227
сами жизнедеятельности, что обеспечивается сложной системой
эндогенной регуляции.
Путь, который проходит вода в растении, можно разделить на
две физиологически различные части: по живым клеткам и по
проводящей системе.
Путь по живым клеткам измеряется в растении всего лишь
миллиметрами или долями миллиметра; это два коротких
участка: один представляет собой радиальный транспорт воды от
поверхности корня до сосудов, расположенных в центральном
цилиндре, другой находится в листе — от сосудов, проходящих по
жилкам листа, до испаряющей поверхности клеток мезофилла.
Благодаря обильному ветвлению ксилемы в листьях расстояние
между окончаниями жилок достигает 50 мкм, т. е. практически
каждая клетка (или по крайней мере через одну) контактирует с
проводящей системой.
В многочисленных опытах с разными видами растений
показано, что наибольшее сопротивление току жидкой воды в
растении оказывают корни. Так, у кукурузы, подсолнечника, томата
сопротивление корней превосходит сопротивление листьев в
1,5 раза, а стебля — в 4 раза. У молодых деревьев яблони
сопротивление корней составляет 60—75 % общего сопротивления
водному току.
Высокое сопротивление корней объясняется тем, что именно
здесь путь движения воды пересекают мембраны. Радиальный
транспорт воды в корне включает три системы: симпласт —
совокупность протопластов всех клеток, соединенных плазмо-
десмами, апопласт, т. е. взаимосвязанную систему клеточных
стенок и межклетников, а также дискретную систему вакуолей.
Все они в большей или меньшей степени связаны с
преодолением мембран. Даже путь воды по апопласту прерывается в
эндодерме, где вода вынуждена проходить через жи-вое
содержимое пропускных клеток, из-за гидрофобных отложений в
радиальных клеточных стенках, образующих пояски Каспари.
Эта необходимость переключения на симпластический путь
имеет большое значение, так как процесс передвижения по
живой протоплазме может регулироваться в отличие от
передвижения по клеточным стенкам.
Следует отметить, что мертвые клетки обладают гораздо
большей проницаемостью для воды, чем живые. Так, энергия
активации для обмена тритиевой воды в мертвых клетках ткани
корнеплода моркови составляет 18,6 кДж/моль, что очень близко к
самодиффузии воды, в живых клетках — 42,8 кДж/моль. Тем не
менее ни у кого не вызывает сомнения, что для нормального
водообмена растения клетки корня должны оставаться живыми,
их высокое сопротивление водному току вполне оправданно.
Высокое сопротивление мембран, обладающих избирательной
228
проницаемостью, позволяет корню контролировать ток воды в
растении.
Скорость движения воды в корне очень незначительна. Если
по ксилемным путям травянистых растений вода движется со
скоростью 10 и/ч, древесных — 25 м/ч, то через корневую
систему, размеры которой во много тысяч раз больше, она проходит
со скоростью 1 мм/ч.
Большая часть водного пути приходится на долю проводящей
системы растения, состоящей из сосудов и трахеид. У
травянистых растений ее длина измеряется сантиметрами, а у деревьев —
метрами. В опытах с меченым фосфором показано, что вещества,
поглощенные каким-либо участком корневой системы яблони,
преимущественно направляются в конкретную группу ветвей.
Это часто наблюдается и при нежелательных последствиях
применения гербицидов. При их локальной передозировке страдают
вполне определенные ветви, получающие воду из обработанных
участков. На листьях этой части кроны появляются типичные
симптомы повреждения гербицидами, тогда как остальные
листья сохраняют зеленый цвет.
Установлено также, что вода и растворенные вещества могут
передвигаться в стебле и в поперечном направлении. Это
происходит, например, при подрезке корней или обрезке ветвей, в
таком случае растение в состоянии обеспечить водой и
веществами те части организма, которые раньше обслуживались
утраченными органами. Возможность радиального транспорта
обусловлена самой структурой проводящей системы, а именно:
контактами сближающих трахеид через поры. Так, у яблони
некоторые сосуды соединяются в среднем один раз на
протяжении 5 см. У плодовых, характеризующихся рассеянно-сосудистой
древесиной, в транспорте воды участвуют несколько (10 и более)
годичных колец. Только центральные (самые старые) годичные
кольца не включены в систему передвижения воды. В них
запасаются неорганические и органические вещества, часто —
окрашенные соединения.
Измерения водопроводящей системы показали, что у сильно
транспирирующих растений на каждый 1 г зеленых органов
приходится 2—3 мм2 водопроводящей площади, у кустарников и
травянистых растений — от 1 до 2 мм /г, у древесных пород —
около 0,5 мм /г. Относительное проводящее сечение изменяется
и в пределах одного растения. У деревьев оно увеличивается
снизу вверх так, что верхушечные побеги оказываются в
привилегированном положении. У высокоинтенсивных спуровых
типов плодовых культур масса дерева редуцирована гораздо
сильнее, чем диаметр ствола, поэтому они имеют более
благоприятные условия для транспорта воды из корней к потребляющим
органам.
229
4.4. ПОГЛОЩЕНИЕ ВОДЫ РАСТЕНИЕМ
4.4.1. ОСОБЕННОСТИ КОРНЕВОЙ СИСТЕМЫ КАК ОРГАНА
ПОГЛОЩЕНИЯ ВОДЫ
Нормальный ход процессов жизнедеятельности в растении
может быть обеспечен только при поддержании относительного
постоянства оводненности тканей. Расход на транспирацию
должен полностью компенсироваться поступлением воды из
возможно большего объема почвы. За счет диффузии влага в почве
передвигается крайне медленно: не более чем на 1 см в сутки.
Поэтому поглотительная деятельность корня непосредственно
связана с его ростовой функцией. В почве не вода движется к
корню, а корень должен устремляться за водой. Н. А. Максимов
(1952) очень образно об этом писал: «Корневая система растений
все время движется в почве вперед и вперед, словно огромная
стая роющих животных, обсасывая каждую встречную песчинку
и слизывая с нее, если можно так выразиться, тойчайшие
пленки воды, которые ее одевают».
Это обстоятельство предопределяет специфическую
организацию корневой системы, которая имеет очень большие размеры и
обладает исключительной способностью к ветвлению. Общая
поверхность корней обычно превышает поверхность надземных
органов в 140—150 раз. Уже у однолетнего сеянца яблони
формируется 5—7 порядков ветвления корней общей протяженностью
250 м, а с корневыми волосками около 3 км. У взрослых
деревьев корневая система измеряется десятками километров,
причем примерно половина ее представлена сосущими корнями
длиной до 5 мм. Плотность корней в пахотном слое, достаточная
для поглощения воды древесными и травянистыми растениями,
составляет 0,3—5 см на 1 см почвы. Для успешного азотного
питания требуется плотность 0,1—1 см на 1 см почвы.
Уникальная способность корней осваивать новые объемы
почвы, иссушив пространства, непосредственно прилегающие к
ним, связана с наличием большого количества точек роста (ме-
ристематические ткани составляют 10 % массы корня, в стебле
только 1 %), высокой скоростью ростовых процессов (1—10 см в
сутки) и положительным гидротропизмом, т. е. способностью
растущих частей изгибаться в сторону более влажных участков
почвы.
Необходимо также учитывать, что недостаток влаги в почв§
обычно вызывает торможение роста надземных органов, рост же
корней сначала может даже ускоряться. Эта защитная реакция
растения направлена на добывание воды, но она приводит к
нарушению пропорции между надземной и корневой системами,
следствием чего может быть снижение урожая.
Рассмотрим теперь особенности анатомического строения,
230
11
Рис. 73. Анатомическое строение корня:
/ — зона корневых волосков; П — зона
растяжения; Я/— зона меристемы; IV— корневой чехлик;
1 — центральный цилиндр; 2— корневые волоски;
3 — зрелые элементы ксилемы; 4 — эндодерма с
поясками Каспори; 5— первичная кора; 6 — ризо-
дерма; 7—незрелые элементы ксилемы; 8—
эндодерма без поясков Каспори; 9 — зрелые
элементы флоэмы; 10—незрелые элементы флоэмы;
11 — перицикл
обеспечивающие поглотительную
функцию корня (рис. 73).
Известно, что корень делится на четыре
зоны: деления клеток, растяжения,
всасывания, или корневых
волосков, и проводящую, или
опробковения.
Зона деления клеток,
защищенная корневым чехликом,
нуждается в небольшом количестве воды.
Клетки этой зоны характеризуются
крупными ядрами, большой
насыщенностью цитоплазмой,
отсутствием вакуолей, первичным
строением клеточных стенок. Их
водный потенциал определяется
только матричными силами, т. е.
способностью к набуханию
коллоидов протоплазмы и клеточных
стенок (у = ут).
Интенсивное поглощение воды начинается с зоны
растяжения. Здесь идет усиленное новообразование белков цитоплазмы.
Их содержание в пересчете на клетку возрастает в 1,5—2 раза,
что увеличивает возможности матричного связывания воды.
Значительное увеличение объема клеток достигается за счет
образования крупной центральной вакуоли, которая служит
резервуаром осмотически активных веществ. Так появляется второй
компонент водного потенциала — осмотический. Одновременно с
возрастанием объема вакуоли наблюдаются размягчение и
растяжение клеточных стенок. Благодаря эластичности они не
оказывают сопротивления поглощению воды. Поэтому водный
потенциал определяется суммой матричного и осмотического
потенциалов (у = ут + уя) и обеспечивает колоссальную способность
поглощать воду. Содержание воды в расчетена клетку возрастает
от (1—5)10 г в зоне деления до (6—35)10 г при растяжении.
Зона корневых волосков является основной поглощающей
зоной корня, которая направляет воду в русло дальнего
транспорта. Здесь на 1 мм находится 230—500 корневых волосков,
231
что увеличивает активную поверхность в 10—15 раз. Сильная
вакуолизация клеток этой зоны, высокая степень развития
мембранных структур и упругость закончивших формирование
клеточных стенок обеспечивают надежные механизмы осмотической
регуляции транспорта воды, в которых наряду с осмотическими
силами большое значение имеет развиваемое гидростатическое
давление (ц/ = \|/я + ур).
Проводящая зона корня характеризуется опробковением
покровных тканей. Ее поглотительная функция заметно снижена,
хотя показано, что опробковевшие части корня также могут
поглощать воду. Особое значение это имеет после окончания
вегетационного периода у многолетних растений.
4.4.2. ПОЧВА КАК СРЕДА ВОДОСНАБЖЕНИЯ РАСТЕНИЙ
Количество доступной растению воды зависит от состояния и
свойств почвы. Помимо прямого почва оказывает и косвенное
влияние на формирование корневой системы — глубину ее
проникновения по почвенному профилю, степень ветвления,
анатомическую структуру, особенности эпидермальной ткани корней.
Вода, поступившая в почву с атмосферными осадками,
взаимодействует с твердой фазой почвы. В зависимости от условий
(количества воды, гранулометрического состава, химического
состава твердой фазы и структуры почвы) преобладает влияние тех
или иных сил взаимодействий молекул воды с твердой фазой. В
связи с этим почвенная вода находится в разном состоянии. В
настоящее время выделяют следующие фракции почвенной
влаги: химически связанная (конституционная и
кристаллизационная), сорбированная (прочно- и рыхлосвязанная), свободная
(гравитационная и капиллярная), парообразная и твердая (лед).
Эти фракции почвенной влаги различаются прочностью связи с
твердой фазой почвы, а следовательно, и доступностью для
растений.
Химически связанная вода входит в состав
вторичных минералов и органических веществ почвы; она
недоступна для растений.
Сорбированная вода делится на прочносвязанную
(гигроскопическую) и рыхлосвязанную (пленочную). Обе эти
формы воды облегают почвенные частицы и удерживаются на их
поверхности силами адсорбции. Гигроскопическая вода
удерживается с силой 1000 МПа и более, поэтому она недоступна
растениям. На поверхности тонких гигроскопических слоев
образуется пленка из адсорбированных менее прочными силами молекул
воды. Это дополнительно связанная сорбционными силами вода
носит название пленочной. Толщина водной пленки может
достигать десятков молекулярных диаметров воды. В отличие от гиг-
232
роскопической пленочная вода отличается, хотя и небольшой,
растворяющей способностью. В пленке происходит постепенное
нарастание концентрации растворенных веществ, начиная от
нуля у поверхности частиц (гигроскопическая влага) и
постепенно увеличиваясь до концентрации свободного раствора.
Пленочная влага частично доступна для растений.
Почвенный профиль характеризуется пористостью. Примерно
половина объема почвы является свободным пространством,
которое в период выпадения осадков или полива заполняется
водой. Эта свободная вода делится на капиллярную и
гравитационную. Капиллярная вода составляет ту часть доступной
для растения влаги, которая находится в верхней части почвы и
удерживается силами, сравнительно легко преодолеваемыми
корнями. Явление подтягивания воды по капиллярам используют в
практике земледелия. В случае иссушения почвы на глубине
посева семян ее уплотняют специальными катками для
восстановления разрушенных при посеве капилляров. Удерживаемая
капиллярная вода образует в почве внутриагрегатную
капиллярную подвешенную влагу. Гравитационная вода содержится в не-
капиллярных пространствах, заполняя поры после дождя и
полива. Она передвигается под действием силы тяжести, легко
стекает вниз, поэтому является недолговременной формой легко
доступной для растений воды. Гравитационная вода находится в
конкурентных отношениях с аэрацией почвы, что негативно
влияет на жизнедеятельность корневой системы, особенно в
бесструктурных почвах.
Парообразная вода представлена в почве в форме
водяного пара, передвигающегося по градиенту упругости или с
током воздуха. При определенных температуре и давлении может
конденсироваться и дополнять содержание в почве свободной
или пленочной воды.
Твердая вода присутствует в почве при снижении
температуры ниже 0 °С, является резервом доступной влаги, которая
образуется после таяния льда.
Существуют различные показатели для определения
доступной растению почвенной влаги. При поступлении в сухую почву
вода вначале впитывается очень быстро. Затем скорость
просачивания воды в нижние горизонты становится все медленнее.
Когда скорость нисходящего движения воды оказывается резко
сниженной, влажность почвы достигает уровня, называемого
полевой влагоемкостъю. Понятие «полевая влагоемкость»
применяют для характеристики максимальных размеров запаса
почвенной влаги, который может быть использован растением.
Показателем минимального размера такого запаса служит влажность
устойчивого завядания. Влажность почвы, при которой
происходит устойчивое завядание различных растений, варьирует
незначительно. Под доступной для растения почвенной влагой понима-
233
ют то количество воды, которое накапливается в почве от уровня
влажности устойчивого завядания до полевой влагоемкости.
С термодинамической точки зрения факторами,
определяющими водные свойства почвы и доступность для растений
почвенной влаги, являются матричный потенциал (\|/от), который
обусловлен связыванием воды почвенными коллоидами и
капиллярными силами, а также осмотический потенциал (\|/я),
величина которого особенно важна на засоленных почвах и при
внесении высоких доз удобрений: у = \|/,„ + уя.
Для сельскохозяйственных растений легкодоступна вода при
депрессии водного потенциала почвы около 500 кПа. Среднедоступ-
ной считается вода при водном потенциале порядка -1000 кПа а
труднодоступная - до -2000 кПа. Определение доступной
почвенной влаги имеет большое практическое значение для
установления сельскохозяйственной ценности почв, так как именно
условия водообеспечения часто являются лимитирующим
фактором сельскохозяйственного производства.
4.4.3. КОРНЕВОЕ ДАВЛЕНИЕ, ЕГО ЗАВИСИМОСТЬ ОТ ВНЕШНИХ
И ВНУТРЕННИХ УСЛОВИЙ
Корневая система не только поглощает подавляющее
количество потребляемой растением воды, но и подает воду в
надземные органы. Развиваемое при этом давление называется
корневым. Оно легко обнаруживается по вытеканию пасоки, или плачу,
срезанных растений. Для учета плача на оставшийся пенек с
помощью резиновой трубки укрепляют дугообразно изогнутый
толстостенный капилляр и собирают пасоку в градуированную
пробирку. Плач может продолжаться в течение нескольких суток
после срезания стебля, и количество пасоки иногда бывает очень
большим. Например, у тыквы и огурца — до 1 л в сутки, у
винограда — несколько литров. Химический состав пасоки
значительно отличается от раствора, поглощаемого корнями из почвы, что
связано с синтетической и распределительной функцией корня.
У травянистых растений осмотический потенциал пасоки
составляет примерно 100 кПа. В пасоке в большом количестве
содержатся минеральные вещества (калий, фосфаты, нитраты), а
также сахара, органические кислоты, азотсодержащие
соединения (низкомолекулярные полипептиды, амиды, свободные
аминокислоты, гормоны, витамины). Содержание веществ
значительно колеблется в зависимости от вида, возраста растения, его
физиологического состояния. Данные о плаче могут быть
использованы как для изучения природы корневого давления, его
размеров и значения в транспорте воды, так и для
характеристики функциональной активности корневой системы, ее активной
поверхности, а также водообеспеченности растения. Результаты
234
анализа пасоки позволяют решать вопросы, связанные с
минеральным питанием и синтетической деятельностью корня.
Другим проявлением нагнетающей деятельности корня
является гуттация, т. е. выделение капельно-жидкой влаги листьями
в условиях затрудненного испарения. Например, в ранние
утренние часы при насыщенности воздуха водяными парами хорошо
гуттируют земляника, роза, картофель, злаковые культуры.
Капельки гуттационной жидкости не спутаешь с росой, потому что
они находятся в определенных местах выхода гидатод. Причем
гидатоды устроены так, что после фильтрации через
мелкоклеточную паренхиму — эпитему — здесь остается большая часть
растворенных веществ сока гуттации, которые потом
используются для нужд растений. Обычно содержание веществ в соке
гуттации в 8—10 раз меньше, чем'в пасоке (табл. 14).
14. Состав соков плача
Анализируемый раствор
и гуттации проростков кабачка
1978)
Концентрация, мМ
К+
№+
Са2+
Н
(Д.
Кларксон,
N01
Гуттационная жидкость
Пасока из листовых
черешков
Пасока из основания
стебля
Наружный раствор
0,5
26,2
12,8
0,5
0,7
0,6
0,3
0,2
0,9
8,0
5,1
0,15
0,2
0,5
0,2
0,01
0,4
12,9
7,1
1,0
В настоящее время разработаны методы, позволяющие
измерить силу, с которой вода подается корневой системой, —
корневое давление. Обычно для этой цели используют манометр,
укрепленный на пеньке декатированного растения. У древесньгх
пород корневое давление достигает 500—800 кПа, у винограда •*-
150—200, у травянистых растений оно в пределах 100 кПа.
Природа корневого давления во многом остается невыясненной.
В изучении нагнетающей деятельности корня выдающееся
место занимают работы Д. А. Сабинина, идеи которого легли в
основу дальнейших исследований в этой области. Д. А. Сабинин
(1949) исходил из представлений об осмотической природе
плача, сформулированных Дж. Пристли (1922).. В их основу
положено соображение, что корневые волоски, находясь в
непосредственном контакте с почвенным раствором, полностью
насыщены водой, их осмотический потенциал уравновешен
гидростатическим давлением и водный потенциал равен нулю
(Ук = УР, у = 0).
'. Сосуды ксилемы, лишенные протоплазмы, имеют самый
низкий для корня водный потенциал, равный осмотическому
потенциалу ксилемного сока (у = уя). За счет этого происходит по-
235
ступление сюда воды из соседних клеток, в них возникает
недостаток насыщения, что компенсируется поглощением воды из
окружающего раствора.
По этой схеме воду из почвы сосут не корневые волоски, а
находящийся в сосудах ксилемы раствор. Живым клеткам корня
отводится роль полупроницаемой перепонки между сосудами
ксилемы и почвенным раствором. В современном написании эта
схема может быть выражена следующим уравнением:
Л, = -Х/Мс - чп),
где ./и> — скорость объемного тока воды; Ьр — гидравлическая проводимость
корня; \|/^с — осмотический потенциал ксилемного сока; ц/" — осмотический
потенциал наружного раствора.
Заслуга Д. А. Сабинина состоит в том, что он показал
зависимость корневого давления от метаболизма и прежде всего от
дыхания. Большое значение Д. А. Сабинин придавал
энергозависимым полярным свойствам живых клеток корня и их участию в
транспорте воды. Он дал следующее определение плача: это
прижизненный односторонний ток воды и питательных веществ,
зависящий от аэробной переработки ассимилятов.
Такое представление о корневом давлении сложилось к 50-м
годам. Дальнейшая же разработка состояла в выяснении вопроса,
в чем состоит связь корневого давления с метаболизмом корня.
Сторонники осмотической гипотезы плача полагают, что
энергия дыхания расходуется на поступление ионов. В результате
поддерживается более высокая концентрация солей в сосудах
ксилемы по сравнению с окружающим раствором, а вода
поступает по градиенту осмотического потенциала. Кажется, что все
просто и логично. Однако эта схема предусматривает остановку
плача в условиях равенства осмотических давлений окружающего
раствора и пасоки, а также отсутствие плача и даже выход воды
из корня в том случае, если осмотическое давление
окружающего раствора выше, чем пасоки. Экспериментальная проверка это
не подтверждает.
В исследованиях, проводимых на кафедре физиологии
растений ТСХА и в лаборатории водного обмена Института
физиологии растений, показано, что осмотическое давление раствора
полиэтиленгликоля, останавливающего плач (компенсационное,
равное корневому давлению), примерно в 2 раза выше
осмотического давления пасоки, т. е. в компенсационном кроме
осмотического есть еще и активное давление. Изучение влияния
химических воздействий на скорость и движущую силу плача
выявило большую лабильность и связь именно этого компонента со
скоростью плача (табл. 15).
236
15. Влияние химических воздействий на скорость и движущую силу
плача (Л. В. Можаева, Н. В. Пилыцикова, 1979)
Вариант опыта
Контроль
10~3 М
раствор аденина
10~4 М
раствор ДНФ
Скорость
плача, мл/ч
0,81
1,21
0,44
компенса-
16,6
19,6
15,4
Давление, кПа
осмотичес-
8,0
5,4
12,2
активное
8,6
14,2
3,2
Доля актив-
ния. в
пенсационном, %
51,8
72,5
20,8
Известно, что аденин и динитрофенол влияют на
энергетический обмен корня. Аденин стимулирует образование макроэрги-
ческих фосфатных связей и энергозависимые процессы.
Динитрофенол является классическим разобщающим агентом. Под его
действием дыхание как бы переходит на холостой ход: идет
окисление субстрата, а энергия в АТФ не запасается. Двухчасовое
воздействие этих веществ на корни вызывает значительное
изменение скорости плача. Аденин стимулирует плач, а динитрофенол
сильно подавляет его. Характеру изменений скорости плача
соответствуют изменения активного давления. Значительное
повышение осмотического давления пасоки под действием динитрофено-
ла не может предотвратить сильное подавление плача.
Если перенести растения огурца, выращенные в водной
культуре, на более концентрированную питательную смесь, то
происходит повышение осмотического давления пасоки. Однако это
довольно-таки длительный процесс: требуется 3—5 дней, чтобы
осмотическое давление пасоки достигло осмотического давления
окружающего раствора. Плач же не прекращается, т. е. идет
неосмотическим путем. Эти данные очень легко воспроизводятся,
и сам факт поглощения воды корнем в условиях, когда
осмотическое давление наружного раствора больше или равно
осмотическому давлению ксилемного сока, не вызывает сомнения.
Невыясненным остается механизм процесса.
Высказано предположение и накоплены косвенные
доказательства, что активная подача воды в сосуды осуществляется
клетками стелярной паренхимы с участием сократительных
белков, подобных актомиозину мышц. Показано, что содержание
актомиозиноподобных белков составляет 0,002 % сырой массы
корней и 0,48 % общего белка в корнях. Это количество
примерно на два порядка меньше, чем его содержание в подушечках
листьев мимозы, что согласуется с более высоким уровнем
подвижности, свойственным мимозе. Пульсирующий характер
плача, действие на плач камфоры, ацетилхолина, курареподоб-
ных препаратов и других веществ, влияющих на АТФ-азы и
сократительные белки, свидетельствуют о связи нагнетающей де-
237
ятельности корня с функционированием белков, подобных акто-
миозину мышц.
Возможно, что скелет цитоплазмы, образованный
микротрубочками и микрофиламентами, в состав которых входят
сократительные белки, обеспечивает перистальтическое движение и
проталкивает воду из живых клеток в сосуды корня. Другими
словами, в клетках стелярной паренхимы создается гидростатическое
давление, большее по абсолютной величине, чем осмотический
потенциал, поэтому водный потенциал становится
положительным и клетки выталкивают воду. Насколько верно
предположение об участии сократительных белков в создании
гидростатического давления, покажут дальнейшие исследования. Однако
связь корневого давления с энергетикой дыхания является
прочно установленным фактом, который необходимо учитывать при
оптимизации условий корнеобитаемой среды для нагнетающей
деятельности корня.
Влияние внешних и внутренних факторов на корневое давление.
Зависимость корневого давления от энергии дыхания определяет
характер влияния факторов на поглотительную деятельность
корня.
Газовый состав корнеобитаемой среды.
Основной механизм энергообеспечения деятельности корня — аэробное
дыхание, для нормального протекания которого концентрация Ог
должна быть не ниже 5 %, а концентрация СОг не превышать
10 %. Дзбыток СОг гораздо опаснее для нагнетающей
деятельности корня, чем временный дефицит кислорода. Сильное
уплотнение почвы или ее затопление вызывает нарушение аэрации, что
приводит к подавлению дыхания и поглощения воды. Случаи
увядания растений при избытке влаги можно наблюдать в
пониженных местах сразу после сильного дождя, когда ослабленное
поглощение воды корнем не компенсирует ее расход на транспи-
рацию. О необходимости хорошей аэрации корневой системы
нужно помнить при подборе условий содержания почвы в
сельскохозяйственных посевах и насаждениях, при выращивании
растений в водной культуре, разновидностью которой является
гидропоника, широко распространенная в защищенном грунте.
Температура. Зависимость поглощения воды корнем от
температуры выражается одновершинной кривой со
следующими кардинальными точками: тт 0—5 °С, ор1 25—30, тах 40—
45 °С (рис. 74). Замедление поглощения воды при снижении
температуры объясняется торможением дыхания и уменьшением
гидравлической проводимости корня (Ьр), что связано с
изменением, свойств мем_бран и с возможностью фазового перехода
жидкого кристалла в гель в результате снижения подвижности
липидной фракции мембран. Температурный максимум
обусловлен денатурационными изменениями белков и
.приближаемся ,^температурной границе жизни. В интервале от 5 до
238
10
20
Рис. 74. Влияние температуры на
скорость «плача»
35 °С температурный
коэффициент скорости плача
находится в пределах 2,0—2,5, т. е.
соответствует (?10 для
химических реакций, что опять-
таки свидетельствует о
зависимости плача от дыхания. У
транспирирующих растений
ведущим является верхний
концевой двигатель, в основе
которого лежит физический
процесс — испарение ((2\о
близко к единице).
Зависимость поглотитель-„
ной деятельности корня от температуры во многом объясняет
некоторые явления. Так, одна из главных причин образования
отделительного слоя в черешках листьев и осеннего листопада
плодовых деревьев и кустарников заключается в водном дефиците
в результате диспропорции между продолжающейся с высокой
интенсивностью транспирацией в солнечные осенние дни и
сильным замедлением поглощения воды из уже охлажденной почвы.
На холодных болотистых почвах наблюдается явление,
получившее название физиологической засухи: несмотря на большое
количество воды, растения испытывают ее недостаток из-за
подавления поглотительной деятельности корней при пониженных
температурах. В результате происходит парадоксальное на
первый взгляд явление: у растений формируются ксероморфная
структура (мелкие клетки, много устьиц и проводящих пучков на
единице листовой поверхности), а также такие анатомические
приспособления для уменьшения потери воды, как мощно
развитая кутикула, заглубление устьиц, шиловидная форма листьев,
характерные для растений сухих мест, несмотря на то, что они
растут на почвах, богатых влагой. Таким образом, холодная
почва физиологически суха, даже если она насыщена водой.
Особенно болезненно реагируют на холодные почвы
теплолюбивые растения. Так, у фасоли, томата, огурца, тыквы
поглощение воды прекращается при температуре 5 °С. Бахчевые
культуры еще более требовательны к теплу. Высаживать или высевать
их можно только в хорошо прогретую почву; их нельзя поливать
водой из родников и колодцев. У растений, более выносливых к
холоду, например у озимых культур, земляники, низкие
температуры в меньшей степени задерживают поступление воды. Эти
растения прекрасно растут и развиваются поздней осенью и
ранней весной.
Растения могут страдать не только от низкой, но и от
высокой температуры корнеобитаемой среды. Например, слишком
высокая температура верхних слоев почвы неблагоприятно ска-
239
зывается на поглощении воды плодовыми культурами с поверх^
ностной корневой системой вследствие большого испарения
влаги из почвы и повышения ее водоудерживающих сил. В
защищенном фунте при использовании искусственных источников
света с большой теплоотдачей такие ситуации очень часты.
Внутренние ф а к т о р ы. Из них в первую очередь
необходимо отметить мощность развития корневой системы и наличие
ростовых процессов. Поглощение воды происходит тем
интенсивнее, чем больше всасывающая поверхность корневой системы и
чем легче корни и почвенная влага приходят в соприкосновение
друг с другом:
ГГ/" лУпОЧВЫ У КОрНИ "Т|
Согласно этой формуле количество воды IV, поглощаемое
корневой системой в единицу времени, прямо пропорционально
обменной поверхности А в корнеобитаемом пространстве
(активная поверхность корней в единице объема почвы), а также
разности водных потенциалов корня и почвы и обратно
пропорционально сумме сопротивлений транспорту воды К в почве и при
переходе из почвы в растение. Активная поверхность корней у
травянистых сельскохозяйственных растений составляет
примерно 1 см /см3, а у древесных растений — 0,1 см /см .
Тесная корреляция между активной поверхностью корневой
системы и корневым давлением позволяет по количеству
выделяемой пасоки судить о степени развития и функциональной
активности корневой системы. Однако к концу вегетационного
периода сбор пасоки сильно затрудняется, поскольку
поглощение воды резко ослабляется вместе с затуханием ростовых
процессов, так как корни должны постоянно продвигаться из
иссушенных слоев почвы к более влажным.
Зависимость корневого давления от дыхания обусловливает
еще одно важное внутреннее требование нагнетающей
деятельности корня — обеспечение кррней органическими веществами.
Продукты фотосинтеза (ассимиляты) поступают из надземной
части в виде углеводов и используются корнем в качестве
дыхательных субстратов. Для весеннего сокодвижения у плодовых
культур очень важное значение имеет запасание с осени
углеводов в корнях и стволе. Если накоплено недостаточно
органических веществ или они израсходованы во время неблагоприятной
зимы (например, при оттепели), весеннее сокодвижение может
не начаться и растение погибнет. На мобилизацию запасных
веществ сильно влияет температура. Так, у винограда при
температуре почвы 8 °С наблюдается очень слабый плач, при 12 °С он
значительно усиливается. Этот температурный порог
соответствует мобилизации запасных углеводов виноградной лозы.
240
10
Время после срезания пооееа,с<//п
Рис. 75. Суточный ритм плача
Для нагнетающей
деятельности корня необходимо
также наличие
высокоструктурированных митохондрий в
корнях, обеспечивающих
эффективное дыхание. Всякие
воздействия, приводящие к
деструкции митохондрий,
нарушению дыхательных
ансамблей, ингибированию
отдельных звеньев дыхательной
цепи, подавляют поглощение
воды корнем. Например,
сильное ингибирующее
действие на плач растений
оказывают наркотические вещества (хлороформ, цианиды, азиды).
Немалую роль в жизнедеятельности корня играют внутренние,
наследственно закрепленные свойства. При изучении поглощения
воды корнем в течение суток оказалось, что днем выделяется
значительно большее количество пасоки, чем ночью, минимум
плача наблюдается в ранние утренние часы (рис. 75). Поскольку у
опытных растений отсутствовала надземная часть, которая
воспринимает смену дня и ночи, света и темноты, можно говорить об
эндогенном ритме плача. Эндогенными называются внутренние,
наследственно обусловленные ритмы, проявляющиеся при
постоянных внешних условиях. Не только поглощение воды корнем, но
и ряд других функций, например фотосинтез, минеральное
питание, рост, также имеют ритмичность. Существование эндогенных
ритмов доказывает, что изменение физиологических процессов во
времени не пассивно следует за изменениями условий внешней
среды, а регулируется самим растением.
4.5. ТРАНСПИРАЦИЯ И ЕЕ РЕГУЛИРОВАНИЕ РАСТЕНИЕМ
4.5.1. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
И РАЗМЕРЫ ТРАНСПИРАЦИИ
В основе расходования воды растительным организмом
лежит физический процесс испарения — переход воды из
жидкого состояния в парообразное, происходящий в результате
соприкосновения органов растения с не насыщенной водой
атмосферой. Расходование воды растением регулируется целым
рядом анатомических и физиологических механизмов. Термин
«транспирация» введен для того, чтобы подчеркнуть отличие
этого физиологического процесса от чисто физического
испарения.
241
Почва
Ксилема и\
корня
Лист
Газобая таза
у выхода
из устьиц
-10,0
V
\1
Атмосфера
Рис. 76. Градиент водного потенциала в системе почва — растение — атмосфера
^Биологическое значение транспирации состоит в
терморегуляций растения, в обеспечении деятельности верхнего концевого
двигателя водного тока, при помощи которого осуществляется и
поступление различных веществ, а также в регулировании
насыщенности клеток водой, благодаря чему создаются оптимальные
условия дли процессов жизнедеятельности. г"
Одной из важных характеристик процесса является!
интенсивность транспирации — количество воды, испаряемое растением с
единицы листовой поверхности в единицу времени. В некоторых
случаях удобнее проводить расчет не на единицу площади, а на
единицу массы листьев. Для большинства сельскохозяйственных
растений интенсивность транспирации составляет днем 15—250,
а ночью 1—20 г/(м2ч).
Высокая интенсивность транспирации, которую К. А.
Тимирязев называл «необходимым злом», обусловлена тем, что
атмосфера характеризуется очень низкими значениями водного
потенциала (рис. 76). Водный потенциал связан логарифмической
зависимостью с относительной влажностью воздуха:
242
где К — газовая постоянная; Т—абсолютная температура; V— парциальный
мольный объем; е — давление водяного пара в воздухе; ео—давление водяного
пара, насыщающего воздух при данной температуре.
Поэтому небольшой перепад относительной влажности
приводит к значительной депрессии его водного потенциала. Так,
при относительной влажности воздуха 100 % водный потенциал
равен нулю, при влажности 99,6 — 0,5 МПа, при 99 и 97 % он
составляет соответственно —1,36 и —4,0 МПа. Относительная
влажность воздуха летом наиболее часто не превышает 60 %,
водный потенциал при этом снижается до —68 МПа, а во время
суховея (влажность 30 %) депрессия водного потенциала
достигает 200^\Ша:^
Кутикулярная транспирация. С самого начала существования
наземных растений возникла дилемма: ассимиляция СОг из
атмосферы требует интенсивного газообмена; предотвращение
значительной потери воды возможно только при наличии хорошей
изоляции от окружающего воздуха, имеющего крайне низкие
значения водного потенциала. Главная проблема газообмена, как
ее сформулировал О. Штоккер (1923), состоит «в лавировании
между жаждой и голодом».
Поддержание водного гомеостаза листа достигается наличием
покровной ткани — эпидермиса, представляющей слой довольно
тесно примыкающих друг к другу клеток, наружные стенки
которых утолщены. Снаружи эпидермис покрыт кутикулой, в состав
которой входит кутин — полимерные эфиры оксимонокарбоно-
вых кислот, содержащих по 16—28 атомов углерода и по 2—3
гидроксильные группы. В состав кутикулы входят также
пластинки воска. От плазмалеммы эпидермальных клеток к кутикуле
отходят канальцы, заполненные рыхлой сетью из целлюлозных
фибрилл. Они служат полярными путями поглощения и
экскреции веществ листом.
Кутикулярное диффузионное сопротивление в большинстве
случаев очень велико. Оно зависит от толщины кутикулы,
расположения, плотности и числа прослоек кутина и воска. На
формировании изолирующих структур на поверхности листьев в
сильной степени сказываются видовые особенности и возраст
растений, а также условия их произрастания. При атмосферной
и почвенной засухе взрослые листья обладают обычно более
толстой кутикулой и более плотным восковым налетом.
Кутикулярная защита от транспирации весьма эффективна. У взрослых
листьев кутикулярная транспирация составляет 10—20 % общего
испарения воды. Например, у семечковых плодовых деревьев она
измеряется 120—160 мг/(дм2ч).
У кутикулы есть уникальное свойство, обусловленное особен-
243
ностями ее состава — изменять гидравлическую проводимость в
зависимости от оводненности. При подсыхании наружных слоев
стенок эпидермиса гидрофобные слои кутикулы плотнее
придвигаются друг к другу, поэтому кутикулярное сопротивление может
удвоиться. При низких температурах оно также возрастает. И,
наоборот, при увеличении оводненности эпидермиса кутикула
набухает за счет гидратации карбоксильных и оксигрупп,
разрыхляется, кутикулярное сопротивление диффузии значительно
снижается и транспирация возрастает. Таким образом, потеря воды
через кутикулу регулируется оводненностью листа. По ночам,
например, при более сильном набухании кутикулы кутикулярная
фанспирация идет интенсивнее, чем днем. Смоченные листья
могут поглощать воду через кутикулу.
Устьичная транспирация. Основной путь сообщения
мезофилла листа с атмосферой — устьица. Процесс устьичной
транспирации можно разделить на ряд этапов (рис. 77).
Первый этап — испарение воды с поверхности клеток в
межклетники. Каждая клетка мезофилла хотя бы одной своей
стороной граничит с межклеточным пространством. Поверхность
всех клеточных стенок, соприкасающихся с межклетниками,
превышает поверхность листа примерно в 10—30 раз.
Необходимо отметить, что уже на этом этапе растение способно
регулировать транспирацию. Уменьшение испарения воды в межклетники
достигается по крайней мере двумя механизмами. Первый
обусловлен изменениями водоудерживающей способности
цитоплазмы путем увеличения осмотического и коллоидного
связывания воды, ее компартментации в отдельных органеллах клетки
и снижения проницаемости мембран. Второй механизм связан с
уменьшением оводненности клеточных стенок. Он получил
название механизма начинающегося подсыхания, или корневого
регулирования транспирации.
{При снижении подачи воды корнем и
увеличении водоудерживающей
способности цитоплазмы клеток мезофилла
оболочки клеток оказываются менее
насыщенными водой, водные мениски в
капиллярах между фибриллами
становятся вогнутыми, что увеличивает силы
поверхностного натяжения и затрудняет
переход воды в парообразное состояние.
Поэтому при открытых устьицах
происходит снижение транспирации за счет
уменьшения количества водяного пара в
межклетниках. Это_внеустьичньш способ
регулирования транспирации, который
представляет несомненную выгоду для
растения, так как позволяет снижать
Рис. 77. Испарение и
диффузия водяного пара
в листе
244
расход воды без ущерба для ассимиляции углекислого газа./У
хлопчатника преобладает именно этот способ регулирования
транспирации. У растений умеренной зоны внеустьичное
регулирование выражено в меньшей степени: транспирация может быть
снижена на 30 % без закрывания устьиц. Возможности внеус-
тьичного регулирования в значительной степени зависят от
условий выращивания и возраста растений. Например, оптимизация
минерального питания увеличивает водоудерживающую
способность тканей, при старении листьев она снижается^
Второй этап — выход паров воды из межклетников через
устьичные щели. Число устьиц и их размещение сильно
варьируют у разных видов растений. У ксерофитов — растений
засушливых мест обитания — на единицу площади обычно приходится
меньшее количество устьиц, чем у мезофитов. Кроме того,
устьица у них часто углублены в сильно кутинизированную
поверхность листьев, что уменьшает потерю воды. У большинства
сельскохозяйственных культур устьица в основном расположены с
нижней стороны листа (табл. 16). Это одно из приспособлений
для меньшей затраты воды.
16. Количество устьиц у сельскохозяйственных культур, шт/см2
Культура
Яблоня
Вишня
Капуста
Картофель
Томат
Кукуруза
верхний
0
0
14000
5000
1200
9300
Эпидермис
нижний
40000
25000
22000
16000
14000
7700
Обычно устьица занимают 1—3 % всей поверхности листа.
Однако ^относительная транспирация, под которой понимают от-
ношениёГиспарения воды листом к испарению с такой же по
величине свободной поверхности, составляет 0,5—0,8 и может
приближаться к единице^ Высокая скорость диффузии через
устьица объясняется темГчто испарение из ряда мелких отверстий
происходит быстрее, чем из одного крупного той же площади.
Это связано с явлением повышенной краевой диффузии.
Согласно закону Й. Стефана испарение с малых
поверхностей, отстоящих друг от друга на 10-кратное расстояние, идет
пропорционально не их площади, а диаметру. При открытых
устьицах испарение может быть таким же, как с открытой
водной поверхности. Закрывание устьиц наполовину еще мало
сказывается на интенсивности транспирации. Полное закрывание
устьиц сокращает транспирацию примерно на 90 %. Для более
точного определения эффективности закрывания устьиц (напри-
245
мер, для эколого-физиологической характеристики тех или иных
сортов растений или характеристики их адаптации) лучше
сравнивать диффузионные сопротивления при максимально
открытых и полностью закрытых устьицах, а не транспирационные
показатели, зависящие от испарения. При этом оказывается, что
максимальное диффузионное сопротивление листьев (когда
устьица закрыты) у лиственных деревьев в 30—45 раз больше, чем
минимальное (когда устьица открыты), у травянистых
двудольных растений диффузионное сопротивление листьев
увеличивается при закрытии устьиц в 10—15 раз, у злаков — в 5—15 раз.
Таким образом, изменение степени открытости устьиц — устьич-
ная регулировка — является основным механизмом контроля
транспирации растением.
Третий этап транспирации — диффузия паров
воды от поверхности листа в более далекие слои атмосферы.
Этот этап регулируется лишь условиями внешней среды:
температурой, влажностью воздуха, скоростью ветра.
4.5.2. ФИЗИОЛОГИЯ УСТЬИЧНЫХ ДВИЖЕНИЙ
Степень раскрытия устьиц зависит от интенсивности света,
оводненности тканей листа, концентрации СОг в межклетниках,
температуры воздуха и других факторов. В зависимости от
фактора, запускающего двигательный механизм (свет или
начинающийся водный дефицит в тканях листа),\ различают фото- и
гидроактивное движение устьиц. Существует также гидропассивное
движение, вызванное изменением оводненности клеток
эпидермиса и не затрагивающее метаболизм замыкающих клеток.
Например, глубокий водный дефицит может вызвать подвядание
листа, эпидермальные клетки при этом, уменьшаясь в размерах,
растягивают замыкающие клетки, и устьица открываются. Или,
наоборот, сразу после дождя эпидермальные клетки настолько
разбухают от воды, что сдавливают замыкающие клетки, и
устьица закрываются. Иными словами, гидропассивное движение
способно вести к ответам в «ложном» направлении. Целесообразная
реакция растений на изменение условий достигается активными
механизмами регулирования ширины устьичных щелей.
Замыкающие клетки имеют сложную вакуолярную систему,
крупное ядро и большое количество высокоструктурированных
митохондрий. Хлоропласты обычно содержат зерна крахмала и
характеризуются слабым развитием фан. Особенностью
замыкающих клеток является наличие крупных перфораций в
основании общих стенок. Это обеспечивает связь протопластов
сестринских замыкающих клеток и их функционирование как
единого целого.
Хотя у представителей разных видов растений замыкающие
246
клетки отличаются характерными чертами строения, все они
имеют сходство в том, что стенки, удаленные от устьичной
щели, тоньше и поэтому более эластичные. Считается, что эта
особенность имеет прямое отношение к способности
замыкающих клеток изменять форму в ответ на изменение тургора и
контролировать таким образом величину устьичного отверстия.
Существенный вклад в физический механизм устьичного
открывания вносит также радиальное расположение микрофибрилл
целлюлозы в стенках замыкающих клеток. Возможная роль
радиальной мицелляции в движении замыкающих клеток установлена
с помощью электронной микроскопии и специально
сконструированных моделей. Модели состоят из эластичных латексных
цилиндров, соединенных в пары своими концами и укрепленных
для жесткости витками тесьмы, расположенными радиально.
При увеличении давления радиальные витки смещаются к
концам цилиндров, некоторые из них ориентируются вдоль
вентральной стенки. Это обеспечивает изменение формы
замыкающих клеток и открывание щели.
Что лежит в основе изменения тургора замыкающих клеток?
Долгое время для объяснения этого явления использовали
«сахарную гипотезу», согласно которой осмотическое
перераспределение воды связано с обратимыми превращениями в системе
крахмал == сахар. Эти превращения катализируются ферментом
фосфорилазой, направленность действия которой зависит от рН.
На свету происходит поглощение СОг, повышение рН, реакция
идет в сторону накопления осмотически активных Сахаров, что
вызывает поступление воды в замыкающие клетки и открывание
устьиц. Малая интенсивность света обусловливает снижение
фотосинтеза и накопление СО2 в межклетниках, что приводит к
снижению рН, синтезу крахмала, выходу воды из замыкающих
клеток и закрыванию устьиц. Однако изучение метаболизма
замыкающих клеток и устьичных движений с помощью
современных биохимических и биофизических методов выявило более
сложную природу этого явления.
В настоящее время общепризнанной стала гипотеза,
связывающая устьичные движения с перераспределением ионов калия
между замыкающими и сопутствующими клетками, вслед за
которыми перемещается вода. Эта идея, высказанная еще в 1943 г.,
принадлежит японским исследователям. Однако только в
последние два десятилетия, когда широкое распространение получила
микроэлектродная техника, появилась возможность измерить
активность ионов калия в отдельных клетках и были получены
экспериментальные доказательства участия перераспределения
калия в движении устьиц более чем у 50 видов растений,
включая папоротники и голосеменные. Известно также, что этот
механизм используют толстянковые для ночного открывания
устьиц. На рисунке 78 представлены данные, иллюстрирующие
247
289*38
•Н8+33
■293*7
Активность к+пП участие калия в устьичных движени-
156*29 ях. Для клеток устьичного комплекса
тип характерны более высокие значения
активности К , чем для
окружающего эпидермиса. Закрытое и открытое
состояния устьиц связаны с
различной активностью К+ в замыкающих
и сопутствующих клетках. Объемы
этих клеток также изменяются:
объем замыкающих клеток при
открывании устьиц увеличивается
примерно в 2,5 раза, размеры
сопутствующих уменьшаются. Поэтому
абсолютное содержание калия должно
изменяться еще более значительно,
чем активность.
Согласно современным
представлениям открывание устьиц
индуцируется усилением выхода Н+ из
замыкающих клеток. Этот процесс
обеспечивается деятельностью
протонной помпы плазмалеммы
замыкающих клеток в ответ на те или иные изменения внутренних и
внешних условий. Например, освещение растений, находящихся
до этого в темноте, включает протонную помпу, откачивающую
Н из замыкающих клеток. Это активный процесс,
сопровождающийся затратой метаболической энергии. Особенности
ультраструктуры митохондрий и хлоропластов замыкающих клеток
свидетельствуют о том, что поставщиком АТФ является дыхание.
Выход Н+ сопровождается поступлением ионов К+ в вакуоли
замыкающих клеток, которое идет по электрическому градиенту
путем облегченной диффузии с переносчиком. Транспорт К+ в
вакуоль уравновешивается входом в нее двух типов анионов:
иона СГ, компенсирующий эффект которого у разных видов
растений составляет 5—100 % (например, у кукурузы 40 %), и
анионов малата. Хлор транспортируется в замыкающие клетки
путем электронейтрального симпорта. Малат же образуется в
самих замыкающих клетках. Уменьшение кислотности
цитоплазмы до 7,2 и более в результате выхода Н+ приводит к следующей
цепи биохимических превращений:
169*21
Рис. 78. Активность К+ в
клетках устьичного комплекса
СотшеМпа соттшк при
закрытых (о) и открытых (б)
устьицах (А. Реппу, XV. В1
1974)
Крахмал
глюкоза
окисление
+ СО-,
ЦАДФ-И
■-+* щавелевоуксусная
кислота
фосфоенолпиро-
виноградная кислота
яблочная кислота
НАДФ
248
Яблочная кислота обеспечивает замыкающие клетки
протонами Н+ для обмена на К+ и анионами малата для баланса заряда
в вакуоли. Показано, что наибольшей чувствительностью к рН в
этой цепи реакций обладает фермент ФБП-карбоксилаза.
Увеличение в вакуолях замыкающих клеток содержания
осмотически активных веществ (К+, СГ, малата) приводит к
усилению поступления воды в вакуоли, повышению тургора и
открыванию устьиц. Рассмотренные процессы могут быть
представлены в виде следующей схемы:
Свет
ото
включение протонной помпы
(выход Н из замыкающих клеток)
+ Т
транспорт К и С1
в замыкающие клетки
повышение рН
образование малата
■■*
снижение осмотического потенциала замыкающих клеток
поступление воды в замыкающие клетки
открывание устьиц
Последовательность событий при закрывании устьиц носит
обратный характер. Отключение протонной помпы приводит к
выходу К+ и С1~ из замыкающих клеток в сопутствующие и ресин-
тезу крахмала в результате глюконеогенеза. Осмотический
потенциал замыкающих клеток при движении устьиц у разных видов
растений изменяется неодинаково. Открытому состоянию устьиц
соответствует осмотический потенциал в среднем —4,0 МПа, при
закрывании устьиц он возрастает на 0,3—1,8 МПа.
Другим важным фактором, регулирующим устьичные
движения, является оводненность листьев. Причем закрывание устьиц
происходит уже на ранних стадиях водного дефицита. В этом
процессе принимает участие фитогормон — абсцизовая кислота
(АБК), одной из функций которой является защита растения от
иссушения. Продемонстрировано это было на завядающем
мутанте томата, полученном случайно в опытах с рентгеновским
облучением семян. Мутант отличается тем, что быстро завядает
при самом небольшом недостатке воды, потому что устьица у
него всегда открыты. Обнаружилось, что у этого мутанта по
сравнению с родительским сортом в 10 раз понижено
содержание АБК. При его обработке абсцизовой кислотой быстрее
закрывались устьица и восстанавливался тургор. Позже выясни-
249
лось, что обработка АБК может вызвать закрывание устьиц и у
других растений. Показано, что в плазмалемме замыкающих
клеток находятся специфические белки связывания (сайты) абсци-
зовой кислоты. Их взаимодействие приводит к структурным
изменениям мембраны и ингибированию деятельности протонной
помпы. Для усиления синтеза АБК достаточно снижения
водного потенциала на 200 кПа, что еще не выражается в видимом
завядании, но приводит к закрыванию устьиц. При нанесении
АБК на основание листа устьица закрываются в течение 3—
9 мин, после ее удаления открывание происходит через 15 мин.
В регуляции закрывания устьиц может участвовать диоксид
углерода. Избыток СО2 вызывает закрывание устьиц,
по-видимому, из-за подкисления цитоплазмы, в результате которого
уменьшается количество малата и накапливается крахмал. Эта реакция
проходит очень быстро. Например, устьица кукурузы при
избытке СС>2 в межклетниках закрываются за 3 с.
Решающее влияние концентрации СОг на степень открытости
устьиц обнаруживается у суккулентов, обладающих
специфическим суточным ритмом обмена органических кислот. Эти
растения открывают устьица ночью, когда парциальное давление СС>2
в межклетниках листьев снижается вследствие интенсивного
образования малата, а закрывают устьица, когда при декарбокеили-
ровании малата днем высвобождается СОг, который
накапливается в межклетниках перед дальнейшим использованием.
В регуляции функционирования устьиц (рис. 79)
взаимодействуют прямые и обратные связи. Одна из них (2) предотвращает
недостаток СО2, который может быть вызван фотосинтезом.
Если межклеточная концентрация СОг снижается до уровня,
недостаточного для фотосинтеза, это служит сигналом обратной
связи и устьица открываются для обмена СО2 с внешней средой.
Другой тип связей (3) реагирует на содержание воды в листьях:
при снижении содержания воды в тканях устьица закрываются.
В результате деятельности этих двух типов обратных связей
обычно наблюдаются небольшие осцилляции открытости устьиц.
Однако одни обратные связи по СО2 (/, 2) и НгО (3) не
оптимизируют газовый обмен листа. Оптимизация достигается
деятельностью прямой связи — прямого действия света (5), влажности и
ветра (6) и положительной обратной связи фотосинтеза (4) и
водного режима эпидермальных клеток и (или) клеток
мезофилла (7). Важным механизмом функционирования отрицательной
обратной связи (3) является синтез АБК. Ряд продуктов
фотосинтеза в клетках мезофилла (и в устьичных клетках) может
контролировать движения устьиц по механизму положительной
обратной связи (4).
Таким образом, устьица очень чутко реагируют на внешние
условия и физиологические изменения в тканях листа. В резуль-
250
о
I
Рис. 80. Дневной ход транспирации при
различной влагообеспеченности
растений (В. Лархер, 1978, с изменениями):
А — испарение со свободной водной
поверхности; Б — транспирация при достаточной
влагообеспеченности; В — при недостатке
влаги в полдень; Г — при глубоком водном
дефиците; Д — во время летней засухи
Восход
солнца
Полдень
солнца
тате этого интенсивность транспирации может быстро
изменяться, приспосабливаясь к складывающимся условиям.
Во влажные дни ход устьичных движений следует за
изменением солнечной инсоляции, в этом случае кривая транспирации
(рис. 80, Б) в течение дня подобна кривой испарения со
свободной водной поверхности (рис. 80, А).
Летом при максимальной инсоляции в середине дня может
развиваться полуденный водный дефицит. В зависимости от его
величины и продолжительности наступают частичное (рис. 80, В)
или полное (рис. 80, Г) гидроактивное смыкание устьиц и
депрессия транспирации: сглаживание пика или даже провал в
полуденные часы. Закрывание устьиц в полуденное время частично
объясняется также высокой концентрацией СО2 в межклетниках,
характерной для этого времени суток. Уровень СО2 в листе
зависит от соотношения интенсивности дыхания и фотосинтеза,
а скорость дыхания с повышением температуры растет в
большей степени, чем фотосинтез. Причем полуденное снижение
транспирации наступает не одновременно во всех частях кроны,
а в определенном порядке: раньше и сильнее оно проявляется в
затененных участках кроны, затем в ее основании, а позднее
всего — в верхушечных листьях. В соответствии с этим снижение
водного потенциала в освещенной части кроны происходит
более резко (на 1000—1200 кПа), что обеспечивает ее
преимущества в снабжении водой и более экономное расходование воды
растением в целом.
Во время летней засухи устьица часто ненадолго открываются
лишь в утренние часы и вскоре снова закрываются, идет только
кутикулярная транспирация (рис. 80, Д).
252
4.5.3. МЕТОДЫ ИЗМЕРЕНИЯ ИНТЕНСИВНОСТИ ТРАНСПИРАЦИИ
Методы измерения интенсивности транспирации растений
подразделяют на две группы. Первую составляют методы,
основанные на учете массы исследуемого объекта через заданные
промежутки времени или непрерывно. В случае, если все другие
причины изменения массы, кроме испарения воды растением,
исключены или учитываются отдельно, [интенсивность
транспирации вычисляют, продифференцировав кривую изменения
массы во времени^ Вывод на самописец показаний электронных
весов, на которые устанавливают сосуд с растением, позволяет
вести непрерывную автоматическую регистрацию процесса.
Однако изменения массы интактных растений контролируют
только при выращивании их в сосудах.
В полевых условиях для определения интенсивности
транспирации обычно применяют различные модификации
предложенного Л. А. Ивановым метода быстрого взвешивания
отчлененного от растения листа или побега. Первое взвешивание проводят
сразу после срезания, а второе — через 3—5 мин, что дает
возможность измерять транспирацию при том состоянии
насыщенности листа водой, в каком он находился на растении. Для
быстрого взвешивания удобно использовать торзионные весы.
Однако надо иметь в виду, что этот метод не отличается
высокой точностью, так как само срезание приводит к
существенному изменению интенсивности транспирации. В первый
момент после срезания она очень сильно возрастает вследствие
нарушения непрерывности натянутых водяных нитей в сосудах
ксилемы. Сразу же после всплеска интенсивность транспирации
падает, сначала очень быстро, а затем все медленнее, иногда она
может слегка подняться. Через некоторое время благодаря
уменьшению содержания воды в листе и увеличению водоудер-
живающей способности тканей интенсивность транспирации
устойчиво снижается. «Скачок» транспирации будет не таким
резким, если лист или побег растения срезать под расплавленным
парафином, который, застывая, предотвращает сокращение
натянутых водных нитей.
Для большинства растений интенсивность транспирации за
время, начиная от первой минуты после срезания и кончая
четвертой (за 3-минутный интервал), равна интенсивности
транспирации неповрежденного растения. Однако характер и
выраженность реакции на отчленение и последующее
обезвоживание листа значительно различаются в зависимости от видовых
особенностей, возраста листа, его оводненности, условий
внешней среды. Поэтому, начиная работать с новым объектом,
следует повторять взвешивания с интервалом 1 мин в течение 10 мин.
Результаты изображают графически и устанавливают время,
когда заканчиваются альтерации и процесс выходит на кратко-
253
временное плато, после которого наблюдается устойчивое
снижение транспирации в результате уменьшения оводненности.
Этот интервал времени в дальнейшем должен соответствовать
экспозиции при определении интенсивности транспирации.
Метод быстрого взвешивания используют также при работе с
частями листовой пластинки, когда необходимо определить
интенсивность транспирации растений с крупными листьями, или
при работе с дисками, когда изучают и другие параметры или
процессы, например водный дефицит, водный потенциал,
интенсивность фотосинтеза, и т. д. Б. Славик рекомендует для
введения поправки на потерю воды срезанной частью,
относительная доля которой в этом случае значительно возрастает,
определять интенсивность транспирации двух дисков с разным
соотношением между площадями интактной поверхности и
среза.
Методы второй группы основаны на учете величины потока
водяного пара, поступающего из растения. В этом случае всю
надземную часть растения или лист помещают в транспирацион-
ную камеру, через которую непрерывно прокачивают воздух.
Пробы воздуха с входа и выхода камеры подаются в
измерительное устройство, что позволяет регистрировать увеличение
влажности воздуха в результате транспирации (АС, мг/см3).
Интенсивность транспирации [мг/(см2- с)] рассчитывают по формуле
./ =
АСУ
где К—объемная скорость движения воздуха через камеру, см3/с' 51—площадь
транспирируюшей поверхности листьев, находящихся в камере, см .
Для обеспечения достаточной точности определения большое
значение имеют создание и поддержание определенной скорости
тока воздуха § системе. При транспирирующей поверхности до
20 см2 используют расход воздуха 50—100 л/ч (14—28 см3/с), для
более крупных объектов — 100—300 л/ч, иногда больше. Для
прокачки воздуха применяют формвакуумные насосы или
микрокомпрессоры, в качестве «сглаживающей емкости» используют
пустой кислородный баллон, скорость потоков воздуха измеряют
с помощью газового счетчика ГСБ-500 или ротаметра.
Одним из основных узлов установки для определения
транспирации в токе воздуха является листовая камера. Имеется
множество различных конструкций камер, однако требования,
предъявляемые к ним, чрезвычайно трудно выполнить. С одной
стороны, условия внутри камеры, (влажность и температура
воздуха, интенсивность и спектральный состав света, концентрация
СС>2 и паров воды, скорость потока воздуха и т. д.) не должны
существенно отличаться от условий вне камеры, чтобы
сохранялся естественный ход физиологических процессов, а это очень
254
сложно соблюсти в ограниченном пространстве. С другой
стороны, на выходе из камеры для четкой регистрации концентрации
паров воды она должна быть иной, чем входная. Чтобы
выполнить эти условия, приходится искать компромиссное решение.
Обычно исследователь выбирает форму, объем и конфигурацию
листовой камеры исходя из конкретной задачи, особенностей
объекта и возможностей измерительной системы.
В качестве измерительного устройства чаще используют
дифференциальный психрометр или инфракрасный газовый
анализатор, которые позволяют с высокой точностью измерять разность
концентраций водяных паров и обладают малой
инерционностью.
Дифференциальный психрометр представляет собой два
непрерывно смачиваемых идентичных датчика температуры,
помещенных в два цилиндрических канала измерительного
устройства, через которые с одинаковой скоростью пропускают воздух,
предварительно нагретый до одинаковой температуры. В первый
канал поступает воздух с входа, а во второй — с выхода листовой
камеры.
Температура, а следовательно, и электросопротивление
каждого датчика зависят от интенсивности испарения воды
батистовым фитилем. Так как скорость и температура воздуха,
поступающего в оба канала, постоянны, интенсивность испарения
зависит только от содержания в нем водяных паров.
Наиболее перспективными приборами для определения
интенсивности транспирации в токе воздуха являются
инфракрасные газоанализаторы, предназначенные для регистрации
концентрации СО2 и паров воды. Обычно используется
дифференциальная схема, т. е. через контрольную кювету непрерывно
пропускается естественный воздух. Прибор регистрирует разницу
между концентрацией водяных паров в исходном воздухе и
воздухе, прошедшем через камеру с листом.
Основное достоинство дифференциального психрометра и
инфракрасного газоанализатора в том, что они дают возможность
вести непрерывную автоматическую регистрацию транспирации
на одном и том же объекте, не отчлененном от растения в
течение длительного времени, как в лабораторных, так и в
полевых условиях.
.,. 4.5.4. СПОСОБЫ СНИЖЕНИЯ УРОВНЯ ТРАНСПИРАЦИИ
Перспективным способом снижения ^уровня транспирации
растений при пересадке, а также в условиях недостатка влаги
является применение, антитранспирантов. По механизму
действия их можно разделить на две группы: вещества, которые
вызывают закрывание устьиц; вещества, которые образуют на поверх-
255
ности листьев пленки, создавая механическое препятствие для
испарения воды.
К первой группе относятся абсцизовая кислота и ее
производные, которые не оказывают токсического влияния на растения и
вызывают закрывание устьиц как при опрыскивании, так и при
введении их через корни с поливной водой. В определенных
концентрациях АБК, не уменьшая фотосинтеза, снижает
транспирацию хлопчатника во время полива и после него.
Эффективными антитранспирантами являются метиловый и
фениловьш эфиры АБК. Опрыскивание эфирами в
концентрации 10"~4 М приводит к уменьшению транспирации на 50 %,
причем к концу 9-го дня после опрыскивания это снижение
сохраняется на уровне 20—25 %.
В последнее время из растений выделены другие природные
антитранспиранты, вызывающие закрывание устьиц. Близкой к
АБК активностью обладает вомифолиол, выделенный из РоН-
погеа а1рта. Из сорго суданского выделен 2-транс-дигидрофар-
незол, который даже более активно способствует закрыванию
устьиц, чем АБК. Далее приведены антитранспиранты
метаболического типа, которые используют для снижения потери воды
различными сельскохозяйственными культурами.
Применение антитранспирантов метаболического действия
(Дж. Никелл, 1984)
Соединение
Абсцизовая кислота
Алахлор
Алкенилянтарная кислота
Хлормекват
8-Оксихинолин
Индолилуксусная кислота
Хлорфлюренол, метиловый эфир
Фенилмеркурацетат
Растение
Ячмень, фасоль, цитрусовые, огурец,
перец, томат
Кукуруза
Табак
Подсолнечник, томат
Томат, земляника
Томат
Хлопчатник
Хлопчатник, табак, томат
Вторая группа веществ — антитранспиранты пленочного
типа —образует на поверхности листьев моно- и
полимолекулярные прозрачные и эластичные пленки, ограничивающие
испарение воды. В отличие от антитранспирантов метаболического
типа они должны слабо проникать через эпидермис, обладать
малой подвижностью в растении и не оказывать влияния на его
метаболизм. Природным прообразом пленочных
антитранспирантов является эпикутикулярный воск, регулирующий
диффузию паров воды и СО2.
При полностью открытых устьицах заполнение воском над-
устьичной полости способно снизить газообмен на 15—35 %. В
качестве антитранспирантов пленочного типа используют
эмульсии высокомолекулярных соединений — полиэтилена, полипро-
256
пилена, полистирола, полиакриламида, натуральный или
искусственный латекс. Пленочные антитранспиранты, уменьшая
транспирацию на 25—30 %, не оказывают существенного
отрицательного влияния на фотосинтез и радиационный баланс
листа. Сохраняется пленка на растении обычно 12—16 дней.
Для использования в качестве пленочного антитранспиранта
на посевах озимой и яровой пшеницы, а также картофеля
рекомендуется 0,3%-ная водная эмульсия полиакриламида (ПАА).
При расходе рабочей жидкости в полевых условиях 500 л/га и
добавлении нейтрального эмульгатора ОП-7 в концентрации
0,3 г/л на верхнем и нижнем эпидермисах листьев образуется
пленка толщиной 0,01—0,04 мм, которая высыхает в течение
20-^30 мин. Обработка ПАА озимой пшеницы в фазе колошения
снижает интенсивность транспирации по сравнению с
необработанными растениями на 2-й день на 6,3 %, на 7-й — на 29,5 и на
12-й —на 22 %. При этом температурные градиенты
лист—воздух изменялись незначительно. Полиакриламидная пленка на
фоне почвенной засухи лишь на 4—5 % снижала интенсивность
фотосинтеза, способствовала увеличению массы листьев (на
13,8—35 %), стеблей, колосьев и 1000 зерен (на. 10,2—11,6 %).
Содержание белка в зерне пшеницы повышалось на 0,7—0,8 %
(Шматько и др., 1989). Достаточно эффективно использование
пленочных антитранспирантов при пересадке саженцев
древесных растений в облиственном состоянии. Обработанные
растения сокращают транспирацию на 20—60 % в течение 12—15 сут,
что значительно повышает их приживаемость,
4.6. ВОДНЫЙ БАЛАНС РАСТЕНИЙ
Водообмен растений включает три процесса: поглощение,
передвижение и испарение воды листьями. Соотношение между
поступлением и расходом воды представляет собой водный баланс
растения. В умеренно влажные и не слишком жаркие дни транс-
пирация хорошо согласована с поступлением воды, оводнен-
ность тканей довольно постоянна, т. е. складывается
благоприятный водный баланс растения. В жаркие летние дни усиление
транспирации нарушает это относительное равновесие, что
вызывает водный дефицит, достигающий даже при достаточной
влажности почвы 5—10 %, а при недостатке влаги в почве —
25 %, что указывает на отрицательный характер водного баланса.
Это объясняется тем, что корни не успевают покрывать расход
воды на транспирацию, интенсивность которой, особенно в
полуденные часы, сильно возрастает. Полуденный водный
дефицит представляет собой нормальное явление и не причиняет
растению особого вреда. Его значительному увеличению
препятствует способность растений снижать транспирацию под влияни-
Ш
ем потери воды за счет возрастания водоудерживающей
способности тканей и закрывания устьичных щелей.
Однако регулирование транспирации небеспредельно. В
жестких условиях жаркого летнего дня при недостатке воды в почве
происходит значительное нарушение водного баланса, которое
проявляется в потере тургора растением — завядании. Завядание
еще не указывает на утрату растением жизнеспособности. При
обеспечении растений водой тургор восстанавливается и их
нормальная жизнедеятельность возобновляется. Но завядание не
проходит для растения бесследно: чем оно было глубже и
длительнее, тем серьезнее его последствия.
Различают два типа завядания растений: временное и
длительное. Первое наблюдается обычно в полуденные часы. При этом
сильнее всего расходующие воду органы, а именно листья теряют
тургор и вянут, остальные части растения, сохраняют тургесцент-
ность. При ослаблений транспирации к вечеру водный дефицит
снижается, а в ночные часы за счет активной деятельности
корневой системы водный баланс полностью восстанавливается.
Большого вреда временное.'завядание не причиняет, хотя возможно
снижение урожая, так как наблюдаются депрессия фотосинтеза и
приостановка ростовых процессов. Временное завядание нередко
наблюдается у сахарной свеклы, подсолнечника, огурца, тыквы и
других сельскохозяйственных растений.
Длительное завядание наступает, когда в почве почти не
остается доступной для растения влаги. В этих условиях водный
баланс растения за ночь не восстанавливается. Такой не
покрываемый к утру водный дефицит получил название остаточного
дефицита. Завядающие листья оттягивают воду из других частей
растения: молодых растущих верхушек, корней, плодов.
Происходит отмирание корневых волосков, поглотительная
деятельность корней значительно снижается. Поэтому даже после
полива водный баланс растения восстанавливается лишь через
несколько дней. Последствия такого завядания могут быть
необратимыми и губительными.
4.7. ВЛИЯНИЕ НА РАСТЕНИЯ НЕДОСТАТКА ВОДЫ
Способность растений переносить недостаточное влагообеспе-
чение является комплексным свойством. Она определяется
возможностью растений отсрочить опасное уменьшение оводнен-
ности протоплазмы (избегание высыхания) и способностью
протоплазмы переносить обезвоживание без повреждения
(выносливостью). Избегание высыхания достигается благодаря
морфологической, анатомической приспособленности растений
к сохранению оптимальной оводненности тканей при сухости
воздуха и почвы. Здесь можно выделить три основных направле-
258
ния: регулирование потери воды за счет ксероморфного строения
листьев; усиление поглощения воды из почвы благодаря
увеличению мощности корневой системы и снижению водного
потенциала корней; накопление воды и активизация ее транспорта.
Листья как органы транспирации обладают значительной
пластичностью, и в их строении наблюдаются большие различия,
зависящие от условий водоснабжения и освещенности, при
которых происходят формирование и развитие растений. Большое
значение для понимания природы засухоустойчивости имеют
исследования В- Р. Заленского. В 1904 г. им было установлено, что
существует строгая ярусная изменчивость анатомического
строения листа. Оказалось, что чем выше расположен лист на стебле,
тем сильнее у него выражены признаки ксероморфности,
повышающие засухоустойчивость, а именно:
больше длина проводящей системы на единицу поверхности;
меньше размеры клеток как верхнего, так и нижнего
эпидермиса;
меньше размеры устьиц на верхней и нижней сторонах листа;
большее число устьиц на единицу листовой поверхности;
толще наружные стенки у кяеток верхнего и нижнего
эпидермиса;
сильнее развит восковой налет;
меньше размеры всех клеток мезофилла;
более типично развита палисадная паренхима;
менее типично выражена губчатая паренхима;
слабее представлена система межклетников;
несколько сильнее развиты механические ткани.
Иллюстрацией этих закономерностей может служить рисунок
81, изображающий строение верхнего и нижнего листьев. С
анатомическими особенностями связаны также и физиологические:
верхние листья отличаются более высокой интенсивностью
процессов фотосинтеза и транспирации. Концентрация клеточного
Рис §1» Ставшие лвегьев
(Я.. А. Ммкямо*, 1952). В
в шншег»
(5) ярусе» шжшахчтшл
слева — шшоой ч-тщде^мис, справа —
сеть
сока в клетках верхних листьев выше, и в условиях водного
дефицита они оттягивают воду от более оводненных нижних
листьев, которые при длительном завядании растения отмирают
раньше.
Одним из главных факторов, обусловливающих ксероморфизм
строения листа, являются условия его водоснабжения на ранних
фазах развития. Удаленность от корневой системы и оттягивание
воды растущей верхушкой способствуют тому, что листья
верхних ярусов формируются в условиях затрудненного
водоснабжения, что приводит к их мелкоклеточности. Такое же ксероморф-
ное строение может быть вызвано и непосредственным
воздействием внешних факторов на растение: повышением сухости
воздуха, понижением влажности почвы, а также периодическим
завяданием. Растения, развивающиеся в таких условиях,
отличаются повышенной засухоустойчивостью.
Установленные закономерности, получившие название закона
Заленского, показали, что неправильно считать основным
признаком засухоустойчивости способность растений расходовать
как можно меньше воды. Сокращение расхода воды неизбежно
влечет за собой и ухудшение условий воздушного и
минерального питания растений. Ксероморфизм обеспечивает возможность
активного функционирования в засушливых условиях.
Другая, не менее значимая возможность избегания
высыхания — развитие мощной корневой системы для добывания воды.
Соотношение между массой надземной системы и массой
корней обычно тем больше смещается в пользу корней, чем сильнее
растения в данной местности подвергаются действию засухи.
Поддерживать нормальную оводненность тканей также помогает
запасание воды в корнях, стволах и толстых ветвях деревьев,
хотя у сельскохозяйственных растений такая способность развита
слабо.
Возможность перераспределения влаги между растениями
обусловливается срастанием корней. Установлено, что между
переплетающимися корнями соседних растений возникают
анатомические системы связи, по которым могут передвигаться
питательные вещества и вода. Так, в опытах с томатом показано,
что вода может транспортироваться между растениями, корни
которых находятся в общем сосуде с почвой, и даже через корни
промежуточного растения, которое само получает воду от других
растений. В обоих случаях вода передавалась в количествах,
достаточных для того, чтобы задержать, а иногда и предотвратить
завядание. Эти наблюдения показывают, что нужно проявлять
особую осторожность, проводя полевые измерения на растениях
в сообществах, если влажность почвы под соседними растениями
существенно отличается от влажности под изучаемыми
экземплярами.
Кроме анатомо-морфологических существуют биохимические
260
механизмы предотвращения обезвоживания. Высокая водоудер-
живающая способность цитоплазмы поддерживается путем
накопления низкомолекулярных гидрофильных белков,
связывающих в гидратных оболочках значительные количества воды.
Этому способствует также накопление пролина и моносахаридов.
Интересным свойством, уменьшающим потерю воды, обладают
некоторые суккуленты. Благодаря особенностям процесса
фотосинтеза (САМ-путь) они запасают в ночные часы при открытых
устьицах СС>2 в составе яблочной кислоты в вакуолях, а днем
используют его для восстановления на свету. Фотосинтез, таким
образом, осуществляется при закрытых устьицах.
Засуховыносливость — это видоспецифическое и способное к
адаптивному изменению свойство протоплазмы переносить
водный дефицит. Протоплазма большинства растений чрезвычайно
чувствительна к обезвоживанию. Клетки надземных органов
мезофитов, к которым относится большинство
сельскохозяйственных культур, погибают, если их несколько часов выдерживать в
воздухе с относительной влажностью 92—96 %, что соответствует
депрессии водного потенциала 5,5—11 МПа. Корни еще более
чувствительны. Водный дефицит приводит к прогрессирующему
обезвоживанию протоплазмы, что вызывает нарушение
физиологических функций, их прекращение и повреждение протоплазма-
тических структур. Снижение содержания воды в клетке ниже
оптимального уровня, вызывающее нарушения метаболизма,
называется водным стрессом.
Одним из показателей водного стресса является депрессия
водного потенциала. Для типичной клетки листа мезофитов с
водным потенциалом примерно 2 МПа установлены три степени
водного стресса: мягкий стресс — снижение водного потенциала
не более чем на 1 МПа; умеренный (средний) стресс —
снижение водного потенциала на 1,2—1,5 МПа; суровый стресс —
снижение водного потенциала более чем на 1,5 МПа. Мягкий стресс
соответствует небольшой потере тургора, тогда как средний
связан с подвяданием листьев, а суровый стресс — с завяданием
растений. В таблице 17 представлены данные о чувствительности
клеточных функций к недостатку воды и изменениям,
происходящим в растении при подсыхании.
Наибольшей чувствительностью к водному стрессу
характеризуются ростовые процессы. Это объясняется, во-первых, тем, что
в основе растяжения клеток лежат тургорные явления, а утрата
тургора во время роста клеток ведет к мелкоклеточности,
во-вторых, рост тесным образом связан с нуклеиновым и белковым
обменом. Сложность этих процессов приводит к их большой
уязвимости при всякого рода неблагоприятных воздействиях, в
том числе и водном стрессе.
261
17.
ки стресса иа фмзишшгтеские егршчеесы (по Т,
1073, с !
щоаеева*
Роет сапок (—)
Обротоюиие клегочмой
СХ_й__(->
Синтез белка {—)
Активность нчгтратредук-
Обржмж-няе хаорофия-
ла(->
Синтез абшкэаяоб
кислоты С+)
Сюпез иктокинйнда (-)
Открытке уетмщ (-)
Фотхюштез (-)
Ддаая»е(+)
Накопление продина (4-)
^(-) — сяижеше, {+) }
" Непрерывные лишш показывают предел уровней стресса, • котором
процесс иерюначаяык» подвергается действию: щвюнром обошиш эффекта,
которые, пока точно не установлены.
_ ________________________________________________________
Из данных таблицы можно увидеть, что по мере того как
водный стресс усиливается от мягкого к умеренному, его
действие на внутриклеточные биохимические процессы увеличивается.
Так, процессы биосинтеза белка и хлорофилла чувствительны к
сравнительно слабому стрессу, тогда как в условиях умеренного
стресса снижается уровень нитратредуктазной активности,
метаболизма фитогормонов, фотосинтеза. Переход от умеренного к
суровому стрессу связан с серьезными нарушениями клеточного
метаболизма, о чем свидетельствует усиление дыхания, которое
характеризуется низкой энергетической эффективностью,
накоплением пролита и Сахаров.
Влияние водного дефицита на метаболические процессы в
значительной мере зависит от дяительности его действия. При
устойчивом завшшши растений увеличивается скорость распада
РНК, белков я одновременно возрастает количество небелковых
азотсодержащих соединений. Влияние водного дефицита на
углеводный обмен листа выражается вначале в снижении моно- и
яисахаридов из-за снижения интенсивности фотосинтеза. Затем
количество моносахаридов может возрастать в результате
гидролиза полисахаридов. При длительном водном дефиците
наблюдается уменьшение количества всех форм Сахаров. Детокснкащш
избытка, образующегося при яротеояизе аммиака происходит с
участием органических кислот, количество которых возрастает в
262
тканях при водном дефиците. Процессы восстановления идут
успешно, если не повреждены при недостатке воды генетические
системы клеток. Защита ДНК состоит в частичном выведении
молекул из активного состояния с помощью ядерных белков и,
возможно, с участием специальных стрессовых белков. Поэтому
изменения количества ДНК обнаруживаются лишь при сильной
длительной засухе.
Действие водного стресса опасно на всех этапах жизни
растения. Начало прорастания семян возможно только подле их
значительного набухания. Существует также тесная корреляция
между скоростью прорастания и поглощением воды, так как
подземный рост путем растяжения клеток идет за счет
гидростатического давления, создаваемого корнем. Количество влаги,
необходимое для прорастания семян, сильно варьирует у разных
видов растений. Для прорастания семян бобовых культур
(клевер, люцерна, бобы, горох) минимальное содержание влаги в
семенах 120—160 % сухого вещества, минимальный водный
потенциал почвы составляет -1,2...-1,5 МПа; для пшеницы,
ячменя, сахарной свеклы эти величины соответственно равны 30—
46 % и -0,4...-1,0 МПа.
Отрицательное действие водного стресса во время вегетации
заключается в подавлении ростовых процессов как наиболее
сложных и требующих координации между отдельными
физиологическими функциями. Вследствие подавления роста
сокращается площадь листьев, т. е. ассимилирующая поверхность, что и
является основной причиной снижения урожаев при засухе.
Следует отметить, что рост листьев более чувствителен к
водному дефициту, чем рост корней. Корневая система, как уже
отмечалось, обладает колоссальными потенциальными
способностями к росту. Несмотря на отмирание при водном дефиците
кончиков главных корней, вскоре начинается рост боковых
корней.
Фотосинтез тормозится не сразу: при неглубоком водном
дефиците (8—10 %) его интенсивность даже немного возрастает и
лишь при сильном и продолжительном — уменьшается.
Подавление фотосинтеза при постепенном развитии засухи, которое
обычно наблюдается в полевых условиях, в значительной
степени вызывается не столько повреждением хлоропластов,
отличающихся повышенной устойчивостью к обезвоживанию, сколько
задержкой оттока из листьев ассимилятов из-за задержки
ростовых процессов. Об этом свидетельствует повышенное
содержание в листьях Сахаров — веский аргумент против представления
о голодании растений как важнейшей причине снижения
урожаев при водном дефиците.
Переполнение листьев ассимилятами не всегда способствует
физиологически оправданному подъему дыхания. Однако
устойчивость самих хлоропластов не является безграничной, и при
263
существенном снижении тургесцентности в них начинаются дег-
радационные изменения, которые касаются как структуры, так и
функции этих пластид: прогрессирующе снижаются
фотохимическая активность, активность РДФ-карбоксилазы, нарушаются
пигментные комплексы. Подавление фотосинтеза также может
быть следствием закрывания устьиц при водном дефиците.
Длительное ухудшение водообеспеченности растений даже
при относительно небольшом уменьшении водного потенциала
(на 0,05—0,10 МПа) приводит к нарушению оптимального
соотношения между фотосинтезом и дыханием, вследствие чего
снижаются уровень синтетических процессов и продуктивность
растений. Особенно опасен длительный водный дефицит при
закладке репродуктивных органов. Не случайно этот период
называют критическим в отношении влагообеспечения. Но даже
завязавшиеся плоды еще не являются гарантией урожая. В
условиях водного дефицита происходит перераспределение воды
между органами. Хотя плоды в большинстве случаев транспири-
руют очень слабо, в течение дня у них наблюдаются заметные
изменения в объеме. Так, на хлопчатнике с большим
количеством развивающихся коробочек листья завядают не столь сильно
главным образом потому, что вода оттекает из коробочек в
листья. Если в почве достаточно доступной воды, все эти изменения
остаются обратимыми и дефицит воды в растении каждую ночь
ликвидируется. При длительном водном дефиците происходит
опадение плодов. Кроме того, изменения в обмене веществ в
условиях водного стресса часто неблагоприятно сказываются на
качестве сельскохозяйственной продукции.
4.8. ВЛИЯНИЕ НА РАСТЕНИЯ ИЗБЫТКА ВЛАГИ В ПОЧВЕ
Постоянное или временное переувлажнение характерно для
многих районов земного шара. Оно нередко наблюдается также
при орошении, особенно проводимом методом затопления.
Избыток воды в почве может быть для растения так же вреден, как и ее
недостаток. Причина этого заключается не в том, что вода сама по
себе вредна для корней. Убедительным доказательством является
успешное выращивание в водной культуре любых растений, даже
ксерофитов. Вред от заболачивания, а также от временного
затопления заключается в ухудшении аэрации почвы, что приводит к
серьезным неблагоприятным последствиям.
Главный вред состоит в уменьшении или прекращении
обеспечения корней кислородом, т. е. в возникновении гипоксии или
аноксии. Наиболее часто в условиях кислородной
недостаточности оказываются озимые хлеба, соя, рис, хлопчатник, плодовые
культуры. Состояния гипоксии и аноксии для разных растений и
их отдельных органов до сих пор не имеют четкого количествен-
264
1114
ного выражения, поскольку отсутствуют надежные методы
определения парциального давления кислорода в клетке. Особенно
неблагоприятно недостаток кислорода сказывается на активно
функционирующих органах. Различные потребности в кислороде
характерны не только для разных по устойчивости растений или
их органов, но и для разных процессов жизнедеятельности. Так,
рост корней тормозится обычно при более высоком содержании
кислорода, чем процесс дыхания.
Выяснение причин и механизмов устойчивости растений к
недостатку кислорода представляет не только теоретический
интерес, но имеет большое значение для разработки технологии
выращивания растений на затопляемых почвах, в водной
культуре, программирования урожая различающихся по
чувствительности к кислородному дефициту растений и для
совершенствования методов отбора селекционного материала.
Как и при других неблагоприятных условиях, стратегия
адаптации к кислородному голоданию включает комплекс различных
приспособительных реакций (рис. 82). Для того чтобы избежать
повреждающего фактора, необходима доставка в корни
атмосферного кислорода. Этому способствуют разнообразные морфо-
лого-анатомические и физиологические свойства растений.
В условиях ограниченной аэрации корни укорачиваются,
утолщаются, не образуют корневых волосков. Деревья
тропических мангровых лесов имеют воздушные корни-подпорки,
покрытые многочисленными порами, через которые воздух поступает в
растение. Для гигрофитов типичным является образование
непрерывной системы воздухоносных полостей от надземной части
растений до корней. Возникновение аэренхимы при
ограничении доступа кислорода происходит и у мезофитов: кукурузы,
ячменя, пшеницы.
Увеличение объемов воздухоносных полостей наблюдается
обычно в дополнительно образующихся адвентивных корнях.
Наибольшую роль в снабжении корневой системы кислородом
играют листья. Существует не только анатомо-морфологическая,
но и метаболическая адаптация листьев к дополнительному
поглощению кислорода и транспорту его в корни. У листопадных
растений снабжение корневой системы кислородом
осуществляется также через чечевички ветвей.
Помимо приспособлений для сохранения близкого к
нормальному уровня содержания кислорода в корнях при
длительном затоплении растения используют внутренние резервы для
функционирования при недостатке и даже отсутствии кислорода.
Таковыми могут быть изменения в обмене веществ, или
метаболические способы адаптации.
В связи со спецификой воздействия ведущими являются
изменения процесса дыхания. Одним из них может быть низкая
интенсивность дыхания устойчивых растений или отдельных их
266
органов даже в нормальных условиях аэрации, что позволяет
растению сохранять его пота* без изменений в условиях
недостатка кислорода. Происходит также качественная перестройка
дыхания. .
Основным путем распада углеводов у всех растений в
анаэробных условиях является гликолиз. У неустойчивых растений
резкое увеличение доли и активности юшколитического распада
глюкозы наблюдается уже в первые часы анаэробного
воздействия, но бывает весьма кратковременным, и растение оказывается
на пороге гибели. У приспособленных же объектов при меньшей
интенсивности этот процесс может происходить в течение
продолжительного времени, что обеспечивает более надежную
доставку энергии. У приспособленных растений положительную
роль также играет включение пентозофоефатног© пути (ПФП),
поставляющего восстановитежи и необходимые длю биосинтеза
промежуточные, продукты.
Усиление иикояюа сопровождается пакопжяясм конечных
продуктов брожения, щревде всего этанола, обладающего
токсическим действием- Физиожого-биохимичеекая стратегия
избавления от высоких концентраций этанола и друтх
неблагоприятных продуктов обмена является разносторонней. При корневой
галоксии происходят экссудация продуктов анаэробного обмена
(этанола, ацетальдегидз, молочной кислоты) в ризосферу, а
также польем с транспиренквнньш током в надземную часть и
выброс их в атмосферу или включение в обмен веществ листа.
Приспособление к аноксии может быть связано также с
частичным предотвращением накопления этанола путем обращения
конечных этапов брожения и дикарбоновой части цикла Кребса,
Известно, что при .затоплении у устойчивых растений вместо
этанола накапливаются нетоксичные соединения —- малат и еук-
дияат. При аноксии роль кислорода как акцептора электронов
временно могут выполнять нитраты. Обычно использование
растением нитратов в анаэробных условиях называют нитратным
дыханием и относят к эндогенному аноксическому окислению.
Причем комплекс защитных реакций имеется у любого растения
независимо от степени его приспособленности. Различие состоит
в том, что у устойчивых объектов переход на новый режим
происходит постепенно и сопровождается изменением состава и
свойств мембран, а также синтезом белков адаптивных
ферментов. Это обеспечивает сохранение целостности мембранных
структур и их нормальное функционирование, т. с поддержание
гомеостаза в новых условиях. У неустойчивых растений
защитные реакции, включаясь быстро, оказываются кратзшсрочяьшн,
и как следствие истощения приспособительных возможностей
возникают необратимые повреждения.
Кроме прямого воздействия недостатка кислорода на корни,
заполнения почвенных капилляров и уменьшения ияи прекраще-
267
ния аэрации почвы существует и ряд косвенных
неблагоприятных последствий. Главное из них заключается в том, что
прекращаются нормальные окислительные процессы в почве,
вызываемые деятельностью аэробных почвенных бактерий, и начинают
преобладать анаэробные, преимущественно маслянокислое и
другие виды брожения. При этом в почве накапливаются
органические кислоты, а также восстановленные органические и
неорганические соединения, многие из которых чрезвычайно
ядовиты для корней растений, например соли гемиоксида (закиси)
железа. Такие продукты называются болотными токсинами. К
числу вредных для растений последствий анаэробных условий
относится и чрезмерное накопление водородных ионов,
делающих почвы сильнокислыми.
Неблагоприятное воздействие избыточного увлажнения почвы
сказывается на протяжении всей жизни растений. Семена,
попавшие в переувлажненную почву, плохо и медленно всходят,
что связано с затруднением их дыхания и ухудшением
энергообеспечения ростовых процессов. При временном чрезмерном
повышении влажности почвы, например весной при таянии
снега или при затяжных дождях, вызывающих на пониженных
местах пашни застаивание воды, наблюдается вымокание
растений. Непродолжительное застаивание воды вызывает
повреждение и задержку роста растений и снижает эффективность борьбы
с сорняками, обычно особенно буйно развивающимися на
вымочках. Длительное же застаивание воды приводит к полной
гибели культурных растений. Наиболее часто от вымокания
страдают озимые культуры и земляника.
4.9. ТРАНСПИРАЦИОННЫЙ КОЭФФИЦИЕНТ
И КОЭФФИЦИЕНТ ВОДОПОТРЕБЛЕНИЯ,
ЗАВИСИМОСТЬ ОТ ВНУТРЕННИХ И ВНЕШНИХ УСЛОВИЙ,
СПОСОБЫ ИХ СНИЖЕНИЯ
Эффективность использования водьг растением выражается
рядом показателей. Количество созданного сухого вещества на
1 л транспирированной воды характеризует продуктивность
транспирации. В зависимости от условий выращивания и
видовых особенностей растений она составляет 2—8, чаще 3—5 г/л.
Величиной, обратной продуктивности транспирации, является
транспирационный коэффициент, который показывает, сколько
воды растение затрачивает на построение единицы массы сухого
вещества. Транспирационные коэффициенты варьируют от 100
до 500, причем у большинства сельскохозяйственных растений
они сравнительно близки и зависят от условий выращивания.
Относительно низкими его значениями отличаются только про-
совидные злаки (просо, сорго)./
268
Практически определить продуктивность транспирации или
транспирационный коэффициент довольно сложно. Расчет
потери воды на транспирацию за вегетационный период на основе
данных об интенсивности транспирации по декадам или месяцам
дает большую ошибку. Трудно учесть и количество
образованного сухого вещества: в течение вегетации отдельные листья
отмирают и опадают, еще сложнее учет накопления массы корней.
Поэтому эти показатели чаще определяют в вегетационных
опытах. Строгий учет количества поливной воды и предотвращение
испарения с поверхности корнеобитаемой среды позволяют
судить о ее расходе на транспирацию.
В полевых опытах и агрономической практике для оценки
эффективности использования воды определяют коэффициент
водопотребления (эвапотранспирационный коэффициент),
который рассчитывают как отношение эвапотранспирации к
созданной биомассе или хозяйственно полезному урожаю. Под эвапо-
транспирацией понимают суммарный расход воды за вегетацию
1 га посева или насаждения, т. е. сюда включаются испарение с
поверхности почвы (эвапорация) и транспирация. Причем в
засоренных посевах и насаждениях это будет транспирация и
культурных растений, и сорняков.
Эвапотранспирацию можно рассчитать балансовым способом.
Она равняется разности в содержании влаги в метровом слое
почвы в начале и конце вегетации плюс приход воды с осадками
и поливом.
Параллельные определения суммарного водопотребления и
транспирации сельскохозяйственных растений, проводимые на
экспериментальной базе учхоза «Михаиловское» под
руководством академика И. С. Шатилова, показали, что доля транспираци-
онного расхода влаги в суммарном водопотреблении за период
посев — уборка полевых культур составляет на низкоплодородных
полях 19—23 %, на хорошо удобряемых участках — 32—45 %.
Коэффициент водопотребления в значительной степени
зависит от почвенно-климатических факторов. В засушливые годы
он выше, чем в более влажные. Так, по данным Безенчукской
сельскохозяйственной опытной станции, во влажные годы
коэффициент водопотребления основных зерновых культур составлял
400—600, а в засушливые поднимался до 2000—2500.
Установлено, что коэффициент водопотребления повышается примерно в
2 раза для одних и тех же чистых линий селекционных сортов
разных полевых культур по мере продвижения с запада на
восток, из влажного климата в сухой. Это объясняется тем, что в
засушливых условиях усиление эвапотранспирации не
сопровождается увеличением продуктивности растений, чаще она
снижается, поэтому эффективность использования воды уменьшается.
Другим метеорологическим фактором, значительно влияющим
на эффективность использования воды сельскохозяйственными
269
культурами, является температура, С повышением температуры
эвапотранспирация усиливается; рост растений и накопление
ими сухого вещества находятся в более сложной зависимости от
температуры, которая выражается одновершинной кривой.
Причем температурный оптимум для ассимиляционных процессов у
разных видов растений: различный. Поэтому температурная
зависимость эффективности использования воды определяется
видовыми особенностями растений. Так, выращивание
сельскохозяйственных культур прохладного ш жаркого климата в теплицах
при температуре 10—13 *С и около 27 *С показало, что яровая
рожь в прохладной теплице имела коэффициент
водопотребления 423, а при 27 *С — 875, теплолюбивое сорго —
соответственно 1236 и 223, Прохладный воздух снижает эвапотранспирацию,
но у теплолюбивых культур вызывает также резкое подавление
ассимиляционных процессов. Надо иметь в виду, что засушяв-
вме годы, особенно на юго-востоке, характеризуются и высокой
температурой воздуха, что неблагоприятно не только для
формирования урожая, но ж для эффективного использования воды
большинством сельскохозяйственных культур.
Задача агронома состоят в создании таких условий, при кото-
рыж коэффициент водопотребления снижается, Мощным
фактором снижения коэффициента водопотребления является
повышение шивдородая тэты. В многоадюжяяых вегетационных и
полевых опытах доказано, что внесение удобрений не только
повышает урожай, но и снижает затраты воды на создание
единицы продукции, так как расход воды на звалотранспирадаю
возрастает незкачдаежшо.. В условиях Московской области в среднем
за 12 яст исследований яолуияш следующие результаты (табя.18).
яшамк куимяр р. €, Шэтшю*
., 1881!
Локниеяь
юк за шриод веш-
Траясотрздщя, мм
Фитомасса, включая
корни, т/га
Уцхшайноста., т/га
Коэффшщену воадаю-
инраяия
Сэгагаиршй р@гавя
жиге т «шшшиу
зерна, клуОтй
Отшт >
:
2»
Я
5,8
1,61
«Ш
1739
Раяюяют 1Ш>
319
Ш
13,7
3^5
233
\ ЗСзртзфель
-и
'] Без ужюреюш
1
216 233
5! 106
5,3 103
Ǥ 216
ж т
27©
Пшеница и пром
О 5 ГО 15 20 25
Капуста
Урожайность, т/га
Рис. 83. Связь потребления воды с
урожаем:
/—капуста; 2 — яровая пшеница; 3— просо
Снижение коэффициента
водопотребления происходит
не только при внесении
удобрений, но и в случае
любого изменения условий
произрастания растений,
сопровождающегося
повышением урожая, в том числе и
улучшения обеспечения их
водой. Поддержание
влажности почвы орошаемого
пастбища в Подмосковье на
уровне 80—85 % НВ
способствует повышению
урожайности зеленой массы до
71,5 т/га, без орошения
получают около 48,0 т/га. При
этом коэффициент
водопотребления соответственно
составляет 95 и 156 м /т.
Приведенные данные свидетельствуют, что водопотребление и
урожайность связаны нелинейной зависимостью. Графически эта
взаимосвязь выражается кривой с насыщением (рис.83).
При некотором достаточно высоком уровне урожайности ее
рост уже не сопровождался повышением водопотребления, так
как испарение в посеве или насаждении приближается к
испарению со свободной водной поверхности.
По многочисленным данным, повышение водопотребления
прекращается по достижении урожайности кукурузы 10,0—
11,0 т/га, озимой пшеницы — 5,2—6,0, люцерны на сено — 18,0—
20,0, картофеля — 42,0—46,0, яблок — 30,0—33,0, винограда —
25,0—27,0 т/га. Получение таких урожаев возможно только при
высоком уровне агротехники, в большинстве районов нашей
страны необходимо также орошение.
4.10. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ОРОШЕНИЯ
Наиболее радикальным способом повышения урожайности
сельскохозяйственных культур в засушливых условиях является
орошение. Однако только правильное его применение
эффективно. Как избыточное, так и недостаточное орошение может дать
отрицательный результат. При избыточном орошении есть
опасность ухудшения снабжения корней растений кислородом,
уплотнения и вторичного засоления почвы. При недостаточных
поливах с длительными межполивными периодами растения пе-
271
риодически попадают в условия засухи, происходят задержка
роста листьев, снижение их фотосинтетической активности.
Для орошаемого земледелия важно установить интервал
влажности почвы, благоприятный для роста и развития
сельскохозяйственных культур. На дерново-подзолистых почвах пороговые
величины влажности, при которых полностью прекращаются
ростовые процессы, составляют 20—30 и 90 % НВ (рис.84).
Нижний предел связан с возрастанием водоудерживающих сил,
верхний — с ухудшением аэрации почвы. Оптимальной для
накопления сухого вещества является влажность 70—80 % НВ. Но
постоянно поддерживать поливом такой узкий интервал влажности в
полевых условиях крайне сложно и невыгодно. Экономически
целесообразно получение примерно 80 % максимального урожая. В
практике орошаемого земледелия наиболее эффективно
поддерживать влажность почвы в пределах 50—80 % НВ с учетом
биологических особенностей сельскохозяйственной культуры, фазы
онтогенеза, уровня агротехники, почвенных и климатических условий.
При разработке рациональных режимов орошения
сельскохозяйственных культур нужно определить оросительную норму —
количество воды, необходимое для полива определенной культуры
за весь вегетационный период в расчете на 1 га. Ее можно
установить на основании многолетнего опыта передовых хозяйств и
исследовательских учреждений или рассчитать на планируемый
урожай с использованием средних коэффициентов водопотребления
данной культуры. Сезонное водопотребление полевых культур
составляет 3000—4000 м3/га, яблони — 5000—6000 м3/га,
среднесуточный расход влаги полевыми культурами — 2,5—3,5 мм.
Можно рассчитать оросительную норму по
метеорологическим данным. Наиболее
широко применяют расчеты по
уравнению водного баланса,
сумме среднесуточных
температур, относительной
влажности, дефициту влажности
воздуха, тепловому и
радиационному балансам. Так,
А. М. Алпатьев (1961)
предложил рассчитывать потребность
в воде (мм) овощных культур
по формуле
_ Е = 0,65 ■ Д,
10 20 30 /а 50 ВО 70 80 90 100 где 0,65 - экспериментально найден-
Влажность поч6ы,°/аН& ный коэффициент; Д - сумма
среднесуточных дефицитов влажности возду-
Рис. 84. Зависимость скорости роста ха за вегетационный период или за
от влажности почвы определенную часть вегетации, мм.
272
Суммарный расход влаги (м3/га) плодово-ягодными
культурами за период вегетации можно подсчитать по формуле
где е — коэффициент расхода воды, приходящийся на 1 °С; ]Г ? — сумма
среднесуточных температур за период вегетации, "С.
Для семечковых и косточковых пород этот коэффициент
составляет 1,4 м3Да, для более требовательных к влаге
ягодников — 1,5—1,9 м3Да на 1 "С.
Для определения потребности растений в орошении
используют данные испарения воды с поверхности эвапорометров. Этот
метод основан на соответствии эвапотранспирации сплошного
покрова растений при оптимальном снабжении их влагой и
испарения со свободной водной поверхности, их сходной
зависимости от метеорологических факторов. Для учета видовых
особенностей растений вводятся поправочные коэффициенты.
Поливная норма = КИ,
где К—коэффициент пропорциональности (для кукурузы он равен 0,85, бобов,
сои, сорго, пшеницы и сахарной свеклы — 0,95, люцерны, клевера, картофеля —
1, плодово-ягодных культур — 1,1); И— испарение с эвапорометра, мм.
Что касается установления сроков орошения, то необходимо
провести полив, когда растение еще не испытывает недостатка в
воде, чно уже успело израсходовать почти всю полученную с
предыдущим поливом воду. Сигналом для очередного полива не
могут служить такие внешние признаки, как завядание листьев,
утрата тургора стебля. Подвядание растений приводит к
серьезным нарушениям в ультраструктуре клеток и обмене веществ.
Даже кратковременный недостаток влаги не проходит для
растений бесследно. После установления оптимальных условий
водоснабжения поглотительная деятельность корня и фотосинтез
восстанавливаются лишь через 5—7 дней, рост — через 2—3
недели, что приводит к значительной потере урожая. Следует также
помнить, что у орошаемых культур развивается большая
листовая поверхность, у них нет анатомо-морфологических
приспособлений для ограничения расхода воды, и поэтому при
перерывах в водоснабжении они страдают сильнее, чем растения на
богаре.
Физиологическими исследованиями установлено, что все
сельскохозяйственные растения особенно чувствительны к
недостатку влаги во время закладки репродуктивных органов. У
хлебных злаков это конец кущения — колошение, у плодовых
культур — осень предшествующего года. Период наибольшей
чувствительности к недостатку влаги называется критическим. Он
273
Ю\- - у--- может не совпадать с
периодом максимальной
потребности в воде, который обычно
приходится на более жаркое
время года или связан с
формированием листового
аппарата и наливом сочных плодов
(рис.85).
В сухие годы плоды
обычно опадают раньше, чем на
листьях можно обнаружить
признаки увядания.
Происходит это не из-за более
высокой транспирации плодов, а
из-за способности листьев в
условиях водного дефицита
оттягивать от них влагу.
Для определения времени
полива часто определяют
влажность почвы. Полезно
также вести наблюдение за
физиологическим состоянием растений. Хорошим показателем
условий водоснабжения плодовых и овощных культур является
динамика устьичных движений: сразу после полива устьица
открываются очень широко, по мере расходования поливной воды
щель их открывается все меньше и меньше, и при исчерпании
запаса доступной воды они вовсе перестают открываться. Полив
необходим раньше, чем наступит такое длительное закрывание
устьиц. Другим достаточно надежным показателем условий
водоснабжения может быть концентрация клеточного сока (ККС)
растительной ткани, которая при недостатке влаги очень быстро
возрастает. Экспериментальным путем установлены критические
значения ККС, при которых необходим полив (табл.19).
19. Критические значения концентрации клеточного сока
для установления сроков полива сельскохозяйственных культур
(Л. А. Филиппов, 1982)
Ж X
Месяцы
Рис. 85. Ритм потребления воды
сельскохозяйственными растениями
(Н. А. Максимов, 1952):
/ — овес (Ленинградская область); 2 —
яровая пшеница (Северный Кавказ); 3 —
хлопчатник (Средняя Азия); 4—яровая пшеница
(Средний Урал); 5— просо (Приуралье)
Культура
Хлопчатник
Сахарная
свекла
Кукуруза
Индикаторный орган
3—4-й лист сверху
Средняя часть
жилки листьев 7-го
яруса
Основание жилки
листьев 10-го яруса
Время
определения, ч
13-14
10-11
10-11
Фаза вегетации или
месяц
Бутонизация—цветение—плодоношение
Формирование лис-
Рост корнеплода
До цветения
После цветения
ККС, %
12-14
7
8
6—7
6-10
274
Продолжение
Кршгура
Картофель и
ташт
Морковь и
свенаа стшо-
яжЯ99
Штзш
Вилограл
Ром эфиро-
машгазая
Индикаторный орган
Листая у пераой
цветочной кисти
Листья среднего
Листая штиапгок
Листья у нижней
грозда
Нешревесневшая
часть растущих
яобеяэв
Время олре-'
жмишя, ч
1©-и
10-11
11-15
10-11
13-14
Фаза вегетации имя
месяц
Весьжрюя.
яелпацш
Тоже
Июнь—август -
Июнь
Июль
Лмуст
До цветения
После цветения
ККС, %
8,5-Ю
Ю
13-24
%о
10,5
12,0
7,0
%5
Ш. Ф. Лобов (1957) для обоснования полива всех овондаыж
культур и картофеля предложил использовать единый 10%-ный
уровень концентраций клеточного сока при следующем яриндн-
пе отбора листьев для определения: у зсапусты — листья 2-го
яруса, у томата и картофеля — листья пераой цветочной кисти, у
перца и баклажанов — листья 5—8-го ярусов, у свеклы и
моркови — листья среднего ярзта, у огурцов — 4—<ий лист от
основания стебля. Определение рекомендуют проводить в оокж свежих
листьев в 10—11 ч.
Снижение водного потенциала растительной ткани указывает
на необходимость проведения полива. Критические значения
©одного потенциала для различных сортов хлопчатника
составляют —1500——1800 кШ, дая косточковых пород в мж—шюж, и
.июле—августе — соответственно —1300 и —1500 кПа.
Разработай экспресс-метод установления срока полива
плодовых культур по величине электрического сопротивления тканей
листа, поскольку она .зависит от их ошднешдост и концентрадшв
клеточного сока я, таким образом, является показателем водного
дефицита. Полив семечковых пород необходимо проводит яри
повышении электрического сопротивления да 1000 кОм, косточ-
кошх — до 1500 кОм. На основании датчиков скорости водного
тока в растении, разработанных в Агрофшичеосом институте
РАСХН, созданы технические системы дая аатомахического
полива производственных насаждений шюдовыж и декоративных
культур. Таким образом, в настоящее гремя оптимиетяяю водного
режима можно проводить с учетом физиологического состояния
самого растения, что повышает эффективность использования
80ДЫ.
В эффективном использовании воды растениями
существенную роль играют удобрения, на что указывая еще Д. Н. Прзгаиш-
275
ников (1955). Даже такие почвы, которые в условиях богарного
земледелия не нуждаются в удобрениях, при орошении уже не в
состоянии обеспечить питательными веществами значительное
повышение урожайности. Оптимизация минерального питания в
условиях орошения снижает транспирационный коэффициент на
20—30 %. В орошаемом земледелии удобрения—важнейший
фактор повышения не только урожая, но и его качества. Известно,
что при орошении наряду с увеличением урожайности часто
снижаются сахаристость плодов, корнеплодов сахарной свеклы,
содержание белка в зерне пшеницы. Однако, применяя
минеральные удобрения, можно добиться повышения качества урожая.
С физиологической точки зрения наиболее рациональны
орошение дождеванием и мелкодисперсные увлажнительные
поливы. Частые поливы малыми порциями, соответствующими 20—
30 мм осадков, позволяют поддерживать почву в равномерно
увлажненном состоянии, снижают в жаркие часы дня
температуру воздуха и растений, что обеспечивает благоприятный баланс
газообмена и высокую продуктивность растений.
4.11. ИСПОЛЬЗОВАНИЕ ПАРАМЕТРОВ
ВОДООБЕСПЕЧЕННОСТИ РАСТЕНИЙ
ПРИ ПРОГРАММИРОВАНИИ УРОЖАЕВ
На большей части территории России величина действительно
возможного урожая (ДВУ) в основном определяется влагообеспе-
ченностью. Годовые осадки не полностью используются
растениями: часть из них стекает с талыми водами, испаряется с
поверхности почвы, а также стекает во время ливневых осадков
с полей, имеющих значительный уклон. По обобщенным
данным, использование годовых осадков на различных по
гранулометрическому составу почвах колеблется от 42 (на песчаных
почвах) до 88 % (на торфяниках). Следует отметить, что на
нижней трети склона содержание влаги в почве на 30 % выше, чем
на возвышенных полях. Такими же условиями влагообеспечен-
ности обладают и пойменные земли. Возможная урожайность
абсолютно сухой биомассы, т/га, при определенной влагообеспе-
ченности
100- IV-
где IV— ресурсы продуктивной влаги, мм; Кк — коэффициент водопотребления,
(ммга)/т.
Коэффициент водопотребления, как было сказано, является
специфичным для каждой культуры и меняется в зависимости от
уровня почвенного плодородия и климатических условий. В
определенных пределах справедливо утверждение, что растение
затрачивает на создание сухого вещества тем меньше воды, чем
276
полнее удовлетворяются его потребности в других факторах
жизнеобеспечения. Чем ниже уровень агротехники и почвенного
плодородия, тем коэффициент водопотребления выше.
М. К. Каюмов (1986) рекомендует в качестве
ориентировочных использовать следующие коэффициенты водопотребления
(м /т): для озимой пшеницы, ржи, ячменя, овса, картофеля —
350—400, для кормовой свеклы, моркови, капусты, кукурузы,
вико-овсяной смеси на зеленый корм — 300—400, для
многолетних трав на сено — 500—700. Для суглинистых почв Московской
области при содержании продуктивной влаги 400—450 мм
расчетная возможная урожайность озимой пшеницы составляет
5,0—5,5 т/га, ячменя — 5,5—6,0, картофеля 30,0—35,0 т/га, при
содержании продуктивной влаги 350—410 мм — соответственно
4,3—4,9; 4,8—5,3; 26,0—31,0 т/га. Такая урожайность в северных
районах области может быть получена в течение восьми-девяти
лет, в центральных — шести-семи лет из десяти. Остальные годы
бывают засушливыми, когда без орошения бывает трудно
достичь уровень возможной урожайности.
Часто более достоверные данные по урожайности получаются,
когда продуктивная влага определяется как запас доступной для
растений влаги в метровом слое почвы в период посева или
возобновления вегетации озимых и многолетних культур плюс
эффективно используемые осадки за вегетационный период.
Продуктивная влага
Ж = Щ> + 0,8 • Ос,
где Щ — запас продуктивной влаги в период посева; Ос — количество осадков за
вегетацию.
Существует тесная связь между приходом фотосинтетически
активной радиации, коэффициентом скрытой теплоты испарения
и необходимым количеством воды для получения
соответствующего урожая. Эта связь также может быть использована для
расчета величины возможной урожайности, количества
продуктивной влаги, необходимого для формирования заданного
урожая, и оросительной нормы. Математическое выражение
взаимосвязи солнечной энергии, влаго- и теплообеспеченности
выражено в формуле А. М. Рябчикова:
где Кр — биогидротермический потенциал продуктивности, баллы; IV—
продуктивная влага, мм; Т — период вегетации, декада; 36 — число декад в году; К —
радиационный баланс, или суммарная ФАР за период вегетации культуры,
кДж/см .
• Например, в Подмосковье при Л = 25,5, IV = 420 и Т = 10 Кр = 4,5 балла.
277
жш балл продуктийностн соответствует в среднем 2 т/га абсолютно сухой
биомассы (3), и К^ ясресчитыкается в бмшюппескмй урожай по формуле
Убит = р^ = 2 т/га - 4,5 = 9 т/га..
Ее» прайда», чт в обшей биомассе зерно составляет примерю 1/3, то
возможный урожай сушжо зерня 3 т/га млн при стандартной яяаашесте 14 % —
3,42 т/га.
Величины возможной урожайности, рассчитанные о©
приведенным формулам, различаются незначительно {на 0,1—0,2 т/га).
Сопоставление прихода суммарной радиации с наличием
шага в почве за вегетационный период имеет большое
практическое .значение, так как затраты теплоты на испарение играют
основную роль в расходной части теплового баланса. При
большей солнечной радиации и оптимальном увлажнении растения
развиваются лучше, чем там, гае влага много, но незначительное
количество солнечной радиации.
Практическое значение имеют также прогнозы урожайности,
учитывающие состояние посева (густоту, площадь листовой
поверхности, число продуктивных побегов и т. д.) и
лимитирующие метеорологические факторы. Методом биологического
контроля выяснено, что на формирование урожайности зерновых
культур влияют .запасы продуктивной шага и температура
воздуха уже на III—IV этапах органогенеза, когда происходит закладка
колосков в колосе (фенофаза кущение—начало выхода в трубку),
а число зерен в колосс при одинаковом количестве колосков
зависит от влагообеспеченности V—VI этапов органогенеза
(выход в трубку—начало стеблевания). Потому при выборе ис-
ходных параметров еяеязжт учитывать 'влияние метеорояогачес-
ких факторов по этапам
органогенеза.
Например, метод прогноза
урожайности кукурузы,
разработанный Ю. И. Чирковым
{1:986), основан на учете связи
урожайности кукурузы с
запасами продуктивной штага в
почве ш с площадью листовой
поверхности посева,
выражающей фотосинтетический
потенциал, т. е. возможность
посева использовать для
формирования урожая солнечную
радиацию.
В уравнение вюиочены
площадь листовой
поверхности 5* (тыс. м2/га); запасы про-
278
щжщш (У) от
(#Э ■ слое шипи •—.
5) ДО. И.
дуктивной влаги IV (мм) в слое почвы 0—50 см в фазе
выметывания метелки; температура воздуха Ц (°С) в период
формирования элементов продуктивности початка на IV—V этапах
органогенеза, которую обычно берут по материалам наблюдений;
температура воздуха *2 (°С) в течение месяца после выметывания
метелки, когда происходят цветение, оплодотворение и налив
зерна (она устанавливается по прогнозу).
Графически система уравнений для различных площадей
листовой поверхности посева в фазе выметывания метелки
представлена кривыми параболы второго порядка (рис.86). В
уравнении для Нечерноземной зоны, где ресурсы тепла ограничены,
учитывается также сумма эффективных температур выше 10 "С.
Влагообеспеченность растений и приход солнечной радиации
в значительной степени определяют не только величину, но и
качество урожая. Это дает возможность составлять
прогностические уравнения для расчета сахаристости сахарной свеклы и
сочных плодов (влагообеспеченность и приход радиации), маслич-
ности семян подсолнечника (условия увлажнения и
температура), содержания белка и клейковины в зерне (запасы
продуктивной влаги, влажность воздуха в период от начала
активной вегетации озимых до колошения, температура воздуха).
Жаркая сухая погода способствует повышению качества зерна.
В настоящее время проводится интенсивная работа по
созданию динамических моделей формирования урожайности,
которые дают возможность ежедекадно рассчитывать биологический
урожай и динамику нарастания биомассы на основании данных
о влагозапасах почвы, состоянии посева и погодных условий.
Схема расчета урожайности и других показателей реализована в
виде программы на ЭВМ. Модели формирования урожая могут
быть использованы в селекционной работе, для оценки
продуктивности новых сортов и гибридов при их внедрении в
различные почвенно-климатические зоны, для оптимизации условий
выращивания сельскохозяйственных растений.
Контрольные вопросы и задания
1. В чем отличие механизмов поглощения воды набухающим семенем и
проростком? 2. Как объяснить сходное влияние на поглощение воды растением
почвенной засухи и засоленности почвы? 3. Какие условия создают
физиологическую сухость почвы? 4. Перенос растений, выращиваемых в водной культуре,
на более концентрированный раствор может вызывать временное завядание,
затем тургесцентность восстанавливается. Как объяснить это явление? 5. В каком
случае интенсивность транспирации больше — у обособленного растения или у
такого же растения в густом посеве? Обоснуйте свой ответ. 6. Каковы средние
величины сезонного водопотребления сельскохозяйственных культур? 7.
Назовите критические периоды в жизни плодовых и зерновых культур по отношению к
влаге. 8. Какие физиологические показатели наиболее точно определяют
необходимость полива?
Глава 5
МИНЕРАЛЬНОЕ ПИТАНИЕ РАСТЕНИЙ
5.1. НЕОБХОДИМЫЕ РАСТЕНИЮ ЭЛЕМЕНТЫ
МИНЕРАЛЬНОГО ПИТАНИЯ
Минеральное питание — столь же уникальное свойство
растения, как и фотосинтез. Именно эти две функции лежат в основе
автотрофности растительного организма, т. е. способности
строить свое тело из неорганических веществ. Причем управление
корневым питанием растений значительно легче, чем
регулирование воздушного питания — усвоения СС>2. Поэтому
минеральное питание издавна привлекает внимание физиологов и
постоянно находится в поле зрения агрономов.
Более столетия назад физиологи, пытаясь вырастить растения
без почвы в водных растворах солей, установили, какие
химические элементы, в каких формах и в каком количестве нужны
растениям для нормального развития. На основе этих
исследований началось производство удобрений, без которых в настоящее
время земледелие немыслимо.
Современные представления о питании растений
основываются на работах многих ученых, в том числе таких крупных
русских исследователей, как Д. А. Сабинин и Д. Н.
Прянишников. Д. А. Сабинин создал школу физиологов минерального
питания в нашей стране, внес большой вклад в изучение
поглотительной деятельности корня и создание концепции круговорота
веществ в растении. Большое значение минеральным
удобрениям придавал Д. Н. Прянишников — основоположник агрохимии
в России. Его научные труды о корневом питании растений и
удобрениях положены в основу химизации сельского хозяйства.
5.1.1. СОДЕРЖАНИЕ И НЕОБХОДИМОСТЬ ЭЛЕМЕНТОВ
Растения способны поглощать из окружающей среды
практически все элементы Периодической системы Д. И. Менделеева.
Причем многие рассеянные в земной коре элементы
накапливаются в растениях в значительных количествах и включаются в
природный круговорот веществ, в частности в круговорот редких
элементов. Однако для нормальной жизнедеятельности самого
растительного организма требуется лишь небольшая группа
элементов.
Питательными веществами называются вещества,
необходимые для жизни организма. Элемент считается необходимым,
280
если его отсутствие не позволяет растению завершить свой
жизненный цикл; недостаток элемента вызывает специфические
нарушения жизнедеятельности растения, предотвращаемые или
устраняемые внесением этого элемента; элемент
непосредственно участвует в процессах превращения веществ и энергии, а не
действует на растение косвенно.
Необходимость элементов можно установить только при
выращивании растений на искусственных питательных средах — в
водных и песчаных культурах. Для этого используют
дистиллированную воду или химически чистый кварцевый песок, химически
чистые соли, химически стойкие сосуды и посуду для
приготовления и хранения растворов.
Точнейшими вегетационными опытами установлено, что к
необходимым для высших растений элементам (кроме 45 %
углерода, 6,5 % водорода и 42 % кислорода, усвояемых в процессе
воздушного питания) относятся следующие:
макроэлементы, содержание которых колеблется от десятков
до сотых долей процента: N. Р, 8, К, Са, М§;
микроэлементы, содержание которых колеблется от тысячных
до стотысячных долей процента: Ре, Мп, Си, 2п, В, Мо.
Для нормального роста и развития некоторых растений
необходимы также Со, N8, 81, С1. Например, кобальт требуется
бобовым культурам для симбиотической фиксации азота. Натрий
поглощается в относительно высоких количествах свеклой и
необходим растениям, приспособленным к засоленным почвам.
Кремний в больших количествах встречается в соломине злаков
и необходим для риса.
Четыре элемента — С, О, Н, ТЧ, называемые органогенами,
составляют 95 % сухой массы растительных тканей, 5 %
приходится на зольные вещества. Так называют входящие в растение
минеральные элементы, содержание которых обычно определяют
в тканях после сжигания органического вещества растений.
Содержание золы зависит от вида и органа растений, условий
выращивания. В семенах содержание золы составляет в среднем
3 %, в корнях и стеблях — 4—5, в листьях —5—15 %. Меньше
всего золы в мертвых клетках древесины (около 1 %). Как
правило, чем богаче почва и чем суше климат, тем больше в
растениях содержание зольных элементов.
5.1.2. МАКРОЭЛЕМЕНТЫ, ИХ УСВОЯЕМЫЕ СОЕДИНЕНИЯ, РОЛЬ
И ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ПРИ НЕДОСТАТКЕ В РАСТЕНИИ
Азот. Составляет около 1,5 % сухой массы растений. Он
входит в состав белков, нуклеиновых кислот, липоидных
компонентов мембран, фотосинтетических пигментов, витаминов и других
жизненно важных соединений.
Основными усвояемыми формами азота являются ионы нит-
281
рата и аммония. Высшие растения способны также усваивать
нитриты и водорастворимые азотсодержащие органические
соединения (аминокислоты, амиды, полипептиды и др.). Но в
естественных условиях эти соединения редко бывают источником
питания, поскольку их содержание в почве, как правило, очень
мало.
Недостаток азота тормозит рост растений. Это выражается не
только в низкорослости и слабом кущении, но и в появлении
признаков ксероморфизма, как и при недостатке воды.
Наблюдается мелколистность, перегиб кривой ярусной изменчивости
размеров листа наступает раньше. Одновременно снижается
ветвление корней, но соотношение массы корней и надземной
системы может увеличиваться. Это приводит к уменьшению площади
фотосинтетического аппарата и сокращению периода
вегетативного роста, что снижает фотосинтетический потенциал и
продуктивность посева.
Недостаток азота вызывает также серьезные нарушения
энергетического обмена. Растения хуже используют световую
энергию, так как снижается интенсивность фотосинтеза, раньше
наступает световое насыщение, а компенсационная точка
находится при более высокой интенсивности света. Интенсивность
дыхания может возрастать, но уменьшаются сопряженность
окисления с фосфорилированием и выработка АТФ. Кроме того,
энергетические затраты на поддержание структуры цитоплазмы
возрастают. Все это также приводит к снижению урожая.
И наконец, азотное голодание влияет на водный режим рас-.
тений. Недостаток азота снижает водоудерживающую
способность растительных тканей, так как уменьшает количество
коллоидно связанной воды. У растений снижается возможность вне-
устьичного регулирования транспирации и водоотдача
возрастает. Поэтому низкий уровень азотного питания не только
снижает урожай, но и уменьшает эффективность использования
воды посевом.
Фосфор. Содержание его составляет 0,2—1,2 % сухой массы
растения. В отличие от азота фосфор поглощается и
функционирует в растении только в окисленной форме — в виде остатков
ортофосфорной кислоты. Собственно весь фосфорный обмен
сводится лишь к присоединению или переносу остатка
фосфорной кислоты (фосфорилирование и трансфосфорилирование).
Фосфорилирование — это присоединение остатка фосфорной
кислоты к какому-либо органическому соединению с
образованием эфирной связи, например фосфорилирование глюкозы,
фруктозо-6-фосфата в гликолизе.
Трансфосфорилирование — это процесс, при котором остаток
фосфорной кислоты, включенный в состав одного органического
вещества, переносится на другое органическое вещество.
Несмотря на относительную простоту фосфорного обмена,
282
значение образующихся при этом фвсфорорганических
соединений огромно. Фосфор — обязательный компонент таких
важнейших соединений, как нуклеиновые кислоты, фосфопротеиды,
фосфодшишы, фосфорные эфиры. сахара,, нуклеощдн,
принимающих участие в энергетическом обмене (АТФ,, НАД, ФДД и
др.), витаминов. Поэтому недостаток фосфора вызывает
серьезные нарушения биосинтетяческих процессов,
функционирования мембран, энергетического обмена... При недостатке фосфора
корневая система буреет, слабо развивается, корневые волоски
отмирают. Приостанавливается рост растений, задерживается
созревание плодов.
Сера. Содержание серн в растнтеяшыж тканях — 0,2—1,0 %
сухой массы. Сера, как и фосфор, поступает в растение в
окисленной форме, в виде аниона 8О|~, но на этом сходство за!санчива-
егся. В органические соединения сера входит только в
восстановленной форме — в составе сульфгадрильных групп (—§Н) и да-
сульфидных связей(—5—&—). Восстановление сульфата
происходит преимущественно в листьях. Восстановленная сера может
вновь переходить в окисленную функционально неактивную
форму. В'молодых листьях сера в основном находится в составе
органических соединений, а в старых накапливается в вакуолях в
виде сульфата кальция.
Сера принимает активное участие в многочисленных
реакциях обмена веществ. Почти все белки содержат серосодержащие
аминокислоты — метионин, цистеин, цисган. Важнейшие
функции серы в белках — участие 8Н-групп и —8—8-связей в
стабилизации трехмерной структуры белков и образование связей с
коферментами и простетическими группами. Сочетание метиль-
ной и 5Н-группы обусловливает широкое участие метионина в
образовании активных центров ферментов, С этой
аминокислоты начинается синтез всех полипептидных цепей.
Другая важнейшая функция серы в растительном
организме, основанная на обратимом переходе 2(—8Н) = — Н8—§Н—,
состоит в поддержании определенного уровня окислительно-
восстановительного потенциала в клетке, необходимого для
нормального функционирования всех ферментных систем. К
серосодержащим окисяительно-восстановительным системам
клетки относятся система цистеин =г цистин и система глу-
татиона. Глутатион является трияептидом, состоящим из трех
остатков аминокислот: глутаминовой, «истина "или цистеина и
глицина. Его окислительно-восстановительные превращения
связаны с переходом — 8—Б-групп цистана в — §Н-группы иис-
теина (О8—8С^г2О8Н). Освобождение или связывание
водорода происходит в зависимости от преобладающих
метаболических условии в клетке и при взаимодействии с тиоловыми
группами ферментов."
Сера является также компонентом важнейших биологических
соединений — коэнзима А (СоА—8Н) и витаминов (тиамина, ли-
поевой кислоты, биотина), играющих важную роль в дыхании и
липидном обмене. Кофермент А поставляет ацетильный остаток
(СНзСО~8КоА) в цикл Кребса или для биосинтеза жирных
кислот, сукцинильный остаток для биосинтеза порфиринов. Причем
в составе этих комплексов сера образует макроэргическую связь,
что значительно повышает реакционную способность
соединения. Липоевая кислота и тиамин входят в состав липотиаминди-
фосфата (ЛТДФ), участвующего в окислительном декарбоксили-
ровании пировиноградной и ос-кетоглютаровой кислот.
Многие виды растений в малых количествах содержат летучие
соединения серы. Например, сульфоксиды входят в состав
фитонцидов лука и чеснока. Представители семейства
Крестоцветные синтезируют серосодержащие горчичные масла.
Недостаточное снабжение растений серой тормозит белковый
синтез, снижает фотосинтез и скорость роста растений, особенно
надземной части.
Калий. Содержание калия в растениях составляет около 1 % в
расчете на сухую массу. В растительных тканях его гораздо
больше, чем других катионов. Содержание калия в растениях в 100—
1000 раз превосходит его уровень во внешней среде. Поступает
калий в растение в виде катиона К+. Калий не входит ни в одно
органическое соединение. В клетках он присутствует в основном
в ионной форме и легкоподвижен. В наибольшем количестве
калий сосредоточен в молодых растущих тканях,
характеризующихся высоким уровнем обмена веществ.
Известно участие калия в регуляции вязкости цитоплазмы, в
повышении гидратации ее коллоидов и водоудерживающей
способности. Калий служит основным противоионом для
нейтрализации отрицательных зарядов неорганических и органических
анионов. Высокая подвижность калия создает ионную
асимметрию и разность электрических потенциалов на мембране, т. е.
обеспечивает генерацию биотоков в растении.
Калий составляет основную часть катионов клеточного сока и
принимает активное участие в осморегуляции. Важное значение
имеет транспорт калия при открывании и закрывании устьиц.
Транспорт углеводов в растении также связан с
перераспределением калия. Установлено, что высокий уровень сахара в
зрелых ягодах винограда коррелирует с накоплением значительных
количеств калия и органических кислот в соке незрелых ягод и с
последующим выходом калия при созревании. Под влиянием
калия увеличивается накопление крахмала в клубнях картофеля,
сахарозы в сахарной свекле, моносахаридов в плодах и овощах,
целлюлозы, гемицеллюлоз и пектиновых веществ в клеточных
стенках растений. В результате повышается устойчивость злаков
к полеганию, к грибным и бактериальным заболеваниям.
Калий является активатором многих ферментных систем. Он
284
необходим для включения фосфата в органические соединения,
синтеза белков, полисахаридов и рибофлавина — компонента
флавиновых дегидрогеназ.
Снабжение калием особенно важно д^ля молодых, активно
растущих органов и тканей. При дефиците калия снижается
функционирование камбия, нарушаются процессы деления и
растяжения клеток, развитие сосудистых тканей, уменьшается
толщина клеточной стенки эпидермиса. В результате
укорачивания междоузлий могут образоваться розеточные формы
растений. Недостаток калия снижает продуктивность фотосинтеза
прежде всего за счет уменьшения оттока ассимилятов из листьев.
Кальций. Входит в состав растений в количестве 0,2 % сухого
вещества. Поступает в растение в виде иона Са . Кальций
накапливается в старых органах и тканях. При снижении
физиологической активности клеток кальций из цитоплазмы
перемещается в вакуоль и откладывается в виде нерастворимых
соединений щавелевой, лимонной и других кислот. Это значительно
снижает подвижность кальция в растении.
В клетках большое количество кальция связано с
пектиновыми веществами клеточной стенки и срединной пластинки. При
недостатке кальция клеточные стенки ослизняются.
Важная роль принадлежит ионам кальция в стабилизации
структуры мембран, регуляции ионных потоков и
биоэлектрических явлениях. Его относительно много содержится в
митохондриях, хлоропластах и ядрах, а также в комплексах с
биополимерами пограничных мембран клетки. Большая часть катио-
нообменной поверхности корня занята кальцием. Кальций
наряду с протоном водорода принимает активное участие в
первичных механизмах поступления ионов в клетки корня.
Ограничивая поступление других ионов в растения, кальций
способствует устранению токсичности избыточных концентраций ионов
аммония, алюминия, марганца, железа, повышает устойчивость к
засолению, снижает кислотность почвы.
В цитозоле концентрация кальция низкая (10—10 моль/г),
однако его функции очень многообразны и важны. Локальное
изменение концентрации Са2+ в цитозоле приводит к
структурной перестройке актомиозиноподобных белков, участвующих в
процессах движения цитоплазмы, обратимых изменениях ее
вязкости, в пространственной организации цитоплазматических
ферментных систем, например гликолиза. Уровнем ионов Са2+
регулируются процессы сборки-разборки микротрубочек,
секреции компонентов клеточной стенки с участием везикул Гольджи.
Кальций активирует ряд ферментных систем клетки,
например дегидрогеназы, амилазы, фосфатазы, киназы, липазы. Его
действие основано на участии в образовании четвертичной
структуры белка, создании мостиков в фермент-субстратных
комплексах, влиянии на состояние аллостерических центров.
285
Установлено, что регуляторное действие кальция на многие
стороны метаболизма связано с функционированием
специфического белка ~ кальмодулнта. Это кислый <рН ИЭТ 3,0—4,3)
термостабилькый низкомолекулярный белок (148
аминокислотных остатков). Комплекс беяка с кальцием активирует- многие
ферментные системы: прегтеигасииазы., транспортную Са-АТФ-
азу, АТФ-азу актомидаина. С участием кальмодулина
регулируется концентрация внутриклеточного кальция. Комплекс Са-каль-
модудик контролирует сборку микротрубочек веретена,
образование штоскелета клетки я формирование клеточной стенки.
При недостатке кальция в первую очередь страдают мериете-
матические ткани и корневая система, У делящихся клеток ие
образуются клеточные стенки, в. результате возникают
многоядерные клетки. Прекращается образование боковых корней и
корневых волосков. Недостаток кальция вызывает также
набухание пектиновых веществ, что приводит к осдизкению клеточных
стенок и загниванию растительных тканей.
Магний. Содержание магния в растительных тканях
составляет около 0,2 % сухой массы. Особенно много магния в молодых
растущих частях растения, а также в генеративных органах и
запасающих тканях. Магний поступает в растение в виде иона
М%г и в отличие от кальция обладает сравнительно высокой
подвижностью. Легкая подвижность М|р+ объясняется тем, что
почти 70 % этого катиона в растениях связано с анионами
органических и неорганических кислот. Около 10—12 % магния
входит в состав хлорофилла.-
Магний является активатором ряда ферментных систем: РДФ-
карбоксилазы, фосфокиназ, АТФ-аз, енолаз, ферментов цикла
Кребса, нентозофосфатного пути, спиртового и молочнокислого
брожения. Магний также активирует промессы транспорта
электронов при фотофосфорияировашш. М^+ необходим для
формирования рибосом и полисом, для активации аминокислот и
синтеза белков. Он активирует ДНК- ш РНК-иолимеразы,
участвует в образовании определенной пространственной структуры
нуклеиновых кислот.
Магний усиливает синтез эфирных масел, каучуков. Образуя
комплексное соединение с аскорбиновой кислотой, он
предотвращает ее окисление. Недостаток магния приводит к
нарушению фосфорного, белкового и углеводного обменов. При
магниевом голодании нарушается формирование пластид: граны
слипаются, разрываются ламеллы стремы, просветляется метрике
хмордаиастов. Впоследствии развиваются хлороз и некроз
листьев.
Жеяезо. Входит в состав, растения в количестве 0,08 %.
Поступает в растение в виде Ре . Роль железа в большинстве случаев
связана с его способностью к обратимом
окислительно-восстановительным превращениям
Ре
з+
+б
—е
2+
и участию в транспорте электронов. *
Железо входит в состав участников ЭТЦ фотосинтетического
и окислительного фосфорилирования (цитохромов, ферредокси-
на), является компонентом ряда оксидаз (цитохромоксидазы, ка-
талазы, пероксидазы).
Кроме того, железо является составной частью ферментов,
катализирующих синтез предшественников хлорофилла (амино-
левулиновой кислоты и протопорфиринов). Поэтому недостаток
железа вызывает глубокий хлороз в развивающихся листьях,
которые могут быть совершенно белыми, и тормозит два
важнейших процесса энергообмена растения — фотосинтез и дыхание;
Растения могут включать железо в запасные вещества. В этом
отношении интересен содержащийся в пластидах ферритин —
белок, который содержит железо в негеминной форме. На долю
железа может приходиться до 23 % сухой массы ферритина.
5.1.3. МИКРОЭЛЕМЕНТЫ, ИХ УСВОЯЕМЫЕ ФОРМЫ, РОЛЬ
И ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ПРИ НЕДОСТАТКЕ В РАСТЕНИИ
Микроэлементы относятся к группе незаменимых
питательных элементов, содержание которых в растительных тканях
измеряется тысячными и стотысячными долями процента.
Несмотря на то что микроэлементы требуются в очень малых
количествах, в их Отсутствие нормальная жизнедеятельность становится
невозможной. Недостаток микроэлементов вызывает серьезные
физиологические расстройства и нередко приводит к гибели
растений уже в раннем возрасте. Объясняется это тем, что
микроэлементы главным образом функционируют в регуляторных
системах клетки. Они выступают в качестве простетических групп
ферментов или кофакторов — активаторов ферментов.
Медь. Поступает в растение в виде иона Си . В основе ее
функционирования лежит способность к обратимым
окислительно-восстановительным превращениям
Она входит непосредственно в состав ряда ферментных
систем, относящихся к группе оксидаз, таких, как полифенолокси-
даза, аскорбатоксидаза, тирозиназы. Два атома меди
функционируют в цитохромоксидазном комплексе дыхательной цепи
митохондрий.
Большая часть меди (75 % всего содержания в листе) кон-
287
центрируется в хлоропластах. Здесь сосредоточен
медьсодержащий белок синего цвета — пластоцианин, осуществляющий
перенос электронов между ФСП и ФС1.
Кроме того, • медь активирует ряд ферментов, в частности
нитратредуктазу, а также протеазы, т. е. играет определенную
роль в азотном обмене. Необходимо отметить также участие
меди в гормональной регуляции в растении. Медьсодержащий
фермент полифенолоксидаза регулирует содержание и
активность в растениях ауксинов и ингибиторов роста фенольной
природы. Это лежит в основе способности меди повышать
устойчивость растений к полеганию и неблагоприятным условиям
среды.
Недостаток меди вызывает задержку роста и цветения. У
плодовых культур при остром дефиците меди наблюдается суховер-
шинность.
Марганец. Он поступает в растение в виде ионов Мп3+.
Марганец активирует ферменты, катализирующие реакции цикла
Кребса (дегидрогеназы яблочной и лимонной кислот), а также
участвующие в окислении важнейшего фитогормона — ауксина
(индолилуксусной кислоты).
Марганец принимает участие в процессе восстановления
нитратов до аммиака, в связи с чем растения, испытывающие
недостаток марганца, не могут использовать нитраты в качестве
источника азотного питания.
Марганец необходим для нормального протекания
фотосинтеза, он участвует в этом процессе на этапе разложения воды и
выделения кислорода (фотолиз воды), а также восстановления
СС>2. Марганец способствует оттоку Сахаров из листьев.
Этот элемент играет специфическую роль в поддержании
структуры хлоропластов. В отсутствие марганца хлорофилл
быстро разрушается на свету.
Марганец является кофактором РНК-полимеразы,
ответственной за синтез мРНК в ядре, и ауксиноксидазы —
ферментативного комплекса, разрушающего ИУК, поэтому он очень важен
для ростовых процессов.
Установлено также влияние марганца на поступление веществ
в растение. При исключении марганца из питательной среды в
тканях растений возрастает уровень основных элементов
минерального питания, нарушается их соотношение.
Особенно чувствительны к недостатку марганца злаковые,
корнеплоды, картофель.
Цинк. Поступает в растение в виде иона 2п2 . Цинк входит в
состав фермента карбоангидразы, катализирующей гидратацию
СОг в Н2СО3. Н2СО3—СО2 + НгО. Этот фермент играет
важную роль в поддержании запасов СО2 для фотосинтеза.
В качестве кофактора Ъл участвует в синтезе растительного
гормона — ауксина (ИУК). Это связано с тем, что цинк, повы-
288
шая активность триптофансинтетазы, влияет на синтез
аминокислоты триптофана — предшественника ауксина. Недостаток
цинка приводит к резкому торможению роста и формирования
побегов, растения приобретают розеточные формы. 2п также
выступает в качестве активатора ряда ферментов гликолиза (гек-
сокиназы, альдолазы, триозофосфатдегидрогеназы) и пентозо-
фосфатного пути (дегидрогеназ глюкозо-6-фосфата и фосфоглю-
коната).
При дефиците цинка в растениях накапливаются
редуцирующие сахара и уменьшается содержание сахарозы и крахмала,
увеличивается количество органических кислот и небелковых
соединений азота — свободных аминокислот и амидов. При
недостатке цинка в растениях нарушается также фосфорный обмен:
включение фосфора в органические соединения и замедление
его транспорта из корней в надземную часть.
К недостатку цинка особенно чувствительны плодовые
деревья. Наиболее характерный признак голодания — задержка роста
междоузлий и листьев, развитие розеточности и мелколистности.
Молибден. Поступает в растение в виде аниона МоО4 и
концентрируется в молодых растущих частях. Молибден играет
особо важную роль в азотном обмене растений. Это связано с
тем, что он входит в активный центр фермента,
восстанавливающего нитраты, — нитратредуктазу, а также является компонентом
активного центра нитрогеназы бактероидов, фиксирующих
атмосферный азот в клубеньках бобовых. Как металл-активатор
молибден необходим в реакциях аминирования и переаминирова-
ния, для включения аминокислот в пептидную цепь,
функционирования различных фосфатаз. Он оказывает влияние на
уровень накопления аскорбиновой кислоты.
При дефиците молибдена рост растений тормозится.
Особенно чувствительны к недостатку молибдена бобовые и овощные
культуры.
Бор. Поступает в растение в виде аниона борной кислоты. Это
один из наиболее важных микроэлементов, особенно для
двудольных растений. При его недостатке нарушаются синтез,
превращение и транспорт углеводов, формирование репродуктивных
органов, происходят гибель меристематических клеток и деградация
проводящей системы растений. Пока еще не установлены
механизмы действия бора и ферментные системы, в деятельности
которых он участвует. Согласно концепции М. Я. Школьника
(1971), бор имеет специфическое значение для растения благодаря
своей уникальной роли в фенольном обмене. Предполагается, что
при недостатке бора в клетках двудольных растений
накапливаются фенолы и супероптимальные концентрации ауксинов, что
нарушает синтез нуклеиновых кислот и белков; затем нарушаются
ритм деления клеток и структура клеточных стенок, появляются
289
уродливые изменения в формирующихся листьях конуса
нарастания. На заключительной стадии борного голодания под действием
полифенолоксидаз в клетке накапливаются токсичные хиноны,
которые приводят к отмиранию конусов нарастания.
5.1.4. ДИАГНОСТИКА ДЕФИЦИТА ПИТАТЕЛЬНЫХ ЭЛЕМЕНТОВ
Для повышения продуктивности сельскохозяйственных
посевов необходимо создать оптимальные условия питания растений
и контролировать их в течение вегетации. Существует несколько
причин, обусловливающих недостаток или избыток элементов
питания в почве: недостаточное внесение одного или нескольких
питательных веществ с удобрениями; одностороннее применение
удобрений (особенно азотных); свойства почвы, препятствующие
поступлению питательных веществ в растения; возделывание
интенсивных сортов, обладающих повышенной потребностью в
питательных элементах; неравномерность поглощения веществ
растениями на протяжении онтогенеза и др.
Корректировка питания должна проводиться на протяжении
всей вегетации, особенно на ранних этапах развития растений.
Диагностику питания растений подразделяют на почвенную и
растительную. Почвенная диагностика проводится путем
агрохимического анализа почвы и сопоставления полученных данных с
установленными нормативами. Однако анализ почвы не всегда
достаточен для определения обеспеченности растений
минеральным питанием из-за сложности взаимосвязей элементов,
физико-химических и других свойств почвы. Кроме того, потребность
растения зависит от многих факторов среды: освещенности,
температуры, снабжения водой. Поэтому для получения более
объективной информации об обеспеченности растений
минеральным питанием наряду с почвенной проводят растительную
диагностику.
В. В. Церлинг дает следующую классификацию методов
растительной диагностики.
1. Визуальная диагностика — определение нарушения питания
по внешнему виду растений.
2. Метод инъекции или опрыскивания. Используют главным
образом для диагностики питания микроэлементами.
3. Морфобиометрическая диагностика по приросту массы,
числу и размерам органов, величине и структуре урожая.
4. Химическая диагностика — химический анализ растений по
фазам их развития.
Остановимся подробнее на визуальной диагностике. В основе
ее лежит наблюдение за изменением окраски, появлением на
листьях и стеблях пятен, полос, некрозов тканей и
отклонениями в анатомии и морфологии растений. Характерное для опреде-
290
ленной культуры проявление дефицита или избытка каждого
элемента достаточно специфично. Однако надо учитывать, что
такие же проявления могут быть вызваны заболеваниями
растений, другими неблагоприятными воздействиями. Например,
очень похожими по внешнему виду могут быть признаки
недостатка азота и воды; у картофеля повреждения, вызванные
фитофторой, могут быть приписаны недостатку калия; у капусты
повреждения килой и личинкой капустной мухи могут
проявиться в лиловом оттенке листьев, похожем на признаки недостатка
фосфора. Опрыскивание листьев пестицидами может вызвать
краевые ожоги или появление бурых пятен, свойственных
недостатку калия или кальция.
Сложность визуальной диагностики состоит также в том, что
нередко наблюдается проявление признаков недостатка или
избытка не одного, а двух или нескольких элементов питания
одновременно. Так, у картофеля на сильнокислых супесчаных
почвах часто наблюдают совместное проявление признаков
недостатка магния и вредного действия марганца. Кроме того,
признаки голодания могут появляться, исчезать и снова
возобновляться. Это зависит от погодных условий, проникновения
корней в глубокие слои почвы и изменения потребностей растений
в отдельных элементах питания в процессе их роста и развития.
Существенным недостатком листовой диагностики является
появление внешних признаков лишь при значительном
голодании в отношении того или иного элемента. Но надо иметь в
виду, что признаки голодания обычно появляются сначала у
одиночных растений и лишь постепенно распространяются на
весь посев или насаждение. Поэтому систематический
внимательный осмотр растений позволяет использовать результат
наблюдений не только для корректировки применения удобрений
на данном участке в последующие годы, но и в ряде случаев
исправить ситуацию с помощью подкормки.
При визуальной диагностике прежде всего следует установить,
внешний вид каких частей растения нарушен. Элементы питания
по их подвижности внутри растения делят на две группы: реути-
лизируемые и нереутилизируемые. При недостатке реутилизиру-
емых элементов они оттекают из ранее образовавшихся частей
растений в молодые, формирующиеся, более активно
поглощающие питательные вещества органы. К таким элементам относят
И, К, Р, М§. Поэтому их недостаток прежде всего и ярче всего
проявляется на закончивших рост листьях. Недостаток остальных
элементов (Са, Ре, 8 и всех микроэлементов), нереутилизируе-
мых или слабореутилизируемых, отражается на самых молодых
растущих частях растений. Так, очень близкие по внешнему виду
хлорозы при недостатке азота проявляются на листьях нижнего
яруса, а при недостатке железа — в верхнем, более молодом
ярусе. Побурение и отмирание тканей по краям листа (краевой
291
ожог) при недостатке калия наблюдаются сначала на более
старых листьях, а при недостатке кальция — на молодых.
При избытке все элементы накапливаются в уже
сформированных органах, и поэтому изменения их внешнего вида
свидетельствуют о токсичности элемента.
5.2. ПОГЛОЩЕНИЕ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
Корневая система растений поглощает из почвы как воду, так
и питательные вещества. Оба эти процесса взаимосвязаны, но
осуществляются на основе разных механизмов. Многочисленные
исследования показали, что почти никогда раствор питательных
солей не поступает в растение в неизменной концентрации. Из
очень разбавленных растворов соли поглощаются быстрее, чем
вода, и раствор становится еще более слабым. Наоборот, из
концентрированных растворов растение берет больше воды, чем
солей, и раствор становится еще более концентрированным.
Растения поглощают вещества избирательно, в результате
соотношение поглощенных веществ обычно оказывается иным,
чем в питательном растворе (табл. 20). В тканях актинидии
китайской концентрация фосфора в несколько тысяч раз, а калия
и азота в десятки раз превышает содержание этого элемента в
почвенном растворе.
20. Сравнительное содержание элементов в тканях АсМгнсНа сЫпепз15
и почвенном растворе (по В. В. Полевому, 1989)
Показатель
Са
Ткани 170
Почвенный раствор 1—3
80 9 28 14
1-2 0,0005-0,002 0,5-1,5 2-4
Примечание. Содержание элементов в тканях — в ммоль/кг сырой
массы плодов и листьев, в почвенном растворе — в ммоль/л.
Эти данные свидетельствуют также о том, что поглощение
веществ идет не только избирательно, но и против градиента
концентраций.
Процесс поглощения веществ делят на два этапа: поступление
ионов в свободное пространство корня; транспорт их в
протопласты клеток. При помещении корней растений на раствор
катионного красителя, например метиленового синего, можно
наблюдать, что в первые же 3 мин из раствора поглощается
примерно половина того количества, которое поглотится за
длительное время (рис. 87). Дальнейшее поглощение будет идти
очень медленно (часами). Действие на корневую систему
дыхательных ядов или пониженной температуры полностью снимает
последующее медленное поглощение вещества из раствора.
292 г
Перенос в воду
или в раствор
Выход
ввод
Количество
обмениваемых
ионов
Врвпя
Рис. 87. Поглощение веществ тканями растений:
I этап — проникновение в кажущееся свободное пространство; II этап — накопление в
клетках; / — в отсутствие дыхательных ядов и при физиологической температуре; 2 — наличие
дыхательных ядов или низкая температура
При переносе корней в воду или раствор соли наблюдается
обратная картина: быстрое выделение красителя в первые
несколько минут и последующий медленный его выход из ткани.
Причем количественно выход красителя в раствор превышает
выход в воду. Первоначальное быстрое поглощение веществ
осуществляется в клеточных стенках и является адсорбцией, а
быстрое выделение — десорбцией. Больший выход красителя в
раствор соли свидетельствует об обменном характере адсорбции. Та
часть объема корня, где происходят процессы обменной
адсорбции, получила название кажущегося свободного пространства
(КСП). Термин «кажущееся» означает, что объем этого
пространства зависит от объекта и природы растворенного вещества.
КСП включает межмолекулярные пространства в толще
клеточных стенок и на поверхности плазмалеммы и клеточных стенок
и занимает 5—10 % объема корня.
Высокая адсорбирующая способность обусловлена
отрицательно заряженными карбоксильными группами пектиновых
веществ (полигалактуроновых кислот), мозаично заряженными
белками и доннановским электропотенциалом на границе
водной среды и катионообменника. Эти факторы уже на первом
этапе обеспечивают избирательность поглощения веществ,
несущих заряд, так как клеточные стенки более активно связывают
293
Почвенные
частицы
Зона
контакта
5нм
клеточная
стенка
Плазпа-
лемпа
Цитоплазма
ЬрН
Щ'-*-
ЮООнн
В ни
Рис. 88. Поглощение веществ клетками ризодермиса корня
катионы, чем анионы. Из-за высокой плотности отрицательных
фиксированных зарядов в клеточной стенке происходит
первичное концентрирование катионов в пространстве,
непосредственно прилегающем к плазмалемме.
В почве корень контактирует с водной фазой (почвенным
раствором) и с частицами почвы, которые также
преимущественно являются катионообменниками (почвенный поглощающий
комплекс).
Катионы и анионы поступают в клеточные стенки ризодермы
как непосредственно из почвенного раствора, так и благодаря
контактному обмену с частицами почвенного поглощающего
комплекса. Оба эти процесса связаны с обменом катионов Н на
катионы окружающей среды и НСО^ или анионов органических
кислот на анионы минеральных веществ (рис. 88).
Способность к обменной адсорбции определяется обменной
емкостью корня. Она зависит от химического состава корневых
выделений и клеточных стенок и поддерживается транспортом
веществ через цитоплазматическую мембрану и дальнейшим их
перемещением внутрь корня.
294
Проблема мембранного транспорта подробно рассмотрена в
главе 1. Отметим лишь, что ионы и различные соединения могут
преодолевать мембрану по электрохимическому градиенту за счет
простой диффузии путем растворения в липидной фракции
мембраны или через гидрофильные поры (ионные каналы), а также
за счет облегченной диффузии гидрофильных веществ с
помощью липофильных переносчиков.
Возможно также поступление ионов против
электрохимического градиента с затратой метаболической энергии при участии
активных переносчиков (насосов).
Особую роль в плазмалемме растительных клеток играет Н+-
насос (протонная помпа), создающий электрический (д\|/) и
химический (дрН) градиенты ионов Н+. Электрический потенциал
ионов Н+ (мембранный потенциал) может быть использован на
транспорт катионов по электрическому градиенту против
концентрационного. В свою очередь, дрН служит энергетической
основой для переноса через мембрану анионов в симпорте с
ионами Н , возвращающимися через мембрану по
концентрационному градиенту.
Аналогично Н+ могут функционировать и НСО^ или ОН~,
избыток которых появляется в примембранном слое цитоплазмы
при интенсивной работе Н+-насоса. Транспорт этих ионов и
анионов органических кислот наружу по электрохимическому
градиенту может протекать в антипорте с поступлением в клетку
анионов минеральных веществ.
Именно мембранное строение клеток обеспечивает
избирательность поглощения веществ растением. Поддержание
структуры мембран, их обновление и функционирование активных
механизмов транспорта ионов являются энергозависимыми
процессами. Поэтому существует тесная связь поглотительной
деятельности корня с дыханием.
При действии дыхательных ядов и низких температур (см.
рис. 87) происходит только первая фаза поглощения веществ —
их проникновение в кажущееся свободное пространство,
дальнейшее поступление веществ в протоплазму не наблюдается из-
за ограниченности энергетических ресурсов клетки.
Наиболее активно поглощают вещества клетки зоны
растяжения и корневых волосков. Корневые волоски не только
позволяют корню осваивать значительно больший объем почвы, но и
обладают более высокой поглотительной активностью. В опытах
О. О. Лялина и И. С. Ахмедова (1978) установлено, что
молодые, только начинающие рост корневые волоски имеют на
порядок большую проницаемость для ионов, чем расположенные
рядом с ними безволосковые клетки. По мере старения
корневого волоска и затухания его роста число ионных каналов на
единицу клеточной поверхности снижается быстрее, чем возрас-
295
тает сама поверхность. Корневой волосок интенсивно поглощает
ионы, пока он растет. Наличие большого количества точек роста
в корневой системе обеспечивает ее высокую поглотительную
активность.
5.3. ИОННЫЙ ТРАНСПОРТ В РАСТЕНИИ
В зависимости от уровня организации процесса различают три
типа транспорта веществ в растении: внутриклеточный, ближний
(внутри органа) и дальний (между органами).
Внутриклеточный транспорт. Передвижение веществ внутри
одной клетки осуществляется в результате совместного действия
циклозиса (круговое движение цитоплазмы) и направленной
поперек этого движения диффузии, чем может достигаться почти
полное перемешивание веществ в гиалоплазме. У высших
растений Движение цитоплазмы происходит при участии
сократительных белков актомиозинового типа. Скорость движения
цитоплазмы 0,2—0,6 мм/мин. Во внутриклеточном транспорте
веществ принимают участие также каналы эндоплазматического
ретикулума и везикулы Гольджи.
Ближний транспорт. Это передвижение ионов, метаболитов и
воды между клетками и тканями внутри органа. Ближний
транспорт включает радиальный транспорт веществ в корнях и
стеблях, передвижение веществ в мезофилле листьев на небольшие
расстояния, измеряемые миллиметрами. Осуществляется он
через клетки неспециализированных для транспорта веществ
тканей по апопласту — совокупности межклетников и
межфибриллярных полостей клеточных стенок, симпласщу —
совокупности протопластов клеток, соединенных плазмодесмами и ва-
куому — дискретной системе вакуолей клеток.
Дальний транспорт. Это передвижение веществ между
органами растения. Осуществляется по специализированной
проводящей системе, включающей сосуды и трахеиды ксилемы
(восходящий ток) и ситовидные трубки флоэмы (нисходящий ток).
5.3.1. РАДИАЛЬНОЕ ПЕРЕМЕЩЕНИЕ ИОНОВ В КОРНЕ
Путем обменных процессов и диффузии ионы поступают в
клеточные стенки ризодермиса, а затем через коровую
паренхиму направляются к проводящим пучкам (рис. 89). Вплоть до
внутреннего слоя коры эндодермы возможно перемещение
ионов по апопласту за счет диффузии и обменной адсорбции.
Транспирационный ток воды ускоряет этот процесс.
Поглощение ионов клетками коры может происходить на всем пути их
движения по апопласту, что увеличивает фактическую
поверхность соприкосновения корня с внешним раствором.
Однако в обычных условиях существования, при сравнитель-
296
Кора
Каналы
дальнего
транспорта
Реактор
Корневой волосок
Рис. 89. Обобщенная схема функций корневых тканей в радиальном транспорте
веществ (Д. Б. Вахмистров, 1985):
/ — центростремительные потоки ионов и продуктов их первичной ассимиляции; 2 —
центробежные потоки органических субстратов из флоэмы. (Толщиной стрелок условно показана
относительная интенсивность потоков.)
но низких концентрациях ионов в наружной среде, их первичное
поглощение осуществляется главным образом ризодермисом.
Основным местом входа ионов в симпласт являются корневые
волоски. Одним из косвенных доказательств этого служит высокая
насыщенность плазмодесмами базальной стенки трихобласта на
его границе с корой. Ризодермис с корневыми волосками
функционирует как нагнетательный насос. Именно здесь происходит
загрузка ионами корневого симпласта, а далее вплоть до сосудов
они проходят весь путь по плазмодесмам внутри симпластичес-
кой фазы без преодоления мембранных барьеров.
Симпластический транспорт веществ сопровождается их мета-
болизацией, т. е. включением в процессы обмена веществ.
Поэтому кору называют метаболическим реактором корня. Здесь
минеральные формы азота, фосфора и серы включаются в
органические соединения и к сосудам уже направляются продукты их
первичной ассимиляции. Кора выполняет также функцию
транспортного буфера, регулирующего ионный поток по радиусу
297
корня. При высоком уровне питания (рис. 90) избыток ионов
изымается из симпластического потока путем сбрасывания их в
вакуоли и к сосудам подается необходимое количество
питательных веществ.
При дефицитном питании ионные потоки на тонопласте
смещаются в сторону симпласта и недостаток ионов смягчается
запасами вакуоли. При отсутствии ионов в среде, например, при
помещении корней в воду в условиях эксперимента наблюдается
«тканевый плач» с достаточно высокой концентрацией ионов в
пасоке в основном за счет содержимого вакуолей коры, которые
составляют до 80 % общего вакуолярного объема корня.
Буферная роль корня наглядно проявляется в существенном
изменении содержания азота, фосфора, калия и других
питательных элементов в корне и относительном постоянстве их
содержания в побеге при изменении условий питания. Так, при
изменении обеспеченности фосфором в 4 раза (выращивание на VI и
двух дозах питательной смеси) его содержание в корнях
увеличивалось в 3 раза, а в листьях практически не изменялось
(табл. 21).
21. Влияние уровня питания на содержание фосфора в листьях и корнях
томата (Д. В. Вахмистров, 1966)
Доза питательного
раствора (№К)
0,5
1
2
Содержание Р (%
в листьях
0,13
0,13
0,13
на сухое вещество)
в корнях
0,12
0,19
0,36
Р в листьях
Р в корнях
1,08
0,68
0,36
Это надо иметь в виду при листовой диагностике. Более
объективную информацию по обеспеченности
сельскохозяйственных культур элементами минерального питания дает не
содержание элементов в листьях, а соотношение их содержания в
листьях и корнях, называемое коэффициентом распределения.
Особое значение в радиальном транспорте ионов имеет
Избыток
Норма
недостаток
Отсутствие в среде
1!
Рис. 90. Взаимосвязь между симпластическим потоком ионов к сосудам ксилемы
{горизонтальные стрелки) и ионным обменом между симпластом и вакуумом
{вертикальные стрелки) при разных уровнях питания. (Толщина стрелок условно
соответствует интенсивности ионных потоков.)
298
самый внутренний слой клеток коры — эндодерма. Пояски Кас-
пари прерывают апопластический транспорт веществ между
корой и центральным цилиндром. Весь поток переходит на
симпластический путь, чем обеспечивается метаболический
контроль поступления веществ. Кроме того, эндодерма
препятствует утечке ксилемного сока из центрального цилиндра.
Следующая ткань — перицикл работает как кольцевой коллектор,
направляя вещества кратчайшим путем из системы симпласта
к сосудам ксилемы.
Механизмы преодоления первой мембраны симпласта и его
последней мембраны различны. Если загрузка симпласта в ризо-
дермисе происходит активно с участием Н -помпы, то его
разгрузка (около сосудов) происходит, вероятно, пассивно. Имеются
экспериментальные данные, позволяющие считать, что
функционирование Н+-помпы в мембранах околососудистых клеток
обеспечивает не выделение К+ в сосуды, а, наоборот, его
обратное поглощение из сосудов клетками паренхимы центрального
цилиндра, что обусловливает рециркуляцию ионов и
стабилизацию ионного состава ксилемного сока.
5.3.2. ВОСХОДЯЩИЙ ТРАНСПОРТ ИОНОВ В РАСТЕНИИ
Восходящий ток ионов осуществляется преимущественно по
сосудам ксилемы, которые лишены живого содержимого и
являются составной частью апопласта растения. Механизм
ксилемного транспорта — массовый ток растворенных веществ вместе с
водой, движимый транспирацией и корневым давлением. Но и
на этом этапе транспорта веществ, так же как и в корне,
осуществляется его активная регуляция.
Применение радиоактивных изотопов фосфора и калия
позволило обнаружить, что, хотя они и движутся вместе с
восходящим транспирационным током, тем не менее в большем
количестве они поступают не в более энергично транспирирующие, а в
растущие части растения — в точки роста, только
развертывающиеся листочки, в формирующиеся плоды. Движение ионов по
сосудам ксилемы происходит при их непрерывном
взаимодействии со стенками самих сосудов. В клеточных стенках ксилемы
имеются многочисленные участки с фиксированными
отрицательными зарядами, способные избирательно связывать катионы
и таким образом тормозить их транспорт по ксилеме.
Ионный поток в ксилеме активно регулируется также
прилегающими живыми клетками. Если какого-то элемента в ксилем-
ном соке слишком много, он извлекается из сосудов. Они же
могут служить и источником недостающих элементов питания,
передавая их по мере необходимости в ксилемный сок. Таким
образом, стебель представляет вторую после корня буферную
299
емкость, обеспечивающую равномерность поступления веществ
и ионный гомеостаз растительного организма. Благодаря этому в
растении при продвижении растущих корней через почвенные
слои, в разной мере обеспеченные питательными веществами,
нет перебоев в снабжении ими надземных органов.
Использование метода меченых атомов ( Р, 42К) позволило
выявить участие в восходящем токе веществ элементов коры.
Ее вклад варьирует в зависимости от обеспеченности растений
минеральными веществами и водой. Такое дублирование
повышает надежность транспортной системы. Пространственная
сближенность ксилемы с сосудами флоэмы структурно
обеспечивает интенсивный диффузионный обмен между ними уже в
стебле. Здесь значительная часть калия вовлекается в обратный
базинетальный транспорт, не достигая листьев. Такая
рециркуляция калия как осмотически активного вещества может
существенно повышать количество воды, транспортируемой по
ксилеме.
5.3.3. ПОГЛОЩЕНИЕ ИОНОВ КЛЕТКАМИ ЛИСТА
На долю проводящей системы приходится около !/4 объема
ткани листа. Суммарная длина разветвлений проводящих пучков
в 1 см листовой пластинки достигает 1 м. Такая насыщенность
тканей листа проводящей системой обеспечивает ее тесный
контакт с клетками мезофилла и разгрузку ксилемы в листе. Вода и
растворенные в ней вещества через поры сосудов ксилемы
попадают как в клеточные стенки (апопласт), так и в цитоплазму
клеток мезофилла. Но диффузия ионов по свободному
пространству листа затруднена из-за крайне сложной его формы. Поэтому
большая часть ионов поступает внутрь клеток мезофилла при
участии Н+-помпы.
Непрерывная доставка ионов в клетки мезофилла
обеспечивает растущий лист неорганическими солями и азотистыми
соединениями, необходимыми для новообразования веществ и
поддержания осмотического потенциала растительных тканей. В
зрелом листе, достигшем конечных размеров, поступление
веществ с транспирационным током превосходит потребности в
них и есть опасность значительного повышения осмотического
давления. В тканях листьев используются три способа
устранения избытка ионов: образование труднорастворимых осадков
солей (карбонатов кальция в клеточных стенках, оксалата
кальция в вакуолях, фосфата кальция в митохондриях); отток ионов
из листа через флоэму; накопление и выделение солей солевыми
желёзками и волосками.
Большинству сельскохозяйственных культур, произрастающих
на незаселенных почвах, свойственны два первых процесса.
300
5.3.4. ОТТОК ИОНОВ ИЗ ЛИСТЬЕВ
Почти все элементы, за исключением кальция и бора, могут
оттекать из листьев, достигших зрелости и начинающих стареть.
Среди катионов во флоэмных экссудатах доминирующее место
принадлежит калию, на долю которого может приходиться около
60 % суммы катионов. Из всех двухвалентных ионов в заметном
количестве перемещается по флоэме только магний; возможно,
что для этого он включается в состав комплексных соединений.
Железо, марганец, цинк и молибден также перемещаются по
флоэме, но их концентрация не превышает средний уровень
содержания в других клетках.
Среди анионов в ситовидных элементах флоэмы преобладает
фосфат. Часть фосфора находится в виде неорганического
фосфата, другая связана в органических соединениях (гексозофосфа-
тах, нуклеотидах, нуклеиновых кислотах). Из других анионов в
ситовидных элементах всегда обнаруживается С1 , концентрация
которого во многом зависит от общего уровня хлоридов в почве
и в самом растении. Нитраты и сульфаты при определенных
условиях (высокая обеспеченность источниками питания,
замедление фотовосстановительных реакций) также транспортируются
с нисходящим током. Однако более типичным является отток из
листа азота и серы в составе органических соединений.
В ситовидные элементы флоэмы ионы могут поступать как
путем транспорта их из клеток мезофилла, так и не выходя за
пределы листовой жилки, при
участии переходных
(передаточных) клеток, в стенках
которых образуются
многочисленные выросты цитоплазмы
(рис. 91). Такие лабиринты,
значительно увеличивающие
контактную поверхность,
могут быть поляризованы.
Например, у переходных клеток
ксилемы (тип А) выросты
цитоплазмы есть лишь в стенке,
примыкающей к сосуду, что
облегчает перенос ионов из
ксилемного сока в симпласт
ксилемной паренхимы. В
переходных клетках,
расположенных в жилке между
сосудами ксилемы и флоэмы (тип
В), выросты имеются на
границе с обеими
транспортными системами, что обеспечи-
Ксилепная
переходная клетка
А-тип
(выросты на
всех стенках)
В-тип
[выросты только
на
стенках,примыкающих к срлоэме)
Рис. 91. Переходные клетки и главные
направления переноса веществ
(Д. Кларксон, 1978)
301
вает эффективный обмен ионами между ними. Нисходящий ток
минеральных веществ по флоэме менее значителен по своим
масштабам, чем восходящий транспорт по ксилеме. В
совокупности они обеспечивают круговорот, способствующий
перераспределению элементов в растении.
5.3.5. ПЕРЕРАСПРЕДЕЛЕНИЕ И РЕУТИЛИЗАЦИЯ ВЕЩЕСТВ
В РАСТЕНИИ
Направление движения минеральных веществ в растении во
многом определяется интенсивностью их использования и
потребностями того или иного органа. Растения характеризуются
большой экономичностью в потреблении питательных веществ.
Это выражается в их способности к реутилизации, т. е.
повторному использованию основных элементов минерального
питания.
Широкие возможности для изучения перераспределения
ионов в растении открыло использование радиоактивных
индикаторов — меченых атомов. В 50—60-е годы в ряде зарубежных
исследований установлено, что 32Р перемещается из зрелых в
молодые листья, которые дифференцировались уже после того,
как поступление 32Р в корни прекращалось. Такая же картина
наблюдалась у растений, получавших 35§С>4~, хотя отношение
оттока к притоку в зрелые листья было меньше, вероятно, из-за
медленного обновления серосодержащих белков. В опытах с
ячменем установлено, что в растущий третий лист примерно 40 %
калия поступает из первого листа.
Дальнейшие исследования показали, что повторному
использованию подвергается большинство элементов минерального
питания. Наиболее подвижен калий, он может проделывать
ежедневно несколько круговоротов через ксилему и флоэму. Это
объясняется его свободным состоянием и важной ролью потока
калия в регуляции транспортных процессов и биоэлектрических
явлений. Хорошо реутилизируются азот и фосфор, которые
входят в состав жизненно важных лабильных соединений. По мере
старения листьев процессы распада превышают синтез,
освобождающиеся азот и фосфор направляются к более молодым частям
растения. Однако есть элементы, которые практически не
реутилизируются. К ним относятся кальций, бор, очень слабо реути-
лизируется железо. Это связано с малой лабильностью и плохой
растворимостью соединений, в которые входят эти элементы.
Магний и сера по степени реутилизации занимают
промежуточное положение.
Возможность повторного использования отдельных
элементов оказывает влияние на их распределение в растении. Для
элементов, подвергающихся реутилизации, характерен базипе-
302
талъный градиент распределения, т. е. чем выше расположен
лист, чем он моложе, тем больше в нем азота, фосфора и
калия. Это особенно проявляется при недостатке данного
элемента в почве. Для элементов, не подвергающихся повторному
использованию (кальций, железо, бор), характерен акропеталь-
ный градиент. Чем старше орган, тем больше содержание в
нем указанных элементов.
Благодаря реутилизации веществ растущие части растения на
более поздних фазах роста получают значительную часть
необходимых им элементов. Зерновые культуры наиболее активно
поглощают азот, фосфор и калий в первые 1,5 мес роста. К
моменту, когда зерно достигает примерно 25 % своей окончательной
величины, поглощение этих элементов уже на 90 %
заканчивается. Дальнейший налив зерна идет за счет мобилизации веществ
листьев и стеблей. У многолетних культур перед осенним
листопадом большие количества ионов оттекают из листьев в корни,
стволы и органы запаса.
5.4. РЕГУЛИРОВАНИЕ РАСТЕНИЕМ СКОРОСТИ
ПОГЛОЩЕНИЯ ИОНОВ
Поглощение ионов корнями растений тесно взаимодействует
с другими функциями растительного организма. Как правило,
ускорение темпов роста увеличивает использование питательных
веществ и тем самым усиливает их поступление. Кроме того,
быстрый рост корневой системы оказывает прямое влияние на
поглощение благодаря освоению новых объемов почвы.
Прочно установленным фактом является зависимость
поглотительной деятельности от дыхания корня. Источником
дыхательных субстратов служат продукты фотосинтеза, поступающие
из надземных органов. Хотя нет прямой зависимости между
поступлением ионов и воды, эти процессы также взаимосвязаны.
Согласованность различных физиологических процессов,
протекающих в растительном организме, обеспечивается строгой
регуляцией каждого из них в конкретных условиях.
5.4.1. ПОГЛОЩЕНИЕ ИОНОВ ИЗ РАЗБАВЛЕННЫХ
И ВЫСОКОКОНЦЕНТРИРОВАННЫХ РАСТВОРОВ
Обычно корни растений соприкасаются с раствором,
имеющим низкую концентрацию солей. Поэтому поступление ионов
идет против концентрационного градиента по каналам катион-
ной и анионной проводимости при активном участии протонной
помпы. Все многообразие мембранных транспортных
механизмов непосредственно и косвенно связано с энергетическим
обменом и метаболизмом клетки. Поэтому кинетика, описываю-
303
щая скорости метаболизма и ферментативных реакций, прило-
жима и к транспорту ионов. Действительно, график зависимости
скорости поступления иона от его концентрации в среде
выражается кривой с насыщением. Максимальная скорость
достигается при полном насыщении мест сорбции транспортной
системы. Следовательно, возможно для транспортных процессов
определить константу Михаэлиса Км как такую концентрацию иона,
при которой он транспортируется в корень со скоростью, равной
половине максимальной Ктах. Низкая величина Км означает
высокое сродство между ионом и транспортной системой,
следовательно, высокую избирательность.
В большинстве случаев потоки ионов из разбавленных
растворов достигают насыщения в диапазоне концентраций от 0,2 до
0,5 мМ (рис. 92). В результате многих исследований удалось
определить величины Км и Утах для различных растительных
тканей и для большинства ионов, поглощаемых растениями.
Установлено, что величина Км в различных экспериментальных
системах остается для данного иона постоянной. Например,
значения Км близки для поглощения К+ корнями ячменя и
листьями кукурузы.
Тип поглощения, при котором Кы остается постоянной,
получил название поглощения системой I. Для системы I характерно
высокое сродство с транспортируемыми ионами. Конкуренция
возможна лишь со стороны очень близких по своим размерам и
свойствам ионов. Парами таких ионов-аналогов являются К+ и
КЬ+, Са2+ и Зг2"1", СГ и Вг~, 8О4"" и 8еО4~. В отношении других
ионов в том диапазоне концентраций, в котором функционирует
система I, проявляется отчетливая дискриминация. Так, в корнях
ячменя на поглощение СГ~ никак не влияет присутствие других
галоген-анионов, Р~ и I", хотя Вг~ конкурентно подавляет это
поглощение. Аналогичным образом поглощение К в ткани
листа кукурузы подавляется ионом РЬ+ и остается
нечувствительным к ионам №+, 1л+, С8+ и 1ЧН4. Между 2п2+ и Си2+
обнаруживается довольно значительная конкуренция: поглоще-
Рис. 92. Поглощение ионов из
растворов с широким диапазоном
концентраций (Е. ЕркСеш, 1973). (Обратите
внимание на изменение масштаба в точке,
соответствующей 0,5 мМ, чтобы не
создавалось впечатление, что при
концентрациях >0,5 мМ внезапно
вступает второй механизм с гораздо более
быстрым поглощением ионов, чем
первый.)
Кщ 0,1 0,2"Ц5 Ю 25 50
Концентрация калия,нМ
304
ние 2п2+ в присутствии эквимолярного раствора Си
сокращается на 20 %. Мп2+ не оказывает влияния на поглощение 2п2+ и
Си2+.
Если значительно повысить концентрацию (см. рис. 92), то
поток ионов будет продолжать довольно медленно
увеличиваться и в конечном счете достигнет величины, во много раз
превышающей Ртах системы I. При концентрациях более
50 мМ опять будет достигнуто насыщение. Этот второй
процесс носит название поглощение системой II. Транспорт ионов
в диапазоне концентраций, в котором действует система II, не
обнаруживает сильной зависимости от метаболизма и
представляет преимущественно пассивный процесс. Результаты многих
опытов позволяют полагать, что при высоких концентрациях
электролитов изменяются физические свойства мембран —
падает электрическое сопротивление, возрастает ионная
проводимость и уменьшается избирательность. Экспериментально
установлено, что у подсолнечника Км для калия при слабом
засолении составляла 0,023, а при сильном —0,17 мМ (С1а$е,
1980). В первом диапазоне концентраций Ыа+ не мешает
поглощению К+, при высоких концентрациях присутствие натрия
снижает поглощение калия.
Детальное изучение кинетики поглощения корнями кукурузы
калия в широком диапазоне концентраций (КоспНап а. 1ддса8,
1982) показало сходство с характеристиками потоков в
трансмембранных калиевых каналах животных мембран. Вероятно, как
при низкой, так и при высокой концентрации ионов в растворе
функционирует единая транспортная система ионоселективных
каналов, количество которых и свойства меняются в
соответствии с условиями.
5.4.2. ВЗАИМОСВЯЗЬ МЕЖДУ ПОТОКАМИ ИОНОВ И ВОДЫ В КОРНЕ
Поступления ионов и воды в корни растений являются
самостоятельными процессами, взаимосвязь между которыми в
зависимости от условий может быть или ничтожно мала, или
достаточно существенна.
Установлено, что в водных культурах растворы питательных
солей никогда не поступают в корни в неизменной
концентрации. Из разбавленных растворов энергичнее поступают соли,
из концентрированных — вода. Убедительным доказательством
независимости поступления ионов и воды является то, что
разные соли и даже катионы и анионы одной и той же соли
поступают в растение с различной скоростью. Так, у сульфата
аммония (N114)2304 более интенсивно поглощается катион
ТЯЩ, менее интенсивно — анион 8О4 , в результате чего
происходит подкисление среды. Поэтому такая соль называется
305
физиологически кислой. №N03 является физиологически щелочной
солью, из нее растением интенсивнее используется нитрат.
Физиологически нейтральной солью может быть нитрат аммония
ТЧЬМЧОз, у которого с одинаковой интенсивностью
поглощаются катионы и анионы.
Определение электропроводности транспирационного тока
воды, поднимающегося по сосудам древесины, показало, что
концентрация солей больше ночью, когда транспирация
ослаблена и воды в растение поступает меньше. Обычно наблюдается
также повышение концентрации пасоки при снижении скорости
плача. Все это свидетельствует об отсутствии прямой связи
транспорта ионов с током воды в растении.
Тем не менее поглощение ионов корнями может косвенно
ускоряться усилением транспирации за счет более быстрого
освобождения клеток корня от растворенных солей восходящим
током воды. Причем эффект зависит от концентрации солей в
среде. У низкосолевых растений (концентрация солей в среде
менее 1 мМ) высокая избирательность мембран, поток ионов
через плазмалемму определяются в основном деятельностью
энергозависимых ионных насосов. Разбавление цитоплазмати-
ческой фазы током воды слабо сказывается на транспорте ионов
через плазмалемму.
У высокосолевых растений (концентрация среды более
10 мМ) более высокие проницаемость плазмалеммы и доля не
зависящего от метаболизма диффузионного потока ионов.
Поэтому разбавление цитоплазматической фазы усиленным током
воды способствует поступлению ионов. Таким образом, при
высокой концентрации корнеобитаемой среды транспирационный
ток может играть решающую роль в поглощении ионов.
5.4.3. ПОГЛОЩЕНИЕ ИОНОВ И ПОТРЕБНОСТИ В НИХ РАСТЕНИЯ
Многочисленные наблюдения над минеральным питанием
целых растений позволяют сделать вывод, что в условиях, когда
доставка ионов растению не лимитирована^ скорость их
поглощения строго регулируется потребностями растения.
Показательны в этом отношении данные М. Дру и П. Ная (1969),
полученные в опытах с проростками итальянского райграса (рис. 93).
Когда единственным источником калия для растения была зона
шириной 1 см, скорость поглощения у корня в этой зоне
оказалась в 8 раз выше, чем когда вся корневая система могла
поглощать калий. Это свидетельствует о больших возможностях
регулирования активности транспортной системы в растении.
Подобное заключение можно сделать также и на основании опыта,
в котором у райграса непрерывно удаляли все придаточные
корни (К. Вгошгег, А. Юешепёогег, 1965). Побеги были при этом
306
\вариант1 Варисшт2
Пе$ок-\
I
I
мельче, но растения выглядели
вполне здоровыми и росли
довольно хорошо, несмотря на то
что отношение массы побегов к
массе корня было очень
большим. Поглощение элементов
минерального питания на 1 г
оставшихся на растении корней
в 5 раз превышало поглощение
у контрольных растений;
концентрация же ионов в побегах
была в контроле и в опыте
приблизительно одинаковой.
Поражает способность
растений извлекать в необходимых
количествах элементы из
растворов, сильно различающихся
по концентрации. При 5000-
кратной разнице концентрации
калия в растворе сухая масса
11-недельных растений ячменя
различалась всего лишь в 1,7
раза, а содержание калия в
побегах — в 1,5 раза (О. ХЩНагпз,
1961). По данным Ц. Эшера и
Дж. Лонерагана (1967), многие
виды растений обладают
способностью расти и
поддерживать надлежащую внутреннюю
концентрацию фосфора в очень разбавленных растворах, если
состав раствора относительно постоянный.
По-видимому, при низких концентрациях фосфора корни
можно заставить работать интенсивнее, чтобы обеспечить
поступление того же количества фосфата в побег. Естественно, на
транспорт того же количества фосфата из разбавленного
раствора требуется затратить больше энергии, чем из
концентрированного.
Даже когда рост растения лимитируется недостатком какого-
либо элемента, содержание этого элемента в тканях растения
может оставаться постоянным. Такие результаты обычно
получают в опытах с нитратом, который оказывает очень сильное
влияние на рост, в особенности у хлебных и кормовых, злаков.
Д. Кларксон (1978), работая с проростками ячменя и диапазоном
концентрации нитрата в среде от 0,1 до 10,0 мМ, заметил, что
рост ячменя заметно ухудшался при концентрации нитрата ниже
1 мМ, но общее содержание азота в побегах оставалось
относительно постоянным.
307
Время, дни
Рис. 93. Поглощение калия
определенным участком корня ЬоШшп тиШ-
Яогит в условиях, когда остальные
части корня находятся либо в не
содержащем калия песке (/), либо в
почве (//) (М. Бгв^ а. Р. ^е, 1969)
Таким образом, свойства самой транспортной системы
растении—не единственный фактор, определяющий скорость
поглощения ионов корнями. Эти свойства могут существенно
меняться в зависимости от потребности растений в элементах
минерального питания.
5.4.4. РИТМИЧНОСТЬ В ПОГЛОЩЕНИИ ИОНОВ КОРНЯМИ РАСТЕНИЙ
Поглощение ионов, как и другие функции растительного
организма, имеет неравномерный характер. В зависимости от
периодичности наблюдения можно регистрировать ритмы с разными
периодом и амплитудой. Углубленное изучение ритмичности
поглотительной деятельности корня началось в 50-е годы, когда
появилась возможность работать в лабораториях искусственного
климата со строго контролируемыми условиями среды и
использовать достаточно точные, в том числе и радиоизотопные,
методы регистрации поглощения веществ из раствора.
Установлено, что у растений независимо от внешних условий
наблюдаются определенные суточные ритмы процессов
поглощения веществ корнями (рис. 94). В дневные часы поглощение
веществ идет интенсивнее, чем ночью, что соответствует
временному ходу других
физиологических процессов, в частности
притоку к корням ассимиля-
тов и метаболизации
поступивших веществ.
При непрерывной или
достаточно частой регистрации
наблюдается также
ритмичность с периодом в несколько
часов, при которой
максимальное поглощение
закономерно сменяется периодами-
слабого поглощения или
выделения веществ в раствор
(рис. 95). Интересный факт
получен при одновременном
определении поглощения
калия и кальция. Как
правило, во время максимального
поглощение калия растение
выделяет кальций и,
наоборот, максимальному
поглощению кальция соответствует
выделение калия (рис. 96).
160
100
60
40
20
О
12 18 24 6 12 18
Вреня суток, ч
6 12
Рис. 94. Суточный ритм поглощения К,
Са и нитратов фасолью в фазе двух
тройчатых листьев (Е. Е. Крастина,
1965). Данные приведены в
относительных величинах. За 100 % принято
поглощение за первый опытный период.
Световой режим 12: 12. (Освещение
растений с б до 18 ч.)
308
Одновременное определение
поглощения фосфатов и суль-
I
1
й
Л
/
/
/
/
\
\
\
\1
\
1
к
/1
\\
I \\
1 \\
Л 1
/
1
■
237
\
I
\
1
\
\
\
1
1
1
1
Г"
1
\
\
в
\
V
V
\
~12\ 13\М 1511В 17А 19\2021 \22 25124 Л 2 3\ 4- 5 6 \
3-
пг
_1
1
/
У
1/
У\
\
у
1
V
1
и
N
1
\
\
\
|
I
\/1
V
7
/Времясуток.ч
1В
12
10
8
6
2
О
2
6
8
Ю
12
/«
16
Рис. 95. Ритм поглощения нитратов томатом в фазе 13 листьев (И. И. Гунар,
Е. Е. Крастина, А. Е. Петров-Спиридонов, 1959). Световой режим 12 : 12
28
24
20
§ 1В
Г
$ 8
! °
-8
-12
-1е.
I
15 16 17 Г8 19 20 21 22 23 24 1 г 3 458
Время суток, ч
7 89 ЮН
Рис. 96. Ритм поглощения калия и кальция томатом в фазе 13 листьев
(И. И. Гунар, Е. Е. Крастина, А. Е. Петров-Спиридонов, 1959)
фатов показало, что их поглощение идет независимо друг от
Друга.
Реципрокное (обратное) поглощение калия и кальция не
является случайным. В отличие от нитратов, фосфатов и
сульфатов, которые при ассимиляции включаются в органические
соединения, калий и кальций выполняют в основном роль
регуляторов функционального состояния растений. Именно эта пара
ионов обеспечивает электрофизиологические процессы и
реакции растительных клеток на внешние воздействия. При
температурных и химических раздражениях корней растений
наблюдается сильное выделение калия с одновременным поглощением
кальция растениями. Размеры поглощения кальция и выделения
калия в таких случаях значительно превосходят те, которые
наблюдаются у растений, не подвергающихся дополнительным
раздражениям. Этот процесс обратим, т. е. через определенное
время происходят обратное поглощение калия и выделение
кальция растением. Первая фаза приурочена, очевидно, к
возбуждению, а вторая — к состоянию торможения. Чередующееся
поглощение и выделение ионов корнями растений нужно
рассматривать как последовательную смену периодов возбуждения и
торможения в деятельности корней при постоянном
раздражителе — питательном растворе.
Таким образом, ритмичность поглотительной деятельности
корня, с одной стороны, обеспечивает временную координацию
и саморегуляцию взаимосвязанных функций растительного
организма, а с другой — лежит в основе раздражимости и
приспособления к изменениям в окружающей среде.
5.5. АЗОТНОЕ ПИТАНИЕ РАСТЕНИЙ
Растения для своего развития нуждаются в значительных
количествах азота. Так, зерновые культуры при среднем урожае
зерна 4 т/га выносят с 1 га около 100 кг азота.
Формы азота в окружающей растение среде чрезвычайно
разнообразны: в атмосфере — молекулярный азот и пары аммиака,
в почве — неорганические (нитраты, нитриты, аммоний, аммиак)
и органические (аминокислоты, амиды, полипептиды и др.)
соединения азота. Такое разнообразие форм, естественно, ставит
вопрос об источниках азотного питания растений и путях
дальнейшего превращения азота растительным организмом.
Установлено, что высшие растения не способны усваивать
молекулярный азот атмосферы. Это монополия азотфиксирую-
щих микроорганизмов (симбиотических и свободноживущих).
Общая мировая биологическая фиксация азота составляет около
17,2 -10 тв год, что в 4 раза превышает химическое связывание
N2 в форме 1ЧНз на предприятиях химической промышленности.
310
Электронно-транспортная цель
.ё
I Лаоелобин
Мембрана
бактероида
Рис. 97. Схема фиксации N2 в бактероиде клубеньков бобовых (В. В. Полевой,
1989)
Свободноживущие азотфиксаторы окультуренных
сельскохозяйственных почв включают бактерии родов Аго1оЬас1ег и Веуеппс-
1йа. На затопляемых рисовых полях эффективными азотфиксато-
рами являются цианобактерии. Свободноживущие
азотфиксаторы — гетеротрофы, нуждающиеся в углеводах, как правило,
поселяются на поверхности корней и используют корневые выделения.
В умеренном климате ежегодная фиксация азота свободноживу-
щими бактериями составляет несколько килограммов на 1 га.
Более значительный вклад в фикрацию атмосферного азота
вносят симбиотические азотфиксаторы, прежде всего бактерии рода
КЫгоЪшт, поселяющиеся на корнях бобовых растений. Их
продуктивность составляет 100—400 кг И/га. Инфицирование
растения-хозяина начинается с проникновения бактерий в клетки
коры, интенсивное деление которых приводит к образованию
клубеньков на корнях. При этом сами бактерии превращаются в
окруженные мембраной бактероиды с высокой нитрогеназной
активностью (рис. 97).
Фермент нитрогеназа состоит из двух компонентов: более
высокомолекулярного Мо-, Ре-белка и низкомолекулярного Ре-
белка. N2 связывается и восстанавливается до Т"Шз первым оли-
гомером, а Ре-белок поставляет для этого процесса электроны,
получаемые через ферридоксин от цикла Кребса. Цикл Кребса
обеспечивает также синтез АТФ, необходимый для поддержания
структуры нитрогеназного комплекса, и поставляет кетокислоты,
которые связывают аммиак с образованием аминокислот.
Синтезируемый растением-хозяином гемсодержащий белок легоглобин
встраивается в мембрану бактероида и осуществляет транспорт
311
кислорода, создавая защиту нитрогеназы от его разрушающего
действия.
Взаимоотношения между высшими растениями и
клубеньковыми бактериями характеризуют как симбиоз. Однако на первых
этапах инфицирования бактерии питаются целиком за счет
высшего растения, т. е. практически паразитируют на нем, поэтому
может наблюдаться торможение роста зараженных растений.
Развитые клубеньки начинают снабжать азотистыми веществами
растение-хозяин и получать от него фотоассимиляты. Согласно
расчетам, сделанным на основании модельных опытов, для
восстановления 1 моль N2 необходимо не менее 12—15 моль АТФ.
Реальные же затраты на процесс азотфиксации значительно
больше: на каждый грамм фиксированного азота окисляется 3—
6 г органического углерода.
В период вегетативного роста в клубеньки поступает 25—40 %
продуктов фотосинтеза, при этом около половины возвращается
в надземную часть растения в виде азотистых соединений. При
переходе растений к репродуктивной фазе развития поток фото-
ассимилятов в клубеньки постепенно снижается, что приводит к
затуханию их азотфиксирующей деятельности.
Тесная связь восстановления молекулярного азота в
клубеньках с фотосинтезом и перераспределением ассимилятов
обусловливает зависимость этого процесса от интенсивности и
продолжительности освещения, концентрации СО2 и водообеспеченности
растений. Повышенные дозы азотных удобрений подавляют
процесс азотфиксации.
Благодаря деятельности клубеньковых бактерий бобовые
растения не только обеспечиваются азотсодержащими
соединениями, но и значительно обогащают почву азотом за счет корневых
выделений и пожнивных остатков. Существуют и другие виды
высших растений, способные симбиотически усваивать азот. К
их числу относятся некоторые деревья и кустарники: ольха, лох,
облепиха и др.
Высшие растения могут поглощать растворимые
азотсодержащие органические соединения — аминокислоты, амиды,
короткие полипептиды, но в основном органический азот почвы
усваивается после его минерализации. В водной культуре
убедительно показано, что зеленое растение представляет собой в
высшей степени автотрофный организм, способный
синтезировать все, в том числе и азотсодержащие, органические
соединения. Основными усвояемыми формами азота для высших
растений являются ионы аммония и нитрата. Причем азот —
единственный из элементов минерального питания, который корни
растений могут поглощать в форме ионов обоих знаков заряда:
анион нитрата N0^ (заряд азота —5) и катион аммония
(заряд азота —3).
312
5 5.1. ОСОБЕННОСТИ НИТРАТНОГО И АММОНИЙНОГО ПИТАНИЯ
РАСТЕНИЙ
ч;,
* Наиболее полно вопрос об использовании растениями
нитратного и аммиачного азота разработан академиком Д. Н.
Прянишниковым (1955) и его сотрудниками. Ими была установлена
равноценность этих источников азота и изучены условия
эффективного использования его высшими растениями.
Одним из важнейших факторов, определяющих поглощение
растениями неорганических форм азота, является реакция
питательной среды. В слабокислой среде, при рН 5, лучше
поглощаются нитраты. Наоборот, в нейтральной среде, при рН 7,
преимущество имеет аммоний. Для усвоения аммония большое
значение имеет и наличие в среде достаточного количества ионов
кальция.
Физиологическая особенность процессов усвоения
заключается в том, что аммоний сразу после поглощения метаболизируется
в корнях, превращаясь в азот аминокислот и амидов.
Концентрация аммония в тканях и пасоке обычно очень низкая. Поэтому
аммонийная форма азота эффективна только при условии
высокой фотосинтетической активности или достаточного количества
запасных углеводов. При недостатке органических кислот
аммиак не успевает связываться и может быть токсичным для
растения.
Исследование большого количества сельскохозяйственных
культур позволило разделить их на группы по способности
ассимилировать аммиачный азот. Основой классификации служит
соотношение между углеводами и белками в семени (С:1Ч).
Наиболее успешно питание аммиачным азотом идет у растений, у
которых углеводы значительно преобладают над белками.
Примером могут служить злаки, у которых отношение С^ примерно
6:1. Находясь в темноте, проростки злаков легко усваивают
аммиак до тех пор, пока углеводные запасы семени не истощены.
Проростки люпина, имеющие соотношение С:1Ч, равное 0,6:1, не
способны ассимилировать аммиак в темноте. Таким образом,
различное отношение к аммонийному азоту определяется не
столько видовыми признаками растений, сколько уровнем
содержания в их тканях углеводов.
Судьба поглощенного растениями нитрата может быть
различной. Поступившие нитраты либо запасаются в вакуолях
клеток корня, либо подаются с пасокой в надземную систему.
Включаться в органические соединения они могут как в корнях,
так и в листьях. Причем метаболизация нитратов начинается с
их восстановления до аммония. Поэтому были основания
полагать, что аммонийное питание энергетически значительно более
выгодно, чем нитратное. Однако термодинамические расчеты
показали, что у райграса затраты энергии на транспорт из среды
313
в корень и усвоение нитрата только на 8 % выше, чем на
использование аммония. Аммоний к тому же должен усваиваться
сразу и требует активного притока в корни углеводов и
достаточной аэрации.
Наличие в среде одновременно обеих форм минерального
азота приводит к увеличению урожая хлебных злаков. Одной из
причин этого может быть экономия энергии за счет
эффективного распределения нагрузки между корнями и листьями при
усвоении аммония и нитратов.
На поглощение растениями нитратов и аммония существенно
влияет температура среды. Причем реакция самых разных
растений на температурные воздействия оказывается очень сходной:
при пониженной температуре относительно или даже абсолютно
больше поглощается аммония, чем нитрата, увеличивается
метаболическая нагрузка корней по ассимиляции азота. Наиболее
неустойчивым к низкой температуре этапом азотного обмена
является загрузка ксилемы азотистыми соединениями, особенно
нитратами. Замедление оттока приводит к снижению их поглощения.
Таким образом, предпочтительность использования
растениями разных форм минерального азота зависит от ряда условий
(рН и ионного состава среды, наличия достаточного пула
органических кислот, способных связывать аммиак, температуры и
др.). Все эти факторы необходимо учитывать при разработке
мероприятий по повышению эффективности применения
азотных удобрений.
5.5.2. АССИМИЛЯЦИЯ НИТРАТНОГО АЗОТА
Азот входит в состав органических соединений только в
восстановленной форме. Поэтому включение нитратов в обмен
веществ начинается с их восстановления, которое может
осуществляться и в корнях, и в листьях. Относительная доля участия
этих органов в первичной ассимиляции нитратов является
видовым признаком. В связи с этим выделяют три основные группы
растений (рис. 98):
1. Растения, практически полностью восстанавливающие
нитраты в корнях и транспортирующие азот к листьям в
органической форме. К этой группе относятся горох, люпин, черника,
многие древесные растения.
2. Растения, практически не проявляющие нитратредуктазной
активности в корнях и ассимилирующие подаваемые с пасокой
нитраты в листьях. Это бурачник, дурнишник, сахарная свекла,
хлопчатник.
3. Растения, способные восстанавливать нитраты как в корнях,
так и в листьях. Это наиболее многочисленная группа,
включающая хлебные злаки, кукурузу, фасоль, сорго, овощные культуры.
У них, как правило, восстановление нитратов активнее протекает
314
Рис. 98. Ассимиляция N03 и ее топография у растений с нитратвосстанавливаю-
щей активностью:
а — в корнях; б — в листьях; в — в корнях и листьях
в листьях, однако доля участия разных органов сильно варьирует
в зависимости от обеспеченности растений нитратами,
концентрации в среде и интенсивности поглощения ионов аммония и
калия, уровня освещенности, температуры и других факторов.
По современным представлениям, восстановление нитрата
осуществляется в два этапа.
Восстановление нитрата до нитрита, сопряженное с
переносом двух электронов и катализируемое ферментом нитратредук-
тазой (НР):
N0,
НР
2ё
N0, (в цитозоле).
Восстановление нитрита до аммиака путем переноса шести
электронов и катализируемое ферментом нитритредуктазой
(НиР):
,т_- НиР тт +
МО2 *" МН4 (в пластидах).
66
Нитратредуктаза представляет собой гем- и молибденсодержа-
щий флавопротеин, участвующий в переносе электрона от
НАД Н к N0^:
НАД
НАД-Н+Н -хх- ФАД
цит
-ФАДНт х ^ 2 гем Ре
2+ 6+
гем Ре -х у- 2Мо
нитратредуктаза
315
Восстановление нитратов до нитритов происходит в цитозоле
клеток корня и листа. Не исключается возможность локализации
нитратредуктазы на плазмалемме и на мембранах органелл,
граничащих с растворимой фазой клетки. Но эти ассоциации
фермента с мембранами удерживаются слабыми связями и легко
разрушаются при выделении органелл.
Вторая стадия восстановления минерального азота
осуществляется при участии фермента нитритредуктазы. Это
относительно низкомолекулярный белок, включающий около 600
аминокислотных остатков, который содержит железопорфириновую
простетическую группу и железо в виде кластера 4Ре48.
Осуществляемая нитритредуктазой реакция может быть представлена
следующим образом:
6ФДв
8Н
+ 6ё
NН4 + 6Фд0
+ 2Н2О
В листьях нитритредуктаза локализована в хлоропластах и в
качестве донора электронов использует восстановленный в
световой фазе фотосинтеза ферридоксин (Фд). В корнях N0^
восстанавливается в пропластидах с использованием НАДФН,
образующегося в пентозофосфатном пути дыхания.
Использование разных источников восстановителя приводит к
существенной разнице в энергозатратах на превращение N03" в
N4^ в надземных и подземных органах. Если привести затраты к
одному эквиваленту, то в листьях на восстановление 14 г азота
нитрата расходуется 15 г глюкозы, а в корнях — 60 г, т. е. в 4
раза больше. Но преимущества перед корнями в энергетических
расходах листья имеют только на свету.
5.5.3. АССИМИЛЯЦИЯ АММИАКА
Аммиак, образовавшийся при восстановлении нитратов или
молекулярного азота, а также поступивший в растение при
аммонийном питании, далее усваивается в результате
восстановительного аминирования кетокислот, поставляемых дыханием.
При аминировании а-кетоглутарата, катализируемого глутамат-
дегидрогеназой (ГДГ), образуется глутамат.
сн2атан2соон
сн2сосоон + КНз + над-н
СН2СООН Н20 НАД СН2СООН
ос-кетоглугарат
глутамат
Подобным способом происходит аминирование щавелевоук-
316
сусной кислоты (ЩУК) под действием аспартатдегидрогеназы,
которое ведет к синтезу аспартата.
ЩУК
Н2О
НАД
аспартат
В результате восстановительного аминирования пирувата при
участии аланиндегидрогеназы образуется аланин.
пируват
Н2О
аланин
НАД
Однако использование высокочувствительных методов
определения активности ферментов показало, что эти ферменты не
столь активны, чтобы внести существенный вклад в общий
процесс ассимиляции аммиака у растений. В начале 70-х годов был
открыт основной путь первичной ассимиляции аммония,
включающий две последовательные сопряженные реакции,
катализируемые ферментами глутаминсинтетазой (ГС) и глутаматсинтета-
зой (ГТС).
глутамат
АТФ
глутамат
глутамин
а-кетоглутарат
Механизм реакции включает перенос амидной группы глута-
мина на а-кетоглутарат в присутствии восстановителя, в
результате чего происходит образование двух молекул глутамата. Глута-
минсинтетаза (ГС) катализирует реакцию, в которой глутамат
функционирует как акцептор NНз для образования глутамина.
Для этой реакции требуется АТФ. Причем ГС обладает гораздо
большим сродством к ЙНз, чем глутаматдегидрогеназа (ГДГ). В
настоящее время ГС — ГТС-путь считается главным в
ассимиляции аммиака, образующегося в хлоропласте в результате
восстановления нитратов. ГДГ имеет преимущества в темноте и в
условиях аммонийного питания растений. Функционируют обе
системы как в листьях, так и в корнях.
Более простым способом связывания аммиака является
образование аммонийных солей органических кислот. У растений с
кислым клеточным соком (щавель, бегония, осоки, хвощи) со-
317
держание аммонийного азота в десятки раз превосходит
содержание амидного азота.
Аммиак в растениях обезвреживается и при образовании
мочевины. Исходным продуктом для синтеза мочевины служит
аминокислота орнитин, которая, присоединяя аммиак и
углекислоту, превращается в цитруллин. Цитруллин присоединяет еще
одну молекулу аммиака и образует аргинин. Аргинин под
действием фермента аргиназы с участием воды расщепляется на
орнитин и мочевину. Схематически синтез мочевины можно
представить так:
орнитин
аргинин
цитруллин
орнитин + мочевина
Мочевина неядовита для растений, хорошо усваивается,
использование ее азота для всевозможных синтетических
процессов происходит очень легко, так как в растительных тканях
имеется фермент уреаза, катализирующий расщепление
мочевины:
СО(1ЧШ)2 + Н2О -> СО2 + 21ЧНз.
Но надо иметь в виду, что орнитиновый цикл не всегда идет
до образования мочевины. В ряде случаев в растениях может
наблюдаться накопление большого количества аргинина.
Установлено, что аргинин, который содержит 32 % азота, т. е.
больше любой другой аминокислоты, наряду с амидами является
соединением, в виде которого связывается избыток аммиака,
поступающего в растение и не используемого для биосинтеза
белков.
5.5.4. ПРИЧИНЫ НАКОПЛЕНИЯ ИЗБЫТОЧНЫХ КОЛИЧЕСТВ НИТРАТОВ
В РАСТЕНИЯХ И ПУТИ ИХ СНИЖЕНИЯ В СЕЛЬСКОХОЗЯЙСТВЕННОЙ
ПРОДУКЦИИ
Темпы поглощения нитратного азота часто могут превышать
скорость его метаболизации. Связано это с тем, что
многовековая эволюция растений шла в условиях недостатка азота и
вырабатывались системы не ограничения поступления, а накопления
азота.
Ключевым ферментом, определяющим ассимиляцию нитра-
318
тов, является нитратредуктаза, активность которой в 5—20 раз
ниже, чем нитритредуктазы. Поэтому нитриты, образующиеся на
первом этапе редукции нитратов, не накапливаются, а быстро
восстанавливаются до аммиака. Степень ассимиляции
аммонийной формы зависит от многих внутренних и внешних факторов,
благоприятного сочетания которых в естественных условиях, как
правило, не бывает. Для растений реально существует опасность
аммиачного отравления, приводящего к хлорозу листьев, подвя-
данию, замедленному росту и последующей гибели. При
усилении нитратного питания активность нитратредуктазы растет до
определенного предела и часть нитратов остается
невосстановленной. Это предохраняет растительные ткани от накопления
токсичных промежуточных продуктов ассимиляции.
Образование нитратов может быть связано также с
окислением избыточного количества аммония в растении, что не только
предотвращает нарушение обмена веществ, но и позволяет
сохранить азот в минеральной форме для дальнейшего
использования в процессах ассимиляции.
Нитраты в клетке распределены в двух фондах: цитоплазмати-
ческом (активном) и вакуолярном (запасном), которые участвуют
в обменных процессах с неодинаковой скоростью. Соотношение
фондов варьирует в широких пределах в зависимости от видовых
особенностей растений, условий минерального питания,и других
факторов. Для листЪев ячменя характерна достаточно высокая
доля запасного фонда (19—28 % общего количества), которая
может возрастать до 60 % при повышении уровня азотного
питания. В листьях гречихи доля запасного фонда невелика — 3—
9 '%. Причем в растениях ассимиляции подвергаются прежде
всего вновь поступившие нитраты, а имеющиеся в запасном
фонде используются лишь ограниченно.
Высокое содержание нитратов в вакуолях абсолютно
безвредно для растительной ткани. Но, попадая с растительной пищей в
организм животного или человека, нитраты восстанавливаются
до нитритов, которые блокируют снабжение клеток кислородом
и вызывают ряд серьезных заболеваний. Допустимой суточной
дозой потребления нитратов считается 300—320 мг, или 4 мг/кг
живой массы.
Интенсификация сельскохозяйственного производства и
увеличение доз азотных удобрений делают очень серьезной
проблему избыточного накопления нитратной формы.азота в
растениеводческой продукции.
С физиологической точки зрения накопление нитратов можно
рассматривать как результирующую процессов их поглощения,
транспорта, ассимиляции и распределения, интенсивность и
направленность которых определяются совокупностью
генетических, почвенно-экологических и агротехнических факторов.
Накопление нитратов различными культурами носит наслед-
319
ственно закрепленный характер. Зерновые культуры практически
не накапливают нитратов. Среди семейств овощных культур
наибольшей способностью к накоплению нитратов отличаются
Капустные, Тыквенные, Сельдерейные. Наибольшее количество
нитратов накапливают редька, свекла столовая, капуста, салат,
шпинат, редис, картофель. Пределы содержания нитратов в
товарной части урожая у этих растений составляют 600—3000 мг/кг
сырой массы. Томаты, перец сладкий, баклажан, чеснок, горох
отличаются низким содержанием нитратов — 20—300 мг/кг.
У ряда овощных и бахчевых культур выявлена сортовая
специфика накопления нитратов. Низким содержанием нитратов
характеризуются сорта моркови Шантанэ, Консервная,
высоким — Лосиноостровская, Нантская. Столовая свекла сорта
Бордо имеет более низкое содержание нитратов, чем Египетская
плоская. Сорта огурца Лель, Парад, Московский тепличный,
томата — Утро, Факел отличаются низким накоплением нитратов.
Видовые и сортовые различия по накоплению нитратов
обусловлены генетически закрепленными возможностями
редуцирующей системы растений, в частности уровнем нитратредуктаз-
ной активности, а также разной реакцией на условия
окружающей среды и режим минерального питания. Имеет также
значение, какие органы составляют товарную часть урожая.
В генеративных органах нитраты отсутствуют или содержатся
на значительно более низком уровне, чем в вегетативных, а
количество нитратов в корне, стебле и черешках листьев выше,
чем в листовой пластинке. Меньшее количество нитратов по
сравнению с листьями и черешками содержится в корнеплодах и
клубнях, среди запасающих органов меньше нитратов содержат
луковицы. Даже внутри одного органа нитраты распределяются
неравномерно (рис. 99). Большее количество нитратов
содержится у основания листа капусты и салата. Содержание нитратов в
сочных плодах семейства Тыквенные уменьшается, от
плодоножки к верхушке. Семенные камеры отличаются более низким
содержанием, чем мякоть и кора.
Одной из причин видовых и сортовых различий в накоплении
нитратов является физиологическая спелость растения к моменту
уборки. Количество нитратов особенно велико, когда период
товарной зрелости наступает раньше физиологического
созревания, например у огурца и кабачка. С возрастом содержание
нитратов в растении снижается из-за уменьшения их
поступления в растение, а также в связи с увеличением запасов ассими-
лятов, вовлекающих азот в метаболизм.
На накопление нитратов большое влияние оказывают условия
минерального питания. Здесь огромная роль принадлежит
правильному выбору доз азотных удобрений с учетом исходных
запасов минерального азота и азотминерализующей способности
почвы, позволяющей учесть обеспеченность азотом в ходе веге-
320
Рис. 99. Распределение нитратов (мг/кг сырой массы) в луке (О. А. Соколов,
Т. В. Бубнова, 1989). (Наименьшее количество нитратов содержится в средней
части луковицы, тогда как в верхней и нижней частях их содержание примерно в
2 раза выше. Наибольшее их содержание в донце луковицы. У зеленого лука зона
стебля над луковицей содержит наибольшее количество нитратов.)
тации растений. Важной причиной накопления нитратов
являются также несбалансированное основными элементами питание
и недостаток микроэлементов, нарушающие нормальный ход
азотного обмена. Особенно большое значение для успешного
усвоения нитратов имеют правильное фосфорно-калийное
питание и достаточная обеспеченность молибденом. Содержание
нитратов в растениях увеличивается при низком значении рН и
преобладающей концентрации К+ и Са в среде.
Среди факторов внешней среды наибольшее влияние на со-
321
держание нитратов в растении оказывают влажность, свет,
температура воздуха и почвы, которые, действуя в комплексе,
усиливают или ослабляют друг друга. Изменение влажности
неоднозначно влияет на накопление нитратов. Переувлажнение почвы
обычно приводит к избыточному накоплению нитратов.
С другой стороны, высокий уровень нитратов в растении в
засушливые периоды можно снизить поливами овощных
культур, так как они повышают темпы роста и способствуют
частичному вымыванию нитратов из верхних горизонтов почвы.
Влияние света на накопление нитратов обусловлено изменением
активности нитратредуктазы. Увеличение интенсивности света,
умеренные температура и азотное питание снижают содержание
нитратов в растениях.
Для снижение содержания нитратов в сельскохозяйственной
продукции применяют комплекс селекционно-генетических,
агрохимических и технологических мероприятий.
Перспективными являются поиск и выведение сортов,
отличающихся высокой эффективностью использования азота почвы
на формирование урожая с низким уровнем содержания
нитратов, что позволит не только снизить дозы удобрений, но и
предотвратить загрязнение окружающей среды. В то же время
внедрение в практику сортов с высоким потенциалом
ассимиляции нитратов обеспечивает, как Правило, повышение
содержания белка в урожае. Поэтому актуальным остается изучение
механизмов наследования признака низкого содержания нитратов
или высокой скорости их ассимиляции. Этот путь наиболее
целесообразен при выращивании овощей с коротким периодом
вегетации (листовые овощи, редис), отличающихся повышенной
способностью к накоплению нитратов.
В связи с тем что ведущим фактором накопления нитратов в
растении является избыточное азотное питание, рекомендуют
использовать дозы удобрений, которые обеспечивают урожай
растений на 5—10 % ниже максимального. Уменьшить
содержание нитратов можно путем применения медленнодействующих
полимерных форм удобрений на основе мочевиноформальдегид-
ных соединений (МФС) и конденсированных фосфатов (КФ),
карбамидоформальдегидных удобрений, а также с помощью
покрытия гранул защитными пленками. Это снижает скорость
растворения удобрений и обеспечивает пролонгированное
равномерное снабжение азотом растений в течение всей вегетации.
Эффективным средством также являются ингибиторы
нитрификации (дециандиамиддидин, сероуглерод), использование
которых обеспечивает временную консервацию в почве аммонийного
азота, что снижает потери азота удобрений и уменьшает
накопление нитратов в урожае зеленных овощей и редиса.
Эффективным решением «нитратной» проблемы является
дробное и локальное применение азотных удобрений под овощ-
322
ные и кормовые культуры. При локальном внесении на 25—30 %
снижаются дозы применяемых удобрений и уменьшается
аккумуляция нитратов у зеленных культур и редиса на 9—58 %, у
кукурузы и кормовой свеклы — на 10—40 %. Для получения
овощной продукции с высоким урожаем и низким содержанием
нитратов необходимы умеренное азотное питание растений в
молодом возрасте, усиленное снабжение азотом в период
интенсивного роста листового аппарата и ограниченное обеспеченное
азотом при созревании кочанов и корнеплодов. Такой азотный
режим растений можно обеспечить только при проведении
подкормок по данным диагностики условий питания.
В снижении содержания нитратов может помочь выбор
оптимальных сроков уборки урожая. В процессе вегетации картофеля
количество нитратов в клубнях снижается. При поздних сроках
уборки содержание нитратов в клубнях на 50—60 % ниже, чем
при ранних. Уборку листовых овощей следует проводить
вечером, так как в это время в них содержится на 30—40 % меньше
нитратов за счет их активного восстановления в светлый период
суток.
В заключение следует отметить, что повышенное содержание
нитратного азота в растениях чаще всего бывает следствием
низкой культуры производства и несоблюдения технологии.
Существуют предельно допустимые санитарно-гигиенические нормы
содержания нитратов, которыми необходимо руководствоваться при
производстве и потреблении продукции растениеводства. Для
зеленных кормов и силоса это 500 мг/кг, картофеля — 250, огурца и
томата открытого грунта — 150—200, закрытого грунта — 300—
400, зеленных культур — соответственно 2000 и 3000 мг/кг.
5.6. ОБЕСПЕЧЕНИЕ РАСТЕНИЙ ПИТАТЕЛЬНЫМИ
ВЕЩЕСТВАМИ В ПОЛЕВЫХ УСЛОВИЯХ
В естественном круговороте элементов необходимые для
растений минеральные вещества поступают главным образом из
почвы. Для пополнения естественного запаса питательных
веществ используют удобрения. Их применение приобретает все
большее значение в связи с необходимостью повышения
продуктивности сельскохозяйственных посевов и насаждений и
увеличения экономической эффективности капиталовложений.
5.6.1. МИНЕРАЛЬНЫЕ ВЕЩЕСТВА В ФИТОЦЕНОЗАХ И ИХ КРУГОВОРОТ
В ЭКОСИСТЕМЕ
Между организмами фитоценоза и почвой существует
круговорот минеральных веществ, который в естественных условиях в
значительной степени замкнут. Минеральные вещества, погло-
323
щаемые растениями, прямым путем или через пищевые цепи
возвращаются в почву включенными в органические вещества,
где они минерализуются сапрофитами и сорбируются
почвенными коллоидами.
Чем больше растения усваивают солнечной энергии и
связывают ее в органическом веществе, тем интенсивнее проходит
почвообразовательный процесс и существенно улучшаются
агрономические свойства почвы. Растения извлекают корнями из
глубоких почвенных слоев элементы минерального питания. Их
накопление в растительных остатках, поступающих в
поверхностный слой, обогащает его усвояемыми соединениями и
закрепляет легкоусвояемые элементы, так как азот и зольные
компоненты растительных остатков по мере минерализации
используются в последующем другими растениями. Кроме того,
растительные остатки служат энергетическим материалом для
микробиологических процессов почвы, в результате которых
дополнительно фиксируется азот атмосферы, происходят
восполнение и обновление гумуса почвы, а также увеличивается емкость
почвенно-поглощающего комплекса.
Минерализация и синтез органических веществ должны
соответствовать друг другу. Там, где разложение органических
веществ почвы идет медленно, скорость прироста растений обычно
на низком уровне.
При высокой интенсивности минерализации первичные
продукты лучше обеспечиваются нужными ионами и могут создавать
большую массу. Значительная продуктивность тропической
растительности обусловлена наряду с другими факторами быстрой
оборачиваемостью минеральных веществ. Равномерная
благоприятная температура и высокая влажность способствуют
разложению органического вещества микроорганизмами, так что
элементы минерального питания лишь ненадолго остаются в почве
связанными в органических соединениях и вскоре переводятся в
доступную для растений минеральную форму. Слишком интен- ■
сивная минерализация или пониженное поглощение минераль- '
ных веществ растительным покровом, например, после пожара
отрицательно сказывается на обмене минеральных веществ в
экосистеме. В минерализованном состоянии эти вещества более
доступны для растений, но они также более подвижны в почве и
поэтому легче вымываются.
Фонд минеральных элементов, связанных в органических
веществах биомассы и почвы, выполняет важную роль резерва,
благодаря которому все компоненты экосистемы застрахованы
на случай неблагоприятных внешних воздействий.
В функциональную систему растения—микроорганизмы—
почва регулярно поступают минеральные вещества извне, в то же
время она постоянно теряет их в результате геохимических про-
324
цессов. Поэтому растения зависят не только от микробной
минерализации в почве.
По сравнению с короткозамкнутым оборотом минеральных
веществ в экосистеме геохимические процессы незначительны,
но ими нельзя пренебрегать. Источником поступления
минеральных веществ служат подстилающая порода, вода и воздух.
Поступающие в почву благодаря химическому выветриванию
подстилающих пород минеральные вещества с грунтовой и
капиллярной водой перемещаются в зону корней. Вода
атмосферных осадков приносит на поверхность растений и в почву
неорганические вещества, содержащиеся в атмосфере в форме газов
(8О2, оксиды азота, ЫНз), пыли, тумана или аэрозоля. Растения
улавливают эти вещества и непосредственно из воздуха.
Ежегодное поступление минеральных веществ (прежде всего С1, N3, Са,
8, К, М§ и К) из атмосферы оценивается в 25—75 кг/га. Потеря
минеральных веществ экосистемой происходит отчасти через
атмосферу (ветровая эрозия), но прежде всего в результате
вымывания из почвы.
С убранным урожаем сельскохозяйственных растений
поглощенные вещества из почвы устраняются. При уборке урожая
зерновых культур с полей отчуждается 60—68 % накопленной
фитомассы. На формирование 1 т зерна и соответствующего
количества побочной продукции зерновые культуры потребляют
30—32 кг азота, 10—12 — фосфора, 15—18 кг калия. Вынос
питательных веществ при уборке урожая должен возмещаться
внесением удобрений.
5.6.2. ПЛОТНОСТЬ И РАСПРЕДЕЛЕНИЕ КОРНЕЙ В ПОСЕВЕ
Классический метод изучения корневой системы, основанный
на измерении и детальной характеристике всех ее ответвлений, в
полевых исследованиях практически не используют. В посеве
обычно определяют плотность корней, т. е. длину корней,
приходящуюся на единицу объема почвы (Ьу) или на единицу
площади поверхности почвы {Ьа). Традиционные методы заключаются
в раскопке корневых систем с помощью траншей, а также взятии
проб из почвы в виде монолитов или вертикальных колонок.
После отмывки корней от почвы определяют количество и длину
живых корневых окончаний. Трудоемкое измерение длины
корней линейкой в настоящее время заменяют сканированием
лазерным лучом помещенных на воду корней или сканированием
цветной пленки, на которой отсняты корни. Анализ
изображения проводят с помощью компьютера.
Однако эти методы изучения связаны с повреждением
корневой системы и не позволяют наблюдать корни в динамике. Более
информативным является изучение корневых систем в ризотро-
325
нах: растения сажают в большие контейнеры и наблюдают за
появлением и ростом корневых окончаний через стеклянные
стенки. Этот способ был разработан в Ист-Молинге в 1959 г. для
длительного изучения корневых систем плодовых деревьев. В
настоящее время в ризотронах воспроизводят различные фитоце-
нозы, где изучают действие дефицита воды, аноксии и условий
питания на развитие корневой системы.
В последние годы получают распространение ризоскопы, или
мини-ризотроны. В почву под углом вставляют прозрачную
трубку из пластика или заполненный воздухом прозрачный мешок с
источником освещения и датчиком видеокамеры. На экране
видеокамеры видны корневые окончания и участки растущих
корней, которые анализируют с помощью компьютерной техники.
Данные, полученные этим методом и методом монолитов,
хорошо согласуются.
Используют также методы, не повреждающие корневые
системы, основанные на различии физических свойств почвы и
корней, например метод ядерного магнитного резонанса и
измерения электропроводности.
Для разных сельскохозяйственных культур плотность корней в
пахотном горизонте сильно варьирует — от 0,8 до 50 см • см , а
протяженность корней на единицу площади поверхности
почвы — от 10 до 1000 см • см , причем травы дают величины,
близкие к верхней границе, а древесные куйщуры — к нижней
границе указанных пределов. Полевые культуры занимают
промежуточное положение. В фазе созревания семян у них
содержится 1—10 мг сухой массы корней на 1 см поверхности почвы.
У молодых растений плотность корней бывает значительно ниже.
Многолетние исследования распределения корней различных
сельскохозяйственных культур в полевых условиях выявили
очень высокую пластичность корневой системы, которая
выражается в варьировании ее размеров и формы за счет корней
разных порядков ветвления. Один и тот же вид растений в
различных условиях формирует разные корневые системы,
причем часто наблюдается горизонтальный или даже направленный
вверх рост корней.
По пластичности корневые системы значительно превосходят
надземные органы. Такая пластичность корневой системы
является основой приспособления растений к разнообразным
почвенным условиям, определяющим поступление воды и
минеральных элементов в растение. Благодаря пластичности
корневых систем в почве фитоценоза устанавливается определенная
иерархическая организация взаимоотношений корневых систем.
Влияние генетических особенностей растения на плотность и
распределение корней отчетливо проявляется у одиночно стоящих
растений при достаточно однородных и благоприятных для роста
условиях. Максимальная глубина проникновения корней фасоли,
326
Рис. 100. Распределение массы корней по
глубине у ячменя, выращенного при различной
плотности посева (Е. .1. ЮгЬу, О. КаскЬаш, 1971):
/—50 растений на I м2; 2— 200 растений на I м2;
3 — 800 растений на 1 м
гречихи, проса 0,9—
1,1 м, гороха,
картофеля 1,6, зерновых
культур, подсолнечника,
свеклы 3, люцерны 5 м
и более. В
сравнительных опытах показано,
что одиночные
растения ржи, пшеницы и
овсюга имели корневую
систему общей
протяженностью 70—90 км, а
в сплошном посеве
длина корней едва
достигала 900 м.
В посеве решающее
значение в реализации
наследственных свойств
растений имеют фито-
ценотическая
обстановка, свойства почвы,
ее плотность, условия
питания и влагообеспе-
чения. Увеличение
плотности посева
приводит к ускоренному увеличению общей длины и массы корней
на ранних стадиях развития растений, кроме того, более раннее
сближение корней соседних растений обусловливает рост корней
в глубину. В дальнейшем плотность посева уже не будет так
сильно влиять на размеры корней. При высокой плотности
посевов, когда размеры растений сильно ограничены, может
наблюдаться уменьшение глубины проникновения корней. Такое же
явление может быть и при низкой плотности посева, хотя в этом
случае оно обусловлено отсутствием конкуренции в верхнем слое
почвы. Максимальной глубины корнеобитаемой зоны можно
ожидать при средней плотности посева (рис. 100).
М. Аткинсон (1974), исследуя в ризотроне распределение
корней яблони, установил, что на глубине до 40 см находилось 92 %
вновь образовавшихся корней, если расстояние между
растениями составляло 240 см, и только 11 %, если расстояние было
30 см. В последнем случае 47 % корней проникало в почву на
глубину более 100 см.
Развитие корневой системы в значительной мере зависит от
почвенных условий. При плотности почвы 1,4—1,5 г/см рост
корней многих сельскохозяйственных культур резко замедляется
или вовсе приостанавливается. Способность корней развиваться
на уплотненных почвах тесно связана с режимом аэрации. Наи-
327
более чувствительны к аноксии зародышевые корни. В
природной обстановке почва уплотнена неравномерно, во всех
направлениях она пронизана ходами землероев. Эти рыхлые прослойки
имеют большое значение для проникновения корней в глубокие
слои подпочвы.
Результатом влияния условий питания на плотность и
распределение корней является сконцентрированность корней в
верхнем слое почвы, плодородие которого поддерживается внесением
удобрений и естественным возвратом пожнивных остатков.
Глубокая заделка удобрений в почву способствует росту корневой
системы в подпахотном слое. В период роста глубина
проникновения корневой системы по профилю почвы увеличивается. Это
отчасти обусловлено высыханием верхнего слоя почвы, в
результате чего расположенные здесь корни снижают поглотительную
активность. Во многих стрессовых ситуациях корневая система
адаптируется, прибегая к интенсивному ветвлению, например
при локальном внесении удобрений. При кислой реакции,
дефиците влаги или уплотнении верхнего горизонта происходит
ветвление в нижнем горизонте почвы.
Отдельные части корневых систем поглощают минеральные
вещества из почвы неравноценно. Поглотительная способность
стержневых корней при прочих равных условиях в несколько раз
превышает таковую у боковых корней. Экспериментально
установлена более высокая поглотительная способность корней узла
кущения и более значительная их роль в питании растений, чем
первичных (зародышевых) корней. Эта роль придаточных корней
особенно возрастает в период кущения злаков, когда происходит
их усиленное ветвление с образованием боковых корней.
Однако, несмотря на это, зародышевые корни сохраняют
определенную долю участия в питании растения и на более поздних этапах
его развития.
Соотношение между надземными и подземными органами
зависит от многих условий. Так, при слабом водном стрессе
наблюдаются торможение роста надземной системы и усиление
роста корней. В целом высокое отношение корень:стебель
обеспечивает большую экологическую стабильность растения. При
ослаблении фотосинтеза это соотношение снижается, причем
число зачатков узловых корней не меняется, но развиваются не
все зачатки. На подсолнечнике притекающие меченые ассимиля-
ты усиливают скорость роста придаточных корней.
Обычно на долю корней приходится 15—25 % органического
вещества растения, причем здесь обнаруживается большая
видовая специфика. На дерново-подзолистых почвах клевер в
пахотном слое накапливает в год 3,8 т/га корней, картофель —
0,65 т/га, промежуточное положение занимают зерновые
культуры. Продуктивность корневых систем в накоплении сухого веще-
328
ства носит обратный характер: у картофеля этот показатель
значительно выше, чем у клевера.
Многочисленные исследования показывают, что
продуктивность растений и отзывчивость на уровень минерального
питания определяются не столько мощностью корневой системы,
сколько ее физиологической активностью. У сортов, более
отзывчивых на удобрения, мецьше недеятельная адсорбирующая
поверхность корня, повышенный приток углеводов к корням.
5.6.3. ПОЧВА КАК ИСТОЧНИК ПИТАТЕЛЬНЫХ ЭЛЕМЕНТОВ
ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР
В почвенном растворе, как известно, содержится лишь весьма
незначительная часть имеющихся в почве запасов питательных
веществ, количество которых недостаточно для полного
удовлетворения потребности растений. Подавляющая часть
питательных веществ находится в почве в связанном состоянии с
органическими веществами и алюмосиликатными комплексами.
Важную роль в круговороте элементов питания в почве играет
гумус. Чем больше запасы гумуса в почве, тем богаче она азотом,
фосфором, серой, калием, кальцием и микроэлементами. С
наличием гумуса связаны физические и технологические свойства
почвы, их водопроницаемость и влагоемкость.
При современной структуре севооборотов ориентировочные
оптимальные параметры содержания гумуса в
дерново-подзолистых почвах составляют: на суглинистых 2,5—3,0 %, супесях 2,0—
2,5, песках 1,8—2,0 %.
Многочисленные почвенные исследования показали, что
валовые и доступные растениям запасы питательных веществ тесно
связаны с гранулометрическим составом почв.
С увеличением в дерново-подзолистых почвах физической
глины, основного показателя классификации почв по
гранулометрическому составу, увеличивается содержание калия. Общее
количество калия в дерново-подзолистых почвах превышает все
другие элементы. Валовые запасы его в 20-сантиметровом слое
колеблются от 25—40 т/га в песчаных почвах до 69—70 т/га в
тяжелосуглинистых. Валовые запасы фосфора в слое 100 см
составляют 16—18 т/га в пылевато-суглинистых почвах, 10—12 — в
супесчаных, 7—9 т/га — в рыхлопесчаных. В то же время доля
хорошо доступных растениям рыхлосвязанных фосфатов кальция
увеличивается на легких почвах. Содержание общего,
минерального и легкогидролизуемого азота в пахотном слое песчаных
почв значительно ниже, чем в суглинистых.
Режим питания растений во многом определяется состоянием
почвенно-поглощающего комплекса.
Наиболее высокую емкость поглощения (50—60 мг • экв на
100 г почвы), а соответственно и сумму поглощенных оснований
329
имеют богатые перегноем черноземные почвы. В хорошо
окультуренных дерново-подзолистых почвах емкость поглощения
достигает 15—17 мг-экв на 100 г почвы, а степень насыщенности
основаниями — 70—80 %.
Доступность растению веществ, адсорбированных
почвенными коллоидами, зависит от различных условий. Наряду с
насыщенностью почвы данным элементом и прочностью его связи
весьма важное значение имеет обеспеченность растений водой.
Даже кратковременное завядание резко снижает адсорбционную
способность тканей корня и приводит к ослаблению
поглотительной деятельности.
Существенное влияние на ход поглощения растением
питательных веществ из почвы оказывают корневые выделения.
Состав этих выделений и пути их использования растениями весьма
многообразны. Выделяемый корнями растений диоксид углерода
повышает растворимость почвенных минералов и увеличивает
доступность растению адсорбционно связанных почвой
питательных веществ. Помимо СОг корни выделяют различные
органические кислоты, сахара и другие соединения, которые также имеют
большое значение для поглотительной деятельности корня.
Важным фактором, определяющим питательный режим
почвы, является концентрация водородных ионов почвенного
раствора. Высокая концентрация ионов водорода, а на дерново-
подзолистых почвах и алюминия оказывает как прямое, так и
косвенное вредное действие на питание растений.
Прямое действие заключается в нарушении
коллоидно-химических свойств протоплазмы растительных клеток,
неблагоприятном изменении концентрации органических кислот в клеточном
соке, нарушении белкового обмена и торможении синтеза белка,
изменении адсорбции и поглощения растениями ионов.
Повышенная кислотность особенно сильно влияет на
фосфатный режим дерново-подзолистых почв — снижаются подвижность
и усвояемость фосфора. Наблюдается прямое неблагоприятное
действие алюминия: поступление фосфорнокислого алюминия в
корневую систему растений подавляет способность последней
подавать фосфор в надземные органы. В результате наблюдается
специфическое фосфатное голодание растений. В опытах с кукурузой
дополнительное внесение с NРК алюминия увеличивало
содержание фосфора в корнях на 62 % при одновременном снижении
содержания в листьях на 8, а в стеблях — на 14 %.
Со степенью кислотности почв связана и обеспеченность
почвы другими элементами минерального питания (рис. 101).
Изучение особенностей питания растений в связи с
кислотностью почвы позволило изменить установившееся мнение об
отрицательном отношении к известкованию льна, картофеля,
люпина. Показано, что кальциефобность этих культур обусловлена
нарушением сбалансированности питания при известковании.
330
4 4,5 5 5,5 в 6,5 7 1,5 8 8,5 3 3,5 10
Киалсппность(рН)
Рис. 101. Доступность для растений питательных веществ в зависимости от рН
почвы (С. .1. РгаМ, 1970). (Ширина горизонтальной полоски на графике
показывает растворимость каждого элемента при различных значениях рН.)
При достаточной обеспеченности магнием, повышенных (на
25—20 %) дозах калийных удобрений и применении борных
удобрений известкование увеличивает продуктивность льна и
картофеля.
Оптимальные показатели рН колеблются в слабокислой зоне
(5,7—7,0) и зависят от множества факторов: структуры посевных
площадей в севообороте, типа гранулометрического состава почвы,
обеспеченности ее гумусом, фосфором и других показателей.
5.6.4. ВЗАИМОДЕЙСТВИЯ МЕЖДУ РАСТЕНИЯМИ
Взаимоотношения растений в посеве носят очень сложный
характер. Их нельзя сводить только к конкуренции за
питательные вещества. Часто в смешанных посевах условия питания
растений значительно улучшаются. Например, вико-овсяная смесь
имеет благоприятный режим фосфатного питания за счет
высокой растворяющей способности бобового компонента.
Убедительно показана также возможность использования небобовыми
растениями азота, выделяемого корнями азотфиксирующих
бобовых растений. При совместном выращивании сои и овса в
стерильных культурах, не содержащих азот, но зараженных
клубеньковыми бактериями, могут развиваться и соя, и овес. Весь
нужный азот овес получает от сои.
331
При подборе соответствующих компонентов смеси можно
более полно использовать плодородие почвы и свет, чем при
посеве чистой культуры. Совместное возделывание растений с
корневыми системами, располагающимися в различных
горизонтах почвы, позволяет использовать питательные вещества почвы
как верхних, так и более глубоких ее слоев. Более эффективное
использование плодородия почвы может быть достигнуто также
за счет несовпадения во времени максимальной потребности в
питательных элементах у компонентов смеси.
Взаимное влияние растений при совместном выращивании
определяется также биохимическими воздействиями корневых
выделений. Такое химическое взаимодействие растений
называется-аллелопатией и подробно рассмотрено в разделе
«Устойчивость растений к биотическим факторам».
5.6.5. ВЛИЯНИЕ РИЗОСФЕРНОЙ МИКРОФЛОРЫ
НА ПОГЛОЩЕНИЕ ВЕЩЕСТВ
Корневая система растений окружена ризосферой, т. е. почвой,
которая непосредственно соприкасается с корнями. Она обогащена
корневыми выделениями, отмершими корневыми волосками и
служит питательной средой для микроорганизмов. Установлено, что в
ризосфере бактерий в сотни и тысячи раз больше, чем вне ее. Это
способствует более интенсивному протеканию здесь почвенных
процессов. Ризосферные микроорганизмы находятся в сложных и
многообразных взаимоотношениях с корневой системой растения,
оказывая большое влияние на ее поглотительную и синтетическую
функции. Эта живая масса дышит, выделяя значительные
количества диоксида углерода. Многие почвенные микроорганизмы
образуют минеральные кислоты — азотную и серную, а также
органические кислоты — уксусную, масляную и другие, ряд ферментов.
Это помогает растворению и превращению недоступных растениям
соединений в доступные. Кроме того, микроорганизмы выделяют
специфические вещества — витамины, регуляторы роста,
антибиотики, оказывающие влияние на рост растений.
Еще большее влияние на усвоение из почвы минеральных и
органических веществ оказывает симбиоз корней с почвенными
грибами, впервые обнаруженный в 1882 г. Ф. М. Каменским. В
1885 г. Г. Франк, рассматривая симбиоз корня высшего растения
с мицелием гриба как вполне сложившийся с морфологической
точки зрения орган, дал ему специальное название микоризы,
что означает грибокорень. Различают микоризу эктотрофную
(внешнюю), эндотрофную (внутреннюю) и эктоэндотрофную
(переходную).
При эктотрофной микоризе гриб своими гифами рыхло
оплетает корневые окончания, одевая корни чехлом (рис. 102), который
растет вместе с ростом корня. Гифы внедряются в межклетники,
332
Рис. 102. Микориза:
/— эктотрофная микориза на корнях яблони; 2 — эндотрофная микориза на корнях
черной смородины
10,0
1,0
достигая эндодермы, но не исключена возможность их
проникновения в некоторые клетки. Микориза в этом случае берет на
себя функции корневых волосков.
При эндотрофной микоризе гриб проникает внутрь клеток
коры, образуя в них плотные клубочки, а отдельные гифы
выходят наружу корня. При наличии
эндотрофной микоризы корневые
волоски не отмирают.
Эндотрофная микориза не
всегда резко отличается от
экзотрофной. В некоторых случаях гифы
экзотрофной микоризы в большом
количестве проникают в клетки,
образуя в них клубки, так же как
это имеет место в случае
эндотрофной микоризы. Такую
микоризу называют эктоэндотрофной.
Известно несколько десятков
видов грибов, в основном из
класса безидиомицетов, принимающих
участие в образовании микоризы.
У большинства высших
растений поглощение питательных
веществ из почвы и рост
значительно усиливаются, когда на их
корнях поселяются грибы-микоризо-
образователи (рис. 103).
Роль микоризы особенно
велика в поглощении и переносе
фосфора. Доказано также, что она
>
I
0,01
25 37
Врет, дни
Рис. 103. Влияние микоризы на
скорость роста лука репчатого
(Р. Е. Т. Запйеге а. Р. В. Тшкег,
1973):
/ — с микоризой; 2—без микоризы
333
способствует поглощению растениями цинка, марганца и меди.
Эти элементы в почве слабоподвижны, и поэтому вокруг
корневых волосков и корней быстро образуются обедненные ими
зоны. Сеть гиф микоризных грибов распространяется на
несколько сантиметров от каждого заселенного ими корня и
увеличивает таким образом объем эффективно используемой почвы.
Способность микоризы поглощать и транспортировать фосфор,
находящийся в почве, была показана в опытах с радиоактивным
Р. Помимо увеличения поглощающей поверхности корней
значение микоризных грибов заключается и в том, что они могут
извлекать фосфор из более разбавленного почвенного раствора и
использовать те его источники, которые обычно растениям
недоступны.
Проростки цитрусовых, имеющие микоризу, не получая
фосфорных удобрений, достигали размеров проростков, не имеющих
микоризы, но получавших удобрения из расчета 560 кг фосфора
на 1 га (рис. 104). Разные виды растений в различной степени
зависят от микоризных грибов. У цитрусовых снабжение
фосфором в такой степени определяется микоризой, что без нее они
могут нормально расти только при очень высоком содержании
фосфора в почве. На фоне высоких доз фосфорных удобрений
микориза уже не является эффективной и часто ее развитие
подавляется. Для многих видов определена степень увеличения
роста в присугствии микоризы: для пшеницы 220 %, кукурузы
122, лука 3155, земляники 250, туи 962 % (П. Рейви с соавт.,
1990).
Микоризные грибы присутствуют в большинстве
растительных сообществ, однако их количество может уменьшиться или
они вообще могут быть уничтожены в результате нарушения
почвенного покрова, например
вследствие горных работ.
Применение фунгицидов против
патогенных грибов также
может привести к гибели
микоризы. Поэтому часто
рекомендуется проводить инокуляцию
растений микоризными
грибами. Эктомикоризные грибы
можно культивировать и
полученный вегетативный мицелий
добавлять в почву. Эндомико-
ризные грибы пока не удается
выращивать в чистой культуре,
поэтому производство их
грибницы требует применения
горшечной культуры
растения-хозяина. Споры гриба или корни
12
О 11 56 112 560 1120
Фоарорное удобрение, ке/еа
Рис. 104. Ростовая реакция
зараженных и не зараженных микоризой
сеянцев цитрусовых на внесение разного
количества фосфора (П. Рейвен,
Р. Эверт, С. Айкхорн, 1990):
/ — с микоризой; 2 — без микоризы
334
колонизированного грибом растения, полученные из горшечных
культур, используют для инокуляции почвы в оранжереях и
питомниках.
5.7. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ПРИМЕНЕНИЯ
УДОБРЕНИЙ
Ведущая роль в повышении урожайности
сельскохозяйственных культур принадлежит удобрениям. В Подмосковье урожаи
зерна озимой пшеницы 3,5—4,0 т/га и их стабильность на 55—
60 % определяются уровнем минерального питания и в 36 %
случаев изменения урожайности обусловливались
непостоянством погодных условий (И. С. Шатилов с соавт., 1988). Во
многих хозяйствах низкая урожайность связана с нарушением
технологии, доз, сроков и способов внесения удобрений.
Рациональное использование удобрений возможно лишь при комплексном
подходе к химизации сельского хозяйства, разработке и
совершенствованию системы удобрения.
Система удобрения — это программа удобрений в севообороте
с учетом предшественников, плодородия почвы, климатических
условий, биологических особенностей растений и сортов, состава
удобрений. Система удобрения разрабатывается с учетом
круговорота веществ и их баланса в земледелии. Баланс питательных
веществ учитывает поступление их в почву с удобрениями,
суммарный расход на формирование урожая и непродуктивные
потери из почвы. Балансовый метод позволяет рассчитать дозу
полного минерального удобрения. Однако для получения
высоких урожаев возникает необходимость дифференцировать
питание в процессе вегетации растений, так как их потребность в
питательных веществах существенно меняется по фазам
развития. Связано это со сложностью взаимоотношения между
минеральными элементами и накоплением органического вещества.
Как уже отмечалось, только часть поглощаемых корнями
минеральных элементов, главным образом азот, а также фосфор и
сера непосредственно входят в состав органических веществ.
Основная же роль катионов состоит в регуляции жизненных
процессов, и их воздействие на накопление органического вещества
является не прямым, а косвенным. Это ясно из того, что
внесение в почву удобрений приводит не только к увеличению в
растениях общего количества золы и азота, но главным образом
к увеличению общего количества органических веществ,
большую часть которых составляют углеводы, не содержащие
минеральных элементов.
Минеральные вещества, особенно калий, магний, фосфор,
способствуют использованию продуктов фотосинтеза на
новообразования, что приводит к усилению роста растений и
увеличению ассимилирующей листовой поверхности, особенно в первые
335
периоды развития растений. Установлено, что применение
удобрений увеличивает фотосинтетический потенциал посевов
озимой пшеницы в 1,4—1,8 раза, ячменя — в 1,4—2,2 и овса — в
1,1— 1,5 раза (И. С. Шатилов с соавт., 1988). Увеличение
рабочей поверхности приводит к значительному усилению
накопления органического вещества не отдельным листом, а всем
растением, и тем самым к повышению урожая.
Тесная связь между накоплением органических и
минеральных веществ объясняет, почему в засушливые годы полевые
культуры на черноземных почвах меньше отзываются на
внесение удобрений, чем при достаточном увлажнении. В условиях
недостатка воды величина урожая на черноземных почвах в
первую очередь зависит от количества доступной растениям влаги.
При улучшении водоснабжения путем орошения и в связи с
этим усилении ростовых процессов растения более отчетливо
реагируют на внесение соответствующих удобрений.
Надо иметь в виду, что и в условиях недостатка влаги
некоторые удобрения оказывают благоприятное влияние на растения,
повышая их устойчивость к частичному обезвоживанию. Так,
фосфорные удобрения ослабляют вредное действие засухи на
растения за счет увеличения количества коллоидно связанной
воды и повышения устойчивости коллоидов протоплазмы
клеток. Кроме того, под влиянием фосфора снижаются потери воды
на транспирацию в наиболее напряженные по водному балансу
полуденные часы.
Так как минеральные вещества являются главным образом
регуляторами жизненных процессов для растений, очень важно
оптимальное снабжение ими на определенных этапах развития
(рис. 105).
При прорастании
используются главным
образом те запасы минеральных
веществ, которые уже
имеются в семенах, и, кроме
того, прирост
органического вещества в это время еще
относительно невелик,
поэтому потребность в
поглощении их из почвы в это
время еще незначительна.
Но она быстро возрастает
ко времени наиболее
энергичного увеличения общей
массы растения, что
отмечается в периоды
интенсивного образования листовой
поверхности, цветения и за-
Май Июнь Июль Адгуст
кущение Выход Молочная Полная
в трубку спелость спелость
Рис. 105. Интенсивность поступления
элементов питания и накопление сухого
вещества яровой пшеницей за один день в
период вегетации:
/ — калий; 2 — азот; 3 — фосфор; 4 — сухое
вещество
336
вязывания плодов. Прекращение же общего накопления
органического вещества во время созревания сопровождается резким
снижением потребности растений в удобрениях и даже обратным
переходом части минеральных веществ из растений.
Растения имеют периоды максимального потребления
питательных веществ, когда в довольно сжатые сроки поступает
большое количество минеральных элементов. Для одних растений
(лен, конопля, яровые зерновые) этот период характеризуется
очень коротким сроком, для других (картофель, сахарная свекла)
свойственно более длительное поступление элементов
минерального питания.
Помимо периодов максимального потребления питательных
веществ растения имеют критические периоды потребления
элементов питания. Отсутствие в это время того или иного элемента
может нанести серьезный ущерб урожаю. Так, в период
прорастания растения очень чувствительны к недостатку фосфора,
который способствует хорошему развитию корневой системы, в
период интенсивного образования вегетативной массы — к
недостатку азота.
Потребность в элементах минерального питания также тесно
связана с продолжительностью вегетационного периода
сельскохозяйственных культур. Культуры и сорта с длинным
вегетационным периодом способны формировать значительно большее
количество органического вещества, а следовательно, потреблять
и большее количество элементов питания, чем растения с
коротким периодом вегетации. "'
Пропашные культуры с вегетационным периодом 120—160
дней образуют сухого вещества и выносят с урожаем
минеральных элементов в 1,5—3,0 раза больше, чем яровые зерновые
культуры и лен с периодом вегетации 90—120 дней.
Продолжительностью вегетационного периода обусловлено не
только общее потребление растениями элементов питания, но и
характер, динамика их потребления. Так, ранние сорта
картофеля, заканчивающие вегетацию за 90—100 дней, к завершению
фазы цветения поглощают 88 % азота, 66 — фосфора, 84 %
калия от суммарного потребления; для среднеспелых сортов эти
показатели составляют соответственно 59, 37 и 46 %. К концу
созревания в клубнях содержится до 80 % азота, 90 — фосфора и
35 % калия от количества, которое растения усвоили на
протяжении всего периода вегетации (Т. Н. Кулаковская, 1990).
Высшие растения являются крайне автотрофными
организмами и для нормального роста и развития не требуют органических
веществ. В многочисленных опытах доказаны равноценность или
даже преимущества действия минеральных удобрений. Однако,
признавая положительную роль гумуса в плодородии почвы,
следует подчеркнуть, что увеличить или сохранить на оптимальном
уровне имеющиеся запасы органического вещества можно толь-
337
ко при совместном использовании органических и минеральных
удобрений. Эффективность навоза и минеральных удобрений
связана с биологическими особенностями культур. Как правило,
действие минеральных удобрений бывает более высоким на
зерновых культурах, а навоза — на плодовых и многолетних травах.
При изменении погодных условий, отклонениях в
агротехнике уровень урожаев обычно выше на почвах с достаточно
высоким содержанием органического вещества, а колебания урожаев
по годам меньше. В значительной степени это обусловлено и
лучшим использованием растениями вносимых элементов
минерального питания, лучшей обеспеченностью растений СОг, что
создает благоприятные условия для агрофитоценоза в
образовании продуктов органического синтеза.
Влияние гумуса на использование растениями питательных
веществ, как содержащихся в почве, так и вносимых с
удобрениями, приобретает особо важную роль в связи с
применением высоких доз удобрений. Внесение большого количества
элементов питания, прежде всего высокоподвижных форм азота
и калия, может вызвать ряд негативных последствий:
избыточное накопление нитратов в растениях и в почвенно-грунтовых
водах, открытых водоемах. Только при совместном применении
минеральных и органических удобрений, увеличении запасов
гумуса в почве можно успешно разрешить возникающие
противоречия необходимости увеличения производства
сельскохозяйственной продукции и сохранения окружающей среды от
загрязнения.
При планировании высокой урожайности
сельскохозяйственных культур приходится вносить удобрения в больших дозах.
Но при единовременном внесении полного удобрения растения
используют их только наполовину или на треть, а коэффициент
использования фосфора часто составляет !/б. Причиной такого
слабого использования удобрений является то, что они
переходят в почве в труднодоступные соединения или вымываются
из почвы прежде, чем используются растениями. В сухом
климате верхние слои почвы пересыхают раньше, чем успевает
развиться корневая система, которая уходит в более влажные
нижние слои почвы. В результате часть внесенных в почву
удобрений остается лежать в сухих слоях почвы
неиспользованной.
Кроме того, при таком способе внесения удобрений
максимальное их количество растения получают во время прорастания
семян, когда слишком высокие, дозы легкорастворимых
удобрений (например, калийных) могут затруднить поглощение воды
проростками. А к моменту усиленного роста растений и
наибольшей их потребности в удобрениях количество доступных
питательных веществ в сфере распространения корней успевает
уже значительно уменьшиться.
338
Наиболее полно обеспечение растений в соответствующие
фазы развития элементами минерального питания достигается
сочетанием внесения основного удобрения с дополнительным в
виде подкормок.
В ряде случаев применяют некорневые подкормки растений.
В принципе все надземные органы могут поглощать
питательные вещества. Это используют в плодоводстве, когда в
отдельных случаях ветви и стволы перед распусканием листьев
опрыскивают сравнительно высококонцентрированными
растворами питательных веществ. У облиственных растений
некорневое питание осуществляется главным образом
листьями. Поступление ионов происходит в растворенном состоянии
в основном через кутикулу. Поэтому поглощение тем
активнее, чем дольше сохраняется на поверхности листа водная
пленка. Теоретически подкормки через листья и через корни
по своему влиянию равноценны. Однако при проведении
только некорневых подкормок в отдельных случаях нарушается
генеративное развитие растений, наблюдается более быстрое
старение листьев. ■
Недостаток удобрения через листья заключается также в том,
что при опрыскивании можно использовать только
разбавленные растворы (0,5—2%-ные) и ввести небольшое количество
питательных веществ, хотя по сравнению с удобрением через
корни они быстрее и полнее усваиваются растениями. С по-
• мощью некорневых подкормок можно добиться
целенаправленного результата, в частности, при необходимости срочного
внесения азота проводят подкормку мочевиной или при появлении
признаков дефицита фиксированных почвой железа и
микроэлементов опрыскивают растворами их хелатов. Мочевина и
хелаты имеют явное преимущество для некорневой подкормки,
так как их молекулы целиком попадают в лист, что
предотвращает накопление сопутствующих ионов на поверхности
листа.
Некорневые подкормки особенно эффективны, когда почва
обеднена элементами питания из-за усиленного их вымывания
или, наоборот, пониженной растворимости вследствие
недостатка влаги, неблагоприятного значения рН почвенного раствора.
Кроме того, низкие температуры почвы часто ослабляют
поглощение через корни и тем самым повышают эффективность
некорневых подкормок.
Правильное построение системы удобрения невозможно без
учета генотипической специфики поглощения и усвоения ионов
растениями. Например, имеются сорта гречихи, эффективно
поглощающие фосфор из труднодоступных соединений. Это
ценное свойство, связанное с особенностями корневых выделений,
генетически закреплено и наследуется.
339
5.8. ОСОБЕННОСТИ ПИТАНИЯ РАСТЕНИЙ
В БЕСПОЧВЕННОЙ КУЛЬТУРЕ
Широкое использование в физиологических исследованиях
водной культуры обеспечило разработку и распространение
методов промышленного выращивания растений на питательных
растворах, которые получили название гидропоники («пуско» —
вода и «ропоз» — работа).
В зависимости от среды, в которой развивается корневая
система, гидропонные методы могут быть разделены на три
основные группы.
Водная культура. Для этого метода характерно отсутствие
субстрата. Корневая система погружена непосредственно в
питательный раствор. Выращивание растений в водной культуре
имеет различные варианты, из которых наиболее
перспективным, вероятно, является технология тонкослойной проточной
культуры (ТПК).
Субстратная культура. При этом способе выращивания
корневая система растений развивается в твердой среде (торф,
древесная кора, перлит, вермикулит, цеолит, песок, гравий,
минеральная вата, полистирол и др.). Обычно субстрат укладывают в виде
грядок или засыпают в полимерные контейнеры. Среда для
выращивания растений без почвы должна быть твердой опорой для
поддержания растений в вертикальном положении, не вступать в
реакцию с питательным раствором, иметь малую емкость
поглощения, непрерывно снабжать корни водой и растворенными в
ней питательными веществами, обеспечивать достаточную
аэрацию корневой системы.
С помощью автоматического устройства питательный раствор
подается снизу в искусственный субстрат и после увлажнения
опять стекает в резервуар. Уровень питательного раствора
поддерживают на 3—4 см ниже поверхности субстрата, что
снижает потерю воды испарением субстрата и предотвращает
появление на нем водорослей и плесени. При поступлении
питательного раствора происходит временное (на 10—15 мин)
вытеснение воздуха, содержащегося в порах субстрата, но при
стекании раствора все пространство между частицами субстрата
снова заполняется воздухом. Питательный раствор образует
вокруг частиц субстрата водные пленки, в которых растворены
минеральные вещества. Достаточное количество воздуха и
питательных веществ в зоне корневой системы обеспечивает
быстрое их поступление и усвоение растениями. Частота подачи
раствора зависит от величины частиц субстрата, фазы развития
растений и времени их выращивания (зимне-весеннее, осенне-
зимнее). В период высадки рассады раствор обычно подают
дважды в день. По мере роста культур число подач раствора
возрастает до 4—6 раз. Еженедельно делают химический анализ
340
питательного раствора и проводят коррекцию его состава, раз
в месяц раствор полностью заменяют. Из данной группы
методов широкое распространение получают технологии
выращивания растений на минеральной вате и торфе с периодической
подачей питательного раствора капельной системой или
другими способами орошения.
Аэропонная культура. Метод аэропонной культуры растений
предусматривает подачу питательного раствора к корням в виде
тумана (аэрозоля). Аэропоника была разработана в России
В. Арциховским еще в 1915 г., но, несмотря на ее преимущества,
не получила широкого распространения главным образом из-за
проблем, связанных с технологическим оборудованием.
В настоящее время успешно используют на большом числе
овощных, цветочных и других культур голландскую гидропонную
систему, при которой создаются два слоя питательного
раствора — аэрозоль у поверхности и циркулирующий раствор у
основания. Аэрозоль обеспечивает непрерывную аэрацию и
способствует быстрому корнеобразованию.
Наиболее важным фактором при беспочвенном питании
растений являются питательные растворы. Их готовят путем
растворения различных солей в воде. По своему составу они подобны
почвенному раствору и должны удовлетворять определенным
требованиям.
Питательный раствор должен содержать все необходимые
элементы в усвояемой форме и быть физиологически
уравновешенным. Общее содержание солей в питательном растворе не
должно превышать 2—3 г/л.
Физиологически уравновешенными являются те растворы,
количество и соотношение ионов в которых исключают их вредное
влияние. Такие растворы обеспечивают нормальный рост, развитие и
высокую продуктивность растений. Физиологическая
уравновешенность раствора имеет особое значение в гидропонике, которая
практически лишена буферных свойств твердой фазы почвы. При
составлении физиологически уравновешенных растворов
необходимо учитывать разный характер взаимодействия ионов.
Растворы чистых солей оказывают токсическое действие на
организм растения или животного. Еще в конце прошлого века
была установлена ядовитость раствора чистой соли КаС1,
концентрация которого соответствовала концентрации морской
воды. Достаточно было добавить незначительное количество
солей кальций и магния, чтобы снять это ядовитое действие
№С1. Взаимодействие ионов, при котором физиологический
эффект воздействия смеси солей меньше, чем действие каждой
соли в отдельности, называется антагонизмом.
Антагонизм ионов проявляется как между разными ионами
одной валентности, например №"*" и К+, №+ и ИЩ, так и
341
между ионами разной валентности (К+ и Са2+, №+ и Мё2+).
Причем чем выше валентность, тем больше антагонистическое
действие иона. Так, для того чтобы устранить ядовитое действие
на проростки пшеницы односолевого раствора КС1, надо
добавить 30 % №С1 или 5 % СаС12. У анионов антагонизм выражен
слабее. В морской воде, которая является природным
физиологически уравновешенным раствором, отношение сумм
одновалентных катионов к двухвалентным равно 8—10. В основе
антагонистического действия ионов лежит их противоположное
действие на физико-химические свойства протоплазмы, что
отражается на обмене веществ, а также конкуренция при
усвоении их растениями.
Наблюдаются также синергизм и аддитивность в действии
компонентов солей. Синергическое действие ионов заключается в
том, что один из них усиливает действие другого. Например,
катионы К, Са, М§ оказывают стимулирующее действие на
поглощение анионов N03 и РО4. Нитратные и фосфатные анионы
благоприятно влияют на усвоение других элементов.
Аддитивность — это действие смеси солевых растворов,
которое равно сумме действия отдельных компонентов. Например,
осмотическое давление питательного раствора равно сумме
парциальных осмотических давлений входящих в смесь солей.
При гидропонных технологиях первостепенное значение
имеет качество воды, на которой готовят питательные растворы.
К наиболее важным показателям относятся общая
концентрация растворимых солей; содержание натрия, хлора, бора и
других элементов, усвояемых растением в малой степени и при
накоплении действующих токсично; содержание бикарбонатов
и их соотношение с суммарной концентрацией Са и М§;
жесткость воды. Вода, пригодная для гидропоники, должна
содержать не более 30 мг/л натрия, 0,3 — бора, 50 мг/л хлора,
количество бикарбонатных ионов не должно превышать суммы
ионов Са и М§.
Наиболее благоприятная реакция питательного раствора для
усвоения почти всех элементов питания корнями растений 5,5—
6,5. В процессе питания растения определенным образом
воздействуют на реакцию питательного раствора, с одной стороны, за
счет кислотности выделяемых корнями соединений (угольная
кислота, низшие карбоновые кислоты), а с другой — за счет
различной скорости, с которой они усваивают катионы и
анионы растворимых солей. Питательный раствор должен обладать
определенной буферностью, т. е. способностью противостоять
изменению реакции среды. Периодически необходимо проводить
коррекцию рН, для чего используют ортофосфорную или
азотную кислоту.
Важным фактором успешного выращивания растений в
гидропонике является хорошая аэрация питательного раствора, так
342
как это необходимое условие для поглотительной деятельности
корней.
В настоящее время существует много рецептов питательных
растворов для конкретных сельскохозяйственных культур и
условий выращивания. Достаточно универсальной является смесь
В. А. Чеснокова и Е. Н. Базыриной. Она содержит в 1 л воды:
Са^Оз)2 - 0,5 г, КШ3 - 0,4, КН2РО4 - 0,14, НН4КО3 - 0,16,
МёЗО4 - 0,28, (Ш4)25О4 - 0,13, РеС13 - 0,06 г.
Микроэлементы добавляют из расчета 0,1—0,5 мг/л.
Концентрацию питательного раствора меняют по мере роста и
развития растений. Проростки растений снабжаются
питательными веществами за счет запасов семени. Поэтому
проращивание целесообразно проводить на питательных растворах низких
концентраций. Во время интенсивного формирования листового
аппарата значение азотного питания особенно возрастает. Перед
цветением увеличивается потребность в фосфорно-калийном
питании. Установлено, что при обильном плодоношении листья
нижних ярусов значительно быстрее стареют, если в растворе
преобладает аммиачная форма азота. Для обеспечения более
длительного плодоношения в питательный раствор нужно включать
на одну часть аммиачного азота две и более части нитратного.
Усиление метаболизма корневой системы за счет
дифференцированного питания в течение вегетационного периода,
поддержание необходимого воздушного режима (температура,
концентрация СО2) и дополнительное освещение обеспечивают более
раннее созревание овощей, повышают урожайность и качество
продукции.
5.9. НЕБЛАГОПРИЯТНОЕ ДЕЙСТВИЕ
НА РАСТЕНИЕ ИЗБЫТОЧНО ВЫСОКОГО УРОВНЯ
МИНЕРАЛЬНОГО ПИТАНИЯ
Интенсификация сельскохозяйственного производства в ряде
случаев связана с применением очень высоких доз минеральных
удобрений. Однако не только недостаток элементов
минерального питания, но и их избыток и несбалансированность оказывают
отрицательное влияние на растительный организм. Необходимо
также учитывать опасность загрязнения почвы тяжелыми
металлами, входящими в состав естественных примесей удобрений.
Среди них обнаруживают значительные количества меди, цинка,
хрома, никеля, стронция, урана.
Высокие дозы минеральных удобрений могут вызывать
нарушение физиологических функций, снижать устойчивость
растений и действовать как засоляющий фактор. Если удобрение
вносят в количествах, превышающих потребности растений, то уро-
343
жайность обычно не повышается, а качество продукции
ухудшается.
Сельскохозяйственные культуры несколько различаются по
реакции на высокие концентрации солей. Наиболее
устойчивыми являются свекла, хлопчатник, люцерна, томат. К
малоустойчивым относят лен, гречиху, овес. Повышение содержания солей
в почве до 0,5 % отрицательно сказывается на большинстве
сельскохозяйственных культур. Высокая концентрация почвенного
раствора затрудняет поглощение воды растениями. Это связано с
осмотическим эффектом, увеличивающимся с возрастанием
концентрации раствора, а также с подавлением клеточного деления
и снижением роста корней.
Избыточно высокий уровень минерального питания нарушает
условия поступления веществ в растения. Это обусловлено
увеличением конкуренции между ионами, изменением
проницаемости мембран, подавлением энзиматической активности и
нарушением энергетических процессов.
Повышенное содержание в почве подвижных форм фосфора
и меди в результате длительного применения высоких доз
фосфорных удобрений и медьсодержащих фунгицидов способствует
нарушению питания цинком и вызывает розеточность и мелко-
листность плодовых деревьев (В. М. Тарасов, 1980).
Избыточное азотное питание часто приводит к недостатку
образования Сахаров в растениях и накоплению нитратов, что
ухудшает качество сельскохозяйственной продукции, затрудняет
ее хранение и переработку (квашение капусты, силосование
кормов). Одностороннее избыточное азотное питание отрицательно
влияет на устойчивость растений к различным заболеваниям,
например, усиливает фитофтороз картофеля и табака.
Повышение концентрации тяжелых металлов вызывает серьезные анато-
мо-физиологические изменения в растениях. В условиях избытка
марганца наблюдается снижение содержания хлорофилла в
листьях и активности ферментов группы железопорфиринов.
Большие количества никеля вызывают склеивание хлоропластов,
лизис их содержимого.
Внесение в почву высоких доз минеральных удобрений
крайне неблагоприятно сказывается на плодородии почвы. На
малобуферных почвах при внесении физиологически кислых
удобрений в почвенный раствор переходят соединения алюминия,
оказывающие токсическое действие на растения и микроорганизмы
почвы. Токсичность этого элемента проявляется в нарушении
поступления необходимых элементов минерального питания,
повреждении протопласта, изменении активности ферментных
систем.
Рассмотренные негативные свойства применения избыточно
высоких доз удобрений не могут служить причиной полного
отказа от них, так как это вызовет катастрофическое снижение
344
производства продовольствия. Необходимо совершенствовать
технологии производства и использования удобрений, при
которых были бы полностью исключены все нежелательные
последствия. Дозы удобрений следует определять с помощью
балансовых расчетов на основании знаний о выносе питательных
веществ с урожаем и коэффициентов использования питательных
веществ из почвы и удобрений с учетом величины планируемого
урожая. Введение противоэрозионных систем земледелия,
известкование кислых почв, использование гранулированных и
медленно растворяющихся удобрений повышают их
эффективность и предотвращает загрязнение среды.
Контрольные вопросы
1. В чем заключается структурообразовательная роль Са и М§ в клетке? 2. На
листьях какого яруса в первую очередь обнаруживаются симптомы недостатка
фосфора и калия? 3. В чем сущность апопластического и симпластического
транспорта веществ в растении? 4. С какими физиологическими процессами
наиболее тесно связана поглотительная деятельность корневой системы? 5.
Какова зависимость усвоения различных форм азота от рН среды? 6. На каком из
этапов онтогенеза значение реутилизации для растения становится особенно
важным? 7. Каковы основные преимущества выращивания растений на тонком
питательном слое по сравнению с выращиванием в питательном растворе?
8. Какие функциональные расстройства наблюдаются при избыточном и
несбалансированном питании растений?
Г л а в а 6
ОБМЕН И ТРАНСПОРТ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
В РАСТЕНИЯХ
Растительный организм представляет собой сложную
самоорганизующуюся и саморегулирующуюся биологическую систему, в
которой постоянно происходят процессы синтеза, распада и
превращения органических веществ, направленные на поддержание
его жизненных функций при изменяющихся условиях внешней
среды. Главная особенность растений, отличающая их от других
организмов, — способность синтезировать огромный набор
простых и сложных органических соединений из воды, диоксида
углерода и минеральных веществ, используя при этом в качестве
первоисточника энергии кванты света, т. е. для них характерен
автотрофный (фототрофный) тип питания.
Однако внутри растения между его органами и тканями
наблюдается довольно выраженное разделение функций и
собственно автотрофный тип питания имеют лишь клетки, в которых
происходит фотосинтез, тогда как все другие клетки
растительного организма питаются гетеротрофно и поэтому зависят от
поступления в них органических веществ, образующихся в фото-
синтезирующих тканях. В связи с этим важную роль в
обеспечении взаимосвязи между клетками организма, а также его
тканями и органами играет транспорт веществ, осуществляемый с
помощью специальных транспортных систем.
Органические вещества, поступающие в те или иные клетки
по транспортным системам растения, используются в них как
источники энергии и биохимические предшественники для
образования структурных компонентов клетки и целых органов,
различных запасных веществ, а также большого набора
биологически активных соединений, выполняющих каталитические, регуля-
торные, защитные и другие функции.
В каждой клетке растительного организма одновременно
протекают тысячи реакций, которые катализируются ферментами и
осуществляются в нужном направлении с помощью систем
регуляции, обеспечивающих согласованный ход всех биохимических
превращений. Всю совокупность биохимических реакций,
происходящих в процессе жизнедеятельности организма, принято
называть метаболизмом или обменом веществ, а различные
продукты таких реакций — метаболитами. Последовательности
биохимических реакций, связанных с биосинтезом и превращениями
определенных химических веществ или групп структурно близ-
346
ких соединений, называют метаболическими путями, которые
очень часто организованы в виде циклических процессов и
некоторые из них уже были рассмотрены ранее.
6.1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ОБМЕНА ВЕЩЕСТВ
В РАСТИТЕЛЬНОМ ОРГАНИЗМЕ
В любом живом организме обмен веществ складывается из
двух противоположно направленных процессов, идущих с
поглощением или выделением энергии, — анаболизма и катаболизма.
В ходе анаболических процессов в клетках организма происходит
синтез сложных органических веществ из более простых
соединений, требующий для своего осуществления значительной
затраты энергии, которая высвобождается в катаболических
процессах, связанных с распадом крупных молекул и последующим
окислением образующихся метаболитов. Следовательно,
анаболические и катаболические процессы тесно связаны между
собой и поэтому ускорение биосинтетических реакций почти
всегда сопровождается усилением распада веществ.
Как уже отмечалось, первичным источником энергии для
растений являются кванты света. Хлоропласты фотосинтезирующих
клеток с помощью фотохимических систем превращают энергию
света в химическую энергию макроэргических связей АТФ и
восстановленных форм нуклеотидов НАДФН, которые далее
участвуют в синтезе углеводов и других соединений.
Значительное количество образующихся в листьях органических веществ,
превращаясь в их транспортные формы, переносятся в другие
органы растения, где происходит катаболический распад этих
соединений, сопровождающийся выделением энергии. Причем
эта энергия не теряется, большая ее часть используется для
образования АТФ и восстановленных форм нуклеотидов
(НАДН, ФАДНг, НАДФН), которые затем участвуют в
анаболических процессах синтеза новых органических веществ.
В процессе катаболизма происходит постепенный и
многоступенчатый распад сложных органических соединений. На
определенных стадиях такого распада у живых организмов выработаны
механизмы синтеза АТФ и восстановленных нуклеотидов,
обеспечивающих таким образом связывание выделяющейся при
распаде веществ энергии и перенос ее к биосинтетическим центрам,
где протекают анаболические процессы.
На первых этапах распада веществ преимущественно
происходят гидролитические процессы, в результате которых из сложных
углеводов (олиго- и полисахаридов) образуются моносахариды,
белки гидролизуются до аминокислот, жиры превращаются в
глицерин и жирные кислоты (рис. 106). Все эти реакции
катализируются соответствующими гидролитическими ферментами и
347
Липиды
Жирные Глицерин
кислоты '
р-окисление
НАД- Н
ФАД-Н2
Сложные
углеводы
I
Моносахариды
Гликолиз
Белки
I
I
Аминокислоты
I
Г
АТФ
НАД- Н
Пировиноградная
кислота
НАД- Н
Ацетилкофермент А
Пентозо-
фосфатный
цикл
а-кетоглутаровая
кислота I
Щавелевоуксусная
кислота
Окислительное
фосфорилиро-
вание
АТФ "21-
Рис. 106. Схема распада важнейших органических веществ
сопровождаются сравнительно небольшим изменением
свободной энергии.
На следующей стадии в результате окисления моносахаридов,
жирных кислот, глицерина, аминокислот образуются три важных
метаболита, занимающих центральное положение в обмене
веществ, — ацетилкофермент А, щавелевоуксусная и
а-кетоглутаровая кислоты. Через эти метаболиты осуществляется
взаимопревращение многих органических веществ в организмах, в том
числе белков, липидов, углеводов.
Большая часть моносахаридов, образовавшихся в результате
гидролиза олиго- и полисахаридов, окисляется в реакциях
анаэробной фазы дыхания (гликолиза), и конечный продукт этой
фазы — пировиноградная кислота — далее путем окислительного
348
I
декарбоксилирования превращается в ацетилкофермент А.
Кроме ацетилкофермента А в этих окислительных реакциях
образуются также восстановленные нуклеотиды НАД-Н.
При усилении биосинтетических реакций, в которых
необходимы НАДФ-Н, пентозы и эритрозо-4-фосфат, происходит
активирование ферментов пентозофосфатного цикла, и в таких
условиях значительное количество гексоз окисляется с образованием
этих метаболитов.
Основной механизм распада жирных кислот — р-окисление, в
результате которого образуются ацетилкофермент А и
восстановленные нуклеотиды НАД Н и ФАД-Н2- Другой продукт гидролиза
липидов — глицерин, как и моносахариды, подвергается
окислению в реакциях гликолиза. Многие аминокислоты в процессе
окисления также образуют ацетилкофермент А. Такие
аминокислоты, как глутаминовая, гистидин, пролин, аргинин, в процессе
окисления превращаются в сс-кетоглутаровую кислоту. Ряд других
аминокислот (аспарагиновая, фенилаланин, тирозин) образуют ща-
велевоуксусную кислоту. На определенных этапах окисления
аминокислот также возможен синтез восстановленных нуклеотидов.
Все три продукта данной стадии окисления —
ацетилкофермент А, щавелевоуксусная и а-кетоглутаровая кислоты — далее
включаются в реакции цикла Кребса и полностью окисляются до
диоксида углерода и воды. В ряде реакций этого цикла
образуются восстановленные нуклеотиды НАД-Н и ФАДН2, а при фосфо-
ролизе макроэргического сукцинилкофермента А из АДФ и
неорганического фосфата синтезируется АТФ.
Восстановленные нуклеотиды, образуемые в реакциях
гликолиза, р-окисления жирных кислот и цикла Кребса, могут
принимать непосредственное участие в биосинтетических реакциях,
однако большая их часть выполняет роль доноров электронов в
системе окислительного фосфорилирования, где их энергия
используется для синтеза макроэргических связей АТФ. Всего в
процессах катаболизма на синтез АТФ используется до 60 %
общего количества энергии, которая выделяется при окислении
органических веществ в живом организме.
Реакции синтеза органических соединений, происходящие в
клетках и тканях растений, сопровождаются увеличением их
внутренней энергии и поэтому могут осуществляться лишь при
сопряжении с другими реакциями, в ходе которых выделяется
свободная энергия. Для того чтобы сопряжение таких реакций
было возможным, должны выполняться по крайней мере два
условия. Первое заключается в том, что в катаболической
реакции должно выделяться больше свободной энергии, чем
поглощается в реакции синтеза, следовательно, в ходе сопряженных
реакций, как и при любом самопроизвольном процессе,
происходит уменьшение свободной энергии. Вторым требованием, не-
349
обходимым для осуществления сопряженных реакций, является
наличие переносчика энергии, роль которого обычно выполняют
промежуточные продукты, общие для этих реакций.
Как указывалось ранее, выделяемая в ходе катаболических
реакций свободная энергия связывается и запасается в виде АТФ
и восстановленных нуклеотидов, которые способны вступать в
сопряженные реакции синтеза веществ и передавать
значительную часть запасенной в них энергии для образования новых
соединений, являющихся продуктами этих реакций.
Очень часто в ходе реакций синтеза веществ происходит
активирование различных метаболитов путем их фосфорилирования с
участием АТФ. При этом образуются фосфорные эфиры этих
соединений, обладающие более высокой реакционной
способностью. Например, моносахариды в свободном виде не могут
участвовать в ферментативных превращениях, для того чтобы
вступить в реакцию, они сначала фосфорилируются с участием
ферментов фосфотрансфераз или киназ.
нон2с
н
он
;н но;
+ АТФ фруктокиназа
СН2ОН
он н
Р-О-фруктоза
ОН
+ АДФ
СН2ОН
ОН Н
фруктозо-6-фосфат
При фосфорилировании фруктозы, по существу, проходят
две сопряженные реакции: взаимодействие фермента с АТФ,
сопровождающееся образованием АДФ и уменьшением
свободной энергии (ДОГ' = ~31 кДж* моль""1), и синтез фосфоэфир-
ной связи фруктозо-6-фосфата, в ходе которого свободная
энергия увеличивается (ДО2°' — 16 кДж-моль"'). Таким
образом, общее количество свободной энергии в процессе
осуществления этих сопряженных реакций уменьшается
(ДО" = ДОГ' + ДОг" = —15 кДж'моль"1) и, следовательно,
они могут протекать самопроизвольно,
В процессе активирования молекул жирных кислот за счет
гидролиза двух макроэргических связей АТФ происходит
сопряженная реакция синтеза макроэргической тиоэфирной связи
С~8 ацетилкофермента А.
АТФ
о
II
К-С~8-КоА
о
ДС
-1
1 У /
= —42 кДж • моль I ДО = +37 кДж ■ моль
АМФ + Н4Р2О7 -*—^— К-.СООН + Н5—КоА
350
В клетках организмов изучено много биосинтетических
реакций, сопряженных с гидролизом АТФ, в ходе которых
происходят процессы карбоксилирования и декарбоксилирования,
синтеза амидных связей, образования макроэргических соединений,
способных переносить энергию от АТФ к анаболическим
реакциям синтеза веществ. Эти реакции играют важную роль в
процессах обмена веществ растительных организмов.
С участием АТФ и других макроэргических нуклеозидполи-
фосфатов (ГТФ, ЦТФ, УГФ) может происходить активирование
молекул моносахаридов, аминокислот, азотистых оснований,
ацилглицеринов путем синтеза активных промежуточных
соединений, являющихся производными нуклеотидов. Так, например,
в процессе синтеза крахмала с участием фермента АДФ-глюкозо-
пирофосфорилазы образуется активированная форма глюкозы —
аденозиндифосфатглюкоза, которая легко становится донором
глюкозных остатков при формировании структуры молекул этого
полисахарида.
сн2он
СН2ОН
+АТФ
АДФ
н но
глюкозо-1 -фосфат
н но
АДФ-глкжоза
Кроме АТФ в процессе катаболических реакций образуются
молекулы восстановленных нуклеотидов НАД-Н, НАДФ-Н,
ФАДН2, которые также способны связывать свободную
энергию, выделяемую при распаде веществ, и затем участвовать в
процессах анаболизма. Как правило, НАД-Н и ФАДНг являются
первичными донорами электронов в системе окислительного
фосфорилирования, обеспечивающей синтез АТФ в клетках
растительного организма, в которых не проходят фотохимические
реакции. В то же время установлено, что восстановительные
реакции биосинтеза веществ для своего осуществления требуют в
качестве восстановителя НАДФ-Н.
В цитоплазме растительных клеток, где происходят многие
восстановительные реакции синтеза веществ, отношение
концентраций НАДФН/НАДФ+ с помощью регуляторных систем
поддерживается на высоком уровне, тогда как отношение
НАДН/НАД+ очень мало. Последнее обусловлено тем, что в
биохимических реакциях, происходящих в цитоплазме клеток,
нуклеотидная система НАД+/НАДН, обладающая высоким
окислительным потенциалом, чаще всего выполняет роль акцеп-
351
Свет
СО.
>■ Фотосинтез
I— Глицин
Серии,
цистеин
г- Эритрозофосфат-
Хоризмовая кислота
гРибозо--
фосфат
Ароматичес-
кие-амино-
кислоты,
триптофан,
фенолы
Аминокислоты ■
семейства
аспарагиновой.
кислоты
Пиримидино-
вые нуклео-
тиды
Алании,
валин,
изолей-
цин
- 3-фосфоглицериновая
кислота
И
- З-фосфоглицсриновый
альдегид
Фруктозо-6-фосфат ^
- Фосфоенолпирови-
ноградная кислота
ГГлицерин
- Пировиноградная
кислота
Щавелевоуксусная -
кислота
Пуриновые
нуклеотиды
Нуклеиновые
кислоты
а-кетоглутаровая
кислота
Аминокислоты
семейства
глутаминовой
кислоты
{^- Моноса--
хариды
Гистидин
-Ацетилко--
фермент А
-Янтарная
кислота
-Лизин
{^Сложные
углеводы
Липиды ^К.
н
Г" Жирные
кислоты
ГлиоксиА
латный
цикл
Рис. 107. Основные пути синтеза и превращения важнейших групп химических
веществ в растительном организме
единением к молекулам синтезируемых веществ различных
радикалов, изомеризацией, образованием биополимеров.
Процессы, лежащие в основе анаболизма растений, включают
большое разнообразие метаболических путей, связанных с
синтезом определенных групп химических соединений, образуемых из
одного биохимического предшественника. В растительном
организме первичным продуктом фотосинтеза является
3-фосфоглицериновая кислота, из которой далее образуются все остальные
углеродсодержащие соединения.
В результате реакций, происходящих в цикле Кальвина и
гликолизе, 3-фосфоглицериновая кислота очень легко
превращается в 3-фосфоглицериновый альдегид, фруктозо-6-фосфат и
фосфоенолпировиноградную кислоту, которые способны к
взаимопревращениям и являются важнейшими предшественниками в
синтезе практически всех органических соединений (рис. 107). В
свою очередь, фосфоенолпировиноградная кислота является
ближайшим биохимическим предшественником пировиноградной,
щавелевоуксусной и а-кетоглутаровой кислот, образующих
метаболические пути синтеза многих аминокислот, жирных кислот и
нуклеотидов, превращения липидов в углеводы.
Рассматривая метаболические пути синтеза различных
химических веществ, следует отметить, что они включают не только
биосинтетические реакции, связанные с поглощением энергии и
усложнением структуры их молекул, но и определенные катабо-
лические стадии, сопровождающиеся деградацией химических
соединений и выделением свободной энергии. Поэтому в ходе
обмена веществ часто трудно определить, на каком этапе
заканчивается синтез веществ и начинается их биологический распад.
тора электронов и протонов при окислении различных
метаболитов.
В хлоропластах фотосинтезирующих клеток растений
содержится еще более сильный восстановитель, чем НАДФН, —
восстановленный ферридоксин, имеющий стандартный
окислительно-восстановительный потенциал (при рН 7) -0,41 В (тогда как
у НАДФ-системы -0,32 В). С участием этого восстановителя
происходят многие биохимические реакции в
фотосинтезирующих клетках растений (восстановление нитритов, синтез
глутаминовой кислоты, образование НАДФН и др.).
Кроме указанных биохимических механизмов, реализуемых
•клетками растений в процессе анаболизма, в ходе обмена
веществ происходят и другие реакции синтеза и превращения
веществ, связанные с внутримолекулярным и межмолекулярным
переносом определенных группировок, отщеплением и присо-
352
6.2. ТРАНСПОРТ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
ПО ФЛОЭМЕ
Важным звеном в обмене веществ растительного организма
является транспорт органических соединений, обеспечивающий
перенос различных метаболитов, энергетических продуктов и
физиологически активных веществ как внутри клетки, так и между
клетками организма, входящими в состав отдельных тканей и
органов растения. Главное направление перемещения
метаболитов в зеленом растении — это отток продуктов фотосинтеза из
листьев в другие органы: стебель, корень, цветки, плоды, клубни,
луковицы и другие структуры, предназначенные для запасания
органических веществ. Транспортную функцию выполняют
элементы сосудистой системы растения, называемые флоэмой. В
состав флоэмы входит несколько типов специализированных
клеток, включающих ситовидные элементы, клетки-спутники и па-
353
ренхимные клетки, волокна и склереиды. Все они выполняют
разные функции, но находятся в тесном взаимодействии.
Основные элементы флоэмы, по которым осуществляется
транспорт веществ, — ситовидные трубки и клетки-спутники,
которые образуют единую транспортную систему. Причем
каждый ситовидный элемент соединен с помощью плазмодесм с
одной или несколькими клетками-спутниками, возникающими
из одной и той же меристематической клетки, что и данный
ситовидный элемент. Торцевые концы ситовидных трубок
образуют перегородки в виде ситовидных пластинок, имеющих поры,
через которые проходят плазмодесмы, соединяющие соседние
ситовидные элементы (рис. 108).
В отличие от сосудов ксилемы, представляющих мертвые
структуры, ситовидные трубки являются живыми клетками, у
которых, однако, цитоплазма занимает небольшой объем,
образуя тонкий периферический слой вдоль клеточной стенки. В
цитоплазме таких клеток содержится очень много пластид, слабо
развиты мембранные системы эндоплазматического ретикулума
и нет ядра, которое в процессе формирования флоэмы
полностью отмирает.
В порах ситовидных пластинок обнаружены полисахарид кал-
лоза и флоэмный белок (Ф-белок), имеющий фибриллярную
структуру. Последний также содержится и во внутреннем
пространстве ситовидной трубки. Наиболее вероятные функции кал-
лозы и Ф-белка — участие в транспорте и предотвращении
потерь органических веществ при повреждении ситовидных трубок,
вызывая под давлением
закупорку пор ситовидных
пластинок.
Ситовидные трубки флоэмы
многочисленными плазмодес-
мами связаны с
сопровождающими их
клетками-спутниками, которые имеют крупное
ядро, довольно плотную
цитоплазму с большим
количеством митохондрий и рибосом,
что свидетельствует о высокой
Рис. 108. Схема строения ситовидной
трубки с клетками-спутниками:
/—клетки-спутники; 2 — вакуоли; 3—
аппарат Голыши; 4 — гранулярный эндоплаз-
матический ретикулум; 5—ядро;
6—митохондрии; 7—свободные рибосомы; 8— элег
мент ситовидной трубки; 9— клеточная
стенка; 10—плазмодесмы; 11— гладкий эн,-
доплазматический ретикулум; 12—
пластиды; 13— флоэмный белок в ситовидных
порах; 14 — ситовидная пластинка с порами
354
активности проходящих в них биохимических процессов. На
тесную связь клеток-спутников с находящимися рядом
ситовидными трубками указывает высокая плотность плазмодесм, которых
в этих структурах во много раз больше, чем в стенках клеток
любых других тканей.
Ситовидные трубки и клетки-спутники обычно окружены па-
ренхимными клетками, с участием которых происходит перенос
веществ к сосудам флоэмы. В составе проводящих тканей, в том
числе и флоэмы, находятся также одревесневшие клетки
склеренхимы в виде волокон или склереид, повышающих
механическую прочность сосудистых систем.
Флоэмные элементы стеблей растений образуют довольно
сложную систему, состоящую из параллельных пучков
ситовидных трубок, которые, по мере того как переходят в листья,
содержат меньше проводящих клеток, и самые мелкие сосуды —
одну ситовидную трубку с ее сопровождающими клетками.
Проводящая система листовой пластинки имеет много ветвлений, и
ее общая длина в расчете на 1 см поверхности листа может
достигать 1 м, так что на каждое флоэмное окончание
приходится всего лишь по нескольку клеток мезофилла листа. От клеток
мезофилла продукты фотосинтеза перемещаются к ближайшему
малому пучку.
Очень часто между элементами флоэмы и клетками
мезофилла находятся передаточные клетки, которые выполняют
функцию переноса веществ к ситовидным трубкам. Клеточные стенки
у них имеют многочисленные внутренние выросты,
увеличивающие площадь плазмалеммы. Передаточные клетки способны
поглощать фотоассимиляты из соседних клеток мезофилла и
передавать их через хорошо развитые утолщенные плазмодесмы
клеткам флоэмы.
Органические вещества передвигаются по флоэме в
растворенном состоянии в двух направлениях — вверх и вниз, что
отличает ее от ксилемы, по которой поток транспортируемых
веществ направлен только вверх. Одновременное перемещение
веществ по флоэме в противоположных направлениях,
по-видимому, происходит по разным ситовидным трубкам.
Более 80 % растворенных во флоэмном соке веществ
составляет дисахарид сахароза, которая служит основной транспортной
формой углеводов. Ее концентрация в жидкой фазе ситовидных
трубок может достигать 1 моль/л, тогда как в клетках мезофилла
листа она в 10—30 раз ниже. По флоэме могут также
переноситься и другие олигосахариды, восстановленные формы
моносахаридов — спирты, фосфорные эфиры моносахаридов. У злаковых,
лилейных и некоторых других растений транспортной формой
углеводов кроме сахарозы могут служить олигосахариды,
состоящие из остатков фруктозы, — фруктозиды.
Азотистые вещества транспортируются в растениях преимуще-
355
ственно в виде аминокислот и их амидов, концентрация которых
во флоэмном соке составляет 10—15 ммоль/л. В соке флоэмы
обнаружены также низкомолекулярные белки. Кроме того, в
небольшом количестве в нем содержатся органические кислоты,
витамины, фитогормоны (ауксины, гиббереллины, цитокинины),
наблюдается довольно высокая концентрация АТФ — 0,4—
0,6 ммоль/л. Из неорганических веществ во флоэме очень много
ионов калия (до 200 ммоль/л). Флоэмный сок имеет
слабощелочную реакцию (рН 8,0—8,5). Аминокислоты и амиды,
синтезируемые в корнях, в значительном количестве переносятся по
ксилеме, и их концентрация в ксилемном соке достигает 1,0—
2,5 ммоль/л.
Органические вещества передвигаются по флоэме с довольно
высокой скоростью — 20—100 см/ч. Например, у двудольных
растений через 1 см2 поперечного сечения ситовидных трубок за
1 мин проходит 0,2—0,5 г сухого вещества.
За передвижением органических веществ по транспортным
системам растения очень легко проследить с помощью
радиоиндикаторов. Для этого проводится экспозиция листьев растения в
атмосфере меченной 14С углекислоты, в результате чего
углекислота в ходе реакций фотосинтеза включается в углеводы и затем
в форме сахарозы переносится по флоэме в корни, где
происходит синтез аминокислот. В составе аминокислот 14С углекислоты
может быть снова обнаружен в листьях. На каждом участке
транспорта меченные С соединения обнаруживаются с
помощью радиоавтографии или индикатора радиоактивности.
Микрорадиоавтография срезов стебля растения показывает,
что из листьев в корни 14С-сахароза передвигается именно по
ситовидным трубкам флоэмы. С использованием радиоактивного
изотопа водорода трития, вводимого в сахарозу или
аминокислоты, установлено, что транспорт этих органических веществ
осуществляется по параллельным ситовидным трубкам, причем
одновременно как вверх, так и вниз, но по каждой ситовидной
трубке лишь в одном направлении.
Весьма наглядные результаты, доказывающие передвижение
органических веществ по флоэме, были получены в опытах с
кольцеванием деревьев, у которых в коре находится флоэма, а в
древесине — ксилема. На стволе дерева по окружности
вырезается часть коры и таким образом прерывается флоэмный
транспорт веществ в ту часть ствола дерева, которая находится ниже
кольцевого выреза коры, вследствие чего рост в нижней части
ствола замедляется.
Из перерезанной флоэмы начинает вытекать сок, содержащий
сахарозу и другие органические соединения. У некоторых
деревьев концентрация сахарозы во флоэмном соке настолько
высокая, что этот сок собирают и используют для получения сахара
(сахарный клен, сахарная пальма).
356
Общее направление транспорта органических веществ в
растении определяется локализацией и интенсивностью
биохимических процессов, связанных с их потреблением. Такие процессы
постоянно протекают в зонах роста (корневые и стеблевые
меристемы, молодые листья, цветки, плоды), где происходит
новообразование клеток и клеточных структур, а также в запасающих
органах и тканях (семена, клубни, луковицы, стебли,
корнеплоды и др.), в которых на определенных этапах онтогенеза
инициируется синтез запасных веществ, связанный с активным
поглощением фотоассимилятов и превращением их в нерастворимые в
воде высокомолекулярные соединения или структурные
элементы запасающих органов.
Клетки и ткани растений, в которых происходит интенсивное
потребление органических веществ, передвигающихся по
транспортным системам растений, называют аттрагирующими или
акцепторными зонами, а центры образования метаболитов,
подлежащих оттоку в акцепторные зоны, — соответственно донорами.
Главные доноры ассимилятов в растении — фотосинтезирующие
ткани, в которых осуществляется первичный синтез
органических веществ. На определенных этапах онтогенеза донорами
веществ для транспорта к акцепторным зонам могут быть
вступающие в фазу старения листья, запасающие ткани и органы
растения.
В формировании и поддержании в активном состоянии
постоянно существующих в растении акцепторных зон важнейшую
роль играют фитогормоны и другие эндогенные регуляторы
биохимических процессов, способные вызывать активацию генов,
индукцию и репрессию синтеза ферментов, оказывать влияние
на проницаемость клеточных мембран и функционирование
систем трансмембранного переноса ионов и веществ-метаболитов.
Участие фитогормонов в процессах обмена и транспорта веществ
в растительном организме можно выразить в виде следующей
схемы.
Внешняя
среда
Онтогенез .
• 1 1
1 < 1
Синтез
гормонов
^
Органы
фотосинтеза
:♦ \
♦ : ♦
Зоны
роста
^
Транспорт
веществ
Генетическая программа
развития растений
Синтез
гормонов
;♦
1 '
*:
<
Центры синтеза
запасных веществ
357
Согласно этой схеме на определенных этапах онтогенеза
активируется синтез гормонов, оказывающих влияние, с одной
стороны, на формирование акцепторных зон (зоны роста и синтеза
запасных веществ) и интенсивность проходящих в них
биохимических процессов, а с другой — на рост, развитие и
функциональную активность фотосинтезирующих тканей, в результате
формируется направленный поток органических веществ от
тканей-доноров к аттрагирующим центрам.
Как установлено, ауксины активируют процессы деления и
роста клеток растяжением, синтез РНК и белков,
функционирование Н+-помп и связанный с ними транспорт веществ через
мембраны клеток; все это приводит к тому, что усиливается
поглотительная активность клеток и тканей, где находятся эти
гормоны, и происходит формирование акцепторной зоны. Под
действием габбереллинов активируется деление клеток в зонах
роста, индуцируется синтез ферментов, участвующих в
новообразовании клеточных структур и запасных веществ, а также
мобилизации запасных веществ во время прорастания семян.
Заметное действие на поддержание аттрагирующей
способности тканей оказывают цитокинины, которые совместно с
ауксинами способны активировать деление клеток и их рост
растяжением, индуцировать синтез ферментов, участвующих в
новообразовании клеточных структур в зонах роста и
фотосинтезирующих тканях. В отличие от ауксинов, гибберелли-
нов и цитокининов абсцизовая кислота ингибирует многие фи-
зиолого-биохимические процессы, в том числе и транспорт
веществ, оказывая замедляющее действие на функционирование
Н+-помп.
Механизмы флоэмного транспорта органических веществ в
растениях до конца еще не выяснены и объясняются в виде
гипотез, проходящих экспериментальную проверку. Наиболее
признаны две гипотезы — массового потока растворенных
веществ под давлением и электроосмотическая.
Первая гипотеза была впервые сформулирована Э. Мюнхом в
1926—1930 гг. Согласно ей между фотосинтезирующими
клетками, где образуются органические вещества, и зонами активного
потребления ассимилятов (корень, плоды, клубни и др.)
создается осмотический градиент, трансформирующийся в ситовидных
трубках в градиент гидростатического давления, в результате чего
возникает направленный поток жидкости от органа-донора к
органу-акцептору (рис. 109). Создание повышенной
концентрации органических веществ в ситовидных трубках, составляющих
флоэмные окончания в листьях, происходит путем активного
транспорта с затратой значительного количества метаболической
энергии.
Поступление органических веществ в ситовидные трубки
усиливает в них осмотическое давление и вызывает приток воды из
358
Рис. 109. Механизм транспорта органических веществ
в соответствии с гипотезой Э. Мюнха:
А — зона загрузки ситовидных трубок ассимилятами, имеющая
повышенное осмотическое и гидростатическое давление
(флоэмные окончания в листьях, где происходит загрузка флоэмы); Б —
зона потребления ассимилятов клетками-акцепторами, имеющая
пониженное осмотическое и гидростатическое давление
(флоэмные окончания в акцепторной зоне); В — движение раствора
органических веществ по ситовидным трубкам в направлении
аттрагирующей зоны
ксилемы, вследствие чего создается зона
повышенного гидростатического давления. В
акцепторной зоне, наоборот, происходят
поглощение низкомолекулярных органических
соединений и использование их на синтез
высокомолекулярных запасных веществ и
структурных элементов, образующихся в зонах
роста новых клеток. В результате снижается
концентрация низкомолекулярных веществ и формируется зона
пониженного осмотического и гидростатического давления в
ситовидных трубках, находящихся в непосредственном контакте с
акцепторными клетками.
Таким образом, в транспортной системе флоэмы
формируются две зоны — с повышенным и пониженным гидростатическим
давлением. Между ними за счет перепада давления образуется
массовый поток жидкости с растворенными в ней сахарозой и
другими органическими веществами. Наличие гидростатического
давления в ситовидных трубках флоэмы подтверждено
экспериментально и не вызывает сомнения. Особенно наглядно это
продемонстрировано в опытах, где для изучения движения
веществ в элементах флоэмы использовали хоботок тли,
представляющий собой специализированный колюще-сосущий ротовой
аппарат, способный проникать в отдельную ситовидную трубку
(тля питается сахарами, переносимыми по флоэме). После
удаления тела тли из оставшегося в ситовидной трубке хоботка, как из
микрокапилляра, вследствие имеющегося там гидростатического
давления будет вытекать флоэмный сок.
Несмотря на целый ряд экспериментальных подтверждений,
гипотеза Э. Мюнха объясняет не все явления, связанные с
транспортом веществ. Она, например, совершенно не
доказывает, почему ситовидные трубки сохраняются живыми и
сопровождаются клетками-спутниками, для чего нужны ситовидные
пластинки и флоэмный белок, сильно замедляющие движение
массового потока жидкости по ситовидным трубкам. В какой-то
степени эти явления объясняет электроосмотическая гипотеза,
современный вариант которой был сформулирован в 1979 г.
Д. Спэннером.
Основная концепция этой гипотезы заключается в том, что в
359
ситовидных трубках флоэмы, как было указано, за счет разницы
гидростатического давления возникает массовый поток
растворенных веществ от органа-донора в направлении к аттрагирую-
щей зоне. Вследствие щелочной реакции среды (рН 8,0—8,5)
поверхность внутренней мембраны боковых стенок ситовидной
трубки и ситовидной пластинки за счет мембранных белков
имеет отрицательный заряд. Такой же заряд образуется и на
поверхности молекул флоэмного белка, находящегося, вероятно,
внутри пор ситовидной пластинки.
Вместе с массовым потоком по ситовидной трубке
перемещаются различные органические вещества и заряженные частицы-
ионы, особенно много во флоэмном соке ионов калия. Ионы
калия и другие катионы свободно проходят через поры
ситовидной пластинки, имеющей на поверхности отрицательный заряд,
и перемещаются в соседнюю ситовидную трубку, тогда как
анионы вследствие электростатического отталкивания не проходят
через ситовидную пластинку и накапливаются в данной
ситовидной трубке, создавая в ней отрицательный заряд (рис. НО).
Как только этот заряд достигнет определенной величины, за
счет возникающей разности потенциалов он вызывает перенос
протонов через мембрану из цитоплазмы во внутреннее
пространство ситовидной трубки, компенсируя в ней отрицательный
заряд. Однако в силу того, что регуляторные механизмы,
ограничивающие перенос протонов через мембрану, срабатывают через
некоторое время, во внутреннее пространство ситовидной трубки
поступает несколько больше протонов, чем требуется для
компенсации создавшегося отрицательного заряда, в результате чего
у поверхности ситовидной трубки на какое-то время возникает
положительный заряд, и тогда определенное количество К+ и
Рис. 110. Ускорение движения ионов и метаболитов через ситовидную пластинку
в соответствии с концепцией электроосмотической гипотезы:
А — движение положительно заряженных ионов (К+) и метаболитов (М) через поры
ситовидной пластинки и возникновение во внутреннем пространстве ситовидной трубки
отрицательного заряда; Б — поступление из цитоплазмы ситовидной трубки в ее внутреннее
пространство протонов (Н ), инициирующих движение ионов (К+) и метаболитов (М) через поры
ситовидной пластинки; В — обратный перенос протонов в цитоплазму ситовидной трубки с
помощью Н -помп
360
других катионов по законам электроосмоса перемещается к
отрицательно заряженной поверхности ситовидной пластинки и
далее мимо фиксированных в ее порах отрицательно заряженных
молекул Ф-белка в соседнюю ситовидную трубку.
Каждый движущийся катион окружен связанными с ним
молекулами воды, которые двигаются вместе с заряженной
частицей, образуя массовый поток жидкости и всех растворенных в
ней веществ, в том числе молекул сахарозы, не имеющих
электрического заряда. Таким образом, в результате передвижения
через ситовидные пластинки определенного количества катионов
за счет электроосмотических сил происходит ускорение
массового потока раствора, переносимого по флоэме.
Избыточный положительный заряд в ситовидной трубке,
возникающий в результате поступления протонов и вызывающий
импульс электроосмотического ускорения движения флоэмного
сока, с помощью регуляторных систем быстро погашается, и в
ситовидной трубке снова начинает накапливаться отрицательный
заряд и все процессы могут повторяться.
Погашение положительного заряда в ситовидной трубке
осуществляется с помощью АТФ-зависимых Н+-помп,
выполняющих обратный перенос протонов из внутреннего пространства
ситовидной трубки в цитоплазму. Энергия для этого процесса
генерируется в форме АТФ клетками-спутниками. Главный
недостаток электроосмотической гипотезы — отсутствие прямых
экспериментальных подтверждений основных ее положений.
Кроме изложенных известны и другие гипотезы,
представляющие попытки более полного объяснения механизмов флоэмного
транспорта веществ, однако они пока не подкреплены
экспериментальными результатами.
Как указывалось, концентрация сахарозы в проводящих
пучках листовой пластинки во много раз выше, чем в фотосинтези-
рующих клетках, и, следовательно, ее поступление в ситовидные
трубки происходит против градиента концентрации. Поэтому
перенос сахарозы и других метаболитов из ближайших клеток
листовой паренхимы в ситовидные трубки осуществляется с
помощью механизмов активного транспорта, функционирование
которых сопряжено с затратой энергии, чаще всего в виде АТФ.
Наиболее хорошо изученным механизмом трансмембранного
переноса метаболитов (сахарозы, аминокислот) против градиента
концентрации является их транспорт в симпорте (совместно) с
ионами Н+, которые активируют белки-переносчики,
находящиеся в мембране. При захвате протона молекула
белка-переносчика одновременно взаимодействует с сахарозой или другим
метаболитом, при этом происходит изменение конформации
белковой молекулы, вызывающее физическое перемещение
связанной с ней молекулы метаболита через мембраны. Движущий
механизм такого переноса метаболитов через мембрану — гради-
361
ент концентрации ионов водорода и связанный с ним
трансмембранный потенциал, который поддерживается с помощью АТФ-
зависимых Н+-помп.
По-видимому, в плазмалемме клеток-спутников
функционируют именно такие Н+-помпы, осуществляющие перенос протонов
в свободное межклеточное пространство (апопласт) и
генерирующие таким образом градиент ионов Н+ и трансмембранный
потенциал (Ад). Работа Н+-помп обеспечивается энергией за счет
гидролиза АТФ, интенсивно образующейся в клетках-спутниках,
которые имеют значительно больше митохондрий, чем
окружающие паренхимные клетки. При достижении определенной
величины трансмембрамиого потенциала протоны начинают
связываться с белками-переносчиками, также находящимися в плазма-
лемме, инициируя тем самым перенос метаболитов через
мембрану из апопласта в цитоплазму клеток-спутников, откуда по
плазмодесмам метаболиты переносятся в ситовидные трубки.
Образование АТФ в клетках-спутниках и работа Н -помп
активируются ауксином, а возможно, и другими эндогенными
регуляторами биохимических процессов. Функционирование Н+-
помп сопряжено также с поглощением клетками-спутниками
ионов К+, концентрация которых в ситовидных трубках, так же
как и сахарозы, очень высокая.
Повышение концентрации сахарозы и других органических
веществ в ситовидных трубках проводящих пучков листовой
пластинки вызывает приток в них воды из окружающих клеток и
ксилемы. Это создает значительное гидростатическое давление,
вызывающее движение сока по флоэме в направлении к аттраги-
рующим зонам, где гидростатическое давление ниже. Возможно,
что трансмембранные переносчики метаболитов, активируемые
соответствующими Н+-помпами, находятся не только в
мембранах клеток-спутников, но и в плазмалемме передаточных клеток,
а также в паренхимных клетках окончаний флоэмы.
В апопласте листовой паренхимы многих двудольных
растений содержится довольно много сахарозы (до 20 %
синтезируемой в листе) и других ассимилятов, являющихся источником их
поступления в сосуды флоэмы. Как установлено, фотосинтези-
рующие клетки очень легко выделяют сахарозу,
синтезирующуюся в их цитоплазме, в межмолекулярное пространство клеточных
стенок и относительно слабо ее поглощают, поэтому по мере
оттока этого дисахарида во флоэму его концентрация в
апопласте не снижается.
У значительной группы растений проводящие пучки в
листовой пластинке окружены клетками обкладки, стенки которых
непроницаемы для воды, поэтому транспорт органических
веществ в зоне обкладки должен проходить через симпласт, где
перенос веществ возможен благодаря движению цитоплазмы.
В акцепторной зоне клетки флоэмы и флоэмных окончаний
обладают повышенной способностью к выделению сахарозы и
других веществ в апопласт, а в плазмалемме акцепторных клеток
функционируют Н+-помпы и белковые переносчики
метаболитов. В результате работы Н+-помп происходит перенос протонов
из цитоплазмы акцепторных клеток в фазу клеточных стенок,
инициируя обратный поток протонов и ионов К+ по
электроосмотическому градиенту, при этом в симпорте с Н+-ионами
осуществляется перенос в цитоплазму клеток сахарозы и других
метаболитов. Далее по симпласту поступившие ассимиляты
могут переноситься в другие клетки.
В результате функционирования Н+-помп и постоянного
связывания метаболитов в ходе процессов новообразования клеток
и синтеза высокомолекулярных запасных веществ создается
поток направленного транспорта веществ, который может
прекратиться только при остановке процессов роста, инициируемых
фитогормонами.
Между процессами, происходящими в акцепторной зоне и
фотосинтезирующих клетках растений, существует довольно
тесная связь. При удалении с растения части листьев в оставшихся,
как правило, наблюдается усиление фотосинтетической
активности, компенсирующее вызванный потерей листьев дефицит
ассимилятов. При последующих актах удаления листьев
достигается определенный критический уровень, при котором
дальнейшее сокращение ассимиляционной поверхности уже не будет
компенсироваться усилением фотосинтеза оставшихся листьев, в
результате чего уменьшается поток ассимилятов, переносимых
по флоэме к акцепторной зоне, что, в свою очередь, вызывает
замедление ростовых процессов.
Благодаря функционированию транспортных систем
обеспечивается постоянный отток из фотосинтезирующих клеток
образующихся там метаболитов, что вызывает смещение в них
биохимических процессов в направлении синтеза этих веществ. Если
учитывать, что оттоку в другие органы подлежат, как правило,
конечные продукты многоступенчатых и взаимосвязанных
превращений веществ, то в результате понижения их концентрации
происходит направленный сдвиг всей последовательности
биохимических реакций, приводящих к синтезу этих конечных
метаболитов. В свою очередь, изменение концентрации метаболитов в
ходе биохимических превращений приводит в действие регуля-
торные системы клеток, вызывающие изменение активности
ферментов.
С другой стороны, при замедлении ростовых процессов
снижается аттрагирующая способность клеток акцепторной зоны,
вследствие чего повышается концентрация органических веществ
в ситовидных трубках флоэмы, вызывающая сильное
гидростатическое давление, которое ингибирует систему трансмембранного
переноса Сахаров в сосуды флоэмы. По-видимому, под воздейст-
363
вием повышенного внутриклеточного давления плазмалемма в
клетках-спутниках и клетках флоэмных окончаний листа
деформируется, вызывая изменение структуры белка-переносчика, что
приводит к ослаблению или полному ингибированию его
транспортной функции.
Механизмы регуляции, оказывающие влияние на
передвижение органических веществ в растении, заложены также в
самой транспортной системе. Например, известно, что работа
КГ-помп, приводящих в действие механизмы трансмембранного
переноса метаболитов, активируется ауксином и ингибируется
абсцизовой кислотой. Ключевую роль в загрузке ситовидных
трубок флоэмы транспортируемыми веществами играют клетки-
спутники, в которых за счет интенсивных дыхательных реакций
происходит образование АТФ, необходимой для
функционирования Н+-помп. Об интенсивных процессах дыхания,
происходящих в этих клетках, свидетельствует наличие у них большого
количества митохондрий, а также многочисленных свободных и
связанных с мембранами эндоплазматического ретикулума
рибосом. Уровень функциональной активности клеток-спутников в
значительной степени зависит от действия внешних факторов —
температуры, обеспеченности растений влагой и питательными
элементами, концентрации диоксида углерода и кислорода.
Контрольные вопросы
1. Что такое обмен веществ и как он происходит в растительном организме?
2. Каковы основные особенности анаболических и катаболических процессов и
какая между ними связь? 3. Какие важнейшие метаболиты и энергетические
продукты образуются в процессе катаболизма? 4. Какую роль играют АТФ и
другие макроэргическис соединения, а также восстановленные нуклеотиды в
синтезе органических веществ? 5. В чем заключаются основные принципы
осуществления биосинтетических реакций? 6. Каковы функции транспортной
системы растения, выполняющей перенос органических соединений? 7. Из каких
структурных элементов состоит флоэма и как они взаимодействуют между собой?
8. Каковы состав флоэмного сока и скорость его передвижения по сосудам
флоэмы? 9. Чем определяется направление транспорта органических веществ по
флоэме? 10. Какое влияние оказывают фитогормоны на функционирование
транспортной системы растения? 11. В чем заключается основная концепция
гипотезы Э. Мюнха, объясняющей механизм флоэмного транспорта
органических веществ в растениях? 12. Как объясняет механизмы транспорта веществ
электроосмотическая гипотеза? 13. Как осуществляется перенос метаболитов от
фотосинтезирующих клеток к сосудам флоэмы и от ситовидных трубок флоэмы к
клеткам акцепторной зоны? 14. Какие факторы влияют на интенсивность
передвижения органических веществ в растениях?
Глава 7
РОСТ И РАЗВИТИЕ РАСТЕНИЙ
7.1. ПОНЯТИЕ ОБ ОНТОГЕНЕЗЕ, РОСТЕ И РАЗВИТИИ
РАСТЕНИЙ
Онтогенез (жизненный цикл), или индивидуальное
развитие, — комплекс последовательных и необратимых изменений
жизнедеятельности и структуры растений от возникновения из
оплодотворенной яйцеклетки, зачаточной или вегетативной
почки до естественной смерти. Онтогенез является
последовательной реализацией наследственной генетической программы
развития организма в конкретных условиях внешней среды.
По продолжительности онтогенеза сельскохозяйственные
растения делят на однолетние, двулетние и многолетние.
Однолетние растения подразделяют на эфемеры — растения, онтогенез
которых совершается в 3—6 недель; яровые — растения
(зерновые, зернобобовые), вегетационный период которых начинается
весной или летом и завершается в это же лето или осенью;
озимые — растения, вегетация которых начинается осенью и
завершается летом или осенью следующего года. Двулетние
растения в первый год жизни образуют вегетативные и зачатки
генеративных органов, во второй год проходят цветение и
плодоношение. Многолетние растения (кормовые травы, плодовые и
ягодные культуры) имеют продолжительность онтогенеза от 3—
10 до нескольких десятков лет.
Однолетние и двулетние сельскохозяйственные растения
относятся к группе монокарпических, однократно плодоносящих
растений и после плодоношения погибают. Много
монокарпических растений среди двулетников (морковь, свекла, капуста),
которые зацветают после перезимовки. У поликарпических
растений плодоношение повторяется ряд лет. После плодоношения
отмирает побег или часть побега, реже одни плодоножки. К
поликарпическим относятся многолетние травы, ягодные
кустарники, плодовые деревья. Деление растений на монокарпические
и поликарпические условно. В тропических странах хлопчатник,
клещевина, томат и другие развиваются как многолетние
поликарпические формы, а в умеренных широтах — как однолетние.
Пшеница и рожь — однолетние растения, но среди них имеются
и многолетние формы.
Периодизация онтогенеза. В зависимости от используемых для
периодизации жизненных явлений и конкретных целей
онтогенез высших растений классифицируют по-разному и выделяют
365
I Ш^ВыкомшиваниЩ
уаметосраза п
I
Споро<раза2п
XII
1О- Полная спелость
Всходы
Рис. 111. Полный цикл развития цветкового растения (12 этапов органогенеза)
на примере пшеницы (по В. В. Мурашову, 1982)
вегетативный и репродуктивный периоды, фенологические фазы,
этапы органогенеза, возрастные периоды.
Вегетативный и репродуктивный периоды.
В течение первого периода интенсивно накапливается
вегетативная масса, усиленно растет корневая система, происходят
кущение и ветвление, закладываются органы цветка. Репродуктивный
период включает цветение и плодоношение.
Фенологические фазы. Отличаются четко
выраженными морфологическими изменениями растений.
Применительно к конкретным культурам фенофазы подробно описаны в
растениеводстве, овощеводстве, плодоводстве. Так, у растений
пшеницы и ячменя различают следующие фазы: прорастание семян,
всходы, появление третьего листа, кущение, выход в трубку,
колошение, цветение, фазы молочной, восковой и полной
спелости.
Этапы органогенеза растений. На протяжении
жизни растение формирует новые органы. Ф. М. Куперман
(1955) выделила 12 этапов органогенеза, отражающих морфофи-
зиологические процессы в онтогенезе растений (рис. 111). Мор-
фофизиологический анализ органогенеза растений позволяет
оценивать действие погодных условий, агротехники на растения
366
с целью повышения их продуктивности. Установлено, что на
I—II этапах происходит дифференциация вегетативных органов,
на III—IV — дифференциация зачаточного соцветия, на V—
VIII — формирование цветков, на IX — оплодотворение и
образование зиготы, на X—XII — рост и формирование семян. При
хорошем обеспечении хлебных злаков на II и III этапах водой и
азотом формируется крупный колос с большим количеством
колосков. Об окончании яровизации у озимых хлебов можно
судить по вытягиванию конуса нарастания и началу
дифференциации колосковых бугорков (III этап). Фотопериодическая
индукция заканчивается с появлением признаков дифференциации
цветков (V этап).
Основные возрастные периоды. В онтогенезе
растений выделяют пять этапов (рис. 112): эмбриональный —
образование зиготы; ювенильный — прорастание зародыша и
образование вегетативных органов; зрелость — появление зачатков
цветков, формирование репродуктивных органов; размножение
(плодоношение) — однократное или многократное образование
плодов; старение — преобладание процессов распада и м&чоак-
тивности структур. Изучение закономерностей онтогенеза
сельскохозяйственных растений — одна из основных задач частной
физиологии растений и растениеводства.
Определение роста и развития. Для характеристики
онтогенеза растений используют термины «рост» и «развитие». Рост
и развитие интегрируют все физиологические функции и
взаимодействие растительного организма с внешней средой.
Растение аккумулирует солнечную энергию, поглощает воду и
минеральные вещества, образует новые клетки и органы, в нем
происходят качественные изменения на протяжении всего
онтогенеза.
Рост. По Д. А. Сабинину (1963), рост — новообразование
цитоплазмы и клеточных структур, приводящее к увеличению
числа и размеров клеток, тканей, органов и всего растения в
целом. Рост растений нельзя рассматривать как чисто
количественный процесс. Так, появляющиеся побеги, листья качественно
отличаются друг от друга. Растения в отличие от животных
организмов растут в течение всей жизни, но обычно с некоторыми
перерывами (период покоя).
Развитие. По Д. А. Сабинину, развитие — качественные
/ изменения живых структур, обусловленные прохождением
организмом жизненного цикла. Более полное определение:
развитие — качественные изменения структуры и функций растения в
целом и его отдельных частей — органов, тканей и клеток,
возникающие в процессе онтогенеза. Процессы роста и развития
тесно взаимосвязаны. Однако быстрый рост может
сопровождаться медленным развитием и наоборот. Озимые растения при
367
Рис. 112. Основные этапы онтогенеза однолетнего семенного растения
(М. X. Чайлахян, 1989):
А — кукуруза, Б— картофель; 1 — эмбриональная жизнь; 2—молодость; 3 — зрелость; 4-
размножение; 5—старение
весеннем посеве быстро растут, но не переходят к репродукции.
Осенью при пониженных температурах озимые растения растут
медленно, но в них проходят процессы развития. Показателем
темпов развития служит переход растений к репродукции.
Показатели темпов роста — скорость нарастания массы, объема,
размеров растения.
368
7.2. КЛЕТОЧНЫЕ ОСНОВЫ РОСТА И РАЗВИТИЯ
Основой роста тканей, органов и всего растения являются
образование и рост клеток меристематической ткани. Различают
апикальную, латеральную и интеркалярную (вставочную)
меристемы. Апикальная меристема — верхушечная образовательная
ткань стеблей и корней. Латеральная меристема (камбий, фелло-
ген) расположена параллельно боковой поверхности органа. Ин-
теркалярная меристема расположена в междоузлиях стебля и в
основании листьев растений злаков.
Клетка проходит ряд последовательных этапов (фаз) своего
роста и развития: деления (эмбриональная фаза), роста
растяжением (фаза растяжения), дифференцировки (фаза
дифференциации), старения и смерти (рис. 113).
Для эмбриональной фазы (деления) характерны деление клеток,
увеличение массы их протоплазмы и ядра. Клетки мелкие, с
очень тонкими стенками, вакуолей нет или зачаточные.
Дочерние клетки, достигая размеров материнской, могут вновь
делиться. Эмбриональные клетки точек роста синтезируют ауксин. Для
делящихся клеток характерно относительно низкое содержание
ИУК и АБК и высокое — цитокининов. Предполагают, что
имеется специфический белок деления клетки, который индуцирует
митоз. Биосинтез его заканчивается за несколько десятков минут
до начала деления клетки. Для деления клеток необходимы
витамины: тиамин, пантотеновая кислота, аминобензойная кислота,
пиридоксин, фолиевая кислота, мезоинозит, аминокислоты (цис-
ЧИП'.;.^-ии. .._.'! '•!,1Х-Л-:2ЁЭ
Рис. 113. Этапы роста и развития клетки:
деление клетки; 2—растяжение клетки; 3 — дифференциация клетки
369
теин, триптофан), а также пурины (гипоксантин, ксантин,
мочевая кислота), содержащиеся в значительных количествах в
эмбриональных тканях. Для зон клеточного деления характерен
интенсивный обмен веществ. После 3—5 делений клетки
периферийной зоны переходят в фазу растяжения. Инициальные же
клетки меристемы продолжают делиться на протяжении всего
периода роста растительного организма, оставаясь
эмбриональными.
Для фазы растяжения характерно быстрое увеличение объема
клеток, который возрастает в 50—100 раз. Рост клетки
происходит благодаря увеличению вакуоли, растягивающей клетку. Вода
поступает в вакуоль осмотически. Концентрация клеточного сока
повышается за счет Сахаров, аминокислот, ионов. Резко
возрастает интенсивность дыхания в расчете на клетку. Условием роста
клеточной оболочки является ее разрыхление, которое связано с
действием ауксина. Ауксин индуцирует активный транспорт
ионов Н+ из цитоплазмы в клеточную стенку. В результате
снижается рН, что способствует разрыву связей кальция с
углеводными компонентами клеточной оболочки, увеличивает ее
пластичность. Рост клеточной оболочки обеспечивается
новообразованием составляющих ее полимеров. Ч
В конце фазы растяжения происходит лигнификация
клеточных стенок, повышается содержание фенольных ингибиторов и
абсцизовой кислоты, снижается содержание ауксина. Рост
растяжением обеспечивает увеличение площади листовых пластинок,
длины стебля и корневой системы растений. Следует отметить,
что клетка в фазе растяжения характеризуется не только
максимальной интенсивностью аэробного дыхания и поглотительной
активности, но и минимальной устойчивостью к
неблагоприятным факторам среды. Поэтому в неблагоприятных условиях
прежде всего повреждаются клетки, находящиеся в этой фазе.
В фазе дифференциациив структуре и функциях клетки
появляются характерные особенности, определяющие ее
принадлежность к конкретной специализированной ткани. Специализация
клеток происходит уже в меристематической зоне под влиянием
местоположения: клеточного окружения, полярности и др. Так,
из меристематической клетки органогенной зоны образуются.
клетки, формирующие лист, а в последующем — метамеры
соцветия; клетки же субапикальной зоны формируют стебель и
т. д. Специализация клеток является следствием
дифференциальной активности их генов. Важную роль в этом процессе играют
фитогормоны, особенно ауксин. На активность генов влияют и
внешние факторы (фитогормоны, свет и др.). Под воздействием
ИУК происходит укоренение черенков растений, в условиях
культуры тканей дифференцированная клетка может вновь стать
эмбриональной. Это явление наблюдается и у раневого каллуса.
В фазе дифференциации большие изменения наблюдаются в
370
клеточной стенке: откладываются новые слои целлюлозы,
включаются лигнин, суберин и др. Появляются клетки механических
и проводящих тканей. После дифференцировки в фазе зрелости
клетка выполняет функции, заложенные в ее организации.
Старение и отмирание завершают онтогенез клеток. В
результате преобладания гидролитических процессов над
синтетическими в стареющих клетках снижается содержание РНК,
белков, повышаются активность пероксидазы и кислых протеаз,
проницаемость мембран, разрушаются хлорофилл и хлороплас-
ты и др. Как отмечает В. В. Полевой (1989), имеются две
гипотезы, объясняющие механизмы старения: накопление
повреждений в генетическом аппарате, мембранах и в других
структурах, увеличение концентрации ядовитых веществ в
клетке; включение генетической программы старения как
последнего этапа онтогенеза. Процессы старения клетки того или
иного органа растения резко ускоряет уменьшение поступления
ауксина, цитокинина, гиббереллина, увеличение содержания
этилена и абсцизовой кислоты. \
7.3. ФИТОГОРМОНЫ КАК ФАКТОРЫ, РЕГУЛИРУЮЩИЕ
РОСТ И РАЗВИТИЕ ЦЕЛОСТНОГО РАСТЕНИЯ
Фитогормоны — соединения, с помощью которых
осуществляется взаимодействие клеток, тканей и органов и которые в
малых количествах необходимы для запуска и регуляции
физиологических и морфогенетических программ растений (В. В.
Полевой, 1989). Выделяют пять групп фитогормонов (рис. 114):
ауксины, гиббереллины, цитокинины, абсцизины, этилен.
Фитогормоны имеют следующие общие черты: это
сравнительно низкомолекулярные органические соединения;
вырабатываются растенкем;_действие проявляют в очень низких
концентрациях (10~13—10~5 моль/л); как правило, образуются в одной
части растения, а действуют в другой, куда транспортируются;
образуются в отдельных частях растения, но распространяются
по всему организму, составляя своеобразное гормональное поле;
регулируют крупные морфогенетические и физиологические
программы и подпрограммы; регулируют рост растений и
эндогенные вещества негормональной природы: фузикокцины,
полиамины, бататастины, фенолы и терпеноиды, производные мочевины,
витамины и др.
Ауксины — соединения преимущественно индольной природы:
индолилуксусная кислота и ее производные (индолил-3-ацеталь-
дегид, индолил-3-ацетонитрил, индолил-3-молочная кислота,
метиловый и этиловый эфиры ИУК, триптамин и др.). Ауксин
образуется из триптофана, который синтезируется из шикимовой
кислоты, возникающей в процессе дыхания из ФЭП (из глико-
371
Природные регуляторы роста
Фитогормоны-стимуляторы
Природные ингибиторы
- индолил-
3-уксусная
кислота
(ИУК)
Н I Н .
сн3 соон
Гиббереллин А 3
(габберелловая кислота)
СООН
Салициловая
кислота
Абсцизовая кислота
Рис. 114. Природные стимуляторы и ингабиторы роста растений
лиза) и Эр-4-Ф (из пентозофосфатного цикла) по схеме:
ФЭП -» Эр-4-Ф -» шикимовая кислота -> триптофан -■> ИУК
(рис. 115). Превращение триптофана в ИУК усиливается под
действием гиббереллина и уменьшается под влиянием хлорхо-
линхлорида, этилена и радиоактивного облучения.
Гибберемины являются тетрациклическими карбоновыми
кислотами — габберелловая кислота (ГА) и другие гиббереллины.
Известно более 70 гиббереллинов, различающихся деталями
строения. Наиболее распространенным и изученным является
гиббереллин Аз или гибберелловая кислота (ГАз). Гиббереллины
образуются из мевалоновой кислоты, синтезированной из ацетил
~КоА: ацетил ~КоА -» мевалоновая кислота -» гиббереллин
(рис. 116).
Цитокинины — производные 6-аминопурина, синтезируются
посредством конденсации аденозин-5-монофосфата и изопенте-
нилпирофосфата. Предшественником цитокининов являются ме-
валонат и пурин. Основным природным цитокинином служит
зеатин, выделенный из семян кукурузы молочной спелости.
Абсцизовая кислота (АБК) и ее производные — соединения
терпеноидной природы. АБК синтезируется двумя способами: из
мевалоновой кислоты через изопентилпирофосфат и геранилпи-
372
СН2-СН-СООН
Триптофан
СН2-С-СООН
1ЧН
Индол илимино-
пропионовая кислота
Индолилпиро-
виноградная кислота
СН2СООН
■СН2СНО
Ш
Индолилацетальдегид Р-Индолилуксусная кислота
Рис. 115. Биосинтез р-ицдолилуксусной кислоты
О
О
ОН
II
сн с —*- о-с-сн2-с-сн2-сн2он
3
о"
Ацетат
сн3
Мевалонат
ОРОР
Геранил-гераниол-
пирофосфат
НО
о
.сн,
' Н СООН
сн,
СООН
С,9-гиббереллины (А3) С20-гиббереллины (А,2)
Рис. 116. Биосинтез гиббереллииов
Каурен
рофосфат; в результате деградации каротиноидов, в частности
виолоксантина, через ксантоксин. В первом случае АБК
образуется из тех же предшественников (ацетат и мевалонат), что и
гиббереллины. Биосинтез АБК ингибируют цитокинины и
ингибиторы биосинтеза гиббереллинов.
Этилен — гормональный фактор, газ Н2С=СН2- Этилен
синтезируется из метионина. Ближайший предшественник
этилена — 1-аминоциклопропан-1-карбоновая кислота (АЦК).
Фенольные ингибиторы — вещества фенольной природы:
кофейная, хлорогеновая, коричная кислоты и др. Эти вещества не
являются фитогормонами. Они не передвигаются по сосудам и
действуют в концентрациях, в 2—3 раза больших, чем гормоны.
Общим для всех предшественников фенольных соединений
является наличие шикимовой кислоты. Дальнейшие ее
превращения приводят к образованию фенилаланина и тирозина, а затем
коричной и паракумариновой кислот, дающих начало всему
разнообразию фенольных веществ (около 2000).
Таким образом, следует подчеркнуть: все регуляторные
соединения синтезируются из аминокислот или органических кислот;
их биосинтез происходит из продуктов фотосинтеза и дыхания;
общие предшественники (хорезмовая, мевалоновая кислоты), от
которых возникают биосинтетические пути, направленные на
образование как стимуляторов, так и ингибиторов, являются
ключевыми.
7.3.1. ЛОКАЛИЗАЦИЯ БИОСИНТЕЗА ФИТОГОРМОНОВ В РАСТЕНИИ.
ТРАНСПОРТ ФИТОГОРМОНОВ
Каждая клетка способна синтезировать все группы гормонов.
Однако в системе целого растения на биосинтетические
функции клеток накладывается ряд запретов. Поэтому ауксины
образуются преимущественно в верхушечных меристемах стебля,
наиболее интенсивно в верхушке главного побега, и корня, а
также в молодых листьях (рис. 117). Содержание ИУК
колеблется от 1 до 100 мкг/кг сырой массы. Больше всего ИУК в
растущих почках и листьях, в пыльце и формирующихся семенах. В
почвенных условиях некоторые микоризные грибы выделяют
ауксин, который тормозит рост корней растений. Образование
клубеньков на корнях бобовых стимулирует ауксин,
синтезируемый клубеньковыми бактериями.
Гиббереллины синтезируются особенно интенсивно в растущих
апикальных стеблевых почках растений, в хлоропластах листьев,
в формирующихся семенах, в зародыше прорастающих семян.
Содержание гиббереллинов колеблется от 0,01 до 1,4 мг/кг
сырой массы.
Основное место синтеза цитокининов — в апикальной
меристеме корней. Образуются они также в молодых листьях и почках,
374
I
Рис. 117. Места
преимущественного образования и
направления транспорта
фитогормонов в растении
в развивающихся плодах и семенах.
Цитокинины обнаружены в галловых
опухолях на листьях растений, возникших
под действием паразитических грибов и
насекомых. Продуцирование
цитокининов клубеньковыми бактериями,
по-видимому, способствует формированию
клубеньков на корнях бобовых растений.
Абсцизовая кислота может
синтезироваться во всех органах растений и
особенно в старых. Содержание АБК 10 —
10 мг/г сырой массы. АБК богаты
старые листья, зрелые плоды, покоящиеся
почки и семена.
Этилен образуется в любом органе
растения. Наибольшая скорость
биосинтеза этилена в стареющих листьях и
созревающих плодах. Содержание
этилена 0,01—25 мкл/кг сырой массы.
Выделение этилена растениями тормозит недостаток кислорода.
Фенольные соединения присутствуют во всех тканях растений.
Их физиологическое действие проявляется при концентрациях,
на 2—3 порядка превышающих концентрацию фитогормонов.
Для обнаружения фитогормонов в растительном материале
используют специальные биотесты, методы газовой
хроматографии, масс-спектрометрии, иммунохимии. Накопление активных
фитогормонов в отдельных частях растений может быть не
только результатом их биосинтеза, но и транспорта, перехода из
связанного состояния в свободную форму.
Транспорт (передвижение) фитогормонов обеспечивает в
конкретных клетках, тканях и органах растения концентрацию и
соотношение гормонов, необходимых для их физиологического
действия. Транспортируются гормоны в 10 раз медленнее сахарозы.
Транспорт ауксина в растении проходит строго полярно, в
основном вниз по стеблю от верхушки побега к кончику корня
(базипетально), к рецепторным клеткам зоны растяжения корня.
Сюда вливаются и потоки ауксина из листьев. Полярный
транспорт ауксина, возможно, является одной из причин полярного
характера роста и морфогенеза растений (В. В. Полевой, 1988).
Транспорт ауксина — активный процесс; он проходит по клеткам
флоэмы, а также по симпласту и апопласту других тканей
растения. По В. В. Полевому, полярный транспорт ауксина
заключается в следующем: в апикальный конец клетки ИУК проникает
пассивно (вместе с ионами Н+), а в базальном конце активно
секретируется через клеточную мембрану. ИУК является
гормоном, транспорт которого происходит наиболее медленно (5—
15 мм/ч) и может контролироваться. Экзогенный ауксин, нане-
375
сенный на корни растений, способен передвигаться по ксилеме
вверх в акропетальном направлении.
Гиббереллины передвигаются в растениях неполярно, пассивно
вверх-вниз и латерально. Однако гиббереллины
преимущественно перемещаются акропетально по флоэме и ксилеме, куда
поступают по клеткам радиальных лучей. Скорость транспорта гиб-
береллинов по сосудистой системе около 5 см/ч.
Цитокинины транспортируются с водным током по сосудам
ксилемы из апексов корней в надземные части растения со
скоростью до 10—50 см/ч.
Абсцизовая кислота в растении перемещается в составе кси-
лемного и флоэмного соков и по паренхиме, главным образом в
направлении очагов высокой меристематической активности и
замыкающих клеток устьиц. АБК перемещается по растению со
скоростью 2—4 см/ч с затратами метаболической энергии.
Очевидно, ближний транспорт этилена по симпласту и апопласту не
требует специализированных механизмов. Предполагают, что
транспортной формой этилена является его предшественник —
аминоциклопропанкарбоновая кислота, перемещающаяся по
растению с транспирационным током.
Фенольные ингибиторы в растениях обычно не
транспортируются.
Таким образом, передвижение ауксинов идет в основном ба-
зипетально, цитокининов — акропетально, другие гормоны
передвигаются в обоих направлениях.
7.3.2. ОСОБЕННОСТИ ДЕЙСТВИЯ ФИТОГОРМОНОВ НА РОСТ ТКАНЕЙ
И ОРГАНОВ. ФОРМИРОВАНИЕ СЕМЯН И ПЛОДОВ
Фитогормоны полифункциональны, регулируют многие
физиологические процессы, физиологическое действие их на
растение зависит от следующих факторов:
специфики фитогормона — спектра физиологических действий
на растительный организм данного фитогормона;
специфики объекта — видовых, органных, тканевых,
возрастных и других особенностей растительного объекта,
определяющих его восприимчивость к фитогормону;
концентрации фитогормона — определенных границ
концентраций, в которых фитогормон активирует или ингибирует
данный физиологический процесс или функцию;
соотношения данного фитогормона с другими — от
функционирования многокомпонентной гормональной системы,
составляющей гормональное поле растения;
обеспеченности растительного объекта необходимыми
факторами минерального и углеродного питания;
эндогенного содержания фитогормона — ответной реакции рас-
376
тительного объекта на экзогенный гормон, зависящей от его
концентрации внутри растения;
напряженности факторов внешней среды (свет, температура,
вода и др.), создающих необходимые условия для действия
фитогормона. N
Физиологические функции фитогормонов. Действуя на
растение экзогенными гормонами, наблюдают возникшие эффекты и
судят о роли фитогормонов.
Физиологические функции ауксина.
Стимулирует все три фазы роста клеток. С этим действием связаны
образование корней, камбиальная активность и образование
каллуса, разрастание завязи партенокарпических плодов. Ауксин
регулирует формирование проводящих пучков, обусловливает
явления фото- и геотропизма у растений, связанные с
несимметричностью его распределения. Смещение ауксина на теневую или
нижнюю сторону стебля усиливает ее рост, что приводит к
изгибанию. В геотропизме корня кроме ауксина большую роль
играют также ингибиторы, синтезируемые в корневом чехлике
растущего корня. Ауксин регулирует двигательную реакцию листьев,
цветков и усиков растений.
Определяет апикальное доминирование — растущая верхушка
побега подавляет пробуждение и рост пазушных почек.
Регуляция этого процесса определяется взаимодействием ауксина с ци-
токининами и гиббереллинами. Гиббереллин усиливает
апикальное доминирование: При обработке же цитокинином пазушная
почка пробуждается и трогается в рост.
Стимулирует ризогенез и утолщение боковых корней.
Образование боковых корней является следствием активизации ауксином
деления клеток перицикла. Вторичное же утолщение корня
регулируется ауксином совместно с цитокинином. Ауксины
регулируют транспорт и распределение различных веществ в растении,
т. е. влияют на полярность тканей и органов растений, в том
числе и на полярность корнеобразования (Р. X. Турецкая, 1961).
Ауксин стимулирует образование корней на листовых и
стеблевых черенках.
Регулирует цветение, рост и созревание плодов. Ауксин
тормозит переход к цветению короткодневных растений и стимулирует
длиннодневных. У огурца при обработке ауксином возрастает
число женских цветков, увеличивается урожай плодов и семян.
Рост цветоноса розеточных растений зависит от транспорта
ауксина из цветка или соцветия. Ауксин пыльцы необходим для
роста пыльцевой трубки. Семена являются источником ауксина
в развивающихся плодах. При удалении их плод не растет,
однако после обработки ауксином его рост возобновляется. Изменяя
содержание ауксина в плодах, можно управлять их созреванием.
Синтетические аналоги ауксина — индолилмасляная кислота
(ИМК), нафтилуксусная кислота (НУК), 2-нафтоксиуксусная
377
кислота (НОУК), 2,4-Д, 4Х — обладают высокой
физиологической активностью.
Регулирует опадение листьев, завязей и плодов. С этой же
целью ауксины применяют при пересадке древесных и овощных
растений, при старении листьев, плохом опылении цветков,
образовании излишнего числа завязей и плодов. Образование
отделительного слоя является результатом уменьшения транспорта
ауксина из этих органов в черешок или плодоножку. Этилен
также ускоряет старение листьев, задерживает поступление
ауксина из листа в черешок и ускоряет его связывание, тем самым
подавляет действие ауксина на отделительный слой. Обработка
растений регуляторами роста позволяет уменьшить осыпание
завязей у томата, предуборочное опадение плодов и ягод, ускорить
опадение листьев хлопчатника для комбайновой уборки.
Физиологические функции гиббереллинов.
Регуляция роста растений. Гиббереллины стимулируют деление и
растяжение клеток апикальных и интеркалярных меристем. Это
хорошо прослеживается у карликовых и у длиннодневных
растений, находящихся в фазе розетки. Под действием гиббереллина
удлиняются стебель, листья, особенно у злаков, цветки, соцветия
становятся крупнее; у винограда образуются более крупные
гроздья. Обработка гиббереллинами не влияет на рост корня или
угнетает его при использовании повышенных концентраций.
Регуляция цветения. Гиббереллины играют важную роль в
процессах перехода растений к цветению. Необходимый для
зацветания длиннодневных растений уровень гиббереллина
формируется на длинном дне или в условиях пониженных температур
яровизации. Поэтому обработка растений гиббереллином
ускоряет цветение длиннодневных растений. На зацветание же ко-
роткодневных растений гиббереллины не действуют.
Вытягивание стебля и цветение розеточных длиннодневных растений
могут быть достигнуты обработкой гиббереллином даже в
условиях короткого дня. С помощью гиббереллина двулетники
переходят к цветению без яровизации. Гиббереллин смещает пол
растений в мужскую сторону (тыквенные, конопля).
Регуляция покоя. Семена и клубни многих растений после
уборки находятся в состоянии покоя и не прорастают даже в
благоприятных условиях увлажнения, аэрации и температуры.
Обработка гиббереллином вызывает их прорастание. Этот прием
используют для стимуляции прорастания свежеубранных клубней
картофеля при повторной его культуре.
Регуляция плодоношения. Развивающиеся после
оплодотворения семена продуцируют гиббереллины, необходимые для роста
и формирования сочноплодных плодов. Недостаток активных
гиббереллинов вызывает приостановку роста плодов. Обработка
гиббереллином способствует формированию крупных
бессемянных (партенокарпических) плодов у томата, винограда, перца,
378
цитрусовых, семечковых и косточковых культур. У некоторых
видов растений ауксин и гиббереллины примерно одинаково
индуцируют партенокарпию. Обработка гиббереллином
задерживает старение плодов цитрусовых, восстанавливает их зеленую
окраску.
Влияние на метаболизм растений. Обработка растений
гиббереллином повышает интенсивность фотосинтеза, несмотря на
уменьшение содержания хлорофилла, усиливает дыхание, при
нормальном водоснабжении интенсивность транспирации.
Поглощение растениями азота, фосфора и калия также обычно
возрастает.
Физиологические функции цитокининов.
Влияние на рост клеток. Цитокинины — первичный фактор
индукции клеточных делений, активизируют рост клеток
двудольных (но не однодольных) растений в длину, способствуют их
дифференцировке. Обработка же цитокинином совместно с ИУК
возвращает дифференцированные клетки к делению.
Цитокинины стимулируют образование стеблевых почек у каллусов. Эти
явления — результат усиления в клетках синтетических
процессов, синтеза ДНК, белка, нитратредуктазы, роста и развития
хлоропластов и других органелл.
Действие на органогенез. Цитокинины стимулируют
формирование почек и рост побегов, но угнетают рост корней, вызывают
переход к цветению некоторых растений в условиях
неблагоприятного фотопериодического или температурного режима.
Снятие апикального доминирования. Цитокинины освобождают
боковые почки от апикального доминирования, вызываемого
ауксином, и стимулируют их рост. Это используют для
получения ветвящихся растений в культуре, в селекции, провоцируя
обработкой цитокинином ветвление, отбирают неветвящиеся
формы растений.
Прерывание покоя. Обработка цитокинином выводит из
состояния глубокого покоя клубни и семена ряда растений, спящие
почки древесных растений, повышает энергию и всхожесть
семян гороха, кукурузы, люпина, ячменя, снизивших их в
результате нарушения режимов или длительного хранения.
Повышение аттрагирующей способности и задержка старения
листьев. При помощи цитокининов корни растения
активизируют рост надземных органов. Цитокинины, влияя на структурное
и функциональное состояние клеточных мембран, повышают ат-
трагирующую способность тканей и органов, в том числе
растущих плодов, семян, клубней. Они задерживают старение листьев.
Обработка цитокинином отделенных от растения стареющих
листьев вызывает как бы их омолаживание, вторичное
позеленение (К. Мотес, А. -Л. Курсанов, О. Н. Кулаева и др., 1964).
Участок изолированного листа, обработанный цитокинином,
притягивает меченые аминокислоты и другие метаболиты, в нем вос-
379
станавливаются структура хлоропластов, синтез хлорофилла,
синтез РНК и белка, повышается интенсивность фотосинтеза.
Недостаток цитокининов в листьях растения наблюдается в
практике при нарушении водоснабжения, затоплении, недостат-.
ке элементов минерального питания и др. В этих случаях
опрыскивание растений раствором цитокинина также задерживает
пожелтение листьев (сахарная свекла, махорка, подсолнечник).
Различные паразиты растений синтезируют цитокинины,
обеспечивая приток к месту своего развития питательных
веществ из других частей растения.
Физиологические функции абсцизовой
кислоты (АБК). Абсцизовая кислота является ингибитором
широкого спектра действия, делает возможным реализацию
активности других фитогормонов.
Влияние на процессы покоя. Переход в покой семян, клубней,
луковиц и почек связан с увеличением в них содержания АБК
(синтез АБК ускоряется на укороченном дне), наоборот, выход
из покоя и возобновление роста связаны с уменьшением
содержания ингибитора. Содержание АБК повышается в
зимующих органах многолетних бобовых и злаковых трав, озимых
зерновых.
Регуляция процессов старения и отторжения органов. Старение
растений и созревание плодов томата, земляники, груши, сливы,
винограда, хлопчатника и других культур связано со
значительным повышением содержания АБК. Она ускоряет распад
нуклеиновых кислот, белков, хлорофилла. Повышение содержания в
листьях абсцизовой кислоты вызывает общее старение листьев и
плодов, предшествующее их опадению. При этом АБК
взаимодействует с этиленом, биосинтез которого резко увеличивается.
Координация ростовых процессов. АБК выступает
координатором ростовых процессов, корреляционным ингибитором,
ответственным за торможение роста и метаболических процессов
определенных органов растения, которое необходимо для
нормального функционирования других органов. АБК может выступать
антагонистом, подавляет активность ауксинов, гиббереллинов и
цитокининов. В случае апикального доминирования абсцизовая
кислота действует противоположно ауксину. В определенных
условиях АБК действует как стимулятор: так, она способствует
образованию партенокарпических плодов у розы, удлинению ги-
покотиля огурца, образованию корней у черенков фасоли. АБК
определяет подавление роста корней под влиянием света и их
геотропическую реакцию. Это связано с наличием АБК в
корневом чехлике, из которого ингибитор передвигается в базипеталь-
ном направлении и накапливается в активно растущей части
корня, тормозит рост клеток растяжением.
Регуляция водного режима. АБК участвует в регуляции усть-
ичных движений. При обезвоживании листьев содержание АБК
380
быстро повышается. Это сопровождается закрыванием устьиц,
снижающим транспирацию. При подсыхании листьев некоторых
растений концентрация АБК повышается до 400—500 мг/г,
главным образом за счет интенсификации ее синтеза.
Обработка листьев пшендцы и ячменя АБК приводит к закрыванию
устьиц и существенному уменьшению потерь воды. Показано,
что АБК ингибирует амилазу устьичных клеток. Поэтому при
обработке листьев АБК осмотическое давление в устьичных
клетках быстро уменьшается в результате повышения
содержания крахмала и резкого падения ионов калия. Указанные
изменения и приводят к закрыванию устьиц. АБК участвует также
в регуляции поступления веществ в клетку, в стрессовых
реакциях растений.
Физлологические функции этилена.
Физиологические функции этилена многообразны.
Ингибирование роста. Этилен тормозит деление клеток,
удлинение проростков, останавливает рост листьев (у двудольных),
изменяет направление роста клеток с продольного на
поперечное, что приводит к уменьшению длины и утолщению стебля
(на этом основано применение ретардантов-этиленпродуцентов).
Регуляция процессов старения, опадения листьев и генеративных
органов. Этилен, способствуя старению тканей, ускоряет опадение
листьев и плодоэлементов. Это проявляется прежде всего в
специализированных клетках, участвующих в формировании
отделительного слоя. Этилен ускоряет созревание плодов и используется
для дозревания плодов в специальных камерах. При локальном
повреждении растение образует так называемый «стрессовый
этилен», который способствует отторжению поврежденных тканей.
Регуляция длительности покоя. Этилен увеличивает покой
семян, клубней, хотя в ряде случаев, наоборот, выводит почки из
состояния покоя, что используют при борьбе с сорняками. У
многих видов растений этилен ускоряет прорастание пыльцы,
семян, клубней и луковиц.
Влияние на генеративную сферу. Этилен способствует
смещению пола растений в женскую сторону, изменяет соотношение
женских и мужских цветков у некоторых сортов огурца,
способствует повышению урожайности. Обработка этиленом
способствует зацветанию некоторых видов растений, например манго и
ананасов.
Участие в корреляционных взаимодействиях. Этилен играет
роль медиатора гормонального комплекса в процессах
корреляционных взаимодействий в растении. Это отчасти
объясняется высокой подвижностью газа в растении. Этилен тормозит
полярный транспорт ауксина и способствует образованию его
конъюгатов. Именно с этим, по-видимому, связана способность
этилена усиливать процессы старения, опадения листьев и
плодов.
381
Предполагают, что в случае апикального доминирования
ауксин, синтезируемый делящимися клетками апекса, индуцирует
биосинтез этилена, который регулирует концентрацию АБК в
покоящихся пазушных почках. Для повышения концентрации
этилена в тканях растений их опрыскивают раствором этрела
(этиленпродуцент).
Физиологическая роль фенольных
соединений. Разнообразие этой группы соединений определяет ее
полифункциональность в растениях.
Фенолы влияют на процессы роста и развития. Активируя
оксидазу ауксина либо, наоборот, ингибируя ее действие,
фенолы, по-видимому, регулируют количество ауксина в клетке.
Фенолы имеют общий с ЙУК предшественник при биосинтезе.
Поэтому синтез фенолов может быть связан с замедлением
биосинтеза ауксина и наоборот.
Фенольные ингибиторы играют важную роль в покое семян,
почек, клубней и луковиц. Концентрация фенолов возрастает в
них при вхождении в покой и снижается при его завершении.
Фенолы участвуют в транспорте электронов при дыхании и
фотосинтезе, в биосинтезе лигнина; некоторые из них нарушают
окислительное фосфорилирование.
7.3.3. ФИТОГОРМОНЫ И СТРЕССОВОЕ СОСТОЯНИЕ
РАСТЕНИЙ
Устойчивость растений к воздействию неблагоприятных
факторов среды связана с защитными реакциями, формирующимися
с участием гормонов. В период действия стрессора преобладает
роль гормонов-ингибиторов, а при выходе растений из
состояния стресса — гормонов-активаторов. АБК является основным
фактором замедления обмена веществ при действии стресса, что
связано с ее способностью интенсивно накапливаться в клетках,
тканях и органах, а при улучшении условий быстро подвергаться
деградации. Абсцизовая кислота особенно быстро накапливается
в растениях при водном дефиците. Этилен также интенсивно
образуется в растениях в ответ на действие засухи, жары, на
повреждение насекомыми и инфекцию, на механические травмы
и др. «Стрессовый» этилен способствует отмиранию и
отторжению поврежденных тканей, листьев и других органов растений,
что обеспечивает нормальную работу растения в целом. При
засухе, недостатке элементов минерального питания и других
факторах нарушаются синтез цитокининов в корневых
окончаниях и их транспорт в надземную часть растений. С помощью
экзогенных цитокининов удается повысить устойчивость клеток
растений к разнообразным стрессовым воздействиям, сохранить
жизнеспособность листьев.
382
I
7.3.4. ВЗАИМОДЕЙСТВИЕ ФИТОГОРМОНОВ
Многокомпонентная гормональная система участвует в
управлении ростовыми и формативными процессами растений, в
реализации генетической программы роста и развития. В онтогенезе
в отдельных частях и в целом растении обеспечиваются
определенные градиенты гормонов, соотношение активаторов и
ингибиторов процессов, определенный гормональный статус. Этот
статус обеспечивается в растении путем синтеза новых порций
гормона, инактивацией гормона, транспорта гормона,
совместного действия гормонов и как результат усиления или
ослабления функций растения.
В. И. Кефели (1991) считает, что для обеспечения каждой
формы ростового процесса имеется доминирующий гормон, а
другие гормоны сопровождают его (рис. 118). Регуляцию
прорастания семян можно представить как доминирование гибберелли-
на, цитокинина или ауксина с редукционным содержанием
эндогенного ингибитора; регуляцию роста корня — как действие
ауксина с редукционным содержанием ингибитора; регуляцию роста
стебля — как функцию совместного действия гиббереллина и
ингибитора; старение стебля — как доминирование ингибиторов
(АБК, этилен) с редуцированным содержанием гиббереллинов;
старение листьев — как
доминирование АБК с
редуцированным содержанием
цитокинина. Следует подчеркнуть,
что ауксин индуцирует, а гиб-
береллин приостанавливает
процесс образования корней;
зеленение листа запускает ци-
токинин, а АБК его
останавливает. Цитокинин вызывает
рост боковой почки, а ауксин
приостанавливает его.
Стареющие органы обедняются
ауксинами и обогащаются
этиленом, начинается формирова-
з -— _____ А ь ^
ние отделительного слоя. Если
ауксины способствуют
биосинтезу белков, клетчатки и
пектинов в растении, то
этилен — их распаду.
Антагонизм цитокинина и
абсцизовой кислоты
проявляется в ростовых явлениях,
движении устьиц, в процессе
старения и др. Повышение
Рост
семядолей
ЦТ?
АБК
, Апикальное
\ доминирование
Растяжение
клеток
сренольный
ингибитор
Риженез
Ауксин
фенольный
ингибитор
Рост корня
Зеленение
листа
НТК
АБК
Опадение
Этилен
Ауксин
Рппт стебля
ГиМШШШ
АБК
Изгиб корня
ИУК
АБК
Рис. 118. Взаимодействие фитогормо-
иов при росте:
в числителе — стимулирующий фактор;
в знаменателе — подавляющий фактор
(по В. И. Кефели, 1984)
383
концентрации ауксина в одном органе растения приводит к
накоплению этилена и АБК в других, что имеет место при
коррелятивном ингибировании, суть которого в том, что
торможением роста одних органов обеспечивается нормальное
формирование других. Аттрагирующая способность тканей (по
притоку меченого фосфора 3^Р из листьев) от совместного
наложения на декапитированную верхушку стебля фасоли ли-
нолиновой пасты, включающей цитокинин, ауксин и гибберел-
лин, многократно возрастает по сравнению с действием одного
из гормонов.
Взаимодействие фитогормонов в растении на уровне
биосинтеза возможно благодаря их общему предшественнику и
взаимодействию метаболических ветвей, ведущих к активации или
подавлению биосинтеза гормонов конечным продуктом. Так, биосинтез
этилена может индуцироваться повышенной концентрацией
ауксина или его аналогов (2,4-Д, НУК и др.). Имеются данные, что
вызываемое экзогенными ауксинами опадение листьев,
подавление роста корня, стебля или почек обусловлены не ауксином, а
индуцированным им этиленом. В растущих клетках молодых
растений этилена образуется больше, чем в закончивших рост и
дифференцировавшихся. Это связано с тем, что синтез этилена в
ткани зависит от содержания в ней ауксина. АБК усиливает
переход в растении гиббереллинов в менее активные формы,
например А[ в А8.
Свет
иук
ГК
АБК
Прорастание
%
АБК
000
Покой
• ЦТ/С
Фототропизм
Этилен
ЦТК
Фотоморфоеенез
Этилен
Этилен
т
Опадение листьев
Созревание семян
АБК
\'
А6К ЦТК
Фотосинтез
Плодоношение
ЦТК
Цветение
Рис. 119. Фитогормоны в онтогенезе растений:
ГК — гибберелловая кислота; ИУК — индолилуксусная кислота; АБК — абсцизовая
кислота; ЦТК — цитокинин; АН — антезин
7.3.5. ВЛИЯНИЕ ФИТОГОРМОНОВ НА РОСТ И МОРФОГЕНЕЗ РАСТЕНИЙ
Благодаря работам отечественных (Н. Г. Холодный,
Н. А. Максимов, Ю. В. Ракитин, М. X. Чайлахян, Г. С.
Муромцев, В. В. Полевой, В. И. Кефели, О. Н. Кулаева) и зарубежных
исследователей сформировалось представление о
физиологической роли фитогормонов в онтогенезе растения, их
взаимодействии в реализации общей генетической программы роста и
развития растений и составляющих ее подпрограмм. Для
использования экзогенных регуляторов необходимо учитывать роль
фитогормонов в отдельные периоды онтогенеза данного
растения (рис. 119).
Прорастание семян. В набухающем семени центром
образования или высвобождения гиббереллинов, цитокининов и
ауксинов из связанного (конъюгированного) состояния является
зародыш. Из зародыша первые порции этих гормонов обеспечивают
мобилизацию запасных белков, углеводов и др., способствуя
питанию зародыша, а также стимулируют начало процессов
деления и растяжения клеток в осевых органах зародыша, запуск
всего ростового процесса молодого растения. Ведущая роль на
этом этапе принадлежит гиббереллину. Гиббереллин вызывает в
384
I
эндосперме синтез новых порций гидролитических ферментов,
которые расщепляют связанные гормонально-белковые
комплексы ауксинов и цитокининов. Следствием этого являются запуск
новых физиологических процессов, повышение ферментативной
активности эндосперма семян (амилазы, протеазы, фосфатазы,
эстеразы, пероксидазы). Апикальная меристема начавшего рост
зародышевого корня синтезирует цитокинины, которые
стимулируют рост колеоптиля и тормозят развитие боковых корней.
Синтезируемый в верхушке колеоптиля ауксин активирует
растяжение клеток в колеоптиле и мезокотиле, а также заложение
боковых и придаточных корней. Апикальные меристемы
образующихся корней интенсивно синтезируют цитокинины и гиббе-
реллины, стимулируя рост побега.
Развитие проростка. В дальнейшем лист прорывает колеоп-
тиль, и проросток превращается в ювенильное растение,
способное к автотрофному питанию. Регуляция роста отдельных
органов растения (стебель, корень, листья) осуществляется прежде
всего за счет изменения соотношения эндогенных гормонов и
определяется различиями в реакции каждого органа на сходные
изменения баланса фитогормонов. Так, для зон проростка с
385
интенсивным ростом клеток растяжения характерно высокое
содержание ИУК и относительно низкое АБК и цитокининов.
Напротив, делящиеся клетки отличаются сравнительно низким
уровнем ауксина и высоким цитокининов. Далее гравитация
ориентирует рост корня проростка вниз, а стебля вверх.
В процессе ориентации роста основную роль играют ауксин,
образующийся в апексе побега, и абсцизовая кислота,
синтезируемая в верхушке корня. Пробившись на поверхность почвы,
побег ориентируется в сторону света в результате повышения
содержания ауксина на теневой стороне проростка
(положительный фототропизм) и усиленного растяжения клеток этой зоны.
На свету проросток разворачивает листья, линейный рост
стебля несколько затормаживается, он утолщается, начинается
фотосинтез. В хлоропластах накапливаются гиббереллины, АБК,
ряд полифенолов. В листья из корней поступают цитокинины.
Активно растущие листья посредством движения черешков (фи-
лотаксис) располагаются на стебле так, чтобы фотосинтез был
максимальным. Филотаксис определяется ауксинами. Растущий
лист кроме собственных продуктов фотосинтеза использует асси-
миляты других листьев за счет синтеза или накопления в
молодом листе фитогормонов, способствующих притоку питательных
веществ. В полностью развившемся листе снижается содержание
этих гормонов и повышается концентрация ингибиторов роста.
Размножение. Перед цветением уменьшается активность
ауксинов, а ряд растений синтезирует большое количество
ингибиторов. Уровень гиббереллинов у длиннодневных растений резко
возрастает (М. X. Чайлахян, 1988). Для растущей пыльцевой
трубки характерно повышенное содержание ауксинов; после
оплодотворения в семяпочке возрастает уровень цитокининов, а
затем ауксинов. Семя становится активным центром притяжения
питательных веществ из других органов растения. В нем
накапливаются также фитогормоны в связанной форме. В период
активного роста семя обычно сильно оводнено, так как ауксины
интенсивно притягивают воду.
В последующем содержание ауксинов и гиббереллинов в
семени снижается при одновременном возрастании АБК.
Накапливающиеся ингибиторы роста способствуют экспорту питательных
веществ в семена и плоды. В сочных плодах при созревании
семян количество стимуляторов в их мякоти снижается при
одновременном увеличении содержания этилена и АБК.
В зимующих органах растений формируются зародышевые
структуры: почки с зачаточным стеблем, клубни с глазками,
луковицы и др., переходящие в состояние покоя. В растениях
снижается содержание гормонов-стимуляторов, накапливаются
ингибиторы и усиливается их активность. Первоначально
накапливаясь в листьях, ингибиторы затем перемещаются в почки,
обеспечивая переход растений в покой. В период глубокого
386
Рис. 120. Механизм корнеобразования
у клубненосного растения (М. X.
Чайлахян, 1984):
Д — длинный день; К — короткий день
покоя в растениях
уменьшается количество ингибиторов, а
содержание стимуляторов
интенсивно увеличивается весной
при возобновлении роста.
Состояние покоя, сопутствующие
ему ингибиторы роста
защищают многолетние и
зимующие растения и их органы
размножения от неблагоприятных
условий зимовки,
препятствуют неожиданному развитию
ростовых процессов.
Гормональная регуляция
клубнеобразования. Все пять
групп фитогормонов
принимают участие в клубнеобразова-
нии растений (М. X. Чайлахян,
1984). Процесс клубнеобразования проходит две фазы:
возникновение и рост столонов; формирование и рост клубней (рис. 120).
Функциональная роль, фитогормонов в этих процессах
следующая: ауксины синтезируются в стеблевых почках и прилегающих
молодых листьях, стимулируют корнеобразование и тормозят
образование клубней; гиббереллины синтезируются в листьях,
стимулируют рост столонов, задерживая образование клубней; абс-
цизины задерживают рост столонов и тем самым стимулируют
образование клубней; цитокинины синтезируются в корнях и
вызывают утолщение столонов и образование клубней.
Между содержанием в растущих клубнях картофеля
фитогормонов — стимуляторов роста и интенсивностью притока в них
ассимилятов из ботвы имеется прямая связь (А. Т. Мокроносов,
1973). Осенние клубни картофеля содержат большое количество
тормозящих веществ, поступивших из ботвы. Это АБК, феноль-
ные ингибиторы, наиболее активные в кожуре и периферийной
части паренхимы клубней. С началом зимы уровень ингибиторов
в клубнях снижается, а весной они почти полностью исчезают.
7.3.6. ИНАКТИВАЦИЯ ФИТОГОРМОНОВ В РАСТЕНИЯХ
Содержание фитогормонов в растениях на необходимом
уровне поддерживается процессами их биосинтеза и инактивации
(рис. 121). Инактивация фитогормонов происходит путем их
деградации (разрушения) с участием соответствующих
ферментативных систем. Связанные фитогормоны могут быть высвобождены
и вновь воздействовать на растения.
Деградация ИУК в растениях осуществляется пероксидазами,
387
Предшественники
Ферменты
БИОСИНТЕЗ
Ферменты
Конъюгаты
Активаторы
Ингибиторы
СВЯЗЫВАНИЕ | ОСВОБОЖДЕНИЕ
рН
Транспортеры
Ферменты
Физико-химические условия
ТРАНСПОРТ
МЕМБРАННЫЙ I ДАЛЬНИЙ
Механизмы
дальнего транспорта
активный и пассивный
РАЗРУШЕНИЕ
Биосинтез
Локализация
Другие фитогормоны
РЕЦЕПТОРЫ
Кофакторы
Ингибиторы
Ферменты
Активаторы
Протекторы
ДЕЙСТВИЕ
Мембраны Рибосомы
Ферменты
Хромосомы
Модификаторы
Рис. 121. Основные компоненты системы фитогормонов (В. В. Полевой,
Т. С. Саломатова, 1991)
действующими как оксидазы (ИУК-оксидаза). В растениях,
однако, содержатся также и ингибиторы ИУК-оксидазы (хлороге-
новая, феруловая, кофейная, синаповая и другие фенолкарбоно-
вые кислоты), которые действуют как синергисты ИУК,
например, при стимуляции образования корней. Цитокинины и АБК
также окисляются с помощью соответствующих оксидаз.
Этилен способен включаться в метаболизм вплоть до
образования СС>2 или окиси этилена, хотя избыточные количества его
обычно просто выделяются в атмосферу. Обратимое связывание
(конъюгация) ИУК происходит благодаря образованию
комплексов с белками, аминокислотами, углеводами. В связанном виде
ИУК не подвергается окислению. Много связанной ИУК в
семенах. Накопление ауксина в вакуолях также его иммобилизует.
Все эти процессы защищают клетки от воздействия
поступающего извне ауксина. Обратимое связывание гиббереллинов с саха-
рами (гликозиды ГА) и некоторыми другими соединениями
распространено у растений.
Связанные гиббереллины выполняют в растениях также
388
функции запасных и транспортных форм, что обнаружено при
изучении процессов транспорта веществ, созревания и
прорастания семян. Физиологическая активность гиббереллинов, в том
числе и инактивация, может быть связана с переходом одних
форм гормона в^другие (известно более 70 форм ГА).
Обнаружены конъюгаты цитокининов с сахарами (риботиды, рибозиды,
гликозиды), представляющие транспортные и запасные формы.
В растительных тканях имеется значительное количество глю-
козного эфира АБК, который при гидролизе высвобождает
ингибитор. Процессы метаболизма этого ингибитора проходят
наиболее интенсивно, очевидно, в апексах. Многие из фенольных
соединений токсичны для ферментов. Токсичность фенолов
неопасна благодаря связыванию их чаще всего углеводами с
образованием гликозидов и эфиров. Связанные фенольные
соединения обычно накапливаются в вакуолях, стенках клеток,
секреторных канальцах. Конденсация фенольных соединений также
является способом снижения их содержания и инактивации.
7.3.7. МЕХАНИЗМ ДЕЙСТВИЯ ФИТОГОРМОНОВ
Фитогормоны, обладая полифункциональным действием,
регулируют многие биохимические и физиологические процессы
растений. Каков предполагаемый механизм этого действия?
Перемещаясь в растении, гормоны проникают в клетки тканей-
мишеней, отличающиеся повышенной чувствительностью к
гормонам. Проникнув в клетки, гормон связывается с
белками-рецепторами, являющимися проводниками гормонального
действия в клетке. Взаимодействие гормона и рецептора приводит к
биохимическим реакциям, обеспечивающим реализацию
физиологического действия данного гормона. Известны два типа
рецепторов: внутриклеточные растворимые белки-рецепторы,
связывающие фитогормоны и мигрирующие между цитоплазмой и
ядром; мембранные белки-рецепторы, связывающие
фитогормоны из внеклеточного пространства. Рецепторы первого типа,
связав гормон, воздействуют на метаболизм в клетке, изменяя
уровень транскрипции соответствующих генов ДНК ядра и орга-
нелл (экспрессия генома). Обнаружены растворимые
связывающие белки первого типа для ауксина, цитокинина и гибберелли-
на. Мембранные белки-рецепторы второго типа, образовав
комплекс с гормоном, вызывают быстрое увеличение в клетке
концентрации метаболитов-посредников, при помощи которых
реализуется физиологическое действие фитогормона. Подобные
белки идентифицированы для ауксина, цитокинина, этилена,
АБК и фузикокцина. Таким образом, механизм действия
фитогормонов в клетке сводится прежде всего к активации
специфических генов, ответственных за синтез необходимых ферментов
389
Цитоплазма
Рецептор
Ядро
Активация
синтеза РНК
Активация
&&& &&о- синтеза
\
Влияние на метаболизм
клетки ^
Рис. 122. Схема действия цитокининов на метаболизм клеток листа
(по О. Н. Кулаевой, 1982)
(рис. 122). Фитогормоны воздействуют также на структуру и
функции клеточных мембран, рибосом, эндоплазматического ре-
тикулума, что приводит к изменению метаболизма клетки.
Механизмы действия как мембранно-связанных, так и растворимых
комплексов белок—гормон изучены крайне недостаточно.
Биосинтез самих фитогормонов контролируется геномом растения.
7.3.8. ИСПОЛЬЗОВАНИЕ ФИТОГОРМОНОВ И ФИЗИОЛОГИЧЕСКИ
АКТИВНЫХ ВЕЩЕСТВ
Изучение роли отдельных групп фитогормонов в регуляции
роста и развития растений определило возможность
использования этих соединений, их синтетических аналогов и других
физиологически активных веществ с конкретным физиологическим
действием в научных целях и в сельскохозяйственной практике
(рис. 123). Регулировать рост и развитие растений — значит
хорошо сбалансировать действия веществ, ускоряющих и
задерживающих эти процессы. Фитогормоны и синтетические
регуляторы роста широко используют в сельском хозяйстве. Некоторые
из применяющихся веществ служат синтетическими аналогами
природных регуляторов. Аналогами ауксинов являются индолил-
масляная кислота (ИМК), нафтилуксусная кислота (НУК), 2,4-Д
(2,4-дихлорфеноксиуксусная кислота) и др.; аналогами абсцизо-
вой кислоты и этилена — этрел, этерон и др. Созданы и многие
390
другие синтетические регуляторы роста, не имеющие природных
аналогов, меняющие гормональный статус растений и как
результат изменяющие течение физиологических процессов в
желательном для земледельца направлении.
Гербициды. Это синтетические препараты, вызывающие
торможение роста и гибель растений в связи с отмиранием точек
роста. Основой применения гербицидов является их
избирательное действие на различные растения. Разная чувствительность
растений к гербицидам связана с особенностями их морфологии
и обмена веществ, ферментативной системы. У чувствительных
растений гербицид нарушает полярность, вызывает утолщение
побегов, эпинастию, опадение листьев, морфозы, в результате
жизнедеятельность растений дезорганизуется и наступает их
гибель. В посевах злаков 2,4-Д избирательно подавляет двудольные
сорняки. Наоборот, ТХА (трихлорацетат натрия) и ДХМ (дихло-
ральмочевина) на посевах двудольных уничтожают злаки. В
посевах кукурузы симазин угнетает все другие растения.
Ретарданты. Это синтетические регуляторы, тормозящие
биосинтез гиббереллинов, подавляющие рост стебля и вегетативных
побегов, придающие растениям устойчивость к полеганию
(рис. 124). В то же время они способствуют росту корней,
листьев, повышают содержание хлорофилла, устойчивость растений
к неблагоприятным воздействиям. К ретардантам относятся ССС
(или тур), алар, которые сдерживают вегетативный рост кроны
плодовых деревьев и стимулируют плодоношение, фосфон, уско-
Прорастание
Рост стебля
+ ГК
Брассанолид
Цветение
Хранение
Покой
Устойчивость
Опадение
Устойчивость
Созревание
Плодоношение
\
Рис. 123. Химические регуляторы онтогенеза растений (по В. И. Кефели, 1984):
ГК — гибберелловая кислота; ССС — хлорхолинхлорид; В-9 — ретардант алар; ГМК — гидра-
зид малеиновой кислоты; ДЯК — ретардант алпр или В-9; ИМК — индолилмасляная кислота,
ИУК — индолилуксусная кислота;
(+) — стимуляция процесса; (-) — подавление процесса
391
Предотвращение полегания
зерновых культур
Получение гибридных
семян — сдвиг пола
в женскую сторону
Облегчение
механизированной
уборки плодов
Повышение
засухоустойчивости,
морозоустойчивости зерновых
и плодовых культур
Ускорение и
синхронность созревания
овощных и плодовых
культур
Предотвращение
опадения завязей
винограда
Ретарданты
и этиленпродуценты
(ССС, этефон, алар,
гидрел)
Увеличение
урожая семян
злаковых трав
Ускорение вступления
в период товарного
плодоношения плодовых
и ягодных культур
Химическая
чеканка
хлопчатника
Рис. 124. Применение ретардантов и этиленпродуцентов в сельском хозяйстве
У
ряющий выгонку декоративных культур и другие соединения.
ССС (хлорхолинхлорид) снижает рост соломины озимой и
яровой пшеницы, ярового ячменя, но делает ее стенки толще,
повышает продуктивную кустистость. Применяется против полегания
в посевах зерновых, семенниках злаковых трав. ССС можно
использовать при выгонке рассады овощных культур, в
частности томата. Он повышает морозоустойчивость клевера и люцерны.
Применение алара (продукт превращения янтарной кислоты)
ослабляет периодичность плодоношения, ускоряет заклйдку
цветочных почек и вызывает плодоношение молодых деревьев,
предупреждает преждевременное опадение плодов яблони,
груши, сливы, вишни, персика, черной смородины. Ретарданты
ССС, алар, фосфон и др. широко применяют в декоративном
садоводстве, так как они укорачивают и делают более прочными
цветоносы.
Регуляторы созревания. Это вещества, ускоряющие
достижение растением, его органами зрелого состояния. Стимуляция
партенокарпического образования плодов винограда, томата
достигается обработкой плодоэлементов гиббереллином, ауксином
и его аналогами (НУК, 2,4-Д, 2-хлорфеноксиуксусная кислота).
Задержка опадения завязей у томата достигается применением
ауксина. Обработка ауксином плантаций ананаса позволяет
вызывать зацветание и образование плодов в любое время года.
392
Применение физиологических аналогов ауксина может
приводить к интенсификации биосинтеза этилена, который ответствен
за ускорение созревания плодов, индукцию цветения некоторых
растений.
Обработка гиббереллином обеспечивает стимуляцию роста
листьев чайного куста, выгонку растений в декоративном
цветоводстве, получение длинноволокнистых стеблей и повышение
урожайности конопли, выход волокна и улучшение его
качества, повышение урожая земляники, черной смородины, огурца,
сокращение до 5—7 сут времени производства солода
(проростки ячменя), значительное повышение его качества.
Опрыскивание раствором кинетина растений подсолнечника на фоне
высокой дозы азотного питания приводит к стимуляции роста
растений, ускоряет их зацветание и увеличивает массу
корзинок.
Этрел, алсоп и другие доноры этилена (этиленпродуценты)
освобождают этилен при метаболизме в растительных тканях.
Этрел повышает урожайность огурца и других растений
семейства Тыквенных, так как при опрыскивании им молодых растений
увеличивается число женских цветков. Опрыскивание этрелом
уменьшает усилие, необходимое для отряхивания плодов и ягод,
облегчает механизированную уборку. Собранные зеленые томаты
хорошо дозревают потом в этиленовых камерах. Этот же метод
применим к плодам, которые в зрелом состоянии не выносят
транспортировки (бананы, томаты и др.). Погружение на 2—
3 мин в раствор этрела ускоряет послеуборочное созревание
зеленых плодов томата, бананов и дынь.
Регуляторы покоя. Продлить покой, улучшить лежкость
клубней, корнеплодов и луковиц можно обработкой посевов за 12—
15 дней до уборки гидразидом малеиновой кислоты (ГМК). Для
прерывания покоя свежеубранных клубней раннего картофеля
(для летних посадок) их обрабатывают раствором гиббереллина и
тиомочевины, что стимулирует пробуждение глазков. Для
прерывания глубокого покоя при зимней выгонке ландышей,
нарциссов, тюльпанов применяют этиленхлоргидрин.
Регуляторы вегетативного размножения растений. Для
улучшения корнеобразования у черенков, сеянцев, саженцев и взрослых
деревьев и кустарников применяют аналог ауксина (ИУК) —
НУК и ИМК. ИУК, попадая в ткани растения, быстро
разрушается и поэтому малопригоден для практических целей.
Дефолианты и десиканты. Применяют для ускорения
опадения и засыхания листьев, что необходимо при механизированной
уборке хлопчатника и других культур. Дефолианты — вещества,
вызывающие опадение листьев, десиканты — вещества,
способствующие обезвоживанию растительных тканей.
Активаторы (регуляторы) транспорта веществ в растении.
Приобретают все более важное значение синтетические регуляторы,
393
ускоряющие транспорт питательных веществ, активизирующие
их накопление в хозяйственно полезных органах (плодах,
семенах), повышающие их аттрагирующую способность. К таким
препаратам относятся вещества, интенсифицирующие отток
углеводов из листьев сахарного тростника или сахарной свеклы в
стебли или корни (ортонил и др.).
В заключение следует отметить, что современное сельское
хозяйство не может обойтись без применения экологически
безопасных, генетически безвредных регуляторов роста
растений.
7.4. БИОТЕХНОЛОГИЯ
7.4.1. ОСНОВЫ МОЛЕКУЛЯРНОЙ И КЛЕТОЧНОЙ БИОТЕХНОЛОГИИ
Одним из приоритетных направлений биологической науки в
последние годы стала биотехнология. В основе молекулярной и
клеточной биотехнологии лежит тотипотентность клеток —
способность растительной клетки при определенных условиях
развиваться в целый организм, основанная на полной генетической
информации в ее ядре. Культура тканей растений — область
биологии, изучающая клетки, ткани и органы, изолированные от
растения и выращиваемые на искусственных питательных
средах, 1п укго.
Изолированные органы, ткани, клетки, протопласты —
удобные модели для изучения метаболизма, роста и развития
растений. Как и любая другая модель, каждая из названных систем
проще моделируемого объекта, т. е. целого растения, и не
отражает всех присущих ему взаимосвязей. Однако собственные
достоинства моделей позволяют в ряде случаев точнее и глубже
понять сущность изучаемого явления. Среди этих достоинств:
выращивание растений в стерильных условиях, исключающих
артефакты, вносимые микрофлорой; изучение процессов на
уровне клетки, ткани, органа вне контроля со стороны других
органов, тканей и целого организма; возможность точного
контроля условий выращивания и более эффективного воздействия
регулирующими факторами; большая простота и сравнительная
однородность изучаемых объектов.
Стерильная культура растений и проростков дает
возможность изучать биохимические основы процессов роста и
развития, не опасаясь появления артефактов. Искусственные
питательные среды в отсутствие микрофлоры дают возможность
изучить влияние органических добавок и промежуточных
метаболитов.
Культура изолированных органов позволяет оценить
собственные возможности метаболизма и рост органа.
394
г
Рис. 125. Совместное действие ИУК и кинетина на рост и процессы дифферен-
цировки каллуса сердцевины стебля табака:
/—ИУК 2 мг/л; 2— ИУК 2 мг/л + кинетин 0,02 мг/л; 3 — ИУК 2 мг/л + кинетин
1 мг/л; 4— ИУК 2 мг/л + кинетин 5 мг/л
Для получения культуры клеток, тканей и протопластов
используют молодые растущие части растений. Поэтому меристе-
матические клетки были впервые использованы в культуре
тканей. Классическим объектом является табак.
Кусочек стерильного участка меристемы табака (эксплантат)
помещают на агар, содержащий необходимые питательные
вещества, а также гормоны ауксин и цитокинины, стимулирующие
деление клеток. На такой питательной среде клетки очень
быстро размножаются, образуя каллусную ткань. Каллус — это
беспорядочно делящиеся клетки, рыхло связанные друг с другом.
Часть каллусной ткани (трансплантат) используют для пересадки
на свежую питательную среду. Таким образом можно получить
большое количество каллусной ткани. Методы выращивания
изолированных тканей были впервые разработаны Ф. Уайтом и
Р. Готре (1949), дальнейшее развитие методов получения
каллусной ткани получено в лабораториях Б. Скуга и Р. Г. Бутенко
(1963).
Пересаживая часть каллусной ткани на новую питательную
смесь и изменяя в ней гормональный баланс, индуцируется
активность тех генов клеток, которые отвечают за переход в мерис-
тематическое состояние с последующей дифференцировкой
стеблевого и корневого апексов или эмбриоидной структуры. При
изменении соотношения ИУК: цитокинины в пользу ауксина в
каллусной ткани формируется группа клеток, которые дают
начало образованию зачатков побега. При увеличении
концентрации цитокинина в каллусе закладываются зачатки корней и
наблюдается процесс органогенеза (рис. 125). Иными словами,
изменение соотношения ауксинов и цитокининов в среде вызывает
у каллусной ткани процессы регенерации.
395
7.4.2. РЕГЕНЕРАЦИЯ РАСТЕНИЙ
Регенерации растений из культуры тканей можно достичь,
используя один из трех методов: культуру зародышей,
соматический эмбриогенез и органогенез. Культура зародышей
представляет собой стерильную культуру зиготических зародышей. Зародыш
изолируют из семени или семяпочки и помещают в
искусственные условия, заменяющие эндосперм (т. е. питательную среду).
Последующие развитие и прорастание зародыша происходят так
же, как в семени.
Соматический, или неполовой, эмбриогенез представляет
собой процесс формирования зародышеподобных структур из
соматических клеток. Соматический зародыш — это независимая
двухполюсная структура, физически не прикрепленная к ткани,
из которой происходит. Такие зародыши в дальнейшем могут
развиваться и прорастать в регенеранты через стадии,
соответствующие тем, что наблюдаются при развитии зиготы. Подобное
явление можно встретить у многих видов растений в условиях т
уКго при работе с культурами различных типов клеток, тканей и
органов, тогда как в природе такие процессы происходят внутри
семяпочки.
Формирование растений путем органогенеза состоит в
появлении и росте побегов из каллусов или в инициации и росте
побегов из пазушных почек, развившихся на культивируемых
верхушках побегов и образовавших впоследствии адвентивные
корни. Побег — это однополюсная структура, физически
связанная с тканью, из которой происходит.
Для образования каллусов можно использовать любые
эксплантаты: стебли, листья, корешки, черешки листьев, лепестки
цветков. Для получения морфогенного каллуса лучше всего брать
органы, в которых клетки митотически активны. Высокие
концентрации ауксинов и низкие — цитокининов вызовут
образование каллусной ткани (рис. 126). Интенсивность, тип и
продолжительность освещения, температура, соотношение 02 и СОг, а
также других газов, как и физический состав среды, — все это
важно в процессе морфогенеза культуры тканей растений.
Обычно каллус растет в темноте. Формирование побегов и зеленение
каллусов происходят на свету.
7.4.3. ВОЗМОЖНОСТИ МЕТОДА КУЛЬТУРЫ КЛЕТОК И ТКАНЕЙ
В РАСТЕНИЕВОДСТВЕ
Культура клеток и тканей может быть использована при
вегетативном размножении растений, для получения
безвирусных сортов и видов различных сельскохозяйственных культур,
для промышленного клонального размножения многих
растений.
396
Рис. 126. Культивирование меристемной ткани картофеля и прорастание
пазушных почек ш уНго (по Б. Тиссеру, 1989):
/ и 2— клубни, выращенные в полевых условиях; 3 — часть клубня, стимулированная на
образование побега; 4— меристемные ткани побега, пересаженные на среду без регуляторов
роста; 5— развитие придаточных корней; 6— развитие пазушных почек на среде с НУК; 7—
растение-регенерант с хорошо развитыми побегами и корнями. Можно перенести в почву (/)
или вызвать образование миниатюрных клубней на среде с БА
Кроме твердой агаризованной среды для культуры клеток
используют суспензионную культуру. Суспензионные культуры —
одиночные клетки и агрегаты, которые растут в жидкой
питательной среде определенного состава в стерильных условиях.
Необходимым условием получения суспензионной культуры
является перемешивание или встряхивание среды.
Обычно суспензию получают из рыхлой каллусной ткани,
помещая ее в исходную питательную среду.
Суспензионная культура используется для изучения путей
вторичного метаболизма, синтеза ферментов, экспрессии генов.
Она может служить источником получения ценных биологически
активных веществ, исходным материалом для клеточной
селекции.
Для проведения клеточной селекции применяют посев на ага-
397
ризованную среду. Конечная цель клеточной селекции —
получение растений из клеточных клонов.
Существуют два направления применения культуры клеток и
тканей для целей селекции. Одно связано с использованием
методов т уИго для получения новых форм растений путем
клеточной селекции и соматической гибридизации (получение
гибридов с помощью слияния изолированных протопластов,
выделенных из клеток тела растения).
Другое направление связано со вспомогательным
применением методов т У11го в традиционной селекции для ускорения и
облегчения селекционного процесса.
Для этого используют изолированные протопласты,
полученные после растворения клеточных стенок. Изолированные
протопласты способны поглощать макромолекулы и органеллы из
окружающего раствора. Благодаря этому, а также возможности
слияния протопластов, индукции у них меристематической
активности и регенерации целого растения культура
изолированных протопластов интенсивно используется как объект генной
инженерии и модификации растительной клетки. С их помощью
получают соматические гибриды отдаленных видов при их
половой несовместимости, а также новые формы растений путем
внедрения в клетку чужеродного генома или части его.
Эффективным приемом является введение в протопласт части генома,
ответственного за устойчивость к болезням.
В настоящее время генная инженерия приобретает все
большее фундаментальное и прикладное значение. Трансгенные
растения получены у довольно значительного числа культур. Среди
них такие хозяйственно ценные, как хлопчатник, картофель,
томат, рапс, подсолнечник, люцерна, клевер. Имеются
сообщения о трансформации видов из семейства злаковых и бобовых
культур.
Культивирование т укго пыльцы и пыльников позволяет
получать гаплоидные растения и каллусные ткани. Это
представляет большой интерес для генетики и селекции, так как у
гаплоидов легче выявить и отобрать ценные мутанты, а с помощью
колхицина можно получить полностью гомозиготные
диплоидные растения.
Растения используются в качестве не только источника
питания, но и поставщиков широкого набора химических
соединений, включая лекарственные препараты, инсектициды, пищевые
добавки, отдушки и красители. Чаще всего основной интерес
представляют продукты вторичного метаболизма растений. За
последние 30 лет на химически стандартных средах
культивировали множество различных видов растений, и в таких культурах
обнаружены многие продукты вторичного метаболизма,
представляющие практической интерес.
398
Развитию культуры клеток растений в качестве
альтернативного источника вторичного метаболизма способствовали
определенные преимущества этого способа, включая независимость от
сезонных условий, болезней и их переносчиков, и возможность
получать требуемый продукт, обладающий стандартными
качественными характеристиками в необходимых количествах.
Культуры клеток растений способны продуцировать вторичные
метаболиты в высоких концентрациях.
Для синтеза продуктов вторичного метаболизма используют
быстрый рост суспензионных культур в больших объемах, из
которых в результате дальнейшего культивирования получают
вторичные метаболиты. Быстрый рост суспензионных культур
клеток поддерживается с помощью регулярных пересадок на той
же среде. Для перехода в дальнейшем культуры клеток к синтезу
вторичных метаболитов необходимо подобрать подходящую
питательную среду, которая обеспечит как рост культуры, так и
образование продуктов вторичного метаболизма. После этого
важно повысить выход продуктов, манипулируя внешними
условиями культивирования: интенсивностью и качеством света,
газовым составом среды, температурой. Максимальный выход
продукта в соответствующих культурах клеток достигается
правильным сочетанием состава среды и внешних условий.
7.5. ЛОКАЛИЗАЦИЯ РОСТА У РАСТЕНИЙ
Рост растений происходит за счет деления и растяжения
клеток стебля, корня, листьев и плодовых органов. Ростовые
процессы локализованы в меристемах. Различают апикальные, ин-
теркалярные и латеральные меристемы. Апикальные, или
верхушечные, меристемы расположены на концах главного и боковых
растущих побегов и кончиках корней всех порядков. Это апексы,
или точки роста. Конусообразный апекс побега называют
конусом нарастания. Апикальные меристемы главного побега и корня
закладываются на ранних фазах развития зародыша. За счет этих
меристем осуществляются рост осевых органов в длину,
образование зачатка органа и первоначальное разделение его на ткани,
формирование всех надземных органов растения. Активируя или
подавляя деятельность апикальной меристемы, можно влиять на
продуктивность и устойчивость растений. По В. В. Полевому
(1989), апикальные меристемы побега и корня — это главные
координирующие (доминирующие) центры растения,
определяющие его морфогенез.
Стебель однодольных растений растет также за счет интерка-
лярной (вставочной) меристемы, расположенной в основании
молодых междоузлий и листьев. Утолщение стебля и корня
обеспечивают латеральные (боковые) меристемы: первичные —
прокамбий и перицикл и вторичные — камбий и феллоген. Посто-
399
янный рост растения на всех этапах онтогенеза позволяет ему
удовлетворять потребности в энергии, воде и элементах
минерального питания. Некоторые органы растений (листья, цветки и
плоды) растут до определенного размера, стареют и отмирают.
Для растений характерны регенерационные процессы.
Активность меристем зависит от влияния внешних условий,
сложных взаимоотношений внутри растительного организма
(полярность, корреляция, симметрия, возрастные изменения и
т. д.). В сельскохозяйственной практике при помощи полива,
подкормок, прореживания и других мероприятий можно влиять
на количество закладывающихся в конусах нарастания метамер-
ных органов (листья, побеги ветвления, соцветия, колоски,
цветки и др.), на их последующий рост, редукцию и в итоге на
продуктивность растений.
7.6. ОСОБЕННОСТИ РОСТА ОРГАНОВ РАСТЕНИЯ
Конус нарастания формирует компоненты побега: стебель,
листья, почки, цветки.
Рост стебля. Апикальная меристема стебля имеет размеры
0,1—0,2 мм в диметре и защищена листьями. Удлинение стебля
происходит благодаря росту образующихся верхних междоузлий.
При закладке генеративных органов пролиферация клеток
апикальной меристемы ускоряется. Этот процесс связан с
фотопериодической чувствительностью, яровизацией и другими
факторами. У злаков дифференциация колоса начинается в фазе
кущения. Для роста каждого отдельного междоузлия характерны
медленный первоначальный рост за счет деления клеток,
последующий быстрый рост при переходе клеток к растяжению и,
наконец, замедление роста клеток у зрелого междоузлия.
В благоприятных условиях самые длинные междоузлия
формируются в средней части побега. Очередное междоузлие
переходит к интенсивному росту при снижении его темпов у
предыдущего. У растущих междоузлий наружные ткани испытывают
натяжение {растягивание), а внутренние — компрессию (сжатие),
что наряду с тургорным давлением клеток обеспечивает
прочность стеблей травянистых растений. Боковое ветвление
происходит за счет роста пазушных почек, заложенных в верхушечной
меристеме побега, или прорастания придаточных, (адвентивных)
почек, закладывающихся на стеблях, листьях и корнях
некоторых растений. Утолщение — результат деятельности латеральных
меристем — камбия.
У однолетних растений деление клеток камбия заканчивается
к цветению. У древесных форм камбий с осени до весны
находится в состоянии покоя, который наступает сначала в ветвях,
затем в стволе и в корнях. Периодичность деятельности камбия
400
определяет наличие годичных колец в стволе дерева.
Пробуждение камбия весной связано с действием ауксинов, опускающихся
вниз из распускающихся почек. Темпы удлинения стебля
побегов регулируются поступающими ауксинами и гиббереллинами,
синтезируемыми стеблевыми апексами и молодыми листьями.
Гиббереллины транспортируются также из корня. Для
интенсивно растущих междоузлий характерно повышенное содержание
гиббереллинов и ауксинов. Отсутствие роста междоузлий у розе-
точных форм растения связано с недостатком гиббереллинов.
Высота растения определяется их геномом, а в значительной
мере — условиями выращивания.
Рост листа. Зачаточные листья возникают на конусе
нарастания побега в виде валиков или бугорков (примордия), клетки
которых и формируют лист. Интервал между заложением двух
листовых зачатков у разных растений составляет от нескольких
часов до нескольких суток и называется пластохроном. Величина
пластохрона зависит от условий выращивания. Несколько
зачатков листьев имеется в зародышевой почке, но большая их часть
формируется после прорастания. Закладка листьев связана с
изменением направления деления и растяжения клеток апекса в
разных его частях.
У двудольных листовая пластинка увеличивается путем
равномерного роста клеток (в основном растяжением) по всей
площади листа. Наличие нескольких точек роста определяет
образование зубцов, лопастей, листочков. У однодольных лист
удлиняется за счет базального интеркалярного роста. Утолщение листовой
пластинки осуществляется растяжением клеток палисадной
паренхимы и делением клеток мезофилла. Рост листа
прекращается, когда начинается интенсивный экспорт продуктов
фотосинтеза. Для формирования примордиев и тканей листа необходимы
цитокинин и ауксин. Ауксин влияет на образование проводящих
пучков, а гиббёреллин — на удлинение листовой пластинки.
Большое влияние на рост листьев оказывают интенсивность и
качество света. В темноте рост листа заторможен. Свет
стимулирует деление, но тормозит растяжение клеток. При затенении
листья крупнее и тоньше, чем на свету. Интенсивный свет
вызывает утолщение пластинки листа за счет образования
дополнительных слоев столбчатой паренхимы.
При недостатке воды формируются мелкие листья с ксеро-
морфной структурой, что связано с увеличением АБК и этилена.
При недостатке азота уменьшается число делений клеток за
период роста листа, сокращается его поверхность. Низкая температура
тормозит рост листа в длину и стимулирует утолщение. При этом
у морозостойких сортов озимой пшеницы длительность фазы
растяжения клеток сокращается в большей степени, чем у нестойких.
Особенности роста корней. В корневой системе растений
выделяют главный корень, боковые и придаточные корни. Первич-
401
ный корень формируется еще в зародыше семени, и его рост до
выхода из семени происходит путем растяжения базальных
клеток меристемы зародышевого корешка. У двудольных растений
зародышевый корень становится главным (стержневым),
образует боковые корни, формируется стержневая корневая система. У
однодольных растений первичный корень дополняется
придаточными корнями, образующимися в основании побега,
формируется мочковатая корневая система.
Прорастание семян начинается с появлением зародышевого
корня, который очень быстро растет, затем темпы его роста
снижаются при одновременном ускорении роста надземных
органов. В дальнейшем рост корня снова возобновляется.
Указанные особенности обеспечивают укоренение на первом этапе и
гармоничное развитие гетеротрофной и автотрофной частей
растения в последующий период.
У корней всех типов выделяют четыре зоны: деления,
покрытая корневым чехликом, растяжения, корневых волосков и
проведения (ветвления). У корней кукурузы, гороха, овса, пшеницы
и других растений растущая часть короткая — меньше 1 см. Чем
тоньше корень, тем короче его меристема. По сравнению с
надземными органами клетки корневой системы растут и делятся
гораздо быстрее. В корне короткая зона растяжения, что важно
для преодоления сопротивления почвы. Зародышевые корни
кукурузы, бобов, пшеницы развивают давление до 8—16 атм на
1 см . Ветвление корней в сочетании с высокой скоростью их
роста обеспечивает постоянное поглощение воды и ионов.
Боковые корни закладываются в зоне поглощения или выше.
При ветвлении различают корни первого, второго и
последующего порядков. Боковые корни закладываются в перицикле
материнского корня. Меристематические клетки образующегося
бокового корня выделяют гидролитические ферменты,
растворяющие оболочки клеток коры и ризодермы, обеспечивая выход
его наружу. Придаточные корни закладываются в меристемати-
ческих или потенциально меристематических тканях (камбий,
феллоген, сердцевинные лучи) разных органов растения (старые
участки корня, стебли, листья и др.).
Апикальная меристема корня формирует корневой чехлик,
выполняющий очень важные функции. Он защищает меристему
при продвижении корня в почве; клетки чехлика выделяют
полисахаридную слизь и постоянно слущиваются с его
поверхности; слизь содержит гликопротеины — лектины, защищающие
клетки меристемы корня от патогенов и высыхания при
недостаточной влажности почвы. Корневой чехлик является сенсорной
зоной, воспринимающей действие гравитации, света, давления
почвы, химических веществ, определяет направление и скорость
роста корня. В нем синтезируется АБК, меняется в обратном
направлении поток ИУК, поступающей из побега.
402
На границе с чехликом в меристеме находятся клетки
покоящегося центра, в состав которого входят инициальные клетки
разных тканей (500—1000 клеток). Покоящийся центр
восстанавливает численность клеток меристемы при их естественном
изнашивании или повреждении. Скорость деления и роста клеток
в корнях намного выше, чем в других органах растения.
В результате роста растяжением первоначальный объем ме-
ристематической клетки увеличивается в 10—30 раз за счет
образования и увеличения вакуоли. Этот процесс обеспечивается
увеличением содержания в вакуоли осмотически активных веществ
(ионов, органических кислот, Сахаров и др.), последующим
интенсивным поступлением в нее воды, в итоге гидростатическое
давление, создаваемое вакуолью, приводит к растяжению
клеточной оболочки. Для зоны растяжения корня характерны
повышенная интенсивность дыхания, активация ряда ферментов (аук-
синоксидаза, полифенолоксидаза, цитохромоксидаза и др.).
Некоторые эпидермальные клетки корня образуют корневые
волоски длиной 0,15—8 мм. Число корневых волосков у
кукурузы достигает 420 на 1 см поверхности корня. Корневые волоски
значительно увеличивают поглотительную поверхность корня.
Они функционируют в среднем 2—3 дня и отмирают. При
отсутствии кальция в питательном растворе, аэрации корневые
волоски не образуются.
Рост корня зависит от возраста и вида растения, условий
внешней среды. Благоприятные для фотосинтеза условия среды
способствуют росту корней, и наоборот. Затенение растений
или скашивание надземной части тормозит рост и уменьшает
массу корней. Оптимальная температура для роста корней
несколько ниже, чем для побега. Отношение корней к
температуре меняется в онтогенезе. Так, корни молодых растений
томата растут лучше при 30 °С, чем при 20 "С, а взрослых
наоборот. При высыхании почвы до влажности завядания рост
корней прекращается. При умеренном орошении корни
пшеницы располагаются в верхних слоях почвы, а без полива
проникают глубже.
Оптимальная плотность почвы для роста корней кукурузы и
других сельскохозяйственных культур 1,1—1,3 г/см3. В плотной
почве уменьшаются длина клеток и размер зоны растяжения
из-за образования этилена. Уплотнение почвы ухудшает
энергетический баланс растений, увеличивает затраты на дыхание.
Критическое содержание Ог в почвенном воздухе для
поддержания жизнедеятельности корней около 3—5 % объема.
Потребность корней в кислороде тем больше, чем выше
температура почвы. Минимальной потребностью в кислороде
отличаются рис и гречиха, а максимальной — томат, горох,
кукуруза. Корни риса имеют специальную воздухопроводящую
ткань — аэренхиму. У растений озимой ржи и пшеницы на
403
посевах, затопленных весной талыми водами, листья, находясь
в воздухе, также могут непродолжительное время снабжать
корни кислородом. Для роста корней большинства растений
оптимальный рН 5—6.
Гормональная регуляция роста корня. Для роста корней
необходимы низкие (10 п—10~'° М) концентрации ауксина.
Увеличение потока ауксина из побега тормозит рост корня в длину,
что объясняете^ и индукцией синтеза этилена. Гиббереллины не
влияют на рост корня, а цитокинины в повышенных
концентрациях тормозят его. АБК, образуемая корневым чехликом,
замедляет рост корня в длину. Верхушка корня тормозит
образование боковых корней, поэтому удаление ее стимулирует их
образование. По-видимому, это результат действия замедляющих
ризогенез цитокининов, образующихся в верхушке корня.
Заложение боковых корней начинается на таком расстоянии
от верхушки корня, где обеспечивается определенное
соотношение цитокинина и ауксина (активатора ризогенеза),
поступающих из стебля. Этилен способствует заложению боковых корней
ближе к верхушке корня, а обработка растений им вызывает
массовое образование придаточных корней. На плотных почвах
механическое сопротивление среды приводит к синтезу в корнях
«стрессового» этилена. При этом в зоне растяжения клеток
вместо удлинения возникает утолщение, что облегчает раздвигание
частиц почвы и последующее удлинение корня. Уменьшение
приростов корня может быть связано и с накоплением в клетках
ингибиторов фенольной природы и дальнейшей лигнификацией
клеточных стенок.
7.7. ЗАВИСИМОСТЬ РОСТА ОТ ВНУТРЕННИХ ФАКТОРОВ
Рост как сложная интегральная функция растений во многом
генетически предопределен. В росте растений каждого
конкретного вида и сорта имеются особенности, определяемые его
генотипом. Так, полиплоидные формы многих растений
отличаются увеличенным размером клеток, листьев, цветков,
плодов, всего растения. Гетерозис многих видов
сельскохозяйственных растений проявляется в ускорении роста
сельскохозяйственных растений (кукуруза, свекла, люцерна, огурец и др.)
и повышении их продуктивности. К внутренним факторам
роста относится особенность гормональной системы
конкретного растения. Разные формы роста регулируются различными
сочетаниями фитогормонов, сменяющихся в процессе
онтогенеза (В. И. Кефели, 1984). Регуляцию прорастания семян
можно представить как доминирование гиббереллина, ауксина
и отчасти цитокинина при редуцированном содержании
эндогенных ингибиторов, регуляцию роста корня — как действие
404
ауксина при редуцированном содержании ингибиторов,
регуляцию роста стебля — как результат совместного действия
гиббереллина и ингибиторов.
7.8. РОСТОВЫЕ ЯВЛЕНИЯ
Периодичность и ритмичность роста. Росту растений, его
органов, тканей и клеток свойственны периодичность и
ритмичность, обусловленные внутренними факторами и генетически
закрепленные в эволюции растений (Н. И. Шмальгаузен, 1935;
Д. А. Сабинин, 1957; Э. Бюннинг, 1961; В. В. Скрипчинский,
1977; Е. Е. Крастина, 1970; В. С. Шевелуха, 1980, и др.).
Благодаря периодичности роста и эндогенным ритмам растения
местной флоры хорошо приспособлены к конкретным условиям
местообитания. Ритмичность и периодичность ростовых процессов
растений наблюдаются в течение суток (циркадные,
околосуточные ритмы). У многолетних, озимых и двулетних форм период
активного роста прерывается периодом покоя. Линейный рост
растений тесно связан с ходом накопления биомассы и может
использоваться для оценки физиологического состояния
растений при агрономическом контроле за посевом. Применительно к
важнейшим сельскохозяйственным культурам Нечерноземья
России В. С. Шевелухой (1980) выявлено пять основных типов
суточной и онтогенетической периодичности и ритмичности
линейного роста растений и их органов в полевых условиях:
синусоидальный — кривая суточной скорости роста имеет макт
симум в дневные (10—12 ч) и минимум в ранние утренние (4—
6 ч) часы (озимая и яровая пшеница, озимая рожь, кукуруза,
сорго, овсяница луговая, тимофеевка луговая, ежа сборная,
кострец безостый и др.);
угловой — суточный рост характеризуется кривой с
восходящей и нисходящей ветвями под острым или тупым углом,
наличием одного максимума (17—20 ч) и одного минимума (3—6 ч)
(стебель, листья и соцветия люпина желтого);
импульсный — кривая скорости роста проходит импульсивно
под прямым или острым углом в течение десятков минут.
Максимум скорости роста наступает в 20—21 ч и сохраняется всю
ночь, в дневные часы заторможен (листья и корнеплоды
сахарной и кормовой свеклы);
импульсно-релаксационный — скорость роста меняется
равномерно: в ночные часы усиливается, а в утренние и дневные
снижается или прекращается (корнеплоды сахарной и кормовой
свеклы, брюквы, моркови, клубни картофеля);
двухволновой — в . течение суток скорость дважды достигает
максимальных (19—21 и 4—6 ч) и минимальных (12—15 и 1—2 ч)
значений (стебли и листья картофеля).
405
во
50
20
10
О
_| I 1
1
1
!
Пло
100
75
50
25
п
/
1
1
1
У
*^^ 1111
6 8 Дни " 4 8 12 16 Дни
Рис. 127. Большая кривая роста
Ритмичность роста проявляется и в факторостатных условиях.
Закон большого периода роста. Скорость роста (линейного,
массы) в онтогенезе клетки, ткани, любого органа и растения в
целом непостоянна и может быть выражена сигмоидной кривой
(рис. 127). Впервые эта закономерность роста была отмечена
Ю. Саксом (1872), а линейная фаза роста названа им большим
периодом роста. Сигмоидная кривая получается, если на оси
абсцисс откладывать время, а на оси ординат — рост в каждый
промежуток времени (интегральная кривая). Если на ординате
откладывать приросты в единицу времени, то кривая будет
одновершинной (дифференциальная кривая).
Сигмоидная кривая роста характерна для изменения
линейных размеров, площади листьев, плодов и др. Выделяют четыре
участка (фазы) кривой: 1) начальный (индукционный), или лаг-
период. Для него характерен медленный рост; 2)
логарифмический (экспоненциальный), или интенсивного роста. Рост
выражается прямой линией по отношению к времени — большой
период роста; 3) замедленного роста; 4) стационарного состояния —
не наблюдается видимых процессов роста. Сигмоидная кривая
характеризует общие особенности роста в онтогенезе
конкретного растительного объекта, позволяет выявить его видовые,
сортовые особенности, действие условий среды.
В период лаг-фазы происходят и процессы, предшествующие
видимому росту (синтез белков, ДНК и РНК, фитогормонов,
ферментов). У разных растений лаг-фаза прорастающего семени
может длиться от нескольких часов до нескольких месяцев, что
связано с отсутствием или избытком в семени определенных
фитогормонов, физиологической незрелостью зародыша, обеспе-
406
ченностью семян необходимой температурой, водой, кислородом
и др.
Вторая и третья фазы кривой связаны с быстрым
растяжением клеток, формированием тканей и органов, усилением
межтканевых и межорганных взаимоотношений (Д. А. Сабинин, 1963;
В. И. Кефели, 1978). Во время второй лаг-фазы идет активный
синтез фитогормонов и пластических веществ. Замедление
ростовых процессов в третьей фазе роста объясняется внутренними
(старение организма или органа, накопление ингибиторов и др.)
и внешними факторами.
Четвертая — стационарная фаза (окончание ростовых
процессов) — это генетически предопределенное состояние. Анализ
кривой скорости роста зерновых культур показывает, что
замедление роста совпадает с началом определенных этапов
органогенеза конусов нарастания (Н. Ф. Батыгин, 1986). Так, у кукурузы
в период заложения мужских и женских соцветий наблюдается
торможение прироста стебля. Для многолетних трав, плодовых
деревьев и кустарников характерны затухание роста к осени и
его возобновление весной следующего года. Сигмоидные кривые
повторяются ежегодно. Закон большого периода роста отражает
течение во времени большинства физиологических процессов
(фотосинтез и дыхание, поглощение воды и элементов
минерального питания и др.).
Знание оптимальных кривых роста конкретного вида и сорта
растений позволяет обоснованно проводить агротехнические
мероприятия, получать высокие экономически выгодные урожаи
сельскохозяйственных культур в защищенном и открытом
грунте. В коммерческих теплицах дорогостоящими факторами —
светом, влагой, теплом — растения следует обеспечивать в
достаточном количестве прежде всего в период их интенсивного роста.
На скорость и продолжительность фаз роста можно влиять
хирургическими (удаление генеративных органов, боковых побегов,
корней, скашивание), химическими (обработка регуляторами
роста) и другими методами. Следует проводить укосы
многолетних трав, убирать зеленные овощные культуры в период, когда
увеличение вегетативной массы уже не существенно (при
переходе в третью и четвертую фазы кривой роста).
Ростовые корреляции. Ростовые корреляции отражают
зависимость роста и развития одних органов, тканей или частей
растения от других, их взаимное влияние. Корреляции роста
проявляются на разных уровнях организации растения. Рост и
дифференциация эмбриональной клетки зависят от окружающих ее
клеток и тканей. Клетки, выделенные из ткани, в клеточной
культуре развиваются по иному пути, могут дать начало целому
растению. Корреляции особенно наглядно проявляются при
рассмотрении роста отдельных органов растения.
Взаимодействие может быть стимулирующим или тормозя-
407
щим рост. При размножении растений черенками, на которых
имеются листья, стимулируется образование корней.
Формирующиеся семена сочноплодных растений, выделяя ауксин,
стимулируют рост околоплодника. Удаление кончика корня усиливает
ветвление корня. Удаление боковых побегов (пасынков)
вызывает усиленный рост плодов. Боковые почки побегов однолетних и
многолетних растений при интенсивном росте верхушечной
почки могут оставаться в покоящемся состоянии. Однако после
удаления верхушечной апикальной почки боковые почки
начинают расти.
Если у подсолнечника удалить корзинку в период ее
формирования, то спящие почки, находящиеся в пазухах листьев,
образуют боковые побеги с небольшими корзинками. Удаление
верхушки побега проявляется после обрезки у древесных и
кустарниковых плодовых и ягодных растений (яблоня, виноград и др.),
после укосов у многолетних трав. Торможение роста боковых
побегов и боковых корней верхушкой побега или корня
называют апикальным доминированием. Степень апикального
доминирования зависит от вида растения, возраста, освещения. Хорошо
освещенные развитые почки угнетают менее освещенные и
находящиеся в тени.
По В. В. Полевому (1989), важнейшим эндогенным
механизмом роста и морфогенеза в целом растении является
гормональное взаимодействие двух доминирующих центров: верхушки побега
(ИУК) и верхушки корня (цитокинин). Роль ауксина в
апикальной почке заключается в создании мощного аттрагирующего
центра, в результате питательные вещества и цитокинин,
синтезированный в корнях, поступают преимущественно в
апикальную почку. Поэтому приток цитокинина к пазушным почкам
после устранения апикальной стимулирует в них клеточные
деления.
Верхушечная почка влияет на растяжение клеток побега и
корня, образование проводящих элементов, верхушка побега —
на ориентацию листьев, боковых побегов и корней растения.
Кончик корня, синтезируя цитокинин и являясь аттрагирующим
центром, контролирует рост клеток корня в зоне растяжения,
закладку проводящих пучков и образование боковых корней.
Верхушка корня влияет на развитие стеблевых апексов,
формирование и активность листьев. Важные ростовые эффекты дает
взаимодействие доминирующих центров с листьями,
вырабатывающими гиббереллины и АБК (рис. 128).
Рис. 128. Структура ростовых центров стебля и корня (по В. И. Кефели) и их
основные функции у высших растений (по В. В. Полевому):
/ — зона синтеза гормона; 2 — центр рецепции гормона; 3 — зоны дистанционного
управления ростом почек, боковых корней, листьев; 4—сенсорные зоны; 5—зоны клеток покоя
408
Верхушка побега
Аттрагирующий центр
Индукция заложения и
деятельности камбия
Индукция образования
проводящих пучков и роста
стебля в толщину
Ингибирование роста
боковых почек
Конкурентная регуляция
старения листьев
Корнеобразование на стебле
Индукция образования
боковых корней
Сенсорная зона
Меристематическая
и тканеобразующая
активность, морфогенез
Регуляция удлинения стебля
Регуляция тропических
движений
Ориентация боковых побегов
Ориентация роста корневищ,
столонов и корней
Регуляция удлинения корня
Индукция развития
стеблевых апексов
Индукция образования
проводящих пучков
Индукция образования
стеблевых почек
Торможение образования
боковых корней
Аттрагирующий центр
Рост и трофика листьев
Регуляция удлинения стебля
Регуляция удлинения и
тропизмов корня
Меристематическая и
тканеобразующая активность
Сенсорная зона
Кончик корня
Коррелятивные отношения между отдельными частями
растения зависят от баланса питательных веществ, складывающегося в
растительном организме. Этим во многом определяются
корреляции между побегом и корнем, размерами листовой
поверхности и урожаем плодов и семян, торможение вегетативного роста
при плодоношении.
В онтогенезе соотношение роста надземной и подземной
частей растения определяется геномом растения и внешними
условиями. Так, к концу вегетации у корнеплодов и
клубнеплодов усиливается рост подземных органов запаса, а у
плодовых деревьев и кустарников, откладывающих запасные
вещества в стволе и ветвях, рост корневой системы отстает от
надземной части.
У однолетних трав и зерновых к концу вегетационного
периода отношение массы надземной и подземной частей растения
увеличивается. Для увеличения доли в общей биомассе
корнеплодов сахарной и кормовой свеклы, клубней картофеля
применяют механические приемы и регуляторы роста, способствующие
оттоку углеводов в запасающие органы. В условиях засухи рост
корней относительно побегов усиливается. Как уже отмечалось,
в обеспечении взаимного влияния органов растения основное
значение принадлежит фитогормонам, особенно ауксинам.
Ростовые корреляции широко используют в сельскохозяйственной
практике. При пикировке рассады овощей и саженцев плодовых
и ягодных культур у растений удаляют верхушку главного корня,
что стимулирует ветвление и образование мочки боковых
корней. Пасынкование у томата обеспечивает образование крупных
плодов. Чеканка хлопчатника способствует формированию пло-
доэлементов. Учет закономерностей коррелятивного роста лежит
в основе формирования кроны плодовых деревьев и
кустарников.
Регенерация. Восстановление поврежденных или утраченных
частей — это защитная реакция растения на повреждения. У
многих растений даже часть листа, стебля или корня в
природных условиях может дать начало новому организму. Явление
регенерации используют в сельскохозяйственной практике при
размножении растений черенками, в биотехнологии при
культуре изолированных клеток и тканей, в физиологии для изучения
механизмов морфогенеза (Н. П. Кренке, 1950; Р. X. Турецкая,
1961; Р. Г. Бутенко, 1964; А. Г. Юсуфов, 1982 и др.).
Выделяют два типа регенерации у растений (В. В. Полевой,
1989): физиологическую и травматическую. К физиологической
регенерациии относятся постоянное восполнение слущиваю-
щихся клеток корневого чехлика, ежегодная замена старых
элементов ксилемы новыми и замена корки у стволов деревьев.
Примерами травматической регенерации являются заживление
ран стволов плодовых деревьев; органогенез, связанный с об-
410
разованием каллуса; восстановление апикальных меристем и
др. Восстановление утраченных надземных органов растений
происходит за счет отрастания покоящихся (пазушных) почек
многолетних трав после укоса и др. Повреждение верхушечной
части корневой системы вызывает образование и рост боковых
корней.
Полярность. Рост и положение в пространстве растения
зависят от полярности. Полярность — это неравноценность
противоположных полюсов клетки, органа, целого растения.
Полярность у растений в онтогенезе проявляется в наличии
различных закономерных осевых и радиальных градиентов.
Различают (С. О. Гребинский, 1961) три типа градиентов:
физико-химические, физиологические, морфологические и
анатомические.
Физико-химические градиенты — это различия в температуре,
осмотическом давлении, концентрации разнообразных
соединений в клетках и тканях, в значении рН, биоэлектрических
потенциалов и др. Так, в растениях содержание воды в листьях
уменьшается от основания стебля к верхушке, а зольных элементов,
наоборот, повышается. Поступление и передвижение в растении
ионов связаны с электрическими градиентами.
Физиологические градиенты — это различия в интенсивности
физиологических процессов (фотосинтез, дыхание, транспира-
ция, транспорт веществ, рост, устойчивость и др.).
Морфологические и анатомические градиенты — это различия в
размерах, форме, строении клеток, листьев, корней по оси
органа или растения. Все градиенты в растении взаимосвязаны.
Физико-химические и физиологические градиенты
обусловливают интенсивность роста и других процессов
жизнедеятельности растения. Уровень этих градиентов характеризует
физиологическую активность растения; их определение важно для
практических целей. Полярность — необходимое условие роста и
развития, реализации генома растения. Различные градиенты,
полярность меняются в онтогенезе растений, в процессах их
адаптации к условиям среды.
Индуцирующее действие оказывают гравитация, свет,
электрическое и магнитные поля, рН среды и др. Полярность клетки
определяет поляризация молекул белков, нуклеиновых кислот и
других полимерных соединений цитоплазмы. Изменения среды,
например рН, меняет их поляризацию. В онтогенезе растения
полярность возникает у зиготы, деление которой приводит к
образованию двух неравноценных клеток: меньшая (апикальная)
дает начало побегу, большая (базальная) — корню. Полярность
органа составляется из полярности клеток.
В опытах с культурой клеток корня моркови (Ф. Стьюард и
др., 1958) при непрерывном вращении клетки только делились.
Дифференциация же клеток каллуса начиналась лишь после пре-
411
кращения вращения и увеличения их поляризации. В опытах
кафедры физиологии растений МСХА при длительном клиноста-
тировании наблюдались падение осевого градиента
электропотенциалов и остановка роста растений кукурузы. Таким образом,
полярность клеток, тканей, органов растения является
результатом сложного взаимодействия внутренних и внешних факторов
его жизни.
7.9. МЕТОДЫ ИЗМЕРЕНИЯ СКОРОСТИ РОСТА
Скорость роста растения — важный интегральный показатель
его физиологического состояния. Для изучения роста используют
ряд методов. В качестве критериев скорости роста периодически
определяют длину (высоту), толщину (диаметр), массу, площадь,
объем растения и отдельных его частей. Полное представление о
росте экспериментатор получает при одновременном учете
нескольких показателей. Для измерений используют обычную
линейку, горизонтальный микроскоп, приборы-ауксанографы
(ростомеры), непрерывно регистрирующие изменение высоты
растений, диаметра клубней, корнеплодов, плодов, луковиц. С этой
же целью применяют фото- и киносъемку.
О скорости роста можно судить по числу митозов в единицу
времени, содержанию нуклеиновых кислот в клетке. Результаты
прямых наблюдений используют для анализа роста: абсолютная
скорость роста; скорость роста массы растений на единицу
площади листа (ЧПФ), листовой индекс; прирост биомассы посева;
продолжительность жизни листьев и др.
Абсолютная скорость роста (К) — величина прироста за
определенный промежуток времени, отнесенная к единице времени.
где Щ и \Уг — параметры растения или его отдельного органа в моменты
времени /1 И Й-
Относительный или процентный рост (К) — прирост,
вычисленный в процентах от исходной массы растений или органа.
где Щ — параметр, характеризующий размеры растения в момент измерения;
Щ — исходный параметр.
Важно периодически измерять рост корней. Имеется ряд
методических подходов: изучение корней растений в водных
культурах; выращивание растений в сосудах, ящиках и лизиметрах с
почвой; метод скелета — корни раскапывают по ходу их в почве
412
и схематически изображают на рисунках в горизонтальной или
вертикальной проекции; метод траншеи — отмывается корневая
система растений целиком или ее части на срезе траншеи; метод
монолита — вырезают монолиты почвы и отмывают корни;
метод бура — отбирают образцы почвы на разную глубину и
отмывают корни; метод стационара, или стекол, — наблюдают за
развитием корней через стекла, установленные в стенках
траншей или в специальных ящиках с наклонной стенкой; метод
радиоактивных индикаторов; изотопный метод, позволяющий
наблюдать за распространением корней в почве. Кроме того,
определяют объем корней, поглощающую поверхность.
Например, в полевых условиях длина корней у кукурузы достигает
50—700 м, а поверхность — 50—150 м. В пахотном слое почвы
длина корней у пшеницы 18—80 м. у ржи — 26—100, у льна —
45 м. Длина корней люцерны в 1 м3 почвы в первый год жизни
составляет 1,8—45,8 км, а на второй год — 37,8—176,2 км.
Всероссийский институт растениеводства (ВИР) рекомендует
следующие показатели, определяемые на основе ростового анализа
двухнедельных растений: число ярусов листьев, средняя высота
растений, средняя длина корней, масса листьев, масса стеблей,
масса надземная, масса корней, общая масса растения, процент
сухого вещества, площадь листьев, поверхностная плотность
листьев (отношение общей массы листьев к площади), отношение
надземной массы к массе корней, отношение массы корней к
надземной массе. Эти простые учеты позволяют сравнивать виды
и сорта растений.
7.10. ЗАВИСИМОСТЬ РОСТА ОТ ЭКОЛОГИЧЕСКИХ
ФАКТОРОВ
Являясь интегральной функцией растения, рост зависит от
влияния абиатических факторов внешней среды: света (его
интенсивности, спектрального состава, .продолжительности и
периодичности); температуры (величины и периодичности);
питательных веществ (минеральных и органических); силы
тяжести и магнитного поля; механических воздействий (ветер и др.);
сопротивления почвенных частиц и т. д. На рост растения в
посевах и насаждениях влияют также продукты
жизнедеятельности и другие ценотические взаимоотношения с одновидовы-
ми и сорными растениями, физиологически активные вещества
(антибиотики, ростовые вещества и др.), выделяемые
микроорганизмами. Связь роста растения с конкретным фактором
внешней среды выражается биологической одновершинной
кривой. Экологические факторы оказывают на рост прямое и
косвенное влияние, опосредованное через изменение других
физиологических процессов.
413
7.10.1. СВЕТ КАК ФАКТОР, РЕГУЛИРУЮЩИЙ РОСТ И РАЗВИТИЕ
РАСТЕНИЙ
Действие света на растение подразделяется на
фотосинтетическое, регуляторно-фотоморфогенетическое и тепловое
(Ю. К. Росс, 1977). Свет действует на рост через фотосинтез,
для которого требуются высокие уровни энергии. При слабой
освещенности растения плохо растут. Однако кратковременный
рост происходит даже в темноте, например при прорастании,
что имеет приспособительное значение. Удлинение ежедневного
освещения в теплицах усиливает рост многих растений. По
отношению к интенсивности освещения растения делятся на
светолюбивые и теневыносливые.
Свет определяет многие фотобиологические явления:
фотопериодизм, фотоморфогенез, фототаксисы, фототропизмы, фото-
настии и др. Наиболее активно регулируют рост красные и сине-
фиолетовые лучи.
Фотоморфогенез — это зависимые от света процессы роста и
дифференцировки растений, определяющие его форму и
структуру. В ходе фотоморфогенеза растение приобретает
оптимальную форму для поглощения света в конкретных условиях
произрастания. Так, на интенсивном свету рост стебля уменьшается. В
тени листья вырастают крупнее, чем на свету, что доказывает
задерживающее влияние света на рост. В растениях обнаружены
две пигментные системы фоторецепторов — фитохром,
поглощающий красный свет, и криптохром, поглощающий синий свет,
с участием которых индуцируются реакции фотоморфогенеза.
Эти пигменты поглощают ничтожную часть падающего
солнечного излучения, которая используется для переключения
метаболических путей (А. А. Красновский, 1975).
Система красный/дальний красный свет. Фотоморфогенети-
ческое воздействие красного света на растение осуществляется
через фитохром. Фитохром — хромопротеид, имеющий
сине-зеленую окраску. Его хромофор — это незамкнутый тетрапиррол.
Белковая часть фитохрома состоит из двух субъединиц (рис. 129).
Фитохром существует в растениях в двух формах (ФббО и Ф730).
которые могут переходить одна в другую, меняя свою
физиологическую активность. При облучении красным светом (КС —
660 нм) фитохром Фббо (или Фк) переходит в форму Ф730 (или
Фдк)- Трансформация приводит к обратимым изменениям
конфигурации хромофора и поверхности белка. Форма Ф730
является физиологически активной, контролирует многие реакции и
морфогенетические процессы в растущем растении, темпы
метаболизма, активность ферментов, ростовые движения, скорость
роста и дифференциации и др. Действие красного света
снимается короткой вспышкой дальнего красного света (ДКС —
730 нм). Облучение ДКС переводит фитохром в неактивную
414
НООС СОО" Протеин
сн3 сн2 сн2 сн2
сн3 сн сн3 сн2 сн2 сн3 сн3 сн
Фитохром
С N
I .
Н Н
+н'
■ т
НООС СОО~ Протеин
СН3 СН2 СН2 СН2
сн3 сн2 сн3 сн2 сн2 сн3 сн3 сн
Фитохром
дк
Протеин Н
Рис. 129. Предполагаемая структура красного (Фк) и дальнего красного (Фдк)
фитохромов
(темновую) форму ФббО (рис. 130). Активная форма Ф730
нестабильна, на белом свету медленно распадается. В темноте Фдк
разрушается или под действием дальнего красного света
превращается в Фк- Таким образом, система
Красный свет (КС)^
< :
Дальний красный
свет (ДКС)
Ф
'ДК
составляет комплекс реакций, запускаемых переходом от
темноты к свету. Реакции метаболизма растений, управляемые фито-
хромом, зависят от концентрации Ф73о и соотношения Ф7зо/ф66О-
Обычно они начинаются, если 50 % фитохрома представлено
формой Ф730-
Фитохром в растении. Фитохром обнаружен в клетках всех
органов, хотя его больше в меристематических тканях. В клетках
фитохром, очевидно, связан с плазмалеммой и другими
мембранами.
Фитохром участвует в регуляции многих сторон
жизнедеятельности растений: прорастании светочувствительных семян,
открытии крючка и удлинении гипокотиля проростков, развер-
415
"730 "" ^730,-'
Темновая реверсия
Физиологическая
активность
Разрушение
Рис. 130. Влияние красного (К).и дальнего красного (ЦК) света на состояние
фитохрома и его физиологическую активность
тывании семядолей, дифференциации эпидермиса и устьиц,
дифференциации тканей и органов, ориентации в клетке хлоро-
пластов, синтезе антоциана и хлорофилла. Красный свет
тормозит деление и способствует удлинению клеток, растения
вытягиваются, становятся тонкостебельными (густой лес, загущенный
посев). Вспомним, что на красном свету в качестве первичных
продуктов фотосинтеза образуются преимущественно углеводы, а
щ синем — аминокислоты (Н. П. Воскресенская, 1965).
Фитохром определяет фотопериодическую реакцию растений,
регулирует начало цветения, опадение листьев, старение и переход в
состояние покоя. В теплицах красный свет способствует
образованию корнеплодов у репы, утолщению стеблеплодов кольраби.
Фитохром участвует в регуляции метаболизма фитогормонов в
различных органах растения.
Влияние синего света на рост растений. Синий свет также
регулирует многие фотоморфогенетические и метаболические
реакции растений. Фоторецепторами синего света считаются фла-
вины и каротиноиды. Желтый пигмент рибофлавин, рецепти-
рующий синий — ближний ультрафиолетовый свет, который
назвали криптохромом, присутствует у всех растений. В
ультрафиолетовой части спектра (320—390 нм), вероятно,
работает еще одна рецепторная система, включающая производные
пиразино-пиримидина, или птерины. Рецепторы претерпевают
редокс-превращения, быстро передавая электроны другим
акцепторам. Фототропизм растений определяется рецепторным
комплексом стеблевого апекса, включающего, по-видимому, крип-
тохром и каротиноиды. Рецепторы синего света имеются в
клетках всех тканей, локализованы в плазмалемме и в других
мембранах.
Синие и фиолетовые лучи стимулируют деление, но
задерживают растяжение клеток. По этой причине растения
высокогорных альпийских лугов обычно низкорослы, часто розеточны.
416
1
Синий свет вызывает фототропичеекий изгиб проростка и других
осевых органов растений путем индукции латерального
транспорта ауксина. Растения при недостатке синего цвета в
загущенных посевах и посадках вытягиваются, полегают. Это явление
имеет место в загущенных посевах и посадках, в-теплицах,
стекла которых задерживают синие и сине-фиолетовые лучи.
Дополнительное освещение синим светом позволяет в теплицах
получить высокий урожай листьев салата, корнеплодов редиса.
Синий свет влияет также на многие другие процессы: угнетает
прорастание семян, открывание устьиц, движение цитоплазмы и
хлоропластов, развитие листа и др. Ультрафиолетовые лучи
обычно задерживают рост, однако в небольших дозах могут
стимулировать его. Жесткий ультрафиолетовый свет (короче 300 нм)
обладает мутагенным и даже смертоностным действием, что
актуально в связи с утончением озонового слоя Земли.
Механизм действия фоторецепторов. Предложено несколько
гипотез механизма регуляторного действия света на растения.
Непосредственное действие на
генетический аппарат. Фоторецепторы при возбуждении их светом
непосредственно действуют на генетический аппарат растений,
способствуя биосинтезу необходимых белков. Так, в ядре и
хлоропласте фитохром регулирует синтез соответственно малой и
большой субъединиц РБФ-карбоксилазы. В ядерном геноме
синий свет ускоряет экспрессию генов комплекса фермента нит-
ратредуктазы.
Регуляция уровня и активности
фитогормонов. Принимая во внимание, что фитогормоны являются
одним из ближайших к фитохрому звеном метаболической цепи,
обеспечивающей рост и морфогенез растения, предполагается
следующая последовательность элементов цепи: свет ->
фитохром —> геном -> фитогормоны —» общие звенья
метаболизма -> рост и морфогенез. В большинстве случаев КС, повышая в
тканях уровень гиббереллинов и цитокининов, снижает
содержание ауксина и этилена. Это действие красного света снимает
ДКС. В листьях пшеницы и ячменя КС увеличивает уровень
гиббереллинов в результате их синтеза или выхода из этиоплас-
тов. ДКС устраняет этот дефект КС.
Влияние на функциональную активность
мембран. Основным результатом действия красного света
является регуляция функций мембран (В. В. Полевой, 1991).
Наиболее быстро под действием света изменяются электрические
характеристики мембран клеток и тканей облучаемых органов
растений, что, по-видимому, вызывает определенный
физиологический эффект, в том числе новообразование фитогормонов и
активацию некоторых генов.
В опытах Т. Танада (1968) кратковременное облучение (30 с)
КС кончиков корней (5 мм) проростков ячменя и маша в рас-
41:7-
творе вызывало «прилипание» отрезков корней к стеклянным
стенкам сосуда, заряженным отрицательно. В темноте отрезки
корней опускались на дно сосуда. В опыте облучение КС
вызывало быстрое изменение заряда клеток корневого чехлика на
положительный, что приводило к прилипанию отрезков.
Изменение потенциалов под действием КС и ДКС наблюдается и на
поверхности этиолированных колеоптилей. Изменение
трансмембранного электрического потенциала и транспорта ионов
(Н , К , С1 ) обеспечивает работу клеток устьичного комплекса,
никтинастические движения листьев бобовых растений.
Красный свет способствует поступлению Са2+ в клетки,
образованию комплекса кальмодулин-Са, участвующего в реакциях
фосфорилирования белков. Мембранные эффекты фитохрома,
изменения в структуре и функциях мембран, возможно, влияют
на содержание фитогормонов в тканях и экспрессию генома
растения. Синий свет, поглощаемый флавиновым компонентом
редокс-цепей, в клеточных мембранах оказывает влияние на
многие метаболические процессы, в том числе на ионные потоки
и величину мембранного потенциала.
Прямое влияние света на активность фермента.
Оно проявляется в том, что молекула пигмента, являющаяся
частью фермента, возбуждается квантом света, вызывая
изменение конформации белковой части фермента, а следовательно, и
его активности. Так, синий свет (460—475 нм) при очень
коротких экспозициях (30 с) активирует в процессе фотосинтеза
включение СО2 в аминокислоты, что, очевидно, объясняется
увеличением активности нитратредуктазы. Активность нитратре-
дуктазы при облучении тканей синим светом возрастает сильнее,
чем при действии красным светом.
Инициация процессов переноса электронов. Свет
включает фоторецепторы и инициирует процессы
метаболического переноса электронов в мембранах, тесно связанные с
перемещением протонов. Далее образуются соединения,
приводящие к конечному физиологическому ответу — действию на
рост и морфогенез растений (А. А. Красновский, 1975).
Электроны, образующиеся при окислении субстрата, могут
использоваться "в реакциях восстановления, в том числе нитратов, а
протоны подкисляют клеточную стенку или остаются в клетке,
вызывая деполяризацию МП.
7.10.2. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА РОСТ РАСТЕНИЙ
Рост растений возможен в сравнительно широком диапазоне
температур и определяется географическим происхождением
данного вида. Требования растения к температуре меняются с
возрастом, различны у отдельных органов растения (листья,
418
I
корни, плодоэлементы и др.). Для роста большинства
сельскохозяйственных растений России нижняя температурная граница
соответствует температуре замерзания клеточного сока (около
—1...—3 °С), а верхняя — коагуляции белков протоплазмы (около
60 °С). Вспомним, что температура влияет на биохимические
процессы дыхания, фотосинтеза и других метаболических систем
растений, а графики зависимости роста растений и активности
ферментов от температуры близки по форме (колоколообразная
кривая).
Температурные оптимумы для роста. Для появления всходов
требуется более высокая температура, чем для прорастания
семян (табл. 22).
22. Потребность семян полевых культур в биологически минимальных
температурах (по В. Н. Степанову)
Культура
Температура, °С
прорастания семян
появления всходов
Горчица, конопля, рыжик
Рожь, пшеница, ячмень, овес,
горох, вика, чечевица, чина
Лен, гречиха, люпин, бобы,
нут, свекла, сафлор
Подсолнечник, перилла
Кукуруза, просо, соя
Фасоль, клещевина, сорго
Хлопчатник, рис, кунжут
0-1
1-2
3-4
5-6
8-10
10-12
12-14
2-3
4-5
5-6
7-8
10-11
12-13
14-15
При анализе роста растений выделяют три кардинальные
температурные точки: минимальную (рост только начинается),
оптимальную (наиболее благоприятная для роста) и максимальную
температуру (рост прекращается).
Различают растения теплолюбивые — с минимальными
температурами для роста более 10 °С и оптимальными 30—35 "С
(кукуруза, огурец, дыня, тыква), холодостойкие — с
минимальными температурами для роста в пределах 0—5 °С и
оптимальными 25—31 °С. Максимальные температуры для большинства
растений 37—44 °С, для южных 44—50 "С. При увеличении
температуры на 10 "С в зоне оптимальных значений скорость
роста увеличивается в 2—3 раза. Повышение температуры выше
оптимальной замедляет рост и сокращает его период.
Оптимальная температура для роста корневых систем ниже, чем для
надземных органов. Оптимум для роста выше, чем для
фотосинтеза.
Можно предположить, что при высокой температуре имеет
место недостаток АТФ и НАДФН, необходимых для восстанови-
419
тельных процессов, что вызывает торможение роста.
Температура, оптимальная для роста, может быть неблагоприятной для
развития растения. Оптимум для роста меняется на протяжении
вегетационного периода и в течение суток, что объясняется
закрепленной в геноме растений потребностью к смене
температур, имевшей место на исторической родине растений. Многие
растения интенсивнее растут в ночной период суток.
Термопериодизм. Росту многих растений благоприятствует
смена температуры в течение суток: днем повышенная, а ночью
пониженная. Так, для растений томата оптимальная температура
днем 26 °С, а ночью 17—19 °С. Это явление Ф. Вент (1957)
назвал термопериодизмом. Термопериодизм — реакция растений
на периодическую смену повышенных и пониженных
температур, выражающаяся в изменении процессов роста и развития
(М. X. Чайлахян, 1982). Различают суточный и сезонный
термопериодизм. Для тропических растений разница между дневными
и ночными температурами составляет 3—6 "С, для растений
умеренного пояса — 5—7 °С. Это важно учитывать при
выращивании растений в поле, теплицах и фитотронах, районировании
культур и сортов сельскохозяйственных растений.
Чередование высоких и низких температур служит
регулятором внутренних часов растений, как и фотопериодизм.
Относительно низкие ночные температуры повышают урожай картофеля
(Ф. Вент, 1959), сахаристость корнеплодов сахарной свеклы,
ускоряют рост корневой системы и боковых побегов у растений
томата (Н. И. Якушкина, 1980). Низкие температуры, возможно,
повышают активность ферментов, осуществляющих гидролиз
крахмала в листьях, а образующиеся растворимые формы
углеводов передвигаются в корни и боковые побеги.
7.10.3. ВЛИЯНИЕ НА РОСТ РАСТЕНИЙ ВЛАЖНОСТИ ПОЧВЫ
При недостатке воды торможение роста наступает раньше
всех других физиологических процессов и функций. Поэтому
хорошее водоснабжение является обязательным условием
интенсивного роста и продуктивности сельскохозяйственных растений.
При длительном недостатке воды у растений растяжение клеток
заканчивается слишком рано, формируется ксероморфная
структура. Благоприятные для роста условия складываются при
влажности почвы 60—80 % НВ. При более высокой влажности
нарушается аэрация почвы, рост растений угнетается. Влажный
воздух стимулирует рост стебля, а сухой ограничивает, даже при
хорошем водосбнажении через корни. К насыщенности водой
очень чувствительны клетки апексов побегов и корней. Если
апексы побегов защищены смыкающимися листочками с
развитой кутикулой, то точки роста корня не имеют такой защиты.
420
I
Поэтому корни могут расти только в достаточно влажной почве,
с осмотическим давлением почвенного раствора, не
превышающим 1,0—1,5 МПа.
7.10.4. ГАЗОВЫЙ СОСТАВ АТМОСФЕРЫ (ВЛИЯНИЕ АЭРАЦИИ)
Содержание кислорода. Рост растений резко
тормозится при снижении в воздухе содержания кислорода до 5 %
(объемных), а в бескислородной среде прекращается. Причины
этого в нарушении энергетического баланса и увеличении в
тканях растения содержания продуктов анаэробного дыхания
(спирт, молочная кислота и др.). Избыточная концентрация
кислорода также угнетает рост. Так, при содержании кислорода
выше 30 % (объемных) прорастание клубней картофеля
подавляется, а при 80 % ростки погибают через несколько дней. Росту
корней благоприятствует содержание кислорода в почвенном
воздухе 10—12 %, а минимальное содержание кислорода для
жизнедеятельности корней 3—5 %. При повышении температуры
почвы потребность корней в кислороде возрастает. При
затоплении почвы некоторое время рост корней продолжается благодаря
использованию кислорода нитратов, образованию воздухоносных
тканей и др. Семена некоторых растений прорастают под слоем
воды.
Содержание С 02- Содержание СО2 в воздухе (0,03 %)
недостаточно для оптимального фотосинтеза, а следовательно, и
роста. Однако избыток СО2 в воздухе, снижая рН клеточных
стенок, индуцирует кратковременный рост тканей, что наряду с
затенением может быть причиной вытягивания нижних
междоузлий хлебных злаков в загущенных посевах и их полегания. При
хранении плодов и овощей высокая концентрация СО2 в газовой
среде улучшает их лежкость, так как ингибирует рост и другие
физиологические процессы растений.
Корни растений в хорошо аэрированной почве длинные,
светлоокрашенные, с многочисленными корневыми волосками. При
недостатке кислорода корни укорачиваются, утолщаются,
темнеют, корневых волосков образуется мало.
7.10.5. МИНЕРАЛЬНОЕ ПИТАНИЕ
Нормальный рост возможен лишь при достаточном
сбалансированном снабжении растения необходимыми элементами
минерального питания. Однако высокий уровень минерального
(особенно азотного) питания приводит к росту вегетативных органов
в ущерб генеративным, что полезно при возделывании
многолетних трав на корм и зеленных овощных культур, однако снижает
урожай семян и их качество.
421
7.10.6. ВЛИЯНИЕ ХИМИЧЕСКИХ СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ,
ЗАГРЯЗНЕНИЯ ПОЧВЫ И ВОЗДУХА
Многие пестициды, используемые для борьбы с сорняками,
болезнями и вредителями сельскохозяйственных культур,
первоначально угнетают рост защищаемых растений. Поэтому особое
значение имеет правильный выбор доз, способов и сроков
внесения препаратов. Растения очень чувствительны к
промышленным выбросам диоксида серы, образующимся при ее соединении
с атмосферной влагой сернистой и серной кислотам. Выпадая на
землю, «кислотный» дождь (рН 3,5 и ниже) вызывает хлороз,
задерживает рост, часто приводит к гибели посевов. Токсичны
для растений фторид и другие вредные выбросы.
Проникающая радиация радиоактивных излучений в
зависимости от дозы и радиочувствительности организма может не
только тормозить, но и стимулировать рост, вызывать
необычные ростовые эффекты. Стимуляция роста — результат усиления
митотической активности (Н. В. Тимофеев-Рессовский, 1970),
угнетение роста — нарушения деления клеток из-за разрывов
хромосом и других поражений аппарата митоза.
7.10.7. ЗАКОН МИНИМУМА И ВЗАИМОДЕЙСТВИЕ ФАКТОРОВ РОСТА
Изменение напряженности и взаимодействия абиотических и
биотических факторов среды во времени является основной
причиной суточной и сезонной неравномерности роста растений.
Закон минимума утверждает преимущественную зависимость
роста от фактора среды, находящегося в относительном
минимуме. Фактор, находящийся в минимуме, подавляет рост даже при
самых благоприятных остальных условиях. Как при
минимальном, так и при максимальном напряжении любого фактора
среды рост подавляется. Максимальный рост растений
обеспечивается при оптимальном уровне всех факторов среды, их
взаимодействии. Действие любого фактора на рост можно выразить
одновершинной кривой.
7.11. НЕОБРАТИМЫЕ НАРУШЕНИЯ РОСТА. КАРЛИКОВОСТЬ
И ГИГАНТИЗМ
Существуют растения одного и того же вида низкорослые
(карликовость), нормальные и высокорослые (гигантизм).
Карликовость растения может быть обусловлена генетическими и
физиологическими причинами.
Генетические карлики. В природе карликовые
растения встречаются в большом количестве в тундре, высоко в горах.
Известны генетические карлики пшеницы, кукурузы, риса, горо-
422
ха, фасоли, бобов, клевера лугового и других растений с
различным содержанием генов карликовости. Генетическая
карликовость одних растений, например моногенных мутантов кукурузы
и гороха, преодолевается обработкой гиббереллином. Другие
генетические карлики, например карликовые формы пшеницы,
слабо чувствительны или совершенно нечувствительны к
действию гиббереллина.
Показано, что мутации, вызывающие карликовость растений,
приводят к изменению содержания гиббереллинов, увеличению
содержания АБК, изменяют соотношение конъюгированных и
свободных форм фитогормонов. Карликовость может быть
связана с нарушением гормонально-ингибиторного баланса растений.
На основе генетических карликов созданы высокоурожайные ко-
роткостебельные и среднестебельные сорта многих
сельскохозяйственных культур (пшеницы, риса, кукурузы и др.), у которых
значительная часть продуктов фотосинтеза накапливается в
соцветии. В промышленном садоводстве распространение получает
использование карликовых яблонь при густых посадках (10 тыс.
деревьев на 1 га) — «луговые сады».
Физиологические карлики. Карликовые растения
появляются в условиях интенсивного освещения, избытка
ультрафиолетового облучения. В растениях накапливаются
снижающие синтез гиббереллинов фенольные ингибиторы. Из семян
персика, выдержанных при высоких температурах в первую
неделю прорастания, развиваются карликовые деревья, остающиеся
таковыми в течение более 10 лет (В. М. Поллок, 1962).
Примечательно, что развитие карликовости предотвращалось
последующим действием низких температур или обработкой
прорастающих семян гиббереллином. Сеянцы некоторых растений,
выращенные из зародышей недозрелых или нестратифицированных
семян, также формируют карликовые растения. Причиной
карликовости могут быть и вирусные заболевания (патологическая
карликовость). Обработка гиббереллином часто помогает
ликвидировать карликовость.
В Японии традиционно выращивание в домашних условиях
карликовых деревьев — культура «бонсай». Взрослые древесные
растения (абрикос, ель, слива, клен, сосна, кедр) в небольших
сосудах имеют высоту 50—100 см. Эта карликовость обусловлена
ограниченными питанием, водообеспеченностью, малым
объемом сосудов.
Гигантизм. Повышение содержания гиббереллинов в
нормальном растении приводит к гигантизму. Так, при длительной
обработке верхушек стеблей капусты, табака и конопли каплями
слабого раствора гиббереллина можно получить гигантские
растения (высотой до 6 м и более). Травянистые и древесные
растения-гиганты в природных условиях и в посевах можно
наблюдать в районах с высокой вулканической активностью и интен-
423
сивного горообразования — на Дальнем Востоке, Сахалине и
Курильских островах, Камчатке, в восточных районах Африки, на
Гавайских островах, на Памире. На Памире куст томата
формирует до 11,5 кг плодов, картофеля —до 4 кг. Стебли гречихи
сахалинской на юге Сахалина достигают высоты 3—5 м, в
Подмосковье это растение значительно мельче. Гигантизм не
наследуется и обусловлен действием специфических региональных
факторов. Предполагают, что гигантизм связан с особенностями
микроклимата, режима грунтовых вод, условий освещения,
комплексов микроэлементов (прежде всего тория и бора).
7.12. РИТМЫ ФИЗИОЛОГИЧЕСКИХ ПРОЦЕССОВ
В природе все процессы ритмичны: смена дня и ночи,
морские приливы и отливы, смена времен года, сокращение
сердечной мышцы у животных, ритм дыхания и т. д.
Исследованиями ботаников и физиологов растений были обнаружены
такие ритмы и у растений. В процессе эволюционного
приспособления к закономерным изменениям внешней среды во
времени у растений развилась способность очень точно
измерять время и согласовывать с его ходом скорость и направление
важнейших физиологических процессов. Огромный
экспериментальный материал ученых-биологов показывает, что все
организмы, в том числе и растения, живут по «солнечным часам».
Они могут приурочить каждый свой физиологический процесс
и жизнедеятельность в целом к оптимальным для них условиям
среды. Первым в мировой литературе высказал это положение
по отношению к растениям молодой российский ботаник
В. М. Катунский (1939).
Биологами и физиологами растений выявлено, что растения
обладают временной «памятью» на смену дня и но^и. Процесс
выделения нектара, образование пыльцы характеризуются
суточной периодичностью. Раскрывание цветка часто регулируется
сменой света и темноты. Многократно отмечалось, что цветки
начинают раскрываться незадолго до рассвета, а закрываться
перед закатом солнца. Листья многих растений днем обычно
расположены горизонтально, а ночью — вертикально. Особенно
четко это видно на фасоли. Фасоль стала классическим объектом
при изучении ритмичности физиологических процессов. Листья
фасоли, как и лепестки цветков, начинают подниматься до
наступления светлого периода, а складываться — до наступления
темноты. Причем эти движения сохранялись и при выращивании
растений в стабильных условиях среды: непрерывный свет или
постоянная темнота и др. По расположению листьев можно
было определить биологическое время. Только один световой
период давал растениям толчок для движения листьев, которое
424
Часы
Рис. 131. Возникновение циркадных
движений листьев фасоли в
непрерывной темноте под действием
однократного 12-часового освещения красным
светом (по Лархеру) (Темновые периоды
заштрихованы.)
не прерывалось в течение
нескольких дней при
дальнейшей постоянной темноте, при
этом изменялась только
амплитуда колебаний (рис. 131).
Сохранялись эти ритмы и при
изменении соотношения света
и темноты -8:8, 12:12, 14:14,
непрерывном освещении
(Е. Е. Крастина, 1956).
Механическое закрепление листа
фасоли не изменяло ритмов
движения листьев после его освобождения, ритм тут же
восстанавливался. Температура, один из важнейших факторов роста и
развития растений, также не оказывала существенного влияния
на ритм движения листьев. При температуре 15, 20, 25 и 30 °С
движение листьев сохранялось, лишь немного отклоняясь в
сторону увеличения или уменьшения периодов. В среднем ритмы
эти были с периодом около 24 ч, т. е. около суток, поэтому и
названы циркадными или околосуточными (лат. «цирка» —
около, «диес» — день). Незначительные отклонения от этого
периода определяются видом растения и условиями произрастания.
В среднем циркадные ритмы у различных видов растений
составляют от 22 до 28 ч.
Хронометрическую систему, контролирующую ход циркадных
ритмов, называют физиологическими или биологическими
часами.
Независимость ритмов от факторов внешней среды дала
возможность предположить, что они обусловлены
внутренними причинами и поэтому названы эндогенными.
Специфическая для каждого живого организма длительность периода
передается по наследству и сохраняется на протяжении многих
поколений.
Один световой период дает начало ритмам, смена дня и ночи
при выращивании растений поддерживает циркадные ритмы,
следовательно, они осуществляют подзарядку «часового
механизма» у растений.
Выяснено, что хотя температура и не оказывает
существенного влияния на циркадные ритмы, однако резкое ее повышение
или понижение (высокая или низкая температура) вызывают у
растений изменение периода. При отрицательных температурах
период ритма сначала увеличивался примерно до 33 ч, а затем
постепенно выравнивался. У растений чередование повышенной
и пониженной температур регулирует ритм таким образом, что
фазе низкой температуры соответствует физиологическое
состояние, наблюдаемое обычно в темновой период, а высокой — в
световой период. Это дало возможность предположить, что при
425
отрицательных температурах у растений наблюдается
компенсационный эффект, который проявляется спустя определенный
промежуток времени. Температура оказывает влияние прежде
всего на мембраны и на связанные с ними физиологические
процессы, в том числе на циркадныё ритмы.
Аналогичные результаты получены при действии на растения
ядов и других химических веществ. Исследования показали, что
при действии химических веществ длительность циклов сначала
увеличивается, а потом уменьшается, наблюдается смещение
фаз. Сильные яды действуют на циркадныё ритмы только тогда,
когда они причиняют вред самим растениям. При этом
подавляется фаза зарядки биологических часов, а фаза разрядки остается
неизменной. И здесь изменения связывают с нарушением
структур мембран.
Дальнейшие исследования физиологов растений показали, что
циркадныё ритмы сказываются не только на движении листьев.
Движение листьев фасоли подтвердило периодичность циркадно-
го ритма колебания тургора в подушечках черенков фасоли.
Э. Бюннингом, основоположником учения о ритмах
физиологических процессов, выявлен ритм выделения СОг и поглощения
02 растениями при дыхании и фотосинтезе. А. А. Рихтером и
другими доказана эндогенность циркадных ритмов активности
ферментов (амилазы, каталазы и др.). Работами Е. Е. Крастиной
и А. Е. Петрова-Спиридонова (1959) была подтверждена
ритмичность поглощения и выделения корнями элементов
минерального питания, «плача» растений.
Была также обнаружена ритмичность гуттации, термоперио-
дизма. Физиологическими часами регулируются объемы
клеточного ядра, формирование хлоропластов, ритмы тургора и роста
клеток в культуре тканей.
Немалый интерес представляет локализация биологических
часов в клетках растений. Установлено, что ни ядро, ни
цитоплазма, ни пластиды не имеют отношения к регуляции
работы биологических часов. Большинство ученых считает, что
механизмы биологических часов «вмонтированы» в мембранах,
а точнее, в плазмалемме. О правильности такого заключения
говорит тот факт, что периодические изменения мембран под
действием температуры, химических веществ и других агентов,
о чем упоминалось, являются частью «часового механизма».
Внешние воздействия на плазмалемму изменяют структуру
белков и липидов, входящих в ее состав. У устойчивых к
раздражителям мембран в липидах присутствуют ненасыщенные и
более короткие остатки жирных кислот, что определяет их
текучесть. Изменения степени насыщенности липидов мембран
отмечены на протяжении каждого суточного ритма и
составляют часть биологических часов.
426
Ученые также предположили наличие в мембранах пигмента,
способного воспринимать действие света и тем самым включать
или выключать биологические часы у растений. Это подтверждал
и тот факт, что на циркадныё ритмы оказывают влияние не
только длина светового периода, но и качество падающего света.
Оказалось, что красный свет включает биологические часы, а
дальний красный — отключает их. Такой пигмент в плазмалемме
был обнаружен и назван фитохромом.
Чередование света и темноты может вызвать сдвиг фаз или
служить указателем времени для ритмов. У растений важнейшей
функцией физиологических часов является, вероятно,
регистрация длины дня, чтобы при определенной длине дня перейти к
цветению или покою.
7.13. ДВИЖЕНИЕ РАСТЕНИЙ
Растения в отличие от животных прикреплены к месту своего
обитания и не могут перемещаться. Однако и для них характерно
движение. Движение растений — это изменение положения
органов растений в пространстве, обусловленное разными факторами
внешней среды: светом, температурой, силой тяжести,
химическими элементами и др.
Движения растений относятся к быстротекущим процессам. В
основе движений лежит раздражимость растений. Движения
могут иметь и эндогенный характер.
Для цветкового растения свойственно главным образом
движение органов путем изгиба, скручивания, откидывания и т. д.,
т. е. движение органов, неподвижно прикрепленных к субстрату.
Среди этих движений есть движения, связанные с изменением
тургора в отдельных клетках и тканях, а также с изменением
скорости роста различных сторон, частей и органов растений. К
первым относятся «сон» растений, обусловленный движением
листьев или лепестков, сейсмонастия и другие явления. Ко
вторым относятся тропизмы и настии.
Тропизмы — это ростовые движения, вызываемые
односторонним действующим раздражителем (свет, сила тяжести,
химические элементы и др.). Изгибание растений в сторону
действующего фактора (раздражителя) называют положительным тропизмом,
а в противоположную от действующего фактора сторону —■
отрицательным.
В зависимости от природы раздражителя, вызывающего изгиб,
каждый конкретный тропизм получил соответствующее
название. Если изгиб вызван действием света — фототропизм, силой
тяжести — геотропизм, неравномерным распределением воды в
почве — гидротропизм, химических соединений (удобрений) —
хемотропизм, кислорода — аэротропизм и т. д.
Наиболее детально исследован механизм фото- и геотропизма.
427
7.13.1. ФОТОТРОПИЗМ
Среди факторов, вызывающих проявление тропизмов, свет
был первым, на действие которого человек обратил внимание.
Многолетними исследованиями выяснено, что к органам
растений, отклоняющимся в сторону источника света
(положительный фототропизм), относятся молодые побеги и листья. Свет не
оказывает влияния на направление роста корней. Отрицательно
фототропны зародышевые корешки растений, усики, гипокотиль
и другие части растений.
Во время развития растений фототропизм его органов может
изменяться. Например, до оплодотворения цветоножки
некоторых растений проявляют положительный фототропизм, а после
оплодотворения — отрицательный. Изменение положительного
фототропизма на отрицательный у одних и тех же органов может
быть вызвано и интенсивностью освещенности. При
относительно слабой освещенности отмечается положительный, а при
сильной — отрицательный фототропизм.
Благодаря изгибаниям, обусловленным фототропизмом,
органы растений занимают наиболее выгодное положение. В
результате изгибания стеблей возникает листовая мозаика, которая
способствует оптимальному использованию света при
фотосинтезе (рис. 132).
Способность растений располагать пластинки листьев
перпендикулярно падающим лучам называют диафототропизмом, а
расположение листьев под острым или тупым углом —
плагиотропизмом. Листовая мозаика особенно отчетливо видна у
тенелюбивых растений.
Рис. 132. Листовая мозаика как результат фототропизма (слева растение,
подверженное фототропизму)
428
Рис. 133. Схема движения ауксина при освещении колеоптиля со всех сторон и
при одностороннем освещении в направлении, указанном стрелками (Р. Вайнар,
1987):
А — освещение колеоптиля со всех сторон; Б — одностороннее освещение; В — изгиб
колеоптиля; Г, Д— изгиба колеоптиля не наблюдается; я — равномерное распределение ауксина в
колеоптиле; б—перераспределение ауксинов в неосвещенную сторону; в — поперечный
поток ауксина прерывается
Как же осуществляются фототропные движения?
Родоначальником учения о фототропизме считают Ч. Дарвина.
Он выяснил, что световое раздражение воспринимается верхушкой,
ответная реакция (изгиб) возникает в зоне растяжения, лежащей
ниже. Следовательно, клетки, воспринимающие световое
раздражение (рецептор), и клетки, отвечающие на это раздражение,
пространственно разобщены. Это дало ему возможность предположить
существование веществ, которые синтезируются в одном месте, а
передвигаются в другое (типа гормонов у животных).
В 1928 г. физиологи Н. Г. Холодный и Ф. В. Вент
независимо друг от друга сформулировали гормональную теорию
фототропизма, которая пользуется всеобщим признанием. В ее
основе лежит представление о фототропизме как о процессе,
стимулирующем перераспределение гормонов в верхушке побега.
Одностороннее освещение вызывает электрическую
поляризацию тканей верхушки: освещенная сторона получает
отрицательный заряд, а затененная — положительный. Под влиянием этой
поляризации ток гормона смещается на затененную сторону,
клетки этой стороны растягиваются сильнее, чем освещенной, в
результате получается изгиб в сторону света.
Выяснено, что гормонами, вызывающими рост клеток при
фототропической реакции, являются ауксины или р-индолилук-
сусная кислота. На рисунке 133 показана схема движения
ауксина на колеоптиле овса при действии света. Из рисунка видно,
что при освещении колеоптилей со всех сторон (А) поток
ауксинов распределен равномерно по всему колеоптилю (а) и при
этом изгиб у растений не наблюдается. При одностороннем
действии света на колеоптиль (Б) происходит поперечное
перераспределение ауксинов в неосвещенную сторону (б), что и приво-
429
дит к изгибу колеоптиля (В). В случае, когда поперечный поток
ауксина прерывается (Г, в), при действии одностороннего света
изгиб не наблюдается (Ц).
Неравномерное распределение ауксина оказывается очень
важным, но не единственным следствием поперечной
поляризации. Возникают также физико-химические различия, связанные
с физиологией обмена веществ, в частности с изменением
содержания сахара и концентрации ионов водорода в клетках
освещенной стороны. Химическая природа других веществ пока еще
неизвестна. В развитие теории Холодного—Вента по данным
последних исследований следует признать и роль ингибиторов,
их соотношение и баланс с ауксином, что принято во всех
процессах, в основе которых лежит рост растений (М. X. Чай-
лахян, О. Н. Кулаева, 1967).
Исследования показали, что спектр действия фототропизма
определяется и качеством света. Фототропизм лучше
проявляется в ультрафиолетовой области и в синей части спектра. У
семенных растений фототропическая реакция вызывается
коротковолновыми лучами. Фототропическая реакция зависит и от
интенсивности освещения: чем слабее свет, тем дольше нужно
освещать растения для получения фототропического эффекта.
Произведение силы света на продолжительность его воздействия
является величиной постоянной. Эта зависимость получила
название закона количества раздражения.
Фототропическая чувствительность может не проявиться, если
освещать растения сразу сильным светом после их
проращивания в темноте. Такое же действие оказывают хлороформ и эфир.
В фототропической реакции свет выступает как раздражитель,
необходимый лишь для запуска различных физиологических
процессов; при этом расходуется малое количество энергии. Для
ростовых процессов требуется много энергии.
7.13.2. ГЕОТРОПИЗМ
Наряду со светом на растения оказывает влияние сила
тяжести, определяющая положение растений в пространстве.
Присущую всем растениям способность воспринимать земное
притяжение и реагировать на него называют геотропизмом. Таким
образом, геотропизм представляет собой ответную реакцию на
ускорение силы тяжести. Положительным геотропизмом
обладают корни или их части, при этом отмечается рост к центру
Земли. Отрицательным геотропизмом обладают надземные
органы, их рост направлен от центра Земли. Уже при прорастании
семени, которое происходит в темноте, т. е. вне влияния света,
и независимо от положения самого семени наблюдается изгиб
зародышевого корешка вниз, а проростков — вверх. Прибитые к
430
земле дождем растения или полегшие хлеба могут снова
подняться за счет геотропической реакции растений. У некоторых
растений, которые способны образовывать воздушные корни, можно
наблюдать и отрицательный геотропизм, если они находятся в
сильно увлажненной среде.
Геотропическая реакция так же, как и фототропическая,
изменяется в процессе онтогенеза. Цветки некоторых растений до
распускания обладают отрицательным геотропизмом, а после
распускания он изменяется на положительный. Геотропизм у боковых
стеблей и корней выражен меньше, чем у главных. В результате
главный побег растет строго вертикально вверх, главный корень —
вертикально вниз, а боковые побеги и корни располагаются под
некоторым углом к ним. Это помогает растению поглощать воду и
минеральные удобрения из почвы, а надземным частям растений —
поглощать СС>2 из воздуха и избегать затенения друг друга.
Первые доказательства того, что раздражителем при
геотропизме является направление силы тяжести, были получены в
начале XIX в. Т. А. Найтом, затем это учение развили Ч. Дарвин
(1887), Г. Габерландт и Б. Немец (1900), Ф. В. Вент и Н. Г.
Холодный (1928).
Для осуществления геотропической реакции требуется
определенное количество раздражения, причем неважно, будет ли это
сильное раздражение в течение короткого времени или слабое в
течение длительного времени. Здесь, как и в фототропизме,
действует закон количества раздражителя.
Для объяснения механизма геотропизма следует обратиться
еще раз к гормональной теории Холодного—Вента, согласно
которой при вертикальном положении проростка ток гормонов
распределяется равномерно, результатом чего является
равномерный рост. При горизонтальном положении проростка гормон
концентрируется на нижней стороне органа. При этом у стебля
рост клеток на нижней стороне ускоряется, и стебель изгибается
вверх, а у корня — тормозится, и он изгибается вниз. Клетки
корня обладают большей чувствительностью, чем клетки стебля,
поэтому одна и та же концентрация гормона на нижней стороне
может подавить рост клеток корня и стимулировать растяжение
клеток стебля. В результате два органа проявляют разную
геотропическую реакцию.
Если при фототропизме рецепторами у коле.оптилей овса
являются флавопротеиды, то у корней органом, воспринимающим
раздражение, служит корневой чехлик. Подтверждение этого
было получено, когда после удаления корневого чехлика
растение утратило способность к геотропизму. После регенерации
корневого чехлика геотропическая реакция восстановилась.
Восприятие силы тяжести может происходить только в
результате перемещения имеющих массу частиц. Такую функцию у
растений могут выполнять статолиты. Чешский ботаник Б. Немец и
431
Рис. 134. Размещение статолитного крахмала в клетках корневого чехлика (А)
(по Б. Немецу) и схема размещения крахмальных зерен и блестящих телец в
качестве статолитов:
а — нормальное положение; <> —горизонтальное положение корня; черные кружки — стато-
литы; окружности — пузырьки Гольджи
немецкий физиолог Г. Габерландт независимо друг от друга в
1900 г. указали на лейкопласты и на образующиеся в них
крахмальные зерна как на структуры, воспринимающие силу тяжести.
Такие крахмальные зерна встречаются в клетках корневого
чехлика и в эндосперме — клетках первичной коры стеблей растений. В
клетках корневого чехлика особенно жидкая цитоплазма, поэтому
при изменении положения корня крахмальные зерна сейчас же в
силу своей тяжести передвигаются и занимают всегда самую
нижнюю часть клетки, оказывая давление на цитоплазму, которая
возбуждается.
Если из лейкопластов удалить крахмал, то способность к гео-
тропным реакциям утрачивается. Следовательно, крахмал
лейкопластов играет решающую роль при выполнении ими функции
статолитов.
В настоящее время предполагают, что у высших растений
432
возможность воздействия статолитного крахмала осуществляется
через давление на плазмалитические структуры, которые и
вызывают возбуждение. Кроме крахмальных зерен статолитами, по-
видимому, могут служить в клетках корня кристаллы белка, хло-
ропласты, митохондрии и другие структуры (рис. 134). В
результате восприятия растением земного притяжения клеток за счет
статолитов наблюдается поперечная поляризация, которая
проявляется в первую очередь в неравномерном распределении
ауксина. Это вызывает усиление роста клеток и активное
передвижение веществ.
В геотропической реакции, как и в фототропизме, различают
четыре основные фазы: восприятие раздражения; возбуждение
клеток, приводящее к накоплению гормонов; проведение
возбуждения; неравномерный рост органа.
Геотропический изгиб как ростовое движение свойствен
молодым частям растений; у взрослых частей, закончивших свой
рост, он наблюдается очень редко. Геотропическая
чувствительность может меняться под влиянием факторов внешней среды.
Так, полегшие растения не могут подняться, если почва сильно
переувлажнена и корни находятся в анаэробных условиях. При
неблагоприятных условиях среды (засуха, низкая или высокая
температура, действие некоторых химических веществ)
крахмальные зерна исчезают и геотропическая чувствительность не
проявляется.
7.13.3. ДРУГИЕ ВИДЫ ТРОПИЗМОВ
Хемотропизм — это изгибы корней при неравномерном
распределении в почве какого-нибудь химического вещества.
Хемотропизм кроме корней свойствен пыльцевым трубкам,
проросткам растений-паразитов. И здесь наблюдается положительный и
отрицательный хемотропизм, который может изменяться в
зависимости от концентрации и характера веществ. У корней хемо-
тропен самый кончик корня, а изгиб находится в зоне
растяжения. Механизм хемотропизма неизвестен.
Благодаря хемотропизму растение способно усваивать
удобрения, избегать их избыточного накопления. Это связано с
движением корня (ростом) в направлении имеющихся удобрений или
при избытке их — от удобрений.
Гидротропизм — разновидность хемотропизма. При этом виде
тропизма наблюдается изгибание растущих частей растений под
влиянием воды. Гидрочувствительность также располагается на
самом кончике корня.
Кроме перечисленных тропизмов существует еще несколько
видов: аэротропизмы, тигмотропизмы (ответ на прикосновение),
термотропизмы, электротропизмы, травматропизмы.
433
7.13.4. НАСТИИ
Как и тропизмы, настии представляют собой изменения
положения органов прикрепленных растений, вызванные
внешними раздражителями. Но в отличие от тропизмов при их
проявлении нет никакой зависимости направления движения от
направления действия раздражителя. Это движения, которые возникают
в ответ на действия диффузных факторов. Такими факторами
могут быть изменения температуры, интенсивности света,
влажности воздуха и т. д., действующие на растение со всех сторон.
Органы, способные к совершению настических ответных
реакций, всегда обнаруживают физиологическую, а в большинстве
случаев и морфологическую двустороннюю симметрию. Насти-
ческие изменения положения органов приурочены к
определенным их участкам, имеющим соответствующее этому
анатомическое строение.
Названия настий, как и тропизмов, зависят от тех
раздражителей, которые их вызывают. Так, различают фото-, термо-,
хемо-, гидро-, тигмо-, сейсмо-, электро- и травманастии.
Если тропизмы осуществляются преимущественно как
ростовые движения, то настии проявляются в первую очередь
благодаря изменениям тургорного давления.
Наиболее распространены никтинастические движения, т. е.
вызываемые сменой дня и ночи. Очень многие цветки
открываются утром, а закрываются на ночь. Раздражителем в данном
случае является изменение только температуры или только
интенсивности света. Никтинастические движения облегчают
опыление цветков в благоприятную погоду и защищают внутренние
органы цветка от неблагоприятных факторов среды.
Заблаговременное закрывание цветков перед грозой — подтверждение
наличия таких движений. Точно так же листья многих растений, в
особенности бобовых, меняют свое положение при смене дня и
ночи. У фасоли в листе сочленения пластинок и черешков (в
подушечках) возникают движения, которые приводят к смене
дневного (горизонтального) положения листовой пластинки на
ночное (вертикальное), а потом к возвращению в исходное
состояние. Такое явление получило название «сон растений». Эта
способность у растений закреплена наследственно
Движения, происходящие в ответ на толчки, сотрясения,
испытываемые растениями, получили название сейсмонастичвских.
Они могут вызываться ветром, дождем или прикосновением.
Такие настические движения можно наблюдать в цветках
растений из семейства сложноцветных, у которых тычиночные нити
быстро сокращаются в ответ на прикосновения, что вызывает
опускание трубки, окружающей пестик и состоящей из
сросшихся между собой пыльников.
Из сейсмонастий наиболее известно быстрое складывание
434
листочков мимозы при прикосновении. Это связано с
особенностями строения ее листьев, наличием моторных клеток,
которые, изменяя тургор, дают движение черешкам и листовым
пластинам. Такие же моторные клетки есть и у других растений.
В отличие от сейсмонастических изменений положения
органов растений, при которых раздражающе действуют сотрясение
или удары, при проявлении тигмонастических движений
раздражение вызывается прикосновением. Наиболее заметные тигмо-
настические движения обнаружены у растений, имеющих усики
и поэтому способных охватывать опору. Такие движения
отмечают у гороха. Самой высокой раздражимостью обладает, как
правило, верхняя треть усиков, наиболее восприимчивая к
раздражению соприкосновением. В основе движения усиков лежат как
колебания тургорного давления, так и процессы роста. Изгиб
происходит лишь в случае, если клетки-рецепторы прикоснутся
к опоре.
Механизм настий до конца не изучен. Предполагают, что они
обусловлены в некоторых случаях (открывание цветков)
неравномерным ростом разных сторон органа. Если при этом более
быстрый рост наблюдается на морфологически верхней части
органа, то говорят об эпинастии, если на нижней — о гипонас-
тии. Неравномерный рост, вероятно, обусловлен гормонами.
Особую группу составляют движения улавливания и
захватывания, присущие насекомоядным растениям. Сравнительное
изучение показало, что механизмы функционирования ловушки у
мухоловки и росянки имеют сходство: обладают быстрыми на-
стическими и более медленными тропическими движениями.
Вместе с тем эти растения отличаются друг от друга участком, на
который распространяется потенциал действия. Повторяющиеся
потенциалы действия вызывают секреторную деятельность
пищеварительных желез. Эти движения можно определить как
механическую реакцию, вызванную потенциалом действия в
моторных клетках, для которых характерна реакция сцепления:
возбуждение -» тургор -» спад.
Кроме перечисленных движений (настии, тропизмы)
существуют таксисы. Таксисы — направленные движения всего
организма, обусловленные односторонним влиянием внешних
раздражителей: силы тяжести, света, химического воздействия и др.
Таксисы свойственны только низшим растениям и не связаны с
ростом.
7.14. РАЗВИТИЕ РАСТЕНИЙ
Физиологов всегда интересовали вопросы развития растений
(Г. Клебс, К. А. Тимирязев, Ю. Сакс, Ф. Вент, Н. Г. Холодный,
М. X. Чайлахян, Д. А. Сабинин, В. Г. Конарев, И. В. Мичурин и
др.). В процессе эволюции растения приспособили свое индиви-
435
дуальное развитие к условиям региона, к конкретной
экологической нише. Растения «ориентируются» во времени, ускоряя
или замедляя свое развитие в соответствии с меняющимися
длиной дня, качеством и количеством света, температурой, и
своевременно переходят к репродукции или в состояние покоя. В
отдельные моменты онтогенеза может происходить развитие, не
сопровождающееся видимым ростом, и наоборот, в другое время
ростовые процессы не сопровождаются качественными
изменениями.
7.14.1. МОРФОЛОГИЧЕСКИЕ, ФИЗИОЛОГИЧЕСКИЕ И БИОХИМИЧЕСКИЕ
ПРИЗНАКИ ОБЩИХ ВОЗРАСТНЫХ ИЗМЕНЕНИЙ У РАСТЕНИЙ
В индивидуальном развитии высших растений (онтогенезе)
М. X. Чайлахян (1983) выделяет пять этапов: эмбриональный
(семенной или почковый); ювенильный, или молодости;
зрелости (половой или вегетативной); размножения — плодоношения
(полового или вегетативного) и старости. Каждый этап имеет
специфические морфологические признаки, физиологические и
биохимические свойства, которые тесно связаны друг с другом и
находятся в постоянном взаимодействии. Основным критерием
начала очередных этапов принимают возникновение
характерных зачаточных структур.
Эмбриональный этап у семенных растений проходит в
семенах — от оплодотворения яйцеклетки до начала прорастания
зародыша, у вегетативно размножающихся растений — в почках
органов вегетативного размножения (клубнях, луковицах и
корневищах). Этап молодости (ювенильный) начинается с
прорастания почек и продолжается до появления на растении первичных
зачатков цветков. Этап зрелости у семенных растений проходит в
период от закладки зачатков цветков до появления новых
зародышей; у вегетативно размножающихся растений он начинается
с появления зачатков органов вегетативного размножения на
молодых растениях. Этап размножения (плодоношения) полового
или вегетативного проходит от возникновения эмбрионов до
полного созревания семян и плодов, он совершается у
однолетников однократно, а у многолетних — поликарпических
растений (плодовые, ягодники, многолетние травы) — многократно.
Этап старости — это период от полного прекращения
плодоношения до отмирания растения.
Прохождение этапов онтогенеза растением сопровождается
взаимодействием между его клетками, тканями и органами. В
этом проявляется целостность растительного организма.
Новообразованию элементов структуры растительного организма
предшествуют необходимые физиологические и биохимические
процессы.
В эмбриогенезе злаковых растений выделяют три фазы: налив
436
зерна (в основном формируется эндосперм); молочная спелость
(преимущественно развивается зародыш); восковая и полная
спелость (интенсивное отложение запасных веществ и быстрое
снижение содержания воды). После оплодотворения в зиготе
возрастает синтез РНК, идет усиленное деление клеток
зародыша и эндосперма. Необходимые для развития эндосперма ИУК и
цитокинины первоначально поступают из нуцеллуса и плаценты.
Развитие зародыша семени зависит от фитогормонов (ГК и
ЦК), поступающих из эндосперма. Затем зародыш сам начинает
синтезировать фитогормоны; ауксин поступает в окружающие
ткани. В результате усиливается приток питательных веществ и
воды в семена и плоды из ассимилирующих органов
материнского растения. Затем влажность семян снижается и они переходят
в состояние покоя. Покой связан с уменьшением содержания
активных ауксинов, цитокининов и гиббереллинов, а также с
увеличением содержания АБК. В покоящихся семенах, клубнях
картофеля и корнеплодах свеклы происходят физиолого-биохи-
мические процессы, обеспечивающие их послеуборочное
дозревание. В этот период у озимых растений (рожь, пшеница,
ячмень) и двулетников (морковь, свекла, капуста) формируется
свойство озимости.
Этап молодости (ювенильный). Ювенильный этап начинается
с прорастания семян или почек органов вегетативного
размножения. Прорастанию способствуют благоприятное сочетание
влажности, температуры и аэрации среды; снижение в семенах
содержания АБК и фенольных соединений в результате
ферментативного окисления и вымывания во влажной среде; нарушение
целостности семенной оболочки и повышение проницаемости
для воды и кислорода в результате гидратации составляющих ее
биополимеров; условия полной темноты либо кратковременного
освещения (салат, табак и др.).
В прорастании семян выделяют следующие фазы: набухание,
проклевывание, гетеротрофный рост проростка, переход к авто-
трофному питанию. Набухание семян — результат физического
поглощения воды биоколлоидами. Под действием возникшего
при набухании давления семенные покровы разрываются.
Набухание практически не зависит от температуры, содержания
кислорода и освещения. Проклевывание происходит при 40—65%-ной
влажности семян (у бобовых выше) за счет растяжения клеток
зародышевого корня и гипокотиля. За зародышевым корнем
начинается рост побега. Направление его роста в почве определяется
прежде всего гравитацией.
Гетеротрофный рост проростка. Побег
удлиняется благодаря растяжению гипокотиля (бобы, тыква и др.) или
мезокотиля (злаки) проростка. Продолжается рост зародышевого
корня. У злаков в первый период прорастания семян ИУК и
цитокинины поступают в зародыш из эндосперма, гиббереллин
437
переходит из конъюгированного состояния и начинается его
синтез в щитке.
В активированных гиббереллином клетках щитка и
алейронового слоя начинается гидролиз сложных запасных веществ
эндосперма, обеспечивающий питание растущего зародыша и
проростка. Гидролиз белков до аминокислот катализируют пептида-
зы и папаиназы. Крахмал расщепляется амилазами до мальтозы,
а затем мальтазами до глюкозы. Липиды гидролизуются
липазами до глицерина и жирных кислот. Затем растущий
зародышевый корень начинает синтезировать цитокинины и гибберелли-
ны, которые направляются в побег. В верхушке колеоптиля у
злаков и почечке у двудольных синтезируется ИУК. Для синтеза
нуклеиновых кислот вначале используются резервные нуклеоти-
ды семени, затем их синтез начинается заново.
Переход к автотрофному питанию. При
достижении этиолированным побегом поверхности почвы рост гипо-
котиля или мезокотиля проростка подавляется, усиливается рост
эпикотиля и листьев. Растение зеленеет и переходит к
автотрофному (фототрофному) питанию. Начинается интенсивный рост
растения, и к концу ювенильного этапа накапливается
значительная вегетативная масса.
Особенности ювенильного состояния
растений. В ювенильный период растения характеризуются рядом
особенностей.
1. Ювенильное растение не обладает чувствительностью к
факторам и условиям, индуцирующим позднее закладку органов
полового или вегетативного размножения, стимулирующим
переход к цветению. Возможная причина этого — отсутствие в
органах-мишенях, воспринимающих гормоны, белков-рецепторов,
участвующих в индукции генеративного развития (В. В.
Полевой, 1989).
2. Ювенильное растение образует хорошую корневую систему,
что используется в практике садоводства при укоренении юве-
нильных, с высоким содержанием ауксинов, черенков.
3. Хорошим признаком ювенильности растений являются
особенности морфологии листьев (хлопчатник, огурец и др.), слабая
дифференциация конуса нарастания верхушечной почки (I—Г/
этапы органогенеза).
4. Ювенильное состояние поддерживается специфическим
соотношением фитогормонов.
5. В ювенильный период растение достигает значительных
размеров и массы, что позволяет ему конкурировать в фитоценозе.
В конце ювенильного периода у растений появляется
чувствительность к условиям, вызывающим заложение цветков.
В ювенильной фазе озимые и двулетние растения проходят
яровизацию пониженными температурами. У озимых однолетних
растений чувствительность к яровизации достигается уже при
438
прорастании семян. Большинство двулетних и многолетних
растений, нуждающихся в яровизации, не реагируют на
пониженные температуры во время прорастания семян. Исключение
составляют морковь, свекла, турнепс и др. В последующем
чувствительность растений к яровизации увеличивается. В умеренной
зоне двулетний характер развития многих растений, требующих
для репродукции воздействия низких температур, объясняется
незавершенностью ювенильной фазы, которая не позволяет
растениям воспринимать яровизацию во время холодных дней и
ночей первой весны (первого года жизни).
Ранние признаки скороспелости. У разных видов
сельскохозяйственных растений ювенильный период
продолжается от нескольких недель (однолетние травы) до нескольких лет
(плодовые деревья). Чем короче ювенильный период (до закладки
зачатков цветков), тем скороспелее растение. У травянистых
растений длительность ювенильного периода соответствует числу
листьев, образующихся до первого цветка или соцветия. Чем
меньше апикальная меристема формирует листовых узлов
(листьев), тем короче ювенильный период и скороспелее растение.
Факторы, обусловливающие ювенильное
состояние. Неспособность молодых растений зацветать даже
при благоприятных внешних условиях, продолжительность
ювенильного периода обусловлены рядом обстоятельств. Задержка
репродуктивного развития характерна для растений, достигающих
крупных размеров. Световые условия, высокая освещенность или
длинный день в начальный период роста, способствующие
интенсивному фотосинтезу, сокращают у многих растений ювенильный
период. Поэтому необходим определенный уровень снабжения
ассимилятами растения для достижения им цветочно-спелого
состояния. У некоторых видов растений заложение цветков
происходит при достижении необходимого соотношения площадей
поверхности молодых и взрослых листьев. Так, удаление молодых,
растущих листьев у растений сои и томата ускоряет образование
цветков. Возможно, что молодые листья продуцируют
ингибиторы цветения, сдерживают транспорт к меристемам фотоассимиля-
тов и стимулам цветения из нижних взрослых листьев. Одна из
причин ювенильности — нечувствительность первых листьев у
некоторых фотопериодически чувствительных растений к
благоприятной длине дня. Однако имеются растения, зацветающие уже в
фазе проростков. Влияние на ювенильность корневой системы
наблюдается у сеянцев яблони и других древесных; у некоторых
растений частичное удаление корней сокращает ювенильный
период. Ювенильное состояние растений, очевидно, связано и с
неспособностью ювенильных меристем реагировать на действие
гормонов цветения, образующихся в листьях.
Агроному следует помнить, что наиболее благоприятные
условия для протекания этапа молодости с характерным для него
439
мощным ростом растений — оптимальные освещенность и
температура, увлажненность почвы и минеральное питание.
Этап зрелости. Это период от появления готовности растений
к заложению зачатков репродуктивных органов до формирования
бутонов и цветков или клубней, луковиц и других органов
вегетативного размножения и возникновения новых зародышей. Этап
зрелости семенных растений начинается закладкой цветочных
зачатков. Далее идут спорангиогенез, спорогенез и гаметогенез. В
результате образования репродуктивных органов у растений
появляется способность к размножению. Озимые и двулетники не
переходят к цветению без яровизации. У многих растений переход
к репродукции индуцирует свет (фотопериодизм).
7.14.2. ЯРОВИЗАЦИЯ
В регуляции развития растений важную роль играют
температуры ниже оптимальных для процессов роста. С действием таких
температур связаны прорастание семян, прерывание покоя почек
и подготовка к закладке цветочных бугорков в конусе
нарастания. Стимуляцию цветения при действии пониженных
температур называют яровизацией. Яровизация наклюнувшихся семян
озимых культур позволяет и при весеннем (яровом) посеве
получить урожай зерна. С помощью яровизации и фотопериодизма
растение координирует свой жизненный цикл с сезонными
изменениями погоды. По отношению к яровизации можно
выделить три группы растений: озимые, двуручки, яровые.
Озимые растения переходят к репродукции только при
воздействии в течение определенного времени пониженными
температурами. К этой группе относятся многие однолетние, двулетние и
многолетние растения (рожь, пшеница, ячмень, клевер, овсяница
луговая, ежа сборная, кострец безостый, райграс пастбищный и
др.). В поле озимые зерновые, высеянные в конце лета — начале
осени, зимуют в фазе кущения, подвергаются длительному
влиянию пониженных температур, весной продолжают кущение,
колосятся и дают урожай зерна. При весеннем же высеве эти
растения интенсивно кустятся, но не переходят к колошению.
У озимых культур яровизация обеспечивает успешную
перезимовку растений и завершение онтогенеза в регионах, где год
резко делится на устойчивые зиму и лето. Большинство
растений, требующих яровизации, является длиннодневными. У
сортов озимых пшениц преобладает распластанный куст, легко
покрывающийся снегом. У озимых двулетних растений (свекла,
репа, морковь, капуста, сельдерей) при посеве весной в первый
год жизни формируются только вегетативные органы. Яровиза-
ционные изменения при длительном воздействии низких
температур в осенне-зимний период возможны при достижении этими
растениями достаточных размеров.
440
У многолетних злаков озимого типа для прохождения
яровизации необходимо, чтобы яровизируемый побег сформировал
достаточно развитую листовую поверхность: у овсяницы луговой не
менее 5—6 листьев, у ежи сборной 6—7, у костреца безостого
7—9 листьев. Осенняя индукция цветения побегов
осуществляется в результате влияния пониженной температуры и короткого
дня (А. К. Федоров, 1968; И. К. Киршин, 1975, и др.).
Двуручки ускоряют развитие при воздействии пониженными
температурами, однако яровизация не является обязательной.
Растения-двуручки дают урожай зерна как при осеннем, так и
при весеннем посеве. На основании изучения многих зерновых
культур (пшеницы, ячменя, овса, ржи, тритикале, гороха и др.)
показано, что двуручки — это самостоятельная по типу развития
группа растений, отличающаяся от озимых и яровых реакцией на
свет и яровизацию (А. К. Федоров, 1983). Двуручки — это
зимующие растения, способные давать высокие урожаи зерна.
Яровые растения не требуют для перехода к цветению
яровизации (многие зерновые, зернобобовые, крупяные, кормовые,
масличные, прядильные и др.). В северных широтах яровые
урожайны только при весеннем посеве и погибают при осеннем, не
выдерживая условий перезимовки.
Условия яровизации. Температуры, которые
необходимы разным растениям для яровизации, различаются,
генетически обусловлены и связаны с адаптацией данного вида к жизни в
определенном климатическом районе. Для большинства видов
растений оптимальная температура яровизации от 0 до 5—10 °С.
Однако для некоторых злаков благоприятна температура ниже
О °С (до -6 °С). Для яровизации озимой пшеницы наиболее
эффективны температуры от 0 до 5 "С. Яровизация маслины
проходит при 10—13 °С, а хлопчатника — при 20—25 °С. Уровень
оптимальных для прорастания и яровизации температур — важный
фактор, определяющий географическое распространение
конкретных видов и сортов растений, регулирующий время их
цветения и плодообразования. Для большинства сортов озимой
пшеницы длительность непрерывного воздействия пониженными
температурами (яровизация) составляет 35—60 сут.
С увеличением длительности воздействия температурный оп-
тимум понижается. Достаточное снабжение растений водой и
кислородом необходимо для яровизации. Растения могут
проходить яровизацию в разном возрасте, начиная с состояния
наклюнувшихся семян. Яровизация в прорастающих семенах
многолетних бобовых и злаковых трав озимого типа не происходит. В
условиях фитотрона, яровизируя семена озимых культур,
получают по 2—3 поколения в год, что важно для ускорения
селекционного процесса.
Локализация процесса яровизации.
Процессы яровизации у прорастающих семян и у зеленых растений
441
проходят в стеблевых апексах (почках), в делящихся клетках
верхушечной меристемы. Образующиеся при этом в клетках
апекса продукты яровизации, по-видимому, не перемещаются по
растению. Однако если меристема апекса яровизирована, то
эффект яровизации передается всем клеткам, образующимся из
яровизированной почки, обусловливает изменения
морфологических проявлений роста, в итоге — переход растения к
репродукции. В пределах куста многолетнего растения яровизацию
проходят только активные меристематические ткани апексов, а
неактивные меристемы остаются неяровизированными и в
последующем формируют побеги.
Природа стимула яровизации. Действие
яровизации связано с рядом изменений в физиологическом состоянии
и метаболизме клеток активных меристем и растения в целом.
Однако неизвестно, что именно задерживает репродуктивное
развитие и зацветание озимых растений в отсутствие
яровизирующих температур, какие метаболиты, возникающие под
влиянием этих температур, придают растениям способность реагировать
на изменение длины дня (М. X. Чайлахян, 1990).
Возможно, что накопленные под влиянием пониженных
температур физиолого-биологические изменения в растениях
влияют на образование специфических веществ-регуляторов,
вызывающих цветение растений. Согласно другой гипотезе яровизация
«дерепрессирует» в клетках особые гены. Так, в растениях сортов
озимых пшениц идентифицированы три группы генов,
ответственных за яровизацию. В течение яровизации в тканях озимых
растений накапливаются углеводы и растворимые азотистые
соединения, некоторые липиды, заметно увеличивается количество
РНК, повышается активность цитохромоксидазы, аскорбинаток-
сидазы, в меристематических клетках изоэлектрическая точка
белков сдвигается в кислую сторону. По данным М. X. Чайлахя-
на (1990), у озимых растений, прошедших яровизацию,
содержание природных гиббереллинов в листьях повышается на
длинном дне и достигает уровня гиббереллинов у яровых форм.
Однако повышения ГК на коротком дне не происходит.
Разъяровизация. Термоиндуцированное состояние
верхушечных меристем достаточно стабильно, ткани «помнят»
низкотемпературное воздействие. Однако последующее
продолжительное (несколько недель или дней) действие относительно
высоких температур (25—40 "С или даже 18—25 °С) приводит к
разъяровизации. У растений сахарной свеклы, лука, озимых
злаков способность клеток апекса к образованию репродуктивных
органов теряется. Такой же эффект у ряда растений вызывают
слабое освещение или короткий день. Разъяровизированные
растения можно вновь яровизировать. У многолетних травянистых
растений (многолетняя рожь, ячмень луковичный, ежа сборная,
овсяница луговая и др.) яровизационные изменения устраняются
442
I
при образований в узле кущения зачатков новых вегетативных
побегов. Поэтому растение в течение ряда лет сохраняет ози-
мость, что и обеспечивает его ежегодную приспособленность к
перенесению морозов и засухи.
Замена яровизации другими факторами. В
ряде случаев действие пониженных температур может быть
заменено выращиванием растений при непрерывном освещении на
коротком дне при синем и красном свете. Обработка растений
гиббереллином может заменить низкотемпературное воздействие
у некоторых двулетников, вызывая при благоприятном
фотопериоде закладку цветочных бугорков (А. Ланг, 1956).
7.14.3. ФОТОПЕРИОДИЗМ
Он был открыт В. Гарнером и Г. Аллардом (1920). Огромный
вклад в изучение этого явления внесли отечественные ученые
М. X. Чайлахян, В. Н. Любименко, В. И. Разумов, Б. С. Мош-
ков и др. Фотопериодизм — это способность растений переходить
к цветению только при определенном соотношении длины
темного и светлого периода суток. Он выражается в изменении
процессов роста и развития, обеспечивающих адаптацию
онтогенеза конкретного вида растений к сезонным особенностям
климатических условий в данном месте его произрастания. Длина
дня и ночи используется растением как астрономические часы,
показывающие лучшее время перехода к активному цветению,
развитию клубней и луковиц или подготовки к сезонным
неблагоприятным условиям (В. М. Катунский, 1940). В процессе
эволюции сформировались три основные группы растений с
различной фотопериодической реакцией: длиннодневные, короткоднев-
ные, нейтральные.
Длиннодневные растения (ДДР) — рожь, ячмень, пшеница и
др. —требуют для своего развития длинного дня и короткой
ночи, зацветают при длине дня больше определенной
(критической) продолжительности (рис. 135). На рисунке 135 показано
влияние длины дня на развитие хризантемы, в таблице —
приложении к рисунку — на цветение шпината и периллы.
Короткодневные растения (КДР) — просо, соя, рис и др. —
требуют для своего развития длинной ночи и короткого дня,
зацветают при длине дня меньше определенной (критической)
продолжительности.
Нейтральные растения — томат, некоторые сорта хлопчатника
и др. — зацветают при любой длине дня.
Большинство растений длинного дня произрастает и возделы-
вается в районах умеренного климата. Растения короткого дня,
южного, тропического происхождения не переходят к цветению
в условиях длинного дня этих зон. Это важно при видовом и
443
$м
т ]
У
7ч 8ч 9ч 10ч 11ч
Оптимальные сроптопериоды
729
5ч Чч
Критические
щтапериоды
У
15ч
Рис. 135. Влияние длины дня на развитие и цветение короткодневных (хризанте-
Культура
Шпитан
Перилла
«+» и «-
Фотопериод, ч
5
6
7
8
9
10
11
12
13
14
15
16
17
непрерывный свет
— — -^_ -р -р -р -р
+ + + + + + + + ----- -
» означают соответственно наличие и отсутствие цйЬтения у растений.
сортовом районировании сельскохозяйственных культур. У
разных видов и сортов растений минимальный фотопериодический
индуктивный период составляет от 1 до 25 сут (циклов) и
приводит к последующему зацветанию растений независимо от длины
дня. Для короткодневных растений необходим непрерывный
темновой период определенной длины. Если его прервать
коротким (10 мин) светом, то индукции цветения не будет. Для длин-
нодневных растений требуется длинный световой период,
который ускоряет их развитие. Индукция вызывается светом очень
малой интенсивности (3—5 лк).
Фотопериодическая реакция растений наиболее успешно
проходит в лучах определенных длин волн (С. Хендрикс и X. Борт-
свик, 1952), совпадающих со спектром действия фитохрома. В
индукции цветения участвует фитохром (система Фк—ФдкХ
который отвечает за восприятие соотношения света и темноты.
Полагают, что белок фитохрома — это фермент,
катализирующий синтез какого-то физиологически активного вещества. В
ночной период Фдк превращается в Фк. и это способствует
началу реакций, приводящих короткодневные растения к
цветению. При вспышке красного света (660 нм) Фк превращается в
Фдк и это ингибирует реакции, приводящие к цветению.
Если растение короткого дня, например хризантему,
выращивать на длинном дне, оно не зацветает. Однако растение
зацветает при временном затенении только листьев
светонепроницаемой тканью. Следовательно, воспринимают фотопериодическое
444
воздействие листья, в которых имеется фитохром. В листьях под
действием соответствующего фотопериода проходят процессы,
приводящие к образованию особых веществ, которые
передвигаются по стеблю и приводят к заложению в конусе нарастания
цветочных зачатков.
Какова природа возникающего в листьях стимула цветения?
М. X. Чайлахян (1937) выдвинул гипотезу двухкомпонентной
гормональной системы зацветания (флориген) (рис. 136).
Предполагается, что в гормональный комплекс флоригена входят
гиббереллины и гипотетические антезины. Цветение возможно
лишь при наличии и благоприятном соотношении в растении
двух компонентов флоригена — гиббереллина и антезина. У
длиннодневных растений образование цветочных стеблей
зависит от наличия гиббереллина, который накапливается в
достаточном количестве лишь на длинном дне. Второй гормон
цветения — антезин у длиннодневных растений всегда присутствует в
достаточном количестве.
При выращивании длиннодневных растений на коротком дне
они не цветут, так как не хватает гиббереллина. Поэтому
опрыскивание гиббереллином вызывает зацветание длиннодневных
растений на коротком дне. У короткодневных растений антезин
образуется только на коротком дне, содержание же гиббереллина
достаточно высокое при любой длине дня. Поэтому
опрыскивание короткодневных растений гиббереллином не вызывает их
зацветания на длинном дне. Следовательно, зацветание длинно-
Короткодневный
Д К
Нейтральный
Д К
д/шнновневный
Д
г
Г+А
Г+А
Рис. 136. Автономный и индуцированный механизмы регуляции цветения
нейтральных, короткодневных и длиннодневных видов (М. X. Чайлахян, 1989):
/ — гиббереллины — гормоны, необходимые для образования стеблей; 2 — антезины —
гормоны, необходимые для образования цветков; 3 — флориген — гиббереллины + антезины,
необходимые для цветения
445
дневных растений лимитирует гиббереллин, а короткодневных —
антезин. Поскольку в листьях цветущих короткодневных и длин-
нодневных растений присутствуют эти фитогормоны, то
прививка этих листьев к нецветущим растениям вызывает их зацветание
при неблагоприятном фотопериоде.
Следует упомянуть и о некоторых аспектах практического
использования фотопериодической реакции при выращивании
культурных растений. Изменяя длину светотемнового периода у
культур, выращиваемых в защищенном грунте, можно
регулировать цветение декоративных растений и получать цветы к
любому сроку, а также собирать несколько урожаев овощных и
зеленных культур в течение года. Выращивание ДДР на коротком дне
в вегетационных домиках с прерыванием темноты вспышкой
света позволит не только стимулировать цветение растений и
получать хороший урожай, но и значительно снизить
себестоимость продукции за счет экономии электроэнергии.
В открытом грунте можно собрать несколько урожаев ДДР
(редис, репа и др.), если в ранний период и во время
формирования корнеплодов закрыть растения ящиками или темной
пленкой, создавая им 12-часовой день. У земляники после получения
весной первого урожая можно вызвать новое формирование
цветков, если на некоторое время закрывать их, так как для
формирования цветков им необходим короткий день. Затем
растения снова открывают и они дают плоды уже на длинном дне.
В этих условиях можно собрать два урожая за сезон.
Изменение фотопериодической реакции во время уборки
сахарного тростника позволит сохранить качество урожая и при
длительном периоде уборки. Для этого в ночные часы плантации
короткое время освещают прожекторами, что вызывает
замедление процессов старения в тканях.
Сочетание слабой освещенности и низкой температуры с
учетом фотопериодической реакции можно использовать для
выгонки цветов, кустарников, хранения картофеля и другой
сельскохозяйственной продукции. Необходимо напомнить, что картофель
и другая продукция не будут прорастать, если их освещать
слабым дальним красным светом. Красный свет, наоборот, будет
стимулировать прорастание клубней.
Этап размножения. Это период заложения, роста, развития и
созревания семян и плодов у растений, размножающихся
семенами, и клубней, луковиц и других органов у вегетативно
размножающихся растений. Этап размножения начинается с
оплодотворения. Завязавшиеся семена становятся мощными аттраги-
рующими центрами, куда начинают передвигаться из других
частей растения значительные количества метаболитов и
минеральных веществ. Биохимические процессы в семенах при их
росте и созревании противоположны таковым при прорастании.
При участии гидролаз и синтетаз из моносахаридов синтези-
446
руется крахмал, из органических кислот и глицерина — жиры, из
аминокислот — запасные белки. В семенах при созревании
содержание сухого вещества быстро увеличивается, а воды
снижается. У сочноплодных растений образование плода
стимулируется фитогормонами, поступающими из образующихся семян. Из
вегетативных органов растения идет активный приток в ткани
плода питательных веществ. После завершения роста плода
происходят процессы, обеспечивающие его полное созревание.
Плоды становятся мясистыми, плотность мякоти снижается.
Размягчение плодов — результат гидролиза пектиновых веществ
клеточных стенок, крахмала и жиров.
В результате гидролиза крахмала увеличивается содержание в
плодах простых Сахаров и яблочной, лимонной и других
органических кислот, продолжается синтез белков. Происходят
разрушение дубильных веществ, синтез душистых эфиров, альдегидов
и кетонов. При разрушении хлорофилла и синтезе каротиноидов
и антоцианов окраска плодов изменяется от зеленой до желтой и
красной.
Начало созревания плодов связано с синтезом в них этилена.
Применяя этилен, можно ускорить созревание и достижение
плодами товарного состояния. Для задержки этих процессов в
плодах при хранении их в камерах уменьшают содержание О2 в
газовой смеси и повышают СО2, что снижает синтез этилена в
плодах. У многолетних поликарпических растений наряду с
плодовыми побегами и почками ежегодно образуются и
вегетативные. Поэтому многолетние растения, достигнув зрелости,
плодоносят ежегодно.
Экспериментально показано (М. X. Чайлахян, В. Н. Хрянин,
1982), что экспрессия генов, определяющих пол у двудомных
(конопля, шпинат) и однодомных растений с раздельнополыми
цветками (огурец,
кукуруза), зависит от
соотношения цитокинина и гиббе-
реллинов, на которое
влияют различные
внешние воздействия.
Факторы внешней среды,
которые благоприятствуют
синтезу цитокининов в
корневой системе,
вызывают проявление
женского пола, в то время как
факторы, способствующие
синтезу гиббереллинов в
листьях, обусловливают
проявление мужского пола
(рис. 137).
<- Свет
красный
<= Высокая•{'
Влажность^
высокая
ЕЕЗ*
■^Влажность
низкая
Рис. 137. Роль факторов среды и фитогор-
монов в проявлении пола у растений:
/ — цитокинины; 2 — гиббереллины
447
7.14.4. ФИЗИОЛОГИЯ СТАРЕНИЯ РАСТЕНИЙ
Этап старения (старости и отмирания) — это период от
полного прекращения плодоношения до естественной смерти
растения. Старение — это период закономерного ослабления
процессов жизнедеятельности, изнашивания, повышения
чувствительности растительного организма к неблагоприятным условиям
среды. Старение включает в себя изменения на молекулярном,
клеточном, органном и организменном уровнях растения.
Отмирание — конечный результат негативных изменений,
накопившихся в растении при старении.
Продолжительность жизни, а следовательно, и отмирание
каждого растения генетически детерминированы: яровая пшеница —
1 год, клевер луговой — 2—5 лет, тимофеевка луговая —5—12 лет,
капуста — 2 года, виноград — до 100 лет, яблоня — до 200 лет.
Процесс старения развивается постепенно. У взрослого растения
благодаря деятельности меристем одновременно функционируют совсем
молодые и отмирающие клетки и органы. На уровне целого
растения рост (корни, побеги и др.) продолжается до глубокой старости,
но скорость его постепенно замедляется.
Типы старения. У однолетних злаков растение отмирает
целиком в результате какого-то общего процесса (рис. 138). У
многолетних трав ежегодно отмирают отплодоносившие генеративные
побеги, а узел кушения, корневая система и другие подземные
части остаются жизнеспособными. У яблони, груши и других
культур ежегодно после плодоношения отмирают плодовые
веточки. Осенью одновременно стареют и опадают все листья, но
большая часть побегов и корневая система сохраняют
жизнеспособность.
Старение отдельных органов может быть полезным для всего
растительного организма: стареющие и отмирающие листья
снабжают питательными веществами более молодые органы,
способствуют подготовке растений к зимним условиям.
Причины и механизмы старения. Старение связывают с
генетически обусловленной программой, а также рассматривают как
результат накопления повреждений в онтогенезе клетки, органа
и растения.
Ученые называют несколько причин старения:
отток большей части питательных веществ от вегетативных
органов к развивающимся репродуктивным органам, смерть
наступает от истощения. Раннее удаление генеративных органов у
гречихи, могара, конских бобов, нута, люпина, льна, горчицы,
фасоли, подсолнечника задерживает старение этих растений.
Укосы многолетних трав до цветения позволяют проводить их
несколько раз, что повышает общий сбор и качество корма;
самоотравление организма продуктами собственного обмена
веществ. Клетки листьев и других органов у некоторых растений
448
Рис. 138. Типы старения растений (В. В. Полевой, Т. С. Саломатова, 1991):
1 — растение отмирает; 2 — отмирает только надземная часть; 3 — одновременное старение
и опадение всех листьев; 4— постепенное старение листьев (направление отмечено
стрелкой)
с возрастом переполняются щавелевокислым кальцием,
алкалоидами, дубильными и другими балластными веществами. Чтобы
избавиться от них, растение сбрасывает часть побегов, корней и
листьев. Старят растения токсины, вырабатываемые почвенной
микрофлорой при бессменной культуре сельскохозяйственных
растений, многие патогенные организмы;
отставание развития корневой системы, изменение отношения
побег : корень в онтогенезе растения (Д. А. Сабинин, 1963;
В. О. Казарян, 1951). Старение во время формирования семян и
плодов определяется угнетением роста корней из-за
ограниченного поступления в них фотоассимилятов. Угнетение же роста
корней снижает общую жизнедеятельность растения, вызывает
старение всего растительного организма. У плодовых деревьев с годами
по мере увеличения высоты ствола ухудшаются трофические,
гормональные и другие связи между листьями и корнями, что
приводит к снижению активности апикальных меристем побегов и
других органов растения.
Изменение соотношения фитогормонов. Старение вызывается
нарушением соотношения фитогормонов, возникающим под
действием внутренних и внешних факторов. В стареющих
органах количество стимуляторов роста резко уменьшается, а
ингибиторов — увеличивается. Начало и развитие процесса старения
листа сопровождаются увеличением АБК и этилена в листьях и
плодах. Процесс старения заканчивается их опадением в
результате формирования клеток отделительного слоя.
449
Основную роль в этом процессе играют уменьшение
содержания ауксина в черешке или плодоножке и увеличение этилена.
Этилен индуцирует синтез целлюлазы и полигалактуроназы,
расщепляющих основные компоненты клеточных стенок и
срединных пластинок в отделительном слое. В результате лист или плод
опадают.
Причиной старения являются нарушение структурной
целостности клеток и их органелл в стареющих органах, возрастание
проницаемости мембран в результате снижения синтетической
активности отдельных органов и всего растения.
Развитие старения связано с уменьшением процессов синтеза
белка и других биополимеров клетки и усилением их распада. В
результате замедляется обновление компонентов клетки,
происходят снижение функций, нарушение регуляции. Клетки в
разных тканях имеют неодинаковую продолжительность жизни.
На выполнение генетической программы старения клеток
влияют различные нарушения обменных процессов (увеличение
содержания модифицированной ДНК, повреждение хроматина
ядра и мембран свободными радикалами, образующимися в
результате стрессов, патологии и др.), что приводит к синтезу
дефектных белков, токсичных веществ, нерегулируемым
процессам автолиза, ускоряющим старение.
Важнейшими показателями старения (Е. П. Алешин, А. А.
Пономарев, 1979) являются снижение оводненности тканей и гидро-
фильности сухого вещества, содержания белков, РНК, калия,
магния, интенсивности фотосинтеза и дыхания, изменение
направленности биохимических процессов в сторону гидролиза,
усиление лигнификации и суберинизации клеточных стенок,
снижение зольности сухого вещества, повышение проницаемости
клеточных мембран для оттока питательных веществ в молодые
растущие органы, замедление и прекращение роста, нарушение
соотношения между стимуляторами и ингибиторами роста.
Старение листа. Процесс старения листа начинается с
остановки его роста, коррелирующей со снижением
фотосинтетической активности, интенсивности и эффективности дыхания. В
листьях снижается содержание хлорофилла, нуклеиновых кислот,
деградируют клеточные органоиды. В желтеющем листе
фотосинтез не обеспечивает постоянство сухой массы. Лист вместо
продуктов фотосинтеза поставляет в растение продукты
гидролиза полимеров клетки (низкомолекулярные соединения,
содержащие азот, фосфор, серу). В процессах старения листьев
принимают участие фитохром и природные ингибиторы роста.
Повышенная температура, недостаток воды и света ускоряют старение
листьев на растениях.
Ускорение старения листьев может быть результатом
конкуренции за питание и регуляторы роста с другими листьями на
растении, побегами, формирующимися цветками и плодами. По-
450
видимому, программа старения конкретного листа включается в
ситуации, когда требуется перераспределение веществ в другие
органы (апексы, плодоэлементы и др.) для поддержания общего
гомеостаза в растительном организме.
В густом травостое или кроне дерева увеличивается доля
дальнего красного света (ДК) в радиации на уровне нижних ярусов
листьев, что ускоряет их старение и опадение. Доказано, что ДК
увеличивает чувствительность тканей листа (черешка) к этилену.
Проведение укоса или прореживание задерживают старение
листьев. У многих растений старение листьев можно задержать
предотвращением цветения, опыления или воздействием
неблагоприятным фотопериодом. Наоборот, у кукурузы, ячменя и
других культур удаление молодых соцветий (метелки, початки,
колос) ускоряет старение листьев.
Старение целого растения. Оно отражает процессы старения
всех составляющих его органов. Старение растения тесно
связано с замедлением или прекращением ростовых процессов его
тканей и органов. В период старения резко снижаются
интенсивность фотосинтеза, дыхания и других физиологических
процессов, оводненность тканей, содержание белков, РНК, калия и
магния, уменьшаются дисперсность и гидрофильность белков,
изменяются электрические свойства мембран (падает МП),
снижается активная компонента транспорта ионов.
При старении растения процессы распада начинают
преобладать над синтезом. Исследованиями Н. А. Максимова (1958)
установлено, что проницаемость молодых растительных тканей (по
выходу электролитов) высокая, затем она снижается, а с началом
старения опять повышается, что, вероятно, способствует оттоку
минеральных и органических веществ из стареющих в молодые
растущие органы.
Старение и факторы внешней среды. У стареющего растения
резко снижается сопротивляемость по отношению к
неблагоприятным факторам среды, которые легко переносятся молодым
организмом и вызывают гибель старого. Возрастные изменения
запрограммированы в наследственной основе, однако их темпы
зависят от внешней среды. Ускоряют старение недостаток
питательных веществ и воды, слишком низкая или высокая
температура, ионизирующее излучение и др. У некоторых растений
старение индуцируется определенным фотопериодом.
7.15^ ЦИКЛИЧЕСКОЕ СТАРЕНИЕ И ОМОЛОЖЕНИЕ
РАСТЕНИЙ И ИХ ОРГАНОВ В ОНТОГЕНЕЗЕ
На протяжении онтогенеза растения происходят
закономерные изменения длины междоузлий, размеров, формы и окраски
листьев в зависимости от их положения на стебле и его боковых
побегах, морфологии корневой системы. Это явление получило
451
название возрастной изменчивости. В процессе развития
растительного организма многие клетки, ткани и даже органы стареют
и отмирают. Одновременно с этим до конца жизни растения
происходят новообразование клеток, тканей и органов, процесс
омоложения. Таким образом, растение составляют клетки, ткани
и органы разного возраста (рис. 139). В 1940 г. Н. П. Кренке
сформулировал основные положения теории циклического
старения и омоложения растений, которая раскрывает сущность
индивидуальных возрастных изменений. Положения этой теории
сводятся к следующему.
Растительный организм с момента возникновения
непрерывно стареет вплоть до своей естественной смерти.
Старение растения в первой половине онтогенеза прерывается
периодическим омоложением благодаря появлению новых
молодых органов — побегов, листьев и др. Молодые органы
замедляют темпы старения материнского растения. Однако полное
омоложение наступает только при оплодотворении. Наиболее
медленно стареют меристематические и покоящиеся клетки.
Новообразования у растений (листья, побеги и др.)
испытывают влияние стареющего материнского организма. Это
проявляется в том, что их жизненный цикл сокращается и общая
жизнедеятельность падает. Различают понятия «возраст» (календарный
возраст) и «возрастность» (физиологический возраст). Возраст
(собственный возраст) растения или его органа (лист, побег)
исчисляют от момента его заложения. Возрастность определяется
возрастом органа и материнского растения.
Чем старше возраст целого растения, тем меньше возраст вновь
появляющегося органа. Листья недельного возраста на годичном
или на десятилетнем сеянце имеют разный физиологический
возраст. В пределах плодового дерева листья на побегах высших
порядков ветвления физиологически более старые, чем листья того
же возраста на побегах низших порядков ветвления. Поэтому по
форме, анатомическому
строению, ряду физиологических и
биохимических признаков
верхние листья, несмотря на
свой меньший возраст, часто
обнаруживают признаки
большего старения, срок их жизни
часто короче, чем у средних
листьев на том же побеге.
С возрастом уменьшается и
способность растений к
омоложению. В начальные
периоды развития растения
преобладают процессы
омоложения, затем процессы старения
Рис. 139. Соотношение процессов
старения и омоложения в онтогенезе
высшего растения:
а — эмбриональная фаза; #—молодость; с —
зрелость; г — размножение; д — старость; 1 —
старение; 2 — омоложение
452
достигают уровня, на котором они уравновешиваются с
процессами омоложения. В дальнейшем преобладает старение, которое
и приводит к смерти. Развитие в онтогенезе, таким образом,
характеризуется одновершинной (биологической) кривой.
Цикличность развития заключается в том, что дочерние
клетки являются временно омоложенными в отношении
материнских. В каждый момент нарастания верхушки побега или корня
происходит частичное омоложение конуса нарастания. Однако в
онтогенезе растения наблюдаются постепенное ослабление
циклов омоложения и прогрессирующее старение меристемы
апексов побегов и корней. Это проявляется в закономерном
изменении формы, размеров, окраски листьев, длины междоузлий и
других признаков на побегах.
Скорость старения, продолжительность жизни растения
определяются исходным, генетически обусловленным потенциалом
жизнеспособности вида. Жизнь растения сводится к
постепенной реализации потенциала жизнеспособности. Имеющийся в
данное конкретное время потенциал жизнеспособности какого-
либо органа растения равен исходному потенциалу минус
использованная его доля за истекший срок собственной жизни
данного органа.
Проблемой старения и омоложения плодово-ягодных культур
занимался П. Г. Шитт (1958). Он впервые установил наличие
возрастных качественных изменений у корней. Теория
циклического старения и омоложения Н. П. Кренке подтверждается
многочисленными исследованиями и практикой. Так, размер,
форма растений хлопчатника, тутового дерева, яблони, сахарной
свеклы и рассеченность листовой пластинки, длина черешка и
другие признаки закономерно изменяются в зависимости от
яруса. По такой же одновершинной кривой в процессе
онтогенеза меняются и физиолого-биохимические признаки. И. В.
Мичурин обращал внимание садоводов и биологов на тесную связь
между органообразовательными процессами в организмах и
возрастной изменчивостью. Он указывал, что с возрастом меняются
строение гибридных сеянцев, тип листьев, строение стебля,
форма и вкус плодов.
Ранние признаки скороспелости. Установленные Н. П. Кренке
закономерности изменения морфологии листьев и побегов в
связи с их возрастом позволили разработать рекомендации по
ранней диагностике скороспелости растений в пределах вида у
тутового дерева, хлопчатника, конопли, льна, проса, гречихи,
капусты и др. Возрастные морфологические изменения листьев
сахарной свеклы коррелятивно связаны с накоплением сахара в
корнеплоде. Для скороспелых сахаристых сортов характерно
резкое изменение морфологических признаков листьев, а у
позднеспелых сортов с пониженным содержанием сахара эти признаки
изменяются постепенно. Выявленная закономерность важна для
453
селекции на сахаристость и скороспелость. У однолетних
сеянцев скороспелых сортов яблони междоузлия короче, ветвление
более сильное, листья расположены гуще, чем у сортов, позже
вступающих в плодоношение. У двулетних сеянцев яблони
интенсивность зеленой окраски листьев при переходе от верхних
ярусов к нижним у скороспелых форм яблони изменяется более
резко, чем у позднеспелых.
Н. П. Кренке отмечал, что верхние почки на стебле и
развивающиеся из них побеги быстрее проходят онтогенетические
изменения, чем нижние. Поэтому при вегетативном
размножении чем выше по стеблю плодового растения взяты черенок или
почка, тем раньше после укоренения или окулировки растение
способно зацветать.
При культуре чая для получения высококачественного
продукта убирают с более старых кустов листья более молодого
календарного возраста.^ Исследования Н. П. Кренке стали
основой для совершенствования приемов подрезки растений,
регулирующей процессы вегетативного роста и генеративного развития
у плодовых деревьев; для выбора побегов и их частей требуемого
качества при вегетативном размножении растений,
обеспечивающего лучшую укореняемость черенков; для достижения
оптимального сочетания вегетативного и генеративного развития
растений при черенковании и прививках.
7.16. ПОНЯТИЕ О РОСТЕ ЦЕЛОСТНОГО РАСТЕНИЯ
Рост целостного растения интегрирует рост отдельных частей
и органов, проходит в соответствии с его генетической
программой роста и развития. Рост растения обеспечивается единством
обмена веществ, разнообразными механизмами взаимосвязи
органов, тканей и клеток, разнокачественностью осевых (стебли и
корни) и метамерных (листья и побеги) органов (Г. Молиш,
1933; Н. П. Кренке, 1940; М. X. Чайлахян, 1954).
Взаимодействие частей растительного организма основано на
круговороте воды и минеральных соединений, поступающих из
почвы, и органических веществ, синтезируемых в листьях, корнях
и других органах растения. Эти взаимодействия обеспечивают
рост целостного растения, создают необходимые условия для
закладки и формирования ..репродуктивных органов, семян и
плодов. В системах регуляции растения особую роль выполняют
верхушки побега и корня — главные доминирующие центры
(В. В. Полевой, 1982), а также листовой аппарат — третий
доминирующий центр (М. X. Чайлахян, 1988), активно участвующие в
синтезе и круговороте трофических и гормональных веществ.
Взаимодействие этих трех центров определяет целостность раститель-
454
ного организма в онтогенезе, особенности его фенотипа в
конкретных почвенно-климатических и агротехнических условиях.
Формирование зачатков генеративных органов начинается в
конусах нарастания в самом раннем возрасте растения (III—IV
этапы органогенеза). Морфофизиологические изменения в
конусе нарастания тесно связаны с процессами, протекающими в
листьях, и наоборот. В одни периоды преобладает влияние листа
на конус нарастания (фотопериодизм), в другие — усиливается
влияние конуса нарастания (яровизация).
Основной причиной задержки или ускорения роста и
дифференциации конусов нарастания побегов, очевидно, является
изменение количества и состава поступающих в них питательных
веществ и фитогормонов. Эти изменения могут быть результатом
снижения метаболизма и роста всего растения, что отмечается
при неблагоприятных условиях выращивания, а также
результатом корреляционных связей, когда в одни органы метаболиты
поступают более интенсивно, чем в другие. Так, в конус
нарастания имеющиеся в растении питательные вещества не
поступают при посеве весной без яровизации озимых сортов пшеницы,
при формировании у ряда растений запасных органов
(корнеплод, луковица).
Задержка роста и дифференциации конусов нарастания
побегов может происходить на всех этапах органогенеза. Наоборот,
рост конуса нарастания может быть ускорен, а рост растения
подавлен, что наблюдается при осенней дифференциации почек
древесных плодовых растений. Взаимодействие частей —
обязательное условие генеративного развития растений (М. X.
Чайлахян, 1980). Растущие вегетативные и генеративные органы
растений оказывают большое влияние на интенсивность
фотосинтеза, скорость поглощения воды и элементов минерального
питания, на направление и скорость передвижения пластических
веществ в организме.
Распускающиеся почки растений являются акцепторами асси-
милятов, поступающих из зрелых фотосинтезирующих листьев,
ауксина, цитокининов и гиббереллинов. Когда молодой лист
достигает примерно '/г своего конечного размера, он
превращается в донора ассимилятов. В пределах растения развивающиеся
и ранее образовавшиеся органы конкурируют за свет, регуляторы
роста, питательные вещества, воду.
Клеткам меристем свойственны активно работающие Н
-насосы и, следовательно, аттрагирующая сила. При этом основная
почка главного побега, имея высокую концентрацию ИУК,
создает наибольшую аттрагирующую силу и перехватывает
питательные вещества, цитокинин у боковых (пазушных) почек.
Подобный же механизм, возможно, определяет торможение роста
пазушных почек листьями в период их собственного роста.
В природе встречаются различные сочетания процессов веге-
455
тативного роста и репродуктивного развития. У семенных
растений генеративное развитие обычно задерживает рост. Так,
озимые пшеницы при весеннем посеве сильно кустятся, образуют
большую массу, но не формируют стеблей. Прошедшие
яровизацию растения тех же сортов, наоборот, имеют ограниченное
кущение, цветут и образуют зерно.
Растения длинного дня (горчица, люпин и др.) в условиях
длинного дня интенсивно растут и рано зацветают, а при
коротком дне растут медленно и поздно зацветают. Растения
короткого дня (конопля, соя и др.) в условиях длинного дня интенсивно
растут, но не цветут, а в условиях короткого дня растут медленно
и рано зацветают. У поликарпических многолетних травянистых
и древесных растений генеративное развитие не останавливает
рост, который продолжается благодаря наличию не только
плодовых, но и вегетативных почек.
Вегетативный рост также задерживает генеративное развитие.
Так, избыточное азотное питание, стимулируя вегетативный рост
многих растений, задерживает образование цветков и плодов.
Наоборот, изменения условий питания, ограничение роста
плодовых прививками на слабых подвоях, обрезкой стимулирует
цветение и плодоношение растений. Усиленный рост ботвы
задерживает развитие клубней картофеля, топинамбура,
корнеплодов свеклы, брюквы, турнепса. Усиленный рост листьев у
луковичных растений ослабляет формирование луковиц, а быстрое
образование и усиленный рост луковиц снижают облиственность
растений.
Одна из важнейших задач агротехники — обеспечение в
посевах наиболее рационального распределения по вегетативным и
генеративным органам растений фотоассимилятов и
метаболитов. Накопленные факты свидетельствуют о сложной
взаимосвязи между вегетативными частями растения и формирующимися
семенами (К. Е. Овчаров, 1976). Условия, подавляющие
синтетическую деятельность вегетативных органов, нарушают
метаболические процессы в семенах, снижают их урожай и качество.
Наоборот, условия, снижающие метаболизм формирующихся
семян, нарушают нормальный ход синтетических процессов в
листьях и других частях растения.
В опытах у растений пшеницы через две недели после
цветения удаляли колосья. Уже через несколько часов интенсивность
фотосинтеза снизилась на 50 %, ослабилось дыхание. У
контрольных растений 45 % ассимилятов поступало в колосья, 11 —
в корни и молодые побеги и 28 % оставалось в листьях. При
удалении же колосьев большая часть ассимилятов оставалась в
листьях, что вызвало депрессию фотосинтеза (Р. Кинг, И. Вар-
длав, Л. Эванс, 1967). Удаление початков у кукурузы снижало
интенсивность фотосинтеза растений на 25—34 %. Следует особо
подчеркнуть, что удаление у озимой пшеницы листьев верхнего
456
яруса на VIII этапе органогенеза почти на треть уменьшало
накопление растениями общей сухой массы, в том числе на 18 %
массы зерна и на 38 % соломы (В. С. Шевелуха, 1980).
Продукты фотосинтеза (метка С14О2), образующиеся в
каждом листе пшеницы, по-разному используются в онтогенезе
растения. Так, основная часть фотоассимилятов нижнего листа
перемещается в корни и в меньшей степени — в боковые побеги,
из третьего листа ассимиляты поступали в равном количестве в
корни и стебли, четвертый лист обеспечивал главным образом
стебли и в меньшей степени корни, пятый лист снабжал ассими-
лятами преимущественно главный побег, из верхнего (шестого)
листа основная часть продуктов фотосинтеза поступала в колос и
главный побег. В фазе колошения пшеницы и созревания зерна
интенсивность фотосинтеза верхнего листа была намного выше,
чем второго или третьего листа (Равсон, Хофстра, 1969). Верхний
(флаговый) лист пшеницы снабжает ассимилятами в пределах
колоса преимущественно зерновки, из второго сверху листа
ассимиляты в относительно большем количестве направляются в
колосковые и цветковые чешуи (И. А. Тарчевский и др., 1973).
Высокопродуктивные сорта пшеницы характеризуются
повышенной аттрагирующей способностью в расчете на одну зерновку
колоса и на весь колос. Это коррелирует с повышенным
содержанием ауксинов во флаговом листе и зерновках колоса
(С. В. Бирюков, 1991).
7.16.1. УПРАВЛЕНИЕ ГЕНЕРАТИВНЫМ РАЗВИТИЕМ И СТАРЕНИЕМ
РАСТЕНИЙ ПУТЕМ РЕГУЛИРОВАНИЯ СВЕТОВОГО, ТЕМПЕРАТУРНОГО
И ВОДНОГО РЕЖИМОВ, МИНЕРАЛЬНОГО ПИТАНИЯ ХИРУРГИЧЕСКИМИ
И ХИМИЧЕСКИМИ СПОСОБАМИ
Применяют различные приемы управления генеративным
развитием и старением растений. У сои (короткодневное растение)
скорость развития семян стимулируется дополнительными
короткими днями. Виды многолетних трав, относящиеся к
растениям длинного дня, ускоряют генеративное развитие при
круглосуточном освещении. Зацветание риса (короткодневное растение)
можно задержать прерыванием длинной ночи кратковременным
воздействием света.
По данным Д. Керр и др. (1973), прерывая ночные периоды
облучением лазерным красным светом (580—800 нм), удается
ускорить цветение растений и созревание семян ячменя и
пшеницы, а у сахарного тростника повысить урожай в результате
увеличения периода вегетативного роста. Осенью у озимых
замедленное развитие обусловливается как влиянием короткого дня,
так и ослабленной интенсивностью освещения и понижающейся
температурой. Поэтому по степени выраженности фотопериоди-
457
ческой реакции у озимых и двуручек в селекционной работе
проводят отбор на зимостойкость (А. К. Федоров, 1983).
Цветение редиса (растение длинного дня) задерживают
коротким днем. В Подмосковье искусственное (светонепроницаемый
ящик) сокращение дня до 12 ч позволяет избежать цветения
редиса и получать полноценные корнеплоды в середине лета.
Этим же приемом можно ускорить цветение в грунте хризантем
(короткодневные растения).
Продолжительность этапов онтогенеза значительно
колеблется в зависимости от температурных условий. Хлопчатник,
клещевина и ряд других многолетних растений тропического
происхождения развиваются в умеренных широтах как однолетние
растения. Для задержки старения (вырождения) растений
применяют летние посадки картофеля, летние посевы для получения
маточных корнеплодов. В каждой агроклиматической зоне
России используют сроки посева озимых зерновых культур
(пшеницы, ржи, ячменя), обеспечивающие наиболее благоприятное
прохождение озимыми этапов онтогенеза, зимостойкость.
Орошение, усиленное азотное питание замедляют процессы
старения. Водный стресс, резкие колебания температуры оказывают
обратное влияние.
Одно из средств регулирования процессов старения и
омоложения растений — изменение условий минерального питания.
М. X. Чайлахян (1988) выделил три группы растений по азотфло-
ральной реакции. Азотнегативные, зацветающие быстрее на
бедной азотными веществами почве (пшеница, ячмень, овес,
горчица, шпинат, люцерна, клевер и др.). Все азотнегативные
растения — растения длинного дня. Азотпозитивные, зацветающие
быстрее на богатой азотными веществами почве (просо,
кукуруза, могар, подсолнечник, хлопчатник, табак, перилла, перец и
др.). Все азотпозитивные растения с ярко выраженной реакцией
на азот — растения короткого дня. Растения со слабовыраженной
реакцией на азот — растения как длинного, так и короткого дня
(промежуточная группа) — люпин, салат, хризантема и др. Азот-
нейтральные, зацветающие одновременно на бедной и богатой
азотными веществами почве (фасоль, гречиха, конопля, соя и
др.). Азотнейтральные растения включают нейтральные,
короткодневные и длиннодневные виды.
Все это указывает на значительную связь между реакцией
цветения растения на азотное питание и фотопериодическими
группами. М. X. Чайлахян объясняет эту связь возникшими в
процессе эволюции видов растений приспособительными
свойствами. Короткодневные теплолюбивые виды являются
выходцами из южных тропических и субтропических стран, где
приспособление растений к репродуктивному развитию (а это главное)
шло по линии максимального использования условий питания, в
том числе азотного.
458
Длиннодневные выносливые виды являются обитателями
умеренных и северных широт, где приспособление к
репродуктивному развитию шло по линии наиболее быстрого, а следовательно,
и относительно меньшего использования условий питания, в том
числе азотного, там, где при недостатке азота азотпозитивным
короткодневным теплолюбивым видам грозит гибель без
сохранения потомства, а азотнегативные длиннодневные
холодостойкие виды успевают дать жизнь новому поколению. Это
необходимо учитывать в системе удобрения конкретных
сельскохозяйственных культур.
Повышенное азотное питание и поливы задерживают
старение растений и их органов у многих видов. Так, подкормка
растений сахарной свеклы в начале пожелтения листьев
азотнокислым аммонием восстанавливает зеленый цвет листьев.
Нормальное обеспечение растений фосфором ускоряет
формирование вегетативных органов и генеративное развитие. У
сахарной свеклы подкормки суперфосфатом ускоряют старение
листьев и вызревание корня.
Недостаток калия приводит к уменьшению оводненности
тканей растений, подавлению процессов синтеза и усилению
процессов распада. А. П. Шенников (1941) указывает, что
долголетие луговых трав увеличивается при улучшении питания (при
удобрении, устранении конкурентов, при более редком посеве и
др.) и уменьшается при его ухудшении (на бедных почвах, в
загущенных травостоях и др.).
После оплодотворения процессы старения растения
значительно ускоряются. Репродуктивные органы интенсивно
мобилизуют питательные вещества из других частей растения, которые
быстро стареют. Удаление генеративных органов у гречихи,
конских бобов, сои, нута, люпина, льна, горчицы, фасоли и
подсолнечника, задерживая старение, увеличивает общую
вегетативную массу растений. Продолжительность жизни растений огурца
зависит от сроков съема плодов. При культуре огурца на семена
растения рано стареют и отмирают. При регулярном съеме 6—10-
дневных завязей рост растений продолжается долгое время.
Формирование семян усиливает процессы старения травостоев
клевера и других бобовых и злаковых трав.
При многоукосном использовании травостоев, когда укос
проводят до цветения растений, удается увеличить длительность
их использования, повысить качество корма. Созревающие
плоды и семена выделяют фитогормоны, которые вызывают
постепенное старение листьев и стебля и отток питательных
веществ из них к соцветиям. Многоукосное использование
стимулирует также побегообразование за счет спящих почек, процессы
омоложения.
В практике плодоводства и городском хозяйстве используют
обрезку деревьев и кустарников, при помощи которой формируют
459
крону молодых деревьев. В последующие годы ее поддерживают
и омолаживают, удаляя дряхлеющие побеги, восстанавливают
прирост, урожайность и качество плодов. Благоприятное
влияние обрезки — результат удаления физиологически ослабленной
верхней части годичного прироста или ветвей высших порядков,
изменения соотношения между кроной и корневой системой,
усиления роста за счет спящих почек и омоложения кроны
(П. Г. Шитт, 1958). Омоложению плодовых деревьев, продлению
их продуктивного долголетия способствует также подрезка
стареющей корневой системы (В. А. Колесников, Ф. Н.
Пильщиков, 1985).
Химические регуляторы роста позволяют управлять
генеративным развитием и старением растений, о чем говорилось ранее.
Опрыскивание растений гиббереллином останавливает распад
хлорофилла, задерживает пожелтение и опадение листьев.
Обработка цитокинином (6-бензиламинопурин) листьев и стеблей
хлебных злаков при формировании зерна, замедляя распад
белков и хлорофилла, задерживает их старение. Наоборот, обработка
колоса пшеницы и початка кукурузы стимулирует налив зерна и
старение вегетативных органов этих растений (Т. Г. Самойленко,
1986; С. А. Варфоломеев, 1988).
7.16.2. ОСОБЕННОСТИ РОСТА РАСТЕНИЙ В ФИТОЦЕНОЗЕ
В одновидовых и разновидовых посевах и насаждениях
сельскохозяйственных растений складываются отношения
взаимопомощи и конкуренции за свет, воду, элементы минерального
питания и другие факторы, определяющие интегральный прирост
биомассы фитоценоза и качество урожая. Пластичность растений
хлебных злаков, их способность регулировать численность
развивающихся стеблей в зависимости от наличия питательных
веществ, света, влаги, тепла позволяет успешно выращивать
зерновые культуры при различающихся нормах высева.
Вегетативные побеги участвуют в накоплении пластических
веществ вплоть до сбрасывания этих побегов в процессе стебле-
отбора. Отмирание побегов связано с переходом растений к
генеративному развитию (С. А. Муравьев, 1973). В густом посеве
под влиянием конкуренции между растениями усиливается
мобилизация запасных веществ на формирование зерна. Оценка
продуктивности растений, выросших в разреженных посевах
(посадках), не может характеризовать их урожайность при густом
посеве.
В процессе селекции утрачены многие механизмы
саморегуляции, или самоизреживания, растения выравнены по генотипу и
фенотипу, что существенно снижает их устойчивость (главным
образом способность к репарациям на уровне организма) и про-
460
дуктивность биомассы и семян с единицы площади (Н. Ф. Баты-
гин, 1986). Среди механизмов дифференциации растений по
интенсивности роста, другим процессам жизнедеятельности, по
выживаемости большую роль играют их химические (аллелопати-
ческие) взаимодействия в ценозах.
Продуктивность фитоценозов зависит и от морфофизиоло-
гических особенностей составляющих их растений. В
многокомпонентных фитоценозах растения, имеющие даже более
высокую удельную активность фотосинтеза, но потребляющие ас-
симиляты преимущественно на гетеротрофные ткани и органы,
как правило, менее урожайны, чем растения, у которых
значительная часть ассимилятов используется на новообразование
фотосинтетического аппарата. Поэтому селекция только на
высокую фотосинтетическую активность листа и хлоропласта
имеет смысл лишь при условии, если этот фактор согласован
с общим анализом роста и с высоким ассимиляционным
потенциалом фитоценоза (А. Т. Мокроносов, 1988).
Оптимизация морфофизиологического типа растений для
высокопродуктивных посевов — важная задача физиологов и
селекционеров. Концепция модели сорта, успешно используемая в
селекции пшеницы, риса, кукурузы и других
сельскохозяйственных культур, носит зональный характер. Короткостебельные
сорта пшеницы в Заволжье в засушливые годы сильнее снижают
урожай, чем сорта с длинным стеблем, так как фонды
ассимилятов, реутилизируемые при наливе зерна, у короткостебельных
сортов ограничены.
Агрономы отмечают ухудшение качества продукции при росте
урожаев: снижение сахаристости корнеплодов сахарной свеклы,
белковости зерна хлебных злаков, крахмалистое™ клубней
картофеля, сахаристости ягод, винограда и т. д. Дело в том, что
интенсификация агротехники стимулирует прежде всего рост и
фотосинтез, изменяет структуру целостного растения, процессы
же биосинтеза белка, сахарозы, крахмала при отложении этих
веществ в запас более консервативны. Поэтому концентрация
этих продуктов в хозяйственно ценной части урожая снижается.
Однако современные технологии позволяют избежать названные
противоречия.
7.16.3. РЕГУЛЯЦИЯ РОСТА И ОНТОГЕНЕЗА
В растении функционирует система, регулирующая процессы
роста и развития растения на трех уровнях его организации:
внутриклеточном, межклеточном и организменном.
Внутриклеточный уровень включает системы генетической, ферментной и
мембранной регуляций. Межклеточный уровень включает
трофическую, гормональную и электрофизиологическую системы
регуляций. Эти регуляции очевидны при культивировании клеток и
461
органов растений. Так, для обеспечения их роста в питательную
среду обязательно включают трофические и гормональные
факторы, поступающие обычно из других органов целостного
растения. Организменный уровень регуляции, кроме названных,
включает также систему фитохрома, участвующую в регуляции многих
ростовых процессов в растениях и семенах.
У адаптированных к конкретному региону растений системы
регуляции обеспечивают цветение растений в наиболее
благоприятное время года, образование достаточной массы
вегетативных органов (корней, листьев) для обеспечения процессов
формирования семян и плодов, а также окончание активной
вегетации до наступления холодов. Растение обладает способностью
измерять время, имеет биологические часы, позволяющие ему
оптимизировать время наступления и успешный ход
репродуктивного периода.
Полагают, что измерение времени осуществляется в
организме по типу песочных часов благодаря процессам накопления
растением определенной массы, числа метамеров, какого-то
вещества, гормона или соотношения гормонов. Так, растения
переходят к образованию цветочных зачатков только после
образования определенного для каждого вида (сорта) числа листьев.
Возможно также измерение времени растением по принципу
маятника осциллятора, по ритмическим колебаниям каких-то
физиологических процессов, которые мало зависят от внешних
условий.
По М. X. Чайлахяну (1988), в растениях имеются два типа
регуляций, влияющих на переход растений от этапа молодости к
зрелости, — автономный и индуцированный. Автономная
регуляция (возрастной контроль) проявляется в переходе растений в
цветочно-спелое состояние лишь в определенном возрасте. У
большинства яровых зерновых цветочно-спелое состояние
наступает при наличии у растений нескольких листьев.
У плодовых деревьев оно наступает через 4—5 лет и более.
Переход к цветению связывается с накоплением
определенного количества и качества питательных веществ. По Г. Клебсу
(1905), переход растений к цветению определяется отношением
углерода к азоту. Зацветанию растений способствуют условия,
вызывающие накопление Сахаров, а вегетативное состояние
поддерживают условия, способствующие накоплению азотистых
веществ. У плодовых деревьев кольцевание ускоряет образование
цветочных почек. В переходе к цветочно-спелому состоянию
важную роль играет накопление гормональных веществ в
побегах, что объясняет определенную последовательность в
зацветании побегов разных ярусов.
Индуцированная регуляция достижения цветочно-спелого
состояния вызывается определенными внешними факторами
(светом, температурой и др.). Особое значение для многих видов
462
растений имеет воздействие температуры (яровизация) и
фотопериода (фотопериодизм). Следует вспомнить о значении света для
регуляции процессов жизнедеятельности растения в онтогенезе.
В семени и проростке имеются системы, воспринимающие
действие света разной интенсивности и качества (фотоморфогенез).
При прорастании семени проросток движется к источнику
света (фототропизм). Далее формируются органы автотрофного
питания (фотосинтез). Закладка генеративных органов многих
растений зависит от длины светового дня (фотопериодизм). В
поле, теплицах и фитотронах необходимо создавать
благоприятные условия для лучшей реализации потенциальной
продуктивности растений, что невозможно без учета наличия сложной
системы регуляции процессов их роста и развития.
7.17. ФИЗИОЛОГИЯ ФОРМИРОВАНИЯ СЕМЯН, ПЛОДОВ
И ДРУГИХ ПРОДУКТИВНЫХ ЧАСТЕЙ РАСТЕНИЙ.
ТИПЫ РАЗМНОЖЕНИЯ РАСТЕНИЙ
Важнейшей функцией живых организмов является их
способность размножаться. Размножение растений — это
физиологический процесс воспроизведения себе подобных организмов,
обеспечивающий непрерывность существования вида и расселения
его представителей в окружающей среде. Для растений
характерны два типа размножения: бесполое и половое. Бесполое
размножение спорами характерно для низших растений и
папоротникообразных. Простое деление наблюдается у одноклеточных
организмов, при этом ему предшествует репликация ДНК. К
бесполому относится также и вегетативное размножение,
заключающееся в воспроизведении потомства из вегетативных частей
многоклеточных растений: отдельных клеток, частей тканей и
органов — листа, стебля, корня и их видоизменений — усов,
клубней, луковиц и др. Размножение клетками и участками
ткани успешно применяют в биотехнологии.
Половое размножение осуществляется путем слияния
гаплоидных половых клеток — гамет, в результате чего образуется зигота.
Половое размножение имеется у всех низших и высших
растений. Если при половом размножении сливаются гаметы
противоположных полов одной (для однодомных) или разных (для
двудомных) особей, то такое размножение называется сингамией.
При этом зигота имеет диплоидное состояние и несет в себе
наследственную основу мужского и женского организмов.
Иногда зародыш развивается из различных клеток гаметофита — такое
размножение называется апомиксисом, при этом образуются либо
гаплоидные зародыши (из редуцированных ядер), либо
диплоидные (из нередуцированных). Примером апомиксиса может слу-
463
жить партеногенез (образование зародыша из неоплодотворенной
яйцеклетки).
Система полового размножения у покрытосеменных растений
включает четыре физиологических процесса: цветение, опыле'
ние, оплодотворение и формирование семян.
7.17.1. ФИЗИОЛОГИЯ ЦВЕТЕНИЯ
Цветок — это репродуктивный орган покрытосеменных
растений, состоящих из укороченного стебля, на котором
расположены чашечка, венчик, андроцей и гинецей. Цветок выполняет
функции спорогенеза, гаметогенеза, опыления и
оплодотворения. Он является органом как бесполого (образование спор), так
и полового (образование гамет) размножения.
Цветение в ботаническом смысле представляет период в
жизни растений от момента раскрывания бутона до засыхания
венчика и тычинок отдельного цветка. Цветение отдельной
особи длится от раскрытия первых цветков до отцветания
последних.
В физиологическом плане цветение рассматривается как
комплекс процессов, протекающих в период от начала закладки
цветочных зачатков до оплодотворения и образования зиготы.
Переход покрытосеменных растений к цветению включает
компетенцию, инициацию и эвокацию.
Компетенция (способность зацветать) возникает у разных
растений только в определенном возрасте. Так, яблоня зацветает в
возрасте 5—6 лет, а дуб — свыше 40 лет. Для зацветания
необходимо также, чтобы растение полностью завершило ювенильный
этап онтогенеза. Большое значение имеет накопление
достаточного количества питательных веществ, столь необходимых для
образования репродуктивных органов и семян. Существует
принцип минимального количества листьев, необходимых для
заложения первых цветков. Время зацветания (переход к
репродуктивной фазе) в значительной степени связано с важнейшими
факторами внешней среды. Известно, что повышенное азотное
питание, усиливающее вегетативный рост растений, тормозит
цветение. Недостаток влаги в почве, как и недостаток многих
других жизненно важных элементов, как правило, ускоряет
репродуктивное развитие растений. В этом выражается стремление
каждого вида создать свое потомство даже в неблагоприятных
внешних условиях. Существенную роль в цветении играют
некоторые микроэлементы и в первую очередь железо и медь.
Наиболее продолжительное цветение наблюдается в благоприятные
годы, когда температура, влажность и другие факторы находятся
на уровне средних многолетних.
Инициация цветения связана с восприятием растением специ-
464
фических внешних и внутренних факторов, создающих условия
для закладки цветочных зачатков. К важнейшим экзогенным
факторам относятся чередование дня и ночи (фотопериодизм) и
температурные условия, необходимые для яровизации.
Эндогенные факторы связаны с возрастными изменениями
растения.
Эвокация цветения представляет собой завершающую фазу
инициации, во время которой в апексе происходят процессы,
необходимые для закладки цветочных зачатков (В. В. Полевой,
1989). Процессы эти происходят на разных уровнях. На
субклеточном уровне увеличивается содержание субстратов
дыхания и его интенсивность, усиливается синтез РНК и белков,
изменяется состав последних, повышается активность
некоторых ферментов.
На клеточном уровне происходит синхронизация
биохимических процессов в клетках, в результате чего наступает их
одновременное и ускоренное деление. На гистологическом уровне идет
реорганизация меристемы: исчезают зоны, вакуолизируется
стержневая сердцевинная меристема.
На макроморфологическом уровне происходят ранняя
инициация боковых меристем, увеличение скорости формирования
бугорков, изменяется порядок расположения листьев на стебле.
Таким образом, в апикальной меристеме происходят изменения,
обеспечивающие развитие цветка и выполнение ими
генеративных функций. В результате дифференциации тканей образуются
структурные элементы цветка: чашечка, венчик, андроцей и
гинецей.
В пыльниках тычинок в результате последовательных
редукционного и эквационного делений образуются пыльцевые зерна
(мужской гаметофит). Пыльцевое зерно состоит из двух оболочек
(эктина и интина), вегетативной и генеративной клеток. В завязи
пестика при мейозе развивается зародышевый мешок (женский
гаметофит). Он состоит из восьми ядер, дифференцирующихся
затем в гаплоидную яйцеклетку, две синергиды, три антиподы и
диплоидное центральное ядро.
7.17.2. ФИЗИОЛОГИЯ ОПЫЛЕНИЯ И ОПЛОДОТВОРЕНИЯ
Процессы, связанные с оплодотворением, разделяют на
четыре фазы: опыление, прорастание пыльцы на рыльце, рост
пыльцевых трубок в тканях столбика и собственно оплодотворение.
Опыление. В зрелом состоянии мужской и женский гаметофи-
ты имеют минимальную физиологическую активность. При
попадании пыльцы на рыльце пестика вследствие их слипания
(адгезии) в зоне соприкосновения поверхностей происходят
активные метаболические процессы. Пыльца начинает поглощать
465
воду из рыльца и набухать. П^и этом она выделяет на
поверхность рыльца белки, аминокислоты, нуклеиновые кислоты,
углеводы, липиды, пигменты, гидролитические ферменты и другие
физиологически активные вещества.
Начальная фаза адгезии происходит вследствие поступления
подвижных веществ на поверхность рыльца из внешней
оболочки пыльцы — экзины, затем начинают высвобождаться вещества
из интины.
С. И. Лебедевым (1982) установлена особая роль в
оплодотворении каротиноидов, которые обусловливают желтый цвет анд-
роцея и гинецея, как правило, энтомофильных растений. Под
влиянием рассеянного света такая пыльца приобретает запах
фиалки или земляники вследствие освобождения из каротина
летучего вещества р-ионона, чем и привлекаются насекомые.
Проникновение (инвазия) желтых пигментов пыльцы в
ткани рыльца активизирует прорастание пыльцевых зерен. При
прорастании пыльцы ксантофиллы играют роль аккумуляторов
кислорода для окислительно-восстановительных реакций.
Наряду с влиянием каротиноидов на прорастание пыльцы их
недостаток приводит к нарушению микроспорогенеза и
образованию абортивных гамет. Каротиноиды также принимают
активное участие в двойном оплодотворении (В. А. Поддуб-
ная-Арнольди, 1976).
Пестик и его рыльце обладают менее высоким содержанием и
активностью ферментов и других физиологических веществ, чем
пыльца, тем не менее гинецей играет важную роль в процессе
прорастания пыльцы.
Ткань рыльца состоит из эпидермальных клеток, которые
могут быть покрыты либо тонким адгезиновым слоем, либо
жидким экссудатом. В первом случае оно называется «сухое
рыльце», во втором — «влажное рыльце». Сухой тип рыльца
свойствен большинству однодольных растений, его поверхность
покрыта эпидермисом в виде одно- или многоклеточных
сосочков. Поверхностный слой рылец (пелликула) насыщен ли-
пидами и белками, обладает высокой активностью эстеразы и
АТФ-азы.
Выделения рылец влажного типа представлены липофильны-
ми экссудатами и гидрофильными слизистыми секретами,
насыщенными белками и углеводами. Эти выделения содержат также
гидролитические ферменты (пероксидазы, эстеразы, амилазы).
Выделяемые рыльцем секреторные вещества обеспечивают
адгезию пыльцы, поступление в нее воды при прорастании, защиту
от инфекции, поддерживают рост пыльцевой трубки в тканях
рыльца.
Рост пыльцевой трубки в столбике пестика. В зависимости от
анатомической структуры столбики разделяют на два основных
типа: открытый и закрытый. Открытый тип (характерен для
466
однодольных растений) имеет специальный канал, выполненный
простой эпидермой и физиологически активной слизью. Через
этот канал происходит рост пыльцевой трубки. У закрытого типа
столбика (характерен для двудольных растений) канал заполнен
проводящей тканью, через которую осуществляется врастание
трубки в завязь.
Пыльцевая трубка изначально образуется из протопласта
пыльцевого зерна, вовлекая в себя вегетативное ядро и
генеративную клетку, а в дальнейшем используются питательные
вещества, содержащиеся в проводниковой ткани столбика пестика.
Рост пыльцевой трубки сопровождается повышенной
активностью метаболических процессов: увеличивается интенсивность
дыхания, изменяется водный режим, наблюдается усиленное
образование ауксина и триптофана.
За счет активного действия гидролитических ферментов
растворяются пектиновые вещества, связывающие клетки
проводящих тканей, что облегчает проникновение трубки через столбик.
В физиологической среде в области роста пыльцевых трубок
увеличивается содержание углеводов, белков, фосфорных
соединений, аскорбиновой кислоты, ауксинов, гиббереллинов и
других веществ.
Процесс роста пыльцевых трубок предопределен наличием в
пыльце рибосомальной и информационной РНК. Во время этого
процесса новый синтез РНК не наблюдается. Из минеральных
веществ особо активное участие принимают ионы кальция,
калия, бора, магния и др.
У большинства покрытосеменных растений при прорастании
пыльцевой трубки происходит образование спермиев путем ми-
тотического деления генеративной клетки. Однако у многих
покрытосеменных растений сперматогенез происходит в пыльниках
до наступления цветения.
Оплодотворение. Пыльцевая трубка проникает через
микропиле в зародышевый мешок, где она входит в контакт с одной из
синергид. Содержимое трубки, ее цитоплазма, вегетативное ядро
и спермин сливаются с цитоплазмой синергиды. Один из
спермиев оплодотворяет яйцеклетку, в результате чего образуется
диплоидная зигота, дающая начало зародышу. Другой спермий
сливается с диплоидным вторичным ядром зародышевого мешка,
что приводит к возникновению тришюидной первичной клетки
эндосперма. В этом заключается свойственное
покрытосеменным растениям двойное оплодотворение, открытое С. Г. Нава-
шиным в 1898 г.
При излиянии содержимого пыльцевой трубки в
зародышевый мешок в нем создается определенная физиологическая
среда, которая в случае совместимости женских и мужских
половых элементов будет способствовать процессу оплодотворения, а
при несовместимости — препятствовать ему.
467
Ч. Дарвин впервые описал самонесовместимость при
самоопылении перекрестноопыляемых растений. Она заключается в
способности отторгать собственную пыльцу из-за разницы в тур-
горном давлении в пыльце и рыльце либо вследствие ингибиро-
вания прорастания образованием полисахарида каллозы.
Известно, что на начальных этапах прорастания пыльцевого
зерна из его оболочек (экзины и интины) на поверхность рыльца
пестика начинают выделяться специфические белки, которые у
совместимого рыльца вызывают активацию физиолого-биохими-
ческих процессов, способствующих образованию и росту
пыльцевой трубки, а у несовместимого — образование каллозы,
изолирующей пыльцевое зерно и таким образом вызывающей
прекращение его прорастания. У некоторых растений в клетках
несовместимого пестика синтезируются белки, являющиеся
ингибиторами роста пыльцевых трубок.
Кроме физиологических и биохимических причин
самонесовместимости она может обусловливаться морфологическими
особенностями цветка. Примером может служить гетеростилия —
наличие цветков с различной длиной столбиков пестиков и
нитей тычинок у разных растений одного и того же вида, что
препятствует самоопылению.
7.17.3. ФОРМИРОВАНИЕ СЕМЯН КАК ЭМБРИОНАЛЬНЫЙ ПЕРИОД
ОНТОГЕНЕЗА РАСТЕНИЙ
В результате опыления и оплодотворения образуются
диплоидная зигота и триплоидная первичная клетка эндосперма.
После этого наступает процесс формирования семян, под которым
необходимо понимать приобретение ими свойственных данному
растению форм, размеров, биохимического состава, способности
прорастать и давать потомство. Этот процесс сопровождается
возникновением новых тканей и органов. Формирование семян
представляет собой эмбриональный период развития растений
(Н. М. Макрушин, 1989) (рис. 140).
Изучение формирования семян имеет важное теоретическое и
практическое значение, поскольку они несут в себе
наследственную основу нового организма, содержат запасные питательные
вещества, необходимые для становления проростка. Нормально
развившееся семя — показатель урожая данного поколения и
основа последующего урожая.
Семя злаковых состоит из покровов (рис. 141, 1—5),
эндосперма (6, 7) и зародыша (8—10). При формировании семян
отмечают несколько последовательных периодов и фаз. Исходя из
исследований ряда ученых (Н. Н. Кулешов, 1963; И. Г. Строна,
1966; Т. Г. Коренев, 1967; Н. М. Макрушин, 1985) процесс
формирования семян можно представить в следующем виде (табл.
23).
468
Вегетационный период (315 дней)
\%%%\ Посев — всходы |////
Ш$& Всходы — кущение [▼_]
Кущение — конец
осенней вегетации
Конец осенней
вегетации — начало
весенней вегетации
I Начало весенней ве-
I гетации — выход в
трубку
20.У1 Онтогенез (400 дней)
Выход в трубку —
колошение
Колошение —
цветение
Цветение —
молочное состояние
Молочное
состояние — восковая
спелость
| Восковая — полная
спелость
I и ц'| Эмбриональный
■ " ' период
Г—-Г1 Ювенильный
период
Период половой
зрелости
Период
размножения
Период
старости
Рис. 140. Схема вегетационного периода и онтогенеза пшеницы (по Н. М. Мак-
рушину, 1989)
Рис. 141. Строение зерновки пшеницы:
Э1Ип-арП7ИЙ' мезокаРпий> эндокарпий, пигментный слой, гиалиновый
й слои, 7- мучнистое ядро эндосперма; 8- щиток; 9- зачаточная
почка; 10— корешок
23. Система периодизации формирования семян злаковых культур
Период развития семени
Фазы развития и созревания
семени
Влажность
семян, %
Образование семени (длится от
оплодотворения до завершения
формирования зерновки в
длину)
Налив (охватывает период
наиболее интенсивного
накопления запасных веществ семени
и соответствует фазе
вторичных морфологических
изменений в зародыше)
Созревание (начиная с
момента, когда в основном
завершено накопление веществ в
семени, наступают процессы
полимеризации и подсыхания,
семена становятся
полноценными зачатками новых растений)
Начальный этап
эмбриогенеза (соответствует фазе
количественного накопления
клеток в зародыше)
Предмолочное состояние
Молочное состояние
Тестообразное состояние
Восковая спелость:
начало
середина
конец
Твердая спелость
Послеуборочное дозревание
(в семенах происходят
сложные биохимические
преобразования)
Полная спелость
(начинается С момента завершения
физиологического
созревания и наступления
максимальной всхожести семян)
90-75
75-65
65-50
50-40
40-32
32-27
27-22
22—14 и ниже
От 14 до
равновесной
влажности
То же
Семена формируются в процессе жизнедеятельности
материнского растения в определенных условиях внешней среды.
Вследствие влияния различных эндогенных и экзогенных факторов на
растения в разные периоды их жизни семена по
анатомо-морфологическим, биохимическим, физиологическим, генетическим и
репродуктивным свойствам приобретают определенные отличия.
Такое явление принято называть разнокачественностью,
изменчивостью семян или гетероспермией. В зависимости от характера
факторов воздействия гетероспермия бывает экологического или
трофического типов. В связи с формами проявления
изменчивости свойств семян гетероспермия делится на генотипическую и
модификационную. Первую используют в селекции, а
последнюю — в семеноводстве и технологии выращивания
сельскохозяйственных растений.
Г*
7.17.4. НАКОПЛЕНИЕ И ПРЕВРАЩЕНИЕ ВЕЩЕСТВ ПРИ ФОРМИРОВАНИИ
СЕМЯН
При переходе растений к этапу половой зрелости и
размножения, в течение которых формируются генеративные органы,
существенно изменяется ход биохимических процессов в растении.
Основным аттрагирующим центром в этот период онтогенеза
471
™Л™™ ' В КОТОрых пР°тека1от Реакции
новообразования структурных элементов и запасных веществ В целом же
растении для формирования семян происходит мобилизация
веществ, накопленных ранее в разных его органах (рис142)
Важную роль в воспроизводстве потомства растений играют
запасные вещества семени, которые обеспечивают питание пр^
К^^Т^0" ЭТаПе °НТ0ГеНе3а Ь
од^^витиТ
Основными запасными веществами семян большинства видов
егестТЮТСЯ ббЛКИ' УГЛеВ°ДЫ И ЛИПИДЫ- Распр—ие
к1^„ ,Щ В разНЫХ частях плода неодинаковое. Например
весь крахмал пшеничного зерна, 80 % сахара и больше половины
белка содержатся в эндосперме. Алейроновый слой таюкебогат
им™еЬГГ Веществами- В нем находятся более шловины
имеющегося в зерновке жира и пятая часть белка и сахара
Масса зародыша составляет незначительную часть массы семени
(У пшеницы около 3 %), однако концентрациявеществ в нем
Д™1Ни ВЫС°КаЯ- В С6МеНаХ Злаков имеютс* ™ свободные
лпугие ЕТ' НУклето»ы* кислоты, ферменты, витамины и
другие физиологически активные вещества. В золе зерна
содержится большое число макро- и микроэлементов (Р, К, М8 А1,
\^Л, О1, \^1, КМ, 1_О И Др.).
Биологический синтез органических веществ в клетках
обеспечивается в первую очередь поступлением и распределением
двух основных органогенов - азота и углерода. В онтогенезе
мстительного организма отложение запасных^азЬтисть!? соеданений
имеет видовую специфику. У бобовых существенную частПмин
ного азота, используемого для синтеза белка в формирующемся
такж1Ынае^пОиСвТаВЛЯЮТ аминокисло™, содержащая вТодах а
также накопившиеся в самом эндосперме. У большинства же
™НтИаИминоТ^НИК°М а3°Та "** обРаз°™ запасного белка
служат аминокислоты, поступающие из листьев, в которых
активизируются процессы гидролиза азотистых веществ
Важнейший запасной продукт многих растений - крахмал -
ших иГп^В пластидах семени вследствие утилизации
поступающих из окружающей цитоплазмы простых Сахаров. Этот процесс
™Р°^ФРМеНТа: агТканФ°сФ°иа ^
ТанФ°сФ°Рилаза' крахм^ин-
^епРй и Р та *еРмента контролируют синтез
цепей полисахарида, в результате чего образуется его
пеп?й,о« КОМПОНент' кот°Рый обусловливает ветвление э™х
цепей с образованием амилопектина
Исходя из особенностей синтеза крахмала в семенах а также
с1м!3„ОВКНпеЯпнИоМФУНКЦИОНИРОВаНИЯ ПЛаСТВД ььщеляюГдва™ш1
вТчение в?ргп У 7 <УТН°™Т С6Мена' накапливающие крахмал
в течение всего или большей части периода их формирования и
содержащие крахмальные зерна в зрелом состоянии (многие рас
тения семейств Бобовые, Мятликовые, Гречишные" Семена вто-
472
Дни
Рис. 142. Изменение содержания различных соединений в семени (/), зародыше
(2) и эндосперме кукурузы (3) в течение 46-дневного периода после опыления
(1п§1е е( а1., 1965):
а — белки; б— жиры; в — РНК; г — ДНК; д — растворимый азот; е — аминокислоты; ж —
сахара; з — растворимые нуклеотиды
рого типа образуют крахмал на ранних этапах своего
формирования до начала накопления запасных белков и липидов. В зрелом
состоянии крахмал они не содержат. К ним относятся семена
высокомасличных растений семейств Капустные, Молочайные,
Астровые.
Липиды локализуются в различных частях семени —
эндосперме, осевой части зародыша, семядолях. Они начинают
накапливаться на очень ранних этапах развития плодов (Н. В. Цингер,
1958).
В зародышах семян липиды в отличие от крахмала
накапливаются в значительных количествах. Одновременное присутствие в
эмбриональных тканях жира и крахмала — явление чрезвычайно
редкое, оно отмечено у некоторых представителей гвоздичных,
лавровых и др. (В. А. Поддубная-Арнольди, 1976).
Важно отметить, что особенно активный синтез липидов
наблюдается в растениях с вступлением их в генеративную фазу
развития. В семенах как основном аттрагирующем центре
процессы липидных реакций протекают значительно интенсивнее,
чем в вегетативных органах растений (С. Ф. Измайлов, 1986).
Важным запасным веществом семян является фитин,
представляющий собой кальциево-магниевую соль инозитфосфорной
кислоты.
Физиологические функции фитина в жизнедеятельности
растений довольно обширны. Он является основным фосфогеном
растений и служит резервом фосфора в зрелых семенах, который
используется проростком в период гетеротрофного питания. При
распаде фитина в прорастающих семенах катионы калия,
кальция и магния переходят в легкотранспортируемые формы, что
способствует их быстрой мобилизации в осевую часть проростка.
Миоинозит — продукт гидролиза фитина — участвует в
углеводном обмене (А. Л. Курсанов, 1976).
В зрелых семенах фитин находится исключительно в
алейроновых зернах в форме калиево-магниево-кальциевой соли.
Большая часть его содержится в сложных алейроновых зернах —
глобоидах, однако некоторое его количество имеется
непосредственно в белковом матриксе алейронового зерна.
В семенах масличных растений фитина больше (до 3 %), чем
в белково-крахмальных и крахмалистых семенах (0,3—1,5 %)■
7.17.5. ВЗАИМОДЕЙСТВИЕ ВЕГЕТАТИВНЫХ И РЕПРОДУКТИВНЫХ
ОРГАНОВ В ПРОЦЕССЕ ФОРМИРОВАНИЯ СЕМЯН
Вегетативные органы растений играют важную роль в синтезе
и накоплении запасных веществ в плодах и семенах.
Установлено, что большая часть белка в семенах (около 2/з) синтезируется
в результате реутилизации азотистых веществ вегетативных
органов, где они накопились к началу налива семян.
474
Различные органы играют неодинаковую роль в снабжении
формирующегося семени азотистыми веществами. В опытах с
пшеницей установлено, что из всего азота, поступающего в
семена из вегетативных органов, на листья приходится около 50 %,
на стебли — 20—30, на корни — 10—30 %, элементы соцветия
дают 10—15 % (А. Н. Павлов, 1984). Вегетативные органы
являются также основным источником углеводов для синтеза в
зерновках крахмала. Если учесть потери на дыхание, то реальный
вклад листьев в накопление в семенах углеводов составляет ПО—
120 % их общего количества в зерне (А. М. Соболев, 1982;
А. Н. Павлов, 1984).
Значительная роль в формировании семян принадлежит ат-
трагирующей способности колоса, т. е. привлечению
метаболитов из вегетативных органов для собственного формирования.
Колосовые, цветковые чешуи и ости наряду с высокой
фотосинтетической деятельностью более активно используют
мономерные вещества других органов для синтеза запасных веществ
семян. У сортов с повышенной аттрагирующей способностью
более высокая транспирация за счет хорошо развитых
колосковых, цветковых чешуи и остей.
Характер передвижения веществ после скашивания растений
хорошо иллюстрируется результатами исследований, проведенных
во Львовском сельскохозяйственном институте с озимой
пшеницей в контролируемых условиях, создаваемых в искусственных
климатических камерах с применением изотопа 32Р (табл. 24).
24. Влияние сроков уборки и условий дозревания на формирование
семян озимой пшеницы
Срок уборки
Условия дозревания растений после скашивания
обмолот и
выделение
зародышей в день
уборки
в
снопиках,
в валках
в
снопиках во
влажной
камере
в
снопиках в
суховейной
камере
Масса 1000 семян, г
Конец формирования
зерновки в длину
Молочное состояние
Тестообразное состояние
Середина восковой спелости
Твердая спелость
Масса
Конец формирования
зерновки в длину
Молочное состояние
Тестообразное состояние
Середина восковой спелости
Твердая спелость
15,4
18,5
19,4
14,6
25,2
35,6
41,9
41,7
26,8
37,9
41,4 '
40,9
1000 зародышей, г
0,500
0,720
1,154
1,301 .
1,318
0,760
0,946
1,122
1,282
—
30,6
38,3
43,0
42,0
0,863
1,080
1,313
1,438
—
24,5
34,9
41,1
41,9
0,650
0,897
1,215
1,289
475
При дозревании скошенных растений во влажной камере
(температура 17 "С, относительная влажность воздуха 90 %)
вегетативная масса подсыхала медленно, что способствовало более
длительному оттоку пластических веществ из стебля и листьев в
зерно. Масса 1000 семян в таких условиях была самой высокой
при всех сроках уборки. При дозревании в суховейной камере
(температура 32 "С, влажность 46—50 %) масса 1000 семян не
увеличивалась, а даже снижалась по сравнению с контролем
(обмолот в день уборки).
Это объясняется тем, что разница в скорости высыхания
семян при суховее и во влажной камере была незначительной, в
то время как стебли при суховее высыхали очень быстро. В этом
случае отток веществ из стеблей быстро прекращался, а зерно,
будучи достаточно влажным, теряло сухое вещество на дыхание.
В поле в валке передвижение веществ из соломы в зерно
определяется естественными условиями: атмосферными осадками,
температурой воздуха и наличием ветра. Более низкая температура,
смена дня на более прохладную ночь и периодическое
увлажнение соломы дождями и росами способствуют оттоку
пластических веществ из вегетативных органов в зерно.
Поступление веществ в зерновку продолжается вплоть до
середины восковой спелости (влажность 30—27 %). Следовательно,
это время необходимо отнести к оптимальному сроку начала
раздельной уборки колосовых культур. Более ранняя уборка
приводит к недобору урожая. Завершать скашивание в валки
необходимо в конце восковой спелости при влажности зерна 23—
22 %.
В накоплении веществ зародышем отмечаются такие же
закономерности, как и при формировании зерновки в целом, причем
увеличение массы зародышей имело место также и при
дозревании растений при суховее, что указывает на активное
использование ими запасных веществ эндосперма. Этому способствуют
более высокая влажность эмбриональных тканей (75—40 % при
разных сроках уборки) по сравнению с эндоспермом (59—35 % в
те же сроки уборки).
Если накопление веществ в зародыше продолжается вплоть до
конца восковой спелости зерна, то количество клеток в нем уже
после тестообразного состояния не изменяется. В зависимости от
условий дозревания масса зародышей варьировала в
значительных пределах, однако число клеток в них также практически не
изменялось.
Соотношение вегетативной массы и массы семян растения в
значительной степени определяет их белковость. Как правило, у
высокобелковых сортов пшеницы на единицу массы семян
приходится больше вегетативной части. А. Н. Павлов (1984)
сообщает, что основным фактором, определяющим уровень накопления
белка в семенах, является количество азота в растении, приходя-
476
щееся на единицу массы зерна, называемое показателем
обеспеченности зерна азотом.
Между соотношением развития корневой системы и
надземной массы существует тесная взаимосвязь. Н. М. Макрушин
1 (1985) установил, что при увеличении площади питания число
корешков на одно растение возрастает. Однако при этом
значительно усиливается кущение растений, образуется подгон с
неполноценными зерновками, что приводит к снижению массы
1000 семян и ухудшению их биологических свойств. Причина
заключается в том, что при увеличении общего количества
корешков, приходящегося в целом на растение, их число в
пересчете на отдельные стебли и семена уменьшается, что
обусловливает снижение обеспеченности последних влагой и элементами
питания. Поэтому лучшие семена получают при оптимальных
площадях питания растений.
7.17.6. ПРЕВРАЩЕНИЕ ВЕЩЕСТВ ПРИ СОЗРЕВАНИИ СОЧНЫХ ПЛОДОВ
Созревание сочных плодов сопровождается сложным
комплексом биохимических превращений. При этом вещества,
образовавшиеся на более ранних этапах формирования плодов,
используются для синтеза новых веществ на завершающихся
стадиях их созревания. Общая схема превращения запасных веществ
при созревании плодов на материнском растении или же при
хранении представлена на рисунке 143.
Обмен запасных веществ (сахаров, кислот и др.)
осуществляется по двум метаболическим путям: окисления и декарбоксилиро-
вания. Образующиеся при этом метаболиты и
высвобождающаяся энергия используются на создание структур клеточных орга-
нелл и обеспечение их функций, а также на активизацию
биосинтеза веществ, необходимых для процесса созревания, —
нуклеиновых кислот, белков, липидов, этилена, ароматических
веществ и др. Превращение запасных веществ происходит с
помощью как ферментов, уже имеющихся в растущем плоде, так и
за счет новых ферментативных систем.
После сбора плодов биохимические процессы более активно
протекают в первые дни и недели. При достижении
определенного максимума активность многих физиологических систем
снижается и их направленность изменяется. Например, если на
первых этапах созревания более интенсивно идут процессы
окисления, то в дальнейшем преобладают реакции декарбокси-
лирования.
Максимальная активность биосинтетических процессов при
созревании плодов сопровождается временным усилением
дыхания, который назван климактерическим. Считается, что климак-
477
ЗАПАСНЫЕ ВЕЩЕСТВА
САХАРА, ОРГАНИЧЕСКИЕ КИСЛОТЫ И
ДРУГИЕ ИСТОЧНИКИ МЕТАБОЛИТОВ, ЭНЕРГИИ
И Н+ ДЛЯ ВОССТАНОВЛЕНИЯ НАД+И НАДФ+
МЕТАБОЛИТЫ
АДФ - АТФ
НАДФ+~НАДФ Н
СО7 Н,0
МЕТАБОЛИТЫ
НАДФ+- НАДФ ■ Н
ПОДДЕРЖАНИЕ
СТРУКТУРЫ И
ФУНКЦИЙ
ВНУТРИКЛЕТОЧНЫХ
СИСТЕМ
АЦЕТАЛЬДЕГИД ~СО2
\
СПИРТ
БИОСИНТЕЗЫ
йе поуо
РНК БЕЛОК ЛИПЙДЫ ЭТИЛЕН ПАХУЧИЕ
У ВЕЩЕСТВА
ВОСК
Рис. 143. Схема превращения запасных веществ ори созревании плодов
(по Л. В. Метлицкому, 1976)
терический подъем дыхания означает кульминацию процесса
созревания и начало старения.
Важная роль в процессе созревания плодов принадлежит
процессу превращения органических кислот. Вследствие окисления
и декарбоксилирования в цикле Кребса они становятся
источниками Н+ и СОг для дыхания и исходным материалом для
биосинтеза ряда веществ в процессе созревания.
Промежуточным продуктом окисления маната в пируват,
происходящего в митохондриях, является щавелевоуксусная кислота
(ЩУК), которая уже в небольших количествах способна подав-
478
лять систему сукцинатдегидрогеназы, что приводит к нарушению
цикла Кребса. В митохондриях плодов яблони обнаружен
механизм превращения ЩУК в аминокислоту путем переаминирова-
ния. Наряду с этим в климактерической фазе увеличивается
проницаемость тонопласта, что обеспечивает возрастание скорости
поступления органических кислот из вакуоли в цитоплазму.
При климактерическом подъеме дыхания величина
дыхательного коэффициента возрастает с 1 до 1,5 и более, что
обусловливается сдвигом дыхания от аэробного к анаэробному. Об этом
свидетельствует заметное увеличение в созревающих плодах
спирта и ацетальдегида. Одной из причин анаэробного сдвига
дыхания при созревании плодов является ослабление доступа
воздуха из-за постоянного. биосинтеза кутикулярных веществ.
Основной же причиной является возникновение
ферментативной системы, состоящей из трех энзимов — малатдегидрогеназы
декарбоксилирующей, пируватдекарбоксилазы и алкогольдегид-
рогеназы.
Этот механизм не связан с гликолизом, а состоит в декарбо-
ксилировании яблочной кислоты с образованием больших
количеств пировиноградной кислоты в созревающих плодах.
Ключевым ферментом данной системы является малатдегидрогеназа,
основная функция которой состоит в регулировании количества
С4-кислот в цитоплазме. Фермент удаляет избыток кислот,
возникающий вследствие ослабления их транспорта в вакуоль.
Деятельность малатдегидрогеназы выражается той же кривой,
что и климактерический подъем дыхания, а поэтому может
служить показателем физиологической активности тканей
созревающих плодов.
7.17.7. ПРИЕМЫ НОРМИРОВАНИЯ ПЛОДОНОШЕНИЯ И УСКОРЕНИЯ
СОЗРЕВАНИЯ ПЛОДОВ И ОВОЩЕЙ
Периодичность плодоношения вызывается чрезмерно
высокими урожаями плодов в отдельные годы, приводящими к
истощению деревьев. Это явление обусловливается как генетическими
факторами, так и условиями среды. В сельскохозяйственной
практике с целью нормирования плодоношения, стабилизации
образования цветочных почек, уменьшения опадения плодов,
облегчения их съема и ускорения созревания используют
физиологически активные вещества.
Для регулирования плодоношения можно проводить
прореживание завязей. Плод остается связанным с побегом до тех пор,
пока синтезируемые в семенах ростовые вещества через
плодоножку транспортируются к месту его прикрепления, что
препятствует образованию отделительной ткани. Путем опрыскивания
синтетическими ауксинами можно вызвать снижение синтеза
этих веществ семенами и тем самым индуцировать образование
479
слоя отделительной ткани. Для яблони применяют препарат кар-
барил. Для стабилизации образования цветочных почек
рекомендуют этефон. Для сортов яблони, склонных к опадению, полезно
применять регуляторы роста, обеспечивающие прочность
соединения плода с плодоножкой. Лучшими при этом являются
кислота а-НУК или ее амид НУД. Можно использовать также
препараты 2,4-Д и КАНУК (калиевая соль нафтилуксусной кислоты).
Часто плоды в технической спелости трудно отделяются от
побегов, что затрудняет уборку урожая, особенно
механизированную. Опрыскивание растений флордимексом за 5—7 дней до
уборки способствует образованию отделительной ткани и
облегчению съема плодов смородины, крыжовника и вишни.
Эндогенным стимулятором созревания плодов является
этилен, который образуется в мясистом околоплоднике. Этилен
ускоряет наступление климактерического подъема дыхания, что
способствует более быстрому созреванию плодов. Он действует
на созревание перикарпия плода и на семена, а также вызывает
распад хлорофилла, благодаря чему зеленые плоды быстро
приобретают свойственную им окраску. Этилен находится в
своеобразной конкуренции с ауксином. В молодых плодах этилена
мало, а ауксинов много. По мере завершения роста плодов
количество ауксинов в них уменьшается, а этилена — увеличивается
(Л. В. Метлицкий, 1976).
Выдерживание плодов в среде с небольшим количеством
этилена стимулирует процесс их созревания. В совершенно зеленых
плодах, богатых ауксином, действие экзогенного этилена
неэффективно.
Этилен применяют для ускорения дозревания томатов, яблок,
груш, айвы, абрикосов, персиков и других плодов. Созревание
происходит за 5—6 дней.
7.17.8. ВЛИЯНИЕ ВНУТРЕННИХ И ВНЕШНИХ ФАКТОРОВ
НА КАЧЕСТВО СЕМЯН
Жизнеспособность семян определяется внутренними
факторами организма и внешними условиями их формирования и
хранения.
Генетические факторы. Важнейшими внутренними факторами
являются процессы, связанные с гаметогенезом,
оплодотворением, развитием семян, а также синтезом и накоплением веществ.
Способность семян к прорастанию зависит прежде всего от
количества хромосом в гаметах, принимающих участие в
оплодотворении. Так, у гетерогеномных пшенично-ржаных гибридов
(тритикале) нарушаются мейоз, а также рост пыльцевых трубок,
процесс оплодотворения, эмбриогенез и эндоспермогенез.
Содержание нуклеотидов в тканях зародышей очень низкое, а
катионы кальция и бора в щитке зародыша и алейроновом слое
480
гибридной зерновки отсутствуют. У тритикале часто наблюдается
щуплость семян. Это обусловлено торможением формирования
мелкозерного крахмала, что приводит к образованию вмятин на
зерновке, а также повышенной активностью у тритикале
фермента а-амилазы, приводящей к растворению накапливающегося
крахмала. Названные причины приводят к образованию
аномальных семян, обладающих слабой жизнеспособностью, либо
вообще не способных прорастать. Преодолеваются эти явления
при помощи мейотической или митотической полиплоидизации,
что обеспечивает нормальный гаметогенез, оплодотворение и
развитие семени.
На жизнеспособность семян значительное влияние оказывает
мутационный процесс. Мутации приводят к изменению
характера роста и формирования органов, торможению или усилению
синтеза и накопления веществ, ослаблению активности
определенных метаболических реакций. Мутации с полезными
отклонениями используют как исходный материал для селекции
сельскохозяйственных культур. Получены формы гречихи с
повышенным содержанием белка. У пшеницы достигнуто снижение
отрицательной корреляции между содержанием белка в семенах,
массой 1000 семян и продуктивностью растений. У сои и фасоли
повышены масса 1000 семян и озерненность соцветий.
Экологические факторы. Воздействие факторов внешней
среды на формирование семян имеет двоякий характер:
косвенное влияние через материнское растение и прямое действие на
семена с момента их образования до уборки урожая и в период
хранения.
Условия среды оказывают большое влияние на эмбриогенез.
Так, при температуре 10 "С в период формирования семян
яровой пшеницы рост ткани колеоптиля был подавлен на 9 %, а
при 30 °С на 30 % превосходил рост ткани, находящейся в
оптимальных условиях (20 °С). Такая же закономерность наблюдалась
в развитии зародышевого листа. Рост тканей корня при
прохладном режиме угнетался в 2 раза сильнее, чем рост ткани листа.
Температура и атмосферные осадки наравне с режимом
питания растений являются определяющими факторами химического
состава семян. При меньшем количестве осадков и повышенной
температуре воздуха содержание белка увеличивается, а
крахмала — уменьшается.
Температурный режим оказывает сильное влияние на состав
жирных кислот в семенах. Например, у сои при повышении
температуры заметно снижается содержание линолевой и мено-
левой кислот, а количество олеиновой кислоты увеличивается.
В условиях повышенных температур (25—30 °С) уменьшается
содержание фруктоолигосахаридов в листьях, что является одной
из причин снижения продуктивности колоса пшеницы,
выращиваемой при неблагоприятном тепловом режиме. На углеводный
481
обмен растений специфическое действие оказывает свет, что
проявляется в сильном изменении соотношения количества и
качества образующихся углеводов. Длинноволновой свет смещает
углеводный обмен растений в сторону более интенсивного
образования транспортных Сахаров, активно участвующих в
обменных процессах. Коротковолновой свет активизирует процессы
полимеризации углеводных мономеров в конечные продукты
метаболизма — гемицеллюлозу и целлюлозу (Ю. В. Терентьев и др.,
Различия в химическом составе, обусловленные погодными
факторами, сказываются и на качестве семян. Сухая и теплая
погода при восковой спелости способствует сокращению
периода покоя семян пшеницы, а влажная и холодная —
увеличению его продолжительности. После восковой спелости
физиологическая активность ■ семян затухает и их устойчивость
ослабляется. При этом как осадки, так и температура при их
неблагоприятном проявлении оказывают более пагубное
воздействие на семена.
Установлено, что оптимальным количеством осадков в период
от начала восковой спелости до уборки является, не более 40 мм,
а оптимальной температурой воздуха — 19—23 °С. Из этого
вытекает важный для семеноводства вывод: необходимо принимать
все меры для того, чтобы начиная с середины восковой спелости
семенные участки находились как можно меньше на корню или
в валках.
С учетом зависимости посевных и урожайных свойств семян
от почвенно-климатических условий в регионах России
выделяют зоны оптимального семеноводства.
7.18. ФИЗИОЛОГИЯ ПОКОЯ И ПРОРАСТАНИЯ СЕМЯН
Типы покоя семян и факторы, их обусловливающие. Покой
семян относится к завершающей фазе эмбрионального периода
онтогенеза. Основным биологическим процессом, наблюдаемым
при органическом покое семян, является их физиологическое
дозревание, вследствие которого происходят структурные и
биохимические превращения и семена приобретают способность, к
активному прорастанию. Этот процесс может осуществляться в
доуборочный период на материнском растении (часто отмечается
у озимых), при хранении (у яровых) и даже в почве после посева
(у женьшеня).
Покой бывает вынужденным и органическим. Причиной
вынужденного покоя являются различные факторы внешней
среды, препятствующие прорастанию, чаще всего
неблагоприятная температура или недостаток влаги.
При органическом покое семена в зрелом состоянии
482
не способны прорастать даже при благоприятных условиях.
Задержка прорастания при этом вызывается свойствами зародыша
или тканей, окружающих его, а именно: эндосперма, семенной
кожуры, а также околоплодника. Все проявления органического
покоя делят на три группы: экзогенный, эндогенный и
комбинированный.
Экзогенный покой. Физический экзогенный покой
обусловлен водонепроницаемостью кожуры, имеющей развитую
кутикулу и слой палисадных клеток. Такие семена называются
твердыми (люпин, люцерна, лядвинец и др.).
Механический экзогенный покой связывается с
механическим препятствием прорастанию, создаваемым
околоплодником или его внутренней частью (скорлупа лещины, косточки
многих плодов). Удаление скорлупы ускоряет прорастание
семян.
Химический экзогенный покой вызывается
содержащимися в семенах ингибиторами, предотвращающими их
прорастание в неблагоприятных условиях. В числе ингибиторов
околоплодника таких семян обнаружены различные фенольные
соединения — салициловая, оксибензойная, коричная, а также
абсцизовая кислоты. Удаление околоплодника или промывание
плодов обеспечивает активное прорастание семян. Наблюдается
у свеклы, ясеня и др.
Эндогенный покой. Морфологический эндогенный
покой обусловлен недоразвитостью зародыша. Семена могут
прорастать только после завершения развития эмбриона.
Указанному процессу способствует теплая стратификация, которая
может длиться несколько месяцев. Распространен у свеклы,
ясеня и др.
Физиологический эндогенный покой обусловлен
пониженной активностью зародыша, которая в сочетании с
ухудшением газообмена покровов создает физиологический механизм
торможения прорастания семян. Физиологический покой
делится на три типа: неглубокий, глубокий и промежуточный.
Неглубокий покой проявляется во временной задержке
прорастания или определенном снижении всхожести. Он
характерен для многих культурных растений (пшеница, ячмень,
подсолнечник, салат и др.). Хранение таких семян, проращивание
в условиях переменных температур и действие света при
набухании способствуют прекращению покоя. Активизируют
прорастание семян также повреждение покровов семени и
обработка цитокининами, гиббереллинами, тиомочевиной и другими
веществами.
Глубокий покой отличается тем, что зародыш, хотя и трогается
в рост, но прорастание проходит замедленно и ненормально.
Покой снимается лишь при длительной холодной стратификации
483
семян. Характерен для многих плодовых и некоторых
травянистых растений.
При промежуточном покое в отличие от глубокого
извлеченные из семян зародыши прорастают более активно, однако с
частыми аномалиями. Активизируется прорастание семян при
длительной стратификации, сухом хранении и обработке гиббе-
реллинами.
Прекращение покоя семян. У большинства возделываемых
растений покой семян снимается в процессе послеуборочного
дозревания. У некоторых видов естественное физиологическое
дозревание протекает в течение длительного времени, что затрудняет
возделывание растений. Для снятия покоя используют
структурные, физические и химические факторы воздействия на семена.
К структурным, или механическим, приемам стимулирования
прорастания относятся скарификация, импакция, локальное
повреждение покровов семени, препарирование оболочек,
отчуждение зародышей. При этом облегчается доступ воды и кислорода
к зародышу, к тому же прорастающий зародыш изолируется от
действия эндогенных факторов покоя, в первую очередь
ингибиторов.
Скарификация, представляющая механическое повреждение
водонепроницаемых покровов семени, проводится вручную или
с помощью специальных механизмов. В последнем случае из-за
механического воздействия снижаются биологические свойства
семян, часть из них теряет жизнеспособность. Импакция
основана на ударах семян друг о друга и о стенки заключающего их
сосуда. При этом нарушается кожура в важной для прорастания
части семян — в области рубчика, травмирование же самого
семени не наблюдается.
Из других приемов применяют накалывание кожуры в
области зародыша, снятие кожуры и отделение зародышей от
эндосперма.
Установлено, что зародыши озимой пшеницы наклевьЬвдются
при посеве целых семян за 24—30 ч, зерновок без оболочек —
за 19, а изолированные зародыши — через 10—12 ч после
помещения их во влажную среду (Н. М. Макрушин, В. А.
Капица, 1973).
Физические факторы нарушения покоя семян. Температу-
р а. Оказывает влияние как на первичный, так и на вторичный
покой. Выводить семена из состояния покоя можно как более
высокими, так и более низкими температурами или их
переменным действием. Особенность семян, нуждающихся в действии
низких температур, состоит в том, что мобилизация запасных
питательных веществ и прорастание разделены во времени:
гидролиз белков и жиров предшествует троганию зародышей в рост.
Температурные же оптимумы обоих процессов в большинстве
случаев различны.
484
Наиболее распространенной термической обработкой семян
древесных и некоторых овощных и лекарственных растений
является холодная стратификация. В зависимости от места
выращивания семян условия стратификации неодинаковы. Так,
стратификация семян северной репродукции проходит наиболее
успешно при 0—3 °С, семена более южного происхождения могут
выйти из состояния покоя при температуре 5—7 "С (М. Г.
Николаева, С. Ф. Лящук, 1981).
Озимые злаки обладают коротким периодом
физиологического дозревания семян, однако в условиях прохладной погоды при
их формировании на материнском растении обнаруживают
пониженную лабораторную всхожесть при высокой
жизнеспособности. Для определения истинной всхожести необходимо
вывести семена из неглубокого покоя. Это достигают действием
переменных температур на набухшие семена. При более низких
(10—15 °С) температурах семена выдерживают в течение 16 ч, а
при высоких (20 °С) — 8 ч. Данный метод широко
распространен в практике семенного контроля.
При обогреве семян в течение 1 ч при 60 °С их всхожесть
повышалась. Однако сушка семян озимой вики при 40 °С
приводила к увеличению твердосемянности более чем в 3 раза по
сравнению с сушкой при 20 °С (Л. А. Пельцих, И. Л. Пельцих,
1980). Обогрев семян арбуза сорта Таврический в условиях
степного Крыма при температуре 50 °С в течение 4 ч повысил
дружность всходов на 41 %.
Отмечена высокая эффективность замачивания семян в
горячей воде при температуре 80—85 "С в течение 10 мин для
преодоления твердосемянности древесных растений. Особо твердые
семена рекомендуют обрабатывать кипятком от нескольких
секунд до нескольких минут.
Вода. Важнейшее условие и в большинстве случаев
лимитирующий фактор прорастания семян. Однако избыток влаги, как
правило, оказывает негативное влияние на них. Пребывание в
воде неблагоприятно сказывается на прорастании семян
большинства крупноплодных видов бобовых. Избыток воды между
семядолями теснит осевые органы зародышей, кроме того,
пузырьки воздуха и кислород, попадающие с водой при
замачивании семян, усугубляют эти повреждения. Семена различных
растений обладают определенным оптимумом влаги для набухания
и прорастания.
Состав газовой среды. Для начала прорастания семян
кислород требуется в очень малых количествах, поэтому
считается, что этот элемент нужен не в качестве фактора нарушения
покоя семян, а для его индукции. Ухудшение аэрации во время
перерыва стратификации препятствует индуцированию
вторичного покоя семян. В то же время повышение концентрации
диоксида углерода при достаточном содержании в атмосфере
485
кислорода не препятствует возникновению в семенах вторичного
покоя. Повышенные концентрации СО2 могут нарушить покой
семян различных видов. Слишком высокое содержание СОг
может сильно замедлить и даже приостановить рост после накле-
вывания зародыша.
В Московской сельскохозяйственной академии имени
К. А. Тимирязева разработан метод предпосевной обработки
семян, заключающийся в выдерживании их в воде, постоянно
аэрируемой кислородом или воздухом. Он получил название
«барботирование» (П. Ф. Кононков, В. Н. Губкин, 1986).
Свет. Фитохром контролирует прорастание семян и
цветение, ускоряя катаболический распад полисахаридов, липидов и
белков.
Влияние химических факторов на покой семян. Прорастание
семян регулируется фитогормонами. Гибберелловая кислота
стимулирует прорастание семян, находящихся в эндогенном
физиологическом покое, и в меньшей степени влияет на экзогенный
покой. Гиббереллины проявляют способность стимулировать до-
развитие зародыша в семенах, находящихся в морфологическом
покое. Важнейшее звено механизма действия гиббереллинов в
прорастающих семенах — стимуляция активности
гидролитических ферментов в алейроновом слое.
Цитокинины способствуют прорастанию светочувствительных
семян в темноте, инактивируют ингибирующее действие абсци-
зовой кислоты на семена и зародыши (М. Г. Николаева, 1982).
Абсцизовая кислота оказывает ингибирующее влияние на
прорастание покоящихся семян. По мере выхода из состояния покоя
у семян проявляется способность инактивировать действие
экзогенной и снижать содержание эндогенной абсцизовой кислоты.
Процессы, протекающие при прорастании семян. При
прорастании семян выделяют следующие фазы.
Поглощение воды — сухие семена, находящиеся в состоянии
покоя, поглощают воду из воздуха или какого-либо субстрата до
наступления критической влажности. Этот показатель составляет
для проса 25 %, кукурузы — 44, пшеницы — 40, гречихи — 47,
ячменя — 48, подсолнечника — 57, ржи — 58, овса — 60, вики — 75,
фасоли — 104, гороха, бобов — 107, сахарной свеклы — 120 % на
воздушно-сухую массу семян. Основу фазы водопоглощения
составляют физико-химические явления, сорбция, однако при этом
происходят некоторые биохимические превращения, связанные с
включением в структуру кислот дополнительных молекул воды.
Набухание начинается, когда семена достигают влажности
выше критической. За счет поступающей влаги активизируется
жизнедеятельность клеток, их ферментативные системы
переходят в активное состояние, усиливаются гидролитические
процессы, происходит перестройка коллоидов, сильно увеличивается
дыхательный коэффициент.
486
Рост первичных корешков отмечается с момента деления их
клеток. Морфологически он фиксируется при появлении над
оболочкой семени первичного корешка, т. е. при наклевывании.
При этом рост корешка обеспечивается в основном за счет
собственных веществ зародыша.
Развитие ростка начинается с его появления и происходит за
счет использования запасных веществ эндосперма
(гетеротрофная эндоспермальная фаза питания). Завершается эта фаза с
появлением у проростка сформированного колеоптиля (у злаков)
или почечки (у других культур).
Становление проростка — заключительная фаза прорастания
семян, продолжается до перехода его к полному автотрофному
питанию.
Приведенная классификация рассматривается с
агрономической точки зрения, ее использование позволяет давать оценку
семенам, наиболее отвечающую производственным целям.
При прорастании семян активно происходит мобилизация
запасных веществ. Уже через 2—3 сут наблюдается
гидролитическое расщепление значительной части крахмала под влиянием
ферментов амилаз с последовательным образованием
декстринов, мальтозы и конечного продукта — глюкозы. Последняя
является основным субстратом для дыхания растений.
Липиды, содержащиеся в зародыше, эндосперме или
семядолях, также подвергаются гидролитическому расщеплению при
каталитическом воздействии другой группы ферментов — липаз
и фосфорилаз. Продуктами гидролиза являются жирные кислоты
и глицерин, которые далее подвергаются окислительному
распаду и другим превращениям. Образующиеся в процессе их
окисления молекулы ацетил-КоА вовлекаются в цикл трикарбоновых
кислот. В прорастающих семенах липиды довольно быстро
превращаются в углеводы. Так, в начале прорастания подсолнечника
количество жиров и жирных кислот в 100 семянках составляло
4 г, на 7-й день прорастания их оставалось лишь 1,5 г.
Содержание же Сахаров при этом увеличилось почти вдвое.
Схема распада запасных белков при прорастании семян
представлена С. М. Бреем (рис. 144). В процессе гидролиза белков
протеазами образуются аминокислоты, которые служат
источником углерода и азота для синтеза белков и других азотистых
соединений в клетках развивающегося проростка. В тканях
проростка имеются все необходимые ферменты, чтобы обеспечить
метаболическое взаимопревращение аминокислот путем пере-
аминирования и дезаминирования и таким образом создать фонд
аминокислот, отвечающих потребностям растения на данном
этапе его развития.
Центром синтеза ферментов у семян злаковых является щиток
зародыша. Синтез амилаз, липаз и протеаз в щитке активируется
при набухании семян, что и обеспечивает утилизацию крахмала,
487
ЗАПАСАЮЩАЯ
Белковое тело
ТКАНЬ
ЗАПАСНОЙ БЕЛОК
гидролизу протеазами
АРГИНИН АМИНОКИСЛОТЫ ГЛУТАМИН ПРОЛИН
аргиназа К-*-МОЧЕВИНА
ОРНИТИН-
^СО2 I
у перерг
перераспределение
ГЛУТАМАТ ЫН3 АМИНО-И
г ' В ГЛУТАМИН
глутамин
синтетаза
у-АМИНО- ПРОЛИН ГЛУТАМИН
БУТИРАТ
транспорт
транспорт
транспорт
У-АМИНО- ПРОЛИН ГЛУТАМИН АМИНО- ГЛУТАМИН ПРОЛИН
БУТИРАТ , I КИСЛОТЫ
перераспределение
АМИНО-Ы
В ГЛУТАМИН
транспорт
Метаболические
взаимопревращения
ПРОЦЕССЫ ■*— УГЛЕРОДНЫЕ ^ ^ ФОНД ► ДРУГИЕ
БИОСИНТЕЗА СКЕЛЕТЫ АМИНОКИСЛОТ
ОКИСЛИТЕЛЬНЫЙ
ОБМЕН ВЕЩЕСТВ
Ч*.
СТРУКТУРНЫЕ И
ФЕРМЕНТНЫЕ БЕЛКИ
(растущий проросток)
Рис. 144. Распад запасных белков при прорастании семян (по С. М. Брею, 1986)
липидов и белков, содержащихся в эндосперме и алейроновом
слое.
Содержание нуклеиновых кислот при прорастании семян в
зародыше и проростке увеличивается. Так, в четырехсуточных
проростках ржи сорта Белта абсолютное содержание РНК по
сравнению с сухими семенами увеличивалось в 2,6 раза, а
ДНК — в 3 раза. Особенно большое количество нуклеиновых
кислот находится в прорастающем зародыше.
Проростки получают из запасных веществ семян в
гетеротрофный период развития также и минеральное питание.
Например, при прорастании семян овса росток активно потребляет
калий, фосфор, магний и азот эндосперма.
Неорганический фосфор в семенах содержится в небольшом
количестве, а поэтому для обеспечения процесса прорастания
семян его недостаточно. Основным источником фосфатов
является фитин, который имеется в значительных количествах в
семенах всех видов растений (К. Е. Овчаров, 1976).
Гидролиз фитина катализируется ферментом фитазои и
происходит с большой активностью. При прорастании семян ржи,
пшеницы, ячменя и кукурузы запас фитина полностью
используется за 5—8 дней, а у овса — за 2 недели (А. М. Соболев, \ЭЫ).
Фитаза наиболее активна в семядолях бобовых и в эндосперме
Дыхание как основной энергетический процесс в прорастающих
семенах. Характер дыхания хорошо отражает величина
дыхательного коэффициента (ДК). При прорастании крахмалистых семян
злаков ДК бывает близким к единице, масличных и
высокобелковых составляет 0,6—0,8. Дыхание сопровождается
уменьшением массы семян вследствие расхода органических веществ,
изменением состава окружающей среды (поглощение кислорода и
выделение углекислоты), выделением влаги и теплоты. Эти
процессы важно учитывать как при создании условий для
прорастания семян, так и для их хранения.
Интенсивность дыхания по мере прорастания усиливается. В
опытах Крымского СХИ этот показатель у разных фракции
семян гибрида кукурузы Краснодарский 303 ТВ составлял: у
сухих семян - 0,005-0,025 мг СОг/г сухого вещества за 1ч,
через 20 ч проращивания - 0,20-0,60, через 40 ч - 0,31-1,05 и
через 60 ч — 1,22—2,06 мг СО2/г сухого вещества за 1 ч.
Дыхание прорастающих семян подвергается влиянию ряда
внутренних и внешних факторов. В зависимости от плотности
покровов семени прорастание может происходить при недостатке
кислорода, т. е. в условиях, близких к анаэробным. С прорывом
кожуры проросток полностью переходит на аэробное дыхание.
Самой высокой энергией дыхания обладают семена
масличных культур, затем кукурузы и других злаков. Слабее дышат
семена гречихи и бобовых. При влажности 16 % семена пшени-
489
цы выделяют 0,90 мг СО2 на 100 г сухого вещества, а гороха —
только 0,08 мг. При увеличении содержания жира у разных
сортов подсолнечника с 30,2 до 46,7 % интенсивность дыхания
повысилась в 6,5 раза. Зародыши семян злаков, имеющие высокую
концентрацию веществ, а также повышенную влажность, дышат
в 12 раз интенсивнее, чем целая зерновка. По Л. А. Трисвятско-
му, у нетравмированных семян интенсивность дыхания в 3 раза
слабее, чем у поврежденных.
7.19. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ХРАНЕНИЯ СЕМЯН,
ПЛОДОВ, ОВОЩЕЙ, СОЧНЫХ И ГРУБЫХ КОРМОВ
Важнейшими факторами, влияющими на сохранность семян,
плодов, овощей и кормов, являются влажность, температура,
газовый состав воздуха, наличие инфекции и вредителей, а также
состояние самих растительных материалов.
Сухие семена в сухом состоянии расходуют на дыхание
ничтожно малое количество органического вещества: при
влажности 11—12 % семена зерновых теряют 0,2 % за несколько лет, а
гороха — 0,001 % своей первоначальной массы. При влажности
около 20 % эти потери доходят до 0,8 % за месяц хранения. При
повышении влажности семян интенсивность их дыхания
значительно возрастает. По данным В. Л. Кретовича и др. (1981), при
влажности семян яровой пшеницы 14,4 % на 100 г сухого
вещества за сутки кислорода поглощалось 0,07 мл, СО2 выделялось
0,27 мл. При влажности 17,6 % эти показатели составляли
соответственно 6,21 и 5,18 мл, а при влажности 21,2 % —17,33 и
13,04 мл.
На дыхание семян большое влияние оказывает температура
среды. Так, при 0 °С семена пшеницы с влажностью 18 %
выделяли 10 мг СОг на 100 г сухого вещества за 6 ч, при 20 °С — 20,
при 30 °С — 43 мг. Для снижения интенсивности дыхания
семена и товарное зерно хранят в холодильных камерах, применяют
их активное вентилирование.
При интенсивном дыхании семян выделяется большое
количество влаги, что в комплексе с высокой температурой и
наличием инфекции приводит к самосогреванию, которое
сопровождается гидролитическими процессами и развитием плесневых
грибов.
Установлено, что при изменении влажности семян ржи с 12,9
до 17 % после года хранения всхожесть снизилась на 15 %, а при
более высокой влажности семян жизнеспособность вообще
терялась (Б. А. Карпов, 1983).
При хранении плодов и овощей непрерывно протекают
сложные биохимические и физиологические процессы. Дыхание
оказывает большое влияние на лежкость продукции. При оптималь-
490
ных условиях хранения 1 кг маточников выделяет СОг (мг/ч):
капуста 4—6, морковь 3—5, лук репчатый 3—4, свекла столовая
2—4. При повышенных температурах дыхание резко усиливается.
Накапливающийся при этом СОг вызывает травмирование почек
и устьиц, а затем удушение, самосогревание и порчу маточников
и товарных овощей. Основой хранения овощей является
регулирование содержания СО2 путем вентилирования и создание
оптимальной температуры и влажности воздуха. Капуста и
корнеплоды хранятся при температуре 0—2 °С и относительной
влажности воздуха до 90—95 %, лук-севок — при 18—20 °С и
влажности воздуха 60—70 %, лук-репка — при 1—5 °С и
влажности 60—80 %. Чеснок хранят при температуре от —1 до 3 °С и
влажности 65—75 %.
При хранении плодов происходит изменение кутикулярных
липидов. Вследствие повышенного содержания СОг в кутикуле
яблок изменяется соотношение фракций мягкого и твердого вос-
ков. Одновременно с этим в плодах увеличивается накопление
спирта и ацетальдегида, происходит распад органических кислот,
что снижает их вкусовые качества. СОг приводит к торможению
синтеза этилена в плодах. Так, после первых 25 дней хранения в
среде с 3 % СОг содержание этилена в плодах яблони было
23 мкг%, а при 12 % СО2 — 51 мкг%.
Аэробные условия хранения способствуют более экономному
расходу углеводов, чем при низких концентрациях кислорода. Для
большинства сортов яблони и груши оптимальными условиями
хранения является газовая среда, состоящая из 3 % 02, 5 % СОг и
92 % N2, для винограда — 3 % Ог, 1 % СОг и 96 % Иг:
Оптимальная температура для хранения большинства плодов от 0- до 4 "С,
что зависит от их вида, сорта и физиологического состояния.
Важнейшими кормами из зеленых травянистых растений
являются сено и силос. К сену относятся корма с влажностью
ниже 40 %, а к силосу — выше 40 %. При хранении этих кормов
происходят сложные биохимические, физиологические и другие
процессы (изменение интенсивности дыхания, повышение
температуры, выделение воды, самосогревание, развитие
болезнетворных микробов).
Для предотвращения порчи сена его необходимо закладывать
на хранение при влажности не более 17 %. При хранении
кормов с более высокой влажностью их подвергают химическому
консервированию.
Значительное распространение в кормопроизводстве имеет
также сенаж, приготовляемый из тонкостебельных травянистых
растений, убранных в ранние фазы вегетации, когда они имеют
максимальную питательную ценность. Скошенные бобовые
травы провяливают до влажности 45—50 %, а злаковые — до 50—
55 %. В процессе их провяливания увеличивается осмотическое
давление клеточного сока, снижается количество эпифитной
491
микрофлоры, изменяется биохимический состав корма. Так, при
влажности смеси клевера с тимофеевкой 75 % ее рН составлял
4,2, содержание молочной кислоты — 12 %, уксусной кислоты —
2,6 %, при влажности 50 % —соответственно 5,5; 6,1 и 0,38.
Созревание сенажа происходит в течение 30 дней после его
закладки. При этом в клеверном сенаже содержание сахара
снижается с 8,31 до 6,2 %, крахмала — с 1,68 до 0,29 %. Этот
процесс протекает при участии осмофильных молочнокислых
бактерий (Г. А. Богданов, О. Е. Привало, 1983).
Контрольные вопросы и задания
1. В чем особенности онтогенеза однолетних, двулетних и многолетних
растений? 2. Каковы физиологическая роль фитогормонов и механизм их действия?
3. Назовите особенности роста отдельных органов растения (лист, стебель,
корень) и целостного растения. 4. В чем проявляются периодичность и
ритмичность роста, их причины? 5. Каково биологическое значение яровизации и
фотопериодизма? 6. Охарактеризуйте значение этапов размножения и старения для
формирования урожая. 7. Какими агротехническими приемами можно влиять на
рост и развитие растений? 8. Каковы возможности использования культуры
клеток и тканей в сельскохозяйственной практике? 9. Какие физиологические
процессы в растениях имеют циркадные ритмы? 10. Как можно использовать
фотопериодическую реакцию при выращивании растений в закрытом грунте и в
полевых условиях? П. Какова роль фитохрома в растениях? 12. Чем отличаются
друг от друга тропизмы и настии? 13. Перечислите и охарактеризуйте типы
размножения растений. 14. В чем проявляется взаимодействие вегетативных и
репродуктивных органов в процессе формирования семян? 15. Назовите типы
покоя семян и факторы, их обусловливающие. 16. Дайте характеристику
основным типам размножения растений. 17. Какова реакция различных растений на
фотопериод при цветении? 18. Какова роль термического фактора в переходе
растений к репродуктивному развитию? 19. Дайте характеристику важнейших
физиологических процессов, протекающих при опылении и оплодотворении.
20. Каковы закономерности накопления и превращения веществ при
формировании семян? Как их использовать при уборке урожая? 21. Охарактеризуйте
процессы, протекающие при покое семян. 22. Какие физиологические и
биохимические процессы протекают при прорастании семян? 23. Назовите важнейшие
процессы, протекающие при хранении семян, плодов и кормов. Как их
необходимо учитывать в семеноводстве, плодоводстве и кормопроизводстве? 24. Каковы
важнейшие причины потери жизнеспособности семян и меры по ее сохранению?
Г л а в а 8
ПРИСПОСОБЛЕНИЕ И УСТОЙЧИВОСТЬ
РАСТЕНИЙ
Территория России включает различные климатические зоны.
Значительная их часть приходится на районы неустойчивого
земледелия, для которых характерны недостаток или избыток
осадков, низкие зимние или высокие летние температуры,
засоленность или заболоченность, закисленность почв и др. В этих
условиях урожайность сельскохозяйственных культур во многом
определяется их устойчивостью к неблагоприятным факторам
среды конкретного сельскохозяйственного региона.
Приспособленность онтогенеза растений к условиям среды
является результатом их эволюционного развития
(изменчивости, наследственности, отбора). На протяжении филогенеза
каждого вида растений в процессе эволюции выработались
определенные потребности индивидуума к условиям существования и
приспособленность к занимаемой им экологической нише. Вла-
голюбие и теневыносливость, жароустойчивость,
холодоустойчивость и другие экологические особенности конкретных видов
растений сформировались в ходе эволюции в результате
длительного действия соответствующих условий. Так, теплолюбивые
растения и растения короткого дня характерны для южных
широт, менее требовательные к теплу и растения длинного
дня — для северных.
В природе в одном географическом регионе каждый вид
растений занимает экологическую нишу, соответствующую его
биологическим особенностям: влаголюбивые — ближе к водоемам,
теневыносливые — под пологом леса и т. д. Наследственность
растений формируется под влиянием определенных условий
внешней среды. Важное значение имеют и внешние условия
онтогенеза растений.
В большинстве случаев растения и посевы (посадки)
сельскохозяйственных культур, испытывая действие тех или иных
неблагоприятных факторов, проявляют устойчивость к ним как
результат приспособления к условиям существования,
сложившимся исторически, что отмечал еще К. А. Тимирязев. Способность
к эффективной защите от действия неблагоприятных
абиотических и биотических факторов среды, устойчивость к ним
возделываемых видов и сортов — обязательные свойства
районированных в данном регионе сельскохозяйственных культур.
Адаптация (приспособление) растения к конкретным условиям
среды обеспечивается за счет физиологических механизмов (фи-
493
зиологическая адаптация), а у популяции организмов (вида) —
благодаря механизмам генетической изменчивости,
наследственности и отбора (генетическая адаптация). Факторы внешней
среды могут изменяться закономерно и случайно. Закономерно
изменяющиеся условия среды (смена сезонов года) вырабатывают
у растений генетическую приспособленность к этим условиям.
8.1. ГРАНИЦЫ ПРИСПОСОБЛЕНИЯ И УСТОЙЧИВОСТИ
В естественных для вида природных условиях произрастания
или возделывания растения в процессе своего роста и развития
часто испытывают воздействие неблагоприятных факторов
внешней среды, к которым относят температурные колебания, засуху,
избыточное увлажнение, засоленность почвы и т. д. Каждое
растение обладает способностью к адаптации в меняющихся
условиях внешней среды в пределах, обусловленных его генотипом.
Чем выше способность растения изменять метаболизм в
соответствии с окружающей средой, тем шире норма реакции данного
растения и лучше способность к адаптации. Это свойство
отличает устойчивые сорта сельскохозяйственных культур. Как
правило, несильные и кратковременные изменения факторов
внешней среды не приводят к существенным нарушениям
физиологических функций растений, что обусловлено их способностью
сохранять относительно стабильное состояние при
изменяющихся условиях внешней среды, т. е. поддерживать гомеостаз.
Однако резкие и длительные воздействия приводят к нарушению
многих функций растения, а часто и к его гибели.
При действии неблагоприятных условий снижение
физиологических процессов и функций может достигать критических
уровней, не обеспечивающих реализацию генетической
программы онтогенеза, нарушаются энергетический обмен, системы
регуляции, белковый обмен и другие жизненно важные функции
растительного организма. При воздействии на растение
неблагоприятных факторов (стрессоров) в нем возникает напряженное
состояние, отклонение от нормы — стресс. Стресс — общая
неспецифическая адаптационная реакция организма на действие
любых неблагоприятных факторов. Выделяют три основные
группы факторов, вызывающих стресс у растений (В. В.
Полевой, 1989): физические — недостаточная или избыточная
влажность, освещенность, температура, радиоактивное излучение,
механические воздействия; химические — соли, газы, ксенобиотики
(гербициды, инсектициды, фунгициды, промышленные отходы и
др.); биологические — поражение возбудителями болезней или
вредителями, конкуренция с другими растениями, влияние
животных, цветение, созревание плодов.
Сила стресса зависит от скорости развития неблагоприятной
494
для растения ситуации и уровня стрессирующего фактора. При
медленном развитии неблагоприятных условий растение лучше
приспосабливается к ним, чем при кратковременном, но
сильном действии. В первом случае, как правило, в большей степени
проявляются специфические механизмы устойчивости, во
втором — неспецифические.
8.2. ЗАЩИТНО-ПРИСПОСОБИТЕЛЬНЫЕ ВОЗМОЖНОСТИ
(РЕАКЦИИ) РАСТЕНИЙ ПРОТИВ ПОВРЕЖДАЮЩИХ
ВОЗДЕЙСТВИЙ
В неблагоприятных природных условиях устойчивость и
продуктивность растений определяются рядом признаков, свойств и
защитно-приспособительных реакций. Различные виды растений
обеспечивают устойчивость и выживание в неблагоприятных
условиях тремя основными способами: с помощью механизмов,
которые позволяют им избежать неблагоприятных воздействий
(состояние покоя, эфемеры и др.); посредством специальных
структурных приспособлений; благодаря физиологическим
свойствам, позволяющим им преодолеть пагубное влияние
окружающей среды.
Однолетние сельскохозяйственные растения в умеренных
зонах, завершая свой онтогенез в сравнительно благоприятных
условиях, зимуют в виде устойчивых семян (состояние покоя).
Многие многолетние растения зимуют в виде подземных
запасающих органов (луковиц или корневищ), защищенных от
вымерзания слоем почвы и снега. Плодовые деревья и кустарники умерен-!
ных зон, защищаясь от зимних холодов, сбрасывают листья.
Защита от неблагоприятных факторов среды у растений
обеспечивается структурными приспособлениями, особенностями
анатомического строения (кутикула, корка, механические ткани
и т. д.), специальными органами защиты (жгучие волоски,
колючки), двигательными и физиологическими реакциями,
выработкой защитных веществ (смол, фитонцидов, токсинов,
защитных белков).
К структурным приспособлениям относятся мелколистность и
даже отсутствие листьев, воскообразная кутикула на поверхности
листьев, их густое опушение и погруженность устьиц, наличие
сочных листьев и стеблей, сохраняющих резервы воды, эректо-
идность или пониклость листьев и др. Растения располагают
различными физиологическими механизмами, позволяющими
приспосабливаться к неблагоприятным условиям среды. Это
САМ-тип фотосинтеза суккулентных растений, сводящий к
минимуму потери воды и крайне важный для выживания растений
в пустыне и т. д.
Многочисленными физиологическими изменениями
сопровождается развитие холодоустойчивости и морозостойкости у
495
озимых, двулетних и многолетних растений при уменьшении
длины дня и снижении температуры в осеннее время. У
сельскохозяйственных растений особое значение имеет устойчивость,
определяемая выносливостью клеток растений, их способностью
адаптироваться в изменяющихся условиях среды, вырабатывать
необходимые для жизнедеятельности продукты метаболизма.
Лучше всего растения переносят неблагоприятные условия в
состоянии покоя.
Первым сигналом для перехода к состоянию покоя яйляется
сокращение светового периода. При этом в клетках растений
начинаются биохимические изменения, приводящие в конечном
счете к накоплению запасных питательных веществ, снижению
оводненности клеток и тканей, образованию защитных структур,
накоплению ингибиторов роста. Примером такой подготовки
могут служить сбрасывание листьев в осенний период у
многолетних растений, развитие запасающих органов у двулетних и
образование семян у однолетних.
8.2.1. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПОВРЕЖДЕНИЯ РАСТЕНИЯ,
ЕГО ТКАНЕЙ И ОРГАНОВ
Неблагоприятный фактор, достигший порогового значения и
превысивший его, может вызывать состояние стресса, обратимые
или необратимые повреждения растений в зависимости от вида
стрессора, напряженности и длительности его действия. Любые
существенные и внезапные изменения внешней среды можно
рассматривать как раздражитель.
Когда говорят о внезапном действии какого-либо
раздражителя (температура, свет, концентрация солей, гербициды и т. д.),
имеют в виду резкие изменения фактора окружающей среды за
короткий отрезок времени. Например, суточный перепад
температур в 10 "С не вызывает существенных изменений в ходе
физиологических процессов. Если же этот перепад температуры
произойдет за 1 ч или тем более за 15 мин, ответная реакция
будет тотчас зафиксирована.
Исследование ответных реакций на изменяющиеся внешние
факторы позволяет понять физиологические механизмы и
пределы адаптации растений к условиям произрастания. Важно
подчеркнуть, что на разные по своей природе факторы растения,
как правило, реагируют двухфазно, т. е. первоначальный знак
реакции со временем меняется на противоположный. В
зависимости от природы и силы действующего фактора двухфазный
ответ (реакция) растений длится от долей секунды до нескольких
недель.
Двухфазность, являющаяся наиболее общим и характерным
показателем ответной реакции растений, обусловлена как
структурными, так и субстанционными изменениями в клетках тка-
496
ней. Чем меньше отклонение функции от нормы и чем быстрее
она возвращается к норме после снятия воздействия, тем выше
устойчивость растения к данному фактору. Если амплитуда
отклонения от нормы велика, то более устойчивым можно считать
такое растение (сорт), которое быстрее вернется к исходному
состоянию. Устойчивость, следовательно, характеризуется
амплитудой отклонения функции от оптимального состояния
растений, временем ее возвращения к норме, а также пределами
переносимых колебаний факторов внешней среды.
Действие одного и того же неблагоприятного фактора при
одной и той же интенсивности может вызывать или не
вызывать стресс конкретного растения в зависимости от его
устойчивости. Функционирование растения в обычных условиях и
при отклонении их от нормы определяется его способностью
не допускать или ликвидировать повреждения растительного
организма на разных уровнях его организации: молекулярном,
субклеточном, клеточном, тканевом, органном, организменном
и даже популяционном. Реакция растения на внешние условия
всегда комплексная, так как происходят изменения как
биохимических, так и физиологических процессов. Для ликвидации
возникших повреждений служат системы репарации
(восстановления): на молекулярном уровне это энзиматическая репарация
поврежденной ДНК, на организменном — пробуждение
пазушных почек при повреждении апикальной меристемы,
регенерация и т. д.
8.2.2. ИЗМЕНЕНИЯ ФИЗИКО-ХИМИЧЕСКИХ И ФУНКЦИОНАЛЬНЫХ
СВОЙСТВ РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ ПРИ ПОВРЕЖДЕНИЯХ
И ПРОЦЕССЫ АДАПТАЦИИ
Растения в отличие от животных обычно отвечают на
действие стрессора не активацией метаболизма, а, наоборот,
снижением своей функциональной активности (табл. 25).
25. Изменение физиологических параметров у растений в условиях
стрессов (по Г. В. Удовенко, 1979)
Параметр
Характер изменения параметров в условиях
засухи
высокой
температуры
низкой
температуры
Растет
Растет
Растет
Концентрация ионов в Растет
тканях
Активность воды в клет- Резко сни- Резко сни- Резко сни- Резко сни-
ке жается жается жается жается
Осмотический потенци- Растет Растет Растет Растет
ал клеток
Водоудерживающая спо- » » » »
собность
Водный дефицит » » » »
497
Продолжение
Параметр
Проницаемость
протоплазмы
Интенсивность транспи-
рации
Эффективность транспи-
рации
Энергоэффект дыхания
Интенсивность дыхания
Фотофосфорилирование
Стабилизация ядерной
ДНК
Функциональная
активность ДНК
Концентрация пролина
Содержание
водорастворимых белков
Синтетические реакции
Поглощение ионов
корнями
Транспорт веществ
Концентрация пигментов
Деление клеток
Растяжение клеток
Число плодоэлементов
Старение органов
Биологический урожай
Характер изменения параметров в условиях
засухи
Растет
Резко
снижается
То же
»
Растет
Снижается
Растет *
Снижается
Растет
»
Подавлены
»
»
Резко
снижается
Тормозится
Подавлено
Снижено
Ускорено
Понижен
засоления
высокой
температуры
Растет Растет
Резко сни- »
жается
То же Резко
снижается
» »
Растет Растет
Снижается —
Растет —
Снижается Снижается
Растет Растет
» »
Подавлены Подавлены
» »
» »
Резко сни- Резко
снижается жается
Тормозится Тормозится
Подавлено Подавлено
Снижено Снижено
Ускорено Ускорено
Понижен Понижен
низкой
температуры
Растет
Резко
снижается
То же
—
—
Снижается
Растет
Снижается
—
— ■
Подавлены
»
»
Резко
снижается
Тормозится
Подавлено
Снижено
—
Понижен
Клеточный уровень. При сильном и быстро нарастающем
действии стрессора, длительном повреждающем воздействии
стрессора (физических или химических факторов) в клетках
растений наблюдается ряд неспецифических реакций, приводящих
обычно к следующим изменениям: уменьшению, а затем
увеличению вязкости цитозоля; изменению проницаемости и заряда
мембран клетки и, как следствие, изменению ионных потоков
между средой и клеткой (повышение проницаемости мембран,
деполяризация мембранного потенциала плазмалеммы); входу
Са2+ в цитоплазму (из клеточных стенок и внутриклеточных
компартментов: вакуоли, ЭС, митохондрий); повышению сродства
цитозоля к красителям, сдвигу рН цитоплазмы в кислую сторону;
усилению выхода веществ из клеток и тканей; усилению
активности Н+-помпы в плазмалемме, препятствующей
неблагоприятным сдвигам ионного гомеостаза; возрастанию гидролитических
процессов; активации синтеза стрессовых белков; усилению
поглощения Ог, ускоренной трате АТФ, снижению коэффициента
498
Р/2ё характеризующего энергетику клеток; увеличению синтеза
этилена и АБК, торможению физиологических и
метаболических процессов, происходящих в обычных условиях.
Перечисленные и некоторые другие ответные реакции на
стрессоры взаимосвязаны и обеспечивают как защиту
внутриклеточных структур, так и устранение неблагоприятных изменении
в клетках. Наряду с неспецифическим эффектом все стрессоры
оказывают и свое специфическое воздействие (это будет
обсуждено в соответствующих разделах). При изучении устойчивости
растений исследование названных функций может оказать
помощь в отборе более устойчивых сортов и популяций
сельскохозяйственных растений. Особое значение имеет активация в
условиях стресса синтеза в клетках стрессовых белков.
У многих растений выявлены белки теплового шока, которые
образуют в ядре и в ядрышке клеток гранулы, связывая матрицы
хроматина, необходимые для синтеза обычных белков. После
прекращения стресса матрицы вновь начинают
функционировать. Белок теплового шока участвует в стабилизации
избирательных свойств плазмалеммы. При действии неблагоприятных
факторов в клетках возрастает содержание углеводов, пролина,
стабилизирующих физико-химические свойства цитоплазмы.
Организменный уровень. На организменном уровне к
клеточным механизмам адаптации дополняются новые, отражающие
взаимодействие органов в целом растении, усугубляются
конкурентные отношения между органами за физиологически
активные вещества и трофические факторы, выражающиеся в
характере донорно-акцепторных связей органов растения, в силе их
аттрагирующего действия. Подобный механизм позволяет
растениям в неблагоприятных условиях сформировать и сохранить
минимум генеративных органов, но в достаточной мере
обеспечить их необходимыми веществами для нормального созревания,
достижения обычных размеров и качества. Наблюдается
редукция или опадение заложившихся ранее плодоэлементов в колосе
(метелке) зерновых, в кусте хлопчатника, в кроне плодовых,
достигающая 60—80 % и более.
При неблагоприятных условиях резко ускоряются процессы
старения и опадения нижних листьев, а питательные вещества из
них направляются в молодые органы (реутилизация). К
механизмам защиты от последствия повреждающих факторов относится
замена (регенерация) поврежденных или утраченных частей и
органов растения.
Во всех процессах, обеспечивающих защиту, адаптацию и
репарацию растений при стрессе, участвуют все системы регуляции
(генетическая, гормональная, трофическая,
электрофизиологическая и др.). Так, при действии неблагоприятных условии в
растениях резко возрастает содержание этилена и АБК,
снижающих обмен веществ, тормозящих ростовые процессы, способст-
499
вующих старению и опадению органов, переходу растения в
состояние покоя. Одновременно в тканях снижается содержание
ауксина, цитокинина и гиббереллинов. Устойчивость регулятор-
ных систем определяет устойчивость растений.
Уровень популяции. В условиях длительного и сильного
стресса в природных условиях или в селекционном процессе на
провокационных фонах гибнут те растения, у которых более узкая
генетически обусловленная норма реакции на данный
экстремальный фактор. В результате семенное потомство образуют
лишь генетически более устойчивые растения и общий уровень
устойчивости в популяции возрастает. Следовательно, на популя-
дионном уровне в стрессовую реакцию включается естественный
(природные условия) или искусственный (селекционный
процесс) отбор.
Уровень устойчивости популяции (сорта) к тому или иному
фактору или группе факторов определяется устойчивостью
составляющих популяцию индивидуумов (биотипов). Наиболее
устойчивые сорта имеют в своем составе ряд биотипов,
обеспечивающих хорошую продуктивность сорта даже в неблагоприятных
условиях.
Возможность приспособления растений к неблагоприятным
условиям среды (закаливание растений). В невысоких дозах
повторяющиеся стрессы (низкие температуры, недостаток воды и др.)
способствуют закаливанию растений, их адаптации к стрессору.
Предложены закалка семян и молодых растений низкими и
переменными температурами, переменным увлажнением и др.
Критические периоды воздействия стрессовых условий на
растение. Устойчивость растения к стрессовому воздействию
зависит от фазы его развития в период действия неблагоприятных
условий. Наибольшую устойчивость имеют растения в
покоящемся состоянии (семена, луковицы и др.). Наиболее
чувствительны как сельскохозяйственные растения, так и сорняки в
самом молодом возрасте, в период появления всходов, так как в
это время нарушаются звенья метаболизма, обеспечивающие
гормонами активный рост и закладку репродуктивных органов, и
повреждаются конусы нарастания у растений. Однако период
формирования гамет (VII—VIII этапы) является критическим. В
это время растения очень чувствительны к стрессу, резко
снижают продуктивность, особенно семенную.
Пороги факторов внешней среды. Агрономическое понятие
устойчивости предполагает возможность получения в
неблагоприятных условиях среды достаточно высокой урожайности
конкретной сельскохозяйственной культуры. Экспериментально для
каждого вида сельскохозяйственных растений (сортов, гибридов)
установлены оптимальные уровни конкретных факторов
внешней среды, их оптимальное сочетание, а также критические
уровни, выше и ниже которых существенно страдает продукци-
500
онный процесс, снижается урожайность. Эти детальные сведения
являются предметом теоретической части технологических
дисциплин (растениеводство, овощеводство, луговодство и др.), а
также специального раздела физиологии — частной физиологии
отдельных растений.
Определение нормы и патологии в физиологии растений.
Воздействием стрессирующих факторов возможно в регулируемых
условиях определить оптимальные уровни физиологических
процессов и функций растений, обеспечивающие нормальный рост
растений и их продуктивность, а также критические уровни
факторов, приводящих к патологическим (отклоненным от нормы)
изменениям физиологических функций и снижению
продуктивности и даже гибели растений. Эти исследования являются
составной частью селекционных программ
научно-исследовательских учреждений России.
Важнейшие типы нарушений регуляции метаболических
процессов. Все системы регуляции в условиях действия
неблагоприятных факторов, достигших экстремальных уровней, обеспечивают
поддержание жизнедеятельности растения, достаточно высокого
уровня его метаболизма. Однако при высоких уровнях
напряженности стрессора происходят нарушения регуляции основных
метаболических процессов (нуклеиновый обмен, активность
ферментных систем и др.), нарушаются межклеточные связи. Все
это приводит к деградации физиологических функций,
снижению продуктивности, а в крайних условиях — к гибели растения.
8.3. ХОЛОДОСТОЙКОСТЬ РАСТЕНИЙ
Устойчивость растений к низким температурам подразделяют
на холодостойкость и морозоустойчивость. Под
холодостойкостью понимают способность растений переносить положительные
температуры несколько выше О °С. Холодостойкость свойственна
растениям умеренной полосы (ячмень, овес, лен, вика и др.).
Тропические и субтропические растения повреждаются и
отмирают при температурах от 0 до 10 "С (кофе, хлопчатник, огурец
и др.). Для большинства же сельскохозяйственных растений низ-
кце^положительные температуры негубительньь Связано это с
тем7~что при охлаждении ферментативный аппарат растений не
расстраивается, не снижается устойчивость к грибным
заболеваниям и вообще не происходит заметных повреждений растений.
Степень холодостойкости разных растений неодинакова.
Многие растения южных широт повреждаются холодом. При
температуре 3 °С повреждаются огурец, хлопчатник, фасоль,
кукуруза, баклажан. Устойчивость к холоду у сортов различна. Для
характеристики холодостойкости растений используют понятие
"температурный минимум, при котором рост растений прекраща-
501
ется. Для большой группы сельскохозяйственных растений его
" величина составляет 4 °С. Однако многие растения имеют более
высокое значение температурного минимума и соответственно
они менее устойчивы к воздействию холода.
Накопление зеленой массы кукурузой не происходит при
температуре ниже 10 °С. Устойчивость растений к холоду зависит от
периода онтогенеза. Разные органы растений также различаются
по устойчивости к холоду. Так, цветки растений более
чувствительны, чем плоды и листья, а листья и корни чувствительнее
стеблей. Наиболее холодостойкими являются растения раннего
срока посева.
Для сравнения рассмотрим особенности прорастания
малоустойчивой к холоду кукурузы. При температуре 18—20 °С всходы
у кукурузы появляются на 4-й день, а при 10—12 °С — только на
12-й день. О холодостойкости растений косвенно можно судить
по показателю суммы биологических температур. Чем меньше
эта величина, тем быстрее растения созревают и тем выше их
устойчивость к холоду. Показатели суммы биологических
температур соответствуют скороспелости растений: очень раннеспелые
имеют сумму биологических температур 1200 °С, раннеспелые —
1200—1600, среднераннеспелые — 1600—2200, среднеспелые —
2200—2800, среднепозднеспелые — 2800—3400, позднеспелые —
3400-4000 °С.
Физиолого-биохимические изменения у теплолюбивых
растений при пониженных положительных температурах. Повреждение
растений холодом сопровождается потерей ими тургора и
изменением окраски (из-за разрушения хлорофилла), что является
следствием нарушения транспорта воды к транспирирующим
органам. Кроме того, наблюдаются значительные нарушения
физиологических функций, которые связаны с нарушением
обмена нуклеиновых кислот и белков. Нарушается цепь
ДНК —р> РНК —■> белок -» признак.
У некоторых видов растений наблюдаются усиление распада
белков и накопление в тканях растворимых форм азота. Из-за
изменения структуры митохондрий и пластид аэробное дыхание
и фотосинтез снижаются. Деградация хлоропластов, разрушение
нормальной структуры пигментно-липидного комплекса
приводят к подавлению функции запасания энергии этими
органоидами, что способствует нарушению энергетического обмена
растения в целом. Основной причиной повреждающего действия
низкой температуры на теплолюбивые растения является нарушение
функциональной активности мембран из-за перехода
насыщенных жирных кислот из жидкокристаллического состояния в
состояние геля, а также общие изменения процессов обмена
веществ. Процессы распада преобладают над процессами синтеза,
происходят нарушение проницаемости цитоплазмы (повышение
ее вязкости), изменения в системе коллоидов, снижается (пада-
502
ет) осевой градиент потенциалов покоя (ПП), активный
транспорт веществ против электрохимического градиента.
Изменение проницаемости мембран приводит к тому, что
нарушаются поступление и транспорт веществ в растения и
отток ассимилятов, токсичных веществ из клеток. Все эти
изменения существенно снижают жизнеспособность растений и могут
привести к их гибели. Кроме того, в этих условиях растения
более подвержены действию болезней и вредителей, что также
приводит к снижению качества и количества урожая.
Приспособление растений к низким положительным
температурам. У растений более холодостойких отмеченные
нарушения выражены значительно слабее и не сопровождаются
гибелью растения (табл. 26). Устойчивость к низким
температурам — генетически детерминированный признак. Изменение
уровня физиологических процессов и функций при действии
низких положительных температур может служить
диагностическим показателем при сравнительной оценке
холодостойкости растений (видов, сортов). Холодостойкость растений
определяется способностью растений сохранять нормальную
структуру цитоплазмы, изменять обмен веществ в период
охлаждения и последующего повышения температуры на
достаточно высоком уровне.
Для оценки холодостойкости растений используют различные
методы диагностики (прямые и косвенные). Это холодный метод
проращивания семян, сверхранние посевы в сырую и непрогре-
тую почву, учет интенсивности появления всходов, темпов роста,
накопления массы, содержание хлорофилла, соотношение
количества электролитов в надземной и подземной частях растения,
оценка изменчивости изоферментного состава и др.
26. Минимальные температуры роста вегетативных и генеративных
органов различных растений, 'С
Культуры по степени устойчивости к холоду
Устойчивые:
яровая пшеница, ячмень, овес,
горох, чина, сахарная свекла
Среднеустойчивые:
люпин однолетний, бобы, лен,
подсолнечник, гречиха
Малоустойчивые:
просо, кукуруза, соя, сорго, фасоль
Неустойчивые:
рис, хлопчатник, бахчевые, арахис
Всходы и
вегетативные органы
4-5
5-6
7-8
11-13
14-15
Генеративные органы
8—10
10—12
12-15
15-18
18-20
503
Способы повышения холодостойкости некоторых растений.
Холодостойкость некоторых теплолюбивых растений можно
повысить закаливанием прорастающих семян и рассады, которое
стимулирует защитно-приспособительную перестройку метаболизма
растений. Наклюнувшиеся семена или рассаду теплолюбивых
культур (огурец, томат, дыня и др.) в течение нескольких суток
(до месяца) выдерживают при чередующихся (через 12 ч)
переменных температурах: от 0 до 5 "С и при 15—20 "С.
Холодостойкость ряда растений повышается при замачивании семян в
0,25%-ных растворах микроэлементов.
Повысить холодостойкость растений можно прививкой
теплолюбивых растений (арбуз, дыня) на более холодоустойчивые
подвои (тыква). Положительное влияние этих приемов связано со
стабилизацией энергетического обмена и упрочением структуры
клеточных органоидов у обработанных растений. У закаленных
растений увеличение вязкости протоплазмы при пониженных
температурах происходит медленнее.
Заморозки. Большой ущерб сельскому хозяйству наносят
кратковременные или длительные заморозки, отмечаемые в весенний
и осенний периоды, а в северных широтах и летом. Заморозки —
снижение температуры до небольших отрицательных величин,
могут быть во время разных фаз развития конкретных растений.
Наиболее опасны летние заморозки, в период наибольшего роста
растений. Устойчивость к заморозкам обусловлена видом
растения, фазой его развития, физиологическим состоянием,
условиями минерального питания, увлажненностью, интенсивностью и
продолжительностью заморозков, погодными условиями,
предшествующими заморозкам.
Наиболее устойчивы к заморозкам растения раннего срока
посева (яровые хлеба, зернобобовые культуры), способные
выдерживать в ранние фазы онтогенеза кратковременные весенние
заморозки до —7...—10 °С. Растения позднего срока посева
развиваются медленнее и не всегда успевают подготовиться к
низким температурам. Корнеплоды, большинство масличных
культур, лен, конопля переносят понижение температуры до
—5...—8 °С, соя, картофель, сорго, кукуруза — до —2...—3,
хлопок—до —1,5...—2, бахчевые культуры —до —0,5...—1,5 °С.
Существенную роль в устойчивости к заморозкам играет фаза
развития растений. Особенно опасны заморозки в фазе
цветение — начало плодоношения. Яровые хлеба в фазе всходов
переносят заморозки до —7...—8 °С, в фазе выхода в трубку до —3, а
в фазе цветения — только 1—2 "С. Устойчивость растений
зависит от образования при заморозках льда в клетках и
межклеточниках. Если лед не образуется, то вероятность восстановления
растением нормального течения функций возрастает. Поэтому
первостепенное значение имеет возможность быстрого
транспорта свободной воды из клеток в межклеточники, что определяется
504
II
высокой проницаемостью мембран в условиях заморозков. У
устойчивых к заморозкам культур при снижении температур в
составе липидов клеточных мембран увеличивается содержание
ненасыщенных жирных кислот, снижающих температуру
фазового перехода липидов из жидкокристаллического состояния в гель
до уровня 0 °С. У неустойчивых растений этот переход имеет
место при температурах выше 0 °С. В целях максимального
снижения повреждения растений заморозками необходимо
проводить посев их в оптимальные сроки, использовать рассаду
овощных и цветочных культур. Защищают от заморозков дымовые
завесы и укрытие растений пленкой, дождевание растений перед
заморозками или весенний полив. Для вертикального
перемещения воздуха около плодовых деревьев используют вентиляторы.
8.4. МОРОЗОУСТОЙЧИВОСТЬ РАСТЕНИЙ
Морозоустойчивость — способность растений переносить
температуру ниже 0 °С, низкие отрицательные температуры.
Морозоустойчивые растения способны предотвращать или уменьшать
действие низких отрицательных температур. Морозы в зимний
период с температурой ниже ~20 °С обычны для значительной
части территории России. Воздействию морозов подвергаются
однолетние, двулетние и многолетние растения. Растения
переносят условия зимы в различные периоды онтогенеза. У
однолетних культур зимуют семена (яровые растения), раскустившиеся
растения (озимые), у двулетних и многолетних — клубни,
корнеплоды, луковицы, корневища, взрослые растения. Способность
озимых, многолетних травянистых и древесных плодовых
культур перезимовывать обусловливается их достаточно высокой
морозоустойчивостью. Ткани этих растений могут замерзать,
однако растения не погибают. Большой вклад в изучение
физиологических основ морозоустойчивости внесли Н. А. Максимов
(1952), Г. А. Самыгин (1974), И. И. Туманов (1979) и другие
отечественные исследователи.
Замерзание растительных клеток и тканей и происходящие при
этом процессы. Способность растений переносить отрицательные
температуры определяется наследственной основой данного вида
растений, однако морозоустойчивость одного и того же растения
зависит от условий, предшествующих наступлению морозов,
влияющих на характер льдообразования. Лед может образовываться
как в протопласте клетки, так и в межклеточном пространстве.
Не всякое образование льда приводит клетки растения к гибели.
Постепенное снижение температуры со скоростью 0,5—1 °С/ч
приводит к образованию кристаллов льда прежде всего в
межклеточниках и первоначально не вызывают гибели клеток.
Однако последствия этого процесса могут быть губительными для
505
клетки. Образование льда в протопласте клетки, как правило,
происходит при быстром понижении температуры. Происходит
коагуляция белков протоплазмы, кристаллами образовавшегося в
цитозоле льда повреждаются клеточные структуры, клетки
погибают. Убитые морозом растения после оттаивания теряют тургор,
из их мясистых тканей вытекает вода.
Условия и причины вымерзания растений. Образующийся при
медленном промерзании в межклеточниках и клеточных стенках
лед оттягивает воду из клеток; клеточный сок становится
концентрированным, изменяется рН среды.
Выкристаллизовавшийся лед действует как сухой воздух, иссушая клетки и сильно
изменяя их осмотические свойства. Кроме того, цитоплазма
подвергается сжатию кристаллами льда. Образующиеся кристаллы
льда вытесняют воздух из межклеточников, поэтому замерзшие
листья становятся прозрачными.
Если льда образуется немного и клетки не были механически
повреждены его кристаллами, то при последующем оттаивании
такие растения могут сохранить жизнеспособность. Так, в
листьях капусты при температуре —5...—6 "С образуется некоторое
количество льда в межклеточниках. Однако при последующем
медленном оттаивании межклеточники заполняются водой,
которая поглощается клетками, и листья возвращаются в
нормальное состояние.
Однако клетки, ткани и растения могут погибнуть от мороза.
Основными причинами гибели клеток растений при низких
отрицательных температурах и льдообразовании являются
чрезмерное обезвоживание клеток или механическое давление, сжатие
клеток кристаллами льда, повреждающее тонкие клеточные
структуры. Оба эти фактора могут действовать одновременно.
Летальность действия мороза определяется несколькими
обстоятельствами. Последствия воздействия низких отрицательных
температур зависят от оводненности тканей растения. Насыщенные
водой ткани легко повреждаются, сухие же семена могут
выносить глубокие низкие температуры (до —196 °С). Низкое
содержание воды предохраняет от образования льда в растениях при
промораживании. Разные растения, их клетки имеют свой
критический предел обезвоживания и сжатия, превышение
которого, а не только снижение температуры приводит к их гибели.
Гибель клеток, тканей и растений под действием морозов
обусловливается необратимыми изменениями, происходящими в
протопласте клеток: его коагуляцией, денатурацией коллоидов
протопласта, механическим давлением льда, повреждающим
поверхностные структуры цитоплазмы, кристаллами льда,
нарушающими мембраны и проникающими внутрь клетки. Вредное
влияние оказывает повышение концентрации и изменение рН
клеточного сока, сопровождающие обезвоживание клеток.
Действие льда, особенно при длительном влиянии низких
506
температур, сходно с обезвоживанием клеток при засухе.
Признаками повреждения клеток морозом являются потеря ими тур-
гора, инфильтрация межклеточников водой и выход ионов из
клеток. Выход ионов К+ и Сахаров из клеток, по-видимому,
связан с повреждением мембранных систем их активного
транспорта. Поврежденные растения при переносе в теплое место
имеют вид ошпаренных, утрачивают тургор, листья быстро
буреют и засыхают. При оттаивании мороженых клубней картофеля,
корнеплодов кормовой и сахарной свеклы вода легко вытекает из
тканей. Важно отметить, что состояние переохлаждения (без
образования льда) растения переносят без вреда; при тех же
температурах, но с образованием льда в тканях растения гибнут.
Растения по-разному реагируют на образование льда в тканях:
клубни картофеля и георгина быстро погибают, капуста и лук
переносят лишь умеренное промораживание, рожь и пшеница
выдерживают на уровне узла кущения морозы до —15...—20 °С. У
устойчивых к морозу растений имеются защитные механизмы, в
основе которых лежат определенные физико-химические
изменения. Морозоустойчивые растения обладают
приспособлениями, уменьшающими обезвоживание клеток. При понижении
температуры у таких растений отмечаются повышение
содержания Сахаров и других веществ, защищающих ткани (криопротек-
торы), это прежде всего гидрофильные белки, моно- и олигоса-
хариды; снижение оводненности клеток; увеличение количества
полярных липидов и снижение насыщенности их жирнокислот-
ных остатков; увеличение количества защитных белков.
На степень морозоустойчивости растений большое влияние
оказывают сахара, регуляторы роста и другие вещества,
образующиеся в клетках. В зимующих растениях в цитоплазме
накапливаются сахара, а содержание крахмала снижается. Влияние саха-
ров на повышение морозоустойчивости растений многосторонне.
Накопление Сахаров предохраняет от замерзания большой объем
внутриклеточной воды, заметно уменьшает количество
образующегося льда.
Сахара защищают белковые соединения от коагуляции при
вымораживании; они образуют гидрофильные связи с белками
цитоплазмы, предохраняя их от возможной денатурации,
повышают осмотическое давление и снижают температуру замерзания
цитозоля. В результате накопления Сахаров содержание прочнос-
вязанной воды увеличивается, а свободной уменьшается. Особое
значение имеет защитное влияние Сахаров на белки,
сосредоточенные в поверхностных мембранах клетки. Сахара увеличивают
водоудерживающую способность коллоидов протоплазмы клеток;
связанная с коллоидами вода в виде гидратных оболочек
биополимеров при низких- температурах не замерзает и не
транспортируется, оставаясь в клетке.
Криопротекторами являются также молекулы гемицеллюлоз
507
(ксиланы, арабиноксиланы), выделяемые цитоплазмой в
клеточную стенку, обволакивающие растущие кристаллы льда, что
предотвращает образование крупных кристаллов, повреждающих
клетку. Так клетки защищаются как от внутриклеточного льда,
так и от чрезмерного обезвоживания. Значительное количество
защитных белков и модификации молекул липидов увеличивают
структурированность клеток. У большинства растений возрастает
синтез водорастворимых белков. Белковые вещества, частично
гидролизуясь, увеличивают содержание свободных аминокислот.
В тканях морозоустойчивых растений в конце лета и осенью
накапливаются в достаточном количестве запасные вещества
(прежде всего сахара), которые используются весной при
возобновлении роста, обеспечивая потребности растений в
строительном материале и энергии. Необходимо также учитывать
устойчивость растений к болезням, вероятность развития которых
увеличивается при повреждении тканей морозом.
Закаливание растений, его фазы. Морозоустойчивость — не
постоянное свойство растений. Она зависит от
физиологического состояния растений и условий внешней среды. Растения,
выращенные при относительно низких положительных
температурах, более устойчивы, чем выращенные при относительно
высоких осенних температурах. Свойство морозоустойчивости
формируется в процессе онтогенеза растения под влиянием
определенных условий среды в соответствии с генотипом растения,
связано с резким снижением темпов роста, переходом растения
в состояние покоя.
Жизненный цикл развития озимых, двуручек, двулетних и
многолетних растений контролируется сезонным ритмом
светового и температурного периодов. В отличие от яровых
однолетних растений они начинают готовиться к перенесению
неблагоприятных зимних условий с момента остановки роста и затем в
течение осени во время наступления пониженных температур.
Повышение морозоустойчивости растений тесно связано с
закаливанием — постепенной подготовкой растений к
воздействию низких зимних температур. Закаливание — это обратимая
физиологическая устойчивость к неблагоприятным воздействиям
среды.
Способностью к закаливанию обладают не все растения.
Растения южного происхождения не способны переносить морозы.
Способность к закаливанию у древесных и зимующих
травянистых растений северных широт, переживающих значительное
понижение температуры в зимний период, в период летней
вегетации отсутствует и проявляется только во время наступления
осенних пониженных температур (если растение к этому
времени прошло необходимый цикл развития). Процесс закалки
приурочен лишь к определенным этапам развития растений. Для
508
приобретения способности к закаливанию растения должны
закончить процессы роста.
Разные органы растений имеют неодинаковую способность к
закаливанию, например, листья листопадных деревьев (яблоня,
груша, вишня) не обладают способностью к закаливанию;
цветочные почки закаливаются хуже, чем листовые. У вегетирующих
растений легко вымерзают растущие и не закончившие рост
органы. Выносливость растений к низким температурам в этот
период незначительная.
Эффект закаливания может не проявиться, если по каким-
либо причинам (засуха, поздний посев, посадки и др.)
произошла задержка развития растений. Так, если в течение лета у
плодовых растений процессы роста из-за летней засухи не
успели закончиться, то зимой это может привести к гибели растений.
Дело в том, что засуха, приостанавливая рост летом, не
позволяет растениям завершить его к осени. Одновременно при закалке
должен произойти отток различных веществ из надземных
органов в подземные зимующие (корневые системы, корневища,
луковицы, клубни). По этой же причине закалку травянистых и
древесных растений ухудшает избыточное азотное питание,
удлиняющее период роста до поздней осени, в результате растения не
способны пройти процессы закаливания и гибнут даже при
небольших морозах.
Яровые злаки при озимом посеве по сравнению с озимыми
растут при более пониженных положительных температурах, в
осенний период почти не снижают темпов роста и не способны к
закаливанию. Большую роль в закаливании играют условия
внешней среды. Так, на озимых культурах убедительно показана
необходимость света для процесса закаливания. Сокращение фотопериода
служит для растений сигналом к прекращению роста и стимулом
для накопления ингибиторов в растениях. Вероятно, с этих
процессов начинается формирование морозоустойчивости у растений.
, Растения, выращенные при несоответствующем фотопериоде,
не успевают завершить летний рост и не способны к закаливанию.
Установлено, что длинный день способствует образованию в
листьях черной смородины фитогормонов стимуляторов роста, а
короткий — накоплению ингибиторов. В естественных условиях к
закаливанию способен лишь организм в целом, при обязательном
наличии корневой системы. По-видимому, в корнях
вырабатываются вещества, повышающие устойчивость растения к морозу.
Фазы закаливания. По И. И. Туманову (1979), процесс
закаливания растений требует определенного комплекса внешних
условий и проходит в две фазы, которым предшествуют замедление
роста и переход растений в состояние покоя. Прекращение роста
и переход в состояние покоя — необходимые условия
прохождения первой фазы закаливания. Однако само по себе оно лишь
немного повышает морозоустойчивость растения. У травянистых
509
растений переход в состояние покоя происходит в период первой
фазы закаливания. У древесных покой наступает в начале осени,
до прохождения первой фазы закаливания.
При переходе в состояние покоя изменяется баланс фитогормо-
нов: уменьшается содержание ауксина и гиббереллинов и
увеличивается содержание абсцизовой кислоты, которая, ослабляя и инги-
бируя ростовые процессы, обусловливает наступление периода
покоя. Поэтому обработка растений озимой пшеницы, люцерны и
других культур в этот период ингибиторами роста (например, хлор-
холинхлоридом — ССС или трииодбензойной кислотой) повышает
устойчивость растений к низким температурам.
Первая фаза закаливания проходит на свету и при низких
положительных температурах в ночное время (днем около 10 "С,
ночью около 2 °С), останавливающих рост, и умеренной
влажности почвы. Озимые злаки проходят первую фазу на свету при
среднесуточной температуре 0,5—2 °С за 6—9 дней, древесные —
за 30 дней. В эту фазу продолжается дальнейшее замедление и
даже происходит полная остановка ростовых процессов.
Свет в этой фазе необходим не только для фотосинтеза, но и
для поддержания ультраструктур клетки. В таких условиях за
счет фотосинтеза образуются сахара, а понижение температуры в
ночное время значительно снижает их расход на дыхание и
процессы роста. В результате в клетках растений накапливаются
сахароза, другие олигосахариды, растворимые белки и т. д., в
мембранах возрастает содержание ненасыщенных жирных
кислот, снижается точка замерзания цитоплазмы, отмечается
некоторое уменьшение внутриклеточной воды.
Благоприятные условия для прохождения первой фазы
закаливания озимых растений складываются при солнечной и
прохладной (дневная температура до 10 °С) погоде, способствующей
накоплению в тканях растений углеводов и других защитных
веществ. В естественных условиях оптимальный срок первой
фазы закаливания озимых злаков до двух недель. За это время
количество Сахаров в растениях возрастает до 70 % на сухую
массу или до 22 % на сырую массу, т. е. близко содержанию
Сахаров в корнеплодах лучших сортов сахарной свеклы.
Растения озимой пшеницы можно закалить и в темноте при
2 °С, если их корни или узлы кущения погрузить в раствор
сахарозы. Такие растения выдерживают морозы до —20 "С
(И. И. Туманов, 1979). Накапливающиеся в процессе
закаливания сахара локализуются в клеточном соке, цитоплазме,
клеточных органеллах, особенно в хлоропластах. При закаливании
растений высокоморозоустойчивого сорта озимой пшеницы при
температуре, близкой к 0 "С, количество Сахаров в хлоропластах
листьев увеличивалось в 2,5 раза, благодаря чему хлоропласты
продолжали функционировать. Повышение содержания Сахаров
в хлоропластах коррелирует с морозоустойчивостью растений.
510
В хлоропластах содержатся те же формы Сахаров, что и в
листьях: фруктоза, глюкоза, сахароза, олигосахара (Т. И.
Трунова, 1970). Имеются данные, что при накоплении Сахаров процесс
фотофосфорилирования продолжается даже при отрицательных
температурах. Более морозоустойчивые виды и сорта растений
лучше накапливают сахар именно при сочетании пониженной
температуры и умеренной влажности почвы. Дело в том, что в
первой фазе закаливания происходит уменьшение содержания
свободной воды, а излишняя влажность почвы при дождливой
осени затрудняет этот процесс, повышается вероятность в
последующем образования внутриклеточного льда и гибели растений.
Метаболические изменения, наблюдаемые во время первой
фазы, могут быть вызваны изменением гормонального и
энергетического балансов, что определяет синтез и активацию
специфических ферментов, свойства клеточных мембран закаленных
тканей. Накапливающаяся в тканях абсцизовая кислота
увеличивает проницаемость мембран для воды, водоотдачу клеток. К
концу первой фазы закаливания все зимующие растения
переходят в состояние покоя. Однако процессы закалки, перестройки
процессов обмена веществ продолжаются.
Вторая фаза закаливания не требует света и начинается сразу
же после первой фазы при температуре немного ниже 0 °С. Для
травянистых растений она может протекать и под снегом. Длится
она около двух недель при постепенном снижении температуры
до —10...—20 °С и ниже со скоростью 2—3 °С в сутки, что
приводит к частичной потере воды клетками, освобождению клеток
тканей от избыточного содержания воды или витрификации
(переходу воды в стеклообразное состояние). Явление
витрификации воды в растительных клетках наступает при резком
охлаждении (ниже —20 °С). Стеклообразная растительная ткань долго
сохраняет свою жизнеспособность.
При постепенном понижении температуры в межклеточниках
образуется лед и начинают функционировать механизмы,
предохраняющие подготовленные в первой фазе закаливания растения
от чрезмерного обезвоживания. Накопившиеся в первой фазе
закаливания сахара изменяют устойчивость биоколлоидов
цитоплазмы к низким температурам, возрастает относительное
количество коллоидно-связанной воды.
Вторая фаза обеспечивает отток из цитозоля клеток почти
всей воды, которая может замерзнуть при отрицательной
температуре. При критических температурах отток воды из клеток
значительно ухудшается, появляется много переохлажденной
воды, которая затем замерзает внутри протопласта и может
привести к гибели клеток. Следовательно, чем менее
морозоустойчиво растение, тем медленнее должна протекать вторая фаза
закаливания.
Действующими факторами второй фазы закаливания являют-
511
ся обезвоживание, вызывающее сближение молекул в цитозоле,
вязкость которого соответственно увеличивается; низкая
температура, уменьшающая тепловое движение молекул в протопласте.
В результате во второй фазе закаливания происходит
перестройка белков цитоплазмы, накапливаются низкомолекулярные
водорастворимые белки, более устойчивые к обезвоживанию,
синтезируются специфические белки. Содержание незамерзающей
(связанной) воды в тканях зимостойкой пшеницы почти в 3 раза
выше по сравнению с незимостойкой.
Перестройка цитоплазмы увеличивает проницаемость ее для
воды, способствует более быстрому оттоку воды в
межклеточники, что снижает опасность внутриклеточного льдообразования.
При обезвоживании, происходящем под влиянием
льдообразования, наблюдаются сближение и деформация белковых молекул,
связи между которыми могут рваться и не восстанавливаются,
что пагубно для клетки. Очевидно, при таких условиях
происходит быстрое смещение структурных частиц по отношению друг к
другу, что приводит к разрушению субмикроскопической
структуры протопласта (И. И. Туманов).
Цитоплазма закаленных растений более устойчива к
механическому давлению. Поэтому важно наличие у молекул белков
сульфгидрильных и других гидрофильных группировок, которые
способствуют удержанию воды, препятствуют слишком сильному
сближению молекул белка. Между содержанием
сульфгидрильных групп и морозоустойчивостью клеток растений установлена
положительная связь. Благодаря изменению свойств молекул
белков и межмолекулярных связей в процессе закаливания
постепенное обезвоживание приводит к переходу цитоплазмы из
состояния золя в гель.
Первая фаза закаливания повышает морозоустойчивость
растений с —5 до —12 "С, вторая увеличивает морозоустойчивость,
например, у пшеницы до —18...—20 °С, у ржи — до —20...—25 °С.
Растения, находящиеся в глубоком органическом покое,
отличаются способностью к закаливанию и выдерживают
промораживание до —195 °С. Так, черная смородина после наступления
состояния глубокого покоя и завершения первой фазы
закаливания переносила охлаждение до —253 °С (И. И. Туманов, 1979).
Не у всех растений процесс закаливания проходит в две фазы.
У древесных растений, имеющих в тканях достаточное
количество Сахаров, сразу же протекают процессы, свойственные второй
фазе закаливания. Однако не все растения способны к
закаливанию. Теплолюбивые растения (хлопчатник, рис, бахчевые
культуры) при длительном пребывании при температурах немного
выше 0. °С не только не становятся устойчивыми, но еще
сильнее повреждаются или даже погибают, так как в них
накапливаются ядовитые вещества, усиливающие губительное действие на
растения низких температур.
512
Обратимость процессов закаливания. 6 период прохождения
фаз закаливания формируется морозоустойчивость растений.
Морозоустойчивость представляет собой процесс, а не постоянное
свойство растений. Процесс закаливания обратим, при этом
морозоустойчивость растений снижается. Развитие процесса
закаливания в значительной степени зависит от условий его
протекания. Особенно заметное влияние на морозоустойчивость
оказывают условия закаливания растений в осенний период,
определяемые в первую очередь соотношением числа ясных дней
с пониженными положительными температурами ночью и числа
пасмурных, дождливых дней с относительно сближенными
высокими температурами днем и ночью. Чем это отношение выше,
тем лучше условия для закалки (табл. 27).
27. Критические температуры (°С) повреждения растений озимой
пшеницы при разных условиях закалки
Украина, Северный Кавказ,
Белоруссия
Центрально-Черноземная
зона, северные районы
Нечерноземной зоны
Поволжье, Западная Сибирь,
Северный Казахстан
Условия закалки
хорошие
-20
-22
-25
средние
-16
-18
-20
-14
-16
-18
У хорошо закаленных растений благодаря высокой
концентрации клеточного сока, пониженному содержанию воды
образуется значительно меньше кристаллов льда, причем не в клетке, а
в межклеточниках. Такие растения погибают только при очень
сильных морозах. При закаливании происходят обратимые
физиологические изменения. При неустойчивой осенней и зимней
погоде приобретенная в процессе закалки морозоустойчивость
снижается. Наблюдается тесная связь между
морозоустойчивостью растений и ростовыми процессами. Переход к состоянию
покоя всегда сопровождается повышением устойчивости, а от
состояния покоя к росту — снижением. В связи с этим
морозоустойчивость одного и того же вида растений довольно сильно
меняется в течение года: летом она минимальная (растения
могут погибнуть при температурах намного выше тех, которые
они выдерживают зимой), осенью увеличивается, а в конце зимы
и в начале весны опять снижается. Повышение температуры
весной сопровождается противоположными закаливанию физио-
лого-биохимическими. изменениями — происходит процесс раз-
закаливания растений. Весной растения часто гибнут даже от
небольших заморозков.
513
Способы повышения морозоустойчивости. Основа решения
этой задачи — селекция морозоустойчивых сортов растений,
хорошо адаптирующихся к климатическим условиям данного
региона. Следует еще раз отметить, что процесс закаливания
представляет собой временную адаптацию цитоплазмы,
определяющую степень устойчивости к последующим повреждениям
низкими температурами. Морозоустойчивость же формируется в
соответствии с генотипом в процессе онтогенеза под влиянием
определенных условий внешней среды и связана с наступлением
периода покоя, его глубиной и длительностью.
Агротехника конкретного вида растений (срок и способ
посева и др.) должна максимально способствовать формированию в
процессе закалки реализации возможной генетически
детерминированной морозоустойчивости сорта. В северных и
центральных районах России с неустойчивой весной и частым
возвращением весенних заморозков более устойчивы и урожайны сорта
озимых хлебов и плодовых многолетних культур с более
глубоким зимним покоем, с поздним сроком возобновления весенней
вегетации (ВВВ). Наоборот, в районах с устойчивым
нарастанием положительных температур весной преимущество имеют ра-
новегетирующие виды и сорта растений.
Морозоустойчивость сортов озимой пшеницы определяется не
только количеством Сахаров, накопленных с осени, но и их
экономным расходованием в течение зимы. У растений
зимостойких сортов озимой пшеницы в зимний период с
понижением температуры содержание моносахаридов (глюкоза, фруктоза)
увеличивается за счет расщепления сахарозы на глюкозу и
фруктозу, что снижает точку замерзания клеточного сока. Узел
кущения злаков, корневая шейка бобовых — своеобразная кладовая
энергетических ресурсов растения в зимний период и орган
побегообразования весной.
Морозоустойчивость растений озимой пшеницы
положительно коррелирует с содержанием Сахаров в узлах кущения. В
хороших посевах озимой пшеницы в листьях в декабре
содержание растворимых углеводов достигает 18—24 % (на сухое
вещество), а в узлах кущения — 39—42 %. В опытах более
морозоустойчивый сорт озимой пшеницы Мироновская 808
расходовал за зиму всего 10 % углеводов, а менее устойчивый
сорт Безостая 1—23 % углеводов. Растения, закладывающие
узлы кущения глубоко (3—4 см), как правило, более
морозоустойчивы, чем те, у которых узел кущения находится близко
к поверхности (1—2 см). Глубина залегания узла кущения и
мощность его развития зависят от качества семян, способа
посева, обработки почвы.
На морозоустойчивость существенное влияние оказывают
условия почвенного питания, особенно в осенний период.
Устойчивость растений к морозу возрастает на постоянно известкуе-
514
мых почвах при внесении под посев озимых калийно-фосфорных
удобрений, тогда как избыточные азотные удобрения,
способствуя процессам роста, делают растения озимых более
чувствительными к морозам. На морозоустойчивость, как и на
холодостойкость растений, положительное влияние оказывают
микроэлементы (кобальт, цинк, молибден, медь, ванадий и др.).
Например, цинк повышает содержание связанной воды,
усиливает накопление Сахаров, молибден способствует увеличению
содержания общего и белкового азота.
Методы изучения морозоустойчивости растений. И. И.
Тумановым с сотрудниками предложены лабораторные методы
ускоренного определения морозоустойчивости различных культурных
растений. Испытуемые растения после закаливания подвергают
воздействию критических низких температур в холодильных
камерах, что дает возможность выявить невымерзающие растения.
Такая ускоренная оценка морозоустойчивости имеет большое
преимущество перед обычным полевым способом оценки, так
как последний требует много времени (иногда нескольких лет).
Другие надежные и удобные в исполнении лабораторные
методы определения морозоустойчивости основаны на измерении
вязкости цитоплазмы в клетках тканей исследуемых органов,
определении электропроводности и др. Определение
морозоустойчивости культурных растений мирового ассортимента
показало, что страны СНГ обладают самыми устойчивыми их
формами. Наиболее устойчивые сорта озимой пшеницы выведены
опытными учреждениями юго-востока и северо-востока России,
где природная обстановка благоприятствует выведению
морозоустойчивых форм.
8.5. ЗИМОСТОЙКОСТЬ РАСТЕНИЙ
Зимостойкость как устойчивость к комплексу неблагоприятных
факторов перезимовки. Непосредственное действие мороза на
клетки — не единственная опасность, угрожающая многолетним
травянистым и древесным культурам, озимым растениям в
течение зимы. Помимо прямого действия мороза растения
подвергаются еще ряду неблагоприятных факторов. В течение зимы
температура может существенно колебаться. Морозы нередко
сменяются кратковременными и длительными оттепелями. В зимнее
время нередки снежные бури, а в бесснежные зимы в более
южных районах страны — и суховеи. Все это истощает растения,
которые после перезимовки выходят сильно ослабленными и в
последующем могут погибнуть.
Особенно многочисленные неблагоприятные воздействия
испытывают травянистые многолетние и однолетние растения. На
территории России в неблагоприятные годы гибель посевов
озимых зерновых достигает 30—60 %. Погибают не только ози-
515
мые хлеба, но и многолетние травы, плодовые и ягодные
многолетние насаждения. Кроме низких температур озимые
растения повреждаются и гибнут от ряда других
неблагоприятных факторов в зимнее время и ранней весной: выпревания,
вымокания, ледяной корки, выпирания, повреждения от зимней
засухи.
Выпревание, вымокание, гибель под ледяной коркой,
выпирание, повреждение от зимней засухи. Выпревание. Среди
перечисленных невзгод первое место занимает выпревание
растений. Гибель растений от выпревания наблюдается
преимущественно в теплые зимы с большим снеговым покровом, который
лежит 2—3 мес, особенно если снег выпадает на мокрую и талую
землю. Исследования И. И. Туманова (1932) показали, что
причина гибели озимых от выпревания — истощение растений.
Находясь под снегом при температуре около О "С в сильно
увлажненной среде, почти полной темноте, т. е. в условиях, при
которых процесс дыхания идет достаточно интенсивно, а фотосинтез
исключен, растения постепенно расходуют сахара и другие
запасы питательных веществ, накопленные в период прохождения
первой фазы закаливания, и погибают от истощения
(содержание Сахаров в тканях уменьшается с 20 до 2—4 %) и весенних
заморозков. Такие растения весной легко повреждаются снежной
плесенью, что также приводит к их гибели.
Н. А. Максимов (1958) отмечал, что при температуре
немного выше 0 °С растения скорее проходят яровизацию, чем
при температуре ниже 0 °С, но вместе с тем теряют свою
устойчивость к морозу и затем быстро погибают при сходе
снегового покрова и весенних заморозков. Устойчивость сортов
озимых против выпревания в районах с очень глубоким
снеговым покровом обусловливается прежде всего накоплением
достаточного запаса растворимых углеводов, а также возможно
меньшей интенсивностью дыхательного процесса при
пониженных температурах.
Вымокание. Вымокание проявляется преимущественно
весной в пониженных местах в период таяния снега, реже во
время длительных оттепелей, когда на поверхности почвы
накапливается талая вода, которая не впитывается в замершую почву
и может затопить растения. В этом случае причиной гибели
растений служит резкий недостаток кислорода (анаэробные
условия — гипоксия). У растений, оказавшихся под слоем воды,
нормальное дыхание прекращается из-за недостатка кислорода в
воде и почве. Отсутствие кислорода усиливает анаэробное
дыхание растений, в результате чего могут образоваться токсичные
вещества и растения погибают от истощения и прямого
отравления организма.
В окружающей растения снеговой воде содержится основной
продукт анаэробного дыхания — спирт. В условиях избытка
516
I
I
влаги в почве образуются вредные для растений закисные
соединения, ряд элементов минерального питания переходит в
неусвояемое состояние. В условиях анаэробиозиса у озимых
нарушаются ультраструктура и связь пигментов с белково-липидным
комплексом мембран хлоропластов, снижаются содержание
хлорофилла и активность нитратредуктазы. В растениях
накапливаются продукты анаэробного превращения углеводов (пируват,
лактат, этанол, ацетальдегид), увеличивается содержание
свободного пролина, накопление которого рассматривается как один из
способов адаптации растений к гипоксии.
Озимая пшеница более устойчива к вымоканию (гипоксии),
чем озимая рожь. У более устойчивых к гипоксии сортов озимой
пшеницы ткани корневой системы имеют более развитые
межклеточники и воздушные полости, при недостаточной аэрации
почвы образуются мелкие дополнительные корни у самой
поверхности (на поверхности) почвы. Растения, выходящие из-под
снега весной, при низких температурах воздуха и воды
относительно устойчивы к затоплению.
С повышением температуры устойчивость резко снижается.
Так, для многих травянистых растений повышение температуры
воды до 10 °С в течение суток приводит к снижению урожая на
одну треть, за 2 сут — примерно наполовину, а при сохранении
повышенной температуры в течение 8 сут урожай практически
равен нулю.
Гибель под ледяной коркой. Ледяная корка
образуется на полях в районах, где частые оттепели сменяются
сильными морозами. Действие вымокания в этом случае может
усугубляться. При этом происходит образование висячих или
притертых (контактных) ледяных корок. Менее опасны висячие
корки, так как они образуются сверху почвы и практически не
соприкасаются с растениями; их легко разрушить катком.
При образовании же сплошной ледяной контактной корки
растения полностью вмерзают в лед, что ведет к их гибели, так
как и без того ослабленные от вымокания растения
подвергаются очень сильному механическому давлению. Причина гибели
состоит в том, что растения утрачивают морозоустойчивость из-
за прекращения аэрации, потому что лед практически
непроницаем для газов, а также вследствие усиления влияния низких
температур. Растения, как и в случае вымокания, переходят на
анаэробное дыхание, при котором образуются спирт и другие
токсичные вещества.
Если ледяная корка нетолстая и вмерзают только узлы
кущения, а листья находятся на воздухе, то такие растения выживают,
поскольку воздух проникает по межклеточникам из листьев в
корневую систему. Л-едяная корка не образуется, если после
оттепели выпадает снег, не позволяющий морозу глубоко
проникнуть в почву, тем самым предотвращая его повреждающее
517
воздействие на растения. Ледяная корка является причиной
гибели озимых на обширных площадях, особенно в Поволжье и на
юге Украины.
Выпирание. Повреждение и гибель растений от
выпирания определяются разрывами корневой системы. Выпирание
растений наблюдается, если осенью морозы наступают при
отсутствии снежного покрова или если в поверхностном слое почвы мало
воды (при осенней засухе), а также при оттепелях, если снеговая
вода успеет всосаться в почву. В этих случаях замерзание воды
начинается не с поверхности почвы, а на некоторой глубине (где
есть влага). Образующаяся на глубине прослойка льда постепенно
утолщается за счет продолжающегося поступления воды по
почвенным капиллярам и поднимает (выпирает) верхние слои почвы
вместе с растениями, что приводит к обрыву корней растений,
проникших на значительную глубину.
Весной после оттаивания почвы растения остаются лежать на
поверхности и погибают от иссушения, если не происходит их
вторичное укоренение. Своевременное прикатывание растений
(почвы) стимулирует образование у них новых корней.
Устойчивость растений к выпиранию определяется способностью корней
к растяжению. На этом основан и метод отбора растений на
устойчивость к выпиранию в селекционном процессе.
Повреждения от зимней засухи. Устойчивый
снеговой покров предохраняет озимые злаки от зимнего
высыхания. Однако они в условиях бесснежной или малоснежной
зимы, как и плодовые деревья и кустарники, в ряде районов
России часто подвергаются опасности чрезмерного иссушения
постоянными и сильными ветрами, особенно в конце зимы
при значительном нагреве солнцем. Дело в том, что водный
баланс растений складывается зимой крайне неблагоприятно,
так как поступление воды из замерзшей почвы практически
прекращается.
Для уменьшения испарения воды, неблагоприятного действия
зимней засухи плодовые древесные породы образуют на ветвях
мощный слой пробки, сбрасывают на зиму листья. При
длительном осеннем бесснежье наблюдается привядание озимых злаков,
которое скорее полезно, так как способствует повышению
морозоустойчивости озимых, что важно при отсутствии снегового
покрова. Однако ранняя осенняя засуха, препятствуя кущению и
укоренению озимых, их закалке, причиняет растениям
значительный вред. Весной иссушение надземных частей
перезимовавших растений за счет солнечного прогрева и ветра усугубляется
недостаточным притоком воды из почвы, которая в это время
еще недостаточно прогрета.
Способы повышения зимостойкости растений.
Зимостойкость — это способность растений противостоять целому
комплексу неблагоприятных факторов внешней среды в зимнее
518
время. Основные способы ее повышения — подбор и селекция
видов и сортов сельскохозяйственных культур, наиболее приспо^
собленных к комплексу неблагоприятных условий перезимовки
конкретного региона. Причины зимних повреждений и даже
полной гибели зимующих растений разнообразны и не
обусловливаются только действием мороза.
Сорта, проявившие себя в одних районах как наиболее
зимостойкие, могут оказаться значительно менее устойчивыми в
других. Наиболее полное представление о зимостойкости сорта
озимых дают полевые испытания, в результате которых растения
подвергаются комплексному воздействию сочетания
неблагоприятных факторов и преобладающему из них, например, для
Поволжья — низкие температуры при недостаточном снеговом
покрове, для Белоруссии или северо-запада Украины — это прежде
всего выпревание. Предпочтение отдают сортам, проявившим з
данном регионе высокую устойчивость к преобладающему
повреждающему фактору.
Озимые злаки наиболее устойчивы в начале яровизации, по
окончании ее устойчивость их снижается. Высокая
зимостойкость лучших сортов озимых в значительной степени
объясняется большей продолжительностью яровизации, которую они
заканчивают уже зимой при отрицательных температурах.
Лаборатория физиологии растений МПО «Подмосковье»
РАСХН успешно использует в селекционном процессе оценку
зимостойкости озимых зерновых культур по комплексу
физиологических показателей (рис. 145).
Меры предупреждения гибели озимых хлебов. Для повышения
устойчивости к морозу и другим неблагоприятным факторам,
особенно слабоустойчивых видов и сортов, необходимо
предварительно провести определенные агроприемы. Повышают
устойчивость растений к неблагоприятным факторам перезимовки
правильный выбор сроков посева, поддержание хорошей
структуры почвы для создания благоприятного водного, воздушного и
теплового режимов, снегозадержание, создание оптимальных
условий питания. К таким приемам относится осеннее
известкование почв, поскольку степень повреждения растений коррелирует
со снижением величины рН в клетках тканей. Своевременное
известкование почв с одновременным внесением удобрений
понижает кислотность среды и повышает зимостойкость растений
за счет улучшения ионного баланса в органах растений.
Особенно важное значение имеет внесение фосфорно-калийных
удобрений.
Методы определения жизнеспособности сельскохозяйственных
культур в зимний и ранневесенний периоды. Для определения
зимостойкости растений используют различные методы и прежде
всего метод диагностики состояния зимующих растений в
монолитах. К лабораторным методам относятся определение зимо-
519
ДИНАМИКА СОДЕРЖАНИЯ
УГЛЕВОДОВ
ПИГМЕНТОВ
СОДЕРЖАНИЕ•
ЭНДОГЕННЫХ
РЕГУЛЯТОРОВ
РОСТА ОСЕНЬЮ
ИНТЕНСИВНОСТЬ'
ДЫХАНИЯ ПОСЛЕ
ПРЕКРАЩЕНИЯ
ВЕГЕТАЦИИ
\
ЗИМОСТОЙКОСТЬ
СТЕПЕНЬ
ПОВРЕЖДЕНИЯ
/ \
ЛИСТЬЕВ КОРНЕВОЙ
ПО ЯРУСАМ СИСТЕМЫ
ИНТЕНСИВНОСТЬ РОСТА
\
КОНУСОВ
НАРАСТАНИЯ ПРИ
ПОВЫШЕННОЙ
ТЕМПЕРАТУРЕ
ОСЕНЬЮ
ЛИСТЬЕВ
ВЕСНОЙ
ВО II ДЕКАДЕ
ПОСЛЕ
ВОЗОБНОВЛЕНИЯ
ВЕГЕТАЦИИ
ПЕРВИЧНЫХ
КОРНЕЙ ПРИ
ПОНИЖЕННОЙ
ТЕМПЕРАТУРЕ
ФОРМИРОВАНИЯ
ВТОРИЧНЫХ
КОРНЕЙ
ВЕСНОЙ ИЛИ
ПОСЛЕ
ДЕЙСТВИЯ
МОРОЗА
Рис. 145. Комплекс физиологических показателей, тесно связанных с
зимостойкостью озимой пшеницы в условиях центральных районов Нечерноземной зоны
(по М. И. Рыбаковой, 1992)
стойкости растений по реакции окрашивания цитоплазмы
клеток конуса нарастания: с увеличением степени повреждения
растения возрастает сродство цитоплазмы к красителям.
8.6. ВЛИЯНИЕ НА РАСТЕНИЯ ИЗБЫТКА ВЛАГИ
Избыток влаги в почве крайне вреден для большинства
сельскохозяйственных культур. Постоянно он наблюдается на
заболоченных почвах и временно пониженных местах пашни или
луга, где в результате весеннего таяния снега или при затяжных
дождях отмечается застаивание воды в виде долго непросыхаю-
щих луж. При нарушении поливных норм на орошаемых полях
также происходит повреждение растений от вымокания. Вред от
избытка воды в почве заключается в том, что доступ воздуха к
корням растений затрудняется (гипоксия) или совсем
прекращается (аноксия).
Кроме того, при длительном избытке воды в почве
прекращаются нормальные аэробные окислительные микробиологические
520
процессы и развиваются анаэробные процессы,
преимущественно маслянокислое и другие виды брожения. В результате в такой
почве накапливаются диоксид углерода, органические кислоты, а
также восстановленные соединения — органические и
неорганические (соли, закиси железа и др.), многие из которых ядовиты
для корней растений. Большинство культурных растений может
развиваться на заболоченных почвах только после их
мелиорации, обеспечивающей отвод поверхностных и снижение уровня
подпочвенных вод, нормальное поступление кислорода в корне-
обитаемый слой почвы.
Отношение культурных растений к избыточному увлажнению
почвы изучено недостаточно. Как правило, длительное
застаивание воды приводит к гибели культурных растений, изреживанию
посевов. Но и непродолжительное застаивание воды, сильно
повреждая и задерживая рост возделываемых растений,
способствует развитию сорной растительности на вымочках.
Зерна пшеницы, ячменя и других культур, попав в
переувлажненную почву, плохо и долго всходят, что связано с недостатком
кислорода для их прорастания. Такие растения задерживаются в
росте, снижают продуктивность. От временного избыточного
увлажнения (затопления) растения страдают и в последующие
периоды онтогенеза, особенно в критический период — выход в
трубку — колошение для колосовых, выметывание для
метельчатых злаков.
Факторы устойчивости против затопления. Однако многие
виды растений (рис и другие влаголюбивые растения)
приспособились к произрастанию на заболоченных или затопляемых
почвах, да и многие культурные растения выдерживают достаточно
длительное переувлажнение почвы. Устойчивость к
переувлажнению (к гипо- и аноксии) определяется у растений комплексом
как анатомо-морфологических, так и физиолого-биохимических
адаптации, обеспечивающих достаточный уровень обмена
веществ. У риса и болотных растений сильно развиты
межклеточники и целые воздухоносные полости (аэренхима) в корнях,
находящихся в сообщении с такими же полостями стеблей и
листьев, чем и обеспечивается сохранение достаточно высокого
уровня кислорода благодаря его транспорту из надземных частей
в корни.
По мнению Н. А. Максимова (1958), кислород,
образующийся в процессе фотосинтеза, расширяясь под влиянием нагрева
листьев солнечными лучами, накачивается по этим полостям в
корни и поддерживает их дыхание. При переувлажнении почвы
происходит образование дополнительных поверхностных корней
у хлебных злаков, кукурузы и других сельскохозяйственных
растений. Физиолого-биохимические (метаболические) адаптации к
существованию при пониженной концентрации кислорода
связаны главным образом с процессом дыхания.
521
У одних видов растений наблюдается снижение общей
интенсивности дыхания и использования дыхательных субстратов, у
других — для поддержания синтеза АТФ происходит перестройка
в путях дыхания: увеличение активности пентозофосфатного
пути дыхания с окислением образующихся в ходе его НАДФН.
Возрастает роль гликолитического пути катаболизма глюкозы и
связанной с ним системы детоксикации продуктов анаэробного
распада (удаление и включение их в обмен), которая
способствует повышению активности гликолиза.
При отсутствии в анаэробных условиях кислорода
приспособительными оказываются процессы, при которых электроны
переносятся на другие акцепторы (нитраты; соединения,
имеющие двойные связи, — жирные кислоты, каротиноиды), что
сохраняет жизнедеятельность растений в условиях гипоксии и
аноксии. На полях, где наблюдается временное переувлажнение
почвы, высевают более устойчивые к гипоксии виды и сорта
сельскохозяйственных растений. В этих условиях продлевают
жизнедеятельность растений, способных к нитратному дыханию,
подкормки нитратами. Устойчивость хлебных злаков к избытку
воды в почве повышают обработка растений и замачивание
семян в растворах хлорхолинхлорида (ССС); семян в растворах
никотиновой кислоты (0,001—0,0001 %) или сульфата марганца
(0,1 %). Обработки способствуют развитию генеративных
органов, формированию зерновок в колосьях хлебных злаков.
8.7. ПОЛЕГАНИЕ РАСТЕНИЙ И ЕГО ПРИЧИНЫ
Полегание причиняет значительный ущерб урожайности
сельскохозяйственных культур (особенно зерновых). В отдельные
годы потери урожая зерна озимой пшеницы доходят до 50 %.
Полегание наблюдается при нарушении нормального
соотношения между массой надземной части растения и прочностью
нижней части его стебля. Это явление связано с недостаточным
утолщением соломины и слабым развитием в ней механических
тканей.
Различают стеблевое полегание, при котором происходит
перегиб или перелом стебля, и прикорневое, когда узловые корни
не удерживают соломину (стебель) в вертикальном положении и
она полегает (наклоняется) без перегиба. Полегшие растения
могут подниматься. У злаков это происходит благодаря
разрастанию и изгибу нижней стороны узлов полегшего стебля под
влиянием геотропизма и фототропизма, стимулирующих активность
интеркалярной меристемы. Однако во всех случаях урожай и его
качество при полегании посевов снижаются, возрастают потери
зерна при комбайновой уборке, затрудняемой при лежащих и
перепутанных стеблях.
522
В полевых условиях полеганию способствуют следующие
факторы.
Избыточное увлажнение почвы и воздуха
в дождливые годы и при орошении. При этом
растения чрезмерно кустятся, развивается мощная листовая
поверхность, что приводит к взаимному затенению, вытягиванию и
этиоляции стебля и как результат — к снижению фотосинтеза.
Уменьшение количества углеводов тормозит накопление в
клеточных оболочках целлюлозы и гемицеллюлозы и процессы их
лигнификации, обеспечивающие образование и прочность
механических тканей стебля. Корни растений в размокшей почве не
становятся должной опорой стеблю.
Загущенные посевы. В загущенных посевах, так же
как при увлажнении, происходят вытягивание стебля и
недоразвитие механических тканей, что увеличивает вероятность
полегания растений.
Избыточное азотное питание при
недостатке калийных и фосфорных уд обре ни й.
Высокие нормы азотных удобрений вызывают чрезмерное
нарастание вегетативной массы, увеличивают размер и массу колоса.
Стебель не выдерживает этой нагрузки и полегает.
Сорт растений. Длинностебельные растения склонны к
полеганию в большей степени, чем короткостебельные.
Выведение устойчивых к полеганию сортов — важная задача
селекционеров. У ржи и некоторых других злаков при наливе зерна
вещества клеточных стенок стеблей (иногда до 20 %) могут
подвергаться ферментативному расщеплению и использоваться на
формирование семян (А. М. Палеев, 1957). Это ослабляет
прочность стеблей и способствует их полеганию.
Сильный ветер с дождем. Часто являются
непосредственным толчком, вызывающим полегание растений. При
этом утяжеленные водой колос и листья образуют изгиб и даже
переламывание соломины злаков у ее основания. При орошении
полегание вызывают чрезмерно высокие поливные нормы и
поздние поливы дождеванием, когда растения имеют тяжелый
колос.
Способы предупреждения полегания. Необходимо высевать
устойчивые к полеганию сорта сельскохозяйственных культур,
имеющие прочный стебель. В каждом конкретном случае нужно
использовать соответствующие агротехнические приемы:
правильно обрабатывать почву, выдерживать глубину посева семян,
четко соблюдать нормы высева, густоты стояния растений в
посеве, рекомендованные для сорта в регионе. Важными
факторами являются научная организация поливов с использованием
физиологических признаков потребности в воде, грамотно
сбалансированное соотношение азотно-фосфорно-калийных
удобрений при внесении их в почву.
523
Для предупреждения полегания посевов
сельскохозяйственных культур применяют ретарданты, которые замедляют рост
растений, вызывают укорачивание и утолщение стебля на 20—
30 %, повышение его эластичности, увеличение ширины
листовых пластинок, усиление роста корней. К наиболее
распространенным ретардантам относятся ССС и его аналоги. Попадая в
зону интенсивного роста и деления клеток, ССС способствует
накоплению целлюлозы, гемицеллюлозы и лигнина, утолщению
клеточной оболочки, клетки становятся менее вытянутыми,
стебель утолщается. В листовых пластинках увеличивается
содержание хлорофилла и каротиноидов, повышается интенсивность
фотосинтеза, происходит Перераспределение веществ в растении.
Посевы пшеницы опрыскивают хлорхолинхлоридом (2—4 кг
препарата на 1 га) в начале выхода в трубку. На ячмене
эффективны смеси ССС с кампозаном.
8.8. ЖАРОУСТОЙЧИВОСТЬ РАСТЕНИЙ
Жароустойчивость (жаровыносливость) — способность
растений переносить действие высоких температур, перегрев. Это
генетически обусловленный признак. Виды и сорта
сельскохозяйственных растений различаются по выносливости к высоким
температурам.
По жароустойчивости выделяют три группы растений.
Жаростойкие — термофильные синезеленые водоросли и
бактерии горячих минеральных источников, способные переносить
повышение температуры до 75—100 °С. Жароустойчивость
термофильных микроорганизмов определяется высоким уровнем
метаболизма, повышенным содержанием РНК в клетках,
устойчивостью белка цитоплазмы к тепловой коагуляции.
Жаровыносливые — растения пустынь и сухих мест обитания
(суккуленты, некоторые кактусы, представители семейства Толс-
тянковые), выдерживающие нагревание солнечными лучами до
50—65 °С. Жароустойчивость суккулентов во многом
определяется повышенными вязкостью цитоплазмы и содержанием
связанной воды в клетках, пониженным обменом веществ.
Нежаростойкие — мезофитные и водные растения. Мезофиты
открытых мест переносят кратковременное действие температур
40—47 "С, затененных мест — около 40—42 °С, водные растения
выдерживают повышение температуры до 38—42 °С. Из
сельскохозяйственных наиболее жаровыносливы теплолюбивые растения
южных широт (сорго, рис, хлопчатник, клещевина и др.).
Многие мезофиты переносят высокую температуру воздуха и
избегают перегрева благодаря интенсивной транспирации,
снижающей температуру листьев. Более жаростойкие мезофиты от-
524
личаются повышенной вязкостью цитоплазмы и усиленным
синтезом жаростойких белков-ферментов.
Изменения обмена веществ, роста и развития растений при
действии максимальных температур. Жароустойчивость во
многом зависит от продолжительности действия высоких
температур и их абсолютного значения. Большинство
сельскохозяйственных растений начинает страдать при повышении температуры
до 35—40 "С. При этих и более высоких температурах
нормальные физиологические функции растения угнетаются, а при
температуре около 50 °С происходят свертывание протоплазмы и
отмирание клеток.
Превышение оптимального температурного уровня приводит
к частичной или глобальной денатурации белков. Это вызывает
разрушение белково-липидных комплексов плазмаллемы и
других клеточных мембран, приводит к потере осмотических
свойств клетки. В результате наблюдаются дезорганизация
многих функций клеток, снижение скорости различных
физиологических процессов. Так, при температуре 20 °С все клетки
проходят процесс митотического деления, при 38 "С митоз отмечается
в каждой седьмой клетке, а повышение температуры до 42 "С
снижает число делящихся клеток в 500 раз (одна делящаяся
клетка на 513 неделящихся).
Иллюстрацией влияния повышения температуры на белково-
липидные комплексы могут служить следующие данные: при
температуре 22 °С лизис ядер не наблюдается совсем, при
повышении температуры до 38 "С он отмечается у 5,3 %
исследованных клеток, а при температуре 52 °С практически все ядра
лизированы. При максимальных температурах расход
органических веществ на дыхание превышает его синтез, растение беднеет
углеводами, а затем начинает голодать (Н. А. Максимов, 1952).
Особенно резко это выражено у растений более умеренного
климата (пшеница, картофель, многие огородные культуры). Общее
ослабление повышает их восприимчивость к грибным
заболеваниям. Фотосинтез более чувствителен к действию высоких
температур, чем дыхание. При субоптимальных температурах
растения прекращают рост и фотоассимиляцию, что обусловлено
нарушением деятельности ферментов, повышением дыхательного
газообмена, снижением его энергетической эффективности,
усилением гидролиза полимеров, в частности белка, отравлением
протоплазмы вредными для растения продуктами распада
(аммиак и др.). У жаростойких растений в этих условиях увеличивается
содержание органических кислот, связывающих избыточный
аммиак.
При действии высоких температур в клетках растений
индуцируется синтез стрессовых белков (белков теплового шока).
Растения сухих, светлых мест обитания более стойки к жаре, чем
тенелюбивые. Кратковременное влияние очень высоких темпера-
525
тур (43—45 °С) может быть таким же губительным, как и
продолжительное воздействие более низких, но превышающих
оптимальные значения температур. Способом защиты от перегрева
может служить усиленная транспирация, обеспечиваемая
мощной корневой системой.
В результате транспирации температура растений снижается
иногда на 10—15 "С. Завядающие растения, с закрытыми
устьицами, легче погибают от перегрева, чем достаточно снабженные
водой. Растения сухую жару переносят легче, чем влажную, так
как во время жары при высокой влажности воздуха регуляция
температуры листьев за счет транспирации ограничена.
Повышение температуры особенно опасно при сильной
инсоляции. Для уменьшения интенсивности воздействия солнечного
света растения располагают листья вертикально, параллельно его
лучам (эректоидно). При этом хлоропласты активно
перемещаются в клетках мезофилла листа, как бы уходя от избыточной
инсоляции. Растения выработали систему морфологических и
физиологических приспособлений, защищающих их от тепловых
повреждений: светлую окраску поверхности, отражающую
инсоляцию; складывание и скручивание листьев; опушения или
чешуйки, защищающие от перегрева глубжележащие ткани; тонкие
слои пробковой ткани, предохраняющие флоэму и камбий;
большую толщину кутикулярного слоя; высокое содержание
углеводов и малое — воды в цитоплазме и др.
В полевых условиях особенно губительно совместное действие
высоких температур и обезвоживания. При длительном и
глубоком завядании угнетаются не только фотосинтез, но и дыхание,
что вызывает нарушение всех основных физиологических
функций растения. Жароустойчивость в значительной степени
определяется фазой роста и развития растений. Наибольший вред
высокие температуры причиняют растениям на ранних этапах их
развития, так как молодые, активно растущие ткани менее
устойчивы, чем старые и «покоящиеся». Устойчивость к жаре у
различных органов растений неодинаковая: менее устойчивы
подземные органы, более — побеги и почки.
На тепловой стресс растения очень быстро реагируют
индуктивной адаптацией. К воздействию высоких температур они
могут подготовиться за несколько часов. Так, в жаркие дни
устойчивость растений к высоким температурам после полудня
выше, чем утром. Обычно эта устойчивость временная, она не
закрепляется и довольно быстро исчезает, если становится
прохладно. Обратимость теплового воздействия может составлять от
нескольких часов до 20 дней. В период образования
генеративных органов жаростойкость однолетних и двулетних растений
снижается.
Вредное действие повышенных температур — одна из
важнейших причин значительного снижения урожаев ранних яровых
526
при запаздывании с их посевом. Например, у пшеницы в фазе
кущения в конусе нарастания идет дифференциация колосков.
Высокая температура почвы и воздуха приводит к повреждению
конуса нарастания, ускоряет процесс и сокращает время
прохождения IV—V этапов, в результате уменьшается число колосков в
колосе, а также число цветков в колоске, что приводит к
снижению урожая.
При совместном действии жары и сухости почвы, что
характерно для районов Юго-Востока, в этот период в зачаточном
колосе оказываются поврежденными все закладывающиеся
цветки, в результате после колошения колос очень быстро засыхает и
белеет — явление пустоколосицы или белоколосицы. Для многих
растений жара особенно опасна в период цветения, так как
вызывает стерильность цветков и опадение завязей. Так,
действие высокой температуры и низкой влажности в период, когда в
пыльниках пшеницы образуется пыльца, а затем идет процесс
оплодотворения, приводит к череззернице (не полностью озер-
ненному колосу) и пустоколосью. Высокая температура в период
молочной зрелости яровой пшеницы вызывает щуплость зерна —
«запал».
Диагностика жароустойчивости. Физиологическая стойкость
растений к перегреву обусловливается особыми
физико-химическими свойствами протоплазмы и способностью обезвреживать
накапливающиеся в тканях аммиак и другие вредные продукты
обмена. Жароустойчивость определяют помещением
исследуемого растительного объекта на определенное время в камеру с
высокой температурой и влажностью воздуха, исключающей
охлаждение объекта благодаря транспирации. Об устойчивости
судят по повреждению клеток, тканей, органов и т. д.
По методу Ф. Ф. Мацкова листья исследуемых растений
опускают последовательно на 30 мин в подогретую воду при
температурах 40, 45, 50 ... до 80 "С, а затем-в холодную воду на
10 мин, каждый раз отбирают пробы и после холодной воды
переносят в 0,2 н. НС1. Отмершие (поврежденные) участки
листьев и мертвые листья буреют. Сравнительную жароустойчивость
растений определяют также по изменению проницаемости
протоплазмы и другими методами.
Способы повышения жароустойчивости растений и избежания
перегрева. Лабораторная инфильтрация в ткани листьев
растворов Сахаров (глюкоза, галактоза, сахароза, маннит, лактоза,
мальтоза, раффиноза) значительно повышает устойчивость к
перегреву. Возможно, что сахара «консервируют» структуру
митохондрий, которая становится менее чувствительной к тепловому
стрессу, и этим сохраняют энергетическую функцию
митохондрий (Ю. Г. Молотковский, 1961).
П. А. Генкель (1982) предложил для повышения
жароустойчивости сахарной свеклы, моркови, томата, дыни обрабатывать их
527
семена перед посевом 0,25%-ным раствором хлорида кальция
(СаС12) в течение 20 ч. Однако эффективность подобной
обработки семян нестабильна. Для повышения жароустойчивости
растений рекомендуют некорневую обработку посевов 0,05%-ным
раствором солей цинка. Хороший эффект дают освежительные
поливы дождеванием во второй половине дня (20—30 м3 воды
на 1 га).
Для древесных растений (кустарников и плодовых деревьев)
рекомендуют побелку: солнечный свет отражается от стволов, и
они предохраняются от перегрева. Из мер, направленных на
борьбу с повышенной температурой, можно отметить посадку
полезащитных полос и полив. Оптимальная температура клубне-
образования у картофеля около 17 °С. При культуре картофеля в
южных районах России и государств СНГ высокие температуры
почвы во время роста и созревания клубней вызывают израста-
ние, вырождение клубней, ускоряя прохождение в них
изменений, приводящих к их одряхлению, снижению урожайности,
потере клубнями сортовых и семенных качеств (неправильная
форма клубней, несвойственная сорту окраска и др.).
Использование вырожденных клубней для посадки приводит к снижению
урожая. Для борьбы с вырождением картофеля в южных районах
используют летнюю (июльскую) посадку его на семена, когда
развитие клубней совпадает с уже более холодной погодой
сентября.
8.9. ЗАСУХОУСТОЙЧИВОСТЬ РАСТЕНИЙ
Обычным явлением для многих регионов России и государств
СНГ стали засухи. Засуха — это длительный бездождливый
период, сопровождаемый снижением относительной влажности
воздуха, влажности почвы и повышением температуры, когда не
обеспечиваются нормальные потребности растений в воде. На
территории России имеются регионы неустойчивого увлажнения
с годовым количеством осадков 250—500 мм и засушливые, с
количеством осадков менее 250 мм в год при испаряемости
более 1000 мм.
Для формирования урожая существенно относительно
равномерное распределение осадков, особенно в период активного
роста растений. Во многих регионах, в том числе в
Нечерноземье, особенно эффективны дожди в мае и июне, однако именно
эти месяцы бывают засушливыми. Наибольший вред засуха
причиняет в весеннее и летнее время, когда идет формирование
генеративных органов растений. В отдельные годы урожайность
сельскохозяйственных культур, пострадавших от засухи,
снижается до минимальных величин (у зерновых до 0,3—0,4 т/га).
Засухоустойчивость — способность растений переносить
длительные засушливые периоды, значительный водный дефицит,
528
обезвоживание клеток, тканей и органов. При этом ущерб
урожая зависит от продолжительности засухи и ее напряженности.
Различают засуху почвенную и атмосферную.
Почвенная засуха вызывается длительным отсутствием дождей
в сочетании с высокой температурой воздуха и солнечной
инсоляцией, повышенным испарением с поверхности почвы и транс-
пирацией, сильными ветрами. Все это приводит к иссушению
корнеобитаемого слоя почвы, снижению запаса доступной для
растений воды при пониженной влажности воздуха. Атмосферная
засуха характеризуется высокой температурой и низкой
относительной влажностью воздуха (10—20 %). Жесткая атмосферная
засуха вызывается перемещением масс сухого и горячего
воздуха — суховея. К тяжелым последствиям приводит мгла, когда
суховей сопровождается появлением в воздухе почвенных частиц
(пыльные бури).
Атмосферная засуха, резко усиливая испарение воды с
поверхности почвы и транспирацию, способствует нарушению
согласованности скоростей поступления из почвы в надземные
органы воды и потери ее растением, в результате растение
завядает. Однако при хорошем развитии корневой системы
атмосферная засуха не причиняет растениям большого вреда, если
температура не превышает переносимый растениями предел.
Продолжительная атмосферная засуха в отсутствие дождей
приводит к почвенной засухе, которая более опасна для растений.
Обычно атмосферная и почвенная засухи сопровождают друг
друга. В чистом виде атмосферная засуха нередко наступает
весной, когда почва еще насыщена водой после схода снега.
Почвенная засуха часто наблюдается в середине или конце лета, когда
зимние запасы влаги уже исчерпаны, а летних осадков оказалось
недостаточно. Почвенная засуха всегда снижает урожай, а если
она начинается очень рано, то может привести к полной потере
урожая.
, Совместное действие недостатка влаги и высокой температуры
на растение. Засуха вызывает в первую очередь нарушения
водного режима растений, которые затем отражаются и на
остальных его физиологических функциях.
При атмосферной засухе в сочетании с высокой температурой
и солнечной инсоляцией отмечаются значительная задержка
роста стеблей и листьев растений, снижение урожая, а иногда
растения в течение короткого времени погибают от «теплового
удара». Внезапно наступающие суховеи вызывают высыхание и
отмирание значительной части листьев травянистых растений,
верхушек ветвей у кустарников и плодовых деревьев. Суховеями
повреждаются цветочные органы и формирующиеся плоды и
семена. Дело в том, что подвядающие листья активно
отсасывают воду от цветочных'бутонов, завязывающихся плодов или
молодых растущих верхушек побегов.
529
Особенности водообмена у ксерофитов и мезофитов.
Засухоустойчивость обусловлена генетически определенной
приспособленностью растений к условиям места обитания, а также
адаптацией к недостатку воды. Засухоустойчивость выражается в
способности растений переносить значительное обезвоживание за
счет развития высокого водного потенциала тканей при
функциональной сохранности клеточных структур, а также за счет
адаптивных морфологических особенностей стебля, листьев,
генеративных органов, повышающих их выносливость, толерантность к
действию длительной засухи.
По отношению к воде выделяют три экологические группы
растений. Ксерофиты — растения засушливых местообитаний,
способные в процессе онтогенеза хорошо приспосабливаться к
атмосферной и почвенной засухе. Гигрофиты — растения водные
и увлажненных местообитаний, неустойчивые к засухе. Даже
незначительное снижение воды в почве вызывает быстрое завя-
дание гигрофитов. Для гигрофитов характерны низкое
осмотическое давление клеточного сока, большая листовая пластинка,
длинный стебель, недостаточно развитая корневая система,
большие размеры клеток с тонкостенными оболочками, большие
устьица при незначительном количестве их на единицу
поверхности листа, слабое развитие механических тканей. Мезофиты —
растения, обитающие в среде со средним уровнем
обеспеченности водой. К этой группе принадлежит большинство
сельскохозяйственных растений умеренного климата.
Для мезофитов и ксерофитов в условиях дефицита воды
характерны три основных способа защиты: предотвращение
излишней потери воды клетками (избегание высыхания);
перенесение высыхания; избегание периода засухи. Остановимся на
физиологической характеристике разных типов ксерофитов.
Единственным общим для всех ксерофитов признаком являются
незначительные размеры испаряющей поверхности.
Первый тип ксерофитов — суккуленты — растения,
запасающие влагу (ложные ксерофиты). К ним относятся кактусы,
алоэ, очиток, молодило, молочай и др. Кактусы — растения
пустынь, районов, где бездождливые периоды сменяются периодами
дождей. Кактусы имеют мясистые сочные стебли с большим
запасом воды. Осмотический потенциал у них невысок. Листья
утратили свою ассимиляционную функцию и редуцированы в
колючки. Развитая неглубокая корневая система располагается в
верхних слоях почвы и в период дождей интенсивно поглощает
воду, которую кактусы расходуют медленно, так как эпидермис
этих растений покрыт толстым слоем кутикулы, а число устьиц
очень мало. Концентрация сока в клетках низкая. Фотосинтез
идет чрезвычайно медленно. У суккулентов, для которых
характерен САМ-тип фотосинтеза, устьица открыты только в ночное
время. В период засухи тонкие боковые корни кактусов отмира-
530
ют и остается только центральный корень. Эти растения
характеризуются очень медленным ростом.
У алоэ, агавы, молодило и некоторых других растений
вместилищами запасов воды служат мясистые листья, покрытые
мощным кутикулярным слоем с немногочисленными
углубленными устьицами. В листьях содержится много воды,
осмотический потенциал невысок. Корневая система развита слабо. Эти
растения также отличаются очень экономным расходованием
воды, растут на песках, скалах и даже на каменных заборах и
крышах, где тонкий слой почвы обычно пересыхает. Все
суккуленты выносят перегрев и малоустойчивы к обезвоживанию. Во
время засухи они выживают, так как содержат большое
количество воды в тканях и медленно ее расходуют.
Второй тип ксерофитов — тонколистные ксерофиты —
растения, имеющие развитые приспособления к добыванию
воды. Тонколистные высокотранспирирующие ксерофиты имеют
тонкие нежные листья с большим количеством устьиц и сетью
жилок. Корневая система уходит в глубь почвы (у верблюжьей
колючки до 15—20 м), хорошо разветвленная. Концентрация
клеточного сока очень высокая, осмотический потенциал
довольно большой, следовательно, клетки корня способны
поглощать труднодоступную воду. Для этих ксерофитов характерна
интенсивная транспирация, особенно на солнце, благодаря
хорошо развитой проводящей системе.
Растения используют для сбора воды очень большие объемы
почвы. В жаркие сухие дни они держат устьица открытыми,
энергично осуществляют фотосинтез. Но в самый сухой период
года растения сбрасывают часть листьев и веток. Листья
некоторых тонколистных ксерофитов покрыты волосками,
защищающими листья, пигментный комплекс от перегрева. К этой группе
ксерофитов относятся верблюжья колючка, степная люцерна,
дикий арбуз, распространенные в степях и полупустынях виды
полыни и др.
Третий тип ксерофитов — жестколистные ксерофиты —
растения, переносящие засуху в состоянии анабиоза. Они имеют
жесткие листья (склерофиты), характеризующиеся сравнительно
малым содержанием воды (степные злаки — ковыль, типчак;
некоторые зонтичные — перекати-поле и др.). Жестколистные
ксерофиты отличаются значительной концентрацией клеточного
сока и высоким осмотическим потенциалом, исключительно
высокой вязкостью протоплазмы. Они имеют листья с большим
количеством устьиц, которые у некоторых растений находятся в
специальных углублениях и сверху закрываются смоляными
пробками, иногда листья редуцированы; слаборазвитую
неглубокую корневую систему.
При достаточном количестве воды интенсивность транспира-
ции у них высокая. В период засухи листья многих жестколист-
531
ных ксерофитов свертываются и устьица оказываются внутри
трубки. В таком состоянии эти растения способны переносить
длительное обезвоживание (содержание воды может опускаться
до 25 %), впадая в анабиоз. Однако при улучшении
водоснабжения они быстро переходят к нормальной жизнедеятельности.
Кроме этих трех типов настоящих ксерофитов в пустынях
обитают ложные ксерофиты — эфемеры — растения, избегающие
засухи благодаря короткому жизненному циклу (полтора-два
месяца), приуроченному к периоду дождей. По всем остальным
физиологическим свойствам эфемеры — типичные мезофиты.
Рассмотренные типы, конечно, не охватывают все многообразие
переходных форм.
Для агронома особенно важно знание признаков и свойств,
определяющих устойчивость к засухе растений третьей
экологической группы — мезофитов. Многие физиологические факторы,
механизмы устойчивости растений к засухе, характерные для
ксерофитов, в той или иной степени представлены у растений-
мезофитов. К мезофитам относятся основные виды злаковых и
бобовых трав, зерновые и зернобобовые культуры, корне- и
клубнеплоды, масличные и прядильные культуры,
возделываемые в России. Мезофиты произрастают в условиях достаточного
увлажнения. Осмотическое давление клеточного сока у них 1—
1,5 тыс. кПа.
Устойчивость к засухе выражается в том, что эти растения
способны регулировать интенсивность транспирации за счет
работы устьичного аппарата, сбрасывания листьев и даже завязей.
Для более засухоустойчивых видов и сортов характерны развитая
корневая система, достаточно высокое корневое давление,
значительна водоудерживающая способность тканей, обусловленная
накоплением в вакуолях осмотически активных веществ
(углеводов, органических кислот, растворимых форм азота и ионов
минеральных веществ).
Влияние на растения недостатка влаги. Недостаток воды в
тканях растений возникает в результате превышения ее расхода
на транспирацию перед поступлением из почвы. Это часто
наблюдается в жаркую солнечную погоду к середине дня. При этом
содержание воды в листьях снижается на 25—28 % по сравнению
с утренним, растения утрачивают тургор и завядают. В результате
снижается и водный потенциал листьев, что активизирует
поступление воды из почвы в растение.
Различают два типа завядания: временное и глубокое.
Причиной временного завядания растений обычно бывает атмосферная
засуха, когда при наличии доступной воды в почве она не
успевает поступать в растение и компенсировать ее расход. При
временном завядании тургор листьев восстанавливается в
вечерние и ночные часы. Временное завядание снижает
продуктивность растений, так как при потере тургора устьица закрываются
532
и фотосинтез резко замедляется. Наблюдается, как отмечал
А. Г. Лорх, «простой» растений в накоплении урожая.
Глубокое завядание растений наступает, когда в почве
практически нет доступной для корней воды. Происходит частичное, а
при длительной засухе и общее иссушение и даже гибель
растительного организма. Характерный признак устойчивого водного
дефицита — сохранение его в тканях утром. Временное и даже
глубокое завядание может рассматриваться как один из способов
защиты растения от летального обезвоживания, позволяющих
некоторое время сохранять воду, необходимую для поддержания
жизнеспособности растения. Завядание может происходить при
разной потере воды растениями: у тенелюбивых — при 3—5 %, у
более стойких — при водном дефиците в 20 и даже 30 %.
Водный дефицит и завядание в разной мере влияют на
физиологическую деятельность растения в зависимости от
длительности обезвоживания и вида растения. Последствия водного
дефицита при засухах многообразны. В клетках снижается содержание
свободной воды, возрастает концентрация и снижается рН ваку-
олярного сока, что влияет на гидратированность белков
цитоплазмы и активность ферментов. Изменяются степень
дисперсности и адсорбирующая способность цитоплазмы, ее вязкость.
Резко возрастают проницаемость мембран и выход ионов из
клеток, в том числе из листьев и корней (экзоосмос); эти клетки
теряют способность к поглощению питательных веществ.
При длительном завядании снижается активность ферментов,
катализирующих процессы синтеза, и повышается ферментов,
катализирующих гидролитические процессы, в частности распад
(протеолиз) белков на аминокислоты и далее до аммиака,
полисахаридов (крахмала на сахара и др.), а также других
биополимеров. Многие образующиеся продукты, накапливаясь, отравляют
организм растения. Нарушается аппарат белкового синтеза. При
возрастании водного дефицита, длительной засухе нарушается
нуклеиновый обмен, приостанавливается синтез и усиливается
распад ДНК. В листьях снижается синтез и усиливается распад
всех видов РНК, полисомы распадаются на рибосомы и
субъединицы. Прекращение митоза, усиление распада белков при
прогрессирующем обезвоживании приводят к гибели растения.
Безусловно, происходящие изменения до определенного этапа
в условиях обезвоживания играют и защитную роль, приводят к
увеличению концентрации клеточного сока, снижению
осмотического потенциала, а следовательно, повышают водоудерживаю-
щую способность растения. При недостатке влаги суммарный
фотосинтез снижается, что является следствием в основном
недостатка СО2 в листьях; нарушения синтеза и распада хлорофил-
лов и других пигментов фотосинтеза; разобщения транспорта
электронов и фотофосфорилирования; нарушения нормального
хода фотохимических реакций и реакций ферментативного вос-
533
становления СОг; нарушения структуры хлоропластов; задержки
оттока ассимилятов из листьев. По данным В. А. Бриллиант
(1925), уменьшение оводненности листа у сахарной свёклы на
3—4 % приводит к снижению фотосинтеза на 76 %.
При нарастающем обезвоживании у незасухоустойчивых
растений в первый период завядания интенсивность дыхания
возрастает возможно из-за большого количества простых продуктов
(гексоз) гидролиза полисахаридов, в основном крахмала, а затем
постепенно снижается. Однако выделяющаяся в процессе
дыхания энергия не аккумулируется в АТФ, а рассеивается в виде
теплоты (холостое дыхание). При действии на растения высокой
температуры (45 °С) и суховея происходят глубокие структурные
изменения митохондрий, повреждение или ингибирование
ферментов фосфорилирующего механизма. Все это свидетельствует о
нарушении энергетического обмена растений. В корнях и пасоке
повышается содержание амидов. В результате тормозится рост
растения, особенно листьев и стеблей, снижается урожай. У
более засухоустойчивых растений все эти изменения менее
выражены.
Из физиологических процессов наиболее чувствительным к
недостатку влаги является процесс роста, темпы которого при
нарастающем недостатке влаги снижаются значительно раньше
фотосинтеза и дыхания. Ростовые процессы задерживаются даже
после восстановления водоснабжения. При прогрессирующем
обезвоживании наблюдается определенная последовательность в
действии засухи на отдельные части растения.
Если рост побегов и листьев в начале засухи замедляется, то
корней даже ускоряется и снижается лишь при длительном
недостатке воды в почве. При этом молодые верхние по стеблю
листья оттягивают воду от более старых нижних, а также от
плодоэлементов и корневой системы. Отмирают корни высоких
порядков и корневые волоски, усиливаются процессы
опробковения и суберинизации. Все это приводит к сокращению
поглощения корнями воды из почвы. После длительного завядания
растения оправляются медленно и функции их полностью не
восстанавливаются. Затянувшееся завядание при засухе приводит
к резкому снижению урожая сельскохозяйственных культур или
даже к их гибели. При внезапном и сильном напряжении всех
метеорологических факторов растение может быстро погибнуть в
результате высыхания (захват) или высоких температур (запал).
Засухоустойчивость различных органов растений неодинакова.
Так, молодые растущие листья за счет притока ассимилятов
дольше сохраняют способность к синтезу, относительно более
устойчивы, чем листья, закончившие рост, или старые, которые
при засухе подвядают в первую очередь.
В условиях затянувшейся засухи отток воды и веществ в
молодые листья может происходить и из генеративных органов.
534
Засуха в ранние периоды развития приводит к гибели цветочных
зачатков, их стерильности (белоколосица), а в более поздние — к
образованию щуплого зерна (захват). При этом захват будет
более вероятен при хорошо развитой к началу засухи листовой
поверхности. Поэтому при сочетании влажной весны и начала
лета с очень сухой второй половиной (или даже отдельных
сильных суховеев) опасность снижения урожая наиболее вероятна.
Физиологические особенности засухоустойчивости
сельскохозяйственных растений. Засухоустойчивость сельскохозяйственных
растений — это комплексный признак, связанный с рядом их
физиологических особенностей. Засухоустойчивые растения
способны переносить временное обезвоживание с наименьшим
снижением ростовых процессов и урожайности. По данным
И. И. Туманова, длительное завядание, вызванное пересыханием
почвы, мало отражается на урожае проса, но очень сильно
снижает урожай овса. Н. А. Максимов (1958) отмечает, что нет
единого типа засухоустойчивости сельскохозяйственных культур,
как нет и универсальных признаков засухоустойчивости. Из
общих признаков следует отметить меньшие отрицательные
последствия обезвоживания и более быстрое восстановление
основных физиологических функций после засухи у более
засухоустойчивых видов и сортов сельскохозяйственных культур.
Засухоустойчивость определяется способностью растительного
организма как можно меньше изменять процессы обмена
веществ в условиях недостаточного водоснабжения. У более
засухоустойчивых растений при нарастающем обезвоживании дольше
сохраняются синтетические процессы, не повреждаются или
меньше повреждаются мембранные системы клеток,
обеспечивающие их нормальный гомеостаз, сохраняются нормальные
физико-химические свойства протоплазмы (вязкость, эластичность,
проницаемость); больше выражен ксероморфизм.
В. Р. Заленский (1904) показал, что анатомическая структура
листьев растений закономерно изменяется в зависимости от их
ярусности. Верхние листья растут в условиях несколько
затрудненного водоснабжения, что формирует их мелкоклеточность,
они имеют больше устьиц на единицу поверхности, развитую
сеть проводящих пучков. Чем выше расположен лист, тем более
высокой транспирацией и большей интенсивностью фотосинтеза
он обладает. Указанные закономерности получили название
закона Заленского. Растения в более засушливых условиях
отличаются меньшими размерами, формируют ксероморфную структуру
листьев как одно из анатомических приспособлений к
недостатку воды.
Ксероморфная структура — один из признаков при селекции
засухоустойчивых сортов. У злаков и других растений важное
значение имеет наличие как бы чехла из более старых высохших
и отмерших листьев, окружающих основание стебля и покрыва-
535
ющих находящиеся в центре этого чехла молодые точки роста
(Н. А. Максимов, 1958). У засухоустойчивых растений
относительно низкая величина транспирационного коэффициента.
Засухоустойчивые виды и сорта растений способны без
особого вреда терять часть своей воды и даже в периоды наибольшей
сухости не закрывать устьица и продолжать фотосинтез. Поэтому
у ряда культур, в том числе у пшеницы, одним из важных
признаков засухоустойчивости является суточный ход устьичных
движений. Н. А. Максимов отмечал, что устойчивые
южнорусские пшеницы в условиях засушливого климата Ростовской
области держат свои устьица открытыми в течение всего дня, тогда
как менее устойчивые канадские пшеницы закрывают их рано
утром, а потому рано прекращают фотосинтез и дают
пониженный урожай. Различия в засухоустойчивости между отдельными
сортами и культурами определяются также развитием корневой
системы, наличием запасов воды в стеблях или корнях,
размерами и характером листовой поверхности и др.
Помимо анатомо-морфологических засухоустойчивые виды и
сорта имеют биохимические механизмы защиты,
способствующие в условиях засухи поддерживать достаточно высокий
уровень физиологических процессов растений. Эти механизмы
предотвращают обезвоживание клетки за счет накопления
низкомолекулярных гидрофильных белков, связывающих значительное
количество воды, взаимодействия их с пролином, концентрация
которого значительно возрастает, увеличения моносахаров,
обеспечивающих детоксикацию продуктов распада (так,
образующийся аммиак обезвреживается с участием возрастающих при засухе
органических кислот); способствуют восстановлению
нарушенных структур цитоплазмы при условии сохранения от
повреждения генетического аппарата клеток. Защита молекул ДНК от
вредного действия обезвоживания обеспечивается частичным
переводом их в пассивное состояние с помощью ядерных белков
или, возможно, специальных стрессовых белков.
Засуха приводит к адаптивным изменениям гормональной
системы регуляции растений. Содержание гормонов —
активаторов роста и стимуляторов роста фенольной природы
уменьшается, а абсцизовой кислоты и этилена возрастает. Все это
обеспечивает остановку ростовых процессов, а следовательно,
выживание растений в жестких условиях засухи. В первый период засухи
стремительно возрастает содержание АБК в листьях,
обеспечивающей закрывание устьиц, уменьшение потери воды через
транспирацию.
При развитии засухи АБК, активируя синтез пролина,
способствует запасанию гидратной воды в клетке, тормозит синтез РНК
и белков, накапливаясь в корнях, задерживает синтез цитокини-
на, способствует переводу обмена веществ клеток в режим
покоя. В условиях водного дефицита отмечаются увеличение
536
биосинтеза и выделения этилена, у многих растений
накапливаются ингибиторы роста фенольной природы (хлорогеновая
кислота, флавоноиды, фенолкарбоновые кислоты). Снижение
содержания ИУК происходит вслед за остановкой роста. Так, в
листьях подсолнечника, в верхушках стеблей и колосках пшеницы и
других растений рост начинает подавляться при влажности
почвы 60 % НВ, а количество ауксинов заметно снижается
только при снижении влажности почвы до 30 % НВ.
Опрыскивание растений в условиях засухи ауксином, цитоки-
нином или гиббереллином усиливает отрицательное действие
водного дефицита на растение. Обработка цитокинином в
период репарации после засухи восстанавливает функции растений.
Предпосевное повышение жаро- и засухоустойчивости.
И. В. Мичурин, пытаясь получить засухоустойчивые сорта
плодовых, выращивал растения в условиях недостаточного
водоснабжения. Растения, перенесшие небольшую засуху, повторно
выдерживают ее с меньшими потерями, становятся более
устойчивыми к обезвоживанию.
Разработаны методы предпосевного закаливания к засухе.
П. А. Генкель (1934) предложил закаливать наклюнувшиеся
семена, подвергая их подсушиванию от одного до трех раз. В
результате повышается засухоустойчивость растений и
увеличивается их урожайность в засушливых условиях (пшеница и
другие культуры). Закаленные растения приобретают анатомо-мор-
фологическую структуру, свойственную засухоустойчивым
растениям, имеют более развитую корневую систему. Окислительное
фосфорилирование у 4-, 8- и 11-дневных проростков кукурузы
было у закаленных растений выше, чем у контрольных.
Эффективность предпосевного закаливания по методу Генкеля
повышается при замачивании семян в слабых растворах борной кислоты.
Улучшает всхожесть и повышает жароустойчивость растений
обработка семян цитокинином (О. Н. Кулаева, 1973).
Диагностика жаро- и засухоустойчивости. Для диагностики
засухоустойчивости растений используют ряд полевых и
лабораторных методов. Сравниваемые сорта и виды растений
выращивают в засушливых районах. Сорта, в меньшей степени
снижающие урожаи, считаются более засухоустойчивыми. Испытания на
засухоустойчивость в засушниках и суховейных установках дают
возможность подвергать растения почвенной и атмосферной
засухе в любой период их вегетации и оценивать сорта. Засушни-
ки — это делянки, на которых исследуемые растения закрывают
в период дождей пленкой. Для отвода воды с соседних делянок
выкапывают стоковые канавы. При использовании суховейных
камер растения выращивают в вегетационных сосудах и затем
подвергают действию струй нагретого и высушенного воздуха.
Как показатель устойчивости растений к засухе можно
использовать водоудерживающую способность растительной ткани,
537
а также вязкость цитоплазмы. У засухоустойчивых растений эти
показатели будут выше. В селекционной работе используют
такой показатель, как содержание статолитного крахмала в
корневом чехлике. Генетически обусловленным признаком
засухоустойчивости растений является способность их вегетативных
органов (особенно листьев) накапливать во время засухи пролин.
При этом концентрация пролина увеличивается в 10—100 раз. В
пролине запасается значительное количество азота, который
используется для последующих метаболических реакций по
окончании засухи.
Критические периоды в водообмене разных растений. В
онтогенезе растения неодинаково чувствительны к недостатку воды.
Очень чувствительны растения к недостатку воды в периоды
наибольшего роста конкретного органа или всего растения. Для
каждого вида растений существуют критические периоды, т. е.
периоды наибольшей чувствительности к снабжению водой. На
I—IV этапах органогенеза злаки относительно устойчивы к
засухе, хотя урожай снижается в данном случае за счет уменьшения
числа заложившихся колосков в колосе.
На V—VIII этапах устойчивость к засухе злаков снижается,
урожай падает за счет уменьшения количества колосков и
цветков в колосе (метелке). Засухоустойчивость, как и жаростойкость
растений, резко снижается с образованием у них генеративных
органов и до цветения (VII—IX этапы) включительно. По
Ф. Д. Сказкину, злаки наиболее чувствительны к влаге в период
фаз выход в трубку — колошение. Следовательно, в критический
период формируются генеративные органы, происходят цветение
и оплодотворение.
В период генеративного развития растений на ранних этапах
развития засуха приводит к стерильности цветков (к череззерни-
це и пустоколосью), а на более поздних (молочная, восковая
спелость) — к снижению качества и количества урожая плодов и
семян, образованию щуплого зерна, недостаточно заполненного
питательными запасными веществами, со слабым зародышем.
Важно подчеркнуть, что именно в критические периоды
растения наиболее интенсивно растут и формируют хозяйственно
полезные органы (плоды, семена и др.).
Повышение засухоустойчивости культурных растений. На
засухоустойчивость влияют удобрения: калийные и фосфорные
повышают ее, азотные, особенно в больших дозах, — снижают.
Засухоустойчивость ряда сельскохозяйственных культур повышают
микроэлементы (цинк, медь и др.). Устойчивости к засухе в полевых
условиях способствует выращивание сельскохозяйственных
культур с соблюдением зональных технологий их возделывания.
Существование различных типов засухи, региональных ее
особенностей сильно затрудняет селекцию сельскохозяйственных
растений на засухоустойчивость, требует учета многих видовых,
538
структурно-анатомических и физиолого-биохимических
показателей растений. Так, засухоустойчивые сорта зерновых культур
при значительном водном дефиците отличаются синтетической
направленностью работы ферментных систем, содержат больше
связанной воды, имеют повышенную концентрацию клеточного
сока, высокий температурный порог коагуляции белков,
интенсивное накопление сухого вещества, устойчивую пигментную
систему, более четкие признаки ксероморфности и др. Засуха в
каждом географическом регионе имеет свои конкретные
особенности: преимущественно почвенная или атмосферная, весенняя
или летняя, продолжительность и глубина. Эти особенности
также определяют выбор критериев для отбора растений.
Еще Н. А. Максимов (1952) отмечал среди засухоустойчивых
сортов яровой пшеницы наличие двух основных биотипов: один,
свойственный главным образом Зауралью, где засуха наблюдается
в начале лета (захватывает у пшениц период кущения), другой —
Среднему и Нижнему Поволжью, где засуха случается обычно в
конце вегетации пшеницы. Поэтому при культуре растений
первого биотипа в Поволжье или второго биотипа в Зауралье они
ведут себя как незасухоустойчивые сорта. При оценке и
выведении засухоустойчивых сортов селекционеры используют
совокупность всех рассмотренных ранее физиолого-биохимических и
других признаков и показателей. Для регионов России и государств
СНГ, подверженных засухе, научными учреждениями
разработаны модели засухоустойчивых сортов основных
сельскохозяйственных культур, включающие и физиологические показатели.
Орошение как радикальное средство борьбы с засухой.
Наиболее эффективным способом борьбы с засухой в аридных
регионах является орошение. Оно эффективно и в районах, где
осадков выпадает достаточно, но распределение их не является
оптимальным. Орошение дождеванием овощных, плодовых,
кормовых культур и картофеля используют в Центральном
Нечерноземье. Необходимо организовать полив растений таким
образом, чтобы свести повреждаемость растений от засухи к
минимуму и наиболее эффективно использовать поливную воду. Для
определения сроков полива руководствуются наблюдениями за
влажностью почвы, не допуская снижения предполивной
влажности ниже оптимального уровня (60—70 % НВ).
На орошаемых полях возделывают влаголюбивые растения с
большой листовой поверхностью, которые требуют больше влаги
и в условиях засухи при нарушении водоснабжения снижают
урожай сильнее по сравнению с растениями на богаре. Особенно
важно обеспечить растения водой в критические периоды.
Яровые и озимые злаки наиболее чувствительны к недостатку влаги
в фазы выхода в трубку и колошения; кукуруза — в период
цветения и молочной спелости; просо и сорго — в фазы
выметывания и налива зерна; зернобобовые — в период цветения; карто-
539
фель — цветения и формирования клубней; подсолнечник —
образования корзинки и цветения; хлопчатник — в фазу цветения и
залож&ния коробочек; бахчевые — в период цветения и
созревания.
Для определения потребности растений в поливе используют
также физиологические показатели: содержание воды в листьях;
степень открытости устьиц; интенсивность транспирации; водный
потенциал тканей; концентрацию клеточного сока; градиент
биопотенциалов (ЭП); интенсивность роста и др. (Н. А. Максимов,
И. В. Красовская, Ф. Д. Сказкин, Н. С. Петинов, В. С. Шарда-
ков, В. А. Лобов, О. Е. Шведова, М. Д. Кушниренко и др.).
Оптимальные и критические уровни этих показателей установлены
применительно к видам и сортам растений и содержатся в
справочной литературе.
Полив, особенно дождеванием, повышает влажность
приземного слоя воздуха, снижает его температуру, создает в стеблестое
(и насаждении) более ровный микроклимат. Наиболее
эффективны частые поливы небольшими нормами, а в засушливых
регионах — в сочетании с влагозарядковым поливом.
Наибольший эффект поливы обеспечивают на высоком агротехническом
фоне при оптимальных дозах удобрений, выполнении всего
комплекса необходимых агротехнических мероприятий,
предусмотренных для данной сельскохозяйственной культуры.
8.10. СОЛЕУСТОЙЧИВОСТЬ РАСТЕНИЙ
За последние 50 лет уровень Мирового океана поднялся на
10 см. Эта тенденция, по предсказаниям ученых, будет
продолжаться и дальше. Следствием этого является возрастающий
дефицит пресной воды, а доля засоленных вод увеличивается.
Таким образом, к обширным территориям в той или иной
степени засоления будут прибавляться новые.
Однако кроме почв первичного засоления, развивающихся
естественным путем в силу природных явлений, увеличивается и
доля почв вторичного засоления, развивающихся не без помощи
человека, чаще всего при нерациональном орошении. Масштабы
вторичного засоления значительны — несколько десятков тысяч
гектаров в год. Есть серьезные опасения, что со временем
вторичное засоление может стать важным фактором,
ограничивающим сельскохозяйственное производство.
Борьба с засолением почв приобрела народнохозяйственное
значение, поэтому в последнее время вопросам солеустойчивости
растений уделяется огромное внимание.
Проблема солеустойчивости растений решается на многих
направлениях: физиологическом, биохимическом, экологическом,
генетическом и селекционном.
540
Физиология растений, по определению К. А. Тимирязева,
представляет собой одну из теоретических основ рационального
земледелия и призвана сыграть важную роль в изучении
солеустойчивости культурных растений. Изучение действия избытка
солей на рост и развитие растений в России впервые было
проведено А. Ф. Баталиным в 1875—1885 гг. Ему же
принадлежит приоритет доказательства приспособления растений к
засоленному субстрату в процессе онтогенеза. В дальнейшем
фундаментальные исследования в области солеустойчивости были
проведены Б. А. Келлером, Н. М. Тулайковым, А. А. Рихтером,
П. А. Генкелем, Б. П. Строгоновым, Г. В. Удовенко, а также
рядом зарубежных ученых: Ь. Ветз1еш, Н. Сгесп\уау, А. МауЬег,
А. ЬаисЪН, Е. Ерзает и др. Ими был установлен ряд
принципиальных положений в области эколого-физиологического
исследования солеустойчивости и сформулированы основные выводы
о процессе приспособления растений к засолению.
В последние годы широко распространилась точка зрения,
согласно которой устойчивость организма к засолению формируется
как приспособительная реакция в процессе онтогенеза,
обусловленная всей предыдущей эволюционной историей организма. У
растений выработались различные приспособительные структуры,
определяющие возможность произрастания их в засоленной
среде. Это группа галофитных растений, отличающихся друг от
друга по своим анатомическим и физиологическим свойствам.
Среди галофитов можно выделить три основные группы.
Эугалофиты. Это «соленакапливающие» растения с
мясистыми стеблями и листьями. Клетки данных растений отличаются
очень высоким осмотическим потенциалом, они легко
поглощают различные соли из почвы, накапливая их в вакуолях. Таким
образом, осмотический потенциал этих растений всегда больше,
чем осмотический потенциал почвенного раствора.
Криногалофиты. Это «солевыделяющие» растения. К ним
относятся кермек, тамариск и др. Протоплазма этих растений
имеет высокую проницаемость для солей, она как бы фильтрует
соли, пропуская их через себя. Содержание солей в самих
клетках при этом постоянное. Растения данной группы имеют
специальные секретирующие клетки на листьях, в которых и
накапливаются соли. Когда эти клетки полностью заполняются солями,
они лопаются и соль остается на поверхности листа. На месте
погибших клеток вырастают новые.
Гликогалофиты. Это «соленепроницаемые» растения. К ним
относятся хорошо известные полынь и лебеда. Цитоплазма
клеток у этих растений плохо проницаема для солей. Высокое
осмотическое давление клеточного сока обусловлено не высокой
концентрацией солей, как у первых двух групп, а наличием
большого количества органических соединений, особенно углеводов,
541
которые предотвращают избыточное поглощение и накопление
солей этими растениями.
Перечисленные группы растений хорошо растут и
развиваются на почвах с высоким содержанием солей. Но есть группы
растений (олигогалофиты), которые растут при малом
содержании солей в среде. Мезогалофиты довольствуются средним
содержанием солей.
Основная группа сельскохозяйственных растений относится к
гликофитам. Согласно определению П. А. Генкеля, гликофиты —
растения пресных местообитаний, обладающие сравнительно
ограниченной приспособленностью к засолению в процессе
индивидуального развития.
Приспособление гликофитов осуществляется многими
путями, но наиболее важными из них являются осморегуляция
органов и целостного организма и регуляция потоков засоляющих
ионов, их накопление, распределение и выведение.
К условиям сильного засоления могут адаптироваться только
растения с интенсивным метаболизмом органических кислот,
сахарозы, которая часто выполняет функцию протектора многих
процессов в растениях, и аминокислот, таких как аспарагиновая
и глутаминовая, способных связывать аммиак с образованием
амидов.
Проблема солеустойчивости у гликофитов долгое время
решалась согласно теории А. Шимлера (1898), по которой вредное
действие солей проявляется главным образом через высокое
осмотическое давление почвенного раствора, что и обусловливает
«физиологическую» сухость засоленных почв. Однако
последующие исследования П. А. Генкеля (1950), Б. П. Строгонова (1958)
и др. показали, что нарушение жизнедеятельности растений при
их росте на засоленных почвах обусловлено не столько
осмотическим, сколько токсическим действием солей.
Засоление обычно связано с накоплением в почве натриевых
солей, и степень повреждения растений зависит от того, какие
анионы находятся в среде. Наиболее токсичными являются
анионы НСОз, меньшей токсичностью обладают анионы хлора и
сульфатов. Б. П. Строганов и Г. В. Удовенко (1973) считают, что
особо токсичное действие оказывают на многие физиолого-био-
химические процессы ионы натрия и хлора. Токсичность
сульфатов и нитратов несколько ниже: сильное сульфатное засоление
оказывает такое же действие, как слабое хлоридное. В условиях
сульфатного засоления растения подвергаются преимущественно
осмотическому действию солей, а в условиях хлоридного — и
токсическому.
Основные культурные растения слабо или совсем неустойчивы
к засолению — высокие концентрации ионов натрия и хлора
изменяют их осмотические свойства, приводят к разрушению цито-
плазматических мембран, снижают активность ферментных сис-
542
тем, связанных с мембранами, а это, в свою очередь, снижает
фото- и окислительное фосфорилирование, следовательно,
энергетический процесс нарушается. Засоленность ведет к нарушению
белкового обмена, вызывая интенсивное накопление свободных
аминокислот, и способствует образованию токсичных продуктов,
таких, как кадаверин, путресцин (аналоги трупного яда) и
аммиак, образующийся при дезаминировании аминокислот.
Большое влияние оказывает засоление на поглощение
корнями растений других помимо засоляющих ионов. У разных видов
растений, как правило, наблюдается торможение поглощения
многих элементов минерального питания. При этом отмечается,
что при засолении не только тормозится поглощение нитратов,
фосфора, кальция, калия и других необходимых элементов, но в
еще большей степени — их транспорт в надземные органы и
метаболическое использование.
Наряду с ограничением поглощения, передвижения и
метаболизма элементов минерального питания наблюдается и
изменение в распределении и локализации их по органам.
Сильному изменению в тканях органов растений при хлорид-
ном засолении подвергается отношение К:ТЧа, которому
придается большое значение для солевого обмена. Поддержание
оптимального отношения между калием и натрием в тканях растений,
вероятно, является проявлением механизма солеустойчивости.
При хлоридном засолении отмечается повышение содержания
магния у таких растений, как пшеница, кукуруза, просо, ячмень,
томат.
Одной из ответных реакций растений на засоление среды
является изменение осмотического потенциала клеток.
Большинство исследователей считает, что повышение осмотического
потенциала клеточного сока растения — адаптивный ответ на
засоление, защитно-приспособительная реакция на
неблагоприятные условия. Благодаря повышенному осмотическому
потенциалу растения могут создавать градиент сосущей силы и таким
образом противостоять внешнему высокому осмотическому
давлению солевого раствора. Однако повышение концентрации
клеточного сока свыше определенного предела задерживает рост
растений, а это в конечном итоге приводит к снижению
продуктивности растений. В то же самое время снижение ростовых
процессов у засоленных растений осуществляет и некоторую
адаптивную функцию, так как снятие засоленности может
впоследствии несколько восстановить рост, правда, уже на более
низком уровне.
Таким образом, рост растений при засолении лимитируется в
основном тремя факторами: нарушением водного баланса,
затрудняющего водоснабжение целостного растения и,
следовательно, работу механизмов саморегуляции; нарушением ионного
равновесия во внешней среде, что приводит к изменению в
543
поглощении и транспорте ионов в растении; специфическим
ионным стрессом или солевой токсичностью, обусловленными
высоким содержанием ионов в растениях. Эти факторы
действуют одновременно, и среди них трудно выделить определяющий.
Исследования характера изменения солеустойчивости
растений в онтогенезе показали, что чувствительность растений к
засолению в различные периоды вегетации меняется. Для многих
культур периодом максимальной чувствительности к засолению
среды являются фазы всходов, проростков, начала цветения. С
возрастом одни культуры становятся более устойчивыми
(ячмень), другие — менее (кукуруза). Вредное действие оказывает
засоленность во время налива зерна на большинство злаковых
культур, при этом зерно получается щуплым, что приводит к
потере урожая.
К солеустойчивым растениям можно отнести ячмень,
горчицу, хлопчатник, клевер, капусту, сахарную свеклу, шпинат, из
древесных — облепиху; к среднеустойчивым — овес, просо,
кукурузу, подсолнечник, рожь, люцерну, картофель, лук, морковь,
томат, виноград; к слабоустойчивым — пшеницу, сорго, гречиху,
лен, редьку, фасоль, огурец, яблоню, вишню, персик, лимон.
Ответная реакция растений на засоленность среды
выражается в проявлении некроза краев листьев, а в дальнейшем в
подсыхании и сбрасывании листьев сначала нижних, а затем и
средних ярусов, а также завязей.
Повышение солеустойчивости растений — фактор получения
стабильных урожаев сельскохозяйственных культур. Вместе с тем
физиологически обоснованных приемов повышения
устойчивости культурных растений к соли мало. В настоящее время можно
применять метод солевой закалки, разработанный П. А. Генке-
лем. Автор предлагает проводить предпосевную обработку семян
некоторых культур растворами солей — КаС1, М§804 и N82003
соответственно для повышения устойчивости к действию хлорид-
ного, сульфатного и содового засоления. Можно выделить и такие
методы, как обработка растений физиологически активными
веществами (ретардантами, антитранспирантами, ауксинами, гиббе-
реллинами и др.); изменение условий минерального питания;
отбор солеустойчивых растений, проводимый методами селекции,
включая мутагенез и генную инженерию. Одним из существенных
достижений в этой области является работа Е. Эпштейна, на
основании результатов которой был выведен солеустойчивый сорт
ячменя. Важны селекционные и физиологические исследования
на основе методов клеточных и тканевых культур.
Методы по увеличению устойчивости к засолению путем
модификации состава питательной среды наиболее многочисленны
и перспективны. Повышение уровня минерального питания в
среде снижает торможение поглощения необходимых элементов
и заметно уменьшает накопление засоляющих ионов. Однако не
544
все культуры становились более устойчивыми. Например, в
условиях умеренного засоления повышенные дозы нитратов
оказывали положительное влияние на рост и урожай томата, но снижали
устойчивость кукурузы, хлопчатника и пшеницы. То же
относится и к таким элементам, как ■ кальций и натрий. Изменение
соотношения натрия к кальцию в субстрате зависит от видовых
и сортовых особенностей растений.
Следовательно, одним из наиболее реальных способов
снижения токсического действия высоких концентраций минеральных
солей на растения является подбор наилучших соотношений
между ионами Са, №, К, нитратов и др. (Б. П. Строганов, 1973;
А. Е. Петров-Спиридонов, 1976).
Солеустойчивость растений можно определить прямыми и
косвенными методами. Прямые — выращивание растений в
засоленной среде с учетом энергии прорастания семян по проценту
всхожести и т. д. Косвенные (лабораторные) — определение
скорости открывания устьиц и степени выцветания хлорофилла в
солевом растворе, по содержанию альбуминов в зеленых листьях
и др.
При борьбе с засоленностью следует применять такие
агротехнические приемы, как гипсование почв, химическая мелиорация.
8.11. ГАЗОУСТОЙЧИВОСТЬ РАСТЕНИЙ
Интенсивное развитие промышленности,
сельскохозяйственного производства и активная деятельность человека привели к
значительным изменениям окружающей среды. Ежегодно
увеличивается выброс газообразных загрязнителей атмосферы, в почве
и воде накапливаются различные химические соединения. Все
это вызывает озабоченность состоянием окружающей среды.
Многие редкие виды растений и животных гибнут и бесследно
исчезают, изменяется и разрушается естественная экологическая
среда, резко снижается урожай сельскохозяйственных культур,
ухудшается его качество.
Детальный анализ топлива, используемого на современных
электростанциях, в промышленности, на транспорте и для
отопления жилых помещений, показал, что при сжигании нефти,
каменного угля и разного мусора в атмосферу в больших
количествах выделяются различные углеводороды, оксиды серы, СО2
и другие газообразные вещества, а также твердые компоненты
отходов — пыль и сажа. Дымы и газы не только отравляют
окружающую среду, но и в значительной степени меняют
климатическую обстановку. Около промышленных предприятий, как
.правило, влажность воздуха и освещенность ниже нормы, а
температура — выше, чем в незадымленных местах.
Проводится работа по защите окружающей среды, которая
545
включает четкое планирование соотношения индустриальных и
экологических факторов, а также разработку стандартов на
предельно допустимые концентрации выбросов. Однако до сих пор
имеют место и даже увеличиваются выбросы, которые приводят
ко все возрастающим повреждениям растений, животных, а
также человека. Из загрязнителей атмосферы наиболее широко
распространенными являются диоксид серы, фторид и хлорид
водорода. Воздействие этих токсикантов причиняет
колоссальный ущерб сельскому хозяйству и экосистеме в целом.
Для разработки профилактических мероприятий по охране
растений на основе контроля загрязнения воздуха необходимо
четко представлять, каково влияние этих токсикантов на
растительность, какие функциональные изменения они могут вызвать,
а также каковы пути их поступления в растительный организм.
Диоксид серы, оксиды азота, галогеноводороды и другие
вредные газообразные соединения проникают в растения из воздуха
в результате газообмена, а также с дождем и при осаждении
тумана или пыли на поверхности побегов. Основная же масса
токсичных газов поступает в лист через устьица. Попадая в
межклетники, они контактируют с губчатой паренхимой мезофилла,
затем диффундируют через плазмалемму в протопласт клетки,
где вызывают различные биохимические, структурные и
функциональные изменения. Скорость поступления газов обусловлена
проводимостью устьиц. Виды растений, имеющие низкую ус-
тьичную проводимость, обладают большей устойчивостью к
этому фактору.
В клетках поврежденных растений отмечается снижение рН
клеточного сока, заметно активизируются такие ферменты, как
пероксидаза, нарушается углеводно-азотный обмен, подавляется
движение цитоплазмы и растяжение клеток, происходит распад
хлорофилла, нарушаются проницаемость и регуляторная
деятельность замыкающих клеток устьиц.
При изучении действия вредных газов на растения следует
различать такие понятия, как газоустойчивость и
газочувствительность. Газочувствительность — это скорость и степень
проявления патологических изменений при действии газов. Это
явление часто используют для диагностики загрязнения среды. А
способность растений поддерживать свою жизнедеятельность в
условиях загрязнения атмосферы без снижения функций, а
также роста и развития называют газоустойчивостью.
Основы газоустойчивости были разработаны Н. А. Красин -
ским в виде теории фотоокисления. Согласно этой теории
диоксид азота и другие токсичные газы нарушают фотосинтетическую
активность растений. При этом на свету начинаются, процессы
фотоокисления белков, аминокислот и других веществ, что
приводит к их разрушению, а в дальнейшем клетки отмирают.
Изменение фотосинтетической активности листьев служит
546
быстрым и чувствительным показателем их повреждения
веществами, загрязняющими внешнюю среду, так как первой мишенью
их действия, видимо, являются фотосинтетические реакции. При
этом фотосинтез может ингибироваться задолго до появления
видимого повреждения тканей растений.
Сернистый газ (8О2), например, выделяющийся при сжигании
ископаемого топлива, весьма токсичен для растений, так как
легко растворяется в воде. Чувствительность листьев к действию
8О2 зависит от особенностей самого процесса фотосинтеза. Так,
Сз-виды менее устойчивы к 502, чем С4-ВИДЫ, что объясняется
большей чувствительностью к этому загрязнителю фермента ри-
булозобисфосфаткарбоксилазы (РБФ) в сравнении с фосфоенол-
пируваткарбоксилазой (ФЕП). Реакция отдельных звеньев
транспорта электронов на 502 неодинакова. У хлоропластов шпината,
выделенных из листьев, находившихся в атмосфере с 1—2
минимальными дозами 802, был подавлен поток электронов,
генерируемый ФСИ, тогда как фотофосфорилирование и активность
ФС1 оставались в норме. В аналогичных условиях в хлоропластах
листьев бобов обнаружено набухание тилакоидов, причем при
слабой освещенности ингибирование фотосинтеза не зависело от
концентрации 502 (в низком диапазоне). Но при этом
существенно возросло темновое дыхание.
Диоксид азота (N02) выделяется вместе с 50г при сжигании
топлива, усиливая ингибирующее действие последнего на
фотосинтез листьев. При совместном действии газов устьица листьев
бобовых быстро закрываются, снижая их проводимость. N02 в
одинаковой мере влияет на фотосинтез и на фотодыхание.
Концентрация СО2 в воздухе повышается одновременно с
загрязнением ее N02 и ^Ог- Обогащение воздуха диоксидом
углерода на фоне загрязнения может частично
противодействовать ингибирующему влиянию как N02, так и совместному
действию N02 и ^02- Таким образом, при повышении
концентрации СО2 либо уменьшается степень открывания устьиц, что
ограничивает поглощение загрязнителей, либо стимулируется
фотосинтез и соответственно повышается устойчивость ткани к
загрязнителям. Однако следует иметь в виду, что того количества
N02 и N0, которое образуется при сжигании углеводов в печах,
используемых для обогащения 02 теплиц, достаточно, чтобы
существенно снизить фотосинтез томата. Монооксид азота,
который может накапливаться при низкой освещенности вследствие
торможения фотохимического превращения в Ог, весьма
токсичен для растений.
Первым проявлением действия озона, загрязнителя
фотохимического происхождения, на хлоропласты бобовых является
снижение активности системы расщепления воды, что
лимитирует перенос электронов в ФСП, а затем транспорт электронов
между фотосистемами. В листьях риса наблюдается также сниже-
547
ние активности РБФ-карбоксилазы:оксигеназы по прошествии
12—24 ч после 2—3-часовой экспозиции в присутствии озона.
Нарушение фотосинтетической активности при действии
различных газообразных загрязнителей в дальнейшем приводит к
нарушению роста и развития растений, снижению в 1,5—2,0 раза
интенсивности транспирации, к значительным потерям урожая и
ухудшению качества сельскохозяйственной продукции. У озимых
культур резко ослабляется морозоустойчивость.
Разнообразна устойчивость отдельных органов и тканей
растения. В большей степени от токсикантов страдают нежные живые
клетки флоэмы, чем клетки ксилемы. Газы неблагоприятно
действуют на развитие корневой системы. Отмечается значительное
уменьшение общей массы корней, а физиологически активных
корней становится в 2—4 раза меньше, скорее всего из-за
нарушения взаимодействия с надземной частью растений.
Газоустойчивость определяется различными
физиологическими и биологическими особенностями организма, на основании
которых Ю. 3. Кулагин (1973) выделил несколько форм
устойчивости у древесных растений, которые вполне можно наблюдать и
у травянистых.
Анатомическая, связанная с особенностями строения
растения, препятствующими проникновению газов.
Физиологическая, основанная на особенностях взаимодействия
внутренних тканей с окружающей средой.
Биохимическая, исключающая повреждение ферментативных
систем и обмена веществ.
Габитуальная, уменьшающая возможность контакта листьев и
цветков с токсичными газами.
Феноритмическая, выделяемая по признаку несовпадения во
времени действия газа и критических периодов вегетации.
Анабиотическая, связанная с состоянием покоя растений
зимой или в летнюю засуху.
Регенерационная, обусловленная способностью побегов к
повторному облиствению, развитию новых побегов.
Популяционная, зависящая от возрастного полиморфизма
популяции.
Фитоценотическая, приобретающая значение в связи с
вертикальной и горизонтальной неоднородностью фитоценоза,
препятствует проникновению газов.
Газоустойчивость у различных растений неодинакова. Она
связана с их систематическим положением: разные семейства, а
также виды и даже сорта растений неодинаково устойчивы и
чувствительны к газам. Так, при действии диоксида серы
особенно сильно повреждается клевер; некоторые сорта тюльпанов и
гладиолусов очень чувствительны к фториду и хлориду водорода
и их можно использовать в качестве биоиндикаторов на
загрязнение среды этими газами. Чрезвычайно чувствительны к 8О2, а
548
также к НР и НС1 мхи, лишайники и некоторые фитопатогенные
грибы. Даже 0,01 % той концентрации 8О2, которая вредна для
высших растений, вызывает у лишайников нарушение дыхания,
разрушение хлорофилла и угнетение роста. Если лишайники
вместе с кусочком коры, на котором они выросли, поместить в
загазованную среду, то по степени их повреждения можно судить
о степени загрязнения воздуха в данном месте. Следовательно,
газочувствительность некоторых организмов можно использовать
для диагностики состояния окружающей среды.
Наряду с высокочувствительными растениями в качестве
биоиндикаторов можно использовать и газоустойчивые растения из
числа тех, которые способны накапливать вредные вещества в
значительных количествах (аккумуляторные индикаторы).
Обнаружить действие диоксида серы, фторида и хлорида водорода на
растения по аккумуляторным индикаторам можно с помощью
химического анализа на содержание этих элементов в органах
индикаторных растений.
Реакция одних и тех же растений на различные газы
неодинакова. Например, кукуруза очень чувствительна к острому
воздействию НР и крайне устойчива к острому воздействию 8О2;
фасоль, томат, шпинат чувствительны к воздействию
азотсодержащих газов и относительно устойчивы к острому воздействию НР;
капуста, тыква, лук устойчивы к азотсодержащим газам и
неустойчивы к НР и 802-
Общими фенотипическими признаками повреждения
растений являются некрозы и хлороз листьев, дальнейшее их
отмирание и преждевременный листопад. Однако по этим признакам
трудно определить, каким именно токсикантом повреждено
растение, так как в целом картина изменений довольно
неспецифична. Действие токсичного вещества зависит от дозы, которая
равна произведению концентрации токсиканта на длительность
его воздействия. Доза того или иного газа в окружающей среде
определяется стандартами по контролю за загрязнением воздуха,
которые учитывают и концентрацию вредного газа, и время его
действия на растения. В разных странах и зонах эти стандарты
различны.
На токсичность газов большое влияние оказывают факторы
внешней среды, особенно влажность воздуха. Например, при
высокой концентрации 8О2 в 'воздухе увеличение влажности
среды приводит к образованию сернистой, а затем и серной
кислот, в результате чего токсичность 8О2 значительно
усиливается. Безветрие также может усилить отрицательное действие
газов из-за высокой их концентрации в среде.
Для снижения токсического действия газообразных
загрязнителей можно рекомендовать посадки устойчивых к газам пород
деревьев. Чаще всего используют такие устойчивые породы, как
тополь, липа мелколистная, клен ясенелистный, бузина, жимо-
549
лость. Для зоны среднего поражения кроме перечисленных
пород можно использовать березу пушистую, различные виды
клена, рябину, черемуху, акацию. Для зоны слабого
поражения — еще и дуб, лиственницу, сосну.
8.12. ДЕЙСТВИЕ РАДИАЦИИ НА РАСТЕНИЯ
Развитие ядерной энергетики сопровождается увеличением
количества радиоактивных отходов, с которыми нужно
непрерывно бороться, как и с другими опасными загрязнителями.
Излучение с очень высокой энергией, способное отнимать
электроны от атомов и присоединять их к другим атомам с
образованием пар положительных и отрицательных ионов,
называют ионизирующим излучением. Источником ионизирующего
излучения служат радиоактивные вещества. Те изотопы элементов,
которые испускают ионизирующее излучение, называют
радиоактивными изотопами.
Радиоактивные вещества способны испускать альфа-, бета- и
гамма-лучи. Радиоактивные вещества, испускающие гамма-лучи,
относят к «внешним излучателям», так как это проникающее
излучение, которое может оказывать действие, когда его
источник находится вне организма. К гамма-лучам близко и
рентгеновское излучение.
Альфа- и бета-излучения состоят из потока атомных и
субатомных частиц, которые передают свою энергетику всему, с чем
сталкиваются. Биологи нередко называют эти частицы
«внутренними излучателями», так как они обладают большим эффектом,
оказавшись внутри или вблизи живой ткани.
Каждый радиоактивный изотоп характеризуется определенной
атомной массой и распадается с определенной скоростью. Эту
скорость называют периодом полураспада. Период полураспада —
величина постоянная для данного изотопа, она не зависит от
факторов внешней среды. Крайне «короткоживущие»
радионуклиды не оказывают никакого влияния на живьге системы в
отличие от «долгоживущих» радионуклидов.
Проникающая сила излучения зависит от его энергии. Чем
выше энергия, тем больше потенциальный ущерб для
биологического материала. С точки зрения отрицательного действия на
живые системы наиболее опасными считаются изотопы таких
элементов, как 60Со, 1311, 908г, 210РЬ, 23811 и др., периоды
полураспада которых довольно длительные — от 8 дней у йода до 28
лет у стронция.
Ионизирующее излучение, испускаемое природными
веществами, содержащимися в воде, почве, образуют так называемое
фоновое излучение, к которому адаптированы живые организмы.
В разных частях биосферы естественный фон различается в 3—4
550
раза. Но развитие ядерной энергетики во всем мире, различные
испытания ядерного оружия, катастрофы, связанные с
излучением, привели и продолжают приводить к искусственной
радиоактивности, которая добавляется к фону и приводит к
непредсказуемым по силе воздействия на все живое на Земле последствиям.
Разные виды организмов сильно различаются по своей
чувствительности к дозам облучения. Размеры повреждающего
действия облучения на растения зависят от дозы и характера
облучения. Наибольший вред причиняет внутреннее облучение
растений, когда радиоактивные альфа- и бета-частицы поступают в
него через корни и листья. При этом радиоактивные вещества
действуют на отдельные молекулы, макромолекулы,
субклеточные структуры, клетки, ткани, органы и целый растительный
организм, вызывая нарушения физиологических и
биохимических процессов.
В зависимости от дозы облучения процессы,
обусловливающие синтез важных составных частей клеток, замедляются или
прекращаются.
Один из ведущих радиобиологов А. М. Кузин (1956) считает,
что в лучевом поражении клеток большую роль играют
образующиеся при радиационном воздействии токсичные продукты
окисления биосубстратов и ненасыщенных жирных кислот
(радиотоксины). Образующиеся при облучении водорастворимые, а
также липоидные радиотоксины взаимодействуют с
генетическими структурами и мембранами и, таким образом, играют важную
роль в развитии лучевого поражения клетки.
Радиотоксины способны активно реагировать с ДНК и
действовать на внутренние мембраны клеток, вызывая мутагенные
эффекты. При воздействии на мембраны митохондрий
возникают нарушения в окислительно-восстановительных процессах,
сопряженных с реакциями окислительного фосфорилирования.
Предполагается, что липоидные радиотоксины действуют в
основном на мембраны, а хиноидные радиотоксины реагируют с
ДНК ядра, вызывая нарушение в ней информации.
У высших растений чувствительность к ионизирующему
облучению прямо пропорциональна размеру ядра, а точнее, объему
хромосом или содержанию ДНК. Растения с большим объемом
хромосом гибнут при дозе в 5—10 раз ниже, чем растения с
мелкими хромосомами или малым их количеством. Установлено,
что растения с малым числом хромосом и крупными ядрами
более чувствительны к облучению, чем полиплоиды и растения с
большим числом хромосом и мелкими ядрами. Такая
зависимость свидетельствует о том, что при увеличении хромосомной
«мишени» вероятность прямого попадания атомных «выстрелов»
повышается.
Первичное действие излучения на генетический материал
приводит к разрыву хромосом, в результате чего образуются
551
фрагменты, а затем и перекомбинации, вызывающие появление
хромосомных перестроек. Более сильное воздействие радиации
приводит к прекращению митозов и сильному повреждению
ядер.
Радиочувствительность растительного организма изменяется в
широком интервале доз облучения и зависит от его
биологических особенностей, возраста, физиологического состояния,
интенсивности обмена веществ. Чувствительность клеток при
облучении зависит от температуры, парциального давления
кислорода, цикла деления, метаболического состояния, оводненности и
интенсивности митозов.
В пределах одного вида растений радиочувствительность
может зависеть от изменения объема ядер в течение цикла
развития растительного организма.
На реакцию растений сильно влияет характер облучения.
Повреждения растений при остром облучении обычно наступают
при»меньших дозах, чем при хроническом облучении. При
хроническом облучении важное значение имеет общая доза,
накопленная за митотический цикл, на продолжительность которого, в
свою очередь, влияет температура окружающей среды. При более
высокой температуре клетки делятся быстрее, а при
пониженной — медленнее. В зависимости от температуры изменяются
длительность митотического цикла и общая доза хронического
облучения.
Действие излучения на растения зависит также от фазы
развития растения. У зерновых, например, в результате облучения во
время кущения сильно поражаются генеративные органы.
Образовавшиеся колосья в значительной степени оказываются
стерильными, а зерно — щуплым. При повреждении
репродуктивных органов и высокой стерильности колосьев отмечается
сильное кущение и у большинства таких растений стебли не
образуются, угнетается рост корневой системы. При облучении
растений в течение всего вегетационного периода генеративные
органы вообще не образуются. Такие же изменения обнаружены
и у двудольных растений (горох, фасоль, бобы и др.).
С возрастом у растений повышается устойчивость к
радиационному повреждению. При облучении растений пшеницы в
период всходов урожай снижается на 53 %, кущения — на 23 %, а
во время созревания снижения не обнаруживается. При
облучении картофеля перед бутонизацией клубни не образуются, а при
облучении в период цветения урожай снижается на 32 %.
Семена наиболее устойчивы, чем целые растения.
Наблюдается довольно тесная связь между радиочувствительностью сухих
семян при остром облучении, объемом ядер клеток и числом
хромосом при условии одинакового содержания в них воды.
При облучении семян различных культур оказалось, что наи-
552
1
более чувствительны к облучению семена крестоцветных, а более
устойчивы семена овса, люпина, клевера, льна.
Ионизирующее излучение радиоактивных изотопов может не
оказать повреждающего действия на урожай материнского
растения. Однако отрицательное влияние накопленных
радионуклидов в семенах может проявиться на последующих поколениях.
Обобщая изложенное, можно сказать, что ионизирующая
радиация прежде всего действует на генетический аппарат клеток
растений. При этом у растений наблюдаются сильнейшие
мутации, отмечаются интенсивный рост биомассы, несоразмерное
увеличение плодов и другие явления. Но особенно опасно, когда
радионуклиды накапливаются в плодах и семенах растений.
Помимо этого облучение приводит к сильнейшему загрязнению
почвы, которую нельзя использовать под сельскохозяйственные
культуры довольно длительное время.
Поддержание стабильности генетического аппарата в клетках
растений — главное условие для выживания и адаптации их к
радиационному облучению.
8.13. АЛЛЕЛОПАТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ В ЦЕНОЗЕ
В агрономической науке понятие «урожайность», или в более
широком смысле «продуктивность», относится к посеву или
ценозу, т. е. искусственно сформированному сообществу
растительных организмов. В сравнении с единичным растением ценоз
представляет собой новый уровень организации живой материи с
очень сложной системой взаимодействия между составляющими
ее элементами.
При формировании ценоза в нем происходят изменения
среды, вызванные непосредственным потреблением
материально-энергетических ресурсов, не связанные с этим косвенные
изменения микроклимата, а также изменения за счет выделения
продуктов жизнедеятельности в виде метаболитов, опада и
различных остатков.
Таким образом, взаимодействие растений при совместном
произрастании связано с использованием абиогенных факторов,
за счет чего могут создаваться условия, которые по отношению к
растениям в отсутствие взаимодействия могут быть оценены как
благоприятные («сотрудничество», «взаимопомощь»),
индифферентные или неблагоприятные (конкуренция). Вся
агрономическая практика направлена на получение высокой продуктивности
посева в основном за счет создания благоприятных условий
роста и развития: достаточного минерального питания,
водоснабжения, режима обеспечения Ог и СО2, т. е. регулирования
абиогенных факторов.
Однако для жизнедеятельности ценоза не менее значима со-
553
вокупность влияний, оказываемых одними организмами на
другие, т. е. влияние биотических факторов. К ним относятся
действие болезней, вредителей, а также изменение среды обитания
в результате выделения химических веществ всеми участниками
сообщества, т. е. так называемые аллелопатические
взаимодействия.
Значение аллелопатических взаимодействий в ценозе связано
с количественным и качественным составом выделений живых
растений или их отмерших частей, а также микроорганизмов,
т. е. с той биохимической обстановкой, которая создается вокруг
организмов на протяжении жизни.
Таким образом, аллелопатией следует называть прямое или
косвенное влияние одного растения на другое путем образования
химических соединений, выделяемых в окружающую среду. Эф
фект в явлениях аллелопатии зависит от химических соединений,
выделяемых в среду, в отличие от конкуренции, когда
происходит полное или частичное изъятие некоторого фактора,
необходимого другому растению (вода, минеральные вещества, свет и
др).
Все сказанное относится не только к посевам
сельскохозяйственных культур, но и в большей степени к естественным фито-
ценозам. Если в первом случае возможно ослабление
отрицательного действия разного рода веществ за счет агротехники, то
во втором влияние растительности друг на друга обусловлено
часто не столько конкуренцией, сколько аллелопатией.
Взаимодействие растений между собой установлено с
незапамятных времен. История науки о взаимодействии растений через
выделения различных веществ начинается с работ А. Декандоля
(1832). Он предположил, что корневые выделения растений
могут причинять вред этому же виду и другим видам, в
частности, выделения сорняков подавляют рост культурных растений.
Большой вклад в развитие этой проблемы внесли работы
австрийского физиолога Г. Молиша, который в 1937 г. предложил
термин «аллелопатия». Этот термин происходит от греческих
слов, означающих «взаимное страдание», хотя автор имел в виду
как вредное, так и благоприятное биохимическое
взаимодействие.
Наиболее впечатляющим является пример токсичности
выделений ореха черного, под кроной которого или вблизи нее не
растет ни одна полевая культура, завядают картофель, томат,
подавляется рост яблони.
Вблизи полыни испытывают угнетение многие виды
растений. Истощение почвы при монокультуре пшеницы, овса также
связано с аллелопатическим действием веществ, выделяемых в
почву из растений.
Развитие работ по аллелопатии полностью подтвердило факт
химического взаимодействия растений и позволило установить,
554
что выделяются не только побочные продукты (как у животных),
но и продукты нормальной жизнедеятельности, так как авто-
трофные растения, по-видимому, с избытком покрывают свои-
энергетические потребности за счет фотосинтеза, а развитие
большой листовой поверхности и корней неизбежно влечет
потерю в пространство компонентов живой протоплазмы — твердых,
жидких и газообразных веществ (экскреторная функция). Нельзя
недооценивать и специальную выделительную деятельность
растений (секреторная функция).
Способностью к выделительной деятельности обладают все
органы растений: корни, листья, стебли, плоды и семена. По
оценке А. М. Гродзинского, общее количество корневых
выделений составляет 3—4 т/га за сезон, что равно половине всего
органического вещества, накапливаемого растениями за это
время в корнях. Различна и степень физиологической
активности выделяемых веществ. Наиболее активные вещества
выделяются из надземной части, особенно листьев, затем стеблей и
наименее активные — из корней.
Принцип аллелопатического действия растений, вещества и
факторы внешней среды, участвующие в этом процессе,
показаны на рисунке 146. На рисунке обозначено: донор — растение, о
выделении которого идет речь; акцептор — растение,
находящееся под воздействием изучаемых выделений. Естественно, что в
случае пары растений каждое из них одновременно является
донором и акцептором.
Выделения растений могут быть в виде газа или водного
раствора, поэтому для аллелопатии существенное значение
имеют два типа веществ — водорастворимые и летучие. К
летучим веществам относятся те, которые в биологическом
интервале температур способны существовать в виде газа, пара,
аэрозолей или пыли.
Выделения растений можно подразделить на прижизненные и
посмертные, происходящие в результате отмирания организма
или отдельных его частей. Прижизненные выделения, в свою
очередь, можно разделить на активные и пассивные. Активные
обусловлены нормальной жизнедеятельностью растений, а
пассивные — вымыванием веществ из листьев с осадками и т. д.
Летучие выделения подразделяются на три типа: фитогенные,
т. е. активные, отчасти пассивные выделения неповрежденных
органов растений; фитонциды — выделения поврежденных
тканей, возникающие вследствие нарушения целостности
вместилищ веществ и автолиза; миазмины — выделения из отмерших
гниющих тканей (от греч. гшазтоз — скверна). Водорастворимые
выделения также делятся на три типа: активные, или экссудаты;
пассивные, или диффузаты; посмертные, или сапролины (от
греч. заргоз — гнилой).
Таким образом, в задачу аллелопатии входит изучение образо-
555
Растение-донор
Миазмины
Фитонцидные
.. вещества
Фщпоеенные
вещества
Активные
прижизненные
выделения
Пассивные
прижизненные
выделения
Посмертные
выделения
Растение-
акцептор
Потери 6 почву
Рис. 146. Схема аллелопатий (А. М. Гродзинский, 1965)
вания физиологически активных веществ в растениях, выделения
этих веществ в среду, их превращения по пути от одного
партнера к другому и, наконец, действия активных веществ на
растение-акцептор.
Для обозначения химических веществ, участвующих в аллело-
патических взаимодействиях на разных уровнях, приняты
следующие термины: колины — вещества, выделяемые высшими
растениями и действующие на высшие растения; фитонциды —
ингибиторы, продуцируемые высшими растениями и действующие
на микроорганизмы; маразмины — вещества, выделяемые
микроорганизмами и вредные для высших растений; антибиотики —
556
йнгиотп
сторы, продуцируемые микроорганизмами и действующие
на микроорганизмы.
Аллелопатию можно охарактеризовать как круговорот
физиологически активных веществ в биогеоценозе.
Благодаря прижизненным вьщелениям веществ из различных
органов растений, а также разложению отмерших частей
гетеротрофных организмов в почве вокруг растения на протяжении
всей жизни создается определенная биохимическая обстановка,
своеобразная «аура» из активных веществ, благотворно или
отрицательно действующих на него и на другие организмы.
Уже упоминалось, что вещества могут выделяться различными
органами растений, среди которых есть и семена. Во время
формирования семян в них откладываются не только запасы
питательных веществ для будущего прорастания, но и вещества,
тормозящие прорастание, а также антимикробные агенты, в
качестве которых выступают одновременно и тормозители роста.
По-видимому, тормозители обеспечивают, во-первых, задержку
прорастания в нежелательное с биологической точки зрения
время, во-вторых, подавляют рост других растений, обеспечивая
себе преимущество, в-третьих, создают благоприятную
обстановку, подавляя деятельность микроорганизмов. Большинство
культурных растений относится к однолетникам. Они часто не имеют
периода покоя и не содержат ингибиторов прорастания, но
антимикробные вещества присутствуют в семенах или синтезируются
во время прорастания. В этом, по-видимому, заключается
наиболее важная с экологической точки зрения роль аллелопатий в
жизни однолетников и значительной части многолетников,
растущих в естественных условиях.
Исследования А. М. Гродзинского показали, что среди 827
видов из 62 семейств наличие веществ-тормозителей отмечено у
всех семейств. Наибольшим содержанием отличались
представители семейств лютиковых, розоцветных, наименьшим — семейств
сосновых, льновых, злаковых, амарантовых и др.
Среди веществ-тормозителей, выделенных из семян,
обнаружены ди- и трикарбоновые кислоты, аминокислоты,
ненасыщенные ароматические кислоты (кофейная, коричная), альдегиды,
ненасыщенные лактоны — кумарин, скополетин и многие
другие. Таким образом, речь идет не об индивидуальном веществе,
а о комплексном биохимическом явлении.
По данным Э. Раиса, в 512 видах семян из 88 семейств
антибактериальные вещества обнаружены у семян и плодов 52 видов,
относящихся к 19 семействам. Антимикробным веществом
является горчичное масло в семенах капусты, которое ядовито и для
грибов. Для микрофлоры токсичны алкалоиды и различные фе-
нольные соединения.
Вещества-тормозители содержатся и в сочных плодах. Так, в
плодах тыквенных они создают условия вынужденного покоя
557
семян до разрушения плода и обеспечивают торможение роста
других семян при своем разложении в почве.
Подобный механизм использования тормозителей
прорастания, способствующий борьбе за существование, присущ многим
другим сочным и сухим плодам. Из семян свеклы
экстрагируются такие сильные вещества-тормозители, что на месте хранения
кучи семян несколько лет не растет трава. В присутствии
соплодий свеклы (в опытах на фильтровальной бумаге) не прорастают
семена сорняка куколя, возможно с этим явлением связано его
отсутствие в посевах свеклы.
Среди активных прижизненных выделений из листьев и
других прижизненных органов наиболее важны гуттация, экскреция
газообразных веществ и выделение твердых продуктов,
смываемых затем осадками. К гуттации способны многие виды
растений. Наиболее склонны к ней многие сельскохозяйственные
культуры из семейств злаковых, гречишных, зонтичных,
губоцветных, тыквенных, пасленовых, бобовых и некоторых других.
В посевах озимой пшеницы, овса, ячменя от кущения до выхода
в трубку гуттация настолько обильна, что ее можно сравнить с
дождем. Очень обильна гуттация у риса.
Аллелопатическое значение гуттации можно представить
следующим образом. Капли, появлющиеся на листьях, стряхиваются
ветром на почву, на расположенные ниже листья, где высыхают
или впитываются ими. Таким способом может происходить
передача физиологически активных веществ от одного растения
к другому и осуществляться химическое взаимодействие. По
расчетам А. М. Гродзинского, суточное выделение органических
веществ при гуттации может составлять 10—15 кг/га и более.
В гуттационной жидкости содержатся минеральные и
органические вещества. Чаще всего встречаются ионы Са и N03, а
также глутаминовая кислота, обнаруживаются и ферменты. С
гуттационной водой могут выделяться вещества, усвоенные
корнями; так, у пшеницы выделяются антибиотики, у галофитов —
избыток солей, что даже вызывает засоление под деревьями.
Состав гуттационной жидкости может изменяться от условий
среды.
Важное экологическое и аллелопатическое значение имеют
кутикулярные экскреты из листьев, появляющиеся на их
поверхности и смываемые осадками, и вещества, выщелачивающиеся
из живых клеток листа. Особенно легко кутикулярно удаляются
из листьев калий, натрий, марганец и другие элементы. Есть
данные, что листья за вегетационный период теряют больше
калия, чем его содержится в урожае.
Из органических соединений, которые составляют 40—60 %
общего сухого остатка, смытого с листьев, отмечено выделение
алкалоидов (табак). Отмечено уменьшение содержания Сахаров и
фитогормонов в листьях деревьев после дождей, что связывают с
558
их вымыванием. У многих видов растений выделение Сахаров в
больших количествах («медвяная роса») наблюдается в жаркую
погоду. Эта «медвяная роса» содержит глюкозу, фруктозу,
декстрины и азотистые вещества и производит сильное
аллелопатическое действие. Так, после появления пади наблюдается полное
исчезновение сорняка сныти. Из смывов листьев хризантемы
выделяются токсины (по-видимому, фенольные соединения),
которые полностью подавляют прорастание семян салата-латука, а
также вызывают самоинтоксикацию этой культуры при
длительном выращивании на одном месте. Из хризантемы вымываются
гиббереллины, которые в зависимости от концентрации
стимулируют или подавляют рост и цветение растений.
В состав корневых выделений входят минеральные и
органические вещества. Наблюдается это явление как вследствие
обычной диффузии, отмирания и слущивания некоторых покровных
тканей, так и активного нормального физиологического
выделения веществ в среду, которое усиливается при неблагоприятных
условиях. В выделениях корней содержится много органических
веществ, которые представлены щавелевой, янтарной, пировино-
градной, яблочной и другими кислотами цикла Кребса, а также
большой набор азотистых соединений (различные
аминокислоты, аммиак, аминосахара) и Сахаров, особенно у молодых
растений.
Особое значение для взаимного влияния высших растений
имеет выделение корнями различных биологически активных
веществ, в частности ферментов, витаминов, алкалоидов,
антибиотиков, естественных и искусственных ростовых веществ.
Наличие ферментов в среде корневого питания растений имеет
большое аллелопатические значение.
То же относится и к гликозидам. Например, установлено, что
корни люцерны выделяют в почву в значительном количестве
сапонины, которые приводят к изреживанию травостоя самой
люцерны и ухудшают рост последующей культуры (хлопчатника).
В почву выделяются такие тормозители роста, как кумарин.
Физиологическое действие корневых выделений заключается
в первую очередь в изменении метаболизма корней акцепторных
растений, в ускорении или замедлении поступления воды и
питательных веществ. Проникая в растения, физиологически
активные выделения оказывают многообразное влияние на обмен
веществ, который выражается в общем усилении или замедлении
ростовых процессов. С другой стороны, корневые выделения
оказывают косвенное воздействие на физиологию растений через
изменения микрофлоры почвы. Особой токсичностью в
биотестах характеризовались корневые выделения костреца безостого,
пырея ползучего, гороха, желтого и синего люпина, осота
колючего, овса, пшеницы, ржи и ячменя. Корневые выделения
кукурузы оказались почти безвредными.
559
Значение закономерностей химического взаимодействия
растений полезно для борьбы с сорной растительностью, поскольку
сорняки вступают не только в конкурентные отношения с
культурными растениями за пищу, воду, свет, но и способны
угнетать их за счет выделения ингибиторов роста из корней или
надземной части. !
Наблюдения за поведением культурных растений в
присутствии сорняков относятся к началу XIX в. А. Декандоль заметил,
что бодяк вредит растениям овса, скабиоза неблагоприятна для
льна, а райграс пастбищный — для пшеницы.
Известно, что урожай льна сильно снижается даже при
незначительном засорении полей рыжиком льняным. Оказалось, что
листья рыжика выделяют сильные ингибиторы роста, которые
попадают при дождевании в почву и действуют на близрастущие
растения льна. Водные экстракты из подмаренника мягкого даже
при очень большом разбавлении подавляют прорастание
пшеницы (на 18—100 %) и редиса (на 19—42 %). Экстракт в разведении
.1:10 и 1:500 замедляет рост подсолнечника на 10—100 %, а также
подавляет развитие луковиц и корней лука. Подавление роста и
снижение урожая кукурузы щетинником гигантским также
обусловлены аллелопатическим взаимодействием.
Но возможно и обратное влияние культурных растений на
сорняки, в этом случае фитотоксины можно рассматривать как
естественные гербициды. Такие культурные растения, как
пшеница, овес, горох, гречиха, подавляют рост, снижают биомассу
надземной части и поверхности листьев мари белой. Овес,
особенно в период цветения, наиболее сильно влиял на эти
показатели, при этом установлено, что у мари не снижалось
поглощение азота, фосфора и калия.
В систему борьбы с сорняками необходимо ввести «аллелопа-
тическую прополку», заключающуюся в применении против
определенных сорняков их аллелопатических антагонистов.
Известно, что рожь способна сократить засоренность полей овсюгом; ее
используют и против пырея. Изучение фитоценотической роли
крестоцветных в фитоценозах показало, что они характеризуются
высоким содержанием серусодержащих веществ, горчичных
масел, гликозидов, индольных веществ и других физиологически
активных соединений. Крестоцветные оказались
благоприятными промежуточными культурами, обеспечивающими санитарную
очистку полей севооборота от сорняков (в пожнивных посевах
после зерновых засоренность снижается на 90—95 %),
вредителей, возбудителей болезней.
Видовой состав сорняков для каждой культуры определяется
также аллелопатическим взаимодействием.
Основным критерием присутствия и эффективности того или
иного аллелопатически действующего вещества обычно служит
увеличение размера и массы тест-объекта, что определяется в
560
конечном счете делением и растяжением клеток. Поэтому один
из механизмов действия ингибиторов, выделенных растением,
связан с влиянием их на эти процессы. Например, кумарин
блокирует митоз в корнях лука и лилии. Колхицин разрушает
веретена, стимулирует накопление метафазных ядер, которые не
могут перейти в анафазу. Из-за нарушения митоза образуются
тетраплоидные ядра и двухъядерные клетки. Аналогично
действуют и такие вещества, как парасорбиновая кислота, которая
тоже вызывает накопление метафазных ядер. Летучие терпены
полностью ингибируют митоз в корнях проростков тыквы,
подавляют растяжение клеток как в корнях, так и в гипокотилях.
Многие фенольные соединения, выделяемые растениями,
являются антагонистами ИУК и гиббереллина.
Имеются данные о том, что многие соединения, выделяемые
растениями, влияют на поглощение минеральных веществ други- „
ми растениями. Предполагают, например, что сахарная свекла
выделяет в почву токсичное вещество, препятствующее
поглощению цинка другими растениями. Отмечено, что после сахарной
свеклы кукуруза и фасоль сильно страдают от нехватки цинка,
хотя в почве этого элемента было достаточно. Есть сведения о
том, что растения, произрастающие в сообществах, оказывают
влияние на поглощение фосфора соседними растениями. В
частности, фасоль в сообществе с такими сорняками, как щирица
или щетинник зеленый, снижала поступление фосфора в эти
сорняки. Однако при этом сорняки в меньшей степени снижали
поступление фосфора у фасоли, чем сама фасоль. При
совместном выращивании кукурузы и гороха в водной культуре
поглощается больше N. Р и К, чем при раздельном их выращивании.
У кукурузы ускорялось поступление элементов минерального
питания в надземную часть, а у гороха замедлялось поступление в
подземные органы по сравнению с раздельным выращиванием.
Предполагается, что корневые выделения влияли на поглощение
элементов минерального питания.
Выделяемые растениями вещества оказывают влияние и на
другие физиологические процессы. Однако эта область еще не
достаточно изучена по сравнению с другими направлениями
физиологии растений. Явления аллелопатии могут иметь
существенное значение при разработке систем выращивания растений
без применения химических средств борьбы с сорняками, так
как фитотоксины культурных растений могут быть
естественными гербицидами.
Однако и в настоящее время, несмотря на довольно
длительное изучение аллелопатии растений, в большинстве случаев
выделяемые вещества остаются неидентифицированными, часто
трудно отделить их прямое действие от косвенного, мало
известно о количестве выделений тех или иных веществ, сложно
оценить их выделение во времени.
561
8.14. ДЕЙСТВИЕ ПЕСТИЦИДОВ НА РАСТЕНИЯ
К биотическим факторам, действующим в ценозе и
оказывающим влияние на рост, развитие и конечную урожайность
растений, наряду с аллелопатическими воздействиями относятся
вредители и болезни.
Кроме агротехнических приемов, снижающих вредное
действие этих факторов, необходимо применение химических мер
борьбы.
Химические вещества (органические и неорганические
соединения), используемые для борьбы с вредными организмами,
повреждающими растения, а также с сорняками, называют
пестицидами. Основой применения различных пестицидов является
разная чувствительность к ним объектов, обусловленная
различной степенью проницаемости поверхности покровов и
особенностями обмена веществ. Таким образом, способность
пестицидов действовать на одни живые организмы без нанесения вреда
другим позволяет широко применять их для защиты растений.
Различного рода пестициды для борьбы с сорняками,
называемые гербицидами, чаще всего одинаково фитонцидны как для
сорняков, так и для защищаемой культуры, поэтому их
применение основано на разной чувствительности к гербицидам в разные
фазы развития. Так, гербициды вносят в почву до посева, во
время посева или до всходов основной культуры, когда она еще
не подвергается их действию. В случае применения гербицидов
на вегетирующйх растениях возможность сохранения основной
культуры также основана на некоторых особенностях
метаболизма культурных растений, способных к детоксикации
поступающих ядов, или их инактивации.
В основе устойчивости разных видов и сортов растений лежат
их биохимические реакции обмена веществ и различия в
физиологической реакции. Среди растений нет ни одной
систематической группы (класс, семейство, род), в которой все
представители были бы одинаково устойчивы. Даже в пределах вида
отдельные сорта растений по отношению к пестицидам могут
вести себя по-разному. Так, двойные межлинейные гибриды
кукурузы значительно более устойчивы к гербициду 2,4-Д, чем
простые гибриды или: самоопыленные линии. Обнаружены
различия в химической реакции на обработку гербицидами у
картофеля, гороха, льна, люпина, сахарной свеклы, табака, плодовых
и ягодных культур. В целом пестициды проявляют большую
избирательность действия по отношению к защищаемым
растениям, что и позволяет применять их для борьбы с вредными
организмами.
Пестицид может легко проникать в растения через корни,
особенно при проведении предпосевной обработки семян или
если он был внесен в почву. Пестициды проникают в корни,
562
несмотря на слабую растворимость в воде, так как они легко
растворяются в липидах мембран.
Поглощение пестицидов происходит, очевидно, так же, как и
поглощение питательных веществ, в результате диффузии,
обменной адсорбции и активного переноса молекул и ионов. Этот
процесс может носить пассивный характер, когда
адсорбированные на поверхности корней ионы и молекулы пестицидов
проникают в неизмененном виде в свободное пространство клеток и
дальше продвигаются с током воды по проводящим сосудам в
клетки тканей надземных органов. Одновременно пестициды
могут поступать и метаболическим путем, когда,
адсорбированные на внешней поверхности цитоплазмы клеток корней, они
сразу вовлекаются в интенсивный обмен. В результате
биохимической реакции пестициды могут необратимо разрушаться или
образовывать комплексы с компонентами клеток. Интенсивность
поступления пестицидов через корни повышается с увеличением
дозы.
При обработке вегетирующйх растений пестициды проникают
главным образом через листья (кутикулярно или устьично) в
виде жидкости или паров. Проникновение через кутикулу во
многом зависит от анатомо-морфологических особенностей
покровных тканей. Кутикула покрывает всю поверхность листа в
виде сплошной пленки и служит главным препятствием на пути
проникновения пестицидов в лист. Она характеризуется
отрицательным зарядом и способна поглощать воду, ее матрикс имеет
липофильные вещества, через него и могут проникать липофиль-
ные пестициды. Эндосперм кутикулы — один из возможных
путей проникновения гидрофильных соединений.
Проникновение пестицидов в листья после их кристаллизации прекращается.
Известны как полярный (водный), неполярный (липоидный)
пути поступления этих веществ в протопласт листа, так и
комбинированный.
Проникновение пестицидов через кутикулу определяется их
растворимостью в воде или отдельных компонентах кутикулы
клеточной оболочки и зависит от степени их полярности.
Кутикула хорошо проницаема для масел, поэтому многие
растворимые в масле препараты легко проникают через нее. Далее
пестициды диффузным путем проникают через клеточную оболочку и
адсорбируются плазмалеммой. Благодаря особым свойствам
мембран и вследствие десорбции или пиноцетоза адсорбированные
молекулы пестицидов десорбируются в цитоплазму. Это
метаболический процесс, в котором источником необходимой энергии
являются дыхание и фотосинтез.
Пестициды проникают в листья и через открытые устьица,
так как последние способны легко пропускать пары пестицидов
из растворов, которыми опрыскивают растения, а также водные
и масляные растворы и эмульсии с низким поверхностным натя-
563
жением. Поступление препарата возможно также
непосредственно через кору и покровные ткани стебля.
Пестициды, поглощенные растениями, могут передвигаться в
нем по флоэме, лучевой паренхиме, клеточным стенкам, по
ксилеме с транспирационным током и по межклетникам.
Пестициды перемещаются в основном в быстрорастущие
части растения. Скорость распространения их различна.
Довольно быстро передвигается по сосудистой системе гексахлоран,
многие гербициды и некоторые фунгициды. Скорость
передвижения препаратов совпадает со скоростью движения эндогенных
вешеств по флоэме и ксилеме.
Пестициды под действием ферментных систем подвергаются
метаболическим изменениям. Скорость метаболических
превращений зависит от свойств препарата и возрастных особенностей
культуры. В молодых растениях этот процесс идет быстрее, чем
в старых, что объясняется высокой физиологической
активностью первых.
В молодых тканях в связи с усиленной метаболической
деятельностью преобладают синтетические процессы. При этом
повышается содержание биокатализаторов и веществ высокой
физиологической активности (ферментов, гормонов, витаминов).
Активная форма этих соединений взаимодействует с
пестицидами, вызывая их изменения.
В старых тканях преобладают гидролитические процессы,
связанные с разложением органических и образованием
низкомолекулярных соединений, вследствие чего не создаются
благоприятные условия для интоксикации пестицидов.
Различные пестициды метаболизируются в растениях
по-разному. Одно и то же вещество может вовлекаться в различные
реакции, в результате чего образуется множество разнообразных
продуктов метаболизма. На первом этапе могут образоваться
даже более токсичные соединения, чем исходные.
Пестициды в растениях способны образовывать и липофиль-
ные конъюгаты с различными соединениями. Так, достаточно
стабильные конъюгаты с углеводами растений обнаружены для
большинства пестицидов или их метаболитов, в том числе для
синтетических перметроидов (перметрин, циперметрин), триази-
нов, производных мочевины, карбаминовой кислоты,
ароматических карбоновых кислот. Пестициды образуют конъюгаты
также с аминокислотами. В большинстве случаев конъюгаты с
сахарами и аминокислотами менее токсичны, чем исходные
химические соединения. Однако известны и обратные случаи.
Конъюгаты многих пестицидов и их метаболиты менее
подвижны и могут сохраняться в растениях длительное время,
иногда до полного созревания урожая. Применение таких
препаратов должно быть строго регламентировано, чтобы в
растениях оставалось возможно меньшее их количество. Предпочтитель-
564
ны пестициды, которые быстро разлагаются с образованием
нетоксичных соединений. На поверхности растений разложение
пестицидов, как правило, происходит быстрее, чем на почве.
Для санитарного контроля за остатками в пищевых продуктах
утверждается ПДК — предельно допустимая концентрация
содержания остатков пестицидов. ПДК устанавливается на основании
результатов опытов по изучению токсичности пестицидов на
животных и определения их остатков в той или иной культуре.
8.15. ТЕСТЫ УСТОЙЧИВОСТИ РАСТЕНИЙ
Одной из главных причин снижения урожайности
высокопродуктивных сельскохозяйственных растений является их
недостаточная устойчивость к неблагоприятным факторам среды.
Поэтому чрезвычайно важно знать основные показатели, которые
могут характеризовать устойчивость растений к тем или иным
неблагоприятным факторам среды. Важность такой постановки
вопроса очевидна, так как ведение современного сельского
хозяйства требует от специалистов знания не только теоретических
основ проблемы, но и умения применять различные
физиологические характеристики состояния растений в экстремальных
условиях.
Для определения устойчивости растений к неблагоприятным
факторам среды используют разнообразные методы. Это в
первую очередь визуальная диагностика состояния растений: высота
растения, кустистость, темпы роста, формирование листового
аппарата, окраска листьев и т. д. Как правило, такие показатели
используют при прямых полевых или вегетационных методах
выращивания. Однако трудоемкость и продолжительность
прямых методов вызвали необходимость разработки лабораторных
методов диагностики устойчивости растений. В основе этих
методов лежат изменения физиологических и биохимических
процессов, происходящих в растениях.
В зависимости от вида действующего фактора можно
выделить такие показатели, как водоудерживающая способность
растений, содержание свободной и связанной воды, эластичность и
вязкость протоплазмы. Для определения засухоустойчивости
растений применяют метод крахмальной пробы, определение
выхода электролитов из тканей растений и содержания статолитного
крахмала, устойчивость пигментного комплекса, скорость
движения цитоплазмы.
При диагностике холодостойкости и морозоустойчивости
используют содержание углеводов, активность (З-фруктонозидазы,
степень склерификации узла кущения, изменение
электропроводности тканей, биопотенциалов и увеличение сродства к
красителям.
565
Устойчивость к засолению можно определять по скорости
прорастания семян в солевом растворе, а также использовать для
этих целей такие показатели, как степень и скорость плазмолиза,
«выцветания» хлорофилла, раскрытия устщц, количество
альбуминов, биохемилюминесценция, и другие показатели.
Применяя различные методы определения устойчивости
растений, можно уже на ранних этапах роста и развития растений
выявить возможность выращивания их в той или иной
экологической среде.
Контрольные вопросы и задания
1. Какими физиолого-биохимическими особенностями отличаются
холодостойкие и морозоустойчивые растения? 2. Назовите условия, необходимые для
прохождения фаз закаливания у травянистых и древесных зимующих растений.
3. Каковы причины гибели зимующих растений в осенний, зимний и ранневе-
сенний периоды? 4. Какие отрицательные действия оказывают на растения
сверхоптимальные высокие температуры? 5. Какие структурно-анатомические и фи-
зиолого-биохимические особенности отличают засухоустойчивые виды и сорта
сельскохозяйственных растений? 6. Назовите изменения элементов
продуктивности растений при недостатке воды в отдельные периоды онтогенеза зерновых
культур. 7. Каковы морфологические и физиологические особенности солеустой-
чивости растений? 8. Каковы пути поступления газообразных загрязнителей в
растения? 9. На какие структуры клеток действуют радионуклиды и к каким
изменениям они приводят? 10. Что такое аллелопатия? 11. Перечислите
основные пути поступления пестицидов в растения.
].. Г-л а в а 9
ФИЗИОЛОГИЯ И БИОХИМИЯ ФОРМИРОВАНИЯ
КАЧЕСТВА УРОЖАЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
КУЛЬТУР
566
В зависимости от целевого предназначения растительной
продукции к ней предъявляется целый ряд стандартных требований,
связанных в первую очередь с оценкой химического состава
урожая, определением соотношения и технологических свойств
различных химических веществ, синтезирующихся и
накапливающихся в растениях в процессе их роста и развития. Например,
цель возделывания зерновых и зернобобовых культур — это
прежде всего получение белков, углеводов^ липидов и некоторых
витаминов (В],- Щ, Вб? РР, Е и др.), которые в основном и
определяют питательные, технологические и семенные свойства
зерна, а поэтому являются главными химическими
компонентами, определяющими его качество.
Основные химические вещества, от которых зависит ценность
кормовых корнеплодов и трав, клубней картофеля, овощей,
плодово-ягодной продукции, ■— это легкоусвояемые формы
углеводов, витаминов, биологически полноценные белки и другие
азотистые вещества. При выращивании технических культур,
предназначенных для получения определенного вида продукции,
создаются необходимые условия для накопления в растениях
одного или группы родственных химических соединений,
например, в корнеплодах сахарной свеклы — Сахаров, в семенах
масличных растений — жиров, в хлопчатнике и льне — клетчатки, в
эфиромасличных растениях — эфирных масел и т. д.
Способность тех или иных растительных форм к синтезу и
накоплению химических веществ определяется специфическим
типом обмена веществ, который сформировался в процессе
эволюции живых организмов и закреплен генетически. Однако
определенные сдвиги в обмене веществ организмов, вызываемые
факторами генетической изменчивости (мутации, гибридизация,
перенос генов), постоянно происходят и могут быть
использованы для создания новых генотипов, более высокопродуктивных и
с направленным изменением метаболизма в сторону большего
накопления в запасающих органах и тканях растений ценных
химических веществ, повышающих качество урожая
сельскохозяйственных культур.
Следовательно, главный и основополагающий путь улучшения
Химического состава сельскохозяйственных растений — создание
высокоурожайных сортов и гибридов с наследственно
закрепленными интенсивными системами синтеза запасных и других ве-
567
ществ, определяющих качество данной растительной продукции.
Вместе с тем очевидно, что для реализации потенциальных
возможностей растительного организма, заложенных в генотипе,
необходимо создание определенных условий выращивания
растений, т. е. подбор оптимальных сочетаний и последовательности
действия факторов внешней среды, обеспечивающих рост и
развитие организма в соответствии с его генетической программой.
К таким факторам относятся интенсивность и качество света,
температура, обеспеченность влагой и питательными
веществами, различные агротехнические приемы и др. Выяснение
действия этих факторов на количественную и качественную
изменчивость химического состава растений, а также изучение
закономерностей синтеза и накопления запасных веществ в
растительных организмах позволит определить оптимальное
сочетание внешних условий, обеспечивающих получение высоких
урожаев сельскохозяйственных культур с наибольшим выходом
ценных химических веществ.
9.1. ЗЕРНОВЫЕ ЗЛАКОВЫЕ КУЛЬТУРЫ
Основные процессы, происходящие при созревании зерновых
злаковых культур, — синтез запасных белков и углеводов,
структурных и запасных липидов, витаминов. Исходя из того, что
зерновые культуры являются важными источниками пищевого и
кормового белка, при их выращивании первостепенное значение
уделяется созданию необходимых условий для накопления
запасных белков, содержание и состав которых в первую очередь и
будет определять качество зерна.
Накопление белков. Наиболее высокобелковой культурой
является пшеница, в ее зерновках содержание белков составляет 9—
18 %, а при создании оптимальных условий может достигать 20—
25 %. В зерне других злаковых культур количество белка обычно
8—15 %, а в зерне риса и кукурузы — 6—10 %. Однако очень часто
в полевых условиях содержание белков в зерновках злаковых
растений находится на низком уровне (8—12 %) и для того, чтобы
повысить их накопление хотя бы на 1—2 %, применяют
специальные приемы и технологии выращивания зерновых культур.
Использование для кормления сельскохозяйственных
животных низкобелкового зерна влечет за собой повышенный расход
кормов на создание единицы животноводческой продукции: по
нормам кормления нужно, чтобы на каждую кормовую единицу
приходилось не менее 100 г переваримого белка. Учитывая, что
переваримость белков зерна в среднем составляет 70—90 %, для
устранения дефицита кормового белка в зерне должно
содержаться 14—15 % белковых веществ.
Ценность продовольственного зерна также зависит от содер-
568
жания в нем белков. У мягкой и твердой пшеницы запасные
белки образуют клейковину, количество и качество которой
тесно коррелирует с хлебопекарными и макаронными
свойствами зерна.
Клейковина представляет собой белковый сгусток, который
образуется из теста при отмывании его водой. На долю белков в
клейковине приходится около 90 % сухого вещества, и они
представлены в основном спирторастворимой фракцией.— глиадина-
ми и щелочерастворимой фракцией — глютелинами, т. е.
запасными формами белков. Другие химические вещества,
содержащиеся в клейковине, — липиды, сахара, крахмал, зольные
элементы в сумме составляют не более 10 %. Для характеристики
качества зерна пшеницы обычно определяют сырую клейковину,
в которой содержится 31—35 % сухого вещества.
Наряду с количественной оценкой проводят также оценку
качества клейковины, главным образом по ее эластичности и
упругости, зависящих от состава и свойств запасных белков,
образующих клейковину. Измерение упругости и эластичности
клейковины выполняют с помощью специальных приборов,
регистрирующих усилие, затрачиваемое на деформацию
клейковины. Результаты измерения выражают в виде показателя индекса
деформации клейковины (ИДК). По этому показателю
клейковину подразделяют на три группы качества: первая имеет ИДК
45-75, вторая - 80-100 и 20-40, третья - 105-120 и 0-15.
По хлебопекарным качествам зерна мягкую пшеницу делят на
три категории: сильная пшеница, средняя (или ценная) и слабая.
В зерне сильной пшеницы должно содержаться не менее 28 %
сырой клейковины первой группы качества, в зерне ценной
пшеницы — 25—27 % сырой клейковины первой или второй
группы качества. К слабой относится пшеница, в зерне которой
содержится менее 25 % сырой клейковины или у которой
клейковина очень низкого качества (третья группа). Из муки сильной
дленной пшеницы выпекают высококачественный хлеб, тогда
как из слабой пшеницы хороший хлеб можно получить только
при добавлении к ней сильной пшеницы, улучшающей
хлебопекарные свойства зерна. Средняя по качеству пшеница не
способна улучшать слабую пшеницу.
Запасные белки зерновых злаков — проламины (спиртораст-
воримые) и глютелины (щелочерастворимые) — откладываются в
эндосперме в виде белковых гранул или белковых тел, имеющих
форму глобул разного диаметра— 1 — 15 мкм. В мучнистом
эндосперме белковые гранулы обычно мельче, чем в
субалейроновом слое. В зрелом зерне пшеницы белковые гранулы образуют
сплошной слой запасного белка, заполняющего пространство
между крахмальными зернами.
Основная часть белков альбумино-глобулинового типа, также
содержащихся в зерне, локализована в зародыше, щитке зароды-
569
ша и алейроновом слое. Ткани зародыша и щитка зародыша
богаты альбуминами, которые в этих тканях не образуют
упорядоченных структур. В клетках алейронового слоя белки
откладываются в виде алейроновых зерен размером 0,1—25 мкм,
представляющих собой структуры, окруженные липопротеиновой
мембраной.
Кроме белков в них также содержится небольшое количество
углеводов и липидов, которые образуют комплексы с белками.
Из белков алейроновых зерен в процессе прорастания зерна
образуются ферменты, участвующие в гидролизе запасных
веществ эндосперма.
При переходе злаковых растений к репродуктивной стадии
развития в формирующемся зерне инициируется синтез фито-
гормонов — ауксина, гиббереллина, цитокининов, являющихся
регуляторами физиолого-биохимических процессов. В результате
резко усиливается аттрагирующая способность зерновок, они
становятся центрами притяжения ассимилятов, образующихся в
листьях, в том числе и низкомолекулярных азотистых веществ,
из которых в зерновках синтезируются компоненты белоксинте-
зирующей системы и весь набор белковых веществ
(каталитические, структурные, запасные белки).
Синтез полипептидов запасных белков начинается в конце
фазы формирования зерна с участием крупных полирибосом,
связанных с мембранами гранулярного эндоплазматического ре-
тикулума (ГЭР). Следовательно, более точно время начала
синтеза запасных белков можно определить по наблюдению
появления в клетках эндосперма мембран ГЭР и увеличению числа
808-рибосом, которые, взаимодействуя с мРНК запасных белков,
образуют комплексы мембраносвязанных полирибосом.
Наибольшее число мембраносвязанных полирибосом в
клетках эндосперма отмечается в фазе молочной спелости зерна, в
это же время наблюдаются максимальное содержание ДНК и
РНК и самая высокая скорость синтеза запасных белков. В фазе
молочно-восковой спелости зерна синтез запасных белков
замедляется и из вновь образуемой мРНК только 50 % включается в
состав полирибосом, а остальная часть связывается в виде ин-
формосом (транспортная и запасная формы мРНК) и, таким
образом, не участвует в синтезе белков.
В фазе восковой спелости зерна только часть вновь
образуемой мРНК (10—15 %) включается в полирибосомы и,
следовательно, участвует в синтезе белков, в то время как ее большая
часть находится в составе информосом. Вместе с тем в фазе
восковой спелости зерна инициируется синтез некоторых
фракций запасных белков. Выяснено, что мРНК запасных белков на
З'-конце имеет участок, включающий 150—160 повторяющихся
нуклеотидов адениловой кислоты (полиА), у которого степень
полиаденилирования увеличивается в процессе созревания зерна.
570
На кукурузе и пшенице показано, что при синтезе запасных
белков вначале образуется «сигнальный пептид», состоящий из
30—40 остатков гидрофобных аминокислот, который
проталкивается рибосомой через мембрану ГЭР, после чего «сигнальный
пептид» отщепляется протеазой, а остальная часть белковой
молекулы в дальнейшем остается без изменения и откладывается в
запас. В крахмалистом эндосперме запасные белки
накапливаются в межмембранном пространстве (цистернах) ГЭР и
постепенно заполняют весь- объем клетки. В алейроновых же клетках
запасные белки откладываются в вакуолях.
Синтез и накопление белков в зерновках злаковых культур
происходят в основном за счет оттока азотистых веществ
(главным образом аминокислот) из вегетативных органов, так как
поглощение минерального азота корнями и использование его в
биосинтетических процессах после цветения сокращаются
(особенно у яровых культур). Наибольшее количество азотистых
веществ поступает в формирующиеся зерновки из листьев,
особенно верхнего яруса, меньше — из колосковых чешуи и стеблей.
После цветения в листьях, стеблях и колосковых чешуях
активизируются процессы гидролиза высокомолекулярных веществ
(полисахаридов, белков, липидов, нуклеиновых кислот) и
усиливается отток образующихся низкомолекулярных продуктов в
зерно.
На первых этапах формирования зерна в нем много
низкомолекулярных азотистых соединений, представленных в основном
аминокислотами, а также легкорастворимых белков —
альбуминов и глобулинов (рис. 147, 148). В дальнейшем в ходе
созревания зерновок концентрация небелковых азотистых веществ и
белков альбумино-глобулинового типа постепенно снижается, но
увеличивается накопление запасных белков — проламинов и
глютелинов, при этом общее количество белков в зерне будет
также увеличиваться.
„При определенных условиях выращивания зерновых культур
может наблюдаться снижение концентрации белков в фазе
молочной спелости зерна. Это обычно происходит при затягивании
созревания, когда интенсивный отток азотистых веществ из
листьев в формирующиеся зерновки смещается на более поздние
фазы развития, или вследствие недостаточного азотного питания
растений.
При высоком уровне азотного питания у большинства
злаковых культур снижение концентрации белковых веществ при
созревании зерна обычно не происходит.
Белковые фракции зерна различаются по аминокислотному
составу, в том числе по содержанию незаменимых аминокислот,
от которых зависит биологическая питательная ценность белков.
Наиболее высокую биологическую ценность имеют
водорастворимые белки — альбумины, в их составе все незаменимые ами-
571
зр
§1,0
/ л ш
Фаза созревания зерна
IV
Л Ш
'Раза созревания
IV
Рис. 147. Изменение содержания
азотистых веществ в процессе
созревания зерна пшеницы, % сухой
массы:
/—фаза формирования зерна;
//—молочная спелость; ///— молочно-восковая
спелость; IV— полная спелость; / —
небелковый азот; 2—белковый азот при
низком уровне азотного питания; 3 —
белковый азот при высоком уровне
азотного питания
Рис. 148. Интенсивность синтеза
различных групп белков в
созревающем зерне пшеницы (поступление
меченого N некорневой подкормки
в белковые фракции зерна, %):
/—фаза формирования зерна;
//—молочная спелость; ///—молочно-восковая
спелость; IV — полная спелость; А —
легкорастворимые белки — альбумины и
глобулины; Б — спирторастворимые белки —
глиадины; В — щелочерастворимые
белки — глютенины; Г— неэкстрагируемые
белки
нокислоты содержатся практически в оптимальных
соотношениях. Солерастворимые белки зерна — глобулины — также
характеризуются довольно хорошо сбалансированным аминокислотным
составом, хотя содержание некоторых незаменимых аминокислот
у них по сравнению с альбуминами понижено (лизин,
триптофан, метионин).
Щелочерастворимые белки — глютелины у ряда злаковых
• культур (рис, овес, ячмень, сорго) по содержанию незаменимых
аминокислот близки к глобулинам, а у других (пшеница, рожь,
кукуруза, просо) характеризуются довольно сильным дефицитом
лизина и треонина. Самую низкую биологическую ценность
имеют спирторастворимые белки — проламины, которые
накапливаются только в семенах злаковых растений. Они отличаются
очень низким содержанием таких незаменимых аминокислот,
как лизин, треонин, триптофан, и высокой концентрацией глу-
таминовой кислоты и пролина, на долю которых приходится от
20—35 (рис, просо, кукуруза) до 40—55 % (пшеница, рожь,
ячмень, сорго, овес) массы этих белков.
В связи с тем что в процессе созревания зерна относительное
содержание альбуминов и глобулинов снижается, а количество
572
проламинов и глютелинов увеличивается, в суммарном белке
зерна наблюдаются соответствующие изменения аминокислот.
Поскольку при созревании в зерновках увеличивается доля
запасных белков с низким содержанием лизина, триптофана и
треонина, то и в общем суммарном белке зерна также
усиливается дефицит этих незаменимых аминокислот. Поэтому
биологическая ценность суммарного белка в процессе созревания зерна
снижается. Такая закономерность в изменении аминокислотного
состава суммарного белка особенно проявляется в процессе
созревания зерна пшеницы, кукурузы, ячменя, проса, сорго, у
которых на долю проламинов приходится 30—50 % общего
количества белка в зерне. В опытах с мягкой пшеницей А. Н. Павлов
(1984) показал, что в ходе созревания зерна содержание лизина в
суммарном белке эндосперма уменьшалось на 4,8 %, в то же
время количество глутаминовой кислоты и пролина возрастало
соответственно на 9,7 и 2,8 %.
У пшеницы по мере накопления запасных белков происходит
формирование клейковинного комплекса зерна, в процессе
созревания зерновок содержание клейковины повышается, улучша^
ется ее качество.
Накопление углеводов. Основной запасной углевод зерновки
злаков — крахмал, который представлен двумя
полисахаридами — амилозой и амилопектином. Соотношение между ними в
зерновках может изменяться в зависимости от условий
выращивания, в среднем количество амилозы обычно варьирует в
пределах 15—25 %, а амилопектина — 75—85 % общего количества
крахмала в зерне.
Запасной крахмал откладывается в мучнистой части
эндосперма в виде крахмальных зерен величиной 5—50 мкм. Размеры и
строение крахмальных зерен у разных видов и даже сортов
злаковых растений имеют определенную специфику и могут
использоваться для характеристики генотипа. Вначале крахмал
накапливается в пластидах (амилопластах), затем их мембранная
структура разрушается и они превращаются в крахмальные зерна.
Содержание крахмала в зерновках большинства злаковых
растений составляет 50—70 %, а в рисе и кукурузе — до 80 %.
Кроме крахмала в зерновках злаков накапливаются и другие
углеводы, но в меньших количествах: сахара — 2—5 % массы
зерна, клетчатка — 2—3 у голозерных и до 10—15 у пленчатых
форм, гемицеллюлозы, слизи, пектиновые вещества, полифрукто-
зиды — в сумме до 18 %. Сахара в зерне наполовину представлены
сахарозой, а также моносахаридами, мальтозой и раффинозой.
Они преимущественно локализованы в зародыше и
периферийных частях мучнистого эндосперма. Клетчатка, гемицеллюлоза,
пектиновые вещества входят в состав клеточных стенок и их
также много в пленках и семенных оболочках. Полифруктозиды
573
образуются в зерне на ранних стадиях созревания, в дальнейшем
происходят их распад и превращение в другие углеводы.
В оболочках семян злаковых растений довольно много сли-
зей — полисахаридов, в основном построенных из пентоз,
особенно много слизей образуется в зерновках ржи (2—3 %).
Установлено, что слизи, содержащиеся в зерне ржи, влияют на
хлебопекарные качества ржаной муки. При увеличении количества
слизей тесто укрепляется, улучшается его формообразующая
способность, в результате оно не растекается при выпечке хлеба.
Полисахариды клеточной стенки (клетчатка, гемицеллюлозы,
пектиновые вещества), а также слизистые вещества зерна
синтезируются в клетках с участием ферментов, образуемых в ГЭР, и
мембранных структур аппарата Гольджи, с помощью которых
осуществляется перенос углеводных компонентов к плазмалемме
и клеточной стенке. Синтез других углеводов происходит в
пластидах и межмембранном пространстве гладкого эндоплазмати-
ческого ретикулума.
Запасные полисахариды зерна синтезируются из углеводных
продуктов, поступающих из вегетативных органов, — листьев,
стеблей, колосковых чешуи. В репродуктивный период развития
злаков наиболее высокой фотосинтетической активностью
обладают листья верхнего яруса и колосья, тогда как в стеблях и
листьях нижнего яруса усиливаются процессы распада веществ и
происходит отток образующихся при распаде продуктов в
формирующиеся зерновки.
Из углеводистых веществ гидролизу подвергаются все
полисахариды, кроме клетчатки. В процессе распада полисахаридов в
вегетативных органах растений наряду с моносахаридами
образуется много сахарозы, являющейся важной транспортной формой
углеводов.
В составе углеводистых веществ, поступающих в зерно,
содержится довольно много водорастворимых фруктозидов,
включающих от 2 до 10 остатков фруктозы. Это объясняется тем, что в
листьях злаковых растений не образуется фотосинтетический
крахмал, у них продукты фотосинтеза превращаются в поли-
фруктозиды, содержание которых в тканях листьев может
достигать 8—10 % их сухой массы.
Из поступающих в зерновку моносахаридов, сахарозы и
фруктозидов синтезируются структурные и запасные углеводы.
Синтез крахмала начинается в фазе начала формирования зерна и
достигает максимума в период молочно-восковой спелости.
Затем интенсивность синтеза крахмала постоянно снижается
вследствие уменьшающегося притока углеводов из отмирающей
вегетативной массы. Наряду с крахмалом происходят также
синтез и накопление гемицеллюлоз, пектиновых веществ, слизей.
Характер превращения углеводов в созревающих зерновках
злаковых растений показан на примере ржи (рис. 149). По дан-
574
25.06 3.07 15.07
Дата
28.07
Рис. 149. Изменение содержания
углеводов в созревающем зерне ржи, % сухой
массы (по А. Р. Кизелю, В. Л. Кретови-
чу, 1934):
/ _ фруктозиды; 2 — клетчатка; 3 — сахара;
4 — гемицеллюлозы; 5 — крахмал
ным А. Р. Кизеля и В. Л. Крето-
вича (1934), на первых этапах
формирования зерновок ржи в
них много моносахаридов и
сахарозы (до 12 % сухого
вещества), а также фруктозидов (свыше
30 %) и очень мало крахмала
(около 9 %). К фазе молочной
спелости зерновок (3 июля)
происходило интенсивное
превращение Сахаров и фруктозидов в крахмал и гемицеллюлозы,
концентрация которых значительно возрастала.
В дальнейшем темпы превращения углеводов в созревающем
зерне ржи замедлялись, однако направление превращений
оставалось прежним. В .окончательно созревшем зерне содержание
Сахаров составляло около 5 %, а фруктозидов оставалось очень
мало, так как они почти полностью превращались в запасные и
структурные полисахариды зерна. Синтез клетчатки проходил
равномерно, и только в конце созревания ее содержание в зерне
несколько повышалось.
Аналогичные результаты получены и в опытах с другими
культурами. При затягивании созревания, что очень часто
бывает при влажной погоде или избыточном азотном питании, может
наблюдаться снижение концентрации углеводов в зерне, и
прежде всего крахмала, вследствие потерь на дыхание.
Лшгады и витамины. Важными качественными компонентами
зерна являются также липиды и витамины, которые
синтезируются непосредственно в созревающих семенах или поступают из
вегетативных органов.
На первых этапах формирования зерна образуются главным
образом структурные липиды — стеролы, фосфоглицериды, гли-
колипиды, а в более поздние стадии происходит накопление их
запасных форм — ацилглицеринов (жиров), свободных фосфатид-
ных кислот, фитина, фосфатидилхолинов и фосфатидилэтанола-
минов. Запасные липиды накапливаются преимущественно в
зародыше и алейроновом слое, а в эндосперме их значительно
меньше. Общее содержание структурных липидов в зрелом зерне
злаковых растений составляет 0,5—0,9 %, запасных — 1,5—3, а в
зерновках овса, кукурузы, проса и сорго — 4—6 %. I
Липиды зерновых культур содержат довольно много
ненасыщенных жирных кислот, в том числе линолевой, относящейся к
575
незаменимым кислотам, которые не могут синтезироваться в
организме человека и животных. Фитин, содержащийся в зерне,
представляет собой важный источник органического фосфора.
Почти все запасные липиды, взаимодействуя с белками и
углеводами в процессе созревания теста, улучшают хлебопекарные
качества зерна.
Зерно и зерновые продукты — источники витаминов тиамина
(В]), рибофлавина (Вг), пиридоксина (Вб), никотиновой кислоты
(РР) и др. Их содержание в зерне колеблется, мг%: В] — 0,4—0,7,
В2 - 0,2-0,3, В6 - 0,4-0,6, РР - 6-9, В3 - 0,5—1,5, Е - 1-4.
Витамины группы В, никотиновая и пантотеновая кислоты
откладываются в основном в тканях щитка зародыша, в самом
зародыше и клетках алейронового слоя, тогда как их содержание
в мучнистой части эндосперма в несколько раз ниже. Токоферол
(витамин Е) преимущественно накапливается в зародыше. В
процессе созревания зерна содержание витаминов, как правило,
увеличивается в 1,5—2,0 раза.
В зерновках кукурузы, пшеницы, проса, сорго в значительном
количестве содержатся каротин (провитамин А), лютеин, зеак-
сантин и некоторые другие пигменты, ценность которых в
основном определяется их влиянием на окраску зерна и
получаемых из него продуктов. Желтый и кремовый цвета макаронной
муки, различных круп, продуктов из кукурузного зерна
объясняются главным образом содержанием каротиноидов. На долю ка-
ротиноидов обычно приходится 2—4 % липидной фракции
зерна.
Влияние внешних условий. В созревающих зерновках злаковых
культур происходят два взаимозависимых процесса — синтез
углеводов и азотистых веществ, каждый из которых
характеризуется своим оптимумом внешних условий. При изменении условий
выращивания могут наблюдаться значительные сдвиги в ходе
этих биосинтетических процессов, в результате чего будут
меняться химический состав зерна и его качественные показатели.
Например, известно, что синтез белков — многоэтапный и
энергоемкий процесс, требующий для своего осуществления высокой
обеспеченности растений солнечной энергией.
В то же время на образование углеводов расходуется больше
воды, чем на синтез белков, вследствие чего при дефиците воды
биохимические процессы в зерне смещаются в сторону большего
накопления белковых веществ. Однако дефицит воды обычно
наблюдается при солнечной погоде и, следовательно,
повышенной температуре.
Таким образом, на формирование качества зерна чаще всего
влияют три взаимосвязанных внешних фактора — свет, тепло,
влага. В дождливую и прохладную погоду обеспеченность
растений световой энергией снижается, в результате замедляется
синтез белков и в зерновках больше накапливается крахмала. И
576
наоборот, при солнечной погоде повышается температура и
усиливается испарение воды, вследствие чего понижается
обеспеченность растений влагой. В результате происходит изменение
биохимических процессов в созревающем зерне в сторону
большего накопления азотистых веществ, т. е. запасных белков.
Аналогичные явления наблюдаются и под влиянием
климатических факторов. В северо-западных регионах нашей страны
более влажный климат с умеренными летними температурами не
обеспечивает оптимальных условий для накопления белков, что
затрудняет получение высококачественного зерна. При
продвижении на юг и юго-восток интенсивность световой энергии и
среднесуточные температуры возрастают, усиливается дефицит
влаги, складываются наиболее благоприятные условия для
накопления в зерне белков. В географических опытах с разными
зерновыми культурами, проведенных по единой методике,
установлено, что в зависимости от действия климатических факторов
и разных погодных условий содержание в зерне белков может
изменяться в 1,5—2,0 раза.
На синтез и накопление в зерновках злаковых растений
запасных веществ оказывает влияние не только интенсивность
световой энергии, но и качество света. Установлено, что при
увеличении доли коротковолнового света в составе общей солнечной
радиации из продуктов фотосинтеза больше образуется
азотистых веществ — аминокислот и белков, в результате чего их
концентрация в тканях растений повышается. С другой стороны,
преобладание красного света активирует синтез и накопление в
растениях углеводов.
Подобные сдвиги в обмене веществ постоянно происходят и в
процессе вегетации злаковых растений, так как спектральный
состав поглощаемого ими света заметно изменяется в
зависимости от погоды, а также условий данного региона. В ясную погоду
и при большей высоте стояния солнца над горизонтом в составе
солнечной радиации увеличивается доля коротковолнового
(синего) света, вследствие чего усиливается накопление в зерновках
запасных белков.
В связи с тем что увеличение содержания белков в зерне
происходит в основном за счет накопления" их запасных форм,
образующих клейковину, количество последней возрастает и
хлебопекарные и макаронные качества зерна улучшаются.
Важный фактор формирования качества зерна —
обеспеченность растений влагой. В условиях относительного дефицита
влаги листья быстрее отмирают и сокращается приток углеводов
в созревающее зерно. В результате в нем снижается накопление
завасных углеводов, а концентрация белков повышается, в
зерновках также быстро понижается активность гидролитических
ферментов. При сильном дефиците влаги (засуха, суховеи) все
биосинтетические процессы быстро ингибируются, в результате
577
образуется щуплое зерно с повышенным содержанием белков.
Следовательно, главный ущерб от засухи — резкое снижение
урожайности зерновых культур, причем семенные качества зерна
также ухудшаются.
С другой стороны, высокая влажность в период налива зерна
затягивает его созревание, в зерновки поступает больше
углеводистых веществ, вследствие чего повышается содержание
крахмала, а накопление белков снижается. Очень часто во время
затяжных дождей в период созревания зерна происходит его
переувлажнение. В зерновках усиливаются гидролитические
процессы, которые сопровождаются выделением Сахаров и
азотистых веществ на поверхность листьев и колосковых чешуи, в
результате зерно быстро уменьшается в массе и становится
щуплым. Такое явление получило название «стекание зерна».
Отекание зерна может наблюдаться также при неправильном
орошении, например, когда проводится дождевание в начале налива
зерновок. Поэтому при орошении очень важно правильно
определять сроки полива зерновых культур.
Если переувлажнение зерна происходит на завершающих
этапах созревания, в нем могут инициироваться процессы скрытого
прорастания (прорастание на корню), повышается активность
гидролитических ферментов и особенно а-амилаз, наблюдается
частичная деградация крахмала и клейковинных белков, что
приводит к ухудшению технологических свойств зерна. Вследствие
деградации крахмала и клейковины усиливается газообразующая
и ослабляется газоудерживающая способность теста, повышается
его растекаемость. В результате уменьшается объем хлеба и
ухудшаются его вкусовые свойства (солодовый привкус), мякиш
хлеба теряет упругость. Проросшее зерно очень плохо хранится и
быстро теряет всхожесть.
К прорастанию на корню особенно склонна такая злаковая
культура, как рожь, зерно которой имеет очень короткий период
покоя. При длительном переувлажнении пшеница также может
подвергаться скрытому прорастанию на корню или в валках при
раздельной уборке. При возделывании данных культур в
регионах с повышенным увлажнением необходимо подбирать сорта с
меньшей склонностью к прорастанию зерна на корню или такие
сорта, у которых созревание зерновок происходит в более
благоприятные по погодным условиям сроки.
В качестве критерия влажности в данном регионе используют
гидротермический коэффициент, который выражает отношение
количества осадков за определенный период вегетации растений
к средней температуре воздуха. При возрастании величины
гидротермического коэффициента в период массовой уборки
зерновых свыше 4—5 возникает опасность переувлажнения и скрытого
прорастания зерна.
При выращивании зерновых культур в засушливой зоне при-
578
меняют орошение. С помощью поливов регулируют водный
режим растений и создают условия, необходимые для
формирования высоких урожаев. Однако при этом очень часто
белковость зерна снижается. В опытах с разными сортами яровой и
озимой пшеницы выявлено, что в условиях орошения
содержание в зерне белков может снижаться на 2—5 %, примерно на
такую же величину увеличивается содержание крахмала.
Одной из причин снижения белковости зерна при поливах
является повышение влагообеспеченности растений, в связи с
чем в период созревания зерна, как указывалось ранее,
складываются более благоприятные условия для накопления углеводов.
Другая возможная причина — недостаток питательных веществ, и
прежде всего азота, в период налива зерна.
Орошение стимулирует ростовые процессы в первой половине
вегетации растений, в результате из почвы поглощается много
питательных веществ на формирование вегетативной массы,
значительная часть азота связывается микрофлорой почвы или
теряется за счет вымывания. Таким образом, к началу налива зерна,
когда происходит интенсивный синтез запасных белков, почва
значительно обедняется доступными для растений формами
азота. Поэтому важной задачей при выращивании зерновых
культур в условиях орошения является обеспечение
необходимого уровня азотного питания в период налива и созревания зерна.
Только в этом случае можно получить высококачественное
зерно.
В северных и восточных регионах нашей страны наряду с
переувлажнением созревающее зерно может подвергаться
действию низких температур (заморозки), при этом в зерновках
образуются кристаллики льда, разрушающие их ткани. После
оттаивания наблюдается замедление или Полное прекращение
биосинтетических процессов в зерне. Поэтому морозобойное зерно
вследствие незавершенности процессов синтеза белков и
крахмала не достигает своей полной массы. Оно отличается
повышенным содержанием Сахаров и небелковых азотистых веществ,
высокой активностью гидролитических ферментов, вследствие чего
характеризуется низкими технологическими свойствами.
Оптимизация питания. Формирование урожая и интенсивность
биохимических процессов в созревающем зерне злаковых
культур зависят от обеспеченности растений элементами питания, и
прежде всего азотом, фосфором и калием. В почве, как правило,
недостаточно питательных веществ в доступной для растений
форме, поэтому для получения высоких урожаев зерна с
оптимальным химическим составом необходимо вносить
минеральные и органические удобрения.
При недостатке фосфора или калия и высоком уровне
азотного питания формируется низкий урожай зерна с повышенным
накоплением белков. Если на таком фоне внести фосфорные
579
или калийные удобрения (в зависимости от того, что находится
в минимуме), то урожайность злаковых культур повышается, а
содержание белков будет зависеть от обеспеченности растений
азотом.
С другой стороны, при хорошей обеспеченности растений
фосфором и калием недостаток азота снижает как урожайность,
так и белковость зерна злаковых культур. При внесении на этом
фоне невысоких доз азота наблюдаются усиление ростовых
процессов и увеличение урожайности, однако белковость зерна чаще
всего не повышается или даже снижается. Последующее
увеличение дозы азота будет повышать как урожайность культур, так
и накопление в зерне белков, пока хотя бы один из двух других
элементов (фосфор или калий) не окажется в минимуме или не
будет достигнут потенциальный уровень урожайности,
характерный для данного сорта.
Таким образом, при увеличении доз азота урожайность
зерновых культур повышается до определенного уровня, после
достижения которого уже будет возрастать только концентрация
азотистых веществ в зерне, в том числе и запасных белков. В одном
из вегетационных опытов МСХА были получены следующие
результаты (табл. 28).
28. Действие удобрений на урожай и качество зерна яровой пшеницы
сорта Московская 35
Показатель
Без
удобрений
РК
1Ч1РК
Урожай зерна, г/сосуд 15,0 17,1 13,3 24,8 32,5 32,7
Содержание в зерне белков, % 10,8 10,0 14,8 12,9 12,3 14,0
Примечание. N1 — 0,7 г/соруд и N2 — 1,5 г/сосуд.
Чрезмерное увеличение доз азота, вносимого под зерновые
культуры, может вызывать понижение урожайности этих культур,
а часто и ухудшение качества зерна, хотя при этом концентрация
азотистых веществ в зерне остается очень высокой. Это
объясняется тем, что усиленное азотное питание растений в первой
половине вегетации стимулирует образование большой
вегетативной массы, вызывая тем самым ее полегание и раннее
отмирание нижних листьев, приводящее к большому недобору зерна.
Кроме того, повышается влажность зерна и затягивается его
созревание, что может инициировать скрытые процессы
прорастания семян на корню. Отрицательное влияние на качество
зерна оказывает также избыточное калийное питание, которое
стимулирует накопление в зерне запасных углеводов, а
белковость зерна снижается.
Учитывая высокую потребность злаковых культур в азоте в
период формирования и налива зерна, разработаны приемы и
580
способы его внесения во время вегетации растений. Причем
установлено, что чем позднее по фазам развития растений
вносят азотные удобрения, тем в большей степени азот удобрений
используется для биосинтеза запасных белков.
В фазах выхода в трубку и колошения азотные удобрения
обычно вносят в виде корневых, а в начале налива зерна — в
виде некорневых подкормок. Корневые подкормки (30—80 кг/га
азота) проводят при помощи поверхностного разбрасывания
гранулированных нитратных и аммиачно-нитратных азотных
удобрений. Для некорневых подкормок (20—40 кг/га азота)
используют мочевину или ее смесь с аммиачной селитрой (2:1), которые
в виде 20—30%-ного раствора разбрызгивают над посевом
зерновых культур.
Наиболее эффективно проведение поздних некорневых
азотных подкормок на посевах пшеницы и кукурузы — белковость
зерна повышается на 1—3 %, содержание клейковины у мягкой
пшеницы — на 2—5 %, улучшается и качество клейковины.
Действие азотных удобрений, внесенных до посева, а также в виде
азотных подкормок, на урожайность и качество зерна показано в
таблице 29. В ней представлены результаты опытов с яровой
мягкой пшеницей сорта Московская 35, проведенных на
дерново-подзолистой почве в учхозе МСХА «Михайловское»
Московской области. Из данных таблицы следует, что в условиях
Московской области высококачественное зерно можно получить
только при внесении достаточно высоких доз азотных удобрений
(150 кг азота на 1 га) в сочетании с поздней некорневой
подкормкой.
29. Действие азотных удобрений на урожай и качество зерна пшеницы
Вариант опыта
Урожайность,
т/га
Рэо'Кэо 2,16
№оР9оК9О 3,64
И|50Р90К90 3,91
^8оР9оК.90 3,42
№оР9оК9о + N60 в ку- 4,07
щение
№50Р90К.90 + N40 В 4,07
виде некорневой
подкормки
Белок, %
12,4
13,8
14,6
14,9
14,7
16,2
Примечание. Дозы удобрений в кг д. I
Сырая
клейковина, %
19,7
23,4
25,7
26,1
26,4
29,7
1. на 1 га.
идк,
ст. ед.
101
89
81
82
73
69
Категория
качества зерна
Слабая
пшеница
То же
Ценная
пшеница
То же
»
Сильная
пшеница
Повышение белковости зерна при некорневой азотной
подкормке объясняется тем, что нанесенная на листья мочевина
581
очень быстро проникает в их ткани (1—2 сут) и включается в
обмен азотистых веществ. В тканях листьев мочевина
расщепляется с образованием аммиака, который далее участвует в синтезе
аминокислот. Ход таких превращений можно представить в виде
следующий схемы:
Н2О
СО2 + ЫН3 + кетокислота -> аминокислота
АДФ
Расщепление мочевины может происходить гидролитически
под действием фермента уреазы или другим путем с участием
АТФ-зависимой ферментной системы. Образующиеся
аминокислоты вместе с потоком ассимилятов поступают в зерно и
используются там для синтеза белков. Кроме того, возможна
ассимиляция мочевины за счет обращения реакций орнитинового цикла,
при этом азот мочевины сразу включается в аминокислоты:
Мочевина + орнитин -» аргинин -> аргининянтарная кислота.
Поздние азотные подкормки — необходимый прием при
выращивании сильных пшениц. Однако, учитывая значительные
затраты на их проведение, необходимо прогнозировать конечный
результат. Если подкормка обеспечивает получение зерна
сильной или ценной пшеницы, то ее проводят, в ином случае
проведение подкормки нецелесообразно.
С целью прогнозирования качества зерна пшеницы в фазах
выхода в трубку — колошения осуществляют диагностику
обеспеченности растений азотом. Чаще всего для этих целей
определяют содержание общего азота в листьях и на основе
полученных данных устанавливают необходимость проведения поздней
некорневой подкормки. В результате обобщения большого
количества данных в каждом регионе определены оптимальные
градации содержания азотистых веществ в листьях пшеницы, при
которых обеспечивается получение зерна с повышенным
содержанием белков.
В зависимости от питания и других условий выращивания
растений изменяется не только уровень накопления в зерне
белков и крахмала, но и их качественный состав. При более
влажных условиях и умеренных температурах, способствующих
большему накоплению крахмала, в нем увеличивается доля амилозы,
а в более сухих и жарких условиях повышается относительное
содержание амилопектина.
Значительные изменения происходят и в составе белков. При
повышении белковости зерна в результате действия любых фак-
582
торов увеличивается накопление запасных белков — проламинов
и глютелинов, а концентрация белков альбумино-глобулинового
типа снижается. Поскольку белки проламиновой фракции у всех
зерновых культур очень бедны лизином и триптофаном,
увеличение их доли в общем белковом комплексе зерна снижает
биологическую ценность суммарного белка. Это наиболее заметно
проявляется у пшеницы, кукурузы, ячменя, т. е. у тех культур,
которые характеризуются высоким содержанием в зерне спирто-
растворимых белков.
Таким образом, регулируя влажность, обработку почвы,
питание растений и другие факторы, можно в значительной степени
повысить накопление в зерне белков и улучшить
технологические свойства зерна. Однако аминокислотный состав и
биологическая ценность белков от действия этих факторов не
улучшаются, а у ряда культур — пшеницы, кукурузы, ячменя — даже
ухудшаются. Объясняется это тем, что изменение аминокислотного
состава белков зерна возможно только генетическими методами,
путем изменения наследственных свойств растительных
организмов.
Примером может служить создание селекционерами высоко-
лизиновых гибридов кукурузы, у которых уровень урожайности
примерно такой же, как и у обычных гибридов, однако в их
зерновках больше белков с повышенным содержанием лизина
(на 50—80 %) и триптофана (на 30—50 %).
Высоколизиновые гибриды кукурузы получены от
скрещивания обычной кукурузы с мутантными формами, имеющими гены
ОПЕЙК-2 и ФЛАУРИ-2, которые вызывают изменение
фракционного состава белков зерна: содержание спирторастворимых
белков — зеинов, имеющих низкую биологическую ценность,
снижается в 2,5—3,0 раза, а доля других белковых фракций
возрастает. В результате таких изменений белкового комплекса
зерна биологическая ценность суммарного белка значительно
повышается.
Существуют также генно-инженерные проекты улучшения
аминокислотного состава белков зерна, в которых
предпринимаются попытки ввести в генотипы злаков природные или
синтетические гены, кодирующие полипептиды, построенные в
основном из незаменимых аминокислот.
9.2. ЗЕРНОБОБОВЫЕ КУЛЬТУРЫ
Зернобобовые культуры отличаются от зерновых злаков более
высоким содержанием азотистых веществ как в вегетативной
массе, так и в семенах. Эти их особенности обусловлены тем,
что они способны с помощью симбиотических микроорганизмов
фиксировать молекулярный азот атмосферы и использовать его
583
на синтез аминокислот и белков, в связи с чем бобовые
культуры не испытывают дефицита азота даже при выращивании на
сравнительно бедной почве.
Кроме того, зернобобовые культуры обладают более
интенсивной системой синтеза запасных белков, в результате чего в их
зерне белков в 2—3 раза больше, чем у злаковых растений.
Наряду с белками ценность зерна зерновых бобовых культур
также определяют крахмал, липиды, витамины.
Накопление белков. Белки семян зернобобовых растений
хорошо сбалансированы по содержанию незаменимых
аминокислот и поэтому имеют высокую биологическую питательную
ценность. Особенно отличается в этом отношении соя, в белках
которой концентрация незаменимых (кроме метионина и
триптофана) аминокислот значительно выше, чем требуется по
нормам питания людей или кормления сельскохозяйственных
животных (табл. 30).
30. Содержание
Показатель
Лизин
незаменимых аминокислот в белках зерна сои, %
Триптофан
Метио-
нин
Треонин
Валин
Лейцин
Изолей-
цин
Фенил-
аланин
Белки сои
Эталон ФАО*
6,6
4,2
1,3
1,4
1,4
2,2
3,8
2,8
5,4
4,2
7,9
4,8
5,3
4,2
5,1
2,8
*Оптимальные количества незаменимых аминокислот в пищевых и
кормовых белках, рекомендованные Международной организацией по продовольствию
и сельскому хозяйству (ФАО).
Исходя из этого, белки сои могут быть использованы в
качестве добавки для обогащения незаменимыми аминокислотами
других растительных белков, имеющих низкую биологическую
ценность, например запасных белков злаковых растений.
Аналогичными свойствами обладают белки и других зернобобовых
культур — бобов, гороха, фасоли, люпина, вики и т. д.
Основными запасными белками зернобобовых растений
являются глобулины, на долю которых в общем белковом комплексе
семян приходится 60—70 %. Большая часть этих белков
представлена двумя типами глобулинов — легуминоподобные 118-
белки и вицилиноподобные 78-белки. Соотношение между ними
в зрелом зерне чаще всего 2:1.
Легумины и вицилины — запасные белки семян гороха;
первые имеют молекулярную массу 300—360 тыс., вторые—ПО—
220 тыс. В семенах всех бобовых растений содержатся белки,
сходные по многим свойствам с легуминами и вицилинами, —
глицинии сои, фазеолин фасоли, конглютин люпина и др. Эти
белки имеют, как правило, довольно сложную четвертичную
структуру, включающую от 2 до 12 полипептидных субъединиц.
Кроме глобулинов в зерне бобовых содержатся белки альбу-
584
мино-глютелинового типа; Большая часть альбуминов
локализована в зародыше, а глютелины — в основном в семядолях, и они,
по-видимому, представляют собой глобулины, связанные с
углеводами.
Запасные глобулины семян зернобобовых культур, как и
запасные белки злаков, синтезируются с участием 808-рибосом,
связанных с мембранами ГЭР, и откладываются в вакуолях
клеток семядолей в виде алейроновых зерен. По мере созревания
семян клетки семядолей заполняются алейроновыми и
крахмальными зернами, другими запасными веществами.
Изучение биосинтетических процессов, происходящих в
семенах бобовых при их созревании, показывает, что запасные белки
в них образуются из аминокислот и амидов, поступающих из
листьев и створок бобов. Начиная с фазы цветения, в этих
органах усиливаются гидролитические процессы и возникает
отток образующихся продуктов распада в репродуктивные
органы. Значительное количество аминокислот и амидов поступает в
созревающие семена из корней, где с помощью клубеньковых
бактерий атмосферный азот связывается и восстанавливается до
аммонийной формы.
На первых этапах формирования в семенах много небелковых
азотистых веществ (рис. 150), структурных и каталитических
белков, а запасных белков очень мало. В дальнейшем содержание
небелковых азотистых веществ снижается и усиливается синтез
запасных белков, однако общее количество белковых веществ в
созревающем зерне почти не изменяется.
В процессе созревания в семенах заметно изменяется
соотношение вицилино- и легуминоподобных белков. В незрелых
семенах очень много низкомолекулярных белков — вицилиноподоб-
ных глобулинов (до 70 % общего количества запасных белков), а
в более поздние фазы созревания зерна усиливается синтез
высокомолекулярных глобулинов — легуминоподобных белков.
Общее количество белков в зрелом зерне зернобобовых культур
обычно достигает 25—30 %, а в
сое и люпине — 30—40 %.
Накопление углеводов.
Основные углеводы, определяющие
качество зерна зернобобовых
культур, — это крахмал, сахара, геми-
целлюлозы, клетчатка. Главный
запасной углевод — крахмал, со-
2,0
Рис. 150. Изменение содержания
азотистых веществ в созревающем зерне
гороха, % сухой массы:
/—зеленые бобы; //—зеленовато-желтые
бобы; III—желтый бобы; IV— зрелые бобы;
/ — небелковый азот; 2— белковый азот
I II ПТ
Фаза созревания
IV
585
держание которого в семенах различных зернобобовых культур
колеблется от 40 до 55 %. В сое и люпине его очень мало, в них
накапливаются другие запасные вещества. Состав крахмала у
многих бобовых культур примерно такой же, как у злаков, —
20—30 % амилозы и 80—70 % амилопектина. Однако в крахмале
гороха доля амилозы может достигать 50 %.
В созревающих семенах запасной крахмал и другие
полисахариды синтезируются из Сахаров, образующихся в листьях, а также
в створках бобов, в которых много моносахаридов и крахмала. В
процессе налива зерна крахмал в створках бобовых распадается и
образующиеся продукты поступают в семена. В листьях в это
время также усиливается распад структурных полисахаридов (ге-
мицеллюлоз, пектиновых веществ) и ассимиляционного крахмала.
В процессе распада этих веществ наряду с моносахаридами и их
фосфорными эфирами образуется много сахарозы.
На первых этапах созревания семян вследствие
усиливающегося оттока углеводов из вегетативной массы в них
накапливается много Сахаров (до 30 % сухой массы), а крахмала очень мало.
Интенсивный синтез крахмала начинается во время налива
зерна, а концентрация Сахаров в семенах в этот период
понижается; происходит также образование других полисахаридов. От
восковой до полной спелости зерна в нем наблюдается
постепенное снижение интенсивности синтеза крахмала вследствие
сокращения поступления углеводов из листьев.
В зародышах семян зернобобовых культур накапливается
значительное количество Сахаров, представленных в основном
сахарозой, а в оболочках семян синтезируется много клетчатки и
пентозанов. Общее содержание клетчатки в семенах бобовых
обычно 3—6 %, а у некоторых культур может достигать 10—15 %.
У люпина в процессе созревания семян синтезируется много
гемицеллюлоз и пектиновых веществ.
Липиды и витамины. У большинства бобовых культур
содержание в зерне липидов составляет 2—3 % и они в основном
представлены жирами и фосфоглицеридами, которые
локализованы преимущественно в зародыше. В семядолях синтезируются
структурные липиды. У некоторых бобовых растений в семенах
может накапливаться значительно больше липидов, главным
образом за счет синтеза жиров (нут, люпин, соя). Особенно много
жира в зерне сои (18—25 %), у которой поступающие из
вегетативных органов углеводы используются не на синтез крахмала, а
на образование ацилглицеринов, в связи с чем соя является не
только высокобелковой, но и масличной культурой.
Наряду с липидами в зародышах семян зернобобовых культур
накапливается много жирорастворимых витаминов и особенно
токоферола (10—50 мг% массы семян), а в оболочках семян —
водорастворимых витаминов: В1 (0,5—1 мг%), Вг (0,2—0,3 мг%),
РР (2—4 мг%). Количество этих витаминов увеличивается в про-
586
цессе созревания семян, в результате чего питательная и
кормовая ценность зерна повышается.
Влияние внешних условий. При созревании семян
зернобобовых растений, как и в зерновках злаковых культур, происходят
биохимические процессы, связанные с синтезом белков,
углеводов, липидов, витаминов, поэтому они одинаково реагируют на
действие внешних факторов. В более жарких и сухих условиях в
семенах бобовых культур интенсифицируются процессы синтеза
запасных белков, а накопление крахмала и других углеводов
уменьшается.
При повышенной влажности и умеренных температурах,
наоборот, снижается содержание белков и увеличивается
количество углеводов в зерне. Такие сдвиги биосинтетических процессов
в созревающем зерне наблюдаются как при изменении погоды,
так и в результате действия природно-климатических факторов.
На территории нашей страны содержание белков в зерне
зернобобовых растений возрастает при продвижении с северо-запада
на юг и юго-восток.
В географических опытах установлено, что в зависимости от
погодных условий и района выращивания уровень белковости
зерна у бобовых растений может изменяться на 5—10 %, а у
таких культур, как соя и люпин, — на 10—15 %. В зависимости
от внешних условий, особенно в период созревания семян,
наблюдаются определенные закономерные изменения в составе
белков и углеводов, что оказывает заметное влияние на качество
зерна зернобобовых культур.
При выращивании бобовых растений в условиях повышенных
температур и относительного дефицита влаги в их семенах
больше синтезируется глобулинов и амилопектина, а количество
водорастворимых белков и амилозы уменьшается. С другой
стороны, повышение водообеспеченности растений (в том числе и за
счет орошения) и относительное снижение температуры во
время созревания семян смещают биосинтетические процессы в
сторону большего накопления водорастворимых форм белков и
запасных углеводов.
В связи с тем что зернобобовые культуры с помощью
клубеньковых бактерий способны фиксировать молекулярный азот
из атмосферы, они в меньшей степени, чем злаковые культуры,
зависят от питания азотом из почвы, и в условиях орошения
накопление в семенах запасных белков у них почти не
снижается.
Оптимизация питания. При выращивании зерновых бобовых
культур важной задачей является создание оптимальных условий
для синтеза и накопления в семенах запасных белков,
содержащих много азота. Поэтому для получения высоких урожаев зерна
с повышенным содержанием белков необходимо обеспечивать
соответствующий уровень азотного питания растений за счет
587
интенсивной азотфиксации с помощью клубеньковых бактерий
или путем внесения азотных удобрений.
Клубеньковые бактерии хорошо развиваются на
окультуренных почвах с нейтральной или слабокислой реакцией среды и
при высокой обеспеченности фосфором, калием, кальцием,
молибденом и другими питательными элементами. На кислых и
бедных питательными элементами почвах на корнях бобовых
образуется очень мало клубеньков, в результате снижаются
урожай и уровень накопления в зерне белков. При известковании
кислых почв создаются благоприятные условия для
жизнедеятельности клубеньковых бактерий, вследствие чего накопление в
семенах белков возрастает, а в составе белкового комплекса
семян увеличивается доля альбуминов, обладающих более
высокой биологической питательной ценностью. •.
Кроме известкования на интенсивность азотфиксации
клубеньковыми бактериями заметное влияние оказывает внесение
молибденовых удобрений. Молибден входит в состав ферментов,
катализирующих восстановление молекулярного азота (нитроге-
наза) и при его недостатке снижается интенсивность
азотфиксации. В опытах Н. С. Авдонина (1979), проведенных с
различными зернобобовыми культурами, показано, что при известковании
дерново-подзолистой почвы и внесении молибденового
удобрения белковость семян может повышаться на 3—7 %.
Эффективным приемом, повышающим интенсивность
использования бобовыми растениями молекулярного азота,
является инокуляция семян соответствующими расами клубеньковых
бактерий (применение нитрагина), при этом накопление белков
увеличивается на 2—6 % массы семян. Однако положительный
эффект от инокуляции семян бобовых растений клубеньковыми
бактериями наблюдается только при создании соответствующих
условий для жизнедеятельности этих микроорганизмов.
Кроме известкования и внесения молибденовых удобрений
важным фактором для развития клубеньковых бактерий и
интенсивной азотфиксации является обеспеченность растений влагой,
в связи с чем в засушливой зоне применение бактериальных
удобрений эффективно лишь в условиях орошения. Следует
также отметить, что при орошении без инокуляции семян
бобовых растений клубеньковыми бактериями накопление в зерне
белков вследствие недостаточной азотфиксации снижается.
Аналогичные явления могут наблюдаться при внесении
фосфорных и калийных удобрений. В результате улучшения питания
растений фосфором и калием повышается уровень урожайности
зернобобовых культур, однако при недостаточной азотфиксации
содержание белков в семенах этих растений очень часто
снижается. При таких условиях для оптимизации процесса синтеза
запасных белков необходимо проведение инокуляции семян
клубеньковыми бактериями или внесение азотного удобрения. На
588
фоне интенсивной азотфиксации внесение фосфорных и
калийных удобрений повышает урожайность зернобобовых культур и
увеличивает в семенах содержание белков на 1—2 %, при этом в
суммарном белке зерна увеличивается доля альбуминов, хорошо
сбалансированных по содержанию незаменимых аминокислот.
При выращивании зернобобовых культур на хорошо
окультуренных и плодородных почвах на их корнях интенсивно
развиваются клубеньковые бактерии, которые в течение вегетации
растений полностью обеспечивают их азотом. Однако в начале
вегетации до образования клубеньков бобовые растения
нуждаются в минеральном азоте, поэтому внесение небольших доз
азотных удобрений стимулирует в этот период более мощное
развитие вегетативной массы. Вследствие этого на последующих
этапах развития растений образуется больше клубеньков и
усиливается фиксация азота, вызывая тем самым повышение урожая
и улучшение его качества. В опытах Р. И. Тучапского (1969),
проводимых в западной лесостепи Украины, были получены
следующие результаты (табл. 31).
31. Действие удобрений на урожайность и качество зерна сои
Вариант опыта
Урожайность, т/га
Содержание в зерне
белков, % сухой массы
Выход белка, кг/га
Без удобрений
N45
^5Р45
Н45Р45К.45
1,55
1,73
1,84
1,91
37,8
41,8
40,3
40,9
527
651
667
703
Как видно из данных таблицы, наиболее высокое содержание
в зерне белков получено от внесения азотного удобрения, а
максимальная урожайность и выход белков — при добавлении к
азотному фосфорно-калийных удобрений. Для улучшения
азотного питания бобовых растений в репродуктивный период
развития можно применять поздние некорневые азотные подкормки,
которые обеспечивают дополнительный приток азотистых
веществ в созревающие семена, вследствие чего увеличивается
накопление запасных белков на 1—5 % (от массы семян).
Подкормки проводят в фазе начала образования бобов 5— 10%-ным
раствором мочевины.
Таким образом, подбирая эффективные штаммы
клубеньковых бактерий и создавая оптимальные условия для симбиотичес-
кой азотфиксации (орошение, известкование почвы,
молибденовые удобрения и др.), можно значительно повысить урожайность
зернобобовых культур и накопление в их семенах запасных
белков. В то же время уровень урожайности и общий сбор белков у
зернобобовых культур зависят от внесения фосфорных и калий-
589
ных удобрений, которые при интенсивной азотфиксации
становятся основными факторами повышения урожайности и
улучшения его качества.
9.3. МАСЛИЧНЫЕ КУЛЬТУРЫ
Масличные культуры возделывают с целью получения
растительных жиров, называемых маслами, которые синтезируются и
накапливаются как запасные вещества в семенах. Кроме жиров
ценность семян масличных растений также определяется
содержанием в них белков, хорошо сбалансированных по
аминокислотному составу, и растворимых в жирах витаминов. Исходя из
особенностей химического состава семян масличных культур
видно, что основное направление их хозяйственного
использования — получение растительных масел и жмыхов, которые
образуются как побочные продукты после экстракции масла и
характеризуются высоким содержанием белков (40—50 % сухой массы).
Из жмыхов после дополнительной экстракции, сушки и
измельчения получают высокобелковые шроты, используемые в
животноводстве для приготовления комбикормов. У некоторых
масличных культур в семенах синтезируются цианогенные гли-
козиды, алкалоиды, токсичные полифенольные вещества,
поэтому при использовании жмыхов, полученных из семян этих
растений, для кормления сельскохозяйственных животных
необходимо удалять из них вредные токсичные вещества.
Накопление жиров. Основные запасные вещества семян
масличных растений — жиры, или ацилглицерины, содержание
которых в семенах льна, конопли, горчицы, подсолнечника составляет
30—50 %, а в маке и клещевине достигает 50—60 %. В семенах
хлопчатника количество жира значительно ниже — 17—25 %.
Растительные жиры — богатые энергией продукты, и при их
окислении высвобождается значительно больше энергии, чем
при окислении таких же количеств углеводов или белков.' В
среднем калорийность белков и углеводов около 17 кДж/г, а
жиров — 39 кДж/г. Питательная ценность жиров определяется
также содержанием в них полиненасыщенных жирных кислот —
линолевой и линоленовой, которые не синтезируются в
организме человека и животных и должны поступать с пищей. В связи с
этим растительные жиры представляют собой важные источники
незаменимых жирных кислот для человека и
сельскохозяйственных животных. В маслах льна, конопли, мака, подсолнечника,
сои, хлопчатника, арахиса содержание этих кислот достигает
40—80 % общего количества жирных кислот.
Технические свойства растительных жиров также зависят от
содержания жирных кислот с двумя и тремя двойными
связями — чем их больше в составе масла, тем оно легче окисляется
590
и быстрее высыхает на воздухе и тем выше качество олифы,
лаков и красок, производимых на основе растительных жиров.
Для характеристики содержания в масле ненасыщенных жирных
кислот используется показатель — йодное число, выражающий
количество йода (в г), которое связывается со 100 г жира.
Установлено, что масла с хорошими техническими свойствами имеют
йодное число 140—180, пищевые масла — 90—140. Если в масле
содержится более 50 % насыщенных кислот (пальмитиновой,
стеариновой, лауриновой и др.), то оно имеет твердую
консистенцию (кокосовое, пальмовое).
Для оценки пищевой пригодности масла используется еще
один показатель — кислотное число, которое показывает
количество свободных жирных кислот в масле, образующихся в
процессе его прогоркания. При значениях кислотного числа свыше
2,2 мг КОН на 1 г жира пищевые свойства масла ухудшаются и
оно подвергается дополнительной обработке.
Жиры откладываются в ядрах семян, образуя упорядоченные
внутриклеточные структуры, называемые сферосомами. Сферосо-
мы — это сферические частицы диаметром 0,5 мкм, окруженные
липопротеиновой мембраной. Кроме жиров в сферосомах
содержатся фосфоглицериды, фитин и ферменты, участвующие в
гидролизе жиров (во время прорастания семян). Образование
структурных компонентов жира — глицерина, насыщенных и
ненасыщенных с одной двойной связью жирных кислот — происходит в
цитоплазме, а ненасыщенных жирных кислот с двумя и тремя
двойными связями и ацилглицеринов — в гладком эндоплазма-
тическом ретикулуме. Синтезируются жиры из углеводов,
поступающих в семена из листьев, стеблей и элементов соцветия.
Вскоре после цветения в завязавшихся семенах довольно
интенсивно синтезируются структурные элементы клеток,
каталитические белки, крахмал, нуклеиновые кислоты. В этот период в
семенах также содержится много растворимых углеводов и
небелковых азотистых веществ, а жира очень мало. Интенсивное
превращение углеводов в жир начинается после того, как
завершается формирование семенных тканей, которое продолжается у
большинства масличных культур 2—3 недели.
Накопление жира сопровождается уменьшением
концентрации Сахаров, крахмала, пентозанов. О начале интенсивного
синтеза жиров можно судить по изменению дыхательного
коэффициента, который в этот период значительно повышается.
Интенсивный синтез жира продолжается почти до полного созревания
семян и заметно снижается лишь в самом конце их созревания.
Динамика содержания жиров и углеводов в созревающих семенах
масличных культур показана на примере клещевины (рис. 151).
Степень зрелости семян оценивают по изменению кислотного
числа, характеризующего содержание в масле свободных жирных
кислот. На первых этапах созревания семян кислотное число
591
28.07
8.08
Дата
28.08
Рис. 151. Изменение содержания
углеводов и жиров при созревании семян
клещевины, % сухой массы:
1 — сахара; 2 — сырой жир
обычно составляет 30—40 мг
КОН на 1 г масла, что
свидетельствует о высоком
содержании свободных жирных кислот
и низкой скорости синтеза
жиров. К концу созревания
семян кислотное числе
снижается до 1,5—2,5.
В процессе созревания
семян изменяется качество масла, которое зависит от состава
жирных кислот. Масло из незрелых семян отличается
повышенным содержанием насыщенных кислот — пальмитиновой и
стеариновой, вследствие чего йодное число такого масла очень
низкое. По мере созревания семян усиливается синтез
ненасыщенных кислот и особенно полиненасыщенных — линолевой и
линоленовой, в связи с чем йодное число повышается на 20—30
единиц и более. Например, в процессе созревания семян
подсолнечника количество пальмитиновой и стеариновой кислот
уменьшается с 25—30 до 6—10 % общего количества жирных
кислот в масле, а содержание линолевой кислоты удваивается и
составляет в масле зрелых семян 65—80 %. Содержание в масле
олеиновой кислоты также снижается. В семенах льна в процессе
созревания повышаются интенсивность синтеза линоленовой
кислоты и включение ее в состав ацилглицеринов, тогда как
количество других кислот в масле уменьшается. Состав и
свойства растительных масел зрелых семян основных масличных
культур представлены в таблице 32.
32. Характеристика
Культура
растительных
масел основных масличных культур
Содержание жирных кислот, % общего количества кислот в
масле
пальмитиновая
стеариновая
олеиновая
лино-
левая
лино-
леновая
эруко-
вая
рици-
нолевая
Йодное
число
Подсолнечник 4—6 2—4 15—25 60—80
Соя
Конопля
Лен
Клещевина
Горчица
Арахис
5-8
4—8
4-6
1
1
5-15
3-6
1-3
2-5
1—3
1-2
3-6
__ _ 120-140
25-30 50-60 3-5 - — 120-130
10-16 50-70 15-25 — — 140-150
5-15 25-40 40-50 - - 150-180
4-8 2-6 - - 75-85 80-90
20-30 10-20 1-3 35-55 — 100-110
50-70 15-25 — - — 90-100
592
В семенах масличных культур накапливаются и другие липи-
ды, главным образом фосфоглицериды (1—2 %) и фитин (1—
3 %), которые при экстракции растворяются в масле. В
растительных жирах содержатся также жирорастворимые витамины,
особенно много токоферола (витамина Е) — 50—100 мг%.
Фосфоглицериды, фитин, жирорастворимые витамины — ценные
компоненты растительного масла, повышающие его питательную
ценность, их содержание в процессе созревания семян
существенно повышается.
Следовательно, при уборке недозрелых семян масличных
растений возможен значительный недобор растительных жиров,
других липидов, витаминов. Масло, полученное из таких семян,
характеризуется низким качеством (низкое йодное и
повышенное кислотное число).
Накопление белков. Основные белки семян масличных
растений — альбумины и глобулины, на их долю приходится 70—80 %
общего количества белков. Это хорошо сбалансированные по
аминокислотному составу белки, имеющие высокую
биологическую питательную ценность. Общее количество белков в семенах
масличных культур 15—30 %. Запасные белки синтезируются в
семенах из аминокислот, поступающих из вегетативных органов
растений. Механизм синтеза примерно такой же, как у
зернобобовых культур.
На первых этапах созревания семян в основном образуются
структурные и каталитические белки, а синтез запасных белков
начинается несколько позже, когда заканчивается формирование
семенных тканей, и продолжается до полного созревания семян.
Концентрация небелковых соединений азота в процессе
созревания семян понижается.
В белковом комплексе семян в процессе их • формирования
увеличивается концентрация высокомолекулярных белков —
глобулинов. У некоторых культур наблюдается накопление глютели-
нов (в горчице до 30 % общего количества белков).
Влияние внешних условий. Во время созревания в семенах
масличных растений происходят главным образом два
конкурирующих и взаимосвязанных процесса — синтез белков из
аминокислот и жиров из углеводов. Жиры содержат значительно
больше воды, чем белки, поэтому при дефиците влаги синтез этих
веществ ослабляется, в результате чего в семенах увеличивается
концентрация азотистых веществ — белков. С другой стороны,
при меньшем поступлении световой энергии сильнее
замедляется синтез белков как более энергоемкий процесс. Таким
образом, между процессами синтеза белков и жиров в семенах
масличных растений существует примерно такая же связь, как
между биосинтезом белков и углеводов в зерне злаковых и
зернобобовых культур. У масличных культур эта связь выражена
593
более заметно, так как образующиеся в их семенах жиры
содержат больше воды, чем углеводы.
При возрастании интенсивности солнечной радиации
повышается температура окружающей среды и усиливается испарение
воды, создавая определенный дефицит влагообеспеченности
растений, вследствие чего процессы синтеза жиров ослабляются, а
накопление белков возрастает. Высокий уровень
влагообеспеченности растений, как правило, наблюдается при более частых
осадках, когда интенсивность солнечной радиации и температура
окружающей среды снижаются. В таких условиях в листьях
усиливается синтез углеводов, а в семенах — жиров.
Аналогичные изменения биологических процессов в
созревающих семенах масличных культур наблюдаются под влиянием
климатических факторов. В географических опытах установлено,
что при культивировании масличных растений в
северо-западных регионах нашей страны в условиях достаточного увлажнения
и умеренных температур в их семенах больше накапливается
жиров, чем на юге и юго-востоке, где в условиях более жаркого
и сухого климата синтез белков усиливается. В зависимости от
климата и погодных условий содержание жиров в семенах
масличных растений может изменяться на 10—15 %.
Влияние влажности почвы на содержание жиров и белков в
семенах масличных культур можно проиллюстрировать данными,
полученными в опытах с подсолнечником (табл. 33).
33. Содержание жиров и белков в семенах подсолнечника
в зависимости от влажности почвы
Влажность почвы,
% НВ
Урожай семян,
г на 1 сосуд
Содержание жиров,
Содержание белков в
обезжиренном остатке, ?
40
60
80
17
29
43
52
58
63
47
38
36
Как показывают результаты опыта, при улучшении
влагообеспеченности растений сбор семян подсолнечника увеличивался в
2,5 раза, накопление жиров — на 11 %, тогда как содержание
белков существенно понижалось.
Условия выращивания влияют на качественный состав масла
и накопление в семенах отдельных групп запасных белков. При
возделывании масличных растений в условиях повышенной
влажности и умеренных температур в их семенах больше
полиненасыщенных жирных кислот и водорастворимых белков, тогда
как при культивировании этих растений в условиях повышенной
температуры и меньшей влагообеспеченности количество
непредельных кислот в масле понижается, а синтез запасных
глобулинов усиливается.
594
С повышением температуры во время созревания семян
усиливаются процессы дыхания, на которые затрачивается больше
кислорода, участвующего в синтезе ненасыщенных жирных
кислот. В результате этих кислот меньше образуется и включается в
состав жира, поэтому йодное число жира снижается. Недостаток
кислорода может быть также вызван закрытием устьиц при
повышенной температуре. В зависимости от условий
влагообеспеченности растений и температуры окружающей среды йодное
число масла может изменяться на 10—25 ед.
Сопоставление многочисленных данных, полученных в
опытах по выяснению действия разных факторов на синтез запасных
веществ в семенах масличных растений, показывает, что условия
выращивания, благоприятные для накопления большего
количества жира в семенах, улучшают и качество масла, стимулируя
интенсивный синтез полиненасыщенных жирных кислот.
Выяснение действия факторов внешней среды на синтез жиров в
семенах масличных культур .имеет важное практическое
значение, так как на основе полученных данных разрабатываются
приемы выращивания этих растений, позволяющие снизить
отрицательное влияние неблагоприятных погодных условий или
особенностей климата данного региона на качество семян.
Легче всего поддается регулированию режим
влагообеспеченности растений в засушливых условиях путем орошения. При
поливе наряду со значительным повышением урожая масличных
растений (в 1,5—2,0 раза) увеличивается и накопление в семенах
жиров (на 2—10 %), а в составе жира возрастает количество
непредельных кислот, в результате чего йодное число
повышается на 5—15 ед.
Оптимизация питания. Многие масличные растения во время
формирования и налива семян интенсивно поглощают из почвы
фосфор и калий (до 70 % общего их поступления в растения),
при недостатке этих элементов снижается накопление жиров.
Поэтому фосфорные и калийные удобрения являются важными
факторами повышения масличности семян. При их внесении в
достаточных дозах, обеспечивающих потребности растений в
фосфоре и калии в репродуктивный период развития,
урожайность масличных культур повышается на 0,3—0,5 т/га и более и
в семенах увеличивается содержание жиров на 2—3 %. При этом
в масле возрастает количество полиненасыщенных жирных
кислот, в результате улучшается питательная и техническая ценность
масла.
Интенсивное поглощение азота масличными культурами
наблюдается в фазы их активного роста, когда происходит
формирование корневой системы, фотосинтетического аппарата и
элементов структуры урожая, а в последующий период развития
растений их потребность в азоте резко снижается. Более того,
усиленное азотное питание масличных растений во время фор-
595
мирования и налива семян стимулирует интенсивный синтез
запасных белков, вследствие чего масличность семян снижается.
При недостатке азота наблюдается слабый рост растений,
закладывается низкий урожай семян с невысоким содержанием
жиров. Следовательно, на посевах масличных культур азотные
удобрения необходимо вносить в дозах, обеспечивающих
оптимальный уровень питания азотом в первой половине вегетации
растений, в период их интенсивного роста.
Влияние удобрений на урожайность и качество семян
масличных растений можно проиллюстрировать на примере
подсолнечника в Ставропольском ктае (табтт. 34).
34. Действие удобрений на урожайность и качество семян подсолнечника
(В. Д. Панников, В. Г. Минеев, 1987)
Вариант опыта
Урожайность семян,
т/га
Содержание жира,
Выход жира, т/га
В этом опыте наиболее оптимально была подобрана доза
фосфорного удобрения, при внесении которого повышались как
урожайность, так и масличность семян подсолнечника. От
внесения азота несколько увеличился сбор семян, но уменьшилось
количество жира в семенах, в результате выход жира с единицы
площади почти не изменился. Доза калийного удобрения была
недостаточной для обеспечения оптимального уровня питания
калием в период налива семян, в результате чего масличность
семян снижалась, однако общий выход жира увеличивался
вследствие повышения урожая подсолнечника.
При внесении удобрений можно не только повысить
накопление жира в семенах, но и улучшить качественный состав масла.
В опытах, где наблюдали за изменением состава и качества жира
в семенах в зависимости от условий питания растений, выявлена
общая закономерность, характерная для всех масличных культур:
если в результате действия удобрений (или других факторов)
увеличивается накопление в семенах жиров, то оно
сопровождается повышением степени непредельности жира, связанным с
уменьшением в нем количества насыщенных жирных кислот и
кислот с одной двойной связью и возрастанием содержания
полиненасыщенных жирных кислот — линолевой и линолено-
вой. Таким образом, создавая оптимальные условия для
накопления в семенах жиров, можно значительно увеличить выход
высококачественного растительного масла.
596
Без удобрений
РбО
КбоРбо
№оРбоК.20
Примечание.
2,07
2,43
2,53
2,70
Почва — карбонатный
44,8
46,9
46,0
45,4
чернозем.
0,93
1,13
1,16
1,23
9.4. КОРНЕПЛОДЫ
Характерная особенность корнеплодов — способность
накапливать в клетках запасающих тканей большое количество Сахаров,
которые главным образом и определяют их хозяйственную
ценность. При оценке качества сахарной свеклы кроме Сахаров
учитывают также ^содержание небелковых азотистых веществ
(вредный азот) и солей калия и натрия, снижающих выход сахара при
переработке корнеплодов. Питательная ценность кормовых и
столовых корнеплодов зависит также от содержания в них
полисахаридов, белков и небелковых азотистых веществ, витаминов.
Накопление углеводов. Углеводный комплекс корнеплодов на
70—80 % представлен легкорастворимыми формами — сахарозой
и моносахаридами, которые обычно называют сахарами. Больше
всего Сахаров (16—20 %) содержится в корнеплодах сахарной
свеклы, и основную часть их (80—90 %) составляет сахароза.
Общее количество моносахаридов (глюкозы и фруктозы) не
превышает 1 % сырой массы корнеплода. Кроме сахарозы в
корнеплодах сахарной свеклы образуется небольшое количество других
олигосахаридов — мальтозы и раффинозы.
В корнеплодах кормовой и столовой свеклы, моркови,
турнепса среднее содержание Сахаров 7—12 %, в репе и редисе
6—8 %. У столовой и кормовой свеклы, турнепса состав Сахаров
примерно такой же, как у сахарной свеклы, а в корнеплодах
репы большая часть Сахаров представлена моносахаридами
(80 %). Много моносахаридов в моркови.
Сахара в корнеплодах в наибольшем количестве
накапливаются в клетках запасающей ткани, концентрируясь в основном в
вакуолях, а в других тканях их содержание существенно ниже. В
корнеплодах свеклы максимальная концентрация сахара
наблюдается в наиболее широкой части корня (шейке) между
периферической и центральной зоной. Минимальное количество Сахаров
содержится в верхней части корнеплода — головке. В корнеплодах
моркови больше Сахаров накапливается в наружных (флоэмных)
тканях и значительно меньше — в центральной части.
Накопление Сахаров в корнеплодах определяется двумя
главными факторами — поступлением углеводов из листьев и
интенсивностью синтеза сахарозы в корнях. Важным условием для
процессов сахаронакопления в корнеплодах является развитие
фотосинтетического аппарата растений. При создании мощного
ассимиляционного аппарата в листьях образуется много
растворимых углеводов и крахмала, которые, превращаясь в
транспортные формы, обеспечивают постоянный приток моносахаридов и
сахарозы в корнеплоды.
Синтез сахарозы из моносахаридов в запасающих тканях у
разных корнеплодов происходит с разной скоростью. Наиболее
интенсивный он у сахарной свеклы и очень слабый в корнешго-
597
дах репы. Накопление Сахаров зависит также от
продолжительности вегетации растений, обычно раннеспелые корнеплоды
характеризуются низким содержанием сахара.
Динамика содержания Сахаров у разных корнеплодов также
неодинакова. У сахарной свеклы в молодых корнеплодах
значительно меньше Сахаров, чем в зрелых, и сахара в основном
представлены моносахаридами, поэтому отношение количества
сахарозы к содержанию моносахаридов обычно находится на
очень низком уровне.
В процессе роста и развития корнеплодов сахарной свеклы
общее содержание Сахаров в них увеличивается в 2,5—3,0 раза
(рис. 152), при этом происходит значительное усиление
биосинтетических реакций, связанных с синтезом сахарозы, в
результате чего отношение сахарозы к моносахаридам во время
созревания корнеплодов постоянно увеличивается. Следовательно, при
уборке недозрелых корнеплодов сахарной свеклы отмечается
значительный недобор продовольственного сахара.
У кормовых и столовых корнеплодов в процессе их роста и
развития в динамике содержания Сахаров наблюдаются примерно
такие же изменения, как и у сахарной свеклы, однако параметры
этих изменений значительно меньше. Например, содержание са-
харов в молодых и зрелых корнеплодах моркови различается на
1—2 %, у кормовой и столовой свеклы, турнепса — на 3—5 %.
При длительном хранении часть Сахаров в корнеплодах
используется на дыхание, однако общая концентрация Сахаров не
уменьшается вследствие снижения содержания воды.
Из полисахаридов в корнеплодах довольно много пектиновых
веществ (1—2 % массы корня) и гемицеллюлоз (до 1,5 %), в
моркови — крахмала (до 1 %). Эти соединения относятся к
легкоусвояемым формам углеводов и поэтому повышают
питательную ценность корнеплодов. Клетчатки больше содержится в
незрелых корнеплодах, в которых происходит интенсивное
формирование запасающих и других тканей, а к концу созревания
корнеплодов ее концентрация снижается.
В полностью
сформировавшихся корнеплодах свеклы
содержание клетчатки 0,5—1 %, в
моркови — 1,5—2,0 %. Много
клетчатки образуется в
корнеплодах при засухе, недостатке
питательных элементов, а также
в корнях цветущих растений, в
Рис. 152. Изменение содержания
Сахаров и азотистых веществ при
созревании корнеплодов сахарной свеклы, %:
/ — сырой протеин; 2— сахара
1
/7.06 Ш 2.08
Дата
598
результате резко понижается переваримость всех органических
веществ корнеплодов и, следовательно, ухудшается их питательная
ценность.
Азотистые вещества. Азотистые вещества корнеплодов —
белки, свободные аминокислоты, амиды, нуклеиновые кислоты
и продукты их распада. Белки составляют 40—60 % общего
количества азотистых веществ, содержащихся в корнеплодах,
свободные аминокислоты и амиды — 30—40 %. Белки корнеплодов на
60—70 % представлены легкорастворимыми формами —
альбуминами и глобулинами, хорошо сбалансированными по
содержанию незаменимых аминокислот. Фракция свободных
аминокислот также содержит незаменимые аминокислоты и поэтому
повышает биологическую ценность азотистых веществ.
Содержание белков и небелковых азотистых веществ
изменяется в процессе роста и созревания корнеплодов (см. рис. 152). В
молодых корнеплодах больше азотистых веществ, чем в зрелых.
Особенно много белков и небелковых азотистых соединений в
корнях перед началом интенсивного сахаронакопления, к концу
созревания концентрация азотистых веществ в корнеплодах
снижается в 1,5—2,0 раза.
Для оценки питательных свойств корнеплодов обычно
определяют общее содержание азотистых веществ в пересчете на
белки и этот показатель называют «сырым протеином» или
«сырым белком». Для того чтобы получить сырой протеин,
определяют содержание общего азота и умножают его на
коэффициент пересчета: для корнеплодов — 6,25. В зрелых корнеплодах
количество сырого протеина составляет 1,0—1,5 %.
Чтобы повысить сбалансированность кормовых корнеплодов
по содержанию белков, проводят селекционную работу,
направленную на получение генотипов, отличающихся повышенным
накоплением в корнях полноценных белков, а также
разрабатывают технологии выращивания этих культур, обеспечивающие
изменение биосинтетических процессов в корнеплодах в
направлении более интенсивного синтеза белков. При культивировании
сахарной свеклы повышенное содержание азотистых веществ и
особенно аминокислот и бетаина не допускается, так как они
снижают выход сахара в процессе промышленной переработки
корнеплодов.
Витамины. Все корнеплоды являются важным источником
аскорбиновой кислоты для человека и сельскохозяйственных
животных. В редисе, репе и редьке ее содержание достигает 20—
30 мг%, в моркови — 5—15, в кормовой свекле и турнепсе —
3—6 мг% массы корнеплодов. В корнеплодах моркови много
каротина (провитамина А) — 6—8 мг%, его содержание в
процессе их роста и созревания увеличивается в 5—6 раз. В кормовой
свекле и турнепсе количество каротина значительно меньше —
2—5 мг%. В корнеплодах содержатся другие витамины: тиамин,
599
рибофлавин, пиридоксин по 0,1—0,2 мг%, никотиновая кислота
0,2—1, пантотеновая кислота 0,1—0,5, фолиевая кислота —0,1—
1 мг%.
Влияние внешних условий. В корнеплодах постоянно
происходят два основных процесса, определяющих ход биохимических
превращений при их созревании, — синтез из поступающих ас-
симилятов, с одной стороны, азотистых веществ, а с другой —
сахарозы и полисахаридов. Как указывалось ранее, синтез
азотистых веществ в растениях усиливается при повышении
интенсивности солнечной радиации и дефиците влаги. Такая
закономерность наблюдается и при выращивании корнеплодов; в
условиях низкой влагообеспеченности растений в сухом веществе
корнеплодов увеличивается доля азотистых веществ.
Концентрация в корнеплодах Сахаров при дефиците влаги
также возрастает, но это происходит вследствие понижения их
оводненности и повышения содержания сухого вещества, тогда
как в пересчете на сухую массу количество Сахаров почти не
изменяется или даже снижается. Условия увлажнения очень
сильно влияют на рост растений и формирование урожая
корнеплодов, в результате чего может изменяться сбор сахара с
единицы площади. Как при низкой, так и при повышенной влажности
почвы резко ухудшается рост растений и, как следствие,
снижаются урожай корнеплодов и выход сахара с 1 га. Поэтому при
выращивании корнеплодов очень важно создать оптимальный
режим влагообеспеченности растений — при засухе и в зонах
недостаточного увлажнения это достигается орошением.
Оптимизация питания. Накопление в корнеплодах Сахаров
зависит от работы фотосинтетического аппарата листьев, для
формирования которого растения потребляют из почвы
значительное количество питательных веществ, поэтому недостаток
любого элемента в этот период замедляет рост растений и в конечном
итоге снижает урожай и очень часто накопление Сахаров в
корнеплодах.
После образования корнеплодов потребность растений в
питательных элементах существенно изменяется. В процессе саха-
ронакопления важную роль играют фосфор и калий, а
поступление в корнеплоды азота должно быть снижено, так как он
усиливает синтез азотистых веществ. При внесении фосфорных и
калийных удобрений сахаристость корнеплодов повышается на
1—2 % и в них уменьшается количество небелковых азотистых
соединений, что очень важно при возделывании сахарной
свеклы, у которой эти вещества снижают выход сахара при ее
переработке. Увеличение потерь сахара при переработке корнеплодов
может также наблюдаться при внесении чрезмерно высоких доз
калийных удобрений, вызывающих повышение в корнеплодах
концентрации растворимых щелочных солей.
Избыточные дозы азотных удобрений увеличивают содержа-
600
I
ние в корнеплодах азотистых веществ и потери сахара при их
переработке, кроме того, снижается сахаристость корней.
Действие удобрений на урожайность и накопление Сахаров в
корнеплодах показано в одном из опытов с сахарной свеклой при
выращивании ее на выщелоченных черноземах
Центрально-Черноземной зоны (табл. 35).
35. Влияние удобрений на содержание Сахаров в корнеплодах сахарной
свеклы (К. Г. Мазепин, А. А. Красных, 1983)
Вариант опыта
Урожайность
корнеплодов,
т/га
Содержание
Сахаров, %
Сбор сахара, т/га
Потери сахара
в мелассе, %
Без удобрений
РвоК.80
И80Р80К8О
ИвоРвоКшо
1^16оР8оК160
^боРшЮбО
25,7
27,3
29,3
29,8
30,4
31,8
20,3
20,7
19,4
19,7
19,4
19,4
5,2
5,7
5,7
5,9
5.9
6,2
1,5
1,4
2,3
2,4
3,0
2,2
При внесении высоких доз азотных удобрений в корнеплоды
поступает много минерального азота, в основном в нитратной
форме, вследствие чего концентрация нитратов может превысить
допустимый уровень. Как известно, нитраты, восстанавливаясь до
нитритов, способны инактивировать гемоглобин, переводя
содержащееся в нем железо в неактивное трехвалентное состояние,
вследствие чего измененный гемоглобин уже не может
функционировать как переносчик кислорода. Считается, что
концентрации нитратов, превышающие 0,1—0,2 % азота N01 на сухую
массу корма, токсичны для сельскохозяйственных животных.
Следовательно, корнеплоды с повышенным содержанием
нитратов не могут быть использованы на пищевые или кормовые цели.
При выращивании корнеплодов на почвах с низким
содержанием бора они хорошо реагируют на внесение борных
удобрений, при этом повышается не только урожайность, но и
накопление Сахаров. Внесение борных удобрений при выращивании
сахарной свеклы на дерново-подзолистой почве повышает
урожайность на 3—4 т/га и содержание Сахаров в корнеплодах на
0,2—1,2 %. На кислых почвах важным фактором повышения
сахаристости корнеплодов является известкование.
9.5. КОРМОВЫЕ ТРАВЫ
У кормовых трав в отличие от других сельскохозяйственных
культур используется вегетативная масса растений — листья,
стебли, соцветия, являющиеся источниками многих полезных
601
веществ, определяющих их ценность как кормов или
компонентов кормов для животных. Более того, из листьев некоторых
травянистых растений (люцерна, клевер) промышленным
способом получают биологически полноценные белки, витамины,
легкоусвояемые углеводы, липиды и другие биохимические
продукты.
При использовании вегетативной массы трав на кормовые
цели в них учитывается прежде всего содержание белков,
легкоусвояемых форм углеводов, витаминов, биологически
полноценных липидов, клетчатки и минеральных веществ, количество и
соотношение которых в растительных тканях сильно варьирует в
зависимости от возраста растений, условий выращивания и
применяемых удобрений.
Азотистые вещества. Основные азотистые вещества
травянистых растений — белки, свободные аминокислоты и их амиды,
нуклеиновые кислоты, нуклеотиды, азотистые основания. На
долю белков обычно приходится 60—70 % общего количества
азотистых веществ, и 30—40 % составляют небелковые
соединения азота, которые на 80—90 % состоят из аминокислот и их
амидов. В связи с тем что основная часть азотистых веществ в
травах представлена белками и аминокислотами, для оценки
питательных свойств вегетативной массы растений часто
используют показатель содержания сырого протеина, выражающий
суммарное количество азотистых веществ в пересчете на белки.
Белки вегетативных органов растений хорошо
сбалансированы по содержанию незаменимых аминокислот и легко
усваиваются организмом животных, так как на 60—70 % состоят из
легкорастворимых фракций — альбуминов и глобулинов, на долю
щелочерастворимых белков приходится не более 25—30 %. Если
принять за 100 % биологическую питательную ценность белков с
оптимальной концентрацией незаменимых аминокислот, то
значения этого показателя у бобовых трав будут составлять 85—
90 %, у мятликовых трав и зеленой массы кукурузы — 75—85 %.
В составе белков кормовых трав наблюдается лишь заметный
дефицит по содержанию метионина. Во фракции свободных
аминокислот содержатся все аминокислоты, входящие в состав
белков, в том числе и незаменимые, что повышает
биологическую питательную ценность азотистых веществ травянистых
растений.
В вегетативных органах трав запасные формы белков не
образуются и их белковый комплекс представлен в основном
структурными и каталитическими белками, а также белками,
выполняющими регуляторные, транспортные и защитные функции в
организме растений. Содержание отдельных групп белков и
небелковых азотистых веществ в вегетативной массе трав заметно
изменяется в онтогенезе.
В ранние фазы роста в листьях травянистых растений содер-
602
жится много белков, легкорастворимых углеводов, липидов,
минеральных веществ, витаминов и относительно мало клетчатки и
лигнина, снижающих питательную ценность кормовых трав
(рис. 153). Белковый комплекс трав в этот период
характеризуется высоким содержанием наиболее полноценных белков —
альбуминов.
В последующие фазы роста и развития кормовых трав
содержание в них азотистых веществ, липидов, витаминов, зольных
элементов снижается и увеличивается количество клетчатки и
лигнина, в результате ухудшается переваримость всех
органических веществ корма. Особенно заметно ухудшается кормовая
ценность трав после цветения, когда происходит образование
генеративных органов, а в листьях растений активизируются
процессы распада высокомолекулярных органических соединений.
Поэтому наиболее высокую питательную ценность кормовые
травы имеют в более ранние фазы развития, что учитывается при
хозяйственном использовании этих культур.
В онтогенезе происходят значительные изменения в составе
азотистых веществ в листьях и стеблях травянистых растений. Во
время формирования листьев в них больше образуется белков и
меньше содержится небелковых азотистых веществ,
увеличивается доля высокомолекулярных и труднорастворимых белков. В
результате активизации процесса гидролиза и оттока веществ в
репродуктивные органы количество белков в листьях
уменьшается, но концентрация небелковых азотистых веществ увеличивает-
;/ /// IV
'Раза разбития
А
во
50
40
30
20
10
-
1
/
-
1
Л
Фаза
■—-
у—
1 1
Ш IV
развития
Б
•—з
2
/
V
Рис. 153. Изменение содержания углеводов и азотистых веществ в вегетативной
массе кормовых трав, % сухой массы:
А — тимофеевка луговая: /— кущение; //— выход в трубку; ///— колошение; IV— цветение;
К—созревание семян; Б— клевер луговой: /—образование розетки; //—ветвление; /// —
бутонизация; IV—цветение; V— созревание семян; / — сырой протеин; 2— клетчатка; 3 —
безазотистые экстрактивные вещества (БЭВ)
603
ся. В стеблях растений во все фазы их роста и развития
содержание небелковых соединений азота значительно выше, чем в
листьях.
Общее количество азотистых веществ, выражаемое
содержанием сырого протеина, у мятликовых трав в фазе выхода в
трубку обычно составляет 10—20 % сухой массы, перед
цветением— 5—15, у бобовых трав в фазе ветвления — 20—30, в фазах
бутонизации — цветения — 15—25, у кукурузы в фазе молочно-
восковой спелости — 8—12 %. Как видно, бобовые и мятликовые
травы представляют собой важный источник полноценных
кормовых белков, содержание которых в вегетативной массе этих
растений может быть выше, чем требуется по нормам
кормления, в связи с чем травяную массу очень часто используют как
высокобелковую добавку к низкобелковым кормам.
Динамика углеводов.- В вегетативных органах кормовых трав,
как и любых других растений, основные продукты
фотосинтеза — углеводы, которые накапливаются как запасные вещества у
бобовых в виде ассимиляционного крахмала, а у мятликовых
растений в виде фруктозидов, содержащих от 3—4 до 30 остатков
фруктозы. Ассимиляционный крахмал откладывается в листьях и
корнях растений, фруктозиды — в листьях и нижней утолщенной
части соломины. Общее количество этих полисахаридов в
кормовых травах может достигать 6—8 % сухой массы.
В клеточных оболочках травянистых растений откладывается
довольно много гемицеллюлоз (до 10—15 % сухой массы),
которые играют роль как структурных, так и запасных веществ.
Содержание клетчатки в зависимости от возраста растений и
условий выращивания колеблется в очень широких пределах, в
среднем оно составляет 20—35 % сухой массы. Если содержание
клетчатки превышает 30 % сухой массы, переваримость
органических веществ корма резко снижается. Другим компонентом,
снижающим переваримость корма, является полифенольное
соединение лигнин, количество которого в молодой траве
составляет 3—5 % сухой массы, а в перезревшей — до 15 %.
Кроме полисахаридов в травах содержится значительное
количество легкорастворимых углеводов — моносахаридов и сахарозы,
в значительной степени определяющих их питательную
ценность. Общее количество Сахаров в вегетативных органах
бобовых трав обычно составляет 6—*10 % сухой массы, у мятликовых
трав — 4—7, кукурузы — 9—14 %, причем более половины саха-
ров представлено сахарозой.
Для характеристики питательных свойств вегетативной массы
трав часто используют показатель «безазотистые экстрактивные
вещества» (БЭВ), выражающий общее количество
легкоусвояемых углеводов — Сахаров, крахмала, фруктозидов,
гемицеллюлоз, пектиновых веществ, пентозанов. В бобовых травах количе-
604
ство БЭВ обычно составляет 40—50 % сухой массы, в
мятликовых травах — 50—60, в кукурузе — до 70 %.
В процессе вегетации растений содержание различных
углеводов в вегетативных органах претерпевает существенные
изменения (см. рис. 153). Общее количество легкоусвояемых
углеводов в начале вегетации возрастает (у бобовых — до фазы
бутонизации, у мятликовых — до фазы выхода в трубку), а
затем постепенно снижается вследствие их оттока на
образование генеративных органов. До фаз выхода в трубку и
бутонизации увеличение концентрации БЭВ происходит главным
образом за счет синтеза и накопления крахмала и фруктозидов,
а в последующий период увеличивается содержание
гемицеллюлоз и клетчатки.
В молодой траве содержится много легкорастворимых
углеводов — Сахаров. В початках кукурузы в процессе созревания
количество Сахаров уменьшается, но происходит накопление
запасного крахмала. Таким образом, можно считать, что наиболее
высокую питательную ценность мятликовые травы имеют в фазе
выхода в трубку, бобовые — в фазе бутонизации (максимальная
концентрация БЭВ), кукуруза — в фазах молочной и молочно-
восковой спелости.
В процессе роста и развития травянистых растений
значительная часть углеводов в их вегетативной массе превращается в
органические кислоты, которые относятся к легкоусвояемым
веществам и, следовательно, повышают питательную ценность
трав. В листьях кормовых трав особенно много яблочной,
лимонной, янтарной, фумаровой кислот, являющихся
промежуточными метаболитами дыхательных реакций. Значительно больше
органических кислот накапливается в бобовых травах (5—10 %
сухой массы) и меньше — в мятликовых (2—3 %).
Липиды и витамины. Липидный комплекс вегетативной массы
растений представлен структурными и запасными формами,
первые из которых связаны с клеточными структурами, а вторые
локализованы в сферосомах; образуя резервный и запасной
фонды липидов в клетках. Большая часть липидов находится в
тканях листьев и соцветий, меньшая — в корнях и стеблях
растений. Липиды кормовых трав содержат много полиненасыщенных
жирных кислот — линолевой и линоленовой (75—80 % общего
количества жирных кислот), вследствие чего обладают высокой
биологической питательной ценностью и поэтому представляют
собой важный источник незаменимых жирных кислот для
сельскохозяйственных животных.
Для характеристики качества кормов липиды в растительном
материале обычно определяют путем экстракции органическими
растворителями, в которых растворяются свободные (структурно
не связанные) липидные фракции, включающие не только жиры,
но и другие группы липидов, поэтому определяемый таким спо-
605
собом показатель принято называть «сырой жир». Значительно
больше сырого жира содержится в вегетативной массе бобовых
растений (2—5 % сухой массы) и меньше — в мятликовых травах
и зеленой массе кукурузы (1,5—3,0 %). В процессе вегетации
содержание липидов в кормовых травах снижается, особенно в
репродуктивный период развития.
В связи с тем что витамины, входя в состав ферментов,
являются активаторами биохимических процессов, их
интенсивный синтез происходит в молодых, активно
функционирующих органах, а по мере старения тканей органа количество
витаминов в них уменьшается. Такая же тенденция
прослеживается и в онтогенезе. В молодой зелени трав количество
витаминов в 1,5—2,0 раза выше, чем в вегетативной массе
растений в фазах бутонизации (у мятликовых — колошения) ~~
цветения. Особенно богаты витаминами бобовые травы. В фазах
бутонизации — цветения в сухой массе бобовых трав
содержание каротина (провитамина А) составляет 20—35 мг%,
аскорбиновой кислоты (витамина С) — 200—-300, тиамина (ВО—
1,2—1,5, рибофлавина (В2) — 2,5—3,5 мг%. В мятликовых
травах содержится 10—20 мг% каротина, 150—200 аскорбиновой
кислоты, 0,5—1,5 тиамина, 2—3 мг% рибофлавина. Основная
масса этих витаминов сосредоточена в листьях растений и
молодых соцветиях.
Другие витамины содержатся в кормовых травах в следующих
количествах, мг% сухой массы: пиридоксин 1—2, никотиновая
кислота 3—6, фолиевая кислота 0,5—1, пантотеновая кислота
1—2, токоферол 10—25. Содержание витаминов в зеленой массе
кукурузы примерно такое же, как у мятликовых трав. В процессе
сушки зеленой массы трав значительное количество каротина и
аскорбиновой кислоты разрушается под воздействием солнечных
лучей и в результате их окисления. Витамины группы В — более
стабильные соединения, поэтому их количество в высушенной
массе трав почти не уменьшается.
Влияние внешних условий. Действие внешних условий (света,
тепла, влаги и др.) на синтез азотистых веществ и углеводов в
листьях кормовых трав такое же, как и на другие растения. При
более интенсивном освещении активизируются
биосинтетические процессы синтеза азотистых веществ, в результате в
вегетативной массе растений увеличивается концентрация белков и
аминокислот. Количество азотистых веществ в травах также
возрастает в условиях повышенных температур (25—35 °С). При
более низких температурах в листьях растений усиливается
накопление углеводов и в первую очередь их лабильных форм —
Сахаров, крахмала, фруктозидов.
От действия света и изменения температуры окружающей
среды содержание сырого протеина в травах может изменяться в
1,5—2,0 раза, а концентрация водорастворимых углеводов — в
606
2—3 раза. Следует также учитывать, что в естественных условиях
повышение интенсивности света и температуры окружающей
среды всегда сопровождается снижением влагообеспеченности
растений.
В специальных опытах по изучению влияния водного
режима на химический состав кормовых трав установлено, что в
условиях дефицита влаги в вегетативной массе растений
снижается концентрация легкоусвояемых углеводов и увеличивается
содержание белков. При орошении наблюдается сдвиг
биохимических процессов в направлении усиления синтеза
легкоусвояемых углеводов, кроме того, повышается содержание
клетчатки.
Оптимизация питания. Обеспечение режима питания
кормовых трав существенно зависит от их видовых особенностей. При
выращивании бобовых трав главное внимание уделяют созданию
оптимальных условий для симбиотической фиксации азота. Под
эти культуры обычно не вносят азотные удобрения, а дозы
фосфорных и калийных удобрений рассчитывают по потребности
растений с целью формирования возможно большего урожая
зеленой массы.
На хорошо окультуренной почве от внесения фосфорно-ка-
лийных удобрений выход белка с единицы площади возрастает в
1,5—2,0 раза, причем это происходит не только за счет
повышения урожайности бобовых трав, но и вследствие усиления
синтеза белков в вегетативной массе растений. При поливах бобовых
трав и достаточном обеспечении фосфором и калием накопление
в листьях белков и аминокислот не снижается, что позволяет
получать прибавку урожая зеленой массы без ухудшения ее
питательных свойств.
На бедных и неокультуренных почвах на рост и развитие
бобовых трав положительно влияет внесение извести,
молибденовых, магниевых, кобальтовых, борных и других удобрений,
которые активируют биохимические процессы в клетках
растений и таким образом способствуют более интенсивной азот-
фиксации и накоплению азотистых веществ в вегетативной
массе.
При выращивании мятликовых трав и кукурузы на зеленый
корм или силос фосфорно-калийные удобрения необходимо
дополнять внесением азотных. Недостаток азота резко снижает
урожай трав, а в вегетативной массе растений — количество
азотистых веществ, липидов, витаминов и увеличивает содержание
клетчатки, в результате чего не только снижается выход
биологической массы, но и ухудшается ее питательная ценность. При
создании необходимого уровня азотного питания выход
кормовой биомассы трав повышается в 3—5 раз, содержание сырого
протеина в вегетативных органах растений — в 1,5—2,5 раза,
каротина— в 1,2—1,5 раза.
607
В опыте по изучению действия азотных удобрений на
формирование качества урожая мятликовых трав (кострец безостый)
были получены следующие результаты (табл. 36).
36. Химический состав вегетативной массы костреца безостого
в зависимости от доз азотного удобрения, % сухой массы
(Б. П. Плешков, 1980)
Вариант опыта | Сырой протеин | Сырой жир | БЭВ
Клетчатка
Без удобрений
N60
N120
9,4
18,3
21,9
3,0
3,2
4,0
52
48
42
27
23
25
Применение высоких доз азотных удобрений приводит к
ухудшению питательных свойств кормовых трав вследствие
повышения концентрации небелковых форм азота и особенно нитратов,
а также в результате чрезмерного снижения содержания в травах
легкоусвояемых углеводов. Установлено, что хорошая
сбалансированность биомассы кормовых трав по химическому составу
наблюдается при отношении содержания сырого протеина к
количеству Сахаров 1:(0,8...1,5), в ином случае корм необходимо
сбалансировать или по белкам, или по содержанию
легкоусвояемых углеводов.
Следует отметить, что нарушение сахаробелкового
соотношения может быть даже при невысоких дозах азота, когда,
например, наблюдается сильный дефицит фосфора или калия. При
этом резко снижается урожай зеленой массы растений и азот
оказывается в значительном избытке. Поэтому регулирование
азотного питания растений проводят с учетом обеспеченности
другими питательными элементами.
Опасные концентрации нитратов в зеленой массе мятликовых
трав наблюдаются при дозах азота более 300 кг/га,
недостаточном фосфорно-калийном питании и пониженных температурах.
Оптимизация питания кормовых трав имеет важное значение
как способ балансирования кормов по содержанию минеральных
веществ. Животные чаще всего испытывают недостаток в
кальции, магнии, фосфоре, йоде, кобальте, меди, селене.
Поступление в раАения этих и других элементов зависит от содержания
их в почве и внесения удобрений. Однако при неправильном
применении удобрений может наблюдаться недостаток или
избыток определенных минеральных веществ, вызывающий у
животных заболевания.
Например, при внесении повышенных доз азотных удобрений
снижается поступление в растения фосфора, калия, кальция,
магния, и в результате длительного кормления животных такой
зеленой массой они заболевают пастбищной тетанией.
Содержание в травах кальция и магния может также снижаться при
608
I
высоких дозах калийных удобрений, не сбалансированных
внесением азота и фосфора, при этом в тканях растений возрастает
концентрация калия, который в количествах выше 3 % сухой
массы становится токсичным для животных.
Таким образом, подбирая нужные биотипы травянистых
растений и регулируя водный режим, питание растений азотом,
фосфором, калием и другими элементами, можно создавать
необходимые условия для получения высоких урожаев кормовых
трав, хорошо сбалансированных по содержанию белков,
углеводов, липидов, витаминов и минеральных веществ.
9.6. ПЛОДОВО-ЯГОДНЫЕ КУЛЬТУРЫ
Плодово-ягодные культуры выращивают с целью получения
плодов и ягод, богатых сахарами, органическими кислотами,
пектиновыми веществами, витаминами и другими полезными
химическими соединениями, определяющими питательную и
биологическую ценность продукции. Накопление ценных для
человека органических веществ происходит в паренхимных
тканях плодов, образующих плодовую мякоть, а в семенах
откладываются запасные вещества, необходимые для образования
проростков. Семена и плодовые оболочки в питательном отношении
не представляют интереса, поэтому в пищу и для переработки не
используются.
Плодовая мякоть образуется в результате разрастания
околоплодника под воздействием фитогормонов, поступающих из
семенных тканей, где происходит их синтез. Клетки
околоплодника начинают усиленно делиться, вызывая интенсивный рост
плодов. В дальнейшем происходит формирование зародыша и
эндосперма, которое сопровождается значительными
изменениями биохимических процессов во всех тканях плодов. В этот
период, хотя и замедляется рост плодов за счет; образования
новых клеток, продолжается интенсивное увеличение их массы
вследствие усиления биосинтетических процессов и накопления
сухого вещества, в связи с чем ранняя уборка плодов приводит к
недобору урожая и ухудшению его качества.
Важную роль в процессах созревания плодов играют фитогор-
моны, особенно этилен, образующийся в тканях околоплодника.
На первых этапах созревания плодов и ягод действие этилена
подавляется ауксином, в дальнейшем после завершения
формирования семенных тканей концентрация ауксина снижается и
синтез этилена усиливается. Под влиянием этилена повышаются
дыхание и проницаемость клеточных мембран, а также
ускоряются превращения запасных веществ, которые вначале
подвергаются окислению, а на завершающих этапах созревания плодов —
декарбоксилированию.
609
20
I1
10
I Л
Фаза созревания
ЛГ
Рис. 154. Изменение содержания углеводов
при созревании бананов, % (по Л. В. Мет-
лицкому, 1976):
/—зеленые плоды; //—зеленовато-желтые
плоды; ///— зрелые плоды; / — крахмал;
2—сахароза; 3 — моносахариды
Динамика углеводов. На ранних
стадиях образования плодов и ягод
в них синтезируется много
структурных углеводов — пектиновых
веществ, гемицеллюлоз, клетчатки,
а у некоторых культур образуется
крахмал. При переходе плодово-
ягодных культур к стадии
созревания плодов в них активизируются
процессы превращения
полисахаридов в сахара (рис. 154), причем состав этой фракции
определяется спецификой обмена веществ данной культуры. В ягодах
очень мало синтезируется сахарозы, и фракция Сахаров в них
представлена в основном глюкозой и фруктозой. В других плодах
кроме глюкозы и фруктозы образуется много сахарозы. Из
моносахаридов в семечковых плодах обычно преобладает фруктоза, а
в косточковых — глюкоза.
Общее количество Сахаров в плодах и ягодах в среднем
составляет 6—12 % сырой массы, в лимоне — 1—3, землянике —
12—20, а в винограде — до 26 %. Накопление в плодах углеводов
зависит от сроков вегетации растений, вследствие чего поздние
сорта характеризуются более высоким содержанием сахара. В
некоторых плодах и ягодах накапливаются восстановленные
производные моносахаридов — спирты, например, в рябине —
сорбит, в ананасах и оливках — маннит.
У ряда плодовых культур на первых этапах формирования
плодов синтезируется довольно много крахмала (бананы, яблоки,
груши), который на последующих этапах созревания
превращается в сахара и другие углеводы, что хорошо видно из данных,
представленных на рисунке 154 (Л. В. Метлицкий, 1976). В
косточковых плодах при созревании снижается концентрация
пектиновых веществ, однако это происходит не в результате их
распада, а вследствие усиления синтеза Сахаров и органических
кислот.
В семечковых плодах в процессе созревания довольно активно
происходит превращение протопектинов в пектины. В зрелых
плодах и ягодах содержание пектиновых веществ составляет 0,3—
1,5 % сырой массы, и они способны образовывать желе. При
созревании плодов и ягод снижается содержание клетчатки (в
2—3 раза) и гемицеллюлоз, в связи с чем они приобретают
мягкую консистенцию.
610
"Органические кислоты. При созревании плодов и ягод важную
роль играют органические кислоты, которые используются как
субстраты дыхания, кроме того, они определяют вкусовые
свойства плодово-ягодной продукции. Если в плодах много кислот и
мало Сахаров, то они имеют кислый вкус. Увеличение количества
Сахаров повышает степень сладости плодов, а при отношении
Сахаров к органическим кислотам, равном 25—30, кислый вкус
не ощущается.
В зрелых плодах органические кислоты в основном
локализованы в плодовой мякоти, а в плодовых оболочках и семенных
тканях их очень мало. В яблоках, грушах, винограде сравнительно
немного органических кислот (0,2—1 % сырой массы),
существенно больше их в землянике, апельсинах, вишне, сливах (1—2 %)
и особенно много в смородине (2—3 %) и лимонах (5—7 %).
Свыше 90 % всех органических кислот в плодах и ягодах
представлены яблочной, лимонной и янтарной кислотами, т. е.
метаболитами цикла ди- и трикарбоновых кислот, на долю других
кислот обычно приходится не более 3—5 %. Однако, несмотря на
их низкое содержание, эти кислоты играют важную роль в
определении вкусовых качеств и аромата плодов. В винограде
синтезируется очень много винной кислоты. В отличие от листьев, где
органические кислоты находятся в связанном состоянии, в плодах
они содержатся преимущественно в свободных формах,
локализованных в вакуолях, где образуется фонд запасных веществ.
При созревании плодов под воздействием этилена
повышается проницаемость мембран, и из вакуолей органические кислоты
поступают в цитоплазму, вызывая активацию ферментных
систем, катализирующих их превращения. Ключевым из этих
ферментов является малатдегидрогеназа декарбоксилирующая, с
участием которой происходят декарбоксилирование яблочной
кислоты и превращение ее в пировиноградную, при этом
образуются восстановленные нуклеотиды НАДФН, используемые в
реакциях синтеза запасных веществ:
сн2соон
СН(ОН)СООН
яблочная
кислота
+ НАДФ -» СН3СОСООН + НАДФН + Н + СО2
пировино-
градная
кислота
Образовавшаяся пировиноградная кислота далее окисляется в
цикле Кребса, а ее избыток подвергается снова декарбоксилиро-
ванию под действием фермента пируватдекарбоксилазы с
образованием уксусного альдегида:
снхосоон
сн3с=о
н
со2
611
Уксусный альдегид далее восстанавливается с образованием
спирта под действием фермента алкогольдегидрогеназы:
СН3С=О + НАД(Ф)'Н + Н+ -> СН3СН2ОН + НАД(Ф)+.
н
Накопление в тканях плодов уксусного альдегида и этилового
спирта обычно происходит на завершающих стадиях их
созревания и вызывает ингибирование фермента малатдегидрогеназы
декарбоксилирующей, в результате чего не образуются
восстановленные нуклеотиды НАДФН и происходит замедление
биосинтетических процессов. Понижение активности этого
фермента в более ранние фазы созревания плодов под влиянием низкой
температуры, повышенной концентрации диоксида углерода
уменьшает количество кислот, затрачиваемых на дыхание.
Поэтому при хранений плодов важное значение имеет поддержание
необходимого температурного режима и состава газовой среды.
В созревающих плодах и ягодах постоянно происходит синтез
органических кислот, однако их концентрация в тканях плодов
не возрастает, так как эти вещества обладают очень высокой
метаболической активностью и легко подвергаются
превращениям. Больше всего органических кислот содержится в незрелых
плодах, а в процессе созревания плодов их концентрация
снижается и одновременно наблюдается увеличение количества саха-
ров, вследствие чего возрастает сахарокислотное отношение
(сахара/кислоты) и плоды становятся более сладкими.
Азотистые вещества. Азотистые вещества плодов и ягод на
60—70 % состоят из белков, основная масса которых
представлена легкорастворимыми формами — альбуминами и глобулинами,
обладающими высокой биологической питательной ценностью.
Фракция небелковых азотистых веществ также имеет
значительную питательную ценность, так как содержит в том или ином
количестве незаменимые аминокислоты. В зрелых плодах
содержание сырого протеина составляет 1—2 % их сырой массы,
однако в пересчете на сухую массу оно в 5—7 раз выше. Поэтому
азотистые вещества наряду с сахарами и органическими
кислотами являются важными питательными компонентами плодово-
ягодной продукции. В процессе созревания плодов и ягод
концентрация азотистых соединений понижается в 2—3 раза, но в их
составе возрастает доля белков.
Витамины. Из витаминов в плодах и ягодах в наибольшем
количестве содержатся аскорбиновая кислота, каротин, фолие-
вая кислота, цитрин.
Во всех плодах и ягодах синтезируется много аскорбиновой
кислоты, которая, участвуя в окислительно-восстановительных
реакциях, оказывает значительное влияние на интенсивность
612
биохимических превращений, происходящих в тканях плодов
при их созревании. По мере созревания плодов снижается
концентрация окисленной и происходит накопление
восстановленной формы аскорбиновой кислоты. Больше этого витамина
локализовано в покровных тканях и меньше — в паренхиме
плодовой мякоти. У большинства плодово-ягодных растений в зрелых
плодах содержится 5—30 мг% аскорбиновой кислоты, в
землянике и цитрусовых — 50—70, в смородине — 200—400 мг%, а в
шиповнике — до 1—4 %.
Во многих плодах и ягодах наряду с аскорбиновой кислотой
содержится много цитрина (витамин Р) — 200—300 мг%. В
рябине, сливах и абрикосах синтезируется много каротина — 2—
5 мг%, в смородине и крыжовнике — 0,5—1 мг%. Количество
фолиевой кислоты больше в незрелых плодах, а в процессе их
созревания концентрация этого витамина снижается и
составляет 0,1—0,2 мг%. Другие витамины в фруктах содержатся в
меньших количествах.
Влияние внешних условий. Специфика биохимических
процессов в созревающих плодах и ягодах определяется тем, что в них
происходит накопление Сахаров и органических кислот. При
более интенсивном фотосинтезе в листьях растений образуется
много углеводных продуктов, которые, поступая в плоды и ягоды,
усиливают процессы накопления Сахаров. Ослабление работы
фотосинтетического аппарата снижает поток ассимилятов,
поступающих в репродуктивные органы, и в них меньше накапливается
Сахаров, в результате чего возрастает концентрация органических
кислот. Поэтому плоды, выращенные на юге в условиях
интенсивного освещения, содержат больше Сахаров и, следовательно,
более сладкие, чем плоды, выращенные в северных регионах.
Понижение концентрации органических кислот и увеличение
количества Сахаров в плодах наблюдаются также при ухудшении
влагообеспеченности растения. Поэтому оптимальный режим
выращивания плодово-ягодных культур, обеспечивающий
получение плодов и ягод с лучшим химическим составом, создается при
таких условиях, когда растения на достаточном уровне снабжены,
с одной стороны, световой энергией и теплотой, а с другой —
необходимым количеством влаги. Содержание в плодах и ягодах
аскорбиновой кислоты в зависимости от условий выращивания
изменяется так же, как и общее количество органических кислот.
Оптимизация питания. В связи с тем что плодово-ягодные
культуры имеют многолетний период развития, у них при
образовании плодов не заканчивается жизненный цикл развития и не
происходит отмирание вегетативной массы. Поэтому процессы
созревания плодов и нарастания вегетативной массы идут
одновременно и требуют постоянного обеспечения доступными
минеральными соединениями. Плодово-ягодные культуры
предъявляют повышенные требования к режиму питания. Недостаток
613
любого питательного элемента вызывает прежде всего ухудшение
роста растения и ослабление развития ассимиляционного
аппарата, что снижает накопление Сахаров в плодах. При
сбалансированном внесении азотных, фосфорных и калийных удобрений
значительно повышается сбор плодов и в них возрастает
содержание Сахаров и снижается концентрация органических кислот,
что приводит к заметному увеличению сахарокислотного
отношения, улучшающего их вкусовые качества. Действие микроудо-
борений на качество плодов и ягод также объясняется их
влиянием на развитие растений и интенсивность работы
фотосинтетического аппарата.
9.7. КАРТОФЕЛЬ
Хозяйственная ценность картофеля определяется довольно
высоким содержанием в его клубнях крахмала, белков,
аскорбиновой кислоты и других веществ. На кулинарные свойства
картофеля сильное влияние оказывают сахара и небелковые азотистые
вещества. В связи с тем что картофель дает высокий выход
полезных веществ с 1 га, эта культура является важным источником
возобновляемых природных ресурсов, используемых в качестве
сырья для пищевой и биотехнологической промышленности.
Накопление крахмала и других углеводов. В сырых клубнях
картофеля содержание крахмала чаще всего составляет 12—18 %,
и он представлен двумя полисахаридами — амилозой и амило-
пектином. В среднем на долю амилозы в клубнях картофеля
приходится 20—25 % общего количества крахмала.
Полисахариды крахмала синтезируются в клубнях из
углеводов, поступающих по флоэме из надземных органов, и
откладываются в клетках запасающей паренхимы в виде крахмальных
зерен, большая часть которых сконцентрирована в камбиальном
слое и внешней части сердцевины. Значительно меньше их
содержится во внутренних слоях сердцевины.
Величина крахмальных зерен оказывает влияние на
кулинарные свойства картофеля. Установлено, что если крахмальные
зерна имеют диаметр менее 20 мкм, то они при варке картофеля
сильнее набухают, вызывая разрыв клеточных стенок, в
результате клубни приобретают полужидкую консистенцию.
В начале клубнеобразования, когда происходит интенсивное
формирование структурных элементов клеток, скорость синтеза
крахмала невелика и его содержание в молодых клубнях не
превышает 8—10 %. Однако в период интенсивного
клубнеобразования синтез крахмала заметно усиливается и его
концентрация в клубнях возрастает до 15—20 %. На завершающих этапах
созревания, когда происходит отмирание листьев, количество
крахмала в клубнях картофеля может понижаться вследствие
614
прекращения притока углеводов из надземных органов и их
расхода на дыхание.
В зависимости от интенсивности синтеза крахмала изменяется
содержание Сахаров — в молодых клубнях их концентрация в
несколько раз выше, чем в зрелых.
Количество Сахаров заметно повышается при хранении
клубней, особенно при пониженной температуре, когда процессы
образования крахмала ингибируются сильнее, чем его распад, в
результате значительная часть крахмала превращается в сахара и
клубни приобретают сладкий вкус.
Повышение концентрации Сахаров в клубнях картофеля
ухудшает их технологические свойства, так как при тепловой
обработке клубней сахара неферментативным путем взаимодействуют
с аминокислотами, вследствие чего образуются темноокрашен-
ные продукты — меланоидины, ухудшающие качество
получаемых пищевых продуктов. В целях предотвращения повышения
концентрации Сахаров рекомендуют хранить клубни картофеля
при температуре не ниже 3—4 "С. При более высокой
температуре усиливаются дыхание клубней и жизнедеятельность
микроорганизмов, что приводит к быстрой порче картофеля.
Для закладки на хранение, а также переработки в различные
пищевые продукты следует использовать только зрелые клубни,
имеющие более низкую концентрацию Сахаров.
Накопление азотистых веществ. Большая часть азотистых
веществ клубней картофеля представлена белками, тогда как на
долю небелковых форм азота обычно приходится 30—40 %.
Азотистых веществ больше накапливается в кожуре и сердцевине
клубня и значительно меньше — в камбиальном слое и
периферийной части сердцевины.
Белки клубней на 50—65 % состоят из запасных форм —
глобулинов, тогда как альбумины составляют 20—30 % и глютели-
ны — 15—20 % общего количества белков. Они довольно хорошо
сбалансированы по составу незаменимых аминокислот, поэтому
имеют высокую биологическую питательную ценность (80—85 %
по сравнению с белками молока или яйца).
Небелковые азотистые вещества клубней картофеля примерно
на 90 % представлены свободными аминокислотами и их
амидами. Однако сбалансированность этой фракции по содержанию
незаменимых аминокислот хуже, чем белков.' Поэтому в целях
улучшения качества клубней при выращивании картофеля
желательно добиваться увеличения доли белков и снижения
концентрации свободных аминокислот, тем более что, как указано ранее,
свободные аминокислоты участвуют в реакциях меланоидинооб-
разования, снижающих качество пищевых продуктов,
получаемых при переработке картофеля.
Свободные аминокислоты также могут быть причиной
потемнения тканей клубня в результате окисления кислородом воздуха
615
тирозина. Образующиеся продукты — меланины — представляют
собой вещества черного цвета.
Интенсивность синтеза белков в процессе клубнеобразования
постепенно повышается и существенно возрастает на
завершающих этапах их созревания. Синтезируются белки из аминокислот,
поступающих в клетки клубней из корней и листьев растений.
Концентрация в клубнях белков оказывает заметное влияние
на кулинарные свойства картофеля, при этом важное значение
имеет соотношение белков и крахмала. При чрезмерном
повышении белковости клубней они после варки имеют очень
вязкую консистенцию, тогда как при слишком высокой
концентрации крахмала клубни при варке растрескиваются.
Выяснено, что хорошие кулинарные качества имеет картофель, у
которого отношение крахмал:белки в пределах 12—16.
На практике для оценки количества белков и общего
содержания азотистых веществ в клубнях картофеля используют
показатель «сырой протеин». Среднее содержание сырого протеина в
картофеле обычно составляет 1,5—2,0 % сырой массы клубней.
Динамика других соединений. Кроме белков и углеводов
питательную и кормовую ценность клубней картофеля определяют
органические кислоты, липиды, витамины, гликоалкалоиды.
Содержание органических кислот в картофеле достигает 1,0—
1,5 % сырой массы клубней, преобладающими являются
лимонная и яблочная. В процессе созревания клубней концентрация в
них кислот постепенно понижается.
Количество липидов в клубнях в среднем составляет 0,1 %,
больше их в перидерме и меньше в сердцевине. В составе
липидов ненасыщенных и насыщенных кислот примерно поровну,
однако при хранении клубней доля ненасыщенных жирных
кислот возрастает, что улучшает биологическую питательную
ценность липидов. В процессе созревания количество липидов в
клубнях почти не изменяется.
Картофель — важный источник аскорбиновой кислоты,
содержание которой в зрелых клубнях составляет 15—25 мг%, а в
молодых может достигать 40 мг%. В процессе созревания
клубней содержание в них аскорбиновой кислоты снижается,
увеличивается доля ее дегидроформы. Особенно заметно понижается
концентрация этого витамина при хранении (за зимний период в
2—3 раза).
Содержание в картофеле других витаминов изменяется
меньше и в среднем составляет, мг%: В) и В2 0,1—0,2, Вб 0,5—1,0,
РР 0,5—1,5, пантотеновой кислоты 0,2—0,3.
Пищевая пригодность клубней картофеля зависит от
содержания в них гликоалкаловдов, молекулы которых построены из
остатков моносахаридов (глюкозы, галактозы, рамнозы) и
стероидного алкалоида соланидина. В зависимости от состава Сахаров
различают две группы гликоалкаловдов: соланины и чаконины,
616
обладающие токсическим действием на организм человека и
животных.
Большая часть гликоалкалоидов локализована в кожуре, и
значительно меньше их содержится в запасающей ткани. При
созревании клубней количество гликоалкалоидов в них понижается в
2—3 раза и в зрелых клубнях не превышает 4—5 мг%.
Картофель, содержащий свыше 20 мг% соланинов и чаконинов,
непригоден для употребления в пищу и на корм скоту.
Концентрация гликоалкаловдов резко возрастает при позеленении клубней.
Влияние внешних условий. В зависимости от условий
выращивания содержание крахмала и азотистых веществ в клубнях
картофеля может изменяться в 1,5—2,0 раза. Как уже отмечалось,
при относительно низкой влажности и высокой температуре в
растениях усиливается синтез азотистых веществ и снижается
накопление углеводов, что характерно и для картофеля. Однако
в таких условиях также возрастает доля крахмала в общем
углеводном комплексе клубней.
,При повышении влажности и снижении среднесуточных
температур интенсивность синтеза крахмала в картофеле
понижается, а концентрация Сахаров возрастает, уменьшается также
содержание сырого протеина и доля белковых веществ. Вместе с
тем недостаток влаги в период клубнеобразования, хотя и
повышает накопление в клубнях крахмала, значительно понижает
урожайность картофеля, поэтому общий выход крахмала с 1 га
уменьшается. В условиях переувлажнения, как правило,
снижаются как урожайность картофеля, так и накопление в клубнях
крахмала.
Примерно такие же изменения химического состава
картофеля наблюдаются под воздействием природно-климатических
факторов. В северных и северо-западных регионах,
отличающихся повышенной влажностью и более низкими температурами, в
клубнях картофеля меньше накапливается крахмала и белков, но
возрастает концентрация Сахаров и свободных аминокислот. При
продвижении на юг накопление в клубнях крахмала и белков
увеличивается вследствие того, что возрастает интенсивность
солнечной радиации, вызывая снижение влажности и повышение
среднесуточных температур.
Под воздействием внешних факторов происходят
существенные изменения в углеводном и белковом комплексе картофеля.
При снижении влажности и повышении температуры в составе
крахмала возрастает доля амилопектина, а в составе белков —
глобулинов.
Оптимизация питания. Картофель предъявляет повышенные
требования к режиму питания. Для получения высоких урожаев
этой культуры с оптимальным химическим составом клубней
необходимо учитывать ряд особенностей, связанных с действием
617
элементов питания на развитие растений и процесс клубнеобра-
зования.
Азот стимулирует интенсивный синтез азотистых веществ и
образование вегетативной массы, однако удлиняет сроки
вегетации растений и задерживает образование клубней. При усилении
азотного питания в клубнях повышается содержание азотистых
веществ и снижается накопление крахмала.
Фосфор ускоряет развитие растений и процесс клубнеобразо-
вания, улучшает кулинарные качества картофеля и повышает
накопление в клубнях крахмала и аскорбиновой кислоты.
Калий активирует процессы углеводного обмена и
превращение Сахаров в крахмал, в результате чего в клубнях накопление
крахмала повышается. В то же время при внесении хлористых
калийных удобрений может происходить значительное
ухудшение качества клубней, связанное с действием хлора,
являющегося активатором гидролитических ферментов, которые
катализируют распад крахмала.
Следовательно, при выращивании картофеля в первой
половине вегетации в целях усиления ростовых процессов
необходимо обеспечивать высокий уровень как азотного, так и фосфорно-
калийного питания, а в период клубнеобразования уровень
азотного питания должен быть существенно снижен.
При культивировании кормового картофеля одной из важных
задач является повышение содержания в клубнях белковых
веществ, в связи с чем необходимо усиление режима азотного
питания. Наряду с этим в целях повышения содержания белков
в клубнях картофеля проводят молекулярно-биохимические
исследования, направленные на изучение генетической системы
растений картофеля и выявление возможности регуляторных
сдвигов, приводящих к усилению синтеза запасных белков.
9.8. ОВОЩНЫЕ КУЛЬТУРЫ
Основные питательные вещества овощных растений — сахара,
белки, органические кислоты, витамины. Важным показателем,
характеризующим питательную ценность овощей, является также
содержание сухих веществ, определяющих выход полезной
продукции.
Накопление Сахаров и других углеводов. В продуктовых органах
овощных растений накапливается довольно много Сахаров — 3—
6 % сырой массы, а в сухом веществе овощей концентрация саха-
ров может достигать 40—60 %. Очень мало Сахаров содержится в
огурце — 1,0—1,5 %. Сахара овощей на 70 % представлены
глюкозой, фруктозой и сахарозой. В капусте, томате, перце, огурце,
баклажане преобладают моносахариды, а в луке — сахароза.
Крахмала в большинстве овощей содержится очень мало — не
618
более 0,1 %, и лишь в листовых овощах его концентрация
составляет 0,3—1 %. В чесноке образуется довольно много полифрукто-
зидов — 20—30 % сырой массы. В овощах содержатся также
пектиновые вещества в количестве 0,1—0,2 %, а в капусте —до 1—
2 %. Все эти углеводы относятся к легкоусвояемым веществам и
поэтому повышают питательную ценность овощной продукции.
Питательные свойства овощей зависят от количества в них
клетчатки. При повышении ее содержания переваримость всех
питательных веществ овощей ухудшается. У большинства овощей
содержание клетчатки составляет 0,5—1 %, у томата — 0,2 %, у
капусты — 1—2 %.
В процессе созревания овощей содержание в них
легкоусвояемых углеводов увеличивается, а количество клетчатки
уменьшается. Так, например, количество Сахаров в незрелых плодах
томата, перца, баклажана на 1,0—1,5 % ниже, чем в зрелых. В
репчатом луке количество Сахаров при созревании луковиц
увеличивается в 1,5—2,0 раза. При дозревании овощей вне
растения содержание Сахаров снижается в результате их расхода на
дыхание. При старении растений у листовых и ряда других
овощей (огурец, кабачок, патиссон) повышается содержание
клетчатки, вследствие чего резко снижается их питательная ценность.
Азотистые вещества. Овощные растения — важный источник
полноценных белков и незаменимых аминокислот. Общее
количество сырого протеина в них обычно составляет 0,5—2,0 % сырой
массы, а в пересчете на сухое вещество — 10—30 %. У большинства
овощей азотистые вещества на 40—60 % состоят из свободных
аминокислот и их амидов, у перца и капусты в составе азотистых
веществ преобладают белки (60—70 % сырого протеина).
Белки овощей обладают высокой биологической питательной
ценностью, так как на 60—70 % представлены легкопереваримы-
ми формами (альбуминами и глобулинами), хорошо
сбалансированными по содержанию незаменимых аминокислот. Фракция
небелкового азота также содержит все незаменимые
аминокислоты и, следовательно, повышает питательную ценность азотистых
веществ овощей.
При созревании овощей в них довольно интенсивно
происходит синтез азотистых веществ, однако общее их содержание во
многом определяется накоплением Сахаров и других углеводов. В
незрелых овощах, имеющих мало Сахаров, очень часто
содержание сырого протеина выше, чем в зрелых. Более заметно это
выражено у зеленных овощей.
Органические кислоты. В тканях большинства овощей
накапливается значительное количество органических кислот, среди
которых преобладают лимонная и яблочная. В некоторых овощах
много янтарной (томат, лук) и щавелевой (ревень) кислот.
Кислоты в овощах в основном находятся в свободном состоянии и
поэтому легко могут превращаться в углеводы и использоваться
619
на дыхание. В процессе созревания овощей концентрация
органических кислот, как правило, повышается, однако усиления
кислого вкуса не наблюдается, так как одновременно происходит
накопление Сахаров.
Витамины. В овощах содержится много аскорбиновой
кислоты, цитрина и провитамина А — каротина.
Для большинства овощей содержание аскорбиновой кислоты
составляет 20—60 мг%, а в цветной капусте, перце, укропе и
петрушке—до 150—200 мг%. Большое количество веществ,
обладающих Р-витаминной активностью, накапливается в перце,
баклажане, листовых овощах — 50—250 мг%. Много каротина
содержится в листовых овощах (4—10 мг%), томате и перце (1—4 мг%).
Содержание в овощах других витаминов составляет в среднем,
мг%: Е 3-10; К 2-5; Вь В2, В6 по 0,05-0,1; РР 0,1-0,2;
пантотеновая кислота 0,1—0,5; фолиевая кислота 0,1—0,6.
Содержание витаминов в овощах зависит от фазы развития
растений. У листовых овощей максимальное накопление
витаминов наблюдается в ранние фазы их развития, а в дальнейшем
содержание витаминов в вегетативной массе растений
уменьшается. Такая же закономерность наблюдается у капусты и
репчатого лука. У других овощных растений (томат, перец, баклажан,
огурец) по мере созревания плодов концентрация витаминов
существенно возрастает.
Влияние внешних условий. У овощных растений, у которых в
качестве товарной продукции используются плоды, накопление
Сахаров и аскорбиновой кислоты, как правило, увеличивается
при усилении солнечной радиации, обычно сопровождающемся
понижением влажности и повышением температуры. Особенно
это проявляется на перце и томате. При выращивании этих
культур в южных регионах, а также в условиях жаркой погоды в
их плодах повышается накопление Сахаров и аскорбиновой
кислоты, тогда как при влажной погоде и поливах количество
Сахаров и аскорбиновой кислоты уменьшается. У листовых овощей
при усилении солнечной радиации возрастает концентрация
азотистых веществ, а количество Сахаров в товарной продукции
уменьшается.
Оптимизация питания. Овощные растения потребляют
довольно много питательных веществ на единицу массы сухого
вещества. Потребность в питательных элементах особенно возрастает во
время формирования продуктовых органов. Поэтому одно из
главных требований при выращивании овощных культур —
обеспечение сбалансированного питания растений.
Недостаток одного из элементов в процессе вегетативного
роста обычно приводит к существенному снижению
урожайности овощных культур, а в период формирования продуктивных
органов —как к снижению выхода товарной продукции, так и ее
качества. Так, например, при недостатке фосфора или калия в
620
овощах снижается накопление Сахаров и аскорбиновой кислоты,
а при недостатке азота наблюдается понижение концентрации
белков и каротина.
Не менее вредным является избыточное азотное питание,
вызывающее уменьшение накопления Сахаров и аскорбиновой
кислоты и повышение концентрации нитратов. Поэтому при
внесении удобрений под овощные культуры строго следят за тем,
чтобы азот в достаточной степени был сбалансирован фосфором
и калием. Очень часто применяют дробное внесение азотных
удобрений небольшими дозами для того, чтобы предотвратить
накопление в овощах опасной концентрации нитратов. Это
особенно важно при выращивании зеленных овощей.
В ряде опытов показано влияние на качество овощей
некоторых микроэлементов — молибдена, бора, меди. При их
недостатке наблюдалось снижение накопления в овощах как Сахаров, так
и азотистых веществ.
Таким образом, учитывая особенности формирования
продуктовых органов и влияние на качество продукции режима
питания и других условий выращивания, возможно получение
высоких урожаев овощных культур с оптимальным содержанием
полезных химических веществ.
Контрольные вопросы
1. Какие основные процессы происходят при созревании зерна злаковых и
зернобобовых культур? 2. Какие факторы действуют на эти процессы и как они
влияют на качество зерна? 3. В чем причины накопления большого количества
крахмала в зерне злаков и белков в семенах зернобобовых культур? 4. Какие
изменения наблюдаются в составе белков и углеводов во время созревания зерна?
5. Как изменяется качество урожая зерновых и зернобобовых культур в
зависимости от условий выращивания? 6. Какие приемы применяют для повышения
накопления в зерне запасных белков и улучшения их состава? 7. Как влияют на
качество зерна другие химические вещества? 8. Каковы особенности физиолого-
биохимических превращений, происходящих при созревании масличных
растений? 9. Как влияют условия выращивания на накопление и качественный состав
жира? 10. Какую ценность имеют белки семян масличных растений? 11. Какие
вещества определяют питательную ценность корнеплодов? 12. Как изменяется
химический состав корнеплодов в процессе их созревания? 13. Какие условия
необходимы для оптимизации процессов сахаронакопления у сахарной свеклы и
других корнеплодов? 14. Какова динамика азотистых веществ и углеводов в
процессе роста и развития бобовых и мятликовых трав? 15. Как изменяется
питательная ценность вегетативной массы трав в зависимости от внешних условий и
особенностей питания растений? 16. В чем различие физиолого-биохимических
подходов при оценке действия факторов внешней среды на качество урожая
бобовых и мятликовых трав? 17. Какие биохимические превращения происходят
в плодах и ягодах при их созревании? 18. Какую роль играют сахара,
органические кислоты, азотистые вещества, витамины при оценке питательных и вкусовых
свойств плодово-ягодной продукции? 19. Как изменяется содержание в плодах и
ягодах Сахаров и органических кислот в зависимости от условий выращивания?
20. Каковы особенности формирования качества урожая картофеля и овощных
культур?
Глава 10
РАСТЕНИЕ КАК САМООРГАНИЗУЮЩАЯСЯ,
САМОРЕГУЛИРУЮЩАЯСЯ
И САМОРАЗВИВАЮЩАЯСЯ
АДАПТИВНАЯ СИСТЕМА
Растениям свойственна высокая степень упорядоченности и
регуляции. Растение — это 'сложная самоорганизующаяся,
саморегулирующаяся и саморазвивающаяся адаптивная
система, все элементы которой Друг с другом функционально
связаны, друг друга обусловливают. Функции отдельных клеток,
тканей и органов (листья, стебли, корни и др.) взаимосвязаны
и влияют друг на друга. Адаптивные и регуляторные
механизмы растения определяют его взаимодействие с внешней
средой. Это подобие кибернетических систем. Изучив эти
системы, человек сможет более полно удовлетворять потребности
растений в факторах среды, управлять процессом
формирования урожая и его качеством. Управление — это процесс
перевода системы из одного состояния в другое путем воздействия
на ее переменные.
В 1950 г. И. И. Гунар определил новое направление
физиологии растений, основанное на том, что у растений имеется
сложная и чувствительная (раздражимая и возбудимая) регуля-
торная система, управляющая всеми процессами их
жизнедеятельности. Растениям свойственны способности к
самонастройке и саморегулированию, которые составляют фундамент
адаптивной (приспособительной) их изменчивости. Так, при
изменении густоты стояния растений в посеве меняются
ориентация их листьев, высота, распределение корней по слоям
почвы и др.
Вопрос о системах и механизмах, воспринимающих и
перерабатывающих поступающую информацию, представляет собой
одну из наиболее интересных и сложных проблем современной
биологической науки. Познание систем регуляции и регулятор-
ных функций растений, связанных со свойствами различных
структур, процессов, реакций, а также получение информации о
связях физиологических функций растений с условиями
внешней среды необходимы для разработки агрономической
кибернетики, совершенствования технологий выращивания
сельскохозяйственных культур. При планировании работы по селекции
растений и разработке агротехнических мероприятий,
обеспечивающих наивысшие урожаи высокого качества, надо исходить из
современных представлений о генотипах и фенотипах растений,
622
наличии у растений сложнейшей регуляторной системы. Система
регуляции целостного растения включает как органические
составные части внутриклеточные и межклеточные системы
регуляции. Внутриклеточные и межклеточные системы регуляции
осуществляются через генетическую систему регуляции, регуляцию
активности ферментов, мембранную регуляцию, трофическую
регуляцию, гормон&чьную систему регуляции,
электрофизиологическую регуляцию.
В генотипе каждого растения заложены (запрограммированы)
все его возможности, которые могут реализоваться в виде
фенотипа при данных условиях (почва, климат, погода, севооборот,
обработка почвы, удобрение, уход за растениями, защита от
болезней и вредителей и др.). Регуляторная система растения
складывается из его генетического аппарата, биологических часов,
клеточных мембран, ферментных систем, ионов, фитогормонов
и межклеточных связей. Эти система обладает большой
чувствительностью («раздражимостью») к физическим и химическим
воздействиям вследствие нековалентных слабых связей
(водородных, гидрофобных, электростатических), образующих вторичные,
третичные и четвертичные конформации белков, нуклеиновых
кислот, нуклеопротеидов, их комплексов с липидами,
углеводами, ионами и фитогормонами. Слабые связи участвуют в
организации и функционировании клеточных мембран, органелл и
ферментных систем.
Все физиологические процессы складываются из цепей,
циклов и сетей биохимических и биофизических реакций,
осуществляемых ферментами по принципу: 1 ген (или несколько
генов) —» 1 белок (или несколько белков) —> 1 фермент —> 1
реакция. Биохимические реакции осуществляются в органеллах
клетки и в цитоплазматических структурах, главной составной
частью которых являются некаталитические (неферментные)
белки, синтез которых также закодирован в ядерных и
цитоплазматических ДНК. Каждая живая клетка содержит полный
набор генов, необходимых для онтогенеза, но в каждый данный
момент времени активны только те гены, которые необходимы
для данного этапа роста и развития растения.
Включение и выключение генов осуществляются репрессора-
ми и дерепрессорами белковой природы в соответствии с
внутренними и внешними условиями. Деятельность .уже
образовавшихся ферментов и структурных белков регулируют
всевозможные активаторы и ингибиторы: промежуточные и конечные
метаболиты, ионы Н+ и ОН~, катионы и анионы питательных
солей, в первую очередь Са2+, К+ и Мо2+. Фоторегулирование
рассматривают как составную часть общей системы
биологического саморегулирования, где внешний сигнал — свет выступает в
роли усилителя и переключателя основных механизмов
эндогенного регулирования.
623
Организменный уровень регуляции. Исходя из изложенного,
онтогенез растения можно представить как реализацию каскада
генетических программ (рис. 155). Всю генетическую программу
роста и развития можно подразделить на подпрограммы
вегетативного и генеративного развития. В свою очередь, эти
подпрограммы разделяются на блоки вегетативного и генеративного
гистогенеза и органогенеза. Имеются многочисленные данные о
том, что гены, необходимые для каждого гистоорганогенеза,
сгруппированы в блоки, которые выключаются или включаются
как одно целое.
Переключение с вегетативного на генеративное развитие
происходит в зависимости, от комплексов внутренних и внешних
условий. В эндогенных и экзогенных включениях, выключениях
и переключениях участвуют метаболиты, фитогормоны, катионы
и анионы, вода. Все эти факторы изменяют структурные и
функциональные свойства ядра, цитоплазматического матрикса,
мембран, микросом, хлоропластов, митохондрий и других
органоидов клетки. При аномальных условиях возможно обратное
переключение с генеративного на вегетативное развитие, что
выражается в израстании соцветий и др. Болезни, вредители и
искусственные регуляторы роста могут исказить нормальную
реализацию генетических программ.
Тело даже травянистого растения составляют мирриады
клеток (на 1 см2 листа приходится более миллиона клеток), каждая
из которых способна превратиться в целое растение, т. е.
обладает всеми возможностями данного вида и сорта растения (тотипо-
тентность). Но в целостном растении деятельность клетки
подчинена общим потребностям организма и в ней осуществляются
лишь процессы, нужные растению в данное время и при данных
условиях.
Управляют деятельностью клеток те части и органы растения,
которые наиболее важны на данном этапе роста и развития:
верхушечные меристемы; ростовые зоны; зачатки плодов и
семян; вегетативные органы запаса и размножения. Эти части и
органы растения обладают большой аттрагирующей
(привлекающей) способностью в отношении продуктов фотосинтеза.
Механизм привлечения веществ от «производителей» — доноров к
«потребителям» — акцепторам пока не выяснен, но очевидно,
что он осуществляется через плазмодесмы и проводящую
систему посредством потоков воды, метаболитов, ионов, фитогормо-
нов и биоэлектрических токов.
В конусах роста стебля, распускающихся почках и молодых
листьях образуется большое количество природных ростовых
веществ — ауксинов, которые регулируют рост расположенных
ниже метамерных органов. У растений в каждый данный момент
времени возникают и функционируют молодые клетки и ткани,
которые «омолаживают» взрослое растение на клеточном, ткане-
624
III
вом, органном и организменном уровнях (Н. П. Кренке, 1940;
Ч. Чайлд, 1941). Возраст определяется генетически, поэтому все
процессы (даже новообразующиеся меристемы) несут в себе
отражение общего возраста растительного организма.
Уровень фотосинтеза, дыхания и других физиологических
процессов определяется внешними возможностями, с одной
стороны, и внутренними потребностями — с другой. При
ослаблении потребностей уменьшается и интенсивность
процессов. Поэтому агроному следует обеспечивать рост и развитие
тех частей и органов растения, ради которых он выращивает
данную культуру (зеленая масса, стебли, плоды и семена,
клубни, корни и т. д.). У местных популяций и сортов в результате
длительной эволюции (изменчивость — наследственность —
отбор) все физиологические процессы и этапы онтогенеза
(ритмы питания, роста и развития) приспособлены к
закономерным изменениями почвенно-климатических условий. При
интродукции новых видов растений, выведении и внедрении
новых сортов надо отдавать предпочтение тем из них, у
которых ритмы жизнедеятельности наилучшим образом совпадают
с ритмами изменения внешних условий. Сорта, малоурожайные
в месте их выведения, могут оказаться высокоурожайными в
других почвенно-климатических условиях, т. е. необходима
совместная работа всех селекционных центров (географическая
селекция).
В России и за рубежом предпринимаются успешные попытки
«диалога с растением», что важно для оптимизации условий
выращивания, проведения поливов, подкормок, борьбы с
вредителями, болезнями и сорняками. Для таких диалогов используют
данные о фотосинтезе, транспирации, температуре, водном токе
растений, росте, слабом постоянном метаболическом свечении
клеток. Эта информация важна также для диагностики
устойчивости растений, контроля развития болезней. Для
диагностических целей особый интерес представляет использование
электрических свойств растений. Имеются приборы, пригодные и для
полевых агрономических оценок.
Доминирующие центры. По В. В. Полевому (1981), основной
принцип организменного уровня регуляции — наличие у
растений центров организации — доминирующих центров (рис. 156).
Растение имеет биполярную структуру, представленную
верхушками побега и корня. Апексы этих органов являются зонами
ткане- и органообразования, сенсорными и аттрагирующими
метаболиты зонами. Верхушка вегетирующего побега ингибирует
рост боковых почек, индуцирует образование проводящих пучков
и корнеобразование, влияет на ориентацию листьев, рост корней
и т. д. Кончик корня тормозит закладку боковых корней,
индуцирует образование и рост стеблевых почек, поддерживает
трофику листьев и т. д. Большинство этих эффектов определяется
626
IV
Регуляция взаимодействия
Анатомо-
морфологичес-
кие особенности
Ярусность
посевов
Устойчивость
Аллелопатия
III
Полярность
Гормональная
регуляция
Генная
регуляция
Взаимовлияние
(положительное и
отрицательное) в
одно- и
многовидовых ценозах
- Симбиотические
отношения
■ Биопотенциалы
• Корневые
выделения
Доминирующие
центры
Канализованная
связь
Регуляторные контуры
Электрофизио-
логическая
регуляция
Мембранная
регуляция
I Регуляция
активности ферментов
Рис. 156. Взаимосвязь и соподчинение систем регуляции у растений
(по В. В. Полевому, 1989; дополненный):
уровни регуляции: /—внутриклеточный; //—межклеточный; ///—организменный; IV-
ценотический
синтезом в доминирующих центрах ауксина и цитокинина.
Доминирующие центры влияют на другие части растения путем
создания физиологических полей (физиологических градиентов).
Наличие физиологических градиентов (осевых, латеральных) —..
признак активности, повышенной жизнеспособности растения.
627
Изменение «силы воздействия» верхушки побега или корня
отражается на состоянии всех органов растения, входящих в поле.
Целостность растительного организма обеспечивают
доминирующие центры с помощью гормональных и электрических полей,
канализованных связей и осцилляции.
Полярность. Целостность растения определяется его
полярностью. Полярность является обязательным свойством живого
растительного организма, выражается в морфофизиологических
различиях противоположных концов или сторон клеток, тканей,
органов и всего растения, интенсивности дыхания и
фотосинтеза, ростовых процессов, электрических потенциалов,
осмотического давления, рН, концентрации веществ, активности
ферментов и др. Полярность определяется прежде всего градиентами
электропотенциалов и фитогормонов.
Канализованные связи. У растений в ходе онтогенеза между
различными органами формируются коммуникации в виде
проводящих сосудистых пучков, по которым транспортируются
вода, питательные вещества, фитогормоны, передаются
электрические сигналы. Канализованные связи обеспечивают до-
норно-акцепторные отношения между гетеротрофными
органами, являющимися акцепторами ассимилятов, и донорами
органических веществ. Канализованные связи наряду с
полярностью определяют пространственную организацию частей и
органов растения, контролируются его доминирующими
центрами.
Осцилляции. Предполагают, что временная интеграция
растительного организма осуществляется через систему
взаимосвязанных ритмических колебательных физиологических процессов —
осцилляции. Морфогенетические осцилляции (ритмы) в апексе
побега преобразуются в закономерное образование метамеров
(чередование листьев, пазушных почек и междоузлий).
Осцилляции (колебательные процессы) одного порядка входят в состав
осцилляции с большей амплитудой, являются своеобразными
биологическими часами, важными элементами регуляторной
системы растения, служат для временной синхронизации
различных взаимосвязанных физиологических процессов в целом
растении. Э. Бюннинг (1956) выделил шесть типов ритмов
физиологических процессов: с длиной периода в несколько лет; годовые;
с длиной периода в несколько месяцев или недель; суточные
(или околосуточные — циркадные); приливные; с коротким
периодом.
Е. Е. Крастина (1965) предложила выделить в группе ритмов с
коротким периодом ритмы с периодом в несколько часов и с
периодом около часа и менее (пульсации). Один и тот же
процесс, например рост, может одновременно иметь ритмы с
различной длиной периода — фазные, суточные и часовые
пульсации (В. С. Шевелуха, 1980). Возможно, что колебательность вза-
628
I
имосвязанных процессов является одним из способов
оптимизации уровня функции, наиболее энергетически выгодного их
хода.
Иерархия системы регуляции. Внутри- и межклеточные
системы регуляции функционируют во взаимодействии в виде регуля-
торных контуров. Внешний сигнал (световой, температурный,
химический и др.) воспринимается рецепторами рецепторных
клеток, которые перекодируют его в гормональный или
электрический сигнал. Гормональный или электрический сигнал
ретранслируется клетками каналов связи компетентным (способным
реагировать на него) клеткам. Сигнал изменяет функциональную
активность этих клеток, что и определяет ответную реакцию
целостного растения на внешний сигнал.
Предполагают существование обратных связей,
корректирующих эти процессы. Наличие их подтверждает колебания
физиологических процессов. Формирование прямых и обратных связей
создает колебательный контур, который объединяет всю
совокупность разнообразных процессов целостного растительного
организма. Следовательно, организменный уровень интеграции
достигается взаимодействием частей растения по принципу регуля-
торных колебательных контуров и благодаря элементам
централизации управления.
Еще более сложные отношения складываются между
растениями в естественных одновидовых и многовидовых ценозах и
агрофитоценозах (IV уровень регуляции). Взаимовлияние
растений на ценотическом уровне может быть положительным и
отрицательным. Регуляция взаимодействия определяется
биологическими особенностями участвующих в ценозе видов
растений, их анатомо-морфологическими признаками,
устойчивостью к неблагоприятным факторам среды, аллелопатически-
ми и симбиотическими отношениями. Эти вопросы являются
предметом изучения фитоценологии, луговодства, частного
растениеводства.
Использование физиологических показателей в
программировании. Получение программированных урожаев основных
сельскохозяйственных культур. Чтобы урожаи были достаточно
устойчивыми, необходимо использовать достижения физиологии
в агрономической практике, приемами агротехники полнее
раскрывать биологический потенциал сортов и гибридов
сельскохозяйственных культур, уменьшать влияние на растения
неблагоприятных факторов среды. На основе комплексных
знаний и имеющихся ресурсов возможно получение
планируемых, расчетных, программируемых урожаев
сельскохозяйственных культур. Так, -рекордные мировые уровни урожайности
сельскохозяйственных культур следующие (т/га): кукуруза 22,2,
пшеница 14,5, соя 5,6, сорго 21,5, картофель 95,0, рис 14,4,
629
сахарная свекла 120,0, сахарный тростник 250,0, овес 10,6,
ячмень 11,4.
И. С. Шатилов и А. Ф. Чудновский (1980) отмечают, что «все
обилие агрономических рекомендаций сводится к учету условий,
обеспечивающих урожай, — к пяти факторам урожайности,
соответствующим пяти основным субстанциям энерго- и массообме-
на в системе растение — почва — приземный воздух. Именно
свет, тепло, влага, углекислый газ и пища — вот чем должно
быть обеспечено растение для своего оптимального развития и
что оно, получая из окружающей среды, должно наилучшим
образом использовать». В каждой конкретной зоне, хозяйстве,
поле свои условия. Их обязательно должен учитывать агроном,
ставя задачу получения программированных урожаев при
применении современной технологии.
Программирование урожаев сельскохозяйственных культур —
это разработка комплекса взаимосвязанных мероприятий,
своевременное и качественное выполнение которых
обеспечивает получение расчетного планируемого урожая с известной
вероятностью при одновременном повышении плодородия
почвы и учете требований охраны окружающей среды.
Программирование обеспечивает построение системы земледелия
на строго количественной основе, учитывающей влияние
основных почвенно-климатических факторов на урожай и
качество продукции, оперативное выявление лимитирующих
условий и приемы их оптимизации для каждого конкретного поля
в складывающейся обстановке. Программирование урожаев
предусматривает:
1. Определение уровня возможного урожая возделываемых
культур и сортов по лимитирующему в зоне (хозяйстве) фактору
с учетом окультуренное™ и плодородия каждого поля. При этом
прежде всего учитывают реальные материальные ресурсы
хозяйства (наличие удобрений, гербицидов, техники и др.). По
фотосинтетической деятельности растений в посевах и
географическому распределению приходящей ФАР ученые определили
теоретически возможные урожаи в различных зонах страны.
Колебания оказались очень значительными — от 0,2 до 50,0 т/га
сухой биомассы в год.
2. Расчет доз внесения минеральных и органических
удобрений с учетом выноса питательных веществ планируемым
урожаем, использования их из доступных соединений почвы и
вносимых удобрений.
3. Составление технологической карты, включающей
обязательные приемы, способы и сроки их выполнения, а также
количество труда и материально-технические затраты на
возделывание программируемого урожая.
4. Оперативную корректировку технологии с учетом реально
складывающихся и прогнозируемых погодных условий для под-
630
ФАЗЫ
Прорастание
семян. Всходы
Третий лист,
кущение
Начало выхода
в трубку
Выход в
трубку—начало
стеблевания
Колошение
ЭТАПЫ
I
I. Дифференциация и
рост зародышевых органов
И. Дифференциация
основания конуса на
зачаточные узлы, междоузлия
и стеблевые листья
III. Дифференциация
главной оси зачаточного
соцветия и брактей
±
IV. Образование конусов
нарастания второго порядка
(колосковых бугорков)
V. Закладка покровных
органов цветка, тычинок
и пестиков
VI. Формирование
соцветия и цветка
(микро- и макроспорогенез)
VII. Гаметофитогенез, рост
покровных органов, удлинение
члеников колосового стержня
VIII. Гаметогенез,
завершение процессов формирования
всех органов соцветия и цветка
ЭЛЕМЕНТЫ
ПРОДУКТИВНОСТИ
Полевая
всхожесть, густота
стояния растений
Габитус растения
(высота, число
листьев),
коэффициент кущения,
зимостойкость
Число члеников
колосового
стержня
Число колосков в
колосе,
засухоустойчивость
Число цветков в
колосках
Фертильность
цветков,
плотность колоса,
жаростойкость
Цветение
IX. Оплодотворение и
образование зиготы
X. Рост и формирование
зерновки
Озерненность
колоса
Величина
зерновки
Налив семени,
молочная
спелость
Восковая и
полная спелость
—*•
—*■
XI. Накопление питательных
веществ в зерновке (семени)
XII. Превращение
питательных веществ в запасные
вещества зерновки (семени)
—►
—►
Масса зерновки,
устойчивость к
суховеям
Рис. 157. Формирование элементов продуктивности пшеницы на разных фазах
развития и этапах органогенеза (по Ф. М. Куперман, О. Г. Семенову, 1977)
Чувствительность
к гормонам
и ингибиторам
А Б В
Реакция на ГК
Реакция на ССС и
другие ингибиторы
(АБК, кумарин)
17771 7777? ч777
Устойчивость
к стрессам
35...40°С
Уровень "; :
питания
Рост - А
Поведение
в ценозе
-
2...-5Т
ЫРК
ДАС
Патоген
В
показатели и диагностические методы применяют в практике
селекционного процесса, используют на различных его этапах
для отбора и оценки растений на продуктивность, устойчивость
и качество продукции. Физиологические показатели входят в
модели создаваемых сортов и гибридов сельскохозяйственных
растений, включаются в физиол ого-экологические паспорта
районируемых сортов и гибридов. Комплексная схема скрининга на
элементы продуктивности новых сортов н форм растений
включает их реакцию на избыток гормонов или ингибиторов роста,
комплекс тестов по устойчивости, уровень питания, условия
фитоценоза, уровень донорно-акцепторных связей (ДАС) и ряд
других показателей (рис. 158). Все большее значение приобретает
моделирование, в том числе математическое, физиологических
процессов и функций растений и ценозов, составляющих
продукционного процесса и в целом формирования продуктивности
и качества в различных экологических и агротехнических
условиях. Этим вопросам агроном должен постоянно уделять
внимание. ■ .
Рис. 158. Схема скрининга на элементы продуктивности нового сорта (В. И. Ке-
фели, 1991). ДАС —- оценка донорно-акцепторных связей
держания в оптимальном режиме основных факторов,
определяющих высокую продуктивность посевов на каждом поле.
Используются физиологические показатели и приборы диагностики
функционального состояния растений в посевах (рис. 157).
5. Систематическую регистрацию условий выращивания
урожая для статистической информации и последующего уточнения
расчетов.
Программированное выращивание сельскохозяйственных
культур по современной технологии предполагает высокую
творческую роль агронома, знание им физиологии
возделываемой культуры, хорошее взаимодействие всех служб хозяйства,
обеспечивающих растениеводство. Опыт, накопленный в
России, показывает, что всюду, где соблюдались разработанные
принципы программированной технологии, сборы урожаев
полевых, овощных и плодово-ягодных культур были близки к
расчетным, в меньшей мере оказывали отрицательное влияние
неблагоприятные погодные условия. Программирование
урожаев — реальное воплощение физиологических знаний в практике
земледелия.
Современные технологии возделывания сельскохозяйственных
культур, рассчитанные на получение планируемых
(программируемых) урожаев, основаны на использовании лучших сортов и
гибридов с высоким уровнем потенциальной продуктивности,
высоким адаптивным потенциалом. Многие физиологические
632
1
633
ОГЛАВЛЕНИЕ
Введение 3
Глава 1. Физиология и биохимия растительной клетки 15
1.1. Структура и функции растительной клетки 15
1.1.1. Основные принципы жизнедеятельности растительной
клетки 15
1.1.2. Некоторые методы изучения растительной клетки .... 17
1.1.3. Строение и функции компонентов клетки 18
1.2. Природа и функции основных химических компонентов
растительной клетки 30
1.2.1. Химический состав растительной клетки 30
1.2.2. Белки и их функции в клетке 31
1.2.3. Биологическая роль ферментов 42
1.2.4. Нуклеиновые кислоты и их функции 51
1.2.5. Биосинтез белка 58
1.2.6. Углеводы растений 61
1.2.7. Липиды растительной клетки 64
1.3. Структура и функции мембран 67
1.3.1. Проблема мембранной проницаемости 72
1.4. Раздражимость и реакция клетки на повреждающее
воздействие 81
1.5. Принципы регулирования физиологических процессов .... 86
Контрольные вопросы и задания 87
Глава 2. Фотосинтез 88
2.1. Фотосинтез как основа энергетики биосферы 88
2.1.1. Планетарная роль фотосинтеза . 88
2.1.2. Физико-химическая сущность фотосинтеза и главные
этапы его изучения 89
2.2. Лист как орган фотосинтеза 91
2.3. Хлоропласта, их состав, строение и функции 95
2.4. Пигменты хлоропластов 101
2.4.1. Хлорофиллы 101
2.4.2. Каротиноиды 110
2.5. Световая фаза фотосинтеза 112
2.5.1. Организация и функционирование пигментных систем . 112
2.5.2. Циклическое и нециклическое фотосинтетическое фос-
форилирование 114
2.6. Метаболизм углерода при фотосинтезе (темновая фаза) .... 117
2.6.1. Сз-путь фотосинтеза (цикл Кальвина) 118
2.6.2. С4-путь фотосинтеза (цикл Хетча и Слэка) 120
634
2.6.3. Фотосинтез по типу толстянковых (САМ-метаболизм) . . 124
2.6.4. Фотодыхание и метаболизм гликолевой кислоты 125
2.7. Интенсивность фотосинтеза и методы его определения .... 128
2.8. Эндогенные механизмы регуляции фотосинтеза 129
2.9. Зависимость фотосинтеза от факторов внешней среды 134
2.10. Посевы и насаждения как фотосинтезирующие системы ... 147
2.10.1. Индекс листовой поверхности (ИЛП) 147
2.10.2. Фотосинтетический потенциал 149
2.10.3. Чистая продуктивность фотосинтеза 150"
2.10.4. Радиационный режим и структура посева 152
2.10.5. Параметры оптимального посева 154
2.10.6. Пути оптимизации фотосинтетической деятельности
посевов / 156
2.10.7. Фотосинтез и урожай 159
2.11. Светокультура сельскохозяйственных растений 162
2.11.1. Источники облучения 162
3.11.2. Влияние искусственного облучения на анатомо-физио-
логическую характеристику растений 164
Контрольные вопросы и задания 165
Глава 3. Дыхание растений 167
3.1. История изучения дыхания 167
3.2. Методы учета дыхания 168
3.3. Строение, свойства и функции митохондрий 169
3.4. Основные пути окисления дыхательного субстрата 170
3.4.1. Типы окислительно-восстановительных реакций 170
3.4.2. Оксидоредуктазы 171
3.5. Химизм дыхания 173
3.5.1. Гликолиз, его регуляция и энергетика 173
3.5.2. Цикл ди- и трикарбоновых кислот (цикл Кребса) .... 177
3.5.3. Окислительный пентозофосфатный цикл 180
3.6. Анаэробное и аэробное дыхание 183
3.7. Электронно-транспортная цепь дыхания и окислительное фос-
форилирование 185
3.8. Взаимосвязь различных типов энергетического обмена в
растении 189
3.9. Роль дыхания в биосинтетических процессах 190
3.10. Связь дыхания и фотосинтеза 193
3.11. Зависимость дыхания от внутренних факторов 196
3.12. Экологические аспекты дыхания 200
3.13. Роль дыхания в управлении продукционным процессом . . '. 206
Контрольные вопросы и задания 211
Глава 4. Водный обмен растений 212
4.1. Вода: структура, состояние в биологических объектах и
значение в жизнедеятельности растительного организма 212
4.2. Термодинамические, основы водообмена растений 221
4.3. Значение транспорта воды и путь водного тока в растении . . 227
4.4. Поглощение воды растением 230
635
4.4.1. Особенности корневой системы как органа поглощения
воды 230
4.4.2. Почва как среда водоснабжения растений 232
4.4.3. Корневое давление, его зависимость от внешних и
внутренних условий 234
4.5. Транспирация и ее регулирование растением 241
4.5.1. Биологическое значение и размеры транспирации . . . .241
4.5.2. Физиология устьичных движений 246
4.5.3. Методы измерения интенсивности транспирации .... 253
4.5.4. Способы снижения уровня транспирации 255
4.6. Водный баланс растений 257
4.7. Влияние на растения недостатка воды 258
4.8. Влияние на растения избытка влаги в почве 264
4.9. Транспирационный коэффициент и коэффициент водопотреб-
ления, зависимость от внутренних и внешних условий, способы их
снижения 268
4.10. Физиологические основы орошения 271
4.11. Использование параметров водообеспеченности растений при
программировании урожаев 276
Контрольные вопросы и задания 279
Глава 5. Минеральное питание растений 280
5.1. Необходимые растению элементы минерального питания . . . 280
5.1.1. Содержание и необходимость элементов 280
5.1.2. Макроэлементы, их усвояемые соединения, роль и
функциональные нарушения при недостатке в растении 281
5.1.3. Микроэлементы, их усвояемые формы, роль и
функциональные нарушения при недостатке в растении 287
5.1.4. Диагностика дефицита питательных элементов 290
5.2. Поглощение минеральных веществ 292
5.3. Ионный транспорт в растении 296
5.3.1. Радиальное перемещение ионов в корне 296
5.3.2. Восходящий транспорт ионов в растении 299
5.3.3. Поглощение ионов клетками листа 300
■ 5.3.4. Отток ионов из листьев 301
5.3.5. Перераспределение и реутилизация веществ в растении . 302
5.4. Регулирование растением скорости поглощения ионов .... 303
5.4.1. Поглощение ионов из разбавленных и
высококонцентрированных растворов . 303
5.4.2. Взаимосвязь между потоками ионов и воды в корне . . . 305
5.4.3. Поглощение ионов и потребности в них растения .... 306
5.4.4. Ритмичность в поглощении ионов корнями растений . . 308
5.5. Азотное питание растений 310
5.5.1. Особенности нитратного и аммонийного питания
растений 313
5.5.2. Ассимиляция нитратного азота 314
5.5.3. Ассимиляция аммиака 316
5.5.4. Причины накопления избыточных количеств нитратов
в растениях и пути их снижения в сельскохозяйственной
продукции 318
636
5.6. Обеспечение растений питательными веществами в полевых
условиях 323
5.6.1. Минеральные вещества в фитоценозах и их круговорот
в экосистеме 323
5.6.2. Плотность и распределение корней в посеве 325
5.6.3. Почва как источник питательных элементов для
сельскохозяйственных культур 329
5.6.4. Взаимодействия между растениями 331
5.6.5. Влияние ризосферной микрофлоры на поглощение
веществ 332
5.7. Физиологические основы применения удобрений 335
5.8. Особенности питания растений в беспочвенной культуре . . . 340
5.9. Неблагоприятное действие на растение избыточно высокого
уровня минерального питания 343
Контрольные вопросы 345
Глава б. Обмен и транспорт органических веществ в растениях . 346
6.1. Общие закономерности обмена веществ в растительном
организме 347
6.2. Транспорт органических веществ по флоэме 353
Контрольные вопросы . 364
Глава 7. Рост и развитие растений 365
7.1. Понятие об онтогенезе, росте и развитии растений 365
7.2. Клеточные основы роста и развития 369
7.3. Фитогормоны как факторы, регулирующие рост и развитие
целостного растения 371
7.3.1. Локализация биосинтеза фитогормонов в растении.
Транспорт фитогормонов 374
7.3.2. Особенности действия фитогормонов на рост тканей
и органов. Формирование семян и плодов 376
7.3.3. Фитогормоны и стрессовое состояние растений 382
7.3.4. Взаимодействие фитогормонов 383
7.3.5. Влияние фитогормонов на рост и морфогенез растений . 384
' 7.3.6. Инактивация фитогормонов в растениях 387
7.3.7. Механизм действия фитогормонов 389
7.3.8. Использование фитогормонов и физиологически
активных веществ 390
7.4. Биотехнология 394
7.4.1. Основы молекулярной и клеточной биотехнологии . . . 394
7.4.2. Регенерация растений 396
7.4.3. Возможности метода культуры клеток и тканей в
растениеводстве 396
7.5. Локализация роста у растений 399
7.6. Особенности роста органов растения 400
7.7. Зависимость роста от внутренних факторов 404
7.8. Ростовые явления 405
7.9. Методы измерения скорости роста 412
7.10. Зависимость роста от экологических факторов 413
637
7.10.1. Свет как фактор, регулирующий рост и развитие
растений 414
^7.10.2. Влияние температуры на рост растений 418
V?. 10.3. Влияние на рост растений влажности почвы 420
7.10.4. Газовый состав атмосферы (влияние аэрации) 421
7.10.5. Минеральное питание 421
7.10.6. Влияние химических средств защиты растений,
загрязнения почвы и воздуха 422
7.10.7. Закон минимума и взаимодействие факторов роста . . . 422
7.11. Необратимые нарушения роста. Карликовость и гигантизм . . 422
7.12. Ритмы физиологических процессов 424
7.13. Движение растений 427
7.13.1. Фототропизм 428
7.13.2. Геотропизм 430
7.13.3. Другие виды тропизмов 433
7.13.4. Настии 434
7.14. Развитие растений 435
7.14.1. Морфологические, физиологические и биохимические
признаки общих возрастных изменений у растений 436
7.14.2. Яровизация 440
7.14.3. Фотопериодизм 443
7.14.4. Физиология старения растений 448
7.15. Циклическое старение и омоложение растений и их органов
в онтогенезе 451
7.16. Понятие о росте целостного растения 454
7.16.1. Управление генеративным развитием и старением
растений путем регулирования светового, температурного и водного
режимов, минерального питания хирургическими и
химическими способами 457
7.16.2. Особенности роста растений в фитоценозе 460
7.16.3. Регуляция роста и онтогенеза 461
7.17. Физиология формирования семян, плодов и других
продуктивных частей растений. Типы размножения растений 463
7.17.1. Физиология цветения 464
7.17.2. Физиология опыления и оплодотворения 465
7.17.3. Формирование семян как эмбриональный период
онтогенеза растений 468
7.17.4. Накопление и превращение веществ при формировании
семян - - 471
7.17.5. Взаимодействие вегетативных и репродуктивных органов
в процессе формирования семян 474
7.17.6. Превращение веществ при созревании сочных плодов . 477
7.17.7. Приемы нормирования плодоношения и ускорения
созревания плодов и овощей ; 479
7.17.8. Влияние внутренних и внешних факторов на качество
семян 480
7.18. Физиология покоя и прорастания семян 482
7.19. Физиологические основы хранения семян, плодов, овощей,
сочных и грубых кормов 490
638
Контрольные вопросы и задания 492
Глава 8. Приспособление и устойчивость растений 493
8.1. Границы приспособления и устойчивости 494
8.2. Защитно-приспособительные возможности (реакции) растений
против повреждающих воздействий 495
8.2.1. Обратимые и необратимые повреждения растения, его
тканей и органов 496
8.2.2. Изменения физико-химических и функциональных
свойств растительных клеток и тканей при повреждениях
и процессы адаптации 497
8.3. Холодостойкость растений 501
8.4. Морозоустойчивость растений 505
8.5. Зимостойкость растений 515
8.6. Влияние на растения избытка влаги 520
8.7. Полегание растений и его причины 522
8.8. Жароустойчивость растений 524
8.9. Засухоустойчивость растений 528
8.10. Солеустойчивость растений 540
8.11. Газоустойчивость растений 545
8.12. Действие радиации на растения 550
8.13. Аллелопатические взаимодействия в ценозе 553
8.14. Действие пестицидов на растения 562
8.15. Тесты устойчивости растений 565
Контрольные вопросы и задания 566
Глава 9. Физиология и биохимия формирования качества урожая
сельскохозяйственных культур 567
9.1. Зерновые злаковые культуры 568
9.2. Зернобобовые культуры 583
9.3. Масличные культуры 590
9.4. Корнеплоды 597
9.5. Кормовые травы 601
9.6. Плодово-ягодные культуры 609
9.7. Картофель 614
9.8- Овощные культуры 618
Контрольные вопросы 621
Глава 10. Растение как самоорганизующаяся,
саморегулирующаяся и саморазвивающаяся адаптивная система 622
I
639