Author: Белан Ф.И.
Tags: общее машиностроение технология машиностроения энергетика машиностроение
Year: 1980
Text
Ф. И. БЕЛАН
ВОДОПОДГОТОВКА
РАСЧЕТЫ
ПРИМЕРЫ
ЗАДАЧИ
МОСКВА «ЭНЕРГИЯ» 19S0
ББК 31Л7
Б 43
УДК 621 182.1
Белан Ф. И.
Б 43 Водоподготовка; (расчеты, примеры, задачи).—
М.: Энергия, 1980 —256 с., ил.
В пер.: 85 к.
В книге нзлагаютеи теоретические основы физико-химических
процессов обработки воды в конденсате, водного режима паровых кот-
лов и оборотных систем водоснабжения. По каждому параграфу
даются задачи и приводятся подробные расчеты типовых задач с об-
суждением или оценкой результатов расчета. Материал книги учиты-
вает практику «жсплуатации и специфику работы электростанций
промышленных котельных
Книга рассч ит на на технический персонал электростанций
промышленных тсотельных я учащихся техникумов теплотехнически ж
специальностей разных отраслей промышленности
30303-019
051(00-80
38-80. 2303030000
ББК 31.37
6П2.22
1.С Издательство «Энергия», 1980 г.
ПРЕДИСЛОВИЕ
Предлагаемая читателю книга посвящена вопро-
сам обработки воды и води о-химическим режимам
тепловых электростанций и промышленных энерге-
тических установок.
Характер примеров и задач, приведенных в кни-
ге, их формулировка и решения рассчитаны на экс-
плуатационный персонал электростанции и про-
мышленных энергоустановок, а также на учащихся
техникумов теплотехнической специальности. В каж-
дом разделе примерам и задачам предшествуют
основные теоретические положения и расчетные
формулы.
При составлении книги автор основное внима-
ние уделил тому, чтобы содержание примеров и за-
дач в наибольшей мере отвечало практике эксплуа-
твнин теплосилового оборудования и соответствова-
ло программе курса «Водоподготовка».
Автор выражает благодарность рецензенту, док-
тору техн наук Кострикнну Ю. М. за ценные заме-
чания и редактору канд. техн, наук Пильщнко-
в\ А. П. за труд по редактированию рукописи.
Все замечания и предложения по дайной книге
просьба направлять по адресу: 113114, Москва,
М-114, Шлюзовая наб., 10, изд-во «Энергия»,
Автор
Глава первая
РАСЧЕТ АКТИВНОСТИ (КОНЦЕНТРАЦИИ)
ВОДОРОДНЫХ ИОНОВ В ВОДНЫХ РАСТВОРАХ
1-1. АКТИВНАЯ КОНЦЕНТРАЦИЯ ИОНОВ
Под активной концентрацией того или иного иона i
понимают действующую (эффективную) концентрацию
а,-, г-ион/л, которая пропорциональна количеству веще-
ства (иона) Ci, находящегося в растворе:
(l-l)
Коэффициент активности зависит не только от С,-,
ио и от концентрации других нонов, присутствующих
в растворе. Суммарное влияние на Д всех ионов харак-
теризуется ионной силой раствора определяемой по
формуле
^,=4 (C.Z’, + СЛ\+... + C„Z*„), (1-2)
где Z — валентность иона.
Дтя разбавленных растворов электролитов разных
типов значение р можно определить, пользуясь следу-
ющими данными [24]-
Вещество NaCl Na2COa ZnSO4 AlClj
KNOa BaClj Ca(NOa)fi MgCO. Na,P04
И См 3 См 6 См
Здесь Сы— молярная концентрация. Зная ионную силу раствора р, можно найти коэффи-
циент активности по формуле
где А имеет следующие значения [23]:
t, К................. 273 288 298 303 313 323
А............. . 0,488 0,50 0,509 0,514 0,524 0,535
4
Для разбавленных растворов, для которых р.^0,01,
можно пользоваться более простым выражением
lgfi=—0,5Z2J>V. (1-За)
В табл. 1-1 [24] приведены приближенные значения
ft для разных р.
Таблица 1-1
Приближенные значения ft для разных р.
Ионная сила раствора р.. г-пон/кг
3
Заряд
иона
s s A e-01-1 s 2 2 СЧ s о ".
0,99 0.98 0.97 0.96 0,95 0.92 0.89 0.87 0.81 0,78 0,7
0,95 0.94 0.9 0.82 0,81 0.72 0,63 0,57 0.44 0.33 0.24
0,9 0.87 0.8 0.73 0,64 0.Ы 0,39 0.28 0.16 0,08 0,04
0,83 0,77 0.6/ 0,5'9 0.45 0,3 0.19 0.12 0.04 0.01 0.003
0.66
Для абсолютного большинства природных вод р
можно определить по эмпирической формуле [1]:
н=4г |0~а> О-4)
где S — солесодержание воды, мг/кг.
Эта формула удобна, когда неизвестен ионный со-
став растворенных в воде веществ и не требуется высо-
кая точность.
ПРИМЕРЫ
1-1. Рассчитать активность ионов в растворе, содержащем NaCl
и Fes(SO«)a в количестве 10-3 моля каждого.
Решение. В соответствии с формулой (1-2)
,х = ’2’(Cn3+z!nj+ + Cci-Z'ci-S+ Cr«,+Z*p.’+ +
+ Cso=-Zaso2-) = 4- (1-Г + >-1‘ + 2-3=+3-2’) Ю- = 1.6-10-
Находим коэффициенты активности по табл. 1-1; / +=0,88;
/С]- =0.88; /рев+=0,32; fso2_ = 0,59, и активные концентрации
будут равны, г-ион/л: aNa = 0,86-IO”’; асг = 0,86-10’’; «Fes+ =
= 0,32-10"’; aso2_ = 0,59.10-’.
1-2. Оборотная система охлаждения конденсаторов турбин элек-
тростанции должна подпитываться водой следующего состава, мг-экв/л:
с .+ = 10; С .+ = 2.5; С+=3; С = 8; С _ = Э.Е-
Cj Mg r Na* ’ SO*- Cl ’
5
С 5. Система будет рабо ать с коэффициентом упаривания
нсо3
= 1,7; температура воды 298 К. Для предотвращения накнпеобра-
зо в ан ия добавляемую воду предполагается обрабатывать H2SO4,
понижая щелочность с 5 до 2,0 мг-экв/л. Определить, будет лн при
этом выпадать в системе гипс?
Решение Произведение растворимости CaSO< при 298 К [24]
равно:
flPcaSO. = ССа,+^БО2- =6.1-10-*.
Для воды указанного состава молярная концентрация ионов Са’+
и в оборотной воде равна;
= 5-10—-1,7 = 8,5*10 — г-ион/л;
Csq2_ = (8 + 3)*-0,5'1,7*10—=9,35-10— г-нон/л.
Тогда
Cca’+Cso2- = 8,5‘ 10-,'9>35' 10-’ -7,95.10- > np^so.,
т. е. выпадение CaSO4 в осадок в циркуляционной системе окажется
возможным. Для подтверждения этого произведем более точный
расчет, используя активные концентрации SQf" и Са’+.
Ионная сила данного водного раствора равна:
Н ^“2" 1°-’ (CjoJ-^soS- + Cc.,+Z’ca,+ + CMg‘+ +) +
+4 >»- (cNa+z,№+ + chco-z,hco-+ Ca-Z’a-) = 4-35''°-’-
Коэффициент активности fj=0,46 (табл. 1-1). Тогда
^aCC^+CSO2- =°'4е’-8.5-Ю-,-9,35.10-’ =
= 0,18 -10- <Z^^CaSO,'
т. e. обработка данной воды подкислением H2SO4 допустима. Этот
пример показывает, что при технических расчетах, связанных с не-
достаточно разбавленными растворами, следует учитывать ионную
силу водного раствора. Вообще говоря, при точных расчетах необхо-
димо также учитывать я степень диссоциации рассматриваемого ве-
щества.
1-3. Определить фактическую и активную концентрацию ионов
SOj~ и ОН~ в кетовой воде, г-ион/кг, еста котел питается водой
следующего состава; Cso2_=60,0 мг/кг; Сс[_ = 9,0 мг/кг; ^Na+=
• Второе слагаемое характеризует увеличение SO^ за счет сер-
ной кислоты.
6
= 69,0 мг/кг; С?он_= 1,5 мг-экв/кг, я кратность упаривания воды
в котте составляет 20.
Решеияе. Быраэвм концентрация ионов в г-ион/кг, для чего
умножим все значения концентрации ионов в питательной воде .на
20-10”* н разделим на молекулярную (атомную) массу Тогда по-
лучим, г-ион/кг:
С- = 12,5-10”"; С _ =5,06.10-’; С . = 60,0-10”*; СпН=
SO?" С] NaT 1
= 30,0.10”’.
Ионная сила раствора (котловой воды) равна;
и 10”» (12,5.2" 4- 5,06.1» + 60,0-1« + 30,0-1») =73,0-10-’.
Находим коэффициенты активности: ^5= 0,8; 0,387 Следо-
вательао, дон_ =/,Сон_ = 24-10-", т. е. 24 мг-экв/т; «so2— —
= /.^ = 4,85-10”", т. е. 465 мг/л вместо 1200 мг/л.
ЗАДАЧИ
1-1. Пользуясь формулой (1-3), построить график
зависимости коэффициента активности от ионной силы
раствора.
1-2. Используя данные примера 1-2, определить фак-
тическое произведение растворимости CaSO4 с учетом
того, что степень диссоциации его в условиях примера
1 -2 составляет 61 %.
1-3. В оборотную систему охлаждения добавляется
вода следующего состава, мг-экв/кг: щелочность 3,5;
жесткость 4,5;
^ = 3,8; Са- = 1,5; См_=4,5; С„а+=1,5.
Определить, при каких условиях (значение коэффи-
циента упаривания, снижение щелочности) возможна
обработка добавляемой воды серной кислотой (подкис-
ление), исключающая выпадение CaSO4. Учесть ионную
силу раствора.
1-Х ПОКАЗАТЕЛЬ КОНЦЕНТРАЦИИ ВОДОРОДНЫХ ИОНОВ pH
Часть молекул воды диссоциирует на иоиы:
н,о^н+-}-он-.
7
Состояние равновесия при дайной температуре ха-
рактеризуется константой
С С
и__ н+ он- ~
л=—. (1-0)
сн,о
В силу незначительной концентрации в чистой воде
ионов Н+ н он- /н+ = /он_=1.
Концентрация ионов или молекул в уравнении (1-5)
может выражаться в г-иои/л, г-моль/л или г-экв/л. Кон-
центрация воды является постоянной и равной
55,56 моль/л. Тогда
Кв=55,56К=Сн+Сон. (1-6)
Величина Кв называется ионным произведением во-
ды, ее значения для разной температуры приведены
в табл. 1-2 [2].
Ионное произведение воды
Таблица 1-2
т. к г. к К0.!О>« г. к Кв-,0'«
273 0,112 298 1.01 333 9,61 423 234
278 0,186 303 1,47 343 21,0 438 315
283 0,293 308 2,09 353 35,0 473 485
288 0,452 313 2,92 363 53,0 523 550
291 0,570 318 4,02 373 59,0 579 304
293 0.68 323 5,47 395 120
При нейтральной реакции С^+==СОН_ и, следователь-
но, (для 295 К) С[+Сон_=С'н+=|0-“ нлн Сн+ =
= 10“' г-ион/л.
Отрицательный логарифм концентрации водородных
ионов обозначают pH, т. е. —lgCH+ = pH, или
Сн+ = 10-(1-7)
аналогично — IgC н_ = рОН, или
С = 1СГрОН.
он_
(1-7а)
8
ПРИМЕРЫ
1-4. Определить pH 0,1 н. раствора НС1 при 298 К-
Решение. Принимаем /н+= fCl- = Ь тогда
Сн+ = 10“1 г-ион/л н pH = — 1g 10-1 = 1.
Определим pH этого же раствора с учетом коэффициента актив-
ности. Ионная сила раствора равна 0,1 (см- § 1-1), значение f * —
= 0,78 (табл. 1-1), тогда вн+=1н+ =0,78-0,1 =0,078 г-нон/л.
рН = — IgcH+ 1g (0.078) = 1,11.
1-з. Определить pH 0.05 М раствора HsSO4 при условии f' + =
Решение. Если концентрация задана в моль/л и в растворе
ваходится вещество К^Ат, то Ск~пС и Сл.=тСу г-нон/л.
В данном случае п=2 и л-=1. Стедовательно, С^+= 2С$&_=
=2-5-10~г=0.1 г-ион/л. Тогда pH —lgCn+=—lg I0-*=1.
С учетом коэффициента активности зиачеияе pH изменятся.
Ионная сила раствора с концентрацией 5-Ю~8 М равна р=0,15,
коэффициент активности /н+= 0,74 (табл. 1-1),„тогда
PH=-lgflH+= -lg(f11+CH+)= lg 0,74.10-1 = 1,13.
Таким образом, при необходимости получить более точные ре-
зультаты следует учитывать ионную силу раствора я коэффициенты
активности. Однако при томном расчете данного примера необходи-
мо принять во внимание, что диссоциация HoSO* происходит в две
ступени:
HaSO„ z н++ HSOf: HSOf Z H+ + SO^-.
Константа диссоциации по второй ступени Кц= 1,2-10~8. Под-
ставив это значение в формулу Оствальда Ка=агС/(1—а) и решив
ее относительно а (степень диссоциации иона HSO^l, найдем, что
а=0,38 (а не единицеп как принималось выше). В этом случае
в растворе будут присутствовать:
С . -- CL v -4- С п С — Сс к — С nj С _п = аСс к-
И+ с.К -Г so2— . С' Sq2—’ SO2— с-к
Подставив значение концентрации Сс к, получим, г-ион/л: С^+=
= 6,9-I0~s; Cso«j_ — 1,9-I0“s; ^-HSO—=3»1 10-а. Коэффициент ак-
тивности при р=8,8 -10“8 равен 0,787, тогда рН=1,45. Это сущест-
венное уточнение. Однако при исходной коицентрацви Cc.«^l-10“8
« достигает 85% и уточнение касается лишь второго знака после
запятой по сравнению со значением pH, определенным без учета
ионной силы раствора. Поэтому дли растворов с концентрацией Н+
9
и ОН_<^10Я и в отсутствие посторонних электролитов расчеты pH
можно вести без учета коэффициента активности.
1-8. Значение pH раствора HiSO« составляет 2,8. Найти моляр-
ную концентрацию раствора.
Решение. Сн+ = 10“рН — 1,63-10-1 г-ион/л. Так как для
HtS04 (см. пример 1-5) ~ 2С> го С = С^^/2~ 0,81 -10“’ М.
1-7. Определить концентрацию водородных н гидроксильных
нонов в 0,0а М растворе NaOH при /он =1.
Решение- рОН=--lgCOH,= .—lg5-10-*= 1,3, но pOH-J-
-4-pH =14 при 29S 1\, тогда pH = 14 — 1,3 = 12,7. Следовательно,
го1!- = 10-'иС^ = 10-"-’-
ЗАДАЧИ
1-4. Определить pH раствора, в котором Сон_ = 1Х
X 10'* г-ион/л при температуре^295 К.
Ответ; pH =9,0
1-5. При температуре 293 К насыщенный раствор
Са(ОН)г содержит 1650 мг/л гидрата окиси кальция.
Определить pH этого раствора, если он приготовлен на
чистом дистилляте и полностью диссоциирован.
Ответ: 11.81.
1-6. Лабораторный опыт заканчивался тем, что
в пробу объемом 100 мл необходимо было прибавить ре-
агент-окислитель. По ошибке колба с пробой была по-
ставлена под бюретку с 0,1 н раствором HCI, и в нее
упала капля (0,05 мл) кислоты. Если pH пробы, кото-
рый был равен 7,0, понизился до 3,0 и ниже, анализ
придется повторить. Установить расчетом, следует ли
продолжать анализ? Буферные соединения в пробе от-
су тствуют.
1-7. К раствору, характеризуемому рН=5, прибавле-
но кис литы столько, что значение С^+ увеличилось
в 10 раз. Определить рОН и pH полученного раствора
при температуре 295 К.
Ответ: рН=4; рОН=10.
1-8. Концентрация ионов водорода в некоторых рас-
творах равна, г-иои/л: а) 8-10~7; б) 4-10-4; в) 0,05Х
ХЮ~°; г) 3,2-Ю~8; д) 2,1-lD-10. Определить pH.
1-9. Определить концентрацию ионов водорода
в растворах, pH которых равен: а) 4,5; б) 8,4; в) 6,5;
г) 10,2; д) 3,02; е) 7,08.
10
1-3. СИСТЕМА СОа—Н2О
При растворении СО2 в чистой воде (конденсате)
протекают следующие реакции:
СО. + Н1О^Н,СО1;
Н,СОв^Н++НСО“;
нсо7^н++соз~.
(1-8)
(1-8а)
(1-86)
Реакция (1-8) сильно сдвинута влево. Из общего ко-
личества СО,, присутствующей в воде, лишь около 0,2*/©
находится в виде HjCO,. Поэтому в дальнейшем под
Сн.00, будем понимать сумму молярных концентраций
С’псО1”^'со»Ч“^щсо8 (исключая ионы НСО^ и Рав-
новесие приведенных реакций характеризуется констан-
тами:
Сн+ Снсо?
К,= С-со, 'нсор;
^н+ СсоГ р ^Н+ ^СО^-
Сисо- ^нсо-
с . с
Н+ 11СО~
к ’___ л
(1-9)
(1-9а)
(1-96)
Т абли да 1-3
Криста иты диссопиапии j глекислоты в еодбом растворе
г. к «ист-10* A'i-10’ Т. К КЮт-'“‘ К»-10’
273 2,5 2,65 2,36 323 1,52 5,16 6,73
278 1,56 3,04 2,77 333 — 5,02 7,20
283 1,72 3,43 3,24 343 4,69 7,52
288 1,75 3,8 3,71 353 —_ 4,21 7,55
291 4,0 4,0 373 5,72 11,1
203 1 75 4,15 4,2 395 — 4,80 9,15
298 1,72 4,31 4,69 423 3,62 7,25
303 1,70 4 >71 5,13 428 2,90 6,3
313 1.62 5,06 6,03 473 — 1,26 4 9
Численные значения Ki, К2, Лист зависят от темпера-
туры (табл. 1-3) £16]'
С _________ Ki f"'11
НС°3- Сн+Г, ь СО?
/-> ___ z>n
СО2-— C«h+/V2 W
(1-10)
(1-11)
где f, и [в — коэффициенты активности соответственно
одновалентного (Н1, НСО3) и двухвалентного (СО3~)
ионов.
Общее количество СОа, моль/кг, определяется сум-
мой:
<7со, = СПсо. + СНсо-+Ссо?-’ О'12’
или после подстановки значений последних двух слагае
мых из уравнений (1-10) н (1-11) получим:
^со =С“со, i 1 + с '/»1 Ь с3 +/Va )e^*co*Vi’ (
н+' 1 н+/ 1/2 у
где
?.= 1 + -С^- + -с/',Л?, (114)
сн+; 1 с н '
По условию электроиейтралыюсти раствора
С 4-С 4-2С , ,
и+ он- 1 нсо- 1 со2
так как в системе СОг-|-НаО из катионов присутствуют
только Н+. Произведя подстановку значений С и
ИСоз
из уравнений (1-10) н (1-11) и учитывая, что
Л»/Сн+=Сон , получим:
н+ сн+ — ССО,^ сн+/', 4" C»H+f"J, ) —с соЛ'
(Ы5)
где
t 2/Г1Аа /I « Г- х
¥’— сн+г, + С*н+Г,/, (Ь15а)
12
Из уравнения (1-13) найдем:
С0, = 9с0,/?1’ (1-16)
Подставив это значение в уравнения (1-10) и (1-11),
получим:
г ______ Л'<‘?со, . г qm^ n.lRal
Снсо3--^Г^-- Ссо’-= C‘n+F.f. —• IBa)
Эти равенства позволяют определить долю каждой
из форм углекислоты, присутствующей в конденсате при
данном значении pH.
1-4. pH РАСТВОРОВ СО2 В КОНДЕНСАТЕ
Исключив Спс0 из уравнений (1-13) и (1-15), получим
(1-17)
Решив это уравнение и отбросив слагаемые, содер-
жащие К2 (как имеющие весьма малое значение), по-
лучим более простое уравнение:
4cO.=^+^ryC^f\-K.). (1-18)
или после раскрытия- скобок
4ai=—к; 1"Сн+ C^rt ~кг- 0-19)
Последними тремя членами ввиду их малости можно
пренебречь, тогда j?c0, моль'кг, равно:
или мг/кг:
<7'со = -т^-4.4.10*. (1-21)
Для разбавленных растворов, каким является кон-
денсат, fi=l. Тогда из уравнения (1-21) получим:
pH = 5,5—1-1g <7^. (1-22)
13
ПРИМЕРЫ
1-8. Определить pH конденсата, содержащего 1 мг/кг СО2.
Решение. Подставив в уравнение (1-22)<?'сОа = 1 мг/кг, полу-
чим pH=5,5.
1-9. Определить верхний предел допустимой концентрации СО?
в паре, не содержащем щелочных соединений, с точки зрения кор-
розионной агрессивности конденсата.
Решение. Изменение pH кондевсата в зависимости от концен-
тр ацин углекислоты, рассчитанное по уравнению (1-22), приведено
на рис. 1-1. Из него следует, что уже весьма незначительные кон-
центрации СО2 резко понижают pH. С другой стороны, скорость кор-
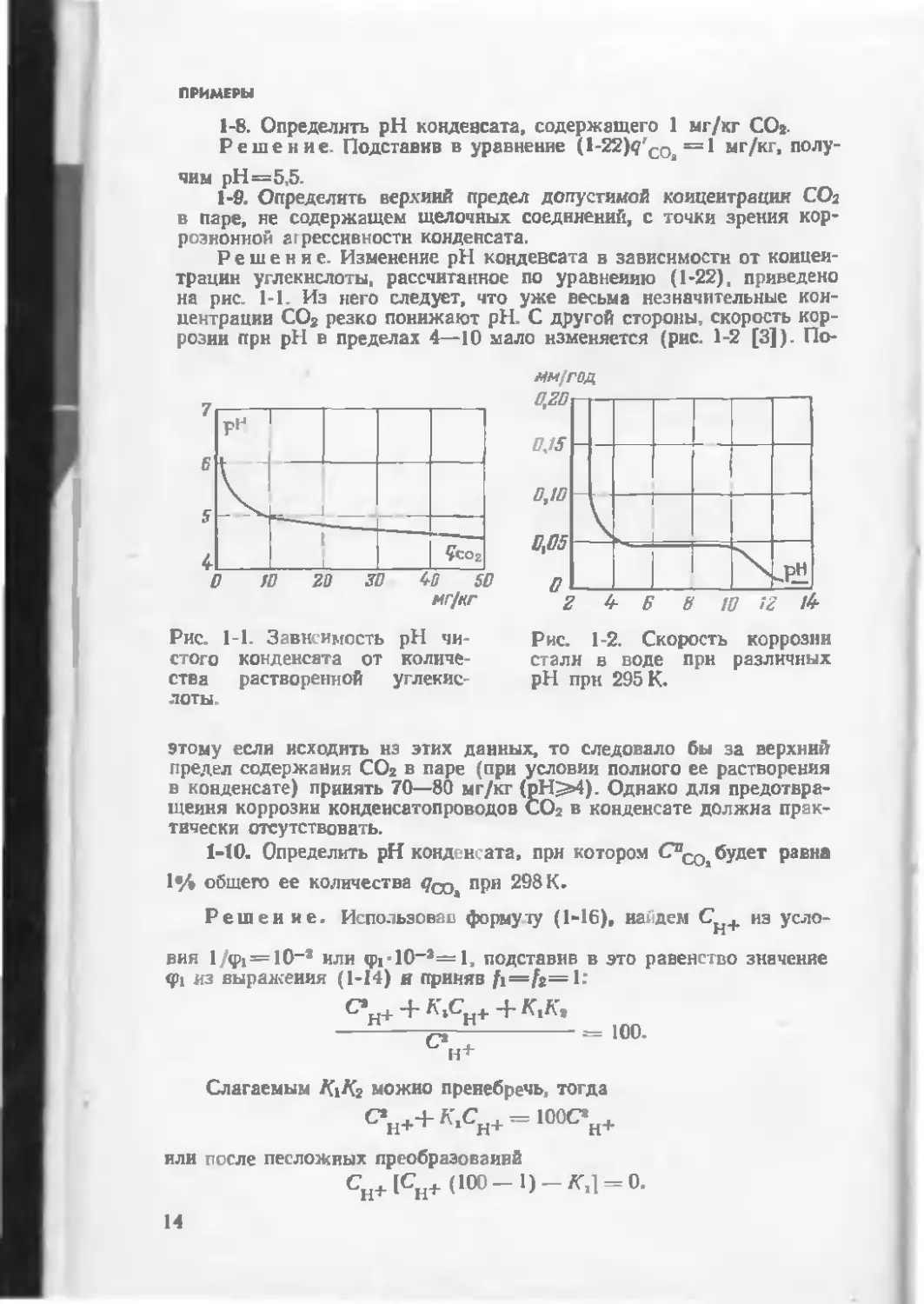
розии прн pH в пределах 4—10 мало изменяется (рис. 1-2 [3]). По-
Рис. 1-1. Зависимость pH чи-
стого конденсата от количе-
ства растворенной углекис-
лоты.
Рис. 1-2. Скорость коррозии
стали в воде прн различных
pH прн 295 К.
этому если исходить нз этих данных, то следовало бы за верхний
предел содержания СО2 в паре (при условии полного ее растворения
в конденсате) принять 70—80 мг/кг (pH^»4). Однако для предотвра-
щения коррозии конденсатопроводов СО2 в конденсате должна прак-
тически отсутствовать.
1-10. Определить pH конденсата, прн котором С°со будет равна
1"4 общего ее количества tfa) прн 298 К.
Решей не. Использовав форму ту (1-16), найдем C^+ нз усло-
вия 1/ф1=10_ 8 или <р1-10-а=1, подставив в это равенство значение
<pi из выражения (1-14) и приняв /1=/8=1:
С*н+ + Л\Сн++К1Л\
= 100.
Слагаемым KiKa можно пренебречь, тогда
С’н++к.сн+ = 1°ос,н+
или после несложных преобразований
Сн+
14
Приравняв второй множитель нулю, найдем
Сн+ =К1/100 = 4,ЗЫ0м = 10“’>а' моль/кг,
т. е. рН=ь 8,36.
f-J. pH КОНДЕНСАТА ГРЕЮЩЕГО ПАРА ТЕПЛООБМЕННИКОВ
В греющем паре теплообменников при отсутствии
дозировки в питательную воду котлов аммиака или ле-
тучих аминов, кроме СОг, могут присутствовать еще
газы Ng, Оз- Следовательно, pH конденсата этого пара
будет зависеть от концентрации в нем СО2 Ск, мг/кг.
Значение Ск определяется содержанием СО2 в паре
Сп, мг/кг, н в паровой фазе, контактирующей с кондеи
сатом Сф, мг/кг. Для установления зависимости между
этими величинами может быть использовано уравнение
баланса СО2 в дифференциальной форме:
?nC„<B=n,?nCKdf+p''W,^C4; 1 (123
q^-n.CJdt^WJCtf", /
где 7п — количество поступающего в теплообменник ла-
ра, кг, за время dt‘, W? — объем паровой фазы в тепло-
обменнике, м3; р"— плотность паровой фазы, т. е. лара
при давлении в теплообменнике, кг/м3; nt — доля скон-
денсировавшегося лара в х-м отсеке теплообменника;
dC$— прирост концентрации СО2 в объеме мг/кг.
По закону Генри
с«=«рТОл И-24)
где а — коэффициент вбсорбции, мг/(кг-МПа) (см. рис.
2-1 [8]), Рсо,— парциальное давление СО2 в объеме
№т, МПа.
Значение Рсо, может быть найдено из уравнения для
идеальных газов Менделеева — Клапейрона
рсо,= o'Mico, СФ’ (i-25)
где Р — универсальная газовая постоянная,
л-МПа/(моль-К); Г—абсолютная температура, К;
/Wqq—молекулярная плотность СО2, г/моль; v"—
удельный объем пара при давлении в теплообменнике,
м3/кг.
15
Подставляя в уравнение (1-24) это значение Рс0, по-
лучаем:
С-=Т^;С*=ЛС*- с1-26)
где
° " исо>
Тогда уравнение (1-23) примет вид:
qn (Сп—п/ Сф) dt =tf'WTdC*. (1-27)
После разделения переменных и интегрирования по-
лучим:
СФ=^-(1-е“В) + С»- 0-28)
где Сп—начальная концентрация СО2 в паровой фа-
зе, мг/кг.
При Св=0 равенство (1-28) приобретает вид:
(1-29)
где
Значение В возрастает с увеличением времени ра-
боты теплообменника. В пределе при достаточно боль-
шом t е~в—>0. Тогда при щ=1 Сф=Сп/Л, нлн
__________________________________ 1
ск ~ сп —Л А ’
где Кр — коэффициент распределения СО2.
Нетрудно установить, что Кр»1, т. е. что для упо-
мянутых выше газов концентрация в паровой фазе всег-
да больше, чем в жидкой (в рассматриваемых усло-
виях).
Выведенные зависимости могут быть использованы
при разного рода расчетах, связанных с определением
коррозионных свойств конденсата греющего лара.
ПРИМЕРЫ
1-11. Определить Сф, Си и pH конденсата подогревателя сетевой
воды ПСВ-500-3-23 для равновесных условий. Расход греющего пара
дп=Ю8 т/ч, давление пара внутри корпуса 0,3 МПа; температура
воды на входе 343 К, на выходе 393 К.
16
Решение. Находим А из уравнения (1-26), подставив числен-
ные значения соответствующих величин: «= 0,48*10’ мг/(кг-МПа).
и"—0,471 мэ/кг, R—0.0082 л* МПа/(моль* К); Г=416 К. Ако. ~
=44 г/моль. Получим Л=79-10~5. Тогда СФ=СВ/Л=1,26* 103 Са.
Значение С$ выражается в мг/кг пара, занимающего объем о", м3,
при данных условиях. Концентрация СО2 н 1 л паровой фазы, мг/л.
равна.
с'Ф=СфХ П-31)
Коэффициент распределения КР зависит от температуры, кал это
можно видеть из рнс. 1 -3.
Рис 1-4. Накопление СО2
Рис 1-3. Зависимость коэф-
фициента распределения СО2
от температуры конденсата
в теплообменнике.
в конденсате греющего пара
теплообменника Ск и в паро-
вой фазе СФ при Сп=2 мг/кг.
При Сп= 1 мг/кг Сф.—12()0 мг'кг, т. е концентрация СО2 в па-
ровой фазе подогревателя для данных устовий в 1260 раз больше,
чем в греющем паре Так как при этом ст—471 л. то С'ф=1260/471*=
=2,67 мг/л (средняя концентрация СО* по всему объему) В этом
случае pH по уравнению () 22) равен 5,5.
1-12. Рассчитать С$, Ск и pH по данным примера 11 для нерав-
новесных условий
Решение. В паровой полости подогревателя господствуют
условия, неблагоприятные дли установлении равновесия: высокие
скорости греющего пара, недостаточное время контакта газовой фазы
с данной массой конденсата, переменное значение Сф и т. п. Все это
приводит к тому, что СО5 собирается в ограниченном объеме пнж-
ней части подогревателя ДЙ7П. Здесь, как показывает опыт, Сф,
мг/кг, может периодически достигать высоких значений. Процесс
этот колеблющийся: Сф то возрастает за счет накопления СО2,
то уменьшается из-за более высокой се растворимости в конден-
сате ——
2— 209 (г
Если обозначить период накоплении через т, мни, то можем иапи-
сать :
Г ,1 от
ДЙ7.60 ’ I1”52'
где а — коэффициент, показывающий, какая доля Св идет в накоп-
ление, а<1; qa— количество греющего пара, кг/ч; ДЙ7 — локальный
объем подогревателя, в котором накапливаетси СО?, л.
Дли подогревателя ПСВ-5О0-3-23 можем принять <7D = 1O8X
ХЮ3 кг/л; Д№=2000 л; и"=471 л/кг; Си=2 мг/кг; а=0,8.
Результаты расчетов представлены на рис 1-4. Из рис. 1-4 вид-
но, что увеличение времени контактирования конденсата с паровой
фазой ведет к увеличению концентрации в нем СОа и снижению pH.
В теплообменниках, в которых отсутствует вентиляция их паровой
полости и имеет место контакт паровой фазы с конденсатом, Св
достигает 1500—2000 мг/кг и более. Поэтому необходимо вентили-
ровать паровые полости теплообменников.
1-6. СИСТЕМА NaOH—COj—Н2О
Если в растворе, кроме СО2 и Н2О, присутствует и
NaOH, то условие электронейтральности раствора бу-
дет иметь следующий вид:
с „д-с .=<? -И' _ Ч-2С . . (1-33)
Na+ 1 Н+ ОН— 1 НСО— 1 СО~~ *
Подставив в правую часть равенства значение вто-
рого и третьего слагаемых пз уравнений (1-10) и (1-11),
SipH условии fj=f2= 1 получим:
/-hi I р, __
Na+_ Сн+ с СО. 4- С»н+ с CD.-t-t'oH- GH+~
=С"со,(
AS
Сн+
2/Г,Л, \ I А'в с
С’н+ Г Сн* н+ '
С учетом выражений (1=13) н (1-15) концентрация
•Сна, моль/кг, равна:
Cn.+ = ?со. *-1-Р. (1-34)
где
f = -^-----С11+. (134а)
н+
18
Численное значение р в широком диапазоне pH весь-
ма мало по сравнению с первым слагаемым, и поэтому
практически можно принимать
CNa+=‘?co.^-=‘7co/. (1-35)
где
Как видим, 6 является функцией Сн+, т.е. pH. При
Сн+—♦со, 8—‘0, если Сн+—*0, 6-2. Оба предела в дей-
ствительности ие достигаются.
В приложении приведены численные значения <рь ф2,
6 н р в зависимости от pH, определенные по уравнени-
ям (1 14), (1-15а) и (1-34а) при условии fi=f2=l и t—
=298 К- Пользуясь соотношением (1-35) и этими дан-
ными, можно решать ряд задач, приведенных в после-
дующих примерах.
ПРИМЕРЫ
1-13. Определить Qqq в коиденсатс, содержащем натрий в коли-
честве CNa+ = 1 мг/кг л имеющем pH—5,5 (следует помнить, что
речь идете системе NaOH— СО8—Н,О).
Решение. Из уравнения (1-34) определяем
Подставив С'кя+= 1-10-’.23 = 4,35’10“’ моль/кг, 3,25-10“*
и 8=0,122, подучим q^ = 32,8-10“* Moib/кг; или 14,4 мг/кг. Из
этого количества СО2 4,35-10-в»44-10’= 1,9 мг/кг находится прак-
тически в форме НСО~э и связана с натрием. В примере 1-8 в кон-
денсате. содержащем только СОя. pH=5,5 достигался растворением
всего 1 мг/кг СО3. Добавка же NaOH в количестве 1,74 мг/кг тре-
бует для достижения того же pH введения большего количе-
ства СО3.
1-14. Выходящий яз подогревателя охлажденный конденсат со-
держит 40 мг/кг СО3. Найти его pH и определить количество NaOH,
необходимое для повышевня pH до 8.
Решение. По уравнению (1-22) pH конденсата равен:
pH=5,,5—0,51g 40=5,5—0,8=4,6.
При рН=8 по табл. 1-4 6 = 0,985, тогда по уравнению (1-35)
сКа+ = о,91-ю-«.0.985-о,896-ю-’ моль/кг
2*
19
или
0,896-10“8-23-101 = 20,5 мг/кг, т. е. 20,5-40/23 =
= 36,5 мг/кг NaOH.
1-15. Определить pH растворов бикарбоната натрия при темпе-
ратуре 298 К.
Решение. Для растворов NaHCOs имеет место соотношение:
CN»+ '= CNaHCO, = ЧСО,’
так как в растворе будут присутствовать главным образом ионы
Na+ и НСО_з- Тогда выражение (1-34) может быть написано в та-
ком виде:
CNaHCOB = С NaHCO,8 + ₽»
откуда
НСО., ' 1 J/a • t1"36)
Равенство имеет физический смысл только при р>0 и <5<1. Но
Д>0 возможно только прн рН>7,0 (приложение). Это — нижний
предел pH дли концентрации
бикарбонатов. Верхний предел
pH определяется условием 6=
=1,0, что имеет место при
рН=8,3. Пользуясь данными
приложения, можно также
определить промежуточные кон-
центрации растворов бикарбо-
натов и их pH, представленные
иа рис. 1-5. По этой таблице
Рис. 1-5. pH растворов бикарбо- можно найти, что при ковден-
иата натрия. трациях Скансоз^Ю»? мг-экв/л
pH растворов остается практи-
чески постоянным, близким к 8,3. Другими словами, бикарбонатом
натрня нельзя создавать pH раствора больше 8,3. Это можно сде-
лать, использовав взамен NaHCOs кальцинированную соду. В этом
случае можно написать:
^Na+ = 2ек ~ 2CNajCO» •
поскольку молекула КагСОз содержит два грамма-иона натрия.
Следовательно, уравнение (1-34) можно написать так:
2СЫа,СОз = СЫа3СО,8 + Р’
«ли
CN01COS - 2 -- 8
(1-37)
Для сохранения физического смысла в этом случае необходимо,
'чтобы 0>О и й<2. По данным приложения £>0 достигается при
рНЭ*7, а 6<2— при рН<12. Это означает, что растворы Ма2СОз
обладают pH в пределах 7—12 в зависимости от концентрации.
20
1-16. Построить график зависимости pH растворов Na2COs от
их концентрации.
Решение. Используя приложение, определяем ₽ и б для не-
скольких значений pH, по которым затем, использовав (1-37), нахо-
дим концентрации Na2CO3:
pH.................. 7 8,0 9,0 10,0 10,6
С, мочь/л...........10-’ Ю-с 10-е 10* 4.02-10-*
«................... 0.812 0,985 1,05 1,36 1,69
CNaC0, моль/л . . . 0 Ю-’ 1,05-10-» 1,52-10-* 13-10-*
Сц^сод. мг/.1 . . . 0 0.1 1,2 16 138
График зависимости pH '/(СШ1СО>) приведен на рис. 1-6.
1-17. В конденсате присутствуют 2 мг/л С02. Оценить точность
определения этого количества путем титрования ее 0,01 н. раство-
ром NaOH с индикатором фенолфталеином (ФФ).
Решение. Есчн в конденсате отсутствуют иэны НСОЭ , а
с 7едоватечьно» и СОд'’, то в уравнение (1-34) вместо Qqq2 можно
подставить ССОа и CNaOH вместо С +. После этого получим:
^NaOH = Qo/ + ₽’ (1-38)
Точка перехода индикатора ФФ лежит прн pH=8,3. Прн этом
6=1 (приложение) и 0^.2.54-10 6 моль/ т. слсдовате шво,
^NaOH = C-CQj + 2,54.10-'.
т. е. расход NaOH превышает его эквизалеитное количество иа
2,54-10 ° моль/л (0,112 мг/л СО2). Вместо 0,455 мл на 100 мл
пробы пойдет 0,484 мл 0,01 и.
раствора NaOH Ошибка в сто-
рону завышения составит
0,029/0,455=6,4%, что приточ-
ных анализах должно быть
учтено.
Если выбрать индикатор
с точкой перехода при рН=7.
то в этом счучае 0=0, а б=
0,812 и найденная титрова-
нием коюдентрация СО2 будет
равна 0,812-2=1,62 мг/л. Та-
ким образом, минимальная
ошибка будет при титровании
с ФФ.
1-18. Отобрана проба кои
деисата 4 мг/кг СО2. К 100 мл этой пробы прибавили 0,6 мл 0,1 и.
раствора NaOH. Определить pH получившегося раствора, концен-
трацию в нем NaHCO3 и СО2.
Решение. Для решения используем уравнение (1-35), кото-
рому придадим вид:
Cn,+/<7co, = «- 0-3»)
Концентрация натрия в оттитрованной пробе в пересчете иа 1 л
будет равна 0,6-10-3 г-иои/л, Ссоа=Ю~® моль/л. Подставлня эти
Рис 1-6. pH растворов углекис-
лого натрия.
значения в (1-39), патучаем 5=0,6, по приложению этому значению
соответствует pH=&6,55. В растворе будет находиться 50,5 мг/л
NaHCO н 17,6 мг/л СО2-
1-19. Общее количество (свободной п связанной) углекислоты
в конденсате составляет qCG, моль/л. Определить концентрацию
СО*. бикарбонатов и карбонатов при рН=9 /=298 К.
Решение. По уравнению (1-13)
СПСО. = — ° 19СО1- (м0>
Подставив в (1-10) н (1-11) это значение СО2, получим:
Снсо3-=сЭ^ = ,7г?СО': (М,)
Сс°г ‘ = ',,’со--
Коэффициенты Д1, Цг н аз зависят только от pH и могут быть
определены (при /«=/•= 1) с использованием табл. 1-3 и приложе-
ния. Для рН=9 о1=-2.2-10-3, q2=0.920 и о3==4,4-Ю-2. т. е. 95,0%
углекислоты находится в виде ионов НСО_3 и лишь 4,55% — в виде
СОд - Свободная СОд практически отсутствует. При рН=7
= 0,187 (3.4%) и Os=5.3 (96,5%). Концентрация яонов СО|~
рактически равна иутю.
Таким образом, требованию отсутствия в конденсате углекисло-
ты отвечает pH$s8.
1-7. ЩЕЛОЧНОСТЬ ВОДЫ И КОНДЕНСАТА ПО ФФ И МО
В водоподготовке часто пользуются понятиями «ще-
лочность по ФФ» (IZ/ф) п «щелочность по МО»* (WM),
мг-экв/кг, для опреде тения характера ионов щелочных
соединений, присутствующих в воде или конденсате.
Как известно, и опретеляется титрованием
0,1 н. кислотой отобранной пробы ю pH, прн котором
происходит смена окраски этих индикаторов (для ФФ
при рН^=8,3, для МО при pH^t4). При pH<8,3
Если раствор (конденсат) является щелочным по ФФ
(Я[ф>0), то при титровании его кислотой с фенолфта-
леином протекают следующие реакции:
ОН"4-Н+ —Н,О;
СОз“-|-Н+—НСО’,
ФФ — индикатор фенолфталеин; МО — метилоранж.
22
т. е. с ФФ оттнтровываются все ^гидраты н половина
карбонатов. Если Сон- и С^- выражены в г-иои/кг
(г-экв/кг), то можно написать, мг-экв/кг:
ZZZ*=i°-(COH.+Cco|_). (1-43)
При титровании второй пробы того же раствора
с МО, кроме приведенных двух реакций, добавится
третья:
НСО“+ Н+—со,+н,о.
Следовательно, мг-экв/кг, равна:
^=i01(COH- + CHco_+2CC(1_). (1-44)
Общее количество СОг (связанной), моль/кг, равно:
<7со.= 10 я(Щм~Щф). (\А5)
Подставив в (1-43) и (1-44) значения ^нсо_« Чю2- и
^соп из U'iO)» 11) и (ЫЗ) и имея в виду, что Сон- =
=КВ/Сн+, получим:
Шф= 10* (1г6)
<м’>
Стоящие в скобках выражения являются функция-
ми pH Поэтом), решив совместно уравнения (1-46) и
(1-47) относительно Сн+, моль/кг, можно получить фор-
мулу для расчета pH по значению Щм и 1ДФ. Для этого
примем (для конденсата) Л=/г=1. значение ?со возь-
мем из уравнения (1-45), а <р> — из уравнения (1-14),
памятуя, что при /Дф>0 COJ =0 и, следовательно,
в уравнении (1-14) первый член суммы будет также ра-
вен нулю. С учетом этого и для случая /Дф>0 совмест-
ное решение этих равенств после подстановки числен-
23
ных значений Лв, Кь К2 приводит к следующей форму-
ле [4]:
_ 0,5-2,8(2Щ>-
Н+ X
/ / 22,7Йи \
ХИ+|' 1+ 15,6((2Шф-Щ„)-11а ) f1'48*
ПРИМЕРЫ
1-20. Определить pH конденсата, если щелочность, мг-экв/кг,
равна, а) Щф = 0,08; Жм=0,16; б) /Цф=0,13; ^=0,21; в) Щф =
= 0,1, Л(и=0,3.
Решение. Подставив эти значения в равенство (1-48), по-
лучим
а)С + = 1,7ЬЮ~“ моть/кг, pH = 9,77; б) Сн+==1,02Х
X 10“’° моть/кг, pH 10,0; в) Сн+ = 1,85.10“10 моль/кг, рН =
= 9,86.
1-21. Определить состав щелочных соединений в пробе конденса-
та, еслп Щф=0,1 и/#„=0,2 мг-зкв/кг.
Решение. Широко известен способ определения щелочных со-
единений в системе NaOH— СОг — Н2О по значению /#ф и Щ» На-
пример, при 2Щф—Щц в пробе присутствует МагСОз с концентра-
цией 2ЩФ> мг-эквДг, если же 21Цф>Щк, то в растворе имеются
Cnhoh — и т. Д- Эти соотношения справедливы при за-
метной или даже значительной концентрации NaOH, №зСОз или
NаНСОз в растворе, что характерно для химически обработанной
воды. Для конденсата, являющегося весьма разбавленным раство-
ром, существенное значение приобретает степень гидролиза указан-
ных соединений, увеличивающаяся с разбавлением. Это приводит
к тому, что наряду с Na^COs в растворе могут присутствовать и
продукты гидролиза NaOH и NaHCOs, что не могут учесть упомя-
нутые выше соотношения
Использовав их, найдем для данного примера, что в конденсате
присутствует Na^COa в количестве С^йаС01= 0,2-53 = 10,6 мг/кг_
Однако более точные формулы (1-41), (1-42), (1-45) и (1-47)
дают для данного примера при рН=9.85;
CNaOH = 2,75’ CNaHCD3 = 5’8; CNa^CO, =3-2 мг/кг’
1-8. СИСТЕМА NH3— СО2—Н2О
Данная система — вода, аммиак и углекислота —
имеет весьма важное значение для пароконденсатных,
водоконденсатных н пароводяных систем илн циклов.
Аммиак находит в них широкое применение для под-
держания pH на заданном уровне с целью предупреж-
дения коррозии железа и медных сплавов. Особенно
24
большое значение имеет эта система для современных
электростанций высокого и сверхкритического давле-
ний, в которых на аммиак возложена роль регулятора
pH. Однако из-за присутствия в цикле электростанций
СО2 и разных температурных режимов отдельных участ-
ков пароводяного тракта регулирование pH с помощью
одного NH3 не всегда и не везде в цикле достигает цели.
Но рассмотрение данной системы представляет значи-
тельный интерес не только для электростанций, но и
для промышленных энергоустановок и пароконденсат-
ного хозяйства технологических установок пром пред-
приятий. Здесь также для устранения коррозии ковден-
сатопроводов н теплообменников используется аммиак
для создания щелочной среды, тормозящей коррозию
железа.
При растворении аммиака в воде происходит образо-
вание слабого основания
NH.+н++oir nh4+ 4- он~ nh.oh
и устанавливается равновесие
nh4+^nh,4-h+.
Эти реакции характеризуются следующими констан-
тами диссоциации:
С С f F
NH+ он- 'nh+ 'он-
К 4_________4_____.
ач cnh4oh ^nh.oh * (1-49)
_ Сн+С™.
Значения Кем можно вычислить по формуле [5]
Лам=Кв/Лк. (1-49а)
В табл. 1-4 [2] приведены значения Лам и в за-
висимости от температуры, взятые из [2] п вычислен-
ные по уравнению (1-49а).
Для рассматриваемой системы условие электроией-
тралыюстн запишется так:
С ^4-С+ = С„_4-С л 4-2С , . (1-50)
nh+ 1 н+ он 1 1,с°з' со» 1
25
Таблица 1-4
Значения JlfeM и KN в зависимости от температуры
г. к *л'°” 7. К
291 14 4,07 373 13,5 437
293 16,2 4,20 395 10,2 11,75-10’
298 17,9 5,74 423 6,9 33.9Л01
308 19,5 10,7 43Я 5,5 57,2-10’
323 19,6 28,0 473 3,1 15,7 Ю’
338 18,6 67,5 523 1.1 50,0-10’
358 17,2 150 579 0,09 33,8-10*
Подставив в правую часть значения второго в треть-
его слагаемых, определяемые соотношениями (1-10) и
(1-11). и решив относительно С_;;+ .получим при fj==:ft=l
с™г=с”сЧ^+^)+(^~Ч(Ь51)
или, использовав соотношения (1-13) и (1-15),
C№4+ = ‘?co.f+f = ?co/+?- (1-52)
Концентрация иелиссоциировавиого гидрата окиси
аммония может быть определена из соотношения (1-48)
С«н+ с°н-
Снн.он= КЗ ' (1-52а)
Подставив значение CNH+ из уравнения (1-52) и
Сон_ =Л'а/Сн+, получим:
cwtPH=с^7 XT Gcd- гГ+0 1,са* +
(1-526)
Поскольку в растворе присутствуют NH+ и NH4OH,
целесообразно в уравнение (1-52) ввести общее количе-
ство аммиака, т. е.
=CNH+ 4* ^nh*oh •
26
Подставив значения слагаемых из соотношений
(1-52) и (1-526), после несложных преобразований по-
лучим:
?«=(* + (?co.^--h)=s(W+₽)- С-53)
ПРИМЕРЫ
1-22. Определить количество аммиака, необходимое для созда-
ния pH=9 в конденсате, содержащем 2 мг/кг СОа (4,55Х
ХЮ-5 моль/кг) пра /=298 К.
Решение. Значения S, б и f) для рН=9 находим по приложе-
нию и табл. 1-4 Получим 5=1,57; 5=1,05; (1—101-Ю-5. Тогда по
уравнению (1-53)
qtt = 1.57 (4,55 • 10"5-1,05+1,01 • IО-5) = 9.1 10-ь моль/кг
или q'n=9,1 •10-5-17-103 = 1,54 мг/кг.
При расчете по реакции
NHj+H^O+COs—*NH,HCO3
получим fl№»0,77 мг/кг.
1-23. Найти предельную концентрацию углекислоты в конденса-
те, при которой доза аммиака 500 мкг /кг была бы достаточной для
создания pH=9 прн 298 К.
Решение. Из уравнения (1-53) находим
qN— S3 29,4 10-’ —1,57+10“*
’to.= —SS 1,674-1,05 = 0-83’10 1 ыоль/кг-
где =500«{0“М7 = 29,4-10“* мль/кг; S — 1 + Kn/Ch+= 1 +
+ 5,74-10-•/10-• = 1,574; 5 = (Яв/Сн+) — Сн+= (1 • {о - »*/10 - •)—
—10“’1 • 10“’ моль/кг; в ~ 1,05. Ита же д'со = 0,83-10_,-44 X
X Юв =&365 мкг/кг.
1-24. Определить pH растворов бикарбоната аммония.
Решение. Ес тн в чистом конденсате находится в растворе
только NH4HCOat то q^ = qCQt = С^ноо»- Tow уравнение (1-53)
может быть написано так:
GfflJiCO, (^NH*HCO,e + 5)>
H.TJI
S3
CNH.HCO> ’ 1 — JS'
Если Р=0. что имеет место при рН^7 (приложение), то
^NiyiCO -0- $то — нижний предет pH.
Верхний предел pH определяется условием BS=1, т. е. прн
/1=/а=1
х.сн++гк.к, 4, , Kn_\ ,
Сн+ +^16’н++К,К1 Сн+/
27
Слагаемыми Hiifa и К\Кл можно пренебречь, тогда решение
этого равенства приводит к выражению
ci+=r^
что дает при 298 К pH^s7,8.
Значение pH=7,8 достигается при концентрации бикарбоната
аммония примерно 2,8 ыг/кг. Эти данные показывают, что рН>8
нельзя создать нейтрализацией углекислоты аммиаком до NH4HCO3.
1-25. Определить количество NH3 для подщелачивания конден-
сата, лишенного СОг, до рН=9
Решение. Используем выражение (1-53), положив
для pH = 9 находим: S = {,574 и рак 1,0-10 ®, тогда при условии
9nHj S р= 1,574-10 ’моль'кг нт 17-Ю». 1,574-10'»^0,270 мг/кг
против 1,54 мг/кг в примере {-22
1-26. Определить дозу аммиака, мг/кг, необходимую для подще-
лачивания конденсата, содержащего СО2 в количестве 10, 50.
100 мг/кг, до pH 7,0; 7,5; 8 и 9 при /=298 К.
Решение. Расчет ведем по уравнению (1-53) и с использо-
ванием приложения и табл 1-4. по которым находим /См. б и £ для
\ казанных значений pH Рез\ штаты расчетов приведены ниже
pH
СО,. мг/пг 7 7.5 8 9
Ш 3, { 3,7 3,8 6,75
50 15,7 18,4 20,0 33
100 31 4 36 38 67,5
Стехиометрические соотношении между СО2 и NH3 достигаются
только при pH==s8,0. Для pH <8 требуются меньшне концентра-
ции NH-,.
1-27. Опредетить предегьную концентрацию уг чекислоты в
конденсате для условий примера 1-23, но прп t = 438 К.
Решение Ото основывается на использовании равенства
(1-53). Однако значения S, 6 и 0 должны быть определены для t~
=438 К Прн этом необходимо иметь в виду следующее. по [6]
оптимальное значение pH с точки зрения предотвращения коррозии
металла в условиях паросиловых установок путем подщелачивания
питательной воды аммиаком или морфолином равно 9 при 298 К,
чему соответствует рОН=5 Это значение рОН (а не pH) целесооб-
разно положить в основу оценки степени подщелачивания воты
аммиаком прн более высоких температурах (более 373 К).
Найдем вначале концентрацию ионов Н+ яз условия рОН—5.
По табл. 1-2 для 438 К KB=3{5-10-J‘=10~ll,s. Так как по условию
рОН=5, то рН=6,5, нлн Сн+=Ю-в-в. Значение величии, входящих
в уравнение (1-53). определенных для /=438 К, равно. S=l +
4-57.2-10-8/10~в-в=2.80; р=31510-14/10-®-5—lO-’-’^lO"’; б =«1,0;
=29,4-10-’. Подставпв их в выражение (1-53), найдем
29,4-10-®—2,80-{О'8
?со,= ------Об-------~— = °'5'10 мочь/кг
или 0,5-10 6 44-1 №^0,022 мг/кг вместо 0 36 мг/кг, которое полу-
28
чается при t—298 К- Из этого примера следует, что с повышением
температуры для создания требуемой щелочности среды необходимы
большие концентрации аммиака А также и то, что уровень или
степень щелочности воды в водокопдеисатном тракте энергоблоков
СКД изменяется в зависимости от температуры среды.
1-9. СИСТЕМА H3POi— NaOH—НО
При растворении в конденсате фосфорной кислоты
протекают следующие реакции:
нгро.1^н2ро44-н+ .
Н£РО4-^НРО^Ч-Н+ ;
нро^ро^н-н* ,
характеризующиеся соответственными константами рав-
новесия при /=298 К:
Сн,РОГСн+
К' =------/---------=7,52-10“‘;
СН,РО,
СНРО;- Сн+ f‘
К',=------Д---------= 6,23- 10-!;
СНаРО—
Сго’-Сн+,1,‘
К’,=----------------= 1.8-10 ".
GHPoS“'3
4 )
Отсюда концентрации анионов будут равны:
Р _______ СИВРО4 .
Сн.РО4-~ Сн+Р1 •
Снро2-— C^+faf\ ’
р _____^нлро, К* «
РОЗ- С.н+РЛ •
Общая концентрация фосфатов составляет:
?Ф = Cl 1.РО. + Сн,ро-- + СГО62- + Стоз- -
4 4 4
(1-55)
(1-56)
(1-57)
Заменяв концентрации ионов выражениями (1-56),
и при условии получим:
а —С /1-4- К'1 I K'iKraK*a \
9ф—СПРО.( 1 + —с- 4 )
\ н+ н+ н+ у
29
Обозначив выражение, стоящее в круглых скобках,
•через <р'ф, можем написать:
—^наро4 (1
Для раствора, содержащего Н3РО4 и NaOH, условие
электронейтральности напишется так:
С + 4-С -=С “К 4-ЗС о
Na+ 1 Н+ ОН’ 1 Н.РО— 1 НРО^~ 1 РО3~
4 4 4
или при использовании (1-56)
_ . - л / K't . ?К‘ Л’1 г
С + 4“ С + — == I С * С* <*’ ) ^Н.РО.•
Na+ * н+ он- ^Сн+ Сн+ Сн+ j
После замены Сон_ =Кв^н+ и выражения в круглых
скобках на уг,ф получим:
С +
Na+
= сВД«.р"ф+/-^— СнА
Но по уравнению (1-58) СНР0 =?ф/?ф» тогда
(где
cNa+=?*4r+₽*=’A+₽*’ (ь59)
₽Ф=К,/Сн+—Сн+; 5ф=ч>"ф/т'ф. (1-59а)
Т а б лица 1-5
Численные значения величин у'ф, ®ф,
?ф для системы Н,РО< — NaOH — Н,0
pH ’ф ’"ф ЙФ ₽ф
3 8,52 7,52 0.88 ^1.0.10-’
3,5 2,48-10 2,38-10 0,96 —3,16-10-*
4,0 7,62-10 7,5-10 0,99 — 1,0-10-*
4,5 2,4-10’ 2,4-10’ 1,0 —3,16-10-’
5,0 7,59-10’ 7,6-10’ 1,0 -1.0-10-*
5,5 2,43.10’ 2,47-10’ 1,02 —3.16-10-*
6,0 8,0-103 8,46.10’ 1,06 —9,9-10-’
6,5 2,85-10* 3,32-10* 1,17 —2,84-10-’
7,0 1.21-Ю» 1,7-10* 1,39 0,01-10-’
7,5 7.0G-105 1,17-10* 1,66 2,88-10-’
30
Пpodoiженив табл. 1-5-
pH •* ₽ф
8,0 5,43-10* 1,01-10’ 1,86 1,0- ю-«
8,5 4,92-10’ 9,61-Ю’ 1,96 3,2-10-*
9.0 4,76-10» 9,46-10» 1.99 1,01-10-»
9,5 4,73-10» 9,46-10* 2,0 3,2-10-»
10,0 4,77-10’» 9,62-10” 2,01 1,01-10-*
10,5 4,95-10” 1,02-10’2 2,06 3,2-10-*
11.0 5,52-10’» 1,19 10” 2,16 1,01-10-»
11,5 7,35-1О'* 1,74 10» 2,37 3,2-10-’
12.0 1,31-10’» 3,4710’» 2,65 1,01-10-»
12,5 3,14-10'' 8,9-10’» 2,85 3,2-10-»
Решение уравнения (1-59) сложно. Но если для раз-
ных pH рассчитать значения <р'ф, <р"ф, 6ф и рф и свести
их в таблицу (табл. 1-6 [4]), то, пользуясь ею, можно
решать разные задачи на основе выражений (1-59) или
(1 60), что иллюстрируется приведенными ниже при-
мерами.
Если в конденсате растворено <?ф, моль/кг, какой-ли-
бо натриевой соли фосфорной кислоты, то концентрация
иагрия равна:
Подставив это значение CNa+ в уравнение (1-59),
получим:
и-60)
где п=1 для NaHjPOj п — 2 для Na2HP04 и л=3 для
Na,P04.
ПРИМЕРЫ
1-28. Определить pH растворов моно-, ди- и тринатрий фосфата.
Решение. Для растворов ыононатрийфосфата равенство
(1 60) имеет вид:
(1-60В).
Оно имеет физический смысл только при положительных значе-
ниях 9ф, чю достигается при 6ф>], при которых р<0 (табл. 1-5).
Минимальное pH, при котором 6$>1, примерно равно 4,7, что легко
31
установить интерполяцией, пользуясь данными табл. 1-5. При этом
= 1,002; Рф~—2,29 -10“в. Следовательно,
— 2,29-10-“
<?'ф ~ —j _2 J fog ‘ = 1.145 • 10 -2 моль/кг,
или 1,145-10-2-120-10®== 1375 мг/кг.
Минимальная концентрация NaH^PO* будет иметь место при
.pH <6,95, дли которого по уравнению (1-59) ₽ф——9,4-10-» и по
табл. 1-5 вф=1.346. тогда
9,4-10"»
<7ф = j ; 346 = 2,72-10 мо 1ь/кг,
или 2,79 • 10-® • 120-103-103=0,33 мкг/кг.
Таким образом, во всем диапазоне концентраций растворы моно-
натрийфосфата имеют кислую реакцию.
Для растворов дияатрийфосфата выражение (1-60) примет вид:
Вф
Знаменатель этой дроби положителен вплоть до рН=^9.5
(табл. I -5). Числитель положителен при рН;>7 Следовательно, прак-
тически pH растворов NaaHPO* лежит в пределах от 7.1 до 9,4.
Минимальная концентрация этой соли (ппимерно 15 мкг/кг) будет
при рН=7.1, а максимальна» (примерно 1960 мг/кг) при рН=9,4.
Переходя к растворам тринатрийфосфата, следует в уравнение
(1-60) подставить л=3, тогда
nt РФ
=з^;-
Из данных табл. 1-5 можно видеть, что д"'$ положите пьно при
всех значениях рН>7. Это означает, что растворы Na3PO4 могут
иметь pH от 7 до 14 в зависимости от концентрации. Все эти рас-
четы проведены прн fi=fs=fs=L что при небольших концентра-
циях фосфатов допустимо. Прн высоких концентрациях и точных
расчетах следует учитывать реальные значения коэффициентов
активности
Выражение (1-60) можно использовать и для определения pH
растворов Н3РО4, для чего следует принять п=0, тогда
РфМф-
Область положительных значений охватывает рН<6,9.
С увеличением 9е ф pH уменьшается.
1-10. pH СМЕСИ РАСТВОРОВ
В практике водоподготовки нередко используются
смеси двух растворов, имеющих разные значения pH.
В таких случаях иногда желательно или необходимо
знать pH смеси. Может танже возникнуть другая зада-
ча: по pH смеси и одного из компонентов определить pH
другого слагаемого. Эти вопросы подробно рассмотрены
в [7].
32
Обозначим pH растворов А, Б, В соответственно а,
б, в, а рОН соответственно аь бь вь Тогда концентра-
ция ионов Н+ будет соответственно равна, г-ион/л:
10—% 10~б, 10~в и концентрация ОН-—
10~а*, 10“в*, 10~в’. Если х, кг, раствора А смеши-
вается с у, кг, раствора Б, то возникает (х-\-у), кг, сме-
си, значение pH которой (раствор В) может быть най-
дено решением следующих двух уравнений, составлен-
ных на основе баланса Н! и ОН':
х- 10-б=(х4-г/) 10~в+10~д; (1-61)
X. 1 (?-“+£/ 10б-м=(х+$0.10»-“+10-Д (1-61 а)
При смешении двух растворов происходит частичная
нейтрализация ионов Н+ и ОН~ или их ассоциация н
диссоциация. В результате этих процессов pH смеси не
будет равно сумме pH смешиваемых растворов. Возни-
кающий небаланс выражен в уравнениях слагаемым
10“д. Кроме того, следует иметь в виду, что
10—=10’“н, 1(Гв’=10в-м и т. д.
Вычтя (1-61а) из (1-61), получим:
х (10-а— 1О0'1*) (10-6— 1 Об-Н) = (х-Н/) (10 н- 10”-н).
Умножив обе части равенства иа 107 и приняв х-\-у=
=1 (что всегда можно сделать), будем окончательно
иметь:
х (107-3—1О7) (107~с— 106-7)=1О7"»—10й-7.
(1-62)
ПРИМЕРЫ
1-29. Определить pH смеси равных объемов растворов NaH2PO*
(А) и NasPO< (Б), имеющих концентрации соответственно 0,5-10“3
и 0,2-10 s моль/кг. или 60-103 и 32,8-103 мкг/кг.
Решение. Прн смешении этих растворов возникает реакция
нейтрализации
NagPOi+NaHaPOi—► 2Na2HPO4,
после чего в смеси будет 0,3 -10-8 моль/кг NaH2PO4 и 0,4 10~8 моль/кг
Na2HPO4. Поэтому можно считать, что раствор В (смесь) состоит
из равных объемов растворов Na2HPO4 и NaH2PO4 указанной кон-
центрации.
Для нахождения pH смеси необходимо в уравнение (1-62) под-
ставить значения а и б н решить его относительно в. Дли этого
запишем уравнение (1-62) в виде
ю-»° —10-’*
".= 10’-’ - 10— = ,0-,,()-.
3—209
33
или
(10--)*— 10-W 10-’— (10~’)2=0, (1 63)
где
N=x (1 О’-*—10* “’) +у (1О’-в—10”-’). (1 -63а)
Уравнение (1-63) является квадратным относительно 10-*, и ре-
шение его приводит к выражению
Ю"’ г______
10-в = __(/у±^‘+4).
Значение 10“* может быть только положительным, и поэтому
знак минус должен быть отброшен, поскольку V№+4>Лг, откуда
ю-»=^—(w+ Кл™+Т) (1-64)
или
, . Л' + Г.Л/«+4
в = 7 — 1g ------g—-----
(1-65)
Значения N в уравнении (1-65) должны быть положительными,
т. е. JV>0. Это будет иметь место при следующих соотношениях а,
б, в: а^б и б<6; а^б, 6^3 и 7—а>б—7; б<6 и а—7>7— б.
При всех других соотношениях j/V<0. В этом случае необходимо
вычесть уравнение (1-61) из (1-61 а). Тогда получим.
-W=x(10*-’—10’— )-Н/(1 Ос-’— 1О’-б), (1-66)
или
-ДГ=|ЛГ| = 10*-’—IO7--. (166а)
Решение уравнения (1-66а) приводит и выражению
B=7+Ig JjM + ^ + 4 .
(1-67)
Определим .V для нашего примера. Для этого по рис. 1-7 най-
дем pH растворов А и Б по их заданной концентрации: а—5,5 и
6=8,7. Определение N ведем по уравнению (1-66):
W=0,5( 10- '-5—10'-5)+0.5 (10*-’—Ю-1-’) =—15,84-25=9,2.
По уравнению (1-67) на-
ходим pH смеси: рН=7-|-
+>g 9,2=7,96.
1-30. Найти pH смеси рас-
творов: 0,3 кг NaOH с концен-
трацией 0,4-10-3 моль/кг (А)
и 0,7 кг HCI с концентрацией
0.2-10-’ моль/кг (Б).
Рис. 1-7. Зависимость pH рас-
творов ортофосфатов от их
концентрации.
34
Решение. Определим значение pH исходных растворов пр в
298 К:
а = — 1g Сн+ = pH =11 — рОН = 14 + 1g 0.4 + 1g 10"’ = 10,6;
б) = —lg (0.2-10-*) = 3,7.
Так как а>8, б<6 и а—7>7—б, то определяем N по выраже-
нию (1-63а). После подстановки значений а и б, х=0,3 и ^=0,7
получим:
N=0,3 (10-’-в—1О3*®) +0,7 (103-3—1О3-8).
Значениями 10~3-3 и 10-можно пренебречь в силу их незна-
чительности, тогда
N=0,7 -1О3-3—0,3 • 103-«=205
и, следовательно, по уравнению (1-64) в=7—Ig205=t+7.
Этот результат можно получить в другим путем. При смешении
растворов NaOH н НС1 происходит реакция нейтрализации; ОН^+
+Н+—*-Н2О. Так как в смесь вносятся 0,12-10 3 моли NaOH и
0,14-10-3 моля НС1, то в конечном итоге в растворе окажется
в избытке (0,14—0,12) •10-3 = 2-10-в моля НС1 в раствор окажется
кислым. Его pH равен: pH——1g 2-10-5=4,7.
1-31. Сточные воды водопод готовя тельной установки содержат
0,2 г/кг NaOH и имеют рН=11,7 (расчетный, без учета ноиной
силы раствора). С каким pH следует взять раствор кислоты, исполь-
зуемой для нейтрализации, в количестве 30% объема сточных вод,
чтобы значение pH смеси составляло 7,5?
Решение. Решение сводится к тому, что по данным айв
следует найти б. Для этого уравнения (1-62) следует представить
в следующем виде:
Ю’-в— 10в-’= [107“в—10—7—х(10т"»—10—7)] /у.
Обозначив правую часть через М по аналогии с рассуждениями,
изложенными в предыдутщ • примерах, придем к следующему реше-
нию (при ЛОО):
6 = 7 —1g
или
и + Кар + 4
2
| Л1 | + КлЯ+4
(1-68)
(1-68а)
при М<0.
В нашем случае Afeb2,31-104-3 и по уравнению (1-68)
pH=7—Ig 2,34- 1О‘-7^2,О.
Этому значению pH соответствует примерно 0,1%-ный раствор
HjSO*.
1-И. pH БУФЕРНЫХ РАСТВОРОВ
Буферными называются растворы, pH которых не
зависит от прибавления небольших количеств кислоты
или щелочи. Они содержат вещества, которые способны
связывать прибавляемые к раствору или возникающие
з* 35
в нем в результате соответствующей реакции ионы Н+
или ОН~. Такими веществами являются слабые кисло-
ты и основания и и.х соли.
РАСТВОР СЯАБОЙ КИСЛОТЫ И ЕЕ СОЛИ
К слабым относятся кислоты, ие полностью диссо-
циирующие в водных растворах на ионы. Это значит,
что наряду с ионами в растворе присутствуют и неднс-
социировапные молекулы кислоты. Для кислоты НА^а.
=г^Н+|~А~ истинная константа диссоциации К'на рав-
на:
С„+ С*- ^Н+ ^А“
к- = ----"* (1-69)
НА СНА 'НА
Если в растворе присутствует только НА и концен-
трация ее мала (меньше или равна 10~3 моль/кг для
бинарных электролитов), то второй множитель можно
принять равным единице, т. е. можно считать, что К'на
равна коистаите, подсчитанной по концентрациям
ионов:
и Сн+=СА_ . (1-69а)
Так как для недиссоциированной части НА [на=1»
то можно написать:
Хн*=Л'В*/н^*-=К'наГ.-
Если к раствору этой кислоты концентрацией Сна,
моль/кг, прибавить Скд, моль/кг» ее соли, то общая кон-
центрация аннона будет равна:
2Са_-=Ска + Сн+, (1-70)
а недиссоциированной части кислоты
СЫНА= ^НА ^Н+ • (1"71)
тогда, подставив уравнения (1-70) и (1-71) в выражение
(1-69а), найдем:
сна “ Сн+
^НА СцА + Сн+ •
36
Концентрация ионов водорода мала по сравнению
с Сна н Сед, и ею можно пренебречь, поэтому
Сн+=КНА-^. (1-72)
После логарнфмировання получим:
рн=—ig с i+ == ркНА - ig снд+ig сКА,
или
рН=рКНА+ Igg*. (1-73)
РАСТВОР СЛАБОГО ОСНОВАНИЯ И ЕГО СОЛИ
Аналогично выводу равенства (1-73) получается и
зависимость концентрации Сон- в смеси слабого осно-
вания КОН и его соли КА:
Сон-=^он^. (1-74)
или, заменив Cqh_ =KJCh+9 получим:
с к* Cra
н+ ^КОнСцон'
откуда после логарифмирования
рН=рК„ — рКцон — lgCKA4-lgCK01I, (1-76)
ИЛИ
рн=ркв—KKOH+ig^.
Выражения (1-73) 11 (1-76) показывают, что значе-
ние pH буферных растворов зависит от отношения кон-
центраций слабых кислот и основаияй к их солям. Из-
менив это отношение, можно получить заданное для
данной системы значение pH.
ПРИМЕРЫ
1-32. Отобранная из теплофикационного подогревателя проба
конденсата греющего пара должна быть длительно сохранена откры-
той при -pH конденсата 6,5±0,5. С этой целью в конденсат добави-
ли 0,1 и. раствор NaOH. Определить:
1. Количество раствора, мл, на 1 кг конденсата, необходимое
37
для создании pH=7, если начальная концентрация СО2 в конденса-
те составляла 8 мг/кг?
2. Количество СО2, абсорбируемое конденсатом из атмосферы,
необходимое дли понижения pH с 7 до 6’
Решение. После прибавления NaOH произойдет нейтрализа-
ция части СОа с образованием NaHCO3 и в конденсате будет при-
сутствовать х, моль/кг. NаНСОз и у. моль/кг, Н2СО3. При этом
х+$г=8-10-я/44=1,82-10-4 моль/кг. Тогда, использовав уравнение
(1-73), можем найти при №=4,31-10“’
7=6,3654-1г (х/у),
откуда x/j/=4,31 и х=4.31у, но £/=1.82-10“*—х, тогда х=
=1.48-Ю—4 н £/=(1,82—1,48) 10-1=0.34-10~4. В соответствии с ре-
акцией
COH-NaOH—*-NaHCO3
в конденсат нужно добавлять NaOH также в количестве х. моль/кг.
или 1,48-10“*/10“*= 1,48 мл/яг, поскольку концентрация NaOH
в растворе составляет 10-4 моль/мл. Для определения количества
СО2 воспользуемся уравнением (1-73), подставив pH = 6:
6=6,365-blg (х/у).
Из этого равенства получим у—х/0,431 = 1,48-10“*/0.431 =
=3,42-10-4 моль/кг, поскольку в дроби х/у изменяется знаменатель
за счет абсорбции углекислоты из атмосферы, в то время как кон-
центрация NaHCO3, т. е х, остается постоянной Итак, дтя пониже-
ния значения pH конденсата с 7 до 6 необходимо, чтобы концен-
трация СО2 в нем возросла с 0.34-10“4 моль/кг (1,5 мг/кг) до
3,42-10“* моль/кг (15,2 мг/кг).
Буферные растворы способны поддерживать pH в заданных
границах только до прибавления определенного количества кислоты
или щелочи, т. е. они обладают определенной емкостью. Она про-
порциональна концентрации основных соединений В данном случае
буферная емкость конденсата исчерпывается растворением всего
13,7 мг/кг СО2.
1-33. Прн определении жесткости воды при f=298 К трилоном
Бк 100 мл пробы добавляется буферный раствор, состоящий из
смеси NH<OH и NH4CI, т. е слабого основания и его соли, дли
создании в ней рН=8,5±0,5. «Аммиачная смесь» добавляется
в пробу в количестве 5 мл. Определить необходимую концентрацию
буферного раствора.
Решение. Анализируемая вода может иметь щелочность
(ОН“) или кислотность (Н+) до 5-10“3 r-нон/л И это не должно
изменять pH пробы более, чем это указано в условиях задачи Бу-
ферность смеси проявляется в том, что при щелочной воде ионы
ОН- связываются ионами NH* с образованием слабодиссоцииро-
ванной гидроокиси аммонии:
NH.C1 — NK^+ CI - + ОН- NH,OH + Cl -.
Наоборот, кислотность воды нейтрализуется гидроокисью аммо-
ния с образованием воды:
NH.OH NH,+ + ОН- + К- -> NH+ + Н.О.
38
Обозначим концентрацию, моль/л, я буферной смеси гидрооки-
си аммония х и хлористого аммония у, а в пробе — соответственно
я и б, тогда, использовав равенство (1-76), можем написать:
8,5=13,9—4,75+1 g (а/б),
где 4,75 = — Jg Anh.oh = ~ 1.75-10- ",
откуда а/б=0,224.
Для обеспечения достаточной емкости буферной смеси примем
значении а в 3 раза больше указанной выше кислотности. Тогда
б=а/0,224= 15-10“’/0,224 =67-10-3 моль/л. Так как буферная
смесь добавляется к 100 мл пробы в объеме 5 мл, то в расчете на
1 л пробы можно составить следующие равенства:
50 х-10“3=15-10~3 и 50-10-3^=67-10-3,
откуда получим: х=0,3 н (/=1,34 моль/л, или
х=0,3-35= 10,5 г/л, ^=1,34-53 = 71 г/л.
Если проба имеет щелочность 10 мг-экв/л, то значение pH про-
бы составит:
15+10
pH = 13,9 — 4,75 + 1 g =5= 8,8.
В случае кислотности пробы в размере 10 мг-экв/л
15—10
pH — 9,15 + 1g gy । j5.0.
По действующей инструкции концентрации аммиачной смеси
должна составлять 2% по NH3 н NFUCl или ж=1,17 моль/кг, у=
=0,374 моль/кг, тогда pH i ейтральной пробы равен:
pH=9,15+1 g (1,17/0.374) =^9,65.
1-34. Приготовить буферный раствор с pH=9,5, пользуясь реа-
гентами NaHCO3 п Na2CO3, т. е. найти их концентрацию соответст-
венно у и х, моль/кг.
Решение. В растворе NaHCO3 и Na2CO3 протекают следую-
щие реакции:
NaHCO, Na+;+ HCCKf;
НСО^ Н+ + СС^—;
Na,ТО, 2Na+ + СС^“;
Н+ +СО5—НСО^.
где в качестве кислоты выступает нои НСО_з. Поэтому прн исполь-
зовании уравнения (1-73) следует помнить, что анионом (А) служит
ион СОз2-, а недиссоциированной частью кислоты — ион НСО 3.
В этом случае в качестве константы Ан а используем вторую кон-
станту диссоциации угольной кислоты #,=5,61 -1011 при 298 К пли
рКг= 10,25. После этого можем написать:
pH=10,25+lg (х/у).
39
Если х=у, то рН= 10,25. Следовательно, отношение этих вели-
чин должно быть меньше единицы, т. е.
1g (х/0) =9,5-10,25=—0,75.
Отсюда */0=0,178 Для определения х н у принимаем, что при-
бавление в приготовляемый раствор кислоты НС1 нли щелочи NaOH
в количестве 0,1 моль/кг изменяет его pH на единицу (от 9 до 10)
В таком случае мы можем составить следующие два уравнения.
V _ 0 1
а) 9 =10,25 +1g—|-п*.:
6 У + 0,1
(1-77)
б) 10 = 10,25+1Е ^±£1,
так как прибавление кислоты уменьшает х и увеличивает у а до-
бавка средней соли этой кислоты действует в обратном порядке.
Решив эти равенства, получим соответственно:
а) х=56.2-10-8^+105,62-10-’;
б) x=56,2-10 sy—156,2-10 *.
Прн совместном решении этих уравнений найдем:
#=0,515 моль/кг, нлн 0,515-84 — 43,4 г/кг; *=0,178-0,515=
=0,0915 моль/кг. или 0.0915-108=9.85 г/кг.
Концентрации этих веществ достаточно высоки, и для более
точного определении pH следует учесть коэффициенты активности
одно- н двухвалентных ионов. Ионная сила раствора, определенная
по уравнению (1-2), равна р=0,745. Это достаточно высокое зна-
чение, н данными табл. 1-1 воспользоваться нельзя. В таком случае
f можно определить по формуле (1-3).
Для одновалентных ионов получим:
0,509-1а К(1,74
1 +К6ТЙ5
= — 0.274,
а для СО’
1£А =
0,509-2я Ио,745
1 + КО; 745
= — 0,735.
Отсюда /1=0 532 и fs—0,185.
Значения pH определим по уравнению (1-73) с учетом коэффи-
циентов активности:
рН = рК, + 1£
(1-78)
рН = 10,25 +1g
0,0915-0,532-0,185
0,515
•еА =
Как видим, более точный расчет показывает, что найденное
выше отношение */0=0,178 не обеспечивает требуемого значения
pH. Для достижения его необходимо, оставив прежнее значение х=
=0,0915 моль/кг, уменьшить у, определив его по уравнению (1-77),
которое (при pH=9,5) дает 0=0,051 моль/кг. Повторный просчет
по уравнению (1-78) с учетом новых значений ц, и /соз_
40
дает рН^ь5,43. Этот пример показывает способ определения pH
растворов с учетом коэффициентов активности путем последователь-
ного приближения.
1-35. Заполненный конденсатом бак выводится в резерв. Для
создания рН^9,5 в конденсат добавили Na2CO3 до концентрации
80 мг/кг. Определить:
а) pH конденсата после добавления Na2COa, если начальная
концентрация СО3 в нем составляла 13 мг/кг;
б) количество СО2, которое, будучи растворено в конденсате,
понизит его pH на единицу против значения, найденного в п. «а».
Решение. После прибавления Na2CO3 происходит связыва-
ние СО2:
N^COs+COa+HaO^SNaHCOa.
В результате этого в растворе будут присутствовать Na2COa
и NaHCOs- Пользуясь приведенной реакцией, нетрудно подсчитать,
что концентрация Na2CO> будет составлять 48,8(0,46 • 10-’),
a NaHCOs 49,5 мг/кг (0,59-10-3 моль/кг), тогда по уравнению
(1-73)
pH=L0,25H-lg 0,46/0,59= 10.15.
Поскольку pH ионденсата определяется отношением х/у, то,
приравняв рН=9.15, нз уравнения (1-73)
9,15= 10^5+lg х/р,
откуда, найдем, что х/у=0,08.
В состоянии равновесия в растворе окажется (х—Стг), моль/кг,
Na3COa и 2Суг, моль/кг, NaHCOe, где Суг— количество растворив-
шейся СО2. В таком случае можем написать равенство
(х—Сут) /2Суг=0,08,
решив которое, найдем Суг=0,б5-10-3 моль/кг или 0.65- 10-э-44-lO3^
=28,6 мг/кг. Итак, при растворении этого количества СО2 pH иов-
денсата снизится с 10,15 до 9,15.
Глава вторая
РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ
2-1. РАСТВОРИМОСТЬ ГАЗОВ В ВОДЕ
Растворенные в воде газы можно разделить на две
категории:
а) химически взаимодействующие как с водой, так и
с некоторыми присутствующими в ней веществами —
аммиак, углекислота;
б) химически не взаимодейств}ющие с водой и со-
держащимися в ней примесями — азот, водород, кисло-
род.
Растворимость химически ие взаимодействующих га-
зов определяется законом Генри
^х=агА, (2-1)
41
(2-2)
где i — индекс газа; а, — коэффициент абсорбции; pi —
парциальное давление рассматриваемого газа над
жидкостью.
Значение ръ если оно неизвестно, можно определить
из уравнения Менделеева — Клапейрона для идеальных
газов, считая на 1 кг воздуха
где Ci — концентрация рассматриваемого газа, г/кг воз-
духа; Vi — удельный объем газа, л/кг; R—газовая по-
стоянная, равная для данного случая 0,082
л-атм/(моль*К); Mt — молекулярная масса данного га-
за, г/моль; Т — абсолютная температура, К.
Отсюда
Qi
C<RT
Cl г a j
‘ Мм
(2-3)
Коэффициент распределения Кр в состоянии равно-
весия равен:
if __Q-10’___AfjoplO1 /о м
ДР— qi aiRT '
ПРИМЕРЫ
2-1. Определить равновесную концентрацию я воде кислорода в
СО2 прн контакте ее с атмосферой (1=293 К, р= 101,31 кПа)
с относительной влажностью 60%.
Решение. Парциальное давление водяных паров р».п при
273 К н влажности 100% составляет 2,34 кПа, а прн влажности
60%—0,6-2,34=1,4 кПа. Следовательно, давление сухого воздуха
рв.с= 101,31—1,34=99,94 кПа.
Парциальное давление данного газа в смеси газов р< можно
определить н из соотношении
А _ ".
Ро Ъ> *
где До — общее давление смеси, равное сумме парциальных дав-
лении
Po=Pi+pi+pi+ +р«;
ло — общее количество молей газов:
Ло=Л1-}-Л24-Л24- ... 4-лп.
Мольнаи доля кис юрода в сухом воздухе /г0 =0,21 (для иде-
альных газов мольная лоая данного газа совпадает с его объемной
долей), тогда р^=0,21-99,91 =21 кПа, ити 21/101,31 =0,207. Под-
ставляя ато значение в уравнение (2-1) и взяв дтв 293 К соответст-
вующую ао (рис. 2-1 [8]), по «учаем =43-0,207 = 8,9 мг/кг.
42
Мольная доля СОд в воздухе составляет 0,03%, и парциальное
давление ее равно:
749,6-3,0-10*
^соа ~ 760
= 2.96.10-*,
а концентрация = 1,6- 1О’-2,96-10_* =0,47 мг'кг.
Этот пример показывает, что содержащаяся в природных водах
СОг имеет своим источником не только воздух, ио и биохимические
процессы, так как концентрация
ее в природных водах значитель-
но выше.
2-2. В закрытый бак большой
вместимости поступает обескис-
лороженная вода с температурой
333 К н выше. Бак сообщается
с атмосферой через вестовую тру-
бу Над уровнем воды в баке объ-
ем <аполнен смесью насыщенного
пара и воздуха.
Определить равновесную
концентрацию кислорода в верх-
нем слое воды при разных ее
температурах.
Решение. Расчет ведем по
методике предыдущего примера.
Результаты расчета сведены в
табл. 2-1.
Опыт показывает, что такие
концентрации кислорода в воде
баков теплофикационных устано-
вок не наблюдаются. Это следует
объяснить замедленным процес-
сом растворения кислорода. Поэто-
му равновесие с газовой средой в б
Рис. 2-1. Зависимость коэффи-
циента абсорбции кислорода
и углекислоты от температуры.
достигается только в верхних
слоях воды, если отсутствует ее перемешивание н длительность кон-
такта воды с этой средой оказывается недостаточной.
2-3. Как видно из рис. 2-1 „ с ростом температуры коэффнпвеит
растворимости цг увеличивается. В связи с этим возникает вопрос»
чему будет равна концентрация кислорода в котловой воде прн
Таблица 2-1
Растворимость и иоде кислорода ноздууа ври разной
температуре в присутствии водяного пара
Т. F давление, 'llfl.IV» “о/ мг/кг Раствори- мость, мг/кг
воздуха пира кислорода
3(3 93 7.9 19,5 33 6,45
323 89 12 ° 18.7 30 5,65
333 80,5 19.7 16,9 28 4,7
343 69 30,7 14,5 26 3,8
353 53 46,5 Н.1 25 2,76
363 Л>,Я 69.2 6,5 21,5 1,58
43
питании барабанных котлов недеаэрнрованной водой. Определить
концентрацию кислорода в котловой воде при разных давлениях и
равновесном состоянии, если концентрация кислорода Соз в пита-
тельной воде равна 6 мг/кг.
Решение. В данном случае воспользоваться рнс. 2-1 нельзя,
так как р, и С,- не известны и не могут быть определены. Поэтому
для решения поставленной задачи используем выражение (2-4) для
коэффициента распределения Кр кислорода между жидкой и паро-
вой фазами, приняв М=32 и /?=0,082. Результаты расчета сведены
в табл 2-2.
Коэффициент распределения кислорода
В котле нри разном давлении
Таблица 2-2
pt, МПа Температура насыщения. К Удельный объем газа V. л/кг Коэффициент абсорбции а оа Коэффициент распределе- ния-10-*
0,2 416 617 27,5 22
0,5 431 321 30,5 9,3
1.0 456 181 35,5 4,4
1.5 473 126 42,5 2,5
2,0 487 97 49 1.5
з.о 508 66 61,5 0,83
4,0 425 51 72 0,53
Так как
Кр ~ Н = ^'п в*
то, решив эти равенства совместно относительно Сж, найдем
Сн.=Спв/(КР+1),
где Сп, С ж, Сив-—концентрация кислорода соответствен-
но в паре, котловой и питательной воде.
Подставив в уравнение (2-4) приведенные данные,
получим:
р„, МПа...... 0,20 0,50 0,10 0,15 0,20 0,30 0 4
Сж, мкг/кг . . . . 0.3 0,6 1,4 2,5 4,0 7,5 11,5
Из этих данных (хотя они и получены без учета не-
которых условий) можно сделать следующие выводы.
В котле происходит глубокая деаэрация питательной
воды. Концентрация кислорода в котловой воде зависит
от его содержания в питательной воде. Степень деаэра-
ции зависит от давления в деаэраторе.
44
2-2. РАСТВОРИМОСТЬ ТРУДНОРАСТВОРИМЫХ ВЕЩЕСТВ
При выпадении в осадок какого-либо трудиораство-
римого вещества с течением времени устанавливается
динамическое равновесие между осадком и раствором.
Оно характеризуется постоянством концентрации этого
вещества в растворе при данной температуре. Произве-
дение активностей ионов труднорастворимого вещества
также постоянно для данной температуры и называется
произведением растворимостей ПР. Для бинарных элек-
тролитов КА оно будет определяться выражением
/7Р1=пкаА=/21СкСА, (2-5)
где ак> ад — активности ионов, г-ион/кг; ft — коэффици-
ент активности однозарядных ионов; Ск, СА —концен-
трации иолов, г-ион/кг.
Для бинарных веществ растворимость, моль/кг, рав-
на концентрации ионов, т. е.
5.=ск=са=-А-/пр;.
Для веществ типа КгА равенство (2-5) будет иметь
вид;
ПР2==С2кСа№, (2-6)
где fz — коэффициент активности для двухзарядиых
ионов.
Растворимость этого вещества равна концентрации
аниона:
S2=CA, тогда Ck=2Ca=2S2
и, следовательно,
nP2=(2S2)2S2f21f2, (2-7)
или
«а=СА = |ХЛ!Д.. (2-8)
Эти же соотношения справедливы и для соединений
типа КА2, если в них катион и аннон поменять местами.
Для соединений типа КзА можем также написать:
и
Отсюта
Ск=3 CA=3S з
nP3=(3S3)3S3f3J3.
(2-9)
(2-9а)
45
Для веществ типа К»АП
аткапА=/ткСтк^АС’'А=ПР7П.
В этом случае
S^C^Im^C/Jn
и
Сг=—С.; С.=—Ск.
К п А ’А т К»
Отсюда
»и+л ' пр ~
S”= |/ ГкГа’^п"’ (2'10)
С '—"i"/ ПР"1'1”' (2-11)
*“ ]/ V**’ ’ ’
т+п ПР тп
Ск= 1/ <212>
ПРИМЕРЫ
2-4. Определить жесткость воды, содержащей CaCOj в количе-
стве, отвечающем равенству
аса,+,’ео|- ’Сса,+Ссо’- = ПРсаСО, •
Решение. Таи как С .. = С_« , то
Са + СО—
ССа’+"|/^7.7^. С2'13»
и жесткость, мг-экв/кг, равна:
< 40ССа,+ -10«
Жа~ 20 •
Для 298 КПРСаСО1 = 4,8-10-’, тогда, приняв ft= 1,0, получим:
^CaCOi = ^Са’+ ~ ^СО2— ~ ^4,8-10“’ -0,69-10“* Моль/кг.
Как следует нз табл. 1-1, при этой концентрации соли действи-
тельно fs= 1,0. Следовательно,
40-0,69-10-*-10я
-------------- 0,14
20
мг-экв/кг;
= 0,69.10“4-100.10’= 6,9 мг/кг.
46
2-5. Определять жесткость содоизвесткованной воды, обуслов-
ленную СаСОз и Mg(OH)j при следующем ее составе, мг-экв/кг:
СИв+=9.0; СС1-=5.0; = 3.5; 1.0; ^.=0,5.
Решение. Для воды такого состава необходимо учесть коэф*
фнциент активности, для отыскания которого находим вначале ион-
ную силу раствора
1 ( 3»5 1 \
Р-=“2' ( 5‘р + “Г2* + 9’ р + ~’2> +0,5.1’Ь10-’ =
= 1,175-10-«.
Этому значению р по таб1. 1-1 соответствует f, я-0,62. Для
нахождения мы не можем воспользоваться уравнением (2-13),
так как С&»+ ф • ^ля этого случая концентрацию кальция
находим из соо ношения
По условию 6^2— = Ю-1 г-ион/кг, тогда
ССа*+ = 0,62».0,5-10-’ = 2’52'10 В г-нон/,кг
г.бг-ю-’ло-ю1
-------гт:----0,05 мг-экв/кг.
Если бы концентрация СОз1- соответствовала условиям приме-
ра 2-4, т. е. была равной 0,69-10-* г-нон/кг, то жесткость воды со-
ставила бы по уравнению (2-13) 0,36 мг-экв/кг. Следовательно,
увеличение концентрации одноименного иона (в данном случаеСОз-)
изменяет содержание в пробе другого иона (Са’+).
Остаточная концентрация магния равна:
nPfrig (ОН), _ 5,5-10“** ~
CMg’+ = PJat’oH- 0.89* 0.62 0.5’-10-' =(1-43-10-’ г-иоя/кг.
По условию Сон- =0,5-10-* г-ион/кг, тогда
^Mg-
0,4510-».24-10’
12
= 0,09 мг-экв/кг.
Таким образом, теоретически общая жесткость известкованной
воды для приведенных условий равна 0,14 мг-экв/кг, в то времн
как в действительности на реальных установках она составляет
0,3 мг-экв/кг. что объясняется пересыщением воды СаСОз п
Mg(OH)2 и другими явлениями.
47
2-6. Определить карбонатную щелочность известкованной воды,
получающейся нз исходной воды следующего состава, мг-экв/кг:
жесткость кальциевая 3,6; магниевая 1,1; щелочность общая Ща=
= 3,1; концентрация ионов, мг/кг:
Ccr = l05; Cs02_120; = 69; Ссо> = 10, мг/кг;
Расчет следует произвести для двук режимов известкования (без
коагуляции) — гидратного н карбонатного.
Решение. По первому режиму количество Ся(ОН)а мг-экв/кг,
рассчитывают с учетом магния, т. е.
/?*ИЗ = Що + 7Л Mg +i-^COa “Ь
Следовательно, в этом режиме магний удаляется из воды и за-
меняется кальцием.
По второму режиму количество извести дается только на нон
НСО^. т. е.
Л"иЗ = Шс 4“ + аН>
где ,ЖС0 — концентрация свободной СОг,£равная для данного случая
10/22-^/0,45 мг-экв/кг; ая — избыток Ca(OH)i, принимаем 0,3.
Концентрация кальция, мг-экв/кг, в известкованной воде равна:
для первого режима
С'с/+- - Щи + ЖМв 4- аи = 3,6 - 3,1.4- 1.1 4- 0,3 = 1.9;
для второго режима
с"1+= ,жСа - Що 4- а, = 3,6 - 3,1 4- 0,3 = 0.8.
Ионная сича известкованной воды.равна:
1 /105 120 69 1,9 \
н=ТГ (.ИЛ+ 9Г2’ - ЙГ * + -Т = 7’38'|0--
чему соответствует /2=0.68, тогда по уравнению (2-14) найдем (для
298 К)
„ 4,8-10’»
С'со2-~ 0,62s-0,95-Ю“» = bOS-lO \ г-ион/кг,
или 1,09-2-10-ь-103^0,022 мг-экв/кг;
4,8.10- =
Ссо|--0,62!0,410-а — 2’610 'г-ион/кг.
илн 0,052 мг-экв/кг.
Гакнм образом, в идеальных условиях карбонатная щелочность
известкованной воды не должна была бы превышать 0,06—
0,07 мг-экв/кг. В действительности же на промышленных установках
(при аналогичный условиях) она составляет 0,5—0,6 мг-экв/кг. Как
результат этого нередко имеют место отложения СаСОэ по пути
течения известкованной воды, в том числе н на механических фильт-
рах. Одним нз способов борьбы с этим явлением является подкисле-
48
нве известкованной воды, которое требует, однако, тонкого и надеж-
ного дозирования кислоты.
2-7. Прямоточный котел-утилизатор с давлением пара 3,9 МПа
должен питаться водой следующего состава, мкг-экв/кг: жесткость
кальциевая 10,0; магниевая 15,0; щелочность карбонатная не более
400; гидратная не более 200; концентрация ионов, мг/кг:
Сс. =302'°: CsoJ- = 2W!-0: С№? = 35Л ска+=294-
Котельный агрегат вырабатывает насыщенный пар с влажиостькь
20%. В связи с этим возникают следующие два вопроса;
1. Будет ли выпадать в котле СаСОд или Са5О<?
2. Нужно лн ввести фосфатирование питательной воды?
Решение. Произведение растворимости прн 523 К для указан-
ных соединений равно:
ПРсаСО^4.12*1»"*. 0,38.10-’.
Наиболее вероятным местом выпаденнн этик веществ является вы-
ходная зона котла, где котловая вода упарнваетси в 5 раз.
Ионная сила раствора равна.
I /302 202 , 294 35,4 \
н =Т (з53 |г+-№ Г2!+Тз1,+ -ЙГ1*)6-1°- =
= 76,0- 10-а моть/Кг.
По табл. Ы находим интерполяцией fe^0,38. Выпадеиве в оса-
док СаСО, и CaSO* не произойдет, если произведение действитель-
ных концентраций нонов Са2+, SO2-, СО2 будет меньше или
равно произведению растворимости, приведенному выше для
=523 К- Действительные концентрация накипеобразующих ионов-
будут равны:
10-10-«-20-5 „ .
С^ац. = -----щ----— — 2,5-10-8 г-ион/кг;
so^—
400.П’-'-ЗО-Б
60
202-40-10-^.5
96
= 1,0-10~8 г-ион/кг;
= 5,0-10_* г-ион/кг.
С =
тогда
/>аСса^Ссо? = 3>6'1С ‘,<4’ 12‘ 10"‘:
^»CCa!+Cso!- =>.810-,<3.8-10-.
и, следовательно, выпадение в котле СаСОз мало вероятно
а СаБОч — невозможно. В этих условиях фосфатирование питатель-
ной воды для рассматриваемого случая нецелесообразно и даже
вредно, если ввод фосфатов будет вызывать выпадение гидрокенл-
апатита или фосфорита.
4—209 . 49
1-3. кондуктометрический контроль концентрации
РАСТВОРИМЫХ ВЕЩЕСТВ
При определении малых концентраций растворен-
ных веществ наряду с другими применяется и кондукто-
метрический способ, использующий зависимость элек-
тропроводности данного раствора от концентрации элек-
тролита. В основе этого способа лежат приводимые ни-
же соотношения, использование которых в эксплуатаци-
онной практике нередко является необходимым для по-
лучения расчетным путем требуемых данных или инте-
ресующей информации.
Электросопротивление Rs проводников прохождению
тока определяется известной формулой.
где р — удельное сопротивление. Ом-см; х— удельная
электропроводность, равная 1/р, ОьН-см-*; £, S — дли-
на, см, н площадь сечения проводника, см2.
Кроме удельной, различают еще эквивалентную
электропроводность %, характеризующую проводящую
способность всех ионов, образующихся из одного экви-
валента электролита в данном растворе. С разбавлени-
ем раствора £ увеличивается и достигает предельного
значения, которое называется эквивалентной электро-
проводностью при бесконечном разбавлении 10,
Ом~’-см2-г-экв_|. Если раствор содержит т], г-экв/см3,
растворенного вещества, то
х=1]Хо. (2-16)
Обозначив концентрацию вещества через Сг мг/л,
можем написать:
C=i]3 10е,
где Э — эквивалентная масса
Отсюда
_ С
1 — 3.10е •
Подставив это значение в уравнение (2-16), полу-
чим:
(2-16а)
Электропроводность воды может обусловливаться не
только ионизованными в растворе солями, но и раство-
50
репными газами С02, 1\|Н3, образующими ионы НСО_3>
СО2-з. ОН-, Н+, NH-4, что, естественно, вносит искаже-
ния в результаты измерения солесодержаиия чистой во-
ды. Для таких вод, содержащих указанные газы, удель-
ную электропроводность можно подсчитать по формуле
(2-166)
где /< — подвижность t-ro ноиа, Ом_,*см2«г-экв-1.
Для следующих ионов подвижности при бесконечном
разбавлении 10 при /=298 К имеют следующие значения
[91:
Н+ HCCTf 1/2 cog- NH* ОН- Ма+ С1-
349,7 44,5 72 73,4 200,0 50,1 76,32
На рис. 2-2 [9] представлен график, позволяющий
находить концентрацию <усо и и по значению </n и pH
конденсата или новое значение </n по новому pH.
51
Соответствующая концентрация NaCl (SNaa), мг/кг,
может быть определена из равенства
(zNa+ +zc,-) = 10-’ (50,1 + 76,32) =
= 2,16 10“'SNaCl, Ом-1 • см-*,
откуда
5«аа=-2^10’- (2')7)
Солесодержаиие Зиаа является условным, оно опре-
деляется нередко для внесения исправлений в показа-
ния солемеров, градуированных в мг/л по NaCl.
ПРИМЕРЫ
2-8. Определить удельную электропроводность к н электросопро-
тивление чистой воды.
Решение. Обозначив концентрацию аоиов Н+ и ОН- через
С', г-ион/л, и использовав выражение (2-16), найден. r)=C'/10s;
х=C'Ao/10s. Эквивалентная электропроводность прн бесконечном
разбавлении Kq равна сумме нонных электропроводностей ^—1+4-
4-Л-. тогда
где концентрация С' — Сн+*= — У Кв и значения А+ и за-
висят от температуры: Х±=Х0> [1+вх (<— 291)]- При 291 К Ха,+=
= 316,2 и= 173.R; «57=1,57-1О-’н<х?н=1,81О-«. Испоть-
зова в значения aj,, можно найти значения Л+ и Л_ я вычислить х.
Результаты расчетов сведены в табл. 2-3.
Таблица 2-3
Значение ионных ц удельной электропроводностей н
электросопротивления чистой воды при рнзных температурах
Г. к кя 10" ХН+’ Ом"’ см1 ХОН-’ Ом"’ см* » 10". Ом-1 см-1 р 10*, Ом-см
283 0,36 275 151 0,026 38,5
291 0,74 315,2 173.8 0,04 25
293 0,86 324 182 0,047 21,3
295 1,0 334 189 0,052 19,3
298 1,27 349,8 198,0 0,0498 18,2
2-9. Столб конденсата высотой 30 см и диаметром 1 см имеет
электросопротивление 2,5-10® Ом. Определить солесодержаиие этого
конденсата в пересчете на NaCl и удельное электросопротивление р.
52
Решение. Для разбавленных растворов (типа конденсатов)
можно использовать выражения (2-15) и (2-16а) и написать:
L3-10’
sa,
откуда
£3-10’ L3
С== SR^= SR’j*» &
где Л\=/?а/10* МОм.
Для растворов NaCl прн 291 К 108,4, а 3=58,5. Тогда
. ди-оо,о
С —0,785 2,5-108,4 = 8’35 мг'
Из уравнения (2-15) найдем
Если в уравнение (2-9) подставить значение /?в, определяемое
формулой (2-15), получим:
Эта формула позволяет с достаточной для практики точностью
быстро определить солесодержание разбавленного раствора, если
известно р.
Значение С нередко выражают в виде концентрации какого-либо
вещества, чаще всего NaCl. В этом случае солесодержание является
уставным С7. Следовательно, в пересчете на NaCl Ст будет равно:
Су=58,5/108,4р'=0,54 /р'=0,54х',
(2-20а)
где р'— удельное сопротивление, МОм-см.
Электросопротивление раствора RB пропорционально удельному
сопротивлению:
Ra=kp,
где k—постоянная датчика, зависящая только от геометрии элек-
тролитической ячейки.
Поэтому, измерив Ra и знай k, можно найти и р. Значение k
может быть определено и расчетом для датчиков следующих про-
стейших конфигураций.
Ячейка, ограниченная двумя концентрическими сферами с ра-
диусами Т1 и г2:
fe = -7-?-----
471Г, — гг
Ячейка, ограниченная двумя коаксиальными цилиндрами-элек-
тродами радиусами п и г2 длиною I: fe=ln (r5/ri)/(2n/).
Параллелепипед с расстоянием между электродами I и пло-
щадью электродов З'вл: k=l/Sna.
53
Электроды — два шара радиусами л и г2, находящиеся в не-
ограниченной жидкости на расстоянии I (г|«С(3>га):
Электроды — два цилиндра радиусами г» длиной L, находящие-
ся в неограниченном объеме жидкости на расстоянии I
fe^in ал)/(л£).
2-10- В отобранной пробе конденсата, охлажденной до 298 К,
анализом было определено, мкг/кг:
с№+=6(1; Са-=46’3: Cso2- = 62-5: ссо, = -™>-
Найти удельную электропроводность этого конденсата, в том
числе обусловленную СО2-
Решение. Комбинируя ионы, найдем, что в данной пробе
растворено: NaCl—76,5 н Na2SO4 — 92,0 мкг/кг, а общая концен-
трация солей составляет 168,5 мкг/кг, т. е. 45,4% NaCl н 54,6%
Na2SO*.
Как показывает опыт, если общая концентрация раствора ^2—
3 г/кг, расчет проводимости смеси электролитов может производить-
ся (с точностью до 10%) по формуле
Хсм(Х1Х1+х2ч2+ ... -4-xtxO• 10-1, (2-21)
где Хен, х, - удельная электропроводность соответственно смеси
солей и раствора каждой из солей, присутствующих в смеси, прн
концентрации ее, равной общей концентрация смесн; Xi, Ха, х» —
процентное (массовое) содержание компонентов смесн.
Следовательно, в нашем случае
*см = 0,454хМас1 + ®>®^®*NasSO1-
Для конденсата применимо выражение (2-20), тогда
ММ0-1 108,4.0,163 Л 1Л . Л
*NaQ -------3------- 58,5-10» - = 0.310.10-” Ом-’-см-’;
111,16-0,168 Л Л ,
XNe0SO, — 71,0-10* —0,275-10 Ом~ -СМ“
н
= (0,454-0,31 + 0,546-0,275)-10-* = 0,29-10“’ Ом-’см-1.
При 298 К
= £' 11 + «х(Г-291у =
= 0,29-10-* [1 + 0,0230(298— 291) ]= 0,34-10-’ Ом-’-см-1.
В пределах от 273 до 303 К значение ах можно принять для со-
лей 0,023, кислот 0,017, щелочей 0,019.
Этот пример можно решить н другим путем, используя форму-
лу (2-18). Подставив в нее концентрацию нонов, г-ион/л,
CNa+ = 2 62-10-’; Сс1 = 1,31-10-*; 1/2CSQ?_ = 1,31 .Ю"*
54
н их подвижности, Оад-’-см1, ^Nb+ ^52; Аа —79; 0,5Ascj2_ = 83,
потучим;
2Э8 (2,62-52+ 1,31.79+ 1,31-83) ot_ f
~”-----------io------------- -10“’-=0,35-10-' Om-'-cm1.
Электропроводность, обусловленную присутствием в пробе COj,
с достаточной для практики точностью можно определить по фор-
муле [10]
^□,=0.96 к Сад-10--. (2-22)
где Сс01 — массовая концентрация СОа в растворе, мг/кг
Подставив CCq =5,0, лотучим х^* = 2,16-10~в Оу-'-см-',
а при 298 К
= 2,16-10’®[1 +0,0170(298 — 291)] =3,4-10-' Ом-’-см"1.
Общая электропроводность раствора
«^ = «’“ + ^=3,74-10-' Ом-.см-1.
Этот пример показывает, что присутствие в конденсате СОа
сильно искажает результаты кондуктометрических измерений. По-
этому при измерении электропроводности разбавленных растворов и
конденсатов следует предварительно удалить растворенную COS ки-
пячением.
2-11. В отобранной пробе конденсата анализом быти определены
концентрации следующих веществ, мг/кг: CNa+ = 1.2; ^С1- = 1.85;
CNII =1,0. Определить удетьную электропроводность раствора при
температуре пробы 29S h.
Решение. Концентрация NaCl составляет Зо05 мг/кг, тогда
CQI 108,4-3,05-10“' „ Л Л
*NaCi“ 58,5 — 5,65-10- Ом-1-см .
Электропроводность, обусловленная присутствием в конденсате
NH4OH, олределяетсн по формуле [10]
х^ = [7,56 |rCNlu +0,073 — С,05] 1О’«.
Подставив CNH =1 мг/кг, потучим х^ц =5,75- 10-вОм“,-см-'.
После пересчета на Г =298 К (^Н' = 0,0193. aJaCI = 0,0226)
потучим: *№cj = 8,9-10-1 Ом-’-см-1; х^^=6,55-10"* Ом-’-см-1.
Из расчета следует, что наличие аммиака в пробе конденсата
вносит сильное искажение в результаты определения электропровод-
ности. На практике аммиак перед измерением электропроводности
удатяется кипячением или Н-катионнрованием (в последнем случае
в результаты измерения вносится поправка на повышенную проводи-
мость нона Н+).
55
2-12. Определить концентрацию углекислоты, растворенной
в конденсате, и электропроводность конденсата, содержащего COj н
NH3, если концентрация NH3 составляет 1000 мкг/кг и pH = 7,5.
Решение. Расчет ведем с использованием рис 2-2. На осн
ординат находим точку, соответствующую концентрации аммиака
qtJ, равной 1 мг/кг, от нее ведем горизонталь до пересечения с пря
мой, соответствующей pH =7,5. Отсюда прокладываем вертикаль
также до пересечения с прямой pH=7,5» после чего по горизонтали
слева на ординате находим значение электропроводности.
Пересечение вертикали с осью д'со дает концентрацию угле
кислоты Следуя этой схеме расчета, находим Ссо2=2,7 мг/кг, х—
=6,55-10~в Ом-1-см-1. Соответствующее этому значению условное
солесодержанне по NaCl составляет 3,17 мг/кг. Характеризуемое
этими данными качество конденсата — весьма посредственное.
Глава третья
ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ
3-1. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Содержание вещества в определенном объеме или
массовом количестве раствора называется его концен-
трацией. Способы выражения концентрации растворов
могут быть различными, в водоподготовке наиболее ча-
сто применяются следующие.
Проценты по массе См, %, которые показывают мас-
су вещества в 100 единицах массы раствора:
с"=т^-,0°- (З-1)
где V —объем раствора, л; qB — масса вещества, раство-
ренного в объеме V, г; рр— плотность раствора, г/см3.
Объемная концентрация Со, г/л, показывает содер-
жание вещества в единице объема раствора. Объемная
концентрация может быть определена по формуле
Co=qB/V. (3-2)
Молярная концентрация Смл, гмоль/л, показывает
количество грамм-молей данного вещества, растворен-
ного в литре раствора. Для вычисления Смл необходи-
мо количество граммов находящегося в литре вещества
разделить на молекулярную массу М этого вещества.
Смл=Со/М=^в/ (VM) - (3-3)
В водоподготовке чаще концентрацию веществ, со-
держащихся в природных водах, конденсатах и паре,
выражают количеством чпллиграмм (микрограмм) -эк-
56
внвалентов в килограмме раствора. Так как эти воды
являются разбавленными растворами, то практически
численные значения мг-экв/л и мг-экв/кг одинаковы. Эк-
вивалентом Э данного вещества называется количество
его массы, соответствующее в данной реакции единице
валентности, т. е. одному атому водорода или другого
одновалентного элемента. Для определения значения Э
необходимо молекулярную массу вещества разделить на
его валентность в данной реакции:
Э=М!п.
(3-4)
Значение эквивалента, как правило, не является по-
стоянным числом, так как зависит от типа реакции. Та-
ким образом, чтобы выразить концентрацию раствора,
например, в миллиграмм-эквнвалентах на литр, необхо-
димо количество растворенного в литре раствора веще-
ства, выраженное в миллиграммах, разделить иа его
эквивалентную массу.
_ Со- Ю’_ <7в-10*
Э *
(3-5)
Поскольку в системе СИ основной единицей являет-
ся килограмм, а также если учитывать, что концентра-
ция веществ в паре котлов относится к килограмму,
в дальнейшем концентрации водных растворов будут
относиться также и к килограмму. Для разбавленных
водных растворов, к которым относятся и многие при-
родные воды, отнесение результатов к килограмму или
литру не вносит существенных неточностей в техниче-
ские расчеты. Однако в практике химических лаборато-
рий нлн при других точных расчетах их результаты сле-
дует относить к литру или вводить в расчет плотность
раствора при отнесении к килограмму.
3-2. ЖЕСТКОСТЬ
Жесткостью называется суммарное количество со-
держащихся в воде катионов кальция Са2+ и магния
Mg2+, выраженное в миллиграмм-эквивалентах в кило-
грамме или лнтре нлн микрограмм-эквивалентах в ки-
лограмме илн литре. Для измерения малых значений
жесткости, которыми обладают конденсат, дистиллят,
питательная вода паровых котлов н катнонированная
вода, применяется микрограмм-эквивалент в литре.
57
По отношению между общей жесткостью воды Ж9 и
концентрацией в ней ионов НССГ" природные воды можно
разделить иа две группы: для одной JKO^C , для
нсоз
другой Ж><^нсо_ В водах первой группы различают
жесткость общую Жо* карбонатную Ж. = С , некар-
Н00Г
бонатную 2^uk» кальциевую /¥<Са и магниевую
Между ними существует следующая зависимость:
Ж^Жк+Ж^Ж^+Ж^-
Для вод второй группы, которые называются щелоч-
ными, понятие карбонатной и некарбонатной жестко-
сти теряет смысл, посколькуС Жо. Для этих вод
НС°3
следует различать жесткость общую, кальциевую и маг-
ниевую, а также щелочность. При расчетах процессов
умягчения воды осадителями внутри н вие котла, а так-
же других процессов водообработкн для щелочных вод
следует условно принимать Жк—Жо\ Жнк=О, учитывая
избыточную концентрацию ионов НСОГ.
Мягкие воды (умягченная питательная, конденсат
н др.) обладают лишь общей или остаточной жестко-
стью Жо. Следует обратить внимание на то, что присут-
ствие в воде соединений натрия не придает ей жест-
кости.
На практике часто приходится определять жесткость
смеси двух или нескольких потоков воды. Например,
в конденсаторы паровых турбин через неплотности про-
никает жесткая охлаждающая вода, вследствие чего
жесткость конденсата увеличивается. В этом случае бы-
вает необходимо установить размер присоса, т. е. коли-
чество проникающей в конденсатор воды. Решение по-
добного рода задач основывается на следующих равен-
ствах:
Жск=Ж'оа-^Ж"^ а+6=1,
где ЖсМ — жесткость смесн; Ж'а, Ж"о — соответственно
жесткости первого и второго потоков; а, b — соответст-
венно значения первого н второго потоков, выраженные
в долях единицы
56
ПРИМЕРЫ
3-1. Требуется приготовить раствор жесткостью 500 мкг-зкв/л.
Определить, сколько необходимо для этого растворить в 1 л бнди-
стиллята MgSO*-7H2O или СаС1-6НгО.
Решение Чтобы получить указанную жесткость, необходимо
внести в 1 л би дистиллята 6,08 мг магния или 10,02 мг кальция.
Масса молекулы MgSOb-7H2O равна 246,49 мг, а СаС12-6НгО
219 мг. Навеска, следовательно, равна:
6,08 [MgS04-7H20]
[Mg] ’
10,02 [CaCl-6Hg0j
PCa — [CaJ
Следует обратить внимание из то, что в расчет входит и кри-
сталлизационная вода. Поэтому, если реактивы потеряли часть кри-
сталлизационной воды, навеска окажется неточной. Поэтому после
приготовления раствора его жесткость необходимо проверить.
3-2. Жесткость исходной воды составляет 4 мг-экв/кг, а ^Са«+=
= 60 мг/кг. Определить магниевую жесткость н концентрацию маг-
ния в воде
Решение. Общая жесткость определяется соотношением
W - ж Сс-,+ .|_С«е,+
^О— '*«Ca“r'”Mg — 20,04 г- 12,16 ’
Из этого равенства находим Жме=4—3=1 мг-экв/кг. Следо-
вательно, Смк^12 мг/кг.
3-3. Качество исходной воды характеризуется следующими дан-
ными: Жо— 5 мг-экв/кг; Жнк=2 мг-экв/кг. Определить Жса, Ж-
и Жме, если Жо/Жмв==4.
Решение Карбонатную жесткость находим нз равенства
Жк=Жо—Жнк = 5—2—3 мг-экв/кг; Жми=Жо/4—1.25 мг-экв/кг,
тогда кальциевая жесткость равна Жсл—Жо—Жмв=5—125=
=3,75 мг-экв/кг.
задачи
3-1. В 1 л дистиллированной воды растворено,
мг-экв: СаС12— 2; MgSO4— 1,5; Na2SO4 —0,7; NaCl —
1,2. Определить общую и карбонатную жесткость рас-
твора.
3-2. В 1 л дистиллированной воды растворено 1,23 мг
MgSO4-7H2O. Определить жесткость раствора.
3-3. Сколько миллиграммов MgCl2-6H2O следует рас-
творить в 1 л дистиллированной воды, чтобы получить
раствор жесткостью 10 мг-экв/л?
3-4. Жесткость раствора сернокислого магния равна
10 мг-экв/л. Сколько миллилитров этого раствора необ-
ходимо взять, чтобы приготовить 1 л раствора жестко-
стью 25 мкг-экв/л?
Ответ: 2,5 мл.
53
3-5. Определить магниевую жесткость воды, если
концентрация в ней катиона кальция составляет
60 мг/л. а общая жесткость ее равна 4200 мкг-экв/л.
Ответ: Жмв=1,2 мг-экв/л.
3-6. Жесткость питательной воды равна 10 мкг-экв/л.
Сколько граммов СаО содержится в 1 м3 этой воды?
3-7. При кипячении исходной воды ее жесткость сни-
жается за счет разложения бикарбоната кальция по ре-
акции
Са (НСО3)^СаСО3+СО2+Н2О.
Определить количество выпадающего в осадок СаСОз
из 10 л воды, если жесткость ее прн кипячении снизи-
лась на 2,3 мг-экв/л.
Ответ: 1,15 г.
3-8. Определить количество СО2, стехиометрически
необходимое для растворения 100 г СаСО3. Растворение
протекает по реакции
СаСО3+СО2+Н2О—>Са (НСО3)2.
3-9. Можно лн получить жесткость воды, равную
3,5 мг-экв/л, путем растворения СаСО3 в дистиллиро-
ванной воде комнатной температуры?
3-10. Какова жесткость насыщенного раствора
Mg (ОН) г и СаСО3 в дистиллированной воде прн темпе-
ратуре 298 К, если произведение растворимости соот-
ветственно равно 5-10—’2 и 4,8- 10-э?
3-11. Жесткость конденсата турбины возросла с 3 до
10 мкг-экв/л. Определить увеличение присоса охлажда-
ющей воды, жесткость которой равна 5 мг-экв/л.
Ответ: 0,14%.
3-12. В практических условиях при определении при-
соса /7В обычно бывают известными жесткость конден-
сата начальная и конечная (после возникновения
присоса) Жн, а также и жесткость охлаждающей воды
Жо.в. Вывести формулу, выражающую зависимость меж-
ду этими величинами и позволяющую определить Пъ.
Ответ: /7В=[(ЖК-ЖВ)/(ЖО.В-ЖН)] 100
3-13. Построить графическую зависимость допусти-
мого присоса /7С от жесткости охлаждающей воды.
Жесткость конденсата принять: начальную 2 и конеч-
ную 5 мкг-экв/кг.
60
3-14. Отношение эквивалентных количеств в исходной
воде Ссв#+/Снсо_=б; кальциевая жесткость
=- С ,. мг-экв/л.
Са +
Определить общую и магниевую жесткость воды, если
некарбонатная жесткость равна Жш, мг-экв/л.
Ответ: Ж0=(МСа/б)+Жнк; Жив=Ж>—Жса-
3-15. Жесткость известкового раствора составляет
45 мг-экв/л. Найти концентрацию Са(ОН)2, г/л.
3-16. Загрязненность технической поваренной соли,
применяемой на водоочистках, соединениями кальция и
магния контролируют обычно путем определения жест-
кости 10%-ного раствора. Определить процентное со-
держание СаСЬ в технической поваренной соли, если
жесткость 10%-ного ее раствора плотностью 1073 кг/м3
равна 13 мг-экв/л.
Ответ: 0,93%.
3-17. Вывести формулу для определения процентного
содержания В в технической поваренной соли загряз-
няющих ее соединений кальция и магния по следующим
данным: жесткость р%-ного раствора Жр, мг-экв/л;
плотность раствора рр, кг/см3; эквивалентная масса за-
грязняющего соединения Э.
Ответив •/,-
3-18. Необходимо приготовить 2 л раствора, имеюще-
го жесткость соответственно магниевую 3 и кальциевую
7 мг-экв/л. Определить, какое количество MgC12-6H2O
и СаСЬбНгО необходимо растворить в указанном объ-
еме воды, чтобы получить раствор с заданной жестко-
стью.
Ответ: MgCls - 6H2O=609,73 Mr;
CaCl‘6Н2О=1534 мг.
3-19. При одном из анализов были получены следу-
ющие данные, мг-экв/л: а) Жо~1 и Жк=3,5; б) Жо~
=4,2 и Ж,=0.7; в) Ж>=0,010; г) Ж>=0,003. Этн дан-
ные характеризуют различные воды, пробы которых ото-
браны на водоочистке. Можно лн сказать, качество ка
кпх вод водоочистки характеризуют приведенные дан-
ные?
61
3-20. Анализ сырой воды содержит следующие дан-
ные: Л<о=4,45 мг-экв/л; Жса=0; ?KMg=4,45 мг-экв/л;
См«о=70 мг/л. Можно ли верить этому анализу? Дать
мотивированное объяснение.
3-21. В лабораторию доставлена проба прозрачной
артезианской воды, в которой требуется качественно
определить наличие кальция. Можно ли это сделать,
если из реактивов имеется только бикарбонат иатрня?
3-22. В пробу воды с карбонатной жесткостью
3,5 мг-экв/л был добавлен раствор соды, приготовлен-
ный в лаборатории. Выделения карбоната кальция не
последовало. Выяснение этой аномалии вскрыло ошиб-
ку, допущенную при приготовлении раствора. В чем она
могла заключаться, если учесть, что приготовленный
раствор действительно был щелочным, а не жестким?
3-3. ЩЕЛОЧНОСТЬ
Щелочностью воды называют общее содержание ве-
ществ, обусловливающих при диссоциации или в резуль-
тате гидролиза образование ионов ОН-, вступающих
в реакцию с сильными кислотами, т. е. с ионами Н+
Расход кислоты выражает значение щелочности воды.
Обычно в природных водах щелочность вызывается
присутствием в них ионов НСО-, SiO2- и реже СО2~, а
также присутствием гуматов. В щелочных и котловых
водах, кроме перечисленных веществ, щелочность обу-
словливается также присутствием ионов РО3”, НРО2~ и
непосредственно ионами ОН-. Процесс определения ще-
лочности заключается в постепенном добавлении к от-
меренной порция воды 0,1 н. или 0.01 и. раствора кис-
лоты (обычно серной млн соляной). Перед этим к воде
прибавляют тот или иной индикатор. Изменение окрас-
ки раствора свидетельствует о достижении такого зна-
чения pH, которое отвечает интервалу перехода цвета
данного индикатора. В этот момент прекращают добав-
лять кислоту н отмечают, какое количество ее было из-
расходовано на нейтрализацию щелочности. Чаще всего
в качестве индикаторов для определения щелочности
воды пользуются метилоранжем и фенолфталеином; по-
этому различают щелочность по метилоранжу Щы, назы-
ваемую также общей щелочностью, н щелочность по фе-
нолфталеину Щф. Между этими величинами имеются раз-
бег
личные соотношения в зависимости от характера щелоч-
ности. Так, если анализируется раствор едкого натра, то
если раствор соды, то Щф~Ъ,ЫЦп\ если рас-
твор содержит только бикарбонаты, то и т. д. Ру-
ководствуясь соотношением между и Щы, можно
определить, какими именно соединениями обусловлена
щелочность данного водного раствора. Однако часто для
решения этой задачи требуются и дополнительные сведе-
ния, в частности необходимо знать концентрацию ионов
SiO^“" или HSiO~, знание содержания гуматов, фосфа-
тов и т. д.
Если в воде могут присутствовать из щелочных со-
единений только гидраты, т. е. NaOH, Са(ОН)2 или
Mg(OH)s, затем карбонаты Na2CO3, СаСО3, MgCO3 и,
наконец, бикарбонаты, т. е. NaHCO3, Са(НСО3)2 и
Mg(HCO3)2, то, обозначив эти щелочности соответствен-
но через Щг, Щк и Що, можно написать следующие
уравнения;
Так как в воде бикарбонаты н гидраты взаимно ней-
трализуются:
NaOH+NaHCO3==Na2CO3+H2O,
то система уравнений распадается на две самостоятель-
ные:
первая система
Ш^Шг+0,5Щк; 1
ЩО=ЩЫ = ШТ+ЩК J
относится к тому случаю, когда в воде отсутствуют би-
карбонаты и когда Щф^0,5Щм‘,
вторая система
J
соответствует тому случаю, когда присутствуют бикар-
бонаты н отсутствуют гидраты; прн этом £Цф<0,5Щм.
Все возможные варианты Щг, Щк и Щъ представлены
в табл. 3-1, в которой даны также и формулы для вы-
числения этих величин исходя из значений Щф и /Дм
Конечно, соотношениями, приведенными в табл. 3-1,
можно пользоваться лишь тогда, когда щелочность за-
63
Таблица 3-1
Варианты систем, состоящих только из гид ратной,
карбонатной и бмкврбонатной щелочностей
Соотношение между '"ф " 'Ч„ "‘к ц'б
Щф>0.5 1Д„. 2 2 Нет
Щф = 0,5 Щк Нет Нет
Щф<0.5 Щ„ Нет 2 Щф Щ„ —2 Щф
Щф = Щ» Нет Нет
Щф = 0, Щм>0 Нет Нет щ«
ведомо обусловлена лишь гидратами или бикарбоната-
ми и карбонатами. Соотношения существенно усложня-
ются, если присутствуют также фосфаты, гумматы и си-
ликаты.
ПРИМЕРЫ
3-4. Карбонатная щелочность известкованной воды равна
0,4 мг-экв/кг. Определить избыток в воде Ca(OH)t, если общая ще-
лочность ее составляет 0,7 мг-экв/кг.
Решение. При отсутствии гумматов 1До=Щг-\-Щк- Следова-
тельно, (oHj#= Щг=0,7—0,4 =0,3 мг-экв/кг.
3-5. В 5 л бидистиллята растворили 0,4 г NaOH в 265 мг
№зСОз- Определить значение н характер щелочности раствора
Решение. Поскольку в растворе содержатся только ионы
ОН- и CO*g, то общая щелочность состоит из гидратной и карбо-
натной Вначале определяем концентрацию растворенных веществ
в лктре Скаон = 400/5=80 мг/л; б*^СОл =265/5=53 мг/л, после
чего 2Z/r=80/40=2 мг-экв/л, Жи=53/53=1 мг-экв/л.
3-6. Щелочность пробы конденсата пара после кипячения снизи-
лась за счет отгонки аммиака с 240 до 50 мг-экв/кг. Определить
количество отогнанного аммиака.
Решение. В паре котлов нередко присутствует аммиак, кото-
рый при конденсации пара переходит в раствор
nhs+h2o^nh4oh
и повышает его pH. Приведенная реакция, если пробу конденсата
прокипитить некоторое время, идет справа налево. Эквивалентная
масса аммиака составляет 17. и количество отогнанного аммиака
будет равно: (240—50)-17=323 мг/кг.
ЗАДАЧИ
3-23. Требуется приготовить 3 л раствора, щелоч-
ность которого должна быть: карбонатная 3 и бикарбо-
натная 2 мг-экв/л. Определить количество карбоната и
64
бикарбоната натрия, которое необходимо растворить
в указанном объеме.
3-24. Известкованная вода обычно представляет со-
бой пересыщенный раствор углекислого кальция, кото-
рый постепенно выпадает в осадок по пути движения
воды. Определить количество выпадающего в механиче-
ских фильтрах СаСОз, в мг/л фильтруемой воды, если
общая щелочность известкованной воды при прохожде-
нии через эти фильтры снижается на 0 05 мг-экв/л.
Ответ 2,5 мг/л.
3-25. Во сколько раз необходимо упарить котловую
воду, щелочность которой обусловлена NaOH и равна
5 мг-экв/л, чтобы концентрация NaOH увеличилась до
10 г/л?
Ответ в 50 раз.
3-26. Гидратная щелочность котловой воды составля-
ет 3 мг-экв/л, а концентрация в ией иона SO2- равна
405 мг/л. Определить отношение эквивалентных коли-
честв (NaOH)/(Na2SO4).
Ответ: 0,2.
3-27. Питательная вода электростанции подщелачи-
вается на 0,1 мг-экв/л. Определить расход едкого натра
иа подщелачивание 1 м3 питательной воды.
3-28. Химически обработанная вода, содержащая би-
карбонат аммония NH4HCO3, подверглась кипячению
для удаления аммиака. Щелочность воды при этом из-
менялась с течением времени следующим образом-
Время кипячения, мии.... 0 5 10 IS
Ше ючность, мг-экв/л:
ZZ/ф — 0,3 0,2 0 15
Що ......................... 1,1 0.8 0,6 0,40
Определить для каждого контрольного момента кон-
центрацию в воде карбоната и бикарбоната аммония,
считая, что эти вещества при титровании ведут себя
аналогично соде и бикарбонату натрия.
3-29. Используя данные предыдущей задачи, найти
количество аммиака, которое удаляется после пятими-
нутного кипячения 1 л воды.
Ответ: 5,1 мг/л.
3-30. Найти концентрацию гидрата, карбоната и би
карбоната натрия, мг/л, для следующих значений те
.точности по феполфта топну и метилоранжу:
11Ц. мгэкв'ч....... 6.0 8.0 5,6 0.8 1,2 2.4 0,8г. 8,0
ZZZ|„ мг-экв/л.....3.5 2,4 5.4 0.5 0,2 1,2 0,25 4,2
5—209
3-31. Найти соединение, присутствующее в растворе,
щелочность п жесткость которого определяется значе-
ниями, приведенными ниже.
Щк, мг-экв/л. . 0,5
Щф, мг-экв/л. . . 0,5
Жо> мг-экв/л............... 0,5
0,8 0,8 1,0 0,6 0,8
0,-1 0,5 0,6 0,3 0,2
0,8 0 1,0 0 0
3-32. Жесткость обработанной воды равна
350 мкг-экв/л, а щелочность 1,6 мг-экв/л. Определить
значение избыточной щелочности и состав общей ще-
лочности, если Д/ф=0,95 н ZZfM=l,60 мг-экв/л.
Ответ; ЩПлб=1,25 мг-экв/л; Щг=
=0,3 мг-экв/л, ZZ/K=s=l,3 мг-экв/л.
3-33. По условиям задачи 3-28 общая щелочность во-
ды при кипячении непрерывно понижалась. Дать объ-
яснения этому явлению.
3-34. Будет лн наблюдаться тот же эффект при кипя-
чении, о котором говорится в задаче 3-28, если взамен
бикарбоната аммония в воде растворить бикарбонат
натрия? Почему?
3-35. Умягченная в результате Na-катноннрования
вода, общая щелочность которой обусловливается содер-
жанием только бикарбоната натрия, подвергается кипя-
чению, в ходе которого протекает следующая реакция:
2N а НСОз—>Na2CO3+CO2+H2O.
Можно лн, определяя время от времени щелочность
воды, установить момент завершения этой реакции?
Дать мотивированное объяснение.
3-36. В 2 л воды содержится 158 мг бикарбоната ам-
мония и 168 мг бикарбоната натрия. Определить,
мг-экв/л. а) общую щелочность воды; б) общую щелоч-
ность после полного удаления аммиака кипячением, прн
котором объем воды уменьшается вдвое.
Ответ, а) 2 мг-экв/л; б) 2 мг-экв/л.
3-37. Раствор содержит 107 мг/л NH4C1 и 79,5 мг/л
Ыа2СОз. Будет ли этот раствор щелочным, если его при
кипятить до полного удаления из него аммиака?
3-38. В 3 л воды содержится 80 мг едкого натра п
106 мг кальцинированной соды. Определить Щф,
мг экв/л.
Ответ: ZZ/.M=0.33; Щф— 1.0
3-39. Для анализа взяли две пробы речной воды, каж-
дая объемом 200 мл. Па титрование первой пробы с пн-
06
днкатором метилоранжем затратили 8,2 мл 0,1 н. рас-
твора серной кислоты Вторую пробу после добавления
в нее 10 мл той же кислоты прокипятили в течение 3 мин
и охладили. Вслед за этим в нее добавили две капли
раствора метилоранжа (после чего проба приобрела
красный цвет) и некоторое количество 0,1 н. раствора
NaOH до появления желтого цвета. После этого в пробу
внесли три капли раствора фенолфталеина и оттитрова-
ли ее тем же раствором щелочи до устойчивого слабо-
розового цвета, на что израсходовали 0,6 мг-экв/л рас-
твора. Определить общую н бпкарбопатпую щелочность
воды и концентрацию в ней гумматов, мг-экв/л.
Глава четвертая
РЕАГЕНТНАЯ ОБРАБОТКА ВОДЫ
4-1. ОСВЕТЛИТЕЛЬ И ЕГО РАБОТА
Основное назначение осветлителя в любой схеме во-
доочистки состоит в удалении из воды осадка. На рис.
4-1 приведена схема осветлителя ВТИ-400И для извест-
кования воды.
В ходе пуска и наладки работы осветлителя, а также
корректировки ее в процессе эксплуатации часто необ-
ходимо знать некоторые параметры и данные, характе-
ризующие режим его работы. Часть из них может быть
получена экспериментально, другая — должна быть най-
дена расчетом. Рассмотрим зависимости, которые ис-
пользуются в этих расчетах.
В табл. 4-1 приведены основные данные по осветли-
телям, разработанным ВТИ.
В нормально работающем осветлителе должно со-
блюдаться следующее балансовое равенство:
Q11 вСп B=<7rnCm-|-Qo вСп вН-/?, (4"1)
где фп.в, Qo в — количество соответственно обрабатывае-
мой (исходной) н осветленной воды, м3/ч; С1!В, Спп,
С,л— общая концентрация взвешенных веществ соответ-
ственно в обрабатываемой (включая и выпадающий при
обработке осадок), осветленной и продувочной (из шла-
моуплотпителя) воды, мг/л; qm— продувка шламоу плот-
5* 67
нителя, ма/ч; R — остаток шлама, удаляемого продувкой
самого осветлитечя, г/ч.
Концентра пня С11а может быть определена расчетом
и анализом. Она имеет различное значение для разных
способов обработки воды, определяемое осадком, выпа-
Рнс. 4-1 Оема 1светлителя ВТИ
j исходное вода, ’ — известковое молоко. 3 — коагу-
лянт, 4 — флокулянт; 5 — воздухоотделитель; 6 — шла-
мпу плотните ль; 7— отвод воды нз гплаыоуплотнителя.
Я—вход исходной волы 9— шлвмопрпемные окно:
10 — продувка шламоуплотннтеля; П — продувка освет-
лителя- 12 — выход обработаиноЛ воды
дающим в результате воздействия реагентов, а также
взвешенными веществами, содержащимися в воде до ее
обработки. Расчетные формулы сведены в табл. 4-2, из
которой следует, что значение Спв зависит также н от
эквивалентного отношения С s+/^HC0—•
68
Таблицу 41
OuioRtibie показатели осветлителей ВТ И
Показатель Осветлители
и ° •
Произволитепьностъ G. м*/ч 100 250 400 1000
O6i»cm общий W, мв 133 413 650 1250
Объем смесителя 1Г.„. М= 8,5 22 36 92
Объем зоны контактной среды 1ГК с, м’ 55 184 285 984
Объем зоны осветления tr, м' 36 102 174 517
Объем воздухоотделителя ^11 о« 13 37 49 150
Объем щламоуплотнителя 1ГШ, м® 18 63 91 337
Площадь сечения осветлители F. м’ 24 63 95 254
Площадь зоны контактной среды FKC. м’ 19 51 79 21D
Площадь зоны осветления in ламоуплотн ителя F3 ш- № 4.3 II .0 16 44
Площадь воздухоотделителя F, с„ ма 4.9 12,6 16 44
Высота зоны контактной среды Акс. м 2,9 3,8 4,0 4,9
Высота зоны осветления м 1,9 2.0 2,2 2,5
Высота зоны уплотнения в шла моу плоти ителе ш< м 1.6 2.2 2.4 3.1
Время пребывания воды в осветлителе 1, ч 1,33 1 .65 1.63 2.13
Время пребывания воды в воз ду хоотделнтеле мин 4,6 4.8 4.6 5.7
Время пребывания воды в сме- сителе мин 5 5,3 5.3 5.5
Время пребывания воды в зо- не контактной среды tK t, мни 32 43 42 59
Время пребывания воды в зо- не осветления Г, мин 21 24 26 31
Время пребывания воды в зо- ве уплотнения щламоуплот цителя G и 3,9 5.3 4.8 5.7
Скорость воды в воздухоот делителе о. м ч 21 20 27 33
Скорость воды в зоне контакт- ной греты IV । м /ч 5.4 5 5.1 4.8
Скорость ноты в зоне осветле- ния *3.11- м ' 4,3 4.0 1.1 3.9
69
о Таблица 4-2
Формулы для определения количества выпадающего в осветлителе осадка» мг/кг
! Отяогиенпе |Сгв.СНсо, Реагенты ь , „,двой <«<Д1 Расчетная формула
Na,СО, 4-Са (ОН), 4- FeSO* Ci.в=" 50 |ZZ/0 4- Сда + CMg + + dK 4- a] 4- 29(CMg — C'Mg) 4. CH4-aK /,
1 < 1 Gi в = 50[2ZZ/o+ CMg + CCOj 4-t/K4- «1 4- 29(CMg — C'Mg) + Crt + ffK/K C|lb ~ 50 (2ZZZo -- Ccoj + Cri + а^с1к
Ci(OH), + FcSO4 < 1 Сн и = 50 (21Ц0 -j- CcoJ + 29 (CMg — C'Mg) 4- CH 4- aKdK Ci н 50 (2ZZ/0 + Cqo.) 4- 29 (ZZZO — CCa — C'Mg) 4. C„ 4- Дк</к £н,н = 50 (2ZZZ) + ^coj 4* Mg^ 4* 4-
Ca(OH), MjO - Fl SO , < J си.в = 50 (2ZZ/0 4- Cco,) ' 23 (^Mg — c'ms> 4- C„ 4- 4- rfMg0
NaOH 2 си В = 50 (-Шо 4- CC01) 4- 29 (CMg — C'Mg) 4- C„
NaOH+CaCl. <2 CH1B — 50(2ZZZo4* CCOj) + 29 (CMg — c'Mg) 4- C„
NaOH+NajCO, >2 С’н.л -50 (Сй+ Сс01) + 29 (СМг — C'Mg) + C„
Приме я а н и е С Mg ~ концентрации кальция и магния в исходной иоде, мг-экв/л; C'^g — то же магния в обработанной вице
/7/0> CqqЩелочность п концентрация СО. в исходной воде, мг-экв/л; С,— начальная концентрацря взвешенных веществ я исходной вид ।
пбряботкч, мг/Kt, dK, d/vlgQ — доза коагулянта и окиси магния, чг/л; ок —коэффициент, см. пример 4-1. В формулах принято, что магний
падает в ваде Mg(OH),, а — избыток Са(ОНЪ <гм §42).
Наиболее рациональным режимом работы осветли-
теля следует считать тот, при котором т. с. почти
неси осадок удаляется продувкой шламоуплотиителя
Для этого необходимо, чтобы
Qff вСп в-^пСл,
(4-2)
где <?п — количество пульпы, поступающее в шламо-
yifjTOiннтсль, м3/ч; Сп — концентрация осадка во взве-
шенном слое, мг/л.
Значение может быть определено из равенства
*/пСп---(С]а-----------$ш) С(1 щ,
откуда следует
(4-3)
где С„ш — концентрация взвешенных веществ в освет-
ленной воде нз шламоуплотиителя, мг/л.
Для обеспечения надежной работы осветлителя же-
лательно, чтобы при номинальной его производительно-
сти Co^l,0-s-l,5 г/л (0,1—0,15%). Прн меньших кон-
центрациях, особенно при обработке маломутных и
цветных вод одним коагулянтом, не удается получить
устойчивый слой взвешенного осадка п, следовательно,
достаточно осветленную воду. На действующем осветли-
теле значение Сп, мг/л, легко определяется анализом.
Расчетным путем оно может быть найдено нз выраже-
ния [Н ].
(4-4)
1де С, -концентрация осадка во взвешенном слое (при
скорости восходящего потока воды 1,8 м/ч); и—рас-
четная (или фактическая) скорость восходящего пото-
ка, м/ч; <р — коэффициент, изменяющийся в пределах
0,5—1,2 для осадков, образующихся при осветлении ма-
ломутных вод, и 1,3—1,5 — прн светленни высокомут-
иых вод (пли при известковании).
При ориентировочных расчетах можно использовать
средине значения допустимых расчетных скоростей вос-
хчцящсю потока воды в центральной зоне и концентра-
ций осадка во взвешенном слое. приведенные в табл 4-3.
Таблица 4-3
Расчетные скорости подъема воды и расчетная эталонная
концентрация осадка во взвшенном слое
С«.,: “г'вг Обработки А1д (SO«h Обработка FeSO.+Ca ОН)
V. м/ч Сд, г/л о, м/ч с8. г/л
100 2.15—2.85 0,8—1,8 2,5—3.25 0,9—1,8
101-400 2.85-3.25 1,8—3,6 3,25—3,6 2,0—4.0
401-1000 3,25—3,6 2.5—5,0 4,0—4.3 3.0-6.0
1001-2500 3.6—4,0 5,0-17,0 4,0—4,3 6.0—20.0
Обработка воды из-
вестью гпи из
вестью и содой при
магнезиальной же-
сткости
<25% —. — 4,3-5,0 6,0—20,0
>25% — — 3.6—4,0 4,0—10,0
Концентрация веществ в осадке шламоуплотиителя
Сш зависит от длительности уплотнения, начальной кон-
центрации, состава осадка. Примерные ее значения мо-
гут быть взяты из табл. 4-4.
Таблица 4-4
Средняя концентрация осадка, г/л, уплотненного под слоем воды
Характеристика осадка Времм уплотнешп!, ч
С 8 12 г<
Обработка коагулянтом вод мут- ностью 1 МГ ,1.
50 6 6.5 7.5 8
50—100 8 8.5 0.5 10
101—400 24 25 27 30
401—f 000 27 29 31 35
1001 2500 Обработка воды известью пли из- вестью м содой при магнезиальной жесткости: 36 38 41
<25% 75 78 80 85
>25% 28 30 32 35
1 Под мутнистыо поипмветеч общее количество иСадкя, поступиплцего
в осветлитель 1СВ Е).
Концентрация взвешенных веществ в воде, выходя-
щей из шламоуплотиителя. СОП| определяется анализом
или рассчитывается по формуле
<Ш = ^(СО..-СО) + СО, (4-5)
¥О.Ш
т
где G,— концентрация взвешенных веществ в воде, вы-
ходящей нз осветлителя, но до смешения с qf)m; 47.» ш—
количество осветленной воды, выходящей нз шламоуп-
лотнптеля, м3/ч.
Количество пульпы ци, поступающее в шламоуплот-
ннтель, определяется свойствами осадка, его концентра-
цией и скоростью подъема воды в шламоуплотнптеле
и должно удовлетворять равенству
^П—(4’6)
где ГП| — площадь сечения шламоуплотннтеля, м2.
Подставив это значение в выражение (4-3) и приняв
Сош=0 (так как С||( н Gi^Gmh), получим предельную
для данных условий концентрацию осадка в шламона-
копнтеле:
сш = (4-7)
Значение qiu обычно составляет 1—2% QU.B, в неко-
торых случаях больше 2% (см. пример 4-2). Значение
зависит от свойств и концентрации осадка во взве-
шенном слое н обычно определяется при технологиче-
ских испытаниях осветлителя. Предельные значения Пш
должны быть равны скорости подъема воды в зоне
осветления г>3.о, которые могут при расчетах принимать-
ся по данным табл. 4-5 [11].
Таблица 4-5
Скорость подъема воды в зоне осветления
с».«- “г/л С „• мг/л п п ' ”, О- «/’
Зимний период Летний период Зимний период Легкий период
10—100 100—400 1,8—2.2 2,2—2,9 2.5-2,9 2,9—3,6 400—1000 1000—2500 2,9—3,6 3.6—4,3 3.6—4,0 3,6—4,3
ПРИМЕРЫ
4-1. Определить основные параметры работы осветлителя про-
изводительностью 250 м3/ч (табл. 4-1) при коагуляции воды сле-
дующего качества: цветность //=60°. Св=50 мг/л, Щв в=
=2,2 мг-экв/л, сухой остаток 165 мг/л.
Решение. Доза коагулянта AlsfSO*)». мг/л, определяется при
обработке цветных вод по формуле
4 КД = 4 <80^; 31 мг/л. (4-8)
73
Прн обработке мутных вод дозу Al2(SO4)s, FeCl3 или FeSO4
можно определять по табл. 4-6 [II] Меньшие значения принимают-
ся прн обработке вод, содержащих грубодислерсные злрязнения.
Для данного примера dF—25 мг/л, т. е меньше d'«=31 мг/л,
в таких случаях принимается большая доза, тогда
CKB^CB+dKa„+0,25U, (4-9)
где Сп—начальная концентрация взвешенных веществ в исходной
воде до ее обработки.
Таблица 4-6
Дозы коагулянта для обработки воды [11]
Концентрация взвешен нш веществ, Mi/i •с- » Концентрация взвешен- ных веществ, мг/л tfK. МГ/Л
100 25—35 800 55—80
200 30—45 1000 60—00
400 40—60 1400 65—105
600 45—70 1800 75—115
2000 80—124
Коэффициент ак соответственно равен 0,65 для очищенного алю-
миниевого коагулянта н FeSO4, 1.0—для неочищенного и 0,8 для
FeCI3 Действительное значение в последующем определяется
прн наладке осветлите тя
Если Щп B<d,«4-I, го необходимо подщелачивание воды Доза
щелочи определяется равенством
<fm=dx+l—(4-10)
где в — общая щелочность исходной воды, мг-экв/л.
Для данного примера Щя я >dF+l, поэтому подщелачивание не
требуется.
Таким образом,
Сив =50+0,55-31+0.25-60^82 мг/л.
Концентрацию осадка во взвешенном слое Сп найдем по урав-
нению (4-4), принимая по табл. 4-3 среднее значение Са—1300 мг/л
и расчетную скорость подъема воды (среднюю) н=2,5 м/ч. Тогда
прн <р=1,0 Св= 1 1300/2,5=^520 мг/л.
В этом случае количество пульпы, отводимой в шламоуплотнн-
тель qa, называемое иногда «отсечкой», определится по уравнению
Скорость подъема воды в шламоуплотнителе прн этом равна
(см табл. 4-1) пш=40/11=г=3,6 м/ч, что яаляется приемлемым.
Время пребывания воды в шламоуплотнителе составит
=63/40= 1,60 ч.
Отсечка и скорость подъема воды в шламоуплотнителе в общем
74
□ели к и, что вызвано сравнительно низким значением Сп, которое
желательно не ниже 0,1% При Сц<0,1% работа осветлителя может
оказаться неустойчивой Улучшить положение можно путем дозиров-
ки в обрабатываемую воду суспензии глины н полиакриламида
4-2. Предполагается установить осветлитель 400 м3/ч для Koaiy-
чяичн воды с начальной концентрацией осадка Сн=2,5 r/л Опре-
делить режим его работы в данных условиях с производительностью
400 м3/ч нетто
Решение. По табл. 4-1 выбираем осветлитель в. Время пре-
бывания воды в зоне контактной среды (взвешенного осадка) со-
ставляет 0,7 ч. По табл. 4-4 при уплотнении осадка в течение 6 ч
концентрация ею ккяавн! 34 г/л (для
Св=2,5 г/л). Следовательно, при уплот-
нении в течение 0,7 ч концентрация
осадка будет составлять примерно Си
=34-0,7/6^4 г/л, а количество пульны,
которое должно поступать в шламоуи-
итннтель, равно:
9п=408-2,5/4=&250 м3/ч
Скорость подъема воды в шлам о
я и. и пиите ле может быть допу щена прп-
О.шзптельно 5—6 м/ч. Тогда для обеспе-
чения нормальной работы шламонаки-
н in ел я в него должна поступать пульпа
в количестве
q□—fs ш-5=16-5=80 м3/ч.
В этих условиях осветлитель может
Рис. 4-2 Уплотнен не
различных осадков (на-
чальная концентрация
500 мг/л)
работать примерно в следующем режи-
ме: продувка 150—170; отсечка 80—100,
поступление воды в осветлитель 550—
570 м8/ч. Концентрация осадка в пуль-
ни. поступающей в шламоуплотиител.
। оставит в этом спучае Сп=5,5—5,7 г7 ।
Такой режим работы осветлителя не
может считаться удовлетворительным
Он может быть существенно улучшен
добавлением в обрабатываемую водч
f—АЦОНЬ; » —
3— FcfOlIh 4 — Al (Oil)
гумматы- — ЛИОНЫ-гли-
на
суспензии глины, а также если
в исходной воде содержатся глинистые и другие минеральные ве-
щества. Как слсчует ил рис. 4-2 [12], прибавка глины значительно
повышает уплотняемость осадка, т. е. делает его тяжелым Можно
н этом случае повысить концентрацию осадка в зопе контактной
среды до 1% (примерно 10 г/л) Тогда qB —1000/10=100 м3/ч, из
которых примерно 90 мэ/ч осветленной воды поступит в сборный
желоб (осечка), а примерно 10 м3/ч будет сброшено через непре-
рывную продувку Концентрация шлама в продувочной воде соста-
вит приблизительно 10% Тот же результат может быть получен и
при известковании воды с коагуляцией FeSO4 и присадкой флоку-
лянта ПАЛ.
4-3. Осветлитель производительностью Qa п. м’/ч, пускается
в работу после ремонта. Определить время /, необходимое ппя обра-
зования слоя взвешенною осадка с концентрацией Си, мг/л если
в исходной воде концентрация взвеси составляет Св п, мг/л
7S
Решение Ежечасно в осветлитель поступает Qa ВСВ и, г,
взвеси а выходит из осветлителя с осветленной водой QIIBC0 п. г
(в период накопления шлама продувка отсутствует), остается в слое
увешенного осадка Qo.b(Cb в—Со в). Если объем зоны контактной
среды №к.с, м\ то
Ук.сС„
Со.в(^и.« —^о.в)
(4-П)
Для осветлителя Qo.b=400 м3/ч (табл. 4-1), 1Гк.с=285 м3, при
Си 0 = 280 мг/л и. приняв Со.8=0, а Св=0,1%, найдем f=2,5 ч.
Прн расчете I значения Сп. если отсутствуют опытные данные, мож-
но определить по уравнению (4-4) н табл. 4-3.
Для того, чтобы осветлитель работал нормально, концентрация
осадка во взвешенном слое Сп желательна не менее 0,1%. Поэтому
при коагулировании и осветлении мало мутных вод значение Св
обычно весьма мало и осветлитель выдает мутную воду. Улучшить
его работу в этих условиях можно искусственным замутнением обра-
батываемой воды путем присадки глинистых суспензий примерно
20—30 мг/л до образования устойчивого слоя взвешенного осадка
с Сц^О.1%, после чего доза суспензии dcn, мг/л, может быть опре-
делена из соотношения
f4n q — Qi.b (4-12)
Vo. в
и откорректирована опытом.
4-2. ОБРАБОТКА ВОДЫ РЕАГЕНТАМИ-ОСАДИТЕЛЯМИ
ИЗВЕСТКОВАНИЕ
Известкование применяют в случаях, когда необхо-
димо снизить щелочность исходной воды. Процессы,
протекающие прн обработке воды известью, могут быть
представлены следующими реакциями:
HGO“^H+ COj“;
Н+ _|-ОН--.Н2О;
Са,+ +СО’“ —СаСО,;
Mg + +2ОН-;— Mg (ОН),,
СО, + 2ОН" СО;-+Н,О.
Таким образом, при известковании разрушается ион
НСО_з. т. е. снижается щелочность пехотной воды, уда-
ляются из нее магний, растворен па я СО?, снижается су-
хой остаток и жесткость.
76
Для характеристики качества природных вод, обра-
батываемых известью, имеет существеннее значение от-
ношение
с а+/с п
Саа+/ НСО-
По его значению природные воды могут быть раз
делены на две группы: I — Л—Л<1. Известко-
вание может осуществляться по двум режимам: гидрат-
ному и карбонатному. При первом доза Са(ОН)2 рас-
считывается на связывание СОа, НСО 3, а также на пол-
ное осаждение магния и дозу коагулянта
+ + (4-13)
Прн карбонатном режиме
R"k-,='WUB+cco,+44a; л 1; 1 .. .
> (4-14)
/?"1о=2Ш,,-Сс,+СС(>1+4+а; Л<1. J
Следовательно, различие этих режимов состоит
в том, что в первом почти весь присутствующий в воде
магний осаждается в виде Mg(OH)2, в то время как во
втором (карбонатном) осаждение магния стараются
свести к минимуму.
На рис. 4-3 графически представлен расчетный ион-
ный состав вод I и 11 групп. Как внднм, в водах I груп-
пы анионов НСО-3 недостаточно для осаждения всего
кальция, присутствующего в воде, и осаждение магния
легко избежать путем применения соответствующей до-
зы Са(ОН)2. В водах же второй группы избыток нонов
НСО~з. равный (Ща—Ссз), связан с магнием, и поэтому,
удаляя его, следует удалить и магний в том же количе-
стве. Практически же целесообразно в обоих случаях
работать в зоне, отмеченной на рис. 4-3 пунктиром.
Удобство в том, что прн передозировке Са(ОН)2 идет
в осадок большая доля магния, при снижении дозы из-
вести магния выпадает меньше. В результате избыток
ионов ОН- в известкованной воде поддерживается на
уровне 0,1—0,2 мг-экв/л.
При известковании карбонатная жесткость (щелоч-
ность) исходной воды снижается до 0,5—1,0 мг-зкв/л.
77
Сухой остаток известкован кой воды снижается за счет
удаления СаСО3 и Mg(OH)2 и становится равным:
при С 8+/С „ 1
r Cds+ НСО-
Slu = s„ в-50(Щ„- 1Д',) + ВСМе,+ +
4-37a + 48dli —3,5ДОК; (4-15)
S,u=S„,,-5DUUo-iU'J 4-8ACMg.+ +
+ 37а + 48<— 5ДО,; (4-15а)
при С . IC „ < 1
н Са*+ НСО-
SL=S, - 42(ZZ4„-C&,+) +
+ 8CMg,+ + 48dK —3,5AOK4-37a; (4-16)
\a=S„ „ - 50(CCa!+ - ZZZ-j - 42 (ZZZ„ - CCbS+ ) +
+ 8ACMgS++48d11 + 37a —3.5ДО,, (4-16a)
где Ul'u—карбонатная щелочность известкованной во-
ды, мг-экв/л; ДС —количество хдаляемого маг-
Mg т j
пня, мг-экв/л, ДОь — снижение окмсляемости, мг/л.
Формулы (4-15) и (4-16) учитывают гидратный ре-
жим, (415а) и (4-16а)— карбонатный. Остальные обо-
значения— см. примечание к табл. 4-2.
Остаточная щелочность известкованной воды будет
примерно равна:
Щоп= (0,5-1,0) -ha, (4-17)
где a — избыток Са(ОН)г, обычно принимаемый в пре-
делах от 0,2 до 0,3 мг-экв/л.
Общая жесткость известкованной воды также сни-
жается и становится равной.
(4-18)
При известковании вод, у которых общая щелочность
больше обшей жесткости (Щ<,>Жи), результат извест-
кования 6}дет несколько иным. Разность Шп—Ж, ха-
рактеризует концентрацию NaHCO3, которая при изве-
стковании с избытком Са(ОН)? будет превращаться
в NaOH:
NaHCO3-rCa (ОН)г—^СаСОа rNaOH.
7В
Поэтому остаточная щелочность примерно равна.
Шы , и. (4-19)
Если разность /Цо—значительна, снижение ее
при известковании возможно путем дозировки в воду
CaCIg.
4 4. Определить расход реагентов и качество известкованной во-
ды при известковании исходной воды следующего состава, мг-экв/л:
= 1.2; СМв,+ -1,2; Cc0i = 0,3; Що^1,2;
sn.B = 350 мг/. ч ок = 10 тг/.r Оа.
79
Известкование производится по карбонатному режиму при dK —
=0,4 mi-экв/л I-eSO*.
Решение. Дозу СаО определяем по уравнению (4-14) для
Л=1
24и я 4- + ^сом +4с 4- «•
где AC Mg -количество удаляемого магния, определяемое из усло-
вия, что в осадке взвешенного фильтра доля Mg(OII)2 составляет
Um. Т. е.
, -Шк.в 4- ^со,
дСмЕ 58
(4-20)
Требуемое значение ам=8-г-15%. Подставив необходимые зна-
чения в (4-20), получим:
2-4,24-0,3
ЛСМ„.+ ’ 8-----58-----= 1.2 мг-зкв/ъ
Следовательно, в данном примере необходимо ввести гидратный
режим известкования с полным осаждением ма! инн. В этом случае
сухой остаток известкованной воды по уравнению (4-15) равен:
S*3=350-50(4,2—0,7) +8 1,2+48 - 0,4 +37 0,3—3.5 -10=
= 350—180=170 мг/л.
Расход технической извести кг/ч, составит:
и ш <7*т_ц. кг №:
2,8/?нз
Лз 1
где — производительность установки (брутто), м3/ч; ряа — со-
держание СаО в техническом продукте, % (принимаем 60%).
Подставив значения, получим
/?'иа=4,2+1.2+0.3+0.4+0,3=6,4 мг-экв/л;
<А.и=2»8-6,4/60=0,3 кг/м’.
Расход FeSO« с учетом семи молекул кристаллизационной воды
равен:
1,83/КЭ-10* 0,4-75,9-1.83
рк- 10« =------98ЙГ--------0,057 кг/м1,
где Э — эквивалентная масса коагулянта; р*—доля FeSOt-7HsO
в техническом продукте, %.
4-5. На известковую предочистку производительностью 400 м3/ч
поступает вода следующего состава, мг-экв/л. Жо=4,5, Жсв=3,2;
щелочность Я[о=2,5; СС()1«=0,3. Определить расход извести СаО
при гидратном и карбонатном режим зх известкования, а также со-
став осадка в осветлителе (dK=O).
80
Решение В соответствии с уравнениями {4-13) и (4-14) на-
ходим
R'uj—2,54-1 ,3+0,3+0,2=4,3 м г -экв/л,
2,54-0,3+0.2=3,0 мг-зкв/л.
т е прн карбонатном режиме расход извести в данном примере
снижается на 30%, что весьма существенно Однако если машин не
удаляется, то осадок в осветлителе будет состоять почти целиком из
СаСОз. Такой осадок обладает высокой плотностью и быстрой осаж-
даемостью. Поддержать его во взвешенном состоянии трудно, н по-
этому в шламоуплотнитель он не попадает, а находится внизу освет-
лителя. Такой режим зашламленпя не всегда оказывается приемле-
мым. Сделать осадок более легким возможно путем осаждения маг-
ния в количестве 8—15% СаСО3.
Карбонатный режим контролируется по остаточной концентрации
кальция в известкованной воде. Беги ^'Саа+/^Со— > *• то
А^Саг+ ~^са’+ ЭДо+ “•
Ec.ui же С'Са2+/С‘нсо_ < 1, контроль ведется по остаточной
концентрации магния
=*-*>-ад-
В данном примере
ЛСгм^я+, которая примерно будет равна
iCCaa+=5;U,9 МГ-ЭКВ/ I Ес.111 > 1»0,
идет нзчишнее осаждение магния. При ДС^+^О,? доза извести
нелоетаточна.
4-6. Известкуется вода оледующего состава, мг-экв/л: }КО =
«4,8; =3,0; ЩО-3,5‘, С^-0,2. Дота FeSO4 dK =
= 22.8 мг/кг.
Определить количество осаждаемого магния при карбонатном
режиме известкования, состав осадка, дозу извести
Решение. Исходная вода относится к водам второй группы.
Количество осаждаемого магнкя составляет Щ„—Сев=0,5 мг-экв/л.
Следовательно, доза извести равна:
— 2Щц.в —’ “Ь 4- ^"СО, а ~ МГ-ЭКВ/л.
Общее количество выпадающего осадка определяется по табл. 4-2,
в том числе C£acQj = 50(2///о4-C^q^) и C^g (он)я=29(Що 0^3+
—Подставляя численные значения, получаем ССаС0> =
= 360 мг'л; CMg (ОН}Ж ~ 14,5 мг/т при =0,35 мг-экв/j. Ко-
личество осадка от коагулянта прк аи=| (пример 4-1) будет равно
22,8 мг/л Доля Mg(OH)2 по отношению СаСОз составят см =
= (14,5/360) -100= 4,0%, что является недостаточным. Было бы же-
лательно иметь ам>5%, поэтому следует увеличить дозу осаждае-
мого Mai ння до I мг-экв/л, т. е. увеличить дозу извести.
6—209 81
4-7. Вода обрабатывается в осветлителе известью и коагулянтом
FeSO4 с дозой г/и=0,8 мг-экв/л. Определить кислородным режим
осветли геля, сели кошхсш рация кислорода в исходном воде состав-
ляет 4,2 mi /л.
Решение. При коагуляции сернокислым закисным железом
вначале образуется i ндрш двухвален тою-железа:
FeSO<-|-Ca (ОН)2—^Fe(OH)a+CaSO<,
которое в последующем окисляется до трехвалентною:
2Fe (OH)S -4- -5- Ов + НаО -> 2Fe (ОН),.
Для протекания этой реакции с необходимом для практики ско-
ростью, а также для ускорения процесса гидролиза железа значение
pH должно быть больше 8. Из приведенной реакции окисления сле-
дует, что иа I mi двухвалентного железа расходуется 0,143 мг/л Оа.
В воду подается 0,80-75,8=60,6 мг/л FeSO4 или (55,8/151,8)-60,6=
=22,4 mi /л Fe, и, следовательно, потребность в кислороде составит
22,4-0,143=3,2 мг/л. Избыток кислорода в обраба1ываемой воде
4,2—3,2=1 мг/л недостаточен, желательный избыток больше 2 мг/л.
Поэтому в данном случае необходимо осуществить барботаж обра-
батываемой воды воздухом для насыщения ее кислородом. Воздух
можно ввести в смеситель, обеспечив при этом соответствующие
условия для удаления 1азовой фазы из воды до поступления ее
в осветлитель.
4-8. Извешковая водоочистка производительностью 60 м3/4 брут-
то расходует в сутки 432 ю извести, содержащей 50% СаО. Опре-
делить удельный расход 100%-ной извести, если качество обрабаты-
ваемой воды следующее: Ссво=Ю5 мг/л; Смео=25 мг/л; щелоч-
ность 2,4 mi-эка/л; концентрация растворенной COj=18 мг/л. Избы-
ток извести принять 0,3 мг-экв/л; da=0.
Решение. Расход 100% -ной извести составляет 432-0,5=
=216 ю/сут, или 216/24=9 кг/ч, 9-Ю3/60= 150 г/м3 обрабатывае-
мой воды Подставив в формулу (4-13) численные значении, приве-
денные в задаче, найдем требуемое количество извести для обработ-
ки воды:
25 18
R'w, = 2,4 + 0,3 4,77 мг-экв/л.
Следовательно, удельный расход извести составит 150/4,77=
31,4 г/1-экв.
4-9. Определить наиболее целесообразный метод обработки лег-
корастноркмыми реаюитам и-оса ди гелями исходной воды с Жл=
= 4,67 мг-экв/л, Жсл=7 мг-экв/л, концентрацией растворенной СО2
20 мг/л.
Решение. Для выбора метода обрабо1кн важное значение
имеет соотношение между потребностью обрабатываемой воды
в ионах СО32“, которая равна Хса+Р (см. § 4-3), я количеством
их, образующимся в процессе у.мя1ченкя воды едким натром
Шк 4- СсОя‘
Для данного примера находим:
Хса+₽=7+15=В,5 мг-экв/л;
2/Wk-F Ссо< =2-4,67 + 0,91 = 10,25 чг-экв/л.
82
Таким образом, для связывания избыточных карбонатных ионов
необходимо подавать известь и обрабатывать воду известью и едким
натром
ЗАДАЧИ
4-1. Щелочность известкованной воды при гидратном
режиме известкования обусловливается содержанием
СаСОз, Mg (ОН)2 и Са(ОН)2- Определить количество
этих соединений, мг/л, если общая щелочность извест-
кованной воды равна 1,25 мг-экв/л, щелочность по фе-
нолфталеину 0.9 мг-экв/л и отношение Сса<+/См s+ —4.
Ответ: СаСОз=35; Са (ОН)2=11,1;
Mg(OH)2=7,25.
4-2. В отчетных документах одной водоочистки было
указано, что удельный расход 100%-ной извести СаО
составил 25 г/г-экв НСО 3 при гидратном режиме изве-
сткования. Можно ли верить этой цифре? Дать необхо-
димые доказательства.
4-3. Определить, сколько килограммов технической
извести перерасходуется в сутки против теоретического
количества на водоочистке, рассмотренной в примере
4-8, если не учитывать потери извести с продувочной
водой.
Ответ: 46,8 кг.
4-4. На известковой предочистке производитетьно-
стью 100 т/ч обрабатывают исходную воду следующего
состава, мг-экв/л: Жс=4,5; И/о=4,0; Ссо, =0,5; Смво=
=20 мг/кг. Избыток извести составляет 0,3 мг-экв/л.
Определить количество расходуемой в сутки 100%-ной
извести и количество выпадающего в осветлителе
СаСОз, если концентрация карбоната кальция, раство-
ренного в известкованной воде, составляет 0,7 мг-экв/л.
Ответ: СаО=390 кг/сут; СаСО3=936 кг/сут.
4-5. Известковая водоочистка производительностью
80 т/ч брутто обрабатывает воду следующего состава:
С _. = 1,5 мг-экв'л; С — 183 мг л и Сгл = 15 мг ’л.
Mg8+ НСО- СО*
Водоочистка работает при избытке извести 0,28 мг-экв/л,
расход воды на собственные нужды равен 2,5% коли-
чества исходной воды. Определить расход СаО, г/м3, ис-
ходной и обработанной воды
Ответ соответственно 153 и 157 г/м3
4-6. В вихревой реактор объемом 17 м3 и производи-
тельностью брутто 80 м3/ч для создания центров кри-
6* 83
сталлизацни было затружсно b т песка. В процессе из-
весткования па зернах песка кристаллизуется карбона г
кальция, и они увеличиваются в размере и массе. Опре-
делить, через сколько часов загруженная контактная
масса удвоится, если известкуется вода, имеющая ще-
лочность 5 мг-экв/д и содержащая II мг/л свободной
СО2. Карбонатная щелочность известкованной воды рав-
на 1 мг-экв/л. Расчет вести в предположении, что на зер-
нах песка откладывается только 80% карбопата каль-
ция, выпадающего в осадок.
Ответ через 202,7 ч
4-7. Определить расход 100%-ной извести иа извест-
кование воды следующего состава Ж(=8 мг-экв/л;
Ссао=168 мг/л, /Яо=5 мг-экв/л; Сс0 =17,6 мг/л. Произ-
водительность известковой предочясткя равна /брутто)
120 т/ч, избыток извести 0,3 мг-экв/л.
Ответ: 25,8 кг/ч.
4-8. По условиям предыдущей задачи определить
количество карбоната кальция, выделяющегося в виде
осадка за сутки При расчете не учитывать количество
СаСОз, находящееся в растворе при карбонатной ще-
лочности известкованной воды, равной 0,9 мг-экв/л.
4-9. Если выпавший при известковании в осадок
СаСОз собрать, высушить и обжечь, то можно получить
известь СаСО3=Са0+СО2. Определить по условиям за-
дачи 4-7, достаточно ли будет того количества извести,
которое можно получить обжигом осадка СаСО3, или
же необходим дополнительный расход извести? Потери
карбопата кальция при обжиге принять 15%.
Ответ: достаточно.
Примечание. Более строго подобная задача ре-
шена в [25]. Авторы учитывают то обстоятельство, что
получающийся в осветлителе осадок содержит балласт
Сс, мг/л, доля которого при повторном многократном
обжиге осадка СаО связывается некоторыми компонен-
тами балласта (Ре20з, SiO2, А12О3 и др.). В конечном
итоге доля СаО, %, в обожженном осадке при много-
кратном его использовании будет стремиться к следую-
щему значению:
CaO=100[l--g-(l+/,)].
где/> - коэффициент связывания (доля бллластз, свя-
। дающегося с СаО).
м
Если р^0,5, Сб=0,15’2 в, то доля СаО по этой
формуле будет равна примерно 85%.
4-10 Необходимо обработать известью 100 л воды,
качество которой приведено в задаче 4-7. Определить:
а) количество прибавляемой в воду 100%-иой извести;
б) количество выпадающего шлама за вычетом остаю-
щегося 1 * в растворе 35 мг/л CaCOj и 8 мг/л Mg(OH)2,
в) состав осадка, т. е. отношение ССаС0, /СМв (ОН)1 в экви'
валентных единицах.
Ответ- а) 22,68 г; б) 55,5 г; в) 5,4
4-11. Определить расход, кг/ч, технической извести
для известковой предочистки производительностью
брутто Сив. т/ч. Доза СаО равна R'm, мг-экв/л. а содер-
жание СаО в техническом продукте составляет СЕЗ, %.
4-12. Определить количество, мг-экв/л, СаСОз, обра-
зующегося при известковании воды, в которой концен-
трация иоиов НСО~з равна а, а растворенной в воде
СО2— б, мг/л.
4-13. Руководствуясь уравнениями реакций известко-
вания, показать, что теоретическая доза нзвести Rfm
равна
R^=^+ckb,+ + c^.
4-14. В лаборатории был выполнен следующий опыт:
в прозрачный раствор гидрата окиси кальция концен-
трацией 10 мг-экв/л при помощи кольцевой трубки с от-
верстиями начали пропускать углекислый газ. Вначале
раствор помутнел и приобрел молочный цвет, затем, по
мере дальнейшего пропускания СО2, раствор начал свет-
леть и сделался вновь прозрачным. Объяснить эти явле-
ния и определить количество всей связанной углекис-
лоты.
Ответ. 440 мг/кг.
4-15. Было внесено предложение заменить в содоиз-
вестковом процессе известь едким баритом Ва(ОН)2.
Можно ли принять это предложение3 Будут ли получе-
ны какие-либо преимущества3
4-16. Какими соединениями, растворенными в исход-
ной воде, будет определяться расход Ва(ОН)2, если во-
ду обрабатывать этим реагентом3
1 Растворимость углекислого кальция при 298 К составляет
69 мг/л Однако известкованная вода обычно явлгется пересыщен
рым раствором уг «ешедого кальция
85
4-3. УМЯГЧЕНИЕ ВОДЫ ПО МЕТОДУ ОСАЖДЕНИЯ
Под умягчением воды понимают удаление из нее ка-
тионов Са2+ и Mg2+ и замену их натрием. По методу
осаждения эти катионы удаляются в виде труднорас-
творимых соединений СаСО3 и Mg(OH)j. Для этого ис-
ходную воду обрабатывают реагентами-осадителями,
содержащими в своем составе анионы СО2- или ОН
К таким реагентам, используемым в водоподготовке,
относятся Na2CO3, NaOH и Са(ОН)2. В зависимости от
качества исходной воды и применяемых реагентов раз-
личают следующие способы обработки: содоизвестко-
вый; едконатровый; содовс-едкоиатровый, кальциево-
едкоиатровый.
СОДОИЗВЕСТКОВАНИЕ
Этот способ универсален, т. е. содой и известью мо-
гут обрабатываться воды почти любого состава Жест-
кость обработанной воды снижается до 300—400, а прн
большом подогреве (363—368 К) — и до 200 мкг-экв/л.
Известью удаляются (снижаются) жесткость карбонат-
ная Жк, магниевая См^1+ и СО2 Некарбопатная жест-
кость, состоящая после известкования в основном из со-
единении кальция, удаляется Na2CO3. Расход извести
определяется по формулам (4-13) и (4-14), а соды по
формулам.
Жлк ' (4-22)
(423)
где Ren — мг-экв/л; —кг/ч, 0— избыток соды, при
ппмаемый в пределах 1—1,5 мг-экв/л; ССц — содержа-
ние Na2CO3 в техническом продукте, %.
ОБРАБОТКА ВОДЫ ЕДКИМ НАТРОМ
При обработке воды NaOH ионы I ICO превращаются
в СО2-:
3
I кхг -4- ci г—со2"+11,о
8Ь
Количество образующихся ионов CO2 равно 2Z//o-f-
“Ь^соа* Если избыток ионов СО'- в умягченной воде со-
ставляет р, то
2^4» + ^c,i!+ + (4-24)
Если 2£//о*~ЕССО13>|С^г'+-f-Р» то в обрабатываемую
воду необходимо добавлять ионы Са,+ для связывания
избыточного количества СО2-. При
+ р будет ощущаться недостаток СО2- для связывания
имеющегося Са2+. Поэтому в воду следует ввести
^агСОз, и только при выполнении равенства (4-24) об-
работка может вестись одним NaOH. Расход реагентов
определяется по следующим формулам:
^ОН = 4°(/^о + СМ8 + СС0. + А + “); ’
^.™i=40(Wo+cMb+cC[1 +<4+«);
^n«,co,=53 (ССа — 2ЩО — CCOj -|- р);
ЯСв.+ = 28 (2ЩО+Crai - ССа - ₽);
^NaOH — 40(7А'ик-|-£4_Ьа_1"РК
(4-25)
ez—sco 11
СОДОВО-РЕГЕНЕРАТИВНЫЙ ПРОЦЕСС
При обработке воды реагентами-осадителями иногда
в осветлитель или в питательный бак подают продувоч-
ную воду котлов для использования содержащихся в ней
щелочных реагентов — едкого натра и кальцинирован-
ной соды. Такой метод обработки воды носит название
содово-регеиеративиого или просто регенеративного.
Рециркуляция котловой воды в этом процессе обуслов-
ливает увеличение сухого остатка умягченной, а следо-
вательно, и питателы ой воды, что вызывает увеличение
размера продувки котла. Хотя в этом случае часть про-
дувочной воды возвращается снова в котел, т. е. не те-
ряется, одиако большие продувки не асегда приемлемы.
Поэтому в оборот, т. е. на водоочистку, может быть на-
правлена лишь некоторая доля tp продувочной воды,
которая может быть определена расчетным путем.
* ^Mg — £ме1+: ^Са — ^Сая+-
87
Введем следующие обозначения: х — снижение сухо-
го остатка продувочной воды, мг/кг, эквивалентное
1 мг-экв/кг расходуемой на умягчение воды, у —
снижение сухого остатка обрабатываемой воды, мг/кг,
соответствующее 1 мг-экв/кг Жк, Шо, Шк, Щг— соот-
ветственно общая, карбонатная и гидратпая щелочность
котловой воды, мг-экв/кг; Сив— добавка обрабатывае-
мой воды в питательную систему котлов, доли; рв—про-
дувка котлов по питательной воде, доли от единицы;
•Sn.s. -Sk.b^—максимально допустимый сухой остаток со-
ответственно питательной и котловой воды, мг/кг; SCB—
сухой остаток исходной (сырой) воды, мг/кг.
Тогда может быть написано следующее очевидное
балансовое равенство:
$п.в=ГХи в (*$и ц уЖк) 1“Рв<р1 (SB.B—хШ.о) ,
(4-25а)
откуда находим
у.=—(4’25б)
РвХ^К.в
Теоретическое значение х определяется следующим
выражением:
х=13пк+17, (4-25в)
в котором аи — карбонатная щелочность котчовой воды,
выраженная в долях от ЩО1 т. е. ац=Щк1Ш0.
Примерное значение уЖк можно определить по сле-
дующим приближенным формулам:
у Жн-50 (Хк-Щ«) —8Смв,
если ССа/Жк>1,
уЖк=50 (Сса -Щ„)+42 (Жк-СсО-вЖпк.
если Сса/Мк<1,
где Щк — щелочность, обусловленная СаСОз.
В равенстве (4-25а) первое слагаемое характеризует
количество примесей, вносимых в питательную воду
умягченной водой; количество примесей, вносимых
в цикл продувочной водой, направляемой иа регенера-
цию, определяется вторым слагаемым. Регенеративный
цикл, очевидно, неосуществим, если
5д.б=с1ц в (5ц в уЖк.} - (4-25г)
Второе ограничение в применении регенеративного
цикла вызывается качеством исходной воды и составом
88
щелочности котловой воды. В общем случае, очевидно,
должно соблюдаться равенство между поступающим
в цикл с продувочной водой количеством NnOH
(цчрвШг) и потребностью в нем (7?и, ОиВ), т. е.
Ч’2рВ^Дг=/?иГХи в» (4-25д)
где /?и—доза NaOH, равная (Мк4-СМе + CCOj4-c?j,
мг-экв/кг; cfZ доля продувочной воды, направляемой
а оборотный регенеративный цикл по условию состава
щелочности котловой воды.
Отсюда
<4-25е)
Если <р2> 1, то ограничения по щелочности котловой
воды снимаются Продувочная вода может быть полно-
стью использована при условии ф1=ф2==1.
Баланс кальцинированной соды при регенеративном
процессе может быть представлен следующим уравне-
нием:
ап в (^s-ь “Ь ₽р) =йи D (2Л4 4“ QoJ “Ь в»
в котором a1I n(CCa5+ -f~pp) определяет потребность об-
рабатываемой воды в соде; alf p(2/WK-|-Cco) — количе-
ство соды, мг-экв/кг, образующейся при реакциях умяг-
чения воды едким натром; — количество соды,
вносимое в обрабатываемую воду продувочной котловой
водой; г/сссин — дополнительная дозировка соды. Если
“я.в(ССа,+ +ft,)=»...(2>W,+Q02)+fA^
то дополнительный расход соды ис требуется.
Пользуясь этими формулами, следует иметь в виду,
что некоторые из них дают лишь приближенные резуль-
таты, которые, однако, могут быть использованы при
оценке эффективности регенеративного процесса.
ПРИМЕРЫ
4-10. Определить способ обработки и расход реа[ентов для вод
с.и-дуюшего состава мг-экп/д.* а) й/п=2.8: 2КО=4 2:
ССЛ’+ 3-2:CMK’r l^CCOj -n.3;a 0.2; ) 1.1»;
б) Z27< - 1.6; ! CMif4 - 1.4; CC11J -Г»л
3 0,8.
ЯП
Решение. Для воды (а) ЪЩо+С^-^С а+ +₽ и, следова-
тельно, обработку нужно вести NaOH с дозировкой соединений каль-
ция. Если ввести в воду NaOH в количестве, г-экв/л,
?№ОН ~ Шо + СМе2+ + ССО„ “И*’
то концентрация ионов СО32 составит 2-2,84-0,3=5,9 мг-экв/л, в то
время как ССа2++₽ равна всего 4,2 мг-экв/л, т. е. в обработанной
воде останется Na2CO3 в количестве 1.7 мг-экв/л, а вместе с избыт-
ком NaOH (а) щелочность ее будет 1,9 мг-экв/л, что следует счи-
тать высоким значением Поэтому едким натром следует нейтрали-
зовать только долю Що. равную х. Она может быть определена и?
уравнения, аналогичного (4-24)*
2* +Хсо,= ^0,3+ + fl-
откуда
Щелочность Що—х может быть нейтрализована Ся(011)2 Ттада
расход pcaieHTOB составит.
Сс,»+ + fl CCOj
^Naol I 2 4- CMg2+ + а;
?CfiO-—Що—X.
Подставив численные значения, найдем
3,2-{- 1.0— 9,3
мг-экв .
Що—Л‘=2,8—1,95=0,85 мг-экв/л; Умаон—3,15 мг-экв/л;
9с»о = 0,85 мг-экв/л.
Возможен и второй вариант обработки Он состоит в том» что
едкий натр добавляется в воду в размере полной дозы, Избыток
ионов С0§— в количестве 1,7 мг-экв/л связывается раствором СаС12,
вводимым в обрабатываемую воду. В этом случае сухой остаток
обработанной воды будет несколько выше, чем в первом, л рясход
VNaOn больше
Для воды (б) также ССа,+4-В- Однако эта водя
характеризуется еще и соотношением Жс=Що которое поваляет
обрабатывать ее одной известью:
Ca(HCOi)24-Ca(OH)2—2СаСОз4-2Н2О;
Mg(HCO3)24-2Ca (ОН)..—2C.TCOj4-Mg(011)2+2НЮ
доза, мг-экв/л, которой должна быть в этом случае равна*
f/Call - 4“ 1 ’
90
Несмотря на это, небольшая присадка NaOH в воду необходима
для атаямя в пей избыточной коипеитраадв помов С03' и ОИ~
в размере р, что позволит снизить остаточную жесткость обработан-
ной воды Таким образом, расход реагентов, мг-экв/л, составит
?ИяОЦ ~ ₽ + а 1.0; СаО = ££Д> — (3 4- а) + ^СО»
Второй вариант обработки аналогичен упомянутому выше вода
обрабатывается едким натром, доза которого рассчитывается на
полную потребность. Избыточная щелочность в количестве
A2Z/ ~2Щ0 Ц- ^cOj ^Cas+ — ®«7 мг'экв 1
удаляется СаС12, вводимым в воду в том же количестве
<5,7 мг-экв/л). Этот вариант более дорогой и связан с увеличением
сухого остатка обрабатываемой воды. Так, в первом варианте сухой
остаток исходной воды будет снижен примерно па YSn—бОС^яц.+
4-42CMg#+ =5s219 мг/л.
Во втором он будет увеличен на
iS(5 -р 1Г),5С’м^2+ =&50 мг/л.
4-11. Определить способ обработки и расход реагентов для воды
следующего состава, мг-экв/л:
-2,1; Сса,+ - 5,8; б^гч- -1,8; == 0,3; 0 — 0,8; а 0,2.
Решение. Д ш этой воды 2/2Д, 4- Ccn^ < C&s+-|-p и обработка
доъкн! вестись по спи-обу — N.iOH 4-NasCOa. Доза NaOH равна
Nt ОН + ^Mg’ + + а = 4.1 мг-ЗКвЛт, ?N31C03 ^Саа+ 2^°~
— CCOj -{-$-» 2,1 мг-экв 'л.
Из рассмотренных способов умягчения наиболее универсальным
является содопзвсстковый, которым можно заменить все остальные
Однако обработка воды NaOH совместно с CaCls или Na2CO3 во
многих случаях оказывается более удобной» поскольку исключается
сравнитетьно громоздкий способ приготовления раствора Са(ОН)2.
Но при наличии порошкообразной извести (пушонки) мспотьзоваиие
извести становится столь же удобным, как и раствора NaOH, и, сле-
допыте тьно, содоизвесгковын способ окажется вполне конкуренто-
способным. Следует отметить, что современные котлы отличаются
высокой форсировкой тепловых процессов, что требует глубокого
умягчения питательной воды, которое может быть достигнуто только
приме'к tincxi ионообменных способов умягчения.
ЗАДАЧИ
4-17. Прибавляемая в вод)' при содоизвестковом про-
цессе кальцинированная сода расходуется на осаждение
только ионов кальция согласно уравнению Са21 -
4- СО“— = СаСО3. Несмотря на это, расход соды, опре-
деляемый формулой (4-22), зависит от значения пекар-
91
бонатной жесткости, обусловливаемой, вообще говоря,
соединениями кальция и магния. Дать объяснения это-
му кажущемуся несоответствию.
4-18. Можно ли рассчитать расход ка «ьцнннровапнон
соды по формуле (4-22) при обработке воды едким на-
тром и кальцинированной содой? Почему?
4-19. В отчетных данных одной содоизвестковой водо-
очистки было указано, что расход 100%-ной кальцини-
рованной соды на умягчение 1000 т исходной воды с не-
карбонатной жесткостью 2,5 мг-экв/л составляет
166,5 кг. Избыток соды при этом составлял 1.2 мг-экв/л,
d{(=0. Проверить правильность приведенного значения
расхода соды
4-20. Содоизвесткованная вода характеризуется сле-
дующим качеством: жесткость остаточная 0,55 мг-экв/л,
щелочность по фенолфталеину 0,325 и по метилоранж)'
0,125 мг-экв/л. Правильно ли работает водоочистка и
достаточна ли дозировка реагентов?
4-21. Сменному химику было сообщено, что содоиз-
весткованная вода, несмотря на высокую общую щелоч-
ность в 2,3 мг-экв/л, характеризуется большой остаточ-
ной жесткостью ЖО=1,35 мг-экв/л. Щелочность по фе-
нолфталеине составляла при этом 2,2 мг-экв/л. Рассмо-
трев этн данные, сменный химик отметил неправильную
дозировку реагентов н дал указания, как ее исправить,
В чем состояла неправильность дозировки реагентов?
4-22. После выполнения указаний сменного химика по
устранению неправильности в дозировке реагентов (см.
задачу 4-21) качество содонзвесткованной воды стало
следующим, мг-экв/л: остаточная жесткость 0,25; общая
щелочность 1,5 и щелочность по фенолфталеину 0,9. Ка-
кие указания были даны сменным химиком, если судить
по приведенным цифрам?
4-23. В лабораторию была доставлена проба воды без
надписи и этикетки. Чтобы определить, какую воду нли
раствор представляет эта проба, был сделан ее анализ,
который показал, мг-экв/л: жесткость общую 10; ще-
лочность общую 10 и по фенолфталеину 10. Что это за
вода?
4-24. Доставленная в лабораторию проба содонзвест-
кованной воды была лаборантом профильтрована в от-
крытый большой стакан н подвергнута анализу, кото-
рый показал: общую щелочность 1,5; щелочность по фе-
нолфталеину 0,9 п метилоранжу 0,6 мг-экв/л. Спустя
92
некоторое время эти цифры ёылй 'проверены старшим
лаборантом; выполнив анализ сам, он нашел Щф—
=0,8 мг-экв/л л Щы=®,7 мг-экв/л. Контрольный анализ
э.тон же пробы, проведенный через некоторое время пос-
ле второго анализа, показал /££ф=0,75 мг-экв/л и
/££„=0,75 мг-экв/л. Объяснить подобную эволюцию со-
става щелочности. Жесткость оставалась неизменной н
равной 0,23 мг-экв/л.
4-25. Исходная вода следующего состава, мг/л:
Сс 8+=32, Снсо_== 122 и €{-0 =13,2 обрабатывается
одним едким натром, избыток которого составляет
0,2 мг-экв/л. Определить общую щелочность обработан-
ной воды.
Ответ- 3,2 мг-экв/л.
4-26. Взято 10 л исходной воды следующего состава:
//<of= 11,7 мг-экв/л; =121,4 мг'л; Ссо>=5 мг/л;
Жк=5,4 мг-экв/л. Сколько необходимо ввести в это ко-
личество воды кальцинированной соды, чтобы получить
умягченную воду с избытком ?NajCO3= 1*2 мг-экв/л.
Ответ: 3,96 г.
4-27. Чему будет равна остаточная жесткость умяг-
ченной воды по условиям задачи 4-26, если в растворе
оставалось 40 мг/л СаСОз
Ответ: 6,23 мг-экв/л.
4-28. Исходная вода следующего состава: yWo=5,4;
/й’ = 1,8 мг-экв/л; С .. =70; Сгп — 11 мг'л может быть
обработана пли NaOH+Na2CO3, или СаО-ММа2СОз.
В каком случае количество образующегося осадка бу-
дет меньше? В обоих случаях количество остающегося
в растворе СаСОч составляет 35 мг/л и Mg(OH)g—
0,28 мг-экв/л.
4-29. На водоочистке производительностью 60 т/ч
брутто умягчается вода, качество которой приведено
в предыдущей задаче. Определить количество осадка,
состоящего нз гидроокиси магния и карбоната кальция,
выпадающего в процессе умягчения в осветлителе за
сутки, в случае обработки воды CaO+Na^COs (а) и
NaOH + №гСОа (б) при условии, что остаточное содер-
жание в умягченной воде СаСОэ=0,3 и Mg(OH)*=
=0,2 мг-экв/л.
Ответ: а) 595 кг; б) 271 кг.
93
4-30. Состав исходной воды следующий, мг-экв/л:
?A"K; ^3+’ ^Mgs+> Qo» содержание в 5мягченной воде
СаСО3=в/ и Mg(OH)»==6'. Определить лочичество вы-
падающего Mg(OH)2 и СаСОз, мг-экв/л, прн обработке
воды: а) содой н известью; б) содой и едким натром.
Ответ: а) (2Лч + ССо, —°') + (СМ|!!+-К');
б) (C&s+ -o') + (CM6,+ -tf').
4-31. В котельной, оборудованной котлами давлением
1,0 МПа н общей паропронзводительностью 20 т/ч,
предполагается организовать умягчение добавочной во-
ды по схеме содово-регенеративного цикла. Определить
долю продувочной воды, направляемой в регенератив-
ный цикл, по значению сухого остатка и по щелочности
для исходной воды следующего качества, мг-экв/л:
2АО=3,9; Мк=2; СГ1,+ = 2,2; Ссо=0.5; сухой остаток
234 мг/л. Добавка исходной воды в питательную систе-
му составляет 80%. Режим котловой воды определяется
количеством сухого остатка, предельное значение кото-
рого составляет 2,5 г/кг прн рв=8%, и щелочности кот-
ловой воды 26 мг-экв/кг. Состав щелочности котловой
воды принять в соответствии с давлением пара в котле,
уЖк и л в формуле (4-25а) определить расчетным спо-
собом, Щ(! принять равном 0,3 мг-экв/кг.
Ответ <pi^±0,44; <рг>1.
4-32. Каков будет сухой остаток питательной воды по
условиям предыдущей задачи, если в регенеративный
цикл направить 80% продувочной воды? Какова была
бы продувка котлов прн этом, если бы предельное зна-
чение сухого остатка котловой воды составляло 2,5 г/кг.
Ответ; 248 мг/кг; рв=9,9%.
4-33. По условиям задачи 4-31 определить количество
едкого натра, которое необходимо дополнительно вво-
дить в осветлитель, чтобы полностью умягчить воду прн
(pi=0,34. Дозу этого реагента подсчитать без избытка.
Ответ: 3,32 мг-экв/л.
4-34. Какую щелочность будет «меть умягченная и
питательная вода при условии ее полного умягчения до-
полнительной дозировкой едкого натра в количестве
3,32 мг-экв/л (см. предыдущую задачу)? Какова будет
щелочность котловой воды в этом случае при рс=8%?
94
Ответ: Щу „=2,67; 2Д„В=2,13,
Щкв=26,7 мг-экв/кг.
4-35. Определить по усповпям задачи 4-31 суточную
экономию едкого натра, получаемую в результате осу-
ществления регенеративного процесса.
Ответ: 5,92 кг/сут.
4-36. В котельной установлены иеэкранированные кот-
лы давлением 1 6 МПа общей паропроизвочителыю-
стью 27 т/ч, водный режим которых характеризуется
предельными значениями сухого остатка (6,0 г/кг) и ще-
лочности (30 мг-экв/кг). Исходная вола, поступающая
на водоочистку, умягчается по схеме содово-регенера-
тивного цикла и имеет следующий состав: Х(.=
=7 мг-экв/л- С я. =5,64 'мг-экв'л; С = 201,3 мг'л;
Са2+ НСО3“
ССОа=15 мг/л; сухой остаток равен 654 мг/л. Возврат
конденсата составляет 55%; продувка котлов рп=5%-
Карбонатная щелочность умягченной воды равна
0.7 мг-экв/л. Рассчитать для этих условий содово-реге-
неративный процесс, т. е определить: а) количество про-
дувочной воды, кг/ч, направляемое на регенерацию;
б) количество дополнительно вводимых реагентов,
мг-экв/кг, питательной воды; в) количество реагентов,
сэкономленных за сутки; г) качество питательной воды
по шеточности и сухому остатку. Прп расчете состав ще-
лочности котловой поды взять согласно давлению в кот-
ле; избыток едкого натра в умягченной воде принять
равным нулю; избыток соды 1.2 мг-экв/л.
Ответ, а) 223 кг/ч; б) (NaOH) =
=2,3 мг-экв/кг: Ыа-СОг—0;
в) NaOH=3,84 кг/сут; г) Sn в=
=286 мг/кг: Щп=1,74 мг-экв/кг.
4-37. Определить продувку кот за по сухому остатку
(а) п щелочности, б) по условиям предыдущей задачи,
считая, что на водоочистку подается 75% продувочной
воды. Предельное значение сухого остатка н щелочности
котловой воды не может быть увеличено.
4-4. ДОЗИРОВАНИЕ РАСТВОРОВ РЕАГЕНТОВ
ДОЗАТОРМ ВЫТЕСНИТЕЛИ ПОПЛАВКОВОГО ТИПА
Дозатор этого типа, схема которого пр иве цепа на
рис. 4-4, наиболее прост в устройстве н обслуживании.
95
Рис 4-4 Схема доза
тора вытесните те по
плавневого типа
Он может использоваться при дозировке легкораство-
римых соединений — растворов кислоты, щелочи, коагу-
лянта, полиакриламида. В бак 2, заполняемый раство-
ром реагента плотностью ррг, кг/л, помещается попла-
вок /, в который поступает т-я доля обрабатываемой
воды, т. е. (Qn B/m) 103=Vn. л/ч. Соответственно нз ба-
ка 2 в воронку 3 и далее по назна-
чению вытекает раствор в объеме
л/ч.
(4-26>
Ррг
Меняя значение т н тем самым
Vf, можно увеличить или уменьшить
дозу раствора. С другой стороны,
р РрГС-,-1О ’ 7
где dv, Э, Ср- -соответственно доза,
мг-экв/л, эквнва 1ентная масса,
мг/экв, и концентрация реагента, %.
Обозначим площадь сечения поплавка 2 Fn, м2, тогда
время срабатывания раствора /р, ч, залитого в бак /,
равно:
” йрЭД— • (4-28>
Если задать tv, то можно определить необходимый
объем раствора Гпй, м3, прн данном Ср. Желательно
иметь /Р<М2 ч
ПРИМЕРЫ
4-12. Определить основные размеры дозатора-вытеснителя для
раствора NaOH при подщелачивании 50 м3/ч воды на 1.2 мг-экв/л
Решение. Приняв концентрацию раствора NaOH С«=10%,
по уравнению (4 27) няГпем*
,, 50-1,2.40
- 1,1-ю.io 22 1
Объем поступающей в поплавок воды равен (4-26):
VB= I -1 -22=24 л/ч,
или 24-21^.580 л/cvt. Объем поплавка принимаем больше ня 20%.
rvh-= 1.2-580=700 л: при Ь=1200 мм Fr=0,7/1,2-^0,6 м2. Диаметр
поплавка d= 1^0.6/0.725 ^0,88 м Прн толщине стенки 1,5 мм масса
потавкя составят примерно 40 кг, что д-ict осадку его в растворе
прнилшнгсльпо 60 мм Диаметр бака 2 следует принять на 100 мм
больше Как видно из расчета, дозаторы-вытеснители поплавковою
Of,
типа достаточно громоздки требуют специального делителя воды
(водораспределителя) и поэтому применяются главным образом на
небольших установках. К достоинствам их следует отнести простоту
устройства и обслуживания, надежность в работе.
СИФОННЫЕ ДОЗАТОРЫ
Схема сифонного дозатора приведена на рис. 4-5.
Обрабатываемая вода в количестве QM/m подается
в дозатор и вытекает далее из отверстия в воронку. Уро-
вень воды Н может изменяться от некоторого минималь-
ного значения до Н путем дросселирования сливного
Рис. 4-5. Схема сифонного дозатора.
I—поступление воды и\ водоотделителя; 2— регулятор уров-
ня //; 3 — сифонная трубка; 4 — регулятор уровня раствора
peaieHra; 5. 6 — ткнвы поплавка и сифона; 7 —стяжки для
регулировки; 8—бак рабочего раствора реагента
отверстия. Зависимость высоты уровня Н от производи-
тельности водоочистки определяется равенством
9.=<?,../т = 360О/аЦУ2^, (4-29)
где Д»— площадь сечения сливного отверстия, м2; р—
коэффициент расхода.
Объем раствора Vp, л/ч, который требуется подать
в обрабатываемую воду, определяется формулой (4-27),
которую можно написать в таком виде:
(4-30)
где
N_____
РрСр-10-
С другой стороны, для подачн такого количества
раствора необходимо погрузить сифонную трубку
7—209 97
в раствор реагента на глубину h„ м, определяемую из
соотношения
Vp=Q„ Л=frpM.6- юп (4-31)
где — площадь сечения сифонной трубки, м2; цтр—
коэффициент расхода трубки.
Обозначив Л,=.3,6 -IOYtpP-tpI^S^, нз уравнения (4-31)
получим:
А<=(^)*- (4-32)
Кроме того, желательно, чтобы при номи-
нальной нагрузке установки Qn. Если й^>0,8йо или
Л,<О,2йо, то целесообразно изменить fTp или Ср, или
обе эти величины, руководствуясь соотношением
ПРИМЕРЫ
4-13. Определить основные параметры сифонного дозатора рас-
твора соды содоизвсстковой установки производительностью 100 т/ч,
если Жни—2,5 мг-экв/л, 0=1.0 мг-экв/л: dK=-=0.
Решение По уравнению (4-22) находим дозу кальцинирован-
ной соды dp=/?cfl=3,5 мг-экв/л; концентрацию рабочего раствора
принимаем равной: Ср=5%. и ррг=1052 кг/мя. Снятие фактических
размеров на установленном дозаторе дало следующие предельные
значения (рис 4-5): Я=0,6 м, ho~0,35 м. диаметр сливного отвер-
стия dB=2-10“a м. Подставив значении Н, fB=0.785dB в (4-29)
при р=0,62, найдем fB%;2,4 мэ/ч. Принимаем ?в=2 м3/ч (2%) и
устанавливаем эту «отсечку» иа водораспределителе. Объем раство-
ра реагента, который необходимо дозировать в обрабатываемою
воду, найдем по уравнению (4-30) прн Э— 53 Ур=352 л ч. Эффек-
тивное значение йр при QKB=100 т/ч принимаем 0,5 Ло=ь:0,18. Тогда
по уравнению (4-31) площадь се тении сифонной трубки должна со-
ставлять
f-гр ~~
352
0,6-3,6-10'./19.6-/0,18 ==П'87',П "•
откуда dTp=10 5 мм После этого сифонную трубку этого размера
обычно тарируют, чтобы уточнить значение коэффициента расхода
Ртр, который в расчете принят 0,6.
4-14. На содонзвестковую установку, приведенную в примере
4-13, должна быть подана вода из другого более минерализованного
источника, для которой Жнк=3,8 мг-экв/л, и, следовательно, d'?—
= 4,8 мг-экв/л. Какие изменения в связи с этим необходимо внести
в сифонный дозатор?
98
Решение. В связи с увеличением d'v возрастает объем дози-
руемого раствора до
г/’о 4,8
У'р Ур -- - 352 _ 482 .1/4.
Для подачи такого количества сифонную трубку необходимо по-
грузить в раствор на глубину Л'р, м.
Лр ! /тр|*гр-3.6-10"К2^- (4'33)
Подставив fTp=0,785• 10“‘, рТр^0,6, £=9,81 н V'p=482, най-
дем Л'р=0,8 м, что значительно превышает фактическую глубину
бачка Ло=О,35 м, указанную в примере 4-13. Таким образом, необ-
ходимо заменить сифонную трубку другой с диаметром
./'тр = d,„ VV"p, Vp = IП /482/352 =s 12 Mv.
4-15. Найти соотношение между диаметрами дпеков 5 и 6
(рнс. 4-5)
Решение. При производительности установки QH в, м’/ч, м
дозе реагента dP, мг-экв/л, можно составить следующее равенство
VpPprCp-108
<2».о'/рЗ=----JJ5---, (4-34)
где V9-—объем раствора реагента, л/ч, подаваемого в обрабатывае-
мую воду; Ср— его концентрация, %; ррг — плотность кг/л, откуда
F»= ppj.Cp-10* ,4'34а)
VP подаетси через сифонную трубку сечеинем /тр> мг, погруженную
в раствор на глубину йь м, тогда
Vp=V>.fTpV2gVh^-3.6-lOe = A1Vhl, (4-35)
о । куда
__ Ои.В^рЭ
Г*.-рр,Ср.10А-^- (4-36>
где
dp3
N‘ = РрсСр.ЮЛ,
Для Qi<Qa а можем по аналогии с уравнением (4-36) напи-
сать
/л7=Л',<21. (4-36а)
Вычтп выражение (4-Зба) из (4-36), найдем
Ahp=AI^ha=№1(Q«B.B-Qzi). (4-37)
7* 99
Но поскольку
Q*.*=rrufa
то
«7'в =f/b v^g КЛ-3,6.10* - A V7rt
и соответственно q”e = А, VHt, тогда
ДЛр=№1тМ*2(Н1—Н,) «Л4ЛН, (4-38)
где Л1=Л?2|ГнМ*2; [в — площадь сечения сливного отверстия в сосуде
с регулирующим поплавком, №; <? —расход воды через отверстие
fH, м3/ч, остальные обозначения — см. рис. 4-5.
Поскольку
ДЛр=л^а1/360 и ДН—nDos/360,
где Qi, аг—угол поворота дисков 5 и 6, то, следовательно,
dO[/(£)a?)— М. Вычислим отношение М для следующих данных:
Qwb=100 мв/ч; Qi =70 м’/ч; m=50; dp=3 мг-экв/л; ррг=1 кг/л;
С,.= Ю%; /в—3.14-10-4 м2 (с?в=2С1 мм); /тР=0,785 10"* и2 (dTp=
= 10 мм); 3=53 (для ЫагСОз), ц%0.62;
Л' kfprCcJnfrIjlx/4i.3,6.IO«/ “
( dp3mf, ( 3.53-50-3,14-10-’ у
“ 1рргср.1О/тр.1О’) “ (. ыо-ю-о./ез-ю-’-ю*J = °-11 •
Задавшись d и щ или D и Оз й располагая значением М, можно
найти характеристику другого диска трансмиссии дозатора.
ДОЗАТОРЫ С РЕГУЛИРУЕМЫМ ПРОХОДНЫМ СЕЧЕНИЕМ
Схема одного из дозаторов такого типа приведена на
рис. 4-6. Вместо сифонной трубки 3 (рис. 4-5), рабо-
тающей по принципу изменения напора h, используется
Рис. 4-6. Схема дозатора с «иглой».
/ — регулятор дозы: 2—бачок с раствором реагенте; 3—регулирующей
«игла>; 4 — стяжка.
100
регулирующее тело («игла»). Здесь изменяющимся па-
раметром является свободное сечение прохода /к=
= -^- {D20—сРя). При проектировании важно бывает по-
строить профиль «иглы». Поэтому найдем зависимость
(/и от Do, Н и h.
Исходя из уравнения (4-35), можем написать Vp—
—/Г/н или
fK=VP/A't (4-39)
где А' = 3,6- 10epV2g/i .
Подставив значение Ур из уравнения (4-34а) и из
вышеприведенного выражения, получим:
С4-40*
откуда
О’. —яррГСр-10Л' ' (4-41)
Подставив TQ„ ,=m<;B=3,6-и А’ иэ
уравнения (4-39), окончательно получим:
или, обозначив выражение перед корнем VHfh через N':
4.=^ (4-42а)
ПРИМЕРЫ
4-16. Определить профиль «иглы» дозатора для условий приме-
ра 4-13
Решение. В уравнении (4-42а) переменной является Ун.
Это значит, что «игла* должна представлять собой простой конус
с определенным углом 2а. Дли его нахождения необходимо для
двух значений производительности водоочистки Qi и Qs, ма/ч, найти
Hi>Hi по уравнению (4-29) (значение т принимают по данным
Характеристики водораспределителя). По уравнению (4-42а) нахо-
дятся соответственно di<;d2. Тогда
dB — d,
tg°°'2(Zf,-tf,)AI > f4"43’
где М=ОЯ/О; £)д. О —диаметр дисков (см. рис. 4-6).
101
Для данного примера принимаем Qi=100 №/ч и <2я=50 м’/ч;
dB=20 мм; £)о=2О мм; ft=350 мм; g=0,62; m=50; q=Qfm\ dp=
=3.5 мг-экв л, 3=53; Ср=5%; рр=1 кг/л; /в=3.14-10~4 м2
Подставив соответствующие значения в уравнение (4-29), най-
дем /71 = 0,415 м, //2=0,104 м. По уравнению (4 42а) определим
di=18,0, ds=19,7 мм. Тогда при М=0,2 по уравнению (4-43)
tg а=0,033 и 2ся^2°. Столь малый угол конуса объяснистся высокой
концентрацией рабочего раствора соды, принятой в расчете. При
Ср=1% 2a=t34*.
Рис. 4-7. Дозатор постоянной дозы.
/ — поплавок, 2 — диск; 3 — патрубок; 4 — бак
На рис. 4-7 изображен дозатор, работающий прн переменном
уровне раствора в баке 4, но с постоянной дозой реагента.
Диаметр диска 2 определвется по формуле
, / 4?р
(4-44)
где D — внутренний диаметр патрубка, м; qv — расход реагента, м’/с.
В тех случаях, когда доза реагента может оставаться постоянной,
этот дозатор имеет преимущества.
НАСОСЫ-ДОЗАТОРЫ
Желательно, чтобы иасос-дозатор работал в преде-
лах 20—80% своей производительности. Следовательно,
концентрация рабочего раствора реагента Ср, %, долж-
на быть выбрана в соответствии с производительностью
насоса дозатора Vp, л/ч:
р,___Ои.в^рЭ
р~ PprVp-10
Схема включения насоса должна обеспечивать точ-
ную дозировку реагента. Основное требование состоит
в том, чтобы гидродинамические условия в системе на
всасывающей стороне насоса оставались постоянными.
На рис. 4-8 приведены возможные схемы включения
насоса дозатора. В схеме (рнс. 4-8,а) с течением вре-
мени уровень в баке / будет постепенно уменьшаться.
102
Вместе с этим будет изменяться н коэффициент напол-
нения цилиндра
где Цф, q-r — фактическая н теоретическая производи-
тельности насоса.
Поэтому такая схема не может быть рекомендована.
В схеме (рис. 4-8,6) напор нагнетания ри циркуляцион-
ного насоса должен быть меньше гидравлического со-
Рис. 4-8. Схемы включения насосов-дозаторов.
/—бак раствора реагента; i—насос-дозатор, 3 — циркуляционный насос:
4 — бачок постоянного уровня; S — мерник.
противления линии нагнетания насоса дозатора Лг.с,
т. е. Рп<Лгс- Если рн>Лг.с, то раствор реагента будет
поступать в реактор непрерывно в ненормированном
количестве. Необходимо также, чтобы рн было практи-
чески постоянным Наиболее целесообразна схема
(рис. 4-8,б) с постоянным напором на всасе насоса-до-
затора и мерным сосудом 5, который необходим для
периодической проверки работы насоса -дозатора и по-
даваемой им дозы. Дело в том, что при попадании в си-
стему воздуха насос прекращает подачу реагента,
а контроль этого состояния возможен только по сосу-
ду 5, на который насос временно переключается. Сосуд
5 снабжается соответствующей измерительной шкалой.
Доза, подаваемая насосом-дозатором, не зависит от
качества и количества обрабатываемой воды. Это при-
емлемо прн дозировке таких реагентов, как полиакри-
ламид, коагулянт и др., допускающих изменение дозы
без ущерба качеству обработанной воды. Во всех других
сзучаях требуется управление работой иасоса» ВТИ раз-
работал способ автоматического регулирования, осно-
ванный на принципе импульсного режима работы иасо-
са. Он состоит в том, что насос-дозатор работает в тече-
103
ние tp, после чего он останавливается иа tn. Длнтель-
ность всего цикла fo=/p+/n.
Можно составить следующее балансовое равенство:
%rfA5=4p^cA’ С4-46)
откуда
Q-.-rfp5
(4-46а)
VpPprCp.lO ’
ПРИМЕРЫ
4-17. Определить tp я t0 дли установки QH B=100 т/ч; dp=
=0,8 мг-экв/л; 3=57; Ср= 15%; ррг=1.0 кг/л; Vp=65 л/ч.
Решение.
fp 100.0,8-57
Г, —65-М6-10;г=0’5'
где ta принимается равной меиее 30 с дли известкового молока в
40 с дли коагулянта.
4-S. ОБРАБОТКА ВОДЫ В СИСТЕМАХ ОБОРОТНОГО
ВОДОСНАБЖЕНИЯ
ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ В ОХЛАЖДАЮЩЕЙ ВОДЕ
Рис. 4-9. Схема цикла оборот-
ного водоснабжения.
Схема цикла оборотного водоснабжения представ-
лена на рис. 4-9. В теплообменник (конденсатор) 2 на-
сосом 3 подается охлаждающая вода с начальной тем-
пературой tt. Подогретая вода с температурой на-
правляется для охлаждения
в брызгальный бассейн
(или градирню) /, в кото-
ром происходит ее разбрыз-
гивание в соплах 4. Пони-
жение температуры воды
происходит за счет ее кон-
вективного охлаждения и
испарения. Ввиду этого в
системе происходят нако-
пление солей и увеличение
их концентрации.
Введем следующие обо-
значения: </д» qnil— количест-
во добавляемой в систему и выводимой из нее (продув-
ка) воды, м3/ч; Сд — концентрация веществ, не выпа-
дающих в осадок (например, хлоридов) в добавочной
воде, мг/л; Сх — то же в охлаждающей (цнркуляцнон-
104
ной) воде в момент времени т; W— объем воды в обо-
ротной системе, м3.
После этого можем написать уравнение баланса ве-
ществ, не выпадающих в осадок, в момент времени т:
9дСд^т=(4-47)
Решение этого уравнения относительно Сх приводит
к следующему равенству:
СХ = ^ (1 - е-8’)+С„е-8’, (4-48)
где B=q^/W.
При длительной работе системы (т->оо) значение Сх
стремится к пределу:
Сх
Ча
Ча— Qi
Qt---Сц»
(4-49)
где qt — количество испаряющейся воды, м3/ч; Сц —
концентрация в циркуляционной воде, мг/л.
Отношение
Л',=&-=—&------=— (4-50)
у Сд Чл — Ч. о >
называется коэффициентом упаривания, показывающим,
Рис. 4-10. Зависимость коэф-
фициента упаривания Кт от
продувки системы при значе-
нии pi, %.
1—0,5; г—0,8; 3—1.2; 4 — 1.6.
во сколько раз концентрация растворенных веществ
в циркуляционной воде больше, чем в добавочной.
Обозначим количество воды, находящейся в обороте,
Qf>6, мэ/ч, тогда
а _. .. _Р10ой
Ча 100 — 100 ’ — 100
ЮБ
Подставив эти величины в уравнение (4-50), полу-
чим:
^у=Рд/ (Рд Pi) =Рд/ Рдр. (4-51)
где рд, рпр, pt — добавки воды в систему, продувка си-
стемы и испарение воды в системе в процентах от Qoc:
Рд=Рпр+Р1; рпр=р2-Ьра, (4-52)
где р2, рз — соответственно потеря воды на разбрызги-
вание (унос) и собственно продувка (сброс) в процен-
тах Qo6.
Зависимость (4-51) приведена на рис. 4-10.
ПРИМЕРЫ
4-18. Система оборотного водоснабжения с объемом воды W=
= 10* м3 заполнена водой следующего качества: Сд—350 мг/л; ще-
лочность Н1а~3,7 мг-экв/л; общая жесткость Жд=4,5 мг-экв/л и
концентрация ионов, мг-экв/л:
ЗЛ Смв!+=0'7’ С№+=3.7; Сс1. = 1.0; CS9_„ =3,5.
Определить.
а) время, в течение которого вода в системе достигает предель-
ней концентрации Сц при рВр=3,0% и Qob=6-103 №/ч;
б) скорость нарастании концентрации, мг/л, при рпр=3%-
Решение. Для определения времени нарастания концентра-
ции необходимо уравнение (4 48) решить относительно т. "Тогда
1g А
п 4пр РлрОэ!»
Сц — .<С„ • B~W~ 10WZ
или, если учитывать соотношение (4-51),
ЛУС„--С, _с„-с,
Сн Сц — С|,
(4-53)
(4-54)
Как видим, время нарастания концентрации т зависит от отно-
шения Qoo/W'. чем оно меньше, тем медленнее изменяется концен-
трация растворенных веществ в циркуляционной воде Предельная
концентрация Сц=К»Сд. Для определения Kv необходимо знать
долю испаряющейся воды, которая равна [1J.
Р1=0,16хД/, (4-55)
где х — доли теплоты, отдаваемая воздуху испарением: лето 1,0,
весна и осень 0.75. зима 0,5; — разность температур циркуляцион-
ной воды до и после ее охлаждения.
106
Для Af=8 К и весенне-осеннего периода найдем pi=0,16-8X
Х0.75=0,86%, Тогда рд=рпр+р1 = 34-0,96=«4% и Лу=Рд/рпР =
-=1,35; Сч= 1,35-550=740 мг/л.
Приняв Сх=0.99 Сп и СВ~СЯ, определим:
С -10-а
А = 7=-----р- =0,039 11 В= I810--
1р 0,039
Тогда : = —|0~4ge ' Ч* илн 7’^ СУТ’
На рис. 4-11 приведена зависимость т от отношения Qoe/V.
а на рис. 4-12—-от рпр- Наиболее сильно т зависит от отношения
Qoc/w, а также от продувки.
Для определения скорости на-
растания концентрации веществ
в воде оборотного цикла необхо-
димо продифференцировать повре-
Рис. 4-12. Зависимость г
от продувки системы.
/. 2 — отношение <2„вЛР со
ответственно 0,6 и 2 для
К, = 1.2. 3 4 —то же для
КТ-1Л
Рис. 4-11. Зависимость времени
нарастания концентрации хорошо
растворимых веществ в циркуля-
ционной воде от соотношения
Qob/W' при рпх>=3%.
1 — Xs=O,t; 2 —/Су-1 Д
мени выражение (4-48), откуда vK, мг/(лч) или мг-экв/(л-ч),
равно:
Рщ>_ Зоб
wo w у
VK---- [QQ ОД/ е Iе Ц <-н) *
(4-56)
Подставив численные значении, получим:
ок=18-1(Г3-190е0-01В1 = 3,42e-D,0lBl-
За первый час скорость роста составят 3,4 мг/(л-ч). С течением
времени скорость будет уменьшаться.
4-19. Для условий, изложенных в примере 4-18, определить па-
раметры водно-химического режима данного оборотного цикла, если
Д(и=4,2 мг-экв/л.
107
Решение. Основными параметрами водно-кинического режима
оборотного цикла являются продувка, добавка и коэффициент упа-
ривания.
Главное требование к водно-химическому режиму систем оборот-
ного водоснабжения состоят в том, что в системе должны отсутство-
вать накипеобразованне и коррозия оборудования и трубопроводов.
Как известно, иакипеобразование в системах обусловливается выпа-
дением нз раствора СаСОз, возникающего при разложении бикарбо-
ната кальпия:
Са (НСОе) —^СаСОз+СОа+НзО
Если такое разложение в системе отсутствует, то имеет место
соотношение
(4-57)
где Ща— щелочность соответственно циркуляционной и доба-
вочной воды, мг-экв/л.
При Шъ>КуШа в систему добавляются или поступают щелоч-
ные вещества; соотношение Щц<.КуЩа свидетельствует о том, что
в системе происходят распад Са(НСОз)а и образование отложений
а количестве
= (4-58)
Дли нашего случая КуЩя = 1,35-3.7=5, следовательно, ДЩ =
=5—4,2=0,8 мг-экв/л. Для предотвращения иакипеобразования
можно прнмеикть два способа, а) ввести соответствующую обра-
ботку добавки; б) увеличить добавку свежей воды в систему. В по-
следнем случае, если указанное значение мг-экв/л является
стабильным параметром, следовало бы работать с коэффициентом
упаривания =4,2/3,7= 1,135. Учитывая уравнение (4-51)„ найдем
добавку рд:
1,135
Ку— 1 А—0,13В1
т. е. и систему следовало бы добавлять свежей воды:
9д=0,084-6-10э=500 м»/ч,
что может оказаться экономически невыгодным и нецелесообразным.
Тогда остается первый способ — специальная обработка добавки.
В этом случае целесообразно снизить добавку воды в систему
к экон! шчески выгодному минимуму.
4-20. В качестве добавочной в оборотную систему объемом
8-103 м5 добавляется свежен вода с расходом 150 мя/ч, загрязнен-
ная Fe(OH)s в количестве 3,5 мг/л. В цикле оборотного водоснаб-
жения происходит ее окисление
2 Fe (ОН), + Н,0 + О, = 2Fe (ОН),
и выпадение гидроокиси железа в осадок с образованием отложений
в трубках конденсаторов паровых турбин.
Рассмотреть способы борьбы с этими отложениями, если Ку =
= 1,2; концентрация Fe(OH) в циркуляционной воде составляет
2,3 мг/л; Qoc=6-105 м’/ч Система замкнута иа брызгальный бас-
сейн площадью F>400 м’.
Решение. Поскольку полное илв достаточно полное удаление
из воды Fe(OH)2 невозможно, to вн первый взгляд остается сдав
108
способ — увеличить добавку свежей воды с целью снижения Кт.
Однако в данном случае этот способ неприменим, так как он приве-
дет к обратным результатам: усиленному образованию отложений.
Такого явления следует ожидать во всех случаях, иогда СД>СД,
т. е. когда концентрация выпадающего в осадок вещества в доба-
вочной воде больше, чем в циркуляционной. Это можно показать
расчетом. При 1,2 и pi = l,O% (для весны н осени) рд =
= [Ку/(Кэ—l)]Pi=6% и в систему добавляется 5’103-6«10“^=
= 300 м’/ч. Поскольку в системе выпадает 3,5—2,3=1,2 мг/л
Fe(OH)b то общее количество ocapjia составит 300-1,2= 360 г/ч.
Снизим значение Кт до 1,05, тогда рд=20% и добавка увеличится
до 0,2-5-103=1000 м’/ч, а количество осадка до 1000-1,2=1200 г/ч.
Следовательно, во всех случаях, когда Сд>Сц, необходимо всемер-
но сокращать добавку, если окажется невозможным путем обработ-
ки воды изменить указанное неравенство и сделать Сд<Сц. В дан-
ном случае целесообразно снизить добавку ря до минимума. pR со-
гласно уравнению (4-52) определяется тремя величинами: рд=Р1+
+Рз+Рз- Потери воды на разбрызгивание зависят от типа охладите-
ля и составляют, % 1.11-
Брызгальные бассейны (^400 м2) 1.5—3,5
То же (>400 м2) . . . . 1,0—2.5
Башенные градирни (^150 м2) . . 0,5—1,0
То же (>150 м2) ..... 0.5
Открытые градиони.............................. . 1,0—2,0
Градирни с искусственной вентиляцией . . 0,25—0,5
Пленочные градирни . 0,25—0,5
Дли нашего примера можно принять рг=к!%, Рз=О, р2=2,5%
(среднее значение). Тогда рд=3,5% и в системе будет выпадать
210 г/ч Fe(OH)2 — минимум, который уже нельэи уменьшить режим-
ными приемами.
ОБРАБОТКА ОХЛАЖДАЮЩЕЙ ВОДЫ СЕРКОЙ КИСЛОТОЙ 1 ПОДКИСЛЕНИЕ!
Обработка циркуляционной (оборотной) воды произ-
водится с целью предотвращения образования в обо-
ротной системе карбонатных отложений. Это может
быть достигнуто подкислением добавочной воды серной
кислотой. При подкислении происходит разрушение
нона НСО-3.
НСО-1 + Н>со2+н2о,
чем достигается снижение щелочности добавочной воды
иа некоторое значение и увеличение концентрации
растворенной СОг в циркуляционной воде. Оба этн про-
цесса способствуют стабилизации щелочности воды
в оборотном цикле Щ'ц, т. е. устранению накипеобра-
зования. Общую щелочность добавочной воды
109
можно представить как сумму AZZ(n и остаточной ще-
лочности ZZ(0C, т. е.
Щл=Щт+ЫЦк. (4-59)
В этом случае
Ку ЩоС—Щ'ц,
откуда Щос=Щ'ц1 Ку.
Подставив это значение Щос в уравнение (4-59), по-
лучим:
(4-60)
Предельная щелочность оборотной воды Щ'ц дей-
ствующего цикла может быть определена анализом.
В других случаях (при проектировании) она находится
расчетом по следующей формуле [13]:
Л [(100 - Рз) Сцу + рд (Сд? + 44ЩД)] + 100b
100 + 44АИ ’ '
где А, b — коэффициенты, принимаемые по табл. 4-7;
Таблица 4-7
Значения коэффициентов А и Ь в формуле (4-61)
Темттепвтура оборот- ной воды, К Л ь
Оквсляеыость добавочное волы, мг/л С\
5 10 20 30
303 0,26 3,2 3,8 4,3 4.6
313 0.17 2,5 3,0 3,4 3.8
323 0,10 2,1 2,6 3,0 3.2
Сцу. Сду— концентрация СО2 в оборотной и добавочной
воде, мг/л.
Зная Ztf'y, можно определить по уравнению
(4-60), т. е. значение, на которое следует снизить ще-
лочность добавочной воды.
ПРИМЕРЫ
4-21. Определить месячный расход серной кислоты при подкис-
лении добавочной воды, подаваемой в оборотные циклы электростан-
ций (а) и (б), характеризующиеся следующими данными-
a) Qo6=45-103 м8/ч; Щд=4,2 мг-экв/л; рп₽=3%; Д| = 1,6%;
t=311 К; Сцу=3 мг/л; СЯ1=6 мг/л: ОИ=Ю мг/л О?; б) Qo в=
«=43-Ю3 м3/ч; 1ЦЛ—3,2 мг-экв/л; рпР=2.5%; p^l.2%, /=303 К,
Сцу=в мг/л. Сду=7 мг/л; QK=& мг/л Оа.
110
Решение. По рис 4-10 находим Ку для указанных значений
О] и Рпр- Затем по уравнению (4-61/ определяем: а) ДГц—
=4,32 мг-экв/л; б) £tf'4=4,45 мг-экв/л, и по равенству (4-60) на-
ходим ДЩд- После соответствующих арифметических операций най-
дем: а) ДЙ?д=1,4 мг-экв/л; б) ЛЩд = 0,2 мг-экв/л. Расход серной
кислоты определяем по формуле
?ис=ДЖдЗ, (1-62)
где Э — эквивалентная масса H2SO4 Он составит, мг/л- a) q*c~
=68,5; б) дис=9,8. Количество выделившейся СО2. мг/л, находим
по формуле
?со,^44Дадд, (4-63)
а) 9Со =61,5 мг/л; б) дсо =8,8 мг л. На это значение повы-
сится концентрация СО2 в добавочной воде В циркуляционной воде
увеличение будет, естественно, меньше. Оно может быть определено
по формуле
= 100 Л 9со,• (1 -64)
где: а) рд=4,6'>/о; б) рд=3,7% и. спедоватетьно, a) hCCQt
-=2,8 мг, л; б) &CCq =0,34 мг/л. Месячный расход HjSO, на под-
кисление добавки будет составлять:
а) ?кс = Соб7рд • 10~в=б8Л-45-103-10 в-4,610 2 720= 102 т/мсс;
б) 9i.c%12,0 т/мес, где 7 —число часов в месяце.
4-22. Оборотная система охлаждения работает с расходом цир-
куляционной воды 250 м3/ч. В качестве добавочной используется
вода со щелочностью Щя~4 3 мг-экв/л; скисл ясмостью О|,=
= 10 Mi/л О2; концентрацией свободной углекислоты Сду=20 мг/л
Условия работы системы: Pi=l,5%; температура нагрева 313 К,
концентрация СО2 в воде, прошедшей градирню, 5 mi/л Определить
значение рд, обеспечивающее безнакнппый режим работы системы
Решение Для этого следует решить уравнение (4-61) отно-
сительно ра, имея в виду, что Ку=Рд/₽пр=Д(ц//Дд. Решение дает
Рд=27%. Это значение добавки достаточно большое, и. следователь-
но, этот путь предупреждения накнпсобразования может быть при-
емлем только для небольших оборотных цпклов, подобных заданно-
му в этом примере.
ОБРАБОТКА ВОДЫ ГАЗАМИ. СОДЕРЖАЩИМИ СО* JРЕКАРБОНИЗАЦИЯ]
Обработка воды дымовыми газами, содержащими
СО2, имеет целью увеличить концентрацию свободной
СО2 в оборотной воде и восстановить нарушенное рав-
новесие реакции
Са (НСО3)2^СаСО3+СО2+Н2О.
Для этого дымовые газы приводят в контакт с об-
рабатываемой водой тем или иным способом, в резуль-
тате чего происходит растворение компонентов газа,
111
в том числе СО2 и SO2. Растворение SO2 вызывает под-
кисление воды:
SO,+Н,О H,SO, + 2Н+ + SO,-;
H,SO, + Ц- О, — H,SO. + 2Н+ + SO,2-;
НССГ + Н+ СО, + Н,О.
Как следует из этих реакций, примерно 32 мг/л
растворенной SO2 понижает щелочность воды на
1 мг-экв/л. Количество SO2 в дымовых газах, г/м3, мо-
жет быть определено из выражения [1]:
^so,= Pso/so, ’ 1 О*» (4-65)
где pSOj — плотность SO,, равная 2,97 кг/м* в нормальных
условиях; pso—парциальное давление SO2, определяемое
иэ выражения
<?
^so,= а(13Ср + 44/7р)" (4'66>
где а — коэффициент избытка воздуха; Ср, Н$, Sn —
концентрация в рабочем топливе углерода, водорода и
летучей серы, %.
В табл. 4-8 [J] приведены значения pSOj для некото-
рых топлив при а=1,5.
Таблица 48
Характеристики топлив
Топливо Ср-% "р-% rso,-10’
Торф ... 30 3,5 0,2 0„25
Антрацитовый штыб 70 1 5 1.5 1.1
Подмосковный уголь 33 2.4 2.1 2,5
Донецкий длинопламенный 52 3,7 3,9 3,5
Кнзеловскнй 56 3,9 5.5 4,1
Челябинский 42 3 1.0 1.0
Необходимая для стабилизации бикарбонатов доза
СО2, мг/л, определяется по следующей формуле [13]
(без учета подкисления воды S02):
fl ___1Р0 Дд _____________Е^с_______— гл
“со,— Л ~~ 100 100 ДУ A*
112
где Сцу, С„у — концентрация углекислоты в циркуляци-
онной воде после охладителя и в добавочной воде, мг/л;
А и b — коэффициенты, определяемые по табл. 4-7.
Количество газов Vr, м3/ч, содержащих рсо.. %, угле-
кислоты, которое необходимо пропустить через обраба-
тываемую воду, чтобы обеспечить указанную выше дозу
СОг, подсчитывается по формуле
У ___ (4со, — £цу) Фоб
г />coi₽co*₽co/10 ’
(4-68)
где рс0 —доля поглощаемой СО,; рсо — плотность СО,*,
равная 1,97 кг/м’; — расход оборотной воды, м’/ч.
ПРИМЕРЫ
4-23. Проектируется система оборотного водоснабжения для тур-
богенератора 100 МВт с расходом циркуляционной воды 15 000 м3/ч.
Температуря воды в системе 308, добавочной воды 298 К, Добавоч
пая вода имеет следующий химический соствв.
ZZf —3,8; Х = 4,7; С^+=3,5 мг-экц/ч; Сду’=7;
Сц , = 3; CNa+=3S; Са_ = 29;
С^^3_ = 77 мг/л, Ок = 10 мг/л О„ сухой остаток 450 мг/л.
4 «
Водный режим оборотной системы должен определяться следую-
щими величинами- рд=2,9; рпР=1,5; р: = 1Д Вычислить основные
технические показатели при обработке оборотной воды дымовыми
газами, если объемная доля углекислоты составляет 18% (мольная
доли 10%), a SO2 0,5%.
Решение. В систему ежечасно будет добавляться IS-IO’X
X0,029 = 435 м3 свежей воды Коэффициент упаривания Кг=
—PvJpnv= 1.93. Количество воды, удаляемой продувкой, составит
225 м3/ч и будет испаряться 210 м3/ч. Щелочность циркуляционной
воды составит 1.93-3.8=7,35 мг-экв/л. Для поддержания щелочности
на этом уровне необходимо, чтобы в воде присутствовало количество
СО21 определяемое по формуле (4 67). Подставив в нее численные
значении, найдем dcol = 13.4 мг/кг По условию в оборотной воде
имеется уже СО2 в количестве
С«У = W СД. + = 3 "Г/КГ' <4-69’
Следовательно, в оборотную коду необходимо ввести дополни-
тельно 10,4. Этот ввод осуществляется барботажем газа через слой
воды, смешением ее с газом в эжекторе или другими способами.
Количество COj, которое в данных условиях может перейти и рас-
8—209 113
гвор (Л Су), должно быть больше необходимой дозы. В данном
случае
ДС,= аС01рС01 СО1> 10,4 мг/кг. (4-69а)
Значение — 1,1-10’ (по рис. 2-1), Pqq равно мольной до ie
COS (0,1), степень использования СОа ₽с0 = 0,4 -?-0,6 [1]. Тогда
ДСЛ=1,1-Ю3* 0,1-0,5=55 >> 10,4 Количество газов, необходимых для
обработки воды, будет равно 890 нм3/ч [формула (4-68)].
После этого целесообразно оценить возможность возникновения
в оборотной системе коррозии, обусловленной относительно высокой
концентрацией СОа- Для этою можно использовать формулу (1-9)
Если концентрацию Снсо_ выразить в мг-экв/кг н иметь в ви-
ду, что
, , с =_____________!______
'н+ 'НСО— Н+ IQPH + Vp. ’
го уравнение (1-9) можно представить в виде
= МСпер, _ 44ВД,
со‘ к,-юрН + K,.iopit+₽p
(4-70)
Из этой формулы можно найти pH, подставив 1Дц~КуЩя—
= 1,93-3,8=7,3 и Ki =4,52-10-7 и определив р. по формуле (1-4).
Значение pH будет примерно равно 7,52, что вполне присяг л емо
Гак обстояло бы дело, если бы в дымовых газах не было SOj. Но
по условию в 1азе содержится объемная Доля SOs 0.5%, что меняет
картину Прн добавке 2,9% в систему поступает 435 м3/ч свежей
воды. Принимаем, что обработка ведется добавлением воды. Тогда
за счет подкисления SO2 щелочность се снизится на
КСьо, PSO.-J0-
й/"- )2.J(J--Qa„,
Птотность SO2 ръо 2,86 кг нм®. С гедовательцо, щелочность
оборо гой волы составит Л/Ц=К,.(3,8—0,9)=5,5. При подкиеденнц
воды SO2 выделится углекислоты 44-0,9^-40 мг/кг добавка нлн
40-0,029^=1,2 мг/кг циркуляционной воды и общая ее концентрация
достигнет 34-1,2=4,2 мг/кг. В связи с уменьшением ДД. уменьшит-
ся и необходимая доза СОз, которая составит по формуле (1-67)
4,4 мг/кг Если не уменьшить количество газов, идущее на обработ-
ку, растворенное количество СО2 станет больше необходимою, что
сделает воду коррозионно-агрессивной. Полому необходим повтор-
ный расчет с уменьшенных! количеством газа
4-24. Рассмотреть вариант работы системы в условиях предыду-
щего примера прн продувке рПр=0,5%, т. е. прн р3=0 и рг~0,5%
(охлаждение в градирне)
Решение. По уравнению (1-67) определяем необходимую дозу
СОа, полагая Cso =0. Д-гя этого предварительно находим Kv~
= Рв/Рпр— 1.9/0,5 = 3,8. Подставив это значение Ку в уравнение
<4-67), найдем dc0 =41,3 мг/л. По уравнению (4-Ь9з) пр» Рсо,=
114
= 41,3— 3=38,3 получим =0,64 к далее по уравнению (4-68}
опреде 1нм Уг 4500 м3/ ч и нормальных условиях. Столь высокое
значение dCQ может быть достигнуто точько путем обработки всего
потока циркуляционной воды перед конденсатором. Увеличение
почти в Б раз расхода дымовых газов есть результат повышения ко-
эффициента упаривания примерно в 2 раза Общая щелочность обо-
ротной воды при безнакнпвом режиме достигнет 3,8-3,8=14,4 мг/л
Такую весьма высокую щелочность, как показывает опыт, практиче-
ски нельзя надежно стабилизировать Поэтому при условиях преды-
дущего примера нельзя работать с малой продувкой, если в газе
нет SO2. Однако и здесь картина меняется, если учесть наличие SO2
Прн продувке 0,5% и добавке 19% в систему будет подаваться
всего 285 м3/ч добавочной воды. Для снижения ес щелочности на
АЩД=2,8 мг-экв/л из уравнения
^r^sOj Pso,'
бЩд. з2<Зг- 1Q* (4-гОа}
находим УР=860 мэ/ч. Тогда щелочность циркуляционной воды бу-
дет составлять 3.8 мг-экв/л, а концентрация свободной СО2. как и
в предыдущем примере, 8,5 мг/л, что достаточно для стабилизации
воды Поэтому рекарбонизация (без S02) может успешно приме-
няться только для стабилизации вод со щелочностью не более
3 мг-экв/л
ОБРАБОТКА ВОДЫ ФОСФАТАМИ
Обработка циркуляционной воды фосфатами имеет
целью воспрепятствовать кристаллизации карбоната
кальция на теплопередающих поверхностях оборудова-
ния, включенного в систему обратного водоснабжения.
Как полагают, это достигается тем, что на гранях ми-
крокристаллов СаСО3 образуется Са3(РОь)г, препятст-
вующий дальнейшему росту кристаллов и их агломера-
ции. В качестве реагентов при фосфатировании приме-
няют гексаметафосфат (НазРО3)6, трииатрийфосфат
Na3POi-12H2O и суперфосфат Са(Н2РСк)2. Эти реаген-
ты дают примерно одинаковый результат по предотвра-
щению низкотемпературного накипеобразования. При-
меняемая доза реагента в пересчете на Р2О5 составляет
1,5—2,5 мг/л.
При температуре охлаждающей воды до 323 К пре-
дельное значение ее щелочности, мг-экв/л, может быть
определено по формуле [13]:
Щцф=а~ 0,15Жнк, (4-71)
где — жесткость некарбонатиая, мг-экв/л; а — со-
ответственно равно, мг-экв/л: 7,0 — для поверхностных
вод; 6,0 — для артезианских.
8*
115
Требуемое значение поддерживается продувкой
«системы р3, определяемой по формуле
р = -Щы»__р
Р‘ Шм-иц Р‘
(4-72)
Если при расчете найдено, что ра^О, то это будет
означать, что продувка системы излишняя, так как
естественного уиоса достаточно для поддержания задан-
ного значения ЩЦф« Такой сличай возникает, если
Вдцф (4-73)
Если решить уравнение (4-72) относительно Л/Цф, то
получим:
Приняв в качестве предельного значения Щд$=
—7 мг-экв/л и Лу=2, найдем Щд=3,5 мг-экв/л. Следо-
вательно, фосфатирование может быть успешно приме-
нено при указанных условиях, если щелочность добав-
ляемой воды не будет превышать 3,5—4,0 мг-экв/л.
В противном случае следует применить комбинирован-
ный способ обработки: фосфатирование плюс подкисле-
ние. В этом случае щелочность в размере Шу,—
=3,5 мг-экв/л следует удалить кислотой, остальную ста-
билизировать фосфатами, если выделяющегося СО2 бу-
дет для этого недостаточно.
ПРИМЕРЫ
4-25. Производственный объект имеет оборотное водоснабжение
с расходом циркуляционной воды 15-10s м3/ч Добавочная вода
имеет щелочность 4,2 мг-экв/л. Сду—10 мг/л. Температура воды
в системе составляет 303 К. Рассчитать режим фосфатирования цир-
куляционной води для летнего периода при охлаж и с оротной
иоды в градирнях с Счт=5 мг/л и А/=10 К, окисляемость Ок=
= 10 мг/л Оз.
Решение. Для летнего периода по уравнению (4-55) pi=
=«1,6%, для больших башенных градирен pi=0,6%. В целях эко-
номии свежей воды принимаем ps—0,6% Тогда по уравнению (4-51)
Ку=2,3 Так как пред. яыгос значение Д/Пф=7 мг-экв/л, то до-
пустимая щелочность добавка будет по уравнению (4-57) равна
Щд=3,0 мг-экв/л. Следовательно, одного фосфатирования при за-
данных условиях будет недостаточно
Возможны следующие пути: а) увеличить продувку до требуе-
мого значения; б) применить подкисление добавочной воды, отка-
завшись от фосфатирования; в) ввести подкисление совместно с фос-
фатированием. Для опреаслгапя про/...-км в варианте (а) найдем
116
требуемое значение коэффициента упаривания
Ку = ЩЦф/Щд =7/4,2= 1,67.
Отсюда можем написать:
г _ Рд____А + А 4- А А . .
Я Рпр Ра + Ра Ра 4" Ра
Решив это уравнение относительно рь, найдем
А —Oft 1,6— (1,67—I).0,6
р, -------к ।----------------1^7-П---------=1.80»/,. (4.74)
Тогда рл₽ = 1,804-0,6=2,4%, что составит 360 м’/ч добавочной
воды на компенсацию потерь с продувкой
В варианте (б) следует по уравнению (4-61) определить пре-
дельно допустимую щелочность циркуляционной воды £Ц'ц, которая
будет равна 5,7 мг-экв/л прн рз=0, т е при минимальной продувке,
тогда
Щ'И/КУ=4,2—5,7/3,7= 1,55 мг-экв/л.
В втом варианте продувка составит всего 0,6%, но потребуется
расход кислоты в количестве
<7ие=15-10’-2^-10-1-1,55-49 10~в-720=18 т/мес.
Экономически вариант (б) более выгоден.
Если принять стоимость добавочной воды 4,0 коп/ма (без стои-
мости электроэнергии), то экономия только от сокращении продувки
составит в варианте (б) по сравнению с (а)
ДЭф=(р“пр—pcnp)Qfl-10-*-4"8-10;,=b;86 тыс. руб/год.
Расход 75%-ной серной кислоты в год составит 18-12-1,33=
=288 т. При стоимости кислоты 13,7 руб/т общие затраты на кисло-
ту составят 288 13,7=3900 руб/год. Экономическая выгода оче-
видна
В варианте (в) необходимо снизить щелочность добавочной во-
ды иа 1,2 мг-экв/л. Тогда степень упаривания циркуляционной воды
будет ЩЦф//^д = 7/3=2,4. По уравнению (4-74) определим р2=
=0,64%, откуда /7д=2,8б%, рпр=1,24%. Расход 75%-ной серной
кислоты составит 1,2-15-103 2,86-10-’ -49 -10“® -720=18 т/мес. Коли-
чество продувочной воды будет равно 185 ма/ч Таким образом, этот
вариант дороже варг нга (б) на 95-8-103-4 10~2=29 500 руб/год
из за большей продувки системы Однако рассматриваемый вариант
имеет важное пренмуще «о, состоящее в том, что он в большей
мере, чем вариант (б), обеспечивает бескоррозионный режим рабо-
ты оборотного цикла. По тому п[ дставляется наиболее подходящим
вариант (б), дополненный фостатированием для создавия в системе
противокоррозионных условий. Расход технического продукта (фос-
фата), г/м®, с учетом потерь в расчете на 1 м8 добавочной воды
определяется по формуле
f, 5W X 100
9Ф=(^4- 2|9д ) Сф ’ <4"75)
117
где W—полный объем системы оборотного водоснабжения, м3; qR —
расход добавочной воды, м3/ч; Сф — содержание Р2О5 в техническом
продукте, % (в гексаметафосфате 50 52%, трннатрвйфосфате 17—
18%, суперфосфате 16—18%); d$— доза Р2О5, принимается в пре-
делах 1,5—-2,5 мг/л Р20з-
В варианте (б) рд=2,2% и, следовательно, дд=2,2-15-10эХ
X 10-^=330 м’/ч; 1Г=1000 м«, тогда ?ф = 2,13( 100/17) = 12,5 г/м’
суперфосфата.
4-26. Объем воды в бассейне оборотного цикла равен 5-Ю5 м3,
а количество воды в обороте 2-10* м’/ч. Через какое время работы
системы с момента пуска начальная концентрация хлоридов Ск
в оборотной воде увеличится вдвое при условии, что pi =0,012
Са~Сл и система работает бет продхвшР
Решение. По условию СЦ=2СИ=2СД
Условие работы системы без продувки определяется следующим
равенством:
W(CR-CJ=qRCKt=PlQRCRt, (4-76)
откуда
_ W (Сц — Си)
<ь£л
Подставив СП=2СВ и 9д=Р1фд. найдем /=5-105/(2-10‘-1,2Х
Х10-2)=2080 ч. Равенству (4-76) можно придать и следующий вид:
ку = с„/сд=1+-^-г.
ЗАДАЧИ
4-38. Как следует из равенства (4-56), скорость уве-
личения концентрации солей в оборотной воде при ра-
боте системы без продувкн зависит от отношения Qo^/W.
Чему должно быть равно это отношение, чтобы после
3,5 тыс. ч работы оборотного цикла и pi=l,2% значение
Ку не превышало 1,8? Какими единицами оно измеря-
ется?
4-39. По условию предыдущей задачи определить ко-
нечную концентрацию в воде хлоридов, если иачальнаи
концентрация равна 50 мг/л.
Ответ: 90 мг/л.
4-40. Какое количество воды необходимо выводить из
оборотного цикла и сколько свежей воды следует в него
подавать, чтобы поддержать значение иа уровне 1,5
при Qnc—50-103 м3/ч и pi=l,5?
Ответ: (^=1500 м3/ч;
р,ч=2250 м3/ч.
4-41. Добавка в оборотную систему водоснабжения
электростанции равна 3%. Определить коэффициент
упаривания, если р,=1,2%.
Ответ: Ку=1,67.
118
4-42. Определить добавку свежей воды в оборотный
цикл при условии, что упаривание воды, находящейся
в обороте, не должно превышать 10% при pi=l,6%.
Ответ: рд=17,6%.
4-43. Потери воды на разбрызгивание для градирен
составляют в среднем 0,5%. Чему будет равен коэффи-
циент упаривания, если градирни будут работать без
продувки, т. е. при рз=0 и р1==1.2%?
Ответ: Ку=3,4.
4-44. Определить максимальное значение коэффици-
ента упаривания для брызгальных бассейнов средней
производительности, работающих с уносом 2%. при
условии работы без продувки и с pi=l,6%?
Ответ: 7(у=1,8.
4-45. Карбонатная жесткость добавляемой воды со-
ставляет 1,5 мг-экв/л, а циркуляционной 2,25 мг-экв/л.
Происходит ли разложение Са(НСО3)2, если рд=2,4%
и pt=0,008?
4-46. Допустимая щелочность циркуляционной воды
равна 4,5 мг-экв/л. Определить предельно допустимое
значение карбонатной жесткости добавляемой воды,
если суммарное значение продувки рпр=4% и pi=0,016.
Ответ: 3,2 мг-экв/л.
4-47. Определить количество выпадающего в оборот-
ной системе СаСОз, если Ку=1,6, карбонатная жест-
кость оборотной воды 4,8 мг-экв/л и добавляемой
3,5 мг-экв/л.
4-48. Конденсатор паровой турбины поверхностью ох-
лаждения 2500 м2 охлаждается водой по прямоточной
схеме. Через 4 тыс. ч работы на всей поверхности кон-
денсатора возникли карбонатные отложения толщиной
0.1 мм при плотности, равной 2000 кг/м3. На сколько
мкг-экв/л должна снизиться карбонатная жесткость
прошедшей через конденсатор воды, если считать, что
весь образующийся СаСО3 при распаде бикарбоната
кальция идет на образование отложений и количество
охлаждающей воды составляет 12,5-103 м3/ч?
Ответ: ДХк±=200 мкг-зкв/л.
4-49. В качестве добавочной воды в оборотную систе-
му электростанции подают речную воду, загрязненную
гидратом закиси железа, количество которого доходит
до 4 мг/л. В оборотном цикле станции это соединение
переходит в гидрат окиси за счет окислении кислородом
119
воздуха, насыщающим воду пои разбрызгивании ее
в бассейне. Выпадающий в осадок Fe(OH)3 дает отло-
жения на трубках конденсаторов, что ухудшает работу
паровых турбин. Для борьбы с отложениями этого рода
были высказаны следующие предложения, нз которых
одно исключает другое: а) значительно увеличить про-
дувку оборотной системы и этим усилить осветление во-
ды в ней; б) снизить продувку воды в системе до ми-
нимума. Какое нз этих предложений правильно и поче-
му? Учесть, что Ку=1,2 и концентрация гидрозакнеи
железа в оборотной воде составляет 2,3 мг/л.
4-50. По условиям предыдущей задачи определить
количество гидроокиси железа, которое вносится в обо-
ротный цикл 1 м3 добавчяемой воды.
Ответ.- 2,47 г/м3.
4-51. Насколько необходимо снизить подкислением
карбонатную жесткость добавляемой воды, значение ко-
торой составляет 5 мг-экв/л, если Лу=1,3 и допустимая
щелочность оборотной воды 5 мг-экв/л?
Ответ: 1,15 мг-экв/л.
4-52. Определить по условиям предыдущей задачи го-
довой (8760 ч) расход технической 75%-ной серной ки-
слоты на подкисление добавляемой воды, если коли-
чество воды в обороте равно 25*103 м3/ч н рд=3%.
Ответ: примерно 470 т/год.
4-53. Подкисление (задача 4-51) было заменено фос-
фатированием. Чему будет равен годовой расход супер-
фосфата, если учесть, что избытокРО3- в оборотной
воде должен быть 3, 5 мг/л, а содержание этого ноиа
в техническом продукте составляет 23%?
Ответ: примерно 100 т/год.
4-54. В оборотную систему добавляют воду нз двух
источников водоснабжения. Щелочность первого источ-
ника .Щ1=1,5 мг-экв/л и второго 2£/г=3,0 мг-экв/л.
Определить максимально возможный размер добавки
воды в систему из второго источника в смеси с водой
первого, если /Су=1,5 и допустимая щелочность обо-
ротной воды равна 4 мг-экв/л. Учесть условия безна-
кипного режима работы системы.
Ответ: смесь состоит из 21% воды
первого источника н 79% воды
второго источника.
4-55. Определить продувку для оборотной системы,
описанной в задаче 4-5, при р1=1,6% и установить, па-
120
сколько она уменьшнтсн, если вместо найденной в этой
задаче смесн подавать воду только нз первого источ-
ника?
Ответ: pnp=z3,2% продувка
уменьшится на 2,26%.
4-56. Для восполнения потерь оборотной воды элек-
тростанции могут быть использованы два источника во-
доснабжения. Стоимость воты первого источника со-
ставляет 1,2 коп/м3 и второго Зв0 коп/м3, а щелочность
воды соответственно равна 3,8 и 1,8 мг-экв/л. Эксплуа-
тационные параметры оборотной системы следующие:
/Су=1,6; pi=l,4%; предельная щелочность оборотной
воды равна 5 мг-экв/л; количество воды в обороте со-
ставляет 23-Ю8 м3/ч. Возможны следующие варианты
использования воды этих источников, а) первого н вто-
рого совместно в различной пропорции; б) только вто-
рого; в) только первого. Какой нз этих вариантов явля-
ется наиболее экономичным по стоимости и количеству
расходуемой воды?
Ответ; по стоимости — вариант (в);
по расходу воды — вариант (6).
4-57. Продувка оборотного цикла составляет 3,5%.
Определить размер добавки в нее свежей воды, если
/71=0,95%
Ответ: 4,45%.
4-58. Количество воды, находящейся в обороте, со-
ставляет 35-Ю3 м3/ч. Концентрация хлор-иона в добав-
ляемой воде 82 мг/л н в оборотной воде 156 мг/л. Опре-
делить значение продувки и добавки, м3/ч, для летнего
периода, когда pi=l,6%.
Ответ: ^Ор=620 м3/ч;
^д=1180 м3/ч.
4-59. Для удаления отложений карбоната кальция со
стенок трубопровода в протекающую по нему воду вво-
дят углекислый газ. Как узнать, идет ли процесс рас-
творения СаСОз?
4-60. На электростанции мощностью 200 тыс. кВт на-
ходится в обороте 50 1 03 м3/ч воды. В распоряжении
станции имеются два источника водоснабжения. 1 и 2,
щелочность воды которых соответственно равна 4,1 и
2,9 мг-экв/л. Продувка оборотной системы составляет
3%; предельная щелочность циркуляционной воды рав-
на 4,9 мг-экв/л н pi=l,2%. Определить, что экономи-
чески более выгодно: а) использовать воду источника 1
121
н подкислять ее; б) смесь воды от источников 1 н 2;
в) взять воду только от источника 2, не обрабатывать
ее. При этом учесть, что стоимость воды источника 1
составляет 1,5 коп/м3, источника 2 равна 2,2 коп/м3,
75% серной кислоты 36,0 руб/т. Размер продувки уве-
личивать нельзя, наоборот, желательно ее снижение.
Ответ: вариант (в).
4-61. В оборотном цикле циркулирует 10-103 м3/ч во-
ды, температура которой после конденсаторов равна
308 К- Определить, какое количество свежей воды тем-
пературой 283 К необходимо было бы добавить в цикл,
чтобы снизить температуру оборотной воды с 308 до
283 К?
Ответ: 6,7*103 м3/ч.
4-62. Добавка свежей воды в оборотную систему со-
ставляет 600 м3/ч. Щелочность добавляемой воды под-
кислением серной кислотой снижают на 3 мг-экв/л.
Определит^ годовой (8760 ч) расход 75%-ной серной
кислоты и дозировку 10%-ного ее раствора (уг=
=1,06 г/см3).
Ответ: примерно 1030 т/год; 13,9 л/мин.
4-63. Предельная щелочность циркуляционной воды
составляет 4,5 мг-экв/л. Щелочность добавочной воды
равна 4,2 мг экв/л. Насколько необходимо снизить под-
кислением щелочность добавляемой воды, если pj=l,4%
и Рпр=3 %.
Ответ: на 1,13 мг-экв/л.
4-64. Через раствор Ca(OH)z, налитый в колбу, про-
пускают СОг- Раствор вначале приобретает молочный
цвет, затем появляется осадок. Прн дальнейшем про-
пускании углекислого газа осадок исчезает и раствор
вновь делается прозрачным. Если его после этого на-
греть до кипения, то вновь выпадает осадок. Объяснить
происходящие процессы.
4-65. По трубопроводу, в котором находились твер-
дые карбонатные отложения СаСОз, начали подавать
артезианскую воду, содержащую свободную углекисло-
ту. Через месяц работы отложений в трубопроводе не
оказалось. Объяснить причину такого явления.
4-66. Трубопровод известкованной воды оказался за-
несенным отложениями СаСОз, толщина которых до-
стигала 10 мм на длине 25 м. Для удаления этих отло-
жений в воду, подаваемую по этому трубопроводу, ста-
ли вводить СОз. Определенная после этого в начале
122
Ща н в конце Щк упомянутого участка трубопровода
щелочность воды оказалась равной соответственно 1,0
и 1,3 мг-экв/л. Определить количество СОп, израсходо-
ванное непосредственно на растворение карбоната каль-
ция, а также время, необходимое для полного растворе-
ния отложений , если диаметр трубопровода 75 мм, рас-
ход воды 25 м3/ч н плотность отложений равна 2Х
Х103 кг/м3.
Ответ: 44,9 кг; 272 ч.
Глава пятая
ОСВЕТЛЕНИЕ ВОДЫ ФИЛЬТРОВАНИЕМ
5-1. ФИЛЬТРЫ С ЗЕРНИСТОЙ ЗАГРУЗКОЙ
Осветление воды фильтрованием широко применяет-
ся в технологии обработки воды. Для этого осветляемую
воду фильтруют через слой зернистого материала (квар-
цевого песка, дробленого антрацита, керамзита и др.),
загруженного в фильтр.
Если обозначить производительность фильтроваль-
ной установки брутто Qg, м3/ч, нетто QH и расход воды
на ее собственные нужды дСц, то
Qp—Qh + ^C Я-
(5-1)
Необходимая для получения этого количества воды
площадь фильтрования определяется по формуле
р --------24Qe---_ Q_ р (5-2)
° О„(24-пД) V. ' >
где Vo — скорость фильтрования, принимаемая в преде-
лах 5—10 м/ч; По — количество промывок фильтра в сут-
ки (не более трех); to— время простоя фильтра в про-
мывке, обычно около 30—45 мин.
Коэффициент
к.
24
24-п,|0
(5-3)
123
учитывает простой фильтров в период промывки. Ко-
личество устанавливаемых фильтров то будет опреде-
ляться формулой
т __________KoQfi /Е
0,785с1>ф—’ О.785г/афСо »
где d$ — диаметр фильтра, м.
В свою очередь
<5-4а>
<5-5)
где То — межпромывочный период, ч; Гр — грязеемкость
фильтрующего материала, кг/м3; Св — концентрация
взвешенных веществ в фильтруемой воде, мг/л.
Значение Гр может изменяться в широких пределах
в зависимости от характера взвешенных веществ, нх
фракционного состава, фильтрующего материала и др.
При расчетах можно принимать Гр=3+-4 кг/м3, в сред-
нем 3,5 кг/м3. Значение Гр может быть подсчитано по
формуле
р лл-ю4
(5-6)
где qo — количество воды, осветленной за фильтроцнкл,
м3; fo — площадь фильтра, м2; ho — высота слоя филь-
трующего материала, м.
Рабочий цикл фильтров прерывается остановкой для
восстановления нх работоспособности. В то же время
потребители обработанной воды расходуют ее непре-
рывно. Ввиду этого возникает необходимость в созда-
нии на установках резерва в фильтрах нли запаса воды
в баках, особенно если учесть периодический вывод 5
фильтров в ремонт. S
Количество фильтров, выводимых одновременно
в промывкх (регенерацию), зависит от общего их числа
то на установке. Если
/тг0<
(5-7)
124
в промывке (регенерапии) будет находиться один
фильтр. При
(5-8)
где х^то, на промывку будут останавливаться два ап-
парата.
Если х>то, то в промывке будут находиться три
фильтра и т. д. Формула (5-4) учитывает это: опреде-
ленное по ней количество фильтров будет достаточным
и при одновременном выводе на промывку (регенера-
цию) двух и большего количества фильтров. Это до-
стигается введением коэффициента Къ-
Если необходимое количество фильтров на установ-
ке составляет тв„ а общее, включая и резервные, то, то
резерв г будет равен:
г— т° — т«. (5-9)
тн
При расчете количества фильтров по уравнению
(5-4) под резервом следует понимать фильтры, уста-
навливаемые для замены выводимых в ремонт. Обычно
устанавливается один резервный фильтр, поэтому
(5-10)
Если производительность установки равна Qo, м3/ч,
то прн данном г единичная производительность уста-
навливаемых фильтров должна быть равна 7<jj=Qc//n0— 1.
Таким образом, производительность фильтров и их ко-
личество ие являются произвольными параметрами, они
зависят от г н Qe
Водоподготовнтельная установка может быть уком-
плектована фильтрами разной производительности и
разным количеством, однако целесообразно устанавли-
вать меньшее количество фильтров, так как это позво-
ляет сократить количество арматуры, фланцев, т. е.
элементов, снижающих надежность.
Средняя фактическая производительность фильтра
7ср за межрегенерациопиый (межпромывочный) период
равна:
п ___vef 4- О /г: in
9ср-------у----. р-11)
С увеличением То дробь (T’o+foJ/T’o стремится к еди-
нице. Следовательно, фактическая скорость фильтрова-
125
ння всегда больше расчетной, если последняя принима-
ется без учета простоя фильтра на регенерации (про-
мывке) .
Значения собственных нужд осветлительных филь-
тров в процентах к исходной воде могут быть подсчита-
ны по формуле
9'е.=2 + ^. (5-12)
Количество воды, идущей на промывку зернистого
осветлнтельного фильтра ди, м3, находится по формуле
й.=3,У‘ , (5 13)
где io — интенсивность промывки, л/(м2-с); f0 — пло-
щадь сечення фильтра, м2; t'o — время промывки, мнн.
ПРИМЕРЫ
5-1. Проектируется водоподготовительная установка производи-
тельностью брутто 850 м3/ч. Исходная вода содержит 60—80 мг/л
взвешенных веществ. Определить количество фильтров, их произво-
дительность и другие технико-экономические показатели установки.
Решение Используем осветлительиые фильтры с высотой
слоя фильтрующего материала 0,9 м Принимаем грязеемкость рав-
ной 4 кт/м3, скорость фильтрования 5 м/ч. Межпромывочный период
в этом случае равен:
_ 4-103-0,9
5-80 -9 ч.
Количество промывок в сутки составит я0~24/(Го+1о) =2.5
Необходимую общую площадь найдем из выражения (5-2).
24-850
(24 — 2,5-0,5) = 180
Принимаем к установке фильтры диаметром 3,4 м с площадью
9 м2. Количество их будет равно 180/9=20 шт. Так как по уравне-
нию (5-8) в данном случае 20>Г0+10, то для регенерации следует
предусмотреть дополнительно один фильтр и для ремонта одни
всего, следовательно, нужно предусмотреть 22 аппарата. Такое ко-
личество фильтров устанавливать нецелесообразно. Для уменьшения
их числа следует установить трехкамерные фильтры диаметром 3 м
м площадью сечения 21 м2. Их необходимо 180/21 ^9 шт., плюс один
для регенерации и один резервный, всего 11 шт.
Собственные нужды по уравнению (5-12) будут равны:
0,4-8(1
• + 4ЧМГ 10,9У°’
что составляет 93 м3/ч. Следовательно, количество осветленной воды
(производительность нетто) будет равно 750 и’/ч. На обработку
126
этого количества необходимо рассчитывать следующую ступень водо-
подготовительной установки (катноннтные фильтры I ступени).
5-2. После сооружения осветлительной установки, рассчитанной
в предыдущем примере, качество исходной воды изменилось в худ-
шую сторону. Концентрация взвешенных веществ в весенне-осенний
период (4 мес/год) увеличилась до 180 мг/л. Как изменится работа
установки и какова будет ее производительность?
Решение. Длительность фильтроиикла теперь уменьшится и.
станет равной
С. „ 80
Г» ’7> С, ~9 180 —4 ’
а количество промывок возрастет до
24 24
"'•= •= 4+1.S *-5,
где J/q=1,5 ч для трехкамерного фильтра.
Собственные нужды увеличатся до 20%, производительность
установки нетто снизятся до 680 м3/ч Это означает, что при этих
условиях установка не обеспечит объект водой Этот вывод весьма
важен, так как показывает, что при проектировании осветлительной
установки весьма важно правильно оценить концентрацию взвешен-
ных веществ в исходной воде. Для условий данного примера могли
бы быть использованы следующие варианты- а) установка предвклю-
ченного осветлителя; б) установка пред включенных осветлительных
фильтров с крупнозернистой загрузкой (1—2 мм); в) в период па-
водковой мутности исходной воды на установку можно подать
осветленную (питьевую) воду в необходимом количестве
Существует н еще одно решение, которое вытекает из рассмот-
рения формулы (5-5). При высоком значении Св для сохранения
того же значения То необходимо увеличить грязеемкость материала
фильтра Гр. Известно, что высокой грязесмксстью обладают более
крупные фракции зернистого материала Поэтому следует применить
двухслойные (а может быть, н трехслойные) фильтры, верхний слой
(й<р=Ю,6 м) крупностью 0,8—1,8 мм, нижний (Ao=k0,6-j-0,8 м) круп-
ностью 0,5—1,2 мм. Верхний материал должен обладать меньшей
насыпной плотностью (например, антрацит нлн керамзит), нижний —
большей (кварцевый песок). Такие фильтры обладают значительно
большей грязеемкостью. Того же эффекта можно достичь, установив
две группы фильтров первая — крупнозернистые (1—2 мм) для гру-
бого фильтрования, вторая — мелкозернистые для тонкого фильтро-
вания.
5-3. Фильтровальная установка состоит из гпо=12 однокамер-
ных однослойных фильтров диаметром 2,6 м с высотой стоя 0,9 м.
На нее поступает исходная вода с концентрацией взвешенных ве-
ществ. а) 56 мг/л зимой и летом; б) 100 мг/л весной и осенью.
Производится коагуляция на фильтрах с дозой Al2(SO4)s 0,6 (а) и
0,8 (б) мг-экв/л- Определить, какое количество осветленной воды
можно [[случить от згой установки.
Решение. Принимаем, что фитьтры должны работать с такой
интенсивностью, чтобы количество промывок в сутки не превышало
трех. Исходя нз этого длительность фильтроиикла будет составлять
при /tf=0,5 ч
Г0=24/(п0—<0)=24/(3—0,5)=7,5 ч.
127
-а скорость фильтрования по уравнению (5-5) будет равна:
0,9-4-10’
а> в» = 7,5 71,6 = 6'7 м/ч:
б) о0=4,0 м/ч.
Производительность брутто найдем по уравнению (5-4):
Л 12-5,3-6,7
а) Об =-----Ц07----- = 400 м - ч;
б) Qc=340 м3/ч.
Собственные нужды установки составят:
0,4-71,8
а) Я с н ‘ 2 + 4.о,д — 10%;
б) фен =15,5%.
Производительность установки по освет темной воде равна:
а) 400-(1—0,1 )=360 м5/ч; б) 340-(1—0.155)^300 м5/ч.
ЗАДАЧИ
5-1. На водоочистке установлено трн фильтра диа-
метром 2,5 м и два—диаметром 2 м. Определить сред-
несуточную производительность всей фильтровальной
установки, если фильтроцикл первой группы фильтров
10 н второй 8 ч, а скорость фильтрования равна
4,8 м/ч.
Ответ: 95,1 м3/ч-
5-2. Фильтровальная установка, состоящая из четы-
рех фильтров, была рассчитана без учета простоя филь-
тров на промывке. Расчетная скорость фильтрования
была принята 5 м/ч. В действительности продолжи-
тельность фильтроцикла составила 10 ч. Определить
фактическую скорость фильтрования.
Ответ: 5,24 м/ч.
5-3. Действующая фильтровальная установка, состоя-
щая из четырех фильтров диаметром 2 м. работая при
максимальной скорости фильтрования 4,5 м/ч, имела
среднесуточную часовую производительность 53,5 м3/ч.
Один фильтр необходимо остановить на ревизию и ре-
монт. Определить скорость фильтрования, с которой
должны работать оставшиеся трн фильтра, чтобы обес-
печить ту же производительность, если количество про-
мывок в сутки каждого фильтра составляет 2,4.
Ответ: 6,0 м/ч.
5-4. Действующая фильтровальная установка, состоя-
щая из трех фильтров диаметром 2 м, работает прн
предельной скорости фильтрования 6 м/ч, превышать
128
которую нельзя. Прн остановке одного фильтра на про-
мывку два оставшихся в работе не могут покрывать
потребность в воде, составляющую 53 м3/ч. Разность
между этой цифрой и производительностью двух ра-
ботающих фильтров должна восполняться за счет бу-
ферного бака фильтрованной воды. Определить полез-
ный объем буферного бака У() при условии, что остаток
воды в нем к моменту включения в работу промывае-
мого фильтра должен быть не менее 6 м3. Найти так-
же время t заполнения его водой при работе всех трех
фильтров.
Ответ: Vo= 13,65 м3; /=2,2 ч.
5-5. Фильтровапьная установка, оборудованная ше-
стью механическими фильтрами диаметром 3 м, рабо-
тает с постоянной производительностью, равной
190 м3/ч. Прн остановке одного фильтра на промывку
производительность работающих фильтров должна
быть \ величена, чтобы компенсировать недостаток
в воде Определить производительность одного фильтра
при работе (а) шести и (б) пяти фильтров и скорость
фильтрования.
Ответ: а) 31,7 м3/ч; 4.45 м/ч;
б) 38 м3/ч; 5,35 м/ч.
5-6. Чему равна длительность фильтроцикла при
осветлении воды, содержащей 100 мг/л загрязнений,
скорости фильтрования 5 и 10 м/ч и грязеемкостн мате-
риала 4 кг/м3.
Ответ: 8 н 4 ч.
5-7. В период паводка количество взвешенных ве-
ществ в исходной воде, поступающей на фильтроваль-
ную установку, состоящую из четырех фильтров d=
=2,6 м и Qg=80 -м3/ч, возросло до 150 мг/л, а доза
коагулянта—до 0,8 мг-экв/л. Определить количество
промывок фильтров в течение суток прн условии, что
предельная грязеемкость фильтров равна 3 кг/м3, а про-
изводительность установки осталась неизменной.
Ответ: ^1=4,65.
5-8. Определить суточный расход воды на промывку
восьми механических фильтров диаметром 3 м, которы-
ми ос5орудована фильтровальная установка с произво-
дительностью пр» работе всех фильтров 280 м3/ч.
Интенсивность промывки 12 л/(м2-с), время промывки
6 мин, количество промывок в сутки — две.
Ответ: 489,6 м3/сут или 20.4 м3/ч.
9—209 129
5-9. Определить необходимый рабочий объем бака для
промывки механических фильтров диаметром 3 м при
интенсивности промывки 12 л/(м2-с).
Ответ: 36,6 м3.
5-10. Определить требуемую производительность насо-
са, который следует установить взамен промывочного
бака для промывки механических фильтров диаметром
1,5; 2,5; 3 м, при интенсивности промывки 12 л/(м2-с).
Ответ: 76, 212, 307 мэ/ч.
5-11. Определить количество исходной воды, которое
необходимо подать на фильтровальную установку, со-
стоящую из пяти фильтров диаметром 2.6 м, с учетом
ее собственных нужд, если производительность ее по
фильтрованной воде должна составлять 150 м3/ч, прн
количестве промывок в сутки 2,4, длительности промы-
вок (взрыхлений) 6 мин и интенсивности промывки
12 л/(м2-с).
5-12. Фильтровальная установка состоящая из т0
фильтров диаметром d$, м, работает прн скорости
фильтрования Со, м/ч. Определить: среднесуточную ча-
совую производительность установки; потребность в во-
де на собственные нужды (в процентах от количества
поступающей на установку исходной воды) прн пнтеи-
снвностн промывки (о, л/(м2-с), длительности взрых-
ляющей промывки t'f), мин, н простое фильтра в про-
мывке to, ч; количество промывок фильтров в сутки
равно по-
5-13. Требуется спроектировать фильтровальную уста-
новку производительностью по осветленной воде (нет-
то) 300 м3/ч. Определить количество фильтров диамет-
ром 3 м, которое необходимо для этого установить, ис-
ходя нз следующих данных: скорость фильтрования
5 м/ч, количество промывок в сутки — две, время про-
стоя фильтра при промывке 40 мни.
Ответ: 9 фильтров.
5-14. Определять расход воды на собственные нужды
фильтровальной установки, рассмотренной в предыду-
щей задаче, в процентах к количеству исходной воды,
поступающей на фильтры, если интенсивность взрых-
ляющей промывки равна 12 л/(м2-с) н длительность
взрыхления 6 мин.
Ответ: 7,14%.
5-15. Необходимо построить фильтровальную установ-
ку производительностью нетто 45 м3/ч. Определить дна-
130
метр фильтров, а также потребность в воде на собст-
венные нужды фильтровальной установки. Необходи-
мые для расчета данные взять нз задач 5-13 и 5-14.
Количество фильтров должно быть не менее трех.
Ответ: 2 м; 7,5%.
5-16. Блочная обессоливающаи установка (БОУ) энер-
гоблока СКД 300 МВт состоит нз трех ФСД и пяти ме-
ханических фильтров диаметром 2,6 м с высотой слоя
1,2 м. Количество конденсата, поступающего на БОУ,
составляет 800 м3/ч. Определить количество задержи-
ваемого каждым нз этих механических (сульфоуголь-
ных) фильтров магнетита БезО4 для следующих усло-
вий: промывка фильтров производятся через 4 тыс. ч,
фильтры задерживают в среднем 5 мкг/л Fe.
Глава шестая
ОБРАБОТКА ВОДЫ ПО МЕТОДУ ИОННОГО ОБМЕНА
6-1. НАТРИЙ-КАТИОНИРОВАНИЕ
Процесс натрнй-катнонирования широко использует-
ся в промышленности для умягчения воды, т. е. удале-
ния нз нее катионов Са2* и Mg2+. Он заключается в том,
что умягчаемая вода фильтруется с определенной ско-
ростью через слой катионита с обменным катионом на-
трия. В этом слое протекают обменные реакции
2RNa4-Cas+ —RlCa + 2Na+; I
2RNa + Mg,+ -►RBMg4-2Na+, J
в результате которых катион натрия переходит в воду,
а Са2* и Mg2+ остаются в катионите. После замещения
всех обменных катионов натрия кальцием н магнием
процесс умягчения прекращается.
Реакции (6-1) протекают во времени. Поэтому, на-
чавшись при контакте обрабатываемой воды с катиони-
том, они заканчиваются в плоскости в, г (рнс. 6-1, /) на
некоторой глубине Лр.8. Ниже плоскости в, г находится
свежнй (неистощенный) катионит. В процессе работы
фильтра работающая зона а-б-в-г смещается вниз, и
спустя некоторое время в слое катионита образуются
три зоны: А— истощенного, Б — работающего, В — све-
9* 131
жего катионита (рис. 6-1,//). Верхняя горизонталь в-г
(рнс. 6-1,/F) соответствует жесткости исходной воды,
а нижняи а-б — умягченной. Точка а характеризует на-
чало работы катионитного фильтра. В момент, когда
плоскость работающей зоны в-г достигнет нижней гра-
ницы слои катионита (рнс. 6-1,///), отмечается повы-
шение жесткости умягченной воды («проскок» жестко-
Рис. 6-1. Графическая интерпретация процесса катиоипро-
вання воды.
сти) н фильтр отключается на регенерацию, чему на
графике соответствует точка б. При дальнейшей работе
фильтра жесткость фильтрата будет возрастать, пока
в точке д не достигнет значении Жив-
Площадь а-б-г-в соответствует полной рабочей ди-
намической обменной емкости (ДОЕ) всего слоя катио-
нита
v. (6-2)
Если Ер разделить на объем катионита в фильтре
получим рабочую удельную динамическую об-
менную емкость ер, г-экв/м3
р /6х йк
(6-3)
132
Из этого равенства можно определить межрегенера-
ционный период работы фильтра 7, ч:
Т=-^-, (6-4)
Л.в ' '
где Жив — жесткость исходной воды, мг-эка/л; f~
площадь сечения фильтра, м2; vK — скорость фильтро-
вания воды, м/ч; hK — высота слоя катионита в филь-
тре, м.
Описанный выше процесс катионирования является
идеальным.
На практике по разным причинам работающая зона
в большей или меньшей мере может искривляться. Воз-
никающая тогда картина схематически представлена на
рис. 6-1, V—VI. Искривленная работающая зона дости-
гает границы слоя катионита участком ж, качество
фильтрата ухудшается и фильтр отключается в точке б'.
Неиспользованная ДОЕ Ле, эквивалентная площади
треугольника б-г-д, равна примерно:
Ле = —
(6-5)
и, следовательно, степень использования ДОЕ катиони-
та, находящегося в фильтре, ?] будет равна:
£р
Ч = £Р + Дг
(6 6)
Так как для случая VI (рис. 6-1) треугольник
б'-г'-д больше треугольника б-г-д, то естественно, что
4Vi <Л- Таким образом, ухудшение гидродинамической
характеристики слоя катионита (местные уплотнения,
комкование ионита, засорение распредустройства
н г. п.) обусловливает снижение степени использования
ДОЕ. В нормально работающем фильтре ц5^85%.
Высота работающей зоны йрз, м, существенно влияет
на значение т]. Для сульфоугля она может быть опреде-
лена по формуле [14]
3=4 • 1 О 2^К^2К ' 2,31g ЖИ В,
(6-7)
где dh — диаметр зерна катионита, мм; ок — скорость
фильтрования, м/ч; Жив — жесткость исходной аоды,
мг-экв/л.
133
Если в катпоннтный фильтр загружено ht;[ нонпта
с обменной емкостью ер, то фильтр может умягчить
воды, м3/ч:
Ах/Ср
Необходимая площадь фильтрования
фильтров, м, определяется выражением
р_________________
к Рк(24 — nKtK) »
(6-7а)
катнонитиых
(6-8)
где Qc.k—производительность установки по исходной
воде (брутто), м3/ч; пк — количество регенераций в сут-
ки; tK — время простоя фильтров в регенерации, ч; vK —
скорость фильтрования, м/ч.
В свою очередь
Сб.к=0и./"1-А.«; 1
п,= - (6-9)
1 “г *К I
где QB.« — производительность установки по обработан-
ной воде (нетто), м3/ч; qc.B—расход воды на регенера-
цию фильтров, м3/ч.
Количество регенераций может быть определено и
другим способом, а именно:
П*------и,;—
(6-10)
где wK — количество загруженного в фильтры катиони-
та, м3.
Необходимое количество работающих фильтров тк,
знай FK, можно найти по формуле
= Q^K _0б.кК
* 0,785d’ pK-0.785J’ qK »
(6-11)
где qK — производительность одного фильтра, м3/ч;
24
=-24-лЛ ’
К
Устанавливаемое количество фильтров mJ(.y будет*
больше тк (при К=1):
mK.y=mK+x+l, (6-12)
где х — количество фильтров, равное числу регенерируе-
мых; 1—дополнительный фильтр, устанавливаемый для
замены выводимого в ремонт.
134
Значение х может быть определено по формх'ле
(5-8).
Диаметр устанавливаемых фильтров следует прини-
мать с учетом единичной производительности выбран-
ного типоразмера и из условия х=0, при котором коли-
чество фильтров, находящихся в одновременной регене-
рации, равно одному. Это условие для практики весьма
удобно и желательно. Поэтому, положив его в основу
определяем диаметр фильтров по формуле
0,785 (7+ м ' (6-13)
В этом случае возможное количество устанавливае-
мых фильтров будет равно:
/пь.у=тк+1, (6-14)
где
тк^(7'+^)Д„. (6-15)
Дли установок с т(-^4 следует пользоваться фор-
мулой (6-11).
Расход соли gc, кг, на регенерацию одного фильтра
определяется по формуле
gc—eph^cf • 10-3, (6-16)
где ус“ удельный расход соли, г/г-экв.
Для вод с солесодержанием не более 800 мг/л
^180 г/г-эка. Одна ко, используя противоточный способ
регенерации, можно существенно снизить ус.
Таблица 6-1 Удельный расход воды иа собственные нужды ионитов, м3/м3, при обработке природных вод
Наямяговаяне иощта fi <» Общий расход
Аниониты типа АВ 17-8 2,5 12 14,5
Сульфоуголь ДЛЯ Н2 ... 1.1 10 Н.1
КУ-2 для Н2 ......... . 1.0 12 13
Слабоосиовные анионнты типа АН-31 1.8 20 21.8
Сульфоуголь ДЛЯ Н[ 1.5 5 '6,5
КУ-2 дли Hi 4 6,5 10,5
Сульфоуголь для Nai 0.7 4.0 4.7
То же для Na2 0.5 6 6.5
КУ-2 для Na, . 1.7 6,0 7.7
То же для Na-, 1.1 8 9,1
Сульфоугс.ль при «толодной> регенерации 0.7 5 5,7
Примечание И(. Н». К’з,. К’я? — соответствен нс
китшге и иатрнп-к 1Т»(оннтпые фильтры первой и второй ступени.
135
Расход воды на приготовление регенерационного рас-
твора соли м3/м3 катионита, и отмывку катионита
от продуктов регенерации </2 определяется по данным
табл. 6-1 [15]
Полный расход воды па регенерацию q0 будет со-
ставлять:
Qo=Qi + Q2 + q$=£q + <7з>
где qs — расход воды на азрыхление, м3/м3:
п __ рвАя_
Чз~ 60Лк ’
где цп.« — скорость взрыхления, м/ч (см. пример 6-6).
Зная qG, можно определить и значения собственных
нужд натрнй-катиоиитного фильтра в процентах от ко-
чичества фильтрата
?св=п^7~-100. (6-17)
7св Vpf
ПРИМЕРЫ
6-1. Высота работающей зоны определяется выражением (6-7),
а степень использования ношпа—(6-6). Определить допустимую
скорость фильтрования умягчаемой воды при изменении ее жестко-
сти от 2 до 15 мг-экц/л. используя указанные зависимости.
Решение Примем для
Рис. 6-2. Зависимость высоты ра-
ботающей зоны для сутьфоутля
от жесткости обраба гывасмой
воды при разных скоростях
фильтрования.
а скорость фильтрования 5, 10,
15 и 20 м/ч и dK=0,7 мм (для
сульфоугля). По уравнению
(6-7) определим высоту зоны
ионного обмела для разных
значений жесткости исходной
воды и ио результатам расчета
строим график, приведенный
па рис. 6-2.
Прн г] 3^90% Дех^10%.
Из этих данных можно найти
наибольшую высоту зоны нои-
ного обмена, использовав
уравнение (6-6), а также ра-
венства £р=й„/ер; Дес —
=0,5йра/ер. Подставив их’ в
уравнение (6-6) и решив отно-
сительно /гр.з прн Лк=2,5 м,
получим йр.з^ь:450 мм.
Пунктирная линия на
рис. 6-2 отсекает область допу-
при которых т)=^0%, и при уело*
стнмых для сульфоугля скоростей, г , , . ... ___
вин удовлетворительной гидродинамики фильтрующего слоя. Для ка-
тионита КУ-2 соотношение будет другим. Данные рис. 6-2 являются
примерными Важный вывод состоит в том, что. увеличивая скорость
фильтрования прн высоких значениях Жя в, следует ожидать повы-
136
шеппя жесткости фильтрата и более раннего, нс пропорционального
увеличению Мм в, отключения фильтра на регенерацию за счет уве-
личения Яр 3-
6-2. Проектируется иатрий-катноннтная установка производи-
тельностью 600 м3/ч для умягчения воды следующего состава: жест-
кость общая 5,2 мг-экв/л; щелочность 2,8 мг-экв/л; солесодержание
735 мг/л. Остаточная жесткость умягченной воды должна быть не
более 5 мкг-экв/л Умягченная вода поступает на нужды техноло! и-
чсскнх цехов предприятия. Определить основные технологические
показатели установки: число катнонитиых фильтров прн /н=1.8 ч
[по уравнению (6-8)], их производительность, расход поваренной
соли, схему установки.
Решение. В качестве ионообменного материала принимаем
сульфоуголь с ср—300 г-экв/м3. Примем скорость фильтрования рав-
ной 15 м/ч, а высоту слоя катионита 2,5 м. Тогда Г по уравнению
(6-4) будет равна:
лв=24/(9.6-1-1,8) =2,1, где 1,8 — время простоя фильтра в режиме
регенерации,
24-600
F*~ 15(24-2,1-1,8) ~47 м’*
Количество фильтров щи принимаем равным:
мк= (9.6-1-1 8)/1,8=6.4.
Предусматриваем к установке семь фильтров к один резервный
Тогда производительность каждого фильтра составит 600 7=86 м3/ч.
Принимаем фильтры диаметром 3 м и площадью сечения 7,1 мг.
Фактическая суммарная поверхность работающих фильтров соста-
вит 49,5 м2. а скорость фильтрования 600/49,5^12,1 м/ч. межреге-
нерационный период 7=300-2,5/12,1 -5,2=trl2 ч. что при условии
автоматизации работы фильтров вполне приемлемо. В этом случае
лл=!,73. Принятая скорость фильтрования 15 м'ч согласуется
с приведенной на рис. 6-2. График зависимости работающей зоны
от жесткости обрабатываемой воды оказывается полезным при оцен-
ке гидравлической характеристики работающего фпзьтра. Если при
данной скорости фильтрования фактическая высота работающей
зоны Л'р л, ы, определяемая по формуле
больше расчетной (при Sqt, см. рис. 6-1), состояние фильтра пе-
удовлетпоритслыю. Расход соли па одну регенерацию прн у«—
=180 г/г-эьв по уравнению (6-16) составит: qc =300-2.5-180-7,1 X
Х10 3=960 кг. Месячная потребность в соли будет равна:
<7'0 = 960-10 -'-1,73-7-30^350 т.
Для обеспечения заданной жесткости умягченной воды прини-
маем двухступенчатое Na-катионирование. В этом случае гучше все-
го применить ступенчато-противоточные фильтры, праветенные на
рис. 6-3, состоящие из двух сосудов, представ тяюших одно целое и
имеющих общий фронт трубопроводов. В данном случае диаметр
137
большого сосуда принят 3 м, малого 2 м. Примерно пятая часть
понята находится в фильтре 2. Регенерация проходят следующий
образом. Весь раствор соли, рассчитанным на оба фильтра, пропус-
кается сверху вниз вначале через сосуд 2, затем 1 (см. рис 6-3,а).
Отмывка производится по схеме рис. 6-3,б, предусматривающей
отмывку ступени 2 умягченной водой. Умягчение же происходит по
схеме рнс. 6-3,в: в первой ступени прямоток, во второй — противо-
ток. При этом в ступени 2 скорость фильтрования составляет не
менее 30 м/ч. При чаких скоростях слои катионита поднимается
вверх и надежно прижимается к верхнему распределительному
г 1-0 Я j
Рис. 6-3. Ступенчато-противоточный фильтр
a — регенерация; б — отмывка, в — ноиированяе.
/ — прямоточный фильтр; ? — противоточный.
устройству. В ступени 1 скорости фильтрования состав 1яют 10—
20 м/ч. Такие фильтры требуют удельного расхода реакнтов при-
мерно 1,2—1,3 г-экв/г-экв.
6-3. Фильтры в примере 6-2 вместо сулъфоугля загрузили ка-
тионитом КУ-2, имеющим ег=950 г-экв/м3. Определить основные
технические параметры катиоиитной установки.
Решение. Приняв ту же скорость фильтрования, найдем сле-
дующее значение Т:
950-2.5
Г=-15^2“ = 30 -•
Такое время Т свидетельствует о наличии существенного резер-
ва в производительности. Принимай Г=12 ч, найдем допустимую
в этом случае скорость фильтрования, которая будет равна 38 м/ч,
а предельная производительность установки даже при шести фильт-
рах Qb=38-7,1-6^1600 mj/4. Следовательно, одним из способов уве-
личения производительности вонитной части установки без ее расши-
рения ивляетсн переход иа работу с ионитами, обладающими боль-
шей ДОЕ.
6-4. Катнонитный фильтр диаметром 2,6 м работает со скоро-
стью фильтрования 15 м/ч. Высота слоя сульфоугля составляет
2,5 м, обменаая емкость его 330 г-экв/м3. Определить расчетный
расход воды иа собственные нужды фильтра дс.я, расход соли на
регенерацию пря ус=18о г/г-экв, межрегенерационным период н ча-
совую производительность фильтра q«, если концентрации регенера-
ционного раствора С равна 6%, Жжв=3,5 мг-экв/л, простой фильт-
ра в регенерации 2 ч.
Решение Площадь фильтра 5,3 м2- Г=330-2,5/3,5-15^ 15,7 ч.
Расход соли на регенерацию qc =330-2,5/180-5,3.10“ 3^>-800 кг, ча-
совая производительность фильтра qK= 15-5,3<К0 м’/ч.
133
Расход воды иа Приготовление соли
ffc 800
10рС “10-1,04-6 = 12,8 м’
Расход воды на отмывку фальтра
Рот/^от Ю-5,3-50
ч* — 60 - 60 — 44 »
Расход воды на взрыхление
Общий расход иа собственные нужды фильтра:
<70=12,8+44+16=72,8 мв
или
, 72.8
1 с-“= 80-15,7 •100 = 6-|°/»-
По табл. 6-1 собственные нужды фильтра для Naj составят
9с н=4,7-5Л-2,5=62,5 м3, или 5,2%. Для сульфоугля при расчетах
можно принимать скорость отмывки Оот=8-ь!2 м/ч, взрыхления
овз=-10-г-15 м/ч, время отмывки /О»=40ч-60 мин, взрыхления /вз=
= 12ч-15 мин.
ЗАДАЧИ
6-1. Для фильтров диаметром 1; 1,4; 2; 2,6; 3 м опре-
делить количество воды, умягчаемое фильтром каждого
размера за межрегенерационный период для следующих
условий: н жесткость исходной воды Жил=ерХ
Х10-2 мг-экв/л (ер=320 г-экв/м3).
6-2. По условиям предыдущей задачи определить ко-
личество соли, расходуемой на одну регенерацию фильт-
ра каждого размера, если ДЕ.Р.=3 мг-экв/л и удельный
расход соли 2,8 г-экв/г-экв.
6-3. Количество поваренной соли, необходимое для
регенерации, нередко задается в килограммах на 1 м3
загруженного в фильтр катионита. Используя данные
задач 6-1 н 6-2, определить удельный расход соли,
кг/м3, для фильтров каждого размера.
Ответ: 60,5 кг/м3.
6-4. Дать объяснение, почему по усповним предыду-
щей задачи расход соли на регенерацию для разных
фильтроа имеет одно н то же значение.
6-5. Определить теоретический расход соли н кисло-
ты, кг/м3, для сульфоугля и КУ-2 (t?p=950 г-чкв/м3 при
139
Na-катионировании и 650 г-экв/м3 при Н-катионнро-
ваиии).
6-6. Натрий-катионитный фильтр диаметром 2 м и
с высотой слоя сульфоугля 2,5 м умягчил за межреге-
нерационный период 785 м3 воды с общей жесткостью
3 мг-экв/л. Определить количество поглощенных катио-
нов в килограммах и в процентах массы загруженного
в фильтр сульфоугля, если эквивалентное отношение
Ca/Mg для исходной воды равно двум, а насыпная плот-
ность влажного катионита 0,42 т/м3.
Ответ: (Са)=31,4 кг или 0,96%;
(Mg) = 9,4 кг или 0,3%.
6-7. По условиям предыдущей задачи определить
удельною обменную емкость катионита, г-экв/л.
6-8. Катионит с обменной емкостью 320 г-экв/м3 загру-
жен в фильтр диаметром 3 м, который за межрегенера-
ционпый период умягчил 1104 м3 воды общей жест-
костью 5 мг-экв/л. При последующей регенерации по-
глощенные фильтром попы Са2+ и Mg2+ были удалены
из фильтра отмывной водой. Определить высоту слоя
катионита и жесткость отмывной воды в предположе-
нии, что все ионы Са2+ и Mg®+ перешли в отмывную
вот\ и равномерно распределились в ее объеме. Скороегь
отмывки 7 м/ч, длительность ее 40 мин.
Ответ: йк=2,43 м; Ж= 166 мг-экв/л.
6-9. На регенерацию натрий-катионитного фильтра
диаметром 2,6 м с высотой слоя 2,5 м было израсходо-
вано 840 кг NaCl (100%-ный). Скотько килограммов из
этого количества будет нспользоаано, если обменную
емкость катионита принять равной 350 г-экв/м3?
Ответ: 254 кг.
6-10. В результате испытания двух катпоиитных
фильтров были получены кривые истощения, приведен-
ные на рис. 6-4. Каком нз фильтров нуждается в ре-
визии?
6-11. Катиоиптиый фильтр, схема которого изображе-
на па рис. 6-5. после регенерации был включен в работу
прн жесткости умягченной воды 15 мкг-экв/л. Одна ко
оюбранная через некоторое время из крана 3 проба
показала, что жесткость увеличилась до 100 мкг-экв/л.
Причинами такого преждевременного повышения жест-
кости умягченной воды могут быть: а) неудовлетвори-
тельная гидродинамическая характеристика стоя катио-
нита или сборно-распределительного устройства, что
1 ю
приводит к преимущественному местному фильтрованию
н преждевременному истощению в этом месте катионита
(рис. 6'4,6); б) пропуск задвижки 1 на линии отмывоч-
ной воды; в) пропуск задвижки 2 на линии раствора
соли. Каким образом можно определить истинную при-
чину повышения жесткости умягченной воды?
6-12. Считая, что причиной повышения жесткости
умягченной воды в предыдущей задаче является пропуск
Рис. 6-5 Схема кзтионнт-
ного фильтра (к задаче
6-11).
1. 2—задвижки соответственно
на отмывочной линии и линии
раствора, 3 — отбор пробы.
Рис. 6 4. Кривые истощения иони-
та в фильтре (к задаче 6-10).
а — удовлетворительно работающий
фильтр б —фильтр с неудовлетвори-
тельной гидродинамикой.
задвижки /. определить количество отмывиой воды, л/ч,
поступающей из бака в пинию умягченной воды.
При расчете принять жесткость отмывочной воды
130 мг-экв/л, скорость фильтрования 10 м/ч, диаметр
фильтра 3 м
Ответ: 46,5 л/ч.
6-13. Производительность катионитиого фильтра диа-
метром d, м, равна д, м3/ч. Определить межрегенера-
ционный период 7, ч, если жесткость умягчаемой воды
составляет Ж,.в, мг-экв/л; высота слоя катионита Л, м;
его обменная емкость ер, г-экв/м3.
6-2. ВОДОРОД-КАТИОНИРОВАНИЕ
Процесс водород-катионирования занимает весьма
важное место в технологии обработки воды. Он позволя-
ет разрушить анион НСО~3 и удалить из воды значи-
тельную часть COs в цикле водообрабатывающей уста-
новки. Благодаря ему становится возможным более или
141
менее полно удалять из обрабатываемой воды раство-
ренные ионы и получать обессоленную воду. При водо-
род-катиоиировании катионит «заряжают» ионом водо-
рода путем регенерации его кислотой. При последующем
фильтровании через него воды в слое катионита проте-
кают реакции:
2HR+Са (НСО,),'— CaR, + 2СО, + 2НаО;
2HR + Mg (НСО,)„—MgR, + 2СО.+ 211,0;
2HR + MgCl, MgR, + 2HC1;
2HR+CaSO4 CaR,+112SO,;
HR+NaCl - - NaR+HC1,
в результате которых катионы Са2ь M.g2+, Na+ обраба-
тываемой воды заменяются водородом. Если катионит
Рис. 6-6. График работы водород-кзтио-
нитного фильтра.
отрегенернровать недостаточным количеством кислоты,
то могут произойти только первые две реакции, веду-
щие к разрушению щелочного иона НСО“3. Такой про-
цесс, именуемый «голодной регенерацией» или «щелоч-
ным Н-катионированием», в действительности и исполь-
зуется для понижения щелочности исходной воды. Прн
достаточном количестве кислоты все катионы заменяют-
ся водородом, вода делается кислой, непригодной для
питания паровых котлов. Поэтому водород-катиоиирова-
иие обычно применяется совместно с натрий-катиоииро-
ванием или анионированнем в обессоливающих уста-
новках.
'г—сгон
142
При полной регенерации катионита кислотой работа
водородного фильтра первой ступени будет характеризо-
ваться примерным графиком рис. 6-6. В момент вклю-
чения фильтра в работу в точке а кислотность фильтра-
та становится равной
= ^SO2- + Cq- 4“ CNO-«
дальше, то
Рнс. 6-7. Н-катнонитный
фильтр при нормальной («)
и «голодной» (б) регене-
рации
В точке б значение Кс уменьшается, что свидетель-
ствует о недостатке в катионите иона водорода. В точке
в Кс=0 и начинается вытеснение из фильтра ионов Na+.
Однако жесткость фильтрата по-прежнему остается
в норме и низкой. От точки в до г происходит увеличе-
ние щелочности воды до исходного значения Що- Вира
ботанное за этот период количество воды характеризу-
ется некоторым значением средней щелочности Щср-
Если продолжать эксплуатаци!
в точке д жесткость фильтра-
та начнет увеличиваться. Это
означает, что почти все катио-
ны Na+ из катионита вытесне-
ны и в фильтрат начинает вы-
тесняться магний. В нормаль-
ном случае при полном водо-
род-катионнроваиин фильтр
выключают на регенерацию
в точке б, так как целью ра-
боты фильтра в этом случае
является полная замена всех
катионов обрабатываемой во-
ды ионами водорода.
При работе водород-ка-
пюнитного фильтра в режиме
«голодной регенерации» результат катнонирования будет
иным. На рис. 6-7 изображены схематично в разрезе два
фильтра, один из которых (рис. 6-7,6) отрегенерирован
недостаточным («голодным») количеством кислоты.
Ввиду этого в нем появляются как бы два слоя: водо-
род-катнонита высотой hK и неотрегенерированного
кальций-магний-катнонита высотой Леа. В водородном
слое происходит поглощение всех катионов
kt=/Wh#b+cNa+=кс+в=cso2_+сС|. -J- смл— +
где Кт — сумма катионов.
143
Взамен их появляются катионы водорода, но уже
в меньшем количестве, чем 7(т, так как часть ионов Н+
расходуется на нейтрализацию Понов НСО 3:
НСО3 Ц- Н+ СО, + Н2О.
Количество таких ионов Н+ равно Л.Щ~ЩН.В—Що<т,
мг-экв/л, где Шост — средняя щелочность обработанной
воды.
Следовательно, ионов водорода возникает
SH+ = кс+ш. „=Сь0=_+Со. 4- CN0- + Щ„т. (6-18)
В слое Аса они обмениваются на Са2+, Mg2\ Na+ н,
таким образом,
^Кс+ШЛт)^/йСае”
откуда
. __ fhCa‘‘
q* Кс-ЬШост’
(6-19)
где д'к—количество обработанной за фильтроцикл во-
ды, м3; еир—средняя обменная емкость катионита по
водороду, г-экв/м3.
С другой стороны, условный водородный слой катио-
нита Ан должен также обработать q\t, м3, воды, т. е.
+ Щ „)=Лн/еср
И
, ^н/сср
9 К — Хе + Ш„ в ’
(6-20)
где еср—средняя обменная емкость по Са2+, Na+
Приравняв уравнения (6-19) и (6-20) и решив равен-
ство относительно Ан. найдем
ь Л’с 4“ Шп в t Bi (Л’с . Щ и)
Н— /fc + Шост Pl^cJ-WllBl + tKc+WoCT)
(6 21)
прн подстановке Аса—й0—Лн н Pi=eHpЗная Ац,
можно найти необходимое для регенерации количество
кислоты, кг.
(6 22)
где a — корректирующий коэффициент, опредетяемый
экспериментально; —удельный расход кислоты, при-
нимается 49 г/г-экв.
144
Водород-катпоиированне (не «голодный» режим)
применяется обычно в сочетании с натрцй-кагнонирова-
ннсм. В этом случае кислая вода водо род-катион in ных
фильтров нейтрализуется щелочной водой Na-катионит-
ных фильтров.
ПРИМЕРЫ
6-5. Определить количество кислой воды qK, м8, выдаваемое
11-катионитным фильтром за фнльтроникл, если количество исходной
воды характеризуется следующими данными: концентрация, мг-экв/л,
натрия Сыа> кальция Сса (условно считаем всю жесткость кальцие-
вой, что в данном случае можно допустить).
Рис. 6-8. Примерная схема
расположения катионов в
слое катионита.
а — после «голодмоП» регене-
рации , б — отработавшего.
Решение Принимаем, что фильтр отключается в точке б
(см рис 6-6) . В этот момент слой катионита можно изобразить как
бы состоящим яз двух слоев (рис. 6-8): верхнего основного, исто-
щенного кальцием и магнием, и нижнего, содержащего в основном
катионы натрия и водорода. Снижение кислотности наступает
в момент вытеснения натрия в фильтрат. Таким образом, количество
полученной кислой воды определяется равенством
+ hcJ<& . (6-23)
откуда
Чк =
где hNa, hQa — высота
(условно) кальцием, м;
натрию и кальцию, г-экв/м3; площадь сечения фильтра, м2; <т—
доля слоя httn, истощенного натрием (0,5—0,6).
Из уравнения (6-23) можно получить
wfffr _ cNa
ССа
10—209 НЗ
Ска+Сс, <6-24’
слоя катионита, истощенного натрием и
— Обменная емкость
или
fha *
hNB — С^а fja hCa'
где
S = CnJCCv •₽ — epa/e^i ha — ANa + ACa"
Заменив йкв в урааденми (6-24) этим выражением, а также
подставив ЛСл = ₽а/1о/(В+₽а), после упрощений получим:
Р(В-)-1)р Cpftio
# + 0° + Ол) ’
(6-25)
6-6. Как следует нз уравнения (6-25), количество кислой воды,
выдаваемой фильтром, существенно зависит от концентрации натрия
в обрабатываемой воде и типа катионита (сульфоуголь, КУ-2).
Определить значение коэффициента
£ = ~S+K"
(6-26)
при В=0; 0,3; 0,5 и 1, ₽=0,6 (сульфоуголь) и 1 (КУ-2), с=0,5.
Решение. Подставив эти данные в уравнение (6-26), получим
для сульфоугля. £=1,0; 0,65; 0,56
6-7. Определить количество кислой воды, которое выдаст за
межрегенерацнонный период Н-катионнтный фильтр диаметром 2,0 м
с высотой слоя катионита 2,5 м прн обработке воды следующего со-
става, мг-экв/л: жесткость 3,3; щелочность 2,0;
С^+ = 1,3; 6^ = 260 г-экв/м’ для су чьфоугля;
е^3 = 650 г-экв/м* Д'<я КУ-2.
Решение. Подставив этв значения в уравнение (6-25), по-
лучим:
для сульфоугля
0,3-1,4 260-3,14 2,5
9к 0,7 * 4,6 = 264 м ;
для КУ-2
1,4 0,5 650-3,14-2,5
1,3 ’ 4,6 = 600 м’.
При скорости фильтрования обрабатываемой воды 10 и 15 м/ч
межрегенерационный период сульфоугольного фильтра составит соот-
ветственно 8,4 п 5,6 ч, при использовании катионита КУ-2 19,0 н
12,8 ч.
Таким образом, для воды данного качества скорость фильтрова-
ния при сульфоугле допустима не более 10 м/ч, прн замене его КУ-2
ее можно увеличить до 20 м/ч.
146
ЗАДАЧИ
6-14. При отмывке Н-катионитиого фильтра I ступе-
ни от продуктов регенерации пошла мутноватая вода
с выпавшим каким-то белым осадком. Оператор сооб-
щил, что все режимные параметры при регенерации вы-
держаны в соответствии с инструкцией, в частности, кон-
центрация регенерационного раствора кислоты по арео-
метру не превышала 1,5%. Требуется ответить, что это
за осадок, появившийся в отобранной пробе отмывиой
воды, и почему он появился? Что необходимо еще знать
для того, чтобы правильно поставить «диагноз» этому
случаю?
6-15. Сульфоугольный Н-катионитный фильтр I сту-
пени диаметром 3 м регенерируется противотоком снизу
вверх серной кислотой концентрацией 1,5%. Высота
слоя сульфоугля 2,5 м. Продукты регенерации отводятся
через средний дренаж, расположенный в слое сульфо-
угля на глубине 150 мм от верхнего уровня слоя. Имеет-
ся предположение, что гидродинамическая характерис-
тика загрузки не совсем удовлетворительна и часть рас-
твора кислоты ие используется. Как можно проверить
это предположение качественно?
6-16. Регенерация Н-катионитного фильтра в задаче
6-15 противотоком производится со скоростью 9 м/ч.
Через сколько времени с момента подачи регенерацион-
ного раствора в фильтр кислота может быть обнаруже-
на на выходе этого раствора из фильтра при условии,
что векторы скорости раствора по горизонтальному се-
чению одинаковы?
Ответ: 20 мин.
6-3. СХЕМЫ КАТИ О НИ TH ЫХ УСТАНОВОК
Наиболее часто катионитные установки используются
для умягчения воды, предназначенной для нужд различ-
ных потребителей. Оно производится обычно с предва-
рительной подготовкой обрабатываемой воды, т. е. пе-
ред катионироваиием ее коагулируют для удаления кол-
лоидных загрязнений, известкуют для разрушения иона
НСО_з, или эти процессы применяют совместно. При
использовании воды питьевого качества предваритель-
ную подготовку воды, как правило, не производят.
На практике широкое распространение получили
следующие схемы Na-катиониткых установок: иепосред-
ш* 147
ствениое Na-катионирование (рис. 6-9,а), фильтрова-
ние— Na-катиоиирование (рис. 6-9,6), коагуляция —
фильтрование Na-катнонированпе (рис. 6-9,в), известко-
вание— фильтрование Na-катнонированне (рис. 6-9,г).
Если ввести буквенные обозначения процессов и фильт-
ров; коагуляция — К, известкование — И, флокуляция —
П, фильтр осветлительный (механический)—М, Na-ка-
тионитный I и II ступеней соответственно Na! и Na2, Н-
Рис 6-4 Схемы ватрий-катпопптиых установок.
катионитный фильтр соответственно Н! и Н21 то приве-
денные иа рис. 6-9 схемы можно изобразить так:
a) Naf или Na!-N2; б) M-NarNa2; в) K-M-NarNa2;
г) И-К-Б-M-Nai-Na2 (Б — бак). Схемы рис. 6-9,а, бив
нередко называются прямоточными, поскотькт обраба-
тываемая вода без разрыва потока проходит всю техно-
логическую цепочку аппаратов.
Как следует из реакций (6-1), Na-катнонировапие не
изменяет щелочность обработанной воды. Следователь-
но, оно может быть применено только в тех случаях,
148
когда отсутствуют ограничения по значению щелочности
котловой воды Щкв при данном значении добавка в пи-
тательную систему котла химически обработанной воды
ах, %, и допустимой продувки рП1 %. Это условие вы-
ражается следующим соотношением:
щ«.в<
Рп Шк.в , лл
1004-Рп «х ’
(6-27)
где Щв.в — щелочность исходной воды перед катнонит-
ными фильтрами.
Рис 6-10 Схемы Н-Ма-катионнтных установок
Если же значение Щвп больше правой части равен-
ства (6-27). то в этом случае стремятся известными спо-
собами увеличить предетьное значение Щав пли умень-
шить ат. Прн отсутствии таких возможностей неизбеж-
ным оказывается применение так называемых декарбо-
иизацпонных схем, позволяющих снизить щелочность
исходной воды. К таким схемам относятся, кроме схемы
рис. 6-9,г, также схемы, изображенные на рис. 6-10: па-
раллельного (а) п последовательного (6) H-Na-катио-
пнрования. Количество Н- и Na-катпонптпыч фильтров
в этих схемах определяется долей кислой у или щеточ-
ной х воды, получающейся при обработке данного каче-
ства исходной воды. Значения их, %, находятся нз сле-
дующих соотношений:
У
Ши в Шост 100-
Я/ив-ЬЛс ’
Щ| н +
иоо.
(6-28)
149
где — кислотность воды, равная 2 (Cso2-+Са. -f-
-j-NO-T); —остаточная щелочность; Ш„.в— общая
щелочность перед фильтрами.
ПРИМЕРЫ
6-7. Добавка умягченной воды в питательную систему котлов
составляет 1Б%. Предельные значения показателей качества котло-
вой воды барабанных котлов без ступенчатого испарения следую-
щие. сухой остаток 750 мг/кг, щелочность 10 мг-экв/кг, продувка
4%. Можно ли рекомендовать к установке схему рис. 6-9,0, если
исходная вода, взятая из городского водопровода, имеет сухой оста-
ток 130 мг/кг и щелочность 2 мг-экв/кг.
Решение Исходя нз качества котловой воды питательная
вода должна иметь сухой остаток
Sb.в = "iqo рп SK.B = jQ4 750 = 28,8 мг/кг;
щелочность
4
/Дп.в — JQ4-10 = 0,385 мг-экв/кг.
В действительности, если принимать, что качество катноинро-
ванной воды не отличается от исходной (на самом деле при Na-кэ-
тнонированин сухой остаток несколько повышается), качество пита-
тельной воды будет примерно равно: Sn в=0,15-130= 19,5 мг/кг;
Ш.п.в = 0,15*2=0,3 мг-экв/кг. Поскольку продувка прн этом не уве-
личивается» рассматриваемая схема является приемлемой. К тому же
выводу можно прийти использовав формулу (6-27):
4,10-100
Шал = 2 <' Ю4.15 = 2,56 ыг-экв/кг.
Однако, рекомендуя эту схему к внедрению, следует учесть по-
вышенную концентрацию СО2 в паре, что может привести к угле-
кислотной коррозии теплообменников, калориферов н другой паро-
нспользующей аппаратуры обратных конденсате проводов и наноса
в котлы продуктов коррозии Поэтому должны быть предусмотрены
специальные меры, устраняющие этот недостаток (аминирование,
удаление СО2 из пароиспользующей аппаратуры, закрытые системы
сбора конденсата я др). Это замечание относится также и к схемам
рис. 6 9,6 я в.
6-8. Проектируется промышленная котельная с барабанными
котлами давлением 4 0 МПа, показатели водно-химического режима
которых не должны превышать следующих значений- SK.B =
=3000 мг/кг; Щ*. =15 мг-экв/кг; /?п=3%. Пар перегретый Исход-
ная вода, забираемая из реки, имеет следующее качество, мг-экв/кг:
Ш. .=3,3; ССа.+ = 3,5: Си.+ = 1,3; С^_ = 1.0; Са-= 0,3;5и в =
= 350 мг/кг, взвешенные вещества 45. я в паводковый период
(3 мес/год) 120—150 мг/кг. Добавка химически очищенной воды
150
в питательную систему котлов достигает 23%. Требуется Выбрать
схему нодиподгокммтельной установки.
Решение. Вначале проверим возможность использования
Na-катнонитных схем (см рис. 6-9,fl—е). По уравнению (6-27) для
5в.в и Щя в нмеем:
3-100-3000
5И в = ^50 <---103.23— = мг/кг;
„ л 3-100-15
Щв в = 3,3> ПОЗ-23— ~ 1 мг-экв/кг’
По сухому остатку эти схемы «проходят», по щелочности — нет.
Следовательно, необходима схема, способная снизить щелочность
исходной воды по крайней мере до 1,92 мг-экв/кг и меньше.
Для рассмотрения могут быть взяты следующие схемы:
а) параллельное Н-Na-катионирование (K-M-H-Nai-.Kr-E-Naj);
б) известкование — Na-катионирование (И-К-Б-M-Nai-Nas);
в) подкисление Пдк исходной воды—дегазация Дг—Na-кягио-
ннрование (К-М-Пдк-Дг-Б-Nai-Nas);
г) коагуляция — Na-катиовировапне — подкисление — дегазация
(K-M-Na.-Nas-Пвд-Дг-Б).
В скобках в условном написании приведены развернутые схемы.
В схемах рис. 6-9,а, е н г щелочной ион НСО-з разрушается кис-
лотой
НСО7 -р 11+ -» СО2 + НаО
с удалением COs в дегазаторе
Однако схема рис. 6-9,а отличается от схемы рнс. 6-9,в я г. Она
позволяет заметно снизить сухой остаток обработанной воды, в то
время как в схемах рис. 6-9щ н г он увеличивается. Но схемы
рис. 6 9,в и г для своего осуществления не требуют Н-катнонитных
фильтров, что устраняет кислые сточные воды н другие проблемы,
связанные с 'Получением кислой воды. Подкисление обрабатываемой
воды должно проводиться с использованием автоматических схем
управления этим процессом. Сравнивая схемы рис. 6-9,в и г, пред-
почгенне следует отдать схеме рис. 6-9,в, в которой процесс обра-
ботки замыкается №-катионитчыми фильтрами. Это исключает воз-
можность подачи в котлы кислой воды даже в случае неисправности
узла подкисления и передозировки кислоты. Несущественный, прав-
да, недостаток (по сравнению со схемой рис 6-9,г) схемы рис. 6-9,е
состоит в том, что свободная СОа после дегазатора будет в катио-
нитных фильтрах превращаться в НСО3, повышая щелочность обра-
ботанной воды и снижая полезную обменную емкость катионита.
Посмотрим, не вызовет ля использование схемы рнс. 6-9,в уве-
личение продувки котлов из-за сухого остатка питательной воды.
Для этого определим, насколько следует снизить щелочность исход-
ной воды. Принимаем, что в эксплуатационных условиях щелочность
котловой воды будет изменяться в пределах 10—15 мг-экв/кг. По
уравнению (6-27) найдем, что щелочность обработанной воды долж-
на находиться в этом случае в границах 1,25—1,9 н, следовательно,
снижение максимально должно быть произведено на 3,3—1,25—
=2,0 мг-экв/кг. Бикарбонаты кальция н магния входят в сухой
остаток исходной воды в виде СаСОэ и MgCOa- При подкислении
они переходят в сульфаты CaSO4 н MgSO4. Следовательно, сухой
остаток увеличится на 18 мг/кг на каждый эквивалент снижения
151
щелочности, т. е. в данном случае на 36 мг/кг. Тогда сухой остаток
обработанной воды с учетом увеличения его в цикле Na-катиониро-
вания превысит допустимый, равный 390 мг/кг. Таким образом, схе-
мы рис. 6-9.в и г не удовлетворяют поставленным требованиям
Остается оценить схемы рис. 6-9.0 и б. Поскольку обе они по-
зволяют снизить щелочность, то целесообразно это снижение про-
изводить не до 1,25—1,9 мг-экв/кг, как указано выше, а до техноло-
гически возможного минимума. Понижение щелочности котловой
воды в этом случае может быть вполне допущено и даже жела-
тельно. Схема рис 6-9,а обеспечивает остаточную щелочность 0,4—
0,5, схема рис. 6-9,6 0,6—1,0 мг-экв/кг. Слабыми местами схемы
рис. 6-9,а являются предочистка, т. е. коагуляция на механических
фильтрах, и освст гамме ноды Длительность фнльтроцнкла может
быть определена по формуле (5-5). Для данного случая принимаем
ип=5 м/ч Ло=1,О м. Св =172 мг/кг [среднее значение для павод-
кового периода с учетом 0,7 мг-экв/кг A1(OH)SJ- Тогда Г0=4,7 ч,
что недопустимо мало, желательно не менее 8 ч Учитывая это
обстоятельство, пелесо образно принять для осуществления схему
рис. 6-9,6. Однако, если в паводковые периоды речную исходную
воду можно заменить питьевой, следует остановить выбор на схеме
рис. 6-9,а, так как прн среднем значении Св=82 мг/кг (с учетом
дозы коагулянта) Тс— 10 ч.
На этом выводе проектные изыскания не следует останавливать.
Необходимо рассмотреть пароконденсатный тракт предприятия или
цеха, являющегося потребителем пара- характер использования пара
(подогрев смешением или через поверхность), загрязнение его про-
дуктом, протяженность конденсатопроводов и другие вопросы — и
наметить технические и организационные мероприятия по предотвра-
щению углекислотной к кислородной коррозии теплообменной аппа-
ратуры и обратных конденсатопроводов.
Доля кислой воды прн схеме рис. 6-9.а будет равна Щи в4-
+Л'С=4,6: Щ„в=3,3; Яе=1,3; Щост=0,6; (/—58,5%.
Доля щелочной воды х=100—58,5 = 41,5%. Количество фильт-
ров определяется по приведенным выше формулам
6-4. ОБЕССОЛИВАНИЕ ВОДЫ ПО МЕТОДУ ИОННОГО ОБМЕНА
ТЕХНОЛОГИЯ ОБЕССОЛИВАНИЯ
Обессоливание, или деионизация, воды состоит в уда-
лении из воды всех растворенных в ней веществ, т. е.
всех катионов (кроме Н+) и аииоиов (кроме ОН ). Но
прежде чем это сделать, из воды возможно полнее уда-
ляют органические вещества, коллоидные и взвешенные
вещества. Это выполняется на головной части установ-
ки, где происходят коагуляция (К), известкование (И)
воды и осветление обрабатываемой воды на осветлитель-
ных фильтрах (М), после которых она может быть по-
дана на «цепочку» понитных фильтров.
Вначале воду направляют на Н-катионитные фильтры
первой ступени Нь которые удаляют (задерживают)
основную массу катионов Са2+, Mg2+, Na+, NH+4 и др.,
152
заменяя их катионом Н+, так что вода после фильтров
Hi является кислой. Часть катионов (0,3—0,5 мг-экв/л)
все же «проскакивает» через Hi, и для полного их уда-
ления за Н] устанавливают Н-катпонитный фильтр вто-
рой ступени Н2. Он может быть расположен непосред-
ственно за Hj, но нередко ои размещается за анионит-
ным фильтром первой ступени Аь Фильтры Ht часто за-
гружаются сульфоуглем, а Н2—КУ-2, ио они (Hi) могут
быть загружены п КУ-2.
Вода после Н,, содержащая в основном только анио-
ны SOj“, С1—, NO3’, HSiO^, НСОз*, направляется на А„
загружаемый слабоосновиым анионитом АН-31, который
и задерживает почти все анионы сильных кислот и про-
пускает анноны НСО_з и HSiO^g. Для удаления этих
анионов после фильтров Aj устанавливают аннонитный
фильтр второй ступени А2, заполняемый высокоосновным
анионитом АВ-17. После А2 вода оказывается сравни-
тельно глубоко обессоленной. Однако для повышения
степени деионизации в ряде случаев за А2 располагают
фильтры смешанного действия (ФСД), которые удаляют
остатки иоиов. После ФСД электропроводность воды
может достигать 0,1—0,15 мкСм/см и меньше.
Проскок ионов в фильтрах при прочих равных усло-
виях тем меньше, чем ниже концентрация их перед
фильтром. ФСД представляет собой как бы длинную
цепочку Н1-А[-Н2-А2-Нз-Аз и т. д., что обеспечивает глу-
бокую деионизацию воды.
СХЕМЫ ОБЕССОЛИВАЮЩИХ УСТАНОВОК
Наиболее простой схемой обессоливающей установки
является следующая: К (или ИК)-М-Н1-Н2-Дг-А2. Она
используется для энергоустановок с барабанными кот-
лами давлением до 4—6 МПа. Более совершенные схе-
мы: ИК(нли К)-М-Н1-АгН2-Дг-А2 или ИК-М-НрАгДг-
Н2-А2, пригодные и для барабанных котлов давлением
10 МПа и более. Прямоточные котлы, особенно СКД,
требуют полного обессоливвния. Поэтому в эти схемы
вводятся ФСД в качестве третьей ступени: И К (или К)-
М Н|-А1-Н2-Дг-А2-ФСД.
Конструктивно описанные и другие схемы обессоли-
вающих установок могут быть выполнены по двум ва-
риантам По первому однородные фильтры располага-
ются группами п объединяются входным и выходным
153
коллекторами, как это указано на рис. 6-11,а— коллек-
торный вариант («гребенка»). По второму варианту
фильтры располагаются блоками (рис. 6-11,6). В каж-
дой блок входит по одному фильтру каждого типа, ко-
торые выстраиваются один за другим, образуя «цепоч-
ку». Обрабатываемая вода проходит последовательно
все фильтры и покидает цепочку, имея заданное ка-
чество»
Рнс. 6-11. Схемы обессоливающих установок
а — коллекторная («rptfiwca»): б — блочная («пеночка»!
/ — подвод обрлбзтыц ।. • А водь> // । твод
154
Оба варианта имеют свои достоинства и недостатки.
В настоящее время второму варианту отдается несколь-
ко большее предпочтение.
Технологический расчет обессоливающей установки
имеет целью определить расход реагентов, воды на соб-
ственные нужды, количество обрабатываемой воды (про-
изводительность брутто), количество фильтров, количе-
ство ионнтов и их эксплуатационный расход. Могут быть
использованы различные способы расчета. Наиболее
распространенный изложен в [15] н используется в дан-
ном слу час. Наиболее целесообразно расчет выполнить
иа примере.
ПРИМЕРЫ
6-9. Определить расход H2SO4, г/мя Н-катяонированной воды,
и NaOH, г/м3 аннонированной воды, расход воды на собственные
нужды установки в процентах от ее производительности нетто, экс-
плуатационный расход ионитов, количество фильтров разного типа
для следующих схем обессоливающих установок:
а) К-М-Н,-Н2-Дг-Ай
б) И-К-М-НсАгНгДг-АгФСД,
производительностью нетто 400 м3/ч. Качество обрабатываемой воды
приведено в табл. 6-2. Избыточное количество реагентов, содержа-
щихся в промывных водах, повторно не используется. Фильтры за-
гружаются следующими нонитами: Hi — сульфоуголь; Н2—КУ-2;
А1—АН-31; As — АВ-17-8. Обе схемы построены по коллекторному
варианту.
Решение. Определение заданных расходов производим по спо-
собу [15].
Расход H2SO4, г/м3, в схеме «а> (Н2 установлен следом за Hj)
на катионированне определяется по формуле
= (SK — 0,5) у Н1 + 0,5УГЬ + 3,5 (6-29)
или (для схемы «б», когда Н2 располагается за Ai)
= 0.5) УНм + 0,5.100 + 3,5, (6-30)
где УН1 —удетьный расход H,SO4, г/г-экв, дтя фильтров Н, (рцс. 6-12)
для сульфоугтя, рис. 6-13 для КУ-2); Уца — то же для Н>, установ-
ленного после Н, (рве. 6-14); при установке посте А, Ун =
-я 100 г/г-экв; 0,5 — концентрация катионов после Н,, мг-экв/л (рас-
четное значение); 3,5—расход H2SO4 на ФСД, г/м1 обессоленной
воды.
Значение Ун> зависит от отношения ra=CHCQ_/ЕЛ. Дозу коа-
гулянта А1г (SOJ3 в схеме «а» принимаем равной 0.7 мг-экв/л,
тогда = 2— 0,7 =1,3 мг-экв/а и т =5:0,28; по рис. 6-12 най-
НСО3
дем Ун =103 г/г-экв.
155
Таблица 6-2
Качество исходной и обработанной на гредочнстке воды
Схемы
а б
Показатель качества Исход- ная вода После коагу- ляции Исход - пан вода После из- вестко- вания
Жесткость, мг-экв/л . Щелочность, мг-экв/л Са2+, мг-экв/л . . - - Mg2+, мг-экв/л . ...... Na+, мг-экв/л . . . Сумма катионов ZK, мг-экв/л: so*~ . . Cl- HCOf . . . cog- СО2 (свободная) - он- HSiO-з Сумма анионов сильных кислот S/lc, мг-экв’ч (HSiO-g+COa) • - - • Сумма всех анионов ЕЛ0> 'мг-экв/л: ^НСО“ Сухой остаток, мг/л .... Взвешенные вещества, мг/л . 3,3 2,0 2,3 1.0 1,3 4,6 1,3 1.3 2.0 0,2 0,065 2.6 2,065 4,6 0,435 240 40—80 3.3 1.3 2,3 1.0 1,3 4,6 2.0 1.3 1.3 0,1 0,037 3.3 1,337 4,6 0,28 250 5,8 5,4 4 1.8 2.3 8,1 1.6 0,8 5.5 о.з 0,104 2,4 5,5 8.1 0.68 480 70—240 1,1 1.0 0.7 0,4 2.3 3.4 1.9* 0,8 0,6 0,4 0,065 2,7* 0,66 3.4 0,175 215 20
• С учетом дозы коагулятора FeSO, 0,3 мг-эквМ-
В схеме «б» на установку поступает известкованная вода со
щелочностью 1 мг-экв/л Для этой воды ЕЛо=3,4 мг-экв/л и т=
=0,6/3,4=0.175, тогда УН1 = Н7 г/г-экв.
Кислотность воды посте Н2 в схеме «а» составляет 3,3 мг-экв/л
и по рис. 6-14 находим Ун=’25 г/г-экв. Для схемы «б» Ун, =
•== 100 г/г-экв. Тогда
для схемы «а»
д*= (4,6—0,5) 103+0,5-225=535 г/м3;
для схемы «б»
(3.4—0 5) 117+ 0,5-100-) 3,5=392 г/м3.
Расход NaOH в схемах, нспользуюшнх только фильтры А2 (схе-
ма определяется по формуле
Йщ = <Cso J- + Cci - + С NO- + С ПО- +
+ Ссо, + С5^_)УА, = Д1Ул,- («>)
156
НСОз
Отношение эквивалентов-----
ЕД
Рнс. 6-12. Удельный расход H2SO, ил
регенерацию Hi, загруженного сульфо-
углем.
I. 2. 3. 4. Б к 7 — значения ZA. мг-экв7л
Рис. 6-13 Удельный расход H2SO< на регенерацию
Hi. загруженного КУ-2, при расходе H2SO4 60 кг/м3
катионита.
Л 2. 3 н 4—- значения ЕЯ. мг-экв/л. соответственно 1. 5,
10. 15.
157
Рис. 6 14 Удельный расход Нг5О< на регене-
рацию На (после Ht).
Рис 6-15 Удельный расход NaOH на регене-
рацию анионита АВ-17-8 в фильтре А2 при
поглощении анионов всех кислот.
/. 2, 3—остаточная концентрация SIO| , мг/л. соответст-
венно 0,2, 0.1в и 0.12 ври расходе NaOH 80. 100,
120 кг/мл анионита
158
В схемах, в которых имеются фильтры А] (со слабоосновным
анионитом), используется формула
= (Cso’- + Cd- + CNO-+ CNO2J У*- +
+ (ССО. + CSI0|_) У А,
Для схемы а отношение т* — /£ЛО = 0,008. Тогда по
нсо3
рис. 6-15 для расхода NaOH 80 кг/м1 анионита АВ-17-8 находим:
yAj =s 160 г/г-экв н дж== 4,6-160 = 735 г/м*. Для схемы <б> для
анионита АН-31 обычно принимают УА =80 г/г-экв. При использо-
вании в фильтрах А, анионита АВ-17-8 значение УА1 определяется
по рис. 6-15. В данном примере для схемы б УА1 находим по
рис 6-16, для суммы + Ссо» = 0,115 + 0,065=0,18 мг-экв/л,
принимая Ссо =5 мг/кг после декарбонизатора.
Этому значению (при расходе NaOH 100 кг/м’) соответствует
У Aj =580 г/г-экв
Тогда
ащ = 3,4-80-J-0,18 580+5=381.
При наличии в схемах а н б ФСД к значениям или <УЩ
прибавляют 5 г/м3.
Прн использовании щелочных регенерационных вод (примерно
60%) от А2 для регенерации фильтров Ai расход NaOH, г/м3, опре-
деляется по формуле
==2АУ общ. (6-32)
Значение Уосщ определяется по рис 6-17.
Количество ионита, необходимого для загрузки фильтра, может
быть определено по формулам*
а) товарного (влажность около 40%)
йгв=ф^; (6-33)
лн т
б) сухою
?см=^яСсв, (6-34)
где f, Ли — площадь сечения фильтра, м1, и высота слоя набухшего
ионита, м; у».я— насыпная масса товарного ионита, т/ма; Квт-—
коэффициент набухания товарного ионита; Сся— количество сухого
ионита, т содержащегося в 1 м5 набухшего материала
Насыпная масса ионитов и коэффициенты набухания приведены
в табл 6-3 [15]
Для дальнейших расчетов необходимо определить состав филь-
тровального оборудования водоочистки Для этого принимаем сле-
дующие скорости фильтрования, м/ч для фильтров в схеме «а>
H\=l0. А,=15. Н2=40. М=7; в схеме б H,= I4. А,-20, А2=20
Н2=40, М=7 Скорость фильтрования для фильтров Hi в обеих
схемах и для фильтров As в схеме <а» выбраны с учетом ГК. Z4
и Т— 16 ч
159
Рис. 6 16. Удельный расход NaOH на ре-
генерацию анионита АВ-17-8 в Л2 при обес-
кремнивании воды.
I, 2,3 4—остаточная концеигмция~81О^“в фгпг.траге.
мкг/л. соответственно 160. 120, |П0, 80 при рас
коде ^<1ОН, кг/м1 100, 120. 150, 200
Рис. 6-17 Удельным расход NaOH на анионированне
воды при повторном использовании щелочных вод
от А2.
/. 2. 3. 4. S. 6 — концентрация (НСО~а+СО2). мг-экв/л, нерол
А; соответственно’ (1.4. 0.3. 0.2 0.150; 0.1: О.СГ»
160
Насыпная масса ноннтов
Таблица 6-3
Ионит 17. % Насыпная масса, т/м* сс и «Н.Т
’т и Ъ1.И
С\"льфо’,'1 о ль 30 0.65 0,82 0,45 1 8 1,25
! тнонит КУ-1 50—60 0.66-0.7 0.6—0.7 0.32-6.35 2 1.0
То же КУ 2 00-60 0 ,•—0,80 0,76-0.80 U.3I1—0.38 2.1 1.0
Лнкоккт АНДО. АН-ЛИГ <15 0,65—0.68 0.75 0,16 2,1 2,0
То ясе ЭДЭ ЮП ^15 0,6-0,64 <1.06 0,31 2,0 2.8
То ясе АН 31 0,72—0. - > 0.8) 0.37 2,1 2.0
То же АВ 17 8 50-v.l 0 7—0,74 0.74 0.35 2.2 1.0
Примечание №'— влажность; ут ув я — насыпная масса соответ-
ственно товарного н набухшего чоннта, Ля с. Л'н т — коэффициент набуха-
ния сухого и товарного понята Указанные здесь катиониты находятся в Н-
н Na-форме. аниониты — в Cl-форме. С£ в — масса сухого ноннта в I ма на-
пухшего в воде материала.
Расход воды, %, на регенерацию фильтров Л2 определим по
формуле
SyEA-IOO
(6-35)
в схеме частичного обессоливания «а» и по формуле
So (С 4- С )-)П0
1 HSIO~~ СО—7
=-----------—е>~----- (6-36)
е Ла
в схеме «б».
Значения Ед принимаем по таб г. 6-1, ЕЛ0 н 4- ^*с0 ) —
по табл. 6-2, обменную емкость д1я анионита АВ-17-8 еА —по
рис. 6-18, е'к^~по рис. 6-19. Подставив численные значения вели-
чин, найдем: СА, = 10%, С'Л>=0,8% от количества фильтрита,
вырабатываемого данной группой фитьтров.
Собственные нужды, %, по расходу воды фильтров Н2 в обеих
схемах определим по равенству
r,cNa+.ioo
н- - <н
(6-37)
Значение ионной нагрузки по натрию иа фильтры Н2 можно при-
нять равным С№+= 0,2 ч-0,3 мг-экв/л, а значение /»Н1 для катио-
нита КУ-2 находим по рис. 6-20 для схемы «а»; для схемы «б»
<?'Hf = 400 г-экв/м3. Для обеих схем получим Сн%1%. Значение
собственных нужд, %, для фильтров А, определяется выражением
ЕуЕД 100
СА,
(6-38)
11—209
161
Рис. 6 18 Обменная емкость анионита АВ-17-8 для А2 при
поглощении аиионов всех кислот; значения берутся при рас-
ходе NaOH 80 кг/м3 анионита.
Остаточная концентра-
ция SiOi4, мг/л
/ — остаточная ковияпрацня StOi-*, жг/’Ч' 2» 3, 4, 5, 6, 1 — отношение
*HS1O£
Si-Оз COg
75,( + W
мг-зкв/л
Рис. 6-19. Обменная емкость анионита АВ-17-8 по
Honv HS1O-3 для А2 при остаточной концентра-
ции SiOs^O.15 мг/л.
I. 2, 3. 4 — расход МяОН. кг/м* анионита, соответственно
100, 150. 200. 300.
162
Значение ₽А для анионита АН-31 принимаем по рис. 6-21 для
отношения H2SO4 НС1 — 70 30 (875 г-экв м*). Посте выполнения всех
действий найдем Сд = 6.15%.
Расход, воды, %, на регенерацию фильтров Hi в обеих схемах
определяется выражением
„ 1й1Х-100
Си.= ------------- <6-39)
Значение для сульфоугтя найдем по рпс. 6-22. Дш обеих
схем его можно принять равным 2-10 г-экв/мг. Тогда май гем Сн -
=» 12,5 (схема <а») н 9.2% (схема «б»).
§ 0 0,2 О,Ь О,Б О,В 1,0
Отношечав зкВиВалентоВ ——
H+Nb
Рис 6-20. Обменная емкость катионита
КУ-2 для Н2 после Hi и после проско-
ка натрия менее 50 мкг-экв/л при рас-
ходе HaSO,: 60 кг/м3 ионита. (Прн уста-
новке Н2 после А] обменная емкость
для всех схем принимается 400 г-экв/м3).
Общий расход воды иа собственные нужды будет составлять:
в схеме «а» 23.5%; в схеме <б» 17,15% Учитывая это, производи-
тельность фильтров, ы’/ч, нетто должна быть равна: а) А2 -400,
На=440, Hj=495; б; ^=400, Нг=404, А)=429. Hi = 470. Это
значение собственных нужд только ионитной части, расход воды на
собственные нужды предочисткн следует рассчитывать по формулам
гд. 5. Исходя нз рассчитанной производительности должны быть
определены количество и типоразмер фильтров.
Часто вместо фильтров Н( ставят так называемые ступенчато-
противоточные (сдвоенные) Н-катионитные фильтры Hrov и Я"Сп,
схема которых приведена на рис. 6-23. Эта схема позволяет снизить
расход кислоты и улучшить качество фильтрата. На рис. 6-24 при-
ведена схема более совершенного ступенчато-противоточного филь-
тра. В этом фильтре вторая ступень имеет меньший диаметр, рабо-
тает по чистому противотоку со скоростью фильтрования более
30 м/ч, слой ионита в ней надежно зажат как при регенерации, так
и при работе Общий расход реагентов (на обе ступени) по опытным
данным не превышает 1.2—1,4 г-зкв/г-экв.
Н* 163
для Hi при расходе H2SO4 25 кг/м3 катио-
нита.
I. 2 3. 4. 10- значения SA. мг-экв.л
Рис 5-21 Обменная емкость анионита АН-Л по
Нг5О4+НС1.
I. 2. 3. 4. 5. S. 7. 8. 9. Ю. Н — соотношение HjSO* и HCL
%, соответственно 100 и 0; 90 н 10: 80 и 20; 70 и 3Q, во
и 40. 50 и 50. 40 и 60. 30 Н 70. 20 к 80. !0 и 90. 0 и 1Q0
Для расчета значения ерл берутся при расходе \зОН
Б0 кг/м3.
Рис. 6-25. Обменная емкость сульфоугля для
//п и Нса при расходе H2SO« 15 кг/м3 кати»
нита
7—Ю — значения SA. мг-экв/л
а
Рис. 6-23. Схема ступенчато-противоточного Н-ка
тионатного фильтра.
а — регенерация, б —работа.
Рис. 6-24 Схема ступенчато-про-
тивоточного фильтра конструкции
МоЦКТИ.
а ~ регенерация; б — работа; / — пер-
вая ступень: 2— вторая ступень
Рис 6-26 Обменная емкость катионитов (а)
и удельный расход HZSO* (б) для Нсв
(в Н'си — сульфоуголь 0,65 и Н^сп — КУ-2
0.35 общего объема) при расходе 100%-ной
H2SO4 35 кг/м3 смеси катионитов
I. S. 3. < 6. Ю — значения ЪА. мг-экв/л.
166
Прн установке Н'си я Н"ож расход воды на собственные нужды
определяется по уравнению (6-39) с введением в нее коэффициента
Q.7, „поскольку фильтры регенерируются совместно Фильтры Н'св
и Н"св могут быть загружены следующими катионитами соответст-
венно [оба сульфоуглем (at). сульфоуглем — КУ-2 (60, КУ-2—КУ-2
<в0- Прн расчете потерь воды иа регенерацию значение обменной
емкости следует принимать по рис. 6-25 (для случая ai), 6-26 (для
случая 6j) и 6-27 (для случая В|).
Рис. 6-27 Обменная емкость катионита КУ-2 для Hi
и Нсп при расходе H2SO* 60 кг/мэ катионита.
1 Я. 3. 4—значения ZK, мг экв/л, соответственно I, Б,
1D 15.
Приведенные выше формулы для расчета потерь воды на соб-
ственные нужды являются частными случаями общей формулы, вы-
водимой из равенства ер/С<=2д-100/Сн. откуда
^gCj 100
еР
где ер — обменная емкость попита, г-экв/м3, 2g — общий расход
воды иа собственные нужды, мя/м3 ноиита; Ci — концентрация уда-
ляемых ионов, мг-экв/л.
167
Глава седьмая
ОБРАЗОВАНИЕ ОТЛОЖЕНИЙ В ПАРОВЫХ КОТЛАХ
7-1. ОБРАЗОВАНИЕ ОТЛОЖЕНИЙ НА ПОВЕРХНОСТЯХ
ПАРОВЫХ КОТЛОВ И ТЕПЛООБМЕННИКОВ
БАРАБАННЫЕ КОТЛЫ
Независимо от характера потребления воду иа элек-
тростанциях и в промышленных котельных подвергают
нагреванию или охлаждению; в ряде случаев в нее вво-
дят те или иные реагенты. Как следствие воздействия
на воду теплоты и реагентов, а также из-за упаривания
ее в паровых котлах в ней протекают различные физико-
химические процессы, в результате чего одни соединения
разрушаются, а дрхгнс образуются. Это ведет во многих
случаях к возникновению различных труднорастворимых
веществ, которые и выделяются из пересыщенных рас-
творов в виде осадка, т. е. твердого вещества, или, как
часто говорят, в виде твердой фазы. Такими веществами
являются соединения кальция и магния, а также продук-
ты коррозии железа и медных сплавов.
Количество Вр, кг, вносимых в котел накипе- и шла-
мообразователей, за период времени t может быть опре-
делено по формуле
Вр=ЖоЭПп.вМ0-з, (7-1)
где Жп — концентрация накипе- или шламообразующих
веществ в питательной воде, в частности жесткость пи-
тательной воды, мг-экв/кг; Э — численное значение
эквивалента для рассматриваемого вещества нли сред-
невзвешенное его значение для данной группы веществ;
Рпв — количество питательной воды. т/ч.
На практике t может равняться 7—8 тыс. ч и более.
Естественно поэтому, что даже при малых значениях
Жг, получаются большие Вр, особенно для котлов высо-
кой производительности £)Пв- Паровой котел по отно-
шению к накипе- и шламообразующим веществам явля-
ется до некоторой степени суммирующим, собирающим
аппаратом. Опыт эксплуатации показывает, однако, что
далеко не все вещества, попадающие в котел, остаются
в нем в виде шлама или накипи. Часть их, иногда весь-
ма значительная, уходит из котла с продувочной водой.
168
Поэтому целесообразно ввести понятие о коэффициенте
накопления загрязнений в котле Лн. равном:
Кн—Вф/Вр,
где Вф, Вр — фактическое и расчетное количество отло-
жившихся в котле твердых веществ, кг (г или г/м2).
При Кв=1 все вносимые в котел вещества остаются
в нем, т. е. происходит максимальное загрязнение котла,
что, одиако, на практике не наблюдается. Условие Кн=
=0 отвечает безнакипному состоянию поверхностей кот-
ла. В действительности 0<Кв<1, и задача эксплуата-
ци заключается в том, чтобы держать Кв возможно бли-
же к нулю. На значение коэффициента Кн влияют мно-
гие факторы, из которых можно, например, упомянуть
свойства шлама, состояние внутренней поверхности, теп-
ловой поток, интенсивность циркуляции и т. Д.
Значение Вф для водотрубных паровых котлов и теп-
лообменников можно определить путем очистки электро-
шарошкой одной или нескольких труб данного участка
поверхности нагрева (передний экран, боковая панель,
конвективный пучок и т. п.) и сбором отложений нлн же
вырезкой контрольных образцов. Зная площадь поверх-
ности очищенной трубы f, м2, и массу собранных с нее
отложений g, г, можно найти удельное загрязнение о=
г/м2, которое можно распространить на всю дан-
ную панель, если Вф достаточно представительна, а все
трубы панели работают примерно в одинаковых усло-
виях.
Поскольку отложения образуются из воды, важным
и интересным показателем является также величина Ь,
г/ма:
6=^..
где Вф — фактическое количество отложений на данной!
поверхности, кг.
Формула показывает, сколько граммов отложений,
образовавшихся на контрольной поверхности нагрева
котла за t, ч, его работы, приходится на 1 м3 питатель-
ной воды, поданной в котел за тот же промежуток вре-
мени. Можно считать приемлемым, если прн t=8 тыс. ч
значение b не превышает 0,04 г/м3, что соответствует
удельной загрязненности поверхности нагрева котла
^20 г/м2.
109
Ь том случае, когда отложения состоят в основном
нз соединений кальция и магния, т. е. обусловлены жест-
костью питательной воды, значение Ь, г/т, можно опре-
делить и из следующего приближенного равенства:
д=ЖоЗс/Сш (7-3)
откуда ЖоЭсКв^Вф' IO3/ (Z?D.B/),
или
Вф.10*
^“= ЛГоЭсЦ, ,< ’ (7'4)
где Эс — средний массовый эквивалент для суммы ве-
ществ, образующих отложений; Жо— жесткость пита
тельной воды, мг-экв/кг.
Среднюю толщину отложений, мм, можно иайти нз
формулы
£=^-’ (7-5>
где Вф — количество отложений, собранных с поверх-
ности нагрева, г; р — плотность отложений, кг/м8; h —
поверхность нагрева, м2.
При прочих равных условиях можно предполагать,
что отложение иакипи или шлама будет пропорциональ-
но пароналряжеипю поверхности нагрева dn, кг/(м2-ч),
т. е.
<j=edD6i(H, (7-6)
или
о^п/Ж<АЛн-10-3. (7-6а)
Вместо Жо может быть подставлена некоторая сред-
няя концентрация всех на кипе- и шламообразующих
соединений, условно выраженная в мг-экв/кг.
Если в котле протекают процессы, связанные с выпа-
дением в осадок или разложением некоторого вещест-
ва, то количество его В, mi/кг (мг-экв/кг), выпавшее
в осадок или разложившееся, может быть определено
нз равенства
R=Sn в—Ра ($м в~5ц в) • (7*7)
где SD.B, SKB—концентрация вещества соответственно
в питательной и котловой воде, мг/кг (мг-экв/кг); рп —
продувка котла в долях паропроизводительиости.
Если /?=0, то получаем равенство
в_______________________Рп
“* 1 + Рп '
170
Если Хпв/5н.в>рп/(1+Рп), то 7?^ О, и, следователь-
но, образуется осадок или происходи г распад вещества.
Максимальное значение 7? достигается при pn(SKB—
SnB)^=0 ИЛИ 5к.в=5п.в-
При данном значении разности SKB—SnB значение/?
тем больше, чем меньше продувка котла рп.
Если вещество подвергается в котле распаду, то зна-
чение распада AS может быть определено по формуле
AS=AzX (7.9)
Эр
где So, 5ф — расчетная [определенная по формуле
(7-8)] и фактическая концентрация рассматриваемого
вещества в котловой воде, мг/кг (мг-экв/кг).
ПРЯМОТОЧНЫЕ котлы
Различают прямоточные котлы бессепараторные и
оборудованные сепараторами, которые позволяют как бы
продувать котлы, сбрасывая небольшое количество отсе-
парироваиной воды и растворенные в ней вещества.
В бессспараторных котлах, к которым относятся и все
мощные промышленные котлы электростанций сверх-
критнческого давления (СКД), вывод веществ из котла
отсутствует и все их количество, поступающее в котел
с питательной водой, остается в котле в виде отложе-
ний или уносится паром. Поскольку целью эксплуата-
ции является обеспечение безнакипного режима работы
котла и турбины, прямоточные котлы электростанций
стремятся питать водой, почти не содержащей нелету-
чих веществ. Питательной водой прямоточных котлов
является турбинный конденсат, в который добавляют
1—2% глубоко обессоленной воды или дистиллята испа-
рителей для восполнения потерь. На современных блоч-
ных электростанциях СКД эта смесь сейчас же после
конденсатора проходит блочную обессоливающую уста-
новку (БОУ), состоящую из механических (сульфоуголь-
иы.х) фильтров и ионообменных фильтров смешанного
действия, удаляющих остатки механических (в основном
окислы железа и меди) и ионных загрязнений. После
БОУ электропроводность воды составляет 0,1—
0,2 мкСм/см, что указывает на ее высокую чистоту. Как
показывает опыт, в прямоточных котлах СКД возникают
главным образом железоокисные отложения преимуще-
ственно в нижней радиационной части (НРЧ), воспри-
нпмающей наиболее высокие нагрузки. Степень чистоты
НРЧ и других поверхностей определяется путем осмотра
контрольных образцов, вырезаемых из парогенернрх то-
щих труб, а также выборочного контроля температуры
металла труб, которая увеличивается сростом толщины
отложений.
ПРИМЕРЫ
7-1. Жесткость питательной воды составляет 10 мкг-экв/кг Ка-
кую концентрацию NaaCOs. г/л, необходимо создать в этой воде,
чтобы при приведенном значении жесткости выпал осадок СаСО3.
если считать, что жесткость является кальциевой и температура
воды равна 298 К’
Решение. Произведение растворимости ПР для карбоната
кальция при 298 К равно 4,8-10-*. Следователыю, для образования
осадка необходимо, чтобы С С - > 4,Я. 10—• ита С - 2>
С.1 ' соз соз
> 4,8-I0~*/C^j+ г-ион/кг. Это неравенство и определяет концент-
рацию кальцинированной соды, при которой возможно образование
осадка карбоната кдлышя при 298 К. Т тя вычисления неото-
СО3
димо концентрацию иона кальция, которая приведена в мкг-экв/кг.
выразить в г-нон/л и найденное значение подставить уже в это не-
равенство Концентрацию пересчитывают по формуле
}КпЭ 10-20 „ „ г
гс,*+ тпм“= WMiT~n-5 |0’
где А— атомная .масса элемента (в данном случае кальция).
Тогда
„ 4.8-10-’
Ссо=-><Г5ЛО^ =*’«-'0-’ ™н/кг.
Поскольку №гСОз в растворе диссоциирует на ионы по урав-
нению
Na,COa 2Na+ + СО3-
т. с. одной молекуле соды соответствует в растворе один ион COJ-»
то количество молей углекислого натрия, находящихся в ра. творе,
будет численно равно концентрации иона СО|~Г r-иои кг. Следова-
тельно, концентрация На^СОз должна составлять:
CNaaCO4> 9-6‘ Ю-4-106 = 0,102 г/кг,
т. е. несколько меньше 2 мг-экв/кг.
7-2. Определить жесткость насыщенного раствора углекислого
кальция, для которого действительно равенство
=4,8-10-9.
Са + СОд
172
Решение. Из уравнения диссоциации карбоната кальция
CaCO.Zt Са>+4- COj-
следует, что количество образующихся ионов кальция равно числу
иояов СО|^ т. е. — С^ .и, следовательно, можно напи-
сать С'®Саг+ — 4,8-10-’, откуда
С^ац.»- А,8-10-’ -6,9-10-® г-ион/л.
Выразив концентрацию в мг/л я разделив ес на эквивалент
кальция, найдем жесткое ib раствора:
Sa+Z'l0,_6 4 10--40.10- !38 ,
Э - 20
7-3. Жесткость насыщенного раствора MgCOs при 298 К равна
6,38 мг-экв/л. Найти произведение растворимости для карбоната
магния.
Решение. Для опреде <еикя ПР необходимо предварительно
найти концентрацию ионов Mg2+ п СО^- в г-мон/я. Углекислый
магний диссоциирует в растворе по уравнению
MgC02z: Mg’+H-CC^-,
из которого следует, что количество ионов Mga+ или СО^~ равно
количеству молекул, находящихся в растворе Молярная концентра-
ция карбоната магния будет равна:
Л ЖпЭ 6,38.42,16
CMsCO,- Й)Щ= 10"-84,33 =3, ,9‘10 г-м011,'л-
Следовал с лыю.
-%’+Ссо|-’'3-,Я-,П->а- 1П"5-
7-4 Жесткость питательной воды промышленной котельной со-
ставляет 0 4 мг-экв/кг. Определить количество вносимых в котел
накипс и шламообразователей в пересчете иа СаСОз за 2500 ч
работы, если производительность котла по питательной воде состав-
ляет 5 т/ч.
Решение В питательной воде могут содержаться различные
шламо- н иакипеобразующие вещества, значение эквивалента кото-
рых различно. Поскольку состав и характер этих веществ во многих
случаях неизвестны, то в целях упрощения расчетов, когда необхо-
димы лишь примерные данные, принимают, что вносимые в Котет
указанные вещества выпадают в виде какого-либо нтиботес вероят-
ного соединения определенного состава, например CaCOs.
В I т питательной воды содержится СаСО3 н количестве
(СаСОз) =ЖоЭ-10-’=0,4-50 -10“а= 2-10“2 кг
Всего в котел будет подано 2500-5= I2.5-103 т воды.
Следовательно, количество шламо- и накипеобразователей соста-
вит 12 3-103-2-10”1—250 кг.
173
7-5. При содержания в воде ионов Са*+, SO* и СО^ воз-
можно выпадеиие в осадок двух веществ: CaSO* и СаСОз- Посколь-
ку в щелочной котловой воде карбонат кальция выпадает в виде
шлама а сульфат кальция образует твердые накипные отложения,
то на практике стремятся создать в котловой воде таияе условия,
чтобы в осадок выпадал карбонат, а не сульфат кальция Этого
достигают тем, что в котловой воде путем ввода кальцинированной
соды поддерживают такую концентрацию ионаСОд-, при которой
выпадение сульфата кальция становится невозможным. Определять
эту концентрацию иарбоиат-иона, решив задачу в общем виде.
Решение. Для насыщенного раствора карбоната н сульфата
кальция можно написать:
Сс.-Сой- = ПР’
C&,+Cs<^- - ПРс’
Выпадение сульфата кальция не произойдет, е -ли будет соблю-
дено следующее неравенство:
С другом стороны, для насыщенного раствора СаСОз концентра-
ции кальция будет равна:
Подставляя значение Сс«>+ в предыдущее неравенство, полу-
чаем:
ПРК < ПРС
Ссо?- CsoJ-'
Это неравенство определяет условие, при котором будет выпа
дать именно СаСОз. Решив его относительно ^т2—’ иа^Дем:
Cm2- > Сенг- .
“з ПРС SO<
Следовательно, концентрация иоиов СО|“ (аналогично и ионов
РО*~ при фосфатном режиме) в котловой воде, при которой нсклю-
чается возможность образован 1Я гипсовой накипи, зависит от кон-
центрации сульфаг-иэиов. Сгрого говоря, предупреждающая накнпе-
оЗразоваиие концентрация ионов СО|~ при введении в котел соды
174
и in ионов РО^- прн фосфатном режиме зависит и от концентрации
в котловой воде других анионов, способных с нонами Са’+ образо-
вать накипь, например ионов Sic^-.
ЗАДАЧИ
7-1. Кальциевая жесткость раствора составляет
20 мг-экв/л. Какую следует создать в этом растворе кон-
центрацию сульфата натрия, чтобы выпал осадок серно-
кислого кальция при температуре 298 К?
7-2. Дан раствор сульфата кальция жесткостью
1,0 мг-экв/л, температура раствора 298 К. Определить
жесткость этого раствора после прибавления к нему
кальцинированной соды в количестве 1 мг-экв/л и после
ликвидации состояния пересыщения раствора
Ответ: 0,138 мг-экв/л
7-3. Котел паропроизводительиостью 200 т/ч питают
водой, кальциевая жесткость которой 10 мкг экв/кг
Определить суточное количество вносимого в котел шла
ма, кг, в предположении, что кальций выпадает в фор-
ме гидроксилапатита. Продувка котла равна 3%.
Ответ: 2,51 кг.
7-4. Каким должен быть по условиям задачи 7-3 ко-
эффициент Кв, чтобы количество отложений в среднем
по всей поверхности нагрева котла составляло 20 г/м2
при непрерывной работе его в течение 8 тыс. ч. Среднее
паронапряжеиие поверхности нагрева принять равным
100 кг/ (м2*ч)
Ответ: Кв—5%.
7-5. Жесткость питательной воды увеличилась на
1 мкг-экв/кг. Какому количеству шлама, вносимому
в котел паропроизводительиостью 150 т/ч за 8 тыс ч его
работы, будет соответствовать такое повышение жест-
кости, если считать, что шлам выпадает в виде гидро
ксилапатита. Продувку котла принять равной 2%.
Ответ: Вр=61,2 кг
7-6. При вскрытии котла в период капитального ре-
монта было обнаружено значительное зашламлсние вну-
тренних поверхностей нагрева, доходившее до 300 г/м2
Указать возможные причины, приведшие к такому за
грязпению. и необходимые мероприятия но предупреж-
дению подобных явлений впредь.
7-7. Определить толщину споя отложений отвечаю
щую удельному загрязнению поверхности нагрева
175
=20 г/м2, при условии их равномерного распределения н
плотности 2,0-103 Ki /м3.
7-8. Конденсатор паровой турбины, в который посту-
пает 120 т/ч пара, охлаждается водой, жесткость кото-
рой 6 мг-экв/л. Присос сырой водь! составляет 0,05%-
Определить, какое количество кальция и магния будет
занесено в котел паропроизводительностью 130 т/ч за
7,5 тыс. ч его работы только за счет этого присоса, если
для охлаждающей воды эквивалентное отношение
Q:a2+/^Mg2+ =3/1. Жесткостью конденсата пара мож-
но пренебречь.
Ответ: (Са)=40,5 кг;
(Mg) = 8,08 кг.
7-9. Используя данные задачи 7-8, определить сред-
нюю удельную загрязненность о поверхности нагрева
котла5 равной 930 м2. Считать, что загрязнения пред-
ставляют собой Mg3(PO4)2, ЗСа3(РО4)2-Са(ОН)2 и Кп=
=0,2.
Ответ: о=28,0 г/м2.
7-10. По условиям задачи 7-9 иайтн толщину слоя
отложений в предположении, что они распределились на
10% поверхности нагрева котла. Плотность отложений
принять равной 1,8-103 кг/м3.
Ответ: 0,157 мм.
7-11. Определить максимально допустимую жест-
кость питательной воды, при которой о=20 г/см2, для
следующих условий, паропроизводительность котла
200 т/ч; продувка 3%; длительность периода работы
котла между его очистками 8 тыс. ч; поверхность нагре-
ва котла 1,1-10* м2; значение коэффициента накопления
загрязнений /(„: а) 0,2, б) 1,0; отложения состоят из
гидроксилапатита.
Ответ: а) Жо=1,3 мкг-экв/кг;
б) Жо=0,26 мкг-экв/кг
7-12. Соединения железа, попадая в котел, выпадают
в осадок к образуют железоокисные отложения, способ-
ные прикипать к поверхности труб, генерирующих пар.
Концентрация Fc в питательной воде котлов среднего
давления по ПТЭ не должна превышать 0,1 мг/кг прн
жидком топливе. Определить количество Fe2O3, которое
может быть занесено в котел паропроизводительностью
150 т/ч, при давлении 3,9 МПа за период работы
7,5 тыс. ч и при концентрации железа в питательной
17b
воде 100 мкг/кг. Коэффициент накопления загрязнений
Кв принять равным единице, а продувку 3%.
Ответ: 166 кг.
7-13. Анализ твердых иакипиых соединений, взятых
из кипятильной трубы котла низкого давления, показал
следующий состав: 44,8% СаО; потеря при прокаливании
35,2%. Какое соединение преимущественно присутству-
с! в отложениях?
7-14. Какое количество 100%-ной соляной кислоты бу-
дет израсходовано на растворение накипи, состав кото-
рой приведен в задаче 7-13, если поверхность иагрева
котла составляет 200 м2, а средняя толщина отложений
при плотности 2,2-103 кг/м3 но всей поверхности равна
2,0 мм?
Ответ: 515 кг.
7-15. Для очистки котла от накипи с площадью по-
верхности иагрева 100 м- его заполнили 4%-ным раство-
ром соляной кислоты, объем раствора составлял 9,7 м3.
После заполнения раствор перемешивался насосом по
замкнутой схеме. Определить концентрацию кислоты
после растворения накипи, состоящей на 80% из СаСОз
и 20% нерастворимых в кислоте соединений Толщина
отложений по всей поверхности котла составляла
2,0 мм. Плотность отложений принять равной 2,3 X
X 103 кг/м3, раствора кислоты 1000 кг/м3.
Ответ: 1,44%).
7-16. Для условий задачи 7-15 примем, что растворе-
ние карбоната кальция происходило таким образом, что
за каждый час растворялась половина всего количества,
которое было до начала данного часа. По мере раство-
рения накипи концентрация раствора будет уменьшать-
ся. Построить график изменения концентрации раствора
кислоты и определить, через сколько часов можно счи-
тать процесс кислотной промывки котла практически
законченным (растворение отложений на 90—95%)-
7-17. В сосуд, на дне которого образовался слой осад-
ка CaSO4, была налита дистиллированная вода. Какова
будет жесткость воды в этом сосуде после достаточного
времени контакта ее с осадком прн 298 К? Начальной
жесткостью воды можно пренебречь. ПР,=6,1 • 10-5.
Ответ: ЛСО=15,6 мг-экв/л.
7-18. Для удаления плотного и прочно сцепленного со
стенками сосуда слоя CaSO4 было предложено периоди-
чески заполнять сосуд дистиллированной водой и после
12—209 177
ье насыщения выливать ее из сосуда» повторяя это до
полного растворения осадка. Определить, сколько раз
необходимо будет сменить воду в сосуде, если толщина
слоя CaSO.b составляет 2 мм, площадь его 1 дм2, плот-
ность 2,5-Ю3 кг/м3 и в сосуд каждый раз заливают 1 л
воды. Значение ПРС взять из задачи 7-17.
Ответ: примерно 47 раз.
7-19. Способ удаления осадка, описанный в задаче
7-18, неудобен н неэкономичен. Поэтому он был заменен
другим, сущность которого заключается в следующем.
В сосуд, содержащий раствор CaSO*, добавлялся кон-
центрированный раствор кальцинированной соды. После
его добавления появился осадок, н через некоторое вре-
мя вместо твердого слоя гипса в сосуде оказался рых-
лый осадок. В растворе должен быть при этом все
время избыток соды, и для ускорения процесса раствор
нагревают до кипения. Объяснить, в силу каких физико-
химических процессов твердый осадок перешел в рых-
лый шлам? Можно ли использовать этот способ для
очистки котлов от накипи?
7-20. Какой следует применить реагент, чтобы, ие
прибегая к кислоте, перевести в рыхлый шлам слой
твердых отложений карбоната кальция, образовавших-
ся в сосуде.
7-21. Котел паропроизводительностью Da, т/ч, пита-
ется водой жесткостью Мо, мг-экв/кг. Определить коли
чество накипеобразующих соединений, которое будет
внесено в котел питательной водой за время /, ч, если
эквивалентная масса этих соединений равиа Э, а про-
дувка котла составляет ра,
Ответ- В _JKo3*Dn(I00 + Aj
итвет. io», цр
7-22. Пароперегреватель котла среднего давления
имел три коллектора. В среднем коллекторе был рас-
положен пароохладитель. При теплохимических испыта-
ниях новых сепарационных устройств, длившихся 2 нсд,
лопнула трубка пароперегревателя между коллектором
перегретого пара и средним коллектором. Назовите по
крайней мере две возможные причины прогара паропе-
регревателя.
7-23. Поврежденная трубка пароперегревателя (см.
условия задачи 7-22) была вырезана н осмотрена. Она
оказалась полностью забитой солями на длине пример
но 1 м. Возник вопрос, произошло ли это вследствие
178
плохого качества иасыщениого пара при испытаниях или
же причиной тому послужила течь пароохладителя, что
решительно отрицалось эксплуатационным персоналом.
Возможно ли это, и если возможно, то каким образом
установить истину, основанную иа объективных данных?
Водный режим котла ие имел каких-либо особенностей:
он питался смесью конденсата и химически обработан-
ной воды, котловая вода фосфатировалась подачей фос-
фатов в барабан котла, продувка котла находилась
в допустимых пределах
7-24. По предложению старшего химика, чтобы ре-
шить возникшую задачу, сделали анализ отложений,
взятых нз прогоревшей трубы (см. задачу 7-22). Дан-
ные анализа отложении и качества питательной воды
позволили точно установить, что причиной за коса паро-
перегревателя, описанного в задаче 7-22, явилась не-
плотность пароохладителя. Каким образом химикам
удалось это установить, что послужило основой в этих
исследованиях’
7-25. На ГРЭС было внесено некоторое изменение
водно-химического режима энергоблока, направленное
на уменьшение концентрации продуктов коррозии же-
леза. Почти вслед за этим была сделана мпкропромьтв-
ка НРЧ корпуса Л котла, в то времи как корпус Б
продолжал работать без остановки и промывки. По
истечении 3,2 тыс. ч после промывки корпуса А энерго-
блок был остановлен и из корпуса А и Б взяты вырез-
ки из одних и тех же труб НРЧ. Обработка вырезанных
образцов показала наличие в ипх отложений: корпус А
85, Б 342 г/м2 Оппе юлить скорость образования желе-
зоокисных отложений в корпусе Б до (а) и после (б)
внесения упомянутых выше изменений в водно-химиче-
ский режим энергоблока. Корпус Б проработал 9125 ч.
При расчете принять, что образовавшиеся и котзе отло-
жения распределены на ’/= поверхности НРЧ, которая со-
ставляет 120 м2 в каждом корпусе.
Отпет: а) 1.05:
б) 0,64 г/(м2-ч).
7-26. Принимая среднюю нагрузку по питательной но-
те корпусов А и Б энергоблока (см. предыдущую за ча-
чу) 420 т/ч, определить количество окислов железа
Ее-О- осадпвптихся на стенках труб НРЧ пз 1 т пита-
тельной возы для случаев «а» и залачи 7-25.
Ответ: 9 5- б) 1.5 мг/т.
12* J79
7-27. Определить для условий, изложенных в задачах
7-25 и 7-26, какова загрязненность окисламп железа
Fe3O4 поверхности НРЧ, если в котле осаждается
1 мкг/кг Fe и длительность работы котла между про-
мывками составит 8 тыс. ч.
7-28. Механические (сульфоугол ьные) фильтры БОУ
энергоблока 300 МВт задерживают в среднем 4 мкг/кг
железа. Определить, какое количество продуктов кор-
розии Fe3O4, кг и л, останется в каждом фильтре при
работе их без промывки 8 тыс. ч при скорости фильтро-
вания конденсата 30 м/ч, диаметре фильтров 2,6 м.
7-2. ФОСФАТИРОВАНИЕ КОТЛОВОЙ ВОДЫ
Применение фосфатирования котловой воды основа-
но на следующих положениях Поступающие в котел
с питательной водой катионы Са24- могут давать труд-
иорастворимые соединения с различными присутствую-
щими в котловой воде анионами и, в частности,
с SiOg , SO*-, РО*“ Возникающие при этом соедине-
ния по-разному ведут себя в котловой воде. Сили-
кат CaSiOg и сульфат кальция CaSO4 осаждаются
главным образом па поверхности нагрева в виде плот-
ных образований, т. е преимущественно в виде накипи
Карбонат кальппя и соединение кальция с ионом
РОр — гидроксилапатит ЗСа3(РО4)г-Са (ОН)2, наобо-
рот, выделяются преимущественно в форме шлама, уда-
ляемого из котла продувкой. Поэтому на практике стре-
мятся создать в котловой воде такие условия, при ко-
торых кальций выпадал бы в виде карбоната или гидро-
ксила пятита. Практически это сводится к тому, что
в котловой воде создают и непрерывно поддерживают
опретелениую концентрацию ионов РО*- или COj*.
Однако щелочной режим котловой воды является эф-
фективным лишь тля пара давлением не выше 1,6 МПа,
а для больших давлений применяется фосфатный ре-
жим. Это объясняется тем. что карбонат-ноны СО3—
подвергаются распаду, скорость которого существенно
повышается с увеличением температхры (давления):
со^+доггон- ;-со,.
1ЯО
Фосфат-ион РО4 ’ обладает достаточной прочностью
и в котловой воде не распадается. Фосфатирование по-
зволяет предупредить образование кальциевой накипи,
а не накипи вообще. Для этого концентрация иона РО^~
в котловой воде ие должна быть ниже некоторого значе-
ния г, м^кг, которое может быть определено по следую-
щей формуле:
i=tf4-0jCSfO2-4-0,01CSO2_f (7-1С)
где N— постоянная величина, равная 5 мг/кг, для кот-
лов без ступенчатого испарения и 3 мг/кг для чистых
отсеков котлов со ступенчатым испа рением: Csiq“,
CS02- —концентрация этих ионов в воде, мг/кг.
Эта формула пригодна обычно для котлов, в пита-
тельною воду которых для восполнения потерь добав-
ляется умягченная (натри й-катионирова иная) вода.
Концентрация г по ПТЭ имеет верхний предел. Для
котлов без ступенчатого испарения не более 15, в соле-
вом отсеке котлов со ступенчатым испарением не более
30 при работе их на жидком топливе и не более
50 мг/кг, если используются другие виды топлива. Фос-
фатирование применяется только для котлов с естест-
венной циркуляцией (барабанных).
При пуске котла в работу после монтажа или капи-
тального ремонта в него необходимо ввести фосфат для
создания начального избытка иона РО4Л Количество
технического фосфата Фь кг, которое вводится для это-
го в котел, может быть определено по приближенной
формуле
где водяной объем котла, м3; Сф—содержание
РО4" в техническом продукте, %•
Во время работы котла в него также необходимо
вводить фосфат, так как часть его расходуется на свя-
зывание накипеобразователей, а другая часть — обычно
заметно большая—-удаляется из котла с продувочной
водой, т. е. теряется. Количество трина грпйфосфата,
181
вводимое в работающий котел, определяется по следую-
щим формулам:
Ф,=^(28,5-*о+а0; 67-12)
Ф,=^Л(28,5Мо+л0: (7-13)
’^-^РвЛЖП+дО+М. (7-,4)
где Ф2 в г/м3; Фч, Ф'3 в кг/ч; Ж»— жесткость питатель-
ной воды, мг-экв/кг; А,п—количество питательной во-
ды, т/ч: Dn — паропроизводитепьиость котла, т/ч; рв,
рп — продувка котла в долях соответственно от количе-
ства питательной во ты и от паропропзводительности
котла; 28,5 — эквивалентная масса иона РОл2- в ги-
дроксила патитр.
В привеченных формулах первое слагаемое опреде-
ляет полезный расход фосфата иа связывание накипе-
образователей, второе характеризует потерн фосфата
с продувочной водой.
При расчетах дозировки иногда является необходи-
мым определить объем, м3/ч, подаваемого в котел
раствора фосфата известной концентрации. В этом слу-
чае можно воспользоваться следующей формулой:
т/ Оп [28^5ДЯ’О (1 4- р„} 4- - г,
— iPCpPfI«- - > (71&)
где Ср — концентрация NaaP04 в растворе, ®/0; л — отно-
шение CpQS-ZC^po =0,579; рф — плотность раствора три-
натрийфосфата, кг<м*.
Если в процессе эксплуатации вести точный учет
количества расходуемого фосфата, то, пользуясь фор-
мулами (7-13) или (7 14), можно определить среднюю
жесткость питательной воды, мг-экв/кг, за некоторый
промежуток времени А/:
D, -aJM
' (716)
1ПФ-.МСД-Опд^
28,5ОпЛ< (1+аО ’ ' 4
где произведения ФЭА/, и означают соот-
ветственно расход фосфата, кг выработку пара, т, и
количество поданной в котлы питательной воды, т,
промежуток времени Д£, ч. Следует иметь в виду, что
подобные расчеты могут дать удовлетворительные ре-
зультаты лишь при условии достаточно точного опре-
деления входящих в правую часть равенств величин за
некоторый промежуток времени.
Концентрация раствора фосфата Сф, %» подаваемого
в котел, и производительность насоса-доза тора #к.д,
л/ч, связаны между собой зависимостью
С ^100ф
ф «7н лРф
(7-18)
Поэтому концентрацию раствора фосфата нельзя вы-
бирать произвольно, без учета производительности на-
соса-дозатора и расхода фосфата Ф3. Целесообразно
значение Сф принимать таким, чтобы насосы-дозаторы
работали с нагрузкой 75—80% номинальной.
Объем баков Ус, м3, может быть определен по фор-
муле
^='3^, (7-«9)
где ti — длительность периода между двумя последова-
тельными заполнениями бака, ч.
Таблица 7-1
Снижение щелочности питательной воды при
использовании кислых фосфатов
Вещество Спмженне щелочности, 1 мг-экв/кг, при ней- трвлнзацин до [ Вещество Снижение щелочное™, мг-экв кг. прн вей- тралвзацни до
NaJiPQ, NUaFO, | Na,HTO4 Мж3РО,
№2НР04 0,01 Ф । №,Р,О„ З.эио-’Ф 0 014 Ф
NaH.PO4 0,01 Ф 0,02 Ф (N.1PO,). 0,01 Ф 0,02 Ф
Кроме тринатрийфосфата, применяют и некоторые
другие фосфаты: динатрийфосфат NasHPOt, гексаме-
тафосфат натрия (NaPOs)e, триполифосфат натрия
Na5PsOio, пирофосфат натрия NfliPsO? Полифосфаты
в водных растворах подвергаются гидролизу и перехо-
дят в кислые ортофосфаты №Н-РО4 и Na-HPO4. Это
означает, что при употреблении перечисленных фосфа-
тов снижается щелочность питательной воды иа неко-
торое значение, определяемое по табл. 7-1. В ией Ф
183
означает количество фосфата, г/т пара, в пересчете па
РО*3-, которое определяется по формуле
Ф^=28,5^Ко (рп +1) + Pni-
При режиме чисто фосфатной щелочности избыток
фосфатов в котловой воде i, мг/кг, зависит от щелоч-
ности Щч.в, жесткости Ж о питательной воды и нейтра-
лизующей способности кислых фосфатов п, под кото-
рой понимают число эквивалентов NaOH, необходимых
для нейтрализации одного моля PO’J":
95 /ZZZn_B^Q,I^o
Рв V П
-0,ЗХ„).
(7-20)
Если в котловой воде фосфаты присутствуют только
в виде NasPO4l то при режиме чисто фосфатной ще-
лочности соотношение будет следующее:
40ZZ/,k.b=0,42i
или
40Щ"к.в=0,84*,
где Щ"к.в, Щ'к.в — щелочность котловой воды соответ-
ственно общая и по фенолфталеину, мг-экв/кг.
Так как режим, отвечающий этим соотношениям,
трудно выдержать, то на практике стремятся придержи-
ваться режимов, удовлетворяющих следующему усло-
вию:
40Щ"к.в<0,84/.
ПРИМЕРЫ
7-6. По анализу концентрация в котловой воде SiOg- состав-
ляет 10 мг/кг и SOJ- 50 мг/кг. Опредешть избыток фосфатов
если котел не оборудован устройствами ступенчатого испарения.
Решение. Подставив численные значения в формулу (7-10).
получим:
i=54-0,l -104-0,01 -50=6,5 мг/кг.
7-7. Определить количество 12-водпого трииатрийфоефзта, ко-
торое необходимо ввести в подготовленный к пуску котел, оборудо-
ванный ступенчатым испарением н имеющий водяной объем 70" №
Концентрация в котловой воде чистого отсека 5Юд—равна I5hSO4~
114 мг/кг.
Решение. Вначале по формуле (7-10) определяем необходи-
мый избыток фосфатов, который будет равен-
<=34-0,1-154-0,0!-{14=5,64 мг/кг.
184
Затем, подставив численные значения в формулу (7-11), найдем
количество фосфата -
70-5,64
ф> -ЁГПГ
1,58 кг,
где Сф принята равной 25% (для Na3PO4-12H2O)-
7-8. Установленные в коте н>пой три котла паропроизводитсль-
ностыо 150 т/ч каждый, не оборудованные устройствами ступенча-
того испарения, питаются водой жесткостью 8 мкг-экв/кг. Опреде-
лить расход, кг/сут, тринатрийфосфата на все котлы, а также то сю
количество в процентах, которое удаляется с продувочной водой.
Концентрация в котловой воде SiO§“ 61 мг/кг,SOj“ 346 мг/Ki,
ггродлвка рп = 3% Значение Сф принять равным 23,8%.
Решение. Необходимый избыток фосфатов t в соогвеютвин
с формулой (7-Ю) равен
1=5+0.1-61+0,01-346=14,6 мг/кг.
Для определении расхода фосфата используем формулу (7-14),
поскольку продувка приведена в процентах от паропроизводитель-
ности котла Подставив численные значения величин, найдем расход
фосфата иа все три котла:
3-150
Ф'. = tn oq н (28,5-8-10-*-1,03 + 0,03-14,6) = 1,27 кг/ч,
[м*,о
или 30,5 кг в сутки.
Па умягчение воды, т. е. на связывание накипсобразователей,
расходуется 0,44 кг/ч, или (0,44/1,27)-100 =34,6%» остальное коли-
чество уходит с продувочной водой
7-9. За А1=120 ч работы котельной, рассмотренной в примере
7-8, израсходовано 180 кг тринатрийфосфата с содержанием РО^
=24,5% За этот период средние значения I и ри были равны: 1=
= 17,2 мг/кг и рп=3,1%. Средняя нагрузка котельной по пару со-
ставляла 432 т/ч Определить среднюю жесткость питательной воды
Решение. Для определения жесткости питательной воды вос-
пользуемся формулой (7-17) При этом следует учесть, что ФзД1=
= 180,0 кг. Находим
10-180-24,5 — 432-120-0,031 -17,2 л
= 28,5-432-120-1,031 =0,011 мг-экв/кг.
Следовательно, в оiдельные периоды времени жесткость пита-
тельной воды была заметно больше того значения (8 мкг-экв/кг),
которое приведено в предыдущей задаче по данным разовых опре-
делений.
7-10. В котлах поддерживается режим чисто фосфатной щелоч-
ности. Определить избыток РО%~ в котловой воде i, мг/кг, необходи-
мый для нейтрализации щелочности питательной попы ЛЩП в,
мг-экв/кг.
185
Решение. Нейтрализация щелочи, например динатрийфосфа-
том происходит по реакции
HPOJ- + ОН- -* POJ- 4- Н,0
или мононатрийфосфатом
В,РО4- 4- 2ОН - POJ- 4- 2ILO.
Нейтрализующая способность дииатрийфосфата равна единице,
моноиатрийфосфвта — двум Концентрации РО^- в питательной
воде, необходимая для нейтрализации Л/Я. будет равна
95
—Л/л,
где п—нейтрализующая способность кислых фосфатов.
В свою очередь
ДЩ=/Япв-0,4Жо,
где Жо—жесткость питательной воды, мг-экв/кг; 0,4 —коэффи-
циент, учитывающий количество щелочи и фосфатов, израсходован-
ных на образование гидроксил апатита.
Избыток РО4 , мг/кг, в котювои воде составит'
95-100
I = —- (Ш„ , - ОЛЖо). (7-20.)
пРп
7-11. Щелочность питательной поды составляет 12 а жесткость
3 мкг-экв/кг Котлы работают на режиме чисто фосфатной щелочно-
сти с продувкой 3% и нормативным избытком РО^“, равным
30 мг/кг Определить возможность поддержания нуль гидратного
режима при фосфатировании котловой воды
Решение Нейтрализация щелочности протекает по реакции
NasHPOt4-NaOH—*Na3P04+HsO,
т. е п=| Тогда по уравнению (7-20а) найдем г=34 мг/кг, что
превышает норматив Следовательно, необходимо использовать смесь
кислых фосфатов, например ди и монофосфата натрия в таком со-
отношении, чтобы
95.100
л ----------(Шп В -о, 4 ад,
Fn PoJ—
где £**£03— — нормативная концентрации фосфятов, мкг/кг.
Подставляя заданные значения, найдем л=|,|4 Следовательно,
Мы можем составить равенство 1+2х=1,14, откуда доля моноиат-
рийфосфата будет равна к=(1Д4—1}/2=0,07 Таким образом, что-
бы получить смесь с п— I 14, следует иа каждый моль Na3HPO4
взять 0,07 моля NaH2PO«, т е Nas’HPOt+0.07 NaH2PO4
И6
ЗАДАЧИ
7-29. Определить количество трииатрийфоефзта (вто-
рой сорт, ГОСТ 201-76), которое необходимо подать
в подготовленный к пуску котел, чтобы создать в котло-
вой воде необходимый избыток фосфата t=18 мг/кг.
Объем воды в котле равен 60 м’
7-30. По условиям задачи 7-29 определить, какая
часть тринатрнифосфата, %, будет связана кальцием,
содержащимся в залитой в котел воде, если кальциевая
жесткость равна 10 мкг-экв/кг. Расчет вести иа три-
кальцийфосфат.
Ответ: 1,76%
7-31. Формула (7-11) приближенная, так как в ней
не учитывается расход фосфата на связывание накипе-
образователей, содержащихся в залитой в котел воде.
По условиям задачи 7-30 ошибка составляет 1,76%. Вы-
вести точную формулу, учитывающую жесткость зали-
ваемой в котел воды.
V
О.вет: Ф,= „)Сф(,_,'МоЭ) ’
7-32. В воду, подаваемую в котел при его заполне-
нии, равномерно ввели 10 л раствора три натрий фосф а та
концентрацией 5,0%, считая иа MajPO4 (р<|»=1,0 г/см3)
После заполнения котла было установлено, что концен-
трация в котловой воде РО4 равна 5,8 мг/кг. Опреде-
лить водяной объем котла.
Ответ: 50 м3
7-33. Определить расход, кг ч, тринатрийфосфата (пер-
вый сорт, I ОСТ 201-76) для котла паропроизводитель-
иостью 150 т'ч. Концентрация в котловой воде SiO^
40 мг/кг и SO;~ 250 мг/кг. Жесткость питательной воды
равиа 12 мкг-экв/кг, ступенчатое испарение отсутствует,
продувка равна 3,6%.
7-34. После капитального ремонта готовится к пуску
котел, водяной объем которого неизвестен. Можно ли и
каким образом, пользуясь формулой (7-11), определить
вначале водяной объем котла а затем и количество
тринатрнифосфата, которое необходимо в него ввести?
7-35. Определить годовой (8760 ч) расход трниатрни-
фосфата котельной, оборудованной котлами, суммарная
паропроизводнтельность которых составляет 750 т/ч.
[87
При расчете пользоваться следующими данными: жест-
кость питательной воды 9 мкг-экв/кг, среднее значение
продувки 2,5%, i=25 мг/кг, содержание NaaPOt-lSHzO
в техническом продукте составляет 93%,
Ответ: 24,5 т.
7-36. По отчетным данным котельной, оборудованной
тремя однотипными котлами, месячный (740 ч) расход
тринатрийфосфата составил 1200 кг. Среднемесячные
данные остальных параметров следующие: жесткость
питательной воды 10 мкг-экв/кг, избыток фосфат-иоиов
в котловой воде 40 мг/кг, паропроизводительиость каж-
дого котла 180 т/ч, продувка котлов 2%. Содержание
Na3PO4 в техническом продукте 41 % Считая остальные
данные верными, проверить правильность указанного
расхода фосфата.
Ответ: в действительности Фл=1085 кг.
7-37. Как указано в предыдущей задаче, за месяц
в котельной было израсходовано 1085 кг трннатринфос-
фата. Используя данные этой задачи, определить ко-
личество фосфата, которое выведено из котлов с про-
дувочной водой.
Ответ: 910 кг.
7-38. Установленные в котельной два котла произво-
дительностью 180 т/ч каждый обслуживает одни насос-
дозатор раствора тринатрийфосфата. Чему равна про-
изводительность этого насоса, л/ч, при концентрации
раствора фосфата 2% (Na^PCX), жесткости питательной
воды 8 мкг-экв/кг, избытке РО*~ в котловой воде
24 мг/кг, продувке Рп—4% и плотности раствора
1,0 г/см3.
Ответ: 37,5 л/ч.
7-39. Производительность одноплунжерного насоса-
дозатора типа НД-60В равна 60 л/ч. Сколько котлов
паропроизводительностью 200 т/ч каждый может обслу-
жить этот иасос-дозатор прн концентрации раствора
ПазРОй=5%; £=20 мг/кг; Жо=10 мкг-экв/кг; рф«
=1,05 кг/л н рп=5%?
Ответ: 7 котлов.
7-40. Два котла производительностью 170 т/ч каж-
дый обслуживает один иасос-дозатор раствора фосфата.
Какую следует принять концентрацию раствора трина-
трнйфосфата, чтобы нагрузка насоса-дозатора составля-
ла 50 л/ч. Водный режим котлов характеризуется сле-
дующими данными: i=15 мг/кг; рп=2,5%; Жо=
188
=12 мкг-экв/кг. Плотность раствора принять равной
1000 кг/ма.
Ответ: Сф=0,88%.
7-41. Гвдроксилапатнт имеет формулу ЗСаДРОДХ
XCa(OHjs, а фосфорит — Са3(РО4)г. Найти для этих со-
единений отношение СС12+'Cp^yi--, показывающее, сколько
эквивалентов ГО3 ' приходится на один эквивалент Са,+.
7-42. В котельной установлено шесть котлов произво-
дительностью 180 т/ч каждый. Определить концентра-
цию раствора фосфата, при которой в сутки расходова-
лось бы не больше 2,5 м3 раствора. При расчете при-
нять t=65 мг/кг; Жо=Ю мкг-экв/кг; рп=3%; рф =
=1050 кг/м3.
Ответ: 3,90%.
7-43. Котельная расходует в сутки Ф, кг, Na3PO,.
Определить объем раствора Рр, получающийся при
растворении Ф, кг, трннатрнйфосфата, если заданная
концентрация его равна Сф, %, н плотность раствора
рф, кг/м3
7-44. В процессе эксплуатации избыток POt2- в кот-
ловой воде начал заметно повышаться. Назовите воз-
можные причины этого и меры, которые необходимо
принять.
7-45. В котельной установлено три котла паропроиз-
водительиостью 120, 150 и 200 т/ч. Определить расход,
л/ч, раствора тринатрийфосфата концентрацией 3% для
каждого котла, если <=20 мг/кг; /¥(п=10 мкг-экв/кг;
1М.= 1,0 кг/л; р(1=5%.
Ответ: 8,9; 11,2; 14,8 л/ч.
7-46. По условиям предыдущей задачи найти концен-
трацию раствора тринатрийфосфата для каждого котла,
если расход этого раствора, подаваемого в каждый ко-
тел, составляет 15 л/ч.
Ответ: 3,0; 3,8; 5,07%.
7-47. Прн концентрации раствора трниатрийфосфата
Ср, %, в котлы подавалось И, л/ч. Вновь приготовлен-
ный раствор имел концентрацию С'ф<Сф, и количество
его, подаваемое в котлы, увеличилось до Us, л/ч. Во
сколько раз V% стало больше Ui, если все прочие усло-
вия остались без изменения?
7-48. Какова должна быть жесткость питательной во-
ды, чтобы при избытке РО3-в котловой воде I, мг/кг,
189
й продувке котла ра, %, расход тринатрнйфосфата на
осаждение накипеобразователей был равен его количе-
ству, удаляемому с продувочной водой, если считать
всю жесткость кальциевой.
Ответ: 28,5(100 + р„) •
7-49. Для котельной, оборудованной котлами, суммар-
ная паропронзводительность которых равна ХДь т/ч,
был проведен расчет требуемого количества трннатрнй-
фосфата, кг, на квартал по следующей формуле:
Ф,з=2Юп[54>7Жо(1 +Рп) +РпП^*»
где 54,7 — эквивалент NasPOt; i —избыток NasPO4
в котловой воде, мг/кг; Т — число часов работы котель-
ной в квартал.
В действительности оказалось, что подсчитанное ко-
личество товарного тринатрийфосфата Ф почти в 2 ра-
за меньше необходимого. В чем ошибка?
7-50. Определить количество технического тринатрнй-
фосфата, содержащего 39,7% Na3PO4, которое необхо-
димо загрузить в подготовленный к пуску котел с водя-
ным объемом 70 м3. Концентрация в питательной воде
SiO^”= 1,5 мг кг и SOj“=30 мг/кг.
Продувка Ри=3%. Ступенчагым испарением котел не
оборудован.
Ответ: 9,27 кг.
7-51. Продувка парового котла паропроизводнтельно-
стью Dn, т[ч, составляет рп, %. Жесткость питательной
воды равна Жо, мг-экв/кг. Определить расход техни-
ческого тринатрнйфосфата Ф, кг/ч, если содержание
РО^~ в нем равно Сф, %, и избыток РО^в котловой
воде составляет i, мг/кг.
7-52. Взамен заказанного три натрийфосфата был до-
ставлен пирофосфат натрия Определить: а) расход
NaOH на подщелачивание 1 кг пирофосфата натрия
(безводного); б) расход пирофосфата, если для Na3PO4
он составлял а. кг[ч.
Ответ: а) 0,3 кг; б) 0,81 а, кг/ч.
7-53. Общая щелочность питательной воды котлов
высокого давления составляет 0,5 мг-экв/кг .Можно ли
в этих условиях создать режим чисто фосфатной ще-
190
лочности котловой воды прн использовании триполи-
фосфата Na5PsOio, если значение i для чистого отсека не
должно превышать 10 мг/кг, продувка котла составляет
2%, а производительность солевого отсека — 15% произ-
водительности котла?
7-54. Избыток фосфатов в котловой воде котла без
ступенчатого испарения прн режиме чисто фосфатной
щелочности не должен превышать 15 мг/кг Определить
минимально допустимую общую щелочность питатель-
ной воды при использовании гекса мета фосфа та натрия
(а) и дняатрийфосфага (б).
Ответ: а) примерно 10 мг-экв/кг;
б) примерно 4,5 мкг-экв/кг.
7-55. Показать, что при использовании гексаметафос-
фата натрия и мононагрийфосфата снижение щелочно-
сти питательной во ты составит:
ДЩ=0.02[28,5Хо(Рп+1)+РпО.
7-56. При растворении гекса метафосфата (NaPOs)e
происходит его гидролиз с образованием кислых орто-
фосфатов. Сколько эквивалентов NaOH необходимо за-
тратить на 1 г-ион РО^~ для нейтрализации этих фос-
фатов до Na^POt?
7-3. ЩЕЛОЧЕНИЕ КОТЛОВОЙ ВОДЫ
При эксплуатации иногда возникает необходимость
в щелочении котловой воды, т. е. в добавлении к пита-
тельной воле, подаваемой в коте?, различных щелочных
соединений. На практике щелочение котловой воды при-
меняют при питании котлов мягкой подой (конденсатом,
смесью конденсата и умягченной катионированпем во-
ды), а также в том случае, когда питательная вода об-
лапает повышенной жесткостью. В первом случае необ-
ходимость щелочения вызывается производственными
требованиями, специфичными для данной установки
(например, низким значением pH питательной воды, не-
обходимостью нейтрализовать аммониевые соли силь-
ных кислот, еспи они присутствуют в питательной воде,
или повысить щелочность котловой воды для нейтрали-
зации кислых фосфатов п т. и.). Во втором случае щело-
чение проводят для того, чтобы предотвратить образо-
вание твердых накипных отложений. ?)то мероприятие
191
известно под названием «внутрнкотловой обработки
воды».
Количество щелочного реагента, которое необходимо
ввести в питательную воду при питании котлов мягкой
водой, может быть определено по следующим форму-
лам:
(7-21
или
ш"°‘ э- (722>
где Щ'к.в требуемая или допустимая щелочность кот-
ловой воды, мг-экв/кг; Щ"пп— фактическая (до подще-
лачивания) щелочность питательной воды, мг-экв/кг;
Э — эквивалент данного щелочного реагента.
В этих формулах выражение Ш'к.п) определя-
ет величину щелочности питательной воды, при которой
щелочность котловой воды равна
Рис 7-1. Разложение
Na2COs в зависимо-
сти от давления
/Я'к.в. если продувка равна рп
В качестве щелочного реагента
для подщелачивания мягкой пита-
1сльной воды обычно применяют
дкий натр. Использование кальци-
нированной воды пли бикарбоната
натрия ограничивается или делает-
ся нецелесообразным вследствие
термического и гидролитического
разложения этих соединений в кот-
ле, что приводит к загрязнению па-
ра углекислотой. Повышенное содер-
жание углекислоты в паре нсжела-
в котле тстьно, так как это может вызвать
углекислотную коррозию конденсат-
ного тракта Быстрота гидролитического разложения каль-
цинированной соды зависит от температуры котловой
воды, которая, как известно, зависит от давления пара
в котле (рис. 7-1). Если щелочность питательной воды
характеризуется соотношением Я/О=Я(К4-Ш.г>, то колн-
19?
чество переходящей в пар углекислоты, мг/кг, будет
равно:
CCOu = 22(ZZ/6(l + a) + aZ^J. (7-23)
Если Що=Щг+Щц, то
Cco=22aZZ4,
где а — степень гидролиза Na^COa, выраженная в до-
лях.
Внутрикотловая обработка жесткой питательной во-
ды, как правило, применима только для неэкранпрован-
ных котлов с давлением пара меньше 1,6 МПа, рабо-
тающих на твердом топливе. Сущность ее заключается
в том, что поступающие в котел накипеобразователи
Са2+ и Mg2+ под действием щелочных реагентов связы-
ваются в труднорастворимые соединения СаСО^ и
Mg(OH)2, выпадающие в виде шлама. Тем самым пре-
дотвращается образование в котле твердых накипных
отложений.
Для получения удовлетворительных результатов не-
обходимо поддерживать определенную щелочность кот-
ловой воды, т. е концентрацию реагентов-осадителей.
Поэтому при пуске заполненного питательной водой во-
дяного объема VK, м®, в него вводят реагенты-осадите-
лн, количество которых, кг, определяют по формуле
10-3 (7.94)
В дальнейшем в процессе эксплуатации количество
реагентов, мг-экв/кг или кг/ч, которое необходимо вво-
дить в когел, определяют по следующим формулам:
Q р=^Сн.к(1 +Рп) 4* РпЩк.в (7-25)
или
10-3[/^FrK(l + рп) +Р1ТЩК.В]Э. (7-26)
При внутрикотловон обработке образуется шлам, ко-
личество которого равно:
B'=DV{ 1+рп) (50ЖСн+29Жме); (7-27)
где В'— количество шлама, поступающее в котел, г/ч;
В"— концентрация шлама в котловой воде, мг/кг; Э—
среднее значение эквивалента для суммы (Ca^+Mg2*);
Эс=«50—29 х, где х —доля магния в общей жесткости.
13—209 143
ПРИМЕРЫ
7-12. Определить суточный расход едкого натра на щелочение
питательной воды котельной, оборудованной четырьмя котлами паро-
производнтельностью 150 т/ч каждый. Исходные данные следующие-
рп = 3%; Щ'к в = 8 мг-экв/кг; Щ'п в=200 мкг-экв/кг.
Решение. Подставив приведенные значения в формулу (7-22),
определим расход NaOH на 1 т питательной воды
/0,03 \
<ГШ (Ц03 8-0,2j.40= 1,32г
Следует обратить внимание на то, чтобы вес входящие в фор-
мулу величины были выражены в соответствующих единицах изме-
рения
7-13. Общая щелочность питательной ноты состоит нз бнкар-
бонатной Щб=0,15 И карбонатной Щк—0,2 мг-экв/кг Определить
количество СО? в паре котлов, работающих при давлении 3,0 МПа
Решение По графику, представленному на рис 7-1, опреде-
ляем степень разложения карбоната натрия в котле, которая для
этого давления равна 0,9 Тогда по формуле (7-23) получим.
€^=22(0,15-1,9- 0,9-0,2) — 10,23 мг кг.
7-14. Промышленная котельная оборудована двумя котлами па-
ропроизводительностыо 3 т/ч каждый Питательной водой служит
речная вода с жесткостью общей 2,6 и карбонатной 1.3 мг-экв/кг.
Определить расход кальцинированной соды, кг/ч, и концентрацию
шлама в котловой воде при Рп—5%, !Цп в=10 мг-экв/кг н 5С=43.
Решение Доза соды равна:
^Na,CO, ~ (Мо — Шц в) (1 + Рп) 4“ РпЩг.в —
=1,3-1,05+0,05• 10зк1,87 мг-экв /кг.
Тогда расход кальцинированной соды составит.
1,87-53-2-3
^№,СО, — ЮОО —0,6 кг/ч.
Ежечасно в котле образуется следующее количество шлама-
в'==3(1+0 05) -2,6-43=352 г/ч,
концентрация которого в котловой воде достигнет
В”= (1,05/0,05) -2,6-43=2348 мг/кг.
ЗАДАЧИ
7-57, В котельной, оборудованной тремя котлами
производительностью 120 т/ч пара каждый, возникла
необходимость повысить щелочность котловом воды на
3 мг-экв/кг путем подщелачивания питательной воды
каустической содой. Определить расход соды за квартал
(2190 ч), если продувка составляет 3%.
Ответ; 2830 кг
194
7-58. Котел паропроизводительиостью 2U0 т/ч работал
на питательной воде, подщелачиваемой каустической со-
дой. Щелочность котловой воды составляла при этом
4 мг-экв/кг. Очередной анализ показал повышение ще-
лочности котловой воды до 6 мг-экв/кг, что явилось
следствием увеличения дозы щелочи, подаваемой в пи-
тательную воду. Определить, насколько возросла доза
реагента, если рп=2,5%.
Ответ: 49,0 мкг-экв/кг.
7-59. Насколько необходимо повысить щелочность пи-
тательной воды, чтобы при продувке рп=5% щелочность
котловой воды увеличилась с 7 до 10 мг-экв/кг.
Ответ: 0,146 мг-экв/кг.
7-60. В котельной, оборудованной тремя котлами па-
рой роизво дител ьностью 150 т/ч каждый и рп=3,2% и
двумя котлами паропронзводительностью 180 т/ч каж-
дый и рп=2,8%, осталось всего 500 кг едкого натра.
Определить, на сколько часов работы станции хватит
этого количества реагентов, если питательная вода всех
котлов подщелачивается на 200 мкг-экв/кт.
Ответ: 77 ч.
7-61. Котел, водяной объем которого 70 м3 должен
быть подвергнут щелочению, для чего необходимо со-
здать в котловой воде концентрацию едкого натра, рав-
ную 1%. Сколько килограммов этого реагента необхо-
димо подать в котел, если плотность раствора принять
1050 кг/м3.
7-62. На станции имеется раствор едкого натра, кон-
центрация в котором NaOH равна 35% (ррг= 1,380 кг/ла).
Определить объем реагента, который необходимо по-
дать в котел, чтобы получить в нем 1%-лып раствор
NaOH с ррг=1000 кг/м3. Объем залитой в котел воды
составляет 60 м3.
Ответ: 1,25 л.
7-63. Определить дозу едкого натра, мг-экв/кг, необ-
ходимую для того, чтобы при продувке рп, %, увели-
чить щелочность котловой воды до Щ, мг-экв/кг. На-
чальная, т. е. до присадки реагента, щелочность пита-
тельной воды составляет Щп.в, мг-экв/кг.
7-64. Котел, водяной объем которого 6,5 м3, заполня-
ют водой, некарбонатная жесткость которой равна
1,4 мг-экв/кг. В воду равномерно поступает раствор
кальцинированной соды концентрацией 200 мг-экв/кг.
Определить объем, л, содового раствора, который необ-
13* 195
м11 агрегатами
Рис. 7-2. Схема дозирова-
ния раствора реагента.
1 — бак питательной воды.
2 —расходный бак с раствором
реагентз; 3— питательный на-
сос.
ходимо подать в котел, чтобы удалить жесткость и со-
здать избыточную щелочность в размере 8 мг-экв/кг.
Учесть, что объем заливаемой в котел воды меньше
6,5 м3 на объем щелочного раствора, подаваемого в ки-
тел.
Ответ: 292 л.
7-65. Какую концентрацию, %, раствора кальциниро-
ванной соды следует принять, чтобы по условиям за-
дачи 7-64 объем раствора, подаваемого в котел, состав-
лял 10% водяного объема котла. Плотность раствора
принять равной 103 кг/м3.
Ответ: примерно 0,5%.
7-66. В котельной установлено четыре котла низкого
давления. Питательной водой служит смесь конденсата
и сырой воды, общая жесткость которой 1,7 и карбонат-
ная 1,0 мг-экв/кг. Определить расход, кг/ч, Na2CO3,
если продувка котлов составляет 5%, а щелочность кот-
ловой воды 10 мг-экв/кг. Паропроизводительность каж-
дого котла равна 4 т/ч.
Ответ: 1,05 кг/ч.
7-67. По условиям задачи 7-66 найти необходимый
объем бака для приготовления раствора кальцинирован-
ной соды в объеме суточной потребности при концен-
трации его 3% и рр-%1,0 г/см3. Бак заполняют до 75%
еги полного объема.
Ответ: 1120 л.
7-68. В котельной, оборудованной шестью котельиы-
ем 1,0 МПа и паропроизводн-
тельностью 5 т/ч каждый, осу-
ществляется внутрикотловая
обработка воды. Некарбонат-
ная жесткость питательной
воды равна 2 мг-экв/кг. Опре-
делить годовой (8000 ч) рас-
ход кальцинированной соды,
если 7//и.в=10 мг-экв/кг и
Рп=5%.
Ответ: 33,0 т.
7-69. Определить условия,
которые необходимо создать,
чтобы дозирование раствора,
осуществляемое по схеме
рис. 7-2, было равномерным,
т. е. чтобы в равные проме-
196
жутки времени поступало одно н то же количество рас-
твора.
7-70. В котел паропроизводительностью 3 т/ч вводят
смесь реагентов в следующем эквивалентном отноше-
нии: Na2CO3/NaOH=4/I. Определить расход, г/ч, едкого
натра, если Щк,п=8 мг-экв/кг; Жн.к=4 мг-экв/кг; ри—
==4%.
Ответ: 107,5 г/ч.
7-71. Котлы давлением 1,0 МПа промышленной ко-
тельной питаются смесью сырой виды (60%) и конден-
сата. Качество сырой воды характеризуется следующи-
ми данными, мг-экв/кг: Жо==3,8; Жв=2,1; Жса=2,5.
Определить концентрацию СОа в паре прн условии, что
в качестве реагента используется NazCO3; Щкл=
=10 мг-экв/кг; рп=5%. Содержанием свободной угле-
кислоты в питательной воде пренебречь.
Ответ: 39,4 мг/л.
7-72. По условиям задачи 7-71 определить количест-
во вносимого в котел питательной водой шлама (а) и
концентрацию его, мг/кг, в котловой воде (б), если сум-
марная паропроизводительность котельной составляет
20 т/ч.
Ответ: а) 2,05 кг/ч; б) 2050 мг/л.
7-73. На известково-катнонитную водоочистку элек-
тростанции вода подается из заводского пруда, в который
поступают сточные воды коксохимического завода, со-
держащие аммониевые соли соляной и серной кислот.
В период максимальной концентрации этих солей в пру-
довой воде отмечается заметное снижение щелочности
котловой воды. Объяснить это явление.
7-74. Питательной водой котлов служит смесь
а % умягченной натрий-катионированной воды и
(1—-0.)% конденсата. Допустимая щелочность котловой
воды прн продувке рп, %, равна Щкл, мг-экв/кг. Учиты-
вая, что прн натрий-катпонировании щелочность умяг-
ченной воды определяется карбонатной жесткостью ис-
ходной воды, определить для этих условий то значение
которое допустимо при предельных значениях про-
дувки и щелочности котловой воды, равных рп и Щкл.
Рп Щк я
100 4- рп а '
Ответ:
197
Глава восьмая
ВОДНЫЙ РЕЖИМ ПАРОВЫХ КОТЛОВ
8-1 КАЧЕСТВО ПИТАТЕЛЬНОЙ ВОДЫ. ПАРОВОДЯНОЙ БАЛАНС
Пароводяной цикл электростанции включает многие
потоки пара, воды и конденсата. Идеальным следует
считать таком пароводяном цикл, при котором весь пар,
вырабатываемый котлами, после использования его
энергии возвращается в питательную систему котлов
в виде конденсата. В действительности в процессе экс-
плуатации часть конденсата или пара теряется:
/7K=/73-H7c^2Dn-Q„, (8-1)
где Пк — суммарные потери конденсата и пара; П3,
tier — потери пара и конденсата соответственно завод-
скими н внутристанционными потребителями; Z£)c—сум-
марная паропроизводнтельность котельной; QK— общее
количество конденсата, возвращаемого в котлы.
Потери пара н конденсата обычно восполняют умяг-
ченной водой, хотя в отдельных случаях эти потери мо-
гут быть компенсированы и дистиллятом от тепловых
или газовых испарителем. Количество умягченной воды,
добавляемом в питательную систему котлов, может быть
найдено из равенства
Фх=77к4-б\гр Сдл, (8-2)
где £>пр — потери продувочной воды; QRJ1—количество
дистиллята, подаваемого в котлы.
Общее количество питательной воды в этом случае
равно:
^п.в=Сх+Ск+ФдЛ" (8’3)
Все эти величины, т. е. Пк> Пв, Псг, Qx, QK, <2ДЛ, ча-
сто выражают в долях или процентах от £>ц нли Dn.B.
Величина Qx или отношение Qx/£>n.B=ax называется
добавкой умягченной воды в питательную систему кот-
лов.
Питательная вода котлов электростанций всегда
представляет собой смесь различных составляющих.
В свою очередь конденсатный поток также является
смесью различных конденсатов — турбинного, отопи-
тельных подогревателей, дистиллята испарителей и др.
198
Поэтому при эксплуатации часто возникает необходи-
мость определять качество смеси или отдельных ее со-
ставляющих. Качество смеси определяют равенством
СГм=сС'1-|-бС2Ч_вС3+... +лСп;
с + б+64*.. .Ч"Л==1г (8 4)
где Ci, С2, С3, Сп — концентрации различных веществ
в первом, втором потоках и т. д.; а, б, в, п — доля пер-
вого, второго потоков и т. д.
Введем следующие обозначения: Сп.в, Сх, Ск — пока-
затели качества, например щелочность, жесткость, соле-
содержание и т. п., соответственно питательной, умяг-
ченной (обработанной) воды и конденсата; р — доля от-
сепарирова иного пара в расширителе непрерывной
продувки; ак, — доля конденсата и доля умягченной
воды в общем количестве питательной воды.
Тогда можно написать:
= (8-5)
и Dnp, т/ч, равно:
Рпр=РпПп(1-р)-Ю-2, (8-6)
где рп выражена в процентах.
Суммарные потери пара и конденсата, т/ч, воспол-
няемые обработанной водой (без продувки), могут быть
определены из выражения
/7K=axDn.B-pnDn(l—р) • 10-2 (8_7)
ПРИМЕРЫ
8-1. По двум трубопроводам поступает в бах вода; концентра-
ция хлор-иона в первом потоке 50 мг/л и во втором 2 мг-экв/л. По
первому трубопроводу поступает 50 м3/ч и по второму 20 м3/ч.
Найти концентрацию хлор-иона в смеси.
Решение Доля воды, поступающей по первому трубопроводу,
составит. д= 50/70=0,715. Тогда концентрация хлор-иона в смесн
будет равна-
С‘см=а-50-г( 1— а) -77—55.0 мг/л.
Концентрацию хлор-иона в смеси можно определять также из
\равнения материального баланса
50-50+20-2-35,4б=70Ссл; Ссм = 55,9 мг/л
8-2. Контнтраинн сульфатов в смесн вод двух источников со-
ставляет 120 mi/л Концентрация SO4- в нчк-первого источника
С) = 60 и второго С3=160 мг/л. Определить процентный состав
смеси.
199
Решение. Для решения этого примера воспользуемся равен-
ством (8-4), из которого найдем долю воды, поступающей из пер-
вого источника:
Сем- С, 120-160
С, —С, -60— 160 ,Л ’
или 40%.
Следовательно, воды, поступающей из второго источника, содер-
жится в смеси 60%.
8-3. Схема деаэрационной установки электростанции, состоящей
нз трех деаэраторов одинаковой производительности, приведена на
Рис. 8-1. Схема контроля
деаэрационной установки.
а — химически обработанная во-
да; б — конденсат.
откуда
рис. 8 1 Определить производитель-
ность каждого деаэратора для про-
верни правильности распределения по
ним обшей нагрузки, если известно
солесодержание воды после первого
Сь второго С2 и третьего Ст деаэра-
тора, смеси воды деаэратора первого
и второго Сем (кран 2) питательной
воды Сп в (кран 3). Количество пи-
тательной воды составляет Dn в. т/ч
Конденсат распределяется равномер-
но по всем трем деаэраторам.
Решение Обозначим про-
изводительность первого, второго и
третьего деаэраторов соответствен-
но через flrIe q2, qs, т/ч; отношение
и q (?H-«s)=4-
Тогда
Си м-(- (1—d) Сз,
Следовательно, производительность третьего деаэратора будет
равна ?s=DBe{l—d). т/ч. Для первого и второго деаэраторов
можно составить следующее уравнение:
Сем == ЪС\-j- (1—Ь)Сг,
из которого найдем долю воды первого деаэратора от общей их
производительности, равной £)г в—q3=dDn >:
Тогда производительности второго и первого деаэратора, т/ч.
равны соответственно:
nd(l-b);
ф —9db.
200
ЗАДАЧИ
8-1. Определить добавку умягченной воды в питатель-
ную систему котлов, %, если солесодержание питатель-
ной, умягченной воды и конденсата соответственно рав-
но 50, 120 и 0,5 мг/кг.
Ответ: 41,5%.
8-2. Ще точность умягченной воды 2 мг-экв/кг, а кон-
денсата 50 мкг-экв/кг. Чему будет равна добавка умяг-
ченной воды в питательную, если предельная щелочность
питательной воды ие должна превышать 350 мкг-экв/кг?
Ответ: 15,4%.
8-3. Солесодержание умягченной воды, добавляемой
в размере 10%, составляет 540 мг/кг. Определить соле-
содержанне питательной воды.
8-4. Солесодержание пара, вырабатываемого в пря-
моточном котле, равно 0,05 мг/кг. Определить предель-
ное значение присоса в конденсаторе турбины, если су-
хой остаток оборотной воды равен 1200 мг/кг, а соле-
содержание конденсата не должно быть более 0,1 мг/кг.
Ответ: 0,004%.
8-5. Установленные на электростанции два деаэратора
работают с нагрузкой по 100 т/ч каждый. В питатель-
ную систему котлов этой станции поступает 40 т/ч умяг-
ченной воды, концентрация хлоридов в которой равна
60 мг/кг. Концентрация хлоридов в деаэрированной во-
де первого деаэратора составляет 9, а второго 15 мг/кг.
Определить: а) количество поступающей в каждый
деаэратор умягченной воды; б) концентрацию хлоридов
в питательной воде при условии равномерного распре-
деления химически обработанной воды по деаэраторам.
Содержанием хлор-иона в паре можно пренебречь.
Ответ: а) первый деаэратор 15 т/ч;
второй деаэратор 25 т/ч.
б) 12 мг/кг.
8-6. Производственный конденсат в количестве 50 т/ч
поступает на ТЭЦ, расходующую 500 т/ч питательной
воды. Определить содержание в этой воде масла, если
концентрация его в конденсате составляет 5 мг/кг.
8-7. Жесткость питательной воды, количество кото-
рой составляет 200 т/ч, не превышает 6 мкг-экв/кг.
Определить количество производственного конденсата
жесткостью 20 мкг-экв/кг, которое можно ввести в пи-
тательную систему ко глав при условии, чти жесткость
201
Рис. 8-2. Схема деаэра-
ционной установки.
А — химически обработан-
ная вода; Б — конденсат.
питательной воды не должна превышать 10 мкг-экв/кг.
Ответ: 57 т/ч.
8-8. Деаэрационная установка электростанции состо-
ит из двух деаэраторов, схема включения которых по-
казана иа рнс. 8-2. Общая производительность нх со-
ставляет 200 т/ч. Солесодержание воды, определенное
при анализе, было равно в точке
а 30, в точке б 56, после пита-
тельного насоса 46 мг/кг. Опре-
делить производительность деа-
эраторов.
Ответ: первый деаэратор
77 т/ч;
второй деаэратор 123 т/ч.
8-9. Какое количество умяг-
ченной воды поступает в каж-
дый деаэратор по условиям за-
дачи 8-8, если известно, что со-
лесодержание ее составляет
230 мг/кг? Солесодержанием кои-
1енсата можно пренебречь.
Ответ: первый деаэратор 10 т/ч;
второй деаэратор 30 т/ч.
8-10. Три деаэратора одинаковой производительно-
сти включены по схеме, представленной на рис. 8-1.
Определить производительность первого и второго деа-
эраторов, если солесодержание питательной воды 60,
после первого деаэратора 51, второго 34,2 и третьего
72 мг/кг. Общее количество умягченной воды солесо-
держанием 300 мг/кг, поступающей иа все деаэраторы,
составляет 100 т/ч. Производительность третьего деа-
эратора равна 200 т/ч.
Ответ: первый деаэратор 140 т/ч;
второй деаэратор 160 т/ч.
8-11. По условиям задачи 8-10 определить количество
умягченной воды, поступающей в каждый деаэратор.
8-12. По условиям задачи 8-9 определять солесодер-
жание деаэрированной воды после каждого деаэратора
при условии, что конденсат распределяется между
деаэраторами равномерно, а умягченная вода — в том
же количестве, т. е. на первый деаэратор 10 и второй
деаэратор 30 т/ч. л
Ответ: после первого деаэратора
25,4 мг/кг; после второго
деаэратора 57,5 мг/кг.
202
8-13. В питательную воду котлов, количество которой
составляет 700 т/ч, поступает также и 105 т/ч умягчен-
ной воды, концентрация хлор-иона в которой равна
132 мг/кг. По данным химического контроля концен-
трация хлоридов в питательной воде равна 10 мг/кг.
Правилен ли анализ?
8-14. По показателям расходомеров в деаэратор по-
ступает 82 т/ч конденсата н 12 т/ч умягченной воды,
солесодержание которой равно 25 мг/кг. Прн анализе
установлено, что солесодержание деаэрированной воды
равно 40 мг/кг. Правильны ли показания расходомеров?
8-15. Для проверки правильности показаний расходо-
меров (см. задачу 8-14) расход деаэрированной воды
был измерен при помощи точного дифференциального
манометра и оказался равным 98 т/ч. На основе этого
опречелить, показания какого расходомера и насколько
являются неточными. Данные химического контроля
считать правильными.
8-16. Резервный бак заполняют умягченной воюй, су-
хой остаток которой равен 180 мг/кг. и конденсатом,
солесодержание которого 0о8 мг/кг. Умягченная вода
поступает в бак равномерно в количестве 50 т/ч. Кон-
денсат подается неравномерно: в первые 20 мин 10 м5,
в следующие 20 мин 15 м3 и в оставшиеся 20 мин 25 мя.
Определить солесодержание воды в баке по истечении
каждого из указанных периодов.
Ответ: 112.8; 103,0; 90,4 мг/кг
8-17. Общая жесткость турбинного конденсата, нор-
мально составлявшая 3 мкг-экв/кг. увеличилась до
0,008 мг-экв/кг. Определить присос охлаждающей воды,
%, жесткостью 3,5 мг-экв/кг -в конденсатор.
Ответ: 0,114%.
8-18. Жесткость охлаждающей конденсаторы воды
равна 10 мг-экв/кг. сухой остаток 920 мг/кг и концен-
трация двуокиси кремния 12 мг/кг. Найти жесткость,
солесодержание и концентрацию SiO2 в турбнниом кон-
денсате, если присос равен 0.01%. жесткость кон-
денсата пара 2 мкг-экв/кг и SiQp в нем отсутствует.
Солесодержание пара равно 0,2 мг/кг
Ответ: Жо~ 3 мкг-экв/кг; Сг=0,29 мг/кг; CS(O =
= 1,2-10“’ мг/кг.
8-19. В деаэратор в качестве греющего был подан на-
сыщенный пар от утилизационной установки печей.
203
В связи с этим было установлено, что солесодержание
питательной воды увеличилось от 50 до 58 мг/кг из-за
наличия солей, содержащихся в капельной влаге пара.
Определить влажность этого пара перед деаэратором,
%, если сухой остаток котловой воды котлов утилиза-
ционной установки составляет 2500 мг/л, а расход грею-
щего пара 10% количества деаэрируемой воды.
Ответ: 5,2%.
8-20. В котельной, оборудованной пятью котлами дав-
лением 3,2 МПа и павопроизводительностью 160 т/ч
каждый, потери питательной воды на собственные нуж-
ды равны 2%, а пара и конденсата на производстве
12,4% производительности всех котлов. Определить до-
бавку умягченной поды в питательную воду, если об-
щее количество отсепарирова много пара давлением
0,1 МПа составляет 9,2 т/ч от продувочной воды всех
котлов и все потери восполняются подачей только умяг-
ченной воды.
Ответ: 143 т/ч.
8-21. В котельной электростанции установлено шесть
котлов давлением 11.0 МПа и производительностью
150 т/ч каждый, работающих с продувкой, равной
2,5%'. Определить суммарные потери (без продувки)
конденсата, восполняемые умягченной водой, если су-
хой остаток ее 244, а котловой воды 1500 мг/кг и дав-
ление в расширителе непрерывной продувки равно
0,6 МПа.
8-2. ПРОДУВКА ПАРОВЫХ КОТЛОВ
Продувкой называется удаление из котла или испа-
рителя части котловой воды, осуществляемое для пре-
дупреж тения чрезмерного увеличения концентрации
растворенных в ней веществ. Продувка может быть
организована для котлов, снабженных барабанами,
а также для сепараторных прямоточных котлов дав-
лением ниже критического. В результате осуществления
продувки в котловой воде устанавливают и поддержи-
вают некоторый баланс веществ, основаиньш на равен-
стве их поступления с питательной водой и вывода
с продувкой:
5п.В^П.Н-^П^П-Ь^к.В^Пр-
(8-8)
204
Подставив в уравнение ба пенса значение ©п.в—Оп4-
+ £>пр и решив его относительно Dnp. найдем
где Оп.в, Dn, Dnp — соответственно количество питатель-
ной воды, пара н продувочной воды, т/ч; Sn.B, 5П, SK.B—
солесодержание (щелочность) этих составляющих,
мг/кг, откуда р„, %, равна:
/,„=^.100=^^-100. (8-9а)
Dn «>к.в ^п.п
Если в балансовое уравнение (8-8) подставить зна-
чение Dn=Dn.B—Dnp и решить его относительно D^, то
получим другое выражение, характеризующее количест-
во продувочной воды:
Drr=f^^D,„ (8-96)
откуда рр, °/п, равно:
Л=Ю0-^-=^=4!100. (8-9в)
Л Пп.„ -Ча—
Формулы (8-9а) и (8-9в) можно упростить, если при-
нять Sn=0; тогда
/>„= о Sn ,s <100; Л=|^-ЮО. (8-10)
ОК.В"“'-’П.А '’к В
Пользование этими упрошенными формулами воз-
можно, однако, лишь в тех случаях, когда численное
значение 5п.в значительно больше Sn.
Имея в виду, что 5П=У5К.И, где У — коэффициент
уноса веществ паром, выраженный в долях единицы,
уравнение солевого баланса (8-8) можно написать и
в еле чующем виде:
( 1 +Рп) Su (У + рп) $к.в, (R-1 1 )
если рп также выразить в долях единицы.
Из уравнения (8-11) видно, что значением У можно
пренебречь только в том случае, когда оно мало по
сравнению со значением рч. Например, по общему со-
лесодержаиию коэгЪЛициент уноса тля котлов высокого
давления обычно не превышает 0.05%, в то время как
унос кремнекислоты тостигает 1—15% концентрации ее
в котловой воле.
рои
Если при расчетах необходимо учитывать коэффи-
циент уноса, следует пользовался точной формулой
(8 9а), которая в этом случае приобретает следующий
вид:
100 (8 -|2)
^х.в — в
Решая эту формулу относительно Sn.e и SK.B> нахо-
дим:
100У + Гп с , с Ю0-ь^п
100 + Рп кв> °«-в— -J-у. 100 пв'
(8-12а)
где значения рп и У выражены в процентах.
Если в равенство, определяющее Sn.D. подставить
значение SK.B из равенства 5к.в=з5п/У, то можно опреде-
лить предельную концентрацию какого-либо вещества
в питательной воде при известной максимально допусти-
мой его концентрации в паре; например, для кремиекн-
слоты концентрация ее в паре не должна превышать
в некоторых случаях 0,02 мг/кг. Следовательно,
КЮУ+Рп Sn__ ЮОУ+д, 0р02
! 100 -J- Ря У 100 4- Рп У
(8-13)
Поступающие в котел вещества частично уносятся
продувочной водой £в. частично паром еп Значения ев
и Еп. %, могут быть определены из следующих соотно-
шений;
100 Sn inf) Ю0 v Sk.r'100 1
100 + Al Sne 1 v r004-pn * sn.B ; 1(8-14)
eB=100— e„. I
Численные значения plf и рв характеризуют продув-
ку, отнесенную соответственно к паропроизволнтелька-
сти котла или к количеств} питательной воды. Если раз-
делить числитель и знаменатель в формуле (8-10) на
Sk.r, то получим:
юо —рв'
откуда
Р» ~ '100 4-Прп (8-15)
206
Для определения ря необходимо» следовательно,
знать Drl) и Dn или Sn.P, Sn и SK.n. Но прн проектирова-
нии котечьных установок эти значения (за исключением
Рп) неизвестны. В таком случае значение рп, %, рассчи-
тывают по формуле
где S/7K-~ суммарные потери конденсата, %; — по-
казатель качества добавляемой умягченной воды (ще-
лочность, сухой остаток и т. п.); р— доля отсепарнро-
ваииого в расширителе непрерывной продувки пара от
количества поступающей в него продувочной воды.
Из равенства (8-10) можно определить концентра-
ции веществ в питательной и котловой воде:
с _____ Рп <? .
пв 100+ рП к
с ____ 100 + рп с
а п °п П-
Рп
(8-П)
Подставив в эти равенства значение Sn.B=arSx, по-
лучим соотношения, характеризующие связь между ка-
чеством добавляемой умягченной Sx и котловой воды:
sx=Tnr+——- (8-18)
х 100+ Л КК ' 1
Если качество котловой воды задано, то (при данных
рп и ах) этим определено и качество умягченной воды.
На практике водный режим котла обычно опреде-
ляется каким-либо одним из следующих показателей
качества котловой воды: щелочностью, сухнм остатком,
концентрациейSiO3~. Для определения одного из этих
показателей для добавочной умягченной илн котловой
воды в формулу (8-18) следует подставлять наиболь-
шее значение рп.
Количество получаемого в расширителе пара равно
dv=₽Dnp, т/ч. В свою очередь р определяют по формуле
p=2’tn=f»j (8-19)
где £к.в, /в, in— энтальпии соответственно котловой, от-
сепарированной в расширителе воды н пара, выходяще-
го из расширителя, Дж/кг; г)— коэффициент, учитываю-
щий тепловые потери в окружающую среду (т|^0,98).
207
ПРИМЕРЫ
8-4. Солесодержание питательной воды составляет 46 мг/кг.
Определить количество солей, уносимых из котла продувочной водой
и паром, если продувка по питательной воде рв=2,1% И У~0,01%.
Решение Вначале иаходям солесодержание котловой воды
„ 100 100
в = Зя з“=40^-г=2190 мг/ю
Ря - >1
и солесодержание пара
У 2190.0,01
$п = що ^к-в ” 100 =0.22 мг/кг.
Затем, подставив численные значения в формулу (8-14), найдем
100-100-0,22 „ Л Л
®л = 46 (100 | 2,16) п ~в — Ю0 - 0,47 _ 99,53у».
8-5. Качество исходной воды характеризуется карбонатной
жесткостью 1,8 мг-экв/кг и сухим остатком 400 мг/кг. Щелочность
котловой воды была принята равной 7 мг-экв/кг и сухой остаток
1400 мг/кг. Добавка умягченной воды составляет 15% Определить,
можно ли применить при умягчении воды натркй-катионитную пря-
моточную схему и будет ли щелочность лимитировать водный ре-
жим котлов.
Решение. Щелочность натрий-катионированной воды опре-
деляется, как известно, щелочностью исходной воды. Для решения
воспользуемся формулой
,,, ,,,_______£11__HL-!
100 + ₽п „х
Неизвестной в этом выражении является продувка рп, численное
значение которой, определенное по щелочности рщ и сухому остат-
ку рс, может быть различно. Поэтому находим рщ н рс, %, по фор-
муле (8-10);
Л= Sk.-Sx“, 1М-
При этом принимаем сухой остаток натрий-катноиированной
воды равным сухому остатку исходной воды, что, однако, не являет-
ся точным, но допустимо для прнкмдочного технического расчета
Находим:
1,8-0,15-100
7—1.8-0,15
400-0,15-100
Pc=s 1400 — 400.0,15=4-5%-
Водный режим котла будет лимитироваться размером сухого
остатка, и, следовательно, по щелочности натрий-катиоиированне до-
пустимо. Такой же результат получим и по первой формуле Под-
ставляем в нее лимитирующее значение продувки, т. е. рс—4,5%:
4,5-7
Щ* (100 + 4,5)-0,15 =2-02 мг-экв/кг.
208
В действительности щелочность исходной воды меньше расчет-
ной, и, следовательно, с этой точки зрения указанная схема может
быть приемлема. Для более полного суждения о целесообразности
применения данной схемы водоочнегки необходимо принять во вни-
мание обогащение пара котлов углекислотой, а также учесть отно-
сительную щелочность котловой воды.
8-6. Суммарные потери конденсата на электростанции, воспол-
няемые умягченной водой, сухой остаток которой составляет 5Х1
мг/кг, равны 77и, т/ч. Определить количество умягченной воды
Qx, т/ч, добавляемое в питательную систему котлов, если сухой
остаток котловой воды не должен превышать SK в, мг/кг.
Решение. Составляем балансовое равенство
Сх=Д1<+©пр(1—₽)
Считаем, что все соли, вносимые в котел умягченной водой,
удаляются с продувочной водой, что весьма близко к действитель-
ности для котлов с давлением пара до 8,0 МПа, а также при малых
значениях коэффициента выноса. В этом случае можно написать:
^npSjf B^^SxQx *,
откуда
£цр =SxQx/Sa.B-
Подставив значение продувки в балансовое равенство, получим:
Sv
Qx _ пк + в Qx U — (О
откуда
Qx - Пк.
Коэффициент
показывает, во сколько раз добавка умягченной воды превышает
суммарные потерн конденсата при данном отношении Sx/SK в. Если
Sx—*0, что соответствует восполнению потерь дистиллятом или
обессоленной водой, то К—*-1; при Sx—»-Sh.b значение К сильно
возрастает и при р=0 К—>-со.
8-7. Определить продувку котла, если солесодержание питатель-
ной воды равно Sn в. котловой SK в н пара Sn, мг/кг.
Решение. При решении этой задачи исходим из уравнения
солевого баланса, показывающего, что количество солей, выводимых
из котла (правая часть), равно количеству поступающих в него
с питательной водой:
Sn.BDn.B — SnDn-f-Sn BZ)Bp.
* Это равенство написано в предположении, что конденсат
в цикле станции не загрязняется солями в результате наличия не-
плотностей в теплообменной аппаратуре.
14—209 209
Подставив в это уравнение значение Da получим
S П. В “{"S П. В^пр == П-f"S к-р
или после некоторого преобразования и решения относительно Dap,
Т/ч, получим выражение
Разделив правую и левую части равенства на Da, окончательно
получим значение продувки котла ра, %:
8-8. Для щелочения питательной воды, т. е. повышения ее pH,
часть щелочной продувочной воды а направляют в питательный бак,
другую (1—о)—в расширитель- В связи с этим сухой остаток пи-
тательной воды возрастает, что ведет к увеличению продувки Сле-
довательно, при данном предельном значении концентрации веществ
в котловой воде SUK.B, mi/кг, и максимально допустимом значении
продувки котла рв должно существовать также предельное значе-
ние о клн добавки кот .топов поды в питательную воду ам в=
=oDavlDa *. Определить эти предельные значения
Р е ш е и и е. Количество веществ, если считать на 1 л питатель-
ной воды, поступает, мг: а) от котлов в расширитель pBSuK в',
б) в питательный бак с частью продувочной воды opBSnK в; в) в пи-
тательный бак с питательной водой (1—аи.в)5ип.я- На основе этого
можно написать следующие равенства:
I) ак в5пк в=арв5п1| и или ак в—арв,
2) (1—ам.я)£нпя+а« Я5ПК.Я =5“п.я.
Решив второе равенство относительно а» &, найдем
__S"n В
ак.в — СП _ СИ >
° к в — 13 п.в
откуда, учитывая первое равенство, получим
5пп.в_— ЗУи
Рв (^"к.в — SHn в) ’
где 5пп в, S“n — предельная и начальная (исходная) концентрации
солей в питательной воде.
Основной предпосылкой возможности использования части про-
дувочной воды котельных агрегатов в качестве питательной является
следующее условие: SHD в<5пп в-
8-9. Суммарные потери конденсата равны 2Z7K, % общей паро-
производятельности котлов. Определить продувку рв, если сухой
остаток умягченной воды равен Sx, котловой SK в, мг/кг, и доля
пара, отсепарированного в расширителе непрерывной продувки,
равна р.
Решение. В расширителе непрерывной продувки испаряется и
возвращается в питательную систему котлов ₽ частей продувочной
воды. Следовательно, из расширителя выводится и теряется 1—Р
частей продувочной воды За счет умягченной воды компенсируют
суммарные потерн конденсата /7В. т/ч, и потерн продувочной воды
Опрп(1—р), т/ч. Поскольку в питательную систему котла соли вно-
210
сятся главным образом с умягченной водой, можно написать сле-
дующее уравнение солевого баланса:
/7к5х4-Осрп (1—Р)5х=^Олрп5к в.
Решив это уравнение относительно рп, получим:
/7К
On * zn„s,
р"~ ” Sk.-u-pjs, >
где
/7К
E/7K = p£-i00.
ЗАДАЧИ
8-22. Концентрация хлор-иона в умягченной воде со-
ставляет 50, а в котловой 240 мг/кг. Определить продув-
ку котла, если размер добавки умягченной воды в пи-
тательную систему котла равен 20%.
Ответ: 4,16%.
8-23. В расширитель непрерывной продувки, давление
в котором равно 0.2 МПа, поступает продувочная вода
котлов среднего давления 3,2 МПа. Определить коли-
чество пара, получаемое
в расширителе, приходя-
щееся на 1 т продувоч-
ной воды при Т] = 1.
Ответ: 0,234 т.
8-24. Продувка котла
давлением 11 МПа осу-
ществляется по двухсту-
пенчатой схеме (рис. 8-3).
Определить количество
отсепарнрованного сухого
насыщенного пара в каж-
Рнс 8-3. Схема непрерывной
дувки котла.
/ — котел; 2 — сепаратор.
дом расширителе при
>1 = 1.
Ответ: 1) 28,8%;
2) 16%.
про-
8-25. Определить количество сухого насыщенного
па-
ра, получаемого в расширителе на 1 т продувочной во-
ды котла давлением 11.0 МПа, при давлении в расши-
рителе 0,2 МПа, т]=0,98.
Ответ: 0,407 т.
8-26. Определить предельно допустимый сухой оста-
ток умяптенной воды, если добавка ее составляет 20%•
211
при условии, что продувка котла не должна превышать
5%, а сухой остаток котловой воды 1200 мг/кг.
Ответ: 286 мг/кг.
8-27. Возможен ля и при каких условиях такой вод-
ный режим электростанции, при котором количество
умягченной воды, добавляемой в питательную систему
котлов, было бы равно количеству теряемого конденса-
та? Доказать.
8-28. Определить предельные значения отношении
Sx/Sk.b, прн которых количество добавляемой в пита-
тельную систему котлов умягченной воды в 1,25; 1,5 и
2 раза больше количества теряемого конденсата прн
р=о.
Ответ: 0,2; 0,33; 0,5.
8-29. Производительность водоочистки составляет
120 т/ч. Будет ли достаточной эта производительность,
если сухой остаток умягченной воды зимой возрастает
(вследствие увеличения сухого остатка исходной воды)
от 294 до 600 мг/кг при допустимом сухом остатке кот-
ловой воды в 1200 мг/кг? Суммарная производитель-
ность котлов равна 650 т/ч, потери конденсата состав-
ляют 12,3%, р=0,2.
8-30. Котел высокого давления без ступенчатого испа-
рения работает при кратности концентрации по общему
солесодержанию SK.B/SnB=41. Определить, какое коли-
чество солей, поступающих с питательной водой, выно-
сится с продувочной водой и паром, если У=0,01%?
Ответ: 99,6 и 0.47 .
8-31. По условиям задачи 8-30 определить вынос крем-
некнслоты паром и продувочной водой, если концентра-
ция ее в питательной воде составляет 0,18 мг/кг, а в кот-
ловой 7.4 мг/кг и У5|О ==0,7%. Найти также концентра-
цию кремнекислоты в паре.
Ответ: 28 и 72%; 0,092 мг/кг.
8-32. Как изменятся количество кремнекислоты, выно-
симой нз котла паром, и концентрация ее в паре, если
в условиях, соответствующих описанным в задачах 8-31
и 8-30 протувкм уменьшить до 2%.
Ответ- 20% и 0,025 мг/кг.
8-33. Котел снабжен двусторонней продувкой бараба-
на; нормальное значение сухого остатка котловой во ты
равно 1200 мг/кг. При очередном анализе установлено,
что сухой остаток продувочной воды, взятой из левой
половины котла, равен 800 мг/кг, а нз правой 1400 мг/кг.
212
Что необходимо сделать для устранения этого солевого
перекоса?
8-34. Нагрузка котла по показаниям расходомера па-
ра составляет 182 т/ч, а количество питательной воды,
фиксируемое водомером, равно 192 т/ч. Солесодержание
питательной воды равно 42 мг/кг и котловой 1300 мг/кг.
Правильны ли показания приборов?
8-35. Сухой остаток котловой воды мощного котла
превысил норму и продолжает увеличиваться, несмотря
иа полностью открытые вентили непрерывной продувки.
Какова причина этого явления? Что необходимо сде-
лать?
8-36. На ‘известково-катионитную’ водоочистку вода
поступает из заводского пруда, который служит одно-
временно и приемником сточных вод коксохимического
завода; поэтому прудовая н умягченная вода значитель-
но загрязнены солями аммония. Отмечено, что в перио-
ды максимальной концентрации аммиака в прудовой
и катиопнрованпой воде наблюдается снижение щелоч-
ности котловой воды. Чем объяснить это явление3
8-37. При работе котла наблюдалось снижен не ще-
лочности и сухого остатка котловой воды. Качество кот-
ловой ноты стало нормальным, когда непрерывную про-
дувке уменьшили примерно вдвое против обычного. На-
грузка котла не изменялась. Каковы две возможные
причины такого явления, если считать величину У по-
стоянной?
8-38. Нагрузка котта составляла 120 т/ч при продув-
ке рп=3,2%. В пернот максимума электрической на-
грузки паропропзвотительность котла была увеличена
до 160 т/ч, причем количество выдуваемой воды оста-
лось неизменным. Через некоторое время после этого
пря анализе было установлено увеличение сухого остат-
ка котловой воды от 1180 до 1510 мг/кг при норме
1250 мг/кг. Качество пптательион воды не изменилось.
Объяснить причину этого явления.
8-39. По условиям предыдущей задачи определить
продхвкх котла при нагрузке 160 т/ч. Степень откры-
тия вентиля непрерывной продувки осталась неиз-
менной.
Ответ: 2.4%.
8-40. Определить начальное и конечное солесодержа-
ние котловой воды при увеличении паропроизводитель-
ности котла от 150 до 180 т/ч, если размер продувки не
213
изменился. Начальная продувка составляет рп-=3,5%
Солесодержание питательной воды равно 45 мг/кг.
Ответ: 1330 и 1580 мг/кг.
8-41. Нагрузка котла снижена со 185 до J35 т/ч Раз-
мер продувки остался неизменным и составлял 4,6%
Определить продувку котла при сниженной нагрузке.
Ответ: 6,3 %-
8-42. Сухой остаток котловой воды работающего кот-
ла начал постепенно увеличиваться. Назвать по мень-
шей мере три возможные причины такого явления.
8-43 Добавка умягченной воды, сухой остаток кото-
рой равен 250 мг/кг, в питательную систему котлов воз-
росла от 15 до 18%. Насколько должна быть увеличена
продувка котлов, если сухой остаток котловой воды не
должен быть выше 1300 мг/кг?
Ответ: от 2,96 до 3,58%.
8-44. Периодическую продувку котлов низкого давле-
ния и небольшой производительности осуществляют сле-
дующим образом. Уровень воды в барабанах котла по-
вышается до некоторой высшей отметки по водоуказа-
тельпому стеклу. Затем открывают вентиль периодиче-
ской продувки, н уровень во ты в барабане снижается до
установленной нижней отметки по стеклу. Следователь-
но, нз барабана удаляется слой воды высотой й, м. По-
казать, что если диаметр барабанов d, м, их длина L,
м, и количество z, число продувок в сутки п, то в сред-
нем за сутки продувка котла в процентах от его паро-
производнтельностн £>п. т/ч, будет определяться выра-
жением
'Щ
0 4 В fZ 1Б 2D
Рис. 8-4. Изменение щелочно-
сти в течение суток
а. б - • щелочность соответственно
котловой к питательной воды,
мг-экв/кг
214
__hdLzn
8-45. Какой вывод следу-
ет сделать из графика
(рнс. 8-4), который харак-
теризует водный режим кот-
ла за 24 ч его работы, если
учесть, что степень открытия
вентиля на линии непрерыв
ной продувки не менялась?
8-46. Продувочная вода
котлов среднего давления
(3,2 ЛШа! концентрация
хлоридов в которой равна
125 мг/кг, поступает в расширитель, где поддержива-
ется давление 0,2 МПа. Определить концентрацию хло-
ридов в воде после расширителя.
Ответ: 163 мг/кг.
8-47. На основании анализа приближенного равенства
£)iriiSnj=D|[pSB.1i указать, в каком месте барабана котла
следует прокладывать водозаборную линию непрерыв-
ной продувкн.
8-48. Солесодержание питательной воды котла паро-
пронзводнтельностью 160 т/ч равно 55 мг/л. Опреде-
лить, какое количество солей, поступающих в котел, вы-
водится из него продувочной водой, если рв=4,5% и 5П=
=0,2 мг/кг.
Ответ: 99,65%.
8-49. Установлены следующие предельные эксплуата-
ционные нормы качества котловой воды для работаю-
щего котла: сухой остаток 1350 мг/кг и щелочность
6,3 мг-экв/кг. Определить действительные значения этих
величин, если в питательную воду добавляется 20%
умягченной воды, сухой остаток которой равен 260мг/кг,
щелочность составляет 1,5 мг-экв/кг, а водный режим
котла лимитируется щелочностью.
Ответ: 1092 мг/кг; 6,3 мг-экв/кг.
8-50. В условиях задачи 8-49 щелочность умягченной
воды снизилась до 1 мг-экв/кг, а сухой остаток остал-
ся прежним. Определить для этих условий фактические
показатели качества котловой воды. Что лимитирует
водный режим котла в данном случае?
Ответ: 1350 мг/кг; 5,17 мг-экв/кг.
8-51. Котлы среднего давления питали водой, сухой
остаток которой равнялся 48 мг/кг н щелочность
0,28 мг-экв/кг. Прн этом сухой остаток котловой воды
составлял 1250 мг/кг (прн норме 1300 мг/кг) и щелоч-
ность 7 мг-экв/кг (при норме 7,2 мг-экв/кг). Вследствие
попадания в источник водоснабжения кислых сточных
вод с соседних предприятий щелочность исходной воды,
приготовлявшейся на прямоточной Na-катионптной
установке, понизилась с 2,8 до 1,8 мг-экв/кг. Несмотря
на это, котлы продолжали работать в прежнем режиме,
а щелочность котловой воды поддерживалась на уровне
7 мг-экв/кг. Через некоторое время после этого один
из котлов был аварийно остановлен из-за прогара паро-
перегревателя, в котором были обнаружены отложения.
В чем причина аварии?
21 5
Рис. 8-5. Схема установки
для определения количества
продувочной воды.
/ — бак; 2 — барабан; 3 — рас-
ширитель.
Vi. котопое необходимо
8-52. Жесткость питательной воды составляет
10 мг-экв/кг. Считая, что вся жесткость кальциевая л
что осадок в котле выпадает в виде гидроксил апатита,
определить концентрацию шлама в котловой воде при
продувке рц=3,5%.
Ответ: 14,4 г/кг.
8-53. Сухой остаток питательной воды равен 35, а кот-
ловой 1200 мг/кг. Определить для этих условий воз-
можную добавку котловой воды в питательную ск.в для
ее подщелачивания, а также количество продувочной
воды о, направляемое в питательную систему котлов,
при условии, что максимальное значение продувки не
должно превышать 5% при этом же значения SK.B.
Ответ: ак.в=«1,84%; 0^36,8%.
8-54. Можно ли успешно подщелачивать питательную
воду котловой (в условиях задачи 8-53), если щелоч-
ность питательной воды необ-
ходимо повысить от 0,1 до
0,26 мг-экв/кг прн щелочности
котловой воды 5,5 мг-экв/кг.
Продувка котла прн этом не
должна превышать 5%.
8-55. Прн проверке количе-
ства продувочной воды ис-
пользуют схему, представлен-
ную на рис. 8-5: в тарирован-
ный бак / наливают Vi, ма, хо-
лодной воды, температура ко-
торой Л. Затем в него направ-
ляют продувочную воду с эн-
тальпией i, Дж/кг, до тех пор,
пока бак не заполнится до
объема V2, м3, после чего из-
меряют температуру смесн tCM.
Определить количество волы
налить в бак, чтобы наполнить
его до объема V2 продувочной водой. Плотность воды
можно принять равной единице.
8-56. Температура воды в тарированном баке после
смешения (см. задачу 8-55) не должна превышать 353 К,
чтобы исключить неточности, связанные с испарением
воды и увеличением тепловых потерь в окружающую
среду. Исходя из этого, определить, сколько килограм
мов холодной воды с температурой 291 К необходимо
216
заливать в бак / на 1 кг продувочной воды, поступаю-
щей в него из котлов давлением 3,3 МПа
Ответ: 2,67 кг.
8-57. Котельная оборудована шестью котламн номи-
нальной паропронзводительности 200 т/ч каждый. Днем
средняя нагрузка каждого котла составляет 130 т/ч, во
время вечернего максимума она возрастает до номи-
нальной. Определить количество умягченной воды, до-
бавляемой в питательную воду котла в период этого
максимума, если продувка котлов в среднем равна
3,5%, а расход умягченной воды в часы спада нагруз-
ки составляет 90 т/ч. Абсолютное значение потерь кон-
денсата остается постоянным, а продувочная вода вся
теряется.
Ответ: примерно 104 т/ч.
8-58. Электростанция конденсационного типа работает
с пиковой нагрузкой. В связи с этим общая паропронз-
воднтельность котлов в часы спада нагрузки составляет
ZDn, т/ч, а в часы максимума XD'B, т[ч (2D'n>2Dn)-
Расход умягченной воды, естественно, также возрастает
от Qx до Q'x, т/ч. Определить производительность во-
доочистки в часы максимума Q'x, т/ч, прн условии, что
потери конденсата в процентах общей паропроизводн-
тельиости котлов, а также продувка являются постоян-
ными прн обоих режимах.
8-59. Коэффициент упаривания питательной воды
в котле равен 28. Определить сухой остаток умягченной
воды, если ее добавка составляет 10%, а сухой остаток
котловой воды равен 1500 мг/кг.
Ответ: 535,0 мг/кг.
8-60. По различным причинам сопротивление линии,
отводящей воду нз расширителя непрерывной продув-
ки, может значительно возрасти. В результате этого
расширитель переполнится продувочной водой, н она
будет вынесена в атмосферный деаэратор. Можно лн
обнаружить такое явление, если оно возникает, и ка-
ким образом?
8-61. Сухой остаток питательной воды равен 40 мг/кг,
а щелочность ее 0,3 мг-экв/кг. По какому показателю:
по щелочности или по сухому остатку необходимо кон-
тролировать водный режим котла, если допустимый су-
хой остаток котловой воды равен 1200 мг/кг, а щелоч-
ность ее не должна превышать 7 мг-экв/кг?
217
8-62. Добавка умягченной воды в питательную систе-
му котлов составляет летом 25 н зимой 40% общего
количества питательной воды. Качество добавляемой
воды характеризуется следующими данными: щелоч-
ность 0,6 мг-экв/кг, сухой остаток 160 мг/кг и концен-
трация кремнекислоты в пересчете на SiO| 1,0 мг/кг.
Определить показатель, лимитирующий качество котло-
вой воды, если предельными значениями для котловой
воды являются щелочность 7 мг-экв/кг, сухой остаток
1500 мг/кг и концентрация кремнекислоты 9 мг/кг. Най-
ти также максимальную продувку котлов летом и зимой
по лимитирующему показателю.
Ответ: 2,86 и 4,58%.
8-63. В условиях, описанных в предыдущей задаче,
усовершенствуя технологию обработки, концентрацию
SiO2 в обработанной воде снизили до 0,6 мг/кг. Какой
показатель качества котловой воды будет лимитировать
водный режим котла в этом случае, если остальные дан-
ные, приведенные в задаче 8-62, остались без измене-
ния?
8-64. Электростанция была оборудована Na-катионит-
ной прямоточной водоочисткой, вследствие чего водный
режим котлов определялся щелочностью котловой воды.
В последующем эта схема была заменена H-Na-катио-
нитной, щелочность умягченной воды после этого соста-
вила 0,5 мг-экв/кг. Будет лн в этом случае водный ре-
жим котлов лимитироваться щелочностью, если добав-
ка умягченной воды равна 20%, продувка котлов рп=
=3% и щелочность котловой воды 3,45 мг-экв/кг?
8-3. СТУПЕНЧАТОЕ ИСПАРЕНИЕ
Количество загрязнений, уносимых нз котла паром,
характеризуется коэффициентом выноса или уноса У,
который можно определить из выражения
У=^5п/5я»в- (8-20)
Качество пара, т. е. его солесодержание Sn или кон-
центрация в нем кремнекислоты CS[Oj и т. д., равно:
5П=У5ВВ. (8 20а)
На практике при эксплуатации котлов стремятся
к тому, чгобы Sn было минимальным. При данном коэф-
218
фициенте уноса X которой для работающего котла при
установившемся режиме можно считать постоянным,
минимального значения SD достигают, максимально сни-
жая концентрацию когловой воды SK.H, что можно вы-
полнить различными способами.
Из уравнения солевого баланса (8-8), пренебрегая
Sji, можно получить, что
Sk.b=Sjj Л в/^пр,
п, следовательно, заменив SK.B=Sn/'V» найдем равен-
ство
S„—y S"'d^B- (8-206)
Таким образом, снизить значение Sn можно умень-
шением 5л.в, например, сократив добавку’ умягченной
воды в питательную систему котлов, уменьшив размер
присосов в конденсаторах турбин, применив обессолива-
ние либо увеличив размер продувки £)пр Уменьшение
Dnfs. очевидно, не может рассматриваться как способ
улучшения Sn. Качество питательном воды Sn.B зависит
от размера потерь конденсата (при достаточной гер-
метичности конденсаторов в отношении присосов сырой
воды), которые в условиях действующей электростан-
ции практически постоянны.
Для обычных котлов, не оборудованных ступенчатым
испарением, увеличить продувку часто затруднительно,
так как это ведет к большим тепловым потерям. Обес-
печение высокого качества вырабатываемого котлом па-
ра в результате увеличенных размеров продувки воз-
можно, если испарение воды в котле организовано по
ступенчатой схеме, приведенной иа рис. 8-6, на котором
представлена схема циркуляции воды в котле с односту-
пенчатым рнс. 8-6,а н двухступенчатым рнс. 8-6,6 испа-
рением. Последняя отличается тем, что в ней предусмо-
трено два самостоятельных контура циркуляции 3, 4,
водяные объемы которых сообщаются между собой
только через отверстие 1, сделанное в разделительной
перегородке 2. Питательная вода поступает в первый,
так называемый чистый, отсек 3, т. е. в первую ступень
испарения. Продувочная вода этого отсека служит пи-
тательной водой второго солевого отсека (вторая сту-
пень испарения).
Эти ступени испарения можно рассматривать как два
самостоятельных паровых котла с общим паровым
219
объемом, последовательно включенных по питательной
воде. В таком случае, снабдив величины, относящиеся
к первому отсеку, одним штрихом, а ко второму—дву-
мя, можно написать, используя формулу (8-20а):
•S'n nP|LB
Mip
S' —У S"°P"° ; S"u = y"
Ь'пр
Найдем отношение
$'п___ B^O в I У' в^п в
S"n Дф I &np
Рис. 8-6 Схема котла.
Для этого следует произвести соответствующие за-
мены и сокращения, пользуясь следующими соотноше-
ниями:
D"Bp=p"BDIIp-t О'щ=р'вОп.в-, У'^У".
Окончательно получим:
П _ *^П в р'\
$ п $ к в Р в
Оба сомножителя меньше единицы, и следователь-
но, концентрация веществ в паре первого отсека (со-
лесодержание) будет существенно меньше таковой во
втором (солевом) отсеке.
Для вывода следующих ниже зависимостей удобно
принять паропроизводительность котла, оборудованного
ступенчатым испаренном, равной 100 т/ч. Тогда числен-
ное значение продувки рп и паропроизводительностп
второй ступени п можно выразить в процентах и в тон-
нах иа час. Для котла с двумя ступенями испарения
220
Можно написать следующие уравнения баланса приме-
сей:
а) для котла в целом
(100^pn)SnE=100Sn+pnSK.B; (8-21)
б) для первой ступени испарения, т. е для чистого
отсека,
(100^-pu)Sn в— (ЮО—л)5,пЧ~(л-|_Рп)£,к в-
Подставив S,n=y/S'1<я> получим:
(1 00 ] рп) £п.в= (100—п) У'S’к в+ (« НМ 5'к в.
откуда
S' — — -10П-+ Р" — Q <8-22\
°«в—л + л?п + (100-л)У
Значением (100—п)У' как весьма малым по сравне-
нию с «Н-ри можно пренебречь, тогда
S' ^-100 + ^Sn.; (8-23)
к 3 п + рп л-в’ ' 7
в) для второй ступени испарения т. е. для солево-
го отсека,
(л-рри) S'K в=пЗ"пЧ~раЗ"к.в-
Так как S"n=y"S"KB, то
(яЧ~Рп) 5ZK. в= (У"п J-рп) 5"к.в,
откуда
S'' „=4»т" -S' (8-24)
кв лУ"4-дп ° ' 7
При малых значениях У" и п произведением пУ"
можно пренебречь, и тогда
(8-24а)
гп
г) уравнение баланса примесей в паре
100$п= (100—л) S'n-MS"!!,
откуда
S.’=(l”^)S'n+®S”n- (8-25)
Выведенные формулы справедливы, если переброс
котловой воды из солевого отсека в чистый отсутствует.
Переброс существенно отражается на водном режиме
221
котла. Если выразить размер переброса из второй ступе-
ни в первую (в процентах от Da) через г, то приведен-
ные формулы для S'kb и S"k.b примут следующий вид'
с' - (ЮО + Рп) Sa B-^-rS 'к а /8-26)
4 ° л-Н+Рп * ' '
(8 27)
Отношение 5"к.в/£/кв=Кр называется кратностью
концентраций между солевым и чистым отсеками Сле-
довательно,
<8-28)
откуда
(«-29)
Произведение КрУ" ие превышает 0,08—0,1; поэтому
в ряде случаев им можно пренебречь и расчет вести по
упрощенной формуле
л(К₽—1)рп. (8 30)
Во всех приведенных формулах коэффициент уноса У
выражен в долях единицы.
ПРИМЕРЫ
8-10. Проектируется котельная, в состав которой входят котлы
давлением 11,0 МПа Добавка обработанной обескремненной воды
составляет 20%, ее сухой остаток 250 мг/кг н концентрация
^'ь102—мг/кг. Возможно лн в этих условиях на котлах,ие
оборудованных ступенчатым испарением, получить пар с концентра-
цией 510зг-=0,02 мг/кг н со л есо держанием 0,2 мг/кг, если коэф-
фициент выноса по общему солесодержанию 0,03%, а по кремне-
кислого 1,0% Продувка котлов ие должна превышать 3%.
Решение Качество пара можно определить по формуле
(8-20), если известно качество котловой воды SK в, которое в свою
очередь определяется выражением.
Следовательно, для решения задачи необходимо вначале опре-
делить солесодержание и крсмнесо держание питательной воды Вос-
пользуемся формулой
SDa-(Hx/100)SIr
где Sx — показатель качества обработанной воды.
222
Подставив значения Sr и Ох, найдем
Sn в =0.2-250 — 50 мг/кг
и Дчя концентрации Siof-
•$пв=0,2 1=0,2 мг/кг.
Сухой остаток котловой воды равен
S„ „==(103/3) 50=1710 мг/кг,
а концентрация в ней кремиекислоты
С®'°*= (103/3) 0.2 6,86 мг/кг.
Солесодержание пара равно
Х„=3-10-‘-1710=0,513 мг/кг,
а кремнесодержание
Cjjlo<- 0,01 6,86 = 0,07 мг/кг
Следоватсчыго качество пара не удовтстворяег условиям при-
мера при продувке 3%
8-11. Для обеспечения качества пара, приведенного в примере
8-10 необходимо оборудовать котлы ступенчатым испарением Опре-
делить производительность второй ступени при продувке котла 3%
и качество пара по солееодержанню и кремнесодсржанию по каж-
дой ступени н по котлу в целом, используя данные рассмотренного
примера
Решение Вначале задаемся кратностью концентраций котло-
вой воды в отсеках, которая обычно лежит в пределах 3—10 При-
нимаем КР=5 Тогда по формуле (8-30) находим я=12% Опреде-
ляем сухой остаток и кремнесодсржание котловой воды, используя
формулы (8-23) и (8 24а)
S'k в= (103/15)-50= 344 мг/кг и (S7 в1'£[оа —
= (103/15) 0,2= 1,37 мг/кг;
S,#K в= (15/3)-344 = 1710 мг/кг и (S 'к n)siOj ~
— (15/3) 1,37 = 6,85 мг/нг.
Использовав формулы (8 20а) и (8 25), находим качество лара
а) по общему солесодержанию, мг/кг Ув=0,1, S/zB=0.5 н
среднее по котлу Sn=0,15. 6) по кремнесодержанию, мг/кг S'D =
=0 013, S"n =0,032 и SB=0,016
Таким образом, применение ступенчатого испарения позволило
получить требуемое качество пара
8-12 Для котла давлением 11,0 МПа оборудованного двухсту-
пенчатым испарением, определить процентное количество кремнокис-
лоты, которое уносится паром, н сравнить его с количеством, уно-
сившимся паром до оборудовании котла ступенчатым испарением
Необходимые для расчета данные взять из примеров 8-10 и 8 11
Решение В уравнении баланса для первой ступени
(1004-pn)Sn вт= (100 -/i)Szn-|- n-f-pi )S,K в,
где величина (ЮО—njS'n, г/ч, характеризует вынос кремнекяслоты
паром, а (я4-рл)5к в> г/ч, — котловой водой Следовательно, отиоси-
223
тельное количество кремнекислоты. %, которое уносится нз котла
паром, будет равно.
(Sio2-r_______(1У—")Л'„
1 J (ioo + r„)s„. •IOU’
где S'„ и Sn_,—в данном счучае концентрации S1O]~ соответ-
ственно в паре первой ступени и пвтатетьной воде. Подставив чис-
ленные значения из примера (8-11), Найдем (S10|—)'„ = 5,85°/о-
Аналогнчио из уравнения баланса примесей для второй ступени
испарения найдем, что доля кремнекислоты, уносимой паром второй
ступени, равна:
„ n_ nS”n 0,032-12 „„
(SIO? )"„ = (10П +А1) S[t в '100= 103 0>2 .100=1.86»/,.
Всего с паром выносится 8,36% кремнекислоты от общего коли-
чества, поступившего в котел.
До оборудования котла ступенчатым испарением выносилось
100-0,07 „
(S1O )п— юзо,2
кремнекислоты от вносимого в котел ее количества
8-13. В котле, оборудованном ступенчатым испарением, как ука-
зано в примере 8-11, появился переброс котловой воды нз солевого
отсека в чистый. Размер этого переброса составляет 4% паропроиз-
водительности котла Определить, пользуясь данными примера 8-10,
как это отразится на размере выноса из котла паром кремнекис-
лоты?
Решение. По формулам (8-26) и (8-27) определяем вначале
концентрацию кремнекистоты в котловой воде первой и второй сту-
пеней. Подставив численные значения входящих в них величин,
найдем
S'K в= 1,08+0,21$"и „ и S"K.B=2,72<S,K в.
Решив совместно два эти уравнения, получим S'K в=2,5 мг/кг
и S"F„—6,8 мг/кг, а также концентрацию кремнекислоты в паре
S'n=yS'F.» = 0,01-2,5=0,025 мг/кг и S"a=0,01 -6,8=0,068 мг/кг
На основе этих данных и соотношений, приведенных в решении при-
мера 8-12, найдем, что уиос кремнекислоты паром первой ступени
составляет i0,8%, второй 4% и по котлу 14,8%. Следовательно, по-
явление переброса увеличило вынос ^SiO^- паром на 6,44%.
ЗАДАЧИ
8-65. Солесодержание питательной во ты котлов высо-
кого давления равно 42 и крсмнесодержаиие 0,25 мг/ кг.
Кратность концентрации котловой воды между солевым
и чистым отсеками равна четырем. Определить солесо-
224
держание (а) и крсмнесодсржание (б) котловой воды
в ступенях и концентрацию кремне кислоты в паре котла
(в) при продувке 2,5% и коэффициенте выноса по
8Юз“У'= 0.8 и У 0,5
Ответ: а) 430 и 1720 мг/кг; б) 2,56
и 10,2 мг/кг; в) 0.024 мг/кг.
8-66. Проектируется котельная, в состав которой вхо-
дят котлы давлением 11,0 МПа, оборудованные ступен-
чатым испарением. Добавка обработанной воды солссо-
дсржаиисм 450 и крсмнесо держанием 2,5 mi /кг состав-
ляет 10%. Рассчитать водный режим котлов, т. е. найти,
а) лимитирующий показатель качества котловой воды
и продувку по нему; б) кратность концентраций котло-
вой воды между ступенями; в) сухой остаток котло-
вой воды в отс ках. Учесть, чго сухой остаток котловой
воды чистою отсека не должен превышать 450 мг/кг,
а предельная концентрация крсмнекислоты а солевом от-
секе составляет 10 мг/кг.
Ответ: a) pSiO1=2,6°/0; б) Кр=4; в) S'KB —450 и S"K.B=
= 1800 мг/кг.
8-67. На основе данных задачи 8-66 определить крат-
ность копнен граций и сухой остаток когловой воды в сту-
пенях в случае появления -переброса воды из второй сту-
пени в первую в размере 1,5% паропроизводительпости
котла; продувка котла остается неизменной.
Ответ: Кр=3*, S'KB=630 и
S"k.b=I800 мг/кг.
8-68. Как следует из условий задачи 8-67, появление
переброса котловой воды из второй ступени в первую
вызвало увеличение сухого остатки воды в чистом отсеке
с 450 до 630 мг/кг. Какими практически приемлемыми
способами можно достигнуть того, чтобы при той же
продувке котла рп—2.6% сухой остаток котловой воды
чистого отсека снизить до прежнего значения 450 мг/кг?
8-69. При расчете схемы двухступенчатого испарения
(переброс не учитывался) быт и получены следующие
данные: продувка котла — 2,5%; солесодержание котло-
вой воды чистого отсека 328 и солевого—1640 мг/кг;
паропроизводительность солевого отсека—10%• Солесо-
держаиие питательной воды составляло 40 мг/кг. После
осуществления этого проекта испытанном на котте было
установлено, что сухой остаток котловой воты в ччетом
15—209 225
отсеке увеличился при проектной продувке котла до
478 мг/кг. Эго произошло из-за появившегося переброса,
размер которого составлял 1,6% паропроизводительиосгл
котла. Для приведения качества котловой воды чистого
отсека к норме было решено изменить паропроизводи-
тельноегь солевого отсека, оставив без изменения про-
дувку. Определить новое значение п.
Ответ: /г=16,4%.
8-70. В условиях, описанных в задаче 8-69, снизить
сухой остаток котловой воды чистого отсека с 478 до
378 мг/кг можно было бы увеличением продувки котла.
До какого значения необходимо увеличить для этого
продувку котла и приемлемо ли это значение?
8-71. Для снижения сухого остатка котловой воды
чистого отсека с 478 до 328 мг/кг в условиях, описанных
в задаче 8-69, необходимо было бы увеличить продувку
до 8,9%. Пользуясь данными упомянутой задачи, опре-
делить кратность концентраций котловой воды между
ступенями, которая установилась бы при таком значе-
нии продувки.
Ответ: Кр=1,98.
8-72. Показать, что при увеличении продувки котла,
оборудованного ступенчатым испарением, кратность кон-
центрации котловой воды между ступенями приближа-
ется к единице, т. е. при рп-*-оо Кр->-1.
8-73. В котле осуществлено двухступенчатое испаре-
ние с выносными циклонами, паропроизводительность
которых составляет 15% производительности котла. Схе-
ма ступенчатого испарения с выносными циклонами от-
личается тем, что в ней переброс г=0. Котел работал
при кратности концентраций КР=8,5, продувке ря=2%
и сухом остатке питательной воды 51 мг/кг. В процессе
эксплуатации вследствие возросшего возврата конденса-
та сухой остаток питательной воды снизился до 30 мг/кг,
в то время как кратность концентраций Кр осталась
прежней.
Является ли неизменяемость Кр при изменении 5ЯВ,
когда г=0, рп—const и У'=:У"^0, частным случаем или
общей закономерностью?
8-74. Показать, что для дайной паропроизводитель-
ности второй ступени п и неизменном продувке котла
рп кратность концентраций Кр котловой воды между сту-
пенями остается постоянной при изменении качества
питательной воды.
226
8-75. Общеизвестно, что при прочих равных условиях
пар, получаемый от котла, оборудованного ступенчатым
испарением, отличается заметно меньшим содержанием
примесей, чем пар, вырабатываемый котлом без ступен-
чатого испарения. Объяснить, вследствие чего достигает
ся такой эффект?
8-76. Какими значениями кратности концентрации
котловой воды между ступенями и продувки будет ха-
рактеризоваться водный режим котла, рассмотренного
в задаче 8-73, если поддерживать постоянной не продув-
ку котла, а концентрацию котловой воды в солевом от-
секе?
Ответ: Кр=13,3; рп=1,22%-
8-77. Схема котла, оборудованного двухступенчатым
испарением, была рассчитана на сухой остаток питатель-
ной воды 5Пв=70 мг/кг. Паропроизводительность вто-
рой ступени испарения была определена в 15% при про-
дувке котла 3%. После пуска котла оказалось, что Snn
изменилось и стало равно 85 мг/кг. Определить расчет-
ное (а) и фактическое (б) значение сухого остатка кот-
ловой воды чистого отсека при условии, что расчетное
значение сухого остатка котловой воды солевого отсека
остается неизменным.
Ответ: а) 400 мг/кг; б) 470 мг/кг.
8-78. В котле, оборудованном двухступенчатым ис-
парением, можно отмстить три величины кратности кон-
центраций, а именно:
Kp=«S,/K В [S'К В* в/Srt.B П /(p=S,/B в/5д в.
Сиязапы ли между собой эти отношения (кратности
концентраций) какой-либо зависимостью и какой имен-
но?
8-79. Сухой остаток питательной воды котла, обору-
дованного двухступенчатым испарением, режимные и
конструктивные параметры которого приведены в задаче
8-73. ввиду возросших потерь конденсата зимой увели-
чился до 95 мг/кг. В связи с этим возросла и концен-
трация котловой воды в чистом и солевом отсеках. Мож-
но ли, увеличив продувку котла, снизить значение сухо-
го остатка котловой воды в чистом отсеке до 450 мг/кг,
если продувка не может быть увеличена сверх 7%? До-
казать расчетом.
8-80. Построить график зависимости величины сухого
остатка котловой воды чистого отсека от размера про-
дувки котла для следующих условий a) SnB=80 мг'кг;
15- 227
г=0 и л=15%; б) Sn.n=4'5 мг/кг; г=1% и «=15%. В ка-
ком из рассмотренных случаев котел будет обладать
большей «чувствительностью» к регулированию качест-
ва котловой воды чистого отсека продувкой?
8-81. Кратность концентраций котловой воды между
двумя отсеками котла, включенного после монтажа в экс-
плуаганию, о залась заметно меньше расчетной. Ука-
зать две возможные причины.
8-82. Определить показатели водного режима (Кр,
S'k.b, S"k.b) котла, оборудованного устройством двухсту-
пенчатого испарения, расчетные данные которого приве-
дены в задаче 8-74 если фактическое солесодержание
питательной воды равно 50 мг/кг.
Ответ: Кр=6: S'B,B=286 мг/кг;
S"k.b=1710 мг/кг.
8-83. Паропролзводитсльиость 1второй ступени испаре-
ния составляет п % производительности котла, оборудо-
ванного устройством двухступенчатого испарения. Опре-
делить концентрацию кремнекислоты вырабатываемого
котлом пара, если солесодержание кремнекислоты -в па-
ре первой ступени составляет S'n и во второй S"n, мг/кг.
8-84. Котел, оборудованный устройством двухступен-
чатого испарения, работает при продувке 1,5% и произ-
водительности второй ступени 15%. Чему будет равно
кремнесодержание пара если концентрация кремнекис-
лоты в котловой воле чистого отсека равна 3 мг/кг, ко-
эффициент выноса для первой ступени У'=1% и второй
ступени У"=0,5% . Кратность концентраций котловой во-
ды между ступенями равна пяти, давление в котле
1 1,0 МПа
Ответ: Sn=0,037 мг/кг.
8-85. Сухой остаток питательной поды составляет
120 мг/кг. Определить кратность концентраций котловой
воды между солевым и чистым отсеками, если продувка
котла составляет 3% при паропроизводительностн вто-
рой ступени 20%.
Ответ: Кр=7.85.
8-4. КАЧЕСТВО ПАРА
Качество пара определяется концентрацией и соста-
вом содержащихся в нем загрязнений — кремнекислоты,
солей, газов и др. Установлено, что содержание некото-
рых примесей в паре S,, пропорционально их концентра-
228
ции в воде, из которой получен пар, т. . в котловой во-
де SK в:
sn=ysK в.
Это соотношение справедливо для таких загрязнений,
как SiO2-3. различные соли и NaOH, ио не для аммиаки
или СОз- Множитель пропорциональности У, выражен-
ный в долях от Sk.b, называется коэффициентом уно-са
данного вещества паром, при неизменной нагрузке котла
сохраняется примерно постоянным. Численное значение У
по общему солесотержанию для котлов давлением 4,0—
11,0 МПа колеблется в пределах Ы0~*—5-Ю-4, а по
выносу кремнекислоты для котлов высокого давления
0,5-10-2—Ы0~2. Меньшие значения У характеризуют
соловые отсеки и котлы, добавка отработанной воды
в которые велика.
Практически концентрации примесей в паре S,, весь-
ма малы, что обусловливает сложность точного их опре-
деления, так как чувствительность применяемых мето-
дов анализа в ряде случаев оказывается недостаточной.
Поэтому па практике прибегают к увеличению различны-
ми способами концентрации содержащихся в паре при-
месей. Одним нз способов является так называемая час-
тичная конденсация пара. Если в потоке насыщенного
пара dn, -кг/ч, получить содержание небольшого коли-
чества влаги WB, кг/ч, частичной его конденсацией, то
эта влага «промывает» весь поток пара, т. е. содержащи-
еся в ием примеси практически полностью переходят
в раствор:
dnSn=T^B-SB,
откуда
W b=Sb / Sn,
где Sn и SB — концентрации примесей соответственно
в паре до образования «в нем влаги и во влаге после про-
мывки пара.
Величина ф называется степенью обогащения пробы;
оиа показывает, во сколько раз концентрация примесей
во влаге больше концентрации их в паре до увлажне-
ния. Если образовавшуюся влагу отделить от пара и
собрать, то определение концентрации примесей может
быть выполнено значительно более точно. Для лара вы-
сокого давления увлажнение может быть достигнуто при
его дросселировании; при этом происходит частичная
кокдепсацня пара. Этот принцип увлажнения пара лс-
22У
жит в основе устройства некоторых солекопцентраторов.
Если обозначить через iB и £„ энтальпии насыщенного
пара до и после дросселирования, а через г—теплоту
парообразования при давлении после дросселя, то можно
написать следующие равенства:
1ГП=‘К^-100;
Ф==
*к — *н
(8-31)
(8-32)
где W'n- увлажненность пара, %.
ПРИМЕРЫ
8-14. Необходимо снизить температуру пара котла 3,2 МПа
с 72«'1 до 683 К впрыиком в паропровод воды, температура которой
423 К- Определить предельно допустимое солесодержание этой воды,
если сухой остаток котловой воды равен 1500 мг/кг и коэффициент
выноса 0.01'5) Cu.it содержание пара по«.ле впрыска Ис должно
превышать 0,2 мг/кг.
Решение. Обозначим солесодержание пара до впрыска через
Sn, после впрыска S п и впрьь •! воды SB. Тогда, прини-
мая. что па каждый килограмм псрегр того пара впрыскивается
Ь, кг, воды, можно написать следующее уравнение баланса при-
месей:
S,n=6SB-|- (1—b)Sn.
откуда
Уп (1--
Следовательно, для нахождения SB необходимо предварительно
найти значения b н SD. Солесодержание пара до впрыска опреде-
ляется сухим остатком котловой воды я коэффициентом уноса, т. е.
Sa=ySK в=0,0001 1500= 0.15 мг/кг.
Что касается доли воды Ь, впрыскиваемой в пар, то она опре-
деляется на основе баланса тепло1Ы, который может быть представ-
лен в виде следующего равенства-
откуда
f к = bi: в + (1 —b) i’a—rb.
b
i. 4 + ' ’
В этом выражении iB, iK, jB означают энтальпии соответственно
пара до впрыска, пара пссл® впрыска и воды; значения этих вели-
чин принимают по таблицам нлн по I, S-диа! рамме. В данном слу-
чае iB=3,34; 1к=3,25 и £>==0,63; г=1,79 МДж/кг. Подставив эти
числовые значения в приведенную формулу и выполнив необходимые
230
арифметические действия, найдем
6=0,02 Использовав это числен-
ное значение в формуле для SB,
окончательно получим
«s^2.72 мг/кг. Следовательно, для
впрыска может быть применен
только достаточно чистый кон-
денсат.
8-1Б. Принципиальная схема
концентра гомера приведена иа
рис. 8-7. Насыщенный пар котла
высокого давления /, пройдя дрос-
сельное устройство 2, попадает в
сепаратор влаги 3, в котором вода
отделяется от пара. Отсепарнро
ванная вода направляется через
холодильник 4 в датчик солемера
Рис. 8-7 Принципиальная схе-
ма концентратомера.
1». а пар — в паропровод соответ-
ствующего давления Давление перед дросселем и в расширителе кон-
тролируется прн помощи манометров 6. Определить степень обога-
щения пробы в этом солемере (без учета тепловых потерь) и коли-
чество образующейся влаги W . кг/ч. если давление пара в котле
11,0 МПа, в расширителе 2,6 МПа, расход отбираемой пробы пара
равен 60 кг/ч
Решение. Для определения степени обогащения пробы ib на-
ходим вначале численное значение входящих в формулу (8-32) ве-
тичин. которые будут равны. кДж/кг- fB=2,7I; iK=2,8 и /п=184.
Подставив эти данные в указанную формулу и проведя вычисления,
найдем ф=20.4. Количество влаги будет равно WD — (1/20.4) -60=
=2.94 кг/ч
ЗАДАЧИ
8-86. Регулирование температуры перегрева пара
котла высокого давления осуществляется в поверхност-
ном пароохладителе. по трубкам которого протекает пи-
тательная вода с солесо держанием 35 мг/кг Определить
пропуск питательной воды в пароохладителе (в процен-
тах паропроязводительности котла), если известно, что
солесодержание пара возрастает в пароохладителе от
0,15 до 0,2 мг/кг.
Ответ: 0,14%.
8-87. Насыщенный пар котла давлением 3,3 МПа кон-
тролировался до пароохладителя поверхностного типа.
Качество пара было удовлетворптечьным, качество пе-
регретого пара не проверялось. Через некоторое время
турбина оказалась занесенной еолямн. что указывало иа
неудовлетворительное качество пара В чем заключается
причина заноса, еспн ошибки контроля исключаются’
8-88. По условиям за чачи 8-86 определить концентра-
цию в паре кремнекислоты, если концентрация ее в пи-
231
тательион воде 0,5 мг/кг, в котловой воде 6 мг/кг. Ко-
эффициент выноса У==0,8%.
Ответ: 0,049 мг/кг.
8-89. Конденсат турбин внезапно начал показывать
окраску по фенолфталеину, которая в пробе насыщенно-
го пара котлов отсутствует. В чем заключаются возмож-
ные причины такого явления?
8-90. Определить влажность пробы пара, %, а также
степень ее обогащения для начальных давлений пара,
МПа: 12,0; 10,0; 8,0; 6,0 и при давлении после дросселя
солемера (см. рис. 8-7) 3.6 МПа. Результаты расчета
изобразить в виде графика.
8-91. В какую сторону и насколько изменится коли-
чество влаги в условиях, аналогичных условиям, рас-
смотренным в задаче 8-90, если дросселирование пара
вести до давления 0s8 МПа.
Ответ: уменьшится до 1,76 кг/ч.
8-92. Определить расчетные значения общего солесо-
держания и концентрации SiO^ в пробе влаги, ото-
бранной из сепаратора (рис. 8-7), для следующих усло-
вий: давление пара в котле 11,0 МПа и давление пос-
ле дросселя 3,0 МПа. Солесодержание котловой воды
800 мг/кг, кремнесодержание воды 6,2 мг/кг, коэффици-
ент выноса по общему солесодержанпю 0.02% н по крем-
иекислоте 0,7%.
Ответ: 5п=3,07 мт'кг; CslO2 =0 83 мг^кг.
8-93. Конденсат турбины внезапно начал показывать
окраску по фенолфталеину. Проверка показала отсутст-
вие в паре аммиака. Какова возможная причина этого
явления? Как проверить правильность предположения.
8-5. ^УСТАНОВИВШИЕСЯ РЕЖИМЫ БАРАБАННЫХ КОТЛОВ
ПО КОТЛОВОЙ ВОДЕ
Концентрация веществ в котловой воде претерпевает
постоянные изменения. Характер этих изменении зависит
от условий работы котла и отношения паровой пагру’зки
к его вотяному объему. Качество воды зависит от ка-
чества питательной воды 5ИС, нагрузки котла Dn и его
продувки рп; изменение одного из этих факторов влечет
за собой изменение качества -котловой воды Поскольку’
при эксплуатации его необходимо поддерживать опреде-
232
ленным, надо знать характер и скорость изменения кон-
центрации растворенных в котловой воде веществ при
изменении SnE, Dn и рп. Прн увеличении концентрации
веществ в питательной воде концентрация их в котловой
воде повышается так же, как и при уменьшении продув-
ки. Увеличение нагрузки также вызывает повышение
концентрации веществ в котловой воде.
Прн пуске котла, заполненною питательной водой,
концентрация веществ в котловой воде начинает увеличи-
ваться. Скорость этого увеличения зависит от того, пус-
кается ли котел с закрытой или открытой продувкой.
В первом случае нарастание сухого остатка, щелочности,
SiO2^ и других примесей можно описать уравнением
S‘„ „ = s„ . + . - s„)f, (8-33)
’К
где S'K в “Концентрация веществ в котловой воде в мо-
мент t; SnH — концентрация веществ в питательной воде,
мг/кг; DB — паропроизводнтельиость котла, т/ч; VK — во-
дяной объем котла, м3; t — время работы котла с момен-
та пуска, ч.
Из этого уравнения видно, что концентрация приме-
сей в котловой воде непрерывно нарастает по линейному
закону. Скорость v, мг/(кг-ч), этого нарастания равна.
»=%(Sn.-S«). (8-34)
В действительности S‘K.B не может увеличиваться бес-
предельно, так как вещества, растворенные в котловой
воде, имеют ограниченную растворимость. Кроме того,
по мере возрастания S'l!b увеличивается и уиос примесей
с паром. Оба этн фактора ограничивают возрастание
S'kb- В тех случаях, когда Sn.e^Sn. концентрацией при-
месей в паре можно пренебречь. Тогда уравнение (8-33)
приобретает более простой вид:
Время т, необходимое для достижения концентрации
котловой воды можно найти нз выражения
233
откуда
_ ук (8-35)
^П.В ^11
Если перед пуском котел содержал -воду, концентра-
ция примесей в которой равна So, то
$,.=5о+%
У современных мощных барабанных котлов кратность
испарения Dn/VK достигает 3—4, что обусловливает вы-
сокую скорость увеличения концентрации веществ в кот-
ловой воде. Это следует иметь в виду, особенно в слу-
чае осложнений при работе продувочных устройств. Прн
пуске котла с открытой продувкой характер нарастания
концентрации примесей в котловой воде уже иной. Опре-
деляется он следующим уравнением:
( — "дРп А
—g """ '• (8-36)
При длительной работе котла, т. е. при S*k.b стре-
мится к пределу, равному
СО ___ '00 Дрп с
КВ Ра П-В‘
Скорость нарастания концентрации примесей в кот-
ловой воде в этом случае уменьшается со временем и
при i-^oo v—Q:
__ i
,IW' S-- (8’37)
Если положить, что SfK.B/50K.B=^n. и учесть, что <при
f->oo значение S£H.B стремится к вышеуказанному пре-
делу, то, решив уравнение (8-36) относительно най-
дем время ть в течение которого будет достигнута за-
данная концентрация котловой воды:
где
р___ РдРп
°— 100Ук
234
При определении tj следует всегда принимать т<1.
так как при т—И т становится неопределенным.
Период времени, в течение которого изменяется ка-
чество котловой воды при изменении рп или (неста-
ционарный. переходный водный режим) также пред-
ставляет интерес для эксплуатации: скорость изменения
концентрации вещества в котловой воде важно знать,
особенно в периоды напряженной работы котлов. Обоз-
начим предельную максимальную концентрацию приме-
сей в котловой воде через S°f- п, а промежуточные кон-
центрации— через S'k-b и причем 5'к.п<5"кп<
<£°к.в. Тогда время, необходимое для достижения кон-
центрации S'KD(r'i) hS/,kb(t,,i) равно:
1g (1— W|) _ _ lg(l — m8)
Big/? • ’ Blge *
(8-39)
хе т1=5/к.в/5°к-Р и m2=S/'Kn/'S0Kn. Значения Dn и рп,
входящие в величину В необходимо принимать для со-
стояния после изменения режима котловой воды Время,
необходимое для изменения концентрации примесей
в котловой воде от S'v в до очевидно, равно"
—т'ь
ПРИМЕРЫ
8-16. Котел пропаши ('Г’ъшигпло 180 т'ч по.- к? капитального ре-
монта включен в работу Определить через сколько часов сухой
остаток котловой воды достигнет нормального значения 1250 мг/кг,
если сухой остаток питательной воды составляет 36 мг/кг, а водяной
объем котла равен 45 м’. Котел пущен в работу прн закрытой про-
тувке.
Решен не. Подставив в формулу (8-35) приведенные ® задаче
/келейные значения величин, получим:
(1250 — 36' 45
36.180
-х=8.45 ч.
8-17. В течение какого времени можно достигнуть примерно
той же концентрации котловой воды, что н в предыдущей задаче,
если котел будет пущен в эксплуатацию прн степени продувки, рав-
ной 2.96 п°
Решение Для решения этой задачи применим формулу
(8-38), в которой примем т~0,99. Подставив численные -печения
рссх величии, найдем
— 1g I — 0,99)
180-2,96
"Ж 45
=39,2
Таким образом, применение продувки значительно увеличивает
промежуток времени, необходимый для достижения заданной кон-
цептрации.
8-18. По условиям примера 8-17 определить прирост сухого
остатка котловой воды за первый и сороковой часы работы котла.
Недостающие данные взять из npnvicpa 8-16
Решение Фактически речь идет о скорости нарастания кон-
центрации котловой воды, значение которой можно определить по
формуле (8-37), если подставить в нее /=1, а затем /=40 ч:
180-Д9.
(100+ 2,96)-180 Л 1СЮ45
О‘ -------ЙЙМ5-------- ’3G = 31 мг/(кгч)-
На сороковом часу прирост сухого остатка составит:
и=148е_*л—1,35 мг/(кг-ч).
8-19. Непрерывная лрод}вка на работающем котле, нс оборудо-
ванном ступенчатым испарением, из а енсправпсс гей уменьшилась
с 3,8 до 2%, что прн сохранении прежней производительности котла
вызвало увеличение концентрации котловой воды. Определить про-
межуток времени, в течение которого сухой остаток котловой воды
повысится на СЭО мг ы и достиг с г, след| штольни, предельного зна-
чения при паропроизводителыюсти котла 120 т/Ч и его водяном
объеме 40 м3. В момент изменения продувки сухой остаток котловой
воды составлял 1150 мг/кг.
Решение. Предельно допустимая концентрация котловой воды
по условию составляет 1150+300 = 1450 мг/кг. Максимальная кон-
центрация солей в котловой воде равна:
Сухой остаток питательной воды может быть найден на основе
данных, характеризующих . >дный рея (М ж гла до изменения пр
дувкн, т е
3,8-1150
5,1 ” ИЯ) + р„ = 1Я 3Ji=4- мг “г
Следовательно, максимальный сухой остаток гловой
равен.
100 + 2
5°к.р -----о---- 42=- 2140 мг/кг.
Воспользовавшись этими данными к формулой (8-39), можно
найти промежуток времени. Сухой остаток котловой поды возрас-
тает от 42 до предельно допустимого значения 1450 мг/кг за сле-
дующее время:
1g (1-0,677)
0,06-0,43
= 19,05 л,
где B/S°K в=0,677;
Д|Г|. 120-2
и_____11/J1---------Il (in
1(ЮУК -100-40“ ’
236
Прн той же продувке 2%-ный сухой остаток кот..- вой воды уве-
личится от 42 до 1150 мг/кг по истечении
Ig (1 — 0.537)
‘:2~ 0,06 0.43 ~12,95 ч’
где m=Sfl( D/S°K,B=0,537.
Таким образом, промежуток времени, в течение которого кон-
центрация примесей в котловой воде увслячнвш-ся от 1150 до
1450 мг/кг, равен:
Лт=Т(—-Та= 19,05—12,95—6,1 ч.
Задачи подобного типа можно решать, пользуясь я другими
формулами. Если счет времени вести не с момента, когда котел
залит питательной водой, а с некоторого другого момента, например
когда концентрация примесей в кот юной воде составляет 5'к в от
зависимость S,F.B от временя, представленная формулой (8-36), бу-
дет иметь следующий вид-
s',.,- +
Гп
Решив это равенство относите ыю е '* и I, in идем
- И___^к.в —
5°к.в р в
В 1g Г'»
где
ЮТ+д, S»„. S' ,
Рп ’“к S7"-
Подставив в формулу для t численные «качения, найдем то же
(качение. Для этого определим вначале ««’елня 4 н В:
2140 1450
t2110—1130 “°’6% " П
120-2
-ёп=0.0б.
iUu-10
Тог ia
1g 0,6%
•> С161g 2,7 =0,1 ч-
ЗАДАЧИ
8-94. Котел паропронзводнтельностыо 2 т/ч и водя-
ным объемом 16,5 м3 заполнен питательном водой, сухой
остаток которой 36 мг/кг н включен в работу при закры-
той npoivBKe. Через сколько времени концентрация со-
лей в котловой воде достигнет 1250 мг/кг? Объяснить
ночсм\ возникает столь большое различие в скорости
нарастания концентрации солеи в котловой воде в при-
мере 8-16.
Ответ: через 27,8 ч.
937
8-95 На котле, работавшем с нагрузкой 140 т/ч, не-
ожиданно испортилась непрерывная продувка К момен-
ту отказа в работе продувочных устройств сухой оста-
ток котловой воды составлял 1150 мг/кг. По данным
теплотехнического испытания этого котла, максимальное
значение сухого остатка котловой воты может быть не
больше 1450 мг/кг Определить, сколько времени остает-
ся в распоряжении дежурного инженера тля принятия
необходимых мер, прежде чем будет достигнута предель-
ная концентрация котловом воты. Что необходимо де-
лать, если не удастся восстановить работоспособность
продувочных устройств за найденное расчетом время?
Сухой остаток питательной воды равен 45 мг/кг, а водя-
ной объем котла 50 м3. _ _ __
Ответ: 2,38 ч.
8-96. На выяснение причины отказа в работе проду-
вочных устройств котла (задача 8-95), работавшего все
это время с нагрузкой 140 т/ч, было затрачено 50 мин,
после чего оказалось что на устранение неисправностей
необходимо еще минимум 2 ч, в то время как согласно
расчету осталось всего 93 мин. Дежурный инженер стан-
ции нашел выход и продержал работающий котел без
продувки еще 2 ч, не превысив в то же время норматива
кот повой воды по сухому остатку. Что сделал дежурный
инженер? Докажите расчетом возможность этого меро-
приятия.
8-97. После капитального ремонта котел пэоопроиз-
вотительностыо 100 т/ч с водяным объемом 40 м3 был
заполнен питательной водой, сухой остаток которой ра-
вен 70 мг/кг. н включен в работу. Котел оборудован
устройством для ступенчатого испарения с паропроизво-
лительностыо второй ступени л=15%. кратность концен-
траций котловой воты в ступенях равна шести Опреде-
лите время, в течение которого будет достигнута пре-
тельная концентрация прнмоссй в котловой воле первой
ступени, если продувка котла равна 3%. а водяной объ-
ем первой ступени 34 м3, переброс отсутствует.
8-98. При условиях, разобранных в примере 8-16, бы-
ло найдено, что предельного солесодержания котловой
воды О250 мг/кг) можно достигнуть при работе котла
без продувки через 8 45 ч Определить солесодержание
котловой волы, которое будет достигнуто через 8,45 ч,
если пустить котел прн открытой продувке, размер кото-
рой 3% Недостающие ппттпые взять из примера 8-17.
Ответ: 790 мг/кг.
23Я
8-99. На котле давлением 11,0 МПа, работающем
с паропроизводительностью 170 т/ч, продувка вследст-
вие ненсправностегг неожиданно в 20 ч снизилась с 3 до
2,2%. Водный режим котла лимитировался содержанием
кремнекислоты, концентрация которой в питательной во-
де была равна 0,43 мг/кг. Предельная концентрация
SiO2^3 в котловой воде солевого отсека составляет
15 мг/кг До утра котел нельзя было останавливать, хо-
тя по графику нагрузки можно было несколько умень-
шить выработку пара котельной. Что необходимо сде-
лать, чтобы продержать котел под нагрузкой 10 ч, не
превышая в то же время предельного содержания крем-
некислоты? Подтвердить расчетом.
8-100. Производительность котла увеличили от 120 до
180 т/ч, оставив при этом прежний размер продувки
2,3%. Определить, через сколько часов с момента изме-
нения нагрузки концентрация примесей в котловой воде
достигнет 1600 мг/кг, если при производительности кот-
ла 120 т/ч сухом остаток котловой воды составлял
1100 мг/кг. Водяной объем котла равен 55 м3.
8-101. При работе котла, данные о котором приведе-
ны в задаче 8-100, с нагрузкой 150 т/ч сухой остаток
питательной воды возрос от 25 до 40 мг/кг. Сухой оста-
ток котловой воды в этот момент был равен 1200 мг/кг.
Опредечить время, в течение которого сухой остаток
котловой воды достигнет критического значения, которое
на 20% выше указанной эксплуатационной нормы, если
не изменять продувку. Необходимые цифровые данные
взять из задачи 8-100.
Ответ: примерно 10 ч.
8-102. Что необходимо делать в условиях, описанных
в предыдущей задаче, чтобы не превысить критическое
солесодержание котловой воды в случае, если невозмож-
но увеличить продувку котла?
8-103. Дать анализ формулы (8-36), в результате ко-
торого нужно ответить на вопрос, какие конструктивные
особенности котла н эксплуатационные факторы способ-
ствуют быстрому нарастанию концентрации вещества
в котловой воде
8-6. КОРРОЗИЯ ОБОРУДОВАНИЯ
В практик эксп|уатанни теплосилового оборудо-
вания электростанции напботее часго встречается корро-
зия, вызываемая электрохимическими процессами, со-
239
стоящими в том. что на участках, именуемых анодами,
металл будет перс цдпть в раствор в виде двухвалент-
ного иона Fe2+.
2e4-2<?Fe2^->Fe2+.
Остающиеся в металле свободные электроны е будут
по металлу перемещаться иа участки с более положи-
тельным потенциалом, которые называются катодами.
Для протекания электрохимического процесса коррозии
необходимо, чтобы свободные (пескомпенсированпые)
электроны непрерывно удалялись с катодных участков.
В противном случае происходит выравнивание потенци-
алов электродов, н процесс коррозии прекращается.
Уменьшение начальной разности потенциалов элек-
тродов [ альвапического коррозионного элемента, приво-
дящее к уменьшению интенсивности коррозии, называет-
ся поляризацией. Электродные процессы, уменьшающие
поляризацию, т. е. интенсифицирующие коррозию, на-
зываются деполяризацией, а вещества, способствующие
деполяризации, — деполяризаторами. Роль деполяриза-
торов могут выполнять окислители различного рода, т. е.
вещества, способные присоединять электроны. В усло-
виях водного режима электростанций роль деполяриза-
торов чаще всего выполняют растворенный в воде кис-
лород (кислородная деполяризация)
O2+4e i 2Н2О^40Н-
(8-40)
или ионы водорода (водородная деполяризация)
2Н+4-2с’^2Н->Н2. (8-41)
Чаще всего эти катодные процессы протекают па-
раллельно, если для этого существуют необходимые
условия.
Как показывает опыт эксплуатации, роль деполяри-
затора могут выполнять и нитриты, т. е. соли азотистой
кислоты HNO2. Вероятное течение процесса может быть
описано следующей реакцией:
NO? Н-1 IaO + е — NO + 201 Г. (8-42)
Возможны и другие схемы протекания процесса де-
поляризации, в котором принимают участие нитриты.
Деполяризатором moivt явиться также ноны меди
Cu24~4-2е->-Си и железа Fc3+-Fe— Fc2+.
240
Система, состоящая из анода и катода, представляет
собой гальваническую пару (гальванический элемент).
В таких системах, как и в обычных гальванических эле-
ментах, в растворе электролита происходит движение ка-
тионов к катоду и анионов к аноду, что делает электри-
ческую цепь элемента замкнутой. Следовательно, для
протекания электрохимического коррозионного процес-
са необходимо возникновение гальванической пары, т. с.
двух учас1ков иа поверхности металла с различными по-
тенциалами, а также электролита, в который погружены
эти участки металла, и деполяризаторов. Если не вы-
полнено хотя бы одно из этих условий, то возможность
протекания процесса коррозии исключается.
Результатом электрохимической коррозии с кисло-
родной деполяризацией является образование гидроза-
кнеи железа Fe(OH)2, которая растворенным в воде
кислородом переводится в гидроокись:
2Fe(OH), 4- -i- О, + Н,О = 2Fe(OH),. (8-43)
Примером химическою процесса коррозии является
реакция перегретого пара е железом:
3Fc+4H2O-^Fe3O4+4H2, (8-44)
сопровождающаяся выделением водорода.
Скорость коррозии может быть выражена массой ме-
талла, разрушенного за 1 год (8760 ч) на 1 м2 его по-
верхности. Ее можно также выразить глубиной прони-
кания коррозионных повреждений в толщу металла за
1 год П, мм/год. При равномерной коррозии для чер-
ных металлов действительно соотношение /7=1,12 К.
Среди различных видов электрохимической коррозии
наибольшую опасность для паровых котлов представля-
ет межкристаллитная коррозия, отличительной особен-
ностью которой является то, что металл разрушается по
границам кристаллитов (зерен) Эти разрушения про-
являются вначале в виде весьма мелких не видимых не-
вооруженным глазом трещин, проходящих по границам
кристаллитов. Межкристаллитная коррозия возникает
при одновременном действии следующих трех факторов:
высоких растягивающих напряжений в металле; неплот-
ностей в заклепочных швах и вальцовочных соединени-
ях; агрессивных свойств котловой воды. Если один из
этих факторов отсутствует, то межкристаллитная корро-
зия маловероятна.
16—209 241
Агрессивность котловой воды зависит от состава
растворенных в ней веществ и их концентрации. Средн
этих веществ наиболее важную роль играет едкий натр.
Агрессивность котловой воды в отношении хрупких раз-
рушений при прочих равных условиях в значительной
мере зависит от относительной щелочности, %, котловой
воды, которую можно определить по формуле
Щщ-оЖрог-
Ш„=---------------- - 40 100, (8-45)
где 5к.в — солесодержание котловой воды, мг/кг;
СроЗ- — концентрация фосфатов в котловой воде, если
фосфатирование проводится трниатринфосфатом, мг/кг.
Для котлов, работающих без фосфатирования, фор-
мула приобретает более простой вид:
///от=40Щс. ]00 (8-46)
•^к в
Принято считать, что допустимое значение относи-
тельной щелочности котловой воды Щот не должно пре-
вышать 20%. Если в питательную систему добавляют
умягченную воду, то относительная щелочность воды
зависит от состава исходной воды и метода ее обработ-
ки. Для некоторых методов обработки могут быть выве-
дены следующие зависимости;
а) прямоточное Na-катионироваиие
(8-47)
б) известкование я содонзвесткование
S,-. -^'^+3'^,; (8-48)
в) H-Na-катиоиироваиис
+-Э'у>№„ (8-49)
где —щелочность умягченной воды, мг-экв/кг;
Sh.b — сухой остаток исходной воды, мг/кг; Э— -эквива-
лент для NaOH; Щот относительная щелочность кот-
ловой воды, %: у — доля воты, поступающей па Н-ка-
тиоиитиые фильтры; Э' —снижение сухого остатка
исходной воды, приходящееся на 1 мг-экв/кг удаленной
карбонатной жесткости, мг.
242
Следовательно, произведения Э'ЖК и Э'уЖк харак-
теризуют общее снижение сухого остатка исходной воды
в результате ее обработки При ориентировочных расче-
тах значение Э* можно принимать равным 45 мг. Как
следует из приведенных зависимостей, чтобы относитель-
ная щелочность котловой воды не превышала предель-
ного значения, сухой остаток исходной воды не должен
быть меньше некоторого определенного значения.
Наиболее радикальной мерой борьбы с агрессив-
ностью котловой воды является полное удаление из нее
свободной натровой щелочи. Режим котловой воды, при
котором в ней отсутствует свободный NaOH, получил
название иуль-каустического режима, или режима чисто
фосфатной щелочности. Он может быть практически осу-
ществлен при питании котлов конденсатом и применяет-
ся на установках высокого давления.
В пароконденсатном тракте этектростанцин протека-
ют процессы, в результате которых образуется свобод-
ный едкий натр. К таким процессам можно отнести сле-
дующие:
а) гидролиз силиката натрия, если SiO2 выпадает из
раствора в осадок:
Na2SiO3+H2O^2NaOH+SiO2;
б) попадание в турбинный конденсат охлаждающей
воды; бикарбонаты кальция и магния в результате ре-
акции с фосфатами в котловой воде образуют едкий
натр:
10Са(НС03)2-^10СаС03Ч-10СО?Ч-10Н20;
1 OCaC034-6Na3P04-|-2NaOH->CaIo (РО4) 6 (ОН) 2+
4-10Na2CO3;
10Na2CO34- 10H2O->20NaOH-j-10СО2;
в) поступление в питательную систему котлов с умяг-
ченной водой карбоната или бикарбоната натрия и рас-
пад их в котле:
2NaHCO3->CO2+Na2CO34-H2O;
Na2CO34-H2O^2NaOH+CO2.
Таким образом, при осуществлении режима чисто
фосфатной щелочности необходимо в большей или мень-
шей мере вести связывание, т. е. нейтрализацию едкой
щелочи.
16* 243
Из реакции образования гидроксилапатнта следует,
что 1 мг-экв v жесткости, если считать ее всю кальциевой,
связывает 0,1 мг-экв NaOH и 0,9 мг-экв или 0,3 мг-нопа
РО'3Если гидратная щелочность питательной воды
равна Д/п.в. мг-экв/кг, то нейтрализоваться должно
М=Щ^.а~ 0,1 Жо-
Количество фосфат-ионов мг/кг, вводимых в пи-
тательную воду, будет во всех случаях определяться
формулой
Сро3_=28,5Жо + pBi.
4
Тогда доза различных вводимых в котел фосфатов
может быть рассчитана, например, для сочетания реаген-
тов NaH2PO4-l-Na2HPO4 при помощи следующих ра-
венств:
0,1 ЖО=М;
т 4- п =Д (28,5,WO+W)=Ф.
откуда
т=(М—Ф)-,
п=(2Ф—М),
гте tn, п — концентрации соответственно NaH2PO4 и
Na2HPO4, мг-моль/кг.
ПРИМЕРЫ
8-20. Прош с эдиктрохимичс кой коррозии с кис дородной депо-
ляризацией может быть представлен следующими реакциями:
2Fe+O2+2H2O—>-2Fe(OH)2;
2Fe(OH)2+ ~Os—2Fc(OH)3
Определить количество кислорода, необходимое для разрушения
слоя металла толщиной в 0,1 мм на площади в 1 ч: с образованием
Fe(OH)3, и количество образующегося Ff->03
Решение. Приведенные две рсан ин мои-но заменить одной
резул т>т пр у ющей
4Fe+3O=+6HsO—4Fe(OlIl .
?44
исходя из которой можно определить расход кислорода на I г про-
корродированного же1еза:
ЗО2 3-32
’о,= 4Fe==4-55,8=°’43r/r-
Масса слоя железа толщиной 0,1 мм на площади 1 мг равна:
/nFn=0,0I-10 000-7,8=780 г.
Стедовательио, требуемое количество кислорода составит 780Х
X0,43=336 г. Количество образующейся FesO3 можно определить
нз отношения
^Fe,O tmFe 1 -59,7 780
—2Fb = 2..M~="16г-
При выводе этого отношения принято во внимание, что формулу
гидроокиси железа можно представить в следующем виде:
2Fe(OH)3=Fes03-3H20
8-21. По устовиям примера 8-20 определить количество обра-
зующегося водорода в предположении, что коррозия происходит
с участием ионов водорода, т. с. с водородной деполяризацией.
Решение Основное уравнение процесса коррозии с водород-
ной деполяризацией может быть представлено в следующем виде:
Fe+2H+—Fe«+4-H2.
Оно позволяет составить пропорцию, решение которой дает сле-
дующее выражение:
9-780 „
-^^рг28г-
чре
что составит 310 л в нормальных условиях.
ЗАДАЧИ
8-! 04. Согласно действующим в настоящее время
нормативам количество растворенного кислорода в пи-
тательной воде котлов с давлением пара 4,0 МПа не
должно превышать 0,02 мг/кг. Определить число язв
(свищей) в форме конуса высотой 3,5 мм и диаметром
у основания 10 мм, которые могут образоваться в котле,
в предположении, что в питательной воде котла содер-
жится 0,02 мг/кг кислорода и он полностью расходует-
ся только иа коррозию металла. В основу расчета по-
ложить следующие данные: паропроизводительность
котла—150 т/ч; продувка — 4%; длительность работы
между капитальными ремонтами — 8000 ч; плотность
железа — 7,8 г/см3; конечным продуктом коррозии яв-
ляется Fc(OH)a.
Ответ: примерно 80 тыс. свищей.
245
8-105. Используя условия предыдущей задачи, опре-
делить количество FesOg, образующееся в котле за
8 тыс. ч его работы.
Ответ: примерно 83 кг.
8-106. Считая, что все количество Fe2O3, найденное
по условиям задачи 8-105, остается в котле, определить
толщину слоя отложений, если поверхность нагрева при-
нять равной 1500 м2, плотность отложений 5,2 г/см3, от-
ложения образовались на 1/10 части поверхности на-
грева.
Ответ: 0,11 мм.
8-107. Паровой котел, находящийся в простое или ре-
зерве, должен быть согласно правилам технической экс-
плуатации предохранен от так называемой стояночной
коррозии. Для этого по очному из применяемых спосо-
бов из котла спускают воду и устанавливают в бараба-
не противни с веществами, поглощающими влагу. В ка-
честве таких веществ могут быть применены безводный
хлористый кальций пли негашеная известь. Определить
количество СаС12 с двойным запасом, которое необхо-
димо поместить в котеч, чтобы поглотить водяные пары,
содержащиеся в воздухе, в объеме котла, равном 75 м1.
Абсолютная влажность воздуха составляет 30 г/см3.
Считать, что водяные пары поглощаются полностью,
а хлористый кальций превращается в СаС12-7Н2О.
Ответ: 4,62 кг.
8-108. Определить по условиям задачи 8-107 коли-
чество негашеной извести, которое необходимо помес-
тить в котел для поглощения того же количества водя-
ных паров, которое принято в условиях предыдущей за-
дачи.
Ответ: 14 кг.
8-109. Объяснить, почему осушка воздуха в котле,
находящемся в простое, влагопоглощающими вещества-
ми устраняет коррозию металла.
8-110. Процесс нитритной коррозии с некоторой ве-
роятностью можно представить следующим суммарным
уравнением:
3NaNO24-Fe-f-3H2O^3NO+Fe (ОН) 3+3NaOH,
вполне аналогичным уравнению коррозии с кислородной
чеполяризациеи:
4Fe+3O2-f-6H2O->4Fe (ОН) 3.
Определить концентрацию в питательной воде нитри-
тов. эквивалентную концентрации кислорода 0.03 мг/кг,
246
при условии, что только половина количества их вос-
станавливается по приведенному уравнению.
Ответ: CNaNOj=0,52 мНкг
8-111. Считается, что наличие в котле продуктов кор-
розии может послужить причиной активной электрохи-
мической коррозии металла котла в процессе работы и
при отсутствии кислорода в питательной воде. Механизм
этого процесса схематически может быть представлен
следующим образом:
4 F е2О3-|- Fe-^-3Fe3O4;
4 F е3О4 -pOj—*-6F е2О3.
Образовавшаяся в котле окисиая форма железа
Ре2О3 способна окпсляш железо в магнитную закпсь-
окнсь Fe3O^=FeO-Fe2O3, которая в последующем при
контакте с воздухом, например в период вскрытия кот-
ла для ремонта, вновь переходит в Fe2O3- Иными слова-
ми, Fe2O3 является как бы «поставщиком кислорода»,
т. е. твердым деполяризатором.
Руководствуясь изложенным, определить количество
Ре2Оз, которое должно быть в котле, чтобы вызвать
такую же коррозию, какая возникает при поступлении
в котел питательной воды, содержащей 0,03 мг/кг кис-
лорода, если считать, что весь этот кислород служит для
окисления железа до двухвалентного. Производитель-
ность котла по питательной воде принять равной J50 т/ч,
длительность работы 1000 ч.
Ответ: 180 кг.
8-112. Используя данные задачи 8-111, определить
количество Fe2O3, которое окажется в котле, если его ие
удалять чисткой после того, как магнитная закись-окись
железа при контакте с воздухом во время остановки
котла вновь перейдет в окись железа.
Ответ: 202 кг.
8-113. Пароводяная коррозия, часто наблюдаемая
в пароперегревателях, сопровождается выделением во-
дорода, который уносится паром. Следовательно, по
концентрации водорода в паре можно судить об интен-
сивности этого вида коррозии, если отсутствуют другие
источники его поступления в пар Какое количество же-
леза будет разрушаться пароводяной коррозией в котле
паропроизводительиостью 150 т/ч, если концентрация
водорода в паре составляет 0,1 мг/кг.
Ответ: 315 г/ч.
247
8-1 И. Положим, что пароводяной коррозии подверга
сгся 10% общей поверхности пароперегревателя, равной
785 м2. Через какой промежуток времени толщина труб
перегревателя уменьшится на 1 мм, если в паре содер-
жится 0,01 мг/кг водорода, образующегося в результате
процесса пароводяной коррозии, и котел работает со
средней нагрузкой 150 т/ч?
Ответ: 19,5 тыс. ч.
8-115. В задаче 8-104 показано, что при питании ко-
тельного агрегата паропроизводительностью 150 т/ч во-
дой, содержащей 0,02 мг/кг кислорода, за 8 тыс. ч ра-
боты может образоваться примерно 80 тыс. свищей,
которые, если они возникнут, полностью выведут котел
из строя. Это — результат местной (локальной) корро-
зии. На какую толщину слоя мог бы быть разрушен
металл по всей поверхности нагрева котла (1430 м2),
если бы коррозия оыла равномерной? Представляло бы
это опасность для работы котла?
8-116. На одной электростанции наблюдался занос
проточной части паровой турбины твердыми отложеини-
ми, в состав которых входило до 90% магнитной заки-
си-окнси железа FC3O4. При проверке качества пара и
конденсата было установлено, что в пароперегревателях
коглов среднего давления пар обогащается железом,
концентрация которого увеличивалась на 60 мкг/кг
(если считать на Fc) в результате протекавшей в зме-
евиках пароводяной коррозии. Какой концентрации во-
дорода в паре отвечает указанное количество в нем же-
леза» если считать, чго все оно появляется в результате
пароводяной коррозии?
Ответ: 0,3 мкг/кг.
8-117. Щелочность и сухой остаток котловой воды
двух котлов, установленных в промышленной котельном,
соответственно равны: Щк.в=12 мг-экв/кг; SKB=
=3700 мг/кг и Щк.в=4 мг-экв/кг; SK.B=600 мг/кг.
В каком котле когловая вода более агрессивна в от-
ношении межкристаллитной коррозии, если судить об
этом по ее относительной щелочности при условии, что
котловую воду не фосфа гируют?
8-118. В питательную систему котлов среднего давле-
ния добавляют 23% умягченной воды щелочностью
2 мг-экв/кг н с сухим остатком 136 мг/кг. Определить
относительную щелочность котловой воды, если размер
продувки составляет 4.5%.
Ответ: 59%.
248
8-119. Как изменится относительная щелочность кот-
ловой волы в условиях, описанных в задаче 8 118, если
вода будет обрабатываться нс иа прямоточной Na-кати-
оинтной установке, а на Н- Na-катпоинтной водоочист-
ке, когда щелочность воды снижается то 0,3 мг-экв/кг,
а сухой остаток то 90%. Продувку котла принять рав-
ной 3%.
Ответ: снизится до 13.4%.
8-120. Введение в питательную воду сульфата натрия
Na2SO3 приводит к связыванию растворенного кислоро-
да по реакции
2Na2SO3 4 O2->2Na2SO4.
Поэтому добавление в питательную воду этого реа-
гента применяют как способ борьбы с кислородной кор-
розией. Определить количество 100%-иого сульфита нат-
рия, мг/кг, которое необходимо подать в питательную
воду, содержащую I мг/кг кислорода, для полного его
связывания.
8-121. Определить для условий, описанных в преды-
дущей задаче, насколько увеличится сухой остаток кот-
ловой воды, если котел работает при продувке 2%.
Ответ: на 442 мг/кг.
8-122. Если умягченную прозрачную питательную во-
ду начать фильтровать через плотно уложенный слой
железных (стальных) стружек, то содержащийся
в фильтруемой воде кислород будет связываться с же-
лезом по следующей суммарной реакции:
4Fe+3O2+6II2O->4Fe (ОН) а.
Определить количество железных стружек, кг/гот,
которое расходуется прн обескислороживании 1 т/ч во-
ды, содержащей 1 мг/кг кислорода, если износ стружек
принять равным 50% и остаточную концентрацию кисло-
рода в фильтровальной воде 0,1 мг/кг Установка ра-
ботает 8,7 тыс. ч в году.
Ответ: 36.4 кг/год.
8-123. Обескислороживание воды по методу десорб-
ции основано на том, что выделяющийся нз воды в га-
зовую фазу кислород связывается затем в реакторах уг-
лем по уравнению
С+О2->СО2.
Образующаяся углекислота растворяется в обескис-
лороженной воле. Определить увеличение концентрации
СО2 в обескислороженной воде, если концентрация кис-
лорода в исходной воде составляет 4 мг/кг, а остаточное
его количество равно 0,1 мг/кг.
Ответ: 5,46 мг/кг.
8-124. Одно из важных требований, предъявляемых
к работе деаэраторов атмосферного типа, сводится к то-
му, что температура деаэрированной воды должна стро-
го соответствовать давлению пара в деаэраторе, так как
эффект деаэрации достигается только при условии, если
вода будет кипеть. Выполняется лн это требование в де-
аэраторе, избыточное давление в котором равно
03 02 МПа, при барометрическом давлении 0,1 МПа н
температуре деаэрированной воды 377 К?
8-125. Избыточное давление в деаэраторе равно
193 кПа, а барометрическое 0,098 МПа. Правильно лн
отрегулирован тепловой режим деаэратора, если темпе-
ратура деаэрированной воды составляет 376 К?
8-126. Исходная вода, карбонатная жесткость кото-
рой 2,5 мг-экв/кг и сухой остаток 400 мг/кг, умягчается
ня Na-катноннпюй установке Определить относитель-
на Ю щелочность котловой воды при питании котлов ука-
занной катяонированной водой
8-127. Унос кремнекислоты в котлах высокого давле-
ния снижается примерно в 2 раза при увеличении гид-
ратной щелочности котловой воды с 0,3 до 1,5 мг-экв/кг.
Чему должна быть равна концентрация в котловой
воде РО3’4, чтобы гидратная щелочность ее, обусловлен-
ная присутствием Na3PO4, составляла 1,5 мг-экв/кг?
Ответ: 142,5 мг/кг.
8-128. Чему будет равна щелочность котловой воды по
условиям задачи 8-127, определенная по метилоранжу?
8-129. В результате реакции гексаметафосфата с ед-
кой щелочью образуются трииатрийфосфат и вода.
Определить количество эквивалентов едкого натра, свя-
зываемых (нейтрализуемых) одной молекулой гексаме-
тафосфата (№РОз)б, и эквивалентную массу последне-
го в этой реакции.
Ответ: 12; 51,1 мг.
8-130. Показать, что если молекула фосфата способ-
на нейтрализовать гц эквивалентов NaOH, то избыток
фосфатного иона в котловой воде будет равен:
05(L7nB 0,1^01-28,5^,
8-131. Охлаждающая вода имеет общую жесткость
Жо.в и карбонатную Жк, мг-экв/кг. Вывести зависимость
250
избытка ионов РО4 в когповой воде i • шчипы
присосов в конденсаторе со, %, нейтрализующей способ-
ности фосфата «1, продувки котлов по пару ро, %, и
щелочности пара Щп, поступающего в конденсатор.
Жесткостью пара, поступающего в конденсатор, можно
пренебречь. Указание; использовать ответ на задачу
8-130.
8-132. Каустическая щелочность питательной воды
равна 0,3 мг-экв/кг, а жесткость 10 мг-экв/кг. Можно
ли создать в этом случае режим чвето фосфатной ще-
точности, если применить динатрийфосфат прн продувке
котлов 5%? Избыток фосфат-ноиов в котловой воде не
должен превышать 70 мг/кг.
8-133. Электростанция, оборудованная котлами сред-
него давления, обратилась к наладочной организации
с просьбой установить ей режим чисто фосфатной ще-
лочности. При этом сообщалось, что восполнение потерь
конденсата в размере 20% осуществляется водой, умяг-
ченной на Прямоточной Na-кэтионнтной \стаповке. Кар-
бонатная жесткость исходной воды 3 мг-экв/кг. Возмож-
но ли это сделать?
8-134. На электростанции при щелочности питатель-
ной воды 50 мкг-экв/кг и жесткости 15 мкг-экв/кг было
принято решение вводить в питательную воду гексамета-
фосфат натрия, чтобы создать чисто фосфатную щелоч-
ность при условии, что избыток РО^- в котловой воде
не должен быть меньше 60 мг/кг. Правильно ли такое
решение?
8-135. Проблема коррозии металла в условиях элек-
тростанций имеет большое значение не только потому,
что с ней связано разрушение металла. Для современных
электростанций, оборудованных прямоточными котлами,
не менее существенно загрязнение питательной воды про’
дуктамн коррозии. При pH питательной воды меньше
девяти п особенно в случае содержания в ней свободной
углекислоты загрязнение ее продуктами коррозии дости-
гает значительных размеров. Указать, какие существуют
в настоящее время способы борьбы с обогащением пи-
тате тыюй ВОДЫ продул ии коррозии.
251
Численные значения у,, J, р для системы NaOH — С02 — Н20 [4]
pH «t V» & pH *
4,0 1,004 4,31.10“» 4,29-10-* —1,0.10-* 7,8 28,4
4,2 1,007 6,83.10'» 6,78-10-» —6,31.10-» 8,0 44,3
4,4 1,01! 1,08-10-’ 10,7.10-’ —3,98-10“» 8,2 69,0
4,6 1,017 1,72.10-» 16,9-Ю-’ —2,51.10-» 8,4 П.ЬЮ
4,8 1,027 2,73.10'» 26.G-10-* -1,5810-’ 8,6 17,7-1(1
а, о 1,043 4,3! 10'» 41,3-10-» —1,0.10-’ 8,8 28,4-Ю
5,2 1,068 6,83.10'» 64,0-Ю-’ -6,31.10-» 9,0 45,6.13
6,4 1,108 10,8-10'» 97,5.10-» —3,98.10-» 9,2 75,2-10
fl.fi 1,!72 17,2.10'» 14,7-10-’ -2,51-10“» 9,4 12,3-10»
5,8 1,273 27,3-10'» 2I.S.10-" -1.Б7.10-* 9,6 21 6-10»
6,0 1,431 43,1 • 10'» 30,1.10-» -9,9-10'’ 9,8 37,0-10»
6,2 1,683 68,3.10'» 40,6-10-» —6,15-10-’ 10,0 67,3-10»
0,4 2,08 10,8-Ю'1 51,9-10-» —3,73.10-’ 10,2 12,9-10’
6,6 2,72 17,2.10'1 63.2-10-’ —2,11-10-’ 10,4 26, ЫО5
6,8 3,73 27,3-Ю'1 73,2-10-» —9,4.10-’ 10,6 55,6-10»
7,0 *5,31 43,1-10" 81,2.10-» 1,0.10“» 10,8 12,6-10*
7,2 7,84 68,4-10'’ 87,3-10-» 9,7-10-» 11,0 2R.5.10*
7,4 11,8 10,8 91,5 10-’ 2,14-10-’ 11,2 67,6-10*
7,6 18,2 17.3 94,5-10-» 3,77-10-’ 4.4 16,4-10»
ПРИЛОЖЕНИЕ
<¥> F
27.5 96,8-10-» 6.23.10-’
43,6 98,5 • 10-» 1,0-10-'
69,5 90,4-Ю-9 1,59-10-'
11.110 10-10-’ 2,54-10“»
18.0-10 10,2-10*’ 4,02-10“»
29,2-10 10,3-10-’ 6,39-10-'
47,9-10 10,5-10“’ 1,01-10-»
80,5-10 10.7-10 -* 1,6.10-»
13,9-Ю5 11,3-10-’ 2,54-10-»
24,9-10» 11,9-10-’ 4,02-10"»
46,7-Ю9 12,6-10-’ 6,39-10-»
91 13,6-10“’ 1,01.10**
19.0-Ю1 14,7-10-’ 1,60-10-*
41,4-10’ 15,9-10“’ 2.54.10-*
94,0-10’ 16,4-10 — » 4,02-10-*
22,1-Ю* 17.8-I0-1 6,39-10-*
52,7-Ю* 18,5-10-’ 1,01-10-'
12,8-108 19,0-10-’ 1,6-10"’
31,7-10» 19,3-10-’ 2.54-10-
СПИСОК ЛИТЕРАТУРЫ
1. Крушель Г. Е. Образование и предотвращение отложений
в системах водяного охлаждении. М.: Госэнергоиздат, 1965.
2. Клочков В. Н. К сцепке коррозионной активности сре-
ды в коидснсатно-пнтателыюм тракте энергетических блоков высо-
ких и за критические параметров —Теплоэнергетика, 1975, JV.
с. 55—59.
3 Томашов Н. Д. Теория коррозии и зашиты металлов — М :
Ihi-во ЛН СССР. 1959.
4. Homig Н. Е. Physikocliemische Grundlagcn dcr Spcisewasser-
chcrnic. Essen: Verlag, 11963.
5. Переход аммиака из воды в пар/ Мартынова О И., Катков-
ская К Я., Вайнекис А. А.. Дубровский И. Я., Федоссйчук Т А.—
Теплоэнергетика, 1965, № (0, с. 75—79.
6. Ахользин П. А. Регулирование химического состава питатель-
ной возы прямоточных котлов с целью предупреждения коррозии.—
В кя.: Водоподготовка, водный режим и химконтроль на паросило-
вых установках. — М: Энергия, 1969, вып. 3, с. 56—63.
7. Balsch Е., Werner М. Beitrag zur Berechnung der pH-Werie
топ Gcjiiischcn. — Mitt. VGB 1943, H. 93, S. 141—150.
8 Руководящие указания по проектировании термических деа-
эрационных установок питательной воды котлов. — М: Энергия,
1968.
9. Мостофин А. А. Расчет значений pH н удельной электропро-
водности водных растворов аммиака и углекислоты — В кн.: Водо-
подготовка, водный режим и химконтроль на паросиловых установ-
ках. М.: Энергия, 1966, вып. 2, с. 178—4181-
ilO. Мостофин А. А. Электрические солемеры для контроля каче-
ства лара и котловой поды И..- Госэнергодэдат, J95J
II. Строительные нормы и правяла.“Ч. IL. Глава 31. Водоснаб-
жение Наружные сети и сооружения. М.: Стройиздат. 1975.
[2 . Физические и технологические свойства взвесей, образую-
щихся пр» обработке вады, информационные материалы ВОДГЕО.
М : ВОДГЕО, 1952
13. Апельцин И. Э. Обработка охлаждающей воды. Труды
ВОДГЕО. М.: ВОДГЕО. 1959.
14. Клячко В. А., Апельпин И. Э. Очистка природных вод. М.:
Стройиздат, 1971.
15. Справочник х/мика энергетика. М..- Энергия, 1972.
16 Мартынова О. И» Современные физико-химические характе-
ристики воды и водных растворов. — В кн.: Водоподготовка, водный
режим и хим контроль на паросиловых установках М Энергия.
1965, вып. I, с. г163—175.
17. Маргулова Т. X. Методы получения чистого вара М.: Гос-
энергонзтат, 1955.
253
18. Стырикович М. А., Мартынова О. И., Миропольский 3. Л.
Процессы генерации вара на электростанциях. М_: Энергия, 1969.
19. Клячко В. А., Алельцнн И. Э. Подготовка воды для про-
мышленного я городского водоснабжения. М.: Госстройнздат, 1962.
20. Субботина Н. П. Водный режим и химический контроль на
тепловых электростанциях. М.: Энергия, 1974.
21. Гурвнч С, М., Кострнкнн Ю. М. Оператор водоподготовки.
М.: Энергия, 1974.
22. Лурье Ю. ГО. Справочник но аналитической химии. М.: Хи-
мия, 1971.
23. Глесстон С. Введение в электрохимию. М.: Изд-во иностр
лит., 19&J.
24. Надей некий Б. П. Теоретические обоснования и расчеты
в аналитической химии М.: Советская наука, 1956
25. Кострнкнн Ю. М-, Дик Э. П., Корбут К. И. Возможность
использования шлама после известкования. — Энергетик, 1966, № 4,
с. 12—15.
ОГЛАВЛЕНИЕ
Предисловие 3
Глава первая. Расчет активности (концентрации) водо-
родных ионов в водных растворах , 4
1-1. Активная концентрация ионов .... 4
1-2. Показатель концентрации водородных ионов pH . 7
‘1-3 Система СОг—Н:О............................. 11
14. pH растворов СО2 в конденсате . . 13
1 5. pH конденсата греющего пара теплообменников . 13
1-6. Система NaOH—COj—Н2О . . 18
1-7. Щелочность воды и конденсата по ФФ и /МО 22
J 8. Система NH—СО*—Н?О 24
1-9. Система Н3РО4—NaOH—Н2О 29
МО. pH смеси растворов . . 32
1-11. pH буферных растворов 35
Глава вторая. Растворимость веществ в воде 41
2-1. Растворимость газов в воде .... 41
2-2. Растворимость труднорастворимых веществ . . . 45
2-3. Кондуктометрический контроль концентрации раство-
римых веществ . . 50
Глава третьи Показатели качества воды 56
3-J. Способы выражения концентрации растворов 56
3-2. Жесткость 57
3-3. Щелочность ..... 62
Глава четвертая. Реагентная обработка воды 67
4J1. Осветлитель и его работа .... 67
4-2. Обработка воды реагентами-осадителямц . 76
4-3 Умягчение воды по методу осаждения . . 86
4-4. Дозирование растворов реагентов ... 95
4-5. Обработка воды в системах оборотного водоснабже-
ния . - ... .............104
Глава пятая. Осветление воды фильтрованием 123
5-11. Фильтры с зернистой загрузкой 123
Глава шестая Обработка воды по методу ионного обмена 131
б-fl. Натрий-катиоинровапне ... 131
6-2. Водород-катнонирование 141
6-3. Схемы катиошггных установок . . 147
6-4 Обессоливание виды по методу ионного обмена . . 152
255
Глава седьмая Образование отложений в паровых ми-
лах ... ... ... >68
7-1. Образование отложений иа поверхностях паровых
котлов и теплообменников ........................ 168
7-2. Фосфатирование котловой воды 180
7-3. Щелочение котловой воды . 191
Глава восьмая Водный режим паровых котлов 19ft
8-1. Качество питательной воды Пароводяной баланс 198
8-2. Продувка паровых котлов . 264
8-3. Ступенчатое испарение ....................... 218
8-4. Качество пара...................................228
8-5. Неустаиовившиеся режимы барабанных котлов по
котловой воде ... . . . 232
8-6 Коррозия оборудования 239
Приложение .... 252
Список литературы 23л
Федор Иванович Белан
ВОДОПОДГОТОВКА [расчеты, примеры, задачи)
Редактор А. П. Пильщиков
Редактор издательства С. К. Брешин
Переплет художника Е. Н. Волкова
Технический редактор Н. М. Пушкарева
Корректор 3. Б. Драчевская
ИБ № 1999
Сдано в набор 25 06 7П Подписало в печать 17 03.80 Т-07102
Формат 84х108,/а» Бумага типографехд*> Л 2 Га;зд шрифта затер.
Издательство аЭнгюгияя, 113114, Москва. M-tU Шлюзовав наб , 10
Московская типография № 10 Союзполигрофпрома при Государственно*,
комитете СССР по д > м и д тсгьсгос, полигр фг и ц книжной торговли
113114, Москва, М-114, Шлюзовая нвб., 10