Author: Полевой В.В. Саламатова Т.С.
Tags: физиология растений растения ботаника
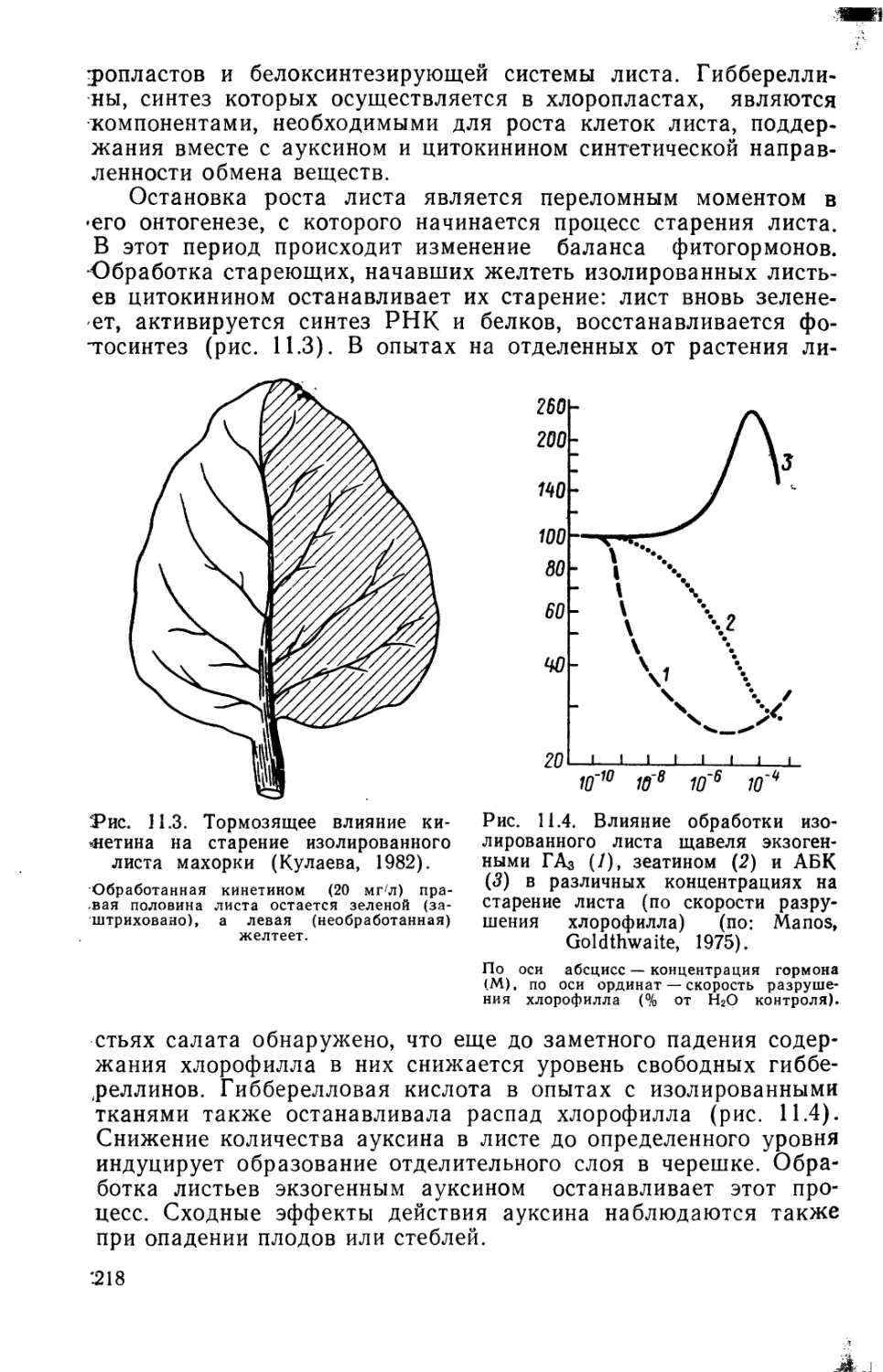
ISBN: 5-288-00372-6
Year: 1991
Text
В. В. ПОЛЕВОЙ Т.С. САЛАМАТОЗА
ФИЗИОЛОГИЯ
РОСТА И РАЗВИТИЯ
РАСТЕНИЙ
ЛЕНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
В. В. ПОЛЕВОЙ, Т. С. САЛАМАТОВА
ФИЗИОЛОГИЯ РОСТА
И РАЗВИТИЯ РАСТЕНИЙ
Учебное пособие
Допущено Государственным комите-
том СССР по народному образова-
нию в качестве учебного пособия
для студентов университетов, обу-
чающихся по специальности «Био-
логия»
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА
1991
Рецензенты: кафедра физиоло-
гии и биохимии растений Воронеж-
ского гос. ун-та (зав. кафедрой —
д-р биол. наук, проф. А. А. Земля-
нухин), д-р биол. наук, проф.
Н. Ф. Батыгин (Агрофизический ин-т
ВАСХНИЛ)
Печатается по постановлению
Редакционно-издательского совета
Ленинградского университета
УДК 581.14
Полевой В. В., Салама то в а Т. С. Физиология роста и
развития растений: Учеб, пособие. — Л.: Изд-во Ленингр. ун-та,
1991. 240 с.
ISBN 5-288-00372-6
В учебном пособии рассмотрены современные представления о физиоло-
гии всех этапов индивидуального развития растений: эмбрионального, юве-
нильного, зрелости и размножения, старения и отмирания. Описаны процес-
сы закладки и роста органов, способы регенерации у растений, теория мор-
фогенеза и коррелятивного роста. Приведены данные о формировании цвет-
ка, процессах опыления и оплодотворения, роста плодов, физиологии веге-
тативного размножения. Рассмотрены роль систем регуляции в этих про-
цессах, влияние факторов внешней среды, эволюция онтогенеза растений.
Учебное пособие предназначено для студентов и аспирантов биолого-
почвенных факультетов университетов, а также педагогических и сельско-
хозяйственных вузов.
П
1906000000—032
076(02)—91
ISBN 5-288-00372-6
© В. В. Полевой,
Т. С. Саламатова,
1991
ПРЕДИСЛОВИЕ
Рост и развитие растений — один из разделов физиологии
растений. Этот раздел в виде спецкурса читается на соответст-
вующих кафедрах многих университетов, сельскохозяйственных,
лесотехнических и педагогических институтов.
В последние годы наблюдается быстрый рост знаний о ме-
ханизмах роста и развития растений, о роли фитогормонов.
В сельскохозяйственном производстве вводятся интенсивные
технологии выращивания культур, развивается биотехнология
низших и высших растений, возникает проблема, как выращи-
вать растения в космосе без гравитации. Начинается разработ-
ка общей теории морфогенеза и растительные объекты все
шире используются для этой цели. Вышеназванные и многие
другие проблемы делают крайне необходимой подготовку учеб-
ного пособия по росту и развитию растений.
В нашей стране учебные пособия на эту тему издавались
несколько раз. Можно назвать книги С. О. Гребинского «Рост
растений» (1961), Д. А. Сабинина «Физиология развития расте-
ний» (1963), П. И. Гупало и В. В. Скрипчинского «Физиология
индивидуального развития растений» (1971), В. И. Кефели
«Рост растений» (1984). Однако они либо в значительной сте-
пени устарели, или предназначены для определенного круга
специалистов. Переведена на русский язык монография англий-
ских ученых Ф. Уоринга и И. Филлипса «Рост растений и диф-
ференцировка» (1984), предназначенная для физиологов расте-
ний и работников сельского хозяйства.
В последнее время появилось большое количество издании
по отдельным вопросам роста и развития растений: о фитогор-
монах и фитохроме, о биологии цветения, физиологии семян,
природе покоя, регенерации и др. Новое учебное пособие бази-
руется на этих отечественных и зарубежных работах. Оно на-
писано по материалам соответствующего спецкурса и спецсе-
3
минара для студентов кафедры физиологии и биохимии расте-
ний Ленинградского университета.
Перед авторами книги стояла задача в систематическом по-
рядке изложить анатомо-морфологические и физиолого-биохи-
мические данные об основных этапах онтогенеза покрытосемен-
ных растений от зиготы до старения, описать процессы роста и
развития их вегетативных органов, способы регенерации, меха-
низмы морфогенеза и коррелятивного роста, биологию полового
и вегетативного размножения. В ряде случаев (например, при
описании формирования частей цветка, зародышевого мешка)
пришлось пользоваться только данными анатомии и морфоло-
гии, так как в физиологическом плане некоторые фазы роста и
морфогенеза до сих пор не изучены. Последняя глава посвя-
щена слабо разработанному вопросу — эволюции онтогенеза
растений. В конце пособия приведен список дополнительной
литературы по главам, который позволит студентам более
углубленно познакомиться с различными проблемами роста и
развития растений на семинарских занятиях.
Авторы будут весьма признательны всем, кто выскажет по-
желания и критические замечания по содержанию этого учеб-
ного пособия.
СПИСОК СОКРАЩЕНИЙ
АБК — абсцизовая кислота
АГ — аппарат Гольджи
АТФ — аденозитрифосфат
АЦК— 1-аминоциклопропан-1 -карбоновая кислота
БС — белый свет
ГА — гиббереллины
2,4-Д — 2,4-дихлорфеноксиуксусная кислота
ДД —длинный день
ДДР — длиннодневное растение
ДКДР — длинно-короткодневное растение
ДКС — дальний красный свет
ИМК — индолил-3-масляная кислота
ИУК — индолил-3-уксусная кислота
КД —короткий день
КДР — короткодневное растение
КДДР — коротко-длиннодневное растение
КС — красный свет
МП — мембранный потенциал
1-НУК—1-нафтилуксусная кислота
ПД — потенциал действия
СС — синий свет
Ф — фитохром
Цк — цитокинин
ЭР — эндоплазматический ретикулум
ВВЕДЕНИЕ
Рост и развитие — наиболее сложные процессы в жизнедея-
тельности организма. Они непосредственно связаны с питанием,
водным режимом, транспортом веществ, двигательной актив-
ностью, механизмами коррелятивных взаимодействий всех час-
тей целого растения.
Из-за своей исключительной сложности процессы роста, мор-
фогенеза и возрастных изменений до сих пор остаются наиме-
нее понятными. Однако в настоящее время, когда достаточно
хорошо изучены механизмы деления, роста, дифференцировки
и старения клеток, когда известны гормональные, трофические
и электрофизиологические факторы регуляции и интеграции,
свойственные целому растению, появляется реальная возмож-
ность представить целостную картину формирования многокле-
точного растительного организма и описать механизмы, управ-
ляющие этим процессом.
Рост растений с давних времен привлекал внимание чело-
века прежде всего потому, что нарастание вегетативной массы,
формирование плодов, т. е. урожая, обеспечивало его продук-
тами питания. Со временем возникла настоятельная потреб-
ность исследовать суть самого явления. Историю изучения роста
и развития растений можно разделить на четыре периода:
1) описание процессов роста и развития; 2) изучение влияния
внешних факторов; 3) поиски внутренних факторов роста и
развития растений; 4) выяснение механизмов роста и морфоге-
неза.
Этап первый — описательный. В древнем мире уже исполь-
зовались культурные растения, было развито огородничество и
садоводство, возделывались хлебные злаки, имелся значитель-
ный практический опыт в уходе за растениями, применялись
удобрения, прививки и другие приемы. В философском плане
растения рассматривались как живые организмы, и им часто
6
приписывали антропогенные черты. Первые научные сведения
о растительном мире были обобщены Аристотелем (384—322 гг.
до н. э.) в трактате «Учение о растениях». По Аристотелю, рас-
тения питаются и растут, но не обладают волей и способностью
чувствовать как животные. Он отмечал, что некоторые низшие
водные организмы похожи одновременно и на растения, и на
животных. Питательные вещества, по Аристотелю, поглощаются
корнем и превращаются в тело растения. В «Учении о расте-
ниях» описаны различные способы размножения растений
(с помощью семян, луковиц, отводков, черенков). Отмечается
сходство между семенем растения и яйцом животного.
Ученик Аристотеля Феофраст (371—286 гг. до н. э.) в вось-
митомном труде «О причинах растений» описывает морфоло-
гию многих растений (побеги, листья, корни, цветки и плоды),
внутреннее строение стебля (кору, древесину, сердцевину), ход
развития хлебных злаков, деревьев и др., движение листьев
у мимозы и явление «сна» у некоторых растений. Он отмечает,
что рост растений завершается приобретением воспроизводи-
тельной способности, старение связано с потерей «изначальной
влаги». Особенно много внимания Феофраст уделяет вопросам
ухода за посевами культурных растений, приемам, обеспечи-
вающим получение высокого урожая. Этот труд — наиболее
полный свод знаний в области биологии растений — определил
развитие ботаники в течение последующих столетий.
Выдающийся немецкий биолог XVIII в. К. Ф. Вольф (1733—
1794), работавший в России, наблюдая за развитием зароды-
шей и органов у животных и растений, предложил для его объ-
яснения теорию эпигенеза, сыгравшую большую роль в борьбе
с преформизмом.
В 1790 г. И. В. Гёте в своей работе «Опыт объяснения мета-
морфоза растений» описал ход индивидуального развития рас-
тения от семени до цветения и плодоношения: превращение
семядолей в листья, формирование и видоизменение листьев,
образование всех частей цветка. По Гёте, органы цветка: ча-
шечка, лепестки, тычинки, пестик ((плодолистики), произошли
из листа в результате его метаморфоза. Эта работа дала силь-
ный толчок развитию исследований в области сравнительной
морфологии и онтогенеза органов растений.
Ботаник М. Я. Шлейден и зоолог Т. Шванн в 1838—1839 гг.
разработали клеточную теорию строения живых организмов.
Голландский ботаник Я. Моль, работая с водорослью кладофо-
рой, в 1835 г. впервые описал процесс деления клеток.
Немецкий ботаник К. Негели в 1844—1848 гг. изучил раз-
витие верхушечных меристем и образование из них органов и
тканей, в том числе и формирование сосудистых пучков.
В XIX в. открыто явление чередования поколений у споровых,
Доказано наличие полового размножения у низших и высших
растений, описаны строение семяпочки и зародышевого мешка,
,7
процесс оплодотворения, образования зародыша и развитие эн-
досперма (В. Гофмейстер, С. Г. Навашин и др.). Таким обра-
зом, на первом этапе изучения процессов роста и развития рас-
тений использовались методы анатомии и морфологии.
Этап второй — исследование влияния внешних факторов на
рост и развитие растений. К. А. Тимирязев назвал это направ-
ление «экспериментальной морфологией». Еще в 1806 г. англи-
чанин Т. А. Найт, использовав вращающееся водяное колесо,
установил, что направление роста растений подчиняется силе
тяжести: корни растут в центробежном направлении, а стеб-
ли— в центростремительном. А. С. Фаминцын (1865), приме-
нив искусственный свет керосиновой лампы и цветные фильтры,
показал, что проростки растений не изгибаются по направле-
нию к источнику красно-оранжево-желтого света, но зеленеют;
синий же свет при одностороннем освещении растения вызы-
вает его изгибы, однако растения не зеленеют.
Немецкий физиолог растений Ю. Сакс (1868, 1870) устано-
вил, что растение и каждая его часть сначала растут медлен-
но, затем быстро и, наконец, опять медленно (большая кривая
роста Сакса). Г. Фехтинг (1878) обнаружил, что растения об-
ладают полярностью: у отрезанного черенка корни отрастают
всегда только с базального конца.
Особенно обширные исследования с 1887 по 1917 г. провел
немецкий физиолог Г. Клебс, который в 1903 г. опубликовал
книгу «Произвольное изменение растительных форм», переве-
денную Тимирязевым на русский язык. Клебс установил, что,
варьируя водносолевой и световой режимы, можно влиять на
рост и развитие как низших, так и высших растений. Он пока-
зал, что усиление освещения и понижение концентрации пита-
тельных солей, особенно азотсодержащих, способствуют пере-
ходу к половому размножению; напротив, ослабление освеще-
ния и усиленное азотное питание благоприятствуют вегетатив-
ному росту и тормозят половое размножение. Г. Гасснер (1918)
описал явление яровизации. Американские исследователи
У. У. Гарнер и Г. А. Аллард (1920—1933) открыли фотоперио-
дическую реакцию у многих растений. Они нашли, что одним
растениям для перехода к зацветанию необходимы в течение
суток длительные периоды освещения (длиннодневные расте-
ния), а другим — периоды с относительно большей продолжи-
тельностью темноты (короткодневные растения). Однако на
этом этапе, как писал Клебс, «внутренние факторы, определяю-
щие направление метаморфоза, не известны были ни в одном
случае».
Этап третий — поиски внутренних факторов роста и разви-
тия растений. Сакс (1887) предположил, что в растительных
тканях функционируют органообразующие вещества. Ч. Дарвин
(1880), изучая явление фототропизма, пришел к выводу, что
верхушки побегов, воспринимая внешние воздействия, выраба-
8
тывают химический стимул, который перемещается в нижеле-
жащие зоны и вызывает ускорение их роста. Это ростовое ве-
щество из верхушек колеоптилей в 1928 г. выделил Ф. Вент,
а датские химики — Ф. Кегль и сотр. (1934—1935)—опреде-
лили его химическую природу. Этим стимулом оказалась индо-
лил-3-уксусная кислота.
Еще раньше сотрудник Фаминцына Д. Н. Нелюбов (1901)
показал, что этилен обладает сильным морфогенетическим дей-
ствием. Затем были последовательно открыты другие фитогор-
моны: гиббереллины, цитокинины, абсцизины.
М. X. Чайлахян в 1937 г. разработал гормональную теорию
развития растений, предположив, что их зацветание индуциру-
ется специальным гормоном — флоригеном.
В середине нашего столетия началось изучение роли генов-
в процессах роста и развития растений.
Этап четвертый — выяснение механизмов роста и морфоге-
неза. В этот период, включающий в себя и последние годы, ин-
тенсивно изучаются механизмы деления, растяжения и диффе-
ренцировки клеток, роль экспрессии генов в этих процессах.
Холодный и Вент в 1924—1926 гг. разработали гормональную
теорию тропизмов, в которой наряду с гормональными рассмат-
ривались и электрофизиологические процессы. X. Бортвик и
С. Хендрикс (1946—1956) открыли фитохром, принимающий^
участие в процессах фотопериодизма и фотоморфогенеза. В на-
стоящее время активно изучаются молекулярные механизмы
действия фитогормонов и фитохрома на уровне ядерного аппа-
рата и мембран. Показано, что поляризация клеток может
быть связана с функциональной активностью мембран. Пред-
ложена концепция об определяющей роли колебательных про-
цессов в явлениях самоорганизации живых организмов. Иссле-
дования в этих областях достигли достаточно высокого уровня,,
и это позволяет надеяться, что в ближайшие годы будет сделана
решающий вклад в понимание механизмов морфогенеза.
1. ОСОБЕННОСТИ И ЭТАПЫ РОСТА
И РАЗВИТИЯ СЕМЕННЫХ РАСТЕНИЙ
Растительные организмы имеют много общего с животными:
клеточное строение, тождественные функции (питание, дыхание,
размножение и т. д.) и метаболические системы. Сходны так-
же основные этапы развития растений и животных — от зиготы
до старения. Однако между высокоорганизованными представи-
телями этих двух царств имеются и кардинальные различия.
Они обусловлены прежде всего различием в способах питания.
Особенности роста и развития растений. Высшее растение —
прикрепленный («неподвижный») организм. Его форма макси-
мально приспособлена для фототрофного питания, характерного
для растений. Максимальная площадь контакта с СО2 воздуха
(концентрация всего 0,03%) достигается пластинчатой формой
листа и системой устьиц и межклетников. Ориентация листа,
перпендикулярная к падающему свету, позволяет наилучшим
образом его использовать. Листья расположены на стебле в
определенном порядке (филлотаксис) и разделены междоуз-
лиями таким образом, чтобы не затенять друг друга. Развет-
вленная корневая система также приспособлена для максималь-
ного контакта растений с почвенными частицами. Почвенное
питание растений осуществляется в условиях низких концен-
траций минеральных солей и возможного дефицита воды. Та-
кие условия воздушного и почвенного питания диктуют необхо-
димость непрерывного удлинения как побегов, так и корней.
Постоянным ростом в течение всего онтогенеза растения отли-
чаются от животных, которые растут только в периоды эмбрио-
генеза и молодости.' Продолжающийся рост позволяет новым
листьям получать достаточно света, а корням проникать в но-
вые участки почвы в поисках воды и минеральных солей.
Стратегия питания, обеспеченная описанными выше особен-
ностями морфогенеза и роста, особую роль отводит верхушке
побега и кончику корня. В этих терминальных участках расти-
10
тельного организма в течение всей жизни функционируют апи-
кальные меристемы, сформированные при развитии зародыша.
В апексах побега и корня постоянно образуются новые клетки,
которые затем удлиняются благодаря специфическому для рас-
тений росту растяжением. При этом рост клеток происходит в
результате образования большой центральной вакуоли, на долю
которой приходится 85—95% объема зрелой клетки, а также
благодаря размягчению и растяжению полисахаридной клеточ-
ной стенки. Движущей силой растяжения является внутрикле-
точное тургорное давление. Растягивающаяся клеточная стенка
постоянно достраивается за счет новых полисахаридов, посту-
пающих из цитоплазмы. Увеличение площади листовой пла-
стинки, обеспечивающее максимальное использование света и
СО2, также обусловлено ростом клеток растяжением. Таким
образом, рост растяжением является основным способам движе-
ния растений: удлинения осевых органов и увеличения площади
листьев. Этот способ движения необратим, и поэтому такого
рода ростовые движения одновременно являются элементами
роста и морфогенеза.
Итак, высшее растение живет и питается одновременно в
двух средах: побеги — в воздушной среде, корни — в почве.
Так как верхушка побега и кончик корня, как правило, первыми
встречаются с новой ситуацией, то в этих участках локализо-
ваны многие рецепторные системы, позволяющие растениям вос-
принимать изменения во внешней среде и адекватно (целесо-
образно) реагировать на них. Эту идею об особой роли вер-
хушки побега и кончика корня у растений впервые высказал
Ч. Дарвин в книге «Способность к движению у растений»
(1880). Он писал: «Едва ли будет преувеличением сказать, что
кончик корешка, наделенный способностью направлять движе-
ния соседних частей, действует подобно мозгу одного из низ-
ших животных, находящемуся в переднем конце тела, восприни-
мающему впечатления от органов чувств и дающему направле-
ние различным движениям» (Ч. Дарвин. Соч. 1941. Т. 8. С. 517).
Эта идея Дарвина, перефразированная в выражение: «мозго-
вая функция верхушки», вызвала критику и до сих пор не при-
знается в физиологии растений. Однако Дарвин не говорил
о том, что в верхушке побега и кончике корня имеется нечто,
подобное мозгу. Он постулировал здесь сенсорную и регулятор-
ную (управляющую) функции дистальных участков побега и
корня. Если принять эту идею, то можно сделать вывод, что
растения обладают двумя основными центрами управления, ко-
торые позволяют ориентироваться как побегу, так и корню в
средах их обитания. Эти центры, как теперь известно, выраба-
тывают специфические фитогормоны и функционируют во вза-
имодействии, причем ведущую роль играет верхушка побега.
Наряду с половым размножением для растений характерна
способность к размножению вегетативному (частями тела, поч-
11
ками, отводками, клубнями, луковицами и т. д.). Причем, если
у животных в ходе прогрессивной эволюции способность к веге-
тативному размножению быстро исчезает, то у растений она,
наоборот, развивается и совершенствуется, что связано с при-
крепленным образом их жизни. Вегетативный способ размно-
жения позволяет видам более эффективно завоевывать жизнен-
ное пространство. Так же как и вегетативное размножение, для
растений характерна высокая способность к регенерации. Это
обусловлено, с одной стороны, тем, что регенерация и вегета-
тивное размножение часто осуществляются одними и теми же
механизмами, а с другой стороны, тем, что регенерация — очень
эффективный способ выживания прикрепленного организма при
разного рода повреждениях.
Суммируя все сказанное, можно констатировать, что высшее
растение — это прикрепленный фототрофный организм, кото-
рый характеризуется постоянным ростом, наличием двух основ-
ных регуляторных центров (верхушка побега, кончик корня),
высокой способностью к вегетативному размножению и регене-
рации. Наряду с зеленой окраской, связанной с автотрофным
способом питания, рост растений и лежащий в его основе рост
клеток растяжением является наиболее характерным признаком
растений. По этому признаку—способности постоянно расти —
растение в русском языке и получило свое название.
Основные понятия. При описании роста и развития организ-
мов используется ряд терминов, с которыми необходимо пред-
варительно -познакомиться.
Онтогенезом (греч. on, род. падеж ontos — существо, лат. ge-
nesis— происхождение, процесс образования) называют инди-
видуальное развитие организма от зиготы (или вегетативного
зачатка) до естественной смерти.* В ходе онтогенеза реализу-
ется наследственная информация организма (генотип) в кон-
кретных условиях окружающей стреды, в результате чего фор-
мируется фенотип, т. е. совокупность всех признаков и свойств
данного индивидуального организма.
Развитие — это качественные изменения в структуре и функ-
циональной активности растения и его частей (органов, тканей
и клеток) в процессе онтогенеза. Возникновение качественных
различий между клетками, тканями и органами получило на-
звание дифференцировки. В понятие «развитие» входят также
и возрастные изменения.
Рост — необратимое увеличение размеров и массы клетки,
органа или всего организма, связанное с новообразованием эле-
ментов их структур. Понятие «рост» отражает количественные
изменения, сопровождающие развитие организма или его
частей.
* Ч а й л а х я н М. X. и др. Терминология роста и развития высших ра-
стений. М., 1982,
12
Если считать, что термины «развитие растений» и «онтоге-
нез» тождественны, то соподчинение всех этих понятий можно
представить в виде следующей схемы:
Онтогенез
—(развитие растений)--
I----------------------------------------I i
Дифференцировка Рост Возрастные изменения
Этапы онтогенеза высших растений. Развитие высших расте-
ний подразделяют на четыре возрастных этапа: 1) эмбриональ-
ный, 2) ювенильный, 3) репродуктивный (зрелость), 4) ста-
рость.
Эмбриональный этап онтогенеза семенных растений — раз-
витие зародыша от зиготы до созревания семени включительно.
Ювенильный этап (этап молодости) включает в себя прора-
стание семян или органов вегетативного размножения (клубни
и др.) и характеризуется накоплением вегетативной массы. Рас-
тение в этот период, как правило, не способно к половому раз-
множению.
Этап зрелости и размножения характеризуется готовностью
к зацветанию, заложением репродуктивных органов (цветков,
органов вегетативного размножения), их ростом и развитием,
формированием семян и плодов.
Этап старости и отмирания — период от полного прекраще-
ния плодоношения до естественной смерти организма.
Каждый из этих этапов включает в себя, как правило, не-
сколько фаз, закономерно следующих друг за другом. Про-
цессы морфогенеза и роста растений на всех этих этапах будут
рассмотрены в последующих главах.
2. ЭМБРИОГЕНЕЗ
Эмбриональный этап онтогенеза семенных растений охваты-,
вает развитие зародыша от зиготы до -созревания семени вклю-;
чительно. Все процессы эмбриогенеза у покрытосеменных осу-
ществляются в семяпочке (семязачатке), которая формируется
на плодолистике. Сросшиеся плодолистики (гинецей) образуют
завязь с гнездами для семяпочек (см. рис. 9.17), столбик и
рыльце. Семяпочка, в свою очередь, состоит из наружного и
внутреннего интегументов (покровов), нуцеллуса, зародышево-
го мешка (женского гаметофита). Она связана с плацентой за-
вязи своим халазальным (базальным) концом непосредственно
или с помощью семяножки (фуникулуса). Дистальный конец
семяпочки называется микропилярным. Через микропиле пыль-
цевая трубка проникает в семяпочку. Зародышевый мешок со-
стоит из гаплоидных яйцеклетки и двух синергид (на микропи-
лярном конце), центральной клетки с одним диплоидным или
двумя гаплоидными полярными ядрами (будущий эндосперм) и
трех или больше антипод на халазальном конце (рис. 2.1; см.
рис. 9.17). В ходе двойного оплодотворения один из двух гап-
лоидных спермиев пыльцевой трубки сливается с яйцеклеткой,
и таким образом формируется диплоидная зигота, а ядро вто-
рого спермия — с центральным ядром, в результате чего обра-
зуется первичная триплоидная клетка эндосперма (см. 9.6.6).
2.1. ФОРМИРОВАНИЕ ЗАРОДЫША
В ходе дальнейшего развития из зиготы образуется заро-
дыш, из семяпочки — семя, из завязи — плод. На эмбриональ-
ном этапе онтогенеза можно выделить несколько последователь-
ных фаз: зиготу, проэмбрио, глобулярную, сердцевидную, торпе-
довидную (для двудольных), фазу накопления питательных ве-
ществ и отложения их в запас (созревание). У многих видов
14
созревшие семена на длительный период переходят в состояние
покоя.
2.1.1. ЗИГОТА
У высших растении условия для первичной поляризации,
т. е. образования главной оси побег — корень будущего орга-
низма, создаются в семяпочке задолго до образования яйцеклет-
ки (см. 9.5). Поляризация самой яйцеклетки в направлении
микроскопом: яйцеклет-
халаза — микропиле хорошо видна под
ка имеет грушевидную форму, причем
ее вытянутый конец обращен к микро-
пилярпому полюсу. В этой части яйце-
клетки имеется крупная вакуоль, кото-
рая оттесняет ядро к апикальному кон-
цу (см. рис. 2.1). Яйцеклетка лишена
клеточной стенки и не связана с дру-
гими клетками плазмодесмами. Она
окружена двумя синергидами, кото-
рые выполняют функции трофическо-
го обеспечения яйцеклетки. Синерги-
ды выделяют хемотропные вещества,
направляя рост пыльцевой трубки. В
одну из синергид врастает пыльцевая
трубка, при этом конец ее разруша-
ется, и содержимое синергиды и
пыльцевой трубки попадает в про-
странство между яйцеклеткой и цент-
ральной клеткой, которая также в
этом участке не имеет клеточной
стенки. Затем происходит двойное
оплодотворение.
Оплодотворенная яйцеклетка (зи- Рис' Зародышевый ме-
х Г v шок покрытосеменных,
гота) некоторое время остается в со-
СТОЯНИИ ПОКОЯ (не делится). У раз- нергиды, 3- яйцеклетка, 4-
НЫХ ВИДОВ период ПОКОЯ занимает ОТ яйцеХткиЙЦеКЛ6^центо71Ж
нескольких часов ДО нескольких су- клетка, 7 —антиподы, в —по-
ток R что ппрмя воэпягтяат гинтря лярные ядра центральной клет-
lUh. £> ЭЮ время Возрастает синтез ки. Утолщенными линиями по-
РНК, увеличивается объем централь- М^Г
нои вакуоли, которая затем распада- назальный полюс,
ется на большое количество мелких
| вакуолей. Поэтому этот период скорее можно назвать не поко-
। ем, а начальным этапом активации яйцеклетки, вызванной
процессом оплодотворения.
2.1.2. РАЗВИТИЕ ЭНДОСПЕРМА
Центральная клетка, становящаяся триплоидной после
оплодотворения, переходит к митотической активности рань-
ше, чем зигота. Это связано с поступлением в зародышевый
15
мешок цитокинина и ауксина. Ауксин вырабатывается плодо-
листиками и формирующейся семяпочкой.
Содержание ауксина в зародышевом мешке возрастает в
период оплодотворения (ИУК пыльцевой трубки и, возможно,
разрушающейся синергиды). Цитокинин, как и питательные ве-
щества, по-видимому, первоначально в зародышевый мешок по-
ступает из материнского организма при участии синергид, ан-
типодов, гаусторий самого эндосперма. В дальнейшем форми-
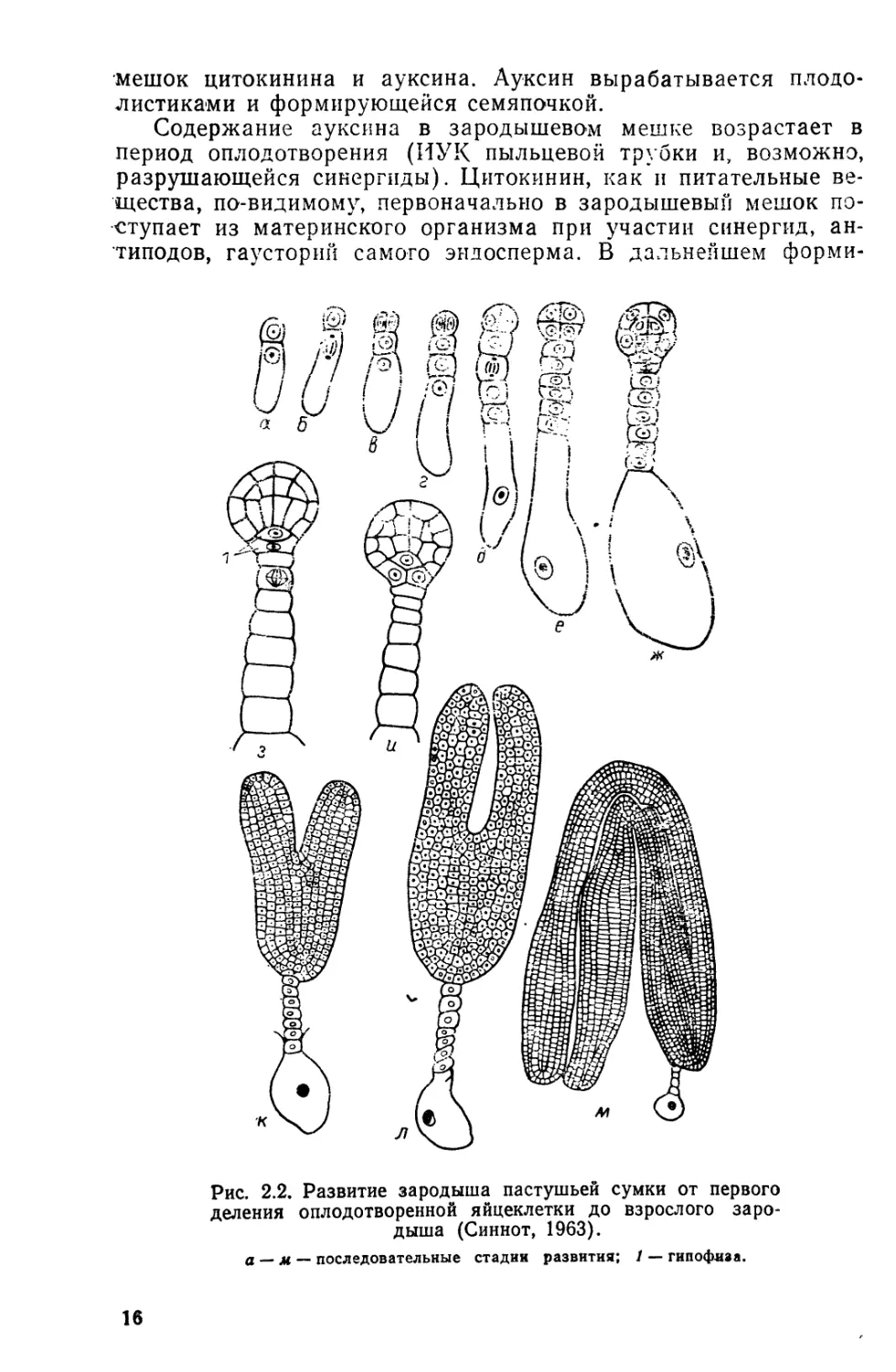
Рис. 2.2. Развитие зародыша пастушьей сумки от первого
деления оплодотворенной яйцеклетки до взрослого заро-
дыша (Синнот, 1963).
а — м, — последовательные стадии развития; 1 — гипофиза.
16
рующийся эндосперм, развиваясь за счет нуцеллуса и интегу-
ментов, сам становится местом интенсивного синтеза ИУК и
цитокининов (зеатина).
Ядро центральной клетки делится, причем ряд последова-
тельных делений дочерних ядер происходит без образования
клеточных стенок (нуклеарная фаза эндосперма). Затем инду-
цируется деление зиготы, а в цитоплазме эндосперма равноуда-
ленно от ядер центростремительно начинают формироваться
клеточные стенки (целлюлярная фаза). Клетки заполняют всю
полость эндосперма, продолжая делиться. Таким образом идет
рост эндосперма.
2.1.3. ПРОЭМБРИО
Проэмбрио — это начальная фаза развития многоклеточного
зародыша вплоть до обособления протодермы. Плоскость пер-
вого деления зиготы проходит поперек ее длинной оси. Это
обычное правило деления и для многих других клеток. Возмож-
Рис. 2.3. Развитие зародыша ^мятлика
(Эзау, 1980)
а — м — последовательность формирования зародыша. 1—4 —
ярусы клеток, 5 — протодерма, 6 — апекс, 7 — колеоптиль, 8 —
примордий первого листа, 9 - щиток, 10 — эпибласт, 11 —
колеориза, /2 — суспензор, 13 — инициали корневого чехлика,
14 — инициали периблемы, 15 — инициали плеромы.
2 Заказ № 399
17
но, на локализации центров-организаторов митотического вере-
тена, формирующихся из элементов эндоплазматического рети-
кулума, сказывается более напряженное (выгнутое) состояние
мембран на концах вытянутых клеток.
Разные семейства цветковых значительно различаются осо-
бенностями развития зародышей (рис. 2.2; 2.3). Рассмотрим в
качестве классического примера развитие зародыша пастушьей
сумки. У двухклеточного зародыша клетка, обращенная к эндо-
сперму (апикальная клетка), дает начало всем частям побега
и у многих видов — основанию корня. Клетка, обращенная в
сторону микропиле, формирует при дальнейшем развитии сус-
пензор (подвесок) (см. рис. 2.2). «Микропилярная» клетка
2-клеточного зародыша у большинства видов крупнее апикаль-
ной, т. е. две дочерние клетки зиготы неравнозначны уже по*
внешнему виду (неравное деление).
Дочерние клетки делятся в свою очередь, но в разных пло-
скостях: «микропилярная» клетка — в поперечном направлении
относительно оси зародыша, а апикальная — в продольном..
Образовавшиеся две апикальные клетки делятся тоже в про-
дольном направлении, но плоскость их деления повернута на
90° по отношению к плоскости предыдущего деления. Клетки
4-клеточного зародыша (квадранта) в результате двух пред-
шествующих продольных делений оказываются вытянутыми, и.
Рис. 2.4. Зародыш в семяпочке покры-
тосеменного растения.
1 — интегументы, 2 — нуцеллус, 3 — эндо-
сперм, 4 — зародыш, 5—плазмодесмы, 6
суспензор.
поэтому следующее деле-
ние проходит поперек их
длинной оси. Образуется
октант. Четыре апикаль-
ные клетки октанта да-
дут начало семядолям и
апексу стебля, а четыре
базальные — гипокотилю
и базальной части корня..
Клетки суспензора де-
лятся с той же скоро-
стью или несколько ре-
же, однако только в по-
перечном направлении.
В результате образуется
нить, состоящая из ряда
клеток, причем дисталь-
ная клетка (пузыревид-
ная) значительно увели-
чивается в размере (см.
рис. 2.2.). Клетки сус-
пензора метаболически
очень активны, в них об-
наружены политенные
хромосомы, идет интен-
18
сивный синтез РНК и белков, возрастающий в направлении
пузыревидной клетки. Между клетками суспензора видны хо-
рошо развитые плазмодесмы (рис. 2.4).
При формировании эмбриона суспензор выполняет по край-
ней мере три функции: 1) действует как мощная гаустория, вса-
сывающая питательные вещества из нуцеллуса, эндосперма и
интегументов; 2) по мере своего удлинения вдвигает зародыш
в питательную ткань эндосперма (см. рис. 2.4); 3) служит
местом выработки фитогормонов (цитокининов и гибберел-
линов).
Проксимальная клетка суспензора, примыкающая к октанту,
округляется и вдается в зародыш. Эта клетка получила назва-
ние «гипофизы» (см. рис. 2.2). Она дает начало кончику корня
(у зародышей, развивающихся по типу пастушьей сумки).
В клетках суспензора, особенно в дистальной гаусториаль-
ной клетке, накапливается ауксин, что, по-видимому, необхо-
димо для возрастания аттрагирующей (притягивающей пита-
тельные вещества) функции суспензора. Известно, что ИУК ак-
тивирует Н+-помпу в клеточных мембранах, что лежит в осно-
ве механизма аттрагирования. Клетки суспензора реагируют
на обработку ауксином появлением «ламповых щеток» на по-
литенных хромосомах. Это указывает на зависимость физиоло-
гической активности суспензора от притока ИУК. Известно, что
у черенков растений и в каллусной ткани повышение концентра-
ции ИУК относительно цитокинина включает в клетках генети-
ческую программу корнеобразования (см. 5.2.1). Поэтому мож-
но думать, что ИУК и здесь индуцирует закладку апекса заро-
дышевого корня в виде гипофизы.
Существенную роль в развитии зародыша играет формирую-
щийся эндооперм. Из него в зародыш поступает специфический
набор питательных веществ: определенные аминокислоты и дру-
гие азотистые вещества, углеводы, инозит, витамины и др. Эндо-
сперм образует гаустории, направленные в сторону нуцеллуса и
интегументов, способствующие его питанию.
2.1.4. ГЛОБУЛЯРНЫЙ ЗАРОДЫШ
На этой фазе развития зародыша возникает радиальная
симметрия, поверхностные клетки делятся антиклинально и диф-
ференцируется протодерма, которая в последующем превра-
тится в эпидермис. Возможно, на дифференцировку протодер-
Мы оказывает влияние механическое давление, возникающее
вследствие увеличения количества клеток во внутренних участ-
Ках глобулы. Гипофиза делится поперечно *на две клетки. При
Дальнейшем делении проксимальная клетка дает начало апек-
СУ корня, а дистальная — корневому чехлику (см. рис. 2.2).
Содержание цитокинина в семяпочке достигает в этот период
19
высокого уровня (см. рис. 9.28). Цитокинин в семяпочку и за-
родыш поступает из перикарпа и материнского растения.
Выращивание изолированных зародышей, находящихся в со-
стоянии проэмбрио или в глобулярной фазе, как правило, не
удается. Зародыши на этих ранних фазах могут успешно разви-
ваться при культивировании в составе изолированной завязи.
В этом случае можно применять сравнительно простые сахароз-
но-минеральные среды, например среду Нича (в мг/л):
KNO3......................125
КН2РО4....................125
MgSO4-7H2O................125
Ca(NO3)2-4H2O.............500
Н3ВО3.....................0,5
MnSO4-4H2O................3,0
Ре-цитрат-5Н2О............10,0
CuSO4-5H2O................0,025
ZnS04-7H2O................0,5
Na2Mo04-2H20..............0,025
2,4-Д.....................0,1
Сахароза.................. 50000
Но иногда требуется добавка кокосового молока, гидролизата
казеина или других сложных сред.
Экзогенные фитогормоны оказывают неоднозначное влияние
на раннее развитие зародыша. Например, при выращивании
семяпочки мака введение в инкубационную среду цитокинина
способствует росту зародыша, а внесение ИУК и гиббереллина
_ тормозит его развитие
(в ранней фазе). Одна-
JL ко оптимальный состав
среды для разных ви-
/х" дов растений и фаз раз-
" вития зародышей очень
\ ?;; •:; : • • различен;
Важную роль в про-
......цессах эмбриогенеза
/.....\ j играют электрические
{ ' у поля и токи. У глобу-
/ * [ лярного зародыша с по-
। 2 ( / мощью платиновых ви-
' брирующих электродов
обнаружены входящий
Рис. 2.5. Эндогенные электрические токи во- ток (вход положитель-
круг глобулярного (/) и торпедовидного (2) чяпяжеиных ипмпв)
зародыша моркови (Brawley е. а., 1984). но заРяженнЫХ ИОНОВ)
г в участках, где будут
Стрелки указывают направление токов. J J
» закладываться семядо-
ли, и выход тока в ба-
зипетальной части зародыша (рис. 2.5). Измерения проводили!
па соматических эмбрионах, полученных в суспензионной куль-
туре клеток корнеплода моркови (см. рис. 5.4). На последую-
щих фазах развития зародыша (сердцевидной, торпедо) распре-?
деление токов остается тем же: ток входит в развивающиеся се-
мядоли и выходит в.районе зародышевых корня и гипокотиля.
Прохождение тока через зародыш, находящийся в глобуляр**
ной фазе, совпадает по времени с детерминацией клеток в зоне
20
будущего прокамбия. Начальные этапы дифференцировки про-
камбия в это время выявляются только гистохимически по по-
явлению реакции на фермент карбоксилэстеразу. Экзогенная
ИУК (3 мкМ) обратимо ингибировала эти токи. Можно пред-
положить, что эндогенные токи, наблюдаемые у развивающе-
гося зародыша, определяются полярным базипетальным тран-
спортом эндогенной ИУК от дистального конца зародыша
к корневому полюсу. Активные Н+-насосы характерны для
клеток корневого полюса растений, развитие которого инду-
цируется ауксином. Выход ионов Н+ может лежать в основе
выходящих токов зародыша. Входящие токи, возможно, свя-
заны с котранспортом ионов Н+ с сахарами, аминокислота-
ми и другими субстратами, которые необходимы для питания
зародыша. Другие катионы также могут участвовать в созда-
нии входящего тока.
2.1.5. СЕРДЦЕВИДНЫЙ ЗАРОДЫШ
Переход зародышей двудольных в сердцевидную фазу свя-
зан с появлением у них билатеральной симметрии, обусловлен-
ной образованием примордиев двух семядолей. Анализ вклю-
чения [3Н]тимидина в клетки зародыша с помощью циторадио-
автографии и подсчет количества митозов свидетельствуют
о том, что в зонах будущих семядолей возрастает митотическая
активность клеток с одновременным ее снижением в зоне между
ними (домен будущего апекса побега). В районах формирую-
щихся примордиев возрастает синтез ДНК и РНК, клетки де-
лятся преимущественно периклиналыю. У зародышей злаков
формируется щиток (видоизмененная семядоля) и развивается
дэрсовентральность (см. рис. 2.3). Клетки корневого полюса
продолжают делиться. Между примордиями семядолей (или
щитка) и корневым полюсом начинает формироваться прокам-
бий. Это свидетельствует о том, что клетки развивающихся
примордиев семядолей способны самостоятельно синтезировать
ИУК, которая, перемещаясь полярно, индуцирует закладку про-
водящих пучков (см. 4.1.4).
Таким образом, при переходе к фазе сердцевидного заро-
дыша в нем формируются элементы побега (примордии семя-
долей, гипокотиль) и зародышевого корня. Для развития за-
родышей в этой фазе in vitro необходима добавка ИУК
(1 мкг/л) и жидкого эндосперма. Содержание эндогенного ци-
токинина в семенах пшеницы в этот период быстро снижается
(см. рис. 9.28). Более того, добавка экзогенного цитокинина в
инкубационную среду подавляет развитие корня. В этот же пе-
риод в формирующихся семенах начинает повышаться концен-
трация гиббереллина (см. рис. 9.28). У фасоли огненной в серд-
цевидной фазе в суспензоре обнаруживается большое количе-
ство гиббереллинов (главным образом ГА1), которые, по-види-
21
мому, в нем и синтезируются. Содержание гиббереллина в сус-
пензоре в это время в 30 раз выше, чем в собственно зародыше.
В суспензоре показана также высокая активность цитокининов
(зеатина, зеатинрибозида и 2-изопентениладенозина). В самом
зародыше присутствует неактивный зеатингликозид, а также
зеатинрибозид с низкой физиологической активностью. У на-
стурции в гаустории суспензора найдено большое количество
ауксина. Активность всех этих фитогормонов в зародыше зна-
чительно ниже, чем в суспензоре. Часть фитогормонов суспен-
зора (гиббереллинов и цитокининов), по-видимому, предназна-
чена для развития собственно зародыша, но все эти фитогор-
моны выполняют определенные функции и в суспензоре. Одна
из этих функций — активация поглотительной активности. Дей-
ствительно, с использованием [14С] сахарозы показано, что имен-
но суспензор — основной орган поглощения у зародыша, особен-
но в сердцевидной фазе.
2.1.6. ТОРПЕДОВИДНЫЙ ЗАРОДЫШ
Рост семядолей и гипокотиля — характерная черта развития
зародыша в фазе Торпедо у двудольных. Семядольные следы
формируются в гипокотиле в направлении к кончику корня.
Суспензор в этот период обычно подвергается автолизу. В за-
родышах фасоли огненной в фазе Торпедо резко возрастает со-
держание гиббереллинов и повышается активность цитокини-
нов (зеатина и 2-изопентениладенозина). Поглотительная ак-
тивность растущих семядолей, погруженных в эндосперм, уве-
личивается, т. е. они функционируют как гаустории.
В фазе раннего Торпедо.зародыш может развиваться in vitro
на сахарозо-минеральной питательной среде с добавкой вита-
минов и аденина. Экзогенная ГА3 в сравнительно высокой кон-
центрации (1 мг/л) усиливает рост семядолей и гипокотиля.
Введение ИУК (0,1 мкг/л) способствует росту зародышевых
побега и корня. Добавление жидкого эндосперма может усили-
вать рост семядолей, но подавлять развитие зародышевого кор-
ня. У злаков период роста щитка соответствует фаз^ Торпедо
двудольных. В этот период содержание гиббереллинов в зер-
новках пшеницы достигает максимума (см. рис..9.28). По-види-
мому, повышение концентрации гиббереллина является решаю-
щим фактором для развития зародыша на этом этапе. В фазе
позднего Торпедо продолжаются удлинение семядолей и гипоко-
тиля и формирование корня. Для развития зародышей ряда ви-
дов in vitro на этой фазе оптимальна концентрация ГА3 10 мг/л.
Таким образом, в формирующихся зародышах в фазе Тор-
педо начинает функционировать собственная гормональная си-
стема. Зародыш позднего торпедо способен нормально раз-
виваться в условиях in vitro на простой минеральной среде
22
с добавкой сахарозы. Семядоли становятся продуцентами ИУК,
а апекс корня — цитокинина и гиббереллинов.
2.1.7. ЗАВЕРШАЮЩИЕ ФАЗЫ ФОРМИРОВАНИЯ СЕМЕНИ
У пастушьей сумки завершение роста семядолей и зароды-
шевой оси в длину за счет деления клеток сопровождается из-
гибом (складыванием) зародыша. Эндосперм полностью ис-
пользуется на процессы роста и развития зародыша. В апикаль-
ной части зародыша между семядолями активируется деление
клеток и формируется апекс побега (см. рис. 2.2). На корневом
полюсе сформированы апекс корня и корневой чехлик. В семя-
долях накапливаются и откладываются запасные питательные
вещества.
В этот же период в зародышах злаков (фаза молочной спе-
лости) развиваются примордии колеоптилей и первичного
листа, образуются апексы побега и корня (см. рис. 2.3). На
этой фазе в эндосперме накапливается максимальное количе-
ство свободной ИУК (см. рис. 9.28). Во второй половине фазы
молочной спелости содержание ауксина начинает снижаться, но
резко возрастает концентрация АБК. Абсцизовая кислота тор-
мозит рост зародыша, заканчивающего свое развитие, и способ-
ствует отложению запасных веществ в эндосперме. Высокий
уровень ауксина в зерновках молочной спелости обусловливает
значительную аттрагирующую силу семян. Окончательное со-
зревание зерновок злаков связано с прекращением увеличения
их сухой массы и потерей воды. В фазе восковой спелости в
зерновках пшеницы остается 20—30% воды, при полной техни-
ческой спелости—12—15%. Этот процесс сопровождается сни-
жением уровня свободной АБК. Свободные ИУК, зеатин, гиб-
береллины и АБК переходят в семенах в связанное состояние.
2.2. ОТЛОЖЕНИЕ ЗАПАСНЫХ ВЕЩЕСТВ В СЕМЕНАХ
Накопление питательных веществ в семенах—большое пре-
имущество высших растений, так как прорастающий зародыш
и проросток на начальных этапах своего развития надежно
обеспечены пластическими веществами и энергией. Запасные
вещества могут откладываться в семядолях. В этом случае эн-
досперм в зрелых семенах отсутствует. Примером растений с та-
кими семенами являются пастушья сумка, бобовые и многие
другие. У других растений (например, у злаков) запасание пи-
тательных веществ происходит в эндосперме. Наконец, у неко-
торых видов (перец, свекла и др.) запасающая ткань форми-
руется из нуцеллуса и в этом случае называется периспермом.
В качестве запасных веществ в семенах накапливаются
белки — до 55% сухой массы (бобовые), углеводы — до 80%
23
(злаки, бобовые и др.), жиры —до 60% (семена масличных
культур); фосфорные соединения откладываются главным обра-
зом в виде фитина (инозингексафосфат, калий-магний-кальцие-
вая соль). ।
Высокополимерные запасные вещества более компактны и
инертны, чем мономеры, и не создают значительного осмоти-
ческого эффекта, что способствует уменьшению содержания
воды в семенах.
2.2.1. ЗАПАСНЫЕ БЕЛКИ
Основные запасные белки семян бобовых — глобулины (со-
лерастворимые белки). Они накапливаются в большем или
меньшем количестве в запасных тканях семян всех высших
растений. У злаков в периферическом слое эндосперма форми-
руется алейроновый слой клеток, богатых запасными белками.
В этих клетках находятся алейроновые зерна, которые пред-
ставляют собой округлые тела размером 0,2—20 мкм, ограни-
ченные одинарной мембраной. В алейроновом зерне различают
белковый кристаллоид, занимающий основную часть его объ-
ема, периферийный аморфный белок и глобулу фитина. Более
просто построенные белковые тела имеются и в остальных
клетках эндосперма. Алейроновые зерна с кристаллическим
белком и глобулами фитина содержатся в семядолях растений
многих видов. В эндосперме злаков главными запасными бел-
ками являются спирторастворимые проламины и глютелины,
растворимые в щелочах.
Алейроновые зерна образуются из специализированных ва-
куолей, производных шероховатого эндоплазматического рети-
кулума (рис. 2.6,/). Синтез запасных белков осуществляется
рибосомами, находящимися на поверхности мембран ЭР. Эти
белки поступают в полость ЭР и накапливаются в расширениях
цистерн, свободных от рибосом. Затем происходит отшнуровы-
Рис. 2.6. Схема формирования алейроновых зерен (/)
в семенах, запасающих белки, и сферосом (2) в семе-
нах с отложением жиров.
ГЭР — гранулярный ЭР, АЭР — агранулярный ЭР.
24
вание вакуолек, превращающихся в алейроновые зерна, в ко-
торых формируется кристаллоид по мере потери воды.
2.2.2. ОТЛОЖЕНИЕ КРАХМАЛА
Крахмал накапливается в запасных тканях семян с низким
содержанием жиров (в эндосперме, в семядолях). Синтез крах-
мала осуществляется в пластидах: в лейкопластах или хлоро-
пластах (зеленые семядоли). Лейкопласты, содержащие боль-
шое количество запасного крахмала, называют амилопластами.
Крахмальные зерна обладают слоистостью. Она возникает
вследствие чередования отложения двух углеводов — амилозы
п амилопектина. Слоистость отражает суточную ритмику син-
теза крахмала.
2.2.3. ЗАПАСНЫЕ ЖИРЫ
Нейтральные жиры (триглицериды) обладают в два раза
большей свободной энергией, чем углеводы и белки. Они не
содержат воды, но при их окислительном распаде при прора-
стании семян образуется значительное количество воды, необ-
ходимой для прорастания в сухой почве.
Синтез жиров осуществляется в гладком ЭР. Образующие-
ся триглицериды поступают в ретикулярные окончания, кото-
рые затем отшнуровываются (см. рис. 2.6,2). Синтез жиров
продолжается в отделенных везикулах, в результате чего тол-
щина их мембран возрастает, а внутренняя полость уменьша-
ется. В конце концов липиды заполняют весь объем везикулы.
Такие образования в клетках называют жировыми каплями,
или сферосомами. В состав сферосом входят также гидролазы,
необходимые для расщепления жиров.
2,3. ПОКОЙ СЕМЯН
Процесс обезвоживания приводит семена в состояние покоя,
который представляет собой пример анабиоза, когда жизнен-
ные процессы настолько замедлены, что отсутствуют видимые
проявления жизни. Состояние покоя семян возникло как спо-
соб переживания таких неблагоприятных условий среды (сезо-
нов), как слишком низкая или высокая температура, дефицит
воды. Семена растений, находящиеся в состоянии покоя, могут
выдерживать длительное охлаждение до очень низких темпе-
ратур порядка —230 °C.
Продолжительность периода покоя у семян разных видов
различна: от нескольких недель до нескольких лет. Семена
многих растений при благоприятных условиях способны про-
растать сразу после созревания. По физиологическим механиз-
25
мам различают два типа покоя: вынужденный и физиологи-
ческий.
2.3.1. ВЫНУЖДЕННЫЙ ПОКОЙ СЕМЯН
Этот тип покоя характерен для семян, прорастание которых
задерживается низкой температурой, недостатком воды или кис-
лорода. Например, у некоторых бобовых семенная кожура не-
проницаема для воды, и поэтому они длительное время не на-
бухают при наличии воды (твердосемянность). У других рас-
тений (например, у тыквы) семенная кожура непроницаема
для О2. Нанесение царапин на семенную кожуру таких семян1
путем перетирания с песком или толченым стеклом способст-
вует проникновению в них воды и О2, последующему набуха-
нию и прорастанию. Этот прием называется скарификацией.
В почве под действием микроорганизмов и физических факто-
ров происходит медленное разрушение семенных покровов, что
ш приводит к прорастанию семян. Вынужденный покой является
неглубоким, при устранении физических причин, мешающих про-
растанию, семена трогаются в рост.
2.3.2. ФИЗИОЛОГИЧЕСКИЙ ПОКОЙ СЕМЯН
В отличие от вынужденного физиологический покой опреде-
ляется внутренними факторами, как правило, балансом фито-
гормонов, хотя к этому типу можно отнести и покой, связанный
с недоразвитием зародыша. Так как при всех благоприятных
факторах внешней среды семена, находящиеся в состоянии фи-
зиологического покоя, не прорастают, то используют термин
глубокий физиологический покой.
Один из примеров такого состояния семян — послеуборочное
дозревание ячменя, пшеницы и других злаков. Дозревание се-
мян происходит при их хранении. Этот вид покоя обусловлен
высоким содержанием фенольных ингибиторов роста в семен-
ных покровах и повышенным уровнем АБК в зародышах. В ус-
ловиях затяжных дождей в конце вегетационного периода ин-
гибиторы роста вымываются из семенных покровов, и зерновки
могут прорастать в колосе.
Семена некоторых растений, например табака, способны
прорастать лишь на свету или после кратковременного (1—
‘2 мин) освещения красным светом. Такие семена называют све-
точувствительными. Во время воздействия светом семена дол-
жны находиться в набухшем состоянии и при температуре, бла-
гоприятной для прорастания. Красный свет воспринимается в
клетках зародыша фитохромом (см. 8.1.1), который переходит
в активное состояние. В результате в тканях зародыша возра-
стает содержание фитогормона, индуцирующего прорастание.
Например, прорастание семян салата можно вызвать облуче-
:26
гнием красным светом или обработкой цитокинином. Действи-
тельно, при действии красного света в семенах повышается уро-
вень эндогенного зеатина.
Для выхода из состояния физиологического покоя семенам
многих растений умеренных и северных широт, в том числе дре-
весных, необходим длительный период воздействия низкими
температурами. Прием выведения таких семян из состояния по-
коя называется стратификацией. Он заключается в том, что се-
мена в набухшем состоянии несколько месяцев выдерживают
при температуре 0—5 °C. Без проведения стратификации на-
чальные этапы прорастания таких семян осуществляются, но
рост их резко замедлен (карликовость) или ростовые процессы
протекают с большими нарушениями: например, у дуба и ка-
лины не формируется эпикотиль. В процессе стратификации
у зародышей некоторых видов возрастает содержание гиббе-
реллинов (ГА4, ГА7). В этих случаях стратификация может
быть заменена обработкой семян гиббереллином.
Таким образом, выведение семян из состояния глубокого фи-
зиологического покоя при действии специфических факторов
среды (свет, температура) связано со сдвигами в соотношении
фитогормонов: ингибиторов роста, цитокининов, гиббереллинов,
ауксина, причем для выхода из состояния покоя необходимы
снижение содержания ингибиторов роста и (или) повышение
концентрации стимулирующих рост фитогормонов. Для разных
видов эти сдвиги в балансе фитогормонов не однозначны
(табл. 2.1).
Таблица 2.1. Схема возможных причин покоя и
прорастания семян с участием ингибиторов (И) и
фитогормонов (Khan, 1975).
биторов.
Между продолжительностью периода физиологического по-
коя и долговечностью семян в ряде случаев наблюдается поло-
жительная корреляция. Долговечность семян у разных видов
очень различна: у ивы — всего несколько дней, у некоторых сор-
няков— до 50 лет; семена лотоса пролежали в маньчжурских
озерах около 200 лет, не потеряв всхожести.
27
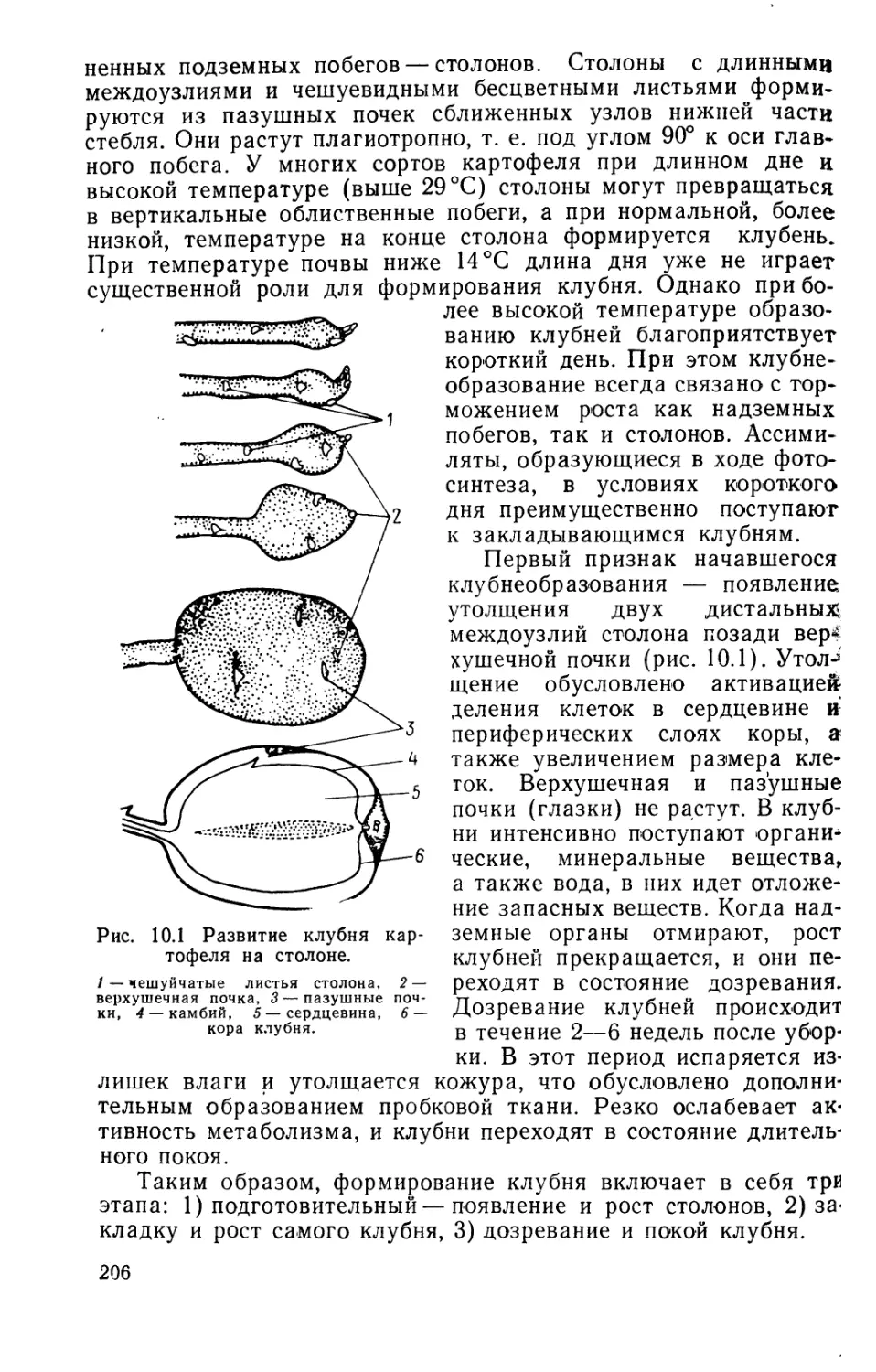
3. ЮВЕНИЛЬНЫЙ ЭТАП
Ювенильный этап онтогенеза, или этап молодости, включает
в себя прорастание семян или вегетативных зачатков (клубней,
луковиц и др.) и формирование и рост вегетативных органов
(листьев, стеблей, корней). Растение в этот период не способ-
но к половому размножению или эта способность слабо выра-
жена. Из этого определения следует, что ювенильный этап мож-
но разделить на две фазы: 1) развитие проростка и 2) накоп-
ление вегетативной массы. В течение первой фазы прорастаю-
щее растение закрепляется в определенном экологическом
участке среды обитания и, достигая света, переходит к авто-
трофному питанию. Во второй фазе создается вегетативная мас-
са, достаточная на следующем этапе развития для обеспечения
трофическими факторами органов размножения и формирую-
щихся семян и плодов, которые питаются гетеротрофно. Для
ювенильных растений характерны интенсивный метаболизм,
быстрый рост и развитие вегетативных органов. Ткани и орга-
ны ювенильных растений имеют относительно высокое содер-
жание фитогормонов. Продолжительность ювенильного периода
у разных растений неодинакова: от нескольких недель (одно-
летние травы) до десятков лет (у древесных).
3.1. ПРОРАСТАНИЕ СЕМЯН
Прорастание семян, в свою очередь, также состоит из ряда
фаз: 1) набухание, 2) проклевывание, 3) гетеротрофный рост
в темноте (в почве), 4) переход к автотрофному способу пи-
тания (всходы).
3.1.1. НАБУХАНИЕ
Поступление воды в семя — пусковой фактор прорастания.
Поглощение воды при набухании семян происходит прежде
всего за счет гидратации биоколлоидов, в результате чего раз-
28
вивается онкотическое давление и разрываются семенные обо-
лочки. Такой способ поглощения воды не зависит от темпера-
туры, кислорода и света. Давление набухания настолько ве-
лико, что семена (например, гороха) при набухании разрывают
стеклянную бутылку. Однако явление набухания обратимо. Се-
мена можно снова высушить без значительной потери всхо-
жести.
При набухании активируются гидролитические процессы, на-
чинается синтез белков и возрастает интенсивность дыхания
(рис. 3.1). Поглощение О2 воздушно-сухими семенами (10—
Рис. 3.1. Последовательность физиологических процессов в семенах кор-
мовых бобов после начала набухания (по: Обручева, 1990).
По оси абсцисс — время (ч), по оси ординат — влажность (%).
11% Н2О) очень мало. При повышении влажности семян до
14—15% дыхание возрастает в 4—5 раз, а при повышении
оводненности семян до 40—45%—увеличивается в тысячи раз.
При этом важную роль играет температура: при 0— 10 °C влия-
ние влажности на интенсивность дыхания значительно меньше,
чем при 18—25 °C.
3.1.2. ПРОКЛЕВЫВАНИЕ
Когда оводнеиность семян достигает уровня критической
влажности (40—60% сырой массы), через разорванные семен-
ные покровы появляется кончик зародышевого корня (прокле-
29
вывание). Появление корня на этой фазе не связано с актива-
цией деления клеток. Дистальная часть корня выталкивается в>
результате растяжения клеток зародышевой оси (гипокотиля
и корня). По-видимому, это растяжение обеспечивается под-
кислением клеточных стенок за счет дыхательного СО2 (эффект
«кислого роста», см. 4.1.5) и, возможно, благодаря активации.
Н+-помпы в результате освобождения ауксина из связанной,
формы. Одновременное накопление осмотически активных ве-
ществ в клетках, обусловленное гидролитическими процессами,,
поддерживает этот рост растяжением (рис. 3.1).
3.1.3. ГЕТЕРОТРОФНЫЙ РОСТ ПРОРОСТКА В ТЕМНОТЕ
Предыдущие этапы прорастания протекали с использованием
РНК, в том числе и мРНК, запасенных при формировании и
созревании зародыша/Дальнейший рост как побега, так и кор-
ня обусловлен синтезом ДНК и делением клеток, которые на-
чинаются через 1,0—1,5 сут после начала набухания. Одновре-
менно происходит массовая моби-
Рис. 3.2. Рост колеоптилей куку-
рузы во времени (Майданова,
Хавкин, 1967).
По оси абсцисс — время (ч), по оси
ординат: 1 — длина колеоптиля (мм),
2 — число клеток (-104) на 1 колеоп-
лизация запасных веществ в за-
пасающих органах и приток их к
растущим органам проростка (см.
рис. 3.1). В последующие 1,0—1,5
суток начинается растяжение кле-
ток (рис. 3.2), в корне и побеге
появляются зоны растяжения (см.
рис. 4.20). У корня выше зоны
растяжения в ризодерме образу-
ются корневые волоски, выпол-
няющие поглотительные функции.
Удлинение корневых волосков
осуществляется за счет верхушеч-
ного роста (см. 4.2.4). Длина
сформировавшегося апекса корня
(апикальная меристема) с корне-
вым чехликом не превышает 1—*
2 мм. Длина зоны растяжения
обычно 5—7 мм, что значительно
меньше величины зоны растяже-
ния у междоузлий побега. Это
объясняется необходимостью для
корня прокладывать путь в плот-
ной почве. Корневые волоски слу-
жат как бы опорой для кончика корня, который продвига-
ется вперед благодаря росту клеток в зоне растяжения. Дина-
мическая картина этого роста похожа на бегущую волну: зона
корневых волосков продвигается все дальше, причем расстоя-
ние от нее до растущего кончика корня не меняется.
30
б
Рис. 3.3. Влияние света (а)
или темноты (б) на рост
и морфогенез проростков
горчицы.
1 — семядоли.
Продвижение побега в почве также осуществляется за счег
растяжения клеток. Процесс пролиферации в дистальной части*
первого междоузлия поставляет клетки для этого растяжения.
В условиях длительной темноты
происходит значительное удлинение
первого междоузлия. Формирование
второго междоузлия и рост зароды-
шевых листьев резко тормозятся.
Вытягивающийся побег не содержит
хлорофилла (у покрытосеменных).
Такое состояние проростка получи-
ло название этиоляции (рис. 3.3).
Для защиты зародышевых листьев
при продвижении побега в плотной
почве у злаков служит колеоптиль—
первый видоизмененный лист (рис.
3.4). У двудольных дистальная часть
первого растущего междоузлия заг-
нута крючком, почкой вниз, и этим
«коленом» проросток раздвигает
почвенные частицы. У одних дву-
дольных первым растущим междо-
узлием является гипокотиль (фа-
соль, подсолнечник), у других—эпи-
котиль (горох, бобы). Изгиб вер-
хушки («крючок») вызывается высо-
кой концентрацией этилена.
Ростовые движения корня и
побега. В почве в условиях темно-
ты ориентация роста осевых органов
осуществляется по гравитационному
полю, корень растет центростреми-
тельно, а побег — центробежно. Еще
Ч. Дарвином было установлено, что
чувствительность корня к гравита-
ционному полю сосредоточена в его
кончике. Действительно, в центральной части корневого
чехлика имеются клетки — статоциты, в которых органоиды
типа лейкопластов выполняют функции статолитов (рис. 3.5).
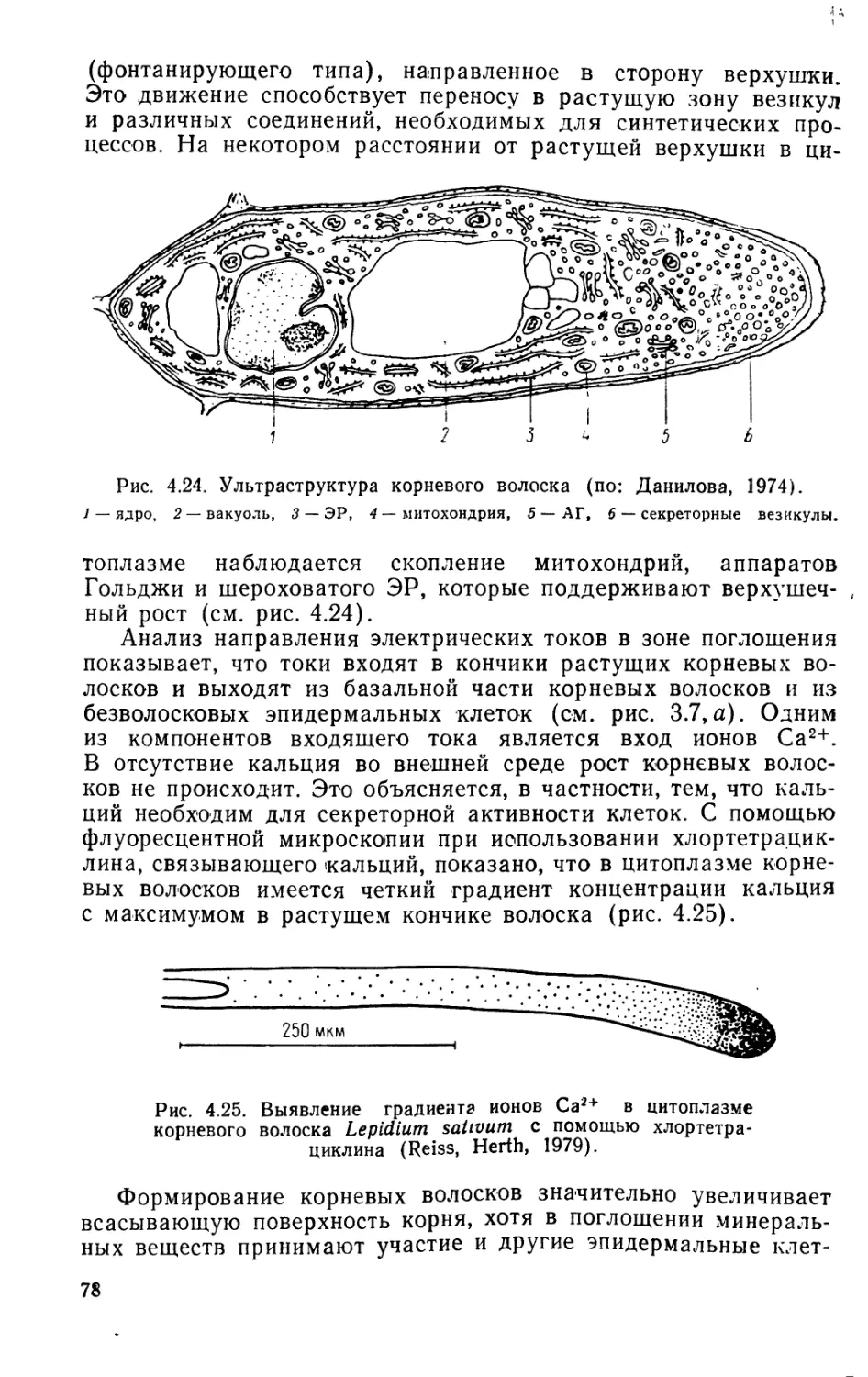
При отклонении корня от вертикального положения статолиты,
перемещаясь под действием тяжести в латеральные участки
статоцитов, оказывают давление на плазмалемму и эндоплазма-
тический ретикулум, из которого в цитоплазму поступает каль-
ций. При этом транспорт ИУК из кончика корня в зону растя-
жения по клеткам коры смещается к нижней латеральной по-
верхности (рис. 3.6) и появляется выходящий электрический
ток вместо входящего на верхней стороне апикальной части
Корня (рис. 3.7). Причинная связь между этими явлениями ин-
31
Рис. 3.4. Особенности прорастания семян кукурузы (а), гороха (б) и
фасоли (в).
колеоптиль, 2 — мезокотиль, 3 — крючок,
4 — эпикотиль, 5 — гипокотиль.
Рис. 3.5. Гравитропическая реакция корня.
а — гравитропический изгиб корня во времени (цифры справа, ч); б — статоциты в
колумелле корневого чехлика; в — статоцит при вертикальном положении корня;
г, О — статоцит при горизонтальном положении корня (г—нулевое время, д — че-
рез 3 мин): / — ЭР, 2 — статолиты (амилопласты), 3 — ядро. Стрелки указывают
положение корня.
тенсивно изучается. Корни очень чувствительны к повышению
концентрации ИУК. Оптимальная концентрация ауксина для
растяжения клеток составляет 10-11—10-10М (см. рис. 7.2).
Повышение его концентрации тормозит рост клеток в зоне рас-
тяжения. Поэтому при отклонении корня от вертикали, когда
32
Рис. 3.6. Схема предполагаемого движения ауксина в
апикальном конце вертикально (а) и горизонтально
(б) ориентированного корня (Hasenstein, Evans, 1988).
/ — центральный цилиндр. 2 — апикальная меристема, 3 —
корневой чехлик. Толстые стрелки — акропетальный транспорт
ауксина, тонкие — латеральный и базипетальный транспорт
ауксина.
Рис. 3.7. Распределение электрических токов вокруг
корня Lepidium sativum в вертикальном (а) и гори-
зонтальном (б) положениях (по: Burgess, 1985).
1 — корневой волосок, 2 — корневой чехлик. Стрелками ука-
зано направление токов.
концентрация ауксина возрастает в нижней его половине, рост
с этой стороны тормозится и корень возвращается в вертикаль-
ное положение. Из-за инерционности процесса изгиб продолжа-
ется в противоположную сторону, что снова включает описан-
•3 Заказ У? 399
33
ный выше механизм корректировки роста. В результате кончик
корня постоянно отклоняется от вертикали, совершая круговые
нутационные движения, которые позволяют ему перемещаться
среди частиц почвы.
Когда кончик корня не в состоянии продвинуться в плотных
структурах почвы, то в результате образования этилена (стрес-
сового этилена) клетки в зоне растяжения растут не в длину,
а изодиаметрически, вследствие чего зона роста утолщается.
Утолщение ростовой зоны раздвигает частички почвы, что поз-
воляет кончику корня перемещаться дальше. Корневой чехлик
служит для защиты апекса корня от повреждений. Его поверх-
ностные клетки постоянно слущиваются и вместе с секретируе-
мой слизью создают «смазку», облегчающую движение кон-
чика корня в почве. В корневом чехлике синтезируются инги-
биторы роста (АБК и др.), которые, по-видимому, также участ-
вуют в механизме гравитропических движений корня.
Гравитационная чувствительность верхнего междоузлия
у двудольных и колеоптиля у злаков проявляется в клетках рас-
тущей зоны. Поток ИУК,
синтезируемой верхушкой
побега или апикальной ча-
стью колеоптиля, при откло-
нении побега или колеопти-
ля от вертикали также пе-
ремещается на их нижнюю
сторону. Это вызывает повы-
шение концентрации ауксина
в нижней части побега, и
рост здесь усиливается, так
как предшествующая кон-
центрация ауксина не была
оптимальной. Оптимальный
уровень ИУК для роста
клеток побега лежит в пре-
делах 10-6—10-5 М (см. рис.
7.2). В результате этого ме-
ханизма побег, как и корень,
совершает круговые нутаци-
онные движения, помогаю-
щие его перемещению в поч-
ве. Круговые нутации объяс-
няются также явлением ав-
тотропизма, суть которого
сторона побега или корня за-
тем распрямляется за счет роста противоположной стороны.
Механизм автотропизма не выяснен.
Мобилизация запасных веществ. Функцию переваривания
запасных веществ эндосперма у однодольных выполняют клетки
Рис. 3.8. Схема внеклеточного кислого
пищеварения в эндосперме зерновок
кукурузы.
1 — проросток, 2 — проводящий пучок, 3 — щи-
ток, 4 — алейроновый слой.
заключается в том, что выгнутая
34
эпителиального слоя щитка и алейронового слоя эндосперма
(рис. 3.8). Это происходит с помощью внеклеточного кислого
пищеварения. Сначала мобилизуются ближайшие к щитку за-
пасные вещества эндосперма. В щитке и эндосперме из связан-
ного состояния освобождаются фитогормоны: ИУК, зеатин, ГА.
Они усиливают деятельность Н+-насосов в плазмалемме эпи-
телиальных клеток щитка, что приводит к увеличению кислот-
ности эндосперма. Н+-насосы щитка функционируют на осно-
ве Н+-АТФазы и редокс-цепи, локализованных в плазмалемме
(рис. 3.9). Закисление эндосперма происходит также за счет
Рис. 3.9. Механизмы Н+-насоса: редокс-цепь и
Н+-АТФаза.
СО2, образующегося в процессе дыхания зародыша, и, возмож-
но, выделения летучих органических кислот, накапливающихся
в клетках щитка при мобилизации запасных жиров. Работе
Н—насосов способствует наличие катионов в эндосперме, осо-
бенно К+ и Са2+.
Закисление тканей эндосперма приводит к активации в нем
кислых гидролаз. Эпителиальные клетки щитка начинают ин-
тенсивно секретировать в эндосперм различные гидролазы: а- и
р-амилазы, целлюлазу, глюканазы, пектиназы, протеазы,.
РНКазу и т. д. Ферменты синтезируются в шероховатом ЭР и
через аппарат Гольджи выделяются с помощью везикул. Все
эти гидролазы имеют оптимум активности в кислой среде. Для
процесса секреции необходимо поступление кальция в эпите-
лиальные клетки. Цитокинины и гиббереллины активируют эту
секреторную активность. Сахара или аминокислоты, образовав-
шиеся в результате гидролиза запасных соединений, поступают
в эпителиальные клетки щитка в симпорте с ионами Н+ (см.
рис. 3.8). Затем эти вещества попадают в проводящий пучок и
по нему — в растущие части проростка.
Вслед за ближайшими к щитку начинают перевариваться
периферические участки эндосперма. Здесь основную роль
играет алейроновый слой, функциональная активность которого
индуцируется под действием гиббереллина, поступающего из
3*
35
щитка и из тканей зародышевой оси. Алейроновые клетки так-
же выделяют ионы Н+ (см. рис. 3.8). В алейроновых зернах
начинается распад запасных белков, из аминокислот которых в
алейроновых клетках синтезируются кислые гидролазы (а-ами-
лаза и др.). ГА индуцирует транскрипцию мРНК, необходимых
для синтеза этих гидролаз. Кислые гидролазы секретируются в
эндосперм, в результате чего в нем завершается процесс гидро-
лиза запасных веществ. Продукты гидролиза вместе с ионами
Н+ поступают в щиток и используются на рост проростка.
3.1.4. ПЕРЕХОД К АВТОТРОФНОМУ СПОСОБУ ПИТАНИЯ
Когда проростки достигают поверхности почвы и на их вер-
хушки падает свет, характер дальнейшего морфогенеза пророст-
ков (всходов) резко изменяется. Этот процесс начинается уже
на некотором расстоянии от поверхности почвы, так как в за-
висимости от ее состава и структуры свет проникает на ту или
иную глубину. У двудольных растений на свету происходит раз-
гибание «крючка» (см. рис. 3.4). Это связано с уменьшением
образования этилена в нем при действии света. На свету резко
тормозится рост первичного междоузлия в длину, начинаются
интенсивный рост листьев и образование новых междоузлий,
происходит усиление роста стебля в толщину. Листья злаков,
свернутые в трубку, разворачиваются под действием света. Эта
реакция регулируется фитохромом, при активации которого в
тканях листьев возрастает содержание гиббереллина, участвую-
щего в механизме разворачивания листьев. Все эти процессы
получили название фотоморфогенеза, под которым подразуме-
ваются ростовые и формативные изменения у растений, возни-
кающие в результате воздействия на них света. Фотоморфогене-
тически активными являются синяя и красная области спектра.
Красный и, возможно, синий свет действует через систему фито-
хрома. Синий свет может влиять на рост и морфогенез через
криптохром (см. 8). Воспринимая свет, эти фоторецепторы ока-
зывают влияние на гормональный баланс в растительных тка-
нях, что и приводит к изменению ростовых процессов. Свет
индуцирует синтез хлорофилла и других пигментов фотосинтеза,
а также ферментов, участвующих в этом процессе, происходит
превращение этиопластов в хлоропласты. Формирование аппа-
рата фотосинтеза, что внешне проявляется в зеленении листьев
и стеблей, позволяет всходам перейти к автотрофному способу
питания.
Гормональный статус различных органов проростков на раз-
ных фазах прорастания изучен недостаточно. Для роста 2—
3-суточных колеоптилей кукурузы решающим условием является
приток цитокинина из корней, затем ведущую роль в росте рас-
тяжением начинает играть ИУК, образующаяся в ^верхушке
колеоптиля. Растяжение мезокотилей в наибольшей степени
36
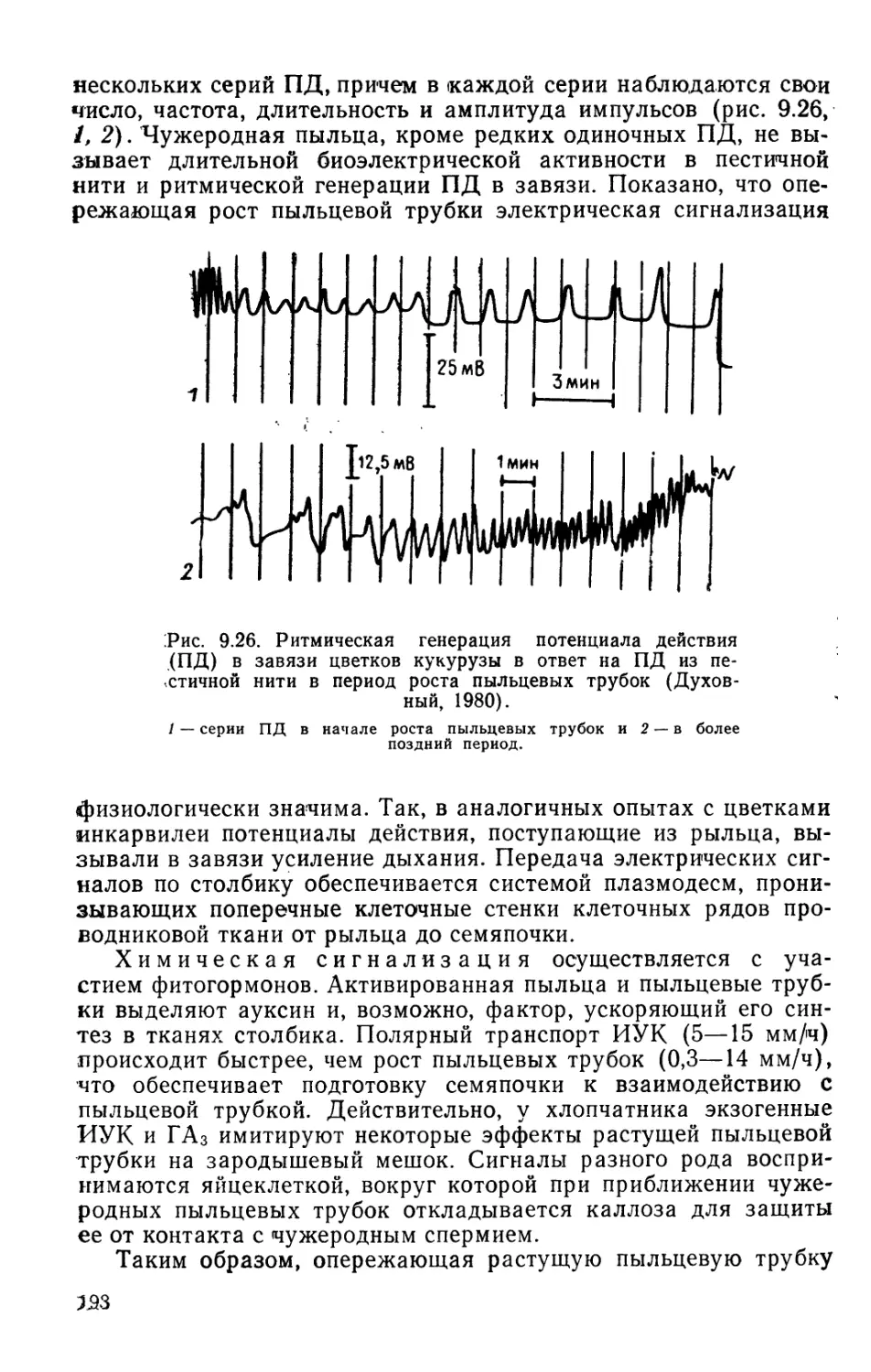
2 - суточные А 3- суточные 4 - суточные 5-суточные
,1 цк-иук-гк ЦК-ИУК-гк ИУК-ЦК - гк ИУК - цк - гк
И ИУК-ГК-ЦК гк- ЦК - ИУК ЦК - ИУК-ГК ЦК - ИУК-ГК 4- 4- +
J иук-цк-гк 4-4-4- ГК-ИУК-ЦК гк - ИУК-ЦК 0 иук-гк-цк 4-4-4-
Q иук-гк-цк ИУК-ГК - ЦК ++ 0 0 ИУК-ГК - ЦК ++ + 0 ИУК-ГК -цк 4-4- 0 0
Д ГК - ЦК-ИУК г. - Рис. 3.10. Эффективна гк - ЦК - ИУК ость действия э гк - ЦК-ИУК кзогенных фитог! гк - ЦК - ИУК ормонов на рост
изолированных частей проростков кукурузы разного возраста (Москале-
ва, Полевой, 1989).
Фитогормоны расположены в порядке уменьшения их активирующего действия (+),
включая отсутствие действия (0) и ингибирование роста (—).
поддерживается поступлением ауксина из колеоптилей в тече-
ние первых 5 сут от начала набухания зерновок. Для роста
листа в течение этого же периода необходим приток гибберел-
лина, который поступает из корней (рис. 3.10). Таким образом,
оптимальный гормональный баланс, поддерживающий рост
проростка,'различен у разных органов.
3.2. НАКОПЛЕНИЕ ВЕГЕТАТИВНОЙ МАССЫ
Увеличение вегетативной массы у молодых растений проис-
ходит в надземной части путем образования все новых и но-
вых метамеров (каждый из которых включает в себя листья,
пазушные почки, узел и междоузлия), а также роста корней в
длину, образования боковых и придаточных корней. Между ро-
стом побега и ростом корня существует сложное гормональное
взаимодействие. В верхушке побега (в почке и молодых листоч-
ках) синтезируется ИУК, которая по паренхимным клеткам
пучков полярно транспортируется в базипетальном направлении
вплоть до кончика корня со скоростью 0,7—1,5 см/ч. Поляр-
ность передвижения ауксина связана с тем, что каждая транс-
портирующая его клетка своим апикальным концом поглощает
ИУК в симпорте с ионами Н+, а на базальном конце клетки в
плазмалемме локализованы белки-переносчики, которые осуще-
37
ствляют секрецию фитогормона из клетки в апопласт, из кото-
рого ИУК поступает
ИУЮН*
ИУК
Н
ИУК
меха-
тран-
уров-
Рис. 3.11. Схема
низма полярного
спорта ауксина на
не клетки.
/ — цитоплазма, 2 —
пая стенка, 3 — активная
секреция ИУК на базальном
конце клетки.
в следующую клетку, и т. д. (рис. 3.11).
Этот полярный базипетальный транспорт
ауксина сформировался уже при разви-
тии зародыша. Полярный транспорт
ИУК — энергозависимый процесс, требу-
ющий поступления О2 и связанный с
функционированием Н+-насоса в плазма-
лемме, который активируется самой ИУК-
Ауксин в апикальной меристеме побе-
га вместе с цитокинином необходим для
деления клеток. В зоне растяжения ИУК
активирует рост клеток. Этот фитогормон
необходим для дифференциации проводя-
щих пучков, по которым он и перемеща-
ется. Достигая корней, ауксин регулирует
их рост и морфогенез. В низких концен-
трациях он активирует деление и растя-
жение клеток в растущих участках кор-
ня. При повышении концентрации ИУК
деление клеток в апексе корня и рост
клеток в зоне растяжения тормозятся, но
индуцируется закладка боковых корней
в перицикле (см. 4.2.8). Таким образом,
при развитии новых листьев и увеличе-
нии вследствие этого притока ауксина в
корень будут образовываться новые бо-
ковые корни. В апикальной меристеме
корней синтезируется цитокинин (зеа-
тин), который с ксилемным соком (пассивно) по проводящим
пучкам поступает в надземные части. Этот фитогормон необхо-
дим для деления клеток в апексе побегов, закладки новых при-
мордиев листьев и почек, для роста и функциональной актив-
клеточ-
ности листьев, для активации роста пазушных почек и ветвле-
ния побега ( см. рис. 7.1). Таким образом, развивающаяся вер-
хушка побега, синтезирующая ауксин, активирует процессы кор-
необразования, в результате чего возрастает выработка цито-
кинина, который необходим для роста, морфогенеза и функцио-
нальной активности побега. Такая обратная положительная
связь лежит в основе саморазвития растительного организма.
Участие других фитогормонов и трофических факторов наслаи-
вается на этот основной регуляторный контур. Гиббереллины
(ГА1, ГА4, ГА7 и др.) при прорастании первоначально синтези-
руются в корне и оттуда поступают в побег, а при переходе
проростка к автотрофному способу питания образуются в основ-
ном в листьях и пассивно транспортируются в другие части
растения. Более подробно явления коррелятивного роста и ме-
ханизмы их регуляции будут обсуждаться далее (см. 7). В’ре-
38
зультате всех этих процессов растения на ювенильном этапе
развития накапливают значительную вегетативную массу.
Характерные особенности ювенильности. Проростки по мно-
гим параметрам не похожи на взрослые растения. Различия
часто хорошо заметны в форме листьев, например, у хлопчат-
ника или плюща. У ювенильных растений апикальная меристе-
ма побегов развита слабее, чем у зрелых растений. В ряде
случаев различия наблюдаются и в характере роста побегов.
Так, плющ в ювенильном состоянии представляет собой лазя-
щий кустарник, а при переходе к зрелости — вертикальный
куст.
Этап молодости отличается полным отсутствием цветения
или слабо выраженным цветением даже при самых благоприят-
ных для этого условиях. Здесь проявляется роль компетенции,
т. е. готовности специфически реагировать на то или иное ин-
дуцирующее воздействие. В данном случае ювенильное расте-
ние не обладает компетенцией к факторам, вызывающим за-
кладку органов полового размножения. Это может быть свя-
зано с отсутствием в органах-мишенях белков-рецепторов гор-
монов, участвующих в индукции генеративного развития.
Однако отсутствие цветения само по себе не может служить
убедительным показателем ювенильности, так как многие рас-
тения, находясь в зрелом состоянии, долго не зацветают, если
для этого нет необходимых условий.
Для ювенильных растений характерна сравнительно высокая
способность к корнеобразованию, что с давних пор используется
в практике растениеводства. Побеги, образовавшиеся из пазуш-
ных почек в нижней части стебля, могут находиться в юве-
нильном состоянии, в то время как побеги верхних яру-
сов уже способны цвести. Это свойство учитывается в садо-
водстве.
Длительность ювенильного периода сильно различается
у разных таксонов и жизненных форм. У древесных растений
ювенильный этап онтогенеза может продолжаться несколько
лет или даже десятки лет. Однолетние растения в ювенильном
состоянии находятся при прорастании и дальнейшем развитии
вегетативной массы в течение нескольких дней или недель.
Однако у однолетних растений, которым для перехода к ре-
продуктивному развитию необходима яровизация (см. 9.1.1),
чувствительность к низким температурам, индуцирующим пере-
ход к зацветанию, появляется уже при прорастании семян.
этих растений (озимых злаков, гороха и др.) чувствитель-
ность к яровизации обнаруживается даже во время эмбриоге-
неза. Зачатки цветков или соцветий у кукурузы и арахиса были
обнаружены уже в зрелых зародышах. Большинство двухлет-
них и многолетних растений, нуждающихся в яровизации, не
Реагирует на действие низких положительных температур в пе-
39
риод прорастания. Затем термочувствительность начинает расти
и, достигнув максимума, сохраняется длительное время. Про-
должительность этапа молодости имеет приспособительное зна-
чение для растений разных широт и экологических ниш.
Причины ювенильности. Факторы, поддерживающие расте-
ние в ювенильном состоянии, у разных видов могут быть неод-
нозначными. Назовем главные из них:
1. Малая площадь листовой поверхности. Это явление, по-
видимому, связано с недостаточностью углеводного питания
(фотосинтеза). Возрастающая площадь листьев и благоприят-
ные световые условия у многих растений сокращают ювениль-
ный этап.
2. Неблагоприятное соотношение молодых и старых листьев.
Удаление молодых листьев у сои, норичника, томата и многих
других растений ускоряет образование цветков. Наоборот, уда-
ление более старых листьев задерживает зацветание. Воз-
можно в молодых листьях образуются ингибиторы цветения.
Другой причиной задержки цветения молодыми развивающи-
мися листьями может быть их конкурентноспособность за асси-
миляты.
3. Нечувствительность первых листьев к восприятию фото-
периодического воздействия. У многих фотопериодически чув-
ствительных растений семядоли и первые ювенильные листья не
способны образовывать -стимул цветения в условиях благо-
приятного фотопериода (см. 9.1.2). Однако такие ювенильные
побеги быстро зацветают, если их привить на взрослый цвету-
щий подвой. Для индукции цветения молодым листьям пе-
риллы требуется значительно больше короткодневных фотопе-
риодов, чем более взрослым листьям, т. е. с увеличением био-
логического возраста фотопериодическая чувствительность воз-
растает. Однако эта закономерность наблюдается не у всех
растений.
4. Тормозящее влияние корней на переход к зацветанию.
У многих растений более удаленные от корней междоузлия
быстрее образуют цветки. Удаление воздушных корней у лиан
или корней у двухлетников и некоторых других растений уско-
ряет зацветание, т. е. сокращает ювенильный период.
5. Нечувствительность меристем апексов побега к стимулам
цветения. Почки ювенильных побегов многих древесных расте-
ний не способны реагировать на стимул цветения, поступающий
в них из взрослых листьев. Цветение ювенильных привоев цит-
русовых, лиственницы и других при их прививке на взрослые
цветущие растения не ускоряется.
Таким образом, причиной ювенильности у одних растений
может быть отсутствие компетенции молодых листьев к фото-
периодическим или температурным воздействиям, а у других —
невосприимчивость апикальных меристем к стимулам цветения.
40
Для ювенильных побегов характерно высокое содержание аук-
сина, образующегося в молодых листьях, и цитокининов, посту-
пающих из корней. В ювенильных листьях могут присутство-
вать ингибиторы цветения, ювенильное состояние зависит от
определенных генов и поддерживается недостатком углеводного
питания.
4. ФИЗИОЛОГИЯ РОСТА И РАЗВИТИЯ
ВЕГЕТАТИВНЫХ ОРГАНОВ
Рост растений происходит в течение всего онтогенеза в от-
личие от животных, у которых увеличение размеров тела осу-
ществляется только в период эмбриогенеза и молодости. Посто-
янный рост в длину стеблей и корней и образование новых
листьев — это способ получения достаточного количества пита-
тельных веществ, т. е. СО2, минеральных солей, воды и. энергии
в виде света. Этот рост обеспечивается постоянным функциони-
рованием апикальных меристем, которые формируют все части
растительного организма. Апикальные меристемы главного по-
бега и корня закладываются на ранних фазах развития заро-
дыша. Все более отдаляясь друг от друга в ходе вегетативного
роста, они функционируют как два постоянно действующих
эмбриональных центра растительного организма.
4.1. РОСТ ПОБЕГА
Побег высшего растения состоит из метамеров, в состав
каждого из которых входят: междоузлие как часть стебля, узел,
отходящие от узла листья и пазушные почки. Все эти компо-
ненты побега формируются его апексом.
4.1.1. АПЕКС ПОБЕГА
Апекс (лат. apex — верхушка), или конус нарастания, — пер-
вичная апикальная меристема побега, занимающая дистальное
положение в верхушечной или пазушной почках.
У покрытосеменных растений в апикальной меристеме по-
бега различают тунику и корпус (рис. 4.1). Туника, или мантия,
состоит из 1—3 или более поверхностных рядов клеток, кото-
рые делятся антиклинально, т. е. плоскость их деления и со-
42
«ответственно новые клеточные стенки перпендикулярны поверх-
ности апекса. За счет антиклинальных делений происходит
рост поверхности апикальной меристемы. Из наружного слоя
туники формируется протодерма, которая в дальнейшем диф-
ференцируется в эпидерму органов побега.
Рис. 4.1. Схема строения конуса нарастания стебля.
/ — туника,, 2 — инициальные клетки туники промеристемы, 3 — ини-
циальные клетки корпуса промеристемы, 4 — периферическая меристе-
ма, 5—стержневая меристема.
Стрелками показано направление деления клеток.
Меристематические клетки, лежащие под туникой, называют
корпусом. Клетки корпуса делятся как антиклинально, так и
периклинально (плоскость деления и новые клеточные стенки
параллельны поверхности), что приводит к увеличению объема
апикальной меристемы. Каждый слой туники и корпус имеют
свои инициали (группы материнских клеток). При делении
инициальной клетки одна из дочерних продолжает функцио-
нировать как инициальная.
На основании преимущественной ориентации клеточных де-
лений, формы и размера клеток, содержания РНК и функцио-
нального предназначения клеток в апексе выделяют три зоны:
Центральную, периферическую и сердцевинную. Границы между
этимй зонами условны и проходят различно у разных видов и
растений разного возраста.
Центральная (аксиальная) меристема включает в себя ини-
циальные клетки туники и корпуса. Материнские клетки кор-
пуса крупнее других клеток апикальной меристемы, вакуолизи-
рованы, имеют крупные ядра, но низкое содержание РНК в
Цитоплазме. Во время вегетативного роста они делятся реже,
Пом другие клетки апикальной меристемы. Продолжительность
пх митотических циклов (табл. 4.1) в 2—3 раза больше (70—
43
Таблица 4.1. Продолжительность митотического цикла (ч) &
апикальных меристемах побегов растений разных видов
(Иванов, 1987)
Вид Меристема
центральная перифериче- ская сердцевин- ! ная
Pisum sativum 69 28—30 26
Datura stramonium . . . 76 36 33
Tri folium repens 108 69—87 136
Chrysanthemum morifolium 135 70-73 —
Coleus blumei 257 122 178
Sinapis alba 288 157 —
280 ч), чем у других клеток апикальной меристемы, причем
эта заторможенность делений связана с длительностью пе-
риода Gi. Когда апикальная меристема побега получает фло-
ральный импульс и начинает формировать органы цветка
(см. 9.5.2), деление клеток в этой зоне резко активируется. На
этом основании французский цитофизиолог Р. Бюва назвал эту
зону «меристемой ожидания».
Периферическая меристема (латеральная, фланговая, ини-
циальное кольцо) состоит из мелких клеток с плотной цито-
плазмой и большим числом рибосом. Продолжительность ми-
тотических циклов этих клеток 30—150 ч. Эта зона включает в
себя клетки как туники, так и периферической части корпуса
и дает начало первичной коре и прокамбию, в ней происходит
закладка примордиев боковых органов вегетативного побега —
листьев и пазушных почек.
Сердцевинная (медулярная, стержневая, колончатая) мери-
стема состоит из вакуолизированных клеток с низким содержа-
нием РНК, которые делятся преимущественно поперек оси по-
бега и поэтому образуют вертикальные клеточные ряды (отсю-
да и название «колончатая меристема»). Продолжительность
митотических циклов медулярных клеток 30—200 ч. Эта мери-
стема формирует сердцевину стебля.
Ни одну из этих зон, за исключением первого слоя клеток
туники, формирующего эпидерму, нельзя назвать гистогеном
(см. 4.2.1), так как они не формируют какую-либо определен-
ную систему тканей в теле растения, и их границы, как уже го-
ворилось, изменчивы и не всегда различимы.
4.1.2. ФОРМИРОВАНИЕ И РОСТ ЛИСТА
Формирование и рост листа включает в себя две фазы:
1) образование листового примордия и его оси, 2) рост пла-
стинки листа и черешка (рис. 4.2).
Образование листового примордия. Примордий листа появ-
44
ляется в виде бугорка в дистальной части периферической ме-
ристемы апекса побега (рис. 4.3 и 4.9). Это происходит в ре-
зультате ориентированных локальных делений клеток туники и
корпуса. Степень вовлечения туники и корпуса в процесс зало-
г — про-
____________________________ 2 —
побега, 3 — прокамбий. Плотность
отражает уровень меристематиче-
ской активности.
Рис. 4.2. Схема роста листа дву-
дольных (по: Эзау, 1980).
а — бугорок примордия; б — недифферен-
цированный примордий (ось листа) без
пластинки и черешка (стрелками пока-
заны направления роста); в, г — рост
пластинки за счет деятельности марги-
нальных меристем, дифференцировка
крупных жилок и удлинение черешка;
д — поперечный срез пластинки с обозна-
чением положения меристем. 1 — апикаль-
ная меристема, 2 — заложение маргиналь-
ной меристемы, 5 —средняя жилка, 4 —
маргинальные меристемы, 5 — основание
листа, 6 — адаксиальная меристема, 7 —
черешок.
Рис. 4.3. Развитие листа двудольно-
го растения (по: Эзау, 1980).
а —в — трехмерное изображение;
дольный срез. 1 — примордий листа,
апекс
точек
жения листового примордия у разных видов различна. У мно-
гих покрытосеменных первые деления происходят в одном или
нескольких рядах клеток, расположенных под протодермой,
и являются периклинальными по отношению к поверхности
апекса (рис. 4.4). Затем следуют антиклинальные и перикли-
нальные деления в протодерме и лежащих под ней слоях.
В месте образования бугорка формируется тяж прокамбия, иду-
щий от ближайшего листового следа (см. рис. 4.3, 4.4 и 4.9).
Клетки прокамбия легко узнать по их вытянутой форме и про-
дольному делению.
Образующийся примордий и связанный с ним узел включают
45
в себя часть периферической меристемы апекса, уменьшая ее
объем. Чтобы заложить следующий метамер, объем апекса дол-
жен достичь определенной величины. Таким образом, апекс —
динамическая структура, форма и размеры которой периоди-
чески меняются. Промежуток времени между закладкой после-
довательных листовых примордиев или между другими одно-
Рис. 4.4. Образование листового примордия и пластинки
листа у льна (по: Эзау, 1980).
1—4 — продольные срезы, 5, 6 — поперечные срезы: 1, 2 — возникно-
вение примордия (периклинальные деления), 3, 4 — верхушечный рост
примордия, 5 — примордий перед началом развития пластинки, 6 —
рост пластинки листа. П — прокамбий.
типными состояниями следующих друг за другом листьев назы-
вается пластохроном (греч. plastos — лепить, chronos — время).
Длительность пластохрона у разных видов различна — от не-
скольких часов до нескольких дней. Характер расположения
листьев на стебле — филлотаксис (греч. phyllon — лист, taxis —
расположение) определяется порядком заложения листовых
примордиев в апексе побега. Это расположение может быть спи-
ральным, супротивным или мутовчатым.
Апекс с примордиями — автономная система в которой за-
ключен механизм последовательной закладки листьев в соот-
ветствии с тем филлотаксисом, который характеризует данный
вид. Это следует из опытов, в которых показано, что'у многих
видов изолированная апикальная меристема побега, включаю-
щая в себя несколько листовых примордиев развивается в це-
лое растение в стерильных условиях без добавления фитогор-
монов. Однако при культивировании изолированного апекса вы-
сотой менее 0,1 мм (без примордиев) для формирования при-
мордиев в среду необходимо добавлять ауксин. Еще лучшие ре-
зультаты получаются при введении в среду вместе с ауксином
46
и цитокинина. Существуют несколько гипотез о факторах, опре-
деляющих место образования листа в апексе:
1. Предполагается, что сам апекс и ближайшие к нему мо-
лодые примордии продуцируют ингибитор, который диффунди-
рует из этих локусов, создавая «поля торможения» («теория
отталкивания» Ю. Шоуте, 1913; «теория физиологических по-
лей» К. Уордлоу, 1953 и др.).
Поскольку по мере заложе-
ния примордиев ранее обра-
зованные удаляются от
апекса, между ингибиторны-
ми полями появляются про-
межутки, где и происходит
закладка новых примордиев
(рис. 4.5,а). Поля торможе-
ния могут быть связаны с
синтезом примордиями мета-
болитов ингибирующего дей-
ствия, с перераспределени-
ем механических давлений и
натяжений, в результате че-
го может изменятвся синтез
этилена (стрессовый этилен)
И т. д.
2. В основе другой груп-
пы гипотез лежит предполо-
жение, что место закладки
нового примордия определя-
ется стимулами, получаемы-
ми от относительно зрелых
органов и(или) сосудистой
а
Рис. 4.5. Теории листорасположения:
а — «поля торможения» (ПТ) по Уордлоу:
на схеме конусов нарастания разных рас-
тений черным отмечены зачатки листьев,
вокруг них и на апексе обведены ПТ;
б — «множественные листовые спирали»
(/, II) по Плантефолю; 8' и 9' — места
будущих листовых зачатков. Листья про-
нумерованы в порядке появления (Г—7').
АЗ—апикальная зона.
ткани, расположенных ниже
апекса. Согласно теории
«множественных листовых
спиралей» Л. Плантефоля
(1948) возникновение нового
примордия на дистальном
конце парастихи (парасти-
ха— спираль на оси побега,
вдоль которой прикреплен
ряд листьев) активируется
более старым примордием, входя-
щим в состав этой парастихи (рис. 4.5,6).
Место закладки нового листового примордия может опреде-
ляться прокамбиальным тяжем, идущим акропетально от более
старого листа. Так, установлено, что клетки, образованные под
протодермой в результате периклинальных делений при возник-
новении листового зачатка, связаны с прокамбием, который
берет свое начало от предшествующего прокамбиального листо-
47
вого следа (см. рис. 4.3). Таким образом, формирующиеся
листья, заложенные ранее и связанные общим проводящим
пучком, могут оказывать влияние на образование нового листо-
вого бугорка путем поставки физиологически активных ве-
ществ и метаболитов. По формирующимся проводящим пучкам
к местам инициации листовых примордиев поступают цитоки-
нины из корней. Возникающий листовой примордий становится
источником ИУК, синтез которой происходит в его клетках.
Этот синтез необходим не только для поддержания пролифера-
тивной активности (увеличения числа клеток) в самом при-
мордии, но и для развития прокамбиального листового следа.
У покрытосеменных растений удаление молодого листового при-
.мордия в большинстве случаев приводит к превращению про-
камбия в паренхимные клетки. Обработка ауксином места уда-
ления примордия предотвращает превращение клеток прокам-
бия в паренхимные, но не способствует их дифференцировке в
сосудистые ткани.
Как уже отмечалось, периклинальные деления клеток, лока-
лизованных под протодермой апекса побега, являются ранним
признаком закладки нового листа (см. рис. 4.4). Причем в этом
месте, как правило, не происходит изменений в интенсивности
клеточных делений и содержании белка, РНК и ДНК. Главное
условие для периклинальных делений — ориентация митотиче-
ских веретен вдоль оси будущего примордия в этом участке, т. е.
определенная поляризация клеток. Отмечено, что еще до пери-
клинальных делений этих клеток наблюдается более быстрое
относительное удлинение (скорость увеличения длины в пере-
счете на единицу длины) в направлении будущего роста бу-
горка. Таким образом, решающим событием в детерминации
заложения листового примордия является поляризация клеток
этого участка. Вполне возможно, что наблюдаемая поляризация
имеет такую же электрическую природу, что и при заложении
семядолей в ходе развития зародыша (см. 2.1.4).
Возникающий в периферической меристеме новый листовой
бугорок с самого начала приобретает дорсовентральное строе-
ние. Его рост в высоту и ширину происходит путем делений и
роста клеток. В результате более интенсивного роста с абакси-
альной (удаленной от оси) стороны примордий изгибается^
к апексу побега (см. рис. 4.3).
Рост пластинки листа и черешка. Пластинка листа форми<
руется благодаря активности краевой, или маргинальной, мери-
стемы, которая функционирует билатерально, на двух сторонах^
примордия (см. рис. 4.2). Наружный слой клеток (протодерма)'
в верхушке примордия и в маргинальной меристеме растет глав-
ным образом за счет антиклинальных делений и дифференци-
руется в эпидерму. Субапикальные и субмаргинальные клетки
делятся также преимущественно антиклинально (см. рис. 4.4).
Производные этих инициальных клеток продолжают делиться в
48
качестве интеркалярных меристем. Распределение митотической
активности в них не обнаруживает какой-либо упорядочен-
ности.
Таким образом, меристематическая ткань листа состоит из
параллельных слоев клеток, делящихся антиклинально. Такая
меристема называется пластинчатой. Новые слои клеток обра-
зуются в результате периклинальных и наклонных делений на
первых этапах формирования пластинки листа. За счет этих де-
лений происходит рост пластинки в толщину. Продолжитель-
ность митотических циклов меристематических клеток листа и
черешка 24—48 ч.
До выхода из почки в листе формируется лишь небольшая
часть клеток будущего взрослого листа: 60—99% клеток обра-
зуется при дальнейшем росте пластинки. За время роста листа
после выхода из почки наблюдаются 2—6 циклов асинхронных
делений его клеток. В листе двудольных клеточные деления за-
канчиваются, когда он достигает 72—2/з своего окончательного
размера. В этот период растущий лист перестает получать асси-
миляты из зрелых листьев и сам начинает производить про-
дукты фотосинтеза на экспорт. Митотическая активность пре-
кращается прежде всего в тканях апикальной части листа,
п дальнейшее снижение интенсивности пролиферации происхо-
дит в базипетальном направлении.
У подсолнечника за время формирования листа в почке
средний объем его клетки возрастает в 4 раза, а в ходе разво-
рачивания и роста листовой пластинки — в 10 раз. Следова-
тельно, рост клеток растяжением происходит главным образом
после выхода листа из почки и значительное время идет одно-
временно с делением клеток. В результате этого объем закон-
чившего рост листа может в 1000 раз превышать объем мери-
стематического зачатка. Расчеты (показывают, что, несмотря на
интенсивный рост растяжением, относительная скорость роста
зачатков листьев в почках может превышать относительную ско-
рость последующего роста листа. После окончания растяжения
листовой пластинки сухая масса листа некоторое время продол-
жает увеличиваться за счет утолщения вторичных клеточных
стенок и процессов, связанных с функциональной активностью
листа.
Особенность закладки листа однодольных растений
состоит в том, что деления в возникшем на одной стороне
апекса листовом бугорке распространяются в обе стороны и
охватывают всю окружность апекса. Образовавшийся серпо-
видный (у злаков) или кольцевой (у осок) меристематический
валик дает начало листу, растущему вверх. Листовая пластин-
ка формируется маргинальной и интеркалярной меристемами.
Затем клетки всех тканей листа переходят к растяжению.
В листьях кукурузы зоны деления и растяжения клеток разде-
ляются после шестого пластохрона. Интеркалярная меристема
4 Зака^ № 399
49
продолжает функционировать в основании листа, причем клетки
делятся преимущественно -поперек листовой оси. Рост листа
осуществляется благодаря делениям клеток интеркалярной ме-
ристемы и их последующего растяжения.
Эпидермальные клетки заканчивают деление первыми, но
продолжают расти растяжением. Палисадные клетки (столбча-
тый мезофилл) делятся и растут со скоростью, близкой к ско-
рости роста эпидермиса. Процесс их роста останавливается не-
сколько раньше, чем завершается растяжение эпидермиса. По-
этому палисадные клетки частично отделяются друг от друга в
продольном направлении, образуя небольшие межклетники. Еще
раньше прекращают рост клетки губчатой хлоренхимы, в ре-
зультате чего между ними образуются большие межклетники»
необходимые для газообмена в тканях листа в процессах фото-
синтеза и дыхания.
Средняя жилка листа часто разрастается с адаксиальной
(повернутой к оси побега) стороны вследствие периклинальных
делений клеток внутри зоны, представленной адаксиальной ме-
ристемой (см. рис. 4.2). Благодаря ее активности утолщается и
черешок. Удлинение черешка идет за счет делений и растяже-
ния клеток.
Жилки второго и третьего порядков по мере роста пластинки
листа формируются за счет антиклинальных, периклинальных и
наклонных делений в определенных участках пластинчатой ме-
ристемы. Сначала, как обычно, формируется прокамбий. Диф-
ференцировка боковых жилок в листе происходит базипетально»
т. е. от верхушки к основанию.
Устьица образуются в результате делений клеток прото-
дермы. У протодермальной клетки-предшественницы происхо-
дит поляризация протоплазмы так, что большее число орга-
ноидов скапливается в одном из концов готовящейся к делению
клетки. Клетка-предшественница асимметрично делится с обра-
зованием двух клеток разного размера. Меньшая клетка с плот-
ной цитоплазмой становится материнской клеткой замыкаю-
щих клеток, а большая вакуолизированная клетка — эпидёр-
мальной. Материнская клетка митотически делится продольно
и симметрично, образуя замыкающие клетки устьица (рис. 4.6).
В месте возникновения устьичной щели срединная пластинка
между замыкающими клетками набухает и затем разрушается
пектиназами, секретируемыми обеими клетками. Для разъеди-
нения стенок существенно также увеличение в этот момент тур-
горного давления в замыкающих клетках. После образования
поры замыкающие клетки продолжают удлиняться, что приво-
дит к развитию подустьичной полости. Для ее формирования
важен также рост клеток мезофилла под устьицем. Околоусть-
ичные (вспомогательные) клетки устьичного комплекса обра-
зуются в результате деления как материнской клетки, так и
других клеток протодермы. Устьица локализованы чаще на ниж-
50
ней, реже на верхней сторонах листа или на обеих его поверх-
ностях.
Устьица возникают последовательно по мере роста листа,
У листьев с параллельным жилкованием (однодольные) они
расположены продольными рядами, и дифференцировка их про-
исходит от верхушки листа к его основанию. У листьев с сетча-
7 2 3
Рис. 4.6. Развитие устьиц овса.
а — образование материнских клеток замыкающих клеток, б — образование*
околоустьичных клеток, в — образование замыкающих клеток делением ма-
теринской (ув.Х262), г — сформированные устьица (ув.ХЭЗ). /—материнские
клетки замыкающих клеток, 2 — околоустьичные клетки, 3 — замыкающие
клетки.
тым жилкованием (двудольные) такой последовательности к
этом процессе нет, и на одном участке листа могут одновре-
менно присутствовать и зрелые, и дифференцирующиеся устьи-
ца. Закладываются новые устьица на определенном (в среднем)*
расстоянии от сформированных ранее. Предполагается, что во-
круг развивающегося устьица существует ингибиторная зона,
которая предотвращает образование других материнских замы-
кающих клеток. На количество и размер устьиц оказывают зна-
чительное влияние такие условия внешней среды, как доступ-
ность и содержание воды в листе, интенсивность света, вели-
чина температуры и концентрация СО2. Плотность устьиц мо-
жет меняться из-за изменения площади листа и действия внеш-
них факторов, однако число их на лист меняется мало.
На всех этапах рост листа определяется гормональным
балансом. Листовые примордии и интенсивно растущие мо-
лодые листочки являются основным местом синтеза ауксина вг
растении. ИУК необходима для деления клеток растущего
листа. Она участвует в механизмах индукции и дифференци-
ровки проводящих пучков и, следовательно, регуляции роста?
листовых жилок.
Цитокинины, поступающие с ксилемным током из корней,,
являются важнейшим фактором, обусловливающим активность
4* _ 51
маргинальной и интеркалярной меристем формирующейся лис-
стовой пластинки. Обеднение проростка цитокинином путем по-
стоянного удаления кончиков корней резко уменьшает размеры
пластинки листка. В ряде случаев, например у хрена, в усло-
виях дефицита цитокинина настолько подавляется рост ткани
между жилками листа, что листья выглядят сильно изрезан-
ными и ячеистыми. Цитокинин необходим не только для деле-
ния клеток листа, но и для роста клеток листовой хлоренхимы
растяжением.
Гиббереллины, синтез которых осуществляется как в листьях,
особенно молодых, так и в
кончике корня, также нужны для
роста листа. Между уровнем гиб-
береллина в тканях листа и ско-
ростью его роста существует по-
ложительная корреляция (рис.
4.7). У некоторых растений, обра-
ботанных гиббереллином, наблю-
дается более интенсивный рост
листьев в длину, чем в ширину.
Деление клеток и переход к рас-
тяжению в интеркалярной мери-
стеме растущих листьев у злаков
активируется гиббереллином. Это
явление позволяет использовать
рост отрезков оснований листьев
злаков в качестве биопробы
на гиббереллин. Развертывание
скрученных в трубку листовых
пластинок у злаков также осуще-
ствляется под действием гиббе-
; реллина, концентрация которого
[ возрастает в тканях листа под
1 влиянием красного света при уча-
стии фитохрома (см. 8.3).
ней среды наибольшее влияние
на рост листа оказывают свет и водный дефицит, а также уро-
вень азотного питания. В отсутствии света, в темноте деления
клеток и рост листа резко заторможены. Красный свет слабой
интенсивности через фитохромную систему и синий свет высо-
кой интенсивности активируют рост листа. Физико-химические
и гормональные механизмы фотоморфогенеза будут рассмот-
рены ниже (см. 8). Свет сверхоптимальной интенсивности спо-
собствует образованию в пластинке листа дополнительных
слоев столбчатой паренхимы. Дефицит влаги приводит к обра-
зованию более мелких по размеру листьев с мелкоклеточной
ксероморфной структурой. Возможно, это связано с увеличе-
нием содержания АБК и стрессового этилена, которые тормо-
зят ростовые процессы. При недостаточном азотном питании
Рис. 4.7. Содержание гибберелли-
на (/) в первом листе карлико-
вой фасоли и скорость его роста
(2) (Wheeler, 1960).
По оси абсцисс — возраст листа (сут),
по оси ординат: (1) — содержание ГА
измерено по стимуляции растяжения
(мм) высечек из листьев экстрактом
из листьев, (2) скорость роста листа
(мм/сут).
Из факторов внеш]
52
уменьшается число делений за период роста листа, но продол-
жительность его роста практически не меняется.
4.1.3. ОБРАЗОВАНИЕ ПАЗУШНЫХ ПОЧЕК
Пазушные, или боковые, почки закладываются в пазухах
листовых примордиев в меристематической ткани, образующей
непрерывную связь с апикальной меристемой. Почки никогда
не образуются одновременно с закладкой листового примордия.
Они появляются на некотором расстоянии от апикальной мери-
стемы обычно в пазухах второго, третьего илщ четвертого от
апекса листового примордия (см. рис. 4.9). Благодаря перикли-
нальным и антиклинальным делениям в клеточных слоях пазухи
листового примордия образуется бугорок почечной апикальной
меристемы. С ростом материнского побега клетки пазушной
меристемы вакуолизируются, и она отделяется от апикальной
меристемы. По мере роста апекса боковой почки на нем обра-
зуются листовые примордии. Под почечным апексом формиру-
ется прокамбий, дифференцирующийся в веточный след (про-
водящий -пучок). Пролиферативная активность апекса пазуш-
ной почки постепенно тормозится, если она переходит в состоя-
ние покоя.
Морфогенетические факторы, индуцирующие закладку па-
зушной почки, не известны. Во всяком случае, при образовании
радиальной пазушной почки реали-
зуется более широкая генетическая
информация, чем при закладке дор-
совентрального листового примор-
дия. Если в апексе папоротника ме-
сто инициации нового листового
примордия или только что заложив-
шийся листовой примордий отделить
глубокими надрезами от апикальной
клетки и соседних примордиев, то в
этом месте вместо листа разовьется
почка (рис. 4.8). Точно так же изо-
лированные и культивируемые в сте-
рильных условиях только что зало-
жившиеся примордии развиваются в
побеги. Более зрелые примордии
(П3—П9) при этих же условиях раз-
виваются как листья. Таким обра-
зом, направляющее воздействие
апекса побега и листовых зачатков
приводит к ограничениям в реализа-
ции морфогенетической программы,
примордия листа, а не пазушной почки.
Рис. 4.8. Формирование
почки из участка I' в апе-
ксе побега Dryopteris dila-
taia, изолированного от
апикальной клетки танген-
циальным разрезом АВ, а
от листовых примордиев —
радиальными разрезами СС'
и DD'.
1—7 — листовые примордии.
Пч — почка.
способствуя- образованию
53
4.1.4. ФОРМИРОВАНИЕ ПРОВОДЯЩЕГО ПУЧКА
Прокамбий у семенных растений является остатком апикаль-
ной меристемы побега в районе, где происходит дифференци-
ровка сердцевины и коры (рис. 4.9). Клетки прокамбия диффе-
ренцируются в сосудистые клетки двух типов — первичной фло-
эмы и первичной ксилемы. Первой дифференцируется флоэма
с наружной стороны прокамбия. Ее элементы появляются у ос-
нования листового примордия, а затем развиваются акропеталь-
но в направлении листа и базипетально для связи со зрелыми
-сосудами более старого листового следа. Через день или поз-
же в прокамбии с его внутренней стороны, обращенной к серд-
цевине, дифференцируются элементы ксилемы на том же уров-
не, где ранее начиналась дифференцировка флоэмы. Дальней-
шая дифференцировка ксилемы осуществляется также в двух
направлениях.
^Основным фактором, контролирующим дифференцировку
h h I7 Iе
Рис. 4.9. Распределения меристем в стебле.
/ — апикальная меристема, 2 — интеркалярная меристема,
.3 — прокамбий, 4 — незрелые элементы флоэмы. 5 — зрелые
.элементы флоэмы, 6 — незрелые элементы ксилемы, 7 —
зрелые элементы ксилемы, 8 — камбий.
34
как флоэмы, так и ксилемы, является ауксин, вырабатываемый
листовыми примордиями и перемещающийся по прокамбию ба-
зипетально. Формирование флоэмы связано с относительно низ-
ким уровнем ИУК и высокой концентрацией гиббереллинов.
Экспериментально показано, что гиббереллины в листьях и стеб-
лях активируют дифференцировку флоэмы. Они поступают в
прокамбий из молодых развивающихся листьев по флоэме. Без
флоэмы дифференцировка ксилемных элементов в прокамбии не
происходит. Для образования ксилемы необходимы повышен-
ная концентрация ауксина и низкое содержание гиббереллинов.
В условиях культуры ткани формированию флоэмы в некото-
рых случаях способствует высокая концентрация сахарозы (4%
и более), а формированию ксилемы — низкая ее концентра-
ция (1%). Однако участие сахаров в контроле соотношения
формирования флоэмы и ксилемы в интактных растениях не
доказано.
На ранних этапах дифференцировки вторичной ксилемы
стебля показано ускоряющее влияние кинетина, что, возможно,
связано с активацией им деления клеток камбия. О роли цито-
кинина в дифференцировке сосудов в интактном растении извест-
но мало, основные данные получены в опытах in vitro. В куль-
туре ткани цитокинин стимулирует деление клеток и контроли-
рует дифференцировку как трахеальных элементов, так и тя-
жей вторичной ксилемы. У интактных стеблей и в культуре
ткани механическое давление стимулирует ксилогенез. Предпо-
лагается, что этот эффект обусловлен стрессовым этиленом.
Ксилогенез усиливается также снижением водного потенциала
(осмотическим стрессом). Свет в большинстве случаев подав-
ляет ксилогенез.
Таким образом, определяющим фактором в закладке и диф-
ференцировке прокамбия и первичных сосудистых тканей яв-
ляется полярный транспорт ауксина из формирующихся примор-
диев. Взаимоотношения между транспортом ауксина и диффе-
ренцировкой сосудов регулируются через положительную обрат-
ную связь: дифференцировка сосудистой ткани повышает спо-
собность клеток к транспорту ИУК, т. е. того сигнала, который
индуцирует их дифференцировку.
4.1.5. РОСТ СТЕБЛЯ В ДЛИНУ
Возникновение листовых примордиев в апексе побега приво-
дит к вычленению узлов (т. е. участков стебля, к которым
прикреплены листья). В результате последующего развития
междоузлий узлы на стебле отодвигаются друг от друга (см.
рис. 4.9). Удлинение стебля в междоузлиях первоначально про-
исходит за счет меристемы колончатого типа, в которой клетки
делятся поперек оси побега, в результате чего формируются
продольные ряды клеток в сердцевине и первичной коре. При
дальнейшем удлинении междоузлий все большую роль начи-
55
нает играть рост клеток растяжением. Клетки, перешедшие
к растяжению, некоторое время продолжают делиться. Рост
междоузлий и формирование их тканей может осуществляться
длительное время за счет
Рис. 4.10. Рост в длину стебля од-
нодольных (злаков) (по: Эзау, 1980).
а — срединный продольный срез корневи-
ща Agropyron. repens. Листья окружают
стебель. Показана связь развивающихся
узлов (точки) и междоузлий (вертикаль-
ные линии) с дисками закладки листовых
примордиев. Листья (14—17) и узлы (/—7)
пронумерованы от апекса книзу. 1 — апекс
побега, 2 — пазушная почка, 3 — диск за-
кладки №3, 4—7— узлы №4, 5, 6, 7 соот-
ветственно. б — стебли Triticum aestivum
с удаленными листьями. У основания от-
мечены сближенные междоузлия (1—6) и
вытянутые выше них. Соцветия на вер-
хушке. Узлы (1—10) пронумерованы, начи-
ная от старых к молодым.
сочка стебля тонким сверлом
столбик этих тканей удлинится, а цилиндр из поверхностных
слоев клеток сократится. Натяжение тканей наряду с тургор-
ным давлением в каждой клетке придает прочность (твердость)
растущим стеблям травянистых растений. Удлинение побега
происходит благодаря росту вновь образующихся верхних меж-
деятельности интеркалярных
(вставочных) меристем, кото-
рые сохраняются у оснований
молодых междоузлий. Приме-
ром такого интеркалярного ро-
ста служит рост стебля злаков
(рис. 4.10). У междоузлий зла-
ков, прекративших рост, интер-
калярная меристема может
быть активирована вновь. При-
гнутая к земле соломина при-
нимает снова вертикальное по-
ложение благодаря такой ак-
тивации.
Сосудистая ткань диффе-
ренцируется в интеркалярной
меристематической зоне, но
дальнейшее растяжение клеток
коры и сердцевины разрушает
элементы зрелой первичной
ксилемы и флоэмы. В резуль-
тате в этих участках стебля
происходит задержка транс-
порта питательных веществ,
что, возможно, служит для со-
средоточения ассимилятов и
минеральных веществ в мери-
стеме.
У растущих междоузлий на-
блюдается явление, которое
получило название натяжения
тканей', наружные клеточные
слои, особенно эпидерма, на-
ходятся в состоянии физиче-
ского натяжения (растягива-
ния), а внутренние ткани под-
держиваются в состоянии ком-
прессии (сжатия). Если из ку-
вырезать внутренние ткани, то
56
доузлий. Динамика роста каждого междоузлия описывается
S-образной кривой: вначале медленный рост за счет деления
клеток, затем быстрый рост благодаря переходу клеток к рас-
тяжению и, наконец, замедление темпа роста у зрелого междо-
узлия. Обычно каждое последующее междоузлие переходит
к интенсивному удлинению, когда у предыдущего междоузлия
темп роста начинает снижаться. Если удлинение междоузлий не
происходит, то формируются розеточные формы растений (оду-
ванчик, подорожник и др.).
Рост стебля в длину регулируется прежде всего ауксином и
гиббереллинами. Ауксин, поступая из листовых примордиев и
развивающихся молодых листьев, активирует деление и растя-
жение клеток в междоузлиях. В стебле базипетальный транс-
порт ИУК идет по живым клеткам проводящих пучков. Если
наложить разность потенциалов на отрезки междоузлий гороха
(анод у апикального конца отрезка, ток 6 мкА), то скорость
их роста возрастает (рис. 4.11). Это, очевидно, связано с уско-
рением транспорта ИУК. В аналогичных опытах с отрезками
Рис. 4.11. Влияние электрического
тока (6 мкА) на скорость роста в
длину отрезков междоузлий гороха
(анод у апикального конца отрезка)
(Медведев и др., 1986).
Стрелками указаны моменты включения
( I) и выключения ( t ) тока. По оси
абсцисс — время опыта (мин), по оси ор-
динат — скорость роста (мкм/ч).
Рис. 4.12. Диффузия ауксина из
камбиальных участков отрезков
(6 мм) стебля сосны в агар за 6 мин
экспозиции (Zajaczkowski е. а., 1984).
/ — контроль (эндогенный ауксин), 2 —
после 100 мин предобработки апикального
конца отрезка экзогенной ИУК 0,1 мг/л.
По оси абсцисс — расстояние от апекса
(мм), по оси ординат — количество аук-
сина (экв.мкг/л).
57
колеоптилей кукурузы установлено, что как рост, так и транс-
порт [14С]ИУК возрастают при наложении внешней разности
.потенциалов. Транспорт ауксина по стеблю происходит в ре-
жиме осцилляций, что показано для стеблей сосны (рис. 4.12).
Концентрация эндогенного ауксина в растягивающихся меж-
доузлиях положительно коррелирует с интенсивностью их роста
(рис. 4.13,а,б). Обработка интактных растущих растений экзо-
Рис. 4.13. Скорость роста междоузлий зеленых растений го-
роха (а, б) и подсолнечника (в, г) и содержание в них
ауксина (б) или гиббереллина (г) (Уорринг, Филлипс, 1984).
а — схема 9-дневного растения гороха, 1—5 — междоузлия эпикотиля,
А—И —участки, в которых анализировали ауксин; б — распределение
диффузионного ауксина (/) и скорость растяжения междоузлий эпи-
котиля гороха (2). По оси абсцисс — участки эпикотиля, по осям ор-
динат: (1) — диффузионный ауксин (по изгибу колеоптилей овса, гра-
дусы), (2) — увеличение длины на 1 мм (%), в — схема проростка
подсолнечника: 1—5 — междоузлия, С — семядоли; г — содержание
гиббереллина (3) и рост междоузлий (4). По оси абсцисс — номера
междоузлий, по осям ординат: (3)—содержание ГА3 (экв. мкг/кг сы-
рой массы), (4)—увеличение длины междоузлия за 72 ч (%).
генным ауксином обычно не приводит к усилению их роста в
длину. Это свидетельствует о том, что количество эндогенного
ауксина в тканях оптимально для их роста.
Механизм действия ИУК на деление клеток не известен.
В самой общей форме можно сказать, что ауксин активирует
синтез РНК и белков и необходим для нормального протекания
Gi- и О2-'периодов митотического цикла. Роль ИУК в росте кле-
ток растяжением изучена намного полнее. Ауксин, взаимодей-
ствуя со своими рецепторами в плазмалемме, шероховатом эн-
58
доплазматичеоком ретикулуме и цитоплазме, активирует Н+-
помпу (Н+-АТФазу) в плазмалемме, синтез белков в цитоплаз-
ме и синтез РНК в ядре. В результате происходит закисление
фазы клеточных стенок, усиливается секреция полисахаридов
и белков клеточных стенок и ферментов, участвующих в
их размягчении и синтезе. В клеточных стенках разрываются
кислотолабильные водородные связи между целлюлозой и геми-
целлюлозами и активируются кислые гидролазы, расщепляющие
ковалентные связи между полимерами стенки. В результате
этого клеточная стенка становится более пластичной и способной
растягиваться под действием внутриклеточного осмотического
давления. Ростстимулирующее действие ауксина поддерживается
активированным синтезом специфических РНК и белков.
Местом действия ИУК в участках междоузлия, растущего
благодаря растяжению клеток, являются главным образом
клетки эпидермы. В результате этого поверхностный эпидер-
мально-кутикулярный слой, который ограничивает рост внутрен-
них тканей, растягивается, что приводит к удлинению междоуз-
лия. Подкисляя внешнюю среду до pH 3—4, можно имитиро-
вать действие ИУК на рост отрезков междоузлий растяже-
нием — эффект «кислого роста». Однако такое растяжение бу-
дет кратковременным, поскольку в этих условиях опыта синтез
РНК, белков и секреторная деятельность не активированы.
Обнаружена также положительная корреляция между ско-
ростью роста междоузлий разного возраста и содержанием в
них гиббереллинов (см. рис. 4.13, в, г). Наибольшая концентра-
ция гиббереллинов, так же как и ауксина, характерна для
быстро растущих междоузлий. При обработке экзогенным гиб-
береллином, особенно некоторых карликовых форм, резко удли-
няются молодые междоузлия. Их удлинение обусловлено уве-
личением как количества клеток, так и их длины. Однако экзо-
генный гиббереллин почти не активирует рост отрезков междо-
узлий, лишенных интеркалярных или апикальных меристем, что
указывает на отсутствие прямого влияния гиббереллина на рост
клеток растяжением. Очевидно, действие гиббереллина лока-
лизовано главным образом в субапикальной и интеркалярной
меристемах. Причем показано, что в тканях, обработанных гиб-
береллином, возрастает содержание эндогенной ИУК, которая,
по-видимому, усиливает рост клеток растяжением. Такие ретар-
данты (тормозители), как XXX (хлорхолинхлорид), АМО-1618
и фосфон Д, ингибирующие биосинтез эндогенных гибберелли-
нов, подавляют деление клеток в субапикальных меристемах
побегов, что приводит к торможению роста новых междоузлий
и уменьшению их конечной длины. Отсутствие роста междоуз-
лий у розеточных форм также связано с дефицитом гибберел-
линов. Гиббереллин, так же как и ауксин, поступает в междо-
узлие из апикальной почки и молодых листьев (рис. 4.14).
Однако в отличие от ауксина поступление гиббереллина оказы-
59
вается недостаточным, так как обработка интактных растений
ГА усиливает рост междоузлий.
Как уже отмечалось, экзогенный
ауксин не влияет на рост интакт-
ных растений.
На рост стеблей у двудоль-
ных растений оказывает влияние
и этилен. При обработке этиле-
ном клетки, растущие растяже-
нием, увеличиваются не в длину,
а изодиаметрически. Это приво-
дит к укорочению и утолщению
молодых растущих междоузлий.
Сверхоптимальные концентрации
Рис. 4.14. Отток гибберелли-
на (/) и ауксина (2) из листь-
ев разного возраста (Уорринг,
Филлипс, 1984).
1 — листья подсолнечника, 2 —
листья колеуса. По оси абсцисс —
номера пар листьев (/ — самый
молодой), по оси ординат — коли-
чество ИУК или ГАз (экв. мкг/кг
сырой массы • 102).
ауксина вызывают сходный эф-
фект. Это происходит потому, что-
ауксин в высоких дозах индуци-
рует синтез фермента — синта-
зы аминоциклопропанкарбоновой
кислоты, под действием которой
образуется предшественник эти-
лена, превращающийся в этилен
некоторых растений, растущих под
под действием оксидазы. У
водой (болотник, рис и др.), растяжение междоузлий под дей-
ствием этилена не тормозится, а ускоряется.
4.1.6. РОСТ СТЕБЛЯ В ТОЛЩИНУ
Первичное утолщение происходит в сердцевине (ме-
дуллярное утолщение), в первичной коре (кортикальное утол-
щение) под апикальной меристемой. Первичный рост стебля
в толщину осуществляется в результате периклинальных деле-
ний и растяжения клеток. Размер зоны первичного утолщения
стебля изменяется по мере роста побега в длину. У проростка
объем апикальной меристемы невелик. Затем по мере формиро-
вания этой меристемой новых узлов объем апекса увеличи-
вается, и при этом относительно возрастает первичное утолще-
ние стебля, т. е. происходит рост усиления.
Вторичное утолщение стебля — результат деятель-
ности камбия (см. рис. 4.9), который возникает из прокамбия.
Камбий состоит из тонкостенных уплощенных клеток, вытяну-
тых вдоль оси стебля. Плоские широкие стороны каждой клет-
ки обращены внутрь и наружу стебля. Камбиальные клетки
делятся тангенциально, т. е. параллельно плоским сторонам.
После каждого деления одна из дочерних клеток сохраняет спо-
собность выполнять функции инициальной клетки. Другая до-
черняя клетка делится еще 2—3 раза, и все ее производные
дифференцируются в элементы либо вторичной ксилемы (внутрь
60
€т инициальной клетки), либо вторичной флоэмы (снаружи от
пнициали). Вторичную ксилему называют древесиной, вторич-
ную флоэму — лубом. Таким образом, вторичное утолщение
стебля связано с отложением вторичных проводящих тканей.
При длительном утолщении у многих видов эпидерма и пер-
вичная кора погибают и заменяются перидермой (вторичной
защитной тканью). Перидерма образуется из феллогена (проб-
кового камбия), который формируется в результате тангенци-
ального деления клеток эпидермы или коры. Некоторые травя-
нистые двудольные и большинство однодольных лишены вто-
ричных утолщений из-за отсутствия камбия.
Деятельность камбия активируется ауксином и гибберелли-
ном, поступающими из почек и молодых листьев. Если у моло-
дых растений подсолнечника удалить апикальную почку, то
у таких декапитированных растений прекращается деление кле-
ток камбия в пучках междоузлий, а межпучковый камбий не
образуется. Если через поверхность среза вводить ауксин, нор-
мальная активность камбия восстанавливается и наблюдается
вторичное утолщение стебля.
У изолированных отрезков гипокотилей клещевины экзоген-
ные ИУК, ГА3 и кинетин ускоряют развитие камбия. Причем
ГА3 проявляет наибольший стимулирующий эффект особенно
при добавлении сахарозы. Деятельность камбия у древесных
начинается весной при распускании почек и распространяется
в базальном направлении вплоть до кончиков корней, что свя-
зано с полярным транспортом ауксина. Действительно, актив-
ный камбий весьма богат ауксином, причем наблюдается па-
раллелизм между количеством экстрагируемой ИУК и актив-
ностью камбия. Как уже отмечалось, сравнительно высокая
концентрация ауксина благоприятствует образованию ксилемы;
высокие концентрации гиббереллина более благоприятны для
формирования флоэмы. В экстрактах из камбия различных рас-
тений обнаружены и цитокинины. В экспериментальных усло-
виях показано, что кинетин активирует не только деятельность
камбия, но и лигнификацию элементов ксилемы.
Формирование в стебле новых листовых и веточных следов
и слияние их со стеблевыми пучками также находится под кон-
тролем ауксина (рис. 4.15,/). Если взять отрезок стебля или
корня (горох, редис и др.) и нанести сбоку на поверхность
среза 1%-ную ИУК в ланолине, то в течение нескольких дней
из клеток коровой паренхимы сформируется новый сосудистый
пучок, аналогичный листовому следу, который отклоняется в
сторону уже имеющегося пучка и наконец сливается с ним.
Это явление можно объяснить полярным транспортом ауксина.
Поток ИУК вызывает поляризацию паренхимных клеток и
в связи с этим их ориентированный рост, а также включает
генетическую программу образования элементов проводящих
тканей. Каждая клетка, индуцированная таким образом аукси-
61
ном, облегчает дальнейший транспорт фитогормона, канализи- >
рует его. Канализация обусловлена тем, что клетка, в апикаль-
ный конец которой поступила ИУК, секретирует ее на базаль-
ном конце (см. рис. 3.1), индуцируя повторение этих процессов
в следующей клетке (автокаталитический процесс). Сосудистый
пучок, по которому транспортируется ИУК, оказывает воздей-
ствие на соседние клетки. Это проявляется в том, что при пол-
ной загруженности пучка транспортируемой ИУК новый пучок
Рис. 4.15. Влияние ауксина на образование со-
судов в отрезках стебля или корня (по: Sachs,
1981).
1 — образование контактов между вновь формирующи-
мися (волнистые линии) и ранее существовавшими со-
судами (прямая линия); 2 — отсутствие контактов при
«загрузке» экзогенным ауксином зрелых сосудов; 3 —
формирование сосудов в ответ на разные концентрации
ауксина (зрелые сосуды удалены). Черными каплями
обозначен ланолин, содержащий ауксин.
не может с ним соединиться. Полная загруженность пучка мо-
жет быть создана нанесением 1%-ной ИУК в ланолине на срез
в районе функционирующего пучка (см. рис. 4.15,2). Такая же
ситуация создается в целом растении, когда из молодых расту-
щих листьев по этому пучку транспортируется большое количе-
ство ауксина. Мощность формирующегося пучка также зависит
от количества транспортируемого ауксина (см. рис. 4.15,5).
Одновременное нанесение цитокинина на базальный конец от-
резка стебля способствовало более интенсивной дифференци-
ровке флоэмных элементов.
4.1.7. ВЕТВЛЕНИЕ ПОБЕГА
Для большинства семенных растений характерно боковое
ветвление, которое обеспечивается закладкой пазушных боко-
вых почек в верхушечной меристеме побега (см. 4.1.3). Распо-
ложение пазушных почек точно соответствует листорасположе-
нию, характерному для того или другого вида. Почки, заклады-
62
вающиеся в других местах (на стебле, листьях, корнях), назы-
вают придаточными, или адвентивными.
Пазушная почка находится под двойным ингибирующим кон-
тролем: со стороны развивающейся верхушечной апикальной
почки и со стороны листа, в пазухе которого она расположена
(кроющего листа). Основное ингибирующее влияние на рост
пазушных почек побега оказывает апикальная почка (апикаль-
ное доминирование). Тормозящее действие кроющего листа про-
является в большей степени в период его роста; зрелый лист
уже может способствовать росту своей пазушной почки, снаб-
жая ее ассимилятами. Затенение листа часто снижает его тор-
мозящее действие. Степень доминирования апикальной почки
сильно варьирует у разных видов растений. Например, у высо-
ких разновидностей подсолнечника оно распространяется почти
на всю длину стебля, подавляя ветвление. У других растений
(томаты, картофель) ингибирующее действие апикальной поч-
ки слабеет по мере ее удаления от нижележащих пазушных
почек; такие растения образуют куст. У многих видов домини-
рование верхушки побега ослабевает с возрастом. Так, у ясе-
ня и явора в первые годы интенсивно растет главный побег,
а затем наблюдается усиленное ветвление.
В экспериментальных условиях снятие апикального домини-
рования наблюдается при удалении апикальной почки. В этих
условиях трогаются в рост одна или более расположенных ниже
боковых почек. При этом обычно начавшая расти самая верх-
няя почка становится доминирующей, подавляя рост остальных..
Еще в 1934 г. К. Тиманн и Ф. Скуг показали, что экзогенная
ИУК, нанесенная на срез стебля после удаления апикальной
почки, ингибирует рост боковых почек. Точно так же тормозя-
щее влияние листа на пазушную почку можно имитировать
обработкой черешка, оставшегося после удаления листовой пла-
стинки ауксином (рис. 4.16). Эти опыты показывают, что глав-
ным фактором тормозящего действия апикальной почки и
листьев на рост боковых почек является ауксин. Гиббереллин
таким действием не обладает. Однако обработка им интактной
верхушечной почки усиливает апикальное доминирование. Этот
эффект может быть связан с усилением роста почки и с повы-
шением уровня ПУК в тканях, что характерно для действия
гиббереллина.
Существует несколько гипотез, объясняющих роль ИУК и
явлении апикального доминирования:
1. Прямое ингибирующее действие ауксина. Предполагается^
что концентрация ИУК, поступающей из апикальной почки,,
слишком велика для пазушной почки, что и приводит к ее ин-
гибированию.
2. Трофическая гипотеза ингибирования. Согласно этой точ-
ке зрения базипетально передвигающийся в стебле ауксин по-
давляет развитие проводящих пучков от стеблевых пучков к бо-
63;
ковым почкам. Однако в ряде случаев обнаружено, что при де-
капитации побега сосуды развиваются после того, как боковая
почка уже начала расти.
Рис. 4.16. Схема, иллюстрирующая эффекты ИУК на рост
пазушных почек и корней у отрезков стебля норичника с
2 листьями.
Заштрихован агаровый блок с ИУК.
3. Гипотеза конкуренции за цитокинин. Известно, что части
растений, обогащенные эндогенным или экзогенным ауксином
(развивающаяся апикальная почка, обработанная ауксином
верхушка декапитированного побега), становятся центрами при-
тяжения питательных веществ и фитогормонов, в том числе
цитокинина. В этом проявляется аттрагирующий эффект ИУК,
который опосредован активирующим действием ауксина на
Н+-помпу. В результате цитокинин перехватывается этими бо-
лее сильными аттрагирующими (притягивающими) центрами и
в пазушные почки не поступает фитогормон, необходимый для
активации клеточных делений. Эта гипотеза кажется весьма
правдоподобной. Действительно, при наличии интактной апи-
кальной почки рост пазушных почек можно индуцировать пу-
тем их прямой обработки цитокинином. Причем в ряде случаев
после обработки цитокинином рост пазушных почек сначала
активируется, а потом затухает. Для поддержания их роста не-
обходима дополнительная обработка ауксином. Последнее сви-
детельствует против гипотезы прямого ингибирующего действия
ауксина. Все сказанное позволяет считать, что конкуренция за
цитокинин между апикальной почкой и листьями, с одной сто-
роны, и пазушными почками — с другой, лежит в основе подав-
ления роста пазушных почек.
Теория конкуренции за цитокинин объясняет и пробуждение
спящих почек в основании ствола лиственных деревьев при
старении или удалении основного ствола (пневая поросль).
В данном случае все цитокинины, поставляемые корневой систе-
64
мой, поступают в эти почки, что индуцирует их пробуждение и
рост. Интенсивность кущения у злаков, по-видимому, опреде-
ляется степенью предварительного развития корневой системы,
поставляющей цитокинины к подземным и приземным почкам
в основании главного побега. В результате из этих почек на-
чинают формироваться боковые побеги.
4.1.8. НАПРАВЛЕНИЕ РОСТА ПОБЕГОВ
Главный побег в большинстве случаев в течение всей жизни
сохраняет первоначальный отрицательный гравитропизм, т. е.
остается ортотропным (вертикальным). Горизонтально расту-
щие побеги называют плагиотропными. Боковые побеги при вет-
влении занимают характерное для каждого вида положение от-
носительно главного побега. От величины угла между стволом
и скелетными ветвями во многом зависит специфическая форма
кроны деревьев разных видов.
Ориентация боковых побегов, корневищ и столонов нахо-
дится под контролем апикальной почки вертикального побега.
При повреждении или удалении у ели верхушки ствола ближай-
шие к ней боковые ветки начинают расти вертикально, конкури-
руя друг с другом. Как правило, одна из них заменяет собою
утраченную верхушку, побуждая остальные конкурирующие по-
беги вернуться в исходное латеральное положение. Горизон-
тальные побеги травянистых растений (корневища, столоны)
начинают расти вверх, если декапитировать надземный верти-
кальный побег и удалить у него все боковые побеги (рис. 4.17).
Все описанные явления можно воспроизвести экспериментально,
Рис. 4.17. Коррелятивные взаимоотношения апикальной поч-
ки побега и ориентация столона у дикого картофеля.
I — в присутствии апикальной почки столоны растут горизонтально,
2 — апикальная почка удалена.
5 Заказ X? 399
65
изменяя соотношение ИУК, в норме поступающей из верхушки
побега, ГА, образующихся в листьях, и цитокинина, поступаю-
щего из корней. В опытах с декапитированными побегами дико-
растущего картофеля, имеющими пазушную почку, было пока-
зано, что нанесенная на поверхность среза ланолиновая паста
с ИУК тормозила рост пазушной почки, формирующей верти-
кальный облиственный боковой побег. ГА3, наоборот, ускоряла
его рост в длину. Однако при совместном нанесении на поверх-
ность среза ИУК и ГА3 пазушная почка начинала расти гори-
зонтально и формировала столон. Если же верхушку такого сто-
лона обрабатывали кинетином, то он начинал расти вертикаль-
но и превращался в облиственный побег (рис. 4.18). Таким об-
Рис. 4.18. Гормональная регуляция развития столонов
у дикорастущего картофеля Solatium andigena (Уо-
ринг, Филлипс, 1984).
Заштрихован участок стебля с нанесенным ланолином, не со-
держащим (контроль) или содержащим фитогормоны. Кн — ки-
нетин.
разом, при достаточном количестве гиббереллина избыток ИУК,
поступающей из верхушки побега, превращает боковой побег
в плагиотропный, а повышение уровня цитокинина относитель-
но ауксина способствует развитию этого побега в вертикальном
направлении. Значение описанного здесь гормонального ба-
ланса вполне объясняет и результаты опыта, представленные на
рис. 4.17.
66
4.1.9. ПОКОЙ ПОЧЕК
У древесных сформированные пазушные почки., коррелятив-
но ингибированные развивающейся апикальной почкой и крою-
щими листьями, не растут и не образуют побеги (см. выше).
Если удалить апикальную почку и (или) листья, то пазушные
почки трогаются в рост (см. рис. 4.16). Таким образом, летний
покой пазушных почек не определяется их собственным внут-
ренним состоянием.
В конце вегетационного периода с укорочением длины дня
все почки древесных растений средних и северных широт пере-
ходят в состояние глубокого физиологического покоя, что позво-
ляет им пережить неблагоприятный зимний период. Эта фото-
периодическая индукция прекращения роста побегов и образо-
вания зимующих почек связана с функционированием фито-
хрома в листьях (см. 8). Следует отметить, что фотопериодиче-
ская реакция древесных в большей степени зависит от длины
темнового периода, и если он прерывается кратковременным
действием красного света, то эффект темнового периода устра-
няется и переход в состоянии покоя задерживается. Дальний
красный свет снимает действие красного света.
Переход почек в состояние глубокого физиологического по-
коя связан с изменением гормонального баланса. В апикальных
почках уменьшается содержание свободных ИУК, ГА и цитоки-
нинов. Как в апикальных, так
концентрация АБК. Однако
экспериментально индуциро-
вать покой обработкой побе-
гов раствором абсцизовой
кислоты удается очень ред-
ко. Короткодневный фотопе-
риод сам по себе без пони-
женных температур также
обычно не приводит к накоп-
лению АБК в листьях и
апексах побегов. Покоящие-
ся почки теряют способность
распускаться при искусст-
венном удалении листьев или
при осеннем их опадении.
Почки долго остаются в
состоянии глубокого физио- \
логического покоя. В тече-
ние зимы покой почек осла-
бевает. Ветки, срезанные в
октябре—начале декабря и
поставленные в воду в теп-
лой комнате, остаются в по-
и в пазушных почках возрастает
Рис. 4.19. Активность цитокинина (1)
и ауксина (2) в ксилемном соке сеян-
цев яблони в течение года.
По оси абсцисс — месяцы года, по осям орди-
нат: (1) — эквиваленты кинетина (мкг/100 мл>
илы (2) — ауксина.
5*
67
кое, а взятые в январе и особенно в феврале — марте, на-
чинают распускаться в тепле. Для снятия состояния глу-
бокого покоя древесные растения должны пройти период
длительного охлаждения. Наиболее эффективны темпера-
туры 0—5 °C в течение 25—60 сут. Под действием низ-
ких температур по мере окончания периода глубокого покоя в
почках и в ксилеме проводящих пучков увеличивается содер-
жание активирующих рост фитогормонов (рис. 4.19) и сни-
жается концентрация АБК. Распускание почек ранней весной
тормозится низкими температурами (вынужденный покой) и
начинается при наступлении теплых дней. Для распускания вес-
ной почек некоторых древесных (например, рододендрона) не-
обходим длиннодневный фотопериод.
4.2. РОСТ КОРНЯ
Корневая система в типичном случае выполняет функцию
закрепления растения в почве и его почвенного питания. Ко-
рень, как и побег, — осевой орган, обладающий радиальной
симметрией и способный к длительному росту благодаря дея-
11
тельности апикальной меристемы.
Внутреннее строение корня про-
ще, чем строение стебля. Он не
расчленен на узлы и междоузлия
и имеет корневой чехлик, кото-
рый защищает апикальную мери-
стему. Боковыми органами корня
являются корни 1-го, 2-го и т. д.
порядков, которые образуются
эндогенно, т. е. из внутренних
тканей. Корень в отличие от по-
бега характеризуется экзархным
заложением протоксилемы, т. е.
первые элементы ее удалены от
оси корня и дальнейшая диффе-
ренцировка осуществляется цен-
тростремительно.
Рис. 4.20. Схема, отражающая распре-
деление зон роста и последовательность
дифференцировки тканей в кончике
корня.
1 — перицикл, 2 — незрелые элементы флоэ-
мы, 3 — зрелые элементы флоэмы, 4 —эндо-
дерма без поясков Каспари, 5 — незрелые эле-
менты ксилемы, 6 — ризодерма, 7 — первич-
ная кора, 8 — эндодерма с поясками Каспа-
ри, 9 — зрелые элементы ксилемы, 10 — корне-
вые волоски, 11 — центральный цилиндр. I —
корневой чехлик, II — зона меристемы, III —
зона растяжения, IV — зона корневых волос-
ков.
68
Первичный корень семенного растения формируется в заро-
дыше (см. 2.1). У голосеменных и двудольных зародышевый
корень становится главным (стержневым) корнем и формирует
боковые корни (стержевая корневая система). У однодольных
первичный корень относительно быстро заменяется придаточ-
ными корнями, образующимися в основании побега (мочкова-
тая корневая система). У двудольных придаточные корни могут
формироваться на любых частях растения. Стержневая корне-
вая система служит для глубокого проникновения в почву,
а мочковатая — для закрепления растения в поверхностных
слоях почвы.
Общий план строения главного, придаточного и боковых кор-
ней одинаков. На дистальном конце корня находится апикаль-
ная меристема (апекс корня), покрытая корневым чехликом.
После ряда делений в меристеме клетки переходят к росту рас-
тяжением и затем по окончании дифференцировки начинают
функционировать. Таким образом, в корне можно выделить че-
тыре зоны: деления, роста растяжением, поглотительную (зону
корневых волосков) и проведения (вся остальная часть корня)
(рис. 4.20).
4.2.1. АПЕКС КОРНЯ И ФОРМИРОВАНИЕ ТКАНЕЙ
Апикальная меристема корня является гетерогенной популя-
цией клеток, которые отличаются друг от друга размерами и
продолжительностью клеточного цикла. Согласно теории гисто-
генов И. Ганштейна (1870) в апексе корня имеются три гисто-
гена, т. е. три группы меристематических клеток, из которых
формируются ткани корня: дерматоген (предшественник эпи-
дермы), периблема (предшественник первичной коры) и плеро-
ма (предшественник центрального цилиндра, или стелы). Каж-
дый из гистогенов происходит от соответствующих инициаль-
ных клеток, которые у покрытосеменных расположены в три
слоя. Эта теория основывается на том, что в корне обычно
легко прослеживаются продольные ряды клеток от их инициа-
лей в дистальном конце апекса. У двудольных из нижних ини-
циальных клеток (рис. 4.21) формируются клетки как корне-
вого чехлика, так и дерматогена (протодермы). Средний слой
инициалей дает начало периблеме и, наконец, верхний слой —
рядам клеток плеромы. У однодольных инициали нижнего слоя
корневого апекса образуют только чехлик, а инициали сред-
него— дерматоген и периблему. Инициали каждого слоя со-
стоят из 1—4 клеток. У некоторых двудольных и однодольных
инициали не имеют четкого' разделения на ярусы. То же самое
наблюдается и у голосеменных.
69
Дистальные клетки в апикальной меристеме корня (инициа*
ли гистогенов) входят в состав популяции клеток покоящегося
центра, клетки которого делятся редко. Клетки проксимальной
Рис. 4.21. Схема организации апекса корня цвет-
кового растения.
1 — три группы инициальных клеток: корневой чехлик
и дерматоген образуются одними и теми же инициа-
лями; 2 — три группы инициальных клеток: корневой
чехлик образуется отдельными инициалями.
части апикальной меристемы (дерматоген, периблема, плеро-
ма), а также клетки чехлика, примыкающие к покоящемуся
центру, делятся более интенсивно, чем клетки покоящегося
центра, образуя все ткани корня.
Покоящийся центр. Клетки покоящегося центра отличаются
от других клеток апикальной меристемы корня меньшими по
размеру ядрышками и более низким содержанием РНК в цито-
плазме. Для этих клеток характерны низкие скорости синтеза
нуклеиновых кислот и белка. Скорость их делений приблизи-
тельно в 10 раз меньше, чем у соседних меристематических
клеток. Время удвоения числа клеток в покоящемся центре кор-
ня кукурузы 107—277 ч (рис. 4.22). Большая продолжительность
митотического цикла создается за счет удлинения Gi-периода.
Клетки покоящегося центра имеют меньшее количество плазмо-
десм. Среднее значение мембранного потенциала в клетках по-
коящегося центра корней кукурузы в три раза ниже, чем в
клетках проксимальной меристемы, и составляет —40 мВ. Акти-
вация деления клеток покоящегося центра, например, после
облучения корня рентгеновскими лучами (см. ниже), приводит
70
к возрастанию МП. Покоящийся центр включает в себя 500—
1000 клеток и имеет полусферическую или дисковидную форму.
Его объем варьирует у разных ви-
дов растений, а также зависит от
размера корня и условий внешней
среды. Покоящийся центр не всегда
обнаруживается в зародышевых кор-
нях при прорастании семян, напри-
мер у горчицы, конских бобов, маль-
вы и др. В этом случае он образу-
ется у вышедших из семени корней.
Полагают, что популяция клеток
покоящегося центра может форми-
роваться из недетерминированных
клеток апекса меристемы.
Клетки покоящегося центра бо-
лее устойчивы к таким повреждаю-
щим воздействиям, как ионизирую-
щая радиация, ультрафиолетовый
свет и т. д., что связано с низ-
кой частотой их деления. В связи
с этим покоящийся центр спо-
собен осуществлять регенера-
цию апикальной меристемы при
|Рис. 4.22. Среднее время
Зудвоения числа клеток (ч)
1в покоящемся центре и
^прилежащих к нему слоях
чехлика и других тканей в
корне кукурузы (Clowes,
1981).
ее повреждении. При удалении
корневого чехлика или гибели части клеток проксимальной
меристемы клетки покоящегося центра начинают интенсивно
делиться и восстанавливают чехлик и утраченные части мери-
стемы апекса корня. После этого клетки покоящегося центра
вновь переходят в состояние митотического покоя. Активация
делений в покоящемся центре происходит и при выходе расте-
ний из периода покоя в результате продолжительного воздей-
ствия низкими положительными температурами.
Причиной замедленного деления клеток в покоящемся центре
может быть интенсивная митотическая активность окружающих
клеток, которые перехватывают питательные вещества и фито-
гормоны. Действительно, при культивировании изолированных
покоящихся центров корней кукурузы в стерильных условиях
для образования оси корня в инкубационную среду помимо тро-
фических факторов и витаминов необходимо добавлять ИУК и
цитокинин (0,1 мг/л). Другой причиной торможения деления
клеток в покоящемся центре, возможно, является действие АБК,
которая синтезируется в корневом чехлике. Изучение содержа-
ния фитогормонов в апексе корня с помощью биотестов и имму-
нохимическим методом показало, что в клетках проксимальной
меристемы содержание цитокинина выше, чем в окружающих,
тканях. Это позволило предположить, что синтез цитокинина в
корне происходит именно в этом участке. В покоящийся центр
71
поступает также ауксин из проводящих тканей в результате его3
полярного транспорта из верхушки побега к кончику корня (см.
рис. 3.6). Регулирующим фактором для функционирования по-
коящегося центра может быть и поставка углеводов, синтези-
руемых в побеге.
Проксимальная меристема апекса. Клетки проксимальной
меристемы на границе с покоящимся центром интенсивно де-
лятся преимущественно перпендикулярно оси корня. У куку-
рузы среднее время удвоения клеток в периблеме составляет
30 ч, а в плероме— 15 ч (см. рис. 4.22). В корнях большинства
растений при оптимальных условиях клетки делятся через
каждые 10—20 ч. Продолжительность митотического цикла
мало меняется у клеток на протяжении большей части прокси-
мальной меристемы. Число митозов на единицу площади в пе-
риблеме наибольшее в нижней ее части, а в плероме — в верх-
ней. Число делений в потомстве клетки в каждом ряду после
выхода ее из покоящегося центра не превышает 5—6, а у мно-
гих растений даже меньше, особенно в тонких корнях. Время
жизни клеток в меристеме ограничено, например, для корней
кукурузы оно составляет около 3 дней. Причем это время не
зависит непосредственно от интенсивности делений клеток. Оно
мало меняется при действии различных метаболических инги-
биторов, но сокращается при повышении температуры. В стеле
в отличие от других тканей по мере удаления от кончика корня
происходит постепенное увеличение продолжительности мито-
тического цикла клеток и их длины.
На продолжительность митотического цикла не влияет аук-
син в низких концентрациях, в которых он активирует рост
корня. В высоких концентрациях ИУК ингибирует пролифера-
цию. Кинетин (5 мкМ) сокращает на 30% время цикла в кор-
нях гороха за счет укорочения периода Gi, тогда как АБК
(20 мкМ), напротив, удлиняет этот период почти в 2 раза. Эти-
лен также удлиняет митотический цикл, увеличивая продолжи-
тельность Gi и в меньшей степени — G2. В проксимальной мери-
стеме, как отмечалось выше, найдено значительное количество
зеатина, и предполагается, что апикальная меристема корня
является основным местом синтеза цитокининов в вегетирую-
щих растениях. В меристеме апекса корня синтезируется так-
же и гиббереллин или завершается его синтез из предшествен-
ников, поступающих из побега. Оба фитогормона транспорти-
руются в побег пассивно по сосудам ксилемы. Содержание
ИУК также выше в апикальной меристеме, чем в других тка-
нях корней. С помощью вибрирующего электрода показано, что
в районе апикальной меристемы и в начале зоны растяжения
(ом. рис. 3.7) регистрируются входящие электрические токи
плотностью от 2 до 28 мА-м-2. Среднее значение мембранного
потенциала в клетках проксимальной меристемы составляет
примерно —120 мВ. Сравнение величин МП и длительности ми-
72
готического цикла клеток проксимальной меристемы и покоя-
щегося центра (см. выше) позволяет предполагать, что эти по-
казатели могут быть причинно связаны.
У многих растений в участке корня, где происходят послед-
ние клеточные деления, увеличивается количество клеток с уд-
военным набором ДНК, т. е. число клеток, находящихся в G2-
фазе, что может иметь значение для быстрого повышения мито-
тической активности при изменении условий роста, а также для
последующего роста клеток растяжением. Клетки проксималь-
ной меристемы весьма чувствительны к действию различных
повреждающих факторов: ионизирующего излучения, химиче-
ских веществ и т. д. При хирургическом удалении покоящегося
центра клетки проксимальной меристемы восстанавливают его.
В проксимальной меристеме начинается дифференцировка
ряда специализированных тканей (см. рис. 4.20), прежде всего-
перицикла (наружного слоя стелы), затем эндодермы (еще без
поясков Каспари) и протофлоэмы. Первыми завершают деле-
ние клетки протофлоэмы. Более продолжительный период деле-
ния наблюдается в эндодерме и перицикле.
4.2.2. КОРНЕВОЙ ЧЕХЛИК
Корневой чехлик занимает терминальное положение в корне*
(см. рис. 4.20). Его функции разнообразны: 1) он защищает
апикальную меристему и помогает растущему корню продви-
гаться в почве; 2) чехлик является сенсорной зоной, восприни-
мающей действие силы тяжести, света, давления, градиентов
химических веществ и регулирующей скорость и направление*
роста всего корня (см. рис. 3.5); 3) в его клетках синтезиру-
ются фитогормоны (АБК и, возможно, другие) и неидентифици-
рованные ингибиторы роста; в чехлике происходит изменение-
направления полярного транспорта ИУК, поступающей из по-
бега, на базипетальный транспорт от кончика корня (см.,
рис. 3.6).
Чехлик состоит из паренхимных клеток, инициали которых
находятся в нижнем слое инициалей апекса корня (см. 4.2.Г,,
рис. 4.21). Клетки, отделяемые инициалью корневого чехлика,
продолжают делиться и часто выглядят как самостоятельная
меристема чехлика. Время удвоения числа клеток в этой мери-
стеме вблизи инициали у кукурузы составляет в среднем'
7 ч и по мере удаления от инициали возрастает до 126 ч (см.
рис. 4.22). Производные этих меристематических клеток в цен-
тральной части чехлика получили название колумеллы (колон-
ки). Клетки колумеллы являются органом, воспринимающим’
действие гравитации (см. 3.1.3).
Клетки корневого чехлика путем везикулярной секреции вы-
деляют полисахаридную слизь и постоянно слущиваются с по-
та’
верхности. При слущивании и сами клетки превращаются в
слизь. Секреторная активность (у кукурузы) осуществляется
ритмично с максимумами через каждые 3 ч и синхронизацией
этого процесса у всех клеток чехлика. От формирования каждой
клетки до ее слущивания проходит не более 5—6 сут. Слизь
облегчает продвижение корня в почве и, кроме того, содержит
вещества, в частности гликопротеины — лектины, которые за-
щищают клетки корня от патогенов.
Как уже отмечалось, удаление чехлика активирует деление
клеток покоящегося центра. Ингибирующее действие чехлика
на пролиферацию клеток покоящегося центра может быть свя-
зано с АБК, которая синтезируется в клетках чехлика и посту-
пает в растущую часть корня. Показано, что АБК угнетает ми-
тотическую активность и снижает среднее значение МП клеток
меристемы корня.
Удаление -корневого чехлика временно активирует также уд-
линение корня, ускоряя рост клеток в зоне растяжения. Одной
из причин этого ускорения может быть уменьшение базипеталь-
ного транспорта ауксина, который начинается от клеток корне-
вого чехлика (см. 3.1.3). Другой причиной может быть резкое
снижение поступления АБК в дистальную часть корня при уда-
лении корневого чехлика. По-видимому, и ауксин, и цитокинин
поступают в корневой чехлик из вышележащих тканей.
4.2.3. ЗОНА РОСТА КЛЕТОК РАСТЯЖЕНИЕМ
Рост растяжением — особый способ увеличения размеров
клеток, присущий только растительным организмам. Его можно
разделить на три периода: переход к растяжению, растяжение,
торможение и остановка роста.
Переход прекративших деление меристематических клеток
к растяжению в корне происходит почти одновременно. Этот
переход определяется окончанием времени жизни клетки в ме-
ристеме и, по-видимому, связан с включением специфической
генетической программы. Одним из компонентов этой програм-
мы может быть синтез белков-рецепторов ИУК, необходимых
для действия ауксина на рост растяжением. Скорость перехода
к растяжению не зависит от числа клеток в меристеме в дан-
ный момент: удаление части меристемы не влияет на срок пере-
хода оставшихся меристематических клеток к растяжению. Про-
цесс перехода к растяжению устойчив к действию таких небла-
гоприятных факторов, как рентгеновское облучение в высоких
дозах, действие ингибиторов синтеза РНК и белков и др. Это
позволяет думать, что метаболический аппарат, обеспечиваю-
щий растяжение клеток, формируется уже в меристеме. В ме-
ристематических клетках, готовящихся перейти к растяжению,
начинается вакуолизация, расширяются цистерны эндоплазма-
тического ретикулума, свободные рибосомы собираются в поли-
74
сомы и связываются с мембранами ЭР, синтез РНК возрастает,
что приводит к увеличению отношения РНК/белок.
Переход клетки, готовой к растяжению, к самому растяже-
нию зависит от градиентов таких физико-химических факторов,
как О2, СО2, pH, электрических полей, от концентрации фито-
гормонов и прежде всего ИУК.
Механизм роста растяжением радикально отличается от спо-
соба роста меристематических клеток, у которых дочерние
клетки достигают размеров материнской благодаря синтезу
компонентов цитоплазмы и клеточных стенок. При росте растя-
жением объем клетки возрастает главным образом за счет
образования и последующего увеличения центральной вакуоли.
Накапливающиеся в вакуоли осмотически активные вещества
(соли, органические кислоты, сахара и др.) способствуют ин-
тенсивному поступлению в нее воды по законам осмоса. Одно-
временно с этим происходит увеличение эластической и пласти-
ческой растяжимости клеточных стенок, в результате чего под
действием осмотического давления вакуолярного сока резко уве-
личивается объем клетки. Растяжение клеточной стенки сопро-
вождается секрецией полисахаридов и синтезом полимерных
компонентов клеточной стенки (целлюлозы, гемицеллюлоз, пек-
тинов), что поддерживает рост клетки. В процессе роста рас-
тяжением в нормальных условиях происходит и синтез элемен-
тов цитоплазмы, которая оттесняется вакуолью к периферии
клетки и располагается тонким пристенным слоем. Объем кле-
ток, растущих растяжением, увеличивается в 10—30 раз по
сравнению с объемом меристематических клеток. Растительные
клетки при растяжении, как и при делении, растут взаимосвя-
занно, без смещения (скольжения) относительно друг друга.
Механизм такого взаимосвязанного роста не известен. Можно
предположить, что существенную роль во взаимной корректи-
ровке роста соседних клеток играют плазмодесмы.
ИУК активирует работу Н+-помпы в плазмалемме и синтез
белков, участвующих в механизме роста растяжением
(см. 6.1.2). Оптимальная концентрация ауксина для роста кле-
ток в зоне растяжения корней составляет 10~и—10-10М (см.
рис. 7.2). При увеличении его концентрации рост клеток растя-
жением продолжается, но они растут не в длину, а изодиамет-
рически. Это связано с тем, что при увеличении концентрации
ИУК в клетках начинается синтез этилена, который меняет ори-
ентацию микротрубочек под плазмалеммой. Поперечное по от-
ношению к оси клетки расположение микротрубочек характер-
но для клетки, растущей в длину. Нарушение упорядоченного
положения микротрубочек под действием этилена создает усло-
вия для роста клетки во всех направлениях. Предполагается,
что ориентация микротрубочек обусловливает ориентацию син-
тезируемых микрофибрилл целлюлозы в клеточных стенках,
что, в свою очередь, определяет направление растяжения клет-
75
ки под действием тургорного давления. Описанное явление на-
блюдается при росте корня в плотных почвах. В этих условиях
высокое механическое сопротивление почвы приводит к выра-
ботке этилена в клетках корня (стрессовый этилен). В резуль-
тате изодиаметрического роста клеток в зоне растяжения воз-
никает утолщение (вместо удлинения), что способствует раз-
двиганию частиц почвы и дальнейшему росту корня. Обработка
корней экзогенным этиленом или ИУК в высоких концентра-
циях вызывает у корней двудольных растений вздутия в зоне
растяжения. В низких концентрациях этилен (0,02—0,1 мкл/л),
способен активировать удлинение корня.
Торможение и прекращение удлинения клеток может быть
связано с накоплением ингибиторов фенольной природы. Тормо-
жение роста растяжением сопровождается усилением лигнифи-
кации первичных клеточных стенок и формированием вторич-
ных клеточных стенок, не позволяющих клеткам растягиваться.
Для нормального роста растяжением в зону растяжения из
побега поступают ассимиляты, некоторые витамины и ИУК, не-
посредственно из почвы — вода и минеральные соединения.
Изолированные отрезки корня, включающие в себя апикаль-
ную меристему и зону растяжения, растут в стерильной среде,
содержащей минеральные соли, сахарозу и витамины: тиамин,
пиридоксин и никотиновую кислоту. Для роста изолированных
апикальных частей корней однодольных и некоторых двудоль-
ных в инкубационную среду необходимо добавлять и ауксин.
Можно думать, что отрезки корней тех двудольных, которые
растут в отсутствие экзогенного ауксина, начинают вырабаты-
вать его сами. Изолированные апикальные отрезки корней
после некоторого периода активного роста прекращают удли-
нение, очевидно, в результате накопления ингибиторов роста.
Продолжения роста изолированных корней в культуре можно
добиться, культивируя апикальные отрезки боковых корней,
образовавшихся на корне, прекратившем свой рост в культуре.
Как уже отмечалось, клетки зоны растяжения имеют сравни-
тельно высокий мембранный потенциал (порядка —120 мВ).
У ряда растений в зоне растяжения регистрируются входящие
электрические гоки, у других — выходящие токи или входящие
и выходящие токи скомпенсированы (см. рис. 3.7).
4.2.4. РОСТ КОРНЕВЫХ ВОЛОСКОВ
По окончании роста растяжением и завершении формирова-
ния проводящих пучков на внешней поверхности эпидермаль-
ных клеток корня появляются корневые волоски. У некоторых
растений (овсяница, пшеница, овес, рожь и др.) корневые во-
лоски образуются только специализированными клетками, на-
зываемыми трихобластами (греч. thrix, род. падеж trichos — во-
лос, и blastds — зародыш). Формирование этих клеток происхо-
76
7
дит в базальной части апикальной меристемы при последнем
делении эпидермальных клеток. В результате поляризации эпи-
дермальных клеток в продольном направлении ядро смещается
к дистальному концу клетки, и путем неравного деления обра-
зуются нижняя короткая клетка, имеющая плотную цитоплаз-
му, — трихобласт и верхняя более
длинная, сильно вакуолизированная
клетка — атрихобласт (рис. 4.23).
Трихобласты содержат более круп-
ные ядра и ядрышки, в них больше
белка и нуклеиновых кислот, чем в
атрихобластах. В период растяже-
ния атрихобласты сильно удлиня-
ются, трихобласты остаются корот-
кими и в зоне поглощения форми-
руют корневые волоски. У многих
других растений (например, у про-
са, кукурузы) корневой волосок мо-
жет возникнуть из любой эпидер-
мальной клетки.
Образование корневого волоска
начинается с локального размягче-
ния наружной клеточной стенки и
активной везикулярной секреции в
этом участке плазмалеммы. Еще
раньше к этому участку смещается
ядро. Секреторные пузырьки явля-
ются производными аппарата Гольд-
жи и поставляют в растущий уча-
сток полисахаридные компоненты
клеточной стенки. Мембраны вези-
кул встраиваются в плазмалемму.
Возникает выступ, который посте-
пенно удлиняется в результате ло-
кального верхушечного роста
(рис. 4.24). Движущей силой этого
ляется тургорное давление, создаваемое главным образом ва-
куолью. Длина зрелого корневого волоска составляет 2—5 мм,
а скорость роста — от 40 до 70 мкм-ч."1.
Встроенные в плазмалемму мембраны секреторных везикул
содержат в большом количестве комплексы синтазы целлюлозы,
которая необходима для образования полимерных цепей цел-
люлозы из УДФ-D- и ГДФ-В-глюкозы, поступающих из цито-
плазмы. Однако преобладающими полисахаридами в клеточной
стенке растущего кончика корневого волоска являются геми-
целлюлозы и пектиновые вещества. В большом количестве се-
кретируется также полисахаридная слизь. Существенную роль
в механизме верхушечного роста играет движение цитоплазмы
Рис. 4.23. Полоски эпидермы
из корня Elodea canadensis.
а — трихобласты в эпидерме, б —
трихобласты с развитыми корне-
выми волосками. 1 — трихобласты,
2 — корневой волосок.
локального удлинения яв-
77
(фонтанирующего типа), направленное в сторону верхушки.
Это движение способствует переносу в растущую зону везикул
и различных соединений, необходимых для синтетических про-
цессов. На некотором расстоянии от растущей верхушки в ци-
Рис. 4.24. Ультраструктура корневого волоска (по: Данилова, 1974).
J — ядро, 2 — вакуоль, 3 — ЭР, 4 — митохондрия, 5 — АГ, 6 — секреторные везикулы.
топлазме наблюдается скопление митохондрий, аппаратов
Гольджи и шероховатого ЭР, которые поддерживают верхушеч- ,
ный рост (см. рис. 4.24).
Анализ направления электрических токов в зоне поглощения
показывает, что токи входят в кончики растущих корневых во-
лосков и выходят из базальной части корневых волосков и из
безволосковых эпидермальных клеток (см. рис. 3.7,а). Одним
из компонентов входящего тока является вход ионов Са2+.
В отсутствие кальция во внешней среде рост корневых волос-
ков не происходит. Это объясняется, в частности, тем, что каль-
ций необходим для секреторной активности клеток. С помощью
флуоресцентной микроскопии при использовании хлортетрацик-
лина, связывающего кальций, показано, что в цитоплазме корне-
вых волосков имеется четкий градиент концентрации кальция
с максимумом в растущем кончике волоска (рис. 4.25).
Рис. 4.25. Выявление градиента ионов Са2+ в цитоплазме
корневого волоска Lepidium saitvum с помощью хлортетра-
циклина (Reiss, Herth, 1979).
Формирование корневых волосков значительно увеличивает
всасывающую поверхность корня, хотя в поглощении минераль-
ных веществ принимают участие и другие эпидермальные клет-
78
ки. Для появления корневых волосков необходим кислород,
й поэтому особенно интенсивно они образуются при росте кор-
ня во влажной камере. У тех растений, которые не имеют три-
хобластов, при росте в воде в отсутствие аэрации корни не фор-
мируют корневых волосков.
В регуляции образования корневых волосков основную роль
играют ауксин и этилен. Обработка корней этиленом в высо-
ких концентрациях или ИУК в концентрациях 0,01—0,1 мМ, ко-
торые индуцируют в клетках синтез этилена, приводит к массо-
вому образованию корневых волосков, причем они могут появ-
ляться даже на клетках протодермы.
Одновременно, как говорилось ранее,
наблюдается образование вздутия в
зоне растяжения (см. З.1.З.; 4.2.3). По-
видимому, этилен вызывает перерас-
пределение микротрубочек в цитоплаз-
ме эпидермальных клеток, что приво-
дит к выпячиванию наружной клеточ-
ной стенки и образованию корневого
волоска. Для последующего роста кор-
невого волоска также, вероятно, необ-
ходима ИУК, но только в очень низ-
ких концентрациях (рис. 4.26). Опти-
мальная для роста корневого волоска
Рис. 4.26. Влияние ИУК в
различных концентрациях
на скорость удлинения кор-
невых волосков (Jackson,
1960).
концентрация ауксина, вносимого из-
вне, составляет 10-13М. ИУК в кон-
центрациях выше 10~8 М тормозит рост
корневого волоска. Причиной появле-
ния корневых волосков при переходе
ОТ ЗОНЫ растяжения К зоне ПОГЛОЩе- По оси абсцисс — концентрация
г ИУК (М), по оси ординат —
НИЯ МОЖеТ бЫТЬ повышение В ЭТОМ скорость удлинения за 2 ч (% от
участке корня концентрации ИУК, скорк°оТдоР^
а следовательно, и этилена из-за рас-
пада цитоплазматических белков в формирующихся сосудах
ксилемы, в результате чего возрастает фонд триптофана, из ко-
торого образуется ИУК. Созревание сосудов ксилемы происхо-
дит акропетально по мере роста корня, и так же акропетально
перемещается по корню зона корневых волосков. Зрелые корне-
вые волоски функционируют в течение 2—3 дней и затем отми-
рают.
4.2.5. ДИФФЕРЕНЦИРОВКА ТКАНЕЙ ЦЕНТРАЛЬНОГО ЦИЛИНДРА
Центральный цилиндр начинает формироваться в апикаль-
ной меристеме корня, в плероме, которую можно рассматривать
как прокамбий. В центральной части меристемы уже появля-
ются белки, характерные для клеток центрального цилиндра,
выявляемые с помощью иммунохимического анализа. Наруж-
79
ный слой центрального цилиндра — перицикл — дифференцируч
ется раньше других тканей стелы. В проксимальной части апи-
кальной меристемы под перициклом развиваются клетки про-
тофлоэмы, которые характеризуются появлением ситовидных
трубок, но дифференцированные клетки-спутники еще отсутст-
вуют. На первых этапах растяжения клеток формируется зре-
лая первичная флоэма — метафлоэма, клетки которой продол-
жают растягиваться (см. рис. 4.20). Элементы прстоксилемц
начинают дифференцироваться в верхней половине зоны растя-
жения. У вытянутых клеток, превращающихся в сосуды, появ-
ляется вторичная клеточная стенка, которая откладывается в
виде спиралей или колец поперек длинной оси клетки, что поз-
воляет прососудистым клеткам растягиваться. В этих клетках
начинается распад цитоплазмы, однако они остаются живыми.
Торможение роста клеток ксилемы связано со сплошным отло-
жением вторичной клеточной стенки и формированием в ней
пор (сетчатые сосуды), с лигнификацией первичной и вторичной
клеточных стенок, полным отмиранием цитоплазмы и исчезно-
вением поперечных клеточных стенок. Таким образом клетки
протоксилемы превращаются в зрелые элементы метаксилемы,
характерные для зоны поглощения. Дифференцировка первич-
ных проводящих тканей как флоэмы, так и ксилемы происхо-
дит акропетально и центростремительно.
С окончанием дифференцировки первичных проводящих тка-
ней заканчивается формирование и эндодермы — внутреннего
слоя клеток первичной коры. В клеточных стенках эндодермы
образуются пояски Каспари, препятствующие перемещению
воды и растворенных в ней веществ по апопласту. Развитие
проводящих тканей (центрального цилиндра) в растущей части
корня, по-видимому, регулируется теми же гормональными ме-
ханизмами, что и в побеге (см. 4.1.4). При культивировании кон-
чиков корней гороха и редиса формируются нормальные про-
водящие ткани. Введение в среду ауксина увеличивает размер
прокамбиального цилиндра.
4.2.6. РОСТ КОРНЯ В ДЛИНУ
Из всего вышесказанного следует, что удлинение корня осу-
ществляется его апикальной частью в зоне растяжения. Корне-
вой апекс постоянно производит новые клетки, которые способ-
ны растягиваться. Если удалить апикальную меристему, то
рост в зоне удлинения продолжается (и даже усиливается) в
течение одних суток и затем прекращается из-за отсутствия но-
вых клеток, способных растягиваться. Таким образом, пролифе-
ративная активность апикальной меристемы обеспечивает дли-
тельность роста корня в длину. Для быстрого удлинения тре-
буются очень низкие концентрации ауксина (см. рис. 7.2). Воз-
растание потока ауксина из побега тормозит деление и растя-
80
жение клеток в апикальной части корня и, следовательно, рост
корня в длину. В интактном корне цитокинин синтезируется в
апикальной меристеме и необходим для пролиферации клеток.
В повышенных концентрациях он может тормозить удлинение
корня. Гиббереллины, как правило, не оказывают влияния на
рост корня в длину. АБК, образуемая корневым чехликом, тор-
мозит рост корня.
В стерильных условиях рост изолированных корней замед-
ляется с 5—6-го дня культивирования вследствие старения ме-
ристемы. Смена среды, улучшение аэрации не устраняют этого
явления. Торможение роста уменьшается при удалении зрелых
базальных частей корня. Предполагается, что в зрелых частях
накапливаются ингибиторы роста. Возможно также, что в ста-
реющих тканях корня образуется избыток ауксина при распаде
белков цитоплазмы, и это ингибирует рост корня в длину. Как
уже отмечалось, чередование при каждой последующей пере-
садке (пассаже) меристем главного и боковых корней поддер-
живает устойчивый рост изолированных корней неограниченно
долго.
Интенсивность удлинения корня зависит от многих факто-
ров внешней среды: достаточного водоснабжения, осмотической
концентрации почвенного раствора, состава солей, снабжения
О2, плотности почвы и т. д. При возрастании плотности почвы
уменьшаются длина клеток в зоне растяжения и размер этой
зоны (из-за образования этилена). Большое значение для роста
корня имеет кислотность среды: оптимум pH для роста корней
большинства растений лежит в пределах 5—6. Рост в длину
корней кукурузы, гороха, риса, пшеницы и других подавляется
светом. Реакция развивается в течение нескольких минут. При
этом свет обычно тормозит как пролиферативную активность,
так и удлинение клеток. У корней риса синий свет ингибиро-
вал как деление, так и растяжение клеток. Предполагается, что
свет задерживает растяжение корня, либо стимулируя образо-
вание ингибитора, либо увеличивая чувствительность тканей
к уже существующему в корне ингибитору. Показано, что в
клетках светочувствительных корней на свету возрастает уро-
вень абсцизовой кислоты, что указывает на возможность ее
участия в регуляции удлинения корня. У корней гороха инги-
биторные эффекты белого и красного света обращались осве-
щением дальним красным светом, что свидетельствует о функ-
ционировании в корне фитохромной системы.
4.2.7. РОСТ КОРНЯ В ТОЛЩИНУ
Утолщение корня происходит в зоне проведения и обуслов-
лено процессами вторичного роста. Этот тип роста наблюдается
у корней голосеменных и двудольных. Однодольные обычно не
имеют вторичного роста. Утолщение корня, как и стебля, свя-
6 Заказ № 399
81
зано с образованием вторичных проводящих тканей — флоэмы
и ксилемы из камбия. Камбий развивается из прокамбиальных
клеток, которые остаются между сформированными первич-
ными флоэмой и ксилемой (метафлоэмой и метаксилемой).
Деятельность камбия находится под контролем ауксина, ко-
торый полярно перемещается от верхушки побега к кончику
корня. В культуре изолированных корней даже в присутствии
ауксина в питательной среде вторичного роста, т. е. утолще-
ния корней за счет деятельности камбия, не наблюдается.
Однако если ИУК вводить через базальную поверхность среза
изолированного корня, то по мере полярного транспорта аук-
сина к кончику деятельность камбия активируется и происхо-
дит утолщение корня. В камбии клетки делятся тангенциально,
образуя на его периферии инициальные клетки, формирующие
все клеточные компоненты флоэмы и ксилемы. Ауксин инду-
цирует образование сосудов ксилемы. При относительно вы-
сокой концентрации ИУК дифференцировка сосудов происходит
ускоренно, и развиваются сосуды с малым диаметром. При бо-
лее низких концентрациях ауксина формирование сосудов осу-
ществляется медленнее. Клетки прососудистой ткани дольше
растут растяжением, и в результате возникают сосуды боль-
шого диаметра. Этилен способствует ксилогенезу. Индукция
образования тканей флоэмы, по-видимому, находится под кон-
тролем гиббереллинов. Тангенциальное деление клеток камбия,
т. е. деление клеток, широкая плоскость которого перпендику-
лярна радиусу осевого органа, указывает на наличие радиаль-
ной поляризации этих клеток, природа которой остается не из-
вестной. Столь же не ясна причина появления в непосредствен-
ной близости друг к другу клеток различных типов при диффе-
ренцировке как флоэмы, так и ксилемы. Очевидно, при форми-
ровании этих проводящих тканей возникают химические и элек-
трические микроградиенты, определяющие направление диф-
ференцировки соседних клеток. Существенный вклад в созда-
ние этих градиентов может вносить комплекс веществ, которые-
образуются при распаде цитоплазмы в созревающих сосудах
как ксилемы, так и флоэмы.
При вторичном росте корней (как и стеблей) появляется
феллоген, который образует перидерму (защитную ткань). Фел-
логен формируется из клеток перицикла в результате перикли-
нальных и антиклинальных делений. Индукция делений клеток,
связанная с появлением феллогена, может быть обусловлена»
механическим давлением изнутри, вызванным отложением вто-
ричных флоэмы и ксилемы. Механическое растяжение перицик-
ла сопровождается изменением значения мембранного потен-
циала в клетках, что оказывает влияние на радиальные элек-
трические поля, которые, в свою очередь, влияют на транспорт’
ауксина и дифференцировку тканей. В результате новообразо-
вания вторичных проводящих тканей и перидермы первичная
82
кора корня разрывается и сбрасывается вместе с эпидермой,
рормональные механизмы формирования перидермы не иссле-
дованы.
4.2.8. ВЕТВЛЕНИЕ КОРНЯ
Боковыми органами корня являются боковые корни, которые
формируются на материнском (главном), боковом или прида-
точном корнях. Боковые корни закладываются во внутренних
тканях (т. е. они эндогенного происхождения) акропетально на
некотором расстоянии от апекса в эоне поглощения или выше.
При многократном ветвлении различают корни 1-го, 2-го и т. д.
порядков. Боковые корни голосеменных и покрытосеменных за-
кладываются в перицикле, который, образовавшись в апикаль-
ной меристеме, сохраняет потенциальную меристематическую
активность. Несколько смежных клеток перицикла с более плот-
ной цитоплазмой сначала делятся только периклинально, а за-
тем периклинально и антиклинально. В результате возникает
примордий корня (рис. 4.27). Из клеток перицикла формируется
Рис. 4.27. Акропетальное заложение боковых корешков в перицикле ма>-
теринского корня сусака.
1 — эндодерма, 2 — перицикл.
апекс корня. Корневой же чехлик часто образуется из эндо-
дермы, которая вначале делится антиклинально и таким обра-
зом сохраняет целостность при росте примордия в тканях мате-
ринского корня. Клетки других его тканей деформируются и
частично разрушаются под действием гидролитических фермен-
тов, и растущий зачаток выдвигается наружу (рис. 4.28). Кор-
невой чехлик, сформированный из клеток эндодермы материн-
ского корня, отпадает, и апекс бокового корня формирует но-
вый чехлик.
Зачатки боковых корней обычно образуются напротив лу-
чей ксилемы главного корня (рис. 4.28,6). Закладывающиеся
флоэма и ксилема молодого корня соединяются с соответствую-
щими тканями материнского корня в результате дифференци-
ровки паренхимных клеток в проводящие элементы. Придаточ-
83
ные корни, т. е. корни, образующиеся на других органах расте-
ния (стеблях, листьях и т. д.), закладываются, как правило, в
меристематических или потенциально меристематических тка-
нях: в камбии, феллогене, сердцевинных лучах, в межпучковой
паренхиме и др. В остальном формирование этих корней не
отличается от хода дифференцировки и плана строения боко-
вых корней и главного корня.
Рис. 4.29. Влияние различных
концентраций ИУК (Z), зеатина
(2), абсцизовой кислоты (5) и
ксантоксина (4) на образование
зачатков боковых корней у горо-
ха за 120 ч (Дерфлинг, 1985).
По оси абсцисс — концентрация гор-
мона (М), по оси ординат — число за-
чатков корней по сравнению с кон-
тролем.
Рис. 4.28. Схема закладки и роста бо-
ковых корней.
а —продольный разрез, б—поперечный раз-
рез. /—эпидерма, 2—кора, 3 — перицикл,
4 — центральный цилиндр, 5 — боковые корни,
6 — ксилема, 7 — флоэма.
Индуктором периклинальных делений клеток в перицикле
материнского корня и заложения боковых корней является аук-
син. Точно так же и образование придаточных корней зависит
от ауксина, причем оптимальные его концентрации для укоре-
нения черенков находятся в пределах 10~6—10~5М. После ин-
дукции корнеобраз-ования содержание ауксина в тканях должно
резко снизиться до уровня, оптимального для роста корней в
длину. Ауксин специфически включает генетическую программу
корнеобразования даже в таких недифференцированных тканях,
как каллусная культура. К. Миллер и Ф. Скуг (1955) в опытах
84
с сердцевинной паренхимой стебля табака показали, что в среде
с преобладанием ИУК (2 мг/л) над кинетином (0,02 мг/л) в
каллусной ткани дифференцируются корни. Если же концентра-
ция кинетина будет повышена (0,05 мг/л), то образуются по-
беги (см. рис. 5.1).
Вторым фактором, оказывающим сильное влияние на корне-
образование, является этилен. При этом боковые корни закла-
дываются ближе к корневому апексу. Обработка стеблей тра-
вянистых растений этиленом вызывает массовое образование
придаточных корней. Однако действие этилена, по-видимому, на-
правлено не на индукцию за-
ложения корней, а на ускоре-
ние их роста. Так как ауксин
в повышенных концентрациях
активирует синтез этилена, то
его роль в корнеобразовании
боковых и придаточных кор-
ней двоякая: как индуктора за-
ложения корней и активатора
синтеза этилена, влияющего
на рост корней самостоятель-
но. Цитокинины и АБК тормо-
зят образование боковых кор-
ней (рис. 4.29).
Существенную роль в кор-
необразовании играют измене-
ния значений электрического
потенциала, что, в частности,
может быть обусловлено меха-
ническим давлением и растя-
жением. Если выращивать ко-
рень в таких условиях, чтобы Рис. 4.30. Развитие боковых корней
у него формировались изгибы, ’ на выпуклых участках изогнутого
то боковые корни будут разви- первичного корня люпина (Синнот,
ваться только на выпуклых
участках (рис. 4.30).
В корнях четко проявляется эффект апикального доминиро-
вания. При хирургическом удалении кончика корня новые боко-
вые корни образуются ближе к дистальному концу. Таким
образом, так же как апикальная почка побега тормозит рост
пазушных почек, кончик корня препятствует появлению боко-
вых корней на его дистальном конце. Однако этот эффект кон-
чика нельзя заменить нанесением ауксина на срез декапитиро-
ванного корня. Возможно, роль ингибитора образования боко-
вых корней в кончике корня играет цитокинин (см. рис. 4.29).
5. РЕГЕНЕРАЦИЯ У РАСТЕНИЙ
Регенерация (лат. regeneratio — восстановление, возрожде-
ние) — восстановление организмом поврежденных или утрачен-
ных частей тела. Способность к регенерации широко распро-
странена у растений от низших до высших. В ходе эволюции это
свойство растений не только не утрачивается, как в животном
мире, а, наоборот, совершенствуется и становится разнообраз-
нее. Появляются покоящиеся зачатки в виде пазушных почек,
зачатков корней, которые начинают расти при повреждении ма-
теринских органов. В то же время не теряется способность к ре-
генерации недостающих тканей и органов за счет практически
любого участка растительного организма. Даже из одной веге-
тативной клетки любого органа в экспериментальных условиях
можно восстановить целый организм. В этом проявляется свой-
ство тотипотентности растительных клеток (лат. totus — весь,
целый и potentia — сила). В основе тотипотентности лежит на-
личие в каждом клеточном ядре генетической программы раз-
вития целого растения. Примером тому может служить образо-
вание целых растеньиц из дифференцированных клеток листа
бегонии при его повреждении или разрезании. Широкое рас-
пространение явления регенерации у растений объясняется дву-
мя причинами. Во-первых, регенерация — это один из эффектив-
ных способов выживания растений как прикрепленных организ-
мов при всякого рода повреждениях. Во-вторых, многие фор-
мы регенерации одновременно служат для вегетативного раз-
множения растений.
Явление регенерации представляет как теоретический, так
и практический интерес. В теоретическом аспекте регенерация,
т. е. повторное развитие тканей, органов или целого организ-
ма,— прекрасная модель для изучения механизмов гистогенеза
и морфогенеза. В практическом плане различные приемы, осно-
ванные на способности к регенерации, широко используются в
S6
растениеводстве. Размножение плодовых и лесных культур уко-
рененными черенками, цветочных культур — листовыми черен-
ками и т. д. позволяет получать в большом количестве генети-
чески однородный посадочный материал.
Этой же цели служит клональное микроразмножение, т. е.
размножение генетически идентичных растений в культуре тка-
ней и клеток. Из одного растения при его размножении по-
средством культуры тканей можно получить в год миллионы
растений. Клональное микроразмножение ускоряет селекцион-
ный процесс, (позволяет оздоравливать ценные сорта, освобож-
дая их от патогенных микроорганизмов и вирусов, и создавать
банки культур с ценными генетическими свойствами. При ми-
кроразмножении резко сокращаются площади для выращива-
ния растений, культура тканей поддерживается круглогодично.
Классификация форм регенерации у растений недостаточно
разработана. Если исходить из физиологических механизмов, то
классифицировать способы регенерации можно следующим об-
разом:
I. Физиологическая регенерация.
II. Травматическая (репаративная) регенерация:
1. Регенерация, обусловленная дедифференцировкой кле-
ток:
а) заживление ран;
б) органогенез, обусловленный образованием каллуса;
в) восстановление частей без образования каллуса;
г) соматический эмбриогенез.
2. Регенерация с участием меристем:
а) восстановление апикальной меристемы;
б) органогенез из предсуществующих зачатков;
в) органогенез из новообразованных адвентивных за-
чатков.
5.1. ФИЗИОЛОГИЧЕСКАЯ РЕГЕНЕРАЦИЯ
Этот вид регенерации представлен и у растений, и у жи-
вотных. Примерами физиологической регенерации у животных
являются постоянное слущивание и возобновление клеток сли-
зистой кишечника, кожи. У высших растений сходные про-
цессы регенерации наблюдаются в корневом чехлике, в прово-
дящих пучках, в покровных тканях.
Как уже говорилось (см. 4.2.2), клетки корневого чехлика
слущиваются с его поверхности, облегчая продвижение корня
в почве, и постоянно возобновляются за счет пролиферативной
активности меристемы чехлика. Наружные слои перидермы на
поверхности побега и корней снашиваются под действием не-
благоприятных факторов среды и из-за утолщения осевых орга-
нов. Феллоген как вторичная латеральная меристема образует
87
новые клетки перидермы (см. 4.1.6 и 4.2.7). У древесных расте-
ний за счет камбия ежегодно формируются новые кольца дре-
весины взамен отмирающей ксилемы предыдущих лет.
5.2. ТРАВМАТИЧЕСКАЯ РЕГЕНЕРАЦИЯ
В отличие от физиологической травматическая регенерация
осуществляется при нанесении организму тех или иных повреж-
дений. Они появляются в результате объедания растений насе-
комыми, травоядными животными, при действии града, ветра
и т. д. Могут быть нарушены покровные ткани, проводящие
системы, повреждены или уничтожены апикальные меристемы.
Все эти механические повреждения индуцируют в растениях
разнообразные механизмы регенерации, что приводит к зажив-
лению ран и восстановлению утраченных частей. В основе од-
них из этих механизмов лежит функционирование меристем.
Там же, где меристем нет, клетки специализированной ткани
в поврежденных участках дедифференцируются и переходят
к делению, что обеспечивает образование новых тканей и
органов.
5.2.1. РЕГЕНЕРАЦИЯ, ОБУСЛОВЛЕННАЯ
ДЕДИФФЕРЕНЦИРОВКОЙ КЛЕТОК
Заживление ран. При повреждении покровных тканей или
разрывах внутренних тканей включаются процессы, приводя-
щие к заживлению ран. Наиболее хорошо они изучены на сре-
зах таких запасающих органов, как клубни картофеля, или тол-
стых травянистых стеблей, как, например, у кольраби. В живых
клетках, примыкающих к поврежденной поверхности, происхо-
дит перемещение ядер и других органоидов, размер ядер.уве-
личивается, активируется образование полисом, повышается
активность пероксидаз. Клетки начинают делиться перикли-
нально, отчленяя новые клетки в сторону раневой поверхности.
В результате на поверхности раны формируется феллоген, ко-
торый образует защитную ткань — перидерму. Механизм, управ-
ляющий последовательностью этих событий, изучен слабо. Од-
нако, так же как и при нормальном развитии феллогена, клет-
ки, примыкающие к раневой поверхности, поляризуются так,
чтобы плоскость их деления стала параллельной поверхности
раны. Это достигается благодаря возникновению демаркацион-
ного потенциала (потенциала повреждения), который всегда
имеет отрицательное значение, так как МП поврежденных кле-
ток снижается (деполяризуется). В результате возникает раз-
ность потенциалов между внутренними клетками и раневой по-
верхностью, что и вызывает поляризацию живых клеток. Спо-
собствовать этому может также стрессовый этилен, образую-
88
щийся при повреждении. Однако одной поляризации для реге-
нерации недостаточно. Необходимо индуцировать деление кле-
ток. Роль индуктора, по-видимому, выполняет ИУК. Ауксин
может образовываться в поврежденных клетках из триптофана
распадающихся белков и поступать в живые клетки. Промывка
раневой поверхности часто устраняет активацию делений в зоне
повреждения. Кроме того, электрический градиент, возникший
в поврежденной области, может способствовать перемещению*
фитогормонов из внутренних тканей в клетки, граничащие с ра-
ной. Такие фитогормоны, вероятно, содержатся в проводящих
пучках. При отсутствии проводящих пучков вблизи зоны по-
вреждения пролиферативная активность под раневой поверх-
ностью выражена слабее. Можно предположить, что активным
фактором в проводящих пучках является цитокинин. Заживле-
ние ран может осуществляться другим способом: путем их за-
тягивания каллусной тканью, способной затем сформировать
перидерму.
Органогенез, обусловленный образованием каллуса. Многие
растительные ткани, например паренхимные клетки изолирован-
ных сегментов сердцевины стебля табака, при наличии ИУК
(1—2 мг/л) и цитокинина (0,02—0,2 мг/л) в инкубационной
среде дедифференцируются и начинают делиться, образуя кал-
лусную ткань. Каллус — это беспорядочно делящиеся паренхи-
матозные клетки, рыхло связанные друг с другом. При измене-
нии соотношения ИУК/цитокинин в пользу ауксина в каллусной
ткани формируются группы клеток, которые дают начало ад-
вентивным побегам. Наоборот, при увеличении концентрации
цитокинина в каллусе закладываются зачатки корней (рис. 5.1).
Здесь мы наблюдаем процесс органогенеза.
Каллусная ткань, как сказано выше, может образовываться
на раневой поверхности. Индукция органогенеза или гистогене-
за в ней будет также определяться соотношением фитогормо-
Рис. 5.1. Совместное действие ИУК и кинетина на рост и процес-
сы дифференцировки каллуса сердцевины стебля табака.
Кинетин: / — отсутствует, 2 — 0,02 мг/л, 3 — 1 мг/л, 4—5 мг,л; ИУК во всех
вариантах 2 мг/л.
89
иов. Удобной моделью для изучения этого явления служат сег-
менты, вырезанные из корня одуванчика. На поперечных сре-
зах таких отрезков корня, взятого осенью, когда в тканях кор-
ня накопилось достаточное количество запасных веществ, в рай-
оне перерезанных сосудистых пучков развивается каллусная
ткань. Затем в каллусе, образованном на дистальном конце
отрезка, формируются адвентивные корни, а в каллусе про-
ксимального (морфологически верхнего) конца — адвентивные
побеги. Причем от положения отрезка корня в пространстве не
зависит место появления побегов и корней. Такая полярность
закладки адвентивных органов объясняется следующим. ИУК в
проводящих пучках перемещается от основания к верхушке
корня. Следовательно, ее концентрация возрастает на дисталь-
ном конце отрезка, что и включает генетическую программу кор-
необразования. Цитокинин, содержащийся в сосудах ксилемы,
в изолированном отрезке корня не перемещается (из-за отсут-
ствия транспирационного тока и корневого давления). Поэтому,
когда ИУК полярно оттекает к дистальному концу, то в прокси-
мальном конце отрезка содержание цитокинина относительно
ауксина резко возрастает, что является необходимым условием
для включения программы побегообразования (рис. 5.2). Если
проксимальный конец отрезка искусственно обогащать ИУК,
то и здесь разовьются корни (рис. 5.2,/). Однако если постоян-
но удалять из дистального конца притекающий ауксин путем
Рис. 5.2. Влияние ауксина на регенерацию орга-
нов из сегментов корня одуванчика (Синнот,
1963).
/ — повышение, 3 — уменьшение содержания ауксина,
2 — контроль.
!9С
многократного срезания тонких слоев тканей с этого конца,
то в этом участке развиваются побеги (рис. 5.2,3).
Восстановление частей без образования каллуса. Регенера-
ция тканей и органов может происходить с дедифференциров-
кой клеток, но без образования каллуса. Так образуются адвен-
тивные побеги из единичных эпидермальных клеток у бегонии
и у некоторых толстянковых при отделении листа или его по-
вреждении. Причиной дифференцировки клетки эпидермиса в
почку побега, по-видимому, служит прекращение поступления
каких-то сигналов, которые сообщают ей, что она находится в
составе листа.,Для развития из единичной клетки целого расте-
ния эта клетка должна попасть в условия максимальной изоля-
ции, которые могут возникнуть при повреждении листа.
В поврежденном стебле проводящие ткани регенерируют из
паренхимных клеток (рис. 5.3). В этом случае клеточное деле-
Рис. 5.3. Регенерация сосудистых тканей в стеблях (Синнот,
1963).
1 — регенерация связи между разрезанными сосудистыми пучками в
стебле колеуса, 2 — дифференцировка клеток паренхимы в клетки
ксилемы с сетчатыми утолщениями. Стрелка указывает направление
развития ксилемного тяжа. Новые клеточные стенки возникают па-
раллельно тяжу ксилемы.
ние может даже не индуцироваться: в паренхимных клетках
включается соответствующая генетическая программа, и они
превращаются в сосуды. Индуктором этого включения является
полярный транспорт ИУК (см. 4.1.6).
Соматический эмбриогенез. Из клеток каллусной ткани или
суспензионной культуры могут образоваться эмбриоидные
структуры — соматические эмбриоиды, развивающиеся в соот-
ветствующих условиях в целый организм. Для индукции со-
матического эмбриогенеза необходимо перенести ткань или сус-
пензию клеток в среду без фитогормонов. Клетка, превращаю-
щаяся в эмбриоид, обычно связана с другой клеткой, которая
служит источником разнообразных органических веществ.
91
Место прикрепления к этой клетке, по-видимому, обеспечивает
поляризацию материнской клетки эм’бриода и образование его
первичной оси. Исходная клетка будущего эмбриоида и ее про-
изводные многократно делятся. В соматическом эмбриоиде дей-
ствует генетическая программа развития эмбриона: формиру-
ется проэмбрио, а затем глобулярная,, сердцевидная фазы, Тор-
педо и т. д. (рис. 5.4). После образования маленького растеньи-
Рис. 5.4. Образование соматических эмбриоидов в группе клеток суспен-
зионной культуры моркови.
1 — агрегаты клеток в среде с ауксином. 2 — формирование глобулярных эмбрио-
идов на агрегатах клеток в среде без ауксина, 3 — свободные соматические эмб-
риоиды в фазе торпедо в среде без ауксина.
ца его высаживают на субстрат для дальнейшего роста и раз-
вития. Соматический эмбриогенез осуществляется и в природ-
ных условиях из отдельных клеток гаметофита (апогамия) или
из вегетативных клеток спорофита (адвентивная эмбриония).
5.2.2. РЕГЕНЕРАЦИЯ С УЧАСТИЕМ МЕРИСТЕМ
Этот тип регенерации не связан с дедифференциацией различ-
ных специализированных клеток, а определяется активностью*
апикальных и латеральных меристем и активацией предшест-
вующих меристематических зачатков.
Восстановление апикальных меристем. При удалении ди-
стальной части апикальной меристемы побега (не более 80мкм)
происходит ее восстановление. Если продольно (тангенциально)
рассечь апекс побега и вложить в разрез пластинку слюды, то
каждая половинка полностью регенерирует, в результате чего»
образуются два апекса. Удаленный корневой чехлик восстанав-
ливается благодаря активации пролиферации клеток покояще-
гося центра. При устранении покоящегося центра проксималь-
ная меристема восстанавливает целостность апекса корня.
У развивающегося молодого листа папоротника восстанавли-
вается отрезанная меристематическая верхушка. Все эти при-
меры говорят о способности апикальных меристем побега и
корня восстанавливаться при повреждении, причем в апексе
корня у покрытосеменных появляется специальная группа кле-
92
ток — покоящийся центр, которая более устойчива к действию
различных неблагоприятных факторов среды и способна восста-
навливать деятельную меристему (см. 4.2.1).
Органогенез из предсуществующих зачатков. У растений в
отличие от животных имеются готовые покоящиеся зачатки-
органов, которые быстро развиваются при нарушении целост-
ности растительного организма. Речь идет о пазушных и спя-
щих почках и о зачатках корней в тканях осевых органов. При
обсуждении роста и развития побега говорилось о том, что па-
зушные почки находятся под двойным контролем (см. рис. 4.16):
их рост ингибируется как развивающейся апикальной почкой,
так и кроющими листьями (хотя и в меньшей степени). При
повреждении или удалении апикальной почки пазушные трога-
ются в рост. То же самое происходит при массовом поврежде-
нии (объедании) листьев. Трудность борьбы с сорняками ме-
ханическими средствами состоит в том, что при срезании каж-
дой верхушки растения вырастают новые побеги из активиро-
вавшихся пазушных почек. О механизмах апикального домини-
рования см. 4.1.7.
В узлах у некоторых травянистых и древесных растений за-
кладываются адвентивные корни, которые могут находиться в
зачаточном состоянии и начинают развиваться при нарушении
целостности побега. Их заторможенное состояние может под-
держиваться сверхоптимальным уровнем ауксина, поступающего
из верхушки побега.
Органогенез из новообразованных адвентивных зачатков.
У большинства растений отдельные побеги способны укоренять-
ся. Новообразование придаточных корней происходит из внут-
ренних меристематических или потенциально меристематических
тканей, таких, как камбий, феллоген, перицикл, сердцевинные
лучи и других. Индуцирующее действие на образование прида-
точных корней оказывает ауксин, который, полярно переме-
щаясь к проксимальной части черенка, включает в меристема-
тических клетках генетическую программу корнеобразования.
Этот способ регенерации одновременно является способом веге-
тативного размножения, которое часто встречается в природе
и широко используется в практике растениеводства. Травяни-
стые или молодые неодревесневшие черенки укореняются во
влажном песке или в других субстратах. Предварительная
обработка базального конца черенков растворами синтетиче-
ских ауксинов (индолилмасляной, 1-нафтилуксусной кислотами
или ИУК) в концентрациях 5-10-6М — 5-10-5М в течение
12—14 ч в большинстве случаев значительно усиливает корне-
образование.
Таким образом, растение способно восстанавливать как над-
земные, так и подземные части при их утрате и даже целый
организм из отдельной вегетативной клетки. Разнообразие ти-
пов регенерации обеспечивает высокий уровень надежности
растительных организмов.
93
6. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РОСТА
И МОРФОГЕНЕЗА
Знакомство с процессами эмбриогенеза, прорастания семян,
формирования побегов и корней из апикальных меристем позво-
ляет перейти к рассмотрению теоретических вопросов, связанных
с механизмами морфогенеза. Несомненно, основные закономер-
ности роста и формирования органов сходны у многоклеточных
животных и растений. Особенно это относится к фазам эмбрио-
генеза, предшествующим формированию нервной системы у жи-
вотного организма и эмбриогенезу растений. Рост и морфогенез
растений и в дальнейшем обеспечиваются постоянно действую-
щими апикальными меристами побега и корня, которые сфор-
мировались в процессе эмбриогенеза и функционируют в тече-
ние всего онтогенеза. Поэтому многие теоретические представле-
ния, сложившиеся на основании изучения развития зародышей
животных, вполне можно применить для анализа закономерно-
стей морфогенеза растений. В то же время нельзя забывать о
существенных отличиях формообразовательных процессов у ра-
стений и животных. Так, в процессах роста и морфогенеза у
растений не наблюдается активной миграции клеток и слоев
клеток. Нет даже скользящего роста (смещения клеток отно-
сительно друг друга), так как клетки растительных тканей взаи-
мосвязаны клеточными стенками и многочисленными плазмодес-
мами. У растений нет зародышевых листков. В качестве их
функциональных аналогов можно рассматривать гистогены апи-
кальных меристем растений (протодерму, периблему, плерому,
прокамбий). Для растений помимо плазматического роста ха-
рактерен рост клеток растяжением, которого нет у животных.
Далее мы рассмотрим общие принципы, которые лежат в основе
роста, морфогенеза и их регуляции у многоклеточных организ-
мов.
94
6.1. РАСТИТЕЛЬНЫЙ ОРГАНИЗМ
КАК САМООРГАНИЗУЮЩАЯСЯ СИСТЕМА
Все живые организмы — самоорганизующиеся системы. По-
знакомимся с основными теоретическими положениями, относя-
щимися к этому понятию.
6.1.1. САМООРГАНИЗУЮЩИЕСЯ СИСТЕМЫ
Согласно современному системному подходу живой организм
представляет собой открытую, неравновесную, саморегулирую-
щуюся и саморазвивающуюся систему, способную к самовоспро-
изведению. Под системой подразумевается сложный комплекс
элементов, связанных друг с другом и выполняющих определен-
ные функции в соответствии с программой этой системы. Раз-
витие системного подхода связано с именем канадского биолога
Л. фон Берталанфи. Этот подход предполагает изучение сово-
купности всех элементов, которые образуют целостный биологи-
ческий объект, и механизмов их взаимодействия друг с другом
и окружающей средой. В основе этих взаимодействий лежат си-
стемы регуляции и управления.
Любой организм, в том числе и растительный, — открытая
система, т. е. существует до тех пор, пока осуществляется обмен
веществом и энергией с внешней средой. Живое состояние орга-
низма обусловлено состоянием термодинамического неравнове-
сия. Принцип устойчивого неравновесия как основной принцип
живого состояния был предложен советским биологом Э. О. Бау-
эром в 1935 г. В настоящее время в качестве материальной ос-
новы неравновесного состояния можно рассматривать электро-
химический потенциал мембран живых клеток. Неравновес-
ность поддерживается постоянной тратой (рассеиванием, или
диссипацией) энергии.
Под термином «самоорганизация» в широком смысле обыч-
но понимают процесс самопроизвольного увеличения упорядо-
ченности или организации системы. Изучением самоорганизую-
щихся систем в живой и неживой пр-ироде занимается новый
раздел науки — синергетика (грёч. synergia — совместное, или
кооперативное, действие). Понятие самоорганизации охватыва-
ет все специфические свойства жизни. Важнейшую роль в са-
моорганизации играют процессы регуляции и управления. Под
регуляцией в узком смысле понимают поддержание параметров
внутренней среды клеток и организма в заданных границах
(явление гомеостаза). Управление — это процесс перевода си-
стемы из одного состояния в другое путем воздействия на ее
переменные, что лежит в основе развития. Изучением общих
законов регуляции и управления, основанных на получении,
хранении, передаче и преобразовании информации, занимается
кибернетика.
95
Регуляция состояния и управление физиологическими функ-
циями и развитием живого организма — сложная иерархическая
информационная система, в которой осуществляется взаимо-
действие механизмов регуляции и управления на разных уров-
нях: метаболических циклов, органоидов, клеток, тканей, фи-
зиологических систем и целого растения. Важнейшая особен-
ВОЗДЕЙСТВИЯ ФАКТОРОВ ВНУТРЕННЕЙ И ВНЕШНЕЙ СРЕДЫ
Обратная связь
I
СИСТЕМЫ
Обратная связь
РЕГУЛЯЦИИ <---------
Гомеостаз <--------
Метаболизм
Адаптационные ответы:
___ физиологический,
> двигательный,
морфогенетический
Рис. 6.1. Схема регуляции и управления в живых организ-
мах.
ность самоорганизации — большое разнообразие обратных свя-
зей на всех уровнях информационной системы. Отрицательная
обратная связь способствует восстановлению исходного состоя-
ния при отклонении от нормы, положительная, напротив, уво-
дит систему все дальше от исходного состояния. Способность
к самоорганизации у живых организмов проявляется в явле-
ниях гомеостаза, в адаптационных физиологических и двига-
тельных реакциях, в процессах роста и развития (рис. 6.1).
6.1.2. СИСТЕМЫ РЕГУЛЯЦИИ И УПРАВЛЕНИЯ У РАСТЕНИЙ
Во многих публикациях термин «регуляция» используется в
широком смысле, включающем в себя также понятие «управ-
ление». В этом разделе для удобства изложения мы будем при-
менять термин «регуляция» в таком расширенном смысле.
Регуляция в живых организмах осуществляется на внутри-
клеточном, межклеточном и организменном уровнях ( рис. 6.2).
На уровне клетки в многоклеточных организмах дей-
ствуют три системы регуляции: метаболическая, генетическая,
и мембранная. Все эти системы связаны между собой.
Метаболическая регуляция, или регуляция активности фер-
ментов. Она может осуществляться различными способами.
Активность ферментов зависит от физико-химических условий
среды: концентрации субстрата и конечных продуктов реакций
(закон действия масс), сдвигов значений pH, ионной силы,
окислительно-восстановительного потенциала, изменений в со-
держании коферментов (НАД, НАДФ и др.) и кофактора*
96
Доминирующие
Рис. 6.2. Схема уровней и взаимосвязей систем регуляции и управления
у растений.
1 — внутриклеточный уровень, II — межклеточный (между клетками, тканями и ор-
ганами), III — организменный (системы интеграции).
(ионов металлов). Изостерическая регуляция осуществляется
на базе каталитических центров ферментов, на состояние ко-
торых могут оказывать влияние перечисленные выше факторы.
Более совершенный способ изменения активности ферментов —
аллостерическая регуляция. В состав ферментов с этим типом
регуляции входит регуляторная белковая субъединица, которая
взаимодействует со специфическими активаторами или ингиби-
торами (эффекторами). В качестве эффекторов могут высту-
пать трофические факторы, промежуточные метаболиты, гормо-
ны и другие физиологически активные вещества. В результате
взаимодействия эффекторов с регуляторной субъединицей меня-
ется ее конформация, что оказывает кооперативно влияние на
функциональную активность каталитической субъединицы.
Активность фермента может изменяться благодаря его мо-
7 Заказ № 399
97
дификации при фосфорилировании протеинкиназами или де-
фосфорилировании (фосфатазами), при ацетилировании, мети-
лировании, разрыве дисульфидных связей, отщеплении белковых
фрагментов и т. д. В клетках присутствуют белковые ингиби-
торы, обладающие высокой специфичностью, которые, связыва-
ясь с ферментами, блокируют их работу. Наконец, фермента-
тивная активность может регулироваться связыванием и осво-
бождением ферментов мембранами, а также их разрушением.
Метаболиты и ферменты объединяются в многочисленные цик-
лы, связанные между собой прямыми и обратными связями.
Таким образом формируется высокореактивная метаболиче-
ская сеть.
Генетическая регуляция. Эта система осуществляет: 1) хра-
нение и репликацию обширной информации о строении инди-
видуального организма и последовательности процессов морфо-
генеза, которые зашифрованы в хроматине ядра и кольцевых
ДНК пластид и митохондрий в виде триплетного кода; 2) ре-
гуляцию считки этой информации (т. е. транскрипции), про-
цессинга синтезируемых РНК и их транспорта, хранение мРНК
в латентной форме (в виде ннформосом) и активацию этих
мРНК; 3) регуляцию сборки рибосом и полисом и процессов
синтеза полипептидов (трансляции).
Мембранная регуляция. В основе мембранной регуляции
лежит то неравновесное состояние, о котором говорилось вы-
ше (см. 6.1.1). Это неравновесное состояние поддерживается в;
каждой клетке на определенном стационарном уровне' благо-
даря работе ионных насосов (помп), локализованных в кле-
точной мембране и в мембранах внутриклеточных органоидов.
В растительных клетках особую роль играют Н+-помпы, функ-
ционирующие на базе мембранных Н+-АТФаз или редокс-цепей
(см. рис. 3.9). Активный вынос ионов Н+ из клетки, осущест-
вляемый с затратой метаболической энергии, создает_на плаз-
малемме электрохимический потенциал ионов Н+(Дрн4), кото-
рый включает в себя два компонента: электрический, или мем-
бранный, потенциал (АТ) и химический, или концентрацион-
ный, потенциал (ДрН): Дцн+=АЧг+АрН.
Значение мебранного потенциала на плазмалемме расти-
тельных клеток достигает 100—200 мВ, причем внутренняя сто-
рона мембраны имеет отрицательный заряд. Электрохимиче-
ский мембранный потенциал представляет собой запас энергии,
которая используется для поглощения клеткой катионов, анио-
нов, сахаров и других соединений. Важнейшее значение имеет
поглощение ионов К4, который поступает в клетку через ка-
лиевые каналы по электрическому градиенту, создаваемому ра-
ботой Н+-насоса против концентрационного градиента. Концен-
трация в клетке достигает 0,1 М. В результате на плазма-
лемме возникает калиевый неравновесный потенциал. Неравно*
98
вескость концентраций калия во внутриклеточной среде по от-
ношению к наружной длительно сохраняется и в. условиях, ког-
да Н4-насосы не функционируют. Таким образом, компонента-
ми неравновесного состояния растительной клетки являются
электрохимический потенциал ионов Н+ (активный компонент)
и неравновесный потенциал (пассивный компонент). Поддер-
жание на стационарном уровне значения мембранного потен-
циала является важнейшей составляющей гомеостаза. При
снижении мембранного потенциала на плазмалемме его вели-
чина восстанавливается в результате открытия калиевых ка-
налов и выхода ионов К+ или активации Н+-насоса. Все опи-
санные процессы с участием трансмембранного транспорта К+
и других катионов, активности Н+-насосов и колебаний
мембранного потенциала являются компонентами системы
мембранной регуляции, которая оказывает влияние на клеточ-
ный метаболизм и функционирование генетического аппарата.
Мембранная регуляция оказывает решающее влияние на
изменение концентраций внутриклеточного Са2+. Ионы Са24“
входят в клетку по электрическому градиенту через кальцие-
вые каналы, а выкачивается из клетки при участии Са2+-
АТФазы или путем антипорта с ионами Н+ (вход в клетку
избытка протонов, связанный с одновременным выходом Са2+).
Кальций может также аккумулироваться в вакуоли, в ЭР и
митохондриях и освобождаться из них. Концентрация Са2+ в
цитоплазме поддерживается на очень низком уровне (порядка
10_7М). Повышение концентрации кальция до 10~6М оказы-
вает влияние на многие процессы в клетке: на активность
Са2+-зависимых протеинкиназ, фосфорилирующих белки, на
состояние цитоскелета (актиновых микрофиламентов и тубу-
линовых микротрубочек), на сократительную активность акто-
миозинового комплекса цитоплазмы, секреторную, митотиче-
скую активность и т. д. Кальций регулирует все эти процессы,
связываясь с кальмодулином и другими кальцийсвязывающими
белками.
В растительных клетках, так же как и в животных, в каче-
стве регуляторной системы функционирует фосфоинозитольный
цикл (рис. 6.3). Фосфатидилинозитол-4,5-дифосфат плазмалем-
мы расщепляется с помощью мембранной фосфолипазы С на
инозитол-1,4,5-трифосфат и диацилглицерол. Первый из них
способствует освобождению Са2+ из ЭР, а второй активирует
при участии Са24' протеинкиназу С в плазмалемме. Активиро-
ванная протеинкиназа С фосфорилирует белки ионных каналов
и, таким образом, регулирует их работу.
Межклеточный уровень регуляции включает в
себя также три системы: трофическую, гормональную и элек-
трофизиологическую (см. рис. 6.2). С помощыцю этих систем
осуществляется взаимодействие между клетками, тканями и
органами.
99
Цитоплазма
Рис. 6.3. Фосфоинозитольный цикл и его роль в регу-
ляции ионного транспорта в плазмалемме.
ДАГ — диацилглицерол, И — инозитол, И-1-Ф — инозитол-1-фос-
фат, И-1, 4, 5-Ф — инозитол-1, 4, 5-трифосфат, КмСа — комп-
лекс кальмодулина с кальцием, Пк — протеинкиназы, ПкС —
протеинкиназа С, Р — рецептор, ФИ — фосфатидилинозитол,
ФИ-4-Ф — фосфатидилинозитол-4-фосфат, ФИ-4, 5-Ф — фосфа-
тидилинозитол-4, 5-дифосфат, ФК — фосфатидная кислота,
ФлС — фосфолипаза С, Ин — индуктор.
Трофическая регуляция. Трофические взаимодействия раз-
личных частей растения — одна из важнейших составляющих,
обеспечивающих целостность растительного организма. Этот
способ регуляции особенно важен для растений потому, что их
система питания двухкомпонентна: воздушное питание, связан-
ное с ассимиляцией СО2, осуществляется в основном листьями,
а поглощение минеральных веществ и воды — корнями. Корне-
вая система нуждается в притоке ассимилятов из надземной
части. В свою очередь, рост побега зависит не только от при-
тока минеральных веществ, но и от поступления из корней спе-
цифических метаболитов, которые образуются в них в том чи-
сле и в результате ассимиляции минеральных веществ. Трофи-
ческая регуляция в большинстве случаев носит количественный
характер. При недостатке минеральных веществ или слабом
фотосинтезе закладывается меньше метамерных органов и об-
разуются растения меньшего размера. Интересно отметить, что
при недостаточном питании, когда на растении формируется зна-
чительно меньше плодов или даже один плод, они достигают,
100
как правило, нормального размера. Дефицит минерального
питания, особенно азотного, ускоряет переход растений к раз-
множению. Разное соотношение элементов минерального пита-
ния оказывает влияние на процессы коррелятивного роста.
Гормональная система. Гормоны — главные факторы регу-
ляции и управления у растений. Фитогормоны — сравнительно
низкомолекулярные органические вещества с высокой физиоло-
гической активностью, присутствующие в тканях в очень низ-
ких концентрациях (пикограммы и нанограммы на 1 г сырой
массы), с помощью которых клетки, ткани и органы взаимодей-
ствуют между собой. Как правило, фитогормоны вырабатыва-
ются в одних тканях, а действуют в других, однако в ряде
случаев они функционируют в тех же клетках, где образуются.
Характерной особенностью фитогормонов, отличающей их от
других физиологически активных веществ (витаминов, микро-
элементов и т. д.), является то, что они включают целые физио-
логические и морфогенетические программы, например такие,
как корнеобразование, созревание плодов и т. д. Известные в
настоящее время фитогормоны — это производные аминокислот
Ферменты Хромосомы
Рис. 6.4. Основные компоненты системы фитогормона.
Ю1
НИЯ
ИС.
Рис. 6.5. Схема метаболического
взаимодействия фитогормонов
(Дерфлинг, 1985).
Сплошные стрелки — повышение, пунк-
тирные — снижение уровня фитогор-
мона.
(индолил-3-уксусная, фенилуксусная кислоты), нуклеотидов
(цитокинины) полиизопренов (гиббереллины, АБК), непре-
дельных углеводородов (этилен). Гормоны белковой природы,
характерные для животных организмов, у растений не обнару-
жены.
Каждый из перечисленных выше фитогормонов является ос-
новой системы, включающей в себя ферменты, кофакторы и
ингибиторы его синтеза, ферменты связывания (конъюгирова-
ния) и освобождения гормона из связанного состояния, спосо-
бы мембранного и дальнего транспорта, механизмы действия,
которые определяются наличием рецепторов и их локализаци-
ей, и, наконец, ферменты, кофакторы и ингибиторы разруше-
свою очередь, системы отдель-
ных фитогормонов связаны в
единую гормональную систему.
Эта связь осуществляется на
уровне как метаболизма фито-
гормонов, так и механизма их
действия.
При повышении концентра-
ции ауксина в клетках возра-
стает синтез этилена. То же,
хотя и в меньшей степени, от-
мечается при действии цитоки-
нинов или гиббереллинов в
высоких концентрациях (рис.
6.5). Этот эффект связан с ин-
дуцирующим действием фито-
гормонов на синтез фермента,
участвующего в превращении
предшественника этилена в
этилен (см. ниже). Возраста-
ние концентрации этилена тор-
мозит полярный транспорт
ауксина и увеличивает его связывание (конъюгирование), что
приводит к снижению концентрации активного ауксина (обрат-
ная отрицательная связь). Высокий уровень этилена способст-
вует повышению содержания АБК, что, в свою очередь, тормо-
зит синтез этилена. Под действием цитокинина в тканях возра-
стает содержание ауксина и гиббереллина. Последний также
способствует повышению концентрации ПУК в клетках.
По спектру физиологического действия все гормоны расте-
ний поливалентны, т. е. все они оказывают влияние на синтез
нуклеиновых кислот и белков, активность ферментов, интенсив-
ность дыхания, деление, рост и дифференцировку клеток и т. д«
Специфичность действия фитогормонов определяется их соот-
ношением. Например, повышение концентрации ауксина отно-
сительно цитокинина включает программу корнеобразования,
102
а относительное повышение цитокинина — программу побегооб-
разования (см. рис. 5.1}.
Ауискны. Основной ауксин растений — индолил-3-уксусная
кислота (ИУК):
Она является производным триптофана и индола и синтезиру-
ется главным образом в листовых примордиях, молодых листь-
ях и в развивающихся семенах. Конъюгированные формы ИУК
с аминокислотами (аспарагиновой кислотой и др.), углевода-
ми (глюкозой, инозитолом), белками являются запасными или
служат для инактивации избытка фитогормона. Транспорт
ИУК происходит активно, полярно (базипетально) и с низкой
скорос1ью (см. рис. 3.11). Разрушение ИУК осуществляется
оксидазами ИУК, основным компонентом которых являются
пероксидазы.
Ауксин стимулирует деление клеток, регулирует рост растя-
жением, индуцирует дифференцировку проводящих пучков и об-
разование корней, способствует аттрагирующему действию тка-
ней, участвует в явлениях апикального доминирования и росто-
вых двигательных реакциях растений и т. д. Действие ИУК на
клетки растений определяется наличием белков-рецепторов,
которые локализованы в цитоплазме, плазмалемме и в ЭР.
Взаимодействие ИУК с рецептором в плазмалемме активирует
ионный транспорт (Н+, Са2+, К+ и др.), что связано с актива-
цией мембранной Н+-АТФазы, выполняющей функции Н+-на-
соса, и регуляцией работы ионных каналов. Взаимодействие
ауксина с рецептором в ЭР, по-видимому, стимулирует синтез
белков, а комплекс ИУК с цитоплазматическим рецептором
служит для дифференциальной активации генов в ядрах. Дей-
ствие ИУК может быть связано с активацией фосфоинозитоль-
ного цикла и протеинкиназ (см. рис. 6.3).
Цитокинины. Главный цитокинин растений — зеатин:
н zCH2OH
хос
/
103
Он может присутствовать в клетках как в свободном виде, так
и в форме рибозида и риботида, причем цитокининовая актив-
ность в этом ряду понижается. Конъюгаты зеатина с глюкозой
неактивны. Помимо зеатина у некоторых растений обнаружены
изопентениладенин, а также дифенилмочевина, обладающие
цитокининовой активностью. Зеатин синтезируется из аденозин-
5-монофосфата и изопентенилпирофосфата. Основные места
синтеза — меристема кончиков корней и развивающиеся семена.
Транспорт цитокининов происходит пассивно из корней в над-
земные части по проводящим пучкам с ксилемным током. Ци-
токинин разрушается отщеплением боковой цепи от аденино-
вого кольца, после чего аденин может окисляться ксантино-
ксидазой до мочевой кислоты.
Функции зеатина разнообразны: он индуцирует деление кле-
ток (однако только в присутствии ИУК), включение генетиче-
ской программы побегообразования, вызывает рост боковых
почек, активирует рост растяжением клеток листа и поддержи-
вает его трофику и функциональную активность, тормозит про-
цессы старения листьев, выраженность женского пола у дву-
домных растений и т. д. Рецепторы цитокининов обнаружены
в растворимой части цитоплазмы и в ЭР. Механизм действия
цитокинина в комплексе с рецепторами связан с активацией
синтеза всех типов РНК в ядре. Показано, что действие цито-
кинина, в частности, на функционирование РНК-полимеразы I
обусловлено активацией протеинкиназ. Цитокинин усиливает
синтез белков и функциональную активность мембращ
Гиббереллины. Эта группа фитогормонов представлена не-
сколькими десятками индивидуальных соединений, построен-
ных на основе структуры энт-гиббереллана. Все они являются
дитерпенами. У растений наиболее часто встречаются гибберел-
лины ГА1, ГА4 и ГА20:
В экспериментальной работе используют гиббереллин грибного
104
происхождения — ГА3 (гибберелловая кислота):
Гиббереллины синтезируются из мевалоновой кислоты в моло>
дых листьях, в развивающихся семенах и, возможно, в кончи-
ках корней. В растительных тканях гиббереллины образуют
глюкозиды и, по-видимому, связываются с белками. Эти конъю-
гаты могут служить запасной и транспортной формами гиббе-
реллинов. Транспорт гиббереллинов по растению осуществля-
ется пассивно по флоэме и ксилеме во всех направлениях. Не-
которые свободные гиббереллины не обладают активностью и
используются как транспортные формы, превращаясь в актив-
ные фитогормоны по мере необходимости.
Гиббереллины активируют удлинение стеблей и цветоносов;,
стимулируя деление и растяжение клеток, индуцируют процес-
сы транскрипции и трансляции гидролаз в алейроновых клет-
ках при прорастании зерновок злаков, устраняют период по-
коя (у семян некоторых видов, клубней картофеля), способст-
вуют закладке и формированию плодов (например, у виногра-
да), индуцируют выраженность мужского пола у двудомных
растений и т. д.
Действие гиббереллинов обусловлено наличием рецепторов
в цитоплазме и, по-видимому, в плазмалемме. Эти фитогормоны
индуцируют синтез специфических РНК и белков, способству-
ют повышению содержания ауксина в тканях, усиливают син-
тез фосфолипидов мембран.
Абсцизины. Абсцизовая кислота (АБК) и ксантоксин отно-
сятся к ряду сесквитерпенов (Ci5):
105
АБК синтезируется, как и гиббереллины, из мевалоновой кис-
лоты. Ксантоксин образуется при окислении каротиноида вио-
лаксантина. Места биосинтеза АБК: зрелые листья, корневой
чехлик. Синтез АБК резко возрастает при стрессовых воздей-
ствиях, особенно при водном дефиците. Абсцизовая кислота
образует сложный эфир с глюкозой, биологическая активность
которого значительно ниже, чем у свободной АБК. Глюкозид
служит для детоксикации излишков фитогормона и является
его транспортной формой. Перемещение АБК происходит пас-
сивно по флоэме и ксилеме. АБК инактивируется при гидрокси-
лировании, которое осуществляется в мебранах ЭР.
АБК при повышении концентрации противодействует мно-
гим эффектам ИУК, ГА и цитокининов, способствует закрыва-
нию устыщ при водном дефиците, -опадению листьев и плодов^
участвует в процессах индукции и поддержания периода покоя
в семенах и почках; она благоприятствует разгрузке флоэмы
в местах потребления ассимилятов и синтезу запасных белков
в семенах
Белковые рецепторы АБК обнаружены на внешней стороне
плазмалеммы. АБК ингибирует синтез ДНК, РНК и белков,
тормозит ионный транспорт через плазмалемму. Эти эффекты
АБК могут быть связаны с действием фитогормона на проте-
инкиназы.
Этилен. Газообразный непредельный углеводород этилен
(СН2=СН2) обладает сильным морфогенетическим действием
на растения. Он может образовываться из метионина во всех
тканях и органах растения. Синтез этилена резко возрастает
при старении органов и при созревании плодов. Как газооб-
разное соединение этилен перемещается по тканям путем диф-
фузии на сравнительно короткие расстояния. Однако его пред-
шественник— 1-аминоцпклопропан-1-карбоновая кислота (АЦК):
Н2С^7СН2
С
”00СХ
может транспортироваться с ксилемным и флоэмным током по
всему растению. Превращение АЦК в этилен осуществляется с
участием оксидазы и требует присутствия кислорода.
Этилен тормозит рост в длину побегов и корней с одновре-
менным утолщением в зоне растяжения вследствие изодиаметри-
'ческого роста клеток, вызывает изгибы стебля и эпинастию (опу-
скание) листьев, способствует созреванию плодов, опадению пло-
дов и листьев, ускоряет процессы старения, но в то же время об-
•106
работка этиленом приводит к устранению состояния покоя,
образованию адвентивных корней и корневых волосков, индук-
ции женской сексуализации. Этиленсвязывающие белки (рецеп-
торы) обнаружены б растительных клетках в составе мембран
(в ЭР, в мембранах алейроновых зерен). Они обладают очень
высоким сродством к этилену. При действии этилена нарушает-
ся упорядоченное (перпендикулярное оси клетки) расположе-
ние микротрубочек в кортикальном слое цитоплазмы, что при-
водит к изодиаметрическому росту клетки. Одновременно с этим
тормозится полярный транспорт ауксина. Под действием этиле-
на активируется синтез нуклеиновых кислот в местах утолщения
осевых органов. Этилен снижает содержание белков в апексе
и повышает в зоне растяжения, где индуцируется утолщение.
На проницаемость клеточных мембран этилен не оказывает
влияния. Можно думать, что действие этилена связано с меха-
низмом нарушения поляризации клеток.
Электрофизиологическая система регуляции. У раститель-
ных организмов отсутствует нервная система, однако электро-
физиологические явления постоянно используются .для регуля-
ции физиологических и морфогенетических процессов. Такая
регуляция осуществляется на базе электротонических потенциа-
лов и потенциала действия. Эти потенциалы могут существо-
вать до тех пор, пока в живых клетках поддерживаются от-
личные от нуля значения мембранных электрохимических по-
тенциалов (см. выше). Как уже говорилось, клетки раститель-
ного организма связаны друг с другом непрерывной мембран-
ной фазой через плазмодесмы. Поэтому при изменении мем-
бранного потенциала в каких-либо клетках между этими и со-
седними клетками возникает разность потенциалов. Точно так
же, если в каких-то клетках на плазмалемме генерируется
электрический импульс, то он может через плазмодесмы пере-
даваться в другие клетки.
Электротонические поля и токи. Между всеми ча-
I стями растений существует разность электрических потенциалов,
I которая изменяется сравнительно медленно. Апикальная почка
двудольных растений заряжена положительно по отношению к
основанию стебля. У проростков кончик корня и зона корневых
волосков заряжены положительно по отношению к зоне
। растяжения. Между этими участками возникают токи
i порядка 0,1—0,4 мкА, которые медленно изменяются, в том
• числе и в режиме колебаний. Эти электротонические разности
! потенциалов имеют, по-видимому, функциональное значение.
। Как мы видели (см. рис. 2.5), вход электрического тока в опре-
деленных участках глобулярного зародыша предшествует об-
разованию в этих местах примордиев семядолей. Наложение
разности потенциалов вдоль отрезка колеоптиля кукурузы уси-
ливает его рост в длину, если положительный полюс (анод)
помещается у апикального конца (см. рис. 4.11). При обрат-
107
ном положении полюсов усиления роста отрезка не происхо*
дит.
Потенциал действия (ПД). При кратковременном дей-
ствии на клетки стрессовыми факторами, например повышенной
или низкой температурой, импульсом света, в клетках развивает-
ся ПД, который может быть местным или распространяющимся.
ПД как у растений, так и животных обусловлен ионными по-
токами через плазмалемму. Из цитоплазмы выходят анионы
С1_ и входят катионы Са2+ и, возможно Н+. Это обусловлено
не только электрическим потенциалом, но и тем, что в клеточ-
ных стенках концентрации Са2+ и Н+ на 2—3 порядка выше,
чем в цитоплазме. Вход катионов и выход С1_ приводит к де-
поляризации МП (негативации при измерении внеклеточным
электродом), что способствует открытию потенциалзависимых
калиевых каналов, и Кг, выходя по электрохимическому гради-
енту из клетки, гиперполяризует мембранный потенциал. Ион-
ные насосы затем возвращают ионное равновесие в исходное
состояние. Таким образом возникает типичный ПД — электро-
отрицательный импульс. Амплитуда этого импульса достигает
100—160 мВ, а длительность — от 0,5 до нескольких десятков
секунд. У высших растений распространение ПД происходит
по проводящим пучкам стеблей. Скорость распространения ПД
у большинства растений 0,08—0,5 см/с.
Сигнальная роль ПД вполне очевидна у растений с быст-
рыми двигательными реакциями (у мимозы, венериной мухо-
ловки). Однако в настоящее время на многих растениях пока-
зано, что при действии различных факторов на листья электри-
ческий сигнал передается корням, и через несколько секунд из-
меняется их функциональная активность, например скорость
поглощения катионов. У проростков ПД возникает даже при
сравнительно незначительных изменениях температуры, поряд-
ка 3—5 °C. Эти данные указывают на существование у расте-
ний быстрой электрической связи, однако объем информации,
передаваемой таким образом, очень мал.
Все три системы межклеточной регуляции тесно взаимосвя-
заны. Фитогормоны, например ПУК, действуя на функциональ-
ную активность мембран, оказывают влияние на электрофизио-
логические градиенты между различными частями растения,
которые, в свою очередь, имеют отношение к регуляции тран-
спорта как фитогормонов, так и трофических факторов. Меж-
клеточные системы регуляции на клеточном уровне действуют
через внутриклеточные системы регуляции и управления.
Все эти системы объединены общими принципами, на основе
которых построен организменный уровень регуля-
ции и управления, обеспечивающий целостность инди-
видуума. К этим принципам относятся: централизация управ-
ления, полярность, канализированные связи, осцилляции и ре-
гуляторные контуры (см. рис. 6.2).
108
Доминирующие центры. Хотя целостность организма
проявляется уже во взаимодействии частей, однако при большом
количестве взаимосвязей возникает необходимость в появлении
центров управления, обеспечивающих единство поведения си-
стемы. Централизация управления в животных организмах осу-
ществляется нервной системой. Однако и в ходе эмбриогенеза
определенные участки формирующегося зародыша оказывают
организующее (директивное) влияние на окружающие ткани.
Примером этого являются классические опыты Г. Шпемана,
проведенные в начале нашего века, в которых было показано,
что дорсальная губа бластопора развивающегося зародыша
индуцирует закладку нервной системы. В этот же период Ч. М.
Чайлд, работая с животными и растительными объектами, при-
шел к выводу, что у всех развивающихся зародышей имеются
участки с наивысшей активностью, которые доминируют над
другими участками и оказывают влияние на их дифференциров-
ку. Он назвал их доминантными областями.
Для растений хорошо известно явление апикального доми-
нирования (см. 4.1.7 и 4.2.8), заключающееся в том, что раз-
вивающаяся апикальная почка побега и апекс корня тормозят
соответственно рост пазушных почек и боковых корней. Наряду
с этим прививка развивающейся почки в коровую паренхиму
стебля или в ткань каллуса индуцирует образование в этих
тканях элементов проводящих пучков. Как указывалось выше,
эти эффекты доминирования и индукции со стороны почки
связаны с образованием и транспортом ауксина. Апикальные
меристемы побега и корня не только являются ткане- и органо-
образующими зонами, но и оказывают дистанционное воздей-
ствие на все процессы коррелятивного роста в целом растении
(см. рис. 7.1).
Полярность и физиологические градиенты. Согласно
разработанной Ч. Чайдлом теории физиологических градиентов
доминирующие области, обладая высокой метаболической ак-
тивностью, обусловливают векторность различных факторов (по-
лярность). Таким образом определяется направление осей раз-
вивающегося организма. Для растений явление полярности, т. е.
специфической ориентации активности в пространстве, вполне
очевидно. Вдоль осевых органов изменяются активность дыха-
ния, концентрация ионов, метаболитов и гормонов, значения
электрических потенциалов и другие показатели. В радиальном
направлении в тканях стебля и корня изменяются содержание
О2, СО2, величина pH в клетках и т. д. Существенную роль
У растений играют механические давления и натяжения. Внут-
ренние ткани оказывают давление на наружные слои клеток
в стебле и других органах (см. 4.1.5). Примером действия этих
механических сил может быть закручивание наружу разрезан-
ных вдоль участков цветоноса одуванчика. Точно так же пла-
109
стинка листа, разрезанная листогрызом в определенном направ*
лении, скручивается в трубочку. Химические, физические и фи*
зиологическе градиенты в тканях, органах и целом растении
являются одним из способов формирования целостности орга-
низма.
Канализированная связь. Передача сигналов по специа-
лизированным тканям—более совершенный способ управления и
регуляции по сравнению с информацией, заключенной в физио-
логических градиентах. Такими специализированными тканями
у растений являются проводящие пучки, по которым осущест-
вляются транспорт ассимилятов, воды, минеральных солей и
вторичных метаболитов, а также фитогормонов и передача
электрических сигналов. Перемещение трофических факторов и
информационных сигналов по проводящим тканям происходит
более целенаправленно и быстро. Трофические факторы по со-
судам ксилемы и ситовидным трубкам транспортируются пас-
сивно (масс-ток) со скоростью до нескольких десятков санти-
метров в час. Активные механизмы, требующие затраты мета-
болической энергии, функционируют при загрузке флоэмы и
ксилемы и в живых клетках проводящих пучков. Фитогормо-
ны, за исключением ПУК, движутся пассивно в составе фло-
эмного и ксилемного соков. Полярный базипетальный транспорт
ИУК происходит медленно (0,5—1,5 см/ч) по живым клеткам
пучков от верхушек побегов к кончикам корней. Механизм
этого перемещения обсуждался выше (см. 3.2). Скорость пере-
дачи электрических импульсов (потенциалов действия) по жи-
вым клеткам проводящих пучков составляет у большинства
растений 0,08—0,5 см/с.
Осцилляции. Физиологические ритмы с различной ампли-
тудой и длительностью периодов выполняют функции синхро-
низации различных жизненных явлений и служат источником ин-
формации. Околоминутные колебания описаны для ПД и дви-
жения цитоплазмы, а околочасовые характерны для таких про-
цессов, как ростовые нутации и транспорт ИУК.
Интенсивность многих процессов в растениях меняется в
околосуточном режиме (циркадные ритмы). Это относится
к фотосинтезу, транспирации, транспорту ассимилятов, росто-
вым процессам. Многолетним растениям присущи сезонные рит-
мы жизнедеятельности. По-видимому, ритмы разных порядков
составляют общую систему взаимосвязанных осцилляций.
Регуляторные контуры. Все перечисленные выше ком-
поненты регуляторных систем—фитогормоны, электрические сиг-
налы, генетические механизмы, метаболические реакции и т.д.—
действуют в живом организме не изолированно, а в составе
сложной системы последовательных и разветвленных (каскад-
ных) реакций с многочисленными обратными связями. В состав
таких регуляторных контуров входят: 1) восприятие внешних
и внутренних сигналов рецепторами и преобразование их в сиг-
110
налы второго порядка, 2) передача этого индуцированного сиг-
нала в другие части растения, 3) восприятие передаваемого
сигнала клетками рабочего органа и изменение его функцио-
нальной активности в соответствии с полученной информацией,
4) сигналы обратной связи.
У растений имеются хемо-, фото- и механорецепторы. Из
фоторецепторов наиболее изучен фитохром (см. 8.11). Приме-
рами хеморецепторов являются белки-рецепторы фитогормо-
нов. /Механорецепция лежит в основе механизма восприятия
гравитации, чувствительности усиков. Регуляторные контуры,
объединяющие в общий механизм все системы регуляции, ле-
жат в основе раздражимости, т. е. свойства клеток и целого
организма адекватно (целесообразно) отвечать на внешние и
внутренние воздействия. Хотя законы раздражимости (законы-
силы, длительности, количества и градиента раздражения) из-
вестны с прошлого века, однако конкретные их механизмы для:
растений остаются мало изученными.
6.2. МЕХАНИЗМЫ МОРФОГЕНЕЗА
Как уже отмечалось, рост связан с увеличением объема и
массы растения (см. 1). Морфогенез — процесс формообразо-
вания, т. е. заложения, роста и развития органов (органоге-
нез), тканей (гистогенез) и клеток (цитогенез). В процессе
роста и морфогенеза возникает целостный организм специфи-
ческой формы в соответствии с генотипом вида и конкретными
условиями существования. Можно сказать, что морфогенез —
это процесс превращения питательных веществ в структуры
тела.
Формообразовательные процессы у высших растений опре-
деляются клеточными взаимодействиями, которые индуцируют
| и поддерживают деление и рост клеток. Скорость, число и ори-
Поляризация клеток
(функция мембран)
се
х
«=(
X
Деление
клеток
Дифференцировка
клеток
’ Морфогенез
и рост
Растяжение клеток
11
и
Дифференциальная активность
-> генов
Рис. 6.6. Основные механизмы морфогенеза.
ентация делений, интенсивность, длительность и направленность
роста клеток являются основными переменными, определяющи*
ми форму органов и целого растения. Все эти процессы нахох-
лятся под контролем систем регуляции и управления целого
организма. Важнейшие компоненты механизмов морфогенеза
поляризация клеток и дифференциальная активность генов,
которые индуцируются специфическими факторами различной
природы. Этими индукторами могут быть физические и хими*
ческие факторы внешней и внутренней среды. Общая схема
основных компонентов механизмов морфогенеза представлена
на рис. 6.6.
6.2.1. ПОЛЯРИЗАЦИЯ КЛЕТОК
О поляризации клеток высших растений можно судить по
ориентации плоскости деления клеток или по направлению их
роста. Механизмы поляризации изучены на очень небольшом
числе объектов.
Поляризация яйцеклетки фукуса. Яйцеклетки морских бу-
рых водорослей Fucus или Pelvetia — уникальные объекты для ,
изучения первичного этапа процессов морфогенеза, так как эти
клетки исходно не имеют поляризации. После оплодотворения
первым внешним признаком поляризации служит появление
выпячивания в месте образования ризоида, что определяет
становление главной оси растения: таллом — ризоид. Эта пер-
вичная и важнейшая в онтогенезе растения поляризация мо-
жет быть следствием вхождения сперматозоида, контакта с
грунтом, одностороннего освещения, градиентов Са2+, электри-
ческого поля. Выступ ризоида формируется в участке, контак-
тирующем с грунтом с затененной стороны, со стороны повы-
шенной концентрации Н+ или Са24~ (или кальциефора А 23187),
а при наложении внешнего электрического поля — на участке,
обращенном к положительному полюсу (аноду). При локаль-
ной обработке зиготы ауксином ризоид формируется на обра-
ботанном участке. В течение первых 10 ч зиготу можно перепо-
ляризировать. Через 11—16 ч после оплодотворения поляриза-
ция становится необратимой. Во всех случаях механизм поля-
ризации связан с локальным входом ионов Са2+. Предполага-
ется, что при наложении внешнего электрического поля кальцие-
вые ионные каналы в плазмалемме зиготы перемещаются в сто-
рону анода в результате электрофореза. Вхождение кальция
способствует сборке в кортикальном слое цитоплазмы актино-
вых микрофиламентов, ассоциированных с плазмалеммой, Я
активирует секрецию везикул АГ в этом участке (рис. 6.7).
Мембрана везикул, встраиваясь в плазмалемму, увеличивает
ее площадь, а полисахариды, содержащиеся в везикулах, фор-
мируют клеточную стенку. Эти процессы и приводят к появ-
лению выступа. Таким образом, первичная поляризация вознй-
112
каст в результате локальной активации функциональной
активности плазмалеммы и распространяется на кортикальный
слой. Между возбужденным и противоположным участками
яйцеклетки возникают электрические токи. Все это приводит
к детерминации главной оси будущего растения. Актиновые ми-
Рис. 6.7. Гипотетическая схема индукции полярности у яйце-
клетки Fucus внешним электрическим полем (по: Jaffe, Nuc-
citelli, 1977; Quatrano, 1978);
a — e — последовательность процессов. 1 — Ca2 -каналы (—) и насо-
сы ( + ), 2 — плазмалемма, 3 — ядро.
крофиламенты закрепляют белковые компоненты в плазмалем-
ме и таким образом делают поляризацию необратимой. Обра-
ботка яйцеклетки в этот период цитохалазином В, разрушаю-
щим микрофиламенты, препятствует фиксации полярности. Цик-
логексимид (ингибитор синтеза белков) не оказывает сущест-
венного влияния на становление первичной оси. Деление
зиготы начинается уже после появления отчетливо видимого
выступа. Плоскость деления проходит перпендикулярно пер-
вичной оси зиготы. Это значит, что первичная поляризация
ориентирует формирование микротрубочек веретена, возникно-
вение которых индуцируется возбужденными участками плаз-
малеммы. При делении зиготы дочерние ядра попадают в клет-
ки, находящиеся в функционально различных состояниях.
Цитоплазма этих клеток ^выбирает» из своих ядер различную
информацию. В результате формируются две разные клетки:
меньшая — ризоидная клетка и большая клетка, дающая нача-
ло будущему таллому.
Поляризация клеток у высших растений. Яйцеклетка у выс-
8 Заказ № 394 ИЗ
ших растений поляризуется при своем формировании под дей-
ствием окружающих тканей. Эта поляризованность проявляет-
ся уже в ее форме, положении в ней вакуоли и ядра (см. рис.
2.1). Первичная поляризация яйцеклетки детерминирует (опре-
деляет) зародышевую ось: корень — побег, которая является
определяющей в дальнейших процессах морфогенеза. После
деления зиготы на две первичные клетки базальная формиру-.
ет суспензор, а апикальная — зародыш. Ориентация плоскостей
делений у этих клеток при их дальнейшем делении различна
(см. рис. 2.2). Очевидно, это связано с взаимодействием двух
первичных клеток проэмбрио и влиянием окружающих тканей.
В результате двух последовательных продольных делений во
взаимоперпендикулярных плоскостях клетки 4-клеточного про-
эмбрио оказываются вытянутыми. Последующее их деление
определяется правилом Ю. Сакса — О. Гертвига: веретено при
клеточном делении располагается вдоль длинной оси вытяну-
той клетки, а плоскость деления — поперек этой оси. По-види-
мому, это явление можно объяснить самополяризацией. На кон-
цах удлиненной клетки возникают значительные механические
напряжения в плазмалемме, что может сказываться на ее функ-
циональной активности в этих участках. Существенную роль
в поляризации могут также играть ядерно-плазменные отноше-
ния, а именно удаленность элементов цитоплазмы от ядра в ди-
стальных концах клеток. У глобулярного зародыша дифферен-
цирующиеся клетки протодермы делятся антиклинально из-за
давления внутренних клеток, направленного наружу. Здесь
поляризация, по-видимому, связана с механическим растягива-
нием поверхностных клеток, при котором особое напряжение
испытывают боковые межклеточные контакты.
Поляризация клеток играет большую роль в определении
характера деления клеток: оно может быть равным (воспроиз-
водящим) и неравным (дифференцирующим) (рис. 6.8). Если
клетка делится поперек постоянно существующей оси поляри-
зации, возникшей при заложении первичной оси растения, то
дочерние клетки будут иметь неравнозначную цитоплазму. Эта
неравнозначность имелась уже в материнской клетке вследст-
вие ее поляризации. В этом случае ядра в дочерних клетках
функционируют в различных условиях, и клетки дифференци-
руются для выполнения разных функций. Если же в резуль-
тате дополнительной поляризации в поперечном направлении
клетка делится таким образом, что плоскость деления совпа-
дает с направлением первичной консервативной оси поляриза-
ции, то возникают совершенно идентичные дочерние клетки.
В первом случае происходит дифференцировка, т. е. появление
качественно новых клеток, во втором — воспроизведение одина-
ковых клеток, т. е. рост ткани.
Ориентация роста клеток растяжением также определяется
поляризацией клеток и связана с расположением микрофиб-
114
рилл целлюлозы в растущих клеточных стенках. Если микро-
фибриллы откладываются перпендикулярно оси колеоптиля,
стебля, корня в соответствии с первичной поляризацией орга-
низма, то под действием тургорного давления клетки растяги-
ваются преимущественно в длину. Такая ориентация микрофи-
брилл детерминируется микротрубочками, которые расположе-
ние. 6.8. Схема неравного (/) и равного (2) де-
ления клеток.
ны в кортикальном слое цитоплазмы (под плазмалеммой) пер-
пендикулярно будущей длинной оси клетки. Механизм такой
ориентации микротрубочек остается не выясненным. По-види-
мому, главную роль здесь играет первичная консервативная
апикально-базальная поляризация клеток в осевых органах
растений. Эта же причина лежит в основе и полярного тран-
спорта ауксина (см. рис. 3.11). ИУК и сама по себе способна
поляризовать клетки и ткани. Поступая в апикальный конец
клетки, ауксин активирует Н+-помпу, что создает разность по-
тенциалов между апикальным и базальным концами клетки.
Ткани, обработанные ауксином, в результате этого приобре-
тают положительный по отношению к другим участкам заряд,
что приводит к возникновению электротонических градиентов.
6.2.2. ДИФФЕРЕНЦИАЛЬНАЯ АКТИВНОСТЬ ГЕНОВ
Растительные клетки тотипотентны. Тотипотентность (лат.
totus — весь, целый и potentia — сила)—это способность рас-
тительной клетки при определенных условиях развиваться в
целый организм, основанная на наличии полной генетической
информации в ее ядре. Однако каждая соматическая клетка
8*
115
реализует лишь часть этой информации. Ограничения создают-
ся взаимодействием клеток и тканей, в результате чего в ядре
функционирует относительно небольшое количество генов. При-
чем в разных тканях транскрибируются различные гены, опре-
деляющие направление дифференцировки. Например, в тканях
табака обнаружено 25 000—30 000 различных видов мРНК, из
них только 8000 были общими, а остальные — специфичными
для разных тканей.
Для активации экспрессии генов необходимо разрыхление
хроматина (переход гетерохроматина в эухроматин). Оно до-
стигается модификацией и удалением части гистонов, уплотня-
ющих хроматин. В основе модификации гистонов лежит их аце-
тилирование, фосфорилирование и другие процессы. Однако
деспирализации тех или других участков хромосом еще недоста-
точно для активации генов. В составе хроматина содержатся
кислые (негистоновые) белки, многие из которых специфичны
для тканей. Они выполняют многообразные функции: участвуют
в модификации гистонов, в активации или репрессии РНК-поли-
мераз и регуляторных локусов генов, в созревании транскриби-
руемых РНК и т. д. После транскрипции в ядре про-мРНК
подвергается процессингу, т. е. кэпированию и метилированию
с 5'-конца, полиаденилированию с З'-конца и сплайсингу. Со-
хранение мРНК в нуклеоплазме достигается путем ее связы-
вания со специфическими белками. Вместе с другими типами
синтезированных РНК (рРНК, тРНК) мРНК через ядерные
поры в свободном виде выходит в цитоплазму, где связывается
с другими белками, образуя информосомы, или начинает функ-
ционировать в составе полисом.
Сборка полисом--также многоступенчатый процесс, кото-
рый начинается с присоединения малой рибосомальной субъеди-
ницы 40 S в составе инициаторного комплекса к мНРК. Син-
тез полипептидов из аминокислот (трансляция) осуществляется
в полисомах с участием всех типов РНК. Регуляция всех этих
многоэтапных процессов на уровне транскрипции и трансляции,
а также репликации ДПК изучена недостаточно. На актива-
цию синтеза РНК и белков оказывают влияние физико-хими-
ческие факторы (К+, Mg2+, pH и др.), кофакторы (Мп2+ и др.),
сбалансированность всех компонентов системы, присутствие ре-
гуляторных белков, в том числе и тех, которые действуют в
комплексе с фитогормонами или другими эффекторами. Осо-
бую роль в избирательном включении активности генов при
взаимодействии клеток и тканей играют фитогормоны, трофи-
ческие факторы и ионные сдвиги.
Однако индукция синтеза специфических белков в клетках
сама по себе еще не объясняет тех процессов, которые мы на-
зываем морфогенезом. Вслед за синтезом белков в клетках
идет самосборка надмолекулярных и субклеточных структур.
Самосборка — это процесс спонтанной агрегации однородных
116
и разнородных молекул, который приводит к упорядочению мо-
лекул и росту многокомпонентных структур. Механизмы само-
сборки основаны на слабых взаимодействиях (без образования
ковалентных связей). Избирательность самосборки обеспечи-
вается наличием у молекул биополимеров участков узнавания,
комплементарных определенным локусам молекул-партнеров,
что обеспечивает высокое сродство и специфичность существо-
вания такого рода комплексов. Самосборка компонентов про-
исходит со снижением свободной энергии и потому самопроиз-
вольно. В клетках осуществляется самосборка нуклеотидов на
полимерных матрицах, полисом, многокомпонентных ферментов
(из субъединиц), полиэнзимных комплексов; на принципах са-
мосборки осуществляется взаимодействие фермента и субстра-
та, рецепторного белка и фитогормона и т. д. Такие сложные
структуры, как мембраны и хромосомы, тоже формируются на
основе самосборки.
Протекающие в клетках процессы самосборки зависят от
физико-химических условий среды, наличия специфических бел-
ков и других факторов. Например, для сборки микротрубочек
необходимо присутствие ионов Mg2+, Са2+, ГТФ и АТФ, при-
чем при увеличении концентрации Са2+ до 0,01 мМ и выше про-
исходит разборка микротрубочек. Для сборки актиновых микро-
филаментов из глобулярных субъединиц необходимо присутст-
вие АТФ и Mg2+. Изменение концентрации Са2+ в цитоплазме
оказывает влияние на сборку и разборку актиновых компонен-
тов цитоскелета. Таким образом, физико-химические градиен-
ты, в том числе концентрационные градиенты Са2+, определяют
векторы самосборки цитоскелета (микротрубочек и микрофила-
ментов), который, в свою очередь, упорядочивает расположе-
ние многих других внутриклеточных структур.
6.2.3. ИНДУЦИРУЮЩИЕ ВОЗДЕЙСТВИЯ
Как поляризация клеток, так и активация генов вызывают-
ся индуцирующими воздействиями. Индуцирующие факторы
могут иметь химическую или физическую природу. Ими могут
быть как факторы внешней среды, так и процессы и сигналы,
возникающие в самом организме.
Индуктор вызывает ответную реакцию в клетках, тканях
и органах, если они обладают соответствующей компетенцией
(готовностью). Компетенция — это способность воспринимать
индуцирующее воздействие; ее природа может быть самой раз-
ной. В случае действия фитогормонов компетенция определяет-
ся наличием белков-рецепторов, при действии красного света —
присутствием фитохрома. Поэтому в условиях действия специ-
фического индуцирующего фактора на него реагируют лишь
клетки-мишени. В системе целого растения индуцирующие воз-
117
действия могут быть контактными и дистанционными. Рассмот-
рим их основные типы.
Эффект массы. В специализированных клетках синтезиру-
ются специфические вещества, и если эти вещества выделяются
из клеток, их концентрация в окружающих тканях будет зави-
сеть от массы специализированных клеток. При делении и росте
этих клеток концентрация выделяемого вещества может достиг-
нуть критического для окружающих тканей уровня, и это ве-
щество становится для них индуктором. Накапливающееся
вещество может быть индуктором и для тех клеток, которые
его вырабатывают.
Эффект биологических часов. Включение новых генетиче-
ских программ может находиться под контролем ритмических
процессов. Одним из таких ритмов является митотический цикл.
В раннем эмбриональном развитии после нескольких циклов
клеточных делений дифференцируются специализированные
клетки, например гипофиза в суспензоре (см. рис. 2.2). В апек-
се корня кукурузы клетки после 5—6 делений переходят к рас-
тяжению. .Однако показано, что в этом случае митотическая ак-
тивность сама по себе не обязательна для включения генетиче-
ской программы растяжения. Подавление митозов с помощью
рентгеновского облучения не останавливает переход к растяже-
нию. Время жизни клеток в меристеме до перехода к растяже-
нию как у контрольных, так и у облученных корней остается
одинаковым и составляет около 3 сут (см. 4.2.1). По-видимому,
счет времени в кончиках корней может осуществляться с уча-
стием других ритмов, возможно, колебаний ионных потоков че-
рез плазмалемму. В результате прохождения определенного чи-
сла ритмов той или иной природы в клетках могут создаваться
индуктивные условия для перехода к следующей фазе развития.
Эффект положения. Г. Дриш в конце прошлого века сфор-
мулировал теорию, согласно которой судьба каждой части заро- >
дыша есть функция ее положения в целом зародыше. Идея ’
Ч. Чайлда о физиологических градиентах явилась материальным
обоснованием закона Дриша. В частности, Чайлд считал, что
верхний (доминирующий) участок градиента (например, апи-
кальный конец у гидры) выделяет некоторые факторы, подавля-
ющие развитие таких же головных структур из других клеток
зародыша. В настоящее время такие морфогены белковой при-
роды выделены из гидры. Развитием этих идей явилась концеп-
ция Л. Вольперта о «позиционной информации». Он полагает,
что развитие каждой клетки определяется концентрацией спе-
цифических веществ — «морфогенов», которые распределены
вдоль оси целого зародыша в виде концентрационного градиен-
та, что и составляет суть «позиционной информации». Однако
использовать эту информацию могут только компетентные клет-.
ки. Сходную точку зрения развивает Дж. Боннер (гипотеза мор-
фогенетических тестов).
118
В настоящее время имеется много подтверждений тому, что
в тканях и органах растительного организма существуют про-
дольные и радиальные градиенты физических (электрические по-
ля, механические натяжения), химических (Н+, Са2+, О2, СО2,
трофические факторы, фитогормоны и др.) и физиологических
(дыхание, транспорт веществ и т. д.) факторов. Эти градиенты
могут меняться в пространстве и во времени в результате но-
вых поляризаций, возникающих в ходе развития организма (см.
рис. 4.13 и 4.14). Отражением такого рода градиентов может
быть, в частности, изменение частоты клеточных делений в раз-
личных зонах апекса корня (см. рис. 4.22).
Эффект соотношения индукторов. Мы уже видели, что из-
менение соотношения разных компонентов, входящих в состав
индуцирующего комплекса, может быть причиной переключе-
ния генетических программ. Наиболее яркий пример — влияние
разных соотношений ИУК и цитокинина на деление, рост и
дифференцировку клеток. В культуре ткани сердцевины стебля
табака одна ИУК стимулирует рост клеток растяжением, вме-
сте с цитокинином — деление клеток; дифференцировка побе-
гов в культуре этой ткани индуцируется повышением концен-
трации цитокинина, а дифференцировка корней — наоборот,
снижением его концентрации (см. рис. 5.1). Такую же индук-
торную специфическую роль соотношение ауксина и цитокини-
на играет и при регенерации листьев и корней у отрезков кор-
ней одуванчика (см. рис. 5.2). Поскольку ИУК синтезируется в
верхушках побегов, а цитокинин (зеатин)—в кончиках корней
и они транспортируются навстречу друг другу, то вполне воз-
можно, что вдоль осевых органов растений создается градиент
соотношения ауксин / цитокинин, который к тому же может из-
меняться во времени.
Обсуждая закономерности онтогенеза И. И. Шмальгаузен
писал: «. . .движущие силы индивидуального развития создают-
ся по мере дифференцировки зародыша в результате взаимо-
действия продуктов этой дифференцировки. Взаимодействие
разных частей ведет к новым дифференцировкам и дальнейшим
взаимодействиям... В результате этих взаимодействий организм
развивается на всех стадиях как одн-о согласованное целое»*.
Эту идею можно выразить следующей схемой:
Типы тканей: I Фазы развития: IV
II III
А —> ааа аа а —
Б —> бб 66 бб бб
В —> — в вв ввв
Г <------------------------------'
Индукция
Как видно из схемы, по мере развития ткань А снижает вы-
* Шмальгаузен И. И. Регуляция формообразования в индивиду-
альном развитии. М., 1964. С. 1.
119
работку метаболита а. Ткань Б выделяет метаболит б на всех
этапах развития равномерно. Появившаяся в результате диф-
ференцировки новая ткань В начинает синтезировать метабо-
лит в, причем со временем выработка этого метаболита воз-
растает. Таким образом, на каждой фазе развития имеются
разные соотношения метаболитов, которые в комплексе выпол-
няют функции индуктора. На IV фазе этот комплекс специ-
фично индуцирует появление (дифференцировку) новой тканн
Г. Схема дает представление об одном из механизмов самораз-
вития.
Автоколебания и автоволны. Синергетика приводит все но-
вые примеры самоорганизации, возникающей в живой и а
неживой природе на базе динамических нелинейных процес-
сов— автоколебаний и автоволн. Такой тип самоорганизации
возможен только в открытых неравновесных системах. Авто-
волнами называют волны, распространяющиеся в активных
средах, т. е. в средах, в которых имеется запас энергии для
поддержания этих волн. Незатухающие, нераспространяющиеся
автоволны, поддерживаемые диссипацией энергии, относят к
автоколебаниям. Автоколебания и автоволны возникают на ос-
нове обратной отрицательной связи и могут индуцироваться
разнообразными воздействиями (возмущениями).
Примером автоколебаний могут быть местные, т. е. нерас-
пространяющиеся, ПД. Автоволна распространяющегося ПД
поддерживается электрохимическим потенциалом плазмалеммы
и энергетическими механизмами (см. 6.1.2). В качестве приме-
ра возможного участия ПД в морфогенетических процессах
можно привести данные о возникновении распространяющихся
серий импульсов в клетках рыльца при прорастании пыльцы,,
передающих информацию в яйцеклетку и зародышевый мешок,
что подготавливает яйцевой аппарат для восприятия спермиев
(см. рис. 9.25).
Другим примером автоволнового процесса у растений явля-
ется активный механизм транспорта ПУК. Он осуществляется
в колебательном режиме с периодом от 30 до 60 мин (см. рис.
4.12). Расчеты показывают, что высококонцентрационный им-
пульс ИУК (пик волны) проходит через каждую клетку за
1—3 мин. В специальных опытах установлено, что однократная
кратковременная (1 мин) обработка отрезков колеоптилей ИУК
(10 мг/л) индуцирует усиление роста растяжением в течение
1—2 ч. Эти данные свидетельствуют о том, что медленное пере-
мещение ИУК (0,5—1,5 см/ч) связано с импульсным характе-
ром ее действия на ростовые процессы. Несколько минут прщ
сутствия ИУК в высокой концентрации в клетке запускает
морфогенетический процесс, имеющий значительно большую
продолжительность. Как отмечалось выше, полярный транс-
порт ауксина сопровождается поляризацией клеток, что выра-
жается в перемещении вместе с ИУК волны электрического по-
120
тенциала. Это явление можно рассматривать как волну кон-
тактной поляризации клеток.
Одной из моделей морфогенеза, связанной с возникновени-
ем автоволн, является реакционно-диффузионная модель, пред-
ложенная А. Гирером и X. Мейнхардтом. Согласно этой кон-
цепции клетки развивающегося организма продуцируют два
вещества: активатор (а) и ингибитор (Л), причем коэффициент
диффузии ингибитора (Dh) больше коэффициента диффузии,
активатора (Da). Синтез активатора—процесс автокаталити-
ческий (выражается квадратичным членом), при этом синтез
активатора подавляется ингибитором. Оба эти процесса выра-
жаются членом Ср-^- . Образование ингибитора индуцируется
активатором и является функцией квадрата концентрации акти-
ватора (С'р'а2). В уравнение вводятся также член, выражаю-
щий фоновую (нс автокаталитическую) продукцию активатора
(pop), и члены, характеризующие распад или удаление акти-
ватора (—ца) и ингибитора (—bh). В результате получаем
уравнения, отражающие изменения концентраций активатора
и ингибитора в единицу времени:
да . а*- , гл да
- = Рор + СРу-|ла + Г)^,
Если в этой модели в одномерном варианте (на плоскости)
локально создать возмущение в виде небольшого подъема кон-
центрации активатора, то в силу автокаталитичности синтеза-
активатора его концентрация будет нарастать (рис. 6.9). Вслед
за этим по условиям модели начнет возрастать концентрация
ингибитора (пропорционально квадрату концентрации актива-
тора). Так как ингибитор диффундирует быстрее активатора,
то это понижает отношение h/a в месте локального возмуще-
ния, но повышает его на некотором расстоянии. В результате-
в месте начального возмущения возникает устойчивый пик кон-
центрации активатора, а вокруг него — зона с преобладанием
концентрации ингибитора. Когда при дальнейшей диффузии и
разрушении концентрация ингибитора понизится до порогового
уровня, возможно формирование новых пиков концентрации ак-
тиватора.
Приведенной модели в какой-то мере соответствует пове-
дение ИУК и этилена. Синтез ИУК в примордиях апекса побе-
га возрастает автокаталитически, так как при каждом делении
уже не одна, а две клетки синтезируют ауксин. Известно, что
ИУК в повышенных концентрациях индуцирует синтез этиле-
на, который тормозит транспорт ИУК. Возникает система с об-
ратной отрицательной связью:
I 1Ф
ИУК Этилен,
et|
121
которая, следовательно, приобретает колебательный характер.
Поскольку этилен как газ диффундирует значительно быстрее,
чем ауксин, и в то же время легко теряется тканью, то соглас-
но модели в апексе побега могут возникать участки с повы-
шенной концентрацией ИУК, окруженные зонами с низким ее
Рис. 6.9. Результаты машинного анализа изменения во вре-
мени (сверху вниз) концентрации активатора а и ингибито-
ра Л в соответствии с моделью Гирера — Мейнхардта (по:
Белоусов, 1987; Meinhardt, 1982).
содержанием. Эту схему интересно сравнить с гипотезой о «по-
лях торможения» (см. рис. 4.5). При этом нужно иметь в ви-
ду, что механизмы морфогенеза в апексе побега значительно
сложнее рассмотренной модели; так, для формирования листо-
вых примордиев необходимо присутствие цитокинина. В явле-
ниях морфогенеза участвуют не только автоволновые процес-
сы, но и те организующие начала, которые обсуждались выше.
Изложенный в этой главе материал позволяет объяснить
некоторые процессы, связанные с морфогенезом, однако общей
теории морфогенеза еще не создано.
7. КОРРЕЛЯТИВНЫЙ РОСТ
Механизмы взаимодействия частей растительного организ-
ма, сформированные в ходе развития зародыша, продолжают
функционировать и усложняются в течение дальнейшего онто-
генеза растения. Это взаимодействие происходит с участием
трофических факторов, фитогормонов и электрических явле-
ний, причем особую роль играют функциональная активность
апикальных меристем побега и корня (доминирующих цент-
ров) и посылаемые ими сигналы. В целом растении осущест-
вляется регуляция процессов роста и морфогенеза, функцио-
нальной активности (фотосинтез, минеральное питание, водный
обмен) и двигательных реакций. Все эти процессы взаимосвя-
заны. В начале развития в растительном организме заклады-
ваются все его органы (эмбриогенез), затем идет прорастание
и переход к автотрофному способу питания, формирование
вегетативной массы (листьев, стеблей, корней), осуществление
процессов полового и вегетативного размножения. На всех этих
этапах происходит перестройка коррелятивных связей, что обе-
спечивает выполнение последовательно включающихся генети-
ческих программ. Важнейшим элементом этих процессов явля-
ется относительный рост различных частей, т. е. коррелятивный
рост. В предыдущих главах мы уже рассматривали взаимоза-
висимость роста разных органов растений. Целесообразно
обобщить эти сведения в виде схемы (рис. 7.1), на которой пред-
ставлено значение верхушки побега и кончика корня для регу-
ляции морфогенетических процессов в целом растении. Верхуш-
ка побега — это функционирующая апикальная почка, кончик
корня — апекс корня с корневым чехликом.
7.1. ВЗАИМОСВЯЗЬ ПОБЕГ—КОРЕНЬ
Эти две главные части растения выполняют функции воз-
душного и корневого питания, и их постоянный рост обеспечи-
вает осуществление этих функций. Корни как гетеротрофные
123
ВЕРХУШКА ПОБЕГА
Аттрагирующий центр —!
Индукция заложения и
деятельности камбия -----
Индукция образования
проводящих пучков и--------
роста стебля в толщину
Ингибирование роста
боковых почек
Конкурентная регуляция---------
старения листьев
L-Сенсорная зона
Меристематическая и
----тканеобразующая ак*
тивность, морфогене^
-----Регуляция удлинения
стебля
-------Регуляция тропизмов
---------Ориентация боковых
побегов
Корнеобразование на
стебле
Индукция образования ______________
боковых корней
Ориентация роста
-----------корневищ, столонов
и корней
Регуляция удлинения
корня
Рис. 7.1. Основные функции верхушки
органы нуждаются в поступлении ассимилятов из листьев, а
части побега — в притоке воды и минеральных веществ. Эти
трофические взаимосвязи, однако, не дают нам ключа для объ-
яснения закономерностей их коррелятивного роста. Главными
факторами коррелятивных взаимосвязей являются фитогормо-
ны. Верхушка побега (развивающиеся листовые зачатки) и в
меньшей степени молодые листья синтезируют и экспортируют
ИУК, которая ответственна за включение общей генетической
программы корнеобразования (см. 6.1.5; рис. 5.1) и оказывает
влияние на рост и морфогенез корня. В свою очередь, кончик
корня вырабатывает цитокинины, которые поступают в надзем-
ную часть. Они ответственны за включение программы побего-
образования (при наличии ауксина), рост и функциональную
активность листьев. Таким образом, между верхушкой побега
и кончиком корня с помощью фитогормонов устанавливается
обратная положительная связь, что лежит в основе саморазви-
тия целого растительного организма:
| Побег
Зеатин
ИУК
Корень
124
Индукция развития
£Теблевых апексов
-----------Рост и трофика листьев
Ориентация роста сто-
лонов и корневищ
Регуляция удлинения
стебля
Индукция образования
стеблевых почек
Регуляция удлинения
корня
Торможение образова-_______
ния боковых корней
Регуляция тропизмов
корня
Индукция образования_____
проводящих тканей
Аттрагирующий центр —т
__Меристематическая и
тканеобразующая актив-
ность
т— Сенсорная зона
КОНЧИК КОРНЯ
побега и кончика корня у высших растений.
Однако взаимодействия между побегом и корнем значитель-
но сложнее. Цитокинин корней активирует синтез белков, хло-
рофилла, оказывает поддерживающее влияние на функцио-
нальную активность зрелых листьев, создавая условия (при на-
личии других необходимых факторов) для интенсивного фото-
синтеза. Цитокинин способствует открыванию устьиц, что бла-
гоприятствует фотосинтезу. Из корней в надземную часть про-
ростков транспортируются гиббереллины. Затем они начинают
вырабатываться в формирующихся листьях, рост которых сти-
мулируется цитокининами из корней. Цитокинины и ГА, в
свою очередь, активируют синтез и транспорт ИУК (см. рис.
6.5). В корнях синтезируются метаболиты, необходимые для
побега. Между побегом и корнем регистрируются электриче-
ские .градиенты, генерируются ПД при изменении условий сре-
ды. Таким образом, возникает сложная многофакторая система
взаимосвязей с участием гормональных, трофических и элек-
трических компонентов, а также соответствующих рецепторов
п клетках. При моделировании процессов роста и развития
Псе эти взаимосвязи должны быть учтены в интегральной мо-
дели.
ИУК, поступающая из надземной части, оказывает коорди-
125
роста различ-
от концентра-
Рис. 7.2. Зависимость
ных органов растений (
ции ИУК.
/ — корень, 2 — почка, 3 — стебель. « + » —
ускорение, «—» — угнетение роста.
пирующее влияние на рост и дифференцировку корней. Так как’
зона роста растяжением корня очень чувствительна к ауксину
/глт^ 7о\ — может происходить при уело
вии поступления ИУК в его
дистальную часть в очень
маленьких количествах
(10-и-ю-io М)> а для ро^
ста корневых волосков опти-
мальны даже более низкие
концентрации ауксина (см.,
рис. 4.26). При появлений
новых примордиев листьев и
поступлении в корни ИУКв’
большей концентрации рост
корня в длину снижается*
но одновременно с этим ин-
дуцируется образование бо-
ковых корней из клеток пе-
рицикла, так как для такой
индукции оптимальна кон-
центрация ИУК на несколь-
ко порядков выше. Ауксин
в повышенных концентрациях вызывает образование придаточ-
ных корней и на стебле.
Цитокинины и гиббереллины, поступающие из корней, регу-
лируют рост стебля в длину, активируя деление клеток в сердце-
винной меристеме апекса побега (см. 4.1.1). Цитокинин инду-
цирует образование стеблевых почек (см. рис. 5.1) и ориента-
цию роста столонов и корневищ (см. рис. 4.17 и 4.18). Если
концентрация цитокинина повышается относительно других
фитогормонов (ИУК и ГА), например при срезании надземной
части, то концы столонов и корневищ начинают расти верти-
кально, превращаясь в облиственный побег. Верхушка побега
(развивающиеся листья, колеоптиль) и кончик корня являются
сенсорными органами. Они воспринимают направление света,
гравитационного поля, действие других векторных факторов и
управляют адаптивными двигательными реакциями — тропиз-
мами и настиями.
В ходе онтогенеза лидерство доминирующих центров и их
взаимосвязи меняются. Например, в начале развития основную
роль играют апикальная почка и апикальная меристема соот-
ветственно главного побега и главного (зародышевого) корня.
Затем могут начать интенсивно развиваться боковые побеги
(кущение, ветвление), боковые и придаточные корни. При за-
ложении цветков или формировании клубней эти апикальные
органы побега становятся ведущими в организации функцио-
нальной активности целого растения. Такую же роль играют и
формирующиеся запасающие ткани корнеплодов и луковиц.
126
Смена лидерства происходит в результате автономного измене-
ния гормональною баланса в меристемах или под действием
сигналов, поступающих из внешней среды, например в резуль-
тате восприятия фотопериодов (см. 9.1.2).
7.2. КОРРЕЛЯТИВНЫЙ РОСТ ЧАСТЕЙ ПОБЕГА
Между всеми органами побега также существуют корреля-
тивные взаимоотношения. Наиболее заметное из них—апи-
кальное доминирование: развивающаяся апикальная почка инги-
бирует рост пазушных почек и тормозит рост боковых побегов
(см. рис. 4.16). Механизм этого доминирования состоит в том,
что апикальная почка главного побега (которая формируется
в ходе эмбриогенеза) благодаря своим листовым примордиям
и развивающимся листочкам вырабатывает наибольшее коли-
чество ауксина, что позволяет ей конкурировать с пазушными
почками за трофические факторы и фитогормоны, прежде всего
за цитокинин. ИУК, индуцируя работу Н+-помпы в мембранах,
активируя деление и рост клеток, создает эффект аттрагирова-
ния (притягивания) питательных веществ и метаболитов. Пере-
хват цитокининов, поступающих из корней, делает апикальную
почку ведущей.
По мере удаления от апикальной почки начинают разви-
ваться боковые побеги (ветвление). Основную роль в конку-
рентных отношениях главного и боковых побегов, по-видимо-
му, играют полярный транспорт ИУК и формирование в связи
с этим транспортом проводящих пучков. Чем сильнее поток
ИУК, тем мощнее формирующийся проводящий пучок (см.
рис. 4.15), а следовательно, и возможности питания побега.
Менее ясен механизм, благодаря которому апикальная поч-
ка главного побега способствует отклонению растущих боковых
ветвей от вертикали. Так как боковые почки более чувстви-
тельны к ауксину, чем стебель (см. рис. 7.2), то можно думать,
что в тканях почек при повышенной для них концентрации ИУК
образуется этилен, который способствует плагиотропному росту,
т. е. росту под углом к оси главного побега. Известно, что бла-
годаря этилену дистальная часть стебля этиолированных про-
ростков изогнута в виде крючка (см. рис. 3.3 и 3.4). Избыток
этилена вызывает эпинастию (опускание) листьев, при этом воз-
растает величина угла между листом и стеблем.
Рост междоузлий в длину зависит от ИУК и ГА, поступаю-
щих из листьев. Гиббереллины могут поступать и из корня,
где они синтезируются или превращаются в активные формы
из неактивных. При недостатке света верхние (растущие) меж-
доузлия вытягиваются. Причины этого могут быть многообраз-
ны: увеличение ИУК в зоне растяжения в результате более
активного транспорта или снижения скорости ее разрушения,
127
возрастание поступления ГЛ или снижение концентрации инги-
биторов роста.
Вслед за удлинением происходит вторичное утолщение стеб-
ля благодаря активности камбия (у двудольных растений).
Функциональная активность камбия поддерживается ИУК,
транспортирующейся из верхушки побега.
Рост листа обусловлен ауксином, который вырабатывается
в нем самом, и цитокинином, поступающим из корней. Причем
цитокинин необходим как для деления, так и для растяжения
клеток листа. При недостатке цитокинина (опыты с отрезани-
ем корней) листовые пластинки не достигают нормального раз-
мера. Гиббереллины также необходимы для роста листа. При
избытке ГА главная жилка и черешок растут более интенсив-
но, в результате чего лист приобретает удлиненную форму (см.
4.1.2).
7.3. КОРРЕЛЯТИВНЫЙ РОСТ ЧАСТЕЙ КОРНЯ
Удлинение корня происходит в зоне растяжения. Затем на-
чинается его утолщение за счет камбия. Выше начала зоны
корневых волосков возникают боковые корни. Как уже гово-
рилось, для индукции их образования необходимо повышение
концентрации ПУК. У корней хорошо выражено явление апи-
кального доминирования: боковые корни в норме не появляют-
ся вблизи апекса корня. Все эти ростовые корреляции связаны
с деятельностью апикальной меристемы корня и с поступле-
нием ИУК из надземной части (см. 4.2.8). В апексе корня син-
тезируются цитокинины (зеатин и его производные), которые
препятствуют образованию боковых корней. Таким же дейст-
вием обладает АБК. Бе синтез осуществляется в корневом чех-
лике. ИУК, направляющаяся из корневого чехлика в базипе-
тальном направлении по клеткам коры (см. рис. 3.6), наряду
с той ИУК, которая транспортируется по центральному цилин-
дру из надземной части, регулирует рост клеток растяжением.
Тормозящее влияние на удлинение клеток в зоне растяжения
может оказывать АБК (см. 4.2.3).
7.4. ДОНОРНО-АКЦЕПТОРНЫЕ ВЗАИМОСВЯЗИ
Как уже говорилось, гетеротрофные органы, в частности ко-
рень, являются акцепторами ассимилятов. Донорами ассимиля-
тов, или более широко — органических питательных веществ,
могут быть листья и запасающие ткани и органы. Донорно-ак-
цепторные отношения -- один из важнейших механизмов кор-
релятивного роста.
Распускающиеся почки являются акцепторами ассимилятов,
128
поступающих из зрелых фотосинтезирующих листьев. Аттраги-
рующие свойства развивающихся листовых примордиев обус-
ловлены высоким содержанием фитогормонов: ауксина, цитоки-
нинов и гиббереллинов. В опытах Уоринга и Сета (1967) пока-
зано, что нанесение на поверхность среза декапитированных
растений фасоли фитогормонов в составе ланолиновой пасты
активирует приток в эту зону 32Р из листьев (в имп/мин):
Контроль
(ланолин)...........23,6±4,7 ИУК±-ГА3 . . . . 849.6±278,6
ГА3 . . . . • ... .84,8+16,9 ИУК±кинетин . . . 889,6±255,4
Кинетин............58,1+17,8 ИУК + ГА3±
ИУК 453 4 4-143 1 кинетин............ 1943 + 312,4
Из этих данных видно, что лишь ИУК обладает самостоятель-
ным и сильным действием, вызывающим аттрагирующий ответ
тканей. Однако присутствие других фитогормонов резко уси-
ливает эффект ИУК. Очевидно, этот эффект связан прежде
всего со способностью ауксина индуцировать работу Н+-насо-
са на плазмалемме. Разнообразные вещества поступают в клет-
ку по электрохимическому градиенту ионов Н+.
Когда лист достигает примерно 1/2 своего окончательного
размера, продукция его фотосинтеза начинает превышать соб-
ственные потребности, и лист превращается в донора ассими-
лятов.
Загрузка флоэмных окончаний (самых маленьких жилок)
сахарозой и другими метаболитами происходит активно. По-
видимому, большую роль здесь также играют Н+-насосы, лока-
лизованные на плазмалемме клеток-спутников, связанных с си-
товидными трубками многочисленными плазмодесмами. Оче-
видно, и в этом случае фитогормомы листа играют роль акти-
ватора загрузки ассимилятами ситовидных трубок, в кото-
рые по осмотическим законам входит вода и создается гидроста-
тическое давление — движущая сила передвижения флоэмного
сока. Возможно, условием загрузки флоэмных окончаний в
клетках листа, аккумулирующих сахарозу, является блокиро-
вание (закрывание) плазмодесм, связывающих их с клетками
хлоренхимы. Это блокирование плазмодесм может осуществ-
ляться каллозой. В зоне, акцептирующей ассимиляты, наобо-
рот, плазмодесмы в клетках пучка открыты, Н+-насос функцио-
нирует слабо или выключен. Эту функцию ингибирования на-
соса может выполнять АБК, концентрация которой в тканях
увеличивается при неблагоприятных условиях, в том числе и
при голодании. Сами клетки акцепторных тканей, где идет ин-
тенсивный рост (меристемы) или иммобилизация веществ (за-
пасающие органы), обладают активно работающими Н+-насо-
сами и, следовательно, аттрагирующей силой.
Конкуренция за питательные вещества у гетеротрофных ча-
стей растения — один из важнейших механизмов коррелятив
9 Зака? № 399 1 29
ного роста. Апикальная почка главного побега, которая содер^
жит наиболее высокую концентрацию ИУК, индуцирует обра-
зование мощного проводящего пучка и создает наибольшую
аттрагирующую силу, перехватывая питательные вещества ц
цитокинин у боковых (пазушных) почек. Тот же конкурентный
механизм, возможно, лежит в основе торможения роста пазуш-
ных почек листьями в период, когда они сами растут (см.
рис. 4.16).
8. ФОТОМОРФОГЕНЕЗ
На рост, дифференцировку и прохождение этапов онтогене-
за, кроме автономных механизмов, оказывают влияние разно-
образные факторы внешней среды; свет, температура, влаж-
ность и др. Особенно важную роль играет свет. Он является
определяющим фактором, обусловившим появление и развитие
царства растений, так как используется растительными орга-
низмами в процессах питания как источник энергии. Форма зе-
леных растений максимально приспособлена для поглощения
света и использования его в фотосинтезе. Для фотосинтеза
требуются высокие уровни энергии: на образование одной мо-
лекулы глюкозы затрачиваются 8—10 квантов света.
Кроме фотосинтеза растениям присущи и другие процессы,
в которых свет выполняет не энергетическую, а сигнальную
функцию: фотодвижения (фототаксисы, фототропизмы, фотона-
стии), фотоморфогенез и фотопериодизм. Фотопериодизмом на-
зывается реакция растения на длину световых и темновых пе-
риодов, дня и ночи (см. 9.1.2). С помощью фототропизмов —
ростовых изгибов в ответ на одностороннее освещение — расте-
ния ориентируются по отношению к свету. Фотоморфогенез —
это зависимые от света процессы роста и дифференцировки
растений. В ходе фотоморфогенеза в соответствии с генотипом
растение приобретает форму, которая оптимальна для погло-
щения света в конкретных условиях обитания. Можно сказать,
что нормальные рост и развитие высших растений и есть фото-
морфогенез.
Наиболее ярко процессы фотоморфогенеза проявляются
при простании семян и в явлениях деэтиоляции. Свет в этих
процессах, выполняя сигнальную функцию, оказывает сильное
морфогенетическое действие в очень малых дозах. Несколько
квантов света, поглощенные клеткой, могут определить ее даль-
нейшее развитие. В растительных тканях обнаружены фоторе-
9*
131
цепторы — фитохром и криптохром, с участием которых инду-
цируются реакции фотоморфогенеза. Содержание их в расти-
тельных тканях очень мало, поэтому количество энергии, необ-
ходимое для их насыщения, на несколько порядков ниже, чем
требуется для фотосинтеза. Фотосинтез поставляет продукты
для поддержания роста, однако формативные эффекты света
непосредственно от него не зависят.
8.1. ФОТОРЕЦЕПТОРЫ
Выполняя в явлениях фотоморфогенеза сигнальную роль,
свет включает цепь событий, завершающуюся морфогенетиче-
ским ответом. Первым шагом на этот пути является взаимодей-
ствие света с рецептором. У всех растений обнаружены две
системы, рецептирующие фотоморфогенетически активный свет:
фитохром и пигменты, поглощающие синий свет.
8.1.1. ФИТОХРОМ
Еще в 1935—1937 гг. было показано, что прорастание семян
салата-латука усиливается после кратковременного облучения
красным светом (КС, 600—690 нм) и подавляется дальним
красным светом (ДКС, 720—780 нм) (рис. 8.1). В 50-х годах
X. Бортвик и С. Хендрикс (США) подтвердили эти данные и,
кроме того, применили многократное последовательное воздей-
ствие КС и ДКС. При этом прорастание семян индуцировал
или ингибировал свет, действовавший последним (даже при
100-кратных переменах) перед темновым периодом. Устране-
ние эффекта красного света дальним красным позволило им
предположить существование у растений пигмента, способного
к обратным фотопревращениям. Обратимость действия КС —
ДКС была показана также при индукции или ингибировании
инициации цветения при изучении явления фотопериодизма (см.
9.1.2). Причем характер спектра действия фотопериодизма ука-
зывал на сходство рецептора света с фикоцианином водорос-
лей. Рецептор красного света был назван ими фитохромом
(греч. phyton — растение и chroma — краситель).
Выделенный фитохром оказался хромопротеином с сине-зе-
леной окраской. Его хромофор является незамкнутым тетра-
пирролом (рис. 8.2) группы фикобилинов и по спектральным
характеристикам близок к аллофикоцианину водорослей. Апо-
протеин фитохрома представляет собой белок с Мг=240 000,
состоящий из двух мономеров по 120 000. В раство-
рах присутствует в мономерной форме. Два мономера соеди-
нены нековалентными связями. Размер молекулы больше, чем
у глобулярных белков, но меньше, чем у фибриллярных. Фито-
хром ржи в форме димера содержит 20% а-спирализованных
132
участков, 30% p-структур и 50% участков с иной структурой.
Хромофор присоединяется к белку боковой цепью кольца А
Рис. 8.1. Влияние красного
(600—690 нм) и дальнего
красного (720—780 нм) света
на прорастание семян чувст-
вительного к свету салата
(Flint, McAlister, 1937).
По оси абсцисс —длина волны
(нм), по оси ординат — всхожесть
(%). «+»—стимулирование, «—»
ингибирование прорастания.
Рис. 8.2. Структура свободно-
го фитохромобилина (Rudiger,
Scheer, 1983).
одной тиоэфирной связью через цистеин (рис. 8.3). Для фито-
хрома овса определена аминокислотная последовательность,
к которой присоединен хромофор:
Лей—Apr—Ала—Про —Гис—Сер —Цис—Гис—Лей—Глн—Тир
S
Хромофор
Предполагается, что существует также эфирная связь между
апопротеином и концом боковой цепи (пропионовая кислота)
в кольце С.
При облучении красным светом (660 нм) фитохром Фбео
трансформируется в форму Ф730 (рис. 8.3). Трансформация при-
водит к некоторому изменению конфигурации хромофора и не-
значительной конформации белка. У водорослей и папоротни-
ков отмечена переориентация хромофора относительно белка.
Вместе с тем показано, что фотопревращение ФббО“>Ф?зо при-
водит к локализованному изменению поверхности белка в до-
мене, который обеспечивает присоединение его к мембране
(увеличивается гидрофобность, доступность для действия про-
теаз и др.).
В спектре поглощения фитохрома (рис. 8.4) при переходе
его в активную форму Ф730 (облучение КС) появляется крас-
133
ный максимум 730 нм и пик в синей области (около 400 нм).
Облучение ДКС переводит молекулу в неактивную (темновую)
форму Ф6бо, имеющую максимумы в красной (660 нм), синей
Рис. 8.3. Предполагаемая структура хро-
мофоров Ф7зо и Фббо и их связывание с
апопротеином при обратимых переходах
под действием красного и дальнего крас-
ного света (Rudiger, 1983).
(380 нм) и ультрафио-
летовой (290 нм) об-
ластях спектра. Пере-
ходы Фббо—^Фтзо и
Ф?зо->Фббо осущест-
вляются через ряд ин-
термедиатов (рис. 8.5),
превращения которых
друг в друга происхо-
дят в темноте, часть
этих процессов инду-
цируется светом. Так
как спектры Ф66о и Ф730
имеют перекрывающие-
ся участки в красной—
дальней красной и си-
ней областях, то в оп-
ределенных условиях
освещенности сущест-
вует динамическое рав-
новесие между основ-
ными формами фито-
хрома. В темноте пре-
обладает Фббо, так как
именно в этой форме
синтезируется фито-
хром. Кроме того, ак-
тивная форма Ф?зо не
стабильна в тканях, и
на свету она медлен-
но теряется. У этиоли-
рованных однодольных
растений в темноте значительная часть Ф730 разрушается,
а у двудольных происходит либо полное превращение в
Фббо, либо частичное разрушение за несколько часов.
При освещении КС (660 нм) образуется до 75—80% Ф?зо-
300 400 500 600 700 800
Рис. 8.4. Спектры поглощения фито-
хрома Фббо (7) и Ф7зо (2) в 0,1 М
натрий-фосфатном буфере с pH 7,8
(Rudiger, Scheer, 1983).
По оси абсцисс — длина волны (нм), по
оси ординат — поглощение (единицы опти-
ческой плотности).
134
ДКС (730 нм) вызывает образование лишь небольшого (око-
ло 2%) количества Ф730. В результате потери на свету части
ф.73О количество фитохрома в фотостационарном состоянии со-
Новый
синтез
,________- ЛКС
Фббо Чбо^ 7
Нестабильные
Фббо промежуточные
продукты
КС
Ф1Г
730-
•Ф.
ф
*730
Разрушение
Физиологическая
активность
Темновая реверсия,
зависимая от темпеиат^оы
Рис. 8.5. Влияние красного (КС) и дальнего красного света
(ДКС) на состояние фитохрома и его физиологическую активность.
ставляет небольшую часть от общего его содержания у расте-
ния, растущего в темноте. Но этот уровень поддерживается как
скоростью биосинтеза фитохрома, так и присутствием популя-
ции фитохрома, устойчивой к разрушению.
Фитохром обнаружен у всех зеленых растений, включая
одноклеточные водоросли, а также у грибов. Он найден во всех
органах растения, причем относительно большее его содержа-
ние отмечено в меристематических тканях. В клетках фитохром,
по-видимому, связан с мембранами этиопластов, хлоропластов,
митохондрий. Показана его локализация в плазмалемме. В свя-
зывании фитохрома с мем-
браной участвуют мембран-
ные стероиды.
Многие процессы фо-
томорфогенеза могут кон-
тролироваться фитохромом
при действии низких доз
красного света и корот-
кого времени облучения, а
ДКС в этих условиях обра-
щает эффект КС. Именно
так происходят подавление
удлинения междоузлий, ус-
Рис. 8.6. Действие КС и ДКС на акти-
вацию (а) и ингибирование (б) прора-
стания чувствительных к свету семян
Lepldium virginicum (/) и Lepidium sa-
tivum (2) при кратковременном облу-
чении.
По оси абсцисс — длина волны (нм), по оси
ординат — относительная эффективность дей-
ствия.
5
60 F
корение роста листа, вы-
прямление «крючка» гипо-
котиля, стимуляция синтеза
антоцианинов и хлорофил-
ла, прорастание семян сала-
та и др. В спектрах дейст-
вия таких реакций (рис.
8.6) обнаруживаются пики
135
при 660 и 730 нм. Световая энергия для насыщения этих реак-
ций варьирует от 1 до 1000 Дж-м-2 (энергия потока полного
солнечного света принята за 42 000 Дж-м-2). Эти реакции на*1
зываются низкоэнергетическими.
При продолжительном действии красного света на многие
из указанных выше процессов, контролируемых КС через низко-
энергетические реакции, получаются результаты, отличающие-
ся от ответов на короткие импульсы КС. При 2—3-часовом
действии ДКС наблюдается стимулирование процессов даже
более значительное, чем при КС. Проростки в этих условиях
сходны с выросшими на белом свету. Эти эффекты продолжи-
тельного действия света получили название высокоэнергетиче^
ской реакции, или реакции высокой интенсивности падающего
Рис. 8.7. Влияние длительного дейст-
вия света разной длины волны на ин-
гибирование роста гипокотиля салата
(Hartmann, 1987).
Обозначения осей, как на рис. 8.6.
излучения, или реакции
продленного света. При
этом продолжительность
освещения более важна,
чем доза излучения. Ре-
акция пропорциональна
интенсивности падающего
излучения в широком ди-
апазоне значений. Спектр
действия этой реакции
имеет пик при 720—730
нм (Ф730) и тройной пики
синей области и ближнем
ультрафиолете (рис. 8.7).
В этом ответе, по-видимо-
му, участвуют две пиг-
ментные системы: фито-
хром в красной области
синий свет (см. ниже). Чем
и пигмент(ы), поглощающий (ие)
объяснить, что одни и те же процессы развития при низко-
энергетической реакции активируются КС, а при высо-
коэнергетической — ДКС? Одной из причин может быть то,
что последняя реакция также контролируется Ф730. Тогда в;
условиях фотостационарного состояния форм фитохрома (см.
выше) при продолжительном действии ДКС всегда поддержи-
вается небольшая фракция Ф730, которая и определяет высоко-
энергетическую реакцию.
8.1.2. ПИГМЕНТЫ, РЕЦЕПТИРУЮЩИЕ СИНИЙ СВЕТ
Многие процессы у растений контролируются ближним
ультрафиолетовым и синим светом (320—500 нм). Синий свет
играет исключительно важную роль в фототропизме, движениях
устьиц и других процессах, он участвует также и в явлениях
фотоморфогенеза.
Сравнение спектра действия (рис. 8.8) фототропической ре-
136
акции и спектров поглощения рибофлавина и р-каротина обнару-
живает сходство максимумов в ближней ультрафиолетовой
(370 нм) и в синей области (450 нм) у фототропизма и рибофла-
вина и трех общих максимумов в синей части спектра (425, 445»
и 474 нм) у фототропизма и каротина. Отсюда был сделан вы-
вод об участии рибофлавина и, возможно, каротиноидов в ре-
цепции синего света. По-
скольку действие синего-
ближнего ультрафиолето-
вого света очень важно в
морфогенезе низших ра-
стений (cryptogams), то
пигмент, рецептирующий
синий-ближний ультра-
фиолетовый свет, назвали
криптохромом. В ходе
эволюции относительное
значение фоторецептора,
поглощающего в этой об-
ласти спектра, снижа-
лось, а роль фитохромной
системы возрастала. Од-
нако этот рецептор при-
сутствует у всех расте-
ний и даже у эволюци-
онно прогрессивных так-
сонов (например, у кре-
Рис. 8.8. Спектры поглощения рибофлави-
на (/) и р-каротина (2) и спектр дейст-
вия фототропизма (5).
По оси абсцисс — длина волны (нм).
стоцветных). Функционированием именно этого рецептора опре-
деляется фототропизм всех растений, а также грибов.
Общепринято, что хромофором криптохрома является флавига
типа рибофлавина:
Пока не выяснена природа боковых цепей в положениях 6, 7, 91
Полагают, что хромофор нековалентно связан с белком. Роль
каротиноидов в качестве хромофора отрицается по двум причи-
нам: мутанты низших (эвглена) и высших растений (кукуруза),
лишенные каротиноидов, осуществляют нормальные реакции со-
ответственно фототаксиса и фототропизма на синий свет. Кроме
того, у таких мутантов не нарушен синтез антоцианинов. По-
видимому, каротиноиды могут участвовать в скрининге (отборе)
света и, возможно, функционируют сопряженно с флавинами.
13Г
У растений спектр действия отражает также влияние фито-
хрома, имеющего пик поглощения в синей области. В некото-
рых случаях фитохром даже усиливает эффект пигментов, по-
глощающих синий свет. Рецептор СС может быть локализован в
плазмалемме и в мембранах внутриклеточных органоидов в со-
ставе редокс-цепи, включающей в себя флавопротеин и цито-
хром Ь5. Ответы на синий свет, как и на красный, бывают двух
типов: триггерный ответ, индуцируемый коротким импульсом, и
ответ при более длительном облучении.
В области ближнего ультрафиолетового света (320—390 нм),
по-видимому, функционирует еще одна рецепторная система.
Роль рецепторов этого света могут исполнять производные пира-
зинов, 3—с!]пиримидина, или птерины:
Спектры поглощения птеринов зависят от их редокс-состояния
(рис. 8.9): полностью окисленная форма имеет пики при 215, 230,
275 и 350 нм, частично восстановленная — при 225, 280 и 320 нм,
а полностью восстановленная — два пика — при 215 и 295 нм.
200 400
Рис. 8.9. Спектры поглощения 6,7-диметилптерина (по: Fuller е. а., 1971).
1 — окисленная форма, 2 — дегидроформа, 3 — тетрагидроформа.
Птерины выделены из синезеленых водорослей, фотосинтези-
рующих бактерий, этиолированных листьев шпината и пророст-
ков гороха, где они были более восстановлены, чем в зеленых
138
растениях гороха. Как и флавины, которые легко восстанавли-
ваются в присутствии донора электронов и протонов, птерины
претерпевают редокс-превращения и из-за способности быстро
передавать электроны другим акцепторам могут функциониро-
вать как редокс-шартнеры в комплексе с флавинами.
8.2. СВЕТОЗАВИСИМОЕ ПРОРАСТАНИЕ СЕМЯН
Для прорастания семян многих дикорастущих и некоторых
культурных растений (салата, табака, томата и др.) необходима
освещенность порядка 1000 лк. Причем КС, переводящий фито-
хром в активную форму Ф?зо, активирует прорастание, а ДКС—
ингибирует. СС также оказывает положительное или отрица-
тельное влияние на прорастание. В сухих семенах обычно фито-
хром отсутствует. Его содержание быстро увеличивается при на-
бухании семян. Семена одних видов прорастают даже после од-
нократного кратковременного (1 мин) освещения красным све-
том (салат, табак), другие — после длительного или периодиче-
ского освещения (кипрей, зверобой и др.). В действии КС на
прорастание мари белой наблюдаются три фазы: слабая стиму-
ляция при минутных обработках, плато активации при увеличе-
нии времени облучения до нескольких часов и дальнейшая сти-
муляция при освещении в течение 10 ч и выше (рис. 8.10). Воз-
Рис. 8.10. Влияние длительности облучения
(ч, ось абсцисс) красным светом на прорастание
(%, ось ординат) семян мари белой (Karssen,
1970).
можно, у некоторых светонезависимых семян в тканях присут-
ствует активная форма фитохрома, так как они прорастают в
темноте, но это прорастание ингибируется дальним красным све-
том. Последующее воздействие КС устраняет ингибирующее вли-
яние ДКС.
Действие КС на прорастание опосредовано гормональным ба-
лансом в тканях. ГА, цитокинины, этилен способствуют прорас-
139
танию; АБК, ингибиторы роста поддерживают покой семян (см.
2.3.2), У семян некоторых видов, например у салата Lactuca, сти-
мулирующее действие КС имитируется обработкой экзогенным
гиббереллином. Кинетин также может заменять КС или дейст*
вует в условиях темноты слабо, но значительно ускоряет прорас-
тание, вызванное КС или экзогенным гиббереллином. Свет и ГД
стимулируют рост гипокотиля, а цитокинин активирует рост
семядолей, в результате чего разрываются семенные покровы.
КС способствует увеличению содержания ГА и цитокининов в
тканях, что приводит к прорастанию. АБК ингибирует действие
ГА. Этилен не устраняет влияние АБК, но способствует свету,
ГА и цитокинину преодолевать тормозящий эффект абсцизовой
кислоты.
В природных условиях соотношения красного и дальнего све*
та меняется при различных обстоятельствах. Например, в пря*
мом солнечном свете КС/ДКС составляет 1,2—1,3, а после про*
хождения через зеленую листву — 0,12—0,7. Фитохромная систе-
ма позволяет семенам получать информацию о наличии или от-
сутствии благоприятных условий для прорастания.
8.3. ДЕЭТИОЛЯЦИЯ
Всем известно, как выглядят этиолированные растения, т. ei
растения, растущие в полной темноте (см. рис. 3.3). Они белые
или желтоватые, так как лишены хлорофилла (у покрытосемен-
ных), их стебель длинный, тонкий и слабый, с плохо дифферен-
цированными проводящими пучками и рудиментарными листь-
ями. У двудольных верхушка побега согнута в виде колена (для
облегчения продвижения в почве). Кратковременный КС, непре*
рывный ДКС или СС тормозят удлинение междоузлий, индуци-
руют распрямление гипокотильного или эпикотильного колена,
рост и развертывание листьев (см. рис. 3.4), развитие хлоро-
пластов, синтез хлорофилла и вторичных веществ, таких, как
антоцианы. Чтобы вызвать изменения, достаточно даже 5-минут-
ного освещения КС этиолированных растений в сутки, причем
светом низкой интенсивности. Таким образом, свет выступает в
качестве сигнала для переключения генетических программ со
скотоморфогенеза (греч. skotos — темнота) на фотоморфогенез.
Первая программа связана с ростом в темноте, вторая — на све-
ту. В течение этиоляции запасные вещества семян или клубней
преимущественно используются на быстрый рост стебля для вы-
хода проростка к свету, а в случае фотоморфогенеза проростки
затрачивают запасные вещества главным образом на создание
аппарата фотосинтеза, включая формирование листьев и диффе-
ренцировку проводящих пучков.
При более детальном изучении закономерностей действия ак-
тивной формы (Ф7зо) фитохрома на рост и морфогенез растений
оказалось, что свет в большинстве случаев ускоряет процессы
140
развития клеток. Действуя на верхнее начинающее развиваться
междоузлие, где высока пролиферативная активность, свет уско-
ряет переход клеток в следующую фазу роста растяжением. В
результате наблюдается фотоусиление скорости удлинения само-
го молодого междоузлия. В нижележащем междоузлии, которое
растет в основном за счет клеточного растяжения, свет ускоряет
дифференцировку и созревание клеток, что приводит к более
ранней остановке роста.
Изучение влияния света на рост интактных колеопти-
лей злаков показало, что кратковременное освещение ДКС об-
ращается КС, СС и белым светом, стимулирующими рост рас-
тяжением клеток верхней части колеоптиля, но снижающими
рост его базальной части. Продолжительный СС (1,65 Вт-м-2)
подавляет рост всех частей колеоптиля. Таким образом, выяв-
лены два эффекта СС на колеоптиль, зависящие от длительно-
сти освещения и общей энергии.
Рост изолированных колеоптилей овса ускоряется КС в низ-
ких дозах (от 10-5 до 50 Дж-м-2). У апикальных отрезков этих
колеоптилей после кратковременного освещения ускоренное
удлинение клеток продолжается около 50 мин. Краткие импуль-
сы СС действуют на отрезки колеоптилей как КС, и его эффект
часто обращается ДКС. Это позволяет думать, что при таких ус-
ловиях СС действует через фитохром. Слабый СС
(1,8—6,4 Дж-м-2) при длительном действии временно снижает
скорость роста отрезков колеоптилей овса, а сильный
(400 Дж-м-2) —сначала стимулирует, а затем снижает. По-ви-
димому, эффекты длительного действия СС медиируются у ко-
леоптилей пшеницы и овса через криптохром. Следует отметить,
что рост колеоптилей может усиливаться также на 10—20% зе-
леным светом (в зависимости от возраста).
Рост мезо ко тилей очень чувствителен к свету, но в от-
личие от роста колеоптилей действие света в этом случае не за-
висит от возраста проростка. КС низкой интенсивности—10-5—
Ю-3 Дж-м-2 — снижает удлинение мезокотиля овса на 15%, от
Ю-1 до 102 Дж-м-2 — подавляет на 50%, и этот эффект обра-
щается ДКС. КС высокой интенсивности (до 105 Дж-м-2) инги-
бирует рост примерно на 50% и необратим ДКС. Действие КС
больше зависит от продолжительности освещения, чем от общей
освещенности. Как и у колеоптилей, низкоэнергетические отве-
ты мезокотилей медиируются фитохромом, а высокоэнергетиче-
ские — криптохромом.
Свет влияет как на деление, так и на растяжение клеток ме-
зокотиля: у овса слабый свет сильно подавляет деление, не ме-
няя растяжения, а более сильный ингибирует растяжение клеток.
Зеленый свет низкой интенсивности (10-минутная экспози-
ция) подавляет удлинение мезокотиля на 15—30%, причем та-
кой же эффект оказывает и 30-секундное освещение. Свет непо-
средственно влияет на клетки мезокотиля и может воздейство-
141
вать на рост мезокотиля через колеоптиль. Облучение кончила
колеоптиля овса (или другой его части) ингибирует рост мез^
котиля на 60% по сравнению с эффектом при освещении всег^
растения. Мезокотили непосредственно рецептируют КС, так
он подавляет рост изолированных отрезков мезокотилей. У прОч
ростков кукурузы мезокотиль лишь частично сам воспринимаем
свет, поэтому рецепция света верхушкой колеоптиля участвуем
в подавлении роста мезокотиля.
Особенности роста гипокотиля и стебля в темноте
рассматривались ранее (см. рис. 3.3). Облучение этиолировав
ных проростков СС и ДКС в режиме высокоэнергетической ре.
акции во всех случаях угнетало рост стеблевых органов. Прц
этом интенсивный свет действует как через фитохром, так и че*
рез криптохром. Однако лаг-период ингибирования роста синим
светом был короче, чем в варианте с ДКС. Необходимо отме-
тить, что в случае отсутствия видимого изменения суммарного
роста в ответ на освещение (например, у гипокотилей салата),
этот эффект может быть результатом баланса двух процессов,
протекающих в разных направлениях в различных частях ор-
гана.
После деэтиоляции рост гипокотилей и стеблей длительное
время не подавляется ДКС в высокоэнергетической реакции, но
сохраняется эффект СС через криптохром (у горчицы — нет).
Ингибирование роста осевых органов синим светом происходит
быстро (за 5 мин) у огурца, томатов, салата. Для проявления
эффекта красного света требуется его продолжительное дейст-
вие, но в ряде случаев сходный эффект оказывает облучение им-
пульсами в 1 ч. Интересно отметить, что у ряда растений (кле-
щевина, горох) для ингибирования роста стебля или гипокотиля
требуется одновременное применение СС и КС. Выращивание
растений при постоянном интенсивном КС не устраняет полно-
стью явления этиоляции, так как в этих условиях значительная
часть Ф730 разрушается.
В ингибирование светом роста осевых органов могут вносить
вклад семядоли деэтиолированных проростков, рецептирующие
свет. Действие белого света, поглощенного семядолями огурца
или редиса, передается гипокотилю, который снижает рост. При
этом гипокотиль и сам способен воспринимать свет. В восприя-
тии синего света семядоли не участвуют, а гипокотили отвеча-
ют на него непосредственно. О регуляции роста удлинением зе-
леных взрослых растений известно мало.
В процессе деэтиоляции происходит выпрямление стеблево-
го «крючка» (колена), образующегося в темноте в верхней ча-
сти стебля. Колено возникает в участке быстрого роста гипо-
котиля (или эпикотиля) и поддерживается постоянным более
интенсивным ростом клеток выпуклой стороны. Распрямление в
ответ на КС или СС обусловлено различной скоростью удлине-
ния клеток на внутренней (усиливается светом) и наружной
<
(тормозится или не меняется) сторонах крючка. При этом раз-
ница в делении клеток не существенна. Участок гипокотиля, чув-
ствительный к красному свету, у фасоли находится на 5 мм ниже
колена, а сам крючок слабо 'чувствителен к облучению. У неко-
торых видов стимул для выпрямления крючка может переда-
ваться также из облученных семядолей (хлопок, огурец и др.).
По-видимому, неравный рост клеток при выпрямлении крючка
обусловлен появлением большей чувствительности к ИУК у кле-
ток на внутренней стороне крючка.
Свет играет определенную роль в регуляции роста листа.
Он контролирует скорость и продолжительность деления, растя-
жение и конечный размер клеток во всех тканях. Сравнение ро-
ста листа фасоли в темноте и на белом свету показало, что по-
верхность листа увеличивается при освещении в 800 раз (до
полного размера) за 14 дней, а в темноте — в 50 раз. Толщина
за этот же период на свету возросла в 3,4 раза и в темноте — в
2,2 раза. Деление клеток на свету кончается на 3-й день (на
6-й — в темноте), и общее число клеток на свету в 2 раза боль-
ше, чем в темноте, как и объем клеток, расширение которых
идет интенсивно на свету, но не в темноте. При длительном
действии КС, СС и ДКС, число и объем клеток увеличиваются
примерно в 60 раз по сравнению с темнотой. Белый свет высо-
кой интенсивности вызывает утолщение листа в результате уве-
личения толщины палисадной ткани (иногда с двух сторон лис-
та) и числа слоев клеток мезофилла.
В экспериментальной работе часто используются изолирован-
ные диски листьев. Рост дисков усиливается КС и обраща-
ется ДКС. Кинетин в темноте активирует их рост за счет расши-
рения клеток. У дисков из зеленых листьев рост клеток активи-
руется сильнее белым светом, чем СС и КС.
Рост листа злаков происходит в зоне влагалища и в пластин-
ке. Активная форма фитохрома (Ф7зо) способствует разверты-
ванию пластинки (что может быть воспроизведено обработкой
гиббереллином) и резко тормозит растяжение клеток. При низ-
кой освещенности площадь и длина листа злаков больше, а тол-
щина и ширина — меньше, чем при высокой освещенности. Мак-
симальной площади лист достигает при относительно невысоком
освещении и при большей длине дня в фотопериоде. Это обус-
ловлено увеличением числа и размера клеток.
В целом можно сказать, что красный, синий и белый свет
ингибирует растяжение клеток в стебле растений (за исключе-
нием разгибания гипокотильного и эпикотильного колена), но
ускоряет рост клеток в листьях.
8.4. МЕХАНИЗМ ДЕЙСТВИЯ ФОТОРЕЦЕПТОРОВ
Механизмы влияния света на морфогенетические реакции еще
не выяснены до конца. Предложены три основные гипотезы дей-
143
ствия света: 1) через генетический аппарат, 2) через регуляцию1
уровня или активности фитогормонов и 3) путем влияния на
функциональную активность мембран.
8.4.1. СВЕТ И ДИФФЕРЕНЦИАЛЬНАЯ АКТИВНОСТЬ ГЕНОВ
При фотоморфогенезе, как отмечалось выше, световой сигнал
инициирует экспрессию новой генетической программы — зеле»
ного растения. Современные данные свидетельствуют, что фито-
хром может осуществлять контроль на транскрипционном уров-
не. Он контролирует транскрипцию собственных генов, а также
реализацию программ синтеза ряда белков зеленых растений,
кодируемых как в ядре, так и в хлоропластах. В. ядре кроме ге-
нов, кодирующих собственный белок, фитохром вместе с ткане-.
специфическими факторами регулирует синтез, в частности, ма-
лой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы (РБФК-.
М) — основного фермента хлоропластов, участвующего в фикса-
ции СО2 белка фотосистемы II, связывающего хлорофиллы а
и b (БСХ) и НАДФ-Н-протохлорофиллидоксидоредуктазы. Од-
новременно в хлоропластах фитохром контролирует экспрессию
генов хлоропластной ДНК, отвечающих за синтез большой субъ-
единицы РБФК (РБФК-Б) и полипептида хлоропластов с моле-
кулярной массой 32 000. Причем экспрессию генов хлоропласт-
ного генома для этих белков он регулирует как на транскрипци-
онном, так и на посттранскрипционном уровнях. Ядерные гены,
кодирующие РБФК-М и БСХ, содержат в 5'-фланговых участках
регуляторные последовательности, связанные с эффектами све-
та и тканевой специфичностью экспрессии. Показано, что с ними
взаимодействуют специфические белки. У гороха, арабидопсиса
и томатов из ядерных экстрактов выделен такой белковый фак-
тор, необходимый для экспрессии гена РБФК-М, который появ-
ляется в ядре после действия короткого импульса красного
света.
Компетенция к действию КС, т. е. эффективность функциони-
рования Ф7зо, меняется в ходе развития растения. Так, в семя-
долях горчицы Ф7зо индуцирует синтез антоцианина у 27-часо-
вых проростков, но не у 63-часовых. Отмечено, что КС не акти-
вирует синтез общих мРНК клетки, а лишь мРНК для опреде-
ленных белков. Для понимания регуляторной роли света на уров-
не генома существенно, что фитохром присутствует в клетках в
различных количествах, и эффективность синтеза транскриптов
меняется в зависимости от стадии развития. Следует отметить,
что гены БСХ семядолей редиса, проростков горчицы и других
отвечают на КС очень низкой интенсивности, т. е. уровень фито-
хрома при транскрипции этих генов не может быть ограничива-
ющим фактором.
Длительное действие ДКС у растений ячменя, редиса, горчи-
цы приводит к возникновению несоответствия между уровнем
144
мРНК для БСХ и количеством синтезируемого БСХ. По-види-
мому, при этом световом режиме синтезируемый белок разруша-
ется из-за отсутствия связи с хлорофиллом а.
8.4.2. ФИТОХРОМ И ФИТОГОРМОНЫ
Ответы растения на свет выражаются в разнообразных из-
менениях скорости и характера роста клеток, тканей, органов и
целого растения. Все эти ответы связаны с функционированием
гормонов. Эффекты света в значительной степени зависят от
фазы роста в момент облучения и поэтому отличаются даже в
разных частях одного и того же органа. Общим эффектом крас-
ного света на ауксин, гиббереллины и цитокинины является из-
менение уровня гормонов в облучаемом участке. Для ауксина
показано, что его содержание изменяется при облучении КС из-
за снижения светом активности связанной с мембраной перокси-
дазы, способной разрушать ауксин, а также из-за изменения ак-
тивности оксидазы ИУК. Последний эффект может быть связан
с образованием или разрушением фенольных ингибиторов фер-
мента. Предполагается также, что КС оказывает влияние на
транспорт ауксина на клеточном и органном уровнях.
Эффекты КС и гиббереллинов часто одинаковы. В листьях
пшеницы и ячменя КС увеличивает уровень гиббереллиноподоб-
ных веществ в результате синтеза или ускорения их выхода из
этиопластов. ДКС утраняет этот эффект КС.
Облучение красным светом семян салата, проростков овса и
других приводит к возрастанию в них содержания цитокининов.
Но такой эффект не наблюдается в листьях ячменя. Распрямле-
ние гипокотильного или эпикотильного колена под действием
света обусловлено снижением образования этилена в тканях
крючка. Светозависимое торможение роста междоузлий во мно-
гих случаях определяется уменьшением содержания ауксина.
Таким образом, КС в большинстве случаев повышает в тка-
нях уровень гиббереллинов и цитокининов и снижает содержа-
ние ауксина и этилена. Это действие красного света снимается
ДКС.
8.4.3. ДЕЙСТВИЕ СВЕТА
НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ МЕМБРАН
Наиболее быстрыми ответами на действие света являются из-
менения электрических характеристик тканей и клеток облуча-
емых органов растений. Кончики корней (5 мм) этиолированных
проростков ячменя и маша, помещенные в опытный раствор
(Са2+, Mg2+, К+, аскорбиновая кислота — по 10~4 М,
АТФ—4-10-6М, ИУК 10-10 М), в темноте опускались на дно (рис.
8.11). Кратковременное облучение красным светом (30 с) вызы-
вало «прилипание» отрезков к стеклянным стенкам сосуда, за-
10 'Мзказ № 399
145
ряженным отрицательно. Облучение ДКС приводило к отсоедц^
нению отрезков от стекла. Описанное явление связано с измене*
нием под влиянием света плотности поверхностных зарядов кон*
чиков корней. Поверхность стекла, содержащего много фосфа*
тов, заряжена отрицательно, как и поверхность корней в темно*
те. Облучение КС вызывало быстрое изменение заряда клеток
корневого чехлика на положительный, что приводило к пр или»
панию отрезков. Изучение миграции протопластов в электриче»
ском поле показало, что наблюдаемые изменения фиксированно»
го заряда под влиянием КС связаны с плазмалеммой.
Изменение потенциалов под действием КС и ДКС наблюда-
Рис. 8.11. Зависимость
электрического «прилипа-
ния» кончиков корней яч-
меня к отрицательно заря-
женным стеклянным стен-
кам сосуда от условий
освещения (по: Tanada,
1968).
1 — в темноте, 2 — при освеще-
нии красным светом, 3 — при
освещении дальним красным
светом.
ются и на поверхности этиолиро»
ванных колеоптилей. Освещение
кончика колеоптиля красным све-
том за 15 с делает верхушку более
электроположительной относительно
основания. Дальний красный свет,
обращает эту реакцию. На клеточ-
ном уровне у различных объектов
при переходе Фббо->Ф?зо наблюда-
ется деполяризация МП на 5—15
мВ (рис. 8.12) с лаг-периодом в не-
зс кс
ДКС
Рис. 8.12. Изменение паренхимных клеток
колеоптилей овса при действии света рав-
ного качества (по: Racusen, 1976).
3C — зеленый свет.
сколько секунд. ДКС обращает реакцию с большим лаг-перио-
дом (около 2 мин) и не всегда до исходного состояния.
Изменение значений электрических потенциалов отражает
влияние света на ионные потоки через мембраны клеток. Наибо-
лее подробно изменения транспорта ионов в разных условиях
146
освещения изучены в специализированных моторных клетках
подушечек листьев бобовых растений, осуществляющих никти-
цастические движения листьев, в клетках устьичного комплекса
и др. Движения эти совершаются в ответ на КС, БС и СС или
на отсутствие света. Например, у Samanea saman в темноте и
при освещении КС листочки опущены. В подушечке клетки экс-
тензоры при этом теряют тургор, а флексоры, наоборот, набу-
хают. В ответ на освещение БС и СС происходит активация
Н+-насосов на плазмалемме клеток-экстензоров (они располо-
жены снизу подушечки). Это выражается в подкислении (на
1 ед. pH за 40 мин) клеточных стенок моторных клеток. Выход
Н+ создает условия для быстрого входа в клетки К+ и С1“. В
клетки поступает вода по осмотическому градиенту. Клетки-экс-
тензоры набухают, способствуя поднятию листочков.
Одновременно противоположно направленные потоки ионов
отмечаются на плазмалемме клеток-флексоров (расположены
сверху подушечки): БС и СС подавляют в них работу Н+-насо-
сов, апопласт подщелачивается, К+, С1_ и Н2О выходят из ва-
куоли в апопласт, и клетки теряют тургор. В моторных клетках
подушечек обнаружен фитохром, но в клетках экстензорах и
флексорах реакция на КС различна. В результате листочки на
красном свету опущены, так как КС подавляет работу Н+-насо-
сов (или облегчает вход Н+) в клетках-экстензорах и активирует
в клетках-флексорах.
Регулирующее действие красного света может осуществлять-
ся как в моторных органах, так и в других тканях, .благодаря
влиянию на поступление ионов Са2+ в цитоплазму. Показано,
что переход Ф&бО“>Ф?зо в колеоптилях, клетках-экстензорах уве-
личивает проницаемость клеточных мембран для Са2+ и ёго
внутриклеточную концентрацию. Еще в 70-х годах по аналогии
с животными объектами было высказано предположение, что
некоторые эффекты фитохрома на рост и развитие, а также ак-
тивность ферментов могут осуществляться через Са2+ и связы-
вающие кальций регуляторные белки, например кальмодулин.
Действительно, ускоряющее прорастание спор папоротника и
вращение хлоропластов у водоросли мужоция действие красного
света осуществляется только в присутствии не менее 3 мкМ Са2+.
Ряд данных указывает, что КС способствует поступлению Са2+
в клетки (рис. 8.13). Увеличение внутриклеточной концентрации
Са2+ приводит к его взаимодействию с кальмодулином. Образо-
вавшийся комплекс кальмодулин—Са может затем участвовать в
реакциях фосфорилирования белков через активацию протеинки-
наз или дефосфорилировать белки путем влияния на протеин-
фосфатазы. О возможности функционирования этого механизма
при облучении КС говорят результаты изучения действия КС,
ДКС и Са2+ на фосфорилирование белков в изолированных ядрах
гороха. Красный свет и Са2+ в микромолярных концентрациях
стимулировали фосфорилирование ядерных белков, а ДКС, дан-
10*
147
ный после КС, устранял этот эффект. Хелатирование кальций
(ЭГТА) и антагонисты кальмодулина (хлорпромазин и др.)
шали фосфорилированию. Фотоморфогенетические эффекты КС в
Рис. 8.13. Схема предполагаемого участия фитохрома иСа2+
в реакциях фосфорилирования-дефосфорилирования белков
(Roux в. а., 1986).
/ — фотоактивация фитохрома, 2 — вход Са2+, 3 — взаимодействие Са‘+
с кальмодулином (Км), 4 — влияние комплекса кальмодулин-Са
(КмСа) на активность протеинфосфатаз (Пф) и 5 — протеинкиназ
(Пк), 6— реакции фосфорилирования и 7 — дефосфорилирования бел-
ков; Пл — плазмалемма.
темноте имитируются индукцией поступления Са2+ в клетки (на-
пример, с помощью А23187) и подавляются антагонистами каль-
модулина. Возможно, мембранные эффекты фитохрома приводят
к изменению содержания фитогормонов в тканях и включению
или выключению генетических программ.
8.4.4. МЕХАНИЗМЫ ДЕЙСТВИЯ СИНЕГО СВЕТА
Ф6бо имеет небольшой пик поглощения в фиолетовой—корот-
коволновой синей области спектра (см. рис. 8.4). В активном
состоянии фитохрома (Ф?зо) коротковолновый максимум сдви-
гается в синюю сторону и по величине уже менее значительно
отличается от красного максимума. Таким образом, фитохром
может рецептировать синий свет. Действительно, добавка сине-
го света к красному усиливает синтез аминокислот и белков в
растительных объектах. Причем это действие синего света имеет
регуляторный характер, так как даже кратковременное освеще-
ние синим светом (30 с) приводит к длительному (несколько
часов) последействию.
Однако в большинстве случаев физиологическое действие си-
него света, особенно в условиях высокоэнергетической реакции
(высокие интенсивности света, длительное освещение), не устра-
няется дальним красным светом. В этом случае СС действует не
через систему фитохрома, а через криптохром.
У многих объектов СС вызывает гиперполяризацию МП кле-
ток. При одностороннем освещении синим светом этиолирован-
ных гипокотилей фасоли регистрируются электропозитивация
148
облучаемого участка с последующей его электронегативацией и
увеличение позитивации неосвещенной стороны, т. е. наблюдается
розникновение поперечной электрической поляризации органа.
Поляризация приводит к перераспределению ауксина, индуциру-
ющего усиление роста клеток на затененной стороне. Эти собы-
тия обнаруживаются по крайней мере на 15 мин раньше начала
ростовой реакции затемненной стороны органа.
СС может оказывать регулирующее действие на рост и мор-
фогенез через влияние на работу редокс-цепи, локализованной
как во внутриклеточных мембранах (ЭР, АГ, глиоксисомы, на-
ружная мембрана митохондрий), так и в плазмалемме раститель-
ных клеток. Компонентами этой редокс-цепи являются флаво-
протеин (ФП) и цитохром Ь5, а субстратами — внутриклеточные
НАД-Н и НАДФ-Н:
Fe3+->Fe + ЬЮГ-* NO.?
СС \ /
1 \/
Н+, е~
НАД (Ф) • Н —> ФП —> цитохром Ьъ -> дегидро—> аскорбат
| /X аскорбат
Н+ / \
Н+-АТФаза в редокс-цепи
митохондрий, ЭР
Электроны, полученные при
окислении субстрата, могут
использоваться в разнооб-
разных реакциях восстанов-
ления у наружной (восста-
новление Fe3+, дегидроас-
корбата, О2) и внутренней
поверхности плазмалеммы
(передача е~ в редокс-цепи
митохондрий, ЭР, поддер-
жание в восстановленном
состоянии SH-групп актив-
ного центра Н+-АТФазы,
восстановление NO7 и др.).
Судьба Н+ в этой системе
различна (рис. 8.14) в зави-
симости от ориентации фла-
вопротеина в мембране.
Протоны могут выноситься
в клеточную стенку, подкис-
ляя ее (редокс-Н+-насос).
Другая возможность состо-
ит в том, что ионы Н+ оста-
ются в клетке, вызывая за-
кисление цитоплазмы и од-
новременно деполяризацию
Плазмалемма
' Цитоплазма
НАД(Ф)-Н
—И
НАД(Ф)
А1 ’ 1
Активация
Клеточная
стенка
Деполяризация
] ! (дрн)н-
I I I АТФ
Н +е
Fe3*
Fe2*
Н -АТ Фаза
АДФ + Ф
К'
Рис. 8.14. Схема предполагаемого взаи-
модействия редокс-цепи с Н + -АТФазой
и К+-каналом в плазмалемме по: Маг-
гё е. а., 1988).
ФП — флавопротеиновая оксидоредуктаза.
К - канал
149
МП. Оба эти события активируют работу Н+-АТФазы и потен*
циалзависимые К+-каналы. Действительно, при облучении СС
у ряда растительных объектов (апикальные отрезки колеопти-
лей овса, диски листьев фасоли) наблюдается подкисление ин-
кубационной среды.
Синий свет, поглощаемый флавиновым компонентом редокс-
системы, может влиять тем самым на ряд метаболических про-
цессов, и прежде всего на транспорт ионов. Так, в моторных
клетках подушечек бобовых, о которых говорилось выше, СС
действует на ионные потоки как БС, т. е. у экстензоров усилива-
ет выход ионов Н+ из клетки (подкисление апопласта) и вход
К+ С1_ и Н2О, а у флексоров — обратные реакции.
У зеленых растений синий свет (460—475 нм) при очень ко-
ротких экспозициях (30 с) активирует в процессе фотосинтеза
включение 14СО2 в неуглеводные продукты, органические кисло-
ты и аминокислоты, прежде всего в аспартат, а через несколько
минут — во фракцию белков. Этот эффект синего света имеет
низкое световое насыщение и сохраняется в присутствии КС и
ДКС. Реакция строго требует наличия О2; в атмосфере N2 ак-
тивирующий эффект не проявляется. Увеличение синтеза амино-
кислот при действии си-
него света может быть
связано с усилением фун-
кциональной активности
нитратредуктазы. Актив-
ность фермента в при-г
сутствии нитрата возра-
стает при облучении тка-
ней как красным, так и
синим светом, но эффект
от действия последнего
более сильный. Для ли-
стьев пшеницы максимум
спектра действия восста-
новления нитратов нахо-
дится при 480 нм. На
уровне ядерного генома
комплекса нитратредуктазы,
Рис. 8.15. Предполагаемая модель
нитратредуктазы, локализованной в
плазмалемме (Jones, Morel, 1988).
ФП — флавопротеиновый компонент ре-
докс-цепи, СС — синий свет.
нитрат включает экспрессию генов
а свет влияет на интенсивность экспрессии, резко ее ускоряя.
Увеличение активности фермента синим светом может быть
связано с активацией им функционирования редокс-цепи в
плазмалемме (а также, возможно, в других мембранах).
Редокс-цепь с участием флавопротеина является компонентом
нитратредуктазы, в состав которой входит также белок, со-
держащий молибден. Современные данные предполагают ло-
кализацию фермента в плазмалемме (рис. 8.15). Восста-
новление нитрата осуществляется передачей электронов от суб-
страта через цитохром Ь5 (557 нм) и Мо-белок. Важно, что оД*
150
повременно с усилением активности фермента СС увеличивает
также и поглощение нитратов клетками. Функционирование нит-
ратредуктазы у водорослей часто совпадает с процессом восста-
новления Fe3+ в Fe2+ при его поглощении. Это обусловлено, по-
видимому, функционированием именно редокс-цепи.
Таким образом, СС, воздействуя на флавиновый компонент
редокс-цепей, выполняющих различные функции в клеточных
мембранах, оказывает влияние на многие процессы, в том числе
па ионные потоки и величину МП. В свою очередь, эти перемен-
ные являются участниками механизмов регуляции роста и мор-
фогенеза.
9. ПОЛОВОЕ РАЗМНОЖЕНИЕ
ПОКРЫТОСЕМЕННЫХ
После того как у растений сформировалась достаточная веге-
тативная масса (этап молодости) (см. 3.2), они приобретают
способность к размножению и при благоприятных условиях ре-
ализуют эту возможность (этап зрелости и размножения). Раз-
множение— это физиологический процесс воспроизведения себе
подобных организмов, обеспечивающий непрерывность существо-
вания вида и расселение его представителей в окружающем про-
странстве.
Для семенных растений характерны два способа размноже-
ния: половое и вегетативное. При половом рамножении новый
организм развивается из зиготы, образующейся в результате
слияния женской и мужской половых клеток —гамет. Органом
полового размножения у покрытосеменных является цветок.
Переход к этапу зрелости, т. е. готовности к размножению, в
физиологическом плане изучен очень слабо. У растений, нахо-
дящихся на этом этапе онтогенеза, возникает компетенция (вос-
приимчивость) к индуцирующим зацветание факторам. Переход
покрытосеменных растений от вегетативного роста и развития к
генеративному развитию связан с процессом инициации цвете-
ния. Инициация цветения — это образование апикальными мери-
стемами цветочных зачатков и все предшествующие события, вы-
зывающие их закладку. Она включает в себя две фазы: индук-
цию и эвокацию. Затем формируется цветок (осуществляется
флоральный морфогенез), происходят процессы опыления и опло-
дотворения, развиваются семена и плоды.
9.1. ИНДУКЦИЯ ЦВЕТЕНИЯ
Индукция цветения — восприятие растением внешних и внут-
ренних факторов, создающее условия для закладки цветочных
зачатков. Эта фаза осуществляется под действием экологических
152
факторов — температуры (яровизация) и чередования дня и но-
чи (фотопериодизм)—или эндогенных факторов, обусловлен-
ных возрастом растения (возрастная, или автономная, индук-
ция). Яровизация—процесс, протекающий в озимых формах од-
нолетних, двулетних и многолетних растений под действием
определенной продолжительности низких положительных темпе-
ратур, способствующий ускорению генеративного развития. Фо-
топериодизм — реакция растений на суточный ритм освещения,
т. е. на соотношение длины дня и ночи (фотопериоды), выража-
ющаяся в изменении процессов роста и развития. Одним из про-
явлений этой реакции является фотопериодическая индукция за-
цветания. Оба фактора — температурный и световой — могут
действовать последовательно, например, у озимых злаков (рожь,
пшеница).
Температурная и фотопериодическая регуляция служат при-
способлением растений к условиям существования, так как обус-
ловливают благоприятные сроки для перехода к зацветанию.
В ходе фотопериодической индукции в листьях образуется сти-
мул цветения, который транспортируется в вегетативные почки
побегов, где включает вторую фазу инициации — эвокацию.
9.1.1. ЯРОВИЗАЦИЯ
Растения, нуждающиеся в яровизации, называют озимыми, а
развивающиеся без нее — яровыми. Так, у яровой ржи темпера-
турные условия во время ювенильного развития не влияют на
цветение, а озимая рожь зацветает, если во время прорастания
семян или на стадии проростков попадает в условия низкой по-
ложительной температуры. Экспериментальное изучение хода
развития озимых и яровых форм культурных злаков было впер-
вые проведено Г. Гаснером (1918).
Условия яровизации. Одни виды без яровизации не зацвета-
ют (качественная реакция), у других при воздействии низкими
положительными температурами лишь укорачивается время пе-
рехода к цветению (количественная реакция). Примеры этих
реакций приведены на рис. 9.1. У четырех видов плевела просле-
живается: отсутствие какой-либо реакции на обработку пони-
женной температурой (/), количественная реакция (2 и 3)—
сокращение времени до начала цветения; у Lolium регеппе на-
блюдается качественная реакция (4) вместе с количественной
(строгая необходимость в яровизации и значительное укороче-
ние времени до цветения). Для цветения двухлетним и некото-
рым многолетним растениям яровизация обязательна, а для мно-
гих однолетних она является факультативной.
Продолжительность действия пониженных температур при
яровизации весьма различна. Яровизация у озимых растений
происходит в течение 1—3 месяцев, а для левкоя, сельдерея и
других достаточно 1—2-дневного охлаждения. Эффективность
153
яровизации определяется также величиной действующих темпе-
ратур. Для растений умеренных широт
{Рис. 9.1. Реакция на яровизацию у четырех ви-
дов плевела (Evans, 1960).
./ — Lolium tementulum, 2 — L. multifloram, 3 - L. mul-
tiflorum x L. perenne^ 4 — L. perenne (без яровизации не
•.зацветает). Условия роста: 23° С—днем, 17° С —ночью, ДД.
'По оси абсцисс — продолжительность яровизации «недели),
по оси ординат — число дней до начала цветения.
оптимальными темпера-
турами являются 1—
5 °C. Для растений юж-
ных мест обитания
эти температуры могут
превышать 10 °C (для
маслины, например,
10—13°C). С увеличе-
нием срока действия
температурный опти-
мум понижается. По-
этому при продолжи-
тельной яровизации
любая эффективная
температура приведет к
максимальному
ту.
Яровизация
происходить у
эффек-
может
расте-
ний на разных этапах
развития. Так, у пше-
ницы воздействие низ-
кой температурой эф-
фективно уже во вре-
мя развития зародыша
на материнском расте-
нии спустя 5 дней после оплодотворения. Это воздействие вос-
принимает зародыш созревающей зерновки в стадии молочной
и восковой спелости до перехода семени в состояние покоя.
У многих видов растений яровизация протекает в набухших
семенах, вышедших из состоя-
ния покоя. Именно этот при-
ем удобен в сельскохозяйст-
венной практике. Озимые зла-
ки после яровизации в стадии
семян выколашиваются как
яровые.
Существуют растения, у ко-
торых яровизироваться могут
как семена, так и проростки.
Таким растением является
Arabidopsis thaliana, который
не цветет без яровизации (рис.
9.2). Но если яровизацию
(2 °C) начинали в первые двое
суток после намачивания се-
мян, то цветение наступало
Рис. 9.2. Эффективность яровизации
(38 дней при 2 °C) у арабидопсиса
в зависимости от фазы роста (Napp-
Zinn, 1960).
Число дней до появления первого цветка
(ось ординат) отсчитывалось с момента
окончания яровизации, ось абсцисс — воз-
раст растения (дни) к началу ярови-
зации.
154
быстро — через 40—45 дней после окончания яровизации. Если
же яровизировали 10—15-дневные проростки, то цветение начи-
налось со значительной задержкой (через ПО дней). У проро-
стков большего возраста чувствительность к действию понижен-
ной температуры вновь возрастала, и цветение наступало
быстро. Таким образом, четко прослеживаются возрастные из-
менения чувствительности к холоду.
У овощных культур — капусты и сельдерея — действие низких
температур воспринимается только зелеными растениями в пе-
риод вегетативного роста. Причем, как и арабидопсис, эти рас-
тения с увеличением возраста быстрее отвечают на воздействие
холодом. После яровизации большинству растений необходимы
длиннодневные фотопериоды. У других растений яровизация ос-
лабляет или даже устраняет потребность в последующем фото-
периодическом воздействии.
Разъяровизации. Яровизацию семян можно прервать, а
позднее их дояровизировать. При этом степень яровизации, до-
стигнутая зародышем, не утрачивается от перерыва в обработке
пониженной температурой, но семена на этот период не должны
подвергаться воздействию факторов, вызывающих разъяровиза-
цию (деяровизацию). К числу таких факторов относятся прежде
всего высокие температуры: 25 — 40 °C. По мере увеличения от-
носительной длины периода воздействия повышенной темпера-
туры прогрессивно уменьшается эффективность низкой темпера-
туры.
Длительная тепловая обработка вслед за яровизацией вызы-
вает замедление цветения. Однако полной разъяровизации обыч-
но не происходит, т. е. клетки и ткани, прошедшие яровизацию,
не возвращаются в качественном отношении в исходное состоя-
ние. Воздействие высокой температурой после яровизации может
вызывать такие изменения в состоянии зародыша или эндоспер-
ма, которые препятствуют нормальной реализации последствий
яровизации. С увеличением периода охлаждения обратимость
эффекта затрудняется, и при полной яровизации высокие темпе-
ратуры не оказывают влияния. Деяровизированные зерновки
можно вновь яровизировать последующим воздействием холода.
Обратимую разъяровизацию могут вызвать анаэробные условия
определенной продолжительности или освещение светом низкой
интенсивности (у хризантем) и т. д.
Эффект разъяровизации с помощью повышенной температу-
ры используется для остановки цветения луковиц, хранившихся
на холоде. При хранении на холоде мелкие луковицы первого
года проходят яровизацию и зацветают при посадке на следую-
щий год, не давая крупных луковиц. Выдерживание их весной
перед посадкой при повышенной температуре снимает состояние
яровизации.
Рецепция низкой температуры. Действие пониженной тем-
пературы при яровизации воспринимается делящимися клетками
155
различных органов растений. В зерновках злаков изменения под,:
действием низкой температуры происходят в точках роста (апек-
сах) зародышей. При культивировании в стерильных условиях
на среде с сахарозой изолированные зародыши ржи проходили,
яровизацию и проявляли типичную для яровизированных зерно-
вок реакцию ускорения цветения. Яровизироваться способны так-
же выращиваемые в культуре изолированные апексы зародыше-
вых побегов или даже части этих апексов.
У вегетирующего растения восприятие пониженной темпера-
туры происходит в меристеме верхушечной почки. Это было по-
казано у сельдерея, свеклы, хризантемы при охлаждении апи-
кальной зоны побега. Листья интактных растений также могут
яровизироваться, если они не завершили рост к началу воздей-
ствия пониженной температурой. Чем моложе лист, тем выше-
митотическая активность его клеток и эффективность яровиза-
ции. Следовательно, необходимое условие яровизации — наличие
делящихся клеток. Исходя из этого можно объяснить, почему
стеблевые апексы являются главным местом восприятия ярови-
зации. При этом яровизацию проходят активные меристемы, а
покоящиеся остаются неяровизированными. Если меристема яро-
визирована, то все развивающиеся из нее ткани также ведут
себя как яровизированные, т. е. состояние яровизированности
передается путем деления клеток.
Предполагается, что для яровизации необходимы сахара. Они
должны присутствовать в среде, в которой яровизируются изо-
лированные стеблевые апексы или зародыши. В отсутствии угле-
водов яровизация происходит медленно, но в конце концов все
же завершается, вероятно, за счет запасов зародыша.
Физиологические аспекты яровизации. Яровизация протека-
ет при пониженной температуре, задерживающей ростовые про-
цессы, но сопровождается рядом других физиологических изме-
нений. Например, после яровизации увеличивается количество
сосудистых тканей в направлении к точкам роста. Таким обра-
зом, в результате яровизации меристема может лучше снаб-
жаться трофическими и регуляторными факторами. В семенах
в процессе яровизации происходит увеличение размеров зароды-
ша за счет использования запасов эндосперма (рис. 9.3).
Градуальный характер реакции на обработку пониженной
температурой позволяет думать, что эта реакция связана с на-
коплением какого-то вещества, стимулирующего цветение. Пред-
полагается, что в результате охлаждения в растениях образуется
стимул цветения, который был назван верналином (лат. verna-
lis — весенний). В ряде случаев показано, что стимул цветения
из яровизированных листьев может перемещаться в другие части
растения, вызывая зацветание. Если листья яровизированной
двухлетней формы белены привить на неяровизированный под-
вой того же вида, наблюдается индукция цветения у неярови-
зированного подвоя без охлаждения. Следовательно, происходит
156
передача некоторого стимула от яровизированного растения к
пеяровизированному. То же происходит, если эти растения отно-
сятся к разным родам. Привитая на табак белена могла выз-
вать его цветение, только если была яровизирована.
Даже растения, не требующие яровизации могут при привив-
ках индуцировать зацветание неяровизированных растений, ко-
торым в норме для этого требуется воздействие низкими темпе-
ратурами. Побеги короткодневного растения (см. ниже) таба-
ка Мамонт, привитые на двухлетние неяровизированные расте-
ния белены, индуцировали зацветание последней, причем этот
эффект не зависел от того, переходил к цветению сам привитый
побег табака (на КД) или оставался вегетативным (на ДД)
(рис. 9.4). Как мы увидим дальше (см. 9.3.1), короткодневные
Рис. 9.3. Влияние яровизации семян
борщевика на изменение сухой мас-
сы эндосперма (/) и зародыша (2)
(Stokes, 1952).
По оси абсцисс — сухая масса семян (%),
по оси ординат — продолжительность яро-
визации (недели).
Рис. 9.4. Индукция цветения у не-
яровизированной двухлетней белены
(/) привитыми растениями коротко-
дневного табака Мамонт (2) (Lang,
1965).
КД и ДД — фотопериоды, при которых
выращивали растения.
нецветущие и любые цветущие растения характеризуются повы-
шенным содержанием гиббереллинов. Очевидно, в описанном
опыте именно ГА индуцировал зацветание белены. Действитель-
но, гиббереллины у некоторых видов могут частично имитиро-
вать эффект яровизации, ускоряя цветение растений, у которых
оно индуцируется воздействием низких температур (капуста,
морковь, салат). У ряда двухлетников показано, что в условиях
яровизации в тканях повышается содержание гиббереллинопо-
добных веществ.
Предполагается, что последовательность событий при ярови-
зации можно представить следующим образом:
157
Низкая Состояние Стимул Образова-
темпера -> яровиза- -► Верналин цветения -> ние
тура ции (гибберел- цветков
лин)
Возможно, верналин является неактивной формой гибберелли-
на, которая превращается в активный ГА в листьях.
Вместе с тем такие виды, как хризантема, не способны пере-
дать стимул цветения от яровизированного растения к неяровизи-
рованному. Если верхушка растения после обработки холодом*
цвела, то остальные почки, не получившие охлаждения, остава-
лись вегетативными. В этом случае состояние яровизации (в про-
тивоположность стимулу цветения) передается только в резуль-
тате клеточного деления.
Изучение генетических аспектов яровизации показало, что
восприимчивость к холоду контролируется одним геном у беле-
ны, Lunaria, ржи Petkus и несколькими — у арабидопсиса в
пшеницы. Причем чувствительность к холоду является доминан-
тной у белены и Lunaria и рецессивной — у ржи и пшеницы. Су-
щественно, что многие из этих генов обладают множественными
(плейотропными) эффектами.
Переходу растений от озимого поведения к типичному яро-
вому способствует непрерывный свет или его высокая интенсив-
ность. Необходимость низкой температуры для некоторых ози-
мых злаков, многолетних трав и других можно имитировать
экспозицией на КД при нормальной температуре. У цикория
сходный с яровизацией эффект вызывают анаэробиоз и этилен.
Неожиданно оказалось, что у ряда озимых растений (Scrophu-
laria alata и др.) необходимость в низких положительных тем-
пературах можно заменить обработкой высокими температу-
рами.
Сложность явления яровизации проявляется в возможности
замены (во многих случаях) действия низких положительных
температур другими факторами внешней среды.
9.1.2. ФОТОПЕРИОДИЗМ
Кроме температуры другими важнейшими экологическими
факторами для роста и развития растений являются свет и за-
кономерное чередование дня и ночи (фотопериод). Понятия фо-
топериод и фотопериодизм были введены в науку американски-
ми селекционерами и физиологами растений У. Гарнером и
Г. А. Аллардом (1920—1923). Их внимание привлекли некото-
рые особенности зацветания ряда сортов табака и сои. Растения
табака Мамонт интенсивно вегетировали в течение лета, но не
цвели. Цветение их наблюдалось зимой при выращивании в
оранжерее. Соя, высаженная в разные сроки в течение весны И
лета, зацветала в одно и то же время. Из этих опытов стало яс-
158
но, что решающим фактором, регулирующим скорость перехода*
от вегетации к цветению для многих видов растений, является
относительная длина дня и ночи.
Типы фотопериодической реакции цветения. Длина дня дей-
ствует на зацветание различных видов и сортов растений неоди-
наково. По реакции зацветания в ответ на длину дня выделяют'
следующие фотопериодические группы растений:
1. Нейтральные к длине дня растения (НДР) — не обладают
фотопериодической чувствительностью.
2. Длиннодневные растения (ДДР)—зацветают при длине
дня, которая больше определенной для каждого вида критиче-
ской длины. Эти виды способны зацветать и при непрерывном*
освещении (рис. 9.5).
Рис. 9.5. Влияние ДД- и КД-фотопериодов на развитие длиннодневного
табака Сильвестрис (/) и короткодневного проса (2) (по: Strasburgerr
1983).
3. Короткодневные растения (КДР) — зацветают или быст-
рее переходят к цветению при наличии длительного темновога
периода выше критической величины при чередовании дня и но-
чи (рис. 9.5).
4. Длинно-короткодневные растения (ДКДР), которым для
перехода к репродукции необходимо пребывание сначала на
длинном, а затем на коротком дне.
5. Коротко-длиннодневные растения (КДДР) — быстрее за-
цветают при их выращивании сначала на коротком, а затем на
длинном дне.
Различают также качественную фотопериодическую реакцию
у растений с облигатным фотопериодическим контролем и ко-
159*
личественную фотопериодическую реакцию — у растений, кото-
рые быстрее зацветают под воздействием короткого или длин-
ного дня, но в конечном итоге переходят к цветению и при не^
благоприятной длине дня.
К ДДР относятся хлебные злаки, многие крестоцветные,
укроп, лен, разные виды клевера, салат-латук, свекла и др., к
КДР— рис, соя, дурнишник, кукуруза, просо, хризантемы, к
НДР—некоторые сорта гречихи, гороха, хлопчатника, к ДКДР-—
Bryophyllum crenatum, Cestrum nocturnum, к КДДР — Campa-
nula medium, Trifolium repens и т. д.
ДДР распространены в основном в умеренных и приполяр-
ных широтах, КДР — в низких широтах (севернее и южнее эква-
тора), НДР — растения с широким ареалом и тропические виды.
Интенсивность освещения, температура и другие факторы мо-
гут менять характер фотопериодических ответов растений. Для
КДР с качественной реакцией решающим фактором служит дли-
на темнового периода. Кратковременное (минуты) освещение
этих растений во второй половине темнового периода препятст-.
вует их переходу к цветению. Прерывание светового периода
темнотой не влияет на сроки цветения.
Чувствительность к длине дня может определяться единствен-
ным геном (табак Мамонт, /d-мутант арабидопсиса) или не-
сколькими генами (сорго, женьшень). Высокая чувствительность
к длине дня может быть доминантным признаком, например
у сорго, или рецессивным( табак, пшеница). Гены Ppd и Vru,
контролирующие соответственно ответ на длину дня й чувстви-
тельность к холоду у пшеницы, являются отдельными и полно-
стью независимыми. Другая ситуация у гороха, где гены Sn и
Dne контролируют последовательные этапы метаболизма, связан-
ные с зацветанием. Многие гены, участвующие в индукции за-
цветания, обладают плейотропными эффектами. Так, у пшеницы
ген Ppd\ влияет также на высоту растения, у гороха гены Sn
и Dne определяют длину междоузлий, морфологию листа, вет-
вление и др. Таким образом, гены, контролирующие явления фо-
топериодизма и яровизации, не являются специфичными.
При фотопериодической индукции в листьях обнаруживаются
изменения в составе мРНК у индуцированных растений по срав-
нению с неиндуцированными. Большинство этих различий явля-
ется количественными, но выявлены и качественно новые мРНК.
Фотопериодический контроль столь же сложное явление, как
и яровизация. Фотопериодическая реакция того или другого рас-
тения может быть резко видоизменена под влиянием других фак-
торов внешней среды. Зацветание, в норме связанное с фотопе-
риодом, может быть индуцировано весьма разнообразными воз-
действиями. Например, у короткодневного растения Pharbitis
«Violet» индукция цветения на ДД может быть вызвана следу-
ющими факторами: недостатком питания, высокой интенсивно-
стью света, низкой температурой, удалением корня, обработкой
160
хлорхолинхлоридом и др. У длиннодневного растения Silene
цветки могут образовываться на КД под действием низкой или
высокой температуры, повышенного уровня СО2 или удаления
корней. Причем высокая температура, заменяющая ДД, воспри-
нимается корнями.
Во многих случаях растения, на которые действовали два
различных индуктивных фактора, каждый на подпороговом уров-
не, цвели. Это указывает на возможность суммирования эффек-
тов, вызванных каждым фактором отдельно. Удивительно, что
иногда могут суммироваться действия прямо противоположных
факторов, например непрерывной темноты и ДД у рудбекии
(ДДР) или низкой и высокой температуры у овсяницы.
Таким образом, у многих видов (генотипов) существуют аль-
тернативные пути для индукции цветения. Причем внешние фак-
торы взаимодействуют таким образом, что каждый из них изме-
няет величину порога для других. Влияние различных факторов
может быть суммировано, если они действуют в определенной
последовательности. Они могут оказывать влияние на разные
части целого растения.
Лист как орган, воспринимающий фотопериодическое воз-
действие. М. X. Чайлахяном и Б. С. Мошковым (1936) в опы-
тах на короткодневных растениях крупноцветной хризантемы
было неопровержимо доказано, что рецептором фотопериодиче-
ских импульсов, ведущих к зацветанию растений, являются ли-
стья. Опыты проводились следующим образом (рис. 9.6). У рас-
тений срезали все верхние листья и оставляли по одной верху-
шечной почке. Нижние листья сохраняли, но все боковые побе-
ги в пазухах этих листьев срезали. Таким образом, была созда-
Рис. 9.6. Роль листьев как рецепторов фотопериодического
воздействия у хризантемы крупноцветной (КДР).
/ — все растение на ДД, 2 — листья на КД, 3 — верхняя часть побега
на КД, 4 — все растение на КД.
П 3ак?з № 399
161
на система листья — верхушечная почка. В течение опыта удаля-
ли новые листья и побеги, появлявшиеся по всей длине стебля.
Растения делили на 4 группы. Контрольные группы постоянно
находились: 1-я — на длинном дне (рис. 9.6, /), 4-я — на корот-
ком (рис. 9.6, 4). Цветение наблюдалось только у растений 4-й
группы растений. У растений 3-й группы обезлиственная верх-
няя часть стебля оставалась на длинном дне, а листья — на ко-
ротком. У растений 2-й группы, наоборот, на длинном дне нахо-
дились листья, а верхняя часть стебля — на коротком дне. Цвет-
ки образовались только у растений 2-й группы, зрелые листья
которых были в условиях короткого дня. Следовательно, именно
листья воспринимают длину дня, хотя ответная реакция проис-
ходит в апексе побега. Из этих опытов следует также, что какой-
то сигнал из листьев, получивших благоприятное фотопериоди-
ческое воздействие, поступает в стеблевой апекс, вызывая зало-
жение цветка. Фотопериод наиболее эффективно воспринимается
молодыми растущими листьями. У некоторых видов растений
чувствительностью к фотопериодическому воздействию могут
обладать также зеленые ткани стебля, почки и даже корни.
Роль фитохрома в фотопериодической реакции. На возмож-
ную роль фитохрома в фотопериодизме впервые указали X. Борт-
вик, М. Паркер и С. Хендрикс. Они обнаружили, что вспышка
КС в конце темнового периода у короткодневных растений ин-
гибирует переход к зацветанию. ДКС, данный после КС, устра-
няет действие последнего. У длиннодневных растений использо-
вание КС (1 ч) в темновой период способствует цветению рас-
тений этого типа. Под действием ДКС у некоторых, но. не у всех,.
ДДР происходит обращение эффекта КС. Из этих данных сле-
дует, что влияние темнового периода у КДР и ДДР снимается
его прерыванием КС, поскольку приводит к появлению высоких
уровней Ф730. В световой период высокий, а в темновой период
низкий уровень Ф7зо благоприятствует цветению КДР. Для ДДР
не требуются такие суточные колебания Ф730, поскольку они
цветут даже при непрерывном освещении.
Фотопериодизм, фотосинтез и дыхание. Для развития КДР
и ДДР в условиях фотопериодической индукции необходимо нес-
колько часов интенсивного света в сутки, достаточного для све-
тового насыщения фотосинтеза. При исключении СО2 из воздуха
фотопериодическая реакция не происходит. Процесс фотосинте-
тического восстановления СО2 можно заменить введением в
лист таких неспецифических метаболитов, как сахароза, другие
сахара, органические кислоты трикарбонового цикла и т. д.
Однако процесс фотосинтеза играет в фотопериодической ре-
акции более специфическую роль, чем роль простого поставщика
энергии и неспецифических ассимилятов. Для осуществления
фотопериодической реакции КДР и ДДР требуется неодинако-
вое количество органического вещества, возникающего в процес-
се фотосинтеза: у ДДР эта потребность выше. У периллы (КДР)
162
задерживающее цветение действие «длиннодневного» листа мо-
жет быть полностью заменено введением раствора сахарозы че-
рез срезанный черешок или листовой след. У ряда ДДР инфиль-
трация в листья различных сахаров ослабляет угнетающее дей-
ствие длительной темноты. Однако не интенсивность фотосинте-
за является регулятором фотопериодического процесса, а фото-
период, который влияя на рост, развитие и потребности расте-
ния в ассимилятах, регулирует интенсивность фотосинтеза.
В явлениях фотопериодизма важная роль принадлежит так-
же процессу дыхания. Анаэробиоз в темновой период КД-цикла
(особенно во вторую его половину) задерживает цветение КДР
и ускоряет цветение ДДР, т. е. приводит к специфическому изме-
нению знака фотопериодической реакции цветения. В период
дополнительного освещения в условиях длинного дня анаэробиоз
задерживает цветение ДДР и ускоряет цветение КДР. Причем
анализ дыхательных коэффициентов, интенсивности дыхания и
других окислительных процессов показал, что подавленные ана-
эробиозом процессы не являются процессами фотоокисления, но
скорее связаны с аэробной фазой дыхания. Следовательно, для
осуществления как темновых реакций КД-цикла, так и фотохи-
мических реакций в период дополнительного освещения ДД-цик-
ла необходим О2 и связанное с ним аэробное дыхание.
В связи с фотопериодической реакцией затрагиваются и дру-
гие стороны метаболизма растений. В частности, важную роль в
переходе растительных организмов от вегетативного развития к
генеративному играют условия их азотного и углеводного пита-
ния. Согласно теории Г. Клебса увеличение содержания угле-
водов способствует генеративному направлению развития, тог-
да как накопление азотсодержащих веществ стимулирует веге-
тацию. Впоследствии было обнаружено, что фотопериодическое
воздействие существенно влияет на динамику и накопление как
углеводов, так и азотсодержащих соединений. В большинстве
случаев на длинном дне увеличивается содержание различных
форм углеводов как у ДДР, так и у КДР. В условиях коротко-
го дня усиливается накопление белков, свободных аминокислот и
органических кислот. КДР и ДДР различаются по реакции цве-
тения на внесение азотных удобрений. Растения с КД-фотоперио-
дической реакцией значительно ускоряли цветение в ответ на
азотную подкормку, тогда как ДДР быстрее зацветали при не-
котором дефиците азота в среде.
9.2. ЭВОКАЦИЯ ЦВЕТЕНИЯ
Эвокация (лат. evocatio — вызывание) — завершающая фаза
инициации цветения, во время которой в апексе происходят про-
цессы, приводящие к появлению цветочных зачатков. Если вос-
приятие фотопериода можно назвать листовой фазой инициации
И*
163
цветения, то эвокация — это фаза, осуществляемая в стеблевом
апексе.
При поступлении флорального стимула (флоригена) в апи-
кальных меристемах последовательно возрастает содержание
растворимых сахаров и активность инвертазы, число митохонд-
рий и интенсивность дыхания, усиливается синтез нуклеиновых
кислот и белков, изменяется в количественном и качественном
отношении состав белков, увеличивается митотическая актив-
ность. Ингибиторы синтеза РНК и белков тормозят инициацию
цветения, причем особенно сильно, когда используются перед
эвокацией.
Все эти данные показывают, что сущность эвокации заклю-
чается в переключении генетической программы развития веге-
тативных почек на генеративную программу, обеспечивающую
закладку и формирование цветков.
Увеличение содержания сахаров в апикальной меристеме яв-
ляется самым ранним проявлением эвокации. Оно наблюдается
даже после одного фотопериодического цикла и не связано не-
посредственно с интенсивностью фотосинтеза. Показано, что для
образования цветков в культуре нефотосинтезирующей ткани
требуется намного более высокая концентрация сахара, чем для
образования вегетативных почек.
Поступление в апикальную меристему побега флорального
стимула запускает двухфазный процесс: 1) возрастает пролифе-
ративная активность в стержневой (субапикальной) меристеме
апекса побега, что подготавливает условия для развития цвето-
носа или цветоножки; 2) индуцируется митотическая активность
клеток в центральной и периферической меристемах (см. рис.
4.1), создавая условия для закладки цветков. Клетки централь-
ной зоны апекса побега в вегетативном состоянии относительно
неактивны (делятся реже, чем в других зонах апекса). В связи
с тем, что деление клеток в этой зоне резко активируется при
поступлении флорального стимула, ее называют «меристемой
ожидания».
Увеличение скорости клеточного деления после первого же
ДД-фотопериодического цикла происходит в виде митотических
волн (подсолнечник, хризантема, горчица и др.). Синхронизация
митотической активности достигается в результате укорочения
Gi- и S-фаз митотического цикла и вступления в фазу G2 клеток,
вышедших из цикла.
Для восприятия стимула цветения апекс побега должен обла-
дать компетенцией к нему. У многих древесных на этапе моло-
дости ювенильные апикальные меристемы не способны отвечать
на флоральный стимул при прививке на плодоносящие деревья,
т. е. не обладают компетенцией. Компетенция к флоральному
стимулу может быть связана с появлением рецепторов в клет-
ках соответствующих зон апекса: в субапикальной меристеме —
это рецепторы к гиббереллину, в меристеме ожидания — к гипо-
164
।
тетическому антезину (см. 9.3.1). У травянистых растений все
апексы побегов, и молодые, и старые, способны воспринимать
флоральный стимул, когда он поступает из листьев. Компетенция
к флоральному стимулу в апексе побега обусловлена определен-
ными генами.
Точно определить время начала эвокации трудно, так как
изменения в клетках апекса побега могут наблюдаться еще до
начала действия индуктивных факторов или одновременно с на-
чалом их действия. В случае фотопериодического воздействия
на листья такая быстрая реакция апикальной меристемы мо-
жет быть связана с электрическими сигналами: изменением
электротонической разности потенциалов между листом и апек-
сом или возникновением распространяющихся потенциалов дей-
ствия. Быстрая электрическая сигнализация может подготавли-
вать стеблевые апексы для восприятия флорального стимула хи-
мической природы, который транспортируется из листьев в апек-
сы гораздо медленнее. В частности, электрические сигналы, ока-
зывающие влияние на функциональную активность мембран, мо-
гут активировать в клетках апекса поглощение сахаров или их
освобождение (в результате гидролиза).
Состояние, при котором переход апикальной меристемы к
образованию цветка становится необратимым, называется фло~
ральной детерминацией. В это время в апексе начинаются интен-
сивные гистологические и морфогенетические изменения. Таким
образом, эвокация включает в себя процессы на молекулярном и
внутриклеточном уровнях, завершение которых создает условия
для флорального морфогенеза (формирования цветка).
9.3. ПРИРОДА ФЛОРАЛЬНОГО СТИМУЛА
На основании того факта, что фотопериодическое воздейст-
вие воспринимается листьями, а затем флоральный стимул пе-
редается в апекс побега, М. X. Чайлахян в 1937 г. сформулиро-
вал гормональную теорию развития растений. Согласно этой тео-
рии при благоприятном фотопериоде в листьях образуется фло-
риген— гормон, индуцирующий переход растений к зацветанию.
Теория флоригена породила многочисленные исследования,
направленные на выяснение природы флорального стимула. В
частности, в опытах с растениями дурнишника (КДР), имеющи-
ми по 2 ветви, было показано, что флоральный стимул образу-
ется в листьях на КД и индуцирует цветение не только побега,
который был на коротком дне, но и ветви, остававшейся на ДД
(рис. 9.7). Если листья у КД-побега были удалены, то оба по-
бега не зацветали. Оказалось, что оставление 1/8 части одного
листа у КД-побега обеспечивало индукцию зацветания у обеих
ветвей. Флоральный стимул, таким образом, может перемещать-
ся как вверх, так и вниз по побегу (т. е. неполярно). Скорость
165
Рис. 9.7. Перемещение флорального стимула из листьев од-
ной ветви КДР дурнишника в другую (1—3) и из одного
побега к другому через прививку (4) (Hamner, 1942).
5— контроль.
его передвижения у разных растений лежит в пределах от 0,4 до
2,0 см/сут и происходит по флоэме и коровой паренхиме. Стимул
может передаваться через место прививки от одного растения
к другому (см. рис. 9.7, 4, 5). Он оказался невидоспецифичным,
так как в опытах с прививками стимул цветения, образовавший-
ся на благоприятном фотопериоде в листьях одного вида, вызы-
вал цветение побегов другого вида, находящихся в неиндуктив-
ных условиях.
У нейтральнодневных растений, зацветание которых происхо-
дит автономно, листья и корни не оказывают решающего влия-
ния на переход растений к репродуктивному развитию. У НДР,
166
зацветание определяется градиентом цветочно-спелого состояния
вдоль стебля (полярностью), причем основную роль в этом игра-
ют ткани коры. Обнаружена корреляция градиента цветения с
градиентом ряда фитогормонов, фенольных соединений, актив-
ности ферментов, содержанием РНК и др. В культуре каллус-
ной ткани к флоральному морфогенезу оказались способными
только те экспланты нейтральных видов, которые были взяты
от цветущих растений.
В настоящее время существует несколько гипотез о природе
флорального стимула. Из них наиболее интересны гипотезы о
бикомпонентности флоригена, об ингибиторе цветения (антифло-
ригене) и о многофакторном контроле.
9.3.1. ГИПОТЕЗА О БИКОМПОНЕНТНОЙ ПРИРОДЕ ФЛОРИГЕНА
Согласно этой гипотезе, предложенной М. X. Чайлахяном
(1958), гормон цветения (флориген) состоит из двух компонен-
тов: гиббереллинов и антезинов. ГА обусловливают образование
и рост цветочных стеблей, а антезины индуцируют заложение
цветков. Длиннодневные растения, особенно розеточные формы,
содержат антезины, но бедны гиббереллинами. В условиях бла-
гоприятного длиннодневного фотопериода в листьях ДДР син-
тезируется значительное количество гиббереллинов, которые по-
ступают в апекс побега и индуцируют рост цветоноса. Под дей-
ствием уже имеющегося антезина на цветоносе образуются цвет-
ки (рис. 9.8). У короткодневных растений, которые, как правило,
имеют сформированный стебель, наоборот, гиббереллинов до-
Рис. 9.8. Схема регуляции цветения ДДР и КДР с участием би-
компонентной гормональной системы (флоригена) (Чайлахян, 1978).
« — перилла красная (КДР), б — руд беки я двуцветная (ДДР). Ан — анте-
зины.
167
статочно при любом фотопериоде, а антезин в листьях синтези-
руется только в условиях короткодневного фотопериода. В по-
следнем случае появляющиеся антезины транспортируются в
апекс побега и вызывают заложение цветка (рис. 9.8). У ней-
тральнодневных растений содержание ГА и антезинов увеличи-
вается с возрастом (автономно) и, когда их уровень достигает
критической величины, растения переходят к зацветанию. Таким
образом, у растений существуют две фазы зацветания: формиро-
вание цветочных стеблей и закладка цветков. При этом у длин-
нодневных растений критической фазой перехода к зацветанию
является закладка цветочных стеблей (цветоносов), а у корот-
кодневных— цветков. Образование цветков у длиннодневных ви-
дов и развитие стеблей у короткодневных осуществляются авто-
номно, как у нейтральнодневных растений.
Рис. 9.9. Влияние обработки гиббереллином на цветение длиннодневной
рудбекии и короткодневного проса (Чайлахян, 1988).
д_рудбекия на коротком дне: / — верхушечная почка обрабатывалась гибберел-
лином, 2 — контроль; б — просо на длинном тне: 3 — верхушечную часть растения
обрабатывали гиббереллином, 4— контроль.
168
Эти положения обосновываются следующими эксперимен-
тальными данными:
1. Ускорение роста стеблей — характерная особенность дей-
ствия гиббереллина. ГА индуцируют образование цветоноса у
длиннодневных розеточных форм на неблагоприятном фотопери-
оде (рис. 9.9, а). При этом формируются цветки (в соответствии
с предположением о наличии эндогенных антезинов). Однако в
ряде случаев под действием экзогенного гиберреллина наблюда-
лось образование цветоносов, но цветки не закладывались. Ни
один короткодневный вид (дурнишник, табак Мамонт, перилла»
каланхоэ, просо и др.) на неблагоприятном фотопериоде не пе-
реходил к зацветанию под действием экзогенного гиберреллина
(рис. 9.9,6). В то же время во всех случаях усиливался рост
стеблей. Предполагается, что короткодневным видам в условиях
длинного дня не хватает тех веществ, которые влияют непосред-
ственно на образование цветков (антезинов).
2. Содержание эндогенных гиббереллинов в листьях всех
растений при выращивании на длинном дне (или при непрерыв-
ном освещении) возрастает, а на коротком — снижается (рис.
9.10).
Рис. 9.10. Изменение содержания гиббереллинов
(/) и ингибиторов роста (АБК) (2) в листьях
ДДР табака Сильвестрис (а) и КДР табака
Мамонт (б) в процессе ДД- и КД-фотопериоди-
ческой индукции (Чайлахян, 1988).
По оси абсцисс — продолжительность индукции (сут),
по оси ординат — активность фитогормонов (мг/кг су-
хой массы).
3. Цветение КДР в условиях длинного дня индуцируется при
их прививке на цветущие ДДР, и наоборот, цветение ДДР в
условиях короткого дня вызывается их прививкой на цветущие
растения КДР. Например, табак Мамонт (КДР), привитый на
цветущий табак Сильвестрис (ДДР), в условиях длинного дня
16»
виях короткого дня (рис. 9.11).
Рис. 9.11. Опыты с прививками, до-
казывающие идентичность флориге-
на у длиннодневных и короткоднев-
ных растений (по: Чайлахян и др.,
1977).
М — табак Мамонт, С — табак Сильвест-
рис. Подвои — цветущие растения. Объяс-
нение в тексте.
зацветал так же, как и табак Сильвестрис (розеточная форма
на КД), привитый на цветущий табак Мамонт, зацветал в усло-
Предполагается, что в первом
случае из подвоя в привой по-
ступали недостающие антези-
ны, а во втором — гибберелли-
ны; у цветущих подвоев имел-
ся полный комплекс флориге-
на: ГА+антезины, одинаковый
как для КДР, так и для ДДР.
4. Из листьев вегетирующе-
го на длинном дне коротко-^
дневного табака Мамонт были
получены содержащие гиббе-
реллин экстракты, обработка
которыми вегетирующей на КД
длиннодневной рудбекии (со-
держит антезины) индуцирова-
ла ее цветение. И наоборот,
экстракты, полученные из
листьев вегетирующего на ко-
ротком дне табака Сильвест-
рис, предположительно содер-
жащие антезины, вызывали
цветение короткодневного рас-
тения мари красной на непре-
рывном свету, т. е. в условиях,
способствующих образованию
в тканях только гиббереллинов.
Эти опыты указывают на ком-
плементарность комплекса фитогормонов, которая состоит в том,
что в условиях благоприятного фотопериода для перехода к цве-
тению один из компонентов флоригена образуется автономно
(как у нейтральнодневных растений), а другой синтезируется в
листьях только при благоприятном фотопериоде.
Согласно гипотезе о бикомпонентной природе флоригена в
регуляции закладки и формирования цветков у всех фотоперио-
дических групп предполагается участие и других известных в на-
стоящее время фитогормонов. Теория флоригена в современном
ее виде достаточно убедительно объясняет механизм регуляции
перехода в генеративное состояние. Однако природа антезина
остается неизвестной.
9.3.2. ГИПОТЕЗА АНТИФЛОРИГЕНА
(ИНГИБИТОРА ПЕРЕХОДА К ЗАЦВЕТАНИЮ)
Предполагается, что в листьях растений в условиях небла-
гоприятного фотопериода содержатся ингибиторы цветения. При
170
благоприятном фотопериоде концентрация этих ингибиторов сни-
жается, что и приводит к зацветанию растений. У некоторых
короткодневных видов листья, находящиеся на ДД, оказывают
ингибирующее влияние на цветение. Ингибирующее действие
длиннодневных листьев проявляется, если они оказываются меж-
ду апексом побега и источником стимула цветения, т. е. листь-
ями, находящимися под действием короткодневного фотоперио-
да. Ингибирующее действие длиннодневного листа проявляется
особенно сильно, если он находится непосредственно над корот-
кодневным листом, т. е. на той же ортостихе.* Исходя из этого
ингибирующий эффект неиндуцированных листьев можно было
бы объяснить торможением перемещения флоригена, который,
как уже говорилось, транспортируется с током ассимилятов. Од-
нако было показано, что в неиндуцированных листьях может об-
разовываться специфический ингибитор цветения, перемещаю-
щийся затем в апекс побега. Например, когда побеги ДДР та-
бака Сильвестрис прививались на стебель НДР табака Трапе-
зонд, последний цвел только в том случае, если привитые расте-
ния содержались в условиях ДД. Под воздействием же усло-
вий КД как у привоя, так и у подвоя цветение ингибировалось,
хотя контрольные (без прививки) растения Трапезонд цвели в
условиях КД. По-видимому, ингибирование цветения НДР та-
бака Трапезонд в вариантах с прививкой подавляется ингибито-
ром, образующимся в листьях табака Сильвестрис при неиндук-
тивном фотопериоде.
В других опытах было показано, что если КДР каланхоэ под-
вергается попеременному действию двух КД- и одного ДД-цик-
лов, то цветение полностью ингибируется. В данном случае мы
имеем дело с ингибирующим эффектом ДД в пределах самого
листа. У ДДР подавляющее влияние на цветение оказывает тем-
новой период.
Химическая природа антифлоригена не выяснена. Вместе с
тем установлено, что задерживающее цветение действие длинно-
дневного листа у КДР (см. выше) может находиться в прямой
зависимости от интенсивности фотосинтеза и избытка ассимиля-
тов. Оказалось, что ингибирующее влияние длиннодневного лис-
та у КДР периллы можно заменить 3%-ным раствором сахаро-
зы, вводимым в растение через черешок. Задерживающее влия-
ние КД-листьев у ДДР, возможно, связано с избыточным синте-
зом азотсодержащих соединений.
Функции ингибитора цветения могут выполнять вещества,
тормозящие приток ассимилятов к апексу побега. Этого можно
достигнуть не только прямым ингибированием транспорта асси-
милятов по флоэме, но и усилением конкуренции за ассимиляты
со стороны других органов. Удаление или ограничение количе-
* Ортостиха — условная вертикальная линия, соединяющая ряд листьев,
расположенных друг под другом.
171
ства конкурирующих за ассимиляты вегетативных органов (мо*
лодых листьев, корней) ускоряет инициацию цветения у многих
растений. Таким образом, агенты, усиливающие приток ассими-^
лятов к апексу побега, будут действовать как флоральные акти-
ваторы, и наоборот. Различные факторы, влияющие на интен-
сивность фотосинтеза и доступность ассимилятов, также могут
контролировать инициацию цветения. Показано, что превраще-
ние ассимилятов в крахмал ниже, а экспорт ассимилятов из ли-
ста выше на ДД по сравнению с КД. Эти различия определя-
ются уже через 24 ч после экспозиции на одном ДД. Повышен-
ные интенсивность света и концентрация СО2 в воздухе часто
ускоряют цветение. Экспозиция на свету высокой интенсивности
в течение первой половины индуктивного ДД активирует цвете-
ние, а во второй — ингибирует (у горчицы). Удаление СО2 из
воздуха устраняет оба эффекта. Как отмечено выше, высокие
концентрации сахарозы способствуют закладке цветков в куль-
туре ткани ДДР и КДР. Однако регуляцию поставок ассимиля-
тов вряд ли можно рассматривать в качестве эквивалента спе-
цифических флоригена и антифлоригена. Такой контроль скорее
играет роль модификатора (промотора или ингибитора).
9.3.3. ГИПОТЕЗА МНОГОФАКТОРНОГО КОНТРОЛЯ
Эта гипотеза выдвинута Ж. Бернье, Ж.-М. Кине и Р. Саксом
(1981). Авторы полагают, что инициация цветения и фло-
ральный морфогенез контролируется не одним-тремя специфиче-
скими морфогенами (флоригеном—антифлоригеном), а сложной
системой многих факторов, каждый из которых в необходимой
концентрации-и в нужное время запускает свою цепь процессов,
ведущих к закладке цветков. Эти факторы образуются в разных
частях растительного организма (в апексах, почках, стеблях,
корнях), причем они не обязательно идентичны у всех видов.
Действительно, различные органы оказывают многообразное
влияние на процессы зацветания. Так, ответ на фотоиндукцию,
например, у КДР дурнишника возрастает с увеличением числа
присутствующих активных почек. Удаление молодых растущих
листьев также влияет (ускоряет или тормозит) на инициацию
цветков у различных КДР, ДДР и НДР. Прекращение роста
корней (при водном стрессе и т. п.) или их обрезка ускоряют
цветение у некоторых растений. Культивирование в маленьких
сосудах уменьшает на 2 ч продолжительность темнового крити-
ческого периода у Pharbitis «Violet». Розеточная рудбекия
(ДДР) не способна к стрелкованию (образованию цветоноса) и
цветению в благоприятных фотопериодических условиях, когда
лишена корней. В то же время цветение может происходить и в
отсутствие стрелкования. По-видимому, корни необходимы не
столько для стрелкования, сколько для инициации цветения.
Многочисленные исследования показывают, что корневая систе-
172
ма участвует в детерминации числа цветков, экспрессии пола,
ветвлении соцветий и т. д. Развивающиеся семена оказывают
сильный ингибирующий эффект на инициацию цветков у некото-
рых плодовых деревьев (яблоня, груша, олива и др.).
Таким образом, судьба всех меристем у однолетних и много-
летних растений находится под влиянием различных корреля-
ций между органами, действующих на дальние расстояния. Ма-
териальными факторами этих корреляций могут быть элемен-
ты питания (ассимиляты и др.). Но особо важную роль в кор-
релятивных связях, обеспечивающих закладку и формирование
цветков, играют фитогормоны.
Цитокинины. Экзогенные цитокинины ускоряют или, реже,
ингибируют инициацию цветков у различных видов. Характер
ответа часто зависит от количества цитокинина и времени обра-
ботки. Следовательно, существуют оптимальные дозы цитокини-
на и время чувствительности к нему. Эффект цитокинина часто
зависит от присутствия других фитогормонов, например, у хри-
зантем, мари, орхидных и др. ГА резко повышает ускоряющее
зацветание действие цитокинина. Чувствительность центральной
зоны апекса побегов.к цитокининам (и ГА) увеличивается с воз-
растом. У ипомеи (КДР) индуктивная длинная ночь делает
апекс побега более чувствительным к экзогенному цитокинину.
В культуре тонкого слоя клеток табака цитокинин необходим
для образования цветочных почек, но если используется сверх-
оптимальная его концентрация, то вместо цветков образуются
вегетативные почки.
Содержание эндогенного цитокинина заметно изменяется при
инициации цветения. В фотоиндуцированных листьях ДДР та-
бака возрастает содержание зеатинрибозида, однако этого' не
наблюдается у КДР табака. У ДДР горчицы фотопериодическая
индукция способствует повышению уровня цитокинина в листь-
ях, у КДР дурнишника, наоборот, — снижению. Однако у того и
другого растения в условиях фотоиндукции увеличивается содер-
жание цитокининов в флоэмном соке. Очевидно, сигнал неизве-
стной природы, образуемый индуцированными листьями, посту-
пает в корни, где он способствует синтезу (или освобождению)
цитокининов и перемещению их в апексы побега. Опыты с коль-
цеванием показывают, что сигнал, распространяющийся в на-
правлении лист корень, движется по флоэме.
Гиббереллины. Как отмечалось выше, экзогенные гибберел-
лины в неиндуктивных условиях индуцируют цветение у широ-
кого круга растений: озимых однолетников, двухлетников и мно-
голетников (см. 9.1.1), длиннодневных, длинно-короткодневных
и коротко-длиннодневных видов (см. 9.1.2), обеспечивая преж-
де всего прохождение первой фазы цветения — образование и
рост цветочных стеблей. У некоторых розеточных ДДР (рудбе-
кия, арабидопсис) ретарданты, ингибирующие синтез ГА, подав-
ляют как стрелкование, так и цветение на ДД, причем ГА обра-
173
щают этот эффект. Следовательно, у этих видов ГА являются
первичными эндогенными стимулами цветения. Однако у других
розеточных ДДР (шпинат, смолевка, куколь) ретарданты зна-
чительно снижают уровень ГА и подавляют стрелкование, но не
ингибируют цветение. ГА не индуцируют цветение многих видов,
формирующих стебли в неиндуктивных условиях. Гиббереллины
подавляют образование цветков у таких многолетников, как КДР
земляники и смородины, ДДР фуксии, КДДР мятлика и костра,
НДР томата, яблони и цитрусовых. Кажущийся разнобой в дей-
ствии экзогенных гиббереллинов (в большинстве случаев исполь-
зовался Г Аз) может быть результатом того, что у разных объек-
тов активностью обладают различные гиббереллины. Кроме то-
го, у разных видов критическое время для обработки гибберел-
лином может отличаться. Например, у карликовой ипомеи ГАз
активирует цветение, когда дается перед индуктивной длинной
ночью, но ингибирует, если обработка проводится сразу после
нее.
Установлено, что несколько этапов биосинтеза ГА в листьях
контролируется длиной дня. Низкая температура снимает блок
между кауреновой кислотой и ГА9. Таким образом, в ходе тер-
мо- и фотоиндукции в растениях происходят качественные и ко-
личественные изменения в составе гиббереллинов. Так, в листьях
индуцированной белены наблюдаются временное повышение
уровня ГА и появление новых гиббереллинов. Эти изменения
предшествуют стрелкованию и образованию цветков. У плевела
через сутки после индуктивного ДД в апексе в 2—3 раза времен-
но возрастает ГА32, а уровень ГА1 не изменяется.
Ауксины. Экзогенный ауксин может как подавлять, так и
ускорять инициацию цветения у ДДР и КДР, причем ингибиро-
вание встречается чаще, чем ускорение. У горчицы и ряда дру-
гих растений ауксин в низких дозах ускоряет, а в высоких —
тормозит инициацию цветков. Это подавление высокими кон-
центрациями ауксина может быть результатом общего ингиби-
рования роста. В опытах с целыми растениями или с культурой
тонкого слоя клеток установлено, что оптимальный уровень кон-
центраций ауксина на разных фазах инициации цветков резко
меняется.
Анализ содержания эндогенной ИУК показывает, что у КДР
мари и сорго ее уровень до инициации цветения низок.
Абсцизовая кислота. Экзогенная АБК оказывает ингибиру-
ющее действие на инициацию цветения в индуктивных условиях
у некоторых ДДР и КДР. У ДДР табака Сильвестрис по мере
фотопериодической индукции содержание АБК в листьях снижа-
ется, а у КДР табака Мамонт возрастает (см. рис. 9.10). В боль-
шинстве же случаев различие в уровнях АБК в растениях, по-
лучивших и не получивших индукцию, невелико (например, в
листьях периллы). Однако даже при отсутствии значительных из-
менений в уровне АБК существенную роль могут играть измене-
ния соотношений между АБК и другими фитогормонами, содер-
жание которых изменяется резко.
Этилен. Экзогенный этилен подавляет цветение у многих
КДР. У мари (КДР) индукция длинной ночью приводит к тор-
можению превращения предшественника этилена 1-аминоцикло-
пропан-1 -карбоновой кислоты в этилен. Прерывание темноты
светом устраняет как это торможение, так и цветение. Экспози-
ция ДДР шпината на ДД, наоборот, заметно увеличивает обра-
зование этилена из АЦК.
У ириса этилен вызывает инициацию закладки цветков у
луковиц, мало способных цвести. Однако после того как цветки
сформированы, этилен вызывает остановку дальнейшего разви-
тия. У зрелой гузмании и некоторых других бромелиевых цвете-
ние индуцируется обработкой этиленом. Ювенильное растение
гузмании обладает слабой способностью превращать АЦК в эти-
лен. Готовность ее к цветению, возможно, связана с развитием
этой способности в апексе. Избыточная теснота благоприятству-
ет образованию этилена у ряски, что может иметь значение для
ее перехода к зацветанию.
Обсуждаемые фитогормоны могут оказывать специфическое
влияние на аттрагирующую активность клеток апекса, последо-
вательную закладку органов цветка, на рост и развитие этих ор-
ганов.
9.4. ДЕТЕРМИНАЦИЯ ПОЛА
Детерминация (определение) пола у покрытосеменных расте-
ний — это появление состояния готовности для формирования
органов цветка, цветков или целых растений определенного пола.
Детерминация пола зависит как от функционирования генов —
генетическое определение пола, так и от условий внешней и
внутренней среды — фенотипическое определение пола.
9.4.1. ВЫРАЖЕННОСТЬ ПОЛА У РАСТЕНИЙ
Цветки как органы полового размножения могут быть обое-
полыми или реже — раздельнополыми. В последнем случае они
формируются на одной и той же (однодомность) или на разных
(двудомность) особях. Двудомных видов сравнительно мало.
К ним относятся конопля, шпинат, тополь, ива, хмель, морошка,
элодея и др. У некоторых двудомных растений морфологические
различия между мужскими и женскими особями, за исключени-
ем строения цветка, почти отсутствуют (земляника, морошка).
У других наблюдается резко выраженный половой диморфизм
(конопля, шпинат, тополь, спаржа, хмель и др.).Половой димор-
физм, если он есть у двудомных, не обнаруживается у ювениль-
ных растений и появляется лишь ко времени готовности к цве-
175
тению. Этот диморфизм выражается не только в морфологиче-
ских и анатомических признаках, но и в биохимических и физи-
алогических свойствах особей разного пола. Так, у шпината жен*
ские растения более сильно развиты и имеют более продолжи*
тельный период жизни, чем мужские. Ткани
разных частей женских растений обладают бо-
лее активной восстановительной способностью
а мужских — более высокой интенсивностью
окислительных процессов.
У многих однодомных растений с раздель-
нополыми цветками мужские и женские цвет-
ки или соцветия появляются на разных участ-
ках стебля. Так, у кукурузы в нормальных ус-
ловиях мужское соцветие (метелка) форми-
руется на верхушке побега, а женские соцве-
тия (початки)—в пазухах листьев в средней
части стебля. У других однодомных видов с
раздельнополыми цветками выраженность по-
ла цветков меняется по мере роста побега.
Например, у тыквы в пазухах первых листьев
образуются недоразвитые мужские цветки,
при дальнейшем росте побега последовательно
появляются развитые мужские и женские,
цветки, крупные женские цветки и недоразви-
тые мужские и, наконец, только женские цвет-
ки, из которых могут развиваться партенокар-
пические (бессемянные) плоды (рис. 9.12).
Степень проявления пола (сексуализация)
у двудомных растений и разнополых цветков—
очень лабильный показатель, сильно изменяю-
щийся под влиянием факторов внешней среды.
Изменения в сторону большего проявления
признаков женского пола получили название
феминизации, а мужского — маскулинизации.
Рис. 9.12. Последовательность появления цветков раз-
ного пола у тыквы (Синнот, 1963).
1 — недоразвитые мужские цветки; 2 — нормальные мужские
цветки; 3 — нормальные мужские и женские цветки; 4 — круп-
ные женские и недоразвитые мужские цветки; 5 — женские
цветки, из которых развиваются партенокарпические плоды.
9.4.2. ГЕНЕТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПОЛА
У некоторых видов растений, главным образом двудомных,
обнаружены половые хромосомы типа XX и XY (элодея, дрема,
конопля, шпинат и др.). Генетической основой определения пола
у этих двудомных растений являются гетероморфные X- и У-хре-
мосомы, однако гены, ответственные за детерминацию пола, ло-
176
кализуются не только в половых хромосомах, но и в аутосомах,
т. е. во всех остальных хромосомах. Тем более это относится к
растениям, у которых нет специализированных половых хромо-
сом.
В качестве примера рассмотрим механизм генетического опре-
деления пола у конопли. Ядра вегетативных клеток мужских
особей имеют 18 аутосом+Х- и У-хромосомы, а ядра женских—
18 + 2Х. Мужские гаметы гетерохромосомны и имеют в ядрах
кроме 9 аутосом десятую, половую, X- или У-хромосому (9 + Х
пли 9 +У), причем Х-хромосома несет задатки женского пола, а
У — мужского. Женские растения, наоборот, гомохромосомны, и
ядро яйцеклетки имеет 9 аутосом + Х-хромосому. Таким обра-
зом, вегетативные клетки мужских и женских растений содержат
соответственно ХУ- и ХХ-хромосомы, причем числовое соотноше-
ние мужских и женских особей в популяции, как правило, со-
ставляет 1:1. Кроме того, у конопли существуют аллельные ге-
ны Хт, которые определяют пониженную феминизацию. У рас-
тений с Хт-хромосомами образуются женские соцветия, но сами
растения не обязательно бывают женскими. Растения, имеющие
XmXm-хромосомы, могут формировать женские соцветия, но по
остальным признакам больше напоминают мужские особи. По-
лагают, что гены, усиливающие маскулинизацию, локализованы
в аутосомах и уравновешиваются генами, усиливающими феми-
низацию в Х-хромосомах, при этом У-хромосомы индифферент-
ны по отношению к генам, регулирующим пол. Такое многооб-
разие генетического выражения пола приводит к широкой из-
менчивости признаков пола при воздействии различных модифи-
цирующих факторов.
9.4.3. ФЕНОТИПИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПОЛА
Проявление пола у раздельнополых цветков и двудомных рас-
тений зависит от таких факторов внешней среды, как интенсив-
ность и спектральный состав света, особенность фотопериода,
температура, минеральное питание, состав воздуха.
У КДР короткий день или уменьшение интенсивности света
в большинстве случаев ускоряет репродуктивное развитие, при
этом в большей степени проявляется женская сексуализация
(кукуруза, конопля и др.). Длинный день вызывает противопо-
ложный эффект, т. е. возрастание маскулинизации.
Характер дифференцировки пола зависит не только от фото-
периода, но и от спектрального состава света. Коротковолновый
свет (СС) в ряде случаев, например у огурца, способствовал
феминизации, а длинноволновый (КС) —тормозил этот процесс.
а некоторых растений (конопля, кукуруза, дыня и др.) хорошее
азотное питание в период заложения репродуктивных органов
приводит к более выраженной женской сексуализации. Калий,
наоборот, благоприятствует маскулинизации. Однако на эти эф-
12 Зака- № 339 177
фекты минерального питания сильное модифицирующее влияние
оказывает характер фотопериода.
Заложению женских цветков способствуют высокая влаж-
ность и относительно низкие температуры; высокие температуры
сказывают противоположный эффект.
9.4.4. ФИТОГОРМОНЫ И ОПРЕДЕЛЕНИЕ ПОЛА
Детерминация пола обусловлена определенным гормональ-
ным балансом: цитокинины, ауксин, этилен и АБК необходимы
для феминизации, а гиббереллины — для маскулинизации цвет-
ков и растений. Доказательством этого положения служат сле-
дующие результаты, полученные главным образом в опытах с
двудомными растениями конопли (КДР), шпината (ДДР), а
также с однодомными растениями, имеющими раздельнополые
цветки, такими, как огурец, кукуруза и др.
1. Обработка молодых растений цитокинином 6-бензиламино-
пурином (6-БАП), ауксином (1-НУК) или этиленом приводила
к большей выраженности женской сексуализации. Сдвиг в сто-
рону женской сексуализации вызывала обработка растений огур-
ца монооксидом углерода (СО), который действует на растения
как аналог этилена. Гиббереллины (ГА3, ГА4, ГА7, ГА]3), на-
оборот, задерживали формирование пестичных цветков (или
женских растений) и стимулировали развитие мужских цветков
(или мужских растений).
2. При удалении листьев как поставщиков гиббереллинов и
сохранении корней как источников цитокинина пол растений
сдвигается в женскую сторону. Наоборот, при удалении корней
и сохранении листьев наблюдается сдвиг в сторону маскулини-
зации (рис. 9.13).
3. В опытах с двудомными растениями конопли и шпината
установлено, что содержание цитокининов выше в органах жен-
ских растений, а концентрация гиббереллинов в листьях в фазу
дифференциации пола (начало бутонизации) выше у мужских
растений. Если учесть, что АБК снижает содержание гибберел-
линов в растительных тканях (см. рис. 6.5), то понятно, почему
обработка экзогенной абсцизовой кислотой способствует феми-
низации растений. С другой стороны, длиннодневное фотоперио-
дическое воздействие, которое усиливает маскулинизацию (см.
выше), действует таким образом, по-видимому, благодаря интен-
сивному синтезу гиббереллинов в листьях на длинном дне. Оче- 1
видно, факторы внешней среды (свет, температура, минеральное
питание, влажность) оказывают влияние на детерминацию пола
через изменение содержания фитогормонов в растительных тка-
нях (рис. 9.14).
Все сказанное позволяет считать, что инициация цветения,
обусловленная действием флоригена (см. 9.2 и 9.3), требует так-
же присутствия в клетках апекса в определенном соотношении
178 '
других фитогормонов, таких, как ауксин, цитокинины и гиббе-
реллины, которые детерминируют сексуализацию формирующих-
ся органов. Только в этом случае начинается развитие цветков.
Фитогормоны действуют на определенные гены, ответственные за
Рис. 9.13. Роль органов и синте-
зируемых в них фитогормонов в
проявлении пола у двудомных
растений (Чайлахян, Хрянин,
1982).
а — удалены корни, б — удалены
листья. / — ГА, 2 — Цк. Объяснение в
тексте.
Рис. 9.14. Роль факторов внешней сре-
ды и фигогормонов в проявлении пола
у растений (Чайлахян, Хрянин, 1982).
/ — Цк, 2 — ГА, N — азотное питание, К — ка*
лийное питание.
включение генетической программы генеративного развития и за
выраженность пола. По-видимому, между гипотезой флоригена
(см. 9.3.1) и гипотезой многофакторного контроля (см. 9.3.3)
инициации цветения нет противоречия: обе они необходимы для
объяснения механизмов, регулирующих формирование цветков.
9.5. ФЛОРАЛЬНЫИ МОРФОГЕНЕЗ
Инициация цветения (индукция и эвокация) создает условия
для развития цветка — органа полового размножения покрыто-
семенных растений.
9.5.1. СТРОЕНИЕ ЦВЕТКА
Сформированный цветок (рис. 9.15) имеет околоцветник — ча-
шечку (чашелистики) и венчик (лепестки), андроцей (совокуп-
ность тычинок) и гинецей (совокупность плодолистиков). Тычин-
ки представляют собой микроспорофиллы, а плодолистики —
мегаспорофиллы.
12*
179
1
Рис. 9.15. Строение цветка.
1 — рыльце пестика, 2 —столбик, 3 — завязь, 4 — антипо-
ды, 5 — семяпочка, 6 — два полярных ядра, 7 — заро-
дышевый мешок, 8 — яйцевой аппарат, 9—прорастаю-
щее на рыльце пыльцевое зерно, 10 — пыльцевая труб-
ка (на кончике видны два спермия), //-—пыльник,
/2 — тычиночная нить, 13 — венчик (лепестки), 14 — ча-
шечка (чашелистики), /5 — цветоложе, 16 — цветоножка.
В состав тычинки входят тычиночная нить и пыльник. Пыль-
ник тычинки обычно состоит из двух половин, соединенных меж-
ду собой связником (рис. 9.16). В каждой половине — по два
гнезда, или пыльцевых мешка’, которые гомологичны микроспо-
рангиям. Снаружи пыльник покрыт эпидермой. Под ней после-
довательно расположены три слоя, причем последний — тапетум
с многоядерными клетками — играет роль питательной ткани.
В центре каждого гнезда имеется спорогенная ткань, из клеток
которой образуются микроспоры (пыльцевые зерна).
Пестик состоит из завязи, столбика и рыльца. Завязь имеет
одно или несколько гнезд, образованных сросшимися плодолис-
180
Рис. 9.16. Строение пыльника (поперечный разрез).
а — пыльцевое гнездо молодого пыльника, б — зрелый пыльник. / — эпидерма, 2 —
эндотеций, 3 — средний слой, 4 — тапетум, 5—спорогенная ткань, 6 — пыльца, 7 —
связник.
Рис. 9.17. Строение пестика (пролеска).
а — общий вид, б — поперечный разрез завязи и в — семяпочки, / — рыльце, 2 —
столбик, 3 — завязь, 4 — стенка завязи, 5 — гнездо, 6 — плацента, 7 — семяпочка,
8 — семяножка (фуникулус), 9 — микропиле, 10 — интегументы, // — халаза, 12— ну-
целлус, 13 — зародышевый мешок, 14—яйцеклетка, 15 — синергиды, 16 — антиподы,
17 — центральная клетка.
181
тиками (рис. 9.17). На внутренней стороне плодолистиков распо-*
ложены семяпочки (семязачатки), которые развиваются на пла-
центе плодолистиков и связаны с ней семяножкой (фуникулу-
сом). Каждая семяпочка имеет снаружи один или два интегу-
мента (покрова), между которыми остается микропиле (пыльце-
вход). Основание семяпочки называется халазой. Под интегу-
ментами семяпочки расположен нуцеллус, который гомологичен
мегаспорангию. Одна из его клеток становится археспориальной.
Из нее (см. ниже) образуются четыре мегаспоры. Одна из мега-
спор дает начало восьмиядерному зародышевому мешку (рис.
9.17).
9.5.2. ЗАКЛАДКА И РОСТ ЧАСТЕЙ ЦВЕТКА
В ходе эвокации под действием флорального стимула в апи-
кальных меристемах главного и (или) боковых побегов экспрес-
сируются гены, ответственные за флоральный морфогенез. Как
уже говорилось, еще до этого события вегетативные апексы пре-
терпевают изменения, связанные с переходом растения от этапа
ювенильности к этапу зрелости и готовности к размножению.
Внешне это выражается в изменении формы апексов и увеличе-
нии их размера.
Закладка органов цветка связана с усилением митотической
активности в центральной зоне апекса (меристеме ожидания) и
сопровождается исчезновением различий между меристематиче-
скими зонами апекса — центральной и периферической. После-
довательное заложение всех частей цветка происходит очень
быстро. Можно сказать, что этот процесс носит «взрывной» ха-
рактер. Очевидно, каждая предыдущая фаза развития цветка
создает условия для прохождения последующей. В результате
закладки всех частей цветка апекс перестает существовать.
В соответствии со строением цветка его части появляются в
акропетальной последовательности. Они закладываются по спи-
рали или мутовками в зависимости от таксона. Между частями
(органами) цветка междоузлия почти не развиваются. Однако
цветонос (там где он есть) начинает интенсивно удлиняться, при-
чем у многих видов раньше, чем закладываются элементы
цветка.
Первыми обычно возникают примордии чашелистиков в виде
бугорков на апексе (рис. 9.18). Это связано с активацией пере-
клинальных делений в тунике. Одновременно формируется и
тяж прокамбия. Таким образом, механизм закладки чашелисти-
ков принципиально не отличается от того, что мы уже видели
при закладке примордиев листьев (см. 4.1.2). И сами чашелисти-
ки по анатомическому строению и зеленой окраске, по характеру
жилкования напоминают листья, что указывает на их происхож-
дение. Однако рост чашелистиков (раздельных или сросшихся)
182
весьма ограничен. В связи с этим они быстро теряют способ-
ность синтезировать ИУК на экспорт.
Следующими (рис. 9.18) появляются примордии лепестков
(хотя у некоторых растений порядок может быть иной). Лепест-
ки по характеру закладки и дальнейшего роста также имеют
много общего с листьями.
Периклинальные деления
в субповерхностных слоях
апикальной меристемы
затем дополняются анти-
клинальными во всех по-
верхностных слоях. Пер-
воначальная апикальная
меристематическая актив-
ность затем сменяется ин-
теркалярным ростом, по-
явлением дорсовентраль-
ности и активности мар-
гинальной меристемы. Ес-
ли при этом происходит
слияние лопастей чаше-
листиков и лепестков, то
говорят о развитии цве-
точной трубки.
Вслед за частями вен-
чика (чашелистики, ле-
пестки) закладываются
примордии тычинок. Опы-
ты с культурой флораль-
ных апексов in vitro и
Рис. 9.18. Закладка органов цветка (мин-
даль обыкновенный) (Васильев и др., 1988).
1—5 — начальные фазы развития цветка. ПЧ —
примордий чашелистика, ПП — проводящий пу-
чок, ПЛ — примордий лепестка, ЦТ — цветочная
трубка, А — апекс, ПЪ — примордий тычинки
1-го круга, ПТ? — примордий тычинки 2-го круга.
данные, приведенные выше (см. 9.4), показывают, что диффе-
ренцировке тычинок способствует гиббереллин. Примордии ты-
чинок появляются как бугорки, которые кратковременно растут
апикально. Затем наблюдается интенсивный интеркалярный
рост. У большинства видов маргинальная меристема функциони-
рует только в верхней части развивающейся тычинки, в резуль-
тате чего формируется пыльник (см. рис. 9.16). Образующийся
пыльник является источником ИУК, которая контролирует удли-
нение тычиночной нити. Скорость роста нити может быть очень
большой, например, у риса она составляет 25 мм/мин.
Каждый формирующийся орган цветка оказывает корреля-
тивное влияние на рост других частей. Так, удаление молодых
тычинок из цветков будры плющевидной вызывает заметное сни-
жение роста венчика. Его рост может быть восстановлен обра-
боткой гиббереллином, но не ауксином.
В дистальной части апекса (см. рис. 9.18) формируются при-
мордии плодолистиков; закладываясь в виде округлых бугорков,
они становятся затем подковообразными, а еще позднее, в резуль-
183
тате краевого роста (маргинальная меристема)—листовидными.:
Они растут вверх, одновременно складываясь. Сливаясь друг с
другом, плодолистики образуют завязь, выше которой формиру-
ются столбик и рыльце. Дифференцировке плодолистиков спо-
собствуют ИУК и цитокинины (см. 9.4). На адаксиальной (внут-
ренней) стороне плодолистиков формируются бугорки, которые
развиваются в семяпочки, или семязачатки (см. рис. 9.16). В
развивающихся семяпочках образуется ИУК, которая, переме-
щаясь полярно, регулирует, в частности, рост цветоноса. Так, уда-
ление семяпочек у рябчика шахматного (см. лилейные) тормозит
рост цветоноса и оказывает влияние на величину изгиба его
дистальной части с формирующимся цветком.
9.5.3. СПОРОГЕНЕЗ И ГАМЕТОГЕНЕЗ
Одновременно с ростом частей цветка в нем осуществляются
процессы спорогенеза и гаметогенеза.
Микроспорогенез. При образовании пыльников у тычинок в
первом слое клеток под протодермой, который называется архе-
спориальным, происходят периклинальные деления. Производ-
ными этих клеток становятся первичные спорогенные клетки
(микроспороциты) центральной части пыльцевого мешка, тапе-
тум, средний слой и эндотеций (см. рис. 9.16). В каждом микро-
спороците последовательно происходят два мейотических деле-
ния ядра, в результате чего формируются четыре гаплоидные
микроспоры (рис. 9.19, а—Ь).
Рис. 9.19. Схема микроспорогенеза.
а — мейоз I, б — мейоз II, в — образование каллозной стенки между мик-
роспорами, г — тетрады микроспор с каллозной оболочкой в начале обра-
зования оболочек пыльцы. 1 — плазмалемма, 2 — каллоза, 3 — фрагмопласт.
Вначале микроспороциты плотно связаны между собой и име-
ют плазмодесмы. Перед мейозом на внешней стороне плазма-
леммы начинает откладываться каллоза (р-1,3-глюкан). Исход-
ные клеточные стенки при этом разрушаются, а микроспороци-
ты округляются (рис. 9.19, а). Вместо плазмодесм микроспоро-
циты теперь соединяются между собой широкими цитоплазмати-
ческими мостиками (диаметром более 1,5 мкм). В результате
этого вся масса микроспороцитов в микроспорангии объединя-
ется в ценоцит (многоядерный протопласт), что обеспечивает
184
синхронизацию мейоза I в микроспорангип. Перед мейозом II
плазматические контакты между микроспороцитами у покрыто-
семенных разрушаются, и тетрады микроспор отделяются друг
от друга. Микроспоры в каждой тетраде изолируются друг от
друга каллозной стенкой, которая соединяется с каллозой, окру-
жающей всю тетраду (рис. 9.19, г).
Тапетум, окружающий спорогенную ткань, снабжает форми-
рующие микроспоры питательными веществами и после мейоза
спорогенных клеток разрушается. При культивировании изоли-
рованных пыльников успешное завершение мейоза можно по-
лучить, если микроспороциты во время изоляции пыльника уже
вступили в мейоз. В этом случае благотворный эффект на обра-
зование тетрад и последующее развитие микроспор оказывает
присутствие в культуральной среде сахаров, минеральных солей.»
нуклеотидов или РНК, цитокинина и гиббереллина.
Рис. 9.20. Микроспора (а), ее прорастание, т. е.
образование мужского гаметофита (пыльны) (б) и
формирование пыльцевой трубки (в).
/ — экзина, 2 — интина, 3 — генеративная клетка, 4 — веге-
тативная клетка, 5 — спермин.
185
У микроспор формируется двухслойная оболочка: наружный^
-слой экзина, внутренний — интина (рис. 9.20, а). Развитие этой'
оболочки, которая становится оболочкой пыльцы, начинается то-
гда, когда тетрады микроспор еще заключены в каллозу. На-
ружный утолщенный слой оболочки — экзина состоит из вы-
полняющего структурную роль вещества спорополленина — по-
лимера, окончательный состав которого не уточнен, но содержа-
щего терпеноидные компоненты, прежде всего каротиноиды и их
эфиры. Из спорополленина образована сложная и разнообраз-
ная «арочная» структура экзины, которой он придает высокую
устойчивость к неблагоприятным воздействим среды. В полостях
экзины локализованы белки, производные тапетума пыльника,
которые откладываются в экзине по мере созревания пыльце-
вого зерна. Эти белки участвуют в контроле несовместимости
чужеродной пыльцы и рыльца. Пыльца на своей поверхности
имеет апертуры (поры)—небольшие участки (один или три) с
тонким слоем экзины, через одну из которых выходит пыльце-
вая трубка при прорастании пыльцевого зерна. <
Интина содержит целлюлозу, пектиновые соединения и^
белки, синтезирующиеся в цитоплазме самой пыльцы. Часть из^
них функционирует в процессах «узнавания» пыльцы и тканей!
рыльца, другие являются гидролитическими ферментами (кислаяi
фосфатаза, РНКаза, протеазы и др.). Ферменты активируются'
при взаимодействии пыльцевого зерна с поверхностью рыльца?
Наружная поверхность пыльцы может содержать липиды и;
быть окрашена в желтый, коричневый, синий или черный тона.
Б цитоплазме пыльцевого зерна, в полисахаридном матриксе’
кнтины и сводах экзины имеются запасные вещества (крахмал,
липиды, белки), а в цитоплазме — физиологически активные со-
единения (витамины, регуляторы роста, в том числе ИУК), ко-
торые используются при росте пыльцевой трубки.
Микрогаметогенез. Ядро микроспоры делится митотически,
в результате чего в вегетативной клетке пыльцевого зерна со
своим вегетативным ядром формируется генеративная клетка с
генеративным ядром. Таким образом, возникает двухклеточный
тиужской гаметофит (рис. 9.20, б). Это происходит перед высы-
панием пыльцы из пыльника. У генеративной клетки может быть
клеточная стенка или она отсутствует. У многих растений неза-
долго до высыпания пыльцы генеративная клетка митотически
делится на два спермия (мужские гаметы). В этом случае зре-
лая пыльца представляет собой трехклеточный гаметофит. У
других растений образование спермиев происходит при росте
пыльцевой трубки (рис. 9.20, в). Клетка спермия отделена от
цитоплазмы вегетативной клетки собственной плазмалеммой.
‘Она содержит ядро, АГ, ЭР, митохондрии, полисомы и у некото-
рых видов — пластиды.
Мегаспорогенез. Образование мегаспор происходит в семя-
почках, развивающихся в завязи. Семяпочка появляется на пла-
•186
r-nr HWJ'IW Ч1Я >" ч J
центе в виде выроста, в дистальной части которого формируется
спорогенная ткань — нуцеллус (мегаспорангий). Внутренний и
наружный интегументы последовательно закладываются в ре-
зультате периклинальных делений клеток эпидермы. Первая спо-
рогенная (археспориальная) клетка почти сразу выделяется под
эпидермой нуцеллярного бугорка (рис. 9.21). Интегументы рас-
Рис. 9.21. Схема формирования семяпочки.
1 — образование нуцеллуса, 2 — обособление археспориальной
клетки, 3 — образование мегаспор (мейоз), 4 — отмирание трех
мегаспор, 5—8 — три последовательных деления мегаспоры (митоз)
и образование женского гаметофита — зародышевого мешка.
тут, постепенно окружая нуцеллус, и заканчивают развитие, ко-
гда зародышевый мешок готов к оплодотворению.
У многих растений археспориальная клетка функционирует
непосредственно как мегаспороцит. В результате двух мейотиче-
ских делений этой клетки образуется линейная тетрада гаплоид-
ных мегаспор (рис. 9.21). Ориентация этих делений указыва-
ет на наличие поляризации у мегаспороцита. Мегаспора в зоне
халазы увеличивается в размерах, а три мегаспоры со стороны
микропиле лизируют и, по-видимому, используются для питания
растущей халазальной мегаспоры. В клеточной стенке этой мега-
споры на короткое время появляется каллоза, которая отклады-
вается также на стенках, разделяющих дегенерирующие мега-
споры. На этом заканчивается процесс мегаспорогенеза.
Мегагаметогенез. Растущая мегаспора дает начало зароды-
шевому мешку (женскому гаметофиту). В результате трех по-
следовательных митотических делений в зародышевом мешке
появляются 8 ядер, причем после первого деления два дочерних
ядра перемещаются к противоположным полюсам поляризован-
ной) гаметофита и там делятся еще два раза (рис. 9.21). Три
187
ядра у каждого полюса обособляются в клетки. На микропич
лярном полюсе одна из клеток становится яйцеклеткой (жен*
ской гаплоидной гаметой), а две другие —спнергидами. Три яд<
ра на халазальном полюсе образуют клетки, называемые анти*
подами (см. рис. 2.1). Два оставшихся ядра мигрируют к цент*
ру и сливаются, превращаясь во вторичное диплоидное ядро,
центральной клетки, которая дает начало эндосперму (рис. 9.21
и см. рис. 2.1). В этом состоянии зародышевый мешок готов для
восприятия мужских гамет.
9.6. ОПЫЛЕНИЕ И ОПЛОДОТВОРЕНИЕ
События, связанные с оплодотворением, можно разделить на
четыре фазы: 1) опыление, 2) прорастание пыльцы на рыльце,
3) рост пыльцевой трубки в тканях столбика и 4) собственна
оплодотворение, т. е. образование зиготы.
9.6.1. ФУНКЦИИ РЫЛЬЦА
С помощью насекомых, ветра или воды пыльца попадает на-
рыльце пестика цветка. Железистая ткань рыльца состоит и»
эпидермальных клеток, секреты которых создают условия длят
прорастания пыльцы. Клетки рыльца могут быть покрыты тон-
ким адгезивным слоем («сухое рыльце») или обильным жидким1
эксудатом («влажное рыльце»). Для большинства однодольных
характерен сухой тип рыльца с эпидермисом в виде одно*
или многоклеточных сосочков. На поверхности сухих рылец име-
ется слой, состоящий из белков и липидов, — пелликула. Пелли-
кулла обладает АТФазной и эстеразной активностью и способная
связывать лектины, взаимодействующие с маннаном или галак-
тозой.
Выделения влажных рылец делятся на две группы: 1) липо-
фильные эксудаты («жидкая кутикула») с малым количеством*
воды или совсем без нее и 2) гидрофильные слизистые углевод-
но-белковые секреты. В выделениях рыльца (и столбика) обна-
ружены изозимы пероксидазы, различные эстеразы (например;
кислая фосфатаза), амилаза. Иммунологически выявлены гли-
копротеины, контролирующие реакцию самонесовместимости на*
уровне рыльца.
Выделения рыльца выполняют ряд функций при взаимодей-
ствии пыльца — рыльце: 1) контроль адгезии пыльцы, ее оводне-
нения и прорастания. Осмотичность эксудатов рыльца варьирует
у разных родов и может быть важна для предотвращения про-
растания чужеродной пыльцы. В реакции самонесовместимости
участвуют гликопротеины рыльца; 2) защиту от инфекции обес-
печивают фенольные компоненты секретов (антоцианы, флаво*
ноиды, коричные кислоты), а от обезвоживания — липофильны*
188
секреты; 3) привлечение насекомых-опылителей и их питание, так
«как состав и концентрация сахаров в эксудатах рылец многих
ендов растений близки к нектару, секретируемому другими ча-
стями цветка; 4) поддержку роста пыльцевой трубки в тканях
рыльца.
У некоторых растений рыльце обладает чувствительностью к
хемо-тактильным стимулам, в ответ на которые происходит быст-
рое (в течение секунд) перемещение частей рыльца («закры-
вание», складывание) и через короткое время обратное их рас-
крывание. Чисто механические стимулы не индуцируют длитель-
ного закрывания, но спиртовые экстракты из живой пыльцы вы-
зывают складывание лопастей рыльца.
9.6.2. ВЗАИМОДЕЙСТВИЕ ПЫЛЬЦА — РЫЛЬЦЕ
Взаимодействие пыльцы с пестиком включает в себя ряд со-
бытий, ведущих к восприятию совместимой пыльцы и отторже-
нию несовместимой собственной или чужеродной пыльцы. После-
довательность этих событий такова: контакт пыльцы и рыльца,
адгезия и прикрепление пыльцы на поверхности рыльца, погло-
щение воды пыльцевым зерном, его прорастание, рост пыльцевой
трубки через рыльце, ее рост через столбик и завязь и, наконец,
оплодотворение.
Контакт пыльцы и рыльца определяется типом рыльца. Он
облегчен у влажных рылец и более труден у сухих, но в любом
случае поверхность пыльце-
вого зерна шероховатая, что
обеспечивает хороший кон-
такт.
Адгезия — следующий
этап взаимодействия — за-
ключается в образовании
химических связей поверхно-
сти пыльцевого зерна с по-
верхностью рыльца. Адге-
зия, свойственная совмести-
мым пыльце и рыльцу, мо-
жет быть обусловлена ара-
биногалактанами и глико-
протеинами поверхности
пыльцевого зерна и рыльца
(иеспецифическая адгезия),
а также участием специфиче-
ских лектинов (специфиче-
ская адгезия). Несовмести-
мая пыльца обладает сла-
бой, неспецифической адге-
зией, а совместимая — силь-
Рис. 9.22. Набухание пыльцы раз-
личных видов растений на рыльце
пестика во времени (Heslop-Harrison,
1979).
/ — крокус, 2 — рожь, З—Siletie. По оси
абсцисс — время (мин), по оси ординат —
объем пыльцы (относительные единицы).
Пыльцевые трубки появляются в каждом
случае в точке максимального объема
пыльцевого зерна.
189
ной и специфической. При попадании пыльцы на рыль-
це пестика она начинает поглощать воду и набухать.
Для зрелой пыльцы характерно низкое содержание воды: 10—
35% сухой массы. Закрепившаяся на рыльце пыльца всегда ме-
нее оводнена, чем рыльце, и вода поступает в пыльцевое зерно.
Продолжительность поглощения воды пыльцой неодинакова у
разных видов, как и время образования пыльцевой трубки
(рис. 9.22).
Набухшая пыльца выделяет на поверхность рыльца белки,
гликопротеины, углеводы, липиды, пигменты. Диффундирующие
белки и гликопротеины — основные информационные молекулы
при взаимодействии пыльцы с рыльцем пестика. Все они явля-
ются компонентами стенки пыльцевого зерна. Среди диффунди-
рующих белков и гликопротеинов обнаружены лектины, аллерге-
ны, ферменты: гидролазы (кислая и щелочная фосфатазы, ку-
тиназа), лигазы, лиазы, трансферазы, дегидрогеназы, оксидазы.
Аллергены могут составлять до 10% выделяемых белков пыль-
цы. Роль многих ферментов и аллергенов пока не ясна. Одновре-
менно при контакте поры пыльцы с тканью рыльца в пыльце-
вом зерне в районе поры активируются гидролазы интины, спо-
собствующие началу образования -пыльцевой трубки.
9.6.3. РОСТ ПЫЛЬЦЕВОЙ ТРУБКИ
Структура пыльцевой трубки. Клеточная стенка начавшей
расти пыльцевой трубки состоит из двух слоев. Наружный слой
является продолжением интины и содержит пектиновые вещест-
ва с небольшим количеством целлюлозных компонентов. Внут-
ренний, более гомогенный слой включает в себя целлюлозопо-
добные микрофибриллы с р-1,4- и р-1,3-связями, белок и калло-
зу. Растущий кончик трубки лишен внутреннего слоя .стенки. На
ранних стадиях прорастания пыльцы кончиком трубки секрети-
руется слизь, содержащая пектиновые вещества, которые в за-
пасной форме находились в пыльцевом зерне в везикулах, со-
держащих полисахариды («Р-частицы»), число которых в пыль-
цевом зерне очень велико (у ржи — до 106 в клетке). Когда
пыльцевая трубка достигает определенной длины (например, у
томата — 150 мкм), вегетативное ядро и генеративная клетка
(или два спермия у трехклеточной пыльцы) перемещаются в
трубку (см. рис. 9.20).
Электронная микроскопия позволила выявить в растущей
верхушечным ростом пыльцевой трубке четыре функционально
различные зоны: 1) апикальную, в которой осуществляется рост и
находятся преимущественно секреторные везикулы — производ-
ные АГ, мембрана которых при экзоцитозе способствует росту
плазмалеммы, а секретируемые полисахариды — росту клеточ-
ной стенки пыльцевой трубки; 2) субапикальную, где локализо-
ваны многочисленные АГ, митохондрии, ЭР и полисомы; 3) зону
196
ядра — с вегетативным ядром пыльцевой трубки и удлиненной
генеративной клеткой (до ее деления) или двумя спермиями;.
4) зону вакуолизации.
В пыльцевой трубке наблюдаются различия в организации
элементов цитоскелета в кончике и в цилиндрической части
клетки. В последней в кортикальном слое цитоплазмы микро-
трубочки и связанные с ними пучки актиновых микрофиламен-
тов ориентированы параллельно оси клетки. В апикальном рай-
оне отмечаются лишь рассеянные короткие микротрубочки и
единичные короткие актиновые микрофиламенты или их группы.
Механизм роста. Для роста пыльцевой трубки требуются
сахара, используемые в синтезе полисахаридов клеточной стен-
ки. Моносахара поступают из тканей рыльца и столбика при
движении через них пыльцевой трубки. Вначале прорастающее
пыльцевое зерно поставляет УДФглюкозу, УДФксилозу, УДФ-
арабинозу и УДФгалактуроновую кислоту, необходимые для
синтеза полимеров клеточной стенки, из собственных резервов,
а позже используются компоненты рыльца и эксудата канала в
столбике пестика.
В опытах с ингибиторами синтеза РНК и белка показано,
что подавление транскрипции РНК и синтеза белка может не
мешать прорастанию пыльцевой трубки, но оба эти процесса не-
обходимы для поддержания ее длительного роста.
Для роста пыльцевой трубки требуются ионы Са2+
(1*10-4М). У некоторых видов он является хемотропным аген-
том. Однако как низкие (Г10-5 М и ниже), так и высокие кон-
центрации Са2+(1-10-3 — 5-Ю-2 М) останавливают рост труб-
ки. Внешний кальций, как и ионы К+, наиболее активно погло-
щается растущим кончиком. В цитоплазме пыльцевой трубки по-
казано существование градиента концентрации Са2+ с максиму-
мом в кончике и градуальным снижением в цилиндрической
части клетки. В пыльцевой трубке лилии цитоплазматический
градиент Са2+ составлял от 1-Ю-7 М (в кончике) до 2-Ю-8 М
в более базальных частях трубки. Намного больше Са2+ связа-
но в клеточных стенках (в форме пектатов) и в органоидах —
митохондриях и цистернах ЭР. Этот фонд Са2+ может использо-
ваться для поддержания в цитоплазме кончика концентрации
кальция, оптимальной для роста. Предполагается, что Са2+ в
этой концентрации: 1) поддерживает структуру элементов цито-
скелета в кончике, благоприятную для транспорта везикул к
плазмалемме; 2) обеспечивает связывание везикул с плазмалем-
мой, способствуя процессу экзоцитоза.
Скорость роста пыльцевой трубки значительно варьирует у
разных видов. Так, у лилии при скорости роста пыльцевой труб-
ки 12 мкм/мин образуется около 2000 везикул/мин; у традескан-
ции при невысокой скорости роста (6 мкм/мин) в кончике воз-
никают 3000—5000 везикул/мин или в расчете на одну диктиосо-
му АГ 1—2 везикулы в минуту; намного выше скорость роста
191
у пыльцевых трубок ржи (72—120 мкм7мин) и кукурузы (240
мкм/мин).
В условиях in vitro у большинства видов пыльца хорошо про-
растает в присутствии сахарозы, минеральных веществ (в том
числе Са2+); в ряде случаев требуется добавление аминокислот
и гиббереллина. ИУК в низких концентрациях, как правило,
ускоряет рост пыльцевых трубок, а в высоких — подавляет.
Прорастание пыльцы на рыльце. Если пыльца и рыльце
совместимы, то гидролитические ферменты, выделяемые набух-
шей пыльцой, в том числе кутиназа, разрыхляют стенки клеток
рыльца, что способствует росту пыльцевой трубки в его ткани.
По-видимому, начальные этапы проникновения пыльцевой труб-
ки в рыльце определяются ее положительной гидротропической
реакцией. Однако в условиях культуры тканей, если в среду
с пыльцой помещают рыльце, то пыльцевые трубки растут в на-
правлении к рыльцу. Эффективное расстояние между ними со-
ставляло 1500 мкм, т. е. рыльце выделяет хемотропные аттрак-
танты, влияющие на рост пыльцевых трубок.
Опыление приводит также к изменению секреторной активно-
сти рыльца. Это могут быть выделение эксудатов с большим ко-
личеством воды (лимон) или усиление голокриновой секреции,
в результате чего содержимое клеток рыльца подвергается авто-
лизу, как только пыльцевая трубка проникает в рыльце (ака-
ция). У петунии гибридной через 6—14 ч после опыления регис-
трируется усиление дыхания рылец и перераспределение жир-
ных кислот в фонде липидов. Кроме того, опыление сопровожда- •
ется изменением биопотенциалов клеток рыльца (см. 9.6.5).
Рост пыльцевой трубки в столбике. Через рыльце пыльцевая:
трубка входит в столбик. Различают три типа столбиков: 1) от-,
крытый, в котором пыльцевая трубка растет до завязи через за-
полненный слизью канал, характерен для многих однодольных
растений; 2) закрытый, в котором пыльцевая трубка растет че-
рез проводниковую ткань столбика, у многих двудольных;
3) столбик с промежуточными свойствами, сем. кактусовые.
Канал в открытом столбике образован секреторными клет-
ками, выделяющими слизистый эксудат в полость канала.
В закрытом столбике клетки, образующие вертикальные ря-
ды проводниковой ткани, начиная с ворсинок рыльца, соедине-
ны друг с другом плазмодесмами в поперечных стенках, а сосед-
ние ряды отделены друг от друга межклеточной слизью (меж-
клеточным матриксом), по которой и растет пыльцевая трубка.
Этот межклеточный матрикс секретируется клетками, если стол-
бик восприимчив к пыльцевой трубке. Прослежена непрерыв-
ность слизистых выделений рыльца и столбика до зародышевой
полости. Перемещению трубки в столбике способствуют также
секретируемые ею гидролитические ферменты, разрыхляющие
пектиновые вещества срединных пластинок между стенками кле-.
ток проводниковой ткани.
192
Столбик поддерживает рост трубок, поставляя субстраты для
их гетеротрофного питания, и регулирует скорость роста разных
пыльцевых трубок. Кроме того, канал столбика или межклеточ-
ный матрикс проводниковой ткани хемотропически направляют
рост пыльцевой трубки. По мере этого роста в столбике проис-
ходит дальнейший отбор пыльцы, начавшийся на рыльце.
С помощью меченых [14С] глюкозы, [14С] белкового гидро-
лизата и 32Р в цветках петунии гибридной изучали распределе-
ние (транспорт) метки до и после опыления. До опыления мет-
ка транспортировалась в основном к пыльникам, завязи и стол-
бику. Спустя 10 ч после опыления происходило перераспределе-
ние веществ — из пыльников, чашечки и венчика субстраты пе-
ремещались к столбику. Через 18 ч после перекрестного опыле-
ния основным местом притяжения веществ из других частей
цветка становилась завязь. Этого не происходило у самоопылив-
шихся цветков. Неопыленный цветок оставался в исходном со-
стоянии.
9.6.4. МЕХАНИЗМЫ НЕСОВМЕСТИМОСТИ
На рыльце пестика может попадать одновременно много
пыльцевых зерен, но прорастают лишь совместимые. Реакции
узнавания происходят первоначально при взаимодействии рыль-
ца и пыльцевого зерна. На рис. 9.23 представлена общая после-
довательность событий, участвующих в реакциях узнавания
пыльцы и «сухого» рыльца. При попадании пыльцы на рыльце
в первые минуты происходит взаимодействие между фактора-
ми узнавания, находящимися в экзине пыльцевого зерна (глико-
протеины, производные тапетума диплоидного пыльника), и фак-
торами узнавания, локализованными в пелликуле рыльца. Воз-
можно также участие иных белков-рецепторов рыльца. Резуль-
татами такого взаимодействия могут быть либо восприятие
пыльцы, ее прорастание и рост пыльцевой трубки (совмести-
мая пыльца), либо отторжение несовместимой пыльцы, которое
выражается в остановке прорастания пыльцевого зерна или пре-
кращении роста пыльцевой трубки.
Наиболее распространенным способом остановки прораста-
ния пыльцы или роста пыльцевой трубки в случае несовмести-
мости пыльцы и рыльца является индукция отложения каллозы
вокруг пыльцевого зерна или пыльцевой трубки на поверхности
рыльца, в столбике или даже в семяпочке.
Интересна гипотеза о возможном функциональном сходстве
взаимодействия несовместимых пыльцы и рыльца с взаимодей-
ствием в системе растение-хозяин — патоген. Как и в случае
патогенеза, в реакциях узнавания в системе пыльца — рыльце
важна адгезия партнеров, в которой участвуют углеводные ком-
поненты клеточных стенок (см. 9.6.2) и каллоза, при несовмести-
мости способная менять метаболизм фенолов в рыльце, выпол-
13 Зака? № 399
193
Синтез факторов
узнавания в тапетуме
пыльника
I
Перенос этих факторов
в экзину пыльцы
в течение ее созревания
I
Взаимодействие факторов
узнавания экзины и
пелликулы
I
Взаимная активация
пыльцы и сосочков рыльца
Синтез факторов
узнавания в сосочках
рыльца
I
Перенос этих факторов
в пелликулу
на поверхности рыльца
Восприятие: Отторжение:
появление пыльцевой ингибирование роста
трубки, проникновение ее пыльцевой трубки,
через кутикулу, рост отложение каллозы
трубки в трубке и сосочках
Рис. 9.23. Последовательность взаимодействия пыльца — рыльце (по: Heslop^
Harrison е. а., 1975).
няя роль элиситера, индуцирующего синтез веществ типа фито-
алексинов (например, у крестоцветных). В опытах in vitro пока-
зано, что такие фитоалексины, как ришитин, способны подав-
лять прорастание пыльцы паслена.
Самонесовместимость. Реакцию активного отторжения пыль-
цы при самоопылении у орхидных впервые исследовал Ч. Дар-
вин. Способность самоопыляющихся цветков отторгать свою соб-
ственную пыльцу и воспринимать пыльцу других растений по-
пуляции называется самонесовместимостью. Это свойство обус-
ловлено генами специфической самонесовместимости (S-генами),
продукты которых (гликопротеины) участвуют в реакциях узна-
вания. Показано, что существуют две основные системы само-
несовместимости: гаметофитная и спорофитная (рис. 9.24). У
спорофитных систем поведение пыльцы детерминируется гено-
типом растения, на котором эта пыльца возникла, так как S-бел-
ки (продукты S-гена), синтезированные в тапетуме материнского
пыльника (спорофит), содержатся в экзине пыльцевого зерна.
Эта несовместимость реализуется при взаимодействии с продук-
тами S-гена рыльца, где и происходит остановка роста пыльцы.
В гаметофитных системах (микроспора, пыльцевая трубка) по-
194
Спорофитная
система
Тапетум
I
S-белки, перенесен-
ные в экзину
микроспоры
i
Компоненты пыльцы | < 1 Компоненты пестика |
1 1 Гаметофитная Гаметофитная 1 1 Рыльцевая Столбиковая
рыльцевая столбиковая система несовместимость несовместимость
система II II II
Микроспоры Пыльцевая трубка (ПТ) 1 1
S-белки, распреде- S-белки, образованные S-белки в пелли- S-белки в провод-
ленные в интине или активированные куле рыльца никовой ткани
пыльцы в стенке ПТ 1 столбика
| | : i i
lit
Реакция узнавания
____________ 1 __________________________________
Поддержка или организация карьера для коммуникаций
Отношения пыльца — рыльце
___________1_______________
| Отношения ПТ — столбик |
Предотвращение набухания и (или)
ингибирование прорастания
Дезорганизация активности гена
и генной регуляции
Образование ошибочных ферментов
Отсутствие важных ферментов
Ф
Прекращение синтеза белка
I
Ингибирование роста ПТ
Реакция отторжения
Рис, 9,24, Последовательность событий в самонесовместимых системах ,(П>. de Nettancourt, 1977).
ведение пыльцы контролируется собственным ее генотипом, так
как S-белки, участвующие в реакциях узнавания, синтезируются
в самой микроспоре и локализованы в интине пыльцевого зерна
(или в клеточной стенке пыльцевой трубки). Рост несовмести-
мой пыльцевой трубки в большинстве случаев останавливается
в проводниковой ткани столбика. Контроль часто осуществляет-
ся через локус единственного S-гена с множественными алле-
лями, и если пыльцевое зерно содержит S-аллель, присутствую-
щий в рыльце или в столбике, то рост пыльцевой трубки подав-
ляется. Белки — продукты S-генов — идентифицированы в эк-
страктах столбика и рыльца у нескольких видов растений; мень-
ше известно о продуктах S-гена пыльцы: у пыльцы Oenothera
такой белок составляет 20% общего белка пыльцы и легко диф-
фундирует в среду.
На уровне взаимодействия пыльцы и рыльца (рис. 9. 24) са-
монесовместимость обычно выражается в предотвращении на-
бухания пыльцы, например, из-за разницы в тургорном давлении
в пыльце и рыльце, или в ингибировании прорастания образо-
ванием каллозы. Более многообразны реакции, связанные с
остановкой роста пыльцевой трубки несовместимой пыльцы в
ткани столбика: они включают в себя нарушение генной регу-
ляции, ошибки в синтезе белков, прекращение их синтеза. Всё
вместе приводит к отторжению самонесовместимой пыльцы.
Интересно отметить, что при самонесовместимости место
ингибирования собственной пыльцы (например, у сливы) в стол-
бике генетически специфично, но степень проникновения пыль-
цевой трубки в столбик различается у разных сортов и очень
зависит от температуры как до развития цветка, так и в момент
опыления (у петунии гибридной, томата, капусты). Реакция не-
совместимости блокируется как низкой, так и высокой темпера-
турой. У капусты изменение температуры и высокая концентра-
ция СО2 могут вмешиваться в механизм узнавания и устранять
ингибирование роста пыльцевой трубки при самонесовместимо-
сти. Экстракты из пестика резко меняют рост пыльцевой трубки
в самонесовместимых системах.
Помимо физиолого-биохимических механизмов несовмести-
мости существуют и другие приспособления, препятствующие
самоопылению. Наиболее распространенным из них является
гетероморфная несовместимость, обусловленная морфологией
цветков. Одним из примеров такой несовместимости является
гетеростилия, т. е. наличие у растений одного и того же вида
цветков с различной длиной столбиков у пестиков и нитей ты-
чинок.
9.6.5. ОПЕРЕЖАЮЩАЯ СИГНАЛИЗАЦИЯ В ПЕСТИКЕ
У петунии гибридной при совместимом опылении пыльцевая
трубка достигает завязи примерно за 30 ч, у кукурузы для этого
требуется 20—35 ч, у сливы — 2—3 дня. Тем не менее у петунии
196
1
через 9 ч после начала роста трубки, когда она прошла уже
около трети длины столбика, в семяпочке значительно увеличи-
вается синтез белка, чего нет у неопыленных семяпочек. Через
10 ч усиливается транспорт аминокислот и углеводов от различ-
ных органов цветка к столбику (см. 9.6.3), а спустя 18 ч основ-
ной поток этих веществ направляется к завязи. Такого рода
данные свидетельствуют о существовании сигналов, поступаю-
щих в завязь, которые опережают рост пыльцевой трубки и ин-
формируют о ходе процессов, связанных с ее ростом в рыльце
и столбике. Передача этой информации может осуществляться
с участием сигналов электрической и химической природы.
Генерация местных и распространяющихся электриче-
ских сигналов сопровождает процессы взаимоузнавания
пыльцы и рыльца, прорастания пыльцы и роста пыльцевых тру-
бок. Эти сигналы в виде импульсов ПД индуцируются в тканях
рыльца, а затем столбика по мере роста пыльцевых тубок.
В опытах с пестичными нитями (длинные рыльца и столби-
ки) кукурузы было установлено, что после нанесения совмести-
мой пыльцы в клетках рыльца через 2—4 мин генерируются
местные колебания МП (рис. 9.25,/). Дальнейшее прорастание
Рис. 9.25. Местная биоэлектрическая реакция пестичной
нити цветков кукурузы, предшествующая прорастанию
пыльцы на рыльце (/), и генерация одиночных ПД в ней
в период роста пыльцевых трубок (2) (Духовный, 1980).
Биопотенциалы регистрировались внутриклеточно.
пыльцы и рост пыльцевых трубок сопровождаются генерацией
одиночных ПД с амплитудой 15—38 мВ, которые почти без за-
тухания распространяются к завязи со скоростью 1,1—2 см/с
(рис. 9.25, 2). В клетках завязи эти ПД индуцируют появление
/ 197
нескольких серий ПД, причем в каждой серии наблюдаются свои
число, частота, длительность и амплитуда импульсов (рис. 9.26,
1, 2). Чужеродная пыльца, кроме редких одиночных ПД, не вы-
зывает длительной биоэлектрической активности в пестичной
нити и ритмической генерации ПД в завязи. Показано, что опе-
режающая рост пыльцевой трубки электрическая сигнализация
Рис. 9.26. Ритмическая генерация потенциала действия
(ПД) в завязи цветков кукурузы в ответ на ПД из пе-
стичной нити в период роста пыльцевых трубок (Духов-
ный, 1980).
1 — серии ПД в начале роста пыльцевых трубок и 2 — в более
поздний период.
физиологически значима. Так, в аналогичных опытах с цветками
инкарвилеи потенциалы действия, поступающие из рыльца, вы-
зывали в завязи усиление дыхания. Передача электрических сиг-
налов по столбику обеспечивается системой плазмодесм, прони-
зывающих поперечные клеточные стенки клеточных рядов про-
водниковой ткани от рыльца до семяпочки.
Химическая сигнализация осуществляется с уча-
стием фитогормонов. Активированная пыльца и пыльцевые труб-
ки выделяют ауксин и, возможно, фактор, ускоряющий его син-
тез в тканях столбика. Полярный транспорт ИУК (5—15 мм/ч)
происходит быстрее, чем рост пыльцевых трубок (0,3—14 мм/ч),
что обеспечивает подготовку семяпочки к взаимодействию с
пыльцевой трубкой. Действительно, у хлопчатника экзогенные
ИУК и ГА3 имитируют некоторые эффекты растущей пыльцевой
трубки на зародышевый мешок. Сигналы разного рода воспри-
нимаются яйцеклеткой, вокруг которой при приближении чуже-
родных пыльцевых трубок откладывается каллоза для защиты
ее от контакта с чужеродным спермием.
Таким образом, опережающая растущую пыльцевую трубку
JJ93
информация вызывает изменение метаболизма, с которого начи-
нается подготовка женской репродуктивной системы к оплодо-
творению.
9.6.6. ОПЛОДОТВОРЕНИЕ
Пыльцевая трубка, пройдя столбик, как правило, продвига-
ется через проводниковую ткань, выстилающую стенки завязи,
и приближается к зародышевому мешку с микропилярного кон-
ца. Полость микропиле заполнена слизистым секретом, участву-
ющим в привлечении пыльцевой трубки. Микропилярная жид-
кость содержит свободные фруктозу, глюкозу и сахарозу, может
содержать также аминокислоты, ионы и другие компоненты. По
составу она близка нектару флоральных нектарников.
Пыльцевая трубка через нитчатый аппарат проникает в одну
из синергид. На этом рост пыльцевой трубки прекращается, ее
кончик лопается, и содержимое с вегетативным ядром и двумя
спермиями попадает в синергиду. Синергида, в которую внедря-
ется пыльцевая трубка, частично дегенерирует еще до того, как
последняя достигает ее. Очевидно, это обстоятельство создает
хемотропный эффект для роста пыльцевой трубки к этой синер-
гиде. Вторая синергида может продолжать функционировать
и деградирует позднее. Вегетативное ядро и ядро синергиды пре-
вращаются в так называемые Х-тельца, а плазмалемма разру-
шается. Один из спермиев входит в центральную клетку, а дру-
гой— в яйцеклетку. Как центральная клетка, так и яйцеклетка
в этом участке не имеет клеточной стенки. Гаплоидные ядра
яйцеклетки и спермия сливаются, в результате чего образуется
диплоидная зигота. В центральной клетке ранее образовавшееся
диплоидное ядро объединяется с ядром спермия, и возникает
первичная клетка эндосперма с триплоидным ядром. Таким об-
разом, осуществляется двойное оплодотворение, открытое в
1898 г. С. Г. Навашиным. Зигота покрывается сплошной оболоч-
кой и дает начало новому растительному организму (см. 2.1).
В зародышевый мешок может проникать несколько пыльцевых
трубок, однако спермин этих трубок в оплодотворении, как пра-
вило, не участвуют и деградируют.
Описанные выше события, происходящие в пестике и семя-
почке, оказывают влияние на процессы, идущие в других частях
цветка и всего растения. Еще во время роста пыльцевых трубок
в столбике начинают завядать лепестки. В период опыления и
оплодотворения увеличивается транспорт ауксина из цветка в
цветоножку. Колебания электрического потенциала в завязи в
период оплодотворения (см. 9.6.5) индуцируют электрическую
волну амплитудой 15—18 мВ, которая перемещается по стеблю
в опытах с кукурузой со скоростью 1 см/с и имеет длительность
порядка 20—50 мин. У цветков, у которых процесс оплодотворе-
199
ния не осуществился, через некоторое время наблюдается завя-
дание, в цветоножке образуется отделительный слой, и они опа-
дают.
9.7. ФОРМИРОВАНИЕ СЕМЯН И ПЛОДОВ
Плод, содержащий семена, является органом размножения
растений. Он выполняет две функции: защиты семян и их рас-
пространения благодаря наличию таких приспособлений, как
крючки, летучие волоски, сочная мякоть и т. д. Ткани плода фор-
мируются из завязи, но нередко в образовании плода участвуют
и другие органы цветка: цветоложе, околоцветник, цветковые
чешуи. Из стенок завязи образуется околоплодник (перикарп),
главная часть которого представляет собой видоизмененный ме-
зофилл стенок завязи. При созревании плода мезофилл диффе-
ренцируется на несколько слоев: наружный (экзокарп), средин-
ный (мезокарп) и внутренний (эндокарп). Наружный и внутрен-
ний слои обычно тонкие, состоящие из 1—2 слоев клеток, мезо-
карп— многослойный. Эндокарп у плодов разных типов может
быть специализированным. Так, у плодов сливы, абрикоса, виш-
ни он, развиваясь в каменистую ткань, образует косточку. В па-
ренхимных клетках мезокарпа у сочных плодов содержится мно-
го сахаров (плоды сливы, черешни и т. д.) или масел (маслина,
авокадо).
В развитии плодов можно выделить четыре фазы: 1) форми-
рование завязи до опыления; 2) рост за счет деления клеток
сразу после опыления и оплодотворения; 3) рост за счет рас-
тяжения клеток; 4) созревание.
9.7.1. РОСТ ПЛОДОВ
После образования зиготы начинается рост завязи, форми-
рование семян и развитие плода. Формирование зародыша и за-
тем семян уже обсуждалось (см. 2). Здесь мы рассмотрим про-
цессы, связанные с ростом плодов.
Часто рост завязи стимулируется прорастающей пыльцой
еще до образования зиготы, причем интенсивность этого роста
прямо пропорциональна количеству прорастающей пыльцы. Да-
же чужеродная пыльца может способствовать росту завязи, что
объясняется высоким содержанием ИУК в пыльце. Обработка
цветков экзогенным ауксином у многих растений, например с
сочными плодами, индуцирует разрастание завязи и образова-
ние партенокарпических, т. е. бессемянных плодов. Обработка
гиббереллином также у многих растений вызывает завязывание
плодов (виноград, яблони, томаты и др.). Для роста молодых
плодов необходимо присутствие цитокинина. Однако экзогенные
цитокинины не вызывают образования партенокарпических пло-
дов.
200
В начале формирования завязи в цветке ее рост происходит
в результате деления клеток, которое резко возрастает после
опыления. Затем наступает более продолжительная фаза растя-
жения клеток. Характер роста находится в сильной зависимо-
сти от типа плода. Плоды делят на коробочки, орешки, семянки,
зерновки, ягоды, костянки и др. Различают плоды сухие и соч-
ные (мясистые).
Как уже отмечалось, регуляция роста плодов осуществляет-
ся фитогормонами, от присутствия которых зависят характер
ростовых процессов и интенсивность притока питательных ве-
ществ. ИУК в завязь сначала поступает из столбика и от про-
растающей пыльцы. Затем источником ИУК становится разви-
Рис. 9.27. Последовательные фазы развития зародыша и
эндосперма в зерновке пшеницы (сорт Диамант) после опы-
ления (Батыгина, 1987).
а — через 5—6 ч, 6—1 сут, в — 2, г — 3—4, 6—7—8, е — 9—10, ж —
11—12, з—13—15, и — 25—30 сут. / — завязь, 2 — интегументы, 3 — ну-
целлус, 4 — эндосперм, 5 — антиподы, 6 — зародыш, 7 — дегенерирую-
щие антиподы.
201
вивающаяся семяпочка. Особую роль в синтезе ауксина играют
•формирующиеся эндосперм и зародыш. Образующиеся семена
поставляют ауксин в околоплодник, что активирует в нем рос-
товые процессы. При недостатке ауксина (малочисленности об-
разующихся семян) происходит опадение плодов. Цитокинины
на ранних фазах развития плода поступают в ткани завязи из
материнского растения, а затем начинают вырабатываться в эн-
досперме и зародыше. То же самое можно сказать о гибберел-
лине.
Содержание фитогормонов и их соотношение различны на
разных фазах роста плодов и формирования семян. Так, в зер-
новках пшеницы максимальное количество цитокининов наблю-
дается сразу после цветения при переходе к формированию цел-
люларного эндосперма (рис. 9.27 и 9.28). Затем начинает воз-
Рис. 9.28. Содержание ростовых веществ, сухой массы и во-
ды (ось ординат, относительные единицы) в зерновках пше-
ницы в течение развития от цветка до спелости (Geisler,
1983).
1 — цитокинин, 2 — гиббереллин, 3 — ауксин, 4 — абсцизовая кислота,
5 —сухая масса, 6 — вода. По оси абсцисс — дни развития.
растать содержание гиббереллинов, а позже ИУК, концентрация
которых достигает максимальной величины в фазе молочной спе-
лости. При переходе к восковой спелости уровень гибберелли-
нов и ауксинов быстро падает, но возрастает содержание АБК,
что способствует отложению в эндосперме запасных веществ.
Когда нарастание сухой массы зерновок прекращается и проис-
ходит обезвоживание семян (полная спелость), содержание АБК
снижается. Уменьшение количества всех перечисленных свобод-
ных фитогормонов объясняется переходом их в связанное со-
стояние. Такой порядок изменения соотношения фитогормонов у
202
формирующихся зерновок пшеницы обусловливает последова-
тельность развития зародыша и эндосперма (см. 2).
В сочных плодах (томаты), где происходит интенсивный рост
околоплодника, наибольшее содержание гиббереллинов и аук-
сина в перикарпе наблюдается в начале его развития (рис.
9.29, б). Затем уровень этих фитогормонов снижается и снова
Рис. 9.29. Изменение интенсивности роста и
дыхания (а) и содержания свободных фитогор-
монов (б) в тканях перикарпа томата в ходе
развития и созревания (Ludford, 1988).
По оси абсцисс — размер плода (%), по оси ординат:
а — выделение СОа (мл/кг/ч) и этилена (мкл/л), б — со-
держание фитогормонов (мкг/кг сырой массы). Стрел-
кой отмечено начало покраснения плодов.
возрастает на последней фазе роста. Содержание цитокинина
временно увеличивается в период наиболее интенсивного роста
плода. Прекращение роста перикарпа совпадает с накоплением
АБК в его тканях.
Период растяжения клеток у сочных плодов и особенно конец
этого периода характеризуются не только интенсивным ростом,
но и накоплением органических веществ. Происходит увеличе-
ние содержания углеводов и органических кислот, откладывается
крахмал. Использование этих веществ на синтез компонентов
цитоплазмы снижается до минимума, что соответствует низкому
уровню дыхания в этот период (рис. 9.29, а).
203
9.7.2. СОЗРЕВАНИЕ ПЛОДОВ
Прекращение роста плодов совпадает с переходом их к со-
зреванию. Созревание сочных плодов сопровождается снижением
отношения кислот и сахаров, образованием ароматических ве-
ществ, разложением хлорофилла и дубильных веществ, накопле-
нием антоцианов, уменьшением твердости и упругости тканей
благодаря гидролизу пектиновых веществ клеточных стенок. В
этот период резко усиливается дыхание тканей перикарпа (кли-
матерический подъем дыхания) и автокаталитически возрастает
синтез этилена (рис. 9.29, а). Обработка экзогенным этиленом
незрелых плодов значительно ускоряет процессы созревания, что
указывает на его роль как гормона, определяющего переход к -
созреванию.
Завершение процессов созревания сопровождается образова-
нием отделительного слоя в плодоножке и опадением плодов.
Формирование отделительного слоя индуцируется уменьшением
содержания ауксина и высоким уровнем этилена. Предуборочное
опрыскивание плодовых, например лимонов или апельсинов,
растворами 1-НУК или 2,4-Д (8 мг/л) не только уменьшает па-
далицу, но и замедляет созревание плодов. Такие плоды долго
остаются зелеными, лучше хранятся и в меньшей степени под-
вергаются заболеваниям. Замедлить процессы созревания и опа-
дения плодов можно также обработкой крон ретардантами (в
частности, аларом), которые ингибируют синтез гиббереллинов.
10. ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
Вегетативное размножение—бесполое размножение путем
образования новой особи из части родительской. Оно приводит
к появлению генетически однородных групп особей — клонов.
Этот способ, помимо размножения, обеспечивает также возмож-
ность ежегодного возобновления надземных побегов и служит
эффективным способом расселения растений.
Растения могут размножаться, отделяя от себя части, кото-
рые становятся новыми особями. Способны укореняться и да-
вать самостоятельные растения нижние ветви трав, деревьев,
кустарников и даже изолированные листья. Путем ветвления и
отделения листовидных пластинок размножается ряска. В ходе
эволюции размножение растений вегетативным способом, в от-
личие от животных, все более совершенствовалось. Появились
специальные органы вегетативного размножения — корневища,
столоны, усы, клубни, луковицы, опадающие пазушные или при-
даточные почки и т. д. Во многих случаях вегетативное размно-
жение становится единственной формой репродукции, обеспечи-
вающей сохранение генофонда и расселение вида. У таких ра-
стений со специализированными органами вегетативного раз-
множения может утрачиваться способность размножаться се-
менами. Совершенствованию в ходе эволюции способов вегета-
тивного размножения у растений способствовало развитие про-
цессов регенерации, которые имеют много общего с бесполым
размножением (см. 5).
10.1. РАЗМНОЖЕНИЕ КЛУБНЯМИ
Клубень — видоизмененный побег, стебель которого, вклю-
чающий в себя одно или несколько междоузлий, сильно разра-
стается и накапливает запасные вещества, преимущественно
крахмал, реже масла.
Процесс клубнеобразования в физиологическом плане наибо-
лее изучен у картофеля. Клубни образуются на концах видоизме-
205
низкой, температуре на
При температуре почвы
существенной роли для
ненных подземных побегов — столонов. Столоны с длинными
междоузлиями и чешуевидными бесцветными листьями форми-
руются из пазушных почек сближенных узлов нижней части
стебля. Они растут плагиотропно, т. е. под углом 90° к оси глав-
ного побега. У многих сортов картофеля при длинном дне и
высокой температуре (выше 29 °C) столоны могут превращаться
в вертикальные облиственные побеги, а при нормальной, более
конце столона формируется клубень,
ниже 14 °C длина дня уже не играет
формирования клубня. Однако при бо-
лее высокой температуре образо-
ванию клубней благоприятствует
короткий день. При этом клубне-
образование всегда связано с тор-
можением роста как надземных
побегов, так и столонов. Ассими-
ляты, образующиеся в ходе фото-
синтеза, в условиях короткого
А2 дня преимущественно поступают
/ к закладывающимся клубням.
Первый признак начавшегося
клубнеобразования — появление
утолщения двух дистальных*
междоузлий столона позади вер<
хушечной почки (рис. 10.1). Утол^
щение обусловлено активацией
s. деления клеток в сердцевине и:
периферических слоях коры, а
— 4 также увеличением размера кле-
.__5 ток. Верхушечная и пазушные
V почки (глазки) не растут. В клуб-
У ни интенсивно поступают органи-
г—-6 ческие, минеральные вещества,
а также вода, в них идет отложе-
ние запасных веществ. Когда над-
Рис. 10.1 Развитие клубня кар- земные органы отмирают, рост
тофеля на столоне. клубней прекращается, и они пе-
/ — чешуйчатые листья столона, 2— реХОДЯТ В СОСТОЯНИС ДОЗрСВаНИЯ.
верхушечная почка, 3 — пазушные поч- т-г _ _
ки, 4— камбий, 5—сердцевина, 6— ДОЗреВЗНИС КЛубнеЙ ПРОИСХОДИТ
кора клубня. в течение 2—6 недель после убор-
ки. В этот период испаряется из-
лишек влаги и утолщается кожура, что обусловлено дополни-
тельным образованием пробковой ткани. Резко ослабевает ак-
тивность метаболизма, и клубни переходят в состояние длитель-
ного покоя.
Таким образом, формирование клубня включает в себя три
этапа: 1) подготовительный—появление и рост столонов, 2) за-
кладку и рост самого клубня, 3) дозревание и покой клубня.
206
Образованию столонов из пазушных почек благопри-
ятствует их затемнение (отсюда полезность окучивания). Если
искусственно поместить в темноту верхушку надземного побега^
то столоны, а затем клубни образуются и там. Важную роль,
для столонообразования играют развивающиеся вегетативные
почки и листья надземной части растения. Удаление верхушки,
и всех боковых надземных почек приводит к превращению сто-
лонов в облиственные вегетативные побеги (см. рис. 4.17). Раз-
вивающиеся почки, как известно, вырабатывают ИУК, а листья,,
особенно на длинном дне, — гиббереллины. Доминирующая фун-
кция верхушечных почек (апикальное доминирование) связана
с образованием и полярным транспортом ауксина (см. 4.1.7 и
4.1.8; рис. 4.16 и 4.17). ИУК вместе с гиббереллинами, посту-
пающие в достаточном количестве из надземных частей, пере-
ключают генетическую программу развития пазушной почки
с развития вертикального облиственного побега на формиро-
вание столона (см. рис. 4.18). Причем гиббереллин необходим,
и для удлинения междоузлий столона. Для его роста требует-
ся интенсивный поток ассимилятов из листьев.
Закладка клубней на дистальных концах столонов,
связана с резким торможением их роста в длину. Предполага-
ется, что это подавление вызывается повышением концентра-
ции АБК, которая в большем количестве образуется в листьях:
на коротком дне. В условиях короткого дня снижаются синтез
и поступление ПУК и гиббереллинов. Одновременно в этих ус-
ловиях в тканях возрастает содержание цитокининов или, во
всяком случае, увеличивается отношение цитокининов к аукси-
нам. В опытах с культурой отрезков дистальных концов столо-
нов было показано, что для индукции и роста клубней необхо-
димы высокие концентрации сахарозы (6%) и цитокинина (ки-
нетин, 2,5 мг/л). С этими данными согласуются результаты^
полученные в опытах с определением эндогенных фитогормо-
нов в развивающихся клубнях картофеля (рис. 10.2). При пе-
реходе от роста столона в длину к утолщению в тканях резко
снижается содержание гиббереллинов, затем начинает падать
концентрация ПУК. Одновременно с этим возрастает содер-
жание АБК и особенно цитокининов.
У растений дикого картофеля, клубнеобразование у которых
строго индуцируется короткодневным фотопериодом, установ-
лено, что стимул клубнеобразования поступает из листьев, так
как «короткодневные» листья, привитые к «длиннодневному»
стеблю, способствуют формированию клубней. Как уже говори-
лось, в листьях на коротком дне синтез гиббереллинов снижа-
ется, а АБК — возрастает (см. рис. 9.10, б); увеличивается так-
же содержание цитокининов. Таким образом, стимул клубне-
образования может быть не особым специфическим фактором, а
определенным соотношением известных фитогормонов, однако
эти соотношения могут отличаться у разных видов растений.
207
Цк
200-
100
Рис. 10.2. Изменение уровней фитогормонов на различных
-стадиях развития клубня картофеля (а—г) (по: Ewing,
1988).
По осям ординат: Цк — сырая масса каллуса сои (мг/пробу), ИУК —
усиление роста колеоптилей овса (%), АБК — подавление роста ко-
леоптилей овса (%), ГА — количество редуцирующих сахаров в эндо-
сперме овса (мкг/мл).
ДД
Рис. 10.3. Гормональная регуляция клубнеобразования
у растений картофеля в зависимости от фотопериода
(Чайлахян, 1984).
208
Общая схема регуляции клубнеобразования фитогормонами
представлена на рис. 10.3.
Покой клубней связан с резким замедлением дыхания,
распада и синтеза биополимеров (крахмала, белков и др.),
остановкой ростовых процессов. У клубней картофеля в со-
стоянии глубокого покоя находятся только меристематические
ткани, прежде всего глазки. Запасающая же ткань способна
быстро активизироваться в ответ на повреждения (образова-
ние раневой перидермы при механических повреждениях, акти-
визация защитных механизмов при инфекции).
Состояние глубокого покоя глазков обусловлено высоким
содержанием АБК в тканях, особенно в клетках глазков. В
глазках и в корневой паренхиме в этот период высока кон-
центрация ингибиторов фенольной природы — кофейной кисло-
ты и скополетина:
кофейная кислота
скополетин
Все эти физиологически активные вещества тормозят синтез
РНК и белков, влияют на состояние мембран.
Выход глазков из состояния глубокого покоя связан с паде-
нием содержания АБК (в 10—100 раз), фенольных ингибито-
ров и возрастанием концентрации свободных гиббереллинов.
Обработкой экзогенной гибберелловой кислотой можно снять
переход глазков в покоящееся состояние у свежеубранных
клубней картофеля. Этот прием позволяет получать два уро-
жая картофеля в год в южных районах.
10.2. РАЗМНОЖЕНИЕ ЛУКОВИЦАМИ
Луковицы — видоизмененные укороченные подземные побе-
ги, которые несут сближенные утолщенные листья (сочные че-
шуи), содержащие запасы питательных веществ. Резко укоро-
ченный стебель называется донцем (рис. 10.4). Дистальная
часть донца заканчивается апексом побега, который ежегодно
формирует надземные листья и цветочные стрелки. Лукович-
ные размножаются делением луковицы на луковички (тюль-
паны), «детками» (лилии) или воздушными луковичками (де-
коративные луки).
У этих растений формирование луковиц индуцируется длин-
14 Зак-’? № 399
209
Рис. 10.4. Луковица тюльпана.
1 — оболочка (наружная луковичная чешуя),
2 — главная боковая луковичка, 3 — донце, 4 —
придаточные корни, 5 — боковые луковички, 6 —
луковичные чешуи, 7 — листья, 8 — цветочная
почка.
ным днем. Органами, рецептирующими действие фотопериода,,
являются листья. Образование луковиц сопровождается сниже-
нием уровня ауксина в тканях. Обработка экзогенным ауксином
приводит к росту листьев у луковичных чешуй в длину. Вегета-
тивное размножение лу-
ковичных растений свя-
зано не столько с форми-
рованием самой лукови-
цы, сколько с образова-
нием на ней пазушных по-
бегов— будущих «деток».
Они закладываются в пе-
риод зимнего покоя луко-
виц. Под действием кине-
тина, ГА3 и ИУК, нане-
сенных на донце, усили-
вается образование па-
зушных почек, формирую-
щих дочерние луковички.
Тот же эффект наблюда-
ется при повышении тем-
пературы или при удале-
нии цветоносного побега^
который образуется в пе-
риод покоя луковицы
(рис. 10.4). Низкая темпе-
ратура хранения луко-
виц, наоборот, благопри-
ятствует закладке цвето-
носных побегов. Таким
образом, у луковичных
растений в период покоя
ростовые процессы не прекращаются, хотя они идут очень мед-
ленно. Состояние покоя поддерживается высокой концентраци-
ей АБК. Перед прорастанием уровень АБК снижается, а содер-
жание цитокининов, гиббереллинов и ауксина возрастает.
10.3. РАЗМНОЖЕНИЕ КОРНЕВИЩАМИ И УСАМИ
Корневище — горизонтально растущий многолетний под-
земный побег с чешуевидными или недоразвитыми листьями,,
рубцами от опавших листьев, почками и придаточными корня-
ми. Он служит для вегетативного размножения, возобновле-
ния (отрастания), для расселения и отложения запасных ве-
ществ. Корневищами размножаются многие многолетние тра-,
вы, кустарнички и кустарники, например многие злаки, осоки,,
ландыш, ревень, сирень, черемуха (рис. 10.5). Корневище мо~
210
жет расти очень быстро. У иван-чая за весенне-летний период
оно отрастает на 85—100 см.
Усами (плетями) называют ползучие, недолговечные над-
земные побеги с длинными междоузлиями, возникающие из по-
чек в пазухах листьев у основания стебля. Они обычно имеют
недоразвитые листья, укореняются в узлах с помощью прида-
точных корней. Боковые почки в узлах дают новые растения
(рис. 10.6). Междоузлия, связывающие их с материнским ра-
Рис. 10.5. Размножение корневищами Рис. 10.6. Размножение земляники
/ — относительно молодое корневище, 2 — ПОЛЗУЧИМИ стеблями усами,
появление индивидуальных растений (кло-
нов) за счет распада корневища.
стением и друг с другом, со временем отмирают, и каждое до-
чернее растение обособляется. Молодые растения образуют
собственную корневую систему и, в свою очередь, формируют
усы.
Усы являются одной из разновидностей столонов — горизон-
тальных, с длинными междоузлиями стеблей, заканчивающих-
ся почками или клубнями. Причина образования столонов уже
обсуждалась (см. 4.1.8 и 10.1). Значительное превышение по-
ступления ИУК и гиббереллинов из надземной части по срав-
нению с притоком цитокинина из корней способствует плагио-
14*
211
тропному росту боковых ветвей и превращению их в столоны.
Ослабление функциональной зависимости боковых и верхушеч-
ных почек от материнского растения (из-за удаления от мате-
ринского растения или постепенного отмирания связывающих с
ним междоузлий) приводит к сдвигу в гормональном балансе
(снижению поступления ГА) и росту из столонов и корневищ
вертикальных облиственных побегов. Обработка мутантов
земляники, не образующих усы, гибберелловой кислотой воз-
вращает растениям способность формировать усы вместо вер-
тикальных облиственных побегов. Недоразвитость листьев у
корневищ связана, по-видимому, с отсутствием прямого дей-
ствия света. Наконец, образование почек и побегов с верхней,
а корней — с нижней стороны горизонтальных побегов обуслов-
лено гравитропической индукцией: в нижней половине стебля
относительно больше ИУК (что способствует корнеобразова-
нию), а в верхней — возрастает отношение Цк/ИУК из-за от-
тока ауксина в нижнюю половину (что благоприятствует вклю-
чению генетической программы побегообразования) (см. 5.2.1).
10.4. РАЗМНОЖЕНИЕ ОТВОДКАМИ И ЧЕРЕНКАМИ
У многих видов нижние ветви, соприкасаясь с влажной поч-
вой, могут образовывать придаточные корни, а затем становить-
ся самостоятельными растениями. Это явление используется для
вегетативного размножения растений путем прижимания ниж-
них ветвей (отводков) к земле.
Отломанные ветви, например, ивы, тополя также могут уко-
Рис. 10.7. Размножение черенками.
/ — укоренившийся черенок вяза, 2 — уко-
ренившийся лист.
реняться в естественных усло-
виях (в песке, почве). Отде-
ленные от растения черенки,
т. е. части стебля, корня, изо-
лированные листья, у многих
видов формируют адвентивные
корни и почки и регенерируют
целые растения (рис. 10.7, см.
также рис. 5.2). Причем корни
образуются на морфологиче-
ски нижнем конце, а побеги —
на верхнем. Это явление объ-
ясняется полярным транспор-
том ауксина, в результате чего
основание черенка обогащает-
ся, а верхний конец обедня-
ется ПУК. Сдвиг отношения
концентраций цитокинина к ауксину приводит к включению
разных генетических программ (см. 5.2.1).
В практике садоводства, цветоводства и лесоводства широ-
212
ко используется обработка базальной части свежесрезанных че-
ренков растворами ауксина для укоренения трудноукореняю-
щихся пород. С этой целью применяют растворы индолилмас-
ляной кислоты, 1-НУК, 2,4-Д, реже ИУК (из-за ее быстрого
разрушения в тканях) в концентрации 1 —100 мг/л в зависимо-
сти от вида и сорта растения, состояния черенков (зеленые или
одревесневшие) и типа фитогормона. Черенки, основания кото-
рых предварительно 18—24 ч выдерживают в растворе ауксина,
высаживают во влажный субстрат. Таким образом размножа-
ются многие ценные сорта. Однако для этой цели в последнее
время в практику активно внедряются методы клонального мик-
роразмножения с использованием стерильной культуры ткани.
11. СТАРЕНИЕ РАСТЕНИЙ
Старение — завершающий этап жизненного цикла клетки, |
органа и организма включает в себя взаимосвязанные измене- |
ния на молекулярном, клеточном, органном и организменном |
уровнях. J
Продолжительность жизни растительного организма генети- |
чески детерминирована, но в значительной мере корректируется 1
внешними и внутренними факторами существования индивидуу- 1
ма. Она существенно различается у разных растений: ?•
Эфемеры................2—4 недели
Клевер красный...........2—5 лет
Тимофеевка луговая .... 5—12 «
Чина .......................10 <
Корневище папоротника-
орляка .................... 10 <
Толокнянка• ............... 80 «
Береза......................150 «
Яблоня ................... 200 «
Брусника, черника. 300 лет <
Ель.......................500 «
Сосна................. 500 «
Липа...............• • 1200 «
Дуб ............ 1 2С0 «
Каштан............... 2 ООО «
Кипарис.............. 3 000 <
Секвойя............. 5000 «
Для растений характерны несколько типов старения (рис. '
11.1). В конце вегетационного периода однолетние растения по-
гибают целиком (1). У многолетних растений наблюдаются три
типа старения надземных органов, тогда как подземные обра-
зования сохраняют жизнеспособность: отмирают ежегодно все
надземные органы у многолетних трав (2); последовательно
стареют и опадают листья снизу вверх по стеблю (4)\ осенью
теряются все листья у листопадных многолетников (3). Эти
типы старения могут отражать количественную сторону общих
для всех растений физиологических процессов, связанных со
старением.
Процесс старения развивается постепенно. Особенность ра-
стения состоит в том, что в течение его онтогенеза непрерывно |
осуществляются закладка и рост новых клеток, тканей и орга- |
нов. Это обеспечивается функционированием меристем. Поэтому |
у взрослого растения в каждый момент времени сосуществуют |
214 1
Рис. 11.1. Типы старения растений.
1 — растение отмирает полностью, 2 — отмирает только надземная часть, 3 — одновре-
менное старение и опадение всех листьев, 4—постепенное старение листьев (направ-
ление отмечено стрелкой).
совсем молодые и уже отмирающие клетки и органы. На уровне
целого растения рост продолжается до глубокой старости, но
скорость его постепенно замедляется.
11.1. КЛЕТОЧНЫЕ МЕХАНИЗМЫ СТАРЕНИЯ
Основным принципиальным
на молекулярном уровне яв-
ляется изменение соотноше-
ния между процессами син-
теза биополимеров клетки и
их распадом в сторону уси-
ления распада. Время жиз-
ни каждого биологического
полимера и структуры, в со-
став которой он входит, оп-
ределяется способностью
к обновлению, их оборотом.
Его характеризуют величи-
ной полупериода жизни, т. е.
временем, за которое поло-
вина данного вещества, ор-
ганоидов клетки, популяции
моментом в развитии старения
Тилы
Виды
Организмы
Клетки
Органеллы
Ферменты
Субстраты t , , , ,
to'2 Ю° 102 104 10s 10е ю’° '
Рис. 11.2. Время оборота (обновле-
ния) биологических систем разной
сложности (Leopold, 1975).
По оси абсцисс — полупериод жизни (дни),
по оси ординат — энтропия ’.
организмов перестает суще-
ствовать. Полупериод жизни субстратов составляет 10—100 мин,
ферментов — 5—500 ч, органоидов — 8—100 дней (рис. 11.2). При
215
усложнении организации удлиняется полупериод жизни и сни- :
жается энтропия системы: у отдельного растения он продолжа-
ется в течение 1—100 лет, а у вида— 1000—10 000 столетий.
Более медленный оборот становится возможным из-за существо-
вания быстрой обновляемости на нижних этажах системы. Под-
держание определенных уровней оборота обусловлено соотно-
шением процессов ассимиляции и диссимиляции. По мере раз-
вития старения происходит замедление обновления компонентов
клетки, а это включает ослабление функций, нарушение регуля- ;
ции, результатом чего является прогрессирующее старение.
Данные, касающиеся пусковых механизмов старения, можно
разделить на две группы: 1) старение связывается с генети-
чески обусловленной программой, и 2) старение рассматрива-
ется как результат накопления повреждений в клетках в тече-
ние их жизни.
Первая группа гипотез предполагает, что процессы диффе- 5
ренцировки клеток, возрастание их специализации могут приво- 1
дить к изменению белкового синтеза, например выключению ча- ;
сти аппарата трансляции, что ускоряет старение. В выполнение ’
генетической программы развития — старения вносят свой вклад j
и различные нарушения обменных процессов. Например, посте-
пенно накапливается количество модифицированой ДНК как
за счет образования химических связей ДНК с РНК, гистона- >
ми, негистоновыми белками, так и вследствие нарушения ме- 1
ханизмов репарации этих повреждений. 1
Хроматин может повреждаться свободными радикалами, ко- |
личество которых увеличивается в результате стрессов, патоло- |
гий и т. д. Свободные радикалы влияют также на проницае- |
мость мембран клетки, что нарушает гомеостаз и способствует ;
старению. Как повреждения хроматина, так и нарушения мем-
бран могут приводить к синтезу дефектных белков и (или) ток- :
сичных продуктов, ускоряющих старение.
Какие же процессы включают программу старения на кле- V
точном уровне? Рассмотрим развитие процессов старения у кле- |
ток листа — объекта, изученного лучше других. |
Поскольку основной функцией листа является осуществле- |
ние фотосинтеза, то в онтогенезе клеток листа важны взаимо- |
отношения ядерного и хлоропластного геномов. Максимальной 1
интенсивности фотосинтез достигает незадолго до прекращения 1
роста листа. Остановка его роста коррелирует с некоторым |
снижением фотосинтетической активности. Последующее посте- |
пенное уменьшение интенсивности фотосинтеза вызвано сниже- 1
нием активности ферментов, кодируемых геномом хлоропла- |
стов, и прежде всего основного белка хлоропластов—рибулозо- 1
бисфосфаткарбоксилазы (РБФК)—и связано с развитием ре- |
прессии генома и белоксинтезирующей системы хлоропластов |
после остановки роста листа. Эти процессы находятся под кон- ж
тролем ядра. Постепенное снижение основной функции листа i
216
приводит к активации гидролитических процессов в клетках, и
лист из поставщика продуктов фотосинтеза превращается в по-
ставщика продуктов гидролиза полимеров клетки — низкомоле-
кулярных соединений, содержащих азот, фосфор, серу.
Такое преобладание процессов диссимиляции над синтезом
может быть связано с изменением гормонального баланса в ли-
сте. Активно растущий лист синтезирует ауксин, гиббереллины
и является органом, аттрагирующим цитокинины, необходимые
для создания и функционирования хлоропластов. Остановка ро-
ста листа и постепенное замедление фотосинтеза сопровожда-
ется уменьшением в листе содержания гормонов, определяющих
синтетическую направленность обмена веществ (цитокинины,
ауксин, гиббереллины), и увеличением количества гормонов,
способствующих процессам диссимиляции, — АБК и этилена
(см. ниже). Снижение поставки цитокининов замедляет процес-
сы обновления и поддержания хлоропластов и приводит к изме-
нениям в белоксинтезирующей системе цитоплазмы клеток. На-
блюдается уменьшение числа работающих рибосом при боль-
шем числе рибосом, связанных с ЭР. Происходит также рас-
щепление рРНК, уменьшение отношения РНК/белок в клетке.
Замедление обновления мембран хлоропластов уже на ранних
стадиях старения приводит к нарушению структуры галакто- и
сульфолипидов мембран и увеличению содержания свободной
линоленовой кислоты. Снижение интенсивности дыхания насту-
пает позже, чем замедление фотосинтеза, но до этого наблю-
дается, уменьшение синтеза АТФ митохондриями из-за увели-
чения количества разобщителей дыхания и окислительного
фосфорилирования.
Система транскрипции сохраняется без изменений, по край-
ней мере до начала пожелтения. Обработка в это время листа
на целом растении азотнокислым аммонием (азотная подкорм-
ка) восстанавливает зеленый цвет листа (происходит регенера-
ция хлоропластов), увеличивает содержание ДНК, РНК и бел-
ков.
Старение не может быть обращено, если в клетке поврежда-
ется тонопласт. Это приводит к нерегулируемым процессам ав-
толиза в клетках. Позже других мембран нарушается прони-
цаемость плазмалеммы.
Гормоны и старение. Как отмечалось выше, ювенильный
лист вырабатывает значительное количество ауксина, который
используется не только в самом листе, но и для нужд всего ра-
стения. Помимо участия в процессах деления и роста клеток,
ауксин в молодом листе способствует созданию аттрагирующей
силы, позволяющей листу: 1) питаться гетеротрофно, получая
ассимиляты из более зрелых листьев, и 2) выигрывать конку-
ренцию с другими листьями за цитокинин, поступающий с кси-
лемным током из корней. Цитокинин необходим как для деле-
ния клеток, так и для формирования и функционирования хло-
217
ропластов и белоксинтезирующей системы листа. Гибберелли-
ны, синтез которых осуществляется в хлоропластах, являются
компонентами, необходимыми для роста клеток листа, поддер-
жания вместе с ауксином и цитокинином синтетической направ-
ленности обмена веществ.
Остановка роста листа является переломным моментом в
<его онтогенезе, с которого начинается процесс старения листа.
В этот период происходит изменение баланса фитогормонов.
Обработка стареющих, начавших желтеть изолированных листь-
ев цитокинином останавливает их старение: лист вновь зелене-
ет, активируется синтез РНК и белков, восстанавливается фо-
тосинтез (рис. 11.3). В опытах на отделенных от растения ли-
Рис. 11.3. Тормозящее влияние ки-
нетина на старение изолированного
листа махорки (Кулаева, 1982).
Рис. 11.4. Влияние обработки изо-
лированного листа щавеля экзоген-
ными ГАз (/), зеатином (2) и АБК
(3) в различных концентрациях на
старение листа (по скорости разру-
шения хлорофилла) (по: Manos,
Goldthwaite, 1975).
По оси абсцисс — концентрация гормона
(М), по оси ординат — скорость разруше-
ния хлорофилла (% от Н2О контроля).
Обработанная кинетином (20 мг^л) пра-
вая половина листа остается зеленой (за-
штриховано), а левая (необработанная)
желтеет.
стьях салата обнаружено, что еще до заметного падения содер-
жания хлорофилла в них снижается уровень свободных гиббе-
реллинов. Гибберелловая кислота в опытах с изолированными
тканями также останавливала распад хлорофилла (рис. 11.4).
Снижение количества ауксина в листе до определенного уровня
индуцирует образование отделительного слоя в черешке. Обра-
ботка листьев экзогенным ауксином останавливает этот про-
цесс. Сходные эффекты действия ауксина наблюдаются также
при опадении плодов или стеблей.
'-218
Начало и развитие процесса старения листа сопровождается
также изменением количества гормонов, ускоряющих старе-
ние,— АБК и этилена. У стареющих на растении листьев овса
уровень АБК возрастал к началу пожелтения в 2 раза, а у
изолированных — в 4 раза. Это увеличение совпадало с актив-
ной деградацией хлорофилла. В системах in vitro АБК также
усиливает распад хлорофилла (рис. 11.4). Предполагаются два
пути активации старения с участием АБК: 1) через влияние на
работу устьиц и 2) через активацию выделения этилена. АБК
вызывает закрывание устьиц и затрудняет их открытие. Это
ухудшает газообмен и транспирацию листа, уменьшает постав-
ки цитокинина с транспирационным током, что способствует
старению органа. Существенно, что уровень АБК повышается
в листе уж:е в процессе идущего старения, поэтому полагают,
что АБК функционирует на заключительных этапах старения.
Старение листьев значительно усиливается водным стрессом
(с участием АБК) и условиями, способствующими образованию
этилена.
Изучение взаимосвязи старения листьев и образования эти-
лена выявило у растений три типа реакций: 1) у изолирован-
ных листьев фасоли, томата и других пик выделения этилена
отмечался до фазы быстрого разрушения хлорофилла; 2) вы-
деление этилена возрастало по мере старения изолированных
листьев табака, свеклы, овса и др.; максимум выделения на-
блюдался после начала быстрого разрушения хлорофилла;
3) два подъема выделения этилена — до и после начала раз-
рушения хлорофилла — отмечено у изолированных листьев ща-
веля.
У стареющих на растении листьев табака выделение этилена
возрастает более чем в 4 раза за период от начала до пол-
ного пожелтения листьев. Помещение изолированных листьев
или целых растений в атмосферу этилена вызывает ускорение
старения листьев (табак, овес, щавель, фасоль). Однако не все
эффекты этилена на старение находят свое объяснение. Так,
добавление в среду к дискам щавеля предшественника этилена
1-аминоциклопропан-1-карбоновой кислоты (АЦК) увеличивало
образование этилена дисками в 90 раз, но старение (измерен-
ное по потере хлорофилла) ускорялось лишь на 13%. Ингиби-
торы образования этилена — СоС12, аминоэтоксивинилглицин,
аминооксиуксусная кислота (1-10-4М во всех случаях)—при-
останавливают старение листьев щавеля на 21—39%, но эффект
двух последних полностью обращался экзогенным этиленом, а
воздействие СоС12— лишь частично.
Выяснение взаимосвязей АБК, этилена и старения показало:
1) АБК стимулирует образование этилена и старение незави-
симыми путями; 2) есть виды, у которых старение регулируется
этиленом; 3) у других растений старение регулируется незави-
219
симо от выработки этилена, хотя его выделение всегда возра-
стает при старении.
Коррелятивные связи между органами и старение листьев-
По мере развития возникающие и ранее образовавшиеся органы
растения конкурируют за свет, регуляторы роста, питательные •
вещества, воду. Эти взаимоотношения в конце концов высту-
пают как морфогенетические факторы. Поэтому старение мо-
жет индуцироваться в данном листе как следствие его положе-
ния относительно других конкурирующих органов (эффект по-
ложения). J
Одним из компонентов эффекта положения является конку- ;
ренция за свет. Затенение нижних листьев под пологом верхних
меняет как количество, так и качество падающего на нижние
листья света. Увеличение доли дальнего красного света на
нижних ярусах может ускорить старение и опадение этих листь-
ев, так как ДКС увеличивает чувствительность тканей листа 1
(черешка) к этилену. Красный и белый свет действуют проти- |
воположным образом и могут задержать старение листа. |
Ускорение старения может быть результатом конкуренции |
за питание и регуляторы роста между листьями и формирую- |
щимися цветками и плодами. У многих растений долговечность f
листа возрастала предотвращением цветения или опыления и |
воздействием неиндуктивной длиной дня (неблагоприятной для |
цветения). Но есть и другие примеры: ускорение старения ли- f
стьев удалением молодых органов размножения (например, у |
кукурузы и ячменя). Столь различающиеся эффекты могут |
быть связаны с различной функцией листьев разного возраста. S
Как уже отмечалось, лист, являясь вначале гетеротрофным ор- *
ганом, экспортирующим ассимиляты из других листьев, затем "
становится поставщиком ассимилятов и, наконец, источником 2
низкомолекулярных соединений азота, фосфора, ионов калия и
др., когда падает его фотосинтетическая функция и активиру-
ются процессы гидролиза. Кроме того, важной адаптивной функ- ;
цией старения органов (в частности, листьев) является именно
использование их компонентов во время старения на нужды ра-
стения как ответ на действие внутренних и внешних факторов '
(особенно в условиях стрессов). Программа старения включа- J
ется в ответ на тот или иной дефицит, что требует перераспре- |
деления соединений между органами. Поэтому растение ис- |
пользует индуцированное старение (самодеструкцию) как важ- |
ный элемент гомеостаза организма. j
Опадение листьев. Процесс старения листа заканчивается его :
опадением. Это событие является результатом формирования у |
основания черешка специального отделительного слоя. Он ?
представляет собой несколько рядов клеток черешка, располо- |
женных примерно под прямыми углами к его оси. Образование |
этих клеток индуцируется изменением соотношения гормонов |
при старении листа. Основную роль играют уменьшение кон- |
220
центрации ауксина в черешке и увеличение количества этилена.
Экзогенный ауксин тормозит формирование отделительного
слоя и опадение листьев. Этилен, наоборот, значительно уско-
ряет опадение. АБК, по-видимому, не имеет прямого отношения
к опадению и действует косвенно, способствуя старению листа.
После формирования отделительного слоя клетки черешка, при-
легающие к нему со стороны стебля, начинают растягиваться и
секретируют в отделительный слой целлюлазу и полигалактуро-
назу, расщепляющие клеточные стенки и пектиновые вещества
срединных пластинок между клетками отделительного слоя.
Показано, что именно этилен индуцирует синтез этих фермен-
тов. Ослабленные клеточные стенки позволяют листу отделиться
от стебля либо под действием собственной массы, либо ветра.
Сходные события происходят при опадении плодов в перио-
ды самого низкого содержания в них ауксина.
11.2. СТАРЕНИЕ ЦЕЛОГО РАСТЕНИЯ
Старение целого растения базируется на старении составля-
ющих его частей и их коррелятивной взаимозависимости. По-
этому выбор критериев, по которым можно определить начало
процесса и его протекание, затруднен. На клеточном и орган-
ном уровнях, как мы видели, такими критериями могут слу-
жить интенсивность фотосинтеза (основной функции), направ-
ленность и характеристики синтеза белков, изменение гормо-
нального баланса. На уровне организма следует учитывать кор-
релятивные взамодействия органов: влияние мощности корне-
вой системы, интенсивности ксилемного тока, уровня снабжения
ассимилятами и функционирование флоэмного транспорта, вод-
ного баланса органов (работа устьичного комплекса, постав-
ки воды корнями) и т. д. Как фотопериодический, так и гормо-
нальный контроли участвуют в каждом из этих взаимодействий.
Фаза развития организма (в частности, переход к репродуктив-
ному развитию) существенна длй реализации программы ста-
рения.
В процесс старения вносят вклад также отношения побег —
корень. Переключение поступления питательных веществ на
формирующиеся цветки и плоды может ухудшать состояние кор-
ней, что, в свою очередь, снижает поставку минеральных ве-
ществ и цитокинина в надземные органы. Необходимо учиты-
вать также, что у растений в каждый данный момент времени
возникают и функционируют молодые ткани и клетки (мери-
стемы), которые таким образом «омолаживают» взрослое ра-
стение на клеточном, тканевом, органном и организменном
уровнях. Эта особенность растений, отсутствующая, как прави-
ло, в животном мире, была отмечена в работах Ч. Чайлда
(1910—1941) и Н. П. Кренке. Существенно также, что конеч-
221
ный возраст определяется генетически, и все процессы (даже- Я
новообразующиеся меристемы) несут на себе следы общего воз- Я
раста организма. Рассмотрим в качестве примера особенности, ж
старения двух бобовых растений — сои и гороха. 1
Как у всех монокарпических растений, на процесс старения 1
вегетативных органов сои индуцирующее влияние оказывает |
конкуренция формирующихся цветков и плодов за гормональ- |
ные и трофические факторы. Индукция цветения и процесс ста- I
рения растений очень чувствительны к внешним условиям— I
фотопериоду (длине ночи) и температурному режиму ночи. У ж
сои скорость развития семян стимулируется дополнительными; <
короткими днями. Взаимосвязь образования плодов и старе- 1
ния изучается у сои как генетическими методами, так и с по- 1
мощью удаления цветков и плодов. Генетические методы пока- у
зали, что у сои фотопериодическую реакцию контролируют 2 ?
локуса хромосом. Два других локуса определяют особенности *
роста побегов после цветения. Их взаимодействие приводит' $
(у определенных линий) к тому, что продолжающееся развитие
семян не сопровождается столь же быстрым старением листьев.
Полное старение листьев наблюдается при максимальном уро-
жае плодов.
Хирургическое удаление всех молодых плодов замедляет ско-
рость старения растений: по накоплению сухой массы и содер- I
жанию азота в побегах они приближаются к контрольным, не "
образующим плодов; тормозится также разрушение хлоро- ..
филла. Старение растений сои с удаленными плодами насту-
пает на 2 недели позже, чем у целых. Задержка старения при -
удалении плодов была выражена заметнее, если удалялись и
возникающие цветки (накопительный эффект удаления репро-
дуктивных структур).
Для объяснения роли формирующихся цветков и плодов в
старении растений сои рассматриваются две возможности:
1) поступление из плодов в листья «сигнала старения» и
2) конкуренция листьев и репродуктивных образований за цито-
кинин и трофические факторы. Допускалось, что функцию сиг-
нала старения может выполнять АБК. Однако через день пос-
ле введения [14С] АБК с ксилемным током в лист сои 60% .?
метки находилось в бобах и лишь 40% —в побегах. Введенная |
в бобы на разных стадиях их развития у интактных растений |
АБК почти не перемещалась в листья и, таким образом, не |
могла выполнять функции «сигнала старения», вырабатываемо- £
го плодами. АБК, по-видимому, участвует в завершающих эта-
пах старения листьев сои, так как значительное ее количество
отмечалось в листьях после разрушения хлорофилла.
Результаты хирургического удаления плодов и замедление
вследствие этого старения у сои прямо указывают на существо- ;
вание конкуренции между вегетативными и репродуктивными <
органами за трофические и регуляторные факторы. Однако еле- |
222
дует отметить, что такие взаимоотношения при старении у сои:
на начальных этапах цветения и развития плодов не столь оче-
видны. Это следует, например, из опытов по обработке паром
черешков листьев. Такая обработка, блокирующая транспорт'
веществ по флоэме, но не по ксилеме, у растений с плодами не
меняла сроков пожелтения листьев. Кроме того, если у базаль-
ных узлов сои удаляли листья, оставляя плоды, то это не уско-
ряло старение верхних листьев, у которых удаляли плоды. Сле-
довательно, семена не оттягивали на себя все физиологически
активные компоненты, переносимые током от корней (минераль-
ные вещества, цитокинины и др.). Наконец, если радиоактивный
зеатин или зеатинрибозид вводили с транспирационным током
в отрезки сои, содержащие узел, лист и один или более плодов,
на стадии их удлинения или раннего налива, то через день 65%
метки содержалось в листе, в бобах — 8%, в семенах — 2%..
Таким образом, вклад конкуренции плодов и листьев в реализа-
цию программы старения монокарпических растений может раз-
личаться в начале и в конце плодообразования.
Другой тип старения целого растения наблюдается у горо-
ха — «апикальное старение», что выражается в локализованном
старении (хлороз) терминальной почки и связанных с ней ли-
стьев. Одновременно происходит остановка развития. Особенно-
стью этого старения является его обратимость в любой моменг
до гибели апекса. Анализу причин апикального старения помо-
гает использование линии гороха G2, у которой цветение и обра-
зование плодов происходит на любом фотопериоде, а апикаль-
ное старение развивается только на ДД и требует обязатель-
ного присутствия развивающегося плода.
Существенно, что ранние симптомы апикального старения у
G2 наблюдаются до максимального развития семян, и, таким
образом, плоды не создавали еще недостатка питания для апек-
са. Однако, поскольку растения, выращенные на ДД, отлича-
лись от растений на КД меньшим числом узлов (с листьями
меньшего размера) между апексом и растущими плодами, со-
здавалось впечатление, что на ДД старение верхушки индуци-
руется снижением поступления к ней питательных веществ и
регулирующих рост соединений. Действительно, перенос расте-
ний гороха G2 с КД на ДД на 90% снижал содержание гиб-
береллинов в листьях верхушки. Это могло быть связано с за-
медлением на ДД функционирования пути превращения ГА12-
альдегида в ГА53, ГА44, ГА19 (и/или ГАп) и ГА20 в листьях вер-
хушки, так как оно идет активно именно на КД. Если верхуш-
ку побега гороха с признаками апикального старения на ДД
обработать ГА20, то она приобретает морфологию, свойственную
ей в условиях КД. Кроме того, в условиях ДД к верхушке дви-
жется меньше ассимилятов из верхних листьев, чем на КД.
Таким образом, апикальная часть побега испытывает недоста-
ток в ассимилятах и гиббереллинах, которые в большем количе-
223
стве (25-кратный градиент) направляются к развивающимся
плодам. Как и у сои, у гороха АБК не является ингибитором,
поступающим из плодов и ускоряющим старение апекса. Из
ИСО2, даваемого растениям гороха G2 на ДД, в апексе обнару-
живалось менее 1% от введенной метки, причем меченой АБК
обнаружено не было.
Таким образом, гормональный баланс в тканях и органах
растений и их конкурентные коррелятивные отношения лежат в
основе процессов старения как их самих, так и целого расте-
ния.
Значение старения. Особенности протекания процессов ста-
рения представляют растениям важные преимущества в адапта-
ции к меняющимся условиям среды. Возможность использова-
ния компонентов стареющих и отмирающих органов (воды, ор-
ганических и минеральных веществ) в условиях стрессов — су-
щественно для выживания как индивидуума, так и популяции.
Старение листьев играет прямую роль в стратегии пережива-
ния неблагоприятных условий. С помощью программированного
старения растение избегает гибели, сохраняя даже в крайних
ситуациях устойчивые структуры (семена, покоящиеся почки). (
При выходе из временных стрессов обратимость старения важ-
на для продолжения развития. Наличие процессов старения
ускоряет оборачиваемость генетического материала, способствуя
тем самым эволюционному процессу.
12. ЭВОЛЮЦИЯ ОНТОГЕНЕЗА
Растительные организмы в ходе прогрессивной эволюции
прошли сложный путь от одноклеточных водорослей до совре-
менных цветковых растений. Результатами этого поступательно-
го развития были оптимизация условий питания, гарантирующая
сохранение индивидуума, и повышение надежности процессов
размножения, что обеспечивает существование вида. Естествен-
ный отбор по этим критериям в ходе борьбы за существование
приводил к появлению все более совершенных форм организ-
мов.
В эволюционном развитии растительного мира можно отме-
тить несколько переломных этапов: 1) появление фотосинтеза,
2) становление полового процесса и чередование поколений,
3) переход к многоклеточности (нитчатые формы), 4) возник-
новение роста растяжением, 5) выход на сушу, 6) формирова-
ние листьев и корней, 7) способность- к размножению без ка-
пельно-жидкой воды и эмбрионизация начала онтогенеза,
8) появление цветков и плодов (покрытосемянность), 9) разви-
тие жизненных форм, приспособленных к самым разным эколо-
гическим условиям.
Эти последовательно появляющиеся эволюционные приобре-
тения возникали в ходе онтогонеза индивидуумов и становились
частью онтогенеза, надстраивая и модифицируя его. Одновре-
менно наблюдались и процессы регрессии. Наиболее важная из
них — редукция гаплоидного гаметофита в ходе прогрессивной
эволюции растений.
Фотосинтез как автотрофный способ питания появился еще
у бактерий. Биохимические механизмы фотосинтеза (пигмент-
ная и редокс-системы, фотофосфорилирование, восстановитель-
ный путь углерода) присутствуют уже у цианобактерий и в
дальнейшем лишь модифицируются.
Половое размножение (образование и слияние гаплоидных
15 Зак<п № 399
225
гамет) способствовало большей приспособительной пластично-
сти потомства, что давало определенные преимущества в борь-
бе за существование, а также при освоении новых экологиче-
ских ниш.
Переход к многоклеточности как у растений, так и у жи-
вотных обеспечил более надежное существование индивидуу-
ма. Так как у водорослей основным ограничивающим фактором
для их жизнедеятельности является свет, то самой оптимальной
формой для получения максимального количества света каждой
клеткой является однорядная нить. Нить удлинялась сначала
благодаря делению клеток (как у улотрикса), а затем возник
механизм роста клеток растяжением (увеличение пластично-
сти клеточных стенок, образование большой центральной ва-
куоли), который стал принципиально новой, характерной толь-
ко для растений, необратимой формой движения. Растяжение
позволило разместить в каждой клетке в пристенном слое цито-
плазмы значительно большее количество хлоропластов. Кроме
того, благодаря осмотическому (гидростатическому) давлению»
вакуолярного сока и противодавлению клеточной стенки тело ра-
стения приобрело большую твердость, что позволило водорос-
лям при выходе на сушу существовать в воздушной среде.
Первые наземные растения (риниофиты) имели дихотомиче-
ски ветвящиеся вертикальные стебли и горизонтальные побеги
(ризомоиды) с ризоидами. Поверхность риниофитов была по-
крыта эпидермой с кутикулой и устьицами. В стебле имелся
простой проводящий пучок (протостела).
Листья у растений появились как приспособления для опти-
мизации поглощения света и СО2. Природа их возникновения
двоякая: 1) выросты стебля (энации)—у плаунов и 2) сраста-
ние уплощенных ветвей благодаря маргинальной меристеме —
у всех других высших споровых и семенных растений. Одновре-
менно появляются и корни, так как количество воды, испаряе-
мой листьями, резко возрастает.
Основной формой развития наземных растений становится
спорофит, так как он (в отличие от гаметофита) состоит из
диплоидных клеток. Сухопутный образ жизни сделал невоз-
можным использование капельно-жидкой воды для процесса раз-
множения с участием подвижных сперматозоидов. У семенных
растений мужские и женские гаметофиты развиваются на споро-
фите и упрощаются. Яйцеклетка защищена покровами семя-
почки. Доставка мужского генеративного ядра к яйцеклетке
осуществляется с помощью пыльцевой трубки. У покрытосемен-
ных семена (зародыши с запасенными питательными вещества-
ми) надежно защищены перикарпом.
Появляются различные жизненные формы, приспособленные
к существованию в самых разных экологических условиях. Про-
цесс фотосинтеза адаптируется к эстремальным условиям: воз-
никают С4-путь фотосинтеза, CAM-метаболизм. Растения при-
спосабливаются к чередованию лета и зимы, благоприятного
сезона и засухи, приобретая способность к предадаптации к
неблагоприятным условиям. Эта предадаптации (предваритель-
ная подготовка) осуществляется с использованием механизмов;
фотопериодизма и яровизации.
Все эти процессы, возникнув на разных этапах эволюции,
продолжают функционировать в современных высших расте-
ниях. Сложность, высокая дифференцировка растительных ор-
ганизмов предполагают наличие столь же сложной системы ре-
гуляции и управления. Причем эта система также усложнялась
и совершенствовалась в ходе эволюции. В системе регуляции
и управления у растений участвуют физиологически активные
вещества типа фитогормонов, трофические факторы и электро-
физиологические явления. Преимущественное развитие в ра-
стительном мире получила гормональная система. Наиболее
древними фитогормонами растений, по-видимому, являются аук-
син, цитокинины и этилен. Они присутствуют уже у однокле-
точных. ИУК и цитокинины участвуют в индукции и регуляции
деления клеток. По мере прогрессивного усложнения растения
ауксин становится также гормоном растяжения клеток, диффе-
ренцировки проводящих пучков и образования корней. Цитоки-
нины участвуют в некоторых из этих процессов. Позже появля-
ются гиббереллины и АБК. Гиббереллины наряду с ИУК
связаны с регуляцией роста стебля, а также участвуют в
процессах инициации цветения, выхода из периода покоя и т.д.
АБК, по-видимому, появилась прежде всего как регулятор' вод-
ногр режима (воздействие на работу устьичного аппарата). За-
тем этот фитогормон начинает использоваться в процессах ре-
гуляции роста, иммобилизации запасных веществ, транспорта
веществ, старения. Усложнение функций фитогормонов сопро-
вождается появлением новых специфических для них рецепто-
ров или расширением функций уже существующих рецепто-
ров.
Электрические явления (электротонические потенциалы,
ПД) также находят применение в системе регуляции и управ-
ления у растений. ИУК и цитокинины оказывают влияние на
электрофизиологические процессы и, таким образом, служат
связующим звеном между этими системами регуляции. Трофи-
ческая регуляция находится под контролем гормональной и
электрофизиологической. Взаимоотношения органов у растений
строятся на основе конкуренции за фитогормоны и питательные
вещества.
Восприятие внешних факторов у растений осуществляется с
помощью фото-, хемо- и механорецепторов. К фоторецепторам
относятся фитохром и криптохром, которые функционируют уже
у водорослей. Все компоненты управления объединены в регу-
ляторные контуры, сложность которых возрастает с усложнени-
ем организма.
15* 227
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА >
ОСНОВНАЯ ??
Батыгин Н. Ф. Онтогенез высших растений. М., 1986. 100 с. у
Белоусов Л. В. Биологический морфогенез. М., 1987. 239 с.
Биология развития растений. М., 1975. 230 с. J
Васильев А. Е., Воронин Н. С., Е л е н е в с к и й А. Г., С е р е б-
Рыкова Т. И. Ботаника. Анатомия и морфология растений. М., 1978.
Гормональная регуляция онтогенеза растений. М., 1984. 239 с.
Гупало П. И., Скрипчинский В. В. Физиология индивидуально- 1
го развития растений. М., 1971. 224 с. Я
Гэлстон А^ Девис П., Сэттер Р. Жизнь зеленого растения. М., S
1983. 549 с. |
Демки в О. Тм Сытник К. М. Морфогенез архегониат. Киев, 1985. >
204 с. I
Дёрфлинг К. Горманы растений. Системный подход. М., 1985. 303с, *
Кефели В. И. Рост растений, М., 1984. 175 с.
Леопольд А. Рост и развитие растений. М., 1968. 494 с.
Рост растений. Первичные механизмы. М., 1978. 288 с.
Рост растений и дифференцировка. М., 1981. 275 с.
Рост растений и природные регуляторы. М., 1977. 295 с. ;;
Сабинин Д. А. Физиология развития растений. М., 1963. 194 с.
С ин нот Э. Морфогенез растений. М., 1963. 603 с.
Словарь ботанических терминов. Киев, 1984. 308 с. f
Строганова М. А. Математическое моделирование формирования [
качества урожая. Л., 1986. 151 с.
Торнли Дж. Г. М. Математические модели в физиологии растений.
Киев, 1982. 310 с.
Уоринг Ф., Филлипс И. Рост растений и дифференцировка. М.,
1984. 512 с.
Чайлахян М. Бутенко Р. Г., Кулаева О. Н. и др. Терми-
нология роста и развития высших растений. М., 1982. 96 с.
Шевелуха В. С. Периодичность роста сельскохозяйственных расте-
ний и пути ее регулирования. М., 1980. 455 с.
Эзау К. Анатомия семенных растений. М., 1980. Т. 1. С. 1—218; Т. 2.
С. 219—558.
Burgess J. Ап introduction to plant cell development. Cambridge,
1985. 246 p.
Hormonal regulation of plant growth and development I Ed. S. S. Pu-
rohit. Dordrecht e. a^ 1985. 412 p.
Plant hormones and their role in plant growth and development / Ed.
P. J. Davies. Dordrecht e. a., 1988. 681 p.
Street H. E., Opik H. The physiology of flowering plants, their
growth and development. London, 1984. 279 p.
ДОПОЛНИТЕЛЬНАЯ 4 >
К главе 2
Банникова В. Щ Хведынич О. А. Основы эмбриологии расте- I
ний. Киев, 1982. 164 с.
Батыгина Т. Б. Хлебное зерно. Л., 1987. 103 с. *
Данович К. Н., Соболев А. М., Жданова Л. П. и др. Физио-
логия семян. М., 1982. 318 с.
Магешвари П. Эмбриология покрытосеменных. М., 1954. 440 с.
Николаева М. Г. Физиология глубокого покоя семян. Л., 1967. 207 с,
Понтович В. Э. Ранний эмбриогенез покрытосеменных и его гормо-
нальная регуляция//Рост растений. Первичные механизмы. М., 1978.
С. 205—234.
228
Соболев А. М. Запасание белка в семенах, растений. М., 1985. 112 с,
Физиология и биохимия покоя и прорастания, семян. М., 1982. 495с,
Embryology of angiosperms /Ed. В. M. John. Berlin e. a., 1984,
830 p.
Raghavan V. Experimental embryogenesis in vascular plants. London
e. a, 1976. 603 p.
К главе 3
Бернье Ж., Кине Ж-M., Сакс Р. Физиология цветения. М., 1985,
Т. 1. С. 159—173.
Данович К. Н., Соболев А. М., Жданова Л. ГТ. и др. Физио-
логия семян. М., 1982. С. 223—310.
Мошков Б. С. Актиноритмизм растений. М., 1987. С. 154—188.
Физиология и биохимия покоя и прорастания семян. М.» 1982L
495 с.
L е w a k S. Hormones in seed dormancy and germination // Hormonal
regulation of plant growth and development / Ed. S. S. Purohit. Dordrecht
e. a., 1985. P. 95—144.
Mayer A. M., Poljakoff-Mayber A. The germination of seeds,
Oxford e. at, 1975. 192 p.
К главе 4
Гамалей Ю. В. Цитологические основы дифференциации ксилемьь
Л., 1972. 144 с.
Гамалей Ю. В., Куликов Г. В. Развитие хлоренхимы листа. Л.,
1978. 192 с.
Данилова М. Ф. Структурные основы поглощения веществ корнем;
Л., 1974. 206 с.
Епифанова О. И., Терских В. В., Полуновский В. А. По-
коящиеся клетки. М., 1983. 176 с.
Иванов В. Б. Клеточные основы роста растений. М., 1974. 222 с.
Иванов В. Б. Пролиферация клеток в растениях // Итоги науки в
техники. Цитология. М.» 1987. Т. 5. 219 с.
Лихолат Т. В. Регуляторы роста древесных растений. М., 1983.
240 с.
Меняйло Л. Н. Гормональная регуляция ксилогенеза хвойных. Но-
восибирск, 1987. 185 с.
Сыт ник К. М., Мусатенко Л. И., Богданова Т. Л. Физиоло-
гия листа. Киев, 1978. 391 с.
Чельцова Л. П. Рост конусов нарастания побегов в онтогенезе ра-
стений. Новосибирск, 1980. 192 с.
Шевченко В. В., Гриних Л. И. Химерность у растений. М., 1981.
212 с.
Aloni R. Differentiation of vascular tissues//Ann. Rev. Plant Physiol.
1987. Vol. 38. P. 179—204.
Dale J. E. The control of leaf expansion//Ann. Rev. Plant Physiol.
Plant Mol. Biol. 1988. Vol. 39. P. 267—295.
Feldman L. J. Regulation of root development//Ann. Rev. Plant
Physiol. 1984. Vol. 35. P. 223—242.
Green P. B. Organogenesis — a biophysical view//Ann. Rev. Plant
Physiol. 1980. Vol. 31. P. 51—82.
Halperin W. Organogenesis at the shoot apex//Ann. Rev. Plant
Physiol. 1978. Vol. 29. P. 239—262.
Roberts L. W., Gahan P. B., Aloni R. Vascular differentiation
and plant growth regulators. Berlin e. a., 1988. 154 p.
Stange L. Cellular interactions during early differentiation//Encyclo-
pedia of plant physiology. New Series. Cellular interactions. Berlin e. a.,
1984. Vol. 17. P. 424—452.
229
К главе 5
Биотехнология растений: культура клеток. М., 1989. 280 с.
Бутенко Р. Г. Экспериментальный морфогенез и дифференциация в
культуре клеток растений. 35-е Тимирязевское чтение. М., 1975. 51 с.
Калинин Ф. Л., Сарнацкая В. В., Полищук В. Е. Методы
культуры тканей в физиологии и биохимии растений. Киев, 1980. 488 с.
Карлсон Б. М. Регенерация. М., 1986. 296 с.
Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение. М.,
1983. 96 с.
Кренке Н. П. Регенерация растений. М., 1950. 675 с.
Лиознер Л. Д. Регенерация и развитие. М., 1982. 166 с.
Смирнов А. М. Рост и метаболизм изолированных корней в стериль-
ной культуре. М., 1970. 455 с.
Юсуфов А. Г. Регенерация высших растений. М., 1981. 64 с.
Юсуфов А. Г. Механизмы регенерации растений. Ростов, 1982. 173с.
Goodwin Р. В., Goll now В. I., Letham D. S. Phytohormones
and growth correlations // Phytohormones and related compounds. A compre-
hensive treatise. Vol. II. Amsterdam, 1978. P. 215—249.
Turgeon R. The sink-source transition in leaves//Ann. Rev. Plant
Physiol Plant Mol. Biol. 1989. Vol. 40. P. 119—138.
К главе 6
Гамбург К. 3. Биохимия ауксина и его действие на клетки расте-
ний. Новосибирск, 1976. 272 с.
Георгиев Г. П. Гены высших организмов и их экспрессия. М., 1989.
254 с.
Ивановская Е. В. Цитоэмбриологическое исследование дифферен-
цировки клеток растений. М., 1983. 152 с.
Кефели В. И. Природные ингибиторы роста и фитогормоны. М.,
1974. 254 с.
Кефели В. И., Коф Э. М., Власов П. В., Кис л ин Е. Н. При-
родный ингибитор роста — абсцизовая кислота. М., 1989. 184 с.
Кибернетика живого: биология и информация. М., 1984. 143 с.
Кулаева О. Н. Цитокинины, их структура и функция. М., 1973. 264с.
. Кулаева О. Н. Гормональная регуляция физиологических процессов
у растений на уровне синтеза РНК и белка. 41-е Тимирязевское чтение. М.,
1982. 83 с.
Курсанов А. Л. Транспорт ассимилятов в растении. М., 1976. 646с.
Лобов В. П., Д а с к а л ю к А. П., Скрипка Л. В., Тищенко
Е. Н. Организация нуклеотидных последовательностей ДНК растений.
Киев, 1986. 120 с.
Люттге У., Хигинботам Н. Передвижение веществ в растениях.
М,, 1984. 408 с.
Молотковский Г. X. Полярность развития растений. Львов, 1961.
262 с.
Муромцев Г. С., Агнистикова В. Н. Гиббереллины. М., 1984.
208 с.
Муромцев Г. С., Чкаников Д. И., Кулаева О. Н., Гам-
бург К. 3. Основы химической регуляции роста и продуктивности ра-
стений. М., 1987. 383 с.
Новосельцев В. Н. Теория управления и биосистемы. М., 1978.
320 с.
Полевой В. В. Фитогормоны. Л., 1982. 248 с.
Полевой В. В. Роль ауксина в системах регуляции у растений. 44-е
Тимирязевское чтение. Л., 1986. 79 с.
Теория систем и биология. М., 1971. 128 с.
X а к е н Г. Синергетика. М., 1980. 404 с.
Grierson DM Covey S. Plant molecular biology. Glasgow; London,
1984. 176 p.
230
The cytoskeleton in plant growth and development /Ed. C. W.
Lloyd. London e. a., 1982. 457 p.
К главе 7
Калинин M. И. Формирование корневой системы деревьев. М., 1983.
152 с.
Крамер П. Д., Козловский Т. Т. Физиология древесных расте-
ний. М., 1983. 462 с.
Мокр о и осов А. Т. Онтогенетический аспект фотосинтеза. М., 1981.
196 с.
Мокроносов А. Т. Фотосинтетическая функция и целостность расти-
тельного организма. 42-е Тимирязевское чтение. М., 1983. 64 с.
Физиология плодовых растений. М., 1983. 416 с.
Encyclopedia of plant physiology. New Series. Hormonal regula-
tion of development II. The functions of hormones from the level of the cell
to the whole plant / Ed. T. K. Scott. Berlin e. a., 1984. Vol. 10. 309 p.
Encyclopedia of plant physiology. New series. Hormonal regulation
of development III. Role of environmental factors / Ed. R. P. Pharis,
D. M. Reid. Berlin e. a., 1985. Vol. 11. 887 p.
Goodwin P. B., Go 11 now В, I., Letham D. S. Phytohormones
and growth correlations // Phytohormones and related compounds. A compre-
hensive treatise. Amsterdam, 1978. Vol. 2. P. ‘>15—249.
Turgeon R. The sink-source transition in leaves//Ann. Rev. Plant
Physiol. Plant Mol. Biol. 1989. Vol. 40. P. 119—138.
К главе 8
Воскресенская H. П. Фоторегуляторные аспекты метаболизма ра-
стений. 38-е Тимирязевское чтение. М., 1979. 48 с.
Конев С. В., Болотовский И. Д. Фотобиология. Минск, 1974.
348 с.
Кузнецов Е. Д., С е и ч я к Л. К., К и н д р у к Н. А., Слюсаре н-
ко О. К. Роль фитохрома в растениях. М., 1986. 287 с.
Молекулярные механизмы биологического действия оптического
излучения. М., 1988. 232 с.
Encyclopedia of plant physiology. New series. Photomorphogenesis
/Ed. W. Shropshire, jr, H. Mohr. Berlin e. a., 1983. Vol. 16A. P. 1—456;
Vol. 16B. P. 457—840.
Lee Y., Satter R. L. Effects of white, blue, red light and darkness
on pH of the apoplast in the Samanea pulvinus//Planta. 1989, Vol. 178,
N 1. P. 31—40.
Roux S. J., Wayne R. O., D a tt a N. Role of calcium ions in phyto-
chrome responses: an update//Physiol. Plantarum. 1986. Vol. 66, N 2.
P. 344—348.
К главе 9
Аксенова H. П., Баврина Т. В., Константинова Т. Н. Цве-
тение и его фотопериодическая регуляция. М., 1973. 295 с.
Банникова В. П., Хведынич О. А., Шпилевая С. П. и др.
Половые клетки и оплодотворение у покрытосеменных и водорослей. Киев,
1985. 220 с.
Бернье Ж., Кине Ж.-М., Сакс Р. Физиология цветения. Т. 1. Фак-
торы цветения. М., 1985. 192 с.
Бернье Ж., Кине Ж.-М., Сакс Р. Физиология цветения. Т. 2. Пе-
реход к репродуктивному развитию. .М., 1985. 317 с.
Бюннинг Э. Ритмы физиологических процессов. М., 1961. 184 с.
Духовный А. И. Электричество в жизни цветка. Кишинев, 1980.
32 с.
Мошков Б. С. Актиноритмизм растений. М., 1987. 272 с.
Резникова С. А. Цитология и физиология развивающегося пыльни-
ка. М., 1984. 272 с.
231
Френкель Р., Галун Э. Механизмы опыления, размноженияе и се-
лекция растений. М., 1982. 384 с.
Чайлахян М. X. Регуляция цветения высших растений. М., 1988.
560 с.
Чайлахян М. X., X р я н и н В. Н. Пол растений и его гормональная
регуляция. М., 1982. 176 с.
Bernier G. The control of floral evocation and morphogenesis // Ann.
Rev. Plant Physiol. Plant Mol. Biol. 1988. Vol. 39. P. 175—219.
Encyclopedia of plant physiology. New series. Cellular inter-
actions / Ed. H. F. Linskens, J. Heslop-Harrison. Berlin e. a., 1984. Vol. 17.
743 p.
Steer M. W., Steer J. M. Pollen tube tip growth // New Phytol.
1989. Vol. 111. P. 323—358.
К главе 10
Иванова 3. Я. Биологические основы и приемы вегетативного раз-
множения древесных растений стеблевыми черенками. Киев, 1982. 288 с.
Мак-Миллан Броуз Ф. Размножение растений. М., 1987. 192 с.
Метлицкий Л. В., Озерецковская О. Л., Кораблева Н. П.
и др. Биохимия иммунитета, покоя, старения растений. М., 1984. 264 с.
С ы р т а н о в а Г. А., Р а х и м б а е в И. Р. Фитогормоны и покой луко-
вичных растений. Алма-Ата, 1983. 127 с.
Турецкая Р. X. Физиология корнеобразования у черенков и стиму-
ляторы роста. М., 1961. 280 с.
Турецкая Р. X., Поликарпова Ф. Я. Вегетативное размножение
растений с применением стимуляторов роста. М., 1968. 94 с.
Физиология роста тюльпана. Алма-Ата, 1976. 152 с.
Физиология сельскохозяйственных растений. Т. 12. Физиология кар-
тофеля и корнеплодов. М., 1971. 375 с.
Чайлахян М. X. Фотопериодическая и гормональная регуляция
клубнеобразования у растений. М., 1984. 70 с.
Юсупов А. Г. Культура изолированных листьев. М., 1988. 104 с.
К главе 11
Гупало П. И. Возрастные изменения растений и их значение в ра-
стениеводстве. М., 1969. 252 с.
Саламатова Т. С. Физиология растительной клетки. Л., 1983. 232с.
Т h i m a n п К. V. The interaction of hormonal and environmental factors
in leaf senescence//Biol, plantarum. 1985. Vol. 27, N 2—3. P. 83—91.
Thomas H., Stoddart J. L. Leaf senescence//Ann. Rev. Plant
Physiol. 1980. Vol. 31. P. 83—111.
К главе 12
Жизнь растений: В 6 т. Т. 4. Мхи, плауны, хвощи, папоротники, го-
лосеменные растения. М., 1978. 448 с.
Жизнь растений: В 6 т. Т. 5(1). Цветковые растения. М., 1980. 430 с.
М а н о й л е н к о К. В., Агаев М. Г., Полевой В. В. и др. Эволю-
ция функций в растительном мире. Л., 1985. 244 с.
Скрипчинский В. В. Фотопериодизм: его происхождение и эволю-
ция. Л., 1975. 299 с.
Скрипчинский В. В. Эволюция онтогенеза растений. 36-е Тимиря-
зевское чтение. М., 1977. 62 с.
Тахтаджян А. Л. Происхождение покрытосеменных растений. М.,
1961. 133 с.
Тахтаджян А. Л. Основы эволюционной морфологии покрытосемен-
ных. М., 1964. 236 с.
Хохряков А. П. Эволюция биоморф растений. М., 1981. 168 с.
Юсуфов А. Г. Лекции по эволюционной физиологии растений. М.,
1985.
232
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсцизины (АБК) 9, 23, 26, 34, 52,
67, 68, 71—74, 81, 85, 102, 105, 106,
128, 129, 140, 174, 175, 178, 202,
203, 207—210, 217, 219, 221, 222,
224, 227
Автоколебания и автоволны 120—122
и см. Осцилляции
Автотропизм 34
1-Аминоциклопропан-1 -карбоновая
кислота (АЦК) 60, 106, 175, 219
Анабиоз 25
Антезины 165, 167—170
Апекс корня 23, 30, 34, 38, 42, 69—
73, 80, 81, 94, 109, 119, 123, 128
— побега 23, 38—48, 53, 60, 92,
94, 109, 122, 125, 126, 156, 162—
165, 168, 182, 183
Аттрагирующие центры 19, 64, 124—
130
Н+-АТФаза 35, 59, 98, 103, 149, 150
Ауксин 16, 19, 22, 23, 27, 30, 32, 34,
37, 38, 41, 46, 48, 51, 55, 57—64,
72, 74, 76, 80—85, 89, 90, 93, 102,
103, 109, 115, 126—129, 145, 149,
174, 178, 179, 200, 202, 203, 207,
210, 213, 217, 218, 221, 227 и см.
ИУК
6-Бензиламинопурин (6-БАП) 178
Биологические часы 118
Вегетативное размножение 4, 11—13,
123, 152, 205—213
Верналин 158
Ветвление корня 83—85
— побега 38, 53, 62—65, 127
Гаметогенез 186—188
Генетическая регуляция 97, 98
Гены 9, 116, 144, 150, 160, 176, 177
Гиббереллины (ГА) 9, 19—23, 27,
35—38, 52, 55, 57, 59—61, 63, 66,
67, 72, 81, 82, 102, 104—106, 125—
129, 139, 140, 145, 157, 158, 164,
167—170, 173, 174, 178, 179, 185,
198, 200, 202—204, 207—212, 217,
218, 223, 227
Гистоны 116, 216
Гомеостаз 96
Гормональная регуляция 97, 101—107,
227
Гормональная теория развития 9,
165
----тропизмов 9
Гравитропизм 31—34
2,4-Д 204, 213
Движения растений 7, 8, 11 31—34
124—126, 131, 137, 147, 150
Деление клеток (пролиферация) 6,
7, 9, 31, 42—62, 69—84, 128, 141
182—188, 206, 227
Дифференциальная активность генов
9, 115, 116, 144, 182
Дифференциация (детерминация) по-
ла 104, 105, 175—179
Дифференцировка 6, 9, 12, 13, 54, 55,.
62, 73, 82, 84, 85, 88—92, 114, 115
Доминирующие центры 11, 63, 64,
85, 93, 97, 103, 109, 123—130, 207
Донорно-акцепторные взаимосвязи
128—130
Зародыш 8, 11, 14—23, 26, 30, 42,.
69, 94, 109, 114, 118, 123, 156, 202,.
203, 226
Зародышевый мешок 4, 7, 14—16,
120, 182, 187, 188, 199
Зеатин 17, 22, 27, 35, 38, 103, 104,.
119, 124, 128, 223
Зигота 4, 10, 12, 14—18, 112, 113,
152, 199
Зоны растяжения 30—32, 34, 69, 74—
76, 80, 81, 126—128
2-Изопентениладенозин 22
Ингибиторы роста 27, 76, 81, 128, 140,
145, 209
— цветения 41, 170—172
Индолилмасляная кислота 213
Индолилуксусная кислота (ИУК) 9,
16—23, 31—38, 48, 51, 55, 57—67,
71—76, 79, 82, 85, 89—91, 93,.
102—104, 106, 108, ПО, 119—130,
143, 174, 183, 184, 186, 192, 198,.
200—202, 207, 208, 210—212, 227
Индукция цветения 40, 152—163
Интеграция 6
Каллус 87, 89—91, 109, 167
Камбий 60, 61, 82, 93, 124, 128
Катионы
— Са2+ 31, 35, 78, 99, 103, 108,
112, 117, 119, 145, 147, 148,
191, 192
— Н+ 21, 35—37, 99, 103, 108, 112,
119, 129, 147, 149
— К- 35, 99, 103, 108, 145, 147,
191, 220
Клеточные стенки 15, 17, 75, 204
Клональное микроразмножение 87,
213
Клубни 12, 13, 28, 105, 126, 140,
205—209
233*
Компетенция 39, 40, 117, 144, 152,
164, 165
Корневище 65, 66, 124—126, 210, 211
Корневой чехлик 23, 34, 68—74, 81,
83, 87, 92, 128, 146
Корневые волоски 30, 68, 69, 76—79,
126
Коррелятивный рост 4, 38, 123—130,
173
Красный свет 8, 26, 27, 36, 52, 67, 81,
132—148, 162, 177, 220
Криптохром 36, 132, 137—139, 141,
227
Круговые нутации 34
Ксантоксин 105, 106
Луковицы 7, 12, 28, 126, 209, 210
Мембранная регуляция 97—100
Мембранный потенциал (МП) 70—
74, 76, 82, 88, 98, 108, 148, 150,
151, 197
Меристема ожидания 44, 164, 182
Метаболическая регуляция 96—98
Механические давления 47, 55, 56, 82,
85, 109, ПО, 119
Митотический цикл 43, 44, 58, 70—73,
118, 164, 182
Мобилизация запасных веществ 34—
36
Морфогенез 3, 4, 6, 9, 11, 13, 36, 86,
94, 111 — 124, 151, 165, 179—188
Негистоновые белки 116, 216
Несовместимость 193—196
1-НУК 178, 204, 213
Обратные связи 96, 102, 111, 120,
121, 124
Онтогенез 4, 12, 13, 42, 94, 123, 131,
225___227
Оплодотворение 8, 14—16, 199, 200
Опыление 188—199
Осцилляции 58, 97, ПО, 118
Отводки 7, 12
Отложение запасных веществ 14, 23—
25, 227
Плазмодесмы 15, 18, 19, 70, 129
Пластохрон 46
Покой 3, 15, 106, 107, 227
— клубней 209
— луковиц 210
— почек 67—68, 224
— семян 25—27
Покоящийся центр 70—73, 92, 93
Половое размножение 4, 7, 8, 11, 13,
28, 123, 152—204, 225
Полярность 8, 9, 15, 37, 38, 48, 55,
61, 88, 90, 92, 97, 102, 103, 107,
109—115, 119, 120, 127, 149, 167,
187, 198, 207
Потенциал действия (ПД) 108, ПО,
120, 125, 197—199, 227
Проводящие пучки 7, 21, 35, 54, 55,
57, 61, 62, 79, 80, 82, 89, 90, 109,
ПО, 124, 125, 127, 129, 130, 140,
156
Прорастание семян 28—37, 139—140
Протеинкиназы 99, 103, 104, 106, 147,
148
Протонная помпа (Н+-помпа) 19, 21,
30, 35, 59, 64, 75, 98, 99, ЛОЗ, 115,
127, 129, 147, 149
Птерины 138, 139
Пыльцевая трубка 14—16, 186, 189—
200, 226
Пыльцевое зерно 189, 190, 192—196,
200
Развитие 3, 4, 6, 8, 10—13
Раздражимость 111
Растяжение клеток 9, 11, 49, 56, 57,.
59, 94, 128, 141, 203, 225, 226
Регенерация 3, 4, 12, 86—93
Регуляторные контуры 97, ПО, 111
Регуляция, определение 95, 96, 227
Ритмы-см. Осцилляции
РНК 15, 19, 21, 29, 30, 36, 43, 44, 48,
58, 59, 70, 74, 75, 98, 104—106, 116,
144, 145, 160, 164, 167, 185, 191,
209, 216—218
Рост 3, 4, 6, 8, 10—13
— корня 68—85
— листа 44—53, 140—143
— побега 42—68, 140—143
Самоорганизующиеся системы 9, 95,
96
Самосборка 116, 117
Семяпочка 7, 14—16, 20, 182, 184,
186, 193, 199, 202
Сенсорная зона 11/ 31, 34, 73, 124—
126, 189
Синергетика 95, 120
Синий свет 8, 36, 52, 81, 134, 136—
143, 148—151, 177
Скарификация 26
Соматический эмбриогенез 20, 87, 91,
92
Спорогенез 184—187
Старение 4, 6, 10, 13, 124, 214—224
Столоны 65, 66, 124—126, 206, 207,
211, 212
Стратификация 27
Суспензор 18—22
Тотипотентность 86, 115
234
Трофическая регуляция 97, 100, 101,
227
Управление 11, 95, 96, 109, 227
Устьица 10, 50, 51, 106, 221, 227
Филотаксис 10, 46
Фитохром 3, 9, 26, 36, 52, 67, 81,
111, 132—141, 144—148, 162, 163,
227
Флориген 9, 167—170, 172, 178, 179
Формирование плодов 6, 200—204,
222
Фосфоинозитольный цикл 99, 100,
103
Фотоморфогенез 9, 36, 52, 131 — 151
Фотопериодизм 8, 9, 40, 67, 68, 127,
131, 132, 143, 153, 158—163, 207,
210, 222, 223
Фототропизм 8, 136, 137
Хлорхолинхлорид (XXX) 59, 161
Цветок 7, 13, 126, 152, 158, 163, 164,
168, 175, 179—188, 193, 222, 225
Цитокинины 9, 16—23, 27, 35—38, 41,
47, 48, 51, 52, 62, 64—67, 71, 72,
74, 81, 85, 89, 90, 102—104, 106,
119, 122, 125, 127—129, 139, 140,
145, 173, 178, 179, 184, 185, 202,
203, 207, 208, 210—212, 217, 218,
223, 227
Цитоскелет 99, 107, 113, 115, 117
Щиток 21, 22, 35, 36
Эвокация цветения 152, 153, 163—
165, 182
Электрические поля 20, 21, 31, 33,
48, 57, 58, 72, 75, 76, 82, 85, 88, 89,
107, 109, 112, 113, 115, 119,
125—127, 146, 149, 165, 227
Электрофизиологическая регуляция
20, 97, 107, 108, 227
Эмбриогенез 10, 13—25, 94, 109, 123,
127
Эндосперм 8, 14—24, 35, 156, 199,
202, 203
Этап зрелости 13, 152
Этилен 34, 36, 47, 52, 55, 60, 72, 75,
76, 79, 81, 82, 85, 88, 102, 106, 107,
121, 127, 139, 140, 145, 158, 175,
178, 204, 217, 219—221, 227
Этиоляция 31, 140—143
Эффект «кислого роста» 59
— массы 118
— положения 118, 119
Ювенильный этап (молодость) 13,
28—41
Яйцеклетка 14, 15, 112—114, 120,
199, 226
Яровизация 8, 39, 153—158
СОДЕРЖАНИЕ
. Предисловие....................................................3
Список сокращений................................................5
Введение ....................................................... в
1. ОСОБЕННОСТИ И ЭТАПЫ РОСТА И РАЗВИТИЯ СЕМЕННЫХ
РАСТЕНИЙ........................................................10
2. ЭМБРИОГЕНЕЗ..................................................14
2.1. Формирование зародыша.............................—
2.1.1. Зигота.....................................15
2.1.2. Развитие эндосперма........................—
2.1.3. Проэмбрио.......................• . . . 17
2.1.4. Глобулярный зародыш........................Ю
2.1.5. Сердцевидный зародыш.......................21
2.1.6. Торпедовидный зародыш......................22
2.1.7. Завершающие фазы формирования семени . . 23
2.2. Отложение запасных веществ в семенах .... —
2.2.1. Запасные белки................................24
2.2.2. Отложение крахмала............................25
2.2.3. Запасные жиры..................................—
2.3. Покой семян.......................................: —
2.3.1. Вынужденный покой семян.......................26
2.3.2. Физиологический покой семян....................—
236
3. ЮВЕНИЛЬНЫЙ ЭТАП...........................................23
3.1. Прорастание семян...................................—
3.1.1. Набухание....................................—
3.1.2. Проклевывание . 29
3.1.3. Гетеротрофный рост проростка в темноте ... 30
3.1.4. Переход к автотрофному способу питания . . 36
3.2. Накопление вегетативной массы
4. ФИЗИОЛОГИЯ РОСТА И РАЗВИТИЯ ВЕГЕТАТИВНЫХ ОРГА
НОВ..........................................
4.1. Рост побега..................................
4.1.1. Апекс побега .......
4.1.2. Формирование и рост листа ....
4.1.3. Образование пазушных почек ....
4.1.4. Формирование проводящего пучка
4.1.5. Рост стебля в длину...................
4.1.6. Рост стебля в толщину.................
4.1.7. Ветвление побега ......
4.1.8. Направление роста побегов ....
4.1.9. Покой почек...........................
4.2. Рост корня...................................
4.2.1. Апекс корня и формирование тканей
4.2.2. Корневой чехлик . . . . .
4.2.3. Зона роста клеток растяжением
4.2.4. Рост корневых волосков................
4.2.5. Дифференцировка тканей центрального цилиндра
4.2.6. Рост корня в длину....................
4.2.7. Рост корня в толщину..................
4.2.8. Ветвление корня.......................
37
42
44
53
54
55
65
62
65
67
68
69
73
74
76
79
80
81
83
5. РЕГЕНЕРАЦИЯ У РАСТЕНИЙ.......................................86
5.1. Физиологическая регенерация...........................87
5.2. Травматическая регенерация............................88
5.2.1. Регенерация, обусловленная дедифференцировкой
клеток ............................................... —
5.2.2. Регенерация с участием меристем .... 92
6. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РОСТА И МОРФОГЕНЕЗА
/ 93
6.1. Растительный организм как самоорганизующаяся система 95
6.1.1. Самоорганизующиеся системы.......................—
6.1.2. Системы регуляции и управления у растений . . 96
6.2. Механизмы морфогенеза.................................111
6.2.1. Поляризация клеток......................112
6.2.2. Дифференциальная активность генов . . .115
6.2.3. Индуцирующие воздействия................117
7. КОРРЕЛЯТИВНЫЙ РОСТ....................................123
7.1. Взаимосвязь побег — корень
237
7.2. Коррелятивный рост частей побега...................127
7.3. Коррелятивный рост частей корня ..... 128
7.4. Донорно-акцепторные взаимосвязи.........................—
8. ФОТОМОРФОГЕНЕЗ...............................................131
8.1. Фоторецепторы.........................................132
8.1.1. Фитохром........................................—
8.1.2. Пигменты, рецептирующие синий свет . . . 136
8.2. Светозависимое прорастание семян......................139
8.3. Деэтиоляция...........................................140
8.4. Механизм действия фоторецепторов......................143
8.4.1. Свет и дифференциальная активность генов . . 144
8.4.2. Фитохром и фитогормоны........................145
8.4.3. Действие света на функциональную активность мем-
бран ...................................................—
8.4.4. Механизмы действия синего света .... 148
9. ПОЛОВОЕ РАЗМНОЖЕНИЕ ПОКРЫТОСЕМЕННЫХ ... 152
9.1. Индукция цветения.......................................—
9.1.1. Яровизация....................................153
9.1.2. Фотопериодизм ....... 158
9.2. Эвокация цветения.....................................163
9.3. Природа флорального стимула...........................165
9.3.1. Гипотеза о бикомпонентной природе флоригена . 167
9.3.2. Гипотеза антифлоригена (ингибитора перехода к
зацветанию)...........................................170
9.3.3. Гипотеза многофакторного контроля . . . 172
9.4. Детерминация пола.....................................175
9.4.1. Выраженность пола у растений .... —
9.4.2. Генетическое определение пола.................176
9.4.3. Фенотипическое определение пола ...» 177
9.4.4. Фитогормоны и определение пола .... 178
9.5. Флоральный морфогенез.................................179
9.5.1. Строение цветка.................................—
9.5.2. Закладка и рост частей цветка .... 182
9.5.3. Спорогенез и гаметогенез......................184
9.6. Опыление и оплодотворение.............................188
9.6.1. Функции рыльца..................................—
9.6.2. Взаимодействие пыльца — рыльце .... 189
9.6.3. Рост пыльцевой трубки.........................190
9.6.4. Механизмы несовместимости ..... 193
9.6.5. Опережающая сигнализация в пестике . . . 196
9.6.6. Оплодотворение................................199
9.7. Формирование семян и плодов........................» 200
238
9.7.1. Рост плодов
9.7.2. Созревание плодов...........................204
10. ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ.................................205
10.1. Размножение клубнями................................—
10.2. Размножение луковицами............................209
10.3. Размножение корневищами и усами...................210
10.4. Размножение отводками и черенками . . . .212
11. СТАРЕНИЕ РАСТЕНИЙ........................................214
11.1. Клеточные механизмы старения......................215
11.2. Старение целого растения..........................221
12. ЭВОЛЮЦИЯ ОНТОГЕНЕЗА......................................225
Рекомендуемая литература ......... 228
Предметный указатель.........................................233
Учебное издание
Полевой Всеволод Владимирович
Саламатова Татьяна Сергеевна
Физиология роста и развития растений
Учебное пособие
Редактор 7\ Н. Пескова
Художественный редактор О. В. Угнич
Обложка художника В. И. Меньшикова
Технический редактор Е. И. Егорова
Корректоры Н. В. Ермолаева, Т. Г. Павлова
ИБ № 3217
Сдано в набор 08.06.90. Подписано в печать 17.01.91. Формат 60x90l/i6. Бумага тип. №2.
Гарнитура литературная. Печать высокая. Усл. печ. л. 15,0. Усл. кр.-отт. 15,25.
Уч.еизд. л. 15,16. Тираж 8541 экз. Заказ № 399. Цена 2 р. 40 к.
Издательство ЛГУ. 199034, Ленинград, Университетская наб., 7/9.
Типография Изд-ва ЛГУ. 199034, Ленинград, Университетская наб., 7/9.
Опечатка
На стр. 103 верхнюю формулу следует читать так:
<-СН,-СООН
NH
ФИЗИОЛОГИЯ
РОСТА И РАЗВИТИЯ
РАСТЕНИЙ
2 р. 40 К.